Титульный лист и исполнители
РЕФЕРАТ
Отчет 55 с., 12 рис., 11 табл., 2 прил., 21 использованных источников.
Название темы: Разработка бактериофагового биопрепарата для защиты от болезней растений, вызываемых Xanthomonas campestris и Pseudomonas syringae в растениеводстве.
Ключевые слова: бактериофаги, биологическая защита растений, органическое растениеводство, сосудистый бактериоз капусты, бактериальный ожог сои.
Объект исследования: возбудители сосудистого бактериоза капусты (Xanthomonas campestris pv. campestris) и бактериального ожога сои (Pseudomonas syringae pv. glycinea)
Цель работы: выделить из природной популяции активные в отношении Xanthomonas campestris pv. campestris и Pseudomonas syringae pv. glycinea штаммы бактериофагов и проверить их эффективность на искусственных инфекционных фонах против сосудистого бактериоза капусты и бактериального ожога сои.
Описание проделанной работы и ее результаты. С растений, имеющих типичные симптомы поражения сосудистым бактериозом капусты и бактериальным ожогом сои, были выделены чистые культуры искомых патогенов. Проведена их характеристика биохимическими и молекулярно-генетическими методами. С образцов почв, на которых культивировались пораженные бактериозами капуста и соя выделены бактериофаги по общепринятым методикам. Далее проведено фаготипирование (оценка штаммового состава бактериофагов) для дальнейшего создания на их основе бактериофагового препарата.
Проверка фаговых препаратов была проведена на искусственном и естественном инфекционных фонах на вегетирующих растениях капусты и сои соответственно. Биологическая эффективность бактериофаговых препаратов против бактериозов капусты и сои была близка к эффективности эталонных бактерицидных препаратов и составляла от 74, 7 % до 90,6 %
ВВЕДЕНИЕ
Капуста белокочанная (лат. Brassica oleracea L. convar capitata L. var. alba DC) и соя культурная (лат. Glycine max L.) являются важными культурами в полевых севооборотах РФ. Капуста – среди овощных культур является наиболее высокоурожайной при наименьших затратах на производство, и на данный момент остается основной овощной культурой во многих странах мира.
Широкое внедрение в сельскохозяйственное производство сои – важный и эффективный способ решения проблемы кормового и пищевого белка, успешно используемый в мировом земледелии, и актуальный для РФ в условиях глобального изменения климата [1].
Рост сельскохозяйственного производства- важнейшая задача, стоящая как перед производителями, так и перед учеными. Ощутимый вред растениям, и как следствие снижение валового сбора продукции наносят возбудители болезней. Международная конвенция защиты растений (The International Plant Protection Convention, IPPC), Продовольственная и сельскохозяйственная организация (The Food and Agriculture Organization, FAO) определили, что до 40% сельскохозяйственного урожая, оцениваемого в 220 млрд долл., теряется ежегодно из-за патогенов и вредителей. При этом, потери растениеводческой продукции от болезней оцениваются в среднем в 10 % [2]. Растения поражаются болезнями разной этиологии, в том числе бактериальными.
К примеру, одной из наиболее экономически важных болезней капусты белокочанной является сосудистый бактериоз, вызываемый Xanthomonas campestris pv. campestris. Патоген способен снижать урожайность культуры до 80%, ухудшает сохранность кочанов и увеличивает потери при хранении [3].
Основной болезнью бактериальной этиологии сои является бактериальный ожог (возбудитель Pseudomonas savastanoi pv. glycinea, синоним — Pseudomonas syringae pv. glycinea). Потери урожая сои из-за болезни могут достигать 40%, еще заметнее снижение посевных качеств семян и масличности пораженных растений [4].
Ввиду принятия в этом году Федерального закона №280-ФЗ «Об органической продукции и о внесении изменений в отдельные законодательные акты Российской Федерации» актуальным становится переход к биологизированной защите растений. Перспективным в данном плане является использование бактериофагов как агентов биологического контроля возбудителей бактериальных болезней растений [5].
1 ОСНОВНАЯ ЧАСТЬ
1.1 Перспективы применения бактериофагов для контроля возбудителей фитобактериозов.
Для защиты растений от бактериальных болезней создают устойчивые сорта, применяют пестициды на основе антибиотиков, соединений меди, цинка и микроорганизмов-антагонистов [6]. Наиболее эффективным и часто применяемым методом защиты является селекция устойчивых сортов. Однако, селекция устойчивых сортов: 1) требует большого количества затрат труда и времени; 2) фитопатогенные бактерии быстро становятся вирулентными к устойчивым растениям, что означает непрекращающуюся селекционную работу для поддержания высокого эффективности защиты.
Применение антибиотиков (д.в. фитобактериомицин и др.) и препаратов на основе меди (Косайд-2000, ВДГ и др.) отрицательно сказывается на экологической обстановке в агроценозе. Эффект от применения бактерий-антагонистов (штаммы Bacillus subtilis и др.) нестабилен и зависит от многих факторов.
Применение бактериофагов в растениеводстве с одной стороны, помогает уменьшить пестицидную нагрузку, с другой стороны – может помочь поддерживать экологический баланс, сохраняя популяции полезных микроорганизмов в агроэкосистеме.
Препараты на основе бактериофагов успешно применяются для защиты картофеля от бурой гнили (возб. Ralstonia solanacearum), лука и плодовых культур от бактериальных ожогов (возб. Pseudomonas syringae pv. porri и Erwinia amylovora) и ряда других [7, 8, 9].
1.2. Цель, задачи и методика проведения исследований по теме проекта
Цель: выделить из природной популяции активные в отношении Xanthomonas campestris pv. campestris и Pseudomonas syringae pv. glycinea штаммы бактериофагов и проверить их эффективность на искусственных инфекционных фонах против возбудителей сосудистого бактериоза капусты и бактериального ожога сои.
Задачи:
- Выделить из пораженных частей растений капусты белокочанной и сои культурной возбудителей сосудистого бактериоза и бактериального ожога
- Изолировать из образцов почв бактериофаги, активные в отношении возбудителей бактериозов капусты и сои и провести их фаготипирование.
- Проверить эффективность фаговых композиций на искусственном инфекционном фоне сосудистого бактериоза капусты и бактериального ожога сои на вегетирующих растениях в условиях остекленной теплицы.
Условия и методика проведения исследований
1.2.1. Выделение Pseudomonas syringae pv. glycinea в чистую культуру
Для выделения бактерий из симптоматичной растительной ткани использовали стандартный метод мацерации и серийных разведений суспензии растительной ткани.
После проращивания поверхностно-стерилизованных семян на фильтровальной бумаге в течение 5 дней, из не проросших, а также из имеющих типичные симптомы бактериального заражения (некроз семядольных листьев, подсемядольного колена, бактериальный экссудат) проростков получали суспензию бактерий путем гомогенизации пораженных фрагментов семени и проростков пестиком в ступке с добавлением стерильной воды (рисунок 1-А).
Последовательные 10-кратные разведения гомогената высевали на среду Кинга Б (пептон – 20,0 г/л, сульфат магния 1,5 г/л, K2HPO4 – 1,5 г/л, бактериологический агар (американский тип) – 14,0 г/л), и инкубировали при 28оС в течении 4 суток. Данную процедуру повторяли несколько раз для убеждения в микробиологической чистоте культур.
При отборе типичных флуоресцирующих колоний псевдомонад их признаки сравнивались с референтным штаммом Psg CFBP 2214 (рисунок 1-В).
Отобранные изоляты имели следующие биохимические и морфологические характеристики: белый, слегка кремоватый цвет колоний, колонии круглые, блестящие, 3-х дневные колонии образуют сидерофор — пиовердин, диффундирующий в среду и окрашивающий ее при УФ-излучении в синий цвет, не обладает пектолитической активностью.
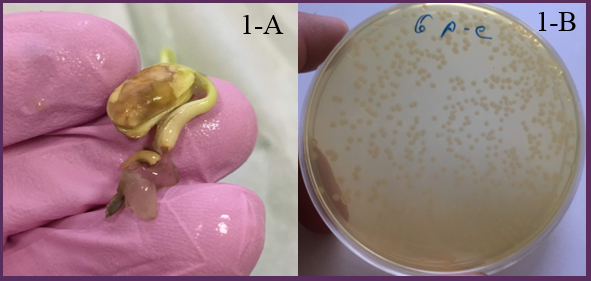
Рисунок 1-А — Проросток сои, пораженный патогеном на 5 день проращивания во влажной фильтровальной бумаге. Рисунок 1-B — Чистая культура Psg, штамм 2214 (CFBP) на среде Кинга Б, 3 день культивирования.
У выделенных изолятов анализировали биохимические признаки по системе LOPAT (образование левана, оксидазы, пектолитическая активность на ломтиках картофеля, аргининдигидролазная активность и реакция сверхчувствительности (РСЧ) на растениях табака) согласно ранее описанным методам [11], в том числе с использованием коммерческих экспресс-тестов Микро-Цитохромоксидаза и Микро-Аргинин (ЗАО «НИЦФ», Ст-Петербург).
Изоляты бактерий, имевшие характерные для вида Pseudomonas syringae физиологические признаки, анализировали методом ПЦР со специфичными праймерами. Для проведения анализа использовали праймеры PsgFOR-1 (’5-GGC GCT CCC TCG CAC TT-3’) и PsgREV-2 (’5-GGT ATT GGC GGG GGT GC-3’) специфичные для фрагмента гена cfl (размер продукта 650 п. н.), кодирующего коронафакат лигазу (coronafacate ligase), термо-регулируемый ген, требующийся для синтеза фитотоксина коронатина [12]. Выделение ДНК проводили с 2-х суточных колоний чистых культур бактерии при помощи набора для выделения ДНК «ГС-проба» (ООО «АгроДиагностика»).
Для проведения амплификации использовали готовили ПЦР-смесь, содержащую 5х Master Mix (5х MasDDTaqMIX-2025 («Диалат ЛТД»)).– 5 мкл; 1,0 мкл каждого праймера с концентрацией 10 пМ/мкл; 5 нг целевой ДНК – 5 мкл и воду для ПЦР – 13 мкл. Окончательный объем смеси составлял 25 мкл. ПЦР-амплификацию проводили в термоциклере АТС 201 «Nyxtechnik» по программе, указанной в работе [13]. Ампликоны разделяли методом электрофореза в 1,5 % агарозном геле с бромистым этидием в буфере TBE 0,5х.
Проверку патогенности изолятов проводили на 25-дневных растениях сои восприимчивого сорта Батя (Дальневосточный НИИ сельского хозяйства), выращенных в пластиковых горшках объемом 0,5 л с торфяным субстратом с перлитом (ООО «Велторф) в теплице при средней температуре 25/20оС (день/ночь) и естественном освещении (июнь-август).
Суспензию бактериальных клеток 2-х суточной культуры патогена готовили в стерильной воде, первоначальным разведением до оптической плотности 0,5, измеряемой фотометром при 590 — 610 нм и последующим доведением до концентрации 108 КОЕ в 1 мл. За 2 суток до инокуляции и в течение суток после неё, в теплице поддерживали повышенную влажность воздуха (95 %) и постоянную температуру воздуха 27°C.
Заражение проводили методом опрыскивания поверхности листьев суспензией патогена с добавлением 0,01 % адъюванта Сильвет Голд, ВЭ для улучшения проникновения патогена в устьица. В качестве отрицательного контроля использовали стерильную воду с адьювантом, положительного – суспензию референтного штамма патогена CFBP 2214. Учет результатов проводили через 14 дней после заражения (рисунок 2)
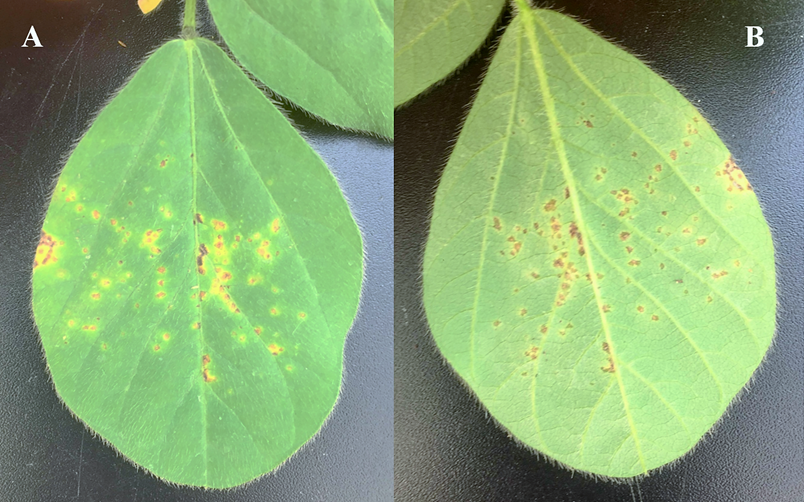
Рисунок 2 — Симптомы поражения бактериальным ожогом сои сорта Батя на 14 сутки после искусственного заражения штаммом Psg CFBP 2214. (A- верхняя сторона, В- нижняя сторона листа).
Идентифицированные вирулентные штаммы хранили в 15%-ном глицерине при температуре -700С и в стерильной воде при температуре +200С.
1.2.2. Выделение Xanthomonas campestris pv. campestris в чистую культуру
Возбудителя сосудистого бактериоза (Xanthomonas campestris pv. campestris, далее Хсс) выделяли из сосудистой системы пораженных растений капусты стандартным методом мацерации пораженных тканей растений и высевом на неселективную питательную среду. После промывки пораженных черешков листьев капусты водой и поверхностной стерилизацией 70%-ным этанолом (рисунок 3), черешки разрезали вдоль пораженных сосудов. Далее стерильным скальпелем вырезали почерневшие сосуды и измельчали их в ступке пестиком при добавлении стерильной воды. Полученную суспензию затем встряхивали на вортексе Microspin FV-2400 «Biosan» и высевали суспензию в чашки Петри на среду YDC (дрожжевой экстракт – 10 г/л, глюкоза – 20 г/л, CaCO3 – 20 г/л, агар – 17 г/л), распределяя по поверхности при помощи шпателя Дригальского.

Рисунок 3 — Симптомы сосудистого бактериоза: А — на семядольных листьях, В – на рассаде, С – на взрослых растениях.
Чашки инкубировали при температуре 270С в течение 48 часов. Колонии бактерии Хсс на среде YDC желтые, слизистые, край ровный, выпуклый. Типичные единичные колонии отсевали штрихом на свежую среду YDC. Тест на амилазную активность проводили на среде с крахмалом. Тест на патогенность выделенных изолятов проводили на растениях капусты восприимчивой линии Цв 9 методом укола в жилку препаровальной иглой, смоченной в бактериальной суспензии в концентрации 108 колониеобразующих единиц бактерий в миллилитре (далее КОЕ/мл). На один лист капусты делали 4-5 уколов, но только одним штаммом на лист. Растения выдерживали в контролируемых условиях при +20-250С. Спустя 10-15 суток проводили учет на наличие симптомов на инокулированных листьях. Идентифицированные штаммы, которые гидролизовали крахмал и давали типичные симптомы сосудистого бактериоза на растениях капусты, хранили в 15%-ном глицерине при температуре -700С и в стерильной воде при температуре +200С.
1.2.3. Выделение бактериофагов
Из образцов почвы с полей, занятых посевами сои, пораженными бактериальным ожогом, проводили выделение бактериофагов общепринятыми методами [14].
Поиск штаммов бактериофагов против Xcc проводили по аналогичной методике. Выделенные изоляты фагов хранили при +4°C для дальнейшей оценки литической активности против штаммов Psg и Хсс.
Для препаративного культивирования и очистки бактериофагов штаммы хозяев выращивали на жидкой среде YD (дрожжевой экстракт и декстроза) при 280С при интенсивном перемешивании до середины логарифмической фазы роста (оптическая плотность при 600 нм от 0,5 до 0,6 о.е.). Выросшую культуру бактерий инокулировали единичной бляшкой фага и инкубировали до проявления признаков лизиса (осветление культуры). Затем добавляли 0,5% объема хлороформа, энергично встряхивали и через 1 ч лизаты центрифугировали при 10 000 g (центрифуга «Jouan») в течение 15 мин для удаления бактериальных фрагментов. Далее, бактериофаги осаждали центрифугированием (22 000 g, 90 мин, 150C, ротор Beckman SW45). Надосадочную жидкость сливали, а для растворения осадка добавляли 2 мл SM-буфера (50 мМ Tris pH 7,5, 0,1 M NaCl, 10 мМ MgSO4, 0,01% желатин) и оставляли на 2-5 часов. Ресуспендированные препараты бактериофагов очищали ультрацентрифугированием (66 000 g, 120 мин, 150C, ротор Beckman SW28) в ступенчатом градиенте плотности CsCl 0,5 – 1,7 г/мл. Суспензии фагов диализовали против фагового буфера (10 мM Tris HCl, pH 7.4, 10 мM MgSO4). Препараты очищенных фагов хранили при 40C.
Электронное микроскопирование изолятов бактериофагов проводили в ИБХ им. М. М. Шемякина и Ю. А. Овчинникова РАН.
Для электронной микроскопии суспензию очищенных бактериофагов наносили на сетки и контрастировали 1% водным раствором уранилацетата. Изображения получали с помощью электронного микроскопа «Zeiss Libra 120» с ускоряющим напряжением 120 кВ. Полученные фотографии анализировали, используя диагностические морфологические признаки основных семейств бактериофагов.
1.2.4. Тестирование специфичности бактериофагов.
Для подготовки к тестированию фагочувствительности, бактерии Psg выращивали 48 часов при температуре 27°C на среде Кинга Б с 1,5 % агара.
Для тестирования вирулентности изолятов бактериофагов использовали капельный метод на двухслойном агаре [14]. В качестве верхнего слоя при титровании фагов выступала среда Кинга Б c содержанием агара 0,7 %. Реакцию считали положительной, если на месте нанесения капли суспензии фага через 12 часов при температуре 27°C происходило формирование бляшки (полное просветление бактериальной культуры).
Фаготипирование бактериофагов, специфичных к Xcc проводили аналогичным методом с единственным отличием: для двухслойного агара вместо среды Кинга Б использовали среду YDC.
1.2.5. Испытание бактериофагов против Psg на вегетирующих растениях сои
Оценку проводили при искусственном заражении растений в теплице лаборатории защиты растений РГАУ-МСХА имени К.А. Тимирязева в июле и августе 2020 года. Для оценки биологической эффективности бактериофагового препарата против бактериального ожога сои проводили обработку растений суспензией фагов в концентрации 107 БОЕ/мл. Концентрацию фагов проверяли путем серийных разведений и посевом на верхний агар с бактерией-хозяином. Первую обработку бактериофагами проводили через 2 дня после заражения растений фитопатогеном в фазе 3-4 настоящих листьев согласно методике, описанной выше. Вторую обработку фагами проводили через 6 дней после заражения патогеном. В качестве эталона использовали двукратную обработку в те же сроки препаратом Стрекар, КС (25 г/л фитобактериомицина + 70 г/л карбендазима, НПЦ «ФармБиомед», Москва). Для защиты фагов от воздействия УФ компоненты солнечного света добавляли 0,75 % обезжиренного молока. Расход рабочего раствора препаратов составлял 1 мл/ растение. Повторность вариантов опыта — трехкратная по 15 растений в каждой.
Оценку развития болезни проводили на 14-е сутки после заражения с помощью ранее разработанной шкалы [18]. Статистическую обработку анализируемых данных проводили методом дисперсионного анализа с помощью программ Statistica 12.0 (StatSoft Co, USA) и Microsoft Excel 2013 (Microsoft Co., USA) со сравнением средних по критерию Дункана. Данные, выраженные в процентах, перед обработкой преобразовывали в арксинусы.
1.2.6. Испытание бактериофагов против сосудистого бактериоза капусты.
Испытание бактериофагов против Xcc на семенах капусты
Для оценки биологической эффективности бактериофагового коктейля против семенной инфекции сосудистого бактериоза капусты проводили искусственное заражение семян белокочанной капусты гибрида F1 Казачок. Инокулировали семена чистой культурой возбудителя сосудистого бактериоза (штамм Ram 1-2) в концентрации 107 КОЕ/мл в условиях вакуума [16]. Затем семена подсушивали при комнатной температуре 24 часа и обработали фагами методам увлажнения с нормой расхода рабочей жидкости 10 мл/кг семян и замачиванием на 30 мин. Положительным контролем служили зараженные семена, а отрицательным контролем — здоровые семена.
Концентрацию жизнеспособных клеток возбудителя на семенах после обработки определяли экстрагированием в стерильной физрастворе. Для этого семена по 250 штук помещали в конические колбы на 50 мл и заливали 2,5 мл стерильного физиологического раствора (0,85% водный раствор NaCl) с добавлением неионного ПАВ Твин-20 (0,01%) и встряхивали на орбитальном шейкере 2,5 часа при 250 об/мин. Затем, переносили 100 мкл экстракта в пробирку с 900 мкл стерильного физраствора. Далее проводили серийные десятикратные разведения в стерильном физрастворе. После проводили посев 100 мкл суспензии из каждой пробирки на селективную среду, содержащую крахмал [16].
Подсчет гидролизующих крахмал колоний проводили через 48 часов. Рассчитывали показатель КОЕ/мл в исходном экстракте.
Для определения зараженности проростков, зараженные и обработанные бактериофагами семена, высевали на увлажненную фильтровальную бумагу в чашки Петри по 50 штук в трех повторностях. Чашки выдерживали на свету при комнатной температуре. Через 6-8 дней после посева учитывали количество зараженных проростков путем визуального осмотра семядольных листочков. В сомнительных случаях использовали бинокулярную лупу. Проводили учет лабораторной всхожести семян по ГОСТу 12038-8.
Методика испытания бактериофагов против Xcc на рассаде капусты
Семена белокочанной капусты F1 гибрида Казачок высевали в обеззараженный автоклавированием торфяной субстрат в кассеты №144 с размером ячейки 3х3см, которые размещали в теплице. Температура в теплице в период эксперимента составляла от 19 до 280С, при естественном световом дне.
В стадии 1-2 настоящего листа, в центр каждой кассеты высаживали по 4 растения, которые за 7 дней до пересадки были инокулированы срезом семядольного листочка лезвием, смоченным в бактериальной суспензии плотностью 108 КОЕ/мл Xcc.
После высадки зараженных растений, ежедневно проводили полив кассет методом дождевания с помощью ранцевого опрыскивателя. Обработку препаратами проводили с помощью ручного опрыскивателя. Контрольные растения обрабатывали водой. Во всех вариантах, включая контроль, для лучшего смачивания листьев добавляли 0,04% ПАВ «Сильвет Голд» (ЭФэМСи, Россия).
Первая обработка фаговым и эталонным препаратами была проведена в день посадки инокулированных растений. Всего было проведено 3 обработки с интервалом 10 дней. Учет симптомов заболевания проводили, начиная с 15 суток после посадки инокулированных растений в центральные лунки кассеты каждые 5 дней. В каждой кассете учитывали по 140 растений (всего 144 растений, из них – 4 первично зараженных). В каждом варианте учитывали 2 повторности по 1 кассете (140 растений).
2 РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
2.1.Выделение чистых культур фитопатогенов.
Результаты выделения чистых культур Psg
Из образцов семян сои, полученных из Амурской и Воронежской областей нами выделено более 150 изолятов флуоресцирующих псевдомонад, из которых отобраны 4 штамма Psg. Они были патогенными на растениях сои, идентичны референтному штамму Psg CFBP 2214 по морфологическим признакам культуры на среде Кинга Б, результатам LOPAT теста (+,-,-,-,+) и ПЦР анализу со специфичными праймерами для гена cfl. Список штаммов, а также их происхождение указаны в таблице 1.
Таблица 1 — Штаммы Pseudomonas savastanoi pv. glycinea, использованные в работе.
| Названия штаммов | Сорт сои | Место выращивания | Год выращивания |
| A31, А7-1, AF-3 | Батя | Амурская область, Благовещенский район | 2018, 2019 |
| В-7 | ОАК Пруденс | Воронежская область, Лискинский район | 2019 |
| CFBP 2214 | Нет данных | Новая Зеландия | 1958 |
Выделенные штаммы хранили в 15%-ном глицерине при температуре 700С и в стерильной воде при температуре +200С.
Результаты выделения чистых культур Xcc.
Образцы пораженных сосудистым бактериозом листьев белокочанной и цветной капусты были собраны в Московской области и Краснодарском крае, на полях с сильным развитием сосудистого бактериоза. Были собраны 13 образцов растительного материала различных гибридов капусты. У всех образцов были характерные для сосудистого бактериоза симптомы: хлороз листьев, некроз сосудов на срезе и V — образные некрозы, переходящие с края на центральную часть листа.
Было собрано 11 образцов растительного материала с симптомами сосудистого бактериоза капусты. Происхождение и список выделенных штаммов предоставлены в таблице 2.
После посева суспензии из некротизированных сосудов на среде YDC в чашках Петри выросли колонии желтого цвета, слизистые, типичные для ксантомонад. Далее, единичные колонии пересевали на свежую среду YDC, чтобы получить чистые бактериальные культуры (рисунок 4-А). Эту процедуру повторяли несколько раз. После получения чистых бактериальных культур, их тестировали на среде с крахмалом, так как известно, что Хсс гидролизует крахмал [19]. При этом тесте все выделенные изоляты гидролизовали крахмал.
Таблица 2 — Происхождение штаммов Хсс
| № | Штаммы | Из гибрида | Производитель гибрида | Место происхождения, культура |
| 1-4 | BК-55, BК-56, BК-57, BК-58 | — | — | Краснодарский край, белокочанная капуста |
| 5-8 | CК-71, CК-72, CК-73, CК-74 | — | — | Краснодарский край, цветная капуста |
| 9- 14 | Хсс 1/1, Хсс 1/5, Хсс 2/12,
Хсс 2/16, Хсс 3/23, Хсс 3/27 |
— | — | Московская область, Дмитровский район, белокочанная капуста |
| 15 | Bes-1 | Тайфун | Bejo | Московская область, Дмитровский район, белокочанная капуста |
| 16 | Bes-2 | Парадокс | ||
| 17 | SM-1 | Северянка | ВНИИССОК | |
| 18 | SM-2 | Мечта | ||
| 19 | Bul | Булат | Гавриш | |
| 20 | Dmo 1-1 | Триумф | Селекционная станция им. Н.Н. Тимофеева | |
| 21 | Dmo 1-2 | Экстра | ||
| 22 | Dmo 1-3 | Дублер |
Продолжение таблицы 2
| 23 | Dmo 2-1 | Колобок | Селекционная станция им. Н.Н. Тимофеева | Московская область, Дмитровский район, белокочанная капуста |
| 24 | Dmo 2-2 | Фаворит | ||
| 25 | Dmo 2-3 | Валентина | ||
| 26 | Dmo 3 | Семко — Юбилейный | ||
| 27 | Cas | Каспер | Rijk Zwaan | Московская область, Дмитровский район, цветная капуста |
Тест на патогенность проводили на восприимчивой линии капусты Цв 9.
В стадии 4-5 настоящих листьев, растения были инокулированы выделенными изолятами в концентрации 108 КОЕ/мл методом укола в жилку листа. 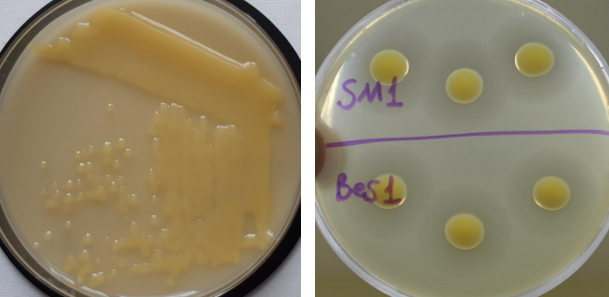
А В
Рисунок 4 — Выделение чистых культур патогена:
А – колонии Хсс на среде YDC; B – тест на крахмальной среде.
В результате заражения, спустя 10 суток все изоляты показали типичные для сосудистого бактериоза симптомы на листьях капусты (рисунок 5).

Рисунок 5 — Результаты тестирования изолятов Хсс на патогенность
Хранение выделенных штаммов проводили аналогичным образом.
2.1.2. Выделение и характеристика бактериофагов.
2.1.2.1. Выделение и характеристика бактериофагов Xcc.
В результате использования 11 штаммов-мишеней Xcc, из образцов почвы был выделен 21 изолят бактериофагов, список которых представлен в таблице 3.
Таблица 3 — Изоляты бактериофагов, вирулентные для Хсс, выделенные в данной работе
| Изоляты бактериофагов | Штаммы-мишени | Происхождение образца |
| B-10 | Bes-1 | Московская область, Дмитровский район |
| B-11 | Bes-1 | |
| B-15 | Bes-1 | |
| К-1 | Cas | |
| К-2 | Cas |
Продолжение таблицы 3
| К-3 | Cas | Московская область, Дмитровский район |
| ВТ-1 | Bul | |
| ВТ-2 | Bul | |
| ВТ-3 | Bul | |
| SM-10 | SM-1 | |
| D-10 | Dmo 1-1 | |
| D-20 | Dmo 2-2 | |
| Bs-25 | Bes-2 | |
| Bs-30 | Bes-2 | |
| Ph-11 | Dmo 1-2 | |
| Ph-20 | Dmo 1-3 | |
| Ph-30 | Dmo 2-1 | |
| Ph-40 | Dmo 3 | |
| Ph-44 | Dmo 3 | |
| Ph 30-1 | SM-1 | |
| BT2х SM1 | SM-1 |
Изучение морфологии бактериофагов методом электронного микроскопирования показало, что они принадлежали к 2 группам.
У фагов первой группы (18 изолятов) длина хвоста составила 124,9 – 78 137,8 нм, а его ширина – 0,30 – 0,36 нм.
У изолятов второй группы (3 изолята) длина хвоста варьировала от 157,6 до 167,3 нм, а ширина хвоста 0,15 – 0,18 нм.
На основании этих характеристик, 3 изолята 2-й группы принадлежали к семейству Siphoviridae (рисунок 6 А, С), остальные 18 образцов (1я группа) принадлежали к семейству Myoviridae (рисунок 6 B, D).
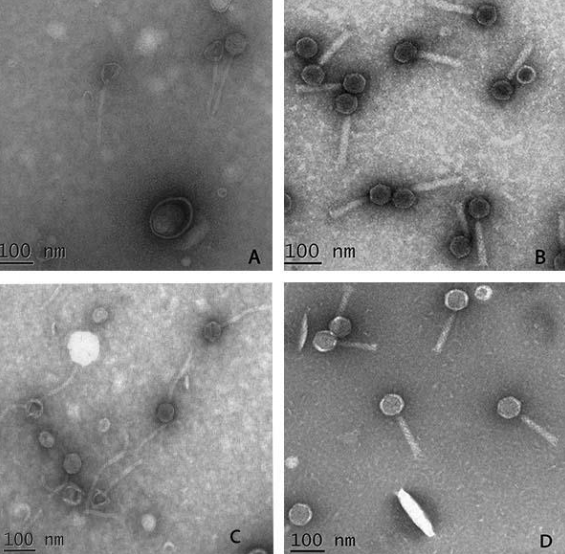
Рисунок 6 — Электронномикроскопическая морфология изолятов бактериофагов, вирулентных для Хсс (А – Siphoviridae, SM 10; B–Myoviridae, K 2; С –Siphoviridae, Ph 30-1; D –Myoviridae, BS 25)
Учитывая, что бактериофаги обладают не только видоспецифичностью, но и специфичностью к отдельным штаммам хозяина, изоляты фагов отобранные для практических целей должны обеспечивать защиту от широкого круга штаммов патогенов растений. Это достигается созданием консорциума или коктейля фагов, в совокупности обеспечивающих защиту от большинства штаммов фитопатогена распространенных в конкретных условиях. Для поиска кандидатов для создания фагового коктейля нами было проведено фаготипирование обширной коллекции штаммов возбудителя сосудистого бактериоза капусты. В работе использовали чистые культуры штаммов возбудителя сосудистого бактериоза различного географического происхождения из коллекции лаборатории защиты растении РГАУ-МСХА имени К.А. Тимирязева, выделенные из капустных культур в разные годы (Таблица 4).
Таблица 4 — Происхождение штаммов Xanthomonas canpestris pv. campestris, используемых в работе.
| № | Название штамма | Дата выделения | Место происхождения, культура |
| 1-4 | BК-55, BК-56, BК-57, BК-58 | 10.2017 | Краснодарский край, белокочанная капуста |
| 5-8 | CК-71, CК-72, CК-73, CК-74 | 10.2017 | Краснодарский край, цветная капуста |
| 9-14 | Хсс 1/2, Хсс 1/5, Хсс 2/12, Хсс 2/16, Хс
с 3/23, Хсс 3/27 |
09.2017 | Московская область, Дмитровский район, белокочанная капуста |
| 15-26 | Bes-1, SM-1, Bul, Bes-2, SM-2, Dmo 1-1, Dmo 2-2, Dmo 1-2, Dmo 1-3, Dmo 2-1, Dmo 2-3, Dmo 3 | 09.2016 | Московская область, Дмитровский район, белокочанная капуста |
| 27 | Cas | 09.2016 | Московская область, Дмитровский район, цветная капуста |
| 28-30 | Tir1, Tir2, Tir3 | 11.2012 | Молдова, город Тирасполь, капуста |
| 31-35 | DК-1, DK-2, DK-3, DВ-1, DВ-3 | 10.2012 | Московская область, Серпуховский район, капуста |
| 36-47 | Rаm 1-1, Rаm 1-2, Rаm 1-3, Rаm 2-1, Rаm 2-2, Rаm 2-3, Rаm 3-1, Rаm 3-2, Rаm 3-3, Rаm 4-1, Rаm 4-2, Rаm 4-3 | 10.2012 | Московская область, Раменский район, капуста |
| 48-51 | ХУ-1-1, ХУ 1-2, ХУ 2-1, ХУ 2-2 | 10.2012 | Украина, город Херсон, капуста |
| 52-54 | B-1, B-2, B-3 | 09.2012 | Московская область, ОПХ Быково, капуста |
| 55-59 | Тlo-1, Тlo-2, Тlo-3, Тlo-4, Тlo-5 | 08.2007 | Тульская область, капуста |
| 60 | Bel-3 | 10.2006 | Белоруссия, капуста |
| 61 | Bun-2 | 09.2006 | Московская область, Дмитровский район, капуста |
Продолжение таблицы 4
| 62 | Dasch-2 | 09.2006 | Московская область, Серпуховский район, капуста |
| 63 | 04-29-B1 | 2004 | США, Калифорния, капуста |
| 64 | Xn-13 | 1997 | Япония, капуста |
| 65 | ex 528, реизолят Хсс NCPPB528T | 1957 | Великобритания, капуста |
| 66 | Tr4 | — | Молдова, город Тирасполь, капуста |
| 67 | 33437 | — | США, Wisconsin, редис |
| 68-70 | 276NZ, 277NZ, 306NZ | — | Голландия |
| 71 | B 100 | — | Германия |
| 72-73 | SM35, SM17 | — | — |
Перед тестированием патогенность штаммов по отношению к капусте была проверена искусственным заражением по меньшей мере 2 восприимчивых сортов капусты.
Тестирование патогенности изолятов бактериофагов по отношению к штаммам Xcc проводили капельным методом (рисунок 7). За положительный результат принимали только литическое действие. Помимо выделенных нами изолятов использовали также 4 ранее изученных изолята бактериофагов (DB 1, Tir 2, R 3-1, B 1), выделенных в 2014 году [20].
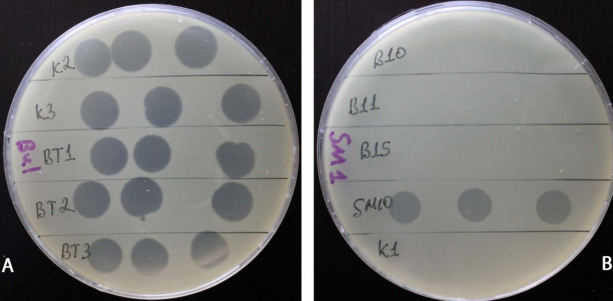
Рисунок 7 — Тестирование патогенности изолятов бактериофагов по отношению к штаммам Xcc Bul (A) и Sm1(B) капельным методом
Результаты испытания специфичности 25 изолятов бактериофагов к 73 штаммам возбудителя сосудистого бактериоза представлены в приложении 1.
Всего были выделены 22 типа реакции, каждый тип был представлен от 1 до 29 штаммами патогена. Специфичность бактериофагов к штаммам хозяина варьировала в широких пределах (от 5,5% до 76,7% от общего числа тестированных штаммов Xcc), или 18 до 73% типов реакции.
Защита бактериофагов Xcc от ультрафиолетового излучения.
Как известно, бактериофаги подвергаются воздействию ультрафиолета, пестицидов и других факторов которые могут существенно снижать эффективность их практического применения в защите растений от болезней. В этой связи поиск компонентов формуляции этих биоагентов имеет большое значение для развития биоконтроля с использованием бактериофагов.
Мы исследовали защитный эффект от UV-B различных веществ, таких как обезжиренное молоко, сахароза, рибофлавин, инозитол, аскорбиновая кислота и гуммиарабик. Выбор этих веществ был обусловлен тем, что они показывали защитный эффект от UV в отношении различных биологических объектов [17].
Для проведения экспериментов бактериофаг (изолят DB 1) размножали на культуре Xcc штамм Ram1-3. Для этого из хранящегося стока отбирали 100 мкл суспензии фага и добавляли в жидкую среду YD с предварительно культивируемой 24 ч при 270С на шейкере культурой Xcc и инкубировали до проявления признаков лизиса. Затем добавляли 0,5% об. хлороформа, энергично встряхивали и через 1 ч лизаты центрифугировали при 10000 g («Jouan») в течение 15 мин для удаления фрагментов бактериальных клеток. Далее с помощью шприца аккуратно отбирали супернатант, пропускали через мембранный фильтр (размер пор 0,22 нм) в стерильную банку и хранили при +40С.
Определение возможного защитного эффекта вышеперечисленных веществ от ультрафиолетового излучения (UV-B) проводили в условиях in vitro. Смеси суспензии бактериофага и тестируемых веществ вносили лунки стерильного 96- луночного планшета (Costar 3599, Corning Incorporated, USA) по 50 мкл в двукратной повторности. В контрольном варианте вместо препарата к суспензии бактериофага добавляли стерильную воду.
Ультрафиолетовую лампу (PL-S 9 W/12/2p, Phillips, Netherlands) включали за 15 мин до использования и устанавливали на высоте 6 см выше планшета, обеспечивая равномерное облучение каждой лунки. После экспозиции 0 (без облучения) 10, 15 и 20 минут отбирали образцы по 80 мкл для определения титра бактериофага. Исходя из параметров лампы, доза облучения в диапазоне UV-B (280-315 нм) на высоте 6 см составляла при 10-ти минутной экспозиции 0,82 дж/см2 , при 15 и 20 минутной экспозиции – 1,23 и 1,64 дж/см2 соответственно.
Для определения титра бактериофага проводили серию десятикратных разведений в SM буфере. Для этого в 2400 мкл расплавленного верхнего агара с температурой 450С (YD + агар 7 г/л) добавляли 300 мкл культуры бактериального хозяина (Ram 1-3) в концентрации 108 КОЕ/мл и 300 мкл разведенной суспензии фага, смесь осторожно перемешивали и заливали на нижний агар (YD + агар 15 г/л). Чашки инкубировали при 270С. Подсчет количества бляшек проводили через 24 часа, рассчитывали количество бляшко-образующих единиц (БОЕ) в 1 миллилитре.
Жизнеспособность изолята бактериофага DB1 с добавлением защитных веществ в разных концентрациях изучали после облучения UV-B в течение 10, 15 и 20 мин. В контрольном варианте концентрация жизнеспособных фагов (БОЕ/мл) при облучении 10 и 15 мин быстро уменьшалась, а после 20 мин облучения фаги полностью теряли свою инфицирующую способность. Это свидетельствует о высокой чувствительности фагов к облучению в диапазоне UVB.
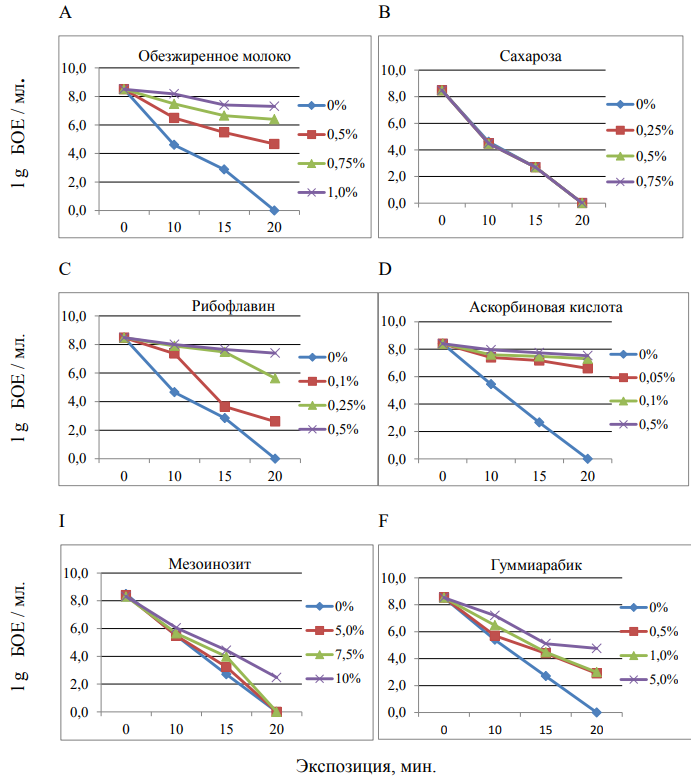 Рисунок 8 — Выживаемость бактериофагов после ультрафиолетового облучения: А-обезжиренное молоко, B-сахароза, C-рибофлавин, D-аскорбиновая кислота, I-мезоинозит, F-гуммиарабик
Рисунок 8 — Выживаемость бактериофагов после ультрафиолетового облучения: А-обезжиренное молоко, B-сахароза, C-рибофлавин, D-аскорбиновая кислота, I-мезоинозит, F-гуммиарабик
Добавление сахарозы в разных концентрациях к суспензии бактериофага не дало эффекта защиты от ультрафиолетового излучения в диапазоне B. Эти варианты не отличались от контроля по снижению концентрации фага (рисунок 8.B).
Слабый защитный эффект наблюдался при добавлении таких веществ как гуммиарабик и инозитол. Они показали защитный эффект от UV-B только при высоких концентрациях, 5% и 10% соответственно (рисунок 4.6 I, F). Наибольший защитный эффект in vitro наблюдался в вариантах с добавлением обезжиренного молока, рибофлавина и аскорбиновой кислоты (рисунок 8.А, С, D).
Добавление обезжиренного молока в концентрациях от 0,5% до 1,0% обеспечивало высокий защитный эффект от UV-B даже при 20-ти минутной экспозиции облучения, т.е. при дозе облучения 1,64 дж/см2. Рибофлавин и аскорбиновая кислота защищали бактериофаги от UV-B даже при низких концентрациях (от 0,05% до 0,5%) (рисунок 8).
В другом эксперименте оценивали влияние тестируемых веществ на выживаемость бактериофага при совместном хранении. Для этого смесь бактериофага с испытываемыми веществами хранили при +40С. Через 30 мин, 2 суток, 5 суток и 30 суток определяли титр бактериофага в смеси, как было описано выше. В результате этого теста установлено, что обезжиренное молоко (0,75%), рибофлавин (0,25%) и гуммиарабик (0,5%) не влияют на выживаемость бактериофагов даже через 30 суток совместного хранения. Аскорбиновая кислота (0,1%) значительно снижала титр бактериофага уже через 2 суток (рисунок 9). Исходя из этих данных, в дальнейших экспериментах аскорбиновую кислоту не использовали в качестве защитного вещества от UV-B.
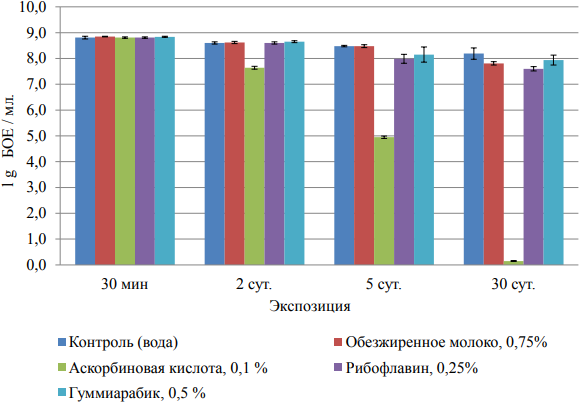
Рисунок 9 — Влияние различных веществ на выживаемость бактериофагов в смеси при +40С.
Мы планировали использовать бактериофаги для защиты рассады капусты в производственных условиях. Поэтому после тестирования выживания бактериофагов при облучении UV-B в условиях in vitro большой интерес представляла проверка этих результатов в условиях реального солнечного излучения в пленочной теплице.
Вещества, показавшие высокий защитный эффект от UV-B в условиях in vitro и не влияющие отрицательно при совместном хранении с бактериофагами, были отобраны для обработки рассады капусты в условиях теплицы. Для проведения экспериментов рассаду капусты F1 Колобок выращивали в кассете с десятью ячейками размером 320х149х55 мм в условиях пленочной теплицы. В стадии 5-6 настоящих листьев растения опрыскивали суспензией бактериофага DB 1 (108 БОЕ/мл) с добавлением одного из следующих веществ: обезжиренное молоко (0,75%), рибофлавин (0,25%), гуммиарабик (0,5%). В качестве контроля использовали воду. Во всех вариантах, включая контроль, добавляли ПАВ — 0,04%-ный Сильвет Голд.
Через 0 мин, 30 мин, 1 суток, 2 сутки, 5 суток и 8 суток отбирали образцы для экстрагирования бактериофагов методом смыва с поверхности листьев капусты. Для этого из листьев вырезали диски диаметром 1 см с помощью пробкового сверла. В каждом варианте было 3 повторности по 20 дисков в каждой. Диски с листовой тканью помещали в конические колбы на 50 мл и заливали 3 мл SM буфера (рH 7,4)+Твин 20 (20мкл/10мл) и встряхивали на орбитальном шейкере 30 мин при 200 об/мин. После этого 1 мл жидкости переносили в центрифужную пробирку на 1,5 мл и центрифугировали 10 мин при 11000 об. мин. Супернатант переносили в чистую пробирку, содержащую 10 мкл хлороформа, и встряхивали на орбитальном шейкере 30 мин при 200 об/мин. Затем определяли титр бактериофага, как было описано ранее.
В результате экстрагирования бактериофага с листьев капусты установлено, что уже через 30 мин после опрыскивания было экстрагировано в 2 раза меньше бактериофагов (рис. 10). В этой экспозиции в зависимости от добавленных веществ количество экстрагированных бактериофагов статистически не отличалось.
Результаты показали, что, начиная с экспозиции в 1 сутки и далее, численность экстрагированных бактериофагов сокращалась даже в вариантах, где были добавлены вещества, обеспечивающие защиту от UV-B in vitro.
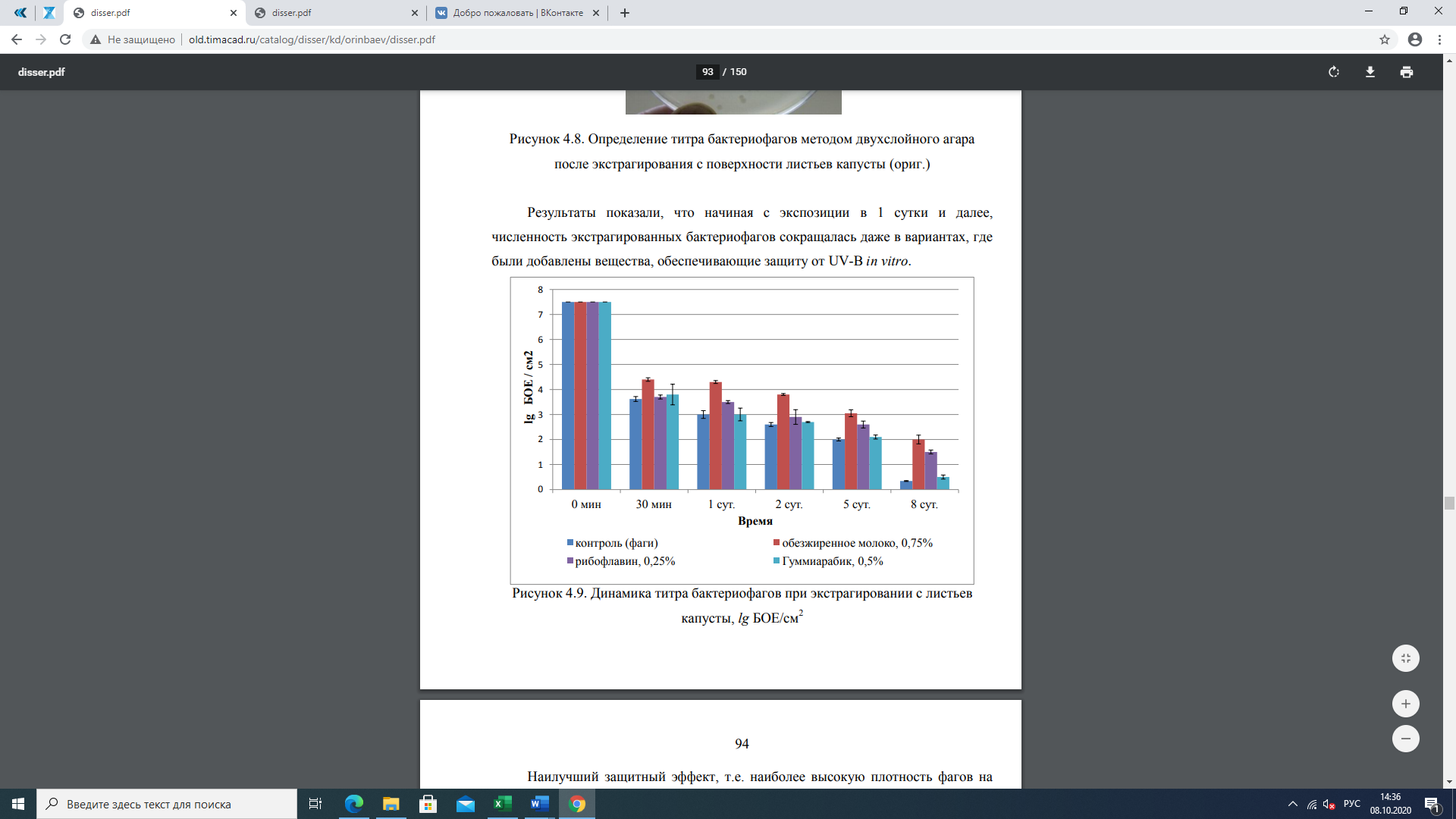
Рисунок 10 — Динамика титра бактериофагов при экстрагировании с листьев капусты, lg БОЕ/см2
Наилучший защитный эффект, т.е. наиболее высокую плотность фагов на единицу листовой поверхности, на 8-е сутки после опрыскивания показал вариант с добавлением 0,75%-ного обезжиренного молока. В этом варианте отмечена наибольшая концентрация экстрагированных бактериофагов lg БОЕ/см2 = 2,0. В этот же срок учета этот показатель в контроле составлял 0,3. Рибофлавин также показал значительный защитный эффект от UV со значением lg БОЕ/см2 = 1,5, правда это вариант был статистически достоверно хуже, чем обезжиренное молоко. Гуммиарабик (0,5%) показал слабый эффект защиты бактериофагов от UV со значением lg БОЕ/см2 — 0,5 и статистически не отличался от контрольного варианта (рисунок 9).
Совместимость бактериофагов Xcc с химическими пестицидами, рекомендованными для применения на овощных культурах.
С практической точки зрения интерес представляло тестирование совместимости фагов с другими пестицидами и агрохимикатами, используемыми на капусте. Для данного эксперимента были выбраны 9 инсектицидов, 6 фунгицидов, 3 гербицида рекомендованных в Российской Федерации для защиты овощных культур и 2 других агрохимиката.
Совместимость бактериофагов с химическими препаратами оценивали смешиванием их с пестицидами и агрохимикатами. Конечная концентрация препаратов в смеси соответствовала рекомендованной рабочей концентрации. После перемешивания смесь выдерживали 60 мин при комнатной температуре. В контрольном варианте вместо препарата использовали стерильную дистиллированную воду. После истечения времени экспозиции определяли титр бактериофага в каждом варианте по описанной выше методике.
В результате оценки совместимости бактериофагов с инсектицидами установлено, что бактериофаги совместимы со всеми протестированными химическими инсектицидами, относящимся к следующим классам химических соединений: пиретроиды, авермектины, неоникотиноиды и фосфорорганические соединения.
При проведении теста на совместимость бактериофагов с химическими гербицидами установлено, что все испытуемые гербициды (Лемур, КЭ; Леопард, КЭ и Хакер, ВРГ) не влияют на жизнеспособность вируса в баковой смеси (таблица 5).
Таблица 5 — Совместимость бактериофагов с пестицидами и другими агрохимикатами
| № | Названия препарата, препаративная форма | Д.в. и его содержание | Норма расхода | БОЕ/ мл | Совмест имость |
| Контроль (вода) | — | — 4,0х108 | |||
| Инсектициды | |||||
| 1 | Каратэ Зенон, МКС | лямбда-цигалотрин (50 г/л) | 0,1 л/га | 3,8х108 | + |
| 2 | Фитоверм, КЭ | аверсектин С (2 г/л) | 1,2 л/га | 4,1х108 | + |
| 3 | Актара, ВДГ | тиаметоксам (250 г/кг) | 0,3 кг/га | 4,3х108 | + |
| 4 | Вертимек, КЭ | абамектин (18 г/л) | 1,0 л/га | 3,9х108 | + |
| 5 | Алиот, КЭ | малатион (570 г/л) | 1,0 л/га | 4,0х108 | + |
| 6 | Эфория, КС | лямбда-цигалотрин (106 г/л) тиаметоксам (141 г/л) | 0,2 л/га | 3,9х108 | + |
| 7 | Кунгфу, КС | лямбда-цигалотрин (50 г/л) | 0,1 л/га | 3,8х108 | + |
| 8 | Биокилл, КЭ | абамектин (10 г/л) | 8 мл/10л | 3,7х108 | + |
| 9 | Борей, СК | имидаклоприд (150 г/л + лямбда-цигалотрин (50 г/л) | 0,1 л/га | 3,3х108 | + |
| Фунгициды | |||||
| 10 | Метамил МЦ, ВДГ | манкоцеб+металаксил (640+80 г/кг) | 2,5 кг/га | 3,5х108 | + |
| 11 | Фундазол, СП | беномил (500 г/кг) | 0,5 кг/га | 1,1х108 | + |
| 12 | Ридомил Голд, ВДГ | манкоцеб (640 г/л) + мефеноксам (40 г/кг) | 2,5 кг/га | 3,0х108 | + |
| 13 | Фитолавин, ВРК | фитобактериомицин – комплекс стептотрициновых антибиотиков (БА 120000 ЕА/мл, 32 г/л) | 2 мл/л | 3,8х108 | + |
| 14 | Косайд 2000, ВДГ | меди гидроокись (350 г/кг) | 1,5 г/л | 3,5х105 | — |
| 15 | Максим 480, КС | флудиоксонил (480 г/л) | 1,5 л/га | 3,5х108 | + |
| Гербициды | |||||
| 16 | Лемур, КЭ | Квизалофоп-Птефурил (40 г/л) | 1,0 л/га | 4,0х108 | + |
| 17 | Леопард, КЭ | Хизалофоп-П-этил (50 г/л) | 1,5 л/га | 4,0х108 | + |
| 18 | Хакер, ВРГ | Клопиралид (750 г/кг) | 0,12 кг/га | 3,8х108 | + |
| Стерилизаторы и ПАВ | |||||
| 19 | НУК 15, ВР | надуксусная кислота 15% + перекись водорода 18% | 10 мл/л | 0,0 | — |
| 20 | Сильвет Голд, ВЭ | трисилоксан + полиоксиэтилен глисол | 0,4 мл/л | 1,5х108 | + |
Испытания сохраняемости бактериофагов в смеси с фунгицидами показали, что препарат Косайд 2000, ВДГ (350 г/кг меди гидроокись) снижает титр вируса в смеси на 3 порядка. Эти наши данные соответствуют опубликованным ранее [21], где при смешивании фага Xanthomonas campestris pv. vesicatoria с этим препаратом значительно снижался титр фагов в условиях in vitro. Бактериофаги были совместимы с остальными фунгицидами, относящимся к классам дитиокарбаматы, фениламиды, бензимидазолы, фенилпирролы и к антибиотикам.
Относящийся к ПАВ Сильвет Голд не снижал жизнеспособность вируса. Бактериофаги при смешивании с надуксусной кислотой полностью теряли жизнеспособность (таблица 5).
Таким образом, исходя из полученных данных, можно сделать вывод, что с помощью электронномикроскопического исследования морфологии бактериофагов из 21 выделенных изолятов 3 изолята следует отнести к семейству Siphoviridae а остальные 18 образцов — к семейству Myoviridae. По результатам фаготипирования 73 штаммов фитопатогена по отношению к 25 изолятам бактериофагов сформулирован консорциум бактериофагов из изолятов BT 2, SM 10, Ph 30-1, Ph 44, DB 1, Tir 2, которые в совокупности способны инфицировать 88% представительной коллекции штаммов возбудителя сосудистого бактериоза капусты. Проведенный в условиях in vitro скрининг веществ для защиты бактериофагов от UV-B показал, что обезжиренное молоко (0,75%), рибофлавин (0,5%) и аскорбиновая кислота (0,1%), обеспечили наивысший уровень выживания фагов. Однако, аскорбиновая кислота оказалась малопригодной для дальнейших исследований, так как в смеси с фагами отрицательно влияла на выживание фагов в условиях инкубации при +40С. Изучение выживания бактериофагов на поверхности листьев рассады капусты в условиях пленочной теплицы показало, что концентрация фагов после нанесения на поверхность листьев снижалась довольно быстро, особенно в контрольном варианте. Однако при добавлении 0,75%-ного обезжиренного молока и 0,25%-ного рибофлавина это снижение было менее выраженным.
Оценка совместимости бактериофагов с 20 пестицидами и агрохимикатами различной химической природы показала, что отрицательное воздействие на выживаемость фагов оказывали только препараты на основе меди (Косайд 2000) и стерилизатор — НУК
2.1.2.2. Выделение и характеристика бактериофагов Psg.
Из образцов почв с полей под посевами сои из Амурской и Воронежской областей, а также из Краснодарского и Хабаровского краев в 2020 г. было выделено 4 изолята фагов, полученных при использовании вышеописанных 5 штаммов бактерии-хозяина.
Тестирование вирулентности изолятов бактериофагов по отношению к штаммам Psg проводили капельным методом (рисунок 11). За положительный результат принимали только литическое действие на месте нанесения капли с суспензией фага.
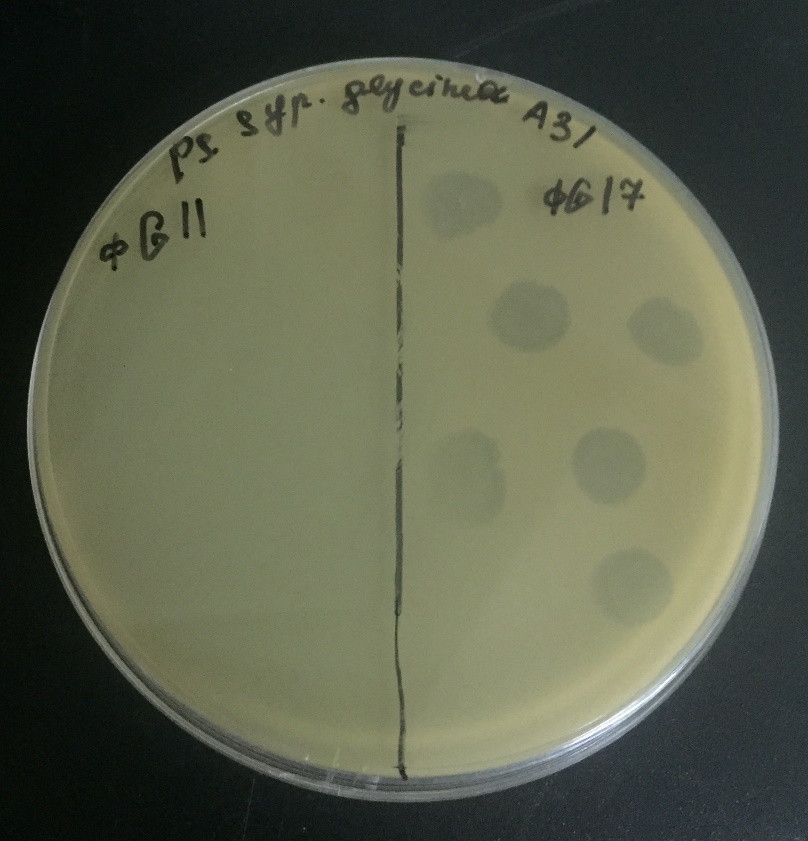
Рисунок 11 — Тестирование вирулентности изолятов бактериофагов ϕG11 и ϕG17 по отношению к штамму Psg А31 капельным методом.
Результаты испытания специфичности 4 изолятов фагов к 5 штаммам патогена представлены в таблице 6. Наиболее вирулентным являлся изолят бактериофага ϕG17, способный поражать 4 из 5 штаммов бактерии-хозяина, используемых в данном исследовании. Это изолят был выбран для дальнейшей работы по оценке защитного действия на растениях сои против бактериального ожога.
Таблица 6 — Специфичность изолятов бактериофагов по отношению к коллекции штаммов P. savastanoi pv. glycinea
| Изоляты
фагов Штаммы PsG |
ϕG3 | ϕG11 | ϕG17 | ϕG4 |
| A31 | — | — | + | + |
| А7-1 | — | + | + | — |
| AF-3 | — | + | — | — |
| В-7 | + | — | + | — |
| CFBP 2214 | — | + | + | — |
| Положительная реакция фагов к штаммам Psg, % | 20 | 60 | 80 | 20 |
Интересно, что 2 из 4 изолятов бактериофагов (ϕG11 и ϕG17) были вирулентны по отношению к референтному штамму CFBP 2214, выделенному в Новой Зеландии в 1958 году. Штамм патогена А7-1 из Амурской области имел идентичный референтному фаготип. Остальные штаммы патогена также поражались чаще двумя изолятами бактериофагов, а два фага (ϕG3 и ϕG4) были вирулентны только к одному штамму бактерии, соответственно A31 и AF-3.
2.1.3. Результаты применения бактериофагов в защите сои и капусты от бактериозов.
Эффективность применения бактериофагов против Psg.
Результаты двух независимых вегетационных экспериментов приведены в таблице 7.
Таблица 7 — Эффективность бактериофагового препарата на основе изолята ϕG17 против бактериального ожога сои при искусственном заражении
(сорт Батя, 2020)
| Название препарата | Эксперимент 1
(июль 2020 г.) |
Эксперимент 2
(август 2020 г.) |
Среднее | ||||||
| P, % | R, % | БЭ, % | P, % | R, % | БЭ, % | P, % | R, % | БЭ, % | |
| Контроль (вода) | 93,2 а | 62,4 а | — | 86,6 а | 49,6 а | — | 89,9 | 56,0 | — |
| Стрекар, КС, (0,5 %) — эталон | 24,4 b | 13,1 b | 79,0 | 26,6 b | 11,0 b | 77,8 | 25,5 | 12,1 | 78,4 |
| Суспензия бактериофага ϕG17, 107 БОЕ/мл | 26,6 b | 15,9 b | 74,5 | 28,7 b | 12,4 b | 75,0 | 27,7 | 14,2 | 74,8 |
Примечание: в таблице между вариантами, обозначенными одинаковыми буквами нет статистически достоверных различий по критерию Дункана при 95%-м уровне вероятности
Обработка вегетирующих растений сои суспензией бактериофага ϕG17 при искусственном заражении приводила к снижению развития болезни почти в 4 раза в варианте с обработкой бактериофагами в сравнении с контролем. Таким образом, биологическая эффективность применения фагового препарата была близка к эффективности эталонного пестицида Стрекар, КС и составляла примерно 75 %.
Эффективность применения бактериофагов против Xcc.
При оценке на искусственном фоне, заражение семян F1 Казачок проводили по методике, описанной выше. Семена инокулировали в разных концентрациях бактериальной суспензии патогена (109 и 106 КОЕ/мл) и затем обрабатывали консорциумом бактериофагов методами замачивания или увлажнения.
Для оценки на естественном фоне нами предварительно при фитоэкспертизе нескольких партий семян капусты белокочанной был выделен образец семян сорта Московская поздняя 15 с высоким уровнем зараженности. Рабочая концентрация суспензии бактериофагов при обработке составляла 107 БОЕ/мл по каждому изоляту. В качестве эталона использовали Гамаир, КС (Bacillus subtilis M-22, 2×1010 кл/мл). Контролем служили зараженные семена без обработки.
Для определения зараженности семена проращивали на влажной фильтровальной бумаге в чашке Петри. В каждом варианте анализировали 3 повторности по 50 семян в каждой. Чашки выдерживали на свету при температуре 23-250С. Через 7 дней после посева количество зараженных сосудистым бактериозом проростков учитывали путем визуального осмотра семядольных листочков. В сомнительных случаях пользовались бинокулярной лупой. Результаты эксперимента представлены в таблице 8.
Таблица 8 — Биологическая эффективность (БЭ, %) обработки семян белокочанной капусты F1 Казачок в отношении семенной инфекции сосудистого бактериоза капусты
| Варианты | Образец семян №1 | Образец семян №2 | ||||
| Лаб. всхожесть, % | Заражен-ность, % | БЭ, % | Лаб. всхожесть, % | Заражен-ность, % | БЭ, % | |
| Контроль | 82,0 | 86,1 a | — | 88,0 | 21,5 a | — |
| Коктейль бактерио-фагов — замачивание | 86,0 | 4,1 b | 95,2 | 88,0 | 2,3 b | 89,3 |
| Коктейль бактерио-фагов — увлажнение | 84,0 | 37,5 c | 56,4 | 90,0 | 6,7 c | 68,8 |
Эффективность инокуляции семян зависела от концентрации инокулюма. Так, если при использовании бактериальной суспензии с концентрацией 106 КОЕ/мл (образец №2) при проращивании семян 21,5% проростков дали симптомы на семядольных листьях, то при концентрации инокулюма 109 КОЕ/мл (образец 108 №1) их было 86,1% (таблица 8).
Обработка семян коктейлем бактериофагов привела к существенному снижению зараженности проростков. В образце семян №1 биологическая эффективность обработки замачиванием составляла 95,2%, а при методе увлажнением — 56,4%. Такая же закономерность наблюдалась в случае образца семян № 2. Здесь биологическая эффективность замачивания составляла 89,3%, а при методе увлажнения – 68,8%.
Обработка семян сорта Московская поздняя 15 с естественной зараженностью сосудистым бактериозом коктейлем бактериофагов привела к снижению зараженности с 25,6% в контроле до 2,4% (рисунок 12).

Рисунок 12 — Влияние фагового коктейля на лабораторную всхожесть семян и зараженность сосудистым бактериозом проростков капусты сорта Московская поздняя 15.
Зараженность в варианте с обработкой препаратом Гамаир, КС статистически не отличалась от таковой при обработке коктейлем бактериофагов. Биологическая эффективность обработки бактериофагами составила 90,6% и была на уровне эталона (Гамаир, КС, 2%) – 89,3%. Таким образом, показана возможность использования бактериофагов для подавления семенной инфекции при сосудистом бактериозе капусты.
Разработка мероприятий для защиты от распространения болезни на рассаде капусты.
Нами были проведены исследования по оценке эффективности обработки рассады капусты различными препаратами. Семена белокочанной капусты F1 гибрида Казачок высевали в торфяной субстрат в кассеты №144 с размером ячейки 3х3см, которые размещали в пленочной теплице лаборатории защиты растений РГАУ-МСХА имени К.А. Тимирязева.
Температура в теплице в период эксперимента варьировала от 19 до 280С. В стадии 1-2 настоящих листьев в центр каждой кассеты высаживали по 4 растения, которые за 7 дней до этого были инокулированы срезом семядольного листочка лезвием, смоченным в бактериальной суспензии плотностью 108 КОЕ/мл X. campestris pv. campestris, штамм Ram1-3. Ежедневно проводили полив растений методом дождевания с помощью ранцевого опрыскивателя.
Для обработки рассады капусты были использованы следующие препараты: Фитолавин, ВРК, 0,2%; Косайд 2000, ВДГ, 0,15%; НУК-15, ВР, 0,15%; бактериофаги, изолят DB1, 108 БОЕ/мл с добавлением обезжиренного молока, 0,75% и смесь Фитолавина с бактериофагами. Контрольные растения обрабатывали водой. Во всех вариантах, включая контроль, для лучшего смачивания листьев добавляли ПАВ Сильвет Голд, 0,04%. Обработку препаратами проводили с помощью ручного опрыскивателя.
Первая обработка препаратами была проведена в день посадки инокулированных растений. Всего было проведено 3 обработки с интервалом 10 дней.
Учет симптомов заболевания проводили, начиная с 15-ти суток до 35-ти суток с интервалом в 5 суток после посадки инокулированных растений в центральные лунки кассеты. В каждой кассете учитывали по 140 растений (всего 144 растений – 4 первично зараженных). В каждом варианте имелось 2 повторности по 1 кассете. Размещение повторностей рендомизированное.
Через 15 суток после посадки инокулированных растений в центр кассеты проводили первый учет симптомов заболевания. Зараженность рассады сосудистым бактериозом через 15 дней была незначительна, даже на контрольном варианте. Начиная с 20 и 25 суток было заметно увеличение количество зараженных растений, но варианты с обработки рассады препаратами и контроль в эти сроки учета статистически не отличались (таблица 9).
Таблица 9. Распространенность сосудистого бактериоза (%) на рассаде F1 Казачок
| № | Варианты | Период после инокуляции, сут. | ||||
| 15 | 20 | 25 | 30 | 35 | ||
| 1 | Контроль (вода) | 0,7 | 4,3 | 5,4 | 6,8 а | 13,6 a |
| 2 | Фитолавин (эталон), 0.2% | 0,4 | 3,2 | 3,9 | 3,9 b | 5,7 b |
| 3 | Надуксусная кислота, 0.15% | 0,7 | 2,1 | 2,5 | 2,5 b | 2,5 c |
| 4 | Бактериофаги, 108 БОЕ/мл | 0,0 | 2,1 | 2,5 | 2,5 b | 2,8 c |
| 5 | Косайд 2000, 0.15% | 0,7 | 2,5 | 2,5 | 2,8 b | 3,6 c |
Начиная с 30 суток после посадки инокулированных растений в центр кассеты и 2-х кратной обработки препаратами, выявлено достоверное различие между вариантами с обработками и контролем. Через 35 суток распространенность заболевания в контроле достигла 13,6%. В этом же сроке учета в вариантах с обработкой бактериофагами, НУК 15 и Косайд 2000 зараженность растений была достоверно ниже (2,8%, 2,5% и 3,6% соответственно). Защитный эффект препарата Фитолавин, ВРК был хуже, чем остальные препараты, зараженность в этом варианте составляла 5,7% (таблица 9).
Во втором эксперименте вторичное распространение сосудистого бактериоза от единичных источников развивалась быстрее, чем в первом (таблица 10).
Таблица 10 — Распространенность сосудистого бактериоза (%) на рассаде F1 Казачок
| № | Варианты | Период после инокуляции, сут. | ||||
| 15 | 20 | 25 | 30 | 35 | ||
| 1 | Контроль (вода) | 5,3 a | 6,4 a | 8,6 | 12,9 a | 19,3 a |
| 2 | Фитолавин (эталон), 0.2% | 2,1 b | 3,6 b | 5,0 | 7,5 b | 11,4 b |
| 3 | Надуксусная кислота, 0.15% | 1,1 b | 1,8 b | 4,3 | 6,4 b | 7,5 bc |
| 4 | Бактериофаги, 108 БОЕ/мл | 0,0 c | 1,8 b | 2,8 | 4,6 b | 6,8 c |
| 5 | Косайд 2000, 0,15% | 0,7 c | 2,8 b | 6,1 | 6,4 b | 10,7 bc |
| 6 | Фитолавин, 0,2% + Бактериофаги, 108 БОЕ/мл | 0,4 c | 2,1 b | 5,4 | 6,1 b | 7,5 bc |
FФ< F05
При учете через 15 суток после посадки 4 инокулированных растений в контрольном варианте наблюдали распространенность 5,3%, а при обработке бактериофагами симптомов сосудистого бактериоза не обнаруживали. В варианте с обработкой остальными препаратами распространенность болезни варьировала от 0,4% до 1,1% на вариантах смеси бактериофагов с Фитолавином и НУК 15 соответственно. Спустя 5 суток после первого учета зараженность растений доходила до 6,4% в контрольном варианте, а обработки препаратами снижали распространенность болезни на рассаде капусты. Варианты различных обработок между собой статистически не отличались, но по сравнению с контролем достоверно снижали распространенность заболевания. Это тенденция сохранилась до срока в 30 суток после посадки инокулированных растений в центр кассеты. При учете через 35 суток распространенность сосудистого бактериоза на рассаде капусты в контрольном варианте доходила до 19,3%. Наивысшую биологическую эффективность обеспечила обработка бактериофагами, снизив распространенность в 2,8 раза по сравнению с контролем. Препараты НУК 15 и косайд 2000 снижали распространенность по сравнению с контролем 2,6 и 1,8 раз соответственно (таблица 10).
В целом бактериофаги с добавлением 0,75%-ного обезжиренного молока при трехкратном опрыскивании рассады капусты с интервалом в 10 дней в двух экспериментах снижали распространенность сосудистого бактериоза капусты с биологической эффективностью 71,6%, что превышало среднюю эффективность Косайда 2000 – 59,1% и Фитолавина – 49,5% (таблица 11).
Таблица 11 — Биологическая эффективность (БЭ) различных препаратов для обработки рассады (35 суток после первой обработки).
| Варианты | Эксперимент 1 | Эксперимент 2 | ||
| Контроль (вода) | Зараженность,
% |
БЭ, % | Зараженность,
% |
БЭ, % |
| Фитолавин (эталон), 0,2% | 13,6 а | — | 19,3 a | — |
| Фитолавин, (эталон), 0,2% | 5,7 b | 58,1 | 11,4 b | 40,9 |
| Надуксусная кислота, 0,15% | 2,5 с | 81,6 | 7,5 bc | 61,1 |
| Бактериофаги, 108 БОЕ/мл | 2,9 c | 78,7 | 6,8 c | 64,8 |
| Косайд 2000, ВДГ, 0,15% | 3,6 c | 73,5 | 10,7 bc | 44,6 |
| Фитолавин, 0,2% + Бактериофаги, 108 БОЕ/мл | — | — | 7,5 bc | 61,1 |
Полученные данные указывают на большие перспективы биоконтроля бактериальных болезней растений с использованием бактериофагов. Использование смеси бактерифагов и Фитолавина не дало дополнительного эффекта, по сравнению с использованием только бактериофагов. Препарат НУК15 также показал высокую биологическую эффективность на уровне бактериофагов — 71,4%. Наименьшую биологическую эффективность в среднем за два года показал вариант с обработкой Фитолавином.
При оценке антибактериальной активности препаратов различного происхождения по отношению к возбудителю сосудистого бактериоза капусты в условиях in vitro сильной антибактериальной активности обладали консорциум бактериофагов, Биокомпозит-коррект, Зерокс, НУК 15, Ps 11 и Косайд 2000. Высокую биологическую эффективность по подавлению семенной инфекции сосудистого бактериоза показали бактериофаги, Биокомпозит-коррект, НУК 15, Зерокс и Косайд 2000.
Обработка семян капусты с естественной зараженностью сосудистым бактериозом коктейлем бактериофагов привела к значительному снижению зараженности проростков сосудистым бактериозом. Биологическая эффективность этого приема составила 90,6%.
ЗАКЛЮЧЕНИЕ
Применение бактериофаговых препаратов является перспективным приемом в биологизированной защите растений от бактериальных болезней.
Проведенные нами исследования показывают значительный эффект от применения бактериофагов против сосудистого бактериоза капусты и бактериального ожога сои.
По результатам фаготипирования 73 штаммов возбудителя сосудистого бактериоза капусты по отношению к 25 изолятам бактериофагов сформирован консорциум бактериофагов из изолятов BT 2, SM 10, Ph 30-1, Ph 44, DB 1, Tir 2, которые в совокупности способны инфицировать 88% коллекции штаммов возбудителя сосудистого бактериоза капусты.
Среди бактериофагов, вирулентных в отношении возбудителя бактериального ожога сои выделен бактериофаг ϕG17, способный поражать большинство штаммов патогена.
Исследование в отношении семенной инфекции сосудистого бактериоза капусты и на фоне искусственного заражения патогеном показывают стабильно высокую биологическую эффективность бактериофагового коктейля. Эффективность данного приема достигает 90,6 %, и она статистически неразличима от применения эталонных препаратов.
Обработка фаговой суспензией растений сои против бактериального ожога на искусственном инфекционном фоне также приводит к значительному снижению развития болезни (почти в 4 раза) по сравнению с вариантом без обработки, а биологическая эффективность близка к эффективности химического эталонного пестицида и составляет 74,5 %
Краткие рекомендации по применению научной разработки.
Использование бактериофагового препарата может осуществляться в нескольких направлениях:
- В товарном производстве органической капусты и сои, а также в производстве детского питания, для которых предъявляются жесткие требования по безопасности продукции (отсутствие в технологии выращивания химических средств защиты растений и антибиотиков)
- В технологиях интенсивного растениеводства в качестве элемента управления антирезистентной стратегией борьбы с болезнями бактериальной этиологии капусты и сои.
Апробация
В ФГБОУ ВО РГАУ-МСХА имени К.А. Тимирязева осуществляется обучение студентов и аспирантов, где в рамках предмета «Биологическая защита растений» используются материалы данного исследования, а именно способ фаготипирования, оценка эффективности бактериофагов против бактериальных болезней, методы оценки качества бактериофагового биопрепарата.
Условия и сроки внедрения научной разработки
Сроки внедрения результатов исследования определяются готовностью инвестора приобрести лицензионные права производителя препарата.
Главным условием внедрения препарата в производство является государственная регистрация и включение в Перечень пестицидов и агрохимикатов, разрешенных к применению на территории РФ.
Эффект от внедрения разработки
Применение препарата на основе бактериофагов позволяет снижать пестицидную нагрузку на агроэкосистему и достигать высокого защитного эффекта на уровне эталонных химических пестицидов. Высокая биологическая эффективность от применения бактериофагового препарата против целевых фитопатогенов бактериальной этиологии обуславливает прибавку урожайности культур, увеличивает сохранность кочанов капусты и технологические свойства маслосемян сои.
Потенциальные потребители научной разработки
Хозяйства АПК регионов Российской Федерации, в том числе производители органической продукции.
Предлагается сотрудничество с производителями средств биологической защиты растений в целях организации опытных производств и апробаций биопрепарата, активного маркетинга, установления и совершенствования договорных отношений, консультирования по оптимальным условиям применения.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1. Магомедов К.Г. Влияние регуляторов роста на структуру урожая и урожайность сои // Фундаментальные исследования. – 2008. – № 5. – С. 35-37.
2. Strange, R.N. Plant disease: a threat to global food security / R.N. Strange, P.R. Scott // Annu. Rev. Phytopathol. – 2005. — Vol. 43. — Р.83–116. doi:
10.1146/annurev.phyto.43. 113004.133839
3. Mguni, C.M. Biological control of bacteria black rot of cabbage / C.M. Mguni, J. Hockenhull, C.N. Mortensen, C.L. Keswani // IX International Conference on Plant Pathogenic Bacteria. Madras, India, August 26-29 1996. – Р.46-49.
4. Jagtap D. Bio-efficacy of different antibacterial antibiotic, plant extracts and bioagents against bacterial blight of soybean caused by Pseudomonas savastanoi pv. glycinea // Scientific Journal of Microbiology. 2012. 1(1) P. 1-9.
5. Jones, Jeff. Bacteriophages for Plant Disease Control // Annual review of phytopathology. 2007. 45. P. 245-262. DOI: 10.1146/annurev.phyto.45.062806.094411.
6. Игнатов А.Н. Распространение бактериальных и фитоплазменных болезней растений в России // Защита и карантин растений. 2015. №5. с. 6-10.
7. Fujiwara A., Fujisawa M., Hamasaki R., Kawasaki T., Makoto F., Yamada T. Biocontrol of Ralstonia solanacearum by treatment with lytic bacteriophages // Applied and Environmental Microbiology. 2011. Vol. 77(12). P. 4155-4162
8. Gill, Jason & Smith, R & Castle, Alan. (2003). Bacteriophages of Erwinia amylovora. Applied and environmental microbiology. 69. 2133-8. 10.1128/AEM.69.4.2133-2138.2003.
9. Rombouts S, Volckaert A, Venneman S, Declercq B, Vandenheuvel D, Allonsius CN, Van Malderghem C, Jang HB, Briers Y, Noben JP, Klumpp J, Van Vaerenbergh J, Maes M and Lavigne R (2016) Characterization of Novel Bacteriophages for Biocontrol of Bacterial Blight in Leek Caused by Pseudomonas syringae pv. porri. Front. Microbiol. 7:279. doi: 10.3389/fmicb.2016.00279
10. Lelliot, R.A. Methods for the diagnosis of bacterial diseases of plants / R.A. Lelliot, D.E. Stead. — Oxford etc.: Blackweell sci. publ., 1987. — 216 р.
11. Lelliott, R. A. Methods in Plant Pathology Vol. 2: Methods for the Diagnosis of Bacterial Diseases of Plants. 1987. Blackwell Scientific Publications. Oxford, UK. P. 216.
12. Ignjatov M. Characterization of Pseudomonas savastanoi pv. glycinea isolates From Vojvodina // Phytopathologia Polonica. 2007. 4: P. 43-54.
13. Schaad N., Jones J.B., Chun W. Laboratory guide for identification of plant pathogenic bacteria // APS Press, St. Paul, Minnesota, USA. 2001. P. 373.
14. Бактериофаги: биология и практическое применение / Под ред. Э. Каттер, А. Сулаквелидзе // Пер. с англ. коллектив переводчиков; науч. ред. А.В. Летаров. -Москва: Научный мир, 2012. — 640 с.
15. Мазурин, Е. С. Методы диагностики возбудителя сосудистого бактериоза капусты и меры защиты: диссертация… кандидата биологических наук: / Е.С. Мазурин. – М.: ТСХА — 2009. — 107 с.
16. Во Тхи Нгок Ха. Антибактериальная активность эфирных масел и их использование для обеззараживания семян капусты от сосудистого
бактериоза / Во Тхи Нгок Ха, Ф.С. Джалилов // Известия ТСХА. — 2014. -Вып. 6. — С. 59-68.
17. Lahlali, R. UV protectants for Candida oleophila (strain O), a biocontrol agent of postharvest fruit diseases / R. Lahlali, B. Raffaele, M.H. Jijakli // Plant Pathology. — 2011. — Vol. 60. – P. 288–295. Doi: 10.1111/j.1365-3059.2010.02368.x
18. Jadhav, Sachin. Grading of Soybean Leaf Disease Based on Segmented Image Using K-means Clustering // IAES International Journal of Artificial Intelligence. 2016. P. 15-18. DOI: 5. 13. 10.11591/ijai.v5.i1.pp13-21.
19. Schaad, N. W. Laboratory Guide for Identification of Plant Pathogenic Bacteria. 3rd edition. The Bacteriology Committee of the American Phytopathological Society / N.W. Schaad, J.B. Jones, W. Chun.- APS Press, St. Paul, MN, USA, 2001. — 373 р.
20.Vo Thi Ngok Ha. Biological properties of bacteriophages specific to black rot pathogen of brassicas Xanthomonas campestris pv. campestris / Vo Thi Ngok Ha, F.S Dzhalilov, A.N. Ignatov // Известия Тимирязевской сельскохозяйственной академии. — 2015. — Вып.6. — С. 28-36.
21. Balogh, B. Improved efficacy of newly formulated bacteriophages for management of bacterial spot on tomato / B. Balogh, J.B. Jones, M.T. Momol, S.M. Olson, A. Obradovic, P. King, et al., // Plant Dis. – 2003. Vol. 87. – Р.949–954.
Приложения
