Титульный лист и исполнители
Отчет 89 с., 4 рис., 36 табл., 147 источн.
Ключевые слова: генетическая структура, генотип, полиморфизм генов, симментальская порода, порода Сибирячка, молочная продуктивность, воспроизводительные качества, крупный рогатый скот.
Объектом исследования являются гены молочных белков: каппа-казеин (CSN3), бета-лактоглобулин (BLG), альфа-лактальбумин (LALBA) и гормона лептин (LEP).
Предмет исследования –генетическая структура пород крупного рогатого скота и оценка их продуктивного потенциала с использованием полиморфных вариантов генов.
Цель работы — изучение генетическое разнообразиев стадах животных симментальской породы и породы Сибирячка, разводимых в условиях Западной Сибири, по аллелям, генотипам и различным генотипическим комбинациям генов CSN3, BLG, LALBA и LEP и оценка прогностического значения этих генов для продуктивности животных.
В работе использованы молекулярно-генетические и популяционно-статистические методы исследований.
В результате исследования установленполиморфизм генов, описана структура пород по аллелям, генотипам и их комбинации, установлено влияние генов на продуктивные показатели животных. Так, среди трёх генотипических классов в каждом локусе наименьшую частоту встречаемости имели генотипы В/В и Т/Т (10%).Гетерозиготность по генамв породах была относительно равной. Наиболее высокий уровень полиморфности установлен по генам LEP и LALBA и низкий – по CSN3. Высокий показатель средней гетерозиготности по изученным локусам свидетельствует о генетической изменчивости и адаптационном потенциале пород.
Анализ ассоциаций генов с селекционно-значимыми признаками животных выявил приоритетные генотипы для направленного отбора. В симментальской породе приоритетным генотипом являются:по удою — BLGАА, жирномолочности — LALBAВВ и LEPCC, белковомолочности – LEPTT. В породе Сибирячка более высокие показатели удоя были у животных с генотипом CSN3ВВ, BLGАА, LALBAАВ и LALBAВВ, а также LEPCC, жирномолочности – LALBAАА и LEPCC, белковомолочности — LEPCC. У пород сходными приоритетными генотипами являются: по удою — BLGАА, содержанию жира в молоке — LEPCC.
ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
В настоящем отчете о НИР применяют следующие термины с соответствующими определениями:
СПК – сельскохозяйственный производственный кооператив;
ООО – общество с ограниченной ответственностью;
ПЦР-ПДРФ–метод амплификации ДНК с помощью полимеразно-цепной реакции и последующего исследования полиморфизма длин рестрикционных фрагментов ДНК;
Генетический полиморфизм — состояние длительного разнообразия генотипов в популяциях с частотой их встречаемости выше 1%;
Аллели – разные формы одного гена;
Амплификация – увеличение числа копий определенного фрагмента ДНК;
Порода(популяция) – совокупность особей одного вида, имеющих генетическое, морфологическое, физиологическое и продуктивное сходство;
Ген – участок молекулы ДНК, кодирующий полипептид;
Генотип – совокупность генов организма;
Гетерозиготность – доля гетерозиготных генотипов в популяции;
Гомозигота – генотип, содержащий одинаковые аллели;
ДНК –дезоксирибонуклеиновая кислота, содержит генетическую информацию о структуре различных видов белков и РНК;
Дрейф генов – случайные колебания частот генов в малых популяциях;
Изменчивость – различия между организмами по признакам и генотипам;
Инбридинг – родственное спаривание;
Генетическая структура популяции – соотношение в популяции различных генотипов и аллелей.
ВВЕДЕНИЕ
На современном этапе развития животноводства большая роль отводится молекулярно-генетическим исследованиям в раскрытии происхождения пород, оценке генетического разнообразия и поиске уникальности популяционной структуры [1-3].Совокупность различных методов селекции, позволяющих оптимизировать разведение сельскохозяйственных животных с применением различных молекулярно-генетических приемов, в частности, с использованием генетических маркеров, дает возможность дать полную характеристику аллелофонда. Она важна для сохранения генофонда, выведения новых пород сельскохозяйственных животных и совершенствования уже имеющихся, а также для ускорения селекционного процесса [4].
Благодаря молекулярно-генетическим методам стало возможным идентифицировать животных, которые способны давать высокую продуктивность и передавать эти качества потомкам [5-6]. Генотипирование племенных животных во многих странах стало обязательным условием селекции. Исследования аллелофонда различных пород по генам, контролирующим показатели продуктивности, продолжаются и в нашей стране [3,7-10]. Многие исследователи отмечают, что в молочном скотоводстве существует риск снижения меж- и внутрипородного генетического разнообразия из-за использования ограниченного числа производителей, линейного разведения, неконтролируемого инбридинга и поглотительного скрещивания. Широкомасштабная голштинизация уже привела к исчезновению многих аборигенных пород, обладающих уникальными адаптационными качествами и устойчивостью к заболеваниям. Кроме того, односторонняя селекция исключительно на повышение удоев, способствует консолидации наследственности и снижает общую генетическую изменчивость. В высокопродуктивных стадах специалисты отмечают сокращение сроков использования животных и раннюю выбраковку по причине болезней. Поэтому стало крайне актуально одновременно с поиском генетических маркеров продуктивности для раннего прогнозирования племенных качеств животных, сохранить меж- и внутрипородное разнообразие, которое обеспечивает приспособительные качества животных в меняющихся или неблагоприятных условиях среды. В литературе наиболее обсуждаемая проблема – контроль генетического разнообразия с использованием микросателлитного и однонуклеотидного полиморфизмов, митохондриальной ДНК и полногеномного сиквенса. До сих пор не определен наиболее информативный способ мониторинга гетерозиготности, с которым связывают адаптивные свойства популяции. Предлагался метод типирования полиморфизма микросателлитных локусов [11-14]. Но, как отмечают авторы, данный подход может быть недостаточно информативным из-за высокой мутабильности сателлитной ДНК, а в таком случае вероятность гетерозиготности каждого из изучаемых локусов является достаточно высокой [15]. Кроме того, ряд исследований не нашли убедительных доказательств участия микросателлитов в поддержании адаптивной функции животных [16]. Следовательно, анализ генетического разнообразия сателлитной ДНК представляет интерес только как инструмент для филогенетического анализа. Другим не менее популярным методом является чипирование SNP высокой и средней плотности [17]. Недостатком этого метода является высокая стоимость исследований. Однако SNPчипирование позволяет изучать полиморфизм различных морфофункциональных фрагментов ДНК, равномерно распределённых по геному. Некоторые из методов включают в себя лишь мониторинг наиболее мутабильных структурных генов [18].
Изучение однонуклеотидных полиморфизмов структурных генов при помощи разгона фрагментов рестрикции в полупроводниковом электрофорезном геле может быть эффективным способом мониторинга генетического разнообразия [19]. Генетический полиморфизм отдельных локусов, ассоциированных с количественными характеристиками, уже достаточно хорошо изучен, например, по генам каппа-казеина, лактоглобулина, соматотропина, пролактина. В то же время результаты исследования других генов, возможно, сцепленных или входящих в комплекс локусов количественных признаков (QTL), также можно было бы использовать в селекции вместе с другими маркерами. Для этого необходимо идентифицировать эти гены, установить их полиморфизм и изучить эффективность использования на основе сравнительного анализа фенотипических проявлений при разных генотипах. Результаты исследований многих авторов, проведённых на разных породах, демонстрируют, что связи полиморфных вариантов изученных генов часто носят противоречивый характер и не всегда подтверждаются в разных популяционных выборках. Объяснить это можно сложной генетической детерминацией признаков и, возможно, невысокой вовлеченностью отдельного аллеля в формирование полифакториального признака. Необходимо исследования в этом направлении продолжать для того, чтобы накопить достаточно информации о функционировании генов, возможности использования известного полиморфизма в контроле генетического разнообразия популяций и прогнозирования будущей продуктивности.
Целью настоящего исследования стало изучение генетического разнообразия крупного рогатого скота породы «Сибирячка», а также симментальской породы, разводимых в условиях Западной Сибири по аллелям, генотипам и различным генотипическим комбинациям полиморфных локусов генов каппа-казеина (CSN3), бета-лактоглобулина (BLG), альфа-лактальбумина (LALBA), лептина (LEP) и оценка прогностического значения этих генов для продуктивности животных.
В задачи исследования входило:
- Проведение ДНК-анализа и установление полиморфизма вышеуказанных генов, и описание генетической структуры выборочных популяций;
- Оценка межпородной дифференциации по частотам встречаемости аллелей, отдельных генотипов и их комбинаций;
- Изучение влияния полиморфизма генов на молочную продуктивность, воспроизводство, рост и развитие молодняка, а также качественные показатели молока.
1. ВЫБОР НАПРАВЛЕНИЯ ИССЛЕДОВАНИЙ
1.1 Генетическое разнообразие сельскохозяйственных животных
Частота редкой формы признака зависит от интенсивности мутационного процесса в определенном локусе и состояния аллелей, которые уже существуют в популяции [20-22]. Изменения в ДНК возникают в результате замены одного или нескольких нуклеотидов, а также потерь или вставок отдельных фрагментов [23]. Формируются разные аллельные варианты генов, которые могут иметь разное фенотипическое проявление. Некоторые изменения оказываются селективно нейтральными и не подвергаются отбору, формируя в популяции полиморфизм. Признак считается полиморфным, если в выборке, имеющей достаточно большие размеры, более 1% особей обладает самой редкой вариацией. Почти любой признак можно считать полиморфным, если в сходных условиях он проявляет вариабельность[24].
Основой микроэволюционных процессов в популяциях является разнообразие организмов. Сохранение генетического разнообразия пород — одна из наиболее обсуждаемых проблем в современном животноводстве [25]. Изучению общей внутривидовой изменчивости и полиморфизма ДНК в связи с разным генетическим потенциалом продуктивности и адаптивными возможностями пород посвящено множество работ. Считается, что большое количество полиморфных локусов и гетерозиготность повышают адаптивные свойства популяции [15, 26-27]. В некоторых исследованиях был показан систематический отбор гетерозигот в репродуктивную группу как наиболее эффективную часть популяции [28]. Механизм связи гетерозиготности с адаптивным потенциалом животных рассматривают с точки зрения полиморфизма нейтральных локусов [29], или взаимодействия продуктов экспрессии строго определённых генов [15]. В природных популяциях существуют эволюционно выработанные способы сохранения генетического разнообразия, такие как миграция самцов из одной субпопуляции в другую [30-31].
Генетическое разнообразие изучается по средней частоте встречаемости особей, которые являются гетерозиготными и гомозиготными по одному локусу или нескольким, а также при выявлении генетических расстояний между изучаемыми популяциями, основываясь на различных частотах генотипов и аллелей в популяциях [32].
Как уже отмечалось, риск снижения генетического разнообразия возрастает из-за сокращения породного разнообразия, использования семени небольшого количества производителей, линейного разведения и инбридинга. Крупномасштабная голштинизация крупного рогатого скотапривела к исчезновению многих местных аборигенных пород. Сокращается генетически эффективная численность популяции из-за снижения жизнеспособности и плодовитости, обедняется аллелофонд вследствие утраты части аллелей посредством случайных процессов [6, 8]. Кроме того, в селекции молочных пород животных практикуется преимущественно односторонний отбор по удою, способствующего фиксации так называемого полигенного комплекса высокой молочной продуктивности [9-11], что так же снижает генетическое разнообразие. Таким образом, проблема сохранения генетического разнообразия стад, пород и видов животныхвсегда будет актуальной, равно как и разработка методов её контроля.
Первым механизм поддержания полиморфизма в популяции попробовал описать R.A. Fischer (1930).Он считал, что приспособляемость особей, имеющих гетерозиготный генотип выше, чем у тех, что имеют гомозиготный. Оба аллеля будут сохраняться с промежуточной частотой, и даже если гомозигота (аа) будет летальной, аллельа в популяции все равно сохранится, при том условии, что селективная значимость гетерозиготы выше. Генофонд будет пополняться за счет гетерозиготных организмов, под влиянием отбора. Такой полиморфизм называется сбалансированным [33]. Есть ряд объяснений превосходства гетерозиготных особей над гомозиготными. В основном они сводятся к одно- и многолокусной моделям проявления гетерозиса. Первая предполагает доминирование, при котором действие вредных рецессивов подавлено доминантным гомологом, а вторая модель рассматривает гетерозис с позиции неаллельных взаимодействий генов или эпистаза.Считают, что гетерозиготы более приспособлены в непостоянных условиях окружающей среды, а если среда становится достаточно однородной, то преимущество в таких условиях приобретают гомозиготные организмы. Гетерозиготы могут утратить превосходство в замкнутой популяции, и следовательно, исчезнет явление сбалансированного полиморфизма в популяции. Гетерозиготность отражает степень генетического разнообразия. Гетерозиготное состояние локусов может быть связано с проявлением более высокой жизнеспособности и продуктивности животных [34].
В заключение следует сказать, что, оценивая генетическое разнообразие животных, мы разрабатываем долгосрочную стратегию сохранения и использования генетического ресурса, определяем приоритеты. Молекулярно-генетические методы позволяют изучать гены, которые могут участвовать в реализации продуктивного и адаптивного потенциала у разных видов и пород.
1.2 Генетические маркерыи область их применения
С появлением молекулярно-генетических методов идентификации генов появилась возможностьоценивать и отбирать особей, способных давать высококачественную продукцию, а также передавать хозяйственно-полезные качества из поколения в поколение. В некоторых странах с развитым животноводством проводят генетическое маркирование племенных сельскохозяйственных животных и изучается породный полиморфизм генов, отвечающих за продуктивные качества животных, что позволяетвыделять селекционно-значимые генотипы [35].
Внедрение ДНК-технологий в практику отбора и последующего подбора животных важно для ускорения селекционного процесса, а также для повышения его эффективности [36-40]. С помощью современных методов молекулярной генетики возможно проводить оценку животных на генетическом уровне, посредством исследования детерминант, формирующих продуктивность животного, при помощи ДНК-маркеров. Совокупность молекулярно-генетических методов дает возможность управлять селекционными процессами, а также осуществлять генетический мониторинг [41].
На настоящее время у сельскохозяйственных животных описаны различные системы генетических маркеров: полиморфизм разных фрагментов хромосом, полиморфные системы ДНК, группы крови, антигены тромбоцитов, аллотипы белков сыворотки крови, лимфоцитарные антигены, принадлежащие различным классам, полиморфные системы белков молока и другие. С помощью них возможно получать информацию об аллельных вариантах генов. Использование большого количества генов-кандидатов продуктивности позволяет наиболее достоверно определить потенциал пород и отдельно взятых животных [39].
Далее представим краткую характеристику маркёров и область их применения. Следует упомянуть, что в качестве первых маркёров сначала использовались морфологические признаки, позже появились биохимические маркёры, в основе которых сталоизучение генных продуктов. В качестве недостатка морфологических маркеров были: низкая информативность, сложный характер наследования, его зависимость от паратипических факторов [42].Биохимические маркёры не позволяют исследовать промоторнуюи регуляторную части генома, а также интроны, то есть фрагменты, которые находились вне структурной части генома [42-43].
Современные молекулярно-генетические методы позволяют исследовать любые области генома, анализировать любой ДНК-содержащий материал, независимо от периода онтогенеза организма. В настоящее время формируется множество ДНК-маркеров, различных по своим свойствам и методам выявления [44]. Ранее было предложено объединить ДНК-маркеры, определяемые с помощью полимеразной цепной реакции, в два основных класса: маркеры, созданные на основе полиморфизма небольших участков последовательности ДНК, и маркеры на основе полиморфизма в тандемно повторяющихся последовательностях ДНК. Однако, данная классификация является слишком обобщенной, поскольку оба класса включают в себя ДНК-маркеры, различающиеся по своим свойствам. Позже предложили классификацию ПЦР-маркеров по типу используемых праймеров. В такую классификацию входят ДНК-маркеры со случайными праймерами (RAPD), с универсальными праймерами (UP-PCR), маркеры со специфическими праймерами (праймеры минисателлитных, микросателлитных локусов и др.) и с комбинированными праймерами (RAMP, SCAR) [45].
Хлесткина Е.К. (2013) разделяет наиболее широко используемые ДНК-маркеры на три группы, в зависимости от метода их анализа: маркеры, исследуемые с помощью блот-гибридизации, ПЦР и ДНК-чипов, а также подразделяет на монолокусные и мультилокусные. Монолокусные маркеры наследуются чаще всего по кодоминантному типу, мультилокусные – по доминантному [46].
Среди множества маркёров выделяют SNP (Single Nucleotide Polymorphism) – маркеры, основанные на определении однонуклеотидного полиморфизма ДНК. SNP имеют очень широкое распространение в геномах всех организмов. Например, у человека точковые мутации встречаются каждые 1000 нуклеотидов [44]. Данный тип маркеров приобретает все большую популярность с каждым годом. Отчасти, это обусловлено возможностью автоматизировано осуществлять генотипирование по нескольким тысячам SNP одновременно при помощи биочипов[47]. Кроме того, ни один другой тип маркера не имеет такую плотность покрытия в геноме.
Для определения этих маркеров необходимы специфические праймеры с известными последовательностями фланкирующих областей. Существует множество методов детекции SNP, основные из них это ПЦР-ПДРФ, аллель-специфичная ПЦР, ПЦР с терминацией синтеза и секвенирование.
SNP используются в создании геномных карт, в филогенетических исследованиях [20, 48], в фармакогенетке и медицине [49], маркерной [50-52] и геномной селекции [53-54]. В исследования вовлечены практически все виды сельскохозяйственных животных: крупный рогатый скот [55-59], свиньи [60-62], овцы [63-64], козы [65-66], лошади [67-68], куры [69-70], а также буйволы [71] и верблюды [72].
У крупного рогатого скота наиболее широко изучаются SNP в генах молочных белков – каппа-казеина, лактоальбумина [73-76], в генах гормональной системы – пролактина, прогестерона, соматотропина [77-78] и других.
Таким образом, современные достижения молекулярной генетики позволяют изучать геномы и вести поиск генетических маркёров различных фенотипических проявлений, связанных с продуктивностью, воспроизводством и резистентностью к заболеваниям, а также контролировать изменения генетической структуры популяций. Внедрение биотехнологических технологий в разные отрасли человеческой деятельности, в том числе использование ДНК-маркёров в животноводстве, требует глубокого и всестороннего анализа.Необходима дальнейшая оценка полиморфизма разных генетических маркеров в популяциях с уникальной эволюционной историей для сохранения и совершенствования пород, обладающих высоким генетическим потенциалом.
1.3.Маркер-ориентированная селекция в животноводстве
Как уже отмечалось,ДНК-маркерывключают селекционные программы разведения животных при условии их высокой полиморфности и связи с признаками. Несмотря на то, что большинство хозяйственно полезных признаков имеет сложный полигенный характер наследования с участием олигогенов, полигенов и генов–модификаторов, поиск генетических маркёров продолжается [79]. Считают, что определенная часть генов может кодировать продукт, участвующий в ряде ключевых процессов, и, следовательно, оказывать более сильное влияние на формирование признака. Такие гены условно называют главными генами, у которых различие по величине признака между особями, несущими альтернативные гомозиготные генотипы, равно либо больше стандартного отклонения [81]. Но, в силу слабой изученности геномов животных известно относительно небольшое число этих генов. Поиск подобных генов базируется на отборе и изучении генов-кандидатов, контролирующих структурные составляющие изучаемого признака (белки молока, мышечные белки), или обуславливающие биохимические процессы его формирования (гормоны и ферменты).
Среди генов-кандидатов выделяют функциональные гены, продукты которых играют ключевую роль в формировании признака. Например, для признаков молочной продуктивности гены каппа-казеина, лактоальбумина, лактоглобулина и пролактина выступают в качестве функциональных генов-кандидатов. Исследованию этих генов посвящено большое количество работ в нашей стране и за рубежом [73-78,80].
Наряду с функциональными генами различают позиционные гены-кандидаты, которые расположены в области, прилегающей к точке локализации QTL [81]. Например, в качестве позиционного гена – кандидата содержания жира в молоке рассматривается ген диацилглицерол О-ацилтрансферазы 1 (DGAT1) [82].
Маркёрная селекция открыла новые возможности для оценки, отбора и подбора племенных животных. ДНК-маркеры не подвержены влиянию паратипических факторов. Оценку можно вести вне зависимости от пола и периода онтогенеза. Показано, что если перед традиционной оценкой по фенотипу провести предварительную селекцию по ДНК-маркерам, выявляющим 50% генетической изменчивости, то эффективность племенной оценки увеличится на 21% по сравнению со стандартной оценкой и на 31%, если преселекцию осуществляли на ранней стадии эмбрионального развития [83]. MAS-селекция является удобным инструментом для отбора по признакам, которые фенотипически могут быть определены только после убоя, имеют относительно позднее проявление, ограничиваются полом, либо находятся под сильным влиянием факторов внешней среды [81].
Несмотря на множество положительных сторон такой селекции, существует и ряд трудностей, ограничивающий массовое внедрение молекулярных технологий в производственный процесс. По мнению Глазко В. И. (2013), экономическая выгода при применении молекулярных технологий в животноводстве часто бывает преувеличена. Причиной этому служит недостаточное изучение оптимальных областей их использования и соответственно уровня проявляемого эффекта [84].
Основываясь на многочисленных исследованиях ассоциаций ДНК-маркеров и признаков продуктивности, очевидной становится проблема низкой воспроизводимости ассоциаций. [84]. Другими словами, различные ДНК-маркеры, статистически достоверно ассоциированные с предпочтительными характеристиками в конкретной популяции, не являются универсальными для пород одного направления продуктивности, а иногда и для различных стад одной породы. К такому выводу пришли французские ученые, изучавшие ассоциации генотипов по ряду структурных генов с показателями молочной продуктивности у молочных пород [85], и российские ученые, изучавшие полиморфизм различных генов-кандидатов продуктивности свиней [86] и крупного рогатого скота [87].
Причинами отсутствия универсальных маркеров Глазко В.И. (2013) называет индивидуальные различия по вкладу конкретных генов в формирование определенного признака. Автор предполагает, что существуют сложные межгенные взаимодействия, приводящие к некоторому антагонизму между аллелями разных генов, участвующих в проявлении одного признака.
Кроме того, Глазко В.И. (2013 г.) отмечает, что предпочтительное проявление признака в большей степени зависит от сочетания генотипов по генам, которые являются «мишенями» естественного отбора. Речь идет о генах, участвующих в адаптационных процессах, генах метаболических и иммунных систем. Этим автор объясняет ассоциации различных генов и конкретного признака в пределах одной породы, но разных популяций.
Несмотря на различные точки зрения, относительно целесообразности использования маркёрной селекции, некоторые страны уже достаточно давно используют маркёры для предварительной оценки племенной ценности животных. Так, например, в Новой Зеландии бычков отбирают с помощью 25 микросателлитных маркеров, сцепленных с шестью локусами QTL, влияющими на качество молока [88]. Во Франции бычков и телят в возрасте 1-12 месяцев тестируют по 33 маркерам для 12 локусов QTL, контролирующих репродуктивные функции и показатели качества молока [89]. Предварительную оценку по ДНК-маркерам проводят также в Германии [90]. В США включена в селекционные программы оценка животных по генам пролактина, лактоглобулина и каппа-казеина [91-92].
Учитывая одновременно преимущества маркерной селекции,а также низкую воспроизводимость ассоциаций, необходимо расширять спектр возможных генов-кандидатов, напрямую или опосредовано участвующих в формировании количественных признаков, и изучать их на разных популяциях и породах, а также в разных географических регионах.
1.4.Ассоциация полиморфизмов генов с продуктивными характеристиками крупного рогатого скота
1.4.1 Ген каппа-казеина (CSN3)
Для экономической целесообразности молоко, из которого изготавливают сыры должно содержать не менее 3% белка [93]. Наибольшую часть молочных белков составляют казеины, на них приходится 78-85% всех белков в молоке, около 17% составляют сывороточные белки. Молочный казеин представлен пятью фракциями – αS1, αS2, β, κ, γ [94-95].
Структура белка каппа-казеина регулируется одним полиморфным геном [96]. Ген каппа-казеина (CSN3) является одним из наиболее часто используемых в поиске ассоциативных связей с молочной продуктивность коров[97-99, 141].
Ген CSN3 локализован на 6 хромосоме, размер данного гена13 т.п.н., он включает в себя 5 экзонов, общая длина которых 850 пар нуклеотидов, и 4 интронов [51, 100]. Синтез белка каппа-казеина, контролируется геном, который имеет 10 аллельных вариантов [94]. Наиболее часто встречающиеся варианты А и В имеют различия в двух аминокислотных заменах — Asp148→Ala иThr136 → lle, которые вызваны точковыми мутациями в позиции 5309 C→T и 5345 [4; 10,100].
На данный момент имеется несколько методов генотипирования А и В аллелей гена каппа-казеина (CSN3) с помощью эндонуклеаз рестрикции: HinfI, HindIII, PstI, TaqI, HaeIII, MboII [101].
Ген связывают с технологическими свойствами молока и белковомолочностью. По данным ряда исследователей наиболее благоприятным для сыроварения является молоко от коров с генотипом B/B, так как такое молоко обладает большим количеством молочного белка и наилучшими коагуляционными свойствами [8, 16,19, 26,102]. Отмечали также, что молоко от коров с генотипом А/В имеет более высокое содержание белка с высоким выходом сыра и творога [47, 96-97, 103-104]. Также имеются данные о лучших вкусовых качествах молока, полученного от коров-носительниц генотипа В/В [3].
Сычужная свёртываемость молока, полученного от коров сгенотипом АА и А/В, зачастую соответствует 2 классу, а от коров с В/В — 1 классу. Имеются данные о содержании белка в сухом веществе при оценке качества сыра, полученного от животных с генотипом В/В — 22,3%, что достоверно выше, чем в продукции, полученной от коров с генотипами А/А и А/В [105].
При исследовании сыропригодности молока различных пород получены данные о том, что по основным качествам при изготовлении сыров молоко коров симментальской породы имеет ряд преимуществ по технологическим свойствам в сравнении с животными айширской, красной степной и черно-пестрой пород. Отмечено, что генотип В/В отрицательно коррелирует с выходом молока, а генотипы А/А и А/В являются наиболее благоприятными для высокого надоя [106].
Также некоторые авторы отмечают преобладание по живой массе животных-носителей этого генотипа и более продолжительную лактацию [99].
Соотношение генотипов по гену каппа-казеина и фенотипические проявления при этом зависят от породы и зон разведения скота (табл.1.1.)По некоторым данным у симменталов, разводимых в степной зоне Республики Казахстан, наблюдается повышенная частота генотипа В/В на 11,7-13,1% и пониженная частота встречаемости генотипа А/А на 16,6-17,7% в сравнении с коровами, разводимыми в хозяйствах Новосибирской области в степной зоне и Республики Алтай горной зоны. Животные степной зоны имели более высокие показатели удоя, нежели коровы из хозяйства, расположенного в горной местности. Но животные из горной местности Республики Алтай и степной местности Республики Казахстан отличались более высоким содержанием молочного жира, по сравнению с коровами Новосибирской области, а содержание белка у животных степной местности было выше, чем у коров из горной [3].
Таблица 1.1 — Генетическая структура пород по гену CSN3
| Порода | Частота генотипов, доли ед. | Частота аллелей, доли ед. | Автор и год упоминания | |||
| А/А | А/В | В/В | А | В | ||
| Голштинская (Республика Татарстан) | 0,62 | 0,34 | 0,04 | 0,79 | 0,21 | Хаертдинов, 2014 |
| Голштинская (канадская селекция) | 0,54 | 0,41 | 0,05 | 0,74 | 0,26 | Новиков, 2014 |
| Голштинская (венгерская селекция) | 0,7 | 0,27 | 0,03 | 0,83 | 0,17 | Новиков, 2014 |
| Черно-пестрая сибирского типа | 0,4 | 0,5 | 0,1 | — | — | Калашникова, 2015 |
| Черно-пестрая (Республика Татарстан) | 0, 61 | 0,35 | 0,04 | — | — | Шайдуллин, 2015 |
| Лимузинская
(Республика Татарстан) |
0,59 | 0,35 | 0,06 | 0,77 | 0,23 | Хаертдинов, 2014 |
| Обрак
(Республика Татарстан) |
0,57 | 0,37 | 0,06 | 0,75 | 0,25 | Хаертдинов, 2014 |
| Герефордская
(Республика Татарстан) |
0,61 | 0,35 | 0,04 | 0,78 | 0,22 | Хаертдинов, 2014 |
| Холмогорская
(Республика Татарстан) |
0,78 | 0,16 | 0,06 | — | — | Загидуллин, 2020 |
| Бестужевская (Республика Башкортостан) | 0,53 | 0,46 | 0,02 | 0,75 | 0,25 | Долматова, 2015 |
| Симментальская
(Республика Башкортостан) |
0,8 | 0,18 | 0,02 | 0,89 | 0,11 | Долматова, 2015 |
| Голштинская
(Германия) быки |
0,66 | 0,34 | 0 | 0,83 | 0,17 | Юдина, 2020 |
| Голштинская (Нидерланды)
быки |
0,57 | 0,43 | 0 | 0,79 | 0,21 | Юдина, 2020 |
В стадах крупного рогатого скота симментальской работы, разводимых в условиях степной зоны Оренбургской области отмечено преобладание коров с генотипом А/А (63%), в сравнении с генотипом В/В (7%) [106-107].
Имеются данные о том, что коровы голштинской породы с гомозиготным генотипом А/А имеют более высокий показатель удоя, а также более высокое содержание молочного белка [108]. У ярославских голштиннизированных коров наилучшими показателями отличаются животные с А/В-генотипом, но отмечено более низкое содержание жира в молоке, в сравнении с А/А [109].
В стадах коров голштинской породы в условиях Рязанской области преобладают животные, имеющие аллель А. Частота встречаемости аллеля А в стадах голштинской пород канадской селекции 74%, а венгерской селекции еще выше — 83% [110]. Отмечают, что использование быков голштинской породы без учета их генотипов по генам-кандидатам молочной продуктивности может привести к снижению качества молока, ухудшению его технологических свойств и химического состава [112].
Высокая частота встречаемости желательного аллеля В наблюдается в стадах джерзейской породы (80%) и швицкой породы (65%). Авторы отмечают, что при изготовлении сыра «чеддер» из 100 кг молока коров голштинской породы выход сыра составляет 10%, из молока бурой швицкой 11,1 %, а из молока коров джерзейской — 12,4% [113]. Отмечено, что в процессе голштинизации этот показатель у скота черно-пестрой породы снизился до 9%, а изначально был на уровне 12%.
На территории Российской Федерации высокая частота встречаемости желательного аллеля В отмечена у красной горбатовской и костромской пород крупного рогатого скота (23-33%) [3].
У коров черно-пестрой породы сибирского типа была высокая частота гетерозиготного генотипа А/В (50%). Около 40% животных имеют гомозиготный генотип А/А, и только 10% желательный генотип В/В [1].
При изучении красно-пестрой породы имеются данные о том, что животные с генотипом А/А имеют более высокие надои, но отличались более низкими показателями по содержанию молочного жира и белка [114].
При изучении технологических свойств молока холмогорской породы получены данные о том, что молоко коров, имеющих генотип В/В по гену каппа-казеина, имеют более высокий выход творога (6,1-8,8%), высокую свертываемость молока по сравнению с другими генотипами.
Наиболее калорийным является молоко, которое получают от коров холмогорской породы татарстанского типа, с гомозиготными генотипами А/А и В/В — 670 ккал, в сравнении с молоком от коров с генотипом А/В — 655 ккал. Коровы с генотипом А/А по гену CSN3 имели достоверно более высокие показатели молочной продуктивности, выше на 10,2% [115].
В стадах черно-пестрого скота, у животных, которые имеют аллель В время коагуляции молока меньше, чем у тех, которые его не имеют [113].
1.4.2 Ген бета-лактоглобулина (BLG)
Бета-лактоглобулин – главный компонент молочной сыворотки, необходимый для роста молодняка. Является амфипатическим кислоустойчивым белком [116], отвечает за белковомолочность и биологическую ценность молока в целом [117-118, 141].
Ген бета-лактоглобулина локализирован на 11 хромосоме крупного рогатого скота и имеет 12 аллельных вариантов [99]. Имеет размер 4662 (длина цепи 178 аминокислот) пар нуклеотидов, включает в себя 6 интронов и 7 экзонов.
В настоящее время известно 11 аллельных вариантов гена бета-лактглобулина — A, B, C, D, E, F, G, H, X, Dr, W. Наиболее часто встречаемыми аллельными вариантами данного гена являются A, B, C и D, отличающимися друг от друга аминокислотной последовательностью. Аллельный вариант B, являющийся основным аллелем гена бета-лактоглобулина, имеет замену в позиции 64, где из-за замены второго основания триплета GAT→GGT аспаргин заменяется на глицин. Наиболее редкий вариант D имеет замену в позиции 45 Glu→Gln. [10,20].
Аллель B связывают с более высоким удоем, а также с повышенным содержанием сывороточных белков в молоке.В стадах черно-пестрой породы отмечают его связьс более высоким содержанием протеина в молоке, большей стабильностью при нагревании и охлаждении молока, меньшим временем коагуляции[120].
В стадах голштинизированных коров черно-пестрого скота по гену BLGотмечали преимущество по удою и жирномолочности коров, имеющих гетерозиготный генотип[116]. В то же время приводятся данные о том, что голштинизированные животные с генотипами А/А и А/В имели более низкую молочную продуктивность.При этом,коровы с генотипом А/А показали более высокие значенияжирномолочности (3,95%), а с генотипом В/В — белковомолочности (до 3%). Есть сведения о том, что ремонтный молодняк, имеющий генотип А/А имел более ранний возраст первого осеменения в сравнении с животными, имеющими генотипы А/В и В/В [121].
При изучении ассоциации генотипов с молочной продуктивностью у чистопородных коров, имеющих генотип ВВ по гену бета-лактоглобулина, симментальской породы отмечается тенденция увеличения надоя с возрастом, в сравнении с коровами-носительницами альтернативных генотипов, особенно в сравнении с гомозиготным генотипом АА. Самая высокая плотность сгустка отмечена у коров, имеющих гомозиготный желательный генотип ВВ, скорость отделения жидкости выше, чем у коров-носительниц генотипа АА и АВ [3].
При изучении генетической структуры в стадах айширской породы отмечается очень низкая частота встречаемости В аллеля бета-лактоглобулина (BLG) [52].
В стадах коров голштинской породы канадской селекции отмечается высокая частота встречаемости аллеля В (87%), связанный с высокими технологическими качествами молока — преобладающий генотип А/В — более 50%, генотип В/В обнаруживается у 35% коров. У голштинских коров венгерской селекции частота встречаемости предпочтительного аллеля В ниже, в сравнении с голштинским скотом, завезенным из Канады, и составляет около 53%. 75% имеют гетерозиготный генотип А/В, а желаемый генотип В/В обнаружен у 20% коров-носительниц. Коровы, имеющие аллель В генов каппа-казеина и бета-лактоглобулина являются более перспективными в качестве матерей быков, так как дочери, которые получат генотип В от отцов, будут иметь молоко с наилучшими технологическими свойствами [110].
У ярославской голштинизованной породы скота отмечается тенденция у животных, имеющих генотип В/В, к более высоким показателям молочной продуктивности, но зачастую сложно судить о достоверности различий между генотипами, так как наблюдается малое число животных, имеющих желательный генотип В/В [122].
Имеется информация о полимофризме гена бета-лактоглобулина у коров холмогорской породы в условиях Республики Саха. У животных, разводимых в Намском улусе желательный генотип В/В встречается с частотой 11%, на территории Олекминского улуса преобладал генотип А/А — 55%, а частота аллеля В была около 0,3 [123].
Исследования, проведенные на дойных коровах холмогорской породы татарстанского типа, показали, что наибольшей калорийностью обладает молоко, полученное от коров с генотипом В/В по гену бета-лактоглобулина — 674 ккал. [115].
Встречаемость А-аллеля у коров голштинской породы может варьировать от 0,37 до 0,57, у черно-пестрых коров данный показатель колеблется от 0,33 до 0,66. Частота встречаемости аллеля В популяция черно-пестрого скота находится в пределах от 0,35 до 0,67 [124].
Таблица 1.2 — Генетическая структура пород по гену BLG
| Порода | Частота генотипов, доли ед. | Частота аллелей, доли ед. | Автор и год упоминания | |||
| А/А | А/В | В/В | А | В | ||
| Голштинская
(канадская селекция) |
0,13 | 0,52 | 0,35 | 0,39 | 0,61 | Новиков, 2014 |
| Голштинская
(венгерская селекция) |
0,25 | 0,45 | 0,3 | 0,47 | 0,53 | Новиков, 2014 |
| Голштинская (Республика Татарстан) | 0,09 | 0,43 | 0,5 | 0,31 | 0,69 | Хаертдинов, 2014 |
| Холмогорская
(Республика Саха) |
0,56 | 0,33 | 0,11 | 0,72 | 0,28 | Павлова, 2015 |
| Симментальская
(Оренбургская область) |
0,33 | 0,58 | 0,09 | 0,82 | 0,18 | Панин, 2020 |
| Бестужевская (Республика Башкортостан) | 0,15 | 0,48 | 0,38 | 0,4 | 0,6 | Долматова, 2015 |
| Симментальская
(Республика Башкортостан) |
0,15 | 0,54 | 0,31 | 0,42 | 0,58 | Долматова, 2015 |
1.4.3 Ген альфа-лактальбумина (LALBA)
Альфа- лактальбумин – это металлопротеин молока, но большая его часть содержится преимущественно в молозиве крупного рогатого скота. Данный белок участвует в синтезе лактозы, путем удерживания молекулы глюкозы при ее образовании [74]. Ген LALBA, кодирующий молочные белки, играет важную роль в изменении объема синтезируемого молока [9]. Данный ген, размером 2784 п.о., локализирован на 5 хромосоме крупного рогатого скота и имеет 4 экзона и 3 интрона. Встречается три аллельных варианта гена – A, B, C, но наиболее широко распространены аллели A и B [125]. Различия двух аллелей заключается изменении аминокислотной последовательности, путем точковой мутации (A –>G) в позиции Arg10 — Gln8. Также имеется информация о третьем варианте данного гена – С. Он выделен из молока коров породы бантенг, но последовательность аминокислот не определена [126]. Информация о связи данного гена с показателями молочной продуктивности зачастую носит противоречивый характер, но результаты исследований, проводимых на стадах черно-пестрой породы, говорят о том, что у коров с генотипом A/A наблюдалось повышенное содержание жира в молоке, белка и сухих веществ (в сравнении с животными-носителями генотипа B/B) [74]. В то время как, в работах, посвященных изучению ясрославской породы крупного рогатого скота, свидетельствуют о том, что коровы с генотипом LALBAAA имели более высокие надои за первую и наивысшую лактацию, а носительницы генотипа LALBAAB превосходили остальных животных по содержанию белка по первой и наивысшей лактации [127]. Наиболее высокими удоями отличаются носительницы генотипа LALBABB. Молоко коров с генотипом А/А у коров черно-пестрой породы имеет более высокую термоустойчивость в сравнении с альтернативными генотипами [75, 128].
В исследованиях О.А. Львиной (2011) отмечается то, что у коров симментальской породы австрийской селекции, имеющих генотип B/B, отмечаются более высокие удои, в сравнении с гетерозиготнымA//B (p<0,01); более высокое содержание жира (A/A>B/B, p<0,01).
Наиболее распространенным генотипом LALBA считается гетерозиготный генотип АВ [127-128].
Таблица 1.3 — Генетическая структура пород по гену LALBA
| Порода | Частота генотипов, доли ед. | Частота аллелей, доли ед. | Автор и год упоминания | |||
| А/А | А/В | В/В | А | В | ||
| Ярославская (Ярославская область) | 0,21 | 0,64 | 0,14 | 0,54 | 0,43 | Ильина, 2017 |
| Черно-пестрая (Республика Башкортостан) | 0,18 | 0,59 | 0,23 | 0,48 | 0,52 | Ракина, 2013 |
| Черно-пестрая (Московская область) | 0,57 | 0,23 | 0,2 | 0,68 | 0,32 | Костюнина, 2011 |
| Симментальская | 0,56 | 0,4 | 0,04 | 0,76 | 0,24 | Сельцов, 2013 |
| Холмогорская | 0,52 | 0,43 | 0,05 | 0,74 | 0,26 | Сельцов, 2013 |
| Швицкая | 0,13 | 0,73 | 0,15 | 0,49 | 0,51 | Сельцов, 2013 |
| Бестужевская (Республика Башкортостан) | 0,21 | 0,6 | 0,19 | 0,51 | 0,49 | Долматова, 2015 |
| Симментальская
(Республика Башкортостан) |
0,52 | 0,38 | 0,01 | 0,71 | 0,29 | Долматова, 2015 |
1.4.4 Ген лептина (LEP)
Ген лептина расположен в четвертой хромосоме крупного рогатого скота, состоит из промоторной части (3 кб), 3 экзонов (501 п.н.), 2 интронов (2 кб), 3’UTR области, и отвечает за синтез гормона лептина, влияющего на мраморность мяса, на содержание жира в молоке и отложение жира в туше [129-130]. Этот гормон, представляющий собой белок из 167 аминокислот и включающий в себя 21 аминокислотную сигнальную последовательность, играет важную роль в формировании пищевого поведения, обмене веществ, развитии иммунной системы, а также оказывает влияние на фертильность, рост и развитие животного, легкость отелов и продолжительность гестации [27,131-133, 137, 139]. Ген лептина зачастую изучается в связи с энергообменом у коров мясного направления и молочной продуктивности у коров голштинской породы [134-136]. Полиморфизмы LEP – R25C, Y7F, A80V [7]. Наиболее изученными аллельными вариантами являются C и T, различия между ними объясняются заменой цитозина на тимин. Есть данные о том, что первотелки с генотипом LEPTT имеют достоверное преимущество над животными с альтернативными генотипами по удою, содержанию сухого вещества в молоке на 1 кг живой массы, а также молоко, вырабатываемое первотелками-носительницами данного генотипа, имеет более высокой питательной ценностью [138]. Животные с генотипом гетерозиготным генотипом LEPCT имеют более высокие показатели молочного жира, высокое содержание белка в молоке (выше, чем у коров с генотипом LEPTT) [140]. В исследованиях Ковалюк (2015) имеются данные о том, что коровы, имеющие генотип LEPCC(SNPR25C) имеют в 3,14 раза больший риск выбраковки, чем коровы с генотипом LEPCT. А животные с генотипом LEPFF (SNPY7F) в 3,64 раза более высокий риск выбраковки, чем у коров-носительниц генотипа LEPYY. Имеются данные о том, что коровы с гомозиготным генотипом T/T имели лучшие результаты по уровню удоя, а также по коэффициенту биологической эффективности коровы (БЭК) и коэффициенту биологической полноценности молока (КБП) [138]. По результатам исследований Зиннатовой (2018) можно сделать выводы о том, что генотип T/T также имеет связь с более высоким уровнем молочной продуктивности и с меньшей живой массой у коров-первотелок. Данные коровы имели более высокий коэффициент молочности.
Таблица 1.4 — Генетическая структура пород по гену LEP
| Порода | Частота генотипов, доли ед. | Частота аллелей, доли ед. | Автор и год упоминания | |||
| C/C | C/T | T/T | C | T | ||
| Голшинская
(Республика Татарстан) |
0,36 | 0,53 | 0,12 | 0,62 | 0,38 | Сафина, 2018 |
| Красная степная | 0,65 | 0,3 | 0,05 | 0,8 | 0,2 | Чижова, 2017 |
| Швицкая | 0,75 | 0,19 | 0,16 | 0,84 | 0,16 | Чижова, 2017 |
| Голштинская
(быки) |
0,33 | 0,47 | 0,2 | 0,56 | 0,44 | Ковалюк, 2017 |
| Айрширская
(быки) |
0,13 | 0,37 | 0,5 | 0,32 | 0,68 | Мачульская, 2015 |
| Симментальская
(быки) |
0,42 | 0,53 | 0,05 | 0,68 | 0,32 | Мачульская, 2015 |
| Англерская
(быки) |
0,63 | 0,12 | 0,25 | 0,69 | 0,31 | Мачульская, 2015 |
| Джейрсерская
(быки) |
0,4 | 0,4 | 0,2 | 0,6 | 0,4 | Мачульская, 2015 |
2 МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
2.1 Место проведения, объект и предмет исследования
Молекулярно-генетические исследования проводились у коров породы «Сибирячка» и симментальской породы, разводимых в хозяйствах Новосибирской области: СПК «Кирзинский» и ООО «Сибирская Нива». Средний уровень молочной продуктивности в стадах составляет более 8000 кг молока. Исследования проведены в лаборатории биотехнологии Сибирский научно-исследовательский и проектно-технологический институт животноводства СФНЦ агробиотехнологий СО РАН. Материалом служила венозная кровь, взятая в пробирку, содержащую антикоагулянт (K2 ЭДТА).
Объектом исследования являлись гены молочных белков:каппа-казеин (CSN3), бета-лактоглобулин (BLG), альфа-лактальбумин (LALBA) и гормона лептин (LEP).
2.2 Забор крови. Выделение и генотипирование ДНК
Забор крови осуществлялся в объеме 7-10 мл в вакуумную пробирку для гематологических исследований, содержащую антикоагулянт ЭДТА К2 (2-замещенная калиевая соль этилендиаминтетрауксусной кислоты). Затем образцы транспортировались в лабораторию в термоконтейнере для перевозки при температуре 2.0-8.0 Со..
ГеномнуюДНКвыделяли из крови с использованием набора экстракции из клинического материала «Ампли Прайм ДНК-сорб-В» по прописи изготовителя ООО «НекстБио» (г. Москва). Качество и концентрацию выделенной ДНК оценивали в 1% агарозном геле методом горизонтального электрофореза с использованием гельдокументирующей системы E-Box-CX5.TS-20.M, в проходящем ультрафиолетовом свете по флуористенции бромистого этидия визуализировали ДНК.
Полиморфизм генов определяли по методике ПЦР-ПДРФ.
Таблица 2.1 — Этапы амплификации с помощью ПЦР при определении генетических маркеров
| Стадия | Шаг | Температура | Время | Количество циклов | |
| Первая | Начало денатурации | 95о | 5 мин | 1 | |
| Вторая | 1 | Денатурация | 94о | 30 сек | 30 |
| 2 | Отжиг | 60о | 30 сек | ||
| 3 | Элонгация (удлинение цепи) | 72о | 30 сек | ||
| Третья | Финальная элонгация | 72о | 2 мин | 1 | |
Генотипирование животных по гену каппа-казеина (CSN3)
Полиморфизм гена каппа-казеина определяли по методике ПЦР-ПДРФ разработанной во Всероссийском НИИ племенного дела [1].
Для проведения ПЦР реакции в конечном объеме 25 мкл использовали 1× ПЦР буфер (16,6 мМ (NH4)2SO4; 67,7 мМ Трис – НCl, pH = 8,8; 0,1 (v/v) Tween 20), 1,5 мМ MgCl2, 200 мкМ диоксинуклеозидтрифосфатов, 30 пмоль каждого из праймеров и 1 Ед Таg-полимеразы.
Aмплификацию проводили стандартным методом ПЦР анализа на ДНК-амплификаторе С 1000 Touch Termal Cycler «BioRad» (Singapore), с двумя олигонуклеотидными праймерами, предложенных DenicourtD. etal., 1990:
F: 5′ – ATA GCC AAA TAT ATC CCA ATT CAG T – 3′
R: 5′ – TTT ATT AAT AAG TCC ATG AAT CTT G – 3′
После начальной денатурации (95ºС, 5 мин) выполняли 35 циклов амплификации в следующем температурно-временном режиме: денатурация – 1 минута при 94ºС, отжиг – 1 минута при 57ºС, синтез – 1 минута при 72ºС. Хранение при 10 °С. Амплифицировался цельный фрагмент длиной 530 bp.
Для проведения ПДРФ-анализа CSN3-гена 20 мкл ПЦР пробы обрабатывали 10 ед. эндонуклеазы рестрикции Hind III в 1×буфере «O» фирмы СибЭнзим (Россия) при 37°С в течение ночи.
Для визуализации ПЦР-ПДРФ-фрагментов образцы ДНК вносили в лунки геля, содержащего 2,0% агарозы с высоким разрешением, 0,5 мкг/мл этидия бромида и выполняли электрофорез горизонтальный при напряжении 15В/см в 1×ТВЕ буфере, продолжительностью 40 мин. Далее электрофорезный гель визуализировали и идентифицировали генотипы CSN3 по количеству и размеру фрагментов под ультрафиолетовым светом при помощи гельдокументирующей системы E-Box-CX5.TS-20.M. Результат электрофореза рестрикционных фрагментов продуктов амплификации фрагмента гена CSN3 представлен на рисунке 2.1.
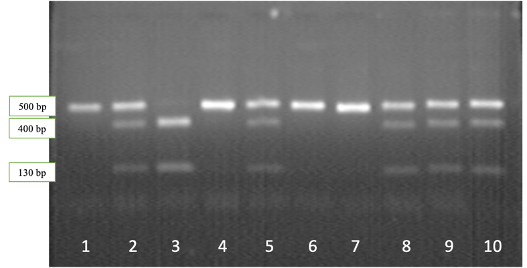
Рисунок 2.1 — Результаты электрофореза рестрикционных фрагментов гена CSN3: дорожки 1,4,6,7 – генотип CSN3AA; дорожки 2,5,8-10 – генотип CSN3AВ, дорожка 3 – генотип CSN3ВВ
Наличие нерестрицированного фрагмента длиной 530 bp соответствует генотипу CSN3AA, двух фрагментов длиной 400 и 130 bp – генотипу CSN3ВВ, в то время как наличие трех фрагментов длиной 530, 400 и 130 bp соответствует генотипу CSN3AВ.
Генотипирование животных по гену бета-лактоглобулина (BLG)
Полиморфизм BLG гена определяли по методике ПЦР-ПДРФ разработанной во Всероссийском НИИ племенного дела [1].
Для проведения ПЦР реакции в конечном объеме 25 мкл использовали 1× ПЦР буфер (16,6 мМ (NH4)2SO4; 67,7 мМ Трис – НCl, pH = 8,8; 0,1 (v/v) Tween 20), 1,5 мМ MgCl2, 200 мкМ диоксинуклеозидтрифосфатов, 30 пмоль каждого из праймеров и 1 Ед Таg-полимеразы.
Aмплификацию проводили стандартным методом ПЦР анализа на ДНК-амплификаторе С 1000 TouchTermalCycler «BioRad» (Singapore) в объеме 25 мкл, с двумя олигонуклеотидными праймерами, предложенных MedranoJ.F., Aguilar-CordovaE., 1990:
BLGP3: 5′ – GTC CTT GTG CTG GAC ACC GAC TAC A – 3′
BLGP4: 5′ – CAG GAC ACC GGC TCC CGG TAT ATG A – 3′
После начальной денатурации (95ºС, 5 мин) выполняли 35 циклов амплификации в следующем температурно-временном режиме: денатурация – 60 секунд при 94ºС, отжиг – 60 секунд при 60ºС, синтез – 60 секунд при 72ºС; достройка – 5 минут при 72ºС. Хранение при 10 °С.
Амплифицировался цельный фрагмент длиной 262 bp.
Для проведения ПДРФ-анализа BLG-гена 20 мкл ПЦР пробы обрабатывали 5 ед. эндонуклеазы рестрикции HaeIII в 1×буфере «G» фирмы СибЭнзим (Россия) при 37 °С в течение ночи.
Для визуализации ПЦР-ПДРФ-фрагментов образцы ДНК вносили в лунки геля, содержащего 2,5% агарозы с высоким разрешением, 0,5 мкг/мл этидия бромида и выполняли электрофорез горизонтальный при напряжении 15В/см в 1×ТВЕ буфере, продолжительностью 40 мин. Далее электрофорезный гель визуализировали и идентифицировали генотипы бета-лактоглобулина по количеству и размеру фрагментов под ультрафиолетовым светом при помощи гельдокументирующей системы E-Box-CX5.TS-20.M. Результат электрофореза рестрикционных фрагментов продуктов амплификации фрагмента BLG гена представлен на рисунке 2.2.
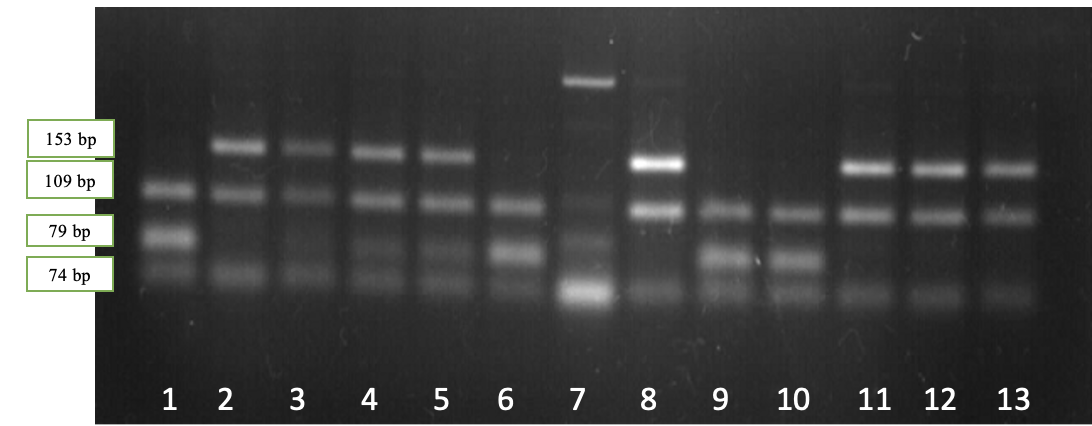
Рисунок 2.2 — Результаты электрофореза рестрикционных фрагментов гена BLG: дорожки 2, 3, 8, 11-13 – генотипBLGAA; дорожки 4,5 – генотип BLGAВ; дорожки 1, 6, 9, 10 – генотипBLGВВ, дорожка 7 — амплификат
Наличие двух фрагментов длиной 153 и 109 bp соответствует генотипу BLGAA, четырех фрагментов длиной 153, 109, 79 и 74 bp – генотипу BLGАВ, в то время как наличие трех фрагментов длиной 109, 79 и 74 bp соответствует генотипу BLGBВ.
Генотипирование животных по гену альфа-лактальбумина (LALBA)
Полиморфизм LALBA гена определяли по методике ПЦР-ПДРФ разработанной во ВНИИЖе [40].
Для проведения ПЦР реакции в конечном объеме 20 мкл использовали 1× ПЦР буфер (16,6 мМ (NH4)2SO4; 67,7 мМ Трис – НCl, pH = 8,8; 0,1 (v/v) Tween 20), 1,5 мМ MgCl2, 200 мкМ диоксинуклеозидтрифосфатов, 30 пмоль каждого из праймеров и 1 Ед Таg-полимеразы.
Aмплификацию проводили стандартным методом ПЦР анализа на ДНК-амплификаторе С 1000 Touch Termal Cycler «BioRad» (Singapore) в объеме 20 мкл, с двумя олигонуклеотидными праймерами, предложенных Гладырь Е.А. и др. (2002):
ALF-LAC1: 5′ – AAG AGT TGG ATG GAA TCA CC – 3′
ALF-LAC2: 5′ – TTC AAA TTG CTG GCA TCA AGC – 3′
После начальной денатурации (94ºС, 4 мин) выполняли 40 циклов амплификации в следующем температурно-временном режиме: денатурация – 10 секунд при 94ºС, отжиг – 10 секунд при 68ºС, синтез – 10 секунд при 72ºС; достройка – 5 минут при 72ºС. Хранение при 10 °С.
Амплифицировался цельный фрагмент длиной 430 bp.
Для проведения ПДРФ-анализа LALBA гена 20 мкл ПЦР пробы обрабатывали 10 ед. эндонуклеазы рестрикции MhiI в 1×буфере «W» фирмы
СибЭнзим (Россия) при 37 °С в течение ночи.
Для визуализации ПЦР-ПДРФ-фрагментов образцы ДНК вносили в лунки геля, содержащего 2,0% агарозы с высоким разрешением, 0,5 мкг/мл этидия бромида и выполняли электрофорез горизонтальный при напряжении 15В/см в 1×ТВЕ буфере, продолжительностью 40 мин. Далее электрофорезный гель визуализировали и идентифицировали генотипы альфа-лактальбумина по количеству и размеру фрагментов под ультрафиолетовым светом при помощи гельдокументирующей системы E-Box-CX5.TS-20.M. Результат электрофореза рестрикционных фрагментов продуктов амплификации фрагмента гена LALBA представлен на рисунке 2.3.
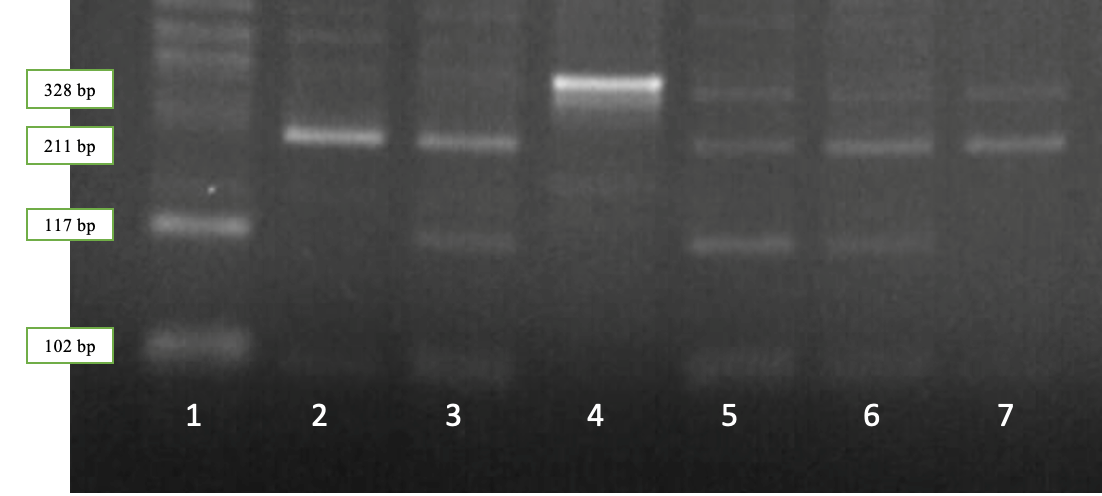
Рисунок 2.3 — Результаты электрофореза рестрикционных фрагментов гена LALBA: дорожка 1 – генотип LALBA ВВ; дорожки 2,7 – генотип LALBA AА; дорожки 3, 5, 6 – генотип LALBA АВ, дорожка 4 – амплификат
Наличие двух фрагментов длиной 328 и 102 bp соответствует генотипу LALBA AA, четырех фрагментов длиной 328, 211, 117 и 102 bp – генотипу LALBA АВ, в то время как наличие трех фрагментов длиной 211, 117 и 102 bp соответствует генотипу LALBA BВ
Генотипирование животных по гену лептина (LEP)
Для проведения ПЦР реакции в конечном объеме 20 мкл использовали 1× ПЦР буфер (16,6 мМ (NH4)2SO4; 67,7 мМ Трис – НCl, pH = 8,8; 0,1 (v/v) Tween 20), 1,5 мМ MgCl2, 200 мкМ диоксинуклеозидтрифосфатов, 30 пмоль каждого из праймеров и 1 Ед Таg-полимеразы.
Aмплификацию проводили стандартным методом ПЦР анализа на ДНК-амплификаторе С 1000 TouchTermalCycler «BioRad» (Singapore) в объеме 20 мкл, с четырьмя олигонуклеотидными праймерами, предложенных Corva P.M. etal. (2009):
LEP-F1: 5′ – GAC GAT GTG CCA CGT GTG GTT TCT TCT GT – 3′
LEP-R1: 5′ – CGG TTC TAC CTC GTC TCC CAG TCC CTC C – 3′
LEP-F2: 5′ – TGT CTT ACG TGG AGG CTG TGC CCA GCT – 3′
LEP-R2: 5′ – AGG GTT TTG GTG TCA TCC TGG ACC TTT CG – 3′
После начальной денатурации (94ºС, 5 мин) выполняли 40 циклов амплификации в следующем температурно-временном режиме: денатурация – 10 секунд при 94ºС, отжиг – 10 секунд при 63ºС, синтез – 10 секунд при 72ºС; достройка – 5 минут при 72ºС. Хранение при 10 °С
Амплифицировались фрагменты длиной 239 и 164 bp (аллель С) и 239 и 131 bp (аллель Т).
Для визуализации ПЦР-ПДРФ-фрагментов образцы ДНК вносили в лунки геля, содержащего 2,5% агарозы с высоким разрешением, 0,5 мкг/мл этидия бромида и выполняли электрофорез горизонтальный при напряжении 15 В/см в 1×ТВЕ буфере, продолжительностью 40 мин. Далее электрофорезный гель визуализировали и идентифицировали генотипы лептина по количеству и размеру фрагментов под ультрафиолетовым светом при помощи гельдокументирующей системы E-Box-CX5.TS-20.M. Результат электрофореза рестрикционных фрагментов продуктов амплификации фрагмента гена LEP представлен на рисунке 2.4.
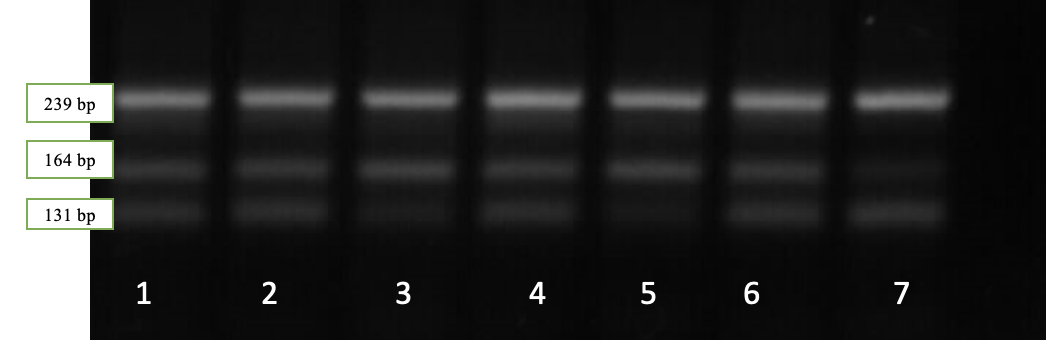
Рисунок 4 — Результаты электрофореза рестрикционных фрагментов гена LEP: дорожка 3, 5 – LEP CС; генотип дорожки 1, 2, 4, 6 – генотип LEPCT; дорожка 7 – генотип LEPTT
Наличие двух фрагментов длиной 239 и 164 bp соответствует генотипу LEPCC, трех фрагментов длиной 239, 164 и 131 bp – генотипу LEPCT, в то время как наличие двух фрагментов длиной 239 и 131 п.н. соответствует генотипу LEPTT.
2.3 Статистическая обработка полученных данных
Статистическая обработка полученных данных проводилась с помощью компьютерных программ RStudio и Microsoft Exel, а также с использованием общепринятых методик (Меркурьева, 1977).
Для вычисления частот генотипов в популяции используется формула:
=,
где Pi – это частота генотипа;
ni– число животных с данным генотипом;
N – общая численность животных в популяции.
Частота аллелей в популяции на основе ранее известных генотипов рассчитывается по формуле:
,
где pi – частота i-го аллеля;
fi – число i-го аллеля в популяции,
N – численность популяции.
Для расчета стандартной ошибки частот генотипов:
S=,
где p – частота признака;
n – число животных в выборке.
Для вычисления ошибки для частот аллелей используют формулу:
S=,
где p – это частота генотипа;
n – объём исследуемой выборки.
Для определения достоверности различий между выборочными частотами генотипов используется формула:
= ,
где – это средние значения признака в данных выборках;
– ошибки средней для каждой из исследуемых выборок.
Для множественного сравнения выборок критерий Стьюдента используется с поправкой Бонферрони.
Проверка соответствия фактического распределения частот генотипов теоретически ожидаемому распределению частот проводили с помощью критерия χ2 (хи-квадрат):
χ2 =,
где Oi — фактическая частота i-го генотипа;
Ei — теоретически ожидаемая i-го генотипа.
Равновесие генных частот по закону Харди-Вайнберга:
p2+2pq+q2=1,
где p2 – частота доминантных гомозигот;
2pq – частота гетерозигот;
q2 – частота рецессивных гомозигот.
Средняя степень гетерозиготности в популяции определяется по следующей формуле:
Caср = ,
где n – число локусов.
Показатель ожидаемой гетерозиготности, который определяется как вероятность того, что данная особь является гетерозиготной по данному локусу в популяционной выборке, вычисляли по формуле:
Не =1- Са,
где Ca – показатель ожидаемой гомозиготности, который определяется с помощью коэффициента гомозиготности, используя формулу Робертсона (Меркурьева Е.К., 1970):
Ожидаемая гетерозиготность в популяции определяется по формуле Робертсона (1956):
,
где Са — показатель ожидаемой гетерозиготности в популяции;
pi – квадраты частот аллелей локуса.
Средняя гетерозиготность особи (наблюдаемая гетерозиготность) по исследуемым локусам в популяционной выборке определяется по формуле М. Нея (1975):
,
где hi– количество гетерозигот на весь объем популяционной выборки, усреднённое по всем изученным локусам.
Уровень полиморфности в популяции, показывающий число активно действующих генов в популяции рассчитывается по формуле:
где , — квадраты частот по каждому аллелю.
Индекс фиксации позволяет установить связь между индивидуумами отдельной популяции и популяцией в целом. Так как данный показатель количественно отражает отклонение частот встречаемости гетерозиготных генотипов от теоретически ожидаемой по Харди-Вайнбергу доли гетерозигот при случайном спаривании внутри популяции, он может рассматриваться одним из критериев инбредности популяции. Определяется по формуле:
Fis=1-(Но/Не),
где Ho – наблюдаемая гетерозиготность,
He – ожидаемая гетерозиготность.
При нулевой встречаемости генотипа в популяционной выборке ошибку оценивали по формуле Б.Л. Ван-дер-Вардена:
p=, Sp=,
где p – частота генотипа по формуле Ван-дер-Вандерна,
P – нулевая частота генотипа,
n – численность выборочной совокупности.
Оценку достоверности различий частот генотипов и аллелей проводили при помощи t-критерия Стьюдента (Лакин, 1990). Для множественного сравнения выборок t-критерий Стьюдента рассчитывали с поправкой Бонферрони. Проверку соответствия фактического распределения частот генотипов теоретически ожидаемому распределению частот проводили с помощью критерия χ2 (хи-квадрат) (Кузнецов, 2014).
3. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
3.1 Оценка генетического разнообразия крупного рогатого скота по полиморфизму генов CSN3, BLG, LALBA и LEP
3.1.1 Генетическая структура симментальской породы и «Сибирячки» по полиморфизму генов CSN3, BLG, LALBA и LEP
Молекулярно-генетические исследования животных по комплексу генов, ассоциированных с показателями молочной продуктивности, были направлены на поиск генетического разнообразия пород, имеющих разное генеалогическое происхождение. Порода Сибирячка (патент № 9498 от 08.02.2018) получена путем использования голштинских быков на коровах черно-пестрой породы, разводимой на территории Сибири. Изначально предполагалось, что она должна быть более гетерогенной, чем чистопородные симменталы. Анализ структуры популяции показал, что генотипические различия между породами незначительны. Доля гомозигот B/B по генам CSN3, BLG, LALBA и T/T по гену LEP не превышала 10%, а частота встречаемости гетерозигот по всем генам была относительно равной. Генетическая структура пород представлена в таблицах 3.1 и 3.2.Уровень достоверных различий между частотами генотипов отражает особенности формирования структуры популяционных выборок. Так, частота гомозигот CSN3AA превышает другие генотипы на уровне p<0,001. По остальным генам частота гомозигот A/A и С/С была значительно выше, чем B/B и T/T (p<0,001). Частоты альтернативных аллелей по всем генам достоверно различались (p<0,001).
Таблица 3.1 –Генетическая структура симментальской породы по генам CSN3, BLG, LALBA и LEP
| Ген | n | Частота генотипа, % | Частота аллеля, доли ед. | χ2 | |||
| A/A | A/B | B/B | A | B | |||
| CSN3 | 182 | 60,4±3,63a | 36,3±3,56a | 3,3±1,32a | 0,79±0,02 | 0,21±0,02 | 1,13 |
| BLG | 182 | 46,2±3,69a | 43,4±3,67b | 10,4±2,26ab | 0,68±0,02 | 0,32±0,02 | 0,061 |
| LALBA | 182 | 50,0±3,71a | 44,0±3,68b | 6,0±1,76ab | 0,72±0,02 | 0,28±0,02 | 1,43 |
| C/C | C/T | T/T | C | T | χ2 | ||
| LEP | 182 | 43,4±3,67a | 47,3±3,70b | 9,3±2,15ab | 0,67±0,03 | 0,33±0,03 | 1,0 |
Здесь и далее одинаковыми буквами отмечены группы, имеющие достоверные различия по частотам генотипов, уровень достоверности указан в тексте.
Таблица 3.2 – Генетическая структура породы «Сибирячка» по генам CSN3, BLG, LALBA и LEP
| Ген | n | Частота генотипа, % | Частота аллеля,
доли ед. |
χ2 | |||
| A/A | A/B | B/B | A | B | |||
| CSN3 | 131 | 71,0±3,96a | 26,7±3,86a | 2,3±1,31a | 0,84±0,02 | 0,16±0,02 | 0,224 |
| BLG | 131 | 35,9±4,19a | 43,5±4,33b | 20,6±3,53ab | 0,58±0,03 | 0,42±0,03 | 1,592 |
| LALBA | 131 | 48,9±4,37a | 45,0±4,35b | 6,1±2,09ab | 0,72±0,03 | 0,28±0,03 | 1,144 |
| C/C | C/T | T/T | C | T | |||
| LEP | 131 | 41,2±4,30a | 48,1±4,36b | 10,7±2,70ab | 0,65±0,03 | 0,35±0,03 | 0,332 |
В выборке животных породы «Сибирячка» наблюдалась высокая частота гомозигот CSN3AA в сравнении с остальными генотипами (p<0,001). По генам BLG и LALBA различий между генотипами A/A и A/B не выявлено.
Сравнительный популяционно-генетический анализ распределениягенотипических классов по изучаемым генам не выявил значительных различий между породами, за исключением частот встречаемости гомозиготCSN3AA и BLGBB, которые у «Сибирячки» были выше, чем у симменталов (p<0,05).
Сходную генетическую структуру отмечают и в других породах крупного рогатого скота [3, 5,10, 111]. Очевидно, что какого-либо селективного отбора в отношении отдельных генотипов не было, а структура формировалась в условиях случайной комбинации аллелей и сохранялась на протяжении многих поколений. В нашей работе соотношение генотипических классов в породах по всем локусам соответствует теоретически ожидаемому, рассчитанному по формуле Харди-Вайнберга, что указывает на генное равновесие в популяции, которое поддерживается при панмиксии и отсутствии действия фактора отбора, дрейфа генов или мутационного процесса. Частота встречаемости аллеля A и C в 2-3 раза превышает альтернативные варианты генов. Вероятно, такое соотношение частот аллелей сформировалось без участия давления отбора, преимущественно за счет использования случайных генотипов племенных животных. Однако, учитывая, что быки ранее не были генотипированы по этим локусам либо их генотипы не учитывались при подборе, а аллельные варианты в гаметах присутствуют с равной вероятностью, то вклад генотипа быков-производителей в формировании структуры становится незначительным в отношении распределения генотипических классов. Возможно, эти гены слабо подвержены также давлению естественного отбора и представляют собой селективно нейтральные локусы. Низкую частоту аллелей В и Т следует связывать с мутационным процессом, в результате которого от предковой формы аллелей A и C появились новые варианты генов, которые не получили широкого распространения. Если связывать высокую частоту аллеля A с повышенным удоем у коров, то отбор более высокоудойных производителей, вероятно с генотипами A/A и A/B, мог снизить долю гомозигот B/B у потомков. Однако, у мясных пород также наблюдается схожая генетическая структура [6], что даёт основание считать, что данные аллельные варианты локусов не подвергались отбору, в том числе естественному. Каких-либо доказательств снижения фертильности или жизнеспособности носителей аллеля B нами в литературе не обнаружено.
В таблице 3.3 представлены значения уровня полиморфности (Na) и средней степени гетерозиготности (Caср) пород по исследуемым генам. У коров симментальской породы и «Сибирячки» число активно действующих аллелей, на что указывает уровень полиморфности, было наиболее высоким по генам LEP и LALBA, и низким – по CSN3. По гену BLG наблюдается породное различие: у симменталов – 1,770 и у Сибирячки — 1,323. Средняя гетерозиготность пород высокая и находится на уровне 40%, что свидетельствует о достаточно высокой генетической изменчивости, которая будет поддерживаться в поколениях.
Таблица 3.3 — Степень гетерозиготности (Ca) и уровень полиморфности (Na) генов CSN3, BLG, LALBA и LEP
| Локус | Показатель | Порода | |
| Симментальская | Сибирячка | ||
| CSN3 | Сa | 0,360,036 | 0,2670,039 |
| Na | 1,497 | 1,357 | |
| BLG | Сa | 0,430,036 | 0,4350,043 |
| Na | 1,770 | 1,323 | |
| LALBA | Сa | 0,430,037 | 0,4580,044 |
| Na | 1,676 | 1,68 | |
| LEP | Сa | 0,480,037 | 0,4810,044 |
| Na | 1,793 | 1,829 | |
| Caср | 0,425 | 0,41 | |
Таким образом, в ходе исследования двух пород установлены незначительные различия по частоте встречаемости генотипов и аллелей. Учитывая значимость отдельных аллелей для продуктивности, для повышения эффективности селекции следует вести поиск комплексных генотипов, сочетающих благоприятные комбинации по разным локусам. Такой отбор позволит выявить, в первую очередь, быков-носителей желательных аллелей, в затем формировать структуру популяции и сохранять генетическое разнообразие не только по уровню общей гетерозиготности, но и по составу гомозиготных вариантов разных селекционно-значимых локусов. Одновременно в стратегии селекции по отбору в пользу отдельных локусов важно учитывать, что генетическая структура популяции формируется в течение многих поколений и поддерживается в состоянии наиболее оптимального соотношения и концентрации аллелей. Изменение структуры популяции даже в отношении отдельных локусов может сопровождаться нежелательными изменениями признаков, в частности ухудшением адаптационных свойств и снижением устойчивости к заболеваниям. Поэтому необходим всесторонний анализ и контроль генетической изменчивости для обеспечения высокого уровня продуктивности и жизнеспособности популяций.
3.1.2 Генетическая структура популяций по комплексным генотипам
В соответствии с поставленной задачей была изучена генетическая структура пород по различным комбинациям генов. В таблице 2.4 представлено генотипическое распределение по полиморфизму генов CSN3 и BLG. Наиболее часто встречается комбинация A/A+A/B, реже всего комбинация с генотипом CSN3BB. Частота встречаемости гомозиготного генотипа A/A+B/B в породе «Сибирячка» была выше, чем у симменталов (p<0,05).
Таблица 3.4 –Частота встречаемости генотипов по комплексу геновCSN3 и BLG
| Генотип | Порода | ||
| CSN3 | BLG | Симментальская | «Сибирячка» |
| A/A | A/A | 25,3±3,22 | 22,1±3,63 |
| A/B | 27,5±3,31 | 29,8±4,0 | |
| B/B | 7,7±1,98a | 19,1±3,43a | |
| A/B | A/A | 19,8±2,95 | 12,2±2,86 |
| A/B | 13,7±2,55 | 13,0±2,94 | |
| B/B | 2,7±1,2 | 1,5±1,06 | |
| B/B | A/A | 1,1±0,77 | 1,5±1,06 |
| A/B | 2,2±1,09 | 0,8±0,78 | |
| B/B | 0,0±0,54 | 0,0±0,75 | |
Следующий изучаемый комплекс генотипов включал полиморфизмы генов CSN3 и LALBA (табл. 3.5). Наиболее распространенным генотипом является комбинация A/A+A/A и A/A+A/B. Уровень гетерозиготных комбинаций занимает промежуточное значение в обеих породах. Достоверных различий не выявлено.
Таблица 3.5 – Частота встречаемости генотипов по комплексу генов CSN3 и LALBA
| Генотип | Порода | ||
| CSN3 | LALBA | Симментальская | «Сибирячка» |
| A/A | A/A | 30,2±3,4 | 34,4±4,15 |
| A/B | 26,9±3,29 | 32,1±4,08 | |
| B/B | 3,3±1,32 | 4,6±1,83 | |
| A/B | A/A | 16,5±2,75 | 13,0±2,94 |
| A/B | 17,0±2,78 | 13,0±2,94 | |
| B/B | 2,7±1,2 | 0,8±0,8 | |
| B/B | A/A | 3,3±1,32 | 1,5±1,06 |
| A/B | 0,0±0,54 | 0,8±0,8 | |
| B/B | 0,0±0,54 | 0,0±0,75 | |
Чаще всего встречается комбинация гомозигот CSN3AA с LEPCC и LEPCT (табл. 3.6.)
Таблица 3.6 – Частота встречаемости генотипов по комплексу генов CSN3 и LEP
| Генотип | Порода | ||
| CSN3 | LEP | Симментальская | «Сибирячка» |
| A/A | C/C | 28,6±3,35 | 28,2±3,93 |
| C/T | 26,4±3,27 | 33,6±4,13 | |
| T/T | 5,5±1,69 | 11,5±2,8 | |
| A/B | C/C | 13,2±2,5 | 12,2±2,86 |
| C/T | 19,8±2,95 | 13,0±2,94 | |
| T/T | 3,3±1,32 | 1,5±1,06 | |
| B/B | C/C | 1,1±0,77 | 0,8±0,8 |
| C/T | 1,6±0,93 | 1,5±1,06 | |
| T/T | 0,5±0,5 | 0,0±0,75 | |
В симментальской породе распространенным генотипом оказался BLGAA+LALBAAA(на уровне 25%), а наиболее редким было сочетание гомозиготных генотипов (табл. 3.7.). У коров породы «Сибирячка» частота генотипа BLGBB+LALBAAA превосходит аналогичную комбинацию в группе симменталов (p<0,05).
Таблица 3.7 – Частота встречаемости генотипов по комплексу генов BLG и LALBA
| Генотип | Порода | ||
| BLG | LALBA | Симментальская | «Сибирячка» |
| A/A | A/A | 24,7±3,2 | 16,0±3,2 |
| A/B | 19,2±2,92 | 19,8±3,48 | |
| B/B | 2,2±1,09 | 1,5±1,06 | |
| A/B | A/A | 21,4±3,04 | 23,7±3,72 |
| A/B | 18,1±2,85 | 18,3±3,38 | |
| B/B | 3,8±1,42 | 0,0±0,75 | |
| B/B | A/A | 3,8±1,42a | 11,5±2,8a |
| A/B | 6,6±3,39 | 7,6±2,32 | |
| B/B | 0,0±0,54 | 3,8±1,67 | |
В двух породах комбинации генотипов BLG и LEP были относительно одинаковыми, за исключением сочетания BLGAA+LEPCT(табл. 3.8.). Частота встречаемости этого генотипа у симменталов была выше, чем у коров породы «Сибирячка» (p<0,05).
Таблица 3.8 – Частота встречаемости генотипов по комплексу генов BLG и LEP
| Генотип | Порода | ||
| BLG | LEP | Симментальская | «Сибирячка» |
| A/A | C/C | 18,7±2,89 | 16,8±3,27 |
| C/T | 23,1±3,12a | 9,1±2,51a | |
| T/T | 4,4±1,52 | 3,1±1,51 | |
| A/B | C/C | 18,7±2,89 | 16,8±3,27 |
| C/T | 19,8±2,95 | 22,9±3,67 | |
| T/T | 4,9±1,6 | 3,8±1,67 | |
| B/B | C/C | 5,5±1,69 | 7,6±2,32 |
| C/T | 4,9±1,6 | 9,2±2,53 | |
| T/T | 0,0±0,54 | 3,8±1,67 | |
Комплекс из двух полиморфизмов генов LALBA и LEP существенно не отличался между породами. Однако, наблюдается различие по комбинации генотипов B/B+C/C, у симменталов их частота была выше, чем у коров породы «Сибирячка» (p<0,05).
Таблица 3.9 – Частота встречаемости генотипов по комплексу генов LALBA и LEP
| Генотип | Порода | ||
| LALBA | LEP | Симментальская | «Сибирячка» |
| A/A | C/C | 14,8±2,63 | 19,8±3,48 |
| C/T | 26,9±3,29 | 24,4±3,75 | |
| T/T | 8,2±2,0 | 4,6±1,83 | |
| A/B | C/C | 23,1±3,12 | 20,6±3,53 |
| C/T | 19,8±2,95 | 21,4±3,58 | |
| T/T | 1,1±0,77 | 3,8±1,67 | |
| B/B | C/C | 4,9±1,6a | 0,8±0,8a |
| C/T | 1,1±0,77 | 2,3±1,31 | |
| T/T | 0,0±0,54 | 2,3±1,31 | |
Сравнительный анализ комплексных генотипов, включающих четыре локуса, не выявил достоверных различий между породами (табл. 3.10.).
Таблица 3.10 – Генетическая структура пород по комплексным генотипам
| Генотип | Порода | ||||
| CSN3 | BLG | LALBA | LEP | Симментальская (n=182) | «Сибирячка» (n=131) |
| A/A | A/A | A/A | С/С | 5,0±1,62 | 3,1±1,51 |
| С/T | 7,4±1,94 | 4,6±1,83 | |||
| T/T | 0,0±0,59 | 1,5±1,06 | |||
| A/B | С/С | 4,9±1,6 | 6,1±2,09 | ||
| С/T | 4,4±1,52 | 6,1±2,09 | |||
| T/T | 2,7±1,2 | 0,8±0,79 | |||
| B/B | С/С | 1,1±0,77 | 0,0±0,75 | ||
| С/T | 0,0±0,59 | 0,0±0,75 | |||
| T/T | 0,0±0,59 | 0,0±0,75 | |||
| A/B | A/A | С/С | 3,3±1,32 | 6,9±2,21 | |
| С/T | 6,6±1,84 | 7,6±2,32 | |||
| T/T | 2,2±1,09 | 1,5±1,06 | |||
| A/B | С/С | 7,7±1,98 | 5,3±1,96 | ||
| С/T | 4,9±1,6 | 6,1±2,09 | |||
| T/T | 0,5±0,52 | 1,5±1,06 | |||
| B/B | С/С | 1,6±0,93 | 0,0±0,75 | ||
| С/T | 0,5±0,52 | 0,8±0,79 | |||
| T/T | 0,0±0,59 | 0,0±0,75 | |||
| B/B | A/A | С/С | 1,6±0,93 | 3,8±1,67 | |
| С/T | 1,6±0,93 | 4,6±1,83 | |||
| T/T | 0,0±0,59 | 0,8±0,79 | |||
| A/B | С/С | 3,3±1,32 | 2,3±1,31 | ||
| С/T | 1,1±0,77 | 3,1±1,51 | |||
| T/T | 0,0±0,59 | 0,8±0,79 | |||
| B/B | С/С | 0,0±0,59 | 0,8±0,79 | ||
| С/T | 0,0±0,59 | 0,8±0,79 | |||
| T/T | 0,0±0,59 | 2,3±1,31 | |||
| AB/ | A/A | A/A | С/С | 2,7±1,2 | 3,1±1,51 |
| С/T | 5,5±1,69 | 3,1±1,51 | |||
| T/T | 0,5±0,52 | 0,0±0,75 | |||
| A/B | С/С | 3,8±1,42 | 3,8±1,67 | ||
| С/T | 5,5±1,69 | 1,5±1,06 | |||
| T/T | 0,0±0,59 | 0,8±0,79 | |||
| B/B | С/С | 1,1±0,77 | 0,0±0,75 | ||
| С/T | 0,0±0,59 | 0,0±0,75 | |||
| T/T | 0,0±0,59 | 0,0±0,75 | |||
| A/B | A/A | С/С | 1,1±0,77 | 2,3±1,31 | |
| С/T | 3,8±1,42 | 3,8±1,67 | |||
| T/T | 2,7±1,2 | 0,8±0,79 | |||
| A/B | С/С | 2,7±1,2 | 2,3±1,31 | ||
| С/T | 2,2±1,09 | 3,1±1,51 | |||
| T/T | 0,0±0,59 | 0,0±0,75 | |||
| B/B | С/С | 1,1±0,77 | 0,0±0,75 | ||
| С/T | 0,5±0,52 | 0,8±0,79 | |||
| T/T | 0,0±0,59 | 0,0±0,75 | |||
| B/B | A/A | С/С | 0,0±0,59 | 0,0±0,75 | |
| С/T | 0,5±0,52 | 0,0±0,75 | |||
| T/T | 0,0±0,59 | 0,0±0,75 | |||
| A/B | С/С | 0,5±0,52 | 0,8±0,79 | ||
| С/T | 1,6±0,93 | 0,8±0,79 | |||
| T/T | 0,0±0,59 | 0,0±0,75 | |||
| B/B | С/С | 0,0±0,59 | 0,0±0,75 | ||
| С/T | 0,0±0,59 | 0,0±0,75 | |||
| T/T | 0,0±0,59 | 0,0±0,75 | |||
| B/B | A/A | A/A | С/С | 0,0±0,59 | 0,8±0,79 |
| С/T | 1,1±0,77 | 0,0±0,75 | |||
| T/T | 0,5±0,52 | 0,0±0,75 | |||
| A/B | С/С | 0,0±0,59 | 0,0±0,75 | ||
| С/T | 0,0±0,59 | 0,8±0,79 | |||
| T/T | 0,0±0,59 | 0,0±0,75 | |||
| B/B | С/С | 0,0±0,59 | 0,0±0,75 | ||
| С/T | 0,0±0,59 | 0,0±0,75 | |||
| T/T | 0,0±0,59 | 0,0±0,75 | |||
| A/B | A/A | С/С | 1,1±0,77 | 0,0±0,75 | |
| С/T | 1,1±0,77 | 0,8±0,79 | |||
| T/T | 0,0±0,59 | 0,0±0,75 | |||
| A/B | С/С | 0,0±0,59 | 0,0±0,75 | ||
| С/T | 0,0±0,59 | 0,0±0,75 | |||
| T/T | 0,0±0,59 | 0,0±0,75 | |||
| B/B | С/С | 0,0±0,59 | 0,0±0,75 | ||
| С/T | 0,0±0,59 | 0,0±0,75 | |||
| T/T | 0,0±0,59 | 0,0±0,75 | |||
| B/B | A/A | С/С | 0,0±0,59 | 0,0±0,75 | |
| С/T | 0,0±0,59 | 0,0±0,75 | |||
| T/T | 0,0±0,59 | 0,0±0,75 | |||
| A/B | С/С | 0,0±0,59 | 0,0±0,75 | ||
| С/T | 0,0±0,59 | 0,0±0,75 | |||
| T/T | 0,0±0,59 | 0,0±0,75 | |||
| B/B | С/С | 0,0±0,59 | 0,0±0,75 | ||
| С/T | 0,0±0,59 | 0,0±0,75 | |||
| T/T | 0,0±0,59 | 0,0±0,75 | |||
В заключение следует отметить,что несмотря на то, что для популяционных сравнений были использованы породы с разной эволюционной историей, степень генотипического разнообразия по исследуемым полиморфным вариантам генов формируется за счет уникальных генотипов отдельных особей. В процессе породообразования отбор по признакам продуктивности нивелирует межпопуляционные различия по генам, контролирующим признаки. При достижении высоких показателей молочной продуктивности эти различия будут неуклонно снижаться. В то же время выявленные нами различия могут свидетельствовать о породных особенностях.
3.1.3 Популяционно-генетические параметры стад на основе полиморфизмов генов CSN3, BLG, LALBA и LEP
В таблице 3.11 представлена популяционно-генетическая характеристика пород по комплексу исследуемых полиморфизмов генов, которая отражает состояние популяции с точки зрения ее адаптационных качеств. Считается, что высокая степень гетерогенности популяции связана с жизнеспособностью и продуктивным долголетием животных. Данные таблицы вновь указывают на сходство генетической структуры пород по показателям ожидаемой (He) и наблюдаемой (Ho) гетерозиготности и гомозиготности (Ca). Рассчитанный индекс фиксации (Fis) характеризует степень отклонения частот встречаемости гетерозигот от теоретического распределения по Харди-Вайнбергу. В обеих породах отрицательный индекс фиксации, приближенный к нулевому значению, указывает на небольшой избыток гетерозигот и равновесное состояние популяции.
Таблица 3.11 — Популяционно-генетические параметры популяции породы «Сибирячка» и симментальской породы крупного рогатого скота
| Показатель | Симментальская порода | «Сибирячка» |
| Ca, % | 59,5 | 60,0 |
| He, % | 40,5 | 40,0 |
| Ho, % | 42,8 | 40,8 |
| Fis | -0,06 | -0,02 |
Са – ожидаемая гомозиготность, Не – ожидаемая гетерозиготность, Но — наблюдаемая гетерозиготность, Fis – индекс фиксации.
Соотношение генотипических классов в породах по всем локусам соответствует теоретически ожидаемому, рассчитанному по формуле Харди-Вайнберга, что указывает на генное равновесие в популяции, которое поддерживается при панмиксии и отсутствии действия фактора отбора, дрейфа генов или мутационного процесса. Частота встречаемости аллеля A и C в 2-3 раза превышает альтернативные варианты генов. Вероятно, такое соотношение частот аллелей сформировалось без участия давления отбора, преимущественно за счет использования случайных генотипов племенных животных. Однако, учитывая, что быки ранее не были генотипированы по этим локусам либо их генотипы не учитывались при подборе, а аллельные варианты в гаметах присутствуют с равной вероятностью, то вклад генотипа быков-производителей в формировании структуры становится незначительным в отношении распределения генотипических классов. Возможно, эти гены слабо подвержены также давлению естественного отбора и представляют собой селективно нейтральные локусы. Низкую частоту аллелей В и Т следует связывать с мутационным процессом, в результате которого от предковой формы аллелей A и C появились новые варианты генов, которые не получили широкого распространения. Если связывать высокую частоту аллеля A с повышенным удоем у коров, то отбор более высокоудойных производителей, вероятно с генотипами A/A и A/B, мог снизить долю гомозигот B/B у потомков. Однако, у мясных пород также наблюдается схожая генетическая структура, что даёт основание считать, что данные аллельные варианты локусов не подвергались отбору, в том числе естественному. Каких-либо доказательств снижения фертильности или жизнеспособности носителей аллеля B нами в литературе не обнаружено.
3.1.4.Генетическая структура популяции симментальского скота по генам CSN3 и BLG в инбредной и аутбредной группах коров
Анализ генетической структуры популяции в зависимости от наличия инбридинга по полиморфизму CSN3 показал, что животные из аутбредной и инбредной групп не различались между собой по частоте встречаемости аллелей. Обе выборки характеризовались преобладанием аллеля A над аллельным вариантом В(p < 0,05).
| Популяционная выборка | n | Частота генотипа, доли ед. | Частота аллеля, доли ед. | χ2 | |||
| A/A | A/B | B/B | A | B | |||
| Инбредная | 67 | 0,672±0,11 | 0,299±0,102 | 0,032±0,122 | 0,821±0,033 | 0,179±0,033 | 0,100 |
| Аутбредная | 87 | 0,529±0,074 | 0,437±0,08 | 0,034±0,105 | 0,747±0,033 | 0,253±0,033 | 0,025 |
Таблица 3.12 — Распределение частот аллелей и генотипов по гену CSN3 в инбредной и аутбредной группах коров
В таблице 3.12 представлены частоты генотипов и аллелей по гену CSN3. В обеих популяционных выборках наблюдалось преобладание гомозиготного генотипа A/A. Наиболее редким генотипом в обеих выборках был гомозиготнй генотип B/B, частота встречаемости которого была максимально 3,4%. Анализ соотношения генотипов по гену CSN3 в инбредной и аутбредной группах животных показал, что достоверных различий между группами не выявлено.
В обеих выборках частота встречаемости аллеля A (63% в инбредной, 69% в аутбредной популяционной выборке) была выше, чем встречаемость аллеля B (37% и 31%, соответственно).
Генетическая структура аутбредной и инбредной популяционных выборок крупного рогатого скота симментальской породы представлена в таблице 3.13.
Таблица 3.13 — Распределение частот аллелей и генотипов по гену BLG в инбредной и аутбредной группах коров
| Популяционная выборка | n | Частота генотипа, доли ед. | Частота аллеля, доли ед. | χ2 | |||
| A/A | A/B | B/B | A | B | |||
| Инбредная | 67 | 0,403±0,094 | 0,552±0,082 | 0,045±0,12 | 0,679±0,04 | 0,321±0,04 | 0,071 |
| Аутбредная | 87 | 0,471±0,077 | 0,388±0,06 | 0,141±0,085 | 0,672±0,036 | 0,328±0,036 | 0,017 |
Анализ распределения генотипов по гену бета-лактоглобулина показал, что в группе инбредных животных преобладал гетерозиготный генотип A/B (55,2%), а в аутбредной популяционной выборке гомозиготный генотип A/A (47,1%). Достоверные различия по частотам генотипов не выявлены.
Эмпирическое распределение частот генотипов в популяционных выборках по генам CSN3 и BLG соответствовало теоретически ожидаемому распределению по закону Харди-Вайнберга, что означает, что во всех группах соблюдается генное равновесие.
В таблицах 3.14 и 3.15 показано процентное соотношение животных с различными генотипами по генам каппа-казеина (CSN3) и бета-лактоглобулина (BLG).
Таблица 3.14 — Соотношение генотипов по гену CSN3 в инбредной и аутбредной популяционных выборках коров, %
| Популяционная выборка | A/A
(n=91) |
A/B
(n=58) |
B/B
(n=5) |
| Инбредная | 50,05,24 | 35,06,26 | 40,021,91 |
| Аутбредная | 50,05,24 | 65,06,26 | 60,021,91 |
Наибольшее количество животных в популяционной выборке имеют генотип A/A, животные-носители данного генотипа находятся в равном соотношении между двумя группами. В аутбредной выборке больше животных, имеющих генотип A/B (p<0,001).
Таблица 3.15 — Соотношение генотипов по гену BLG в инбредной и аутбредной популяционных выборках коров, %
| Популяционная выборка | A/A
(n=69) |
A/B
(n=70) |
B/B
(n=15) |
| Инбредная | 39,05,87 | 53,05,97 | 20,010,33 |
| Аутбредная | 61,05,87 | 47,05,97 | 80,010,33 |
Аутбредная выборка характеризуется более высокой частотой встречаемости гомозиготного генотипа A/A и желательного генотипа B/B (p<0,001).
3.1.5 Популяционно-генетические характеристики стада симментальской породы по генам CSN3, BLG, LALBA и LEP
В таблице 3.16представлены значения уровня полиморфности (Na) и средней степени гетерозиготности (Caср) пород по исследуемым генам. У коров симментальской породы и «Сибирячки» число активно действующих аллелей, на что указывает уровень полиморфности, было наиболее высоким по генам LEP и LALBA, и низким – по CSN3. По гену BLG наблюдается породное различие: у симменталов – 1,770 и у Сибирячки — 1,323. Средняя гетерозиготность пород высокая и находится на уровне 40%, что свидетельствует о достаточно высокой генетической изменчивости, которая будет поддерживаться в поколениях. Небольшие различия по гетерозиготности отмечены между породами по локусу CSN3.
Таблица 3.16 – Популяционно-генетические характеристики популяций по четырем локусам
| Локус | Показатель | Порода | |
| Симментальская | «Сибирячка» | ||
| CSN3 | Сa | 0,360,036 | 0,2670,039 |
| Na | 1,497 | 1,357 | |
| BLG | Сa | 0,430,036 | 0,4350,043 |
| Na | 1,770 | 1,323 | |
| LALBA | Сa | 0,430,037 | 0,4580,044 |
| Na | 1,676 | 1,68 | |
| LEP | Сa | 0,480,037 | 0,4810,044 |
| Na | 1,793 | 1,829 | |
| Caср | 0,425 | 0,41 | |
3.2 Оценка продуктивных качеств животных с разными генотипами по генам CSN3, BLG, LALBA и LEP
3.2.1 Молочная продуктивность коров симментальской породы разных генотипов
Данные по молочной продуктивности животных симментальской породы представлены в таблице 3.17-3.20. Сравнение средних значений показателей между разными генотипическими группами по CSN3 не выявило достоверных различий. В то же время животные с генотипами BLGAA имели более высокий удой за первую лактацию в сравнении с BLGAB (p<0,01). Жирномолочность по первой и второй лактациям достоверно выше у животных с генотипом LALBABB в сравнении с животными-носителями генотипа LALBAAA (p<0,05). По данным таблицы 3.14 у коров первой лактации белковомолочность с генотипом LEPTTвыше, чем у LEPСС(p<0,05). По второй лактации животные с генотипом LEPTT превосходили коров с генотипом LEPСС по удою(p<0,05), но уступали по жирномолочности (p<0,05).
Таблица 3.17 — Показатели молочной продуктивности коров симментальской породы с разными генотипами по гену CSN3
| Генотип | n | Показатели за первые 305 дней лактации | ||
| Удой, кг | Жир, % | Белок, % | ||
| 1 лактация | ||||
| A/A | 67 | 7408163,23 | 3,970,02 | 3,250,01 |
| A/B | 49 | 7416156,4 | 3,940,02 | 3,280,01 |
| B/B | 6 | 7616556,48 | 3,970,03 | 3,250,05 |
| 2 лактация | ||||
| A/A | 53 | 8886210,72 | 3,90,02 | 3,260,01 |
| A/B | 39 | 9454210,25 | 3,920,02 | 3,290,01 |
| B/B | 6 | 9139515,05 | 3,870,04 | 3,260,04 |
| 3 лактация | ||||
| A/A | 42 | 8876228,46 | 3,860,02 | 3,290,01 |
| A/B | 30 | 8958401,55 | 3,880,03 | 3,30,01 |
| B/B | 3 | 8993653,82 | 3,930,05 | 3,310,02 |
Таблица 3.18 — Показатели молочной продуктивности коров симментальской породы с разными генотипами по гену BLG
| Генотип | n | Показатели за первые 305 дней лактации | ||
| Удой, кг | Жир, % | Белок, % | ||
| 1 лактация | ||||
| A/A | 51 | 7756170,55a | 3,930,02 | 3,260,01 |
| A/B | 56 | 7127163,15a | 3,990,02 | 3,250,01 |
| B/B | 14 | 7319311,64 | 3,920,04 | 3,270,02 |
| 2 лактация | ||||
| A/A | 39 | 9270234,31 | 3,890,02 | 3,270,01 |
| A/B | 47 | 9152208,72 | 3,930,02 | 3,270,01 |
| B/B | 12 | 8627416,93 | 3,880,03 | 3,290,02 |
| 3 лактация | ||||
| A/A | 25 | 8619355,63 | 3,870,03 | 3,290,01 |
| A/B | 42 | 9129275,0 | 3,870,02 | 3,290,01 |
| B/B | 8 | 8893728,25 | 3,920,04 | 3,290,02 |
Таблица 3.19 — Показатели молочной продуктивности симментальской породы с разными генотипами по гену LALBA
| Генотип | n | Показатели за первые 305 дней лактации | ||
| Удой, кг | Жир, % | Белок, % | ||
| 1 лактация | ||||
| A/A | 54 | 7497171,45 | 3,940,02a | 3,270,01 |
| A/B | 56 | 7438154,2 | 3,970,02 | 3,260,01 |
| B/B | 7 | 6740439,96 | 4,020,03a | 3,20,05 |
| 2 лактация | ||||
| A/A | 41 | 9199208,77 | 3,870,02a | 3,260,01 |
| A/B | 48 | 9005213,49 | 3,920,02 | 3,280,01 |
| B/B | 9 | 9465617,59 | 4,020,06a | 3,290,03 |
| 3 лактация | ||||
| A/A | 28 | 9152336,39 | 3,880,03 | 3,290,01 |
| A/B | 38 | 8717271,28 | 3,880,03 | 3,30,01 |
| B/B | 9 | 9001838,96 | 3,850,05 | 3,270,04 |
Таблица 3.20 — Показатели молочной продуктивности коров первой лактации симментальской породы с разными генотипами по гену LEP
| Генотип | n | Показатели за первые 305 дней лактации | ||
| Удой, кг | Жир, % | Белок, % | ||
| 1 лактация | ||||
| С/С | 61 | 7357172,49 | 3,970,01 | 3,230,01a |
| C/T | 51 | 7535160,34 | 3,940,02 | 3,280,01 |
| T/T | 9 | 7179387,98 | 3,960,03 | 3,290,03a |
| 2 лактация | ||||
| С/С | 52 | 8851224,61a | 3,950,02a | 3,280,01 |
| C/T | 40 | 9352199,75 | 3,870,02a | 3,270,01 |
| T/T | 6 | 9806352,07a | 3,870,06 | 3,250,02 |
| 3 лактация | ||||
| С/С | 47 | 8800231,04 | 3,860,02 | 3,30,01 |
| C/T | 25 | 9013427,19 | 3,880,03 | 3,280,02 |
| T/T | 3 | 9767331,3 | 3,950,05 | 3,310,01 |
Таким образом, установленные различия между группами животных симментальской породы разных генотипов демонстрируют ассоциативную связь полиморфных вариантов генов с некоторыми показателями продуктивности.
3.2.2 Молочная продуктивность коров породы «Сибирячка» разных генотипов
Данные по молочной продуктивности животных породы «Сибирячка» представлены в таблицах 3.21-3.24. Как следует из таблицы 3.15 животные первой лактации с генотипом CSN3BBимеют более высокий удой, чем коровы с генотипом CSN3AA(p<0,001). По гену BLG коровы с генотипом A/A превосходили гомозигот B/B на 947 кг (p<0,05). Животные с генотипом LALBAAAуступали по удою за третью лактацию LALBAAB (p<0,05) и LALBABB (p<0,001), при этом содержание жира в молоке у гетерозигот было выше (p<0,001). По первой лактации у коров с генотипом LEPCC наблюдаются более высокий удой в сравнении с генотипом LEPCT(p<0,05) и более высокая жирномолочность и белковомолочность по сравнению с генотипом LEPTT(p<0,001).
Таблица 3.21 — Показатели молочной продуктивности коров породы «Сибирячка» с разными генотипами по гену CSN3
| Генотип | n | Показатели за первые 305 дней лактации | ||
| Удой, кг | Жир, % | Белок, % | ||
| 1 лактация | ||||
| A/A | 70 | 6197,8164,8a | 4,000,03 | 3,120,01 |
| A/B | 21 | 6741,8287,7 | 4,030,04 | 3,140,02 |
| B/B | 2 | 7242,0122,00a | 3,990,24 | 3,070,02 |
| 2 лактация | ||||
| A/A | 39 | 5958,8178,73 | 3,950,02 | 3,120,01 |
| A/B | 10 | 6508,5173,79 | 3,900,05 | 3,110,01 |
| 3 лактация | ||||
| A/A | 103 | 5870,6106,59 | 4,140,02 | 3,130,01 |
| A/B | 17 | 5688,5274,01 | 4,140,06 | 3,150,01 |
Таблица 3.22 — Показатели молочной продуктивности коров породы «Сибирячка» с разными генотипами по гену BLG
| Генотип | n | Показатели за первые 305 дней лактации | ||
| Удой, кг | Жир, % | Белок, % | ||
| 1 лактация | ||||
| A/A | 29 | 6790,1255,28a | 4,040,04 | 3,130,01 |
| A/B | 40 | 6319,1209,88 | 4,010,04 | 3,110,01 |
| B/B | 24 | 5842,9265,35a | 3,980,03 | 3,120,01 |
| 2 лактация | ||||
| A/A | 11 | 6404,1244,08 | 4,020,07 | 3,120,01 |
| A/B | 22 | 6152,4226,74 | 3,910,02 | 3,120,01 |
| B/B | 16 | 5730,2280,87 | 3,930,02 | 3,120,01 |
| 3 лактация | ||||
| A/A | 22 | 6006,2263,03 | 4,080,04 | 3,130,01 |
| A/B | 51 | 5815,8161,96 | 4,110,04 | 3,140,01 |
| B/B | 47 | 5800,8137,23 | 4,050,03 | 3,130,01 |
Таблица 3.23 — Показатели молочной продуктивности коров третьей лактации породы «Сибирячка» с разными генотипами по гену LALBA
| Генотип | n | Показатели за первые 305 дней лактации | ||
| Удой, кг | Жир, % | Белок, % | ||
| 1 лактация | ||||
| А/А | 46 | 6404,2224,33 | 3,990,03 | 3,110,01 |
| А/В | 41 | 6248,8197,70 | 4,040,04a | 3,130,01 |
| В/В | 6 | 6519,2333,01 | 3,920,03a | 3,120,02 |
| 2 лактация | ||||
| А/А | 22 | 5875,5263,93 | 3,940,03 | 3,120,01 |
| А/В | 23 | 6235,2169,80 | 3,950,03 | 3,120,01 |
| В/В | 4 | 6202,5588,74 | 3,900,04 | 3,110,01 |
| 3 лактация | ||||
| А/А | 68 | 5582,1124,56a b | 4,080,02 | 3,140,01 |
| А/В | 40 | 6058,6179,78b | 4,140,05a | 3,140,01 |
| В/В | 11 | 6715,5138,89a | 3,930,04a | 3,110,01 |
Таблица 3.24 — Показатели молочной продуктивности коров породы «Сибирячка» с разными генотипами по гену LEP
| Генотип | n | Показатели за первые 305 дней лактации | ||
| Удой, кг | Жир, % | Белок, % | ||
| 1 лактация | ||||
| C/C | 39 | 6726,3193,73a | 4,060,04a | 3,130,01a |
| C/T | 40 | 6086,8232,53a | 3,980,03 | 3,120,01 |
| T/T | 14 | 6007,6350,98 | 3,940,02a | 3,100,01a |
| 2 лактация | ||||
| C/C | 15 | 6044,9285,02 | 3,930,04 | 3,120,01 |
| C/T | 22 | 6317,5187,79 | 3,960,03 | 3,110,01 |
| T/T | 12 | 5651,9344,39 | 3,930,03 | 3,120,01 |
| 3 лактация | ||||
| C/C | 34 | 5612,7195,41 | 4,110,04 | 3,130,01 |
| C/T | 46 | 6055,59161,45 | 4,020,04 | 3,140,01 |
| T/T | 40 | 5799,8159,17 | 4,040,03 | 3,130,01 |
Полученные результаты свидетельствуют о возможном генетическом сцеплении полиморфных генов с локусами количественных признаков. В то же время необходимо учитывать, что вклад отдельных генов в формирование сложно детерминированных признаков может быть незначительным. В любом случае влияние генотипа по генам, ассоциированным с признаками молочной продуктивности, в первую очередь, обусловлено генетической конституцией отдельной особи, а популяционная выборка отражает общую генотипическую компоненту в формировании различных фенотипических характеристик.
3.2.3 Частота аллельных вариантов генов у животных с разным уровнем молочной продуктивности
В таблице 3.25 представлено соотношение частот встречаемости аллельных вариантов генов у животных с высокими и низкими показателями молочной продуктивности по первой лактации. Из данных таблицы следует, что частота аллеля В гена CSN3 у высокопродуктивных животных выше, чем у низкопродуктивных по удою и содержанию жира (p<0,05-0,001). У животных с невысоким содержанием белкав молоке частота аллеля А по этому гену была выше, чем у высокопродуктивных (p<0,05). Аллель BLGАнаиболее часто встречался у животных, имеющих более высокие удои (p<0,01). Полученные различия были обнаружены только у коров породы «Сибирячка». Достоверных различий у симменталов не выявлено. Таким образом, вовлеченность полиморфных вариантов генов в признаки продуктивности наиболее ярко проявляется у молодой породы.
Таблица 3.25 – Частота встречаемости аллелей у низко- и высокопродуктивных животных
Здесь *-p<0,05, **-p<0,01, ***-p<0,001.
Таким образом, анализ молочной продуктивности в породах крупного рогатого скота у животных разных генотипов по полиморфизму генов свидетельствует об определённой доле влияния полиморфизма в формировании признаков молочной продуктивности. Не исключено, что высокая продуктивность в породах может нивелировать фенотипические различия по данным локусам, что снижает количество выявленных достоверных ассоциаций.
3.3 Воспроизводительные качества коров симментальской породы с разными генотипами по генам CSN3, BLG, LALBA и LEP
Показатели воспроизводства коров симментальской породы с разными генотипами представлены в таблице 3.26. Животные с генотипамиLALBAAAи LEPCTимели более ранний возраст осеменения в сравнении с LALBABBи LEPCC(p<0,05). Продолжительность стельности коровс генотипомLALBABBбыла достоверно ниже остальных (p<0,001). Межотельный период у коров с генотипм LEPCT был в среднем на 21 дней продолжительней по сравнению с генотипом LEPCС(p<0,05). Между группами животных с другими генотипами достоверных различий по показателям воспроизводства не установлено.
Таблица 3.26 — Воспроизводительные качества коров симментальской породы в зависимости от генотипа по генам CSN3, BLG, LALBA и LEP
| Генотип | n | Возраст первого осеменения, мес. | Стельность, дней | Сервис-период, дней | Межотельный период, дней | Сухостойный период, дней |
| CSNAA | 110 | 13,5±0,17 | 147,3±7,30 | 97,7±7,03 | 383,4±6,84 | 65,9±2,41 |
| CSNAB | 66 | 13,5±0,18 | 134,7±11,67 | 112,2±9,13 | 387,2±9,39 | 71,4±4,85 |
| CSNBB | 6 | 13,8±0,87 | 148,5±38,5 | 110,0±40,0 | 392,0±18,86 | 61,0±2,92 |
| BLGAA | 84 | 13,5±0,16 | 147,1±8,36 | 100,1±7,2 | 394,7±9,35 | 66,2±3,61 |
| BLGAB | 79 | 13,5±0,21 | 135,6±10,71 | 109,6±10,0 | 381,6±7,4 | 69,6±3,74 |
| BLGBB | 19 | 13,6±0,39 | 152,1±15,33 | 90,8±13,75 | 368,3±10,92 | 67,1±5,30 |
| LALBAAA | 91 | 13,2±0,13a | 149,0±9,23a | 99,9±6,95 | 389,4±9,41 | 64,5±2,83 |
| LALBAAB | 80 | 13,7±0,21 | 144,2±8,07b | 105,3±9,33 | 378,9±5,66 | 70,6±3,95 |
| LALBABB | 11 | 14,6±0,58a | 93,6±12,25ab | 114,2±31,07 | 400,7±24,98 | 70,7±8,74 |
| LEPCC | 78 | 13,8±0,2a | 134,9±8,76 | 104,5±8,24 | 372,7±5,59a | 67,2±3,11 |
| LEPCT | 87 | 13,2±0,17a | 145,6±8,96 | 104,5±8,17 | 399,8±10,11a | 67,1±3,78 |
| LEPTT | 1 | 13,6±0,31 | 163,4±20,9 | 83,6±12,19 | 389,4±18,03 | 75,4±10,38 |
Одним из важных показателей воспроизводительных качеств коров является легкость отела. Нами была проведена сравнительная оценка этого признака в зависимости от генотипа животных. Каких-либо ассоциативных связей между группами животных с учетом разной степени проявления признака не выявлено (табл. 3.27.).
Таблица 3.27 — Легкость отела в зависимости от генотипа по четырем генам, %
| Генотип | n | Легкость отела | |||
| Нормальный | Легкая патология | Умеренная патология | Тяжелая патология | ||
| CSNAA | 109 | 73,4±4,23 | 6,4±2,34 | 19,3±3,78 | 0,9±0,9 |
| CSNAB | 64 | 78,1±5,17 | 6,3±3,04 | 15,6±4,54 | 0±1,48 |
| CSNBB | 6 | 66,7±19,24 | 33,3±19,24 | 0±11,02 | 0±11,02 |
| BLGAA | 83 | 80,7±4,33 | 4,8±2,35 | 14,5±3,86 | 0±1,16 |
| BLGAB | 78 | 69,2±5,23 | 6,4±2,77 | 23,1±4,77 | 1,3±1,28 |
| BLGBB | 17 | 76,5±10,28 | 23,5±10,28 | 0±4,99 | 0±4,99 |
| LALBAAA | 90 | 73,3±4,66 | 7,8±2,83 | 18,9±4,13 | 0±1,08 |
| LALBAAB | 78 | 78,2±4,68 | 6,4±2,77 | 14,1±3,94 | 1,3±1,28 |
| LALBABB | 11 | 63,6±14,51 | 9,1±8,67 | 27,3±13,43 | 0±7,12 |
| LEPCC | 77 | 79,2±4,63 | 6,5±2,81 | 14,3±3,99 | 0±1,25 |
| LEPCT | 85 | 72,9±4,82 | 8,2±2,98 | 17,6±4,13 | 1,2±1,18 |
| LEPTT | 17 | 64,7±11,59 | 5,9±5,71 | 29,4±11,05 | 0±4,99 |
Таким образом, выявленные ассоциации по некоторым показателям воспроизводства свидетельствуют о вовлеченности полиморфизма генов в проявление репродуктивных качеств крупного рогатого скота. Что касается отсутствия схожих ассоциаций в разных породах, то это возможно связанно с особенностями генотипов, формирующих генетически разнородные группы.
3.4 Живая масса животных в зависимости от генотипа
Рост и развитие животных является важным селекционным признаком, определяющим бедующую продуктивность животных. Сведений о генетических маркерах, которые связаны с интенсивностью роста молодняка, достаточно мало. Очевидно, что при формировании такого сложного интегрального и многофакторного признака участвует целый комплекс генетических систем организма. В нашем исследовании был проведен анализ ассоциаций изученных генов с показателями живой массы животных в разные периоды онтогенеза (табл. 3.28 – 3.31). В ходе сравнительного анализа было установлено влияние генотипа по гену BLG на живую массу телят в возрасте 6 месяцев и по гену LEP при достижении возраста первого осеменения. У телят с генотипом BLGAAпоказатель был на 10,8 кг выше по сравнению с генотипом BLGAB(p<0,05). Живая масса коров с генотипом LEPCC в возрасте первого осеменения была выше, чем с генотипом LEPTT(p<0,05).
Таблица 3.28 – Живая масса животных с разными генотипами по гену CSN3
| Генотип | Живая масса, кг | |||||
| При рождении | 6 мес. | 10 мес. | 12 мес. | При 1-ом осеменении | 18 мес. | |
| A/A (n=110) | 30,5±0,3 | 170,9±1,3 | 275,3±2,8 | 335,6±3,2 | 371,6±4,2 | 447,7±4,0 |
| A/B (n=66) | 29,9±0,3 | 169,3±1,5 | 274,2±3,7 | 338,5±4,8 | 380,3±5,4 | 456,5±5,6 |
| B/B (n=6) | 29,7±0,8 | 161,2±5,2 | 277,8±13,4 | 334,0±15,8 | 358,5±13,6 | 433,4±23,4 |
Таблица 3.29 — Живая массаживотных с разными генотипами по гену BLG
| Генотип | Живая масса, кг | |||||
| При рождении | 6 мес. | 10 мес. | 12 мес. | При 1-ом осеменении | 18 мес. | |
| A/A (n=84) | 30,7±0,3 | 170,9±1,4a | 276,4±3,0 | 336,4±3,6 | 374,4±4,7 | 452,2±4,6 |
| A/B (n=79) | 29,7±0,4 | 160,1±1,6a | 271,8±3,4 | 333,3±4,1 | 370,1±4,8 | 445,08±4,8 |
| B/B (n=19) | 30,3±0,5 | 170,1±2,5 | 282,3±6,6 | 350,8±9,5 | 391,5±10,0 | 466,4±12,0 |
Таблица 3.30 — Живая массаживотных с разными генотипами по гену LALBA
| Живая масса, кг | ||||||||
| При рождении | 6 мес. | 10 мес. | 12 мес. | При 1-ом осеменении | 18 мес. | |||
| A/A (n=91) | 30,6±0,3 | 171,3±1,3 | 277,3±3,0 | 338,0±3,9 | 368,1±4,3 | 451,2±4,7 | ||
| A/B (n=80) | 30,1±0,3 | 168,8±1,5 | 273,8±3,4 | 335,3±4,0 | 379,6±5,2 | 450,8±5,0 | ||
| B/B (n=11) | 28,1±0,9 | 167,6±5,0 | 264,2±7,2 | 332,7±6,5 | 387,3±9,3 | 442,0±9,2 | ||
Таблица 3.31 – Живая массаживотных с разными генотипами по гену LEP
| Живая масса, кг | |||||||
| При рождении | 6 мес. | 10 мес. | 12 мес. | При 1-ом осеменении | 18 мес. | ||
| C/C (n=78) | 29,8±0,4 | 167,5±1,7 | 269,2±3,4 | 334,8±4,2 | 383,4±5,1a | 451,1±5,0 | |
| C/T (n=87) | 30,5±0,2 | 169,81±1,0 | 281,6±3,1 | 339,7±3,6 | 369,5±4,4 | 451,7±4,6 | |
| T/T (n=17) | 30,7±0,8 | 172,1±2,5 | 267,8±5,0 | 329,0±9,4 | 357,5±10,0a | 441,1±11,9 | |
Исходя из результатов анализа по ассоциированности полиморфизма генов с живой массой животных следует заключить о перспективности дальнейшего изучения полиморфизма этого гена в качестве маркера. Информация о его ассоциациях с показателями роста может быть полезной для проведения селекции племенных быков на легкость отела дочерей, поскольку это является залогом быстрого восстановления здоровья и последующей реализации продуктивного потенциала.
ЗАКЛЮЧЕНИЕ
В заключении следует сказать, что полученные в работе данные, по нашему мнению, вносят определенный вклад в понимание процесса формирования межпопуляционных различий и сходства по локусам, напрямую связанных с отбором по продуктивным признакам. Исследования полиморфных вариантов генов имеют важное значение не только в сравнительной оценке генотипического разнообразиястад, но и поиска генетических маркеров продуктивных и адаптивных качеств сельскохозяйственных животных.
В качестве объекта для популяционных сравнений были использованы разные по своему историческому происхождению породы, но с высокой реализованной молочной продуктивностью. В результате установлена генетическая структура в стадах по генам, генотипам и с учетом различных их комбинаций. Показано, что популяционные выборки находятся в состоянии генного равновесия, а значит факторы, способные его изменить, оказывают незначительное влияние. И даже длительный отбор по молочной продуктивности может не нарушить частотное распределение аллелей. За счет достаточно высокой степени гетерозиготности в породах будет поддерживаться генетическая изменчивость. Поэтому высокая специализация молочных пород, в частности разводимых в условиях Западной Сибири, не приводит к потере внутрипопуляционного наследственного разнообразия,во всяком случае, по изучаемым генами соответственно к снижению адаптивности.
В породах наблюдается полное совпадение фактических и ожидаемых частот генотипов, что может указывать на селективную нейтральность этих генов. При изучении влияния генотипа на различные показатели продуктивности, воспроизводства, роста и развития закономерной связи в породах часто не наблюдается. Во многих случаях отдельные генотипы оказывали положительное влияние на признак в одних стадах, в других – отрицательное. Это может быть связано как с генетическими породными особенностями, так и с неравновесием по сцеплению исследуемых генов с локусами, контролирующими количественные признаки. Если оценивать полученные нами достоверные различия между генотипами по различным показателям, то наиболее «желательным» генотипом в симментальской породе по удою является BLGАА, жирномолочности — LALBAВВ и LEPCC, белковомолочности – LEPTT. В породе Сибирячка более высокие показатели по удою у животных с генотипом CSN3ВВ, BLGАА, LALBAАВ и LALBAВВ, а также LEPCC, по жирномолочности – LALBAАА и LEPCC, по белковомолочности — LEPCC. Таким образом, сходные приоритетные генотипы у пород выявлены по удою — BLGАА и по содержанию жира в молоке — LEPCC. Нужно отметить, что коровы породы Сибирячки с генотипом LEPCC имели повышенный удой, жир и белок в молоке, а симменталы — более высокую живую массу при первом осеменении и короче межотельный период. При отборе животных с такими генотипами в качестве родительских пар можно ожидать появление потомков, имеющих более высокую частоту предпочтительных аллелей, либо их эффективную комбинацию, и как следствие, более высокую продуктивность по сравнению с родителями. Коррекцию генетической структуры стада можно проводить селекционно-племенной работой с максимальным использованием быков – носителей наиболее благоприятных генотипов по маркёрным генам.
ВЫВОДЫ
- Генетическая структура симментальской породы и Сибирячки по генам каппа-казеина (CSN3), бета-лактоглобулина (BLG), альфа-лактальбумина (LALBA) и лептина (LEP) находится в состоянии генного равновесия, так как соответствует теоретически ожидаемому распределению генотипических частот по формуле Харди-Вайнберга, что указывает на отсутствие существенного влияния факторов отбора, миграции, дрейфа генов и мутации на данном временном этапе существования пород.
- Среди трёх генотипических классов в каждом локусе наименьшую частоту встречаемости имели генотипы В/В (CSN3, BLG, LALBA) и Т/Т (LEP), уровень которых не превышал 10%. Низкую частоту этих гомозигот и соответствующих аллелей отмечают в других породах крупного рогатого скота.
- Частота встречаемости гетерозигот по каждому гену была относительно равной в породах. Высокий показатель средней гетерозиготности по локусам (на уровне 40%) свидетельствует о генетической изменчивости, адаптационном потенциале пород и создает основу для сохранения и поддержания генетического разнообразия.
- В породах отмечено значительное превосходство аллелей A и C по отношению к альтернативным аллелям В и Т. Уровень полиморфности был наиболее высоким по генам LEP и LALBA и низким – по CSN3. По гену BLG наблюдается породное различие: у симменталов – 1,77 и у Сибирячки — 1,32.
- Контроль над уровнем гетерозиготности популяции и оценка меж- и внутрипородного генетического разнообразия в разных эколого-географических зонах разведения животных обеспечит высокий уровень продуктивности без снижения адаптационных характеристик.
- Анализ ассоциаций полиморфных вариантов генов с показателями молочной продуктивности, воспроизводительными качествами, живой массой в разные периоды онтогенеза, выявил приоритетные генотипы для направленного отбора животных.
- Наиболее «желательным» генотипом в симментальской породе по удою является BLGАА, по жирномолочности — LALBAВВ и LEPCC, по белковомолочности – LEPTT. В породе Сибирячка более высокие показатели по удою были у животных с генотипом CSN3ВВ, BLGАА, LALBAАВ и LALBAВВ, а также LEPCC, по жирномолочности – LALBAАА и LEPCC, по белковомолочности — LEPCC. Таким образом, сходные приоритетные генотипы у пород выявлены по удою — BLGАА и по содержанию жира в молоке — LEPCC. В породе Сибирячка генотип LEPCCвлияет на повышение удоя, содержание жира и белка в молоке, а также живой массы при первом осеменении и сокращение межотельного периода (p<0,05 – 0,001) .
Список использованной литературы
