Титульный лист и исполнители
РЕФЕРАТ
Отчет о НИР «Исследование, разработка и практические мероприятия по применению препаратов биологического происхождения для защиты растений от биотических и абиотических стрессоров в органическом сельском хозяйстве» содержит 236 стр., 1ч., 60 рисунков, 63 таблиц,150 литературных источников, приложения.
Ключевые слова: химические пестициды, биопрепараты, регуляторы роста, органическое земледелие, озимая пшеница, яровой ячмень, горох.
Объекты исследования: Озимая пшеница, яровой ячмень, горох. химические пестициды, биопрепараты, возбудители корневых гнилей Fusarium oxysporum. Trichoderma atrobronium.
Цель исследования: Разработка комбинированных защитно-стимулирующих СЗР против возбудителя корневых гнилей Fusarium oxysporum. и агротехнические приемы их применения.
В задачи исследования входило:
- изучение эффективности экзометаболитов Trichoderma аtrobrunneum (ВКПМ F-1434) в отношении фитопатогенных возбудителей болезней;
- изучение влияния биофлаваноидов гречихи: хлорогеновая кислота, рутин, кверцетин на развитие гриба, вызывающего корневые гнили гороха, Fusarium oxysporum, in vitro;
- изучение влияния экзометаболитов гриба Trichoderma atrobrunneum на развитие гриба, вызывающего корневые гнили гороха, Fusarium oxysporum, in vitro;
- изучение влияния экзометаболитов гриба Trichoderma atrobrunneum на антиоксидантный статус проростков гороха, пшеницы, ячменя проростков гороха, пшеницы, ячменя, зараженных Fusarium oxysporum;
- испытание нового защитно-стимулирующего биологического препарата на рост и развитие проростков яровой пшеницы, ячменя и гороха;
- разработка и испытание комбинированного биопрепарата защитно-стимулирующего действия на зараженных сельскохозяйственных растениях в сравнении с химическими пестицидами и биопрепаратами в лабораторных условиях и полевых опытах.
Научная новизна.
Изучено влияние экзометаболитов Trichoderma atrobrunneum (ВКПМ F-1434), индивидуальных биофлаваноидов гречихи на развитие Fusarium oxysporum, in vitro и их влияние на антиоксидантный статус проростков гороха, пшеницы и ячменя, зараженных Fusarium oxysporum; разработан и испытан комбинированный биопрепарат защитно-стимулирующего действия против возбудителя корневых гнилей Fusarium oxysporum. в сравнении с химическими пестицидами, биофунгицидами и биопрепаратами в лабораторных и полевых условиях для органического сельского хозяйства.
Теоретическая и практическая значимость работы.
Получены патенты на изобретение: Штамм trichoderma atrobrunneum, обладающий антибактериальной активностью в отношении Bacillus anthracisо.а./ Патент на изобретение RU 2710783 C1, 13.01.2020. Заявка № 2019102438 от 29.01.2019; Линимент ранозаживляющий, содержащий бактериостатические метаболиты T. atrobrunneum f-1434 и сумму биофлавоноидов гречихи/ Патент на изобретение RU 2719723 C1, 22.04.2020. Заявка № 2019121127 от 03.07.2019.
Получен акт внедрения на новый биопрепарат. Получена золотая медаль на XXI Всероссийской агропромышленной выставке «Золотая осень», 2020 г.
Результаты исследований позволят рекомендовать эффективные приемы защиты озимой пшеницы от грибных болезней на основе биофунгицидов, ярового ячменя и гороха с помощью комбинированного защитно-стимулирующего СЗР. Внедрение разработанных технологических приемов повысит устойчивость агроценоза озимой пшеницы и ярового ячменя к сумме неблагоприятных абиотических и биотических факторов. В результате будет получена прибавка урожайности культур и снижена себестоимость производства зерна.
В настоящем отчете о НИР использованы ссылки на следующие нормативно-правовые и нормативно-технические акты.
- Доктрина продовольственной безопасности Российской Федерации, утвержденная Указом Президента Российской Федерации от 30 января 2010 г. N 120 «Об утверждении Доктрины продовольственной безопасности Российской Федерации»
- Постановление правительства Российской Федерации от 14 июля 2012 г. N 717 о государственной программе развития сельского хозяйства и регулирования рынков сельскохозяйственной продукции, сырья и продовольствия на 2013 — 2020 год.
- Комплексная программа развития биотехнологий в Российской Федерации на период до 2020 года (утвержденной Правительством РФ от 24 апреля 2012 г. № 1853п-П8
- Проект Закона «Об органическом производстве и обороте продукции», принятый в первом чтении Государственной Думой 25 июля 2018 года и одобренный Советом Федерации 28 июля 2018 года.
- Федеральный закон от 29 декабря 2006 года N 264-ФЗ «О развитии сельского хозяйства».
- Федеральный закон от 3 августа 2018 г. N 280-ФЗ «Об органической продукции и о внесении изменений в отдельные законодательные акты Российской Федерации».
- Постановление правительства Российской Федерации от 14 июля 2012 г. N 717 о государственной программе развития сельского хозяйства и регулирования рынков сельскохозяйственной продукции, сырья и продовольствия на 2013 — 2020 год.
ОБОЗНАЧЕНИЯ И СОКРАЩЕНИЯ
В настоящем отчете о НИР применяют следующие термины с соответствующими определениями:
СЗР- средства защиты растений. Все средства защиты растений классифицируются по химическому составу, объектам применения, по характеру действия и способам проникновения во вредный организм.
in vitro — это технология выполнения экспериментов, когда опыты проводятся «в пробирке» — вне живого организма.
БАВ- биологически активные вещества — химические вещества, обладающие при небольших концентрациях высокой физиологической активностью по отношению к определённым группам живых организмов (к человеку, растениям, животным, грибам и пр.)
ПДК — предельно допустимые концентрации – это величина, характеризующая максимальное количество вещества, которое может находиться в определенном объеме измерений и не причинять ущерба живым организмам (в том числе, и человеку).
NADPH – никотинамиддифосфат восстановленный — широко распространённый в природе кофермент некоторых дегидрогеназ — ферментов, катализирующих окислительно-восстановительные реакции в живых клетках. НАДФ принимает на себя водород и электроны
СОД – супероксиддисмутаза, это антиоксидантный фермент, защищает клетки от постоянно образующихся высокотоксичных кислородных радикалов
ТСХ – тонкослойная хроматография — способ анализа (реже препаративного разделения) смесей жидких или твердых веществ, основанный на различном сродстве разделяемых веществ к неподвижной (сорбент) и подвижной (элюент) фазам.
NDVI – вегетационный индекс — это числовой показатель качества и количества растительности на участке поля. Он рассчитывается по спутниковым снимкам и зависит от того, как растения отражают и поглощают световые волны разной длины.
ВВЕДЕНИЕ
На современном этапе для сельхозпроизводителей актуальной проблемой является замена действующих химических средств биологическими, которые применяются в растениеводстве. Несмотря на высокую эффективность, химические пестициды одновременно влияют на полезные нецелевые объекты, вызывают развитие резистентности у фитофагов и фитопатогенов, что приводит к нежелательному увеличению норм расхода пестицидов. Постепенное накопление синтетических химических средств защиты растений в почве, водоемах, растительной продукции отрицательно влияет на здоровье человека и животных.
Биопрепараты помогают эффективно решить все те же проблемы, которые решают с помощью химических аналогов, но делают это намного более качественно и менее затратно, а главное — безопасно. Федеральным законом от 29 декабря 2006 года N 264-ФЗ «О развитии сельского хозяйства» определены виды экономической деятельности, при осуществлении которых применяются способы, методы и технологии, направленные на обеспечение благоприятного состояния окружающей среды, укрепление здоровья человека, сохранение и восстановление плодородия почв. Федеральным законом от 3 августа 2018 г. N 280-ФЗ «Об органической продукции и о внесении изменений в отдельные законодательные акты Российской Федерации», статья 4 «Требования к производству органической продукции» введен запрет на применение агрохимикатов, пестицидов, а для борьбы с вредителями, болезнями растений применять средства биологического происхождения.
Спрос на органические продукты намного опережает предложение, как в отношении экспорта продукции, так и продукции для внутреннего рынка. Для обеспечения спроса на продукцию, произведенную в соответствии с ГОСТом 33980-2016 «Продукция органического производства. Правила производства, переработки, маркировки и реализации» необходимо ввести в органическое сельхозпроизводство не менее 2000 сельхозпроизводителей.
Следовательно, предприятиям, планирующим работу в направлении органического земледелия, уже сейчас необходимо знать о существующих и разрабатываемых биологических препаратах. В Законе утверждён ассортимент биологических средств защиты растений, разрешенных к применению. Этот перечень, безусловно, может расширяться с появлением более эффективных препаратов. Биологизация — это насущная необходимость, но подходить к ней нужно с учётом многих факторов, чтобы процесс шёл не спонтанно и резко, а постепенно и мягко.
В связи с этим исследования по разработке препаратов биологического происхождения для защиты растений от биотических и абиотических стрессов в органическом сельском хозяйстве являются актуальными.
Цель исследования: Разработка комбинированных защитно-стимулирующих СЗР против возбудителя корневых гнилей Fusarium oxysporum. и агротехнические приемы их применения.
В задачи исследования входило:
- изучение эффективности экзометаболитов Trichoderma аtrobrunneum (ВКПМ F-1434) в отношении фитопатогенных возбудителей болезней;
- изучение влияния биофлаваноидов гречихи: хлорогеновая кислота, рутин, кверцетин на развитие гриба, вызывающего корневые гнили гороха, Fusarium oxysporum, in vitro;
- изучение влияния экзометаболитов гриба Trichoderma atrobrunneum на развитие гриба, вызывающего корневые гнили гороха, Fusarium oxysporum, in vitro;
- изучение влияния экзометаболитов гриба Trichoderma atrobrunneum на антиоксидантный статус проростков гороха, пшеницы, ячменя проростков гороха, пшеницы, ячменя, зараженных Fusarium oxysporum;
- испытание нового защитно-стимулирующего биологического препарата на рост и развитие проростков яровой пшеницы, ячменя и гороха;
- разработка и испытание комбинированного биопрепарата защитно-стимулирующего действия на зараженных сельскохозяйственных растениях в сравнении с химическими пестицидами и биопрепаратами в лабораторных условиях и полевых опытах.
Научная новизна.
Изучено влияние экзометаболитов Trichoderma atrobrunneum (ВКПМ F-1434), индивидуальных биофлаваноидов гречихи на развитие Fusarium oxysporum, in vitro и их влияние на антиоксидантный статус проростков гороха, пшеницы и ячменя, зараженных Fusarium oxysporum; разработан и испытан комбинированный биопрепарат защитно-стимулирующего действия против возбудителя корневых гнилей Fusarium oxysporum. в сравнении с химическими пестицидами, биофунгицидами и биопрепаратами в лабораторных и полевых условиях для органического сельского хозяйства.
Теоретическая и практическая значимость работы.
Получены патенты на изобретение: Штамм trichoderma atrobrunneum, обладающий антибактериальной активностью в отношении Bacillus anthracisо.а./ Патент на изобретение RU 2710783 C1, 13.01.2020. Заявка № 2019102438 от 29.01.2019; Линимент ранозаживляющий, содержащий бактериостатические метаболиты T. atrobrunneum f-1434 и сумму биофлавоноидов гречихи./ Патент на изобретение RU 2719723 C1, 22.04.2020. Заявка № 2019121127 от 03.07.2019.
Получен акт внедрения (приложение 1) на новый биопрепарт.
Получена золотая медаль (приложение 2) на XXI Всероссийской агропромышленной выставке «Золотая осень», 2020 г
Результаты исследований позволят рекомендовать эффективные приемы защиты озимой пшеницы от грибных болезней на основе биофунгицидов, ярового ячменя и гороха с помощью комбинированного защитно-стимулирующего СЗР. Внедрение разработанных технологических приемов повысит устойчивость агроценоза озимой пшеницы и ярового ячменя к сумме неблагоприятных абиотических и биотических факторов. В результате будет получена прибавка урожайности культур и снижена себестоимость производства зерна.
РАЗДЕЛ I. ИНФОРМАЦИОННО-АНАЛИТИЧЕСКИЙ ОБЗОР СОСТОЯНИЯ ИЗУЧЕННОСТИ ВОПРОСА ПО СОЗДАНИЮ ПРЕПАРАТОВ ДЛЯ ОРГАНИЧЕСКОГО СЕЛЬСКОГО ХОЗЯЙСТВА
1.1 Современные биопрепараты для растениеводства и земледелия
Двадцатый век характеризовался широким применением и внедрением минеральных удобрений и химических средств защиты растений. Однако на рубеже веков стало ясно, что, широкое применение химикатов в сельском хозяйстве, ведет к накоплению почвами химических соединений и способствует ухудшению плодородия почвы и получению продуктов питания с высоким содержанием нитратов, нитритов, пестицидов, гербицидов и т.д., что, несомненно, отрицательно сказывается на здоровье населения планеты. В конце столетия свою нишу в растениеводстве и земледелии заняли принципиально новые удобрения и средства защиты – это биологические препараты и удобрения.
В настоящее время на рынке удобрений и средств защиты растений всё чаще встречаются средства биологического происхождения, но пока не находят широкого применения. Одна из причин такой ситуации – недооценка их положительных качеств и увлечение химическими средствами. Именно желание скорейшего достижения максимального эффекта до сих пор остается приоритетом в выборе удобрений.
Сокращение объемов применения минеральных удобрений и средств защиты растений в сочетании с использованием новейших биотехнологических разработок позволяют в совокупности получить высококачественную экологически чистую сельскохозяйственную продукцию и способствуют снижению загрязнения окружающей среды.
Внедрение биологических препаратов к тому же направлено на оптимизацию биологических показателей, которые определяют механизмы саморегуляции почвенных экосистем и часто используют в качестве диагностирующих уровень плодородия почв [29].
В отличие от химических препаратов биопрепараты обладают более ярко выраженной избирательностью действия, они признаны также безвредными для человека и животных и быстро разлагаются в почве.
Внедрение таких агротехнологий, наравне с получением высоких урожаев, позволяет получать экологическую безопасность сельскохозяйственного производства, не нанося вред окружающей .
Применение биологических препаратов и стимуляторов роста растений может привести к большей доходности, поскольку они стоят гораздо меньше, по сравнению с традиционными удобрениями. Еще одна причина продолжать разработки – их инвестирование и внедрение, а также запрет использования пестицидов в Европе к 2030 г. Благодаря этому биологические препараты смогли бы когда-нибудь полностью заменить химические удобрения и пестициды [99].
1.1.1 Регуляторы роста растений
Существует большое количество регуляторов роста растений биологического происхождения: бактериальные и природные (Трандафилова и др., 2009). Система регуляции физиологически активными соединениями во многом определяет характер таких важнейших физиологических процессов, как рост и формирование различных органов, время и характер цветения, сроки созревания, переход к состоянию покоя и выход из него семян и почек. При этом интенсивность воздействия на растения зависит от вида препарата, его концентрации, способа применения (отдельно и в смеси) и кратности обработок (семян и растений).
Низкие нормы расхода и возможность управлять процессами роста и развития растений определяют перспективность более широкого применения регуляторов роста биологического происхождения в сельскохозяйственном производстве [25].
По мнению многих ученых, участвующих в разработке технологических приемов выращивания сельскохозяйственных культур, регуляторы роста растений должны пользоваться не меньшим спросом, чем минеральные удобрения или средства защиты растений.
Перспективное направление – создание микробиологических (бактериальных) препаратов, представляющих собою живые клетки отселектированных по полезным свойствам микроорганизмов, которые находятся или в культуральной жидкости, или адсорбированы на нейтральном носителе.
Еще в Советском Союзе выпускали три вида бактериальных удобрений: азотобактерин, нитрагин и фосфоробактерин, не получившие тогда широкого применения. В настоящее время интерес к применению биопрепаратов на основе почвенных микроорганизмов для растениеводства и земледелия возрос и сопровождается бурным ростом сообщений о новых формах биопрепаратов и их применении, регистрацией товарных знаков, патентов [23, 29].
Биопрепараты на основе ассоциативных микроорганизмов комплексного действия хорошо зарекомендовали себя в широком спектре сельскохозяйственных культур в России и за рубежом. Микроорганизмы, наряду с азотфиксацией, продуцируют физиологически активные вещества, которые, воздействуя на растения, стимулируют их рост и развитие. Новые штаммы микроорганизмов способны подавлять развитие патогенной микрофлоры, что в итоге снижает заболеваемость растений, повышает их продуктивность, улучшает качество растениеводческой продукции (Завалин, 2005). Связано это с тем, что микроорганизмы хорошо приживаются в зоне корневой системы растений, усиливая свою активность. В результате значительно возрастает интенсивность микробиологических, биохимических и иных процессов в ризосфере, повышается растворимость труднодоступных элементов питания, накапливается биологический азот [67].
Самым крупным разработчиком бактериальных препаратов в России является ВНИИ сельскохозяйственной микробиологии, располагающий уникальной коллекцией бактерий и налаженной схемой производства биопрепаратов на их основе. ГПП «Экос» ВНИИСХМ выпускает ряд бактериальных препаратов – Ризоаргин, Флавобактерин, Агрика и др. Входящие в состав Флавобактерина бактерии штамма Flavobacterium sp. 30 фиксируют азот из атмосферного азота и питают им растения, продуцируют высокоактивный антибиотик флавоцин с широким спектром действия на фитопатогенные грибы и бактерии. Препарат стимулирует рост и развитие растений за счет продуцирования физиологически активных веществ, позволяет получать экологически безопасную продукцию, улучшая ее качество [55, 102]. Бактериологический бактериальный препарат группы ассоциативных диазатрофов Ризоагрин создан на основе штамма Agrobacterium radiobakter 204 (в 1 г торфяного препарата содержится не менее 2,5 млрд. активных клеток бактерий). Агрика относится к этой же группе бактерий и создана из штамма Bacillus subtilis Б-04 (в 1 мл ферментационной жидкости не менее 200х106 активных клеток бактерий) [54, 98].
Широко рекламируемый биопрепарат Экстрасол (основа – азотфиксирующие бактерии) способствует лучшему использованию элементов минерального питания растений, синтезирует ростовые и другие биологически активные вещества, снижает поражение растений фитопатогенами родов Fusarium, Alternaria, Helminthosporium, Puccinia, Phytophtora и др., а также оказывает положительное влияние на развитие агрономически полезной микрофлоры. Микроорганизмы, содержащиеся в рабочем растворе биопрепарата и продукты их метаболизма (витамины, ферменты, гормоны, аминокислоты), попадая на листовую поверхность, являются регуляторами жизненно важных функций. В процессе своей жизнедеятельности бактерии биопрепарата вырабатывают вещества, способные оказывать стимулирующее действие на рост и развитие растений, в результате чего обеспечивается нормализация физиологии и биохимии растительной клетки, увеличение индекса листовой поверхности, увеличение интенсивности фотосинтеза и дыхания, регуляция транспирационного коэффициента и коэффициента водопотребления; снижение дефицита усвояемых форм микроэлементов. Все эти факторы в целом влияют на продуктивность и качество выращиваемой продукции [Смирнова Ю.Д.2017].
Другой ряд биопрепаратов, выпускаемых ВНИИСХМ, созданы на основе эндомикориозного гриба, который проникает в корень и образует с растением симбиоз, обеспечивая питание растений фосфором – Микориз, Микофил, Глиокладин. Эти биопрепараты можно применять как под овощные, так и под зерновые культуры, исключение составляют только крестоцветные, с которыми эндомикоризный гриб не образует симбиоз [117, 118].
Микориз содержит споры и активный мицелий девяти различных микоризообразующих грибов, включая виды с повышенной зимостойкостью, а также специальный биостимулятор. Он стимулирует рост корневой системы растений, способствует насыщению растения питательными веществами и влагой, оптимизирует баланс питания, повышает жизнестойкость растений к различным болезням и экологическим стрессам.
При внесении в почву минеральных фосфорных удобрений растения поглощают только 20-25 % вносимого фосфора. Микроорганизм, входящий в Микофил, обладает уникальным свойством – он способен поглощать фосфор из недоступных растению соединений и транспортировать в корень. Таким образом, Микофил обеспечивает поступление в растения фосфора, который накопился в почве за многие годы использования минеральных удобрений и который лежит там мертвым капиталом. Применение Микофила заменяет внесение 80-150 кг фосфорных удобрений на гектар и гарантирует практически полное усвоение растениями поставляемого фосфора. При использовании биопрепарата прибавки урожая колеблются от 5 до 50 % в зависимости от культуры [38, 56].
В настоящее время особое внимание уделяется биологически активным препаратам, обладающим одновременно ростстимулирующим и иммуноиндуцрующим действиями. Они должны повышать урожайность и устойчивость растений к заболеваниям [109].
Препарат, выпускаемый фирмой ООО «Деметра плюс», Агропон С не только увеличивает продуктивность культур, но и способствует возрастанию адаптационных способностей и иммунитета растений к неблагоприятным факторам среды и патогенным организмам. Действующие вещества – комплекс ростовых веществ, продуктов метаболизма микромицета (штамм Cylindrocarpon magnusianum, 1г/л ВСР). В состав препарата входят природные фитогормоны цитокининовой и ауксиновой природы, аминокислоты, полиненасыщенные жирные кислоты, аминосахара (хитозаны), олигосахара и биогенные микроэлементы. Синергизм действия компонентов препарата обеспечивает его высокую физиологическую активность (ООО «Деметра плюс» — биопрепарат Агропон С [Электронный ресурс]. – Режим доступа: http://demplus.ru -– (Дата обращения: 29.02.20)
Микробиологические препараты Гуапсин (Pseudomonas aureofaciens IBM B-7096 и IBM B-7097, продукты их метаболизма и стартовые дозы NPK) и Триховит (водная суспензия бактерии Trichoderma viride) также обладают не только ростостимулирующей активностью, повышают всхожесть и энергию прорастания семян, но и повышают их устойчивость к стрессам (заморозкам, засухе, высоким темпера- турам), комплексу грибных и бактериальных заболеваний [92, 119]. В настоящее время также возрос интерес к получению регуляторов роста для растениеводства и земледелия из природного сырья (морфологических органов растений и тканей животных). Так, экстракт из древесной зелени пихты сибирской послужил основой для высокоэффективного природного регулятора роста растений Силк, представляющего собой 10 %-ную водную эмульсию растворимых в воде натуральных тритерпеновых кислот, выделенных из хвои пихты сибирской. Он действует на фитогормональную систему растений, резко изменяя их реакцию на факторы окружающей среды. В результате наблюдаются изменения в продуктивности растений, и выявляется достаточно высокая активность по подавлению развития патогенных грибков. Установлено, что Силк оказывает положительное влияние на сдерживание листовых заболеваний зерновых культур, а также корневых гнилей.
Известен регулятор роста растений Стифун, который является комплексом физиологически активных веществ натуральной природы. Было изучено влияние этого препарата на рост и развитие пшеницы при обработке растений его стимулирующей концентрацией (0,003 %). У опытных растений стимулировалось развитие, повышалась устойчивость к болезням и неблагоприятным условиям среды, увеличивалась продуктивность. Наиболее эффективен Стифун при обработке семян и молодых растений. Он повышает полевую всхожесть, увеличивает содержание хлорофилла и каротиноидов, листовую поверхность, число семян в колосе и положительно влияет на гормональный баланс растений [111, 127].
Ростстимулирующие препараты Амир и Амиросел разработаны во ВНИИССОК на основе надземной биомассы растения амарант. В состав фитопрепарата Амир входят основные действующие вещества – бетацианины, оксикоричные кислоты, биофлавоноиды. Амиросел – комплексный ростстимулирующий препарат, созданный на основе фитопрепарата Амир с добавлением микроэлементов. Амир и Амиросел позволяют снизить химическую нагрузку на сельскохозяйственные культуры [Смирнова Ю.Д.,2017. ]
Фитохит – препарат на основе хитозана, разработанный в ВИЗР – высокоэффективное росторегулирующее вещество. Активность Фитохита объяснятся тем, что при его разложении образуется легко усвояемый азот и этилен. В результате такого комплексного действия на растение формируется развитая корневая система и, более мощные стебли, оно лучше борется с патогенами и неблагоприятными условиями.
ГП МНТЦ «Агробиотех» (Украина) производит ряд стимуляторов роста растений различного происхождения: природные стимуляторы – Эмистим С, Биолан; композиционные – Агростимулин, Биосил, Зеастимулин, Радостим и др.; синтетические – Ивин, Потейтин (Биопрепараты для защиты растений [Электронный ресурс]. – Режим доступа: https://www.ogorod.ru/ru/now/pests/11207/Biopreparaty-dlja-zashhity-rastenij-ih-vidy-i-sposoby-primenenija.htm).
1.1.2 Биофунгициды
В последние годы большое внимание, в том числе и в России, уделяется развитию экологически чистых биологических методов борьбы с заболеваниями растений, которые рассматриваются как альтернатива традиционному использованию химических пестицидов (Азизбекян, 2013). В настоящее время в мире разработано и продается более 40 коммерческих биопрепаратов [1].
Одним из самых перспективных новых направлений защиты сельскохозяйственных культур от фитопатогенов является индукция устойчивости к патогенам и неблагоприятным факторам внешней среды с использованием биопрепаратов [126, 133]. Биологический метод защиты растений от патогенных микроорганизмов основан на использовании микроорганизмов-антагонистов. В настоящее время описан ряд микроорганизмов, оказывающих антагонистическое действие на фитопатогенные грибы. Антагонисты принадлежат к различным видам – Agrobacterium, Bacillus, Candida, Lactobacillus, Pseudomonas, Streptomyces и др. [1].
Благодаря биогенному происхождению и чрезвычайно низким рабочим концентрациям действующих веществ, абсолютное большинство препаратов данной группы относится к экологически безопасным средствам. Помимо слабой токсичности, биопрепараты характеризуются также широким спектром действия в отношении различных растений и патогенов, способностью повышать устойчивость растений к неблагоприятным факторам, низкой стоимостью.
Биопрепараты выпускаются в виде стабилизированных порошков, сухих пылевидных форм, концентратов эмульсий, жидких форм, суспензированных концентратов, таблетированных форм в блистерах. Ко всем бактериальным препаратам предъявляют общие требования, они должны быть стандартными. Титр препарата (концентрация или число вирулентных спор в 1 г для сухих или в 1 мл для жидких форм) должен быть постоянным, соответственно конкретному препарату. Титр определяется путем подсчета под микроскопом спор и кристаллов в камерах счисления (камера Горяева и др.).
Биофунгициды применяют как для обработки посадочного материала, так и для опрыскивания вегетирующих растений [108]. Существует ряд биопестицидов, отечественный и зарубежный опыт по применению которых свидетельствует о их высоком фитозащитном потенциале, к таким препаратам относят Биофугус (Trichoderma spp., Бельгия), Бинаб-Т (T. harzianum и T. polysporum, Швеция), Биотрек (T. harzianum, США), Серенада, Кодиак (Bacillus subtilis, США), Ризо-плюс (B. subtilis, Германия), Бактофит, Фитоспорин (B. subtilis, Россия), Фитолавин (Streptomyces griseus, Россия), Планриз (Pseudomonas fluorescens, совместная разработка Белоруссии и России) [65].
В республике Башкортостан широкое распространение получил биопрепарат Фитоспорин-М (производства НВП «БашИнком») – биофунгицид на основе эндофитной бактерии Bacillus subtilis 26Д на гуминовом носителе, подавляющий развитие многих грибных и бактериальных болезней растений, а также повышающий уровень их иммунитета. Фитоспорин-М эффективен против широкого спектра грибных и бактериальных заболеваний. Обработка семян Фитоспорином вызывает существенное изменение в структуре комплекса микроскопических грибов. На фоне действия препарата отмечается уменьшение видового разнообразия грибов с 23 до 16 видов, что свидетельствует о глубине сдвигов в микоценозе [78].
Планриз производства ООО «Биотехагро» (Тимашевский филиал, Россия, Краснодарский край, г. Тимашевск) – бактериальный препарат на основе бактерии Pseudomonas fluorescens, эффективное биологическое средство защиты растений от грибных и бактериальных заболеваний. Бактерии Планриза выделены из почвы. Препарат представляет собой жидкость желто-коричневого цвета, в каждом грамме которой содержится 3-4 млрд. живых бактериальных клеток, обладающих лечебными свойствами. Этот природный микроорганизм способен активно подавлять возбудителей болезней зерновых колосовых и других сельскохозяйственных культур. Преимущества Планриза: эффективен в борьбе с грибными и бактериальными болезнями, а также при их профилактике; укрепляет иммунный статус растений; экологичен (Разработка и производство микробиологических препаратов для животных и растений [Электронный ресурс]. – Режим доступа: http://www.biotechagro.ru -– (Дата обращения: 29.02.20)
Витаплан, КЖ (биофабрика ООО «Агроком») – бактериальный препарат на основе Планриза, представляет собой вспученный вермикулит с частицами размером 2 мкм, на поверхности которых закреплены бактерии Pseudomonas fluorescens. Это эффективное биологическое средство защиты растений от грибных и бактериальных заболеваний. Витаплан, КЖ обладает ростостимулирующими свойствами, способствуя развитию мощной корневой системы, устойчивости к полеганию и обеспечивая увеличение урожая [http://агроком-био.рф/index.php/vitaplan-kzh].
Триходермин – является экологически безопасным биологическим препаратом, созданным на основе грибов рода Trichoderma lignorum. Данный гриб, размножаясь, продуцирует антибиотики, которые уничтожают возбудителей заболеваний растений, а также, используя чужие грибницы как питательную среду, уничтожает грибы-патогены более чем 60 видов, вызывающих такие болезни, как корневые и плодовые гнили, семенные инфекции, макроспориоз и др. [109].
1.1.3 Биоудобрения
Другая группа биопрепаратов – землеудобрительные, которые представлены бактериальными препаратами, при внесении которых в почву синтезируются физиологически активные вещества и улучшается жизнедеятельность почвенной микрофлоры [129].
Бактериальные удобрения Азотовит и Бактофосфин представляют собой суспензию несимбиотических, свободноживущих отселектированных бактерий, начинающих активно размножаться при попадании в почву и интенсивно заселять прикорневую зону. Микроорганизмы, входящие в состав Азотовита, фиксируют атмосферный азот, а микрофлора Бактофосфина расщепляет нерастворимую минеральную часть почвы, переводя фосфор и калий в легкоусвояемые формы, улучшая тем самым пищевой режим почв [54].
Препараты, разработанные на основе оригинальных штаммов бактерий, выделенных в Томском госуниверситете из местных почв, апробированы в хозяйствах Томской области. Бактериальные препараты показали высокую рентабельность и хороший экологический эффект. Биопрепараты выпускаются в виде жидких концентратов живых почвенных бактерий 3-х видов: Азотобактерин – препарат на основе свободноживущих азотфиксаторов Azotobacter chroococcum, Фосфоробактерин – на основе кислотообразующих бактерий Bacillus megaterium var. phosphaticum, Кремнебактерин – на основе бактерий Bacillus mucilaginosus (Гиль, 2008).
ООО «Научно-технический центр биологических технологий в сельском хозяйстве» (НТЦ БИО) г. Шебекино Белгородской области выпускает биоудобрения для активизации почвенного плодородия Весна и Белогор. В составе биоудобрения Весна – раствор концентрата лизина, витамины группы В, микроэлементы, минеральные и органические вещества и нитроаммофоска. Концентрат Белогор содержит комплекс молочнокислых и пропионовокислых бактерий, дрожжи и культуры микроорганизмов родов Bacillus и Pseudomonas, а также бактериальные продукты метаболизма, макро- и микроэлементы, необходимые для жизнедеятельности микроорганизмов и полезные для развития растений [90].
1.1.4 Полифункциональные препараты
В последние годы все чаще приходят к мнению, что биопрепараты для растениеводства и земледелия должны быть полифункциональными, поскольку должны включать функции регулятора роста, биофунгицида, иммуномодулятора и землеудобрительного препарата. Ассортимент полифункциональных средств растет и получает все большую популярность среди практиков.
Микробиологические препараты серии Сияние – разработка новосибирских ученых (НПЦ «ЭМ-Биотех» совместно с кафедрой агроэкологии и микробиологии НГАУ), включает в себя несколько десятков видов культур агрономически полезных микроорганизмов. Без них невозможно восстановить и накопить гумус в почве, а значит, повысить ее плодородие. В серию Сияние входят следующие микробиологические препараты. Концентрат и препарат Сияние-1 производятся из японского маточного сырья и реализуются в жидком виде. Биоудобрение-субстрат Сияние-2 состоит из специально подобранных агрономиически полезных культур микроорганизмов, выделенных из почв Сибирского региона и засеянных на пшеничные отруби. Совместное применение данных биоудобрений позволяет добиться наилучшего результата. Микробиологический препарат Сияние-3 – отрубной субстрат, засеянный полезными культурами микроорганизмов в высокой концентрации, что позволяет ускорить процесс ферментации и разложения органических отходов в компостных кучах и выгребных ямах [48].
Препарат Байкал ЭМ-1 (ООО «НПО ЭМ-ЦЕНТР») представляет собой композицию штаммов микроорганизмов, включающую фотосинтезирующие, молочнокислые, азотфиксирующие бактерии, дрожжи и некоторые микроскопические грибы. Эти микроорганизмы способствуют вытеснению патогенной микрофлоры, вместе с нейтральными бактериями они проводят комплексную работу по восстановлению плодородия почвы, оптимизации ее структуры, накоплению гумуса. В Байкале ЭМ-1 успешно сосуществуют две группы эффективных микроорганизмов, требующих противоположных условий существования: аэробные, которым необходим кислород и анаэробные, жизнедеятельность которых проходит без доступа кислорода («Байкал ЭМ-1» [Электронный ресурс]. – Режим доступа:http://shablin.ru/prodazhi/produkcziya-dlya-ogoroda/658-bajkal-em-1-(preparat).html–(Дата обращения: 25.02.2020).
Микробиологический препарат БисолбиФит, получаемый на основе ризосферных бактерий, разработан ВНИИСХМ. Препарат повышает урожайность кормовых и зерновых культур, оптимизирует состояние почвенно-биотического комплекса, оптимизируя показатели биологической активности почв. Использование БисолбиФита способствует получению экологически чистой продукции, так как снижает содержание нитратов, свинца и кадмия в зеленой массе кормовых культур; увеличивает КИУ, что снижает непроизводительные потери биогенных элементов, вносимых с удобрениями, из почвы и связанную с этим нагрузку на окружающую среду; использование биопрепарата способствует повышению устойчивости фитоценоза к неблагоприятным погодным условиям [Сайдяшева Г.В., Захаров С.А.. 2017].
Агат-25К создан на основе грунтовых бактерий Pseudomonas aureofaciens и продуктов их жизнедеятельности. Составные части препарата: культуральная жидкость инактивированных (убитых) бактерий (титр 5-8х1010 в мл до инактивации); сбалансированные стартовые дозы макро- и микроэлементов, биоактивные вещества из ростков растений; природные флавоноидные вещества; активные фракции хвойного экстракта. Сочетание комплекса таких компонентов определяет широкий спектр и эффективность действия препарата: как фунгицидных и иммуномодулирующих функций против корневых и листовых грибковых болезней, так и свойства стимулятора роста растений, при абсолютной безопасности для людей, животных, пчел и окружающей среды. Такой мультисистемный препарат дает максимальный эффект при минимальных затратах – одновременно решаются проблемы защиты, подкормки и стимуляции растений (Смирнова Ю.Д.,2017).
Эмистим С производимый ГП МНТЦ «Агробиотех» (Украина) является полифункциональным препаратом широкого спектра действия, продукт биотехнологического выращивания грибов-эпифитов из корневой системы лекарственных растений. Содержит сбалансированный комплекс фитогормонов ауксиновой, цитокининовой природы, аминокислот, углеводов, жирных кислот, микроэлементов. Препарат повышает энергию прорастания и полевую всхожесть семян, развитию более мощной корневой системы, снижает фитотоксическое действие пестицидов, улучшает качество выращенной продукции, повышает устойчивость растений к стрессовым факторам (Смирнова Ю.Д.,2017).
В институте микробиологии НАН Беларуси разработан биопрепарат клубеньковых бактерий – Сапронит, субстратом-носителем которого является органический сапропель. Сапронит используется для предпосевной обработки семян бобовых культур или предпосевного внесения в почву с целью интенсификации процесса симбиотического связывания атмосферного азота, повышения урожайности бобовых (на 10-15 % и более), улучшения качества продукции, а также положительного воздействия на последующую культуру севооборота и окружающую среду в целом [Комплексное применение микроэлементов, регуляторов роста растений и бактериальных удобрений в предпосевной обработке семян проса и люпина узколистного : рекомендации /Т. Ф. Персикова, Ю. В. Коготько, М. Л. Радкевич. – Горки :БГСХА, 2015 – 24 с.].
Альбит – комплексный биопрепарат, универсальный регулятор роста растений со свойствами фунгицида и комплексного удобрения, содержит очищенные действующие вещества из почвенных бактерий – Bacillus megaterium и Pseudomonas aureofaciens. В состав препарата также входят хвойный экстракт (терпеновые кислоты), сбалансированный стартовый набор макро- и микроэлементов. В отличие от биопрепаратов, содержащих живые микроорганизмы, действие Альбита, по словам производителей (ООО НПФ «Альбит», Россия, г. Пущино), стабильнее, менее подвержено влиянию условий внешней среды. Альбит характеризуется низкой стоимостью и экологичностью биологических препаратов, в то же время по эффективности и сроку хранения он приближается к химическим веществам [Комплексное применение микроэлементов, регуляторов роста растений и бактериальных удобрений Т. Ф. Персикова, Ю. В. Коготько, М. Л. Радкевич. – Горки :БГСХА, 2015 – 24].
Альбит обладает защитным действием, сдерживая развитие широкого круга возбудителей основных болезней сельскохозяйственных культур (корневых гнилей, бурой ржавчины, мучнистой росы, пятнистостей, белой и серой гнилей, бактериозов и т. д.) путём повышения естественной устойчивости (иммунитета) растений к заболеваниям. Биологическая эффективность препарата против болезней составляет, по словам производителей, в среднем 50-80 % [Комплексное применение микроэлементов, регуляторов роста растений и бактериальных удобрений Т. Ф. Персикова, Ю. В. Коготько, М. Л. Радкевич. – Горки :БГСХА, 2015 – 24].
Полифункциональное, эффективное и относительно недорогое микробиологическое удобрение Азолен на основе свободноживущих азотфиксирующих почвенных бактерий Azotobacter vinelandii ИБ 4 (титр клеток 4-8х109 КОЕ/мл), разработанное в Институте биологии Уфимского научного центра РАН (Пат. 2245918 РФ, 2005). Промышленное производство осуществляется в г. Уфа на ГУП «Опытный завод Академии наук Республики Башкортостан». Биоудобрение Азолен безопасно для человека, сельскохозяйственных животных, птиц, рыб и пчел. Оно предназначено для улучшения азотного питания растений за счет восполнения дефицита азота в грунте, повышения урожайности и качества получаемой продукции и подавления жизнедеятельности патогенов, вызывающих поражение болезнями.
Есть ряд биопрепаратов, получаемых синтезом из природного сырья. Биопрепарат Вэрва (в переводе с коми – «Природа» или «Лесная вода»), разработанный в институте химии Коми научного центра Уральского отделения РАН, – препарат растительного происхождения, получен из пихты экологически безопасным способом без применения органических растворителей. Экологически безопасен, отличается высокой эффективностью и простотой использования. Действующее вещество – природные тритерпеновые кислоты пихты.
Вэрва – это высокоэффективный природный стимулятор роста растений и фунгицид, обладающий широким спектром биологического действия, адаптогенными и антиоксидантными свойствами. Препарат укрепляет иммунную систему растений, повышает их выносливость к стрессам. Стимулирующее действие препарата в большей степени проявляется при неблагоприятных почвенно-климатических условиях (резкие перепады температур, морозы, весенние возвратные заморозки, жара и засуха или напротив, переувлажнение почвы и недостаточная сумма активных температур).
Нарцисс (ОАО Группа Компаний «Агропром-МДТ» и ЗАО «Восток 1-Центр») – препарат биогенного происхождения на основе природного полисахарида – хитозана, а также янтарной и глутаминовой кислот. Эти вещества, проникая в растительный организм, активируют ферментативный комплекс, подавляя грибную и почвенно-гнилостную инфекцию, усиливают иммунитет растений, улучшают работу корневой системы и листового аппарата [22]
Полифункциональным препаратом, оказывающим заметное влияние на иммунную систему растения, является Иммуноцитофит (Рябчинская и др, 2004), представляющий собой смесь этиловых жирных кислот и мочевины с содержанием действующего вещества – этилового эфира арахидоновой кислоты 0,16 г/кг. Его ростстимулирующая активность состоит в активизации прорастания семян, ускорении появления дружных всходов, улучшении роста и развития растений.
Препарат широкого спектра Циркон (0,1 г/л смеси гидроксикоричных кислот) разработанный, запатентованный (Патент № 2257059 от 04.02.04 г.) и зарегистрированный фирмой ННПП «НЭСТ М» с 2001 г., широко применяется при возделывании более 60 видов культурных растений, как открытого, так и закрытого грунта. Среди них зерновые, зернобобовые, технические, овощные, плодово-ягодные, цветочно-декоративные, лесотехнические и лекарственные культуры.
Циркон обладает сильным фунгицидным и антистрессовым действием, является иммуномодулятором, корнеобразователем, индуктором цветения. Изготавливается из природного сырья – эхинацеи пурпурной. Нормализует гомеостаз и обмен растений, защищает их от загрязнения тяжелыми металлами, обеспечивает устойчивость к заморозкам, засухе, недостатку освещенности (http://www.nest-m.ru/).
Жидкое органическое удобрение БИОУД-1 – продукт бактериальной термофильной (52-530С) метангенерации органических отходов крупного рогатого скота и др. домашних животных и птиц, а также отходов растениеводства. Сертифицировано Госстандартом РФ и разрешено к применению Госхимкомиссией РФ. БИОУД-1 содержит все необходимые элементы питания в растворимом виде и в соотношениях, необходимых для растений, а также содержит активные биологические стимуляторы роста растений класса ауксинов, повышающих выход урожая от 20 % и выше, в зависимости от культуры и почвы [73].
Заслуживает внимания препарат для экологического земледелия «Эликсир урожая» (ТМ ТИМИРЯЗЕВЪ), микробиологическое удобрение для повышения урожайности и качества, повышения энергии прорастания и всхожести, улучшения перезимовки у озимых, устойчивости к заболеваниям, водному, температурному и гербицидному стрессам, стимуляция роста и развития, повышение иммунитета к заболеваниям.
К преимуществам такого биопрепарата относятся:
1. Многофункциональность – препарат стимулирует рост и развитие растений, усиливает естественный иммунитет, защищает от стрессов (гербицидный, температурный, засуха и т.д.).
2. Универсальность – применяется к различным видам сельскохозяйственных культур: полевые культуры, в том числе зерновые, масличные, технические; овощные культуры, в том числе открытого и закрытого грунта; плодовые, ягодные культуры и виноград.
3. Безопасность – препарат безопасен для человека, животных и пчел. Не имеет фитотоксичности в рекомендованных дозировках, а также совместим с другими препаратами.
Существует несколько эффектов применения «Эликсира Урожая».
Хозяйственные эффекты – увеличение раннего и общего урожая, ускорение созревания, повышение содержания углеводов и витаминов в плодах, повышенные выходы стандартной продукции, снижение накопления нитратов и тяжелых металлов в продукции.
Агрономические – при последовательном, многократном применении препарат повышает почвенное плодородие, содержание основных питательных элементов, доступных растениям, и органических веществ, влагоудерживающую способность почвы, снижение количества патогенных микроорганизмов.
Физиологические эффекты – стимуляция роста и развития, корнеобразования, предотвращение опадения завязей, повышение холодостойкости, повышение естественного иммунитета и снижение заболеваемости.
Характеристики препарата. Включает в свой состав комплексы почвенных микроорганизмов:
- Bacillus megaterium;
- Bacillus licheniformis;
- Bacillus subtilis;
- Bacillus mycoides;
- Azotobacter chroococcum;
- Pseudomonas fluorescens.
Концентрация клеток штаммов составляет: 1,4*107 КОЕ/мл. Также в состав препарата входят биологически активные вещества:
- пептиды;
- поли – и олигосахариды;
- регуляторы роста микробного происхождения;
- витамины;
- L-аминокислоты;
Питательные вещества и стимуляторы:
- макро и микроэлементы в сбалансированном соотношении;
- комплекс гуминовых солей и кислот с наибольшей полезной активностью.
Таким образом, такое разнообразие биопрепаратов, кажется, что уже не оставляет простора ученым для новых разработок, но все же с каждым годом на рынке средств для растениеводства появляются новые, с расширенным списком функций, безопасные для человека и окружающей среды, изготовленные из микроорганизмов, растений и природного материала. Исследователи во всем мире ведут поиск универсального, высокоэффективного средства, экологичного и относительно недорогого. Все чаще биопрепараты имеют жидкую консистенцию, что предполагает легкое применение, смешивание в баковых смесях, простоту внесения, транспортирования и хранения.
1.2 Объекты тестирования биопрепаратов для растениеводства
Все разрабатываемые биопрепараты проходят апробацию сначала на лабораторном уровне, затем в полевых условиях. Изучение влияния биопрепаратов на сельскохозяйственные культуры, как правило, разработчики сначала проводят на опытных полях, принадлежащих их институтам, или совместно с профильными организациями. Также внедренческие исследования проводятся рядом с фермерскими хозяйствами. Некоторые из биопрепаратов получили широкую известность, включены в официальные списки разрешенных к применению и имеются в розничной продаже. Исследования по влиянию биопрепаратов проводят на всех видах овощных и злаковых культур, а также на пастбищах и кормовых травах, но чаще всего на двух стратегически значимых культурах: зернобобовые и зерновые.
Зерновые культуры – важнейшая группа культурных растений, возделываемых в основном для получения зерна. Зерно злаковых культур имеет большое продовольственное и кормовое значение, является сырьем для мукомольной, крупяной, комбикормовой промышленности. Зерно – основная часть государственных производственных запасов и предмет экспорта. Солома – корм для скота, подстилка, удобрение, из нее делают плетеные и др. изделия [75].
Ячмень (лат. Hоrdeum) – род растений семейства злаковых (Poaceae), один из древнейших, возделываемых человеком, является четвертым по значимости злаком после пшеницы, риса и кукурузы. Ячмень – ценная продовольственная, техническая и кормовая культура. По аминокислотному составу его белок более ценен, чем белок пшеницы. Из зерна получают перловую и ячневую крупы, суррогат кофе, муку, с добавлением к пшеничной.
В качестве сырья в пивоваренной промышленности используют яровой ячмень, так как он содержит меньше белка, чем озимый, что важно для производства солода и пива высокого качества. Зерно служит хорошим концентрированным кормом для сельскохозяйственных животных.
Зернобобовые культуры. К этой группе относятся следующие культуры: горох, чечевица, вика, чина, арахис, соя, фасоль, маш, нут, бобы, вигна и люпин, принадлежащие к семейству Fabaceae. Они отличаются высоким содержанием в семенах белков, в состав которых входят важнейшие аминокислоты – лизин, триптофан, валин и др. (Шпаар Д. и др., 2000). Кроме того, семена некоторых из них содержат много жира (арахис, соя), минеральных веществ и витаминов (А, В1, В2, С, D, Е, РР и др.), что значительно повышает их пищевое значение. Зернобобовые культуры широко используются в пищевой промышленности (консервированные в зеленом виде горох и фасоль, крупа, мука, масло и др.). Из них также производится много различных материалов, которые требуются в быту (растительный казеин, лаки, эмаль, пластмассы, искусственное волокно, экстракты для борьбы с вредителями и т. д.). Большое значение эти культуры имеют в кормопроизводстве из-за высокого содержания белка в зеленой массе, зерне, полове и соломе.
Горох — культура влаголюбивая, дает хороший урожай на почвах, удобренных известью, с достаточной аэрацией. Не переносит тяжелых, суглинистых, заболоченных почв. Горох хорошо растет рядом с яровыми злаками.
Посевной горох способна уничтожить сорная трава, поэтому обработка от сорняков в обязательном порядке, должна проводиться по графику. Благоприятным предшественником для гороха послужит любая пропашная культура. Горох относится к высокоурожайным зернобобовым культурам, при правильном соблюдении агротехники даст с гектара около 45 ц зерна.
Постоянное применение минеральных удобрений приводит к нанесению серьезного ущерба экологии. Использование в этой связи биоудобрений и биопрепаратов направлено на оптимизацию биологических показателей почвы, на получение высоких урожаев сельскохозяйственных, в том числе зерновых, культур с сохранением их качественных характеристик.
Применение удобрений и регуляторов роста растений являются неотъемлемым элементом современной технологии выращивания овощных культур и в защищенном грунте. Переход на рыночную экономику и забота населения о своем здоровье, заставляют товаропроизводителей переходить на биологические агроприемы. Весьма актуальным является внедрение технологий, при которых обеспечение овощных основными элементами питания, их защиты от фитопатогенов,а также стрессовых воздействий достигается за счет использования биопрепаратов [52].
Поэтому внедрение высокоэффективных биопрепаратов, повышающих урожайность, защищающих от болезней и неблагоприятных природных факторов, экологически чистых, приобретает еще большую актуальность.
Технология применения биологических препаратов почти не отличается от применения синтетических химических удобрений и инсектицидов. Используются те же методы наземного и авиационного мелкокапельного и ультрамалообъёмного опрыскивания (УМО) или методы аэрозольных технологий оптимальной дисперсности. Следует иметь ввиду, что ультрафиолетовые лучи солнца инактивируют споры бактерий и грибов, поэтому опрыскивание проводят в конце дня или рано утром. Также при применении биопрепаратов необходимо учитывать погодные условия [51].
1.3 Корневые гнили – вредоносные заболевания гороха и ярового ячменя
Корневые гнили являются наиболее распространенным и вредоносным заболеванием зерновых и зернобобовых культур. Явный и скрытый ущерб от них очень часто превышает вред, наносимый колосовым хлебным злакам всем остальным патогенным комплексом, паразитирующим на этих культурах [19].
Основные виды корневых гнилей. В зависимости от типа возбудителя различают следующие виды корневых гнилей. Фузариозная корневая гниль Fusarium spp. (рисунок 1, 2).
Болезнь вызывается грибами F. culmorum, F.avenaceum, F.oxysporum и др. Поражает взрослые растения и всходы, проявляется в виде побурения проростков, колеоптиль, первичных и вторичных корней, узла кущения. Заболевание можно распознать по трухлявости корней, побелению стебля и пустоколосости. Также в условиях повышенной влажности может появиться желтоватый или розовый налет спороношения патогенов на пораженных участках.

Рисунок 1 — Фузариозная корневая гниль гороха |

Рисунок 2 — Фузариозная корневая гниль ячменя |
Гельминтоспориозная (обыкновенная) корневая гниль – Bipolaris sorokiniana) (рисунок 3). Вызывается грибами Bipolaris sorokiniana и сначала заражает проростки, приводя к их гибели. На фазе всходов болезнь проявляется в виде темных некрозов, образующихся у основания проростка и на колеоптиле. На фазе выхода в трубку начинают буреть подземное междоузлие, влагалища прикорневых листьев, основания стеблей, корни могут загнивать и отмирать. По мере распространения болезни продуктивные стебли начинают отмирать, наблюдается пустоголовость, щуплость зерна.
 |
 |
Рисунок 3 — Гельминтоспориозная (обыкновенная) корневая гниль
Офиоболезная корневая гниль (рисунок 4) вызывается Opkiobolus graminis и приводит к отмиранию продуктивных стеблей на протяжении всего периода вегетации. Болезнь можно распознать по почернению корней, влагалищ прикорневых листьев и их постепенному отмиранию. Растение отстает в развитии, его легко можно вырвать из почвы. Также наблюдается пустоколосость и белостебельность.
 Рисунок 4 — Офиоболезная корневая гниль Рисунок 4 — Офиоболезная корневая гниль |

Рисунок 5 — Церкоспореллезная прикорневая гниль |
Церкоспореллезная прикорневая гниль — Pseudocercosporella herpotrichoides. Ее возбудителем является P. herpotrichoides. Болезнь сопровождается образованием светлых пятен в виде глазка с темным окаймлением на надземных частях растения. В связи с этим стебель теряет прочность и начинает обламываться. Наблюдается полегание посевов и пустоколосость.
Причины появления корневых гнилей. Как уже было сказано, источниками болезней всех видов корневых гнилей является почва, семена и пожнивные остатки. На развитие инфекции влияют такие факторы, как неблагоприятные условия среды (резкие перепады температур, недостаточный или избыточный уровень влажности), несоблюдение севооборотов, нарушение агротехники. Комплекс патогенов может различаться в зависимости от климатической зоны возделывания, сорта растений, агротехники и степени насыщенности зерновыми культурами. Болезнь может проявляться как на ранней стадии вегетации, что приносит существенный вред урожаю, так и к концу уборки.
Общие рекомендации по защите от корневых гнилей. Борьба с корневыми гнилями должна вестись в комплексе с уничтожением прочих вредных объектов, либо целенаправленно в зависимости от вида болезни. Дважды в сезон необходимо проводить обследование посевов для определения степени вредоносности корневых гнилей. Рекомендуется использовать относительно устойчивые к болезни сорта зерновых, соблюдать севооборот и сроки посева, вносить органические и фосфорно-калийные удобрения. Также в зависимости от вида возбудителя может потребоваться протравливание семян и обработка фунгицидами.
Современная концепция защиты сельскохозяйственных культур от поражения возбудителями корневых гнилей выдвигает на первый план вопросы совершенствования экологических принципов и разработку на их основе экологически безопасных фитосанитарных технологий возделывания (Косолапова А.И. и др., 2010; Борисенко В., 2011). Необходимо, чтобы разработанные технологии были хорошо адаптированы к местным условиям региона, отражали научно-обоснованный уровень антропогенного воздействия на структуру популяции возбудителя, заболевание и функционирование сообществ организмов.
По мнению С.С. Санина экологическая направленность передовых технологий предусматривает применение мероприятий, не только не наносящих вред человеку и окружающей среде, но и исполняющих роль природоохранного фактора (повышение плодородия почвы, улучшение среды обитания полезной энтомофауны, снижение содержания микотоксинов в сельскохозяйственной продукции).
Перспективное научное направление в современной теории защиты растений, получившее широкое развитие в связи с необходимостью реализации концепции интегрированной системы защиты растений, представляет разработку адаптивных экологически безопасных технологий выращивания сельскохозяйственных культур.
При разработке концептуальной основы наших исследований мы исходили из того, что на территории Орловской области в центральной Нечерноземной зоны, главная роль в патогенном комплексе корневых гнилей принадлежит представителям рода Fusarium spp., относящихся к группе несовершенных грибов. Отмечено 6 видов (F.oxysporum, F. heterosporum, F. sporotrichioides, F. verticillioides, F. redolens, F. tricinctum), среди которых доминирующими является первый вид.
1.4 Перспективы применения биопрепаратов в сельскохозяйственной практике
В условиях глобализации экономики человечество все больше стало задумываться о своем будущем. Наша свобода движения, стремление к лучшей жизни ограничиваются в результате увеличения численности населения, индустриализации, нарушений окружающей природной среды. Наступает кризис в снабжении, сырьем, продуктами питания, энергией и водой.
Одной из важных и острых глобальных проблем человечества является продовольственная проблема, поскольку она непосредственно относится к самому физическому существованию сотен миллионов людей. В последнее время ее проявления носят довольно сложный характер, так как несут в себе отпечаток противоречий современной технологической цивилизации.
Одним из важных путей решения продовольственной проблемы является экологизация сельского хозяйства с применением биологических средств защиты растений от вредителей, сорняков, болезней, а также применение биопрепаратов для увеличения продуктивности сельскохозяйственных культур.
Однако в настоящее время использование и применение биологического метода в нашей стране не максимизировано. Основными проблемами урожайности и качества сельскохозяйственных культур являются: низкий потенциал почвы, высокие цены и низкий коэффициент полезного действия минеральных удобрений, негативное влияние пестицидных препаратов на растения и почвенные биоты.
Химические средства защиты растений в общей системе мер борьбы с болезнями занимают большое место по объему применения и имеют много преимуществ. Однако, наряду с достоинствами следует отметить и их недостатки, прежде всего токсичность для теплокровных и человека.
Применение химических протравителей, популярное до недавнего времени, в настоящий момент требует пересмотра по нескольким причинам:
- отрицательное влияние на здоровье человека;
- аккумуляция остатков химических препаратов в почве, воде, продуктах питания;
- химические препараты способствуют появлению устойчивых рас возбудителей болезней;
- химические препараты нарушают биологическое равновесие между ризосферой живых организмов.
Однако полностью отказаться от применения химии в сельском хозяйстве невозможно. Альтернативным вариантом является использование химических методов наряду с биологическим методом.
По сравнению с химическими средствами защиты растений – пестицидами, биопрепараты безопасны или малотоксичны для человека и окружающей среды, не нарушают природных связей в биоценозе, обладают избирательным действием и не способствуют возникновению устойчивости у насекомых.
Идея использования патогенов в борьбе с насекомыми-вредителями принадлежит И. И. Мечникову (1879) (споры плесневого гриба против хлебного жука). Однако первый промышленный препарат на основе тюрингской бациллы был получен во Франции. Сегодня на основе этой бациллы производится не менее 20 препаратов.
В 1965 году в Японии был открыт препарат касугамицин (касумин). Его ежегодное производство составляет в Японии около 20 тысяч тонн. Он применяется для защиты риса от пирикуляриоза, а также перца, фасоли, огурца, картофеля, табака и риса от бактериозов (Pseudomonas sp., Erwinia carotovora), огурцов, томатов, петрушки, баклажанов, сахарной свеклы, риса, яблонь и груш от 8 видов фитопатогенных грибов, включая мучнистую росу. Для большинства культур препарат в рекомендуемых дозах нефитотоксичен, для пчел и ряда других насекомых-опылителей вредного действия не оказывает. Большим преимуществом касугамицина является исключительно короткое время ожидания: его разрешено применять даже за двое суток до уборки.
В настоящее время биопрепараты разрабатывают и используют ведущие страны мира.
В России Всероссийским научно-исследовательским институтом сельскохозяйственной микробиологии Россельхозакадемии разработан ряд биопрепаратов на основе активных штаммов ризосферных микроорганизмов. Например, препарат экстрасол, созданный на основе Pseudomonas (различные штаммы), используется для предпосевной обработки семян и клубней, используется для пролива почвы до и после высадки рассады, а также для внекорневой подкормки растений. Он хорошо зарекомендовал себя при выращивании картофеля в различных почвенно-климатических зонах. Препарат способствует большему поступлению элементов минерального питания в растения, синтезирует ростовые и другие биологически активные вещества и образует соединения, снижающие активность фитопатогенных микроорганизмов.
В Республике Казахстан широкое применение получили разработанные ТОО НПО «Ана Жер» наноматериалы-микробиоудобрения серии МЭРС. ТОО НПО «Ана-Жер» и ТОО «Хазрат-Али-Акбар» с участием ведущих ученых республики разработано и сформулировано новое научное направление по обеспечению продуктами питания населения нашей планеты без многомиллиардных затрат, а с использованием совершенно новой энергии – неисчерпаемой бесплатной энергии почвенных микроорганизмов. При применении биоудобрений в растениеводстве Казахстана достигается: повышение урожайности сельскохозяйственных культур в северных регионах на 25-70 %, южных – 40-100 % и более, люцерны и однолетних трав на поливе – 200-400 %; получение высоких и качественных урожаев продукции растениеводства при снижении нормы поливной воды в 1,5-2 раза.
Микробиологические препараты (МБП) представляют собой живые клетки отселектированных по полезным свойствам микроорганизмов, которые находятся или в культуральной жидкости, или адсорбированы на нейтральном носителе. Такой препарат позволяет создать огромную концентрацию полезных форм микроорганизмов (в 1 миллилитре или грамме препарата содержится до 1‑5 млрд клеток бактерий) в нужном месте и в нужное время. За счет этого внесенные формы могут успешно конкурировать с аборигенной микрофлорой и захватывать экологические ниши, предоставляемые им растением.
Источником получения исходных штаммов микроорганизмов и продуктов их жизнедеятельности служит, как правило, природная среда: активное начало биопрепаратов выделяют из почвы, с поверхности растений, из больных и погибших насекомых. Природные штаммы селектируют для отбора наиболее активные.
При применении биопрепаратов следует обращать внимание на природу действующего начала. Действие препарата, в состав которого входит микробный метаболит (токсин, антибиотик), меньше зависит от экологических факторов внешней среды, чем препарата на основе спор или клеток микроорганизмов. Эффективность грибных препаратов в большей степени зависит от влажности, чем бактериальных и вирусных.
Ведущими функциональными видами МБП для земледелия являются микробиологические удобрения, фунгициды, стимуляторы роста, ризобиальные инокулянты для бобовых культур (биоинсектициды и родентициды в данной статье не рассматриваются). Собственно, под МБП мы понимаем препараты, содержащие живые клетки отселектированных по полезным свойствам микроорганизмов, а также продукты их метаболизма, которые находятся или в культуральной жидкости, или адсорбированы на нейтральном носителе.
Рассмотрим главные преимущества применения биопрепаратов.
1. Влияние биопрепаратов на всхожесть семян и биомассу растений. Исследования физиологии роста и развития растений показано, что воздействие на семена бактерий препаратами вызывает последействие на продуктивность растений. Поэтому инокуляция семян зерновых культур ризосферными диазотрофами способна повышать поступление в корневую систему элементов питания и стимулировать прорастание семян вследствие продуцирования физиологически активных веществ типа витаминов, ауксинов, гиббереллинов, и ингибирования развития патогенной микрофлоры, увеличивать биомассу корней.
2. Установлена роль биопрепаратов в улучшении минерального питания растений. Биопрепараты, изготовленные на основе ризосферных микроорганизмов способны улучшать минеральное питание растений как за счет вовлечения в агроценоз азота атмосферы, так и в результате усиления поглощения корнями из почвы основных элементов питания.
3. Биопрепараты подавляют развитие фитопатогенных микроорганизмов, обеспечивая снижение поражаемости растений болезнями. В подавлении фитопатогенных микроорганизмов используют грибные, бактериальные и биопрепараты на основе антибиотиков.
4. Биопрепараты способны усиливать устойчивость растений к неблагоприятным условиям (засуха, заморозки);
5. Повышают коэффициенты использования минеральных удобрений и поступление питательных веществ из почвы;
6. Регулируют накопление в растениях тяжёлых металлов, радионуклидов, нитратов и других вредных соединений.
Все вышеперечисленное делает биопрепараты не заменимыми в сельском хозяйстве.
Разработка биопрепаратов – это новый этап развития сельского хозяйства. Применение их для увеличения продуктивности повышает урожайность сельскохозяйственных культур и тем самым становится реальным победа продовольственной проблемы.
Применение препаратов тем более актуально, что многие годы интенсификации не прошли даром и во многих почвах отмечена тенденция исчезновения полезных групп микроорганизмов и в то же время повышение численности и разнообразия вредных видов, что вызывает резкое и часто необратимое падение почвенного плодородия. Поэтому использование биопрепаратов ведет к снижению химической нагрузки на агроценоз сельхозугодия. Достигается это счет частичного замещения агрохимикатов и возможности сокращения доз минеральных удобрений.
В большинстве стран мира задача обеспечения национальной безопасности является приоритетом государственной политики. В связи с этим, внедрение и широкое применение биотехнологий в агропромышленном секторе национальной экономики является одним из значимых факторов достижения поставленных целей и задач. В условиях современной России инновационный бизнес вообще, а инновационный бизнес в агропромышленном комплексе, в особенности, является чрезвычайно рискованным. Тем не менее, частные инвестиции в агробизнес на уровне регионов все больше и больше становятся ключом к достижению государственных целей развития экономики и роста капитала по всей территории России.
Реализация инновационных проектов и программ предполагает концентрацию финансовых, технических и интеллектуальных ресурсов для интеграции научных разработок в реальное аграрное производство. На сегодняшний день, одним из таких примеров является проект «Биопрепараты в экотехнологиях АПК РФ 2003-2010г.г.», компании «BISOLBI-INVEST», которая начинает инвестировать средства в производство сельхозпродукции, выращиваемой по современным агробиотехнологиям, с применением микробиологических препаратов, тем самым, ориентируя сельхозпроизводителей на выращивание экологически чистых продуктов.
Принципиальные схемы внедрения экологически ориентированных систем сельского хозяйства России.
Существует несколько принципиальных схем внедрения экологически ориентированных систем сельского хозяйства:
1. Внедрение экологически ориентированных систем сельского хозяйства на вновь осваиваемых целинных и залежных земельных участках.
2. Внедрение современных биотехнологий в хозяйствах, занимающихся традиционным, по сути биоорганическим, но низкопродуктивным сельскохозяйственным производством (приусадебные хозяйства, хутора и др.).
3. Полный отказ от применения химических удобрений и пестицидов в существующих хозяйствах, замена их на биологические средства защиты растений, широкое внедрение органических удобрений, природных мелиорантов, энерго- и ресурсосберегающих технологий:
а) сразу на всей площади сельскохозяйственного предприятия;
б) поэтапно – сперва на определенной фиксированной части (отделении, севообороте, земельном массиве) с последующим внедрением экологически ориентированных систем сельского хозяйства во всем хозяйстве, с использованием полученного опыта;
в) по определенному направлению хозяйствования (например, кормопроизводству и животноводству, овощеводству и др.).
4. Постепенное замещение химических препаратов биопрепаратами, агротехническими, приемами, биотехнологиями по различным направлениям деятельности на всей или большей части площади хозяйства.
Очевидно, что схемы 1, 2 и 3а могут быть применены на сравнительно небольших площадях, при организации специализированных хозяйств, направленных на производство экологически чистого продовольствия, либо в пределах природоохранных зон (заповедники, национальные парки, водные объекты). Подобные программы внедрения экологически ориентированных систем сельского хозяйства для успешной реализации требуют внешнего стартового финансирования.
Практическое внедрение биотехнологий в сельском хозяйстве проходит в несколько этапов:
1. Разработка, апробирование на опытных модулях (установках, полях, агрегатах и пр.), сертификация.
2. Производственные демонстрационные испытания в опорных, базовых хозяйствах региона, доработка технологий применительно к конкретным условиям. Экономическое обоснование внедрения технологий.
3. Маркетинг новых агротехнологий. Пропаганда преимуществ технологии среди управленческого звена сельского хозяйства: распространение методических материалов, проведение лекций, семинаров, работа со средствами массовой информации.
4. Масштабное внедрение технологий в сельскохозяйственное производство. Подготовка специалистов. Консультационная служба. Создание производственных мощностей (в том числе региональных) по выпуску необходимых препаратов, техники, оборудования.
5. Разработка региональных и федеральной программ внедрения экологически ориентированных систем сельского хозяйства. Взаимодействие с административными органами, РАСХН, РАН, заинтересованными организациями. Поиск ресурсов дополнительного финансирования программ.
6. Совершенствование технологий, поиск новых технологических решений, повышение эффективности экологически ориентированного сельского хозяйства.
Естественно, на практике все происходит гораздо менее последовательно, зависит от конкретных людей, экономической и экологической ситуации в данном хозяйстве, районе, подготовленности общественного мнения и мнения специалистов о внедрении экологически ориентированных систем сельского хозяйства и т.д. Данное положение может быть проиллюстрировано на примере внедрения микробиологических препаратов для повышения эффективности растениеводства.
В 60-80-е годы отечественная сельскохозяйственная микробиология находилась на подъеме. По всей стране создавались производства микробиологических препаратов, которые, как правило, распространялись по разнарядке. В 90-е годы, вместе с всеобщим спадом сельскохозяйственного производства, спрос на микробиологические препараты упал практически до нулевой отметки. Только к середине 90-х выяснилось, что полноценных производственных испытаний биопрепаратов с расчетом экономической эффективности в условиях рынка практически не проводилось. Большинство препаратов выпускалось на торфяной основе, то есть форме, неудобной для применения. Оказалось, что многие высокоэффективные препараты не прошли необходимые сертификационные процедуры и потому не включены в «Список пестицидов и агрохимикатов, разрешенных к применению на территории РФ», не отработаны технологические схемы применения препаратов в производственных условиях различных регионов, неизвестна реальная стоимость производства препаратов и т.д. Аргументация о необходимости экологизации сельского хозяйства посредством замещения лишь одного из звеньев полностью химизированного производства, да еще в условиях нехватки техники, посадочного материала, оказалась явно слабой.
В настоящее время развитые страны Европы вводят ограничения на применение химических препаратов, минеральных удобрений и антибиотиков, пересматривают соответствующее гигиенические нормы и правила, а также вносят изменения в существующую практику ведения сельского хозяйства.
Ученые и производители сельхозпродукции многих стран все больший интерес проявляют к новейшим разработкам современной микробиологии. Используя современные агробиотехнологии можно:
- в кратчайшие сроки (три-четыре сезона) восстановить плодородие почв, нарушенное длительной химизацией;
- повысить урожайность основных с/х культур и обеспечить сохранность собранного урожая при его длительном хранении;
- улучшить усвоение кормов животными и птицей, стимулировать привесы и увеличить продуктивность;
- полностью отказаться или значительно сократить применение различного рода химических препаратов во всех отраслях сельского хозяйства.
Реально оценивая тенденции изменения АПК России, Всероссийский НИИ сельскохозяйственной микробиологии (один из немногих институтов РАСХН, сохранивший в 90-е годы научно-технический, кадровый и производственный потенциал) разработал для различных групп хозяйств – производителей сельскохозяйственной продукции – серию экологически ориентированных высокопродуктивных технологий с применением микробиологических препаратов нового поколения для растениеводства, животноводства и кормопроизводства в рамках проекта «МИР БИСОЛБИ». Внедрением данных технологий в различных секторах АПК на региональном уровне занимается инновационная компания «Бисолби-Интер», образованная при ВНИИСХМ и являющаяся членом Международной федерации движений за органическое земледелие (IFOAM).
Производственные опыты, проведенные во многих регионах РФ и странах СНГ, показали, что внедрение экологически ориентированных систем сельского хозяйства с применением микробиологических препаратов обеспечивает:
- снижение (на 25-60%) доз минеральных, в первую очередь азотных, фосфорных и микроудобрений;
- увеличение урожая основных культур и повышение качества с/х продукции;
- возможность отказа от использования ряда дорогостоящих пестицидов;
- возможность переориентации ряда хозяйств на более рентабельное производство новых видов продукции, в том числе экологически чистой;
- полноценное использование всех видов органических отходов хозяйства (животноводство, растениеводство, жизнедеятельность);
- повышение плодородия почв, оздоровление почвенной микробиоты (снятие почвоутомления или аллелопатии);
- улучшение роста, продуктивности, сохранности, качественных показателей конечной продукции, конверсии корма у всех видов сельскохозяйственных животных, а именно: бройлеров, яичных кур, свиней, крупного рогатого скота, форели и карпа;
- увеличение рентабельности сельскохозяйственных предприятий на 30-50%
Микробиологические препараты пережили свое второе рождение – рыночное, пройдя описанные выше этапы внедрения в производство. Однако и в настоящее время далеко не все внедряемые препараты включены в список, разрешенных к применению, выпускаются в удобной для потребителя форме, имеют длительные сроки хранения, совместимы с существующими агротехнологиями.
Производственные испытания подтверждают высокую экономическую эффективность применения препаратов. Рынок микробиологических препаратов постепенно расширяется, чему способствует стабилизация экономики и сельхозпроизводства, усиление экологического сознания населения, производителей, властей. Увеличивается количество потенциальных потребителей экологически чистого продовольствия. Сегодня это уже не только детские и медицинские учреждения, иностранные туристы и обеспеченные слои населения, но и значительная часть населения, желающая вести здоровый образ жизни, либо компенсировать качественным питанием неблагоприятную экологическую обстановку.
Итак, биопрепараты это новое весомое «экологически» направленное слово в решении глобальных проблем. Их разработка и применение решает не только проблематичные вопросы в сельском хозяйстве, но и такие вопросы как: продовольственная проблема, проблема утраты плодородия, деградации земель. Поэтому, я вижу хорошие перспективы использования биопрепаратов в растениеводстве, которые, безусловно, будут расширяться вместе с ростом уровня сельскохозяйственного производства.
1.5 Перспективные биологически активные вещества растительного происхождения для включения в состав препаратов-биостимуляторов
По данным производителей все описанные в предыдущих разделах «Обзора литературы» биопрепараты высокоэффективны и способны повышать плодородие почвы и урожайность.
Вопрос применения растений для создания новых экологически безопасных средств защиты и увеличения продуктивности сельскохозяйственных растений изучен, однако, недостаточно. Наиболее известными отечественными регуляторами роста, синтезированными из продуктов переработки хвойных пород, являются Новосил, Растим и др. Институт цитологии и генетики СО РАН). Их применение на различных сельскохозяйственных культурах (зерновые, овощные, технические) способствует не только снижению развития вредных организмов, но и увеличению биометрических показателей роста и развития растений, и в итоге – достоверному повышению продуктивности сельскохозяйственных культур.
В Кубанском государственном университете на основе фурфурола из подсолнечника синтезирован препарат Фуролан. При предпосевной обработке им семян риса всхожесть культуры увеличилась на 8%, высота растений – на 7,7%, площадь листа – на 20%, озерненность колосков – на 20%, продуктивность – на 28%.
В ВНИИ биологической защиты растений (г. Краснодар) ведутся разработки нового регулятора роста растений на основе эфирного мала кориандра – Биостата. Препарат обладает широким спектром действия: инсектицидным, фунгицидным и антисептическим. На винограде он снижал развитие милдью на 46%, серой и белой гнили – на 90%.
В ВИЗР Т.Д. Черменской было проанализировано более 147 растений на способность в той или иной степени снижать развитие вредных организмов в теплицах. Выявлено 125 видов растений-продуцентов биологически активных веществ.
В Китае была исследована способность олигосахарида, выделенного из корней лопуха индуцировать системную приобретенную устойчивость у всходов огурца к фитопатогенам. Предварительная обработка этим веществом семян растений на 56% снижала степень развития некрозов, вызываемых патогеном, увеличивала содержание лигнина и активность ферментов, связанных с защитной реакцией растений.
Аналогичное действие оказывают 7-10-дневные водные настои крапивы жгучей и хвоща полевого. Эти растения, помимо витаминов и других биологически активных веществ, содержат много кремния и кальция, которые оказывают определенное отрицательное действие на вредные объекты.
Интересным является использование в качестве физиологически активных веществ растительных масел. За рубежом известны некоторые фунгицидные препараты (Тимор и Тиморекс), действующим веществом которых является масло, полученного из австралийского растения Melaleuca. В опытах они подавляли прорастание спор и мицелиальный рост грибов, вызывающих мучнистую и ложную мучнистую росу.
В косточках и виноградных ягодах обнаружен природный фитоалексин ресвератрол, который относится к группе полифенолов. Из данной группы химических соединений известно много веществ элиситорного механизма действия на растение. Это вещество является одним из самых мощных среди всех известных антиоксидантов и защищает клетки живых организмов от действия свободных радикалов, а именно антиоксидантный эффект в первую очередь определяет антистрессовое действие вещества.
Другим перспективным БАВ для включения в состав препарата-биостимулятора является абсцизовая кислота (АБК) – гормон роста растений. Известно, что АБК в значительном количестве накапливается в плодоэлементах сахарной свеклы, а именно, в перикардии или околоплоднике. Считается, что АБК в качестве гормона роста в большинстве случаев тормозит рост растений: ингибирует прорастание семян и рост почек, содействует опаданию листьев, которое связано с их старением. Однако зарубежными исследователями у растений описаны сигнальные пути, связанные с абсцизовой кислотой при ответе на абиотический стресс и поражение патогенами. АБК особенно важен для поддержания водного баланса в условиях засухи. В ответ на повышение концентрации АБК в клетке синтезируются полиамины, включающиеся в сигнальные сети растений.
ЦКП «Орловский региональный центр сельскохозяйственной биотехнологии» ФГБОУ ВО Орловский ГАУ также давно работает в этом направлении. Особое место в ряду достижений научного Центра занимают биотехнологические разработки, применение которых позволяет единовременно решать ряд задач, направленных как на сохранение, воспроизводство и улучшение почв, так и на получение высоких урожаев и экологически чистой продукции растениеводства.
ЦКП является разработчиком и патентообладателем нескольких биотехнологий, в том числе средства для предпосевной обработки гороха [89], включающий в свой состав в том числе природные компоненты: салициловую кислоту, биофлавоноиды гречихи, источник магния. В небольших дозах средство повышает всхожесть, урожайность и устойчивость гороха к болезням.
Биофлавоноиды гречихи являются регуляторами транспорта ауксинов – растительных гормонов и контролируют развитие растений. Также биологическим действием биофлавоноидов являются антибактериальные и антигрибковые свойства против различных инфекционных заболеваний растения. Биофлавоноиды предохраняют растений от стрессовых воздействий окружающей среды.
Преимущество данного средства обусловлено способностью индуцировать болезнеустойчивость растений гороха за счет компонентов сигнальной системы устойчивости, тем самым повышение продуктивности.
1.6 Экзометаболиты Trichoderma atrobrunneum
Одним из широко используемых в растениеводстве и животноводстве грибов является оппортунистический гриб Trichoderma. Грибы рода Trichoderma, выделенные из почвы, впервые были описаны в 1794 году как микроорганизмы, активно разлагающие органическое вещество. В настоящее время они имеет важное хозяйственное значение в связи с широким использованием многих видов для получения ферментов, биологически активных веществ и препаратов для защиты растений. Есть учения, что данный грибок также обладает активностью против возбудителя сибирской язвы [122, 123, 127].
К роду Trichoderma относятся следующие виды грибов: T. Lignorum, T. Harzianum, T. Viride, T. Koningii, T. Reesei, T. Pilulifermum, T. Polysporum, T. Hamatum, T. Aureoviride, T. Longibrachiatum, T. Pseudokoningii [120; 123].
Микромицет обладает очень быстрой скоростью роста, неприхотлив и легко культивируется как в лабораторных условиях, так и на производстве. Имея высокий антагонистический потенциал (т.е. он подавляет действия другого вещества проявляя противоположные ему эффекты), он широко используется для создания и разработки антибиотических (фунгицидных биопрепаратов) препаратов по всему миру. Он способен подавлять около 70 видов фитопатогенов на овощных и сельскохозяйственных культурах. Микроорганизм безвреден для человека и теплокровных животных, полезной энтофауны и пчел, не вызывает ожогов у растений, повышает их иммунитет и ускоряет их рост. Также этот гриб используют для уничтожения насекомых-вредителей и для биодеструкции стерни и соломы [120, 128, 137].
Грибы рода Trichoderma довольно неприхотливы в росте, оптимальная кислотность почвы для этих грибов от 4 до 6. На сусловом агаре они появляются в виде мицелия, который быстро разрастается (Рис.6).
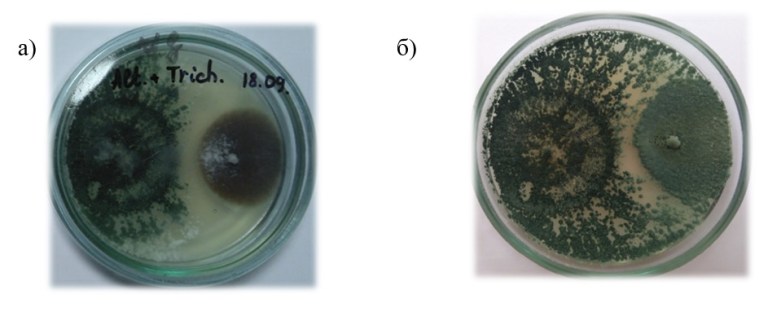
Рисунок 6 – Внешний вид микромицета на чашке Петри: а) 6-е сутки после посева; б) 20-е сутки после посева
На рост гриба Trichoderma имеет влияние температурный режим. На рисунке ниже представлен характер роста гриба при различной температуре (Рис.7). Вообще, считается, что температурные границы для Trichoderma весьма широки. Нижний предел, который нужен для начала роста по сравнению с другими почвенными грибками более снижен и достаточно изменчив.

Рисунок 7. Внешний вид колонии микромицета, выращенного при различных температурных режимах
Таким образом, можно сделать вывод о том, что наиболее оптимальная и благоприятная температура для роста гриба Trichoderma является температура 23-25 0С. Температура выше 28 0С замедляет рост Trichoderma и не приводит к образованию воздушного мицелия.
Мицелий у данных грибов светлый или бесцветный, колонии образует белого, желтого, чаще зеленого цвета. Споры одноклеточные, шаровидные или эллипсоидные, светлые или бесцветные, часто скученные в небольшие головки (Рис. 8).
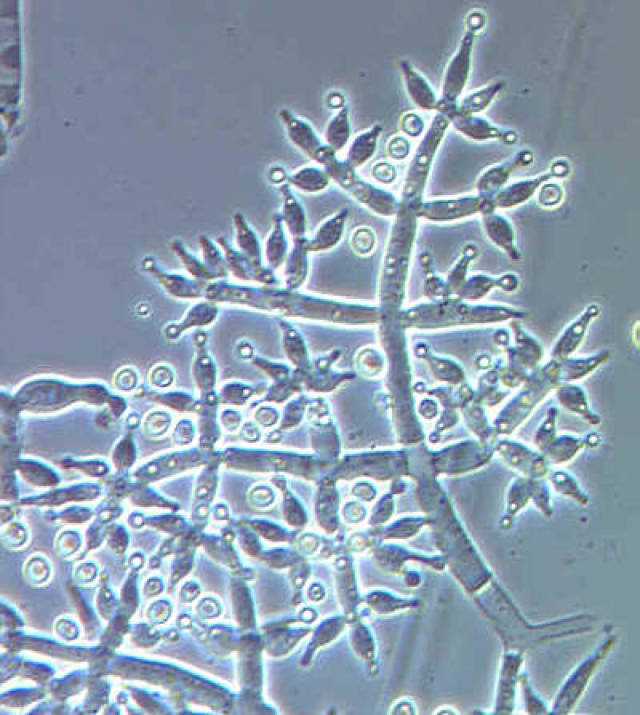
Рисунок 8 — Мицелий гриба рода Trichoderma под микроскопом
Грибы рода Trichoderma чаще всего встречаются в почвах тайги, лесных и лесолуговых зонах, тоесть в почвах богатых органическими остатками. Также, достаточно обильно они заселяют культурные почвы. В зоне подзолистых почв этих грибов больше, чем в других почвах. Особенно часто их обнаруживают в кислых почвах с низким значением рН (обычно 3,6-5,3) [128].
На развитие и рост грибов рода Trichoderma оказывают влияние многие факторы среды, такие как: температура, влажность, рН среды. Реакция среды оказывает значительное влияние на рост грибов. В связи с развитием биотехнологии возрастает интерес к данным грибам, связанный с практическим применением для получения биологически активных веществ, средств защиты растений и как активного деструктора растительных полисахаридов. Разработка на их основе экологически чистых технологий является важным направлением в экологической биотехнологии [130].
Среди метаболитов Trichoderma выявлены следующие соединения: ауксины, цитокины и этилен [124; 147]; цитокинин- подобные молекулы, например, зеатин и гибберилин гибберилин [116]; органические кислоты (глюконовая, фумаровая, лимонная) [124; 121]; аминокислоты [67]; витамины: тиамин, биотин и другие; антибиотики [64], среди которых виридин, глиовирин; ряд пептаиболов, а также стероиды, сесквитерпены и многие другие [86]. Из тканей гриба можно получить трихотецин – антибиотик и «Триходермин» — средство защиты растений от грибных болезней. Все эти соединения обладают высокой биологической активностью.
Микромицет рода Trichoderma активно производит фермент целлюлазу и, в связи с этим, способен к разрушению клеточных стенок растений и трудно расщепляемых растительных полисахаридов: целлюлозы, гемицеллюлозы, пектина до мономерных форм [7, 117, 125].
Грибы рода Trichoderma приводят к увеличению роста и массы корней, что, в свою очередь, повышает урожайность. Также, эти полезные грибы повышают потребление питательных веществ растениями, способствуют усвоению азота, а также происходит произвольное проникновение элементов из почвы в мицеллы [119]. Например, использование данных грибов как стимуляторов роста гороха является перспективным, так как Trichoderma усиливает рост корней, увеличивает их массу, повышает иммунитет растений, не проявляет фитотоксичности (увеличивает пероксидазную активность) [129, 130].
На основе грибов рода Trichoderma перспективна разработка ростостимуляторов. Так как эти грибы способны изменять вблизи корней растений состав микроорганизмов за счет выделения экссудата, это способствуют долгосрочной защите, даже если их применение было однократно, например в начале сезона. Грибы рода Trichoderma даже после однократной обработки остаются на корнях, они как бы внедряются внутрь корней и их клетки размножаются и делятся вместе с растущими корнями растений и остаются жизнеспособными во время всей вегетации культуры. Таким образом, можно сделать вывод, что биологические средства защиты более эффективны, чем химические, в защите корней и ускорении роста растений. Биологические средства защиты на основе грибов Trichoderma способны подавлять возбудителей не только семенной, корневой и почвенной инфекции, но и развитие болезней плодов и листьев при нанесении препарата на поверхность этих структур. Также у данных грибов есть еще один важный механизм, благодаря которому у растений появляется устойчивость к стрессам, за счет улучшения корневой системы и повышения жизнеспособности растений. Как раз-таки устойчивость к высушиванию и повышенная усвояемость азота являются примерами этого механизма. Благодаря улучшению состояния корневой системы с помощью Trichoderma, появляется устойчивость к патогенам, которые непосредственно не контролируются. Способность паразитирующих микроорганизмов поражать растения зависит от продукции ими пектинолитических, хитинолитических и целлюлолитических ферментов, сериновых протеаз, которые разрушают клеточные стенки растительных клеток. И вот как раз механизмом защиты, который воплощают грибы рода Trichoderma, является разрушение продуцируемых ферментов фитопатогенами, и это, в свою очередь, приводит к понижению их контагиозности и патогенности [131; 133].
За последние время наши почвы потеряли запас гумуса, это связано с нецелесообразной обработкой и использованием растительных остатков. Стерни и солому просто сжигают, а вместе с ними и погибают полезные микроорганизмы, а также снижается плодородие почвы. Для избегания этих пагубных последствий применяют препарат на основе гриба рода Trichoderma, который приводит к деструкции стерни и соломы. В результате это формируется биогумус, почва становится более плодородной, улучшается ее водный и воздушный баланс, кислотно-щелочное состояние.
В наши дни существует довольно много научных исследований и разработок в отношении применения грибов рода Trichoderma как агентов биоконтроля фитопатогенов и фитофагов, что является благоприятным для роста и развития растений. Это объясняется тем, что грибы рода Trichoderma обладают высокой скоростью роста, склонны к выживанию в неблагоприятных условиях, также повышают и стимулируют рост растений и вызывают у них выработку защитных механизмов. На основании этого представлены несколько теорий, которые объясняют положительное воздействие этих микроорганизмов на растение-хозяин. Они производят довольно много метаболитов, это и объясняет их полезную биологическую деятельность. Благодаря этим метаболитам происходит подавление роста, развития и деятельности патогенных микроорганизмов, а также повышается устойчивость к другим патогенам, благодаря запуску системы обороны в растении-хозяина. Более того, эти метаболиты также способны к усилению роста растений. В дополнение этого, у грибов рода Trichoderma, имеются вторичные метаболиты, которые оказывают влияние на метаболизм растений и играют важнейшую роль в сложных взаимодействиях этого агента биоконтроля с растениями и микроорганизмами [131; 133].
В настоящее время происходит смена направлений в сельском хозяйстве по использованию синтетических, химических удобрений и пестицидов, на применение микроорганизмов, которые выполняют аналогичную функцию. Trichoderma и является одним из этих микроорганизмов. Этот вид грибов является наиболее признанным, экономически выгодным и способствующем росту грибков, а также является агентом биологического контроля. Также, экономически выгодным является использование вторичных метаболитов, выделяемых Trichoderma, в смежных отраслях. Таким образом, можно сказать, что признание Trichoderma в научном сообществе обосновано полным пониманием механизма его действия против большого набора грибковых, бактериальных и в некоторых случаях вирусных инфекций. Применение конкретных целевых вторичных метаболитов имеет потенциальные возможности использования Trichoderma как фитопатогенов в качестве замены имеющихся в продаже [131, 133].
Первым делом, при анализе биологических свойств гриба смотрят на процесс торможения (ингибирующую активность) в отношении фитопатогенных грибов. Именно поэтому грибы рода Trichoderma применяются во всем мире для создания биологических средств защиты растений, исходя из высокого антагонистического потенциала, скорости роста и возможности культивирования в производственных условиях [131, 133].
Естественная упорядоченность численности фитопатогенных микроорганизмов с помощью Trichoderma может происходить косвенно: а) первым является естественное соперничество за питательные вещества и пространство для роста; б) за счет возможности синтеза и сопротивления метаболитам агентов биоконтроля сдерживать прорастание спор фитопатогена (фунгистазис); в) третьим является способность Trichoderma уничтожать клетки фитопатогена (антибиоз); г) четвертым является возможность преобразовывать узкий слой почвы, который находится вблизи к корням растений (ризосферу) путем закисления почвы, в результате чего патогенные микроорганизмы не способны к росту.
Не так давно появились учения, о том, что при взаимодействии Тrichoderma с фитопатогенами идут отрицательные реакции. На данном этапе изучения известно, что действуют эти полезные грибы путем различных клеточных процессов, а не только ферментативного гидролиза, как предполагалось ранее. Благодаря проведенным исследованиям подтверждается, что один комплекс ферментов – хитиназ – играет одну из главных ролей в отрицательных взаимодействиях Trichoderma с фитопатогенами [145]. Хитиназы – это ферменты которые гидролизируют хитин, то есть хитин взаимодействует с водой и в результате такого взаимодействия происходит разложение хитина и воды с образованием новых веществ.
Как известно, грибы рода Trichoderma защищают растения от действия патогенных микроорганизмов за счет их подавления, а также путем индуцирования системной и локальной резистентности растений. Именно такие прямые эффекты Trichoderma на рост и развитие растений очень важны для применения в сельском хозяйстве и для понимания роли грибов Trichoderma в природных и искусственных экосистемах [94].
Грибы рода Тrichoderma осуществляют контроль фитопатогенных микроорганизмов с помощью действия множества механизмов. Поэтому не приходиться удивляться, что разные штаммы обладают различными биоконтрольными способностями. Больше того, даже мутанты этих штаммов реализуют различные механизмы контроля фитопатогенов. Мало того что эти грибы вооружены самым разным «биологическим оружием», они относятся к грибам, которые быстро адаптируются к различным стрессовым факторам и не специфичны по отношению к контролируемым ими фитопатогенам. Например, штаммы, которые лишенные одного механизма, быстро адаптируются и используют другой механизм. По мнению многих самым важным механизмом действия является микопаразитизм грибов рода Trichoderma. Доказано, что управление микофильных грибов, которые паразитируют на других грибах, многими генами и генными продуктами. Каждая функциональная ферментная группа включает в себя несколько ферментов, которые различаются по своим свойствам. Описано более 10 отдельных хитинолитических ферментов, установлена дивергентность и для b_1,3_глюканаз и протеаз [132]. Управление каждой ферментной группы осуществляется по-разному, что делает регуляцию микопаразитизма чрезвычайно сложным процессом. На первом этапе микопаразитизма его управление осуществляется более чем тридцатью генами и генными продуктами и является довольно сложным механизмом. В основном все гены действуют друг на друга и усиливают действие друг друга, тоесть они синергичны друг другу. Синергизм – регуляторный механизм, который является довольно сложным, он является неотъемлемой частью осуществления атаки видов Trichoderma против других фитопатогенных микроорганизмов. Неудивительно, что род Тrichoderma объединяет много грибов, которые способны к контролю фитопатогенных грибов. Одним из классических примеров биологического контроля у грибов рода Тrichoderma является конкуренция за местообитание и питательные вещества с фитопатогенами. Во многих случаях, когда очевидный микопаразитизм или антибиоз отсутствует, предполагается механизм конкуренции [130].
Таким образом можно сделать вывод, что влияние экзометаболитов грибов рода Trichoderma повышает устойчивость сельскохозяйственных растений к фитопагенам на молекулярном уровне и является перспективным и актуальным. Эти грибы усиливают рост растений и повышают их иммунитет, увеличивают массу корневой системы, не являются патогенными для человека, животных и насекомых. На их основе перспективно создание биологических средств защиты растений, так как они обладают фунгицидным, антибактериальным и антивирусными действиями. Они имеют преимущество над химическими и синтетическими средствами защиты, так как представляют собой экологически чистый продукт, а также необходимо более меньшее количество биологических препаратов чем химических. Эти грибы модифицируют ризосферу растений и это приводит к вытеснению фитопатогенных микроорганизмов из среды обитания путем блокирования роста их спор, невозможности использовать ими питательных веществ из почвы, а также из-за нехватки пространства для роста.
Некоторые штаммы грибов способны к колонизации в корневой системе, путем внедрения в нее, либо находиться на поверхности растений, тем самым способствуя защите растений. Штаммы грибов имеют не одинаковую антибиотическую активность, отсюда вывод, что принадлежность к одному виду не является определяющим фактором в выборе штамма для разработки препаратов защиты [142].
Еще одним важным свойством является выделение грибами рода Trichoderma метаболитов в почву, в результате этого даже одной профилактической обработки растений будет достаточно для подавления возможного роста фитопатогенов. Также эти грибы выделяют вторичные метаболиты, которые играют важнуюо роль во взаимодействиях этого агента биоконтроля с растениями и микроорганизмами [144]. У этих грибов очень быстрая скорость роста, они не прихотливы к условиям среды, в результате этого они легко культивируются в условиях лаборатории, на производстве и в окружающей среде, также они способны быстро адаптироваться к новым стрессам со стороны окружающей среды, что является благоприятным моментом.
В обобщении вышесказанного можно сказать, что грибы рода Trichoderma высокоэффективны в отношении фитопатогенов и разработка на их основе биологических средств защиты растений является перспективным, актуальным, экономически выгодным и важным направлением в биотехнологии. Также важно отметить, что грибы рода Trichoderma используются в текстильной промышленности. Например, для окрашивания джинсовой одежды с помощью целлюлазы, или использование целлюлаз для обработки целлюлозных тканей, в результате этого ткань становится гладкой, легче очищается, повышается ее гидрофобность, становится более прочной и качественной.
Также ферменты данного гриба применяют в пищевой (алкогольное производство, виноделие, соки, оливковое масло), кормовой промышленности, деревообрабатывающей и бумажной промышленности (как продуценты белка, наличие ферментов, которые действуют на углеводы древесины). Перспективен данный грибок и в области медицины, например как препарат, который подавляет рост противоопухолевых клеток, или препарат, который обладает антибиотической активностью относительно сибирской язвы. Из вышесказанного можно сделать вывод, что грибы рода Trichoderma используются во многих отраслях, а не только в агропромышленном комплексе. А использование их именно в агропромышленности пророчит успех, за счет того, что они улучшают ризосферу, способствуют росту растений, являются биологически эффективными средствами защиты и их применение актуально, перспективно, целесообразно, разумно и рационально. У грибов рода Trichoderma имеется очень большой биотехнологический потенциал, который должен использоваться агропромышленном комплексе, а также в различных отраслях производства, экономики и медицины.
1.7 Характеристика Fusarium oxysporum
Фузариоз зерна – широко распространенное в мире заболевание, повсеместно снижающее урожай и качество сельскохозяйственной продукции. Уже около 120 лет в России изучают грибы рода Fusarium, вызывающие ухудшение качества зерна.
Fusarium oxysporum – несовершенный гриб, полифаг. Возбудитель фузариозов различных растений. В частности: фузариозного увядания картофеля, корнееда сахарной свеклы.
Мицелий – воздушный, пленчато-паутинистый, невысокий, окрашен в различные оттенки розово-карминово-лилового цвета, иногда в светло-желтый или белый цвет [93] (Рис. 9).
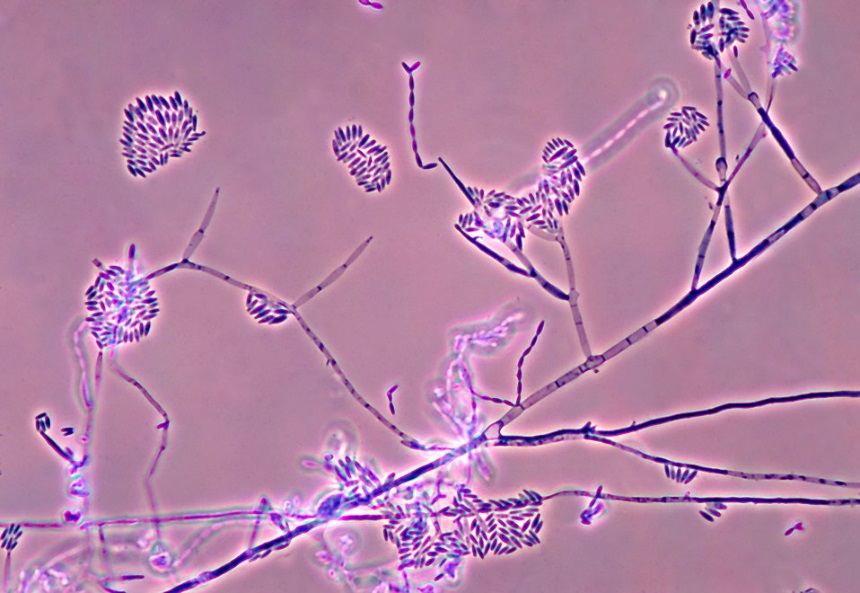
Рисунок 9 — Мицелий Fusarium oxysporum под микроскопом
Макроконидии (экзоспоры грибов) – образуются в воздушном мицелии, иногда в спородохиях и пионнотах. Форма – веретеновидно-серповидная, эллиптически изогнутая, либо почти прямая. На большей части диаметр одинаковый, оболочка тонкая. Верхняя клетка не удлиненная, постепенно и равномерно сужается. К основанию макроконидии суженны, имеют ясно выраженную ножку или сосок. Перегородок от 3 до 5. Размеры: 25–50х3,7–5 мкм [43; 56]. Микроконидии – формируются в мицелии, часто в ложных головках. Всегда обильные. Продолговатые, одноклеточные, бесцветные [91, 51]. Хламидиоспоры – обильные, промежуточные, верхушечные, гладкие или шероховатые, одноклеточные или двухклеточные, неокрашенные [91, 51]. Микросклероции – темные. Распространен во всех частях света.
Для выращивания чистой культуры Fusarium oxysporum используют следующие питательные среды: картофеле-сахарозный агар, картофельный агар, мальц-пептонный агар, синтетический агар Чапека, сусло-агар. Инокулюм патогена выделяют из клубей картофеля с явными признами сухой гнили или стеблей с симптомами фузариозного увядания [91].
Морфолого-культуральные типы колоний обычно изучают на картофеле-глюкозном агаре. Культуры высевают в тридцатикратной повторности в чашки Петри на КГА и в течение двух недель выращивают при температуре +22°C–+24°C. На 12–14 день роста проводят оценку морфолого-культуральных признаков колонии (Рис.10).
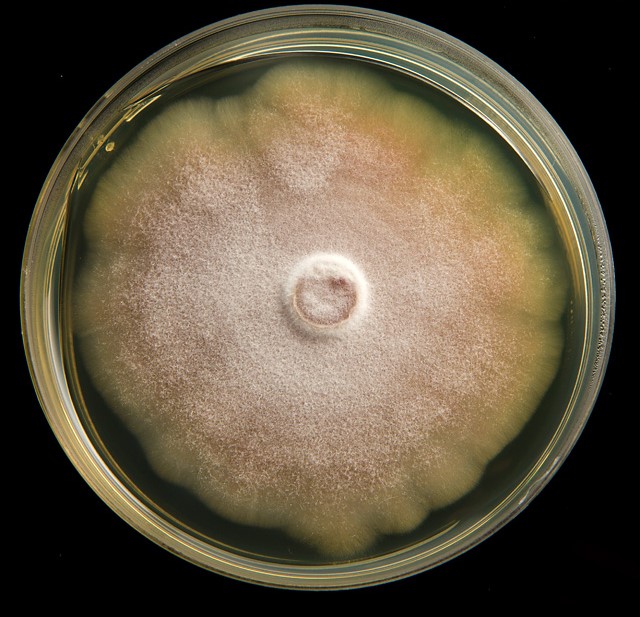
Рисунок 10 — Рост Fusarium oxysporum в чашке Петри на среде Чапека
Fusarium oxysporum в зависимости от морфотипа колонии характеризуется следующими признаками:
— Воздушный мицелий – невысокий, паутинистый, белый однородный. Субстратный мицелий – белый.
— Воздушный мицелий – высокий, белый, паутинистый. Субстратный мицелий – белый.
— Воздушный мицелий – паутинистый, невысокий, белый с лиловыми участками. Субстратный мицелий – от лилового до черного.
— Воздушный мицелий – пленчато-паутинистый, невысокий, белый с оттенками светло-желтого цвета, иногда с лизирующими участками. Субстратный мицелий – от белого до оливкового [51].
Fusarium oxysporum продуцируют микотоксины – низкомолекулярные вторичные метаболиты. Токсигенность – это способность организма образовывать вещества, обладающие токсическим действием на другие организмы. Исследования токсинопродуцирующей способности видов грибов с использованием изолятов различного происхождения, идентификация которых подтверждена молекулярно-генетическими методами, в настоящее время являются бурно развивающимся разделом микотоксикологической науки. Микотоксины, образуемые фузариевыми грибами: ТрМТ (трихотеценовые микотоксины) – является наиболее широко распространенной и изученной группой метаболитов. По химическому строению они подразделяются на группу А (включает Т2 и НТ2 токсины, диацетоксисцирпенол – ДАС, моноацетоксисцирпенол – МАС, неосоланиол – НЕО) и группу В (ДОН, НИВ и их моноацетат и диацетат производные). Считается, что трихотецены группы А в основном более токсичны, чем группы В, а Т2 токсин – один из наиболее остротоксичных среди фузариотоксинов. Основные продуценты ТрМТ группы В – виды F. graminearum, F. culmorum и F. Сerealis. ФУМ – фумонизины – представлены большой группой соединений – на сегодняшний день идентифицировано 28 аналогов, из которых наиболее распространены и изучены ФУМ группы В (ФB1, ФB2, ФВ3). ФУМ оказывают фитотоксический эффект. Показано, что высокая концентрация фумонизинов в семенах кукурузы может значительно влиять на их прорастание. Длина корешков уменьшалась на 75 % после 48 ч замачивания семян кукурузы в растворе фумонизинов (100 мг/кг) [52].
Грибы рода Fusarium существуют в анаморфной (бесполой) стадии развития, у некоторых видов отмечается и теломорфная (половая или сумчатая) стадия. За счет бесполой стадии развития фузариоз быстро распространяется по всему полю. В основном, большая часть жизни грибов проходит в анаморфной стадии развития, включающей развитие вегетативного мицелия, конидий и образование хламидоспор (для некоторых видов, способных к этому). Вегетативное спороношение гриба на растительной ткани, заражение новых растений и вновь образуемое спороношение могут быть лимитированы только отсутствием восприимчивого питательного субстрата и наступлением неблагоприятных условий для развития гриба. Формирование конидий происходит довольно просто, что позволяет грибу за короткий промежуток времени образовывать огромное количество инфекционных структур. Оптимальные условия среды позволяют уже через несколько суток образовываться многочисленным конидиям на колосковых чешуйках, которые служат новым источником заражения растений. Период появления видимой массы конидий в поле зависит от времени инокуляции, восприимчивости растений, условий окружающей среды и в среднем составляет 5–10 суток. Как мицелий гриб длительное время сохраняется в семенах, почках, на растительных остатках и на дикорастущих сорняках. Многие виды гриба образуют из клеток мицелия и конидий хламидоспоры (толстостенные прочные капсулы), которые помогают пережить неблагоприятные условия для расселения гриба. Как только мицелий попадает вместе с почвой или растительной тканью в благоприятную среду, он может развиваться дальше, прорастать и формировать вегетативный мицелий. В весеннее время, в связи с потеплением, начинается активный рост грибов и образование конидий. Конидии и фрагменты гиф разносятся ветром, каплями воды или насекомыми и прорастают, попадая на поверхность восприимчивых тканей растений [52]. Сок растений нужен патогенному грибу для размножения. Благодаря тому что грибы образуют споры, они могут длительное время сохраняться в почве, в течении нескольких лет. Споры устойчивы к перепадам окружающей среды, поэтому то и сохраняются долгое время. Грибок поражает все части растения (Рис.11).

Рисунок 11 — Пораженные части растений грибами рода Fusarium
Грибы Fusarium oxysporum вызывают заболевание зерновых, клубневых и других культур, а именно фузариоз. Характерными симптомами заболевания на зерновых культурах проявляются в виде потери цвета колосковых чешуй. Это как раз хорошо заметно в начальном периоде созревания растений на фоне еще зеленой окраски здоровой ткани (Рис.11). Если поражение колоса происходит на начальных этапах, то это приведет к появлению худых, щуплых зерен, которые не способны дать нормальный росток. Все тело их пронизано белыми гифами грибка. На зернах можно увидеть проросшие грибницы.

Рисунок 11 — Фузариоз колоса
При благоприятных условиях для развития заболевания на колосковых чешуйках появляется налет мицелия и спороношения гриба, имеющий, в зависимости от вида возбудителя, розово-оранжевую или красновато-кирпичную окраску. Однако многие виды фузариевых грибов макроконидий не образуют или образуют редко, и вместо хорошо заметного розового налета на колосковых чешуйках развиваются слабозаметные или нетипичные симптомы заболевания – некротическое потемнение колосковых чешуй, штриховатость, глазковая пятнистость. Зерновые культуры восприимчивы к заражению патогенами с периода цветения и до уборки. Чем раньше произошло заражение, чем агрессивнее патоген и восприимчивее растение, тем большему разрушительному воздействию подвергается зерновка. До цветения генеративные органы растений практически иммунны к заболеванию, а при заражении растений в ранние сроки в колосе образуются деформированные, легковесные зерна, которые обычно удаляются при послеуборочной обработке, что приводит к значительным прямым потерям урожая. Пораженные зерна морщинистые, с выраженной бороздой и заостренными концами. Зерна обесцвечены, без блеска. Эндосперм рыхлый. В борозде, в зародышевой части зерна, виден налет мицелия в виде паутины. Такие зерна нежизнеспособны (Рис.12).

Рисунок 12 — Фузариоз зерна (слева)
В зерне разрушается белок и происходит накопление продуктов его распада. К ним относятся пептиды, аммиак, аминокислоты. Количество клейковины не только уменьшается, но и ухудшается ее качество, она становится мягкогй, расплывчатой, с неприятным запахом. Фузариоз зерна определяют не только путем визуального осмотра, а также с помощью микологического анализа. Инфицированные части растения помещают на питательную среду, через несколько дней под микроскопом можно увидеть грибы рода Fusarium. Также используют метод полимеразной цепной реакции для определения грибка. Проводят двадцать циклов (денатурация, отжиг, расширение) имеется достаточное количество копий для определения желаемой ДНК. Планорный волновод: возможность одновременного определения нескольких микотоксинов в короткий срок с помощью прибора с различными показателями преломления.
От степени зараженности зерен зависит скорость прорастания семян, а также зависит сама их всхожесть. Смотря насколько глубоко мицелий патогенного грибка, проник в глубину, зерно может дать слабые проростки, которые будут заражены гнилью, либо вообще может быть невсхожим.
Микотоксины, продуцируемые определенными видами грибков, являются факторами риска для здоровья человека и животных, поэтому сами грибки и микотоксины, как таковые, представляют весьма серьезную проблему для здравоохранения и экономики.
Микотоксины, продуцируемые грибами рода Fusarium: зеараленон (рис. 13) проявляет эстрогенное, тератогенное действие; трихотеценовые микотоксины (рис. 14) оказывают нейротоксическое, геморрагическое, лейкопеническое, иммунодепрессивное, дерматоксическое, тератогенное (для Т-2-токсина и вомитоксина), канцерогенное (для Т-2-токсина фузаренона-Х).
Рисунок 13 – Структурная формула зеараленона |
|
Фузариотоксины являются очень опасными как для здоровья человека, так и для сельскохозяйственных животных. Эти грибные токсины вызывают фузариотоксикоз. Он вызывается из-за употребления в пищу продуктов, изготовленных из зерна зараженных Fusarium oxysporum. В пораженном зерне существенно меняется химический состав, в результате чего происходит разрушение белка, клетчатки, крахмала. Глютен, который необходим в производстве хлебобулочных изделий теряет эластичность. В результате этого, хлеб, изготовленный из такого зерна, имеет темную окраску и вид крупнопористого мякиша. Отравление таким инфицированным хлебом называют «болезнь пьяного хлеба», так как симптоматика похожа на алкогольное отравление: рвота, расстройства зрения, судорожный синдром.
Также фузариотоксикоз может проявляться в виде кожных поражений: гранулемы, язвы, некротические очаги на коже на фоне высокой лихорадки. Для диагностики проводят биопсию данных инфильтратов с последующим гистологическим исследованием и выявлением возбудителя, а также возбудителя выявляют в крови. Токсины гриба оказывают подавляющее действие на иммунную систему. Так как зараженные зерна, из которых приготовлены патогенные продукты питания, выделяют продукты распада, которые после различных технологических обработок трансформируются в канцерогенные вещества. Именно эти вещества находятся на первом месте в этиологии развития раковых заболеваний. Существует мнение, что патогены грибов влияют на репродуктивную функцию человека, вызывают нейротоксические расстройства. Специфического лечения фузариотоксикоза у людей не разработано, так как еще не был найден эффективный препарат, который бы «выключал» действие токсинов из путей метаболизма. В основном для лечения используют противогрибковое средство из группы триазолов, которое вводят внутривенно по схеме. Также проводят симптоматическую терапию, используют дезинтоксикационную терапию, антибиотики широкого спектра действия, гепатопротекторы, пробиотики, пищеварительные ферменты, витамины [98].
Особенно фузариотоксикоз опасен для детей, в рационе которых зерновые продукты занимают существенную долю. Например, это дети с непереносимостью лактозы, в этом случае из их рациона питания исключают все молочносодержащие продукты и переводят на глютеновую диету, тоесть заменяют молочные белки на белок злаковых культур. Поэтому более четким критерием опасности считается не содержание микотоксинов в килограмме зерна или продуктов его переработки, а их допустимый уровень суточного потребления в перерасчете на вес тела, оценивающий вредное влияние на организм в зависимости от суммарного количества поглощенного метаболита [106].
При фузариотоксикозе у животных происходит следующее: корм, зараженный фузариотоксинами, попадает в желудочно-кишечный тракт животного, там происходит его всасывание и попадание в кровеносную систему, в результате чего, токсины разносятся по всему организму. В основном токсины накапливаются в органах кроветворения тем самым нарушая их функцию. Возникает жировая дистрофия печени, это приводит к снижению ее барьерной функции. Также токсины оказывают неблагоприятное действие на выделительную систему животного, а именно на почки. Токсины из организма животного выделяются в окружающую среду вместе с мочой и калом. Если говорить о симптоматике фузариотоксикоза, то в первую очередь обращает внимание на себя отсутствие аппетита у животного, его беспокойство, при осмотре отмечается гиперемия и отечность слизистой оболочки ротовой полости, язык сухой, с участками некроза. Отмечается слюнотечение. Также характерны симптомы поражения центральной нервоной системы: атаксия, нарушения чувствительности, скованность и пошатывание при походке, судороженность мимических мышц. Если говорить о симптомах фузариотоксикоза у домашней птицы, следует отметить, что они забиваются в угол, перестают двигаться, постоянно сидят, при осмотре наблюдается синюшность гребня и сережек, участки некроза на слизистой оболочке ротовой полости, пищевода, клюва. Слизистая, как и у животных, гиперемирована, отечна, с мелкоточечными кровоизлияниями. Возможно, появления поноса. Патологоанатомические изменения у животных следующие: слизистые оболочки цианотичны, слизистая желудочно-кишечного тракта имеет очаги гиперемии и в тяжелых случаях некроза, в паренхиматозных органах и лимфатических узлах застойные гиперемии, почки дряблые, гиперемированные, инъецированы сосудами, печень увеличена в объеме, наблюдается жировая дистрофия. Сердце дряблое, увеличено в размерах. Мочевой пузырь увеличен в объеме, растянут, заполнен мутной мочой, слизистая оболочка покрыта грязным налетом. Специфического лечения фузариотоксикоза у животных не разработано, в основном оно симптоматическое. Первым делом стоит прекратить давать корм, зараженный грибком. Второе – это промывание желудка раствором пищевой соды, взвесью активированного угля.
Для того чтобы снизить заражение зерна и загрязнения его микотоксинами применяют систему мероприятий, которые проводят как в предпосевной, так и в вегетационный и послеуборочный периоды. Это является некой профилактикой заболеваемости. Предпосевная подготовка семян. Санитарное состояние продуктов растительного происхождения зависит от качества семенного материала (всхожесть, энергия прорастания, наличие примесей, заспоренность и зараженность зерна). Необходимо проведение лабораторного анализа (фитоэкспертизы) семян всех посевных партий, одна из целей которого – выявление количественного и качественного состава присутствующих патогенов. Агротехнические мероприятия снижают численность популяции патогена и улучшают общее состояние растений. Агротехнические факторы в порядке убывания вклада в сдерживание развития фузариоза зерновых культур ранжируются следующим образом: предшественник, система обработки почвы, азотное питание, срок сева, норма высева, способ уборки, послеуборочные мероприятия. Ошибки на любом из этих технологических этапов, особенно при повышенной влажности в период формирования зерна, неизбежно приведут к значительному развитию заболевания, интенсивность проявления которого может сдерживать только устойчивость сорта. Организационно-хозяйственные мероприятия. Дикорастущие растения могут быть резервуарами грибной инфекции, способствуют повышенной влажности почвы, а также забирают себе значительную часть питательных веществ. Для снижения фузариоза среди растений важным аспектом является ликвидация сорняков агротехническими приемами или применением. Химический метод. Фунгицидных препаратов, которые качественно защищают зародышевое зерно от проникновения патогена, очень мало. В основном, самая высокая эффективность существующих препаратов составляет 60–70 % снижения видимых симптомов заболевания в поле. Уменьшение микотоксинов в сырье. Применение приемов, способствующих некоторому снижению загрязнения зерна микотоксинами, зависит от его целевого назначения. Частичная очищение от патогенов возможна путем механического удаления спор, мицелия и грибниц грибов с поверхности зерновых культур и из оболочки при сепарировании, сухой и мокрой очистке зерна перед использованием в перерабатывающей промышленности. Распределение микотоксинов в продуктах переработки зерна неравномерно, что вызвано их локализацией в определенных частях зерна. Сортовые помолы снижают концентрацию токсинов за счет выделения и дифференцированного размола внутренних, наименее загрязненных токсинами частей зерновки. В связи с этим, в отдельных зернопродуктах (например, в отрубях) возможно превышение ПДК даже при содержании микотоксинов в зерне в пределах нормы, тогда как в других наблюдается значительное его снижение. У пленчатых культур (ячмень, овес) в процессе сепарирования, шелушения и шлифования зерна с отходами удаляется значительное количество токсинов. Загрязненное зерно можно использовать для производства этилового спирта, в некоторых случаях его можно разбавить чистыми кормами [52].
Таким образом, можно сделать вывод о том, что Fusarium oxysporum – это несовершенный гриб, который вызывает фузариоз. Этот вид грибов широко распространен в природе, они участвуют в общем природном круговороте. Так как они содержат большое количество ферментов это способствует разрушению органических соединений. Гриб оказывает влияние и на корни, и на стебли, и на листья, и на зерна. Этот грибок продуцирует токсины, которые накапливаются в растении и оказывают на него токсическое действие, замедляя их рост, ухудшают их качество, приводит к их гниению, а также делают не пригодными для употребления в пищу в дальнейшем. Первая фаза заражения проявляется появлением нескольких очагов, которые увеличиваются в размерах, сливаются друг с другом и распространяются по всему растению. Если заболевание произошло на начальных стадиях, то зерно становится щуплым, с очагами проросших грибниц. В зерне происходит распад белка, накопление продуктов распада, уменьшается количество клейковины и ухудшается ее качество, в результате этого зерно становится токсичным. Важно отметить, что в зоне риска заражения данным грибком являются растения с повреждениями, которые им оставили насекомые-вредители или птицы. Гриб продуцирует фумонизины с канцерогенным действием. А как известно канцерогенные вещества являются первыми в этиологии раковых заболеваний. Благодаря насекомым, а также природным условиям, таким как ветер, капли воды, происходит разнос участков гиф, в результате чего они попадают на другие растения. Это приводит к перемещению и циркуляции Fusarium oxysporum в естественной среде обитания и распространению фузариоза. Фузариоз зерна можно определить не только с помощью визуального осмотра, но и при помощи микологического анализа, полимеразной цепной реакции, планорного волновода. К факторам, которые способствуют развитию заболевания относятся: жаркая погода с большим количеством выпадения осадков, несбалансированность питания растения, особенно важное значение здесь имеет фосфор и азот, и еще одним фактором является несвоевременный сбор урожая. Важно отметить, что фузариоз не только снижает численность урожая, а также опасен для здоровья человека и животных, вызывая фузариотоксикоз, проявления которого граничат от симптомов общей интоксикации до некротических процессов. Также фузариотоксикоз опасен для детей в рационе которых преобладают злаковые продукты. Поэтому, для снижения случаев фузариоза необходимо проводить фитосанитарную обработку во все периоды роста растений. Факторы, которые способствуют развитию фузариоза у растений многочисленны: плохой уход за растением; густая посадка; застой влаги в земле, что препятствует поступлению воздуха в почву; применение химических удобрений и пестицидов; недостаточная поливка растений, что приводит к сухости корней; наличие вблизи посадки автомагистралей и промышленных предприятий; повышенная температура и влажность являются еще одними факторами, которые способствуют развитию фузариоза; закисленность почвы; применения удобрений содержащих хлор. Также необходимо соблюдать меры защиты зерна, такие как: воздушный и тепловой обогрев зерна, его сушка и прочистка; фосфорно-калийные удобрения; хранение зерна при оптимальной температуре и влажности; соблюдение чередования культур и паров; соблюдение сроков посева. Лечить фузариоз растений невозможно, поэтому требуется проводить профилактику: соблюдение чередования культур на участке (севооборот), а также дезинфекция почвы, где наблюдалась вспышка фузариоза; соблюдение технологии растениеводства (агротехники) для избегания понижения иммунитета у здорового растения; дезинфекция парников, теплиц, инструментов; не делать компостную кучу из полумертвых и больных растений, так как она является рассадником фузариоза; Fusarium любит кислую почву, поэтому ее нужно делать нейтральной, например с помощью золы; защищать растения от стрессов (излишнее увлажнение, перемещение, затемнение и др.); ликвидация насекомых-вредителей, так как они являются переносчиками фузариоза; своевременная уборка урожая; осенняя зяблевая вспашка; хранить семена в благоприятных для них условиях.
1.8. Характеристика полифенольных соединений гречихи посевной
К уникальным особенностям высших растений относится способность к образованию фенольных соединений – веществ, обладающих высокой антиоксидантной активностью. Таким представителям вторичного метаболизма отводится важная функциональная роль, в том числе в защите тканей и клеток от неблагоприятных условий и стрессовых воздействий.
Флавоноиды играют огромную роль в защите растений от бактериальной, вирусной и грибковой инфекции, от проникновения паразитов и повреждения насекомыми. Одной из наиболее заметных функций флавоноидов является их участие в защите растений от окислительного стресса благодаря выраженной антиоксидантной активности.
Флавоноиды являются мощными антиоксидантами, препятствующими развитию окислительного стресса в клетках, где метаболизм нарушен в результате действия токсических прооксидантов, УФ-радиации и других повреждающих факторов. Полифенолы обладают, кроме того, бактериостатическим действием. Так, некоторые флавоноиды, например кверцетин, катехин, таксифолин, способны инициировать агрегацию и даже медленное слияние мембран в присутствии катионов железа, которые могут образовывать мостики между двумя молекулами флавоноидов, «заякоренными» в соседних мембранах. Было обнаружено, что некоторые флавоноиды способны специфически взаимодействовать с определенными белками бактериальных клеток, вызывая нарушение их функционирования. Флавоноиды способны нарушать функционирование различных ферментов, участвующих в синтезе мембранных липидов бактерий. Флавоноиды препятствуют взаимодействию NADPH с ферментом бета-оксоацил-протеинредуктазу. В результате этого наблюдается сильный цитотоксический эффект не только в отношении грамположительных и грамотрицательных бактерий, но также некоторых грибков. Кверцетин, апигенин и сакуранетин (sakuranetin – флавонон, присутствующий в рисе) способны подавлять активность бета-гидроксиацил-переносящего белка. Большинство полифенольных соединений растительного происхождения способно поглощать излучение в УФ-диапазоне и, следовательно, может выполнять функцию экрана.
Важной сельскохозяйственной культурой, содержащий широкий спектр полифенольных соединений является гречиха посевная.
Гречиха посевная (Fagopyrum esculentum Moench) крупяная культура промышленного использования. Она обладает пищевой ценностью, а также для нее характерно образование фенольных соединений, таких как рутин, который очень популярен в использовании фармакологии и кверцитин, а также апигенин. Гречиха посевная является не конкурентоспособной, по сравнению с другими крупяными культурами, так как у нее недружное созревание посевов, высокая чувствительность к воздействию низких температур.
Гречиха посевная содержит в своем составе элементы: железо, кальций, фосфор, йод, фтор, молиблен, кобальт, а также витамины группы В (В1, В2 и фолиевую кислоту), витамин РР и Е.
Цветущая (надземная) часть содержит хлореновую, пирокатехиновую и галловую, а также кофейную кислоты.
Семена гречихи содержат крахмал, белок, сахарное масло и органические кислоты, такие как малеиновая, щавелевая, яблочная и лимонная и витамины: тиамин (В1) и рибофлавин (В2).
Гречиха содержит незаменимые аминокислоты – метионин и лизин, которые способствуют быстрой усвояемости гречихи (до 80%). Гречиха посевная содержит токсический пигмент – фагопирин, который вызывает отравление животных при поедании растения во время цветения. Существуе заболевание фагопиризм или гречишная болезнь, которая наносит большой ущерб животноводству, который прявляется в потере привеса животных и продуктивности [53].
Углеводов в гречихе около 60%, имеющиеся углеводы долго усваиваются организмом, благодаря этому после приема пищи из гречки можно чувствовать себя сытым длительное время. При долгом хранении гречневая крупа не прогоркнет и не заплесневеет при повышенной влажности.
Также гречиха содержит флавоноиды, (рутин, кверцетин, антоцианы) и дубильные вещества [3, 4, 60].
Антоцианы (рис.15) являются окрашенными растительными гликозидами, которые в качестве агликона-антоцианидина содержат гидрокси- и метоксизамещенные соли флавилия (2-фенилхромены), относящиеся к флавоноидам. У некоторых антоцианов гидроксилы ацетилированы.
Углеводная часть с агликоном в положении 3, а у некоторых в положениях 3 и 5, в роли углеводного остатка могут выступать моносахариды, такие как глюкоза, галактоза и рамноза, также ди- и три- сахариды.
Рисунок 15 – Общая формула антоцианов
Находятся антоцианы в стебле и подземной части растения, обуславливая фиолетовую и синюю окраски плодов и листьев. Будучи пирилиевыми солями антоцианы легко растворяются в воде и в полярных растворителях, но малорастворимы в спирте и нерастворимы в неполярных растворителях, проявляют антимикробное действие и антиокислительную активность.
Основная структура антоцианов описана в таблице 1.
Таблица 1. Описание радикалов к общей формуле антоцианов
| Антоцианы | R1 | R2 | R3 | R4 | R5 | R6 | R7 |
| Аурантинидин | -H | -OH | -H | -OH | -OH | -OH | -OH |
| Цианидин | -OH | -OH | -H | -OH | -OH | -H | -OH |
| Дельфинидин | -OH | -OH | -OH | -OH | -OH | -H | -OH |
| Европинидин | -OCH3 | -OH | -OH | -OH | -OCH3 | -H | -OH |
| Лютеолинидин | -OH | -OH | -H | -H | -OH | -H | -OH |
| Пеларгонидин | -H | -OH | -H | -OH | -OH | -H | -OH |
| Мальвидин | -OCH3 | -OH | -OCH3 | -OH | -OH | -H | -OH |
| Пеонидин | -OCH3 | -OH | -H | -OH | -OH | -H | -OH |
| Петунидин | -OH | -OH | -OCH3 | -OH | -OH | -H | -OH |
| Розинидин | -OCH3 | -OH | -H | -OH | -OH | -H | -OCH3 |
Строение антоцианов было установлено в 1913 году немецким биохимиком Вильштеттером. Антоцианы и антоцианидины выделяют из кислых экстрактов растительных тканей при невысоких значениях рН, агликоновая антоцианиновая часть существует в форме флавилиевой соли, в которой электрон гетероциклического атома кислорода участвует в гетероароматической системе безпирилиевого (хроменилиевого) цикла, который является хромофором и обуславливает окраску. На окраску антоцианидинов влияет число и природа заместителей. Это могут быть гидроксильные группы, в которых есть свободные электронные пары, несущие батохромный сдвиг при увеличении их числа.
В силу высокой электрофильности хроменилиевого цикла структура и, соответственно, окраска антоцианов и антоцианидинов обуславливается их чувствительностью к pH: в кислой среде (pH < 3) антоцианы (и антоцианидины) существуют в виде пирилиевых солей, при повышении pH до 5 происходит присоединение гидроксид-иона с образованием бесцветного псевдооснования, при дальнейшем повышении pH примерно до 7 происходит отщепление воды с образованием хиноидной формы, которая, в свою очередь, при pH примерно до 8 отщепляет протон с образованием фенолята, и, наконец, при pH выше 8 фенолят хиноидной формы гидролизуется с разрывом хроменового цикла и образованием соответствующего халкона.
Синтезируются антоцианы в цитоплазме и при помощи глутаминового насоса депонируются в клеточные вакуоли. Антоцианы обнаружены в специальных везикулах – антоцианопластах, хлоропластах, а также в кристаллическом виде.
Антоцианы применяют в качестве пищевых добавок (Е163). Способствуют снижению воспалительных реакций и оксидативного стресса в кишечнике, при потреблении избыточного количества жиров и углеводов улучшают барьерные функции кишечника.
Одним из следующих веществ, входящих в состав гречихи посевной является рутозид (рутин). Содержится в листьях растений, обеспечивает защиту от ультрафиолетового излучения.
Рутин (рутозид, кверцетин-3-О-рутинозид, софорин) (2-(3,4-дигидроксифенил)-5,7-дигидрокси-3-[α-L-рамнопиранозил-(1→6)-β-D глюкопиранозилокси]-4H-хромен-4-ОН) – биофлавоноид, отвечающий за устойчивость растения к неблагоприятным условиям среды, гликозид флавоноида кверцетина (Рис.16). Относится к группе витамина Р. В медицине применяется в виде добавок и используется при гиповитаминозе (повышение проницаемости сосудов), при геморрагическом диатезе, при лучевой болезни, при ревматизме, скарлатине, аллергических заболеваниях, артериальной гипертензии, септическом эндокардите и при кровоизлиянии в сетчатку глаза [77].
Рисунок 16 – Общая химическая формула рутина
Фенольные соединения являются вторичными метаболитами растений, наиболее распространены у высших растений. Фенилпропаноиды, представлены оксикоричными и оксибензойными кислотами, а флавоноиды (флавонолы, флавоны и антоцианы). Фенольные соединения образуются во всех растительных тканях, функциональная роль связана с процессами дыхания, фотосинтеза, аллелопатии, регуляции роста, развития и стрессовых воздействий. Накопление фенольных соединений зависит от фазы роста растения и условий.
Также гречиха посевная содержит дубильные вещества, которые придают терпкий и вяжущий вкус, их еще называют танины (Рис.17). Они являются безазотистыми химическими соединениями, своим названием обязаны высокомолекулярным, фенольным и природным соединениям. По химической структуре являются полифенолами. В основном аморфны, имеют кислотный характер и способны к затвердеванию характеризуются фунгицидными и бактерицидными свойствами, а также выполняют защитную функцию против патогенных микроорганизмов [57].
Рисунок 17 – Общая химическая формула дубильных веществ (танин)
В гречишном зерне содержится 70% резистентного крахмала, который необходим для снижения содержания влаги, поэтому лучше не применять биотехнологическую переработку. Лучше использовать в качестве кормов, с высокой концентрацией, также в составе смесей в кормопроизводстве для птиц и сельскохозяйственных животных [57]. Из цветков гречихи делают гречишный мед, он содержит в себе много железа, фосфора и калия.
Хлорогеновая кислота является одним из важнейших веществ фенилпропаноидной цепи метаболизма; это одно из наиболее важных производных коричных кислот в плодах растений (Рис.18). В ряде случаев термин «хлорогеновые кислоты» рассматривается как обобщенное название продуктов этерификации хинной кислоты кофейной. При этом даже среди моноэфиров может быть четыре изомера, из которых обычно отмечают три реально встречающихся: 3-кофеоилхинная (3-QCA), 4-кофеоилхинная (4-QCA) и 5-кофеоилхинная (5-QCA) кислоты:
Рисунок 18 – Получение хлорогеновой кислоты
Но часто, речь идет об одном изомере, который и подразумевается под названием «хлорогеновая кислота». Он соответствует этерификации гидроксила в положении 5 (5-QCA) по указанной выше схеме нумерации атомов углерода шестичленного цикла хинной кислоты. Интерес к хлорогеновой кислоте неслучаен. Так, методом радиоактивных индикаторов было показано, что замещенные коричные кислоты, которые встречаются в растениях преимущественно в виде сложных эфиров, являются промежуточными веществами синтеза лигнина из аминокислот (фенилаланинаитирозина). Так же известно, что хлорогеновая кислота рассматривается как регулятор ростовых процессов, как защитный фактор по отношению к некоторым микроорганизмам [42].
Витамины группы В – органические вещества, относятся к эндогенным БАВ (биологически активные вещества), отвечают за обмен веществ в организме. Гречиха посевная содержит в себе водорастворимый витамин В1 (тиамин), который отвечает за процессы метаболизма в организме, является важным в углеводном, белковом и липидном обменах, а также в процессах проведения нервного возбуждения в синапсах, защищает мембраны клеток от токсического воздействия (Рис.19).
Рисунок 19 — Структурная формула витамина В1
Кверцетин (3,4,4,5,7 — пентагидроксифлавон) – природное биохимическое вещество группы флавоноидов (Рис.20). Входит в состав биологически активных добавок (БАД) к пище при лечении гипертонии и саркоидоз, а также пищевых добавок, применяется в медицине, так как является сильным антиоксидантом, который обладает противовоспалительными свойствами.
Рисунок 20 – Структурная формула кверцетина
Апигенин – относится к классу флавоноидов. Очень распространен в природе. Является одной из фракций при проведении хроматографии (Рис.21).
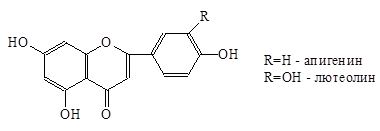
Рисунок 21 – Структурная формула апигенина
Следовательно, зеленая масса гречихи представлена многочисленными классами флаваноидов, отличающихся по химической структуре и биологической активности. Разнообразие флавоноидов огромно и составляет около восьми тысяч веществ. При этом известно, что до 20 % фиксируемого при фотосинтезе углерода идет на производство полифенольных соединений, среди которых значительное место занимают флавоноиды [110].
1.9. Биологические средства защиты против грибных заболеваний овощных и сельскохозяйственных культур
Биологические средства защиты подразумевают использование живых организмов или продуктов их жизнедеятельности для подавления различных возбудителей болезни. Основой биозащиты является природный антагонизм – один вид микроорганизмов подавляет другой.
Биологические средства защиты сельскохозяйственных культур имеют преимущество над химическими, так как они не наносят вреда для человека и окружающей среды, в том числе и домашним животным, насекомым-опылителям и т.д. Важным аспектом применения биопрепаратов является их способность не вызывать привыкания и устойчивости патогенных микроорганизмов, что позволяет использовать средство в течении многих лет в одном и том же количестве, что существенно влияет на экономический аспект. Также, биологические средства защиты не накапливаются в растениях и не изменяют его вкусовых и полезных качеств, запаха и цвета, способны к быстрому растворению в природных условиях не нанося вред окружающей среде, это позволяет использовать их без опасений. Важно отметить, что биопрепараты справляются с болезнями только на ранних стадиях, они не способны контролировать уже развившееся заболевание. Для избегания развития заболевания следует заранее проводить профилактические обработки [19].
Итак, если говорить подробно о биофунгицидах следует отметить, что это биологические препараты, которые подавляют жизнедеятельность патогенных грибков. Данных препаратов достаточно много, одними из них являются средства на основе грибов рода Trichoderma. Триходерма – почвенный грибок, суть действия которого заключается в следующем: после обработки растения грибок внедряется в корни патогенного гриба и начинает свой рост, жизнедеятельность и разрастание, в результате чего происходит гибель патогенного гриба. В мире микробов данный грибок называют хищником, так как он уничтожает другие патогенные грибки своими токсинами, затем растворяет их с помощью литических ферментов и потребляет их. Эти препараты изготовляют на основе массового (производственного) размножения этого гриба, с использованием разных растительных отходов и других субстратов (хлебного мякиша, соломенной резки, отходов зерна и хлебных злаков, перегретого торфа). При культивировании в глубинных условиях с использованием растворимых субстратов (глюкоза, фруктоза, лактоза) образуется рыхлый разветвленный мицелий со слабой пеллетизацией [102]. Для разработки биологических средств защиты существуют некоторые характеристики, которые должны обязательно соблюдаться. Во-первых, препарат должен иметь преимущества над химическими пестицидами. Во-вторых, сопутствующие микроорганизмы в препарате должны быть сведены до минимума в отличие от основного штамма. В-третьих, препарат не должен оказывать токсического и неблагоприятного действия на другие виды, животных, насекомых, человека. В-четвертых, препарат должен долго храниться и не должен менять свои свойства в независимости от времени хранения. В-пятых, биопрепарт должен иметь низкую стоимость, так как он будет использоваться в масштабных целях.
Действие гриба рода Trichoderma на растение можно описать следующим образом: вокруг поверхности корня растений находится узкий слой почвы, толщиной до 5 мм, который содержит различные питательные вещества необходимые для нормальной жизнедеятельности растений. Эти вещества также привлекают к себе различные патогенные для растений микроорганизмы и грибки, которые используют эти же питательные вещества для своей жизнедеятельности. Гриб рода Trichoderma вступает в тесную связь с корнями растений (симбиоз), и подавляет прочие грибки используя их грибницы как питательную среду, размножается и выделяет антибиотики (глитоксин, триходермин, виридин, сацуккалин), которые подавляют патогены, а также способствует к повышенному притоку азота к корням растения. Еще одной важной особенностью является то, что биопрепарат высвобождает углерод и расщепляет органические вещества в неорганические, которые постепенно превращаются в фосфатазотные соединения, что является благоприятным моментом для почвы, так как это способствует ее обогащению. Биологические средства защиты, в составе которых имеется гриб рода Trichoderma способствуют активации в растениях выработки клеточного сока, а это в свою очередь усиливает рост растений, повышает их иммунитет и дает высокий урожай. При взаимодействии растения с грибом Trichoderma первое приобретает некоторые признаки, которые не свойственны для здорового растения, в том числе это и повышение стойкости к различным заболеваниям.
Белок МАРК (митоген-активируемой протеинкиназой) — фермент который осуществляет активацию и инактивацию ферментов и других белков за счёт фосфорилирования (то есть присоединения фосфатной группы), является посредником сигнала стрессовых реакций и развития заболевания. Действие этого сигнала приводит к сверхчувствительному ответу и растением под действием гриба начинает производится фитоалексин (защитные фенольные соединения), отсутствующий у здорового растения (присутствующего только у растения зараженным микромицетом и образуется как ответная реакция на поражение возбудителем) [52].
Огромное признание получило применение различных ферментов метаболитов грибов рода Trichoderma, таких как ксиланаза (гидролитический фермент, используется для повышения выхода белковых веществ, пигментов, крахмала, пектина, сахаристых и биологически активных веществ за счет разрушения клеточных стенок), ThPG, TasSwo. А также биосинтезированые микромицетом фитогормоны, такие как SA (салициловая кислота), JA (жасмоновая кислота) и ET (фермент образующейся под действием солнечного света), и производство антимикробных соединений [52, 73].
Наглядным примером служит использование грибов рода Trichoderma для подавления роста грибов рода Fusarium (Рис. 22,23).
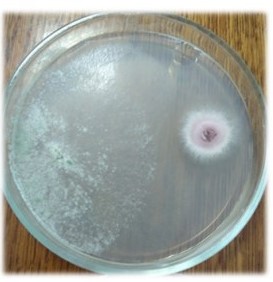
Рисунок 22 — 5-е сутки после посева Trichoderma, формирование зоны подавления роста |
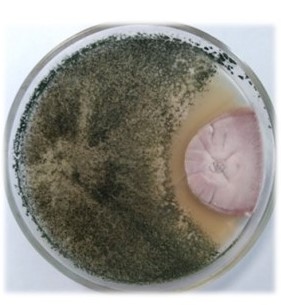
Рисунок 23 — 20-е сутки после посева Trichoderma, сформированная зона подавления роста |
Также, было бы глупо не сказать, о том, что биопрепараты защищают растения и от насекомых-вредителей. Главным является то, что препарат не оказывает негативного влияния на полезных насекомых. Биофунгицид может проникать в организм насекомого-вредителя через желудочно-кишечный тракт (если растение было опрыскано) и в результате происходит гибель насекомого от кишечной инфекции. Второй путь – это воздействие на нервную систему вредителя, в результате чего он гибнет от голода.
Состав биопрепарата на основе гриба рода Trichoderma: в качестве основы препарата (действующего вещества, субстрата) выступают продукты жизнедеятельности гриба рода Trichoderma, например споры. Основной средой, с которой начинается развитие и рост гриба является зерновая основа, например ячменная. Также в состав входит комплекс витаминов, благодаря которым стимулируются рост и развитие гриба рода Trichoderma. Формы выпуска: таблетки, порошок, суспензия.
Одним из представителей биопрепартов сделанных из грибов рода Trichoderma является «Триходермин». Он представляет собой сухой порошок с титром не менее 6 млрд. жизнеспособных спор в 1 грамме. Препарат применяют свежеприготовленным, или высушивают при 30-40°С и хранят в бумажных мешках в сухом помещении при 5-10°С. Срок хранения – 1 год. У препарата отсутствует вирулентность, токсичность и токсигенность по отношению к теплокровным животным и человеку [65].
«Трихофит» — производится на основе водной суспензии Trichoderma lignorum. Данный гриб выделяет биологически активные вещества, которые стимулируют рост и развитие растений, а также подавляет развитие фитопатогенов путем прямого паразитизма. В основном данный препарат применяют против грибов рода Cytospora, которые поражают побеги косточковых пород, что в итоге приводит к усыханию плодовых деревьев. В России Трихофит применяют для борьбы с некоторыми болезнями винограда и сухой гнили картофеля. Трихофит используется как в закрытых грунтах, так и в открытых на протяжении всего периода вегетации. Данный препарат можно сравнить с минеральным удобрением, так как он освобождает соединения калия и фосфора [65, 66].
«Фитоспорин-М» — биофунгицид с широким спектром действия и длительный по времени. Защищает зерновые, клубневые, овощные, плодово-ягодные и декоративные культуры как от бактериальных, так и от грибковых болезней. Данный препарат продуктами своей жизнедеятельности подавляет размножение патогенных микроорганизмов для растений. А также Фитоспорин-М повышает иммунитет растений и стимулирует их рост [66].
В практике применения биопрепаратов для защиты растений до настоящего времени часто бытуют неверные представления по данному вопросу. В частности, считается, что биопрепараты менее эффективны и доступны, чем химические пестициды, а биопрепарат, введенный в почву или ризосферу, не способен влиять на фитопатогены в течение длительного периода времени [16]. Поэтому биопрепараты эффективны для защиты семян от болезней проростков, но бесполезны для защиты растений в период вегетации. Считается также, что один биоконтрольный агент не может быть эффективен в различных условиях, на различных культурах и против широкого спектра патогенов, поэтому лучше применять смешанные препараты, а механизм действия биоконтрольного агента очень прост и контролируется только одним или несколькими генами и генными продуктами [22].
Таким образом, можно сказать, что биопрепараты имеют преимущество над химическими средствами защиты, так как являются экологически чистыми препаратами защиты, их нужно более меньшее количество для обработки, чем химических, так как даже небольшое количество препарато способно справится с заболеванием. Они не накпливаются в растении, не ухудшают его вкусовых свойств, не изменяют цвета, запаха. К биопрепаратам, содержащим грибы рода Trichoderma, относятся Триходермин, Трихофит, Фитоспорин-М и другие. Они подавляют не только возбудителей корневой, но и семенной, и почвенной инфекции, а также предотвращают развитие болезней плодов и листьев при нанесении их на поверхность. Также биологические средства защиты не вызывают привыкания патогенных микроорганизмов, поэтому их можно использовать в течении нескольких сезонов. Они эффективно защищают растения от патогенных бактерий и грибков, борются с вредителями, сорниками, и, самое главное, не наносят никакого вреда природе, человеку, животным. Действие биопрепаратов на основе Trichoderma заключается во внедрении «хищников» микробного мира в корневую систему патогенного гриба, его вытеснения, разрушения и в последующем гибели. Микроорганизмы, из которых изготовлены биопрепараты в своем большинстве выделяют различные экзометаболиты, которые подавляют рост и развитие различных патогенных возбудителей. Также биопрепараты способствуют повышению иммунитета растений, стимулируют их рост и укрепляют защитные функции. Растение использует все свои возможности и функции для защиты себя от различных стрессов окружающей среды, если его корни колонизированы биопрепаратом с Trichoderma. Биологические средства защиты могут защищать растения от насекомых-вредителей путем внедрения в их желудочно-кишечный тракт, либо путем действия на нервную систему насекомых. Важным является то, что на «полезных» насекомых патогенного действия не оказывается. Для создания биопрепарата нужно соблюдать определенную методику разработки, чтобы биологическое средство защиты было эффективным, экономически выгодным и безопасным. Но также было бы ни правильно не сказать об отрицательных моментах биологических средств защиты. Первым таким моментом является отсутствие моментального эффекта, именно поэтому растения должны проходить предпосевную подготовку. Вторым моментом является технологическая сложность процесса. Третий момент – это короткий срок хранения. В основном срок годности биопрепаратов 1-2 года. Четвертым моментом является то, что биопрепараты борются с заболеваниями только на ранних стадиях, поэтому целесообразно уделять больше внимания профилактике растений как в предпосевной период, так и в периоды вегитации. Но все эти недостатки незаметны за счет положительных качеств биологических средств защиты, а также легко устранимы. Из вышесказаного можно сделать вывод, что использование биопрепаратов на основе Trichoderma целесообразно, экономически выгодно, экологически безопасно, актуально, разумно и рационально.
Таким образом, согласно литературного обзора, показано, что наибольшую ценность для любого живого организма, а особенно в качестве сигнальных веществ представляют именно природные, а не синтетические компоненты, поэтому для создания биологических препаратов-регуляторов роста элиситорного действия, сочетающие свойства фунгицида наиболее предпочтительно использование биологических продуцентов БАВ.
Все производимые биологические препараты для растениеводства и земледелия должны тестироваться в самых разных условиях и на разных сельскохозяйственных культурах. Разработанное в ЦКП «Орловский региональный центр сельскохозяйственной биотехнологии» средство для предпосевной обработки гороха, повышающее всхожесть, урожайность и устойчивость гороха к болезням, должно быть протестировано на других культурах, в частности, на яровом ячмене, который наряду с горохом подвержен злостным заболеваниям, корневым гнилям. Изучение может быть реализовано в разных условиях: лабораторных, и полевых, что и явилось основной целью настоящей исследовательской работы.
РАЗДЕЛ 2. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
2.1 Объекты исследования
Для эксперимента использовали живые культуры грибов Trichoderma: Trichoderma atrobrunneum ВКПМ F-1434, Trichoderma harzianum 5/14, Trichoderma Lixii T4/14; фитопатогенных грибов рода Fusarium: Fusarium oxysporum Б/14, Fusarium oxysporum MOS509, Fusarium fujikuroi IMI 58289 из учебной коллекции кафедры биотехнологии ФГБОУ ВО Орловский ГАУ, длительно хранившиеся в холодильнике при температуре +40.
Все представленные виды Trichoderma до 2015 года относились к одному виду Trichoderma harzianum.
Определение вида было проведено на изучении морфологических данных, характеристик культуры и филогенетической информации (Tef1_int4) (Druzhinina et al., 2008). Для каждого отдельного вида, ниже представлены генетические последовательности в формате FASTA.
Штамм Trichoderma atrobrunneum ВКПМ F-1434 был выделен из почвы Московской области (Россия) в 2014 году, поступил из коллекции кафедры микологии и альгологии МГУ (Россия) и депонирован в Национальном биоресурсном центре — Всероссийская коллекция промышленных микроорганизмов (НБЦ ВКПМ) (Россия) под номером F-1434.
ACATTCAATTGTGCCCGACAATTCTGCAGAGAATTTTCGTGTCGACAATTTTTCATCACCCCGCTTTCCATTACCCCTCCTTTGCAGCGACGCAAATTTTTTTTGCTGTCGTTTGGTTTTTAGTGGGGTTCTCTGTGCAACCCCACTAGCTCACTGCTTTTTCCTGCTTCACTCTCACTTCCTCGTCATCATTCAACACGCTCTGTGTCTTTGGTCATTCAGCGATGCTAACCACTTTTCCATCAATAGGAAGCCGCCGAACTCGGCAAGGGTTCCTTCAAGTACGCTTGGGTTCTTGACAAGCTCAAGGCCGAACGTGAGCGTGGTATCACCATCGACATTGCTCTGTGGAAGTTCGAGACTCCCAAGTACTATGTCACCGTCATTGGTAGGTCTTCATTAATTTCATGCTGCAATTGCGGACCAGTCCTAACAGGCAATTCACAGACGCTCCCGGCCACCGTGATTTCATCAAGAACATGATCACTGGTACTTCCCAGGCCGATTGCGCTATCCTCATCATTGCCGCCGGTACTGGTGAGTTCGAGGCTGGTATCTCCAAGGATGGCCAGACCCGTGAGCACGCTCTGCTCGCCTACACCCTGGGTGTCAAGCAGCTCATCGTTGCCATCAACAAGATGGACACTGCCAACTGGGCCGAGGCTCGTTACCAGGAAATCATCAAGGAGACCTCCAACTTCATCAAGAAGGTCGGCTTCAACCCCAAGGCTGTTGCTTTCGTCCCCATCTCCGGTTTCAACGGTGACAACATGCTCCAGGCCTCCACCAACTGCCCCTGGTACAAGGGCTGGGAGAAGGAGACCAAGGCTGGCAAGTTCACCGGCAAGACCCTCCTTGAGGCTATCGATTCCATCGAGCCCCCCAAGCGTCCCACGGACAAGCCCCTCCGTCTTCCCCTCCAGGATGTCTACAAGATCGGTGGTATCGGAACAGTTCCCGTCGGCCGTATCGAGACTGGTATCCTCAAGCCCGGTATGGTCGTCACCTTCGCTCCCTCCAACGTCACCACTGAAGTCAAGTCCGTCGAGATGCACCACGAGCAGCTCGTCCAAGGGTGTTCCCGGTGACAACGTTGGTTTCAACGTCAAAAAACGTTTCCGTTAAGGAAATTCGCCGTGGTAACGTTGCCGGTGACTCCAAGAACGACCCCCCCATGGGTGCCGCTTCTTTCACCGCTCAGGTCATCGTCATGAACCACCCTGGCCAGG
Рост микромицета на чашке Петри – рисунок 24.
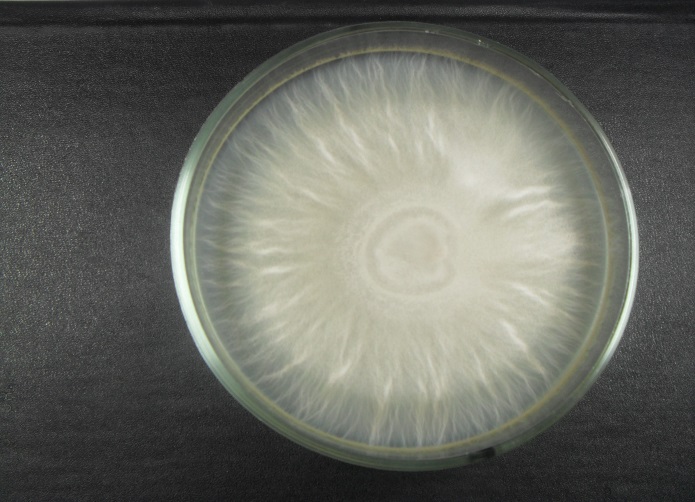
Рисунок 24 — Рост Trichoderma atrobrunneum штамм ВКПМ F-1434 на синтетическом бедном агаре (SNA) при 25°С в течении 7 дней
Микромицет Trichoderma Lixii T4/14 был выделен в 2014 году из биогумуса .
TGAGGAAGTAAAAGTCGTAACAAGGTCTCCGTTGGTGAACCAGCGGAGGGATCATTACCGAGTTTACAACTcCCCAAACCCAATGTGAACGTTACCAAACTGTTGCCTCGGCGGGATCTCTGCCCCGGGTGCGTCGCAGCCCCGGACCAAGGCGCCCGCCGGAGGACCAACCAAAACTCTTATTGTATACCCCCTCGCGGGTTTTTTTATAATCTGAGCCTTCTCGGCGCCTCTCGTAGGCGTTTCGAAAATGAATCAAAACTTTCAACAACGGATCTCTTGGTTCTGGCATCGATGAAGAACGCAGCGAAATGCGATAAGTAATGTGAATTGCAGAATTCAGTGAATCATCGAATCTTTGAACGCACATTGCGCCCGCCAGTATTCTGGCGGGCATGCCTGTCCGAGCGTCATTTCAACCCTCGAACCCCTCCGGGGGGTCGGCGTTGGGGATCGGCCCTCCCTTAGCGGGTGGCCGTCTCCGAAATACAGTGGCGGTCTCGCCGCAGCCTCTCCTGCGCAGTAGTTTGCACACTCGCATCGGGAGCGCGGCGCGTCCACAGCCGTTAAACACCCAACTTCTGAAATGTtGACCTCGGATCAGGTAGGAATACCCGCTGAACTTAAGCATAT
Рост микромицета на чашке Петри – рисунок 25.

Рисунок 25 — Рост Trichoderma Lixii изолят T4/14 на синтетическом бедном агаре (SNA) при 25°С в течении 7 дней
Микромицет Trichoderma harzianum изолят 5/14 был выделен из ризосферы гороха посевного из почв Орловской области.
GATATGCTTAAGTTCAGCGGGTATTCCTACCTGATCCGAGGTCaACATTTCAGAAGTTGGGTGTTTAACGGCTGTGGACGCGCCGCGCTCCCGATGCGAGTGTGCAAACTACTGCGCAGGAGAGGCTGCGGCGAGACCGCCACTGTATTTCGGAGACGGCCACCCGCTAAGGGAGGGCCGATCCCCAACGCCGACCCCCCGGAGGGGTTCGAGGGTTGAAATGACGCTCGGACAGGCATGCCCGCCAGAATACTGGCGGGCGCAATGTGCGTTCAAAGATTCGATGATTCACTGAATTCTGCAATTCACATTACTTATCGCATTTCGCTGCGTTCTTCATCGATGCCAGAACCAAGAGATCCGTTGTTGAAAGTTTTGATTCATTTTCGAAACGCCTACGAGAGGCGCCGAGAAGGCTCAGATTATAAAAAAACCCGCGAGGGGGTATACAATAAGAGTTTTGGTTGGTCCTCCGGGCGGGCGCCTTGGTCCGGGGCTGCGACGCACCCGGGGCAGAGATCCCGCCGAGGCAACAGTTTGGTAACGTTCACATTGGGTTTGGGAGTTGTAAACTCGGTA
Рост микромицета на чашке Петри – рисунок 26.
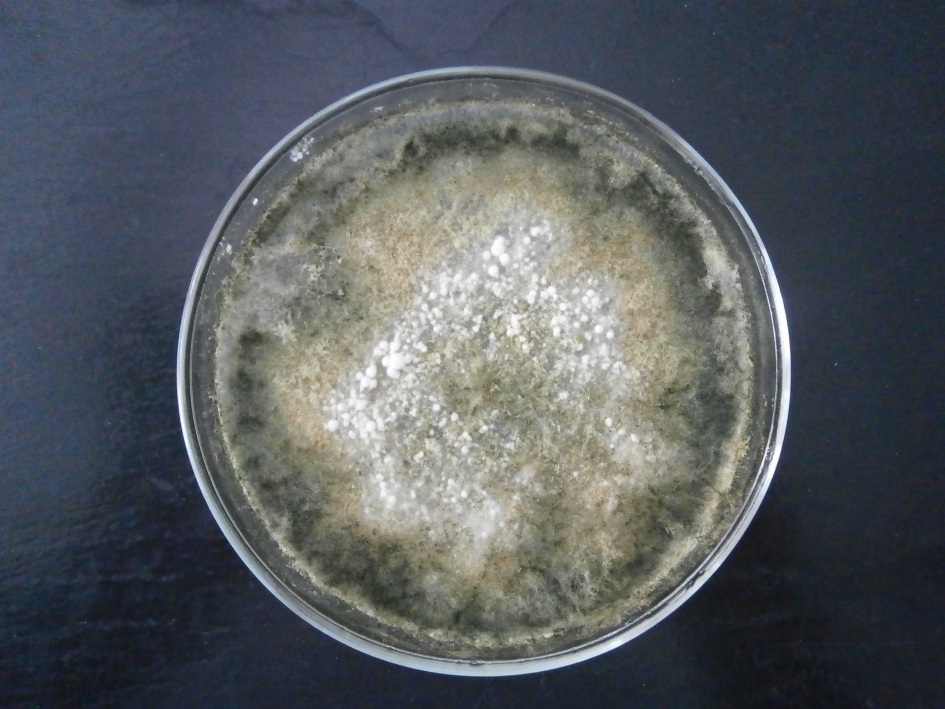
Рисунок 26 — Рост Trichoderma harzianum изолят 5/14 на синтетическом бедном агаре (SNA) при 25°С в течении 7 дней
Штамм Fusarium oxysporum изолят Б/14 из коллекции кафедры микологии и альгологии МГУ (Россия) был выделен из плода огурца, больного фузариозной инфекцией.
GGAAGCCGCTGAGCTCGGTNAGGGTTCCTTCAAGTACGCCTGGGTTCTTGACAAGCTCAAGGCCGAGCGTGAGCGTGGTATCACCATCGATATTGCTCTCTGGAAGTTCGAGACTCCTCGCTACTATGTCACCGTCATTGGTATGTTGTCGCTCATGCTTCATTCTACTTCTCTTCGTACTAACATCACTCAGACGCTCCCGGTCACCGTGATTTCATCAAGAACATGATCACTGGTACTTCCCAGGCCGATTGCGCCATTCTCATCATTGCCGCGGTACTGGTGAGTTCGAGGCTGGTATCTCCAAGGATGGCCAGACCCGTGAGCACGCTCTTCTTGCCTACACCCTTGGTGTCAAGAACCTCATTGTCGCCATCAACAAGATGGACACCACCAAGTGGTCTGAGGCCCGTTACCAGGAGATCATTAAGGAGACCTCCTCTTTCATCAAGAAGGTCGGCTACAACCCCAAGGCTGTCGCTTTCGTCCCCATCTCCGGTTTCAACGGTGACAACATGCTTACCCCCTCCACCAACTGCCCCTGGTACAAGGGTTGGGAGCGTGAGATCAAGTCCGGCAAGCTCAGTGGCAAGACCCTCCTCGAGGCCATTGACTCCATCGAGCCCCCCAAGCGTCCCGTTGACAAGCCCCTCCGCCTTCCCCTCCAGGATGTCTACAAGATCGGTGGTATTGGAACGGTTCCCGTCGGCCGTATCGAGACTGGNGTCATCAAGCCTGGTATGGTCGTTACCTTCGCTCCTTCCAACGTCACCACTGAAGTCAAGTCCGTCGAGATGCACCACGAGCAGCTCACTGAGGGCCAGCCCGGNGACAACGTTGGTTTCAACGTGAAGAACGTNTCCGTCAAGGACCAAGTNNGCACAANCCTGCAAGTTACCACATTGCCTGCAAGTTACCACATTGCCTGCAAGTTACCACATTGCCTGCAAGTTACCACATTGCCTGCAAG
Рост микромицета на чашке Петри – рисунок 27.

Рисунок 27 — Рост Fusarium oxysporum изолят Б/14 на синтетическом бедном агаре (SNA) при 25°С в течении 7 дней
Fusarium oxysporum изолят MOS509 выделен из ризосферы огурца, пораженного корневыми гнилями, из теплицы на территории Орловской области в 2014 году.
GGAAGCCGCTGAGCTCGGTNAGGGTTCCTTCAAGTACGCCTGGGTTCTTGACAAGCTCAAGGCCGAGCGTGAGCGTGGTATCACCATCGATATTGCTCTCTGGAAGTTCGAGACTCCTCGCTACTATGTCACCGTCATTGGTATGTTGTCGCTCATGCTTCATTCTACTTCTCTTCGTACTAACATCACTCAGACGCTCCCGGTCACCGTGATTTCATCAAGAACATGATCACTGGTACTTCCCAGGCCGATTGCGCCATTCTCATCATTGCCGCGGTACTGGTGAGTTCGAGGCTGGTATCTCCAAGGATGGCCAGACCCGTGAGCACGCTCTTCTTGCCTACACCCTTGGTGTCAAGAACCTCATTGTCGCCATCAACAAGATGGACACCACCAAGTGGTCTGAGGCCCGTTACCAGGAGATCATTAAGGAGACCTCCTCTTTCATCAAGAAGGTCGGCTACAACCCCAAGGCTGTCGCTTTCGTCCCCATCTCCGGTTTCAACGGTGACAACATGCTTACCCCCTCCACCAACTGCCCCTGGTACAAGGGTTGGGAGCGTGAGATCAAGTCCGGCAAGCTCAGTGGCAAGACCCTCCTCGAGGCCATTGACTCCATCGAGCCCCCCAAGCGTCCCGTTGACAAGCCCCTCCGCCTTCCCCTCCAGGATGTCTACAAGATCGGTGGTATTGGAACGGTTCCCGTCGGCCGTATCGAGACTGGNGTCATCAAGCCTGGTATGGTCGTTACCTTCGCTCCTTCCAACGTCACCACTGAAGTCAAGTCCGTCGAGATGCACCACGAGCAGCTCACTGAGGGCCAGCCCGGNGACAACGTTGGTTTCAACGTGAAGAACGTNTCCGTCAAGGACCAAGTNNGCACAANCCTGCAAGTTACCACATTGCCTGCAAGTTACCACATTGCCTGCAAGTTACCACATTGCCTGCAAGTTACCACATTGCCTGCAAG
Рост микромицета на чашке Петри – рисунок 28.

Рисунок 28 — Рост Fusarium oxysporum изолят MOS509 на синтетическом бедном агаре (SNA) при 25°С в течении 7 дней
Необходимо отметить, что представленные виды Fusarium oxysporum является опасным вредоносным возбудителем фузариоза и входят в число наиболее распространенных в России. В связи с этим, данное исследование приобретает не только научный, но и большой сельскохозяйственный интерес.
Fusarium fujikuroi изолят IMI 58289 был выделен из ризосферы огурца в условиях открытого грунта на территории Орловской области в 2013 году.
TCGGTAAGGGTTCCTTCAAGTACGCCTGGGTTCTTGACAAGCTCAAGGCCGAGCGTGAGCGTGGTATCACCATCGATATTGCTCTCTGGAAGTTCGAGACTCCTCGCTACTATGTCACCGTCATTGGTATGTTGTCGCTCATACTTCATCCTACTTCCTCATACTAACATATCATTCAGACGCTCCCGGTCACCGTGATTTCATCAAGAACATGATCACTGGTACTTCCCAGGCCGATTGCGCCATTCTCATCATTGCCGCCGGTACTGGTGAGTTCGAGGCTGGTATCTCCAAGGATGGCCAGACCCGTGAGCACGCTCTTCTTGCCTACACCCTTGGTGTCAAGAACCTCATCGTCGCCATCAACAAGATGGACACCACCAAGTGGTCTGAGGCCCGTTACCAGGAGATCATCAAGGAGACCTCCTCTTTCATCAAGAAGGTCGGCTACAACCCCAAGGCTGTCGCTTTCGTCCCCATCTCCGGTTTCAACGGTGACAACATGCTTACCCCCTCCACCAACTGCCCCTGGTACAAGGGTTGGGAGCGTGAGATCAAGTCCGGCAAGCTCTCCGGCAAGACCCTCCTCGAGGCCATTGACTCCATCGAGCCTCCCAAGCGTCCCGTTGACAAGCCCCTCCGTCTTCCCCTCCAGGATGTCTACAAGATCGGTGGTATTGGAACGGTTCCCGTCGGCCGTATTGAGACTGGTGTCATCAAGCCCGGTATGGTCGTTACCTTCGCTCCCTCCAACGTCACCACTGAAGTCAAGTCCGTCGAGATGCACCACGAGCAGCTCAGCGAGGGCCAGCCCGGTGACAACGTTGGTTTCAACGTGAAGAACGTCTCCGTCAAGGACATCCGACGTGGTAACGTCGCTGGTGACTCCAAGAACGACCCCCCCCAGGGTGCCGCTTCTTTCACCGCCCAGGTCATCGTCCTCAACCACCCCGGCCAGGT
Рост микромицета на чашке Петри – рисунок 29.
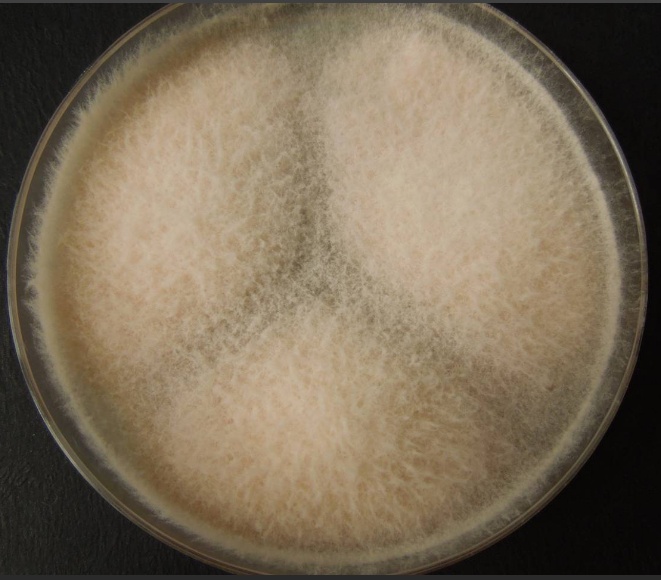
Рисунок 29 — Рост Fusarium fujikuroi изолят IMI 58289 на синтетическом бедном агаре (SNA) при 25°С в течении 7 дней
Известно, что Fusarium fujikuroi продуцирует широкий спектр вторичных метаболитов, среди которых гиббереллины, каротины, бикаверины и гидроксилированные антрахиноны (в основном, пигменты), поэтому представляет интерес исследование биологического потенциала изолята данного вида, который может стимулировать рост и развитие культурных растений.
Перед исследованием грибные культуры культивировали на картофельно-декстрозном агаре (PDA) с хлорамфениколом (400 мкг / мл) на чашках Петри, покрытых целлофаном при 25°С в течение 3 дней в атмосфере при циклических условиях освещения.
В качестве объектов исследования использовали следующие биопрепараты.
БиоОрганический раствор «Эликсир Урожая» (Тимирязевъ, Россия) является экологически-чистым удобрением, применяемым в растениеводстве, цветоводстве, садоводстве, огородничестве. Показывает отличные результаты увеличения урожайности плодовых, ягодных и огородных культур, а также стимулирует рост, развитие комнатных растений и цветов. В составе препарата содержатся комплексы почвенных микроорганизмов, включая бактерии рода Bacillus, Azotobacter, Pseudomonas, а также пептиды, поли- и олигосахариды, регуляторы роста микробного происхождения, витамины, L-аминокислоты, макро- (NPK) и микроэлементы в сбалансированном соотношении, комплекс гуминовых солей и кислот с наибольшей полезной активностью средства для предпосевной обработки гороха «Нигор» (Патент РФ 2463759), включающий в свой состав в том числе природные компоненты: салициловую кислоту, биофлавоноиды гречихи, источник магния.
Многими исследованиями показано, что препарат повышает урожайность и качество продукции, улучшает приживаемость рассады после пересадки, повышает устойчивость растений к заболеваниям, водному, температурному и гербицидному стрессам, стимулирует рост и развитие, повышает иммунитет и многое другое (рисунок 30).

Рисунок 30 – Товарная форма препарата «Эликсир Урожая»
Биопрепараты (Орловский ГАУ) на основе флавоноидов гречихи и метаболитов гриба триходерма. Для получения метаболитов использовали штамм гриба Trichoderma atrobrunneum ВКПМ F-1434 из учебной коллекции кафедры биотехнологии ФГБОУ ВО Орловский ГАУ (рисунок 31).
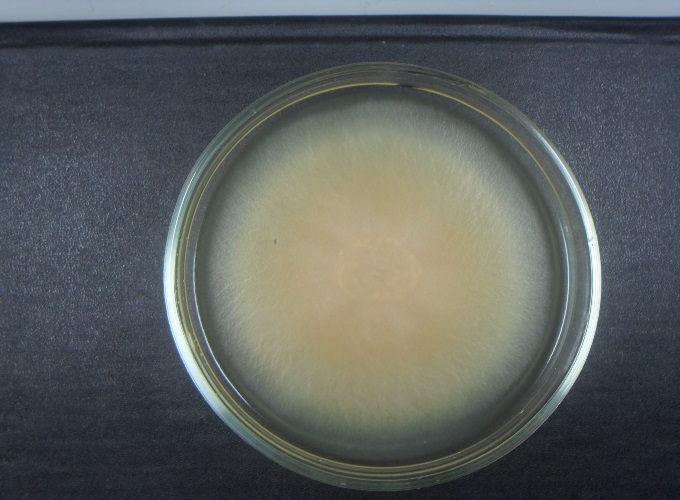
Рисунок 31 – Штамм гриба Trichoderma atrobrunneum ВКПМ F-1434 на питательной среде Чапека на чашке Петри
Данный микромицет найден в естественных условиях и выделен из почвы в 2014 году в Московской области Александровой А.В. В лаборатории биотехнологии ЦКП «Орловский региональный центр сельскохозяйственной биотехнологии» из него был получен путем ступенчатого клонирования селекционный штамм (клон), депонированный в ВКПМ под номером F-1434.
Из Trichoderma atrobrunneum ВКПМ F-1434 готовили биопрепарат: культуральную жидкость после глубинного культивирования культуры Trichoderma atrobrunneum ВКПМ F-1434 на среде Чапека в течение 14 дней отделяли от мицелия (проросших конидий) с титром 1*108 конидий/мл.
Выделение биофлавоноидов проводили из соломы гречихи сорта Девятка. Гречиха посевная сорт «Девятка» включен в Госреестр селекционных достижений РФ в 2004 г., защищен патентом.
Метод создания. Многократный негативный и массовый отбор из комбинации Деметра (Д-12) x Молва (ОВ-5) по признакам габитуса и продуктивности. Тип роста детерминантный. Верхушечное соцветие – длинная кисть.
Среднеспелый, вегетационный период 83-95 дней. Характеризуется дружным цветение и созреванием. Устойчивость к полеганию и осыпанию высокая. Обладает повышенной устойчивостью к ранневесенним холодам, высоким температурам и засухе. Сорт высокоурожайный. Средняя урожайность в регионах допуска 1,78 т/га, на 0,07 т/га выше среднего стандарта. Максимальная урожайность 4,97 т/га получена в 2003 г. в Красноярском крае. На территории европейской части РФ высокая урожайность 3,8…4 т/га получена на сортоучастках Воронежской, Смоленской, Тульской, Владимирской и Курской областей.
Технологические и кулинарные качества высокие. Сорт крупноплодный, масса 1000 зерен 30-36 г. Пленчатость 20,9%, выравненность 52,4%, выход крупы 75,5%, выход ядрицы 68,1%, крупность крупы 82,2%.
Включен в список ценных по качеству сортов. Устойчивость к аскохитозу выше средней. Зона возделывания. Допущен к возделыванию в Центральном, Центрально-Черноземном, Северо-Кавказском, Уральском и Дальневосточном регионах России [Гречиха сорт «Девятка» [Электронный ресурс]. – Режим доступа: https://vniizbk.ru/progress/varieties/16/54-nine.html– (Дата обращения: 29.02.20)].
Гречиха посевная Fagopyrum esculentum Mill. является высокоценной крупяной культурой. Содержит в себе витамины группы В (тиамин, рибофлавин). Помимо богатого белкового и микроэлементного состава, гречиха содержит флавоноиды, фенольные соединения, антоцианы и дубильные вещества, ее зерна издавна используется в качестве продукта диетического, лечебного и вегетарианского питания. Также гречиха посевная содержит органические кислоты, такую как яблочная и лимонная и хлорогеновая, которые отвечают за нормализацию метаболического обмена в организме. Важной особенностью является наличие флавоноидов, таких как рутин, кверцетин и апигенин.
Изучаемые препараты состояли из ранее созданного препарата Нигор, Эликсир урожая и их смеси в подобранных концентрациях с метаболитами Trichoderma atrobrunneum ВКПМ F-1434.
Штаммы фитопатогенных микроорганизмов рода Fusarium spp. были выделены в 2019 году из растений огурца закрытого грунта с признаками фузариозного увядания и фузариозной корневой гнили.
Объектами исследования являлись семена сельскохозяйственных культур.
Сорт гороха посевного «Фаранон». Передан на Государственное сортоиспытание в 2006 г. Селекционеры: П.М. Чекрыгин, И.Н. Безуглый, А.Д. Бекаревич, Н.П. Луценко, И.В. Кондыков, Н.Н. Кондыкова.
Метод создания: Создан совместно с Украинским институтом растениеводства им. В.Я. Юрьева методом многократного отбора из сложной гибридной популяции F3 (Таловец 60 x 616/88) x (Смарагд x Харьковский 85) x (Харьковский 85 x Смарагд) x Орлус. Характеристика: Разновидность persistens. Среднестебельный (длина стебля 65-100 см). Среднеспелый (вегетационный период 68-82 дня); безлисточковый (с усатым типом листа). Число узлов до первого соцветия 11-15. Прилистники и усы хорошо развиты. Максимальное число цветков и бобов на узле – три. Бобы слабоизогнутые, с тупой верхушкой, 3-6 семянные. Семена угловато-округлые, без признака неосыпаемости, с мелкими вдавлинами, светло-желтые. Рубчик семени черный. Содержание белка в семенах 23…25%.
Средняя урожайность семян за годы КСИ составила 3,18 т/га (у стандарта Орловчанин – 3,07 т/га), максимальная – 5,0 т/га. В Госсортоиспытании 2006 г. наиболее высокие показатели урожайности получены в Средневолжском регионе, так на Батайском сортоучастке при урожайности 4,9 т/га он превзошел стандарт Орловчанин на 0,9 т/га. Максимальная урожайность – 5,6 т/га получена на Заинском ГСУ в республике Татарстан.
Достоинство сорта:
высокая устойчивость к полеганию за счет усатого типа листа;
хорошо приспособлен к уборке прямым комбайнированием;
устойчив к засухе и корневым гнилям;
неосыпающиеся семена.
Зона возделывания. Рекомендуется к возделыванию в Центральном, Центрально-Черноземном, Нижневолжском, Средневолжском, Северо-Кавказском регионах России и в Республике Украина.
С 2008 года допущен к использованию в Средневолжском и Северо-Кавказском регионах.
Сорт ярового ячменя Раушан создан в НИИСХ центральных районов Нечерноземной зоны совместно с Татарским НИИСХ и НПФ «Российские семена». Родословная сорта: Индивидуальный отбор из гибридной популяции F2 (Grand Prix, Московский 3). Ботаническая характеристика: Разновидность нутанс. Куст полупрямостоячий. Растение среднерослое. Колос полупрямостоячий, цилиндрический, рыхлый, со слабым восковым налётом и салатовой окраской во время цветения. Ости длиннее колоса, зазубренные, со средней антоциановой окраской кончиков. Опушение основной щетинки зерна длинное. Зерновка округлая, средней крупности, с неопущенной брюшной бороздкой и охватывающим расположением лодикул. Окраска алеройного слоя белая. Масса 1000 зёрен 47–56 г. Биологические особенности: Сорт Раушан среднеспелый, вегетационный период 76–93 дня. По устойчивости к полеганию равен стандарту Зазерский 85, а по устойчивости к засухе превосходит его. Слабовосприимчив к пыльной и твёрдой головне, сетчатой пятнистости, корневым гнилям и ринхоспориозу. Коммерческая ценность: Высокий потенциал продуктивности сорта Раушан и отличные качества делают сорт вполне конкурентоспособным в местах его допуска к использованию. Экологически пластичен. Хорошо реагирует на внесение удобрений, но на высоких азотных фонах склонен к полеганию. Внесён в список пивоваренных сортов. Содержание белка 9,9–14,8%. Экстрактивность 79–81%. Выход зерна составляет 90–92%, прорастаемость на 5–й день 95–97%.
Сорт мягкой озимой пшеницы Московская 39 создан НИИСХ Центральных районов Нечерноземной зоны (НИИСХ ЦРНЗ). Авторы: Б.И. Сандухадзе, Е.Т. Вареница, Г.В. Кочетыгов и другие.
Разновидность эритроспермум. Куст промежуточный, соломина полая, средней толщины, флаговый лист имеет восковой налёт. Колос веретеновидный, средней плотности, белый, ости прямые, длиной 6–7 см. Масса 1000 зёрен 34-42 г. Зерно красное, удлинённояйцевидной формы.
Биологические особенности. Сорт среднеспелый, вегетационный период 305-308 дней. Зимостойкость и морозоустойчивость на уровне стандарта, устойчив к ранневесенней засухе. Устойчив к полеганию, высота растений 91-100 см. Устойчив к твёрдой головне, снежной плесени и септориозу, в средней степени поражается бурой ржавчиной и мучнистой росой. Обладает высокими хлебопекарными качествами, содержание белка выше стандарта на 1,5-2,0% и клейковины — на 6-8%.
Московская 39 признана лучшим сортом озимой пшеницы по итогам Международного испытания в Канаде в 1998-2000 г. Сорт Московская 39 предназначен для получения продовольственного зерна (сильная пшеница) в Центральном, Центрально-Черноземном регионах России. Обладает высокой технологичностью возделывания, отзывчив на удобрения, практически не полегает, имеет повышенные показатели в производстве. Сбор высококачественного зерна составляет 35-50 ц с 1 га.
Сорт ярового ячменя Грейс. Включен в Госреестр по Центральному и Центрально-Черноземному регионам. Рекомендован для возделывания в Брянской, Московской, Тульской, Липецкой и Орловской областях. Разновидность нутанс. Куст промежуточный. Влагалища нижних листьев без опушения. Антоциановая окраска ушек флагового листа слабая — средняя, восковой налет на влагалище средний — сильный. Растение короткое — средней длины. Колос цилиндрический, рыхлый — средней плотности, без воскового налета. Ости длиннее колоса, зазубренные, с антоциановой окраской кончиков средней интенсивности. Первый сегмент колосового стержня средней длины, со слабым — средним изгибом. Стерильный колосок параллельный. Опушение основной щетинки зерновки длинное. Антоциановая окраска нервов наружной цветковой чешуи слабая — средняя, зазубренность внутренних боковых нервов наружной цветковой чешуи очень слабая — слабая. Зерновка от крупной до очень крупной, с неопушенной брюшной бороздкой и охватывающей лодикулой. Масса 1000 зерен 39-50 г. Средняя урожайность в регионах допуска — 35,6 ц/га. Среднеспелый, вегетационный период 70-85 дней, созревает одновременно с сортами Раушан и Ксанаду и на 3-5 дней раньше сорта Атаман. Устойчив к полеганию. По засухоустойчивости в год проявления признака уступает стандартным сортам на 0,5-1,0 балла. Пивоваренный. Восприимчив к гельминтоспориозу. В зоне районирования пыльной головней поражался сильно.
В качестве «положительного» контроля в исследовании использовали протравитель «Скарлет» по общепринятой норме.
Скарлет — фунгицидный протравитель, предназначенный для предпосевной обработки семян зерновых культур, кукурузы, рапса, сои, подсолнечника против широкого спектра болезней.
Преимущества препарата:
- превосходит большинство протравителей семян по широте спектра действия за счет комбинации двух действующих веществ;
- обеспечивает высокий уровень фунгицидной активности, в том числе против гельминтоспориозной и фузариозной корневых гнилей, мучнистой росы, плесневения семян, септориоза и др.;
- оказывает продолжительное защитное действие от прорастания семян до фазы выхода в трубку и флаг-листа;
- стимулирует развитие колеоптиля, формирование мощной корневой системы;
- повышает засухо- и морозоустойчивость;
- исключаются потери препарата при транспортировке и севе;
- сохраняется стабильность рабочего раствора неограниченно долгое время;
- присутствие имазалила снижает вероятность возникновения резистентности.[
В качестве «отрицательного» контроля использовали семена исследуемых сельскохозяйственных культур, обработанные водой. необработанные семена.
Варианты обработок в исследовании:
- Контроль без обработки
- Пестицид «Скарлет»
- «Эликсир урожая»
- «Нигор»
- «Эликсир урожая» +«Нигор»
2.2 Методы исследования
Прямой конфронтационный анализ Trichoderma atrobrunneum ВКПМ F-1434 против Fusarium oxysporum тестировали методом двойной культуры на PDA (Zhang, et al 2017). Мицелиальные блоки (диаметром 5 мм), вырезанные из активно растущих краев колоний свежих субкультивированных штаммов Trichoderma atrobrunneum штамм ВКПМ F-1434 и Fusarium oxysporu помещали на чашки Петри с PDA на расстоянии 5 см друг от друга. В контрольном измерении, рост фитопатогенного микроорганизма проводили без Trichoderma atrobrunneum ВКПМ F-1434. Затем чашки Петри помещали в термостат и выдерживали в течение 7 дней при 25 ° С.
Процент ингибирования (I%) роста Fusarium oxysporum на 5 и 10 сутки культивирования был рассчитан по формуле:
I% = (C – T) / C × 100, где
C — средний радиус роста Fusarium oxysporum в контроле;
T — средний радиус роста Fusarium oxysporum в двойной культуре.
Для тестирования антагонистической активности грибов рода Trichoderma (You, et al, 2016) брали биомассу микромицета из активно растущих краев колоний и инокулировали в колбу на 250 мл, содержащую 50 мл жидкой картофельно-декстрозной среды и культивировали глубинным способом в течение 7 дней при 200 об / мин и 27°С. Надосадочную жидкость (споровую суспензию) культуры фильтровали через фильтр 0,22 мкм (Merck Millipore, Германия), затем смешивали с питательной средой PDA в соотношении 10% (об./об.). Затем мицелиальный блок грибов рода Fusarium инокулировали на чашки Петри с PDA, выдерживали в течение 3 дней при 25°С в термостате.
Антагонистическую активность (I%) грибов рода Trichoderma против грибов рода Fusarium рассчитывали по формуле:
I (%) = (C – R) / C × 100, где
C – среднее значение радиуса роста Fusarium в контроле (без добавления споровой суспензии грибов рода Trichoderma;
R — среднее значение радиуса роста Fusarium в опытном варианте.
Споровые суспензии антагонистов для исследования готовили следующим образом. Наращивали биомассу исследуемых микроорганизмов на плотных питательных средах PDA на чашках Петри, инкубировали в течение 72 ч в термостате при температуре 27°С до стадии активного спорулирования. Затем смывом получали водную суспензию конидий с титром (108 клеток (конидий) / мл) согласно методам [Коломбет, Л.В.,2007].
Определение ферментативной активности. Литическую активность антагонистов определяли с помощью экспресс-тестов: наличие липазы – на желточном агаре, хитиназы – на синтетической среде с хитином, протеиназы – на молочном агаре. О способности антагониста продуцировать экзофермент судили по наличию маслянистого перламутрового слоя над и вокруг колонии (2-недельной) (тест на липазу); образованию зоны просветления вокруг колонии (тест на хитиназу и протеиназу) [De la Cruz‑Quiroz R.,, et al., 2017].
Определение стимулирующего и фунгицидного влияния обработки семян огурца суспензиями антагонистов. Перед обработкой семян огурца водными суспензиями антагонистов их предварительно замачивали в 0,05%-ном растворе KMnO4 в течение 2 ч и оставляли просохнуть при комнатной температуре. Затем семена замачивали в водных суспензиях антагонистов (107 спор/г) на 2 часа и в стерильной воде (контроль) на то же время. Обработка семян KMnO4 способствует гибели вегетативных клеток многих бактерий и грибов, существенно уменьшая общую микробную численность и, тем самым, позволяет развиваться популяциям микробов-антагонистов на их поверхности. Через сутки после обработки семена помещали во влажную камеру и выдерживали при 25○С. Энергию прорастания и лабораторную всхожесть на 6 — сутки определяли согласно требованиям ГОСТ 12038-84.
Дальнейшее проращивание семян огурца для оценки ростостимулирующих свойств проводили в лабораторных условиях на инфекционном фоне в пластиковых кюветах с почвой при комнатной температуре и систематическом (каждые 2 дня) поливе. Особенности взаимоотношений между антагонистами и фитопатогенами (развитие / подавление) в почве проверяли следующим образом: в пластиковые кюветы с посевами 7-суточных семян огурца, обработанных суспензиями антагонистов, методом полива вносили 50 мл водной суспензии грибов рода Fusarium, титр которых выше, чем у антагониста (109 конидий / мл). Численность фитопатогенов и антагонистов на 1 г почвы определяли методом высева почвенной суспензии на среду Чапека в чашки Петри и подсчета выросших колоний каждые пять дней.
Морфометрические параметры оценивали по стандартным методикам.
Распространенность фузариозной инфекции учитывали в фазу активного плодоношения на 40 день вегетации проводили комбинированным методом (Чумакова, 1974).
Опыты сопровождались лабораторно-полевыми наблюдениями, учетами и анализами, в соответствии с методическими указаниями Б. А. Доспехова (1985), Государственной комиссии по сортоиспытанию сельскохозяйственных культур (1971), П. Г. Найдина (1969) и Л. Л. Балашева [Билай В.И.1982; Билай В.И.1980; Методы почвенной микробиологии и биохимии: Учебное пособие/ Под ред. Д.Г. Звягинцева,1991].
Для выявления антагонизма (влияния на рост грибного мицелия) изучаемого штамма и контрольных микробных препаратов к фитопатогенным микроорганизмам рода Fusarium использовали метод укола.
Размножение чистых грибных культур для получения достаточного количества спорового инокулюма проводили на картофельно-глюкозном бульоне. Выращивали грибы в условиях световой комнаты при температуре 25○С, при 16-часовом фотопериоде и интенсивности света 3000 лк. Пересадку микроорганизма осуществляли на 5-7 сутки в ламинарном боксе. В глубинной культуре концентрация спор составляла 105 спор/мл.
Суспензию спор грибов каждого вида тест-системы смывали стерильной водой с колоний 10-14 суточного возраста (100 мкл при плотности спор 105 спор/мл – 0,5 ЕД по оптическому стандарту мутности Мак-Фарланда) и распределяли по поверхности среды в чашках Петри на среде Чапека.
Затем на агаровую поверхность производили посев суточной биомассы микробов-антагонистов уколом. Чашки инкубировали в термостате при температуре 28○С в течение 3-5 суток. Контролем служили газоны фитопатогенов, посеянные одновременно с экспериментальными, но к которым не добавляли исследуемые микробные биопрепараты.
Учитывали следующие показатели: наличие и интенсивность роста фитопатогенных грибов. Измеряли диаметр зон ингибирования роста, образовавшихся вокруг лунки. Наличие стерильных зон подавления грибного мицелия вокруг лунок свидетельствовало о фунгицидном действии исследуемых биопрепаратов.
Фунгистатическое действие исследуемых штаммов на грибы оценивали по величине диаметра зоны задержки роста грибов вокруг колонии штамма.
Определение стимулирующего и фунгицидного влияния обработки семян. Семена обрабатывали полусухим способом биопрепаратами. Контрольные семена обрабатывали водой.
Через сутки после обработки семена помещали во влажную камеру и выдерживали при 25○С. Учет развития гриба на семенах проводили через 3 суток, а измерение длины корня и ростка – через 6 суток после размещения во влажной камере.
Семена огурца в течение 2 часов обрабатывали экстрактом, разбавленным до концентрации 10-6, 10-7, 10-8, 10-9 % относительно исходной. Проращивание проводили в лабораторных условиях в рулонах фильтровальной бумаги при температуре 21-25○С.
Методика выделения суммы биофлаваноидов из гречихи посевной. Биофлавоноиды выделяли из вегетативной массы гречихи посевной вида Fagopyrum esculentum Mill. Перед экстракцией взвешивали 100 г вегетативной массы гречихи посевной, предварительно измельченной на мельнице и высушенной до 8%. Для 100 граммов навески массы гречихи брали 1 литр 70% этилового спирта и экстрагировали в течение 5 часов. Экстракцию проводили в аппарате Сокслета. Экстракция происходит непрерывно, растворитель 70% этиловый спирт циклично переходит из колбы в насадку и, проэкстрагировав часть вещества, возвращается в колбу. Один цикл составляет от 10 до 15 минут, от момента наполнения сифона до его перелива. Экстракция проходила в течение 5 часов, количество циклов 20.
Количественный анализ биофлаваноидов гречихи. Для оценки количественного содержания суммы флавоноидов, содержащихся в траве гречихи посевной, использовали метод дифференциальной спектрофотометрии с комплексообразователем AlCl3.
Расчет содержания суммы флавоноидов в гречихе посевной проводили при длине волны λ = 362 нм. Содержание суммы флавоноидов в пересчете на ГСО рутин и абсолютно сухое сырье в процентах (X) вычисляли по формуле 1:
, где
D – оптическая плотность испытуемого раствора; Do – оптическая плотность раствора ГСО рутина; m – масса сырья, г; mо – масса ГСО рутина, г; W – потеря в массе при высушивании в процентах.
Разделение компонентного состава биофлаваноидов гречихи методом тонкослойной хроматографии. На линию старта пластинки «Сорбфил–ПТСХ-АФ-А-УФ» микропипеткой наносят 0,02 мл извлечения в виде пятен диаметром около 5 мм. Около 0,02 мл извлечения с помощью микропипетки наносят на стартовую линию, проведенную на расстоянии 1,5-2 см от нижнего края хроматографической пластинки «Сорбфил–ПТСХ-АФ-А-УФ». Пластинку с нанесенными пробами высушивают на воздухе, затем помещают в хроматографическую камеру, которую предварительно насыщают смесью растворителей и хроматографируют восходящим способом. Когда фронт растворителей пройдет около 8 см, пластинку вынимают из камеры, сушат на воздухе в течение 5 минут. Детекцию веществ осуществляли в УФ-свете (254 нм и 366 нм). Пластинки «Сорбфил ПТСХ-АФ-А-УФ» (ТУ 26-11-17-89) разрезают поперек линий накатки соответственно на 2 части размером 10х5 см и перед использованием активируют в сушильном шкафу при 100-105оС в течение 1ч.
Определение чувствительности фитопатогена Fusarium oxysporum в отношении биофлаваноидов гречихи диско-диффузионным методом. Cтерильные бумажные диски, пропитанные исследуемыми экстрактами рутина, кверцетина, хлорогеновой кислотой и биопрепаратом под торговой маркой «РутиФлав» и инфицированные фитопатогеном Fusarium oxysporum помещали на чашки Петри со стандартной средой Чапека, в качестве контроля использовали диски с амфотерицином В. Величину диаметра зоны подавления роста тест — культур оценивали на 2-3 сутки.
Определяли лабораторную всхожесть, энергию прорастания семян. На 3-и, 7-е, 10-е, 14-е сутки измеряли длину корешков и проростков у растений огурца. На 10-е и 14-е сутки оценивали длину надземной части и главного корня, определяли сырую биомассу.
В лабораторных условиях устанавливали влияние изучаемых препаратов на рост и развитие проростков гороха и ячменя. Оценка семян на биологическую полноценность и фитоэкспертиза семян проводилась до и после обработки изучаемыми препаратами.
Лабораторную оценку производили по показателям энергии прорастания, всхожести, длине проростков, степени зараженности возбудителями болезней. Определение энергии прорастания, лабораторной всхожести и других показателей качества семян проводили по действующим ГОСТам (ГОСТ 12038-84, ГОСТ 12042-80, ГОСТ 12037-81). (1968) и др.
Энергия прорастания и всхожесть семян определялись по ГОСТу – 12038-84 (1991). Для определения этих показателей от семян культуры брали по четыре пробы в количестве по 100 штук от каждого варианта опыта. Семена укладывали на двухслойные полоски увлажненной фильтровальной бумаги, шириной 10 см, длиной 110 см на расстоянии 1–1,5 см друг от друга зародышами вниз на расстоянии 2–3 см от верхнего края полоски. Сверху накрывали еще одной полоской фильтровальной бумаги. Полосы скатывали в рулон, устанавливали в растильню с небольшим количеством воды и помещали в термостат на 7 дней при температуре 20 С. Энергия прорастания семян яровой мягкой пшеницы и ячменя определялась через трое суток, всхожесть – через семь, а семян твердой яровой пшеницы через четыре и восемь суток соответственно. Величина этих показателей определялась как среднее арифметическое четырех проб.
Полевые опыты закладывались по общепринятой методике на делянках с учетной площадью 10 кв. м в шестикратной повторности в НОПЦ «Интеграция». Размещение рендомизированное. Технология выращивания – общепринятая в условиях Орловской области (рисунок 32).

Рисунок 32 – Деляночный опыт в НОПЦ «Интеграция»
В процессе вегетации растений делались наблюдения и учеты в соответствии с Методикой Государственного сортоиспытания сельскохозяйственных культур (1971).
Учет полевой всхожести проводили в период полных всходов. Изучалось влияние обработки семян на динамику их роста, пораженность болезнями. В течение вегетации в фазу всходов проводили учет пораженности опытных растений корневыми гнилями (грибами рода Fusarium).
Результаты лабораторных и полевых опытов кроме тех, для которых достоверность определялась по соответствующим стандартам, подвергали математической обработке методом дисперсионного анализа для выявления степени достоверности полеченных между вариантами отличий.
Статистическую обработку результатов проводили с помощью пакета Microsoft Office 2010 (Excel). Все опыты проводились в пятикратной повторности.
2.2.1 Определение активности каталазы.
Приборы и оборудование. Весы лабораторные, центрифуга типа ОП-8, термостат, фарфоровая ступка с пестиком, конические колбы на 50, 150, 250 мл, мерные стаканы, мерный цилиндр на 25мл, стеклянные пипетки на 1, 2,5 мл.
Реактивы. Ацетатный буфер рН 5,4:0,2М ацетата натрия и 0,2М уксусной кислоты, 1%-я перекись водорода, 10%-ая серная кислота.
Методика. Для определения активности каталазы была использована методика, основанная на измерении объема выделившегося кислорода после прибавления к водному экстракту каталазы перекиси водорода. Количество выделившегося кислорода измеряют в специальном приборе. Для определения активности каталазы навеску листьев пшеницы, растирали в фарфоровой ступке с молотым стеклом в 20 мл фосфатного буферного раствора с рН 7.8. Полученную массу переносили в мерную колбу на 100 см3, доводили до метки буферным раствором, переносили взвесь в коническую колбу и помещали её на механический встряхиватель на 30 минут. Далее суспензию переносили в реакционный сосуд прибора, прибавляли против вспенивания 3-5 капель толуола. Затем помещали туда маленький стаканчик с 3 см3 3 %-й НаСЬ. Реакционный сосуд соединяли с остальной частью прибора и запускали связанную с реакционным сосудом 1 магнитную мешалку (скорость 600 об./мин), которая опрокидывала стаканчик с перекисью водорода, запуская тем самым реакцию. Объем выделившегося кислорода регистрировали с 3-ей по 15-ю минуту после начала реакции с интервалом 3 мин. Затем выстраивали кинетические кривые зависимости объема выделившегося О2 от времени и аппроксимировали их функцией вида у=а-Lп(x)+b. В качестве исходного показателя активности каталазы использовали предлогарифмический коэффициент а. Для того чтобы нивелировать влияние колебаний навески на результат эксперимента коэффициент а делили на массу навески, получая, таким образом, приведенный предлогарифминеский коэффициент, являющийся окончательным показателем активности каталазы.
2.2.2 Колориметрический метод определения активности пероксидазы.
Приборы и оборудование. Весы лабораторные, фотоэлектроколориметр КФК-22, центрифуга типа ОП-8, термостат, фарфоровая ступка с пестиком, конические колбы на 50, 150, 250 мл, мерные стаканы, мерный цилиндр на 25мл, кварцевые кюветы.
Реактивы. Ацетатный буфер рН 5,4:0,2М ацетата натрия и 0,2М уксусной кислоты; раствор бензидина: готовят на ацетатном буфере( в мерную колбу на 200 см³ наливают примерно 100 см³ дисттиллированной воды, прибавляют 2,3см³ ледянной уксусной кислоты 184 мг бензидина; колбу нагревают на водяной бане при 60°С, постоянно взбалтывая; после полного растворения бензидина в колбу добавляют 5,45 г уксуснокислого натрия, олаждают и доводят водой до метки; 0,3%-я перекись водорода.
Методика. Для определения активности пероксидазы растительный материал измельчали в ступке с молотым стеклом в 20 мл ацетатного буферного раствора с рН 4.8 и центрифугировали с частотой 4000 об./мин в течение 15 минут, затем отделяли надосадочную жидкость и вели дальнейшие эксперименты с ней (в дальнейшем — экстракт пероксидазы). Для определения активности пероксидазы была использована методика [5], основанная на окислении бензидина перекисью водорода под действием пероксидазы. В кювете спектрофотометра КФК-2 смешивали 1.95 мл ацетатного буферного раствора с рН 4.8, 0.05 мл экстракта пероксидазы, 1 мл 3%-й перекиси водорода и 1 мл 0.005 М раствора бензидина. После добавления бензидина сразу включали секундомер и записывали его показания после того, как оптическая плотность реакционной смеси на длине волны 490 нм достигала 0.15. Активность пероксидазы рассчитывали по формуле А=Dабв/(сt), где
D-оптическая плотность растворв, D=0,15; а-степень разбавления навески в экстракте, к массе сырой ткани, мл/г; б-степень разбавления экстракта, взятого для реакции; с-длина оптического пути в кювете, с=1см, с; в-степень разбавления экстракта в реакционной смеси; t-время в секундах, требующееся реакционной смеси для достижения оптической плотности D=0,15.
2.2.3. Метод определения активности супероксиддисмутазы.
Приборы и оборудование. Весы лабораторные, фотоэлектроколориметр КФК-22, центрифуга типа ОП-8, фотореактор.
Реактивы: 1) дигидроортофосфат калия, М=136г/моль; 2)гидроксид калия, М=56г/моль; 3) метионин, М=149г/моль; 4)ЭДТА, динатриевая соль, М=416г/моль; 5)нитросиний тетразолий, М=818г/моль; 6)рибофлавин, М=376г/моль.
Методика. Для определения активности супероксиддисмутазы (СОД) растительный материал измельчали в ступке с молотым стеклом в 25 мл фосфатного буферного раствора с рН 7.8 и центрифугировали с частотой 7000 об./мин в течение 15 минут, затем отделяли надосадочную жидкость и вели дальнейшие эксперименты с ней (в дальнейшем – экстракт СОД). Для определения активности СОД была использована методика, основанная на ингибировании восстановления нитросинего тетразолия.
Реакционная среда, общим объемом 2.5 мл содержала 50 мМ фосфатного буфера с рН 7.8, 13 мМ L-метионина, 75 мкМ нитросинего тетразолия, 2 мкМ рибофлавина, 0.1 мМ ЭДТА и 0.5 мл экстракта СОД. Рибофлавин добавляли в последнюю очередь и облучали контрольные и опытные пробирки светом люминесцентной лампы, мощностью 30 Вт. Через 15 мин. Реакцию прекращали, выключая лампу, затем измеряли оптическую плотность растворов на спектрофотометре КФК-2 при длине волны 540 нм. Необлученная реакционная смесь не окрашивалась и служила базовой линией для спектрофотометра. Реакционная смесь, лишенная фермента приобретала интенсивное пурпурное окрашивание в результате максимального восстановления нитросинего тетразолия. Интенсивность окрашивания смеси, содержащей супероксиддисмутазу, была невысока и зависела от активности фермента.
Активность СОД рассчитывали по формуле: АСОД=(D‾контр— D‾х)/ D‾контр(Vреакц.смесиVэкстракта)/(Vдля реакцииmнавески),
где АСОД-акктивность супероксиддисмутазы, D‾контр-среднее арифметическое из оптических плотностей контрольных растворов, D‾х-среднее арифметическое из оптических плотностей растворов с содержанием экстракта, Vреакц.смеси-общий объем реакционной смеси, Vэкстракта-объем экстракта, Vдля реакции –объем экстракта, взятого для реакции; mнавески-масса навески биологического материала.
2.2.4 Определение лабораторной всхожести семян.
Лабораторная всхожесть считается одним из важнейших показателей. Чем меньше разница между величиной энергии прорастания и всхожестью, тем выше качество семян.
Для определения всхожести подряд, без выбора, с помощью пневматических счётчиков или вручную отсчитывают 4 пробы по 100 семян.
Семена проращивают в растильнях, чашках Петри, помещая их в термостат, где поддерживают температуру, установленную для каждой культуры. Растильни, чашки Петри моют горячей водой с моющим средствами, ополаскивают 1%-ным раствором перманганата калия, а затем водой. В качестве подстилки (ложа) использовали кварцевый песок. Перед использованием песок промывают, прокаливают для обеззараживания и просеивают через сито.
Подготовленным песком наполняют растильню на 2/3 её высоты, семена раскладывают рядами на расстоянии 0,5-1,5 см одно от другого, трамбовкой вдавливая в песок на глубину равную их толщине при температуре 20°С. В каждую пробу семян кладут этикетку с указанием регистрационного номера средней пробы, номера проращиваемой пробы дат учёта энергии прорастания и всхожести.
Как правило, семена проращивают в темноте. В термостатах следует поддерживать рекомендуемую температуру, проверяя её три раза в день утром, в середине дня и вечером (температура не должна отклонятся от установленной более чем на±2°С).
Оценку и учёт проросших семян при определении энергии прорастании и всхожести проводят через 3 и 7 суток, соответственно. При учёте энергии прорастания подсчитывают и удаляют только нормально проросшие и явно загнившие семена, а при учёте всхожести отдельно подсчитывают нормально проросшие, набухшие, твёрдые, загнившие и ненормально проросшие семена. Показатели энергии прорастания и всхожести вычисляют в процентах.
РАЗДЕЛ 3. ВОЗДЕЙСТВИЕ ЭКЗОМЕТАБОЛИТОВ TRICHODERMA И БИОФЛАВОНОИДОВ ГРЕЧИХИ НА ФИТОПАТОГЕННЫЕ ВОЗБУДИТЕЛИ БОЛЕЗНЕЙ
3.1 Изучение эффективности экзометаболитов Trichoderma Atrobrunneum ВКПМ F-1434 в отношении фитопатогенных возбудителей болезней
3.1.1 Определение антагонистической активности грибов рода Trichoderma
Для оценки степени проявления антагонистической активности и механизмов действия на фитопатогены исследовали влияние антагонистов Trichoderma atrobrunneum штамм ВКПМ F-1434, Trichoderma Lixii изолят T4/14, Trichoderma harzianum изолят 5/14, на штаммы фитопатогенных грибов Fusarium oxysporum изолят Б/14, Fusarium oxysporum изолят MOS509, Fusarium fujikuroi изолят IMI58289 в условиях in vitro методом двойных культур.
Результаты исследований показали, что в контроле все фитопатогенные микроорганизмы интенсивно разрастались по чашке Петри и занимали практически всю площадь чашки Петри, при этом они образовывали хорошо развитый воздушный мицелий с ярким пигментом.
Большинство антагонистов сдерживали рост и развитие фитопатогенных микроорганизмов, у которых в некоторых случаях терялась способность образовывать развитый воздушный мицелий и вырабатывать пигмент (таблица 2).
Отмечено, что все антагонисты в двойной культуре способны ингибировать рост фитопатогенов, при этом гриб T. atrobrunneum ВКПМ F-1434 на 10-сутки культивирования с фитопатогенными микроорганизмами показал наибольшую степень ингибирования (100%); T. Lixii изолят T4/14 в отношении F. fujikuroi изолят IMI 58289 – 100%; T. harzianum изолят 5/14 в отношении F. fujikuroi изолят IMI 58289 – 84%. T. Lixii изолят T4/14 и T. harzianum изолят 5/14 имели очень низкий уровень ингибирования F. oxysporum изолят Б/14, F. oxysporum изолят MOS509 (<60%).
Таблица 2 – Процент ингибирования роста колоний грибов рода Fusarium антагонистами в двойной культуре, %
| Штаммы-антагонисты | F. oxysporum изолят Б/14 | F. oxysporum изолят MOS509 | F. fujikuroi изолят IMI 58289 | |||
| сутки | сутки | сутки | ||||
| 5 | 10 | 5 | 10 | 5 | 10 | |
| T. atrobrunneum штамм ВКПМ F-1434 | 39,1±0,14 | 100 | 47,5±0,51 | 100 | 77,2± | 100 |
| T.Lixii изолят T4/14 | 27,6±0,36 | 42,6±0,21 | 28,7±0,5 | 59,0±0,62 | 78,3±0,25 | 100 |
| T. harzianum изолят 5/14 | 28,2±0,11 | 34,8±0,08 | 28,1±0,16 | 54,2±0,32 | 63,8±0,11 | 84,6±0,65 |
По результатам визуального скрининга антагонистической активности исследуемых штаммов фитопатогенных микроорганизмов по отношению к грибам рода Trichoderma отмечали два механизма воздействия:
— образование зоны антагонистического действия – зоны сдерживания роста патогена (антагонизм);
— использование антагонистом патогена в качестве субстрата, захват большой площади питательной среды и рост на патогене – гиперпаразитизм [148, 150].
Кроме того, следует отметить, что все штаммы фитопатогенных микроорганизмов в присутствии антагонистов не образовывали плотного воздушного мицелия по сравнению с контрольными.
3.1.2 Определение гиперпаразитарной активности грибов рода Trichoderma
Изучение гиперпаразитарной активности грибов рода Trichoderma необходимо для исследования потенциала экзометаболитов, продуцируемых ими. Результаты ингибирования роста колоний грибов рода Fusarium на питательных средах PDA с исследуемыми антагонистами представлены в таблице 3.
Таблица 3 – Процент ингибирования роста колоний грибов рода Fusarium на питательных средах с исследуемыми антагонистами, %
| Штаммы-антагонисты | F. oxysporum изолят Б/14 | F. oxysporum изолят MOS509 | F. fujikuroi изолят IMI 58289 | |||
| сутки | Сутки | сутки | ||||
| 5 | 10 | 5 | 10 | 5 | 10 | |
| T. atrobrunneum штамм ВКПМ F-1434 | 68,9±0,21 | 100 | 67,2±0,38 | 100 | 70,7± | 100 |
| T. Lixii изолят T4/14 | 58,4±0,58 | 66,7±0,25 | 59,5±0,65 | 69,5±0,58 | 64,9±0,58 | 94,5±0,11 |
| T. harzianum изолят 5/14 | 56,8±0,36 | 69,5±0,28 | 58,1±0,38 | 61,9±0,54 | 62,4±0,65 | 74,2±0,65 |
Результаты определения гиперпаразитарной активности среди исследуемых грибов рода Trichoderma коррелируют с ранее показанными данными по определению антагонистической активности методом двойных культур. Экзометаболиты всех исследуемых антагонистов в составе питательной среды способны ингибировать рост фитопатогенов, при этом гриб T. atrobrunneum штамм ВКПМ F-1434 на 10-сутки культивирования с фитопатогенными микроорганизмами также показал наибольшую степень ингибирования (100%); T. Lixii изолят T4/14 и T. harzianum изолят 5/14 имели высокий уровень ингибирования (61-94%).
Таким образом, в результате проведенных исследований по определению антагонистической и микопаразитической активности микромицетов рода Trichoderma установлено, что микробы-антагонисты показали разную степень ингибирования в зависимости от времени инкубации (5-е или 10-е сутки) и вида фитопатогена. Отмеченные способности к антагонизму и гиперпаразитизму свидетельствуют о полифункциональном механизме воздействия на патогены – они способны не только сдерживать и подавлять рост фитопатогенных грибов рода Fusarium посредством выделения антагонистических веществ, но также способны использовать мицелий в качестве субстрата.
3.1.3 Определение активности ферментов грибов рода Trichoderma, связанных с микопаразитизмом
Известно, что грибы рода Trichoderma являются гиперпаразитами по отношению ко многим фитопатогенным микроорганизмам [137]. Ингибирование роста патогенов грибами является их родовым признаком и обусловлено способностью микопаразита гидролизовывать клеточные стенки фитопатогенных грибов и использовать их в качестве субстрата за счет продуцируемых ферментов и выделяемых различных соединений.
У исследуемых антагонистов проверяли активность образования литических ферментов, с помощью которых осуществляется способность к микопаразитизму. Именно литические ферменты ответственно за способность антагонистов не только гидролизовывать сложные органические соединения, давая им преимущества, но и гидролизовывать клеточные стенки патогенов, используя их как субстрат.
Исследовали штаммы антагонисты на наличие трех основных литических ферментов – хитиназы, липазы и протеиназы. Липаза катализирует расщепление сложноэфирных связей в липидах, хитиназа отвечает за деградацию хитина до мономеров и N-ацетилглюкозаминов, протеиназы катализируют гидролитическое расщепление белков как растительного так и животного происхождения.
Результаты определения ферментативностой активности исследуемых штаммов-антагонистов представлены в таблице 4.
В нашем исследовании все виды Trichoderma способны продуцировать литические ферменты. У T. atrobrunneum штамм ВКПМ F-1434 степень проявления липазной и хитиназной активности сильная, протеиназаная средняя. Штаммы T. Lixii штамм T4/14 и T. harzianum штамм 5/14 обладают средней липазной и хитиназной активностями, слабой – протеиназной. Что и подтверждает данные, микопаразитарной способности штаммов внутри видов [9].
Таблица 4 – Способность к образованию литических ферментов у исследуемых штаммов-антагонистов
| Штаммы-антагонисты | Активность фермента | ||
| липазы | протеиназы | хитиназы | |
| T. atrobrunneum штамм ВКПМ F-1434 | ++++ | +++ | ++++ |
| T. Lixii изолят T4/14 | +++ | ++ | +++ |
| T. harzianum изолят 5/14 | +++ | ++ | +++ |
Примечание. Степень проявления ферментативной активности определяли визуально: — отсутствие; + очень слабая; ++ слабая; +++средняя; ++++ сильная
Таким образом, в результате проведенных исследований показано, что все исследуемые штаммы-антагонисты способны к антагонизму и гиперпаразитизму. Перспективным штаммом является T. atrobrunneum ВКПМ F-1434.
3.2 Изучение влияния биофлавоноидов гречихи: хлорогеновая кислота, рутин, кверцетин на развитие гриба F. Oxysporum, вызывающего корневые гнили гороха, in vitro
3.2.1 Выделение биофлаваноидов гречихи
Извлечение фенольных соединений проводили обработкой предварительно измельченной гречихи, хлороформом, а затем 70%-ным этанолом. Выход фракции составил 5,8 %. Поскольку агликонов и гликозидов имеют различную растворимость, соотвественно, флавоноиды извлекали последовательно экстрагентами разной полярности. С помощью избирательной экстракции было проведено фракционирование этанольного экстракта: извлечение последовательно обрабатывали этанолом, хлороформом, бензолом, петролейным эфиром, этилацетатом и ацетоном соответственно.
Затем полученные экстракты фракций биофлаваноидов разделяли методом тонкослойной хроматографии. Для подтверждения наличия определенной фракции флаваноидов провели анализ экстрактов методом тонкослойной хроматографии. Результаты представлены в таблице 5.
Таблица 5- Анализ биофлавоноидов гречихи методом ТСХ
| Название фракции | Экстрагент | |||||||
| Этанол | Хлороформ | Бензол | Петролейный
эфир |
Этил-
ацетат |
Ацетон | Вода | ||
| Значение Rf | ||||||||
| Рутин | 0,025 | линия старта | линия старта | 0,108 | 0,031 | 0,02 | 0,03 | |
| Кверцетин | 0,116 | 0,065 | 0,065 | 0,02 | 0,096 | 0,02 | 0,96 | |
| Хлорогеновая кислота | 0,05 | — | — | — | — | — | — | |
Таким образом, проведя качественный анализ по определению компонентного состава биофлаваноидов гречихи, получили разделенные фракции: рутин, кверцитин, хлорогеновая кислота.
3.2.2 Определение чувствительности фитопатогена Fusarium oxysporum в отношении биофлаваноидов гречихи диско-диффузионным методом
С целью микробиологической оценки экстрактов биофлаваноидов из гречихи проводили исследования с помощью диско-диффузионного метода на чашках Петри с универсальной питательной средой Чапека для определения чувствительности фитопатогена Fusarium oxysporum к исследуемым экстрактам рутина, кверцетина, хлорогеновой кислоты. Результаты проведенных исследований приведены в таблице 6.
Таблица 6- Показатели зоны подавления роста фитопатогена Fusarium oxysporum экстрактами биофлаваноидов
| Исследуемый экстракт | Возбудитель | Зона чувствительности |
| рутин | Fusarium oxysporum | — |
| кверцетин | 11 | |
| хлорогеновая кислота | — | |
| «РутиФлав» | 16 |
0 мм – активности нет;
до 10 мм – слабая чувствительность;
от 10 до 25 мм – средняя чувствительность;
25 мм и более – высокая чувствительность
Согласно полученным данным исследуемые экстракты из гречихи: рутин и хлорогеновая кислота не обладают активностью в отношении фитопатогена Fusarium oxysporum, в свою очередь кверцетин обладает слабой чувствительностью в отношении фитопатогена Fusarium oxysporum. Однако, препарат под торговой маркой «РутиФлав», представляющий собой по химическому составу смесь биофлаваноидов обладает средней чувствительностью в отношении фитопатогена, вызывающего корневые гнили гороха, поэтому может рекомендоваться в качестве компонента питательной среды для оздоровления растений in vitro.
3.2.3 Изучение ростостимулирующего и фунгицидного влияния биофлаваноидов гречихи в сравнении с биопрепаратами на основе природных компонентов в условиях in vitro
На основании различных исследований установлено, что биофлаваноиды гречихи оказывают ростостимулирующее действие на рост и развитие растений. Кроме того, биофлаваноиды проявляют ингибирующее действие в отношении растительных фитопатогенов. Нами были проведены исследования компонентного состава биофлаваноидов гречихи в сравнении с биопрепаратами на культурах, пораженных Fusarium.
Результаты определения ростстимулирующего и фунгицидного влияния обработки семян гороха, яровой пшеницы и ячменя исследуемыми биопрепаратами на основе природных компонентов и компонентами флаваноидов гречихи представлены в таблице 7,8,9.
Таблица 7. Морфометрические показатели 6-дневных проростков гороха
| Вариант обработки | Длина корешка, мм | Длина проростка, мм | Количество пораженных Fusarium семян, % |
| Контроль (вода) | 4,0±0,24 | 0,8±0,06 | 44 |
| Скарлет | 2,4±0,22 | 1,05±0,46 | 30 |
| Эликсир Урожая | 5,2±0,52 | 1,4±0,21 | 14 |
| Нигор | 3,78±0,24 | 1,0±0,34 | 9 |
| рутин | 4,6±0,22 | 2,2±0,32 | 12 |
| кверцетин | 4,8±0,56 | 2,7±0,48 | 10 |
| Хлорогеновая кислота | 4,4±0,36 | 2,0±0,54 | 18 |
| «РутиФлав» | 5,0±0,24 | 5,2±0,54 | 8 |
Таблица 8. Морфометрические показатели 6-дневных проростков ячменя
| Вариант обработки | Длина корешка, мм | Длина проростка, мм | Количество пораженных Fusarium семян, % |
| Контроль (вода) | 2,7±0,24 | 0,8±0,08 | 60 |
| Скарлет | 2,7±0,42 | 1,05±0,44 | 38 |
| Эликсир Урожая | 3,9±0,15 | 1,9±0,52 | 8 |
| Нигор | 3,8±0,11 | 1,5±0,39 | 6 |
| рутин | 4,1±0,22 | 2,1±0,32 | 16 |
| кверцетин | 4,3±0,54 | 2,4±0,48 | 14 |
| Хлорогеновая кислота | 3,8±0,36 | 2,1±0,52 | 20 |
| «РутиФлав» | 5,2±0,24 | 2,6±0,50 | 12 |
Таблица 9. Морфометрические показатели 6-дневных проростков яровой пшеницы
| Вариант обработки | Длина корешка, мм | Длина проростка, мм | Количество пораженных Fusarium семян, % |
| Контроль (вода) | 3,5±0,14 | 1,6±0,24 | 36 |
| Скарлет | 3,6±0,36 | 2,1±0,26 | 28 |
| Эликсир Урожая | 4,8±0,21 | 2,8±0,51 | 10 |
| Нигор | 4,7±0,17 | 2,4±0,32 | 10 |
| рутин | 4,2±0,20 | 1,9±0,32 | 14 |
| кверцетин | 4,6±0,56 | 2,5±0,48 | 10 |
| Хлорогеновая кислота | 4,2±0,36 | 2,1±0,54 | 16 |
| «РутиФлав» | 5,1±0,24 | 2,8±0,54 | 9 |
Согласно полученным данным, стимулирующее и фунгицидное действие исследуемых биопрепаратов на основе природных компонентов во всех случаях достоверно превышало показатели в контроле.
При обработке гороха биофлаваноидами гречихи оптимальные результаты наблюдали в варианте с «РутиФлавом» , который представляет собой смесь биофлаваноидов различной химической природы. Так, длина корешка на 25% по сравнению с контролем, длина проростка на 86%. В сравнении с препаратом «Скарлет» длина корешка в два раза больше, в том числе и длина проростка. При обработке семян гороха «Эликсиром урожая» длина корешка на 4% меньше, а длина проростка в два раза больше.
Проводя исследования компонентного состава биофлаваноидов гречихи установлено, что кверцетин оказывает ростостимулирующее и фунгицидное действие на проростки гороха: длина корешка в два раза больше, чем в контроле, длина проростка на 28% увеличивает длину. Так же показатели длины корешка и проростка при обработке фракцией кверцетина превышают значения в вариантах обработки с препаратами «Скарлет», «Эликир урожая», «Нигор».
Согласно проведенным исследованиям влияния биопрепаратов и компонентного состава биофлаваноидов гречихи на ячмене и яровой пшенице оптимальные результаты ростостимулирующего и фунгицидного действия наблюдали в вариантах при обработке препаратом «РутиФлав», в том числе фракцией кверцетина.
3.2.3 Изучение влияния биофлавоноидов гречихи в сравнении с биопрепаратами на основе природных компонентов на интенсивность развития проростков исследуемых сельскохозяйственных культур в лабораторных условиях
Таблица 10. Морфометрические показатели гороха на 3-е, 7-е, 10-е и 14-е сутки
| Вариант обработки | Сутки вегетации | |||
| 3 | 7 | 10 | 14 | |
| 1 | 2 | 3 | 4 | 5 |
| Длина проростка, мм | ||||
| Контроль (вода) | 0 | 6,54±0,12 | 34,2±0,11 | 64,6±0,51 |
| Скарлет | 0 | 10,0±0,32 | 36,6±0,52 | 74,3±0,08 |
| Эликсир Урожая | 0 | 12,0±0,14 | 46,9±0,62 | 89,9±0,06 |
| Нигор | 0 | 12,8±0,05 | 59,5±0,32 | 105,6±0,25 |
| рутин | 0 | 30±0,16 | 42±0,34 | 79±0,44 |
| кверцетин | 0 | 28±0,14 | 38±0,56 | 82±0,24 |
| Хлорогеновая кислота | 0 | 27±0,18 | 36±0,48 | 80±0,34 |
| «РутиФлав» | 0 | 32±0,26 | 44,5±0,32 | 98±0,56 |
| Длина корешка, мм | ||||
| Контроль (вода) | 12,45±0,32 | 35,6±0,08 | 44,16±0,32 | 59,18±0,61 |
| Скарлет | 12,58±0,36 | 30,5±0,19 | 54,12±0,36 | 66,3±0,24 |
| Эликсир Урожая | 12,55±0,19 | 39,4±0,54 | 66,8±0,84 | 74,9±0,51 |
Продолжение таблицы 10
| 1 | 2 | 3 | 4 | 5 |
| Нигор | 13,51±0,24 | 45,4±0,47 | 80,4±0,24 | 87,6±0,36 |
| рутин | 12,56±0,26 | 67±0,36 | 73±0,46 | 78±0,36 |
| кверцетин | 11,68±0,54 | 64±0,24 | 72±0,58 | 76±0,54 |
| Хлорогеновая кислота | 9,94±0,36 | 58±0,14 | 68±0,36 | 73±0,56 |
| «РутиФлав» | 12,6±0,12 | 72±0,22 | 79±0,48 | 87±0,32 |
Таблица 11. Морфометрические показатели ячменя на 3-е, 7-е, 10-е и 14-е сутки
| Вариант обработки | Сутки вегетации | |||
| 3 | 7 | 10 | 14 | |
| Длина проростка, мм | ||||
| Контроль (вода) | 0 | 48,9±0,11 | 60,21±0,32 | 74,9±0,36 |
| Скарлет | 0 | 53,1±0,21 | 77,00±0,24 | 87,2±0,14 |
| Эликсир Урожая | 0 | 63,5±0,60 | 100,01±0,25 | 105,2±0,84 |
| Нигор | 0 | 48,0±0,04 | 69,6±0,35 | 95,6±0,54 |
| рутин | 0 | 30±0,11 | 38±0,12 | 76±0,58 |
| кверцетин | 0 | 26±0,24 | 36±0,69 | 74±0,36 |
| Хлорогеновая кислота | 0 | 24±0,16 | 37±0,47 | 71±0,54 |
| «РутиФлав» | 0 | 48±0,24 | 54±0,36 | 98±0,23 |
| Длина корешка, мм | ||||
| Контроль (вода) | 10,71±0,64 | 67,0±0,08 | 80,0±0,08 | 65,4±0,36 |
| Скарлет | 8,73±0,51 | 70,01±0,54 | 87,39±0,11 | 79,05±0,34 |
| Эликсир Урожая | 10,27±0,25 | 90,8±0,69 | 112,20±0,24 | 85,01±0,84 |
| Нигор | 10,37±0,69 | 88,00±0,32 | 80,4±0,24 | 87,6±0,54 |
| рутин | 10,27±0,14 | 52±0,38 | 58±0,12 | 68±0,47 |
| кверцетин | 10,06±0,26 | 49±0,46 | 56±0,13 | 70±0,10 |
| Хлорогеновая кислота | 9,16±0,46 | 46±0,34 | 52±0,31 | 67±0,38 |
| «РутиФлав» | 10,02±0,54 | 62±0,52 | 71±0,43 | 76±0,57 |
Таблица 12. Морфометрические показатели яровой пшеницы на 3-е, 7-е, 10-е и 14-е сутки
| Вариант обработки | Сутки вегетации | |||
| 3 | 7 | 10 | 14 | |
| Длина проростка, мм | ||||
| Контроль (вода) | 0 | 49,4±0,12 | 58,3±0,36 | 71,3±0,54 |
| Скарлет | 0 | 50,3±0,41 | 59,5±0,52 | 86,3±0,17 |
| Эликсир Урожая | 0 | 59,8±0,36 | 95,4±0,26 | 99,4±0,56 |
| Нигор | 0 | 51,6±0,65 | 70,1±0,65 | 96,3±0,95 |
| рутин | 0 | 36±0,12 | 39±0,12 | 63±0,59 |
| кверцетин | 0 | 34±0,64 | 38±0,69 | 61±0,36 |
| Хлорогеновая кислота | 0 | 33±0,48 | 37±0,22 | 59±0,11 |
| «РутиФлав» | 0 | 52±0,32 | 58±0,22 | 76±0,12 |
| Длина корешка, мм | ||||
| Контроль (вода) | 9,71±0,32 | 62,8±0,15 | 76,2±0,56 | 79,8±0,64 |
| Скарлет | 9,65±0,95 | 69,8±0,69 | 78,8±0,28 | 86,91±0,25 |
| Эликсир Урожая | 10,14±0,36 | 63,6±0,68 | 89,6±0,64 | 93,69±0,69 |
| Нигор | 9,98±0,97 | 84,3±0,26 | 91,6±0,39 | 94,35±0,58 |
| рутин | 9,46±0,12 | 54±0,36 | 59±0,12 | 69±0,47 |
| кверцетин | 10,02±0,24 | 51±0,47 | 57±0,11 | 71±0,14 |
| Хлорогеновая кислота | 9,36±0,44 | 46±0,33 | 53±0,45 | 68±0,56 |
| «РутиФлав» | 10,14±0,37 | 64±0,27 | 73±0,58 | 78±0,13 |
Исходя из полученных результатов по определению морфометрических показателей гороха, ячменя и яровой пшеницы при предварительной обработке исследуемыми биопрепартами, в том числе биофлаваноидами гречихи, как компонентами: рутин, кверцетин, хлорогеновая кислота, так и суммой биофлаваноидов, которая представлена в составе препарата «РутиФлав» можно сделать вывод, что «Эликсир урожая» эффективен на проростках ячменя и яровой пшеницы, а «Нигор» — на горохе.
Оптимальные показатели длины корешка и проростка гороха по результатам исследования наблюдали в варианте с «РутиФлав», в том числе в варианте при обработке проростков фракцией рутина.
Показатели энергии прорастания и всхожести семян гороха и ячменя при их обработке исследуемыми биопрепаратами представлены в таблице 13.
Таблица 13. Показатели энергии прорастания семян гороха и ячменя (3-е сутки) и всхожести (7-е сутки)
| Вариант обработки | Показатели, % | |||
| горох | ячмень | |||
| Энергия прорастания | Всхожесть | Энергия прорастания | Всхожесть | |
| Контроль (вода) | 96 | 98 | 49 | 86 |
| Скарлет | 96 | 96 | 34 | 92 |
| Эликсир Урожая | 94 | 100 | 54 | 98 |
| Нигор | 98 | 100 | 60 | 98 |
| рутин | 96 | 100 | 52 | 72 |
| кверцетин | 92 | 100 | 47 | 70 |
| Хлорогеновая кислота | 92 | 100 | 42 | 64 |
| «РутиФлав» | 96 | 100 | 54 | 72 |
Исследования показали, что предпосевная обработка семян гороха и ячменя растворами исследуемых биопрепаратов способствует повышению энергии прорастания и всхожести. Наибольшей энергией прорастания и всхожестью обладали семена сельскохозяйственных культур, обработанные препаратами «Нигор» и составила 98 и 100% на горохе, 60 и 98% соответственно на ячмене, и препаратом, состоящим из суммы биофлаваноидов, представленных под торговой маркой «РутиФлав» энергия прорастания и всхожесть составила 96 и 100% на горохе, 54 и 72% на ячмене.
Исследованиями компонентного состава биофлаваноидов гречихи установлено, что наибольшие показатели энергии прорастания и всхожести наблюдали в варианте с рутином. Показатели всхожести и энергии прорастания составили соответственно для гороха 96% и 100%, для ячменя 52 и 72%.
3.2.4. Изучение влияния экзометаболитов Trichoderma Atrobrunneum на развитие гриба F. Oxysporum, вызываещего корневые гнили гороха, in vitro
3.2.4.1 Изучение ростостимулирующего и фунгицидного влияния T. atrobrunneum ВКПМ F-1434 в сравнении с биопрепаратами на основе природных компонентов в условиях in vitro
Многими исследователями показано, что микроорганизмы, обладающие антагонистической активностью, способны стимулировать рост и развитие различных растений, а также изменять почвенную микробиоту, тем самым улучшая фитосанитарное состояние почвы [86].
В наших исследованиях особое значение придавалось использованию аборигенных штаммов антагонистов, так как их биологическая активность непосредственно связана с местом обитания и со всем почвенным комплексом в целом [134].
Основываясь на полученных результатах антагонистической, микопаразитической и ферментативной активности исследуемых микроорганизмов-антагонистов, в опытах in vitro проводили их испытание на способность стимулировать прорастание семян гороха посевного, ячменя, яровой пшеницы.
Результаты определения ростстимулирующего и фунгицидного влияния обработки семян гороха, яровой пшеницы и ячменя исследуемыми биопрепаратами на основе природных компонентов представлены в таблице 14, 15, 16.
Таблица 14. Морфометрические показатели 6-дневных проростков гороха
| Вариант обработки | Длина корешка, мм | Длина проростка, мм | Количество пораженных Fusarium семян, % |
| Контроль (вода) | 4,3±0,25 | 0,9±0,08 | 40 |
| Скарлет | 2,6±0,24 | 1,03±0,54 | 32 |
| Эликсир Урожая | 5,5±0,54 | 1,5±0,25 | 12 |
| Нигор | 3,84±0,24 | 1,1±0,36 | 8 |
| Экзометаболиты T. atrobrunneum ВКПМ F-1434 | 5,8±0,12 | 1,68±0,61 | 4 |
Таблица 15. Морфометрические показатели 6-дневных проростков ячменя
| Вариант обработки | Длина корешка, мм | Длина проростка, мм | Количество пораженных Fusarium семян, % |
| Контроль (вода) | 2,6±0,11 | 0,7±0,18 | 60 |
| Скарлет | 2,7±0,42 | 1,05±0,44 | 38 |
| Эликсир Урожая | 3,9±0,15 | 1,9±0,52 | 8 |
| Нигор | 3,8±0,11 | 1,5±0,39 | 6 |
| Экзометаболиты T. atrobrunneum ВКПМ F-1434 | 4,1±0,64 | 2,15±0,24 | 4 |
Таблица 16. Морфометрические показатели 6-дневных проростков яровой пшеницы
| Вариант обработки | Длина корешка, мм | Длина проростка, мм | Количество пораженных Fusarium семян, % |
| Контроль (вода) | 3,5±0,14 | 1,6±0,24 | 36 |
| Скарлет | 3,6±0,36 | 2,1±0,26 | 28 |
| Эликсир Урожая | 4,8±0,21 | 2,8±0,51 | 10 |
| Нигор | 4,7±0,17 | 2,4±0,32 | 10 |
| Экзометаболиты T. atrobrunneum ВКПМ F-1434 | 5,2±0,48 | 3,1±0,26 | 6 |
Согласно приведенным данным, стимулирующее и фунгицидное действие исследуемых биопрепаратов на основе природных компонентов во всех случаях достоверно превышало показатели в контроле. Также стимуляция роста корней и проростков в случае использования биопрепаратов «Эликсир урожая» и «Нигор» сильнее, чем при воздействии контрольных препаратов.
Следует отметить, что обработка семян гороха биопрепаратом «Эликсир урожая» стимулирует рост корешка и проростка на 27% и 66% больше, чем в контроле. Обработка семян ячменя биопрепаратом «Эликсир урожая» стимулирует рост корешка и проростка в 0,5 и 2 раза больше, чем в контроле.
Обработка семян гороха биопрепаратом «Нигор» ингибирует рост корешка на 10% по сравнению с контролем, а стимулирует рост проростка на 22%. Обработка семян ячменя биопрепаратом «Нигор» стимулирует рост корешка и проростка 46% и 100% по сравнению с контролем.
Количество пораженных семян при использовании биопрепарата «Эликсир урожая» по сравнению с контролем, на горохе меньше на 70%, на ячмене на 86%. Количество пораженных семян при использовании биопрепарата «Нигор» по сравнению с контролем, на ячмене меньше на 80%, на ячмене на 90%.
Так, на горохе, использование экзометаболитов T. atrobrunneum ВКПМ F-1434 увеличивает длину корешка по сравнению с контролем на 34%, по сравнению с биопрепаратом «Эликсир Урожая» — на 30%; увеличивает длину проростка по сравнению с контролем на 86%, по сравнению с биопрепаратом «Эликсир Урожая» — на 12%.
На ячмене, использование экзометаболитов T. atrobrunneum ВКПМ F-1434 увеличивает длину корешка по сравнению с контролем на 57%, по сравнению с биопрепаратом «Эликсир Урожая» — на 5%; увеличивает длину проростка по сравнению с контролем в 2 раза, по сравнению с биопрепаратом «Эликсир Урожая» — на 18%.
На яровой пшенице, использование экзометаболитов T. atrobrunneum ВКПМ F-1434 увеличивает длину корешка по сравнению с контролем на 48%, по сравнению с биопрепаратом «Эликсир Урожая» — на 8%; увеличивает длину проростка по сравнению с контролем в 2 раза, по сравнению с биопрепаратом «Эликсир Урожая» — на 10%.
Таким образом, в условиях in vitro биопрепараты на основе природных компонентов «Эликсир урожая» и «Нигор» обладают выраженным ростстимулирующим и фунгицидным действием. Компоненты биопрепарата «Нигор» менее эффективно стимулируют рост 6-суточных проростков как гороха, так и ячменя, яровой пшеницы, но и проявляют наиболее выраженным фунгицидным действием в отношении грибов рода Fusarium. Во всех исследованиях нами показано, что использование экзометаболитов T. atrobrunneum ВКПМ F-1434 в отношении гороха, яровой пшеницы и ячменя, увеличивает рост корня и проростка тест-объектов, снижает количество пораженных фитопатогенами семян.
Совместное применении этих препаратов может обеспечить увеличение показателей исследуемых активностей. В связи с чем, в дальнейшем исследовании проводили подбор эффективной комбинации исследуемых биопрепаратов с целью создания нового биопрепарата с защитно-стимулирующими свойствами для применения на горохе, яровой пшенице и ячмене.
3.2.4.2 Изучение влияния T. atrobrunneum ВКПМ F-1434 в сравнении с биопрепаратами на основе природных компонентов на интенсивность развития проростков исследуемых сельскохозяйственных культур в лабораторных условиях
Наибольшим ростостимулирующим эффектом уже на ранних стадиях развития гороха и ячменя обладал новый биопрепарат на основе природных компонентов растительного и микробного происхождения является «Эликсир урожая» и «Нигор» 1:1 со споровой суспензией Trichoderma atrobrunneum ВКПМ F-1434 (ССТr) (с титром 1*108 конидий/мл из расчета 2 мг/л готового раствора (таблица 17,18).
Таблица 17. Морфометрические показатели гороха на 3-е, 7-е, 10-е и 14-е сутки
| Вариант обработки | Сутки вегетации | |||
| 3 | 7 | 10 | 14 | |
| 1 | 2 | 3 | 4 | 5 |
| Длина проростка, мм | ||||
| Контроль (вода) | 0 | 6,54±0,12 | 34,2±0,11 | 64,6±0,51 |
| Скарлет | 0 | 10,0±0,32 | 36,6±0,52 | 74,3±0,08 |
| Эликсир Урожая | 0 | 12,0±0,14 | 46,9±0,62 | 89,9±0,06 |
| Нигор | 0 | 12,8±0,05 | 59,5±0,32 | 105,6±0,25 |
| Экзометаболиты T. atrobrunneum ВКПМ F-1434 | 0 | 13,75±0,21 | 71,21±0,21 | 116,4±0,32 |
Продолжение таблицы 17
| 1 | 2 | 3 | 4 | 5 |
| Длина корешка, мм | ||||
| Контроль (вода) | 12,45±0,32 | 35,6±0,08 | 44,16±0,32 | 59,18±0,61 |
| Скарлет | 12,58±0,36 | 30,5±0,19 | 54,12±0,36 | 66,3±0,24 |
| Эликсир Урожая | 12,55±0,19 | 39,4±0,54 | 66,8±0,84 | 74,9±0,51 |
| Нигор | 13,51±0,24 | 45,4±0,47 | 80,4±0,24 | 87,6±0,36 |
| Экзометаболиты T. atrobrunneum ВКПМ F-1434 | 13,96±0,32 | 50,64±0,05 | 99,54±0,36 | 105,2±0,47 |
Таблица 18. Морфометрические показатели ячменя на 3-е, 7-е, 10-е и 14-е сутки
| Вариант обработки | Сутки вегетации | |||
| 3 | 7 | 10 | 14 | |
| Длина проростка, мм | ||||
| Контроль (вода) | 0 | 48,9±0,11 | 60,21±0,32 | 74,9±0,36 |
| Скарлет | 0 | 53,1±0,21 | 77,00±0,24 | 87,2±0,14 |
| Эликсир Урожая | 0 | 63,5±0,60 | 100,01±0,25 | 105,2±0,84 |
| Нигор | 0 | 48,0±0,04 | 69,6±0,35 | 95,6±0,54 |
| Экзометаболиты T. atrobrunneum ВКПМ F-1434 | 0 | 72,0±0,21 | 91,21±0,08 | 126,9±0,65 |
| Длина корешка, мм | ||||
| Контроль (вода) | 10,71±0,64 | 67,0±0,08 | 80,0±0,08 | 65,4±0,36 |
| Скарлет | 8,73±0,51 | 70,01±0,54 | 87,39±0,11 | 79,05±0,34 |
| Эликсир Урожая | 10,27±0,25 | 90,8±0,69 | 112,20±0,24 | 85,01±0,84 |
| Нигор | 10,37±0,69 | 88,00±0,32 | 80,4±0,24 | 87,6±0,54 |
| Экзометаболиты T. atrobrunneum ВКПМ F-1434 | 10,52±0,32 | 91,03±0,44 | 109,54±0,28 | 105,23±0,38 |
Таблица 19. Морфометрические показатели яровой пшеницы на 3-е, 7-е, 10-е и 14-е сутки
| Вариант обработки | Сутки вегетации | |||
| 3 | 7 | 10 | 14 | |
| Длина проростка, мм | ||||
| Контроль (вода) | 0 | 49,4±0,12 | 58,3±0,36 | 71,3±0,54 |
| Скарлет | 0 | 50,3±0,41 | 59,5±0,52 | 86,3±0,17 |
| Эликсир Урожая | 0 | 59,8±0,36 | 95,4±0,26 | 99,4±0,56 |
| Нигор | 0 | 51,6±0,65 | 70,1±0,65 | 96,3±0,95 |
| Экзометаболиты T. atrobrunneum ВКПМ F-1434 | 0 | 64,3±0,54 | 98,4±0,32 | 111,6±0,29 |
| Длина корешка, мм | ||||
| Контроль (вода) | 9,71±0,32 | 62,8±0,15 | 76,2±0,56 | 79,8±0,64 |
| Скарлет | 9,65±0,95 | 69,8±0,69 | 78,8±0,28 | 86,91±0,25 |
| Эликсир Урожая | 10,14±0,36 | 63,6±0,68 | 89,6±0,64 | 93,69±0,69 |
| Нигор | 9,98±0,97 | 84,3±0,26 | 91,6±0,39 | 94,35±0,58 |
| Экзометаболиты T. atrobrunneum ВКПМ F-1434 | 11,65±0,27 | 92,3±0,71 | 104,9±0,258 | 107,35±0,45 |
Исходя из полученных результатов по определению морфометрических показателей гороха и ячменя при предварительной обработке исследуемыми биопрепартами, можно сделать вывод, что «Эликсир уроожая» эффективен на проростках ячменя, тогда как «Нигор» — на горохе. Новый биопрепарат на основе природных компонентов в обоих случаях показал наилучший вариант.
При обработки гороха новым биопрепаратом, на 7-е сутки вегетации длина проростка в 2 раза больше, чем в контроле и на 7% больше в мирокрастениях, обработанных «Нигор». На 14-е сутки динамика сохраняется, в 1,8 раза больше, чем в контроле и на 10% больше, чем при использовании «Нигор».
При обработки гороха новым биопрепаратом, на 7-е сутки вегетации длина корешка в 1,4 раза больше, чем в контроле и на 11% больше в мирокрастениях, обработанных «Нигор». На 14-е сутки динамика сохраняется, в 1,7 раза больше, чем в контроле и на 20% больше, чем при использовании «Нигор».
При обработки ячменя новым биопрепаратом, на 7-е сутки вегетации длина проростка в 1,5 раза больше, чем в контроле и на 47% больше в мирокрастениях, обработанных «Эликсир урожая». На 14-е сутки динамика сохраняется, в 1,7 раза больше, чем в контроле и на 20% больше, чем при использовании «Эликсир урожая».
При обработки ячменя новым биопрепаратом, на 7-е сутки вегетации длина корешка в 1,4 раза больше, чем в контроле и незначительно (0,2%) больше в мирокрастениях, обработанных «Эликиср урожая». На 14-е сутки динамикаэффективнее, в 1,6 раза больше, чем в контроле и на 24% больше, чем при использовании «Эликсир урожая».
Показатели энергии прорастания и всхожести семян гороха и ячменя при их обработке исследуемыми биопрепаратами представлены в таблице 20.
Таблица 20. Показатели энергии прорастания семян гороха и ячменя (3-е сутки) и всхожести (7-е сутки)
| Вариант обработки | Показатели, % | |||
| горох | ячмень | |||
| Энергия прорастания | Всхожесть | Энергия прорастания | Всхожесть | |
| Контроль (вода) | 96 | 98 | 49 | 86 |
| Скарлет | 96 | 96 | 34 | 92 |
| Эликсир Урожая | 94 | 100 | 54 | 98 |
| Нигор | 98 | 100 | 60 | 98 |
| Новый биопрепарат | 100 | 100 | 62 | 100 |
Исследования показали, что предпосевная обработка семян гороха и ячменя в растворах исследуемых биопрепаратов способствует повышению энергии прорастания и всхожести. Так, наибольшей энергией прорастания обладали семена сельскохозяйственных культур, обработанные препаратами «Нигор» и новым комплексным препаратом на основе природных компонентов и составила 98 и 100% на горохе, 60 и 62% соответственно на ячмене. Всхожесть семян была наибольшая после обработки их препаратами «Эликсир урожая», «Нигор» и новым комплексным препараом на основе природных компонентов и составила на горохе во всех вариантах обработки 100% , на ячмене – 98 и 100% соответственно.
Таким образом, новый биопрепарат на основе природных компонентов растительного и микробного происхождения является «Эликсир урожая» и «Нигор» 1:1 со споровой суспензией Trichoderma atrobrunneum ВКПМ F-1434 (ССТr) (с титром 1*108 конидий/мл из расчета 2 мг/л готового раствора) при использовании в качестве средства для предпосвеной обработки семян обладает выраженными ростостимулирующими свойствами в отношении микрорастений гороха и ячменя.
РАЗДЕЛ 4. ПОЛЕВЫЕ ИСПЫТАНИЯ
Полевые исследования проведены в НОПЦ «Интеграция» ФГБОУ ВО Орловский ГАУ, Орловская область, Орловский район, с. Лаврово.
В качестве объектов исследования использованы новые и рекомендованные к использованию фунгициды Азорро и Триада, озимая пшеница Московская 39 и яровой ячмень Грейс.
Озимая пшеница – 2 обработки: фаза кущения-выхода в трубку и фаза флагового листа
Яровой ячмень – предпосевная обработка семян и 2 обработки по вегетации: фаза кущения-выхода в трубку и фаза флагового листа.
Расположение делянок систематическое.
Размер опытной делянки 12 х 20 = 240 м2
Размер учетной делянки 50м2.
Защитные полосы между делянками и повторностями по 0,5 м.
Общая площадь опыта 4,5 га.
4.1. Совершенствование технологии защиты озимой пшеницы и ярового ячменя от грибных болезней
В условиях обострившихся экономических и экологических проблем современного состояния земледелия Российской Федерации назрела необходимость значительных изменений применяемых агротехнологий, базирующихся на их биологизации и ресурсосбережении при обеспечении рентабельности сельскохозяйственного производства [44, 50, 62, 63].
В последнее десятилетие в силу ряда экономических, организационно-хозяйственных причин, в том числе и изменения климата, во многих хозяйствах отмечено значительное развитие грибных болезней зерновых культур [81, 99, 103]. Исследования в Московской и Орловской области, ЦЧР в целом позволили вскрыть фитосанитарные проблемы и наметить пути их решения [2, 71, 72, 99].
В настоящее время изучается влияние разных способов основной обработки почвы на динамику и патогенный состав корневых гнилей [10, 12]. В условиях необходимости биологизации земледелия и растениеводства проводятся исследования и внедряются в производство препараты нового поколения, созданные на биологической основе [39, 40, 69, 70].
Комплексные исследования в области интегрированной защиты растений от повреждающих абиотических и биотических факторов также являются актуальными и требуют дальнейшего изучения. Это обусловило необходимость исследований по актуальной проблеме регулирования фитосанитарного состояния агроценозов и на этой основе повышения продуктивности сельскохозяйственных культур [11, 82, 105].
В мире ежегодно пополняется список регламентированных к использованию химических средств защиты растений. На современном этапе ведения сельскохозяйственного производства не обойтись без использования химических средств [20, 45, 68]. Однако в условиях необходимости импортозамещения актуальным является изучение эффективности отечественных препаратов, в том числе и фунгицидов.
Пшеница и ячмень – важнейшие продовольственные, кормовые и технические культуры. Среди зерновых культур яровой ячмень по посевным площадям занимает первое место, а по валовому сбору зерна – второе, уступая лишь озимой пшенице [62]. В структуре площадей в 2020 году наибольшую долю занимают озимая и яровая пшеница — 36,9% всех площадей и озимый и яровой ячмень — 10,7%. В связи с этим для повышения урожайности и возможности растениям реализовать генетический потенциал продуктивности необходимо обеспечить посевы надежной защитой от болезней и вредителей. В данном разделе изучены отечественные химические фунгициды Азорро и Триада. Несмотря на то, что они относятся ко 2-му классу опасности, строгое соблюдение регламентов применения в ранние и при необходимости в средние сроки развития зерновых культур не приводит к накоплению остаточных количеств пестицидов в почве и продукции [101]. Эти фунгициды быстро проникают в растения и останавливают развитие болезней. В отличие от многих других аналогичных препаратов более раннего срока производства и регистрации фунгициды Азорро и Триада отличаются хорошим прилипанием к органам растений, они не скатываются и в минимальных количествах попадают на почву.
Целью полевых исследований является научное обоснование системы защиты зерновых культур (на примере озимой пшеницы и ярового ячменя) от возбудителей грибных заболеваний.
Эта система должна обеспечить хозяйственную и экономическую эффективность, а также экологическую безопасность. Исходя из этого, были поставлены следующие задачи:
- определение распространенности и вредоносности грибных болезней;
- выявление зависимости роста и развития озимой пшеницы и ярового ячменя от условий внешней среды (абиотические и биотические факторы) в связи с защитными мероприятиями;
- изучение влияния используемых средств защиты на урожайность и качество продукции;
- экономическая оценка эффективности применения средств защиты при возделывании озимой пшеницы и ярового ячменя.
В исследованиях использовались промышленные фунгициды.
Фунгицид Азорро
Преимущества
- Проявляет усиленный фунгицидный эффект за счет комбинации двух действующих веществ со взаимодополняющими биологическими свойствами
- Обеспечивает высокоэффективную защиту озимых зерновых культур после перезимовки, а также яровых культур от прикорневых гнилей и мучнистой росы на ранних фазах развития культуры
- Профилактические обработки предотвращают развитие листовых заболеваний в более поздний период развития культуры
- Обладает профилактическим, лечебным и искореняющим действием (Таблица 21)
Таблица 21. Различный механизм действия веществ, входящих в состав препарата фунгицида Азорро
| Действующие вещества: | |
| Азоксистробин | 100 г/л |
| Карбендазим | 300 г/л |
| Препаративная форма | Концентрат суспензии |
| Химический класс | Бензимидазолы + стробилурины |
| Способ проникновения | Контактный пестицид, системный пестицид |
| Характер действия | Защитный пестицид |
| Действие на организмы | Пестицид, фунгицид |
| Класс опасности для человека | 2 |
| Класс опасности для пчел | 3 |
| Производитель | Щелково Агрохим |
| Номер государственной регистрации | 018-02-1859-1 |
| Дата окончания срока регистрации | 08.04.2028 |
- Различный механизм действия веществ, входящих в состав препарата, обусловливает гарантированную защиту и предупреждает проявление резистентных штаммов патогенов
- Оказывает стимулирующий эффект на рост и развитие культуры, усиливает фотосинтез во флаговых листьях – выраженный эффект «зеленого листа», положительно влияет на формирование урожая.
Преимущества препарата Триада (Таблица 22)
- три высокоэффективных действующих вещества в оптимальном соотношении;
- незаменимый препарат в борьбе с листостебельными заболеваниями;
- зерновых культур (септориоз, мучнистая роса, ржавчина и т.д.);
- высокая биологическая эффективность за счет уникальной препаративной формы (наноуровень);
- быстро проникает в растение и останавливает развитие болезни;
- оптимальное сочетание действующих веществ исключает возникновение резистентности;
- формирует качество зерна.
Таблица 22. Различный механизм действия веществ, входящих в состав препарата фунгицида Триада
| Действующие вещества: | |
| Пропиконазол | 140 г/л |
| Тебуконазол | 140 г/л |
| Эпоксиконазол | 72 г/л |
| Препаративная форма | Концентрат коллоидного раствора |
| Химический класс | Триазолы |
| Способ проникновения | Системный пестицид |
| Характер действия | Защитный пестицид, лечащий фунгицид |
| Действие на организмы | Пестицид, фунгицид |
| Класс опасности для человека | 2 |
| Класс опасности для пчел | 3 |
| Регистрант | ЗАО «Щелково Агрохим» |
| Производитель | Щелково Агрохим |
| Номер государственной регистрации | 018-02-584-1 018-02-584-1/90 |
| Дата окончания срока регистрации | 30.03.2024 |
Схема опыта представлена в таблице 23 (2 обработки: 1 — фаза кущения-начала выхода в трубку, 2- фаза флагового листа)
Таблица 23. Схема опыта
| 1-я повторность | |||||
| Контроль без обработок | Азорро | Триада | 1 — Азорро
2 — Триада |
||
| 2-я повторность, защитная полоса 0,5 м | |||||
| Контроль без обработок | Азорро | Триада | 1 — Азорро
2 — Триада |
||
| 3-я повторность, защитная полоса 0,5 м | |||||
| Контроль без обработок | Азорро | Триада | 1 — Азорро
2 — Триада |
||
Краткая характеристика зоны проведения испытания
Орловская область расположена на юго-западе Европейской части России, в центральной части Среднерусской возвышенности в лесостепной зоне. Протяжённость территории с севера на юг — более 150 км, с запада на восток — свыше 200 км. Поверхность — холмистая равнина, рассечённая обрывистыми берегами рек и оврагами.
Климат — умеренно континентальный, с устойчивой зимой и преобладанием теплой, нередко полузасушливого и засушливого характера погоды в летний период. Средняя температура воздуха самого теплого месяца июля +19,0-20,7ºС, а самого холодного – января — 10,5-11,5ºС. Продолжительность безморозного периода 150 дней. Сумма температур выше 10ºС составляет 2350-2580ºС. Количество осадков за вегетационный период выпадает 298-308 мм, но распределение их по месяцам неравномерное. Гидротермический коэффициент изменяется от 0,5 в сухие годы до 2,0 – во влажные. Поэтому дефицит влаги представляет собой один из основных факторов, лимитирующий формирование урожая сельскохозяйственных культур. Годовая сумма осадков равна 469,9 мм.
Регион находится в зоне переходных почв от дерново-подзолистых к преимущественно выщелоченным и оподзоленным чернозёмам. В северной части области преобладают выщелоченные черноземы и серые лесные почвы, в южной части – мощные черноземы. Содержание гумуса в пахотном слое от 5 до 9%. Механический состав преимущественно глинистый и тяжелосуглинистый. Тяжелосуглинистый механический состав обуславливает высокую влагоемкость и значительный запас влаги в ранневесенний период до 180-200 мм и более доступной влаги в метровом слое почвы.
Агрохимическая характеристика почвы (опытного участка) (Таблица 24)
НОПЦ «Интеграция» расположен в Орловском районе и относится к центральной зоне Орловской области. Почвенный покров опытного участка представлен типичной для тёмно-серой лесной среднесуглинистой по механическому составу глееватой почвой, способной заплывать и слипаться после дождей, уплотняться и образовывать трещины в сухую погоду. Почвообразующие и подстилающие породы – оглеенные покровные суглинки (пятна оглеения встречаются с глубины 75 см). Склон юго-западной экспозиции крутизной 0-3о. Рельеф участка выровненный.
Таблица 24 – Агрохимическая характеристика почвы опытного участка (данные ФГБУ центра химизации и сельскохозяйственной радиологии «Орловский», Орловский район)
Агротехнические мероприятия
Используемые пестициды по всем вариантам опыта:
Инсектицид Залп, КЭ (250 г/л циперметрина) – 0,2 л/га (рабочей жидкости – 200-400 л/га).
Гербицид Лорнет, ВР (300 г/л клопиралида) – 0,16-0,66 (р.ж. – 200-300 л/га).
Предшественник озимой пшеницы – люпин на сидерат, ярового ячменя – яровая пшеница по черному пару. Вспашка на глубину 23-25 см. Ранневесеннее боронование. Культивация предпосевная. Посев с нормой высева 5 млн. всхожих семян.
В таблице 25 представлена методика испытания фунгицидов.
Таблица 25. Методики проведения испытаний
| Виды анализов и учетов | Метод, методика | Прибор |
| Фенологические наблюдения | Методика Государственного сортоиспытания с.-х. культур (1982, 1995 гг.) | — |
| Пораженность растений болезнями | — « — | — |
| Урожайность | — « — | САМПО-500 |
| Структура урожая | Методика Государственного сортоиспытания с.-х. культур (1982, 1995 гг.) | весы MVP-300, линейки |
| Клейковина | ГОСТ 54478-2011 | — |
| Сырой протеин | ГОСТ 10846-74 | ФЭКС КФК-2 |
| ИДК | ГОСТ 54478-2011 | ИДК-1М |
| Масса 1000 зерен | ГОСТ 12042-80 | весы MVP-300 |
| Натура | ГОСТ 10840-64 | ПХ-1М |
Биологическую эффективность фунгицидов рассчитывают в основном по двум показателям: распространенности болезни и интенсивности ее развития (степени поражения).
Распространенность болезни Р (%) рассчитывают по формуле:
Р = n / N • 100,
где n – количество растений в пробе с признаками заболеваний;
N – общее число проанализированных растений в пробе.
В отношении распространенности болезни в сравнении с контролем биологическую эффективность фунгицида (%) рассчитывают по модифицированной формуле Аббота:
С = 100 • (Р – р) / Р,
где Р и р – распространенность болезни, соответственно, в контроле и опытном варианте.
Интенсивность развития болезни (степень поражения растений болезнью) оценивается в процентах или баллах. Наиболее распространена следующая шкала степени пораженности:
0 – отсутствие признаков заболевания;
1 – поражено до 10 % поверхности растения или его отдельных органов;
2 – поражено 11 – 25 % поверхности растения или его отдельных органов;
3 – более 50 % поверхности растения или его отдельных органов получили поражения.
Развитие болезни R (%), отражающее среднюю степень поражения территории или поля, рассчитывают по формуле:
R = 100 • Σ (nb) / NK,
где n – количество пораженных растений;
b – соответствующий балл их поражения;
N – общее количество растений в пробе,
K – высший балл шкалы учета.
Биологическую активность фунгицидов с учетом развития степени болезни в опытном варианте и контроле также рассчитывают по модифицированной формуле Аббота.
Метеорологические условия 2019-2020 сельскохозяйственного года представлены в таблице 26. Анализ хода среднесуточных температур позволяет заключить, что теплообеспеченность зерновых культур была достаточной и соответствовала биологии озимой пшеницы и ярового ячменя.
Таблица 26. Метеорологические условия в период развития озимой пшеницы и ярового ячменя 2019-2020 гг.
(данные по г. Орел http://www.pogodaiklimat.ru/monitor)
| Месяц | Фактическая среднесуточная температура, оС | Норма среднесуточной температуры, оС | Выпало осадков, мм | Норма осадков, мм |
| Сентябрь | 12,8 | 12,1 | 43 | 61 |
| Октябрь | 9,1 | 6,1 | 32 | 55 |
| Ноябрь | 1,8 | -0,8 | 38 | 43 |
| Декабрь | 0,3 | -5,1 | 30 | 43 |
| Январь | -0,5 | -6,3 | 35 | 43 |
| Февраль | -0,7 | -6,7 | 54 | 38 |
| Март | 4,4 | -1,3 | 22 | 34 |
| Апрель | 6,3 | 7,2 | 18 | 43 |
| Май | 11,2 | 13,9 | 74 | 42 |
| Июнь | 20,0 | 17,5 | 75 | 69 |
| Июль | 19,2 | 19,3 | 122 | 76 |
| За вегетацию | — | — | 543 | 547 |
В течение всего вегетационного периода среднесуточная температура была выше нормы. Суммарное количество выпавших осадков за вегетационный период озимой пшеницы соответствовало норме, но распределение их было неравномерным. В осенний период 2019 года и в марте-апреле 2020 г. осадков было недостаточно, а в мае и, особенно, в июле, выпало осадков значительно больше нормы. Так, в июле сумма осадков составила 162% от нормы, что представляло определенные трудности при уборке урожая.
4.2. Результаты исследований на посевах озимой пшеницы
Даты наступления основных фаз вегетации озимой пшеницы представлены в таблице 27. Вегетационный период составил 302 дня. Развитие культуры проходило в соответствии с её биологическими особенностями и обеспеченностью теплом и влагой.
Таблица 27 — Даты наступления основных фаз вегетации озимой пшеницы
Московская 39
| № п/п | Фенологические наблюдения | Даты | Продолжительность межфазных периодов, дни |
|---|---|---|---|
| 1 | Посев — полные всходы | 28.09.2019 | 18 |
| 2 | Начало кущения | 12.10.2019 | 14 |
| Кущение – возобновление весенней вегетации | 15.04.2020 | 186 | |
| Выход в трубку-начало колошения | 04.05.2020 | 19 | |
| Полное колошение-цветение | 25.05.2020 | 21 | |
| Уборочная спелость | 26.07.2020 | 62 |
Анализ высоты растений показал, что к фазе начала выхода в трубку растения существенно различались по данному показателю (табл. 28).
Таблица 28 — Высота растений по фазам вегетации, см
| Вариант | Кущение | Начало выхода в трубку | Уборочная спелость | |
| Контроль | 22,2 | 45,2 | 92,4 | |
| Азорро | 22,2 | 48,6 | 96,2 | |
| Триада | 22,2 | 49,0 | 97,4 | |
| Азорро+Триада | 22,2 | 51,0 | 98,6 | |
| НСР05 | — | 2,8 | 3,2 | |
К фазе уборочной спелости разница по высоте растений в зависимости от способа защиты от грибных болезней сохранилась. На контрольном варианте растения были ниже на 5,8-6,2 см по сравнению с вариантом с обработкой суммой фунгицидов Азорро +Триада.
Растения озимой пшеницы различались и по динамике накопления воздушно-сухого вещества в зависимости от обработок фунгицидами (табл. 29). В фазу кущения масса воздушно-сухого вещества составила 2,05-2,08 г, т.е. практически не различалась по вариантам опыта. В фазу начала выхода в трубку выявлено существенное различие по данному показателю между обработанными вариантами и контрольным. На опытных вариантах масса воздушно-сухого вещества составила 5,9-6,6 г., на контрольном – 4,8 г. Прибавка массы воздушно-сухого вещества в связи с обработкой фунгицидами составила 22,9-33,5%.
Таблица 29 – Динамика массы воздушно-сухого вещества растений озимой пшеницы в зависимости от обработок фунгицидами
| Вариант опыта | Средняя масса растений, г | |||
| Кущение | Начало выхода в трубку | Уборочная спелость | Прибавка к контролю, % | |
| Контроль | 2,05 | 4,8 | 11,7 | — |
| Азорро | 2,07 | 5,9 | 12,5 | 11,6 |
| Триада | 2,06 | 6,2 | 13,1 | 17,0 |
| Азорро+Триада | 2,08 | 6,6 | 13,5 | 20,5 |
| НСР05 | — | 0,43 | 0,67 | — |
В фазу уборочной спелости на контрольном варианте средняя масса растений составила 11,7 г. Прибавка к контролю на опытных вариантах составила 11,6-20,5%. Выявлена несущественная разница по изучаемому признаку между обработкой посевов Триадой и смесью Азорро и Триады. В целом анализ полученных результатов показывает, что растения озимой пшеницы на ранних фазах развития (начало выхода в трубку) более отзывчивы на защитные мероприятия, что выражается в большем накоплении сухой массы по сравнению с фазой уборочной спелости.
В наших исследованиях зимостойкость озимой пшеницы составила 4 балла (табл. 30). Засухоустойчивость растений — сложное свойство, зависящее от целого комплекса защитно-приспособительных механизмов. Поэтому для надежной и объективной оценки использовали метод определения индекса комплексной устойчивости прорастания семян.
Таблица 30- Показатели устойчивости озимой пшеницы к факторам среды
| № п/п | Вариант | Устойчивость (балл) к | Зимостойкость, балл | ||
| полеганию | Осыпанию | засухе | |||
| 1 | Контроль | 5 | 5 | 4 | 4 |
| 2 | Азорро | 5 | 5 | 4 | 4 |
| 3 | Триада | 5 | 5 | 4 | 4 |
| 4 | Азорро+Триада | 5 | 5 | 4 | 4 |
Отмечена гибель растений озимой пшеницы в поздневесенний – летний период от засушливых условий вегетации, когда выпало малое количество осадков, поэтому степень устойчивости к засухе 4 балла.
Высота растений озимой пшеницы Московская 39 в среднем составила 97 см. Устойчивость растений к полеганию связана с физико-механическими особенностями, физиологическими процессами, происходящими в период формирования стебля озимой пшеницы. Полегшая пшеница значительно снижает урожай, ухудшается качество зерна. Сорта, устойчивые к полеганию, легче переносят избыточное увлажнение и другие неблагоприятные условия, влияющие на полегаемость. В наших исследованиях сорт озимой пшеницы Московская 39 показал наивысший балл (5) по устойчивости к полеганию.
Склонность сортов к осыпаемости наблюдают и отмечают с начала созревания путем осмотра растений. Разница в устойчивости сортов особенно проявляется, когда в период созревания дождливая погода чередуется с жаркой и ветреной. В наших исследованиях озимая пшеница показала наивысший балл (5) по устойчивости к осыпанию.
Устойчивость растений — это разная степень проявления иммунитета. Она может возникать как под влиянием паразита, так и в результате деятельности человека. Степень повреждения наиболее распространенными грибными болезнями озимой пшеницы в фазу колошение-начало цветения показана в таблице 31.
На контрольном варианте без обработок фунгицидами отмечена средняя степень поражения растений мучнистой росой и бурой ржавчиной – 2,3 и 2,5 балла соответственно. На опытных вариантах степень повреждения грибными болезнями значительно снизилась. Так, на варианте с обработкой фунгицидами Азорро+Триада степень повреждения септориозом снизилась в 5 раз, бурой ржавчиной – в 3,6 раза и мучнистой росой – в 4,6 раз.
Таблица 31 — Степень повреждения грибными болезнями озимой пшеницы в фазу колошение-начало цветения, балл
| Вариант | Септориоз | Бурая ржавчина | Мучнистая роса |
| Контроль | 1,5 | 2,5 | 2,3 |
| Азорро | 0,7 | 1,3 | 1,0 |
| Триада | 0,5 | 1,0 | 0,7 |
| Азорро+Триада | 0,3 | 0,7 | 0,5 |
| НСР05 | 0,33 | 0,32 | 0,44 |
Распространенность болезней снизилась с 85% на контрольном варианте до 12-19% на опытных вариантах. Биологическая эффективность фунгицидов составила 77,6-85,9%. Двукратная обработка посевов фунгицидом Триада и смесью препаратов более эффективна по сравнению и использованием фунгицида Азорро. Разница между двумя последними вариантами статистически не подтвердилась (табл. 32).
Таблица 32 — Биологическая эффективность фунгицидов против грибных болезней (септориоз, мучнистая роса, ржавчина) озимой пшеницы
| Вариант опыта | Распространенность болезни, % | Биологическая эффективность |
| Контроль | 85 | — |
| Азорро | 19 | 77,6 |
| Триада | 14 | 83,5 |
| Азорро+Триада | 12 | 85,9 |
| НСР05 | 4,6 | — |
Таким образом, проведение защитных мероприятий от наиболее распространенных грибных болезней озимой пшеницы в фазу кущения-начала выхода в трубку и фазу флагового листа позволило значительно улучшить фитосанитарное состояние посевов и в последующие фазы развития. Это положительно отразилось на формировании репродуктивных органов и урожайности культуры, поскольку флаговый лист обеспечивает поступление до 43% ассимилятов в зерновку озимой пшеницы.
Урожайность озимой пшеницы — это количество зерна, полученного с одного гектара в результате жизнедеятельности определенной совокупности растений, которая состоит в усвоении питательных веществ и воды из грунта и синтеза органических веществ под действием солнечной энергии. Урожайность и качество зерна являются интегральными показателями, характеризующими сорт и технологию возделывания.
Согласно полученным экспериментальным данным наибольшая урожайность зерна озимой пшеницы была получена при двукратной обработке посевов фунгицидом Триада – 48,62 ц/га и смесью фунгицидов – 48,16 ц/га (табл. 33). Прибавка к контролю составила 3,99 и 3,53 ц/га или 8,9 и 7,9% соответственно.
Таблица 33 — Урожайность озимой пшеницы, ц/га
| Вариант | Урожайность, ц/га | Прибавка к контролю | ||
| ц/га | % | |||
| Контроль | 44,63 | — | — | |
| Азорро | 47,24 | 2,61 | 5,8 | |
| Триада | 48,62 | 3,99 | 8,9 | |
| Азорро+Триада | 48,16 | 3,53 | 7,9 | |
| НСР05 | 1,16 | — | — | |
Анализируя структурные показатели урожая озимой пшеницы, можно сделать вывод, что урожайность находится в определенной зависимости от продуктивной кустистости и массы 1000 семян.
Интенсивность кущения зависит от условий произрастания, видовых и сортовых особенностей зерновых культур. При благоприятных условиях (оптимальной температуре и влажности почвы) период кущения растягивается, а число побегов увеличивается. Достаточно высокая продуктивная кустистость (от 2,1 до 2,5 плодоносящих стеблей на одно растение) способствовала получению хорошего урожая в условиях достаточного увлажнения начала вегетации 2019 года (табл. 34). Масса 1000 зерен характеризует величину зерна, его крупность.
Таблица 34 — Хозяйственно-биологическая характеристика озимой пшеницы
| Вариант | Продуктивная кустистость, шт. | Масса 1000 зерен, г |
| Контроль | 2,1 | 40,08 |
| Азорро | 2,3 | 41,84 |
| Триада | 2,4 | 42,15 |
| Азорро+Триада | 2,4 | 42,22 |
| НСР05 | 0,12 | 0,96 |
Чем крупнее зерно, тем больше масса 1000 зерен. При равном размере большая масса 1000 зерен свидетельствует о большем запасе в них питательных веществ.
В нашем опыте масса 1000 зерен была высокой и составила 40,08-42,22 г.
Ценность зерна определяется его качеством, оцениваемым по многим показателям. Очень важным показателем качества зерна, определяющим его технологические свойства, является содержание белка. На вариантах с использованием фунгицидов содержание сырого протеина отмечено на уровне 15,8-16,6% (табл. 35).
Таблица 35 — Характеристика качества зерна озимой пшеницы
| Вариант | Содержание сырой клейковины в зерне, % | ИДК, усл. ед | Сырой протеин, % | Натура зерна, г/л |
| Контроль | 29,2 | 83 | 15,8 | 824 |
| Азорро | 30,4 | 86 | 16,3 | 835 |
| Триада | 30,6 | 88 | 16,6 | 841 |
| Азорро+Триада | 30,5 | 88 | 16,4 | 840 |
| НСР05 | 0,87 | — | 0,38 | 5,7 |
Вторым важным биохимическим показателем является содержание клейковины. Она обусловливает способность теста удерживать бродильный углекислый газ. На опытных вариантах содержание сырой клейковины в зерне составило 30,4-30,6%, что на 4,1-4,8% больше, чем на контроле.
Качество клейковины, так же как и ее количество, имеет очень большое значение. Оно обусловлено соотношением целого ряда свойств: упругостью, эластичностью, растяжимостью, вязкостью, связностью, а также цветом клейковины. Показатели ИДК не превышали 100 единиц, и качество клейковины соответствовало 2-й группе — удовлетворительная, слабая.
Натура зерна на контрольном варианте составила 824 г. На опытных вариантах этот показатель увеличился на 11-16 г.
Сельское хозяйство, как и всякое другое производство, направлено в конечном итоге на получение прибыли. Исходя из этого, все предлагаемые изменения в технологиях получения продукции растениеводства должны быть экономически обоснованы. Результаты расчетов представлены в таблице 36.
Таблица 36 — Экономическая оценка возделывания озимой пшеницы Московская 39
| Показатели | Контроль без обработок | Триада, двукратная обработка | |
| Площадь, га | 1 | 1 | |
| Урожайность, т/га | 4,463 | 4,862 | |
| Прибавка урожайности, ц/га | х | +3,99 | |
| Стоимость продукции, руб. | 44630 | 55913 | |
| Производственные затраты, руб. | 27789 | 30945 | |
| Себестоимость 1 т основной продукции, руб. | 6226,5 | 6364,7 | |
| Чистый доход (убыток), руб. | 16841 | 24968 | |
| Рентабельность (убыточность), % | 60,6 | 80,68 |
Таким образом, в ходе исследований было выявлено, что двукратная обработка посевов озимой пшеницы сорта Московская 39 фунгицидом Триада способствует повышению урожайности и качества зерна, что в свою очередь увеличивает чистый доход на 48,3%.
4.3.Результаты исследований на посевах ярового ячменя
Яровой ячмень менее требователен к температурному режиму воздуха и почвы, поэтому его можно сеять рано. Мы произвели посев 7 мая, уборку 3 августа. Вегетационный период составил 89 дней. Определение биометрических параметров ячменя показало, что в фазу выхода в трубку высота растений по вариантам составила 51,5-58,7 см (табл. 37). Прибавка на лучшем варианте с фунгицидом Триада составила 14% по сравнению с контролем. При использовании фунгицида Азорро высота растений увеличилась на 9,5%. И на варианте с совместным применением Азорро и Триады — на 11,7%. Это свидетельствует об эффективности фунгицидов на ранних фазах развития ячменя.
Таблица 37 — Биометрические параметры растений по основным фазам
развития ярового ячменя
| Варианты опыта | Высота растений, см | Сырая масса одного растения, г | Сухая масса одного растения, г |
| Фаза выход в трубку | |||
| Контроль | 51,5 | 1,67 | 0,53 |
| Азорро | 56,4 | 1,77 | 0,58 |
| Триада | 58,7 | 1,87 | 0,63 |
| Азорро+Триада | 57,5 | 1,82 | 0,61 |
| Фаза колошение-цветение | |||
| Контроль | 72,4 | 3,20 | 0,82 |
| Азорро | 75,2 | 3,75 | 0,91 |
| Триада | 79,0 | 4,18 | 0,95 |
| Азорро+Триада | 78,9 | 4,15 | 0,94 |
Сырая масса одного растения на контроле составила 1,67 г, на опытных вариантах отмечена прибавка на 6,0-12,0%. Сухая масса одного растения на контроле составила 0,53 г. На опытных вариантах – на 9,4-18,9% больше.
В фазу колошение-цветение сохранилась намеченная тенденция. Высотта растений по сравнению с контролем увеличилась на 3,9-9,1%, сырая масса одного растения – на 17,2-30,6%, сухая масса одного растения – на 11,0-14,4%.
Нами были проанализированы посевные качества семян, полевая всхожесть и сохранность растений к уборке. Результаты приведены в таблице 38. Энергию прорастания семян определяли как отношение количества зерен, проросших за 72 ч, к общему количеству анализируемых зерен, выраженное в процентах. Способность прорастания определяли аналогично через 120 часов (5 суток).
Таблица 38 — Показатели посевных качеств семян ячменя и сохранившиеся к уборке растения
| Вариант | Энергия прорастания, % | Способность прорастания, % | Полевая всхожесть, % | Сохранившиеся к уборке растения, % |
| Контроль | 28,8 | 94,8 | 88,4 | 78,8 |
| Азорро | 91,9 | |||
| Триада | 94,8 | |||
| Азорро+Триада | 92,6 | |||
| НСР05 | — | — | 6,8 |
Анализ результатов показал, что семена соответствуют требованиям ГОСТ 10469-76 к качеству посевного материала. Энергия прорастания составила 28,8%, способность прорастания – 94,8%, полевая всхожесть – 88,4%. На контрольном варианте к уборке сохранилось 78,8%. Это обусловлено в большей степени гибелью растений от темно-бурой пятнистости и корневых гнилей. На вариантах с обработкой фунгицидами сохранность составила 91,9-94,8%. В нашем опыте на посевах ячменя отмечены следующие грибные болезни: септориоз, темно-бурая пятнистость, мучнистая роса, пыльная головня и корневые гнили.
Мучнистая роса проявляется в виде белого, сперва паутинистого, а затем мучнистого налета, на котором образуются черные подушечки — клейстотеции. Возбудитель болезни — сумчатый гриб Erysiphe graminis DC. f. hordei Em. Marchal. С помощью конидий гриб распространяется в период вегетации растений. Зимует гриб в виде клейстотециев на пораженных остатках растений. Растения заражаются весной от сумкоспор при температуре 0-20°C и относительной влажности воздуха 50-100%. Инкубационный период болезни длится от 3 до 11 дней. При температуре выше 30°C развитие мучнистой росы прекращается.
Темно-бурая пятнистость распространена повсеместно. Поражаются всходы, а также взрослые растения ячменя. У пораженных всходов часто образуется один корешок вместо трех. На корешках, колеоптиле и первых листьях появляются продольные темные пятна в виде штрихов и полосочек, ростки искривляются и гибнут.
Септориоз проявляется обычно в середине вегетации растений в виде белеющих и засыхающих пятен, на которых образуются пикниды. При повышенной влажности болезнь может быть причиной усыхания большого числа листьев, что вызывает недобор урожая зерна.На ячмене известно два возбудителя — септориоза — Septoria hordei Jacz. И Septoria nodorum Berk. Сохраняются грибы на остатках пораженных растений в форме пикнид. Устойчивых сортов нет.
Пыльная головня распространена повсеместно. Проявляется в период колошения. В пораженном растении все части колоса, кроме стержня, превращаются в оливково-коричневую массу распыляющихся телиоспор. У выхода из влагалища листа пораженный колос вначале прикрыт тонкой прозрачной пленкой, сквозь которую хорошо заметна споровая масса. Затем пленка быстро растрескивается, и споры распыляются в окружающее пространство. Возбудитель болезни — базидиальный гриб Ustilago nuda Kell. et Swing. Растения заражаются во время цветения. Телиоспоры, попадая на рыльце цветков, прорастают и образуют грибницу, которая проникает в завязь. Зараженное зерно внешне почти не отличается от здорового. При прорастании зерна начинает расти и грибница. Она проникает в точку роста, распространяется по всему растению, а при формировании колоса усиленно разрастается, превращает его в споровую массу, которая образуется вследствие распадения грибницы на шаровидные кусочки. В настоящее время идентифицировано 8 физиологических рас Ustilago nuda с различной вирулентностью к сортам ячменя. Вредоносность пыльной головни очень велика. Кроме явного недобора урожая возможны и скрытые потери вследствие того, что в больном колосе образуется меньше зерен, и часть пораженных растений погибает еще в период всходов.
В нашем опыте степень повреждения растений ячменя септориозом на контрольном варианте составила 1,5 балла, мучнистой росой – 2,0 балла. На 2,6-2,8 балла отмечены повреждения темно-бурой пятнистостью и пыльной головнёй. Максимально (3,5 балла) растения были повреждены корневыми гнилями (Рис. 33).
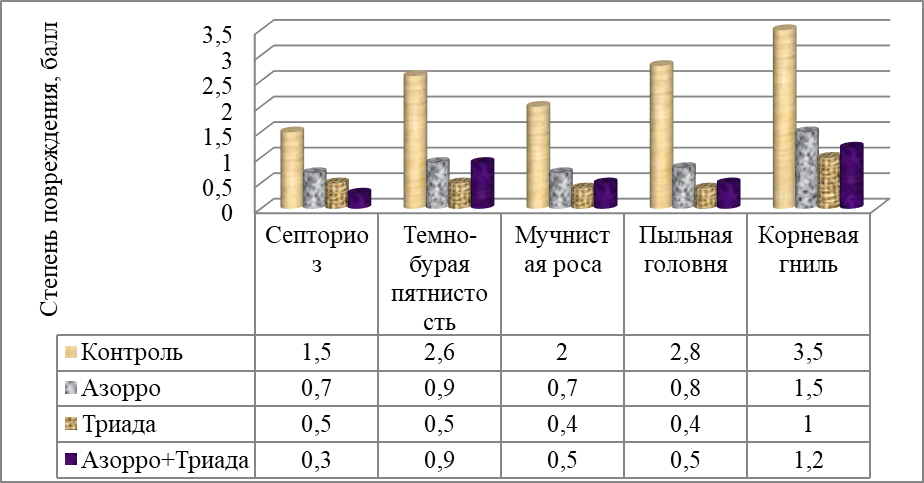
Рисунок 33 — Степень повреждения грибными болезнями ярового ячменя в фазу колошение-начало цветения, балл
Использование фунгицидов значительно снизило степень повреждения ячменя септориозом, темно-бурой пятнистостью, мучнистой росой и пыльной головнёй — до 0,3-0,9 балла. Эффективность фунгицидов против корневых гнилей несколько ниже, поскольку они в большей степени влияют на листостебельные инфекции. Степень повреждения растений корневыми гнилями на опытных вариантах составила 1,0-1,5 балла. Разница между вариантами с обработкой растений Триадой и Азорро+Триада статистически не доказана. Незначительно уступает по эффективности фунгицид Азорро в отношении темно-бурой пятнистости и пыльной головни вариантам с использованием Триады, что объясняется наличием в последней трех действующих веществ.
Наибольшее распространение на растениях ячменя выявлено по темно-бурой пятнистости и корневым гнилям (табл. 39). На контрольном варианте распространенность темно-бурой пятнистости составила 89,6%, корневых гнилей 59,4%.
Таблица 39 — Распространенность грибных болезней на ячмене после двукратного применения фунгицидов
| Вариант | Темно-бурая пятнистость, % | Биологическая эффективность, % | Корневые гнили, % | Биологическая эффективность, % |
| Контроль | 89,6 | — | 59,4 | — |
| Азорро | 18,0 | 79,9 | 44,4 | 25,3 |
| Триада | 10,4 | 88,4 | 39,6 | 33,3 |
| Азорро+Триада | 12,8 | 85,7 | 42,0 | 29,3 |
| НСР05 | 5,4 | — | 5,1 | — |
Биологическая эффективность фунгицидных обработок против темно-бурой пятнистости составила 79,9-88,4%. Против корневых гнилей — 25,3-33,3%, что подтверждает необходимость протравливания семян, поскольку заражение происходит, в основном, в момент их прорастания. В последующие фазы развития растений фунгициды в большей степени воздействуют на листья и стебли. Максимальная биологическая эффективность выявлена на варианте с двукратной обработкой фунгицидом Триада — 88,4%.
Структура урожая ярового ячменя представлена в таблице 40.
Общая кустистость составила 2,3-2,5 шт., продуктивная была ниже на 21,8% на контроле и 8,7% на лучших вариантах – Триада и Азорро+Триада. Длина колоса варьировала в пределах 5,2-5,6 см, число колосков – от 15,5 до 16,0 шт., число зерен в колосе – от 14,4 до 15,9 шт. На опытных вариантах масса зерна существенно превышала данный показатель контрольного варианта. Также выявлено, что при двукратной обработке фунгицидом Азорро масса зерна с колоса ниже по сравнению с двумя другими вариантами.
Таблица 40 — Структура урожая ярового ячменя Грейс
| Вариант | Кустистость, шт. | Колос | ||||
| Общая | Продуктивная | Длина, см | Колосков, шт. | Зерен, шт. | Масса зерна, г | |
| Контроль | 2,3 | 1,8 | 5,2 | 15,5 | 14,4 | 0,70 |
| Азорро | 2,4 | 2,1 | 5,4 | 15,8 | 15,2 | 0,75 |
| Триада | 2,5 | 2,3 | 5,6 | 16,0 | 15,9 | 0,79 |
| Азорро+Триада | 2,5 | 2,3 | 5,6 | 15,9 | 15,8 | 0,78 |
| НСР05 | — | — | — | — | — | 0,021 |
Урожайность ячменя определяется продуктивным стеблестоем и массой зерна с колоса. На контрольном варианте урожайность составила 28,18 ц/га. Прибавка на опытных вариантах варьировала в пределах 3,01-5,09 ц/га, что соответствует 10,7-19,6%. Максимальная урожайность получена при двукратной обработке посевов фунгицидом Триада (табл. 41).
Таблица 41 — Урожайность ярового ячменя
| Вариант | Продуктивный стеблестой, шт. | Урожайность, ц/га | Прибавка, ц/га | Прибавка, % |
| Контроль | 402,6 | 28,18 | — | |
| Азорро | 415,8 | 31,19 | 3,01 | 10,7 |
| Триада | 421,2 | 33,27 | 5,09 | 19,6 |
| Азорро+Триада | 418,4 | 32,64 | 4,46 | 15,8 |
| НСР05 | 2,14 | — | — |
Научный интерес представляет также изучение влияния фунгицидов на крупяные качества зерна ячменя (табл. 42). Натура зерна на контрольном варианте составила 612,2 г. На опытных вариантах данный показатель увеличился на 4,4-6,0%. Масса 1000 зерен по сравнению с контролем увеличилась на 5,7-12,6%. Выравненность зерна при проходе на ситах 2,8 и 2,5 мм на опытных вариантах выше и составила в сумме 96-98%. На контроле – 86%.
Таблица 42 — Крупяные качества зерна ярового ячменя Грейс
| Вариант | Натура, г | Масса 1000 зерен, г | Стекловидность, % | Выравненность, % при проходе на ситах 2,8 мм | Выравненность, % при проходе на ситах 2,5 мм |
| Контроль | 612,2 | 43,6 | 39,5 | 59 | 27 |
| Азорро | 639,2 | 46,1 | 40,0 | 64 | 32 |
| Триада | 649,0 | 49,1 | 40,5 | 67 | 30 |
| Азорро+Триада | 643,4 | 48,4 | 40,1 | 65 | 33 |
Стекловидность характеризует качество эндосперма. В нашем опыте стекловидность по вариантам была практически одинаковой и составила 39,5-40,5%.
К основным показателям качества зерна можно отнести содержание белка, крахмала и экстрактивность. Экстрактивность – это количество сухих веществ солода, которое может быть использовано при производстве пива. Содержание белка в зерне на контроле составило 11,0% (табл. 43). На опытных вариантах несколько ниже – 10,1-10,5%. Это можно объяснить тем, что пластические вещества в большей мере были израсходованы растениями на формирование прибавки урожая.
Таблица 43 – Биохимические качества зерна ярового ячменя
| Вариант | Белок, % | Крахмал, % | Экстрактивность, % |
| Контроль | 11,0 | 63,7 | 78,4 |
| Азорро | 10,1 | 64,3 | 80,8 |
| Триада | 10,5 | 64,2 | 81,3 |
| Азорро+Триада | 10,3 | 64,5 | 80,6 |
Содержание крахмала составило 63,7% на контроле и 64,2-64,5% на вариантах с использованием фунгицидов. Экстрактивность достаточно высокая — 78,4-81,3%, что отвечает требованиям пивоваренного ячменя.
Расчет экономической эффективности возделывания ячменя с двукратным использованием фунгицида Триада показал, что прибавка урожайности составила 0,52 т/га (табл. 44).
По ряду показателей качество зерна выше по сравнению с контрольным вариантом. Поэтому цена реализации на 1 тыс. рублей больше. Стоимость продукции на опытных вариантах увеличилась на 28,4%. При этом производственные затраты выросли на 23,3%, что связано с закупкой фунгицида, обработкой посевов и уборкой дополнительного урожая. Чистый доход от реализации зерна увеличился на 40,1%. Рентабельность производства составила 49%, что на 5,9% больше по сравнению с контрольным вариантом.
Таблица 44 – Экономическая оценка возделывания ярового ячменя Грейс
| Показатели | Контроль без обработок | Триада, двукратная обработка | |
| Площадь, га | 1 | 1 | |
| Урожайность, т/га | 2,81 | 3,33 | |
| Прибавка урожайности, т/га | х | +0,52 | |
| Цена реализации за 1 т | 12000 | 13000 | |
| Стоимость продукции, руб. | 33720 | 43290 | |
| Производственные затраты, руб. | 23561 | 29054 | |
| Себестоимость 1 т основной продукции, руб. | 8384,7 | 8804,2 | |
| Чистый доход (убыток), руб. | 10159 | 14236 | |
| Рентабельность (убыточность), % | 43,12 | 49,00 |
Таким образом, двукратная обработка посевов ярового ячменя сорта Грейс фунгицидом Триада способствует повышению урожайности и качества зерна, что в свою очередь увеличивает чистый доход на 40,1%.
Поскольку стоимость фунгицида Азорро почти в 2 раза ниже, а эффективность на варианте Азорро+Триада такая же, как и на варианте с двукратной обработкой Триадой, то целесообразно использовать в фазу кущение-начало выхода в трубку фунгицид Азорро и в фазу флагового листа фунгицид Триада.
4.4. Полевые испытания влияния нового комбинированного средства защиты растений на яровом ячмене и горохе в условиях мелкоделяночного опыта
Работа проводилась в условиях Научно-образовательного производственного центра (НОПЦ) «Интеграция» ФГБОУ ВО Орловского ГАУ. Мелкоделяночный опыт заложен на делянках размером 1 м2 в четырехкратной повторности на яровом ячмене сорта Раушан.
Биологически активными препаратами для растениеводства называют биоудобрения, биостимуляторы, биорегуляторы. Они повышают эффективность питания сельскохозяйственных растений, устойчивость к абиотическим стрессам, качество урожая, независимо от содержания питательных веществ.
Для повышения урожайности и устойчивости сельскохозяйственных культур, в частности ячменя, к заболеваниям все большее внимание уделяется в настоящее время биологически активным препаратам, обладающим одновременно ростстимулирующим, фунгицидным и иммуноиндуцирующим действиями.
Например, применение биостимуляторов роста и развития растений «Вермисол» и «Агровит» на яровом ячмене, включающих в своем составе вермикомпост, споры полезных микроорганизмов, а также минеральные элементы, приводит к увеличению всхожести семян, количества белка в зерне и биологической урожайности.
Результаты исследований влияния биологически активных веществ нового поколения в составе биопрепаратов «Экстрасол», «Био-дон» и «Изабион» в смеси с химическим пестицидом «Винцит» при снижении его дозы на 25% на урожайность ячменя в условиях сухостепной зоны Нижнего Поволжья также оказали положительное действие не только на урожайные данные культуры, но и на снижение поражаемости корневыми гнилями.
Среди регуляторов роста и биопрепаратов, применяемых на ячмене, в России зарегистрированы «Агат-25К30» на основе 3-индолилуксусной кислоты, «АгроСтимул8», «Агропон С», «Биодукс», «Эмистим», «Глиокладин» (Trichoderma harzianum, штамм 18 ВИЗР).
Известно, что яровой ячмень очень чувствителен к воздействию гербицидов и других химических средств защиты и одним из путей преодоления этого негативного воздействия является совместное их применение с биологическими средствами защиты (антидотами), например, «Гуми-М», «Рифтал» и др.
Многие регуляторы роста растений нового поколения обладают антистрессовым эффектом при использовании для предпосевной обработки семян и опрыскивания вегетирующих растений, переключая обмен веществ растений в сторону повышения устойчивости к биотическим и абиотическим факторам. В частности, к таким препаратам относятся «Эмистим» и «Эпибрассинолид», которые применяют совместно с химическими фунгицидами «Приемис» и «Винцит».
«Вигор Форте», широко применяемый препарат на яровом ячмене можно отнести к регуляторам роста. Он повышает полевую всхожесть, усиливает ростовые и формообразовательные процессы, устойчивость к неблагоприятным факторам среды и урожайность. Его влияние на фотосинтетическую продуктивность, антиоксидантную систему и урожайные данные в сравнении с биологическим средством с рабочим названием «Нигор» (патент РФ №2463759) показал, что регуляторы роста и биопрепараты являются экономически эффективными средствами в технологии выращивания ярового ячменя.
Учитывая несомненную перспективность биологически активных препаратов в защите ячменя от инфекции, необходимы исследования по влиянию микробных компонентов почвенного гриба – антагониста возбудителей корневой гнили – Trichoderma spp. для повышения урожайности и устойчивости культуры. Экзометаболиты грибов рода Trichoderma spp. являются потенциальными биохимическими агентами в агротехнологиях, ранее нами было показана эффективность их применения для оздоровления овощных культур и гороха от фитопатогенной инфекции, а также их влияние на посевные качества семян.
Исходя из вышеизложенного, целью исследования являлось изучение влияния биоудобрения «Эликсир Урожая» и нового биостимулятора «Нигор» с экзометаболитами Trichoderma atrobrunneum ВКПМ F-1434» в сравнении с химическим пестицидом «Скарлет» на полевую всхожесть семян, рост, развитие и урожайные данные ярового ячменя сорта Раушан.
Условия, материалы и методы. Работа проводилась в условиях Научно-образовательного производственного центра (НОПЦ) «Интеграция» и ЦКП «Орловский региональный центр сельскохозяйственной биотехнологии» ФГБОУ ВО Орловского ГАУ в 2020 году. Мелкоделяночный опыт заложен на делянках размером 1 м2 в четырехкратной повторности на яровом ячмене сорта
Агрохимическая характеристика почвы под яровым ячменем: P2O5 (по Мачигину ГОСТ 26205-91) 104 мг/кг, К2О (по Мачигину ГОСТ 26205-91) 135 мг/кг, pH 5,5 (ГОСТ 26483-85); гумус по методу Тюрина в модификации ЦИНАО (ГОСТ 26213-91) 4,09.
Вариантами опыта служили: 1. контроль — без обработки биопрепаратами (замачивание в воде); 2. химический пестицид «Скарлет», 3. биоудобрение «Эликсир Урожая» (Тимирязевъ, Россия); 4. Новый биостимулятор «Нигор» (патент РФ №2463759)+ экзометаболиты Trichoderma atrobrunneum ВКПМ F-1434; 5. новый комплексный биостимулятор — «Нигор+ экзометаболиты Trichoderma atrobrunneum ВКПМ F-1434 + Эликсир Урожая» в соотношении компонентов 1:1.
Защитно-стимулирующее биологическое средство – новый биостимулятор «Нигор+экзометаболиты Trichoderma atrobrunneum ВКПМ F-1434» имеет состав: биофлавоноиды гречихи, салициловая кислота, источник магния, с добавлением экзометаболитов штамма Trichoderma atrobrunneum ВКПМ F-1434 из учебной коллекции кафедры биотехнологии ФГБОУ ВО Орловский ГАУ, полученных по оригинальной методике (Гнеушева, Лушников, 2019) в подобранных концентрациях.
В составе биоудобрения «Эликсир Урожая» (Тимирязевъ, Россия) (исследование влияния это препарата на рост и развитие ярового ячменя проводилось впервые) содержатся биогумус, комплекс почвенных микроорганизмов, включая бактерии рода Bacillus, Azotobacter, Pseudomonas, а также пептиды, поли- и олигосахариды, регуляторы роста микробного происхождения, витамины, L-аминокислоты, макро- (NPK) и микроэлементы в сбалансированном соотношении, комплекс гуминовых солей и кислот.
Предпосевная обработка семян ярового ячменя проводилась путем замачивания в растворах исследуемых препаратов: «Скарлет» 0.3 мл/1 м2, «Нигор+ экзометаболиты Trichoderma atrobrunneum ВКПМ F-1434» 1 мл/ 10-4%, «Эликсир Урожая» 0.2 мл/м2, «Нигор+ экзометаболиты Trichoderma atrobrunneum ВКПМ F-1434+ Эликсир Урожая (1:1) 1 мл/ 10-4%.
Опрыскивание растений ячменя в период вегетации осуществлялось вышеуказанными растворами в фазу колошения. В течение вегетации проводились фенологические наблюдения за всхожестью, ростом и развитием растений. Статистическую обработку результатов проводили с помощью пакета Microsoft Office 2010 (Excel). Для подтверждения достоверности полученных результатов все исследования проводили с десятикратным повторением.
4.4.1.Изучение влияния препаратов на яровом ячмене Раушан
Изучение энергии прорастания и всхожести семян ячменя, обработанного исследуемыми препаратами в полевых условиях, показало, что все опытные варианты по сравнению с контролем имеют более высокую всхожесть. Однако химический препарат менее эффективен, как по всхожести по сравнению с другими препаратами (+ 7 % у «Скарлет», +1.4% у «Эликсир Урожая» и «Нигор + экзометаболиты»), так и по энергии прорастания (-31% у «Скарлет», +10.2% «Эликсир Урожая» и +22.4% у «Нигор + экзометаболиты») (табл. 45).
Морфометрические показатели проростков ячменя, обработанных исследуемыми препаратами, на протяжении 14 суток, показывают явное преимущество по сравнению с контрольными растениями (табл. 46).
Таблица 45 — Показатели энергии прорастания ячменя (3-е сутки) и всхожести (7-е сутки)
| Варианты обработки | Показатели, % | |
| Энергия прорастания | Всхожесть | |
| 1 | 49±0,12 | 86±0,12 |
| 2 | 34±0,08 | 92±0,25 |
| 3 | 54±0,06 | 98±0,17 |
| 4 | 60±0,24 | 98±0,11 |
| 5 | 74±0,14 | 98±0,09 |
Таблица 46 — Морфометрические показатели ячменя на 3-е, 7-е, 10-е и 14-е сутки
| Варианты обработки | Сутки вегетации | |||
| 3 | 7 | 10 | 14 | |
| Длина проростка, мм | ||||
| 1 | 0 | 48,9±0,11 | 60,21±0,32 | 74,9±0,36 |
| 2 | 0 | 53,1±0,21 | 77,00±0,24 | 87,2±0,14 |
| 3 | 0 | 63,5±0,60 | 100,01±0,25 | 105,2±0,84 |
| 4 | 0 | 48,0±0,04 | 69,6±0,35 | 95,6±0,54 |
| 5 | 0 | 68,0±0,14 | 106,6±0,32 | 109,3±0,05 |
| Длина корешка, мм | ||||
| 1 | 10,71±0,64 | 67,00±0,08 | 80,00±0,08 | 65,41±0,36 |
| 2 | 8,73±0,51 | 70,01±0,54 | 87,39±0,11 | 79,05±0,34 |
| 2 | 10,27±0,25 | 90,80±0,69 | 112,20±0,24 | 85,01±0,84 |
| 4 | 10,37±0,69 | 88,00±0,32 | 80,40±0,24 | 87,61±0,54 |
| 5 | 11,24±0,17 | 98,02±0,12 | 118,36±0,11 | 89,32±0,15 |
Наиболее существенное преимущество по воздействию на длину проростка имеют растения, обработанные биоудобрением «Эликсир Урожая» и новым комплексным биостимулятором. На 14-е сутки разница между ними по сравнению с контрольными составила соответственно 40,4 % и 45,9 %, в то время, как преимущество между химическим препаратом и контролем составило 16,4 %.
Преимущество длины корешков 14-дневных проростков ячменя между вариантами по сравнению с контролем составило: «Скарлет» +20.87%, «Эликсир Урожая» +29.98%, новый комплексный биостимулятор +36,5 %.
Мелкоделяночные опыты, заложенные в НОПЦ «Интеграция», убедительно показали эффективность действия нового комплексного биологического средства — биостимулятора перед химическим пестицидом и контрольными растениям. Прежде всего это отразилось на начальном росте ярового ячменя (до 14 суток вегетации) (рис.34).

Рисунок 34 — Влияние препаратов на развитие 14 -дневных проростков ячменя (15.05.2020 года): 1 — контроль; 2 — «Эликсир Урожая»; 3 – «Нигор+ экзометаболиты»; 4 – «Скарлет» ; 5 – новый комплексный биостимулятор
Все препараты сохранили свое преимущество перед контрольным вариантом и химическим пестицидом, но наиболее интересным оказался новый вариант при смешении двух препаратов: биоудобрения «Эликсир Урожая» и нового биостимулятора «Нигор+экзометаболиты». Разница с контрольными растениями была в 1,5 раза больше.
Преимущество перед контрольным вариантом сказалась и на урожайных данных (табл. 47).
Таблица 47 — Влияние препаратов на урожайные данные ячменя
| Варианты обработки | Число растений на 1 м2/шт | Число продуктивных стеблей на м2/шт | Коэффициент хозяйственной
эффективности % |
| 1 | 490±0,21 | 542±0,21 | 15±0,04 |
| 2 | 502±0,36 | 560±0,54 | 17±0,11 |
| 3 | 515±0,02 | 598±0,25 | 20±0,31 |
| 4 | 532±0,32 | 630±0,04 | 34±0,09 |
| 5 | 587±0,02 | 671±0,36 | 38±0,11 |
| НСР 05 | 10,8 | 11,8 | — |
Из данных таблицы 47 следует, что все изученные препараты оказали положительное действие на урожайные данные ярового ячменя. Прежде всего это сказалось на числе выживших растений. Их количество в поле под влиянием биоудобрения «Эликсир Урожая» возросло на 5.3%, под влиянием нового биостимулятора «Нигор+экзометаболиты» – на 8.6%, а под влиянием нового комплексного биостимулятора — на 19.8 %, в то время как при обработке семян химическим пестицидом «Скарлет», количество сохранившихся растений было на уровне контрольного варианта.
Число продуктивных стеблей на растениях под влиянием биоудобрения возросло на 10.3%, под влиянием биостимулятора – на 16.2%, а под влиянием нового комплексного биостимулятора – на 24%. Число продуктивных стеблей под влиянием химического препарат возросло всего на 3%.
Коэффициент хозяйственной эффективности возрос под влиянием биоудобрения на 5%, биостимулятора – на 9%, нового комплексного биостимулятора – на 13%. Под влиянием химического пестицида «Скарлет» хозяйственная эффективность возросла всего на 2%. Это произошло за счет увеличения массы 1000 семян, которая под влиянием биоудобрения возросла на 7.8%, биостимулятора — на 14.9%, нового комплексного биостимулятора – на 24.8%. В то время как применение химического препарат «Скарлет» увеличило вес 1000 семян всего на 3.0% (табл. 48).
Таблица 48 — Влияние препаратов на характеристику колосьев ярового ячменя
| Варианты обработки | Количество колосьев с 1 растения, шт | Вес 10 колосьев, г | Длина колоса, см | Кол-во зерен, шт | Масса 1000 семян, г | Сахара % |
| 1 | 3,02±0,12 | 7,01±0,09 | 5,0±0,06 | 14,0±0,06 | 33,2±0,13 | 6,21±0,28 |
| 2 | 4,20±0,09 | 9,99±0,21 | 6,0±0,09 | 16,3±0,11 | 35,8±0,25 | 6,83±0,15 |
| 3 | 4,70±0,21 | 11,99±0,17 | 7,5±0,10 | 18,4±0,26 | 38,2±0,36 | 7,58±0,18 |
| 4 | 3,03±0,22 | 8,99±0,14 | 6,0±0,21 | 14,8±0,36 | 34,8±0,69 | 6,15±0,39 |
| 5 | 5,02±0,27 | 12,07±0,16 | 8,7±0,22 | 20,5±0,28 | 41,5±0,11 | 8,28±0,25 |
| Нср | — | — | 0,13 | 0,12 | 1,3 | 0,11 |
Установлено, что количество колосьев на растении под влиянием всех биологических препаратов возросло на 39,7-66,2% в сравнении с контролем и химическим пестицидом «Скарлет». Самые высокие показатели в варианте нового комплексного биостимулятора (+66.2%). Вес колоса, длина колоса, количество зерен в колосе возрастает в той же последовательности с наивысшими показателями при совместном применении биоудобрения и нового биостимулятора. При этом и в варианте с химическим пестицидом отмечены преимущества по сравнению с контрольным вариантом.
Количество растворимых сахаров в семенах ярового ячменя под влиянием всех исследуемых препаратов увеличивается. При химической обработке «Скарлет» содержание сахаров остается на уровне контроля.
Анализируя данные учетов пораженности опытных растений корневыми гнилями в фазу всходов, мы пришли к следующим выводам: новый комплексный биостимулятор повышал сопротивляемость проростков ярового ячменя к поражению возбудителями корневых гнилей, о чем свидетельствует снижение на 85,7% распространенности заболевания в среднем на по отношению к контролю и интенсивности развития болезни на 89,2% соответственно (табл. 49).
Таблица 49 — Пораженность ярового ячменя корневой гнилью в фазу всходов (контроль — %, опыт – отклонение от контроля, %)
| Варианты обработки | Показатели, % | |
| Распространенность болезни | Интенсивность поражения | |
| 1 | 19,8 | 13,7 |
| 2 | -38,8 | -51,4 |
| 3 | -74,5 | -77,0 |
| 4 | -79,6 | -78,4 |
| 5 | -85,7 | -89,2 |
Обработка семян ячменя перед посевом новым комплексным биостимулятором на фазе всходов наиболее эффективно защищала микрорастения от фузариозных заболеваний.
4.4.2. Изучение влияния препаратов на горохе Фараон
Горох «Фараон» урожай 2019г. был посеян 15.05.2020. Делянки 1м2, 30см дорожка между образцами 5 образцов по 4 повторности:
1.Контроль
2.Элексир Урожая 0,2мл/м2
3.Нигор+ экзометаболиты триходермы 1мл/1литр (10 -4)
4.Скарлет 0,03мл/м2
5.Элексир Урожая+Нигор+ экзометаболиты 1:1
 |
  |
| 1 | 2 3 |
 |
 |
| 4 | 5 |
Рисунок 35 — Вид посевов гороха по вариантам 7.06.2020 г: 1- контроль; 2- Эликсир Урожая; 3- Нигор+ экзометаболиты; 4- Скарлет; 5- Нигор+ экзометаболиты+Эликсир Урожая
Как видно, из рис. 35, посевы гороха в вариантах с обработкой препаратами во всех случаях менее разреженные, чем в контроле. Особенно отличаются варианты с обработкой Нигор+ экзометаболиты и вариант совместного применения Нигор+экзометаболиты+ Эликсир Урожая.
Это соответстввует полевой всхожести, которая в вариантах с обработкой была выше.
Установлено, что полевая всхожесть гороха Фараона под влиянием всех препаратов увеличивается в различной степени (рис. 35, табл. 50 ).
Под влиянием Эликсира Урожая всхожесть увеличилась на 6% по сравнению с контролем, а под влиянием Нигор+экзометаболиты – на 7%, под влиянием совместного применения Нигора и Эликсира Урожая – на 12%, а под влиянием химического пестицида всего на 4%.
Таблица 50. Полевая всхожесть семян гороха под влиянием препаратов
| Образец | Всхожесть, % |
| Контроль | 79,16 |
| Эликсир урожая | 85,41 |
| Нигор | 86,25 |
| Скарлет | 83,33 |
| Нигор-эликсир урожая | 91,33 |
Развитие растений гороха показало преимущество препаратов Нигор+экзометаболиты и Нигор+ экзометаболиты_ Эликсир Урожая по сравнению с другими вариантами как по внешнему виду (Рис.36), так и по морфометрическим показателям (таблица 51).

Рисунок 36 — Влияние препаратов на развитие растений гороха Фараон (7.06.2020 г): 1-Контроль; 2- Эликсир Урожая; 3-Нигор+ экзометаболиты;
4-Скарлет; 5- Нигор+экзометаболиты+ Эликсир Урожая
Из данных таблицы 51 следует, что более эффетивными препаратми являются Нигор+экзометаболиты и Нигор+ экзометаболиты+Эликсир Урожая. Увеличиваются высота проростка, корня, число листьев и их площадь, а также наблюдаются весовые преимущества опытных вариантов по зеленой массе.
Таблица 51. Влияние препаратов на рост и развитие растений гороха на 7.06.2020.г
| вариант | Длина проростка,см | Длина корня,см | Влажность,% | Вес вег.массы 10 раст.(вег./корень),г | Число листьев,ср | Длина листа,мм | Ширина листа,мм |
| 1 | 13,7 | 5,4 | 86,53 | 6,10/4,40 | 8 | 23,75 | 17,43 |
| 2 | 14,2 | 6,01 | 86,78 | 7,18/5,01 | 9,1 | 24,53 | 18,18 |
| 3 | 16,8 | 7,9 | 87,50 | 8,20/6,23 | 10 | 25,21 | 19,23 |
| 4 | 13,8 | 5,8 | 86,98 | 6,50/5,0 | 10,2 | 24,02 | 17,58 |
| 5 | 17,5 | 8,76 | 87,53 | 7,5/6,47 | 11 | 27,53 | 21,02 |
Эти преимущества сохраняются на протяжении всех сроков наблюдения (таблица 52).
Таблица 52. Влияние препаратов на рост и развитие растений гороха на 22.06.2020
| вариант | Длина зел.массы,
см |
Длина корня,
см |
Влажность,
% |
Вес зел. массы,
гр |
Вес корня,
гр |
Число листьев,
шт |
Длина листа,
мм |
Ширина листа,мм |
| 1 | 14,83 | 6,14 | 83,76 | 7,77 | 7,93 | 10,61 | 25 | 19,45 |
| 2 | 17,67 | 8,71 | 85,01 | 9,34 | 6,35 | 11,12 | 25,1 | 19,68 |
| 3 | 18,34 | 9,75 | 85,43 | 10,28 | 6,81 | 13,24 | 28,66 | 21,07 |
| 4 | 14,23 | 7,01 | 83,27 | 8,23 | 5,27 | 11,02 | 26 | 20,04 |
| 5 | 19,23 | 10,02 | 85,04 | 11,02 | 7,57 | 12,02 | 30,02 | 22,07 |
К моменту формирования бобов на растениях гороха (Таблица 53) наблюдается
Преимущество опытных вариантов перед контролем и по количеству завязываемых бобовы и по их весу, а значит и по формированию урожая. Особенно это касается вариантов с Нигор+ экзометаболиты+Эликсир Урожая.
Таблица 53. Влияние препаратов на рост и развитие растений гороха на 07.07.2020 г
| Вариант | Длина растения,
см |
Количество листьев
,шт |
Длина листа,
см |
Ширина листа,
см |
Кол-во
Бобов, шт |
Длина боба,
см |
Ширина боба,
см |
Вес зел.массы,
10раст,гр |
Вес боба,10 шт.,гр |
| 1 | 40 | 16 | 2,7 | 1,5 | 3 | 4 | 0,7 | 21,73 | 4,66 |
| 2 | 43 | 22 | 2,8 | 1,8 | 3 | 4,5 | 1 | 23,11 | 5,08 |
| 3 | 50 | 24 | 3,2 | 2 | 4 | 5,5 | 1,5 | 33,08 | 7,26 |
| 4 | 42 | 22 | 3 | 1,5 | 3 | 4,2 | 1,3 | 22,04 | 5,34 |
| 5 | 60 | 28 | 3,7 | 2,8 | 5 | 6,2 | 1,7 | 42,07 | 8,12 |

Рисунок 37 — Влияние препаратов на развитие растений гороха на 07.07.2020
По данным таблицы 53 и рис. 37 следует преимущество данных вариантов по морфометрическим показателям. Растения в данных вариантах отличает мощностью развития, формированием крепкого стебля и мощного корня. Это сказалось на урожайных данных гороха (Таблица 54).
Из данных таблицы 54 следует, что 50-ый день после посева гороха на растениях завязалось вдва раза меньше бобов, чем в среднем по годам. Это связано с неблагоприятными условиями развития данной культуры, поэтому данные, полученные по гороху, неудовлетворительны. И тем не менее в экстремальных условиях препараты оказали благоприятное воздействие на накопление биомассы и массы зерна.
Таблица 54. Влияние препаратов на урожайные данные гороха на 7.07.2020 г
| вариант | Вес 10 бобов,гр. | Вес гороха с 10 бобов,гр. | Число бобов на 1 растении, г | Вес боба с 1 растения, г | Вес гороха с 1 боба | Вес гороха с 1 растения,г |
| 1 | 4,66 | 4.29 | 3 | 0,46 | 0,43 | 1,26 |
| 2 | 5,08 | 4,68 | 3 | 0,51 | 0,47 | 1,38 |
| 3 | 7,26 | 9,44 | 4 | 0,73 | 0,67 | 2,68 |
| 4 | 5,34 | 6,76 | 3 | 0,53 | 0,67 | 1,47 |
| 5 | 8,12 | 13,92 | 5 | 0,81 | 0,75 | 3,75 |

Рисунок 38 -Влияние препаратов на величину бобов гороха на 07.07.2020
Выводы по главе. На основании проведенных исследований можно резюмировать, что биологические средства защиты растений являются перспективным элементом в технологии выращивания ярового ячменя и гороха.
Исследованные новые препараты: новый биостимулятор «Нигор + экзометаболиты Trichoderma atrobrunneum ВКПМ F-1434», биоудобрение «Эликсир Урожая» и новый комплексный биостимулятор «Нигор + экзометаболиты Trichoderma atrobrunneum ВКПМ F-1434 + Эликсир Урожая» повышают всхожесть и энергию прорастания семян, увеличивают число сохранившихся при посеве растений, число продуктивных стеблей, массу 1000 семян, коэффициент хозяйственной эффективности, накопление сахаров в семенах и устойчивость к корневым гнилям.
Новый комплексный биостимулятор «Нигор + экзометаболиты Trichoderma atrobrunneum ВКПМ F-1434 + Эликсир Урожая» является наиболее эффективным биологическим препаратом в отношении ярового ячменя и гороха.
РАЗДЕЛ 5 ПРОИЗВОДСТВЕННЫЕ ИСПЫТАНИЯ НОВОГО БИОСТИМУЛЯТОРА «НИГОР+ЭКЗОМЕТАБОЛИТЫ»
5.1. Влияние биостимулятора на морфометрические показатели и структуру урожая ячменя Скарлет
Методика опыта
Ячмень «Скарлет». Предпосевная обработка семян и двухкратное опрыскивание. В фазу кущения (с гербицидной обработкой), и в фазу трубкования (с фунгицидной).
Заложен производственный опыт. Площадь опытной делянки 10 га.
Дата уборки 1.09.2020. Влажность ячменя при уборке составляла 13 %.
Агрохимическая характеристика почвы, P2O5 (по Мачигину ГОСТ 26205-91) 99 мг/кг, К2О (по Мачигину 26205-91) 102 мг/кг, pH 5 (ГОСТ 26483-85), Гумус по методу Тюрина в модификации ЦИНАО (ГОСТ 26213-91) 4,54. Предшественник ячмень. Почва сера лесная, среднесуглинистая.
Проводилась предпосевная обработка ярового ячменя Скарлет с помощью перемешивания инсектицидного протравителя системного действия Имидор Про 0,75 л/т и Биостим Старт 1 л/т в протравителе КС-10 и двухкратное опрыскивание в фазу кущения (27.05.2020) совместно с гербицидом Фенизан, ВР 0,15 л/га (расход рабочей жидкости: при наземной обработке — 200 л/га) и в фазу трубкования (15.06.2020) совместно с фунгицидом Титул Дуо 0,25 л/га. (Расход рабочей жидкости: при наземной обработке – 200 л/га), с помощью опрыскивателя AMAZONEN D492-05. В данной работе производилось производственные полевые испытания улучшенного биологического средства «Нигор» на двух сельскохозяйственных культурах: ячмень сорта «Скарлет», пшеница сорта «Московская 40».
Для исследования влияния активного вещества препарата на продуктивность сельскохозяйственных культур наряду с полевыми испытаниями проводились и лабораторные исследования.
Уборка ячменя проводилась 1 сентября 2020 г.
Учетные данные брались с четырех учетных площадок площадью 1 м2, в разных частях поля.
Изучение влияния биопрепарата на всхожесть, высоту растений ярового ячменя в онтогенезе и густоту стеблестоя показало ( Таблица 55, рис.39) преимущество растений с опытного варианта по сравнению с необработанными растениями по всем показателям в течение вегетации.
Таблица 55. Влияние биопрепарата на всхожесть, высоту и густоту стеблестоя ячменя Скарлет.
| Варианты | Полевая всхожесть,% | Высота,см. (кущение) | Высота,см. (трубкование) | Высота, см. (колошение) | Высота, см. (восковая спелость ) | Густота стеблестоя, шт/м2 |
| Контроль | 81,3 | 29,2 | 44,5 | 51,3 | 58,7 | 515 |
| Биопрепарат | 83,5 | 33,1 | 47,2 | 54,1 | 61,3 | 523 |
| НСР05 | 1,2 | 0,7 | 0,9 | 1,1 | 1,1 | 2,3 |
Густота стеблестоя в варианте с биопрепаратом увеличилась по сравнению с контрольными растенияи незначительно (1,55%).


Рисунок 39 — Влияние биопрепарата на рост и развитие ярового ячменя
Вместе с тем, площадь листовой поверхности у опытных вариантов была больше на 9,8% больше, чем в контрольном варианте (Таблица 56).
Таблица 56. Влияние биопрепарата на параметры флагового листа у ячменя Скарлет.
| Варианты | Дина флаглиста, мм | Ширина флаглиста, мм | Площадь флаглиста, м2 |
| Контроль | 22,21 | 0,78 | 12,13 |
| Биопрепарат | 24,10 | 0,79 | 13,32 |
| НСР05 | 0,51 | 0,42 | 0,45 |
В таблице 57 представлены данные по структуре урожая ярового ячменя по сравнению с контрольными. Установлено, что за счет увеличения размера колоса, количества и массы 1000 семян урожайность ярового ячменя под влиянием биопрепарат увеличилась на 9,1%.
Таблица 57. Влияние биопрепарата на структуру урожая ячменя Скарлет.
| Варианты | Длина колоса, см | Количество зерен в колосе | Масса
1000 семян |
Масса зерна, г/м2 | Урожайность, ц/га |
| Контроль | 6,3 | 16,11 | 32 | 265,41 | 19,7 |
| Биопрепарат | 6,5 | 17,21 | 33 | 297,01 | 21,5 |
| НСР05 | 0,1 | 0,34 | 0,02 | 4,23 |
5.2. Влияние биостимулятора на морфометрические показатели и структуру урожая озимой пшенице Московская 40
Методика проведения опыта на озимой пшенице
Агрохимическая характеристика почвы, P2O5 (по Мачигину ГОСТ 26205-91) 104 мг/кг, К2О (по Мачигину 26205-91) 135 мг/кг, pH 5,5 (ГОСТ 26483-85), Гумус по методу Тюрина в модификации ЦИНАО (ГОСТ 26213-91) 4,09. Предшественник соя. Почва сера лесная, среднесуглинистая.
Проводилось двухкратное опрыскивание в фазу кущения (24.05.2020) совместно с гербицидом Фенизан, ВР 0,15 л/га (расход рабочей жидкости: при наземной обработке — 200 л/га) и в фазу трубкования (10.06.2020) совместно с фунгицидом Титул Дуо 0,25 л/га. (Расход рабочей жидкости: при наземной обработке – 200 л/га), с помощью опрыскивателя AMAZONEN D492-05, фото опытных образцов преставлено на рис. 40.


Рисунок 40 — Посевы озимой пшеницы Московская 40
В результате испытаний установлено преимущество растений озимой пшеницы с опытного варианта по сравнению с контрольными растениями по всхожести, высоте растений в течение онтогенеза и высоте кущения (Таблица 58).
Таблица 58. Влияние биопрепарата на полевую всхожесть, высоту озимой пшеницы Московская 40.
| Варианты | Полевая, всхожесть, %. | Высота, см. (кущение) | Высота, см. (трубкование) | Высота, см. (колошение) | Высота, см.(восковая спелость ) |
| Контроль | 84,3 | 32,6 | 49,5 | 61,3 | 67,2 |
| Биопрепарат | 86,1 | 33,1 | 52,6 | 65,1 | 69,4 |
| НСР05 | 0,9 | 0,5 | 1,1 | 1,2 | 1,3 |
Это сказалось и на густоте стеблестоя (Рис. 41, 42). Густота продуктивного стеблестоя озимой пшеницы Московская 40, перед уборкой. Контроль 561 шт/м2, опыт 565 шт/м2.
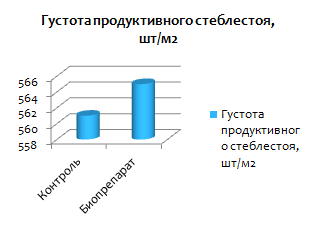 Рисунок 41 — Густота продуктивного стеблестоя озимой пшеницы под влиянием биопрепарата Рисунок 41 — Густота продуктивного стеблестоя озимой пшеницы под влиянием биопрепарата |
 
Рисунок 42 — Стеблестой озимой пшеницы по вариантам |
Густота продуктивного стеблестоя озимой пшеницы Московская 40, перед уборкой в опытном варианте незначительно превышает контрольные растения.
Рост высоты растений сказался и на площади флагового листа (Таблица 59). На опытных растениях площадь флагового листа увеличилась на 3,7%
Изучение структуры урожая озимой пшеницы (Таблица 60) показало положительный эффект от применения биопрепарата. Увеличились размеры колоса, масса зерна и обшая урожайность по сравнению с контрольным вариантом возростла на 7%.
Таблица 59. Влияние биопрепарата на параметры флагового листа у озимой пшеницы Московская 40.
| Варианты | Дина флаглиста, мм | Ширина флаглиста, мм | Площадь флаглиста, м2 |
| Контроль | 24,21 | 0,81 | 19,6 |
| Биопрепарат | 25,10 | 0,81 | 20,3 |
| НСР05 | 0,39 | 0,45 | 0,45 |
Таблица 60. Влияние биопрепарата на структуру урожая озимой пшеницы Московская 40.
| Варианты | Длина колоса, см | Количество зерен в колосе | Масса, 1000 семян | Масса зерна, г/м2 | Урожайность, ц/га |
| Контроль | 7,4 | 25,02 | 35,1 | 492,6 | 38,8 |
| Биопрепарат | 7,8 | 26,41 | 35,3 | 526,7 | 41,5 |
| НСР05 | 0,2 | 0,34 | 0,03 | 4,23 |
5.3. Изучение показателя вегетационного индекса и количества хлорофилла по вариантам
Управление растениеводством, связанное с прогнозированием урожайности сельскохозяйственных культур, последствиями воздействия окружающей среды, химическим составом почвы, влажностью и т.д., может быть основано на спектральной сигнатуре растительных посевов, т.е. коэффициенте отражения/излучения в зависимости от длины волны. В мировой практике сельского хозяйства широко используются вегетационные индексы NDVI, помогающие провести качественный анализ состояния растительности на основании дистанционного зондирования (Pooja Vinod Janse, Ratnadeep R. Deshmukh, Priyanka U. Randive. Vegetation Indices for Crop Management: A Review. /IJRAR January 2019, Volume 6, Issue 1, Р.413-415).
Вегетационные индексы (VI) являются важной характеристикой для изучения состояния посевов, указывающих на структурные, биохимические и физиологические изменения. Большая часть структурно связанных растительных индексов создается на основе отражательной способности, полученной в красной и ближней инфракрасной областях. К структурным свойствам относятся биомасса зеленого листа, индекс площади листьев и фотосинтетически поглощенные активные излучения. Биохимические свойства включают пигменты (хлорофилл, антоциан и каротиноиды), а также воду, азотсодержащие соединения, лигнин, целлюлозу и др. К третьей категории состояния растительного покрова относится физиологическое состояние растений, связанное с изменениями, происходящими под влиянием различного рода стрессов. Например, изменение содержания хлорофилла, ксантофилла, влажности и пр. (Pooja Vinod Janse, Ratnadeep R. Deshmukh, Hyperspectral Remote Sensing for Agriculture: A Review, IJCA, Vol.-172, No.-7, 2017; Jinru Xue and Baofeng Su, Significant Remote Sensing Vegetation Indices: A Review of Developments and Applications, Hindawi Journal of Sensors, Volume 2017).
Индексы растительности используются для анализа посевов, содержания питательных элементов в почве, управления пестицидами, оценки урожайности, моделирования и т.д.( J.O. Payero, C.M.U. Neale, J.L. Wright, Сomparison of eleven vegetation indices for estimating plant height of alfalfa and grass, Applied Engineering in Agriculture, American Society of Agricultural Engineers, Vol. 20(3): 385−393, 2004; Thenkabail, P.S., Smith, R.B. and Pauw, E.D., Hyperspectral vegetation indices and their relationships with agricultural crop characteristics. Remote Sensing Environment, 71:158–182, 2000).
Индексы растительности являются полезной информацией, особенно это касается выявления стрессов для своевременного принятия соответствующих мер для управления растениеводством. В России использование зондирования для прогнозирования урожайности и управления растениеводством еще недостаточно широко внедрено и целью наших исследований является изучение возможности использования аэрофотосъемок растительного покрова в условиях Орловской области.
Изучение вегетационного индекса на посевах ярового ячменя Скарле (Таблица 61) показало, что в различные фазы развития культуры они различаются. Наибольшие величины отмечены в фазу трубкования (0,60) – у контроля и 0,65- у обработанных препаратом .
Таблица 61. Влияние биопрепарата на вегетационный индекс NDVI у ячменя Скарлет.
| Варианты | NDVI (кущение) | NDVI (трубкование) | NDVI (колошение) |
| Контроль | 0,456 | 0,601 | 0,582 |
| Биопрепарат | 0,0471 | 0,652 | 0,594 |
На посевах озимой пшеницы (таблица 62) эти показатели значительно выше и по вариантам также отличаются. 0,70 – у контроля и 0, 72- у обработанных биопрепратом растений.
Таблица 62. Влияние биопрепарата на вегетационный индекс NDVI у озимой пшеницы Московская 40.
| Варианты | NDVI (кущение) | NDVI (трубкование) | NDVI (колошение) |
| Контроль | 0,521 | 0,701 | 0,682 |
| Биопрепарат | 0,532 | 0,723 | 0,702 |
Поскольку величина индекса связана с количеством хлорофилла, то наши исследования подтверждают данный факт (Таблица 63). Содержание хлорофилла а и в и их общеее содержание у ярового ячменя и озимой пшенице по фазам развития превосходит этот показатель у контрольных растений на 45,7% и 27,6% соответственно.
Таблица 63. Содержание хлорофилла в листьях ярового ячменя и озимой пшеницы
РАЗДЕЛ 6. ИСПЫТАНИЯ БИОСТИМУЛЯТОРОВ НА АНТИОКСИДАНТНУЮ СИСТЕМУ РАСТЕНИЙ
6.1. Влияние биологического средства защиты растений на энергию прорастания и всхожесть семян гороха, ярового ячменя и озимой культуры.
В лабораторных условиях проводили предпосевную обработку семян улучшенным препаратом «Нигор+экзометаболиты Trichoderma atrobrunneum» в концентрации 10-4 %. Контроль без обработки. Результаты исследования представлены на рис.43, 44, 45 (прил.3).
В лабораторных условиях энергия прорастания ячменя в опытном варианте составила 78,2 %, всхожесть 93,2 %, что выше, чем в контрольном варианте в среднем на 10% (Рис. 43).
Рисунок 43 — Влияние биологического средства защиты растений на энергию прорастания и всхожесть ячменя сорта «Скарлет».
Энергия прорастания в лабораторных условиях в опытном варианте пшеницы составила 79,5%, всхожесть 94,1%, что превышает контрольный вариант около 10% (Рис. 44).
Рисунок 44 — Влияние биологического средства защиты растений на энергию прорастания и всхожесть пшеницы сорта «Московская 40».
Рисунок 45 — Влияние биологического средства защиты растений на энергию прорастания и всхожесть гороха сорта «Фараон»
При обработке семян гороха сорта «Фараон» улучшенным препаратом «Нигор+экзометаболиты Trichoderma atrobrunneum» энергия прорастания стала равной и составила 100% (Рис. 45). Это свидетельствует о хороших посевных качеств семян, выравненности посевов, одинаковых сроках созревания, что в свою очередь облегчит уборку урожая. В лабораторных условиях в опытном варианте энергия прорастания при обработке возрасла на 2%, а всхожесть на 4%, что доказывает ростстимулирующие свойства препарата.
6.2. Активность антиоксидантных ферментов под влиянием биостимулятора
После предварительного замачивания проводили исследования биологической активности биопрепарата в лабораторных условиях. Для этого измеряли активность антиоксидантных ферментов в проростках ячменя, пшеницы и гороха на протяжении первых четырнадцати суток.
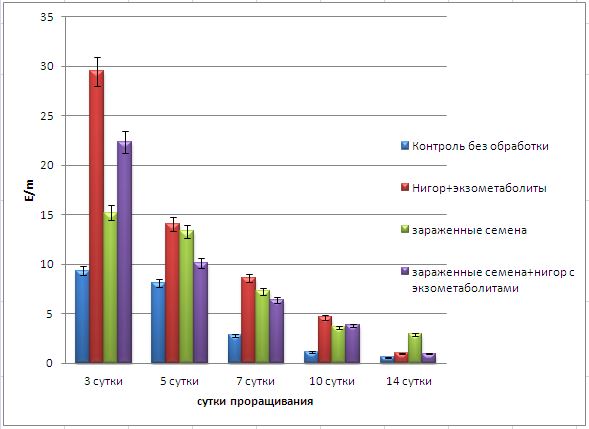
Рисунок 46 — Влияние биологического средства защиты растений на активность фермента каталазы проростков ячменя сорта «Скарлет»
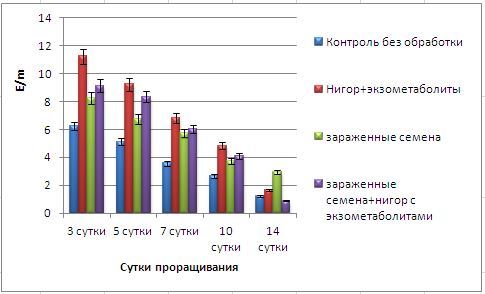
Рисунок 47 — Влияние биологического средства защиты растений на активность фермента каталазы проростков пшеницы сорта «Московская 40»
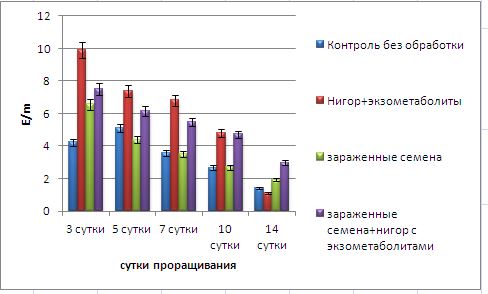
Рисунок 48 — Влияние биологического средства защиты растений на активность фермента каталазы проростков гороха сорта «Фараон»
Как видно на рисунке 48 активность фермента каталазы по всем вариантам исследования неуклонно снижается, однако, в опытном варианте с применением биопрепарата «Нигор улучшенный» на 3-и сутки эксперимента наибольшую активность фермента 29,482 Е/100 г на ячмене, 11,234 Е/100 г на пшенице, 9,892 Е/100 г на горохе и наиболее низкую активность к концу эксперимента 1,0234 Е/100 г на ячмене, 1,673 Е/100 на пшенице, 1,127 Е/100 на горохе что указывает на проявление действия нашего препарата.
На рисунке 49 показано изменение активности фермента каталаза по вариантам исследования. Выявлено, снижение, однако, в опытном варианте с применением биопрепарата «Нигор» на начало эксперимента активность выше чем, у варианта с применением промышленного препарата Эпин в два раза, а в сравнении с контролем без обработки практически в три раза. Мы видим неуклонное снижение активности по всем вариантам.
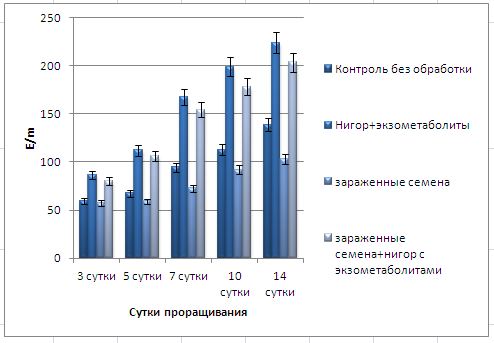
Рисунок 49 — Влияние биологического средства защиты растений на активность фермента каталазы проростков ячменя сорта «Скарлет»
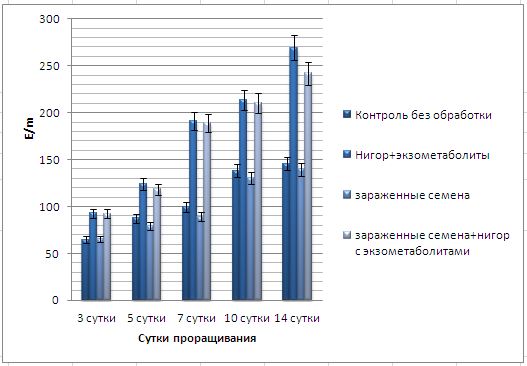
Рисунок 50 — Влияние биологического средства защиты растений на активность фермента каталазы проростков пшеницы сорта «Московская 40»
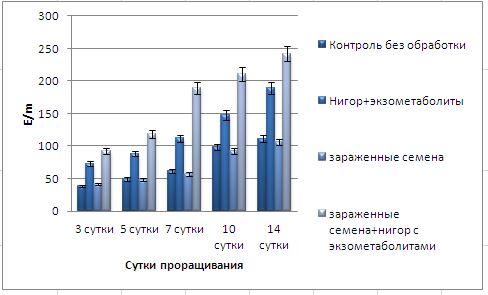
Рисунок 51 — Влияние биологического средства защиты растений на активность фермента каталазы проростков гороха сорта «Фараон»
Анализ активности фермента пероксидазы показал по всем вариантам повышение, однако, в контрольном варианте, без обработки наблюдалось незначительное, при этом в опытном образце с применением нового препарата «Нигор улучшенный» активация фермента значительная и составляет около 45 % (Рис. 51).
6.3. Изучение антиоксидантной активности ячменя по фазам развития
Изучали активность показателей антиоксидантной системы. На всех стадиях развития активность ферментов показывает наглядно формирование устойчивого иммунного ответа на предпосевную обработку.
На протяжении эксперимента мы наблюдаем неуклонный рост активности фермента пероксидаза. Высокая активность фермента выявлена в растениях ячменя, обработанных новым улучшенным биопрепаратом до 1489 Е/100 г. У контроля активность значительна ниже и на конец эксперимента составила 822 Е/100 г. (Рис. 52).
При этом активность фермента каталазы снижается по всем вариантам исследования (рис. 53). При обработке улучшенным биопрепаратом «Нигор» активность снизилась от фазы кущения до фазы выхода в трубку на 49,3299 единиц, при этом повысилась в фазу начала колошения на 20,1948 единиц. В фазу кущения активность контрольного варианта составила 21,4211 Е/100 г, в фазу выхода в трубку снизилась до 13,0613 Е/100 г, а в фазу начало колошения возросла до 14, 5634 Е/100 г.
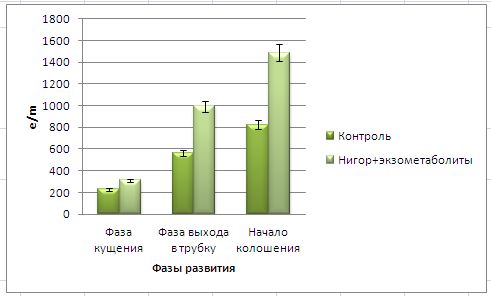
Рисунок 52 — Активность пероксидазы в растениях ячменя сорта «Скарлет» по фазам развития.
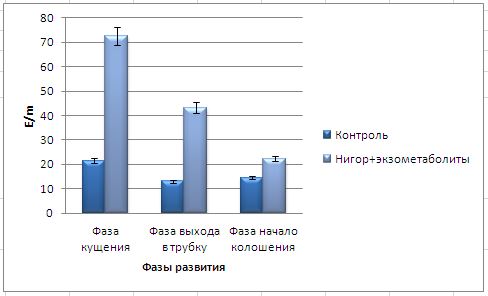
Рисунок 53 — Активность каталазы в растениях ячменя сорта «Скарлет» по фазам развития
Активность супероксиддисмутазы в растениях ячменя по фазам развития представлена на рис. 54.
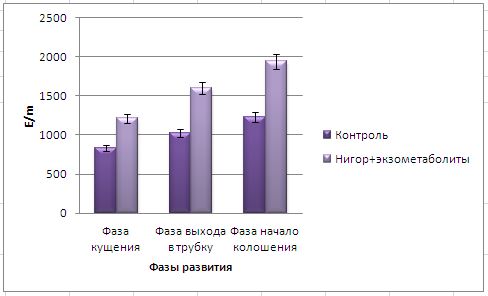
Рисунок 54 — Активность супероксиддисмутазы в растениях ячменя сорта «Скарлет» по фазам развития
Мы наблюдаем по всем вариантам повышение активности фермента супероксиддисмутазы.
6.4. Изучение антиоксидантной активности пшеницы по фазам развития
При изучении активности показателей антиоксидантной системы пшеницы показано увеличение активности фермента пероксидазы. В контрольном варианте активность повышалась с 254 Е/100 г до 1231 Е/100 г, а в варианте с применением нового улучшенного препарата «Нигор» так же активность возрастает с 643 Е/100 г до 5761 Е/100 г (Рис. 55).
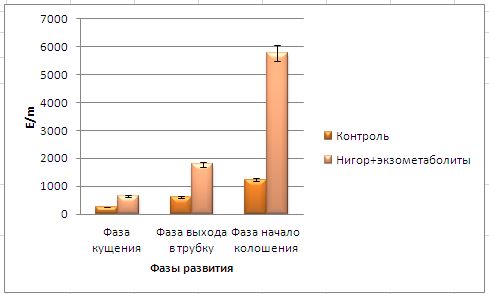
Рисунок 55 — Активность пероксидазы в растениях пшеницы сорта «Московская 40» по фазам развития.
Активность фермента каталазы уменьшалась в контрольном варианте с 23,3489 Е/100 г — фаза кущения до 7,4512 Е/100 г — фаза начало колошения. В варианте с применением нового улучшенного средства «Нигор» активность также понижалось с 66,7122 Е/100 г — фаза кущения до 29,0771 Е/100 г — фаза начало колошения (Рис. 56).
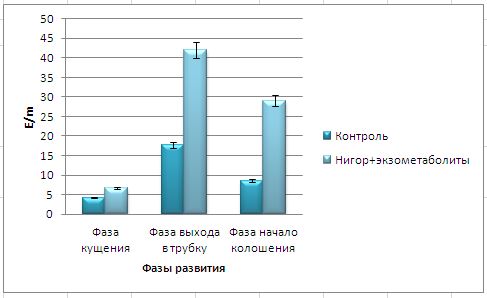
Рисунок 56 — Активность каталазы в растениях пшеницы сорта «Московская 40» по фазам развития.
Мы наблюдаем по всем вариантам повышение активности фермента супероксиддисмутазы.
При этом активность фермента супероксиддисмутаза повышается от начала эксперимента к концу на 584,6 единиц, а у образцов с применением «Нигор» на 906,8 единиц (Рис. 57).
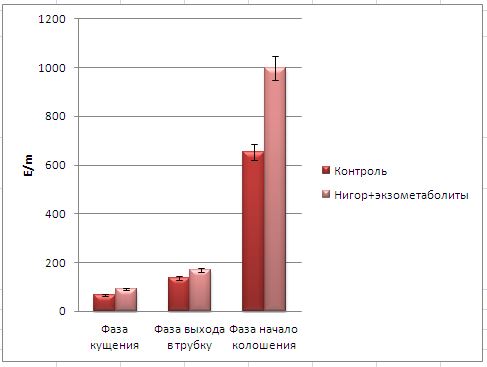
Рисунок 57 — Активность супероксиддисмутазы в растениях пшеницы сорта «Московская 40» по фазам развития.
6.5. Изучение антиоксидантной активности гороха по фазам развития
Как и в предыдущих опытах изучение активности показателей антиоксидантной системы гороха показало увеличение активности фермента пероксидазы. В контрольном варианте активность повышалась со 184 Е/100 г до 823 Е/100 г, а в варианте с применением нового улучшенного препарата «Нигор улучшенный» так же активность возрастает с 553 Е/100 г до 1143 Е/100 г (Рис. 58).
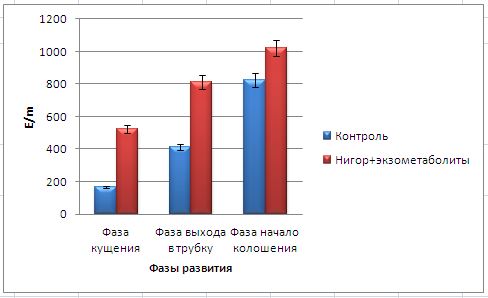
Рисунок 58 — Активность пероксидазы в растениях гороха сорта «Фараон» по фазам развития.
Активность фермента каталазы уменьшалась в контрольном варианте с 13,3489 Е/100 г — фаза кущения до 3,4512 Е/100 г — фаза начало колошения. В варианте с применением нового улучшенного средства «Нигор» активность также понижалось с 27,7122 Е/100 г — фаза кущения до 2,0771 Е/100 г — фаза начало колошения (Рис. 59).
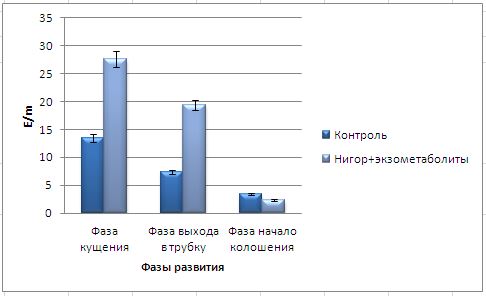
Рисунок 59 — Активность каталазы в растениях гороха сорта «Фараон» по фазам развития.
Мы наблюдаем по всем вариантам повышение активности фермента супероксиддисмутазы.
При этом активность фермента супероксиддисмутаза повышается от начала эксперимента к концу на 25 %, а у образцов с применением «Нигор улучшенный» на 43% (Рис. 60).
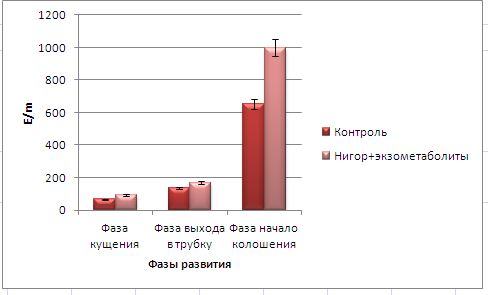
Рисунок 60 — Активность супероксиддисмутазы в растениях гороха сорта «Фараон» по фазам развития.
На основании проведенных анализов можно сделать вывод, что использование биопрепарата способствует активизации ферментов антиоксидантной системы. Таким образом, проведенные мероприятия, позволяют увеличить продуктивность зерновых и бобовых культуры и получить при этом экологически безопасную продукцию.
При возделывании ячменя, пшеницы и гороха с применением нового биопрепарата требуется проведение предпосевной обработки и 2-х кратное опрыскивание в фазу кущения и колошения, что позволяет достичь прибавку урожайности на озимой пшенице на 6.9 % , на яровом ячмене 9.1 %, а на горохе 8,3 % в сравнении с контролем без обработки.
ЗАКЛЮЧЕНИЕ
В результате проведенных исследований по определению антагонистической и микопаразитической активности микромицетов рода Trichoderma установлено, что микробы-антагонисты показали разную степень ингибирования в зависимости от времени инкубации (5-е или 10-е сутки) и вида фитопатогена. Отмеченные способности к антагонизму и гиперпаразитизму свидетельствуют о полифункциональном механизме воздействия на патогены – они способны не только сдерживать и подавлять рост фитопатогенных грибов рода Fusarium посредством выделения антагонистических веществ, но также способны использовать мицелий в качестве субстрата.
Все исследуемые штаммы-антагонисты способны к антагонизму и гиперпаразитизму. Перспективным штаммом является T. atrobrunneum ВКПМ F-1434.
Проведя качественный анализ по определению компонентного состава биофлаваноидов гречихи, получили разделенные фракции: рутин, кверцитин, хлорогеновая кислота. Согласно полученным данным исследуемые экстракты из гречихи: рутин и хлорогеновая кислота не обладают активностью в отношении фитопатогена Fusarium oxysporum, в свою очередь кверцетин обладает слабой чувствительностью в отношении фитопатогена Fusarium oxysporum. Однако, препарат под торговой маркой «РутиФлав», представляющий собой по химическому составу смесь биофлаваноидов обладает средней чувствительностью в отношении фитопатогена, вызывающего корневые гнили гороха, поэтому может рекомендоваться в качестве компонента питательной среды для оздоровления растений in vitro.
При обработке гороха биофлаваноидами гречихи оптимальные результаты наблюдали в варианте с «РутиФлавом» , который представляет собой смесь биофлаваноидов различной химической природы. Так, длина корешка на 25% по сравнению с контролем, длина проростка на 86%. В сравнении с препаратом «Скарлет» длина корешка в два раза больше, в том числе и длина проростка. При обработке семян гороха «Эликсиром урожая» длина корешка на 4% меньше, а длина проростка в два раза больше.
Проводя, исследования компонентного состава биофлаваноидов гречихи установлено, что кверцетин оказывает ростостимулирующее и фунгицидное действие на проростки гороха: длина корешка в два раза больше, чем в контроле, длина проростка на 28% увеличивает длину. Так же показатели длины корешка и проростка при обработке фракцией кверцетина превышают значения в вариантах обработки с препаратами «Скарлет», «Эликир урожая», «Нигор». На ячмене и яровой пшенице оптимальные результаты ростостимулирующего и фунгицидного действия наблюдали в вариантах при обработке препаратом «РутиФлав», в том числе фракцией кверцетина.
Исследованиями компонентного состава биофлаваноидов гречихи установлено, что наибольшие показатели энергии прорастания и всхожести наблюдали в варианте с рутином. Показатели всхожести и энергии прорастания составили соответственно для гороха 96% и 100%, для ячменя 52 и 72%.
Биопрепараты на основе природных компонентов «Эликсир урожая» и «Нигор» обладают выраженным ростстимулирующим и фунгицидным действием. Компоненты биопрепарата «Нигор» менее эффективно стимулируют рост 6-суточных проростков как гороха, так и ячменя, яровой пшеницы, но и проявляют наиболее выраженным фунгицидным действием в отношении грибов рода Fusarium. Во всех исследованиях нами показано, что использование экзометаболитов T. atrobrunneum ВКПМ F-1434 в отношении гороха, яровой пшеницы и ячменя, увеличивает рост корня и проростка тест-объектов, снижает количество пораженных фитопатогенами семян.
Совместное применение этих препаратов может обеспечить увеличение показателей исследуемых активностей. В связи с чем, в дальнейшем исследовании проводили подбор эффективной комбинации исследуемых биопрепаратов с целью создания нового биопрепарата с защитно-стимулирующими свойствами для применения на горохе, яровой пшенице и ячмене. Новый биопрепарат на основе природных компонентов растительного и микробного происхождения является «Эликсир урожая» и «Нигор» 1:1 со споровой суспензией Trichoderma atrobrunneum ВКПМ F-1434 (ССТr) (с титром 1*108 конидий/мл из расчета 2 мг/л готового раствора) при использовании в качестве средства для предпосвеной обработки семян обладает выраженными ростостимулирующими свойствами в отношении микрорастений гороха и ячменя.
На основании проведенных исследований можно резюмировать, что биологические средства защиты растений являются перспективным элементом в технологии выращивания ярового ячменя и гороха.
Исследованные новые препараты: новый биостимулятор «Нигор + экзометаболиты Trichoderma atrobrunneum ВКПМ F-1434», биоудобрение «Эликсир Урожая» и новый комплексный биостимулятор «Нигор + экзометаболиты Trichoderma atrobrunneum ВКПМ F-1434 + Эликсир Урожая» повышают всхожесть и энергию прорастания семян, увеличивают число сохранившихся при посеве растений, число продуктивных стеблей, массу 1000 семян, коэффициент хозяйственной эффективности, накопление сахаров в семенах и устойчивость к корневым гнилям.
Новый комплексный биостимулятор «Нигор + экзометаболиты Trichoderma atrobrunneum ВКПМ F-1434 + Эликсир Урожая» является наиболее эффективным биологическим препаратом в отношении ярового ячменя и гороха.
Применение биопрепарата способствует активизации ферментов антиоксидантной системы. Таким образом, проведенные мероприятия, позволяют увеличить продуктивность зерновых и бобовых культуры и получить при этом экологически безопасную продукцию.
При возделывании ячменя, пшеницы и гороха с применением нового биопрепарата требуется проведение предпосевной обработки и 2-х кратное опрыскивание в фазу кущения и колошения, что позволяет достичь прибавку урожайности на озимой пшенице на 6.9 % , на яровом ячмене 9.1 %, а на горохе 8,3 % в сравнении с контролем без обработки.
По результатам исследования опубликовано: 1 патент, 25 статей (1 -ВАК, 3 — Scopus, 1 — Web of Science, 17- РИНЦ ):
1. Патент на изобретение RU 2710783 C1, 13.01.2020. Павловская Н.Е., Гнеушева И.А., Лушников А.В., Маркина О.А.
Штамм trichoderma atrobrunneum, обладающий антибактериальной активностью в отношении Bacillus Anthracis. Заявка № 2019102438 от 29.01.2019.
2. Павловская Н.Е. Испытание влияния новых биопестицидов на возбудителей болезней овощей с применением ДНК-маркеров. / Павловская Н.Е., Гагарина И.Н., Гаврилова А.Ю., Бородин Д.Б.// Известия вузов. Прикладная химия и биотехнология. 2020. Т. 10. № 3 (34). С. 401-411.
3. Волков В.А. Новые стимуляторы роста растений на основе водорастворимых наночастиц n-замещенных моноаминокислотных производных фуллерена C 60 и изучение механизма их действия. /Волков В.А., Ямскова О.В., Воронков М.В., Курилов Д.В., Романова В.С., Мисин В.М., Гагарина И.Н., Павловская Н.Е., Горькова И.В., Лушников А.В.// Биофизика. 2020. Т. 65. № 4. С. 745-752
4. Гнеушева И.А., Солохина И.Ю. Оценка антифунгальных и ростостимулирующих свойств биопрепаратов на основе природных компонентов // Вестник ИрГСХА. 2020. № 99. С. 31-39.
5. Павловская Н.Е. Оценка состояния посевов озимой пшеницы и ярового ячменя по среднему значению NDVI, на основе космоснимков. / Павловская Н.Е., Родимцев С.А., Бородин Д.Б., Вершинин С.В., Гагарина И.Н. // Вестник Аграрной науки. 2020. № 6
6. Pavlovskay N.E., Gorkova I.V., Gagarina I.N., Gavrilova A.Y. Creation of new polymer composite bioplastics to produce disposable tableware based on starch В сборнике: IOP Conference Series: Earth and Environmental Science. 6th International Conference on Agriproducts Processing and Farming. 2020. С. 012120.
7. Pavlovskay N.E., Gorkov А.А.
Effect of new biologies on winter wheat structure and technological properties В сборнике: IOP Conference Series: Earth and Environmental Science. 6th International Conference on Agriproducts Processing and Farming. 2020. С. 012022.
8. Pavlovskaya N., Gneusheva I., Solokhinа I., Ageeva N. В The biological activity of subspecies trichoderma harzianum against fusarium oxysporum, the causative agent of fusarium wilt cucumber in vitro В сборнике: BIO WEB OF CONFERENCES. 2020. С. 00021.
9. Pavlovskay N.E., Gorkova I.V., Gagarina I.N., Borodin.D.B. Testing the effect of new biopesticides on soilborne pathogens of vegetable diseases using DNA markers Рroceedings of universities. Applied chemistry and biotechnology
10. Агеева Н.Ю., Павловская Н.Е., Гнеушева И.А. Изучение влияния биопрепарата, созданного на основе природных компонентов, на интенсивность развития проростков сельскохозяйственных культур./ В сборнике: Рациональное использование сырья и создание новых продуктов биотехнологического назначения Материалы Международной научно-практической конференции по актуальным проблемам в области биотехнологии. 2020
11. Гагарина И.Н. Исследование влияния пестицида биологического происхождения в условиях НОПЦ «Интеграция». /Рациональное использование сырья и создание новых продуктов биотехнологического назначения: материалы международной научно-практической интернет конференции по актуальным проблемам в области биотехнологии. – Орел: Орловский ГАУ, 2020. – с. 87
12. Гагарина И.Н. Биологическая активность растительных экстрактов /Рациональное использование сырья и создание новых продуктов биотехнологического назначения. Материалы международной научно-практической интернет конференции по актуальным проблемам в области биотехнологии. – Орел: Орловский ГАУ, 2020. – с. 151.
13. Гнеушева И.А. Обоснование применения препарата на основе природных компонентов на овощных культур /Состояние, проблемы и перспективы развития аграрной науки на современном этапе: материалы Всероссийской научно-практической конференции с международным участием (г. Чебоксары, 20 февраля 2020 г.) – Чебоксары, 2020. – с. 121-126.
14. Гнеушева И.А., Солохина И.Ю. Исследование качественного состава комплекса фенольных соединений гречихи посевной Агроэкологические аспекты устойчивого развития АПК / Материалы XVII Международной научной конференции. – Брянск: Изд-во Брянский ГАУ, 2020. – с. 190-194
15. Гнеушева И.А., Агеева Н.Ю. Изучение действия микробных биопрепаратов на рост Fusarium spp в условиях in vitro /Агроэкологические аспекты устойчивого развития АПК Материалы XVII Международной научной конференции. – Брянск: Изд-во Брянский ГАУ, 2020. – с. 158-162
16. Гнеушева И.А. Изучение антифунгальных и ростостимулирующих свойств Trichoderma atrobrunneum ВКПМ F-1434 на микрорастениях огурца /Агроэкологические аспекты устойчивого развития АПК. Материалы XVII Международной научной конференции. – Брянск: Изд-во Брянский ГАУ, 2020. – с. 162-166
17. Гнеушева И.А., Солохина И.Ю. Изучение фитогормон-подобной активности штамма Trichoderma atrobrunneum ВКПМ F-1434 /Агроэкологические аспекты устойчивого развития АПК Материалы XVII Международной научной конференции. – Брянск: Изд-во Брянский ГАУ, 2020. – с. 167-171
18. Горьков А.А., Павловская Н.Е., Гагарина И.Н., Горькова И.В. Выявление реакции озимой пшеницы на способы и нормы обработки биопрепаратами. / В сборнике: Биотехнология: состояние и перспективы развития. International forum issue 18 28-30 October, 2020 Moscow. 2020. с. 340-341.
19. Горьков А.А., Павловская Н.Е. Современные технологии выращивания озимой пшеницы с применением криоадаптеров /В книге: биотехнология: состояние и перспективы развития. International forum issue 18 28-30 October, 2020 Moscow.2020. с. 341-343.
20. Горьков А.А., Павловская Н.Е. Исследование влияния биопрепаратов на качество семян озимой пшеницы. / В сборнике: рациональное использование сырья и создание новых продуктов биотехнологического назначения материалы международной научно-практической конференции по актуальным проблемам в области биотехнологии. 2020
21. Костромичева Е.В. Исследования влияния микотоксинов Fusarium oxysporu на активность фермента супероксиддисмутазы в клетках проростков гороха и пшеницы. / В сборнике: Рациональное использование сырья и создание новых продуктов биотехнологического назначения Материалы Международной научно-практической конференции по актуальным проблемам в области биотехнологии. 2020
22. Костромичева Е.В. Исследование влияния микотоксинов грибов рода Fusarium на рост и развитие проростков яровой пшеницы. / В сборнике: Рациональное использование сырья и создание новых продуктов биотехнологического назначения Материалы Международной научно-практической конференции по актуальным проблемам в области биотехнологии. 2020
23. Матулкин Д.К., Павловская Н.Е. Стимуляторы роста на основе метаболитов гриба Trichoderma. /В сборнике: Рациональное использование сырья и создание новых продуктов биотехнологического назначения Материалы Международной научно-практической конференции по актуальным проблемам в области биотехнологии. 2020
24. Павловская Н.Е., Сидоренко В.С., Горьков А.А. Структурный анализ урожая озимой пшеницы под влиянием биопрепаратов. / В сборнике: Рациональное использование сырья и создание новых продуктов биотехнологического назначения Материалы Международной научно-практической конференции по актуальным проблемам в области биотехнологии. 2020
25. Павловская Н.Е., Яковлев А.В. Исследования влияние компонентов комплексных биопрепаратов на динамику роста гриба Fusarium. / В сборнике: Рациональное использование сырья и создание новых продуктов биотехнологического назначения Материалы Международной научно-практической конференции по актуальным проблемам в области биотехнологии. 2020
26. Солохина И.Ю. Биологическая активность фракционного состава биофлавоноидов гречихи. / Современное состояние, перспективы развития АПК и производства специализированных продуктов питания
Омск, 24 апреля 2020 г. С.167-170.
На XXII Российской агропромышленной выставке «Золотая осень — 2020» Конкурс «За успешное внедрение инноваций в сельское хозяйство» Получена золотая медаль за разработку: «Пестицид биологического происхождения «Нигор плюс»»
Получены:
— Акт внедрения нового биологического средства защиты растений Управление Россельхознадзора по Орловской и Курской областям
— Акт внедрения биологического средства защиты растений ООО «Андреевичи»
