Титульный лист и исполнители
РЕФЕРАТ
Отчет 37 с., 1 кн., 4 рис., 15 табл., 41 источн.
КРУПНЫЙ РОГАТЫЙ СКОТ, КОСТРОМСКАЯ ПОРОДА, ЛОКУС β-СN и k-СN, ВИРУС ЛЕЙКОЗА, АНТИГЕНЫ ЛЕЙКОЦИТОВ, ПЦР-РВ, АЛЛЕЛЬНЫЙ ПРОФИЛЬ ГЕНОВ
Объект исследований: крупный рогатый скот костромской, ярославской, черно-пестрой пород, разводимых на территории Костромской области.
Цель работы – определение особенностей аллельного профиля генов, ассоциированных с хозяйственно полезными признаками крупного рогатого скота костромской породы с целью ее дальнейшего совершенствования.
В процессе работы проводили молекулярно-генетические исследования образцов ДНК (n=142), полученных из крови коров костромской, черно-пестрой и ярославской пород. Методом ПЦР-РВ определяли полиморфизм гена бета-казеина: три генотипа β-CN А2/А2, β-CNА1/А2, β-CNА1/А1 и два аллеля β-CNА1 и β-CNА2 с некоторыми модификациями. С помощью тест-системы «ЛЕЙКОЗ», разработанной ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, г. Москва, было протестировано 32 животных костромской, 37 – черно-пестрой и 29 – голштинской пород хозяйств Костромской области. Полиморфизм гена BoLA DRB3 по аллелям, связанным с высокой (*1501) и низкой (*0902) провирусной нагрузкой, определяли методом секвенирования.
В ходе проведения научно-исследовательской работы получены новые данные об особенностях аллельного профиля генов, ассоциированных с хозяйственно полезными признаками крупного рогатого скота костромской породы.
Результаты исследований будут использованы при разработке планов селекционно-племенной работы в регионе для формирования стад крупного рогатого скота костромской породы по генам, ассоциированным с хозяйственно полезными признаками, в учебном процессе при чтении лекций и проведении лабораторно-практических занятий по дисциплине «Генетика и селекция в животноводстве» для подготовки студентов по направлению 36.05.01 Ветеринария, 36.03.02 Зоотехния, магистров по направлению 36.04.02 Зоотехния, аспирантов по направлению подготовки 36.06.01 Ветеринария и зоотехния.
ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
В настоящем отчете о НИР применяют следующие термины с соответствующими определениями:
Аллель – один из возможных структурных состояний гена, каждая из которых характеризуется уникальной последовательностью ДНК. Аллели гена находятся в парных хромосомах (одна из которых наследуется от матери, другая от отца) и определяют направление развития одного и того же признака.
Ген (локус) – наследуемая часть генома, оказывающая влияние на какой-либо фенотипический признак.
Гетерозиготность – наличие в организме одной или нескольких пар различающихся аллелей.
Гетерогенность групп животных генотипическая – неоднородность составляющих групп особей, обусловленная разнообразием генотипов в пределах одной группы.
Гомозиготность – наличие в генотипе организма одной или нескольких пар одинаковых аллелей.
Гомогенность групп животных генотипическая — однородность составляющих групп особей, обусловленная однообразием генотипов в пределах группы.
Дезоксирибонуклеиновая кислота – генетический материал, который определяет наследственные характеристики большинства живых организмов.
ДНК-маркеры – участки нуклеиновой последовательности ДНК, отличающиеся полиморфизмом и тесно связанные с генами, отвечающими за нужный признак.
Мутация – стойкое, то есть такое, которое может быть унаследовано потомками изменение генома.
Полиморфизм – гены, которые представлены в популяции несколькими разновидностями – аллелями, что обуславливает разнообразие признаков внутри вида.
ПЕРЕЧЕНЬ СОКРАЩЕНИЙ И ОБОЗНАЧЕНИЙ
В настоящем отчете о НИР применяют следующие сокращения и обозначения:
НИР – научно-исследовательская работа
CSN2 (β-CN) – ген бета-казеина
CSNЗ (k-CN) – ген каппа-казеина
ПЦР-РВ – полимеразная цепная реакция в режиме реального времени
ДНК – дезоксирибонуклеиновая кислота (deoxyribonucleic acid, DNA)
КРС – крупный рогатый скот
ЭДТА – этилендиаминтетрауксусная кислота (ethylenediaminetetraacetic acid, EDTA)
BoLA – антигены лейкоцитов крупного рогатого скота (Bovine Leukocyte Antigenes)
ВЛКРС – вирус лейкоза крупного рогатого скота
ВВЕДЕНИЕ
Современные достижения молекулярной генетики сделали возможным идентифицировать гены, связанные с хозяйственно полезными признаками крупного рогатого скота. Принимая во внимание современные тенденции селекции крупного рогатого скота с точки зрения технологических свойств молока, информация о генотипах аллелей молочных белков является существенным фактором, который должен быть учтен в селекционной работе, особенно в стратегии выбора быков-производителей [1].
Каппа-казеин (CSNЗ) – одна из фракций казеина и ген, контролирующий его образование в молоке, имеет 10 аллельных вариантов из которых выделено два, встречающихся наиболее часто – А и В, в трех различных сочетаниях генотипов – АА, АВ, ВВ. При производстве сыра из молока коров с генотипом CSNЗ В/В установлено, что время коагуляции было короче на 24%, консистенция сгустка была лучше, а выход готовой продукции на 6% больше, чем при производстве сыра из молока коров, несущих гомозиготный генотип CSNЗ АА [2, 3, 4, 5].
В последнее время все чаще исследователи обращают внимание на бета-казеин (CSN2), его роль менее известна зоотехникам. Бета-казеин имеет в составе 209 аминокислот как минимум в 12 вариантах. В результате точечной мутации в VII-м экзоне гена бета-казеина (хромосома 6) замена цитозина на аденин привела к конверсии пролина (аллель А2, кодон ССТ) на гистидин (аллель А1, кодон САТ). На основании этой изменчивости молоко делится на две группы – А1 и А2 [6].
Интерес к этой проблеме связан с тем, что аллель β-CNА1 способствует развитию серьезных отклонений в организме человека [7, 8, 9, 10, 11]. Есть все основания полагать, что производство А2-молока может быть выгодно и производителям, и переработчикам молока, а также многим потребителям, вынужденным отказываться в настоящее время от этого ценного продукта [3].
Не теряет свою актуальность проблема распространения вируса лейкоза крупного рогатого скота. В России, несмотря на усилия, направленные на борьбу с лейкозом, эта болезнь занимает первое место среди инфекционных заболеваний крупного рогатого скота – на него приходится около 65,5% учтенных случаев инфекционной патологии [12]. На сегодняшний день диагноз на лейкоз устанавливается по реакции иммунной диффузии (РИД) и иммуноферментному анализу (ИФА), что не позволяет выявить вирусоносительство у молодняка моложе полугода [13]. Используя метод полимеразной цепной реакции (ПЦР) диагностировать интегрированную форму ВЛКРС можно с 10-дневного возраста животных. Генетически обусловленная устойчивость к болезни связана с геном BoLA-DRB3, который входит в главный комплекс гистосовместимости. Кроме устойчивости (восприимчивости) к лейкозу ген BoLA-DRB3 связан с признаками продуктивности и качеством молока. Данные о полиморфизме гена BoLA-DRB3 позволяют проводить маркерную селекцию с целью получить высокопродуктивных и устойчивых к заболеванию животных [14].
Таким образом, изучение полиморфизма генов каппа- и бета-казеина, выявление генотипов, определяющих устойчивость к лейкозу в сочетании с повышенной молочной продуктивностью, является актуальной научной задачей, так как именно акцент на качественные показатели молока, долголетие, устойчивость к ряду заболеваний и поддержка со стороны государства дает шанс на сохранение и рациональное использование малочисленных отечественных пород.
ОСНОВНАЯ ЧАСТЬ ОТЧЕТА О НИР
1. Обзор литературы
1.1. Племенная база молочного скота Костромской области
Племенная база по разведению крупного рогатого скота молочного направления продуктивности региона представлена тремя породами: костромской, ярославской и черно-пестрой. Разведением занимаются 11 племенных заводов и племенных репродукторов Костромской области.
В таблице 1 представлен породный и классный состав крупного рогатого скота.
Таблица 1 – Породный и классный состав*
| Молочные породы | Всего,
голов |
По классам, голов | ||
| Элита-рекорд | Элита | 1 класс | ||
| Костромская | 3616 | 3614 | — | 2 |
| Черно-пестрая | 3600 | 3515 | — | 65 |
| Ярославская | 802 | 677 | 18 | 91 |
| Все поголовье | 8018 | 7806 | 18 | 178 |
Примечание: *данные бонитировки 2019 года
Среди племенного скота Костромской области, оцененного по комплексу хозяйственно полезных признаков (прошедших бонитировку), на долю костромской и черно-пестрой породы приходится по 45,0%, при этом остальное поголовье (10,0%) составляют животные ярославской породы. Из животных комплексных классов элита-рекорд и элита в костромской породе составляет 99,9% животных, в черно-пестрой – 97,6%, в ярославской – 86,7%.
Племенная база по разведению крупного рогатого скота костромской породы представлена тремя племзаводами (ОАО «Племзавод «Караваево» Костромского района, СПК «Гридино», СПК «Колхоз «Родина» Красносельского района) и двумя племрепродукторами (ООО Агрофирма «Планета» Буйского района, ООО «Минское» Костромского района).
Характеристика коров по молочной продуктивности и сроку хозяйственного использования приведены в таблице 2.
Таблица 2 – Характеристика коров по молочной продуктивности и сроку хозяйственного использования
| Порода | Всего, голов | Удой,
кг |
Молочный жир | Молочный белок | Срок хоз. использ., отел | ||
| % | кг | % | кг | ||||
| Костромская | 2650 | 6435 | 4,11 | 266,2 | 3,26 | 210,7 | 4,0 |
| Черно-пестрая | 3032 | 7150 | 3,98 | 285,0 | 3,26 | 233,3 | 3,4 |
| Ярославская | 452 | 5887 | 3,74 | 220,2 | 3,12 | 183,7 | 3,7 |
Как показывают данные таблицы 2, коровы черно-пестрой породы дают в среднем более высокий удой и производят больше молочного жира и молочного белка за лактацию. Однако при пересчете на пожизненную продуктивность картина меняется (рисунок 1).
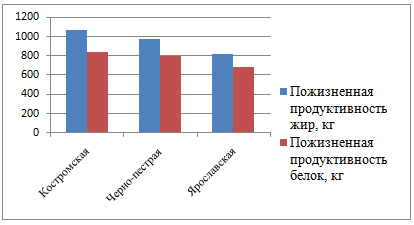
Рисунок 1– Величина пожизненной продуктивности (жир, белок, кг.) у пород молочного направления продуктивности региона (данные бонитировки 2019 года)
Пожизненная продуктивность по молочному жиру и молочному белку выше у коров костромской породы. При этом разность по молочному жиру между коровами костромской породы и животными черно-пестрой и ярославской пород составила 95,8 кг и 250,1 кг соответственно. По выходу молочного белка костромская порода превосходит вышеуказанные породы на 49,6 и 163,1 кг соответственно.
Эти данные, безусловно, подтверждают уникальный статус костромской породы крупного рогатого скота, как породы с длительным продуктивным долголетием. К сожалению, за последние два десятилетия поголовье костромской породы, как и других пород, разводимых в России, сократилось более чем в 3 раза. Сузился и ареал ее распространения. На сегодня основной массив животных этой породы сосредоточен в Костромской области. Именно акцент на качественные показатели молока, долголетие, устойчивость к ряду заболеваний и поддержка со стороны государства дает шанс на сохранение и рациональное использование этой малочисленной отечественной породы.
1.2. Ген каппа-казеина
Ген каппа-казеина – один из немногих известных генов, однозначно связанный с признаками белковомолочности и технологическими свойствами молока. Исследования зарубежных и отечественных ученых показали, что независимо от породной принадлежности коров объем и качество сыров и творога, производимых из их молока, в значительной степени определяются содержанием в сырье одной из фракций казеина – каппа-казеина. Структура этого белка контролируется одним полиморфным геном [15, 16, 17]. На сегодняшний день выявлено 10 его аллелей. Наиболее распространены в породах аллели А и В. В фенотипе у гетерозиготы проявляются оба аллеля, то есть наблюдается кодоминантный тип наследования признака. Причем лучшие технологические свойства молока (консистенция казеинового сгустка, время сычужного свертывания), меньшие его затраты на производство сыра и творога, а также более высокое качество этих продуктов отмечаются у коров с генотипом ВВ. Расход молока, полученного от животных с аллелями АА выше на 8-10%, особи с генотипом АВ занимают промежуточное положение [18, 19]. В связи с большой практической значимостью этого показателя в каталогах быков-производителей ведущих племенных предприятий России в последние годы стали указывать генотип животного по каппа-казеину.
Частота встречаемости желательных генотипов по каппа-казеину существенно варьирует по породам и странам [18, 20]. Так, при использовании швицкой породы американской селекции и голштинского скота в качестве улучшающих в популяциях молочного скота России наблюдается значительное снижение доли генотипов с аллелем В [18, 19, 21]. Частота B-аллеля у пород, относящихся к Bos taurus, выше и находится в диапазоне от 0,34 до 0,56 [22]. Согласно данным D. Vasicek et al. [23], аллельный вариант B представлен у животных голштино-фризской породы с частотой 0,21, у чёрно-пёстрой породы (немецкий тип) – 0,22, у симментальской породы – 0,56 и у породы пинцгау – 0,24.
Довольно высокая частота встречаемости этого же аллеля характерна для таких российских аборигенных пород, как калмыцкая (0,324), костромская (0,405) и ярославская (0,475) [17, 24].
Европейская ассоциация животноводов и ряд крупных коммерческих фирм по животноводству предложили считать ВВ генотип каппа-казеина экономически важным селекционным критерием для пород КРС, специализированных в молочном направлении продуктивности [25].
1.3. Ген бета-казеина
У пород крупного рогатого скота молочного направления локус бета-казеина очень полиморфен. Установлено, что β-CNА1 является мутантным и образован из β-CNА2 аллеля. Исследованиями последних 20 лет показано, что β-CNА1 вариант белка молока крупного рогатого скота и его производное бета-казоморфин 7 при потреблении могут способствовать развитию у человека патологий желудочно-кишечного тракта, ишемической болезни сердца, диабета, аутизма у детей, синдрома внезапной смерти новорожденных [7, 8, 9, 10, 11, 26].
Суть работ, посвященных данной теме, сводится к тому, что некоторые аллели бета-казеина вырабатывают белки, вызывающие разные болезни в организме взрослого человека и детей. Так, группой ученых [27], известные аллели в локусе бета-казеина (β-CN) предложено делить на два семейства, с учетом влияния на качество молока. В семейство А1 входят следующие пять аллелей, продукты которых являются ухудшателями молока (β-CNA1, β-CNB, β-CNC, β-CNF, β-CNG). Причем из пяти аллелей А1 семейства наибольшими ухудшателями молока коров, как известно, являются белки, образуемые мутантным β-CNА1 аллелем. В то же время А2 семейство представлено группой из семи аллелей: β-CNA2, β-CNA3, β-CND, β-CNE, β-CNH1, β-CNH2, β-CNI [1]. Установлено, что β-CNА1 аллель распространен там, где использовались быки-носители данного аллеля в селекционных мероприятиях. На формирование аллелотипа стада коров с учетом β-CNА2 и β-CNА1 аллелей влияют такие факторы, как генетическая генеалогия быка, эффект основателя линии, дрейф мутантного или нормального аллеля. Причем дрейф мутантного β-CNА1 аллеля, как внутри одного государства, так и между странами обусловлен искусственным отбором. Главной причиной такого явления служит жесткая селекция и широкое использование небольшой группы элитных быков-носителей β-CNА1 аллеля для искусственного осеменения большого массива коров, множественная овуляция и эмбриотрансплантация. Поступление мутантного β-CNА1 аллеля в Россию происходит также за счет покупки неаттестованного племенного материала (животные, семя, эмбрионы). Коровы тоже являются поставщиком мутантного аллеля, но в меньшей степени. Они больше служат резерватом, т.е. хранителем его в стаде в виде гомозигот (β-CNА1/β-CNА1) или гетерозигот (β-CNА1/β-CNА2) [10].
Мутантный β-CNА1 аллель является кодоминантным фактором. Следует отметить, что это новое явление в диагностике аномальных аллелей в молочном скотоводстве. Ранее выявленные мутантные аллели, вызывающие наследственные болезни, встречались только в виде рецессивных факторов [10]. Поэтому молоко А2 получают только от коров-носителей генотипа β-CNА2/А2 по локусу бета-казеина. В производственной практике обычно молоко от разных коров смешивают. Поэтому в обычном молоке всегда есть β-CNА1 белок.
Таким образом, есть все основания полагать, что производство А2 молока может быть выгодно и производителям, и переработчикам молока, а также многим потребителям, вынужденным отказываться в настоящее время от этого ценного продукта. Исследование полиморфизма гена β-CN в отечественных породах позволит считать его дополнительным перспективным селекционным признаком.
1.4. Ген BoLA-DRB3
Особый интерес представляют гены, участвующие в формировании полезных признаков. Одним из наиболее значимых в этом отношении генов является ген BoLA-DRB3, кодирующий антигены класса II главного комплекса гистосовместимости КРС, обладающий высоким аллельным разнообразием. Комплекс BoLA локализован на 23-й хромосоме. Отмечена гомология в строении проксимального района 17-й хромосомы мыши, несущей гены Н-2, 6-й хромосомы человека, несущей гены HLA, и 23-й хромосомы крупного рогатого скота [28].
Высокий полиморфизм BoLA-DRB3, чьи аллели связаны с устойчивостью или восприимчивостью к лейкозу крупного рогатого скота, позволяет рассматривать анализируемый ген в качестве молекулярного маркера, используемого в селекционно-генетических исследованиях [29, 30, 31, 32].
Связь между полиморфизмом гена BoLA DRB3 с восприимчивостью и устойчивостью к болезням широко изучена [29, 33, 31, 34, 35]. Обширное исследование BLV-инфицированного крупного рогатого скота голштинской породы показало значительную связь между наличием аллеля DRB3 *16 (*1501) с высокой провирусной нагрузкой в периферической крови, в то время как BoLA DRB3 *0902, подтип аллеля DRB3 *11, ранее связанный с устойчивостью к стойкому лимфоцитозу, был связан с низкой провирусной нагрузкой. Крупный рогатый скот с низкой провирусной нагрузкой, по-видимому, представляет состояние устойчивости к BLV, и было высказано предположение, что они не передают инфекцию в естественных условиях. Следовательно, идентификация этих аллелей может помочь в борьбе с инфекцией BLV с помощью генетически поддерживаемого отбора [36, 37].
На сегодняшний день согласно «Методическим указаниям по диагностике лейкоза крупного рогатого скота», утвержденным 23 августа 2000 года, диагноз на лейкоз устанавливается по реакции иммунной диффузии (РИД) и иммуноферментному анализу (ИФА), что не позволяет выявить вирусоносительство у молодняка моложе полугода [13]. Кроме того, «молчащий» интегрированный провирус не производит антигенов, и на него не вырабатываются антитела. В данном случае иммунологический тест дает отрицательный результат, однако животное, несущее провирус, сохраняет способность к передаче инфекции в результате вертикальной или горизонтальной передачи поражённых клеток при вскармливании, осеменении, вакцинировании стада. Развитие молекулярной генетики в мире и в нашей стране позволяет диагностировать интегрированную форму ВЛКРС уже с 10-дневного возраста животных, используя метод полимеразной цепной реакции (ПЦР). С технологической точки зрения ПЦР-диагностика провирусной ДНК является более удобной по сравнению с иммунологическими методами. Преимущества заключаются в относительно низкой стоимости подхода, высокой степени надежности и возможности использования в автоматизированных лабораторных комплексах. Как отмечают Глазунов В.И. с соавторами [38], высокая чувствительность ПЦР позволяет наиболее точно определять инфицированных животных и рационально, с меньшими экономическими потерями, проводить оздоровительные мероприятия, снижая уровень заболеваемости и напряженность эпизоотической ситуации.
Несмотря на то, что различные породы КРС в разной степени восприимчивы к лейкозу, в официальной статистике отсутствуют систематизированные данные по мониторингу и эпизоотологической характеристике распространения ВЛКРС среди российских пород. Согласно исследованиям Галеева Р.Ф. и соавт. [39], в России относительно устойчивы к лейкозу красная горбатовская, ярославская, симментальская породы крупного рогатого скота и их производные (сычевская, костромская, курганская и др.). Чаще подвержены болезни чёрно-пёстрые и красные породы с долей крови немецкого, датского или голландского скота.
Некоторые исследователи отмечают ассоциации разных аллельных вариантов гена BoLA-DRB3 с признаками молочной продуктивности и качества молока. Очевидно, это связано с тесным физическим сцеплением этого гена и гена пролактина (bPRL). Установлено, что ген bPRL находится в непосредственной близости с геном BoLA-DRB3 на 23 хромосоме и в большинстве случаев эти гены наследуются сцеплено [40].
Так, в работе S. Sharif [31] на значительной выборке (n=835) показана достоверная взаимосвязь наличия *8 аллеля с увеличением удоев, содержания жира и белка в молоке, *22 – со снижением количества молока и белка в лактации. Наличие *11 и *23 аллелей, по мнению R. Rupp [34], ассоциировано с повышенной молочной продуктивностью. Интересная взаимосвязь выявлена между наличием в генотипе аллелей: *3, *9, *11, *26 и высоким уровнем содержания белка в молоке у норвежского скота [31]. В этой работе прослеживается гипотеза о том, что следует рассматривать взаимосвязь присутствия не отдельно взятых аллелей и продуктивных качеств, а взаимосвязь таковых с генотипами в целом. Установлено также, что наличие у животного аллелей *22 и *11 влияет на жирность молока, *22 и *24 – на содержание в нем белка [31, 34].
Данные о полиморфизме гена BoLA-DRB3 позволяют проводить маркер-направленную селекцию с целью получить высокопродуктивных, а главное устойчивых к заболеваниям животных. Это позволит снизить необходимость сложных и дорогостоящих мер профилактики и борьбы с распространением лейкоза [32].
Таким образом, многими авторами установлено, что существует определенная связь между полиморфными генетическими структурами и хозяйственно полезными признаками крупного рогатого скота. Одними из перспективных генов-маркеров продуктивности коров являются гены бета- и каппа-казеина, а также ген главного комплекса гистосовместимости (BoLA-DRB3). Изучение полиморфизма генов, ассоциированных с параметрами молочной продуктивности крупного рогатого скота, позволяет более эффективно вести селекцию, направленную на улучшение хозяйственно полезных признаков.
Племенная база крупного рогатого скота молочного направления продуктивности Костромской области представлена костромской, ярославской и черно-пестрой породами. Известно, что костромская порода крупного рогатого скота по сравнению с другими разводимыми на территории региона породами обладает значительным генетическим потенциалом, выраженным, в том числе, продолжительным сроком продуктивного использования, хорошим качеством молока при достаточно высоком удое, а также естественной резистентностью к ряду заболеваний. Тем не менее, постоянный процесс притока генетической информации в породу за счет улучшения швицкой породой, миграция генов между популяциями, смена поколений неизбежно влияют на генетическую структуру костромской породы, и это требует тщательного изучения. Кроме того, имеется множество генов, значение которых в последние годы оценено весьма высоко, но в костромской породе они до сих пор не изучены. Примером такого гена является ген бета-казеина, оказывающий значительное влияние на диетические и технологические свойства молока.
2. Материал и методы
При исследовании полиморфизма по генам каппа- и бета-казеина использовались данные по 225 быкам-производителям сравниваемых и родственных пород, представленных на официальных сайтах АО «Головной центр по воспроизводству сельскохозяйственных животных» и ОАО «Ярославское» по племенной работе.
В процессе работы проводились молекулярно-генетические исследования образцов ДНК (n=142), полученных из крови коров костромской, черно-пестрой и ярославской пород. Отбор крови осуществляли из хвостовой вены в промаркированные стерильные вакуумные пробирки «Vacumed» с ЭДТА К2. Выделение ДНК из биологического материала проводили с помощью набора «DNeasy Blood & Tissue Kit» для выделения ДНК из образцов крови и тканей животных, а также из клеток, дрожжей, бактерий и вирусов (производитель «Qiagen», Германия) в соответствии с инструкцией производителя. Полиморфизм гена бета-казеина определяли методом ПЦР-РВ – определяли три генотипа β-CNА2/А2, β-CNА1/А2, β-CNА1/А1 и два аллеля β-CNА1 и β-CNА2 с некоторыми модификациями [22].
Для решения задач исследования, связанных с генотипированием однонуклеотидного полиморфизма гена бета-казеина (rs43703011), реализован метод, позволяющий определять полиморфизм генов на уровне аллелей. Метод основан на определении температуры плавления олигонуклеотидых зондов, которая напрямую зависит от наличия или отсутствия нуклеотидных замен в матрице ДНК в области гибридизации зондов.
Для определения температуры плавления, помимо флуоресцентно-меченого типирующего зонда, в реакционную смесь добавлялся тугоплавкий олигонуклеотидный зонд с гасителем флуоресценции, который гибридизуется на матрице ДНК в непосредственной близости к типирующему зонду («примыкает» к нему). При низкой температуре происходит гибридизация зондов с амплифицированной в ходе ПЦР ДНК, в результате чего флуоресцентный краситель оказывается рядом с гасителем флуоресценции. По увеличению флуоресцентного сигнала при повышении температуры можно определить температуру плавления типирующего зонда и, следовательно, определить наличие однонуклеотидной замены. Для повышения надежности типирования в данной работе предложен метод одновременной гибридизации с двумя альтернативными типирующими зондами, меченными различными флуорофорами (рис. 2).
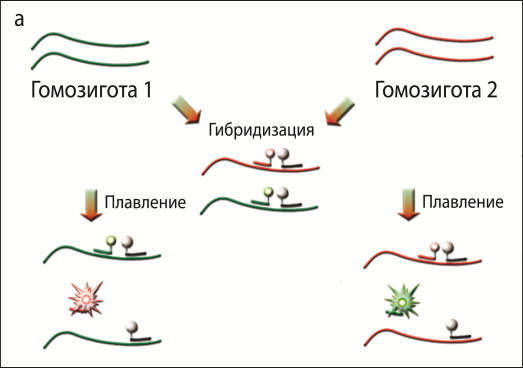
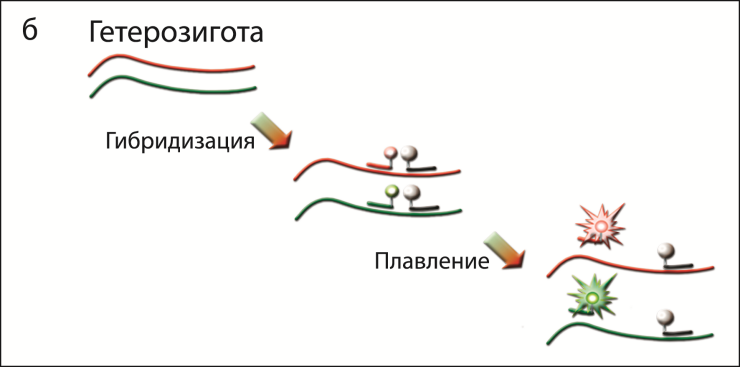
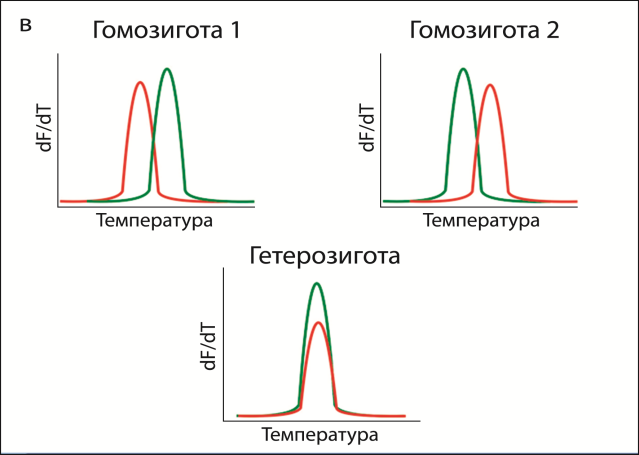
Рисунок 2 – Схема генотипирования по гену бета-казеина: а) принцип метода генотипирования, б) анализ гетерозиготного образца, в) схема реализации разработанного подхода в программе DTmaster (ЗАО «НПФ ДНК-Технология»).
В состав смеси для постановки ПЦР (из расчета на 1 образец ДНК) входило 5 мкл образца ДНК, 20 мкл ПЦР-смеси, 10 мкл раствора полимеразы (0,5 мкл TAQ-AT+полимеразы и 10 мкл ПЦР-буфера) и 1 капля минерального масла. В состав ПЦР-смеси из расчета на 1 пробу ДНК входили следующие компоненты: однократный ПЦР-буфера, 4*25 мМ смеси дезоксирибонуклеотидов, 0,1 пм/мкл зонда FAM, 0,1 пм/мкл зонда VIC, 0,3 пм/мкл зонда BHQ, 0,1 пм/мкл праймера №1 и 0,6 пм/мкл праймера №2.
Амплификацию ДНК гена β-CN и его типирование проводили по следующей программе (таблица 3).
Таблица 3 – Программа амплификации ДНК гена β-CN
| Этап | Температура, °С | Продолжительность, мин | Кол-во циклов | Режим оптических измерений | Тип блока |
| 1 | 80 | 0:15 | 1 | Цикл | |
| 94 | 1:30 | ||||
| 2 | 94 | 0:30 | 5 | Цикл | |
| 67 | 0:15 | V | |||
| 3 | 94 | 0:10 | 45 | Цикл | |
| 67 | 0:15 | V | |||
| 4 | 94 | 0:05 | 1 | Цикл | |
| 5 | 25 | 0:30 | 1 | Цикл | |
| 6 | 25 | 0:15 | 50 | V | Плавление |
| 7 | 10 | Хранение | Хранение | ||
С помощью тест-системы «ЛЕЙКОЗ», разработанной ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, г. Москва, для определения ДНК провируса лейкоза крупного рогатого скота (bovine leukosis virus), методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией в режиме реального времени было протестировано 32 пробы биологического материала животных костромской, 37 – черно-пестрой и 29 – голштинской пород из хозяйств Костромской области. В основе метода лежит амплификация специфического участка ДНК провируса лейкоза крупного рогатого скота (последовательности, интегрированной в ДНК лейкоцитов КРС) за счет многократного повторения циклов денатурации ДНК в исследуемой пробе, отжига специфических олигонуклеотидных затравок (праймеров) и зондов, меченных флуоресцентными красителями, и синтеза комплементарных цепей ДНК с помощью фермента Taq-полимеразы. Программа ПЦР состояла из 4 этапов (таблица 4).
Таблица 4 – Программа для амплификации ДНК провируса лейкоза КРС
| Этап | Температура, °С | Продолжительность, мин | Кол-во циклов |
| 0 | 95 | пауза | |
| 1 | 95 | 5:00 | 1 |
| 2 | 95 | 0:10 | 42 |
| 69 | 0:10 | ||
| 72 | 0:10 | ||
| 3 | 72 | 1:00 | 1 |
| 4 | 10 | Хранение | |
Для определения полиморфизма гена BoLA-DRB3 по аллелю *1501, связанному с высокой провирусной нагрузкой, и аллелю *0902 – с низкой провирусной нагрузкой, были собраны образцы периферической крови от 50 животных костромской породы. Выделение ДНК из крови осуществляли на сорбирующих колонках производства «Qiagen» (Германия). Образцы были использованы для проведения генетического анализа. Подготовка образцов включала амплификацию фрагмента 2 экзона гена BoLA-DRB3 (праймеры ex2_for — GTGTCATTTCTTCAACGGGAC и ex2_rev – CGACCCCGTAGTTGTGTCTG) с нанесением ПЦР-продуктов на электрофорез для исключения наработки неспецифических продуктов. Очистка ПЦР-продуктов осуществлялась с помощью «AMpure XP Beads» («Beckman Coulter», США) в соответствии с инструкцией производителя.
Для контроля качества ДНК и оценки эффективности работы праймеров продукты ПЦР анализировали методом агарозного гель-электрофореза. Для приготовления 1 л 10-кратного TBE-буфера добавляли в мерную колбу 108 г TRIS (основного), 55 г борной кислоты, 40 мл 0,5М ЭДТА (pH 8,0) и добавляли mQ до 1 л. Для приготовления геля для электрофореза в мерном стакане на 50 мл смешивали 25 мл 1% TBE-буфера, 0,25 г агарозы и 1 мкл бромистого этидия. Разогревали смесь в микроволновой печи до полного растворения агарозы. Заливали смесь в камеру для приготовления гелей. Образцы наносили в лунки в составе 5x загрузочного буфера (бромфенол/глицерин). Условия проведения электрофореза выставляли в соответствии с инструкцией производителя камеры «Mupid-exU» (Япония).
Специфические ПЦР-продукты использовали в качестве ДНК-матрицы при проведении сиквенсной реакции. В сиквенсной реакции использовали комплементарный праймер ex2_for и набор меченых дидезоксирибонуклеотидтрифосфатов «BigDye Terminator Kit» («Applied Biosystems», США). Реакцию ПЦР проводили в соответствии с протоколом, рекомендованным производителем, по следующей программе: 94˚С – 10 с, 56˚С – 20 с, 72˚С – 20 с в течение 40 циклов, при этом использовалась реакционная смесь, состоящая из 1-кратного ПЦР-буфера, смеси дезоксирибонуклеотидов (25 мМ каждого), 0,1 пм/мкл праймера №1 и 0,6 пм/мкл праймера №2.
Таблица 5 – Программа амплификации фрагмента 2 экзона гена BoLA-DRB3
| Этап | Температура, °С | Продолжительность, мин | Кол-во циклов | Тип блока |
| 1 | 80 | 0:30 | 1 | Цикл |
| 94 | 1:30 | |||
| 2 | 94 | 0:30 | 5 | Цикл |
| 64 | 0:15 | |||
| 3 | 94 | 0:10 | 45 | Цикл |
| 64 | 0:15 | |||
| 4 | 10 | Хранение | Хранение | |
Дальнейшая подготовка продукта для проведения реакции секвенирования включала химическую денатурацию матрицы с помощью денатурирующего буфера TSR («Template Suppression Reagent», «Applied Biosystems», США) в соответствии с протоколом, рекомендованным производителем. Секвенирование проводили с помощью автоматического секвенатора «ABI PRISM 310 Genetic Analyzer» («Applied Biosystems», США) согласно рекомендациям производителя.
Возможность определения первичной нуклеотидной последовательности обеспечивалась добавлением в сиквенсную реакцию меченых нуклеотидов, терминирующих синтез. Формирующиеся фрагменты разной длины, несущие меченый концевой нуклеотид, разделялись по длине с фиксацией спектра излучения флуорофора. Продукт сиквенсной реакции использовался для постановки на автоматическом секвенаторе «ABI 3130 Genetic Analyzer» («Applied Biosystems», США) в соответствии с инструкцией производителя. Визуализация хроматограмм осуществлялась с помощью онлайн алгоритма «Benchling» (https://www.benchling.com/). Определение аллелей производится автоматически с помощью программного сценария BDRB32ex.
Результаты исследований обработаны методами популяционно-генетического и биометрического анализа с использованием программных возможностей Мicrosoft Excel, 2010. Достоверность результатов оценивали по критерию Стьюдента.
3. Результаты и их обсуждение
3.1. Особенности аллельного профиля генов κ-CN и β-CN быков-производителей молочных пород
Данные по распространению генотипов каппа-казеина у быков-производителей восьми молочных пород приведены в таблице 6.
Таблица 6 – Полиморфизм гена k-CN у быков-производителей пород молочного направления продуктивности
| Порода | Частота встречаемости генотипов и аллелей k-CN | ||||
| генотипы | аллели | ||||
| АА | АВ | ВВ | А | В | |
| Черно-пестрая (n=17) | 0,5294 | 0,4706 | – | 0,7647 | 0,2352 |
| Голштинская (n=92) | 0,5000 | 0,3587 | 0,1413 | 0,8044 | 0,1956 |
| Айширская (n=20) | 0,8000 | 0,2000 | – | 0,8000 | 0,2000 |
| Симментальская (n=18) | 0,5556 | 0,3889 | 0,0555 | 0,7778 | 0,2222 |
| Ярославская (n=39) | 0,6154 | 0,2820 | 0,1026 | 0,8205 | 0,1795 |
| Джерсейская (n=13) | 0,0769 | 0,2308 | 0,6923 | 0,1538 | 0,8462 |
| Бурая швицкая (n=16) | 0,1875 | 0,3125 | 0,5000 | 0,3437 | 0,6563 |
| Костромская (n=10) | – | 0,6000 | 0,4000 | 0,3000 | 0,7000 |
Оценка племенных ресурсов быков-производителей по гену k-CN показала, что наибольшая частота желательного генотипа ВВ встречается среди бурых пород – джерсейской, бурой швицкой и костромской – от 0,4000 у быков костромской до 0,6933 у джерсейской породы. Следует отметить, что у быков-производителей костромской породы не выявлено животных, гомозиготных по аллелю А. У быков черно-пестрой, голштинской, айширской, симментальской и ярославской пород преобладает генотип k-CNА/А, с частотой встречаемости от 0,5000 в голштинской до 0,800 в айширской породе. Частота распространения аллеля А варьирует у этих пород от 0,7647 в черно-пестрой породе до 0,8205 в ярославской породе. В то время как желательный генотип k-CN В/В имеет низкую частоту встречаемости от 0,0555 в симментальской до 0,1413 в голштинской породе. Из 20 быков-производителей айширской породы не выявлено животных с генотипом k-CN В/В.
В последнее время интерес селекционеров направлен на изучение полиморфизма гена β-CN, так как он может повлиять на закупочную цену молока. На волне интереса к молоку А2 многие племенные предприятия стали определять генотип быков-производителей по гену β-CN (гену белка β-казеина). Данные по встречаемости аллельных вариантов гена β-CN у производителей восьми пород приведены в таблице 7.
Таблица 7 – Полиморфизм гена β-CN у быков-производителей пород молочного направления продуктивности
| Порода | Частота встречаемости генотипов и аллелей β-CN | ||||
| генотипы | аллели | ||||
| А1А1 | А1А2 | А2А2 | А1 | А2 | |
| Черно-пестрая (n=13) | 0,1538 | 0,7696 | 0,0769 | 0,5385 | 0,4615 |
| Голштинская (n=92) | 0,1315 | 0,3815 | 0,4870 | 0,3224 | 0,6776 |
| Айширская (n=11) | 0,3636 | 0,3636 | 0,2728 | 0,5454 | 0,4546 |
| Симментальская (n=7) | 0,4285 | 0,4285 | 0,1430 | 0,6429 | 0,3571 |
| Ярославская (n=24) | 0,3334 | 0,4583 | 0,2083 | 0,58338 | 0,4167 |
| Джерсейская (n=13) | 0,1540 | 0,5384 | 0,3076 | 0,4231 | 0,5769 |
| Бурая швицкая (n=11) | 0,0910 | – | 0,9090 | 0,0909 | 0,9091 |
| Костромская (n=10) | – | 0,3750 | 0,6250 | 0,1875 | 0,8125 |
Оценка распространения желательного генотипа β-CNА2/А2 среди быков-производителей молочного направления продуктивности показала, что лидируют две породы – швицкая и костромская, с частотой встречаемости 0,9090 и 0,6250 соответственно.
Если же принять во внимание частоту распространения аллеля β-CNА2 у быков-производителей разных пород, то он выше у швицкой породы (0,9091), костромской (0,8125) и голштинской (0,6776).
Однако следует признать, что получение стад, полностью состоящих из коров с желательными комплексными генотипами k-CNА/В β-CNА2/А2 и k-CNВ/В, β-CNА2/А2 – это длительная и трудоёмкая зоотехническая работа. В связи с этим необходимо ответить на вопрос: возможно ли отбирать гетеро- и гомозиготных животных по гену k-CN и гомозиготных по гену β-CN, не ухудшая при этом молочную продуктивность?
Для ответа на этот вопрос проанализирована разность по продуктивности между дочерями производителей с разными генотипами и их сверстницами (таблица 8, рисунок 3).
Таблица 8 – Продуктивность дочерей быков разных генотипов по гену β- и k-казеина
| Генотип быков | n, голов | Удой дочерей быков, кг | Разность по удою дочери ± сверстницы, кг | |
| β-CN | k-CN | |||
| А1А1 | АА | 15 | 6326,8±225,9 | 340,5±157,4 |
| АВ | 5 | 6770,8±451,2 | 416,3±219,1 | |
| ВВ | 3 | 6448,0 ±174 | 31,7±96,36 | |
| А1А2 | АА | 17 | 6647,0±232,3 | 573,4±137,53** |
| АВ | 27 | 6301,7±278,0 | 428,4±98,123* | |
| ВВ | 8 | 6103,0±701,1 | 308,3±32,73 | |
| А2А2 | АА | 23 | 6376,3±219,3 | 343,5±107,9 |
| АВ | 14 | 6181,8±630,2 | 971,9±187,6 1* 2* 3*** 5* 6** 7** | |
| ВВ | 10 | 6913,0±483,9 | 959,8±225,9 1* 3** 6* 7* | |
| В среднем по всем генотипам | 124 | 6452 | 486,0 | |
Примечание. Цифровыми индексами обозначена достоверная разность текущего значения и значения определенного генотипа: 1 — А1А1АА, 2 — А1А1АВ, 3 — А1А1ВВ, 4 — А1А2АА, 5 — А1А2АВ, 6 — А1А2ВВ, 7 — А2А2АА, 8 — А2А2АВ при различных уровнях достоверности (* – Р<0,05; ** – Р<0,01; *** – Р<0,001).
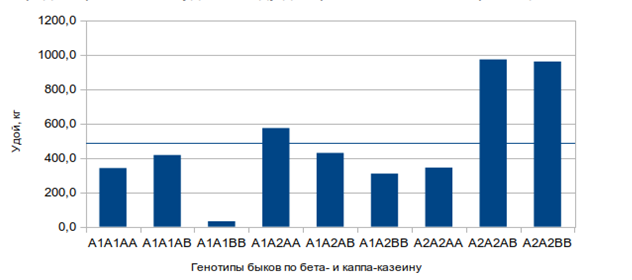 Рисунок 3 – Разность по удою между дочерями быков-производителей разных генотипов и их сверстницами
Рисунок 3 – Разность по удою между дочерями быков-производителей разных генотипов и их сверстницами
Как показывают данные таблицы, только у дочерей быков с комплексным генотипами k-CNВ/В, β-CNА2/А2и k-CNА/В β-CNА2/А2 разность по удою по сравнению со средним значением была выше на 455 и 474 кг (Р<0,05) соответственно.
Таким образом, быки с данными генотипами являются наиболее ценными в селекционном отношении. После определения желательных генотипов по генам k-CN и β-CN возникает вопрос: в каких молочных породах крупного рогатого скота данные генотипы преобладают?
Анализ распространения желательных комплексных генотипов k-CNВ/В, β-CNА2/А2 и k-CNА/В β-CNА2/А2 у быков-производителей 8 пород показал, что лидируют две породы – швицкая и костромская с частотой встречаемости 0,7273 и 0,5000 соответственно (таблица 9).
Таблица 9 – Частота комплексных генотипов по генам k-CN и β-CN
| Порода | Частота генотипов по генам k-CN и β-CN | ||||||||
| АА | АВ | ВВ | |||||||
| А1А1 | А1А2 | А2А2 | А1А1 | А1А2 | А2А2 | А1А1 | А1А2 | А2А2 | |
| Черно-пестрая (n=13) | 0,0770 | 0,3076 | 0,2038 | – | 0,4116 | – | – | – | – |
| Голштинская (n=92) | 0,0790 | 0,0391 | 0,0131 | 0,1579 | 0,1579 | 0,0657 | 0,2235 | 0,1710 | 0,0928 |
| Айширская (n=11) | 0,1428 | – | – | – | 0,5714 | – | 0,2858 | – | – |
| Симментальская (n=7) | 0,1428 | – | 0,1428 | 0,1428 | 0,4286 | – | 0,2858 | – | – |
| Ярославская (n=24) | 0,1250 | – | – | 0,2500 | 0,3750 | – | 0,1250 | – | 0,1250 |
| Джерсейская (n=13) | – | – | 0,0770 | – | 0,0770 | 0,1538 | 0,1538 | 0,4614 | 0,0770 |
| Бурая швицкая (n=11) | – | – | 0,1818 | – | – | 0,0909 | 0,0909 | – | 0,6364 |
| Костромская (n=10) | – | – | – | – | 0,3750 | 0,2500 | – | 0,1250 | 0,2500 |
Особое внимание следует обратить на костромскую породу крупного рогатого скота, которая является одной из лучших отечественных пород. В настоящее время относительная численность скота костромской породы в РФ составляет всего 0,37% от всего поголовья коров молочного направления продуктивности. Именно акцент на технологические и диетические свойства молока костромских коров даст возможность сохранить ценную отечественную породу.
Дальнейшая работа c костромской породой должна быть направлена на создание референтной популяции с улучшенными качественными показателями молока. Это позволит сохранить малочисленные ценные отечественные породы крупного рогатого скота, неспособные на сегодняшний день конкурировать с обильномолочными импортными породами.
3.2. Особенности аллельного профиля гена β-CN у коров костромской породы
По мнению многих исследователей, аллель β-CNА1 распространен в тех стадах, где в селекционных мероприятиях использовались быки-носители данного аллеля. На формирование аллелотипа стада коров с учетом β-CNА2 и β-CNА1 аллелей влияют такие факторы, как генетическая генеалогия быка, эффект основателя линии, дрейф мутантного или нормального аллеля.
Коровы тоже являются поставщиком мутантного аллеля, но в меньшей степени. Они больше служат резерватом, т.е. хранителем его в стаде в виде гомозигот (β-CNА1 / β-CNА1) или гетерозигот (β-CNА1/β-CNА2).
В таблице 10 приведены данные по частоте встречаемости аллелей и генотипов по гену β-CN у коров костромской, ярославской, черно-пестрой породах.
Таблица 10 – Частота встречаемости аллелей и генотипов по гену β-CN у коров ярославской, черно-пестрой и костромской породах
| Порода | Частота встречаемости генотипов и аллелей β-CN | ||||
| генотипы | аллели | ||||
| А1А1 | А1А2 | А2А2 | А1 | А2 | |
| Костромская порода: | |||||
| СПК «Гридино» (n= 43) | 0,0232 | 0,3023 | 0,6744 | 0,1744 | 0,8256 |
| СПК «Колхоз «Родина» (n= 40) | 0,1000 | 0,3750 | 0,5250 | 0,2875 | 0,7125 |
| Итого (n= 83) : | 0,0602 | 0,3373 | 0,6025 | 0,2289 | 0,7711 |
| Ярославская (n= 30) | 0,6666 | 0,2981 | 0,0333 | 0,8200 | 0,1800 |
| Черно-пестрая (n= 29) | 0,2068 | 0,5173 | 0,2759 | 0,4655 | 0,5345 |
Среди коров ярославской породы реже встречались животные с генотипом β-CNА2/А2 – 0,0333 и чаще с генотипом β-CNА1/А1 – 0.6666. По частоте аллелей среди коров больше встречается β-CNА1 – 0,8200 и меньше β-CNА2 – 0,1800.
У скота черно-пестрой породы чаще выявляли генотип CNА1/А2 с 0,5173, на втором месте генотип β-CNА2/А2 – 0,2759.
Высокая частота генотипа β-CNА2/А2 выявлена у коров костромской породы –0,6025, аллель β-CNА2 встречается у 77,1 % коров.
Таким образом, у коров и быков-производителей костромской породы преобладают животные с желательным генотипом β-CNА2/А2, что дает возможность быстро перестроить селекционные программы на создание референтной популяции продуцирующей молоко А2А2.
3.3. Молочная продуктивность коров с разными генотипами по локусу β-CN
Изучить влияние уровня удоя и качественных свойств молока у коров ярославской породы с разными генотипами не представляется возможным, так как выявлена только одна корова с генотипом CNА2/А2. По костромской породе в СПК «Гридино» так же выявлена только одна корова с генотипом CNА1/А1.
Результаты по молочной продуктивности коров костромской породы СПК «Колхоз «Родина» за 305 дней лактации показали, что удой выше у коров с генотипом CNА2/А2 (таблица 11).
Таблица 11 – Молочная продуктивность коров костромской и черно-пестрой пород с разным аллелотипом по локусу бета-казеина
| Генотип | I лактация | III- лактация и старше | ||||
| удой, кг | жир, % | белок, % | удой, кг | жир, % | белок, % | |
| Костромская порода | ||||||
| СПК «Колхоз «Родина» | ||||||
| А1А1 | 5204±233 | 3,90±0,02 | 3,21±0,01 | 5459±245 | 3,95±0.03 | 3,23±0,02 |
| А1А2 | 4962±241 | 3,98±0,03 | 3,22±0,02 | 5856±278 | 3,99±0,04 | 3,24±0,03 |
| А2А2 | 5334±332 | 3,99±0,03 | 3,24±0,02 | 6238±211 | 3,99±0,03 | 3,23±0,01 |
| СПК «Гридино» | ||||||
| А1А1 | 3987 | 4,58 | 3,21 | 6063 | 4,77 | 3,31 |
| А1А2 | 5585±487 | 4,54±0,06 | 3,33±0,02 | 6008±211 | 4,61±0,04 | 3,33±0,02 |
| А2А2 | 5881 ±321 | 4,47±0,07 | 3,33±0,02 | 6670±228 | 4,37±0,06 | 3,33±0,02 |
| Черно-пестрая порода | ||||||
| А1А1 | 9015±342** | 3,97±0,04 | 3,10±0,03 | 10683±288 | 3,51±0,05 | 3,28±0,04 |
| А1А2 | 7849±328 | 3,98±0,05 | 3,16±0,03 | 9925±412 | 3,99±0,06 | 3,16±0,04 |
| А2А2 | 7784±301 | 3,99±0,06 | 3,15±0,04 | 10011±332 | 3,78±0,05 | 3,10±0,04 |
Примечание. Достоверность различий представлена в сравнении показателей А2А2 с А1А1 черно-пестрой породы крупного рогатого скота (* – Р<0,05; ** – Р<0,01; *** – Р<0,001).
Так, по третьей и последующим лактациям коровы костромской породы гомозиготные по аллелю CNА2 имели достоверно выше удой на 779 кг, чем коровы гомозиготные по аллелю CNА1. По качественному составу молока коровы разных генотипов различались незначительно.
В популяции скота черно-пестрой породы наблюдалась иная картина – коровы гомозиготные по аллелю CNА1 имели по первой лактации достоверно выше удой на 1231 кг, чем коровы гомозиготные по аллелю CNА2. По третьей и последующим лактациям достоверной разницы не получено.
Таким образом, определены особенности влияния генотипа β -CN у костромской и черно-пестрой породы в условиях региона.
3.4. Особенности аллельного профиля гена k-CN у коров костромской породы
За рубежом и у нас в стране полиморфизм гена CSN3 изучают уже многие годы. На сегодняшний день в литературе накопилось достаточно много сведений о влиянии B-аллельного варианта не только на качество и выход белковомолочных продуктов, но и на содержание белка в молоке коров. В таблице 12 приведены данные по частоте встречаемости аллелей и генотипов по гену k-CN у коров костромской, черно-пестрой и ярославской пород.
Таблица 12 – Частота встречаемости генотипов и аллелей k-CN у коров костромской, черно-пестрой и ярославской пород
| Порода | Частота встречаемости генотипов и аллелей k-CN | ||||
| генотипы | аллели | ||||
| АА | АВ | ВВ | А | В | |
| Костромская | 0,0602 | 0,3373 | 0,6025 | 0,2289 | 0,7711 |
| Черно-пестрая 1 | 0,6270 | 0,3240 | 0,0490 | 0,7900 | 0,2100 |
| Ярославская ч/п 2 | 0,3897 | 0,4123 | 0,1980 | 0,6011 | 0,3989 |
| Ярославская Михайловский тип2 | 0,6281 | 0,3400 | 0,0319 | 0,8000 | 0,2000 |
Примечание. Ссылка на первоисточники: 1 – Шайдуллин Р.Р., Ганиев А.С. (2015), 2 – Коновалов А.В., Ильина А.В., Серова Т.А., Зверева Е.А. (2015).
Из табличных данных видно, что наибольшее число животных костромской породы являлись носителями гетерозиготного генотипа ВB гена CSN3. Частота его у коров составила 0,6025. Значения двух других генотипов были ниже. Генотип АB был представлен у коров с частотой 0,3373, а генотип AA – 0,0602. В черно-пестрой породе преобладал генотип АА с частотой 0,6270. Анализ генетической структуры ярославской породы выявил преобладание аллеля А (0,6011) гена каппа-казеина над аллелем В (0,3989) у чистопородных животных и 0,8000 и 0,2000 соответственно у животных михайловского типа. Следует отметить также, что в михайловском типе наблюдается высокий процент животных с генотипом АA (62,8%). Отмечено, что наиболее предпочтительный для выработки твёрдых сортов сыра B-аллель и его гомозиготное состояние. Ранее проведенная оценка племенных ресурсов быков-производителей по гену k-CN показала, что наибольшая частота желательного генотипа ВВ встречается среди бурых пород – джерсейской, бурой швицкой и костромской – от 0,4000 у быков костромской до 0,6933 у джерсейской породы. Среди быков-производителей костромской породы не выявлено животных, гомозиготных по аллелю А, то есть любой бык костромской породы с большой долей вероятности имеет аллель B в своем генотипе.
3.5. Молочная продуктивность коров с разными генотипами по локусу k-СN
В таблице 13 приведены данные по молочной продуктивности коров с разными генотипами.
Таблица 13 – Молочная продуктивность коров костромской породы с разными аллелями и генотипами каппа-казеина
| Генотип | Число коров, гол | Удой,
кг |
Жир | Белок | |||
| % | кг | % | кг | ||||
| I-лактация | |||||||
| A/A | 14 | 6351±321 | 4,25±0,08 | 277,4±16,5 | 3,18±0,02 | 201,9±10,2 | |
| A/B | 66 | 6364±133 | 4,15±0,04 | 264,1±5,8 | 3,23±0,01* | 205,5±4,3 | |
| B/B | 45 | 6494±164 | 4,15±0,04 | 269,0±7,1 | 3,25±0,01* | 210,6±5,2 | |
| III-лактация и старше | |||||||
| A/A | 10 | 6676±452 | 4,15±0,07 | 277,6±19,5 | 3,25±0,04 | 216,3±14,0 | |
| A/B | 42 | 7079±160 | 4,11±0,05 | 291,2±7,7 | 3,20±0,01 | 226,7±5,3 | |
| B/B | 30 | 7378±202 | 4,15±0,06 | 306,6±9,5 | 3,21±0,02 | 236,1±6,1 | |
Примечание. Достоверность различий представлена в сравнении А/В и В/В с А/А (* – Р<0,05; ** – Р<0,01; *** – Р<0,001).
Из полученных данных видно, что достоверно большим содержанием белка в молоке характеризовались коровы с генотипами AB и BB и только за первую лактацию. Разность по удою между первотёлками с генотипом AB и AA составила 0,05% (P<0,05), между первотёлками с генотипом BB и AA – 0,07 % (P<0,05). По другим показателям и по последующим двум лактациям достоверных различий между животными различных генотипов не установлено.
Таким образом, костромская порода КРС характеризуется довольно высокой частотой B-аллельного варианта гена каппа-казеина. Причем первотелки с генотипом ВВ имели выше содержание белка в молоке, чем первотелки с генотипом АА.
3.6. Внедрение ПЦР — диагностики лейкоза в хозяйства региона
Лейкоз крупного рогатого скота относится к злокачественным лимфопролиферативным болезням, этиологическим агентом которого является вирус семейства Retroviridae. На сегодняшний день согласно «Методическим указаниям по диагностике лейкоза крупного рогатого скота», утвержденным 23 августа 2000 года, диагноз на лейкоз устанавливается в реакции иммунной диффузии (РИД) и иммуноферментного анализа (ИФА), что не позволяет выявить вирусоносительство у молодняка моложе полугода. Развитие молекулярной генетики позволяет диагностировать лейкоз крупного рогатого скота с применением геномных технологий уже с 10-дневного возраста животных, используя метод ПЦР-анализа. Высокая чувствительность ПЦР-метода позволяет наиболее точно определять инфицированных животных и рационально, с меньшими экономическими потерями проводить оздоровительные мероприятия, снижая уровень заболеваемости и напряженность эпизоотической ситуации.
В качестве биоматериала использовалась кровь коров разных пород, разводимых на территории региона. Отбор крови осуществляли в промаркированные стерильные вакуумные пробирки «Vacumed» с ЭДТА К2 из хвостовой вены. Пробоподготовка проводилась с применением реактивов из комплекта «ПРОБА-НК» (ООО «ДНК-Технология», Россия). Анализ проводили методом полимеразной цепной реакции в реальном времени (ПЦР-РВ) при помощи тест-системы, разработанной в ООО «ДНК-Технология» (таблица 14).
Таблица 14 – Результаты ПЦР-анализа КРС на наличие провируса лейкоза в разрезе пород
| Порода | Проведено тестов | Положительные |
| Костромская | 32 | отсутствуют |
| Черно-пестрая | 37 | отсутствуют |
| Голштинская | 29 | отсутствуют |
Таким образом, ПЦР-тестирование крупного рогатого скота костромской, черно-пестрой и голштинской пород в хозяйствах Костромской области в 2020 г. показало отсутствие инфицированных животных.
3.7. Анализ распространения аллелей BoLA-DRB3 *0902 и BoLA-DRB3 *1501 у коров разных пород
Поскольку вакцины для профилактики лейкоза крупного рогатого скота отсутствуют, отбор резистентных животных с помощью маркеров представляется стратегически важным подходом. Проведенные зарубежными учеными исследования показали, что генетическая устойчивость к лейкозу у крупного рогатого скота ассоциирована с аллельным вариантом BoLA-DRB3 *0902, который играет важную иммунологическую роль в подавлении репликации вируса, а чувствительность к заболеванию связана с вариантом BoLA-DRB3 *1501. Борьба с инфекцией BLV на основе генетической устойчивости показывает, что крупный рогатый скот с низкой провирусной нагрузкой, инфицированный BLV, несущий аллель *0902, не передает вирус к скоту, свободному от BLV. В таблице 15 приведены данные по аллелям BoLA-DRB3 *0902 и BoLA-DRB3 *1501 у коров разных отечественных и импортных пород.
Таблица 15 – Частота аллелей BoLA-DRB3 *0902 и *1501 у коров разных пород
| Порода | аллели BoLA-DRB3 | |
| *0902 | *1501 | |
| Костромская | 0,1891 | отсутствует |
| Якутский скот1 | отсутствует | отсутствует |
| Зебувидный скот1 | 0,0210 | отсутствует |
| Ярославская 1 | 0,0400 | 0,0460 |
| Черно-пестрая1 | 0,1020 | 0,0970 |
| Голштинская 1 | 0,1221 | 0,0916 |
Примечание. Ссылка на первоисточник: 1 – Рузина М.Н. (2012).
Из табличных данных видно, что аллельный вариант BoLA-DRB3 *0902, ассоциированный с устойчивостью к лейкозу, имеет выше частоту встречаемости у коров костромской 0,1891, голштинской – 0,1221 и черно-пестрой пород – 0,1020, реже встречается у зебувидного – 0,0210 и ярославского скота – 0,0400.
Однако, аллель BoLA-DRB3 *1501, связанный с высокой вирусной нагрузкой у животных костромской породы, а также у якутского и зебувидного скота отсутствует, что дает основание считать эти породы устойчивыми к распространению провируса лейкоза. Выше частота аллеля BoLA-DRB3 *1501 у скота черно-пестрой и голштинской пород.
Таким образом, при нацеливании на контроль устойчивости к лейкозу популяции крупного рогатого скота с помощью генетического отбора животные, несущие аллели, связанные с восприимчивостью BoLA‐DRB3 *1501, нежелательны.
3.8. Оценка влияния аллеля BoLA-DRB3 *0902 на молочную продуктивность
Ряд исследователей отмечают связь между отдельными вариантами гена BoLA-DRB3 и хозяйственно полезными признаками молочного скота. Интересным является связь между аллельным вариантом BoLA-DRB3 *0902 и молочной продуктивностью скота костромской породы. На рисунке 4 приведены данные по молочной продуктивности у коров костромской породы, носителей аллеля BoLA-DRB3*0902 и средняя молочная продуктивность скота костромской породы (данные итогов бонитировки 2019 г).
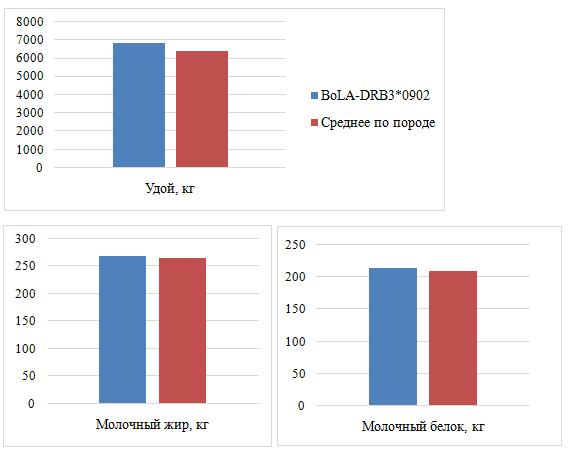 Рисунок 4 – Влияние аллеля BoLA-DRB3*0902 на молочную продуктивность у скота костромской породы
Рисунок 4 – Влияние аллеля BoLA-DRB3*0902 на молочную продуктивность у скота костромской породы
Анализ показателей молочной продуктивности коров костромской породы в генотипе, который имел аллель BoLA-DRB3 *0902, показал их достоверное превосходство по удою на 395 кг. Разность со средними показателями по породе по содержанию жира и белка была недостоверной.
Таким образом, выше показатели удоя были у животных, несущих аллель BoLA-DRB3 *0902, ассоциированной с устойчивостью к лейкозу.
ЗАКЛЮЧЕНИЕ
В результате проведенного исследования по изучению полиморфизма генов, ассоциированных с хозяйственно полезными признаками, установлены особенности аллельного профиля скота костромской породы. Анализ распространения желательного генотипа β-CNА2/А2 среди быков-производителей молочного направления продуктивности показал, что лидируют две породы – швицкая и костромская, с частотой встречаемости 0,9090 и 0,6250 соответственно. Высокая частота генотипа β-CNА2/А2 выявлена и у коров костромской породы – 0,6025, аллель β-CNА2 встречается у 77,1 % животных. В то время как у коров ярославской породы реже встречались животные с генотипом β-CNА2/А2 – 0,0333 и чаще с генотипом β-CNА1/А1 – 0,6666, у скота черно-пестрой породы чаще выявляли генотип CNА1/А2 – 0,5173, на втором месте генотип β-CNА2/А2 – 0,2759.
Анализ влияния полиморфизма гена β-CN на молочную продуктивность показал, что по третьей и последующим лактациям коровы костромской породы гомозиготные по аллелю CNА2 имели достоверно выше удой на 779 кг, чем коровы гомозиготные по аллелю CNА1. По качественному составу молока коровы разных генотипов различались незначительно. В популяции скота черно-пестрой породы наблюдалась иная картина – коровы гомозиготные по аллелю CNА1 имели по первой лактации достоверно выше удой на 1231 кг, чем гомозиготные по аллелю CNА2. По третьей и последующим лактациям достоверной разницы не получено.
Оценка племенных ресурсов быков-производителей по гену k-CN показала, что наибольшая частота желательного генотипа ВВ встречается среди бурых пород – джерсейской, бурой швицкой и костромской – от 0,4000 у быков костромской до 0,6933 у джерсейской породы. У быков черно-пестрой, голштинской, айширской, симментальской и ярославской пород преобладает генотип k-CNА|А. Различия по содержанию белка между первотёлками с генотипом AB и AA составила 0,05% (P<0,05), между первотёлками с генотипом BB и AA – 0,07 % (P<0,01). По другим показателям и по третьей и последующим лактациям достоверных различий между животными различных генотипов не установлено.
У дочерей быков с комплексным генотипами k-CNВ/В, β-CNА2/А2 и k-CNА/В, β-CNА2/А2 разность по удою по сравнению со средним значением выше на 455 и 474 кг (Р<0,05) соответственно. Быки с данными генотипами являются наиболее ценными в селекционном отношении. Анализ распространения желательных комплексных генотипов k-CNВ/В, β-CNА2/А2 и k-CNА/В у быков-производителей восьми пород показал, что лидируют две породы – швицкая и костромская с частотой встречаемости 0,7273 и 0,5000 соответственно.
Дальнейшая работа c костромской породой должна быть направлена на создание референтной популяции с улучшенными качественными показателями молока. Это позволит сохранить малочисленные ценные отечественные породы крупного рогатого скота, неспособные на сегодняшний день конкурировать с обильномолочными импортными породами.
Проведенные зарубежными учеными исследования показали, что генетическая устойчивость к лейкозу у крупного рогатого скота ассоциирована с аллельным вариантом BoLA-DRB3 *0902, который играет важную иммунологическую роль в подавлении репликации вируса, а чувствительность к заболеванию связана с вариантом BoLA-DRB3 *1501. Аллельный вариант BoLA-DRB3 *0902, ассоциированный устойчивостью к лейкозу, имеет выше частоту встречаемости у коров костромской – 0,1891, голштинской – 0,1221 и черно-пестрой пород – 0,1020, реже встречается у зебувидного – 0,0210 и ярославского скота – 0,0400. Однако, аллель BoLA-DRB3 *1501, связанный с высокой вирусной нагрузкой, у скота костромской и зебувидной породы отсутствует, что дает основание считать эти породы устойчивыми к распространению провируса лейкоза. Выше частота аллеля BoLA-DRB3 *1501 у скота черно-пестрой и голштинской пород. Ряд исследователей отмечают связь между отдельными вариантами гена BoLA-DRB3 и хозяйственно полезными признаками молочного скота. Анализ показателей молочной продуктивности коров костромской породы с генотипом, содержащим аллель BoLA-DRB3 *0902, показал их достоверное превосходство по удою на 395 кг. По содержанию жира и белка достоверных результатов не выявлено.
Для повышения эффективности селекционной работы желательно проводить типирование по генам каппа- и бета-казеина и BoLA-DRB3 не только быков-производителей, но и маточное поголовье племенных стад.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1. Овсянникова Г.В. Использование мирового генофонда молочного скота в создании сырьевой базы молочной промышленности Черноземья // Вестник международной академии холода. – 2017. – № 1. – С.7-12.
2. Гончаренко Г.М., Горячева Т.С., Рудишина Н.М., Медведева Н.С., Акулич Е.Г. Сравнительная оценка сыропригодности молока симментальской и красной степной породы с учётом генотипов k-казеина // Вестник Алтайского государственного аграрного университета. – 2013 – Т. 110. – № 12. – С. 113-117.
3. Ельчанинов В.В. Номенклатура и биохимические свойства казеинов коровьего молока. Каппа-казеин // Сыроделие и маслоделие. – 2008 – № 5. – С. 53-56.
4. Сулимова Г.Е., Лазебная И.В., Перчун А.В., Воронкова В.Н., Рузина М.Н., Бадин Г.А. Уникальность костромской породы крупного рогатого скота с позиции молекулярной генетики // Достижения науки и техники АПК. – 2011. – № 9. – С. 52-54.
5. Тюлькин С., Ахметов Т., Нургалиев М. Технологические свойства молока коров с разными генотипами каппа-казеина // Молочное и мясное скотоводство. – 2011. – № 8. – С. 4-5.
6. Tyulkin S., Vafin R., Zagidullin L., Akhetov T., Petrov A., Diel F. Technological properties of milk of cows with different genotypes of kappa-casein and beta-lactoglobulin // Foods and Raw Materials – 2018. – V. 6, №1. – Р. 154–162.
7. Вудфорд К. Дьявол в молоке. Болезнь, здоровье и политика. Молоко A1 и A2 // Издательство РАМН. – Москва, 2018. – 320 с.
8. Гуськова С.В. А2-молоко – продукт для детского питания // Информационный бюллетень Национального союза племенных организаций. – 2017. – №1. – С.24-27.
9. Дубынин В.А., Каменский А.А. Бета-казоморфины и их роль в регуляции поведения // Товарищество научных изданий КМК. – Москва, 2010. – 306 с.
10. Марзанов Н.С., Девришов Д.А., Марзанова С.Н., Абылкасымов Д.А., Коновалова Н.В., Либет И.С. Характеристика российских молочных пород крупного рогатого скота по встречаемости генотипов и аллелей в локусе бета-казеина // Ветеринария. Зоотехния. Биотехнология. – 2020. – № 1. – С. 47-52.
11. Kaminski S., Cieslinska A., Kostyr E. Polymorphism of bovine beta-casein and its potential effect on human health // J. Appl. Genet. – 2007. – V. 48 (3). – Р. 189-198.
12. Козырева Н.Г., Гулюкин М.И. Распространение лейкоза крупного рогатого скота и генетические варианты возбудителя на территории животноводческих хозяйств центрального федерального округа Российской Федерации // Ветеринария Кубани. – 2017. – № 5. – С. 4-9.
13. Методические указания по диагностике лейкоза крупного рогатого скота. Утв. руководителем Департамента ветеринарии Министерства сельского хозяйства Российской Федерации Кравчуком М.В. от 23 августа 2000 г. №13-7-2/2130 [Электронный ресурс]: Электронный фонд правовой и нормативно-технической документации [Сайт]. URL: http://docs.cntd.ru/document/1200118749 (дата обращения 03.06.2020).
14. Pashmi M., Qanbari S., Ghorashi S.A., Salehi A. PCR based RFLP genotyping of bovine lymphocyte antigen DRB3.2 in Iranian Holstein population // Рак. J. Biol. Sci. – 2007. – V. 10., № 3. – Р. 383-387.
15. Коновалов А.В., Ильина А.В., Серова Т.А., Зверева Е.А. Полиморфизм ДНК у ярославской породы КРС по гену каппа-казеина // Сыроделие и маслоделие. – 2015. – №6. – С. 33-35.
16. Сулимова Г.Е., Шайхаев Г.О., Берберов Э.М. и др. Генотипирование локуса каппа-казеина у крупного рогатого скота с помощью полимеразной цепной реакции // Генетика. – 1991. – № 12. – С. 27.
17. Сулимова Г.Е., Ахани Азари М., Ростамзадех Д., Мохаммад Абади М.Р., Лазебный О.Е. Аллельный полиморфизм гена каппа-казеина (CSN3) у российских пород крупного рогатого скота и его информативность как генетического маркера // Генетика. – 2007. – Т. 43. – № 1. – С. 88-95.
18. Афанасьев М.П. Генетическая структура, белковый состав и технологические свойства молока холмогорской, венгерской голштино-фризской пород скота и их помесей: автореф. дис. … канд. биол. наук. – Казань, 1996. – 24 с.
19. Дунин И.М., Харитонов С.Н., Ермилов А.Н., Сперанский А. Т., Кондрашев А.А. Бурый скот России. – М.: ВНИИплем, 1998. – 101 с.
20. Зиновьева Н.А., Гладырь Е.А. Применение ДНК диагностики для анализа генов-кандидатов локусов количественных признаков сельскохозяйственных животных // Животноводство – XXI век: Сб. науч. тр. Вижа. – 2003. – Т 1. – № 61. – С. 218-224.
21. Стрекозов Н.И., Романосова Е.Г., Попов А.Н. Генотипирование быков-производителей швицкой породы по локусам каппа-казеина // Научное обеспечение устойчивого развития сельскохозяйственного производства в Нечерноземной зоне России: Докл. межвуз. науч.-практ. конференции (г. Смоленск, 17-18 апреля 1997г.) – Смоленск, 1997. – С. 208-212.
22. Lien S., Alestrom P., Klungland H., Rogne S. Detection of multiple P-casein (CASB) alleles by amplification created restriction sites (ACRS) // Animal Genetics. – 1992. – V. 23. – Р.333-338.
23. Vasicek D., Uhrin P., Chrenek P., Bauerovа M., Oberfranc M., Bulla J. Genotyping of κ-casein in different cattle breeds in Slovakia // Ziv. Vyr. – 1995. – V. 40. – Р. 241-244.
24. Рузина М.Н. Анализ полиморфизма гена BoLA-DRB3 в связи с генетической устойчивостью крупного рогатого скота к лейкозу и вирусоносительством: дис. …канд. биол. наук. – Москва, 2012. – 141 с.
25. Калашникова Л.А., Ганченкова Т.Б. Оценка холмогорских быков-производителей по генотипу каппа-казеина // Молочное и мясное скотоводство. – 2008. – № 3. – С. 10-12.
26. Elliott R.B., Harris D.P., Hill J.P., Bibby N.J., Wasmuth H.E. Type I (insulindependent) diabetes mellitus and cow milk: casein variant consumption // Diabetologia. – 1999. – V. 42. – Р. 292-296.
27. Farrell H.M. Jr., Jimenez-Florez R., Bleck G.T., Brown E.M., Butler J.E., Creamer L.K., Hicks C.L., Hollar C.M., Ng-Kwai-Hang K.F., Swaisgood H.E. Nomenclature of the proteins of cows’ milk — sixth revision // J. Dairy Sci. – 2004. – V. 87. – Р. 1641-1674.
28. Beever J.E., Lewin H.A., Barendse W., Andersson L., Armitage S.M., Beattie C.W., Burns B.M., Davis S.K., Kappes S.M., Kirkpatrick B.W., Ma R.Z., McGraw R.A., Stone R.T., Taylor J.F. Report of the first workshop on the genetic map of bovine chromosome 23 // Anim Genetics. – 1996. – V. 27, № 2. – Р.69-75.
29. Эрнст Л.К., Сулимова Г.Е., Орлова А.П. Особенности распространения антигенов BoLA-А и аллелей гена BoLA-DRB3 у черно-пестрого скота в связи с ассоциацией с лейкозом // Генетика. – 1997. – Т. 33. – № 1. – С.67-95.
30. Juliarena M.A., Poli M., Sala L., Ceriani C., Gutierrez. S., Dolcini G. Association of BLV infection profiles with alleles of the BoLA-DRB3.2 gene // Animal Genetics. – 2008. – №39 (4). – Р.432-438.
31. Rupp R., Hernandez A., Mallard B.A. Association of bovine leukocyte antigen (BoLA) DRB3.2 with immune response, mastitis, and production and type traits in Canadian Holsteins // J.Dairy.Sci. – 2007. – V. 90, № 2. – Р. 1029-1038.
32. Russell G.C., Smith J.A., Oliver R.A. Structure of the BoLA-DRB3 gene and promoter // European Journal of Immunogenetics. – 2004. – №31(3) – Р. 145-151.
33. Forletti A., Juliarena M.A., Ceriani C., Amadio A.F., Esteban E., Gutierrez S.E. Identification of cattle carrying alleles associated with resistance and susceptibility to the Bovine Leukemia Virus progression by real-time PCR // Research in Veterinary Science. – 2013 – №95 (3). – Р. 991-995.
34. Schwartz I., Levy D. Pathology of bovine leukemia virus // Vet. Res. – 1994. – V. 25. – Р. 521-536.
35. Zambrano J.C., Echeven J., Lopez-Herrera A. Alleles of the BoLA DRB3.2 gene are associated with mastitis in dairy cows. Revista Colombiana de Ciencias Pecuarias. – 2011. – №24 (2). – Р.145-156.
36. Sharif S., Mallard B.A., Wilkie B.N., Sargeant J.M., Scott H.M., Dekkers J.C., Leslie K.E. Associations of the bovine major histocompatibility complex DRB3 (BoLA-DRB3) with production traits in Canadian dairy cattle // Animal Genetics. – 1999. – V. 30, № 2. – Р. 157-160.
37. Hayashi T., Mekata H., Sekiguchi S., Kirino Y., Mitoma S., Honkawa K. Cattle with the BoLA class II DRB3*0902 allele have significantly lower bovine leukemia proviral loads. – J Vet Med Sci. – 2017. – №79 (9). – Р.1552-1555.
38. Глазунов Ю.В., Кабицкая Я.А., Плотников И.В. Сравнительная оценка методов прижизненной диагностики и эпизоотическая ситуация по лейкозу крупного рогатого скота в Тюменской области // Вестник АПК Ставрополья. – 2017. – № 2 (26). – С. 63-68.
39. Галлеев Р.Ф., Руденко А.А., Валиев Ф.Р., Абубакиров Р.Р. Диагностика и профилактика лейкоза КРС // Практик. – 2003. – № 7-8. – С.43-46.
40. Fries R, Eggen A., Womack J.E. The bovine genome map // Mamm. Genome. – 1993. – № 4. – Р. 405-428.
41. Шайдуллин Р.Р., Ганиев А.С. Оценка полиморфизма гена каппа-казеина у животных черно-пестрой породы // Вестник Ульяновской государственной сельскохозяйственной академии. – 2015. – № 3 (31). – С. 104-109.
