Титульный лист и исполнители
Реферат
Отчет 143 с., 1 кн., 48 рис., 11 табл., 32 источ., 8 прил.
СЕЛЬСКОХОЗЯЙСТВЕННЫЕ ЖИВОТНЫЕ И ПТИЦА, ПОЛЛЮТАНТЫ, ЭНТЕРОСОРБЕНТЫ, ОБМЕН ВЕЩЕСТВ, МИКРОБИОЦЕНОЗ, ПРОДУКТИВНОСТЬ, КАЧЕСТВО ПРОДУКЦИИ.
Объектом исследований послужил молодняк крупного рогатого скота и птицы на раннем этапе постэмбрионального развития.
Цель исследований заключалась в формировании стад здоровых животных, устойчивых к действию поллютантов.
В 2020 году научные исследования были направлены на решение следующих конкретных задач:
1.обоснование комплексного применения и мониторинг эффективности действия сыворотки против пастереллеза, сальмонеллеза, эшерихиоза, парагриппа-3 и инфекционного ринотрахеита крупного рогатого скота(«Армавирская биофабрика», Россия. Регистрационный номер: ПВР-1-1.5/02079 от 03.10.14) и энтеросорбента ЭнтероЗоо (ООО «Силма тнк», Россия. Регистрационное удостоверение: РК-ВП-4-3077-15 от 29.12.15) телятам в период раннего постэмбрионального развития (в первый критический период развития);
2. обоснование комплексного применения и мониторинг эффективности действия пробиотика Зоонорм (ЗАО «Партнер», Москва. Россия. Регистрационный номер ПВР-1-1.1/00621 от 2014 г.) и энтеросорбента ЭнтероЗоо (ООО «Силма тнк», Россия. Регистрационное удостоверение: РК-ВП-4-3077-15 от 29.12.15)цыплятам на раннем этапе постэмбрионального развития (от вывода до окончания линьки (замена пуха на первичное перо));
3. подбор методик для оценки показателей обмена веществ у молодняка животных и птиц.
Поисковые комплексные научные исследования базировались на передовом опыте отечественных и зарубежных ученых с применением средств и методов современной ветеринарной науки и техники.
В результате совокупности проведенных исследований по основным из обозначенных выше направлений (задач) было установлено следующее:
- наиболее подвержен заболеваниям, сопровождающихся расстройством функции желудочно-кишечного тракта, снижением резистентности, нарушением обмена веществ и адаптационных процессов, отставанием в росте и развитии молодняк крупного рогатого скота и птицы;
- комплексное применение отечественных препаратов – сыворотки против пастереллеза, сальмонеллеза, эшерихиоза, парагриппа-3 и инфекционного ринотрахеита крупного рогатого скота и энтеросорбента ЭнтероЗоо телятам в раннем постнатальном периоде развития
- регулирует переваривающую и всасывающую способность кишечника, стимулирует увеличение лактобактерий, кишечной палочки с нормальной ферментативной активностью и энтерококков до 1×108 КОЕ/г; 1×108 КОЕ/г и 1×105 КОЕ/г, препятствует заселению желудочно-кишечного тракта патогенной и условно-патогенной микрофлорой;
- способствует повышению гемоглобина до 119,00-142,00g/L, эритроцитов до 8,76-9,67×1012/L, тромбоцитов до 471,60-602,00×109/L;
- повышает иммунную защиту путем усиления адаптационного потенциала, защитных механизмов и снижения интоксикации, стимулирует выведение билирубина, продуктов распада азотистых оснований, предотвращает развитие эндотоксикоза;
- нормализует энзиматическую активность и белковый коэффициент,
- стимулирует белок-синтетическую функцию печени, энергетический и минеральный обмен;
- применение энтеросорбента ЭнтероЗоо телятам с нарушением пищеварения способствует восстановлению моторной и секреторной функции желудочно-кишечного тракта и метаболических процессов в течение 7 суток;
- комплексное применение отечественных препаратов – пробиотика Зоонорм и энтеросорбента ЭнтероЗоо цыплятам на раннем этапе постэмбрионального развития
- способствует формированию в кишечнике биопленки, стимулирует количественное увеличение лактобактерий, энтерококков, типичной E.coli и бактероидов, снижает количество клостридий и препятствует пролиферации Enterobactercloacae;
- способствует эффективному использованию запасов желточного мешка и питательных веществ корма;
- стимулирует гемопоэз, синтетическую функцию печени, глюконеогенез, минеральный обмен;
- не нарушает развитие и функцию органов и систем организма;
- препятствует развитию окислительного стресса, снижая концентрацию малонового диальдегида и повышая общую антиоксидантную защиту до 56,00-57,00%;
- препятствует развитию полиэтиологического стресса, стабилизирует уровень кортизола в крови на отметке 5,20-5,60 мкмоль/л;
- обработка 0,01% взвесью ЭнтероЗоо яиц и последующая выпойка его цыплятам стимулирует процессы обмена веществ;
- применение 0,1% взвеси ЭнтероЗоо при выращивании утят повышает сохранность до 95,7%, живую массу, среднесуточные привесы, однородность стада, снижает количество транзиторных и условно патогенных микроорганизмов и метаболитов;
- применение взвеси ЭнтероЗоо при выращивании перепелов
- стимулирует повышение живой массы, наступление половой зрелости, раннее начало яйцекладки и массы яиц до 12,70±0,40 г;
- способствует снижению молочной кислоты на 20,90% в сыворотке крови;
- снижает общее микробное число, бактерий группы кишечной палочки, стафилококков и стрептококков в кишечном содержимом;
- при наличие в кормах Афлотоксина В1 до 47,50 мкг/кг и Т2-токсина до 169,20 мкг/кг способствует сохранности перепелов до 86,20% и выведению токсических продуктов;
- энтеросорбент ЭнтероЗоо при моноприменении и в комплексе с сывороткой против пастереллеза, сальмонеллеза, эшерихиоза, парагриппа-3 и инфекционного ринотрахеита крупного рогатого скота и пробиотиком Зоонорм обладает способностью выводить промежуточные метаболиты, токсины, стимулировать заселение пищеварительной системы резидентной микрофлорой, нормализовать переваривающую и всасывающую способность желудочно-кишечного тракта молодняка, стимулировать обменные процессы, гемопоэз, антиоксидантную защиту, устойчивость к стрессу и неспецифическую резистентность;
- разработан алгоритм применения энтеросорбента ЭнтероЗоо в качестве монопрепарата и в комплексе с сывороткой против пастереллеза, сальмонеллеза, эшерихиоза, парагриппа-3 и инфекционного ринотрахеита крупного рогатого скота и пробиотиком Зоонорм молодняку крупного рогатого скота и птице в раннем постэмбриональном периоде развития согласно которому выпойка взвеси ЭнтероЗоо эффективна через 2 часа после кормления животных и птицы. При комплексном применении энтеросорбента ЭнтероЗоо с другими биологически активными добавками, вводимыми перорально, рекомендуется их введение в разное время суток, доза препарата рассчитывается грамм на килограмм живой массы и подбирается индивидуально в диапазоне 0,01-0,5 г/кг;
- предложены доступные методы оценки влияния изучаемых биологических активных препаратов на гомеостаз и метаболизм молодняка животных и птицы, где приоритетное значение имеют биохимические показатели крови, микробиологическое исследования кишечного содержимого, копрологическое исследование, а также интегральные индексы крови, рентгенологическое и ультразвуковое исследование органов и систем.
ВВЕДЕНИЕ
Животноводство – наукоемкая, комплексная, динамично развивающаяся отрасль аграрно-промышленного сектора[18].
Животноводство занимает более 50% в структуре валовой и свыше 60% в структуре товарной продукции сельского хозяйства, выполняет важную экономическую и социальную функцию. Отрасль обеспечивает население высококалорийными продуктами питания и дает сырье для пищевой, легкой, фармацевтической, химической, кожевенной промышленности и ряда других направлений. Из отходов переработки скота и птицы изготавливают обрат, мясо-костную и костную муку, побочную продукцию используют в качестве органического удобрения.
Развитие отрасли обеспечивает системное воспроизводство стада. Интенсивное высокотехнологичное ведение отрасли предъявляет повышенные требования к молодняку животных и птицы. За последние годы в стране значительно изменилась кормовая база, что заставляет специалистов вносить коррективы в рационы и программы кормления молодняка крупного рогатого скота и птицы.
Низкое качество кормов, нарушение технологии их приготовления и кормления, высокое содержание концентратов и неадресных премиксов в рационе, устаревшие подходы к профилактике и лечению заболеваний, стремление к снижению затрат приводят к развитию метаболических патологий. Подтверждением тому служит анализ многочисленных данных отечественных и зарубежных авторов, которые свидетельствуют, что из всех незаразных болезней у крупного рогатого скота свыше 50% приходится на заболевания обменного характера, у птиц – около 35% от общего числа павшей птицы [10; 25].
На протяжении многих лет широко применялись кормовые антибиотики, которые обладали ростостимулирующим и антимикробным действием. Однако их повсеместное применение привело к резистентности возбудителей, а продукция стала небезопасной для здоровья человека.
Сегодня глобальное значение имеет проблема гуманизации промышленных технологий, благополучия и защиты животных [21; 30], в странах ЕС существует запрет на использование кормовых антибиотиков. Поэтому в отрасли активно внедряются органические кормовые добавки: пре- и пробиотики, адсорбенты, гипериммунные сыворотки и другие БАВ.
Биологически активные вещества обеспечивают сохранность, рост молодняка,формируют кишечный микробиоценоз, стимулируют процессы обмена веществ и энергии, модулируют антиоксидантную защиту, хелатируют ионы металлов и безопасны для здоровья потребителей [21; 22; 26; 29; 30; 31].
1 ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ: Актуальность темы исследования
Постэмбриональныйпериод развития молодняка подвержен комплексу экстремальных воздействий, требующих непрерывной смены механизмов адаптации на разных уровнях саморегуляции[11]. Кроме глобальной перестройки гемодинамики, существенно изменяется метаболизм, происходит сопряжение процессов анаэробного гликолиза и окислительного фосфорилирования, включение собственных систем терморегуляции, пищеварения, регуляции ионного гомеостаза [15]. Как правило, у животных после рождения наблюдается широкий размах колебаний отдельных параметров в процессе общей адаптации и является показателем высоких резервных возможностей. Многие изменения гемодинамического и метаболического статуса в раннем неонатальном периоде носят компенсаторно-приспособительный характер. Следовательно, основные функции организма находятся в состоянии неустойчивого равновесия. Поэтому, важнейшим условием развития молодняка сельскохозяйственных животных и птицы является профилактика ранней патологии.
Концентрация большого поголовья на ограниченной территории, нарушение температурно-влажностного режима, сквозняки на фоне нарушений режима кормления приводят к снижению естественной резистентности. У ослабленного молодняка часто развиваются бактериальные и вирусные инфекции, приводящие к задержке роста и развития или гибели. С целью формированию пассивного иммунитета, повышения устойчивости молодняку животных в первые сутки вводят гипериммунные сыворотки, механизм действия которых основан на связывании и нейтрализации патогенных антигенов специфическими антителами биопрепарата.
Тем не менее, успешное функционирование промышленных комплексов по выращиванию животных и птицы в значительной мере зависит от наличия и применения кормовых добавок, порой содержащих потенциально токсичныекомпоненты, такие как полихлоринатные бифенилы, мышьяк, гормоны и прочие вещества.Ежедневно с кормом в организм животных попадает один или несколько микотоксинов [5].В настоящее время насчитывается более 350 видов микроскопических грибов, которые выделяют в окружающую среду не менее 300 различных микотоксинов [32]. Содержание вторичных метаболитов плесневых грибов приводит к появлению как острых, так и хронических микотоксикозов животных и птицы, наносящих значительный экономический ущерб [6].
Наиболее эффективным способом профилактики микотоксикозов является адсорбция микотоксинов в желудочно-кишечном тракте животных специальными кормовыми добавками – энтеросорбентами. Эффективность адсорбентов обусловлена рядом специфических показателей: коротким периодом адсорбции, высоким сродством к полярным и неполярным микотоксинам, минимальной десорбцией при прохождении по пищеварительному тракту животного и т. д. [13].Естественно, чем выше сорбционные свойства, тем больше токсикантов удерживает препарат.
В то же время колонизационную резистентность пищеварительного канала у животных обеспечивает облигатная микрофлора, которая является неотъемлемым, эволюционно связанным с макроорганизмом компонентом, защищающим его от болезнетворных микробов [1]. Толстокишечный нормобиоценоз представляет собой количественное и качественное соотношение различных популяций микробов, поддерживающих биохимическое, метаболическое и иммунное равновесие организма хозяина [4].Основную массу микрофлоры, характерную для молодняка животных и птицы составляют облигатные анаэробы, бактерии родов Lactobacillus, Bifidobacterium и Propionibacterium [3; 7]. Различные микроэкологические нарушения могут быть причиной или способствовать развитию комплекса патологических процессов, что приводит к ферментопатиям с последующим нарушением обмена веществ [12; 14; 19; 23].
Многочисленные публикации показывают, что включение только пробиотиков как отдельно, так в комплексе с другими БАВ в систему выращивания молодняка снижает заболеваемость желудочно-кишечными болезнями, повышает сохранность поголовья, сокращает продолжительность выращивания, снижает затраты кормов на единицу продукции, улучшает мясные качества тушек, стимулирует яйценоскость и качество яиц [8; 9].
Поэтому, исходя из конкретных условий, целесообразно разрабатывать схему профилактики ранней постэмбриональной патологии обмена веществ в зависимости от вида животных.
Исходя из выше изложенного, можно сделать вывод, что вначале необходимо разработать и испытать схемы профилактики патологии обмена веществ для молодняка крупного рогатого скота и птицы, применяя комплексы биологически активных веществ, а затем, используя полученные результаты внедрить их в технологию выращивания.
Одной из наиболее сложных задач, которую предстоит решить, является подбор дозы препарата-адсорбента, разработка схемы введения комплекса препаратов и выбор критериев оценивания эффективности действия применяемых композиций.Следует отметить, что изменение отдельного показателя не может служить мерой эффективности действия препаратов, поэтому необходим выбор валидных методик для оценивания показателей метаболизма.
Цель и задачи исследования:
Цель: формирование стад здоровых животных, устойчивых к действию поллютантов.
Задачи:
- обоснование комплексного применения и мониторинг эффективности действия сыворотки против пастереллеза, сальмонеллеза, эшерихиоза, парагриппа-3 и инфекционного ринотрахеита крупного рогатого скота(«Армавирская биофабрика», Россия. Регистрационный номер: ПВР-1-1.5/02079 от 03.10.14) и энтеросорбента ЭнтероЗоо (ООО «Силма тнк», Россия. Регистрационное удостоверение: РК-ВП-4-3077-15 от 29.12.15) телятам в период раннего постэмбрионального развития (в первый критический период развития);
- обоснование комплексного применения и мониторинг эффективности действия пробиотика Зоонорм (ЗАО «Партнер», Москва. Россия. Регистрационный номер ПВР-1-1.1/00621 от 2014 г.) и энтеросорбента ЭнтероЗоо (ООО «Силма тнк», Россия. Регистрационное удостоверение: РК-ВП-4-3077-15 от 29.12.15) цыплятам на раннем этапе постэмбрионального развития (от вывода до окончания линьки (замена пуха на первичное перо));
- подбор методик для оценки показателей обмена веществ у молодняка животных и птиц.
Научная новизна:
- получены новые сведения, расширяющие научное представление о влиянии энтеросорбента на жизненные функции молодняка сельскохозяйственных животных и птицы;
- получены новые сведения о механизме действия комплексного применения сыворотки против пастереллеза, сальмонеллеза, эшерихиоза, парагриппа-3 и инфекционного ринотрахеита крупного рогатого скота и энтеросорбента ЭнтероЗоона молодняк крупного рогатого скота;
- получены новые сведения о механизме действия комплексного примененияпробиотика Зоонорм и энтеросорбента ЭнтероЗоо цыплятам;
- уточнены некоторые данные о влиянии изучаемых препаратов на анатомо-морфологические показатели молодняка сельскохозяйственных животных и птиц;
- получены новыесведения о влиянии изучаемых препаратов на видовой состав и динамику резидентной микрофлоры,переваривающую способность желудочно-кишечного тракта молодняка крупного рогатого скота и цыплят;
- установлено влияние энтеросорбента ЭнтероЗоо при моновведениии в комплексе с биологически активными веществами на метаболизм, антиоксидантный статус у молодняка животных и птиц;
- доказанацелесообразность применения комплекса изучаемых препаратов на раннем этапе постэмбрионального развития для нивелирования симптомов адаптационного, полиэтиологического стресса у молодняка сельскохозяйственных животных и птицы;
- выявленаэффективностьэнтеросорбента ЭнтероЗоо при сочетанном применении с другими биологически активными веществами с привлечениемлабораторных и инструментальных методов исследования.
Практическая значимость:Установлена дозаи алгоритм применения энтеросорбента ЭнтероЗоо в комплексе с биологически активными веществами телятам и цыплятам на раннем этапе постэмбрионального развития. Определены диагностические маркеры эффективности применения композиции энтеросорбента ЭнтероЗоо и сыворотки против пастереллеза, сальмонеллеза, эшерихиоза, парагриппа-3 и инфекционного ринотрахеита крупного рогатого скота телятам, энтеросорбента ЭнтероЗоо и пробиотика Зоонорм цыплятам.
Научно-техническая результативность НИР: основные положения выполненной работы были представлены в 25 научных публикациях, в том числе 9 в изданиях рекомендуемых ВАК МОиН РФ, 2 в международных наукометрических базахScopus иWebofscience, 8 на международных и всероссийских конференциях, зарегистрировано заявлениео выдаче патента РФ на изобретение (№2020138603 от 24.11.2020).
2 АНАЛИТИЧЕСКИЙ ОБЗОР
Задача повышения конкурентоспособности животноводства страны на внутреннем и внешнем рынках диктует необходимость получения качественной, экологически безопасной продукции при одновременном росте экономической эффективности производства [20]. В связи с этим,животноводство требует научно-обоснованного и рационального подхода к кормлению животных.В числе эффективных мер по вопросам кормления одной из главных является разработка типов кормления и структуры рационов для каждой конкретной биогеохимической зоны страны.При этом рационы для животных и птицы должны соответствовать требованиям, следуя современными нормами кормления согласно продуктивности, физиологического состояния и возраста.
В настоящий момент рационы нормируются более чем по 30 показателям, каждый из которых имеет определенное значение для обмена веществ. Важную роль в рационах играют биологически активные вещества (БАВ) такие, как стабилизаторы, антиокислители, аминокислоты, витамины, макро- и микроэлементы, ферменты, вкусовые добавки, антимикробные препараты, пре- и пробиотики, детергенты, транквилизаторы, сорбенты и другиевещества.Некоторые из них являются условно инертными, другие характеризуются физиологической активностью.
Многообразие и сложность взаимоотношений перечисленных веществтребует исключительного внимания к их применению, дополнительных исследований для выяснения положительного или отрицательного их влияния на организм животных.
Идея коррекции микрофлоры пищеварительного тракта принадлежит нашему соотечественнику И.И. Мечникову (1845-1916). Непосредственно термин пробиотик, как смесь микробных метаболитов, обладающих способностью стимулировать рост микроорганизмов, ввели D.M. Lilly и R.H. Stillwell в 1965 г. Для производства пробиотиков вначале использовали неспорообразующие бактерии, обладающие свойствами выделять органические кислоты. Поскольку в нормальной микрофлоре теплокровных преобладает ацидофильная палочка, то в качестве пробиотика стали использовать ацидофильную бульонную культуру. В дальнейшем использовали бифидо- и лактобактерии.На их основе были созданы бифидобактерин и лактобактерин.
Не менее перспективным направлением является создание комбинированных препаратов.При совместном культивировании ацидофильной палочки с бифидобактериями установлен высокий антагонистический эффект в отношении кишечной палочки. Комплексными бактериальными препаратами являются бифилак и бифимол.
Для создания активных пробиотиков использованы бактерии рода Bacillus. На их основе разработаны такие препараты, как эндоспорин, энтеробактерин, ветом, зимун и другие.
Пробиотики обладают комплексным действием: проявляют антагонистическую активность против патогенных и условно-патогенных микроорганизмов за счет образования антибиотиков, бактериоцинов, лизоцима, органических кислот (молочной, уксусной, янтарной, муравьиной), пероксида водорода; конкуренции за места обитания и питательные вещества; принимают участие в пищеварении, синтезируя гидролитические ферменты – аналоги пищеварительных ферментов макроорганизма; продуцируют аминокислоты, витамины (К, В1, В3) и некоторые другие БАВ, потребляемые макроорганизмом; оказывают иммуномодулирующее действие; осуществляют деструкцию токсинов, аллергенов; снижают уровень холестерина в крови; способствуют выведению из организма тяжелых металлов (Ag, Cr, Cd и др.) [27; 28]. Угнетая рост нежелательных микроорганизмов, пробиотики создают условия для развития нормальной микрофлоры кишечника, которая обеспечивает колонизационную резистентность, осуществляет пищеварительную, синтетическую, иммуномодулирующую, детоксикационную функции [24].
Тем не менее, все промежуточные метаболиты, микотоксины и возможные поллютанты, резидентная микрофлора и интродуцированные с помощью пробиотиков микроорганизмы не в состоянии обезвредить. В этом случае целесообразно использовать биологические активные вещества, обладающие сорбционной активностью.
Собственно говоря, энтеросорбенты – это вещества различной природы и структуры, осуществляющие связывание экзо- и эндогенных веществ в желудочно-кишечном тракте путем адсорбции, абсорбции, ионообмена, комплексообразования. Несомненным преимуществом сорбентов по отношению к другим препаратам фармакологических групп является их опосредовательность, то есть они действуют на саму причину – токсин, оказывая при этом ослабление аллергических и воспалительных реакций в организме [16].
Впервые сорбенты были описаны Авиценной, а чуть позже и Гиппократом. В XVIII в. Т.Е.Ловиц подвел теоретическую базу о сорбционных свойствах углей под метод энтеросорбции [17].
К настоящему времени накоплен большой опыт по применению энтеросорбентов в животноводстве, результаты которого показывают, что отечественное минеральное сырье– цеолиты, пористые кремнеземы,бентониты, шунгиты и многие другие могут быть успешно внедрены в практику животноводческих хозяйств различных форм собственности.
Наибольшее использование энтеросорбенты получили в таких отраслях животноводства, как птицеводство, свиноводство, скотоводство и кролиководство.
В последние годы возрос интерес крезультативным энтеросорбентам, которые можно вводить в рацион в качестве кормовой добавки в смеси с кормом, путем выпойки взвеси или дачи геля в зависимости от вида животных и технологии содержания.
Проведя анализ известных энтеросорбентов отечественного и импортного производства, выслушав мнения специалистов и руководителей хозяйств, где используются сорбенты, были обобщены их достоинства и недостатки.
Достоинство сорбентов заключается в том, что производители широко рекламируют производимые энтеросорбенты и распространяют их через крупные торговые сети; сорбенты способны связывать и выводить из организма поступающие извне и образующиеся внутри токсические вещества различной природы (микроорганизмы и микробные токсины, антигены, кормовые аллергены, иммунные комплексы, лекарственные препараты и их метаболиты, соли тяжелых металлов, радионуклиды); избыток билирубина, холестерина и липидных комплексов;продукты распада азотистого обмена; энтеросорбенты не расщепляются, не всасываются в желудочно-кишечном тракте и выделяются в неизмененном виде; имеют одинаковый объем пор.
Недостатками известных марок энтеросорбентов является высокая цена за курс лечения; низкая сорбционная активность; неудовлетворительные органолептические свойства;определенный способ применения; необходимость подготовки перед применением;ограниченные возможности в лечении и профилактике заболеваний; изменение функции кишечника; поглощение питательных веществ, в том числе витаминов, микроэлементов и аминокислот; увеличение уровня ввода некоторых сорбентов для профилактики острых и хронических микотоксикозов до 2-4%.
Таким образом, сорбционная активность известных сорбентов отличается в 3-5 раз, высокие уровни энтеросорбентов в рационе приводят к эффекту разбалансировки комбикормов, сопровождаются снижением питательности рационов, экскрецией лимитирующих факторов и пагубным механическим воздействием на эпителий пищеварительного тракта, что лишь усугубляет состояние здоровья животных и птицы.
Тем не менее, потенциал веществ, перспективных для использования в качестве энтеросорбентов, еще не до конца изучен, что дает возможность поиска и рационального использования именно тех субстанций, которые окажутся наиболее целесообразными для профилактики кормовых отравлений и связанных с ними интоксикаций в конкретных условиях, с обстоятельным изучением и обоснованием необходимости усиленной экскреции из организма продуктов аномального обмена, как при выраженном течении патологического процесса, таки и у молодняка животных и птиц в критические периоды развития и вакцинального прессинга.
Каждое предприятие, специализирующееся на выращивании определенного вида животных, сталкивается с проблемой времени, способа и дозы введения препаратов, что влечет за собой определенные затраты труда, с одной стороны, но способствует полному усвоению питательных веществ рационас последующим выведением антипитательных веществ, метаболитов и токсинов.
Исходя из этого, мы находим эффективным раздельное введение современных биопрепаратов, таких как пробиотики и энтеросорбенты в практике птицеводства, что обусловлено систематическим плановым проведением различных ветеринарно-зоотехнических мероприятий и сосредоточением большого поголовья на ограниченной площади.
На животноводческих комплексах по выращиванию крупного рогатого скота на основании особенностей эпизоотологической ситуации нельзя обойтись без средств пассивной иммунизации молодняка, поскольку вирусные и бактериальные болезни широко распространены в мире и причиняют большой материальный ущерб. Экономический ущерб складывается из снижения продуктивности, замедления роста и развития,затрат на лечениеживотных, падежа и вынужденного убоя, применения карантинных мер.
Гибель телят в неблагополучных хозяйствах может достигать 20-30%.
Широкое распространение данной группы заболеваний связано с высокой контагиозностью, длительным носительством и обильным выделением вирусов и бактерий больными животными, а также одновременное инфицирование животных несколькими возбудителями.
Дефицит пассивного иммунитета у телят можно восполнить введением специфических антител, содержащихся в высокоиммунной сыворотке крови крупного рогатого скота.При введении гипериммунных сывороток эффект проявляется через 12-24 часа, иммунная защита сохраняется до 10-20 дней.Механизм действия сыворотки основан на связывании и нейтрализации патогенных антигенов специфическими антителами биопрепарата. Также при введении сыворотки отмечается рост окислительной и фагоцитарной активности крови.
Несмотря на восполнение возрастной иммунокомпетентной недостаточности искусственным введением специфических антител с гипериммунной сывороткой у новорожденных телят образуются промежуточные метаболиты, недоокисленные продукты обмена которые оказывают негативное, а в комплексе с неудовлетворительными зоогигиеническими условиями содержания, и токсическое влияние на организм. Проведение дезинтоксикационной терапии с применением внутривенных введений специальных растворов технологически и финансовоневыгодно, требует больших финансовых затрат, что экономически нерентабельно. Наиболее простым способом для решения проблемы является применение энтеросорбентов в адекватных дозах.
Подводя итог, можно отметить, что при выращивании молодняка птицы для улучшения метаболических процессов, создания колонизационной резистентности и формирования биопленки в кишечнике наиболее гуманно раздельное введение пробиотикови веществ, обладающих сорбционной активностью. Телятам в раннем постэмбриональном периоде развития для предотвращения заражения и распространения вирусных и бактериальных заболеваний, улучшения пищеварения целесообразно применение гипериммунных сывороток с последующим введением энтеросорбентов.
3 Постановка проблемы исследования
Главной целью при выращивании молодняка является формирование стад здоровых животных, устойчивых к действию поллютантов. Важным условием достижения поставленной цели выступает высокая скорость роста, продуктивность и продуктивное долголетие, сохранение здоровья молодняка.
Немаловажное значение имеет правильное и сбалансированное кормление в стартовый период – период адаптации и последующие периоды индивидуального развития. Развитие животного организма сопровождается качественными изменениями и имеет свои характерные морфологические и физиологические особенности.
Период новорожденности, первый критический период в развитии молодняка крупного рогатого скота и цыплят. В этот период происходит адаптация организма к условиям послеутробного развития, становление многих функций: иммунной защиты, кроветворения, терморегуляции, экскреции продуктов обмена и др.
Срыв адаптации может быть обусловлен множеством факторов: неудовлетворительный микроклимат и антисанитарные условия содержания и кормления; для телят запоздалая выпойка молозива, плохое качество молозива, нарушение режима выпойки или выпойка из ведра; для цыплят – длительная перевозка, запоздалое кормление, не соответствующий размер гранул, низкое качество корма, наличие в корме микотоксинов или солей тяжелых металлов.
Применение гипериммунных сывороток молодняку крупного рогатого скота в первые часы после рождения с целью повышения неспецифической резистентности и добавка к рациону цыплят пробиотиков с целью формирования нормофлоры имеют чрезвычайно важное значение.
В связи с ухудшением условий окружающей среды, дестабилизацией экологического равновесия целесообразно применение энтеросорбентов молодняку с первых дней жизни.
Эффективность энтеросорбционной терапии базируется на таких принципах, как:
- участие в связывании и выведении различных токсических веществ и метаболитов, бактериальных токсинов, тяжелых металлов, радионуклидов и других веществ, которые попадают в желудочно-кишечный тракт из внешней среды с кормом и водой;
- участие энтеросорбентов в связывании и выведении токсических веществ, метаболитов и других веществ,образующихся в процессе межуточного обмена и пищеварения;
- влияние энтеросорбентов на микробиоценоз кишечника. Помимо способности выводить энтеротоксины транзиторных и патогенных микроорганизмов, большинство сорбентов могут связывать и выводить из просвета кишечника сами патогенные микроорганизмы, которые обладают высокой адгезивностью и более активно взаимодействуют с сорбентами;
- снижение токсического воздействия различных агентов на эпителиальные клетки кишечника, усиление защитного действия слизистого барьера, что способствует быстрому восстановлению эпителиального слоя.
Таким образом, осуществляетсясистемная детоксикация энтеральной среды,системная эндогенная детоксикация организма, позволяющая уменьшить токсическую и метаболическую нагрузку на органы с высокой функциональной активностью (печень, почки, сердце); санация желудочно-кишечного тракта и стабилизация микробиоценоза кишечника; стабилизация и защита энтерального барьера, что ведет к снижению проницаемости кишечной стенки для токсических веществ [2].
Основная проблема современного скотоводства и птицеводства – это проблема выбора энтеросорбента.
По химической структуре энтеросорбенты подразделяются на несколько групп:
1) природные органические;
2) углеродные;
3) кремнийсодержащие;
4) комбинированные.
К эффективным энтеросорбентам относятся препараты, изготовленные на основе алюмосиликатных минералов, которые благодарясвоим физико-химическим свойствам и строению способны эффективно связывать и удалять из организма токсические вещества, и, тем самым, снижать токсическую нагрузку.
Примером может служить ЭнтероЗоо – полимерное гелевидное кремнийорганическое соединение, имеющее пористую структуру. Препарат обладает выраженными сорбционными и детоксикационными свойствами. В просвете желудочно-кишечного тракта ЭнтероЗоо связывает и выводит из организма эндогенные и экзогенные токсические вещества различногогенеза, также сорбирует некоторые продукты обмена веществ организма, в том числе избыток билирубина, мочевины, холестерина, липидных комплексов, и метаболиты, ответственные за развитие эндтоксикоза.
ЭнтероЗоо не уменьшает всасывание витаминов и микроэлементов, способствует восстановлению нарушенной микрофлоры кишечника и не влияет на его моторику.
Особенностью поведения таких сорбентов в кишечнике является то, что при контакте с живой биологической тканью возникает принципиально новая биоминеральная среда, состоящая из частиц сорбента, молекул токсина и клеток лимфоидного ряда, группирующихся вокруг них. Адсорбенты активно притягивают и удерживают полярные функциональные группы молекул токсинов, создавая на их основе новые структурные соединения, которые за счет увеличения своих размеров не способны сорбироваться внутренними стенками кишечника. Связанные микотоксины фиксируются на поверхности частиц сорбента, что предотвращает их всасывание и распространение по организму, и затем выделяются с фекалиями.
Таким образом, если ЭнтероЗоо способен выводить эндо- и экзогенные токсины из организма, то при его комплексном применении с гипериммунными сыворотками и пробиотиками необходимовыяснить оптимальную дозу, способ, время и курс применения, что:
- повысит сохранность поголовья молодняка первых дней жизни;
- будет стимулироватьв ыведение микроорганизмов и их метаболитов из организма молодняка;
- поспособствует эффективному использованию питательных веществ корма;
- поддержит формирование биоценоза пищеварительного тракта;
- будет содействовать снижению токсической нагрузки на печень и предотвратит развития гепатозов;
- простимулирует синтетическую функцию печени;
- улучшит гемопоэз;
- повысит устойчивость к технологическим и окислительному стрессу, антигенной нагрузке.
Все эти факторы в конечном итоге снизят затратына выращивание молодняка,увеличат прибыль при получении и реализации продукции.
Таким образом, вложение средств на комплексное применение гипериммунных сывороток и энтеросорбентов телятам, и применение пробиотиков и энтеросорбентов цыплятам не только оправдано экономически, но и гарантия получения качественной и безопасной продукции.
4 МЕТОДИКА И РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
4.1. Тема: ОБОСНОВАНИЕ КОМПЛЕКСНОГО ПРИМЕНЕНИЯ И МОНИТОРИНГ ЭФФЕКТИВНОСТИ ДЕЙСТВИЯ ПРЕПАРАТ СЫВОРОТКИ ПРОТИВ ПАСТЕРЕЛЛЕЗА, САЛЬМОНЕЛЛЕЗА, ЭШЕРИХИОЗА, ПАРАГРИППА-3 И ИНФЕКЦИОННОГО РИНОТРАХЕИТА КРУПНОГО РОГАТОГО СКОТАИ ЭНТЕРОСОРБЕНТА ЭНТЕРОЗОО ТЕЛЯТАМ В ПЕРИОД РАННЕГО ПОСТЭМБРИОНАЛЬНОГО РАЗВИТИЯ (В ПЕРВЫЙ КРИТИЧЕСКИЙ ПЕРИОД РАЗВИТИЯ)
Материал и методы исследования: объектом для исследования послужили доморощенные телята костромской породы, полученные от коров 3-4 летнего возраста. В соответствии с планом ветеринарных мероприятий всем телятам в первые сутки жизни вводят сыворотку против пастереллеза, сальмонеллеза, эшерихиоза, парагриппа-3 и инфекционного ринотрахеита крупного рогатого скота с повторным введением через 7-10 дней в соответствии с наставлением по применению.
Для выполнения исследования сформировали 4 группы телят-аналогов по 12 голов в каждой, где 1 группа служила контролем и получала основной рацион (молозиво и молочные продукты); 2, 3 и 4 группы – опытные, кроме основного рациона (ОР), спустя 2 часа после последнего кормления перорально получали взвесь энтеросорбента ЭнтероЗоо, первая группа в дозе 0,1 г/кг, вторая – 0,3 г/кг, третья – и 0,5 г/кг живой массы. Энтеросорбент предварительно растворяли в 200 мл воды индифферентной температуры. Выпаивание сорбента осуществляли в течение 15 суток.
Основными методами исследования были копрологические, микробиологические, гематологические и биохимические.
Схема эксперимента представлена на рисунке 1.
| НОВОРОЖДЕННЫХ ТЕЛЯТА | ||||||||||||||||
| сыворотка против пастереллеза, сальмонеллеза, эшерихиоза, парагриппа-3 и инфекционного ринотрахеита крупного рогатого скота, подкожно в дозе 20 мл | ||||||||||||||||
| 1 группа | 2 группа | 3 группа | 4 группа | |||||||||||||
| копрограмма, микробиоценоз, гематологические, биохимические показатели крови | ||||||||||||||||
| ОР | ОР+0,1г/кг
ЭнтероЗоо |
ОР+0,3г/кг
ЭнтероЗоо |
ОР+0,5г/кг
ЭнтероЗоо |
|||||||||||||
| ЧЕРЕЗ 2 ЧАСА ПОСЛЕ ПОСЛЕДНЕГО КОРМЛЕНИЯ | ||||||||||||||||
| 5-СУТОЧНЫЕ ТЕЛЯТА | ||||||||||||||||
| копрограмма, микробиоценоз, гематологические, биохимические показатели крови | ||||||||||||||||
| 7-10 СУТОЧНЫЕ ТЕЛЯТА | ||||||||||||||||
| сыворотка против пастереллеза, сальмонеллеза, эшерихиоза, парагриппа-3 и инфекционного ринотрахеита крупного рогатого скота, подкожно в дозе 20 мл | ||||||||||||||||
| 15-СУТОЧНЫЕ ТЕЛЯТА | ||||||||||||||||
| копрограмма, микробиоценоз, гематологические, биохимические показатели крови | ||||||||||||||||
Рисунок 1 – Схема проведения эксперимента по теме 4.1.
4.1.1 Тема: ДИНАМИКА КОПРОГРАММЫ У ТЕЛЯТ НА ФОНЕ ПРИМЕНЕНИЯ СЫВОРОТКИ И ЭНТЕРОЗОО
Цель:оценить переваримость корма у телят на фоне примененияэнтеросорбентаЭнтероЗоо и сывороткипротив пастереллеза, сальмонеллеза, эшерихиоза, парагриппа-3 и инфекционного ринотрахеита крупного рогатого скотапо копрограмме.
Методика и результаты исследования: пробы фекалий отбирали непосредственно из прямой кишки в стерильные контейнеры (FL-medical) в течение двух часов после рождения, до выпойки первой порции молозива, а также на 5 и 15 сутки жизни телят.
Использованы клинико-лабораторные методы с применением микроскопии нативных препаратов, препаратов с реактивами Люголя и Саатгофа, а также микроскопия мазков, окрашенных по Романовскому-Гимзе, в соответствии с общепринятыми методиками, при помощи микроскопа Микромед 3Вар3-20 и видеокамеры с программным обеспечением MicroscopeColorDigitalCameraLevenhukC 1400 NG, объектив SP40X/0.65 и SP10X/0.25 и окулярWF10X/22.
У новорожденных телят кал (меконий) буро-желтого цвета, запах не выражен, консистенция густая, вязкая, неоформленная с незначительной примесью волос, реакция среды – от слабо-кислой до кислой.
При микроскопии нативных препаратов в 50% случаев в незначительном количестве присутствует слизь. Микрофлора представлена кокковой и палочковидной формами в равном соотношении, и варьирует от единичных клеток до значительного количества (рисунок 2). Встречаются эритроциты и лейкоциты (до 5-7 клеток в поле зрения) и единичные клетки кишечного эпителия. При микроскопии в 70% случаев нейтральные жиры обнаруживаются в единичном и умеренном количестве, в 30% – в большом и очень большом количестве (рисунок 2). Во всех пробах обнаруживается внеклеточный крахмал (до 10-15 зерен) и единичные зерна внутриклеточного крахмала. Йодофильная микрофлора в кале представлена палочковидными формами в единичных экземплярах.
 |
 |
| Рисунок 2 – Смешанная микрофлора (окраска по Граму). Препарат кала новорожденного теленка(Объектив SP40X/0.65; окуляр WF10X/22.) | Рисунок 3 – Нейтральный жир в препарате кала телят с реактивом Саатгофа (Объектив SP10X/0.25; окуляр WF10X/22). |
В 1 группе у 5-суточных телят цвет каловых масс от светло-желтого до охристо-коричневого, запах – от кисловатого до кислого, консистенция – от линиментообразной со щелочной рН (30%) до мазевидной с кислой рН (70%). В отличие показателя у новорожденных телят, в пробах кала посторонние примеси отсутстуют, однако на поверхности кала в 100% проб имеется слизь в умеренном количестве. Обнаружены эритроциты (до 5 клеток в поле зрения), лейкоциты (до 10 клеток) и клетки кишечного эпителия в большом количестве. В 100% проб обнаружены нейтральные жиры в очень большом количестве, и единичные зерна вне- и внутриклеточного крахмала. В большом количестве установлена йодофильная палочковидная микрофлора, а кокковая в 30% проб.
У 5-суточных телят 2 группы цвет кала от желтого до светло-коричневого. В 70 % случаев незначительное количество слизи на поверхности и в смеси с каловыми массами, единичные клетки кишечного эпителия, запах и рН кислые; у 30% в кале умеренное количествослизи, запах специфический, рН слабо-щелочная. В пробах присутствуют эритроциты и лейкоциты, соответственно до 6 и 12 клеток в поле зрения. Консистенция кала мазевидная, обнаружены единичные зерна внутри- и внеклеточного крахмала. Нейтральный жир (от незначительного до очень большого количества) выявлен в 100% проб. В 30% проб отмечены единичные струвиты (рисунок4). Микрофлора представлена кокками и палочками, с преобладанием кокковой микрофлоры у 30% животных. Йодофильная палочковидная микрофлора отсутствовала во всех пробах (рисунок 5).
 |
 |
| Рисунок 4 – Кристаллы струвитов в нативном препарате кала 15-дневного теленка (Объектив SP40X/0.65; окуляр WF10X/22). | Рисунок5 – Смешанная микрофлора (окраска по Граму).Препарат кала 15-дневного теленка (Объектив SP40X/0.65;окуляр WF10X/22). |
У пятисуточных телят 3 группы кал коричневого цвета с зеленоватым, сероватым или терракотовым оттенком, специфическим запахом, слабокислой рН, мягкой (30%) или тестообразной (70%) консистенции. На поверхности кала слизи не обнаружено, в смеси с калом обнаружены слизистые тяжи в 70% проб; внутриклеточный крахмал и очень большое количество жира выявлены в 30% проб, внеклеточный крахмал и незначительное количество нейтрального жира выявлены в 70% проб. Йодофильная микрофлора представлена палочками в незначительном количестве.Эритроциты до 2 клеток в поле зрения были во всех пробах, лейкоциты до 2 клеток в 70% проб. В 30% проб, где содержание лейкоцитов более 2 клеток в поле зрения микроскопа, обнаружено умеренное количество клеток кишечного эпителия с преобладанием палочковидной микрофлоры.
У 5-суточных телят 4 группыкал желто-коричневого, буроватого цвета, мазевидной консистенции, с кислым запахом и слабо-кислой рН. В 70% проб на поверхности присутствовало незначительное или умеренное количество слизи, и в 100% проб слизь обнаружена в смеси с калом. В 30 % пробах выявлены соли оксалата кальция дигидрата. Наличие от 5 до 8 эритроцитов, от 5 до 10 лейкоцитов, незначительное количеств кишечного эпителия и нейтрального жира в поле зрения микроскопа выявлено в 70% проб. В 30% случаев обнаружены клетки кишечного эпителия и нейтральный жир в умеренном количестве. Во всех пробах обнаружены единичные зерна внутри- и внеклеточного крахмала. Йодофильная микрофлора представлена палочками в незначительном количестве.
У телят 5-суточного возраста в 1-4 группах не обнаружена переваримая и непереваримая клетчатка, мышечные волокна, жирные кислоты и мыла.
У телят 15-суточного возраста 1 группы кал серо-желтого цвета с гнилостным запахом, мазевидной консистенции, щелочной рН. Слизь на поверхности и в смеси с калом от умеренного до значительного количества в виде тяжей. Внутри- и внеклеточный крахмал в умеренном количестве присутствует, соответственно, в 100% и 30% проб. Нейтральный жир и кишечный эпителий в значительном количестве выявлены в 100% проб, в 30% проб присутствуют микроскопические кристаллы струвитов. Микрофлора представлена кокками и палочками в равном соотношении во всех пробах. В значительном количестве йодофильная микрофлора (палочковидные формы) обнаружена в 30% проб, в умеренном количестве – в 70%. Значительное содержание эритроцитов (до 20 в поле зрения) выявлено в 70% проб, содержание лейкоцитов достигло 25 клеток в поле зрения каждой пробы. Во всех пробах кала переваримая и непереваримая клетчатка, мышечные волокна, жирные кислоты и мыла отсутствовали.
У телят 15-суточного возраста 2 группы при макроскопическом исследовании кал без примесей, желто-серого– серо-коричневого цвета, специфического запаха, мягкой консистенции, слабощелочной рН. Слизь в виде мало заметного блестящего налета на поверхности кала в 100% проб; в смеси с калом – в 30% проб. Во всех пробах в небольшом количестве встречался внеклеточный крахмал в виде темно синих зерен, внутриклеточный крахмал в умеренном количестве отмечен лишь в 30% проб. Переваримая растительная клетчатка отсутствовала во всех пробах, непереваримая растительная клетчатка в виде клеток с толстыми двухконтурными оболочками и широкими межклеточными перегородками наблюдалась в умеренном количестве в 30% проб. Единичные капли нейтрального жира, и умеренное его количество отмечены в 60%, значительное количество – в 40% проб. Содержание мыла в незначительном количестве и кристаллы струвитов установлены в 30% пробах. Клеточные элементы в 30% проб представлены эпителиальными клетками кишечника в умеренном количестве и эритроцитами (до 2 в поле зрения), в 100% проб лейкоцитами (2-3 в поле зрения). В 30% проб микрофлора представлена кокками и палочками в соотношении 70:30, тогда как у 70% в соотношении 50:50. Йодофильная флора в 30% обнаружена в виде палочковидной и кокковой формах в соотношении 1:1, а у 70% представлена только палочковидной формой.
Кристаллы жирных кислот отсутствовали во всех пробах.
У 15-суточных телят 3 группы при визуальном исследовании кал коричневого или охристого цвета, с нерезким, специфическим запахом, мягкой консистенция, слабокислой рН с примесями в виде тяжей слизи во всех пробах. Слизь на поверхности кала в умеренном и незначительном количестве, соответственно, в 30% и 70% проб. Внеклеточный и внутриклеточный крахмал обнаруживался единично в поле зрения лишь в 30% проб. Растительная клетчатка как переваримая, так и непереваримая отсутствовала во всех пробах. Капли нейтрального жира в 30% проб отмечены единично в поле зрения, в 70%–в небольшом количестве. Кристаллы жирных кислот, мыла, мышечные волокна, соли – отсутствовали. Содержание эритроцитов во всех пробах единично в поле зрения, вариации лейкоцитов значительно выражены: от 0 до 2 в поле зрения в 80% проб, до 10 в поле зрения – в 20% проб. Микрофлора представлена кокками и палочками в соотношении 70:30 во всех пробах. Йодофильная флора в 80% проб представлена палочковидной формой, а в 20% проб кокковой формой.
У 15-суточных телят 4 группы кал буроватого, серо-зеленого цвета, мягкой консистенции, с нерезким специфическим запахом, кислой рН, незначительным количеством слизи на поверхности. Наличие значительного количества примесей в виде слизистых тяжей выявлено в 30% проб. Единично в поле зрения обнаружены зерна внеклеточного крахмала в 30% проб, в незначительном количестве – в 70% проб. Крахмал внутриклеточный отсутствовал во всех пробах. В 30% проб обнаружены капли нейтрального жира единично в поле зрения, в 70% проб – незначительное количество. Единичные эритроциты наблюдались во всех пробах, тогда как лейкоциты и кишечный эпителий отмечали лишь в 30% проб. Соотношение кокковой и палочковой флоры в 20% проб находилось в равных пропорциях, в 80% проб – соотношение составило, как 90:10.
У 15-суточных телят в 1-4 группах отсутствовали соли жирных кислот и переваримая клетчатка.
Таким образом, у всех телят 5-суточного возраста в кале отсутствует переваримая и непереваримая клетчатка, мышечные волокна, жирные кислоты и мыла;у 15-суточных телят в 1-4 группах соли жирных кислот и переваримая клетчатка не выявляются.
В кале 5-суточных телят контрольной группы в большом количестве присутствуют клетки кишечного эпителия, нейтральные жиры, йодофильная палочковидная микрофлора, у 15-суточных отмечается гнилостный запах кала и сдвиг рН в щелочную сторону
У 5-суточных телят 2 группы выявлены единичные струвиты, отсутствие йодофильной палочковидной микрофлоры; у 15-суточных телят в 30% проб обнаружены непереваримая растительная клетчатка, мыла, струвиты и клеточные элементы.
У 5-суточных телят 3 группы отмечено незначительное количество форменных элементов, йодофильная палочковидная микрофлора в незначительном количестве; у 15-суточных телят – единичные эритроциты, преобладает кокковая микрофлора, среди йодофильной – палочковидная.
У 5-суточных телят 4 группыв 30 % проб отмечены соли оксалата кальциядигидрата, клетки кишечного эпителия и нейтральный жир в умеренном количестве, йодофильная микрофлора представлена палочками в незначительном количестве; у 15-суточных телят отсутствует крахмал внутриклеточный, в 30% проб отмечены единичные элементы крови и кишечный эпителий, преобладающая кокковая флора.
4.1.2 Тема:ДИНАМИКА МИКРОФЛОРЫ У ТЕЛЯТ В РАННЕМ ПОСТЭМБРИОНАЛЬНОМ ОНТОГЕНЕЗЕ НА ФОНЕ ПРИМЕНЕНИЯ СЫВОРОТКИ И ЭНТЕРОЗОО
Цель: оценить динамику кишечной микрофлоры у новорожденных телят в постнатальном развитии на фоне применения энтеросорбентаЭнтероЗоо и сывороткипротив пастереллеза, сальмонеллеза, эшерихиоза, парагриппа-3 и инфекционного ринотрахеита крупного рогатого скота.
Методика и результаты исследования:пробы фекалий для микробиологических исследований отбирали непосредственно из прямой кишки в стерильные контейнеры (FL-medical) в течение двух часов после рождения, до выпойки первой порции молозива, а также на 5 и 15 сутки жизни телят.
Оценку микрофлоры проводили по стандартному протоколу, включающему количественное определение Bifidobacterium; Lactobacillus; E.coli (с нормальной ферментативной активностью, со сниженной ферментативной активностью, лактозонегативной и гемолизирующей активностью); Enterococcuss; Klebsiella; Enterobacteriaceae(Hafnia; Serracia; Citrobacter); Enterobacter; Staphylococcusaureus и Staphylococcusepidermidis;Pseudomonasaeruginosa; Clostridium; также неферментирующих грамотрицательных бактерий;патогенных микроорганизмов семейства Enterobacteriaceae (Salmonella, Shigella и энтеропатогенной кишечной палочки (O157:H7)); Proteus и Candida.
Оценка заселения кишечника облигатной микрофлорой выявила, что у новорожденных телят присутствуют бифидо- и лактобактерии, кишечная палочка с нормальной ферментативной активностью и энтерококки пропорционально 1×106 КОЕ/г; 1×104 КОЕ/г; 1×102 КОЕ/г и 1×104 КОЕ/г (таблица 1).
У 5-суточных телят 1 группы количество бифидобактерий увеличилось до 1×108 КОЕ/г, лактобактерий и кишечной палочки с нормальной ферментативной активностью до 1×106 КОЕ/г, энтерококков до 1×105 КОЕ/г, выявлены клостридии, уровень которых достиг 1×103 КОЕ/г.
К 15-суточному возрасту концентрация бифидо-, лактобактерий и кишечной палочки с нормальной ферментативной активностью, энтерококков и клостридий не изменилась. Обнаружена гемолизирующая кишечная палочка в концентрации до 1×106 КОЕ/г и энтеробактер – до 1×106 КОЕ/г.
У 5-суточных телят 2 группы не выявлены отличия по видовому и количественному составу микроорганизмов от аналогичных показателей контрольной группы.
Таблица 1 – Динамика кишечной микрофлоры у телят контрольной и опытных групп, КОЕ/г
| Группы телят | Бифидобактерии | Лактобактерии | Кишечная палочка
с нормальной ферментативной активностью |
Энтерококки |
| Новорожденные | 1×106 | 1×104 | 1×102 | 1×104 |
| 5-суточные | ||||
| 1 группа | 1×108 | 1×106 | 1×106 | 1×105 |
| 2 группа | 1×108 | 1×106 | 1×106 | 1×105 |
| 3 группа | 1×108 | 1×108 | 1×108 | 1×105 |
| 4 группа | 1×108 | 1×108 | 1×108 | 1×105 |
| 15-суточные | ||||
| 1 группа | 1×108 | 1×106 | 1×106 | 1×105 |
| 2 группа | 1×109 | 1×108 | 1×108 | 1×107 |
| 3 группа | 1×108 | 1×108 | 1×108 | 1×105 |
| 4 группа | 1×108 | 1×108 | 1×108 | 1×105 |
У телят 3 и 4 групп видовой состав соответствовал ранее установленному в 1 и 2 группах, но в количественном отношении превосходил таковое: содержание лактобактерий, кишечной палочки с нормальной ферментативной активностью и энтерококков достигло соответственно 1×108 КОЕ/г; 1×108 КОЕ/г и 1×105 КОЕ/г.
У 15-суточных телят 2, 3 4 групп содержание колониеобразующих единиц бифидо-, лактобактерий и кишечной палочки с нормальной ферментативной активностью соответствовало 1×109;1×108 и 1×108. Концентрация энтерококков у телят 3 и 4 опытных групп достигала 1×105 КОЕ/г, во2 – до 1×107 КОЕ/г.
Анализ динамики колонизации кишечника новорожденных телят показал ступенчатое, поэтапное заселение микроорганизмами. Наиболее активными колонизаторами являются бифидобактерии, их концентрация увеличилась от 1×106 КОЕ/г у новорожденных телят до 1×108 КОЕ/г у 15-суточных телят контрольной группы и до 1×109 КОЕ/г у телят опытных групп.
Концентрация лактобактерий от 1×104 КОЕ/г у новорожденных телят увеличивается до 1×106 КОЕ/г у 15-суточных телят контрольной и 1×108 КОЕ/г в опытных группах. Обладая высокой ферментативной активностью и способностью к адгезии на слизистой оболочке кишечника, метаболизму белков, липидов, углеводов и детоксикации организма лактобактерии улучшают процесс пищеварения и обмен веществ.
Кишечная палочка с нормальной ферментативной активностью в кишечнике новорожденных телят имела концентрацию, не превышающую 1×102 КОЕ/г, к 5-суточному возрасту у телят контрольной группы ее содержание достигло 1×106 КОЕ/г и стабилизировалось. В опытных группах 15-суточных телят ее концентрация увеличилась до 1×108 КОЕ/г. Эта группа микроорганизмов продуцирует антибиотикоподобные вещества, тормозящие рост патогенной кишечной палочки и является непосредственным конкурентом условно-патогенной микрофлоры. Немаловажное значение кишечная палочка имеет в холестериновом обмене и обмене жирных кислот. Дефицит резидентных микроорганизмов ведет к нарушению липидного и углеводного обменов, что в дальнейшем способствует развитию ожирения.
Энтерококки, или фекальные стрептококки, не превышающие 105-106 КОЕ/г фекалий относятся к нормальной микрофлоре желудочно-кишечного тракта. У новорожденных телят энтерококки не превышали 104 КОЕ/г, однако к пятым суткам их концентрация увеличилась до 105 КОЕ/г у телят 1-4 групп и не изменилась к 15-суткам в 1, 3 и 4 группах. Во2 группе у 15-суточных телят концентрация энтерококков достигла 107 КОЕ/г.
У 5-суточных телят контрольной группы выявлены клостридии (до 103 КОЕ/г), а к 15-суточному возрасту кроме клостридий появились гемолизирующая кишечная палочка и энтеробактер (до 106 КОЕ/г).
Таким образом, выпаивание взвеси ЭнтероЗоо в дозе 0,3 г/кг и 0,5 г/кг живой массы целесообразно до 5-суточного возраста, после 5-суточного – наиболее эффективно выпаивание энтеросорбента в дозе 0,1 г/кг.
4.1.3 Тема: ИЗМЕНЕНИЕ ПОКАЗАТЕЛЕЙ ПЕРИФЕРИЧЕСКОЙ КРОВИ НОВОРОЖДЕННЫХ ТЕЛЯТ НА ФОНЕ ПРИМЕНЕНИЯ СЫВОРОТКИ И ЭНТЕРОЗОО
Цель:оценить изменение гематологических показателей у телят на фоне применения энтеросорбента ЭнтероЗоо и сыворотки против пастереллеза, сальмонеллеза, эшерихиоза, парагриппа-3 и инфекционного ринотрахеита крупного рогатого скота.
Методика и результаты исследования: кровь для анализа получали из яремной вены у новорожденных телят и в утренние часы (до кормления) у 5-и 15-суточных телят.
Отбор проб кровисовершалив специальные вакуумные пробирки с ЭДТА К3, анализ выполнялина автоматическом гематологическом анализатореPCE-90Ve.
Мазки крови окрашивали по Романовскому-Гимзе. Подсчет интегральных лейкоцитарных индексов (ЛИИр, РОН, ЯИ, ИГ, ИСНМ и ЛГИ) осуществляли в соответствии с формулами.
Наиболее информативным показателем у новорожденных животных, определяющих их жизнеспособность, является содержание эритроцитов, гемоглобина и эритроцитарные индексы.
Характерным для телят первых суток жизни является низкое содержание эритроцитов и гемоглобина, обусловленное заменой фетального гемоглобина c последующим гемолизом эритроцитов. Поэтому у новорожденных телят относительно низкий гематокрит, высокое среднее содержание гемоглобина в эритроците и невысокая его концентрация, а также отмечается анизоцитоз, макроцитоз, полихромазия (таблица2).
Концентрация эритроцитов в периферической крови у телят уже на 5 сутки достоверно увеличилась: в контрольной группе на 33,6%, в опытных 2, 3 и 4, соответственно, на 37,7%; 26,2% и 38,7% (р≤0,05) (рисунок 6).
Таблица 2– Динамика показателей красной крови у новорожденных телят контрольной и опытных групп, M±m
| Показатель | RBC,
×1012/L |
HGB,
g/L |
HCT,
% |
MCV,
fL |
MCH,
pg |
MCHC,
g/L |
| Новорожденные | 6,97
±0,04 |
98,40
±2,08 |
30,16
±0,58 |
43,34
±0,58 |
14,06
±0,19 |
326,0
±3,2 |
| 1 группа | ||||||
| 5 суток | 9,31
±0,52 |
129,60
±2,08 |
37,46
±1,59 |
40,28
±0,62 |
14,02
±0,62 |
340,6
±11,1 |
| 15 суток | 8,80
±0,14 |
116,20
±3,36 |
33,34
±1,69 |
38,86
±2,61 |
13,02
±0,78 |
348,6±
8,7 |
| 2 группа | ||||||
| 5 суток | 9,60
±0,24 |
128,50
±2,50 |
38,57
±0,38 |
40,60
±1,10 |
13,50
±0,47 |
333,0
±3,7 |
| 15 суток | 9,37
±0,24 |
119,67
±3,33 |
37,40
±0,67 |
39,93
±0,87 |
12,83
±0,13 |
320,2
±7,5 |
| 3 группа | ||||||
| 5 суток | 8,76
±0,38 |
122,67
±3,56 |
34,97
±1,04 |
40,00
±1,60 |
14,00
±0,40 |
351,0
±8,0 |
| 15 суток | 9,28
±0,05 |
121,60
±2,08 |
35,42
±0,10 |
38,16
±0,23 |
13,12
±0,18 |
343,6
±5,3 |
| 4 группа | ||||||
| 5 суток | 9,67
±0,22 |
142,40
±3,52 |
42,06
±0,61 |
43,60
±1,36 |
14,72
±0,10 |
339,8
±4,2 |
| 15 суток | 9,25
±0,13 |
124,20
±1,44 |
40,52
±0,46 |
43,82
±0,18 |
13,42
±0,06 |
307,0
±1,2 |
Также во всех группах заметно повышение гемоглобина, гематокрита и эритроцитарных индексов (рисунок 7).
Несмотря на наиболее высокое содержание гемоглобина и гематокрита у телят 4 группы, средняя концентрация гемоглобина в эритроцитеу телят 3 группы имела тенденцию к превышению аналогичного показателя в контрольной, 2 и 4 опытных группах.
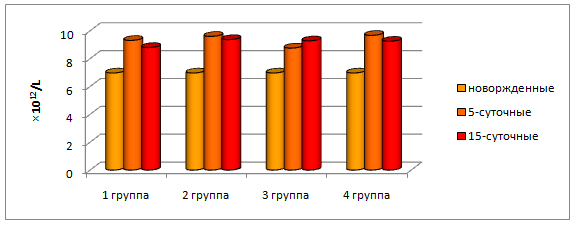
Рисунок 6– Динамика эритроцитов в крови у телят контрольной и опытных групп.
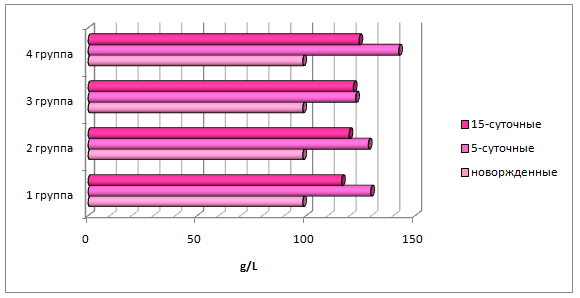
Рисунок 7– Динамика гемоглобина в крови у телят контрольной и опытных групп.
На 15 сутки у телят 1 группы отмечалось снижение концентрации эритроцитов и гемоглобина на 5,5% и 10,3% (р≤0,05), у телят 2 и 4 опытных групп наметилась тенденция к снижению эритроцитов и снижению гемоглобина, тогда как у телят 3 группы увеличилось содержание эритроцитов на 5,9% (р≤0,05), а достоверного изменения гемоглобина не выявлено.
Анализируя корреляционную зависимость между изучаемыми показателями, установили по шкале Чеддока положительную весьма высокую и высокую взаимосвязь между содержанием гемоглобина, соответственно, у 5-суточных и 15-суточных телят 1 и 3 групп. Известно, что после первоначального подъема гемоглобина, в последующем он начинает снижаться, параллельно с ним изменяется и гематокрит, что влечет изменение и эритроцитарных индексов. Так, MCHCу телят опытных групп имел тенденцию к снижению, тогда как в контрольной группе – к повышению. Такое состояние является физиологически нормальным.
У новорожденных телят содержание тромбоцитов на фоне последующих исследований было меньше, но не выходило за пределы референсных значений (таблица 3). Наибольшее количество тромбоцитов у телят 5-суточного возраста было во 2 группе, и превышало аналогичный показатель в 1, 3 и 4 группах на 16,1%; 3,7% и 16,8%, соответственно. У 15-суточных телят 4 группы содержание тромбоцитов больше, чем в 1 группе на 12,8%, 2 группы – на 10,9% и 3 группы – на 7,7% (р≤0,05).
В первые дни после рождения концентрация циркулирующих лейкоцитов в периферической крови может увеличиваться (таблица 3).
Таблица 3 – Динамика тромбоцитов и лейкоцитов у новорожденных телят контрольной и опытных групп, M±m
| Показатель | Новорожденные | 1 группа, сутки | 2 группа, сутки | 3 группа, сутки | 4 группа, сутки | ||||
| 5 | 15 | 5 | 15 | 5 | 15 | 5 | 15 | ||
| PLT, ×109/L | 359,40±5,68 | 475,4
±7,68 |
524,8
±8,64 |
566,7
±4,67 |
536,5
±13,5 |
545,7
±4,33 |
555,4
±12,9 |
471,6
±16,5 |
602,0
±8,8 |
| WBC, ×109/L | 15,86±0,13 | 30,98
±0,26 |
13,80
±0,32 |
12,43
±0,24 |
7,82
±0,22 |
13,14
±0,52 |
7,84
±0,11 |
11,54
±0,37 |
7,12
±0,34 |
В результате введения новорожденным телятам сыворотки против пастереллеза, сальмонеллеза, эшерихиоза, парагриппа-3 и инфекционного ринотрахеита крупного рогатого скота у контрольной группы на 5 сутки отмечена лейкоцитарная реакция. На 15 сутки исследования их концентрация меньше первоначального показателя на 12,99% (р≤0,05). В контрольной группе телят в первые часы после рождения в спектре белой крови преобладают нейтрофилы, общее количество которых превышает 65%, что свидетельствует о подчинении ее общему закону онтогенеза. К 5-суточному возрасту устанавливается равновесие между лимфоцитами и нейтрофилами, к 15-суточному – преобладание процентной концентрации лимфоцитов.
У телят опытных, 2, 3 и 4 групп на 5 сутки отмечено снижение процентной концентрации лейкоцитов на 21,6%; 17,2% и 27,2%, соответственно (р≤0,05). К 15-суточному возрасту содержание лейкоцитов в периферической крови относительно предыдущего периода исследования также снизилось (на 37-40%).
На 5 сутки у телят среди клеток белой крови преобладали лимфоциты, на 15 сутки в лейкограмме не выявлено достоверных изменений.
Экспериментальнымииклиническимиисследованиямиустановлено, что определениеклеточногосоставакровипоморфологическимпризнакампозволяетнетолькоопределять, ноипрогнозироватьсостояниесистем специфическогоинеспецифическогоиммунитетаиорганизмавцелом.
Наиболее информативными индексами интоксикации (ИИ) являются ЛИИр (индекс интоксикации Б.А. Рейса), РОН (реактивный ответ нейтрофилов Т.Ш. Хабирова) и ЯИ (ядерный индекс Г.Д. Даштаянца), они позволяют оценить иммунологический статус (таблица 4).
У новорожденных телят наиболее высокий индекс ЛИИр, который с возрастом снижается. Так в контрольной группе у 5- и 15-суточных телят ЛИИр снизился в 2,46 раза и в 3,03 раза. Пероральное введение взвеси ЭнтероЗоо телятам 2 группы способствовало снижению ЛИИр у 5- и 15-суточных телят в 5,69 раз; 3 группы – в 3,31 и 3,37 раза, 4 группы – в 3,64 и 3,87 раза соответственно. Фактически ЛИИр отражает в количественном выражении сдвиг лейкоцитарной формулы в сторону отдельных видов лейкоцитов, подтверждая физиологический лейкоцитарный перекрест (таблица 4).
Таблица 4 – Динамика лейкоцитарных индексов у телят контрольной
и опытных групп
| Показатель | Индексы интоксикации | Индексы неспецифической реактивности | Индекс контроля воспаления | |||
| ЛИИр | РОН | ЯИ | ИГ | ИСНМ | ЛГИ | |
| Новорожденные | 1,82 | 8,41 | 0,16 | 0,51 | 13,58 | 0,48 |
| 1 группа | ||||||
| 5 суток | 0,74 | 2,16 | 0,22 | 1,2 | 5,4 | 1,15 |
| 15 суток | 0,60 | 2,37 | 0,22 | 1,49 | 5,22 | 1,45 |
| 2 группа | ||||||
| 5 суток | 0,32 | 0,46 | 0,12 | 3,14 | 13,30 | 2,93 |
| 15 суток | 0,32 | 0,25 | 0,16 | 3,22 | 11,06 | 2,80 |
| 3 группа | ||||||
| 5 суток | 0,55 | 1,06 | 0,07 | 1,78 | 21,36 | 1,73 |
| 15 суток | 0,54 | 0,93 | 0,12 | 1,79 | 19.20 | 1,69 |
| 4 группа | ||||||
| 5 суток | 0,50 | 2,44 | 0,07 | 2,01 | 23,86 | 1,93 |
| 15 суток | 0,47 | 0,58 | 0,07 | 2,12 | 40,24 | 2,00 |
РОН, как и ЛИИр наиболее высокий у новорожденных телят. В контрольной группе уже на 5 сутки он снизился в 3,89 раза, и оставался на низком уровне у телят 15-сточного возраста. Во 2 опытной группе у 5- и 15- суточных телят РОН снизился в 18,28 и 33,64 раза, 3 опытной – в 7,93 и 9,04 раза, 4 опытной – в 3,45 и 14,50 раза, соответственно.
ЯИ показывает соотношение суммы моноцитов и палочкоядерных нейтрофилов к содержанию сегментоядерных нейтрофилов в крови.
У 5-суточных телят 1 группы индекс увеличился в 1,37 раза и не изменился при достижении 15-суточного возраста. У 5-суточных телят 2 группы индекс снизился в 1,33 раза и к 15-суткам достиг первоначального показателя. У телят 3 группы к 5-суточному возрасту ЯИ снизился в 2,29 раза, к 15-суточному повысился, однако был ниже, чем первоначальный показатель. В 4 группе отмечено снижение индекса в 5-суточном возрасте в 2,29 раза и отсутствие дальнейших изменений.
Анализ группы ИИ показал, что применение ЭнтероЗооспособствует существенному снижению интоксикации у телят опытных групп на фоне двукратного введения сыворотки.
Вторая группа анализируемых лейкоцитарных индексов – группа, отражающая реактивность организма, то есть способность организма дифференцировано отвечать на действие раздражителей. От реактивности зависит способность новорожденного приспосабливаться к меняющимся условиям среды обитания, поддерживать гомеостаз.
Рассматриваемые индексы – ИГ (индекс адаптации Л.Х Гаркави) и ИСНМ (индекс соотношения нейтрофилов и моноцитов) у новорожденных телят соответствовали 0,51 и 13,58.
Индекс Гаркави представляет отношение процента лимфоцитов к проценту сегментоядерных нейтрофилов, и, как правило, с увеличением процента лимфоцитов повышается. У 5-суточных телят 1 группы ИГ повысился в 2,35 раза, 15-суточных – в 2,92 раза.У телят 2 группы 5- и 15-суточного возраста ИГ увеличился в 6,16 и 6,31 раза, у телят 3 группы – в 3,49 и 3,51 раза, 4 группы – в 3,94 и 4,16 раза, соответственно.Повышение ИГ можно трактовать как фактор активной ответной реакции организма на введение сыворотки.
ИСНМ позволяет судить о соотношении компонентов микрофагально-макрофагальной системы защиты. У новорожденных телят индекс составил 13,58. В 1 группе телят в 5- и 15-суточном отмечено снижение индекса в 2,5 и 2,6 раза.
Во 2 опытной группе у телят 5- и 15-суточного возраста отмечено незначительное снижение ИСНМ (в 1,02 и 1,23 раза). У телят 3 опытной и 4 опытной групп наблюдали повышение данного индекса, в частности у 5- и 15-суточных телят 3 группы в 1,57 и 1,41 раза, 4 группы – в 1,75 и 2,96 раза соответственно, что, свидетельствует о повышении защитных механизмов.
ЛГИ – лимфоцитарно-гранулоцитарный индекс И.С. Шевченко. У новорожденных телят концентрация лимфоцитов меньше, чем суммарное содержание гранулоцитов, что было установлено при анализе лейкограммы, соответственно,ЛГИсоставил 0,48. У 5-суточных телят контрольной группы индекс увеличился в 2,39 раза, у 15-суточных – в 3,02 раза (р≤0,05).
У телят, получивших взвесь ЭнтероЗоо в дозе 0,1 г/кг ответная реакция организма была выше: у 5-суточных телят ЛГИ повысился в 6,1 раза, у 15-суточных – в 5,83 раза. У 5- и 15-суточных телят, получивших взвесь препарата в дозе 0,3 г/кг живой массы, индекс увеличились в 3,6 и 3,52 раза, а у получивших взвесь в дозе 0,5 г/кг – в 4,0 и 4,17 раза соответственно.
Таким образом,на фоне введения телятам сыворотки против пастереллеза, сальмонеллеза, эшерихиоза, парагриппа-3 и инфекционного ринотрахеита крупного рогатого скота у 5-суточных телят контрольной группы отмеченоувеличение концентрации лейкоцитов и последующее их снижение. У телят 5-суточного возраста наблюдалось повышение показателей красной крови, и незначительное снижение их к 15-суточному возрасту.
Опытные группы телят, получившие на протяжении всего периода исследования взвесь ЭнтероЗоо, менее подвержены физиологической эндотоксинемии. Отражением детоксикационных свойства ЭнтероЗоо можно считать менее выраженную лейкоцитарную реакцию в ответ на введение сыворотки, более высокое содержание гемоглобина, эритроцитов, гематокрита и тромбоцитов.
У телят 2, 3 и 4 групп индексы интоксикации были значительно ниже, индексы реактивности и уровень клеточной защиты выше по сравнению с контрольной группой.
4.1.4 Тема: ВЛИЯНИЕ КОМПЛЕКСА ПРЕПАРАТОВНА БИОХИМИЧЕСКИЕ ПОКАЗАТЕЛИ КРОВИ ТЕЛЯТ
Цель:изучить особенности обмена веществ у телят в период новорожденности на фоне применения сыворотки и ЭнтероЗоо.
Методика и результаты исследований:отбор проб крови проводили в специальные вакуумные пробирки с активатором свертывания, исследование выполняли на биохимическом анализаторе BA-88A.
Значимыми показателями для новорожденных телят является активность трансамназ: аспартат- и аланинаминотрансферазы. АСТ и АЛТ участвуют в аминокислотном и энергетическом обмене, обеспечивая глюконеогенез, поддерживают организм в работоспособном состоянии в периоды голодания или дефицита питательных веществ.
На фоне активности АСТ у новорожденных телят, у 5-суточных 1 и 4 групп отмечен недостоверное повышение концентрации фермента, тогда как во 2 и 3 группах отмечено снижение, соответственно, на 23,1% и 11,4% (р≤0,05) (таблица 5). У 15-суточных телят активность фермента снизилась, наиболее значительно в 3 (на 31,9%) и 4 (на 35,6%) группах по сравнению с первоначальным показателем (р≤0,05) (рисунок 8).
Таблица 5 – Динамика активности энзимов у телят контрольной и опытных групп, Ед/л
| Показатель | Группы телят, возраст | ||||||||
| новорожденные | 1 | 2 | 3 | 4 | |||||
| 5 | 15 | 5 | 15 | 5 | 15 | 5 | 15 | ||
| АСТ | 55,66±2,19 | 57,18±1,22 | 48,72±2,10 | 42,82±3,98 | 45,62±1,98 | 49,32±1,52 | 37,92±1,14 | 57,30±1,44 | 35,84±2,19 |
| АЛТ | 11,74±1,63 | 17,56±0,82 | 14,60±0,76 | 13,62±1,74 | 17,12±0,22 | 18,43±0,86 | 17,54±0,19 | 16,80±0,24 | 15,22±0,54 |
| Щелочная фосфатаза | 565,54±57,37 | 851,6±24,7 | 561,7±9,00 | 841,9±23,4 | 383,9±5.70 | 706,2±13,6 | 311,5±4,03 | 610,3±4,63 | 299,4±7,99 |
Изначально активность АЛТ у телят низкая, так как клетки печени не испытывали ощутимую нагрузку (рисунок 8). У 5-суточных телят происходит повышение активности фермента, что наиболее заметно у телят 1 и 3 групп, где АЛТ увеличилась на 49,6% и 56,9% соответственно (р≤0,05). На 15 сутки в 1, 3 и 4 группах произошло снижение активности фермента, тогда как во 2 его содержание достоверно увеличилось на 25,7% по сравнению с предыдущим сроком исследования. У 15-суточных телят 2 и 3 опытных групп не выявлено достоверной разницы активности АЛТ.
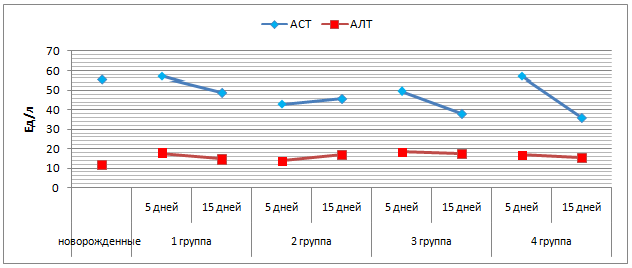
Рисунок 8 – Динамика трансаминаз у телят контрольной и опытной групп.
Несмотря на то, что щелочная фосфатаза образуется во всех тканях, для новорожденных телят этот показатель сопоставим с формированием и обновлением костной ткани. Известно, чем выше активность остеобластов, тем выше активность щелочной фосфатазы в крови. У телят на 5 сутки происходит значительное повышение концентрации щелочной фосфатазы в сыворотке крови, в частности, у телят 1 группы на 50,6%, 2 группы – на 48,9%, 3 группы – на 24,9% и 4 группы – на 7,9% (р≤0,05). На 15 сутки произошло снижение активности щелочной фосфатазы, что может свидетельствовать о замедлении скорости роста костной ткани (таблица 5).
Качественные и количественные изменения обменных процессов, наблюдаемые в период новорожденности у телят, происходят в соответствии с генетической программой развития и потребностями организма. Так у 5-суточных телят отмечается повышение концентрации глюкозы в сыворотке крови, что особенно выражено в опытных группах, где ее содержание увеличилось на 58,9-63,3% (р≤0,05). На 15 сутки у телят 2-4 групп отмечено недостоверное снижение глюкозы, ее содержание находилось в диапазоне 5,30-5,36 ммоль/л (рисунок 9). В то же время у контрольной группы телят отмечено повышение глюкозы на 23,2% (р≤0,05) относительно предыдущего срока исследования.
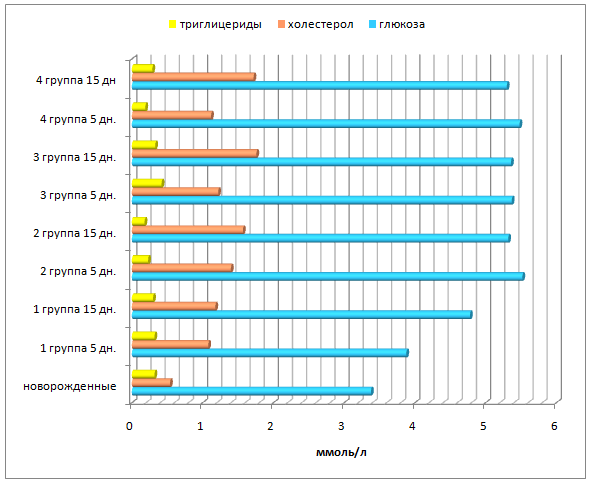
Рисунок9 – Динамика показателей энергетического обмена у телят контрольной и опытной групп.
К 5-суточному возрасту наблюдается повышение уровня холестерола, особенно у телят 2 группы – до 1,40 ммоль/л. В дальнейшем показатель также повышался и достиг максимальной отметки в 3 и 4 группах (рисунок 9).
У 5-, 15-суточных телят в контрольной группе не происходит значимого изменения содержания триглицеридов (рисунок 9). Во 2 группе 5- и 15-суточных телят отмечено постепенное снижение триглицеридов, соответственно, на 28,1% и 43,8% (р≤0,05). В 3 группе у 5-суточных телят отмечено повышение триглицеридов на 31,3% и последующее снижение на 21,4%, тогда как у телят 4 группы на 5 сутки выявлено снижение показателя на 40,6% с последующим повышением на 15 сутки на 52,6% (р≤0,01).
Неустойчивость обменных процессов в период новорожденности у телят проявляется лабильностью исследованных биохимических показателей.
В связи с увеличением массы тела и развитием внутренних органов в организме возникают специфические потребности в пластическом материале, чтои обусловливает высокую интенсивность анаболизма. Внеутробное питание стимулировало увеличение общего белка, соответственно, и его фракций в сыворотке крови (таблица6).
Таблица 6 – Динамика азотистого и белкового обмена у телят контрольной и опытных групп, M±m
| Показатель | Группы телят, возраст | ||||||||
| новорожденные | 1 | 2 | 3 | 4 | |||||
| 5 | 15 | 5 | 15 | 5 | 15 | 5 | 15 | ||
| Общий белок, г/л | 56,46±1,59 | 70,80±2,24 | 76,00±3,04 | 67,02±2,24 | 66,27±1,38 | 79,58±0,88 | 67,00±1,16 | 72,84±1,79 | 64,50±1,32 |
| Альбумин, г/л | 32,86±1,85 | 28,08±1,86 | 34,62±0,53 | 35,32±1,12 | 32,73±0,73 | 36,98±0,98 | 32,66±0,74 | 33,62±0,42 | 31,4±0,76 |
| Глобулины, г/л | 23,60±1,20 | 42,72±3,06 | 41,38±2,54 | 21,70±1,47 | 33,53±0,66 | 42,60±1,00 | 34,33±0,49 | 39,18±1,86 | 33,10±0,64 |
| А/Г, % | 1,40±0,13 | 0,66
±0,08 |
0,84
±0,04 |
1,11
±0,04 |
0,98
±0,01 |
0,84
±0,08 |
0,95
±0,02 |
0,86
±0,05 |
0,94
±0,02 |
| Креатинин, мкмоль/л | 139,72±4,86 | 110,4±4,61 | 89,02
±2,76 |
91,1±5,63 | 92,98
±3,35 |
105,6±2,40 | 89,38
±2,62 |
100,6±2,90 | 74,70
±1,76 |
| Мочевина, ммоль/л | 2,00±0,41 | 3,16
±0,31 |
2,86
±0,13 |
2,47
±0,17 |
1,97
±0,20 |
1,67
±0,07 |
2,14
±0,21 |
2,86
±0,27 |
2,58
±0,26 |
| Общий билирубин, мкмоль/л | 4,06±0,19 | 4,00
±0,20 |
3,46
±0,19 |
2,83
±0,19 |
2,92
±0,12 |
2,10
±0,24 |
2,28
±0,08 |
2,94
±0,19 |
2,38
±0,14 |
У 5-суточных телят 3 группы уровень белка увеличился на 40,90%, в тоже время у 2 группы только на 18,70% (р≤0,05). У телят 1 группы значительно увеличилось содержание глобулинов, что повлекло снижение альбумин-глобулинового коэффициента.
У 15-суточных телят регистрировалось увеличение общего белка относительно первоначального и предыдущего. Повышение уровня общего белка обусловлено возрастанием альбуминовой фракции, что повлекло рост альбумин-глобулинового коэффициента до референсного значения. В опытных группах отмечалось снижение общего белка в сыворотке крови, стабилизация альбумин-глобулинового соотношения. Достоверной разницы между этими показателями в опытных группах не установлено (рисунок 10).
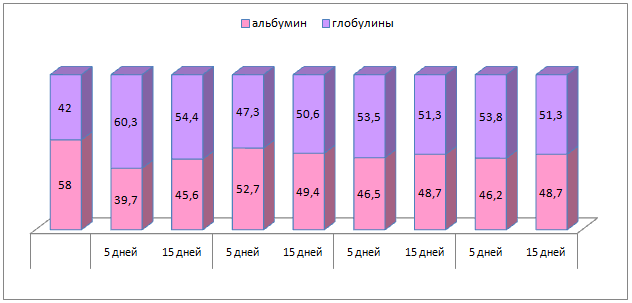
Рисунок 10 – Процентное соотношение альбуминов и глобулинов в сыворотке крови телят контрольной и опытной групп.
Высокий уровень креатинина после рождения постепенно снижается (таблица6). Наиболее стремительное его уменьшение отмечено у 5-сточных телят 2 группы, процент снижения составил 34,8 (р≤0,01). На 15 сутки жизни телят также происходит уменьшение концентрации креатинина в сыворотке крови, что более выражено у телят 4 группы: относительно предыдущего срока исследования показатель снизился на 25,7% (р≤0,05).
Мочевина выступает основным продуктом распада белков. К 5-м суткам ее концентрация в сыворотке крови у телят 1, 2 и 4 групп повышается, у 3 группы телят – снижается на 16,5% (таблица 6). К 15-суточному возрасту ее количество по-прежнему выше первоначального показателя, но меньше чем у телят 5-суточного возраста 1, 2 и 4 групп, соответственно, на 9,5%; 20,2% и 9,8% (р≤0,05). В тоже время у телят 3 группы содержание мочевины увеличилось на 28,1%.
Билирубин образуется в селезенке и костном мозге при распаде эритроцитов. Содержание этого пигмента у новорожденных телят больше, чем при последующем наблюдении, что соответствует критериальным возрастным нормам (рисунок 11). Наиболее интенсивное снижение общего билирубин отмечалось на 5 сутки в 3 группе. Во 2 и 3 группах у 5- и 15-суточных телят не установлено достоверного изменения показателя. В 1и 4 группах у 15- суточных телят меньше содержание билирубина чем у 5-суточных на 13,5% и 19,1% соответственно (р≤0,05).
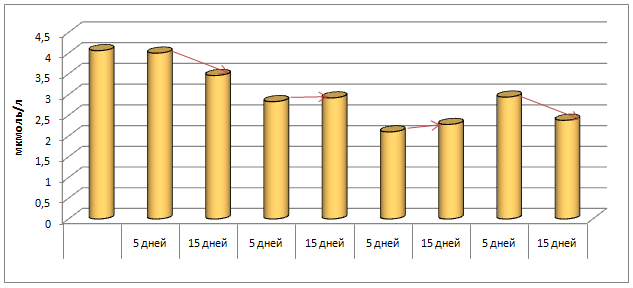
Рисунок 11 – Динамика общего билирубина в сыворотке крови телят
контрольной и опытной групп.
Минеральный обмен у молодняка определяет не только развитие костной системы, но и функционирование систем организма, так как макро- и микроэлементы входят в состав биологически активных веществ, определяющих скорость ана- и катаболических процессов.
Анализируя изменение общего кальция и неорганического фосфора в сыворотке крови установили, что у 5-суточных телят 1, 2, 3 и 4 групп содержание фосфора увеличилось пропорционально на 38,5%; 23,9%; 31,3% и 20,8% (р≤0,01), тогда как уровень кальция повысился в 1 группе на 8,0% (р≤0,05), снизился во 2 группе – на 6,9% (р≤0,05), в 3 и 4 группах достоверных изменений не выявлено (рисунок 12). У 15-суточных телят опытных групп уровень кальция соответствовал 3,18-3,34 ммоль/л, в контрольной – 2,98 ммоль/л.
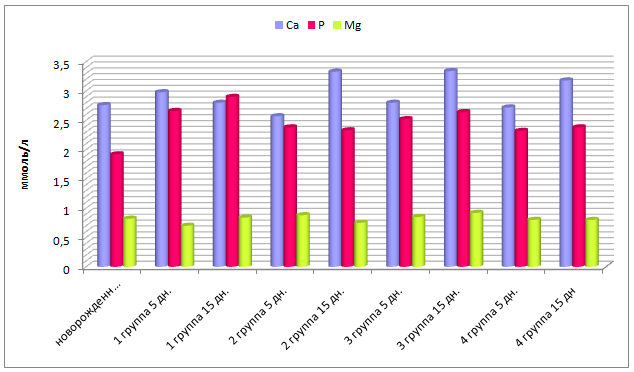
Рисунок 12– Динамика показателей минерального обмена у телят контрольной и опытной групп.
Для телят важно не только содержание, но и соотношение кальция и фосфора в сыворотке крови. У новорожденных телят кальций-фосфорное соотношение составило 1,44:1, у 15-сточных телят 1 группы 0,97:1, второй – 1,43:1; третьей – 1,27:1; четвертой – 1,34:1.
Содержание магния у новорожденных телят находится на нижней границе физиологического уровня. У 5-суточных телят 1 группы его содержание снижается на 14,6%, у телят 2 и 3 групп наметилась тенденция к его повышению. У 15-суточных телят 2 и 3 групп отмечено повышение концентрации магния на 7,3% и 12,2% соответственно (р≤0,05), у телят 4 группы показатель остался без изменений (рисунок 12).
Таким образом, применение ЭнтероЗоо на фоне сыворотки способствовало нормализации энзиматической активности, белкового коэффициента, снижению концентрации креатинина, мочевины, общего билирубина, стимуляции энергетического обмена, установлению реципрокности между глюкозой и триглицеридами, активации минерального обмена.
ЭнтероЗоо проявил свойства адаптогена, способствовал более быстрому выведению промежуточных метаболитов (билирубина, продуктов распада азотистых оснований и др.), не оказал отрицательного влияние на всасывание минеральных веществ, предотвратил развитие эндотоксикоза.
4.1.5 Тема: ДИНАМИКА КОРТИЗОЛА У ТЕЛЯТ В ПЕРИОД ПОСТЭМБРИОНАЛЬНОЙ АДАПТАЦИИ НА ФОНЕ ПРИМЕНЕНИЯ СЫВОРОТКИ И ЭНТЕРОСОРБЕНТА
Цель: оценить динамику кортизола у телятв период новорожденности на фоне применения сыворотки и ЭнтероЗоо.
Методика и результаты исследований:кровь получали в специальные вакуумные пробирки с активатором свертывания и гелем, и в течение 40-60 минут доставляли в лабораторию «Гемотест», где методом ИФА выполнялись исследования на предмет содержания кортизола в сыворотке крови.
В период, предшествующий рождению, кортизол индуцирует созревание ферментных систем печени, включая ферменты гликогеногенеза и аминотрасфераз, а также дифференцировку альвеолярных клеток, синтез сурфактанта и его выделение в альвеолы, предупреждая развитие респираторного дистресс-синдрома новорожденных, также стимулирует созревание b-клеток поджелудочной железы и эпителия тонкой кишки, активность щелочной фосфатазы. Тревожный прогноз может быть в случае высокой концентрации кортизола в сыворотке крови при низкой живой массе новорожденных.
При рождении средняя живая масса телят была не менее 46-48 кг.
У новорожденных телят уровень гормона составил 7,12±0,06 мкг/дл (рисунок 13), при этом активность щелочной фосфатазы достигла 565,54±57,37 Ед/л, аланинаминотрансферазыиаспартатаминотрансферазы соответственно 13,62±1,74 и 4,82±3,98 Ед/л. Полученные результаты свидетельствуют о сформированности пищеварительных желез и пищеварительного трака, готовности новорожденных телят к внеутробной жизни. После рождения кортизол участвует в переводе организма с фетального на взрослый тип гемоглобина. Содержания гемоглобина в крови у новорожденных телят (в переходный период) составило 98,4±2,1 г/л.
Рисунок 13– Динамика кортизола у телят контрольной и опытной групп.
Переход к внеутробной жизни для телят является экстремальным состоянием и в данном случаекортизол обеспечивает защитную реакцию. К 5-суточному возрасту (окончанию молозивного периода) содержание кортизола в сыворотке крови у телят контрольной группы снижается в 5,84 раза до уровня 1,22±0,26 мкг/дл. У телят опытных, 2, 3 и 4 групп также отмечено снижение количества кортизола в сыворотке крови, соответственно, в 6,3 раза, 9,13 раза и 8,68 раза (р≤0,05). Вероятно, ЭнтероЗоо способствует выведению промежуточных метаболитов, образовавшихся после введения сыворотки и утилизации продуктов распада фетального гемоглобина и билирубина.
Внешние факторы (пищевые, температурные, механические и др.) стимулировали функцию органов и систем, энзиматическую активность и синтез гемоглобина у телят контрольной и опытных групп.
В 15-суточном возрасте на фоне повторного введения сыворотки содержание кортизола в сыворотке крови телят контрольной группы составило 0,10 мкг/дл, то есть от момента рождения его концентрация снизилась более чем в 70,0 раз, а по сравнению с результатом, полученном в 5-суточном возрасте в 12,0 раз. У телят 2 опытной группы уровень кортизола составил 0,11±0,02 мкг/дл, в 3 опытной – 0,12±0,03 мкг/дл, в 4 опытной – 0,14±0,04 мкг/дл.
Следует также отметить, что кортизол имеет большое значение в развитии организма, так как стимулирует синтез веществ, влияющих на возбудимость нейронов и гликогена, катаболизм белков в мышцах и коже, глюконеогенез, на что указывает динамика общего белка и глюкозы у телят контрольной и опытных групп.
Таким образом,стресс уникальный стимулятор гипоталамо-гипофизарно-надпочечниковой системы приводит к увеличению уровня циркулирующего в крови кортизола, и у телят в послеродовом периоде уровень кортизола 7,12 мкг/дл является вероятным показателем нормы (физиологической зрелости новорожденных). Снижение кортизола в сыворотке крови у телят в первые пять дней жизни зависит от концентрации ЭнтероЗоо. Применение препарата телятам в дозе 0,1 г/кг живой массы способствовало снижению кортизола на 7,4%, в дозе 0,3 г/кг – на 36,1%, в дозе 0,5 г/кг – на 32,8%.
Применение ЭнтероЗоона фоне двукратного введения сыворотки показало, что у телят опытных групп уровень кортизола незначительно выше, чем у контрольных,что свидетельствует об адаптивной пластичности животных.
Следовательно, для телят 5-суточного возраста оптимальной концентрацией кортизола можно считать 0,78-1,22 мкг/дл, для 15-суточных соответственно 0,11-0,14 мкг/дл.
4.1.6 Тема: ЭФФЕКТИВНОСТЬ ПРИМЕНЕНИЯ ЭНТЕРОСОРБЕНТА У ТЕЛЯТ С ДИСПЕПСИЕЙ
Цель: оценить эффективность применения ЭнтероЗоо телятам с нарушением пищеварения в раннем постэмбриональном онтогенезе.
Методика и результаты исследований:отбор проб крови проводили в специальные вакуумные пробирки с активатором свертывания, исследование выполняли на биохимическом анализаторе «SMT-120» («Seamaty», Испания-Китай) при этом до и после лечения проводили оценку таких показателей, как общий белок и его фракции, глюкоза, аспартатаминотрансфераза (АСТ), аланинаминотрансфераза (АЛТ) и креатинкиназа (КК).
Лечение телят контрольной группы (К) согласно стандартному протоколу, приятому в хозяйстве, выполняли с использованием электролитного напитка «Элдиар» в дозе 100г/50кг путем выпаивания за 30 минут до утреннего кормления.
Телятам опытной группы (О) на фоне стандартной схемы вводили энтеросорбент ЭнтероЗоо в дозе 0,5 г/кг через 2 часа после утреннего кормления. Курс лечения – 7 дней.
При клиническом исследовании до терапии у больных телят отмечали характерныйсимптомокомплекс: диарея, незначительное угнетение, снижение аппетита; при аускультации – громкие, частые, постоянные перистальтические шумы; при бимануальной пальпации – напряжение мышц брюшной стенки, выгибание спины, вокализация; температура тела – в пределах физиологической нормы.
В результате исследований у телят контрольной и опытной групп концентрация общего белка и альбуминов в сыворотке крови соответствовала референсным значениям (таблица 7).
Таблица 7 – Биохимические показатели сыворотки крови телят контрольной и опытных групп, M±m
| Показатели | До лечения | После лечения | ||
| К(n=10) | О(n=12) | К(n=10) | О(n=12) | |
| Общий белок, г/л | 65,60±3,95 | 72,30±4,06 | 64,95±4,00 | 69,92±4,11 |
| Альбумин, г/л | 29,30±1,10 | 26,55±2,65 | 31,37±0,88 | 29,30±1,53 |
| Глобулины, г/л | 36,30±5,03 | 45,80±3,90 | 33,57±4,88 | 40,65±3,10 |
| Белковый коэффициент | 0,83±0,14 | 0,59±0,07 | 0,96±0,16 | 0,83±3,71 |
| Глюкоза, ммоль/л | 5,83±0,93 | 4,85±0,84 | 6,64±0,52 | 6,15±0,75 |
| АСТ, Ед/л | 29,50±2,50 | 46,50±20,25 | 36,50±3,00 | 31,25±4,25 |
| АЛТ, Ед/л | 6,13±2,44 | 5,50±1,00 | 4,28±0,28 | 4,75±0,15 |
| КК, Ед/л | 99,50±32,75 | 106,50±32,00 | 242,00±75,00 | 113,50±8,50 |
У больных телят до лечения в сыворотке крови выявлено повышенное содержание глобулинов в контрольной и опытной группах, 36,3±5,03 г/л и 45,8±3,9 г/л, соответственно.При этом белковый коэффициент составил в контрольной группе 0,83, в опытной – 0,59.На фоне диареи у телят уровень глюкозы достиг в контрольной группе 5,83±0,93 ммоль/л, в опытной – 4,85±0,84 ммоль/л.
У телят контрольной и опытной группы изначально концентрация АЛТ соответствовала референсным значениям (таблица 7), АСТ несколько снижена. По сравнению с контрольной группой на фоне проводимой терапии, у опытных телят активность АСТ ниже на 14,40% (P≤0,05). Концентрация КК у контрольной группы составила 99,5±32,75 Ед/л, а у опытной группы – 106,5±2Ед/л. Совокупность результатов по изменениям АСТ и КК является диагностическим маркером поражения скелетных мышц или повреждения печени.
В свою очередь креатинкиназа катализирует обратимую реакцию превращения креатинфосфата в креатин в присутствии аденозиндифосфата (АДФ), который превращается в аденозинтрифосфат (АТФ). Последний является источником энергии для мышечных сокращений.
После семидневного курса лечения у телят из контрольной группы аппетит восстановлен, при пальпации болезненности не наблюдалось, у 80 % телят акт дефекации в норме, физико-химические свойства кала соответствовали физиологическим параметрам. У телят опытной группы клинические признаки, отражающие патологические процессы отсутствовали в 100% случаев.
При повторном исследовании сыворотки крови установлена тенденция к снижению общего белка в обеих группах, а также снижение концентрации глобулинов в контрольной группе на 7,50%, опытной – на 11,20%, и соответствующее повышение альбумина и белкового коэффициента на 7,10% и 10,40%; на 15,70% и 40,70% (P≤0,05).
Уровень глюкозы в контрольной и опытной группах увеличился на 13,90% и 26,80%, соответственно.Повышение глюкозы при повторном исследовании сыворотки у обеих групп животных можно объяснить тем, что одним из основных компонентов электролитного напитка «Элдиар» является глюкоза, которая накапливается в крови и депонирующих органах.
Концентрация АСТ в контрольной группе возросла на 23,70%, в опытной, напротив, снизилась на 32,80%, АЛТ достоверно снизилась в обеих группах, соответственно, на 30,20% и 13,60%. Активность КК увеличилась в контрольной группе до 242,00±7,50Ед/л, а в опытной – до 113,50±8,50 Ед/л, но не превышала референс-диапазон.
Выявление взаимосвязи показателей белкового состава и энзиматической активности сыворотки крови до и после лечения указывают на выраженность патологического процесса и положительное влияние ЭнтероЗоо в схеме стандартного лечения принятого в хозяйстве. Наличие сорбента в схеме терапии нивелирует токсическое действие метаболитов на печень, как основного органа обеспечивающего детоксицирующую функцию. Динамика изменений в опытной группе (снижение уровня глобулинов, повышение белкового коэффициента, умеренное повышение КК в сыворотке крови) на седьмой день указывают на положительное действие энтеросорбента в дозе 0,5 г/кг наряду с положительной динамикой клинического статуса у телят.
4.2. Тема: ОБОСНОВАНИЕ КОМПЛЕКСНОГО ПРИМЕНЕНИЯ И МОНИТОРИНГ ЭФФЕКТИВНОСТИ ДЕЙСТВИЯ ПРОБИОТИКА ЗООНОРМ И ЭНТЕРОСОРБЕНТА ЭНТЕРОЗОО ЦЫПЛЯТАМ НА РАННЕМ ЭТАПЕ ПОСТЭМБРИОНАЛЬНОГО РАЗВИТИЯ
Цель:оценить влияние монопрепаратов – пробиотика Зоонорм и энтеросорбента ЭнтероЗоо и их комплекса на физиологические показатели развития цыплят на раннем этапе постэмбрионального развития.
Методика и результаты исследований: для реализации цели сформировали 4 группы цыплят-аналогов кросса Dealbпо 40 голов в каждой, 1 группа служила контролем, 2, 3 и 4 группы – опытные (рисунок 14).
| 5-СУТОЧНЫЕ ЦЫПЛЯТА | ||||||||||||||||
| Морфометрические, копрологические, микробиологические, гематологические, биохимические, сонографические, рентгенологические исследования | ||||||||||||||||
| 1 группа | 2 группа | 3 группа | 4 группа | |||||||||||||
| ОР | ОР+ Зоонорм | ОР+ ЭнтероЗоо | ОР+ Зоонорм+ ЭнтероЗоо | |||||||||||||
| 15-, 25-СУТОЧНЫЕ ЦЫПЛЯТА | ||||||||||||||||
| Морфометрические, копрологические, микробиологические, гематологические, биохимические, сонографические, рентгенологические исследования | ||||||||||||||||
| ОТМЕНА ПРИМЕНЕНИЯ ПРЕПАРАТОВ В ОПЫТНЫХ 2,3,4 ГРУППАХ | ||||||||||||||||
| 35-СУТОЧНЫЕ ЦЫПЛЯТА | ||||||||||||||||
| Морфометрические, копрологические, микробиологические, гематологические, биохимические, сонографические, рентгенологические исследования | ||||||||||||||||
Рисунок 14– Схема проведения эксперимента по теме 4.2.
Цыплятам опытных групп задавались препараты в течение 20 дней, с 5- до 25-суточного возраста. Опытные, 2 группа цыплят получила пробиотик Зоонорм, в смеси с кормом в дозе 0,2 г на голову в первое кормление, третья – 0,3% взвесь энтеросорбента ЭнтероЗоо путем выпойки через 2 часа после последнего кормления, четвертая – комбинацию двух препаратов в соответствующее время.
4.2.1 Тема: ВЛИЯНИЕ ПРОБИОТИКА ЗООНОРМ,ЭНТЕРОСОРБЕНТА ЭНТЕРОЗОО И ИХ КОМБИНАЦИЙ НА ДИНАМИКУ МАССЫ И МАССУ ВНУТРЕННИХ ОРГАНОВ ЦЫПЛЯТ
Цель:оценить динамику живой массы и массы внутренних органов цыплят кросса «Декалб» на фоне применения биологически активных веществ и их комбинаций.
Методика и результаты исследований: предметом для исследования послужила динамика и прирост живой массы, абсолютная и относительная масса органов.
Определение живой массы и внутренних органов проводили на весах марки ВАТ-1 (Россия) и аналитических весах ViBRA HT-124CE (Япония). Относительную массу рассчитывали по формуле:

Скорость роста цыплят рассчитывали по формуле Шмальгаузена И.И.и БродиС. (1927):
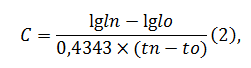
где ln — масса животного в конце опыта; lo — масса животного в начале опыта; tn-to — время опыта.
Живая масса 5-суточных цыплят составила 49,5±4,5 г.
В первой, интактной, группе скорость роста в период от 5- до 15-суточного возраста составила 0,099, от 15- до 25-суточного – 0,041, от 25- до 35-суточного 0,051, во 2 группе 0,101; 0,045 и 0,052; в 3 группе 0,097; 0,049 и 0,045; в 4 группе – 0,088; 0,054 и 0,042, соответственно.
Скорость роста за период наблюдений от 5- до 35-суточного возраста в первой группе равна 0,065; во второй – 0,066; в третьей – 0,063; в четвертой – 0,062.
У 5-суточных цыплят масса желточного мешка составила 0,5 г, в процессе роста у 15-суточных цыплят желточный мешок обнаружен у цыплят 1, 2 и 4 группы, причем его масса была различна. Так в 1 группе желточный мешок обнаружен у 50% цыплят, массой 0,14±0,01 г, во второй, также в 50% случаев, массой 0,27±0,01 г, в четвертой – у 30% цыплят массой 0,25±0,00 г.
На 25 сутки исследования в интактной группе у 50% цыплят обнаружен желточный мешок, массой 0,123±0,004 г, во 2 группе желточный мешок был обнаружен у 10% цыплят в брюшной полости (не соединен с тонкой кишкой), масса его составила 0,03 г. У цыплят 3 и 4 групп желточный мешок не выявлен. На 35 сутки желточный мешок обнаружен у 10% цыплят 2 группы (в брюшной полости), его масса не превышала 0,027-0,030 г.
Наиболее стабильной абсолютной массой в первой декаде эксперимента отличается трахея: у 15-суточных цыплят ее масса составила 0,22-0,27 г, в 25-суточном возрасте ее масса находилась в пределах 0,330-0,357 г, в 35- суточном 0,43-0,45 г, при этом относительная масса органа снижалась.
Абсолютная масса легких у 5-суточных цыплят 0,342±0,079 г, относительная – 0,69%, у 15-суточных цыплят наибольшая абсолютная и относительная масса установлена в 1 группе 1,24±0,03 г и 0,95%, соответственно, у 25-суточных в 4 группе: 1,68±0,04 г и 0,82%, у 35-суточных во 2 группе: 2,72±0,11 г и 0,76%.
У 5-суточных цыплят относительная масса сердца составила 0,75%, абсолютная 0,37 г,15-суточные цыплята 3 группы отличались наиболее высокой относительной и абсолютной массой сердца – 0,89% и 1,15±0,17 г; эти же показатели в 25- и 35-суточном возрасте цыплят самые высокие были во 2 группе: 0,94% и 1,99±0,09 г и 0,99% и 2,83±0,24 г, соответственно.
Наиболее развиты у 5-суточных цыплят органы пищеварения. Абсолютная масса печени, желудка и кишечника (без содержимого) составила 2,14±0,23 г, 2,54±0,19 г и 5,34±0,08 г, соответственно.Наибольшая абсолютная масса печени у 15-сутчных цыплят, 4,68±0,05 г, установлена во 2 группе, а относительная в 4 – 3,61%. Также у цыплят 4 группы наиболее высокая абсолютная и относительная масса желудка и кишечника, соответственно, 4,83±0,1 г и 4,08%; 7,60±0,27 г и 6,42%.
У 25-суточных цыплят 1 группы самая большая масса печени и кишечника, 6,63±0,12 г и 12,30±0,26 г, соответственно, при этом относительная масса 3,3% и 6,13%. Вторая группа цыплят имела наибольшую массу желудка – 7,99±0,38 г.
Тридцати пяти суточные цыплята 2 группы имели наиболее развитый желудок и печень, масса органов 12,57±0,14 г и 12,37±0,40 г соответственно, при этом относительная масса желудка имела тенденцию к снижению, а печени – к повышению.
У 15-суточных цыплят 2 и 3 групп масса желчного пузыря достигла 0,17 г, относительная масса составила 0,13%, у 25-суточных цыплят 3 группы желчный пузырь достиг массы 0,34 г и составил 0,16% от массы тела. У 35-суточных цыплят 2 группы масса желчного пузыря 0,74±0,01 г, что достоверно превышало аналогичный показатель во 2-4 группах в 2 раза.
У 15-суочных цыплят активно развивалась поджелудочная железа, ее масса варьировала от 0,64 до 0,77 г, а к 25-суточному возрасту абсолютная масса составила 1,04-1,17 г. Самая большая масса железы регистрировалась у цыплят 2 группы. У 35-суточных цыплят 3 группы масса железы 1,80±0,04 г, а относительная масса имела тенденцию к снижению.
Относительная масса почек у 5-суточных цыплят составила 0,79% или 0,39±0,04 г, при достижении 15-суточного возраста у цыплят 1-3 групп абсолютная масса почек составила 1,43-1,45 г, относительная 1,07-1,12%; в 4 группе, соответственно, 1,11±0,1 г и 0,94%.
У 25-суточных цыплят 1 и 2 групп масса почек достигла 2,61 г, у 3 и 4 групп – 2,40-2,42 г, у цыплят 1-4 групп отмечен рост относительной массы почек. У 35-суточных цыплят относительная масса почек увеличилась и варьировала от 1,20 до 1,44%, самая большая масса почек установлена во 2 группе 4,70±0,08 г, самая маленькая в 3 (3,94±0,05 г).
Масса селезенки у 5-суточных цыплят была 0,070±0,019 г, составила при этом 0,14% от массы тела. В 15-суточном возрасте абсолютная масса селезенки варьировала от 0,22 до 0,25 г, а ее относительная масса – 0,18-0,19%. В 25-суточном возрасте наибольшая абсолютная и относительная масса селезенки регистрировалась у цыплят 3 группы 0,393±0,013 г и 0,19% соответственно. В 35-суточном возрасте абсолютная и относительная масса селезенки у цыплят 1 и 2 групп составила 0,73-0,75 г и 0,21-0,22% соответственно.
Таким образом,более высокий прирост живой массы установлен у цыплят 2 группы, также на последнем этапе наблюдений цыплята 2 группы отличались хорошим развитием внутренних органов, при этом разброс данных по группе был значительно больше, чем в 3 и 4 группах. Тем не менее, скорость роста цыплят не имела выраженных отличий
Во время первого критического периода наиболее эффективно применение пробиотика Зоонорм. Во время второго критического периода, связанного с линькой, эффективно применение ЭнтероЗоо и комбинации двух препаратов. После отмены препаратов у цыплят, получивших ЭнтероЗоои комплекс двух препаратов, отмечено завершение ювенальной линьки.
4.2.2 Тема: АКТУАЛЬНОСТЬ КОПРОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ У ЦЫПЛЯТ ПРИ ВВЕДЕНИИПРОБИОТИКА ЗООНОРМ,ЭНТЕРОСОРБЕНТА ЭНТЕРОЗОО И ИХ КОМБИНАЦИЙ
Цель:оценить копрограмму у цыплят в динамике на фоне применения пробиотика, энтеросорбента и их комбинации.
Методика и результаты исследований:примененыобщепринятые клинико-лабораторные копрологические методикиисследования: микроскопия нативных препаратов, препаратов с реактивами Люголя и Саатгофа; микроскопия мазков, окрашенных по Романовскому-Гимзе. Исследованиемазков провели при помощи микроскопа Микромед 3Вар3-20 и видеокамеры с программным обеспечением MicroscopeColorDigitalCameraLevenhukC 1400 NG, объектив SP40X/0.65 и SP10X/0.25 и окулярWF10X/22.
Макроскопическиу 5-суточных цыплят цвет кала коричневый, запах специфический, консистенция тестоватая, оформленный, без видимых примесей, снаружи покрыт слизью. Концентрация водородных ионов варьировала в широких пределах – от 6,5 до 8,5 ед. В 100% проб в единичных экземплярах обнаружены зерна внеклеточного крахмала, капли нейтрального жира и переваримая растительная клетчатка. Единичные зерна внутриклеточного крахмала выявлены в 15% проб, непереваримая растительная клетчатка в умеренном количестве в 60% проб. Во всех пробах обнаружена микрофлора с преобладанием палочковидных форм в количестве от незначительного до умеренного и большого, кокковая – от незначительного до умеренного. Среди йодофильной микрофлоры выявлено незначительное количество палочковидных форм.
У 15-суточных цыплят цвет кала приобрел светло-коричневую окраску, консистенцию от жидкой (в 1 и 2 группах), до пастообразной (в 3 и 4), рН кала в 1 группе составила 8,5-9,0 ед., в 3 и 4 группах – 7,5 ед.
Все пробы кала покрыты незначительным количеством слизи, в 50 % проб 2 и 4 групп слизь в небольшом количестве встречается в смеси с калом.
В 1 группе единичные зерна вне- и внутриклеточного крахмала обнаружены в 100 % проб; во 2 – внутриклеточный крахмал присутствует в 50% проб; в 3 группе обнаружены единичные зерна внеклеточного крахмала в 50% проб; в 4 группе – зерна вне- и внутриклеточного крахмала отсутствуют. Незначительное количество переваримой и непереваримой растительной клетчатки обнаружены в 100% проб в 1 и 2 группах. В 3 и 4 группах в 50% проб обнаружена непереваримая клетчатка (рисунок 15). Капли нейтрального жира выявлены в 100% и в 50% проб, соответственно, в 1 и 3, и во 2 и 4 группах (рисунок 16).
 |
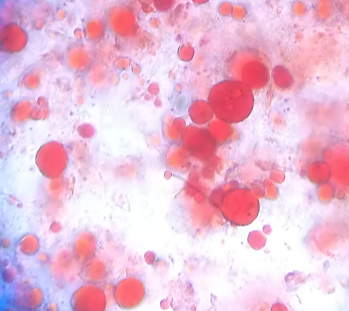 |
 |
| Рисунок 15 – Непереваримая растительная клетчатка в кале, нативный препарат, ×160. | Рисунок 16 – Капли нейтрального жира. Препарат кала с реактивом Саатгофа, ×160. | Рисунок 17 – На фоне калового детрита кристаллы струвитов. Нативный препарат, ×160. |
В 1 и 2 группах обнаружены единичные клетки кишечного эпителия. В 100% проб 1-4 групп выявлена кокковая и палочковидная микрофлора в умеренном и большом количестве, йодофильная микрофлора в 1, 3 и 4 группах представлена кокковой и палочковидной формами в равных пропорциях. Лейкоциты 1-2 в поле зрения в 100% случаев обнаружены у цыплят 1 и 2 групп. При попадании мочи в каловые массы, на фоне калового детрита обнаруживается незначительное количество струвитов (рисунок 17).
У 25-суточных цыплят цвет кала от коричневого до серо-коричневого, оформленный, тестообразный. Концентрация водородных ионов в 100% проб в 1 группе составила 7,5 ед., в 3 и 4 группах 8,5 ед., в 50% проб 2 группы рН=8,0 ед. Кроме незначительного количества слизи на поверхности кала у цыплят 1-4 групп, тяжи слизи обнаружены в 100% проб во 2 группе. Переваримая растительная клетчатка и внутриклеточный крахмал отсутствовали у цыплят 4 группы, а клетки кишечного эпителия у цыплят 2 и 3 групп. Большое количество кокковой и палочковидной микрофлоры выявлено в 100% случаев во 2 и 4 группах, у цыплят 3 и 4 групп йодофильная микрофлора представлена единичными клетками палочковидной формы. Единичные лейкоциты встречаются в кале у цыплят 3 группы, в отличие от проб в 1 и 2 группах, где кроме лейкоцитов обнаруживаются и эритроциты до 2 клеток в поле зрения микроскопа.
У 35-суточных цыплят 1-4 групп рН составила 6,0 ед. Очень большое и большое количество, соответственно, внутри- и внеклеточного крахмала обнаружено в кале цыплят 1 группы. Единичные зерна внутриклеточного крахмала обнаружены в 100% проб в 3 и 4 группах, во 2 группе крахмал не выявлен. Незначительное количество переваримой клетчатки установлено в 1 и 2 группах. Умеренное количество непереваримой растительной клетчатки и единичные капли нейтрального жира регистрировались у цыплят 1-4 групп. Единичные клетки кишечного эпителия присутствуют в пробах кала у цыплят 2 и 4 групп. Форменные элементы крови – до 4-6 клеток в поле зрения микроскопа отмечены в 1 группе, до 2 клеток во 2 группе. В 100% случаев очень большое и умеренное количество, соответственно, кокковой и палочковидной микрофлоры выявлено в 1 и 2 группах; единичные кокки и большое количество палочковидной флоры в 3 и 4 группах. Йодофильная микрофлора, представленная палочками и кокками, в умеренном количестве обнаружена в 1 группе, кокковая – во 2 группе, палочковидные формы в единичном количестве – в 3 и 4 группах.
Таким образом,у цыплят контрольной группы выявлено большое количество внутри- и внеклеточного крахмала, кокковой микрофлоры, лейкоцитов и эритроцитов. Во 2 группе цыплят, получивших пробиотик Зоонорм, в мазках кала установлено большое количество кокковой и йодофильной палочковидной микрофлоры, единичные клетки кишечного эпителия, эритроциты и лейкоциты. В 3 группе цыплят, получивших энтеросорбент ЭнтероЗоо, к окончанию эксперимента в кале не обнаружено внеклеточного крахмала и переваримой клетчатки, эпителия и форменных элементов крови.
В 4 группе птиц, получивших пробиотик и энтеросорбент в комплексе, на протяжении всего периода исследований не выявлено внеклеточного крахмала, переваримой растительной клетчатки и эритроцитов. В кале отмечали единичные клетки кишечного эпителия, лейкоциты и представители йодофильной микрофлоры.
Результаты свидетельствуют, что применение энтеросорбента снижает риск развития воспалительной реакции при выращивании цыплят и сохраняется после отмены препарата.
4.2.3 Тема: ДИНАМИКА МИКРОФЛОРЫ ПИЩЕВАРИТЕЛЬНОГО ТРАКТА ПРИ ВВЕДЕНИИ ПРОБИОТИКА ЗООНОРМ,ЭНТЕРОСОРБЕНТА ЭНТЕРОЗОО И ИХ КОМБИНАЦИЙ
В РАЦИОН ЦЫПЛЯТ
Цель: оценить динамику микрофлоры у цыплят на фоне применения пробиотика, энтеросорбента и их комбинации.
Методика и результаты исследования:Пробы фекалий для микробиологических исследований отбирали непосредственно из клоаки в стерильные контейнеры (FL-medical) в 5-, 15-, 25- и 35-суточном возрастецыплят.Оценку микрофлоры проводили по стандартному протоколу, предусматривающему количественное определение Bifidobacterium; Lactobacillus; E.coli(с нормальной ферментативной активностью, со сниженной ферментативной активностью, лактозонегативной и гемолизирующей активностью); Enterococcuss; Klebsiella; Enterobacteriaceae(Hafnia; Serracia; Citrobacter); Enterobacter; StaphylococcusaureusиStaphylococcusepidermidis;Pseudomonasaeruginosa; Clostridium; неферментирующих грамотрицательных бактерий;патогенных микроорганизмов семейства Enterobacteriaceae (Salmonella, Shigella и энтеропатогенной кишечной палочки (O157:H7));ProteusиCandida.
У 5-суточных цыплят 1-4 групп содержание бифидобактерий составило 109 КОЕ/г, лактобактерий – от 106 до 107 КОЕ/г.Типичная E.coliсоздает комфортные условия для первых двух микроорганизмов,препятствует заселению кишечной стенки чужеродными микроорганизмами, ее содержание достигло 106-107 КОЕ/г, что является очень ценным, так как снижение концентрации менее, чем 105КОЕ/г свидетельствует о выраженных процессах интоксикации в организме. Количественное содержание энтерококков в кишечнике находится в строгом соответствии с уровнем содержания E.coli (типичной), лактобацилл и бифидобактерий. У цыплят содержание энтерококков колеблется в пределах 104-106 КОЕ/г, тогда как уровень бактероидов составил105-107 КОЕ/мг.
Концентрация лактозонегативных E.coli и клостридий не превышала 102КОЕ/г и 101-102 КОЕ/г, соответственно, что не представляло угрозы для здоровья цыплят. Уровень Staphylococcusepidermidisне превышал 102 КОЕ/г, что может можно оценить как вариант нормы.
У цыплят контрольной группы на 15 сутки произошло снижение концентрации лактобактерий и E.coli (типичной),соответственно, до 105 и 104 КОЕ/г, что, вероятно, обусловлено наступлением линьки (замена пуха на первичное перо). На 25 сутки происходит изменение микробного пейзажа. Возрастает количество лактобактерий, типичныхE.coli, бактероидов, энтерококков, Staphylococcusepidermidis, сообразно, до 106, 106, 105, 107 и 103 КОЕ/г, а также отмечается усиленная пролиферация Enterobactercloacae. К 35-суточному возрасту отмечено повышение количества клостридий до 103 КОЕ/г, в остальных случаях достоверных изменений не наблюдается (рисунок 18).
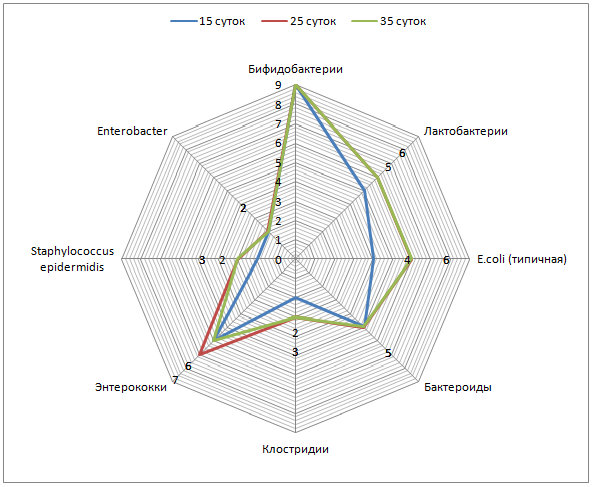
Рисунок 18 – Динамика видового и количественного состава микрофлоры
у цыплят 1 группы.
Во 2 группе 15-суточных цыплят, получивших пробиотик Зоонорм, содержание лактобактерий и E.coli (типичной) снизилось также как и у цыплят контрольной группы. У 25-суточных цыплят отмечено повышение лактобактерий до 107 КОЕ/г, снижение энтерококков до 104 КОЕ/г, у 35-суточных – восстановление уровня энтерококков и E.coli (типичной) до первоначального показателя и незначительная пролиферация Enterobactercloacae (рисунок 19).
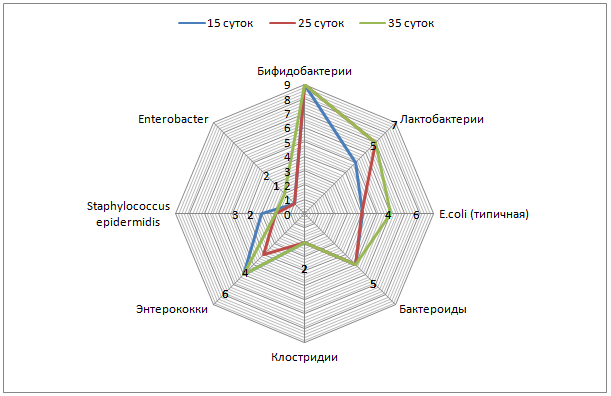
Рисунок 19 – Динамика видового и количественного состава микрофлоры
у цыплят 2 группы.
В 3 группе цыплят, получивших энтеросорбент, на 15 и 25 сутки отмечено снижение лактобактерий, E.coli (типичной) и бактероидов до 105 КОЕ/г и повышение содержания энтерококков до 107 КОЕ/г.
К 35-суточному возрасту отмечено увеличение содержания лактобактерий до 107 КОЕ/г, наличие клостридий менее чем 101 КОЕ/г, отсутствие пролиферации Enterobactercloacae на всем протяжении исследования (рисунок 20).
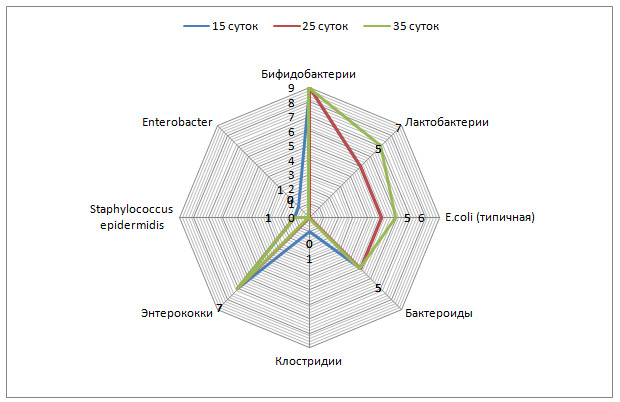
Рисунок 20 – Динамика видового и количественного состава микрофлоры
у цыплят 3 группы.
В 4 группе цыплят, получивших пробиотик и энтеросорбент, на 15 сутки не выявлено изменение концентрации как бифидо-, так и лактобактерий. На 25 сутки отмечено увеличение содержания лактобактерий до 108 КОЕ/г, энтерококков до 107 КОЕ/г, стабилизация E.coli (типичной) и бактероидов на уровне 105-106 КОЕ/г. Так же в этой группе, как и в 3, отмечено минимальное количество клостридий и отсутствие пролиферации Enterobactercloacae в течение всего периода наблюдений (рисунок 21).
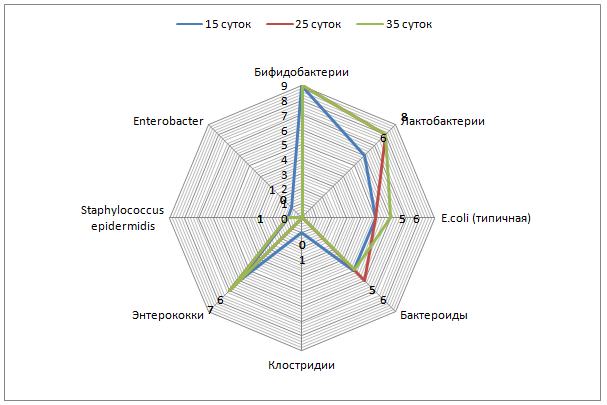
Рисунок 21 – Динамика видового и количественного состава микрофлоры
у цыплят 4 группы.
Таким образом, на 15 сутки исследования у цыплят контрольной и опытных группв кишечнике происходит снижение содержания резидентной микрофлоры. Количестволактобактерий и типичной E.coli снижается, что связано с процессом адаптации к смешанному и экзогенному типу питания, формированием микробиоты и началом линьки. Несмотря на увеличение уровня лактобактерий, типичныхE.coli, бактероидов, энтерококков, Staphylococcusepidermidis у цыплят контрольной группы отмечается усиленная пролиферация Enterobactercloacae и рост клостридий.
Введение пробиотика Зоонорм стимулирует развитие облигатной микрофлоры, а применение энтеросорбента на основе полиметилсилоксана полигидрата препятствует пролиферации Enterobactercloacae.
Комплексное применение пробиотика и энтеросорбента способствует формированию биопленки в кишечнике, стимулирует количественное увеличение лактобактерий, энтерококков, типичной E.coli и бактероидов, а также снижает количество клостридий и не допускает пролиферации Enterobactercloacae в течение всего опыта.
На протяжении эксперимента в контрольной и опытной группах, содержание бифидобактерий практически не подвержено изменениям. Бифидобактерии, интродуцируемые в организм цыплят путем введения их в рацион как монопрепарата (пробиотика), так и в комплексе с кишечным сорбентом, стимулируют продукцию биологически активных веществ, необходимых для роста и развития симбионтной микрофлоры, улучшают процессы переваривания и всасывания питательных веществ, препятствуют развитию патогенов.
4.2.4 Тема: ДИНАМИКА ГЕМАТОЛОГИЧЕСКИХ ПОКАЗАТЕЛЕЙ ПРИ ВВЕДЕНИИ ПРОБИОТИКА ЗООНОРМ,ЭНТЕРОСОРБЕНТА ЭНТЕРОЗОО И ИХ КОМБИНАЦИЙ В РАЦИОН ЦЫПЛЯТ
Цель: оценитьдинамику гематологических показателей у цыплят на фоне применения пробиотика, энтеросорбента и их комбинаций.
Методика и результаты исследований:взятие крови осуществили утром, до кормления; исследование проводили с интервалом 10 дней в ходе опыта и через 10 дней после окончания введения препаратов, т.е. в 5-, 15-, 25- и 35-суточном возрасте цыплят.
В крови анализировали содержание гемоглобина и гематокрит на автоматическом гематологическом анализатореBCE-90Vet, подсчет форменных элементов осуществляли в камере Горяева, подсчет отдельных видов лейкоцитов на мазках, окрашенных по Романовскому-Гимзе, расчет эритроцитарных индексов согласно общепринятым методикам.
Анализ содержания форменных элементов в периферической крови 5-суточных цыплят показал концентрацию тромбоцитов 18,3±1,0×109/L, лейкоцитов 23,6±0,4×109/L и эритроцитов 1,97±0,01×1012/L.Среди лейкоцитов доминировали лимфоциты и гетерофилы, соответственно, 51,6±3,8% и 45,7±3,6%. Содержание гемоглобина составило 131,0±4,0 g/L, гематокрит 25,8±0,2%, средний объем эритроцитов (MCV) 130,9±1,1 fL, ширина распределения эритроцитов (RDW) 13,9±2,2%.
Отмечена высокая концентрация гемоглобина и содержание гемоглобина в одном эритроците, что характерно для первых дней постэмбрионального развития цыплят.
У цыплят 1-4 групп в 15-суточном возрасте отмечено некоторое снижение концентрации тромбоцитов с постепенным повышением при дальнейшем исследовании до референсных значений.
Содержание лейкоцитов в крови у 5-35-суточных цыплят изменялось в пределах 2,6-3,1%. С началом линьки в 1-2 группе отмечено недостоверное повышение лейкоцитов на 1,7%; в 3 группе содержание лейкоцитов ниже первоначального показателя на 0,4-1,9%; в 4 группе в разгар линьки и к моменту ее окончания (25-35 суток) отмечено повышение лейкоцитов на 0,8-3,1% (р≥0,05).
Более принципиальное значение имеет процентное соотношение отдельных видов лейкоцитов. У 15-суточных цыплят в крови появляются базофилы, клетки, имеющие высокую функциональную специализацию. В 1-3 группах их процентная концентрация составила 3,3-3,8, тогда как в 4 группе их концентрация не превышала 1,2±0,3 %. В 1 группе у 25-35-суточных цыплят содержание базофилов снизилось в 2 раза. В то же время у 25-суточных цыплят (в разгар линьки) их концентрация резко увеличилась в опытных группах, что наиболее выражено у цыплят 2 группы, где процент базофилов достиг 5,3. К 35 суткам у цыплят 2-4 групп процентная концентрация базофилов не превышала 2,2-3,0.
Единой закономерности динамики эозинофилов не установлено. В 1 группе у 15-суточных цыплят их концентрация составила 5,7%, к 35 суткам снизилась до 1,1%. Во 2 группе к 25 суткам концентрация эозинофилов составила 3,2%, к 35-м снизилась до 2,1%. В 3 группе у 15-суточных цыплят уровень эозинофилов достиг 4,8%, к 25 суткам снизился до 1,6% и увеличился до 3,3% на 35 сутки. В 4 группе у 15-суточных цыплят содержание эозинофилов в крови было 1,8%, к 25-35-суточному возрасту составило 2,7%.
Содержание клеток с выраженной фагоцитарной функцией, моноцитов, у цыплят 1 группы подвержено такой же закономерности, как и изменение содержания в крови базофилов и эозинофилов. Их процентная концентрация, достигавшая в 15-суточном возрасте 6,5 в 25- и 35-суточном возрасте составила 5,5. В опытных группах процент моноцитов достигал 4-8,3 и в постепенно снижался, составив у 35-суточных цыплят от 2,5 до 4,5.
Преобладающими клетками в абсолютном и процентном отношении у кур являются лимфоциты. Наиболее низкое содержание лимфоцитов в 15-суточном возрасте регистрировалось у цыплят 4 группы (48,8%), в 25-суточном возрасте во 2 группе (53,3%), в 35-суточном – в 3 группе (49,4%).
Интересно отметить, что в 1 группе снижение базофилов, эозинофилов и моноцитов сопровождалось снижением лимфоцитов, во 2 группе повышение эозинофилов сопутствовало увеличению лимфоцитов, в 3 группе – снижение моноцитов происходило наряду со снижением лимфоцитов, в 4 группе – увеличение базофилов происходило параллельно с повышением лимфоцитов.
В процентном отношении в 1 группе 15-суточных цыплят концентрация гетерофилов (псевдоэозинофилов) составила 26,3, после незначительного снижения у 25-суточных цыплят, увеличилась до 33,5% у 35-суточных. У цыплят 2 группы, снижение и повышение процента гетерофилов происходило аналогично таковому в 1 группе. В 3 группе у 15-суточных цыплят содержание гетерофилов составило 31,4%, незначительно снизилось на 25 сутки и резко увеличилось, достигнув 43,2% у 35-суточных цыплят. В 4 группе 15-суточных цыплят уровень гетерофилов составил 40,3%, резко снизился в 25-суточном возрасте и повысился до 38,0% у 35-суточных цыплят.
Из этого следует, что у 35-суточных цыплят 1-4 групп процентная концентрация гетерофилов варьировала от 33,5% до 43,2%, а лимфоцитов от 49,4% до 57,7%. При этом показатели не выходили за физиологические пределы, характерные для молодняка кур.
У 15-суточных цыплят 1-4 групп содержание эритроцитов увеличилось на 16,8-20,8% (р≤0,05), причем в опытных группах имелась тенденция к повышению. У 25-суточных цыплят содержание эритроцитов по сравнению с предыдущим сроком исследования увеличилось на 27,4-34,6% (р≤0,05), наиболее высокое содержание клеток отмечено у цыплят 3 и 4 групп, соответственно, 3,05×1012/L и 3,19×1012/L. К 35-суточному возрасту у цыплят 1-4 групп отмечено недостоверное снижение эритроцитов, при этом наиболее высокая их концентрация обнаружена у цыплят 4 группы (3,12×1012/L).
У испытуемых цыплят 15-суточного возраста установлено повышение гемоглобина с последующим снижением к 35 суткам до 115,4-123,5 g/L (рисунок 22).
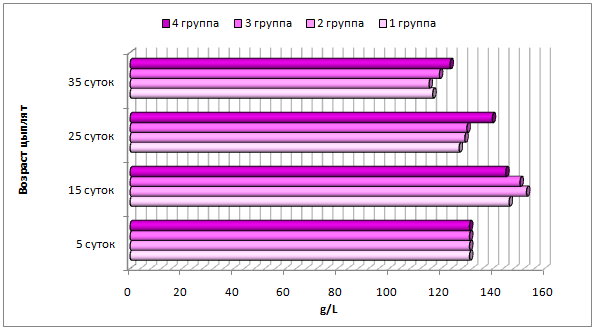
Рисунок 22 – Динамика гемоглобина у цыплят контрольной и опытной групп.
Согласно изменению концентрации эритроцитов, изменялась гематокритная величина. К 25-суточному возрасту показатель достиг максимума во всех группах и несколько снизился к 35 суткам, составив в 1 группе 36,6%; во 2 – 37,2%; в 3 – 37,4%, в 4 – 39,0%.
В связи с морфологическими особенностями эритроцитов у кур, интегральные эритроцитарные индексы имеют отличия от аналогичных показателей у млекопитающих животных. Вариации показателей характерны для цыплят в раннем постэмбриональном онтогенезе. В 35-суточном возрасте диапазон среднего объема эритроцитов (MCV) составил 125,4-127,9 fL, среднее содержание гемоглобина в одном эритроците (MCH) 39,6-40,2pg, средняя концентрация гемоглобина в эритроците (MCHC) 310,2-317,3g/L, ширина распределения эритроцитов по объему(RDW) 7,6-8,3%.
Таким образом,применение пробиотика, энтеросорбента и их комбинации стимулирует синтез эозинофилов, потенцирует эритропоэз и содержание гемоглобина. После отмены препаратов эффект сохраняется в течение 10 суток.
4.2.5 Тема: СОНОГРАФИЧЕСКАЯ ОЦЕНКА ПЕЧЕНИ В РАННЕМ ПОСТЭМБРИОНАЛЬНОМ ОНТОГЕНЕЗЕ У ЦЫПЛЯТ НА ФОНЕ ПРИМЕНЕНИЯ ПРОБИОТИКА, ЭНТЕРОСОРБЕНТА И ИХ КОМБИНАЦИИ
Цель: оценитьструктуру печени у цыплят в постэмбриональном развитии на фоне введения в рацион пробиотика, энтеросорбента и их комбинации с применением безинвазивных технологий.
Методика и результаты исследований: ультразвуковое исследование органов брюшной полости выполняли на аппарате Сономед-500.
Кровь для исследования получали из плечевой вены.Синтетическую функцию печени оценили по содержанию общего белка, альбумина,глобулинов, глюкозыи трансаминаз на полуавтоматическом биохимическом анализаторе BioChemBA с наборами для исследований Диакон-вет.
В стартовый период исследования у 5-суточных цыплят содержание общего белка составило 47,2±0,13г/л с преобладающей концентрацией альбумина.
В контрольной группе у 15-суточных цыплят отмечено снижение общего белка на 6,4% (р≤0,05) с последующим недостоверным повышением у 25-суточных цыплят, и снижением до 39,0±0,32 г/л у 35-суточных. Максимальная концентрация глобулинов (49,3%) отмечена у 15-суточных цыплят, альбумина (57,6%) – у 25-суточных цыплят.
В опытных группах у 15-суточных цыплят отмечено значительное снижение общего белка до 34,0-38,9 г/л. Во 2 группе у 25-суточных цыплят содержание общего белка увеличилось до 44,68 г/л, а процентная концентрация глобулинов достигла 48,1. У 35-суточных цыплят отмечено незначительное снижение уровня общего белка и возрастание альбумина до 58,0%.
В 3 группе 15-суточных цыплят на фоне снижения общего белка отмечено повышение концентрации глобулинов до 54,8%. Повышение общего белка у 25-суточных цыплят сопровождало повышение альбумина. У 35-суточных цыплят содержание общего белка составило 44,11±0,48 г/л, процентная концентрация альбумина превышала таковую глобулинов на 3,2.
В 4 группе у 15-суточных цыплят преобладала альбуминовая фракция белка, у 25-суточных цыплят при повышении общего белка преобладали глобулины. У 35-суточных цыплят содержание общего белка 41,4±1,5 г/л, при этом белковый коэффициент составил 1,0.
О глюконеогенезе судили по концентрации глюкозы в сыворотке крови. У 5-суточных цыплят уровень глюкозы составил 16,9±0,5 ммоль/л.
У цыплят 1-3групп в 15-суточном возрасте отмечено снижение уровня глюкозы с последующим повышением на 25 сутки. В 1 и 2 группах также происходило увеличение глюкозы в сыворотке крови на 35 сутки. В 3 группе у 35-суточных цыплят отмечено снижение глюкозы по сравнению с предыдущим периодом. В 4 группе у цыплят 5-25-суточного возраста достоверных изменений содержания глюкозы не выявлено, но к 35 суткам ее уровень составил 12,32±0,43 ммоль/л, что меньше первоначального показателя на 27,1% (р≤0,01).
Исключить синдром цитолиза нам позволила оценка активности аспартатаминотрансферазы (АСТ) и аланинаминотрансферазы (АЛТ).
У 5-суточных цыплят активность АСТ 206,5±2,1 Ед/л, АЛТ 21,1±3,37 Ед/л. У 15-суточных цыплят установлено снижение активности АСТ с последующим повышением у 25-суточных цыплят 1, 3 и 4 групп до 218,6 Ед/л и последующим снижением в 35-суточном возрасте до 161,2-182,4 Ед/л. Снижение активности энзима более выражено в 3 и 4 группах. У цыплят 2 группы 15-25-суточного возраста выявлено снижение активности АСТ до 193,5 Ед/л и последующее повышение в 35-суточном возрасте (после отмена пробиотика) до 233,0 Ед/л.
Динамика АЛТ также имела свои особенности. Во всех группах на 15 сутки отмечено повышение активности фермента, во 2 и 3 группах в 25- и 35-суточном возрасте наблюдали снижение его активности. В частности в 3 группе после отмены энтеросорбента на 35 сутки активность АЛТ составила 12,4 Ед/л. В 1 и 4 группах активность АЛТ в 25-суточном возрасте цыплят достигла 29,7±0,53 и 23,8±0,28 Ед/л, соответственно, и снизилась на 35 сутки до 16,5-18,0 Ед/л.
О целостности гепатоцитов мы можем судить на основании результатов сонографии печени.
При ультразвуковом исследовании брюшной полости 5-суточных цыплят область печени безболезненная. Печень визуализировалась хорошо. Размеры ее не увеличены (рисунок 23). Контуры чёткие, ровные. Эхогенность умеренно повышена, структура однородная. Сосудистый рисунок слабо выражен. Желчный пузырь плохо визуализировался.
У 15-суточных цыплят печень анатомической формы, границы четкие, ровные (рисунок 24). Капсула не утолщена. Эхогенность нормальная, структура однородная. Сосудистый рисунок хорошо выражен. Желчные ходы не расширены. Желчный пузырь каплевидной формы, размеры 12×7 мм, стенка не утолщена.
Печень 25-суточных цыплят имела анатомическую форму, не увеличена (рисунок 25). Контуры четкие, ровные. Эхогенность в норме. Эхоструктура однородная, мелкозернистая. Сосудистый рисунок хорошо выражен. Желчный пузырь каплевидной формы, размеры не увеличены. Стенка не утолщена, содержимое однородное (рисунок 26).
Печень у 35-суточных цыплят имела нормальные размеры, четкие контуры (рисунок 27). Эхогенность паренхимы печени в норме, структура мелкозернистая, однородная. Сосудистый рисунок хорошо выражен. Желчный пузырь нормального наполнения, овальной формы. Стенка не утолщена. Содержимое однородное, анэхогенное (рисунок 28).
Разницы в УЗ-картине печени между группами на протяжении всего периода эксперимента не обнаружено.
 |
 |
| Рисунок 23 – Сонограмма печени
5-суточного цыпленка. |
Рисунок 24 – Сонограмма печени
15-суточного цыпленка. |
 |
 |
| Рисунок 25 – Сонограмма печени
25-суточного цыпленка. |
Рисунок 26 – Сонограмма печени и желчных протоков 25-суточного цыпленка. |
 |
 |
| Рисунок 27 – Сонограмма печени
35-суточного цыпленка. |
Рисунок 28 – Сонограмма печени и желчных протоков 35-суточного цыпленка. |
Таким образом,после первого критического периода через 2-5 суток наблюдается второй, связанный с линькой, что во многом объясняет подвижность, неустойчивость гематологических показателей. В тоже время смешанный тип питания, а затем переход на экзогенное питание может провоцировать нарушение функции и структуры печени. Альтернативой контрольному убою может служить безинвазивное сонографическое исследование печени и анализ биохимических показателей сыворотки крови.
Введение в рацион пробиотического препарата и энтеросорбента не повлекло изменений в структуре органа. Применение энтеросорбента и комплекса Зоонорм и ЭнтероЗоо стимулировало белок-синтетическую функцию печени, глюконеогенез, стабилизировало активность трансаминаз.
4.2.6 Тема: СПОСОБЫ КОНТРОЛЯ И ПРЕДОТВРАЩЕНИЯ РИСКОВ ПАТОЛОГИИ МИНЕРАЛЬНОГО ОБМЕНА У ЦЫПЛЯТ НА ФОНЕ ПРИМЕНЕНИЯ ПРОБИОТИКА, ЭНТЕРОСОРБЕНТА И ИХ КОМБИНАЦИИ
Цель:оценить минеральный обмен у цыплят на фоне введения пробиотика, энтеросорбента и их комбинациипри помощи современных безинвазивных технологий.
Методика и результаты исследований:кровь получали из подкрыльцовой веныв специальные вакуумные пробирки с активатором свертывания и гелем,утром, до кормления. Сыворотку крови исследовали на предмет содержания общего кальция, неорганического фосфора, магния и щелочной фосфатазы у цыплят 5-, 15-, 25- и 35-суточного возраста на полуавтоматическом биохимическом анализаторе Mindray BA-88A. рентгенологическое исследование грудной кости проводили с помощью аппарата DIAGNOSTIC-X-RAYUNIT в 25- и 35-суточном возрасте цыплят.
В сыворотке крови 5-суточных цыплят уровень общего кальция составил 2,87±0,03 ммоль/л. У цыплят интактной группы 15-суточного возраста его концентрация снизилась на 14,6% (р≤0,05). У 25-суточных цыплят отмечено незначительное повышение общего кальция на 5,3% (р≤0,05) с последующим недостоверным снижением у 35-суточных цыплят (рисунок 29). У 15-суточных цыплят 2 группы также отмечено снижение кальция на 10,1% (р≤0,05), с тенденцией к повышению в 25-суточном возрасте, с достижением 2,82±0,08 ммоль/л в 35-суточном возрасте. У цыплят 3 группы в 15- и 25-суточном возрасте выявлено снижение кальция на 15,7 и 15,3% (р≤0,05) с последующим повышением к 35-суточному возрасту до 2,72±0,07 ммоль/л. У цыплят 4 группы, как и в предыдущих группах, в 15-суточном возрасте отмечено снижение кальция на 9,4% (р≤0,05), но в отличие от них тенденция к снижению сохранилась до 25-суточного возраста с последующим повышением до 2,85±0,04 ммоль/л у 35-суточных цыплят.
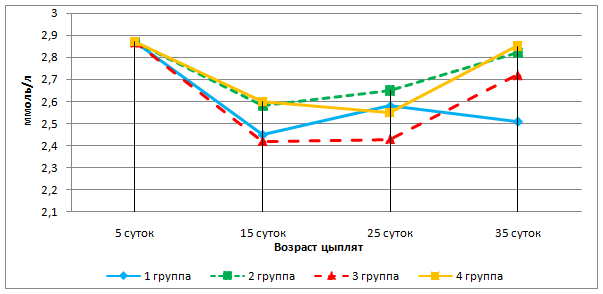
Рисунок 29 – Динамика общего кальция в сыворотке крови у цыплят контрольной и опытных групп.
Содержание неорганического фосфора в сыворотке крови у 5-суточных цыплят составило 2,33±0,10 ммоль/л. У интактных цыплят 1 группы отмечено снижение фосфора в 15-суточном возрасте на 30,5% (р≤0,01), с последующим повышением к 25-суточному возрасту на 9,9% и снижением к 35-суточному. Во 2 группе снижение фосфора происходило постепенно, и к 35 суткам его уровень снизился на 24,0% (р≤0,01). В 3 группе активное снижение фосфора отмечено у 25-35-суточных цыплят до 1,42±0,06 ммоль/л. В 4 группе, также как и во 2 группе, отмечено постепенное снижение фосфора, и более резкое к 35 суткам (рисунок 30).
Кальций-фосфорное соотношение в стартовый период составило 1,23:1,00. К 25-суточному возрасту, к моменту окончания введения в рацион цыплят биологически активных веществ, в 1 и 2 группах соотношение составило 1,45:1,00, в 3 – 1,4:1,0, в 4 – 1,26:1,00. К 35-суточному возрасту соотношение между минеральными веществами изменилось, достигнув в 1 группе 1,54:1,00, во 2, 3 и 4 группах, соответственно, 1,59:1,00; 1,92:1,00 и 1,94:1,00.
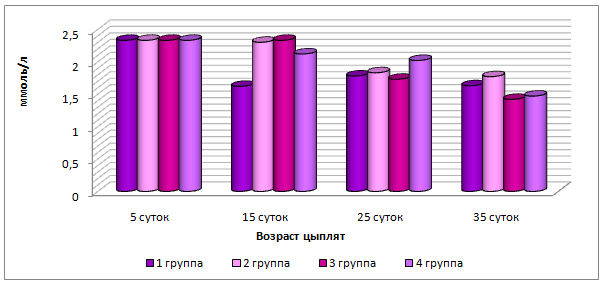
Рисунок 30 – Динамика неорганического фосфора в сыворотке крови у цыплят контрольной и опытных групп.
Содержание магния у 5-суточных цыплят было 1,23±0,04 ммоль/л с последующим равномерным снижением у цыплят 1-4 групп. В 15-суточном возрасте уровень магния находился в пределах 0,82-0,88 ммоль/л, в 25-суточном – 0,70-0,74 ммоль/л и в 35-суточном – 0,90-0,98 ммоль/л. При этом достоверной разницы между группами не установлено.
Активность щелочной фосфатазы у всех цыплят на протяжении исследований была высокой с незначительным снижением в 25-сутчном возрасте и последующим повышением к 35 суткам.
У цыплят линька началась в возрасте 12-13 дней, что в первую очередь, сопровождалось изменением концентрации кальция в сыворотке крови, и было отмечено в 15-25-суточном возрасте цыплят опытных групп и в 15-35-суточном возрасте контрольной группы. Изменение содержания одного микроэлемента неминуемо повлекло изменение концентрации другого, в частности неорганического фосфора, что особенно четко прослеживается в 1 группе цыплят, и менее выражено у цыплят опытных групп. Так же, снизилась концентрация магния, поскольку он не только регулирует обмен Ca и P, но и участвует в деятельности гормонов и энзимов, метаболизме основных питательных веществ.
Следует отметить, что спустя 10 дней после отмены препаратов у 35-суточных цыплят 3 и 4 групп отмечено завершение ювенальной линьки.
Подвижность минеральных веществ в период линьки побудила провести рентгенологическое исследование грудной кости у цыплят, поскольку при рахите наиболее выражено её изменение. У цыплят контрольной и опытных групп 25-35-суточного возраста не установлено нарушение плотности, целостности, деформации, искривления грудной кости (рисунки31-32). Отчётливо виден рост кости, изменение ее длины и высоты с возрастом. Так у 25-суточных цыплят длина кости варьировала от 48,92 мм до 52,48 мм, высота от 13,05 мм до 15,15 мм, у 35-суточных цыплят эти показатели составили, соответственно, 59,37-60,84 мм и 18,78-19,32 мм. Вариации параметров грудной кости пропорциональны живой массе цыплят.
 |
 |
| Рисунок 31 – Рентгенограмма
25-суточного цыпленка. |
Рисунок 32 – Рентгенограмма
35-суточного цыпленка. |
Таким образом, в раннем постэмбриональном периодеизучаемые показатели не выходили за пределы референсных величин; рентгенологически не выявило деформации, нарушения целостности грудной кости. Вводимые добавки стимулировали обмен кальция и фосфора. К35-суточному возрасту у цыплят, получивших комбинацию двух препаратов, соотношение Ca и P приближалось к показателям у взрослых птиц.
4.2.7 Тема:ФОРМИРОВАНИЕ АНТИОКСИДАНТНОЙ ЗАЩИТЫ В РАННЕМ ПОСТЭМБРИОНАЛЬНОМ ОНТОГЕНЕЗЕ У ЦЫПЛЯТ НА ФОНЕ ПРИМЕНЕНИЯ ПРОБИОТИКА, ЭНТЕРОСОРБЕНТА И ИХ КОМБИНАЦИИ
Цель:оценить динамику антиоксидантной защиты у цыплят в постэмбриональном периоде на фоне применения пробиотика, энтеросорбента и их комбинации.
Методика и результаты исследований:оценку перекисного окисления липидов и показателей антиоксидантной защиты (малоновый диальдегид, суммарная антиоксидантная активность сыворотки крови, суммарные нитраты и нитриты) проводили при помощи спектрофотометра «Solar 1251» (Беларусь) и биохимического анализатора «Микролаб» (Merk, ФРГ).
Клинико-лабораторным маркером оксидативного стресса является малоновый диальдегид (MДA). Его уровень у цыплят 5-суточного возраста 1-4 групп находился в интервале 7,78-8,63 нмоль/мл (8,2±0,4 нмоль/мл)и не имел достоверного различия у испытуемых цыплят. Относительно первоначального показателя у 15-суточных цыплят в контрольной группе концентрация МДА увеличилась в 1,96 раза, во 2, 3 и 4 группах, соответственно, в 3,22 раза, 2,58 раза и 2,78 раза (р≤0,01). У 25-суточных цыплят, относительно предшествующего показателя более выраженное повышение МДА отмечено у контрольной группы (в 1,78 раза) и наименее значимое – во второй группе (рисунок 33). У 35-суточных цыплят отмечено снижение концентрации МДА по сравнению с результатом, полученным при исследовании 25-сутоных цыплят в 1 группе – в 1,76 раза, во 2-й – в 1,42 раза, в 3-й – в 1,48 раза и в 4-й – в 2,13 раза (р≤0,01).
Введение биологически активных веществ стимулировало процессы обмена веществ и перекисного окисления липидов, что вероятно, необходимо для формирования иммунной системы. Спустя 10 дней после отмены препаратов концентрация МДА снизилась, что наиболее четко прослеживается в 4 группе.
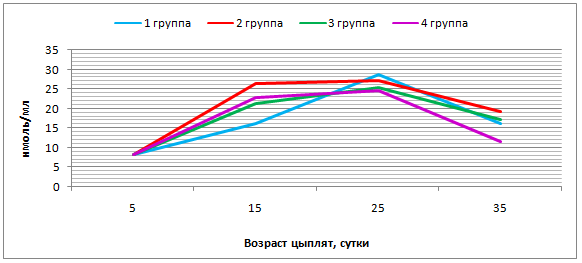
Рисунок 33 – Динамика МДА у цыплят контрольной и опытных групп.
У цыплят контрольной группы концентрация оксида азота снижалась с 5- до 25-суточного возраста (на 17,5%), затем к 35 суткам повысилась на 9,1% (рисунок 34).
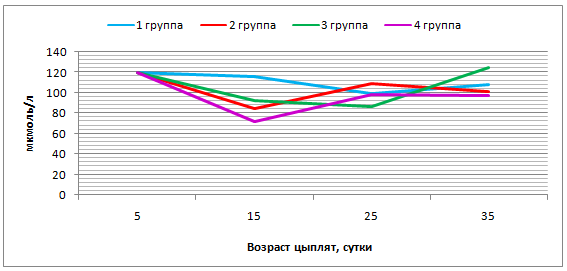
Рисунок 34 – Динамика NOx у цыплят контрольной и опытных групп.
У цыплят опытных групп значительное снижение содержания NOx произошло на 15 сутки (на 22,5-40,0%). У 25-суточных цыплят 2 и 4 групп концентрация NOx увеличивается относительно предшествующего показателя на 28,2 и 36,1%, соответственно. В тоже время в 3 группе содержание оксида азота снизилось еще на 6,5% (р≤0,05).
К 35-суточному возрасту уровень оксида азота у цыплят 2 и 4 групп имел тенденцию к снижению и достиг отметки 97,0-102,0 мкмоль/л, в 3 группе, напротив, произошло повышение концентрации NOx на 43,7%.
Общая антиоксидантная активность сыворотки крови у цыплят контрольной группы снижалась постепенно вплоть до 25-суточного возраста (до 48,0%) и на 35 сутки имела незначительную тенденцию к повышению (рисунок 35). Изменение АОА происходило синхронно с изменением NOx.
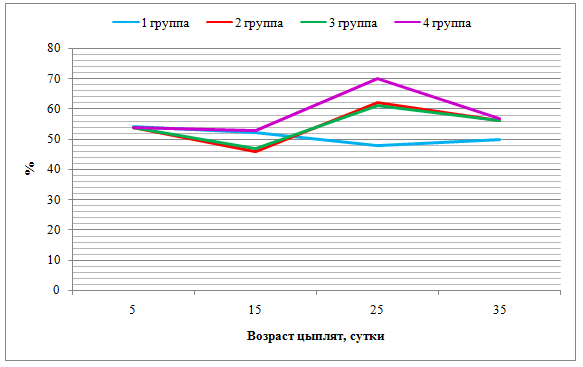
Рисунок 35 – Динамика АОА у цыплят контрольной и опытных групп.
У 15-суточных цыплят 2 и 3 опытных групп отмечено снижение АОА. На 25 сутки наблюдалось повышение общей антиоксидантной активности сыворотки крови, что наиболее выражено у цыплят 4 группы.
К 35 суткам у цыплят опытных групп АОА составила 56,0-57,0%, что выше, чем в контрольной группе на 6,0-7,0%.
Стоит отметить, что в 3 группе в 25-суточном возрасте цыплят повышение АОА сопровождалось снижением NOx, в 35-суточном возрасте снижение АОА сопровождается повышением NOх.
Коэффициент корреляции Спирмена относительно динамики МДА между группами равен 1,000.
Коэффициент корреляции Спирмена между содержанием МДА и NOx, а также между МДА и АОА у цыплят контрольной группы равен -0,800. Связь между исследуемыми признаками – обратная, высокая. В тоже время коэффициент корреляции между NOx и АОА равен 1,000, и свидетельствует о том, что связь между исследуемыми признаками – прямая, функциональная.
В опытных группах установлена связь между анализируемыми признаками статистически значимая (p<0,05).
Во 2 группе коэффициент корреляции между МДА и АОА равен 0,600, связь между исследуемыми признаками – прямая, теснота связи – заметная. В тоже время коэффициент корреляции между МДА и NOx, между АОА и NOxравен 0,400, связь между исследуемыми признаками – прямая, умеренная.
В 3 группе коэффициент корреляции между МДА и АОА равен 0,600. Связь между исследуемыми признаками – прямая, заметная. Коэффициент корреляции между МДА и NOx – 0,200, что свидетельствует о прямой, слабойсвязи, а коэффициент корреляции между АОА и NOx составил -0,200, что характеризует связь как слабую, обратную.
В 4 группе коэффициент корреляции между МДА и АОА равен 0,600, связь прямая, заметная. Коэффициент корреляции между МДА и NOx равен -0,400, связь обратная, умеренная. Коэффициент корреляции между АОА и NOx– 0,400, и соответствует умеренной, прямой степени связи.
Таким образом, пробиотик активизировал обменные процессы, которые сопровождались изменением концентрации NOx и общей антиокислительной активности сыворотки крови, что особенно выражено в период начала (15 суток) и окончания линьки цыплят (35 суток), несмотря на отмену препарата.ЭнтероЗоо обладает высокой сорбционной активностью, предотвращая накопление продуктов перекисного окисления липидов (ПОЛ). Комбинация пробиотика и энтеросорбентаэффективно снижает концентрацию МДА.
4.2.8 Тема:СТРЕССОУСТОЙЧИВОСТЬ ЦЫПЛЯТ НА РАННЕМ ЭТАПЕ ПОСТЭМБРИОНАЛЬНОГО ОНТОГЕНЕЗА НА ФОНЕ ПРИМЕНЕНИЯ ПРОБИОТИКА, ЭНТЕРОСОРБЕНТА И ИХ КОМБИНАЦИИ
Цель: оценить динамику кортизола у цыплят на раннем этапе постэмбрионального развития и степень влияния на его концентрацию пробиотика Зоонорм, энтеросорбента ЭнтероЗоои их комбинации.
Методика и результаты исследований:Цыплят разместили в виварии кафедры в клетках по 10 голов. В качестве основного рациона использовали комбикорм «Солнышко» (АО «Капитал-ПРОК», Россия), поение – из групповых поилок кипячёной водой комнатной температуры. Кормление и содержание осуществляли согласно зоогигиеническим нормам без ограничений в доступе к корму и воде.
Для проведения опыта сформировали 4 группы 5-суточных цыплят кросса Dekalb, где 1 группа служила контролем, 2, 3 и 4 группы – опытные. Цыплятам опытных групп задавали препараты в течение 20 дней (с 5- до 25-суточного возраста), и после отмены препаратов в течение 10 последующих дней вели наблюдение.
Вторая группа цыплят получала пробиотик в смеси с кормом в дозе 0,2 г на голову в первое (утреннее) кормление; 3 группе выпаивали 0,3% взвесь энтеросорбента через 2 часа после последнего кормления; 4 группа получала комбинацию двух препаратов в соответствующее время.
Кровь получали из подкрыльцовой вены в утренние часы до кормления в 5-, 15-, 25- и 35-суточном возрасте цыплят.Содержания кортизола в сыворотке крови исследовали методом ИФА, биохимические показатели крови (белковые фракции, глюкоза, холестерол, триглицериды) – с помощью полуавтоматического биохимического анализатора BioChemBA.
У 5-суточных цыплят уровень кортизола составил 5,12±0,11нмоль/л (рисунок 36). У цыплят 1 группы, получивших основной рацион, концентрация кортизола в сыворотке крови повышалась с возрастом: у 15-суточных на 13,7%; 25-суточных – на 33,5% и 35-суточных – на 41,6% (р≤0,05).
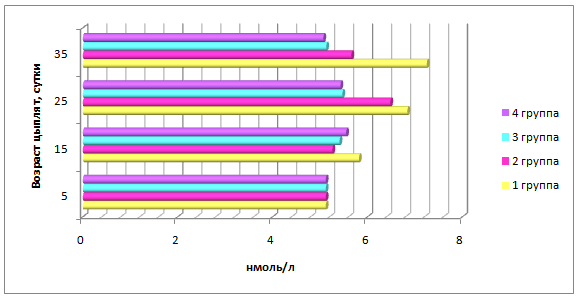
Рисунок 36 – Динамика кортизола у цыплят на фоне применения биологически активных веществ.
У цыплят 2 группы на фоне применения пробиотика на 15, 25 и 35 сутки исследования также отмечено повышение кортизола, соответственно, на 2,7%; 26,6% и 10,5% (р≤0,05).
В 3 группе цыплят на фоне применения ЭнтероЗоо уровень кортизола на 15 сутки повысился на 5,7% (р≤0,05), 25 сутки – на 6,8% (р≤0,05). На 35 сутки содержание кортизола снизилось до 5,12 нмоль/л.
У цыплят 4 группы на 15 сутки исследования произошло достоверное повышение кортизола на 8,4%, на 25 сутки – на 6,1% (относительно первоначального показателя), а на 35 сутки отмечено его недостоверное снижение.
У цыплят кросса Dekalb в 12-13-суточном возрасте началась линька – замена пуха на первичное перо, что, несомненно, требует затрат энергии и пластического материала. Несмотря на критический период развития у 15-суточных цыплят 1 группы отмечено повышение глобулиновой фракции белка на 5,9%, одновременно наблюдалось снижение глюкозы, триглицеридов и холестерола, соответственно, на 26,6%; 66,5% и 29,0% (рисунок 37). К 25-суточному возрасту у цыплят отмечалось повышение глюкозы до 13,9±0,3 ммоль/л, к 35-суточному – до 14,6±0,5 ммоль/л при снижении холестерола и триглицеридов.
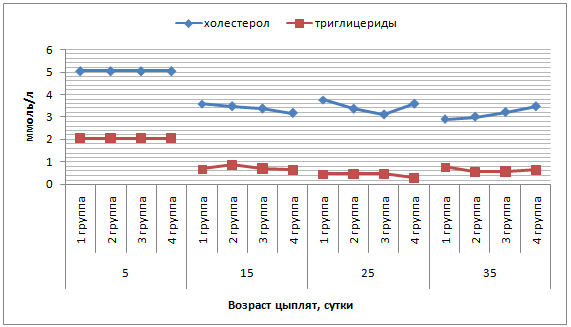
Рисунок 37 – Динамика холестерола и триглицеридов у цыплят контрольной и опытных групп.
У 15-25-суточных цыплят 2 группы наблюдалась тенденция к повышению процентной концентрации глобулинов (на 4,4-4,7%). Как и в 1 группе, на 15 сутки отмечено достоверное снижение концентрации глюкозы на 19,8%, триглицеридов на 58,1% и холестерола на 31,4%. У 25-35-суточных цыплят установлено повышение глюкозы в крови до 14,63-15,58 ммоль/л, снижение холестерола до 3,37-3,01 ммоль/л и триглицеридов до 0,43-0,52 ммоль/л.
У 15-суточных цыплят 3 группы также отмечено снижение глюкозы на 18,3% с последующим повышением на 25 сутки до 14,91±0,23 ммоль/л и снижением на 35 сутки до 13,23±0,21 ммоль/л. Также у 15- и 25-суточных цыплят регистрировалось снижение холестерола и триглицеридов, соответственно на 33,3 и 38,7%; 66,5 и 77,8% (р≤0,01). У 35-суточных цыплят наряду со снижение концентрации глюкозы в крови отмечено повышение содержания холестерола и триглицеридов относительно предыдущего показателя.
В 4 группе у 15-25-суточных цыплят концентрация глюкозы в сыворотке крови не претерпела достоверных изменений и находилась на уровне 16,9-16,68 ммоль/л. В тоже время концентрация триглицеридов и холестерола у 15- и 25-суточных цыплят относительно первоначального показателя снизилась на 68,9% и 86,7%; 37,3% и 29,0%, соответственно (р≤0,05).У 35-суточных цыплят при снижении содержания кортизола отмечено снижение глюкозы до 12,32±0,13 ммоль/л, повышение триглицеридов до 0,62 ммоль/л (относительно предыдущего показателя). У цыплят отмечалось более высокая процентная концентрация глобулинов на всем протяжении исследования (48,0-54,3%).
Следует особо отметить, что у цыплят 3 и 4 групп на 35 сутки практически завершилась линька.
Таким образом, более высокое содержание кортизола в сыворотке крови отмечено у цыплят 1 группы на протяжении всего периода исследования. У цыплят 35-суточного возраста контрольной и опытных групп отмечено повышение концентрации триглицеридов. У цыплят, получивших ЭнтероЗоо в качестве монодобавки или в комбинации с пробиотиком,на 35 сутки исследования отмечено снижение уровня глюкозы, холестерола и триглицеридов на фоне снижения кортизола и завершения процесса линьки.
Результаты свидетельствуют об эффективном выведении промежуточных метаболитов, ускорении линьки, снижении стрессовой нагрузки, и, следовательно, повышают устойчивость цыплят и более раннее начало продуктивного периода.
4.2.9 Тема:ДИНАМИКА МЕТАБОЛИЧЕСКИХ ПРОЦЕССОВ У ЦЫПЛЯТ НА ФОНЕ ПРЕДИНКУБАЦИОННОЙ ОБРАБОТКИ ЯИЦ ЭНТЕРОЗОО И ВВЕДЕНИЕ ЕГО В РАЦИОН
Цель: оценить влияния энтеросорбента ЭнтероЗоо на биохимические показатели крови у цыплят при прединкубационной обработке яиц и применения его в период раннего постэмбрионального развития.
Методика и результаты исследований.Исследование выполнено в 2 этапа. На первом этапе партию инкубационных яиц разделили на 2 порядка, 1 порядок – опытный, 2 –контрольный. Перед закладкой в инкубатор яйца однократно в течение 30 секунд обработали аэрозолью 0,01% взвеси ЭнтероЗоо. Инкубировали яйца по стандартной технологии.
На 2 этапе, после вывода сформировали 4 группы цыплят в соответствии со схемой (рисунок 38). Каждая группа включала по 50 голов цыплят.
Основу рациона (ОР) цыплят составил комбикорм «Солнышко» (АО «Капитал-ПРОК», Россия) и кормовая добавка «Добрый селянин» («МирАгро», Россия), в дозах, рекомендованных производителем. Поение цыплят кипячёной водой температурой 20-22°С из групповых поилок без ограничений. Температурно-влажностный режим соответствовал возрасту цыплят. Взвесь ЭнтероЗоо выпаивали 2 и 3 группе цыплят через 2 часа после последнего кормления.
| Обработка яиц ЭнтероЗоо | Стандартная подготовка яиц | |||||
| 1 группа | 2 группа | 3 группа | 4 группа | |||
| ОР | ОР+0,01% взвесь
ЭнтероЗоо |
ОР+0,01% взвесь
ЭнтероЗоо |
ОР | |||
| общий белок, альбумин, глобулины, белковый коэффициент, мочевая кислота, глюкоза, холестерол, триглицериды, Сa, P, Mg,
АСТ, АЛТ, щелочная фосфатаза |
||||||
Рисунок 38– Схема проведения исследования по оценке влияния ЭнтероЗоо на биохимические показатели крови у цыплят при прединкубационной обработке яиц и последующего его применения в период раннего постэмбрионального развития
Для биохимического исследования кровь у 30-суточных цыплят бралииз подкрыльцовой вены в специальные вакуумные пробирки с активатором свертывания и гелем. Исследование сыворотки крови осуществили на полуавтоматическом биохимическом анализаторе MindrayBA-88A. Результаты подвергли статистической обработке с помощью специального пакета программ.
У цыплят 1 и 4 групп содержание общего белка меньше чем во 2 и 3 группах на 7,24-9,03 % и 6,25-7,45% (р≤0,05), соответственно (таблица 8). У цыплят 2 и 3 групп в сыворотке крови преобладала альбуминовая фракция, белковый коэффициент составил 1,26 и 1,32 против 1,05 и 0,99 в 1 и 4 группах.
В результате прединкубационной обработки яиц у цыплят 1 группы содержание мочевой кислоты меньше, чем во второй на 10,80%, в третьей – на 11,93% и четвертой – на 35,33% (р≤0,05), тем не менее ее концентрация не превышала физиологически допустимого уровня (220,0-880,0 мкмоль/л).
Наиболее низкое содержание глюкозы обнаружено у цыплят 4 группы, у цыплят 1 и 3 групп имелась тенденция к ее повышению. У цыплят 2 группы концентрация глюкозы больше по сравнению с другими группами на 7,14-8,11% (р≤0,05).
Содержание триглицеридов и холестерола у цыплят 2 группы достоверно меньше на 33,33-66,67% и 3,70-22,23%, чем у цыплят других групп. Полученные данные подтверждают тесную взаимосвязь между обменом углеводов и липидов: в результате сложных превращений организм птиц способен использовать углеводные метаболиты для синтеза необходимых компонентов.
Таблица 8 – Биохимические показатели крови у экспериментальных групп цыплят, M±m
| Показатель | 1 группа | 2 группа | 3 группа | 4 группа |
| Общий белок, г/л | 44,30±1,23 | 48,30±0,98 | 47,60±0,86 | 44,80±1,09 |
| Альбумин, г/л | 22,70±0,78 | 26,90±0,38 | 27,10±0,36 | 22,30±0,47 |
| Глобулины, г/л | 21,60±0,82 | 21,40±0,53 | 20,50±0,43 | 22,50±0,59 |
| Белковый коэффициент | 1,05±0,09 | 1,26±0,07 | 1,32±0,08 | 0,99±0,06 |
| Мочевая кислота, мкмоль/л | 195,30±8,64 | 216,40±6,22 | 218,60±7,14 | 264,30±13,81 |
| Глюкоза, ммоль/л | 11,20±0,21 | 12,00±0,13 | 11,20±0,08 | 11,10±0,17 |
| Холестерол, ммоль/л | 3,20±0,12 | 2,70±0,04 | 2,80±0,04 | 3,30±0,06 |
| Триглицериды, ммоль/л | 0,40±0,05 | 0,30±0,01 | 0,40±0,03 | 0,50±0,02 |
| Общий кальций, ммоль/л | 2,50±0,13 | 2,40±0,04 | 2,50±0,05 | 2,30±0,11 |
| Неорганический фосфор, ммоль/л | 2,00±0,73 | 1,30±0,03 | 1,40±0,07 | 1,60±0,18 |
| Магний, ммоль/л | 0,60±0,05 | 0,60±0,02 | 0,70±0,04 | 0,60±0,06 |
| АСТ, Ед/л | 243,00±11,0 | 228,00±10,60 | 205,50±9,73 | 285,50±13,64 |
| АЛТ, Ед/л | 16,50±0,30 | 20,40±0,42 | 21,30±0,27 | 26,20±0,48 |
| Щелочная фосфатаза, Ед/л | 1269,00±48,50 | 801,00±26,20 | 866,40±28,15 | 1534,00±62,70 |
Содержание магния и общего кальция в группах цыплят не имело достоверных отличий. Прединкубационная обработка яиц и последующее введение цыплятам энтеросорбента способствовали снижению неорганического фосфора в сыворотке крови до 1,30 ммоль/л и вовлечению его в обменные процессы. Наряду с этим у цыплят 1 группы, где была проведена лишь прединкубационная обработка яиц, содержание фосфора больше на 35,0%, чем у цыплят 2 группы. В 3 группе цыплят, получивших кроме основного рациона, ЭнтероЗоо, уровень фосфора не имел достоверных отличий от данных, полученных во 2 группе цыплят. В тоже время у цыплят 4 группы, получивших только ОР, концентрация фосфора составила 1,60 ммоль/л и была достоверно больше чем в 3 группе на 14,28% (р≤0,05).
Для растущего молодняка, как и для продуктивной птицы, не маловажное значение имеет соотношение кальция и фосфора. У цыплят 2 и 3 групп соотношение Ca 😛 составило 1,85:1,00 и 1,79:1,00, что, вероятно, является следствием активного вовлечения ионов фосфора в синтез макроэргических соединений (нуклеотидов, цитоплазмы и ядер РНК и ДНК, фосфоаминолипидов, клеточных коэнзимов, АТФ, креатинфосфата, гексозофосфата, ацетилфосфата и др.).
У цыплят 1 и 4 групп выражено отклонение активности ферментов индикаторной группы, трансаминаз и щелочной фосфатазы, являющееся следствием дисфункции билиарной системы.
Метод эфферентной профилактики, примененный в прединкубационный период и ранний постинкубационный, показал, что у цыплят в сыворотке крови более высокое содержание общего белка и альбумина, активное вовлечение глюкозы, триглицеридов, холестерола и минеральных веществ в метаболические процессы. Также 0,01% взвесь ЭнтероЗоо выводит промежуточные метаболиты, обладает гепатопротекторным действием, что подтверждается концентрацией маркерных ферментов в сыворотке крови.
4.3. Тема: ОБОСНОВАНИЕ ПРИМЕНЕНИЯ ЭНТЕРОСОРБЕНТА ЭНТЕРОЗОО ПЕРЕПЕЛАМПРИ ЗАРАЖЕНИИ КОРМОВ МИКОТОКСИНАМИ
Цель: Определить эффективность ЭнтероЗоо при выращивании перепелов при заражении кормов микотоксинами.
Методика и результаты исследований.Исследование состояло из серии опытов (рисунок 39). Объектом для исследования послужили перепела японской породы, выращиваемые в фермерских хозяйствах Ивановской области. После вывода перепелят в течение 5 минут облучали ультрафиолетовыми лучами лампой ЛЭ и помещали в брудеры, где до 30-суточного возраста облучали лампами ИКЗК-220-250. Тридцатисуточный молодняк по 20 голов размещали в клетках.
| Опыт 1 | влияние ЭнтероЗоо на сохранность и живую массу перепелов от 1- до 60-суточного возраста | |
| Опыт 2 | эффективность ЭнтероЗоо при скармливании комбикорма с повышенным содержанием Афлотоксина В1 и Т2-токсина | |
| Опыт 3 | влияние препарата ЭнтероЗоо на физиологический статус перепелов | |
| Опыт 4 | динамика кишечной микрофлоры на фоне применения ЭнтероЗоо |
Рисунок 39– Схема проведения исследования по теме 4.3.
Для реализации плана исследования оценивали сохранность и живую массу перепелов на весах марки «SITITEK C03».
Для оценки физиологического статуса оценили содержание общего белка, альбумина, мочевой кислоты,глюкозы, триглицеридов, холестерола, общего кальция, неорганического фосфора, активность щелочной фосфатазы (ЩФ), аланинаминотрансферазы (АЛТ); аспартатаминотрансферазы (АСТ) – на полуавтоматических биохимических анализаторахBioChem BA иBA-88A.
Оценку видового состава кишечной микрофлоры проводили путем посева на питательные средыЭндо, Гарро, Плоскирева, Чапека, МПА, солевой МПА и ЖСС.
Микотоксикологический анализ был выполнен в ФНЦ «ВНИТИП» РАН в соответствии с ГОСТ Р 52471-2005.
В первом опыте сформировали 2 группы перепелов по 180 голов в каждой. Кормление птиц комбикормами (ПК-5, ПК-2) в соответствии с возрастом. Первая группа служила контролем, вторая – опытная, где спустя 2 часа после вечернего кормления выпаивали 0,1% взвесь ЭнтероЗоо.
Динамику живой массы в первый месяц выращивания учитывали с 5-дневным интервалов, во второй – с 15-дневным (рисунок 40).
Рисунок 40 – Динамика массы перепелов на фоне применения 0,1% взвеси ЭнтероЗоо.
В контрольной группе живая масса 30-суточных перепелов увеличилась в 10,0 раз, 60-суточных в 20,2 раза, в опытной, соответственно, в 12,0 и 23,2 раза. Опытные 30- и 60-суточные перепела превосходили по живой массе контрольных на 17,0% и 13,5% (р≤0,01). Сохранность в 60-суточном возрасте перепелов контрольной группы составила 84%, в опытной – 92%.
Во втором опыте были сформированы две группы перепелов суточного возраста по 270 особей в каждой, перепела получали комбикорм собственного приготовления, опытной группе спустя 2 часа после вечернего кормления выпаивалась 0,1% взвесь ЭнтероЗоо.
В первую декаду выращивания в контрольной группе пало 49 голов, во второй 7 голов. При исследовании корма на предмет содержания микотоксинов установлено, что концентрация Афлотокисна В1 достигла 47,5 мкг/кг, Т2-токсина 169,2 мкг/кг, превысив многократно ПДК для молодняка птицы. К 60-суточному возрасту в контрольной группе сохранность перепелов составила 63,7%, вопытной– 86,2%. В опытной группе отмечался не только больший прирост живой массы, но и начало яйцекладки у 65% птиц.
В третьем опыте в стартовый период и в разгар яйцекладки перепелов провели оценку физиологического статуса птиц (таблица 9).В стартовый период опыта достоверных отличий биохимических показателей сывороти крови у перепелок-несушек не выявлено.
Спустя 30 дней в контрольной группе наметилась тенденция к снижению общего белка (на 2,5%), в опытной – к повышению (на 2,0%), белковый коэффициент в обеих группах не претерпел изменений.
У 150-суточных несушек контрольной группы увеличилось содержание глюкозы, триглицеридов и холестерола на 10,2%, 73,0% и 45,5%, соответственно (р≤0,05). В опытной группе достоверных изменений этих показателей не выявлено. Концентрация мочевой кислоты в контрольной группе птиц постепенно повышалась и превысила первоначальный показатель на 17,1%, в опытной, напротив, снизилась на 20,9% (р≤0,05).
В результате изменения содержания минеральных веществсоотношение общего кальция и неорганического фосфора в контрольной группе составило 1,9:1,7, а в опытной – 2,3:1,4.
У контрольных перепелок-несушек отмечен рост концентрации щелочной фосфатазы, АСТ и АЛТ соответственно на 111,3%; 163,6% и 23,4%. В опытной группе птиц активность щелочной фосфатазы снизилась на 66,8%,аспартатаминотрансферазы на 33,4% (р≤0,01).
Таблица 9 – Динамика показателей крови у перепелок-несушек японской породы на фоне применения 0,1% взвеси ЭнтероЗоо, n=60, M±m
| Показатель | Контроль, возраст, сутки | Опыт, возраст, сутки | ||||
| 120 | 135 | 150 | 120 | 135 | 150 | |
| Общий белок, г/л | 67,9±2,3 | 66,6±1,7 | 66,2±2,3 | 68,0±2,1 | 68,7±0,8 | 69,3±0,3 |
| Альбумин, г/л | 34,3±1,6 | 31,6±0,9 | 33,5±1,1 | 34,7±1,2 | 34,8±0,4 | 35,6±0,2 |
| Глюкоза, ммоль/л | 9,5±0,8 | 11,8±0,3 | 10,6±0,2 | 9,3±0,4 | 9,2±0,2 | 9,6±0,2 |
| Холестерол, ммоль/л | 3,0±0,4 | 4,7±0,5 | 5,2±0,3 | 3,1±0,6 | 3,2±0,2 | 3,2±0,3 |
| Триглицериды, ммоль/д | 1,1±0,1 | 2,2±0,3 | 2,7±0,2 | 1,0±0,2 | 1,1±0,1 | 1,3±0,2 |
| Мочевая кислота, мкмоль/л | 708,2±23,4 | 800,0±31,2 | 829,3±36,0 | 713,0±26,2 | 608,0±12,7 | 564,3±13,2 |
| Кальций, ммоль/л | 1,7±0,2 | 1,9±0,1 | 1,9±0,3 | 1,8±0,3 | 2,2±0,1 | 2,3±0,1 |
| Фосфор, ммоль\л | 1,2±0,3 | 1,4±0,2 | 1,7±0,4 | 1,4±0,2 | 1,3±0,1 | 1,4±0,2 |
| Щелочная фосфатаза, Ед/л | 199,7±12,2 | 237,2±16,6 | 422,0±18,5 | 193,3±9,7 | 83,7±11,2 | 64,2±1,3 |
| АЛТ, Ед/л | 24,8±1,2 | 34,5±1,7 | 30,6±1,2 | 24,6±1,0 | 26,5±1,3 | 26,2±0,6 |
| АСТ, Ед/л | 102,8±7,6 | 258,9±11,4 | 271,0±10,3 | 100,3±4,2 | 64,6±1,7 | 66,8±1,4 |
В обеих группах яйценоскость была стабильной, изменения коснулись массы яиц, в контрольной группе она осталось на прежнем уровне, и составила 11,4±0,9 г, в опытной увеличилась до 12,7±0,4 г.
В четвертой серии опытов, 90-суточным перепелкам-несушкам достигшим пика продуктивности, в течение 20 суток выпаивали 0,1% взвесь ЭнтероЗоо, как и в предыдущих опытах спустя 2 часа после вечернего кормления.
Для оценки изменения кишечного микробиоценоза с интервалом в 10 дней проводили исследования по ряду показателей (таблица 10).
Таблица 10 – Динамика кишечной микрофлоры на фоне применения
0,1% взвесь ЭнтероЗоо, n=30
| Показатель | Среда | 90 суток | 100 суток | 110 суток |
| Общее микробное число | МПА | 39×106 | 48×103 | 16×103 |
| Бактерии группы кишечной палочки | Эндо | 17×106 | 25×103 | 4×103 |
| Staphylococcus | Солевой МПА | 14×106 | 14×103 | 6×103 |
| Streptococcus | Гарро | 8×106 | 8×103 | 4×103 |
| Clostridium | ЖСС | — | — | — |
| Salmonella | Плоскирева | — | — | — |
| Proteus | МПА | — | — | — |
| Грибы | Чапека | — | — | — |
| Bacillus | МПА | — | — | 1×103 |
В результате применения энтеросорбента отмечено снижение общего микробного числа, бактерий группы кишечной палочки, стафилококков, стрептококков.
Таким образом, применение биопрепарата нового поколения повлияло на скорость роста, сохранность, стимулировало обмен веществ, устойчивость к действию микотоксинов, оказало влияние на массу яиц и видовой состав микрофлоры желудочно-кишечного тракта перепелов.
4.4. Тема: ОБОСНОВАНИЕ ПРИМЕНЕНИЯ ЭНТЕРОСОРБЕНТА ЭНТЕРОЗОО ПРИ ВЫРАЩИВАНИИ УТЯТ
Цель исследования: установить влияниеЭнтероЗоо на сохранность, динамику живой массы, показатели копрограммы у утят пекинской породы.
Условия и методика проведения эксперимента. Утки доморощенные, принадлежат крестьянско-фермерскому хозяйству по выращиванию птицы (Ивановская область).
После выемки из выводного шкафа и двукратного ультрафиолетового облучения утята помещены в брудеры со специальным оборудованием, снабженные инфракрасными облучательными установками. Поение без ограничения. Кормление вволю до 5-суточного возраста, в дальнейшем согласно нормам кормления уток.
После перевода в брудеры сформировали две группы утят, первая служила контролем и получала основной рацион, принятый в хозяйстве, включающий комбикорм и пробиотическую кормовую добавку Ветом 1.1. в дозе 50 мг/кг живой массы один раз в день утром с кормом в течение трех недель (ОР); вторая – опытная, кроме стандартной схемы кормления, принятой в хозяйстве, через 2 часа после вечернего кормления получала 0,1% взвесьэнтеросорбента в течение 21 дня.
Учет сохранности утят проводили ежедневно, динамику живой массы фиксировали с сточного возраста, в 7-, 14- и 21-суточном возрасте. Взвешивание утят проводили на весах марки ВАТ-1 (Россия, «Невские весы»).
Копрологические исследования выполнены в 1- и 21-суточсном возрасте утят с использованием общепринятых методик, микроскопию препаратов осуществили при помощи микроскопа Микромед 3Вар3-20 и видеокамеры с программным обеспечением MicroscopeColorDigitalCameraLevenhukC 1400 NG, объектив SP40X/0.65 и SP10X/0.25 и окулярWF10X/22.Анализ микрофлоры проводилипо культурально-биохимическим, морфологическим, гемолитическим, тинкториальным свойствам методами общей микробиологии с последующей идентификацией.
Культурально-биохимические свойства бактерий изучали на мясо-пептонном агаре (МПА), мясо-пептонном бульоне (МПБ), средах Эндо, Левина, Плоскирева, Гарро, Вильсон-Блера, солевом и висмут-сульфитном агаре. Морфологические свойства определяли по изучению характера роста микроорганизмов на питательных средах. Гемолитические свойства, выделенных микроорганизмов, изучали путем посева на кровяной мясо-пептонный агар. Тинкториальные свойства, выделенных бактерий, изучали методом световой микроскопии, окрашивая мазки из суточной агаровой культуры по методу Грама. Культурально-морфологические свойства грибов определяли по характеру роста колоний на среде Чапека и методом световой микроскопии нативных мазков.
Учет сохранности показал, что в контрольной группе за период 1-7 сутки пало 8 утят, в период 8-14 и 15-21 сутки – по 6 утят, в опытной группе в течение 1-7 суток пало 2 утенка, в период 15-21 сутки – один.
Таким образом, на 21 сутки исследования сохранность утят в контрольной группе составила 71,4%, в опытной – 95,7% (рисунок 41).
Рисунок 41 – Сохранность утят в контрольной и опытной группах.
Средняя масса утят опытной группы превышала аналогичный показатель контрольной группы в 7-, 14- и 21-суточном возрасте на 7,6%, 17,3% и 30,7% соответственно (р≤0,05) (рисунок 42). Живая масса 21-суточных утят опытной группы превосходила контрольных на 210,4 г, прирост живой массы утят опытной группы составил 843,1 г, контрольной – 632,7 г.
Рисунок 42 – Динамика живой массы утят контрольной и опытной групп.
При анализе однородности стада по живой массе установили, что у 1- суточных утят диапазон по живой массы достиг 32,0%. В контрольной группе в 7-, 14- и 21-суточном возрасте показатель составил 67,0%; 10,0% и 5,0%, в опытной группе – 39,0%; 5,0% и 4,5%соответственно. У утят контрольной и опытной групп выраженная разница живой массы наблюдалась в период 1-7 сутки. Тем не менее, в опытной группе показатель был меньше в этот период и все последующие.
При копрологическом исследовании у утят первых суток жизни отмечались единичные включения нейтрального жира и зерен крахмала, от 1 до 3 лейкоцитов и 1-2 эритроцита в поле зрения.
Исследования у 21-суточных утят контрольной группы показали наличие в препаратах большого количества непереваримой клетчатки, нейтрального жира и микроорганизмов (рисунки 43-45).
 |
 |
 |
| Рисунок 43 – Переваримая клетчатка и жировые включения | Рисунок44 –Непереваримая клетчатка. | Рисунок 45 –Микрофлора в поле зрения микроскопа. |
В этот же возрастной период у утят опытной группы содержание в кале микроорганизмов, клетчатки и нейтрального жира было значительно меньше (рисунок 46-48).
 |
 |
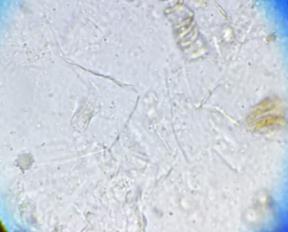 |
| Рисунок 46– Микрофлора в поле зрения микроскопа. | Рисунок 47 – Жировые включения. | Рисунок 48 – Переваримая клетчатка. |
У суточных утят контрольной и опытной групп не выявлено отличий количественного и видового состава микроорганизмов в пищеварительном канале. На 21 сутки установлено, что в контрольной группе общее микробное число превысило таковое в опытной группе почти в 2 раза, при этом концентрация бактерий группы кишечной палочки, стафилококков, стрептококков, бацилл была выше в контрольной группе в 1,3 раза, 2,2 раза, 5,0 раз и 1,7 раза соответственно (таблица 11).
Таблица 11 – Количество и видовой состав микроорганизмовв пищеварительном канале у утят контрольной и опытной групп
| Показатель | Среда | Контрольная группа | Опытная
группа |
| Общее микробное число | МПА | 100×103 | 52×103 |
| Бактерии группы кишечной палочки | Эндо | 24×103 | 18×103 |
| Staphylococcus | Солевой МПА | 56×103 | 26×103 |
| Streptococcus | Гарро | 10×103 | 2×103 |
| Clostridium | ЖСС | — | — |
| Salmonella | Плоскирева | — | — |
| Proteus | МПА | — | — |
| Грибы | Чапека | — | — |
| Bacillus | МПА | 10×103 | 6×103 |
Таким образом, выпойка 0,1% взвеси ЭнтероЗоо спустя 2 часа после вечернего кормления в течение 21 дняи последующее наблюдение показали, что увеличилась сохранность утят, живая масса, среднесуточные привесы, однородность стада.
ЭнтероЗоо способствует лучшему перевариванию корма, связывает и выводит из организма транзиторные и условно патогенные микроорганизмы и их метаболиты.
Заключение
В настоящем исследовании было установлено следующее:
1.наиболее подвержен заболеваниям, сопровождающихся расстройством функции желудочно-кишечного тракта, снижением резистентности, нарушением обмена веществ и адаптационных процессов, отставанием в росте и развитии молодняк крупного рогатого скота и птицы;
2.комплексное применение отечественных препаратов – сыворотки против пастереллеза, сальмонеллеза, эшерихиоза, парагриппа-3 и инфекционного ринотрахеита крупного рогатого скота и энтеросорбента ЭнтероЗоо телятам в раннем постнатальном периоде развития
- регулирует переваривающую и всасывающую способность кишечника, стимулирует увеличение лактобактерий, кишечной палочки с нормальной ферментативной активностью и энтерококков до 1×108 КОЕ/г; 1×108 КОЕ/г и 1×105 КОЕ/г, препятствует заселению желудочно-кишечного тракта патогенной и условно-патогенной микрофлорой;
- способствует повышению гемоглобина до 119,00-142,00 g/L, эритроцитов до 8,76-9,67×1012/L, тромбоцитов до 471,60-602,00×109/L;
- повышает иммунную защиту путем усиления адаптационного потенциала, защитных механизмов и снижения интоксикации, стимулирует выведение билирубина, продуктов распада азотистых оснований, предотвращает развитие эндотоксикоза;
- нормализует энзиматическую активность и белковый коэффициент,
- стимулирует белок-синтетическую функцию печени, энергетический и минеральный обмен;
3.применение энтеросорбента ЭнтероЗоо телятам с нарушением пищеварения способствует восстановлению моторной и секреторной функции желудочно-кишечного тракта и метаболических процессов в течение 7 суток;
4.комплексное применение отечественных препаратов – пробиотика Зоонорм и энтеросорбента ЭнтероЗоо цыплятам на раннем этапе постэмбрионального развития
- способствует формированию в кишечнике биопленки, стимулирует количественное увеличение лактобактерий, энтерококков, типичной E.coli и бактероидов, снижает количество клостридий и препятствует пролиферации Enterobactercloacae;
- способствует эффективному использованию запасов желточного мешка и питательных веществ корма;
- стимулирует гемопоэз, синтетическую функцию печени, глюконеогенез, минеральный обмен;
- не нарушает развитие и функцию органов и систем организма;
- препятствует развитию окислительного стресса, снижая концентрацию малонового диальдегида и повышая общую антиоксидантную защиту до 56,00-57,00%;
- препятствует развитию полиэтиологического стресса, стабилизирует уровень кортизола в крови на отметке 5,20-5,60 мкмоль/л;
5.обработка 0,01% взвесью ЭнтероЗоо яиц и последующая выпойка его цыплятам стимулирует процессы обмена веществ;
6.применение 0,1% взвеси ЭнтероЗоо при выращивании утят повышает сохранность до 95,7%, живую массу, среднесуточные привесы, однородность стада, снижает количество транзиторных и условно патогенных микроорганизмов и метаболитов;
7.применение взвеси ЭнтероЗоо при выращивании перепелов
- стимулирует повышение живой массы, наступление половой зрелости, раннее начало яйцекладки и массы яиц до 12,70±0,40 г;
- способствует снижению молочной кислоты на 20,90% в сыворотке крови;
- снижает общее микробное число, бактерий группы кишечной палочки, стафилококков и стрептококков в кишечном содержимом;
- при наличие в кормах Афлотоксина В1 до 47,50 мкг/кг и Т2-токсина до 169,20 мкг/кг способствует сохранности перепелов до 86,20% и выведению токсических продуктов;
8.энтеросорбент ЭнтероЗоо при моноприменении и в комплексе с сывороткой против пастереллеза, сальмонеллеза, эшерихиоза, парагриппа-3 и инфекционного ринотрахеита крупного рогатого скота и пробиотиком Зоонорм обладает способностью выводить промежуточные метаболиты, токсины, стимулировать заселение пищеварительной системы резидентной микрофлорой, нормализовать переваривающую и всасывающую способность желудочно-кишечного тракта молодняка, стимулировать обменные процессы, гемопоэз, антиоксидантную защиту, устойчивость к стрессу и неспецифическую резистентность;
9.разработан алгоритм применения энтеросорбента ЭнтероЗоо в качестве монопрепарата и в комплексе с сывороткой против пастереллеза, сальмонеллеза, эшерихиоза, парагриппа-3 и инфекционного ринотрахеита крупного рогатого скота и пробиотиком Зоонорм молодняку крупного рогатого скота и птице в раннем постэмбриональном периоде развития согласно которому выпойка взвеси ЭнтероЗоо эффективна через 2 часа после кормления животных и птицы. При комплексном применении энтеросорбента ЭнтероЗоо с другими биологически активными добавками, вводимыми перорально, рекомендуется их введение в разное время суток, доза препарата рассчитывается грамм на килограмм живой массы и подбирается индивидуально в диапазоне 0,01-0,5 г/кг;
10.предложены доступные методы оценки влияния изучаемых биологических активных препаратов на гомеостаз и метаболизм молодняка животных и птицы, где приоритетное значение имеют биохимические показатели крови, микробиологическое исследования кишечного содержимого, копрологическое исследование, а также интегральные индексы крови, рентгенологическое и ультразвуковое исследование органов и систем.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
- Арушанян А.Я. Профилактика острых кишечных заболеванийноворожденных телят бактериальной этиологии с использованием метаболитных пребиотиков: автореф. дис…. канд. вет. наук. – Краснодар, 2013. – 22 с.
- Архицкая Е.В., Якушкин И.В. Практическое значение и эффективность применения энтеросорбентов в животноводстве // Электронный научно-методический журнал Омского ГАУ[Электронный ресурс] – 2016. – Спецвыпуск №2. – URL http://e-journal.omgau.ru/index.php/spetsvypusk-2/31-spets02/400-00149(дата обращения 12.06.2020).
- Баринов Н.Д. [и др.]. Гастроэнтерология в ветеринарии: Учебное пособие /Н.Д. Баринов, И.И. Калюжный, Г.Г. Щербаков, А.В. Коробов. – М.: Аквариум-Принт, 2006. – 192 с
- Бондаренко В.М., Мацулевич Т.В. Дисбактериоз кишечника как клинико-лабораторный синдром: современное состояние проблемы. – М.: ГЭОТАР-Медиа, 2006. – 304 с.
- Герунова Л.К., Герунов В.И., Корнейчук Д.В. Профилактика микотоксикозов в животноводстве// Вестник Омского ГАУ. –2018.– №3. –С.36-43.
- Дубинич В.Н. Общая сорбционная ёмкость адсорбентов минерального и органического происхождения // Сборник научных трудов всероссийского научно-исследовательского института овцеводства и козоводства, 2016. –№9. –С.517-519.
- Ерина Т.А. Микробиоценоз кишечника и иммунный статус новорожденных телят с разным морфофункциональным развитием и их коррекция: автореф. дис. … канд. вет. наук.– Курск, 2015.–20 с.
- Клетикова Л.В., Козлов А.В., Копоть О.Ю. Физиологическое обоснование использования пробиотиков в ранний постэмбриональный период онтогенеза цыплят кросса Хайсекс коричневый для коррекции метаболизма и повышения продуктивности // Материалы VI международного ветеринарного конгресса по птицеводству (Москва, 26-29 апреля 2010). – М.: Корпорация Знак, 2010. – С.167-170.
- Клетикова Л.В. Влияние кишечной микрофлоры на содержание триглицеридов и холестерина в крови у цыплят и кур // Птицеводство. –2012. –№2. –С. 37-39.
- Карсаков Н.Т. Некоторые аспекты патологии обмена веществ у коров и меры профилактики в условиях предгорного Дагестана: автореф. дис. канд. вет. наук. – Махачкала, 2003. – 23 с.
- Ковальчикова М., Ковальчик К. Адаптация и стресс при содержании и разведении сельскохозяйственных животных / Под ред. и с предисл. Е.Н. Панова. Пер. со словац. Г.Н. Мирошниченко. – М.: Колос, 1978. – 271 с.
- Красочко И.П. [и др.]. Иммунокоррекция в клинической ветеринарной медицине / Под ред. П.А. Красочко. – Минск: Техноперспектива, 2008. – 507 с.
- Красочко П.А., Дубинич В.Н. Влияние комплексного препарата «Биотокс» на обменные процессы организма свиней // Эпизоотология. Иммунобиология. Фармакология. Санитария. –2015.– № 3. –С. 59-66.
- Курзаева А.В. [и др.]. Состояние кишечного микробиоценоза телят при острых кишечных расстройствах / А.В. Куразеева, В.А. Коноплёв, Л.А. Лаврушина, И.С. Шульга// Вестник КрасГАУ. –2015.– №12. –С. 173-176.
- Лобанова Л.В. Допплерография в диагностике и прогнозе гипоксических поражений головного мозга у доношенных новорожденных // Российский вестник перинатологии и педиатрии. –2001. – №4.– С. 21-24.
- Мигина Е. И. Применение энтеросорбентов в ветеринарии // Молодой ученый[Электронный ресурс]. –2016.– № 21 (125).– С. 291-295. – URL: https://moluch.ru/archive/125/34800/(дата обращения: 10.07.2020).
- Научное обоснование применения сорбента «Ковелос-Сорб» и энергетической кормовой добавки «Ковелос-Энергия» в рационах сельскохозяйственных животных. Монография. / Н.А. Юрина, З.В. Псхациева, Е.А. Максим, Н.Н. Есауленко, В.В. Ерохин. – Краснодар, 2014. – 167 с.
- Папуниди Э.К.[и др.]. Влияние кормовых добавок на качество жировой ткани цыплят-бройлеров/Э.К.Папуниди, С.Ю.Смоленцев, Г.С.Степанова, Л.В.Абдуллина //Вестник Марийского государственного университета. Серия: Сельскохозяйственные науки. Экономические науки.– 2019. –Том 5. –№2. –С.185-190.
- Урбан В.П., Найманов И.Л. Болезни молодняка в промышленном животноводстве. – М.: Колос, 1984. – С. 36-37.
- Феоктистова Н.В.[и др.]. Пробиотики на основе бактерий рода Bacillus в птицеводстве / Н.В.Феоктистова, А.М.Марданова, Г.Ф.Хадиева, М.Р. Шарипова //Ученые записки Казанского университета. Серия: Естественные науки.– 2017.– Том 159.– №1.– С.85-107.
- Фисинин В.И., Мифтахутдинов А.В., Аминева Э.М. Инвазивная и неинвазивная диагностика адаптационных реакций мясной птицы при применении стресс-протекторного антиоксиданта// Сельскохозяйственная биология. –2017. –Том 52.– № 6.– С. 1244-1250.
- Чиков А.Е. [и др.]. Эффективность использования пробиотиков «Биостим» и «Бацелл» при выращивании цыплят-бройлеров / А.Е. Чиков, Л.Н. Скворцова, H.A. Пышманцева. // Научные основы повышения продуктивности сельскохозяйственных животных. Сб. науч.трудов межд.науч.-практич. конф. – Краснодар, 2008. – С. 148-149.
- Шахов А.Г. [и др.]. Формирование кишечного микробиоценоза у телят с синдромом гипотрофии в молочный период / А.Г. Шахов, Л.Ю. Сашнина, Д.В. Федосов, Т.Е. Ерина, Ю.Н. Алехин // Сельскохозяйственная биология. – 2014. – № 2. – С. 105-111.
- Dylag K.[et al.]. Probiotics in the mechanism of protection against gut inflammation and therapy of gastrointestinal disorders/ K.Dylag, M.Hubalewska-Mazgai, M.Surmiak, J.Szmyd, T. Brzozowski // Curr. Pharm. Des. – 2014. – V. 20, № 7. P. 1149-1155.
- Hadden J. W., Kishimoto T. Introduction to immunopharmacology // Immunol. Today. –1993.– V. 14, № 6. P. 242
- Klijn A., Mercenier A., and Arigoni F. Lessons from the genomes of bifidobacteria. // FEMSMicrobiology Reviews. – 2005. –V. 29, №. 3. pp. 491-509.
- Patel R., DuPont H.L. New approaches for bacteriotherapy: Prebiotics, new generation probiotics, and synbiotics // Clin. Infect. Dis. – 2015. – V 60, Suppl. 2, P. S108-S121.
- Sánchez B.[et al.]. Probiocitcs, gut microbiota, and their influence on host health and disease /B.Sánchez, S.Delgado, A.Blanco-Míquez, A.Lourengo, M.Gueimonde, A.Margolles// Mol. Nutr. Food Res. – 2017. – V 61, № 1.
- Shen Q., Shang N., Li P. In vitro and in vivo antioxidant activity of Bifidobacterium animalis 01 isolated from centenarians. Curr. Microbiol. –2011. –№ 62, P.1097-1103.
- Stress protective properties of the pharmacological complex SPAO in the period of transfer, vaccination and spiking of hens / Anosov D., Ponomarenko V., Miftakhutdinov A.// Advances in Agricultural and Biological Sciences. –2015. – № 1. P. 23-29.
- Xiao M., Xu P., Zhao J. et al. Oxidative stress-related responses of Bifidobacterium longum subsp. longum BBMN68 at the proteomic level after exposure to oxygen. //Microbiology. – 2011. – V. 157, №. 6, pp. 1573-1588.
- Zain M.E. Impact of mycotoxins on humans and animals // J Saudi Chem Soc. – 2011.– Vol. 15. Issue 2. P. 129-144.
Приложения
