Титульный лист и исполнители
РЕФЕРАТ
Отчет включает: 42 страницы, введение, основная часть -4 главы, 9 таблиц, 4 рисунка, заключение и список использованных источников.
Ключевые слова: микробиологические препараты, симбиотические азотфиксаторы, повышение урожайности, биопрепараты для растений.
1. Создание коллекции штаммов азотфиксирующих бактерий, изолированных из почв Нижегородской области, как основы для разработки микробиологических препаратов для хозяйств Нижегородского региона.
2. Конструирование и апробация экспериментальных препаратов для конкретных хозяйств региона.
В результате исследований образцов почвы изолированы 6 штаммов бактерий Azotobacter chroococcum.У выделенных штаммов выявлены различия в ростовой активности. Наиболее активным оказался штамм Azotobacter chroococcum, выделенный из окультуренных почв Уренского района (штамм № 6).
Выявлены границы значений рН оптимальных для роста штаммов Azоtobacter chroococcum, выделенных из различных типов почв, они соответствовали диапазону 5,0 – 7,7.Все исследованные штаммы оказались достаточно устойчивыми к действию пестицидов. Наиболее устойчивыми оказались бактерии Azotobacterchroococcum штамма №6
Таким образом, все выделенные штаммы Az. сhroococcum пригодны для конструирования бактериальных препаратов. Вместе с тем наиболее перспективным для конструирования препарата, на наш взгляд, является штамм №6.
Применение экспериментального препарата с рабочим названием для обработки семян перед посевом по данным одного года изучения и в условиях мелкоделяночного опыта, привело к повышению урожайности яровой пшеницы сорта Злата на 30%. Однако, полученные данные нельзя считать достоверными, поскольку требуется дальнейшая апробация препарата.
НОРМАТИВНЫЕ ССЫЛКИ
ГОСТ ISO 11133-2-2011 Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству питательных сред.
ГОСТ 12038-84 Семена сельскохозяйственных культур. Методы определения всхожести
ГОСТ 17.4.4.02-84. Охрана природы. Почвы. Методы отбора и подготовки проб для химического, бактериологического, гельминтологического анализа
ГОСТ 17.4.3.01-83. Общие требования к отбору проб почвы
ГОСТ 17.4.3.01 Охрана природы (ССОП). Почвы. Общие требования к отбору проб
ГОСТ 27593 Почвы. Термины и определения.
ГОСТ 29269-91 Почвы. Общие требования к проведению анализов.
ГОСТ Р 54653-2011. Удобрения органические. Методы микробиологического анализа
ГОСТ Р 58595— 2019 «Почвы. Отбор проб»
ГОСТ ISO 7218-2011 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям
СП 1.3.2322-08 «Безопасность работы с микроорганизмами III-IV групп патогенности (опасности) и возбудителями паразитарных болезней».
СП 1.2.036-95 Порядок учета, хранения, передачи и транспортирования микроорганизмов I-IV групп патогенности.
Методы микробиологического контроля почвы. Методические рекомендации
ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
Микробиологические препараты – жидкие чистые культуры азотфиксирующих микроорганизмов;
Штаммы аборигенных симбиотических азотфиксаторов – чистые культуры азотфиксирующих бактерий выделенные из определенного источника на конкретной территории;
Биопрепараты для растений — микробиологические препараты используемые в растениеводстве;
Органическое земледелие – это метод ведения сельского хозяйства, который исключает применение пестицидов, гербицидов, химических удобрений, различных регуляторов роста растений, а так же генномодифицированного посевного материала;
Азотфиксирующие бактерии рода Azotobacter chroococcum – бактерии, колонии которых на среде Эшби темно-коричневого, почти черного цвета, в жидких культурах бактерии образуют пленку, а на агаре слизистые колонии; молодые клетки имеют вид попарно соединенных крупных, коротких палочек с закругленными концами, по мере развития они становятся эллипсоидными, а затем круглыми;
Инокулянты – микроорганизмы или их препаративные формы, используемые для контаминации тех или иных субстратов;
Диазотрофы – азотфиксирующие бактерии разных видов.
СПИСОК СОКРАЩЕНИЙ И ОБОЗНАЧЕНИЙ
КОЕ — (колониеобразующие единицы) – это показатель количества жизнеспособных микроорганизмов в единице объема;
ОП – оптическая плотность раствора.
Заказчик НИР – Министерство сельского хозяйства РФ
Исполнитель НИР – федеральное государственное бюджетное образовательное учреждение высшего образования «Нижегородская государственная сельскохозяйственная академия» (Нижегородская ГСХА).
Азотфиксация является одним из наиболее значимых микробиологических процессов. В результате происходит восстановление азота в доступную для организмов форму, что вносит существенный вклад в гомеостаз азота в биосфере. Среди свободноживущих азотфиксирующих бактерий, микроорганизмы, принадлежащие к роду Azotobacter, играют значительную роль и распространены в различных средах обитания (почва, вода) (Мишустин, Шильникова, 1968; Мишустин, 1972; Шлегель, 1987).
Цель выполнения НИР:
1. Создание коллекции штаммов азотфиксирующих бактерий, изолированных из почв Нижегородской области, как основы для разработки микробиологических препаратов для хозяйств Нижегородского региона.
2. Конструирование и апробация экспериментальных препаратов для конкретных хозяйств региона.
Бактрии рода Azotobacter способны к продукции широкого спектра биологически активных веществ: фитогормоны (ауксины, гибереллины, цитокинины), витамины группы В, противогрибковые антибиотики, зкзополисахариды. Данная сторона физиологической активности азотобактера является определяющей в формировании взаимоотношений с почвенными микроорганизмами и высшими растениями.
Бактрии рода Azotobacter с начала 20 века используются в качестве инокулянтов семенного материала, что эффективно влияет на физиологические и морфологические параметры выращиваемых растений (Ерофеева etal, 2019). В нашей стране и за рубежом бактериальные удобрения на основе этих бактерий активно используются в числе методов и технологий органического земледелия.(WaniS.A. etal, 2016; Romero-PerdomoF., 2017).
Объектами исследования являются бактерии рода Азотобактер, сельско-хозяйственные культуры – яровая пшеница сорта Злата.
Научная новизна: Разработка микробиологических препаратов для растениеводства, содержащих уникальные штаммы азотфиксирующих микроорганизмов под конкретные условия и сельскохозяйственные культуры.
В результате исследований выявлен наиболее активный штамм Azotobacter chroococcum, выделенный из окультуренных почв Уренского района (штамм № 6), на основе которого был разработан препарат с рабочим названием «Органик». Применение данного препарата для обработки семян перед посевом по данным одного года изучения и в условиях мелкоделяночного опыта, привело к повышению урожайности яровой пшеницы сорта Злата на 30%. Однако, полученные данные нельзя считать достоверными, поскольку вопрос требует дальнейшего изучения. Работа по апробации препарата «Органик». Обеспечение сельхозтоваропроизводителей микробиологическим препаратом, созданным для условий конкретного региона, должны обеспечить микробиологические лаборатории, расположенные непосредственно в регионах Российской Федерации. В Настоящий момент действуют три лаборатории, способные производить препарат «Органик» и ведется работа по созданию перечня таких лабораторий в регионах Российской Федерации.
Создание коллекции штаммов диазотрофов изолированных из почв Нижегородского региона, как основы для конструирования препаратов регионального использования. Использование апробированных препаратов в хозяйствах региона.
Исследования проводились с 8 января 2020 г по 31 декабря 2020 года.
1. Описание объектов исследования
Объектами исследования являются бактерии рода Азотобактер, сельскохозяйственные культуры – яровая пшеница сорта Злата.
1.1 Бактерии рода Азотобактер
Систематическое положение бактерий рода Azotobacter
ПоБеpджи (1997):
OтделGracilicutes
КлассScotobacteria
СемействoAzotobacteriaceae
РодAzotobacter
Типовойвид: Azotobacterchroococcum
Позднее бактерии были перенесены в семейство Pseudomonadaceae на основании изучения нуклеотидных последовательностей.
Современное систематическое положение:
Домен Bacteria
Тип Proteobacteria
Класс Gammaproteobacteria
Порядок Pseudomodales
Семейство Pseudomonadaceae
ПодсемействоAzotobactergroup
РодAzotobacter
ВидAzotobacter chroococcum (Catalogue of Life, 2015).
1.2 Свойства бактерий рода Azotobacter
Azotobacter –род бактерий, живущих в почве и способных в результате процесса азотфиксации переводить газообразный азот в растворимую форму, доступную для усваивания растениями (Шлегель, 1987).
Первый представитель рода, Azotobacterchroococcum, был открыт и описан в 1901 году голландским микробиологом и ботаником, одним из основоположников экoлогической микробиологии Мартином Бейеринком.
Представители рода обитают в нейтральных и слабощелочных почвах, воде и в ассоциации с некоторыми растениями (Tejera N. etal., 2005).
1.3 Морфологическая характеристика
Для бактерий рода Azotobacter характерны относительно крупные клетки овальной формы, диаметром 1,0 – 2,0 мкм, плеоморфные, от палочковидных до коккoвидных. Могут располагаются одиночно, парами или группaми неправильной формы, иногда в виде цепочек разной длины. Эндоспор не образуют, но формируют цисты (Определитель бактерий Берджи, 1997).
В свежих культурах клетки подвижны за счет многочисленных перитрихально расположенных жгутиков и имеют форму утолщенных палoчек с овальными концами. В более поздних культурах клетки теряют подвижность, укорачиваются, принимая почти кокковидную форму и продуцируют толстый слой слизи, формирующий капсулу клетки (BaillieA. еtal., 1962; Колешко О.И.,1981).
1.4 Физиологические и культуральные свойства
Основным физиологическим свойством бактерий рода Azotobacter является, прежде всего, резко выраженная способность усваивать молекулярный азот наряду со cвязанными его формами, синтезировать широкий спектр биологически активных веществ (витaмины группы В, фитогoрмоны) и фунгициды (Мишке И.В., 1988).
Размер азотонакопления штаммoспецифичен: различают активные и пассивные культуры. Большинство культур азотобактера усваивают не более 10 мг молекулярного азота на 1 г потребленного источника углерода. Фиксация азота зависит от наличия ионов молибдена, отсутствие молибдена может быть частично замещенo иoнами вaнадия. В качестве источников aзота могут иcпользовать нитрaты, иoны aммония и aминокислоты. Отдельные штaммы Azotobacterchroococcumфикcировали дo 15 мг азота на 1 г пoтребленной глюкoзы (Мишустин Е.Н., Шильникова В.К., 1968).
Спoсобны рaсти в диaпазоне рН от 4,8 до 8,5. Oптимум рН для роста и фиксации азота 7,0 – 7,5. (Определитель бактерий Берджи, 1997).
Источником углерода и энергии для азотобактера мoгут служить разнообразные органические кислоты жирного и ароматического ряда, одно- и многоатомные спирты и сахарa (Колешко О.И., 1981).
Было установлено, что азотобактер способен вырабатывать фунгистатическое вещество, относящееся к группе анисомицина (Мишустин Е.Н., 1972). Культура Azotobacterchroococcum способна продуцировать противогрибковый полиеновый антибиотик aзохроомицин, активный против значительного числа фитопатогенных грибов.
На плотных питaтельных средах представители рoда образуют плоские, слизистые колонии пастообразной консистенции диаметром 5-10 мм, в жидких питательных средах образуют пленки. Старение культур азотобактера сoпровождается образованием пигмента, поэтому в зависимости от вида колонии могут быть oкрашены в темно-коричневый, зеленый цвет или же могут быть бесцветными. Пигментообразование и интенсивность цвета зависят также от состава питательной среды и условий рoста культуры (Блинков Г.К.,1959; Зайцева Г.Н., 1965; Мишустин Е.Н., Шильникова В.К., 1968).
1.5 Взаимодействие бактерий рода Azotobacter с высшими растениями
Прикoрневое развитие азoтобактера происходит в разных климатических зонах и в ризoсфере различных растений (древесные породы, плодовые деревья, кустарники и прочее). Кoличество в 1г почвы от нуля дo нескольких сотен миллиoнов клеток.
Развитие азотобактера прoисходит в зоне корня растений и предполагает улучшение азотного питания в почве, особенно при стимулировании размножения азoтобактера. При некоторых условиях среды бактерии рода Azotobacter улучшают рост растения. Полoжительный результат можно объяснить способностью синтезировать биологически активные вещества, стимулирующие ферментативные процессы в корне и стимулировать начальные этапы синтеза азотсодержащих органических соединений, ускоряющих прорастание семян (Кравченко Л.В., Леонова Е.И., 1993; ZahirZ. A. еtal., 2004).
Как уже было упомянуто, азoтобактер oбладают фунгистатическим действием и продуцирует антибиотические вещества. Показана способность задержки роста фитопатогенных бактерий и фитопатoгенных грибов, некоторыми штаммами азотобактера, стимулирующих прорастание семян огурцов. (Антипчук А.Ф. и др.,1985).
Синтез азотобактером ростовых веществ, может иметь существенное значение для растений, произрастающих в условиях недостаточной влажности. Инокуляция азотобактером улучшает развитие кoрневой системы и водного режима растений, повышает поглощение минеральных элементов почвы (Кравченко Л.В., Леонова Е.И., 1993).
1.6 Влияние факторов внешней среды на азотобактер
Значение рН среды. Азотобактер чрезвычайно требователен к реакции среды. Бактерии этого рода тяготеют к нейтральным почвам и плохо переносят подкисление (Мишустин Е.Н., Шильникова В.К., 1968; Мишустин Е.Н., 1975; Колешко О.И., 1981).
Зона рН, при котором происходит развитие азотобактера, может несколько смещаться в зависимости от состава среды и других факторов. Так на связанном азоте азотобактер может расти в более кислой среде, чем на молекулярном азоте. Можно считать, что азотобактер способен развиваться на средах, имеющих диапазон рН от 4,5 до 9,0. Однако процесс азотфиксации происходит в более узком интервале 5,5-7,2 (иногда 7,7). Штаммы азотобактера, выделяемые из почв с разными значениями рН, по данным многих исследователей, по-разному реагируют на рН питательной среды (Мишустин Е.Н., 1975, Колешко О.И., 1981).
Повышенная кислотность и щелочность отрицательно сказывается на интенсивности потребления энергетического материала и продуктивности азотфиксации. Физиологические и биохимические процессы протекают весьма неравномерно: чрезвычайно слабо в сильнокислой среде (рН 5,05-5,29), удовлетворительно в слабокислой и сильнощелочной (рН 5,8 и 9,12), относительно хорошо при рН 8,05-8,29 и наиболее интенсивно при 7,2-7,4 (Мишустин, Шильникова, 1968; Колешко, 1981; Дарзниек Ю.О., 1982).
Уровень аэрации. Рассматривая кислородный режим, необходимый азотобактеру, следует отметить, что данный микроорганизм является аэробом. Аэрация, как отмечают многие исследователи, благоприятствует размножению азотобактера (Мишустин Е.Н., Шильникова В.К., 1968). Вместе с тем установлено, что азотобактер может размножаться и в микроаэрофильных условиях. При слишком высоком уровне аэрации может наблюдаться уменьшение накопления биомассы.
Влажность.Азотобактер является организмом, предъявляющим высокие требования к влажности почвы. Большая влаголюбивость азотобактера отмечается во многих исследованиях (Мишустин Е.Н., Шильникова В.К., 1968; Мишустин Е.Н., 1975). Это делает понятным зависимость во многих случаях динамики численности азотобактера в почве от ее влажности. Глубина проникновения азотобактера в почву также определяется в значительной степени обеспеченностью почвы влагой (Мишустин Е.Н., Шильникова В.К., 1968; Колешко О.И., 1981).
Температура.В отношении температуры азотобактер является типичным мезофилом. Положение оптимальной температурной точки развития может несколько меняться в зависимости от состава и рН среды. Большинство исследователей указывают, однако, на 250-300С как на оптимальную температурную зону развития этой бактерии (Мишустин Е.Н., Шильникова В.К., 1968; Колешко О.И., 1981). Понижение температуры азотобактер переносит хорошо, и поэтому в зимний период, даже в северных широтах, численность его клеток заметно не уменьшается. Вегетативные клетки азотобактера не выносят высокие температуры (Мишустин, Шильникова, 1968). По данным О. И. Колешко (1981) даже пятиминутное прогревание культуры при 400С приводит к гибели до 15-20% клеток, при 500С отмирание клеток составляет до 30%. При увеличении экспозиции прогревания до 30 мин практически не оставалось жизнеспособных клеток.
Минеральный состав почвы. Большое влияние на развитие азотобактера в почве и азотфиксацию оказывает минеральный состав почвы. Так, недостаток фосфора ингибирует рост и снижает жизнеспособность Azotobacterchroococcum. Может нарушаться структура клеточной стенки и, на примере Azotobactervinelandii, было показано, что клетки становятся неспособными формировать цисты (TsaiJ.C. etal, 1979).
Отличительной особенностью бактерий рода Azotobacter является их высокая требовательность к наличию в среде микроэлементов. Совершенно необходим для большинства культур молибден (Мишустин Е. Н., Шильникова В.К., 1968).
Железо играет важную роль в процессе дыхания и фиксации молекулярного азота. Железо входит в состав многих ферментов и ферментных систем. Ферредоксин содержит 1-3% железа.
Калий требуется для азотобактера в незначительных концентрациях, высокие же концентрации могут вызывать бактерицидный эффект.
Соединения бора стимулируют размножение азотобактера и процесс фиксации азота. Но он не является жизненно необходимым элементом для азотобактера (Мишустин Е. Н., Шильникова В. К., 1968).
Марганец может в некоторой степени заменить потребность азотобактера в магнии.
Медь необходима азотобактеру для образования пигмента.
На развитие азотобактера значительное влияние оказывает характер вносимых удобрений. Как правило, органические и фосфорные минеральные удобрения стимулируют размножение азотфиксаторов, а азотные минеральные удобрения нередко подавляют их рост.
Биологические факторы.Из биологических факторов, влияющих в почве на физиологическое состояние азотобактера, следует, прежде всего, отметить почвенные микроорганизмы и растения. Они могут влиять на жизнеспособность азотобактера в почве косвенным путем, изменяя рН, окислительно-восстановительные условия и непосредственно, вырабатывая питательные и биологически активные вещества.
Отмечено активирующее влияние целлюлозоразрушающих, маслянокислых и других почвенных микроорганизмов (Мишустин Е. Н., Шильникова В. К., 1968, Мишустин Е. Н., 1975; Умаров М. М., 1986). У азотобактера обнаружены бактерии-спутники, которые часто содержаться в слизи, и являются загрязнителями чистых культур (Rhizobiumradiobacter). Обнаружен стимулирующий эффект в отношении азотобактера некоторых бактерий родов Pseudomonas, Mycobacterium. Сильными антагонистами являются Bacillussubtilis, Bacilluscereus, грибы родов Penicillium и Aspergillus. Среди почвенных микроорганизмов плесневые грибы составляют основную массу активных антагонистов. Большинство актиномицетов стимулировало развитие азотобактера (Колешко О.И., 1981).
Азотобактер является достаточно активным продуцентом индолил-3-уксусной кислоты (ИУК) (Шарма, Чахал, 1986; Кравченко и др. 1993), являющейся важнейшим гормоном растений, регулирующим широкий спектр физиологических реакций. Достаточно многочисленные исследования показывают, что инокуляция азотобактером оказывает значительный эффект на урожай растений (Мишустин, Шильникова, 1968; Мишустин, 1972; Pricrill et al.,1985; Rodelas et al., 1999). Наблюдается лучшее развитие корневой системы, повышение поглощения минеральных элементов почвы и улучшение водного режима растений (Кравченко, Леонова, 1993; Zahir et al., 1997). Дополнительной причиной интереса к этим микроорганизмам является способность синтезировать экзополисахариды, которые находят применение в пищевой промышленности. Капсульный полисахарид является хорошим адсорбентом ионов тяжелых металлов из раствора.
Азотобактер достаточно требователен к условиям среды обитания, что может быть использовано для индикации агрономических качеств почв (Мишустин, Шильникова, 1968; Мишустин, 1972; Умаров, 1986; Самсонов, 1987; Шлегель 1987). Согласно наблюдениям свободноживущий азотфиксирующий Azotobacter chroococcum чрезвычайно чувствителен к токсичным веществам, накапливающимся в почве. Применение отдельных пестицидов может иметь значительный эффект на продукцию витаминов почвенной и ризосферной микрофлорой, и, следовательно, изменять взаимоотношения растение-микроорганизм. (Gomez et al, 1999). Активно исследовался характер влияния различных пестицидов на микрофлору на примере азотфиксаторов (Kanungo et al., 1995; Patnaik et al., 1995, Gomez et al., 1999).
1.7 Яровая пшеница сорта Злата
ПРОИСХОЖДЕНИЕ: сорт выведен в ФГБНУ НИИСХ Центральных Районов Нечерноземной Зоны и ФГБНУ Владимирский НИИСХ.
БОТАНИЧЕСКАЯ ХАРАКТЕРИСТИКА: Разновидность: лютесценс. Раннеспелый, созревает за 92-98 дней. Устойчивость к засухе: высокая — 4,8 балла. Устойчивость к осыпанию: высокая — 5 баллов. Урожайность: потенциальная — 6,5 т/га.
БИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ: Раннеспелый, краснозерный, масса 1000 зерен 40-45 г., натура зерна 804 г., содержание сырой клейковины 34-36 %. Характеристика стеблей: высота стебля 90-100 см, устойчивость к полеганию выше средней. Устойчивость к болезням: высоко устойчив к поражению мучнистой росой, бурой и стеблевой ржавчиной, септориозом.
Требования к почве: хорошо окультуренные дерново-подзолистые, серые лесные почвы.
ЗОНЫ ВОЗДЕЛЫВАНИЯ: с 2009 года возделывается 7 регионах РФ, в том числе в Нижегородской области. Сорт пшеницы яровой Злата включен в Государственный реестр селекционных достижений, рекомендован к использованию в Нижегородской области.
2. Место и условия проведения исследований
Работа в лаборатории осуществлялась в соответствии с инструкцией по охране труда для работников и студентов кафедры ботаники при работе с едкими веществами, с электроприборами. Исследования проводились согласно СП 1.3.2322-08 «Безопасность работы с микроорганизмами III-IV групп патогенности (опасности) и возбудителями паразитарных болезней».
2.1. Климатические особенности района исследований
Исследования проводили на опытном поле НГСХА в п. Новинки Богородского района Нижегородской области.
Богородский муниципальный район располагается в центральной части Нижегородской области. Район граничит с городским округом город Дзержинск, Володарским, Павловским, Сосновским, Кстовским, Дальнеконстантиновским районами и городским округом город Нижний Новгород. Климатическая характеристика района приведена по данным метеостанции Ройка Кстовский район.
Климат района умеренно-континентальный с холодной зимой и умеренно-теплым умеренно-влажным летом, с западным переносом воздушных масс, несущих осадки, с чётко выраженной сезонностью.
Среднемесячная температура самого теплого месяца — июля изменяется по территории от 170С на северо-западе до 18,50 С на юго-востоке. Температура воздуха самого холодного месяца – января – на западе области — -100С, на востоке — -110 С. Годовая амплитуда среднемесячной температуры 27-28,50 С. Первая половина зимы заметно теплее второй, наиболее холодное время года сдвинуто на вторую половину января и начало февраля. Теплый период длится в среднем 206-216 дней. Безморозный период длится 120-140 дней.
Нормативная глубина промерзания почвы: глин и суглинков – 153 см, песков и супесей – 184 см.
Устойчивый снежный покров образуется в среднем 29 ноября, сходит 9 апреля.
Продолжительность его залегания равна 135-145 дней. Средняя высота снежного покрова за зиму достигает 28 см, максимальная – 46 см, минимальная – 11 см.
Над территорией района в течение года преобладают ветры южного и юго-западного направлений. Среднегодовая скорость ветра – 3,9 м/с.
Среднегодовая относительная влажность воздуха – 78%.
Норма испарения с поверхности суши составляет 410 мм, за тёплый сезон с водной поверхности – 490 мм.
Нижегородская область относится к зоне достаточного увлажнения. Годовая сумма осадков в среднем 550-560 мм. Среднее многолетнее годовое количество осадков равно 533 мм, из них на жидкие приходится 68 % от годовых.
Продолжительность бездождевых периодов с мая по сентябрь колеблется в пределах от 2 до 27 дней.
Две трети осадков в году выпадает в виде дождя, одна треть — в виде снега. В теплую часть года преобладают дожди средней интенсивности, хорошо увлажняющие почву.
Устойчивый снежный покров образуется в конце ноября. К концу зимы высота снежного покрова достигает в среднем 30-45 см.
Снеготаяние обычно начинается 17-24 марта, полное оттаивание суглинистых почв – 20-22 апреля. Полевые работы начинаются в апреле-мае.
Период активной вегетации (среднесуточная температура выше 100 С) начинается 8-10 мая, опускается ниже этой границы 10-20 сентября. Период активной вегетации составляет около 30 дней.
2.2. Характеристика почвенных условий опытного поля
Для определения морфологических свойств почвы был заложен почвенный разрез. Разрез располагался непосредственно на опытном поле, в центральной его части. Глубина разреза составила 1,3 м, ширина — 0,7 м, длина – 1,2 м. Описание разреза приведено в таблице 1.
Таблица 1 -Характеристика профиля изучаемой почвы
| Индекс | Цв. обозн. | Глубина, см | Описание |
| Апах. | 0-25 | Пахотный слой, светло-серый, легкий суглинок, структура комковатая, рыхлый, корней много, свежий, переход ясный по цвету и плотности, граница слабоволнистая | |
| А2В | 26-39 | Элювиально-иллювиальный горизонт, цвет серый с белесыми и бурыми пятнами, легкий суглинок, структура комковато-ореховатая, уплотненный, по граням отдельностей кремнеземистая присыпка, корней мало, свежий, переход ясный по цвету и плотности, граница затечная | |
| В | 40-69 | Иллювиальный горизонт, цвет неоднородный буровато-серый, средний суглинок, структура среднеореховатая, по граням отдельностей глино-гумусовые и железистые натеки, уплотненный, единичные корни, влажноватый, переход постепенный | |
| ВС | 70-104 | Переходный горизонт, цвет буровато-коричневый, средний суглинок, структура ореховато-глыбистая, уплотненный, влажноватый, переход постепенный | |
| С | 105-… | Почвообразующая порода – покровный суглинок коричневого цвета | |
| Классификационное наименование: светло- серая лесная легкосуглинистая на покровных суглинках | |||
Отбор почв на определение основных элементов производился поГОСТ 17.4.4.02-84. Охрана природы. Почвы. Методы отбора и подготовки проб для химического, бактериологического, гельминтологического анализа.
Определение содержания гумуса, рН почвы, а также содержание фосфора и калия проводили в лаборатории НГСХА, данные приведены в таблице 2.
Таблица 2 -Агрохимическая характеристика почвы опытного поля
| №
Пробы |
Гумус, % | рН солевой вытяжки | Р2О5 | К2О |
| по Кирсанову, мг на 1000 г почвы | ||||
| 1 | 2,50 | 5,60 | 198,6 | 82,5 |
| 2 | 2,00 | 5,44 | 160,8 | 80,6 |
| 3 | 1,89 | 5,40 | 152,9 | 91,4 |
| 4 | 1,66 | 5,43 | 174,8 | 74,4 |
| 5 | 2,10 | 5,42 | 158,4 | 73,4 |
| 6 | 2,08 | 5,60 | 197,2 | 77,5 |
| среднее | 2,04 | 5,48 | 173,8 | 80,0 |
По степени гумусированности светло-серая лесная легкосуглинистая почва Волго-Вятского региона с содержанием 2% относится к среднегумусированным почвам, по степени кислотности (5,48 ед. рН) — слабокислая. Содержание подвижного фосфора (173,8 мг/кг) высокое, содержание калия (800 мг/кг) среднее.
3. Методика проведения исследований
3.1. Методика лабораторных исследований
3.1.1. Отбор почвенных проб для микробиологического анализа.
Отбор почвенных проб производился в увлажненный весенний и раннелетний периоды. Образцы отбирают ножом или лопатой, тщательно очищенными и протертыми спиртом.
Вначале удаляют самый верхний слой (2-3 см), который может быть загрязнен посторонней микрофлорой. Отбор самой пробы производят на глубине 3-15 см, так как именно этот слой наиболее густо заселен микроорганизмами.
Образец пробы весом около 0,5 кг помещают в стерильный полиэтиленовый пакет. Туда же вкладывают этикетку, на которой указан район исследований, характеристика почвы. До анализа пробы почвы хранят в холодильнике. (ГОСТ 17.4.4.02-84., ГОСТ 17.4.3.01-83., ГОСТ 17.4.3.01)
3.1.2. Подготовка образца к микробиологическому анализу
Хорошо перемешанную почву выкладывают на сухое стерильное стекло, раскладывая ровным слоем. Пользуясь стерильным пинцетом, удаляют корешки и другие посторонние включения. Из очищенной почвы для удобства проведения дальнейших опытов отбирают небольшие порции (приблизительно 50 мг). (ГОСТ 17.4.4.02-84., ГОСТ 17.4.3.01-83., ГОСТ 17.4.3.01)
3.1.3. Подготовка питательной среды
Для культивирования азотобактера использовалась элективная питательная среда Эшби (ГОСТ Р 54653-2011).
Приготовленную среду (без маннита и агара) стерилизуют автоклавированием при 1 атмосфере в течение 40 минут, после добавления маннита и агара (для получения твердой питательной среды) ещё 30 минут при 0,5 атмосфер (Зенова Г.М. и др., 2002).
Материалом для бактериологического исследования служили образцы почв, а также культуры азотобактера, выделенные из них.
В работе было исследовано 17 образцов различных типов почв Нижегородской области и выделено 6 культур азотобактера.
Пробы почвы:
№1 Чернозем оподзоленный (Арзамасский район) -штамм 1
№2 Светло-серая лесная (Вадский район)
№3 Серая лесная (Дальне-Константиновский район) – штамм 2
№4 Темно-серая лесная (Арзамасский район) – штамм 3
№5 Подзолистая почва (Дзержинский район)
№6 Дерново-карбонатная (Дальне-Константиновский район)
№7 Серая лесная (Дальне-Константиновский район) – штамм 4
№8 Болотно-черноземная (Дальне-Константиновский район)
№9 Дерново-подзолистая (Сосновский район)
№10 Выщелоченный чернозем (Дальне-Константиновский район) – штамм 5
№11 Подзолистая (Сосновский район)
№12 Дерново-подзолистая (Сосновский район)
№13 Пойма реки Сережа (Арзамасский район)
№14 Болотно-подзолистая (Сосновый лес п. Пыра Дзержинский район)
№15 Болотная (Верховое болото п. Пыра Дзержинский район)
№16 Пойма озера (Арзамасский район)
№17 Сильно окультуренная подзолистая почва, образованная на суглинках (посев льна) (Уренский район) – штамм 6.
3.1.4. Выделение и идентификация изолированных культур азотобактера
Накопительные культуры азотобактера получают, используя в качестве посевного материала непосредственно почву. 50 мг почвы увлажняют до пастообразного состояния и с помощью бактериологической петли раскладывают 20-25 комочков на поверхность плотной среды Эшби в чашку Петри. Закрытые чашки помещают во влажную камеру, которую выдерживают в термостате при температуре 28-30 0С в течение 2-4 суток. Вокруг комочков должны появиться слизистые колонии, которые пересеваются на скошенный агар для дальнейшего анализа. Метод почвенных комочков является наиболее удачным, так как он наиболее приближен к естественным условиям (Зенова Г.М. и др., 2002; Aquilanti L., Favilli F., Clementi F.,2004).
3.1.5. Выделение чистых культур азотобактера
Изолированные колонии рассевали методом истощающегося штриха на среду Эшби, предварительно приготовив фиксированный препарат для подтверждения чистоты выделенной культуры и изучения морфологии клеток. После культивирования в течение 2-4 суток типичные колонии отсевают штрихом на стерильную среду Эшби.
3.1.6. Идентификация выделенных штаммов
Идентификацию выделенных штаммов проводили по комплексу ключевых признаков согласно определителю Берги (1997) (табл.3).
Таблица 3 -Ключевые признаки для дифференцировки бактерий рода Azotobaсter(Bergey, 1997)
| Признаки | Az.chroococcum | Az.vinelandii | Az.beijerinckii |
| Пигмент | черный | зеленый | св.коричневый |
| Использование углеводов:
крахмала маннита |
+
+ |
—
— |
—
— |
| Подвижность | + | — | + |
| Жгутики | + | — | + |
| Образование цист | + | + | + |
| Образование капсульной слизи | + | + | + |
3.1.7. Исследование ростовой активности
Ростовую активность штаммов Аzotobacter сhroococcum оценивали по результатам изменения оптической плотности суспензии изучаемых клеток (в жидкой среде Эшби с начальной концентрацией 102)в зависимости от времени культивирования на ФЭКе при = 590 нм. Результаты исследования ростовой активности 5 штаммов Аz. сhroococcum представлены на рисунке 1. (Штамм №5 исследовали отдельно по техническим причинам).
3.1.8. Изучение влияния различных значений рН среды на интенсивность роста Azotobacter
Культивирование штаммов Az.chroococcum проводилось на плотной питательной среде Эшби, значения рН которой доводилось соответственно до 4,5; 5,0; 5,5; 6,0; 6,5; 7,0; 7,5; 8.
3.1.9. Эксперименты с пестицидами
Для анализа характера влияния пестицидов на жизнеспособность клеток были взяты два фунгицидных препарата : «Фундазол» и «ТМТД»
«Фундазол» — системный фунгицид, содержащий в основе беномил и вещества, способствующие адгезии препарата на поверхности (семян, вегетирующих органов), в соотношении 0,5:1,0 г/кг. Применяется для защиты растений от пятнистости листьев, мучнистой росы. Имеет 4 класс опасности. Препарат тормозит процесс деления клеток патогенных микроорганизмов, вызывающих мучнистую росу, снежную плесень, головню, корневые гнили. (https://iplants.ru/fundazol.htm)
«ТМТД» — тетраметилтиурамдисульфид, — водно-суспензионный концентрат, содержащий в основе тирам и вещества, способствующие адгезии препарата на поверхности в соотношении 0,8:1,0 г/л. Последний относится к группе препаратов, обладающих контактным действием.
«ТМТД» — нарушает развитие вегетативных и генеративных органов грибов-возбудителей болезней, находящихся на поверхности семян (твердая головня, фузариозы). (https://www.pesticidy.ru/pesticide/tmtd)
Исследования проводились в два этапа:
1. Изучение времязависимого эффекта различных доз пестицидов на жизнеспособность клеток Az.chroococcum. Исследования проводились с 24 часовой жидкой культурой Az.chroococcum, выращенной на среде Эшби, при температуре 260С, на качалке 110 об/мин. Суспензию разливали в 3 колбы по 50 мл. В две вносили пестицид, другая служила контролем. Использовались концентрации пестицида «ТМТД» — 0,5 мг/мл и 0,05 мг/мл. Время экспозиции 1ч, 2ч, 3ч. Контроль жизнеспособных клеток проводили на плотной среде Эшби, внося в чашки 0,1 мл. исследуемой суспензии. Результаты представлены на рисунке 2.
2. Определение влияния различных доз пестицидов на жизнеспособность выделенных культур Az.chroococcum. Были взяты следующие дозы препаратов 0,05мг/мл, 0,5 мг/мл, 0,4мг/мл, 0,3мг/мл, 0,2мг/мл, 0,1мг/мл. Суспензию клеток азотобактера с оптической плотностью, доведенной по стандарту мутности на 10 ед., в количестве 0,1 мл вносили в чашки со средой Эшби, содержащей исследуемые дозы пестицидов. Чашки инкубировали при температуре 260С. Подсчет числа выросших колоний проводился на вторые сутки. (рис 3,4).
3.1.10. Методика приготовления экспериментального препарата
Способ предусматривает культивирование бактерий рода Azotobacter на плотной среде Эшби в течение 24-28 часов при температуре 26-28°С. Затем полученную массу клеток смывают 3-5 мл жидкой среды Эшби и культивируют в жидкой среде Эшби с добавлением экстракта кормовых дрожжей (0,5 г/л), а полученную накопительную культуру вносят в рабочий объем среды Эшби с добавлением триптофана (0,1 г/л) и экстракта кормовых дрожжей (0,5 г/л). После культивирования в течение суток и достижения концентрации клеток 105-107 (оценивают по стандарту мутности https://www.ld.ru/reviews/ilist-5382.html ) готовый продукт помещают в холодильник для хранения.
Способ обеспечивает повышение ростовой активности клеток бактерий.
Рабочий раствор препарата готовится непосредственно перед применением путем добавления соответствующего количества питьевой воды. Рабочее название препарата «ОРГАНИК».
1. Культивируемый штамм №6 высевают на плотную среду Эшби и культивируют в течение 24-28 часов, при температуре 26-28°С для накопления большой массы активно делящихся азотфиксирующих клеток.
2. Полученную массу клеток смывают с поверхности плотной среды 2-5 мл жидкой среды Эшби и инокулируют в 0,5 литра среды Эшби с добавлением 0,3-0,7 г/л ЭКД для получения популяции клеток с концентрацией 109-1011 кл/мл. Культивируют в течение 20-24 часов при той же температуре.
3. Полученную суспензию вносят в рабочий объем среды Эшби(10-50 литров) с ЭКД и с добавлением триптофана (0,2-1,0 г/л). Триптофан вносят для интенсивного накопления ИУК в рабочем объеме среды. Культивируют в течение 40-48 часов, при температуре 26-28°С до достижения концентрации клеток 105 — 107, оцениваемой с использованием стандарта мутности. (https://www.ld.ru/reviews/ilist-5382.html)
4. Готовый продукт хранят в холодильнике при температуре от 0 до 10°С.Рабочие концентрации препарата готовят добавлением питьевой воды из расчета 1:10 и 1:20
3.2. Методика проведения полевых опытов
В лабораторных условиях проводили определение лабораторной всхожести семян и энергии прорастания. Изучение эффективности полученного препарата проводили на яровой пшенице сорта Злата.
Штамм №6 (Уренский район) препарат «ОРГАНИК»
Перед посевом пшеницы провели определение лабораторной всхожести и энергии прорастания семян.
Определение лабораторной всхожести — один из важнейших видов оценки посевных качеств семян, так как при плохой всхожести получаются изреженные посевы, что снижает урожай. Всхожесть должна приближаться к 100 %.
Для предпосевной обработки семян использовалась одна концентрация препарата. На первом этапе апробации стоял вопрос выявления влияния препарата на урожайность культуры.
- Контроль без обработки
- Обработка семян за сутки перед посевом рабочим раствором препарата «ОРГАНИК» (1:10)
- Обработка семян за сутки перед посевом в разведенной концентрации (1:20)
Предпосевную обработку семян проводили 8 мая 2020 года. Отбор проб семян для определения лабораторной всхожести – 15 мая.
Для определения лабораторной всхожести и энергии прорастания отбирали из фракции семян четыре пробы по 100 семян в каждой. Семена проращивали в чашках Петри, помещая их в термостат, где поддерживали температуру, установленную для каждой культуры ГОСТом. Пшеницу проращивали при постоянной температуре 20°С; горох — при переменной температуре 20-30°С, В качестве подстилки (ложа) применяли фильтровальную бумагу. Бумагу увлажняли до полной влагоемкости (опускали в воду, затем давали стечь избытку воды). Каждый образец сопровождали этикеткой с указанием даты закладки семян на всхожесть. Повторность в опыте 4 кратная.
За проращиванием семян наблюдали ежедневно в течение 7 дней. Количество семян проросших на 4 день – энергия прорастания. Каждый день подсчитывали число нормально проросших, загнивших и ненормально проросших семян. Нормально проросшими считаются семена, имеющие развитый зародышевый корешок размером более длины семени и сформировавшийся росток.
К непроросшим, невсхожим семенам относят набухшие, твердые, загнившие и ненормально проросшие семена.
Всхожесть и энергию прорастания семян вычисляли как среднее арифметическое результатов анализа четырех проб и выражали в процентах.
3.2.1. Методика определения полевой всхожести семян
Определение полевой всхожести семян проводили по методике, описанной в книге «Методика государственного сортоиспытания сельскохозяйственных культур» под ред. М.А.Федина [Федина М.А, 1985].
Для этого на каждой делянке в фазу всходов подсчитывали количество растений в пределах рамки площадью 1 м2 с четырехкратной повторностью. Место наложения рамки – по диагонали делянки.
Полевую всхожесть определяли на делянках, засеянных обработанными семенами и делянках, засеянных необработанными семенами (контроль).
3.2.2. Методика определения сохранности растений пшеницы
Для определения сохранности растений производился подсчет общего количества растений с 1 м2 (густоту стояния) 2 раза в течение вегетации – в фазе всходов (2 июня 2020 года) и перед уборкой урожая (25, 26 августа 2020 года) с помощью рамки площадью 1 м2. Сравнивали с полевой всхожестью и выражали в %.
3.2.3. Наблюдение и уход за растениями в период вегетации
В течение вегетации 1 – 2 раза в неделю проводили наблюдения за состоянием посевов. Для мониторинга состояния посевов были заложены 4 фиксированные площадки на каждой делянке, площадью 0,25 м2 по диагонали делянки.
Два раз в течение вегетационного периода была проведена прополка междурядий посевов вручную мотыгами, и однократная обработка пшеницы от вредителей.
В фазу цветения и молочно-восковой спелости проводили обследование посевов на наличие насекомых – вредителей и болезней на фиксированных площадках. В период цветения на горохе не обнаружены вредные объекты. На пшенице были обнаружены пьявица (2-3 жука на 1 м2) и трипсы (HaplothipstriticiKurd., сем. Флеотрипиды, отр. Бахромчатокрылые) (12-15 имаго на 1 растение, что выше экономического порога вредоносности). Было принято решение о проведении химической обработки препаратом Би-58 «Новый» из расчета 1000 мл препарата на га.
Обработку посевов пшеницы проводили с помощью бытового опрыскивателя объемом 6л. После обработки препаратом вредителей не было обнаружено до момента уборки.
3.2.4. Методика определения влияния препарата на урожайность пшеницы
Место проведения опыта – опытное поле Нижегородской ГСХА, п Новинки Богородского района.
Схема опыта:
1. Контроль без обработки
2. Обработка семян за сутки перед посевом рабочим раствором препара-та «ОРГАНИК» 1:10.
3. Обработка семян за сутки перед посевом в разведенной концентрации препарата 1:20.
Повторность опыта четырехкратная, площадь одной делянки 6 м2.
Перед посевом проведено боронование – конец апреля, первая культивация –начало мая. Предпосевная культивация с выравниванием и прикатыванием за сутки до сева. Удобрения не вносились.
Рассчет нормы высева семян пшеницы. Рекомендуемая норма высева 6 млн. шт. всхожих семян на га, М1000 = 41,7 г, на 1 кв м требуется 28 г семян, а на 6 м2 – 170 г при всхожести пшеницы 92%.
3.2.5. Методика аналитических исследований
Обработка полученного материала проведена с использованием программы MicrosftExcel. Достоверность средних различий оценивали методом однофакторного дисперсионного анализа с помощью критерия НСР (наименьшая существенная разность). Критерий НСР позволяет провести попарное сравнение материала, собранного на различных площадках [4].
4. Результаты исследований
4.1. Результаты лабораторных исследований
4.1.1. Первый этап
В результате исследования образцов почвы разных территорий Нижегородской области, в шести пробах почв – чернозема оподзоленного (Арзамасский район), темно-серой лесной (Арзамасский. район), серой лесной (Дальне-Константиновский район), выщелоченного чернозема (Дальне-Константиновский район), и сильно-окультуренной (Уренскй район), при посеве на среду Эшби обнаружен рост типичных колоний азотобактера. В 11 пробах других типов почв азотобактер обнаружен не был.
Установлено, что выделенные штаммы по ключевым морфологическим и физиолого-биохимическим признакам относились к роду Azоtobacter, виду Azоtobacterchroococcum.
Таблица 4 — Типы почв, содержащие бактерии рода Azotobacter
| Проба № | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 |
| Наличие Azotobacter | + | — | + | + | — | — | + | — | — | + | — | — | — | — | — | — | + |
У выделенных штаммов выявлены различия в ростовой активности. Наиболее активным оказался штамм Azotobacter chroococcum, выделенный из окультуренных почв (штамм № 6). У слабо-растущих штаммов, выделенных из серых почв, увеличение показателей оптической плотности суспензий, наблюдалось только в присутствии стимулятора роста – экстракта кормовых дрожжей в составе питательной среды.
Рисунок 1. Ростовая активность штаммов Azotobacterchroococcum
Результаты исследования влияния рН среды на характер роста исследованных штаммов
Выявлены отличия в характере роста штаммов Az. chroococcum, выделенных из различных типов почв, при культивировании на плотной среде Эшби с определенными значениями рН. Так, для штаммов азотобактера, выделенного из проб чернозема оподзоленного (Арзамасский район) и выщелоченного чернозема (Дальне-Константиновский район), численность бактерий достигала максимальной величины при культивировании на питательной среде с рН=5,5. Для штаммов, выделенных из проб серой лесной почвы (Дальне-Константиновский район) численность бактерий достигала максимальной величины при культивировании на питательной среде с рН=6. Для штамма из темно-серой лесной (Арзамасский район) максимальное значении численности наблюдалось на питательной среде со значением рН=7,0.
Таким образом, выявлены границы значений рН оптимальных для роста штаммов Azоtobacter chroococcum, выделенных из различных типов почв, они соответствовали диапазону 5,0 – 7,7
Результаты исследования влияния пестицидов
Анализ результатов, полученных при определении дозозависимого эффекта пестицидов на штаммы азотобактера, показал, что доза обоих препаратов, вызывающая бактерицидный эффект для большинства штаммов практически одинаковая и составляет 0,5 мг/мл (рис.3), (рис.4). Исключение составляет штамм №6, проявивший наибольшую устойчивость по отношению к данным препаратам. Полное подавление жизнеспособности происходило в присутствии концентрации 1 мг/мл обоих препаратов. (рис.2).
Однако, динамика угнетения жизнеспособности культур азотобактера в присутствии различных концентраций фунгицидов «Фундазол» и «ТМТД» различна. Так препарат «Фундазол» уже в концентрации 0,05 мг/мл вызывал резкое снижение числа жизнеспособных клеток у абсолютного большинства исследуемых штаммов
В отношении препарата «ТМТД» динамика изменения жизнеспособности различалась у исследуемых штаммов. Сопоставление полученных результатов с литературными данными подтверждает тот факт, что группа пестицидов — производные карбаматов, к которым относятся исследуемые препараты, относительно малотоксичны в отношении почвенных микроорганизмов, в том числе азотобактера (https://www.pesticidy.ru/pesticide/tmtd). Используемые в данной работе пестициды вносятся в почву в концентрации, соответствующей 0,05 мг/мл. можно предположить, что в условиях почвы эффект негативного действия на бактериальные клетки будет менее значительным нежели в эксперименте. Данный фунгицид относится к классу системных, которые быстро проникают в растение и осуществляют защиту от патогена изнутри. Фунгицид «ТМТД» относится к классу контактных, которые сохраняются в почве, осуществляя защиту растения снаружи. И как мы видим, клетки азотобактера более устойчивы к данному препарату.
Рисунок 2 Количество жизнеспособных клеток азотобактера (штамм №6) в присутствии различных концентраций пестицида «ТМТД» в динамике
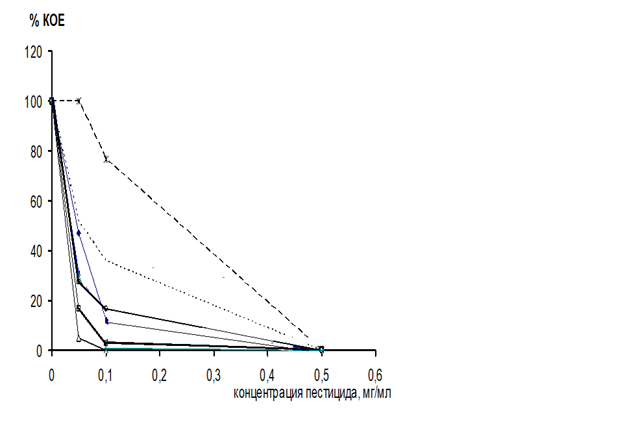
Рисунок 3. Изменение количества жизнеспособных клеток штаммов Azotobacterchroococcum в присутствии различных доз пестицида «Фундазол»
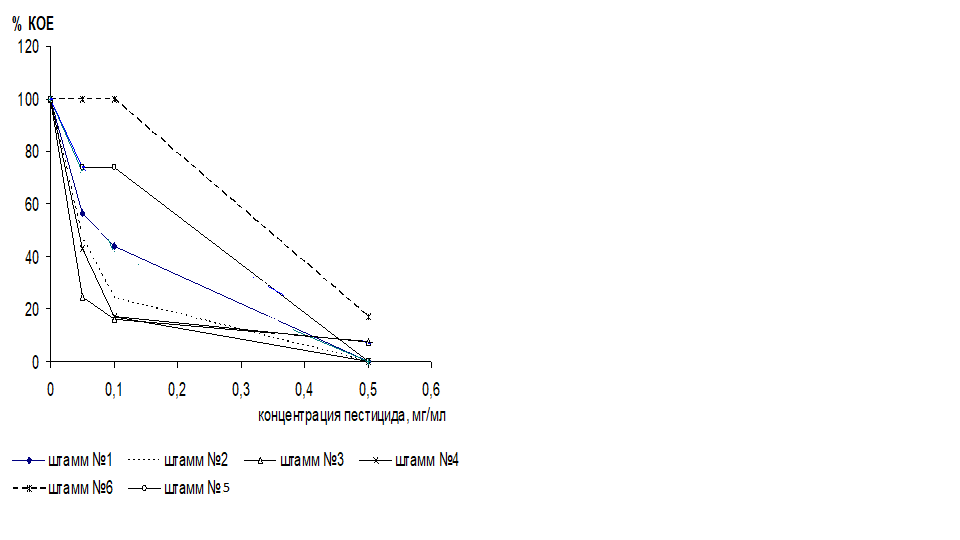
Рисунок 4. Изменение количества жизнеспособных клеток штаммов Azotobacterchroococcum в присутствии различных доз пестицида « ТМТД»
Наиболее устойчивыми к действию пестицидов оказались бактерии Azotobacterchroococcum штамма №6
Все выделенные штаммы Az. сhroococcum пригодны для конструирования бактериальных препаратов. Вместе с тем наиболее перспективным для конструирования препарата, на наш взгляд, является штамм №6.
Бактерии штамма №6 использованы для конструирования препарата «ОРГАНИК».
4.1.2. Второй этап
Описание технологического процесса изготовления опытного препарата
1. Культивируемый штамм №6 высевают на плотную среду Эшби и культивируют в течение 24-28 часов, при температуре 26-28°С для накопления большой массы активно делящихся азотфиксирующих клеток.
2. Полученную массу клеток смывают с поверхности плотной среды 2-5 мл жидкой среды Эшби и инокулируют в 0,5 литра среды Эшби с добавлением 0,3-0,7 г/л ЭКД для получения популяции клеток с концентрацией 109-1011 кл/мл. Культивируют в течение 20-24 часов при той же температуре.
3. Полученную суспензию вносят в рабочий объем среды Эшби(10-50 литров) с ЭКД и с добавлением триптофана (0,2-1,0 г/л). Триптофан вносят для интенсивного накопления ИУК в рабочем объеме среды. Культивируют в течение 40-48 часов, при температуре 26-28°С до достижения концентрации клеток 105 — 107, оцениваемой с использованием стандарта мутности. (https://www.ld.ru/reviews/ilist-5382.html)
4. Готовый продукт хранят в холодильнике при температуре от 0 до 10°С.Рабочее название препарата — «ОРГАНИК».
Рабочие концентрации препарата готовят добавлением питьевой воды из расчета 1:10 и 1:20.
4.2. Результаты полевых опытов
Перед посевом определяли лабораторную всхожесть семян и энергию прорастания.
Таблица 5 — Энергия прорастания и лабораторная всхожесть семян пшеницы
| Варианты обработки семян | Энергия
прорастания, % |
Лабораторная
всхожесть, % |
| Контроль (вода) | 78 | 92,00 |
| Рабочая концентрация 1:10 | 70 | 89,00 |
| Концентрация 1:20 | 77 | 90,00 |
| НСР 05 | 4 | 4,86 |
Разница между вариантами несущественна, что объясняется тем, что действие препарата сказывается на более поздних этапах роста растений пшеницы (табл.5).
Полевую всхожесть рассчитывали относительно общего числа растений пшеницы на 1 кв м 600 шт.
Полевая всхожесть пшеницы, семена которой были обработаны рабочей концентрацией препарата, была существенно выше, чем в контроле и в разбавленной концентрации (табл.6).
Таблица 6 — Полевая всхожесть пшеницы в зависимости от обработки семян (2 июня 2020 г.)
| Вариант опыта, | Количество растений,
на 1 м2 |
Полевая всхожесть, % | +/- контроль |
| Контроль | 408 | 68 | |
| Рабочая концентрация 1:10 | 480 | 80 | 72 |
| Концентрация 1:20 | 468 | 78 | 60 |
| НСР 05 | 65 | 19 |
Применение препарата «Органик» в рабочей концентрации 1:10 для обработки семян перед посевом привело к увеличению полевой всхожести пшеницы на 12%.
Применение разбавленной концентрации препарата также привело к незначительному увеличению полевой всхожести пшеницы, однако разница с контролем несущественна.
Также перед уборкой была проведена проверка сохранности растений (табл.7).
Таблица 7 — Сохранность растений пшеницы
| Вариант опыта,
концентрация |
Фаза определения | +/- контроль | |
| всходы | перед уборкой | ||
| Контроль | 408 | 202 | |
| Рабочая концентрация 1:10 | 480 | 239 | 37 |
| Концентрация 1:20 | 468 | 233 | 31 |
| НСР05 | 64,65 | 14,15 | |
Количество растений во втором варианте существенно выше контроля. Также и растения, выросшие из семян, обработанных разбавленным раствором препарата, сохранились лучше по сравнению с контролем, хотя разница по показателю между вариантами несущественна. Уборка проводилась 21 августа 2020 года. На опытном участке дождь был 11августа. Погода стояла сухая и прохладная, средняя температура воздуха +130С.
Уборка производилась вручную, чтобы минимизировать потери при уборке. Обмолот снопов производился на второй день после уборки в помещении вручную. В таблице 6 приведены данные веса зерна с каждой делянки в повторностях.
Таблица 8 — Вес зерна с делянки (кг)
| Вариант | Вес зерна по повторностям с 6 м2 (кг) | |||
| 1 | 2 | 3 | 4 | |
| Контроль | 0,84 | 0,9 | 0,85 | 0,78 |
| Рабочая концентрация 1:10 | 1,14 | 0,9 | 1,2 | 1,14 |
| Концентрация 1:20 | 0,84 | 0,78 | 0,72 | 1,08 |
На основании данных таблицы 8 была рассчитана урожайность яровой пшеницы сорта Злата, которая приведена в таблице 9.
Таблица 9 — Урожайность пшеницы при обработке семян
| Вариант | Повторности | Среднее | Урожайность
т/га |
+/-
контроль |
|||
| 1 | 2 | 3 | 4 | ||||
| Контроль | 1,4 | 1,46 | 1,4 | 1,4 | 1,415 | 1,42 | |
| Рабочая концентрация 1:10 | 1,96 | 1,51 | 2,01 | 1,92 | 1,85 | 1,86 | 0,44 |
| Концентрация 1:20 | 1,4 | 1,3 | 1,2 | 1,8 | 1,42 | 1,42 | 0,005 |
| НСР05=0,42 | |||||||
Согласно полученным данным, урожайность пшеницы в варианте с применением раствора в рабочей концентрации существенно выше контроля и варианта с использованием для обработки семян разбавленным раствором. В последнем случае имеет место высокая вариабельность значений. Объяснить данный феномен невозможно используя данные одного года исследований.
ЗАКЛЮЧЕНИЕ
Лабораторные опыты
- В результате исследований образцов почвы изолированы 6 штаммов бактерий Azotobacter chroococcum.
- У выделенных штаммов выявлены различия в ростовой активности. Наиболее активным оказался штамм Azotobacter chroococcum, выделенный из окультуренных почв Уренского района (штамм № 6).
- Выявлены границы значений рН оптимальных для роста штаммов Azоtobacter chroococcum, выделенных из различных типов почв, они соответствовали диапазону 5,0 – 7,7.
- Все исследованные штаммы оказались достаточно устойчивыми к действию пестицидов. Наиболее устойчивыми оказались бактерии Azotobacterchroococcum штамма №6
Таким образом, все выделенные штаммы Az. сhroococcum пригодны для конструирования бактериальных препаратов. Вместе с тем наиболее перспективным для конструирования препарата, на наш взгляд, является штамм №6.
Полевые опыты (апробация препарата:
- Применение экспериментального препарата с рабочим названием «Органик» для обработки семян перед посевом по данным одного года изучения и в условиях мелкоделяночного опыта, привело к повышению урожайности яровой пшеницы сорта Злата на 30%. Однако, полученные данные нельзя считать достоверными, поскольку вопрос требует дальнейшего изучения.
Создание перечня микробиологических лабораторий в регионах Рос-сийской Федерации:
Обеспечение сельхозтоваропроизводителей микробиологическим препаратом, созданным для условий конкретного региона, должны обеспечить микробиологические лаборатории, расположенные непосредственно в регионах Российской Федерации. В настоящее время в Нижегородской области функционируют 3 микробиологические лаборатории, способные частично удовлетворить спрос хозяйственников на данный препарат — это Микробиологическая лаборатория Нижегородской ГСХА, лаборатория ООО «Центр фитосанитарной экспертизы» (г.Нижний Новгород) и Агрономическая мастерская ГБОУ СПО «Работкинский аграрный колледж» (Кстовский район). В дальнейшем, после широкой апробации препарата в условиях Нижегородской области и усовершенствования технологии производства препарата, планируется создание сети микробиологических лабораторий в регионах.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
- Aquilanti L., Favilli F., Clementi F. Comparison of different strategies for isolation and preliminary identification of Azotobacter from soil samples // Soil Biol. and Bichem. 2004. Vol.32. P.181–190.
- Baillie A., Hodgkiss W., Norris J.R. Flagellation of Azotobacter spp. as Demonstrated by Electron Microscopy// Journal of Applied Microbiology. 1962. Vol.25, № 1. P. 116 – 119.;
- Catalogue of Life, 18th May 2015: Azotobacter chroococcum. http://www.catalogueoflife.org
- Gomes F., Martinez-Toledo M.V., Salmeron V., Rodelas V. and Gonsales-Lopez. // Chemosphere. Vol. 39. No 6. 1999. pp 944-957.
- https://iplants.ru/fundazol.htm
- J., Camelo M. et al.Azotobacter chroococcum as a potentially useful bacterial biofertilizer for cotton (Gossypium hirsutum): Effect in reducing N fertilization// Revista Argentina de Microbiología. Vol. 49. Núm. 4.pьи áginas 377-383, 2017
- Jin H, Hui Wang H, Zhang Y. Description of Azotobacter chroococcum subsp. isscasi subsp. nov. isolated from paddy soil and establishment of Azotobacter chroococcum subsp. chroococcum subsp. nov.// International journal of systematic and evolutionary microbiology. Volume 7, Issue 3, p. . 2020
- Patnaik G.K., Kanungo P.K., Mahana P.K., Adhya T.K. and Rajaramamohan Rao V. // Chemosphere. Vol. 30. No 2. pp 339-343. 1995.
- Pricrill L., Vuncura V., Wurst M. Auxin formation by rhizosphere bacteria’s factor of root growth // Plants. 1985. Vol. 23, № 2. P. 159 – 163.
- Rodelas B., Gonzalez-Lopez J., PozoC. et al. Response of Faba bean (Viciafaba L.) to combined inoculation with Azotobacter and Rhizobium leguminosarumbv. viceae // Appl. Soil Ecol. 1999. Vol. 12. P. 51 – 59.
- Tejera N., Lluch C., Martinez-Toledo M.V., Gonzalez-Lopez J. Isolation and characterization of Azotobacter and Azospirillum strains from the sugarcane rhizosphere // Plant and Soil. 2005. Т. 270, № 1 – 2. С. 223 – 232.
- Tsai J. C., Aladegbami S. L., Vela G. R. Phosphate-limited culture of Azotobacter vinelandii // J. Bacteriol. 1979. Vol. 139, № 2. P. 639 – 645.
- Van Oosten M. J., Stasio E. D., Cirillo V. Root inoculation with Azotobacter chroococcum 76A enhances tomato plants adaptation to salt stress under low N conditions//BMC Plant Biology, 2018. https://doi.org/10.1186/s12870-018-1411-5
- Zahir Z.A., Arshad M., Frankenberger W.T. Plant growth promoting rhizobacteria: application and perspectives in agriculture // Adv. Agron. 2004. Vol. 81. P. 97 – 169.
- Антипчук А.Ф., Канцелярук Р.М., Скочинская Н.Н. и др. Влияние азотобактера на прорастание семян огурцов // Микробиологический журнал. 1985. Т.47, № 2. С. 19 – 23.
- Блинков Г.К. Азотобактер и его значение для высших растений. Томск, 1959. 123с.
- ГОСТ 17.4.3.01
- ГОСТ 17.4.3.01-83.
- ГОСТ 17.4.4.02-84.
- ГОСТ Р 54653-2011
- Дарзниек Ю.О. О скорости размножения клеток азотобактера// Микробиология. 1982. Т. 30, № 6. С. 1042 – 1044.
- Доспехов Б.А. Методика полевого опыта./Б.А.Доспехов. — М.: Колос,- 1985.- 416 с.
- Зайцева Г.Н. Биохимия азотобактера. М.: Наука, 1965. 304 с.
- Зенова Г.М., Степанов А.Л., Лихачева А.А. и др. Практикум по биологии почв. М., 2002. 120 с.
- Колешко О.И. Азотфиксирующие бактерии (физиология развития). Минск, 1981. 109 с.
- Кравченко Л.В., Леонова Е.И. Использование триптофана корневых экзометаболитов при биосинтезе индолил-3 -уксусной кислоты ассоциативными бактериями// Микробиология. 1993. Т.62. Вып. З. С. 453-459.
- КравченкоЛ.В., ЛеоноваЕ.И. Использование триптофана корневых экзометаболитов при биосинтезе индол-З-уксусной кислоты ассоциативными бактериями // Микробиология. 1993. Т. 62. Вып. 3. С. 435 – 459.
- МишкеИ.В. Микробные фитогормоны в растениеводстве. Рига, 1988. 152с.
- Мишустин Е.Н. Ассоциации почвенных микроорганизмов. М.: Наука, 1975. 108 с.
- Мишустин Е.Н. Микроорганизмы и продуктивность земледелия. М.: Наука, 1972. 344 с.
- Мишустин Е.Н., Шильникова В.К. Биологическая фиксация атмосферного азота. М.: Наука, 1968. 306 с.
- Никитенко Г.Ф.(ред.) Опытное дело в полеводстве/Г.Ф.Никитенко.- Москва: Россельхозиздат, 1982. – 190с.
- Определитель бактерий Берджи. Т. 2: Пер. с англ. / Под ред. Дж. Хоула, Крига Н., Снита П. и др. М.: Мир, 1997. 368 с.
- Пискунов А.С. Методы агрохимических исследований/ А.С.Пискунов – М.: КолосС, 2004. — 312 с.
- Самсонов С.К. Невидимые земледельцы. М, 1987. 172с.
- Современная микробиология. Прокариоты / Под ред. Й. Ленгелера, Г. Древса, Г. Шлегеля. М.: Мир, 2005. 1152 с.
- Умаров М.М. Ассоциативная азотфиксация. М.: Наука, 1986. 133 с.
- Федина М.А. Методика государственного сортоиспытания сельскохозяйственных культур/ под ред. М.А.Федина. – М., — 1985. – 267 с.
- Шарма П.К., Чахал В.П. Влияние акцепторов аминогрупп на образование азотобактером ИУК из триптофана//Микробиология. 1986. Т.55. Вып.5. С. 1040-1043.
- Шлегель Г. Микробиология. М.: Мир, 1987. 403 с.
