РЕФЕРАТ
Отчет 99 с., 1 кн., 65 рис., 14 табл., 128 источн.
ПЛОДОВЫЕ КУЛЬТУРЫ, ЯГОДНЫЕ КУЛЬТУРЫ, ДЕКОРАТИВНЫЕ КУЛЬТУРЫ, КЛОНАЛЬНОЕ МИКРОРАЗМНОЖЕНИЕ, ПРОЦЕСС РИЗОГЕНЕЗА, БИОПРЕПАРАТЫ, АДАПТАЦИЯ МИКРОРАСТЕНИЙ, ЗАЩИЩЕННЫЙ ГРУНТ.
В 2020 г в рамках выполнения госзадания проведен аналитический обзор современной научно-технической литературы, затрагивающей проблему, исследуемую в рамках НИР.
С учётом видо- и сортоспецифичности генотипов оптимизированы условия прохождения двух ключевых этапов технологии клонального микроразмножения — ризогенеза и адаптации для широкого набора новых и перспективных генотипов садовых культур: сортов ирги, актинидии, ремонтантной малины, бесшипых сортов ежевики, ежемалиновых гибридов, жимолости, роз, клематисов, гейхер, сортов сирени обыкновенной и т.д.
Проведен подбор наиболее эффективных индукторов ризогенеза. Разработаны методические приемы обработки микрочеренков химическими агентами и биофизическими факторами на этапе ризогенеза in vitro и изучено их последействие на этапе адаптации к условиям ex vitro.
Установлено, что укоренение ряда садовых культур достигается и на безгормональных средах, но для достижения максимальной частоты ризогенеза и оптимального развития корневой системы необходимо добавление в питательные среды ИУК в концентрации 0,5 — 1,0 мг/л, ИМК в концентрации 0,25 — 0,5 мг/л, или НУК в концентрации 0,125- 0,25 мг/л.
Изучено применение в качестве стимулятора ризогенеза кофеина при добавлении его в среду укоренения. Наиболее эффективным определен диапазон концентраций кофеина в среде от 1 до 100 мг/л. Установлено, что содержание кофеина в среде свыше 0,1% оказывает негативное действие на растительные ткани, замедляя и останавливая процесс образования корней, останавливая рост побегов и вызывая некроз тканей.
На примере ягодных культур показано, что эффективность ризогенеза при облучении микропобегов НКИ в 1,3-2,2 раза превышает контроль, возрастает средняя длина корней и прирост побегов по отношению к контролю. Стимулирующий эффект получен как при использовании гелий-неонового лазера, так и полупроводникового, но при разных экспозициях.
Разработана эффективная схема воздействия ультразвука на биологические объекты с использованием цилиндрической и конической насадки излучателя. При использовании цилиндрической насадки излучателя оптимальная мощность облучения составляет 2,7-4,7 Вт/см2, при использовании конической -3,6-14,1 Вт/см2. В результате исследований повышена эффективность ризогенеза микрочеренков на 20 – 35% в зависимости от генотипа.
Оптимизирована технология адаптации садовых культур. Проведен подбор компонентов субстрата, удобрений, биопрепаратов на бактериальной основе, повышающих приживаемость микрорастений на этапе адаптации и стимулирующих их рост и развитие.
При проведении адаптации в условиях зимних отапливаемых теплиц оптимальным сроком высадки микрорастений в субстрат является вторая половина февраля – апрель. Оптимальная температура для высадки большинства видов растений +23-250 С.
Корневые обработки микростений микробиологическими препаратами после высадки их в торфяной субстрат марки «Агробалт-С» способствуют более интенсивному развитию ягодных культур на этапе адаптации. Применение биопрепаратов на этапе адаптации в 1,3-1,5 раза ускоряет рост побегов и в 1,3-1,8 раза увеличивает массу корневой системы. Максимальный прирост побегов в длину получен при использовании бактериального удобрения Байкал ЭМ1, по совокупности показателей наиболее эффективными были варианты с применением Азотовита и Фосфатовита.
Усовершенствованная технология акклиматизации микрорастений повышает эффективность адаптации по разным видам растений на 15-35%. Применение разработанных подходов способствует улучшению качества адаптированных растений: прирост надземной части увеличивается на 20-30%, объем корневой системы на 30-45%.
На примере двух культур с разным морфогенетическим потенциалом – ремонтантной малины и гейхеры проведен расчет экономической эффективности применения методов клонального микроразмножения для производства посадочного материала с закрытой корневой системой в условиях защищенного грунта.
Перечень сокращений и обозначений
MS – питательная среда Мурасиге-Скуга
QL – питательная среда Кворина-Лепуавра.
6-БАП – 6 — бензиламинопурин.
ИУК – β-индолилуксусная.
индолилуксусная кислота.
ИМК – β-индолилмасляная кислота.
НУК – α-нафтилуксусная кислота
УЗ – ультразвук.
НКИ – низкоинтенсивное когерентное излучение.Введение
Получение корнесобственных плодовых и ягодных растений методом клонального микроразмножения является важным компонентом в интенсификации сельскохозяйственного производства. В развитых странах микроразмножение растений, начало распространяться еще в 60-е годы прошлого столетия, а сейчас оформилось как мощное промышленное производство, быстро реагирующее на запросы рынка.
Производством растением in vitro и доращиванием растений in vivo занимаются крупные коммерческие фирмы, которые имеют в собственности как биотехнологические лаборатории, так и теплицы для их адаптации и доращивания. На сегодняшний день признанными лидерами в этой области являются такие страны как Нидерланды, США, Индия, Израиль, Италия, Польша. В этих странах насчитывается более 300 коммерческих лабораторий, ряд из которых имеют производительность 15-20 млн. растений в год. В нашей стране пока нет ни одной фирмы с таким объемом производства микрорастений. Всего в мире методом клонального микроразмножения производят более 500 млн. растений в год.
Успехи, достигнутые в области клонального микроразмножения растений, позволяют выделить этот способ вегетативного размножения как наиболее перспективный для многих плодово-ягодных и декоративных культур, в том числе новых гибридных форм растений, имеющих особо ценные характеристики по отношению к исходным сортам.
Применение методов биотехнологии позволяет выращивать генетически однородный и свободный от болезней растительный материал, обладающий, к тому же, хорошими морфометрическими признаками. Кроме этого, культура тканей растений это один из самых надежных методов анализа и сохранения зародышевой плазмы ex situ редких и исчезающих видов растений [39]. Без него невозможно проведение фундаментальных исследований по тканевой селекции и генетической инженерии растений.
Для большинства ягодных и декоративных культур метод клонального микроразмножения разработан достаточно эффективно. Однако в связи с изменяющимся сортиментом и генотипическими особенностями культивирования in vitro уже разработанные технологии не всегда приемлемы и требуют постоянного совершенствования и корректировки.
Список видов, сортов и гибридных форм растений, используемых в научных исследованиях, а также в промышленном и любительском садоводстве, неуклонно расширяется, что обусловливает необходимость подбора и оптимизации состава питательных сред и условий культивирования в зависимости от видовой и сортовой специфичности эксплантов. Для малораспространенных ягодных растений морфогенез в культуре тканей остается открытым вопросом, что обусловлено видо- и сортоспецифичностью этих растений, требующих индивидуальной оптимизации условий культивирования.
Такие культуры, как малина, жимолость, ежевика, активно культивируются in vitro и успешно поддаются размножению в лабораторных условиях, что опосредует необходимость опытного определения наилучших условий культивирования, особенно на завершающем и критическом для многих растений этапе адаптации.
Неправильный выбор условий адаптации может свести на нет усилия, затраченные на всех предшествующих этапах микроразмножения. Перенос растений в нестерильные условия in vivo создает стрессовую ситуацию и приводит во многих случаях к их гибели [4, 112].
Условия in vitro, коренным образом отличаясь от условий in vivo, индуцируют образование уникального культурального фенотипа (КФ) растения. Длительное нахождение эксплантов в таких условиях вызывает разнообразные анатомические и физиологические аномалии длительного характера, например, пористость паренхимы листа и уменьшение числа ее слоев. Н.В. Катаева [28] отмечает, что у пробирочных растений, выращенных почти при 100% влажности воздуха, устьица широко открыты. У листьев отсутствует эпикутикулярный воск, что приводит к чрезмерной потере воды и плохой фотосинтетической способности [94].
Еще одним фактором, препятствующим успешной адаптации растений ex vitro является слабая корневая система, которая не приспособлена к самостоятельному поглощению и не в состоянии восстановить потери воды растением в результате возросшей транспирации [122]. Корни in vitro растений не имеют корневых волосков, их проводящая система слабо развита, клетки сильно увеличены, и, как показывают исследования, их роль в обеспечении жизнедеятельности растений, в частности ягодных культур, незначительна [15, 90].
Дополнительная гибель растений может происходить вследствие высокой инфекционной нагрузки, создаваемой при использовании нестерильного почвенного субстрата, где при повышенной влажности и благоприятной температуре быстро развиваются бактерии, грибы, а иногда и насекомые паразиты.
Технологии адаптации включают подбор субстрата и оптимальных условий для адаптации, роста и развития микрорастений – освещенности, фотопериода, влажности воздуха и субстрата, температурный режим. Немаловажным фактором является определение оптимальных сроков высадки растений-регенерантов в почву.
Для успешной акклиматизации микрорастений необходимо подготовить их к переходу на фототрофное питание в условиях низкой влажности воздуха, активизировать рост корневой системы за счет развития придаточных корней на этапе укоренения и обеспечить эффективную стерилизацию субстрата перед пересадкой регенерантов. При попадании в стрессовые условия растения должны как можно быстрее приспособить к ним ткани и органы, образованные in vitro или сформировать новые побеги и листья. Желательно, чтобы эти два процесса проходили одновременно [15].
Таким образом, адаптация является ключевым этапом успешного размножения большинства растений in vitro. Только отработка эффективной технологии перевода микрорастений в нестерильные условия делает возможным промышленное микроразмножение садовых культур.
Несмотря на значительное количество научных работ по клональному микроразмножению большого числа видов растений, сведения по акклиматизации полученных in vitro растений, разрознены, относятся к отдельным видам и посвящены решению отдельных проблем. Практически нет отечественных исследований, посвященных разработке комплексного подхода акклиматизации стерильных растений, направленного на широкомасштабное экономически выгодное производство разнообразного сортимента наиболее перспективных и коммерчески востребованных видов.
Современная технология акклиматизации микрорастений должна учитывать видовую специфику растений, сроки высадки, необходимость получения, выровненного по морфобиологическим параметрам растительного материала, быть экономически выгодной и воспроизводимой.
Анализ российского рынка плодовых, ягодных и декоративных культур свидетельствует: в последние годы интерес на новые сорта существенно вырос. В ходе процесса перехода экономики страны к импортозамещению очевидна необходимость сокращения импорта посадочного материала. Все более актуальной становится проблема массового производства различных сортов однолетних и многолетних садовых культур внутри России. Отстраняться от неё нельзя: наличие высокого инфекционного фона у завезённого посадочного материала сказывается не только на качестве цветения, внешнем виде и продолжительности жизни растений, но и вызывает заражение окружающей среды опасными патогенами, что оказывает отрицательное влияние на эпидемиологическую обстановку в регионах. Проблема может быть успешно решена с использованием методов биотехнологии при размножении ценных форм растений.
Цель НИР: Разработка способов повышения эффективности адаптационного потенциала микрорастений садовых культур путём стимуляции процесса ризогенеза микрочеренков и применения биологически активных препаратов в условиях защищённого грунта.
Задачи исследований:
— подобрать наиболее эффективные индукторы ризогенеза и способы обработки микрочеренков химическими агентами для включенных в исследования генотипов;
— разработать методические приемы обработки микрочеренков химическими агентами и биофизическими факторами на этапе ризогенеза in vitro и изучить их последействие на этапе адаптации к условиям ex vitro;
-определить оптимальные параметры температуры и влажности воздуха на этапе адаптации микрорастений к нестерильным условиям;
— изучить влияние субстрата на эффективность адаптации микрорастений садовых культур;
— оценить влияние минеральных подкормок на развитие микрорастений на этапе адаптации;
— оценить влияние биопрепаратов на бактериальной основе на рост и развитие растений на этапе адаптации.
— подобрать оптимальные субстраты и подкормки, повышающие приживаемость микрорастений и стимулирующие их рост и развитие;
— разработать методику, совмещающую этап укоренения микрочеренков с этапом адаптации микрорастений к нестерильным условиям.
— дать оценку экономической эффективности применения современной технологии вегетативного размножения методом клонального микроразмножения.
Глава 1 Обзор литературы по теме исследований
1.1 Индукция ризогенеза садовых культур in vitro и in vivo
Вопросы укоренения in vitro и приживаемости in vivo тесно связаны между собой, потому что, как показывает практика, большие потери материала при переводе микрорастений в нестерильные условия могут быть связаны со слабым или аномальным развитием корневой системы и неразвитостью листового аппарата микрорастений.
Этап ризогенеза микрочеренков in vitro — важнейший этап клонального микроразмножения [22]. Эмпирический подход, широко используемый в экспериментах по органогенезу в культуре растительных тканей, показал, что процесс ризогенеза in vitro зависит от многих факторов, которые можно разделить на внутренние (генотип растения и тип экспланта) и внешние (состав питательной среды и физические условия культивирования). Установлена зависимость процесса корнеобразования от генотипа, минерального и углеводного состава среды, ее консистенции, веществ фенольной природы, светового и температурного режима, последействия условий этапа пролиферации, длины укореняемых побегов и других факторов.
В ходе клонального микроразмножения растений любой из факторов, будь то генетические особенности или недостатки питательной среды, может лимитировать развитие экспланта, вызвать его витрификацию или гибель. Формирование качественной корневой системы и развитых побегов при культивировании на питательных средах садовых культур во многом является залогом успешного прохождения микрорастениями этапа адаптации и последующего быстрого развития. В связи с этим, используют различные факторы физической и химической природы, стимулирующие ризогенез.
На этапе укоренения практикуется использование менее богатых питательных сред. Считается, что использование уменьшенной концентрации минеральных солей более целесообразно, так как на таких средах (при оптимально подобранной концентрации ауксина) не формируется каллусная масса на базальной части микропобега [11]. Для этого разбавляется в два раза минеральная основа основной среды размножения и снижается концентрация сахарозы до 1-2% [25, 103, 108]. При укоренении наиболее часто используется половинная концентрация солей макроэлементов питательной среды на основе прописи Мурасиге-Скуга [92], кроме того используется и разбавленная в четыре раза минеральная основа основной среды размножения [56].
В качестве индукторов ризогенеза широко используются ауксины: β-индолилмасляная (ИМК), β-индолилуксусная (ИУК) и α-нафтилуксусная (НУК) кислоты.
Существует несколько основных методик укоренения и последующей адаптации растений. Чаще всего для укоренения микрочеренков их высаживают на питательные среды, содержащие ауксины, с последующей пересадкой укорененных растений в теплицу для дальнейшей адаптации.
В результате обзора литературы можно сделать вывод, что ИМК при укоренении плодовых, ягодных и декоративных культур в составе питательной среды наиболее часто применяется в концентрации 0,5-2,0 мг/л [30, 34, 40, 56, 66, 71]. Согласно другим источникам, наибольшая эффективность ИМК отмечена при концентрации 2,0-4,0 мг/л [114] и 0,2 мг/л [92]. При укоренении Sorbus torminalis и S. aucuparia ИМК и НУК использовали в концентрации 13,5 мг/л [100, 101]. Однако, по данным других авторов ИМК в концентрации 6,5 и 13,5 мг/л была не эффективна при укоренении разных видов рябины [99]. После 12 недель культивирования частота укоренения микропобегов рябин не превышала 20 % [99].
В литературе имеются сообщения об использовании ИМК и в более низкой концентрации. Так, микропобеги актинидии коломикта успешно укореняли на среде ½ QL с 0,1 мг/л ИМК [70], малину красную на среде, содержащей 1/5 нормы солей MS и 0,01 мг/л ИМК [41]. Некоторые ягодные культуры укореняются на средах без фитогормонов [48].
Достаточно широко при укоренении растений in vitro используется природный ауксин — β-индолилуксусная кислота. ИУК в концентрациях 0,5 и 1 мг/л использовали при укоренении ежевики [66], в концентрации 1,0 мг/л [80] и 2,5-5,0 мг/л [95] в качестве индуктора ризогенеза для сливы. При укоренении малины ремонтантного типа, оптимальная концентрация ИУК в среде составила 0,75 мг/л. При этом для ряда форм более эффективным оказалось применение ИМК в концентрации 0,5 мг/л [44].
НУК при использовании на этапе укоренения микрочеренков может вызывать формирование обильного каллуса, который затрудняет рост корней и изменяет их структуру [28, 108]. Поэтому на этапе укоренения этот ауксин обычно используется в низких концентрациях, например, Шарма и Падья [117] наблюдали индукцию ризогенеза у Crataeva nurvala через 7 дней на среде MS с низкой концентрацией НУК (0,5 мкМ). Анис М. [78] достигли 80% укоренения микрочеренков M. alba при концентрации НУК в питательной среде 1 мг/л. Эффективность этого ауксина при индукции ризогенеза шелковицы Morus nigra L. подтверждена работами З. Мебуба с коллегами [102]. Применение НУК в концентрации 0,5 мг/л, было более эффективным, чем применение ИУК в концентрации 0,5-1 мг/л и ИМК в концентрации 2-3 мг/л. Хорошие результаты получены при использовании НУК в концентрации 0,01 мг/л с добавлением 0,1 мг/л 6-БАП [78] для укоренения сливы.
Применение ауксинов в составе питательной среды — наиболее распространенный способ укоренения микрорастений, но он имеет ряд недостатков. Так, микрорастения, выращенные и укоренненые в условиях in vitro имеют ряд существенных морфологических отличий в строении листьев и корней. Из-за длительного контакта со средой, содержащей высокую концентрацию ауксина, отмечается повышенное каллусообразование, и корни не могут функционировать полноценно [15].
Эту методику чаще всего оптимизируют за счет поиска новых веществ, регулирующих процессы ризогенеза и дальнейшего роста растений на этапе адаптации. Для укоренения микрочеренков ясеня применяли Мелафен, Циркон, Фумар, Эпин [36]. Добавление в среду укоренения 0,05% — 0,2% циркона, а также 10−5% мелафена повышало частоту ризогенеза на 29% — 37% и 31% соответственно. Через 4 недели культивирования 100% укоренения микрочеренков было получено на среде ½ WPM с 0,1% Циркона. Наибольшее число корней на укорененный микрочеренок образовалось на среде с 10−6% мелафена.
При культивировании растений in vitro большое внимание уделяется фенольным соединениям. При этом в зависимости от химического строения, концентрации и ряда других факторов они могут действовать как стимуляторы или как ингибиторы ризогенеза. Наиболее часто практикуют добавление в среду укоренения флороглюцина и фенолкарбоновых кислот [65-67]. Для стимуляции процесса ризогенеза большинство исследователей рекомендуют совместное применение ауксина и флороглюцина в строго определенных соотношениях. Положительное действие его объясняют тем, что флороглюцин используется как субстрат для оксидазы индолилуксусной кислоты или пероксидазы, что приводит к увеличению содержания эндогенной ИУК [108]. Одновременное использование ауксина и флороглюцина повышало частоту укоренения персика на 50-70% [95]. Флороглюцин увеличивал число укоренившихся микрочеренков ягодных культур – земляники, ежевики и малины [65, 66, 84]. Совместное применение ИМК и флоридзина в концентрации 10 мг/л способствовало повышению укореняемости груши сорта Лада в 2 раза [69]. Галловая кислота повышала процент укоренения ежевики Торнфри [68], а салициловая кислота малино-ежевичных гибридов [68]. В других случаях фенолкарбоновые кислоты, внесенные в питательную среду без ауксинов, не оказывали заметного действия, либо подавляли ризогенез [67]. При совместном применении с ИМК наиболее эффективными оказались галловая, хлорогеновая и салициловая кислоты [67, 82]. Так салициловая кислота, добавленная в питательную среду вместе с ИМК, стимулировала корнеобразование у ряда плодовых и ягодных культур (малина красная ремонтантного типа, малина черная сорта Кумберленд, малино-ежевичные гибриды Логанберри и Тайберри, рябина сорта Невеженская, груша сорта Лада). Повышение укореняемости побегов отмечено в диапазоне концентраций салициловой кислоты от 1,0 до 5,0 мг/л, тогда как для оптимального роста корней предел допустимых концентраций ниже – от 0,7 до 2 мг/л [67]. На начальном этапе укоренения (по сравнению с ИМК) она индуцировала более активное корнеобразование и ингибировала рост каллуса. Стимулирующий эффект зависел от концентрации салициловой кислоты, а также видовой и сортовой специфики растений.
В целом же, литературные данные о действии фенольных соединений на процесс ризогенеза носят достаточно противоречивый характер и требуют уточнения применительно к конкретной культуре и условиям проведения опыта.
Использование элиситеров — эмистима и экофуса в качестве компонента питательной среды на этапе укоренения (10-5) у сортов ежевики Торнфри и Агавам также приводило к ускорению ризогенеза (на 14-16 дней раньше, чем в контроле), укореняемость при этом достигала 75% [26, 27]. Отмечается положительное действие гуматов (0,1-0,5 г/л) на процессы корнеобразования. Помимо общеизвестных свойств, связанных с высокой ёмкостью катионного обмена и наличием некоторых питательных элементов, они способны специфически воздействовать на физиологические процессы, происходящие в растении in vitro.
Присутствие ауксина в среде, при общей стимуляции ризогенеза, может ингибировать рост корней [52]. Поэтому используют альтернативные способы применения ауксинов. В связи с этим прибегают к кратковременной обработке оснований микрочеренков (от нескольких часов до нескольких дней) препаратами с ауксиновой активностью с последующим помещением черенков на среды без регуляторов роста или же непосредственно в субстрат [18, 54, 120].
Опыты с микрорастениями яблони показали, что в зависимости от генотипа оптимальными являются как варианты с использованием среды для укоренения (индуктор ризогенеза — ИМК 2 мг/л), так и с замачиванием микропобегов в течение 18 часов в растворе ИМК (30 мг/л). В опытах с виноградом было установлено, что при использовании второй методики более эффективно совместное применение ауксинов и физиологически активных веществ нового поколения: лигногумата калия, циркона и экстрассола-55 [55]. Способ имеет существенный недостаток: длительное выдерживание микропобегов в растворах регуляторов роста сопряжено с высокой вероятностью заражения.
Есть мнение, что эффективность ауксина при укоренении в значительной мере зависит от доз цитокининов, используемых в питательных средах на этапе микроразмножения. Ряд авторов рекомендует снижать концентрацию 6-БАП в пассаже, предшествующем укоренению, до 0,1-0,2 мг/л [16, 17]. По данным В.А.Высоцкого и О.А. Леонтьева-Орлова [17], полученных на подвоях яблони, процент укоренения побегов, культивируемых на средах с пониженной концентрацией 6-БАП, в три раза выше, чем на средах с концентрацией 6-БАП 3 мг/л. Кроме того, культивирование на питательных средах с пониженным содержанием 6-БАП, повышает долю побегов с длиной более 1,5-2 см. Это важно, так как установлена зависимость процесса ризогенеза от размера укореняемых микрочеренков. Побеги яблони [88], сливы [39] и других косточковых культур [24], длиной менее 1,5 см характеризовались пониженой жизнеспособностью, хуже укоренялись и формировали слабо развитую корневую систему по сравнению с побегами длиной 1,5-3,0 см.
Кроме того, на процесс укоренения влияют условия культивирования микрочеренков. Многие авторы процесс инициации корней с помощью ауксинов рекомендуют проводить в темноте, объясняя это усилением поглощения регулятора роста. П Друарт и П. Груселле [88] отмечают, что темновая фаза в течении 7-9 дней на начальном этапе ризогенеза достаточна для достижения 100% укоренения побегов сливы. Среднее число корней на укорененное растение увеличилось в 2,8 раза у P.domestica и в 1,5 раза у P. insitit по сравнению с побегами, укорененными при стандартных условиях культивирования (16 час. день / 8 час. ночь). Эффективность темнового этапа показана на яблоне [88], груше [124], персике [96], айве [109], акации [104], эвкалипте [126].
В качестве физических факторов применяют лазерное излучение [5, 42, 73, 106], ультразвук [47, 50, 62], свет определенного спектрального состава [108].
Несмотря на то, что стимулировать рост и развитие растений могут источники когерентного излучения почти всей видимой части спектра, оптимальными длинами волн являются те, которые соответствуют максимуму поглощения фитохромов. Формой, стимулирующей физиологическую активность растений, является ФХ730. Ее высокая концентрация поддерживается излучением в спектральном интервале 600…690 нм [13]. Таким образом, для облучения растений с целью стимуляции их роста, размножения и корнеобразования перспективно использовать гелий-неоновые (λ=632,8 нм) и красные полупроводниковые лазеры (λ=655 нм) [6].
Реакция растительных организмов на лазерное излучение зависит от целого ряда факторов, которые необходимо учитывать при постановке биотехнологического эксперимента. Наиболее важными являются генотипические особенности растений, физиологическое состояние эксплантов, условия культивирования и параметры облучения.
В многочисленных экспериментах установлено, что ответная реакция растений на облучение различной длительности имеет нелинейный многомодальный характер с максимумами и минимумами стимуляционного эффекта. Проведенные разными авторами исследования показывают, что лазерное облучение тканей in vitro способствует увеличению регенерационной активности меристем и улучшению ризогенеза ягодных культур [42, 59, 106].
Существенное влияние на интенсивность укоренения и степень развития корневой системы оказывает температура. Однако ее действие достаточно специфично для разных видов растений. Розати с коллегами [114] считают, что наиболее благоприятна для укоренения сливы температура 210 С. Через 10 дней при этой температуре укоренялось свыше 80% побегов, при 150С – 60%, при 260С – 5%. Но еще через 10 дней процент укоренения был сходен во всех вариантах.
Учет всех факторов, влияющих на эффективность ризогенеза и степень развития растений на этапе укорения in vitro, позволяет вплотную подойти к решению вопроса адаптации микрорастений садовых культур, что необходимо для разработки эффективной схемы перевода растений в естественные условия обитания с учетом физиологических особенностей каждого генотипа.
1.2 Факторы, влияющие на эффективность перевода микрорастений в нестерильные условия
Адаптация является ключевым этапом успешного размножения большинства растений in vitro. Только отработка эффективной технологии перевода микрорастений в нестерильные условия делает возможным промышленное микроразмножение садовых культур.
К важнейшим факторам, определяющим успешный переход микрорастений в нестерильные условия следует отнести:
1. Влажность воздуха. Перевод пробирочных растений в нестерильные условия затруднен по двум основным причинам – слабого контроля самим растением транспирации и их пониженной способностью к фотосинтезу вследствие гетеротрофного способа питания. В естественных условиях движущей силой для транспирации служит разница водного потенциала между растением и атмосферой (примерно 1000 бар). В замкнутых системах культивационных сосудов такой градиент водного потенциала отсутствует. В течение первых 10-14 дней после пересадки устьица пробирочных растений не функционируют, и растения теряют воду [87].
У растений, культивируемых in vitro, нарушена деятельность устьичного аппарата, вследствие чего у них происходит потеря большого количества воды [91]. Есть данные, что интенсивность транспирации воды у растений, находящихся в культуральных сосудах, в 3 раза больше по сравнению с растениями, выращиваемыми при естественной влажности воздуха [57]. Высокая влажность и отсутствие солнечной радиации в условиях in vitro способствуют формированию так называемого культурального фенотипа, в частности, уменьшается образование кутикулярного воска на листьях и увеличивается пористость паренхимы листа, в результате уменьшается поглощение воды растениями и усиливается транспирация [91, 121]. У in vitro растений меняется структура листа, сокращается слой палисадной паренхимы и в 2 раза уменьшается количество проводящих жилок [119]. Листья меристемных растений неспособны полностью обеспечить потребности растения в продуктах фотосинтеза [35].
После пересадки в нестерильные условия микрорастения испытывают водный стресс, проявляющийся в обезвоживании тканей и в разрушении мембран. Особенно чувствительны растения к иссушению сразу после их извлечения из культуральных сосудов. Уже спустя 40 минут после нахождения растений при относительной влажности воздуха 40% наблюдается потеря листьями более 40% воды, а в течение первых 15-30 минут — повреждение клеток [83].
Многие исследователи рекомендуют первое время после высадки микрорастений в субстрат поддерживать влажность воздуха в пределах 95-99% постепенно, в течение 10-14 дней, снижать ее до 50-60%. Некоторые авторы советуют уменьшать влажность на 5% в день. Такую процедуру возможно провести в рамках эксперимента и крайне сложно в промышленных масштабах [112].
Изменить форму устьиц, их расположение на листе, а, следовательно, увеличить приживаемость растений в нестерильных условиях может увеличение интенсивности света и сокращение влажности в сосуде на этапе укоренения [20].
Сообщалось о положительном влиянии на акклиматизацию растений метода температурного градиента в сосудах. При температуре атмосферы в сосудах на 1-20С выше, чем температура среды, уменьшалась витрификация растений и улучшалась выживаемость при высадке их из стерильных сосудов в почву [19].
Адаптацию листового аппарата пробирочных растений можно начинать непосредственно в культуральных сосудах. Для стимуляции фотосинтеза пробирочных растений перед высадкой в грунт увеличивают интенсивность освещения и проницаемость культуральных сосудов для углекислого газа.
Для этого практикуют открывать сосуды на несколько дней до посадки в нестерильные условия [111]. Одни авторы использовали неполное закрытие сосудов (до 80%) из 2 типов пленки, вискозной (внутренний слой) и термоусадочной, чтобы предотвратить увядание растений. Однако при этом способе уже через 7 дней на поверхности питательной среды развивается грибная инфекция, что приводит к гибели растений [33, 122]. Другие исследователи предлагают наносить на поверхность питательной среды растворы системного фунгицида, что может в свою очередь вызывать опадение листьев [15].
Уменьшить потерю воды листьями возможно и с помощью антитранспирантов. Существуют несколько типов антитранспирантов: закрывающие устьица, создающие пленку на поверхности листа, увеличивающие отражение света.
Для опрыскивания можно использовать 50%-ный водный раствор глицерина или смесь парафина, или жира в диэтиловом эфире (1:1). Применение этого метода часто обеспечивает высокую приживаемость микрорастений. Однако, применение антитранспирантов снижает интенсивность фотосинтеза, который у пробирочных растений слабо выражен. Исследования показали, что положительные результаты в опыте с антитранспирантами отмечены только для быстро растущих в нестерильных условиях травянистых растений [121]. Таким образом, основная причина неудач от применения антитранспирантов — это уменьшение интенсивности фотосинтеза наряду с фитотоксичностью.
Воздействие на растения полиэтиленгликоля улучшало анатомическое строение листьев, способствовало развитию кутикулярного слоя, увеличивало проводимость ксилемы и водоудерживающую способность листьев [115]. Растения на среде с полиэтиленгликолем не увядали при влажности воздуха 80% [118], однако рост растений заметно замедлялся [21]. В других опытах с петунией было показано, что применение полиэтиленгликоля все-таки достоверно не снижало количество стекловидных микрорастений [123].
Необходимый уровень влажности воздуха на этапе адаптации можно обеспечить с помощью искусственного тумана, влажного тента, индивидуального пластикового покрытия, системы «смог». Система «смог» представляется идеальной для адаптации пробирочных растений, но она очень затратная.
Искусственный туман позволяет контролировать и поддерживать влажность воздуха, но он способен вымывать питательные вещества из растений, переувлажнять субстрат, что приводит к серьезным грибным заболеваниям [53, 93]. А.Б. Бургутин [7] рекомендовал для адаптации винограда снять покрытие с тех пробирок, в которых побег достиг пробки, и через 1,5-2 недели пересадить растение вместе с агаровой средой в почвенный субстрат с сильным заглублением побега. При данном способе пересадки отпадает необходимость в туманообразующей установке.
При небольших объемах влажный тент увеличивает приживаемость и силу роста по сравнению с туманом. Влажный тент создает высокую влажность, но при этом трудно осуществлять контроль за температурой и необходимой влажностью на конкретном этапе [81].
На этапе адаптации микрорастений кроме того применяют пластиковые контейнеры емкостью 0,5 л с крышкой, которые обычно используются для фасовки пищевых продуктов. Их заполняют на половину простерилизованным субстратом, высаживают по 2 растения и накрывают крышкой. В таком виде контейнеры выставляют на стеллажи с освещенностью 4000-5000 лк на 3-4 недели. В течение этого срока растения не требуется никакого ухода, даже полива. Затем в крышках делают отверстия площадью 0,5-1,0 см2 для снижения влажности, а через неделю их снимают полностью. Выход после такой адаптации растений вишни и сливы по разным сортам составлял 70-90% [31]. Пластиковые контейнеры под полиэтиленовой пленкой обеспечивали максимальный процент приживаемости и быстрое развитие ряда сортов сирени [33].
Для адаптации микрорастений используют и специальные камеры с регулируемыми климатическими параметрами [38]. Однако стоимость таких камер высока, что резко снижает экономическую эффективность метода клонального микроразмножения.
2. Температура. Оптимальная температура для высадки большинства видов растений на адаптацию +23-250С. Как пониженная, так и повышенная температура в первые недели адаптации крайне опасны для микрорастений. Постоянно пониженная температура (15-20ºС) в сочетании с высокой влажностью субстрата могут привести к тому, что микрорастения перейдут в состояние долговременного покоя, из которого их будет очень трудно вывести. Такой эффект наблюдали при адаптации разных видов актинидии. При высадке растений на адаптацию в почву в феврале месяце в пасмурные дни при отсутствии дополнительного освещения и температуре 18ºС, при регулярном орошении микрорастений происходило замокание субстрата, растения, подвергшиеся стрессу или, погибали, или переходили в состояние физиологического покоя, из которого не выходили даже при оптимизации температурного и светового режима [64]. Температура в адаптационном помещении выше 40-45ºС в момент высадки в сочетании с высокой влажностью приведет к тому, что микрорастения просто “сварятся”. Этот момент следует учитывать, если адаптация проводится в теплицах с нерегулируемым температурным режимом.
3. Освещение. Фотосинтетическая способность клеток и тканей растений, выращенных in vitro, играет жизненно важную роль в обеспечении их выживания вне инкубационной среды.
Свет, его интенсивность и спектральный состав играет важную роль в развитии фотосинтетических способностей эксплантов in vitro [116].
На рост и развитие микрорастений в процессе адаптации большое влияние оказывают условия освещенности в теплице [87]. В культуральных помещениях биотехнологических лабораторий обычно поддерживается освещенность в пределах 3-3,5 тыс. люкс и фотопериод 16 ч.день/ 8 ч. ночь. В первое время после высадки интенсивность освещения рекомендуется поддерживать на том же уровне. Оптимальная освещенность среднего яруса климакамеры (температура 25-27ºС и освещенность 3 тыс. лк.) способствовала развитию корневой системы и обеспечивала 100%-ную адаптацию растений винограда [9]. Недостаточная освещенность подавляла рост и развитие растений, угнетенные растения полностью погибали через 2-3 недели. На рост и развитие растений влияет и спектральный состав света. Так, активному развитию растений ежевики на этапе адаптации способствовал красный свет с длинной волны 611-660 нм [110].
При акклиматизации растений in vitro более высокая выживаемость, развитие, меньшая потеря воды зафиксирована у эксплантов культивируемых в условиях LED освещения, по сравнению с FL освещением.
Было показано, что светодиодное освещение оказывает положительное влияние на развитие укоренённых эксплантов in vitro, что приводит к повышению эффективности адаптации к естественным условиям среды микрорастениями.
Ханг с коллегами [98] исследовал влияние светоизлучающих диодов (LED) с длинами волн 90% красного и 10% синего, 70% красного и 30% синего, 50% красного и 50% синего, 30% красного и 70% синего цветов, а также люминесцентных ламп, которые служили контролем, на развитие микропобегов земляники садовой in vitro и их дальнейшем развитии как in vitro, так и ex vitro. LED освещение (90% красный и 10% синий) было оптимальным для развития растений in vitro. LED освещение (70% красный и 30% синий) было эффективно как для развития in vitro, так и ex vitro. По сравнению с контролем все светодиоды значительно способствовали развитию проростков и увеличению выживаемости, биомассы побегов и корней, количества и длины корней, количества и площади листьев, а также содержания хлорофилла.
4. Субстрат. В технологии клонального микроразмножения на этапе адаптации наиболее часто используют субстраты, состоящие из следующих компонентов в различных соотношениях: перлит, торф, торф и песок (2:1), перлит и торф (1:1; 1:2; 1:3), сфагновый мох, сфагновый мох и вермикулит, торф, песок и хвойная земля (1:1:1), керамзит [22, 51, 77], цеолит [22], кроме того, использовалось сочетание торфа и осадков городских сточных вод (ОГСВ) [1], последовательно в два этапа – стерильный кварцевый песок, затем смесь песок : торф : дерновая земля (1:2:1) [43], смесь торф : дерновая земля : вермикулит в соотношении 1:3:3 и смесь дерновая земля и вермикулита (1:1) [75]. Ионообменные субстраты БИОНА были высокоэффективными при выращивании косточковых культур [23] и герберы [10].
Фитосанитарное состояние субстрата играет большую роль в приживаемости растений ex vitro. Заметное влияние на приживаемость винограда оказала стерилизация песка раствором перманганата калия [2]. Эффективны обработки субстрата горячим паром, 0,1% раствором бенлата, эупарена [20], противомикробными препаратами с добавлением терразола [111]. Однако некоторые авторы говорят о несущественной разнице между использованием стерильного и нестерильного субстрата [15]. Для развития пробирочных растений земляники лучшим вариантом оказалась нестерильная смесь лесной почвы и песка (3:1) [48].
При перенесении пробирочных растений в субстрат большое значение имеют не только влажность воздуха, но и рН субстрата. Постепенное привыкание растений к пониженной влажности воздуха и рН 6-7 обеспечивают их хорошую приживаемость [56, 79].
Положительный эффект дают минеральные внекорневые обработки пробирочных растений, например, минеральной основой среды МС [63], раствором кальциевой [109] или аммиачной селитры [9]. После того как микрорастения успешно приживались в почве, более интенсивному развитию саженцев способствовали корневые обработки растений микробиологическими препаратами [72, 73].
Существует достаточно много технологических схем перевода микрорастений в нестерильные условия. При том, что оборудованные климокамеры с регулируемыми параметрами освещения, температуры и влажности представляются идеальным вариантом для адаптации микрорастений, на практике в производственных условиях их используют достаточно редко вследствие высокой стоимости и сравнительно малого количества выращиваемых в них растений.
С целью значительной экономии затрат труда и материалов и ускорения производства посадочного материала в ряде случаев предприняты попытки объединения этапов укоренения и адаптации растений. При этом основания микропобегов выдерживали в ламинар-боксе в растворе ауксина для индукции корневых зачатков и высаживали в почвенный субстрат для одновременного укоренения и адаптации [85, 128].
Т. Дас с коллегами [86] сообщали, что укоренение микрочеренков чая было достигнуто при погружении оснований, срезанных микропобегов на 30 минут в раствор ИМК (50 мг/л) с последующей высадкой в смесь почвы с торфом (1:1). Микрочеренки, которые были укоренены непосредственно в почве дали более высокий процент растений, выживших в поле, по сравнению с теми, которые были укоренены в пробирках. По данным Высоцкого В.А. [15] такая методика успешно применяется для земляники, смородины, малины, вишни, яблони и сирени. Растения помещают в стерильный субстрат, состоящий из смеси почвы, торфа и песка в отношении 1:1: 1 или торфа и песка (перлита) в объемном отношении 3:1.
В опытах с малино-ежевичным гибридом Тайберри было показано, что предварительная обработка микрочеренков ИУК (2 мг/л) и пересадка регенерантов на мох сфагнум обеспечивают высокую укореняемость, хорошее развитие надземной части (высота, сухая, сырая масса) и хорошую приживаемость [29]. Преимущества данной методики в том, что из цикла in vitro исключается этап укоренения, что уменьшает трудозатраты и время культивирования. Основной недостаток методики – побеги должны иметь развитые листья, покровные, механические и проводящие ткани и достаточную высоту. Данная методика индивидуальна для каждого вида растений, и требует подбора оптимальной фазы развития для минимизации потерь
В большинстве случаев степень влияния на процесс адаптации того или иного фактора или их совокупности зависит от генотипа растения. Некоторые сорта и виды хорошо адаптируются в условиях стандартной технологии [34]. Однако для успешной акклиматизации большинства видов и сортов садовых растений в нестерильных условиях необходима разработка эффективных приемов, позволяющих не только сохранить микрорастения, но также обеспечить их активный начальный рост и сократить сроки получения качественного, выровненного корнесобственного посадочного материала.
Глава 2 Объекты, методы и условия проведения исследований
2.1 Место проведения исследований
Научные исследования выполнены на базе Учебно-исследовательского тепличного комплекса «Роща» и учебно-исследовательской лаборатории биотехнологии (рис. 1).
 |
 |
| а) | б) |
| Рисунок 1 — Научно – исследовательский тепличный комплекс Мичуринского ГАУ: а) операционная учебно-исследовательской лаборатория биотехнологии; б) зимняя теплица. | |
Все работы по культивированию растений in vitro выполнены на материально-технической базе учебно-исследовательской лаборатории биотехнологии Мичуринского ГАУ.
В лаборатории имеются следующие производственные помещения: моечная, комната для приготовления питательных сред, автоклавная, операционная, культуральные.
Оборудование моечного помещения: мойка с горячей и холодной водой; дистилляторы и бидистилляторы; сушильные шкафы с режимом работы для сушки посуды — до 100-130 °С, для инструментов — до 170 °С; шкафы для хранения чистой посуды и инструментов, емкости для хранения моющих средств.
Оборудование помещения для приготовления питательных сред: лабораторные столы; холодильники для хранения маточных растворов солей, гормонов и витаминов; аналитические и торсионные весы; иономер; магнитные мешалки; плитки, набор посуды (колбы, стаканы, мерные цилиндры, мензурки, пробирки и др.), необходимый набор химических реактивов надлежащей степени чистоты (ХЧ, Ч, ЧДА).
Оборудование автоклавной: автоклавы с режимом работы — давление 1-2 атмосферы и температура 120оС. Данное помещение оборудовано приточно-вытяжной вентиляцией и имеет канализационный слив для отвода конденсата из автоклава.
Оборудование помещения для инокуляции растительных эксплантов на питательные среды (операционная): ламинар-боксы, лабораторные столы, стеллажи, бактерицидные лампы, холодильники для хранения гормонов и витаминов; шкафы для материалов и оборудования.
Оборудование культуральных помещений: световое отделение — источники освещения со спектром близким к спектру дневного света (от 3 до 5 kLx), кондиционер для регуляции температуры (24±2°С) и влажности воздуха (70%), стеллажи для культивируемого биологического материала.
Основная работа проводилась в зимней отапливаемой теплице. Теплица поликарбонатная, многорядная, построена по проекту французской фирмы «Ришель», общая площадь 5000м2, (0,5 га). Состоит из семи климатических зон. Общая площадь одной климатической зоны составляет 672м2, полезная площадь 628 м2.
Выращивание овощей в УИТК «Роща» производится по малообъемной технологии на минераловатном субстрате. Для контроля и управления системой полива заложен дозирующий узел PRIVA Nutriflex 15-3 AB pH CIS, который включает в себя смесительный бак, емкостью 100л. с соединениями.
Полив и питание растений через компенсированные капельницы PCJNL-2л/ч. Расстояние между капельницами 0,25м.
Для хранения раствора с удобрениями имеются 3 бака: А-В для удобрений и 1 кислотный бак для регулирования рН. А-В баки имеют объем 1000л., кислотный бак – 500л.
Теплица включает две климатические зоны для выращивания огурца, в зимне-весенней и летнее-осенней культуре; четыре зоны – для выращивания томата в продлённом обороте, одна зона (рассадное отделение) для выращивания рассады овощей, однолетних цветов и адаптации микрорастений, полученных in vitro, в лаборатории биотехнологии.
Рассадное отделение имеет общую площадь 75 м в длину и 9,6 м в ширину. В нем размещено 36 стеллажей» УГС-4, по 18 штук с каждой стороны.
Рассадное отделение оснащено лампами досвечивания, что позволяет выращивать растения в зимнее месяцы, при недостатке естественного освещения. Регулировка микроклимата и поливов в теплице автоматизирована.
Растения выращиваются по современным технологиям на УГС-4 (установка гидропонная стеллажная, модель 4. Эта установка оборудована герметичным пластиковым поддоном, на котором имеются глубокие продольные и мелкие поперечные канавки для равномерного распределения воды по поверхности они же, придают поддону необходимую жесткость. Пластиковый поддон установлен на металлическом каркасе, позволяющем регулировать высоту и уклон. Установка оснащена клапаном подачи раствора, что обеспечивает технологию полива «прилив – отлив». Допустимая нагрузка на пластиковый поддон – 70 кг/м2. Стол имеет размеры 1,8м на 8м, на него устанавливается 75 стандартных кассет для выращивания рассады 54 ячейки (515х335мм). Выращивание на УГС-4 значительно облегчает работу по высадке растений и уходным работам, так как работа ведется в удобном положении.
2.2 Объекты и методы исследований
В качестве растительного материала взяты перспективные для производственного размножения виды и сорта садовых культур: ежевика, малино-ежевичные гибриды, актинидия, жимолость, другие нетрадиционные ягодные культуры, клоновые подвои яблони селекции Мичуринского ГАУ, а также популярные декоративные культуры: сирень, клематисы, розы, гейхеры, хосты и др.
Для культивирования растений in vitro на этапе укоренения использовали минеральную основу питательной среды Мурасиге-Скуга [105] и минеральную основу питательной среды Кворина-Лепуавра [113] со сниженной вдвое концентрацией макросолей, дополненную мезоинозитолом – 50 мг/л, пиридоксином HCl – 0,5 мг/л, никотиновой кислотой – 0,5 мг/л, тиамином HCl – 0,4 мг/л, агаром – 8 г/л и сахарозой – 20 г/л. В среду добавляли ауксины: β-индолил-3-масляную кислоту (ИМК), β-индолилуксусную кислоту (ИУК) или α-нафтил-1-уксусную кислоту (НУК) в концентрации 0,1-1,0 мг/л.
В следующей серии опытов среда ризогенеза была без регуляторов роста или с 1 мг/л ИМК с добавлением от 0,0001 до 0,5% кофеина (1-5000 мг/л) кофеина. Контролем служила среда без кофеина.
При другом способе индукции ризогенеза черенки высаживали непосредственно в субстрат после обработки их оснований ауксином (24 ч, 50 мг/л ИМК).
рН питательной среды в процессе приготовления устанавливали в пределах 5,6-5,8 с помощью децинормального раствора NaOH. Среды стерилизовали автоклавированием (1 атм., 20 мин.). Витамины и регуляторы роста растений стерилизовали фильтрованием и добавляли после автоклавирования (“Millipore” 0,22 μm, France).
При изучении биофизических факторов воздействия на эффективность ризогенеза садовых культур стерильные микрочеренки обрабатывали излучением гелий-неонового лазера ГН – 40 (длина волны 632,8 нм) и полупроводникового HLDPM12-655-10HJ (длина волны 655 нм) с плотностью мощности светового потока 2 Вт/м2 и диаметром светового пятна 14 см при различных экспозициях (30, 60, 120, 240, 480, 960 с) на 3-4 сутки после высадки их на среду укоренения непосредственно в культуральных сосудах. Расчет более длительного периода облучения производили путем удвоения предыдущего временного отрезка. Для равномерного облучения колбу с эксплантами ставили на вращающуюся с постоянной скоростью подставку (рис. 2). После облучения сосуды с растениями выставляли в культуральную, и в целях чистоты эксперимента разделяли перегородками. Таким образом, контрольные и опытные растения находились в одних условиях культивирования, но также были оптически изолированы друг от друга.
 |
| Рисунок 2 — Обработка растений когерентным оптическим излучением in vitro. |
Для облучения микрочеренков УЗ использовали ультразвуковую установку УЗДН-2Т (рис. 3). Параметры УЗ излучения: частота излучения – 22 кГц; мощность воздействия в пределах P=0-10,0 Вт/см2. Плотность мощности ультразвука рассчитывали по количеству выделившейся за единицу времени тепловой энергии в пересчете на единицу площади. При расчёте мощности температуру воды фиксировали с помощью электронных приборов с погрешностью ±0,1°С.
 |
| Рисунок 3 — Ультразвуковая установка: 1 – ультратермостат (система охлаждения); 2 – ультразвуковой диспергатор УЗДН 2Т; 3 – блок управления. |
Конструкция блока излучателя обеспечена водяным охлаждением и позволяет передавать колебания от магнито-стрикционного привода к двум типам насадок.·Излучатели размещены в звукозащитном шкафу со смотровым окном.
Время воздействия на микрочеренки 60 с. Ультразвуковую обработку микрочеренков проводили в непрерывном режиме.
Микрочеренки (1,5-3,5 см), культивируемых in vitro растений, нарезали в количестве 25-30 шт. на вариант. Использовали две схемы облучения (рис. 4). В случае применения конической насадки излучателя, подготовленные микрочеренки помещали в стеклянные лабораторные стаканы объемом на 100 мл с 20 мл жидкой среды ½ MS или с 20 мл раствора ауксина (ИМК, 50 мг/л) в жидкой среде ½ MS в каждом, так, чтобы основания всех микропобегов были погружены в жидкость. Использовали следующие мощности облучения: 1-1,15; 2-3,6; 3-7,2; 4- 11,5; 5-14,1; 6-17,4 Вт/см2 и контрольный вариант (без ультразвуковой обработки).
При второй схеме облучения микрочеренки помещали в цилиндрическую насадку излучателя с 10 мл жидкой среды ½ MS (1, 3, 5, 7, 9 варианты) или с 10 мл раствора ауксина (ИМК, 50 мг/л) в жидкой среде (2, 4, 6, 8, 10 варианты), так, чтобы основания всех микропобегов были погружены в жидкость. Ультразвуковое воздействие осуществлялось непосредственно на основания микрочеренков, находящихся в цилиндрической насадке излучателя. Использовали следующие мощности УЗ облучения: 1, 2 вариант – 0,7 Вт/см2; 3, 4 вариант – 2,7 Вт/см2; 5, 6 вариант – 4,7 Вт/см2; 7, 8 вариант – 5,7 Вт/см2; 9, 10 вариант – 6,7 Вт/см2.
| Рисунок 4 —. Схема воздействия ультразвуком на растительный материал:
1 – жидкая питательная среда; 2 – микрочеренок; 3 – стеклянный цилиндр; 4 – коническая насадка излучателя; 5 – стакан; 6 – дистиллированная вода; 7 – цилиндрическая насадка излучателя |
После облучения микрочеренков в растворе солей без ауксина, микрочеренки высаживали на питательную среду укоренения QLУК или MSук содержащую 0,5 мг/л ИМК. Микрочеренки после облучения в растворе солей и ИМК высаживали после 24 ч выдержки в растворе ауксина на питательную среду укоренения QLУК или MSук (без гормонов).
Субкультивирование побегов проводили в широкогорлых конических колбах емкостью 250 мл и стеклянных банках емкостью 400 мл. Культуральные сосуды закрывали тонкой алюминиевой фольгой и герметизировали лентой “Parafilm”. Культивирование растений осуществляли в специально оборудованной культуральной комнате при 16-часовом световом дне с освещенностью 2000-2500 люкс (люминесцентные лампы Osram L36W/765 Cool Daylight), температуре воздуха 24±20С.
Учет результатов производили с периодичностью 1 раз в 7 дней. Учитывали число укоренившихся побегов, число и длину корней на укорененный микрочеренок, длину побегов. На каждый вариант опыта брали по 25-30 эксплантов. Повторность опытов трехкратная. Статистическую обработку данных проводили с использованием программы Microsoft Excel.
Для пересадки в почву использовали укорененные микрорастения, полученные in vitro, имеющие не менее 4-5 листьев и развитую корневую систему длиной не менее 1,5-2 см (рис. 5, 6). Растения осторожно вынимали из колб или пробирок пинцетом с длинными концами, убирали с корней излишки агара и высаживали в почвенный субстрат. Чтобы избежать подсушивания микрорастений до высадки в почву их держали в закрытых контейнерах с погруженными в воду корнями.
 |
 |
| Рисунок 5 — Укорененные на среде QLУК с 0,5 мг/л ИМК микрочеренки ежевики (сорт Эльдорадо) перед высадкой на адаптацию. | Рисунок 6 — Укорененные на среде QLУК с 0,25 мг/л ИМК микрочеренки актинидии коломикта (сорт Изобильная) перед высадкой на адаптацию. |
Укоренённые микрорастения в феврале-августе с искусственной питательной среды высаживали в субстрат на основе нейтрального минерализованного верхового сфагнового торфа марки «Агробалт-С» в кассеты и помещали в плёночные минитеплицы с воздушно-капельным орошением (рис. 7, 8). Субстрат полностью готов к работе и имеет следующие характеристики: рН 5,5-6,6, N=150 мг/л, Р2О5=150 мг/л, К2О=250 мг/л, Мg=30 мг/л, Са= 120 мг/л. Этих элементов питания в целом хватает на весь срок от высадки до пересадки в горшки или грунт.
От прямых солнечных лучей растения затеняли укрывным материалом «Спанбол». Минитеплицы устанавливали на подвижных столах в рассадном отделении зимней отапливаемой теплицы с регулируемой температурой и влажностью воздуха, и возможностью досветки. Первые две недели поддерживалась высокая относительная влажность воздуха (до 90%) и температура 22-28°С, после чего влажность воздуха в тепличках постепенно снижали, приоткрывая укрытия и через 3,5-4 недели плёнку полностью снимали. В пасмурные дни растения досвечивали, поддерживая освещенность 3-3,5 лк. не менее 12 часов в сутки.
Через 21 и 35 дней после посадки, укоренившиеся растения подкармливали раствором минеральных солей (NH4+ — 1,0; K+— 7,55; Ca 2+ -5,3; Mg2+ — 2,25; NO3— — 15,65; SO42- — 3,3; H2PO4– 1,4 ммоль/л) разбавленным в 4 раза раствором минеральных солей по прописи Мурасиге-Скуга или комплексным минеральным удобрением (Азофоска, 20 г/10 л раствора).
Состав питательной среды Мурасиге-Скуга:
Основные соли (макроэлементы):
Нитрат аммония (NH4NO3) 1650 мг/л
Хлорид кальция (CaCl2·2H2O) 440 мг/л
Сульфат магния (MgSO4 7H2O) 370 мг/л
Гидрофосфат калия (КH2РО4) 170 мг/л
Нитрат калия (КNО3) 1900 мг/л
Минорные соли (микроэлементы):
Борная кислота (Н3ВО3) 6,2 мг/л
Хлорид кобальта (CoCl2· 6Н2О) 0,025 мг/л
Сульфат меди(II) (CuSO4· 5Н2О) 0,025 мг/л
Сульфат железа(II) (FeSO4· 7Н2О) 27,8 мг/л
Сульфат марганца(II) (MnSO4· 4Н2О) 22,3 мг/л
Йодид калия (КІ) 0,83 мг/л
Молибдат натрия (Na2МoО4· 2Н2О) 0,25 мг/л
Сульфат цинка (ZnSO4·7H2О) 8,6 мг/л
По мере роста растений их рассаживали в большие емкости (горшок 0,5л КВ9М или горшок 1,0 л Д13М) со свежим субстратом.
Дальнейшее выращивание акклиматизированных растений соответствовало принятой агротехнике выращивания для каждого индивидуального вида растений.
 |
 |
| Рисунок 7 — Подготовленная для высадки микрорастений теплица. | Рисунок 8 — Высаженные на адаптацию микрорастения актинидии. |
В опытах по влиянию микробиологических препаратов на рост и развитие растений на этапе адаптации были включены следующие биопрепараты: Байкал ЭМ 1; Азотовит, Фосфатовит, Пралин-Экстра.
Байкал ЭМ-1:
Действующее вещество — фотосинтезируюшие бактерии, молочнокислые бактерии, дрожжи, актиномицеты и ферментирующие грибы.
Класс опасности: 4 (мало опасный продукт) – нетоксичен, непатогенен, пожаровзрывобезопасен.
Производитель: ООО «ЭМ-Кооперация».
Гарантийный срок хранения: 1 год.
Применение: применяется для создания более благоприятных условий для роста растений, повышения общего иммунитета, снижения роста патогенной микрофлоры, полива почвы или любых органических остатков. Улучшает качество урожая большинства культур, повышает его сохранность и зимнюю лежкость, повышает устойчивость растений к болезням, вредителям, неблагоприятным погодным факторам, в частности, к засухам и заморозкам.
Азотовит:
Действующее вещество — живые клетки и споры бактерий Azotobakter chroococcum, штамм В-9029.
Концентрация: (титр живых или продукта их жизнедеятельности) — не менее 5,0 х 109 КОЕ/г.
Класс опасности: 4 (мало опасный продукт) – нетоксичен, непатогенен, пожаровзрывобезопасен. Azotobakter chroococcum не являются генетически модифицированными штаммами, относятся к микроорганизмам, непатогенным для человека, не требуют специальных мер предосторожности во время работы, что подтверждено свидетельством ФГУП ГосНИИГенетика.
Производитель: ООО «Промышленные инновации».
Гарантийный срок хранения: 9 месяцев со дня изготовления при температуре от -3С до +30 С.
Применение: применяется в органическом земледелии в качестве удобрения, которое улучшает состав почвы и способствует высокой всхожести семян и росту надземной части растения (стеблей, листьев, цветов). Способствует переводу атмосферного азота в форму, пригодную для питания растительного организма, обеспечивая растения азотным питанием. Активирует иммунную систему растений. Бактерии вырабатывает антибиотики, подавляющие фитопатогенную микрофлору (корневые гнили, ризоктониоз и др.).
Фосфатовит:
Действующее вещество— живые клетки и споры бактерий Bacillus mucilaginosus, штамм В-8966
Концентрация (титр живых или продукта их жизнедеятельности) — не менее 0,12 х 109 КОЕ/г
Класс опасности: 4 (мало опасный продукт) нетоксичен, непатогенен, пожаровзрывобезопасен. Bacillus mucilaginosus не являются генетически модифицированными штаммами, относятся к микроорганизмам, непатогенным для человека, не требуют специальных мер предосторожности во время работы, что подтверждено свидетельством ФГУП ГосНИИГенетика
Производитель: ООО «Промышленные инновации».
Гарантийный срок хранения: 9 месяцев со дня изготовления при температуре от -3С до +30 С
Применение: мобилизует труднодоступные формы фосфора и калия, обеспечивая растения фосфорным и калийным питанием, является стимулятором корнеобразования и роста растений. Подавляет патогенную микрофлору. Повышает урожайность сельскохозяйственных культур.
Пралин-Экстра:
Действующее вещество— живые клетки и споры бактерий Bacillus subtilis.
Концентрация (титр живых или продукта их жизнедеятельности) — не менее 1010 КОЕ/г
Класс опасности: 4 (мало опасный продукт) нетоксичен, непатогенен, пожаровзрывобезопасен.
Производитель: ООО «БИОМ-ТОРГ».
Гарантийный срок хранения: 1 год со дня изготовления.
Применение: в качестве лечебного и профилактического средства, эффективно подавляет возбудителей грибных и бактериальных заболеваний
В серии опытов по изучению влияния микробиологических препаратов на рост и развитие растений на этапе адаптации через 4 недели после высадки растений в почву проводили корневую подкормку микрорастений биопрепаратами Байкал ЭМ 1, Азотовит, Фосфатовит, Пралин-Экстра (30 мл/1 л воды).
Через 4 и 8 недель определяли приживаемость микрорастений в нестерильных условиях, оценивали последействие способов укоренения микрорастений на этапе ризогенеза, влияние подкормки минирастений растворами минеральных солей и внекорневых обработок растений по динамике роста надземной части (высота растений), листовой поверхности (число, размеры листьев, их общая площадь) и корневой системы (число, средняя, суммарная длина и масса корней) при адаптации в кассетах и при доращивании в контейнерах. Учеты проводили раз в три-четыре недели. Повторность опыта – трехкратная, в каждой повторности не менее 54 растений.
Дальнейшее выращивание акклиматизированных растений соответствовало принятой агротехнике выращивания для каждого индивидуального вида растений.
По мере роста растений их рассаживали в большие емкости (горшок 0,5л КВ9М или горшок 1,0 л Д13М) со свежим субстратом.
Для профилактики повреждения минирастений насекомыми — вредителями каждые 2 недели после высадки в субстрат их опрыскивали препаратом Фитоверм (4 мл/л).
Статистическую обработку данных проводили с использованием программы Microsoft Excel.
Глава 3 Результаты исследований
3.1 Индукция ризогенеза микрочеренков химическими агентами
Различные виды и сорта культурных растений существенно отличаются по способности к образованию корней in vitro. Существует мнение, что виды, которые легко образуют новые органы в естественных условиях, обладают высокой способностью к вегетативному размножению, в частности, легко образуют корни при размножении одревесневшими и зелеными черенками, отличаются высокой способностью к ризогенезу в культуре in vitro. Способность к регенерации органов и соматических тканей in vitro у большинства многолетних древесных растений значительно ниже по сравнению с ягодными кустарниками и травянистыми растениями [82].
Наши исследования подтверждают эти наблюдения. Изучаемые нами формы ягодных и декоративных растений укоренялись гораздо быстрее и эффективнее по сравнению с многолетними древесными садовыми культурами такими как яблоня, слива, вишня, абрикос. С высокой частотой в культуре in vitro укореняются многие сорта ежевики, актинидии, жимолости, гейхеры, вейгелы, хосты. Для легко укореняющихся культур достаточно высокая эффективность ризогенеза и хорошее развитие корневой системы достигается при высадке растений на любые среды укоренения. Микрочеренки этих культур формируют корни даже при минимальном содержании ауксина в среде (рис. 9), однако в этом случае качественные показатели развития корневой системы обычно хуже, чем при использовании 0,5-1,0 мг/л индолилмасляной кислоты, в первую очередь, образуется меньшее количество корней на укорененное растение (рис. 10). У микрорастений жимолости, кизильника блестящего, ряда сортов сирени даже при достаточно высокой частоте укоренения на средах с ауксинами образуется существенно меньше корней на укорененный микрочеренок по сравнению с другими культурами.
Хорошее развитие корневой обеспечивает практически 100% приживаемость и больший прирост побегов на этапе адаптации, поскольку лучшее развитие корневой системы способствует более быстрой адаптации растений к почвенным условиям. Поэтому так важно для каждого вида растений подобрать оптимальный состав среды укоренения, обеспечивающий хорошее развитие корневой системы без образования значительного количества каллуса.
| Рисунок 9 — Эффективность укоренения микрочеренков разных
видов садовых культур в условиях in vitro. |
| Рисунок 10 — Образование корней на микрочеренках разных видов
садовых культур в условиях in vitro. |
Результаты опытов по определению влияния типа и концентрации ауксина на ризогенез ягодных культур, проведенные на сортах ежевики и ежемалиновых гибридах, показали, что, если генотип отличается высокой способностью к образованию корней в условиях in vitro он укореняется с высокой частотой на средах с разными ауксинами в широком диапазоне концентрации. При этом качество корневой системы и побегов будет разным. Так у ежевики на средах с ИУК формируется более слабая корневая система с тонкими темными корешками, при этом частота ризогенеза высокая (рис 3). Побеги на средах с ИУК отставали в росте по сравнению с побегами, культивируемыми на средах с ИМК и НУК. Применение НУК было удачным только при концентрации ауксина 0,125 — 0,25 мг/л, в этом случае получили достаточно хорошо развитую корневую систему и максимальный прирост укорененных побегов. Избыточное содержание этого ауксина (0,5-1,0 мг/л) приводило к каллусному разрыхлению корней и частичному оводнению побегов или некрозу нижних листьев (рис. 11). Подобные результаты были получены ранее при укоренении разных видов актинидии [61]. По результатам полученных данных можно рекомендовать использовать НУК для индукции ризогенеза ягодных культур при концентрации не выше 0,25 мг/л, так как избыточное содержание этого ауксина приводит к образованию значительного количества каллуса и снижает качество полученных микрорастений.
На средах с ИУК при любой концентрации ауксина побеги развивались нормально, но росли медленнее. Из нашего опыта работы следует, что оптимальным индуктором ризогенеза для ежевики следует признать ИМК в концентрации 0,4-0,5 мг/л.
 |
 |
 |
 |
 |
|
| а) | б) | в) |
| Рисунок 11 — Влияние типа ауксина (0,5 мг/л) на ризогенез и развитие побегов ежевики (сорт Дирксен Торнлесс) на среде MSУК: а) ИМК, б) ИУК, в) НУК. | ||
На примере ежемалинового гибрида Тайберри показано, что для укоренения микрочеренков ежемалины можно успешно применять все три ауксина, но оптимальная концентрация каждого в питательной среде будет разная. Максимальная частота укоренения (80-85%) ежемалинового гибрида Тайберри получена при концентрации ИУК в питательной среде 0,4-0,5 мг/л. При такой же концентрации ИМК частота укоренения была существенно ниже. На безгормональных средах частота укоренения микрочеренков не превышала 50-55%. При этом, наибольшее число корней на укорененный микрочеренок у этого гибрида образовалось на средах с ИМК и количество их росло с повышением концентрации этого ауксина в питательной среде. Как и у других культур меньше всего корней образовалось на безгормональных средах и эти корни наиболее активно росли.
Подобные результаты получены и при укоренении ремонтантной малины. Ремонтантная малина на безгормональных средах ризогенеза укореняется на 40,2-60,5% в зависимости от генотипа. На безгормональных средах образуется незначительное число корней на укорененный микрочеренок. На средах с ауксинами процесс формирования корней проходит быстрее и возрастает число корней на укорененный микрочеренок ремонтантной малины. Микрочеренки ремонтантной малины эффективно укореняются как при использовании ИМК, так и при использовании ИУК в разных концентрациях. Например, частота ризогенеза сорта Бриллиантовая была 57,1- 75,0% на средах с ИМК и 60,5 — 69,2 % на средах с ИУК. Среднее число корней на укорененный микрочеренок малины ремонтантной составляет от 1,4 до 2,4 шт. на безгормональных средах и от 2,6 до 4,5 шт. на среде с ауксином.
Эффективность применения разных ауксинов была изучена при укоренении декоративных культур. Как показали результаты наших опытов, частота укоренения легко укореняемых сортов сирени, таких как Нина, Мадам Казимир Перье, Никитская, как при использовании ИУК, так и при использовании ИМК достигала 80-95% (рис. 12). При этом число корней было большим на средах с ИУК (рис. 13), а интенсивность роста корней и побегов была схожей при использовании как одного, так и другого ауксина (рис. 14, 15).
| Рисунок 12 — Влияние типа и концентрации ауксина на эффективность укоренения сирени обыкновенной (сорт Мадам Казимир Перье). | Рисунок 13 — Влияние типа и концентрации ауксина на образование корней у микрорастений сирени обыкновенной (сорт Мадам Казимир Перье). |
| Рисунок 14 — Влияние типа и концентрации ауксина на рост корней у микрорастений сирени обыкновенной (сорт Мадам Казимир Перье). | Рисунок 15 — Влияние типа и концентрации ауксина на рост побегов сирени обыкновенной (сорт Мадам Казимир Перье). |
Эффективность укоренение роз также существенно зависит от биологических особенностей сорта, и у некоторых видов достигается практически 100% укоренение микропобегов [97].
Результаты наших исследований подтверждают эти данные. Сорт плетистой розы Цезарь укоренялся с частотой от 86,4 до 100% при концентрации ИМК от 0,125 до 0,5 мг/л и концентрации ИУК и НУК от 0,125 до 1,0 мг/л. Для сорт английской розы селекции Д. Остина Tess of the d’Urbervilles оптимальными были среды ризогенеза, содержащие 0,25 мг/л НУК и 1,0 мг/л ИУК. На этих средах частота ризогенеза микрочеренков была наибольшей (рис. 16). При этом максимальное число корней на укорененный микрочеренок образовалось на среде, содержащей 0,5 мг/л ИМК (рис. 17). Частота укоренения розы сорта Hope for Humanity, относящихся к канадским шрабам, также была максимальной (92,5%) при концентрации ИУК в питательной среде 1,0 мг/л. Высокая эффективность этого ауксина при укоренении микропобегов канадских роз была показана ранее Заидан с соавторами (2017). Есть данные, что в зависимости от генотипических особенностей сортов этой культуры лучшими для ризогенеза микрочеренков могут быть безгормональные среды. Так, при введении в состав питательной среды ИМК в концентрации 0,5-1,0 мг/л отмечали снижение частоты ризогенеза гибридов розы эфиромасличной в 1,7-2,3 раза по сравнению с безгормональной средой [60].
| Рисунок 16 — Эффективность укоренения розы (сорт Tess of the d’Urbervilles) на средах с разными ауксинами. | Рисунок 17 — Образование корней на микрочеренках розы (сорт Tess of the d’Urbervilles) на средах с разными ауксинами. |
Применение ИУК было эффективным и при укоренении клематиса. У ряда сортов, например, сорта Принцесса Диана на средах с этим ауксином сформировалась мощная корневая система и корни росли быстрее чем на средах с ИМК (рис. 18).
 |
 |
| а) | б) |
 |
 |
| в) | г) |
| Рисунок 18 — Развитие корневой системы клематиса (сорт Принцесса Диана) на среде МСУК: а) 0,4 мг/л ИМК; б) 0,4 мг/л ИУК; в) 0,8 мг/л ИМК, г) 0,8 мг/л ИУК. | |
В целом, степень развития корневой системы определялась, прежде всего, биологической предрасположенностью сорта к вегетативному размножению. Для большинства форм клематиса в культуре in vitro характерно образование длинных толстых корней. При этом ряд сортов хорошо укоренялось и на средах без регуляторов роста. Например, анализ динамики ризогенеза сорта Blue pirouette при использовании различных концентраций фитогормонов показывает, что быстрее всего корни у этой формы растут на среде МSук без гормонов. Процесс образования корней начинается через 2,5-3 недели культивирования. Через 3-4 недели начинается укоренение на средах с добавлением 0,2 — 0,5 мг/л ИМК.
На безгормональных средах как полного минерального состава (МС), так и редуцированного состава (МСук) укоренялись и сорта хосты Golden Tiara и Blue Cadet.
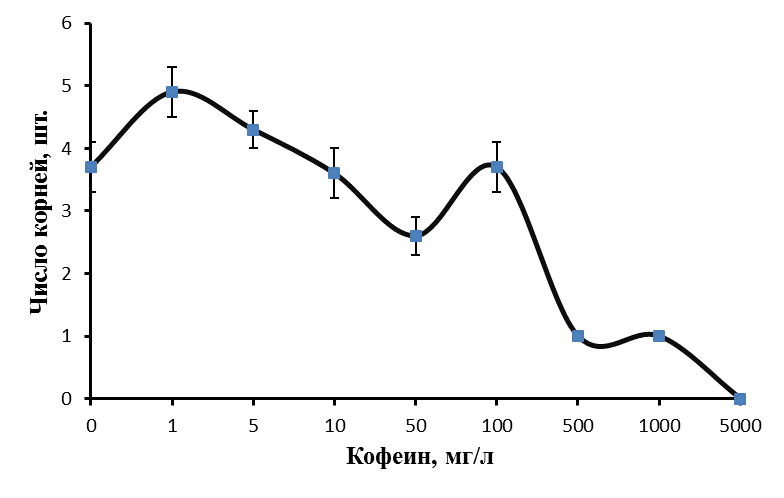
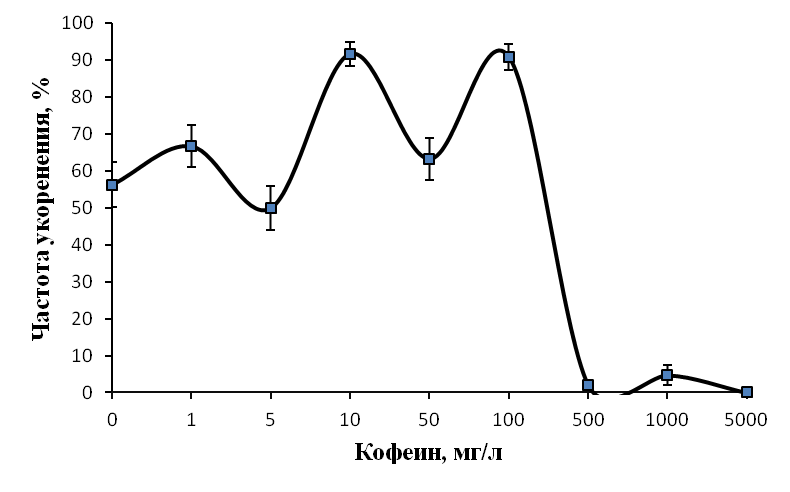
Изучали влияние кофеина в качестве регулятора роста. Полученные нами данные говорят о том, что включение кофеина в состав питательной среды укоренения может давать как положительный, так и отрицательный эффект в зависимости от используемой концентрации. Применение кофеина на этапе ризогенеза в концентрации 5-100 мг/л позволило повысить эффективность укоренения ежевики Логан Торнлесс (рис. 19).
Эффект кофеина в большей степени был выражен на ауксинсодержащих средах. Частота укоренения микрочеренков ежевики на среде с 1 мг/л ИМК, содержащей 5 мг/л кофеина, возросла до 71,4%, при концентрации кофеина в питательной среде 10 мг/л до 82,6%, при концентрации кофеина 100 мг/л до 78,3% по сравнению с 63,9% в контроле. При этом зависимость показателей ризогенеза от концентрации кофеина в среде не имела четкого линейного характера.
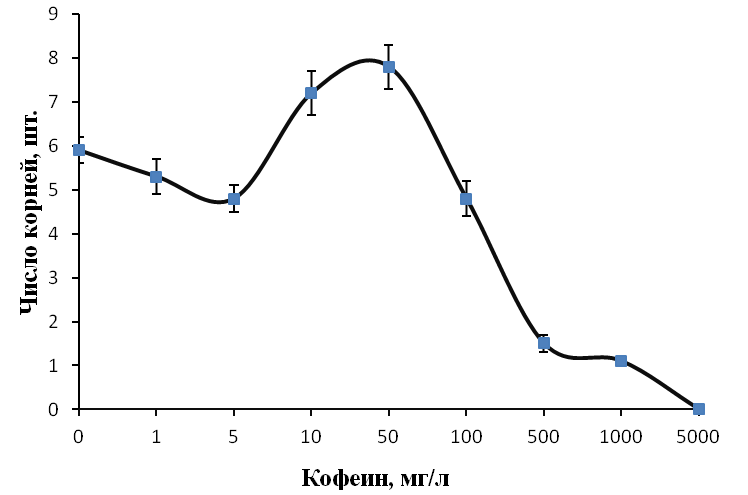
Максимальное число корней на укорененный микрочеренок было получено при низких концентрациях кофеина. При концентрации кофеина 1 мг/л среднее число корней на укорененный микрочеренок составило 4,9 шт. /побег, при концентрации кофеина 5 мг/л среднее число корней на укорененный микрочеренок было 4,3 шт. по сравнению с 3,7 шт. в контроле (рис. 20).
Стимуляция процесса корнеобразования была получена и на ежевике сорта Сантиам. Частота укоренения этого сорта на среде с 1 мг/л ИМК и 10 мг/л кофеина, возросла до 71,3% по сравнению с 40,1% в контроле, среднее число корней на укорененный черенок возросло до 3,4 шт. при концентрации кофеина в питательной среде 1 мг/л и до 2,9 шт. при концентрации кофеина в питательной среде 10 мг/л. На среде без ауксина частота укоренения микрочеренков возросла до 66,7% (контроль 46,7%) только при концентрации кофеина 100 мг/л.
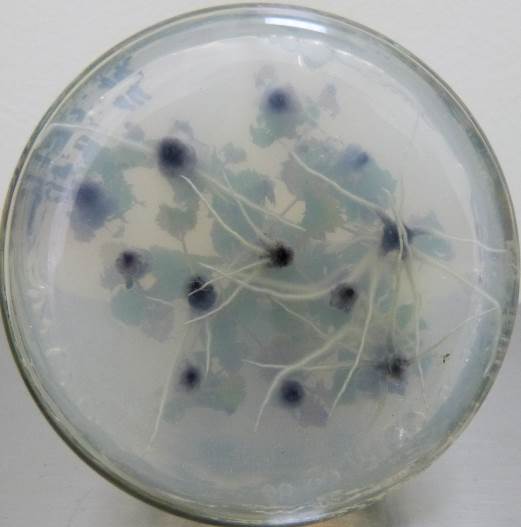
Низкие концентрация кофеина в питательной среде ускоряли процесс ризогенеза. Корни начинали образовываться быстрее, корневые зачатки закладывались дружно и одновременно (рис. 21). Корни росли быстрее на безгормональных средах, содержащих 5-100 мг/л кофеина, чем на средах, содержащих ауксин и кофеин одновременно.
| Рисунок 19 — Эффективность укоренения ежевики Логан Торнлесс
на среде MSУК с ИМК 1 мг/л при разной концентрации кофеина. |
 |
| Рисунок 20 — Образование корней у микрочеренков ежевики Логан Торнлесс
на среде MSУК с ИМК 1 мг/л при разной концентрации кофеина. |
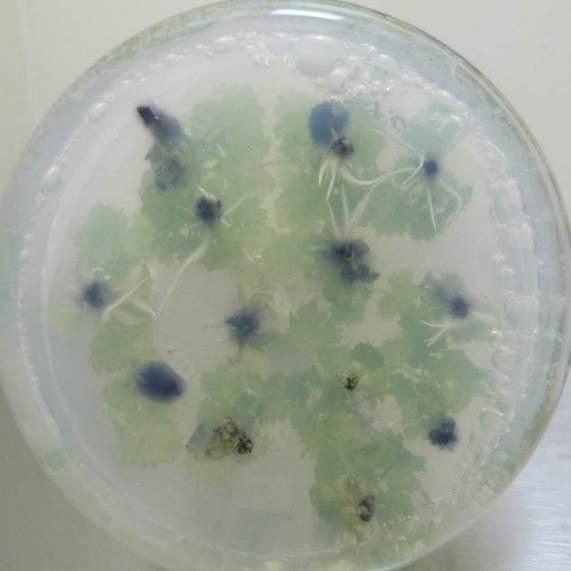
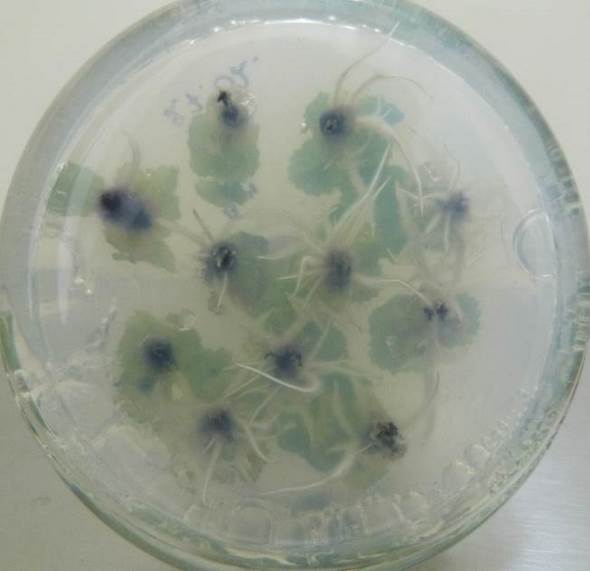
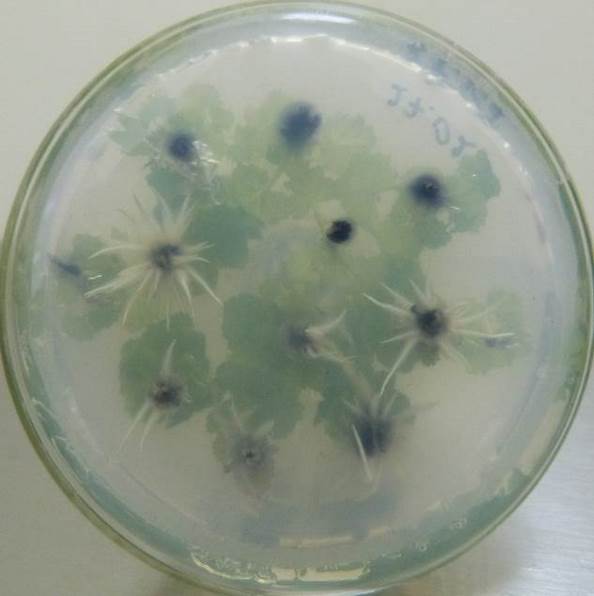
Содержание кофеина в питательной среде свыше 100 мг/л оказывало негативное действие на растительные ткани, замедляя и останавливая процесс образования корней, останавливая рост побегов и вызывая пожелтения листьев.
 |
 |
| а | б |
 |
 |
| в | г |
| Рисунок 21 — Ризогенез микрочеренков ежевики Логан Торнлесс
на среде MSУК с ИМК 1 мг/л при разной концентрации кофеина: а — контроль (без кофеина); б — кофеин 1 мг/л; в — кофеин 10 мг/л; г — кофеин 100 мг/л. |
|
Применение кофеина на этапе ризогенеза позволило в 1,6 раза повысить эффективность укоренения ежемалинового гибрида Бойзенберри. Частота укоренения возросла до 91,7% при концентрации кофеина 10 мг/л и до 90,9% при концентрации кофеина 100 мг/л по сравнению с 56,3% в контроле (рис. 22).
 |
| Рисунок 22 — Эффективность укоренения ежемалинового гибрида Бойзенберри
на среде MSУК с ИМК 1 мг/л при разной концентрации кофеина. |
Среднее число корней на укорененный микрочеренок возросло от 5,9 шт. в контроле до 7,2 и 7,8 шт. при концентрации кофеина 10 и 50 мг/л соответственно (рис. 23).
На контрольной среде без кофеина лишь отдельные микрочеренки укоренились быстро и образовали значительное число корней на укорененное микрорастение, тогда как на средах с кофеином образование корней происходило одновременно в массовом порядке (рис. 24). Это вело к сокращению продолжительности этапа ризогенеза и повышению экономической эффективности метода клонального микроразмножения.
В то же время присутствие кофеина в среде в высокой концентрации было губительным для растительных тканей, вызывая некрозы оснований побегов, погруженных в питательную среду и пожелтение листьев с последующим частичным некрозом тканей побегов. Подобные результаты были получены и на сортах ремонтантной малины. Частота укоренения сорта Геракл при концентрации кофеина 500 и 1000 мг/л была 0%, частота укоренения сорта Оранжевое чудо составила 7,7 и 11,1% соответственно.
 |
| Рисунок 23 — Образование корней у микрочеренков ежемалинового гибрида
Бойзенберрина среде MSУК с ИМК 1 мг/л при разной концентрации кофеина |
 |
 |
| а | б |
 |
 |
| в | г |
| Рисунок 24 — Ризогенез микрочеренков ежемалинового гибрида Бойзенберри
на среде MSУК с ИМК 1 мг/л при разной концентрации кофеина: а — контроль (без кофеина); б — кофеин 5 мг/л; в — кофеин 10 мг/л; г — кофеин 50 мг/л. |
|
Полученные нами результаты позволяют сделать вывод о том, что кофеин может использоваться как стимулятор ризогенеза при добавлении его в среду укоренения в оптимальной концентрации. Наиболее эффективным при укоренении рода Rubus определен диапазон концентраций кофеина в среде от 1 до 100 мг/л. Содержание кофеина в среде в питательной среде свыше 0,1% оказывало негативное действие на растительные ткани, замедляя и останавливая процесс образования корней, останавливая рост побегов и вызывая некроз тканей.
3.2 Повышение эффективности ризогенеза садовых культур применением биофизических факторов воздействия.
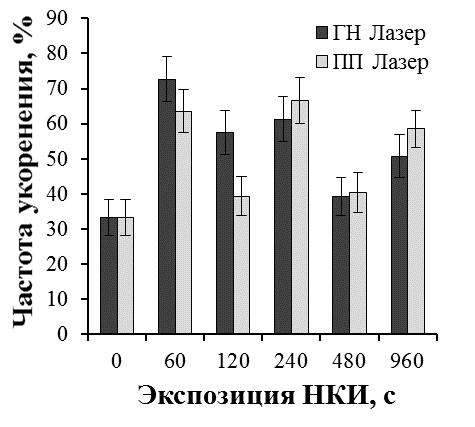
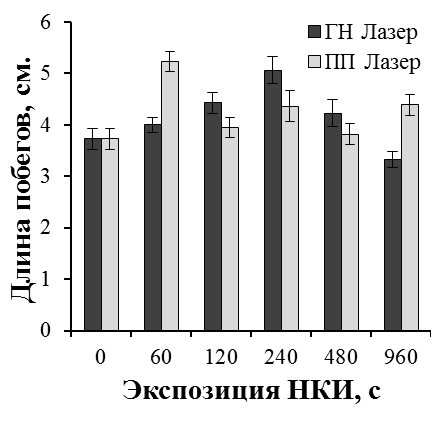
Результаты наших исследований показали, что лазерное облучение микрочеренков может существенно влиять на эффективность ризогенеза и рост побегов культивируемых растений. Эффект лазерного излучения был наиболее выражен при обработке культур с более низким морфогенетическим потенциалом. Так, существуют определенные трудности на этапе укоренения микрочеренков ремонтантной малины in vitro. В целом, процесс укоренения микрочеренков ремонтантной малины достаточно длителен (до двух месяцев). В результате на укорененном микрочеренке образуется 2-4 длинных корня с корешками второго порядка. Поэтому прибегают к различным способам стимуляции ризогенеза, как путем применения препаратов с ауксиновой активностью, биопрепаратов, так и регуляцией спектрального состава света на этапе укоренения [31, 37].
В проведенных нами исследованиях применение НКИ в 1,5-2,2 раза повысило эффективность ризогенеза малины ремонтантной сорта Оранжевое чудо (рис. 25). При оптимальных экспозициях облучения процесс образования корней значительно ускорялся. Через шесть недель культивирования в контроле частота укоренения составила 33,3%, при облучении гелий-неоновым лазером 72,7% (экспозиция 60 с), 61,3% (экспозиция 240 с), при облучении полупроводниковым лазером 63,6% (экспозиция 60 с), 66,6% (экспозиция 240 с). В лучших вариантах опыта увеличилось количество корней на укорененный микрочеренок и корни росли быстрее. Так, средняя длина корней при облучении гелий-неоновым лазером при экспозиции 60 с была 4,7 см, при экспозиции 120 с — 4,5 см, при облучении полупроводниковым лазером 4,7 см при экспозициях 60 с и 480 с по сравнению с 3,5 см в необлученном контроле.
Более мощное развитие корневой системы привело и к более быстрому росту побегов облученных микрорастений уже на этапе укоренения (рис. 26).
 |
 |
| Рисунок 25 — Влияние лазерного облучения на эффективность укоренения ремонтантной малины сорта Оранжевое чудо. | Рисунок 26 — Влияние лазерного облучения на рост побегов ремонтантной малины сорта Оранжевое чудо. |
Подобные результаты получены и на других сортах ремонтантной малины. Так, удалось повысить частоту укоренения микрочеренков ремонтантной малины сорта Рубиновое ожерелье на среде MSУК с 1,0 мг/л ИМК с 55,6% в контроле до 84,4% при облучении гелий-неоновым лазером (экспозиция 120 с) и 80,4% (экспозиция 960 с). Число корней на укорененный микрочеренок возросло соответственно c 2,0±0,2 шт. до 2,9±0,3 и 3,0±0,3 шт. соответственно. В лучших вариантах опытов получены хорошо развитые микрорастения ремонтантной малины, которые можно было высаживать в почву на адаптацию.
Положительный эффект лазерной стимуляции получен и на культурах, отличающихся хорошей способностью к укоренению микрочеренков in vitro.
При оптимальных параметрах облучения корневая система облученных растений отличалась значительно лучшим развитием по сравнению с контрольными растениями. Подобный результат был получен на разных сортах ежевики и актинидии. Так, частота укоренения ежевики Блэк Сэтин на среде QLУК с 0,5 мг/л ИМК через месяц культивирования при 2-х минутной экспозиции облучения гелий-неоновым лазером составила 75,9% по сравнению с 46,1% в контроле. Эффект стимуляции достигался как при использовании гелий-неонового лазера, так и полупроводникового, но в каждом случае самыми оптимальными были разные экспозиции облучения (рис. 27). Частота укоренения ежемалинового гибрида Логанберри на среде MSУК с 0,5 мг/л ИМК при 16-ти минутной экспозиции облучения гелий-неоновым лазером составила 46,7%, при 4-х минутной экспозиции облучения полупроводниковым лазером укоренилось 42,1% микрочеренков по сравнению с 27,8% в контроле. Лазерное облучение существенно повлияло на количественные и качественные показатели корневой системы. При оптимальных параметрах облучения у растений сформировалась мощная корневая система без изменения состава питательной среды только за счет активизации работы фитохромного механизма растений и как следствие повышенного синтеза эндогенного ауксина.
Например, у микрочеренков ежевики Блэк Сэтин на среде QLУК с 0,5 мг/л ИМК среднее число корней при 2-х минутной экспозиции облучения гелий-неоновым лазером при плотности мощности 2 Вт/м2 возросло до 5,9±0,6 шт. и при 4-х минутной экспозиции до 6,0±0,6 шт. по сравнению с 3,9±0,4 шт. в контроле. У микрочеренков ежевики Блэк Сатин, облученных гелий-неоновым лазером, на среде QLУК с 1 мг/л ИМК среднее число корней при 4-минутной экспозиции и плотности мощности 2 Вт/м2 возросло до 7,4±0,7 шт. по сравнению с 4,2±0,6 шт. в контроле (рис. 28). При облучении полупроводниковым лазером — число корней при экспозиции 60 с составило 6,7±0,8 шт., при экспозиции 480 с – 7,8±0,9 шт. Различия с контролем статистически существенны (P>0,98).
 |
 |
| Рисунок 27 — Влияние лазерного облучения на эффективность укоренения ежевики Блэк Сатин. | Рисунок 28 — Влияние лазерного облучения на образование корней у ежевики Блэк Сатин. |
У облученных микрочеренков актинидии коломикта (сорт Изобильная), культивируемых на среде QLУК с 0,25 мг/л ИМК, среднее число корней на укорененный микрочеренок возросло от 6,8±0,6 шт. при 2-х минутной экспозиции и плотности мощности 2 Вт/м2 до 8,2±0,6 шт. при 16-ти минутной экспозиции по сравнению с 5,9±0,4 шт. в контроле. При оптимальных параметрах облучения у растений сформировалась мощная корневая система без изменения состава питательной среды (рис. 29) только за счет активизации работы фитохромного механизма растений и как следствие повышенного синтеза эндогенного ауксина. Корневые зачатки при облучении закладывались практически одновременно, что приводило к выравниванию длины образующихся корней и хорошему качеству укорененных микрорастений.
 |
 |
 |
| а | б | в |
 |
 |
 |
| г | д | е |
| Рисунок 29 — Ризогенез микрорастений актинидии коломикта (сорт Изобильная) при облучении гелий-неоновым лазером:
а – (контроль); б — 60с; в — 120с; г — 240с; д — 480с; е — 960с. |
||
Вызванная лазерной обработкой стимуляция развития корневой системы не только улучшала показатели ризогенеза, но обусловила более интенсивный рост побегов ягодных культур уже на этапе укоренения (рис. 30). При этом в зависимости от типа используемого лазера при одной и той же экспозиции облучения эффект был выражен в разной степени (рис. 31).
 |
| Рисунок 30 — Развитие побегов ежевики сорта Блэк Сатин на этапе укоренения
после облучения микрочеренков (справа – контроль, слева – гелий-неоновый лазер, экспозиция 240с). |
 |
| Рисунок 31 — Рост микропобегов ежевики сорта Блэк Сатин на этапе укоренения
при 480 с экспозиции облучения: справа – полупроводниковым; слева – гелий-неоновым лазером. |
Таким образом, лазерное когерентное излучение положительно влияет на рост и развитие эксплантов in vitro. Применение НКИ на этапе ризогенеза существенно стимулирует процесс укоренения микрочеренков in vitro и способствует увеличению числа и длины корней и росту побегов. Стимулирующий эффект получен как при использовании гелий-неонового лазера, так и полупроводникового. Степень достигнутого эффекта нелинейно зависит от продолжительности воздействия, для оптимизации режимов лазерной обработки необходимо использовать различные длительности облучения: 4-6 экспозиций.
Как показали результаты наших исследований, степень достигнутого эффекта при использовании УЗ в значительной степени зависит от биологических особенностей культур, включенных в исследования.
Применение ультразвукового облучения для стимуляции ризогенеза жимолости показало, что для этой культуры наиболее эффективными были варианты с низкими значениями плотности мощности (0,7-2,7 Вт/см2). Это, по нашему мнению, связано с морфологическими особенностями культуры в условиях in vitro, а именно, тонкими побегами, удлинёнными междоузлиями, мягким эпидермисом.
Как правило, чем ниже была укореняемость микрочеренков в контроле, тем больше был выражен положительный эффект ультразвукового излучения. Кроме того, на эффективность ризогенеза влиял способ введения ауксина – индуктора ризогенеза в микрочеренки. Так, при укоренении микрочеренков ирги сорта Менден положительный эффект был получен как при выдерживании микрочеренков в течение суток в растворе ИМК (50 мг/л) после их обработки УЗ, так и при высадке их после озвучивания на среду укоренения, содержащую 0,5 мг/л ИМК.
При использовании цилиндрической насадки излучателя итоговая частота укоренения при культивировании на среде МSук с 0,5 мг/л ИМК возросла более чем на 30 % с 53,3 в контроле до 86,7 % в 3 варианте опыта (рис. 32). Число корней на укорененный микрочеренок возросло более чем в два раза с 1,6 шт. в контроле до 3,5 шт. в 3 варианте и до 3,7 шт. в 7 варианте опыта (рис. 33). Длина образовавшихся корней была примерно равной во всех вариантах.
При оптимальных параметрах озвучивания процесс корнеобразования на микрочеренках начался быстрее. Итоговая частота укоренения изменилась в опытных вариантах с замачиванием микрочеренков в растворе ИМК не слишком значительно (рис. 32), в то время как число корней на укорененный микрочеренок в лучших вариантах опыта увеличилось более чем в два раза, например, с 3,1 шт. в контроле до 7,6 шт. в 6 варианте при мощности ультразвука 4,7 Вт/см2 (рис. 33). Длина корней также была больше у опытных растений.
| Рисунок 32 — Влияние УЗ на эффективность укоренения ирги сорта Менден. |
| Рисунок 33 — Влияние УЗ на интенсивность корнеобразования на
микрочеренках ирги сорта Менден. |
При высадке облученных микрочеренков на среду укоренения с 0,5 мг/л ИМК сразу после озвучивания процесс укоренения начался практически одновременно во всех вариантах опыта, но проходил интенсивнее в вариантах с озвучиванием (рис. 34).
 |
 |
| а | б |
 |
 |
| в | г |
 |
 |
| д | е |
| Рисунок 34 — Ризогенез микрочеренков ирги (сорт Менден) на среде МSук с 0,5 мг/л ИМК после обработки УЗ: а – вариант 1; б – вариант 3; в – вариант 5; г – вариант 7;
д – вариант 9; е – контроль. |
|
Следует отметить, что при одинаковой мощности излучения выдерживание микрочеренков в растворе ИМК приводило к более интенсивному корнеобразованию (рис. 35).
При использовании конической насадки излучателя эффект в ряде случаев был выражен не так ярко. Так, при укоренении озвученных микрочеренков сирени на среде с ауксином при достаточно высокой итоговой частоте ризогенеза, эффективность укоренения микрочеренков в разных вариантах опыта была схожей и превышала контроль не более чем на 10-15 %.
 |
 |
| А | б |
| Рисунок 35 — Влияние УЗ облучения (2,7 Вт/см2) на интенсивность корнеобразования на микрочеренках ирги сорта Менден: а — 0,5 мг/л ИМК в среде укоренения;
б — выдерживание в растворе ИМК 50 мг/л, 24 ч. |
|
При этом практически во всех случаях выросло количество корней на укорененный черенок (рис. 36, 38) и после обработки микрочеренков УЗ они росли быстрее (рис. 37, 38). Активное развитие корневой системы на среде укоренения обеспечило интенсивный рост побегов сирени на этапе ризогенеза.
| Рисунок 36 — Влияние УЗ на интенсивность корнеобразования на микрочеренках
сирени сорта Бюффон на среде МSук с 0,5 мг/л ИМК. |
| Рисунок 37 — Влияние УЗ на рост корней сирени сорта Бюффон
на среде МSук с 0,5 мг/л ИМК. |
 |
 |
 |
| а | б | в |
 |
 |
 |
| г | д | е |
| Рисунок 38 — Влияние УЗ излучения на развитие корневой системы у микрорастений сирени обыкновенной (сорт Бюффон): а) контроль без УЗ; б) 1 вариант- 1,15 Вт/см2;
в) 2 вариант-3,6 Вт/см2; г) 3 вариант-7,2 Вт/см2; д) 4 вариант- 11,5 Вт/см2; е) 5 вариант — 14,1 Вт/см2. |
||
3.3 Влияние сроков высадки в почву и физических факторов на эффективность адаптации садовых культур.
Заключительным и наиболее ответственным этапом клонального микро размножения является адаптация микрорастений к нестерильным условиям. Эффективность адаптации зависит от комплекса факторов: типа используемого субстрата, освещенности, температуры и влажности воздуха, инфекционной нагрузки, деятельности устьичного аппарата, степени развития листового аппарата и корневой системы [2, 15, 121].
При культивировании in vitro биологический ритм развития растений нарушен, что особенно заметно в случае с косточковыми и семечковыми породами [30]. Если после пересадки в почвенный субстрат микрорастение подвергается какому-либо стрессу — водному, температурному, световому — включается в действие генетическая память, и оно переходит в состояние покоя. В покое растение может находиться достаточно долго и прервать это состояние можно только продолжительным воздействием низких положительных температур. Если выращивать растения в прежних условиях, то покой все же периодически прерывается, что заметно по пробуждению почек, но прироста так и не образуется [110].
Перевод пробирочных растений в нестерильные условия затруднен по двум основным причинам – слабого контроля самим растением транспирации и их пониженной способностью к фотосинтезу вследствие гетеротрофного способа питания. Известно, что растения, выросшие in vitro, при влажности воздуха близкой к 100% очень восприимчивы к ее изменению. Из-за неработоспособности устьичного аппарата может произойти быстрое усыхание листьев в условиях in vivo.
После пересадки в нестерильные условия микрорастения испытывают водный стресс, проявляющийся в обезвоживании тканей и в разрушении мембран. Особенно чувствительны растения к иссушению сразу после их извлечения из культуральных сосудов. Уже спустя 40 минут после нахождения растений при относительной влажности воздуха 40% наблюдается потеря листьями более 40% воды, а в течение первых 15-30 минут — повреждение клеток [80]. Поэтому до высадки в почву микрорастения следует переносить в адаптационные помещения в закрытых контейнерах с небольшим количеством воды. В ряде случаев, например, при адаптации гейхеры, растения лучше из культуральных сосудов сразу высаживать в субстрат.
Важнейший компонент адаптации – закрытие устьиц, которое в свою очередь может произойти при относительной влажности воздуха 65% [83]. Однако такая влажность опасна гибелью растений. Поэтому многие исследователи рекомендуют определенное время поддерживать влажность воздуха в пределах 95-99% и постепенно, в течение 10-14 дней, снижать влажность до 50-60%. Некоторые авторы советуют уменьшать влажность на 5% в день. Такую процедуру возможно провести в рамках эксперимента и крайне сложно в промышленных масштабах. Однако необходимо снижать уровень влажности после образования новых листьев у пересаженных растений [112].
По нашим наблюдениям высокая влажность субстрата и воздуха на этапе адаптации, особенно в сочетании с пониженной температурой (15-20 ºС) и недостаточной освещенностью крайне опасны для микрорастений. При нахождении в таких условиях более двух недель микрорастения могут перейти в долговременное состояние покоя, из которого их будет очень трудно вывести.
Такой эффект мы наблюдали при адаптации разных видов актинидии. При высадке растений на адаптацию в почву в феврале месяце в пасмурные дни при отсутствии дополнительного освещения и температуре 18ºС, при регулярном орошении микрорастений происходило замокание субстрата, растения, подвергшиеся стрессу или, погибали, или переходили в состояние физиологического покоя, из которого не выходили даже при оптимизации температурного и светового режима.
Как следует из наших наблюдений. при высадке микрорастений на адаптацию важно, как можно скорее, добиться образования и роста новых листьев, увеличения продуктивности фотосинтеза и поступления ассимилятов в растение, что смягчает водный стресс после пересадки. В одинаковых условиях микрорастения ягодных культур с большой массой и хорошо развитой листовой поверхностью, как правило, приживались с наименьшими потерями и активней развивались на этапе акклиматизации к условиям ex vitro.
При изучении теплового и водного режима пленочных теплиц, в которых происходит адаптация пробирочных растений, было установлено, что суточные колебания температуры воздуха в теплице (до 20ºС) не оказывают влияния на процесс адаптации, которая успешно идет даже при температуре воздуха в теплице +40ºС. В этом случае относительная влажность воздуха поддерживается постоянной на уровне не ниже 75%.
Как было показано на растениях земляники, температурный шок в теплице (из-за разницы между дневными температурами в +15 и + 40ºС) в момент пересадки пробирочных растений может даже оказывать на них положительное влияние [21, 22].
Многие авторы отмечают влияние сроков пересадки в асептические условия на успешный рост полученных in vitro растений. У регенерантов вишни, перенесенных из пробирок в нестерильные условия в марте, были отмечены хорошая приживаемость (68-90%) и интенсивный верхушечный рост, тогда как в середине декабря растения не трогались в рост. Пробирочные растения яблони, пересаженные в третьей декаде мая, хорошо адаптируются в пленочных теплицах. Растения, высаженные в более поздние сроки, развиваются гораздо хуже [32]. По другим источникам оптимальный срок переноса растений в почвенный субстрат — период с сентября по март. В весенне — летний период выпады микрорастений значительно увеличиваются из-за высокой температуры воздуха в культивационных сооружениях [12].
Из нашего опыта работы следует, что наименее трудоемка и экономически выгодна сезонная адаптация полученных in vitro растений. В этом случае активно размножали с октября по декабрь, с января месяца микрочеренки переносили на среды укоренения и после образования корней микрорастения из культуральных сосудов высаживали в субстрат. Оптимальная температура для высадки большинства видов растений +23-260 С. Влажность воздуха в теплице в первые дни адаптации должна быть близка к 100%, затем ее постепенно снижают. При этом важно не допустить замокания корней, т.к. это может привести к их отмиранию и последующей гибели растений.
При проведении адаптации в условиях зимних отапливаемых теплиц, с регулируемой температурой и дополнительным освещением оптимальным сроком высадки микрорастений в субстрат является вторая половина февраля – апрель. Важно, чтобы растения в первые недели после высадки в почву не попали в стрессовые условия, поскольку отсутствие оптимальных для данного вида параметров среды на начальном этапе адаптации может привести к стойкому замедлению роста растений и свести на нет все преимущества более ранних сроков перевода в условия ex vitro (рис. 39). Высадка микрорастений в более поздние сроки, но в оптимальные условия температуры и влажности обеспечивала более интенсивное развитие растений (рис. 40).
 |
 |
| Рисунок 39 — Растения актинидии аргуты, высаженные на адаптацию в феврале месяце в условия повышенной влажности при естественном освещении и температуре 17-19ºС. | Рисунок 40 — Растения актинидии аргута, высаженные на адаптацию в апреле месяце в условия нормальной влажности при естественном освещении и температуре 24-26ºС. |
Следует исключить воздействие прямых солнечных лучей на микрорастения на начальном этапе адаптации, т.к. это может привести к ожогам листьев на которых будут капельки воды. Если адаптация проводится при естественном освещении для затенения микрорастений следует использовать сетчатые ширмы или укрывной материал типа «Спанбонд». В зависимости от длины светового дня в момент перевода микрорастений в нестерильные условия можно довольствоваться естественным освещением или использовать досветку лампами дневного света. При отрастании новых листьев в нестерильных условиях интенсивность освещения следует увеличивать, доводя постепенно до уровня естественного.
При соблюдении основных необходимых физических параметров, обязательных для данного этапа, адаптацию микрорастений можно успешно провести, используя недорогие малогабаритные пленочные укрытия. Наличие зимних отапливаемых теплиц, где можно разместить эти парники значительно расширяет временные рамки для прохождения этого этапа. Допустимая гибель микрорастений при соблюдении оптимальных условий адаптации составляет не более 5-10%.
При создании требуемого микроклимата и высадке микрорастений в указанные сроки многие культуры переходят в условия ex vitro с высокой частотой и быстро развиваются (рис. 41 и рис. 42).
 |
 |
| Рисунок 41 — Растения ежемалинового гибрида (сорт Торнфри) на этапе адаптации (6 недель после высадки). | Рисунок 42 — Растения гейхеры на этапе адаптации (6 недель после высадки). |
3.4 Влияние условий прохождения этапа ризогенеза in vitro на развитие растений на этапе адаптации к условиям ex vitro.
Как следует из наших данных, степень развития корневой системы на этапе ризогенеза во многом определяет интенсивность развития растений при пересадке их в почву. Так, растения, укорененные на среде, содержащей 0,25- 0,5 мг/л индолилмасляной кислоты, отличались более активным приростом, по сравнению с растениями, укорененными на среде без гормонов. Поскольку каждый вид и сорт растений предъявляет свои требования к условиям культивирования, для укоренения микрочеренков применяли различные типы ауксинов и их концентрации.
При выборе оптимальных условий корнеобразования старались добиться образования мочки корней при незначительном образовании каллуса (рис. 43, рис. 44).
Например, высокие результаты (85-95%) приживаемости растений сирени при пересадке в нестерильные условия получены в варианте совместного использования на этапе укоренения 6-БАП и ИМК. Приживаемость растений, укорененных на средах с использованием только ИМК, была ниже и не превышала 80%. Приживаемость растений сирени зависела от концентрации использованных регуляторов роста. Для сортов Сенсация и Примроуз адаптация растений лучше проходила при концентрации ИМК в среде укоренения 1,0 мг/л, в то время как остальные сорта лучше приживались при укоренении на средах с 0,25-0,5 мг/л ИМК. Сорта Флора, Виолетта, Самал, Надежда и Сенсация лучше приживались при пересадке в нестерильные условия, чем Примроуз и Богдан Хмельницкий.
 |
 |
| Рисунок 43 — Укорененные на среде QLУК с 0,5 мг/л ИМК микрочеренки ежевики (сорт Эльдорадо) перед высадкой на адаптацию. | Рисунок 44 — Укорененные на среде QLУК с 0,25 мг/л ИМК микрочеренки актинидии коломикта (сорт Изобильная) перед высадкой на адаптацию. |
Более мощное развитие корневой системы in vitro отражалось на росте растений и после их высадки на адаптацию в теплицу. Эффективность адаптации при высадке крепких (4-8 см), необводненных побегов с хорошо развитым листовым аппаратом и корневой системой, состоящей из 4-9 корней с корешками второго порядка, на 10-20% выше по сравнению с вариантами, когда на адаптацию высаживали слабые растения.
Результаты нашей работы показали, что стимулирование ризогенеза лазерным воздействием на этапе укоренения влияет на развитие и рост микрорастений на этапе адаптации в теплице. Растения в лучших вариантах облучения отличаются большей скоростью роста и более развитой корневой системой, состоящей из 4- 10 крупных корней длиной не менее 10-15 см и хорошо развитой мочкой по сравнению с контрольными. Прирост надземной части был существенно больше у облученных растений (рис. 45-49).
 |
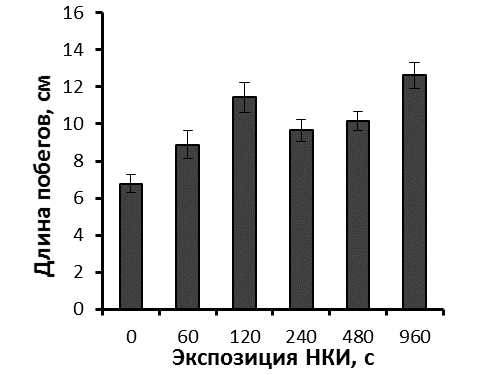 |
|
|
Рисунок 46 — Прирост облученных растений актинидии коломикта (сорт Изобильная) на этапе адаптации. |
Эффект последействия лазерного излучения на биометрические показатели растений был показан нами на разных культурах. Наиболее четко он проявлялся на начальном этапе адаптации микрорастений (рис. 47-49).
 |
| Рисунок 47 — Этап адаптации ежевики: слева — контроль, справа — ГН-лазер, 480с. |
Таким образом, комплексное использование методов культуры тканей растений и средств и методов биофотоники позволяет увеличить выход и качество растений in vitro практически без дополнительных затрат.
Высадка в почву хорошо развитых укорененных микрорастений увеличивает приживаемость пробирочных растений на этапе адаптации и способствует лучшему развитию саженца.
 |
|
| Рисунок 48 — Этап адаптации актинидии коломикта (сорт Изобильная):
справа-контроль, слева ГН-лазер, 120с. |
|
 |
 |
| а | б |
| Рисунок 49 — Развитие растений актинидии коломикта на этапе адаптации
(сорт Изобильная): а-контроль, б — ГН-лазер, 120с. |
|
3.5 Влияние субстрата и минеральных подкормок на развитие микрорастений на этапе адаптации
Многие работы по адаптации растений к нестерильным условиям подтверждают большое значение субстрата, в котором происходит их акклиматизация. Как правило, при адаптации пробирочных растений используют искусственные субстраты, состоящие из органической основы (кора хвойных пород, торф, компост, льняная костра, почва, древесные опилки) [74, 109] и инертных материалов (песок, вермикулит, минеральная вата, перлит, цеолит) [3, 23, 89, 110, 125, 127] в разном соотношении компонентов.
При переводе регенерантов в почвенные условия применяют различные технологические элементы, которые улучшают качество субстратов. Обычно в качестве компонента, удерживающего влагу, используют слаборазложившийся торф из сфагнового мха, а для улучшения воздушного режима- крупнозернистый песчаник, не содержащий щелочных примесей. Для улучшения агрофизических и физико-химических показателей субстратов используют природный материал – вермикулит.
В наших исследованиях почвогрунты готовили на основе субстрата на основе верхового сфагнового торфа «Агробалт-С». Использовали следующие варианты: 1) субстрат на основе верхового сфагнового торфа; 2) торф: речной песок (3:1); 3) торф : вермикулит (3:1); 4) торф : речной песок : перегной (2 : 1: 1); 5) торф : вермикулит : перегной (2 : 1: 1).
Как показали результаты наших исследований, все использованные типы субстратов вполне подходят для адаптации микрорастений садовых культур. По ряду культур эффективность адаптации и биометрические показатели адаптированных растений имели сходные показатели в разных вариантах опыта (табл. 1).
Таблица 1 — Влияние состава субстрата на эффективность адаптации и развитие микрорастений жимолости (сорт Волхова).
| Субстрат | Приживаемость растений, % | Высота побегов, см. | Количество корней, шт./растение | Средняя длина корней, см. |
| Субстрат на основе торфа | 78,8 | 10,8 | 4,4 | 6,0 |
| Торф : речной песок (3:1) | 70,5 | 9,4 | 3,6 | 6,2 |
| Торф: вермикулит (3:1) | 83,4 | 10,6 | 4,3 | 7,1 |
| Торф : речной песок : перегной (2 : 1: 1) | 80,6 | 13,2 | 4,9 | 7,3 |
| Торф : вермикулит : перегной (2 : 1: 1) | 86,2 | 14,7 | 5,0 | 7,9 |
Лучшие результаты получены при использовании субстрата торф : вермикулит : перегной (2 : 1: 1). Добавление в верховой торф только речного песка не имело положительного эффекта.
Растения каждого сорта и вида поглощают питательные элементы в различных количествах и соотношениях, что определяется их потребностью в минеральных веществах. В этом одна из причин изменения первоначального баланса раствора в течение вегетации.
Поглощаемые растением ионы, находятся во взаимосвязи, которая в зависимости от их специфических свойств, электрического заряда и концентрации питательного раствора проявляется как антагонизм (снижают поглощение) и синергизм (увеличивают поглощение).
Антагонизм проявляется наиболее часто между катионами K и Ca, Na Mg, В, Ca и Н, Mg, K, Na и NH4, Na и Mg.
У анионов антагонизм выражен слабее, только анионы с общими свойствами конкурируют между собой. Для каждой культуры и для определенных фаз развития концентрация питательного раствора различна. Обычно ее выражают через удельную электропроводность ЕС в мs, где 1 мs = 700 мг соли на 1 литр или 3 мs/см = 1 атм осмотического давления. Содержание элементов питания в растворах, соотношение Na к K может манятся по фазам развития растений, а также в зависимости от погодных условий и данных анализов субстратов.
Основным требованием при приготовлении растворов является равенство суммы катионов и анионов. В настоящее время расчет производится мл/л или молях.
Соотношение между единицами измерения.
1 ммоль аммония NH4 = 1 мэкв NH4 = 14 мг N
1 ммоль калия К = 1 мэкв К = 39,1 мг К
1 ммоль кальция Са = 2 мэкв Са = 40,1 мг Са (т.к. Са двухвалентный)
1 ммоль магния Mg = 2 мэкв Mg = 24,3 мг Mg (т.к. Mg двухвалентный)
1 ммоль нитрата NО3 = 1 мэкв NО3 = 14 мг N
1 ммоль бикарбоната НСО3 = 1 мэкв НСО3 = 61 мг НСО3
Как правило, при использовании миксеров готовят маточный раствор заданной концентрации необходимой для полива.
С оборудованием поставляют два бака для удобрений (А и В) и один для кислот (С). Бак А служит для растворения кальциевой селитры, остальных селитр, хелата железа. В баке В готовят маточный раствор для оставшихся водорастворимых удобрений, возможно добавление фосфорной кислоты. Бак С служит для хранения кислот.
Маточный раствор микроэлементов готовят отдельно, при этом необходимо соблюдать следующий порядок. Борную кислоту растворять в горячей воде, возможно подкислить кислотой для лучшего растворения, затем сернокислый цинк, затем поочередно добавляют марганец сернокислый, медь сернокислую, аммоний молибденовый, раствор тщательно перемешивают и вносят в бак В.
Чтобы облегчить растворение, резервуары на 70-80% объема заполняют водой, затем последовательно удобрения, каждый раз энергично перемешивают до полного растворения. Не рекомендуется предварительно смешивать удобрения и потом растворять их в воде. Нельзя смешивать концентрированные растворы удобрений, содержащих кальций и серу, поскольку при этом образуется гипс, который забивает капельницы и регулирующие вентили.
Подача рабочего раствора возможна разной концентрации из одного и того же маточного. Это зависит от количества удобрений на один куб воды.
Низко концентрированные менее 0,8 мs
Средне концентрированные 0,8 – 1,5 мs
Нормально концентрированные 1,5 – 2,5 мs
Высоко концентрированные более 3,5 мs
При капельном поливе вода доводится до оптимальной рН, и только затем растворяют удобрения. Оптимальной для растений является РН 5-6,5 При использовании миксеров это осуществляется автоматически подачей кислоты из бака С.
Для подкормки микрорастений на этапе адаптации мы использовали питательный раствор с концентрацией 1,5-2 мs, применяемый для выращивания огурца при малообъемной технологии на минераловатном субстрате. Кроме того, использовали разбавленный в 4 раза раствор минеральных солей по прописи Мурасиге-Скуга и комплексное минеральное удобрение (Азофоска, 20 г/10 л раствора).
Большинство включенных в исследования генотипов переходили в нестерильные условия с высокой частотой и хорошо развивались на этапе адаптации, что делает их весьма перспективными культурами для тиражирования современной технологией вегетативного размножения.
Грунт для посадки должен быть легким и свободным от болезней. Для субстрата лучше использовать торф верховой с необходимой кислотностью, освободить его от микроорганизмов можно с помощью термической обработки. Для дезинфекции лучше использовать фунгицид Топсин М.
После того как микрорастения успешно приживались в почве, более интенсивному развитию саженцев способствовали регулярные (1 раз в 2 недели) подкормки растений растворами минеральных солей, содержащими основной набор макро и микроэлементов (табл. 2).
Как следует из полученных нами данных, любой вариант подкормки оказывал благоприятное воздействие на рост и развитие растений, но лучшие результаты получены при использовании минеральной основы среды Мурасиге-Скуга и питательного раствора для выращивания тепличного огурца.
Спустя 8 недель растения в зависимости от вида вырастают на высоту от 10 до 40 см, после этого их можно сажать в питомник (однако не позже чем во второй половины июля), или оставить их в теплице, пересадив в горшки.
Таблица 2 — Влияние минеральных подкормок на развитие микрорастений ежемалинового гибрида Тайберри.
| Варианты | Среднее число корней, см | Средняя длина корней, см | Высота побегов, см | Среднее число листьев, шт. |
| Контроль (без подкормки) | 3,8 | 12,6 | 14,1 | 9,3 |
| ¼ минеральных солей среды МС | 5,2 | 17,4 | 22,3 | 12,5 |
| Питательный раствор для выращивания огурца | 5,5 | 18,2 | 21,8 | 11,8 |
| Азофоска (20 г/10 л раствора) | 4,7 | 15,2 | 17,1 | 10,0 |
3.6 Влияние корневых обработок микрорастений бактериальными препаратами на рост и развитие растений на этапе адаптации
Использование всех типов микробиологических удобрений способствует получению экологически чистой продукции (табл. 3), поэтому широко используется в органическом земледелии.
Таблица 3 — Сравнительная характеристика различных видов удобрений
| Минеральные | Органические | Микробиологические | |
| Питание растений | + | + | + |
| Почвоулучшение | — | + | + |
| Отрицательные последствия передозировки | + | + | _ |
| Экологичность | — | +/- | + |
| Подавление фитопатогенной микрофлоры, фунгицидные свойства | — | — | + |
| Стабильность состава | + | — | + |
После того как высаженные на адаптацию микрорастения успешно приживались в почве, более интенсивному развитию саженцев способствовали корневые обработки растений микробиологическими препаратами (табл. 4, табл. 5, рис. 50, 51). Растения в этой серии опытов не испытывали недостатка в минеральном питании.
Таблица 4 — Влияние корневой подкормки микробиологическими удобрениями на рост побегов (см.) микрорастений ежевики (сорт Эвергрин Торнлесс).
| Варианты | через 2 недели | через 4
недели |
через 6
недель |
через 8 недель |
| Контроль | 3,72±0,17 | 7,06±0,26 | 9,25±0,35 | 12,76±0,38 |
| Байкал ЭМ1,
3 мл/1 л воды |
5,30±0,21 | 8,86±0,34 | 11,74±0,34 | 16,07±0,41 |
| Азотовит,
3 мл/1 л воды |
4,72±0,31 | 8,14±0,27 | 11,08±0,34 | 15,61±0,32 |
| Фосфатовит,
3 мл/1 л воды |
3,80±0,22 | 7,16±0,20 | 9,54±0,28 | 14,29±0,38 |
| Пралин-Экстра, 3 мл/1 л воды | 3,60±0,19 | 7,41±0,28 | 10,06±0,34 | 14,37±0,43 |
Таблица 5 — Влияние корневой подкормки микробиологическими удобрениями на массу корней (г) микрорастений ежевики (сорт Эвергрин Торнлесс).
| Варианты | через 2 недели | через 4 недели | через 6 недель | через 8 недель |
| Контроль | 1,60±0,27 | 2,08±0,32 | 4,20±0,39 | 7,04±0,43 |
| Байкал ЭМ1,
3 мл/1 л воды |
1,30±0,18 | 2, 26±0,34 | 4,54±0,36 | 7,17±0,42 |
| Азотовит,
3 мл/1 л воды |
1,92±0,31 | 3,31±0,35 | 7,32±0,34 | 9,65±0,37 |
| Фосфатовит,
3 мл/1 л воды |
1,80±0,24 | 3,06±0,25 | 6,54±0,28 | 8,39±0,38 |
| Пралин-Экстра, 3 мл/1 л воды | 1,74±0,29 | 2,91±0,28 | 6,26±0,34 | 8,27±0,43 |
Как следует из полученных нами данных, каждый вариант обработки оказывал благоприятное воздействие на рост и развитие растений.
Лучшие результаты по приросту побегов в длину получены при использовании бактериального удобрения Байкал ЭМ1 (табл. 4, рис. 50), но развитие корневой системы у растений при этом было на уровне контроля. Применение биопрепаратов Азотовит, Фосфатовит, Пралин-Экстра способствовало лучшему развитию корневой системы растений (табл. 5, рис. 51). По суммарной длине и массе корней опытные растения существенно обгоняли контрольные. Эффект достигался за счет образования и увеличения числа корней второго порядка, которые способны к активному поглощению воды и элементов питания, что крайне важно при адаптации пробирочных растений к нестерильным условиям.
 |
| Рисунок 50 — Влияние корневой подкормки микробиологическим удобрением на развитие микрорастений ежевики (сорт Эвергрин Торнлесс) на этапе адаптации: Байкал ЭМ1 (справа), контроль (слева). |
При этом по длине побегов варианты с применением Фосфатовита и Пралин-Экстра на начальном этапе адаптации были на уровне контроля. Но при дальнейшем культивировании растения в опытных вариантах начинали превосходить контроль.
Как следует из результатов наших опытов, дополнительная обработка микрорастений микробиологическими биопрепаратами обеспечивает быстрый и интенсивный начальный рост микрорастений на начальном этапе адаптации (рис. 52) и хорошее развитие корневой системы, корни в опытных вариантах оплетают весь объем ячейки (рис. 53).
 |
 |
| Байкал ЭМ 1, 3мл/1 л воды | Фосфатовит, 3мл/1 л воды |
 |
 |
| Азотовит, 3мл/1 л воды | Пралин – Экстра, 3мл/1 л воды |
 |
|
| Контроль | |
| Рисунок 51 — Влияние микробиологических препаратов на развитие микрорастений ежевики (сорт Эвергрин Торнлесс) на этапе адаптации | |
 |
| Рисунок 52 — Развитие микрорастений ежевики (сорт Трипл Краун) на этапе адаптации после корневой подкормки микробиологическим удобрением
(азотовит, 30 мл/10 л). |
 |
| Рисунок 53 — Развитие корневой системы у микрорастений ежевики
(сорт Трипл Краун) на этапе адаптации после корневой подкормки микробиологическим удобрением (фосфатовит, 30 мл/10 л). |
В лучших вариантах с применением микробиологических удобрений отметили увеличение числа корней, их сумарной длины, средней массы корневой системы и самих растений. Корни практически полностью оплетают корневой ком в ячейке, доля растений с хорошо развитой корневой системой возрастает почти в два раза по сравнению с контролем, что дает возможность получить высококачественный посадочный материал в более сжатые сроки.
По совокупности показателей наиболее эффективными были варианты с применением Азотовита и Фосфатовита. В обоих вариантах у регенерантов в нестерильных условиях существенно быстрее формируется хорошо развитая корневая система, что крайне важно для растений, полученных in vitro. Отмечаются довольно существенные различия между вариантами по числу корней первого и второго порядка ветвления и, следовательно, по суммарной длине корней.
Со временем увеличивается облиственность и средняя площадь листьев по отношению к контролю. Таким образом, применение бактериальных препаратов позволяет сохранить полученные in vitro растения в нестерильных условиях и добиться быстрого восстановления всех физиологических функций и ростовых процессов. Микробиологические препараты оказывают положительное влияние на приживаемость микрорастений, уровень физиологических процессов и устойчивость к неблагоприятным внешним факторам.
Стоит отметить эффективность используемых физиологически активных веществ при разных способах их применения. Норма реакции микрорастений на разные способы безусловно зависит генотипа, концентрации применяемых растворов, сроков обработки и пр. При адаптации новых форм потребуются уточнения, но в целом разработанные приемы обеспечивают значительный эффект, увеличивая выход хорошо развитых корнесобственных растений с закрытой корневой системой.
3.7 Оценка методики, совмещающей этап укоренения микрочеренков с этапом адаптации микрорастений к нестерильным условиям и особенности посадочного материала, полученного in vitro
Обобщая результаты нашего опыта работы, можно сделать вывод, что способ клонального микроразмножения хорошо зарекомендовал себя при размножении сортов ежевики, ежемалиновых гибридов, актинидии, аронии, айвы японской, жимолости, клоновых подвоев яблони, а также многих цветочно-декоративных культур, таких как гейхеры, сирень, розы, клематисы, хосты и др. Обобщенные данные по размножению in vitro и адаптации ряда садовых культур представлены в таблице 6.
Таблица 6 — Эффективность клонального микроразмножения, укоренения и
адаптации к нестерильным условиям разных видов садовых культур
| Культура | Коэффициент
размножения за пассаж |
Частота
укоренения in vitro % |
Частота
адаптации к условиям in vivo, % |
Прирост
надземной части за 2-2,5 месяца, см |
| Ежевика | 8-14 | 85-98 | 85-100 | 30-80 |
| Ежевично-
малинов.гибриды |
7-12 | 80-98 | 75-85 | 15-60 |
| Жимолость
синяя |
5-10 | 75-95 | 80-90 | 5-15 |
| Ирга | 3-6 | 80-95 | 75-85 | 15-25 |
| Айва японская | 4-6 | 85-95 | 80-90 | 15-20 |
| Арония | 5-8 | 90-95 | 85-98 | 20-35 |
| Актинидия
коломикта |
3-6 | 80-95 | 90-95 | 15-50 |
| Актинидия аргута | 4-8 | 90-98 | 90-100 | 40-60 |
| Клематис | 3-8 | 65-80 | 70-90 | 10-45 |
| Сирень
обыкновенная |
4-10 | 70-90 | 80-95 | 4-10 |
| Роза | 3-6 | 70-95 | 80-90 | 15-50 |
| Гейхера | 8-14 | 85-98 | 85-95 | 5-8 |
| Клоновые подвои яблони | 5-15 | 80-100 | 55-75 | 5-20 |
Для сокращения затрат и ускорения производства посадочного материала исключали этап укоренения побегов in vitro, высаживая черенки непосредственно в субстрат после обработки их оснований ауксином (24 ч, 50 мг/л ИМК). По нашим данным, укоренение in vivo достаточно эффективно для ежевики и ежевично-малиновых гибридов и в меньшей степени для актинидии. Плодовые древесные и кустарниковые культуры, следует высаживать в грунт только с корнями. Неудовлетворительные результаты при укоренении черенков непосредственно в субстрате получены при высадке микрочеренков калины, ирги, айвы японской.
Таблица 7. – Влияние способа укоренения на эффективность адаптации растений ежевики и ежемалинового гибрида.
| Культура | Способ укоренения | Адаптировано растений, % (от числа укорененных) | Число корней, шт./раст. | Длина побегов, см |
| Ежевика Блэк сэтин | В колбах | 95,7±2,9 | 5,6±0,4 | 35,7±2,9 |
| В субстрате | 88,2±4,7 | 4,2±0,4 | 18,3±1,5 | |
| Ежемалиновый
гибрид Тайберри |
В колбах | 85,7±4,5 | 4,4±0,3 | 24,6±1,9 |
| В субстрате | 49,2±4,3 | 3,3±0,4 | 14,1±1,3 | |
| Айва японская Гефест | В колбах | 80,4±3,7 | 4,1±0,3 | 17,6±1,2 |
| В субстрате | 39,4±2,8 | 3,0±0,4 | 10,2±0,7 |
Следует отметить, что растения, высаженные в теплицу после укоренения в стерильных условиях, отличаются более развитой корневой системой, интенсивнее растут (табл. 7) и имеют осенью более вызревшие побеги, по сравнению с растениями, полученными из микрочеренков, укорененных непосредственно в субстрате. По своему развитию (рис.3), они обгоняют и саженцы, полученные укоренением обычных зеленых черенков. После доращивания они развиваются в мощные растения, более кустистые, по сравнению с растениями, полученными традиционными способами размножения (рис. 54, рис. 55).
Растения, полученные с помощью культуры ткани, имеют серьёзные преимущества перед растениями, полученными путем зеленого черенкования, за счет выравненности морфобиологических признаков, лучшего развития корневой системы, повышенной кустистости, большего прироста побегов за вегетационный период, что выражается в увеличенном выходе высококачественных товарных саженцев (рис. 54, рис. 55). Это омоложенные и оздоровленные растения, свободные от грибной и бактериальной инфекции.
Особенности данного способа размножения позволяют в сжатые сроки получать омоложенный оздоровленный посадочный материал как старых, но не теряющих свою актуальность, сортов так и селекционных новинок.
 |
 |
| Рисунок 54 — Посадочный материал актинидии аргуты (сорт Пурпурная садовая), полученный на основе адаптированных микрорастений. | Рисунок 55 — Однолетние саженцы актинидии коломикта (сорт Гладкая), полученные на основе адаптированных микрорастений. |
Коммерческие фирмы, садовые центры, питомники, занимающиеся выращиванием и реализацией посадочного материала садовых культур, охотно покупают адаптированные кассетные растения по цене 35-40 руб. за одно растение. Наличие хорошо сформированной мочки корней в ограниченном объеме (рис. 56, 57) и ювенильное состояние растений делает их идеальным материалом для выращивания на их основе посадочного материала с закрытой корневой системой (рис. 58, 59).
Выращивание микрорастений в стандартизированных условиях обеспечивает высокую степень однородности посадочного материала между различными партиями, что дает возможность более точно планировать объемы и сроки посадок. Герметичная пластиковая тара и питательный субстрат, в котором выращиваются микрорастения, дают возможность транспортировки продукции на дальние расстояние с сохранением жизнеспособности и посадочных качеств микрорастений. Компактность упаковки и небольшой вес контейнеров значительно уменьшают транспортные расходы.
 |
 |
| Рисунок 56 — Развитие корневой системы у кассетных растений ежемалинового гибрида Тайберри, полученных на основе адаптированных микрорастений. | Рисунок 57 — Развитие корневой системы у контейнерных растений сирени обыкновенной (сорт Надежда), полученных на основе адаптированных микрорастений. |
 |
 |
| Рисунок 58 — Саженцы актинидии аргута, полученные методом in vitro. | Рисунок 59 — Саженцы гейхеры, полученные методом in vitro. |
Глава 4 Экономическая эффективность использования современной технологии вегетативного размножения растений методом клонального микроразмножения
Применение современной технологии вегетативного размножения позволяет: получить посадочный материал, свободный от грибных, фитоплазменных и вирусных заболеваний, за короткое время и в достаточном количестве; быстро размножить ценный клон растения (сорт);·получить в большом количестве вегетативное потомство трудноразмножаемых в обычных условиях сортов и форм растений; работать в лабораторных условиях круглый год и планировать выпуск растений к определенному сроку; длительно сохранять растительный материал в условиях in vitro, а также обменивать его в международном масштабе без риска заражения карантинными вредителями и болезнями; получать растения с измененной плоидностью и трансгенные растения.
Метод клонального микроразмножения считается дорогостоящим и трудоемким. Для проведения биотехнологических работ требуются специализированные лаборатории с соответствующим оборудованием и высококвалифицированным штатом сотрудников. К недостаткам метода можно также отнести и то, что после операций in vitro при переносе материала для выращивания в нестерильных условиях, требуются дополнительные затраты для достижения растениями стандартных показателей.
Себестоимость и рентабельность производства растений in vitro у различных культур будет отличаться. По данным разных авторов, себестоимость укорененного in vitro и адаптированного микрорастения, которое будет использовано для доращивания, может варьировать от 10 до 55 рублей в расчете на одно растение. Это связано, с объемом производства, коэффициентом размножения и способность к укоренению и адаптации конкретного генотипа, затратами на химреактивы и т.д.
Мы провели расчет себестоимости производства 1 растения исходя из разработанных нами технологических карт, на примере двух культур, с разным коэффициентом размножения и эффективностью адаптации: декоративного растения – гейхеры и малины ремонтантной. Произведена разбивка статей затрат по этапам проводимых работ (табл. 8).
Большинство сортов гейхеры на этапе микроразмножения отличаются высоким коэффициентом размножения, в среднем 8 новых побегов за 1 пассаж. Из расчета емкости автоклава в 12 литров имеем 216 колб питательной среды, в каждую колбу на размножение высаживаем 7 микрорастений, итого 1512 растений.
Таблица 8 — Затраты на производство гейхеры на этапе микроразмножения
и укоренения.
| Статьи расходов | На весь объем
работ, руб. |
На микрорастение, 1шт |
| Микроразмножение и укоренение (9251 шт.) | ||
| Тарифный фонд оплаты труда | 17606,22 | 1,90 |
| Начисления на зарплату (30.2%) | 5317,08 | 0,57 |
| Итого оплаты с начислениями | 22923,30 | 2,48 |
| Электроэнергия | 4175,72 | 0,45 |
| Питательная среда | 2943,33 | 0,32 |
| Расходные материалы | 4580,00 | 0,50 |
| Итого | 34622,35 | 3,74 |
При коэффициенте размножения равном 8 по результатам этапа микроразмножения получаем 12096 штук растений, но мы закладываем риски 15%, поэтому к этапу укоренения останется 10281 растение, которые будут рассажены в культуральные сосуды. Так как работа с таким количеством растений очень трудоёмка, то в структуре затрат на рисунке 60 видим, что доля оплат труда в структуре затрат составляет 66%.
К моменту высадки укоренных растений в кассеты погибнет около 10% растений, т.е. к этапу адаптации останется 9251 растение.
| Рисунок 60 — Структура затрат в производстве гейхеры на
этапе микроразмножения и укоренения. |
После высадки в кассеты потери составят еще 15%, таким образом, к этапу доращивания в горшочках останется 7863 растения. Затраты на производство гейхеры на этапе адаптации представлены в таблице 9.
Таблица 9 — Затраты на производство гейхеры на этапе адаптации
в кассетах по 54 ячейки.
| Адаптация в кассетах (7863 шт.) | |||
| Тарифный фонд оплаты труда | 33640,08 | Из расчета на 1 растение: | 4,28 |
| Начисления на зарплату (30.2%) | 10159,31 | 1,29 | |
| Итого оплаты с начислениями | 43799,39 | 5,57 | |
| Электроэнергия | 4342,30 | 0,55 | |
| Питательная среда | 2943,33 | 0,37 | |
| Расходные материалы | 19575,85 | 2,49 | |
| Итого | 70660,86 | 8,99 | |
На этом этапе происходит увеличение доли расходных материалов в структуре затрат с 13% до 28% за счет приобретения кассет и торфогрунта, доля затрат труда остается высокой и составляет 62% (рис. 61).
| Рисунок 61 — Структура затрат в производстве гейхеры на этапе адаптации. |
Этапы технологического процесса этапа доращивания представлены в таблице 10.
Таблица 10 — Технологический процесс доращивания гейхеры в горшочках.
| № п/п | Наименование работ | Ед.изм. | Объем работ | Кол-во человек | Кол-во нормосмен | Затраты на весь объем работ, ч/час | Тарифная ставка, руб/час | Тарифный фонд, руб. |
| 1 | Набивка горшочков торфогрунтом | шт. | 7863 | 1 | 16,38 | 131,05 | 48,20 | 6316,61 |
| 2 | Извлечение растений из кассет | шт. | 7863 | 1 | 8,19 | 65,53 | 48,20 | 3158,31 |
| 3 | Посадка растений в горшочки | шт. | 7863 | 1 | 16,38 | 131,05 | 48,20 | 6316,61 |
| 4 | Полив и опрыскивание (2 раза/день) | дни | 45 | 1 | 2,81 | 22,50 | 48,20 | 1084,50 |
| Итого | х | х | х | 43,77 | 350,13 | х | 16876,03 | |
Итого после доращивания гейхеры в горшочках мы теряем еще 5% растений, и остается 7469 растений, готовых к реализации.
| Рисунок 62 — Структура затрат в производстве гейхеры на этапе доращивания. |
Как мы видим, на этапе доращивания за счет покупки горшочков и необходимого субстрата доля расходных материалов выросла с 28% до 64%, а затраты труда наоборот снизились с 62% до 32%.
Для сравнения мы рассмотрели технологический процесс производства сортов малины ремонтантной, у которой коэффициент размножения в среднем составляет 4 новых побега за 1 пассаж. Таким образом, из 1512 растений, высаженных в колбы на этапе микроразмножения исходя из 12 литров питательной среды, мы получим 4838 растений с учетом риска 20%. В связи с меньшим количеством получаемых растений затраты при культивировании in vitro существенно уменьшаются (табл. 11). Малина обладает невысоким процентом выживаемости на этапе укоренения – 70%, и к этапу высадки в кассеты мы имеем 3386 шт. микрорастений.
Таблица 11 — Затраты на производство малины на этапе микроразмножения и укоренения.
| Статьи расходов | На весь объем работ, руб. | На микрорастение, 1шт |
| Микроразмножение и укоренение (3386 шт.) | ||
| Тарифный фонд оплаты труда | 11568,05 | 3,06 |
| Начисления на зарплату (30.2%) | 3493,55 | 0,92 |
| Итого оплаты с начислениями | 15061,60 | 3,98 |
| Электроэнергия | 3829,35 | 1,01 |
| Питательная среда | 2981,45 | 0,79 |
| Расходные материалы | 4580,00 | 1,21 |
| Итого | 26452,39 | 7,00 |
Изменения в структуре затрат отражены на рисунке 63. Доля затрат на оплату труда в структуре производства малины на этапе микроразмножения и укоренения составляет 57% в сравнении с 66% у гейхеры, что вызвано меньшим количеством микрорастений и как следствие меньшим количеством операций персонала.
| Рисунок 63 — Структура затрат в производстве малины на этапе микроразмножения и укоренения. |
Затраты на этапе адаптации микрорастений малины представлены в таблице 12 и на рисунке 64.
Таблица 12 — Затраты на производство малины на этапе адаптации
в кассетах по 54 ячейки.
| Адаптация в кассетах (2539 шт.) | |||
| Тарифный фонд оплаты труда | 19158,95 | Из расчета на 1 растение: | 6,34 |
| Начисления на зарплату (30.2%) | 5786,00 | 1,91 | |
| Итого оплаты с начислениями | 24944,95 | 8,25 | |
| Электроэнергия | 3907,78 | 1,29 | |
| Питательная среда | 2981,45 | 0,99 | |
| Расходные материалы | 10254,15 | 3,39 | |
| Итого | 16873,59 | 13,92 | |
| Рисунок 64 — Структура затрат в производстве малины на этапе адаптации. |
В итоге, по сравнению с гейхерой в производственном цикле выращивания посадочного материала малины несколько снижается доля затрат труда и расходных материалов (табл. 13). В итоге, в структуре производства малины доля затрат на расходные материалы составляет 57%, а на оплату труда 36% в сравнении с 64% и 32% у гейхеры соответственно (рис. 65).
Таблица 13 — Технологический процесс доращивания малины в горшочках.
| № п/п | Наименование работ | Ед.изм. | Объем работ | Кол-во человек | Кол-во нормосмен | Затраты на весь объем работ, ч/час | Тарифная ставка, руб/час | Тарифный фонд, руб. |
| 1 | Набивка горшочков торфогрунтом | Шт | 2539 | 1 | 5,29 | 42,32 | 48,20 | 2039,66 |
| 2 | Извлечение растений из кассет | Шт | 2539 | 1 | 2,64 | 21,16 | 48,20 | 1019,83 |
| 3 | Посадка растений в горшочки | Шт | 2539 | 1 | 5,29 | 42,32 | 48,20 | 2039,66 |
| 4 | Полив и опрыскивание (2 раза/день) | Дни | 45 | 1 | 2,81 | 22,50 | 48,20 | 1084,50 |
| Итого | Х | х | х | х | 16,04 | 128,29 | х | |
| Рисунок 65 — Структура затрат в производстве малины на этапе доращивания. |
Но наиболее ярко сравнение 2-х культур мы видим, исходя из данных таблицы 14, т.к. в абсолютном значении затраты на производство малины и гейхеры отличаются более чем в 2 раза. Так конечный выход растений исходя из использования 12 литров питательной среды составляет 2412 растений малины и 7469 растений гейхеры, только благодаря различиям в морфологических качествах культур.
Таблица 14 — Производственная себестоимость и рентабельность культур на этапе производства.
| Гейхера | Малина | |
| Рыночная цена в розницу, руб. | 100 | 150 |
| Производственная себестоимость, руб. | 27,19 | 30,79 |
| Рентабельность производства, % | 367,78 | 487,17 |
| Затраты всего, руб. | 203108,60 | 91398,21 |
Таким образом, технология производства высококачественного посадочного материала на основе микрорастений, полученных in vitro, должна учитывать видовую специфику растений, необходимость получения выровненного по морфобиологическим параметрам растительного материала к определенному сроку, быть экономически выгодной и воспроизводимой.
Заключение
Выбор оптимальных условий прохождения этапа ризогенеза важен для последующего развития микрорастений. В одинаковых условиях укорененные микрорастения ягодных культур с большой массой и хорошо развитой листовой поверхностью, как правило, приживаются с наименьшими потерями и активней развиваются на этапе адаптации к условиям ex vitro.
Эффективность укоренения in vitro во многом определяется биологической предрасположенностью изучаемых генотипов к вегетативному размножению. Различные виды и сорта культурных растений существенно отличаются по способности к образованию корней in vitro и по реакции на изменение типа и концентрации ауксина в составе питательной среды.
Укоренение микрочеренков in vitro достигается и на безгормональных средах, но для достижения максимальной частоты ризогенеза и оптимального развития корневой системы большинства садовых культур необходимо добавление в питательные среды ИМК в концентрации 0,25-0,5 мг/л, ИУК в концентрации 0,5 -1,0 мг/л или НУК в концентрации 0,125- 0,25 мг/л.
На примере ежемалинового гибрида Тайберри показано, что для укоренения микрочеренков ежемалины можно успешно применять все три ауксина, но оптимальная концентрация каждого в питательной среде будет разная. Максимальная частота укоренения (80-85%) ежемалинового гибрида Тайберри получена при концентрации ИУК в питательной среде 0,4-0,5 мг/л. При такой же концентрации ИМК частота укоренения была существенно ниже. На безгормональных средах частота укоренения микрочеренков не превышала 50-55%. При этом, наибольшее число корней на укорененный микрочеренок у этого гибрида образовалось на средах с ИМК и количество их росло с повышением концентрации этого ауксина в питательной среде. Как и у других культур меньше всего корней образовалось на безгормональных средах и эти корни наиболее активно росли.
Подобные результаты получены и при укоренении ремонтантной малины. Ремонтантная малина на безгормональных средах ризогенеза укореняется на 40,2-60,5% в зависимости от генотипа. На безгормональных средах образуется незначительное число корней на укорененный микрочеренок. На средах с ауксинами процесс формирования корней проходит быстрее и возрастает число корней на укорененный микрочеренок ремонтантной малины. Микрочеренки ремонтантной малины эффективно укореняются как при использовании ИМК, так и при использовании ИУК в разных концентрациях. Например, частота ризогенеза сорта Бриллиантовая была 57,1- 75,0% на средах с ИМК и 60,5 — 69,2 % на средах с ИУК. Среднее число корней на укорененный микрочеренок малины ремонтантной составляет от 1,4 до 2,4 шт. на безгормональных средах и от 2,6 до 4,5 шт. на среде с ауксином.
Эффективность укоренение декоративных культур также существенно зависит от биологических особенностей сорта, и у некоторых видов достигается практически 100% укоренение микропобегов.
Так, сорт плетистой розы Цезарь укоренялся с частотой от 86,4 до 100% при концентрации ИМК от 0,125 до 0,5 мг/л и концентрации ИУК и НУК от 0,125 до 1,0 мг/л. Для сорт английской розы селекции Д. Остина Tess of the d’Urbervilles оптимальными были среды ризогенеза, содержащие 0,25 мг/л НУК и 1,0 мг/л ИУК.
Установлено, что в качестве стимулятора ризогенеза может использоваться кофеин при добавлении его в среду укоренения в оптимальной концентрации. Наиболее эффективным при укоренении рода Rubus определен диапазон концентраций кофеина в среде от 1 до 100 мг/л. Содержание кофеина в питательной среде свыше 0,1% оказывает негативное действие на растительные ткани, замедляя и останавливая процесс образования корней, останавливая рост побегов и вызывая некроз тканей.
Применение НКИ на этапе ризогенеза существенно стимулирует процесс укоренения микрочеренков in vitro и способствует увеличению числа и длины корней и росту побегов. На примере ягодных культур показано, что эффективность ризогенеза при облучении микропобегов НКИ при оптимальных экспозициях в 1,3-1,7 раза превышает контроль, возрастает средняя длина корней и прирост побегов по отношению к необлученному контролю. Так, удалось повысить частоту укоренения микрочеренков ремонтантной малины сорта Рубиновое ожерелье на среде MSУК с 1,0 мг/л ИМК с 55,6% в контроле до 84,4% при облучении гелий-неоновым лазером (экспозиция 120 с) и 80,4% (экспозиция 960 с). Число корней на укорененный микрочеренок возросло соответственно c 2,0±0,2 шт. до 2,9±0,3 и 3,0±0,3 шт. соответственно.
Стимулирующий эффект достигается как при использовании гелий-неонового лазера, так и полупроводникового, но при разных экспозициях. Степень достигнутого эффекта нелинейно зависит от продолжительности воздействия, для оптимизации режимов лазерной обработки необходимо использовать 4-6 экспозиций облучения.
Подобраны оптимальные параметры ультразвукового облучения. При использовании цилиндрической насадки излучателя оптимальная мощность облучения составляет 2,7-4,7 Вт/см2, при использовании конической -3,6-14,1 Вт/см2. В результате исследований повышена эффективность ризогенеза микрочеренков на 20 – 35% в зависимости от генотипа.
Кроме того, на эффективность ризогенеза влиял способ введения ауксина – индуктора ризогенеза в микрочеренки. Так, при укоренении микрочеренков ирги сорта Менден положительный эффект был получен как при выдерживании микрочеренков в течение суток в растворе ИМК (50 мг/л) после их обработки УЗ, так и при высадке их после озвучивания на среду укоренения, содержащую 0,5 мг/л ИМК.
Итоговая частота укоренения ирги при культивировании на среде МSук с 0,5 мг/л ИМК возросла более чем на 30% с 53,3 в контроле до 86,7 % при мощности УЗ 2,7 Вт/см2. Число корней на укорененный микрочеренок возросло более чем в два раза с 1,6 шт. в контроле до 3,5 шт. — 3,7 шт. в опыте. Длина образовавшихся корней была примерно равной во всех вариантах.
При оптимальных параметрах озвучивания процесс корнеобразования на микрочеренках начался быстрее. Итоговая частота укоренения изменилась в опытных вариантах с замачиванием микрочеренков в растворе ИМК не слишком значительно, в то время как число корней на укорененный микрочеренок в лучших вариантах опыта увеличилось более чем в два раза, например, с 3,1 шт. в контроле до 7,6 шт. в 6 варианте при мощности ультразвука 4,7 Вт/см2. В оптимальных вариантах воздействия показатели числа корней и их длины превышают контрольные в несколько раз. Установлено, что реакция каждого генотипа на воздействие УЗ индивидуальна. На всех без исключения биологических объектах достигнут стимуляционный эффект воздействия УЗ по всем исследуемым параметрам.
Результативность этапа адаптации определяется биологическими особенностями культуры и условиями прохождения данного этапа.
Для легко укореняющихся культур, таких как актинидии и ежевика высокая эффективность адаптации достигается при высадке растений с любых сред укоренения. Однако больший прирост побегов за адаптационный период в теплице достигается при использовании ауксинсодержащих сред. На средах с оптимальным составом ауксинов достигается лучшее развитие корневой системы, что способствует более быстрой адаптации растений к почвенным условиям. Стимулирование ризогенеза лазерным воздействием на этапе укоренения влияет на развитие и рост микрорастений на этапе адаптации в теплице. Прирост надземной части в лучших вариантах опыта в 1,5-2 раза больше у облученных растений.
При проведении адаптации в условиях зимних отапливаемых теплиц, с регулируемой температурой и дополнительным освещением оптимальным сроком высадки микрорастений в субстрат является вторая половина февраля – апрель. Оптимальная температура для высадки большинства видов растений +23-250 С.
Хорошим субстратом для адаптации микрорастений является субстрат на основе нейтрального минерализованного верхового сфагнового торфа марки «Агробалт-С». Его состав можно оптимизировать добавлением вермикулита и перегноя в соотношении торф : вермикулит : перегной (2 : 1: 1).
Корневые обработки растений микробиологическими препаратами (3 мл/л) через месяц после высадки в почву способствуют более интенсивному развитию микрорастений ягодных культур на этапе адаптации и увеличивает выход посадочного материала с высокими товарными качествами, что повышает уровень рентабельности производства корнесобственных саженцев.
Применение биопрепаратов на этапе адаптации в 1,3-1,5 раза ускоряет рост побегов и в 1,3-1,8 раза увеличивает массу корневой системы. Лучшие результаты по приросту побегов в длину получены при использовании в качестве корневой обработки бактериального удобрения Байкал ЭМ1, но развитие корневой системы у растений при этом остается на уровне контроля. Применение биопрепаратов Азотовит, Фосфатовит, Пралин-Экстра способствует лучшему развитию корневой системы растений. По совокупности показателей наиболее эффективными были варианты с применением Азотовита и Фосфатовита. Усовершенствованная технология акклиматизации микрорастений повышает эффективность адаптации по разным видам растений на 15-35%. Применение разработанных подходов способствует улучшению качества адаптированных растений: прирост надземной части увеличивается на 20-30%, объем корневой системы на 30-45%.
