Титульный лист и исполнители
РЕФЕРАТ
Отчет 137 с., 2 части, 31 таблица, 17 рисунков, 85 источников.
БАКТЕРИОФАГ, БАКТЕРИИ, PSEUDOMONAS SYRINGAE, ФИТОПАТОГЕН, БИОПРЕПАРАТ, БИОКОНТРОЛЬ, ИНДИКАЦИЯ, ПОЧВА, СЕМЕННОЙ МАТЕРИАЛ, СВОЙСТВА, ПАРАМЕТРЫ ПРИМЕНЕНИЯ
Объектами исследования являются нативные и искусственно контаминированные бактериями Pseudomonas syringae пробы семенного материала, почвы, воды, растительной продукции. Подбор параметров индикации Pseudomonas syringae проводился с использованием оригинальных гомологичных бактериофагов.
Цель работы – разработать экологически безопасный биологический препарат на основе специфических бактериофагов, который позволит проводить биоконтроль растений на наличие бактерий Pseudomonas syringae на разных стадиях (посевной материал, в период вегетации и при хранении).
В результате исследований:
— сконструирован фаговый биопрепарат на основе наиболее производственно-перспективных фагов Ps.s-7 УлГАУ и Ps.s-27 УлГАУ, специфичных для Pseudomonas syringae;
— произведен подбор технологических параметров изготовления биопрепарата на основе бактериофагов;
— разработана пилотная технология получения экспериментального фагового биопрепарата, позволяющая нарабатывать средство для индикации фитопатогенных бактерий Pseudomonas syringae с высоким титром фаговых частиц, включающая многоступенчатую схему контрольно-испытательных мероприятий;
— разработана методология индикации Pseudomonas syringae в пробах семенного материала, пробах почвы, пробах воды, пробах растительной продукции методом постановки реакции нарастания титра фага;
— изучена эффективность применения сконструированного фагового биопрепарата для индикации Pseudomonas syringae в пробах семенного материала, пробах почвы, пробах воды, пробах растительной продукции; на основании полученных данных определена степень распространения бактерий Pseudomonas syringae в объектах внешней среды и объектах растениеводства;
— разработана нормативно-техническая документация по изготовлению и контролю экспериментальной серии фагового биопрепарата и методические рекомендации по его применению для индикации в объектах внешней среды и объектах растениеводства.
Сельскохозяйственным предприятиям предложен новый биопрепарат на основе консорциума 2 бактериофагов Ps.s-7 и Ps.s-27 серии УлГАУ, специфичных для Pseudomonas syringae, для индикации фитопатогена в объектах внешней среды и объектах растениеводства и разработана методика его применения.
ВВЕДЕНИЕ
Pseudomonas syringae — это видовой комплекс фитопатогенов, поражающий более 180 видов растений. Pseudomonas syringae являются причиной заболеваний многих важных для человека культурных растений, что ведет к значительному экономическому ущербу [1].
Среди болезней, которые они вызывают, различают опухолевые новообразования, гниение, прекращение роста и гибель части растения без загнивания, хлороз, некроз [2,3,4,5].
Заболевания растений, вызываемые Pseudomonas syringae трудно контролировать из-за высокой частоты мутаций, горизонтального переноса генов и видоспецифической изменчивости [2,6,7]. Никаких специфических антимикробных средств в настоящее время не разработано. Бесконтрольное воздействие химических веществ, применяемых для дезинфекции в растениеводстве, может привести к развитию устойчивости у данных бактерий [8,9,10].
В настоящее время перспективным направлением для контроля бактериальных заболеваний растений являются бактериофаги. Бактериофаги (фаги) — это вирусы, которые заражают бактерии, используя их метаболизм для завершения своей репликации, что приводит к лизису их бактериального хозяина, не причиняя прямого вреда растениям или животным. Фаги являются одним из наиболее распространенных типов организмов в биосфере и почти всегда очень специфичны для своего целевого бактериального хозяина. В настоящее время потенциал использования бактериофагов для биологического контроля Pseudomonas syringae активно изучается рядом исследовательских групп [11,12,13]. Литическая природа фага, высокая степень специфичности к хозяину, способность сохраняться и размножаться в окружающей среде делают бактериофаги потенциальными кандидатами для биоконтроля фитопатогенов [14 — 20].
Цель работы – разработать экологически безопасный биологический препарат на основе специфических бактериофагов, который позволит проводить биоконтроль растений на наличие бактерий Pseudomonas syringae на разных стадиях (посевной материал, в период вегетации и при хранении).
Задачи:
1. Конструирование фагового биопрепарата на основе имеющихся фагов, специфичных для Pseudomonas syringae, характеризующихся определенными биологическими свойствами (максимально широкий спектр литического действия и явно выраженная специфичность, максимально высокий титр литической активности при хранении, устойчивость к факторам внешней среды, отсутствие в геноме производственно-перспективных бактериофагов «локусов патогенности»).
2. Подбор технологических параметров изготовления биопрепарата на основе бактериофагов (разработка количественных и качественных параметров культивирования, подбор методики очистки биопрепарата, контроль стерильности).
3. Разработка технологической схемы наработки экспериментальной партии биопрепарата.
4. Разработка методологии индикации Pseudomonas syringae в пробах семенного материала, пробах почвы, пробах воды, пробах растительной продукции.
5. Изучение эффективности применения сконструированного фагового биопрепарата для индикации Pseudomonas syringae в пробах семенного материала, пробах почвы, пробах воды, пробах растительной продукции.
6. Разработка нормативно-технической документации на сконстуированный фаговый биопрепарат Pseudomonas syringae и методические рекомендации по его применению в растениеводстве.
Новизна научных исследований
Впервые проведены исследования по разработке экологичного и высокоэффективного фагового биопрепарата для индикации бактерий Pseudomonas syringae в объектах внешней среды и объектах растениеводства, который позволилит в перспективе снизить производственные потери в растениеводстве от фитопатогенных бактерий Pseudomonas syringae за счет своевременного выявления возбудителя.
Полученные результаты помогут в перспективе сформировать теоретические и практические предпосылки для создания нового для Российской Федерации класса технологических вспомогательных средств на основе бактериофагов – безопасного продукта для биоконтроля фитопатогенных бактерий Pseudomonas syringae, вызывающих опухолевые новообразования, гниение, прекращение роста и гибель части растения, хлороз, некроз.
Сформирована и адаптирована многоступенчатая схема контрольно-испытательных мероприятий нового средства для индикации фитопатогенных бактерий Pseudomonas syringae в объектах внешней среды и объектах растениеводства.
Усовершенствована пилотная технология получения фагового биопрепарата, позволяющая нарабатывать средство для индикации фитопатогенных бактерий Pseudomonas syringae с высоким титром фаговых частиц.
Бактериофаги, входящие в состав биопрепарата, специфичны для фитопатогенных бактерий Pseudomonas syringae, не подавляют рост пробиотических штаммов и нормофлору растения и ризосферы. Что позволит, в перспективе, снизить количество применяемых при производстве средств химической защиты растений, сохранить урожай и получить органическую (экологически чистую) продукцию.
Теоретическая и практическая значимость полученых результатов
Получены данные о биологических свойствах бактериофагов, специфичных для бактерий Pseudomonas syringae, включая их молекулярно-генетическую характеристику (литическая активность, спектр литического действия и специфичность, влияние факторов внешней среды, урожайность и скорость адсорбции; дана молекулярно-генетическая характеристика).
Получены данные о степени распространения бактерий Pseudomonas syringae в объектах внешней среды и объектах растениеводства.
Сконструирован фаговый биопрепарат, активный в отношении фитопатогенных бактерий Pseudomonas syringae, имеющий высокий титр и срок хранения в течение 1 года.
Подобраны максимально эффективные методы индикации бактерий Pseudomonas syringae в объектах внешней среды и объектах растениеводства.
Разработана нормативно-техническая документация: «Временная инструкция по изготовлению и контролю лабораторной серии бактериофагов Pseudomonas syringae» и «Методические рекомендации по индикации бактерий Pseudomonas syringae».
Сельскохозяйственным предприятиям предложен новый биопрепарат на основе консорциума 2 бактериофагов Ps.s-7 и Ps.s-27 серии УлГАУ, специфичных для Pseudomonas syringae, для индикации фитопатогена в объектах внешней среды и объектах растениеводства и разработана методика его применения.
Внедрение результатов НИР
В процессе исследования получен биопрепарат на основе имеющихся фагов, специфичных для Pseudomonas syringae, характеризующийся определенными биологическими свойствами — максимально широкий спектр литического действия и выраженная специфичность, максимально высокий титр литической активности при хранении, устойчивость к факторам внешней среды, отсутствие в геноме производственно-перспективных бактериофагов «локусов патогенности».
Известно, что вышеназванные микроорганизмы наносят значительный экономический ущерб российскому растениеводству. Разработка методологии индикации Pseudomonas syringae в пробах семенного материала, пробах почвы, пробах воды, пробах растительной продукции позволяет сократить экономические потери, так как в течение 24 часов лаборатория, оснащенная ламинарным боксом, термостатом, водяной баней и бытовым холодильником, может достоверно определить наличие этого микроорганизма в пробе.
Фаговый биопрепарат Pseudomonas syringae представляет собой прозрачную жидкость от светло-желтого до желтого цвета, розлитую в стеклянные флаконы под резиновую пробку и алюминиевый колпачок объемом 100-500 мл, титр фага не менее 108 БОЕ/мл, условия хранения: 2-4 0С в течение 12 месяцев при относительной влажности воздуха 70-80 %, при транспортировании необходимо учитывать хрупкость упаковки.
Полученные в результате исследований данные используются в учебном процессе обучающихся по направлениям подготовки:
— 35.03.03 Агрохимия и агропочвоведение (высшее образование — бакалавриат);
— 35.04.03 Агрохимия и агропочвоведение (высшее образование — магистратура);
— 35.03.04 Агрономия (высшее образование — бакалавриат);
— 35.04.04 Агрономия (Высшее образование — магистратура);
— 06.01.04 Агрохимия (высшее образование — подготовка кадров высшей квалификации);
— 06.01.01 Общее земледелие, растениеводство (высшее образование — подготовка кадров высшей квалификации);
-35.02.06 Технология производства и переработки сельскохозяйственной продукции (среднее профессиональное образование – программа подготовки специалистов среднего звена);
-35.03.07 Технология производства и переработки сельскохозяйственной продукции (высшее образование — бакалавриат);
— 06.04.01 Биология (высшее образование — магистратура);
— 03.01.06 Биотехнология (в том числе бионанотехнологии) (высшее образование — подготовка кадров высшей квалификации);
— 03.02.03 Микробиология (высшее образование — подготовка кадров высшей квалификации).
ОСНОВНАЯ ЧАСТЬ ОТЧЕТА НИР
1 Обзор литературных источников
1.1 Бактериальные патогены растений – как глобальная проблема
По данным Всемирного банка, население планеты, как ожидается, достигнет более 9,6 миллиарда человек к 2050 году, что неизбежно увеличит спрос на продовольствие примерно на 59%–98% [21]. Хотя Продовольственная и сельскохозяйственная организация Объединенных Наций (ФАО) стремится решить проблему голода к 2030 году, продовольственная безопасность несколько снизилась с 2015 года из-за изменения климата, конфликтов и вредителей. По данным ФАО, на вредителей приходится ежегодные потери до 40% продукции растениеводства, что обходится мировой экономике в более чем 290 миллиардов долларов. Как таковые, эти вредители не только создают угрозу продовольственной безопасности и экономике, но и представляют собой значительную часть ограниченных ресурсов нашей планеты, которые теряются. В этой связи борьба с вредителями имеет решающее значение для перехода сельского хозяйства к большей устойчивости [22].
Многие экономически важные продовольственные культуры, включая рис, картофель, помидоры, капусту, бананы, оливки и цитрусовые, страдают от бактериальных инфекций, на которые, как полагают, приходится 5-10% потерь урожая [23]. Традиционно химические вещества используется для защиты этих культур от бактериальных заболеваний.
Однако бактериальные патогены растений уже сегодня приобрели устойчивость к биоцидам на основе меди [24,25], перекиси водорода [26] и другим химическим веществам, включая антибиотики, такие как стрептомицин [27].
Поэтому стратегии борьбы с болезнями часто могут сдерживать вспышки только путем сосредоточения внимания на профилактике. Кроме того, в связи с возросшей осведомленностью об их воздействии на окружающую среду и здоровье человека широкая общественность и правительства требуют, чтобы химические вещества были ограничены или, предпочтительно, заменены альтернативой (Директива ЕС 2009/128/EC). В связи с этим бактериофаги снова привлекли внимание со стороны научных кругов и промышленности в качестве агентов биологического контроля фитопатогенов [28-29].
1.2 Фаговый биоконтроль – современное состояние
Концепция использования фагов в качестве средств защиты растений не нова. На самом деле первые попытки датируются 1924 годом, когда Hemstreet и Mallmann [30] использовали фильтрат разлагающейся капусты, содержащий фаг, для лечения Xanthomonas campestris pv. campestris. Эта бактерия по-прежнему представляет всемирную угрозу для производства крестоцветных культур, таких как цветная капуста, брокколи и другие [31]. Однако по мере того, как химические биоциды становились легкодоступными и имели более широкий диапазон применения, они становились более простыми в использовании и интерес к фаговому биоконтролю значительно ослаб [32]. С начала 21-го века фаговый биоконтроль вновь приобрел интерес, движимый достижениями в области биотехнологии, о чем свидетельствует растущее число публикаций, патентов и патентных заявок [29].
На сегодняшний день в мире представлено более 20 биопрепаратов для биоконтроля фитопатогенов на основе фагов, протестированных илиапробированных в крупномасштабных испытаниях. Многие исследования были проведены для небольшого числа потосистем в течение последних трех лет с особым акцентом на Pectobacterium, Ralstonia, Pseudomonas и Xanthomonas. Патосистема определяется как отношение между растением и конкретным патогеном, например, Pectobacterium atrosepticum-картофель или патосистема Xanthomonas oryzae-рис [33]. Для каждого исследования суммируются применяемые бактериофаги, рассматриваемый патоген, вызываемое им заболевание, стратегии применения, дозировка препарата и основные результаты борьбы с заболеванием. Большинство исследований показывают значительное снижение развития симптомов заболевания, доказывая потенциал биоконтроля на основе фагов.
Интересно, что диверсификация стратегии применения фагов может наблюдаться в различных исследованиях, в основном следуя стратегии заражения. Для биоконтроля Pectobacterium или Dickeya, в литературе основное внимание уделяется послеуборочной обработке продукции и посевного материала, так как это один из моментов развития инфекции [34-38]. С другой стороны, контроль Ralstonia показывает оптимальные результаты, когда фаги доставляются в почвенные системы [39-41]. Это еще больше подчеркивается в патосистеме дыни- Acidovorax, в которой обработка почвы также увеличивает количество жизнеспособных семян [42]. Более того, те же авторы описывают профилактическую обработку семян на основе фагов для этой патосистемы, которая способна ограничить воздействие патогена [43]. Эта стратегия применения была опробована и на других культурах, таких как картофель, кукуруза, лук-порей и рис [44-46]. Для последних обработка семян превосходит обработку распылением с уменьшением симптомов на 95,4%-83,1% соответственно [46]. Наконец, для борьбы с болезнями, которые в основном проявляются на уровне филосферы, такими как Pseudomonas, ученые в первую очередь описывают успешные методы лечения распылением снижающие титр бактерий и развитие симптомов [47-49]. Таким образом, определенно существует связь между жизненным циклом и средой обмтания бактерий и оптимальным применением фаговой обработки (например, различные типы обработки необходимы для почвенных бактерий, таких как Ralstonia solanacearum, по сравнению с эпифитами/язвообразующими бактериями, такими как Pseudomonas syringae). Это также демонстрирует, что продолжающиеся усилия по разработке и адаптации методов фагового биоконтроля в соответствии с этой и другими специфическими особенностями не теряют актуальности.
Так же, исходя из проанализированной информации, можно утверждать, что детальное понимание биологии патогена и фага необходимо для внедрения эффективного фагового биоконтроля в растеневодстве.
1.3 Место бактериофагов в растеневодстве и перспективы применения
Как правило, стратегии комплексной защиты растений (IPP) включают передовые методы, позволяющие в первую очередь предотвращать вспышку заболевания, раннее обнаружение и тщательный мониторинг потенциальных инфекций, использование адекватных, но достаточных доз предпочтительно биологических обработок и оценку эффективности [57]. В IPP взаимодействие (-и) с патогеном (-ами) растение считается ключевым, поскольку эта взаимосвязь очень специфична и варьируется между этим разнообразием и инфекционностью фага. Однако помимо конструирования оптимального коктейля фагов, понимание биологии патогена, то есть их биологического разнообразия, основного источника инфекции и пути заражения, имеют решающее значение для разработки любой целевой стратегии IPP на основе фагов.
1.4 Влияние биоразнообразия патогенов и путей заражения для определения оптимальной стратегии применения
Детальное понимание разнообразия патогенов и взаимодействия растений и бактерий включает в себя выделение репрезентативной коллекции штаммов и их характеристику на уровне генома, а также сопоставление филогенетических данных с метаданными, включая, например, региональное местонахождение и период выделения [59]. Например, недавнее филогенетическое исследование Xanthomonas oryzae pv. oryzae показало, что внутри этого бактериального подвида существует шесть различных групп с различными генотипическими характеристиками [60,61]. При разработке фагового коктейля против этого патогена и многих других фитопатогенов, необходимо принимть во внимание это внутривидовое разнообразие, которое имеет решающее значение для обеспечения эффективной работы фагового коктейля против наиболее релевантных патогенных штаммов в данном географическом местоположении [23,62]. Более того, такие данные, связанные с вирулентностью конкретных штаммов, позволили бы рационально разрабатывать предложеия специально для наиболее инвазивных штаммов в этом регионе. Информация о сроках появления этих высоковирулентных штаммов потенциально позволит идентифицировать источник инфекции и остановить заболевание на ранней стадии. Поэтому определение источника инфекции и регулярный мониторинг необходимы для предотвращения вспышки и дальнейшего распространения болезни в интенсивном сельском хозяйстве.
На рисунке 1 представлен схематический обзор наиболее распространенных стратегий заражения, используемых фитопатогенами, и того, как фаги могут вмешиваться на разных стадиях при рациональном проектировании стратегии применения. Рационально разработанные стратегии защиты растений должны быть направлены на предотвращение неконтролируемого размножения вредителя путем непосредственного взаимодействия с его жизненным циклом, ограничивая при этом влияние на текущую и будущую сельскохозяйственную практику.
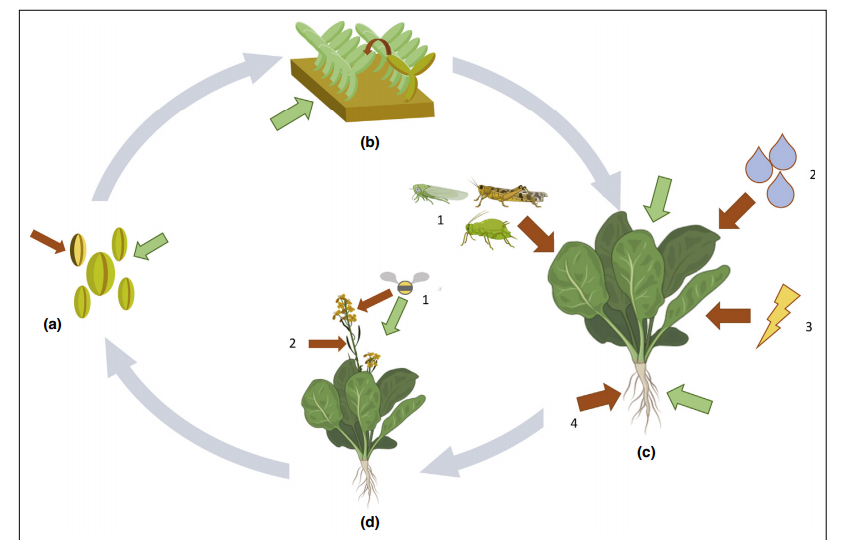
Рисунок 1 — Обзор наиболее распространенных путей заражения растений патогенными бактериями (красные стрелки) и способов рационального применения фагов (зеленые стрелки).
(а) Бактерии, такие как Clavibacter michiganensis subsp. nebraskensis, Xanthomonas campestris pv. campestris или Acidovorax citrulli способны заражать семена. Здесь целенаправленное обеззараживание семян на основе фагов может служить инструментом борьбы с болезнью.
(b) Многие культуры сначала выращиваются в питомниках, а затем пересаживаются в поле. Рассаду и молодые растения выращивают при относительной высокой влажности и в непосредственной близости. Следовательно, болезни могут легко распространяться от одного растения к другому. Фаги могут применяться в таких условиях, чтобы защитить соседние растения от возможность заражения и сдерживать распространение бактерий после высадки рассады.
(с.1.) Насекомые — известные носители множественных заболеваний, вызываемых фитоплазмами, Xylella fastidiosa и Candidatus liberibacter spp. (с.2.) Загрязненная вода с соседних растений и зараженная почва способствуют распространению патогенов. Часто, бактерии используют несколько путей заражения, чтобы проникнуть в ткани листа. (c.3.) Физические повреждения и ранения являются идеальной отправной точкой для бактерий, колонизирующих растение. (c.4.) Патогены, такие как Ralstonia solanacearum и другие, заражаются растения через загрязненную почву и воду. В этих системах, фаги могут применяться в качестве добавки и/или обработки почвы для защиты или лечения заболеваний.
(d.1.) Бактерии, такие как Erwinia amylovora, способны заражать цветы и соцветия, поднимая опылителей и брызги воды, тогда как другие (d.2.) Проникают в зародыши семян, чтобы произвести зараженные. Здесь возможны прямые внесения, а опылители могут действовать как энтомовекторы для доставки фагов.
1.5 Подбор фагового коктейля и его значение для патоген-фаговых взаимодействий
Для разработки устойчивой стратегии биоконтроля фагов сначала необходимо выделить разнообразный и взаимодополняющий набор фагов. Глубокое молекулярное понимание геномики этих вирусов необходим для обеспечения их безопасности для применения в сельском хозяйстве [63,64]. Кроме того, следует позаботиться о предотвращении развития резистентности бактерий к фагу. Так как механизмы бактериальной резистентности к фагам чрезвычайно разнообразны [65,66]. Однако развитие резистентности в основном наблюдается в стандартных (богатых питательными веществами) лабораторных условиях, но в меньшей степени у растений. Одним из способов развития резистентности бактерий является потеря или модификация внешних мембранных структур [67,68], что является ключевой особенностью дизайна коктейлей. Устойчивость бактерий к коктейлю из фагов может возникать и на уровне распознавания рецепторов. Например, при обработке семян фагами [45]. Считается, что использование нескольких фагов, нацеленных на разные рецепторы, может ограничить возникновение этой резистентности, поскольку развитие резистентности часто связано с приспособляемостью. Действительно, Wright и его коллеги показали, что появление устойчивости Pseudomonas aeruginosa PAO1 в лабораторных условиях зависит от стратегии введения фага [69]. При использовании коктейля из 2 фагов, включающего фаги с различными рецепторами, наблюдаемая устойчивость была снижена по сравнению с последовательным использованием фагов, в то время как обе стратегии имели одинаковые затраты. Таким образом, развитие резистентности не обязательно является непреодолимым препятствием (по крайней мере, в краткосрочной перспективе), и на результат резистентности может повлиять рациональная разработка стратегии применения. Остается открытым вопрос, верно ли то же самое для внешней среды. Hernandez и Koskella, обратились к этому, разработав эксперимент, в котором они совместно культивировали патоген растений Pseudomonas syringae pv. Tomato и два фага, в богатой среде и на листьях томата [70]. Они обнаружили, что устойчивость легко приобретается в богатой среде, как и ожидалось. Однако им не удалось выделить из листьев устойчивые к фагам мутанты. Таким образом, они подтвердили предыдущую работу, которая показала, что лабораторно приобретенная устойчивость может возникать из-за преспособляемости [71], и показали, что у растений не возникло альтернативной устойчивости. Однако в настоящее время не существует основы для оценки развития и воздействия потенциальной устойчивости к фагам, и этот аспект следует внимательно учитывать при практическом применении.
1.6 Индивидуальные стратегиям применения фагов
В настоящее время существуют различные варианты применения фагов в зависимости от пути заражения. Однако, применение внекорневой подкормки в открытом грунте представляется довольно ограниченным методом, из-за проблем со стабильностью, вызваемых биотическими и абиотическими стрессами, включая солнечный свет, изменение погодных условий и высыхание [54]. Поэтому предпринимаются попытки по повышению выносливости фагов на листовой поверхности. Born и его коллеги протестировали рецептуру фага Erwinia amylovora Y2 и смогли выявить 28%, 34% и 38% исходного фага после воздействия высокоинтенсивного ультрафиолетового излучения, смешав фаг с 10% морковным соком, 5% соком перцев и 50 mM ароматических аминокислот соответственно. Это гараздо выше по сравнению с 0,21% выявления без предложенной рецептуры [72]. В другом примере GasˇI c et al. повысил стабильность фага Xanthomonas euvesicatoria Kf1, смешав его с 0,75% обезжиренного молока и 0,5% сахарозы. Таким обзаром подготовленная популяция фагов обнаруживалась после шестидесяти дней инкубации в УФ/темном состоянии 16/8 часа, в то время как неподготовленная популяция фагов была необнаружима через сорок дней [55]. Поскольку все фаги состоят из белкового капсида, аналогичные стратегии можно было бы предусмотреть для всех обработок распылнием в открытом поле. Другой подход в этой перспективе был предложен Svircev и др. для борьбы с инфекциями Erwinia amylovora для обработки цветков яблони и груши фагом в полевых условиях [73]. Чтобы минимизировать потерю фагов из-за стрессов, они применяют штаммы-носители фагов Erwinia такие как Pantoea agglomerans для поддержания высокой концентрации фагов in situ для предотвращения распада фагов [74]. Во многих патосистемах зараженные семена считаются одним из основных путей заражения [75]. Следовательно, фаги могут применяться в качестве дезинфекционного этапа при подготовке семян или замачивании для уменьшения развития болезней. Так, искусственно контаминированные Pseudomonas syringae pv. porri семена лика были замочены в растворе фага, после чего происходило снижение бактериального титра [45]. Другой подход в этой перспективе основан на покрытии семян. Например, Kimmelshue et al. снижал бактериальные титры Clavibacter michiganensis subsp. nebraskensis у кукурузы на 76% на семя в семенах контаминированны снаружи и 51% и 78% в семенах, инфицированных изнутри, в семенах и тканях проростков, соответственно [44]. Rahimi получил аналогичные результаты при контроле бактериальной пятнистости плодов дыни. Авторам удалось увеличить всхожесть семян с 13% в семенах без покрытия до 96%, в семенах покрыты фагами [43]. Они также показали, что фаги поглощаются рассадой и возможно использовать такой способ защитить растение от инфекции [42]. Поглощение фагов растениями описано и для других патосистем, таких как яблоки и бобы [76-78]. Эти подходы показывают потенциал бактериофагов в качестве обеззараживающего средства семян.
Кроме того, известно, что некоторые бактериальные заболевания растений распространяются в питомниках и проявляются после пересадки в полевые условия. Тут фаги могут быть применены в качестве обработки почвы для дезинфекции или их можно использовать в качестве профилактической обработки, промочив лотки для растений перед посадкой их в поле или теплицу. Полный потенциал этих методов еще предстоит изучить.
1.7 Интеграция фагового биоконтроля в цифровое земледелие
Современные революции в растениеводстве и сельском хозяйстве вцелом, именуемые умным или цифровым земледелием, включают в себя внедрение новых технологий и приборов. Смартфоны, робототехника, машинное обучение и сенсорные технологии могут быть интегрированы в сельскохозяйственный процесс, что облегчает обнаружение различных фитопатогенов как в тепличных, так и в полевых условиях [35, 79]. Гиперспектральные сенсоры, способны обнаруживать возникающие бактериальные инфекции с точностью до 96%, что позволяет своевременно идентифицировать возбудителя и применять терапию на ранних стадиях [80,81]. Таким образом, лечение может быть направлено конкретно на отдельные больные растения и их соседей. В случае интенсивного вертикального земледелия растения выращивают в гидропонных системах в условиях искусственного освещения с использованием светоизлучающих диодов (светодиодов) в качестве основного источника света. Эти условия идеально подходят для применения фагов, поскольку они не приводят к высыханию фага на поверхности листа, отсутствует воздействие ультрафиолетового излучения и другие абиотические стрессы,присутствующие в поле. Здесь фаги могут быть применены до развития симптомов в качестве профилактического средства в питательном раствор, предотвращающем заболевание, или в виде спрея для лечения потенциально зараженных растений после обнаружения. Шмели и другие энтомовекторы также могут быть использованы для распростронения бактериофагов, как агентов биоконтроля в тепличных условиях [82]. Кроме того, сенсорное обнаружение больных культур также возможно в условиях открытого поля благодаря оптимизации беспилотных технологий и беспилотных автоматизированных транспортных средств [83]. В этом случае больные культуры снова могут быть точно обнаружены в поле и уничтожены во время обработки почвы. Фаговые технологии вместе с другими организмами биоконтроля могли бы служить в этом контексте комплексной стратегией борьбы с болезнями, которую еще предстоит изучить или использовать. Однако такое рациональное использование ресурсов служит экономической и экологической логике, поскольку сокращает количество необходимых обработок. Эффект самоусиления и автоматического дозирования фагов еще больше увеличивает эффективность применения. Автоматизированное прецизионное нанесение также позволяет поддерживать постоянную скорость нанесения, обеспечивая равномерную обработку там, где это необходимо. Кроме того, при обработке только загрязненных культур и применение агентов биоконтроля заболевание может быть сдержано, а риск развития резистентности патогена снижен, поскольку он вводится только локально.
На рисунке 2 представлен схематический обзор полного внедрения фагов в качестве устойчивых агентов биоконтроля в современную сельскохозяйственную практику.
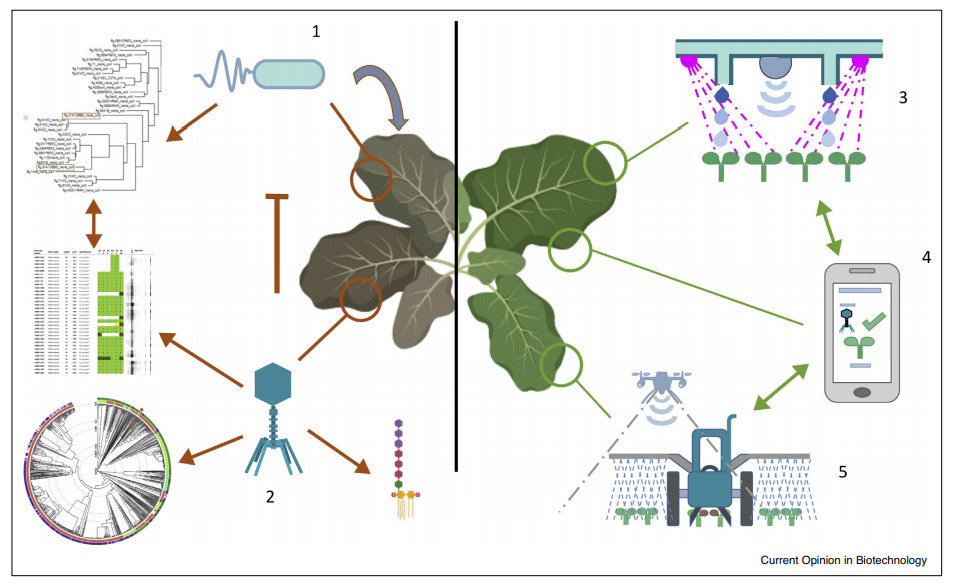
Рисунок 2 — Обзор комплексной стратегии защиты растений на основе фагового биоконтроля. 1. Репрезентативная бактериальная коллекция должна быть создана путем выделения штаммов из больных культур. Филогенетический анализ этих бактерий позволяет оценить общее бактериальное разнообразие. Метаданные о географическом местоположении и периоде ыделения помогают понять географическое распределение штаммов. Кроме того, необходимы данные о вирулентности штаммов, находящихся в коллекции, для определения наиболее релевантных штаммов из коллекции. 2. Коллекция бактериофагов может быть получена из различных зараженных районов. Диапазон хозяев различных фагов должен быть протестирован и соотнесен с бактериальной филогенией, чтобы иметь возможность разработать рациональное применение фагов на основе распределения штаммов. Кроме того, глубокие геномные данные позволяют отбирать на литических фагах те, которые безопасны для использования в сельскохозяйственных условиях. При составлении фагового коктейля коктейль предпочтительно должен состоять из фагов, распознающих различные рецепторы, чтобы ограничить развитие резистентности. 3. В вертикальном земледелии растения выращиваются в полностью контролируемых гидропонных теплицах с использованием светодиодов в качестве основных источников света. Растения можно контролировать с помощью сенсорных методов, позволяющих контролировать рост растений. С этой точки зрения гиперспектральные датчики, могут быть использованы для раннего выявления заболеваний. Как только инфекция обнаружена, и подтверждена уведомление может быть отправлено на смартфон фермера 4. и зараженные растения могут быть уничтожены, а соседние растения обработаны биопестицидом, таким как бактериофаги. 5. Гиперспектральные датчики могут быть прикреплены к БПЛА, которые могут отправить отчет фермеру, что позволит своевременно избавиться от больных культур и рационально обработать зараженный участок.
1.8 Перспективы полноценной вирусо-ориентированной комплексной борьбы с вредителями сельскохозяйственных культур
Исследования по биоконтролю фагов привели к появлению ряда коммерчески доступных продуктов. В США они зарегистрированы как биопестициды. В отличие от этого, до настоящего времени не зарегистрировано ни одного фагового продукта в Европе или России. На сегодняшний день несколько вирусов насекомых и вирусов растений были зарегистрированы в качестве биопестицидов для борьбы с вредителями (База данных активных веществ для пестицидов растений; URL:https://ec. https://ec.europa.eu/food/plant/pesticides/eu-pesticides-database/). Кроме того, в пищевом секторе несколько фагов получили статус GRAS от Управления по контролю за продуктами питания и лекарствами США, в том числе Фаги листерий, сальмонелл, эшерихий и шигелл используют как технологические добавки (URL-адрес:https://www.accessdata.fda.gov/scripts/fdcc/). Кроме того, применение фагов Pectobacterium в качестве упаковочного средства для поверхностной стерилизации клубней картофеля после уборки урожая разрешено в пищевой промышленности Европы. Изменения в регистрации фагов в качестве биопестицидов в соответствии с требованиями пищевой промышленности могли бы послужить дополнительным стимулом для полного изучения потенциала бактериофагов. Это даст толчок целенаправленным исследованиям и потенциальной коммерциализации методов борьбы с болезнями на основе фагов.
Все же сегодня отсутствуют устойчивые биологические стратегии борьбы с бактериальными инфекциями в растениеводстве. Предпринимаются усилия для решения этой проблемы путем применения бактериофагов. Предыдущие исследования действительно показали, что фаги перспективны в качестве биоконтролирующего средства для индикации профилактики и лечения бактериальных инфекций. Однако современные цифровые технологии земледелия, до сих пор таят в себе неисследованные и уникальные возможности для внедрения фагового биоконтроля. В последующем необходима полноценная оценка безопасности бактериофагов с точки зрения развития долговременной резистентности и их влияния на природные микробные сообщества. Сбор таких данных будет иметь решающее значение для регулирования и коммерческого внедрения фаговых технологий в современные методы ведения сельского хозяйства.
2 Результаты исследований
2.1 Объекты, материалы и методы исследований
Научная литература, посвященная исследованиям бактериофагов, была проанализирована формально-логическими методами. В работе использованы микробиологические, иммунохимические, молекулярно-генетические и статистические методы исследований.
Для работы со штаммами бактерий и фагами, выделенными из объектов внешней среды были использованы изолированные боксированные помещения для проведения микробиологических исследований.
Обязательными начальными этапами работы было:
— определение спектра чистых культур Pseudomonas syringae — как перспективных штаммов бактерий (т.е. кандидатов в производственные штаммы бактерий);
— определение спектра вирулентных бактериофагов, специфичных для Pseudomonas syringae для конструирования фагового биопрепарата.
Объектами исследования стали 8 бактериофагов активных в отношении Pseudomonas syringae выделенные из объектов окружающей среды: почвы, воды (река, сточные воды) и сельскохозяйственных растений (листья, плоды, стебли).
Для исследований были предусмотрены раздельные микробиологические боксы для работы с производственными бактериальными штаммами и маточными фагами.
При производстве фаговых препаратов проводили валидацию технологического процесса, технологического оборудования, сырья и методов контроля. Все исходные материалы и сырье, используемые при производстве, имело документы, подтверждающие их качество. Производственные питательные среды обладали хорошими ростовыми свойствами и были стерильными.
В экспериментах применяли штамм бактерий Pseudomonas syringae Ps.s № 3 (коллекция музея бактериальных штаммов и бактериофагов кафедры (МВЭ и ВСЭ) микробиологии, вирусологии, эпизоотологии и ветеринарно-санитарной экспертизы ФГБОУ ВО Ульяновский ГАУ); референс-штамм бактерий Pseudomonas syringae В-10917 из коллекции БРЦ ВКПМ НИЦ «Курчатовский институт» — ГосНИИгенетика.
Для изучения специфичности бактериофагов были использованы штаммы бактерии: Pseudomonas stutzeri, Pseudomonas aeruginosa, Pseudomonas putida, Pseudomonas fluorescens, Рectobacterium carotovorum, Хanthomonas campestris, Saimonella enteritidis, Yersinia enterocolitica, Shigella sonnei, Salmonella typhimurium, Klebsiella pneumoniae, Echerichia coli, Proteus vulgaris, Proteus mirabilis.
Термостат (ТСО-1/80) ОАО «Смоленское СКТБ СПУ»; Термометр; Ультрафиолетовая лампа марки «Phillips» с длиной волны 253 нм; Спиртовка; Петля пастеровская; Плитка электрическая; Лабораторная стерильная посуда; Дистиллированная вода; Лабораторные весы; Автоклав (ГК-100-3); Дистиллятор (Liston); генцианвиолет 548-62-9 (ЗАО «Вектон», РФ); Набор реагентов для окраски микроорганизмов по методу Грама (НИЦФ Россия, Санкт-Петербург; ГРМ-агарагар (ФБУН ГНЦПМиБ Россия г Оболенск);ГРМ-бульон (ФБУН ГНЦПМиБ Россия г Оболенск); Среда Кинга В (Пептон Пептон ферментативныйООО НИЦФ СПБ; Глицерин раствор ОАО Самарамедпром РФ; калий фосфорнокислыйдвузамещенный ГОСТ 4198-75 УлХИМ РФ; магний сернокислый УлХИМ РФ; ГРМ-агарагар (ФБУН ГНЦПМиБ Россия г Оболенск)); Оксидазные диски HiMediaLaboratoriesPvt. Limited (Индия); Водорода перекись раствор 3% ООО «ЮжФарм». Краснодарский край, Крымский р-н, ст. Троицкая; Аргининовый бульон HiMediaLaboratoriesPvt. Limited (Индия); Питательный желатин HiMediaLaboratoriesPvt. Limited (Индия); Раствор Люголя (НИЦФ Россия, Санкт-Петербург); Пептон ферментативный ООО НИЦФ СПБ; Натрий хлористый ГОСТ 4233-77 УлХИМ РФ; калий фосфор¬нокислыйдвузамещенный ГОСТ 4198-75 УлХИМ РФ; бромтимоловый синий (HiMediaLaboratoriesPvt.Limited (Индия);Натрий хлористый ГОСТ 4233-77 УлХИМ РФ; Кальций хлористый ГОСТ 450-77 УлХИМ РФ; ГРМ-агарагар (ФБУН ГНЦПМиБ Россия г Оболенск);Tween 80 (HiMediaLaboratoriesPvt. Limited (Индия); Сахароза (чда) ГОСТ 5833-75УлХИМ РФ; Полоски с реактивом Ковача (на индол) HiMediaLaboratoriesPvt. Limited (Индия); Железосодержащий пептонныйагарHiMediaLaboratoriesPvt. Limited (Индия); питательные среды Гисса (ООО «НПЦ «Биокомпас-С» Россия, г. Углич), хломамин Б, 70 % этиловый спирт, среда Кесслера, среда Эндо, среда Раппапорта-Вассилиадиса с соей (RVS-бульон), среда Мюллер-Кауфман тетратионатный бульон (МКТ-бульон).
Среда CRL содержала следующие компоненты: пептон 12.0 г, глицерин 10.0 г, агар 18.0 г, MgSO4 0.7 г, K2HPO4 2.0 г, KH2PO4 2.0 г, глюкозу 2.5 г, дрожжевой экстракт 2.0 г, мясной пептон 2.0 г, сахарозу 15.0 г, NaCl 2.0 г, CaCO3 20.0 г (реактивы производства PanReac AppliChem, Испания) на 1 л дистиллированной воды. Среда CRL.2 состояла из тех же компонентов, за исключением CaCO3. Все ингредиенты перемешивали, доводили рН 20%-м раствором соляной кислоты до 7,0-7,2 с помощью pH-метра (МР 220, Mettler Toledo, Швейцария) и стерилизовали при температуре 121℃ в течение 15 мин (автоклав MLS-3020U, Sanyo, Япония). Для получения среды mCRL.2 к среде CRL.2 после стерилизации и охлаждения до 50℃ добавляли спиртовой (70%) раствор циклогексимида до его конечной концентрации 200 мг на 1 л среды и водный раствор 2,3,5-трифенилтетразолия хлористого (ТТХ) до конечной концентрации 50 мг на 1 л среды.
Изучение биологических свойств фагов проводили по методам, описанным в научных работах (Н.А. Феоктистова и др., 2017; Д.А. Васильев и др., 2017; П.С. Майоров и др., 2020).
Реакция нарастания титра фага – это метод индикации, позволяющий выявить бактериальный агент в анализируемом материале, не выделяя чистую бактериальную культуру (Г.Р. Садртдинова, 2017).
Реакцию нарастания титра фага ставили на пробах почвы (садоводческое общество «Садовод УСХИ» п. Октябьский Чердаклинского района Ульяновской области), семенах огурца «Китайский змей», речной воде (р.Свияга, г.Ульяновск), томатах сорта «Бычье сердце», цуккини сорта «Цукеша», огурцах сорта «Аэлита» на базе кафедры (МВЭ и ВСЭ) микробиологии, вирусологии, эпизоотологии и ветеринарно-санитарной экспертизы ФГБОУ ВО Ульяновский ГАУ). Пробоподготовку осуществляли следующим образом: гомогенизация и последующее разведение анализируемого материала в стерильном физиологическом растворе, используя соотношение 1:10.
При подборе оптимального времени экспозиции компонентов фагового биопрепарата с исследуемой пробой эмпирически подбирали временной диапазон термостатирования с учетом температуры культивирования индикаторной бактериальной культуры. Эксперименты ставили на стерильном МПБ.
Параметры постановки эксперимента:
— исследуемый субстрат вместе с введенным бактериофагом термостатировали при температуре 28±1 0С, не применяя этап «предварительного подращивания», в течение 3,5; 7,0; 15,0; 24,0 часов);
— исследуемый субстрат вместе с введенным бактериофагом термостатировали при температуре 28±1 0С, включая этап «предварительное подращивание», в течение 3,5; 7,0; 15,0; 24,0 часов).
Схема исследования показана в рисунке 3.
Результаты индикации бактерий в анализируемом субстрате методом реакции нарастания титра фага (РНФ) учитывались следующим образом: увеличение на чашке Петри количества негативных колоний фага (бляшкообразующих единиц) по сравнению с контролем в пять и более раз свидетельствует об наличии в опытной пробе искомых бактерий, на которых адсорбировался специфичный им бактериофаг и был зафиксирован цикл его развития (Е.О. Чугунова и др., 2016).
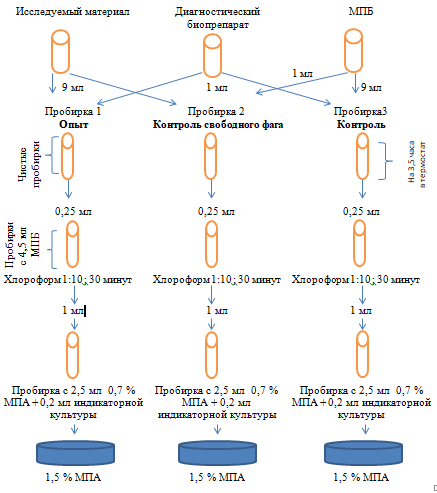
Рисунок 3 – Схема индикации бактерий Pseudomonas syringae с методом реакции нарастания титра фага с использованием изучаемого бактериофагового биопрепарата
Для протеомного анализа нами были использованы ресурсы систем SnapGene Viewer v.4.1.7 и UGENE (v.36).
Статистическую обработку результатов исследований проводили с помощью пакета программ Statistica Desktop 13 Russian (for Windows; StatSoft Russia (TIBCO USA), Microsoft Excel 2010).
2.2 Результаты собственных исследований
2.2.1 Конструирование фагового биопрепарата на основе имеющихся фагов, специфичных для Pseudomonas syringae, характеризующихся определенными биологическими свойствами
Морфологию негативных колоний изучали на плотных питательных средах по методу Грациа. Установлено, что бактериофаги бактерий Pseudomonas syringae на МПА формировали схожие между собой негативные колонии — прозрачные, округлой формы, без зоны вторичного роста диаметром от 5 до 9 мм (рис 4).
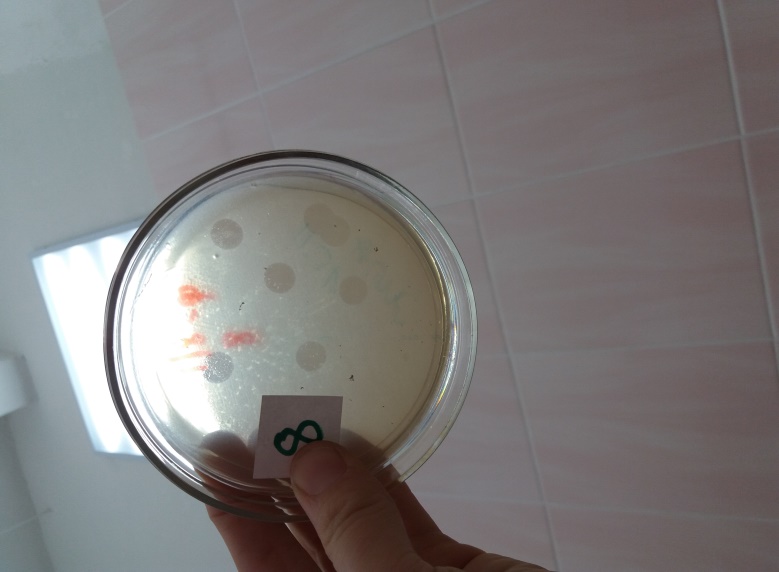
Рисунок 4 – Морфология негативных колоний бактериофага Pseudomonas syringae Ps.s-8 УлГАУ
Литическая активность — это свойство фага вызвать лизис бактериальной культуры на плотной (по методу Грациа) или жидкой (по методу Аппельмана) питательной среде. Для получения достоверных результатов такая активность фага всегда определяется в конкретных, стандартных условиях. В связи с этим, индикаторный штамм Pseudomonas syringae — Ps.s №3, выращивали на стандартном мясопептонном бульоне в течение 18-20 часов и использовали в эксперименте.
Установлено, что бактериофаги проявляли разную литическую активность на культуре бактериальных клеток штамма №3 Pseudomonas syringae. Результаты представлены в таблице 1.
Литическая активность изучаемых бактериофагов Pseudomonas syringae составила по Аппельману от 10-4 до 10-8; по Грациа от 1,0±0,1×106 до 2,0±0,1×109 (БОЕ/мл).
За изменениями литической активности во время хранения наблюдали в течение года, проверяя результаты через каждые 3 месяца. Все фаги хранились в виде фаголизата бульонной культуры в закупоренных стекляных флаконах в условиях холодильника при температуре 2 — 4 ºС. Результаты определения литической активности по методам Аппельмана и Грациа приведены в таблице 2. Установлено, что бактериофаги Ps.s-7 УлГАУ, Ps.s-13 УлГАУ и Ps.s-27 УлГАУ не изменяют свою литическую активность в течение 12 месяцев. Литическая активность фагов Ps.s-1 УлГАУ, Ps.s-8, Ps.s-15 УлГАУ, Ps.s-30 УлГАУ, Ps.s-77 УлГАУ снижалась при хранении в течении года в пределах 1-2 порядков и легко востанавливалась после 3-5 последовательных пассажей.
Таблица 1 — Литическая активность
| № | Наименование фага | Литическая активность | |
| по Аппельману | по Грация | ||
| 1 | Ps.s-1 УлГАУ | 10-8 | 1,0±0,1×109 |
| 2 | Ps.s-7 УлГАУ | 10-8 | 2,0±0,1×109 |
| 3 | Ps.s-8 УлГАУ | 10-6 | 1,0±0,1×108 |
| 4 | Ps.s-13 УлГАУ | 10-5 | 2,0±0,1×108 |
| 5 | Ps.s-15 УлГАУ | 10-5 | 5,0±0,1×107 |
| 6 | Ps.s-27 УлГАУ | 10-8 | 1,0±0,1×109 |
| 7 | Ps.s-30 УлГАУ | 10-7 | 2,0±0,1×108 |
| 8 | Ps.s-77 УлГАУ | 10-4 | 1,0±0,1×106 |
Таблица 2 — Литическая активность бактериофага через 3 месяца хранения
| № | Наиме-нования фага | Литическая активность через 3 месяца хранения | Литическая активность через 6 месяца хранения | ||
| по Аппельману | по Грациа | по Аппельману | по Грациа | ||
| 1 | Ps.s-1 | 10-8 | 1,0±0,1×109 | 10-7 | 2,0±0,1×108 |
| 2 | Ps.s-7 | 10-7 | 2,0±0,1×109 | 10-8 | 2,0±0,1×109 |
| 3 | Ps.s-8 | 10-6 | 1,0±0,1×108 | 10-4 | 2,0±0,1×106 |
| 4 | Ps.s-13 | 10-5 | 2,0±0,1×108 | 10-5 | 2,0±0,1×108 |
| 5 | Ps.s-15 | 10-5 | 5,0±0,1×107 | 10-5 | 3,0±0,1×106 |
| 6 | Ps.s-27 | 10-8 | 2,0±0,1×109 | 10-8 | 1,0±0,1×109 |
| 7 | Ps.s-30 | 10-7 | 1,0±0,1×108 | 10-6 | 3,0±0,1×107 |
| 8 | Ps.s-77 | 10-4 | 1,0±0,1×106 | 10-4 | 2,0±0,1×105 |
| № | Наиме-нования фага | Литическая активность через 9 месяца хранения | Литическая активность через 12 месяца хранения | ||
| по Аппельману | по Грациа | по Аппельману | по Грациа | ||
| 1 | Ps.s-1 | 10-7 | 2,0±0,1×108 | 10-6 | 1,0±0,1×107 |
| 2 | Ps.s-7 | 10-8 | 2,0±0,1×109 | 10-8 | 1,0±0,1×109 |
| 3 | Ps.s-8 | 10-4 | 2,0±0,1×106 | 10-4 | 1,0±0,1×106 |
| 4 | Ps.s-13 | 10-5 | 2,0±0,1×108 | 10-5 | 2,0±0,1×108 |
| 5 | Ps.s-15 | 10-5 | 3,0±0,1×106 | 10-4 | 2,0±0,1×105 |
| 6 | Ps.s-27 | 10-8 | 1,0±0,1×109 | 10-8 | 1,0±0,1×109 |
| 7 | Ps.s-30 | 10-6 | 3,0±0,1×107 | 10-5 | 4,0±0,1×106 |
| 8 | Ps.s-77 | 10-4 | 2,0±0,1×105 | 10-3 | 3,0±0,1×104 |
Спектр литической активности бактериофагов, т.е. диапазон лизиса гомологичных к бактериофагу бактерий является их характерной особенностью и одним из критериев отбора для включения бактериофага в состав биопрепарата. Диапазон литической активности устанавливали на 15 штаммах Pseudomonas syringae, 2 из которых референс-штаммы и 13 — полевые.
На подсушенный газон бактериальной культуры наносили каплю бактериофага по секторам и инкубировали при температуре 28°С в условиях термостата. Оценку результатов проводили через 16-20 часов (рис. 5).
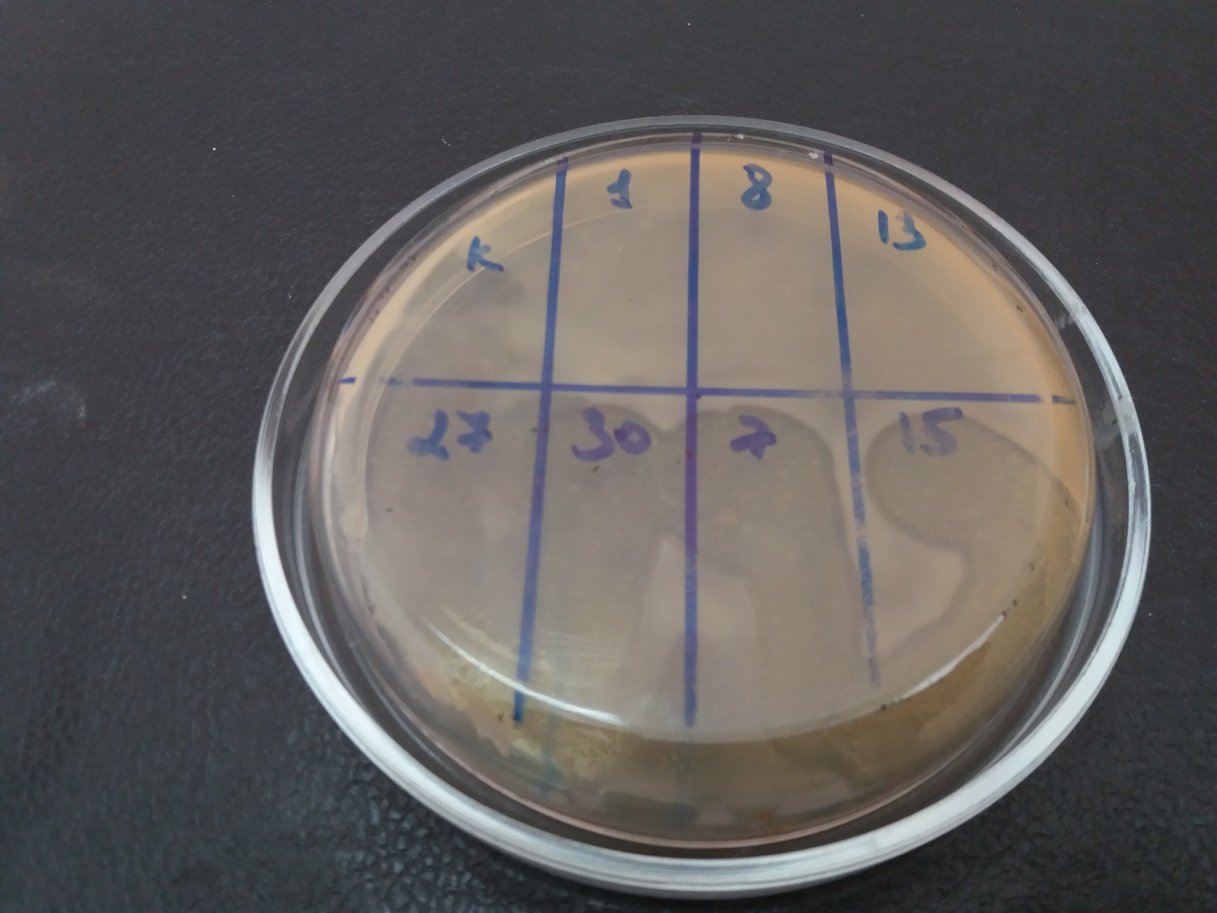
Рисунок 5 – Стерильные зоны лизиса в месте нанесения бактериофагов — положительный результат
Опыты показали, что фаги характеризуются различным спектром литической активности по отношению к бактериальным культурам.
Установлено, что спектр литической активности изучаемых фагов варьировал от 21,4% (Ps.s-13 УлГАУ) до 85,7% (Ps.s-7 УлГАУ, Ps.s-27 УлГАУ).
Изучение специфичности действия бактериофагов Pseudomonas syringae проводили по методу Отто. Установлено, что все 8 изучаемых бактериофагов специфичны к бактериям вида Pseudomonas syringae и не проявляют активности по отношению к представителям других родов и видов бактерий: Pseudomonas stutzeri, Pseudomonas aeruginosa, Pseudomonas fluorescens, Pseudomonas putida, Pectobacterium carotovorum, Хanthomonas campestris, Saimonella enteritidis, Klebsiella pneumoniae, Echerichia coli, Salmonella typhimurium, Yersinia enterocolitica, Shigella sonnei, Proteus vulgaris, Proteus mirabilis (табл. 4).
Таблица 3 — Спектр литической активности фагов по отношению к штаммам Pseudomonas syringae
| № | Наименования фага | Спектр действия % | Наименование штамма бактерии Pseudomonas syringae |
| 1 | Ps.s-1 УлГАУ | 42,9 | В-10917, №3, №5б, №7, №23, №33 |
| 2 | Ps.s-7 УлГАУ | 85,7 | В-10917, №3, №3б, №5б, №6б, №11, №7, №23, №4, №33, №37, №38 |
| 3 | Ps.s-8 УлГАУ | 64,3 | №7, №1, №5б, №11, №7, №23, №4, №33, №35 |
| 4 | Ps.s-13 УлГАУ | 21,4 | В-10917, №3, №33 |
| 5 | Ps.s-15 УлГАУ | 50,0 | В-10917, №3, №3б, №6б, №7, №23, №33 |
| 6 | Ps.s-27 УлГАУ | 85,7 | В-10917, №3, №3б, №4, №5б, №11, №7, №23, №33, №37, №38, №77 |
| 7 | Ps.s-30 УлГАУ | 50,0 | В-10917, №3, №3б, №5б, №7, №23, №33 |
| 8 | Ps.s-77 УлГАУ | 50,0 | В-10917, №3, №3б, №6б, №7, №23, №33 |
Степень устойчивости бактериофагов и клеточных хозяев к инактивирующим факторам физического воздействия имеет теоретическое и практическое значение, поэтому при изучении биологических свойств фагов определение их чувствительности к таким агентам является обязательным. Нами было проведены исследования по изучению термоустойчивости бактериофагов в диапазоне 40-64 °С в течение 30 минут.
Бактериофаги прогревали на водяной бане при температуре от 40°С до 62 °С с интервалом 2°С в течение 30 минут. Контролем служил стерильный мясопептонный бульон. Качественное изучение активности фагов подвергнутых прогреванию проводили по методу Отто. Культивировали посевы в условиях термостата в течение 18 часов при температуре 28±2 0С. Наличие зоны лизиса в виде «дорожки» свидетельствовало об устойчивости фагов к воздействию температуры (табл. 5).
Таблица 4 — Результаты изучения специфичности действия бактериофагов Pseudomonas syringae
| № | Виды бактерии | Наименование бактериофага | |||||||
| Ps.s-1 УлГАУ | Ps.s-7 УлГАУ | Ps.s-8 УлГАУ | Ps.s-13 УлГАУ | Ps.s-15 УлГАУ | Ps.s-27 УлГАУ | Ps.s-30 УлГАУ | Ps.s-77 УлГАУ | ||
| 1 | Pseudomonas fluorescens | — | — | — | — | — | — | — | — |
| 3 | Pseudomonas putida | — | — | — | — | — | — | — | — |
| 4 | Pseudomonas struzeri | — | — | — | — | — | — | — | — |
| 5 | Pseudomonas aeruginosa | — | — | — | — | — | — | — | — |
| 6 | Xantomonas camprestis | — | — | — | — | — | — | — | — |
| 7 | Pectobacterium carotovorum | — | — | — | — | — | — | — | — |
| 8 | Saimonella enteritidis | — | — | — | — | — | — | — | — |
| 9 | Salmonella typhimurium | — | — | — | — | — | — | — | — |
| 10 | Yersinia enterocolitica | — | — | — | — | — | — | — | — |
| 11 | Shigella sonnei | — | — | — | — | — | — | — | — |
| 12 | Klebsiella pneumoniae | — | — | — | — | — | — | — | — |
| 13 | Echerichia coli | — | — | — | — | — | — | — | — |
| 14 | Proteus vulgaris | — | — | — | — | — | — | — | — |
| 15 | Proteus mirabilis | — | — | — | — | — | — | — | — |
| 16 | Pseudomonas syringae | + | + | + | + | + | + | + | + |
Таблица 5 — Определение температурной устойчивости бактериофагов Pseudomonas syringae
| Фаг | Показатель температуры, 0С | |||||||||||
| 40 | 42 | 44 | 46 | 48 | 50 | 52 | 54 | 56 | 58 | 60 | 62 | |
| Ps.s-1 УлГАУ | + | + | + | + | + | + | + | + | + | + | — | — |
| Ps.s-7 УлГАУ | + | + | + | + | + | + | + | + | + | + | + | — |
| Ps.s-8 УлГАУ | + | + | + | + | + | + | + | + | + | + | — | — |
| Ps.s-13 УлГАУ | + | + | + | + | + | + | + | + | + | + | + | — |
| Ps.s-15 УлГАУ | + | + | + | + | + | + | + | + | + | + | — | — |
| Ps.s-27 УлГАУ | + | + | + | + | + | + | + | + | + | — | — | — |
| Ps.s-30 УлГАУ | + | + | + | + | + | + | + | + | + | + | — | — |
| Ps.s-77 УлГАУ | + | + | + | + | + | + | + | + | + | + | — | — |
Установлено, что бактериофаги бактерий Pseudomonas syringae умеренно термоустойчивы. Нагрев выше 62 °С приводит к инактивации бактериофагов.
Изучение устойчивости фагов к воздействию хлороформа проводили при следующих условиях: соотношение фаголизата и хлороформа 10:1, время воздействия 5-40 минут с 5-минутным интервалом. Надосадочную жидкость после отстаивания использовали в исследованиях с индикаторным штаммом Pseudomonas syringae по методу Отто. Культивировали посевы в условиях термостата в течение 18 часов при температуре 280С. Наличие зоны лизиса в виде «дорожки» свидетельствовало об устойчивости фагов к воздействию хлороформа. Результаты исследований представлены в таблице 6.
В экспериментах также определено, что контроль в виде индикаторной культуры Pseudomonas syringae Ps.s №3 не выдерживал воздействие хлороформа даже в течении 5 минут. В свою очередь изучаемые фаги Pseudomonas syringae показали устойчивость к воздействию хлороформа даже при воздействии в течении 45 минут, таким образом обработку хлороформом можно считать оптимальным способом очистки фаголизатов от бактериальных клеток.
Таким образом, нами изучены биологические свойства 8 фагов, которые обладают способностью инфицировать и лизировать эти бактериальные патогены и, следовательно, потенциально могут быть использованы в качестве агентов биологического контроля Pseudomonas syringae.
Таблица 6 — Определение устойчивости фагов Pseudomonas syringae к воздействию хлороформа
| Временной интервал воздействия трихлорметана объект, минут | Ps.s-1 УлГАУ | Ps.s-7 УлГАУ | Ps.s-8 УлГАУ | Ps.s-13 УлГАУ | Ps.s-15 УлГАУ | Ps.s-27 УлГАУ | Ps.s-30 УлГАУ | Ps.s-77 УлГАУ | Индикаторная культура Pseudomonas syringae Ps.s №3 |
| 5 | + | + | + | + | + | + | + | + | — |
| 10 | + | + | + | + | + | + | + | + | — |
| 15 | + | + | + | + | + | + | + | + | — |
| 20 | + | + | + | + | + | + | + | + | — |
| 25 | + | + | + | + | + | + | + | + | — |
| 30 | + | + | + | + | + | + | + | + | — |
| 35 | + | + | + | + | + | + | + | + | — |
| 40 | + | + | + | + | + | + | + | + | — |
| 45 | + | + | + | + | + | + | + | + | — |
Для того чтобы фаг был эффективным агентом биологического контроля, предпочтительно, чтобы он обладал способностью лизировать целый ряд генетически разнообразных штаммов бактериального патогена. В связи с этим спектр литической активности фагов устанавливался нами на 15 штаммах Pseudomonas syringae, в т.ч выделенных из объектов внешней среды, что позволило определить штаммы фагов с широким диапазоном хозяев — Ps.s-7 УлГАУ, Ps.s-27 УлГАУ.
Изучение специфичности фагов на 15 видах гетерологичных культур, показало, что все 8 изучаемых бактериофагов видоспецифичны для Pseudomonas syringae и не оказывают негативного воздействия на другие бактерии.
Все изучаемые фаги, имели схожую морфологию негативных колоний и продуцировали прозрачные бляшки, демонстрируя цикл литической инфекции, что ограничивает риск горизонтальной передачи патогенного гена, возможного при лизогенном фаге.
Для определения оптимального способа очищения фаголизата от бактериальных клеток была изучена устойчивость фагов Pseudomonas syringae к воздействию физических и химических факторов. Исследования показали, что изучаемые фаги умеренно устойчивы к нагреванию и теряют активность при 30-минутном воздействии температуры выше 62°С.
Оптимальным же способом освобожения фаголизатов от жизнеспособных бактериальных клеток Pseudomonas syringae стал трихлорметан в соотношении 10:1 и временной экспозицией 45 минут.
Чтобы использовать фаг в качестве агента биологического контроля, он должен быть способен сохраняться в течение продолжительного периода времени, не снижая свою литическую активность. Результаты изучения литической активности фагов при хранении в условиях холодильника показали, что бактериофаги Ps.s-7 УлГАУ, Ps.s-13 УлГАУ и Ps.s-27 УлГАУ не снижали литическую активность в процессе хранения, а литическая активность фагов Ps.s-1 УлГАУ, Ps.s-8, Ps.s-15 УлГАУ, Ps.s-30 УлГАУ, Ps.s-77 УлГАУ снижалась при хранении в течении года в пределах 1-2 порядков и легко востанавливалась после 3-5 последовательных пассажей. Таким образом, хранение фагов в условиях холодильника при температуре 2 — 4 ºС является оптимальным.
Изучаемые фаги потенциально могут быть использованы в качестве биологического контроля Pseudomonas syringae, наиболее производственно-перспективными с учетом биологических свойств являются фаги: Ps.s-7 УлГАУ и Ps.s-27 УлГАУ, обладающие характеристиками:
Ps.s-7 УлГАУ: выделен из пробы почвы, индикаторная культура Ps.s № 3, литическая активность — 10-8 (при определении по методу Аппельмана) и 2,0±0,1х109 БОЕ/мл (бляшкообразующих единиц) (при определении по методу Грациа), специфичность — 85,7 % на 14 бактериальных штаммах Pseudomonas syringae; в исследованиях установлена устойчивость к температуре до 600С в течение 30 минут и трихлорметану в соотношении 1:10 (временная экспозиция 35 минут).
Ps.s-27 УлГАУ: выделен из пробы почвы, индикаторная культура Ps.s № 3, литическая активность — 10-8 (по методу Аппельмана) и 1,0±0,1х109 БОЕ/мл (по методу Грациа), специфичность — 85,7 % на 14 бактериальных штаммах Pseudomonas syringae; определено, что бактериофаг устойчив к воздействию температуры до 600С в течение 30 минут и трихлорметана в соотношении 1:10 (время экспозиции составило 35 минут).
Для данных производственно перспективных штаммов фагов был проведен еще ряд исследований.
На первом этапе исследовании были изучены температурные показатели культивирования выделенного бактериофага. Для этого в опытную пробирку, содержащую стерильный 1,5% МПБ в объеме 4,5 мл (рН 7,4-7,6) вносили 0,2 мл суточной культуры Pseudomonas syringae штамм № 3 в две пробирки, в одну добавляли 0,2 мл бактериофага Ps.s-7 УлГАУ и другую – 0,2 мл Ps.s-27 УлГАУ. Параллельно ставился контроль. Для чего, в пробирки, содержащие стерильный 1,5% МПБ в объеме 4,5 мл (рН 7,4-7,6), вносили суточную культуру Pseudomonas syringae штамм №3 в количестве 0,2 мл. Пробирки помещали в термостат (культивирование при температуре: 19 °С). Далее опыт проверяли 22°С, 25°С, 28°С, 31°С, 34°С, 37°С, 40°С соответственно.
Помутнение пробирки указывало на отсутствие лизиса, просветление в сравнении с контролем на наличие лизиса.
Таблица 7 – Температурные показатели культивирования бактериофага
| Название
бактериофага |
Температура культивирования фага, 0С | |||||||
| 19 | 22 | 25 | 28 | 31 | 34 | 37 | 40 | |
| Ps.s-7 УлГАУ | — | — | + | + | + | — | — | — |
| Ps.s-27УлГАУ | — | — | + | + | + | — | — | — |
Примечание: «-» — отсутствие лизиса, «+» — лизис.
Результаты исследований свидетельствуют о том, что оптимальная температура культивирования бактериофагов Ps.s-7 УлГАУ и Ps.s-27 УлГАУ находится в диапазоне 250С -31 0С. Нами решено инкубировать систему фаг-культура Ps.s-7 УлГАУ — Pseudomonas syringae штамм №3 и Ps.s-27 УлГАУ — Pseudomonas syringae штамм №3 при температуре 280С.
На втором этапе исследовании мы подбирали количественное соотношение бактериофага и культуры для культивирования. В опытную пробирку, содержащую стерильный 1,5% МПБ в объеме 4,5 мл (рН 7,4-7,6), вносили 0,2 мл фага Pseudomonas syringae Ps.s-7 УлГАУ и также в другую пробирку Ps.s-27 УлГАУ, затем в пробирку вносили 24 часовую культуру Pseudomonas syringae штамм №3, сначала 0,2 мл, затем 0,4 мл и т.д. постепенно доводя объем культуры до 2,5 мл. Параллельно ставился контроль. Для этого в пробирку, содержащую стерильный 1,5% МПБ в объеме 4,5 мл (рН 7,4-7,6) вносили культуру Pseudomonas syringae штамм №3 по 0,2 мл.пробирки помещали в термостат и культивировали при температуре 280С.
В результате исследований было установлено, что для бактериофагов Pseudomonas syringae Ps.s-7 УлГАУ и Ps.s-27 УлГАУ оптимальным количественным соотношением бактериофага и культуры является соотношение 1:1, т.е. 0,2 мл фага х 0,2 мл индикаторной культуры и температуре 28 0С.
Анализ протеомов селектированных бактериофагов
Нуклеотидная последовательность выделенных и селектированных бактериофагов, полученная при секвенировании, позволила нам провести сравнительный анализ их геномов. Однако исследование биологических свойств бактериофагов включает в себя также их протеомный анализ (аминокислотную последовательность протеинов, их качественный и количественный состав, а также молекулярный вес).
Основной целью исследования протеомов выделенных бактериофагов было определение отсутствия факторов патогенности для возможности их дальнейшего использования при фагоиндикации бактериальных культур.
Исходя из данной цели были определены следующие задачи:
Составление карты протеомов бактериофагов в соответствии с аннотированными геномами бактерий и вирусов на основе триплетной кодировки аминокислот;
Исследование протеомов бактериофагов на предмет соответствия локусам патогенности;
Составление филогенетической схемы каждого из протеомов исследуемых бактериофагов на предмет аналогии с аннотированными факторами патогенности.
Ps. syr. phage 7 УЛГАУ
При анализе протеома бактериофага Ps. syr. phage 7 УЛГАУ было выявлено 29 белков с молекулярными массами от 18,8 до 138,8 кДа. Качественный протеомный состав фага представлен на рисунке 6.
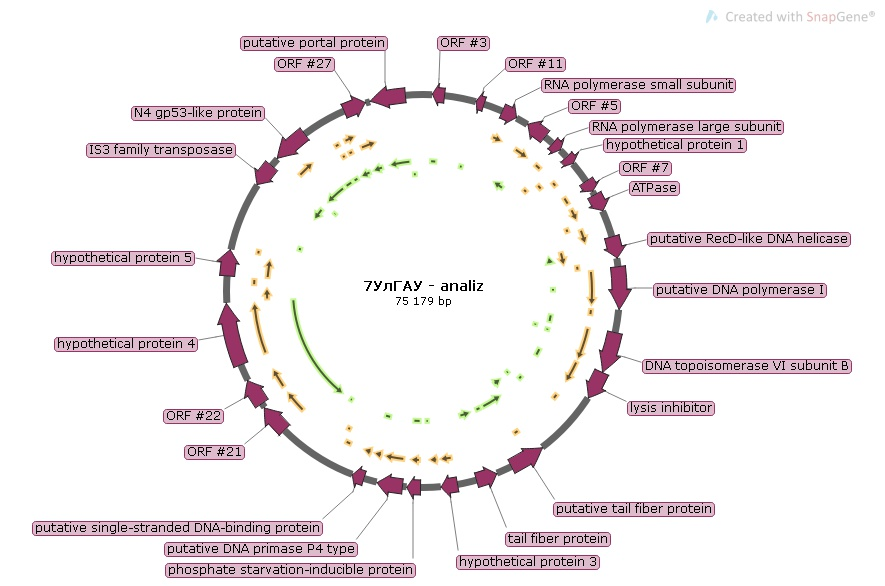
Рисунок 6- Качественный протеомный состав фага Ps. syr. phage 7 УЛГАУ
✓ORF #3 566 .. 1315 750 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/translation = MTTWVSTVSGNPLLIRVTCTRKPVSFPLVGMILILYRRPTRVRLWLVLMVVPFDEVVVGPDEELEPVLLGIRQPCYLQIAQHYWRSIGR
DLLVHPFLAEGALLLGDLLTVEHIGQDIAHVWRTLLLHVVLQAELDQLCNGTHGSVPHVSKADGISRTVVLIAEVPKVLVQLVPDTGELFP
GLDRTEAEPHQQQPALLELESLGPAKTSKVIDGDVTDTVETSELEHQMFSLVSVRSRRAMTTSTSSDTK*
249 amino acids = 27,6 kDa
✓ ORF #11 3268 .. 3789 522 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/translation = MEASQTTANAGHLEVHVAVLPGEVHEPLYGLGYVTDVTGDQPPTVGPVLGGQGIGHASRPFPYAHFCTLVVSCIEGSTSPVDASIVATEH
EHHVIGFHQLNPPNLLRGPLPRWLISWFRTGISHLGIRLDFFTGLGSWSSMWAIILSSSAVMSMYTMSIFQPLYLRTSSSLFR*
173 amino acids = 18,8 kDa
✓ RNA polymerase small subunit 4987 .. 5919 933 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/translation = MTITHMLPEDMQRANEYRFARAHIDGYIREFIRGDEDLPGLMEQGVALLEEYRTTEYSYNSKNLRMETVRNLDLEHIVFEIIVASAYCQVP
DMFISFTAKLAGVLGFDDKADSIKTIAEMVAVLAELDVYDIEQVSKYGTYKVISNIQLPEKLQHAVERAMYLPPMVCKPSKLTGNKSKLHLT
LEKESLILNNNHHNEDICLDVLDKMNAVELCLNTEFLSTVEEESHKYLDTQDKKDDWYRFVSESHEMYKLMVQQGNRFYLLHKYDKRGRV
YAQGYHISTQGSPYKKAMLDLANKKVVTGVPEHLKIK*
310 amino acids = 35,9 kDa
✓ ORF #5 6708 .. 7994 1287 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/translation = MASSDLVNDIVEDVAVGQFGEDVDVVLAHLVAEVRVALELIVHGDQFEGFVNPHGVPQGTQSFQVVSLQLTHVDSVDVVEDHCIDHVGA
VVQVFVDSQLGVQGFTGFTLTRVTVHQFSPNQLHYLGDGFAVVVAAAVHGTQHVGVDGVDDVGSILHSTLYTAVLLVDVLEACTFHLVY
FHPSLEHVRGLDDGVEVVRQHPGVLHGIGLPSVDQVIPHLVGDGSYHLHALVEGFQFRSVLTEQVLRLSLRAIEVGHGCSLDVRPLDLTY
RLTQVGRGGSGDQAIRILTEASVDEVGGLCTRFTATQGGHDLHARAAGIQPYKVADRLTTLSSTDGHDSLEILRTSLLVALQILQVVEVV
VAPLDTLFEEPLVMAHLVCSVDQQVFESGVRGHGLVPIKRRWIGIKDRRWSTVLEVLSVFPRYKLQACTY*
428 amino acids = 46,4 kDa
✓ RNA polymerase large subunit 8614 .. 9240 627 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/translation = MQVRNFTYEDGGWVLDGMDTFDPGDSLTVIHDSFEHIDSTEGLEAELRAFGAMWWLRGETDWWCRFPRMDPRPEQVMYYDIATFIR
ENDFLIDNVGKRFKLGVDEESFLDVLRKLVEDALERDSQYLDKPVARKVIQEAASTAMDWLRVGYRAARRKYPDNFAVADLMYDIYCRVY
ALNFRALEGSMLQLKYTLNGKLVEISLDGEPI*
208 amino acids = 24,3 kDa
✓ hypothetical protein 1 9791 .. 10 372 582 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/translation = MDKITWFRRGEPIEVPIERCLYFLADGKLVQFLYYDERGLFQIAHVTGISVGKIYSAVKGKFVYVRHGFIVKNERVGITLGHGEDYRRPVC
VYVKGFEHVRGSLTAGAQELITAQLLGDHVRLCTKQNIGGTLVMLPGEPGERVRKKVIIEEIGTDIHRNWCGNACFEIAVIDKHGRRYTEL
NDHFQLYGVNK*
193 amino acids = 22,0 kDa
✓ hypothetical protein 2 10 372 .. 10 890 519 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/translation = MLMSEDKFQYEISAMKSKMKRLRRRVEVLNNKRDILLEDIDATNKMVENLSGQVETLLREANKVKGPVMQPGHLHQSDVLLTGQNIQGM
MDSGEAVAQFEVKKGDDQTTTILKDAVVTQMSNKLAELLDALGFGKEHVQKHGLDETVYDACLYIQSLKGGEALLNNLRSMLK*
172 amino acids = 19,3 kDa
✓ ORF #7 11 731 .. 12 432 702 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/translation = MDQCNRLDIMLPMTEVNCASLTKEGYSGLSLSKALAPLATLGNVPNVVFCDEMDKLFLSGNSNDSHANEISIGVQNEFLRVLEGSTTQTFG
DYGKYNTVSVERSLFIFAGAFNGQENMDATELLKCGVKTEFIGRTGLVYNLEKPTLEALVQYLKESELWANYRSLFPKEDHKKAEKWLIKEI
GHQYPDSNIGVRLINTLIHQYYINAGEDSKPQAGKKEFARTLDFSTGRLK*
233 amino acids = 26,1 kDa
✓ ATPase 12 703 .. 13 773 1071 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/translation = MHFPQEQEVSIFDAKFIAEGFLRAGLKPMIHGSPGIGKSAVACQIAKENNLKLIDLRLTQMDPADLNGLPNLSGERAKFQVFEQFPLVGDE
LPVNPETNEPFAGWLLFLDELTSADDDRQAAAYKLILDRQIGNEDLHPKCLVMGAGNLETDGAIVNPMSSALISRLHHIVVRNDLKRWLQ
VVAPKLDIATKVQAFLEFSPRAFYTFDPQNSGRVYACPRTWEDFSKWFLKMSPEQDPRALDDMLNLAAAMGIIGTVATDFKAFLAYFGRL
PSLEEILTSPSTIYVPKDEPGLMFAMCSMLADNAKVDNIEKILIFLDRFNPDHMVITLRMACQRNKGLIQNPRISEWVKKNLNML*
356 amino acids = 40,0 kDa
✓ N4 gp25-like protein 14 302 .. 15 528 1227 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/translation = MTDRSAEDIALSKAKIRIIGDSKVSFYANIMMGLKYVWEEGMGTAAIDGVTMFIDPKFFLSLDETSRKAVILHEIEHVWRHHIGETRRGD
RDPMLYNIAGDHVINNNLLACGYGPISWTDYKTGAKCNWVCDPKFADMSTEEVYDALYQEQKSQSGGGSGALDQGNSGNNPVPFDDI
SRPTPTKEDGTPMSETEIQGAINDLILSAATAARANGNPGSIPGEVQVFIDSLMFPKLPLPHLLRQFFQVVKRGGFTWARPNRRLINRYY
LPSRRGKALLRIAIAMDLSASVSNEEIRRYLSEIANIFVTLKPAQLDIIQFDASIRSVDTVPNLNALMNMELKGWGGTCIAPVMQWAAENK
PHALVVFSDGEFHHYNDNPGVPILWLIHPYSRKSNWKAPYGQVILFDPKE*
408 amino acids = 45,6 kDa
✓ putative RecD-like DNA helicase 15 447 .. 16 784 1338 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/translation = MVDSPVQQEIELESPVRASDPVRPEGVGKPAPFVLTPGQEAGFQTFINFYTNPDAQVMVLKGWSGTGKSTLIRRILDEMESLDRALSTL
DDNFEPFEPLLTATTNQACDALAVAMKEFNHEVKTIHRALGLRLRTDYKTGKSELMPIRNFDIPFRCLIVVDEASYIDSALLQFCFDRTYCC
KFIFVGDDCQLTPVGTNIMPAFAMKDIVVELTEVKRQNSGPLLDLCNAFRHTVKTGEWPKIQLDGDQLIHVPRDKFVEMAEEAFQNPQV
HGSTKVLAYTNACVTEYNKHFSQLLLGSSDPQVGQKMLVNEAVINKHAQLSNGSEVVIEDIRPTREFDVDGYLVKLMHHNSSFFLPKSLK
DRKDREKLARKEEDYKILQLIDQNWVDLRPAFSCTVNKSQGSTYDTVFIDLDNICGKVHRPNALARLLYVGFSRARRRVVMTGDM*
445 amino acids = 50,3 kDa
✓ putative DNA polymerase I 17 311 .. 19 926 2616 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/translation = MKYITWEEQDSYPVAILIKEAAVSRSAAESTYIKQLEGLGVPRKNVIVISLDYEGKKVSAKAIKECIKDRDQLLRDLGVQYAYVADSKYFK
EWTKRKTDADFGNLSPPAGYDPGYLVTPGVNHQVLLFDPGQMHKLSRGFKAIVDHANGVYRPVGSDLLHNVTYIYRGHVSQAREALAR
LMDKPEISCDIEGFSLSMFDSGIATIGFAWNEHDAVQIQCDYREMIQDENKHHGYYEPNAEMREVLKWFFTEYPGRIIYHRANHDVKVLI
YTLFMEHDLDKEGMHRGLEIMTPRMDDTKIIAYLALNSTADVSYSLKDLGQEHAGNWAQDDIKDIRLITLDDLMKYNAVDAVTTVWVKN
KYYPIMVQDQQDALYHGLFKDSLDLIIQMELVGMPMNPRKITEVNTELNNLRDGYHNTVMSHPAVAKVEVLIQTSEMEKANAKLKTIQHP
LSKFSHIRFNPNSGPQVARLLHEVLDLPVLDVTATKQPSTSGGTLKKLLNHIKAEPYKDLIQALMDLGAVEKVISAFMPAFKAGRMKADGM
MYLHGSFNLGGTISGRLSSSDPNLQNLPAGSTYGKLVKSLFCAPPGFLFGGADFAALEDRINALLTQDPNKIKVYTDGYDGHSMRTFAFW
PDKCDGIVDTVDSINSIQKVYPDLRSKAKTPHFLLQYGGSWMGLVRQVGFSDEEAQEIETNYNKLYRVSNEWVAGEIDKATKTGYVELAF
NLRLRTPLLGSTILGLKATPKEAAAESRSAGNAVSGQSWGLLTNRAAVEFRKLLLDSPYKLKVEIISLIHDAIYVMWPDDPDVTVWVNNTL
CKCMAWQEDPKINDKRVPLGANLDIFWPSWREACTLDYPITKERLIEQCREHAAALKEKAA*
871 amino acids = 98,1 kDa
✓ DNA topoisomerase VI subunit B 21 354 .. 23 873 2520 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/translation = MQVTHQKDYATHVVIGGKQAISMGISDDPAFFQVLSSSLYTDKILAVVRETLCNAYDAHKMVGIEKETPVEITLKDDEFVIRDFGPGIHP
DDVGTIYGVYGGSTKKHDGSQTGGFGLGCKSPFAYVDNFQVTIHHEGKTNVYRMQKASIQNGGRPAITPVVTDIPTDQTGLEVRINIK
NEDVRRFGTLIRRIVANAEMLANFNGVKLPTLPFSQVTEDWSIATEQVLEYNGHIICVRYGDVIYPVERDEFIAEVYDPAHKFVNSLPGNVN
VLVLQAKPNSVSITPSREALSMEDHTRKTLLQLLNKFLRATRNITKERSDILAKSCEELVQARKGAMVQPEEVNANRVLVSSMCGSKLCTK
GLMSTMEEVGLSQLYHSHNRSEKEHFKALLKQLSLIGKQPRNQGNTLYLSFIRLLKKVGLADGISHYERSNFGELLRFNKSSWQALEVQK
WGQKHLVSKLLPLIHEEGLCPTRLVWYGFGRNLHNGDSVRNYNNHAAYPLVRYWSKNPMSYVPLFRRCIVLTHSRRDIHNRVKDHDEW
VGGYGADDSLIAYVVPRSEKKLQEARKALSTLKGWSVIDLTEEYEKVEYSSASSSSTTVATKPRKKGYPMLSACQSSGIFSLEMARTDSV
ARVENPSYYVRLPTKSDYYTRKCVRGLDKVCSAYLLKNFGDVGAVVYTETQEANMEKKGIKSARDFLLVKLLEEVEKPEFSKACSLRYTLLL
DAAKEPEYVDLIRKMMQVEECRKVFKLPEPEDPAAEELLTTVYSMDSRFFTQEQKESLETLGKKIKAIPGDKQVLEMLKKISEAPLVALLNT
SEVRRALGDKKTVTSAVKLLKTAIRG*
839 amino acids = 94,5 kDa
✓ lysis inhibitor 23 885 .. 25 663 1779 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/translation = MSNKVTVVGAVLDERYLTLYVKGSAEQIRIPQGDPRVAVFVEKYVPILSQGGEVDYSEDLLVINNVYEAAEKKSGGIMRFFRVAKKKVAEFF
SAASASEPAAPVAPVTAGAVPGDCAPDTDAGQDVGEEVVEKVTIKDPALAKAVDDILAHAVPASAPQFSSVDLENLSEDGVESEDPDDDV
GEGDTIIAVTDQGTIVPDAQKLKTQLTAAVQSKAKGSTVGIENFLRRAGAVSVKRQHSVQDLMRFIERGDLPIADDGCIVIYKLLLKGGP
DGHKEFSYRDIHSQKVPQGVSTLVCMNESLVDPDRRNECSNGLHVARRQYLGSFSGNVCVLAKVAPEDVIAVPSYDANKMRVHAYHILF
ELPNEAMVALKANRSMTDIKEASRMLGAALSGQHSEPAYHVEITGHRGSSIVVHKGPASTKNKVQTAVPKNAPEARSLPTKPNEVVGEKV
DVLDVVDTVMTETKKPEPEAPSLTKDVPVAEPKPVKAEKKSKSRVPARKAKKLKSVKVEAKPVAQPVQDTFKAKGKPLPSDKKTAMTLVE
QGQVLWQAFVDSKGDKAKAQACLDFKKAKKKGWTVLGMPGDAADKLAKALK*
592 amino acids = 63,5 kDa
✓ putative tail fiber protein 29 803 .. 31 995 2193 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/translation = MTTKVIFTFHSPDGSPQANEKFTVRLTRPGMSDAEHCVVIPETYEMVTDAKGEFTMDLESSTSAYRVTAIGDDDEYEDDPCSQYTFTFYV
PDSVDPVYVQELILMPPPNNLPWDEEAMNKITQAVVDARNARDDAEESADRAEAQVGLAAEQVTLAKAEVTKATAQADRSKAEADRATT
QATNAANSATAAANSATQANTQANRAKTEADRAKTEADRSKSEADRARDLADAVAEKVEGGSLPPLVGMNETFTYEGTDPYRWTVSGPA
TAVSDGNVMRLTKTDGSGSRAFLRQAVTFPDSHWIVYMRVKTQTGTAAQNRSAQIRFIAADNKDCVVYFNVNANGLVEPNTIHMQGTE
GGTRNAATMFTGLGTEDWLDLAVKYDAVNRHIELFRRMPNGIWQKGGGRLMVDAIKPAFIEVSSMPVAPQNWWLDLDYISVCKPNLIC
YGDSIAAGQNEYGVTRGNNPYNNNRNWAGTWFGKVPLYATNRNNLVLVQGVQGRRTWQYLSQLSEISNSGVKVVFMHASTNDVKDAT
MTMAKRTSDTQAIIDQLHAVGAQVVLFNSMQGTKAYNDASSNTVKLRDYTDQWWNTELPKVNGLAQTLDIARLIAKDGYMDPDLAAS
DGLHLTNASAQKIAYKLGQFFSNSSDTNGFASLDSPAFTGTPTVPTQTPFLPYGRLSPTPSTWLRSSKTGLNGTATVNSPWIAAPVLSCL
AEVYVAATTMFPLVQVTPCLLA*
730 amino acids = 79,5 kDa
✓ tail fiber protein 32 998 .. 34 287 1290 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/translation = MVDTCNINGVCGTGDWNGPKPGDPNMNDLLLKATPAFGGIDIEFTWPTTNPGAVGTTRLFRSTDANFAGATIRAFVNGNFYFDKTDPGS
KVDQRYYYWIQLVSINGTDGDIIGPATATARPLIEQMIEQLTGEIDNGLLSQELRKEIAQIELNKLGITQEEIERAKNDDALGVRLTQIDAK
MDQNTAILQEEVRARVTADSSLVQTVNTMYADFNGNIAAIQQENTALATKVNALASSVTTINATVNGDSASGKVGLVAEVQTLDGKVTQI
GARWTATVDVNGLVGGFGVYNDGRTVEAGFNVDRFWIGRPGTPKNPGSYPFIIDNNIVYIKEAAIQKLTFDKLRAQDGSFIVQNGKIQAD
YIEAKDIVVNNIQSDNYQPGVQGWAFRPNGIMEINGTAGTGRMTINNATIKVFDQAGKLRVHIGNLQA*
429 amino acids = 46,4 kDa
✓ hypothetical protein 3 35 487 .. 36 497 1011 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/translation = MGQIYTNQTGIPMAMALWLASDYYDYSEAGLSATTLMKPIRQVVLARRIKPSDSMADIEGMIANRMGAAIHDSIEKAWTMNKDRALDA
LGIPASVAKRVLVNPTEAELKAFNEANEQPAITVYMEQRSKKEYAGVTVSGKYDFVADGQVEDFKSTTTFSYIKDTKDNDYILQGSIYRAL
NPELITKDTMRIHFIFTDWQKFMAKQNKDYPQSRVASKVFNLMPIAETEEWITNRVKWLMSLKDTPEADLPLCSDEELWRSQPVYKYY
RDPAKADQKGARSTKNFDSLSEAMAHRAKDGNVGVVKTIPGQVKACLYCPAYLLCTQKDMLIAKGDLIV*
336 amino acids = 37,9 kDa
✓ phosphate starvation-inducible protein 37 741 .. 38 580 840 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/translation = MPRKNRNSQSNQHSQGNRSQQRSRKDRRQNETHAGLHAQADLDIAAHEAAKLVKARDTSPVVGRNPNQKEYIKGIKHSPITIGDGPA
GVGKTWVVAALAAEMLELGEIDKILLTRPAQEAGEKLGFLPGEKEEKYEPYLQPFREALEERLGKSTLEYYLKVGKIEGAPLAYMRGRTFKN
TLMILDEAQNTTPVQMKMFLTRAGEGSRIVVNGDLAQQDTYGVSGLLTAKKKLGWLPSVKLVEFKVADVVRSGLVQEVLEAWEAPDLPP
NELDSHVKEVA*
279 amino acids = 30,9 kDa
✓ putative DNA primase P4 type 38 846 .. 40 423 1578 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/translation = MDKKWFDYRLLHPTVATYLFAQCYTKGYQRFIRVSQDHERAAFVKGFKGYARRCFFGMAGEGKKVDMTPEEVYDLMTKNSTSTFIEDL
CDDLERLADASNMRRVLTMDKDTALLSIEYKLKCEKIAAGLPEHQEAKKAEVTHRYFKALKLAGAYAFVDDSPVLTMDHLYAAIKVAEESG
ECFDMLMTRDRPYVKLAKYLAATNAETTVAELDEDLPFYRGSRQQKDDMLVMATAWGYKNNIIIKKTYEQDIMFLRGEALQATDIHDKS
MIVAYSQDIAYGYFNDLATWDDLWKMTQANGIHWINHHLNGGEDRKGHRNEENCRVGFNLLVIDIDHGCKMSTAKEFLKGYKALLYTTK
RHQTENNGDRFRIILPLNYTLKMDAKEYKEFYNAVIESLPFEVDDGVGQRARKWLSHAGHYEYLDGELFDALPYIPKTTKDEERRRNLKD
QASMDKLERWVINNTGDGNRNNMLLRYAMILLDAGFSVNAIHGKVNELNSKMADKLSEIEIASTIMVSVAKKAGANGN*
525 amino acids = 60,3 kDa
✓ putative single-stranded DNA-binding… 41 233 .. 41 979 747 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/translation = MFGNLSTSNNSDIKEAKDSIGGGSRIFDTDIYAFKILAAYGSESSGGALAVNFEFEEHGTGRKLKIQQYVTSNKEKGQTNYYVNAEGEKHY
LPGFNIVNAICLMTAEKELAACAPEQRTLKIYDYDAKAEVPKQVPVLTDLTGKDIYLALEKIIENKRVKNEATGQYEDSSETRESNDVAAVFH
FGTKKTLNEARAKAEPEFFDKWKEAKAGTVRDKSKKVAGGGAASGRPAPAGGQAGGGKPASLFS*
248 amino acids = 26,8 kDa
✓ ORF #21 46 945 .. 48 795 1851 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/translation = MHTGVAHRTSQQANLTTTTTGHQNLVGFQASTLVYLHITSNSVAALLEVGQVTAVYGQHFDLGVEDVRYIAIGVQTFGALEQGILGALT
QAMMHGQDQIHTVAIGTVGFGLQHFTGTALHLGTRVLPPIDSLQLVQQFDGFRTICLGGLEHTLGTKHVCDVRTVQHQVRTDVAANH
TVVSQVLHSTQVILTIRQCQKLVFEVFAEIGELAIVQKDFLQPIHTQSFTQVAHVGTQETLGQCSTVFSAQVLTVVLEALIDHRSGVLDVL
LTSHLVGLGLLEQSVCSEVTLVCSTHLVHYLHGHAVLALESVVTDASDTVQDQANTLIGDGADGLASYPNEGAVRLSEEGRFSDPVQVVL
DGFTSVRQGSFHLVQGTHFLVSQTATTLGFDVYQTIHQSEQAALSHFTRTGLVVQLTQTGKQATEHLHQTSSQWHTSQGLLAATGSEL
KQIRYFLARYTQGSKAAQVVAAGTHTLRTEQEVVLLLGHILLCLGGLIPLAREEVLRSQSILGFTPQILQAAAYEDTVVAVQGSGHSSLD
LLQHVGFLRADNERRSQCLRGEWQAASVQGLQDSISGGQCLATSNLVAECTHGTVKLGDDAVQDRLQLVAVSLGKRGLLAL*
616 amino acids = 66,1 kDa
✓ ORF #22 49 108 .. 50 733 1626 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/translation = MHVRHSVGVLGRQTTVLAQHVASTGTDHLQVVDHTPGHGIVVGVGLLLVQFTLDGTAQAHMEQFVGQHLFGDARLDELRTLHIERFEV
ALGCIPATSLAHTLTDGTVRASGRGDQLDRYIFTDGPESSTQYLLAERVIGASYQSLSQTTSGQVIGFGQQIHQCLVRRSYRLAQFTPY
RGLGTAVLLNGLDHLSSTIFRQDFLGRLQAQVGLLHHLGYLLDVLLQLTFSLDAVHGVQRSSRSQGLYRVIAQRLTSSGLGFTRSSLQLS
VDSISHRFRFRVEGATDLFAGLHSSSTVSIGDDVATAIGGVLTHCTHVGQHVQLVGVSLFSDVTDAGQLSGDGSFLAFQVLAELVCNLRIL
YPLAEASKGTLEGRNHLTGCRVVQHQLEGLLVQTLASSVHTQYTHTVSIVDVQDIFTHQCIVGDERVTCVGSSDERSYTRTFVDGGHAT
GTEALHGLLTAFLIGELQRFSEVDFRAVQGRVVQFTTSLRHQHPRIQVTTSFRESGVQDRFHVLQLVADLVDLSTSEVSEGLAIIATRQV
GRSQ*
541 amino acids = 58,8 kDa
✓ hypothetical protein 4 51 796 .. 55 659 3864 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/translation = MHLAGLRVDHVGSQANTLRLPHAPVEVQRLFHAKVRNLLDPTEELVEVVDLTHQTIVLGLSASTVGLVYEPTFDVYSTSDGGQCVLGQVA
PHLVHVLTKTHGTLTCVVQDLGQFLGNRLLSTLGILLCERHRSEARLSLTFSRTEQLGQDGLATGIGFTDLASNCTRNQLAIYTLTDRGQ
EVVLDTRVGRFVGVHQGLQLGIAHSGDLGHAHLHQKSQGMFTKGSFQSSTLVHRSIRQDFQTKDINDLGTQLGSCGGLASTYVAQDC
IGSRRDFFISVLAQDGIDTGIGVHQVVGSIDSPVVRTVGNGGGQVLVQSTVSIHQELSIVPEVVTSGVTGLRGVWLQRTLDDRLGSTLE
LHELLDGRLLLTSEALHTSEFSHAAFTSTDLGSEVFDCYQRLLSVTVVTCRGLLEESRNQIGSLVVLSSNFLATHSFTLTDSREFTSFGLGS
RFCLDRLGFTDWDIFSDLSDRRLYRGHLFSYLYGRFLCGGSFLHHRGRTSNRTSLDQFTQGLSRARQCSGFQCYSITQLEGASGDLQ
TTSRLQLAGSHGLRCFGPVASFITYDTDGVVGTLDLLIRSVDGIELRHTTVSEGTQLVYLTSSRFFVAVHQSHTHSVAVLRQTFEAITTR
LDVSAYTAQTREFVECNLCFAEATQGCTLLSGKGVAGVSYQSIYLLQAQSIRVDHGQGDQTLGGFRLDSSFLNQSLYLGSLRSGFHLETL
DGVTSSGQYLLSILQFLGLSLTLLRSDVADLLTYAAQVGQFFVQAGNGSFISTLLGLLTLFDGLLDLGQTFFTEQDLFLLQLGYTLGSFLLD
GVSLLQGTVLDLLGHTISHDLFLENYHCTSRVIGLRGHIGQGRDVAGFTGSIHSFTRSQSSLSTGSTRAGTYSSTATDVHGSADSSTNG
CSFDDLFQARVLQVGNVLTPGLVTLGHAFTSAGTKSRADQTTAFTTDTTQDASNGYLFSYCQGGSSKTHPQTIVSIRQLALVLGLVLGD
AFTVFIRGIAHVGSSTQYRVSGIGQHLRSVLHSVLADCQRVGCRCTDSGSSGLANTECTLHQAIQNLATAEGLACIAETFYATSSRISDV
VAQLVTASSVYDARPVEELVHVGRELAEFVHTLHALQHGLGNTVVTGSSLAQDGFIAFLHLAGDIAVVGFDGFVGYASLTHVSSSVDRQS
NHVAENTASTGYEGSSSVEDLSASSTGGDTHLADEGFFHVALLALADAVEVVSLLRTLHVQAHTGKVQSVECRALQPLLDDGRAQDITIT
AEQPHNGWLNLQIDITDATGNPQVFRQPVRVN*
1287 amino acids = 138,3 kDa
✓ hypothetical protein 5 57 303 .. 58 922 1620 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/translation = MQKIGDSTSTANASGEYTEGNPGAGVDATLIRAPWLNAVQRELVGLVQGAGIDLDPADDAQVLKAVRALAALALGKALPNNNPLPGGSL
DLHGASYAFVTAPSESSVCQNCYYSGTAWLRHDISRPAICVTVDGGQFYVRRAGAGQNPIIWQTMSPVWDASNAKFSGLLERPTTLA
GYSISDAFTKAETNANIETAIARLIGSAPGAVDTIEELARALNNNPNFATDVINGLATKADKATSLQGYGITDALQNVNPLPGGSIDIHGAAY
GFLSAQSEASLCQNCYWNGSAWMRHNTSAPAVSITADSGRVTVRKAPAGANPIAWGTVRELWDSGNATFANLSAKPTSIDGYGITDAI
KNINPLSGGSIDLHAAAYGFLSAQEEASVCQNCYWSGSVWMRHDTSRAASTLTVSNGQVRIRSVAAGANPIAWVTDSPVWHNAAVTT
SLSSSLGILALPNGWTQQVFEVTESTSATDYRYYPLEFPNGVFGVFPVLLSSTVGTGWGTNVGLVTGAWDKQKFVLNGGGSFSSEGRFR
ILALGW*
539 amino acids = 56,5 kDa
✓ IS3 family transposase 63 203 .. 64 633 1431 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/translation = MNVNNAKLQREANTQSYLDQVAASTLEQLSNADYRSGLEAQRDAMGMNLDRAATRDAITKQISAQQNQAAATQKFDDMQAEVGQRGI
VDQLRTLAAEGRAGEVNQILAEQQLINEGEIRKELTGVQDAIQNRQYRAAGEQRAQAAANRAAEAHSLSMAAGRENLAFTREQRDELRR
DRDEAKLVSGTIATTFQDYDESRQAQSEIMRIVGKEVGMPTDDQGMPDMSRASQDQLDAFSNALNEAGVQANTSPTERRNAALKSLVD
AGVSSKGIAQAKQEMELRESLEGLAPQDRTKVEATIGAVNAELDTLQRTATEDYEREVARNPFVEPDKDPLGSVNKIVDKAVKSGFGWEG
DRQDLNNMLVDFATNGIKLPDGRTAVVPSKLLEQAFNTTNTWLFNNAGDVEKRIIELMTTDGMTQMREDAPTIRENFLKTVSDIANQKRS
NAVKVTRSAEREKGVTMDPTDDLTFALRGRKR*
476 amino acids = 52,5 kDa
✓ N4 gp53-like protein 65 209 .. 67 431 2223 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/translation = MGLFSSKKKTVVNTTVQRVFDDAHIPDSPRTGVIQGITHETGIVENILEKLADSIGVRANTAYLWAQRNNYYWGLPESKVVNGVDARAV
VVQTIARSEGTITTYYNQFGPLNSLHWGFTELVRLYQYNPLTNELPGLSTTKGSKVYLFDMIPVFQTDTVAWADETANKGMLQDFGFSPK
SGYAPSRPYNTIGGMGQFAGWSPYRTDNSYGEDYVLLTYEWKDAQGVIKQETIRMLMNLDLSLDYHQVRYRRQNGTQGFFTYQDGK
GTYPLIDGVFNLDYTKQGTYYPWMYCRFNKMNVKDIPGNAYRDVKEVAKISGIGIDELIDGVHADPDIGDVAQVVLFYGVPPGATNQDQ
LTYIFEYLLLLHSEALAQIQKAENLQGKLGDYSNTADQMITMRDKYFKMDFSFSGITVNRKSGKVGPIGFINVKSGMADKSSGQIKTQQP
AYTYTRQAMDSMYDEVIIYNPAMHYQITSKKGHVAQLGQPELLIPVDRVVLSQLGLRAQEQLLCRSLHMAINTQVQIKTPWYASGFFK
VILIVVSVAVTIFTAGSAWGTIVAAASLGVAALTMVIVQMIVTTLAVSYGVKLFVRAVGPELGILAAVAALAVGAYGMSNNATWSENLMAV
SHGIAKESQTMEQAGLMDTLKELERNQTYYADQLQSLEDQRRELGLVQFQALQGEDFVNRPLAILGESTDDFFSRTVHAGNIGAASFQL
TEYFVDAKLQLPSINETIEEINNGLSVQ*
740 amino acids = 82,2 kDa
✓ ORF #28 69 344 .. 70 336 993 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/translation = MHRNLVVRVHGLADAGPVHHLRVDDDAEATQLADFAVHGGTTGSVLLDGDEGRIAVVVLHGFDGRNQIGTNVQSTGVAHGTGVDHAG
TGDHLDLGRSTRVVQVQTQTHQRVVGDLGGGVDFSVGGCSARITDGASRVEQVDLQQVFGDLVRALHHFGGDVTFHRRIAVEVELLL
GVLAEEAVLLQLALDLDTLETNTVHATADLGEGRHLRGDVAHVTARTVEVAVGDGSAGSVDTLVVHVAVVEQRDVVQSHDLFAVVLRHRE
GIGQLTEVRFLGGVDERALVPVAGMDLGTDGRLYPVRGVVVLHRLDVIYRTGHEMFSLFQFQGLLS*
330 amino acids = 35,1 kDa
✓ ORF #27 70 224 .. 71 627 1404 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/translation = MEDSTPFAGSLYFIGLMLSTGPAMRCFPYSSFRDCLVEAQLLEFFVRHRQGIELGRLSLSRYSFGRSRSPTFFFHSRFLCLGAGGDSLHR
FSGCFTLAFSGRGLNQIVECTLSLKLIPNRLICVQVRGTISDRAECLTALDLGVDSVEYPIGHVLFEVADDLRMFGNQLLRSFIQLAQRSN
HSVVGWTVLDGIELFVQCFTNLVEWYSSRFVIRNTLLIQVERIYTGIFSQLSDGFRFLVFEKIDHIGDSLRVQQTSIIQLTHHVQVRFERG
HLVVVVSTHLHQTDSLFRRLDLEITAIRFERCSDLRHEVSRIYLLLGSLGLLGFRFFFSRSIFRLFLVAVFFFLPRLFFSRFLFRRKIAEFIVR
RVERILFLLLFFFLLFISRFFFFFLDNFFRLHVVLLSLLGFFLIGASLLFYFVELGQIVVTHFEEVSHYSSSSSSRTRSSSASQSLMACSASSP
RTPISWK*
467 amino acids = 54,0 kDa
✓ putative portal protein 71 933 .. 74 113 2181 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/translation = MADVDEDYLTLPNEDGDPSKRLQPEWSNAPSLAQLKQDYQEAKQVTDEKITQINRWLDYMHVRGEGKPKTEKGKSAVQPPTIRKQAE
WRYSSLSEPFLSSPNIFEVNPVTWEDAESARQNGLVLNQQFNTKLNKQRFIDEYVRAGVDEGTIIVKVGWNYQSRTVKEQVVTYEMMPD
SSEELAQIYQTAAQIREESPSEYPEIPEDVRLGLEETEANGIQVRAVPVGSEEEEREETVENHPTVQVCDYNNIVIDPSCGSDFSKAKFLIET
FESSYAELKADGRYQNLDKIQVEGQNLLSEPDYTGPSEGVRNFDFQDKSRKRLVVHEYWGYYDIHGDGVLHPIVATWVGAVMIRMEENP
FPDKRIPYVVVNYIPRKRDLYGESDGALLIDNQRIIGAVTRGMIDTMARSANGQVGVMKGALDVTNRRRFDRGENYEFNPGADPRAAVH
MHTFPEIPQSAQYMINLQQAEAESMTGVKAFNAGISGAALGDTATAVRGALDAASKRELGILRRLSAGIIEIGRKIIAMNAEFLDDVEVVRI
TNEHFVDIRRDDLAGNFDLKLDISTAEEDNAKVNDLTFMLQTMGPNMDPMMAQQIMGQIMELKKMPDFAKRIREFQPQPDPIAQQKAQ
LELMLLQAQIEAERARAAHYMSGAGLQDSKVGTEQAKARALASQADMTDLNFLEQESGVQQARKRELQQAQSEAQGKLAMLNSQLKR
LDEATSARTSQK*
726 amino acids = 81,7 kDa
Ps. syr. phage 27 УЛГАУ
При анализе протеома бактериофага Ps. syr. phage 27 УЛГАУ было выявлено 34 белков с молекулярными массами от 19,7 до 128,4 кДа. Качественный протеомный состав фага представлен на рисунке 7.
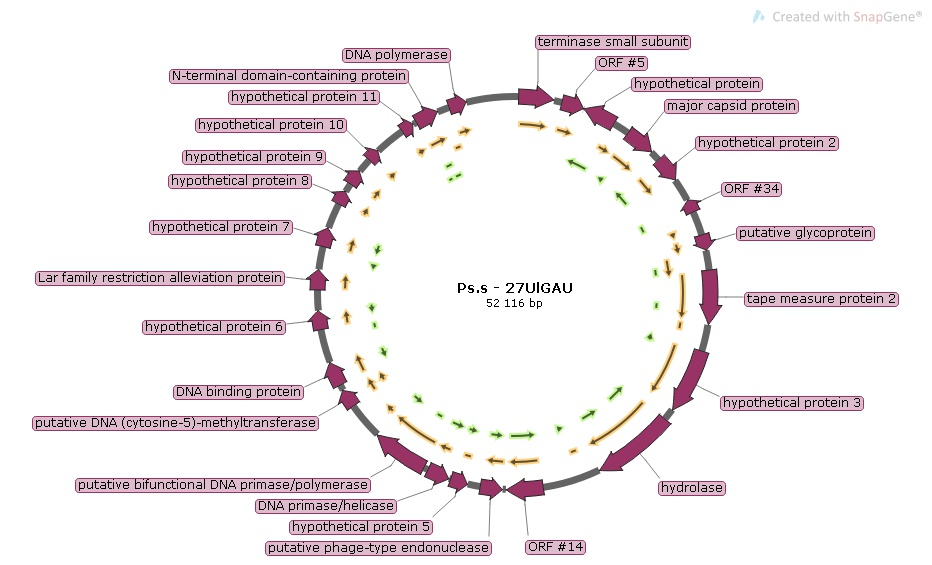
Рисунок 7- Качественный протеомный состав фага Ps. syr. phage 27 УЛГАУ
✓ terminase small subunit 198 .. 1694 1497 bp CDS
/product = terminase small subunit
/translation = MVIALVDKHREVVRVIQLVGREVVDVDKAPEIYIPQVFEPYLYPAMVKVARGGRASAKTHSFIRIILARMQATRTHVGCFREIQKSIADSI
KQTIETVIEDLGLKDQFYITDKEISHVATGSKMVFAGLYRNVVSVKGMDWIDIAFCEEAENISEASWNVLIPTLRKPGAELMVCYNPKNAL
DATHLRFGPGVCKAWHYKDDGTKFRYSVTRQVNYTENPYFTETSRIQMETMRDDDPDLFQHIWLGMPNADSELAIIKPSWIEAAVDAH
LVLGFEAEGRKRVGQDVADEGKDTSALCYAHGSIVEDLEEWRDQDTNYTARRCYAYAKAVDADEIVYDSIGVGAGVKAELRQIMSKDVD
RNGGQVFDVRVYGFNAGGEVQNKNQVYRSGKKNKDMFSNVKAQAWWHVADRFRKTYQAVREGKQIHPDELISLPKNLPHLDKLKAEL
SRPRVDYAENGKVAVESKKAMKKRDIPSPNLADALIMCFAPIKADHKGMLTS*
498 amino acids = 56,3 kDa
✓ ORF #5 2049 .. 2990 942 bp CDS
/product = ORF #5
/translation = MAMPILPSSVTDPTGQDRRERGAIAEFNRRFKQINKGAQAILAAIPVTKKTLSVNVRGLSFALNAESLTRYEFQVDTIQMELIGEEIDRLV
DQWIEVRGDASEQWLNSGYVGPAYQQGTAMTFANLSAQSVQYKASRQSLTELIKTPEYRRRIGFVRGRVFEEMKGLSASVKTGLRNAL
SDGIAQGLNPLEVARNIDEATRVGEVRARRIARTEITTALRRARLDEAEQASGDLGLGMRMMQMSALSSTTRPSHAARHSKLYTFEQAR
VWMATSPNMINCKCSFVEVLVDANGKPLTPKIVSLAFAQKAKNGW*
313 amino acids = 34,7 kDa
✓ hypothetical protein 3018 .. 4436 1419 bp CDS
/product = hypothetical protein
/translation = MQNAITLPAPGTPMALALNSALGETRAAWARQRFGGPAYGMDDKRQNAWQAFGWKEHPTFMDYYRLWERGSLANGAVGRTISKCW
QDEPKVIRGAEDTDDREQSEWEVELAKFAKTYKLWEAIRETDLRRCVGHYAGMILQIADNKTWESPVRGRIKRLVKIIPAWEGQLTVSE
WDTDETSPTYGEPKMYQFQEGAVGIQANTASAVGSAGRNVMVHPDRVIILGDLVNGVPLLRAGFNDFSNIEKILGGSGESFLKNAARQLA
IAFDKEVDLEDIAAAHKVSMAGLKTLYDDVTRGLNQGIDQTVVTQGAQVTPLVASVPDPEQHFNVAVMSAAASIMIPVMVWIGSQTGER
ASGEDQKDWAATCQGRRVRVLASDIEKIITHLVRIGLVKPVDEFSVIWTDLTEATQAEKLGNSKLLGEINEKFASMGEVPFSIEEARTAAGY
ANKGRQRVVLPDQQDTGESEEEKEKPE*
472 amino acids = 52,1 kDa
✓ hypothetical protein 2 4266 .. 5030 765 bp CDS
/translation = MLFPAEGLPCVLALVVHAVCRPAKTLTSPCSTGLAKRAIQRQGHRRPWCWQSDSVLHWVPLNLRLAIVHRLNPVYLGGSYHNGDTRP
MKSTIVTRALIFLGTCFPLLLAYAFPAKADAFGLAGVISAYVVAALTALGIFFLEATRIGVGQDKVEDYKNAANILDKDPLGRSGIIFFALNW
GLFAVLLLSLNHIVPVAVLATAAFVSILSLGRLKRIVTIARLNPRAYYKIAKYRDSEAQKGWTEAKDKSQATRT*
254 amino acids = 27,8 kDa
✓ major capsid protein 5120 .. 6409 1290 bp CDS
/translation = MAVSSTLRINASAKVRNQDIKMIQHNGKDHWVIPSYTLPAGVVMNGGLYPGDEIDKAYKTLEGTLAPIGHPVVNSKAVKAGTAEAINSHY
HGVWNKNVSKSKCGRIYIEKWVDIEFAGRTEEGRQLLGAIEAGLPIHTSTGLYCEKEPVTNGAAGYSWIARNMRFDHDAILFDEPGAATP
DDGVGMMVNSAELVVNAVVPELTTNGVLKNSWGMKRDALNAALREVYGTNDNWVSVEDFDDTDVVFYSKEGVRMVSYEFDDGVPVLGS
NITELVSRTEFVAKGTVVGTNLSLQKNSVESEPSTTITQPEKTPDMDPKELAAALKDALAVGLAPIQEALTATNQAVAKLQSEADARQEQLT
ANAKKADDELRTAIIAADPGLEMVANSLSGEPLELLAAKTAKAAPLGAGASMTTNSKDGVAAFDNVKGA*
429 amino acids = 45,7 kDa
✓ ORF #11 6406 .. 7590 1185 bp CDS
/translation = MQGKRLVPEVQDCIVGGARRSQIDAHDGHVDLTGVAVVADALAVEAFFGHVRRAVQDVITHGLEHVAHFQRLRLGHGVHVGQLVTLPL
APVDTETGLENRNRVTVAGAVDVVVGDQALTVHGDFNLLVDVAGDRVRLEGVADVHRGGQLHQVGQQLTTLVVVTNGNGALVHRQPEL
WRELVGVVLDQILGRQRVAVHVNQALLYGVTELALVPYGLELPLELMGAMLLAEAVFLFHHVRHGAPLEHANFDVTAGNRGSRYGVGLEG
DGDGISRAGGDFQLTASTDGQQGLTFYDGNAGLDQSRKDAGFVNVVGGDAIADSDWVEDRAADLVVAASDVKRLDGISSSQNQSARS
ELEELARQDRHGRFADDGLRLAVDVDAMRALAHYRIASHGD*
394 amino acids = 42,1 kDa
✓ hypothetical protein 2 6871 .. 7962 1092 bp CDS
/translation = MSYVMEQKYRLGEEHGSHEFEGQFQAVWNQRKLGYAVQKGLVDMYGNALSSEDLVKNNADQFAPEFWLSMDKRAVAIRDNDKGRELLT
DLMKLATPVDIGHTFKAYPISGDIDKEVKISMDGQRLITYDHVDRTSDGNPIPIFQTGFGINWRKWKGHQLANMNTVAESQALKMRDM
FEAMCDYVLDGSPDVTEKGFDGQGIRNHRNTRKIDMTVVGIDLTAASTTNDAILNFWNQTFALHLDANYVNGKIDVVWVSPEIERRMNV
PFSNSQGFKGGTLRSFIMEFGRVGEFRSTYKLSGNEFLAYNRDQEAISPLVAQAVATVPVERRGPRDNYNFEIWGAMGLEIKADMNGRGS
VFYAAPLT*
363 amino acids = 41,0 kDa
✓ ORF #34 8951 .. 9520 570 bp CDS
/translation = MNGATVLFEPLFEKARLGVGVPVVPVPGTATELYAGLGDAKVSTRLALERALGVMHRKGVGSGVTNDGAPAVPVVAQPAEHGVNQVRGV
DRCEQRREGLPGCGASGSRSLRLDVYDVVGHCRALGADACKSDHWHQHALLKSGSGSLKNDISQFVWLRIGLAPTVVGLGSACSPC
AIMSPNLTRLSSWK*
189 amino acids = 19,7 kDa
✓ putative glycoprotein 10 537 .. 11 214 678 bp CDS
/translation = MHIITEIGEQGITIGEKTYILRPSFRAMTRLGEPDEIVEIFAAIHKPPNFIEHMEWDGVGVRSAGDTVSRTVFKRYWLEMLYLSRDVMIAC
CDEDLTPAIGEPGSRYGSYRIGPVSPEIMLAMARSLMQHGCIGPVAKAVQRSERSGSKSGYTREFNALGFVSKAIANLGVTESDAWNMT
MSSFHAHWEAKYGEPKEARYVDEHEATMSWLAKVNAIRDKGKTNG*
225 amino acids = 25,1 kDa
✓ tape measure protein 11 207 .. 12 286 1080 bp CDS
/translation = MAETVVGDIVYNLDVNTKKFVDGMQTADKNLEKMGESMDKTDQKAQQLGGGLTKLAAAIGGLVLIDKLRDLQKLSEEFTVLSARINRVSA
DSAEGAENYQRLLAISSKSGADLGTAVKTWESLTLSLREFGKTNDEILGVTDSIMKMGAIGGSSTEEMKNGLRQLGQSFSGGIVRAEEFN
SVLENVPEIARQIAKGIGIPFSELRQMMLDGKLTAEVVLEALKKQAAEVDAEFAKMPRTVAQASNAMTNNFGTMISKLDQTSGASANLAKA
IDIVAGAFLSLSGDANAIQTIFDGITMAGASRCQCHSNHLRRHHHGWRIARSHPGWSTPDGPVQRYSGESVDDARYHCQHRSAARS
SC*
359 amino acids = 38,6 kDa
✓ tape measure protein 11 207 .. 12 286 1080 bp CDS
/translation = MAETVVGDIVYNLDVNTKKFVDGMQTADKNLEKMGESMDKTDQKAQQLGGGLTKLAAAIGGLVLIDKLRDLQKLSEEFTVLSARINRVSA
DSAEGAENYQRLLAISSKSGADLGTAVKTWESLTLSLREFGKTNDEILGVTDSIMKMGAIGGSSTEEMKNGLRQLGQSFSGGIVRAEEFN
SVLENVPEIARQIAKGIGIPFSELRQMMLDGKLTAEVVLEALKKQAAEVDAEFAKMPRTVAQASNAMTNNFGTMISKLDQTSGASANLAKA
IDIVAGAFLSLSGDANAIQTIFDGITMAGASRCQCHSNHLRRHHHGWRIARSHPGWSTPDGPVQRYSGESVDDARYHCQHRSAARS
SC*
359 amino acids = 38,6 kDa
✓ tape measure protein 2 12 060 .. 14 372 2313 bp CDS
/translation = MPMPFKPSSTASPWLAHRDANAIQTIFDGITMAGASLAAILAGRLLTALYSATAAKVSMMRATIANTAAQRVAAAEAVRAATAEFAAARAE
QQRAAAHLAATSAVVQGSAARAAAADAMAAANARAVLAEKGLQAAMAASAAVAKTTSIAMRGLQTVMGFLGGPVGVVLLAATALYQFAT
SAREAKDPTDLLTQSVDALGNAQLRLQKIKLTEAIAEQDKLAKGSMWTQYKVNALKKDIAEAPEGSNAWKGYTKQLTEIEAESEGAREMS
AKLQEQLAKVNAEIGKRSGEKQVVNTPKRKEDPEDAKVRQRLQDELELAKLSGEAKARQAALQKLSANATDEERQKVSDLAAEVWRLDE
AKKATTKTDKEGAALAKKKTAEEKKGAEENKQAIIDYAIEIGKLADKTQDYSEASALAKLNKFATPEDVRVMRELAAAQAQIIEAEKNKALLG
QLDPMAGEDQRFTKQLEDLKKLNDAKLLEDERYLELKGIAERQHLETVRQLQEENFKAASLGNEILMNSIDAMASGATGALSGILSGTMSL
QEALGNLANTVLNSVIGAFVQAGVDFVKQEIIKRAAIQATQTTQQASMAAVAATQAGTTAAMAATTTTTAATTGASVAGSMAPAAGLSSI
ASFGGAAVIGGAALLATMALAKSFGGGRRYGGDVNSDSFYRINESGPEIFTANDGKQYMTGANGHVTSNADAFNNGGGSRPVQVIIEDY
RGNGADPQVSQETLTDRDVIRIVLNDMQSGGQLARATNQITGTKRPGG*
770 amino acids = 80,7 kDa
✓ hypothetical protein 3 15 525 .. 18 296 2772 bp CDS
/translation = MMTPKIPKMNSLAAAGQGKDLDSATAKGNKVKINQVRPEVAGKCRIYGNYAKPARRFFNDKRDQRVDLCLDLGVGDIEVLPSEIYIGLTP
VTSYGADVSYAIYRPGQSLAADRRADWWHDVQEVGSGSNGSSGLDMTESTELTKSYVAYSHQMNGYQVLIPSGAGNFPADWTAGLIV
RIVVPYQYNVIDDATADIIEGDNLTMLAPVVGQSIEIVGASGGFYTVRSFSPKVPAVPADPGSPAYSTGSAAPSTFNFTTTPANFTVRVGT
TDYPVTINTNTTNMAGLISAINAAKPSGAPFVASDVGGRVRCTDNASVNTGRALTITGDSRIFGLSTNAVAGVAATGGTPEVPPRMTLNL
NGQPAKSLALGQQSMCIGPAGLRYRLTAASTTALTVVRLNSTGGNDNSFPGFTYQETTGTVITLDQSNLQGGFRGPFACCPEGEKITKI
QWDVFHPSGLFGLGREGQIYDIRSFHRLEWRDMDLAGAWTQVDIEHVGGKQDAMGFTYELTLPYPMRAEARIVKRFVSQPGRIDNEK
QDEIVWYGLRGLIPRGRKVYPNSTILCLTVRGGDRLSAESEAQVWVKGTRRLPVRRGGVWQPPEPTRDIVPFALHVLKSAGYTDDALD
LEEWDALDALYRSRGDRYDRLHTEESTVQSVLEDCLNAGFARLTVKHGLLTPVRDESRSIFTALYTFDTQLEGEGLDIRFNMISGDDYDG
VDVQYTDQVKWQNDTVKCRLPGVPNPKKVKVIKAEGITERLQAYRYGMRDLMEIRYRRKTGEWASEMAAFNSNFGDLVQVGGECPGY
AQSHVMRSVSADKKTFTLRAPLDLSQLAPPYMASFRRIDGTCFGPALVTNIVGDRTFTIANPLDFDPILDQPGTVLPTYVLFGNGYGVLI
DEIDPEGTESARIKATFYDERVYTYDNAPLPAGA*
923 amino acids = 100,6 kDa
✓ hydrolase 18 788 .. 22 336 3549 bp CDS
/translation = MADLPYNTGNAIGSADPKDRWDNSIGLDYAMLSTTDYWKDRLGRNRRTLYWMERAATGIPAVSAAERAETAAAAAQLSAGIYDTTAAG
LAATTNGKYFSVPQPGNPSTALMLYKNNAGAALYITSYATGVASSLTINYGKTFPNRRAVRNGVDSADSTQLNEFVLDACVIGAEPGYYYR
IGYYVNGNPTYPISPDGWAIERIASANYETAANAAEDVVRYTDPAPTIGNGIQTITLTSVVYPDLKFVLTVDGSKRPARGTSITTRLPAYA
GYSHIIDPSVYLETTRRNGLNLNSGSIVPFKSMTRDGTVSPSNSLMFNAILGVTVINAKPGMYYGLKYFQNGNADAVPAADNWMIEEIKV
ADYATSAVIDPANLISTIQEITQPPISRSLGIQTITLTTKTDVRILVTIDPAQLPAYGTAVAMSSKGGSGWSHIIDPAFYQTKSDKGGEMS
YYIDANGRLTVNWLDTNGETRGYTFGINGANDLPNFFNFLKGTKIVSQFGTDMLPPMVLDAVNNVDADPYPIDFTGGNHTIDGQKTAVNT
IFDIIADGRLVSVKGTSGRARSLVVRITNRLMACNTVKSGRYVGQQNFVVSFFPGGAQVEAQFTPYEAVQVYIDYGPQLVTINVEETIFFF
DGQYASPIPYDPGANSGKPSEYPNTWAVVTTGADGQLGAWIDRSYGIAEAKNSSDEFGFITGSGAGSTSRKLYPTAIHQPLRRADGGI
QFMAGESYFWRGGYTWSPKVTRAGMVATMEYMLGGTVRRAEAATGSRTYAPDADWVAREVRRISNELDAVAKDVETIGVPPQELSEL
AKALRNPFHSVCLLGIGDSITYGSGAAYIPGANPVPEYDVPNAKINFAMRTWFNRFRENIGTTYGEGDVIQDGSGNGYYEKLHLVDVLDG
YKYADWYDGRTGFKIAMPVPVISASATFGKYLDLSTWIRPTVDVTGNNITVIHAKLTASDPAQAIVEVWDTITETKLGEFNWHSATPSFG
NRSAVTFPWGKYRVQLRTVGPIAQLRFEGFEVTQRIQARNIGVSGSGTMSWLPGSANMNNVAPEDEFVTVMLGTNDRGNNSLPLNYAR
TKANIKTIVNHLRSLGKTVIVMCANVAVGTAEYPNSPYRYSMSTVARALRESTQELNVSFVDHYAPTRKAYLDGEVIFSNGDYLHPNDLG
HKLINDTLTGRIYETEE*
1182 amino acids = 128,4 kDa
✓ ORF #12 18 797 .. 20 086 1290 bp CDS
/translation = MRPAATALARHGNGCAIGWQLRRIDGHQDPDIGFGGQSDGLDTEGSRDWRLRDFLNGRDQVCRVDDCRGGVIGNLDLLNHPVVSS
RNSVGVAVLEILEAVIHAWLGVDYGNAEDRVKHQAVTWRYRAVAGHRLERHNRPAVQVQAVAASGLQVDARVDDVRIASIRRESSGN
RGSARRALAAVDRKDEFQVRVDDRGQGDGLNAVANSRRRVGVADDILGGVGGGLVVRGCDALDGPAVRRDRIGRVAVDVVADPVVV
AGLGTNHAGIEHELVELGAVGAVDAVAHGAAVRERLSVVDGQRGGNASGVAGDVQRGACVVLVQHERGAGVARLRHAEIFAVGGGGKT
CGSGVVNASGKLGGSGSGLRAFGGAYCWNAGRGALHPVQGAAIAAQAVFPVIGGGQHGVVKTNGVIPSVFGVGGADGVAGVIW*
429 amino acids = 44,2 kDa
✓ ORF #14 24 820 .. 26 400 1581 bp CDS
/translation = MLELLPLGRQPVVAARGLVIDRERPIRRGVRHHALGVAVTADAVLVLHADHLVALRLVRVFLLALELDAKLGVRVDQLALTLFAVPCRDIV
VVPAIVVRARLGRPAISALVAEPVRVLMERLASSPEMGWHGKLFRLPLVVEFGAVDKDAVTGEVGEVPVLVDGVPLVILAQAELVGELALRT
HKISRRAGGATKACLDIRLEDIAIRAVLLKVLRVVEDQHMVFTLVQSQATANDLLQESAGLGLAQDRNDIDVRRIETGRENGDVDQVLEL
LRLEVFDGLLAVGLAGYLGVARDHPGQLWRQRAHDLLSVLDGRGEDHDATLVARLVNDVRDDCGGLAAIAHESPVDLAFDLGLAGAKV
DPGGVVGLLAERANHRRRQVPEVDQLASQDRVDLLHEVRVASLLVRHGLAVLVHAVDIAVTQHVWRAGQAYHANLGVLLADVLNDLAD
GLGHALAFVDDDQAITLANLFRDLDEGLRRGENHRVPQVLFAEAGAVDRRRLAGEQVLHIVLLNQLLRRRNAQGALS*
526 amino acids = 57,0 kDa
✓ ORF #15 26 499 .. 27 506 1008 bp CDS
/translation = MPKLHRSHSADTGEGCNSLFQFPANRGGATILFQVQAWQVLFNDLAVLDRAGGLGPREPTTADENRLVFGKGLELVKDFLFARRVVVDD
QLQLVKLRHQLLHMLAVKRFARRLQVVLVLGLVLVLRIEALKVGHCAIYLALVKLHQLMLGAQHRPLEEDAPRAASKRHFDLHLYGHVRLI
IQRVELAAVGNVALVERQPDKDQARAWVFVGMHHGWVHGQEFMRLLEIALDQCLAELRLECCLCCSAVAVGVLCRSVGNILAWHVVVL
THHFADHVGALAVFVHAEDWCHVAHGDLGMHLARGTLLGCNFLWGVLGHQVFGCSYVGFRHFVKFPW*
335 amino acids = 37,5 kDa
✓ putative phage-type endonuclease 26 550 .. 27 485 936 bp CDS
/translation = MSESDVAAAENLMAQDSPKEVAAKQRAARKVHPKITMGNVAPILGMHKYRKRSDVIREMVRQYHNMPSEYVANAPAEYADRYRAAAEA
AFEAKLGKALIKCDLKKPHKFLTMHPTMVHSDKYPGPGLVFIRLPFHKRDIAHRSEFDSLDDQAHMAIQMQVEMALAGCTWGVFFQWS
VLCTKHELVQLDQGQVDRAMADLERFYAEYKDETKNKDHLEAPRKSLDSEHVQKLMAELDELQLVIDNHTSRKEEILDEFKALAKDKSVFI
CGRRFTRSESSGSVQYSKIVKEHLPSLDLEKYRGAPSVSWKLEK*
311 amino acids = 35,6 kDa
✓ hypothetical protein 5 28 034 .. 28 786 753 bp CDS
/translation = MSLNFWDLGEGQKALEAGKTSIEVEGGGNLDMPIPAGTQVRIIIADAKWETSDGAGTYINLKYQVEAPACYKGRIIFHKLHVRCHEFPAA
RENARLTEEKLANKRVKALRMFAVIDANAGGKLLASGKMPDDVALQTNLSGKTMAMTLDVYEFDTDKDGKKLPNRIDWNRGNWVKKVD
PRTAFVDMTKEQQEAAVEASKREFEKMLNDAGGVRNTPAASGPAGGGGGMPGRPAGGAPAADFDSFDDDIPF*
250 amino acids = 27,0 kDa
✓ DNA primase/helicase 28 857 .. 29 828 972 bp CDS
/translation = MIIEAPKRRPPFITLLGEPGLGKTTLACMFPDPIIIRLEDGIESVPEQFKPSIMPVVTTFAELDAQIRWVFAKRKEHKRKTIIIDSITKAESM
LEQHLIDTDPNKPQSINQACGGYGAGPKALGGLHGYFKKLLDHANKAGDMTIVVIAHAATDTVEPPDGENYSRYVLRLGKHSMAPWVD
DVDLVGFLRLQQTVRGAKEGNAKGIGAKAGKVLSGGVRELVCHTAAANVSKNRFGIRDAIEIPDPMDNPKVPNPLLALIPYYVENGLAVAP
EKPKEVEPEPEPEPEQQHTPDLNTEMADGDDYSDAPSRSDVEPMDDDGPAI*
323 amino acids = 35,2 kDa
✓ ORF #19 29 157 .. 29 924 768 bp CDS
/translation = MTHQLADAARQDLASLGPNALGVAFFRATNGLLQAQEADEVNVVNPRGHGVLAEAQHVAAVVLAIRRFDRIGSGVSDDHDGHIASLVGV
VEQLLEVAMQAAERLWTSTVTAARLVDRLRLVRVGVDQVLFQHGLGLGDRVDDDGFALVFLALGEHPANLRIKLGEGGNHRHDRRLELL
GDGLDTILKADDDRIGEHTGQGGLAQAWLTQQGDEGRAPFRCFDDHGYWVSRGWLSFDRANSTDSDYSRQPLFQNNY*
255 amino acids = 27,9 kDa
✓ putative bifunctional DNA primase/pol… 29 996 .. 32 425 2430 bp CDS
/translation = MSTLSDALNFLDNGYRIFGLYGEKNGECGCSRPGCLAAYKHPTISNWQVVPEWSEEQLEGFEALGHFNTGYGVLVSGLLVIDVDARNGGT
DSYARLVEDLRLDFAASSGLTVLTGSGSGSMHIYYKAPEGVALIQNHKKYPGIDFKSSGFCVGPGSLHASGNRYETLFGSPKEIGVAPDCL
VELLKRPDTFRADRDGMQMDITTQEMARMLTFISPSCDRPTWISIGFALHHATGGSAFELWDNWSSGGDTYPGPQELRKQWDHMGK
KGSPITLGTLFHYAEQGGWKEEEQADVPDFPEGSWMAELAAGRTVAMMEKAEVIEAEVALYAEENGLDEAEKVKETIKRKLGNRPFDIDD
VDLLRPPGFVGEVCKWINGQSRYPRENLAVAGAIQSVGNICGLRYTDDYDGVTANLFTLCVAASSTGKEAVLNAVGTLHRTAGVARAVV
GSIKSEQEIIRNLIDNQAAYYVIDEFGIILKTITTSKEAYHTGVVGTMMAAYSKADSFLQLNGDTKREVRKILVNEQKTVRKMISENEGDR
DQLQRREANLDRAIKSIDNGLERPYLSMLGFTTPVTFESLVTPEQATNGFIGRSIIVTEKDTNPRAKPDFKKAKMSARMEATLMSLYAGLS
YDPDDYRVENYDEREEIPTTAEAKRMLDDVYEWGWQLAESHKEKTGLESIPRRAREMVSKLSLILAAAGRIRTAEHVRWAFAFIERDIRE
KCALAYANELEQTAGDEGVNQAIRARIMTVIDDKHGESQAVLINRCKKWSRAQVITVINMMVDKGQLVKRESIHARNGTKVEKYHRPET
EE*
809 amino acids = 89,9 kDa
✓ putative DNA (cytosine-5)-methyltran… 33 989 .. 34 798 810 bp CDS
/translation = MARTNRKGPSTPMAKVLIGYSCCGNTRAAFEKYGHDVWTCDLLPPRHDSQKHLQMDVWRALEMSWDFAILHPMCTYLTSSAEWAYK
DPDFKRYKEKGGYHQRLKPGTLFGADRRKAREEAVENFKRIMALPFPVVAENPARGALSTLMRGPDQVLHPYQAGDDASKATGLWRNQ
GDIPPLPIDPAAFVKPRMVCNNSTREDPHHSPYGSTQCIKCGSPKMLPRWANQTDSGQNNLSPGDQRWLDRSETYPGIAALLGDTYG
PWLNRKVA*
269 amino acids = 30,3 kDa
✓ DNA binding protein 35 057 .. 36 094 1038 bp CDS
/translation = MKCCALSQSAPPFTSSAFNGALPMTQAKITHAVATAKEIHRNMLKMEPGSVERLGARTYRDRHLTYARDMIDALALEQQPLDQRAEAAI
RTLERLGYTYQGGELWKPPLGVRRPIASAPARRKALHARIEFNPDDYRRQMGQQLASDELRGVFDYDPQPLRHTAQILPDQFARPVSS
ADIRESGFTTAQAMIDCLARAQHRVDLKGPLGYDHKVAACIRFSMQDPHGAFRPGQFISFVRRTDDVGNFVHERCIVLSAGVSGMRIA
NVDTALEWQIDGHTIGMGSSPSFHDRVSAVYPLMPTEWAQTCLDNYKRNWLKEEIRRLDEQSEYSKRRELMVELASVGMR*
345 amino acids = 39,0 kDa
✓ hypothetical protein 6 37 541 .. 38 341 801 bp CDS
/translation = MRGNIKVIGMAGMSENQKAALEQLKTNMDKAFEEQAVLDELLALPQPKIGANSHSAAEISEKIQTGNQACGGEVAGKEFVIHQLNSNDSG
DRPRRYIGRDVTLSWPADAPLPRHLSVQHEGVQVEDGRVVDMGRQVSMSYSMDGETWQEIGALQAKEFAVSWDEARPGDDVTAVQ
YRELPKTSPVLVVGGGRHGQVAALIAHMRHILLCARVTEMATRRGYQHIFSDVPRVDRAFEIETAKNVLPKGFRGVYSSTRSRAGRAAR
WR*
266 amino acids = 29,3 kDa
✓ Lar family restriction alleviation protein 39 216 .. 40 079 864 bp CDS
/translation = MACNHQRSQAFLHGRRAHDQARGLRGREVHMGNNTTGLDQGRVVDSLQNLYEEAYVDGQNAPNGYSCNKKRDDAVAAAMVSACEPG
HAIAGRVILNAEGVKAISFGDEQWASLQVGDVIYSAGMGVGLGHGDPVGEVVAFGKGLHEIAWAAGRMPKLGAKLYTHADPGEVERLAI
LLRQTQVKHSQERDTLRAQLAERVALLREVIDGKTRTQFDGNLMHRILMVLSASAEPSAPVERPVISGTALAEITTIIDEAFVAGQNGPY
YAEDCINWVDRILEQVGKRRDD*
287 amino acids = 31,1 kDa
✓ hypothetical protein 7 41 057 .. 41 878 822 bp CDS
/translation = MATNKLEVTMRGDMDSASLVARLIAQAVNGDLTGGVPLFMGYNINYTGMTVCPRIDLERRTGQDLEQEHEIIKRRLNALRAANRMPPVD
IWKCGMVDSGCAPIHEVLEHQLNALRTEYGLQPLAVSAQGVVLPPEPAPVELVAIKAPFGKIRKAIREVLGHVVEIHKGVKELVHLARDAE
TRRKGQTINVTDDPLHGMEIEVQLEQVRKRDPEYHFHFKGRTFKANTGDSLLNRREALRQAAMTPDCDSDTLAKLVASIRDEEARRAIP
KGRQ*
273 amino acids = 30,5 kDa
✓ hypothetical protein 8 42 994 .. 43 578 585 bp CDS
/translation = MQMKSNIRDYQLEAIADITGNVNLRNRAINEQRLRAAHYGRELGVQPCAYDSLDAIYEHLELTNDRLREAVERGEMAKRFLLDRARVTLS
QMYCERWGRLEAELKTLRRWGLVNAKVAWHQANADQKRYGVMLAYAQTDWVDQSAVLDAHRSLQCARHCRDHRPPRTSADLIGK
YAAIQIQPARNLGKTISVKV*
194 amino acids = 22,4 kDa
✓ N-terminal domain-containing protein 47 793 .. 48 803 1011 bp CDS
/translation = MQECKMIKRTDSGQMIQLKHIYDKTREDGSLWNRRDMESPETKAHIQDIITHLQKGGIVPAIEVQPREGGGVEKVDGHCRTEAYKAID
ASGTGELWVSIVPFKGDTLKALARIKTSNHDRKLTPLENLDLFKSIRQELVDMGEKGSLQQIADEVGCTRQYVDQILKLDKLDDEGKQAL
SEGKINAAQALKVARTGVKEGKEAAKAALKTEVKRSAPKPLTASRALLDDMYVGMTDLFYSVPAEAKTAAAEFLKGDRPATDMVRIPVGEL
AKLMALKAEGDRQIEAAAERQMQKAEKAAQEEMGSDLDPVQKAAEPEPKAEHAEQPEENDEPDLSFL*
336 amino acids = 37,1 kDa
✓ DNA polymerase 49 318 .. 50 085 768 bp CDS
/translation = MAIKDFFGCILDTETTGNDPETCKVIETARLAITGSPLEFMKIPVEDSIMDGQLYSPGDAPFAFGAMAANRITPSMLEGKPKFEGFSYYGKL
VVGHNIDFDQRVTAYNVQHQICTLALSRYLWPELDSHSQSAVLLYIGSITRKGIDWAMDLLKNAHRAQDDVQNCARVLKFIIFTLSRSP
EHKHHVESWEALAALSLDCKVPRHMPFGKHKGLPIEQGGALDQGYVDYLVNNGNTDRYLMSAFRRAGFNVPENL*
255 amino acids = 28,5 kDa
Согласно проведенному анализу бактериофага Ps. syr. phage 7 УЛГАУ — было выявлено 29 белков с молекулярными массами от 18,8 до 138,8 кДа; бактериофага Ps. syr. phage 27 УЛГАУ — было выявлено 34 белка с молекулярными массами от 19,7 до 128,4 кДа. Протеинов, являющихся факторами патогенности или их аналогами (анализ на основе филогенетического родства) в составе данных бактериофагов выявлено не было.
2.2.2 Подбор технологических параметров изготовления биопрепарата на основе бактериофагов (разработка количественных и качественных параметров культивирования, подбор методики очистки биопрепарата, контроль стерильности)
Разработка количественных и качественных параметров культивирования. Для определения количественного соотношения для бактериофагов Ps.s-7 УлГАУ и Ps.s-27 УлГАУ и их индикаторной культуры Pseudomonas syringae №3 было необходимо подобрать оптимальное соотношение для последующего культивирования на МПБ. Для этого была разработана схема постановки эксперимента, отраженная на рисунке 8. Варианты эксперимента – индикаторная культура Pseudomonas syringae №3 вносилась в пробирки с 4,5 мл МПБ в различных объемах: 0,2 мл, 0,4 мл, 0,6 мл, 0,8 мл и 1,0 мл. Объем суспензии каждого фага варьировал в объемах от 0,2 мл до 1,0 мл. Время экспозиции подбиралось визуально, ориентиром служил контроль культуры в МПБ. Температура культивирования была стандартной и составляла при (28±1) 0С.
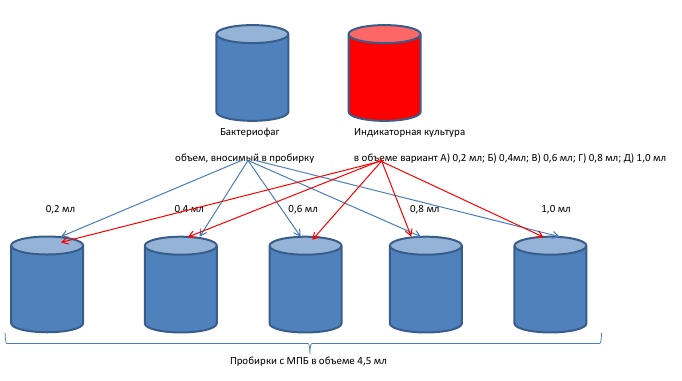
Рисунок 8 – Схема постановки эксперимента по подбору оптимальных количественных соотношений фаговой суспензии и индикаторной культуры
В таблице 8 представлены результаты исследований по подбору количественных соотношений выделенных фагов и индикаторных культур и технологические параметры их культивирования (временной интервал) при концентрации микробных клеток равной nх108(КОЕ/мл) бактериофагов, специфичных для бактерий Pseudomonas syringae. Температура культивирования в условиях термостата при (28±1) 0С.
Установлено, что для выделенных нами бактериофагов Pseudomonas syringae — Ps.s-7 УлГАУ и Ps.s-27 УлГАУ, было подобрано универсальное оптимальное соотношение фага и культуры для пассирования равное 1:1 (0,2 мл фага: 0,2 мл 18±2 часовой индикаторной культуры при концентрации микробных клеток nх108 КОЕ/мл), временной интервал культивирования в условиях термостата при температуре 28±1 0С находится в пределах 3,5 часов.
Таблица 8 – Подбор количественных соотношений выделенных фагов и индикаторных культур и технологические параметры их культивирования
| № | Название фага / индикаторная бактериальная культура | Времен
ной интервал, ч |
Оптимальное количественное соотношение выделенного бактериофага и 18±2 часовой индикаторной культуры |
| 1. | Ps.s-7 УлГАУ | 7,5 | 0,2 мл / 0,2 мл |
| 2. | Ps.s-27УлГАУ | 7,0 | 0,2 мл / 0,2 мл |
Подбор методики очистки бактериофагов. Метод очистки бактериофагов от бактериальных клеток мы выбирали из трех методов
— ) трехступенчатой фильтрации, включающей:
1.осветляющую микрофильтрацию через мембраны «Владипор» марки МФАС-ОС-3 с размером пор 0,8 мкм,
2. осветляющую микрофильтрацию через мембраны «Владипор» марки МФАС-ОС-2 с размером пор 0,45 мкм,
3. стерилизующую фильтрацию с применением фильтрующей насадки фирмы «Millipore Millex-GP» с полиэфирсульфоновым наполнителем и диаметром пор 0,22 мкм.
— воздействие температурного фактора в диапазоне 40-60 0С — степень устойчивости бактериофагов к воздействию температуры проводили следующим способом: исследуемые бактериофаги прогревали на водяной бане при определенной температуре в течение 30 минут. По завершении обработки бактериофага определяли количество бляшкообразующих единиц фага методом диффузии в «мягкий агар» — метод агаровых слоев по Грациа;
— обработка трихлорметаном — определение чувствительности бактериофагов к трихлорметану проводили методом обработки фаговой суспензии им в соотношении 1:10 при постоянном перемешивании.
В экспериментах было установлено, что индикаторная культура Pseudomonas syringae № 3 не выдерживает воздействия хлороформа во временном интервале равном 5-85 минут. Установлено, что бактериофаги Pseudomonas syringae — Ps.s-7 УлГАУ и Ps.s-27 УлГАУ — устойчивы к хлороформу.
Ниже представлен протокол исследования:
в пробирки с 4,5 мл МПБ, вносится по 0,2 мл испытываемого бактериофага и 0,2 мл бактериальной культуры, чувствительной к данному фагу (индикаторная культура): пробирки культивировали при температуре 28±1 0С 18 ч;
в каждую пробирку добавляется по 0,5 мл трихлорметана. Время экспозиции с трихлорметаном при непрерывном встряхивании соответственно: 1-я пробирка – 5 мин; 2-я пробирка – 10 мин; 3-я пробирка – 15 мин и так с интервалом в 5 минут до 90 минут; полученную смесь откручивали на центрифуге 30 мин при 5000 об/мин, собирали супернатант;
активность бактериофага определяли по методом Отто (контролем служил стерильный фильтрат фаголизата, полученный с использованием бактериальных фильтров).
Простота и эффективность трехступенчатой мембранной фильтрации стали основополагающими факторами при выборе метода очистки фагового биопрепарата от бактериальных клеток индикаторной культуры и т.п.
Контроль стерильности. Контролируемые по каждому исследуемому бактериофагу микробиологические показатели приведены в ТР ТС 029/2012 и указаны в таблице 9.
Протокол исследований на определение КМАФАнМ
С соблюдением правил асептики готовили разведения исследуемого фагового биопрепарата в стерильной воде 1:10; 1:100; 1:1000.
Из каждого приготовленного разведения делали высевы на девять чашек Петри с МПА (по три на одно разведение). Для этого стерильной пипеткой у пламени горелки отбирали 0,2 см раствора и переносили на поверхность МПА в чашки Петри, тщательно распределяя его по всей поверхности путем мерного покачивания чашки. После этого засеянные чашки Петри помещали в термостат при температуре (37±0,2) °С на 24 и 48 ч. Через 24 ч подсчитывали выросшие бактериальные колонии.
Затем чашки Петри оставляли в термостате еще на 24 ч для выявления медленно растущих бактериальных колоний.
Таблица 9 – Контроль микробиологической чистоты фаголизата
| Показатели | Результаты | Требования ТР ТС 029/2012 к ферментным препаратам |
| КМАФАнМ, КОЕ/мл, не более | 0 | 5×10 4 |
| БГКП в 0,1 мл | Не обнаружено | Не допускается |
| Сальмонеллы в 25 мл | Не обнаружено | Не допускается |
| E. coli в 25 мл | Не обнаружено | Не допускается |
В результате проведенных исследований было установлено, что КМАФАнМ во флаконах с бактериофагами равно 0, то есть рост бактерий через 48 часов на всех девяти чашках Петри с МПА нами зафиксирован не был.
К БГКП относятся факультативно-анаэробные, грамотрицательные, оксидазоотрицательные, не образующие спор палочки, сбраживающие лактозу (глюкозу) с образованием кислоты и газа при (37 + 1)0С в течение 24-48 часов, в основном, являющиеся представителями родов Escherichia, Citrobacter, Enterobacter, Klebsiella, Serratia (т. е. учитываются цитрат положительные и цитрат отрицательные варианты БГКП). Для выявления БГКП производили посев на среду Кесслера. Через 24 часа инкубирования при (37 + 1)0С делали пересев на среду Эндо. Было отмечено отсутствие на среде Эндо колоний, типичных для БГКП (красных и темно-красных с металлическим блеском или без него, розовых или бледно-розовых).
Бактерии рода Salmonella могут присутствовать в исследуемом объекте в небольшом количестве вместе с большим количеством других бактерий из семейства Enterobacteriaceae или других семейств. Поэтому предварительное обогащение необходимо для выявления небольшого числа бактерий рода Salmonella или сублетально поврежденных бактерий рода Salmonella. Навеску массой 25 мл вносили в забуференную пептонную воду, затем инкубировали при температуре (37±1) °С в течение (18±2) ч. Далее производили посев на среду Раппапорта-Вассилиадиса с соей (RVS-бульон) и одну из двух сред: Мюллер-Кауфман тетратионатный бульон (МКТ-бульон). После посева RVS-бульон инкубировали при температуре (41,5±1,0) °С в течение (24±3) ч, а МКТ-бульон — при температуре (37±1) °С в течение (24±3) ч. Далее небходимо было провести пересев выделенных культур на две селективные агаризованные среды: ксилоза-лизин-дезоксихолатный агар (XLD-arap) и висмут-сульфит агар. Отсутствие роста бактериальных культур на средах предварительного обогащения в неселективной питательной среде и на селективной среде обогащения свидетельствует о том, что бактерий рода Salmonella выделено не было.
При определении количества E. coli в 25 мл фагового биопрепарата делали последовательные разведения и наносили на поверхность агара лактозного с бриллиантовым зеленым и феноловым красным, разлитого в две параллельные чашки Петри. Для подсчета количества определенных групп или видов микроорганизмов на селективно-диагностических или диагностических средах учитывали колонии характерной морфологии, показавшие характерную цветную реакцию с присутствующим в среде индикатором. Отсутствие роста бактериальных культур свидетельствует о том, что бактерий E. coli в 25 мл фагового биопрепарата выделено не было.
Параметры микробиологической чистоты фагового биопрепарата экспериментально производственных серий фагового биопрепарата соответствовали контрольным значениям приведенным в таблице 9. Результаты проведенной работы свидетельствуют о том, что в процессе хранения готового фагового биопрепарата при температуре 4±2°С активность обоих бактериофагов не опускалась ниже нормативных значений в течение 6 месяцев (содержание БОЕ в 1 мл бактериофага 109).
2.2.3. Разработка технологической схемы наработки экспериментальной партии биопрепарата
2.2.3.1 Требования к производственным штаммам бактерий Pseudomonas syringae
Производственный штамм бактерий Pseudomonas syringae №3 обладает типичными для вида тинкториальными, культуральными, биохимическими свойствами, не продуцирует энтеротоксины и не содержит умеренных бактериофагов. Оценку наличия индуцируемых профагов проводили путем обработки бактерий индукторами (ультрафиолетовым излучением, митомицином C) с последующим контролем появления бляшек лизиса, вызванного активацией умеренных бактериофагов, содержащихся в геноме бактерии. В качестве химического фактора воздействия использовали митомицин С в дозе 0,5 мкг/мл.
Протокол исследования
Исследуемые бактериальные культуры засевали в пробирки с МПБ, содержащим 0,5 мкг/мл митомицина С. После инкубации пробирок в течение 5±1 ч при 28±1 °С содержимое пробирок центрифугировали (3000 об./мин) и пропускали через фильтры «Millipore Millex-GP» с полиэфирсульфоновым наполнителем и диаметром пор 0,22 мкм.
Суспензии индикаторных бактериальных штаммов наносили в объеме 0,1–0,2 мл на поверхность МПА в чашках Петри и втирали досуха шпателем.
Чашка Петри с МПА делили на 3 сектора, на которые наносили по 100 мкл:
содержимого пробирки с физ.раствором с 0,5 мкг/мл митомицина С (отрицательный контроль),
фаголизат бактериофага (положительный контроль),
тестируемую бактериальную культуру (опыт).
После инкубации в течение 18 ч при 28±1 °С чашки исследовали на наличие зон лизиса на бактериальном газоне.
Учет результатов. В месте внесения физ.раствора с 0,5 мкг/мл митомицина С зоны лизиса фиксироваться не должны. В месте нанесения фаголизата бактериофага визуализируется зона лизиса. Наличие зоны лизиса газона на секторе с нанесенным содержимым тестируемой пробирки указывает на лизогенное состояние штамма.
В качестве физического фактора воздействия применялось ультрафиолетовое облучение (УФО) с длинной волны 250 нм. Эксперимент проводили в полузатемненном помещении с целью предохранения облученных бактерий от фотореактивации
Протокол исследования:
Исследуемые культуры в период эксперимента должны были находиться в экспоненциальной фазе роста. Суточная культура бактерий разводилась в соотношении 1:100 в фосфатном буфере с рН 7,6.
Разведение бактериальной культуры в объеме 2 мл помещали в чашку Петри и облучали в течение 20 (25, 30, 35, 40) секунд на расстоянии 40 (45, 50, 55, 60) см.
Затем облученные штаммы бактерий засевались на мясо-пептонный бульон (МПБ) комнатной температуры (20-22 0С) в соотношении 1:100.
Посевы инкубировались при 28±1 0С в течение 6,5-7,0 часов, после чего делается посев методом диффузии в «мягкий агар» — метод агаровых слоев по Грациа.
Накануне опыта по чашкам Петри разливается 1,5 % МПА в ламинарном боксе. Чашки Петри с МПА ставят в термостат для проверки на стерильность на 11±5 часов. Перед применением чашки Петри с МПА дополнительно подсушивают в термостате при (28±1) 0С 15-20 минут.
Готовят штатив с 10 пробирками, содержащими по 4,5 мл МПБ; в первую из них добавляют облученную бактериальную культуру в количестве 0,5 мл, тщательно перемешивают другой пипеткой и в количестве 0,5 мл переносят в следующую пробирку, из второй — 0,5 мл в третью и т.д. В серии пробирок обученная культура разводится 1:10; 1:100; 1:1000 и т.д. до 10-10 (из этой пробирки после перемешивания выливается 0,5 мл разведения с целью соблюдения количественного единства в эксперименте).
Стерильный 0,7% МПА, разлитый в пробирки по 2,5 мл, расплавляют на водяной бане и остужают до температуры 46±2 0С.
В пробирку с 2,5 мл 0,7% МПА вносят 0,2 мл индикаторной культуры и 0,2 мл облученной культуры, в которой предполагается выход профага. Содержимое каждой пробирки тщательно перемешивается вращением в ладонях и выливается на поверхность 1,5% МПА.
Дополнительно ставится опыт на контроль бактериальной культуры (в пробирку с 2,5 мл 0,7% МПА вносится 0,2 мл индикаторной культуры и 0,2 мл стерильного МПБ). Содержимое пробирки тщательно перемешивается вращением в ладонях и выливается на поверхность 1,5% МПА.
Опыт на контроль бактериофага (в пробирку с 2,5 мл 0,7% МПА вносится 0,2 мл облученной культуры, в которой предполагается выход профага и 0,2 мл стерильного МПБ). Содержимое пробирки тщательно перемешивается вращением в ладонях и выливается на поверхность 1,5% МПА. Смесь осторожными движениями распределяли по поверхности МПА.
Чашки Петри оставляют на горизонтальной поверхности стола до полного застывания верхнего слоя МПА, затем посевы инкубируют в термостате при температуре 36±1 0С в течение 18 часов.
Учет результатов. При положительном результате на чашках Петри образуются зоны лизиса, при этом в чашках с контролем бактериальной культуры должен быть зафиксирован ровный газон культуры, а в чашке Петри с облученной культуры, в которой предполагается выход профага, отсутствие роста бактериальной культуры.
При проведении исследований было установлено, что производственный штамм бактерий Pseudomonas syringae №3 не содержит профага. Биологические свойства производственного штамма бактерий Pseudomonas syringae № 3 представлены на рисунке 9 и в таблице 10. В качестве контрольного бактериального штамма используется референс-штамм бактерий Pseudomonas syringae В-10917 из коллекции БРЦ ВКПМ НИЦ «Курчатовский институт» — ГосНИИгенетика.
Производственный штамм бактерий Pseudomonas syringae №3 лизируется маточными фагами в титрах по методу Аппельмана и Грациа не менее чем на 1-2 порядка выше показателей специфической активности конечного продукта (бактериофаг Ps.s-7 УлГАУ имеет показатели литической активности — 10-8 (при определении по методу Аппельмана) и 2,0±0,1х109 БОЕ/мл (бляшкообразующих единиц) (при определении по методу Грациа); бактериофага Ps.s-27 УлГАУ имеет показатели литической активности — 10-8 (по методу Аппельмана) и 1,0±0,1х109 БОЕ/мл (по методу Грациа); полифаговый биопрепарат состоит из двух бактериофагов — Ps.s-7 УлГАУ и Ps.s-27 УлГАУ, которые культивировались на индикаторной культуре Pseudomonas syringae Ps.s № 3, показатель литической активности 1,0±0,2х107 БОЕ/мл). При этом стабильность лизиса сохранялась после 48 часов инкубирования при температуре 28 °C.
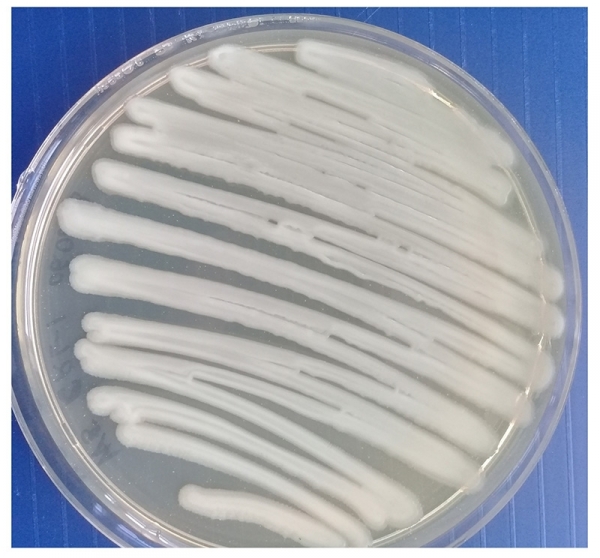
Рисунок 9 — Культура Pseudomonas syringae №3 на среде CRL.2 после инкубирования при 25℃ в течение 48 ч
Таблица 10 — Биологические свойства производственного штамма бактерий
| № | Наименования показателя | Bergey’s Manual of Systematics of Archaea and Bacteria | Бактериальный штамм | |
| контрольный
В-10917 |
производст
венный № 3 |
|||
| 1 | Окраска по Граму | — | — | — |
| Форма клеток | палочки | палочки | ||
| 2 | Подвижность | + | + | + |
| 3 | Споры | — | — | — |
| 4 | Флуоресценция | + | + | + |
| 5 | Оксидаза | — | — | — |
| 6 | Каталаза | + | + | + |
| 7 | Аргинингидралаза | — | — | — |
| 8 | Гидролиз: желатина | d | — | — |
| 9 | крахмала | d | — | — |
| 10 | O/F тест | О | О | О |
| 11 | Липолитическая (твиназная) активность | + | + | + |
| 12 | Лецитиназная активность | — | — | — |
| 13 | Образование левана | + | + | + |
| 14 | индола | — | — | — |
| 15 | сероводорода | — | — | — |
| 16 | Феорментация глюкозы | + | + | + |
| 17 | лактозы | — | — | — |
| 18 | сахарозы | + | ± | ± |
| 19 | маннозы | + | + | ± |
| 20 | сорбита | + | + | — |
| 21 | Рост при 41°С | — | — | — |
| 22 | Рост в МПА с 5%NaCl | — | — | — |
| 23 | Тест на мацерацию ткани (картофель) | — | — | — |
| 24 | Гиперчувствительность (листья табака) | + | + | + |
| 26 | Наличие умеренного фага | d | — | — |
Примечание – «+» — положительный результат,
«-» — отрицательный результат,
«d» — вариабельный результат.
На средах CRL.2 и CRL Pseudomonas syringae №3 имела белые, матовые, растекающиеся колонии неровной формы, характеризующиеся быстрым агрессивным ростом (рис. 9).
Производственные штаммы бактерий Pseudomonas syringae №3 хранятся в специальных изолированных помещениях в лиофилизированном состоянии в ампулах при температуре 2 — 8 °C в течение 10 лет или в бактериологических пробирках с 0,4 — 0,7 процентной агаризованной питательной средой (на основе МПБ) под стерильным вазелиновым маслом, при температуре 2-6 °C и регулярном пересеве каждые 2-3 месяца.
2.2.3.2 Маточные бактериофаги
Для получения фаговых препаратов мы использовали только вирулентные бактериофаги. Их выделяли из природных, пассируя на штамме целевого вида бактерий — Pseudomonas syringae №3. Маточные бактериофаги включали вирулентные фаги с широким диапазоном действия по отношению к штаммам Pseudomonas syringae, обладали высокой активностью, стабильностью лизиса, специфической направленностью антимикробного действия. Характеристика кандидатных фаговых рас (штаммов) при отборе была дополнена современными молекулярно-биологическими методами (полногеномное секвенирование с последующим биоинформационным анализом). Хранение производственной коллекции бактериофагов осуществляется в жидком состоянии при температуре от 2 до 8 °C в течение 5 лет с ежегодным пересевом на бактериальных штаммах и в лиофилизированном состоянии.
Расширение диапазона действия препаратов в отношении циркулирующих бактериальных возбудителей может быть достигнуто путем подбора фаговых рас из коллекции предприятия или из природных источников. Это обеспечивает возможность выпуска производственных серий бактериофагов целевого назначения. Например, при вспышке или появлении очага инфекции, обусловленной фагоустойчивым возбудителем, передача на производство бактериального штамма – возбудителя инфекции в конкретном случае, позволит адаптировать препарат к конкретным условиям путем подбора к этому бактериальному штамму активных фаговых рас из коллекции производителя и последующего использования их при изготовлении препарата.
Характеристика биологических свойств фаговых штаммов, включенных в состав фагового биопрепарата
Бактериофаги должны иметь строго литический инфекционный цикл. Наиболее полной характеристикой, позволяющей всесторонне оценить наличие генов перехода в лизогенный цикл, факторов вирулентности и токсинов, является определение полной последовательности генома бактериофага.
Экспериментальными признаками такой классификации может служить ПЦР-типирование по наиболее консервативным генам, характерным для данной группы бактериофагов.
Каждый из фаговых штаммов, используемых в препарате:
— демонстрировал высокую специфическую литическую активность, выявляемую путем титрования в жидкой питательной среде по методу Аппельмана;
— имел высокую концентрацию (количество бляшкообразующих единиц в 1 мл), определяемую методом агаровых слоев по Грациа;
— обладал широким диапазоном литического действия на коллекции бактериальных штаммов, музейных и «полевых»;
— был изучен с помощью молекулярно-генетических методов (полногеномного секвенирования) для определения его полной нуклеотидной последовательности ДНК с последующим биоинформационным анализом.
Другими характеристиками, которые должны были определены для каждого фагового штамма, являются:
— частота генерации фагоустойчивых форм;
— длительность латентного периода в ходе инфекции;
— урожайность и величина выхода фаговых частиц из одной инфицированной бактериальной клетки.
Штамм, на котором проводится культивирование бактериофага -Pseudomonas syringae №3 — не содержал легко индуцируемых профагов, загрязняющих препарат. Оценку наличия индуцируемых профагов проводили путем обработки бактерий индукторами (ультрафиолетовым излучением, митомицином C) с последующим контролем появления бляшек лизиса, вызванного активацией умеренных бактериофагов, содержащихся в геноме бактерии.
Характеристика основных биологических фагового биопрепарата
Представленные материалы на препарат в целом, помимо характеристик на отдельные фаги, должны содержать следующую информацию:
— специфическая литическая активность, определяемая по методу Аппельмана с использованием соответствующих бактериальных тест-штаммов (контрольных штаммов), типичных по своим морфологическим, культуральным, биохимическим свойствам, которые не были использованы при изготовлении препарата.
Активность бактериофага, определяемая по методу Аппельмана, выражается отрицательным десятичным логарифмом, указывающим последнее разведение бактериофага в жидкой питательной среде, в которой рост бактериальной культуры визуально не наблюдается;
— диапазон действия изучаемого препарата в отношении соответствующих ему видов бактериальных возбудителей инфекций, выделенных из объектов внешней среды (пораженных растений, воды, почвы), циркулирующих в современных условиях на территории РФ (не менее 3-х регионов);
— стабильность препарата. Активность препаратов бактериофагов сохраняется при регламентированной температуре хранения. Определение стабильности препарата (способности сохранять литическую активность бактериофага) проводится по методу Аппельмана.
При проведении исследования антимикробного действия бактериофагов были обеспечены следующие условия, гарантирующие достоверность результатов:
питательные среды для культивирования бактерий, на которых изучалось антимикробное действие бактериофага, отвечали требованиям стандартности и воспроизводимости результатов;
стандартность бактериальной нагрузки (посевной дозы) штаммов-мишеней для изучаемого бактериофага.
2.2.3.3 Основные этапы производства
Производственный процесс включает в себя:
- работу с бактериальными возбудителями,
- подбор к ним вирулентных штаммов бактериофагов,
- отбор бактерий — продуцентов бактериофагов,
- получение маточных бактериофагов,
- культивирование производственных штаммов бактерий — продуцентов и маточных бактериофагов с целью получения биомассы бактериофагов,
- приготовление препаратов бактериофагов:
6.1 подготовка стартерных культур пары бактериофаг – штамм-хозяин.
Штамм бактерий Pseudomonas syringae №3, используемый для наработки бактериофагов, лиофилизируют, используя сублимационную сушку CoolSafe110 Freeze Dryer. Штаммы бактерий в соотношении 1:1 смешивают с защитной средой (сахароза 20 %, желатин 1 %), разливают во флаконы по 2 мл и высушивают в течение 12 ч при давлении ≤0,03 гПа и при постепенном повышении температуры от -50 до +20°С.
Фенотипически и молекулярно-генетически охарактеризованные штаммы бактериофагов Ps.s-7 УлГАУ и Ps.s-27 УлГАУ лиофилизируют по схеме, соответствующей изложенной выше в отношении штаммов бактерий, используя следующую защитную среду: сахароза 20 %, желатин 8 %.
6.2 подготовка помещения и оборудования
Перед началом дезинфекции проверяют эффективность вентиляционного оборудования и HEPA фильтров. Боксированное помещение и ламинарный бокс обрабатывают при помощи хлорамина Б. Дезинфекцию оборудования, предназначенного для розлива и укупорки флаконов с фаговым биопрепаратом, а также поддонов для флаконов и емкости для крышек, проводят 70 % раствором спирта.
6.3 приготовление расходных материалов
Перед стерилизацией осуществляют мойку стеклянной посуды. Стерилизацию лабораторной посуды осуществляют по следующему режиму: сухожаровой шкаф – 1 ч при 200 ºС. Стерилизацию емкостей большого объема и частей перистальтического насоса (силиконовый шланг) проводят в автоклаве под давлением пара 1,2 атмосферы и рабочей температуре 121 ºС, время стерилизации – 20 мин. Сухая стерилизация гамма-лучами пластиковых флаконов и крышек производится по контракту по следующей схеме: 18,5 кГр при скорости конвейера 3,0 см/сек.
6.4 приготовление питательных сред
Разливают в литровые матрасы и стерилизуют при следующих режимах: под давлением 1,2 атмосферы и рабочей температуре 121 ºС.
6.5 подготовка фаголизатов бактериофагов
Фаголизаты бактериофагов получали способом, запатентованным в РФ (патент №2525141)– с учетом модификации, приведенной выше, 4,5 мл 18-часовой бактериальной культуры Pseudomonas syringae №3 в титре 109 КОЕ/мл засевают в матрац для культивирования – скошенная плотная питательная среда толщиной слоя от 10 мм до 25 мм, культивируют в течение 3–3,5 ч при оптимальной температуре – 28 0С, затем на полученный газон культуры Pseudomonas syringae №3 засевают маточный бактериофаг (Ps.s-7 УлГАУ или Ps.s-27 УлГАУ) в титре 106–107 БОЕ/мл, герметично закрывают сосуд для культивирования. Культивируют в течение 4–5 ч при оптимальной температуре для роста культуры штамма бактериофага и толщине слоя воздуха над поверхностью плотной питательной среды от 25 мм до 40 мм, получают фаголизат при суспендировании бактериофага с поверхности плотной питательной среды физиологическим раствором или буферным раствором с pH 7,0–7,2 в количестве 9–10 мл, отсасывают фаголизат в стерильную емкость, добавляют трихлорметан в количестве 1:10, выдерживают в течение 30 мин при непрерывном шуттелировании, центрифугируют в течение 30 мин при 5000 об./мин, отбирают надосадочную жидкость в стерильные пробирки и проверяют титр по Грациа. Полученные раздельно бактериофаги в титре не менее 1011 БОЕ/мл смешивают в стерильной емкости, в равных объемах.
6.6 стерилизация фаголизата
Полученный коктейль фаголизатов фильтруют через мембранный фильтр 0,22 мкм.
6.7 сведение компонентов фагового биопрепарата
Коктейль стерильных фильтратов фаголизатов с учетом конечного титра бактериофагов доводят до объема 100 мл, с помощью уравновешенного буфера (Hyglos) в стерильном флаконе.
6.8 розлив
Асептический розлив и укупорка во флаконы по 100 мл с крышкой, содержащей контроль первого вскрытия.
6.9 маркировка
Маркировка включает следующие сведения о продукте: наименование, указание «не для розничной продажи», наименование и местонахождение изготовителя, объем, дату изготовления и дату упаковывания, срок годности и условия хранения, номер партии.
6.10 определение срока годности фагового биопрепарата
Необходимым этапом при конструировании рецептуры и разработке технологии получения фагового биопрепарата является определение срока годности готовой формы. Для этого образцы из 6 партий продукции хранили в течение 9 месяцев при температуре 4±2°С, периодически отбирая для контроля согласно ОФС.1.1.0004.15 Отбор проб «Государственная фармакопея Российской Федерации», XIII издание, том I, 2015 год. В таблице 11 представлены данные по изучению стабильности специфической литической активности бактериофагов в разные сроки с момента выпуска продукции.
Таблица 11 – Стабильность специфической литической активности бактериофагов (по Грациа) при нормативном хранении фагового биопрепарата
| Бактериофаг | Титр бактериофагов БОЕ/мл | |||
| 1 мес. | 3 мес. | 6 мес. | 9 мес. | |
| Ps.s-7 УлГАУ | 2,4х1011 ±1,1 | 1,7х1011 ±1,0 | 1,4х1011 ±1,2 | 1,2х1011 ±0,7 |
| Ps.s-27 УлГАУ | 1,6х1011 ±1,2 | 1,5х1011 ±1,1 | 1,3х1011 ±0,7 | 1,1х1011 ±0,2 |
6.11 контроль стерильности (микробиологической чистоты, аномальной токсичности и определение эндотоксина фагового биопрепарата)
Критические контрольные точки на этапах создания фагового биопрепарата.
В процессе производства бактериофагов на разных этапах получали промежуточные продукты, которые должны соответствовать определенному уровню качества.
При подготовке производственных штаммов бактерий контроль посевных культур бактериальных штаммов-продуцентов включал в себя следующие показатели:
— чистота;
— типичность биологических свойств;
— отсутствие легко индуцируемых профагов.
При подготовке маточных бактериофагов контроль маточных бактериофагов включал в себя следующие показатели:
содержание бляшкообразующих единиц в 1 мл — специфическая активность фаголизатов, определяемое методом агаровых слоев по Грациа (табл. 12);
литическая активность, определяемая титрованием в жидкой питательной среде по методу Аппельмана и методу Грациа на Pseudomonas syringae №3;
стабильность лизиса (сохранность полученных результатов лизиса по методу Аппельмана) в течение 48 часов инкубации при температуре 37 ± 1 °C. Температурный режим и время инкубации зависят от специфических особенностей бактерий и их фагов;
микробиологическая чистота фаголизата. Контролируемые по каждой партии фагового биопрепарата микробиологические показатели приведены в ТР ТС 029/2012 и указаны в таблице 9.
Таблица 12 – Контроль специфической активности фаголизатов
| Бактериофаг | Средний титр по 10 экспериментально производственным партиям, БОЕ/мл | Контрольные значения титра,
БОЕ/мл |
| Ps.s-7 УлГАУ | 2,4х1011 ±1,1 | Не менее 1011 |
| Ps.s-27 УлГАУ | 1,6х1011 ±1,2 | Не менее 1011 |
Параметры микробиологической чистоты фагового биопрепарата экспериментально производственных серий фагового биопрепарата соответствовали контрольным значениям приведенным в таблице 9. Результаты проведенной работы свидетельствуют о том, что в процессе хранения готового фагового биопрепарата, состоящего из 2 бактериофагов Pseudomonas syringae (Ps.s-7 УлГАУ или Ps.s-27 УлГАУ) при температуре 4±2°С активность обоих бактериофагов не опускалась ниже нормативных значений в течение 6 месяцев (содержание БОЕ в 1 мл фагового биопрепарата более 109).
Контроль микробиологической чистоты флаконов и крышек для розлива. 5 флаконов из партии отбирали в боксе из двойного пакета. Заливали 10 мл стерильного МПБ. Флаконы закрывали, тщательно встряхивали, ставили в термостат при 37 ºС и 25 ºС на 48 ч. Затем, из каждого флакона, делали высев 0,1 мл на чашки с плотными питательными средами (кровяной агар, Сабуро) методом spot-теста. Инкубировали при 37 ºС 24 часа на кровяном агаре и при 25 ºС – 72 часа на среде Сабуро. После инкубации контролировали наличие или отсутствие роста на чашках. Стерильным пинцетом выбирали 5 крышек из партии, замачивали в емкости с 250 мл стерильной жидкой питательной среды (МПБ). Емкость закрывали, ставили в термостат при 37 ºС и 25 ºС на 48 ч, после чего повторяли методику высева и учета результатов в соответствие с процедурой, приведенной для флаконов.
Контроль фаголизата на аномальную токсичность
Объем 1 мл фаголизата вводили внутрибрюшинно 5 здоровым мышам обоего пола. После введения фаголизата наблюдали за животным в течение 7 суток. Фаговый биопрепарат считался прошедшим испытание, так как в течение вышеназванного срока наблюдения не погибло ни одно из подопытных животных.
Определение эндотоксина в фаговом биопрепарате
Определение уровня эндотоксина после рабочего разведения фагового биопрепарата (до титра каждого бактериофага 109 БОЕ/мл) определяли с помощью реакции гелирования лизата амебоцитов крови мечехвоста Limulus polyphemus (ЛАЛтест). Предельные значения уровня эндотоксина составляло не более 50 ЕЭ/мл.
Для получения жидкого препарата после финальной стадии бактериофаг разливали по флаконам и укупоривали.
Для получения других форм препаратов бактериофагов: в концентрированный бактериофаг добавляли стабилизаторы и лиофилизировали; сухую массу бактериофага контролировали в тестах на специфическую активность и микробиологическую чистоту; готовый продукт контролировали по всем показателям, указанным выше.
К специфическим методам исследования, используемым для характеристики бактериофагов, относятся методы Аппельмана и Грациа.
Транспортирование и хранение
Транспортирование осуществляется при температуре от 2 до 8 °C, в пределах 1 месяца — допускается при температуре от 9 до 25 °C.
Хранение в сухом, защищенном от света и недоступном для детей месте при температуре от 2 до 8 °C в течение 1 — 2 лет. Однако возможно расширение температурного режима хранения до 25 °C при подтверждении активности препарата в течение заявленного срока годности.
2.2.4. Разработка методологии индикации Pseudomonas syringae в пробах семенного материала, пробах почвы, пробах воды, пробах растительной продукции
При подборе оптимального времени экспозиции бактериофагов Ps.s-7 УлГАУ и Ps.s-27 УлГАУ с исследуемым материалом (в эксперименте использовался стерильный мясо-пептонный бульон) было установлено, что этап «предварительное подращивание» применять в схеме постановки эксперимента нецелесообразно, так как определено, что культивирование системы «бактериофаг — исследуемый материал» при температуре 28 ± 1 0С в течение 3,5 часов позволяет выявить бактерии Pseudomonas syringae при методом РНФ в концентрации 103 м.к./мл. Увеличение экспозиционного времени не повышает качества реакции. Результаты проведенных экспериментов представлены в таблице 12.
Далее эксперименты были направлены на отработку параметров постановки РНФ на тест-объектах (семена огурца, проба почвы, речная вода), которые были контаминированы бактериями Pseudomonas syringae в концентрации 103 – 107 м.к./мл (г) в лабораторных условиях. Схема эксперимента отражена на рисунке 1. Полученные нами результаты экспериментов представлены в таблицах 13-15.
Таблица 12 – Результаты постановки реакции нарастарния титра фага с целью индикации бактерий Pseudomonas syringae бактериофагами Ps.s-7 УлГАУ и Ps.s-27 УлГАУ в стерильном мясо-пептонном бульоне
| Концентрация бактерий Pseudomonas syringae, используемая для контаминации тест объекта – мясо-пептонный бульон, (м.к./мл) | Контроль индикаторного бактериофага (М±m) | Контроль свободного бактериофага (М±m) | Опыт (М±m) | Увеличение количества БОЕ (раз) |
| Количество БОЕ/мл | ||||
| Ps.s-7 УлГАУ | ||||
| 103 | 5±2 | — | 31±11 | 6 |
| 104 | 5±2 | — | 55±11 | 11 |
| 105 | 5±2 | — | полный лизис бактериальной культуры | — |
| 106 | 5±2 | — | полный лизис бактериальной культуры | — |
| 107 | 5±2 | — | полный лизис бактериальной культуры | — |
| Ps.s-27 УлГАУ | ||||
| 103 | 3±1 | — | 19±3 | 6 |
| 104 | 3±1 | — | 28±8 | 9 |
| 105 | 3±1 | — | полный лизис бактериальной культуры | — |
| 106 | 3±1 | — | полный лизис бактериальной культуры | — |
| 107 | 3±1 | — | полный лизис бактериальной культуры | — |
Таблица 13 – Результаты экспериметов постановки РНФ с целью индикации бактерий Pseudomonas syringae бактериофагами Ps.s-7 УлГАУ и Ps.s-27 УлГАУ на семенах огурца
| Концентрация бактерий Pseudomonas syringae, используемая для контаминации тест объекта — семян огурца, (м.к./г) | Контроль индикаторного бактериофага (М±m) | Контроль свободного бактериофага (М±m) | Опыт (М±m) | Примерное увеличение количества БОЕ (раз) |
| Количество БОЕ/мл | ||||
| Ps.s-7 УлГАУ | ||||
| 103 | 4±2 | — | 55±12 | 13 |
| 104 | 4±2 | — | полный лизис бактериальной культуры | — |
| 105 | 4±2 | — | полный лизис бактериальной культуры | — |
| 106 | 4±2 | — | полный лизис бактериальной культуры | — |
| 107 | 4±2 | — | полный лизис бактериальной культуры | — |
| Ps.s-27 УлГАУ | ||||
| 103 | 2±1 | — | 12±3 | 6 |
| 104 | 2±1 | — | 25±8 | 12 |
| 105 | 2±1 | — | полный лизис бактериальной культуры | — |
| 106 | 2±1 | — | полный лизис бактериальной культуры | — |
| 107 | 2±1 | — | полный лизис бактериальной культуры | — |
Таблица 14 – Результаты экспериментов постановки РНФ с целью индикации бактерий Pseudomonas syringae бактериофагами Ps.s-7 УлГАУ и Ps.s-27 УлГАУ в пробе почвы
| Концентрация бактерий Pseudomonas syringae, используемая для контаминации тест объекта — пробы почвы, (м.к./г) | Контроль индикаторного бактериофага (М±m) | Контроль свободного бактериофага (М±m) | Опыт (М±m) | Примерное увеличение количества БОЕ (раз) |
| Количество БОЕ/мл | ||||
| Ps.s-7 УлГАУ | ||||
| 103 | 3±1 | — | 15±2 | 5 |
| 104 | 3±1 | — | 24±3 | 8 |
| 105 | 3±1 | — | 48±8 | 16 |
| 106 | 3±1 | — | полный лизис бактериальной культуры | — |
| 107 | 3±1 | — | полный лизис бактериальной культуры | — |
| Ps.s-27 УлГАУ | ||||
| 103 | 2±1 | — | 12±3 | 6 |
| 104 | 2±1 | — | 25±2 | 12 |
| 105 | 2±1 | — | полный лизис бактериальной культуры | — |
| 106 | 2±1 | — | полный лизис бактериальной культуры | — |
| 107 | 2±1 | — | полный лизис бактериальной культуры | — |
Таблица 15 – Результаты экспериметов постановки РНФ с целью индикации бактерий Pseudomonas syringae бактериофагами Ps.s-7 УлГАУ и Ps.s-27 УлГАУ в пробе речной воды
| Концентрация бактерий Pseudomonas syringae, используемая для контаминации тест объекта
— речной воды, (м.к./мл) |
Контроль индикаторного бактериофага (М±m) | Контроль свободного бактериофага (М±m) | Опыт (М±m) | Примерное увеличение количества БОЕ (раз) |
| Количество БОЕ/мл | ||||
| Ps.s-7 УлГАУ | ||||
| 103 | 6±2 | — | 32±12 | 6 |
| 104 | 6±2 | — | 48±12 | 8 |
| 105 | 6±2 | — | полный лизис бактериальной культуры | — |
| 106 | 6±2 | — | полный лизис бактериальной культуры | — |
| 107 | 6±2 | — | полный лизис бактериальной культуры | — |
| Ps.s-27 УлГАУ | ||||
| 103 | 4±2 | — | 24±2 | 6 |
| 104 | 4±2 | — | 36±7 | 9 |
| 105 | 4±2 | — | полный лизис бактериальной культуры | — |
| 106 | 4±2 | — | полный лизис бактериальной культуры | — |
| 107 | 4±2 | — | полный лизис бактериальной культуры | — |
Принимая во внимание полученные нами положительные результаты экспериментов по индикации бактерий Pseudomonas syringae в концентрации 103 м.к./г (мл) бактериофагами Ps.s-7 УлГАУ и Ps.s-27 УлГАУ на пробах семян огурца, почвы и речной воды, было принято решение провести исследования на тех же тест-объектах с применением фагового биопрепарата, состоящего из вышеназванных бактериофагов. Применение бактериофагов в составе полифагового биопрепарата позволило бы сократить затраты расходных материалов и трудозатраты на исследования. Таким образом, продолжительность постановки РНФ с бактериофагами Ps.s-7 УлГАУ и Ps.s-27 УлГАУ составляет 23 часа, включающие этап подготовки реакции 30 минут + 3,5 часа — время термостатирования посевов + этап очистки субстрата трихлорметаном — 30 минут + высев субстрата методом агаровых слоев — 30 минут + 18 часов — время термостатирования посевов = 23 часа. В расчет времени не был включен этап предварительной подготовки бактериофага до концентрации 103 БОЕ/мл.
Следующий этап исследований – это отработка схемы постановки РНФ с целью индикации бактерий Pseudomonas syringae фаговым биопрепаратом (два бактериофага — Ps.s-7 УлГАУ и Ps.s-27 УлГАУ — культивировались в одном флаконе) на следующих тесмт-объектах: почве, речной воде, семенах огурца, товарных томатах, огурцах и цуккини. Результаты экспериментов отражены в таблицах 16-22.
Результаты постановки РНФ на тест объекте – семенах огурца –показали, что выявленная при помощи фагового биопрепарата концентрация бактерий Pseudomonas syringae составила 103 м.к./мл, то есть визуально нами было подсчитано, что количество бляшкообразующих единиц бактериофагов на опытных чашках Петри в сравнении с контрольными увеличилось примерно в 8 раз.
Из материалов таблицы 17 следует, что эффективность РНФ в пробе почвы показала, что обнаруживаемая в пробе почвы концентрация бактерий Pseudomonas syringae — это 104 м.к./г. Согласно вышезаявленным критериям оценки результатов постановки РНФ полученные результаты не являются положительными. Было зафиксировано снижение «чувствительности» реакции, что, по нашему мнению, связано с адаптацией искусственно вносимой бактериальной культуры на тест-объекте, и его структурой, которые, возможно, усложняют адсорбцию бактериофагов на индикаторной культуре.
Таблица 16 – Результаты экспериметов постановки РНФ с целью индикации бактерий Pseudomonas syringae полифаговым биопрепаратом в пробе семян огурца
| Концентрация бактерий Pseudomonas syringae, используемая для контаминации тест объекта
— семян огурца, (м.к./г) |
Контроль индикаторного бактериофага (М±m) | Контроль свободного бактериофага (М±m) | Опыт (М±m) | Примерное увеличение количества БОЕ (раз) |
| Количество БОЕ/мл | ||||
| 103 | 7±2 | — | 56±6 | 8 |
| 104 | 7±2 | — | полный лизис бактериальной культуры | — |
| 105 | 7±2 | — | полный лизис бактериальной культуры | — |
| 106 | 7±2 | — | полный лизис бактериальной культуры | — |
| 107 | 7±2 | — | полный лизис бактериальной культуры | — |
Таблица 17 – Результаты экспериметов постановки РНФ с целью индикации бактерий Pseudomonas syringae полифаговым биопрепаратом в пробе почвы
| Концентрация бактерий Pseudomonas syringae, используемая для контаминации тест объекта — пробы почвы, (м.к./г) | Контроль индикаторного бактериофага (М±m) | Контроль свободного бактериофага (М±m) | Опыт (М±m) | Примерное увеличение количества БОЕ (раз) |
| Количество БОЕ/мл | ||||
| 103 | 6±2 | — | 24±6 | 4 |
| 104 | 6±2 | — | 36±8 | 6 |
| 105 | 6±2 | — | полный лизис бактериальной культуры | — |
| 106 | 6±2 | — | полный лизис бактериальной культуры | — |
| 107 | 6±2 | — | полный лизис бактериальной культуры | — |
С целью повышения эффективности РНФ мы решили снизить исходную концентрацию изучаемого фагового биопрепарата с 103 БОЕ/мл до 102 БОЕ/мл. Далее мы поставили реакцию по ранее описанному алгоритму. Результаты отражены в таблице 18.
Таблица 18 – Результаты экспериметов постановки РНФ с целью индикации бактерий Pseudomonas syringae полифаговым биопрепаратом в пробе почвы (титр фага 102 БОЕ/мл)
| Концентрация бактерий Pseudomonas syringae, используемая для контаминации тест объекта — пробы почвы, (м.к./г) | Контроль индикаторного бактериофага (М±m) | Контроль свободного бактериофага (М±m) | Опыт (М±m) | Примерное увеличение количества БОЕ (раз) |
| Количество БОЕ/мл | ||||
| 103 | 9±2 | — | 54±3 | 6 |
| 104 | 9±2 | — | полный лизис бактериальной культуры | — |
| 105 | 9±2 | — | полный лизис бактериальной культуры | — |
| 106 | 9±2 | — | полный лизис бактериальной культуры | — |
| 107 | 9±2 | — | полный лизис бактериальной культуры | — |
Таблица 19 – Результаты экспериметов постановки РНФ с целью индикации бактерий Pseudomonas syringae полифаговым биопрепаратом в пробе речной воды
| Концентрация бактерий Pseudomonas syringae, используемая для контаминации тест объекта — речной воды, (м.к./мл) | Контроль индикаторного бактериофага (М±m) | Контроль свободного бактериофага (М±m) | Опыт (М±m) | Примерное увеличение количества БОЕ (раз) |
| Количество БОЕ/мл | ||||
| 103 | 8±1 | — | 43±8 | 5 |
| 104 | 8±1 | — | 65±8 | 8 |
| 105 | 8±1 | — | полный лизис бактериальной культуры | — |
| 106 | 8±1 | — | полный лизис бактериальной культуры | — |
| 107 | 8±1 | — | полный лизис бактериальной культуры | — |
Экспериментально было установлено, что снижение исходного титра полифагового биопрепарата до концентрации 102 БОЕ/мл позволило провести индикацию бактерий Pseudomonas syringae в концентрации 103 мк/г почвы.
Результаты постановки РНФ с целью индикации бактерий Pseudomonas syringae фаговым биопрепаратом в пробе речной воды представлены в таблице 19. В исследованиях пробы воды речной были получены результаты, сходные с данными эксперимента на пробе семян огурца. Концентрация выявленных бактерий Pseudomonas syringae составила 103 м.к./мл.
Таблица 20 – Результаты экспериметов постановки РНФ с целью индикации бактерий Pseudomonas syringae полифаговым биопрепаратом в пробе томатов
| Концентрация бактерий Pseudomonas syringae, используемая для контаминации тест объекта — томатов, (м.к./г) | Контроль индикаторного бактериофага (М±m) | Контроль свободного бактериофага (М±m) | Опыт (М±m) | Примерное увеличение количества БОЕ (раз) |
| Количество БОЕ/мл | ||||
| 103 | 6±1 | — | 32±2 | 5 |
| 104 | 6±1 | — | 46±4 | 8 |
| 105 | 6±1 | — | полный лизис бактериальной культуры | — |
| 106 | 6±1 | — | полный лизис бактериальной культуры | — |
| 107 | 6±1 | — | полный лизис бактериальной культуры | — |
Таблица 21 – Результаты экспериметов постановки РНФ с целью индикации бактерий Pseudomonas syringae полифаговым биопрепаратом в пробе цуккини
| Концентрация бактерий Pseudomonas syringae, используемая для контаминации тест объекта – цуккини (м.к./г) | Контроль индикаторного бактериофага (М±m) | Контроль свободного бактериофага (М±m) | Опыт (М±m) | Примерное увеличение количества БОЕ (раз) |
| Количество БОЕ/мл | ||||
| 103 | 7±2 | — | 46±2 | 7 |
| 104 | 7±2 | — | 65±2 | 9 |
| 105 | 7±2 | — | полный лизис бактериальной культуры | — |
| 106 | 7±2 | — | полный лизис бактериальной культуры | — |
| 107 | 7±2 | — | полный лизис бактериальной культуры | — |
Таблица 22 – Результаты экспериметов постановки РНФ с целью индикации бактерий Pseudomonas syringae полифаговым биопрепаратом в пробе огурцов
| Концентрация бактерий Pseudomonas syringae, используемая для контаминации тест объекта – огурцов (м.к./мл) | Контроль индикаторного бактериофага (М±m) | Контроль свободного бактериофага (М±m) | Опыт (М±m) | Примерное увеличение количества БОЕ (раз) |
| Количество БОЕ/мл | ||||
| 103 | 9±1 | — | 48±3 | 5 |
| 104 | 9±1 | — | 66±3 | 7 |
| 105 | 9±1 | — | полный лизис бактериальной культуры | — |
| 106 | 9±1 | — | полный лизис бактериальной культуры | — |
| 107 | 9±1 | — | полный лизис бактериальной культуры | — |
Концентрация бактерий Pseudomonas syringae, которую можно определить в вышеназванных пробах, используя данный метод составила 103 м.к./г. Свободный бактериофаг не обнаружен ни в одном из экспериментов.
Таким образом, все проведенные исследования и полученные в ходе них данные принципиально не расходятся с данными аналогичных исследований на иных бактериальных агентах (Г.Р. Садртдинова, 2017; Н.В. Пименов и др., 2019), и позволяют рекомендовать данный алгоритм в качестве метода индикации фитопатогенных бактерий Pseudomonas syringae в пробах почвы, воды, семенном материале и товарных овощах (томатах, огурцах и цуккини). Длительность исследования составляет 23 часа, простота постановки РНФ не требует высокой квалификации исследователя и сложнотехнического оснащения лаборатории.
2.2.5 Изучение эффективности применения сконструированного фагового биопрепарата для индикации Pseudomonas syringae в пробах семенного материала, пробах почвы, пробах воды, пробах растительной продукции
Для оценки эффективности реакции нарастания титра фага в условиях производства нами были проведены исследования проб семенного материала (семена огурцов некоммерческого (домашние) пробы под номерами 1-4, 10-11 и коммерческого происхождения – пробы № 5-9), проб почвы (ПФО – 1-10, ЮФО – 11-20, ЦФО -21-30), воды (1-5 пробы — р. Волга, 6-9 пробы — р. Свияга, 9 проба р. Гуща, 10 проба – р. Сура, 11 – р. Малый Черемшан, 12 проба – р. Майна, 13 проба – р. Большой Черемшан), растительной продукции (цуккини, томаты, огурцы плоды и семенной материал), приобретенной на продовольственных рынках г. Ульяновска и г. Димитровграда на наличие бактерий вида Pseudomonas syringae с помощью специфических бактериофагов Ps.s-7 УлГАУ и Ps.s-27 УлГАУ.
Материал для исследований отбирали в соответствии с требованиями, указанными в ГОСТ 26669-85 Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов (с Изменением № 1)
Обнаружение бактерий вида Pseudomonas syringae проводили бактериологическим методом по авторской схеме (рис. 10) и с помощью реакции нарастания титра фага.
При индентификации выделенных штаммов из объектов санитарного надзора мы определяли следующие свойтва бактерий: морфологические, тинкториальные, культуральные и биохимические. Определение тинкториальных свойств (окраска по Грамму, подвижность культуры, образование спор) проводили по стандартной методике.
Для изучения биохимических свойств выделенных штаммов из окружающей среды мы определяли у них наличие оксидазы, каталазную активность, способность использовать источников углерода (глюкозу, лактозу, сахарозу, маннозу, сорбит), использование аргинингидролазы, способность к гидролизу эскулина, желатина и крахмала, а также продукцию сероводорода. Устойчивость штаммов к абиотическим факторам: рост при среде 5 % концентрации NaCl, действие температурного фактора (рост при +41оС). Определение каталазной активности проводили с применением 3% раствора перекиси водорода. На суточную культуру бактерий, засеянную на МПА (культивирование при температуре 280С в течение 24 часов), наносили 2 капли 3% раствора перикиси водорода. Реакция считалась положительной, если на поверхности МПА образовывались пузырьки.
Высевали суточную культуру на картофельный агар (культивирование при температуре 280С в течение 24 часов), добавляли раствор Люголя для определения гидролиза крахмала.
Тест на оксидазу проводили экспресс методом. Суточные культуры наносили на диски (оксидазные диски HiMedia Laboratories Pvt. Limited, Индия), результаты оценивали по изменению цвета дисков.
Протеолитическую активность определяли на среде с питательным желатином. К МПБ добавляли 15% желатин, нагревали до полного его набухания, после стерилизации при 0,5 атм разливали в пробирки по 5 мл. На эти пробирки высевали культуры. Результаты смотрели 1-3 суток. Наличие протеолитических ферментов выделяемых в процессе роста культуры наблюдали разжижение столбика.
Суть определения аргинингидралазы состоит в том, что бактерии, обладающие аргинингидралазой, образуют из аргинина NH3 в анаэробных условиях, что сопровождается защелачиванием среды и изменением цвета индикатора. Обычно этот метод используется для дифференциации псевдомонад.
Индол определяли с помощью реактива Ковача, способность к окислению углеводов определяли в аэробных условиях с помощью цветного ряда Гисса, определяли реакцию на образование сероводорода.
Для определения роста при 41оС, суточную культуру высевали на МПА и помещали в термостат при 41оС на 24 часа. Результаты учитывали по росту колонии на чашке. Паралелльно определяли рост в среде с 5% NaCl, культуру засевали на МПА с 5% NaCl и инкубировали в термостате при 28оС на 24 часа.
Окислительно-ферментативный тест на использование глюкозы (тест ХьюЛейфсона). Для определения анаэробной ферментации (O/F). Готовили среду (пептон ферментативный, NаС1, К2НР04, агар-агар, дистиллированная вода; после автоклавирования при 0,5 атм. вносили бромтимоловый синий), разливали на 2 пробирки и суточные культуры засевали уколом параллельно в 2 пробирки, затем на одну пробирку заливали стерильным вазелином. Результаты регистрировали ежедневно в течение 3 суток. Изменения смотрят по окраске индикатора. Кислота образуется вначале только в верхней части. Если же микроорганизмы не катаболизируют углевод, то кислота не образуется ни в одной из пробирок. Если микроорганизмы образуют кислоту в открытой пробирке (О-реакция) с окислительным типом метаболизма.
Липолитическую активность (ТВИНазную) определяли с помощью Tween-80, лецитиназную активность. Липолитическая (твиназная) активность используют для идентификации бактерий рода Pseudomonas. Твины – это эфиры спиртов (сорбитол, маннитол и др.) и жирные кислоты. Твин 80 является эфиром олеиновой кислоты. Под действием бактериальных липаз жирные кислоты отщепляются, затем осаждаются в виде мыла присутствующими в питательной среде ионами кальция. Весь этот процесс сопровождается помутнением среды. Для выполнения работ готовили среду (дистиллированная вода, пептон, NaCl, СaCl2·2H2O, агар-агар), после автоклавирования при 1,5 атм к среде добавляли Твин 80 и стерилизовали при 0,5 атм. Затем перемешивали и разливали в чашки Петри. Суточные культуры засевали на поверхность среды медальонами и инкубировали в течение 7 суток. Результаты смотрели по образованию вокруг бляшек замутнения.
Определение лецитиназной активности: готовили яично-желточную плотную среду (300 мл стерильного, охлажденного до 45-50оС мясопептонного агара добавляли 1 желток куриных яиц. Смесь тщательно перемешивали и разливали в чашки Петри). Затем суточные культуры засевали в чашки, инкубировали в течение 24 часов при 28оС. Если реакция будет положительной вокруг колонии формируется небольшой ареол, отливающий металлическим блеском. При отрицательной реакции цвет среды вокруг колонии не изменяется.
Образование левана на среде с 5% сахарозой. Тест на продукцию левана используют для установления видовой принадлежности бактерии рода Pseudomonas. Многие бактерии из рода Pseudomonas утилизируют сахарозу в качестве источника углерода и продуцируют из нее леван, это свидетельствует о наличии фермента левансахаразы. Для исследований мы засевали суточные культуры на МПА с 5% сахарозой. Результаты учитывали в течение 1-3 суток. Если на среде с сахарозой культуры образуют белые, мукоидные, тянущиеся колонии, то это свидетельствует продуцирование левана.
Определение гиперчувствительности состоит в том что, если заразить растение фитопатогенными бактериями, не являющимися патогенным для этого вида растений, на месте введения бактерий запускаются быстрые механизмы защитного ответа в виде почернения и усыхания. Для работы суточные культуры на скошенном агаре смывали 3-4 мл физиологическим раствором и 15-20 мкл вводили в мякоть листа с помощью стерильного шприца. В качестве контроля использовали стерильный физиологический раствор. Результаты смотрели через 1-3 суток.
Общее время исследований по схеме занимает 192 часа.
Каждую исследуемую пробу массой/объемом 10 мл вносили в стерильную колбу, содержащую 90 мл стерильного МПА (рН 7,2-7,4) в соотношении 1:10. Содержимое колбы встряхивали в шуттель-аппарате в течение 15 минут с последующим отстаиванием взвеси в течение 10 минут. Далее работали по методике, отраженной на рисунках 10-17.
Рисунок 10 – Бактериологическая схема идентификации бактерий Pseudomonas syringae
Результат реакции нарастания титра фага учитывали путем подсчета бляшкоообразующих единиц фага в опытных и контрольных чашках. Оценку реакции проводили в соответствии с показателями таблицы 23. Положительная реакция характеризовалась увеличением количества бляшкообразующие единиц фага по сравнению с контролем в 5 и более раз.
При исследовании 11 проб семян огурцов бактериологическим методом на наличие в них бактерий Pseudomonas syringae было обнаружено наличие искомых микроорганизмов в пробах № 3 и № 11.
Таблица 23 — Оценка реакции нарастания титра фага (РНФ)
| Увеличение количества корпускул индикаторного фага в опытной пробе (пробирка №1) в отношении к количеству корпускул в контроле (пробирка №3) | Оценка |
| Увеличение в 2,5 раза
Увеличение от 3 до 5 раз Увеличение свыше 5 раз Увеличение более 10 раз |
Сомнительная
Слабо положительная Положительная Резко положительная |

Рисунок 11 – Рост Pseudomonas syringae (полевой штамм, выделенный из пробы семян огурцов № 5) на среде Кинг Б в течение 24 часов при температуре 28°С (под УФ лучами виден флюоресцирующий оттенок)

Рисунок 12 – Реакция на аргинингидролазу у Pseudomonas syringae (первая пробирка с полевым штаммом, выделенным из пробы огурцов № 5) — с вазелиновым маслом, вторая пробирка полевым штаммом, выделенным из пробы огурцов № 5) — без вазелинового масла, третья пробирка — контроль) (время экспозиции 24 часа при температуре 280С)

Рисунок 13 — O/F тест (определение анаэробной ферментации) слева пробирка контроль, по середине пробирка с вазелиновым маслом (полевым штаммом, выделенным из пробы огурцов № 7), справа пробирка без вазелинового масла (полевым штаммом, выделенным из пробы огурцов № 7)



Рисунок 14 — Объекты исследований – семена огурцов


Рисунок 15 — Объект исследований — цуккини


Рисунок 16 — Объект исследований – огурцы


Рисунок 17 — Объекты исследований – томаты и огурцы
Реакция нарастания титра фага с использованием фагового биопрепарата, включающего фаги Ps.s-7 УлГАУ и Ps.s-27 УлГАУ также дала положительный результат индикации бактерии вида Pseudomonas syringae в исследуемых пробах семян огурцов № 3 и № 11. Результаты исследований представлены в таблице 24. Бактериологическим методом также в данных пробах были выделены и идентифицированы бактерии вида Pseudomonas syringae.
Таблица 24 — Результаты использования РНФ для индикации бактерий вида Pseudomonas syringae в пробах семян огурца
| №
пробы |
Количество
БОЕ в контроле (М±m) |
Количество
БОЕ в опыте (М±m) |
Увеличение титра фага, раз | Результат РНФ | Результат
бактериологических исследований |
| 1 | 7±2 | 7±2 | — | отрицательный | отрицательный |
| 2 | 7±2 | 8±1 | — | отрицательный | отрицательный |
| 3 | 7±2 | 56±1 | 8,0 | положительный | положительный |
| 4 | 7±2 | 9±1 | — | отрицательный | отрицательный |
| 5 | 7±2 | 7±1 | — | отрицательный | отрицательный |
| 6 | 7±2 | 12±1 | — | отрицательный | отрицательный |
| 7 | 7±2 | 8±1 | — | отрицательный | отрицательный |
| 8 | 7±2 | 10±1 | — | отрицательный | отрицательный |
| 9 | 7±2 | 7±2 | — | отрицательный | отрицательный |
| 10 | 7±2 | 12±1 | — | отрицательный | отрицательный |
| 11 | 7±2 | 63±1 | 9,0 | положительный | положительный |
Свободный фаг при исследовании обнаружен не был.
При исследовании 12 проб огурцов бактериологическим методом на наличие в них бактерий Pseudomonas syringae было обнаружено наличие искомых микроорганизмов в пробах № 5 и № 7.
Таблица 25 — Результаты использования РНФ для индикации бактерий вида Pseudomonas syringae в пробах огурцов
| №
исследуе мой пробы |
Количество
бляшкообразующих единиц в контроле (М±m) |
Количество
бляшкообразующих единиц в опыте (М±m) |
Увеличение титра фага, раз | Результат РНФ | Результат
бактериологических исследований |
| 1 | 9±1 | 10±1 | — | отрицательный | отрицательный |
| 2 | 9±1 | 8±2 | — | отрицательный | отрицательный |
| 3 | 9±1 | 11±1 | — | отрицательный | отрицательный |
| 4 | 9±1 | 9±3 | — | отрицательный | отрицательный |
| 5 | 9±1 | 63±1 | 7,0 | положительный | положительный |
| 6 | 9±1 | 8±2 | — | отрицательный | отрицательный |
| 7 | 9±1 | 56±1 | 6,2 | положительный | положительный |
| 8 | 9±1 | 12±2 | — | отрицательный | отрицательный |
| 9 | 9±1 | 10±1 | — | отрицательный | отрицательный |
| 10 | 9±1 | 14±2 | — | отрицательный | отрицательный |
| 11 | 9±1 | 15±2 | — | отрицательный | отрицательный |
| 12 | 9±1 | 9±2 | — | отрицательный | отрицательный |
Свободный фаг при исследовании обнаружен не был.
Поставив реакцию нарастания титра фага с использованием скунструированного авторами фагового биопрепарата, включающего фаги Ps.s-7 УлГАУ и Ps.s-27 УлГАУ мы получили положительные результаты индикации бактерии вида Pseudomonas syringae в исследуемых пробах огурцов № 5 и № 7. Результаты исследований представлены в таблице 26.
Изучение 12 проб цуккини на наличие бактерий Pseudomonas syringae бактериологическим методом показало, что пробы под номерами 6 и 7 кокнтаминированы вышеназванными микроорганизмами.
Таблица 26 — Результаты использования РНФ для индикации бактерий вида Pseudomonas syringae в пробах цуккини
| №
исследуе мой пробы |
Количество
бляшкообразующих единиц в контроле (М±m) |
Количество
бляшкообразующих единиц в опыте (М±m) |
Увеличение титра фага, раз | Результат РНФ | Результат
бактериологических исследований |
| 1 | 7±2 | 7±1 | — | отрицательный | отрицательный |
| 2 | 7±2 | 8±1 | — | отрицательный | отрицательный |
| 3 | 7±2 | 7±1 | — | отрицательный | отрицательный |
| 4 | 7±2 | 11±1 | — | отрицательный | отрицательный |
| 5 | 7±2 | 8±2 | — | положительный | положительный |
| 6 | 7±2 | 50±1 | 7,0 | положительный | отрицательный |
| 7 | 7±2 | 36±1 | 5,0 | положительный | положительный |
| 8 | 7±2 | 8±1 | — | отрицательный | отрицательный |
| 9 | 7±2 | 7±2 | — | отрицательный | отрицательный |
| 10 | 7±2 | 8±2 | — | отрицательный | отрицательный |
| 11 | 7±2 | 10±1 | — | отрицательный | отрицательный |
| 12 | 7±2 | 12±1 | — | отрицательный | отрицательный |
Свободный фаг при исследовании обнаружен не был.
Используя предлагаемый метод фагоиндикации, авторами в пробах № 6 и № 7 цуккини были также выявлены бактерии Pseudomonas syringae, так как титр фагового биопрепарата увеличился в 5 раз и более.
Дальнейшие исследования проводились на пробах томатов. Применяя авторскую бактериологическую схему выделения и идентификации бактерий Pseudomonas syringae, было установлено обсеменение проб томатов под номерами 3, 8 и 10. Последующие эксперименты по фагоиндикации подтвердили полученные бактериологическим методом результаты (табл. 27).
Таблица 27 — Результаты использования РНФ для индикации бактерий вида Pseudomonas syringae в пробах томатов
| №
исследуе мой пробы |
Количество
бляшкообразующих единиц в контроле (М±m) |
Количество
бляшкообразующих единиц в опыте (М±m) |
Увеличение титра фага, раз | Результат РНФ | Результат
бактериологических исследований |
| 1 | 6±1 | 7±1 | — | отрицательный | отрицательный |
| 2 | 6±1 | 6±2 | — | отрицательный | отрицательный |
| 3 | 6±1 | 37±1 | 6,0 | положительный | положительный |
| 4 | 6±1 | 8±1 | — | отрицательный | отрицательный |
| 5 | 6±1 | 7±1 | — | отрицательный | положительный |
| 6 | 6±1 | 9±1 | — | отрицательный | отрицательный |
| 7 | 6±1 | 6±2 | — | отрицательный | положительный |
| 8 | 6±1 | 54±3 | 9,0 | положительный | положительный |
| 9 | 6±1 | 11±1 | — | отрицательный | отрицательный |
| 10 | 6±1 | 48±2 | 8,0 | положительный | положительный |
| 11 | 6±1 | 7±2 | — | отрицательный | отрицательный |
| 12 | 6±1 | 8±2 | — | отрицательный | отрицательный |
| 13 | 6±1 | 9±2 | — | отрицательный | отрицательный |
Свободный фаг при исследовании обнаружен не был.
Анализируя данные, полученные при исследовании 13 проб томатов было установлено, что 3 пробы были контаминированы бактериями Pseudomonas syringae, так как титр фагового биопрепарата увеличился в 5 раз и более в опыте по сравнению с контролем.
Изучение речной воды методом постановки РНФ с 13 пробами показало, что в пробах 1, 8 и 11 было установлено увеличение титра фага в опыте по сравнению с контролем, что свидетельствует о наличии в данных пробах бактерий вида Pseudomonas syringae. Использование в исследованиях авторской бактериологической схемы выделения и идентификации бактерий Pseudomonas syringae позволило также в вышеназванных пробах обнаружить бактерии Pseudomonas syringae.
Таблица 28 — Результаты использования РНФ для индикации бактерий вида Pseudomonas syringae в пробах воды речной
| №
исследуе мой пробы |
Количество
бляшкообразующих единиц в контроле (М±m) |
Количество
бляшкообразующих единиц в опыте (М±m) |
Увеличение титра фага, раз | Результат РНФ | Результат
бактериологических исследований |
| 1 | 8±1 | 72±1 | 9,0 | положительный | положительный |
| 2 | 8±1 | 12±2 | — | отрицательный | отрицательный |
| 3 | 8±1 | 14±1 | — | отрицательный | отрицательный |
| 4 | 8±1 | 9±1 | — | отрицательный | отрицательный |
| 5 | 8±1 | 8±2 | — | отрицательный | положительный |
| 6 | 8±1 | 10±1 | — | отрицательный | отрицательный |
| 7 | 8±1 | 13±2 | — | отрицательный | отрицательный |
| 8 | 8±1 | 41±2 | 5,0 | положительный | положительный |
| 9 | 8±1 | 9±1 | — | отрицательный | отрицательный |
| 10 | 8±1 | 10±1 | — | отрицательный | отрицательный |
| 11 | 8±1 | 48±2 | 6,0 | положительный | положительный |
| 12 | 8±1 | 11±2 | — | отрицательный | отрицательный |
| 13 | 8±1 | 10±1 | — | отрицательный | отрицательный |
Свободный фаг при исследовании обнаружен не был.
При исследовании проб почвы различного хозяйственного назначения Приволжского, Южного и Центрального федеральных округов было установлено, что уровень контаминации бактериями вида Pseudomonas syringae составил 20 %, то есть увеличение титра фага было зафиксировано в 5 пробах под номерами 5, 7, 15, 18, 22, 28. В данных пробах также были выделены вышеназванные бактерии бактериологическим методом.
Таблица 29 — Результаты использования РНФ для индикации бактерий вида Pseudomonas syringae в пробах почвы
| №
исследуе мой пробы |
Количество
бляшкообразующих единиц в контроле (М±m) |
Количество
бляшкообразующих единиц в опыте (М±m) |
Увеличение титра фага, раз | Результат РНФ | Результат
бактериологических исследований |
| 1 | 9±2 | 9±1 | — | отрицательный | отрицательный |
| 2 | 9±2 | 10±1 | — | отрицательный | отрицательный |
| 3 | 9±2 | 9±2 | — | отрицательный | отрицательный |
| 4 | 9±2 | 11±2 | — | отрицательный | отрицательный |
| 5 | 9±2 | 72±1 | 8,0 | положительный | положительный |
| 6 | 9±2 | 9±2 | — | отрицательный | отрицательный |
| 7 | 9±2 | 54±3 | 6,0 | положительный | положительный |
| 8 | 9±2 | 10±2 | — | отрицательный | отрицательный |
| 9 | 9±2 | 9±1 | — | отрицательный | отрицательный |
| 10 | 9±2 | 9±2 | — | отрицательный | отрицательный |
| 11 | 9±2 | 11±1 | — | отрицательный | отрицательный |
| 12 | 9±2 | 9±1 | — | отрицательный | отрицательный |
| 13 | 9±2 | 10±2 | — | отрицательный | отрицательный |
| 14 | 9±2 | 10±1 | — | отрицательный | отрицательный |
| 15 | 9±2 | 63±3 | 7,0 | положительный | положительный |
| 16 | 9±2 | 10±2 | — | отрицательный | отрицательный |
| 17 | 9±2 | 9±1 | — | отрицательный | отрицательный |
| 18 | 9±2 | 50±1 | 5,5 | положительный | положительный |
| 19 | 9±2 | 9±1 | — | отрицательный | отрицательный |
| 20 | 9±2 | 9±2 | — | отрицательный | отрицательный |
| 21 | 9±2 | 10±2 | — | отрицательный | отрицательный |
| 22 | 9±2 | 65±2 | 7,2 | положительный | положительный |
| 23 | 9±2 | 9±2 | — | отрицательный | отрицательный |
| 24 | 9±2 | 10±2 | — | отрицательный | отрицательный |
| 25 | 9±2 | 9±1 | — | отрицательный | отрицательный |
| 26 | 9±2 | 11±2 | — | отрицательный | отрицательный |
| 27 | 9±2 | 10±1 | — | отрицательный | отрицательный |
| 28 | 9±2 | 75±2 | 8,3 | положительный | положительный |
| 29 | 9±2 | 11±2 | — | отрицательный | отрицательный |
| 30 | 9±2 | 10±2 | — | отрицательный | отрицательный |
Свободный фаг при исследовании обнаружен не был.
Проведенные нами исследования по идентификации выделенных бактериальных культур бактериологическим методом отражены в таблицах 30-31.
Таблица 30 – Биологические свойства выделенных бактериальных культурр из проб объектов санитарного надзора
| № | Показатель | Объекты исследований и номера проб | |||||||||||
| семена огурца | огурцы | цуккини | томаты | речная вода | |||||||||
| 3 | 11 | 5 | 7 | 6 | 7 | 3 | 8 | 10 | 1 | 8 | 11 | ||
| 1 | Окраска по Граму | — | — | — | — | — | — | — | — | — | — | — | — |
| 2 | Подвижность | + | + | + | + | + | + | + | + | + | + | + | + |
| 3 | Споры | — | — | — | — | — | — | — | — | — | — | — | — |
| 4 | Флуоресценция | + | + | + | + | + | + | + | + | + | + | + | + |
| 5 | Оксидаза | — | — | — | — | — | — | — | — | — | — | — | — |
| 6 | Каталаза | + | + | + | + | + | + | + | + | + | + | + | + |
| 7 | Аргинингидралаза | — | ± | ± | ± | — | — | — | — | — | — | — | — |
| 8 | Гидролиз: желатина | — | — | — | + | — | — | — | — | — | — | — | — |
| 9 | крахмала | — | — | — | — | — | — | — | — | — | — | — | — |
| 10 | O/F тест | О | О | О | О | О | О | О | O | O | O | О | O |
| 11 | Липолитическая (твиназная) активность | + | + | + | + | + | + | + | + | + | + | + | + |
| 12 | Лецитиназная активность | — | — | — | — | — | — | — | — | — | — | — | — |
| 13 | Образование левана | + | + | + | + | + | + | + | + | + | + | + | + |
| 14 | индола | — | — | — | — | — | — | — | — | — | — | — | — |
| 15 | сероводорода | — | — | — | — | — | — | — | — | — | — | — | — |
| 16 | Ферментация глюкозы | + | + | + | + | + | ± | ± | ± | — | + | + | ± |
| 17 | лактозы | — | — | — | — | — | — | — | — | — | — | — | — |
| 18 | сахарозы | ± | + | ± | + | ± | ± | ± | ± | + | + | + | ± |
| 19 | маннозы | + | + | + | + | — | ± | — | ± | + | + | — | — |
| 20 | сорбита | — | + | + | + | — | — | — | — | — | — | — | — |
| 21 | Рост на МПА при 41°С | — | — | — | — | — | — | — | — | — | — | — | — |
| 22 | Рост в МПА с 5% NaCl | — | — | — | — | — | — | — | — | — | — | — | — |
| 23 | Тест на мацерацию ткани | — | — | — | — | — | — | — | — | — | — | — | — |
| 24 | Гиперчувствительность | + | + | + | + | + | + | + | + | + | + | + | + |
Примечание: «+» — положительная реакция, «-» — отрицательная реакция.
Таблица 31 – Биологические свойства выделенных бактериальных культурр из проб почвы
| № | Показатель | Номера проб почвы | |||||
| 5 | 7 | 15 | 18 | 22 | 28 | ||
| 1 | Окраска по Граму | — | — | — | — | — | — |
| 2 | Подвижность | + | + | + | + | + | + |
| 3 | Споры | — | — | — | — | — | — |
| 4 | Флуоресценция | + | + | + | + | + | + |
| 5 | Оксидаза | — | — | — | — | — | — |
| 6 | Каталаза | + | + | + | + | + | + |
| 7 | Аргинингидралаза | — | ± | ± | ± | — | — |
| 8 | Гидролиз: желатина | — | — | — | + | — | — |
| 9 | крахмала | — | — | — | — | — | — |
| 10 | O/F тест | О | О | О | О | О | О |
| 11 | Липолитическая (твиназная) активность | + | + | + | + | + | + |
| 12 | Лецитиназная активность | — | — | — | — | — | — |
| 13 | Образование левана | + | + | + | + | + | + |
| 14 | индола | — | — | — | — | — | — |
| 15 | сероводорода | — | — | — | — | — | — |
| 16 | Ферментация глюкозы | + | + | + | + | + | + |
| 17 | лактозы | — | — | — | — | — | — |
| 18 | сахарозы | ± | + | ± | + | ± | ± |
| 19 | маннозы | + | + | + | + | — | — |
| 20 | сорбита | — | + | + | + | — | — |
| 21 | Рост на МПА при 41°С | — | — | — | — | — | — |
| 22 | Рост в МПА с 5% NaCl | — | — | — | — | — | — |
| 23 | Тест на мацерацию ткани | — | — | — | — | — | — |
| 24 | Гиперчувствительность | + | + | + | + | + | + |
Примечание: «+» — положительная реакция, «-» — отрицательная реакция.
Из данных таблиц 30-31 видно, что у выделенных бактериальных культур зафиксированы отрицательные результаты по тестам на оксидазу и аргинингидралазу, определена продукция каталазы. По литературным данным бактерий Pseudomonas syringae гидролизуют желатин вариабельно, по нашим исследованиям оба референс-штамма не разжижают желатин. О/F тест положительный. Липолитическая (твиназная) активность регистрировалась, лецитиназная активность не фиксировалась. Изучаемые бактериальные штаммы образуют леван, индол не выделяют, не растут на МПА при температуре 41ºС. Ферментируют глюкозу, сахарозу, маннозу и сорбит. Тест на мацерацию ткани картофеля через 24 часа – результат отрицателен. Реакция на гиперчувствительность ткани положительная, что соответствует литературным данным.
Полученные результаты позволяют сделать вывод о том, что выделенные штаммы Pseudomonas syringae обладают типовыми свойствами.
Изучение эффективности применения сконструированного фагового биопрепарата для индикации Pseudomonas syringae в пробах семенного материала, пробах почвы, пробах воды, пробах растительной продукции показало, что реакция нарастания титра фага не уступает по эффективности бактериологическому методу выделения и идентификации вышеназванных бактерий. Очевидна также экономия расходных материалов и трудозатрат при ее постановке по сравнению с бактериологическим методом. Необходимо также отметить и сокращение времени исследования с 192 часов до 23 часов.
ЗАКЛЮЧЕНИЕ
Бактериальные фитопатогены значительно снижают урожайность сельскохозяйственных культур и, следовательно, наносят значительный экономический ущерб и представляют угрозу для продовольственного обеспечения растущего мирового населения. В этом контексте бактериофаги исследуются как агенты биоконтроля, позволяющие своевременно провести индикацию специфичного микроорганизма, предотвратить распростронение заболевания и снизить экономический ущерб.
Цель работы – разработать экологически безопасный биологический препарат на основе специфических бактериофагов, который позволит проводить биоконтроль растений на наличие бактерий Pseudomonas syringae на разных стадиях (посевной материал, в период вегетации и при хранении).
Первый этап работы — конструирование фагового биопрепарата на основе имеющихся фагов, специфичных для Pseudomonas syringae, характеризующихся определенными биологическими свойствами. Для этого были изучены биологические свойства 8 бактериофагов активных в отношении Pseudomonas syringae. Отобраны 2 наиболее производственно-перспективных штамма фагов Ps.s-7 УлГАУ и Ps.s-27 УлГАУ с максимально широким спектром литического действия и явно выраженной специфичностью, максимально высоким титром литической активности при хранении, устойчивостью к факторам внешней среды, отсутствием в геноме «локусов патогенности».
Ps.s-7 УлГАУ: выделен из пробы почвы, индикаторная культура Ps.s № 3, литическая активность — 10-8 (при определении по методу Аппельмана) и 2,0±0,1х109 БОЕ/мл (бляшкообразующих единиц) (при определении по методу Грациа), специфичность — 85,7 % на 14 бактериальных штаммах Pseudomonas syringae; в исследованиях установлена устойчивость к температуре до 600С в течение 30 минут и трихлорметану в соотношении 1:10 (временная экспозиция 35 минут).
Ps.s-27 УлГАУ: выделен из пробы почвы, индикаторная культура Ps.s № 3, литическая активность — 10-8 (по методу Аппельмана) и 1,0±0,1х109 БОЕ/мл (по методу Грациа), специфичность — 85,7 % на 14 бактериальных штаммах Pseudomonas syringae; определено, что бактериофаг устойчив к воздействию температуры до 600С в течение 30 минут и трихлорметана в соотношении 1:10 (время экспозиции составило 35 минут).
Произведен подбор технологических параметров изготовления биопрепарата на основе бактериофагов (разработаны количественные и качественные параметры культивирования – соотношение системы фаг/индикаторная культура: 1/1 – 0,2 мл/0,2 мл, подобрана оптимальная методики очистки фагового биопрепарата – многоступенчатая мембранная фильтрация, произведен контроль микробиологической чистоты, аномальной токсичности и определено отсутствие эндотоксина в фаговом биопрепарате).
Разработана пилотная технология получения экспериментального фагового биопрепарата, позволяющая нарабатывать средство для индикации фитопатогенных бактерий Pseudomonas syringae с высоким титром фаговых частиц, включающая многоступенчатую схему контрольно-испытательных мероприятий. Таким образом, фаговый биопрепарат Pseudomonas syringae представляет собой прозрачную жидкость от светло-желтого до желтого цвета, розлитую в стеклянные флаконы под резиновую пробку и алюминиевый колпачок объемом 100-500 мл, титр фага не менее 108 БОЕ/мл, условия хранения: 2-4 0С в течение 12 месяцев при относительной влажности воздуха 70-80 %, при транспортировании необходимо учитывать хрупкость упаковки.
Далее при проведении исследований по разработке параметров практического применения фагового биопрепарата Pseudomonas syringae с целью индикации в пробах воды, почвы, в семенном материале и продуктах питания — товарных овощах (томатах, огурцах и цуккини) в реакции нарастания титра фага было определено, что культивирование системы: бактериофаг-проба при температуре 28 ± 1 0С в течение 3,5 часов позволяет выявить в вышеназванных тест-объектах бактерии Pseudomonas syringae методом РНФ в концентрации 103 м.к./г (мл). Увеличение экспозиционного времени не повышает качества реакции. Бактериофаги Ps.s-7 УлГАУ и Ps.s-27 УлГАУ в монокультуре были использованы в экспериментах в концентрации 103 БОЕ/мл.
При тестировании в РНФ полифагового биопрепарата на основе вышеназванных бактериофагов было установлено, что в исследованиях пробы воды речной и семенном материале (огурца) были получены результаты, сходные с данными эксперимента на пробах товарных томатов, огурцов и цуккини. Концентрация выявленных бактерий Pseudomonas syringae составила 103 м.к./мл. Экспериментально было установлено, что снижение исходного титра полифагового биопрепарата до концентрации 102 БОЕ/мл позволяет провести индикацию бактерий Pseudomonas syringae в пробе почы в концентрации 103 мк/г.
Полученные данные позволят в перспективе использовать реакцию нарастания титра фага в качестве ускоренного и методически простого метода тестирования продуктов питания (товарных овощей), семенного материала, проб почвы и воды на наличие фитопатогенного бактериального агента Pseudomonas syringae. В случае положительного результата разработать систему мероприятий по их санации специфичным и экологически чистым фаговым биопрепаратом.
На основании полученных данных разработана нормативно-техническая документация: «Временная инструкция по изготовлению и контролю лабораторной серии бактериофагов Pseudomonas syringae» и «Методические рекомендации по индикации бактерий Pseudomonas syringae».
Сельскохозяйственным и перерабатывающим предприятиям предложен новый биопрепарат на основе консорциума 2 бактериофагов Ps.s-7 УлГАУ и Ps.s-27 УлГАУ, специфичных для Pseudomonas syringae, для биоконтроля фитопатогена в объектах внешней среды и объектах растениеводства и разработана методика его применения.
СПИСОК ЛИТЕРАТУРНЫХ ИСТОЧНИКОВ
- Xin X. F., Kvitko B., He S. Y. Pseudomonas syringae: what it takes to be a pathogen //Nature Reviews Microbiology. – 2018. – Т. 16. – №. 5. – С. 316.
- Jones J. B. et al. Bacteriophages for plant disease control //Annu. Rev. Phytopathol. – 2007. – Т. 45. – С. 245-262.
- Stone A., Baker B. Organic management of late blight of potato and tomato with copper products. – 2017. URL: https://eorganic.org/node/573
- O’Leary B. M. et al. Early changes in apoplast composition associated with defence and disease in interactions between Phaseolus vulgaris and the halo blight pathogen Pseudomonas syringae pv. phaseolicola //Plant, cell & environment. – 2016. – Т. 39. – №. 10. – С. 2172-2184.
- Moyano L. et al. Bacteriophytochromes from Pseudomonas syringae pv. tomato DC3000 modulate the early stages of plant colonization during bacterial speck disease //European Journal of Plant Pathology. – 2020. – Т. 156. – №. 3. – С. 695-712.
- Hadley J., Radford P. The Use of Copper-based Formulations on Pseudomonas Syringae Pv. Actinidiae //Caribbean Journal of Science. – 2018. – Т. 51. – №. 2. – С. 380-383.
- Monteil C. L. et al. Population-genomic insights into emergence, crop adaptation and dissemination of Pseudomonas syringae pathogens //Microbial genomics. – 2016. – Т. 2. – №. 10. Doi 10.1099/mgen.0.000089 URL: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5359406/
- Durairaj K. et al. Characterization and assessment of two biocontrol bacteria against Pseudomonas syringae wilt in Solanum lycopersicum and its genetic responses //Microbiological research. – 2018. – Т. 206. – С. 43-49.
- Xin X. F., Kvitko B., He S. Y. Pseudomonas syringae: what it takes to be a pathogen //Nature Reviews Microbiology. – 2018. – Т. 16. – №. 5. – С. 316.
- Yoo S. J. et al. Aspergillus terreus JF27 Promotes the Growth of Tomato Plants and Induces Resistance against Pseudomonas syringae pv. tomato //Mycobiology. – 2018. – Т. 46. – №. 2. – С. 147-153.
- Yu J. G. et al. Isolation and characterization of bacteriophages against Pseudomonas syringae pv. actinidiae causing bacterial canker disease in kiwifruit //J. Microbiol. Biotechnol. – 2016. – Т. 26. – №. 2. – С. 385-393.
- Rombouts S. et al. Characterization of novel bacteriophages for biocontrol of bacterial blight in leek caused by Pseudomonas syringae pv. porri //Frontiers in microbiology. – 2016. – Т. 7. – С. 279.
- Pinheiro L. A. M. et al. Efficiency of Phage φ6 for Biocontrol of Pseudomonas syringae pv. syringae: An in Vitro Preliminary Study //Microorganisms. – 2019. – Т. 7. – №. 9. – С. 286.
- Yu J. G. et al. Environmental Microbiology/Microbial Diversity: Isolation and Characterization of Bacteriophages Against Pseudomonas syringae pv. actinidiae Causing Bacterial Canker Disease in Kiwifruit //Journal of Microbiology and Biotechnology. – 2016. – Т. 26. – №. 2. – С. 385-393.
- Buttimer C. et al. Bacteriophages and bacterial plant diseases //Frontiers in microbiology. – 2017. – Т. 8. – С. 34.
- Quiñones-Aguilar E. E. et al. Bacteriophages in the biological control of Pseudomonas syringae pv. phaseolicola, causal agent of halo blight in bean //Ecosistemas y Recursos Agropecuarios. – 2018. – Т. 5. – №. 14. – С. 191-202.
- Jagdale S. et al. Green approach to phytopathogen: Characterization of lytic bacteriophages of Pseudomonas sp., an etiology of the bacterial blight of pomegranate //Microbiological research. – 2019. – Т. 228. – С. 126300.
- Yin Y. et al. Isolation and characterisation of phages against Pseudomonas syringae pv. actinidiae //Acta Agriculturae Scandinavica, Section B—Soil & Plant Science. – 2019. – Т. 69. – №. 3. – С. 199-208.
- Rombouts S. Management of the bacterial pathogens Xanthomonas campestris pv. campestris and Pseudomonas syringae pv. porri in cabbage and leek production using novel bacteriophages. – 2017.
- James S. L. et al. Isolation, Characterisation and Experimental Evolution of Phage that Infect the Horse Chestnut Tree Pathogen, Pseudomonas syringae pv. aesculi //Current Microbiology. – 2020. – С. 1-10.
- Valin H. et al. The future of food demand: understanding differences in global economic models //Agricultural Economics. – 2014. – Т. 45. – №. 1. – С. 51-67.
- High Level Panel of Experts. Agroecological and other innovative approaches for sustainable agriculture and food systems that enhance food security and nutrition. – 2019.
- Buttimer C. et al. Bacteriophages and bacterial plant diseases //Frontiers in microbiology. – 2017. – Т. 8. – С. 34.
- Lugo A. J. et al. Copper resistance in Xanthomonas campestris pv. campestris affecting crucifers in Trinidad //European journal of plant pathology. – 2013. – Т. 136. – №. 1. – С. 61-70.
- Bondarczuk K., Piotrowska-Seget Z. Molecular basis of active copper resistance mechanisms in Gram-negative bacteria //Cell biology and toxicology. – 2013. – Т. 29. – №. 6. – С. 397-405.
- Bosmans L. et al. Efficacy of hydrogen peroxide treatment for control of hairy root disease caused by rhizogenic agrobacteria //Journal of applied microbiology. – 2016. – Т. 121. – №. 2. – С. 519-527.
- Sundin GW, Wang N: Antibiotic resistance in plant-pathogenic bacteria. In Annual Review of Phytopathology, , vol 56. Edited by Leach JE, Lindow S. 2018:161-180.
- van Lenteren J. C. et al. Biological control using invertebrates and microorganisms: plenty of new opportunities //BioControl. – 2018. – Т. 63. – №. 1. – С. 39-59.
- Holtappels D. et al. Protection of phage applications in crop production: A patent landscape //Viruses. – 2019. – Т. 11. – №. 3. – С. 277.
- Narayanasamy P. Detection and Identification of Viral Biological Control Agents //Biological Management of Diseases of Crops. – Springer, Dordrecht, 2013. – С. 431-469.
- Vicente J. G., Holub E. B. X anthomonas campestris pv. campestris (cause of black rot of crucifers) in the genomic era is still a worldwide threat to brassica crops //Molecular plant pathology. – 2013. – Т. 14. – №. 1. – С. 2-18.
- Ansaldi M. et al. Antibacterial applications of bacteriophages //Virologie. – 2020. – Т. 24. – №. 1. – С. 23-36.
- Sundin G. W. et al. Bacterial disease management: challenges, experience, innovation and future prospects: challenges in bacterial molecular plant pathology //Molecular plant pathology. – 2016. – Т. 17. – №. 9. – С. 1506-1518.
- Carstens A. B. et al. Unlocking the potential of 46 new bacteriophages for biocontrol of Dickeya solani //Viruses. – 2018. – Т. 10. – №. 11. – С. 621.
- Zaczek-Moczydłowska M. A. et al. Phage cocktail containing Podoviridae and Myoviridae bacteriophages inhibits the growth of Pectobacterium spp. under in vitro and in vivo conditions //PloS one. – 2020. – Т. 15. – №. 4. – С. e0230842.
- Carstens A. B. et al. A novel six-phage cocktail reduces Pectobacterium atrosepticum soft rot infection in potato tubers under simulated storage conditions //FEMS microbiology letters. – 2019. – Т. 366. – №. 9. – С. fnz101.
- Buttimer C. et al. Novel N4-Like bacteriophages of Pectobacterium atrosepticum //Pharmaceuticals. – 2018. – Т. 11. – №. 2. – С. 45.
- Voronina M. V. et al. Characterization of Pectobacterium carotovorum subsp. carotovorum bacteriophage PP16 prospective for biocontrol of potato soft rot //Microbiology. – 2019. – Т. 88. – №. 4. – С. 451-460.
- Wei C. et al. Developing a bacteriophage cocktail for biocontrol of potato bacterial wilt //Virologica Sinica. – 2017. – Т. 32. – №. 6. – С. 476-484.
- Wang X. et al. Phage combination therapies for bacterial wilt disease in tomato //Nature biotechnology. – 2019. – Т. 37. – №. 12. – С. 1513-1520.
- Elhalag K. et al. Potential use of soilborne lytic Podoviridae phage as a biocontrol agent against Ralstonia solanacearum //Journal of basic microbiology. – 2018. – Т. 58. – №. 8. – С. 658-669.
- Rahimi-Midani A., Choi T. J. Transport of Phage in Melon Plants and Inhibition of Progression of Bacterial Fruit Blotch //Viruses. – 2020. – Т. 12. – №. 4. – С. 477.
- Rahimi-Midani A. et al. Potential use of newly isolated bacteriophage as a biocontrol against Acidovorax citrulli //Archives of microbiology. – 2020. – Т. 202. – №. 2. – С. 377-389.
- Kimmelshue C., Goggi A. S., Cademartiri R. The use of biological seed coatings based on bacteriophages and polymers against Clavibacter michiganensis subsp. nebraskensis in maize seeds //Scientific reports. – 2019. – Т. 9. – №. 1. – С. 1-11.
- Holtappels D. et al. Preparing for the KIL: receptor analysis of Pseudomonas syringae pv. porri phages and their impact on bacterial virulence //International journal of molecular sciences. – 2020. – Т. 21. – №. 8. – С. 2930.
- Ogunyemi S. O. et al. Identification and characterization of five new OP2-related Myoviridae bacteriophages infecting different strains of Xanthomonas oryzae pv. oryzae //Journal of Plant Pathology. – 2019. – Т. 101. – №. 2. – С. 263-273.
- Pinheiro L. A. M. et al. Use of phage ϕ6 to inactivate Pseudomonas syringae pv. actinidiae in kiwifruit plants: In vitro and ex vivo experiments //Applied microbiology and biotechnology. – 2020. – Т. 104. – №. 3. – С. 1319-1330.
- Flores O. et al. Characterization of Bacteriophages against Pseudomonas Syringae pv. Actinidiae with Potential Use as Natural Antimicrobials in Kiwifruit Plants //Microorganisms. – 2020. – Т. 8. – №. 7. – С. 974.
- Rabiey M. et al. Phage biocontrol to combat Pseudomonas syringae pathogens causing disease in cherry //Microbial biotechnology. – 2020. – Т. 13. – №. 5. – С. 1428-1445.
- Schwarczinger I. et al. Characterization of Myoviridae and Podoviridae family bacteriophages of Erwinia amylovora from Hungary-potential of application in biological control of fire blight //European Journal of Plant Pathology. – 2017. – Т. 149. – №. 3. – С. 639-652.
- Born Y. et al. Engineering of bacteriophages Y2: dpoL1-C and Y2:: luxAB for efficient control and rapid detection of the fire blight pathogen, Erwinia amylovora //Applied and environmental microbiology. – 2017. – Т. 83. – №. 12.
- Álvarez B., López M. M., Biosca E. G. Biocontrol of the major plant pathogen Ralstonia solanacearum in irrigation water and host plants by novel waterborne lytic bacteriophages //Frontiers in microbiology. – 2019. – Т. 10. – С. 2813.
- Ibrahim Y. E., Saleh A. A., Al-Saleh M. A. Management of asiatic citrus canker under field conditions in Saudi Arabia using bacteriophages and acibenzolar-S-methyl //Plant disease. – 2017. – Т. 101. – №. 5. – С. 761-765.
- Balogh B., Nga N. T. T., Jones J. B. Relative level of bacteriophage multiplication in vitro or in phyllosphere may not predict in planta efficacy for controlling bacterial leaf spot on tomato caused by Xanthomonas perforans //Frontiers in microbiology. – 2018. – Т. 9. – С. 2176.
- Gašić K. et al. Complete genome of the Xanthomonas euvesicatoria specific bacteriophage KΦ1, its survival and potential in control of pepper bacterial spot //Frontiers in microbiology. – 2018. – Т. 9. – С. 2021.
- Dong Z. et al. Isolation and characterization of a novel phage Xoo-sp2 that infects Xanthomonas oryzae pv. oryzae //Journal of General Virology. – 2018. – Т. 99. – №. 10. – С. 1453-1462.
- Mahlein A. K. et al. Hyperspectral sensors and imaging technologies in phytopathology: state of the art //Annual review of phytopathology. – 2018. – Т. 56. – С. 535-558.
- Abdullah A. S. et al. Host–multi-pathogen warfare: pathogen interactions in co-infected plants //Frontiers in plant science. – 2017. – Т. 8. – С. 1806.
- Bergsma-Vlami M. et al. Phylogenetic Assignment of Ralstonia pseudosolanacearum (Ralstonia solanacearum Phylotype I) Isolated from Rosa spp //Plant disease. – 2018. – Т. 102. – №. 11. – С. 2258-2267.
- Quibod I. L. et al. The Green Revolution shaped the population structure of the rice pathogen Xanthomonas oryzae pv. oryzae //The ISME journal. – 2020. – Т. 14. – №. 2. – С. 492-505.
- Timilsina S. et al. Xanthomonas diversity, virulence and plant–pathogen interactions //Nature Reviews Microbiology. – 2020. – Т. 18. – №. 8. – С. 415-427.
- Ross A., Ward S., Hyman P. More is better: selecting for broad host range bacteriophages //Frontiers in microbiology. – 2016. – Т. 7. – С. 1352.
- Hyman P. Phages for phage therapy: isolation, characterization, and host range breadth //Pharmaceuticals. – 2019. – Т. 12. – №. 1. – С. 35.
- Svircev A., Roach D., Castle A. Framing the future with bacteriophages in agriculture //Viruses. – 2018. – Т. 10. – №. 5. – С. 218.
- Labrie S. J., Samson J. E., Moineau S. Bacteriophage resistance mechanisms //Nature Reviews Microbiology. – 2010. – Т. 8. – №. 5. – С. 317-327.
- Azam A. H., Tanji Y. Bacteriophage-host arm race: an update on the mechanism of phage resistance in bacteria and revenge of the phage with the perspective for phage therapy //Applied microbiology and biotechnology. – 2019. – Т. 103. – №. 5. – С. 2121-2131.
- Gómez P. et al. The impact of resource availability on bacterial resistance to phages in soil //PLoS One. – 2015. – Т. 10. – №. 4. – С. e0123752.
- De Sordi L., Lourenço M., Debarbieux L. “I will survive”: a tale of bacteriophage-bacteria coevolution in the gut //Gut microbes. – 2019. – Т. 10. – №. 1. – С. 92-99.
- Wright R. C. T. et al. Resistance evolution against phage combinations depends on the timing and order of exposure //MBio. – 2019. – Т. 10. – №. 5.
- Hernandez C. A., Koskella B. Phage resistance evolution in vitro is not reflective of in vivo outcome in a plant‐bacteria‐phage system //Evolution. – 2019. – Т. 73. – №. 12. – С. 2461-2475.
- Meaden S., Paszkiewicz K., Koskella B. The cost of phage resistance in a plant pathogenic bacterium is context‐dependent //Evolution. – 2015. – Т. 69. – №. 5. – С. 1321-1328.
- Born Y. et al. Protection of Erwinia amylovora bacteriophage Y2 from UV-induced damage by natural compounds //Bacteriophage. – 2015. – Т. 5. – №. 4. – С. e1074330.
- Boulé J. et al. Isolation and characterization of eight bacteriophages infecting Erwinia amylovora and their potential as biological control agents in British Columbia, Canada //Canadian journal of plant pathology. – 2011. – Т. 33. – №. 3. – С. 308-317.
- Parcey M. et al. Molecular profile of phage infection: A novel approach for the characterization of Erwinia phages through qPCR //International journal of molecular sciences. – 2020. – Т. 21. – №. 2. – С. 553.
- Gitaitis R., Walcott R. The epidemiology and management of seedborne bacterial diseases //Annu. Rev. Phytopathol. – 2007. – Т. 45. – С. 371-397.
- Nagy J. K. et al. Penetration and translocation of Erwinia amylovora-specific bacteriophages in apple-a possibility of enhanced control of fire blight //European Journal of Plant Pathology. – 2015. – Т. 142. – №. 4. – С. 815-827.
- Iriarte F. B. et al. Soil-based systemic delivery and phyllosphere in vivo propagation of bacteriophages: two possible strategies for improving bacteriophage persistence for plant disease control //Bacteriophage. – 2012. – Т. 2. – №. 4. – С. e23530.
- Ward R. L., Mahler R. J. Uptake of bacteriophage f2 through plant roots //Applied and Environmental Microbiology. – 1982. – Т. 43. – №. 5. – С. 1098-1103.
- Thomas S. et al. Benefits of hyperspectral imaging for plant disease detection and plant protection: a technical perspective //Journal of Plant Diseases and Protection. – 2018. – Т. 125. – №. 1. – С. 5-20.
- Pineda M., Pérez-Bueno M. L., Barón M. Detection of bacterial infection in melon plants by classification methods based on imaging data //Frontiers in plant science. – 2018. – Т. 9. – С. 164.
- Simko I., Jimenez-Berni J. A., Sirault X. R. R. Phenomic approaches and tools for phytopathologists //Phytopathology. – 2017. – Т. 107. – №. 1. – С. 6-17.
- Mommaerts V., Smagghe G. Entomovectoring in plant protection //Arthropod-Plant Interactions. – 2011. – Т. 5. – №. 2. – С. 81-95.
- Abdulridha J., Batuman O., Ampatzidis Y. UAV-based remote sensing technique to detect citrus canker disease utilizing hyperspectral imaging and machine learning //Remote Sensing. – 2019. – Т. 11. – №. 11. – С. 1373.
- De Smet J. et al. Pseudomonas predators: understanding and exploiting phage–host interactions //Nature Reviews Microbiology. – 2017. – Т. 15. – №. 9. – С. 517.
- Morella N. M. et al. The impact of bacteriophages on phyllosphere bacterial abundance and composition //Molecular ecology. – 2018. – Т. 27. – №. 8. – С. 2025-2038.
