Титульный лист и исполнители
РЕФЕРАТ
Отчет 115 с., 3 ч., 12 табл., 24 рис., 269 источников литературы.
ВИНОГРАД, АБОРИГЕННЫЕ СОРТА, ДНК, ГИБРИДЫ, СЕЛЕКЦИЯ, ДНК-МАРКЕРЫ, ИНТРОДУЦИРОВАННЫЕ СОРТА, АБОРИГЕННЫЕ СОРТА, КЛОНЫ, МОБИЛЬНЫЕ ДНК-ЭЛЕМЕНТЫ.
Объект исследований – перспективные аборигенные и интродуцированные сорта и клоны винограда, отобранных в условиях Юга Российской Федерации и содержащихся в национальной ампелографической коллекции Анапской зональной опытной станции СКЗНИИСиВ.
В работе представлены результаты исследований молекулярно-генетического разнообразия аборигенных и иснтродуцированных сортов и клонов винограда, их филогенетические взаимоотношения, а также особенности распределения аллелей в популяциях и групп сортов виноргада; сделаны выводы о потенциальном родстве между изученными сортами, особенностями их генетических профилей; в результате были построены кластерные древа отображающие филогенетические взаимоотношения между изученными генотипами; в том числе, были построены координатные плоскости на основе генетической дистанции между образцами, которые также отображали их генетическое родство; по итогу, были сделаны предположения о происхождении некоторых сортов и их родстве.
Выявлены родственные взаимоотношения между аборигенными и интродуцированными сортами посредством сравнения их генетических профилей, а также кластеризации и распределении PCoA. Также, было проанализировано генетическое разнообразие внутри и между выбранными популяциями. Данные выводы могут быть использованы как при подборе пар для скрещивания с целью селекции новых высокопродуктивных и адаптивных сортов для выращивания на Юге Российской Федерации.
ВВЕДЕНИЕ
Культурный виноград (Vitis vinifera subsp. sativa D. C.) является одной из наиболее ценных плодово-ягодных культур в мире по экономической эффективности и площади выращивания. Литературные, археологические и палео-ботанические источники позволяют понять распространение виноградарства в Европе и, в частности, в Российской Федерации, начиная с территории Кавказа [1, 18].
Сорта винограда, которые возделываются веками в традиционных винодельческих регионах, все чаще заменяются более высокопродуктивными клонами. Генетическое разнообразие, накопившееся за столетия культивирования традиционных сортов, крайне важно для улучшения их генома. Аборигенные сорта, вытесняемые новыми, представляют собой огромный, еще не раскрытый пласт знаний и значительный источник ценных генов для селекционной науки. Поэтому так важна молекулярно-генетическая идентификация коллекции АЗОСВиВ (Анапская зональная опытная станция виноградарства и виноделия), позволяющая не только узнать ее биологическое разнообразие, но также установить сортосоответствие в сравнении с другими известными мировыми коллекциями. Описание аборигенных сортов винограда по широкому спектру генетических признаков позволит не только создать ДНК-паспорта генотипов, но и использовать эти данные для установления родственных связей между ними и при поисках их родителей, что станет неоценимой помощью селекционерам во время подбора родительских пар для скрещиваний.
Обширная исследовательская программа проводится во всех странах развитого виноградарства на распространенных известных сортах для отбора «чистокровных» высокоурожайных и высококачественных генотипов, обладающих различным спектром полезных для сельского хозяйства и востребованных потребителем признаков. И конечной целью проведения этих исследований является обеспечение материальной и теоретической базы для обоснования совершенствования клоновой селекции и повышения ее результативности [113, 229].
Как известно, с развитием молекулярной биологии возникла возможность ускорения селекционного процесса на базе использования молекулярно-генетических методов, в результате чего появилась маркерная селекция.
Сортовой состав популяций Краснодарского края и, в целом, Юга России крайне многообразен. Распространение современной методологии маркер опосредованной селекции выявило перспективность использования молекулярно-генетических методов анализа, что повысило ее эффективность, особенно после открытия наличия генов детерминирующих антоциановую окраску ягод винограда, набор которых не только специфичен для каждого сорта винограда, но и может отличаться по своему строению как от сорта
к сорту, так и от клона к клону.
Первые результаты по идентификации клонов молекулярными маркерами показали, что такие НИР ограничиваются лишь набором использованных локусов, в которые могут входить различные маркерные признаки, такие как, например, микросателлитные маркеры, iPBS-маркеры, IRAP, ISSR и пр. Таким образом, при использовании большого количества маркеров вероятность найти различающиеся аллели повышается [217, 218].
Целью исследования является молекулярно-генетический анализ особенностей строения геномов аборигенных и интродуцированных сортов винограда с использованием маркеров, основанных на присутствии ретротранспозонных последовательностей в ядерном геноме.
Для выполнения цели исследований были поставлены следующие задачи:
Сбор образцов планируется выполнять в несколько этапов на нескольких коллекциях: Ампелографическая коллекция АЗОС ВиВ и Ампелографическая коллекция Крымской ОСС. Помимо этого, коллекции АЗОС ВиВ
и Крымской ОСС находятся близко к предполагаемому месту проведения исследований, что дает возможность в случае необходимости повторить сбор образцов или заготовить черенки на проращивание. Также, на кафедре имеются Сосуд Дьюара, хладогенты и специальные ящики для транспортировки охлажденных образцов.
Пробоподготовка и выделение ДНК. Пробоподготовка образцов листьев к выделению ДНК будет проводиться путем высушивания их в лиофильной сушке Martin Christ BETA 2-8 LDplus, имеющейся на кафедре биотехнологии, биохимии и биофизики Кубанского ГАУ. Дробление высушенных листьев будет производиться на вибрационной мельнице GT200, которая также доступна на кафедре. Выделение ДНК из дробленых листьев будет осуществляться при помощи DNeasy Plant Mini Kit, так как для последующего ПЦР-анализа и секвенирования потребуется высокое качество образцов.
ПЦР анализ. Праймерные пары и параметры амплификации уже разработаны, стандартны для данного метода и доступны в открытых литературных источниках. Поэтому будет требоваться выполнить повторение стандартного набора методик предлагаемых к изучению образцов. При этом важно отметить, что авторы проекта имеют контакты со специалистами из Европейского Союза (ЕС), которые уже выполняли подобные работы и готовы оказать консультационную помощь не только на этом, но и последующих этапах выполнения проекта. Также на кафедре имеется все необходимое оборудование для выполнения госзадания.
Анализ полученных данных планируется проводить in silico с использованием программ: FAMD 1.14, GenAlEx 6.3, STRUCTURE и пр.
1 ОБЗОР СОСТОЯНИЯ ИЗУЧЕННОСТИ ВОПРОСА
1.1 Основы ДНК-маркирования генотипов винограда
Внутривидовая гибридизация применяется в течение многих веков. Результатами ее являются многие сорта сельскохозяйственных культур, в том числе винограда. Анализ литературных источников показывает, что полученные результаты в этом направлении, хотя и значительные, но не решают всех проблем виноградарской отрасли.
Основная причина невысокой эффективности селекции винограда – недостаток знаний о биологических особенностях сортов и генетически обусловленных механизмах передачи признаков и свойств потомству. Это, конечно, не означает, что возможности межсортовой гибридизации исчерпаны и что от нее следует отказаться, как от устаревшего и непродуктивного метода. В последнее время получено немало сортов, обладающих комплексом ценных свойств, которые были выделены методами как традиционной гибридизации, так и клоновой селекции, они регистрируются и обогащают промышленный сортимент [15, 24, 79, 91].
Генетическая изменчивость сортов винограда, выраженная в возникновении мутаций и неоднородности исходного материала, выражается в фенотипическом варьировании морфологических признаков, например, темпом роста, формирования органов, физиологических свойствах, изменяющих жизнеспособность организмов [45, 57, 76, 80]. Или фенотипически не выражается, например, в случаях изменения биохимических свойств, регулирующих синтез химических веществ [27, 40, 54]. Поэтому отбор можно вести по всем вышеперечисленным признакам и свойствам, особенно выделяя из них хозяйственно ценные. Однако морфологические, физиологические и биохимические признаки находятся в корреляции с генотипом и изменяются вместе с ним [25, 83, 88, 90]. Эти изменения могут быть вызваны влиянием каких-либо внешних условий, поэтому установить причину варьирования не всегда удается с достаточной точностью [32, 53, 75, 97]. Для этого необходимо использовать новые методы исследования сортов, такие как ДНК-маркирование [34, 56, 71]. В частности, направленных на идентификацию конкретных генов, несущих важное сельскохозяйственное значение.
ДНК-маркеры – характеристика генотипа, не зависящая от фенотипа, что обеспечивает богатство полиморфизмов, позволяющих идентифицировать сорта и строить точные генетические карты во многих высших растениях [22, 26, 48]. Высокое генетическое разнообразие у винограда, распространенного по всему миру, вызывает интерес к оценке генеалогии внутри рода Vitis, а также необходимость улучшения распознающих систем, пригодных для идентификации виноградных сортов [72, 98, 99]. Это поощряет попытки внедрения и использования данных о строении генов и генотипов в целом, из которых можно создавать сортовой резерв для улучшения существующего ампелографического разнообразия [8, 49, 78, 82, 188].
На данный момент, генетический резерв винограда – это смесь стародавних и недавно выведенных сортов [6, 18]. Перед тем как новые сорта полностью заменят старые, важно идентифицировать ценные древние генотипы и редкие формы. В настоящее время сорта идентифицируются различными молекулярными маркерами, такими как микросателлиты. Они представляют собой короткие последовательности ДНК, повторяющиеся несколько раз при каждом локусе. В связи с ошибками прочтения, полимеразы, во время репликации ДНК, создали множество аллелей, которые различны по длине из-за разного количества повторов последовательности. В растениях микросателлиты встречаются часто – один на каждые 1–2,4 тыс. нуклеотидов в таких видах, как арабидопсис, рис, соя, кукуруза и пшеница. Множество SSRs было обнаружено в винограде, а также выявлена высокая гетерозиготность, что повышает полиморфизм микросателлитных маркеров и ведет к решению многих проблем, связанных с клоновой и сортовой идентификацией, а также анализом генеалогии [42, 43, 44, 269].
Молекулярные маркеры имеют огромный потенциал по поиску генетических различий между генотипами и определению разнообразия между клонами. Среди молекулярных маркеров, SSR-маркеры являются наиболее подходящими из-за их кодоминантности, огромного числа повторов и высокой частоты в селективно нейтральной области. Высоко насыщенные карты сцепления на основе одних только микросателлитных маркеров, а также их совместное использование с другими типами маркеров доступных в винограде. Микросателлитные маркеры оказались полезными для установления «личности» генотипов, фингерпринтинга и анализа разнообразия подвоев
и сортов, а также межвидовых гибридов [158, 173].
В последние годы создание ДНК-отпечатков показало себя очень полезным для картирования геномов и изучения биоразнообразия. Достаточно высокий полиморфизм позволяет получать большое разнообразие генетических «отпечатков» при известном наборе генетических маркеров. Они доказали свое преимущество перед биохимическими и фенотипическими маркерами, которые имеют низкую величину полиморфизма. В основном, ДНК методы основаны на обнаружении полиморфных геномных последовательностей для внутренних сайтов рестрикции путем гибридизации клонированных зондов
с ДНК. Например, длина полиморфных рестрикционных фрагментов (AFLP), случайно амплифицированная полиморфная ДНК (RAPD) или амплификация между простыми повторами последовательностей или микросателитов (SSR). Метод амплификации полиморфных фрагментов опирается на полиморфизм в сайтах узнавания для ферментов рестрикции, но с начала использования праймеров есть необходимость в анализе последовательности ДНК для обнаружения полиморфизмов.
1.2 Методы исследования полиморфизма ДНК
На сегодняшний день существует огромное количество методов исследования ДНК. Каждый из них предоставляет большое количество возможностей получить ответы на бесконечное количество вопросов. В данном разделе диссертации мы рассмотрим только те, которые использовались в процессе работы по исследованию полиморфизма генетических ресурсов винограда.
Наиболее простой способ выделения ДНК СТАБ-методом был описан еще в 1994 г. в статье Л. Муххамад с соавторами – «Простой и эффективный способ для выделения ДНК из виноградных растений» [194].
Развитие методов потребовало более «чистую» ДНК. Приведенный ниже метод выделения дает достаточно большой «урожай» ДНК, но имеющей примеси-загрязнители [213, 252]. Поэтому при дальнейшей работе этот метод был улучшен применением бета-меркаптоэтанола и поливинилпропиллидона, которые позволяют для очистки ДНК от фенольных соединений и соединений ДНК с сахаридами [108, 159, 160]. Такой метод называют «модифицированным СТАБ-методом». Он позволяет выделять ДНК не только из свежих листьев, но и из гербарных и мумифицированных, т. е. дает возможность изучать очень старые препараты листьев, что крайне важно при изучении происхождения видов и филогенеза [30, 31, 165].
Наличие загрязнителей сильно влияет на использование ДНК в исследованиях из-за ингибирования процесса реакции в целом и снижения активности Taq-полимеразы, а также из-за плохой очистки ДНК может меньше храниться из-за нестабильности. Поэтому так важно не только выделить большое количество ДНК, но и правильно и хорошо ее очистить [129, 181, 228].
В статьях, приведенных выше, описывается метод, дающий высокое количество чистой ДНК, которая долго хранится, но этот способ выделения имеет ряд отрицательных факторов. Во-первых, тратится много времени, во-вторых, используемые вещества, такие как хлороформ, изоамиловый спирт, бета-меркаптоэтанол являются крайне вредными для организма человека.
Такие чувства, как страх за свое здоровье, желание сделать больше за одинаковое количество времени, создали наборы для выделения нуклеиновых кислот различными методами. В настоящее время это направление активно развивается, создаются «наборы», позволяющие делать больше, быстрее и безопаснее, что сказывается не только на здоровье и работоспособности рабочих, но и на финансовом положении лаборатории, так как исключаются затраты на защитное снаряжение лаборантов.
К примеру, выделение ДНК с использованием PeqGOLD PLANT DNA mini KIT – это дорогой, но очень эффективный способ выделения и очистки ДНК. Если при использовании вышеописанных методик медленно, но верно выделялось 12 образцов, то при применении данного набора и двух центрифуг выделялось 24 биотипа сразу [55, 182].
ПЦР – полимеразная цепная реакция. Этот этап был разработан Кэри Мюллисом, за что в 1993 г. он был удостоен Нобелевской премии по химии [215].
Следует упомянуть, что для более эффективной работы разработаны наборы и для ПЦР-реакций, тот же Peqlab-Kit. Результатом этого явилась унификация параметров реакции, так теперь не надо подбирать для каждого праймера свою температуру отжига [207]. Тем не менее, данный набор удобно использовать при мультиплексной ПЦР, когда применяется большое число ДНК-маркеров одновременно. В случае же, когда используются маркеры на конкретные генетические признаки, применяются специализированные под каждый маркер параметры, а они, в свою очередь, применяются отдельно друг от друга.
На сегодня разработано огромное количество праймеров, используемых в работе. Они применяются как для генотипирования различных участков ДНК, как связанных, так и не связанных с кодирующими последовательностями. И, конечно же, разработаны маркеры, помогающие идентифицировать гены устойчивости к вредителям и болезням, которые обычно имеются не только в литературных источниках, но и в базах данных [197, 235].
Как уже было сказано, для большего упрощения и убыстрения работы были разработаны мультиплексы – подборка групп праймеров, гибридизирующихся с цепью исследуемой ДНК одновременно. Их подбирают таким образом, чтобы размер получаемых амплифицированных аллелей не перекрывал друг друга. Это крайне важно при анализе, дабы не возникло путаницы при дифференциации продуктов амплификации. При использовании мультиплексов в гель-электрофорезе используют Touch Down PCR. Это такая разновидность полимеразной цепной реакции, где в первых циклах температура отжига праймера выше необходимой, а в последующих она снижается до оптимальной. Таким образом, убираются неспецифичные элементы отжига, мешающие различать продукты амплификации. Следует заметить, что
в капиллярном электрофорезе аллели могут накладываться друг на друга, но при отображении в программе GeneMapper прекрасно различимы по цветам, поэтому они могут применяться вместе [183].
Существует много видов ПЦР-реакции. На мой взгляд, следует обратить внимание на ПЦР в реальном времени. Это далеко не дешевый метод, но он позволяет определить, где и сколько ПЦР продукта амплифицировалось, что избавляет от проверки наличия результатов на любом электрофорезе.
В данном методе используют флюоресцентно-меченые праймеры или ДНК-зонды. Также используется краситель SybrGreen 1, он обеспечивает достаточно простой и экономичный способ детекции, без необходимости применения зондов или специальных праймеров [183].
Очень важно, что qPCR (количественная ПЦР) можно комбинировать
с ОТ-ПЦР (обратно-транскрипционная ПЦР) для измерения малых количеств мРНК, что позволяет исследовать количественную информацию о содержании мРНК в клетке и, следовательно, позволяет судить о величине экспрессии гена в клетке или ткани.
Все полученные данные выводятся на экран компьютера и обрабатываются в реальном времени.
После амплификации следует визуализировать полученные ПЦР-продукты.
Визуализация результатов ПЦР. Как экспериментальный метод электрофорез был разработан отечественными учеными, профессорами Московского университета П. И. Стаховым и Ф. Ф. Рейссом в 1809 г.
На данный момент существует большое количество публикаций, описывающих или конкретно электрофорез в полиакриламидном геле или же статьи, повествующие о работах, в которых гель-электрофорез применялся как основной метод разделения продуктов амплификации или же белков [125, 177, 250].
Самый распространенный в мире метод оценки длины амплифицированных фрагментов – это электрофорез в полиакриламидном геле. Но с этим методом связано большое количество проблем и трудностей в использовании. Например, плохая полимеризация акриламидного геля, когда с виду он без изъянов, а после просвечивания ультрафиолетом оказывается, что образцы уползли в край спейсера. Также возможно, что ДНК просто растеклась по акриламиду во время вымачивания в растворе бромистого этидия. Или же произошло отключение электроэнергии и после четырех часов электрофореза, оказывается, что все образцы выстроились в одну линию, где невозможно что-либо идентифицировать [33, 36].
В 1960-х годах был предложен метод секвенирования биополимеров – установление их нуклеотидной или аминокислотной последовательности.
В результате чего получают строение первичной структуры молекулы. Обычно, размеры секвенируемых участков ДНК 100 пар нуклеотидов (при использовании методов next-generation sequencing) и 1000 пар (при секвенировании по Сенгеру). В итоге получают последовательности участков генов, всю мРНК и даже целые геномы [2].
При секвенировании обычно применяют методы Эдмана, Сэнгера и др. До начала сиквенса производят амплификацию участка ДНК при помощи ПЦР, последовательность которого нужно установить.
Метод определения первичной последовательности пептидов разработан в 1950–1956 гг. Виктором Эдманом. Обрабатывается исследуемый пептид специальным набором реагентов, это приводит к отщеплению одной аминокислоты с N-конца. Циклическое повторение реакции и анализ получаемой информации дают знания об исследуемом пептиде. В настоящее время он практически не применяется из-за неколичественного протекания реакции
и побочных продуктов [62].
Другой метод секвенирования был открыт Фредериком Сенгером в 1977 г., за что он был удостоен Нобелевской премии по химии в 1980 г. Также метод известен как «метод обрыва цепи». Принцип метода заключается в том, что одна из цепочек ДНК является матрицей для синтеза второй [224].
Капиллярный электрофорез. Если в вышеописанных методах разделение происходит в полиакриламидной пластине, то здесь уже происходит разделение ионов по заряду, в тонком капилляре, заполненном электролитом.
Детектирование с помощью флуоресценции используют для образцов, имеющих собственную флуоресценцию или же модифицированных химическими метками. Данный способ обеспечивает высокую чувствительность. Также используют детектирование флуоресценции, вызванное лазером, подобные системы могут детектировать в пределах 10–18–10–21 моль [230]. При этом важно сказать, что именно данный метод обычно и используется для таргетного секвенирования выбранных участков геномов, полученных в результате амплификации с ДНК-маркерами, при использовании прямого и обратного праймеров.
1.3 Ампело-генетический анализ сортов и клонов винограда
Комбинированные маркерные системы являются отличными дескрипторами, описывающими сорта винограда. Использование их совместно с фенотипическими характеристиками дает наиболее полную картину о состоянии совокупности внешних и внутренних признаков виноградной лозы.
В настоящее время изучение генофонда и фенотипического разнообразия винограда – приоритетная цель для ученых многих стран мира. Этот процесс происходит по признакам, принятым на вооружение под эгидой Международной организации винограда и вина. По большей части, это фенотипические признаки, такие как окраска и форма ягод, цвет и вкус вина, наличие антоциана, биохимические свойства, но большинство исследователей склоняются к тому, что следует использовать молекулярно-генетические маркеры, которые способны не только выявить отличия, но и показать скрытый потенциал у гетерозиготных особей.
В целом и частности, проблема дифференциации сортов и клонов винограда, отбор протоклонов и выделение из них самостоятельных сортов существует давно.
В практике виноградарства известны случаи изменчивости отдельных свойств и признаков. Древнеримские ученые Палладий и Колумелла, наблюдая такие факты, советовали использовать их в практически полезных для человека целях. Колумелла, например, писал, что следует черенковать и использовать в производстве самые их плодородные части. Использовать клоновую селекцию советовали такие виноградари Швейцарии, Германии
и Франции как Казенава, Гюйо, Каррьер, Сарториус, Мюллер-Тургау.
В нашей стране основоположниками ее были С. А. Мельник, А. С. Мержаниан, М. П. Цебрия и др. Настойчиво рекомендовал применять отбор наиболее продуктивных растений И. В. Мичурин: «Тщательной селекцией (отбором) черенков, повторением отводки лучших частей лозы, сравнительно короткой обрезкой и посадкой на лучшую почву следует способствовать развитию лучших качеств» – писал он [12].
На данный момент, клоновой селекции винограда посвящено множество работ, признанных мировой научной элитой. Если говорить в целом, то работа по дифференциации клонов винограда включает в себя изучение фенотипической и генотипической изменчивости. И, как известно, иногда бывает, что фенотипа недостаточно, чтобы отличить сорта, тогда на помощь приходят молекулярно-генетические маркеры [26, 35, 46, 65].
В нашей стране методология проведения клоновой селекции винограда разработана профессором А. С. Мержанианом. На основании многолетних опытов и литературных данных о сортах Каберне-Совиньон, Рислинг, Алиготе, он пришел к выводу, что отбор клонов надо вести учитывая соотношение хозяйственно-ценных и морфологических признаков [63, 87]. Их он разделил на три группы: мутации, модификации (не передаются вегетативному потомству) и длительные модификации (передаются вегетативному потомству). Далее этот метод был улучшен применением использования многомерного статистического анализа и технологии in vitro, что позволило поднять результативность клоновой селекции [85, 89].
Наиболее традиционным считается метод оценки полиморфизма по морфологическим признакам листьев среднего яруса кроны [19, 20]. В ампелографии полиморфизм – это явление биоразнообразия, одновременное существование нескольких форм растений, отличающихся друг от друга генотипически и фенотипически и, таким образом, наличие клоновой изменчивости [1, 9, 10]. Гетерогенный полиморфизм сортов и клонов имеет большое практическое применение, так как они обеспечивают высокую экономическую отдачу при правильном их использовании. И ранее уже проводились исследования различных групп фенотипов сортов Пино и Рислинг (Л. П. Трошин, Е. В. Луценко, П. П. Подваленко, А. С. Звягин), показано различие фенотипов групп винограда 231 учетного куста по 10 листовым признакам [81]. Помимо этого, также была проведена оценка полиморфизма сортогруппы Мерло (Л. Трошин,
А. Звягин, Д. Сидоренко) на базе учебного хозяйства «Кубань» Кубанского ГАУ. В процессе работы авторами установлено, что суммарно незначительное отличие по каждому признаку, в комплексном анализе дает достаточно большую разницу при отборе клонов [84. Таким образом, это позволило отобрать протоклоны сортов для дальнейшего исследования. В целом, как в нашей, так и в других странах, этому направлению исследований отводятся отдельные темы научно-исследовательских работ [135, 255, 267].
Появление ДНК-маркеров произвело взрыв в клоновой селекции. Возможности ДНК-фингерпринтинга практически безграничны, они позволяют не только отличить друг от друга виноградные растения по каким-либо признакам, будь то гены или микросателлитные последовательности, но и создавать эталоны, с которыми можно сравнивать новые сорта и клоны.
Высокая изменчивость и генов и микросателлитных последовательностей дает возможность дифференцировать клоны внутри популяции [111, 164]. Применение этого метода привело к ускорению селекционного процесса. Вместе с идентификацией фенотипа этот метод дает огромное преимущество [187, 232, 241]. Например, описанным способом шестьдесят два иранских сорта были проанализированы по девяти микросателлитным маркерам. Было обнаружено наличие от 4 до 16 аллелей на локус в группах генотипов. Фенограммы, созданные для поиска различий среди сортов и клонов выделили три группы, в которые были собраны все выбранные образцы. Среди иранских столовых сортов были обнаружены синонимы и омонимы [148].
В северо-западной части Испании, на астурианских виноградниках, выращивается много автохтонных сортов винограда. В связи со старостью виноградников, они характеризуются сортосмесью. С целью различения этих сортов и отбора перспективных протоклонов винограда, были проведены исследования по генотипированию 62 клонов виноградной лозы. По итогам отбора 62 генотипа были введены в селекционный процесс [186].
Достаточно большая работа была проведена Министерством сельского хозяйства США по генотипированию 3600 генотипов 35 видов винограда. Для исследования использовали 550 праймерных комбинаций. Было обнаружено от 16 до 38 различных аллелей на локус. Отсутствие аллелей не было обнаружено. В результате исследования были созданы ДНК-паспорта выбранных клонов, также обнаружены два сорта, показавшие одинаковые аллели, а также выявлена высокая полезность SSR маркирования для винограда [259].
Созданы карты сцепления признаков при помощи SSR и SNP маркеров основных популяций винограда, таких как Сирах, Пино нуар, Гренаш, Каберне-Совиньон и Рислинг. В общей сложности для создания карты было использовано 1134 молекулярных маркера. Данные карты могут служить отличным инструментом в селекции виноградной лозы [229].
В Хорватии проводится постоянная работа по выведению новых сортов и отбору протоклонов из старых образцов. Так, в соответствии с международной программой GrapeGen 06 на факультете агрономии в университете Загреба при помощи совместных методов фенотипического и генотипического анализа уже отобрано 100 сортов. Была запущена не только клоновая селекция по отбору продуктивных клонов, но и фитосанитарная селекция наиболее устойчивых сортов к вредителям и болезням [206].
В Турции ведется активная работа по генотипированию сортов и клонов винограда. Например, 23 гибрида были отобраны для селекции по их сортовым характеристикам. Их исследовали в два этапа: по морфо-физиологическим и генетическим параметрам. Фенотипирование проводили в соответствии со стандартной методикой OIV. В генотипировании использовали
20 микросателлитных маркеров, которые показали размер аллелей от 88 до 294 пар оснований [110].
Также странами-участницами программы GeneRes являются Молдова
и Румыния. В их задачу входит изучение сортов винограда бассейна Черного моря. Данная программа финансируется не только Европейским союзом, но
и персонально правительством Люксембурга, что подчеркивает ее значимость для мирового научного сообщества [184].
В Республике Словения широко выращивают технические сорта винограда. Более 50 редких традиционных сортов используется в производстве. Методика их сохранности как генотипов, а также идентификация их по внешним и внутренним признакам была разработана на факультете биотехнологии Университета Любляна [223].
Наука не стоит на месте и поэтому произошло создание так называемых REMAP и IRAP техник для картирования генома винограда с помощью ретротранспозонных и интро-SSR маркеров. Данные методы показывают еще большую вариабельность признаков не только между клоном и контролем, но и между клонами в популяции. Это позволяет поднять на новый уровень клоновую селекцию. Совместное использование этой техники с ампелографическими данными и SSR-маркерами, позволяет получить наиболее полное представление об изучаемом клоне [114, 172, 225].
Мобильные генетические элементы были найдены почти во всех живых организмах в гетеро- и эухроматиновых областях генома. Последствия движения этих элементов в геноме может спровоцировать расширение повторяющихся некодирующих регионов, нарушение функции гена дикого типа, ведущее к статусу псевдогена, модифицирование гена функционирования, что приводит к искажению выбираемых фенотипов и хромосомным перестройкам, приводящим к видообразованию [124, 173]. В европейском винограде наиболее известны три таких элемента Gret-1, Tvv-1 и Vine-1. Интересно, что Gret-1 и Vine-1 впервые были определены по их вставкам в регуляторные последовательности функциональных генов. В настоящее время только Gret-1 был полностью секвенирован, а также раскрыта его связь с мутациями, в результате чего в темно окрашенных сортах появляются светло окрашенные ягоды из-за его включения в промоутер VvMybA1 транскрипционного фактора, управляющего биосинтезом антоцианов в процессе созревания винограда [112, 118, 191].
Ретротранспозоны – это главные двигатели генетического разнообразия и инструменты для обнаружения изменений в геноме, возникших под их влиянием. После демонстрации того, что они часто встречаются в растительных кариотипах, были созданы различные маркерные системы для детекции полиморфизма, вызванного ими, а также анализа генетического разнообразия
в популяциях [170].
Ретротранспозоны являются основным агентом эволюции генома. Были разработаны различные системы молекулярных маркеров, которые используют метод анализа этих генетических элементов и их стабильную интеграцию в дисперсные хромосомные локусы, которые полиморфны внутри каждого вида. Ключевыми методами SSAP, IRAP, REMAP, RBIP и ISBP обнаруживают сайты, в которых ретротранспозоны ДНК сохраняются между семьями элементов, интегрированых в геном. Маркерные системы, использующие эти методы, могут быть легко разработаны и применимы
в отсутствии обширных данных о последовательностях генома. Они предлагают доступ к динамическим и полиморфным частям генома и дополняют методы, такие как SNPs, которые нацелены, в первую очередь, на разделение генов [227].
Ретротранспозоны могут быть использованы в качестве маркеров, потому что их интеграция создает новые соединения между геномной ДНК и их консервативными концами. Для обнаружения полиморфизмов вставки ретротранспозона маркерные системы обычно полагаются на ПЦР-амплификации между этими концами и некоторые фланговые компоненты геномной ДНК.
В связи с этим были разработаны два метода: анализ ретротранспозона-микросателлит (REMAP) и внутренний полиморфизм ретротранспозона (IRAP), которые не требуют рестрикции ферментами. IRAP продукты, полученные от двух близлежащих ретротранспозонов, используются для амплификации последовательностей, стоящих перед праймерами. В REMAP амплификация между ретротранспозонными последовательностями простых повторов (микросателлитов) производит маркерные полосы [171, 172, 174].
В Испании были исследованы клоны сорта Темпоранилло с совместным использованием микросателлитных и ретротранспозонных маркеров. Всего было описано 28 клонов, из которых только один смог пройти отбор по генетическим маркерам. Учитывая, что в исследовании использовался всего один ретротранспозонный маркер, можно сделать вывод о их высоком полиморфизме [126, 257, 260, 263].
В Японии было проведено исследование по изучению влияния ретротранспозонов на окраску кожицы ягод винограда. По результатам был сделан вывод, что мутации в изменении окраски ягод могут быть вызваны ретротранспозонами, что было подтверждено молекулярно-генетическими исследованиями с применением маркеров на гены VvmybA1 и VlmybA1-1 [179]. Окраска ягоды является одной из самых главных характеристик сортов винограда. Это морфологическое свойство различает сорта друг от друга в момент полной зрелости [127, 254, 256]. Дополнение формы листа, грозди и окраски побега может быть достаточно, чтобы идентифицировать сорт [117, 233]. Сорта с окрашенной ягодой содержат антоцианы в эпидермисе. Количество и концентрация красящего вещества определяет их типичную окраску. VvmybA1 (Myb-связанный транскрипционный фактор) регулирует синтез антоцианов
и экспрессию гена, ответственного за окраску ягоды [243, 245, 246]. Наличие ретротранспозона Gret-1 рядом с кодирующей последовательностью блокирует его экспрессию, вызывая осветление окраски кожицы [221, 239, 242].
В Италии были описаны 62 сорта по 30 SSR и 4 REMAP и 1 IRAP маркерам. В результате выявили 58 маркер-специфичных аллелей, 22 генотип-специфичные аллели и четыре REMAP и IRAP частных аллели [264]. После чего в выборке сортов были найдены синонимы и омонимы. Также был сделан вывод, что совместное использование различных маркеров показывает себя наиболее эффективно и делает идентификацию генотипов наиболее легкой [265, 266, 268].
1.4 Анализ генетического разнообразия сортов и клонов винограда с использованием ретротранспозонных маркеров
Аборигенные сорта винограда – это те сорта, которые произошли от диких видов, произрастающих на конкретной местности [37]. Эти сорта отличаются довольно высокой стойкостью к неблагоприятным климатическим явлениям, способны выдерживать тяжелые природные условия. Аборигенные сорта V. vinifera являются одними из самых ценных на передовых винодельческих производствах [39]. Именно они позволяют получить вино высочайшего качества, которое будет востребовано у потребителя [58, 102]. Однако, аборигенный виноград сложен в выращивании, так как не обладает устойчивость к таким обыденным заболеваниям, как, например, оидиум и милдью. Это является отягощающим фактором в процессе возделывания, так как требует постоянной борьбы путем обработки фунгицидами, что влечет за собой дополнительные статьи денежных расходов, а также времени и человеческих ресурсов [61]. Именно поэтому в современном виноградарстве ценятся сорта, обладающие в оптимальном соотношении устойчивостью к грибковым, и не только, заболеваниям и урожайностью. Селекционная работа должна вестись именно по этому направлению. Новые сорта должны обладать не менее качественным урожаем, однако превосходить родителей по устойчивости к заболеваниям. Аборигенные сорта – это основа данного направления селекции, потому что, как было сказано ранее, именно они обладают высококачественным ценным урожаем, и работать необходимо непосредственно с ними.
Начало любой селекционной работы – анализ материала, с которым предстоит работать. Существует множество методов для подобных исследований. К ним относятся отбор по морфологическим и биологическим признакам в селекционном фонде, методы иммунологической оценки гибридного потенциала, физиологические методы, цито-эмбриологическая оценка селекционного материала, химико-технологическая оценка плодов, анатомо-морфологическая оценка адаптивного потенциала сортов [17]. Однако для того, чтобы селекционная работа была рациональная и желаемый результат был достигнут с наименьшими потерями, необходимо внимательно изучать исходные генетические данные. Поэтому, помимо всех перечисленных, существует еще и генетический анализ материала. Изучение ДНК – наиболее современный, и, что самое важное – очень информативный метод исследований. Именно этот метод дает наиболее полное представление обо всех генетических предрасположенностях любого организма, а также о том, каким потенциалом обладают сорта, с которыми предстоит работать, и предоставляет возможность производить отбор родительских пар более корректно.
Сам генетический анализ проводится с использованием молекулярных ДНК-маркеров. Он необходим для того, чтобы иметь возможность установления ассоциативных взаимосвязей, которые, в свою очередь, нужны для осуществления целенаправленной идентификации и локализации генов или локусов хромосом, определяющих хозяйственно ценные признаки у растений [106]. Молекулярные маркеры, чаще всего применяемые в исследованиях, очень сильно варьируют в своем строении и назначении, например, Restriction fragment length polymorphism (RFLP) [137], Variable Number Tandem Repeat (VNTR) [169], Simple Sequence Repeats (SSR) [73], Random Amplified Polymorphic DNA (RAPD) [16, 261], inter PBS amplification (iPBS) [167] и многие другие.
Как известно, виноград – одна из самых популярных по возделыванию культур во всем мире и на Юге России, в частности, так как данный вид поставляет исходное сырье для многих продуктов и напитков, без которых на сегодняшний день невозможно представить жизнь ни одного человека. Плоды винограда культурного потребляются как в свежем, так и в сушеном виде, а также являются исходным продуктом в приготовлении различных алкогольных и безалкогольных напитков. Широкий спектр применения плодов этого вида обусловил и высокое разнообразие сортов, которым сейчас располагают производители. Несмотря на то, что спрос на продукцию с каждым годом только увеличивается, удовлетворять потребности потребителя становится все сложнее. Здесь важнейшую роль начинает играть селекция, способная создать абсолютно новые, ранее не существовавшие сорта, отвечающие необходимым требованиям [93].
И очевидным является то, что для того чтобы создать новый сорт за основу необходимо взять уже существующие, и обладающие нужными свойствами сорта. В свою очередь, для того, чтобы заранее знать, каким потенциалом обладают исходные сорта, их исследуют различными способами, два основных из которых – фенотипирование и генотипирование. Фенотипирование проводится на основе наблюдений различных внешних признаков,
и является важным и перспективным направлением [96], однако оно не способно дать тот объем информации, который ученые получают с помощью генетических анализов [67]. И такие признаки исследуются при помощи молекулярно-генетических маркеров [41].
Таким образом, для дальнейшего применения генетического материала
в селекции очень важным является его изучение с использованием ДНК-маркеров [95]. Это позволит быстрее расширить область знаний о генетическом материале сортов, являющихся перспективными для селекции. Современный этап развития селекции винограда в мире невозможно представить отдельно от использования генетического анализа исходного материала, имеющегося у селекционеров.
Между тем, создание устойчивых сортов винограда, способных производить высококачественный урожай в больших объемах – главнейшая задача современного виноградарства [65, 70]. В результате изучения имеющихся генетических ресурсов, с каждым годом количество информации о биологическом разнообразии увеличивается, что дает широкий простор в процессе создания новых гибридных форм, отличающихся от родителей наличием или более сильным проявлением ценных и редких признаков.
Понимание того, насколько один генотип схож по своей структуре
с другим, сильно упрощает задачу селекционеру, так как дает представление о потенциально перспективных парах для скрещивания. С этой целью
и необходимо пополнять знания о генетическом разнообразии сортов винограда и изучать ресурсы ампелографических коллекций, с привлечением различного рода молекулярных маркеров [3, 68, 50, 51].
Сохранение мирового биологического разнообразия – одна из наиболее важных задач сельскохозяйственной науки сегодняшнего дня [236, 244]. Это касается любой сельскохозяйственной культуры, но особенно остро данная задача стоит для тех культур, селекция и использование которых происходят наиболее активно. К такой культуре относится Vitis vinifera L. – виноград культурный.
В последние годы этот вопрос встает особенно остро, так как ускоренными темпами возрастает потребление природных ресурсов, восстановление которых занимает намного большее время, чем их использование [210]. Биоразнообразие планеты не успевает восстанавливаться, и, если не предпринимать соответствующие меры, велика вероятность того, что большая часть полезных растений, существующих сегодня, будет утрачена в ближайшие годы. Такой исход категорически нельзя допускать, ведь на смену сегодняшнего человечества придет новое поколение людей, также нуждающихся в улучшенных и более продуктивных сельскохозяйственных растениях [66]. А это означает, что необходимо сохранять, изучать и структурировать то, чем мы располагаем сейчас [7, 21].
Как известно, данная проблема является общей вне зависимости от страны и имеющегося биоразнообразия и для того, чтобы ее решить, следует заниматься отдельными региональными вопросами изучения и сохранения биоразнообразия [21, 60]. Таким образом, необходимо предпринимать шаги для ее решения в каждом отдельно взятом регионе, учитывая его особенности [134]. Именно поэтому изучение локального биоразнообразия, например, аборигенных и интродуцированных сортов винограда Юга России – важная составляющая часть в изучении биоразнообразия мира.
Изучение генетического разнообразия любых сельскохозяйственных растений является неотъемлемой частью современной селекционной работы и является важной ее частью [47, 101], в том числе это справедливо и для винограда [240]. Это позволяет селекционерам получать наиболее точные сведения об организмах, работу с которыми предстоит вести, а именно об их наследственных особенностях и наличии ценных генов для сельского хозяйства, и, как следствие, наиболее корректно производить подбор родительских пар при гибридизации, с целью получить максимально качественный результат [59, 64, 94]. В свою очередь, такой подход обеспечивает минимальные затраты времени и средств, что положительно сказывается на производительности и эффективности [38, 92]. Вышесказанное характерно для любой отрасли сельского хозяйства, включая одну из наиболее важных и интересующих производителей и потребителей – виноградарство и виноделие. И, как известно, виноград культурный – одна из самых популярных культур практически в любой стране мира. Его важность для мировой экономики можно легко объяснить широким спектром использования: употребление в пищу в свежем и высушенном виде, приготовление соков и нектаров, и, что является немаловажным – изготовление различных вин. Данная отрасль интересна своей широкой вариабельностью в применении ее продуктов. Например, из получаемого сырья производится большое количество безалкогольной и алкогольной продукции – соки, нектары, вино – которое и является, по большей мере основной целью виноградарства в целом [13, 14].
Однако, помимо технических сортов, используемых для производства, существуют также и столовые сорта, обеспечивающие население свежими ягодами и сухофруктами. Тем не менее, в том и другом случае, важную роль играет исходное растение, с которого получены ягоды. В частности, полученный от растения урожай должен соответствовать высоким требованиям качества и быть конкурентоспособным, что дает возможность получать хорошее сырье [5, 100, 105]. Это, в свою очередь, обеспечивают селекционеры, выводя новые сорта, ориентируясь на требование потребителя. Чтобы успевать за короткий промежуток времени создавать новые сорта, важно изначально, еще до проведения скрещивания, наверняка знать, какой результат может быть достигнут и по средствам подбора каких родительских пар [103]. Эту возможность предоставляет изучение уже имеющихся завезенных и аборигенных генетических ресурсов.
Изучение генетического разнообразия происходит с помощью молекулярно-генетических маркеров. Существует множество разнообразных маркерных систем, однако оптимальными характеристиками для проведения генотипирования как сортов, так и клонов различных видов растений обладают iPBS маркеры, что подтверждают проведенные исследования [193]. Эти маркеры являются универсальными и могут использоваться как для генотипирования винограда [192], так и для изучения других культур, например, абрикоса [248], гуавы [144], турецкого лавра [147] и т. д. Кроме того, iPBS маркеры могут использоваться даже при генотипировании видов, для которых отсутствуют собственные молекулярные маркеры [247]. Помимо всего вышесказанного, молекулярные маркеры iPBS дают возможность не только изучать сорта, но и различать между собой клоны [150, 201].
Как известно, виноградное растение может заражаться множеством болезней и имеет достаточно большое количество поражающих его вредителей. Так, наиболее распространенными грибными заболеваниями у винограда являются такие как милдью (Plasmopara viticola Berl. Et de Toni), серая гниль (Botrytis cinerea Pers.) и оидиум (Uncinula necator Burr.) [121, 138, 141]. В то время как основными вредителями считаются клещи, листовертки, мраморный хрущ и др. [122, 176, 208]. В сумме такие заболевания зачастую приводят к достаточно большим потерям урожая, поражая листья, стебли и корни растений [116, 163, 214]. Но, среди них, конечно же, особое место занимает опаснейший вредитель – филлоксера (Viteus vitifolii Shimer), уничтожающая виноградное растение целиком, в отличие от грибных болезней, которые
в отдельные годы могут уничтожить значительную часть урожая [115, 139].
Тем не менее, известно, что в Северной Америке филлоксера, как вредитель, сожительствовала с местными видами, задолго до ее появления в Европе [216]. Таким образом, американским видам винограда, которые уже очень давно сожительствуют с данным вредителем, свойственно быть толерантными присутствию филлоксеры [200, 209, 258]. В Европе же на виноградниках были достаточно благоприятные условия для ее развития, неся в дальнейшем огромные бедствия виноградарям [29, 220, 253]. Так, ученые путем применения знаний и опыта пришли к некоторым решениям дальнейшего ведения виноградарства и одно из них – это восстановление погибших ценнейших виноградников прививкой на американские подвои [211].
Поэтому, использование устойчивых подвоев стало основной стратегией в борьбе с филлоксерой в виноградарстве. Так, в Краснодарском крае посадка большинства виноградников осуществляется с помощью привитых саженцев [52]. Тем не менее, селекция подвойных сортов винограда также не стоит на месте, равно как и привойных. В настоящее время все сорта подвоев по своему происхождению подразделяются на четыре группы: 1) чистые виды или естественные гибриды (Рипариа Глуар де Монпелье, Рупестрис дю Ло, Рипариа гран глабр, Рупестрис Брюнье, Рупестрис Мартен, Берландиери Рессегье №1 и др.); 2) гибриды межамериканских видов (Рипариа × Рупестрис 101-14, 3306, 3309, Берландиери × Рипариа Кобер 5ББ, СО4, Кречунел-2
и др.); 3) гибриды американских видов с европейскими (Шасла × Берландиери 41-Б, Феркаль, Мурведер × Рупестрис 1202, Арамон × Рупестрис Ганзен №1 и др.); 4) гибриды американских и европейских видов с лабруской (Vitis labrusca L.) [161, 178, 226]. В виноградном питомниководстве России, в основном, используются подвои второй и третьей групп [4, 28]. Однако все они имеют свои особенности выращивания и формирования куста, в связи с чем селекция и пополнение сортового разнообразия должны продолжаться [23, 74]. Поэтому молекулярно-генетическая идентификация является и здесь необходимой частью исследований, равно как и паспортизация подвойных сортов с целью использования этих результатов в дальнейшем селекционном улучшении подвойных сортов.
Благодаря комфортному для культуры климату и подходящему составу почв юг России, и, в частности, Краснодарский край, является одним из лучших мест для выращивания винограда. Около 60 % всего винограда России выращивается на Кубани [69, 77, 104]. Ценность культуры и постоянно растущий и, конечно же, меняющийся спрос у потребителей, требует непрерывной работы над созданием новых сортов более устойчивых к воздействию внешней среды и с улучшенными вкусовыми качествами. Для этого необходимо как использовать в селекции стародавние сорта винограда, так и изучать и разводить те сорта винограда, которые уже зарекомендовали себя как эффективные [1, 85, 86].
Конечно, в современной селекции существуют различные пути улучшения культуры, такие как традиционная селекция и отбор лучших гибридов, так и генетическое модифицирование отдельных особей, а также клоновая селекция. Если же обычная селекция основывается на скрещивании, то основой клоновой селекции является спонтанная мутация. Мутантные особи
в процессе размножения становятся родоначальниками клонов – материалом, с которым потом уже работают селекционеры [11, 85]. Тем не менее, любая селекционная работа начинается именно с изучения имеющегося генетического материала.
В целом, генетические ресурсы растений – это самое ценное, что у нас есть для нужд селекции и питания человека [142]. Очевидно, что кормление населения мира – это глобальная задача, которую необходимо решать каждый год, учитывая не только потребление энергии, но и потребности в витаминах [212]. Широко известно, что существуют различные распространенные культурные растения, которые используются для питания населения мира, такие как пшеница, ячмень, рис, картофель, кукуруза, яблоня и др. [107] Но одним из культурных растений, которые производят широкий спектр пищевых добавок и имеют одну из самых древних историй, издавна возделываемых человеком, является виноградная лоза – Vitis vinifera L. [119, 120, 166]. И в наше время существует несколько способов выращивания этого культурного растения: интенсивное и органическое [130, 202, 238]. По сути, эти два подхода к выращиванию растений различаются использованием удобрений и пестицидов, но все они требуют продуктивных и устойчивых сортов. Более того, если мы примем во внимание устойчивое сельское хозяйство, оно даже еще больше зависит от сортов, которые оно использует для выращивания, потому что снижение использования пестицидов и удобрений зависит от генотипов, устойчивых к биотическим и абиотическим стрессам. И эти совершенно новые генотипы, которые удовлетворяют потребности производителей, в основном, возникают путем традиционного отбора.
Изучение и сохранение редких генотипов играет важную роль в будущем выборе и сохранении редких признаков, которые [133, 143, 180, 185]. Для решения этой проблемы были разработаны разные способы, такие как, например, криоконсервация [132], но общепринятым и наиболее популярным способом сохранения редких генотипов является выращивание их в специальных местах, обычно называемых «коллекциями». Например, коллекции виноградной лозы, также называемые «ампелографическими» коллекциями [234, 237, 249]. И одна из крупнейших ампелографических коллекций в мире – это Российская коллекция, которая содержит более 3300 генотипов, включая разновидности, виды и клоны [231]. Как уже говорилось ранее, изучение генетического разнообразия необходимо для отбора и развития генетических ресурсов растений. В частности, для этих задач важно изучение филогенетических взаимоотношений между выбранными генотипами. Более того, изучение происхождения и родословной редких генотипов может выявить непредсказуемые связи между генетическими пулами разных географических регионов. Например, наиболее изученным районом выращивания и происхождения виноградной лозы является Европа [145, 149]. Но некоторые локации до сих пор не исследованы или, откровенно говоря, плохо исследованы
и имеют много пробелов в генофонде. Таким образом, Кавказ – это край, известный своим высоким генетическим разнообразием, наличием диких виноградных лоз (V. silvestris Gmel.) И большим количеством различных местных сортов [140, 152]. Конечно, эта территория поделена на несколько зон между Арменией, Азербайджаном, Грузией, Россией и Турцией. Впоследствии российская часть Северного Кавказа разделилась на несколько регионов, один из которых назывался Дагестан – эта местность славится своими старыми сортами винограда, расположенными недалеко от старых торговых путей и содержит сорта неизвестной родословной, интересные для селекции. А его биологическое разнообразие ранее изучалось только по микросателлитным (SSR) маркерам [128, 190]. Сравнительно недавно новая система маркеров была разработана Kalendar et al. [171]. Она основана на усиленном полиморфизме ретротранспозона и была недавно протестирована для изучения генетического разнообразия винограда и других видов [150, 153, 168]. Данная система доказала свою эффективность для изучения генетического разнообразия и филогенетических отношений путем создания различного количества полос ДНК для большого числа видов. Кроме того, эти маркеры применялись для изучения внутрисортового и клонального разнообразия [136, 151, 248].
Таким образом, генотипирование сортов – одно из важнейших направлений виноградарства и селекции винограда в целом. Оно позволяет использовать полученные данные для выведения новых, более устойчивых к условиям окружающей среды, и более продуктивных сортов. Поэтому, целью нашего исследования был выбран анализ и сравнение генетических данных сортов винограда с использованием iPBS маркеров. В список данных генотипов вошли аборигенные, интродуцированные, а также подвойные сорта винограда для понимания их филогенетических взаимоотношений в виду того, что данные сорта исследуются впервые с использованием ретротранспозон-основанных маркеров.
2 МАТЕРИАЛЫ И МЕТОДЫ
2.1 Растительный материал
В качестве растительного материала, нами были выбраны генотипы аборигенных, подвойных и интродуцированных сортов, форм и клонов винограда для изучения строения их ядерных геномов (таблица 1). При этом в список вошли: аборигенные сорта, сорта новой селекции и перспективные клоны, отобранные в результате предыдущих работ профессором Л. П. Трошиным.
Таблица 1 – Список генотипов, отобранных для исследования
| 1 | Кумшатский |
| 2 | Варюшкин 9 ряд кл.19 (26) |
| 3 | Совиньон Таманский 114-35 куст |
| 4 | Бургундский |
| 5 | Португальский синий |
| 6 | Чиляки 1-23 (35-36) |
| 7 | Коринка белая мутация |
| 8 | Гарс Левелю |
| 9 | Серсиаль |
| 10 | Сильванер |
| 11 | Пино черный |
| 12 | Слитной |
| 13 | Мускат белый 7-10-4 |
| 14 | Мускат белый 20-11-1а |
| 15 | Достойный |
| 16 | Августин |
| 17 | Яй изюм белый |
| 18 | Кишмиш белый овальный (Султанина) |
| 19 | Яй изюм розовый |
| 20 | Кишмиш красный туркменский (Султанина розовая) |
| 21 | Цимлянский черный |
| 22 | Кобер 5ББ |
| 23 | 420А |
| 24 | 101 14 |
| 25 | Паульсен |
| 26 | Ричтер |
| 27 | Антарис |
| 28 | Жупски Байадисер |
| 29 | Амур |
| 30 | Будаи шули |
| 31 | Гок изюм |
| 32 | Гуляби дагестанскиы |
| 33 | Аг изюм |
| 34 | Агадаи |
| 35 | Гок ала |
| 36 | Яй изюм розовый |
| 37 | Яй изюм белый |
| 38 | Сибирковый |
| 39 | Кулджинскиы |
| 40 | Анюта 5-5 |
| 41 | Анюта |
| 42 | Анюта Ф |
| 43 | Ливия 14-6 |
| 44 | Ливия 14-5 |
| 45 | Ливия |
| 46 | Ливия Ф |
| 47 | Гелиос 50-5 |
| 48 | Гелиос 50-6 |
| 49 | Академический К |
| 50 | Долгожданный 6-8 |
| 51 | Долгожданный 6-9 |
| 52 | Долгожданный |
| 53 | Долгожданный Ф |
| 54 | Антоний Великий 30-5 |
| 55 | Антоний Великий 30-6 |
| 56 | Антоний Великий |
| 57 | Антоний Великий Ф |
| 58 | Аркадия розовая 2-5 |
| 59 | Аркадия розовая 2-6 |
| 60 | Ляли холдор туркони |
| 61 | Ляли сурх казнаки |
| 62 | Ляли сурх таджикский |
| 63 | Ляли холдор |
| 64 | Ляли хамирак |
| 65 | Хусайне из Калайхумба |
| 66 | Гуломак |
| 67 | Ляли сурх боги хабиб |
| 68 | Хусайне люнда |
| 69 | Хусайни сафед казнаки |
| 70 | Хусайне кальта |
| 71 | Ляли хуша дороз |
| 72 | Ляли сурх боги |
Таким образом, с целью изучения генетического разнообразия сортов
и клонов ампелографической коллекции, нами были выбраны сорта и формы различных эколого-географических групп.
2.2 Выделение ДНК
Сбор образцов проводился несколькими способами: непосредственно отбором листьев у взрослых растений, а также отбором верхушечных листьев
у пророщенных черенков. При этом проращивание черенков проводилось
в банках с водой, накрытых непрозрачной пленкой, с целью получить верхушечные побеги с наименьшим содержанием хлорофилла. Выделение ДНК проводилось двумя способами: ЦТАБ-методом и при помощи коммерческого набора DNeasy Plant Mini Kit фирмы QIAGEN. Перед выделением ДНК из листьев, отобранные растительные ткани высушивались в лиофильной сушке Martin Christ BETA 2-8 LDplus в течении 24 ч. После этого, производилось их дробление при помощи металлических шариков в пробирках с пробами в вибрационной мельнице GT200. Ниже для каждого метода приводятся протоколы.
2.2.1 Выделение ДНК ЦТАБ-методом
Протокол выделения ЦТАБ-методом:
К дробленой растительной ткани добавляли 1–2 % поливинилплоипиролидина и 810 мкл ЦТАБ-буфера. Полученный гомогенизат перемещали на инкубацию в термостат на 30 мин при 65 °С. В процессе инкубации перемешивали содержимое пробирки на вортексе каждые 5 мин.
После инкубации охлаждали пробирки до комнатной температуры и добавить в каждую пробу по 810 мкл смеси хлороформа с изоамиловым спиртом, смешанной в соотношении 24 : 1.
Далее перемешивали на вортексе, после чего центрифугировали 15 мин со скоростью 13000 об/мин.
Получившийся супернатант переносили в новую пробирку объемом 1,5 мл.
К нему добавляли 50 мкл 3М ацетата натрия, 150 мкл 4М хлорида натрия и 540 мкл холодного изопропанола.
Далее, перемешивали на вортексе и инкубировали при температуре минус 20 °С в течении 30 мин.
После чего центрифугировали в течении 15 мин со скоростью
13000 об/мин.
Промывание образовавшегося осадка выполняли 70%-м этиловым спиртом объемом 500 мкл. Для этого удаляли из пробирки жидкую фазу, приливали к осадку спирт, перемешивали на вортексе, после чего спирт удаляли пипеткой.
Следующим этапом в термостат помещали пробирки с открытыми крышками и высушивали осадок при температуре 37 °С в течении 20 мин.
После чего добавляли к осадку 300 мкл ТЕ буфера и 1 мкл РНКазы.
Данную смесь перемешивали на вортексе и инкубировали на термостате час при температуре 37 °С.
Потом добавляли 100 мкл 10М ацетата аммония и 1000 мкл холодного этилового спирта.
После перемешали на вортексе и инкубировали при температуре минус 80 °С в течении 5 мин.
После чего центрифугировали 10 мин при 13000 об/мин.
Жидкую фазу удаляли и промывали 70%-м этиловым спиртом объемом 500 мкл.
Потом осадок высушивали в пробирках с открытыми крышками 20 мин в термостате при температуре 37 °С до полного испарения этанола.
В конце к осадку приливали 50 мкл ТЕ. Для лучшего растворения ДНК, пробирки инкубировали при 3 °С в течении 12 ч.
2.2.2 Выделение ДНК с использованием набора
DNeasy Plant Mini Kit
Протокол выделения ДНК коммерческим набором DNeasy Plant Mini Kit компании QIAGEN:
К раздробленным тканям листьев добавить 400 мкл буфера AP1 и 4 мкл РНКазы А. Перемешать на вортексе и инкубировать в течение 10 мин при
65 °С. Перемешивать содержимое пробирки 2–3 раза во время инкубации.
Прилить 130 мкл буфера P3. Перемешать и инкубировать в течение
5 мин на льду.
После чего нужно центрифугировать лизат в течение 5 мин на скорости 20000 об/мин.
Затем перенести верхнюю фазу в спин-колонку QIAshredder, находящуюся в прозрачной пробирке для сбора без крышки объемом 2 мл. Центрифугировать в течение 2 мин на скорости 20000 об/мин.
Аккуратно перенести жидкость, образовавшуюся под колонкой, в новую пробирку, не допуская встряхивания. К жидкости добавить 1,5 объема буфера AW1 и перемешать на вортексе.
Перенести 650 мкл смеси в спин-колонку DNeasy Mini, помещенную
в пробирку объема 2 мл. Центрифугировать в течении 1 мин на скорости ≥ 6000 об/мин. Повторить этот шаг с оставшимся образцом необходимое количество раз.
Поместить спин-колонку в новую пробирку объемом 2 мл. Добавить
500 мкл буфера AW2, центрифугировать в течение 1 мин на скорости
≥ 6000 об/мин. Удалить жидкость, образовавшуюся под колонкой в прозрачной пробирке.
После добавить еще 500 мкл буфера AW2. Центрифугировать в течение 2 мин на скорости 20000 об/мин.
Перенести спин-колонку в новую пробирку объемом 1,5 мл или 2 мл.
Примечание: извлекать спин-колонку из пробирки следует осторожно, не допуская контакта с жидкостью, находящейся под ней.
Затем добавить 100 мкл буфера AE для элюции и инкубировать в течение 5 мин при комнатной температуре (15–25 °C). После инкубации центрифугировать в течении 1 мин на скорости 6000 об/мин
Еще раз повторить 11 шаг для увеличения количества полученной ДНК.
2.2.3 Оценка качества и количества выделенной ДНК
Оценку качества и количества ДНК, выделенной из высушенных листьев, проводили двумя методами: 1) при помощи агарозного гель-электрофореза; 2) при помощи спектрофотометра Implen NanoPhotometer NP80.
После проведения измерений, тотальная ДНК разбавлялась в деионизированной воде до концентрации 20 нг/мкл.
2.3 Проведение полимеразной цепной реакции
Полимеразная цепная реакция проводилась в амплификаторах ДТ-322, компании «ДНК-Технология», Applied Biosystems и Bio-Rad. Для проведения ПЦР были выбраны праймеры, созданные с целью идентификации в генотипах аллелей ретротранспозонов и, соответственно, ранее опубликованные в статьях [167, 222, 251]. Последовательности праймеров приведены в таблице 2.
Таблица 2 – Нуклеотидные последовательности использованных
в работе праймеров
| Name | Sequence (5’-3’) | Source |
| 2374 | CCCAGCAAACCA | [167] |
| 2375 | TCGCATCAACCA | [167] |
| 2376 | TAGATGGCACCA | [167] |
| 2075 | CTCATGATGCCA | [167] |
| 2078 | GCGGAGTCGCCA | [167] |
| 2095 | GCTCGGATACCA | [167] |
| 2230 | TCTAGGCGTCTGATACCA | [167] |
| 2373 | GAACTTGCTCCGATGCCA | [167] |
| 2415 | CATCGTAGGTGGGCGCCA | [167] |
| 2074 | GCTCTGATACCA | [167] |
При проведении ПЦР использовались следующие параметры амплификации:
95 °С – начальная денатурация, 5 мин;
Далее 30 циклов:
95 °С – денатурация, 30 с;
55 °С – отжиг праймеров, 30 с;
72 °С – элонгация, 1 мин;
После чего дополнительный шаг:
72 °С – финальная элонгация, 5 мин.
2.4 Проверка наличия амплифицированных фрагментов (ДНК-бендов)
Проверка наличия амплифицированных фрагментов в результате ПЦР проводилась в камере для горизонтального электрофореза компании «Helicon», в 2 % ТАЕ-агарозном геле. Параметры гель-электрофореза были выбраны следующие: 150V, 150А, в течение 20 мин. Далее агарозные пластины фотографировались в ультрафиолетовом свете и неудачные образцы ПЦР отмечались для повторного проведения амплификации.
2.5 Проведение гель электрофореза в полиакриламидном геле
С целью разделения продуктов амплификации генотипов с использованными ДНК маркерами, мы использовали ДНК-электрофорез в полиакриламидном геле. Таким образом, как уже было сказано, результаты амплификации проверялись изначально в 2%-м агарозном геле на наличие ДНК-бендов и, в целом, амплификации. После чего, электрофоретическое разделение продуктов амплификации маркеров проводилось в 6 % ПААГ, при силе тока 70А и мощности 70В, 7 ч. После чего, гель-пластины погружались на 10 мин в раствор бромистого этидия для окрашивания ДНК. По итогу, пластины просвечивались в ультрафиолетовом свете и фотографировались для последующего изучения.
2.6 Анализ полученных данных
Оценка и статистика диапазонов iPBS и IRAP. Программа GenAlEx 6.3 [204] использовалась для проведения анализа AMOVA [146] с 999 пермутациями. Для статистики частотных диапазонов (информационный индекс Шеннона, разнообразие, несмещенное разнообразие, процент полиморфных локусов, количество диапазонов и количество частных диапазонов) использовались GenAlEx 6.3 и таблица Excel. Затем было рассчитано генетическое расстояние (GD) и проведен анализ главных компонентов (PCoA) с использованием метода стандартизированной ковариации.
Кластеризация и построение деревьев. Для построения дерева использовались MEGA X [189] и DARWin 6.0. Для MEGA X 0-1 список полос ДНК был перенесен в список A-C (где A – наличие и C – отсутствие полосы), а затем с Maximum Likelihood method [196] было построено дерево кластеров. Для DARWin 6.0 был выбран метод Weighted Neighbor-Joining [123] (по умолчанию из стандартного набора методов программы).
3 РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
В результате исследований были получены последовательности исследованных генов у 72 генотипов. Данные, полученные в результате амплификации генотипов с выбранными маркерами, были сравнены между собой
и выявлены полиморфные аллели, проведен анализ частот встречаемости
в популяциях, а также проведено филогенетическое сравнение внутри популяций. В итоге, для получения понятия о родстве генотипов были использованы методы кластеризации изученных ДНК-последовательностей. Результаты проведенных за 2020 г. исследований отображены на рисунках, отображающих разделение продуктов амплификации в полиакриламидном геле
и приведенных в приложении 1.
3.1 Изучение популяций новейших перспективных сортов винограда
В результате исследования нами были изучены четыре сортотипа винограда: Анюта, Гелиос, Аркадия розовая, Ливия с использованием десяти молекулярных маркеров. Общие результаты приведены в таблице 3.
Таблица 3 – Статистика ДНК бендов столовых сортов винограда
по популяциям
| Название | № популяции | Количество бендов на генотип |
Количество бендов в популяции |
Количество полиморфных бендов |
Процент полиморфных бендов |
Индекс Шеннона | Разнообразие | Количество частных бендов |
|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 1 | Анюта 5-5 | 1 | 61 | ||||||
| 2 | Анюта | 1 | 87 | ||||||
| 3 | Анюта Ф | 1 | 74 | ||||||
| 4 | Ливия 14-6 | 2 | 82 | ||||||
| Продолжение таблицы 3 | |||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 5 | Ливия 14-5 | 2 | 85 | ||||||
| 6 | Ливия | 2 | 76 | ||||||
| 7 | Ливия | 2 | 84 | ||||||
| 8 | Гелиос 50-5 | 1 | 80 | ||||||
| 9 | Гелиос 50-6 | 1 | 76 | 378 | 249 | 66,06 | 0,392 | 0,27 | 35 |
| 10 | Аркадия розовая 2-5 |
2 | 52 | ||||||
| 11 | Аркадия розовая 2-6 |
2 | 69 | 448 | 287 | 64,25 | 0,365 | 0,25 | 27 |
| Всего | 826 | 826 | 687 | 83,26 | |||||
Так, амплификация выбранных генотипов с маркером 2230 выявила всего 42 бенда, при этом минимальное количество бендов (3 шт.) показали такие клоны как Анюта Ф, Ливия и Аркадия розовая 2-5. Наибольшее их количество показал клон Анюта (5 шт.). Далее амплификация выбранных для исследования генотипов с маркером 2074 выявила всего 125 бендов, при этом минимальное количество бендов (8 шт.) показали клоны Аркадия розовая 2-5 и Аркадия розовая 2-6. Наибольшее же количество бендов выявлено у клона Анюта (15 шт.).
Использование ДНК-маркера 2228 выявило всего 56 бендов, при этом минимальное количество (4 шт.) показали клоны Аркадия розовая 2-5 и Аркадия розовая 2-6. Наибольшее же количество бендов (6 шт.) показали клоны Анюта 5-5, Ливия Ф и Гелиос 50-5. Также, исследование выбранных генотипов с использованием маркера 2373 выявило всего 94 бенда. При этом неожиданным была крайне низкая амплификация у клона Анюта 5-5, которая не выявила ни одного бенда у данного генотипа, что само по себе является неожиданным. В то время как наибольшее количество бендов (12 шт.) показал клон Ливия Ф.
Амплификация же выбранных генотипов с маркером 2237 выявила всего 140 бендов, при этом наименьшее количество бендов (3 шт.) показал клон Аркадия 2-5, а наибольшее количество (19 шт.) – клон Анюта. Дальнейшее изучение выбранных генотипов с маркером 2415 выявила всего 51 бенд. При этом наименьшее количество бендов (3 шт.) показал сортотип Анюта, а также его клоны Анюта 5-5, Анюта, Анюта Ф. Наибольшее же количество бендов (6 шт.) выявил сортотип Ливия и его клоны Ливия 14-5, Ливия 14-6, Ливия и Ливия Ф.
Амплификация выбранных генотипов с маркером 2075 выявил всего
101 бенд. Так, наименьшее количество бендов (6 шт.) показали клоны Анюта 5-5 и Ливия. В то время как наибольшее количество – клон Анюта и Ливия Ф. С маркером Vine-1 выявлено всего 88 бендов, при этом наименьшее их количество показали клоны Гелиос 50-6 и Аркадия розовая 2-5, а наибольшее (11 шт.) – клон Ливия. Также, изучение выбранных генотипов с применением маркера Tvv-1 выявило всего 88 ДНК-бендов. При этом наименьшее количество бендов (5 шт.) показал сортотип Аркадия розовая, его клоны Аркадия розовая 2-5 и Аркадия розовая 2-6.
В нашем исследовании все генотипы были разделены на две популяции по происхождению: на столовые сорта, выведенные селекционером В. Н. Крайновым (Популяция 1) и популярные столовые сорта современной селекции (Популяция 2), которые мы выбрали для сравнения.
Как мы можем видеть в таблице 3, минимальное общее количество бендов, сгенерированное генотипом Аркадия розовая 2-5, при амплификации со всеми маркерами было 52 шт., в то время как максимальное количество бендов (87 шт.) при амплификации было выявлено при изучении генома Анюта 5-5. Среднее же количество бендов на генотип было 82 шт. В то время как всего в нашем исследовании было 826 бендов.
При этом наибольшее количество бендов в популяции было выявлено
у Популяции 2 (448 ДНК бендов), а наименьшее (378) у Популяции 1, но, несмотря на это, процент полиморфных бендов был выше в первой популяции – 66,06 %, или 249 полиморфных бендов от общего количества, в то время как во второй популяции их было меньше (64,25 %, или 287 бендов в популяции).
Также, нами было подсчитано общее количество полиморфных бендов во всей выборке исследованных генотипов. Для этого мы представили нашу выборку как единую популяцию столовых сортов в программе GenAlEx
и подсчитали процент полиморфных бендов среди всех выбранных для исследования организмов, который, в итоге, составил 83,26 %, или 687 ДНК бендов.
И, как мы можем видеть из данных таблицы 3, логичным было то, что индекс разнообразия в популяции 1 выше, чем в популяции 2 (0,269 и 0,247, соответственно). Это вполне объяснимо, тем, что процент полиморфных бендов в популяции 1 выше, чем в популяции 2, не смотря на то, что, по факту, количество генотипов в первой популяции меньше, чем во второй популяции.
Помимо этого, были обнаружены и частные бенды, число которых составило 27 – для популяции 1 и 35 – для популяции 2.
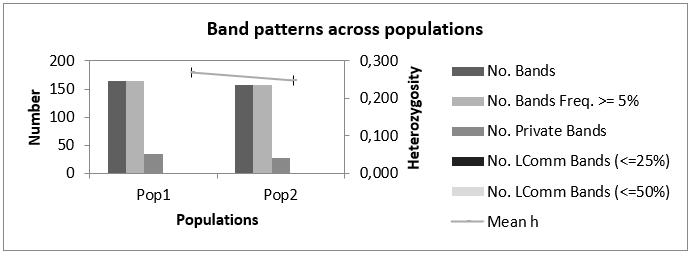
Рисунок 1 – Анализ частот встречаемости аллелей
в двух популяциях столовых сортов
Далее, для изучения генетического родства между выбранными сортотипами и их клонами мы провели кластерный анализ с использованием параметров UPGMA метода (рисунок 2).
Как мы можем видеть из рисунка 2, кластерное древо разделилось на два макрокластера, в один из которых вошел сортотип Анюта, а в другой – все остальные. При этом отдельным подкластером была выделена Аркадия розовая. Вторым субкластером стали сорта Гелиос и Ливия, что в свою очередь, является вполне объяснимым ввиду того, что они имеют общего предка – сорт Аркадия. Рядом с ними расположен сортотип Аркадия розовая. Далее же от этих двух сортотипов расположен сорт Анюта, который обладает наименьшим с ними сходством по происхождению.
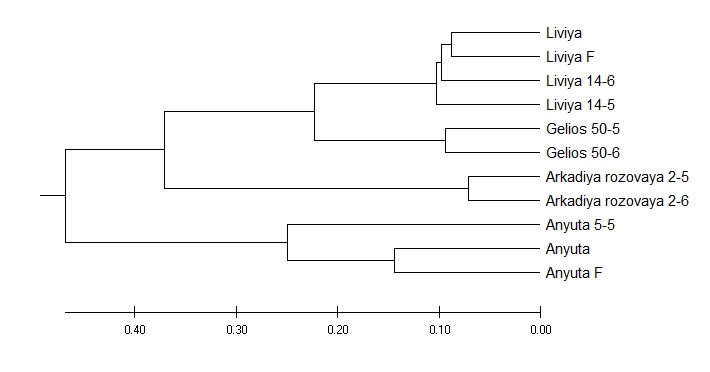
Рисунок 2 – Кластеризация изученных генотипов методом UPGMA
Также, помимо кластерного анализа мы провели PCoA анализ в программе GenAlEx для уточнения полученных результатов и сравнения разных результатов между собой по одним и тем же сортам выполненные с использованием разных методов (рисунок 3). Как мы можем видеть, распределение организмов на координатной плоскости произошло таким же образом, как и в кластерном анализе. В отдельный кластер, отдаленный от всех, был выделен сортотип Анюта, клоны сортов Гелиос и Ливия и отдельным кластером между двумя этими сортотипами был сортотип Аркадия розовая. Отличие же состоит в том, что в PCoA анализе Аркадия розовая расположена ближе к Анюте, нежели чем к Гелиосу и Ливии, хотя она, также как и в кластерном анализе, была выделена отдельно от других сортов, что подтверждает результат кластерного анализа.
Таким образом, нами было проведено исследование одиннадцати клонов столового винограда современной селекции, принадлежащих к четырем сортам с использованием iPBS маркеров. Всего было получено 826 ДНК бендов, из которых полиморфными были 687, что говорит нам о достаточно большом генетическом разнообразии, проявившимся среди сортов и клонов. Также, нами было построено кластерное древо, которое показало, что сорта разделились на два крупных кластера, один из которых, в свою очередь, был разделен еще раз. Помимо этого, в отдельный микрокластер был выделен генотип Аркадии розовой. Такое расположение сортов объясняется тем, что многие из них обладают общими предками. Также, нами был проведен PCoA анализ, в котором были представлены все изученные генотипы таких сортов как Анюта, Ливия, Гелиос, Аркадия розовая и их генотипы. Результаты оказались вполне ожидаемые, так как было известно происхождение некоторых сортов. В частности, у Гелиоса и Ливии есть общий родитель Аркадия, что, очевидно, послужило причиной их расположения рядом. В тоже время,
у Анюты общие родители с Кишмишем Находка, который в свою очередь является одним из родителей Гелиоса. Но, не смотря на это, данные сорта были расположены достаточно далеко друг от друга, что, само по себе является интересным, в частности, и в виду результатов кластерного анализа, где данные сорта также находились в разных частях кластерограммы. Однако такие сорта как Гелиос и Аркадия розовая, которые считаются синонимичными, были распределены в два разных кластера, расположенных по соседству. Это говорит о том, что эти сорта генетически близки, но, тем не менее, судя по всему, имеют отличную друг от друга генетику.
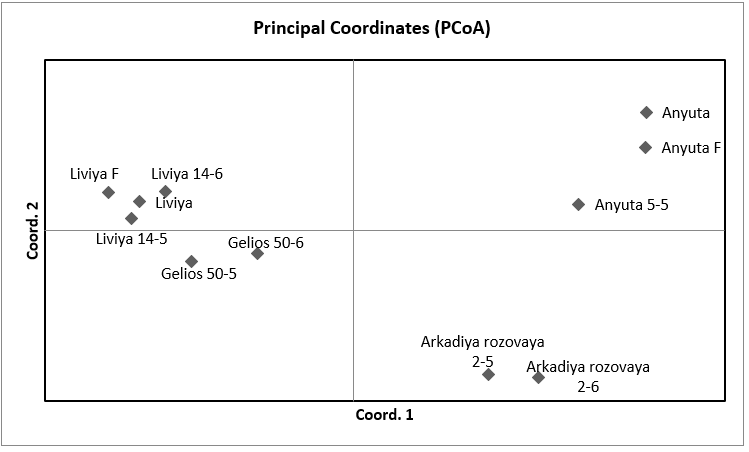
Рисунок 3 – PCoA анализ двух популяций винограда
Далее с помощью десяти молекулярных маркеров были изучены три сортотипа винограда (таблица 4): Долгожданный, Антоний великий и Академик Трубилин. Амплификация ДНК генотипов выбранных сортов винограда с маркером 2230 выявила всего 42 бенда, при этом минимальное количество бендов (4 шт.) показали такие клоны как Долгожданный 6-9, Долгожданный, Долгожданный Ф, Антоний великий и Антоний великий Ф. В то время как сорта Академик Трубилин и Антоний великий 30-6 показали наибольшее количество бендов – 6 шт. Последующая амплификация выделенной ДНК
с маркером 2074 выявила всего 83 бенда, при этом минимальное количество бендов (7 шт.) показал сорт Долгожданный Ф, а наибольшее количество бендов (14 шт.) выявлено у сорта Академик Трубилин.
Амплификация с маркером 2078 выявила всего 51 бенд, при этом наибольшее количество ДНК бендов (8 шт.) показал сорт Академик Трубилин, наименьшее количество бендов (5 шт.) выявил сорт Долгожданный и его клоны, а также Антоний великий Ф. При амплификации генотипов с маркером 2228 наибольшее количество бендов (5 шт.) было выявлено у клонов Антоний великий 30-6 и Антоний великий Ф. Меньшее количество бендов
(4 шт.) показали остальные сорта: Академик Трубилин, Долгожданный, Антоний великий и их клоны.
Исследование выбранных генотипов с использованием маркера 2373 выявило всего 60 бендов, при этом наименьшее количество бендов (5 шт.) показал сорт Антоний великий 30-5, в то время как наибольшее количество бендов (12 шт.) при амплификации с данным маркером – сорт Академик Трубилин. Использование ДНК-маркера 2237 выявило всего 116 бендов, при этом минимальное количество (7 шт.) показал клон Долгожданный 6-9, а наибольшее их количество (16 шт.) – клон этого же сорта Долгожданный Ф. Изучение выбранных генотипов с использованием маркера 2415 выявило всего 45 бендов, при этом наибольшее количество бендов (6 шт.) показали такие сорта как Академик Трубилин и Долгожданный, а наименьшее (4 шт.) – клоны сорта Долгожданный: Долгожданный 6-9 и Долгожданный Ф.
Амплификация выбранных генотипов с маркером 2075 выявила всего
87 бендов, при этом наибольшее количество бендов показал клон Антоний великий 30-6. В свою очередь, наименьший показатель по количеству бендов (8 шт.) отмечен у клона Антоний великий Ф. Использование ДНК-маркера Vine-1 выявило всего 58 бендов, при этом минимальное количество бендов
(5 шт.) было выявлено у клонов сорта Долгожданный, а именно: Долгожданный 6-9, Долгожданный, Долгожданный Ф. При этом, наибольшее количество бендов (8 шт.) показал сорт Академик Трубилин. Также, изучение выбранных генотипов с применением маркера Tvv-1 выявило всего 48 ДНК бендов. При этом наименьшее количество бендов (4 шт.) было у сорта Долгожданный: Долгожданный 6-8, Долгожданный 6-9, Долгожданный и Долгожданный Ф. Наибольшее же их количество (7 шт.) показали клоны – Антоний великий 30-6, Антоний великий и Антоний великий Ф.
Таблица 4 – Общая статистика по выявленным ДНК бендам
| Название | № популяции | Количество бендов на генотип |
Количество бендов в популяции |
Количество полиморфных бендов |
Процент полиморфных бендов |
Индекс Шеннона | Разнообразие | Количество частных бендов |
|
| 1 | Академик Трубилин | 0 | 85 | ||||||
| 2 | Долгожданный 6-8 | 1 | 73 | ||||||
| 3 | Долгожданный 6-9 | 1 | 58 | ||||||
| 4 | Долгожданный | 1 | 67 | ||||||
| 5 | Долгожданный Ф | 1 | 64 | 262 | 75 | 28.96 | 0.179 | 0.124 | 32 |
| 6 | Антоний Великий 30-5 |
2 | 68 | ||||||
| 7 | Антоний Великий 30-6 |
2 | 73 | ||||||
| 8 | Антоний Великий | 2 | 71 | ||||||
| 9 | Антоний Великий Ф | 2 | 69 | 281 | 78 | 28.05 | 0.170 | 0.117 | 36 |
| Всего | 628 | 543 | 389 | 61.99 | 68 |
Интересно, что в нашем исследовании мы наблюдали неожиданный факт: количество сгенерированных бендов у технического сорта винограда Академик Трубилин при амплификации с большинством молекулярных маркеров было значительно выше, чем в других исследуемых генотипах. К сожалению, на данном этапе исследования мы не можем объяснить данный факт, но, полагаем, что это может быть связано с принадлежностью сортов
к разным направлениям использования, так как селекция столовых сортов шла менее интенсивно, нежели технических. И, соответственно, это предполагает, что данный сорт имеет более сложную родословную в сравнении
с другими сортами, взятыми в этом исследовании. Тем не менее, данное предположение должно быть проверено и подтверждено научными данными по сравнению генетического разнообразия столовых и технических сортов.
Как мы можем видеть из таблицы 4, всего в данном исследовании было выявлено 628 ДНК бендов. Среднее же количество бендов на генотип было 69 шт. Минимальное число бендов (58 шт.) при амплификации со всеми молекулярными маркерами было сгенерировано генотипом клона Долгожданный 6-9, в то время как максимальное количество сгенерированных ДНК бендов (85 шт.) было у генотипа сорта Академик Трубилин, как уже упоминалось ранее.
Как известно, сорта Долгожданный и Антоний великий являются родственниками, так как у них общие родители (Кишмиш лучистый и Талисман), и, соответственно, созданы селекционером-любителем В. Н. Крайновым. Можно сделать вывод, что именно из-за родственных связей и, очевидно, похожих по своему строению генотипов, количество бендов в этих двух популяциях примерно одинаковое. Также, при сравнении этих двух популяций мы можем видеть, что количество полиморфных генов также мало отличается (75 и 78 шт.). Это может быть объяснено тем, что исследуемые сорта выведены недавно. Общее же количество генов обеспечивающих разнообразие признаков равно 153 шт. Полиморфные гены в процентном содержании у сортотипов Долгожданный и Антоний великий были равны 28,96 и 28,05 %, соответственно. Следовательно, как мы можем видеть, что внутриклоновая полиморфность довольно низкая, что было ожидаемым для относительно недавно выведенных сортов. При этом интересно заметить, что общее процентное содержание полиморфных бендов во всех исследуемых генотипах вместе с генотипом Академик Трубилин было равно 61,99 %. Содержание частных бендов в Популяции 1 и Популяции 2 составило 32 и 36 шт., соответственно, всего – 68 шт. В целом, результаты анализа частот встречаемости аллелей
в двух популяциях столовых сортов отображены на рисунке 4.
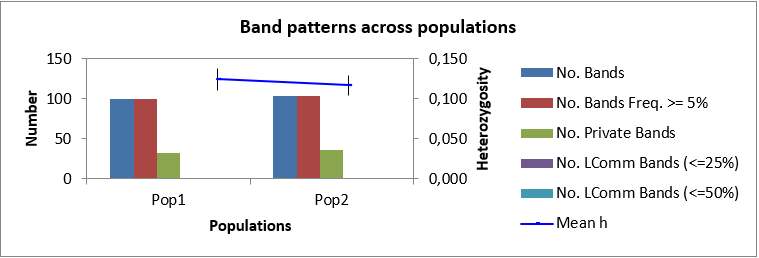
Рисунок 4 – Анализ частот встречаемости аллелей
в двух популяциях столовых сортов
Далее, для того чтобы проанализировать генетическое родство изученных сортов и их клонов, мы провели кластерный анализ с использованием параметров UPGMA метода (рисунок 5).
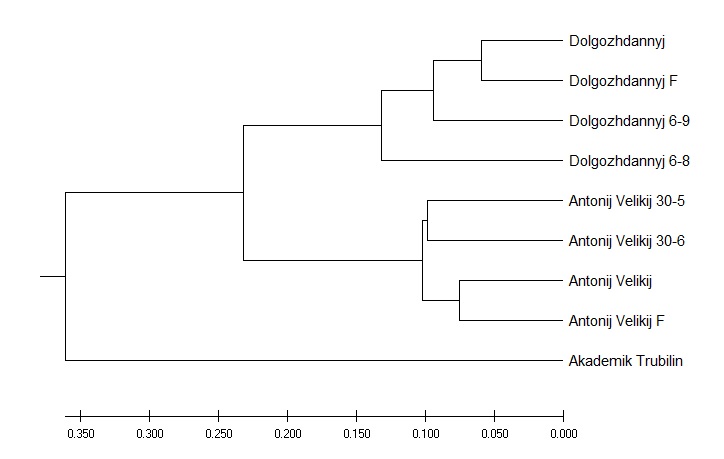
Рисунок 5 – Кластеризация изученных генотипов методом UPGMA
Как мы можем видеть, на кластерном древе (см. рисунок 5) в отдельную ветвь, как и предполагалось, выделился сорт Академик Трубилин. Вторая же ветвь, в свою очередь, разделилась на два подкластера, в которые вошли сортотипы наших исследуемых родственных популяций. Данные подкластеры сортотипов программой были разделены на группы отдельных клонов представленных популяций. При этом, не смотря на крайне близкое родство между двумя сортами, не наблюдается смешение между отдельными генотипами и их ложного попадания в соседний кластер.
Также, нами был проведен PCoA анализ (рисунок 6) для того, чтобы получить больше информации разными возможными методами о распределении изученных генотипов между собой.

Рисунок 6 – PCoA анализ исследуемых популяций винограда
Как мы видим, каждая группа клонов из популяций сконцентрирована в одной части координатной прямой. Как мы предполагаем, из-за небольшого количества сортов клоны двух родственных сортов (Антоний великий и Долгожданный) и сорт с отличительными признаками (Академик Трубилин) расположением напоминает равносторонний треугольник. Это не означает, что предполагаемые нами родственные сорта в равной степени генетически схожи с сортом, выбранным как аут-группа, данное расположение сортов на координатной плоскости объясняется малой выборкой генотипов. Конечно, если бы в исследование были включены другие сорта с неродственными генотипами, то данные сорта оказались бы значительно ближе друг к другу из-за генетической близости. В этом смысле построение кластерного древа дает более ясное нахождение клонов на генетическом уровне.
Таким образом, с использованием iPBS маркеров было изучено восемь клонов столового бело-ягодного винограда селекции В. Н. Крайнова, а также один клон технического винограда с темными ягодами (таблица 5, рисунки 7, 8).
Таблица 5 – Общая статистика по всем сортам
| Название | № популяции | Количество бендов на генотип |
Количество бендов в популяции |
Количество полиморфных бендов |
Процент полиморфных бендов |
Индекс Шеннона | Разнообразие | Количество частных бендов |
|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 1 | Anyuta 5-5 | 1 | 61 | ||||||
| 2 | Anyuta | 1 | 87 | ||||||
| 3 | Anyuta F | 1 | 74 | ||||||
| 4 | Liviya 14-6 | 2 | 82 | ||||||
| 5 | Liviya 14-5 | 2 | 85 | ||||||
| 6 | Liviya | 2 | 76 | ||||||
| 7 | Liviya F | 2 | 84 | ||||||
| 8 | Gelios 50-5 | 1 | 80 | ||||||
| 9 | Gelios 50-6 | 1 | 76 | ||||||
| 10 | Akademicheskij K | 2 | 85 | ||||||
| 11 | Dolgozhdannyj 6-8 | 1 | 73 | ||||||
| 12 | Dolgozhdannyj 6-9 | 1 | 58 | ||||||
| 13 | Dolgozhdannyj | 1 | 67 | ||||||
| 14 | Dolgozhdannyj F | 1 | 64 | 640 | 498 | 77.83 | 0.421 | 0.282 | 53 |
| 15 | Antonij Velikij 30-5 |
2 | 68 | ||||||
| 16 | Antonij Velikij 30-6 |
2 | 73 | ||||||
| 17 | Antonij Velikij | 2 | 71 | ||||||
| 18 | Antonij Velikij F | 2 | 69 | ||||||
| Продолжение таблицы 5 | |||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 19 | Arkadiya rozovaya 2-5 |
2 | 52 | ||||||
| 20 | Arkadiya rozovaya 2-6 |
2 | 69 | 814 | 556 | 68.33 | 0.359 | 0.239 | 35 |
| Всего | 1454 | 1454 | 1388 | 95.48 | 88 | ||||
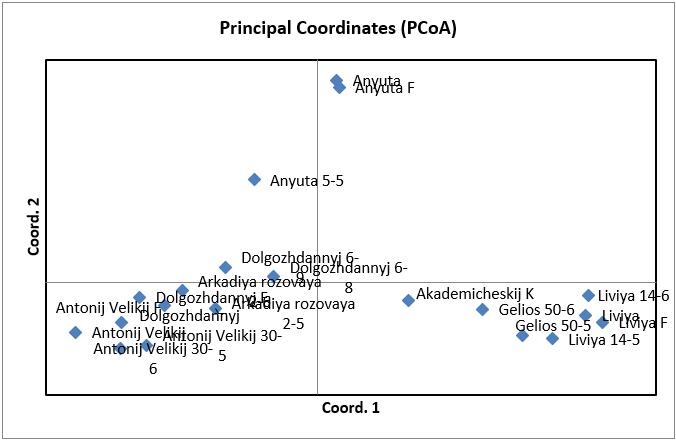
Рисунок 7 – PCoA анализ всех сортов
(где Akademicheskij K – сорт винограда Академик Трубилин)
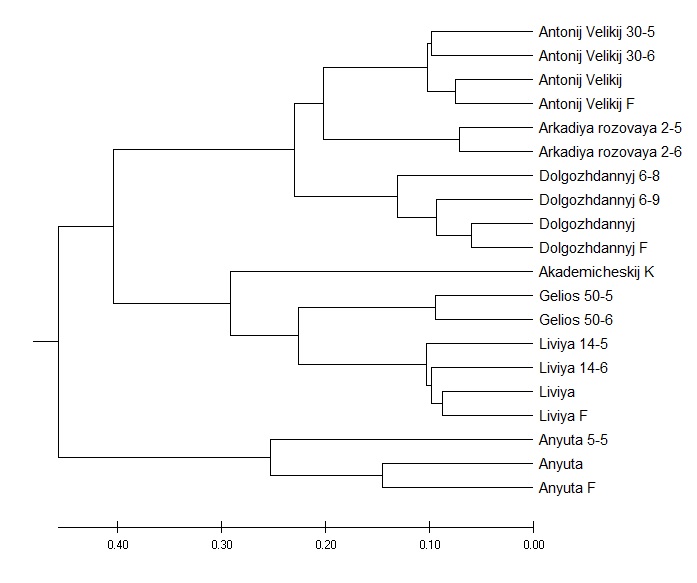
Рисунок 8 – Кластеризация всех генотипов в программе MEGA
Всего было получено 628 ДНК, в частности количество бендов у сортогрупп Антоний великий и Долгожданный их оказалось – 543 шт., из которых 153 шт. были полиморфными. Достаточно низкое содержание полиморфных бендов по сравнению с общим количеством говорит о том, что исследуемые сорта имеют небольшое количество аллелей, которые бы отличали клоны друг от друга, что объясняется тем, что сорта выведены относительно недавно. Также, построение кластерного древа, выделило сорт Академик Трубилин в отдельный макрокластер, что было вполне ожидаемо. В свою очередь, сорта Антоний великий и Долгожданный выделены в отдельную ветвь, которая была поделена еще раз на отдельные клоны. Также, мы провели PCoA анализ, результаты которого также распределили сорта и клоны по родству на координатной плоскости. Таким образом, при построении кластерного древа было выявлено близкое расположение родственных бело-ягодных столовых сортов и отделение сорта, выбранного как аут-группа, в отдельный кластер.
3.2 Изучение популяций аборигенных, интродуцированных и подвойных сортов винограда
Данные с фотографий гелей были описаны при помощи программы GelPro 3.1 и переведены в вид бинарной таблицы (0 и 1) для удобства подсчета статистических данных ДНК-бендов, после чего уже проводилась статистическая обработка. В процессе изучения подвоев были рассчитаны общие статистические показатели, приведенные в таблице 6.
Таблица 6 – Основные общие статистические показатели
| Номер образца |
1 | 2 | 3 | 4 | 5 | ||||||||||
| Количество бендов на генотип |
104 | 118 | 101 | 130 | 109 | ||||||||||
| Всего категорий бендов | 455 | ||||||||||||||
| Общее количество бендов | 562 | ||||||||||||||
| Название маркера | 2074 | 2228 | 2075 | 2078 | 2095 | 2230 | 2374 | 2375 | 2376 | 2373 | 2415 | Tvv-1 FaF | Vine-1 RaR | ||
| Минимальное количество бендов |
8 | 1 | 1 | 3 | 7 | 1 | 11 | 5 | 10 | 7 | 12 | 0 | 5 | ||
| Максимальное количество бендов |
18 | 12 | 11 | 11 | 10 | 9 | 19 | 13 | 15 | 21 | 15 | 6 | 8 | ||
| Общее количество бендов для каждого из маркера | 59 | 23 | 25 | 34 | 41 | 25 | 75 | 45 | 64 | 56 | 70 | 14 | 30 | ||
В нашем исследовании подвойные сорта винограда были разделены на две популяции. При этом, как мы можем видеть из таблицы 6, число категорий ДНК-бендов сгенерированное на генотип варьировало от 101 (101-14) до 130 (Paulsen 1103). Всего было выявлено 455 категорий бендов различной длины амплифицированных фрагментов и их общее количество составило 562.
Далее, при анализе показателей, полученных каждым ДНК-маркером
в отдельности, было выявлено, что наименьшее количество бендов на генотип показал маркер Tvv-1 FaF (от 0 до 6 для каждого), в то время как наибольшее было сгенерировано iPBS2373 (от 7 до 21). Это, также сходится и с общим количеством бендов, сгенерированным при амплификации маркеров с генотипами, так как у Tvv-1 FaF было выявлено наименьшее (14 шт.),
а у iPBS2374 наибольшее (75 шт.) количество ДНК-бендов.
Количество бендов (таблица 7) Популяции 1 – 222 шт. и в Популяции 2 – 340 шт. При этом количество полиморфных бендов составило 43 шт. (19,78 %) и 147 шт. (43,30 %) для первой и второй популяции, соответственно. Далее для подсчета общего количества полиморфных бендов мы представили выборку как единую популяцию. Таким образом, их количество составило 308 шт., или же 54,95 %.
Далее, мы провели обработку полученных данных в программе GelPro 3.1 для представления генетических характеристик выборки генотипов уже как двух популяций. Первая – Kober 5BB и 420-A, вторая – 101-14, Paulsen 1103 и Richter57. Данные популяции были объединены на основе происхождения генотипов, выбранных для исследования. Полученные результаты представлены в таблице 8 и на рисунках 9 и 10.
Таблица 7 – Статистические показатели по популяциям
| Название | № популяции | Количество бендов на генотип |
Количество бендов в популяции |
Количество полиморфных бендов |
Процент полиморфных бендов |
Индекс Шеннона | Разнообразие | Количество частных бендов |
|
| 1 | Kober 5BB | 1 | 104 | ||||||
| 2 | 420A | 1 | 118 | 222 | 43 | 19,78 | 0,137 | 0,099 | 47 |
| 3 | 101 14 | 2 | 101 | 340 | 147 | 43,30 | 0,276 | 0,192 | 115 |
| 4 | Paulsen | 2 | 130 | ||||||
| 5 | Richter | 2 | 109 | ||||||
| Всего | 562 | 562 | 308 | 54,95 | 162 |
Таблица 8 – Генетические характеристики популяций
| Показатель | Количество | |
| Номер популяции | 1 | 2 |
| Число ДНК-бендов | 156 | 224 |
| Количество бендов со встречаемостью ≥ 5 % | 156 | 224 |
| Количество частных бендов | 47 | 115 |
| Выявленное генетическое разнообразие | 0,099 | 0,192 |
| Непредвзятое генетическое разнообразие | 0,198 | 0,289 |
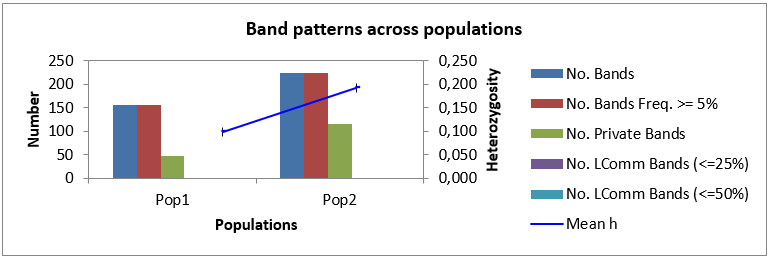
Рисунок 9 – Визуальная структура ДНК-паттернов для изученных популяций
Как мы видим из таблицы 8 и рисунка 8 обе изученные популяции сгенерировали разное количество ДНК-бендов, 156 – для Популяции 1 и 224– для Популяции 2. При этом было выявлено, что все они встречаются с частотой более 50 %, на что нам указывают показатели встречаемости менее 25
и 50 % (0 для обоих популяций). Также в процессе анализа найдено 47 и 115 уникальных ДНК-бендов для первой и второй популяции, соответственно. Это говорит нам о том, что некоторые генотипы не просто отличаются от общей выборки клонов, но и обладают уникальными, присущими только им характеристиками. Как мы видим, у Популяции 1 выявленное генетическое разнообразие почти в два раза меньше, чем у Популяции 2 (0,099 и 0,192), что вполне объясняется меньшим количеством частных бендов, а также тем, что в Популяции 1 было выявлено количество полиморфных генов в два раза меньше (19 и 43 %, соответственно).
При этом обнаружено, что для обоих популяций выявленное генетическое разнообразие не превышает непредвзятое, что говорит нам в общем
о низком генетическом разнообразии, что вполне ожидаемо при изучении клонов. Тем не менее, процент полиморфных локусов внутри популяций, согласно анализу частоты встречаемости аллелей в GenAlEx 3.1, составил
19,78 % (для первой) и 43,30 % (для второй). Таким образом, для дальнейшего изучения генетического разнообразия, нами был построен кластерный анализ в программе MEGA7 (рисунок 9).
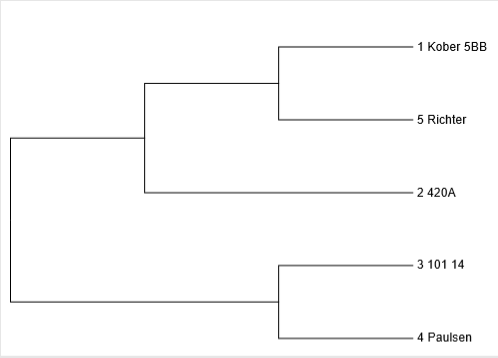
Рисунок 10 – Кластеризация изученных генотипов
Как мы видим из рисунка 9, кластеризация генотипов методом Maximum Likelihood Method в программе MEGA7 создала два супер-кластера и три меньших, входящих в них. При этом кластеризация выявила близкородственные генотипы (1, 2, 5 и 3, 4). Данное положение этих образцов было выявлено при проведении дополнительной кластеризации с использованием «Minimum Evolution method». Тем не менее, как мы видим из результатов кластеризации, не смотря на близкое родство генотипов, у каждого из них имеется уникальный набор локусов и мутаций, отличающий их друг от друга. Полученные нами данные подтверждаются в статье M. O. Costa с соавторами [162].
Также, помимо кластерного анализа, для уточнения положения и взаимоотношений между выбранными для изучения сортами, нами был проведен PCoA анализ (рисунок 11).

Рисунок 11 – PCoA анализ изученных генотипов
Как мы видим из рисунка 10, распределение изученных генотипов на координатной плоскости произошло следующим образом: сорта 420-А
и Kober 5BB были объединены, так как они имеют общих родителей (Vitis berlandieri и V. riparia). У сорта Richter 57 среди родительских форм также имеется Vitis berlandieri, и очевидным было, что на кластере и на координатном анализе расположение его будет возле родственных сортов. Подвои Paulsen 1103 и 101-14 были сгруппированы также по генетическому происхождению. Общим родителем у них является Vitis rupestris.
Таким образом, в данной работе нами был проведен анализ подвойных сортов винограда с использованием iPBS маркеров, который, в свою очередь, показал их генетическое разнообразие. Как было выявлено, наименьшее количество бендов составило 156 шт. для первой популяции, в то время как вторая популяция показала наибольшее (224 шт.). Процент полиморфных локусов внутри популяций, согласно анализу частоты встречаемости аллелей
в GenAlEx 3.1 составил 19,78 %, или 47 шт. бендов от общего количества для первой популяции, в то время как во второй популяции их было в два раза больше (43,30 %, или 115 шт.). По результатам анализа была выполнена Maximum Likelihood Method кластеризация, которая выявила, что сорта разделились на несколько кластеров. По результатам распределения генотипов подтвердилось их общее происхождение и родственность. Итоги PCoA анализа также были похожи на кластеризацию, что было очевидно, учитывая литературные данные и родственность сортов. Показано, что точки 420-А
и Kober 5BB были ближе друг к другу, так как известно, что они имеют схожие родительские формы от которых и были получены в результате скрещивания, в то время как у других сортов только один общий родитель. Таким образом, полученные данные могут служить не только основой для дальнейшего селекционного отбора, основанного на ДНК маркировании и распределении генотипов в формах PCoA и кластерного анализа, но также и дополнительной основой при изучении распределения аллелей между родительскими и получаемыми гибридами.
Далее, при анализе следующей группы сортов результаты, проведенных анализов, оказались следующими: маркер Vine-1 выявил 78 шт. бендов, из которых минимальное количество оказались у сорта Пино черный – 6 шт.,
а максимальное у сорта Бургундский – 11 шт. Также для всех выбранных клонов маркер iPBS 2415, в целом, выявил 70 бендов. При этом, наибольшее число было у Савиньона Таманского – 14 бендов, в то время как наименьшее у Сильванера – всего 3 ДНК-бенда. Маркер iPBS 2074 показал наличие
92 бендов при амплификации со всеми выбранными генотипами, при этом наименьшее количество оказалось у сорта Португальский синий – 15 ДНК-бендов, а наибольшее у Совиньона Таманского 114-35 – 40. Маркер iPBS 2230 показал наличие 111 бендов у всей выборки организмов, из которых наименьшее количество ДНК-бендов показал сорт Сильванер (3 шт.), а самое большое – сорт Мускат белый 20-11-2а.
Всего же при амплификации всех генотипов со всеми ДНК-маркерами был выявлен 351 ДНК-бенд. При этом наилучшую амплификацию показал сорт Совиньон Таманский – 53 ДНК-бенда, в то время как меньше всех бендов выявилось у сорта Сильванер. В целом, после разделения сортов на две популяции (имеющие окрашенную и неокрашенную ягоду), количество ДНК-бендов на популяцию варьировало от 111 (Популяция 2) до 240 (Популяция 1).
В первую популяцию вошли неокрашенные сорта – Совиньон Таманский 114-35, Гарс Левелю, Серсиаль, Мускат белый 7-10-4, Мускат белый 20-11-1a, Сильванер. Вторую популяцию составили, соответственно, сорта
с окрашенной ягодой – Бургундский, Португальский синий, Пино черный.
Таким образом, в результате исследований, наибольшее количество ДНК-бендов сгенерировала первая популяция, что, скорее всего, может быть объяснено большим количеством генотипов, включенных в нее (рисунок 12). Анализ в программе GenAlEx 6.3 показал, что процент полиморфных бендов в первой популяции составил 62,75 %, что соответствует 33 шт., во второй –
52,94 %, или 58 шт.
Как видно из полученных данных, в обеих популяциях достаточно высокое генетического разнообразие, несмотря на то, что в первой популяции изначально больше исследуемых образцов. При этом, всего в выборке выявлено 36 частных ДНК-бендов: 23 – у первой популяции и 13 – у второй.
Также, по результатам анализа всего было обнаружено 76 категорий бендов у Популяции 1 и 66 – у Популяции 2. При этом все ДНК-бенды встречаются в популяциях с частотой не менее 5 %, как было выявлено при анализе частот встречаемости аллелей по каждой из популяций отдельно в программе GenAlEx.
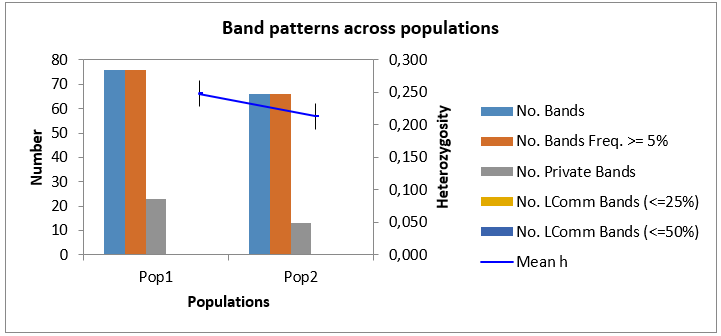
Рисунок 12 – Анализ частот встречаемости аллелей в изученных популяциях
Так, для дальнейшего анализа в программе MEGA7 было сгенерировано кластерное древо с целью изучения родственных взаимоотношений между выбранными для исследования сортами (рисунок 13).
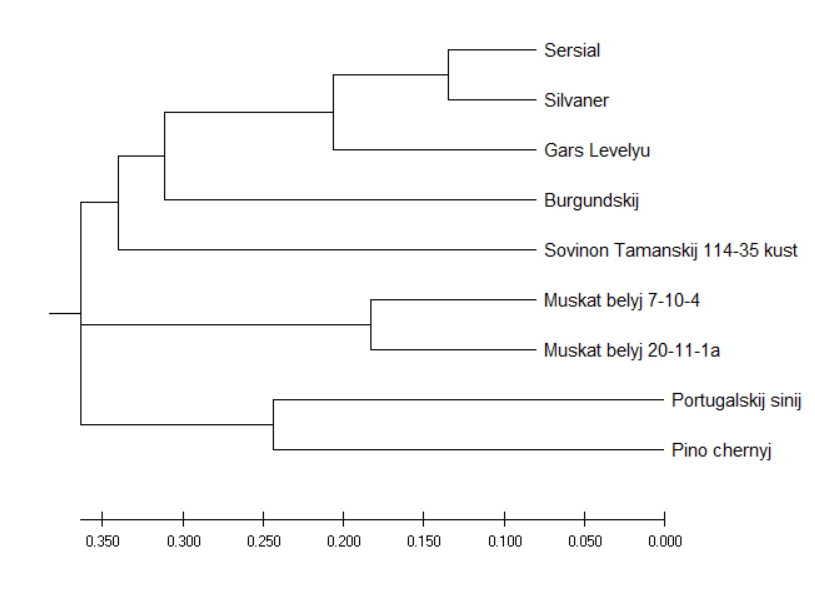
Рисунок 13 – Дендрограмма исследуемых сортов
Как видно из дендрограммы, все имеющиеся генотипы были разделены на три макрокластера, в одном из которых отдельно ото всех были выделены сорта Португальский синий и Пино черный, что является интересным в виду центрально-европейского происхождения первого сорта (Словения) и французского происхождения второго сорта. Это можно объяснить обменом генетическим материалом, который происходил между европейскими странами. Другой же макрокластер разделился на отдельные микрокластеры, и, что было ожидаемо, два клона – Мускат белый 7-10-4 и Мускат белый 20-11-1ф, были объединены программой вместе. Другие же макрокластеры образованы остальными западноевропейскими сортами. К сожалению, объяснить их расположение в кластерном древе и, соответственно, родство между собой представляется сложным, в виду того, что наличие их общих предков присутствует только в очень давних поколениях.
Далее, для более детального изучения и сравнения результатов, нами был проведен координатный анализ Principal Coordinates Analysis (PCoA).
В результате чего было выявлено похожее разделение генотипов, что представлено на рисунке 14.

Рисунок 14 – Principal Coordinates Analysis
Как видно из рисунка 13, клоны Мускат белый 7-10-4 и Мускат белый 20-11-1а расположены рядом на координатной плоскости, что было вполне ожидаемо и очевидно ввиду их крайне близкого родства. Однако на графике они находятся отдельно от всех остальных сортов, в то время как на кластерограмме они обособлены в отдельном кластере. Возможно, это объясняется тем, что сорт был выведен на востоке Азии. Также, на кластерограмме клоны Пино черный и Португальский синий расположены рядом, в то время как на координатном анализе Пино черный оказался рядом с Совиньоном Таманским. Данное расположение также достаточно сложно объяснить, в виду того, что родительские формы до сих пор неизвестны, равно как и другие родственные им сорта. Тем не менее, оба сорта являются французскими, поэтому такое расположение вполне объяснимо со стороны географического происхождения и выделения их из одного генетического бассейна. Интересно также и то, что между ними и Гарс Левелю располагается сорт Бургундский, что подтверждает и кластерограмма. Серсиаль и Сильванер и на кластерограмме, и на координатном анализе находятся рядом, что также может указывать на, отдаленное родство и наличие некоторых схожих между собой аллелей.
Можно заключить, что генетический анализ клонов интродуцентов с использованием iPBS маркеров может выполнятся в процессе создания новых сортов винограда, так как каждый из маркеров показал достаточную степень амплификации. Однако результаты неоднородные, и самые низкие показал маркер iPBS 2415 (70 ДНК-бендов), а самые высокие – iPBS 2230 (111 ДНК-бендов). Несмотря на это, различия могут быть лишь следствием немного отличающихся концентраций ДНК, и все маркеры одинаково эффективны.
Анализ в программе MEGA7 показал четкое разделение всех сортов на три макрокластера. Интересно, что сорта Португальский синий и Пино черный были выделены в отдельный макрокластер. Это явление можно объяснить обменом генетическим материалом между Европейскими странами, который мог происходить раньше. Остальные макрокластеры образованы другими заподноевропейскими сортами. Координатный анализ показал аналогичное анализу в программе MEGA7 расположение всех сортов, включая Португальский синий и Пино черный. Однако здесь рядом с ними также находится Совиньон Таманский, что может подтверждать обмен генетическим материалом между этими странами и, соответственно, отдаленное родство этих сортов. Сорта Серсиаль, Гарс Левелю и Сильванер находятся рядом как на кластерограмме, так и на координатной плоскости PCoA анализа.
В свою очередь, это указывает на их отдаленное родство и распределение схожих аллелей между этими генотипами. Очевидно и то, что оба клона сорта Мускат белый были расположены рядом. Тем не менее, обе точки не находились в одном положении, что говорит о наличии изменений в геноме, вызванными ретротранспозонами, что в принципе не является чем-то необычным, так как этот сорт является старинным и претерпел множество вегетативных генераций. Тем более что данные клоны имеют различное территориальное происхождение и, соответственно, отобраны от разного материнского материала. Интересным же было и то, что такие сорта как Бургундский и Совиньон Таманский (клон сорта Совиньон блан) располагались в разных местах на координатной плоскости и на кластерограмме. В частности, на кластерограмме они были определены программой как наиболее близкие из данной выборки к группе сортов Серсиаль, Гарс Левелю и Сильванер, в то время как PCoA анализ показал их расположение как более близкое к сортам Португальский синий и Пино черный. Тем не менее, можно предположить, что сорт Бургундский был выведен с использованием стародавних французских сортов, как исходного селекционного материала.
По итогам анализирования удалось установить, что маркер Vine-1 выявил 82 ДНК-бенда, при этом их наименьшее количество оказалось у сорта Яй изюм розовый – 4 шт., и такое же количество у сорта Яй изюм белый. Наибольшее же количество сгенерированных бендов (10 шт.) оказалось
у сорта Чиляки 1-23 (35-36). Молекулярный маркер iPBS 2415 выявил
в сумме 107 ДНК-бендов для всех сортов, при наибольшем количестве у сорта Каринка белая мутация – 14 бендов, а наименьшее у Цимлянского черного – всего 2 бенда. Маркер iPBS 2074 выявил 128 бендов в целом. Наименьшее их количество для данного маркера было у сорта Цимлянский черный – 7 шт., а наибольшее у Кумшатского и Чиляки 1-23 (35-36) – по 13 ДНК-бендов у каждого. Маркер iPBS2230 выявил 127 ДНК-бендов в сумме, наибольшее количество наблюдается у сорта Августин – 23 шт., а наименьшее у Слитного – 2 шт.
В целом при амплификации все маркеры в совокупности сгенерировали 444 ДНК-бенда. Наилучший результат показал маркер iPBS 2072 – с его помощью обозначилось 128 ДНК-бенда, а наименьшее количество получилось с молекулярным маркером Vine-1 – 82 ДНК-бенда. Однако это не говорит
о наибольшей эффективности конкретного маркера, и скорее всего связано
с немного варьируемой концентрацией ДНК в анализе. Далее все сорта были разделены на две популяции по принципу наличия окраски (окрашенные
и неокрашенные сорта), при этом, в первую популяцию вошли такие сорта, как Кумшатский, Чиляки 1-23 (35-36), Каринка белая мутация, Августин, Яй изюм белый, Кишмиш белый овальный (Султанина), а во второю популяцию неокрашенных сортов – Варюшкин 9 ряд кл 19, Слитной, Достойный, Яй изюм розовый, Кишмиш красный туркменский, Цимлянский черный. В этом случае количество бендов составило 243 шт. – для популяции неокрашенных сортов и 201 шт. – для популяции окрашенных сортов. Очевидно, что большее количество сгенерированных ДНК-бендов у популяции, в которую входят неокрашенные сорта, однако, это объясняется лишь количественным преимуществом неокрашенных сортов в выборке, так как отбор производился рандомизированным методом. Следующим этапом стало проведение анализа в среде Microsoft Excel, используя макрос GenAlEx 6.3. Было выявлено, что процент полиморфных бендов в первой популяции составил 60,78 %, а во второй – 59,80 %. В общем. процент полиморфности для всех генотипов 84,31 %. При этом количество частных бендов в первой популяции равно
22 шт., а во второй – 14 шт. Также анализ позволил установить, что количество категорий ДНК-бендов у первой популяции равно 78 шт., а у второй – 70 шт., и их частота не превышает 5 %, что было выявлено в результате анализа частот встречаемости (рисунок 15).
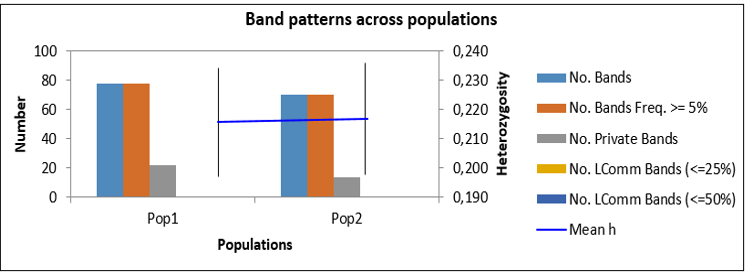
Рисунок 15 – Анализ частот встречаемости аллелей в изученных популяциях
В ходе проведения анализа данных в программе MEGA7 было визуализировано кластерное древо, отражающее родственные связи внутри и между изучаемыми популяциями. Древо представлено на рисунке 16.
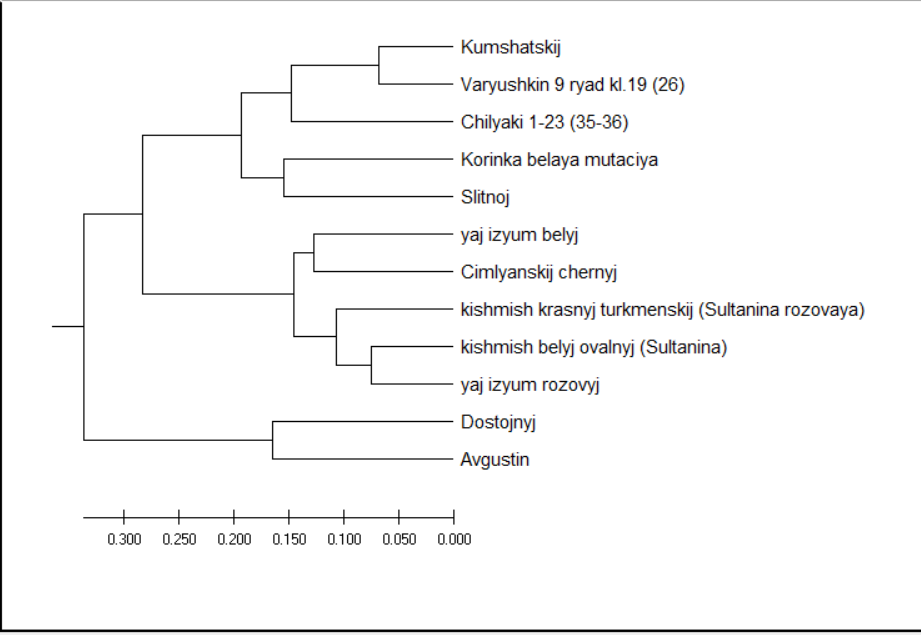
Рисунок 16 – Дендрограмма исследуемых сортов
Как видно из сложившейся дендрограммы, все исследуемые генотипы аборигенных сортов были разделены на два макрокластера. Можно заметить, что сорта Достойный и Августин при этом обособлены в отдельный макрокластер ото всех остальных. Такое разделение можно объяснить тем, что они являются сортами новой селекции, и именно поэтому вынесены отдельно ото всех. Так, сорт Достойный был получен на Анапской зональной опытной станции виноградарства и виноделия (АЗОСВиВ) в результате скрещивания двух сортов – Филлоксероустойчивый Джемете и Мускат Гамбургский, и зарегистрирован в Госреесте РФ в 2002 г., а сорт Августин продукт скрещивания Плевен и Виллар блан, и принадлежит к числу достижений болгарской селекции, также был зарегистрирован в Госреестре РФ в 2002 г. Скорее всего, если они генетически отличаются от остальных сортов в выборке, то и их родители тоже имеют такие отличия. Тот факт, что сорта Кишмиш красный туркменский (Султатнина розовая) и Кишмиш белый овальный (Султанина), расположены рядом, объясняется их близким родством и происхождением (Ближний Восток). Сорта Яй изюм белый и Яй изюм розовый расположились вполне ожидаемо. Оба сорта являются столовыми дагестанскими сортами, и располагаются в одном макрокластере. Но Яй изюм белый принадлежит группе восточных сортов, а Яй изюм розовый группе сортов бассейна Черного моря, и о происхождении Яй изюм белого в настоящий момент нет сведений, в то время как Яй изюм розовый включен в районированный сортимент винограда.
Для более четкого представления о родственных связях сортов выборки был проведен координатный анализ Principal Coordinates Analysis (PCoA). Результаты представлены на рисунке 17.
Результаты оказались следующими: Кишмиш красный туркменский (Султанина розовая) и Кишмиш белый овальный (Султатнина) расположены в разных частях координатного анализа, в то время как на дендрограмме они находятся рядом. Яй изюм белый и Яй изюм розовый находятся практически аналогично дендрограмме, а между ними Цимлянский черный. При чем, он все же ближе к Яй изюму розовому, что можно объяснить его принадлежностью к эколого-географической группе сортов бассейна Черного моря, так же как и Яй изюм розовый. Аналогично с дендрограммой расположились сорта Августин и Достойный. Так же на кластерограмме Кумшатский и Варюшкин 9 ряд кл 19 обозначены рядом, и это вполне объяснимо ввиду того, что они оба являются донскими аборигенными сортами.
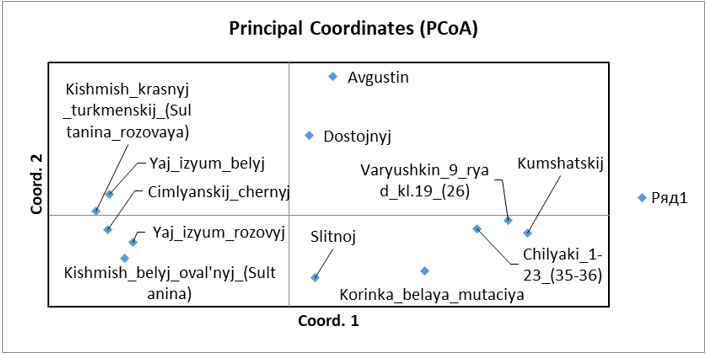
Рисунок 17 – Координатный анализ Principal Coordinates Analysis
Как показали результаты всех проведенных испытаний, молекулярно-генетические маркеры IPBS, а именно iPBS2074, iPBS2230, iPBS2415, Vine-1, могут успешно использоваться в доселекционных исследованиях культуры
V. vinifera, так как каждый из использовавшихся маркеров показал достаточную степень амплификации. Результаты варьируются следующим образом: наименьшее количество сгенерированных бендов принадлежит маркеру Vine-1 – 82, а наибольшее iPBS 2074 – 128 ДНК-бенда. Получившуюся вариабельность можно объяснить концентрационным превосходством нуклеиновых кислот в некоторых образцах. При обращении к результатам, полученным в ходе работы в программе GenAlEx 6.3, можно заключить, что в процент полиморфности для всех генотипов составил 84,31 %, что подтверждает факт эффективности IPBS маркеров в изучении аборигенных сортов. Координатный анализ Principal Coordinates Analysis также показывает вполне ожидаемые и логичные результаты.
При сравнении данной группы сортов, количество сгенерированных при амплификации ДНК бендов в совокупности для всех маркеров – 795 шт. При этом, количество бендов у маркера Vine-1 – 160 бендов всего, с наименьшим количеством у сорта Цимлянский черный – 4 шт., и с таким же у сортов Яй изюм белый и Яй изюм розовый, наибольше же количество бендов принадлежит сорту Бургундский – 11 шт. Молекулярный маркер IPBS2230 в процессе анализа выявила 238 ДНК-бенда, из которых больше всего их оказалось у сорта Августин – 23, а меньше всего Слитной – 2. Маркер IPBS 2074 сгенерировал всего 220 ДНК бенда, из которых самым высоким результатом обладает сорт Кумшатский – 13, наряду с Чиляки 1-23 (35-36), Серсиаль
и Гарс Левел. Молекулярный маркер IPBS 2415 показал 177 ДНК-бенда, в то время как меньше всего их принадлежит сорту Цимлянский черный – всего 2, а больше Совиньон Таманский 114-35 и Коринка белая мутация – по 14 бендов каждый.
После того, как была проанализирована эффективность выполненного анализа, и получены удовлетворительные результаты, все исследуемые сорта винограда разделили на две большие группы по принципу их окраски ягод,
а именно на сорта, обладающие белой окраской ягод и сорта окрашенные, обладающие черной окраской ягод. В группу неокрашенного (белого) винограда вошли следующие сорта: Мускат белый 7-10-4, Мускат белый 20-11-1а, Серсиаль, Сильванер, Гарс Левелю, Совиньон Таманский 114-35, Кишмиш красный туркменский (Султатнина розовая), Яй изюм розовый, Кишмиш белый овальный (Султанина), Яй изюм белый, Августин, Коринка белая мутация, Чиляки 1-23 (35-36). Вторую же группу составили сорта, обладающие черной окраской ягод (окрашенные), а именно: Кумшатский, Варюшкин 9 ряд кл 19, Слитной, Достойный, Цимлянский черный, Бургундский, Португальский синий, Пино черный. Далее были произведены подсчеты, в ходе которых было выявлено, что количество ДНК-бендов для популяции неокрашенных сортов составило 471 шт., а для популяции, состоящей из окрашенных сортов – 323 шт. В целом, количество сгенерированных бендов не сильно отличается в популяциях, а незначительные расхождения вызваны неодинаковым количеством сортов винограда в каждой группе. Следующим шагом стало проведение анализа с помощью макроса GenAlEx 6.3 для среды Microsoft Excel. Используя его, были получены результаты, отражающие процент полиморфности для всех генотипов – 98,04 %, а также для первой популяции – 85,29 % и для второй – 67,65 %. При этом, количество частных ДНК-бендов в первой популяции равно 25, а во второй – 9. Также было установлено, что количество категорий бендов для первой популяции равно
93 шт., а для второй – 77 шт., а также их частота встречаемости остается не выше 5 %, что было выявлено в ходе анализа частот встречаемости, соответственно (рисунок 18).
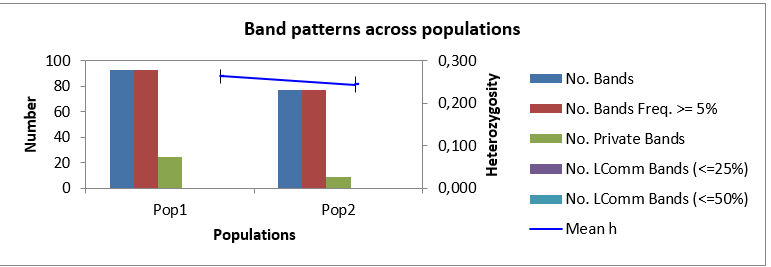
Рисунок 18 – Анализ частот встречаемости
После проведенных подсчетов, в программе MEGA 7 было сгенерировано кластерное древо, которое демонстрирует родственные связи исследуемых сортов внутри и между популяциями. Данное древо представлено на рисунке 19.
Как можно увидеть исходя из представленного изображения, все сорта винограда, используемые в исследовании, разделились на два макрокластера. Вполне ожидаемо в одном кластере оказались такие сорта, как Яй изюм белый и Яй изюм розовый – они оба являются дагестанскими сортами винограда. Однако Яй изюм белый – группа восточных сортов, в то время, как Яй изюм розовый включен в районированный сортимент винограда и относится к сортам бассейна Черного моря, а вот о происхождении Яй изюм белого
в настоящий момент ничего неизвестно. Так же, рядом с ними расположились сорта Кишмиш белый овальный (Султанина) и Кишмиш красный туркменский (Султанина розовая), что тоже является вполне логичным, так как оба сорта относятся к эколого-географической группе восточных сортов винограда.
Рисунок 19 – Кластерное древо исследуемых сортов, построенное
с помощью программы MEGA 7
Виноград сорта Цимлянский черный аналогично находится в том же кластере, однако относится по своим морфологическим признакам к эколого-географической группе сортов винограда бассейна Черного моря. Слитной
и Гарс Левелю, расположившиеся в следующим кластере, находятся близко друг к другу. Это можно объяснить тем, что данные исследуемые сорта оба принадлежат к группе сортов винограда бассейна Черного моря. Серсиаль, берущий начало происхождения в Португалии, относится к группе сортов винограда Северной Африки, однако, рядом с ним на кластерном древе расположился Сильванер. Возможно, это объясняется тем, что его родина – Центральная Европа, а относится он к эколого-географической группе западноевропейских сортов винограда, что относительно недалеко от Северной Африки, и в целом можно предположить их далекое родство ввиду этого факта. Сорт винограда Бургундский является словенским сортом. Чиляки, находящийся с ним в одном кластере, – группа восточных сортов винограда. Также, сорта Мускат белый 7-10-4 и Мускат белый 20-11-1а совершенно ожидаемо находятся рядом. Сорта Августин и Достойный были селекционированы относительно недавно, что и объясняет их расположение на дендрограмме, а именно рядом и обособленно.
Для того чтобы сформировать наиболее четкое представление о родственных связях винограда исследуемых сортов, был проведен Principal Coordinates Analysis (PCoA), результаты которого можно видеть на рисунке 20.

Рисунок 20 – Principal Coordinates Analysis (PCoA)
Результаты оказались следующими: сорт винограда Достойный расположился между сортами Мускат белый 7-10-4 и Мускат белый 20-11-1а, в то время как на дендрограмме между ними нет никаких других сортов, но Августин по-прежнему находится рядом с Достойным, и, в целом, расположение всех четырех сортов соответствует их расположению на кластерном древе. По остальным сортам точно также можно сказать, что существенных отличий кластерного древа и анализа PCoA не обнаружено.
Полученные результаты проделанной работы свидетельствуют о том, что молекулярно-генетические маркеры IPBS, использовавшиеся в исследовании, а именно Vine-1, IPBS2415, IPBS2415, IPBS2074, успешно проявили себя. Степень их амплификации оказалась достаточно высока для того, чтобы вышеназванные маркеры могли служить инструментом в доселекционных
и послеселекционных испытаниях, а именно: маркер Vine-1 в процессе амплификации успешно сгенерировал 160 ДНК-бенда, маркер IPBS 2415 выявил 177 ДНК-бенда, маркер IPBS2074 – 220, и, наконец, IPBS2230 успешно сгенерировал 238 ДНК-бенда. Таким образом, наиболее успешно проявил себя IPBS2230, количество его бендов наибольшее среди всех, а наименьшее,
в свою очередь, имеет маркер Vine-1. Однако полученные результаты нельзя интерпретировать как превосходство того или иного маркера, так как выборка образцов сортов винограда производилась рандомизированным методом
и оказалась неравномерной, а значит, все маркеры имеют одинаковую эффективность. Это суждение доказывает анализ, проведенный в программе GenAlEx 6.3 и показавший процент полиморфности 98,04 % для всех образцов. То же самое относится к Principal Coordinates Analysis, показавшему ожидаемые и логичные результаты.
Далее в наших исследованиях амплификация использованных в работе молекулярных маркеров дала всего 2316 полос ДНК (таблица 9). Размер амплифицированных полос ДНК составлял от 300 до 3000 пар оснований. Для каждого генотипа количество полос варьировалось от минимального 97 (Жупски Баджадисер) до максимального 166 (Кульджинский и Сибирьковый). Все генотипы были разделены на три популяции: сортовые гибриды (Популяция 1), современные сорта (Популяция 2) и аборигенные сорта (Популяция 3). После амплификации у первой популяции было выявлено 548 полос, в то время как 329 и 1439 полос ДНК были идентифицированы для второй и третьей популяции. Эти цифры можно объяснить количеством генотипов, входящих в каждую группу. Таким образом, наибольшее количество генотипов и, следовательно, полос ДНК отмечено в Популяции 3. Как мы видим, такой же способ распределения числа был идентифицирован для другого значения. Так, наибольшее разнообразие было выявлено в Популяции 3 (0,225), но количество разнообразия в Популяции 1 (0,222) было немного ниже, что можно объяснить сложным происхождением и родословной местных генотипов, выбранных для исследования, что также согласуются и с результатами исследования AMOVA (таблица 10): среди популяций – 28
и 72 % внутри популяций. Ожидается, что такая высокая величина вариации между популяциями была выявлена из-за присутствия сортовых гибридов
и ранее уже была продемонстрирована для винограда и других видов, а также для различных типов молекулярных маркеров [131, 157, 219].
Таблица 9 – Результаты наблюдаемого генетического разнообразия
и оценки полос
| № | Название | PN | NTI | TNB | PB | PPL (%) | NPB | Индекс Шеннона | Разнообразие |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 1 | Кобер 5ББ | 1 | 101 | – | – | – | – | – | – |
| 2 | 420A | 1 | 113 | – | – | – | – | – | – |
| 3 | 101 14 | 1 | 101 | – | – | – | – | – | – |
| 4 | Паульсен | 1 | 130 | – | – | – | – | – | – |
| 5 | Рихтер | 1 | 103 | 548 | 304 | 55.43 | 49 | 0.326 | 0.222 |
| 6 | Антарис | 2 | 127 | – | – | – | – | – | – |
| 7 | Жупски Баядисер | 2 | 97 | – | – | – | – | – | – |
| 8 | Амур | 2 | 105 | 329 | 115 | 35.10 | 17 | 0.223 | 0.156 |
| 9 | Будай шули | 3 | 121 | – | – | – | – | – | – |
| 10 | Гок изюм | 3 | 131 | – | – | – | – | – | – |
| 11 | Гюляби дагестанский | 3 | 163 | – | – | – | – | – | – |
| 12 | Аг изюм | 3 | 127 | – | – | – | – | – | – |
| 13 | Агадаи | 3 | 137 | – | – | – | – | – | – |
| 14 | Гок ала | 3 | 144 | – | – | – | – | – | – |
| Продолжение таблицы 9 | |||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 15 | Яй изюм розовый | 3 | 153 | – | – | – | – | – | – |
| 16 | Яй изюм белый | 3 | 131 | – | – | – | – | – | – |
| 17 | Сибирьковый | 3 | 166 | – | – | – | – | – | – |
| 18 | Кульджинский | 3 | 166 | 1439 | 977 | 67.90 | 96 | 0.343 | 0.225 |
| Всего | – | 2316 | – | 2241 | 96.77 | 162 | 0.460 | 0.298 | |
| Примечание: PN – численность популяции; NTI – количество амплифицированных полос на генотип; TNB – общее количество полос на популяцию; PB – количество полиморфных полос; PPL – процент полиморфных полос; NPB – количество частных бендов. | |||||||||
Таблица 10 – Результаты анализа AMOVA
| Показатель | df | SS | MS | Est. Var. | Процент | P |
| Между популяциями |
2 | 333.189 | 166.594 | 21.093 | 28 | <0.001 |
| Внутри популяций | 15 | 829.033 | 55.269 | 55.269 | 72 | <0.001 |
| Всего | 17 | 1162.222 | – | 76.362 | 100 | – |
| Примечание: df – степень свободы, SS – сумма квадратов, MS – средний квадрат, Est. Var. – расчетная дисперсия, P – вероятность (данные r и ≥) для сравнения между различными популяциями и генотипами. | ||||||
Расчетная дисперсия среди популяций составила 21,093, внутри популяций – 55,269, а общее количество – 76,362. Эти результаты также отражают комплексное разнообразие этого исследования и наличие видов и разновидностей. В частности, дисперсия среди популяций была ниже, чем внутри популяций, что согласуется с исследованием AMOVA. Кроме того, изменчивость внутри популяций показывает сложную генетическую структуру выбранных генотипов и наличие смешанных географических групп.
Результаты в таблице 11 представляют попарное генетическое расстояние Нея [199] между исследуемыми популяциями. Интересно, что Популяция 3 (включая местные генотипы) показала самые высокие значения расстояния Нея по сравнению с Популяциями 1 и 2, которые были немного ближе друг к другу. Эти результаты можно объяснить межвидовым происхождением сорта Амур, одним из родителей которого является Датье де Сен-Валье. Но как мы увидим позже (рисунок 21), этот сорт был расположен рядом с европейскими разновидностями V. vinifera, что, в свою очередь, предполагает, наличие большего количества общих аллелей с европейскими разновидностями, чем с американскими видами или изученными местными образцами. В любом случае, более высокая разница в Популяции 3 может указывать на очевидное дальнее родство с европейскими гибридами V. vinifera и, тем более, с американскими видами.
Таблица 11 – Парная популяционная матрица генетического расстояния Неи
| Популяция 1 | Популяция 2 | Популяция 3 | |
| Популяция 1 | 0.000 | – | – |
| Популяция 1 | 0.180 | 0.000 | – |
| Популяция 1 | 0.205 | 0.212 | 0.000 |
Генетические отношения изученных сортов винограда были оценены
с помощью кластеризации и анализа главных компонентов. В частности, для этой оценки использовались два набора маркеров (на основе ретротранспозонов и SSR). Кроме того, используемые программы имеют различный набор методов и моделей, поэтому мы используем два метода, выставленные в программах по умолчанию (метод максимального правдоподобия для MEGA X
и Weighted Neighbor-Joining для DARWin 6.0). Наконец, генотипы были включены в два кластерных дерева и разделены на отдельные кластеры, после чего они сравнивались. Учитывая тот факт, что не все генотипы представлены в базе данных VIVC, мы исключили некоторые генотипы из дерева SSR.
Дерево, построенное с использованием данных об аллелях ретротранспозонов (рисунок 22), было разделено на три кластера. В первый кластер вошли аборигенные сорта, во второй – современные сорта, полученные скрещиванием западных сортов, а в третий – межвидовые гибриды. Очевидно, это подразумевает способность маркеров определять различия между происхождением образцов, в то время как близкородственные образцы группируются вместе. Затем, как мы видим, некоторые известные разновидности (Яй изюм белый и Яй изюм розовый) были помещены вместе, что предполагает их реальное близкое родство. То же самое мы видим при сравнении межвидовых скрещиваний. Интересно, что Kober 5BB, 420 и Richter были близки друг к другу, что предполагает наличие общих аллелей.
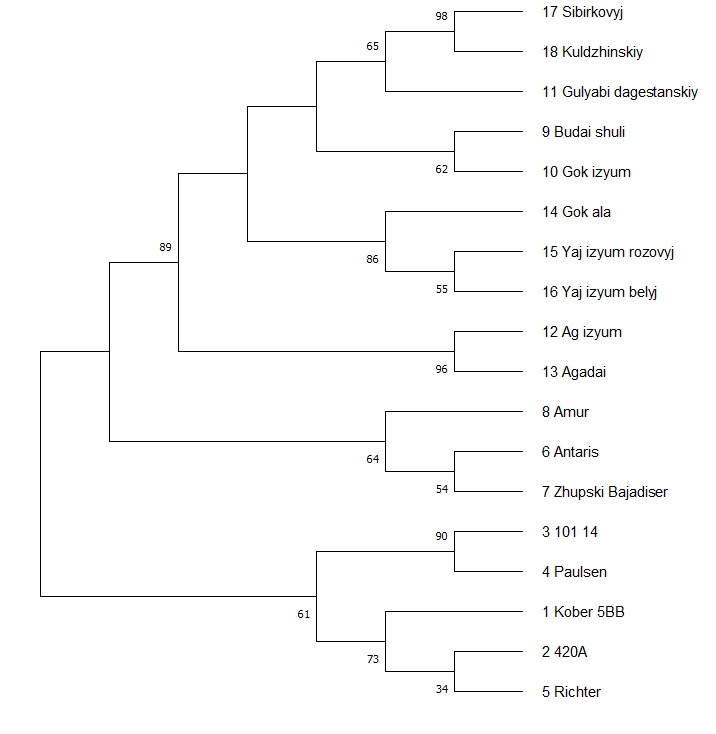
Рисунок 21 – Древо, построенное с помощью программы MEGA X
методом максимального сходства (все бутстрепы ниже 50 были скрыты)
Построение дерева на основе микросателлитов выявило также родство исследуемых выборок. Например, таким же образом Яй изюм белый и Яй изюм розовый были помещены вместе, и родство сортов Сибирьковый
и Кульджинский было подтверждено также этим типом генетических маркеров. Кроме того, сорт Гок изюм был помещен рядом с этими генотипами, в то время как Будай шули находился близко к Гок ала. Тем не менее, построенное дерево было разделено на две общие группы, имеющие схожую форму
с древом, основанным на данных о ретротранспозонах. Например, Гок ала был помещен в подкластер рядом с подкластером Яй изюм. Таким образом, для дальнейшего сравнения мы провели анализ главных компонентов (рисунок 23 и 24) также для обоих наборов маркеров.

Рисунок 22 – Дерево, построенное с помощью программы DARWin 6.0
методом Weighted Neighbor-Joining
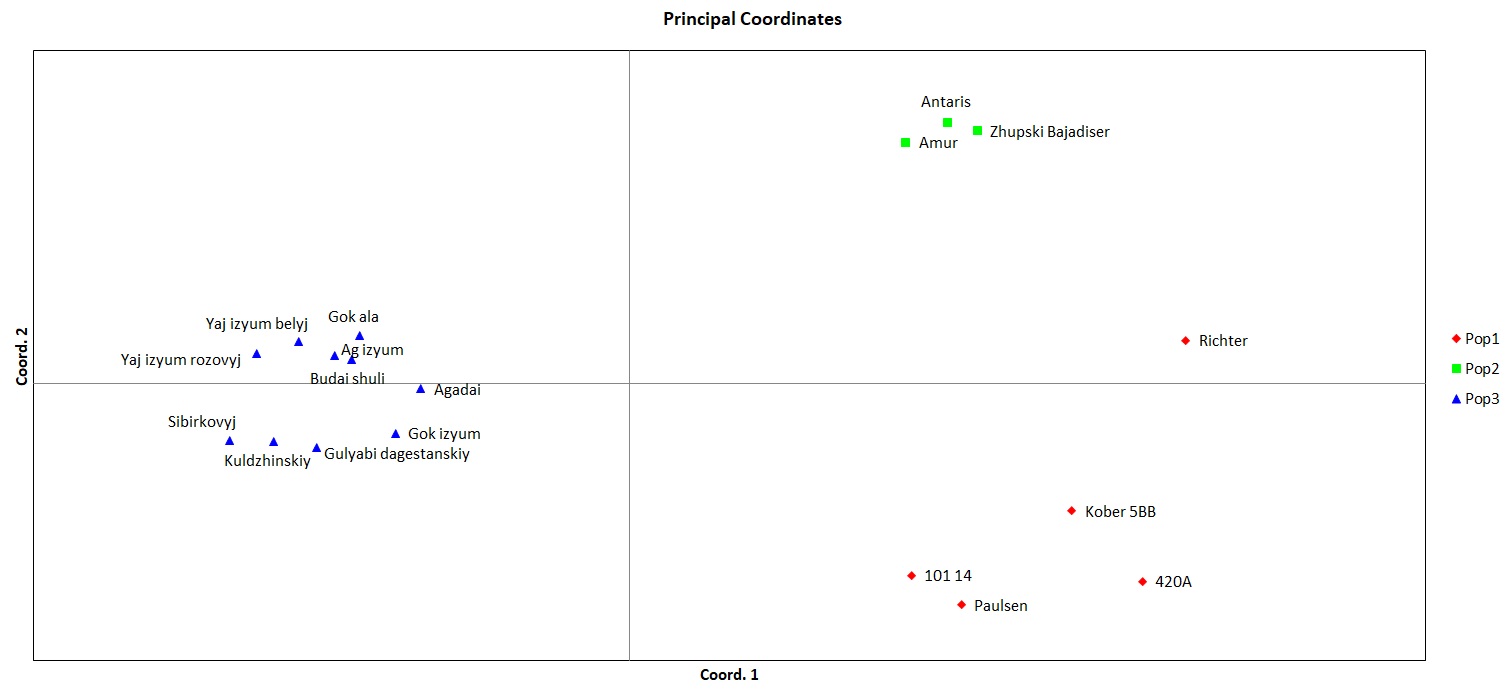
Рисунок 23 – Анализ главных компонент, построенный на основе
набора ретротранспозоных маркеров
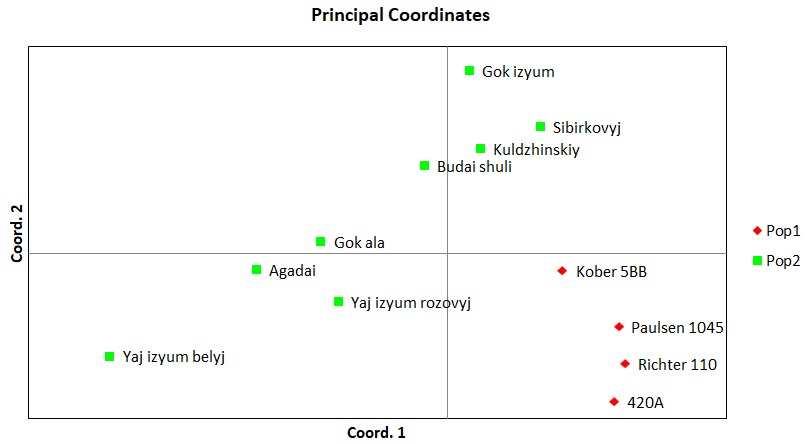
Рисунок 24 – Анализ главных компонент, построенный на основе
набора SSR маркеров
Анализ главных компонент, построенный на основе набора ретротранспозонных маркеров, выявил три основных кластера изучаемых генотипов.
В основном, они были разделены также, как и кластерное дерево: слева – аборигенные сорта, вверху – современные сорта, полученные скрещиванием западных сортов, и внизу – межвидовые гибриды, что согласуется с данными кластеризации. Для ветви межвидовых гибридов была сохранена та же основная форма, но на этот раз сорта Рихтер не было в основном кластере. Что касается аборигенных сортов, большинство из них были помещены в одну
и ту же форму, но, например, Аг изюм и Будай шули были близко к расположению Яй изюм белый и Яй изюм розовый.
Для анализа основных компонент по данным SSR маркеров, мы видим, что были идентифицированы три пула генотипов. Очевидно, сначала были поданы подвои, но два других кластера разделили генотипы аналогичным образом в результате PCoA по данным амплификации ретротранспозонов. Как видим, положение генотипа Будай шули было смещено.
Всего амплификация всех трех популяций дала 2316 полос ДНК. Как
и ожидалось, Популяция 3 имела максимальное количество полос ДНК (1439), что можно объяснить наибольшим количеством генотипов, включенных в эту группу. Но разнообразие в третьей популяции было несколько выше (0,225), чем в Популяции 1 (0,222), что объясняется сложной генетической структурой первой группы, поскольку в этот пул вошли генотипы, отобранные в результате межвидовых скрещиваний. С другой стороны, эти результаты интересны, потому что на самом деле Популяция 3, состоящая только из аборигенных сортов, имела более высокий уровень разнообразия, чем межвидовая популяция, и, кроме того, имеет самый высокий процент полиморфных полос на популяцию. Таким образом, это предполагает их смешанное происхождение и, возможно, участие аборигенной дикорастущей виноградной лозы (Vitis silvestris Gmel.) в ее селекции, поскольку один из центров происхождения культивируемой виноградной лозы находится на Кавказе [195, 262]. Более того, это, возможно, объясняется расположением этого региона вблизи торговых путей и миграции людей и, как следствие, предполагает участие разных регионов в селекции сортов винограда этого региона [156]. Кроме того, анализ AMOVA выявил высокий генетический полиморфизм в популяции, что также подтверждает результаты, что они имеют смешанную генетическую структуру, и, также, предполагает высокое фенотипическое разнообразие между выбранными генотипами [154]. Также, мы попытались соотнести уровень разнообразия с количеством полос, генерируемых каждым генотипом. Для этого мы пошагово исключили каждый сорт и пересчитали «Параметры данных частоты аллелей» в GenAlEx. Таким образом, результаты их влияния представлены в таблице 12.
Таким образом, мы обнаружили, что исключение генотипов, имеющих 131 и меньшее количество полос, привело к увеличению уровня разнообразия. Это означает, что у них, прежде всего, имеются с остальными общие аллели, и, в меньшей степени, уникальные. Напротив, исключение генотипов
с большим количеством полос привело к снижению уровня разнообразия. Интересно, что исключение из пула сорта Агадаи привело к значительному снижению разнообразия, что может свидетельствовать о том, что этот генотип имеет большое количество уникальных бендов по сравнению с другими генотипами. Вероятно, это также и привело к его «плавающему» положению при кластеризации и в координатах PCoA.
Таблица 12 – Эффект пошагового исключения генотипа из Популяции 3
| Название исключенного из выборки образца |
Количество бендов на генотип |
Уровень разнообразия после исключения из выборки |
| Будай шули | 121 | 0.230 |
| Гок изюм | 131 | 0.227 |
| Гюляби дагестанский | 163 | 0.218 |
| Аг изюм | 127 | 0.225 |
| Агадаи | 137 | 0.214 |
| Гок ала | 144 | 0.221 |
| Яй изюм розовый | 153 | 0.223 |
| Яй изюм белый | 131 | 0.226 |
| Сибирьковый | 166 | 0.219 |
| Кульджинский | 166 | 0.217 |
Как и ожидалось, оба дерева (на основе ретротранспозонных и на SSR данных) были разделены на два суперкластера, которые включали генотипы Vinifera и не-Vinifera. Дерево на основе ретротранспозонных данных и его ветви были разделены на подкластеры, состоящие из местных и зарубежных разновидностей. Таким образом, один из подкластеров (состоящий из сортов Амур, Антарис и Жупски Баджадисер) был помещен между сортами не-Vinifera и Vinifera, что объясняется их происхождением и, в частности, межвидовым происхождением сорта Амур ((Nimrang × Pamyati Мечурина) × Даттье де Сен-Валлье [175]). Очевидно, что расположение сорта Амур предполагает, что этот генотип имеет больше аллелей, полученных от генотипов, принадлежащих к V. vinifera. Результаты, касающиеся генетики подвоев, отражают их родословную и согласуются с предыдущими исследованиями [162]. Кроме того, неожиданным оказалось то, что 101 14 и Paulsen 1045 были помещены вместе, но это могло быть объяснено родословной Paulsen 1045 (Berlandieri Resseguier 2 × Ganzin 1). Потому что происхождение Ganzin 1 включает Арамон × Рупестрис Ганзина (www.vivc.de/index.php?r=passport/
viewtree&id=4393), а родословная 101 14 – Рипария × Рупестрис. Несмотря на то, что в ходе SSR-анализа мы исключили некоторые генотипы, из-за отсутствия информации об их микросателлитных последовательностях, форма древа на основе микросателлитов была похожей. В частности, Richter 110 и 420A были помещены вместе, а также Kober 5BB был, ожидаемо, расположен рядом
с Paulsen 1045, в виду того, что на древе на основе данных о ретротранспозонных аллелях, этот образец был помещен между двумя суб-ветвями.
При сравнении двух древ не было выявлено четкого местонахождения сортов Агадай и Гок изюм. С одной стороны, это может означать их сложную родословную (что, например, согласуется с результатами изучения изменения уровня разнообразия), но, с другой стороны, не были все данные SSR для всех изученных сортов, которые могут повлиять на результаты. В любом случае, в свете того, что мы не знаем точную родословную изучаемых сортов, мы можем подозревать, что эти два генотипа имеют аллели общие
с двумя группами сортов одновременно, и только включение дополнительных генотипов в исследуемый пул может прояснить понимание его происхождения. Но, к сожалению, даже если по литературным данным родословная известна, все равно, иногда она не может быть правильной [155, 205]. Напротив, мы можем видеть некоторые устойчивые позиции внутри обоих деревьев, например, сорта Яй изюм белый и Яй изюм розовый, а также Сибирьковый и Кульджинский были помещены вместе, и результаты, полученные с помощью двух маркерных систем, подтверждают их тесное родство.
И, по открытым данным, это очень интересно, потому что происхождение якобы из Казахстана [109] (что следует из названия, происходит из села Кульджинка, где впервые был обнаружен этот сорт), а сорт Сибирьковый (согласно Ампелографии СССР [198] был завезен из Венгрии на Дон). Но эта ситуация усложняется, если мы используем ампелографию СССР как основу для понимания происхождения Кульджинского, поскольку предполагается, что эта разновидность была завезена в Казахстан из Китая. В любом случае, результаты подтверждают друг друга, и этим тоже можно объяснить их родство, ведь все эти территории лежат недалеко от старых торговых путей, «Кульджинского тракта» из Китая [203]. Такие генотипы, как Будай шули
и Гок ала, были размещены аналогичным образом и входили в один субкластер с сортами Яй изюм белый и Яй изюм розовый. Что, вероятно, результат их близкого географического происхождения и, возможно, родства.
Использование анализа главных компонент показало аналогичные результаты кластеризации для обеих маркерных систем. Таким образом, PCoA, полученный с использованием системы маркеров на основе ретротранспозонов, сгруппировал все генотипы в три кластера (отмечены синим – для Популяции 1, зеленым – для Популяции 2 и красным – для Популяции 3), очевидно, разделенных по происхождению и родословной исследуемых образцов.
В отличие от предыдущих кластеризаций деревьев, Агадай и Гок изюм имели более строгое расположение. Таким образом, Гок изюм был помещен рядом
с Сибирьковым и Кульджинским, а Агадай был размещен программой вплотную к Яй изюм белый и Яй изюм розовый, что трудно объяснить.
И, наконец, схожие позиции занимали изученные сорта.
Восемнадцать генотипов виноградных лоз, принадлежащих к разным географическим группам и видам, были изучены с использованием маркеров на основе ретротранспозонов. В результате амплификации маркеров на основе ретротранспозонов было получено более двух тысяч полос ДНК, которые были подсчитаны и статистически проанализированы. В результате мы определили разный уровень разнообразия в трех популяциях. Уровень разнообразия в Популяции 1 по сравнению с Популяцией 2 предполагает сложное происхождение и, возможно, участие местных диких виноградных лоз (V. silvestris Gmel.) в процессе отбора. Кроме того, результаты теста AMOVA показывают нам высокую молекулярную дисперсию между популяциями, но это можно объяснить включением в исследовательский пул межвидовых гибридов. С другой стороны, интересные результаты были получены при вычислении генетического расстояния Нея, поскольку Популяция 3 показала высокую ценность по сравнению с обеими другими популяциями, что подразумевает уникальное происхождение изученных местных генотипов и, вероятно, отдаленное отношение к генотипам по сравнению с остальной выборкой. Учитывая то, что все отобранные образцы относятся к V. vinifera. Затем анализ данных на основе ретротранспозонов с помощью PCoA и кластеризации подтвердили эти результаты, поскольку Популяция 3 также была разделена как отдельные популяции. Наконец, были обнаружены некоторые ожидаемые и неожиданные отношения. Очевидно, такие генотипы, как Яй изюм белый
и Яй изюм розовый, располагались вместе. Но, как уже ранее упоминалось, было неожиданным, что сорта Сибирьковый и Кульджинский оказались рядом друг с другом по результатам обоих анализов (на основе ретротранспозонов и на основе SSR), что трудно объяснить, но можно предположить древнюю связь между изученными регионами старыми торговыми и миграционными путями.
ВЫВОДЫ
Проведенные нами исследования позволили осуществить молекулярно-генетический анализ особенностей строения геномов аборигенных и интродуцированных сортов винограда с использованием маркеров, основанных на присутствии ретротранспозонных последовательностей в ядерном геноме.
Впервые было выполнено изучение аборигенных, интродуцированных
и подвойных сортов винограда, содержащихся в Анапской зональной ампелографической коллекции Российской Федерации с использованием маркеров, основанных на ретротранспозонных последовательностях, мобильных ДНК элементов.
Результаты выполненной работы представлены в виде гелей, отражающих разделение продуктов амплификации ДНК изученных сортов и использованных в работе молекулярных маркеров, а также в виде рисунков, отражающих филогенетические взаимоотношения между изученными генотипами.
Впервые было проведено изучение филогенетических связей между исследуемыми редкими образцами ампелографической коллекции, были проведены анализ главных компонент и кластеризация изученных генотипов внутри сравниваемых популяций.
Для групп изученных сортов были проведены анализы частот встречаемости аллелей в популяциях, анализ молекулярно-генетического разнообразия, рассчитаны генетические расстояния как между генотипами, так и между популяциями, в целом, а также проведен анализ главных компонентов.
Нами было установлено для каждой из групп по отдельности общее количество амплифицированных ДНК бендов, количество и процентное соотношение полиморфных полос, общая и частная статистика по использованным в исследовании праймерам.
В результате работы были подтверждены предполагаемые взаимоотношения между исследованными генотипами. В частности, как и предполагалось, было подтверждено близкое родство таких генотипов как Яй изюм розовый и Яй изюм белый, Агадаи и Гок изюм, Richter 110 и 420A, Kober 5BB
и Paulsen 1045, Будай шули и Гок ала и др., что говорит об их несомненном родстве. Также, было выявлено, что группа аборигенных сортов кластеризовалась вместе, в то время как, например, сорта интродуценты были помещены программой MEGA X в процессе кластеризации отдельно.
В результате работы нами были выявлены также и неожиданные связи между образцами. В частности, нами была выявлена связь между такими сортами как Сибирьковый и Кульджинский, которая подтвердилась как и по результатам анализа с использованием ретротранспозонов, так и с использованием микросателлитных маркеров. Также, интересным было то, что Султанина розовая и Султанина не располагались рядом, хотя и входили в один кластер.
Помимо этого, нами было проанализировано генетическое разнообразие клонов известных сортов, таких как Антоний Великий, Аркадия розовая, Долгожданный, Гелиос, Ливия и Анюта. При этом было выявлено, что у данных сортов имеется полиморфность полос ДНК, полученных с использованием ретротранспозонных маркеров, что, собственно, не является в данном случае необычным, в виду того, что использованные нами маркеры являются высоко полиморфными.
