Титульный лист и исполнители
РЕФЕРАТ
Отчет 130 с., 1 кн., 60 рис., 13 табл., 99 источн.
КЛОНОВЫЕ ПОДВОИ ЯБЛОНИ, СЕЛЕКЦИОННЫЙ ПРОЦЕСС, МОЛЕКУЛЯРНЫЕ МАРКЕРЫ, ЛОКУСЫ ГЕНОВ СИЛЫ РОСТА, КУЛЬТУРА ТКАНИ, МАТОЧНИК, ПИТОМНИК, СОРТО-ПОДВОЙНЫЕ КОМБИНАЦИИ, ПРИВОЙ, САД КОНКУРСНОГО ИСПЫТАНИЯ
В ФГБОУ ВО Мичуринский ГАУ в 2020 г. продолжены многолетние селекционные исследования по созданию, изучению и выделению новых генотипов высокоадаптивных клоновых подвоев яблони с комплексом ценных хозяйственно-биологических показателей. Получено 4798 гибридных семян, 648 гибрида в школке. Генколлекция пополнена 5 образцами рода MalusMill.
В результате молекулярно-генетических исследований проведена идентификация локусов количественных признаков (QTL) Dw1 и Dw2, вовлеченных в контроль признака карликового роста у клоновых подвоев яблони, проанализированы 14 подвоев с карликовым и полукарликовым типом роста. Создана коллекция 80 образцов ДНК районированных и перспективных генотипов клоновых подвоев, сортов, кребов-опылителей и дикорастущих форм яблони.Разработаны методические приемы тканевой селекции при культивировании соматических тканей новых генотипов клоновых подвоев яблони на питательной среде с добавлением хлорида натрия.
Отмечено, что среди мировых территорий, где производится селекция, испытание и выращивание клоновых подвоев яблони, наиболее холодным и континентальным климатом отличается Центральная Россия, где получены высокоустойчивыеклоновые подвои.
Выявлены основные закономерности развития в маточнике перспективных клоновых подвоев яблони селекции Мичуринского ГАУ, установлены корреляции между основными морфологическими признаками. Наибольшая доля стандартных укорененных отводков отмечена у подвойных форм 2-9-49, 2-9-90, 2-15-2, 2-15-15, 4-6-5.
В питомнике конкурсного испытаниявпервые были изучены однолетние саженцы наиболее распространенных районированных сортов яблонизимнего срока созревания – Лобо и Ханни (Хоней)Крисп, привитых на 48 новых перспективныхи районированных клоновых подвоев селекции Мичуринского ГАУ. Выделены наиболее слаборослыеперспективные клоновые подвои 2-3-14, 2-9-56, 2-9-90, 2-12-36, 5-26-127, 9-1-1, 9-1-4, 9-1-9.
В саду конкурсного испытания выраженными признаками карликовости и компактным габитусом кроны обладают деревья сорта Мелба и Антоновка обыкновенная, привитые на подвое 2-14-2.
ПЕРЕЧЕНЬ СОКРАЩЕНИЙ И ОБОЗНАЧЕНИЙ
В настоящем отчете о НИР применяют следующие сокращения и обозначения:
СПК – сорто-подвойная комбинация.
П-К (полукарлики) – растения клоновых подвоев, обладающие полукарликовой силой роста.
К – карликовые по силе роста растенияклоновых подвоев.
С-К (суперкарлики) – растения клоновых подвоев, обладающие наименьшей силой роста среди карликовых форм.
Лобо/54-118 – обозначение привойно-подвойной комбинации: сорт Лобо привит на клоновый подвой 54-118.
МБ – суперкарликовый клоновый подвой Малыш Будаговского (76-6-6).
ПБ – карликовый клоновый подвой Парадизка Будаговского (B9).
MS – искусственная питательная среда Мурасиге-Скуга.
ИУК – индолилуксусная кислота.
НУК – нафтилуксусная кислота.
ИМК – β-индолил-3-масляная кислота.
ГК – гибберелловая кислота
6-БАП – 6-бензиламинопурин.
2,4-Д — 2,4-дихлорфеноксиуксусная кислота.
NaOH – гидроксид натрия.
NaCl – хлорид натрия.
ВВЕДЕНИЕ
Яблоня является основной промышленно возделываемой плодовой культурой в большинстве стран мира, в том числе и в России, что подтверждается как размером площадей ее насаждений, так и суммарным сбором плодов.Для реализации отечественных экономических программ по импортозамещению особое значение имеет создание на территории РФ новых высокоурожайных многолетних промышленных насаждений яблони с повышенной рентабельностью[1-5]. Яблоки, выращенные в новых производственных насаждениях интенсивного типа Южного и Центрального федерального округов, по качеству и основным потребительским показателям являются полностью конкурентоспособными как на внутреннем, так и внешнем рынках, однако средняя урожайность яблони в большинстве садов России существенно ниже, чем в некоторых европейских странах[2, 6]. Одной из основных причин является различие природно-климатических условий возделываемых территорий, в том числе сумма эффективных температур, средняя годовая температура, повреждающие температуры зимнего периода, что не только снижает урожайность, но и существенно ограничивает выбор возделываемых сортов яблони в пользу наиболее устойчивых. Тем не менее, при полном соблюдении технологии возделывания промышленных насаждений яблони, потенциальные биологические возможности данной культуры позволяют в различных регионах России стабильно получать высокие урожаи – до 600-700 ц/га в Южном федеральном округе и200-400 ц/га в Центральном округе[1, 2, 5, 6].
Для получения высокихэкономических и товарно-потребительских показателейпромышленного интенсивного плодового сада необходимовозделывание слаборослых плодовых деревьев с малообъемными кронами по уплотненным схемам размещения. Основой для всех интенсивных садов служат слаборослые клоновые подвои[2, 7, 8]. В настоящее время традиционные экстенсивные насаждения яблонина семенных и сильнорослых клоновых подвояхпрактически нерентабельны и технологически малопригодны к массовому производственному возделываниювысококачественных плодов: большая высота и крупнообъемные кроны деревьев всаду затрудняют их обрезку, обработку от вредителей и болезней, сбор плодов, а малая плотность размещения деревьев в саду и разнокачественные по размерам плоды существенно снижают товарный урожай, пригодный к реализации по рыночным ценам.
В связи с этим, активная замена устаревших насаждений яблони на новые интенсивные, адаптивные к условиям конкретного региона произрастания, будут способствовать существенному увеличению производства отечественных плодов.Однако расширение площадей садов яблони на клоновых подвоях в нашей стране сдерживается недостаточной изученностью подвоев и современных сорто-подвойных комбинаций в различных природно-климатических регионах садоводства с существенно различающимися условиями окружающей среды, в которых генотипы подвоев проявляют себя по-разному.Целенаправленный выбор лучших сортов и клоновых подвоев яблони для каждой природно-климатической зоны является одним из главнейших факторов модернизации и интенсификации современного отечественного садоводства. Для этого необходимы многолетние комплексные исследования новых перспективных генотипов клоновых подвоев яблони в экспериментальных и промышленных маточниках, питомниках и садах с использованием районированных и перспективных сортов для каждого региона. В связи с этим проблема селекции слаборослых клоновых подвоев яблони и их хозяйственно-биологической оценки в настоящее время имеет особую актуальность и значимость.
Для ускоренного получения и изучения ценных генотипов клоновых подвоев яблони и производственно-биологического испытания новых сорто-подвойных комбинаций необходима разработка новых высокоэффективных методик оптимизации селекционного процесса. Современные биотехнологии позволяют качественно изменить получение и анализ новых генотипов и предоставляют для этогоширокие возможности.Применение методов маркер-опосредованной селекции способствует значительному ускорению и повышению эффективности выделения целевых генотипов сжелаемыми фенотипическими признаками.Оперативнаяидентификация локусов хозяйственно-значимых признаков и выделение источников ценных геновпозволяет более рационально планировать схемы гибридизации и значительно повысить выход ценных гибридных форм.Технологии и приемы тканевой селекции в условиях стерильной культуры invitro позволяют целенаправленно изучать влияние действующих агентов и факторов биотических и абиотических стресс-факторов на изолированные растительные клетки и ткани, ускоряя отбор ценных генотипов.
Разработка и применение новых селекционных технологий в совокупности друг с другом будет способствовать многократному ускорению создания, испытания и выделения ценных форм растений, в том числе слаборослых клоновых подвоев яблони с комплексом ценных биологически и производственно-технологических показателей.
1 СОЗДАНИЕ ГИБРИДНОГО ФОНДА ЗИМОСТОЙКИХ СЛАБОРОСЛЫХ КЛОНОВЫХ ПОДВОЕВ ЯБЛОНИ
Цель исследований: создание нового гибридного фонда яблони в рамках продолжения многолетних селекционных исследований для последующего комплексного изучения и выделения новых форм слаборослых клоновых подвоев яблони с комплексомценных биологических и хозяйственно-технологических признаков.
Задачи исследований:
— увеличить количество единиц гибридного фонда яблони в селекционной школке посредством посева семян 2019 г. гибридизации;
— провести гибридизацию весной 2020 г., получить и выделить гибридные семена;
— высадить сеянцы яблони отгибридизации2018 г.из селекционной школки в адвентивный маточник для их дальнейшегоизучения;
— увеличить количество новых образцов генетической коллекции растений рода MalusMill. в структурном подразделении ФГБОУ ВО Мичуринский ГАУ – НОЦ имени В.И. Будаговского для их дальнейшего изучения и использования в селекционном процессе.
Научная новизна и практическая значимость исследований
Уникальный гибридный фонд клоновых подвоев яблони селекции ФГБОУ ВО Мичуринский ГАУ увеличен посредством посева семян 2019 г. гибридизации в селекционной школке, а также путем получения и выделения гибридных семян от гибридизации 2020 г. для продолжения многолетних селекционных исследований. В селекционный процесс вовлечены новые гибриды и проведены межвидовые скрещивания для получения и последующего изучения гибридного фонда с целью выделения перспективных слаборослых клоновых подвоев яблони с комплексом значимых биологических признаков и ценных потребительских показателей. При составлении гибридизационных схем были использованы несколько типов скрещивания – подвойных родительских форм друг с другом, в том числе с элитными формами и производными нескольких видов рода MalusMill. (с формой14-1, полученнойранее в Мичуринском ГАУс участием высокоустойчивой к болезнямяблони Зибольда –M. sieboldii (Rgl.) Rehd.; с карликовым клоновым подвоемG16 селекции Женевской станции Корнеллского Университета (США, штат Нью-Йорк), являющегося производным природного вида – яблони обильноцветущей – M. floribunda Siebold ex Van Houtte), а также срайонированными сортами (Лобо) и отборными отечественными автотетраплоидами яблони (2n=4х=68)– Папировка тетраплоидная, Спартантетраплоидный, гибриднымиформамиселекции ВНИИСПК (Россия, г. Орел) 13-6-106 (4х)и 25-37-45 (4х).
От данных направленных скрещиваний в 2020 г. получены гибридные семена. В дальнейшем среди гибридного потомства предполагается выявление уникальных генотипов клоновых подвоев с повышенным уровнем плоидности, потенциально способные образовывать более одномерные побеги из-за снижения удельной доли мелких нестандартных побегов.
Использование отдаленной гибридизации способствует расширению спектра изменчивости у получаемого растительного материала, позволяя выделить генотипыс ценными хозяйственно-биологическими признаками.
Объекты, условия и методика проведения исследований
В качестве биологических объектов исследования и выбора родительских форм при составлении гибридологических схем в 2020 г. были использованы произрастающие в гибридном саду генотипы клоновых подвоев яблони 1957-2005 годов гибридизации (более 80 генотипов), полученные в Мичуринском ГАУ, диплоидные и тетраплоидные сорта яблони, элитные сеянцы,а такжедве видовые формы – яблони Зибольда M. sieboldii (Rgl.) Rehd. и яблони сибирскойM. baccata (L.) Borkh.
Перед проведением гибридизации предварительно были изучены особенности формирования мужского гаметофита у генотипов яблони, которые были запланированы для использования в качестве отцовских родительских форм – источников пыльцы. В результате отбраковывались генотипы со стерильной и крайне низкофертильной пыльцой, так как их использование впоследствии не позволит получить достаточного количества гибридных семян.Кроме того, в вариантах с использованием отдаленных гибридов учитывали, что полученные гибридные семена и проростки могут обладать сниженной всхожестью.
Гибридизацию проводили с использованием изоляторов, сшитых из нетканого укрывного материала марки «Спанбонд 60» (рисунок 1). В сравнении с традиционными марлевыми мешками они имеют ряд преимуществ – защищают опыленные цветки и развивающиеся после опыления семяпочки в завязи от неблагоприятных климатических условий (ночных заморозков, мелкого града, высокой температуры воздуха и перегрева тканей цветка и др.).Гибридные плоды снимали после наступления их полной биологической зрелости, выделенные семена помещали в бумажные пакеты в холодильник для непродолжительногохранения до организации их стратификации в феврале 2021 г.
Статистическую обработку данных проводили в программной среде MicrosoftOfficeExcel 2016.
 |
| а |
 |
| б |
Рисунок 1– Использование изоляторов из спанбонда
при гибридизации клоновых подвоев яблони
Результаты исследований
Селекционная школка. В селекционной школке проведён посев гибридных семян 2019 года гибридизации.
В 2020 г. стратификацию гибридных семян проводили ранее разработанными апробированнымнами способом –путем их равномерного высева в малообъемные пластиковые контейнеры с торфяным субстратом «Агробалт-С», предварительно обработанной в термошкафу в течение 1 ч при +150°С с целью ликвидации патогенных микроорганизмов и их спор. Затем контейнеры размещали в крупногабаритной климатической камере с микропроцессорным контролем температуры, находящейся в структурном подразделении ФГБОУ ВО Мичуринский ГАУ – Учебно-исследовательском тепличном комплексе (УИТК) «Роща». Данным способом 17-18 февраля 2020 г. было высеяно 899 гибридных семян, полученных по схемам скрещивания: карлик х полукарлик, полукарлик х карлик, полукарлик х смесь пыльцы карликов, видовая форма х карлик, карлик х видовая форма, видовая форма х видовая форма, а также от скрещиваний с участием сортов – доноров гена Coколонновидного габитуса кроны.Контейнеры с субстратом и семенами выдерживали при температуре +1,5…+2,0°С, периодически увлажняя. Общая продолжительность стратификации гибридных семян в контейнерах до получения первых всходов семян составила 80-97суток в зависимости от комбинации скрещивания. После массового появления проростков контейнеры переносили в крупногабаритную пленочную теплицу тоннельного типа и выдерживали их там в течение 10 дней при естественной температуре воздуха данного периода (рисунок 2). Для предотвращения развития патогенных микроорганизмов и гибели проростков, субстрат в контейнерахи всходы сеянцев поливали биопрепаратом «Триходермин», содержащим споры полезных микроскопических грибов Trichoderma sp.
В конце мая 2020 г. произвели посадку полученных гибридных проростковв селекционную школку, расположенную в структурном подразделении ФГБОУ ВО Мичуринский ГАУ – Научно-образовательном центре (НОЦ) имени В.И. Будаговского
Для их защиты на ранних стадиях роста и развития от неблагоприятных природно-климатических условий летнего периода (высокой температуры и сниженной относительной влажности воздуха) ряды растений закрывали смонтированной малообъемной каркасной теплицей, накрытой белым нетканом агроволокном марки «Спанбонд 60».
Всхожесть семян составила 83,6%, таким образом, весной 2020 г. после стратификации получен 752 проростка, высаженные в открытый грунт. К окончанию вегетационного периода в селекционной школке насчитано 648гибридных растения, что составляет86,2% от высеянных проростков и 72,1% от исходного числа застратифицированных гибридных семян (рисунок 3).

Рисунок 2 – Всходы гибридных проростков яблони после стратификации семян
в малообъемных пластиковых контейнерах с торфяным субстратом
Впервые в 2020 г. в селекционную школку были высажены сеянцы от гибридизации клоновых подвоев и генотипов яблони колонновидного габитуса роста с геном колонновидности Co – четырех отечественных сортов (Валюта, Московское ожерелье, Каскад, Корнет) и отборной формы 27-96(2), полученной во ВНИИГиСПР им. И.В. Мичурина с участием M. baccata (L.) Borkh. Также в 2020 г. в селекционной школке были получены уникальные сеянцы от гибридизации клоновых подвоев яблони селекции Мичуринского ГАУ и карликового клонового подвоя G16 селекции Женевской станции Корнеллского Университета (США, штат Нью-Йорк), производного природного вида – яблони обильноцветущей (M. floribunda Siebold ex Van Houtte). В дальнейшем среди полученного гибридного потомства предполагается поиск и выявление гибридных генотипов клоновых подвоев с доминантным аллелем гена колонновидности Co и генами устойчивости к биотическим и абиотическим стрессорам от M. floribunda.

Рисунок 3 – Гибридныесеянцы яблони в селекционной школке
Гибридизация и получение гибридных семян. В 2019 г. гибридизацию проводили в двух гибридных садах – 2003-2008 гг. и 2015-2017 гг. посадки. Весной 2020 г. сложились в целом благоприятные условия для цветения деревьев яблони.
Для получения гибридных генотипов слаборослых клоновых подвоев с ценными хозяйственно-биологическими признаками в мае 2020 г. были проведены 29 комбинаций направленных скрещиваний, в которых участвовали 12 материнских и 13 отцовских форм(таблица 1). В отдельных вариантах гибридизации были использованы генотипы, являющиеся по происхождению производными видов M. sieboldii (Rgl.) Rehd.,M. baccata (L.) Borkh.,M. floribundaSieboldexVanHoutte.В сентябре также были собраны плоды от свободного опыления 8 генотипов рода MalusMill.
Таблица 1 – Комбинации скрещиваний генотипов яблони и эффективность гибридизации (2020 г.)
| №
п/п |
Комбинации родительских форм при гибридизации | Количество
опыленных цветков, шт. |
Кол-во
плодов, шт. |
Кол-во
семян, шт. |
Среднее
количество нормальных семян на 1 плод, шт. |
| 1 | Папировка 4х (зел.) × 62-396 (красн.) | 107 | 61 | 23 | 0,4 |
| 2 | Спартан 4х (зел.) × 62-396 (красн.) | 109 | 74 | 28 | 0,4 |
| 3 | G16 (зел.) × 62-396 (кр.) | 65 | 49 | 72 | 1,5 |
| 4 | 5-27-1 (красн.) × Лобо (зел.) | 54 | 43 | 95 | 2,2 |
| 5 | 5-27-1 (красн.) × 70-20-21 (зел.) | 157 | 118 | 173 | 1,5 |
| 6 | 5-27-1 (красн.) × 2-15-2 (зел.) | 41 | 32 | 52 | 1,6 |
| 7 | 83-1-15 (зел.) × 62-396 (красн.) | 57 | 38 | 69 | 1,8 |
| 8 | 83-1-15 (зел.) × 57-491 (красн.) | 56 | 31 | 57 | 1,8 |
| 9 | 2-15-2 (зел.) × 62-396 (красн.) | 378 | 283 | 418 | 1,5 |
| 10 | 2-15-2 (зел.) × 2-9-102 (красн.) | 93 | 79 | 164 | 2,1 |
| 11 | 2-15-2 (зел.) × 2-12-15 (красн.) | 35 | 23 | 40 | 1,7 |
| 12 | 2-15-2 (зел.) × 14-1 (зел.) | 15 | 11 | 19 | 1,7 |
| 13 | 2-15-2 (зел.) × МБ (красн.) | 55 | 46 | 95 | 2,1 |
| 14 | 2-15-2 (зел.) × ПБ (красн.) | 153 | 141 | 308 | 2,2 |
| 15 | 2-15-2 (зел.) × 13-6-106 4х (зел.) | 128 | 76 | 43 | 0,6 |
| 16 | 2-15-2 (зел.) × 25-37-45 4х (зел.) | 253 | 148 | 102 | 0,7 |
| 17 | 2-9-102 (красн.) × 2-9-96 (красн.) | 61 | 49 | 84 | 1,7 |
| 18 | 2-9-102 (красн.) × 57-491 (красн.) | 58 | 45 | 76 | 1,7 |
| 19 | 2-9-102 (красн.) × 14-1 (зел.) | 105 | 68 | 72 | 1,1 |
| 20 | 4-2-41 (красн.) × 70-20-21 (зел.) | 317 | 214 | 295 | 1,4 |
| 21 | 3-4-7 (красн.) × 62-396 (красн.) | 44 | 38 | 81 | 2,1 |
| 22 | 3-4-7 (красн.) × 2-15-2 (зел.) | 91 | 79 | 173 | 2,2 |
| 23 | 62-396 (красн.) × 13-6-106 4х (зел.) | 117 | 62 | 40 | 0,6 |
| 24 | 62-396 (красн.) × 25-37-45 4х (зел.) | 271 | 108 | 47 | 0,4 |
| 25 | Лобо (зел.) × 62-396 (красн.) | 68 | 12 | 15 | 1,3 |
| 26 | 14-1 (зел.) × 62-396 (красн.) | 473 | 279 | 462 | 1,7 |
| 27 | 14-1 (зел.) × 2-9-102 (красн.) | 125 | 97 | 168 | 1,7 |
| 28 | 14-1 (зел.) × МБ (красн.) | 67 | 48 | 103 | 2,1 |
| 29 | 14-1 (зел.) × ПБ (красн.) | 304 | 227 | 319 | 1,4 |
| 30 | 70-20-21 св. опыление | — | 187 | 421 | 2,3 |
| 31 | 83-1-15 св. опыление | — | 31 | 56 | 1,8 |
| 32 | 98-7-77 св. опыление | — | 52 | 128 | 2,5 |
| 33 | МБ св. опыление | — | 36 | 82 | 2,3 |
| 34 | Спартан 4х св. опыление | — | 8 | 6 | 0,8 |
| 35 | 13-6-106 4хсв. опыление | — | 5 | 3 | 0,6 |
| 36 | 25-37-45 4х св. опыление | — | 11 | 8 | 0,7 |
| 37 | РоялБьюти (RoyalBeauty) св. опыл. | — | 24 | 38 | 1,6 |
| ИТОГО | 3857 | 2933
(2579+354) |
4435
(3693+742) |
1,5 | |
Выбранные родительские формы характеризуются высокой устойчивостью к основным абиотическим и биотическим стрессорам и потенциально могут передать ценные целевые гены получаемым гибридам, среди которых в дальнейшем будут отобраны слаборослые клоновые подвои, обладающим высокой зимостойкостью и комплексной устойчивостью к болезням.
Всего в схемах целенаправленной гибридизации было опылено3857 цветков, завязалось 2579 плодов, из которых выделено 3693 семян. Также собрано 354 плода от свободного опыления, из которых выделено 742 семени. Таким образом, общее количество полученных гибридных семян составило 4435 шт. Вследствие сложного гибридного происхождения большинства родительских генотипов клоновых подвоев и вариантов отдаленной гибридизации выход семян в расчете на 1 плод составил в условиях индуцированного аутбридинга от 0,4 до 2,2 шт., а при естественной спонтанной гибридизации – 0,6-2,5 шт.
Расширение генетической коллекции рода MalusMill. В 2020 г. генетическая коллекция ФГБОУ ВО Мичуринский ГАУ была пополнена 5 новыми образцами яблони – формами-опылителями (кребами) ЭверестиПрофессор Шпренгер, широко распространенных в промышленных садах мира, а также перспективными зарубежными промышленными сортами Лигол, Ханни (Хоней) Крисп, Эмпайр.В дальнейшем планируется использовать данные генотипы для изучения генетического разнообразия рода MalusMill. методами молекулярно-генетического анализа, а также в экспериментах по исследованию перекрестного опыленияформ яблони и подбора эффективных опылителей.
В питомнике структурного подразделения ФГБОУ ВО Мичуринский ГАУ – Научно-образовательного центра (НОЦ) имени В.И. Будаговского для закладки коллекционно-гибридного сада выращены однолетние саженцы яблони, представленные 34 образцами рода MalusMill. из коллекции Филиала Майкопская опытная станция Федерального исследовательского центра (ФИЦ) Всероссийский научно-исследовательский институт генетических ресурсов растений имени Н.И. Вавилова (ВИР), расположенного в поселке Подгорный Майкопского района Республики Адыгея.Данные генотипы яблони были получены в 2019 г. в рамках соглашения о научном сотрудничестве; они являются уникальными генетическими источниками ценных биологических и товарно-потребительских свойств и относятся к двум группам растений – природным дикорастущим видам (29 образцов), и кребам-опылителям (5 образцов). После их дальнейшей высадки в коллекционно-гибридный сад, они будутизучены с помощью методов молекулярно-генетического, морфометрического и цитоанатомического анализа для выделения ценных генотипов и их последующего использования в селекционном процессе.
Выводы по главе 1
В 2020 году было увеличено количество единиц гибридного фонда яблони в селекционной школке. Для повышения сохранности проростков и как следствие – выхода гибридных растений, стратификацию семян 2019 г. гибридизации осуществляли ранее апробированным нами способом – посредством их высева в малообъемные пластиковые контейнеры со стерильной торфосмесью, которые помещаются в климатическую камеру с автоматическим контролем температурыи выдерживаются 55-70 суток (в зависимости от появления всходов) при +1,5…+2,0°С.
Использование данного методического приема позволило значительно увеличить всхожесть гибридных семян – до 83,6%: получено 752 проростка, к окончанию вегетационного периода в селекционной школке насчитано 648 гибридных растения (86,2% от высеянных проростков и 72,1% от исходного числа застратифицированных гибридных семян).
Впервые в 2020 г. в селекционную школку были высажены сеянцы от гибридизации клоновых подвоев селекции Мичуринского ГАУ с генотипами яблони колонновидного габитуса роста, имеющими ген колонновидности Co, а также с производным природного вида – яблони обильноцветущей (M. floribunda Siebold ex Van Houtte). В дальнейшем среди полученного гибридного потомства предполагается поиск и выявление гибридных генотипов клоновых подвоев с доминантным аллелем гена колонновидности Co и генами устойчивости к биотическим и абиотическим стрессорам от M. floribunda.
Полученные в 2018 г. молодые сеянцыот гетероплоидных скрещиваний доноров нередуцированных гамет с клоновыми подвоями яблони, были пересажены осенью 2020 года из селекционной школки в адвентивный маточник для дальнейшего комплексного изучения.
Для получения новых гибридных генотипов слаборослых клоновых подвоев яблони с ценными хозяйственно-биологическими признаками в мае 2020 г. были проведены направленныескрещивания в 29 комбинациях скрещиваний с участием 12 материнских и 13 отцовских форм, а также в8 вариантах свободного опыления. Общее количество полученных гибридных семян составило 4435 шт.
Для закладки экспериментального коллекционно-гибридного сада вструктурном подразделении ФГБОУ ВО Мичуринский ГАУ – Научно-образовательного центре(НОЦ) имени В.И.Будаговского подготовлен посадочный материал в виде однолетних саженцев 34 образцов рода MalusMill. из коллекции Филиала Майкопская опытная станция ФИЦ Всероссийский научно-исследовательский институт генетических ресурсов растений имени Н.И. Вавилова,полученных в 2019 г. в рамках соглашения о научном сотрудничестве. Также в 2020 г. генетическая коллекция Мичуринского ГАУ была пополнена 5 новыми образцами яблони. В дальнейшем планируется комплексное изучение новых генотипов для оценки их потенциальной возможности использования в селекционном процессе и научно-производственных экспериментов в области садоводства.
2 СОВЕРШЕНСТВОВАНИЕ МЕТОДИК ИНТЕНСИФИКАЦИИ СЕЛЕКЦИОННОГО ПРОЦЕССА
2.1 Идентификация локусов Dw1 и Dw2 карликового роста яблони у генотипов клоновых подвоевс помощью молекулярно-генетического анализа
В интенсификации современного садоводства немаловажную роль играет внедрение в производство сортов яблони с компактной невысокой кроной, более удобной для механизированного возделывания и уборки урожая.
Особое значение здесь принадлежит использованию в посадках яблони слаборослых сортов типа спур, которые обладают ранним и обильным плодоношением и более доступны для механизированного возделывания. Благодаря малым размерам кроны, а, следовательно, более уплотненной схемеразмещения деревьев в саду, применение этих сортов позволяет получать урожаи с единицы площади, намного превышающие показатели сильнорослых сортов на той же площади.
Однако на практике получение интенсивных яблоневых насаждений с невысокой кроной в последнее время решается на основе широкого применения карликовых и полукарликовых подвоев [9].
Использование карликовых подвоев придает ряд особенностей прививаемым сортам яблони. Уменьшается длина и количество скелетных ветвей, увеличивается доля генеративных почек. Это приводит к появлению новых точек роста и уменьшению длины междоузлий[10, 11].
Считается, что подвои для яблони используются более 2000 лет [12]. Прививка на клоновые подвои (парадизки и дусены) упоминается еще во Франции в XVI – XVII веках. Применялись они для получения компактного роста растения[13].
Происхождение карликовых форм подвоев впервые обосновал В.И. Будаговский [7, 14, 15]. Им были обнаружены и описаны культивируемые в Закавказье вегетативно размножаемые карликовые формы яблони: в Грузии – Хомандули, в Армении – Марга Хндзор, в Дагестане и Азербайджане – Дипчек Алма (Дипчек Алмасы). Он считал, что карликовые яблони Закавказья и Передней Азии в античные времена попали в Грецию, а позднее в Римскую Империю в результате походов Александра Македонского. Вначале их размножали ради плодов, как корнесобственные сорта, а затем, с распространением по Европе, их стали использовать как подвои для создания карликовых деревьев [13].
Парадизки (карликовые подвои) и дусены (полукарликовые подвои) традиционно относят к подвидам яблони низкой Malus pumila var. paradisiaca и M. pumila var. praecox, соответственно. Однако большинство систематиков считает, что отдельного вида яблони низкой не существует, поэтому часто карликовые и полукарликовые формы группируют в сборный вид яблони M. pumila[16, 17]. Одни исследователи относят карликовые яблони Закавказья (Хомандули, Марга Хндзор и др.), иранскую Себи Меджлис и болгарскую Эр Алма к окультуренным формам яблони восточной (M. orientalis) [17], другие – к яблоне Туркменов (M. turkmenorum). Однако карликовые формы яблони отмечены и среди других видов. Это яблоня сибирская (M. baccata), яблоня Сиверса (M. sieversii), яблоня Жуковского (M. manshurica subsp. zhukovskyii Ponom.), яблоня Комарова (M. komarovii), яблоня Зибольда (M. sieboldii), яблоня Саржента (M. sargentii) [13].
Несмотря на то, что слаборослые клоновые подвои довольно широко используются в современном садоводстве, основные механизмы, с помощью которых контролируются такие признаки, как сила роста и раннее цветение, остаются недостаточно ясными. Малопонятен механизм влияния карликового подвоя на привой яблони. После прививки изменения происходят не только клеточного уровня, но и на уровне экспрессии сотен генов [18].
Карликовость проявляется как более быстрое физиологическое старение, связанное с сокращением длины первого однолетнего побега нижних ветвей и высоким уровнем цветения этого побега [19].
Наибольшее влияние на архитектуру растения оказывают гормоны. Установлено, что чем больше будет вырабатываться ауксина, тем более энергичный рост дерева [20-22]. Карликовый рост наиболее распространенного подвоя М9 связан с низким уровнем экспрессии генов MdPIN, которые кодируют белки-носители ауксина, что ограничивает базипетальный транспорт питательных веществ к корням. Низкое содержание зеатина в корнях подвоя, вызванное низкой экспрессией гена MdIPT, кодирующегофермент изопентенилтрансфераза, способствует ослаблению вегетативного роста привоя [23-24].
В последнее время проделана значительная работа в картировании признака карликовости для ускоренного отбора новых генотипов при маркер-опосредованной селекции. В гибридной популяции M9 ×Robusta 5 в пятой группе сцепления был идентифицирован локус количественных признаков (QTL) Dw1. Данный локус включает 547 генов и имеет размер 4,74-7,62Mb. Другой QTLDw2 был выявлен в 11 группе сцепления и объединяет 1141 генов. Общий размер QTLDw2 1.88-8.98Mb [11].
Фенотипический анализ показывает, что комбинация Dw1 и Dw2 оказывает наиболее сильное влияние на признак карликовости у подвоев. При этом Dw1 имеет более сильный эффект, чем Dw2. Для обоих QTL были созданы генетические маркеры. Они были испытаны на 41 образце подвоев. Большинство образцов карликовых и полукарликовыхклоновых подвоев подвоя несли маркерные аллели, связанные с Dw1 и Dw2 [11].
QTL с незначительным эффектом также были обнаружены на других группах сцепления (хромосомы 6, 9, 10, 12 и 13) [25].
Ряд генов, сцепленных с QTL Dw1 и Dw2, были обнаружены при анализе 64 генотипов растений рода Malus. В локусе Dw1 идентифицированы домен контролирующий границы ветвления растения (MdLBD3) и фактор ответа на ауксин(MdARF6). В локусе Dw2 выявлен ген MdG3OX3 контролирующий выработку гиббереллин 3-бета-диоксигеназы. Для идентифицированных генов созданы функциональные микросателлитные маркеры, которые были успешно тестированы на гибридных растениях и рекомендованы для маркерной селекции. Однако у ряда подвойных форм и гибридов не было выявлено маркеров, но фенотипически они имели все признаки карликовости. Это говорит о сложном характере механизма формирования карликового роста у яблони и требует более глубоко изучения [22].
Слаборослые клоновые подвои Мичуринского ГАУ широко используются в промышленном садоводстве как в России, так и за рубежом. Однако работ, посвященных изучению признака карликовости на молекулярном уровне недостаточно. Целью нашего исследования было проведение молекулярно-генетического анализа форм слаборослых клоновых подвоев яблони для идентификации QTLDw1 и Dw2.
Цель исследований: скрининг генетической коллекции клоновых подвоев яблони методами молекулярно-генетического анализа дляидентификации генотипов-источников целевых генов – локусов Dw1 и Dw2 карликового роста яблони.
Задачи исследований:
— провести скрининг генетической коллекции клоновых подвоев яблони для поиска локусов количественных признаков (QTL) Dw1 и Dw2 карликового роста яблониметодами молекулярно-генетического анализа;
— провести анализ генетической коллекции клоновых подвоев яблони для поиска генисточников карликового роста;
— провести апробацию существующих молекулярных маркеров генов карликового роста яблони;
— выделенить генотипы клоновых подвоев, являющихся носителямицелевых генов, для их дальнейшей рекомендации к использованию в селекционном процессе в качестве родительских форм.
Научная новизна и практическая значимость исследований
Впервые получены экспериментальные данные по идентификации локусов количественных признаков (QTL) Dw1 и Dw2 карликового роста яблони у отечественных клоновых подвоев яблони с использованием молекулярных маркеров, а также отобраны генисточники сдержанного роста среди исходных форм клоновых подвоев яблони. Впервые среди генотипов отечественных клоновых подвоев яблони апробированы ДНК-маркеры локусов количественных признаков Dw1 и Dw2 карликового роста яблони, оценена возможностьих использования в селекционном процессе.
Полученные данные о генетических основах сдержанного роста у образцов коллекции клоновых подвоев яблони позволят более рационально составлять схемы гибридизации и подбирать родительские формы, что значительно ускорит селекционный процесс и снизит материальные и трудозатраты при оценке полученного гибридного материала.
Объекты, условия и методика проведения исследований
Биологическими объектами исследования служили формы клоновых подвоев яблони из коллекции ФГБОУ ВО Мичуринский ГАУ. Всего было проанализировано 14 форм подвоев.
Экстрагирование ДНК было проведено с использованием набора для экстрагирования ДНК Quick-DNA Plant/Seed Miniprep Kit (Zymo Research, USA) согласно протоколу производителя.
Для идентификации локусов количественных признаков Dw1 и Dw2 использовали микросателлитные маркеры (таблица2), созданные ранее [11].
Таблица 2–Последовательности праймерных пар, используемых в работе
| Название | Последовательность | Размер, п.н. |
| Hi01c04 F | 6FAM-GCTGCCGTTGACGTTAGAG | 114-124 |
| Hi01c04 R | GTTTGTAGAAGTGGCGTTTGAGG | |
| Hi04a08 F | R6G-TTGAAGGAGTTTCCGGTTTG | 228-249 |
| Hi04a08 R | GTTTCACTCTGTGCTGGATTATGC | |
| CH03a09 F | TAMRA-GCCAGGTGTGACTCCTTCTC | 142-162 |
| CH03a09 R | CTGCAGCTGCTGAAACTGG | |
| MDP0000365711F | 6FAM-TCTCTCTCCTCTGCTTCCTCA | 137-152 |
| MDP0000365711R | TTGTGCGATCTCGTAGCGTA | |
| MDP0000243703F | TAMRA-AACCCCATTGCCATCTTCTA | 160-181 |
| MDP0000243703R | CAAATGGGTTCGGGTCCTAT |
Амплификацию проводили в приборе SimpliAmp производства «Applied Biosystems» (USA) с использованием набора реактивов Type-it Microsatellite PCR Kit (Qiagen) и праймеров производства ООО «Синтол», в том числе содержащих флуоресцентную метку (FAM, R6G, TAMRA). Фрагментный анализ проводили на автоматическом генетическом анализаторе ABI Prism 3130xl (Thermo Fisher Scientific). Полученные результаты анализировали с использованием программ Peak Scanner v1.0 (Thermo Fisher Scientific). Анализ генетической дифференциации проводился с помощью программы PAST 3.10.
Все предложенные методы полностью воспроизводимы и обеспечивают высокую достоверность получаемых результатов.
Результаты исследований
Идентификацию локусов Dw1 и Dw2 проводили с использованием микросателлитных маркеров. Данное исследование является предварительными и направлено на выявление эффективности маркеров для маркер-опосредованной селекции слаборослых клоновых подвоев яблони.
Для идентификации QTLDw1 анализировали наличие трех маркеров Hi01c04, Hi04a08 и CH03a09, а для Dw2 – двухмаркеров MDP0000365711 и MDP0000243703. Эти маркеры были отобраны из 13 микросателлитных последовательностей и ассоциированы с признаками карликовости и раннего цветения яблони. Процент ассоциации составляет 68,6% [11].
Большинство исследователей предполагает, что наибольшее влияние на проявление признака карликовости оказывает локус Dw1, а локус Dw2 усиливает его действие[11, 26]. При этом важным фактором является аллельное состояние маркера. Гомозиготная форма является доминирующей при идентификации признака роста [25].
Ожидаемые размеры фрагментов при наличии локуса карликового роста отображены в таблице 3.
Таблица 3– Ожидаемые размеры фрагментов
| Локус | Маркер | Ожидаемый размер, п.н. |
| Dw1 | Hi01c04 | 120 |
| Hi04a08 | 230 | |
| CH03a09 | 158 | |
| Dw2 | MDP0000365711 | 153 |
| MDP0000243703 | 167 |
Для проведения анализа были отобраны 14 генотипов клоновых подвоев яблони с фенотипическим проявлением признака сдержанного роста. В качестве положительного контроля был использован наиболее распространенный карликовый подвой М9. Результаты проведенного молекулярного анализа представлены в таблице 4.
Таблица 4–Результаты фрагментного анализа клоновых подвоев яблони
| Генотип | Тип растения
по силе роста |
QTL Dw1 | QTL Dw2 | |||
| Hi01c04 | Hi04a08 | CH03a09 | MDP0000365711 | MDP0000243703 | ||
| ПБ-4 | суперкарликовый | 120
122 |
234
237 |
155 | 153 | 182 |
| ПБ (B9) | карликовый | 122
123 |
234
239 |
155
163 |
153 | 164
177 |
| 57-491 | карликовый | 120
105 |
239
263 |
153
163 |
153 | 164
177 |
| МБ | карликовый | 122
124 |
222
234 |
141
155 |
153 | 164
172 |
| 70-20-21 | карликовый | 123 | 233
239 |
155
163 |
153 | 177 |
| 83-1-15 | карликовый | 120
122 |
234
272 |
155 | 0 | 172
177 |
| М9 | карликовый | 120
122 |
234
272 |
151
155 |
153 | 172
177 |
| G16 | карликовый | 120
122 |
233
234 |
149
155 |
153 | 182
188 |
| 62-396 | карликовый / полукарликовый | 122
124 |
222
234 |
141
155 |
153 | 164
172 |
| 54-118 | полукарликовый/ среднерослый | 124 | 222
239 |
141
163 |
153 | 164
172 |
| 2-12-10 | полукарликовый/ среднерослый | 120 | 233
263 |
145
155 |
0 | 170
172 |
| 2-9-102 | полукарликовый/ среднерослый | 120
124 |
222
263 |
141
155 |
153 | 170
174 |
| 4-6-5 | полукарликовый/среднерослый | 120
123 |
237
239 |
149
163 |
153 | 172
177 |
| 70-20-20 | среднерослый/ сильнорослый | 120
123 |
234
237 |
149
155 |
0 | 164
177 |
Анализ результатов показал расхождение полученных данных и предполагаемого результата. Из трех маркеров локуса Dw1 только у Hi01c04 амплифицируется фрагмент ожидаемого размера 120 п.н. Он выявлен у 9 форм подвоев (ПБ-4, 57-491, 83-1-15, М9, G16, 2-12-10, 2-9-102, 4-6-5 и 70-20-20). При этом маркер Hi01c04 идентифицирован как у карликовых форм, так и среднерослых. У формы 2-12-10 микросателлит представлен в гомозиготном состоянии Размеры фрагментов, полученных для остальных двух маркеров не совпадают с ожидаемыми.
Из двух маркеров локуса Dw2 искомый фрагмент амплифицируется у MDP0000365711. Он характерен практически для всех генотипов подвоев. Исключение составляет три формы 83-1-15, 2-12-10 и 70-20-20 у которых присутствует нулевой аллель. Все образцы, у которых идентифицирован маркер, являются гомозиготными. Размеры фрагментов, полученных для маркера MDP0000243703, не совпадают с ожидаемыми.
Отсутствие четкой зависимости между наличием маркера и наличием признака при использовании данных микросателлитных последовательностей отмечено и в других исследованиях. Так, наличие QTLDw2 незначительно влияло на силу роста растения яблони [26]. В оригинальной статье [11] также у ряда генотипов с фенотипическим проявлением признака карликовости отсутствовали маркеры локусов.
Микросателлитные последовательности генома наиболее часто используют для анализа генетического разнообразия и оценки степени сходства образцов [27-30]. При этом для разделения образцов достаточно анализа небольшого количества SSR-маркеров [31].
Для оценки генетического разнообразия по локусам Dw1 и Dw2 использовали 6 микросателлитных последовательностей Hi01c04, Hi04a08, CH03a09, CH02d08, MDP0000365711 и MDP0000243703. У 14 исследуемых образцов выявлено 29 аллельных вариантов размером от 102 п.н. до 170 п.н. Число аллелей на локус варьировало от 1 (для локуса MDP0000365711) до 7 (для локуса Hi04a08). У двух образцов (83-1-15 и 2-12-10) из 14 выявлена нулевая аллель микросателлита MDP0000365711. Редких аллелей идентифицировано не было. Все аллели встречались более трех раз.
На основании анализа SSR-спектров была построена дендрограмма, отражающая сходство изучаемых генотипов (рисунок4).
Как видно из дендрограммы, четкое разделения на кластеры у коллекционных образцов отсутствует, что подтверждает и низкое значение индекса бутстреп. Вероятно, что исследуемые генотипы имеют большое генетическое сходство или общее происхождение, о чем свидетельствует и отсутствие уникальных аллелей. Для получения более полных результатов требуется расширение количества анализируемых образцов с более контрастными признаками. Все исследуемые формы подвоев являются карликовыми и полукарликовыми формами. Необходимо привлечение сильнорослых генотипов, а также сортов яблони типа спур. Кроме того, используемая система маркеров является специфической для определения локусов количественных признаков карликовового типа роста яблони.
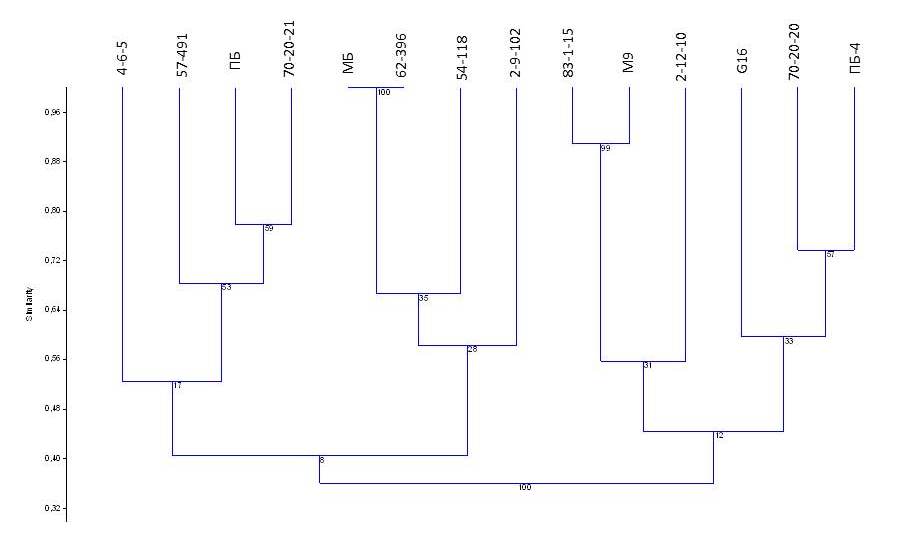
Рисунок 4– Дендрограмма генетического сходства клоновых подвоев яблони
на основании анализа 6 микросателлитных локусов
Таким образом, проведенные исследования показали, что только часть маркеров локусов карликового роста была идентифицирована у исследуемых образцов. Однако фенотипическое проявление признака у растений присутствовало. Анализ генетического родства на основе оценки микросателлитных последовательностей генома также показал отсутствие четкого деления на группы. Такие результаты, возможно, связаны с незначительной выборкой и ее однообразием для оценки маркеров, либо с небольшим процентом ассоциации между QTL и признаком. Так как проведенные исследования носят предварительный характер, то дальнейшая работа будет направлена на расширении выборки, а также поиск более эффективных маркеров для маркер-опосредованной селекции.
2.2 Создание коллекции образцов ДНК районированных и перспективных генотипов клоновых подвоев, сортов, кребов-опылителей и дикорастущих форм яблони для молекулярно-генетического анализа
Для проведения молекулярно-генетического анализа клоновых подвоев яблони в 2020 г. расширена коллекция образцов ДНК. Были получены образцы новых форм подвоев селекции Мичуринского ГАУ, а также дикорастущие формы рода MalusMill., являющиеся перспективными для использования в селекции. Биологический материал дикорастущих видов получен из Майкопской станции ВИР. Кроме того, в коллекцию внесены генетические источники признака морозоустойчивости – сорта селекции Свердловской селекционной станции садоводства.
Всего получено 80 образцов ДНК. Экстрагирование проводили из молодых листьев с использованием коммерческого набора для выделения НК Quick-DNA Plant/Seed Miniprep Kit (Zymo Research, USA) согласно протоколу производителя, а также модифицированного СТАВ-метода [32].Характеристики коллекционных образцов ДНК представлены в таблице 5.
Таблица 5– Характеристика образцов ДНК яблони, полученных в 2020 году
| № | № в коллекции | Название генотипа | Концентраци ДНК, нг\мкл | Дата выделения | Место хранения |
| 1 | 2 | 3 | 4 | 5 | 6 |
| Клоновые подвои яблони | |||||
| 1 | 41п | 2-12-15 | 50 | 20.05.2020 | Лабораторный корпус №9 Мичуринского ГАУ, комната №32 |
| 2 | 42п | 2-9-49 | 50 | 20.05.2020 | |
| 3 | 43п | 2-15-15 | 50 | 20.05.2020 | |
| 4 | 44п | 2-12-10 | 50 | 20.05.2020 | |
| 5 | 45п | 2-9-102 | 50 | 20.05.2020 | |
| 6 | 46п | 2-3-49 | 50 | 20.05.2020 | |
| 7 | 47п | 4-6-5 | 50 | 20.05.2020 | |
| 8 | 48п | 9-1-9 | 50 | 20.05.2020 | |
| 9 | 49п | 9-1-2 | 50 | 20.05.2020 | |
| 10 | 50п | 9-1-1 | 50 | 20.05.2020 | |
| 11 | 51п | 9-1-3 | 50 | 20.05.2020 | |
| 12 | 52п | 4-2-5 | 50 | 20.05.2020 | |
| 13 | 53п | 3-4-7 | 50 | 22.05.2020 | |
| 14 | 54п | 5-21-27 | 50 | 22.05.2020 | |
| 15 | 55п | 9-1-4 | 50 | 22.05.2020 | |
| 16 | 56п | 9-1-5 | 50 | 22.05.2020 | |
| 17 | 57п | 2-3-8 | 50 | 22.05.2020 | |
| 18 | 58п | 2-9-102 | 50 | 22.05.2020 | |
| 19 | 59п | 2-15-2 | 50 | 22.05.2020 | |
| 20 | 60п | 2-3-17 | 50 | 22.05.2020 | |
| 21 | 61п | М9 (Т337) | 50 | 22.05.2020 | |
| 22 | 62п | G16 | 50 | 22.05.2020 | |
| 23 | 63п | ПБ-4 | 50 | 22.05.2020 | |
| 24 | 64п, 65п | 2-9-94 | 50 | 22.05.2020 | |
| 25 | 66п, 67п | 2-12-36 | 50 | 22.05.2020 | |
| 26 | 68п, 69п | 2-3-14 | 50 | 22.05.2020 | |
| 27 | 70п, 71п | 3-10-3 | 50 | 22.05.2020 | |
| 28 | 72п, 73п | 2-9-90 | 50 | 22.05.2020 | |
| Сорта яблони | |||||
| 29 | 1с, 2с | Свердловчанин | 100 | 10.06.2020 | Лабораторный корпус №9 Мичуринского ГАУ, комната №32 |
| 30 | 3с, 4с | Сокол ясный | 100 | 10.06.2020 | |
| 31 | 5с, 6с | Таватуй | 100 | 10.06.2020 | |
| 32 | 7с, 8с | Краса Свердловска | 100 | 10.06.2020 | |
| 33 | 9с, 10с | Розочка | 100 | 10.06.2020 | |
продолжение таблицы 5
| 1 | 2 | 3 | 4 | 5 | 6 |
| 34 | 11с, 12с | Исеть белая | 100 | 10.06.2020 | |
| 35 | 13с, 14с | Первоуральское | 100 | 10.06.2020 | |
| 36 | 15с, 16с | Папироянтарное | 100 | 10.06.2020 | |
| 37 | 17с, 18с | Данила | 100 | 10.06.2020 | |
| 38 | 19с, 20с | Аксена | 100 | 10.06.2020 | |
| 39 | 21с, 22с | Экранное | 100 | 10.06.2020 | |
| 40 | 23с, 24с | Розоватое зимнее | 100 | 10.06.2020 | |
| 41 | 25с, 26с | Вэм розовый | 100 | 10.06.2020 | |
| 42 | 27с, 28с | Соковое-3 | 100 | 10.06.2020 | |
| 43 | 29с, 30с | Горнист | 100 | 10.06.2020 | |
| 44 | 31с, 32с | Родниковая | 100 | 10.06.2020 | |
| 45 | 33с, 34с | Серебряное копытце | 100 | 10.06.2020 | |
| 46 | 35с, 36с | Исетское позднее | 100 | 10.06.2020 | |
| 47 | 37с, 38с | Румянка свердловская | 100 | 10.06.2020 | |
| 48 | 39с, 40с | Благая весть | 100 | 10.06.2020 | |
| 49 | 41с, 42с | Уральское розовое | 100 | 10.06.2020 | |
| Дикорастущие виды яблони | |||||
| 50 | 1д | Malus floribunda (2346)* | 100 | 6.08.2020 | Лабораторный корпус №9 Мичуринского ГАУ, комната №32 |
| 51 | 2д | Malus niedzwetzkyana (29424) | 100 | 6.08.2020 | |
| 52 | 3д | Malus sieversii (12275) | 100 | 6.08.2020 | |
| 53 | 4д | Malus hupehensis (43206\1) | 100 | 6.08.2020 | |
| 54 | 5д | Morengo (креб) (2357) | 100 | 6.08.2020 | |
| 55 | 6д | Malus prunifolia (2380) | 100 | 6.08.2020 | |
| 56 | 7д | Malus sachalinensis | 100 | 6.08.2020 | |
| 57 | 8д | Aurea (креб) (2315) | 100 | 6.08.2020 | |
| 58 | 9д | Malus purpurea var pendula (2336) | 100 | 6.08.2020 | |
| 59 | 10д | Malus sylvestris(6144) | 100 | 6.08.2020 | |
| 60 | 11д | Malus × robusta(43200) | 100 | 6.08.2020 | |
| 61 | 12д | Malus purpurea var eleyi (2394) | 100 | 6.08.2020 | |
| 62 | 13д | Malus x scheideckeri(2407) | 100 | 6.08.2020 | |
| 63 | 14д | Malus coronaria | 100 | 6.08.2020 | |
| 64 | 15д | Malus cerasifera var auraniaca (2314) | 100 | 6.08.2020 | |
| 65 | 16д | Malus pallasiana | 100 | 6.08.2020 | |
| 66 | 17д | Malus × spectabilis (2415) | 100 | 6.08.2020 | |
| 67 | 18д | Malus turkmenorum (13293) | 100 | 6.08.2020 | |
| 68 | 19д | Malus baccata var corulescens (2333) | 100 | 6.08.2020 | |
| 69 | 20д | Malus zumi(креб) (41272) | 100 | 6.08.2020 | |
| 70 | 21д | Malus orientalis (29483) | 100 | 6.08.2020 | |
| 71 | 22д | Ample (креб) (2311) | 100 | 6.08.2020 | |
| 72 | 23д | Malus sargentii (14984) | 100 | 6.08.2020 | |
| 73 | 24д | Malus ioensis (2352) | 100 | 6.08.2020 | |
| 74 | 25д | Malus × purpurea (2392) | 100 | 6.08.2020 | |
| 75 | 26д | Sertonia (креб) (2408) | 100 | 6.08.2020 | |
| 76 | 27д | Malus caspiriensis (14943) | 100 | 6.08.2020 | |
| 77 | 28д | Malus asiatica var ringo | 100 | 6.08.2020 | |
| 78 | 29д | Malus pumila | 100 | 6.08.2020 | |
| 79 | 30д | Malus niedzwetzkyana (2389) | 100 | 6.08.2020 | |
| 80 | 31д | Malus mandshurica (44277) | 100 | 6.08.2020 | |
Примечание:* — каталожный номер ВИР
Выводы по разделам 2.1 и 2.2 главы 2
В результате молекулярно-генетических исследованийпроведена идентификация локусов количественных признаков (QTL) Dw1 и Dw2, вовлеченных в контроль признака карликового роста у клоновых подвоев яблони. Для их выявления был проанализированы пять микросателлитных маркеров (три маркера локуса Dw1 – Hi01c04, Hi04a08 и CH03a09 и двамаркера локуса Dw2 –MDP0000365711 и MDP0000243703). Проанализированы 14 генотипов подвоев яблони с карликовым и полукарликовым типом роста. Для каждого локуса был идентифицирован только один маркер.
На основании анализа микросателлитных последовательностей генома проведена оценка генетического разнообразия. Кластерный анализ полученных данных не выявил отдельных групп по степени схожести.
Создана коллекции образцов ДНК районированных и перспективных генотипов клоновых подвоев, сортов, кребов-опылителей и дикорастущих форм яблони для молекулярно-генетического анализа. Всего подготовлено 80 образцов рода MalusMill.
2.3 Разработка методических приемов регенерации адвентивных побегов клоновых подвоев яблони из соматических тканей при имитации анионного засоления
Тканевая селекция сельскохозяйственных культур: обзор
современного уровня отечественных и мировых исследований
Современные сорта, помимо хорошей урожайности и высокого качества плодов, должны обладать достаточным для сохранения нормального физиологического состояния и стабильного плодоношения адаптивным потенциалом к неблагоприятным экологическим условиям. Засоление почвы является существенным фактором потери урожайности сельскохозяйственных культур во всем мире, и в первую очередь в засушливых и полузасушливых районах, где засоление почв и засоление воды являются основными проблемами [33, 34]. Засолением почвы называют избыточное скопление в корнеобитаемом слое электролитных (растворенных или поглощенных) солей, которые угнетают или губят сельскохозяйственные растения, снижают качество и количество урожая. Избыточное засоление почв приводит к ингибированию роста и развития растений, снижает их продуктивность. Оно действует постоянно и приносит гораздо больший суммарный вред, чем засуха, заморозки и другие нерегулярные неблагоприятные абиотические факторы [34, 35].
По данным ФАО (Продовольственная и сельскохозяйственная организация ООН), засоленные почвы занимают в мире огромные площади – около 25% всей поверхности суши.
На сегодняшний день значительные массивы засоленных почв находятся вЮжном Казахстане, Средней Азии, на западе США, в особо засушливых районах Южной Америки и Австралии, в Северной Африке.
По данным Российской академии наук, общая площадь засоленных земель в РФ составляет более 40 млн га. К засоленным почвам в России относятся солончаки, солончаковатые, солончаковые и глубокозасоленные почвы, солонцы, солонцеватые почвы, солоди и осолоделые почвы. Они широко распространены на юго-востоке европейской части России, особенно в Среднем и Южном Поволжье, в Северо-Восточном Предкавказье, на юге Западной и Восточной Сибири, в Якутии [36].
Дополнительной проблемой современного аграрного производства становится загрязнение почв тяжелыми металлами – от металлов биофилов (Mn2+) до особо токсичных ионов (Сd2+). Неблагоприятные последствия почвенной ионной токсичности усугубляются при дефиците влаги в период вегетации растений.
Существует множество механизмов, позволяющих растениям переносить эти стресс. Эти механизмы можно разделить на триосновные категории: во-первых, осмотическая толерантность, которая запускается до накопления Na+ в побегах и регулируется удаленными сигналами, снижающими рост побегов; во-вторых, исключение ионов, когда процессы транспорта Na+ и Cl— в корнях снижают накопление токсичных концентраций Na+ и Cl— в листьях; и, наконец, толерантность тканей, при которой обнаруживаются высокие концентрации солей в листьях, но они компартментированы на клеточном и внутриклеточном уровне (особенно в вакуоли) [37].
Растения используют различные механизмы, чтобы активировать комплекс генов, способных обеспечить систему противодействияосмотическим и ионным стрессам, вызванным избыточным количеством соли. Генетическое изменение толерантности к засолению является сложной задачей, поэтому прогресс, достигнутый за последние несколько десятилетий в этом направлении оказался гораздо меньшим, чем ожидалось. Накопленный за последние несколько десятилетий багаж знаний и технологий, связанных с генетикой и геномикой, является перспективным в плане предоставления мощных инструментов для будущего создания солеустойчивых сортов. Несмотря на значительный прогресс в определении основных механизмов толерантности к засолению, все еще существуют серьезные проблемы, которые необходимо преодолеть при переводе и интеграции полученной информации на молекулярном уровне в практику селекции растений.
Конечной целью исследований толерантности к засолению является повышение способности растений поддерживать рост и продуктивность на засоленных почвах на уровне их роста на незасоленных почвах, то есть для уменьшения влияния засоления на рост и урожайность. Предложены различные подходы к повышению эффективности селекции растений, направленной на повышениеих продуктивности на засоленных средах. В этом контексте селекция на толерантность к засолению сельскохозяйственных культур в значительной степени зависит от наличия генетических ресурсов толерантности, надежных методов скрининга, идентификации генетических компонентов толерантности и успешной генетической манипуляции желаемыми генетическими предпосылками. Эффективность селекции и размножения в стрессовых условиях может быть повышена с помощью маркерного отбора. Методы генотипирования с высокой пропускной способностью и разработка набора «функциональных» маркеров могут оказать большую поддержку селекционерам.
Введение новых генов или изменение паттернов экспрессии существующих генов посредством генерации трансгенных растений также может быть использовано для преодоления ограничений классической селекции растений. Интрогрессия генов галофитных признаков от дикорастущих растений, облегченная генной инженерией, является альтернативным подходом для обхода межвидовых барьеров гибридизации, что может послужить стимулом будущего прорыва в сельском хозяйстве [38]. Молекулярная диссекция признака устойчивости к засолению, сопровождающая классическую количественную генетику, является существенным прогрессом в обновлении инструментов и методов манипулирования геномами растений. Методы обнаружения генов, такие как идентификация генов-кандидатов, клонирование QTL, картирование связей и ассоциаций, а также функциональная геномика, такая как идентификация и белков, участвующих в переносимости засоления, необходимы для манипулирования молекулярными механизмами, лежащими в основе сложного фенотипа переносимости засолености [39].
Для получения солеустойчивых сортов биотехнологические методы могут быть применены в сочетании с другими стратегиями улучшения сельскохозяйственных культур. Мутагенез и селекция на клеточном уровне позволяют вовлечь в процесс селекции большое число клеток и создать жесткие селективные условия для отбора мутантных клеток с желательными признаками [40].
Для проведения работ по клеточной селекции растений в условиях in vitro в качестве объекта исследования могут быть использованы каллусные, суспензионные культуры или изолированные протопласты. Выбор объекта зависит от наличия разработанных технологий, применимых к различным видам растений, а также от конечных целей исследования[41, 42].
В то же время, работы по получению растений, устойчивых к повышенным концентрациям солей, а также к токсинам, выделенным из грибов-возбудителей болезней, показали, что устойчивость клетки и растения к исследуемому селективному фактору может как совпадать, так и не совпадать [43].Прямая корреляция между устойчивостью растений и клеток in vitro отмечена лишь для низких температур, устойчивости к гербицидам, высоким концентрациям алюминия и некоторым другим факторам.
Большое число работ по культивированию каллуса, с целью получения нового селекционного материала, проведено на пшенице, ячмене, рисе, кукурузе, сорго, а также на картофеле, томатах, люцерне, эфиромасличных растениях и, крайне редко, на ягодных и древесных [44-52].
Получены положительные результаты по отбору стрессоустойчивых растений методом селекции in vitro для некоторых сельскохозяйственных и плодовых культур [40, 53-55].
Вкачествеэксплантовисследователииспользовалипроростки, каллусные ткани, суспензионные культуры клеток и изолированные органы [55-58].
Уже достигнуты первые положительные результаты по получению растений пшеницы, риса, картофеля, устойчивых к NaCl или Na2SO4. Известно о получении кислото- и солеустойчивых форм растений-регенерантов ячменя [59] и создании скороспелого сорта ячменя Омский 96 путем отбора на каллусогенной среде in vitro [60].
В то же время для древесных культур работы в этом направлении крайне редки и часто имеют поисковый характер. Широкое практическое использование методов тканевой селекции сдерживается в связи с биологическими особенностями древесных видов и необходимостью проведения длительных, трудоемких и дорогостоящих испытаний исходного и отселектированного материала в полевом опыте. Отсутствие надежных приемов идентификации генотипов по реакции на действие неблагоприятных абиотических факторов среды делают актуальной разработку методов ранней диагностики хозяйственно ценных свойств древесных растений [61].
В настоящее время начаты работы по селекции in vitro с лесными древесными растениями [62-65].
Наряду с перечисленными выше объектами (каллусная, суспензионная культура, изолированные протопласты), в качестве исходного материала для селекции могут быть использованы культуры соматических или андрогенных эмбриоидов, такие органогенные экспланты, как сегменты листьев или различные меристематические и стеблевые части растений, а также культура изолированных зародышей.
Сомаклональная изменчивость репродуктивных органов растений-регенерантов земляники, полученных из каллусных тканей, позволяет проводить селекцию на такие признаки, как урожайность, количество цветоносов, окраска околоцветника и др.
Во ВНИИГиСПР им. И.В. Мичурина проводились исследования по тканевой селекции земляники ананасной (Fragaria ananasa Duch.) на устойчивость к грибным патогенам Ph. cactorum и B. cinerea, а также на устойчивость к засухе и засолению. В процессе тканевой селекции были отобраны каллусы сортов земляники Урожайная ЦГЛ, Золушка, Фейерверк и Куйбышевская, сохраняющие способность к росту на средах с высокими (15-20%) концентрациями культуральных фильтратов фитопатогенных грибов.
В результате индукции морфогенеза на селективных средах были получены растения-регенераты, среди которых выделены генотипы земляники с повышенной устойчивостью к патогенам Ph. сactorum и B. cinerea, а также растения малины с повышенной засухоустойчивостью и устойчивостью к засолению [66, 67].
Таким образом, применение методов биотехнологии в селекционных целях открывает огромные возможности в создании новых форм растений, несущих ценные признаки, необходимые для человечества. Применение методов биотехнологии для решения задач селекции имеет большое научное и практическое значение, позволяя значительно сократить сроки и объемы полевых испытаний. Клеточная и тканевой селекция обеспечивает применение более сложных схем селекции, повышая ее эффективность, и является удобной моделью для анализа морфогенеза растений при выращивании на фоне воздействия факторов среды различной природы в контролируемых условиях [68-69].
В отличие от гибридизации, культивирование клеток invitroне разрушает ценного сочетания генов, достигнутого в результате предыдущей селекции. Вариации затрагивают лишь отдельные участки генома без изменения основного генетического фона. В основе этих изменений лежит сомаклональная изменчивость, которая обусловлена дестабилизацией генетической и эпигенетической программы растительной ткани при отсутствии онтогенетического (организменного) контроля. Однако растения-регенеранты сохраняют относительную генетическую стабильность, несмотря на высокую изменчивость каллусной ткани в процессе культивирования. Потомству первичных регенерантов передаются только точковые мутации, не вызывающие резкого снижения жизнеспособности растений. Наличие полезных мутаций среди сомаклонов позволяет использовать сомаклональную изменчивость в создании нового исходного материала для селекции [70-72].
Использование селективных сред при отборе in vitro устойчивых генотипов повышает преимущества сомаклональной изменчивости перед обычной мутационной селекцией. Регенеранты, полученные из сомаклонов, отличаются от исходного растения не только качественными моногенными, но и количественными полигенными признаками (например, по устойчивости к абиотическим стрессам), которые могут быть наследуемы и полезны в повышении урожая [73].
Сохранение высоких показателей морфогенных процессов у растений, культивируемых в присутствии осмотически активных веществ, может служить одним из показателей их адаптивного потенциала, устойчивости или чувствительности к засолению. В настоящее время не разработаны универсальные подходы к регуляции морфогенеза на селективном фоне, направленные на повышение уровня регенерации в каллусной ткани. Остаются до конца нерешенными технические трудности при создании селективных сред с тем или иным стрессовым фактором и, особенно, с комплексом стрессовых воздействий различной природы, когда необходимо учитывать малопрогнозируемые эффекты их совмещения. Кроме того, при проведении клеточной селекции приходится учитывать характер формирования устойчивости растений (полигенный/моногенный) к стрессору, а также биохимические и физиологические ее составляющие на уровне изолированной клетки и на уровне растения-регенеранта.
Разработка методических приемов тканевой селекции
гибридных генотипов клоновых подвоев яблони
к повышенному уровню анионного засоления в условиях invitro
и оптимизация состава селективных питательных сред
В 2020 г. были продолжены исследования по тканевой селекции перспективных клоновых подвоев яблони селекции Мичуринского ГАУ.
Цель исследований: разработка методических приемов тканевой селекции гибридных генотипов клоновых подвоев яблони к повышенному уровню анионного засоления в условиях invitro.
Задачи исследований:
— оптимизация методических приемов регенерации адвентивных побегов из каллуса соматического происхождения, размножения, укоренения и адаптации к условиям invivo генотипов рода MalusMill;
— разработка методических приемов оценки устойчивости изучаемых форм клоновых подвоев к моделируемого анионному засолению;
— отбор каллусов при культивировании эксплантов на питательных средах, содержащих селективный агент, и получение адвентивных побегов из каллуса соматического происхождения, образовавшегося на селективных средах;
— разработка методических приемов повышения регенерационной способности каллусных культур путем совместного использования стресс-факторов и химических соединений с антистрессовым действием.
Научная новизна и практическая значимость исследований
Получены новые экспериментальные данные по влиянию натриево-хлоридного засоления на развитие соматических тканей клоновых подвоев яблони в культуре invitro.Выявлено отрицательное действие NaCl, содержащегося в питательной среде культивирования, на коэффициент размножения и состояние культивируемых растений. Установлено, что в качестве селективного агента на солеустойчивость для получения сомаклональных вариантов в условиях invitro эффективным является использование концентрации 0,6% NaCl.Оптимизированы методические приемы регенерации адвентивных побегов из каллуса соматического происхождения путем совместного использования стресс-факторов и химических соединений с антистрессовым действием.
Разработаны методические приемы тканевой селекции гибридных генотипов клоновых подвоев яблони к повышенному уровню анионного засоления в условиях invitro и впервые получены растения-регенеранты перспективных форм клоновых подвоев яблони селекции ФГБОУ ВО Мичуринский ГАУ с повышенной устойчивостью к хлоридному засолению в экспериментально моделируемых условиях.
Объекты, условия и методика проведения исследований
Биологическими объектами исследования служили районированные и новые клоновые подвои яблони селекции Мичуринского ГАУ: 62-396, 2-15-2, 2-12-10, 3-4-7. Данные формы были выбраны как перспективные в плане их дальнейшего использования и как формы, обладающие достаточно высоким регенерационным потенциалом при культивировании каллусных культур.
Биологический материал необходимый для опытов получали, культивируя побеги клоновых подвоев яблони на питательной средеMS (Murashige, Skoog, 1962) с добавлением 30 г/л сахарозы и 8 г/л агара при рН 5,5-5,7. На этапе микроразмножения побегов использовали регуляторы роста растений: 6-бензиламинопурин (6-БАП) – 0,5-1,0 мг/л, гибберелловую кислоту (ГК) – 0,5-1,0 мг/л, β-индолил-3-масляную кислоту (ИМК) – 0,1-0,2 мг/л.
В опытах по тканевой селекции использовали каллусные культуры, полученные из листовых высечек, культивируемых invitroклоновых подвоев яблони. Образование каллусов инициировали на питательной среде c минеральным и углеводным составом по прописи MS (Murashige, Skoog, 1962) с добавлением витаминов по Мурасиге-Скугу, сахарозы – 30 г/л, 2,4-Д – 2,0 мг/л, регенерацию адвентивных побегов осуществляли на среде MS, с добавлением 6-БАП в концентрации 5 мг/л и ИУК в концентрации 0,5 мг/л. Инициацию каллуса проводили в темноте, при температуре 24°С.
рН питательной среды в процессе приготовления устанавливали в пределах 5,6-5,8 с помощью децинормального раствора NaOH. Среды стерилизовали автоклавированием (1 атм., 20 мин.). Витамины и регуляторы роста растений стерилизовали фильтрованием(фильтр «Millipore» 0,22 μm, France) и добавляли после автоклавирования.
Оценку устойчивости изучаемых форм клоновых подвоев к моделируемого анионному (хлоридному) засолению проводили, культивируя верхушки побегов и высечки листьев площадью 0,5-1,0 см2 соответственно на средах размножения и регенерации,содержащих 0,1-1,2% NaCl.
Селекцию каллуса проводили при постоянном воздействии концентрации соли 0,6% в течение четырех месяцев на среде MS, с добавлением 2,0 мг/л 2,4-Д. Отобранные каллусы переносили на среду регенерации. Регенерировавшие побеги срезали с листовых пластинок и доращивали по стандартной схеме клонального микроразмножения растений.
Разрабатывали методические приемы повышения регенерационной способности каллусных культур путем совместного использования стресс-факторов и химических соединений с антистрессовым действием В качестве стресс фактора использовали хлорид натрия, в качестве факторов антистрессовой активности тестировали аскорбиновую кислоту, салициловую кислоту, гидролизат казеина, добавляемые непосредственно в питательную среду. Кроме того, испытывали действие гелий-неонового лазера ЛГ-113 (длина волны 632,8 нм, экспозиция 60 с), облучая культивируемые ткани на третьи сутки после пассирования их на свежую питательную среду.
Субкультивирование эксплантов проводили в широкогорлых конических колбах емкостью 250 мл. Культуральные сосуды закрывали тонкой алюминиевой фольгой и герметизировали лентой «Parafilm». Культивирование растений осуществляли в специально оборудованной культуральной комнате при 16-часовом световом дне с освещенностью 2000-2500 люкс (люминесцентные лампыOsramL36W/765 CoolDaylight), температуре воздуха 24±2°С, каллусы культивировали в термостате, в темноте, при температуре 25°С.
Эффективность воздействия оценивали по ростовым показателям – коэффициенту размножения, интенсивности каллусообразования и уровню регенерации, приросту сырой массы каллуса.
Результаты исследований
Моделирование стресса в культуре in vitro – одно из перспективных направлений селекции растений на устойчивость к негативным факторам среды (засухе, засолению почв и др.) [63].
Суть метода тканевой селекции состоит в отборе на селективном фоне клеток или каллусов, несущих ценные сомаклональные изменения, и последующей регенерации из них растений. Таким способом можно проводить скрининг большого количества растительного материала в малом объёме и строго контролируемых условиях, что позволяет существенно ускорить процесс получения хозяйственно ценных форм растений. Важным преимуществом тканевой селекции является то, что в процессе её не проводят скрещиваний и не затрагивают тем самым основных хозяйственных свойств сорта.
Тканевая селекция включает в себя несколько этапов, а именно: введение объекта в культуру, инициирование первичного каллуса и наращивание каллусной массы, отбор на селективных средах устойчивых каллусов, регенерация адвентивных побегов из отобранных тканей, размножение и укоренение побегов in vitro, адаптация растений in vivo, тестирование их на наличие заданного признака. Для каждого из включенных в исследования генотипов необходима разработка и уточнение методик прохождения каждого из перечисленных этапов.
Каллусные культуры представляет собой материал, который наиболее часто используют для клеточной селекции. В то же время для многолетних древесных растений прохождение всех этапов тканевой селекции связано с серьезными проблемами, в первую очередь с трудностями индукции морфогенеза из клеток и тканей, прошедших длительное культивирование invitro.
Поскольку эффективность морфогенеза из соматических тканей и каллуса в значительной мере определяется генотипом растения для опытов по тканевой селекции были выбраны генотипы с достаточно высоким морфогенетическим потенциалом.
Была проведена оценка устойчивости изучаемых форм клоновых подвоев к хлоридному засолению при культивировании эксплантов на средах, содержащих NaCl в разных концентрациях.
Помещали верхушки побегов клоновых подвоев яблони на среды размножения, содержащие NaCl в разной концентрации. Негативное воздействие избыточного засоления определяется несколькими факторами: изменением осмотического давления, замещением ионами хлора других ионов в обменных процессах и развитием окислительного стресса (неспецифическая реакция на целый ряд дестабилизирующих воздействий). По результатам наших исследований негативное влияние засоления выраженно проявлялось уже при содержании NaCl в среде 0,3% (рисунок5). При данной концентрации происходило снижение коэффициента размножения побегов и интенсивности роста побегов, которое было существенно выраженным при повышении концентрации NaCl до 0,6% NaCl. При концентрации NaCl 0,6 % если в первые дни культивирования и происходило образование новых побегов, то в дальнейшем они не росли, деформировались, обесцвечивались и некротизировали. При дальнейшем повышении концентрации соли негативный эффект засоления усиливался (рисунок 6). Отмечены генотипические различия изучаемых подвоев по устойчивости к хлоридному засолению среды.
Рисунок 5– Влияние содержания NaCl в питательной среде на эффективность размножения микропобегов клоновых подвоев яблони
 |
 |
 |
| а | б | в |
 |
 |
 |
| г | д | е |
| Рисунок 6– Влияние NaCl на развитие микропобегов клонового подвоя яблони 2-15-2
на среде размножения: а – контроль; б – 0,1%; в– 0,3%; г – 0,6; д – 0,9%; е– 1,2% NaCl |
||
Оценку устойчивости изучаемых форм клоновых подвоев к хлоридному засолению провели и культивируя высечки листьев на средах регенерации,содержащих 0,1-1,2% NaCl. По нашим данным, засоление среды отрицательно влияет на листовые ткани подвоев, культивируемые в стерильной культуре. По сравнению с контрольной средой, не содержащей соль, на средах с NaCl существенно возрастает количество наркотизирующих тканей листовых высечек клоновых подвоев яблони. С возрастанием концентрации хлорида натрия увеличилось количество дисков с некротическими участками, возникающими вследствие повреждения растительных клеток, в особенности при максимальных концентрация (рисунок 7).
Соответственно, число листовых дисков на которых образовался каллус снижалось (рисунок8), уменьшалось количество каллусов на листовой диск и каллусы были меньшего размера, резко снижалась частота регенерации побегов (рисунок 9).
В результате анализа полученных данных, в качестве селективного агента на солеустойчивость для получения сомаклональных вариантов в условиях invitro при культивировании каллусных тканей нами была выбрана концентрация 0,6% NaCl, которая потенциально позволяла отобрать каллусы, сохранившие рост при селективном давлении и получить из них регенеранты с потенциальной устойчивостью к хлоридному засолению. При более низких концентрациях селективного агента уровень селективного давления был недостаточным, а концентрации NaCl 0,9-1,2% вели к почти полному некрозу тканей.
Рисунок 7– Жизнеспособность листовых эксплантов клоновых подвоев
яблони на среде с NaCl
Рисунок 8– Частота каллусообразования из листовых эксплантов
клоновых подвоев яблони на среде с NaCl
 |
 |
 |
| а | б | в |
 |
 |
 |
| г | д | е |
| Рисунок 9– Влияние NaCl на листовые экспланты клонового подвоя яблони 2-12-10
на среде регенерации: а – контроль; б – 0,1%; в– 0,3%; г – 0,6%; д – 0,9%; е– 1,2% NaCl |
||
Создание селективной системы in vitro включает в себя наряду с определением рабочих концентраций селективных агентов выявление оптимальной схемы их применения, а именно кратность, последовательность и длительность использования.
В опытах по тканевой селекции использовали каллусные культуры клоновых подвоев яблони, полученные из листовых эксплантов культивируемых in vitro растений. Для успешного проведения клеточной селекции необходимо получить достаточное количество каллусной ткани. Учитывая трудность получения морфогенного каллуса на селективных средах создавали стрессовые условия лишь во втором пассаже, предварительно накопив определенную каллусную биомассу. А первичный каллус индуцировали на питательной среде c минеральным и углеводным составом по прописи MS, содержащей 2,0 мг/л 2,4-Д, в темноте, с нейтральным уровнем рН и в отсутствие ионов Cl—.
Полученные каллусы помещали на селективные среды, содержащие 0,6% NaCl. Отбирали каллусы, сохраняющие способность к пролиферации в присутствии селективного агента, и через 5 недель пересаживали их на свежие селективные среды. Установлено, что по мере культивирования на селективных средах вследствие отбора от субкультивирования к субкультивированию увеличивается число каллусов, сохраняющих способность к пролиферации в присутствии токсичной концентрации NaCl. Так, процент растущих каллусов в четвёртом субкультивировании увеличился по сравнению с таковым во втором субкультивировании в 4,2 раза у подвоя 3-4-7, в 3,5 раз у подвоя 2-12-10, в 3,3 раза у подвоя 2-15-2 и в 2,7 раза у подвоя 62-396.
Отобранные в процессе трехкратного пассирования на селективных средах каллусы были высажены на среды регенерации по прописи MS, содержащие 5,0 мг/л 6-бензиламинопурина (6-БАП) и 0,5 мг/л ИУК. После такого длительного культивирования каллусов in vitro наблюдали крайне низкую частоту регенерации адвентивных побегов (рисунок 10). У подвоя 3-4-7 из 170 каллусов, отобранных на селективных средах с NaCl получены 4 адвентивных побега, у подвоя 2-12-10 из 106 каллусов образовалось 3 побега. Из каллусов подвоев 2-15-2 и 62-396 регенерантов получено не было. Во время процесса регенерации культуральные сосуды содержали в темноте. По мере появления адвентивных побегов сосуды переносили в культуральную комнату. После адаптации к интенсивному освещению полученные адвентивные побеги переносили на среды для размножения.
 |
|
| а | б |
| Рисунок 10– Регенерация адвентивных побегов клоновых подвоев яблони
из отселектированных на среде с 0,6%NaCl каллусов: а) 3-4-7; б) 2-12-10 |
|
Полученные адвентивные побеги размножили на среде MS, содержащей 1,0 мг/л 6-БАП, 0,2 мг/л ИМК и 0,5 мг/л гибберелловой кислоты (ГК). Принято считать, что полученные из отселектированных на солеустойчивость клеток и тканей растения должны также обладать этим признаком, т.к. он определяется на клеточном уровне. Однако даже после длительной тканевой селекции каллусы могут сохранять гетерогенность, и именно неустойчивая к NaCl клетка может дать начало новому растению [58]. Поэтому проводили диагностику полученных в результате тканевой селекции растений на резистентность к засолению.
Предварительную оценку солеустойчивости полученных побегов-регенерантов проводили путём культивирования на питательной среде MS, содержащей 1,0 мг/л 6-БАП, 0,2 мг/л ИМК 0,5 мг/л ГК и 0,6% NaCl. Отбирали побеги, сохраняющие способность к размножению и имеющие меньшее количество некрозов в течение первого месяца культивирования. Вегетативное потомство одного из полученных регенерантов подвоя 3-4-7 показало коэффициент размножения на засолённой среде равный 2,4±0,3, по сравнению с 1,5±0,2 у контрольных микропобегов (не прошедших тканевую селекцию). Микропобеги, полученные из одного регенеранта подвоя 2-12-10, оказались более солеустойчивыми, чем исходная форма. На среде, содержащей 0,6% хлорида натрия, они продемонстрировали коэффициент размножения 2,1±0,3 по сравнению с 1,3±0,2 у контрольных. Клоны, полученные при размножении остальных побегов-регенерантов, не продемонстрировали различий с контролем по признаку солеустойчивости. Полученные в процессе тканевой селекции in vitro растения, показавшие повышенную солеустойчивость, посажены на среды для укоренения с целью их последующей адаптации in vivo и дальнейшего изучения.
Поскольку стоит серьезная проблема повышения частоты регенерации адвентивных побегов из отселектированных каллусов, прошедших несколько циклов культивирования, изучали возможность повышения морфогенетического потенциала каллусных культур путем добавления в среды веществ, обладающих антистрессовым действием.
В следующем эксперименте мы изучали действие гидролизата казеина на пролиферацию каллусов клонового подвоя яблони 62-396 в условиях хлоридного засоления (рисунок 11).
Рисунок 11 – Влияние гидролизата казеина на рост каллусной ткани
клонового подвоя яблони 3-4-7 в условиях солевого стресса
Как показали результаты эксперимента, гидролизат казеина способствует существенному приросту сырой массы каллуса, как в контроле, так и в условиях хлоридного засоления различной интенсивности. В отсутствие стресс-фактора и при более низкой концентрации хлорида натрия в среде, наиболее эффективной концентрацией является 250 мг/л, при более высоком уровне стрессового воздействия (0,6% NaCl) пролиферация каллуса идет более активно при 500 мг/л гидролизата казеина.
Также было изучено действие кислот аскорбиновой и салициловой и лазерного излучения на процессы регенерации побегов клоновых подвоев яблони из каллуса в условиях хлоридного засоления (рисунок 12).
Рисунок 12 – Влияние различных факторов на регенерацию побегов
клонового подвоя яблони 2-15-2 в условиях хлоридного засоления
(аскорбиновая кислота 2 мг/л, салициловая 14 мг/л, гелий-неоновый лазер 120 с)
Как показали результаты исследований, данные факторы не оказывали существенного влияния на интенсивность регенерации в контроле, не содержащем хлорид натрия. Уровень регенерации составлял при этом 17-20% вне зависимости от варианта среды. На среде с хлоридным засолением (0,3% NaCl) частота регенерация в контроле и вариантах с салициловой кислотой и лазером снижалась по сравнению с контролем почти на 50%. Наиболее эффективным антистрессором показала себя аскорбиновая кислота (2 мг/л), которая восстанавливала уровень регенерации до контрольных значений.
Выводы по разделу 2.3 главы 2
Выявлено отрицательное действие наличия NaCl в питательной среде культивирования на коэффициент размножения и состояние культивируемых растений. По результатам исследований снижение коэффициента размножения побегов наблюдается уже при 0,3% NaCl в питательной среде, при повышении концентрации NaCl замедляется и прекращается размножение побегов, наблюдаются некрозы листьев. При концентрации NaCl 1,2% экспланты полностью некротизируют. В качестве селективного агента на солеустойчивость для получения сомаклональных вариантов в условиях invitro эффективным является использование концентрации 0,6% NaCl.
Оптимизированы методические приемы регенерации адвентивных побегов из каллуса соматического происхождения путем совместного использования стресс-факторов и химических соединений с антистрессовым действием. Наиболее эффективным антистрессором показала себя аскорбиновая кислота.
Разработаны методические приемы тканевой селекции гибридных генотипов клоновых подвоев яблони к повышенному уровню анионного засоления в условиях invitro и впервые получены растения-регенеранты перспективных форм клоновых подвоев яблони селекции ФГБОУ ВО Мичуринский ГАУ с повышенной устойчивостью к хлоридному засолению в экспериментально моделируемых стрессовых условиях invitro, с целью дальнейшего изучения данных форм в условиях природного и антропогенного загрязнения почв.
2.4 Анализ многолетней динамики климатических показателей мировых территорий возделывания производственных насаждений яблони
Яблоня является основной плодовой культурой во многих регионах мира, в том числе и в России. Несмотря на сложившийся в течение длительного периода сортимент, при возделывании ее насаждений в настоящее время возникают новые серьезные проблемы, требующие поиска разносторонних способов их решения, – общемировые и локальные тенденции изменения климата; дефицит ценных плодородных земель; сложности в организации систем орошения и фертигации; появление более патогенных популяций и разновидностей основных вредителей и болезней, в том числе карантинных; значительное удорожание средств защиты растений, удобрений, технических средств и необходимого специального оборудования и др. Одним из способов решения данных проблем является создание новых высокоустойчивых, продуктивных сортов и клоновых подвоев яблони, позволяющих получать качественный посадочный материал и рекомендовать его для возделывания в менее благоприятных природных областях.
Цель исследований:анализ многолетней динамики климатических показателей (прежде всего – температура воздуха) мировых территорий возделывания производственных насаждений яблони
Задачи исследований:
— осуществить сравнительный анализ многолетней динамики климатических показателей территорий мира в Северном полушарии, где осуществляются селекция, конкурсные испытания клоновых подвоев яблони и их промышленное возделывание в маточниках и питомниках, а также производится выращивание производственных насаждений яблони интенсивного типа;
— выявить различие средней месячной и годовой температуры рассматриваемых территорий за 15 лет;
— изучить повреждающие климатические факторы территории России (отрицательная температура воздуха в зимний период), лимитирующие возделывание современных промышленных насаждений яблони.
Объекты, условия и методика проведения исследований
Рассматриваемые территории возделывания яблони в промышленной культуре, как правило, характеризуются исторически сложившейся развитой инфраструктурой, необходимой для выращивания и изучения клоновых подвоев и сортов яблони, посадочного материала на их основе, разработки технологий селекции, сортоизучения, возделывания маточников, питомников и многолетних насаждений различного типа, в т.ч. интенсивных (таблица 6).
В связи с тем, что рассматриваемые территории и находящиеся там основные профильные учреждения расположены в различных регионах мира, значительно различающихся природно-климатическими условиями, необходимо провести их сравнение, в первую очередь, по показателям динамики температуры воздуха в разные месяцы в течение года (таблица7).
Таблица 6 – Территории выращивания и изучения клоновых подвоев и сортов яблони
| Территория, государство | Объекты выращивания и изучения | Научно-исследовательские и учебные учреждения
(селекция и сортоизучение) |
Производственные предприятия и компании
в области питомниководства и плодоводства |
| 1 | 2 | 3 | 4 |
| Мичуринск, Тамбовская обл.
(Россия) |
клоновые подвои,
саженцы и производственные насаждения яблони |
Мичуринский государственный аграрный университет,
Федеральный научный центр имени И.В. Мичурина |
АО Учхоз-племзавод «Комсомолец»,
ООО «Сады Мичурина», ООО «Мичуринские сады», ООО «Садпитомникмаш», ООО «Снежеток», АО «Дубовое» и др. |
| Минеральные
Воды, с. Сунжа (Россия) |
клоновые подвои,
саженцы и производственные насаждения яблони |
– | ООО «Плодообъединение «СадыСтаврополья» |
| продолжение таблицы 6 | |||
| 1 | 2 | 3 | 4 |
| с. Сунжа, Ингушетия (Россия) | клоновые подвои,
саженцы и производственные насаждения яблони |
– | ООО «Сад-Гигант Ингушетия» |
| с. Григорьевка,
Челябинская обл.(Россия) |
производственные насаждения яблони | – | «Григорьевские сады»
(КФХ Филиппова А.А.) |
| Анже (Франция) | клоновые подвои,
саженцы и производственные насаждения яблони |
Университет Анже
(Université d’Angers), Национальный Институт аграрных исследований(INRA) |
Плодопитомник «Dalival» |
| Баарло
(Нидерланды) |
клоновые подвои,
саженцы и производственные насаждения яблони |
– | Плодопитомник «BoomkwekerijFleuren» |
| Больцано (Италия) | клоновые подвои,
саженцы и производственные насаждения яблони |
Исследовательскийсельскохозяйственный и лесотехнический центр Лаймбурга (ResearchCentreforAgricultureandForestry, Laimburg),
СвободныйуниверситетБоцена-Больцано (FreeUniversityofBozen-Bolzano) |
ПредприятияассоциацииплодопитомниковипроизводителейяблокЮжногоТироля– Трентино
(the South Tyrolean Apple Consortium, the Association of Fruit and Vegetable Producers in Trentino, APOT) |
| Скерневице (Польша) | клоновые подвои,
саженцы и производственные насаждения яблони |
Научно-исследовательский институт садоводства
(Instytut Ogrodnictwa) |
«Питомник плодовых деревьев Анджей Сулек и сыновья», плодопитомник «Анджей и Шимон Новаковские» и др. |
| Алнарп
(Швеция) |
клоновые подвои
и опытные насаждения яблони |
Шведский университет сельскохозяйственных наук (Шведскийсельскохозяйственный институт – Sveriges lantbruksuniversitet, SLU) | – |
| Сент-Пол,
Миннесота (США) |
клоновые подвои,
опытные насаждения яблони |
УниверситетМиннесоты (University of Minnesota) | – |
| Вайнленд, Онтарио
(Канада) |
клоновые подвои,
саженцы и производственные насаждения яблони |
ЦентрисследованийиинновацийВайнленда
(The Vineland Research and Innovation Centre) |
Предприятия ассоциации производителей плодов Вайнленда
(VinelandGrowersCo-operativeLtd.) |
Исходные климатические данные соответствующих метеорологических станций были взяты из профильных информационных источников, предоставляющих их в свободном доступе (таблица 7). Для повышения точности и объективности анализируемых показателей всех территорий нами были исследованы их данные за период 15 лет – с 2006 по 2020 гг. Это позволяет получить усредненные показатели природных регионов с меньшим статистическим проявлением экстремальных по климатическим показателям лет, а также по продолжительности охватывает практически полный срок производственной эксплуатации современного суперинтенсивного сада яблони.
Таблица 7 – Расположение анализируемых метеорологических станций на территориях выращивания и изучения клоновых подвоев и сортов яблони
| Территория, государство | Географические координаты | Высота над уровнем моря, м | |
| широта | долгота | ||
| Мичуринск
(Россия) |
52.88 | 40.48 | 158 |
| Минеральные Воды,
с. Сунжа (Россия) |
44.22 | 43.10 | 313 |
| с. Сунжа, Ингушетия (Россия) | 43.15 | 44.85 | 665 |
| с. Григорьевка,
Челябинская обл.(Россия) |
56.88 | 59.98 | 328 |
| Анже (Франция) | 47.93 | 0.20 | 52 |
| Баарло (Нидерланды) | 51.45 | 5.42 | 22 |
| Больцано (Италия) | 46.47 | 11.33 | 241 |
| Скерневице (Польша) | 51.73 | 19.40 | 190 |
| Алнарп (Швеция) | 55.57 | 13.07 | 21 |
| Сент-Пол,
Миннесота (США) |
44.94 | -93.09 | 240 |
| Вайнленд, Онтарио
(Канада) |
43.15 | -79.42 | 110 |
Научная новизна и практическая значимость исследований
Проведенный анализ природно-климатических условий различных регионов мира, где широковозделываются сорта и клоновые подвои яблони, позволяет выявить различия условий для роста и развития растений, а также необходим для дальнейшей разработки рекомендацийметодики экспериментальной оценки устойчивости новых генотипов отечественных клоновых подвоев к неблагоприятным абиотическим факторам, прежде всего к повреждающим температурам зимнего периода.
Результаты исследований
Основными климатическими показателями любой природной территории мира являются температурный режим воздуха и уровень выпадения осадков, а также их ежемесячная динамика. Современные производственные насаждения яблони интенсивного типа возделываются по единой технологической схеме, обязательно включающей организацию капельного орошения и часто одновременную фертигацию, поэтому влияние уровня выпадающих за вегетационный период осадков и плодородия почвыв случае их сниженных относительно биологического оптимума показателей можно в определенной степени нивелировать данными агротехнологическими приемами. В связи с определенной неравномерностью выпадения осадков в течение года, которое отмечается практически в любом природном регионе мира, применение искусственного орошения в настоящее время является необходимым условием и неотъемлемым элементом технологии многих агроценозов, особенно интенсивных садов, в связи с чем при проведении данного анализа мировых областей возделывания яблони мы не уделяли особого внимания уровню распределения осадков, больше акцентируя на температуре воздуха.
Температура воздуха,как и атмосферные осадки,оказывает непосредственное влияние на почву и все растения, но ее невозможно искусственно компенсировать в широком диапазоне в случае отклонения от растительного биологического оптимума.Если приемы полива насаждений плодовых культур путем сочетания капельного и надкронового спринклерногоорошения позволяют частично защитить деревья от колебаний температуры воздуха среднего уровня – при наступлении возвратных весенних заморозков илижаркого и засушливого периода в летние месяцы, то сильное понижение отрицательной температуры невозможно надежно предотвратить любыми методами, вследствие чегоэкстремальные морозы способны необратимо повредить возделываемые растения яблони, вплоть до их массовой гибели в саду.В связи с этим, значения температуры воздуха в зимний период являетсяодним из основных лимитирующих климатических факторовв процессе выбора природного региона для закладки и возделывания многолетних плодовых насаждений.
При анализе средней годовой температуре воздуха (рисунок 13, таблица 8), а также ее значений в зимние месяцы среди изучаемых мировых областей наиболее благоприятными условиями для производственного возделывания насаждений яблониотличаютсяобласти Центральной (Франция, Нидерланды, Италия) и Восточной Европы (Польша).
Климатические особенности стран Центральной и Восточной Европы являются наиболее благоприятными для выращивания клоновых подвоев и саженцев яблони и возделывания многолетних плодовых насаждений интенсивного типа. Средние месячные температуры здесь не опускаются ниже нуля даже в самом холодном месяце года – январе (таблица 8, рисунок 14). Достаточный уровень инсоляции и сумма активных температур позволяют получать хорошо развитые саженцы яблони с разветвленной кроной и сильным развитием корневой системы, а в условиях производственного интенсивного сада – возделывать лучшие сорта зимнего срока созревания со всего мира, которые полностью успевают сформировать зрелые плоды из-за увеличенного по продолжительности вегетационного периода – с конца февраля до начала-середины ноября. В природно-климатических условиях Центральной Европы на протяжении XXвека были созданы и изучены несколько десятков клоновых подвоев яблони – их самые известные серии M (Malling), MM (Malling–Merton), EMLA (EastMalling–LongAshton) в Великобритании, полученные при реализации многолетних селекционных программ в английском Ист-Моллинге и институтах-партнерах, серия Pi (Supporter) в Германии (Дрезден-Пильниц),обнаружены и выделены ряд производственно-ценных клонов самого распространенного в мире подвоя M9– T337 в Нидерландах, Pajam 1 (Lancep) иPajam 2 (Cepiland) во Франции, в Восточной Европе в рамках самостоятельных селекционных программ получены – серия P (podkladki–в переводе с польского «подвои») с несколько увеличенной зимостойкостью в Польше (Скерневице), серия J-TEв Чехии (Техобузице), в в условиях Северной Европы – выведен самый зимостойкий клоновый подвой Европы – среднерослая форма А2 в Швеции (Алнарп).
Рисунок 13 – Вариабельность средней годовой температуры воздуха на
территориях выращивания и изучения клоновых подвоев и сортов яблони
Таблица 8 – Средние месячные и годовые температуры воздуха на территориях выращивания и изучения клоновых подвоев и сортов яблони(в 2006-2020 гг.)
| Территория, государство | Месяцы | Средн.
за год |
||||||||||||
| янв | фев | мар | апр | май | июн | июл | авг | сен | окт | ноя | дек | |||
| Мичуринск
(Россия) |
-8,1 | -6,9 | -1,1 | 7,8 | 16,1 | 19,3 | 21,1 | 20,3 | 14,0 | 7,0 | 0,2 | -4,0 | 7,1 | |
| Минеральные
Воды (Россия) |
-2,8 | -1,2 | 4,6 | 10,5 | 16,6 | 21,4 | 23,9 | 23,7 | 18,2 | 11,2 | 4,1 | 0,2 | 10,9 | |
| с. Сунжа, Ингушетия (Россия) | -2,1 | -0,6 | 4,4 | 9,6 | 15,3 | 19,8 | 22,1 | 21,7 | 16,9 | 10,7 | 4,5 | 0,4 | 10,2 | |
| с. Григорьевка,
Челябинская обл.(Россия) |
-14,8 | -11,8 | -4,4 | 3,9 | 11,5 | 16,0 | 17,9 | 16,0 | 10,0 | 2,4 | -5,6 | -11,8 | 2,5 | |
| Анже (Франция) | 5,6 | 6,0 | 8,6 | 12,0 | 15,2 | 18,7 | 20,9 | 20,0 | 17,1 | 13,1 | 9,1 | 6,1 | 12,7 | |
| Баарло
(Нидерланды) |
3,6 | 3,9 | 6,5 | 10,7 | 14,1 | 17,2 | 19,1 | 18,2 | 15,1 | 11,4 | 7,4 | 4,6 | 11,0 | |
| Больцано (Италия) | 2,0 | 4,5 | 9,4 | 14,4 | 18,5 | 22,4 | 23,9 | 22,7 | 18,3 | 13,7 | 7,1 | 1,8 | 13,3 | |
| Скерневице (Польша) | -1,6 | -0,2 | 3,5 | 9,4 | 13,8 | 17,8 | 19,5 | 18,9 | 14,1 | 8,9 | 4,9 | 1,1 | 9,2 | |
| Алнарп
(Швеция) |
1,2 | 1,3 | 3,5 | 8,1 | 12,5 | 16,2 | 18,5 | 17,9 | 14,5 | 9,9 | 6,2 | 3,3 | 9,4 | |
| Сент-Пол,
Миннесота (США) |
-7,5 | -6,5 | 0,5 | 8,0 | 15,0 | 20,0 | 22,5 | 21,5 | 16,5 | 9,0 | 1,0 | -7,0 | 7,5 | |
| Вайнленд, Онтарио
(Канада) |
-2,2 | -2,5 | 2,4 | 8,5 | 14,5 | 20,1 | 22,8 | 22 | 17,9 | 12 | 5,5 | 0,7 | 10,4 | |
Во многом, вследствие биологических, исторических и производственных особенностей, форма M9и ряд ее клонов являютсяосновными клоновыми подвоями яблони для массового выращивания посадочного материала в питомниках, а также дальнейшей закладки и возделывания промышленных насаждений интенсивного типа. Однако сравнительно мягкий климат регионов их селекции, изучения и возделывания объясняют невысокий уровень зимостойкости как исходного подвоя M9, так и его многочисленных клонов. Их корневая система способна выдерживать промерзание почвы до -8…-9°C, что является приемлемым для большинства основных мировых регионов промышленного возделывания яблони, однако в зонах рискованного плодоводства и питомниководства с нестабильным многолетним климатическим режимом данный подвой может подмерзать в отдельные суровые зимы, приводя к гибели производственных маточников, питомников и мнгоголетних плодовых насаждений.
Рисунок 14 – Средние месячные температуры воздуха на территориях выращивания и изучения клоновых подвоев и сортов яблони
Среди рассматриваемых природно-климатических областей мира менее благоприятными условиями для возделывания ряда клоновых подвоев и сортов яблони в нашей стране обладают территории Средней России (Тамбовская область, г. Мичуринск) и Южного Урала (Челябинская область, с. Григорьевка), в США – штат Миннесота (г. Сент-Пол). При этом рассматриваемые территории Швеции (Алнарп) и Канады (Вайнленд, штат Онтарио) обладают немного более мягким климатом из-за близости крупных водоемов. Если в Алнарпе в первой половине XXвека только был получен зимостойкий среднерослый / сильнорослый клоновый подвой яблониA2, не получивший большого распространения в Европе и мире, то канадский Вайнленд является не только местным центром селекции клоновых подвоев серии Vineland (V-series), но и известен своими интенсивными насаждениями яблони, которые оказалось возможным выращивать благодаря мягкому климату из-за близкого расположения крупного озера Онтарио.
Несмотря на то, что территория России является крупнейшей в мире, ареал промышленного возделывания культуры яблони достаточно сильно ограничен природно-климатическими условиями ее отдельных регионов, в первую очередь динамикой температуры воздуха (рисунки15, 16). В России низкие температуры являются основным лимитирующим фактором для возделывания насаждений яблони, особенно интенсивного типа. Температуры воздуха ниже -35…-38°С зимнего периода способны вызвать повреждения генеративных и вегетативных образований кроны. В особенно тяжелых условиях при отсутствии достаточного снежного покрова даже более щадящие температуры способныспособны нанести большой урон плодовым деревьям.Температуры воздуха более-40…-41°С вызывают гибель даже самые зимостойких сортов яблони. В связи с этим для возделывания яблони пригодна европейская часть России до Урала (точнее – ее центральная и южная часть), Южный Урал и Алтайский край.
Другим важным климатическим показателем любой территории является сумма эффективных (активных) температур, при которых растения в норме осуществляют свои рост и развитие. Для плодовых культур рассчитывают сумму среднесуточных значений температуры воздуха выше +10°С за вегетационный период. Для летних сортов яблони сумма активных температур составляет не менее 2000°С, осенних – 2200°С и зимних – 2400°С [74].Плоды яблони раннелетних, летних и позднелетних сортов достигаютстадии съемной зрелости за период, включающий 60-90 дней, при суммеактивных (10°С) температур 1275±38 – 1602±40°С. Формирование яблок осенних сортов происходит за период 95-115 дней с суммой активных температур 1942±65 – 2052±80 °С, зимних и позднезимних сортов– 116-135 дней и 2074±80 – 2162±83 °С, соответственно [75, 76].
Рисунок 15 – Зонирование территории Российской Федерации в соответствии
с показателями минимальной температуры воздуха за год [77]
Рисунок 16 – Зонирование территории Российской Федерации в соответствии
с показателями минимальной температуры воздуха в январе [77]
Учитывая, что в промышленном садоводственаиболее ценными для производства, хранения, реализации и потребления являются сорта яблони зимнего срока созревания, то пригодными для их выращивания являются только центральная и южная территории европейской части России, где сумма активных температур достигает 2400-2500°С (рисунок 17), а минимальная температура воздуха в самом холодном месяце – январе не опускается ниже -35…-37°С (рисунок 16).
Рисунок 17 – Зонирование территории Российской Федерации в соответствии
с показателями суммы активных температур выше 10°C [78]
Основные промышленные насаждения яблони в России расположены в Северо-Кавказском и Центрально-Черноземном округах, где благоприятный климат позволяет выращивать лучшие отечественные или часть зарубежных сортов. Однако при научно-обоснованном выборе высокоустойчивых сорто-подвойных комбинаций яблони возделывать их возможно и на территориях с более суровыми климатическими показателями, в первую очередь для обеспечения местного населения свежими плодами и продуктами их переработки. Так, единственные на Урале интенсивные производственные сады яблони расположены в селе Григорьевка в северной части Челябинской области (Каслинский район на границе со Свердловской обл.). В природно-климатической зоне Южного Урала хозяйство «Григорьевские сады» занимается выращиванием многолетних насаждений интенсивного типа с использованием шпалеры и местных сортов яблони свердловской, южноуральской и алтайской селекции, районированных для 4-го и 9-го агрорегионов: Краса Свердловска, Персиянка, Экранное, Свердловчанин, Первоуральская (селекции Свердловской селекционной станции садоводства) и др. Данные сорта были привиты на районированный карликовый / полукарликовый клоновый подвой 62-396 селекции Мичуринского ГАУ, который в отличие от зарубежных аналогов способен выдержать неблагоприятные климатические условия данного региона и, при условии соблюдения всех необходимых агротехнических мероприятий, обеспечить нормальный рост и развитие плодовым деревьям.
Большой интерес представляет сравнение климатических условий территорий Северного полушария с умеренно-континентальным климатом, расположенных на разных континентах – центральной части Средней полосы России (на примере г. Мичуринск Тамбовской области) и штата Миннесота в США, отличающегося самыми низкими в стране температурами зимнего периода (не считая Аляски). В Миннесоте расположеносамое холодное место в континентальной части США – город Интернешенал-Фолс, называаемый «холодильником нации».Для сравнения климатических показателей был взят город Сент-Пол, являющийся столицей данного штата.
Среднее количество дней с температурой ниже -17°С (0 F) за последние 30 лет проведения измеренийв Сент-Поле составило всего 16,5, из них 7,6 – в январе, 3,7 – в феврале, 0,5 – в марте, 0,2 – в ноябре и 4,5 – в декабре. В самом холодном месяце – январе за данный период минимальная средняя суточная температура изменялась от -5 до -14°С (в Интернешенал-Фолс – от -9 до -21°С). Средняя годовая продолжительность дня – 12,9 ч. Средняя суммарная дневная солнечная радиация – 13,4 МДж/м2 [79].
При этом следует также учитывать, что крупных промышленных насаждений яблони в Миннесоте нет, здесь проводятся лишь отдельные эксперименты в области садоводства, а в 1974 г. при гибридизации сортов Мекаун и Хонейголд был получен новый сорт яблониХанни (Хоней) Крисп – HoneyCrisp (Медовое хрустящее), который характеризуется высококачественными плодами зимнего срока созревания и высокой зимостойкостью побегов, благодаря чему к настоящему времени получил широкое распространение в США, Канаде, отдельных территориях Центральной и Восточной Европы и Центральной России.
Город Мичуринск Тамбовской области, находящийся в Центрально-Черноземном регионе (юг Центральной России), уже на протяжении более 100-летнего периода является признанным центромроссийского садоводства, где за это время И.В. Мичуриным, его учениками и последователями были получены сотни ценных сортов и гибридов различных культур, в первую очередь, яблони.
В Мичуринске за последние 36 лет наблюдений максимальная отрицательная суточная температура была зафиксирована на уровне -33,9°С; по месяцам – соответственно: -33,9°С – в январе и феврале; -23,9°С – в марте; -18,9°С – в апреле; -2,8°С – в мае; -3,0°С – в сентябре; -13,0°С – в октябре; -23,9°С – в ноябре; -27,2°С –в декабре. В самом холодном месяце – январе за данный период минимальная средняя суточная температура изменялась от -9 до -14°С. Средняя годовая продолжительность дня – 12,9 ч. Средняя суммарная дневная солнечная радиация – 10,8 МДж/м2 [80].
Таким образом, на двух данных территориях близки значения средней годовой продолжительности дня, средней суммарной дневной солнечной радиации. Динамика средних месячных значений температуры воздуха также отличаются незначительно, но в целом Мичуринск характеризуется более континентальным климатом. Это позволяет считать жесткими природно-климатические условия Тамбовской области, в которых проводятся все этапы первичных и сравнительных конкурсных испытаний новых и перспективных клоновых подвоев яблони селекции Мичуринского ГАУ. Очевидно, оптимальное сочетание высокого уровня устойчивости к сложившимся климатическим условиям и хозяйственной продуктивности является одним из важнейших составляющих элементов успеха данных подвоев при выращивании в различных регионах мира.
Выводы по разделу 2.4 главы 2
Выращивание клоновых подвоев и сортов яблони в мире производится на территориях с сильно различающимися природно-климатическими условиями. Среди рассмотренных территорий наиболее благоприятными условиями для возделывания насаждений яблони отличаются страны Центральной и Восточной Европы с «мягкой» зимой и высокими показателями средней годовой температуры, сходными показателями обладает Южный Федеральный округ РФ. Наименее благоприятными климатическими условиями отличаются центральнаячасть европейской территорииРоссии, Южный Урал, а также штат Миннесота в США – данные территории позволяют возделывать культуру яблони, но при обязательном научно-обоснованном подборе высокоустойчивых сортов и клоновых подвоев.
Среди мировых территорий, где производится селекция, испытание клоновых подвоев яблони и организованы крупные региональные плодопитомники, наиболее холодным и континентальным климатом также отличается Центральная Россия (г. Мичуринск Тамбовской области). Это позволяет считать клоновые подвои яблони, которые получены здесь и успешно прошли конкурсное сортоиспытание, одними из самых устойчивых в мире к неблагоприятным природно-климатическим условиям.
3 ОЦЕНКА СЛАБОРОСЛЫХ КЛОНОВЫХ ПОДВОЕВ ЯБЛОНИ В МАТОЧНИКЕ КОНКУРСНОГО ИСПЫТАНИЯ
В современном интенсивном садоводстве важное значение имеют слаборослые клоновые подвои яблони, позволяющие направленно управлять балансом плодового дерева в саду между наращиванием вегетативных компонентов кроны и плодоношением. Деревья на слаборослых клоновых подвоях формируют меньший объем кроны при одновременном увеличении прироста плодовых образований. Это позволяет увеличить плотность размещения деревьев в саду, формировать малообъемные конструкции их крон и благодаря этому оптимизировать световой режим фотосинтетического аппарата и получать плоды высокого качества [1-7, 13-15, 81-83].
Большое научно-практическое значение имеет изучение новых подвоев по основным морфологическим и физиологическим показателям. Их листовой аппарат играет важную роль в осуществлении нормального протекания ряда физиологических процессов в маточнике, в первую очередь фотосинтеза и транспирации [13, 83, 84-86].
Ведущим российским учреждением в области селекции клоновых подвоев яблони является Мичуринский государственный аграрный университет, где на протяжении более 80 лет проводится селекционный процесс и ежегодно получают новые генотипы рода MalusMill., в том числе на основе межвидовой гибридизации. Сейчас в университете созданы значительные генетическая коллекция и гибридный фонд слаборослых клоновых подвоев яблони, которые ежегодно участвуют в комплексном сравнительном изучении. Выделенные подвои характеризуются наличием антоцианов в тканях и повышенной устойчивостью к неблагоприятным природно-климатическим условиям, особенно к повреждающим температурам зимнего периода [84].
Цель исследований: сравнительная оценка новых слаборослых клоновых подвоев яблони в условиях маточника и выделение перспективных форм для передачи на изучение в питомник и сад.
Задачи исследований:
— изучить основные производственно-биологические признаки новых вегетативно размножаемых подвоев (зимостойкости; устойчивости к болезням и вредителям; предварительной оценки силы роста; способности к укоренению; побегопроизводительной способности маточных кустов и выхода стандартного материала отводков; склонности к ветвлению);
— изучить комплекс основных биометрических показателей перспективных клоновых подвоев яблони селекции Мичуринского ГАУ в условиях маточника;
— провести цитоанатомический анализ проводящих тканей побегов коллекции генотипов клоновых подвоев яблони;
— выделение перспективных форм клоновых подвоев яблони с высокими производственными показателями в маточнике.
Научная новизна и практическая значимость
Продолженымноголетние сравнительныеисследования хозяйственно-биологических признаков новых форм клоновых подвоев яблони 2002-2009 годов гибридизации в маточнике конкурсного изучения.Проведен цитоанатомический анализ проводящих тканей побегов коллекции отечественных генотипов клоновых подвоев яблони для дальнейшей разработки методики предварительной экспресс-диагностики карликовых форм.
Объекты и методы исследований
Биологическими объектами исследования служили 36 перспективных клоновых подвоя яблони из 10 гибридных семей селекции Мичуринского государственного аграрного университета (2002-2009 гг. получения), а также ряд районированных клоновых подвоев. В качестве контроля использовали 4 районированных в России клоновых подвоя яблони, также селекции университета, характеризующиеся различной силой роста привойных компонентов, – суперкарликовый Малыш Будаговского, карликовый Парадизка Будаговского (за пределами России более известный под названием B9 – Budagovsky 9), карликовый/ полукарликовый 62-396, полукарликовый/ среднерослый 54-118.Также были изучены другие отечественные подвои – 1 форма Оренбургской ОССиВ (Урал 5) и 2 формы дагестанских селекционеров (К-1 и Б-7-35).
Маточник конкурсного изучения был заложен осенью 2015 г. в структурном подразделении ФГБОУ ВО Мичуринский ГАУ –Научно-образовательного центре имени В.И. Будаговского,расположенном в Мичуринском районе Тамбовской области.Климат – умеренно-континентальный, почва – выщелоченный чернозем с повышенным содержанием гумуса. Все клоновые подвои размещены по схеме 150х30 см в маточнике вертикальных отводков. Формы в ряду чередуются по наличию антоциановой окраски листьев и коры побегов (зеленолистные, краснолистные). В течение вегетационного периода осуществляли спринклерный полив маточных кустов, поддерживая необходимый уровень влажности почвы. Агротехнические мероприятия стандартные. Удобрения на маточнике не вносили для исключения их влияния на хозяйственно-биологические показатели маточных кустов.
Методика проведения исследований составлена с учетом «Методики государственного сортоиспытания» [88], «Программы и методики селекции плодовых, ягодных и орехоплодных культур» [89, 90], «Программы и методики сортоизучения плодовых, ягодных и орехоплодных культур [91], методик изучения подвоев плодовых культур [92-94], а также оригинальных методик, разработанных сотрудниками кафедры плодоводства Мичуринского ГАУ[95-98].Исследования проводили в трехкратной повторности по 10 растений. Контролем в опытах служили районированные подвои – карликовой силы роста 62-396 и полукарликовой –54-118.
Измерения показателей маточных кустов проводили в конце августа – по окончанию их активного роста [91].
Площадь листовых пластинок рассчитывали с помощью компьютерной программы ImageJ по анализу сканированных изображений 20 листьев со средней части побегов.
Предварительную оценку силы роста определяли по прочности древесины при отделении отводков. Все изучаемые формы по прочности древесины были разделены на 3 группы: карлики, полукарлики и среднерослые.При оценке этого показателя учитывали результаты исследований В.И. Будаговского, М.Л. Филипповой, В.А. Коровина, Л.И. Лотовой [94-99]. По данному признаку подвоибыли распределены на три группы: 1 – подвои с ломкой древесиной и гладким, без волокон изломом; 2 – подвои с прочной древесиной, побеги которых на изломе сильно волокнистые; 3 – формы промежуточные, со среднеломкой древесиной, на поверхности излома имеющие небольшое количество волокон.
Поражаемость болезнями и вредителями учитывали в августе, когда наиболее заметны проявления имеющихся заболеваний и вредителей. Определение развития болезней, проводили согласно «Программе и методике сортоизучения плодовых, ягодных и орехоплодных культур»[29].
Оценку заселения растений вредителями и поражения вредителями и болезнями проводили по 5-ти бальной шкале:
0 – поражение отсутствует (иммунитет);
1 – поражено до 1% органов или площади листа, поверхности побегов (высокая устойчивость);
2 – поражено 1-10% органов или их поверхности (повышенная устойчивость);
3 – поражено 11-25% органов или их поверхности (средняя устойчивость);
4 – поражено 26-50% органов или их поверхности (повышенная восприимчивость);
5 – поражено свыше 50% органов или их поверхности (высокая восприимчивость).
Ветвление отводков учитывали по методике, предложенной М.Л. Филипповой [97].
Степень вызревания побегов определяли перед отделением отводков визуально и оценивали по пятибалльной шкале:
1 – рост продолжается;
2 – рост прекратился, но верхушки побегов на значительном протяжении имеют травянистое состояние;
3 – рост прекратился, но верхушки побегов имеют травянистое состояние на небольшую длину (2-3 междоузлия);
4 – верхушечные почки слабо оформились, верхушки побегов полностью не одревеснели;
5 – рост прекратился, верхушечные почки оформились, побеги вызрели.
Ранжирование отводков после их отделения с маточных кустов осуществляли по методике В.И. Будаговского [7] с учетом предложенного им подразделения на 5 групп:
1) стандартные отводки (балл укоренения 3-5, диаметр условной корневой шейки 5-10 мм);
2) черенки (балл укоренения 1-2, диаметр условной корневой шейки 5-10 мм и более);
3) недогон, хорошо укоренившийся (балл укоренения 3-5, диаметр условной корневой шейки менее 5 мм);
4) недогон, плохо укоренившийся (балл укоренения 1-2, диаметр условной корневой шейки менее 5 мм);
5) переросшие отводки (укоренение 3-5 баллов, диаметр условной корневой шейки более 11 мм).
Экспериментальные данные обработаны с использованием основных методов вариационной статистики и дисперсионного анализа [99], рассчитаны и графически визуализированы в программной среде Microsoft Office Excel 2016.
Результаты исследований
Изучение производственных показателей продуктивности
коллекции клоновых подвоев яблони селекции Мичуринского ГАУ
Основным показателем, характеризующим производственную ценность любого генотипа клонового подвоя, является количество укорененных отводков и их качество – диаметр стволика, балл укоренения, отсутствие боковых разветвлений.
Основным производственным показателем любого генотипа клонового подвоя на маточнике является выход стандартных (I и II технического сорта) укорененных отводков, образующихся в течение вегетационного периода на маточных кустах. В свою очередь данный показатель зависит от других сопряженных биологических признаков.
Общее количество стандартных отводков в расчете на один маточный куст изменялось у изучаемых генотипов от 4,2 до 21,9 шт. Образование более 15 вертикальных отводков с маточного куста отмечено у клоновых подвоев71-3-88, 2-314, 2-344, 2-949, 2-990, 2-1210, 2-1215, 2-1227, 2-1515, 9-11, 9-15 (рисунок 18). В процентном отношении доля стандартных отводков (I и II технического сорта)на маточных кустах составляет от 22,8 до 72,5%, наиболее высокие значения по данному показателю отмечены у подвойных форм 2-9-49, 2-9-90, 2-15-2, 2-15-15, 4-6-5 (рисунок 19). Такой широкий диапазон изменчивости признака связан с различным генетическим происхождением подвойных форм, индивидуальными морфоанатомическими особенностями строения их побегов и различием способности к ризогенезу.
У изучаемых клоновых подвоев яблони удельная доля укорененных отводков на маточных кустахварьировала в широком диапазоне – от 34,8 до 97,1%. Наибольшие значения данного признака отмечены у районированного клонового подвоя Малыш Будаговского и перспективных форм 2-33, 2-949,2-956, 2-990, 2-152, 2-1515, 3-103, 4-23,9-14, 9-19 (рисунок 20).
Между количеством стандартных укорененных отводков и их общим количеством на маточном кусте изучаемых клоновых подвоев установлена средняя положительная корреляция, равная 0,67. Между удельной долей стандартных укорененных и неукорененных отводков, образуемых маточными кустами различных генотипов, выявлена отрицательная корреляция среднего уровня -0,53.
Характер ветвления побегов клоновых подвоев нами был дополнительно изучен в ходе трехлетнего эксперимента, результаты которого представлены в следующем подразделе. Для производства клоновых подвоев наибольшее значение имеет отсутствие сильного разветвления побегов у однолетних укорененных отводков, это облегчает процесс их отделения на маточнике, позволяет быстрее проводить сортировку, а затем – зимнюю прививку или окулировку.
Подвойных форм с сильноветвящимися побегами не выявлено, средняя степень ветвления наиболее крупных отводков отмечена у форм 2-12-10, 3-4-7, 5-26-127, 5-27-1.
Осень2020 г.отличалась продолжительным периодом положительных температур выше +5°C, однако к окончанию октября практически все изучаемые подвойные формы закончили ростовые процессы и сформировали верхушечную почку. На 4,7 балла вызрели побеги форм 2-3-17, 2-9-94.
Рисунок18– Общее количество стандартных вертикальных отводков, образуемых маточными кустами изучаемой коллекции клоновых подвоев яблони
Рисунок 19 – Удельная доля стандартных отводков (IиIIтехнического сорта)
на маточных кустах коллекции клоновых подвоев яблони
Рисунок 20 – Выход стандартных укорененных отводков маточных кустов
изучаемой коллекции клоновых подвоев яблони
Анализ биологических и хозяйственных показателей маточных кустов
клоновых подвоев яблони селекции Мичуринского ГАУ
Для выявления многолетней динамики роста побегов маточных кустов и характера их ветвления в маточнике конкурсного испытания были изучены 40 генотипов клоновых подвоев яблони селекции Мичуринского ГАУ. В качестве контрольных форм выступали районированные клоновые подвои различной силы роста – Малыш Будаговского (МБ – суперкарликовый), Парадизка Будаговского (ПБ, также известный как B9 – карликовый), 62-396 (карликовый / полукарликовый – в зависимости от генотипа прививаемого сорта, определяющего его ростовой потенциал), 54-118 (полукарликовый / среднерослый).
Все изучаемые генотипы клоновых подвоев характеризовались высоким уровнем зимостойкости. Полевая оценка состояния однолетних побегов маточных кустов, оставленных для перезимовки, проведенная весной 2020 г., показала отсутствие повреждений почек, коры и анатомических структур внутренних тканей – флоэмы (луба) и ксилемы (древесины).
Кроме количественных показателей выхода укорененных отводков, другим важным хозяйственным показателем маточных кустов является интегральная оценка их общего состояния в период окончания вегетации, отражающим состояние листового аппарата и степень его повреждения основными вредителями (тля, паутинный клещ) и болезнями (парша, мучнистая роса, филлостиктоз). Средний показатель данного признака у коллекции клоновых подвоев составляет 3,95 баллов, изменяясь в диапазоне от 3,4 до 4,6 баллов у отдельных генотипов (рисунок 21).
У большинства генотипов подвоев изучаемой коллекции не отмечено поражения листьев паршой и мучнистой росой, у ряда форм установлено полное отсутствие симптомов данных болезней, хотя в 2020 г. сложились благоприятные условия для развития данных заболеваний – «мягкая» зима, умеренные летние температуры и высокий уровень влажности воздуха и листового аппарата растений вследствие спринклерного орошения. Основные повреждения растений на маточнике были связаны с развитием двух генераций зеленой и серой яблонной тли, а также поражении листового аппарата филлостиктозом – бурой листовой пятнистостью, вызываемой патогенным микроскопическим грибком Phyllosticta mali Pr. et. Del.
На фоне полного отсутствия обработок средствами защиты растений на маточнике в вегетационный период, все контрольные формы клоновых подвоев характеризовались средним уровнем общего состояния облиственных побегов своих маточных кустов: МБ – на уровне 3,8 баллов; 62-396 – 3,9 баллов; ПБ – 4,1 баллов; 54-118 – 4,2 баллов (рисунок 21).
Рисунок 21 – Сравнительный анализ общего состояния маточных кустов
коллекции клоновых подвоев яблони селекции Мичуринского ГАУ
Самый высокий показатель общего состояния маточных кустов на уровне 4,6 баллов отмечен у подвойных форм 85-11-9 и 2-9-49, характеризующихся сдержанным ростом привойного компонента. Из новых генотипов высокой комплексной устойчивостью на уровне 4,3 баллов отличались подвои 2-9-56, 2-15-15.
У изучаемых образцов генетической коллекции отмечена значительная вариабельность комплекса морфоанатомических показателей, что обусловлено их различным эколого-генетическим происхождением и связанной с этим неодинаковой силой роста маточных кустов.
У маточных кустов изучаемых клоновых подвоев яблони выявлены генотипические различия между минимальным и максимальным значением каждого из анализируемых морфологических признаков:
— средней длины одного побега – в 2,5 раза (в диапазоне от 43,3 см у районированного суперкарликового подвоя Малыш Будаговского до 108,9 см у формы 3-4-7);
— длины междоузлий на побеге – в 2,1 раза (от 1,46 см у формы 2-9-49 до 3,07 см у формы 2-12-10);
— угла отклонения побегов от вертикали – в 4,5 раза (от 9,7° у формы 9-1-2 до 43,9° у районированного карликового подвоя B9);
— площади листовой пластинки – в 2,9 раза (от 7,7 до 22,6 см2 у форм 4-2-50 и 2-12-34);
— количества листьев на побеге – в 2,9 раза (от 20,0 до 57,4 шт. у форм 9-1-2 и 3-4-7);
— площади листовой поверхности побега – в 6,1 раза (от 185,9 см2 у подвоя 4-2-50 до 1129,6 см2 у формы 2-12-34);
— площади листовой поверхности маточного куста – в 7,3 раза (от 1718 см2 у районированного карликового подвоя B9 до 12610 см2 у формы 2-12-15).
Удельное количество листьев на 1 м побега, рассчитанное для сравнения подвоев различной силы роста, изменялось в 1,52 раза – от 32,5 до 68,3 шт. у гибридов 2-12-10 и 2-9-49 соответственно. По удельной площади листовой поверхности в расчете на 1 м побега различия между генотипами составили 8,9 раз – от 7007 см2 у карликового подвоя 4-2-50 до 62532 см2 у формы 2-12-34. Между показателями длины побегов маточного куста и площади их листовой поверхности установлена корреляция 0,71, которая в отдельных гибридных семьях достигала 0,86.
Важными технологическими показателями возделывания в маточнике клоновых подвоев являются геометрические размеры их маточных кустов – высота, степень ветвления и раскидистости побегов.
По высоте маточных кустов все изученные генотипы отличаются значительной вариабельностью, определяемой как генотипическим фактором, так и природно-климатическими особенностями конкретного сезона.
Так, вариационная кривая значений высоты маточного куста коллекции генотипов в 2020 г. имела вид четко выраженной трехмодальной кривой (рисунок 23). Различия между подвоями по высоте куста в 2019 г. оказались менее выражены, что на вариационной кривой отражено в виде отсутствия локальных максимумов, наблюдаемых ранее в 2018 и 2017 гг. Это связано с относительно благоприятными условиями 2020, 2018 и 2017 гг. в период наиболее активной вегетации подвоев, в то время как в предыдущем, 2019 г. были отмечены неблагоприятные климатические условия большей части летнего периода – тогда, несмотря на спринклерное орошение маточника, относительная влажность воздуха была значительно снижена, а средняя температура, наоборот, оказалась повышенной. В связи с этим наблюдается прямая зависимость – в более неблагоприятных условиях существенно ухудшаются показатели продуктивности маточных растений.
Рисунок 23 – Динамика силы роста маточных кустов коллекции генотипов
клоновых подвоев яблони селекции Мичуринского ГАУ в 2017-2020 г.
В 2020 г. высотой куста в маточнике менее 60 см отличалась формы 2314,2949, 2-15-2, 2-15-15, 5-28-11,911, 912,913, 914.Наиболее высокими маточными кустами (более 100 см) отличались подвои 3-4-7 и 54-118 (рисунок 24).
Рисунок 24–Динамика высоты маточных кустов коллекции клоновых подвоев яблони селекции Мичуринского ГАУ за 2017-2020 гг. (цифрами указан
диапазон варьирования признака за указанный период)
При оценке качества отделяемых отводков учитывают негативный признак конкретных подвоев – наличие разветвлений на побеге, так как в производстве эта биологическая особенность затрудняет их культивирование в питомнике и вносит дополнительные затраты на борьбу с ней. 87,4% изучаемых подвоев являлись слабоветвящимися. В группу средневетвящихся отнесено 12,6% генотипов: 2-12-10, 3-4-7, 3-10-3, 5-27-1. Сильноветвящихся подвоев не выявлено.
Степень раскидистости маточных кустов определяет технологичность возделывания подвоев в маточнике и возможность механизации отдельных этапов. Более предпочтительны формы с ровными прямостоячими побегами, образующими компактный маточный куст. Это позволяет упростить механизацию большинства технологических операций в маточнике в период вегетации маточных кустов – их окучивание органическим субстратом, культивирование с одновременной прополкой междурядий, разокучивание и отделение отводков. Чем более компактный куст и больше прямостоячих побегов, тем менее они повреждаются рабочими органами различных механизмов и технических устройств. У склоненных к земле побегов велика вероятность быть сильно поврежденными в процессе работы данных устройств. Для объективности анализа степени раскидистости маточных кустов у растений в маточнике измеряли угол отклонения побегов от вертикали – чем он меньше, тем более компактным является куст. Вариационная кривая значений угла отклонения побегов имеет три обособленных локальных максимума, что соответствует распределению подвоев по форме маточных кустов на три группы – компактные, полураскидистые, раскидистые (рисунок 25). Наиболее прямостоячими побегами (отклонение от вертикали менее 15°) и самыми компактными маточными кустами отличаются подвои Малыш Будаговского, 233, 2317, 2956, 2990, 21210, 21236, 2-15-2, 2-15-15, 423, 42-50, 912, 913, 914, 915, 919. Самые раскидистые маточные кусты со средним отклонением побегов от вертикали более 40° имеют подвои B9, 2996, 34-7.
Подвои с укороченными междоузлиями побегов менее удобны при прививке, особенно методом окулировки. Среди 40 генотипов не выявлено существенных корреляций между длиной междоузлий и другими признаками – количеством листьев на побеге (-0,44) и высотой маточных кустов (0,24). Вариационная кривая значений длины междоузлий двумодальная, с четко оформленными максимумами в области 2,0 и 2,4 см (рисунок26). Междоузлия более 2,5 см имеют подвои 54-118, B9, 2317, 2344, 2-12-10, 423, 42-50.
Рисунок 25 – Вариабельность угла отклонения от вертикали побегов маточного куста коллекции клоновых подвоев яблони
Рисунок 26 – Вариабельность длины междоузлий на побегах клоновых подвоев яблони
У изучаемой коллекции клоновых подвоев установлено, что вариационные кривые площади листовых пластинок и количества листьев на одном побеге одномодальные и не имеют локальных максимумов (рисунки 27, 28). Выявлены корреляции среднего уровня между площадью листовой пластинки и размером листовой поверхности всего растения – в расчете на один побег (0,68) и маточный куст в целом (0,48).
Рисунок 27 – Вариабельность площади листовых пластинок
коллекции клоновых подвоев яблони
Рисунок 28 – Вариабельность количества листьев на одном побеге
у изучаемых клоновых подвоев яблони
Отмечены положительные корреляции между количеством листьев на побеге и другими признаками – высотой маточных кустов (0,76); площадью листовой поверхности побега (0,71); долей неукорененных отводков (0,59); углом отклонения побегов от вертикали (0,48).
Площадь листовой поверхности маточного куста характеризуется наибольшей изменчивостью у изучаемых подвоев из-за вариабельности исходных морфологических признаков – длины побегов и количества листьев на них, средней площади листовой пластинки, количества побегов в кусте (рисунок 29). По величине листовой поверхности маточного куста на вариационной кривой отчетливо выделяются 4 группы генотипов с интервалами показателя 2000-5000 см2, 5000-8000 см2, 8000-11000 см2, 11000-13000 см2 (рисунок 30). Наименьшей площадью листовой поверхности у растений в маточнике (менее 5000 см2) отличаются подвои Малыш Будаговского, B9, 232, 233, 2319, 2956, 2990, 2994, 21236, 2-15-2, 2-15-15, 42-50, 5-26-127, а наибольшей (более 11000 см2) – формы 21210 и 21215. Установлена положительная корреляция среднего уровня, равная 0,59, между величиной листовой поверхности одного побега и всего растения.
Рисунок 29 – Вариабельность площади листовой поверхности одного побега
у изучаемых клоновых подвоев яблони
Среди изученных подвоев выявлены положительные корреляции между высотой маточного куста и площадью его листовой поверхности – в расчете на один побег 0,71; для всего маточного куста 0,45.
Основными производственными показателями любого подвоя в маточнике являются количество образуемых укорененных отводков и доля среди них стандартных. Чем выше оба данных показателя, тем большую ценность для производства представляет подвой. Отмечена положительная корреляция на уровне 0,58 между общим количеством отводков с одного куста и числом стандартных. Установлена взаимосвязь процента неукорененных отводков с высотой маточных кустов (r = 0,56), количеством стандартных отводков в одном кусте (-0,49) и их процентным выходом (-0,72).
Рисунок 30 – Вариабельность площади листовой поверхности маточного куста
у изучаемых клоновых подвоев яблони.
В изучаемой коллекции подвоев установлена высокая положительная корреляция на уровне 0,72 между выходом стандартных отводков с куста и средним баллом их укоренения. Наибольшая укореняемость побегов в маточнике была у подвоев Малыш Будаговского, 2-9-94, 2-15-2, 62-396, у которых отводки без корней составляли не более 5% от общего количества.
Осенью 2020 г. среди образцов коллекции новых перспективных клоновых подвоев яблони селекции Мичуринского ГАУ был проведен сравнительный анализ коэффициента разветвления трехлетних побегов на маточных кустах, рассчитанный как отношение суммарной длины боковых разветвлений к длине главного побега(рисунок 31). Также вычисляли другой показатель – отношение суммарной длины трехлетнего прироста побега к его диаметру у основания (рисунок 32). Корреляция между двумя данными показателями положительна и составляет 0,73.
Наименее выраженной разветвленностью трехлетних побегов на маточных кустах отличались подвойные формы 2-3-2, 2-9-77, 2-9-90, а также контрольный районированный подвой яблони 54-118. Наибольшие значения коэффициента разветвления трехлетних побегов отмечены у генотипов 2-3-14, 2-3-44, 2-12-10, 2-12-15, 2-15-15, 5-24-1, 5-28-11, 3-4-7, 4-6-5, 9-1-1, 9-1-3 (рисунок 31).
На рисунках 33 и 34отмечен трехмодальный характер соответствующих вариационных кривых обоих данных признаков, что позволяет разделить все изученные генотипы на три группы в соответствии со степенью разветвления их побегов – соответственно, слабо-, средне- и сильноразветвленные формы.
Рисунок 31 – Сравнительный анализ коэффициента разветвления трехлетних побегов
на маточныхкустах клоновых подвоев яблони селекции Мичуринского ГАУ
Рисунок 32 – Сравнительный анализ морфометрических показателей трехлетних побегов
на маточных кустах клоновых подвоев яблони селекции Мичуринского ГАУ
Рисунок 33 – Вариабельность значенийкоэффициента разветвления трехлетних побегов
у клоновых подвоев яблони различной силы роста селекции Мичуринского ГАУ
Рисунок 34 – Вариабельность отношения суммарной длины прироста трехлетнего побега
к его диаметруу клоновых подвоев яблони различной силы роста
селекции Мичуринского ГАУ
Выводы по главе 3
Установлена значительная вариабельность показателей роста и развития побегов, а также степени их укоренения у перспективных и районированных подвоев селекции Мичуринского государственного аграрного университета. Это вызвано генетическим разнообразием изученной коллекции генотипов рода MalusMill. в связи с их различным происхождением и использованием метода межвидовой гибридизации. Наибольшей изменчивостью характеризуется площадь листовой поверхности маточного куста.
Выявлены основные закономерности развития в маточнике перспективных клоновых подвоев яблони селекции Мичуринского ГАУ. Установлены корреляции между основными морфологическими признаками, которые в дальнейшем планируется использовать в селекции для отбора потенциально ценных гибридов. Отмечена корреляция показателей высоты маточного куста и площади его листовой поверхности – в расчете на один побег 0,71; для всего маточного куста 0,45; между выходом стандартных отводков с куста и средним баллом их укоренения (на уровне 0,72). Изученные показатели роста и развития побегов, а также степени их укоренения у генотипов демонстрируют значительную гетерогенность гибридных растений, что обусловлено их различным генетическим происхождением и связанной с этим неодинаковой силой роста маточных кустов. Выделены перспективные клоновые подвои с высокими производственными показателями в маточнике.
Основными производственными показателями любого подвоя в маточнике являются количество образуемых укорененных отводков и доля среди них стандартных. Чем выше оба данных показателя, тем большую ценность для производства представляет подвой. Отмечена положительная корреляция на уровне 0,58 между общим количеством отводков с одного куста и числом стандартных. Установлена взаимосвязь процента неукорененных отводков с высотой маточных кустов (r = 0,56), количеством стандартных отводков в одном кусте (-0,49) и их процентным выходом (-0,72).
Самый высокий показатель общего состояния маточных кустов на уровне 4,6 баллов отмечен у подвойных форм 85-11-9 и 2-9-49, характеризующихся сдержанным ростом привойного компонента. Из новых генотипов высокой комплексной устойчивостью на уровне 4,3 баллов отличались подвои 2-9-56, 2-15-15.
Наименее выраженной разветвленностью трехлетних побегов на маточных кустах отличались подвойные формы 2-3-2, 2-9-77, 2-9-90, а также контрольный районированный подвой яблони 54-118. Наибольшие значения коэффициента разветвления трехлетних побегов отмечены у генотипов 2-3-14, 2-3-44, 2-12-10, 2-12-15, 2-15-15, 5-24-1, 5-28-11, 3-4-7, 4-6-5, 9-1-1, 9-1-3.
В 2020 г. высотой куста в маточнике менее 60 см отличалась формы 2314,2949, 2-15-2, 2-15-15, 5-28-11, 911, 912,913, 914. Наиболее высокие маточные кусты (более 100 см) отмечены у подвоев 3-4-7 и54-118.
Наиболее прямостоячими побегами (отклонение от вертикали менее 15°) и самыми компактными маточными кустами отличаются подвои Малыш Будаговского, 233, 2317, 2956, 2990, 21210, 21236, 2-15-2, 2-15-15, 423, 42-50, 912, 913, 914, 915, 919. Самые раскидистые маточные кусты со средним отклонением побегов от вертикали более 40° имеют подвои B9, 2996, 34-7.
В процентном отношении доля стандартных отводков на маточных кустах составляет от 22,8 до 72,5%, наиболее высокие значения по данному показателю отмечены у подвойных форм 2-9-49, 2-9-90, 2-15-2, 2-15-15, 4-6-5.
Между количеством стандартных укорененных отводков и их общим количеством на маточном кусте изучаемых клоновых подвоев установлена средняя положительная корреляция, равная 0,67. Между удельной долей стандартных укорененных и неукорененных отводков, образуемых маточными кустами различных генотипов, выявлена отрицательная корреляция среднего уровня -0,53.
4 ОЦЕНКА ПЕРСПЕКТИВНЫХ СОРТО-ПОДВОЙНЫХ КОМБИНАЦИЙ ЯБЛОНИ В ПИТОМНИКЕ КОНКУРСНОГО ИСПЫТАНИЯ
Цель исследований: оценка перспективных сорто-подвойных комбинаций яблони в питомнике конкурсного испытания в природно-климатических условиях Центрально-Черноземного региона (Тамбовской области) и выделение лучших форм клоновых подвоев яблони селекции Мичуринского ГАУ для дальнейшего изучения в конкурсном саду.
Задачи исследований:
— провести сравнительный анализ перспективных сорто-подвойных комбинаций яблони в условиях питомника конкурсного испытания по комплексу значимых биологических признаков и высоких производственных показателей;
— определить динамику изменения биометрических показателей сорто-подвойных комбинаций в питомникена основе перспективных клоновых подвоев;
— по показателям в питомнике выделить лучшие формы клоновых подвоев и наиболее перспективные сорто-подвойные комбинации яблони, рекомендуемые для дальнейшего комплексного изучения в саду конкурсного испытания.
Научная новизна и практическая значимость: в условиях питомника конкурсного испытания проведена оценка новых перспективных сорто-подвойных комбинаций яблони на основе лучших производственных сортов яблони Лобо и Ханни (Хоней) Крисп для Средней полосы России, привитых на 48 перспективных и районированных клоновых подвоев селекции Мичуринского ГАУ. Для морфометрического анализа использован ряд учетных признаков, позволяющих комплексно оценить особенности развития надземной части растений каждой из изученных сорто-подвойных комбинаций. Установлено влияние привойного и подвойного компонентов однолетних саженцев яблони, на основе которого были выделены лучшие формы клоновых подвоев яблони, рекомендуемые для дальнейшего изучения в саду конкурсного испытания.
Объекты, условия и методика проведения исследований
Питомник конкурсного изучения, в котором проведены исследования, расположен в структурном подразделении ФГБОУ ВО Мичуринский ГАУ – Научно-образовательном центре (НОЦ) имени В.И. Будаговского и служит для ежегодного исследования перспективных генотипов клоновых подвоев при получении высококачественного посадочного материала яблони.
В 2020 г. в первом поле питомника было изучено 45 подвойных формяблони, из них 34– перспективных клоновых подвоев селекции Мичуринского ГАУ 2002-2009 гг. гибридизации, во втором и третьем полях – по 48 генотипов. Контролем служили районированные подвои различной силы роста – Парадизка Будаговского, также известный в других странах мира как B9 (карликовый), 62-396 (карликовый/полукарликовый), 54-118 (полукарли-ковый/среднерослый), 70-20-20 (среднерослый). В качестве привойного компонента прививки использовали районированные сортаяблони Лобо и Ханни (Хоней) Крисп с плодами зимнего срока созревания, востребованные в настоящее время в производственных интенсивных садах Средней полосы России. Подобный крупномасштабный опыт по сравнению сорто-подвойных комбинаций на основе перспективных клоновых подвоев яблони нового поколения, полученных в Мичуринском ГАУ, проводится впервые.
В питомнике проводили комплекс стандартных агротехнических мероприятий – механическое рыхление почвы, прополка сорняков, регулярный полив. Кристаллические и жидкие удобрения не вносили, чтобы исключить возможность их дополнительного влияния на рост и развитие клоновых подвоев.
При изучении коллекции клоновых подвоев яблони учитывали следующие хозяйственно-биологические показатели: приживаемость отводков, процент подошедших к окулировке подвоев, приживаемость «глазков» после окулировки, сохранность окулянтов в зимний период, удельный выход и развитие однолетних саженцев по результатам осенней ревизии, удельный выход и развитие двухлетних саженцев по результатам осенней ревизии.
Исследования проводили с учетом «Методики государственного сортоиспытания» [88], «Программы и методики селекции плодовых, ягодных и орехоплодных культур» [89, 90], методики изучения подвоев плодовых культур [91, 92], методики выявления сортов интенсивного типа [93], а также методик, разработанных сотрудниками кафедры плодоводства Мичуринского ГАУ [95-98]. Статистическую обработку полученных данных проводили в программной среде Microsoft Office Excel 2016.
Результаты исследований
Изучаемые клоновые подвои яблони на первом поле питомника характеризовались высокой приживаемостью после посадки. Во многом это связано со сложившимися благоприятным температурным режимом в вегетационный период, а также благодаря регулярному и достаточному для поддержания оптимального уровня влажности почвы капельному орошению питомника.После высадки отделенных стандартных укорененных отводков весной в первое поле питомника в среднем по генотипам в среднем прижилось 97,2%, из них в свою очередь затем оказались пригодными к окулировке 97,4%. От исходного количества высаженных подвоев пригодных к окулировке по изучаемым генотипам в июле 2020 г. в среднем отмечено 86,0%. Доля подвоев с прижившимися щитками («глазками») после окулировки составила 97,4% от заокулированных и 83,8% от исходного количества высаженных подвоев. Наибольшей приживаемостью окулянтов в первом поле питомника выше контрольногоуровня (более 94%) характеризовались подвои 2-3-14, 2-9-49, 2-9-90,2-12-36, 2-15-2(таблица9).
Таблица 9 – Производственные показатели первого поля питомника (2020 г.)
| №
п/п |
Подвой | Высажено,
шт. |
Прижившихся подвоев, | Пригодных к окулировке | С прижившимися глазками | ||||
| шт. | % | шт. | % от
прижив. |
шт. | % от окулир. | % от высаж. | |||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 1 | 54-118 | 58 | 58 | 100 | 56 | 96,6 | 54 | 96,4 | 93,1 |
| 2 | 62-396 | 50 | 49 | 98,0 | 48 | 98,0 | 46 | 95,8 | 92,0 |
| 3 | ПБ (B9) | 68 | 66 | 97,1 | 65 | 98,5 | 63 | 96,9 | 92,6 |
| 4 | 70-20-20 | 51 | 49 | 96,1 | 47 | 95,9 | 45 | 95,7 | 88,2 |
| 5 | МБ | 50 | 48 | 96,0 | 46 | 95,8 | 43 | 93,5 | 86,0 |
| 6 | 57-146 | 50 | 48 | 96,0 | 45 | 93,8 | 42 | 93,3 | 84,0 |
| 7 | 57-491 | 50 | 49 | 98,0 | 47 | 95,9 | 46 | 97,9 | 92,0 |
| 8 | 71-7-22 | 51 | 48 | 94,1 | 46 | 95,8 | 45 | 97,8 | 88,2 |
| 9 | 76-3-6 | 50 | 49 | 98,0 | 48 | 98,0 | 46 | 95,8 | 92,0 |
| 10 | 83-1-15 | 62 | 61 | 98,4 | 60 | 98,4 | 58 | 96,7 | 93,5 |
| 11 | Б7-35 | 56 | 54 | 96,4 | 53 | 98,1 | 51 | 96,2 | 91,1 |
| 12 | 2-3-2 | 53 | 51 | 96,2 | 50 | 98,0 | 48 | 96,0 | 90,6 |
| 13 | 2-3-3 | 65 | 64 | 98,5 | 62 | 96,9 | 60 | 96,8 | 92,3 |
| 14 | 2-3-8 | 55 | 53 | 96,4 | 52 | 98,1 | 51 | 98,1 | 92,7 |
| 15 | 2-3-14 | 60 | 59 | 98,3 | 58 | 98,3 | 57 | 98,3 | 95,0 |
| 16 | 2-3-17 | 53 | 51 | 96,2 | 50 | 98,0 | 48 | 96,0 | 90,6 |
| 17 | 2-3-19 | 53 | 50 | 94,3 | 50 | 100,0 | 47 | 94,0 | 88,7 |
| 18 | 2-3-44 | 55 | 53 | 96,4 | 52 | 98,1 | 50 | 96,2 | 90,9 |
| 19 | 2-9-49 | 75 | 74 | 98,7 | 72 | 97,3 | 71 | 98,6 | 94,7 |
| 20 | 2-9-56 | 53 | 52 | 98,1 | 50 | 96,2 | 49 | 98,0 | 92,5 |
| 21 | 2-9-77 | 57 | 55 | 96,5 | 54 | 98,2 | 52 | 96,3 | 91,2 |
| 22 | 2-9-90 | 80 | 79 | 98,8 | 77 | 97,5 | 76 | 98,7 | 95,0 |
| 23 | 2-9-94 | 60 | 58 | 96,7 | 57 | 98,3 | 56 | 98,2 | 93,3 |
| 24 | 2-9-96 | 64 | 62 | 96,9 | 61 | 98,4 | 60 | 98,4 | 93,8 |
| 25 | 2-12-10 | 60 | 59 | 98,3 | 57 | 96,6 | 55 | 96,5 | 91,7 |
| 26 | 2-12-15 | 66 | 65 | 98,5 | 64 | 98,5 | 62 | 96,9 | 93,9 |
| 27 | 2-12-27 | 60 | 57 | 95,0 | 56 | 98,2 | 55 | 98,2 | 91,7 |
| 28 | 2-12-34 | 54 | 52 | 96,3 | 51 | 98,1 | 49 | 96,1 | 90,7 |
| 29 | 2-12-36 | 72 | 71 | 98,6 | 70 | 98,6 | 68 | 97,1 | 94,4 |
| 30 | 2-15-2 | 82 | 81 | 98,8 | 80 | 98,8 | 78 | 97,5 | 95,1 |
| 31 | 2-15-15 | 60 | 58 | 96,7 | 57 | 98,3 | 56 | 98,2 | 93,3 |
| 32 | 3-4-7 | 56 | 55 | 98,2 | 53 | 96,4 | 51 | 96,2 | 91,1 |
| 33 | 3-10-3 | 66 | 65 | 98,5 | 63 | 96,9 | 62 | 98,4 | 93,9 |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 34 | 4-2-3 | 60 | 58 | 96,7 | 57 | 98,3 | 56 | 98,2 | 93,3 |
| 35 | 4-2-50 | 60 | 57 | 95,0 | 56 | 98,2 | 55 | 98,2 | 91,7 |
| 36 | 4-6-5 | 58 | 57 | 98,3 | 55 | 96,5 | 54 | 98,2 | 93,1 |
| 37 | 5-21-27 | 57 | 56 | 98,2 | 54 | 96,4 | 52 | 96,3 | 91,2 |
| 38 | 5-21-93 | 56 | 54 | 96,4 | 52 | 96,3 | 51 | 98,1 | 91,1 |
| 39 | 5-24-1 | 60 | 58 | 96,7 | 57 | 98,3 | 55 | 96,5 | 91,7 |
| 40 | 5-26-127 | 54 | 53 | 98,1 | 52 | 98,1 | 50 | 96,2 | 92,6 |
| 41 | 5-27-1 | 47 | 45 | 95,7 | 43 | 95,6 | 40 | 93,0 | 85,1 |
| 42 | 5-28-11 | 50 | 48 | 96,0 | 46 | 95,8 | 43 | 93,5 | 86,0 |
| 43 | 9-1-3 | 58 | 57 | 98,3 | 55 | 96,5 | 54 | 98,2 | 93,1 |
| 44 | 9-1-4 | 66 | 64 | 97,0 | 63 | 98,4 | 61 | 96,8 | 92,4 |
| 45 | 9-1-5 | 82 | 81 | 98,8 | 79 | 97,5 | 77 | 97,5 | 93,9 |
| Итого | 2663 | 2591 | 97,2 | 2526 | 97,4 | 2448 | 96,8 | 91,7 | |
Продолжение таблицы 9
Продолжение табл. 10
В питомнике выход однолетних саженцев яблони составил в среднем по сортам 88,5%. Наибольший выход на уровне 93,6% отмечен у саженцев сорта Лобо, а наименьший (83,4%) – у сорта Ханни Крисп.
Изучение сорто-подвойных комбинаций сортов яблони на клоновых подвоях различной силы роста во втором поле питомника
В результате проведенных исследований изучены СПК районированных производственных сортов яблони Лобо и Ханни (Хоней) Крисп, привитых на на новых перспективных и районированных клоновых подвоях различной силы роста селекции Мичуринского ГАУ. Выявлена значительная вариабельность биометрических показателей растений, вызванная взаимным влиянием компонентов прививки (таблицы 10, 11). Вариационные кривые значений данных признаков имеют вид как стандартного нормативного распределения, так и двумодальных кривых (рисунки 35-44). Это может быть связано с различием показателей у СПК на клоновых подвоях различной силы роста.
Наименьшим ростом в питомнике характеризовались СПК саженцев с участием клоновых подвоев селекции Мичуринского ГАУ 2-3-2, 2-3-14, 2-9-56, 2-12-34, 2-12-36, 5-26-127, 9-1-1, 9-1-9.Часть морфометрических показателей саженцев на контрольных подвоях 62-396 и 54-118 оказались сходными между собой, при этом у последнего оказались более выражены параметры боковых однолетних разветвлений саженцев и увеличена площадь листовой поверхности.
На примере сорто-подвойных комбинаций сорта Ханни Крисп установлено, что у саженцев на основе более слаборослых клоновых подвоев имеют меньшее количественное выражение как исходные морфометрические признаки (высота саженца, диаметр штамба, суммарная длина однолетнего прироста, площадь листьев), так и их взаимные соотношения – удельная площадь листового аппарата, индекс роста (рисунки45-51).
Таблица 10 – Вариабельность морфометрических признаков однолетних саженцев яблони у 48 сорто-подвойных комбинаций сорта Лобо
| Признак | Среднее значение | Интервал
варьирования значений |
Минимальное
значение |
Максимальное
значение |
| Высота саженца, см | 144,1 ± 1,6 | 44,2 | 120,2 | 164,4 |
| Диаметр штамба, мм | 14,9 ± 0,2 | 6,2 | 12,0 | 18,2 |
| Длина боковых разветвлений, см | 20,3 ± 2,0 | 59,5 | 1,7 | 61,2 |
| Количество боковых разветвлений, шт. | 5,6 ± 0,3 | 11,4 | 1,2 | 12,6 |
| Количество листьев на центральном побеге, шт. | 44,6 ± 0,5 | 14,2 | 36,8 | 51,0 |
| Кол-во листьев на боковых разветвлениях, шт. | 12,8 ± 1,1 | 31,8 | 1,3 | 33,0 |
| Суммарное количество листьев на саженце, шт. | 57,4 ± 1,4 | 41,2 | 39,3 | 80,4 |
| Площадь листовой пластинки, см2 | 54,4 ± 0,8 | 25,0 | 40,6 | 65,6 |
| Площадь листового аппарата саженца, см2 | 3134,5 ± 97,3 | 2990,0 | 1738,6 | 4728,6 |
| Суммарная длина побегов, см | 164,4 ± 3,2 | 94,7 | 125,7 | 220,4 |
| Удельная доля суммарной длины боковых побегов относительно высоты саженца, % | 13,7 ± 1,3 | 37,7 | 1,3 | 39,0 |
| Удельная доля площади листьев на боковых разветвлениях относительно общей площади листового аппарата саженца, % | 19,4 ± 1,3 | 35,1 | 3,0 | 38,1 |
| Удельная площадь листового аппарата,
см2/см длины побегов |
18,9 ± 0,3 | 10,6 | 13,8 | 24,4 |
| Отношение суммарной площади листового аппарата к площади поперечного сечения штамба, см2/ мм2 | 1790,9 ± 44,0 | 1675,9 | 1170,1 | 2846,0 |
| Индекс роста саженца
(высота саженца в см × диаметр штамба в мм) |
2164,1 ± 52,8 | 1476,6 | 1493,3 | 2969,9 |
Таблица 11– Вариабельность морфометрических признаков однолетних саженцев яблони у 48 сорто-подвойных комбинаций сорта Ханни Крисп
| Признак | Среднее значение | Интервал
варьирования значений |
Минимальное
значение |
Максимальное
значение |
| Высота саженца, см | 115,4 ±2,3 | 69,8 | 79,0 | 148,8 |
| Диаметр штамба, мм | 11,4 ±0,2 | 6,2 | 8,4 | 14,6 |
| Длина боковых разветвлений, см | 22,1 ±3,6 | 143,1 | 0 | 143,1 |
| Количество боковых разветвлений, шт. | 4,6±0,4 | 11,2 | 0 | 11,2 |
| Количество листьев на центральном побеге, шт. | 40,3 ±0,7 | 23,5 | 29,7 | 53,2 |
| Кол-во листьев на боковых разветвлениях, шт. | 19,6 ±2,3 | 76,8 | 0 | 76,8 |
| Суммарное количество листьев на саженце, шт. | 59,9±2,7 | 91,9 | 33,3 | 125,2 |
| Площадь листовой пластинки, см2 | 29,2±0,6 | 19,64 | 19,01 | 38,65 |
| Площадь листового аппарата саженца, см2 | 1773,8 ±93,9 | 3222,1 | 703,9 | 3926,0 |
| Суммарная длина побегов, см | 137,4±5,4 | 212,6 | 79,3 | 291,9 |
| Удельная доля суммарной длины боковых побегов относительно высоты саженца, % | 17,5±2,6 | 96,5 | 0 | 96,5 |
| Удельная доля площади листьев на боковых разветвлениях относительно общей площади листового аппарата саженца, % | 26,1±2,2 | 58,5 | 0 | 58,5 |
| Удельная площадь листового аппарата,
см2/см длины побегов |
12,6 ±0,3 | 8,23 | 7,76 | 15,99 |
| Отношение суммарной площади листового аппарата к площади поперечного сечения штамба, см2/мм2 | 1693,2 ±54,6 | 1560,9 | 972,5 | 2533,4 |
| Индекс роста саженца
(высота саженца в см× диаметр штамба в мм) |
1334,3 ±49,0 | 1445,6 | 732,8 | 2178,4 |
Рисунок 35 – Вариабельность высоты однолетних саженцев яблони сортов Лобо и
Ханни Крисп, привитых на 48 клоновых подвоев различной силы роста
Рисунок 36 – Вариабельность диаметра стволика саженцев у однолетних саженцев яблони сортов Лобо и Ханни Крисп, привитых на 48 клоновых подвоев различной силы роста
Рисунок 37 – Вариабельность суммарной длины боковых разветвлений
однолетних саженцев яблони сортов Лобо и Ханни Крисп,
привитых на 48 клоновых подвоев различной силы роста
Рисунок 38 – Вариабельность количества боковых разветвлений
однолетних саженцев яблони сортов Лобо и Ханни Крисп,
привитых на 48 клоновых подвоев различной силы роста
Рисунок 39 – Вариабельность количества листьев однолетних саженцев яблони сортов Лобо и Ханни Крисп, привитых на 48 клоновых подвоев различной силы роста
Рисунок 40 – Вариабельность площади листовой пластинки однолетних саженцев яблони сортов Лобо и Ханни Крисп, привитых на 48 клоновых подвоев различной силы роста
Рисунок 41 – Вариабельность площади листовой пластинки однолетних саженцев яблони сортов Лобо и Ханни Крисп, привитых на 48 клоновых подвоев различной силы роста
Рисунок 42 – Вариабельность суммарной длины надземной части
однолетних саженцев яблони сортов Лобо и Ханни Крисп,
привитых на 48 клоновых подвоев различной силы роста
Рисунок 43 – Вариабельность удельной площади листового аппарата (относительно длины прироста) однолетних саженцев яблони сортов Лобо и Ханни Крисп,
привитых на 48 клоновых подвоев различной силы роста
Рисунок 44 – Вариабельность удельной площади листового аппарата (относительно площади поперечного сечения стволика) однолетних саженцев яблони сортов
Лобо и Ханни Крисп, привитых на 48 клоновых подвоев различной силы роста
Рисунок 45 – Вариабельность высоты однолетних саженцев яблони сорта Ханни Крисп, привитых на клоновые подвои различной силы роста селекции Мичуринского ГАУ
Рисунок 46 – Вариабельность диаметра штамба однолетних саженцев яблони сорта Ханни Крисп, привитых на клоновые подвои различной силы роста селекции Мичуринского ГАУ
Рисунок 47 – Вариабельность суммарной длины побегов у однолетних саженцев яблони сорта Ханни Крисп, привитых на клоновые подвои различной силы роста
селекции Мичуринского ГАУ
Рисунок 48 – Вариабельность удельной площади листового аппарата (относительно длины побегов)у однолетних саженцев яблони сорта Ханни Крисп, привитых на клоновые подвои различной силы роста селекции Мичуринского ГАУ
Рисунок 49 – Вариабельность удельной площади листового аппарата (относительно площади поперечного сечения штамба) у однолетних саженцев яблони сорта Ханни Крисп, привитых на клоновые подвои различной силы роста селекции Мичуринского ГАУ
Рисунок 50 – Вариабельность индекса роста(по высоте растения) однолетних саженцев яблони сорта Ханни Крисп, привитых на клоновые подвои различной силы роста селекции Мичуринского ГАУ
Рисунок 51 – Вариабельность индекса роста (с учетом суммарной длины однолетнего прироста) однолетних саженцев яблони сорта Ханни Крисп, привитых на клоновые подвои различной силы роста селекции Мичуринского ГАУ
У однолетних саженцев яблони отмечены положительные корреляции среднего и высокого уровня по следующим парам сопряженных биометрических показателей, которые учитывают генотипические особенности как подвойного, так и привойного (сортового) компонентов прививки (рисунки 52-54):
— между соответствующими значениями высоты саженца и диаметра его штамба у СПК с участием сорта Лобо – на уровне 0,73; Ханни Крисп0,91;
— между высотой саженца и количества его листьев – у сорта Лобо 0,66; Ханни Крисп 0,77;
— между диаметром штамба саженца и количеством его листьев – у сорта Лобо 0,63; Ханни Крисп 0,77;
— между высотой саженца и площадью его листового аппарата – у сорта Лобо 0,71; Ханни Крисп 0,81.
— между диаметром штамба саженца и площадью его листового аппарата – у сорта Лобо 0,72; Ханни Крисп 0,81;
— между количеством листьев на саженце и площадью его листового аппарата – у сорта Лобо0,90; ХанниКрисп 0,95;
— между высотой саженца и удельной площадью его листового аппарата(относительно поперечного сечения штамба)– у сорта Лобо0,91; ХанниКрисп 0,98.
Отмечены корреляции среднего уровня:
— междузначениями высотыоднолетнего саженца исуммарной длины его боковых разветвлений у СПК сорта Лобо на уровне 0,54; Ханни Крисп 0,62;
— между значениями высотыоднолетнего саженца и количеством его боковых разветвлений – у СПК сорта Лобо 0,51; Ханни Крисп 0,69.
Выявление корреляций биометрических признаков растений также имеет практическое значение: при оценке большого количества саженцев десятков различных СПК в питомнике достаточным будет являться измерение только одного признака из группы сопряженных. Это позволит без снижение приемлемой точности получить достоверные показатели для большого количества генотипов. При этом измерение основных биометрических показателей саженца – высоты и диаметра штамба является наиболее простым и быстрым, а также при необходимости может производиться в автоматическом режиме с использованием современных технических средств.
| а |
| б |
Рисунок 52 – Зависимость между показателями высоты саженца и диаметра его штамба
у 48 сорто-подвойных комбинаций яблони сорта: а – Лобо;б – Ханни Крисп.
| а |
| б |
Рисунок 53 – Зависимость между показателями высоты саженца и суммарной длины его побегов (однолетнего прироста) у 48 сорто-подвойных комбинаций яблони сорта: а – Лобо;б – Ханни Крисп.
| а |
| б |
Рисунок 54 – Зависимость между показателями диаметра штамба саженца и суммарной длины его побегов (однолетнего прироста) у 48 сорто-подвойных комбинаций яблони сорта: а – Лобо;б – Ханни Крисп.
Одной из важнейших практических задач при анализе особенностей роста и развития саженцев яблони различных сорто-подвойных комбинаций является выявление маркерных диагностических признаков для ускорения идентификации и отбора карликовых клоновых подвоев в питомнике.
Для проведения более эффективного сравнительного количественного анализа степени развития саженцев различных СПК в питомнике, нами был предложен и рассчитан показатель, условно названный индексом роста. При его вычислении использовали два способа:
1) с учетом только высоты растения:произведение высоты саженца (в см) и диаметра штамбаего привойного компонента в 3 см выше уровня прививки (в мм);
2) кроме высоты растения дополнительно учитывали длинувсех егобоковых разветвлений – в этом случае показатели высоты саженца и общей длиныего боковых разветвлений суммировали(в см) и умножали на диаметр штамба его привойного компонента(в мм).
Первый способ расчета индекса роста саженцев СПК яблони более прост в использовании, а второй способ точнее, поскольку позволяет в ряде анализов учитывать суммарную площадь листьев, образующихся на боковых разветвлениях и составляющих общую фотосинтетическую поверхность двулетнего саженца.
В пределах одного привойного компонента установлена высокая положительная корреляция между двумя данными показателями индекса роста: 0,95 у сорта Лобо и 0,91 у Ханни Крисп. Между сортами по индексу роста саженца выявлена только корреляция среднего уровня: 0,63 при расчете первым способом и 0,55 – вторым (рисунок 55).Некоторое различие обоих индексов роста у однолетних саженцев яблони в пределах одного сорта вызвано влиянием не только подвойного, но и генотипа привойного компонента, так как все сорта яблони также характеризуются индивидуальными особенностями темпов роста и развития.
При анализе вариационных кривых показателей индекса роста саженцев у изучаемых СПК обоих сортов отмечен двумодальный характер кривой, соответствующей распределению признака у растений двух групп – на наиболее слаборослых (карликовых) и полукарликовых / среднерослых клоновых подвоях (рисунок 56).
| а |
| б |
Рисунок 55 – Взаимосвязь показателей индексов роста саженцев СПК сортов Лобо и Ханни Крисп на клоновых подвоях селекции Мичуринского ГАУ, рассчитанных двумя способами: а – по формуле «высота растения × диаметр штамба»; б – по формуле «суммарная длина побегов × диаметр штамба».
Рисунок 56 – Вариабельность показателей индекса роста (по высоте растения) однолетних саженцев яблони сортов Лобо и Ханни Крисп, привитых на 48 клоновых подвоев различной силы роста
Выводы по главе 4
Впервые в одном экспериментев условиях питомника конкурсного испытания изучены 96 СПК с участием районированныхпроизводственных сортов яблони Лобо и Ханни Крисп, востребованных в Средней полосе России, привитых на новые перспективные клоновые подвои селекции Мичуринского ГАУ. У однолетних саженцев выявлено взаимное влияние привойного и подвойного компонента прививки, установлены корреляции высокого и среднего уровня между сопряженными биометрическими признаками растений.
Наибольшей приживаемостью окулянтов в первом поле питомника выше контрольного уровня (более 94%) характеризовались подвои 2-3-14, 2-9-49, 2-9-90,2-12-36, 2-15-2.В питомнике выход однолетних саженцев яблони составил в среднем по сортам 88,5%. Наибольший выход на уровне 93,6% отмечен у саженцев сорта Лобо, а наименьший (83,4%) – у сорта Ханни Крисп.
Для проведения более эффективного сравнительного количественного анализа степени развития саженцев различных СПК в питомнике, нами был предложен и рассчитан показатель, условно названный индексом роста. При его вычислении использовали два способа – с учетом только высоты растения или суммарной высоты саженца и длинывсех его боковых разветвлений, умноженных на диаметр штамба привойного компонента.При анализе вариационных кривых показателей индекса роста саженцев у изучаемых СПК обоих сортов отмечен двумодальный характер кривой, соответствующей распределению признака у растений двух групп – на наиболее слаборослых (карликовых и суперкарликовых) и полукарликовых / среднерослых клоновых подвоях
Установлено, что у саженцев наоснове более слаборослых клоновых подвоев имеют меньшее количественное выражение как исходные морфометрические признаки (высота саженца, диаметр штамба, суммарная длина однолетнего прироста, площадь листьев), так и их взаимные соотношения – удельная площадь листового аппарата, индекс роста.
К группе наиболее слаборослых по результатам изучения СПК в питомнике можно выделитьсаженцы яблони, привитые на перспективные клоновые подвои селекции Мичуринского ГАУ 2-3-2, 2-3-14, 2-9-56, 2-12-34, 2-12-36, 5-26-127, 9-1-1, 9-1-9. В дальнейшем эти генотипы рекомендованы к изучению в саду конкурсного испытания по комплексу ценных хозяйственно-биологических и производственно-технологических признаков.
5 КОМПЛЕКСНАЯ ОЦЕНКА СОРТО-ПОДВОЙНЫХ КОМБИНАЦИЙ ЯБЛОНИ В САДУ КОНКУРСНОГО ИСПЫТАНИЯ
Клоновые подвои являются важнейшим и неотъемлемым элементом современного интенсивного садоводства во всем мире. Они позволяют регулировать силу роста привойного компонента (сорта) и оказывать решающее влияние на его скороплодность, урожайность и товарные качества плодов [2-4, 6]. При получении посадочного материала в питомнике и дальнейшем возделывании плодовых деревьев в саду каждый используемый клоновый подвой и сорт рассматривают в структурно-функциональном единстве конкретной сорто-подвойной комбинации, которая характеризуется комплексом ценных хозяйственно-биологических признаков и определяет технологию производства и хранения плодов данного сорта [2, 8].
Мичуринский государственный аграрный университет является лидером в России в области селекции слаборослых клоновых подвоев яблони: здесь получены 24 из 50 районированных в настоящее время подвойных форм, согласно последней редакции Государственного реестра селекционных достижений, допущенных к возделыванию на территории РФ [87]. При получении нового гибридного материала важным являяется комплексный анализ каждого генотипа по комплексу ценных хозяйственно-биологических и технологических признаков. Изучение и выделение перспективных генотипов клоновых подвоев яблони завершают по итогам изучения роста и продуктивности их сорто-подвойных комбинаций в многолетних насаждениях.
Влияние подвойной формы на ростовые показатели кроны и продуктивность плодового дерева является его важнейшей характеристикой. Для интенсивных насаждений яблони наиболее перспективно использование наиболее слаборослых клоновых подвоев – карликовых и суперкарликовых.
Цель исследований: изучение основных биометрических показателей привойно-подвойных комбинаций яблони, влияющих на формирование продуктивности, для выделения перспективных подвойных форм, пригодных к возделыванию в промышленных насаждениях.
Задачи исследований:
— определить влияние перспективных форм клоновых подвоев на силу роста плодового дерева и габитус его кроны;
— провести анализ особенностей роста побегов, расположенных на несущих ветвях кроны, у конкретных сорто-подвойных комбинаций яблони;
— изучить особенности площади листового аппарата у различных сорто-подвойных комбинаций яблони в условиях сада и его вариабельностьу каждого из сортов.
— провести оценку урожайности сорто-подвойных форм яблони;
— провести анализ многолетней динамики роста изучаемых показателей;
— выделить генотипы подвоев, наиболее перспективные в условиях сада.
Научная новизна и практическая значимость исследований
Проведено изучение динамики ценных биологических и хозяйственно-технологических количественных показателей сортов яблони летнего и осеннего сроков созревания, привитых на новых перспективных клоновых подвоях разной силы роста. Изученные особенности указывают на возможность использования ряда подвоев для возделывания в промышленных насаждениях садах интенсивного типа. Экспериментально установлен характер влияния новых форм слаборослых клоновых подвоев селекции Мичуринского ГАУ на хозяйственно-ценные признаки растений яблони и биологические закономерности их изменения.
Объекты, условия и методика проведения исследований
Исследования сорто-подвойных комбинаций яблони проведены в саду конкурсного испытания, расположенном в структурном подразделении ФГБОУ ВО Мичуринский ГАУ – Научно-образовательном центре (НОЦ) имени В.И. Будаговского. Схема посадки растений 5х3м (667 шт./га). Залужение междурядий чересполосное, чередующееся с черным паром. Агротехнические мероприятия стандартные. Внесение гранулированных удобрений в почву и некорневых подкормок не проводилось.
Объектом исследования являлись 19 сорто-подвойных комбинаций яблони, полученных с участием 11 перспективных подвойных форм селекции Мичуринского ГАУ. Привоем служили районированные сорта яблони, распространенные в Средней полосе России – Мелба (летнего срока созревания плодов) и Антоновка обыкновенная (осеннего срока созревания плодов).
Основные учеты и наблюдения осуществлялись в соответствии с «Программой и методикой сортоизучения плодовых, ягодных и орехоплодных культур» [91], «Методикой учетов и наблюдений в опытах с плодовыми и ягодными культурами» [92], «Изучением коллекции семечковых культур и выявление сортов интенсивного типа» [93].
Результаты исследований
Проведена сравнительная оценка биометрических показателей надземной части деревьев яблони различных СПК в саду конкурсного испытания по окончании вегетационного периода 2020 г. (таблицы 12, 13, рисунки57-58).
В зависимости от силы роста подвоя отмечена вариабельность учитываемых морфометрических признаков.
Таблица 12 – Биометрические показатели роста и развития деревьев сорто-подвойных комбинаций яблони в саду конкурсного испытания по окончании вегетационного периода 2020 г.
| Клоновый подвой | Высота, см | Объем кроны, м3 | Диаметр штамба, мм |
| Сорт Антоновка обыкновенная | |||
| 2-14-2 | 214,1 ± 7,3 | 1,28 ± 0,18 | 41,1 ± 2,3 |
| 62-296 (контроль – к) | 229,2 ± 5,1 | 1,43 ± 0,16 | 43,7 ± 1,7 |
| 2-3-49 | 232,7 ± 8,9 | 2,12 ± 0,22 | 55,1 ± 1,9 |
| 2-9-49 | 245,2 ± 3,4 | 1,84 ± 0,27 | 61,9 ± 2,1 |
| 54-118 (контроль – п/к) | 278,3 ± 3,1 | 3,48 ± 0,32 | 59,8 ± 1,8 |
| 2-15-2 | 271,0 ± 4,1 | 3,21 ± 0,57 | 62,3 ± 2,3 |
| 2-15-15 | 279,2 ± 6,5 | 3,38 ± 0,52 | 67,3 ± 1,9 |
| 4-6-5 | 305,8 ± 3,9 | 3,64 ± 0,35 | 69,8 ± 1,7 |
| Сорт Мелба | |||
| 2-14-2 | 223,8 ± 9,6 | 1,48 ± 0,23 | 42,3 ± 4,7 |
| 3-4-7 | 238,3 ± 6,2 | 2,37 ± 0,17 | 46,9 ± 2,4 |
| 2-3-49 | 241,6 ± 8,8 | 3,07 ± 0,28 | 54,1 ± 2,3 |
| 62-396 (контроль – к) | 251,8 ± 9,7 | 3,25 ± 0,28 | 48,1 ± 2,8 |
| 83-1-15 | 252,3 ± 6,9 | 3,52 ± 0,35 | 55,3 ± 2,8 |
| 2-9-49 | 274,1 ± 10,4 | 3,04 ± 0,24 | 59,7 ± 1,4 |
| 2-12-10 | 288,4 ± 11,5 | 3,71 ± 0,14 | 56,8 ± 4,9 |
| 54-118 (контроль – п/к) | 279,5 ± 6,4 | 3,82 ± 0,29 | 59,8 ± 1,4 |
| 2-15-2 | 278,1 ± 4,5 | 4,09 ± 0,43 | 65,8 ± 3,1 |
| 2-15-15 | 289,7 ± 6,8 | 3,72 ± 0,35 | 61,8 ± 3,2 |
| 4-6-5 | 317,2 ± 5,3 | 4,87 ± 0,34 | 76,2 ± 2,1 |
| НСР05 | 5,1 | 0,42 | 4,1 |
Различия между минимальными и максимальными показателями у СПК сорта Антоновка обыкновенная составили по высоте дерева 1,4 раза, по объему кроны – 2,8 раза, по диаметру штамба – 1,7 раза. У СПК сорта Мелба соответствующая разница по высоте дерева 1,4-кратная, по объему кроны – 3,3-кратная, по диаметру штамба – 1,8-кратная.
Между всеми парами исследованных биометрических показателей надземной части деревьев СПК яблони на клоновых подвоях различной силы роста установлены высокие положительные корреляции. У обоих сортов яблони ее значение на уровне +0,89…0,95 выявлено между высотой дерева и объемом его кроны, между высотой дерева и диаметром штамба коэффициент корреляции составил +0,85…0,91, а между объемом кроны и диаметром штамба +0,89…0,91.
 |
 |
 |
 |
| 54-118 (контроль – п-к) | 62-396 (контроль – к) | 2-3-49 | 2-9-49 |
 |
 |
 |
 |
| 2-14-2 | 2-15-2 | 2-15-15 | 4-6-5 |
Рисунок 57 – Сравнение по высоте кроны деревьев изучаемых сорто-подвойных комбинаций яблони сорта Антоновка обыкновенная (апрель 2020 г.). Высота линейки – 2 м
Анализ всех морфологических показателей надземной части деревьев показывает, что выраженными признаками карликовости и компактным габитусом кроны на уровне контрольного районированного подвоя 62-396 обладают деревья сорта Мелба, привитые на подвоях2-14-2, 3-4-7, 2-3-49, а также СПК сорта Антоновка обыкновенная на клоновых подвоях 2-14-2, 2-3-49, 2-9-49. Деревья обоих сортов на подвое 2-14-2 характеризуются самой сдержанной силой роста и наименьшим объемом кроны на уровне контроля 62-396. Биометрические показатели роста надземной части деревьев на уровне полукарликового / среднерослого подвоя 54-118 отмечены у подвойных форм 2-15-2и 2-15-15. Промежуточное положение между показателями деревьев на контрольных подвоях занимают СПК с участием экспериментальных подвойных форм 83-1-15 и 2-12-10. Наиболее сильный рост отмечен у СПК с участием подвоя 4-6-5, высота деревьев которых у сорта Антоновка обыкновенная достигает 3 м, а у сорта Мелба немного превышает ее.
 |
 |
 |
 |
||
| 54-118 (контроль – п-к) | 62-396 (контроль – к) | 83-1-15 | 2-3-49 | ||
 |
 |
 |
 |
||
| 2-9-49 | 2-12-10 | 2-14-2 | 2-15-2 | ||
 |
 |
 |
|||
| 2-15-15 | 3-4-7 | 4-6-5 | |||
Рисунок 58 – Сравнение по высоте кроны деревьев изучаемых сорто-подвойных комбинаций яблони сорта Мелба(апрель 2020 г.). Высота линейки – 2 м
Изучение особенностей биометрических показателей деревьев СПК яблони показало, что плотность обрастания скелетных ветвей плодовыми образованиями по окончанию вегетационного периода 2020 г. у сорта Мелба оказалась значительно выше, чем у сорта Антоновка обыкновенная, что связано с генотипическими особенностями подвойного компонента (таблица 13).
Таблица 13 – Плотность обрастания несущих ветвей сорто-подвойныхкомбинаций яблони в саду конкурсного испытания
| Клоновый подвой | Длина междоузлий, см | Количество боковых разветвлений, шт. на 1 м скелетной ветви | Количество плодовых образований, шт.на 1 м скелетной ветви |
| Сорт Антоновка обыкновенная | |||
| 62-396 (контр. – к) | 3,9 | 39,5 ± 3,1 | 35,7 ± 2,8 |
| 54-118 (контр. – п-к) | 4,1 | 41,1 ± 4,3 | 29,2 ± 3,9 |
| 2-15-15 | 4,1 | 42,8 ± 3,6 | 27,9 ± 3,2 |
| 2-15-2 | 4,1 | 42,1 ± 3,1 | 32,6 ± 2,9 |
| 4-6-5 | 4,2 | 41,7 ± 3,2 | 32,5 ± 4,1 |
| 2-14-2 | 3,9 | 43,5 ± 4,2 | 35,2 ± 3,1 |
| 2-9-49 | 4,0 | 48,1 ± 3,4 | 38,1 ± 3,0 |
| 2-3-49 | 3,9 | 51,8 ± 4,7 | 40,8 ± 3,2 |
| НСР05 | 0,2 | 1,9 | 1,7 |
| Сорт Мелба | |||
| 2-15-15 | 3,7 | 43,8 ± 1,7 | 39,3 ± 2,0 |
| 2-15-2 | 3,5 | 51,1 ± 3,1 | 42,8 ± 4,3 |
| 54-118 (контр. – п-к) | 3,7 | 50,3 ± 2,4 | 44,1 ± 3,8 |
| 4-6-5 | 4,0 | 52,0 ± 3,8 | 45,8 ± 3,9 |
| 2-12-10 | 3,6 | 53,1 ± 2,2 | 47,2 ± 2,0 |
| 2-9-49 | 3,8 | 57,5 ± 2,9 | 48,9 ± 3,1 |
| 3-4-7 | 3,5 | 58,1 ± 3,1 | 52,8 ± 2,7 |
| 62-396 (контр. – к) | 3,4 | 57,2 ± 3,6 | 53,7 ± 3,2 |
| 83-1-15 | 3,5 | 65,8 ± 4,6 | 59,6 ± 3,8 |
| 2-14-2 | 3,3 | 64,2 ± 5,7 | 56,7 ± 4,2 |
| 2-3-49 | 3,4 | 70,8 ± 6,0 | 61,7 ± 4,5 |
| НСР05 | 0,2 | 2,7 | 2,0 |
По количеству заложенных боковых разветвлений на скелетных ветвях различие между минимальным и максимальным значениями признака у СПК сорта Антоновка обыкновенная – 1,3-кратное (39,5-51,8 шт./м), Мелба – 1,6-кратное (43,8-70,8 шт./м). При этом между сортами корреляция значений данного показателя составила +0,67.
У деревьев сорта Мелба плотность обрастания плодовыми образованиями свыше 55 шт. на 1 м скелетной ветви отмечена на подвойных формах 2-14-2, 83-1-15, 2-3-49; в диапазоне 50-55 шт./м – у СПК с участием подвоев 3-4-7, 62-396. По данному показателю у сорта Антоновка обыкновенная выделяются подвойные формы 2-3-49, 2-9-49, 2-14-2, плотность обрастания плодовыми образованиями на 1 м ветви у данных СПК составила более 35 шт./м.Различие между минимальным и максимальным значениями данного признака у СПК сорта Антоновка обыкновенная – 1,4-кратное (29,9-40,8 шт./м), Мелба – 1,6-кратное (39,3-61,7 шт./м). При этом между сортами корреляция значений данного показателя составила +0,86.
Между соответствующими значениями количества плодовых образований и боковых разветвлений у СПК в пределах каждого сорта выявлены положительные корреляции высокого уровня: у сорта Антоновка обыкновенная +0,71, Мелба на уровне +0,98. Вариабельность данных компонентов плодоношения связана с генотипическим влиянием подвоев различной силы роста.
У СПК сортов Антоновка обыкновенная и Мелба в течение вегетационного периода 2020 г. отмечено меньшее увеличение количества плодовых образований деревьев, сформированных в сравнении с сезонами 2018/2017 гг.
Частично это оказалось связано с наблюдаемой периодичностью плодоношения деревьев яблони и сложившими неблагоприятными природными условиями. В 2018 г. были отмечены высокие показатели цветения и плодоношения большинства СПК изучаемых деревьев, что способствовало снижению процента закладки плодовых образований у них на следующий сезон. В свою очередь, в 2019 г. вследствие сложившихся неблагоприятных климатических условий в первой половине мая (продолжительные осадки и понижение температуры воздуха) оказалось затруднено опыление пчелами малочисленных распустивших цветков. Как следствие, товарное плодоношение в сезоне 2019 г. практически полностью отсутствовало.
В конце вегетационного периода 2020 г. был проведен сравнительный анализ площади листового аппарата у изучаемых сорто-подвойных комбинаций яблони в условиях сада. Данный признак имеет важное значение при комплексном изучении новых перспективных клоновых подвоев, так как позволяет оценить продуктивность плодовых деревьев в связи с их силой роста и урожайностью в условиях многолетних промышленных насаждений.
Одним из важнейших количественных показателей плодовых деревьев в саду является формируемая ими. У СПК сорта Антоновка обыкновенная площадь листового аппарата изменялась в диапазоне 623 – 1117 см2 в расчете на 1 м однолетнего прироста, у СПК сорта Мелба – от 791 до 1086 см2/м. При этом минимальное значение удельной площади листового аппарата отмечено у деревьев обоих сортов на экспериментальном карликовом подвое 2-14-2, а наибольший показатель по данному признаку – на полукарликовом/среднерослом районированном подвое 54-118. У СПК сорта Антоновка обыкновенная отмечены различия между минимальным и максимальным значениями в 1,8 раза, сорта Мелба – 1,4 раза (рисунок 59). При этом корреляция значений удельной листовой поверхности у соответствующих СПК двух данных сортов составила +0,71.
Рисунок 59 – Влияние генотипа подвойного и привойного компонентов на величину удельной листовой поверхности деревьев яблони в условиях сада
При этом отмечено варьирование площади листовой пластинки у СПК на клоновых подвоях различной силы роста, даже в случае единого привойного компонента (сорта). Различие между минимальным и максимальным значениями площади листовой пластинки у изучаемых СПК сорта Антоновка обыкновенная – 1,7-кратное, Мелба – 1,5-кратное (рисунок 60).
Сравнительный анализ площади фотосинтетического аппарата у различных сорто-подвойных комбинаций яблони имеет важное значение при комплексном изучении новых перспективных клоновых подвоев, так как позволяет оценить продуктивность плодовых деревьев в связи с их силой роста и урожайностью в условиях многолетних промышленных насаждений.
Рисунок60 – Влияние генотипа подвойного и привойного компонентов на вариабельность площади листовой пластинки деревьев яблони в условиях сада
По длине междоузлий на однолетних приростах различие между минимальным и максимальным значениями у СПК сорта Антоновка обыкновенная составило 10,5% (от 3,8 до 4,2 см), Мелба – 35,5% (от 3,1 до 4,2 см) при корреляции между сортами, привитыми на одинаковые подвои, равной +0,71. Корреляция между высотой деревьев на различных подвоях и длиной междоузлий их побегов составила у сорта Антоновка обыкновенная +0,55, Мелба +0,57. Следует отметить, что четкой закономерности по длине междоузлий у разных СПК в рамках каждого изучаемого сорта яблони не отмечено, но в целом деревья на более сильнорослых подвоях характеризуются увеличенными значениями данного параметра. У деревьев на карликовых подвоях отмечена наименьшая длина междоузлий на однолетних приростах, что способствует незначительному увеличению количества листьев на единицу длины побегов у данных СПК, однако показатель удельной листовой поверхности при этом не возрастает.
Выводы по главе 5
По окончанию вегетационного периода 2020 г. в саду конкурсного испытания различия между минимальными и максимальными показателями у СПК сорта Антоновка обыкновенная составили по высоте дерева 1,4 раза, по объему кроны – 2,8 раза, по диаметру штамба – 1,7 раза. У СПК сорта Мелба соответствующая разница по высоте дерева 1,4-кратная, по объему кроны – 3,3-кратная, по диаметру штамба – 1,8-кратная.
Между всеми парами исследованных биометрических показателей надземной части деревьев СПК яблони на клоновых подвоях различной силы роста установлены высокие положительные корреляции. У обоих сортов яблони ее значение на уровне +0,89…0,95 выявлено между высотой дерева и объемом его кроны, между высотой дерева и диаметром штамба коэффициент корреляции составил +0,85…0,91, а между объемом кроны и диаметром штамба +0,89…0,91.
Изучена вариабельность площади листового аппарата у различных сорто-подвойных комбинаций яблони в условиях сада. Минимальное значение удельной площади листового аппарата отмечено у деревьев обоих сортов на экспериментальном карликовом подвое 2-14-2, а ее наибольший показатель – на полукарликовом / среднерослом районированном подвое 54-118. Различия между минимальным и максимальным значениями данного признака у привойно-подвойных комбинаций сорта Антоновка обыкновенная составили 1,8 раза, Мелба – 1,4 раза.Отмечено варьирование площади листовой пластинки у деревьев каждого из изучаемых сортов, привитых на клоновые подвои различной силы роста. В целом, с увеличение силы роста подвойного компонента у привоя наблюдали увеличение площади листовой пластинки и листовой поверхности на единицу длины побега.У сорта Антоновка обыкновенная в зависимости от подвоя величина площади листовой пластинки изменялась в 1,7 раза, Мелба – в 1,5 раза. По длине междоузлий на однолетних приростах различие между минимальным и максимальным значениями у сорто-подвойных комбинаций сорта Антоновка обыкновенная составило 10,5% (от 3,8 до 4,2 см), Мелба – 35,5% (от 3,1 до 4,2 см) при корреляции между сортами, привитыми на одинаковые подвои, равной 0,71.
Сравнительный анализ площади фотосинтетического аппарата у различных сорто-подвойных комбинаций яблони имеет важное значение при комплексном изучении новых перспективных клоновых подвоев, так как позволяет оценить продуктивность плодовых деревьев в связи с их силой роста и урожайностью в условиях многолетних промышленных насаждений.
ЗАКЛЮЧЕНИЕ
В 2020 году было увеличено количество единиц гибридного фонда яблони в селекционной школке. Для повышения сохранности проростков и как следствие – выхода гибридных растений, стратификацию семян 2019 г. гибридизации осуществляли ранее апробированным нами способом – посредством их высева в малообъемные пластиковые контейнеры со стерильной торфосмесью, которые помещаются в климатическую камеру с автоматическим контролем температуры и выдерживаются 55-70 суток (в зависимости от появления всходов) при +1,5…+2,0°С.
Использование данного методического приема позволило значительно увеличить всхожесть гибридных семян – до 83,6%: получено 752 проростка, к окончанию вегетационного периода в селекционной школке насчитано 648 гибридных растения (86,2% от высеянных проростков и 72,1% от исходного числа застратифицированных гибридных семян).
Впервые в 2020 г. в селекционную школку были высажены сеянцы от гибридизации клоновых подвоев селекции Мичуринского ГАУ с генотипами яблони колонновидного габитуса роста, имеющими ген колонновидности Co, а также с производным природного вида – яблони обильноцветущей (M. floribunda Siebold ex Van Houtte). В дальнейшем среди полученного гибридного потомства предполагается поиск и выявление гибридных генотипов клоновых подвоев с доминантным аллелем гена колонновидности Co и генами устойчивости к биотическим и абиотическим стрессорам от M. floribunda.
Полученные в 2018 г. молодые сеянцыот гетероплоидных скрещиваний доноров нередуцированных гамет с клоновыми подвоями яблони, были пересажены осенью 2020 года из селекционной школки в адвентивный маточник для дальнейшего комплексного изучения.
Для получения новых гибридных генотипов слаборослых клоновых подвоев яблони с ценными хозяйственно-биологическими признаками в мае 2020 г. были проведены направленные скрещивания в 29 комбинациях скрещиваний с участием 12 материнских и 13 отцовских форм, а также в 8 вариантах свободного опыления. Общее количество полученных гибридных семян составило 4435 шт.
Для закладки экспериментального коллекционно-гибридного сада в структурном подразделении ФГБОУ ВО Мичуринский ГАУ – Научно-образовательного центре(НОЦ) имени В.И.Будаговского подготовлен посадочный материал в виде однолетних саженцев 34 образцов рода MalusMill. из коллекции Филиала Майкопская опытная станция ФИЦ Всероссийский научно-исследовательский институт генетических ресурсов растений имени Н.И. Вавилова, полученных в 2019 г. в рамках соглашения о научном сотрудничестве. Также в 2020 г. генетическая коллекция Мичуринского ГАУ была пополнена 5 новыми образцами яблони. В дальнейшем планируется комплексное изучение новых генотипов для оценки их потенциальной возможности использования в селекционном процессе и научно-производственных экспериментов в области садоводства.
В результате молекулярно-генетических исследований проведена идентификация локусов количественных признаков (QTL) Dw1 и Dw2, вовлеченных в контроль признака карликового роста у клоновых подвоев яблони. Для их выявления был проанализированы пять микросателлитных маркеров (три маркера локуса Dw1 – Hi01c04, Hi04a08 и CH03a09 и двамаркера локуса Dw2 –MDP0000365711 и MDP0000243703). Проанализированы 14 генотипов подвоев яблони с карликовым и полукарликовым типом роста. Для каждого локуса был идентифицирован только один маркер.
На основании анализа микросателлитных последовательностей генома проведена оценка генетического разнообразия. Кластерный анализ полученных данных не выявил отдельных групп по степени схожести.
Создана коллекция образцов ДНК районированных и перспективных генотипов клоновых подвоев, сортов, кребов-опылителей и дикорастущих форм яблони для молекулярно-генетического анализа. Всего подготовлено 80 образцов рода MalusMill.
Выявлено отрицательное действие наличия NaCl в питательной среде культивирования на коэффициент размножения и состояние культивируемых растений. По результатам исследований снижение коэффициента размножения побегов наблюдается уже при 0,3% NaCl в питательной среде, при повышении концентрации NaCl замедляется и прекращается размножение побегов, наблюдаются некрозы листьев. При концентрации NaCl 1,2% экспланты полностью некротизируют. В качестве селективного агента на солеустойчивость для получения сомаклональных вариантов в условиях invitro эффективным является использование концентрации 0,6% NaCl.
Оптимизированы методические приемы регенерации адвентивных побегов из каллуса соматического происхождения путем совместного использования стресс-факторов и химических соединений с антистрессовым действием. Наиболее эффективным антистрессором показала себя аскорбиновая кислота.
Разработаны методические приемы тканевой селекции гибридных генотипов клоновых подвоев яблони к повышенному уровню анионного засоления в условиях invitro и впервые получены растения-регенеранты перспективных форм клоновых подвоев яблони селекции ФГБОУ ВО Мичуринский ГАУ с повышенной устойчивостью к хлоридному засолению в экспериментально моделируемых стрессовых условиях invitro, с целью дальнейшего изучения данных форм в условиях природного и антропогенного загрязнения почв.
Выращивание клоновых подвоев и сортов яблони в мире производится на территориях с сильно различающимися природно-климатическими условиями. Среди рассмотренных территорий наиболее благоприятными условиями для возделывания насаждений яблони отличаются страны Центральной и Восточной Европы с «мягкой» зимой и высокими показателями средней годовой температуры, сходными показателями обладает Южный Федеральный округ РФ. Наименее благоприятными климатическими условиями отличаются центральная часть европейской территории России, Южный Урал, а также штат Миннесота в США – данные территории позволяют возделывать культуру яблони, но при обязательном научно-обоснованном подборе высокоустойчивых сортов и клоновых подвоев.
Среди мировых территорий, где производится селекция, испытание клоновых подвоев яблони и организованы крупные региональные плодопитомники, наиболее холодным и континентальным климатом также отличается Центральная Россия (г. Мичуринск Тамбовской области). Это позволяет считать клоновые подвои яблони, которые получены здесь и успешно прошли конкурсное сортоиспытание, одними из самых устойчивых в мире к неблагоприятным природно-климатическим условиям.
Установлена значительная вариабельность показателей роста и развития побегов, а также степени их укоренения у перспективных и районированных подвоев селекции Мичуринского государственного аграрного университета. Это вызвано генетическим разнообразием изученной коллекции генотипов рода MalusMill. в связи с их различным происхождением и использованием метода межвидовой гибридизации. Наибольшей изменчивостью характеризуется площадь листовой поверхности маточного куста.
Выявлены основные закономерности развития в маточнике перспективных клоновых подвоев яблони селекции Мичуринского ГАУ. Установлены корреляции между основными морфологическими признаками, которые в дальнейшем планируется использовать в селекции для отбора потенциально ценных гибридов. Отмечена корреляция показателей высоты маточного куста и площади его листовой поверхности – в расчете на один побег 0,71; для всего маточного куста 0,45; между выходом стандартных отводков с куста и средним баллом их укоренения (на уровне 0,72). Изученные показатели роста и развития побегов, а также степени их укоренения у генотипов демонстрируют значительную гетерогенность гибридных растений, что обусловлено их различным генетическим происхождением и связанной с этим неодинаковой силой роста маточных кустов. Выделены перспективные клоновые подвои с высокими производственными показателями в маточнике.
Основными производственными показателями любого подвоя в маточнике являются количество образуемых укорененных отводков и доля среди них стандартных. Чем выше оба данных показателя, тем большую ценность для производства представляет подвой. Отмечена положительная корреляция на уровне 0,58 между общим количеством отводков с одного куста и числом стандартных. Установлена взаимосвязь процента неукорененных отводков с высотой маточных кустов (r = 0,56), количеством стандартных отводков в одном кусте (-0,49) и их процентным выходом (-0,72).
Самый высокий показатель общего состояния маточных кустов на уровне 4,6 баллов отмечен у подвойных форм 85-11-9 и 2-9-49, характеризующихся сдержанным ростом привойного компонента. Из новых генотипов высокой комплексной устойчивостью на уровне 4,3 баллов отличались подвои 2-9-56, 2-15-15.
Наименее выраженной разветвленностью трехлетних побегов на маточных кустах отличались подвойные формы 2-3-2, 2-9-77, 2-9-90, а также контрольный районированный подвой яблони 54-118. Наибольшие значения коэффициента разветвления трехлетних побегов отмечены у генотипов 2-3-14, 2-3-44, 2-12-10, 2-12-15, 2-15-15, 5-24-1, 5-28-11, 3-4-7, 4-6-5, 9-1-1, 9-1-3.
В 2020 г. высотой куста в маточнике менее 60 см отличалась формы 2314,2949, 2-15-2, 2-15-15, 5-28-11, 911, 912,913, 914. Наиболее высокие маточные кусты (более 100 см) отмечены у подвоев 3-4-7 и54-118.
Наиболее прямостоячими побегами (отклонение от вертикали менее 15°) и самыми компактными маточными кустами отличаются подвои Малыш Будаговского, 233, 2317, 2956, 2990, 21210, 21236, 2-15-2, 2-15-15, 423, 42-50, 912, 913, 914, 915, 919. Самые раскидистые маточные кусты со средним отклонением побегов от вертикали более 40° имеют подвои B9, 2996, 34-7.
В процентном отношении доля стандартных отводков на маточных кустах составляет от 22,8 до 72,5%, наиболее высокие значения по данному показателю отмечены у подвойных форм 2-9-49, 2-9-90, 2-15-2, 2-15-15, 4-6-5.
Между количеством стандартных укорененных отводков и их общим количеством на маточном кусте изучаемых клоновых подвоев установлена средняя положительная корреляция, равная 0,67. Между удельной долей стандартных укорененных и неукорененных отводков, образуемых маточными кустами различных генотипов, выявлена отрицательная корреляция среднего уровня -0,53.
Впервые в одном эксперименте в условиях питомника конкурсного испытания изучены 96 СПК с участием районированных производственных сортов яблони Лобо и Ханни Крисп, востребованных в Средней полосе России, привитых на новые перспективные клоновые подвои селекции Мичуринского ГАУ. У однолетних саженцев выявлено взаимное влияние привойного и подвойного компонента прививки, установлены корреляции высокого и среднего уровня между сопряженными биометрическими признаками растений.
Наибольшей приживаемостью окулянтов в первом поле питомника выше контрольного уровня (более 94%) характеризовались подвои 2-3-14, 2-9-49, 2-9-90,2-12-36, 2-15-2.В питомнике выход однолетних саженцев яблони составил в среднем по сортам 88,5%. Наибольший выход на уровне 93,6% отмечен у саженцев сорта Лобо, а наименьший (83,4%) – у сорта Ханни Крисп.
Для проведения более эффективного сравнительного количественного анализа степени развития саженцев различных СПК в питомнике, нами был предложен и рассчитан показатель, условно названный индексом роста. При его вычислении использовали два способа – с учетом только высоты растения или суммарной высоты саженца и длинывсех его боковых разветвлений, умноженных на диаметр штамба привойного компонента. При анализе вариационных кривых показателей индекса роста саженцев у изучаемых СПК обоих сортов отмечен двумодальный характер кривой, соответствующей распределению признака у растений двух групп – на наиболее слаборослых (карликовых и суперкарликовых) и полукарликовых / среднерослых клоновых подвоях
Установлено, что у саженцев наоснове более слаборослых клоновых подвоев имеют меньшее количественное выражение как исходные морфометрические признаки (высота саженца, диаметр штамба, суммарная длина однолетнего прироста, площадь листьев), так и их взаимные соотношения – удельная площадь листового аппарата, индекс роста.
К группе наиболее слаборослых по результатам изучения СПК в питомнике можно выделить саженцы яблони, привитые на перспективные клоновые подвои селекции Мичуринского ГАУ 2-3-2, 2-3-14, 2-9-56, 2-12-34, 2-12-36, 5-26-127, 9-1-1, 9-1-9. В дальнейшем эти генотипы рекомендованы к изучению в саду конкурсного испытания по комплексу ценных хозяйственно-биологических и производственно-технологических признаков.
По окончанию вегетационного периода 2020 г. в саду конкурсного испытания различия между минимальными и максимальными показателями у СПК сорта Антоновка обыкновенная составили по высоте дерева 1,4 раза, по объему кроны – 2,8 раза, по диаметру штамба – 1,7 раза. У СПК сорта Мелба соответствующая разница по высоте дерева 1,4-кратная, по объему кроны – 3,3-кратная, по диаметру штамба – 1,8-кратная.
Между всеми парами исследованных биометрических показателей надземной части деревьев СПК яблони на клоновых подвоях различной силы роста установлены высокие положительные корреляции. У обоих сортов яблони ее значение на уровне +0,89…0,95 выявлено между высотой дерева и объемом его кроны, между высотой дерева и диаметром штамба коэффициент корреляции составил +0,85…0,91, а между объемом кроны и диаметром штамба +0,89…0,91.
Изучена вариабельность площади листового аппарата у различных сорто-подвойных комбинаций яблони в условиях сада. Минимальное значение удельной площади листового аппарата отмечено у деревьев обоих сортов на экспериментальном карликовом подвое 2-14-2, а ее наибольший показатель – на полукарликовом / среднерослом районированном подвое 54-118. Различия между минимальным и максимальным значениями данного признака у привойно-подвойных комбинаций сорта Антоновка обыкновенная составили 1,8 раза, Мелба – 1,4 раза.Отмечено варьирование площади листовой пластинки у деревьев каждого из изучаемых сортов, привитых на клоновые подвои различной силы роста. В целом, с увеличение силы роста подвойного компонента у привоя наблюдали увеличение площади листовой пластинки и листовой поверхности на единицу длины побега.У сорта Антоновка обыкновенная в зависимости от подвоя величина площади листовой пластинки изменялась в 1,7 раза, Мелба – в 1,5 раза. По длине междоузлий на однолетних приростах различие между минимальным и максимальным значениями у сорто-подвойных комбинаций сорта Антоновка обыкновенная составило 10,5% (от 3,8 до 4,2 см), Мелба – 35,5% (от 3,1 до 4,2 см) при корреляции между сортами, привитыми на одинаковые подвои, равной 0,71.
Сравнительный анализ площади фотосинтетического аппарата у различных сорто-подвойных комбинаций яблони имеет важное значение при комплексном изучении новых перспективных клоновых подвоев, так как позволяет оценить продуктивность плодовых деревьев в связи с их силой роста и урожайностью в условиях многолетних промышленных насаждений.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
- Парахин, Н.В. Современное садоводство России и перспективы развития отрасли // Современное садоводство [Электронный ресурс]. – 2013. – №2. – С. 1-9. – URL: http://www.journal.vniispk.ru/pdf/2013/2/51.pdf (дата обращения 14.03.2020).
- Анализ состояния и перспективные направления развития питомниководства и садоводства: науч. аналит. обзор / В.Ф. Федоренко, Н.П. Мишуров, О.В. Кондратьева, А.Д. Федорови др. – М.: ФГБНУ «Росинформагротех», 2019. – 88 с.
- Койнова А.Н. Будущее за интенсификацией садоводства // АгроФорум. – 2019. – №7. – С. 10-11.
- Маркус А. Садоводство? Только интенсивное // Селекция, семеноводство и генетика. – 2018. – №3 (21). – С. 38-41.
- Настоящее и будущее отечественного садоводства //АгроФорум. – 2019. – №7. – С. 18-23.
- Проблемы и перспективы развития промышленного садоводства // АгроФорум. – 2019. – №3. – С. 33-40.
- Будаговский В.И. Карликовые подвои для яблони. – М.: Сельхозгиз, 1959. – 352 с.
- Винтер М.А. Выращивание посадочного материала плодовых культур в системе современного питомниководства [Электронный ресурс] // Плодоводство и виноградарство Юга России. – 2017. – № 46 (04). – С. 1-9. – URL: https://journalkubansad.ru/pdf/17/04/03.pdf (дата обращеня 14.03.2020).
- Щербатко В.Д. Сравнительная характеристика силы роста сортов яблони мировой селекции //Бюллетень Государственного Никитского ботанического сада. – 2013. – №. 106. – С. 45-50.
- Seleznyova A.N., Tustin D.S., Thorp T.G. Apple dwarfing rootstocks and interstocks affect the type of growth units produced during the annual growth cycle: precocious transition to flowering affects the composition and vigour of annual shoots //Annals of botany. – 2008. – Т. 101. – №5. – P. 679-687.
- Two quantitative trait loci, Dw1 and Dw2, are primarily responsible for rootstock-induced dwarfing in apple / T.M. Foster, J.M. Celton, D. Chagné et al. // Horticulture research. – 2015. – Т. 2. – №1. – P. 1-9.
- Webster A.D., Wertheim S.J. Apple rootstocks // Apples: Botany, Production and Uses /Eds.D.C. Ferree, I.J. Warrington. – CAB International, Cambridge, MA, 2003. – Pp. 91-124.
- Соломатин Н.М. Генофонд вегетативно размножаемых форм яблони для улучшения сортимента подвоев, сырьевых и декоративных сортов в условиях ЦЧР: дис. … докт. с/х наук. – Мичуринск-наукоград, 2018. – 304 c.
- Будаговский В.И. Культура карликовых подвоев для яблони // Сад и огород. –1947.– №8. – С. 34-38.
- Будаговский В.И. Зимостойкость корневой системы у карликовых и полукарликовых подвоев яблони // Известия АН СССР, сер. Биол. – 1954. – №6. – С. 11-25.
- Лангенфельд В.Т. Яблоня. Морфоанатомическая эволюция, филогения, география, систематика.– Рига: Зинатне, 1991. – 234 с.
- Пономаренко В.В., Пономаренко К.В. Генетический потенциал рода Malus Mill. в селекции яблони XXI в. //Плодоводство и ягодоводство России. – 2011. – Т. 28. – №2. – С. 156-163.
- Rootstock-regulated gene expression patterns in apple tree scions / P.J. Jensen, I. Makalowska, N. Altman et al.// Tree Genetics & Genomes. – 2010. – Т.6. – №. 1. – P. 57-72.
- Architecture and size relations: an essay on the apple (Malus× domestica, Rosaceae) tree / P. Lauri, K. Maguylo, C. Trottier //American Journal of Botany. – 2006. – Т. 93. – №3. – P. 357-368.
- Auxin polar transport and flower formation in Arabidopsis thaliana transformed with indoleacetamide hydrolase (iaaH) gene / M. Oka, J. Ueda, K. Miyamoto et al. //Plant and cell physiology. – 1999. – Т. 40. – №2. – P. 231-237.
- Identification of dehydrocostus lactone and 4-hydroxy-β-thujone as auxin polar transport inhibitors / J. Ueda, Y. Toda, K. Kato et al. //Acta physiologiae plantarum. – 2013. – Т. 35. – №7. – P. 2251-2258.
- Development and validation of functional markers from Dw1 and Dw2 loci to accurately predict apple rootstock dwarfing ability / F.Yang, F.Shen, Z.Liu et al. // Research Square (BMC Genomics). – 2020 (In Review). – DOI: 10.21203/rs.2.24669/v2.
- MdCOP1 ubiquitin E3 ligases interact with MdMYB1 to regulate light-induced anthocyanin biosynthesis and red fruit coloration in apple / Y.Y.Li, K.Mao, C.Zhao//Plant physiology. – 2012. – Т. 160. – №2. – P. 1011-1022.
- Enzymatic browning and antioxidant activities in harvested litchi fruit as influenced by apple polyphenols / Z.Zhang, D.J.Huber, H.Qu et al. //Food Chemistry. – 2015. – Т. 171. – P. 191-199.
- A new three-locus model for rootstock-induced dwarfing in apple revealed by genetic mapping of root bark percentage / N.Harrison, R.J. Harrison, N.Barber-Perez et al. //Journal of experimental botany. – 2016. – Т. 67. – №6. – P. 1871-1881.
- Dw2, a new dwarfing locus in apple rootstocks and its relationship to induction of early bearing in apple scions / G.Fazio, Y.Wan, D.Kviklys et al. //Journal of the American Society for Horticultural Science. – 2014. – Т. 139. – №2. – P. 87-98.
- Genetic diversity in Swedish and Finnish heirloom apple cultivars revealed with SSR markers / L. Garkava-Gustavsson, C. Mujaju, J. Sehic et al. //Scientia Horticulturae. – 2013. – Т. 162. – P. 43-48.
- Development and characterisation of 140 new microsatellites in apple (Malus x domestica Borkh.) / R.Liebhard, L.Gianfranceschi, B.Koller et al. //Molecular Breeding. – 2002. – Т. 10. – №4. – P. 217-241.
- Towards improvement of marker assisted selection of apple scab resistant cultivars: Venturia inaequalis virulence surveys and standardization of molecular marker alleles associated with resistance genes /A.Patocchi, A.Frei, J.E.Frey et al. //Molecular Breeding. – 2009. – Т. 24. – №4. – P. 337-347.
- Microsatellite genotyping of apple (Malus× domestica Borkh.) genetic resources in the Netherlands: application in collection management and variety identification / R.Van Treuren, H.Kemp, G.Ernsting et al. //Genetic Resources and Crop Evolution. – 2010. – Т. 57. – №6. – P. 853-865.
- Variability of microsatellite loci in apple landraces (Malus domesticaborkh.) from the VIR collection / A.V.Shlyavas, A.S. Sidnin, A.A. Trifonova et al. //N.I. Vavilov’s ideas in the modern world. – 2017. – P. 211-211.
- Doyle J.J., Doyle J.L. Isolation ofplant DNA from fresh tissue // Focus. – 1990. – Т. 12. – №13. – P. 39-40.
- Rengasamy P. Soil processes affecting crop production in salt-affected soils // Funct. Plant Biol. – 2010. – V. 37. – P. 613-620.
- Munns R., Tester M. Mechanisms of salinity tolerance // Annu. Rev. Plant Biol. – 2008. – V.59. – P. 651-681.
- Удовенко, Г.В. Солеустойчивость культурных растений. – Л.: Колос,1977. – 253 c.
- Панкова Е.И., Новикова А.Ф. Засоленные почвы России (диагностика,география, площади) // Почвоведение, 1995. – № 1. – С. 73-83.
- Roy S.J., Negrão S., Tester M. Salt resistant crop plants// Current Opinion in Biotechnology. – 2014. – V. 26. – P.115-124.
- Харченко П.Н., Ванюшин Б.Ф. ХХI век – время агробиотехнологий //Защита и карантин растений. – 2012. –№3. – С. 3-8.
- Toward Unravelling the Genetic Determinism of the Acquisition of Salt and Osmotic Stress / А.M. Elmaghrabi, H.J. Rogers, D. Francis et al.// Functional Genomics in Medicago truncatul: Methods in Molecular Biology.- 2018.– Vol. 1822.– P. 291-314.
- Jan N., Qazi H.A., Ramzan Sand J.R. Developing Stress-Tolerant Plants Through In Vitro Tissue Culture: Family Brassicaceae // Biotechnologies of Crop Improvement. –2018. – V.1.– P.327-372.
- Мезенцева О.Ю. Использование тканевых и клеточных культур в селекции на устойчивость к фитопатогенам //Селекция и семеноводство. – 1990. – №4. – С. 59-62.
- Метод клеточной селекции гороха на устойчивость к абиотическим факторам среды: Методические рекомендации / Г.В.Соболева, Г.Н.Суворова, И.В.Кондыков и др. – М.: Россельхозакадемия, 2011. – 24 с.
- Švabova L., Lebeda E. In vitro selection forimproved plant resistancetotoxin-producing pathogens // J. Phytopathology. – 2005. – Vol. 153. – P. 52-64.
- Аль-Холани Х.А.М., Тоайма В.И.М., Долгих Ю.И. Получение растений кукурузы с повышенной устойчивостью к засухе путем клеточной селекции на среде с маннитом // Биотехнология. – 2010. – №1. – С. 60-67.
- Гладков, Е.А. Получение растений, толерантных к ионам кадмия и свинца // Биотехнология. – 2006. – № 4. – 87-92 с.
- Гладков Е.А., Гладкова О.В. Оценка комплексной фитотоксичности тяжёлых металлов и получение растений, обладающих комплексной устойчивостью // Биотехнология. – 2007. – № 1. – 81-85 с.
- Егорова Н.А. Исследование устойчивости к солевому стрессу каллюсных культур эфиромасличной герани // Физиология и биохимия культ. растений. – 2009. – Т. 41. – №6. – С. 523-530.
- Егорова Н.А. Разработка методических основ клеточной селекции лаванды in vitro на устойчивость к NaCl // Экосистемы, их оптимизация и охрана. – 2011. – Вып. 5. – С. 173-179.
- Конышева Е.Н., ЗобоваН.В. Результативность получения растений-регенерантов ярового ячменя в культуре in vitro на селективных средах //Вестник КрасГАУ. – 2006. – №10. – С. 137-141.
- Получение новых перспективных линий картофеля с повышенной устойчивостью к засухе на основе клеточных технологий / Н.П. Малахова, Б.К. Жумагельдинов, А. Хасейн и др. // Известия национальной академии наук республики Казахстан. Серия биологическая и медицинская. – 2014. – №6. – С. 73-81.
- Расторгуев С.Л. Применение биотехнологических приемов для создания новых форм ягодных растений // Вестник МичГАУ. – 2006. – Т. 3. – №1. – Р. 50-54.
- Разработка и использование биотехнологических методов для создания новых форм растений зернобобовых и крупяных культур / Г.Н. Суворова, Г.В. Соболева, С.В. Бобков и др. // Зернобобовые и крупяные культуры. Научно-производственный журнал. – 2012. – №2. – С. 10-13.
- Developing stress tolerant plants through in vitro selection – an overview of the recent progress / M.K. Rai, R.K. Kalia, R. Singh et al. // Environmental and Experimental Botany. – 2011. – V.71. – N.1. – P. 89-98.
- Characterization of the response of in vitro cultured Myrtus communis L. plants to high concentrations of NaCl / P.D. Cori, S. Lucioli, A. Frattarelli et al. // Plant Physiology and Biochemistry. –2013. – Vol. 73. – P.420-426.
- Evaluation of orange-fleshed sweet potato (Ipomoea batatas L.) genotypes for salt tolerance through shoot apex culture under in vitro NaCl mediated salinity stress conditions / M. Dasgupta, M.R. Sahoo, P.C. Kole et al. // Plant Cell, Tissue and Organ Cult. – 2008. –Vol. 94. – P.161-170.
- Sakhanokho H.F., Kelley R.Y. Influence of salicylic acid on in vitro propagation and salt tolerance in Hibiscus acetosella and Hibiscus moscheutos (cv ‘Luna Red’) // Afr. J. Biotechnol. – 2012. – V.8.–P.1474-81.
- Effects of salt stress on ion content, antioxidant enzymes and protein profile in different tissues of Broussonetia papyrifera / M. Zhang, Y. Fang, Y. Ji et al. //South African Journal of Botany. – 2013. – Vol.85.–P.1-95.
- Соловых Н.В. Тканевая селекция растений рода Rubusна солеустойчивость //Аграрная наука. – 2012. – №5. – С. 16-18.
- Зобова Н.В., Кошышева Е.Н. Использование биотехнологических методов в повышении соле- и кислотоустойчивости ярового ячменя. – Новосибирск, 2007. – 124 с.
- Россеев, В.М. Тестирование in vitro разных форм ячменя на устойчивость к неблагоприятным абиотическим факторам среды // Труды по прикладной ботанике, генетике и селекции. – 2009. – Т.165. – С. 158-161.
- Царева, Р.П. Ускоренная оценка солеустойчивости тополей с помощью функционального теста // Селекция древесных растений на устойчивость и продуктивность. – Воронеж, 1990. – С. 119-126.
- Оценка засухоустойчивости отдельных генотипов PinussylvestrisL. на основе метода культуры ткани in vitroв моделируемых стрессовых условиях / Е.Ю. Аминева, Т.М. Табацкая, О.С. Машкина и др. // Труды Санкт-Петербургского научно-исследовательского института лесного хозяйства. – 2017. – №1. – С. 14-22.
- Табацкая Т.М., Аминева Е.Ю., Машкина О.С. Биотехнологическая оценка коллекционного материала березы и тополяв условиях солевого стресса в культуре in vitro// Современное состояние, проблемы и перспективы развития аграрной науки. – 2020. – С. 190-191.
- Cadmiumaccumulationanditseffectontheinvitrogrowthofwoodyfleabaneandmycorrhizedwhitebirch / R. Fernández, A. Bertrand, A. Casaresetal. // EnvironmentalPollution. – 2008. –Vol.152.–P.522-529.
- Clone Specificity of White Poplar (Populus alba L.) / V. Vuksanovic, B. Kovacevic, M. Kebert et al. // Acidity Tolerance in Vitro Fresenius Environmental Bulletin – 2019. – Vol.11 –P.8307-8313.
- Соловых Н.В. Использование биотехнологических методов в работе с ягодными культурами. – Мичуринск-наукоград РФ, 2009. – 47с.
- Соловых Н.В. Тканевая селекция растений рода Rubus на толерантность к абиотическим стрессорам // Современные тенденции устойчивого развития ягодоводства России (земляника, малина): сборник науч. тр., посвящ. 90-летию со дня рожд. канд. с.-х. наук К.Т. Ярковой. – Воронеж: Кварта, 2019. – Том 2. – С. 278-291.
- Калашникова Е.А., Нгуен Т.Х. Применение клеточных технологий в селекции растений // Доклады ТСХА. – 2007. – Вып. 279. – Ч. 1. – С. 326-330.
- Bajaj Y.P.S., Gupta R.K. Different tolerance of callus cultures of Pennisetum americanum L. аnd P. purpureum Schum. to sodium chloride // J. Plant Physiol. – 1986. – Vol. 125. – P. 491-495.
- ДолгихЮ.И. Сомаклональная изменчивость растений и возможности ее практического использования (на примере кукурузы): автореф. дисс. … докт. биол. наук. – М., 2005. – 45 с.
- Рожанская О.А. О сомаклональной изменчивости растений как источнике биоразнообразия для селекции // Селекция растений: прошлое, настоящее и будущее. Сб. матер. I Всеросс. научно-практ. конф. с междун. участием, посвящ. 140-летию НИУ «БелГУ» (24-26 ноября 2016 г.). – Белгород: Издательский дом «Белгород», 2016. – С. 152-156.
- Differential Resistance of Two Subtropical Rice Cultivars to Aluminum Toxicity / H. Xu, W. Gu, D. Dong et al. // J. Plant Nutrit. – 2004. – V. 27. – №9. – P. 1601-1609.
- Создание стрессоустойчивого материала яровой мягкой пшеницы с использованием клеточной селекции invitro/ Е.Д. Никитина, Л.П. Хлебова, Г.Г. Соколова и др. // Известия Алтайского государственного университета. – 2013 – Т. 2. — №3 (79). – С. 95-98.
- Трушечкин В.Г., Костякин А.С.Ареалы промышленного возделывания плодовых и ягодных культур в Нечерноземной зоне РСФСР // Плодоводство Нечернозем. полосы. – М., 1980. – С. 8-27.
- Гегечкори Б.С. Плодоводство: Курс лекций. Часть 1. Введение. Биологические основы плодоводства. – Краснодар: ФГОУ ВПО «Кубанский ГАУ», 2010. – 21 с.
- Гегечкори Б.С. Плодоводство: Курс лекций. Часть 4. Частное плодоводство. – Краснодар: ФГОУ ВПО «Кубанский ГАУ», 2010. – 86 с.
- Минимальные температуры воздуха на территории Российской Федерации: карта[Электронный ресурс]. – URL: https://geographyofrussia.com/ minimalnaya-temperatura-vozduxa/ (дата обращения 10.06.2020 г.).
- Суммы активных температур выше 10°C на территории Российской Федерации: карта [Электронный ресурс]. – URL: http://www.agroatlas.ru/content/agroecology/climatic_maps/Sum_t/Sum_t10/Sum_t10_ru_big.gif(дата обращения 10.06.2020 г.).
- Saint Paul, Minnesota. Travel Weather Averages (Weatherbase). – URL: http://www.weatherbase.com/weather/weather.php3?s=593718&cityname=Saint-Paul-Minnesota-United-States-of-America (датаобращения 07.05.2020 г.).
- Michurinsk, Russia. Travel Weather Averages (Weatherbase). – URL: http://www.weatherbase.com/weather/weather.php3?s=592158&cityname=Michurinsk-Russia (датаобращения 07.05.2020 г.).
- Будаговский В.И. Культура слаборослых плодовых деревьев. – М.: Колос, 1976. – 304 с.
- Перспективные клоновые подвои яблони для интенсивных садов / Ю.В.Трунов, А.В.Соловьев, Р.В.Папихин и др. // Садоводство и виноградарство. – 2020. – №2. – С. 34-40.
- Чурикова Н.Л. Агробиологическая оценка новых клоновых подвоев яблони селекции Мичуринского ГАУ в условиях ЦЧР: Дисс. … канд. с.-х. наук. – Мичуринск, 2019. – 194 с.
- Бобрович Л.В., Андреева Н.В. Статистические характеристики вариабельности показателей роста и развития саженцев яблони // Наука и Образование. –2020. –Т. 3. –№2. –С. 329 (1-8).
- Ростовые характеристики привойно-подвойных комбинаций яблони в условиях Новгородской области / З.Н.Тарова, Л.В.Бобрович, О.А.Борисова и др. // Приоритетные направления развития садоводства (I Потаповские чтения): материалы Национальной науч.-практ. конф., посвящ. 85-й годовщине со дня рожд. проф., д-ра с.-х. наук, лауреата Гос. премии Потапова Виктора Александровича. –Мичуринск, 2019. –С. 278-281.
- Бобрович Л.В., Андреева Н.В. Новые оценочные показатели в исследованиях с плодовыми культурами // Наука и Образование. –2020. –Т. 3. – №2. –С. 328 (1-8).
- Государственный реестр селекционных достижений, допущенных к использованию. Т.1. «Сорта растений» (официальное издание). – М.: ФГБНУ «Росинформагротех», 2020. – 680 с.
- Методика Государственного сортоиспытания сельскохозяйственных культур. Вып. V. Плодовые, ягодные, субтропические, цитрусовые, орехоплодные культуры, виноград и чай. – М.: Колос, 1970. – 160 с.
- Программа и методика селекции плодовых, ягодных и орехоплодных культур / Науч. ред. Г.А. Лобанов. – Мичуринск, 1980. – 531 с.
- Программаиметодикаселекцииплодовых,ягодныхиорехоплодных культур / Под общ. ред. Е.Н. Седова. – Орел: Изд-во ВНИИСПК, 1995. – 502 с.
- Программа и методика сортоизучения плодовых, ягодных и орехоплодных культур / Под общ. ред. Е.Н. Седова и Т.П. Огольцовой. – Орел: Изд-во ВНИИСПК, 1999. – 608 с.
- Методика учетов и наблюдений в опытах с плодовыми и ягодными культурами: Метод. рекомендации / Укр. с.-х. акад. – Киев, 1987. – 69 с.
- Изучение коллекции семечковых культур и выявление сортов интенсивного типа: Метод. указания / ВАСХНИЛ, ВНИИ растениеводства им. Н.И. Вавилова. – Сост. Я.С. Нестеров. – Л., Изд-во ВИР, 1986. – 160 с.
- Лотова Л.И. Некоторые данные об анатомии карликовых подвоев яблони // Вестник Московского университета. – Серия 16: Биология. – №2. – М.: Изд-во Моск. ун-та, 1957. – С. 59-65.
- Будаговский В.И. Промышленная культура карликовых плодовых деревьев. – М., 1963. – 382 с.
- Коровин В.А. Совместимость привоя и подвоя яблони. – М.: Колос, 1979. – 127 с.
- Филиппова М.Л. Клоновые подвои яблони в отводочном маточнике: Дисс. … канд. с.-х. наук. – Мичуринск, 1988. – 158 с.
- Коровин В.А. Отбор клоновых подвоев яблони для средней зоны РСФСР: дис. … канд. с.-х. наук. – Мичуринск, 1961. – 168 с.
- ДоспеховБ.А. Методика полевого опыта(с основами статистической обработки результатов исследований): учебник для студентов высших с.-х. учебных заведений поагрономическим специальностям. – Изд. 5-е, доп. и перераб. – М.: Агропромиздат, 1985. – 351 с.
