Титульный лист и исполнители
Реферат
Отчет содержит: 3 раздела, 98 страницы, 15 таблиц, 3 рисунка, 120 литературных источников.
Убойные цеха мясокомбинатов и животноводческих ферм являются одними из крупнейших потребителей природных водных ресурсов, из которых до 70% приходится на сточные воды — выбросы жидкостей с высокой концентрацией органических веществ, токсичных элементов, условно-патогенных и патогенных микроорганизмов.
По нашим расчетам в последние годы объем сточных вод убойных цехов и мясокомбинатов составляет более 60,0 млн. м3.
Поэтому сточные воды скотобоен могут служить серьезным источникам загрязнения водных объектов. Вместе с тем имеют высокую удобрительную ценность по содержанию элементов питания для растений и могут быть использованы для орошения после соответствующей подготовки.
В настоящее время на большинстве предприятий отсутствуют локальные очистные сооружения сточных вод убойных цехов, стоки смешиваются с хозяйственно-бытовыми сточными водами и сбрасываются в канализацию.
Цель и задачи исследований:
-
- изучение объема и состава стоков скотобоен, анализ существующих способов их очистки,
- разработка технологии эффективной очистки сточных вод скотобоен с применением аборигенной микрофлоры, интродуцированных активных штаммов,
- разработка технологии доочистки сточных вод боен с помощью новых природных коагулянтов (МагТрит-С),
- Изучение возможности обеззараживания стоков от патогенной микрофлоры с помощью СВЧ-излучений,
- определение степени токсичности очищенной сточной воды для их использования на орошение кормовых культур,
- закладка опытов по изучению влияния стоков на почвенно-поглощающий комплекс, рост, развитие, урожайность кормовых и полевых культур и их качество.
Научная новизна работы заключается в использовании новых штаммов деструкторов органических соединений, естественных антагонистов патогенных микроорганизмов, биосорбентов тяжелых металлов, в применении на этапе доочистки для осветления стоков, удаления тяжелых металлов и обеззараживания стоков новых природных коагулянтов и СВЧ –излучений.
Практическая значимость. Полученные результаты могут быть использованы для эффективной локальной очистки стоков скотобоен на предприятиях различной мощности и являться предпосылкой для рекомендации очищенных сточных вод скотобоен для орошения кормовых и полевых культур.
Ключевые слова: стоки скотобоен, локальные очистные сооружения, аборигенные микроорганизмы тяжелые металлы, патогенная и условно-патогенная микрофлора, земледельческие поля орошения.
Введение
В настоящее время в Российской Федерации насчитывается около 3 тысяч предприятий разного типа (мясокомбинаты, животноводческие и птицеводческие хозяйства), занимающихся убоем скота.
Убойные цеха мясокомбинатов и животноводческих ферм являются одними из крупнейших потребителей природных водных ресурсов, из которых до 70% впоследствии превращается в сточные воды — выбросы жидкостей с высокой концентрацией органических веществ, токсичных элементов, условно-патогенных и патогенных микроорганизмов [1].
Существенной особенностью сточных вод убойных цехов и мясокомбинатов является сильная загрязненность по БПК (биохимическому потреблению кислорода), ХПК (химическому потреблению кислорода), по содержанию количество белка и жира, солей натрия, тяжелых металлов, сульфатов, для них также характерна большая бактериальная обсемененность [2], [3]. Поэтому сточные воды скотобоен могут служить серьезным источникам загрязнения водных объектов. Вместе с тем сточные воды скотобоен имеют высокую удобрительную ценность по содержанию элементов питания для растений, а именно азота – более 100 мг/л, фосфора – более 30 мг/л, калия – более 70 мг/л [4].
Следовательно, изучение возможности использования сточных вод скотобоен и мясокомбинатов для орошения сельскохозяйственных культур представляет значительный интерес и является актуальным. Орошение сточными водами не должно вызывать осолонцевание почвы, угнетения роста и развития растений, снижения урожайности возделываемой культуры.
Качество сточных вод, используемых для орошения, регламентируется по химическим, бактериологическим и паразитологическим показателям. При орошении учитываются почвенно-мелиоративные условия орошаемого участка, климатические условия района.
В целом, используемые на орошение сточные воды должны отвечать агромелиоративным требованиям, предъявляемым к поливной воде [5].
При орошении полей сточными водами решается сразу несколько задач: происходит почвенная очистка сточных вод путем утилизации их питательных элементов сточных вод, тем самым предотвращается сброс сточных вод в водоисточники, почва увлажняется и тем самым повышается её плодородие и урожайность сельскохозяйственных культур. Длительное регулярное орошение недостаточно очищенной сточной водой скотобоен, ведёт к ухудшению качества грунтовых вод также отмечается тенденция постепенного увеличения нитритов и нитратов в стоках, несет эпидемиологическую опасность [6].
К наиболее простым методам подготовки сточных вод для орошения относятся отстаивание, нейтрализация, длительное хранение. При неблагоприятном составе поливных сточных вод для улучшения их качества требуются специальные очистные сооружения. Качество сточных вод убойных цехов мясокомбинатов и уровень их пригодности для сельскохозяйственного использования в качестве орошения и удобрения зависит во многом от уровня и мощности очистных сооружений. В настоящее время не все мясокомбинаты и животноводческие предприятия в нашей стране могут позволить дорогостоящие очистные сооружения аппаратного типа, где сточные воды подвергаются комплексной очистке, в том числе биохимической очистке [7].
Цель и задачи исследований:
-
-
- изучение объема и состава стоков скотобоен, анализ существующих способов их очистки,
- разработка технологии эффективной очистки сточных вод скотобоен с применением аборигенной микрофлоры, интродуцированных активных штаммов,
- разработка технологии доочистки сточных вод боен с помощью новых природных коагулянтов (МагТрит-С),
- изучение возможности обеззараживания стоков от патогенной микрофлоры с помощью СВЧ-излучений,
- определение степени токсичности очищенной сточной воды для их использования на орошение кормовых культур,
- закладка опытов по изучению влияния стоков на почвенно-поглощающий комплекс, рост, развитие, урожайность кормовых и полевых культур и их качество.
-
I Обзор литературы
1.1 Пути решения экологических проблем очистки сточных вод боен
Ежегодно на скотобойнях мира забивают более 50 миллиардов животных для употребления в пищу. В США ежегодно забивают более 100 миллионов коров, свиней и овец, а также 5 миллиардов домашних птиц. Крупнейшая скотобойня в мире принадлежит компании Smithfield Foods и располагается в штате Северная Каролина США. Она способна перерабатывать свыше 32 000 голов свиней в сутки. Крупнейшая скотобойня в Азии расположена в, пригороде Мумбаи в Индии [8].
В Росси по данным Росстата был произведено на убой хозяйствами всех категорий более 14,5 млн. тонн скота и птицы. В том числе 45% составило мясо птицы, 35% мясо говядины, 19% мясо свинины. В настоящее время в Российской Федерации насчитывается около 3 тысяч предприятий разного типа, занимающихся убоем, переработкой скота и выработкой готовой мясной продукции (мясокомбинаты, мясохладобойни и мясоперерабатывающие предприятия [9].
По итогам рейтинга 2019 года, составленного Агроинвестором», крупнейшими переработчиками мяса стали:
1.группа «Черкизово». -830 тыс. т мяса бройлера, свинины и индейки (здесь и далее — в убойном весе;
2. группа «Мираторг» — крупнейший в стране производитель свинины и говядины- 554 тыс. т мяса;
3.группа «Ресурс» — 483,7 тыс. т мяса бройлера;
4. группа «Агрокомплекс» им. Н. Ткачева. — 365 тыс. т мяса птицы и свинины;
5. Группа «Приосколье».- 339 тыс. т мяса бройлера;
6. группа «Белгранкорм» — 268 тыс. т. мясо бройлера и свинины;
7. группа «Чароен Покпанд Фудс» (входит в тайскую CP Foods) с 265 тыс. т бройлера и свинины;
8. группа «Сибирская аграрная группа» (недавно она изменила название на «Сибагро»). — 219,6 тыс. т. мяса;
9. группа «Великолукский свинокомплекс» -208,3 тыс. т свинины; 10. Группа «Русагро» — 189,5 тыс. т свинины [10].
Наиболее крупный потребитель воды — мясожировое производство. Для действующих предприятий цеховые расходы внутри этого производства распределяются следующим образом (%): убойно-разделочное отделение — 33,9 %, субпродуктовое — 17,6 %, кишечное — 17, 3 %, шкуроконсервировочное — 12,8%, вытопка пищевых жиров — около 18%. От 70 % до 90 % расходуемой воды образуют загрязненные в процессе производства сточные воды, которые имеют высокую нагрузку органическими загрязнениями [11].
Предприятия мясной промышленности расходуют на обработку 1 т мяса от 20 до 30 м3 воды и сбрасывают загрязненные сточные воды в количестве 80-90 % расхода свежей воды. Сточные воды мясокомбинатов наносят большой вред водоемам, так как содержат токсичные вещества. Растворенный в воде водоемов кислород расходуется на окисление органических загрязнений сточных вод, в результате биологическая жизнь водоемов нарушается, и в них развиваются процессы гниения. Масса загрязнений, поступающих в сточные воды от убоя и разделки крупного рогатого скота (в расчете на 1 голову), составляет около 20 кг, что эквивалентно массе загрязнений в хозяйственно-бытовых стоках от 90 человек [12].
Для сточных вод мясокомбинатов и скотобоен характерны высокие концентрации ХПК, БПК, жира и взвешенных частиц. Эти параметры являются основанием для взимания платы за сброс сточных вод. Причем в будущем ожидается увеличение платы. Поэтому предприятиям мясной промышленности необходимо снизить количество сточных вод и минимизировать нагрузку на городские очистные сооружения [13]. Требования для очистки сточных вод мясокомбинатов очень сильно зависят от размера производства и объема сточных вод (таблица 1). Тогда как маленькому заводу необходимо очистить сток от жира и взвешенных частиц, то для скотобойни обязательно дополнительно снизить очень высокую нагрузку по БПК и ХПК, вызванную присутствием крови 14].
Таблица 1
Удельные нормы водопотребления и водоотведения на предприятиях мясной промышленности (м3 на 1 т продукции)
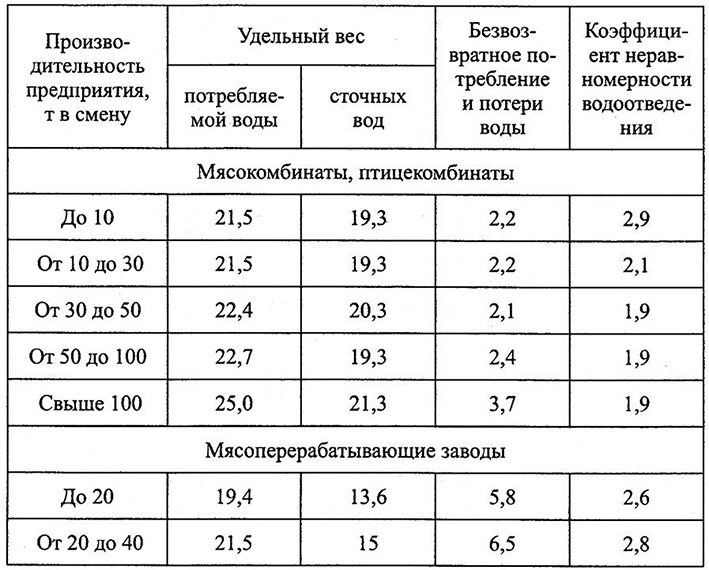
Одним из существенных факторов, определяющих величину негативного воздействия на водные объекты, является неспособность обеспечить достаточный уровень очистки всего объема сточных вод [15]. При высоких содержаниях органических соединений технология очистки сложна, многостадийна и не существует универсальных методов, которые были бы пригодны для любого типа сточной воды. В результате тенденция снижения качества воды, забираемой на нужды орошения полей, сельскохозяйственного водоснабжения отрицательно сказывается на урожайности сельскохозяйственных культур и качестве растениеводческой продукции [16].
Методики, реализованные сегодня на мясокомбинатах, не разрешают серьезно снизить использование воды. Фактические расходы ресурса зависят от масштаба предприятия, его специфики, типа оборудования, интенсивности работ, потерь, которые могут достигать 15%. Способы направленного изменения качества оросительной воды могут быть различными и должны способствовать созданию условий получения качественной продукции, улучшению физических и химических свойств почвы [17].
Из существующих, нашедших наибольшее распространение, можно выделить следующие способы: механические (фильтрование, гидроциклонирование, отстаивание, смешивание), химические (фертигация, коагуляция, сорбция), физические (вымораживание,выпаривание, гелиоопреснение), магнитоэлектрические (воздействие на воду и растворенные в ней вещества физическими полями), мембранные (обратный осмос, ультрафильтрация, электродиализ), биологические и биохимические. Все они имеют как положительные, так и отрицательные моменты и могут применяться в комплексе.
1.2 Методы очистки высококонцентрированных сточных вод
Очистные сооружения для очистки стоков боен, должны быть выполнены в коррозионно-стойком исполнении, поэтому важно подобрать материалы, устойчивые в химически агрессивной среде. Для очистки сточных вод скотобоен необходимо применять самые разнообразные методы: механические, физико-химические, химические и биологические методы [18].
Механическая очистка используется для задержки крупных загрязняющих частиц путем отстаивания, процеживания, фильтрации (решетки, песколовки, фильтры, отстойники). Очистка механическим способом применяется в качестве первой стадии в общей системе очистки сточных вод. В зависимости от назначения, отстойники подразделяются на первичные (до сооружений биологической очистки) и вторичные (после этих сооружений).
Физико-химическая очистка включает разнообразные методы: коагуляция, флотация, а в последнее время широко используется ионный обмен. Эти методы, как правило, требуют использования дорогостоящих реактивов, однако используются в виду их эффективности, а иногда невозможности решить задачу очистки другим способом. Этот метод широко используют для очистки многокомпонентных промышленных сточных вод с малой концентрацией загрязнений [19].
Химическая очистка применяется, когда другие способы неэффективны и выделение загрязнений возможно только в результате химических реакций (конденсации, окисления, нейтрализации). Они требуют большого расхода реагентов и обычно используются в сочетании с другими методами. Однако в ряде случаев применение химического метода очистки является необходимым и единственным [20].
Биологическая очистка сточных вод — это очистка, с помощью микроорганизмов. Из множества известных способов очистки предпочтение отдается биологическому методу очистки [21]. Сущность биологической очистки состоит в биохимическом разрушении коллоидальных, растворенных и эмульгированных веществ в результате деятельности микроорганизмов. Биохимическая очистка может применяться только в тех случаях, когда необходимо удалить из воды органические вещества, если загрязнения воды неорганического происхождения, то биологическая очистка не имеет смысла.
Основные факторы, определяющие возможность биологической очистки сточных вод, следующие:
• способность органических веществ сточных вод биохимическим способом окисляться;
• наличие необходимых питательных веществ (азот, фосфор, калий, углерод, микроэлементы; активная реакция среды, близкая к нейтральной);
• концентрация загрязненных веществ не должна превышать установленную норму; чтобы не мешать процессу;
• в сточных водах должны отсутствовать поверхностно активные вещества (ПАВ), мешающие доступу кислорода на очистное сооружение.
Биологическую очистку сточных вод можно осуществлять естественных условиях (поля орошения, поля фильтрации, биологические пруды) и в искусственно созданных условиях (аэротенки, биофильтры и другие). Анаэробные процессы можно осуществлять в метантанках — герметически закрытых резервуарах, где происходит метановое брожение [22].
Очистные сооружения по своему техническому оформлению различны, но все они рассчитаны на использование аэробного окислительного процесса, который протекает за счет кислорода воздуха, поступающего на активный субстрат. Для очистки сточных вод мясокомбинатов применяют три основных типа очистных сооружений: районные (городские), общие (заводские) и локальные (цеховые) [23].
К почвенным методам очистки сточных вод относятся поля орошения и поля фильтрации. Очистка на этих сооружениях происходит в процессе фильтрации сточных вод через почву, которые подвергаются биохимическому окислению. Окислительные процессы в почве происходят на глубине (0,2—0,3 м) интенсивного проникновения воздуха. Органический углерод окисляется до СО2, аммонийный азот до нитритов и нитратов (NO2, NO3), то есть нитрифицируется. Процесс денитрификации происходит на большой глубине, вследствие недостатка или отсутствия воздуха и на окисление органических веществ расходуется кислород, освобождающийся от нитратов. При почвенных методах очистки окисление органических веществ идет в присутствии кислорода с активным участием микроорганизмов (бактерий, грибов, водорослей, простейших и беспозвоночных животных). В процессе участвуют микроорганизмы сточной жидкости и самой почвы. Основные окислительные процессы протекают в верхних слоях почвы до 40 см и этот слой наиболее обильно заселен микроорганизмами. На верхние 10 см приходится на 1 г сухой почвы до 1×1010 бактерий, на глубине 30 см до 2×109, а на глубине 50 см до 1×109. Адсорбционная способность биологической пленки почвы очень велика, так как на площади в 1 м2 суммарная поверхность тел для глубины 40см составляет 48000 м2. Бактерии минерализуют органическое вещество, водоросли продуциру¬ют кислород, а простейшие уничтожают избыточное количество бактерий. Уничтожая старые бактерии, они тем самым создают более благоприятные условия для роста молодых, биохимически активных особей. Дождевые черви, клещи, личинки жуков рыхлят почву и тем способствуют лучшему проникновению воздуха. Кроме того, они перерабатывают трудно расщепляемые органические вещества (целлюлозу, хитин, кератин и др.) [23].
Искусственные очистные сооружения
Процессы очистки сточных вод, осуществляемые в искусственных сооружениях, Могут быть аэробными или анаэробными. Для аэробных процессов обычно применяют аэротенки и биофильтры, а для анаэробных — метантенки.
Аэробные очистные сооружения. Биофильтры впервые были внедрены для очистки сточных вод в конце прошлого века: в США (1890), в Англии (1893). Далее они получили распространение во всем мире, в том числе и в России. Биофильтрами называются очистные сооружения прямоугольной или круглой формы, заполненные слоем из крупнозернистого материала (камня, шлака, щебня и т. д.), на поверхности которого в процессе орошения стоками образуется биологическая пленка, заселенная аэробными микроорганизмами. В биофильтр сточные воды подаются после осветления их в первичных отстойниках. При фильтрации сточных вод через слой загрузки происходит адсорбция биологической пленкой коллоидальных, растворенных и тонкодисперсных веществ, оставшихся в жидкости после первичных отстойников [24].
Органическая часть загрязнений подвергается окислению (минерализации) аэробными микроорганизмами (биопленка). Кислород, необходимый для жизнедеятельности микроорганизмов, поступает в биофильтр естественным путем или искусственной вентиляцией.
Сущность процесса биологической очистки сточных вод на биофильтрах не отличается от процесса очистки почвенными методами, однако процесс биохимического окисления в биофильтрах происходит значительно интенсивнее, чем на полях орошения и фильтрации, за счет искусственно созданных наиболее благоприятных условий для жизнедеятельности микроорганизмов. Поэтому размеры биофильтров во много раз меньше естественных сооружений.
По конструкции и производительности биофильтры подразделяются на капельные и высоконагружаемые.
Капельные биофильтры (стандартные) применяются для полной биологической очистки сточных вод. Органические вещества в биофильтре почти полностью подвергаются биохимическому окислению. БПКполн. очищенных сточных вод составляет 15 мг/л. Характерной особенностью этих фильтров является небольшая нагрузка на них сточных вод. Гидравлическая нагрузка на капельные биофильтры (выраженная в м3/м2 поверхности фильтра) составляет 1—2 м3/м2 в сутки. Обычно капельные биофильтры допускаются применять на производительность не более 1000 м3/сутки [25].
Высоконагружаемые биофильтры характеризуются высокой окислительной мощностью, которая в несколько раз больше, чем в капельных биофильтрах. Гидравлическая нагрузка также больше в 10-30 раз. Это связано с особенностями устройства высоконагружаемых биофильтров. Загрузка в них крупнее (от 40 до 60 мм) и этим увеличивается объем и размер пор в теле фильтра. Искусственная вентиляция увеличивает подачу воздуха, увеличивая тем самым интенсивность его обмена. Высокая скорость движения сточной воды в биофильтрах обеспечивает постоянный вынос задержанных трудноокисляемых и нерастворимых веществ, также отмершую биопленку.
Известно, что при очистке концентрированных сточных вод их необходимо разбавлять. Часто используют при этом очищенные стоки, содержащие адаптированные к данным загрязнениям микроорганизмы, что способствует процессу окисления органических веществ. Для очистки концентрированных сточных вод и применяются высоконагружаемые биофильтры как для частичной очистки, так и для полной [26].
Биохимические процессы разложения органических веществ в биофильтре осуществляются микроорганизмами биопленки, образующейся на зернах загрузки. Биоценозом биопленки являются бактерии, простейшие, личинки, черви, грибы, зеленые, сине-зеленые и диатомовые водоросли. В верхних слоях биофильтра разрастаются зеленые и сине-зеленые водоросли, нуждающиеся в кислороде и свете, необходимых для их развития. Ниже (от 10 до 50 см) развиваются диатомовые водоросли, которые не нуждаются в высоком содержании кислорода и света. Простейшие обита¬ют во всех слоях биопленки. Зона червей располагается в нижних ее слоях на орошаемых участках [27].
Все микроорганизмы принимают активное участие в очистке сточных вод. Бактерии минерализуют органические вещества. Простейшие питаются бактериями, водоросли продуцируют кислород, черви рыхлят биопленку и обеспечивают доступ кислорода. Кроме того, черви, питаясь органическими веществами, переваривают и разлагают ряд стойких соединений (хитин, клетчатку).
Таким образом, следует отметить, что окислительная мощность биофильтров колеблется в широких пределах, так как она зависит от многих факторов (температуры сточной воды и воздуха, состава загрязнений, нагрузки, материала загрузки фильтра, способа подачи воздуха, сроков подачи жидкости, типа сооружений). Поэтому даже на самых совершенных биофильтрах не достигается полной очистки. В очищенных стоках остаются органические вещества и микроорганизмы, поэтому необходимо стоки обеззараживать хлором или другим способом [28].
Аэротенки. Аэротенки широко начали применяться с 1914 г. В 1915 г. в Москве для очистки сточных вод начали использовать непрерывно действующие аэротенки. Аэротенки — это прямоугольные железобетонные резервуары, через которые медленно протекают подвергающиеся аэрации сточные воды, смешанные с активным илом [29].
Аэротенки состоят из секций, разделенных продольны¬ми перегородками. Сточные воды непрерывно подаются в один конец длинного коридора, а очищенные воды выводят из другого конца. Подача воздуха в аэротенки производится воздухонагнетательными машинами (компрессорами, воздуходувками, вентиляторами) или механическими средствами (засасыванием воздуха из атмосферы, барботажем воздуха с помощью мешалок и т. д.)
Кислород воздуха необходим для жизнедеятельности сапрофитных микроорганизмов, а также частично подавляет развитие патогенных бактерий. Аэрация способствует большему контакту активного ила с загрязнениями сточной жидкости [30].
Действующим началом при очистке сточных вод в аэротенке является активный ил. Получение хлопка активного ила является одним из основных условий работы аэротенка. Активный ил представляет собой частицы органических веществ, населенных различными группами микроорганизмов аэробов и факультативных анаэробов. Основную часть активного ила составляют бактерии, численность которых в активных илах составляет от 108—1012 клеток на 1 г сухого вещества. Бактерии представлены α и β мезосапробными группами. Их видовой состав зависит от того, какими веществами загрязнена сточная вода. Среди бактерий есть гетеротрофы и литотрофы. В биоценозе активного ила есть бактерии родов Bacillus, Bacterium, Sarcina, Micrococcus и др. В большом количестве в иле развиваются бактерии-нитрификаторы до 3*107 клеток на 1 г активного ила. В нормально работающем иле содержится небольшое количество нитчатых бактерий (сферотилюс и кладотрикс), а также встречаются дрожжи, грибы. Бактерии в процессе очистки воды образуют слизистые скопления — зооглеи, которые характерны для хорошо сформированного активного ила [31].
Микрофауна активного ила представлена разнообразными группами простейших (жгутиковыми, саркодовыми, инфузориями), коловратками, червями, малощетинковыми червями (олигохетами), реже — водными клещами, циклопами, личинками. Представители микрофауны очень чувствительны к концентрации органических веществ, количеству растворенного кислорода, наличию токсичных соединений и др., поэтому, в процессе очистки при разных режимах наблюдается преобладание различных групп простейших.
При нормальной работе аэротенка устанавливается равновесие между микрофлорой и микрофауной, нарушение которого свидетельствует об ухудшении работы очистного сооружения.
Скорость осаждения хлопка активного ила зависит от его плотности, обусловленной составом микрофлоры. Мелкие микроорганизмы образуют плотный быстрооседающий активный ил, а длинные нитчатые и разветвленные организмы создают рыхлый плохо оседающий ил.
Причинами, нарушающими работу аэротенка, являются перегрузка очистного сооружения органическими веществами, образование анаэробных зон, недостаток биогенных элементов, резкое изменение температуры, реакции среды, присутствие в воде токсических веществ.
Активный ил имеет следующий химический состав: зола -1 5,58 %; фосфорный ангидрид (Р2O5) 2,14%; азот органический 3,615; сырой жир 2,51%; жирные кислоты 0,39% [32].
Аэротенк может работать круглый год, так как даже при низкой температуре протекает процесс минерализации органических веществ, однако в зимнее время процессы нитрификации замедляются. В очищенной воде наблюдается резкое снижение количества бактерий по сравнению с исходной водой (например, кишечной палочки на 98 % от начального количества). Снижение бактерий происходит за счет адсорбции их активным илом, поеданием фауной и растворением бактериофагом. Однако аэротенк не может обеспечить полную очистку воды от патогенных микроорганизмов, поэтому перед выпуском ее необходимо обеззараживать.
Анаэробные очистные сооружения.
Анаэробная обработка сточных вод находит все более широкое применение. Комплексная очистка стоков, содержащих растворимые и трудно растворимые органические вещества, обеспечивается специальными процессами [33].
Одним из методов обработки осадков сточных вод является метод метанового брожения. Брожением называется процесс ферментативного преобразования сложных органических веществ в простые.
Сбраживание осадка сточных вод ведется в анаэробных условиях, в которых органические вещества под действием различных микроорганизмов, проходя через большое число промежуточных продуктов, разлагаются до углекислоты и метана, который является конечным продуктом, потому и сам процесс называется метановым брожением. На очистных сооружениях образуется большое количество осадков. При биологической очистке на биофильтрах появляется биопленка, в аэротенках — избыточный активный ил, а также осадок в первичных отстойниках. Анаэробная обработка осадков является наиболее эффективным приемом для предотвращения их загнивания, улучшения структуры, уменьшения объема и обезвоживания [34].
В составе осадков бытовых сточных вод содержится до 80 % органических веществ, в производственных он может колебаться от 65 до 85 %. Органическая часть осадка состоит на 80 % из углеводов, жиров, белков и на 20 % — гумуса [35].
Метановое брожение сточных вод может происходить в мезофильных условиях, если температура бродящей массы не превышает 35 °С, или в термофильных условиях, если температура поддерживается в пределах 45 — 65 °С с помощью термофильных и мезофильных бактерий.
Двухъярусный отстойник. Осаждение осадка в отстойнике происходит в отстойных лотках через продольную щель на дне, где накапливается слоем до 7 м. В иловой жидкости содержится большая концентрация гидрокарбоната аммония, что обусловливает ее высокую буферность. Поэтому рН иловой жидкости лежит в пределах 6,5-7,8. В составе газов отсутствует сероводород, и сброженный осадок не обладает плохим запахом из-за лучшего перемешивания и частичной смены воды во время выпуска зрелого осадка [36].
Метантенки — это сооружения с оптимальными условиями для анаэробного разложения органических веществ осадка сточных вод. Метантенки разнообразны по форме и размерам. Главное в них — температура бродящего осадка, регулирующая интенсивность процесса, доза загрузки свежего осадка и тщательное перемешивание. Общий вид метантенков показан на рисунке 1 [37].
Сброженный осадок имеет высокую влажность (около 97 %), и поэтому должен подсушиваться, прежде чем может быть использован как удобрение. Сброженный осадок подсушивается двумя методами: 1) сушка на иловых площадках (прудах); 2) механическое обезвоживание с последующей термической сушкой.
Иловые площадки площадью в несколько га находятся па расстоянии 20—40 км от территории очистных сооружений вблизи полей колхозов и совхозов, использующих осадок в качестве удобрения. Осадок на иловые площадки подается системой илопроводов и иловых насосных станции. Процесс сушки на площадках определяется естественными условиями и продолжается около двух лет. За это время влажность осадка уменьшается до 78—80 % [38].

Рисунок 1 Общий вид метантенков.
Метантенк подогревается водой или паром. Вода циркулирует по трубам, а пар вводится прямо в бродящий осадок. Перемешивание проводят механическими или гидравлическими насосами, при этом выделяется в большом количестве газ. Сброженный осадок в метантенке обильно заселен микроорганизмами, адаптированными к данному загрязнению.
При термофильном брожении происходит отмирание патогенных бактерий и яиц гельминтов. Кроме того, в метантенках образуется газ метан и углекислота, которые можно использовать — метан как топливо, а двуокись углерода для получения сухого льда [39]. Осадок богат минеральными и органическими веществами (азотом, фосфором, калием и др.), поэтому его можно широко использовать как удобрение или в брикетах как топливо, если нет в этих осадках солей тяжелых металлов [40].
Таким образом, резюмировав сказанное, можно отметить, что наибольшее распространение для обработки стоков скотобоен имеет метод анаэробного сбраживания. Затем следуют способы обработки стоков скотобоен методом флотации и на сооружениях искусственной биологической очистки (аэротенки, биофильтры); комбинированные способы, где имеется сочетание механической, химической и биологической видов обработки стоков скотобойни, также имеют распространение, но уже меньше, чем первые три. И, наконец, меньше всего применяются естественные способы и обработка стоков анаэробно — аэробным путем [41]. Количественные соотношения всех используемых, по литературным данным, способов для очистки стоков скотобоен представлены в таблице 2.
Таблица 2
Частота применения технологий при обработке стоков скотобойни
| Вид технологического процесса | Частота встречаемости, в % |
| Анаэробное сбраживание | 32,0 |
| Флотация | 26,0 |
| Искусственная биологическая очистка | 26,0 |
| Комбинированные способы (механическая, химическая и биологическая виды очистки) | 15,0 |
| Естественные способы очистки (биопруды и поля орошения) | 5,0 |
| Анаэробная обработка с аэробной доочисткой | 5,0 |
| Метод ультразвуковой обработки и озонирование | 5,0 |
Анаэробное сбраживание наиболее выгодно с точки зрения охраны окружающей среды, не загрязняет её; однако технологический процесс и оборудование, в котором это сбраживание происходит, требуют весьма тщательного подхода и контроля, в противном случае могут происходить взрывы установки. Строительство и эксплуатация данного вида сооружений обходится недешево [42]. Поэтому, исходя из этих изученных материалов, при выборе метода очистки и обеззараживания сточных вод большинство хозяйств останавливаются на обработке их в биопрудах с последующей утилизацией на полях орошения [43].
1.3 Перспективы использования биосорбции тяжелых металлов в очистке сточных вод скотобоен
Сорбция ионов металлов микробной биомассой является одним из возможных методов детоксикации сточных вод. В качестве сырья для получения биосорбентов используют биомассу чистых культур некоторых видов дрожжей, бактерий и мицелиальных грибов. Тяжелые металлы (ТМ) – это группа химических элементов с высокой плотностью и атомной массой более 50, которая включает все металлы, за исключением щелочных и щелочноземельных элементов [44]. Попадая со сточными водами в окружающую среду, ТМ оказывают токсическое воздействие на флору и фауну, тем самым снижают биоразнообразие и продуктивность экосистем. Согласно данным ВОЗ ТМ занимают второе место после пестицидов по степени опасности для здоровья человека, поскольку обладая способностью концентрироваться при движении по трофической цепи, могут стать причиной тяжелых заболеваний человека [45]. Сточные воды, содержащие от 1 до 10 мг/л тяжелых металлов во взвешенной, коллоидной, растворенной и нерастворенной формах, при поступлении на биологические очистные сооружения, неблагоприятно воздействуют на нормальное функционирование и жизнеспособность активного ила. Некоторые из солей тяжелых металлов, например, меди и цинка, трехвалентного хрома в щелочной среде выпадают в осадок; другие, гидролизуясь, значительно подкисляют сточные воды. Как правило, тяжелые металлы и их соли действуют на активный ил как токсиканты уже через 4-20 часов после накопления их активным илом, тем самым нарушают проницаемость мембран, вызывают денатурацию ферментов у микроорганизмов сообщества активного ила, что приводит к выводу из строя работы очистных сооружений [46]. Поэтому содержание металлов в сточных водах, поступающих на биологическую очистку, нормируется. Максимальные концентрации металлов, поступающих на сооружения биологической очистки не должны превышать следующих концентраций (мг/дм3): Fe3+ — 5,0; Mn2+ — 30,0; Cu2+— 0,5; Pb2+ — 0,1; Cr 3+ — 2,5; Cr 6+ — 0,1; Zn2+— 1,0; Sn2+— 10,0 [47]. Поэтому извлечение тяжелых металлов на локальных очистных сооружениях промышленных предприятий необходимо осуществлять с учетом разбавления в канализационных сетях до концентраций, указанных в рекомендациях. Часть тяжелых металлов образует комплексные соединения с органическими веществами, присутствующими в сточных водах, и те методы, которые используются контролирующими организациями, часто дают заниженные значения [48]. Степень токсичности того или иного металла может изменяться в зависимости от вида организма, от концентрации в объектах окружающей среды и от того, присутствуют ли эти элементы в растворе в виде свободного иона, недиссоциированной соли, либо входят в состав органических или неорганических комплексных соединений. Недиссоциированные соли и ионы, образующие комплексы, обычно менее токсичны, чем свободные ионы в тех же концентрациях. При оценке влияния металла на организмы важно учитывать также их валентность. [49]. Для удаления тяжелых металлов из сточных вод промышленных предприятий предложен целый ряд химических и физико-химических методов: гравитационное осаждение, флотация, фильтрация, адсорбция, обратный осмос, электродиализ, дистилляция и химическое осаждение. Все эти способы не обеспечивают очистку больших объемов воды или дороги, поэтому экономически невыгодны. Химические способы, например, не годятся для очистки вод с очень низкими концентрациями ионов металлов и вызывают вторичное загрязнение остатками вносимых в воду реагентов [50]. В последние десятилетия внимание исследователей привлек процесс накопления тяжелых металлов биомассой микроорганизмов. Методы биосорбции основаны на способности многих бактерий, микроскопических грибов, водорослей, простейших аккумулировать тяжелые металлы в количествах, намного превышающих их физиологические потребности [51]. Механизмы накопления металлов микроорганизмами разнообразны — от биосорбции до энергозависимого транспорта с участием мембранных переносчиков ионов с последующей внутриклеточной компартментализацией и внеклеточным осаждением. Адсорбция положительно заряженных металлов на поверхности микробных клеток, как полагают, зависит от физиологических особенностей микроорганизмов, наличия карбоксильных, гидроксильных, сульфгидрильных, сульфатных, фосфатных, аминогрупп, липополисахаридов, хелатных соединений клеточной стенки – сидерофоров. [52]. Набор сорбируемых ионов чрезвычайно широк, сорбционная способность очень высока, в связи с чем можно рассматривать эти организмы как эффективные и дешевые сорбенты для очистки промышленных сточных вод [53].
Металлы сорбируются как живыми, так и мертвыми клетками микроорганизмов, при этом мертвая биомасса обладает большей сорбционной способностью, что позволило многим авторам использовать это явление в ряде технологических процессов [54]. Проведенные исследования по изучению сорбции живым и мёртвым илом ионов меди, свинца, в зависимости от времени контакта биомассы активного ила и концентрации металлов. Результаты показали, что при небольшой биомассе 1,45 мг/л, до 60% металлов сорбировалось в течение 1 часа. При увеличении биомассы до 2,7г/л основная часть металла сорбировалась в первые 20 минут. Существенно повысить биосорбционную способность ила, ускорить процесс сорбции металлов, можно, используя гранулированный либо термически обработанный ил. [55]. Микробные гранулы или биопленки, в виде микрочастиц, растущие в аэробных условиях, являются самоиммобилизированными агрегатами бактерий, которые имеют компактную структуру, повышенную способность к осаждению и могут продолжительно функционировать в системе очистки сточных вод. Гранулированный активный ил по сравнению с флоккулированным является более структурированным сообществом микроорганизмов. Агрегация микробных клеток в компактные гранулы служит эффективной защитой от токсических веществ [56]. Добавление к активному илу компонентов, адсорбирующих металлы, уменьшает вредное влияние поступающих в высоких концентрациях металлов. Внеклеточные полимерные вещества, доминируя в активном иле, могут составлять до 80% его массы. Показано, что они играют важную роль для связывания тяжелых металлов [57].
Повышение эффективности мер по охране окружающей среды связано, прежде всего, с широким внедрением ресурсосберегающих, малоотходных и безотходных технологических процессов, уменьшением загрязнения окружающей среды. При работе предприятий пивоваренной, спиртовой, молочной промышленности, производства ферментов, белковых препаратов, витаминов, стимуляторов роста и развития растений, антибиотиков и других ценных продуктов микробиологического синтеза, происходит образование специфического отхода производства – биомассы микроорганизма – продуцента, основная часть которой не утилизируется и попадает на очистные сооружения. Биомасса представляет собой частично разрушенные, а частично живые клетки микроорганизмов и содержит в основном биополимеры (около 50% массы сухого вещества составляют белки, 10 – 20% — компоненты клеточной стенки, в том числе полиаминосахариды, 10 – 20% — РНК, 3 – 4% — ДНК и приблизительно 10% — липиды). Кроме того, любая биомасса содержит компоненты питательной среды и остаточные количества целевого продукта [58].
В способе очистки сточных вод от ионов меди (II), серебра и хрома (III), присутствующих в концентрациях 3-60 мг/л, 40-195 мг/л и 10 мг/л соответственно в сточную воду вводился 3-60 мг/л фильтр-картона с иммобилизированным штаммом дрожжей Saccharomyces carlsbergensis. Параллельно ставился контрольный опыт с «чистым картоном», не использованным в производстве. Отходы производства пивоваренной промышленности, содержащие фильтр-картон с иммобилизированным штаммом дрожжей Saccharomyces carlsbergensis, сорбировали металлы из сточной воды от ионов меди за 3-4 часа контакта на 99,8 — 100%, от ионов серебра за 2- 4 часа контакта на 99 — 100%, от ионов хрома за 94 часа на 95%. Отходы производства значительно быстрее и полнее сорбировали ионы металлов, чем «чистый» картон [59].
Исследовалась сорбционная способность трех штаммов дрожжей Saccharomyces cerevisiae, сухих дрожжей и биосорбентов на их основе (активированный хитин–глюкановый комплекс) на модельных средах, содержащих соли (хлориды и сульфаты) меди (40,0 мг/дм3), никеля(100,0 мг/дм3) и цинка 20,0 мг/дм3. Установлено, что уже через 24 часа при температуре 29°C концентрация тяжелых металлов в модельных средах с живыми штаммами дрожжей снижалась до следующих значений: меди — 2,7 мг/дм3; 3,2 мг/дм3 и 5,4 мг/дм3), никеля (5,3 мг/дм3, 11,5 мг/дм3 и 15,0 мг/дм3) и цинка (0,04 мг/дм3, 2,2 мг/дм3 и 0,60 мг/дм3), то есть биосорбция обеспечивала очистку воды на 65,2% — 99,6% [60]. При этом наименьшая сорбционная способность наблюдалась у хитин-глюканового комплекса и сухих дрожжей, и концентрация тяжелых металлов снижалась до следующих значений: медь (11,2 мг/дм3 и 11,9 мг/дм3), никель (32 мг/дм3 и 34 мг/дм3) и цинк (7,2 мг/дм3 и 7,7 мг/дм3). Об этом свидетельствует также сопоставление значения по эффективности сорбции тяжелых металлов. Как показано в таблице 2 эффективность сорбции тяжелых металлов живыми клетками дрожжей составляет живыми дрожжами составляет 81- 99,7 % [ 61].
После использования сорбентов возможно извлечение сорбированных веществ десорбцией либо утилизацией путём озоления (зольность сорбентов составляет 1.5 – 30% мас.) [62].
1.4 Использование сточных вод боен для орошения полей
При орошении полей сточными водами решается одновременно несколько задач: происходит почвенная очистка сточных вод, предотвращается сброс сточных вод в водоисточники, увлажняется почва и утилизируются питательные элементы сточных вод, что повышает плодородие почв и урожайность сельскохозяйственных культур. В то же время в орошаемом земледелии критерием пригодности очищенных сточных вод является их химический состав, удобрительная ценность, санитарно-бактериологическая безопасность. Под воздействием применяемой для орошения сельскохозяйственных полей некачественной воды происходит ухудшение их мелиоративного состояния, снижение плодородия почв и, как следствие, что отражается на урожайности и качестве растениеводческой продукции [63]. Орошение сточными водами не должно вызывать засоления, осолонцевания почвы, угнетения роста и развития растений, не представлять санитарно-эпидемиологическую опасность. При сельскохозяйственном использовании сточные воды должны способствовать сохранению и повышению плодородия почвы, получению продукции высокого качества. Сточные воды, образующиеся при забое крупного рогатого скота, свиней или птицы, содержат высокое содержание трудноразлагаемых органических веществ, тяжелые металлы, сульфаты, соли натрия, патогенную микрофлору и яйца гельминтов и являются одними из крупнейших источников загрязнения окружающей среды [64]. Длительное регулярное орошение недостаточно очищенной сточной водой скотобоен, богатых различными химическими соединениями ведёт к ухудшению качества грунтовых вод за счёт накопления различных форм азота – основного загрязняющего вещества – выше нормативных величин в несколько раз [65]. Также отмечается тенденция постепенного увеличения нитритов и нитратов в стоках [66]. Сточные воды мясокомбинатов могут содержать патогенные микроорганизмы и гельминты, представлять эпидемиологическую опасность. Поэтому производственные сточные воды мясокомбинатов должны пройти обязательную подготовку на локальных сооружениях и могут быть дочищены на полях орошения или фильтрации только в случае, если их состав идентичен бытовым стокам и не содержит токсичных и ядовитых веществ [67], [68].
Земледельческие поля орошения (ЗПО) — вид очистных сооружений, основанных на очищающих свойствах почвы и почвенной микрофлоры, воздействии солнца, воздуха и жизнедеятельности растений. Поля орошения -это специально подготовленные для биологической очистки участки земли, с одновременным использованием очищенной воды для орошения и выращивания сельскохозяйственных культур. Если поля предназначаются только для биологической очистки без выращивания на них сельскохозяйственных культур, то они носят название полей фильтрации [69]. В условиях современного хозяйства применение полей орошения позволяет решать комплексные проблемы благоустройства городов и развития пригородного сельского хозяйства как базы снабжения населения городов овощами.
Различают следующие типы полей орошения.
1. Коммунальные поля, задачей которых является очистка сточных вод, а использование их для сельского хозяйства играет вспомогательную роль.
2. Земледельческие поля орошения, служащие для полной биологической очистки сточных вод, а также для увлажнения и удобрения сельскохозяйственных земель.
3. Поля орошения летнего типа, при которых орошение земель производится только летом в вегетационный период развития растений. Главная задача таких полей состоит в выращивании сельскохозяйственных культур, для развития которых, земли увлажняются и удобряются сточными водами. Очистка сточных вод не представляет собой основную задачу [70]. На полях орошения выращиваются различные сельскохозяйственные культуры, а также декоративные и плодовые деревья.
Сущность процесса биологической очистки сточных вод на полях состоит в том, что сточная вода, проходя через фильтрующий слой земли, теряет взвешенные и коллоидные вещества, которые образуют на частицах грунта пленку, густозаселенную микроорганизмами. На этой пленке собираются растворенные и коллоидные вещества органического происхождения, которые в присутствии кислорода воздуха, проникающего через поры грунта, окисляются микроорганизмами, превращаясь в минеральные соединения. Для устройства коммунальных полей орошения выбираются земельные участки со спокойным рельефом местности. Лучшими для устройства полей являются песчаные и супесчаные грунты. На поля подается предварительно осветленная сточная жидкость. Расчет коммунальных полей орошения и полей фильтрации производят по так называемой норме нагрузки, под которой понимают количе¬ство стачных вод, очищаемых на 1 га площади полей [71].
Для вычисления полной площади полей орошения учитывают резервную площадь и площадь, необходимую для устройства валиков, дорог, осушительной сети и вспомогательных сооружений.
Резервные участки необходимы потому, что в определенное время года (например, весной во время подготовки земли к посеву) напуск сточных вод на поля орошения не допускается [72].
Сточные воды, направленные на поля орошения без предварительной подготовки, приводят к заиливанию и закупорке пор почвы взвешенными и другими веществами, что затрудняет или вовсе прекращает доступ воздуха в почву и нарушает процесс минерализации органических загрязнений сточных вод [73]. Поэтому сточные воды необходимо вначале направлять в отстойники для осветления и осаждения взвешенных веществ, а также для освобождения от гельминтов, которые выпадают вместе с осадком на дно отстойников [74]. В течение 1—2 ч отстаивания сточные воды можно освободить от гельминтов на 75—95 %. Яйца червей обладают высокой выживаемостью. Они могут жить в почве на глубине 2 см около 1,5 лет. На полях орошения запрещается по санитарным правилам производить и поливать культуры, которые в сыром виде могут употреблять в пищу (морковь, редис, лук, салаты, петрушка и др.). Персонал, имеющий отношение к полям орошения, подвергается систематически профилактическому осмотру и прививкам от инфекционных болезней [75].
Поля фильтрации, как и поля орошения, предназначены для очистки сточных вод только без выращивания на них растений или сельскохозяйственных культур. Основным назначением полей фильтрации является только очи¬стка сточных вод, поэтому нагрузка на них гораздо большая, чем на полях орошения. Сточные воды подаются в специальные борозды, где и происходит их очистка. Для полей фильтрации выбирают на пригодные почвы, обладающие хорошей проницаемостью и фильтрационной способностью. Наиболее благоприятными являются песчаные почвы, а непригодными торфяные и глинистые, а также солончаки. Отсутствие активного слоя почвы и ризосферой микрофлоры неблагоприятно влияет на интенсивность разрушения органических загрязнений. Поэтому как метод очистки, особенно промышленных сточных вод, поля фильтрации имеют ограниченное значение. Они используются только как резервные территории на ЗПО при временном прекращении полива [76].
Санитарно-защитные зоны между населенными пунктами и полями зависят от количества сточных вод в сутки, направляемых на поля.
Поля фильтрации Поля орошения
От 0,2 до 5 тыс. м3 — 300 м 200 м
От 5 до 50 тыс. м3 — 500 м 400 м
От 50 до 500 тыс. м3 —1000 м 1000 м
Поля орошения и поля фильтрации необходимо располагать так, чтобы избежать загрязнения сточными водами грунтовых вод, служащих источником водоснабжения. Такие показатели, как биологическая потребность в кислороде (БПК), химическая потребность в кислороде (ХПК), запах, цветность, прозрачность, содержание кислорода, не лимитируют использование сточных вод на орошение.
Сложность оценки пригодности сточных вод для орошения обусловливается не только разнообразием химического состава, но и тем, что одни и те же виды сточных вод находятся в разных почвенно-климатических зонах.
При расчете годовых норм внесения сточных вод в почву учитываются лимитирующие факторы (содержание токсичных солей, опасность осолонцевания и др.) содержание биофильных элементов в почве и применяемых водах и потребности растений в питании. М.Ф. Будановым разработаны следующие требования к поливным водам: воды с минерализацией 1000 мг/л применяют для орошения, если соотношение Na : Ca (мгэкв/л) будет больше 1, а соотношение Na : Ca : Mg – не больше 0,7.
Для приведения сточных вод в соответствие с требованиями необходимы разбавление их чистой водой. В зонах с преобладанием дерново-подзолистых почв пригодность оросительных сточных вод определяется менее жесткими требованиями, чем в южных районах страны, где распространены черноземы и каштановые почвы.
В южных районах почвообразовательный процесс легко направляется на развитие засоления и осолонцевания почв.
При отсутствии ограничивающих факторов нормы использования сточных вод для удобрения сельскохозяйственных культур лимитируются по содержанию в них азота, особенно на почвах легкого механического состава. Образующиеся нитраты могут мигрировать в нижние горизонты почв, загрязняя грунтовые воды. Максимальная доза не должна превышать 200 кг общего азота [77].
Во время вегетации культур в условиях недостаточного увлажнения, сточные воды не должны содержать азот: более 750 мг/л при применении под многолетние травы второго года вегетации; 500 мг/л для трав первого года вегетации и однолетних трав без бобовых; 400 мг/л под кукурузу и колосовые; 250 мг/л под свеклу и подсолнечник [78].
На орошаемых сточными водами землях следует выращивать кормовые, технические, зерновые культуры на фураж, а также древесно-кустарниковые насаждения. Культивирование на полях орошения овощей, ягод, фруктов, а также бахчевых культур запрещается.
Набор культур, как правило, должен состоять из многолетних трав и других интенсивных культур (кукуруза на силос и зерно, подсолнечник, соя, корнеплоды, однолетние травы). В качестве основной культуры возделывают многолетние травы на сено, травяную муку, сенаж или на выпас [79].
Регулярные удобрительные поливы обеспечивают быстрый рост трав и дают возможность получать по три-четыре укоса в течение вегетационного периода.
Севообороты при орошении сточными водами должны отвечать агрономическим, санитарно-гигиеническим и хозяйственным требованиям. При их построении учитывают химический состав и удобрительную ценность сточных вод. При орошении сточными водами средней и низкой удобрительной ценности необходимо дополнительное внесение удобрений. Количество основных питательных элементов определяется выносом их с урожаем. Используют удобрения при орошении сточными водами дифференцированно, с учетом почвенно-климатических условий и вида возделываемой культуры [80].
Азотные удобрения целесообразно вносить дробно с поливной водой, используя для этого баки дождевальных машин. Фосфорные удобрения применяют не более 1-2 раз за вегетацию (весной и осенью) путем поверхностного рассева туковыми сеялками. Калийные удобрения также вносят дробно – весной , летом и осенью.
Кислые почвы известкуют из расчета 4-5 т/га извести через каждые 2-3 года.
Внесение органических удобрений в виде навоза, торфонавозных компостов, торфа резко повышает эффективность использования сточных вод, особенно на участках, где в результате мелиоративных и культурно-технических работ значительно снижена мощность гумусового горизонта.
При орошении сточными водами убойных цехов особенно важны уход за посевами, введение севооборотов и повышение культуры земледелия. Важны своевременные сроки уборки урожая. При уборке важны соблюдения карантинных сроков, который составляет от 7 до 21 дня со дня последнего полива, соблюдение санитарно-гигиенических правил, исключающих возможность загрязнения продукции и заражения рабочих, занятых на уборочных работах. Запаздывание с уборкой и растягивание сроков вызывает потери урожая и ухудшение его качества, поэтому уборка должна проводиться своевременно и быстро. Ответственность за выполнение санитарных требований при использовании сточных вод на полях орошения несут руководители хозяйств, в ведении которых- они находятся. Плановое обследование полей орошения проводят органы и учреждения санитарно-эпидемиологической службы, не менее трех раз в год [81].
II Материал и методы исследований
2.1. Объекты исследований
-служили выделенные селекционным путем накопительные и чистые культуры микроорганизмов, выделенные из загрязненных стоками убойного цеха свинооткормочного комплекса хозяйства ООО «СГЦ» Вишневский» Сакмарского района Оренбургской области. Штамм микроскопического гриба Hypomyces odoratus 94/77, хранится в ВКПМ под коллекционным номером F-242 как продуцент комплекса протеолитических ферментов и антибиотически активного препарата антибактериального и фунгицидного спектра действия [82].
2.2 Выделение чистых культур, изучение морфологических, культуральных и биохимических свойств. Идентификация микроорганизмов.
Для получения изолированных колоний использовали метод последовательных разведений, для этого стерильную водопроводную воду разливали стерильной пипеткой по 9 мл в стерильные пробирки. Затем переносили стерильной пипеткой 1 мл исследуемого материала в пробирку с 9 мл стерильной водопроводной воды. Если исследуемый материал (почва) уже был разведен в 100 раз, получали разведение 1:103. Суспензию этого разведения тщательно перемешивали с помощью новой стерильной пипетки, вбирая в пипетку и выпуская из нее полученную взвесь. Эту процедуру повторяли 3-5 раз, что обеспечивало перемешивание суспензии и уменьшало адсорбцию клеток на стенках пипетки. Затем этой же пипеткой взяли 1 мл полученного разведения и перенесли его во вторую пробирку – это разведение 1:104. Аналогичным способом готовили и последующие разведения.
Выделение накопительных культур микроорганизмов получали рассевом разведений накопительных культур на чашках Петри с элективными агаризованными средами [83], где в качестве источника углерода использовали 1% свиного навоза или 1% птичьего помета. В качестве исходной суспензии использовали 1 мл накопительной культуры в 100 мл стерильной среды. Далее наносили 0.1 мл разведенной культуры на поверхность среды в чашках Петри и затем равномерно распределяли шпателем по чашке, стараясь покрыть всю ее поверхность. Чашку закрывали крышкой, на крышке делали надпись, характеризующую данное испытание. Далее чашку не помещали в термостат, где выдерживали для инкубирования микроорганизмов при температуре 26-28оС в течение 3 и 7 суток. Для каждого разведения микроорганизмов проводили три параллельных посева и инкубирования. После окончания инкубирования чашки вынимали из термостата и помещали вверх дном для счета колоний визуально. По числу колоний, выросших на среде трех чашек для одного разведения, рассчитывали среднее арифметическое значение, которое принимали как основную исходную величину для дальнейшего расчета. Число колоний, выросших на среде каждой из трех чашек не должно отличаться от среднего арифметического значения более чем на 10% относительных, рассчитанных и округленных до целого числа.
Чистые культуры получали рассевом разведений накопительных культур. В качестве исходной суспензии использовали 1 мл накопительной культуры в 100 мл стерильной среды. Далее наносили 0.1 мл разведенной культуры на поверхность среды в чашках Петри и затем равномерно распределяли шпателем по чашке, стараясь покрыть всю ее поверхность. Далее чашку не переворачивая помещали в термостат, где выдерживали для инкубирования микроорганизмов при температуре 26-28оС в течение 3 и 7 суток.
Для каждого разведения микроорганизмов проводили три параллельных посева и инкубирования. После окончания инкубирования чашки вынимали из термостата и помещали вверх дном для счета колоний визуально. По числу колоний, выросших на среде трех чашек для одного разведения, рассчитывали среднее арифметическое значение, которое принимали как основную исходную величину для дальнейшего расчета. Число колоний, выросших на среде каждой из трех чашек не должно отличаться от среднего арифметического значения более чем на 10% относительных, рассчитанных и округленных до целого числа.
Микроскопированием определили морфологические особенности микроорганизмов. При изучении морфологии бактерий учитывали: форму клеток (кокк, палочка и т.д.); характер взаимного расположения; размеры клеток; наличие спор; капсул; подвижность; окраска по Граму [84].
Изучение культуральных свойств проводили по характеру роста на плотных и жидких питательных средах. Описание поверхностных колоний, выросших на плотных питательных средах проводили по следующим признакам:
а) форма колонии (округлая, неправильная, ризоидной и т.д.);
б) поверхность колоний (гладкая, бугристая, морщинистая, блестящая; в) профиль (плоский, выпуклый, кратерообразный и т.д.);
г) цвет колонии;
д) размер (диаметр) колонии измеряется с помощью линейки;
е) край колонии (ровный, волнистый, зубчатый, бахромчатый);
ж) структура (мелко-, крупнозернистая, однородная);
з) консистенция (мягкая, плотная, слизистая, тягучая).
При росте культуры на скошенном агаре:
а) рост (пышный, скудный, умеренный);
б) характер налета колонии (сплошной, диффузный);
в) характер края штриха (ровный, волнистый);
г) поверхность штриха (блестящая, матовая, мучнистая);
д) профиль штриха (плоский, выпуклый);
е) консистенция культуры (сочная, сухая, слизистая);
ж) оптические признаки штриха (прозрачная, полупрозрачная, непрозрачная);
з) цвет налета и изменение окраски среды.
При росте культуры на жидких средах:
а) интенсивность роста;
б) характер (муть, осадок, пленка);
в) мутность среды и степень мутности;
г) характер осадка;
д) характер пленки (гладкая, сухая, морщинистая, плотная);
е) появление запаха и изменение цвета среды.
Изучение биохимических свойств проводили с учетом способности ферментации углеводов на цветных средах Гисса, восстановления нитратов, характера роста на желатине.
Для определения ферментации углеводов готовили среды Гисса: к 100 мл дистиллированной воды прибавляли 1 г пептона и 0,5 г NаС1. Растворяли при нагревании воды в течение нескольких минут, фильтровали через бумажный фильтр до совершенно прозрачного раствора, устанавливали рН 7,0-7,4, потом прибавляли 0,5-1,0 г одного из углеводов и индикатор Андреде в количестве 1 мл на 100 мл среды. Готовую среду разливали по 3 мл в пробирки, стерилизовали вместе с поплавками, расположенными запаянным концом вверх текучим паром три дня подряд по 30 минут, при 112 °С. Среды Гисса имеют соломенно-зеленый цвет (рН 7,0-7,2). В результате роста бактерий, сопровождающегося расщеплением углеводов с образованием кислых продуктов распада, цвет среды меняется. Образование газа в среде определяли по наличию пузырьков в поплавке.
Для выяснения способности восстанавливать нитраты делали посев в МПБ с 0,1% нитратом калия. Через несколько дней определяли наличие нитратов реактивом Гисса и наличие аммиака – реактивом Несслера. При малом содержании аммиака окраска желтая, при значительном оранжево-желтая, при большом – красно-бурая. Для определения нитратов реактив Гисса употребляли в сухом виде. На каплю, культуры скальпелем насыпали немного реактива. Окраска менялась до густо-малинового цвета сразу при большом количестве нитратов и постепенно – при малых количествах.
Определение сероводорода проводили на плотной среде следующего состава: к 1 л стерильного 1,7—2 %-ного МПА добавляли сернокислое железо (FeSO4) — 0,2, гипосульфит (тиосульфат Na2S2O3) натрия — 0,3, глюкозу — 1 г, индикатор фенолрот водный 0,3 % — 12 мл. Среду разливали в стерильные пробирки по 5-6 мл, стерилизовали текучим паром 20 мин. Перед употреблением среду расплавляли и охлаждали в наклонном положении пробирки. Посев делали на скошенную поверхность агар-агара, а затем уколом в нижнюю часть столбика среды. При наличии сероводорода под действием растущей бактериальной культуры столбик среды краснеет, нижняя часть окрашивается в черный цвет.
Протеолитическую способность – на желатиновой среде. Делали посев уколом в столбик МПЖ, после чего пробирки инкубировали в термостате, при температуре 28-30 °С. На другой день помещали пробирки на 60 минут в холодильник и отмечали наличие разжижения и его характер:1) равномерное, начиная с поверхности (строгие аэробы); 2) кратеровидное, воронковидное, реповидное (менее строгие аэробы); 3) мешковидное (факультативное, анаэробы); 4) пузыревидный рост в глубине среды (строгие анаэробы). Использование органических соединений азота. Индол устанавливали с помощью реактива Эрлиха: в пробирку с 5 мл 2-3-суточной бульонной культуры бактерий добавляли 2 мл эфира, содержимое встряхивали и дали отстояться. Затем под слой эфира пастеровской пипеткой подслаивали 0,5-1 мл реактива Эрлиха. При наличии индола в течение 3-5 мин на границе между эфиром и бульонной культурой образовывался интенсивно-розовое кольцо [85].
Молекулярно-биохимическую идентификацию штаммов микроорганизмов проводили с использованием полимеразной цепной реакции по видоспецифическому гену штамм. Выделение ДНК и ПЦР анализ проводили согласно [86]. Построение древа родства Ribosomal Database Project II [87] .
Выращивание отобранных чистых культур аборигенных микроорганизмов проводили в режиме накопительной биомассы с применением проточной системы культивирования, работающей в режиме хемостата [88], также методом твердофазного культивирования [89], [90].
2.3 Использование специальных штаммов-деструктов.
Выращивание штамма проводили на сточной воде убойного цеха свинооткормочного комплекса в ферментерах мешалочного типа емкостью 10 л с подачей воздуха с подачей воздуха 0,2 — 0,4 л/л в мин., при перемешивании 300 об/мин. в течение 48 — 72 часов при температуре 300 С.
2.4 Определение физиологически активных соединений, образуемых наиболее активными штаммами в лабораторных условиях
Амилолитическую, липолитическую и протеолитическую активности определяли согласно [91], [92]. Активность протеазы определяли по модифицированному методу Ансона. За единицу протеолитической активности (ПЕ) принимали количество фермента, содержащегося в культуральной жидкости, которое за одну минуту катализирует переход в неосаждаемое ТХУ состояние такого количества казеина, которое содержит один микромоль тирозина.
Антибиотическую активность определяли методом диффузии в агар-агар.
Метод основан на способности антибиотического вещества диффундировать в толщу агар-агара и ,тем самым, задерживать рост находящегося в агар-агаре тест организма или убивать его
В качестве тест – микроорганизмов использовали бактериальные и дрожжевые культуры: Escherichia coli К12 (АТСС 25922), Escherichia coli 354, Staphylococcus aureus P 209 (ATCC 6538- 452, Pseudomonas aeruginosa (АТСС 27853), Pseudomonas fluorescens ВКПМ №В-350, Pseudomonas putida КМ МГУ №95, Candida albicans (получены с кафедры микробиологии и заразных болезней ФГБОУ ВО «Оренбургский государственный аграрный университет») и фитопатогенные грибы: Alternaria tenius, Monilia fructigena, Botrytis cinerea, Rhizoctonia solani, Fusarium roseus, Fusarium oxysporum, Helmintosporum sativum, Microsporum canis, Mucor sp., Candida albicans, Puccinia graminis, Cladobotrium cladobotrium из музея чистых культур кафедры микробиологии Биологического факультета МГУ им. М.В.Ломоносова.
2.5 Определение веса сухой биомассы.
Этот метод широко применяется для оценки роста микроорганизмов в жидких питательных средах. Мицелий с колбы, содержащей 100 мл культуральной жидкости, перемешивали и фильтровали в воронке через бумажный фильтр, предварительно доведенный до постоянного веса. Осадок троекратно промывали дистиллированной водой. Фильтр с мицелием доводили до постоянного веса в сушильном шкафу при t=1050C и охлаждали 2 часа при комнатной температуре. Вес сухой биомассы ( г/100 мл ): M = (A-B) 100/V, где A – вес фильтра с мицелием, г. B — вес фильтра без с мицелия, г. V – объем культуральной жидкости при фильтровании, мл [93].
2.6 Изучение биосорбирующей способности микроскопического гриба проводили при использовании модифицированной среды Чапека-Докса следующего состава (в %): сахароза – 4. NH4 H2PO4 0.3. MgSO4 * 7H2О.- 0,05. FeSO4* 7H2О — 0,001 . Гриб выращивали в условиях аэрации в колбах Эрленмейера объемом 750 мл на качалках (200-220 об/мин.) в течение 48 — 72 часов при температуре 24-260 С. После завершения процесса культивирования биомассу мицелия отделяли от культуральной жидкости.
2.7 Влияние предпосевной обработки семян на всхожесть семян пшеницы проводили в лабораторных условиях. Для этого семена предварительно обрабатывали в растворе культуральной жидкости, помещали в чашки Петри по 50 штук в каждую и равномерно распределяли на фильтровальной бумаге и заливали в каждую чашку Петри по 10 мл воды. Чашки Петри закрывали крышками и ставили в термостат на 24 часа при температуре 25°С. Через сутки подсчитывали проросшие семена и вновь раскладывали в чашках Петри на фильтровальной бумаге, заливали водой и оставляли в растительной камере, создавая в ней увлажненную атмосферу, при комнатной температуре.
2.8 Метод отбора проб ила. Для анализа пробу ила отбирали в аэротенке. Вначале приготовленную посуду для отбора проб ополаскивали отобранной водой. Для анализа пробу отбирали повторно, используя ковш объемом 500см3. Вначале погружали в воду на 3 мин, чтобы его температура сравнялась с температурой воды, затем ковш погружали на глубину 0,5 м и сразу же извлекали. Отбор повторяли до тех пор, пока не набралось 2,8-2,9 дм3 иловой смеси. Иловую смесь перелили в стеклянную бутыль объемом 3дм3. Бутыль доставляли в лабораторию, где ее содержимое тщательно перемешивали и разливали следующим образом: а) 1 дм3 – в литровый мерный цилиндр, калиброванный от самого дна для определения дозы ила по объему; б) 1,5 дм3 – в склянку для отстаивания и определения прозрачности надиловой воды; в) 100 см3 – в цилиндр объемом 100см3 для определения дозы ила по весу. При взятии проб измеряли температуру воды. Для этого использовали, термометры с ценой деления 0,1ºС. Для определения температуры на месте взятия пробы 1дм3 воды наливали в склянку, нижнюю часть термометра погружали в воду и через 5 мин отсчитывали показания, держа, его вместе со склянкой на уровне глаз. При проведении помещения, в котором он проводился [94]
2.9 Определение концентрации активного анализа температура пробы соответствовала температуре ила по массе. Определение концентрации активного ила по массе заключается в фильтровании определенного объема иловой смеси с последующим высушиванием и взвешиванием осадка [95]. В сушильный шкаф ставили открытые пронумерованные бюксы с помещенными в них обеззоленными бумажными фильтрами. После того, как температура устанавливалась на 105ºС, отмечали время и сушили один час, затем повышали температуру до 120ºС и сушили еще 30 минут. В шкафу бюксы закрывали, охлаждали эксикаторе до комнатной температуры и взвешивали. Отобранную иловую смесь тщательно перемешивали и наливали в 100см3 цилиндр. Фильтровали этот объем через (предварительно высушенный и взвешенный) бумажный фильтр с помощью водоструйного насоса через воронку Бюхнера. Иловую смесь равномерно распределяли по поверхности фильтра. После того, как иловая смесь вся прошла через фильтр, цилиндр тщательно споласкивали не большим количеством дистиллированной воды, которая также отфильтровывали. Фильтр, сохранивший форму воронки, накладывали в соответствующий бюкс и помещали в холодный сушильный шкаф, крышку бюкса помещали рядом. После того, как весь анализируемый материал размещен в шкафу, дверца его закрыли, шкаф включили при 120ºС пробы выдерживали до постоянного веса. Первое взвешивание бюксов производили через 30 мин высушивания. Перед взвешиванием шкаф выключали, каждый фильтр осторожно, чтобы не потерять осадок, складывали и помещали в соответствующий бюкс. После этого с помощью специальных щипцов бюксы закрывали крышками и переносили из шкафа в эксикатор. После того, как бюксы в эксикаторе охлаждались до комнатной температуры, начинали взвешивание ила. Взвешивали, вычитая, начальную массу бюкса с фильтром. Доза ила по d весу рассчитывали по формуле:
d=(a-b)∙1000/V, г/дм3
где 1000 – коэффициент пересчета см3 в дм3;
a и b – вес бюкса с осадком и без осадка соответственно, г;
V – объем отфильтрованной пробы, см3.
2.10 Определение илового индекса и видового состава микроорганизмов активного ила [96]
Определение илового индекса характеризует седиментационные свойства активного ила, но уже с учетом его сухой массы. Иловый индекс это объем 1 грамма сухого ила занимаемый им за 30 минут отстаивания в 1 дм3 цилиндре. Отобранная иловая смесь находилась в лабораторном помещении пока ее температура не сравнялась с комнатной. После чего тщательно перемешивали и наливали в 1 дм3 цилиндр, который ставили на горизонтальную поверхность стола. Включали секундомер и через каждые 3 минуты отмечали объем в см3, занимаемый оседающей массой активного ила. Через 30 мин отстаивания записывали окончательное значение дозы ила по объему, выраженное в см3. Результат округляли до целых см3. Наблюдения проводили в прохладном помещении, вдали от источников тепла, так как при температуре выше 25ºС во время наблюдений может произойти всплывание осевшего активного ила вследствие денитрификации. Иловый индекс I рассчитывали, после того как получены значения дозы ила по сухому весу и объему. Результат, получили, делением численных значений дозы ила по объему V (см3/дм3) на дозу ила по сухому веществу d (г/дм3):
I=V/d, см3/г
Видовой состав микроорганизмов активного ила определяли на основании морфологических, культуральных и биохимических свойств чистых культур. Для идентификации использовали определитель Берги [97]
2.11 Определение БПК
БПК – это биохимическая потребность в кислороде, или количество кислорода, использованного при биохимических процессах окисления органических веществ (не включая процессы нитрификации) за определенный промежуток времени (5 и 20 суток), в мг кислорода на 1мг вещества. БПК является мерой содержания только тех органических соединений, которое могут служить активным субстратом для микроорганизмов. Присутствие в пробе веществ, не подвергающихся биохимическому распаду, не отражается на определяемой величине БПК. Суть метода в том , что в исследуемой воде вычисляют количество растворенного кислорода до и после выдерживания пробы в термостате при 20ºС в течение определенного времени (2,3,5,20 суток). Перед определением БПК готовили разбавляющую воду. Для этого исследуемую воду разбавляли в 10-100 раз водопроводной водой, приливали 2-8 мл реактивов для разбавляющей воды и отстаивали в открытой стеклянке на 2-3 дня. [98].
Содержание растворенного кислорода определяли йодометрическим методом. Подготовили 4 калиброванные склянки на 150-200 мл. В первую и вторую склянку наливали предварительно разбавленную исследуемую воду, в третью и четвертую – разбавленную воду. В первой и третьей склянке сразу же определили содержание растворенного кислорода, вторую и четвертую склянку поставили в термостат при 20ºС через 5 суток определили в этих пробах содержание растворенного кислорода.
- БПК5 разбавляющей воды (х1, мг/л)
Х1=[(а1/(V1-2) – a2/(V2-2)]· K 0.08·1000,
где а1 – объем 0,01н раствора тиосульфата натрия титрование пробы до выдерживания в термостате, мл;
a2 – объем 0,01н раствора тиосульфата натрия титрование пробы через 5 суток, мл;
V1 – объем склянки, в который проводилось определение кислорода до выдерживания, мл;
V2 – объем склянки, в который выдерживалась проба, мл;
K – поправочный коэффициент для приведения концентрации тиосульфата натрия точно 0,01н;
0,08 – сотая доля грамм-эквивалента кислорода;
2 – объем реактивов, прибавляемых в склянку при определении содержания кислорода, мл
- БПК5 исследуемой воды (х2, мг/л)
Х2= [(а1/(V1-2) – a2/(V2-2) · K 0.08·1000 – Х1]·1000/b
где b – объем исследуемой сточной воды (в мл), взятой для анализа и разбавленной до 1л [99].
2.12 Определение ХПК. ХПК – химическая потребность в кислороде, то есть количество кислорода, эквивалентное количеству расходуемого окислителя, необходимого для окисления всех восстановителей, содержащихся в воде. ХПК также выражают в мг кислорода на 1 мг вещества [100]. Для определения ХПК использовали ускоренный метод определения. К 1мл или 5мл сточной воды добавляли 2,5 мл 0,25н раствора бихромата калия и при перемешивании приливали концентрированную серную кислоту (7,5 или 15 мл). Смесь выдерживали 3 минуты. Окисление органических веществ происходит при температуре раствора 100˚С, достигаемой за счет экзотермической реакции. Далее содержимое колбы охлаждали до комнатной температуры. Смесь в колбе доводили дистиллированной водой до 150 мл и содержимое колбы титровали раствором соли Мора в присутствии 2 капель индикатора N-фенилантраниловой кислоты. Цвет раствора в эквивалентной точке резко менялся из вишнево-фиолетового в буровато-зеленый. Аналогичным образом проводили «холостое» определение с 10 мл дистиллированной воды. Расчет проводили по формуле:
ХПК= (V1-V2)·N·K·8·1000/V, мл/л
где V1 — объем раствора соли Мора, израсходованного в «холостом» опыте, мл;
V2 – объем раствора соли Мора, израсходованного на титрование исследуемой пробы, мл;
N – Нормальность применяемого раствора соли Мора;
K – поправочный коэффициент раствора соли Мора;
8 – эквивалент кислорода;
V – объем исследуемой воды, взятой для анализа, мл [101].
2.13 Метод анализа биосорбирующей способности микофильных грибов к раствору Na3[Co(NO2)6]
Готовят стандартные образцы растворов Na3[Co(NO2)6] с концентрацией 0,1; 0,2; 0,3;…; 1,0%. Измеряют оптическую плотность данных концентраций на КФК — 2 при длине волны λ = 400 нм. По полученным результатам строят градуировочный график. Далее готовят пять 0,1% растворов Na3[Co(NO2)6] по 100 мл в мерных колбах. В них вводят по 1 г мертвой биомассы гриба. Оставляют на качалке на 3 ч. Затем данные растворы отфильтровывают и в течение 1 ч. центрифугируют до полного осаждения гриба. Полученные растворы измеряют на КФК – 2 при длине волны λ = 400 нм, в результате чего получают значения оптической плотности. По градуировочному графику определяют среднюю остаточную концентрацию ионов [Co(NO2)6]3+ в растворе [102].
2.14 Метод анализа биосорбирующей способности микофильных грибов к раствору FeCl3·6H2O [103].
Готовят 3 образца по 300 мл раствора FeCl3·6H2O с концентрацией 0,1%. В них ввели по 1 г мертвой биомассы гриба и поставили на качалку. Через 30, 60, 90, 180, 210, 240 мин., через 6 и 24 часа после смешения биомассы с 0,1% раствором FeCl3·6H2O часть раствора отделяли от раствора фильтрованием. Отбирали пипеткой 25 мл фильтрата и оттитровывали 0,1 н соляной кислотой в присутствии 2 капель метилового красного до перехода желтой окраски в красную. Определяли затраченный объем титранта.
Концентрацию раствора железа после его контакта с грибом определяли по среднему значению объема титранта по формуле:
С[Fe]=CHCl VHCl/V[Fe] [104].
2.15 Микробиологические и гельминтологические исследования проводились известными способами [105].
2.16 Выделение ДНК и ПЦР анализ проводили согласно [106], [107]. Условия электрофореза ПЦР исследуемых образцов: 1,0% агарозный гель, электрофорез при напряженности электрического поля 5 В/см. Секвенирование генов, кодирующих 16S рРНК проводится на автоматическом секвенаторе АЕЗООО. Построение древа родства Ribosomal Database ProjectII [108].. Для обработки СВЧ-излучением суспензий чистых культур, сточной воды и илового осадка использовали микроволновую печь «Электроника 3 С» при частоте 2450 МГц, длине волны 12.5 см, при номинальных мощности 400 и 800 Вт и экспозициях облучения: от 1 до 10 минут)
2.17 Определение токсичности сточных вод боен
Объектами исследований являлись сорта люцерны «Ярославна», кукурузы «Катерина», ячменя «Оренбургский совместный». Определение токсинов в культуральной жидкости проводили по скорости прорастания семян, согласно методу, предложенному Н.А. Красильниковым (1966) [109].
Семена пшеницы предварительно промывали водопроводной и дистиллированной водой, затем раскладывали в подготовленные чашки Петри по 50 штук и равномерно их распределяли на фильтровальной бумаге. Чашки Петри расставили по числу вариантов в четыре ряда. В каждую чашку налили по 10 мл воды (водопроводной, исходной, недоочищенной, очищенной). В контрольные чашки налили по 10 мл воды. Чашки Петри закрыли крышками и поставили в термостат при температуре 25°С на сутки. Через сутки семена промывали водопроводной и дистиллированной водой, вновь раскладывали в чашках Петри на фильтровальной бумаге, заливали водой и оставляли при комнатной температуре. В процессе динамики роста растений определяли энергию прорастания семян, длину главного корня, длину проростков[110].
III Результаты и обсуждение
3.1 Исследование состава сточных вод и эффективности биологической очистки свинооткормочного предприятия
При забое крупного рогатого скота, свиней, птиц и других животных образуются жидкие отходы, так называемые стоки скотобоен. Для того, чтобы такие стоки могли быть использованы для орошения полей, необходим принять определенные меры для их предварительного обезвреживания. Без предварительного обезвреживания и переработки использование таких стоков для орошения полей не представляется возможным, поскольку они несут определенную опасность. Как известно, биологическая очистка сточных вод активным илом аэротенков, так хорошо зарекомендовавшая себя при очистке хозяйственно-бытовых сточных вод, оказалась не эффективной для очистки высококонцентрированных сточных вод [111].
С предприятия свинооткормочного комплекса, на биологическую очистку поступают хозяйственно-бытовые сточные воды, с убойного цеха и производственные сточные воды. Система сбора ливневых стоков отсутствовала. Соотношение количеств отдельных видов сточныхвод менялось в зависимости от времени года. Сточные воды цеха убоя и производственные сточные воды являлись наиболее загрязненными. Они образовывались в результате различных технологических операций, а также при мойке емкостей и уборке производственных помещений. Анализ поступающих на очистку сточных вод цеха убоя скота показал высокие показатели ХПК, БПК, взвешенных веществ, жира, азота, фосфора, хлоридов, присутствие тяжелых металлов и патогенных микроорганизмов (таблица 3).
Действующие очистные сооружения запроектированы Ленаэропроект ТП 902-03-13 и пущены в эксплуатацию в 1991 году. Производительность очистных сооружений – 1400 м3/сутки.
Таблица 3
Состав исходной сточной воды цеха убоя птицы
| № п/п | Определяемый показатель | ед/измерения | Исходная до очистки |
| 1. | БПК5
БПК полн. |
Мг О2 / дм3
мг О2 / дм3 |
2153±140
2769±200 |
| 2. | ХПК | мг / дм3 | 6784±5468 |
| 3. | Сухой осадок | мг / дм3 | 7300±365 |
| 4. | Взвешенные вещества | мг / дм3 | 339±24 |
| 5. | Железо (общее) | мг / дм3 | 141,3±7,1 |
| 6. | Аммония ионы | мг / дм3 | 160,0±4,8 |
| 7. | Нитрит-ионы | мг / дм3 | 36,7±3,7 |
| 8. | Нитрат-ионы | мг / дм3 | 85,0±8,5 |
| 9. | Сульфат-ионы | мг / дм3 | 176±18,0 |
| 10. | Фосфат-ионы | мг / дм3 | 179,7±18,0 |
| 11. | Хлорид-ионы | мг / дм3 | 281±128 |
| 12. | Жиры | мг / дм3 | 574±31 |
| 13. | АПАВ | мг / дм3 | 0,32±0,03 |
| 14. | КПАВ | мг / дм3 | 3,47±0,80 |
| 15. | рН | мг / дм3 | 7,6±0,2 |
| 16. | Колиформы | кл/г | 109 |
| 17. | Энтеробактерии | кл/г | 100 |
| 18. | Сальмонеллы | кл/г | 113 |
| 19. | Стафилококки | кл/г | 103 |
| 20. | Яйца гельминтов | экз./л | 320 |
| 21. | Личинки и куколки синантропных мух | экз/кг | 80 |
| 22. | Цисты кишечных патогенных простейших | 120 | |
| 23. | Кадмий | мг/кг | 0,05±0,01 |
| Мышьяк | мг/кг | 1,06±0,19 | |
| Ртуть | мг/кг | менее 0,7 | |
| Свинец | мг/кг | 2,83±0,28 | |
| Стронций | бк/кг | менее 0,1 | |
| Цезий | бк/кг | менее 3 |
Состав очистных сооружений:
- Приемная камера;
- Решетки РМУ-1;
- Песколовки;
- Первичный отстойник из трех секций;
- Аэротенк из трех секций;
- Вторичный отстойник из трех секций;
- Регенератор из трех секций;
- Стабилизатор-минерализатор из трех секций;
- Резервуар биологически очищенной воды;
- Резервуар фильтрованной воды и для промывки фильтров;
- Песчаные фильтры;
- Контактный резервуар из двух секций;
- Пруды-аккумуляторы – 3 шт.;
- Хлораторная;
- Песковые площадки;
- Иловые площадки.
Сточная вода, поступает в приемную камеру. Затем проходит решетки (механизированные), где происходит очистка сточной воды от крупного мусора. Долее по лоткам подводится в песколовки (горизонтальные с круговым движением воды) и затем проходит водоизмерительный лоток, после которого распределяется по секциям блока емкостей. В блоке емкостей с первичным отстаиванием сточная вода проходит последовательно: первичные отстойники, аэротенки, вторичные отстойники и контактные резервуары. В аэротенке в процессе биохимической очистки стоков происходит окисление и распад сложных органических соединений и не окисленных неорганических соединений за счет кислорода воздуха и жизнедеятельности микроорганизмов (активного ила).
Процесс биохимической очистки сточных вод в аэротенке происходит в три стадии:
- в первой, начальной стадии, сразу же после смешения поступающей сточной воды с активным илом, происходит процесс адсорбции или изъятия органических загрязнителей активным илом и окисление легкоокисляющихся веществ. Первая стадия продолжается 0,5-2 часа.
- во второй стадии процесса происходит окисление окисляющихся веществ и регенерация активного ила, то есть восстановление его активных свойств, значительно сниженных к концу первой стадии. Скорость потребления кислорода во второй стадии значительно ниже, чем в первой;
- в третьей стадии происходит нитрификация аммонийных солей, и скорость потребления кислорода вновь возрастает.
Вторичные отстойники составляют с аэротенками технологически связанные сооружения и служат для отделения активного ила от очищенной жидкости. Иловая смесь движется от центра отстойника к периферии и за счет гидравлических сил происходит осаждение ила на дно отстойника. После контактных резервуаров очищенная вода отводится на сооружения доочистки – песчаные фильтры. Процесс фильтрования происходит через крупнозернистую песчаную загрузку при движении потока жидкости сверху вниз. После установки доочистки, на выходе, установлены два водомера ВМХ 100. Отфильтрованная вода отводится в пруд-аккумулятор. Отбросы с решеток собираются в контейнер, и вывозится мусоровозом на специально отведенные площадки, согласованные с местными санитарными органами. Складирование осадка с песколовок производится на двух песковых площадках, по проекту возможно накопление шлама до 24 т/год, общий объем – 16 м3. На данный момент площадки заполнены примерно на 1/6 часть. Активный ил из вторичных отстойников с помощью эрлифтов отводится в аэротенк, а избыточный ил – в аэробный стабилизатор, где совместно с осадком из первичных отстойников сбраживается в аэробных условиях. В процессе сбраживания должна достигаться такая степень распада беззольного вещества 25-30%, при которой обеспечивается наибольшая водоочистка и возможность интенсивного компостирования осадка. Для отведения иловой воды в аэробном стабилизаторе предусмотрена отстойная зона, откуда она перепускается в аэротенк. Сбраживаемый осадок из стабилизаторов перекачивается насосами, установленными в производственно вспомогательном здании на иловую площадку. Имеются 4 иловые карты (две рабочие), заполнены на 30%. Общий объем карт – 142,3 м3, вместимость – 38 т. Дренажные воды песковых и иловых площадок возвращаются на очистку в голову очистных сооружений. Обеззараживание очищенных стоков не производится. Построенная хлораторная не работает. На территории очистных сооружений эксплуатируются 3 аэротенка рабочим объемом 216 м3, мощность очистных сооружений 1400м3/суток. Аэрация в аппаратах осуществляется подачей сжатого технического воздуха через аэратор, расположенные на дне каждой секции. Подача воздуха регулируется в каждой секции индивидуальной задвижкой, что позволяет при необходимости создавать микроаэробные условия. На аэраторах предусмотрены 3 порции подачи кислорода от 0,5 – 2 мг/дм3. Время пребывания сточных вод в установке 24 часа. За работой установок осуществляется химико-аналитический гидробиологический контроль, проводимой в лаборатории. На очистных сооружениях предприятии производится определение дозы активного ила, илового индекса, взвешенных веществ, ХПК, реже – БПК и морфологии индикаторных организмов – простейших.
Мы сочли целесообразным провести гидрохимический и микробиологический контроль состояния биоценоза активного ила изучаемого нами предприятия, без которого невозможно нормальное функционирование очистных сооружений.
Результаты исследований физических свойств ила показали, что хлопья ила светло-коричневые и темно-коричневые, внешний вид надиловой воды – это прозрачная неокрашенная жидкость. Иловый индекс в аэротенках превышает 300 мг/л, что свидетельствует о нарушениях нормальной работы аэротенка.
В изучаемых нами биоценозах аэротенков — смесителей периодического действия основную массу организмов активного ила составляли микроскопические грибы родов Aspergillus, Mucor, Rhizobium, Penicillium, а также мицелиальный гриб Mycelia sterile.
Из литературных данных известно, что микроскопические грибы способны эффективно усваивать специфические загрязнения сточных вод. Однако массовое развитие грибов ухудшает аэрацию и осаждению ила во вторичном отстойнике. По этой причине массовое развитие грибов в очистных сооружениях канализации нежелательно. Микрофлора активного ила при хорошем качестве очистки должна отличаться также богатым видовым разнообразием (от 25 до 45 видами простейших). И хотя простейшие не участвуют в процессе деструкции токсичных соединений, их роль важна как звено трофической цепи в поглощении клеток бактерий. Простейшие, населяющие активный ил, являются чувствительными биологическими индикаторами, реагирующими на изменение условий внешней среды.
В активном иле изучаемых нами биологических очистных сооружений преобладали представители жгутиковых и мелких инфузорий: Paramecium caudatum, Colpoda cuculus, Podophrya fixa, Chylodonella cucullulus. Это может быть вызвано недостатком кислорода или в связи с протеканием процесса гниения. Из полученных нами экспериментальных данных можно сделать следующий вывод: биоценоз изучаемого нами активного ила по составу микроорганизмов не соответствует качеству очищаемых сточных вод вследствие их отрицательного влияния на микроорганизмы. Состав очищенных сточных вод не соответствовал требованиям, предъявляемым для использования их на земледельческих полях орошения.
3.2 Подбор наиболее активных штаммов микроорганизмов и включение их в биоценоз активного ила
Для биологических очистных сооружений первостепенное значение имеет поиск активных культур с повышенной деструктивной активностью, их всестороннее изучение и создание новой системы их использования [112]. Как правило, это консорциумы микроорганизмов, выделенные методом накопительных культур из мест, где имел место длительный контакт микроорганизмов с соответствующими ксенобиотиками. Такие микроорганизмы обладают высокой утилизирующей способностью к тому или иному загрязнителю и проявляют способность обмену генетическим материалом, изменению типа обмена веществ бактериальных клеток и индукции адаптивных ферментов, закреплению ими приобретенных свойств. Улучшению характеристик полученных активных культур способствует их иммобилизация на различных бионосителях [113]. [114],
Нами было выделено около 50 чистых культур наиболее активных бактерий-деструкторов жира, целлюлозы, белка из загрязненной стоками бойни в течение длительного периода почвы с территории свинооткормочного комплекса, проведена их идентификация по совокупности морфологических, культуральных и биохимических свойств и молекулярно-генетическим методом.
Первоначально по совокупности морфологических. культуральных и биохимических признаков бактерии были отнесены к представителям рода Enterococcus, Lactobacillus, Pseudomonas. Методом полимеразной цепной реакции с помощью анализа генов, кодирующих 16S РНК по 8f — aga gtt tga tec tgg etc ag; 926r — ccg tea att cct ttr agt tt; 1492r — ggt tac cct tgt tac gac tt и секвенировании вариабельных участков генов, кодирующих 16S рРНК, для бактерии Enterococcus получена следующая собранная нуклеотидная последовательность: CGCTTCGGTTTACGCCCAAWACWTTASGACTACGCTCGCCACCTACRTATTACCGCGGCTGMTGGCACGTASYTMGCCSTGGCTTTCTGGTTAGATACCGTCAAGGGATGAACATTTTACTCTCATCCTTGTTCTTCTCTAACAACAGAGTTTTACGATCCGAAAACCTTCTTCACTCACGCGGCGTTGCTCGGTCAGACTTTCGTCCATTGCCGAAGATTCCCTACTGCTGCCTCCCGTAGGAGTCTGGGCCGTGTCTCAGTCCCAGTGTGGCCGATCACCCTCTCAGGTCGGCTATGCATCGTTGCCTTGGTGAGCCGTTACCTCACCAACTAGCTATGCACCGCGGGTCCATCCTCAGTGACGCAAAAGCGCCTTTCAAYTTTCTTCCATGCGGAAAATAGTGTTATACGGTATTAGCACCTGTTTCCAAGTGTTATCCCCTTCTGATGGGCAGGTTACCCACGTGTTACTCACCCGTTCGCCACTCTTTTTCTTTCGRTGGAGCAAGCTCCGGTRAAAGAAAAAGCGTTCGACTTGCATGTATTAGGCACGCCGCCAGCGTTCGTCCTGAGCCAGGATCAAAC. Анализ филогенетического родства, построенный с использованием типовых штаммов близкородственных бактерий показал, что наиболее близким к исследуемому штамму является вид Enterococcus casseliflavus (98%).
В активном иле были обнаружены также грамположительные, палочковидные анаэробные неспорообразующие бактерии, первоначально по совокупности морфологических, культуральных и биохимических свойств отнесенные к роду Lactobacillus. Секвенирование вариабельных участков генов, кодирующих 16S рРНК показало следующую собранную нуклеотидную последовательность для исследуемого штамма:
CTGTTCGCTACCCATGCTTTCGAGCCTCAGCGTCAGTTACAGACCAGACAGCCGCCTTCGCCACTGGTGTTCTTCCACTCCCGGGGAGT
Первичный скрининг по базе данных GenBank и RDP-II показал, что исследуемый штамм принадлежит к следующим систематическим группам Bacteria; Firmicutes; Bacilli; Lactobacillales; Lactobacillaceae; Lactobacillus, причем гомология с некоторыми видами рода Lactobacillm составляет 99%. Последовательности были выровнены с соответствующими последовательностями ближайших видов бактерий, доступными из базы данных GenBank. Результаты обработки секвенсов при помощи компьютерной программы находящейся на сайте RDB II (Ribosomal Database Project II), предназначенной для определения родства микроорганизмов и построения филогенетических деревьев, представляются в графическом виде.
S000003746 0.9880.8971404 Lactobacillus rhamnosus (T); JCM 1136; D16552
S000009879 0.990 0.940 1431 Lactobacillus zeae (T); ATCC15820; D86516
S000319968 0.990 0.943 1416 Lactobacillus paracasei (T); NBRC 15906; AB181950
S000386800 0.974 0.825 1470 Lactobacillus manihotivorans (T); OND 32; LMG 1801 ОТ; AF000162
SOOQ395052 0.990 0.940 1432 Lactobacillus casei (Т); АТСС 393; AF469172
S000413948 0.990 0.943 1438 Lactobacillus paracasei (T); JCM 8130; D79212
S000652804 0.981 0.871 1424 Lactobacillus camelliae (Т); МСНЗ-1; АВ257864
S003258472 0,976 0.847 1380 Lactobacillus porcinae (T); type strain: R-42633; DH 7.6; HE616585
S003260459 0.979 0.849 1402 Lactobacillus nasuensis (T); SU 18; AB608051
S003658497 0.974 0.830 1417 Lactobacillus hokkaidonensis (T); LOOC260; AB721549
Анализ филогенетического родства, построенный с использованием типовых штаммов близкородственных бактерий показал, что наиболее близким к исследуемому штамму является вид Lactobacillus paracasei.
И наконец, из активного ила очистных сооружений свинооткормочного комплекса были выделены бактерии, которые на агар-агаре (рН =7,0-7,2) формируют непрозрачные колонии беловато-бежевого цвета, с ровным краем, диаметром 2-3 мм, консистенция мягкая, легко снимаются с агар-агара. С возрастом могут образовывать розоватый пигмент. Клетки грамотрицательные палочки, по форме могут быть прямые или слегка изогнутые, расположенные одиночно или парами, длиной от 0,5 до 1,5 мкм, неспорообразующие. Первоначально бактерия напоминала представителей рода Pseudomonas. При секвенировании вариабельных участков 16S rDNA получена следующая собранная нуклеотидная последовательность для исследуемого штамма:
ACTCCCACGCGGCGTCTTAACGCGTTAGCTTCGATACTGCGTGCCAAATTGCA CCCAACATCCAGTTCGCATCGTTTAGGGCGTGGACTACCAGGGTATCTAATCC TGTTTGCTCCCCACGCTTTCGTGCCTCAGTGTCAGTGTTGGTCCAGGTAGCTGC CTTCGCCATGGATGTTCCTCCCGATCTCTACGCATTTCACTGCTACACCGGGA ATTCCACTACCCTCTACCACACTCTAGTCGCCCAGTATCCACTGCAATTCCCA GGTTGAGCCCAGGGCTTTCACAACAGACTTAAACAACCACCTACGCACGCTTT ACGCCCAGTAATTCCGAGTAACGCTTGCACCCTTCGTATTACCGCGGCTGCTG GCACGAAGTTAGCCGGTGCTTATTCTTTGGGTACCGTCAGAACAACCGAGTAT TAATCGACTGCTTTTCTTTCCCAACAAAAGGGCTTTACAACCCGAAGGCCTTC TTCACCCACGCGGTATGGCTGGATCAGGCTTGCGCCCATTGTCCAATATTCCC CACTGCTGCCTCCCGTAGGAGTCTGGACCGTGTCTCAGTTCCAGTGTGGCTGA TCATCCTCTCAGACCAGCTACGGATCGTCGCCTTGGTGGGCCTTTACCCCGCC AACTAGCTAATCCGACATCGGCTCATCTATCCGCGCAAGGCCCGAAGGTCCCC TGCTTTCACCCGAAGGTCGTATGCGGTATTAGCGTAAGTTTCCCTACGTTATCC CCCACGAAAAGGTAGATTCCGATGTATTCCTCACCCGTCCGCCACTCGCCACC CATAAGAGCAAGCTCTTACTGTGCTGCCGTTCGACTTGCATGTGTTAGGCCTA CCGCCAGCGTTCACTCTGAGCCAG
Первичный скрининг по базе данных GenBank и RDP-II показал, что исследуемый штамм принадлежит к следующим систематическим группам: Bacteria; Proteobacteria; Gammaproteobacteria; Xanthomonadales; Xanthomonadaceae; Stenotrophomonas. Последовательности были выровнены с соответствующими последовательностями ближайших видов бактерий, доступными из базы данных GenBank. Анализ филогенетического родства, построенный с использованием типовых штаммов близкородственных бактерий, показал, что наиболее близким к исследуемому штамму является вид Stenotrophomonas rhizophila.
Выделенные культуры были проверены а устойчивость к алюминию, кобальту и меди в концентрациях выше 10 раз ПДК рыбохозяйственных водоемов. Как видно из рисунков 2 и 3, воздействие тяжелых металлов оказалось губительным для бактерий активного ила. В то же время при сокультивировании с теми же металлами консорциума, состоящего из Enterococcus casseliflavus , Stenotrophomonas rhizophila и Lactobacillus paracasei отмечалась устойчивость ассоциации к металлам. Это очень ценное свойство бактерий-деструкторов, используемых на биологических очистных сооружениях.
Поступление на биологическую очистку жиров в количествах, превышающих 50 мг/л препятствует поступлению кислорода к микроорганизмам за счет образования вокруг хлопков активного ила жировой пленки, эффективность очистки стоков снижается. Для использования сточных вод на земледельческих полях орошения также недопустимо присутствие жиров свыше 50 мг/л. Наиболее целесообразным является использование микроорганизмов, прирост биомассы которых происходит за счет потребления углерода жировых веществ, входящих в состав загрязняющих компонентов стока. Полученный селекционным путем и идентифицированный консорциум бактерий Enterococcus casseliflavus, Stenotrophomonas rhizophila и Lactobacillus paracasei проявлял способность хорошо развиваться на исходной воде убойного цеха в режиме глубинного культивирования в хемостате, совмещая при этом высокую скорость размножения, устойчивость к тяжелым металлам и высоким концентрациям хлоридов. При культивировании консорциума на исходной воде убойного цеха наблюдалось снижение содержания жиров от 500 мг/л до 250 мг/л.
Возможным направлением в очистке жиросодержащих сточных вод является использование микробных ферментных препаратов, способных ускорять биохимическое окисление жира до глицерина и жирных кислот [115]. Недостатком предлагаемых способов является накопление в очищаемой сточной воде дополнительных органических загрязнителей – ферментов, имеющих белковую природу, большие материальные затраты, связанные с их получением и очисткой.
В результате использования штамма микроскопического гриба Hypomyces odoratus 94/77 в глубинных условиях при температуре 24-260С в течение 24 часов на сточной воде убойного цеха птицефабрики состава: БПК5=2163±40 мг О2/дм3; ХПК=11800±20 мг/дм3; взвешенные вещества=1500±375 мг/дм3; общий азот = 281 мг дм3; фосфат-ионы = 79,7±24 мг /дм3; хлорид-ионы =281±128 мг/дм3; жиры и масла = 374±31 мг/дм3; рНисх = 7,0. В этом случае нарастание биомассы слабое, через 48 часов роста составило 2,6 г абсолютно сухого вещества на 1 л культуральной жидкости (г АСВ/л). Результаты по накоплению биомассы и ферментативной активности через 24 часа роста той же культуры при исходных рН= 3,5; 4,0; 4,5; 5,0; 5,5; 6,0; 6,5 в таблице 4.
Таблица 4
Влияние рН на биосинтез биомассы и липолитическую активность гриба Hypomyces odoratus после 16 и 24 часов культивирования гриба
| рН | Выход биомассы , г АСВ/л | Липазная активность | ||
| 1* | 2* | *1 | *2 | |
| 3,5 | 6,3 | 7,5 | 5,9 | 6.7 |
| 4,0 | 10,1 | 11,8 | 10,5 | 11,0 |
| 4,5 | 10,0 | 12,3 | 10,8 | 11,2 |
| 5,0 | 10,9 | 12,8 | 11,0 | 11,8 |
| 5,5 | 11,2 | 12,7 | 11,1 | 11,9 |
| 6,0 | 9,5 | 11,2 | 11,2 | 11,9 |
| 6,5 | 5,2 | 8,6 | 7,3 | 6,8 |
*Примечание: 1 – 16 часов культивирования; 2 – 24 часа культивирования
Из анализа полученных результатов можно сделать вывод, что рНисх.=4,0-6,0 обеспечивают наиболее оптимальный прирост биомассы гриба.
Результаты определения накопления биомассы, липолитических ферментов, а также изменений показателя химического потребления кислорода (ХПК) и содержания жира в сточной воде при культивировании гриба в течение 16, 24 и 48 часов представлены в таблице 5.
Таблица 5
Влияние длительности культивирования и исходного рН на выход биомассы и липазную активность, а также на изменения ХПК*
| Время, в час. | рНисх. | Биомасса,
г АСВ/л |
*Липазная активность | *ХПК мг О2/дм3 | Жиры
мг/ дм3 |
|||||
| 4,0 | 6,0 | 4,0 | 6,0 | 4,0 | 6,0 | 4,0 | 6,0 | 4,0 | 6,0 | |
| 16 | 4,0 | 6,0 | 10,1 | 11,8 | 10,8 | 11,0 | 700 | 600 | 110 | 90 |
| 24 | 3,8 | 5,6 | 10,4 | 11,7 | 11,3 | 11,9 | 520 | 450 | 90 | 70 |
| 36 | 3,8 | 5,4 | 10,8 | 11,3 | 10,5 | 10,1 | 650 | 680 | 90 | 80 |
| 48 | 3,5 | 5,0 | 10,0 | 10,0 | 11,5 | 10,6 | 660 | 700 | 110 | 85 |
Примечание: ХПК – химическое потребление кислорода (мг О2/дм3)
Из анализа полученных результатов можно сделать вывод, что прирост биомассы гриба происходит уже через 16-24 часов роста за счет потребления жиров, о чем можно судить по значениям снижения показателей ХПК и содержания жира.
В то же время в культивировании гриба более, чем 24 часа роста нет необходимости, так как данный период обеспечивает достаточный прирост биомассы и снижение ХПК. Полученный консорциум бактерий и микофильный гриб аналогично при культивировании в хемостате в течение 24 часов обеспечивал снижение показателя ХПК и содержание жира (таблица 6). Предлагаемый нами способ очистки жиросодержащих сточных вод имеет преимущества в том, что в процесс биологической очистки жиросодержащих стоков вносится консорциум микроорганизмов — активных продуцентов липазы, в связи с чем сокращаются сроки культивирования до 16-24 часов; обеспечивается использование более широкого оптимального диапазона рН =4,5 — 7,5; и температуры культивирования (t= 24 — 360С); увеличивается выход биомассы гриба; значительно снижается содержание жира в сточной воде, показатель ХПК.
Таблица 6
Влияние длительности культивирования на показатель ХПКН, выход биомассы и липазную активность консорциума бактерий и микроскопического гриба Hypomyces odoratus при росте на сточной воде убойного цеха
| Варианты | рН опт. | Время,
в час. |
Биомасса
( г АСВ/л) |
Макс. липазная акт-ть, мл 0,5 н NaOH | Снижение ХПК
(мг О2/л) |
Конечное содержание жира мг/л |
| Консорциум бактерий | 7,0 | 24 | 3,38-4,45 | 4,24-4,48 | от 17442,9 до 466,8 | от 500
до 250 |
| Hypomyces odoratus | 4,0-6,0 | 16-24 | 10,4 | 11,7 | 17000 до 450 | от 500
до 50 |
3.3 Подбор методов доочистки для осветления очищенных стоков, обезвреживания и удаления токсичных элементов
Для удаления тяжелых металлов из сточных вод промышленных предприятий предложен целый ряд химических и физико-химических методов: гравитационное осаждение, флотация, фильтрация, адсорбция, обратный осмос, электродиализ, дистилляция и химическое осаждение. Все эти способы не обеспечивают очистку больших объемов воды или дороги, поэтому экономически невыгодны. Химические способы, например, не годятся для очистки вод с очень низкими концентрациями ионов металлов и вызывают вторичное загрязнение остатками вносимых в воду реагентов [116].
В последние годы на стадиях доочистки сточных вод широко используются коагулянты на основе природных минералов, например, таких как продукт компании ООО «РГХО». Для апробации суспензии гидроксида магния под названием МагТрит-С и оценки эффективности его применения для доочистки сточных вод боен мы первоначально подбирали оптимальные концентрации, при которых не происходило угнетение активного ила. Выбранные концентрации МагТрит от 200 до 700 мг/дм3 не оказывают подавляющего воздействия на микрофлору активного ила очистных сооружений, а более высокие (свыше 700 мг/дм3) концентрации вызывают осаждение клеток активного ила и подавление процессов деструкции загрязнителей. Результаты проведенных экспериментов приведены в таблице 7.
Таблица 7
Влияние суспензии гидроксида магния МагТрит-С в концентрации 300-400 мг/дм3 на оседаемость активного ила
| Повтор-
ности |
Объемы смеси, мл | Время отстаивания, мин | |||||
| АИ | МагТрит-С | 0 | 30 | 45 | 60 | 120 | |
| 1 | 100,0 | — | 100,0 | 92,0 | 91,0 | 90,0 | 89,0 |
| 2 | 100,0 | — | 100,0 | 93,0 | 92,0 | 90,0 | 89,0 |
| 3 | 100,0 | — | 100,0 | 93,0 | 91,0 | 90,0 | 90,0 |
| Сред. знач. | 100,0 | — | 100,0 | 92,7 | 91,3 | 90,0 | 89,3 |
| 1 | 96,5 | 3,5 | 100,0 | 40,0 | 40,0 | 39,0 | 38,0 |
| 2 | 96,5 | 3,5 | 100,0 | 40,0 | 40,0 | 40,0 | 40,0 |
| 3 | 96,5 | 3,5 | 100,0 | 39,0 | 39,0 | 39,0 | 38,0 |
| Сред. знач. | 96,5 | 3,5 | 100,0 | 39,7 | 39,7 | 39,6 | 38,7 |
Примечание: АИ – активный ил
Из данных таблицы видно, что добавление МагТрит-С в концентрации 350 мг/дм3 (при массовой доле основного вещества 35 % в 1 мл раствора содержится 100 мг вещества) вызывает тотчас улучшение процесса осаждения ила, очевидно, за счет улучшения структуры ила, что будет иметь немаловажное значение в процесса очистки сточных вод. Влияние добавок МагТрит-С на активный ил исследован по изменению величин ХПК. Результаты исследования приведены в таблице 8.
Таблица 8
Влияние МагТрит-С на величину ХПК активного ила
| Варианты | ХПК, мг/дм3 | ||
| в начале опыта | через 1 час | через 15 сут. | |
| АИ без полимера | 158,0 | 152,0 | 145,0 |
| АИ + МагТрит-С | 325,0 | 270,0 | 82,0 |
В результате применения в процессах доочистке сточных вод боен препарата МагТрит-С в концентрации 350 мг/дм3 наблюдали улучшение функционирования вторичных отстойников, получали хорошо осажденный осадок активного ила, прозрачную очищенную сточную воду, в которой содержание тяжелых металлов, санитарно-бактериологических и санитарно-паразитологических показателей соответствовали нормативам (таблица 9).
Таблица 9
Исследование эффективности использования препарата МагТрит-С в очистке сточных вод птицефабрики
| Показатели | Без МагТрит-С | После воздействия МагТрит-С |
| Санитарно-бактериологические и санитарно-паразитологические показатели | ||
| Колиформы, кл/г | 120 | 8 |
| Энтеробактерии, кл/г | 110 | 7 |
| Сальмонеллы, кл/г | 130 | Нет |
| Стафилококки, кл/г | 90 | Нет |
| Яйца гельминтов,экз/кг | 380 | Нет |
| Личинки и куколки синантропных мух,экз/кг | 100 | Нет |
| Цисты кишечных патогенных простейших,экз/100г | 140 | Нет |
| Токсические элемента | ||
| Кадмий | 0,09±0,02 | Отсутствует |
| Мышьяк | 1,2±0,3 | Отсутствует |
| Ртуть | менее 1,0 | Отсутствует |
| Свинец | 2,9±0,1 | Отсутствует |
| Стронций | менее 0,2 | Отсутствует |
| Цезий | менее 2 | Отсутствует |
Примечание: АИ – активный ил БОС
3.4 Изучение сорбирующей способности микроскопического гриба Hypomyces odoratus к некоторым тяжелым металлам
3.4.1 Определение содержания меди
Содержание меди определяли до и после культивирования гриба на сточной воде скотобойни аммиачным методом. Аммиачный метод основан на образовании ионом Cu 2+ с аммиаком комплекса [Cu (NH3) 4] 2+, окрашенного в интенсивно – синий цвет: Cu 2+ + 4 NH3 → [Cu (NH3) 4] 2+
Окраска его достаточно устойчива, поэтому колориметрировать раствор можно с помощью фотоэлектрического колориметра КФК – 2.
Перед определением концентрации меди в растворе построили градировочный график, пользуясь специальным растворителем и стандартным раствором соли меди. Измерили оптическую плотность всех растворов и вычислили концентрации растворов меди в мерных колбах по формуле:
C1 = 1.0 / 25 = 0.04 (мг/мл); C2 = 1.5 / 25 = 0.06(мг/мл) ;C3 = 2.5 / 25 = 0.1 (мг/мл) C4 = 4.0 / 25 = 0.16 (мг/мл); C5 = 5.0 / 25 = 0.2(мг/мл)
По полученным данным составили таблицу 10.
По данным таблицы построили градировочный график, отложив по оси абсцисс – концентрации ионов Cu 2+, а по оси ординат – соответствующие им оптические плотности.
Таблица 10
Концентрация ионов меди в сточной воде после биосорбции
| Концентрация, С, мг/мл | Оптическая плотность, D |
| 0.04 | 0.0165 |
| 0.06 | 0.0200 |
| 0.1 | 0.0300 |
| 0.16 | 0.0325 |
| 0.2 | 0.0350 |
Рисунок 2 — График зависимости оптической плотности от концентрации
Зависимость оптической плотности (D) от концентрации (С) растворов CuSO4 · 5H2O Расчетная степень адсорбции мицелиев и их ХГК, представлена в таблице 11.
Таблица 11
Степень адсорбции (Q) ионов меди на различных средах
| Состав среды | Dмиц | Смиц, мг/мл | Qмиц,
% |
| Сточная вода свинокомплекса | 0.025 | 0.072 | 43 |
| Крахмал | 0.024 | 0.068 | 41 |
Из таблицы 11 видно, что наибольшей степенью адсорбции к ионам меди обладают мицелий гриба, выращенный на сточной воде 43%.
3.4.2 Анализ биосорбирующей способности микофильного гриба к ионам кобальта (II)
Были приготовлены стандартные образцы растворов Na3[Co(NO2)6] и измерены их оптические плотности на КФК — 2 при длине волны λ = 400 нм. По полученным результатам был построен градуировочный график. После контакта с биомассы гриба с раствором кобальта полученные растворы измерили на КФК- 2 при длине волны λ = 400 нм, в результате чего получили следующие значения оптической плотности (А): 0,462; 0,438; 0,431; 0,466; 0,451.
По градуировочному графику определили среднюю остаточную концентрацию, равную 0,03% ионов [Co(NO2)6]3+ в растворе. Начальная концентрация раствора кобальта составляла 0,1%. Из полученных данных следует, что микофильный гриб абсорбирует ион кобальта (II) на 70%.
Величину сорбционной емкости биомассы по отношению к кобальту нельзя объяснить только протеканием ионного обмена, так как количество способных к взаимодействию с ионами кобальта карбоксильных групп не может превышать значение полной статической обменной емкости по отношению к анионам, что дает возможность предположить, что извлечение катионов кобальта происходит за счет образования комплексов. В качестве лигандов в этом процессе могут участвовать карбоксильные и аминогруппы, способные как к хелатированию, так и к ионному обмену
Таблица 12
Концентрация ионов меди в сточной воде после биосорбции
| Концентрация С, % | Оптическая плотность А |
| 0,01 | 0,135 |
| 0,02 | 0,280 |
| 0,03 | 0,448 |
| 0,04 | 0,595 |
| 0,05 | 0,760 |
| 0,06 | 0,932 |
| 0,07 | 1,140 |
| 0,08 | 1,341 |
| 0,09 | 1,577 |
| 0,1 | 1,792 |
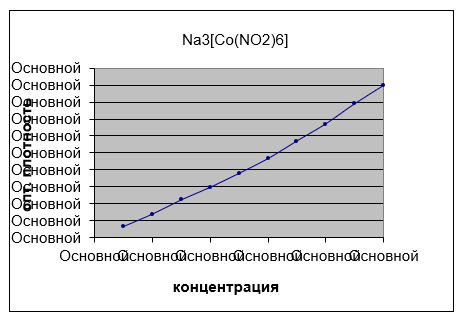
Рисунок 3 — Зависимость оптической плотности от концентрации ионов кобальта (II).
3.5 Изучение стерилизующего эффекта электромагнитного излучения на условно-патогенную микрофлору сточной воды
По некоторым данным, комбинаты мясной промышленности характеризуются большой бактериальной обсемененностью. В сточных водах скотобоен имеется значительная концентрация бактерий Escherichia coli (коли-индекс) колеблется от 10 000 до 100 000 000, общее микробное число составляет: при температуре +22°С 1 700 – 210 000 и более, при температуре +37°С – 434 000 и более); такие стоки содержат значительное количество патогенных бактерий что явно свидетельствует о их санитарно-эпидемиологической опасности. Непосредственно (напрямую) использовать такие сточные воды на орошение нельзя использовать [117].
В последнее время, помимо таких способов обезвреживания сточных вод как обработка хлорной известью, аммиаком, ультрафиолетовое облучение, ионизирующее облучение, представляется перспективным использование электромагнитного излучения или СВЧ-обработка стоков. Применение СВЧ-энергии для подавления микроорганизмов и стерилизации жидкостей, требует тщательного исследования, поскольку даже при наличии ряда публикаций по данному вопросу, данные по влиянию на различные группы микроорганизмов весьма противоречивы и однозначного ответа на вопрос, каков механизм действия электромагнитных полей дать в настоящий момент затруднительно [118].
Согласно одних исследований воздействие СВЧ-обработки приводит к гибели микроорганизмов даже при малых мощностях [119]. Однако, некоторые микроорганизмы имеют дополнительные защитные оболочки, обладающие высоким тепловым сопротивлением, для уничтожения таких микроорганизмов требуется использование более мощных генераторов диапазона СВЧ-излучения или совокупность как минимум пяти факторов — СВЧ-энергия, электролиз, синхронизация питания, рекуперация и серебро. В литературе имеются сведения, что отклик микроорганизмов на влияние магнитного поля видоспецифичен и включает как ингибирование, так и стимуляцию. В результате проделанной работы мы установили, что электромагнитные волны сантиметрового диапазона оказывают влияние на изученные культуры бактерий. Однако реакция на облучение СВЧ-излучением у изученных штаммов не одинакова (рисунок 6). Как показали результаты, наиболее устойчивы к облучению оказались микобактерии — Mycobacterium cyaneum КМ МГУ № 98 и Mycobacterium mucosum КМ МГУ №116, оставаясь жизнеспособными даже при экспозиции 10 минут, то есть реагировали на облучение после длительной обработки (5-10 минут). Только через 15 минут воздействия эти бактерии оказались наиболее чувствительны. Такую устойчивость микобактерий к воздействию СВЧ излучений можно объяснить, согласно литературным данным, наличием в их клеточной стенке миколовых кислот. Наиболее чувствительными к облучению номинальной мощностью 800 Вт оказались Escherichiae coli К12, Escherichiae coli 354 и Pseudomonas putida КМ МГУ № 95, эффект подавления роста наблюдался уже при 5 минутной экспозиции.
Примечание: 0 – отсутствуют клетки; 1 – очень мало; 3 – мало; 4 – много; 5 – очень много.
Рисунок 4 — Влияние СВЧ-излучений (800 Вт) на сохранение изнеспособности бактерий
У бактерий Bacillus subtilis 534 и Pseudomonas fluorescens ВКПМ № В-350 при 5 минутной экспозиции мы наблюдали снижение индекса выживаемости до 10-20%. Относительно бактерии Rhodococcus erythropolis КМ МГУ №119 можно отметить, что она оказалась более оказалась устойчивой к облучению, чем отмеченные выше бактерии: Escherichiae coli К12 (АТСС 25922), Escherichiae coli 354, Pseudomonas putida КМ МГУ № 95, Bacillus subtilis 534 и Pseudomonas fluorescens ВКПМ № В-350. Как мы видим из рисунка 6, эффект снижения жизнеспособности на 50% наблюдался при 5 минутной экспозиции, а подавление роста только при 10 минут воздействия СВЧ-излучений. Воздействие СВЧ-излучений номинальной мощностью 400 Вт оказалось не целесообразным, поскольку для достижения эффекта подавления потребовалось более длительное время экспозиции. В результате наших экспериментов были получены несколько неожиданные результаты: вегетативные клетки Rhodococcus erythropolis КМ МГУ №119 оказались более устойчивыми к воздействию СВЧ — лучей, чем споровые. Исходя из литературных данных, этот факт можно объяснить тем, что микроорганизмы, синтезирующие природные пигменты, более устойчивы к микроволновому облучению [120]. Эксперименты по изучению влияния СВЧ-излучений на микроорганизмы цеха убоя птицы показали, что бактерии, яйца глист и простейшие при номинальной мощности 400 Вт погибают через 10 минут и через 5 минут при номинальной мощности 800 Вт. Для уничтожения простейших оказалась достаточная 3-5 минутная экспозиция (таблица 13).
Таблица 13
Влияние СВЧ-излучений на выживаемость микрофлоры в надиловой жидкости от времени экспозиции
| Микроорганизмы | Количество кл/мл в исходной пробе | Количество кл/мл после обработки СВЧ (%) |
| Бактерии | ||
| 1. Pseudomonas | 7,9*106 | 3 мин. – 80
5 мин. – 20 7 минут – 0 |
| 3. Proteus | 3,0*104 | 2 мин. – 20
5 минут – 0 |
| 4. Escherichia | 4,5*106 | 2 мин. – 20
5 минут – 0 |
| 6. Micrococcus | 9,8*106 | 5 мин. – 20
10 мин. – 0 |
| 7. Staphylococcus | 4,0*106 | 5 мин. – 80
7 мин. – 20 10 минут – 0 |
| Простейшие | ||
| 1.Flagellata | 4 | 3 мин. – 0 |
| 2. Sarcodina | 4 | 3 мин. – 0 |
| 3. Infusoria | 3 | 3 мин. – 0. |
| 4. Яйца глист | 5 | 3 мин. – 2; 5 мин. – 0 |
Примечание: 0 – отсутствуют клетки; 1 – очень мало; 3 – мало; 4 – много; 5 – очень много.
Таким образом, изучение влияния СВЧ-излучения на сохранение жизнеспособности у чистых музейных бактериальных культур показало зависимость эффекта воздействия от таксономического положения, биохимической активности и образования пигментов. Для получения стабильного бактерицидного эффекта важно учитывать дозу и время экспозиции. СВЧ -энергия номинальной мощности 800 Вт оказывает губительное воздействие на бактерии сточных вод локальных очистных сооружений цеха убоя птицы родов Pseudomonas, Proteus, Esherichia, Micrococcus, Staphylococcus при экспозиции 5 минут. Mycobacterium cyaneum КМ МГУ № 98 и Mycobacterium mucosum КМ МГУ №116 оставались жизнеспособными после достаточно длительной обработки (5-10 минут). СВЧ-энергия губительно воздействует на бактерии, яйца глист, содержащихся в иловом осадке очистных сооружений: при номинальной мощности 400 Вт через 10 минут, а при номинальной мощности 800 Вт их гибель наступает уже через 5-7 минут. Для уничтожения простейших оказалась достаточная 3 минутная экспозиция.
В результате подбора активных деструкторов загрязнителей сточных вод скотобоен, использования эффективного процесса биосорбции металлов на биомассе гриба, подбора коагулянта, физических методов обезвреживания сточных вод от патогенных бактерий и простейших организмов была получена очищенная от органических загрязнителей, хлоридов, тяжелых металлов, патогенных микроорганизмов сточная вода боен, по химическим и санитарным нормам.
Состав исходной и очищенной сточной воды цеха убоя свинофермы и после очистки консорциумом аборигенных микроорганизмов представлен в таблице 14.
Таблица 14
Состав исходной сточной воды цеха убоя свинофермы и после
очистки консорциумом аборигенных микроорганизмов .
| № п/п | Определяемый показатель | ед/измерения | Исходная до очистки | После очистки предлагаемым консорциумом микроорганизмов |
| 1. | БПК5
БПК полн. |
мг О2 / дм3
мг О2 / дм3 |
2153±140
2769±200 |
100±18
305±97 |
| 2. | ХПК | мг / дм3 | 6784±5468 | 984±820 |
| 3. | Сухой осадок | мг / дм3 | 7300±365 | 53±2 |
| 4. | Взвешенные вещества | мг / дм3 | 339±24 | 44,8±9,0 |
| 5. | Железо (общее) | мг / дм3 | 141,3±7,1 | 19,3±2,0 |
| 6. | Аммония ионы | мг / дм3 | 160,0±4,8 | 65,0±5,2 |
| 7. | Нитрит-ионы | мг / дм3 | 36,7±3,7 | менее 0,2 |
| 8. | Нитрат-ионы | мг / дм3 | 85,0±8,5 | 16,2±2,6 |
| 9. | Сульфат-ионы | мг / дм3 | 176±18,0 | 51±15 |
| 10. | Фосфат-ионы | мг / дм3 | 179,7±18,0 | 66,6±6,7 |
| 11. | Хлорид-ионы | мг / дм3 | 281±128 | 100±11 |
| 12. | Жиры | мг / дм3 | 574±31 | 25±12 |
| 13. | АПАВ | мг / дм3 | 0,32±0,03 | 0,010±0,001 |
| 14. | КПАВ | мг / дм3 | 3,47±0,80 | 0,82±0,19 |
| 15. | рН | мг / дм3 | 7,6±0,2 | 7,8±0,2 |
| 16. | Колиформы | кл/г | 109 | 8 |
| 17. | Энтеробактерии | кл/г | 100 | 7 |
| 18. | Сальмонеллы | кл/г | 113 | Нет |
| 19. | Стафилококки | кл/г | 103 | Нет |
| 20. | Яйца гельминтов | экз./л | 320 | Нет |
| 21. | Личинки и куколки синантропных мух | экз/кг | 80 | Нет |
| 22. | Цисты кишечных патогенных простейших | экз/100г | 120 | Нет |
| Токсичные элемента | ||||
| 23. | Кадмий | мг/кг | 0,05±0,01 | Отсутствует |
| Мышьяк | мг/кг | 1,06±0,19 | Отсутствует | |
| Ртуть | мг/кг | менее 0,7 | Отсутствует | |
| Свинец | мг/кг | 2,83±0,28 | Отсутствует | |
| Стронций | бк/кг | менее 0,1 | Отсутствует | |
| Цезий | бк/кг | менее 3 | Отсутствует | |
Обязательным приемом, предшествующим заключению о пригодности сточной воды скотобоен для орошения является проверка токсичности сточной воды на проращивание семян. Проверка токсичности сточной воды для орошения определялась на проращивании семян люцерны изменчивой сорта «Виктория», кукурузы «Катерина» и ячменя «Оренбургский совместный ». Семена ячменя, люцерны и кукурузы предварительно замачивали в течение 24 часов в воде водопроводной, в исходной воде убойного цеха свинокомплекса, недоочищенной воде и очищенной предлагаемым нами консорциумом микроорганизмов, с последующей доочисткой коагулянтом МагТрит-С, Результаты представлены в таблице 12. Наиболее эффективной, в условиях данного опыта, оказалась вода водопроводная и очищенные сточные воды убойного цеха свинокомплекса. На второй день после замачивания количество проросших семян люцерны в контроле (вода водопроводная составило 76%, а в опыте при замачивании очищенной сточной водой 88% проросших семян. Исходные и недоочищенные стоки оказывали токсичное воздействие на семена люцерны , в этих вариантах количество проросших семян составляло 4% и 35% соответственно Особенно большие различия отмечались на третьи сутки роста, в когда количество проросших семян люцерны в контроле и в опыте с очищенными стоками составило 100 %, а замачивание в неочищенной воде и в контроле не превышало 30% и 70% соответственно. Аналогичные данные были получены с ячменем и люцерной (таблица 15).
Таблица 15
Влияние сточной воды убойного цеха свинокомплекса на проращивание семян кормовых культур
| Сорт | Варианты | На 2-й день после замачивания | На 3-й день после замачивания | Длина , см | |||
| количество проросших семян | в % к общему числу | Кол-во проросш. семян | в % к общему числу | Длина главного корня | Длина проростков | ||
| Ячмень | Исходная сточная вода | 2 | 4 | 15 | 30 | 0,1 | 0,06 |
| Недоочищенная сточная вода | 15 | 30 | 35 | 70 | 0,4 | 0,1 | |
| Очищенная сточная вода | 44 | 88 | 50 | 100 | 3,92 | 1,10 | |
| Контроль | 38 | 76 | 50 | 100 | 3,18 | 0,16 | |
| Люцернаь | Исходная сточная вода | 4 | 8 | 21 | 42 | 0,09 | 0,07 |
| Недоочищенная сточная вода | 19 | 38 | 40 | 80 | 0,7 | 0,2 | |
| Очищенная сточная вода | 46 | 92 | 50 | 100 | 4,0 | 0,14 | |
| Контроль | 40 | 80 | 50 | 100 | 3,9 | 0,18 | |
| Кукуруза | Исходная сточная вода | 6 | 12 | 26 | 52 | 0,3 | 0,09 |
| Недоочищенная сточная вода | 22 | 44 | 41 | 82 | 0,5 | 0,2 | |
| Очищенная сточная вода | 48 | 96 | 50 | 100 | 3,8 | 0,2 | |
Таким образом, в процессе проведенных исследований была проанализирована деятельность биологических очистных сооружений цеха убоя скота одного из свинооткормочных предприятий с целью определения дальнейшего использования очищенных сточных вод для орошения сельскохозяйственных полей. Оценка состава промышленных сточных вод показала, что они характеризуются высокими величинами БПК, ХПК (данные цеховой лаборатории); наличием фосфатов, хлоридов; тяжелых металлов, превышением ПДК, также сточная вода содержала жиры и белки в достаточно больших концентрациях. Такие стоки не соответствуют требованиям, предъявляемым для спуска в водоемы рыбного и хозяйственного назначения. С целью повышения эффективности работы очистных сооружений были изучены режимы аэротенков, качественный и количественный состав активного ила. Активный ил характеризуется следующими показателями: иловый индекс, возраст ила, микробиальный состав. Анализ показал, что биологические очистные сооружения не обеспечивают достаточную очистку по следующим показателям: ХПК, БПК, взвешенным частицам, содержанию азота, жиров, фосфатов, хлоридов, тяжелых металлов. В связи с этим был проведен тщательный микробиологический анализ активного ила. Активный ил очистных сооружений представляет собой сложный ценоз, состоящий из бактерий, грибов, дрожжей и простейших. Родовой состав бактерий мало разнообразен. Мы обнаружили, что нередко в активном иле встречались представители патогенных бактерий Micrococcus, Staphylococcus, бактерии кишечной группы. В активном иле были обнаружены группы простейших, свидетельствующих о недостаточной очистке стоков. Из микробиоценоза активного ила биологических очистных сооружений выделены наиболее активные деструкторы загрязнителей, устойчивые к содержанию тяжелых металлов, проведена их идентификация. Enterococcus casseliflavus Lactobacillus paracasei, Stenotrophomonas rhizophila, устойчивые к содержанию хлоридов в сточной воде. Выделенные нами культуры активных деструкторов были проверены на устойчивость к алюминию, кобальту и меди в концентрациях, выше ПДК рыбохозяйственных водоемов в 10 раз. Воздействие тяжелых металлов оказалось губительным для бактерий активного ила.
В то же время при сокультивировании с теми же металлами Stenotrophomonas rhizophila., выделенных из активного ила биологических очистных сооружений, отмечалась устойчивость ассоциации к металлам. Поступление на биологическую очистку жиров в количествах, превышающих 50 мг/л препятствует поступлению кислорода к микроорганизмам за счет образования вокруг хлопков активного ила жировой пленки, эффективность очистки стоков снижается.
В результате использования штамма микроскопического гриба Hypomyces odoratus 94/77 происходит прирост биомассы гриба уже через 16-24 часа роста за счет потребления жиров, о чем можно судить по значениям снижения показателей ХПК и содержания жира.
Также при очистке сточных вод стоит проблема удаления тяжелых металлов, избыточного количества фосфора, сульфатов, присутствие которых даже в незначительных количествах недопустимо для использования таких вод для орошения сельскохозяйственных и иных угодий.
Нами было обнаружено свойство биомассы микроскопического гриба Hypomyces odoratus адсорбировать тяжелые металлы
Целесообразным является использование природных компонентов, например, таких как продукт компании ООО «РГХО».
Использоввание в белой водной суспензии гидроксида магния, под названием МагТрит-С, в концентрации 350 мг/дм3 очищаемых стоков в качестве коагулянта на последнем этапе биологической очистки привело к улучшение функционирования вторичных отстойников, обеспечило хорошо осажденный осадок активного ила, прозрачную очищенную сточную воду, в которой отсутствовали патогенные микроорганизмы, содержание сульфатов, фосфатов, азота , жиров, показатели ХПК и БПК5 соответствовали требуемым нормам для использования сточных вод для орошения сельскохозяйственных полей.
Выводы
Определение состава стоков скотобоен при существующих традиционных методах очистки показало, что они характеризуются высокими показателями ХПК,БПК. содержанием трудноразлагамых органических соединений, высоким содержанием тяжелых металлов, наличием условно-патогенных микроорганизмов, что дает основание считать их непригодными на земледельческих полях орошения.
Анализ качественного и количественного состава активного ила на традиционных биологических очистных сооружениях показал, что родовой состав бактерий – дестукторов малоразнообразен, часто встречаются представители условно-патогенных бактерий и простейших.
В результате проведенных исследований из числа аборигенной микрофлоры, выявлены наиболее активные деструкторы загрязнителей сточных вод использование которых на локальных биологических очистных сооружениях скотобоен и предприятий мясоперерабатывающей промышленности, содержащих высокие концентрации органических веществ, хлориды, сульфаты, тяжелые металлы, патогенные микро-организмы обеспечивает очищение стоков до нормативов для орошения сельскохозяйственных культур.
Установлена эффективность удаления тяжелых металлов. патогенных микроорганизмов и простейших под воздействием природного коагулянта «МагТрит-С» и СВЧ-излучения.
Полученная в результате экспериментов очищенная сточная вода не содержала токсичных элементов, а также патогенных микроорганизмов, оказывала бла-гоприятное воздействие на энергию прорастания, длину главного корня и проростка рас-тений люцерны, кукурузы и ячменя.
Установлено, что влияние СВЧ-излучения на сохранение жизнеспособности бактериальных, грибных культур и простейших зависит от таксономического положения, биохимической активности и образования пигментов.
Полученная в результате экспериментов очищенная сточная вода не содержала токсичных элементов, а также патогенных микроорганизмов, оказывала благоприятное воздействие на энергию прорастания, длину главного корня и проростка растений люцерны, кукурузы и ячменя.
Рекомендации производству Рекомендовано для цехов убоя скота на предприятиях вести локальную очистку сточных вод, с использованием предлагаемого нами консорциума микроорганизмов, использование в качестве коагулянта гидроксид магния МагТрит-С, целесообразно на локальных очистных сооружениях использование СВЧ –излучений для обеззараживания сточной воды и илового осадка с целью дальнейшего их использования на земледельческих полях орошения.
Список использованных литературных источников
- Бренч, А.А. Технологии переработки продукции животноводства. ч. II Переработка мяса и производство мясной продукции / А. А. Бренч, И. Е. Ветров, В. С. Дацук. – Минск: Наука, 2015. — 272 c.
- Иванченко, О.Б. Токсические свойства сточных вод мясоперерабатывающего предприятия / О.Б. Иванченко, Р.Э. Хабибуллин // Известия ВУЗов. Пищевая технология. — 2006. — № 4.- С. 114–116.
- Скориков, В.Т. Изучение использования сточных вод на орошение в условиях Йемена /В. Т. Скориков, А. В. Шуравилин, С. А. Койка, Е. А. Пивень // Агрохимический вестник.- 2012. -№ 2.- С. 38–40.
- Брындина, Л.В. Перспективное использование осадков сточных вод в экологическом земледелии /Л. В.Брындина, К. К. Полянский, О.В. Бакланова // Продовольственная безопасность: научное, кадровое и информационное обеспечение.- 2018.- С. 337–341.
- Вихрева, Д.Р. Санитарно-гигиеническая оценка использования сточных вод на орошение /Д. Р. Вихрева, Д. Д. Гамазина // Современный взгляд на будущее науки: сборник статей. -2015. -С. 214–216.
- Гарипова, Р.Ф. Практика устройства земледельческих полей орошения как способ утилизации хозяйственно-бытовых, промышленных стоков и проблема техногенного загрязнения / Р.Ф. Гарипова // Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета.- 2006.- № 23.- С. 206–219.
- Ильдеспаева, Д. Е., Очистка сточных вод мясокомбината / Д.Е. Ильдеспаева, Н. Н. Рахимова // Перспективы развития пищевой и химической промышленности в современных условиях. — 2019.- С. 297–301.
- Панова, И.И. Очистка сточных вод мясоперерабатывающих производств / И.И. Панова , И.Н. Нойберт // Мясные технологии. 2014. № 5. С. 44–45.
- Домашенко, Ю. Е. Аспекты ресурсосбережения при орошении сельскохозяйственных угодий / Ю. Е. Домашенко //Пути повышения эффективности орошаемого земледелия: сб. науч. тр. /ФГБНУ «РосНИИПМ». – Новочеркасск: Геликон, 2013. – Вып. 51. – С. 49-52.
- Shirokova, Y. The problems of pollution water-sources in the Republic of Uzbekistan / Y. Shirokova, S.Mamatov, T. Dermoyan //2nd International Toxic Algae Control Symposium.- Tsukuba Japan, 2002.- P. 20-22.
- Желязко, В.И. О пригодности сточных вод предприятий агропромышленного комплекса для удобрительного орошения /В.И. Желязко //Вестник Белорусской государственной сельскохозяйственной академии.- 2018.- № 1.- С. 122–130
- Белоусова, Н.И. Способы снижения техногенного влияния мясожирового производства на окружающую природную среду Н.И. Белоусова, Н.Ф.Панков , Т.А. Мануйлова // Все о мясе.- 2007.- № 3.- С. 43–46.
- Иванченко, О.Б. Токсические свойства сточных вод мясоперерабатывающего предприятия / О.Б. Иванченко, Р.Э. Хабибуллин // Известия ВУЗов. Пищевая технология.- 2006. -№ 4.- С. 114–116.
- Сатыбалдиева, Д.К. Очистка сточных вод мясоперерабатывающих предприятий /Д.К. Сатыбалдиева, Ж.Б. Намазбекова // Вестник КГУСТА. -2014.- № 4. -С. 77–79.
- Свинцов, И.П. Рациональное использование водных ресурсов при орошении сельскохозяйственных культур сточными водами / И.П. Свинцов, Д.П. Гостищев // Использование и охрана природных ресурсов в России. — 2008.- № 5 (101- С. 47–50.
- Стукановская, Е.В. Патентные исследования по очистке сточных вод мясокомбинатов / Е.В. Стукановская, С.В. Степанов С. В. //Традиции и инновации в строительстве и архитектуре. Самара: Строительные технологии, 2017. — С. 193–195.
17. Субботина, Ю.М. Очистка и обеззараживание сточных вод мясокомбинатов /Ю.М. Субботина // Социальная политика и социология. -2010. -№ 9.- С. 145–156.
18. Биотехнологическое направление в решении экологических проблем /Н.Н.Соловых, Е.В. Левин, Г.В. Петухова: монография.- Екатеринбург: УрО РАН, 2003. – 295 с.
19. Зуева, С.Б. Технологические схемы очистки сточных вод мясоперерабатывающих предприятий / С.Б. Зуева, Н.М. Ильина, О.А. Семенихин, А.А. Епифанова, Л.Г. Петухова // Вестник ВГТУ-. 2009. -№ 1. -С. 51–53.
20. Алиева, Р.М. Микробиологические аспекты очистки промышленных сточных вод / Р.М. Алиева.- М.: Наука, 1987.- 360с.
22. Aziz, A. Biological wastewater treatment (anaerobic-aerobic) technologies for safe discharge of treated slaughterhouse and meat processing wastewater /А. Aziz, F. Basheer, A. Sengar, S. U. Khan, I. H. Farooqi //Science of the total environment.- 2019. –V. 686.- P. 681–708.
23. Киселева, М. Г. Современные сооружения естественной биологической очистки (БОКС-пруды) для утилизации сточных вод /М.Г. Киселева, Ю.М. Субботина // Проблемы ветеринарной санитарии, гигиены и экологии.- 2011.- № 2.- С. 72–74.
24. Ламм, Э. Л. Комплексная переработка отходов скотобоен / Э.Л. Ламм, Н. А Баер // Мясные технологии.- 2010.- № 2. — С. 56–58.
25.Чудакова, О.Г. Очистка сточных вод мясоперерабатывающих предприятий /О.Г. Чудакова , А.В. Желавицкая //Вестник технологич. ун-та.- 2016.-Т.19.- № 22.- С.182-186.
26. Яковлев, С.В. Биологические процессы в очистке сточных вод /С.В. Яковлев, Т.А. Карюхина.- М.: Стройиздат,1980. — 225с.
27. Липеровская, Е.С. Индикаторные организмы активного ила на сооружениях биологической очистки /Е.С. Липеровская, Л.А. Исаева, О.Е. Лагунова //Самоочищение и биоиндикация загрязненных вод.- М.: Стройиздат., 1980. — 154 с.
28. Карелин, Я.А. Очистка производственных сточных вод в аэротенках Я.А. Карелин, Д.Д. Жуков, В.Н. Жуков.- М.: Стройиздат, 1973.- 351с.
29.Кульский Л.А. Проблемы чистой воды /Л.А. Кульский, В.В. Даль.- Киев: Наука, 1974.- 130 с.
30. Левин, Е.В. Новые технологии в интенсификации биологической очистки сточных вод от анилина /Е.В. Левин //Экология и промышленность России.- 2015.- Т.19.- №8.-С.10-14.
31. Роговская, Ц.И. «Биохимический метод очистки производственных сточных вод» Ц.И. Роговская.- М.: Стройиздат, 1967. — 205 с.
32. Эпов, А.Н. Очистка сточных вод предприятий агропромышленного комплекса /А.Н. Эпов, М.А. Канунникова //Философия выбора.-2015.- №1.- С. 51-59.
33. Степанов, С. В. Очистка сточных вод мясоперерабатывающих предприятий /С.В.Степанов, Т.В.Соколова, Ю. Е. Сташок, А.С. Степанов // Традиции и инновации в строительстве и архитектуре, Самара: Строительные технологии, 2017. — C. 259–262.
34. Лучицкая, О.А. Воздействие осадков сточных вод на почву и растения /О.А.Лучицкая, С.М.Севостьянов //Агрохимия. -2007. — № 9. -С. 80–84.
35. Тиньгаев, А.В. Перспективы использования органических отходов для повышения плодородия почв Алтайского края /А.В.Тиньгаев // Агрохимический вестник.- 2010.- № 2.- С. 34–36.
36. Калюжный, C.B. Анаэробная биологическая очистка сточных вод /С.В. Калюжный, Д.А.Данилович, А.Н. Ножевникова //Итоги науки и техники. Сер. Биотехнология.-М., 1991. — T. 29.- С. 35 — 39.
37. Логинов О.Н., Силищев H.H., Бойко Т.Ф., Галимзянова Н.Ф. Биотехнологические методы очистки окружающей среды от техногенных загрязнений /О.Н. Лог инов, Н.Н. Силищев, Т.Ф. Бойко, Н.Ф. Галимзянова Уфа: Реактив. — 2000.- 99 с.
38. Новохатко, Т.Н. Технологии биоферментной очистки сточных вод пищевых предприятий //Материалы III Международной научно- техн. конф.: Наука, образование, производство в решении экологических проблем Т.Н. Новохатко, А.М. Михельсон. — Уфа.: НИИ БЖД РБ, 2006. — Т. 2.- С. 79-81.
39. Нуртдинова, Л.А. Окисление растительных и животных жиров микроорганизмами биопрепарата «Ленойл» //Материалы XVII Международной научн-техн. конф.: Химические реактивы, реагенты и процессы малотоннажной химии / Л.А. Нуртдинова, С.П. Четвериков, Н.Н. Силищев, О.Н. Логинов. — Уфа: Реактив. — 2004.- С. 60-61.
40. Яковлев, C.B. Водоотведение и очистка сточных вод /С.В. Яковлев, Ю.В. Воронов.- М.: Ассоциации строительных вузов, 2004. — 704 с.
41. Субботина, Ю. М. Методы очистки и обеззараживания сточных вод скотобоен и мясокомбинатов /Ю.М. Субботина // Экологический вестник Северного Кавказа. — 2011. Т. 7.- № 2. — С. 37–41.
42. Леонов, В.Е. Технология очистки сточных вод: учеб. Пособие /В.Е. Леонов. — Новосибирск: НГАВТ, 2001. — 116 с.
43. Киселева, М.Г. Современные сооружения естественной биологической очистки (БОКС-пруды) для утилизации сточных вод М.Г. /Киселева, Ю.М. Субботина // Проблемы ветеринарной санитарии, гигиены и экологии.- 2011-. № 2. — С. 72–74.
44. Авакян, З.А. Сравнительная токсичность тяжелых металлов для некоторых микроорганизмов /З.А. Авакян //Микробиология.- 1967, — Т. 36, № 6 – С. 446-450.
45. Фрумин, Г.Т. Экологическая химия и экологическая токсикология /Г.Т. Фрумин, 2002.- СПб: РГГМУ. – 204 с.
46. Эльбекьян, К.С. Экологическая и экспериментальная характеристика токсичности тяжелых металлов и оценка возможного антитоксического механизма: автореф. дисс. … д-ра биол. наук: 03.00.16 /Карине Сергеевна Эльбикян; СГУ.- Саратов.- 2008 .- 35 с.
47. Борисенко, Е.Г. Разработка комплексной технологии белковых препаратов на основе нетрадиционного сырья и дрожжей /Е.Г. Борисенко .- М.: МГУ.- 1990. — 474 с.
48. Использование иммобилизированных клеток бактерий при очистке сточных вод от шестивалентного хрома / Квасников Е.М. и др. // Микробиология. – 1986. – Т. 48. – № 6. – С. 39-44.
49. Зигель, Х Некоторые вопросы токсичности ионов металлов / Зигель Х, Зигель. А – М.: Мир, 1993. – 368 с.
50. Илялетдинов, А.Н. Микробиологическая очистка воды от тяжелых металлов / А.Н. Илялетдинов // Водные ресурсы. – 1980. – №2. — С.158-169.
51. Святохина, В.П. Исследование реагентного метода очистки сточных вод от ионов тяжелых металлов. дисс. к.т.н. / Святохина Виктория Петровна, 2002. – 164 с.
52. Плакунов, Микробные биопленки: перспективы использования в очистке сточных вод / Плакунов, Ю.А. Николаев // Вода: химия и экология. – 2008. — № 2. – С. 11-13.
53. Суторкин, А.Т. Технологические и экологические основы биосорбционных процессов очистки сточных вод. авторферат дис. на соиск. уч степ. докт.техн.наук / А.Т. Суторкин, 2003.- 40 с.
54. Биосорбция тяжелых металлов на микробной биомассе – перспективное направление в очистке промышленных сточных вод / Е.В. Левин, А.Д. Буракаева, Р.Ф. Сагитов, Т.С. Ковтунова // Водоочистка. – 2014. – № 11. – С. 30-37.
55. Gadd, G.M. Microbial treatment of metal pollution – a working biotechnology? / G.M. Gadd, C. White // Trends Biotechnol. 1– 993.-V.11. — № 8. – P.353-359.
56. Илялетдинов, А.Н. Микробиология и биотехнология очистки промышленных сточных вод / А.Н. Илялетдинов, Р.М. Алиева. — А-Ата: Гылым, 1990. — 250 с.
57. Гаранин, Р.А. Метод биосорбции тяжелых металлов из промышленных сточных вод с использованием пивоваренных дрожжей Saccharomyces cerevisiae: автореф. дисс.. на соиск. уч. степ. канд. биол. наук. /Гаранин Роман Анатольевич. – МГУ.- Москва, 2011. – 24 с.
58.Эффективность применения биомассы Hypomyces rosellus – отхода получения красителя – в очистке сточных вод от тяжелых металлов / А.Д. Буракаева, Е.В. Левин, Р.Ф., Сагитов, Т.С. Ковтунова // Экология и промышленность России. – 2015. – Т.19. –№1. – С.14-16.
60. Яковлева, А.В. Технологические и биохимические аспекты биологического контроля процессов очистки металлосодержащих сточных вод / А.В. Яковлева, А.А. Халилова, А.С. Сироткин // Материалы международной молодежной конференции Экологические проблемы горнопромышленных регионов. – 2012 г. –С. 407-408.
61.Сироткин, А.Т. Технологические и экологические основы биосорбционных процессов очистки сточных вод. авторф. дис. докт. техн. наук / Александр Семенович Сироткин, 2003. – 40 с.
62. Изучение сорбирующей способности биомассы микроорганизмов по отношению к некоторым радионуклидам / М.П. Ховрычев, И.Ю. Мареев, В.Ф. Помыткин // Микробиология. –1994. –Т.63. –вып. 1. – С. 145-151.
63.Очистка промышленных сточных вод от тяжелых цветных металлов с помощью биосорбентов / В.И. Захарова, А.А. Игнатьев, А.А. Кореневский и др. // Прикладная биохимия и микробиология. – 2001. – Т.37. – 4. – С.405-412.
64 Алейник, С. Н. Внутрипочвенное орошение сточными водами и плодородие почвы / С. Н. Алейник, М. С. Григоров, С. М. Григоров // Плодородие. – 2007. – № 1 (34). – С. 31–32.
65. Сельскохозяйственное использование сточных вод как перспективное направление их утилизации / С. Н. Волкова, Е. Е. Сивак, И. В. Панченко // Вестник Курской государственной сельскохозяйственной академии. – 2009. –№ 3. – С. 66–69.
66. Влияние круглогодового использования сточных вод на агрохимические и агрофизические свойства черноземов/ Н. И. Алешина, С. В. Макарычев, А. А. Томаровский // Вестник АГАУ. – 2013. –№3 (101). – С. 32–37.
67. Давыдов А.С. Удобрительная ценность сточных вод убойного цеха птицеводческого комплекса / А.С. Давыдов, В.Б. Шепталов // Вестник АГАУ. – 2011. –№ 9. – С. 22–24.
68. Баринов, А.А. Перспективы орошения сточными водами /А.А. Баринов, Л.И. Карадаян, С.В. Бурлака // Фундаментальные и прикладные исследования в науке и образовании. – Таганрог, 2019. – С. 195–197.
69. Шепталов, В.Б. Подготовка сточных вод и режим орошения сельскохозяйственных культур в условиях лесостепной зоны Челябинской области: автореф. дис. … канд. с.-х. наук. / Вячеслав Борисович Шепталов.- Барнаул. – 2011. – 17 с.
70. Формирование, очистка и использование сточных вод / П. И. Белоконь, С. И. Белоконь, И. А. Юсупов, Ю. А. Титова // Наука, новые технологии и инновации Кыргызстана. – 2017. – № 3. – С. 36–39.
71. Современные возможности утилизации осадков сточных вод / Л. В. Брындина, К. К. Полянский, Д. С. Лазарев // Вестник российских университетов. – Математика. – 2016. – № 1. – С. 297–301.
72.Волкова, Н. Е. Использование очищенных сточных вод в Крыму: опыт прошлого, реалии настоящего / Н.Е. Волкова, Р.Ю. Захаров // Научный журнал РосНИИПМ. – 2017. – № 3 (27). – С. 144–159.
73. Джайсамбекова, Р.А. Влияние орошения сточными водами на инфильтрацию, солевой состав почв и урожайность кормовых культур / Р.А. Джайсамбекова // Наука и мир. – 2017. – Т. 1. –№ 10 (50). –С. 55–58.
74.Видякин, М.Н. Особенности внедрения мембранных биореакторов для обработки сточных вод / М.Н. Видякин, С.А. Гарипова // Экология производства. – 2014. – № 14. – С. 61–68.
75. Влияние круглогодового использования сточных вод на агрохимические и агрофизические свойства черноземов / Н.И. Алешина, С.В. Макарычев, А.А. Томаровский // Вестник АГАУ. – 2013. – №3 (101). – С. 32–37.
76. Экологические проблемы охраны окружающей среды при орошении сточными водами и животноводческими стоками / Д. П. Гостищев, Н. В. Хватыш, Д.С. Валиев // Научный журнал РосНИИПМ. – 2016. – № 3 (23). – С. 238–250.
77. Экологические проблемы охраны водных ресурсов от загрязнения сточными водами и животноводческими стоками / Д.П. Гостищев, А.О. Хуторова, В. А. Широкова // Природообустройство. – 2013. –№ 3. – С.18-24.
78. Захарова, О. А. Изменение направления эволюции серых лесных почв в результате длительного орошения сточными водами / О.А. Захарова, К.Н. Евсенкин // Вестник Рязанского государственного агротехнологического университета им. П.А Костычева. – 2011. – № 1. – С. 39–42.
79. Расчет норм минеральных удобрений, вносимых при орошении сточными водами / С.Н. Волкова, Е.Е. Сивак, И.В. Панченко // Вестник Курской государственной сельскохозяйственной академии. – 2009. – № 4. – С. 53–55.
80. Формирование, очистка и использование сточных вод/ П.И. Белоконь, С.И. Белоконь, И.А. Юсупов, Ю.А. Титова // Наука, новые технологии и инновации Кыргызстана. – 2017. – № 3. – С. 36–39.
81. Вихрева, Д.Р. Санитарно-гигиеническая оценка использования сточных вод на орошение/ Д.Р. Вихрева, Д.Д. Гамазина // Современный взгляд на будущее науки: сборник статей. – Уфа, 2015. – С. 214–216.
82. Патент РФ № 2687340 Средство для зашиты сельскохозяйственных растений от фитопатогенных микроорганизмов. /Буракаева А.Д., Петрова Г.В., Егоров Н.С., Ахметова В.Р., Шангараева Г.С., Шангараев К.Р., Филлипова А.В., заявл. 28.08.2017 г., опубл. 13.05.2019 г. бюл. 14.
83. Практикум по микробиологии: учебн. пособ. для студ. высш. учеб. Заведений / А.И. Нетрусов, Л.М. Захарчук и др. –Москва: Академия, 2005. – 608 с.
84. Буракаева, А.Д. Основы общей микробиологии: учеб. пособие / А.Д. Буракаева. – Оренбург, 2014. – 160 с. – ISBN 978-5-905383-16-8.
85. Егорова, Н.С. Руководство к практическим занятиям по микробиологии: учеб. пособие / Н.С. Егорова. – Москва: МГУ, 1983. – С. 143-145.
86. Irmis, M.A Guide to methods and applications/ Irmis M.A., Gelfand D., Sninsky J. // PCR Protocols.- 1998.-p.14-15.
87. Pavlicek A., et al. Fre-Tree-freeware program for construction of phylogenetic trees on the basis of distance data and bootstrap jackknife analysis of tree robustness. //Application in the RAPD analysis of genus Frenkelia Folia Biol (Praha).- 1999.- V. 45(3).- C. 97-99.
88. Смирнова, И.Р. Теоретическое обоснование, усовершенствование и разработка мероприятий, направленных на оптимизацию технологий естественной биологической очистки сточных вод с возможностью использования их на орошение и рыборазведение: дисс…уч. степ. док. вет. наук по спец. 16.00.06 – ветеринарная санитария и экология / Ирина Робертовна Смирнова -Москва.- 1997.- 341 с.
89. Твердофазное и поверхностно-мембранное жидкостное культивирование микромицетов, особенности их развития и образования ферментов / Осмоловский. А.А., Баранова Н. А., Крейер В. Г. и др. // Прикладная биохимия и микробиология. – 2014. –Т.50. –№3. – С. 245–255.
90. Sarocladium strictum – перспективный продуцент протеолитических ферментов с выраженной фибринолитической активностью/Е.И. Корниенко, Л.Ю. Кокаева, Е.Н. Биланенко и др. //Микология и фитопатология.- 2020.- Т.54. –№ 3. – С.206-213.
91. Termostable alkaline proteaseprodaced by Bacillus termoruber-new specles of Bacillus. / Manachini P.L., Fortina M.G., Parini C. //Appl.Microbiol.Biotechnol. – 1988. – № 28(4/6). – С. 409-413
92. Филиппович, Ю.Б. / Практикум по общей биохимии/ Ю.Б. Филлипович, , Т.А. Егорова, Г.А. Севастьянова. — Москва: Просвещение, 1982.- 420 с.
93.Методика выполнения измерений содержаний взвешенных веществ и общего содержания примесей в пробах природных и очищенных сточных вод гравиметрическим методом, ПНД Ф 14.1:2.110-97. – Москва, 1997г.
94.Методические указания. Методика выполнения измерений химического потребления кислорода в водах РД 52.24.421 – 95. – Ростов-на-Дону, 1995г.
95. Методика выполнения измерений биохимической потребности кислорода после n-дней инкубации в поверхностных пресных, подземных, питьевых сточных и очищенных сточных водах. ПНД Ф 14.1:2:3:4.123-97. – Москва, 1997. – 60 с.
96. Жмур, Н.С. Методическое руководство по гидробиологическому и бактериологическому контроля процесса биологической очистки на сооружениях с аэротенками/ Н.С. Жмур. – ПИДФ СБ 14.1.77-96. –70 с.
97. Краткий определитель бактерий Берги под ред. Дж.Холулта М., 1986. –494с.
98. Гвоздяк, П.И. Микробиология и биотехнология очистки воды./П.И. Гвоздяк // Химия и технология воды. – 1989. – Т.11. – № 9. – С.854-859.
99.Количественный химический метод анализа вод ПНД Ф.14.1:2:3:4, 123-97 ШФР.1.31.2007.03.796. – Москва, 2007.
100. Методика выполнения измерений биохимической потребности кислорода после n-дней инкубации в поверхностных пресных, подземных, питьевых сточных и очищенных сточных водах. ПНД Ф 14.1:2:3:4.123-97. Москва, 2003г. – 80 с.
101. Байбордин, А.М. Локальная очистка сточных вод целлюлозо-бумажных предприятий методом коагуляции: автореф. дисс…..канд. техн. Наук:05.21.03/Артем Михайлович Байбородин; АГУ.- Архангельск.-2014.- 30 с.
102. Карюхина, Т.А. Химия воды и микробиология /Т.А. Карюхина, И.Н. Чурбанова — М: Стройиздат, 1983.- 167 с.
103. Карюхина, Т.А. Контроль качества воды /Т.А. Карюхина, И.Н. Чурбанова — М: Стройиздат, 1986. — 180 с.
104. Наумов, И. И. Наукоемкие технологии в приборо- и машиностроении и развитие инновационной деятельности в Вузе. /И.И. Наумов//Основы технологии биосорбционного извлечения тяжелых металлов при обработке осадков сточных вод, -2012. – С. 51-56.
104. Liu, Y. Y. Origin, nature, and treatment of effluents from dairy and meat processing factories and the effects of their irrigation on the quality of agricultural soils /Y. Y Liu, R. J. Haynes // Critical Reviews in Environmental Science and Technology.- 2011. –V. 41- № 17. — P. 1531–1599.
105. Ахмедова, О.О. Повышение эффективности локальных очистных сооружений сточных вод за счѐт применения комбинированных электрофизических методов воздействия /О.О. Ахмедова, С.Ф. Степанов, А.Г. Сошинов, К.Н. Бахтиаров //Современные проблемы науки и образования. — 2009. — № 5. — 261 с.
106. Gremion, F. Comparative 16S rDNA and 16S rRNA sequence analysis indicates that Actinobacteria might be a dominant part of the metabolically active bacteria in heavy metal-contaminated bulk and rhizosphere soil /F. Gremion F., A. Chatzinotas, H. Hauke // Environ. Microbiol. — 2003. V. 5, № 10. – P. 896-907.
107. Petanen, Т. Toxicity and bioavailability to bacteria of particle-associated arsenite and mercury / Т. Petanen, M. Romantschuk // Chemosphere]. — 2003. – V. 50, № 3. — С 409413.
108. Pavlicek, A.. Fre-Tree-freeware program for construction of phylogenetic trees on the basis of distance data and bootstrap jackknife analysis of tree robustness. A. Pavlicek //Application in the RAPD analysis of genus Frenkelia Folia Biol (Praha). — 1999.- V. 45 (3). — C. 97 — 99.
109. Рогожин, В. В. Практикум по физиологии и биохимии растений: учеб. Пособие /В.В. Рогожин, Т.В. Рогожина .- СПб: ГИОРД, 2013. 352 с.
110. Доспехов, Б. А. Методика полевого опыта (с основами статистической обработки результатов исследований) /Б.А. Доспехов.- М.: Книга по Требованию, 2012. — 352 с.
111. Жмур, Н.С. Технологические и биохимические процессы очистки сточных вод на сооружения с аэротенками /Н.С. Жмур.- М.:АКВАРОС, 2003.- 506 с.
112. Архипченко, И.А. Микробиологические основы безотходной технологии переработки стоков свинооткормочных комплексов: автореф. дисс. …докт. биол. наук: 03.00.12 / Ирина Александровна Жмур.- ЛГУ.- Ленинград- 1991.- 35 с.
113. Белопольский, Л.М. Интенсификация работы сооружений биологической очистки сточных вод предприятий агропромышленного комплекса : автореф. дисс…. канд. техн. наук / Леонид Михайлович Белопольский – ВНИиТИБП. —
Кашинцево (Моск. обл.). — 2005. — 25 с.
114. Fukumoto, Y. Advanced treatment of swine wastewater by electrodialysis with a tubular ion exchange membrane /Y.Fukumoto, K. Haga //Anim. Sci. J. — 2004. – V. 75.- № 5. — С 479 – 485.
115. Сафронов, Р.В. Интенсивная малоотходная система биодеструкции загрязнений высококонцентрированных стоков : автореф. дисс. … канд. техн. наук / Р.В. Сафронов.- РХТУ. — Москва. — 2004. — 19 с.
116. Гапоненков, И.А., СВЧ-обработка осадков сточных вод пищевых производств / И.А. Гапочникова, О.А. Федорова //Вестник МГГУ, 2011.- Т.16. — №4. — С. 681 — 686.
117. Комарова, А.С. Влияние микроволнового излучения на почвенные бактерии: автореф. дисс…..канд. биол. наук: 03-00-07, 03-00-27 /Анастасия Сергеевна Комарова. — МГУ.- Москва. — 2008. — 19 с.
118. Федорович, Г.В. Экологический мониторинг электромагнитных полей /Г.В. Федорович. — М.: Стройиздат . — 2004.- 140 с.
119. Асланян, Р.Р. Взаимодействие живой системы с электромагнитным полем /Р.Р. Асланян, С.В. Тульская, А.В. Григорян, Е.С. Бабусенко //Вестник Моск. Ун-та.-Сер.16 Биология. — 2009. — №4. — С.20 — 23.
120. Гапочка, Л.Д., Гапочка М.Г., Дрохакина Т.С., Исакова Е.Ф. Эффекты облучения культуры Daqfnia magna на разных сталиях развития электромагнитным полем миллиметрового диапазона низкой интенсивности /Л.Д.Гапочка, М.Г. Гапочка, Т.С. Дрохакина, Е.Ф. Исакова //Вестник Моск. Ун-та.- Сер.16 Биология.-2012. — № 2.- С.43-47.
Список опубликованных работ по теме:
Scopus, Web of Science
1.Буракаева, А.Д., Повышение эффективности очистки сточных вод предприятий с одновременным получением биоПАВ для нефтяной отрасли/ Петрова Г.В., Хлытчиев А.И., Ахалаиа Н.А., Сорокун С.В., Баширова З.А. //Экология и промышленность России.2020.Т.24.№2.С.41-45. DOI: 10.18412/1816-0395-2020-2-41-45
2. Петрова,Г.В. Повышение эффективности биологической очистки убойного цеха стоков птицефабрики / Г.В. Петрова, А.Д. Буракаева Е.В. Левин, С.В. Сорокун //Экология и промышленность России, 2020 (принята в печать).
RCSI
- Буракаева, А.Д. Перспективы использования Hypomyces odoratus для получения фунгицидного препарата на отходах животноводства /А.Д. Буракаева, Г.В. Петрова // Достижения науки и техники АПК.- 2020. -Т. 34. -№ 12.- С. 33–38. doi: 10.24411/0235-2451-2020-11205.
4. Буракаева, А.Д. Очистка стоков скотобоен от ионов металлов путем биосорбции на биомассе микроскопического гриба /А.Д. Буракаева, Г.В. Петрова //Вестник КрасГАУ, 2020 (принята в печать).
Заявка на изобретение
- Буракаева, А.Д. Способ очистки жиросодержащих сточных вод /А.Д. Буракаева, Г.В. Петрова. – Заявка на изобретение № 2020137797 от 17.11.2020 г.
Участие в конференциях
- Петрова, Г.В. Проблемы утилизации стоков предприятий мясопереработки / Г.В. Петрова // Материалы Международного научно-практического форума «ASU SciTech Forum 2020», 12 — 13 ноября 2020 г. в Алтайском государственном университете (г. Барнаул, Россия).
- Петрова, Г. В. Проблемы утилизации отходов птицеводства /Г.В. Петрова. — ЦПО «Парадигма. 83-ая международная форум «Обращение с органическими отходами. Опыт и перспективы». — 20-21 октября 2020 г. — Москва.
