Титульный лист и исполнители
РЕФЕРАТ
Отчет 73с., 11 рис., 18 табл., 176 источн.
МОЛОЧНАЯ СЫВОРОТКА, ПРЕБИОТИКИ, КОРМОВАЯ ДОБАВКА, БИФИДОГЕННЫЙ ЭФФЕКТ, ГИДРОЛИЗ, SACCHAROMYCES CEREVISIAE, ОЛИГОСАХАРИДЫ ПЕКТИНА
Объекты исследования – свекловичный жом, молочная сыворотка, дрожжи Saccharomyces сerevisiae, олигосахариды пектина
Цель работы – разработка технологии бифидогенной кормовой добавки на основе продуктов гидролиза пектина с использованием молочной сыворотки.
В работе будут использованы теоретические и экспериментальные (лабораторные) методы научного исследования. Для получения экспериментальных физико-химических и микробиологических показателей используются общепринятые ГОСТы, стандартные и стандартизированные методики физико-химического, биохимического и микробиологического анализов, методы математического моделирования и обработки экспериментальных данных.
Полученный продукт обладает пребиотическим эффектом, стимулируя рост и жизнедеятельность эндогенной микрофлоры желудка, тем самым повышая перевариваемость корма, его усвояемость. Так же осуществляется профилактика желудочно-кишечных заболеваний, что снизит процент гибели молодняка сельскохозяйственных животных по причине острых кишечных заболеваний. Ферментация сыворотки молочными дрожжами и бифидобактериями повысит содержание витаминов и ряда биологически активных веществ, что существенно скажется на биологической ценности рационов.
Себестоимость продукции составит 57,57 рублей за 1 кг добавки. Рентабельность производства добавки 26,1%.
ОПРЕДЕЛЕНИЯ, ОБОЗНАЧЕНИЯ И СОКРАЩЕНИЯ
ПОС – пектиновые олигосахариды
ГОС — галактоолигосахариды
ФОС — фруктоолигосахариды
КОС – кислые олигосахариды
ВВЕДЕНИЕ
Предполагается, что к 2050 году число людей в мире достигнет 9 миллиардов. Постоянный рост человеческой популяции неразрывно связан с растущим спросом на продукты питания растительного и животного происхождения. По этой причине ученые ищут решения, позволяющие интенсифицировать производство продуктов питания, одновременно снижая производственные затраты и соблюдая высокие стандарты качества и безопасности (как для людей, так и для окружающей среды). Виды используемых кормовых добавок влияют на здоровье животных и увеличивают производство высококачественного мяса, яиц, молока и рыбы. Животноводство неотделимо от питания и здоровья потребителя, а кишечные патогенные микроорганизмы животных, такие как Campylobacter, Salmonella, Listeria и Yersinia, являются прямым источником загрязнения пищи и причиной зоонозов. Поэтому внедряются новые методы разведения животных, направленные на повышение качества и безопасности мяса, с учетом благополучия животных и уважения к окружающей среде.
И корм для животных, и кормовые добавки должны соответствовать некоторым строгим критериям, без одновременного увеличения затрат на животноводство. В прошлом антибиотики и другие лекарственные средства широко использовались, главным образом, для изменения пищевой микробиоты и повышения продуктивности и роста животных. Долгосрочное использование этих веществ привело к развитию устойчивых к лекарствам микроорганизмов, представляющих угрозу для здоровья потребителей и оказывающих негативное воздействие на окружающую сред. В результате с 1 января 2006 года в Европейском Союзе было запрещено использование стимуляторов роста на основе антибиотиков. Поэтому были найдены альтернативные природные вещества, обеспечивающие аналогичные эффекты. Регламент (ЕС) № 1831/2003 Европейского парламента и Совета от 22 сентября 2003 года о добавках, используемых в питании животных, упоминает пробиотики и пребиотики среди других веществ, в Регламенте (ЕС) № 767/2009 о размещение на рынке и использование корма, этот аспект не изменился. Большие надежды также связаны с синергетической комбинацией обоих этих компонентов, а именно так называемых синбиотиков.
Для правительства Российской Федерации и всего аграрного сектора в текущей экономической ситуации решение проблемы увеличения объёмов производства сельскохозяйственной продукции, а также её экологической безопасности выходит на одно из лидирующих мест.
Целью научного исследования является разработка технологии получение пребиотических компонентов с использованием вторичного сырья на основе ферментативного гидролиза пектина ферментами дрожжей Saccharomyces сerevisiae.
Процессы культивирования дрожжей с целью получения вина, хлеба, кваса известны человечеству с глубокой древности. Не потеряли своей актуальности дрожжи и в настоящее время. Наряду с традиционным направлением использования, дрожжи используются в качестве основы в генной инженерии и не менее широко используются автолизаты дрожжей как концентраты белка и биологически активных веществ (витаминов, макро- и микроэлементов) для различных отраслей пищевой промышленности. Важная особенность дрожжей Saccharomyces сerevisiae, значимая для данной работы, заключается в отсутствии фермента β-галактозидазы, и, как следствие, они не способны расщеплять и усваивать лактозу.
Исследованная возможность роста дрожжей в среде с пектином при отсутствии других доступных для них углеводов – новое направление в биологии дрожжей Saccharomyces сerevisiae. Рост дрожжей за счет пектина возможен при одновременно протекающем ферментативном гидролизе с образованием различных форм галактуроновой кислоты – главного компонента молекулы пектина, и продуктов деструкции макромолекулы – пектиновых олигосахаридов (ПОС). ПОС являются важным фактором здоровья человека и животных.
Пектиновые олигосахариды, полученные химическими способами из пектинов растительных источников, чаще всего обладающих априори лечебными свойствами, широко изучаются медициной с целью лечения различных трудно поддающихся медикаментозному лечению заболеваний.
Использование пектиновых олигосахаридов (ПОС) для создания особых продуктов и кормов, обладающих выраженными функциональными пребиотическими свойствами, является новым актуальным направлением использования пектина. В данном исследовании приоритетом в выборе сырья и способов деструкции пектина до уровня ПОС являлись доступность, стоимость, экологичность.
1 АНАЛИТИЧЕСКИЙ ОБЗОР ЛИТЕРАТУРЫ
1.1 Использование пробиотиков в животноводстве
Термин «пробиотик» происходит от двух греческих слов («про» и «биос») и означает «для жизни». Первая концепция пробиотиков была предложена в 1907 г. Мечниковым [18], который отметил, что бактерии кисломолочных продуктов могут оказывать благотворное влияние на естественную микрофлору кишечника. Термин «пробиотик», вероятно, был придуман Фердинандом Вергиным, который в своей статье 1954 года под названием «Anti-and Probiotika» сравнивал вредное действие антибиотиков и других антимикробных агентов на кишечную микробиоту с благоприятным эффектом («пробиотика») изолированных бактерий [25]. Со временем определение пробиотика было расширено.
Современное определение, сформулированное в 2002 году экспертами рабочей группы ФАО/ВОЗ, гласит, что пробиотики являются «живыми штаммами строго отобранных микроорганизмов, которые при введении в адекватных количествах приносят пользу здоровью хозяина» [29]. Это определение было сохранено в 2013 году Международной научной ассоциацией по пробиотикам и пребиотикам (ISAPP). Термин «пробиотик» зарезервирован для формул или продуктов, которые соответствуют некоторым строго определенным критериям. Наиболее важные из этих критериев включают: надлежащее количество жизнеспособных клеток, благотворное влияние на здоровье хозяина (которое может также включать стимуляцию роста собственной микрофлоры) и благотворное влияние на функцию пищеварительного тракта.
Эффективность пробиотических препаратов зависит от множества факторов. По этой причине правильный выбор бактериальных штаммов и применение правильной дозы очень важно. Из-за их благотворного влияния на здоровье и стимуляции роста пробиотики широко используются в кормах для животных, особенно для свиней и птицы. Составы этого типа могут содержать один или несколько выбранных штаммов микроорганизмов, и в зависимости от вида и возраста животных-хозяев их можно вводить в виде порошка, суспензии, капсул, пеллет, геля или пасты. Они используются периодически или постоянно, непосредственно перорально или в качестве добавки к корму и премиксам. Пробиотические культуры, используемые в качестве кормовых добавок, должны соответствовать определенным критериям.
Критерии отбора и требования к пробиотическим штаммам
Отбор новых пробиотических организмов включает в себя штаммы и клоны микроорганизмов, демонстрирующих наиболее полезные или наиболее специфические эффекты. Оценка в основном сфокусирована на безопасности и соотношении пользы и риска, связанных с использованием данного пробиотического штамма. Микроорганизмы, используемые для производства пробиотических формул для животных, должны быть изолированы от особей, принадлежащих к виду, для которого они предназначены, поскольку часть полезных для здоровья эффектов, вероятно, зависит от вида. Благодаря этой процедуре полученный биологический материал максимально адаптирован к условиям, присутствующим в пищеварительном тракте данного вида животных [35]. Кроме того, пробиотические культуры, добавляемые в корм, должны быть устойчивы к температурам и давлениям, используемым в процессе гранулирования, а также к влажности и воздействию вредных веществ во время обработки и хранения кормов, таких как тяжелые металлы или микотоксины. Период высокой активности пробиотиков в кормах и премиксах не должен быть короче 4 месяцев [35]. Чтобы продлить этот период, формулы инкапсулированы, что приводит к увеличению выживаемости штаммов [36].
Пробиотические микроорганизмы
Пробиотические продукты могут содержать один или несколько выбранных микробных штаммов. Микроорганизмы, используемые в качестве кормовых добавок в РФ, в основном являются бактериями (таблица 1). Чаще всего это грамположительные бактерии, принадлежащие к следующим родам: Bacillus, Enterococcus, Lactobacillus, Pediococcus, Streptococcus. Также пробиотиками являются некоторые штаммы грибов и дрожжей видов Saccharomyces cerevisiae и Kluyveromyces. Бактерии, принадлежащие к видам Lactobacillus и Enterococcus, являются компонентами естественной микробиоты желудочно-кишечного тракта животных и обычно присутствуют в количествах 107–108 и 105–106 КОЕ/г соответственно. Дрожжи и бактерии рода Bacillus обычно не присутствуют в желудочно-кишечной системе. Большинство вышеперечисленных микроорганизмов должны быть потенциально безопасными для хозяина. Тем не менее, некоторые из них могут создавать проблемы; например, бактерии рода Enterococcus могут участвовать в передаче устойчивости к антибиотикам, а бактерии вида Bacillus cereus способны продуцировать эндотоксины и рвотные токсины [38].
В 2005 году только 13 из 21 пробиотических продуктов были одобрены в качестве кормовых добавок в ЕС для использования поросятами, а некоторые — для свиноматок и свиней [39]. Семь из этих продуктов содержали штаммы Enterococcus faecium (естественная среда желудочно-кишечного тракта), два из них содержали споры рода Bacillus (чаще всего встречающиеся в почве), еще два содержали дрожжи Saccharomyces cerevisiae, и только один содержал Lactobacillus farciminis и штаммы Pediococcus acidilactici, встречающиеся в желудочно-кишечном тракте и в молочных продуктах [39]. Следовательно, происхождение штаммов, которые могут потенциально использоваться в качестве кормовых добавок, может быть различным. Однако важно, чтобы пробиотические организмы присутствовали в соответствующих количествах. Рекомендуемая доза для большинства пробиотических штаммов составляет 109 КОЕ/кг корма [39].
На пробиотики распространяются правила, содержащиеся в общем законе о пищевых продуктах, и в соответствии с ними они должны быть безопасными для здоровья людей и животных.
Таблица 1 – Пробиотики, использующиеся в животноводстве
| Lactobacillus | Bifidobacterium | Другие молочнокислые бактерии | Другие микроорганизмы |
| L. brevis | B. animalis | Enterococcus faecalis | Bacillus cereus |
| L. casei | B. longum | Enterococcus faecium | Bacillus licheniformis |
| L. crispatus | B. pseudolongum | Lactococcus lactis | Bacillus subtilis |
| L. farciminis | B. thermophilum | Leuconostoc citreum | Propionibact. Freudenreichi |
| L. fermentum | — | Leuconostoc lactis | Saccharomyces cerevisiae (boulardi) |
| L. murinus | — | Leuconostoc mesenteroides | Saccharomyces pastorianus |
| L. gallinarium | — | Pediococcus acidilactici | Kluyveromyces fragilis |
| L. paracasei | — | Pediococcus pentosaceus | Kluyveromyces marxianus |
| L. pentosus | — | Streptococcus infantarius | Aspergillus orizae |
| L. plantarum | — | Streptococcus salivarius | Aspergillus niger |
| L. reuteri | — | Streptococcus thermophilus a | — |
| L. rhamnosus | — | Sporolactobacillus inulinus | — |
| L. salivarius | — | — | — |
Готовые пробиотические составы для животных обычно содержат один, два или более штаммов микроорганизмов [48]. Из-за содержания жизнеспособных микроорганизмов пробиотические составы чувствительны к неблагоприятным условиям, таким как температура и свет. Важно, чтобы при введении пробиотиков не использовались никакие другие вещества, а вода, используемая для разбавления, не содержала хлора или других дезинфицирующих средств. Воду с формулой следует вводить животным в течение 6–12 часов. Интервал 24–48 ч между окончанием антибактериальной терапии или введением любых других противомикробных препаратов и началом пробиотической терапии также важен. Формулы, содержащие много ингредиентов (наибольшее количество видов микробов), как правило, наиболее эффективны [49].
Пробиотики в животноводстве
Сельскохозяйственные животные подвергаются стрессу, связанному с окружающей средой (например, методы выращивания, рацион и т.д.). Различные факторы могут вызвать нарушение баланса в кишечной экосистеме и могут стать факторами риска патогенных инфекций. Независимо от вида, здоровье животных имеет решающее значение для производственной цепочки. Использование пробиотиков в кормлении животных связано с их подтвержденной эффективностью при модуляции кишечной микробиоты. Введение пробиотических штаммов, как индивидуальных, так и комбинированных, может оказывать существенное влияние на усвоение и использование корма, ежедневное увеличение массы тела и общей массы тела различных животных. Добавление пробиотических микроорганизмов в корм приводит к улучшению количества и качества молока, мяса и яиц [59]. В случае поросят основным ожидаемым эффектом от пробиотиков является снижение частоты диареи, что создает проблему в первые недели после отъема. Эффективность пробиотиков в борьбе с диареей является одним из наиболее часто изучаемых аспектов. Рекомбинированные пробиотики являются одним из самых новых биомедицинских применений генетически модифицированных организмов (ГМО) [59]. Отсутствие клинических побочных эффектов является важным преимуществом пробиотиков.
В случае свиноводства отлучение является критическим моментом, когда животные наиболее подвержены стрессу (переход от питания к молоку на рацион на основе растительных полисахаридов). Также меняется условия содержания. Все эти факторы могут нарушать иммунологические функции и оказывать негативное влияние на баланс кишечной микробиоты свиней [61]. Бемер и соавт. [62] использовали корм с добавлением добавки пробиотического штамма Enterococcus faecium DSM 7134 при кормлении 33 свиноматок в период между 90-м днем беременности и 28-м днем лактации. Наблюдалось значительное улучшение потребления корма, количества потомства и веса изучаемых животных. Повышенное потребление корма и продуктивность могут помочь предотвратить так называемую «голодную стерильность» молодых свиноматок, вызванную снижением потребления корма наряду с мобилизацией тканей организма и недостатком энергии во время лактации [62]. Пробиотики оказывают положительное влияние на различные процессы пищеварения, особенно на целлюлолитические, и синтез микробных белков [63]. Авторы [64] изучали эффективность пробиотической формулы, содержащей два штамма рода Lactobacillus и один штамм каждого клона: Bifidobacterium, Enterococcus, Pediococcus, по сравнению с авиламицином. Эксперимент проводился на 400 цыплятах-бройлерах в течение 6 недель. Было обнаружено, что введение пробиотика вызывало стимуляцию роста животных, сравнимое с эффектом лечения авиламицинсодержащим продуктом. Кроме того, добавление формулы в корм и/или воду для цыплят вызывало значительный пробиотический эффект за счет модуляции состава и активности кишечной микробиоты [64].
Также было подтверждено положительное влияние корма, дополненного бактериальными штаммами Bacillus licheniformis и Bacillus subtilis [65], на качество молока (содержание жира и белка) и увеличение массы тела ягнят. Пробиотик использовался в поздний период беременности и во время кормления молоком. Другие исследования показали, что добавление пробиотика Bio Plus 2B®, содержащего штаммы Bacillus subtilis и Bacillus licheniformis, привело к значительному улучшению показателей крови свиноматок (более высокий уровень холестерина и общего липида) и параметров молока (более высокое содержание молочного жира и белка) во время кормление молоком [66]. Авторы [67] определили влияние пропаренной кукурузы с добавлением культуры Aspergillus oryzae в рацион коров на их молочную продуктивность. Эксперимент проводился на 32 коровах в течение 70 дней. Было подтверждено, что добавление A.oryzae в пропаренную кукурузу приводило к увеличению процентного содержания белка и сухих обезжиренных твердых веществ (Solids-Not-Fat, SNF) в молоке. В исследованиях [68] основное внимание уделялось влиянию пробиотиков: YEASTURE, MICROBOND и фитобиотиков: YUCCA, QUILLAYA на рост свиней и качество мяса. Было установлено, что исследуемые пробиотики способствовали увеличению массы туш в группе экспериментальных животных. Кроме того, эти формулы также влияли на улучшение кулинарных свойств свинины, снижение потерь при варке и улучшение нежности мяса. Однако в группах, получавших фитобиотики, по сравнению с контролем не было обнаружено значительного улучшения суточного увеличения массы тела и продукции туш.
Кроме того, пробиотики способствуют увеличению производства и улучшению качества яиц [69, 70], а также уменьшению загрязнения сальмонеллы в яйцах [71].
1.2 Пребиотики
Помимо пробиотиков, в качестве натуральных кормовых добавок используются также пребиотики. Уже в 1921 году Реттгер и Чеплин сообщили, что после употребления углеводов кишечная микробиота человека обогащается молочнокислыми бактериями [91]. Концепция пребиотика была впервые принята в 1995 году [92]. С тех пор эта концепция эволюционировала. Используемое в настоящее время определение было описано в декабре 2016 года Международной научной ассоциацией пробиотиков и пребиотиков (ISAPP). В определении говорится, что в группу пребиотиков могут входить другие вещества, помимо углеводов (например, полифенолы и полиненасыщенные жирные кислоты, превращенные в соответствующие сопряженные жирные кислоты), и они могут действовать не только в пищеварительном тракте. Другим важным аспектом является то, что они больше не ограничиваются человеческой пищей, но могут также рассматриваться в других категориях, таких как питание животных. Однако требования, касаемо избирательных механизмов модуляции микробиоты, а также эффектов задокументированных благоприятных воздействий на здоровье хозяина, должны быть соблюдены [93].
Многие различные питательные вещества, такие как пектины, целлюлоза и ксиланы, способствуют развитию различных кишечных микроорганизмов. Пребиотики не должны подвергаться интенсивному метаболизму, а должны вызывать целенаправленные метаболические процессы, принося таким образом пользу для здоровья экосистемы хозяина. Наиболее изучено в качестве пребиотиков фруктаны и галактаны [94]. Это явление объясняется, среди прочего, легкой способностью к разложению связей, присутствующих в структуре фруктоолигосахаридов (FOS) и галактоолигосахаридов (GOS), некоторыми ферментами, такими как β-фруктанозидаза и β-галактозидаза, обычно встречающиеся в роду Bifidobacterium. Некоторые типы пищевых волокон можно считать пребиотиками. При оценке влияния пребиотиков на здоровье необходимо учитывать тот факт, что все группы животных различаются по анатомии, физиологии, питанию, кишечной микробиоте и среде обитания [95].
Критерии выбора пребиотика
Чтобы определить и продемонстрировать, что вещество является потенциальным пребиотиком, необходимо указать его источник, происхождение, чистоту, химический состав и структуру.
По словам Вана [100], существует пять основных критериев классификации пищевых компонентов в качестве пребиотиков. Прежде всего, предполагается, что пребиотические вещества должны быть устойчивы к пищеварению в верхних отделах пищеварительного тракта. В результате пребиотики достигают толстой кишки, где они избирательно ферментируются потенциально полезными кишечными бактериями (второй критерий). Ферментация может привести к изменениям метаболических процессов и улучшению работы иммунологической системы, что оказывает благотворное влияние на здоровье хозяина (третий критерий). Очень важным является избирательная стимуляция роста пробиотических бактерий (еще один критерий). Также важны технологические особенности пребиотиков, связанные с их успешным производством и доступностью для бактериального обмена в кишечнике (последний критерий).
Пребиотические вещества
Среди пребиотических веществ имеются: неабсорбируемые углеводы (олигосахариды и полисахариды), пептиды, белки и липиды. Бобовые, фрукты и злаки являются естественными источниками пребиотиков. Однако многие подобные вещества синтезируются промышленными химическими и ферментативными методами [101]. Некоторые обычно используемые пребиотики: фруктоолигосахариды (FOS), олигофруктоза, транс-галактоолигосахариды (TOS), глюкоолигосахариды, гликоолигосахариды, лактулоза, лактит, мальтоолигосахариды (MOS), ксилоолигосахариды, стахиоза и рафиноза. Когда они достигают толстой кишки, эти вещества становятся питательными субстратами для полезных кишечных бактерий [107]. По свойствам, которые определяют благоприятное влияние на здоровье хозяина, пребиотики можно разделить на следующие группы: не перевариваются (или только частично перевариваются), не всасываются в тонкой кишке, плохо ферментируются бактериями в полости рта, хорошо ферментируются кишечными бактериями, плохо ферментируются потенциальными патогенами в кишечнике [108]. Пребиотиками, наиболее часто используемыми в кормлении скота, являются [108, 109]: ФОС, ГОС, инулин, изомальтоолигосахариды (ИМО), ксилоолигосахариды (ХОС), лактитол, лактулоза, злаковые волокна. При составлении композиции пребиотических формул важно определить подходящую дозировку. Передозировка пребиотиков может привести к метеоризму и диарее. Большое преимущество таких формул заключается в том, что они могут использоваться в течение длительного времени и в профилактических целях, не оказывая неблагоприятного воздействия. В таблице 2 представлены примеры составов, используемых в кормлении скота и содержащих пребиотические вещества.
Таблица 2 – Коммерческие препараты пребиотиков для животных
| Торговое название | Пребиотик | Группа животных |
| Bacto CS1000 | Полисахариды, олигосахариды | птица |
| BionatStart | мальтоолигосахариды, β-глюканы | телята |
| DOLSORB DN (Dolfos) | мальтоолигосахариды, β-глюканы | птица |
| MetSac MOS (VITTRA) | мальтоолигосахариды, β-глюканы | Телята, поросята, птица |
| Mycocyd forte (Herbiline) | β-глюканы | птица |
| Mycostop (Extra-vit) | мальтоолигосахариды, β-глюканы | Птица, поросята |
| PROFEED® (Beghin Meiji) | фруктоолигшосахариды | Лошади, поросята, птица, телята |
| Bacto CS1000 | Полисахариды, олигосахариды | птица |
| BionatStart | мальтоолигосахариды, β-глюканы | телята |
| DOLSORB DN (Dolfos) | мальтоолигосахариды, β-глюканы | птица |
| MetSac MOS (VITTRA) | мальтоолигосахариды, β-глюканы | Телята, поросята, птица |
| Mycocyd forte (Herbiline) | β-глюканы | птица |
| Mycostop (Extra-vit) | мальтоолигосахариды, β-глюканы | Птица, поросята |
| PROFEED® (Beghin Meiji) | фруктоолигосахариды | Лошади, поросята, птица, телята |
Пребиотики для животных
В исследованиях влияния пребиотиков на желудочно-кишечную микробиоту и общее состояние здоровья свиней используются различные кормовые добавки. Авторы [110] вводили TOS в дозе 35 г/кг корма для свиней в течение 6 недель. По сравнению с контрольной группой в стуле было обнаружено значительное увеличение количества Bifidobacterium и Lactobacillus. Цортзис и др. [111] использовали новую смесь GOS, полученную в результате активности галактозилтрансферазы в бактериях Bifidobacterium bifidum 41171. Введение этого пребиотика свиньям в дозе 40 г/кг корма в трехступенчатой системе непрерывного культивирования вызвало значительное увеличение количества Bifidobacterium и уровня уксусной кислоты при одновременном снижении рН в кишечнике по сравнению с контрольной группой и рационом с добавлением инулина. Более того, изученная смесь олигосахаридов вызывала сильное ингибирование адгезии Escherichia coli (ETEC) и Salmonella enterica серотипа Typhimurium к клеткам HT29 в исследованиях in vitro [111]. Также было проведено интересное исследование влияния сортов ячменя и овса с различным содержанием углеводов на кишечную микробиоту 72 поросят-отъемышей в течение 15 дней. Было обнаружено, что повышенные уровни β-глюкана и изменения в соотношении амилопектина и амилозы приводят к селективной модуляции роста маслянокислых бактерий, которые способны гидролизовать некоторые сложные углеводы, такие как ксилан или β-глюкан. Таким образом, различия между сортами злаков по форме и количеству углеводов оказывали влияние на кишечную микробиоту поросят, а соответствующий выбор злаков оказывал положительное влияние на количество Bifidobacterium и Lactobacillus.
Сюй и соавт. [124] проверили влияние FOS в дозах: 0, 2, 4 и 8 г/кг корма на активность пищеварительных ферментов, а также на морфологию кишечника и микробиоту. Было обнаружено, что введение FOS в дозе 4 г/кг корма положительно влияло на среднесуточный рост исследуемых животных и на рост бактерий Bifidobacterium и Lactobacillus при одновременном ингибировании роста Escherichia coli в желудочно-кишечный тракт кур. С другой стороны, в исследовании Juśkiewicz et al. [112] у индеек в течение 8 недель, не было обнаружено влияния FOS, используемого в концентрациях 0,5, 1 и 2%, на рост и продуктивность животных. Тем не менее, снижение кишечного рН было отмечено в случае введения ФОС в концентрации 2%. Дополнение рациона цыплят-бройлеров пребиотиками приводит к снижению рН в желудочно-кишечном тракте и увеличению количества Lactobacillus и Bifidobacterium, вызванному увеличением количества летучих жирных кислот [113]. В своем исследовании Yusrizal и Chen [114] проверили влияние кормления цыплят-бройлеров фруктаном (цикорийного происхождения на рост птиц, длину и структуру кишечника исследуемых животных. Эксперимент проводился на 96 цыплятах-бройлерах в течение 6 недель. Было обнаружено улучшение прироста массы тела, оборота корма и снижение сывороточного холестерина. Кроме того, кормовые добавки с фруктанами вызывали увеличение количества бактерий рода Lactobacillus и уменьшение количества потенциальных патогенных микроорганизмов, таких как Salmonella и Campylobacter, в желудочно-кишечном тракте цыплят-бройлеров [114]. В своем исследовании Kleessen et al. [115] разводили 380 цыплят в течение 35 дней, давая им питьевую воду с добавлением фруктансодержащего (0,5%) сиропа на основе артишока. Было изучено влияние добавок фруктана на кишечную микробиоту животных. Было отмечено, что добавление фруктанов в питьевую воду вызывало снижение количества Clostridium perfringens и снижение уровня бактериального эндотоксина. Spring et al. [118] изучали влияние введения дрожжей Saccharomyces cerevisiae на снижение количества различных кишечных патогенов у цыплят. Было отмечено, что введение дрожжей привело к снижению количества сальмонелл в кишечнике цыплят на 26% по сравнению с контрольным животным, получавшим немодифицированную диету. Исследования, завершенные Thitaram et al. [119] подтвердили влияние изомальтоолигосахаридов (ИМО), вводимых в следующих концентрациях: 1, 2 и 4% (по массе) на кишечную микробиоту цыплят-бройлеров, зараженных Salmonella Typhimurium.
1.3. Синбиотики
Также в питании животных используются смеси, содержащие как пробиотики, так и пребиотики. В 1995 году Гибсон и Роберфроид ввели термин «синбиотик», указав таким образом «смесь пробиотиков и пребиотиков, которые благотворно влияют на хозяина, улучшая выживаемость и имплантацию живых микробных пищевых добавок в желудочно-кишечный тракт путем избирательной стимуляции рост и / или активация метаболизма одной или ограниченного числа полезных для здоровья бактерий и, таким образом, улучшение благосостояния хозяина »[92]. Поскольку слово «синбиотик» подразумевает синергизм, этот термин следует зарезервировать для тех продуктов, в которых пребиотический компонент избирательно благоприятствует пробиотическому микроорганизму [127]. Основной целью такого типа комбинации является улучшение выживаемости пробиотических микроорганизмов в желудочно-кишечном тракте. Синбиотики обладают как пробиотическими, так и пребиотическими свойствами и были созданы для того, чтобы преодолеть некоторые возможные трудности в выживании пробиотиков в желудочно-кишечном тракте [128]. Учитывая огромное количество возможных комбинаций, применение синбиотиков для модуляции кишечной микробиоты у животных представляется многообещающим [134].
Критерии выбора синбиотика
Прежде всего, пробиотические штаммы и пребиотики, рассматриваемые в процессе разработки синбиотической формулы, должны соответствовать всем критериям, представленным в «Критериях отбора и требованиях к пробиотическим штаммам» и «Критерии отбора пребиотиков». При составлении формулы синбиотика решающее значение имеет выбор пробиотиков и пребиотиков, которые оказывают благотворное влияние на здоровье хозяина при отдельном использовании. При выборе пробиотических веществ полезно определить их потенциально полезные свойства для метаболизма пробиотика. Формула может считаться синбиотиком, если подтверждена селективная стимуляция роста полезных микроорганизмов, наряду с отсутствием или ограниченной стимуляцией роста других микробов. Также следует учитывать технологические аспекты. Определение состава синбиотической формулы является чрезвычайно сложной задачей, требующей многих исследований.
Синбиотики для животных
Комбинация бактерий рода Bifidobacterium или Lactobacillus с ФОС в синбиотических продуктах представляется наиболее популярной. Доступные в настоящее время данные о влиянии синбиотика на здоровье животных недостаточны и требуют дальнейших исследований. Тем не менее, они четко указывают на эффективное синергетическое действие пробиотиков и пребиотиков в сокращении популяций бактериальных желудочно-кишечных патогенов.
Немцова и соавт. [137] подтвердили синергетический эффект бактерий Lactobacillus paracasei в сочетании с ФОС в микробиоте кишечника поросят. Исследователи наблюдали увеличение общего анаэробного и аэробного количества и увеличение числа полезных бактерий рода Lactobacillus и Bifidobacterium в группе животных, получавших синбиотик. В то же время количество бактерий рода Escherichia coli, Enterobacteriaceae и Clostridium уменьшилось [137].
Ли и соавт. [113] в 16-дневном эксперименте изучали влияние синбиотиков на рост, усвояемость питательных веществ, выброс вредных газов и состав кишечной микробиоты у 150 свиней в период отъема. Потребление добавки синбиотического продукта, содержащего комбинацию пробиотика (бактерии — 109 КОЕ / мл, дрожжи — 105 КОЕ / мл, плесень — 103 КОЕ / мл) и пребиотик (мальтоолигосахарид, ацетат натрия, цитрат аммиака) приводило к улучшению усвоения питательных веществ, уменьшению выбросов вредных газов и предотвращению бактериальных инфекций в период отлучения от груди [138].
Mohnl et al. [139] отметили, что синбиотический продукт (Biomin® PoultryStar) обладает сравнимым потенциалом роста с авиламицином (стимулятором роста на основе антибиотиков) у цыплят-бройлеров. Висенте и соавт. [140] подтвердили действие синбиотического продукта, содержащего Lactobacillus spp. с добавлением лактозы. У 320 индеек, инфицированных сальмонеллой, было продемонстрировано положительное влияние синбиотика на конверсию корма и увеличение массы тела. Li et al. [141] оценивали эффект введения ФОС и Bacillus subtilis на рост цыплят-бройлеров. У 720 шт цыплят-бройлеров наблюдали улучшение среднесуточного прироста и коэффициента конверсии корма, а также снижение частоты возникновения диареи и смертности животных по сравнению с животными, получавшими ауреомицин (антибиотик тетрациклин). Во время введения комбинации бактерий Bifidobacterium lactis с галактоолигосахаридами цыплятам-бройлерам в течение 40-дневного периода выращивания, в кишечной микробиоте исследуемых животных наблюдалось значительное увеличение количества Bifidobacterium и Lactobacillus и общей популяции анаэробных бактерий. Однако никакого влияния на потребление и преобразование корма, а также на массу тела не наблюдалось. Авад и соавт. [142] изучали влияние синбиотического продукта, содержащего бактерии Enterococcus faecium и ФОС в качестве пребиотика, и иммуномодулирующих веществ из морских водорослей (фикофитных веществ) на здоровье цыплят-бройлеров. Изучено 600 цыплят-бройлеров, выведенных в течение 5 недель. По сравнению с контрольными животными обнаружено значительное увеличение среднесуточного прироста массы тела, коэффициента туш и коэффициента конверсии корма. Однако никакого эффекта синбиотика на увеличение массы тела не наблюдалось, за исключением тонкой кишки, в которой в двенадцатиперстной кишке и подвздошной кишке наблюдался значительный рост кишечных ворсинок. На основании исследования 240 цыплят-бройлеров было установлено, что пробиотики и пребиотики оказывают благоприятное влияние на показатели производительности, в некоторые сроки даже превосходящие антибиотики, используемые для сравнения. Кроме того, было замечено, что добавка пребиотиков может быть полезна для уменьшения абдоминального жира после 42 дней размножения. Было отмечено, что пробиотики и пребиотики могут быть использованы в качестве заменителей стимуляторов роста на основе антибиотиков [143].
Подводя итог, исследователи сходятся во мнении, что синбиотические продукты обеспечивают лучшую эффективность по сравнению с раздельным применением пробиотиков и пребиотиков [121, 142, 144, 145]. В таблице 9 приведены примеры результатов исследований, посвященных
1.4 Пектиновые олигосахариды и их пребиотический потенциал
Наиболее широко распространенными пребиотиками являются лактулоза, инулин, фруктоолигосахариды (FOS), галактоолигосахариды (GOS) и олигосахариды молока человека (HMO). Однако существует растущий список потенциальных пребиотиков, некоторые из которых уже коммерциализированы, а другие, такие как полидекстроза (PDX), пектиновые олигосахариды (ПОС), бактериальные экзополисахариды (EPS), полисахариды, полученные из водорослей и сахарные спирты, которые все еще находятся на ранних стадиях исследования [115].
Пектиновые олигосахариды (ПОС) совсем недавно были выявлены как пребиотики и их потенциал в настоящее время оценивается.
ПОС являются олигосахаридами, которые могут быть получены путем частичного гидролиза пектинов, которые являются гетерополисахаридами с очень сложной структурой. Пектин имеет большое количество применений, включая его применение в качестве ингредиента для лечения желудочно-кишечных расстройств, диабета, высокого кровяного давления или гиперхолестеринемии [121-123]. В настоящее время основными источниками пектина являются целлюлоза цитрусовых и яблочный жмых, но этот полимер можно найти и в других агропродуктах, таких как свекловичный жом [124].
Пектины в основном состоят из блоков галактуроновой кислоты (GalA), соединенных α-(1,4), которые могут быть случайным образом ацетилированы в положениях О-2 и / или О-3 и метилированы при С-6. Эта фракция известна как «гладкая область», и она иногда прерывается «шероховатой областью», где можно найти боковые цепи, образованные различными нейтральными сахарами. На рисунке 1 показаны основные структурные фрагменты пектина:
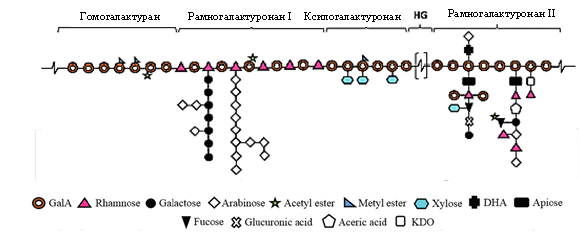
Рисунок 1 – Структура пектина
где GalА – галактуроновая кислота, Rhamnose – рамноза, Galactose — галактоза, Arabinose — арабиноза, Acetyl ester – ацитилированная связь, Metyl ester – метилированная связь, Xylose –ксилоза, DHA — деоксиликсогептулопураноновая кислота ,Apiose – апиоза, Fucose – фукоза, Glucuronis acid – глюкуроновая кислоты, KDO — кетодеоксиманнооктулопириловая кислота
а) Гомогалактуронан. Гомогалактуронан представляет собой линейный полимер, состоящий из цепи с расчетной длиной 72-100 единиц галактуроновой кислоты, которая составляет примерно 60% от общего количества пектина [117].
Степени ацетилирования и метилирования (DA и DM соответственно) изменяются в зависимости от происхождения и стадии развития растения [118].
б) Ксилогалактуронан. Ксилогалактуронан представляет собой цепь остатков галактуроновой кислоты, частично замещенных остатками D-ксилозы, соединенных β- (1,3) звеньями в положениях C-3 и / или C-2.
в) Рамногалактуронан I. Он представляет собой до 7-14% пектинов [119] и содержит чередующиеся звенья α- (1,4) -галактуронозила и α- (1,2) -рамнозила. Во многих случаях остатки рамнозы показывают боковые цепи в качестве заместителей в положении О-4, состоящие из арабинана и / или арабиногалактана I и II, хотя могут быть также найдены более низкие концентрации ксилозы или глюкозы [118].
г) Рамногалактуронан II. Представляет собой область, характеризующуюся длиной 7-9 единиц галактуроновой кислоты, где могут существовать сложные ветви, состоящие из 12 типов моносахаридов (как максимум), включая некоторые мономеры меньшинства, такие как апиоза, фукоза, уксусная кислота [120].
Способы получения пектиновых олигосахаридов. Исходным сырьем для получения пектиновых олигосахаридов могут служить апельсиновая корка, корень цикория, цитрусовые корки, цветная капуста, пульпа эндивия, соцветие подсолнечника, свекловичный жом, яблочный жом, мякоть лайма, соевая шелуха, виноградная кожица.
Для того, чтобы образовались низкомолекулярные полисахариды необходимо воздействовать на их ковалентные связи, то есть осуществить деполимеризацию крупных молекул. Для получения ПОС как из агропромышленных побочных продуктов, так и из очищенных пектинов используются несколько методов, в том числе частичный ферментативный гидролиз, кислотный гидролиз, гидротермическая обработка, динамическая микрофлюидизация под высоким давлением или фотохимическая реакция в средах, содержащих TiO2 [124].
Ферментный метод. Использование ферментов для получения пектиновых олигосахаридов основано на их высокой специфичности и избирательности. Использование ферментов по сравнению с другими методами предварительной обработки рассматривается как безопасный метод благодаря минимальному риску образования вредных химических модификаций конечных продуктов. Обычно используется несколько пектин-деградирующих ферментов, которые действуют синергетически. Сложные метиловые эфиры и ацетильные группы на остатках галактуроновой кислоты удаляются пектинметилэстеразой и пектинацетилэстеразой. Оба фермента действуют перед воздействием эндополигалактуроназы, которая способна расщеплять гликозидную связи α-(1→4)-полигалактуронана случайным образом. Эндополигалактуроназа обычно более склонна воздействовать на неэтерифицированный субстрат и проявляет пониженную активность с увеличением степени метоксилирования пектинов. Экзополигалактуроназа действует на субстрат с невосстанавлявающего конца и способна удалять 1-связанные остатки галактуроновой кислоты гомогалактуронановых цепей.
Рамногалактуронановые участки разветвленных «шероховатых» областей могут деградироваться последовательно рамногалактуронангидролазой и рамногалактуронанлиазой, действующие на α-D-1,4- GalpA- α-L-1,2- Rhap и α-L-1,2- Rhap- α-D-1,4- GalpA связи рамногалактуронановой цепи, соответственно. Рамногалактуронанацетилэстераза является экзодействующей пектиназой, активной по отношению к ацетильным группам и также удаляет концевые остатки рамнозы.
Удаление боковых цепей рамногалактуронана может быть достигнуто воздействием нескольких ферментов, таких как арабинофуранозидаза В, которая удаляет концевые остатки арабинозы арабинановых боковых цепей пектинов, эндоарабиназа, которая гидролизует линейные области арабинановой цепи и способствует высвобождению олигомеров арабинозы, экзоарабиназы, которые удаляют арабинозу, арабинобиозу и арабинотриозу из линейного α-связанного арабинана. Совместное действие этих ферментов приводит к быстрой деградации арабинанов. С другой стороны, относительно длинные (1→4)-связанные галактановые боковые цепи могут быть деградированы эндогалактаназой, в то время как β-галактозидаза может удалять терминальные остатки галактозы из галактанов или арабиногалактанов.
Восемь разветвленных нейтральных арабиноолигосахаридов (α-1,5-связанной основы L-арабинофуранозиловых остатков) из арабинана сахарной свеклы были получены с использованием смеси арабиногидролаз, abn 1 (эндоарабиназа), abn 2 (экзоарабиназа) и abn 4 (арабинофуранозидаза). Холк с соавторами разделили свекловичный пектин на гомогалактуронан и рамногалактуронан-I путем последовательного применения ферментов, таких как пектинлиаза, β-галактозидаза-1, β-галактозидаза-2, арабинофуранозидаза и арабинаназа. На продукцию олигосахаридов влияют такие характеристики процесса, как время, температура, концентрация ферментов и присутствие или отсутствие специфического фермента. Предполагают, что разветвленные арабиноолигосахариды могут образоваться, если в смеси ферментов нет арабинофуранозидаза. При этом более высокая ферментная нагрузка приводит к ускоренному превращению арабинана в арабинозу. Наличие галактуроновой кислоты и олигомеров с низкой степенью полимеризации указывало на присутствие экзополигалактуроназы, которая расщепляет олигомеры полигалактуроной кислоты.
Отсутствие рамногалактуронангидролазы и рамногалактуроназы приводило к продукции устойчивых олигосахаридов, в то время как присутствие рамногалактуроназы приводило к продукции рамногалактуронановых олигомеров.
Ферулоилированные арабинозные ди-, три-, гекса-, гепта- и окта-сахариды, также, как и ферулоилированные галактозные дисахариды были получены после гидролиза свекловичной пульпы дриселазой. Для получения гомогалактуронановых и рамногалактуронановых олигосахаридов применяли гидролиз картофельной пульпы с помощью пектинлиазы, полигалактуроназы и пектинметилэстеразы.
Полисахариды пектина (ПОС) были предложены в качестве нового класса пребиотиков, способных оказывать ряд оздоровительных эффектов, включая [24] стимуляцию апоптоза в клетках аденокарциномы толстой кишки человека, потенциал для сердечно-сосудистой защиты in vivo, уменьшение воздействия тяжелых металлов, антибиотические эффекты, антитоксические, антиинфекционные, антибактериальные и антиоксидантные свойства.
Основными производными продуктами кишечной бактериальной ферментации ПОС, а также других пищевых волокон являются КЦЖК (ацетат, пропионат и бутират). КЦЖК имеют следующее влияние в организме: играют ключевую роль в профилактике и лечении метаболического синдрома, расстройств кишечника и рака; оказывают защиту от ожирения, вызванного питанием, учувствуют в регуляции гормонов кишечника; оказывают положительный эффект при лечение язвенного колита, болезни Крона и связанной с антибиотиками диареи и ожирения. В частности, бутират является основным источником энергии для колоноцитов, пропионат играет роль в процессах глюконеогенеза, а ацетат используется для липогенеза.
В нижеследующих пунктах обобщаются результаты, полученные в результате недавних исследований in vitro и in vivo, проведенных с использованием ПОС в качестве субстрата:
a) Исследования in vitro
Отходы переработки цитрусовых и сахарной свеклы подвергали гидротермической обработке, а полученные растворы очищали мембранной фильтрацией. Конечные смеси ПОС затем ферментировали с помощью образцов фекалий человека, что приводило к увеличению бактериальной популяции до восьми различных групп. В частности, ПОС сахарной свеклы показали наивысший бифидогенный потенциал и максимальную концентрацию КЦЖК. Между тем наибольшее увеличение популяции Lactobacillus наблюдалось с использованием ПОС апельсиновой кожуры в качестве источника углерода, тогда как лучшие результаты для других бактериальных групп, таких как Eubacterium, Faecalibacterium или Roseburia, наблюдались для ПОС из цедры лимона. ТВ другом исследовании ПОС, полученные из свекловичного жома использовали в качестве субстратов в тестах на ферментацию in vitro. Экспериментально установлено, что ПОС приводя к увеличению популяций бифидобактерий (которые предпочитали фракции с низкой молекулярной массой), не стимулирует рост Clostridium. В недавнем исследовании с ПОС из сахарной свеклы, содержащей галактоолигосахариды, арабиноолигосахариды, и смеси кислотных олигосахаридов, не было обнаружено явного бифидогенного эффекта, но сообщалось о важном увеличении Faecalibacterium. Более того, концентрации КЦЖК были обнаружены выше в тестах с ПОС, чем с фруктоолигосахаридами.
Что касается яблочного пектина, сообщается, что ПОС может быть интересным кандидатом на пребиотик с немного улучшенными физиологическими свойствами, если их сравнить с коммерческими. В этом контексте Gulfi и др. [117] указали, что пектиновые «шероховатые области» из спелых яблок являются очень легко перерабатываемым субстратом для бактерий кишечника человека, что оказывает существенное влияние на продукцию pH и КЦЖК. Suzuki et al. [118] обнаружили, что арабиноолигосахариды из яблочного пектина, особенно те, которые состоят из более чем трех единиц, более избирательно используются Bifidobacterium adolescentis, B. longum и Bacteroides vulgatus, чем фруктоолигосахриды и ксилоолигосахариды. Между тем, Chen и др. [115] сообщили о способности ПОС из яблочного пектина к стимулированию роста бифидобактерий и лактобацилл, а также уменьшения количества бактериоидов и клостридий, тогда как ферментация очищенной смеси ПОС из яблочного жмыха с человеческими фекалиями привела к увеличению популяций Bifidobacterium, Eubacterium rectale и Lactobacillus, но также Clostridium и Bacteroides [121].
Некоторые авторы как Мандалари и др. [122] использовали другие типы источников пектина, демонстрируя, что семена миндаля, которые содержат богатый арабинозой пектин, обладают потенциалом для их использования в качестве новых источников пребиотиков, увеличивая популяции бифидобактерий и Eubacterium rectale с последующим увеличением концентрации бутирата. Guevara-Arauza и др. [131] отметили, что ПОС из нопала действует как пребиотики, уменьшая производство аммония, увеличивая продукцию КЦЖК и поддерживая бифидогенные эффекты в течение более длительных периодов времени.
Кроме того, для выяснения структурно-функциональных отношений в ПОС Onumpai и др.[104] сравнивали ферментационные свойства пектиновых фракций и их родительских пектинов с использованием метода BCF. Все тестируемые углеводы увеличивали популяции бактериоидов, но только олигосахариды, полученные из галактана и арабинана, увеличивали количество бифидобактерий. С другой стороны, метилированные олигогалактурониды по сравнению с исходным полисахаридом и другими пектическими фракциями вызывали значительное увеличение популяций Faecalibacterium prausnitzii [117].
б) Исследования in vivo
Несмотря на успехи в моделях in vitro, исследования in vivo, связанные с использованием животных и особенно людей, являются наилучшими моделями для изучения изменений в популяциях микробиот. Тем не менее, они часто требуют специализированных средств и являются как дорогостоящими, так и трудозатратными, ограничивая количество таких анализов [125]. Jiao и др. [126] показали, что водорастворимые олигосахариды, выделенные из женьшеня, значительно ингибируют рост опухоли у мышей, усиливая их иммунную систему.
Что касается клинических анализов, Fanaro и др. [128] наблюдали увеличение количества бифидобактерий и лактобацилл путем введения ПОС в качестве компонента детских смесей.
Грудное молоко человека содержит нейтральные (75-85%) и кислые (15-25%) олигосахариды. Для получения продукта, лучше соответствующего по химическому составу материнскому молоку, к хорошо известным нейтральным пребиотикам — галактоолигосахаридам (ГОС) и длинноцепочечным фруктооли-госахаридам (ФОС) — добавили кислые олигосахариды (КОС), полученные при гидролизе пектина. Введение комбинации ГОС/ФОС/КОС в молочную смесь приводит к повышению содержания бифидобактерий и лактобацилл в фекалиях младенцев [123]. Схожие результаты продемонстрированы в другом исследовании [107]: повышение количества бактерий рода Bifidobacterium и снижение доли групп Bacteroides и Clostridium coccoides в фекалиях детей на смешанном вскармливании, получающих комбинацию ГОС/ФОС/КОС. Отмечено, что доля бифидобактерий значительно выше в группе детей, получавших ГОС/ФОС/КОС (по сравнению с группой ГОС/ФОС).
Наконец, потребление ПОС в смеси с короткоцепочечным ГОС и длинноцепочечным ФОС добровольцами, которые находились на ранних стадиях заражения ВИЧ-1, привело к модуляции микробиоты кишечника путем увеличения числа бифидобактерий и путем уменьшения количества патогенов [108].
1.5 Дрожжи как источник ферментов для получения олигосахаридов пектина
Согласно современной классификации, дрожжи, используемые в хлебопекарном деле, виноделии, производстве пива и спирта, относятся к одному семейству, роду и виду Saccharomycetaceae Saccharomyces cerevisiae. Указанные дрожжи, наряду с традиционным направлением использования (хлебопечение, виноделие, пивоварение), применяются в генной инженерии в производстве лекарственных и других необходимых человеку веществ. Широко используются и автолизаты дрожжей в качестве концентрата белка и биологически активных веществ (витаминов, макро- и микроэлементов) в различных отраслях пищевой промышленности.
Дрожжи – типичные факультативные анаэробы. Структурная организация клетки позволяет им осуществлять свой жизненный цикл, как в анаэробных условиях (брожение), так и в аэробных (дыхание). При брожении дрожжи получают необходимую им энергию (АТФ) за счет гликолиза, а в среде накапливается продукты катаболизма глюкозы этанол и диоксид углерода. Такой процесс используется в виноделии (пивоварении) и доступ воздуха к субстрату брожения является лимитирующим фактором концентрирования спирта. При доступе кислорода дрожжи переходят на типичное дыхание (работают ферментные системы цитоплазмы и митохондрий одновременно): глюкоза расщепляется полностью до конечных продуктов (диоксида углерода и воды), образуется максимально возможное количество энергии (АТФ) и этот вариант жизненного цикла дрожжей тоже широко используется человечеством в производстве дрожжевых хлебобулочных изделий [1-18].
В аэробных условиях резко сокращается потребность в субстрате окисления и не накапливаются токсичные для дрожжей метаболиты.
Необходимо отметить, что степень выраженности типов энергетического обмена дрожжей зависит также и от условий культивирования. При аэробном развитии дрожжей и низком содержании сахара брожение подавляется дыханием, такое течение процесса называется эффектом Пастера, а при высоком содержании сахара наблюдается обратный эффект: активизируется брожение и тормозится дыхание – эффект Кребтри [9].
При развитии клеток в анаэробных условиях происходит резкая перестройка энергетического обмена дрожжевой клетки – основным источником получения энергии становится процесс брожения, при этом уменьшается число митохондрий и одновременно увеличивается их размер (происходит деградация митохондрий). Деградированные митохондрии (промитохондрии) способны к восстановлению своей структуры и функции при соответствующем изменении условий культивирования дрожжей. В митохондриях последовательно протекают реакции трикарбоновых кислот (ЦТК) под действием цепи ферментов взаимосвязанных и структурно и последовательностью протекающих реакций.
В ЦТК ступенчато «сгорает» активная уксусная кислота до конечных продуктов метаболизма: диоксида углерода и воды с максимально возможной аккумуляцией энергии.
Из выше представленного анализа следует, что дрожжи Saccharomyces cerevisiae имеют высокую жизненную силу: они растут и при брожении, и при дыхании, при высокой и низкой концентрации субстрата окисления.
Энергетической основой для роста дрожжей Saccharomyces cerevisiae обычно являются моно- и дисахариды. Из моносахаридов дрожжи используют гексозы – глюкозу, фруктозу, галактозу, маннозу, из дисахаридов – сахарозу и мальтозу. Важная особенность дрожжей Saccharomyces сerevisiae: они не способны расщеплять и усваивать лактозу, пентозы (рибозу, ксилозу, арабинозу), крахмал, клетчатку. На отсутствие роста этого вида дрожжей в среде с лактозой указывает и Т.В. Меледина [15].
На сегодняшний день особый интерес дрожжи Saccharomyces cerevisiae представляют как возможный источник пектинолитических ферментов.
Рабочая гипотеза
Высокая адаптивная способность дрожжей к условиям культивирования позволяют предполагать, что хлебопекарные дрожжи Saccharomyces cerevisiae должны иметь пектолитические ферменты (пектиназы). О наличии пектиназ свидетельствуют экспериментальные данные по изучению секреции пектиназ из дрожжевой клетки винных дрожжей в виноматериал (Лисовец, 2017, с. 106). Только при наличии пектиназ хлебопекарные дрожжи смогут расщеплять пектин и получать энергетический необходимый им субстрат окисления. Жизнеобеспечивающим процессом для роста дрожжей при отсутствии в питательной среде доступных сахаров и наличии только пектина должен быть синхронно протекающий ферментативный ступенчатый его гидролиз. Пектин – гетерополисахарид, по числу структурных единиц состоит на 80-90% из D-галактуроновой кислоты, связанной α-1,4-связями с различной степенью метилирования карбоксильной группы.
Из пектолитических ферментов (ГОСТ Р 55298-2012) в направлении образования ПОС должны работать два вида ферментов эндополигалактуроназа и пектин-лиаза. Эндополигалактуроназа катализирует гидролиз полимерной цепи пектина внутри молекулы, его активность измеряется вискозиметрическим методом. Для использования продуктов гидролиза пектина в энергетическом обмене дрожжей гипотетически должен требоваться и фермент пектин-лиаза. Данный фермент катализирует неупорядоченное расщепление молекулы высокоэтерифицированного пектина с образованием ненасыщенных продуктов. Пектин-лиаза отщепляет галактуроновую кислоту с конца цепи или расщепляет полигалактуроновую цепь внутри молекулы пектина не гидролитическим путем за счет трансэлиминирования с образованием двойной связи в положении 4,5 галактуронового цикла (ГОСТ Р 55979-2014). Наличие двойной связи в положении 4,5 пиранового цикла и последующая теоретически возможная реакция гидратации позволяют трансформировать галактозу в глюкозу. Последняя является стартовым субстратом и для брожения (анаэробное окисление) и для дыхания (аэробное окисление) дрожжей. Действие фермента пектин-лиазы должно проявляться в приросте биомассы дрожжей.
Независимо от выше названных ферментов в расщеплении пектина участвует пектинэстераза. Данный фермент катализирует гидролиз сложноэфирных связей в молекуле высокометоксилированного пектина с образованием кислотной группы и метилового спирта. Активность пектиэстеразы проверяется по повышению кислотности среды (ГОСТ Р 55298-2012).
Продукты деструкции молекулы пектина (ПОС), полученные с участием дрожжей, предполагается использовать в качестве пребиотика для роста пробитических культур при производстве как пищевой, так и кормовой продукции.
2 ОРГАНИЗАЦИЯ ЭКСПЕРИМЕНТАЛЬНЫХ ИССЛЕДОВАНИЙ
2.1 Выбор объектов исследований
В научной работе использован яблочный пектин. Пектин вырабатывается в соответствии с ТУ 9199-012-01014470-04 «Пектин яблочный, биологически активная добавка к пище». Для гидролиза пектина до уровня олигосахаридов использовались хлебопекарные дрожжи Saccharomyces cerevisiae (Fermipan red) и пектолитический фермент марки LALLZYME С–MAX, выделяемый из дрожжей рода Saccharomyces, содержащий высокую концентрацию трех главных пектиназ, участвующих в гидролизе пектина: полигалактуроназу, пектин-эстеразу и пектин-лиазу. И дрожжи, и пектинолитический ферментный комплекс не обладают β-галактозидазной активностью и не могут расщеплять лактозу.
В качестве среды для осуществления процесса используется творожная сыворотка, выбор был обоснован рядом причин. Согласно ГОСТ Р 55298-2012. «Ферментные препараты для пищевой промышленности. Методы определения пектолитической активности» оптимальная кислотностью среды для ферментов, катализирующих гидролиз пектина, должна соответствовать рН 5 ед. Естественная кислотность свежей творожной сыворотки находится в близком значении к оптимуму рН для гидролиза пектина. В результате исключается необходимость использования химических буферных систем для искусственного создания требуемого уровня кислотности. Пектинолитические ферменты не расщепляют лактозу, значит, в сывороточной среде смогут в дальнейшем активно размножаться молочнокислые бактерии. Минеральный и белковый состав сыворотки создают оптимальный уровень осмотического давления для размножения и питания живых клеток дрожжей. К тому же сам факт использования творожной сыворотки решает ряд проблем, связанных с ее утилизацией.
2.2 Выбор методов исследований
Исследование проводилось на хлебопекарных дрожжах, культивируемых в творожной сыворотке, используемой в качестве жидкой питательной среды, с внесением в нее пектина Творожную сыворотку предварительно пастеризовали при температуре 90-95°С с целью исключения побочного влияния живых форм молочнокислых бактерий. В сыворотку при температуре 70-72ºС вносили непрерывными малыми порциями при интенсивном перемешивании порошок пектина. Сывороточный раствор пектина фильтровали через сетчатый фильтр с целью получения однородной гомогенной структуры. В подготовленную питательную сывороточно-пектиновую среду при температуре 26-28°С вносили дрожжи, смесь перемешивали до образования однородной смеси. Температура культивирования дрожжей 26-28°С. Компоненты смеси (сыворотка, пектин и дрожжи) взвешивали на лабораторных весах с точностью до 0,001г. Количество дрожжей измеряли массой сырого осадка, взвешенного после центрифугирования проб со скоростью вращения центрифуги 5000 об./мин в течение 10 мин. В контроль дрожжи не вносили, пробы центрифугировали при тех же условиях. Массу дрожжей определяли по разности общей массы осадка опытных образцов и массой осадка в контрольной пробе.
Исследуемые показатели, периодичность анализов в экспериментах и дополнительные сведения по методике указаны в конкретных исследованиях ниже.
Остальные физико-химические показатели выполнялись общепринятыми для молочной отрасли стандартными методами:
— титруемая кислотность, ГОСТ Р 54669-2011, титриметрическим индикаторным методом;
— активная кислотность (рН), ГОСТ Р 54669-2011, потенциометрическим методом рН-метр/иономер Мультитест ИПЛ-201;
— вязкость, вискозиметрическим методом ГОСТ Р 55298-2012 для пектин содержащих объектов, вискозиметр Оствальда с диаметром капилляра 0,95мм;
— масса осадка, гравиметрическим методом, с точностью взвешивания
± 0,001г.
В качестве контроля использовали субстрат, полученный при ферментации пектина коммерческим препаратом пектолитических ферментов LALLZYME С–MAX. Степнь гидролиза оценивали по измению вязкости раствора пектина в молчоной сыворотке по ГОСТ Р 55298-2012. Ферментные препараты для пищевой промышленности. Методы определения пектолитической активности.
Для изучения влияния субстратов на динамику роста бифидобактерий к 9 мл жидкой питательной среды MRS (пептон, дрожжевой экстракт, глюкоза, порошок «Lab-Lemco», ацетат натрия, сульфат магния, сульфат марганца, ацетат триаммония, сорбит моноолеат, pH = (6,2±0,2) добавляли 1 мл пастеризованного (t = 98 ºС, τ = 20 мин) раствора исследуемого субстрата. Образцы культивировались 0,1 мл тест-штамма и инкубировались 24 часа при 37 ºС. Определение оптической плотности проводили через 0, 12, 24, 48 и 60 часа. В качестве позитивного контроля использовали инулин.
Количественный учет бифидобактерий в конце эксперимента проводился методом предельных разведений и посевов в стандартную кукурузно-гидролизатную среду ГМК-1. Изучение морфологии микроорганизмов проводилось методом микроскопирования фиксированных и окрашенных фуксином препаратов на микроскопе «БиоЛам» при увеличении 90х15.
Определение антипатогенной активности осуществляли методом совместно развивающихся тест штамов.
3 РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТАЛЬНЫХ ИССЛЕДОВАНИЙ
3.1 Изучение пектинолитической активности фермента марки LALLZYME С–MAX
Характеристика фермента:
- Lallzyme С–MAX – пектолитический фермент для осветления, «сложного» сусла с высоким содержанием пектинов, при низких температурах и/или низком рН.
- Lallzyme С–MAX – содержит высокую концентрацию трех главных пектиназ, участвующих в гидролизе пектина: полигалактуроназу, пектин-эстеразу и пектин-лиазу.
- Lallzyme С–MAX – содержит высокий уровень эндо-действующих ферментов (пектинлиазы и эндо-полигалактуроназы).
Согласно инструкции фермент Lallzyme С–MAX фермент работает в широком диапазоне температур от 5 до 20°С и проявляет достаточно высокую активность при его содержании 0,05г/10 л сусла.
Первый этап работы с указанным ферментом был направлен на проверку его пектинолитической активности для растворов пектина с концентрацией от 1 до 5% с шагом 1%, приготовленных на воде. При содержании пектина свыше 5% раствор теряет текучесть.
Для исследования использовали 1%-ный водный раствор фермента Lallzyme С–MAX (0,5 г фермента растворяли в 49,5 см3 дистиллированной воды). В исследуемые образцы пектолитический фермент вносили в количестве 10 мг% (2 см3 1%-ного раствор для общей массы образца 200 г).
Методика подготовки образцов к исследованию.
Контроль – отмеряли 198 см3 воды (или сыворотки) и добавляли 2 см3 1%-ного раствора фермента Lallzyme С–MAX, смесь перемешивали. Общая масса образца 200 г.
В опытные образцы сначала взвешивали расчетные массы пектина и воды (или сыворотки). Общая масса (пектин и растворитель) 198 г. Растворитель подогревали до50-55 °С, растворяли в нем пектин, далее раствор пектина охлаждали до температуры 20-22°С и вносили 2 см3 1%-ного раствора фермента Lallzyme С–MAX. Общая масса каждого образца 200 г.
Пектолитическая активность фермента LALLZYME С – MAX для водных растворов пектина приводится в таблице 3.
Таблица 3 – Пектинолитическая активность фермента LALLZYME С – MAX для водных растворов пектина (температура растворов 21°С)
| Концентрация в водном растворе | Растворы пектина имеют высокую вязкость, использовали вискозиметр Оствальда с диаметром капилляра 1,31 мм | ||||
| Время истечения растворов
через капилляр |
Вязкость
относительно контроля, % |
Понижение вязкости
растворов через час, % |
|||
| пектин,
% |
фермент,
мг% |
свежий раствор
(контроль), сек |
через 1 час
(опыт) |
||
| 1 | 10 | 10,18 | 8,23 | 80,84 | 19,16 |
| 2 | 10 | 51,02 | 19,06 | 37,36 | 62,64 |
| 3 | 10 | 138 | 47,62 | 34,51 | 65,49 |
| 4 | 10 | 203 | 70,37 | 34,66 | 65,34 |
| 5 | 10 | 1223 | 767,2 | 62,73 | 37,27 |
В водном растворе фермент LALLZYME С– AX при концентрации 10 мг% эффективно проявляет пектолитические свойства при содержании пектина в водном растворе 2, 3, 4%. При концентрации 5% пектолитическая активность фермента резко снижается за счет высокой структурной вязкости раствора пектина. Наглядно результаты исследований отражены на рисунке 2.
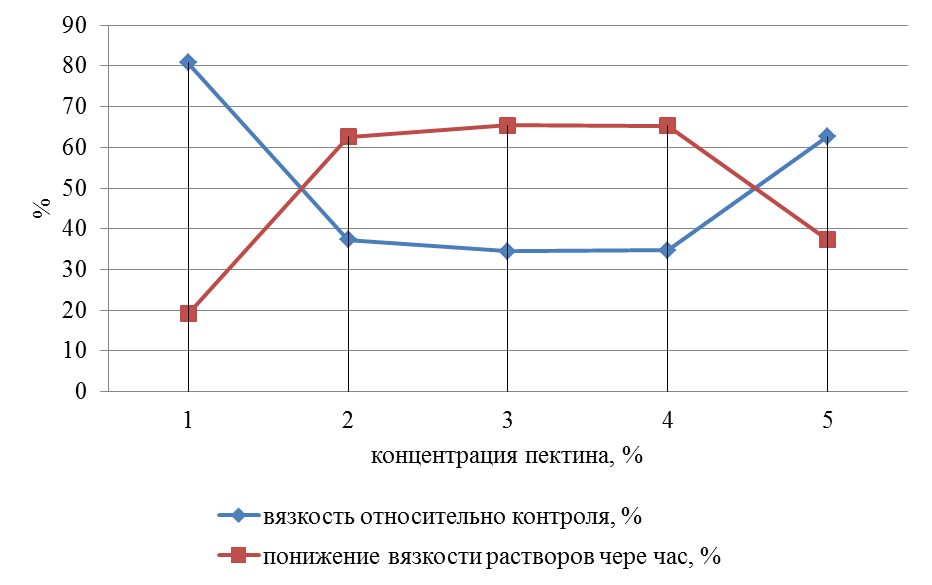
Рисунок 2 – Изменение вязкости растворов пектина при воздействии фермента LALLZYME С– МAX
Для проверки эффективности работы фермента LALLZYME С– МAX в сывороточных растворах пектина внесли изменения в методику исследования, в связи низкой растворимостью пектина в сыворотке. Пектин вносили не сухим, а виде водного 5%-ного раствора. Растворение пектина проводили в горячей воде с температурой 67-70°С, порошок вносили небольшими порциями при непрерывном перемешивании. Пектин является типичным ВМС (высокомолекулярным коллоидом) и растворение подобных систем протекает через стадию неоднородного набухания вещества. После полного растворения пектина (густая масса) раствор фильтровали через сетчатый фильтр, чтобы обеспечить однородность. Приготовленный 5%-ный водный раствор пектина охлаждали до 20-22°С и использовали в качестве рабочего раствора
Исследования пектолитической активности фермента LALLZYME С– МAX провели для концентраций пектина 0,5 и 1% в пересчете на сухой пектин.
Методика подготовки образцов к исследованию приводится
в таблице 4.
Таблица 4 – Методика подготовки образцов к исследованию
| Вариант | Масса смеси, г | Содержание в смеси, % | Последовательность действий | |
| фермент, мг% | пектин, % | |||
| контроль | 200 | 10 | нет | Взвешивали 198 г сыворотки и вносили 2 г 1%-го р-ора фермента LALLZYME С– МAX (контроль без пектина). |
| 1 | 200 | 10 | 0,5 | Взвешивали 178 г сыворотки и вносили 20 г 5%-ного раствора пектина и 2 г3 1%-го раствора фермента LALLZYME С– МAX . |
| 2 | 200 | 10 | 1.0 | Взвешивали 158 г сыворотки и вносили 40 г 5%-ного раствора пектина и 2 г3 1%-го раствора фермента LALLZYME С– МAX . |
Оценку протекающим процессам проводили по рН и вязкости смесей. Периодичность контроля: свежеприготовленная смесь (старт) и через 1 и 2 часа от начала процесса. Температура комнатная 21°С.
Результаты эксперимента в системе «творожная сыворотка-пектин- фермент LALLZYME С– МAX» приводятся в таблице 5.
Таблица 5 – Результаты эксперимента в системе «творожная сыворотка-пектин-фермент LALLZYME С–МAX» (t=21°C)
| Контроль
(сыворотка-фермент) |
Опытные образцы (сыворотка-фермент-пектин) | |||||
| Содержание пектина 0,5% | Содержание пектина 1% | |||||
| рН | Время истечения
р-ров через капилляр (Д=0,95 мм) |
рН | Время истечения
р-ров через капилляр (Д=0,95 мм) |
рН | Время истечения
р-ров через капилляр (Д=0,95 мм) |
|
| 0
(старт) |
5,08 | 13,36 | 4,82 | 14,75 | 4,58 | 17,65 |
| 1 | 5,06 | 13,33 | 4,74 | 13,93 | 4,55 | 16,31 |
| 2 | 5,08 | 13,35 | 4,70 | 13,93 | 4,46 | 15,43 |
| Примечание | Среднее 13,35 | Фермент активно расщепляет пектин в сывороточном растворе и рН в обоих случаях понизился на 0,12 ед | ||||
| Вывод | Фермент не работает | |||||
Влияние концентрации пектина (таблица 5) на пектилитическую активность фермента LALLZYME С – MAX приводится в таблице 6.
Таблица 6 – Влияние концентрации пектина (таблица 8) на пектилитическую активность фермента LALLZYME С – MAX (t=21.1°C)
| Время от начала, час | Содержание пектина в системе «сыворотка-фермент-пектин» | |||||
| 0,5% пектина в расчете на сухой | 1% пектина в расчете на сухой | |||||
| рН
среды |
Вязкость,% | рН
среды |
Вязкость,% | |||
| относительно старта | понижение
относительно старта |
относительно старта | понижение
относительно старта |
|||
| 0
(старт) |
4,82 | 100
(14,75 сек) |
— | 4,58 | 100
(17,65 сек) |
— |
| 1 | 4,74 | 94,44 | 5,56 | 4,55 | 92,40 | 7,60 |
| 2 | 4,70 | 94,44 | 5,56 | 4,46 | 87,42 | 12,58 |
Изменение времени истечения растворов пектина под действием коммерческого фермента через 12 часов представлено на диаграмме
(рисунок 3).
Фермент работает, низкая эффективность гидролиза может быть связана с низкой концентрацией пектина в среде. Как показал предыдущий опыт, выполненный на водной основе, для гидролиза пектина указанным ферментом требуется более высокая концентрация пектина в среде (2…4%).
Однако, однозначно видно, что возможен гидролиз сложноэфирной связи в пектине, приводящий к снижению степени его этерификации, как следствие, повышению доли карбоксильных групп в молекуле, что приводит к незначительному, но системному понижению рН среды.
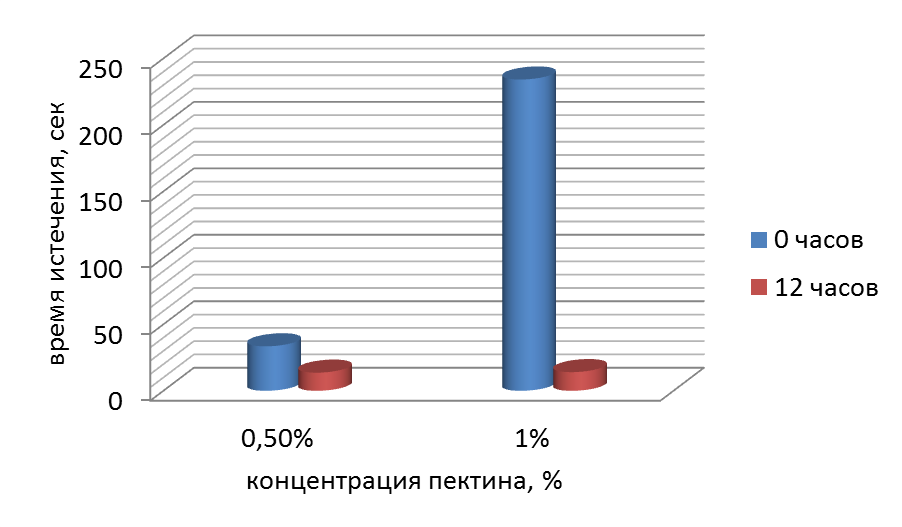
Рисунок 3 – Изменение вязкости растворов пектина под действием фермента LALLZYME С – MAX
3.2 Изучение пектинолитической активности хлебопекарных дрожжей (Saccharomyces cerevisiae)
Средой для культивирования дрожжей во всех вариантах выполненного исследования являлась творожная сыворотка. Стартовые физико-химические показатели сыворотки определяли после пастеризации, охлаждения до температуры 20-22°С и фильтрации через фильтрующую ткань, с целью удаления взвешенных частиц коагулированного белка (таблица 7, средние арифметические результаты, n = 3).
Таблица 7 — Стартовые физико-химические показатели творожной сыворотки
| Сухое
вещест-во, % |
Плот-ность,
при 20°С, кг/м3 |
Кислотность | Время истечения
через капилляр, сек |
Вязкость
Па·с |
||
| титруемая, °Т | активная,
рН |
вода | сыворотка | |||
| 6,0 | 1027,5 | 65 | 4,91 | 12,2 | 13,65 | 1, 034·10-3 |
Предварительно выполнено тестовое исследование по выявлению реагирования указанных дрожжей на присутствие пектина при одновременном наличии в среде глюкозы. В пастеризованную творожную сыворотку вносили 1% глюкозы и 1% прессованных дрожжей к общей массе смеси 400 г. Смесь тщательно перемешивали до однородной суспензии, делили пополам, разливая в конические колбы вместимостью 300 см3. Одна часть служила контролем (без пектина), в другую – вносили 1% пектина (опыт). Точки контроля: старт, 3 и 24 часа. Определяемые показатели: кислотность (титруемая и активная), вязкость по истечению жидкости через капилляр диаметром 0,95 мм в соответствии с ГОСТ Р 55298-2012 для обнаружения действия разжижающего фермента эндодействия, расщепляющего α-1-4 связи в D-полигалакуроновой цепи пектина. В результатах исследования приводится относительная вязкость (время истечения жидкости контроля через капилляр принято за единицу).
Влияние пектина на жизнедеятельность хлебопекарных дрожжей Saccharomyces cerevisiae при наличии в среде глюкозы отражено в таблице 8.
Таблица 8 — Влияние пектина на жизнедеятельность хлебопекарных дрожжей Saccharomyces cerevisiae при наличии в среде глюкозы
| Время
от начала, час |
Контроль (проба с глюкозой) | Опыт (проба с глюкозой и пектином) | ||||
| кислотность | Относительная вязкость к
исходной сыворотке |
кислотность | Относительная вязкость к
исходной сыворотке |
|||
| рН | °Т | рН | °Т | |||
| Старт | 4,51 | 64 | 1,05 | 4,42 | 66 | 2,33 |
| Пробы на старте одинаковые (газообразования нет) | ||||||
| 3 | 4,51 | 64 | 1,05 | 4,23 | 72 | 2,31 |
| умеренное выделение газа | обильное газообразование газа | |||||
| 24 | 4,50 | 65 | 1,05 | 4,16 | 75 | 2,46 |
| Разница между контролем и опытом сохраняется | ||||||
В пробах с пектином и кислотность, и вязкость относительно контроля выше за счет химической природы пектина. Из таблицы 1 следует, что дрожжи положительно реагируют на пектин. Пектин стимулирует процесс брожения.
На следующем этапе исследовали способность дрожжей осуществлять свой жизненный цикл при наличии в сыворотке только пектина. В подготовленную творожную сыворотку вносили 1% прессованных дрожжей, смесь перемешивали до гомогенной суспензии, далее также делили пополам, как указано выше. В опытную пробу вносили 1% пектина, контроль без пектина. В данном эксперименте и во всех последующих глюкозу не вносили.
Влияние пектина на жизнедеятельность хлебопекарных дрожжей Saccharomyces cerevisiae в отсутствии в среде глюкозы отражено в таблице 9.
В контроле (таблица 9) исследуемые показатели не изменялись, дрожжи не росли. Необходимо отметить, указанные дрожжи не могут расщеплять лактозу, и творожная сыворотка исполняет роль только жидкой питательной среды. В опыте уже через 3 часа наблюдалось заметное выделение газа в виде множества мелких пузырьков и этот эффект сохранялся в течение всего периода наблюдения.
Таблица 9 — Влияние пектина на жизнедеятельность хлебопекарных дрожжей Saccharomyces cerevisiae в отсутствии в среде глюкозы
| Время
от начала, час |
Контроль (без пектина) | Опыт (в среде пектин) | ||||
| кислотность | Относительная вязкость к
исходной сыворотке |
кислотность | Относительная вязкость к
исходной сыворотке |
|||
| рН | °Т | рН | °Т | |||
| Старт | 4,51 | 65 | 1,04 | 4,35 | 71 | 3,5 |
| 3 | 4,51 | 65 | 103 | 4,32 | 75 | 2,2 |
| 24 | 4,51 | 65 | 1,04 | 4,31 | 79 | 3,1 |
Выполненный эксперимент указывает на способность дрожжей расщеплять пектин и использовать его в качестве источника энергии. Наблюдается заметное понижение вязкости, что свидетельствует о гидролизе пектина ферментом эндодействия (эндополигалактуроназы) дрожжей. Вязкость в пробе с пектином понизилась в 1,5 раза. Последующее повышение вязкости в пробе с пектином в конце наблюдения (через 24 часа) можно отнести за счет побочного влияние накапливающейся биомассы дрожжей (заметный белый слой внизу колбы), влияющей на скорость истечения смеси через капилляр вискозиметра при определении вязкости. Возникла очевидная необходимость центрифугирования проб. Исследовали два варианта скорости 3000 и 5000 оборотов в минуту, продолжительностью 5 и 10 минут.
В последующих исследованиях использовались сухие хлебопекарные дрожжи с высоким содержанием чистой культуры Saccharomyces cerevisiae, без консервантов и дополнительных компонентов, используемых при производстве прессованных дрожжей. Пробы, отобранные для анализа, центрифугировали со скоростью 5000 об/мин в течение 10 мин. Высокая скорость центрифугирования и указанная продолжительность обеспечивает формирование плотного осадка, позволяющего сливать без потерь надосадочную жидкость. Исполняя все правила гравиметрического метода, была проведена количественная оценка роста дрожжей в среде с пектином. Титруемую кислотность и динамическую вязкость относительно контроля определяли в надосадочной жидкости.
В исследованиях также использовали сывороточный 1%-ный раствор пектина. Сухие дрожжи вносили в количестве 0,1% (опыт 1) и 0,3% (опыт 2) к массе питательной среды. Контроль – без дрожжей.
Динамика изменения массы осадка в пробах при культивировании дрожжей в среде с пектином приводится на диаграмме (рисунок 4).
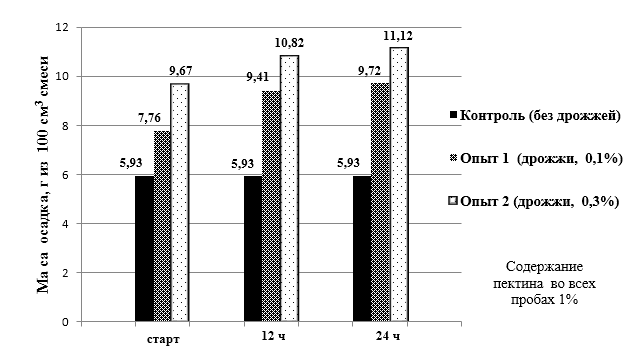
Рисунок 4 – Динамика изменения массы осадка в пробах при культивировании дрожжей в среде с пектином
В дополнении к диаграмме (рисунок 4) в таблице 10 отражено влияние пектина на физико-химические показатели жизнедеятельности хлебопекарных дрожжей Saccharomyces cerevisiae.
Таблица 10 — Влияние пектина на физико-химические показатели жизнедеятельности хлебопекарных дрожжей Saccharomyces cerevisiae (n=3, P=0,95)
| Наименование
показателя |
Контроль без дрожжей | Опыт 1
(дрожжи 0,1%) |
Опыт 1
(дрожжи 0,3%) |
||||
| старт | 12 ч | 24 ч | старт | 12 ч | 24 ч | ||
| Титруемая кислотность, ºТ | 75 | 75 | 80 | 87 | 75 | 85 | 87 |
| Вязкость
относительно контроля |
1,00 | 1,12 | 1,08 | 0,91 | 1,14 | 1,08 | 0,91 |
| Масса дрожжей,
г из 100 см3 смеси |
— | 1,83 | 3,48 | 3,79 | 3,74 | 4,89 | 5,19 |
| Прирост массы дрожжей, относительно старта, % | — | 100 | 190,2 | 207,1 | 100 | 130,7 | 138,8 |
Во всех выполненных исследованиях при культивировании дрожжей в среде с пектином имеет место достоверное повышение титруемой кислотности, что указывает на действие фермента пектинэстеразы, отщепляющей метанол от этерифицированных карбоксильных групп глюкуроновой кислоты.
Понижение вязкости в среде с пектином свидетельствует о расщеплении молекулы пектина пектолитическими ферментами дрожжей, что обеспечивает их рост при отсутствии других доступных углеводов и отражается в приросте массы.
Все указанные процессы хорошо выражены в опыте 1 при массовой доле в смеси сухих дрожжей 0,1%. При содержании в пробах 0,3% дрожжей явно проявляется конкуренция за источник энергии, связанная с недостатком субстрата (пектина) в смеси.
Ряд косвенных показателей (наличие мелких пузырьков газа, равномерно распределенных в смеси, слабый запах этанола, естественный доступ воздуха к культуре дрожжей с пектином, отсутствие доступных углеводов) указывают на рост дрожжей за счет дыхания. При дыхании дрожжи сохраняют жизнеспособность в течение длительного времени при низком расходе субстрата окисления и достаточном его содержании в среде.
В наших исследованиях относительно достаточным содержанием пектина для дрожжей было в опыте 1. С целью подтверждения, изложенной выше рабочей гипотезы, выполнен дополнительный эксперимент, направленный на изучение продолжительности жизни дрожжей в среде с пектином.
В выполненном эксперименте пастеризованная сывороточно-пектиновая смесь содержала порошка пектина 1%, сухих дрожжей 0,1%.
Влияние продолжительности культивирования на жизнедеятельность хлебопекарных дрожжей Saccharomyces cerevisiae в среде с пектином приводится в таблице 11.
Таблица 11 — Влияние продолжительности культивирования на жизнедеятельность дрожжей Saccharomyces cerevisiae в среде с пектином (n=3, P=0,95)
| Наименование показателя | Контроль
без дрожжей |
Продолжительность культивирования дрожжей, час | |||
| старт | 24 | 72 | 120 | ||
| Титруемая кислотность, ºТ | 73 | 73 | 87 | 84 | 82 |
| Вязкость относительно контроля | 1 | 0,92 | 0,86 | 0,83 | 0,81 |
| Общая масса осадка, г
из 100 см3 смеси |
5,91 | 7,72 | 9,45 | 10,35 | 10,41 |
| Масса дрожжей, г
из 100 см3 смеси |
— | 1,81 | 3,52 | 4,44 | 4,50 |
| Прирост массы дрожжей
относительно старта, % |
— | 100 | 195,6 | 245,3 | 248,6 |
Полученные результаты (таблицы 10,11) подтверждают изложенную выше гипотезу по наличию пектолитической способности хлебопекарных дрожжей Saccharomyces cerevisiae. Невысокий расход энергетического материала и жизнеспособность дрожжей в течение длительного времени указывают на аэробный путь его использования по типу классического дыхания.
3.3 Исследование пребиотического потенциала олигосахаридов пектина
Для изучения влияния субстратов на динамику роста бифидобактерий к 9 мл жидкой питательной среды MRS добавляли 1 мл пастеризованного (t = 98 ºС, τ = 20 мин) раствора исследуемого субстрата. Образцы культивировались 0,1 мл тест-штамма и инкубировались при 37 ºС. Определение оптической плотности проводили через 0, 12, 24, 48 и 60 часов. В качестве позитивного контроля использовали 1% раствор инулина.
Таблица 12 – Показатель мутности питательных сред при развитии пробиотических культур в среде с пребиотиком
| Субстрат | Вид культуры | Показатель мутности А 640 нм | ||||
| 0 ч | 12 ч | 24 ч | 48 ч | 60 ч | ||
| ПОС 1* | B. longum | 0,081 | 0,092 | 0,151 | 0,212 | 0,221 |
| B. bifidum | 0,081 | 0,101 | 0,155 | 0,156 | 0,160 | |
| B. adolescentis | 0,081 | 0,102 | 0,122 | 0,125 | 0,126 | |
| ПОС 2** | B. longum | 0,078 | 0,078 | 0,109 | 0,175 | 0,189 |
| B. bifidum | 0,078 | 0,097 | 0,175 | 0,188 | 0,195 | |
| B. adolescentis | 0,078 | 0,097 | 0,101 | 0,165 | 0,166 | |
| инулин | B. longum | 0,083 | 0,098 | 0,295 | 0,315 | 0,321 |
| B. bifidum | 0,083 | 0,097 | 0,255 | 0,287 | 0,281 | |
| B. adolescentis | 0,083 | 0,083 | 0,188 | 0,260 | 0,260 | |
| контроль | B. longum | 0,067 | 0,087 | 0,097 | 0,108 | 0,108 |
| B. bifidum | 0,067 | 0,071 | 0,121 | 0,165 | 0,169 | |
| B. adolescentis | 0,067 | 0,068 | 0,081 | 0,155 | 0,158 | |
* — олигосахариды пектина, полученные коммерческим ферментом
**- олигосахариды пектина, полученные при ферментации смеси дрожжами Saccharomyces cerevisiae
Динамика изменения оптической плотности в образцах представлена в виде диаграмм на рисунке 5.
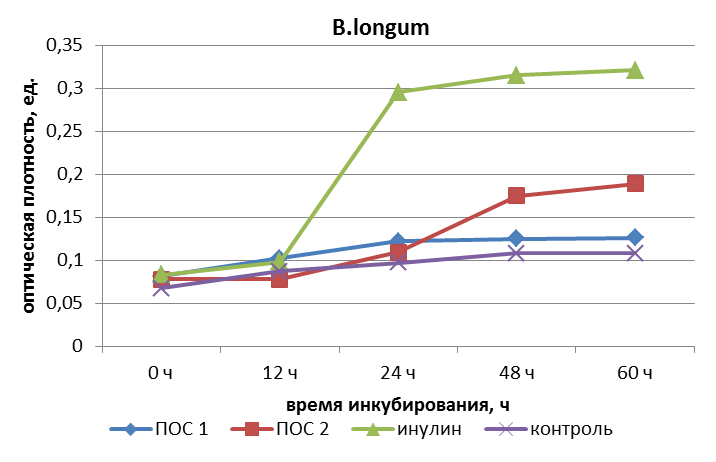
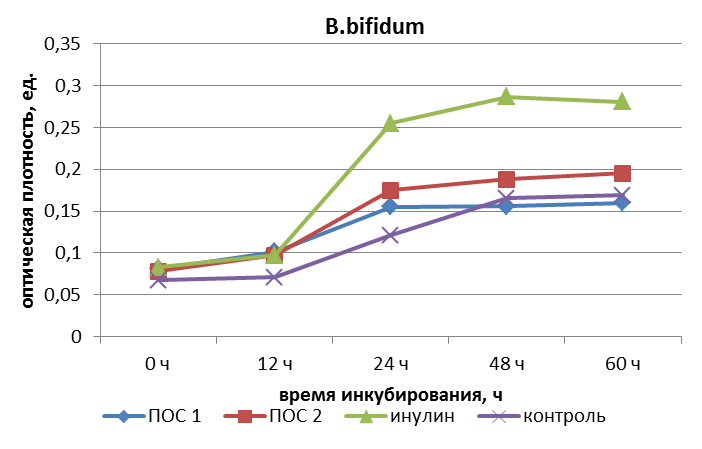
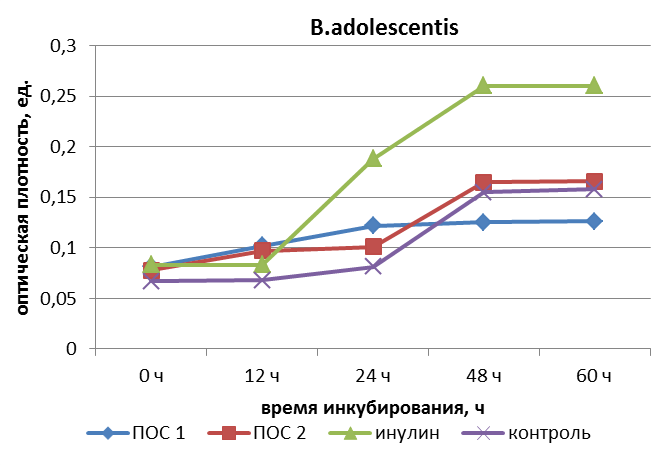
Рисунок 5 – Динамика роста пробиотических культур в среде с пребиотиком
Согласно полученным данным, наиболее интенсивный рост микрофлоры наблюдался в образцах с инулином. Во всех образцах с субстратами показатель мутности через 48 часов ингибирования был выше, чем в контроле. Наименьший показатель мутности при включении пребиотиков был у культуры B.adolescentis.
Количественный учет бифидобактерий в конце эксперимента (60 часов) проводился методом предельных разведений и посевов в стандартную кукурузно-гидролизатную среду ГМК-1. Изучение морфологии микроорганизмов проводилось методом микроскопирования фиксированных и окрашенных фуксином препаратов на микроскопе «БиоЛам» при увеличении 90х15.
В опытных образцах колонии бифидобактерий обнаруживались в 11 разведении при ферментации инулина, при добавлении в среды ПОС 1 или ПОС 2 — в 10 разведении, в контроле культуры мкироорганизмов обнаруживались в 9 разведении. При микроскопировании клетки из контрольного образца имели палочковидную, раздвоенную форму, иногда с утолщениями на концах. Бифидобактерии из опытных образцов имели вид более тонких палочек, иногда раздвоенных, с выраженной грануляцией. Коккоподобные формы клеток встречались как в контроле, так и в опыте, совместно с палочками. Колонии бифидобактерий в ГМК имели штрихообразную форму (рисунок 6).
Так как не обнаружено существенных различий в морфологии бифидобактерий, выращенных в контрольной и опытной средах, можно сказать, что добавляемые ПОС не оказывают влияния на форму клеток. При этом можно наблюдать некоторый бифидогенный эффект.
Рисунок 6 – Посев бифидобактерий B.longum из опытного и контрольного образца, 9-ое разведение
а – колонии бифидобактерий в опытном образце;
б – колонии бифидобактерий в контроле.
3.4 Исследование возможности использования свекловичного жома как источника пектина для гидролиза
Исследование процесса ферментации свекловичного жома дрожжами Saccharomyces cerevisiae проводили по следующей схеме. Жом вносили в сывортку температурой 65±5°С в молочноую сыворотку в соотношении 1:10, 1:20, 1:30,1:40, 1:50. Тщательно перемешивали, охлаждали до комнатной температуры и оставляли набухать на 1 час. Далее в образцы вносили 0,3% сухих дрожжей и оставляли культивироватьна 24 часа. После образцы фильтровали для отделения жома. Пробы, отобранные для анализа, центрифугировали со скоростью 5000 об/мин в течение 10 мин. Высокая скорость центрифугирования и указанная продолжительность обеспечивает формирование плотного осадка, позволяющего сливать без потерь надосадочную жидкость. Исполняя все правила гравиметрического метода, была проведена количественная оценка роста дрожжей в среде с пектином. Титруемую кислотность и динамическую вязкость относительно контроля определяли в надосадочной жидкости (таблица 13). Образец в соотношении 1:10 не подвергалсядальнейшим исследованиям, так как технологически затруднительно было отделитьжомот сыворотки.
Таблица 13 — Влияние количества свекловичного жома на жизнедеятельность дрожжей Saccharomyces cerevisiae в среде с пектином (n=3, P=0,95)
| Наименование показателя | Контроль
без дрожжей |
Соотношение свекловичного жома к сыворотке | |||
| 1:20 | 1:30 | 1:40 | 1:50 | ||
| Титруемая кислотность, ºТ | 100 | 110 | 115 | 121 | 130 |
| Вязкость относительно контроля | 1 | 0,92 | 0,80 | 0,82 | 0,82 |
| Общая масса осадка, г
из 100 см3 смеси |
5,91 | 7,72 | 10,32 | 10,35 | 9,91 |
| Масса дрожжей, г
из 100 см3 смеси |
— | 1,81 | 4,5 | 4,44 | 3,9 |
| Прирост массы дрожжей
относительно старта, % |
— | 100 | 248,6 | 245,3 | 218,2 |
Далее проводили исследование возможности использования свекловичного жома как источника пектина для гидролиза. Согласно полученным результатам оптимальным соотношением свекловичного жома к сыворотке было 1:30 и 1: 40. Однако наблюдается значительное снижение рН и титруемой кислотности образцов, что может влиять на процесс жизнедеятельности дрожжей. Для избежания этого рекомендуется добавлять к смеси гидроксид кальция.
3.5 Исследование бифидогенной активности ПОС свекловичного жома
В оценке пробиотического действия кормовой добавки (КД) ключевое значение имеет реагирование бифидобактерий на продукты гидролиза пектина. После ферментации свекловичного жома дрожжами, образцы фильтровали и пробы центрифугировали. Надосадочную жидкость исследовали на воздействие на тест культуру B.bifidum. Культивирование B.bifidum на питательных средах с различными источниками углеводов отражено на рисунке 7. В опытах к 9 см3 жидкой питательной среды ГМК-2 добавляли 1 см3 раствора исследуемого субстрата. В контроль (среда ГМК-2) исследуемые компоненты не вносили. Образцы культивировались 0,1 см3 тест-штамма и инкубировались при 37 ºС в течение 48 часов. Тест-штамм B.bifidum сухой предварительно растворяли в питательной среде и активизировали при температуре 37 — 38 °С в течение 24 ч.
Накопление биомассы бифидобактерий измеряли нефелометрически при длине волны 540 нм. В качестве эталона пребиотических свойств использовали среду с лактулозой (1%-ный раствор).
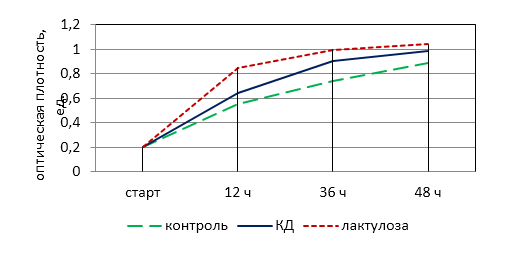
Рисунок 7– Динамика изменения оптической плотности питательной среды при культивировании бифидобактерий в присутствии пектиновых олигосахаридов и лактулозы
Аналогичный эксперимент был выполнен для молочнокислых палочек (L. delbrueckii subsp. bulgaricus и L.acidophilus), обладающих относительной способностью приживаться в кишечнике. Базовой основой питательных сред для молочнокислых палочек служила среда MRS, время инкубирования составило 24 часа (рисунок 8).
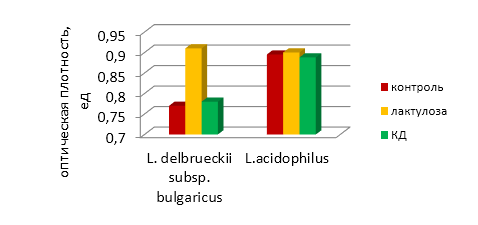
Рисунок 8 – Оптическая плотность питательной среды через 24 часа культивирования молочнокислых бактерий в присутствии пектиновых олигосахаридов и лактулозы
Динамика роста бифидобактерий на питательных средах с различными источниками углеводов показала, что максимальное накопление бифидобактерий наблюдалось через 48 часов. Образцы имели различную скорость и интенсивность роста культуры в зависимости от источника питания. Наибольшую активность бифидобактерии проявили, как и следовало ожидать, в присутствии лактулозы. Смесь продуктов гидролиза пектина свекловичного жома тоже значительно активировала рост B.bifidum относительно контроля.
Через 48 часов культивирования по количеству клеток на фиксированных препаратах в контроле содержалось — 7×107, в образце с лактулозой — 9×1011, в образце с олигосахаридами пектина — 8×1010.
Микрокопирование образцов показало, что морфология клеток была типичной и одинаковой для всех образцов: клетки имели форму палочек с утолщением на концах, соединённых в небольшие цепочки.
На рост молочнокислых бактерий раствор гидролизованного пектина практически не оказывал влияние. Молочнокислые бактерии в питании используют моно- и дисахариды, и только некоторые виды способны использовать олигосахариды. Микроорганизмы вида L. delbrueckii subsp. bulgaricus и L.acidophilus относятся к группе гомоферментативных лактобацилл. Метаболизм сахаров у видов бактерий этой группы происходит по гликолитическому пути расщепления глюкозы по схеме Эмбдена-Мейергофа-Парнаса. Рост культур осуществляется главным образом за счет высокой β-галактозидазной активности и последующего сбраживания глюкозы образующейся при гидролизе лактозы. Галактоза относится к трудно сбраживаемым сахарам, и она накапливается в среде при развитии некоторых гомоферментативных лактобацилл, что подтверждено исследованиями.
Результаты исследования подтверждают тот факт, что продукты гидролиза пектина, полученные путем ферментации свекловичного жома, оказывают стимулирующий эффект на рост бифидобактерий in vitro в целом.
3.6 Влияние ПОС свекловичного жома на антипатогенную активность пробиотических культур
ПОС свекловичного жома (концентрат) вносили в питательную среду MRS из расчета 1 г пектиновых олигосахаридов на 100 мл среды. Среду развивали по 10 мл в пробирки и стерилизовали. В подготовленную среду вносили по 0,1 мл тест-штама B.bifidum инкубировали 48 часов при 37 °С.
Динамику антагонистической активности изучали методом развивающихся смешанных популяций в сравнении с ростом тест-штамма на жидких питательных средах с последующим высевом на плотные среды (рисунок 9). В качестве тест-культур патогенов использовали восемнадцатичасовые штаммы микроорганизмов, культивированные при 37 °С и постоянном перемешивании. В пробирки к 9 мл жидкой питательной среды, помимо 0,1 мл взвеси тест-культуры, вносили 1 мл исследуемого образца культуры бифидобактерий инкубированных совместно с ПОС. Каждый образец готовили в трех экземплярах. Совместное культивирование длилось 24 часа при описанных выше условиях. 0,1 мл каждого образца отбирали через 0, 18 и 24 часа, готовили серию разведений и делали посев на соответствующую питательную среду в чашки Петри. Количество жизнеспособной патогенной микрофлоры определяли путем прямого подсчета количества колоний на твердых питательных средах через 24 часа инкубирования при 37 °С.
Антагонистическую активность оценивали по формуле (1):
На рисунке 10 представлны полученные результаты
Рисунок 9 – Образцы чашки Петри с выросшими культурами.
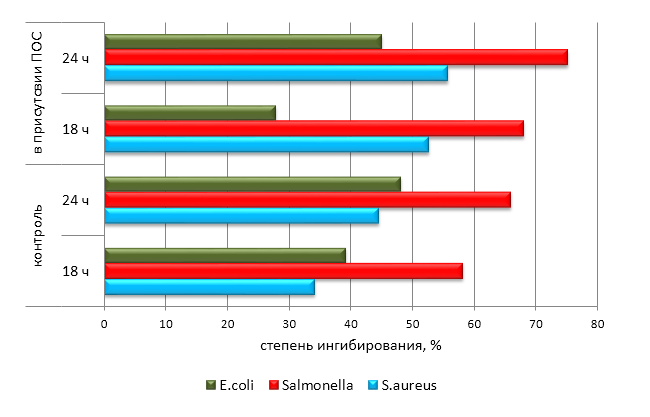
Рисунок 10 – Антогонистическая активность B.bifidum
Согласно полученным результатам, присутствие ПОС усиливает антипатогенное действие пробиотика. Скорее всего, это связано с большей популяцией клеток бифидобактерий в питательной среде в присутствии ростового для них фактора.
3.7 Технологическая схема производства кормовой добавки
Технологическая схема представлена на рисунке 11.
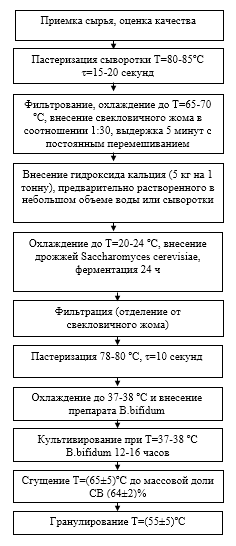
Рисунок 11 – Последовательность технологических этапов производства кормовой добавки
Основные технические параметры, определяющие количественные, качественные и стоимостные характеристики продукции:
— кормовая добавка представляет собой гранулы от светло-коричневого до коричневого цвета, имеет сладковато-солоноватый привкус;
— содержание полисахаридов пектина 12,5% от массовой доли сухих веществ;
— продукт должен оказывать бифидогенное действие, стимулируя рост и жизнедеятельность эндогенной микрофлоры желудка, тем самым повышая перевариваемость корма, его усвояемость. Направлен на профилактику желудочно-кишечных заболеваний сельскохозяйственных животных, что снизит процент гибели молодняка по причине острых кишечных заболеваний;
— добавку необходимо использовать по разработанным рекомендациям в дозировке и периодичности, опреденной опытным путем для каждого вида сельскохозяйственных животных и птицы;
— по сравнению с аналагоми процесс производства более экологичен, прост, используются вторичные сырьевые ресурсы (жом, жмых, сыворотка). Использование дрожжей Saccharomyces cerevisiae как источник пектинолитических ферментов для получения галактозосодержащих пребиотиков — новое направление в биологии данного вида дрожжей.
3.8 Влияние кормовой добавки на живую массу телят и показатели крови
С целью повышения интенсивности роста, оптимизации гомеостаза и микробиоценоза кишечника у телят ООО «Мясные Фермы – Искра» с 27 мая 2019 года по 02 сентября 2019 года был проведен эксперимент. С учетом породы, возраста и живой массы методом групп аналогов были сформированы 3 группы по 12 голов телят породы Обрак 1 – 1,5 месячного возраста. Животные первой группы были контрольные, телята 2 группы получали один раз в сутки по 10 грамм, а 3 группы – по 20 грамм кормовой добавки в течение 2 месяцев. Телята содержались в соответствующих ветеринарно-зоогигиеническим требованиям условиях, получали хозяйственный рацион в соответствии с общепринятыми нормами.
Установлено, что введение в рацион телятам кормовой лечебно-профилактической добавки способствовало более интенсивному приросту живой массы (таблица 14).
Живая масса животных подопытных групп перед началом опыта достоверно не различалась. Через 1 месяц после использования добавки отмечена тенденция к более высокой живой массе у телят 2 и 3 групп на 1,7 и 1,9%, а через 2 месяца установлено достоверно значимое повышение этого показателя у животных 2 и 3 групп на 2,4 и 3,2 % соответственно, через месяц после окончания выпаивания кормовой добавки также установлена достоверно более высокая живая масса у телят 2 и 3 групп по сравнению с контролем (на 2,7 и 3,9% соответственно), с тенденцией к более высокому значению этого показателя у животных 3 группы по сравнению с телятами 2 группы (на 1,2% соответственно).
Таблица 14 — Влияние введения в рацион кормовой добавки на динамику живой массы телят
| Показатели | 1 группа, n=12 | 2 группа, n=12 | 3 группа, n=12 |
| Живая масса перед началом опыта, кг | 76,25±0,70 | 76,42±0,94 | 76,08±0,56 |
| Живая масса через 30 суток выпаивания препарата, кг | 102,92±0,85 | 104,67±0,72 | 104,83±0,47 |
| Живая масса через 60 суток выпаивания препарата, кг | 133,17±0,84 | 136,33±0,90** | 137,42±0,80** |
| Живая масса через месяц после окончания выпаивания препарата, кг | 164,83±0,73 | 169,25±0,62** | 171,33±0,57** |
Примечание: ** — p<0,01 к 1 группе.
Изучение биохимических показателей сыворотки крови, характеризующих гомеостаз телят, показало, что все они перед началом опыта и на протяжении опытного периода соответствовали нормативным значениям без достоверно значимых межгрупповых различий (таблица 15). Исключением являлся более высокий уровень (р<0,05) кальция в крови у телят 3 группы (на 10,76%) по сравнению с контролем через два месяца после опытного периода. При этом следует отметить, что у животных второй группы в этот период также была установлена тенденция к более высокому уровню кальция в крови по сравнению с контролем (на 8,76%), но без существенной разницы по сравнению с величиной этого показателя у животных 3 группы. Тенденция к более высокому содержанию кальция в крови у животных 2 и 3 групп была отмечена и через 1 месяц опытного периода (на 9,84 и 8,66% соответственно). Вероятно, при скармливании кормовой добавки в желудочно-кишечном тракте у телят создаются условия, способствующие более активному всасыванию кальция, которые затем, видимо, используется для минерализации кости.
Следует отметить выраженную тенденцию к более высокому содержанию в крови у телят 2 и 3 групп глюкозы по сравнению с контролем: на 2,77 и 2,15% — через 1 месяц опытного периода; 5,40 и 6,35% — через 2 месяца опытного периода; 9,48 и 3,06% — через 1 месяц после окончания выпаивания препарата. Таким образом, использование добавки создает условия для повышения уровня глюкозы в крови у телят и активизации энергетического объекта.
Таблица 15 — Влияние разных доз кормовой добавки на биохимические показатели крови телят.
| Показатели | Группы | Перед началом опыта | Через месяц опытного периода | Через 2 месяц опытного периода | Через месяц после окончания вскармливания |
| Глюкоза, ммоль/л | 1, n=5 | 3,14 ± 0,27 | 3,25 ± 0,15 | 3,15 ± 0,17 | 3,27 ± 0,18 |
| 2, n=5 | 2,80 ± 0,1 | 3,34 ± 0,13 | 3,32 ± 0,19 | 3,58 ± 0,11 | |
| 3, n=5 | 3,13 ± 0,27 | 3,32 ± 0,17 | 3,35 ± 0,06 | 3,37 ± 0,10 | |
| Кальций, ммоль/л | 1, n=5 | 2,34 ± 0,07 | 0,32 ± 0,02 | 2,51 ± 0,04 | 2,58 ± 0,15 |
| 2, n=5 | 2,35 ± 0,04 | 0,30 ± 0,03 | 2,73 ± 0,09 | 2,79 ± 0,09 | |
| 3, n=5 | 2,42 ± 0,04 | 0,33 ± 0,02 | 2,78 ± 0,05 | 2,58 ± 0,10 | |
| Фосфор, ммоль/л | 1, n=5 | 1,40 ± 0,07 | 1,67 ± 0,18 | 1,65 ± 0,11 | 1,31 ± 0,07 |
| 2, n=5 | 1,56 ± 0,07 | 1,41 ± 0,11 | 1,64 ± 0,10 | 1,54 ± 0,14 | |
| 3, n=5 | 1,53 ± 0,10 | 1,68 ± 0,11 | 1,55 ± 0,14 | 1,85 ± 0,32 | |
| Креатинин, ммоль/л | 1, n=5 | 94,00 ± 5,43 | 94,30 ± 4,72 | 90,21 ± 4,68 | 107,58 ± 3,98 |
| 2, n=5 | 100,25 ± 3,90 | 101,14 ± 1,56 | 89,93 ± 4,11 | 115,33 ± 4,39 | |
| 3, n=5 | 96,38 ± 4,62 | 98,47 ± 3,06 | 108,48 ± 7,12 | 112,01 ± 5,44 | |
| Мочевина, ммоль/л | 1, n=5 | 3,74 ± 0,07 | 3,86 ± 0,9 | 3,87 ± 0,09 | 3,88 ± 0,06 |
| 2, n=5 | 3,95 ± 0,09 | 3,95 ± 0,08 | 3,91 ± 0,06 | 3,87 ± 0,06 | |
| 3, n=5 | 3,90 ± 0,11 | 3,91 ± 0,10 | 3,89 ± 0,09 | 3,83 ± 0,07 | |
| Холестерин, ммоль/л | 1, n=5 | 3,02 ± 0,35 | 2,47 ± 0,19 | 2,44 ± 0,19 | 2,65 ± 0,09 |
| 2, n=5 | 2,12 ± 0,30 | 2,84 ± 0,10 | 2,79 ± 0,05 | 2,89 ± 0,04 | |
| 3, n=5 | 2,14 ± 0,13 | 2,26 ± 0,12 | 2,39 ± 0,15 | 2,71 ± 0,13 | |
| Общий белок г/л | 1, n=5 | 66,60 ± 1,57 | 66,60 ± 1,51 | 65,69 ± 1,49 | 66,30 ± 1,52 |
| 2, n=5 | 63,45 ± 2,29 | 63,45 ± 2,22 | 63,67 ± 1,72 | 64,10 ± 2,07 | |
| 3, n=5 | 61,77 ± 2,20 | 61,43 ± 2,09 | 61,04 ± 2,07 | 61,26 ± 1,81 |
Применение добавки в дозе 10 грамм в течение 2 месяцев кроме вышеуказанных общих эффектов обусловило устойчивость организма телят к действию стресс-факторов через месяц после окончания выпаивания препарата.
Учитывая незначительное повышение живой массы у телят, получавших 20 грамм добавки (3 группа), по сравнению с животными, получавшими 10 грамм добавки (2 группа), следует рекомендовать использование кормовой добавки при выращивании телят в течение 2 месяцев один раз в сутки по 10 грамм на голову.
4 ЭКОНОМИЧЕСКИЕ АСПЕКТЫ
4.1 Расчет себестоимости кормовой добавки
Расчет стоимости сырья для производства представлены в таблице 16.
Таблица 16 – Расчет себестоимости сырья и основных материалов
| Продукт | Сырье и основные материалы | Затраты сырье и основных материалов
на 1т продукции |
||
| Наименование | Цена за 1т, тыс. руб. | Кол-во тонн | Сумма затрат,
тыс.руб |
|
| КД | Молочная сыворотка | 6,0 | 120,0 | 0,72 |
| Свекловичный жом | 10,5 | 40,0 | 0,42 | |
| Дрожжи | 500 | 48,0 | 24 | |
| Бактериальный концентрат | 6000 | 0,00001 | 0,00006 | |
| ИТОГО | 25,14006 | |||
Структура затрат в калькуляции себестоимости приводится
в таблице 17.
Таблица 17 – Структура затрат в калькуляции себестоимости продукции
| Статья затрат | Затраты на 1 т продукта, тыс. руб. |
| Сырье и основные материалы | 25,14 |
| Транспортные расходы | 1,7 |
| Вспомогательные материалы | 3,56 |
| Топливо и энергия всех видов | 16,76 |
| Зарплата персонала | 3,4 |
| Страховые взносы | 0,8 |
| Расходы по содержанию и эксплуатацию оборудования | 0,93 |
| Цеховые расходы | 0,56 |
| Общезаводские расходы | 0,4 |
| Прочие производственные расходы | 0,002 |
| Производственная себестоимость | 43,252 |
| Коммерческие расходы | 4,32 |
| Полная себестоимость, тыс. руб. | 57,57 |
Расчет возможной прибыли и рентабельности от внедрения приводится в таблице 18.
Таблица 18 – Прибыль от реализации одной тонны продукции
| № п/п | Наименование продукции | Себестоимость
продукции, тыс. руб. |
Товарная продукция,
тыс. руб. |
Прибыль от реализации, тыс. руб. | Рентабельность, % |
| 1 | КД | 57,57 | 70,0 | 12,428 | 26,1 |
4.2 Расчет экономической эффективности применения кормовой добавки в рационах телят
В таблице 19 представлен расчет экономической эффективности применения кормовой добавки в условиях ООО «Мясные Фермы – Искра».
Таблица 19 – Экономическая эффективность при скармливании в рационе телят кормовой добавки
| Показатели | I контроль | II опытная |
| Общая стоимость израсходованных кормов на 1 голову, тыс.руб. | 14,11 | 14,1604 |
| Получено прироста живой массы, кг | 88,58 | 92,83 |
| Стоимость кормов, затраченных на 1 кг прироста, руб. | 159,2 | 152,5 |
| Удельный вес кормов в структуре себестоимости, % | 71,7 | 71,7 |
| Себестоимость 1 кг прироста, руб. | 222,036 | 212,69 |
| Получено дополнительно прироста живой массы, кг | — | 4,42 |
| Затрачено на период исследования добавки, г | — | 7200 |
| Стоимость добавки, затраченной на исследования, тыс.руб. | — | 0,504 |
ПУБЛИКАЦИИ ПО РЕЗУЛЬТАТАМ ВЫПОЛНЕНИЯ ПРОЕКТА
Список публикаций по проекту.
- Федосова, А. Н., Каледина, М. В., Шевченко, Н. П., Волощенко, Л. В., Байдина, И. А., & Трубчанинова, Н. С. (2019). Исследование пектолитической способности дрожжей Saccharomyces Cerevisiae. Хранение и переработка сельхозсырья, (3), 78-89. https://doi.org/10.36107/spfp.2019.184 (WoS)
- Каледина М.В., Федосова А.Н. Шевченко, Н. П., Волощенко, Л. В., Байдина, И. А. Пектиновые олигосахариды как фактор роста пробиотиков//Молочная промышленность. 2020. №2. С.54-53 (ядро РИНЦ, ведущий отраслевой журнал, ВАК)
- Волощенко Л.В., Зюбан А.В. Влияние новых пребиотических компонентов на рост и развитие пробиотических культур IN VITRO//Пища. Экология. Качество: сборник статей в 2 томах. Т1. – Барнаул: Из-во Алт.ун-та, 24-26 июня 2019 — С.175-178
- Каледина М.В., Зюбан А.В. Олигосахариды пектина: получение и применение в технологии функциональных продуктов//Innovations in life sciences: сборник материалов Международного симпозиума.Белгород, 10–11 октября 2019 г./ под общ. ред. И.В.Спичак. –Белгород: ИД «Белгород» НИУ «БелГУ», 2019. С. 99-101
- Дмитренко Ю.В., Федосова А.Н. Использование пектина как источника питания дрожжами Saccharomyces Scerevisiae//Научные основы развития АПК: Сб.науч.тр.по материалам XXI Всерос.(нац.) научн.-практ.конф. студентов, аспирантов и молодых ученых с международным участием (19 апреля –10 июня 2019г.)–Томск-Новосибирск: ИЦ Золотой колос, 2019. С. 214-218
- Федосова А.В., Дмитренко Ю.В. Изучение развития пекарских дрожжей в молочной среде с пектином//Международная студенческая научная конференция «Горинские чтения. Наука молодых – инновационному развитию АПК» (28-29 мая 2019), 2019. С. 288-289.
- Каледина М.В. Получение пребиотических компонентов для кормовых и пищевых добавок// В книге: Инновационные решения в аграрной науке – взгляд в будущее Материалы XXIII международной научно-производственной конференции. 2019. С. 13-15.
- Каледина М.В., Зюбан А.В. Влияние олигосахаридов пектина на рост пробиотических культур// В книге: Горинские чтения. Наука молодых — инновационному развитию АПК Материалы Международной студенческой научной конференции. 2019. С. 290-291.
ЗАКЛЮЧЕНИЕ
В настоящее время все больше специалистов обращают свое внимание на применение пребиотиков в животноводстве. Использование пребиотиков – метод протекции – строится на активизации роста и жизнедеятельности собственной полезной микрофлоры внедрением в кишечник веществ, селективно поддерживающих нормофлору кишечника. Концепция пребиотиков достаточно молода и продолжает интенсивно развиваться. Поиск веществ, способных избирательно стимулировать нормофлору желудочно-кишечного тракта, является актуальной проблемой.
Производные пектины – олигосахариды пектины – потенциальные пребиотики, с еще не оцененным потенциалом. Одной из возможностей их получения является ферментативный гидролиз пектинсодержащего сырья. Источниками таких ферментов являются некоторые бактерии, плесени и дрожжи.
Результаты исследования достоверно подтверждают возможность роста дрожжей Saccharomyces cerevisiae за счет энергетического использования пектина, при отсутствии других доступных для них углеводов. Масса дрожжей увеличивается через 12 часов практически в два раза, и тенденция роста сохранялась весь период наблюдения. Динамика роста дрожжей и визуальные наблюдения указывают на использование пектина по типу дыхания.
Способность дрожжей использовать пектин в качестве источника энергии подразумевает его гидролиз. У всех полимеров гидролиз протекает ступенчато, что приводит к накоплению в среде фрагментов стартовой молекулы процесса. Расщепление пектина неизбежно связано с образованием в среде фрагментов молекулы кислотного типа, состоящих из α-D-галактуроновой кислоты и ее метилированной формы, объединенных общим понятием пектиновые олигосахариды (ПОС).
К пектиновым олигосахаридам проявляет необычайно высокий интерес медицина, и в скором времени их будут использовать в качестве пребиотиков нового поколения в производстве продукции для людей, животных и птицы.
Предполагаемые направления использования результатов исследования:
- расширение спектра веществ пребиотической направленности для применения в агропромышленном комплексе;
- разработка новых технологических решений комплексной и безотходной переработки сырья, в том числе технологии бифидогенных добавок;
- расширение ассортимента продукции бифидогенного действия, как пищевой, так и кормовой продукции для животных и птицы.
В рамках программы импортозамещения разработка и внедрение технологий производства пребиотиков на базе собственных ресурсов имеет большое значение, поскольку рынок отечественных пребиотиков практически отсутствует. Использование вторичного сырья (сыворотка, жом и др.) для решения поставленной задачи экономит ресурсы пищевой отрасли, увеличивает экономическую эффективность производства.
В качестве источника пектина был выбран свекловичный жом, а средой для роста дрожжей являлась молочная сыворотка. На основании полученных данных о росте дрожжей в среде с пектинсодержащим сырьем, разработа технология кормовой добавки бифидогенного действия.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
- Банницына Т.Е., Ле АньТуан, А.В. Канарский. Применение дрожжей и продуктов их переработки в пищевой промышленности // Вестн. Воронежского ГАУ. 2015. № 4 (47). С. 176-183.
- Валышев А.В., Головченко В.В. Пребиотическая активность пектинов и их производных [Электронный ресурс]// Бюллетень Оренбургского научного центра УрО РАН (электронный журнал). 2012. №3. Режим доступа: http://elmag.uran.ru:9673/magazine/Numbers/2012-3%20/Annotations/a_5Valyshev-Golovchenko.pdf (дата обращения 25.07.19).
- Влияние условий культивирования на выход и качество хлебопекарных дрожжей / О.И. Пономарева [и др.] // Научный журнал НИУ ИТМО. Серия «Процессы и аппараты пищевых производств». 2011. С.10.
- Влияние экстремальных значений pН на орфологические особенности дрожжей saccharomyces cerevisiae /Исламмагомедова Э. А. [и др.] // Изв.. Самарского научн. центра Российской академии наук. Общая биология. 2018. т.20, №5(2) с.219-225.
- ГОСТ Р 55 298-2012 Методы определения пектолитической активности. Дата введения 2014-01-01. М.: Стандартинформ, 2014. 39 с.
- ГОСТ Р 55577-2013 Продукты пищевые специализированные и функциональные. Информация об отличительных признаках и эффективности (с измен. N 1 от 2017г.) Дата введения 2015-01-01 М.: Стандартинформ, 2014. 45 с.
- ГОСТ Р 55979-2014 Методы определения пектат- и пектин-лиазной активностей. Дата введения 2015-07-01. М.: Стандартинформ, 2014. 20 с.
- Исламмагомедова Э.А., Котенко С.Ц. Физиолого-биохимические особенности дрожжей Saccharomyces cerevisiae в зависимости от состава среды культивирования // Пиво и напитки, № 4. 2007. С.14-15.
- Каледина М.В., Федосова А.Н. Использование полисахаридов в технологии функциональных продуктов // Молочная промышленность, 2017. № 6. С. 65-67.
- Качмазов Г. С. Дрожи бродильных производств. Практическое руководство: учебное пособие. Спб.Изд. Лань, 2012. 224 с
- Лисовец У.А., Агеева Н.М. Секреция ферментов из дрожжевой клетки в виноматериал в технологии белых столовых вин. // Науч. труды КубГТУ, № 5, 2017. С. 93-106.
- Меледина Т.В., Давыденко С.Г. Дрожжи Saccharomyces cerevisiae. Морфология, химический состав, метаболизм: Учеб. пособие. СПб.: Университет ИТМО, 2015. 88 с.
- Мударисов Т., Яхин А., Кумарин С. Автолизат пивных дрожжей в рационах. // Животноводство России. 2009. № 8.С.31.
- Сафонова Е.А., Потапов А.Н., Вагайцева Е.А. Интенсификация технологических процессов производства пива при использовании роторно-пульсационного аппарата // Техника и технология пищевых производств. 2015. № 1. 10 с.
- Тёпел А. Химия и физика молока. Пер. с нем. С. А. Фильчаковой. СПб. Профессия, 2012. 832 с.
- Тулякова Т.В., Пасхин А.В., В.Ю. Седов. Дрожжевые экстракты – безопасные источники витаминов, минеральных веществ и аминокислот // Пищевая промышленность. 2004. № 6. с. 60-62.
- Эльдаров М.А., Равин Н.В. Дрожжи как фабрика для получения лекарств// Центр «Биоинженерия» РАН. 2014. URL: http://portal.tpu.ru/SHARED/a/ALLYSY/academic/Tab4/pr10_dr.pdf (дата обращения: 15.07.2019).
- Miecznikow E. O Naturze Ludzkiej – Zarys Filozofii Optymistycznej (translation F. Wermiński). Wydawnictwo Biblioteka Naukowa. Warszawa; 1907.
- Alexopoulos C, Georgoulakis IE, Tzivara A, et al. Field evaluation of the efficacy of a probiotic containing Bacillus licheniformis and Bacillus subtilis spores, on the health status and performance of sows and their litters. J Anim Physiol Anim Nutr. 2004;88:381–92.
- Anadón A, Castellano V, Martínez-Larrañaga MR. Regulation and guidelines of probiotics and prebiotics. In: Ötles S, editor. Probiotics and prebiotics in food, nutrition and health. Boca Raton, FL: CRC Press, LLC Taylor & Francis Group; 2014. p. 91–113. ISBN 978-1-4665-8623-9.
- Anadón A, Martínez-Larrańaga MR, Martínez MA. Probiotics for animal nutrition in the European Union, regulation and safety assessment. Regul Toxicol Pharmacol. 2006;45:91–5.
- Awad WA, Ghareeb K, Abdel-Raheem S, et al. Effects of dietary inclusion of probiotic and synbiotic on growth performance, organ weights, and intestinal histomorphology of broiler chickens. Poult Sci. 2009;88:49–55.
- Bajagai YS, Klieve AV, Dart PJ, Bryden WL. Probiotics in animal nutrition-production, impact and regulation. In: Makkar HPS, editor. FAO animal production and health paper No. 179. Food and Agriculture Organization of the United Nation, Rome, Italy; 2016.
- Lee IK, Kye YC, Kim G, Kim HW, Gu MJ, Umboh J, et al. Stress, nutrition, and intestinal immune responses in pigs—a review. Asian Australas J Anim Sci. 2016;29:1075–82.
- Baurhoo B, Letellier A, Zhao X, et al. Cecal populations of Lactobacilli and Bifidobacteria and Escherichia coli after in vivo Escherichia coli challenge in birds fed diets with purified lignin or mannanoligosaccharides. Poult Sci. 2007;86:2509–16.
- Bengmark S. Bioecological control of the gastrointestinal tract: the role of flora and supplemented probiotics and synbiotics. Gastroenterol Clin North Am. 2005;34:413–36.
- Biernasiak J, Śliżewska K, Libudzisz Z. Negatywne skutki stosowania antybiotyków. Postęp Nauk Rol. 2010;3:105–17.
- Biggs P, Parsons CM, Fahey GC. The effects of several oligosaccharides on growth performance, nutrient digestibilities, and cecal microbial populations in young chicks. Poult Sci. 2007;86(11):2327–36.
- Biggs P, Parsons CM. The effects of probiotic on growth performance, nutrient digestibilities, and cecal microbial populations in young chicks. Poult Sci. 2008;87:1796–803.
- Bindels LB, Delzenne NM, Cani PD, et al. Towards a more comprehensive concept for prebiotics. Nat Rev Gastroenterol Hepatol. 2015;12:303–10.
- Bindels LB, Delzenne NM, Cani PD, Walter J. Towards a more comprehensive concept for prebiotics// Nature Reviews Gastroenterology & Hepatology. 2015. 12:303–10.
- Blottiere H, Cherbut C, Le G, et al. Prolonged intake of fructoligosaccharides inductes a short-term elevation of lactic lacid—producing bacteria and a persistent increase in cecal butyrate in rats. Am Soc Nutr Sc. 1999;129:2231–5.
- Bode L. The functional biology of human milk oligosaccharides. Early Hum Dev. 2015; 91(11):619–622.
- Böhmer BM, Kramer W, Roth-Maier DA. Dietary probiotic supplementation and resulting effects on performance, health status and microbial characteristics of primiparous sows. J Anim Physiol Anim Nutr. 2006;90:309–15.
- Bomba A, Nemcova R, Gancarcikova S, Herich R, Guba P, Mudronova D. Improvement of the probiotic effect of micro-organisms by their combination with maltodextrins, fructo-oligosaccharides and polyunsaturated fatty acids. Br J Nutr. 2002;88(1):95–9.
- Borchers AT, Selmi C, Meyers FJ, Keen CL, Gershwin ME. Probiotics and immunity. J Gastroenterol. 2009;44:26–46.
- Casey PG, Gardiner GE, Casey G, et al. A 5-strain probiotic combination reduces pathogen shedding and alleviates disease signs in pigs challenged with Salmonella enterica serovar Typhimurium. Appl Environ Microb. 2007;73:1858–63.
- Cencic A, Chingwaru W. The role of functional foods, nutraceuticals, and food supplements in intestinal health. Nutrients. 2010;2(6):611–25.
- Ceslovas J, Vigilijus J, Almantas S. The effect of probiotic and phytobiotics on meat properties and quality in pigs. Vet Zootech. 2005;29:80–4.
- Chateau N, Castellanos I, Deschamps AM. Distribution of pathogen inhibition in the Lactobacillus isolates of a commercial probiotic consortium. J Appl Bacteriol. 1993;74:36–40.
- Chiofalo V, Liotta L, Chiofalo B. Effects of the administration of Lactobacilli on body growth and on the metabolic profile in growing Maltese goat kids. Reprod Nutr Dev. 2004;44:449–57.
- Collins MD, Gibson GR. Probiotics, prebiotics, and synbiotics: approaches for modulating the microbial ecology of the gut. Am J Clin Nutr. 1999;69:1042S–57S.
- Corr SC, Li Y, Riedel CU, et al. Bacteriocin production as mechanism for the anti-infective activity of Lactobacillus salivarius UCC118. PNAS. 2007;104:7617–21.
- Crittenden R, Playne MJ. Prebiotics. In: Lee YK, Salminen S, editors. Handbook of probiotics and prebiotics. Hoboken, New Jersey: Wiley; 2009. p. 535–61.
- Current state and latest advances in the concept, production and functionality of prebiotic oligosaccharides/ Moreno F.J. et al. //Current Opinion in Food Science. 2017. 13:50–55.
- Dalloul RA, Lillehoj HS. Recent advances in immunomodulation and vaccination strategies against coccidiosis. Avian Dis. 2005;49:1–8.
- de Rezende ASC, Trigo P, Lana AMQ, Santiago JM, Silva VP, Montijano FC. East as a feed additive for training horses. Cienc Agrotecnol. 2012;36:354–62.
- De Vrese M, Schrezenmeir J. Probiotics, prebiotics and synbiotics. In: Stahl U, Donalies UEB, Nevoigt E, editors. Food biotechnology, advances in biochemical engineering/biotechnology. Berlin: Springer; 2008. p. 1–66.
- Doreau M, Jouany JP. Effect of a Saccharomyces cerevisiae culture on nutrient digestion in lactating dairy cows. J Dairy Sci. 1998;81:3214–21.
- Effects on faecal microbiota of dietary and acidic oligosaccharides in children during partial formula feeding/ Magne F. et al.// J. Pediatr. Gastroenterol. Nutr. 2008. 46 (5): 580-588.
- EFSA. Opinion of the Scientific Committee on a request from EFSA related to a generic approach to the safety assessment by EFSA of microorganisms used in food/feed and the production of food/feed additives. EFSA J. 2005;226:1–12.
- EFSA. Scientific opinion on the maintenance of the list of QPS biological agents intentionally added to food and feed (2013 update). EFSA J. 2013;2013(3449):1–108.
- EFSA. Scientific opinion on the update of the list of QPS-recommended biological agents intentionally added to food or feed as notified to EFSA (2017 update). EFSA J. 2017;15(3):1–177. https://doi.org/10.2903/j.efsa.2017.4664.
- EFSA. The European union summary report on trends and sources of zoonoses, zoonotic agents and food-borne outbreaks in 2011. EFSA J. 2013;3129:1–250.
- Fairbrother JM, Nadeau É, Gyles CL. Escherichia coli in postweaning diarrhea in pigs: an update on bacterial types, pathogenesis, and prevention strategies. Anim Health Res Rev. 2005;6(1):17–39.
- FAO, Bajagai YS, Klieve AV, Dart PJ, Bryden WL. Probiotics in animal nutrition-production, impact and regulation. In: Makkar HPS, editor. Paper No. 179. Rome: FAO Animal Production and Health; 2016.
- FAO. Food and Agriculture Organization of the United Nations. Guidelines for the evaluation of probiotics in food. 2009;27.01.2009.
- FAO. Guidelines for the evaluation of probiotics in food. Report of a Joint FAO/WHO Working Group on Drafting Gidelines for the evaluation of probiotics in food. 2002;30.04–01.05.2002, London, Ontario, Kanada.
- FAO. Technical Meeting on Prebiotics: Food Quality and Standards Service (AGNS), Food and Agriculture Organization of the United Nations (FAO) 15-16.09.2007. FAO Technical meeting Report. 2007.
- Fedosova А.N., Kaledina M. V. New Approaches to Creating Functional Products for a Closed Milk-Polysaccharide System //Foods and Raw Materials. 2017. 5(2):44-53.
- Fuller R. Probiotics for farm animals. Probiotics: A Crit Rev; 1999. p. 15–22.
- Fuller R. Probiotics in man and animals. J Appl Bacteriol. 1989;66:365–78.
- Fuller R. Probiotics: the scientific basis. 1st ed. New York: Chapman & Hall; 1992.
- Fuller R. What is a probiotic? Biologist. 2004;51:232.
- Gaggia F, Mattarelli P, Biavati B. Probiotics and prebiotics in animal feeding for safe food production. Int J Food Microbiol. 2010;141:S15–28.
- García-Lafuente A, Antolín M, Guarner F, Crespo E, Malagelada JR. Modulation of colonic barrier function by the composition of the commensal flora in the rat. Gut. 2001;48:503–7.
- Gibson G. R., Probert H. M., Van Loo J. Dietary modulation of the human colonic microbiota: Updating the concept of prebiotics. Nutr Res Rev. 2004. Vol. 17: 257-259.
- Gibson GR, Hutkins R, et al. The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of prebiotics. Nat Rev Gastroenterol Hepatol. 2017;14(8):491–502. https://doi.org/10.1038/nrgastro.2017.75 (Epub 2017 Jun 14).
- Gibson GR, Probert HM, van Loo J, et al. Dietary modulation of the human colonic microbiota: updating the concept of the prebiotics. Nutr Res Rev. 2004;17:259–75.
- Gibson GR, Scott KP, Rastall RA, et al. Dietary prebiotics: current status and new definition. Food Sci Tech Bull Funct Food. 2010;7:1–19.
- Gibson GR. Prebiotics. Best Pract Res Clin Gastroenterol. 2003;18:287–98.
- Gibson RG, Roberfroid MB. Dietary modulation of the human colonic microbiota: introducing the concept of prebiotics. J Appl Bacteriol. 1995;125(6):1401–12.
- Gómez B, Gullón B, Yáñez R. Pectic Oligosacharides from lemon peel wastes: production, purification, and chemical characterization// Journal of Agricultural and Food Chemistry. 2013. 61:10043–53.
- Grajek W, Olejnik A, Sip A. Probiotics, prebiotics and antioxidants as functional foods. Acta Biochim Pol. 2005;52(3):665–71.
- Guarner F, Schaafsma GJ. Probiotics. Int. J Food Microbiol. 1998;39:237–8.
- Haddadin MSY, Abdulrahim SM, Hashlamoun EAR, et al. The effects of Lactobacillus acidophilus on the production and chemical composition of hen’s eggs. Poult Sci. 1996;75:491–4.
- Havenaar R, Huis In’t Veld JHJ. Probiotics: a general view. In: Wood BJB, editor. Lactic acid bacteria in health and disease. London: Elsevier Applied Science Publishers; 1992. p. 151–70.
- Hill C, Guarner F, Reid G, et al. Sanders expert consensus document: the International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nat Rev Gastroenterol Hepatol. 2014;11:506–14.
- Hollister A, Cheeke P, Robinson A, et al. Effects of water administrated probiotics and acidifiers on growth, feed conversion and enteritis mortality of weanling rabbits. J Appl Rabbit Res. 1989;12:143–7.
- Holzapfel WH, Schillinger U. Introduction to pre- and probiotics. Food Res Int. 2002;35:109–16.
- Imperial ICVJ, Ibana JA. Addressing the antibiotic resistance problem with probiotics: reducing the risk of its double-edged sword effect. Front Microbiol. 2016;7:1983.
- Isolauri E, Salminen S, Ouwehand AC. Probiotics. Best Pract Res Clin Gastroenterol. 2004;18:299–313.
- Jung SJ, Houde R, Baurhoo B, et al. Effects of galactooligosaccharides and a Bifidobacteria lactis-based probiotic strain on the growth performance and fecal microflora of broiler chickens. Poult Sci. 2008;87:1694–9.
- Juśkiewicz J, Jankowski J, Zduńczyk Z, et al. Performance and gastrointestinal tract metabolism of turkeys fed diets with different contents of fructooligosaccharides. Poult Sci. 2006;85:886–91.
- Kantas D, Papatsiros V, Tassis P, Giavasis I, Bouki P, Tzika E. A feed additive containing Bacillus toyonensis (Toyocerin®) protects against enteric pathogens in postweaning piglets. J Appl Microbiol. 2015;118(3):727–38.
- Kleessen B, Elsayed NA, Loehren U, et al. Jerusalem artichokes stimulate growth of boiler chickens and protect them against endotoxins and potential cecal pathogens. J Food Prot. 2003;11:2171–5.
- Konstantinov SR, Smidt H, Akkermans ADL, Casini L, Trevisi P, Mazzoni M, De Filippi S, Bosi P, de Vos W. Feeding of Lactobacillus sobrius reduces Escherichia coli F4 levels in the gut and promotes growth of infected piglets. FEMS Microbiol Ecol. 2008;66:599–607.
- Kritas SK, Govaris A, Christodoulopouls G, et al. Effect of Bacillus licheniformis and Bacillus subtilis supplementation of Ewe’s feed on sheep milk production and young lamb mortality. J Vet Med Ser. 2006;53:170–3.
- Kurtoglu V, Kurtoglu F, Seker E, et al. Effect of probiotic supplementation on laying hen diets on yield performance and serum and egg yolk cholesterol. Food Addit Contam. 2004;21:817–23.
- Kyriakis SC, Tsiloyiannis VK, Vlemmas J, et al. The effect of probiotic LSP 122 on the control of post-weaning diarrhea syndrome of piglets. Res Vet Sci. 1999;67:223–8.
- Lee YK. Selection and maintenance of probiotic microorganisms. In: Lee YK, Salminen S, editors. Handbook of probiotics and prebiotics. New Jersey: Wiley; 2009. p. 177–87.
- Lei X, Piao X, Ru Y, Zhang H, Péron A, Zhang H. Effect of Bacillus amyloliquefaciens-based direct-fed microbial on performance, nutrient utilization, intestinal morphology and cecal microflora in broiler chickens. Asian Austral J Anim. 2015;28(2):239–46.
- Li X, Liu LQ, Xu CL. Effects of supplementation of fructooligosaccharide and/or Bacillus subtilis to diets on performance and intestinal microflora in broilers. Archiv für Tierzucht. 2008;51:64–70.
- Li X, Yin J, Li D, et al. Dietary supplementation with zinc oxide increases igf-I and igf-I receptor gene expression in the small intestine of weanling piglets. J Nutr. 2006;136:1786–91.
- Liao SF, Nyachoti M. Using probiotics to improve swine gut health and nutrient utilization. Anim Nutr. 2017;3(4):331–43.
- Lilly DM, Stillwell RH. Probiotics: growth promoting factors produced by microorganisms. Science. 1965;147:747–8.
- Madsen K, Cornish A, Soper P, McKaigney C, Jijon H, Yachimec C, et al. Probiotic bacteria enhance murine and human intestinal epithelial barrier function. Gastroenterology. 2001;121:580–91.
- Maiorano G, Stadnicka K, Tavaniello S, et al. In ovo validation model to assess the efficacy of commercial prebiotics on broiler performance and oxidative stability of meat. Poult Sci. 2017;96(2):511–8.
- Microbial Pectic Enzymes in the Food and Wine Industry/ Carmen Sieiro et al. // Food Industrial Processes – Methods and Equipment. 2012. 201-218. Available from: http://www.intechopen.com/books/food-industrial-processes-methods-and-equipment/microbial-pecticenzymes-in-the-food-and-wine-industry
- Mizak L, Gryko R, Kwiatek M, et al. Probiotyki w żywieniu zwierząt. Życie Weterynaryjne. 2012;87(9):736–41.
- Modesto M, D’Aimmo MR, Stefanini I, et al. A novel strategy to select Bifidobacterium strains and prebiotics as natural growth promoters in newly weaned pigs. Livest Sci. 2009;122:248–58.
- Mohnl M, Acosta Aragon Y, Acosta Ojeda A, et al. Effect of synbiotic feed additive in comparison to antibiotic growth promoter on performance and health status of broilers. Poult Sci. 2007;86(1):217.
- Monsan P, Paul F. Oligosaccharide feed additives. In: Wallace RJ, Chesson A, editors. VHC biotechnology in animal feeds and animal feeding New York. Weinheim: Wiley; 1995. p. 233–45.
- Mountzouris KC, Tsirtsikos P, Kalamara E, et al. Evaluation of the efficacy of a probiotic containing Lactobacillus, Bifidobacterium, Enterococcus, and Pediococcus strains in promoting broiler performance and modulating cecal microflora composition and metabolic activities. Poult Sci. 2007;86(2):309–17.
- Muñoz-Atienza E, Gómez-Sala B, Araújo C, Campanero C, Del Campo R, Hernández PE, et al. Antimicrobial activity, antibiotic susceptibility and virulence factors of lactic acid bacteria of aquatic origin intended for use as probiotics in aquaculture. BMC Microbiol. 2013;13:15.
- Musa HH, Wu SL, Zhu CH, et al. The potential benefits of probiotics in animal production and health. J Anim Vet Adv. 2009;8(2):313–21.
- Naidu AS, Bidlack WR, Clemens RA. Probiotic spectra of lactic acid bacteria (LAB). Crit Rev Food Sci Nutr. 1999;39:13–126.
- Nemcová R, Bomba A, Gancarčı́ková S, et al. Effects of the administration of lactobacilli, maltodextrins and fructooligosaccharides upon the adhesion of E. coli O8:K88 to the intestinal mucosa and organic acid levels in the gut contents of piglets. Vet Res Commun. 2007;31:791–800.
- Nemcová R, Bomba A, Gancarčı́ková S, et al. Study of the effect of Lactobacillus paracasei and fructooligosaccharides on the faecal microflora in weanling piglets. Berl Munchener Tierärztliche Wochenschr. 1999;112:225–8.
- Ng SC, Hart AL, Kamm MA, Stagg AJ, Knight SC. Mechanisms of action of probiotics: recent advances. Inflamm Bowel Dis. 2009;15:300–10.
- Olveira G, González-Molero I. An update on probiotics, prebiotics and synbiotics in clinical nutrition. Endocrinol Nutr. 2016;63(9):482–94.
- Orban JI, Patterson JA, Sutton AL, et al. Effect of sucrose thermal oligosaccharide caramel, dietary vitamin-mineral level, and brooding temperature on growth and intestinal bacterial populations in broiler chickens. Poult Sci. 1997;76:482–90.
- Panesar PS, Kaur G, Panesar R, et al. Synbiotics: potential dietary supplements in functional foods. Cent: Food Sci; 2009.
- Parker RB. Probiotics, the other half of the antibiotic story. Anim Nutr Health. 1974;29:4–8.
- Patel S, Shukla R, Goyal A. Probiotics in valorization of innate immunity across various animal models. J Funct Foods. 2015;14:549–61.
- Patterson JA, Burkholder KM. Application of prebiotics and probiotics in poultry production. Poult Sci. 2003;82:627–31.
- Patterson JA, Orban JI, Sutton AL, et al. Selective enrichment of bifidobacteria in the intestinal tract of broilers by thermally produced kestoses and effect on broiler performance. Poult Sci. 1997;76:497–500.
- Pectic oligosaccharides: Manufacture and functional properties/ Gullon B. et al.//Trends Food Sci Tech. 2013. 30(2):153–161.
- Plavnik I, Scott ML. Effects of additional vitamins, minerals or brewers yeast upon leg weaknesses in broiler chickens. Poult Sci. 1980;59:459–64.
- Pontes DS, Lima-Bittencourt CI, Chartone-Souza E, Amaral Nascimento AM. Molecular approaches: advantages and artifacts in assessing bacterial diversity. J Ind Microbiol Biotechnol. 2007;34:463–73.
- Rachwał A. Naturalne promotory wzrostu. Hodowca drobiu. 2003;8:31–2.
- Rastall RA, Gibson GR. Recent developments in prebiotics to selectively impact beneficial microbes and promote intestinal health. Curr Opin Biotechnol. 2015;32:42–6.
- Rettger LF, Cheplin HAA. Treatise on the Transformation of the Intestinal Flora: with Special Reference to the Implantation of Bacillus acidophilus. New Haven: Yale University Press; 1921. p. 13.
- Revolledo L, Ferreira CSA, Ferreira AJP. Prevention of Salmonella Typhimurium colonization and organ invasion by combination treatment in broiler chicks. Poult Sci. 2009;88:734–43.
- Rioux KP, Madsen KL, Fedorak RN. The role of enteric microflora in inflammatory bowel disease: human and animal studies with probiotics and prebiotics. Gastroenterol Clin North Am. 2005;34:465–82.
- Roberfroid M. Prebiotics: the concept revisited // J. Nutr. 2007. 137(3 Suppl. 2): 830-837
- Salminen S. Uniqueness of probiotic strains. Int Dairy Fed Nutr Newsl. 1996;5:16–8.
- Samli HE, Senkoylu N, Koc F, et al. Effects of Enterococcus faecium and dried whey on broiler performance, gut histomorphology and intestinal microbiota. Arch Anim Nutr. 2007;61:42–9.
- Sanders ME, Akkermans LM, Haller D, Hammerman C, Heimbach JT, Hörmannsperger G, et al. Safety assessment of probiotics for human use. Gut Microbes. 2010;1:164–85.
- Sanders ME. How do we know when something called “probiotic” is really a probiotic? A guideline for consumers and health professionals. Funct Food Rev. 2009;1:3–12.
- Sara A, Cighi V, Odagiu A, et al. Research concerning the effect of the probiotic YEA-SACC-1026 on productive performances in sheep. Ser Zooteh si Biotechnol. 2002;57:254–8.
- Scavuzzi BM, Henrique FC, Miglioranza LHS, et al. Impact of prebiotics, probiotics and synbiotics on components of the metabolic syndrome. Ann Nutr Disord Ther. 2014;1:1009.
- Schaafsama G. State-of-the-art concerning probiotic strains in milk products. Int Dairy Fed Nutr Newsl. 1996;5:23–4.
- Schrezenmeir J, dr Vrese M. Probiotics, prebiotics and synbiotics—approaching a definition. Am Soc Clin Nutr. 2001;73:361S–4S.
- Simon O. Microorganisms as feed additives—probiotics. Adv Pork Prod. 2005;16:161–7.
- Sims MD, Dawson KA, Newman KE, et al. Effects of dietary mannanoligosaccharide, bacitracin methylene disalicylate, or both on the live performance and intestinal microbiology of turkeys. Poult Sci. 2004;83:1148–54.
- Singh B, Gautam SK, Verma V, Kumar M, Singh B. Metagenomics in animal gastrointestinal ecosystem: potential biotechnological prospects. Anaerobe. 2008;14:138–44.
- Śliżewska K, Biernasiak J, Libudzisz Z. Probiotyki jako alternatywa dla antybiotyków. Zeszyty Naukowe Politechniki Łódzkiej. 2006;984:79–81.
- Śliżewska K, Nowak A, Barczyńska R, et al. Prebiotyki — definicja, właściwości i zastosowanie w przemyśle. ŻYWNOŚĆ Nauka Technolog Jakość. 2013;1(86):5–20.
- Smiricky-Tjardes MR, Grieshop CM, Flickinger EA, et al. Dietary galactooligosaccharides affect ileal and total-tract nutrient digestibility, ileal and fecal bacterial concentrations, and ileal fermentative characteristics of growing pigs. J Anim Sci. 2003;81:2535–45.
- Sperti GS. Probiotics. West Point (CT): AVI Publishing Co; 1971.
- Spring P, Wenk C, Dawson KA, et al. The effects of dietary mannanoligosaccharides on cecal parameters and the concentrations of enteric bacteria in the ceca of Salmonella-challenged broiler chicks. Poult Sci. 2000;79:205–11.
- Stanczuk J, Zdunczyk Z, Juskiewicz J, et al. Indices of response of young turkeys to diets containing mannanoligosaccharide or inulin. Vet Zootech. 2005;31:98–101.
- Stern NJ, Cox NA, Bailey JS, et al. Comparison of mucosal competitive exclusion and competitive exclusion treatment to reduce Salmonella and Campylobacter sp. colonization in broiler chickens. Poult Sci. 2001;80:156–60.
- Stevens CE, Hume ID. Contributions of microbes in vertebrate gastrointestinal tract to production and conservation of nutrients. Physiol Rev. 1998;78:393–427.
- Szeleszczuk P. Weterynaryjne aspekty stosowania żywych kultur mikroorganizmów w praktyce drobiarskiej. Cz I Praktyka kliniczna. 2005;11(99):56–8.
- Takahashi S, Egawa Y, Simojo N, et al. Oral administration of Lactobacillus plantarum strain Lq80 to weaning piglets stimulates the growth of indigenous lactobacilli to modify the lactobacillal population. J Gen Appl Microbiol. 2007;53:325–32.
- Takahashi T, Nakagawa E, Nara T, Yajima T, Kuwata T. Effects of orally ingested Bifidobacterium longum on the mucosal IgA response of mice to dietary antigens. Biosci Biotechnol Biochem. 1998;62:10–5.
- Taras D, Vahjen W, Macha M, et al. Performance, diarrhoea incidence, and occurrence of Escherichia coli virulence genes during long-term administration of a probiotic Enterococcus faecium strain to sows and piglets. J Anim Sci. 2006;84:608–17.
- Taras D, Vahjen W, Macha M, Simon O. Response of performance characteristics and faecal consistency to long-lasting dietary supplementation with the probiotic strain Bacillus cereus var. toyoi to sows and piglets. Arch Anim Nutr. 2005;59(6):405–17.
- Tellez G, Petrone VM, Escorcia M, et al. Evaluation of avian-specific probiotic and Salmonella Enteritidis, Salmonella Typhimurium and Salmonella Heidelberg-specific antibodies on cecal colonization and organ invasion of Salmonella Enteritidis in broilers. J Food Prot. 2001;64:287–91.
- The Phenomenon Of Pectin And Its Use In The Dairy Industry/AN Fedosova [et al] //Research Journal of Pharmaceutical, Biological and Chemical Sciences. 2018. 9(5):950-959.
- Thitaram SN, Chung CH, Day DF, et al. Siragusa, “Isomaltooligosaccharide increases cecal Bifidobacterium population in young broiler chickens. Poult Sci. 2005;84:998–1003.
- Toghyani M, Toghyani M, Tabeidian SA. Effect of probiotic and prebiotic as antibiotic growth promoter substitutions on productive and carcass traits of broiler chicks. Int Conf Food Eng Biotechnol. 2011;9:82–6.
- Torres-Rodriquez A, Donoghue AM, Donoghue DJ, et al. Performance and condemnation rate analysis of commercial turkey flocks treated with a Lactobacillus sp.—based probiotic. Poult Sci. 2007;86:444–6.
- Truszczyński M, Pejsak Z. Wpływ stosowania u zwierząt antybiotyków na lekooporność bakterii chorobotwórczych dla człowieka. Med Weter. 2006;62:1339–43.
- Tzortzis G, Goulas AK, Gee JM, et al. A novel galactooligosaccharide mixture increases the bifidobacterial population numbers in a continuous in vitro fermentation system and in the proximal colonic contents of pigs in vivo. J Nutr. 2005;135(7):1726–31.
- Van Immerseel F, Russell JB, Flythe MD, et al. The use of organic acids to combat Salmonella in poultry: a mechanistic explanation of the efficacy. Avian Pathol. 2006;35:182–8.
- Vandeplas S, Dubois Dauphin R, Thiry C, et al. Efficiency of a Lactobacillus plantarum-xylanase combination on growth performances, microflora populations, and nutrient digestibilities of broilers infected with Salmonella Typhimurium. Poult Sci. 2009;88:1643–54.
- Varankovich NV, Nickerson MT, Korber DR. Probiotic-based strategies for therapeutic and prophylactic use against multiple gastrointestinal diseases. Front Microbiol. 2015;6:685.
- Vergin F. Anti- und Probiotica. Hipokrates. 1954;25:116–9.
- Vicente J, Wolfenden A, Torres-Rodriguez A, et al. Effect of a Lactobacillus species-based probiotic and dietary lactose prebiotic on turkey poultry performance with or without Salmonella Enteritidis challenge. J Appl Poult Res. 2007;16:361–
- Wang Y. Prebiotics: present and future in food science and technology. Food Res Int. 2009;42:8–12.
- Willing BP, Malik G, van Kessel AG. Nutrition and gut health in swine. In: Chiba LI, editor. Sustainable swine nutrition. Chichester: Wiley; 2012. p. 197–213.
- Xu ZR, Hu CH, Xia MS, et al. Effects of dietary fructooligosaccharide on digestive enzyme activities, intestinal microflora and morphology of male broilers. Poult Sci. 2003;82:1030–6.
- Yang F, Wang A, Zeng X, Hou C, Liu HS, Qiao S. Lactobacillus reuteri I5007 modulates tight junction protein expression in IPEC-J2 cells with LPS stimulation and in newborn piglets under normal conditions. BMC Microbiol. 2015;15:32.
- Yasuda K, Hashikawa S, Sakamoto H, et al. A new synbiotic consisting of Lactobacillus casei subsp. casei and dextran improves milk production in Holstein dairy cows. J Vet Med Sci. 2007;69:205–8.
- Yeo S.K., Liong M.T. Effect of prebiotics on viability and growth characteristics of probiotics in soymilk//J. Sci. Food Agric. 2010. 90 (2): 267-275.
- Yirga H. The use of probiotics in animal nutrition. J Prob Health. 2015;3:132.
- Yoon IK, Stern MD. Influence of direct-fed microbials on ruminant microbial fermentation and performance of ruminants: a review. Asian Australas J Anim Sci. 1995;8:533–55.
- Yu P, Huber JT, Theurer CB, et al. Effect of steam-flaked or steam-rolled corn with or without Aspergillus oryzae in the diet on performance of dairy cows fed during hot weather. J Dairy Sci. 1997;80(12):3293–7.
- Yusrizal X, Chen TC. Effect of adding chicory fructans in feed on fecal and intestinal microflora and excreta volatile ammonia. Int J Poult Sci. 2003;2:188–94.
- Yusrizal X, Chen TC. Effect of adding chicory fructans in feed on broiler growth performance serum cholesterol and intestinal length. Int J Poult Sci. 2003;2:214–9.
- Zeyner A, Boldt E. Effects of a probiotic Enterococcus faecium strain supplemented from birth to weaning on diarrhoea patterns and performance of piglets. J Anim Physiol Anim Nutr. 2006;90:25–31.
- Zhang ZF, Kim IH. Effects of multistrain probiotics on growth performance, apparent ileal nutrient digestibility, blood characteristics, cecal microbial shedding, and excreta odor contents in broilers. Poult Sci. 2014;93(2):364–70.
- Ziggers D. Tos, a new prebiotic derived from whey. Anim Feed Sci Technol. 2000;5:34–6.
