Титульный лист и исполнители
РЕФЕРАТ
Отчет 458 с., 2 части, 96 таблиц, 108 рисунков, 243 источника.
Ключевые слова: бактериофаги, порча, предотвращение, снижение, плодоовощная продукция, биопрепарат, штаммы, Bacillus pumilus, Bacillus subtilis, Bacillus coagulans, Listeria monocitogenes, Yersinia enterocolitica, деконтаминация.
Объекты исследования – специфические бактериофаги Bacilluspumilus, Bacillus subtilis, Bacillus coagulans, Listeria monocitogenes, Yersinia enterocoliticaи индикаторные культуры, обладающие для данных видов характерными биологическими свойствами;образцы пищевого сырья растительного происхождения и готовых продуктов питания, искусственно контаминированные (зараженные) бактериями Bacillus pumilus, Bacillus subtilis, Bacillus coagulans, Listeria monocitogenes, Yersinia enterocolitica.
Цель работы — разработка фагового биопрепарата и методов фаг-опосредованного биопроцессинга (обработка бактериофагами) плодоовощной продукции с целью увеличения сроков хранения и профилактики пищевыхотравлений.
При выполнении задач проекта были достигнуты следующие результаты:
— выделены новые бактериальные штаммы Bacillus pumilus, Bacillus subtilis, Bacillus coagulans, Listeria monocitogenes, Yersinia enterocolitica;
— выделены и селекционированы бактериофаги, активные в отношении бактерий Bacillus pumilus, Bacillus subtilis, Bacillus coagulans, Listeria monocitogenes, Yersinia enterocolitica;
— изучены биологические свойства (литическая активность, спектр литического действия, специфичность бактериофагов, изменение литической активности при хранении, морфология корпускул фагов, урожайность бактериофагов, влияние физических и химических факторов на бактериофаги, дана молекулярно-генетическая характеристика) выделенных фагов;
— сконструирован полифаговый биопрепарат на основе отобранных фагов с заданными биологическими свойствами (специфичность, максимально высокий титр литической активности, широкий спектр литического действия, устойчивость к факторам внешней среды, отсутствие в геноме участков, отвечающих за патогенность; сохранение показателя литической активности при хранении);
— для получения фаговых биопрепаратов разработана технология, позволяющая получать фаголизаты с высокими титрами литической активности, не значительно изменяющимися при хранении;
-референтным центрам ветеринарии и сельскохозяйственным и перерабатывающим предприятиям предложены новые высокоэффективные фаговые биопрепараты для опосредованного биопроцессинга (обработки бактериофагами пищевого сырья и готовой продукции, способствующей увеличению сроков хранения), позволяющие элиминировать (разрушать) патогенные микроорганизмы, контаминирующие плодоовощную продукцию, и снизить или предотвратить, тем самым, пищевые отравления;
— разработан комплект нормативно-технической документации по изготовлению и контролю экспериментальной серии фаговых биопрепаратов и методические рекомендации для фаг-опосредованного биопроцессинга (обработки бактериофагами) плодоовощной продукции с целью увеличения сроков хранения и профилактики пищевыхотравлений.
Введение
Основной причиной потерь растительного сырья при хранении является микробиальная порча. Современные способы обработки сырья при хранении такие, как обработка химическими препаратами, искусственное охлаждение, озонирование, электромагнитное излучение и другие, предотвращают микробиальную порчу, но, в тоже время, уничтожают биологический барьер, препятствующий проникновению патогенных микроорганизмов, снижая естественный иммунитет растительного сырья [1].
Перспективным направлением в хранении растительного сырья является применение биологических средств защиты, на основе активных штаммов антагонистов патогенной микрофлоры. Биопрепараты используют для борьбы с фитопатогенными организмами в послеуборочный период и при длительном холодильном хранении. При этом не создается угрозы нарушения экологического равновесия в биосфере, так как микроорганизмы, применяемые в качестве биопрепаратов, являются естественной микрофлорой окружающей среды [2].
Биоиндустрия в современном мире развивается высокими темпами. Мировой рынок биотехнологий в 2025 году может достигнуть уровня в 2 трил. долларов США, темпы роста по отдельным сегментам рынка колеблются от 5-7 до 30% ежегодно [3].
В России биотехнология в сельском хозяйстве развивается в рамках программы: «Государственная программа развития сельского хозяйства и регулирования рынков сельскохозяйственной продукции, сырья и продовольствия». На сегодняшний день доля России на рынке биотехнологий составляет менее 0,1%. Долгосрочной целью реализации Программы является выход в 2020 году на объем биоэкономики в России в размере около 1% ВВП и в 2030 году — не менее 3% ВВП [3].
Одним из направлений развития биотехнологий является производство биопрепаратов для использования в сельском хозяйстве, в том числе и в практике хранения продукции растениеводства. Применение биопрепаратов является наиболее эффективным, экологически безопасным и экономически выгодным способом хранения растительного сырья [1].
Наиболее приемлемой защитой растений с точки зрения её экологизации является биологический контроль с помощью микробных препаратов. Использование биопрепаратов на основе бактериофагов в качестве профилактического и терапевтического средства борьбы с болезнями представляется более целесообразным, поскольку фаги обладают рядом преимуществ:
1.Вирусы бактерий обладают высокой специфичностью в отношении бактерий, что позволяет избежать неблагоприятных последствий по отношению к окружающей среде и организму хозяина.
2.Устойчивость к бактериофагам у бактерий вырабатывается гораздо реже, чем к антибиотикам. При использовании на практике комплексных препаратов из нескольких штаммов фагов устойчивости у бактерий может не вырабатываться.
3.Благодаря наличию в составе бактериофагов литических ферментов, фаги могут разрушать экзополисахаридный матрикс бактериальных биопленок и воздействовать на клетки. Образование биопленок бактериями создает большие трудности для применения антибиотиков или пестицидов, поскольку в таком состоянии клетки обладают повышенной устойчивостью к действию химических агентов.
4.Бактериофаги в сравнении с химическими средствами оказывают меньшее токсическое воздействие, не вызывают аллергических реакций у человека и животных, не воздействуют на растения [4].
Цель работы — разработка фагового биопрепарата и методов фаг-опосредованного биопроцессинга (обработка бактериофагами) плодоовощной продукции с целью увеличения сроков хранения и профилактики пищевыхотравлений.
Задачи:
1. Выделение из плодоовощной продукции бактерий Bacillu spumilus, Bacillus subtilis, Bacillus coagulans, Listeria monocitogenes, Yersinia enterocolitica, вызывающих их порчу и пищевое отравление и их идентификация.
2. Выделение и селекция бактериофагов, активных в отношении вышеназванных видов микроорганизмов различными методами.
3. Изучение биологических свойств(литической активности, спектра литического действия, специфичностибактериофагов, изменения литической активности при хранении, морфологиикорпускул фагов, урожайности бактериофагов, влияния физических ихимических факторов на бактериофаги, молекулярно-генетической характеристики) выделенных штаммов фагов.
4. Конструирование полифагового биопрепарата на основе отобранных фагов с заданными биологическими свойствами (специфичность, максимально высокий титр литической активности, широкий спектр литического действия, устойчивость к факторам внешней среды, отсутствие в геноме участков, отвечающих за патогенность; сохранение показателя литической активности при хранении).
5. Разработка технологии изготовления лабораторной серии фагового биопрепарата для дальнейших исследований.
6. Подбор методов применения полифагового препарата для осуществления фаг-опосредованного биопроцессинга и оценка его эффективности с учетом физико-химических показателей обрабатываемой плодоовощной продукции.
7. Проведение экспериментальных исследований по обработке плодоовощной продукции полифаговым биопрепаратом и анализ эффективности с учетом временных и температурных параметров хранения.
8. Разработка нормативно-технической документации на сконстуированный полифаговый биопрепарат и методические рекомендации по его применению.
Новизна научных исследований
В результате проведенных исследований были выделены новые бактериальные штаммы Bacillus pumilus, Bacillus subtilis, Bacillus coagulans, Listeria monocitogenes, Yersinia enterocolitica.
Выделены и селекционированы новые бактериофаги, специфичные для вышеназванных бактерий,контаминирующих плодоовощную продукцию и вызывающих пищевые отравления. Изучены их основные биологические свойства (литическая активность, спектр литического действия и специфичность, влияние факторов внешней среды, урожайность и скорость адсорбции; дана молекулярно-генетическая характеристика).
Анализ полученной информации позволил нам сконструировать полифаговый биопрепарат, активный в отношении бактерий Bacillus pumilus, Bacillus subtilis, Bacillus coagulans, Listeria monocitogenes, Yersinia enterocolitica, имеющий высокий титр и срок хранения в течение 1 года.
Бактериофаг представляет собой прозрачную жидкость от светло-желтого до желтого цвета, закрытую в стеклянные флаконы под резиновую пробку и алюминиевый колпачок объемом 100-500 мл, титр фага составляет 107-108 БОЕ/мл, условия хранения: 2-4 0С в течение 12 месяцев, относительная влажность воздуха 70-80 %, при транспортировании учитывать хрупкость упаковки.
Теоретическая и практическая значимость
Сельскохозяйственным и перерабатывающим предприятиям будет предложен новый высокоэффективный полифаговый биопрепарат для опосредованного биопроцессинга (обработки пищевого сырья и готовой продукции, способствующей увеличению сроков хранения), позволяющий элиминировать (разрушать) патогенные микроорганизмы, вызывающие не только порчу, но и пищевые отравления.
Подобраны максимально эффективные методы для фаг-опосредованного биопроцессинга (обработка бактериофагами) с учетом физико-химических показателей обрабатываемой плодоовощной продукции.
Разработана нормативно-техническая документация по изготовлению и контролю экспериментальной серии полифагового биопрепарата и методические рекомендации по его применению в условиях производства:
— «Временная инструкция по изготовлению и контролю лабораторной серии полифагового биопрепарата, специфичного для бактерий Bacillus pumilus, Bacillus subtilis, Bacillus coagulans, Listeria monocitogenes, Yersinia enterocolitica»;
— «Методические рекомендации по применению полифагового биопрепарата Bacillus pumilus, Bacillus subtilis, Bacillus coagulans, Listeria monocitogenes, Yersinia enterocolitica для деконтаминации плодоовощной продукции»
Уровень значимости
Ульяновская область располагает обширными сельскохозяйственными угодьями (60% всех земель), отличается наибольшей их распаханностью (80%). Площадь посевов в области составляет 1,35 млн. га. Большую часть посевных площадей (2/3) занимают зерновые и зернобобовые культуры, в том числе — яровые 540 тыс. га. По основным показателям сельскохозяйственного производства Ульяновская область занимает 5-е место в Поволжском экономическом районе и 32-е — в стране. Основными видами производимой сельскохозяйственной продукции являются: в растениеводстве — зерно, картофель и овощи, подсолнечник и сахарная свекла.Биологический потенциал продуктивности вышеназванных сельскохозяйственных культур в условиях лесостепи Поволжья используется не в полной мере. Одной из причин, препятствующих получению высоких и стабильных урожаев, является широкое распространение бактериозов, обусловленное особенностями культуры, а также изменением биологических свойств патогенов (повышение их генетической пластичности, адаптивности, патогенности).
В Российской Федерации отмечают усиление вредоносности известных и появление новых бактериозов растений. Увеличению потерь способствуют погодные условия, оптимальные для размножения фитопатогенной бактериальной микрофлоры и неблагоприятные для развития растений. Вредоносность бактериальных заболеваний растений возрастает из-за нарушения агротехники, отсутствия своевременной и достоверной диагностики фитопатогенных бактерий в посевном материале и в поле, а также неправильно разработанной системы земледелия и защитных мер. Так, от 60 до 90% заражения здорового семенного материала происходит во время уборки урожая, сортировки и подготовки к посадке.
Органическое земледелие, получившее широкое распространение в Европе, только начинает развиваться в РФ. По данным ФГБНУ «ВНИИ защиты растений» (ВИЗР), в Государственном каталоге пестицидов Российской Федерации насчитывается около 50 биопрепаратов, а в мировой сводке – 300. При этом, по данным Союза органического земледелия, в реальную практику биологическая система защиты растений внедрена только на 2% сельхозугодий Российской Федерации.
В РФ региональные законы об органическом земледелии приняты в Ульяновской, Воронежской областях и Краснодарском крае. Наиболее приемлемой защитой растений с точки зрения её экологизации являетсябиологический контроль с помощью микробных препаратов. Использование биопрепаратовна основе бактериофагов в качестве профилактического и терапевтического средства борьбы с болезнями представляется более целесообразным, поскольку фаги обладают рядом преимуществ. Это устойчивость к бактериофагам у бактерий вырабатывается гораздо реже, чем к антибиотикам. При использовании на практике комплексных препаратов из нескольких штаммов фагов устойчивости у бактерий может не вырабатываться; бактериофаги в сравнении с химическими средствами оказывают меньшее токсическое воздействие, не вызывают аллергических реакций у человека и не воздействуют на растения.
Международный рынок органической продукции сейчас составляет 90 млрд. долл. США и, по прогнозам, будет расти на 15% ежегодно. Основной тормозящий фактор роста органического сельского хозяйства в мире – отсутствие подходящих земельных ресурсов, что дает большие перспективы России, где свыше 20 млн. га земли не получали агрохимикатов более 3 лет и могут быть пригодны для введения в оборот как органические. Органическое сельское хозяйство практикуется в 179 странах мира, из них в 87 странах действуют специальные законы в данной сфере. На постсоветском пространстве законы об органическом сельском хозяйстве приняты в Казахстане, Молдове, Армении, Грузии. Использование разрабатываемого нами биопрепарата для фаг-опосредованного биоконтроля позволит не только получать экологически чистую плодоовощную продукцию, но и сохранять ее от «грядки до прилавка».
Необходимость импортозамещения в аграрном секторе возникла для России с введением продуктового эмбарго в августе 2014 г. Эскалация экономических санкций со стороны ЕС, США, Канады Австралии и других стран, на долю которых в совокупности приходится 58 % мирового ВВП, заставляет по-новому оценить угрозы и риски для России, которая производит лишь 2,8 % мирового ВВП. Для расширения ассортимента отечественной овощной продукции необходимо не только возведение в стране тепличных комбинатов и пленочных теплиц в хозяйствах разных типов, а также производство биопрепаратов для органического земледелия, которое сделает плодоовощную продукцию, выработанную без применения химических препаратов экспортоориентированной. Импортозамещение в сельском хозяйстве – это неиссякаемое количество нереализованных возможностей для малого и среднего бизнеса. Ниже представлены потенциальные потребители разработанного нами препарата и технологии его применения.
Агрофирма «Раздолье» (Пензенская область) выбрала проект по импортозамещению — производство клубники. На российском рынке появилось 4 новых сорта по цене от 160 рублей, что намного дешевле иностранных аналогов. Несмотря на то, что на выращивание ягод отведено всего 1,5 гектара земли, аграрная компания «Раздолье» получает около полумиллиона чистой прибыли.
Основанная еще при СССР компания «Адлерский чай» (Краснодарский край) выращивает и перерабатывает собственное сырье. Помимо чая, компания выращивает баклажаны, хурму, фундук и другие культуры. Несмотря на активную деятельность во многих направлениях, компания не может продемонстрировать большую прибыль, доход компании примерно составляет 21,2 млн. рублей. Так как при производстве плодоовощной продукции имеются значительные потери при хранении и транспортировании. В ближайшее время компания планирует увеличить площадь выращиваемых субтропических культур до 100 гектаров и построить новый тепличный комбинат. Сельскохозяйственное угодье «ЖАК» (Тульская область) поставляет на сегодняшний рынок существенное количество своей продукции, такой как картофель, свекла, капуста. На протяжении одиннадцати лет плодотворной работы обрабатываемые земли увеличены с 40 до 11000 га.
Управление инновационным развитием социальной инфраструктуры города и региона осуществляется в рамках региональной инновационной политики. В настоящее время основным инструментом реализации инновационной политики являются региональные инновационные программы.
2019 год объявлен Годом изобретательства и инноваций.
Ульяновская область на протяжении многих лет реализует особую модель экономического роста, в основе которой:
— развитие малого и среднего бизнеса,
— формирование индустриальных и промышленных зон,
— развитие инновационного технологического предпринимательства.
Промышленное производство Ульяновской области вырос с 9% в 2009 году до 18% в 2018 году. Доляинвестиций в ВРП сегодня в Ульяновской области составляет 27,2%, что в значительной степени опережает среднероссийский показатель -17,3 %.
В основе стратегического развития региона лежит инновационный путь, формирование экономики инновационного типа, создание и развитие экосистемы технологического предпринимательства. В регионе создан единый центр поддержки и развития бизнеса — полноценный центр компетенций по развитию несырьевой экономики. Развивается женское предпринимательство. Все это позволяет развивать в регионе бизнес по выращиванию и переработке плодоовощной продукции с применением разработанных нами технологических приемов по фаг-опосредованному биопроцессингу.
ОСНОВНАЯ ЧАСТЬ ОТЧЕТА НИР
Глава I. Обзор литературных источников по проблеме исследований
1.1 Обзор современных технологий хранения плодоовощной продукции
Современный человек нуждается в потреблении свежих фруктов и овощей высокого качества круглый год.
По результатам мероприятий государственной программы развития сельского хозяйства [6], в 2016 году были достигнуты рекордные показатели сбора основных сельскохозяйственных культур.
Так, валовой сбор овощей составил 16,3 млн. т, что на 0,9% выше 2015 года и на 6,2% — среднегодового производства за предыдущие 5 лет.
Валовой сбор фруктов и ягод составил 3,3 млн. т — на 14,6% больше, чем в 2015 году, и на 20,9% — среднегодового производства в 2011-2015 годах [7].
Не менее 40 % собранных фруктов и овощей подлежит длительному хранению, так как не могут быть переработаны и потреблены в течение 2-3 месяца после сбора урожая.
Несмотря на то, что емкость современных хранилищ сельскохозяйственной продукции в России увеличилась на 2125 тыс. т. единовременного хранения, несовершенство существующей системы хранения, как в плане ее организации и размещения хранилищ по регионам, так и в техническом и технологическом их оснащении, приводит к значительным потерям сельскохозяйственной продукции растительного происхождения [8-9].
Одна из причин такого положения — потери продукции на всех этапах ее продвижения к потребителю. Только при хранении потери достигают 35-40%. Проблема эффективного хранения выращенного урожая имеет комплексный характер и требует решения целого ряда вопросов, начиная от селекции, предпосевной подготовки семян, соблюдения севооборотов и всех приемов агротехники и до своевременной уборки с последующей закладкой на хранение здорового материала. Кроме того, функционирует лишь 70% от необходимого количества хранилищ, из них только 30% имеет искусственное охлаждение, недостаточно используются газовые методы хранения, пункты предварительного охлаждения и холодильники в зонах производства плодов и овощей, не налажен выпуск современного оборудования и приборов по контролюмикроклимата, а также средств механизации погрузочно-разгрузочных работ. Основными причинами потерь, являются во-первых, убыль массы в процессе дыхания, испарения и прорастания, с потерями воды и сухих веществ (10 до 35% общей убыли массы). Причем потеря воды -предельная величина, различная для каждого вида сырья (например, 3-4% она составляет у яблок, винограда, шпината, салата, брокколи, моркови в пучках с листьями, 5-6 — у груш, вишни, персиков, земляники, малины, смородины, свеклы, гороха, огурцов, фасоли (в бобах), 7-8 — у моркови, свеклы, капусты белокочанной, картофеля, перца, томатов, 10% — у лука репчатого). Если максимальный уровень превышен, продукт становиться не пригодным для продажи [11].
Во-вторых, потери, связанные с болезнями; их объем трудно поддается прогнозам, но в случае массового распространения может достигать 100%.
Серьезные последствия могут вызвать и механические повреждения (третья группа потерь), особенно на заключительном этапе хранения, когда в результате созревания происходит размягчение мякоти плодов и овощей и снижается их прочность. Этот фактор оказывает преобладающее влияние во время транспортирования (особенно на дальние расстояния). Ухудшение качественных показателей обусловлено как естественными причинами (созревание, старение, ростовая активность и т.д.), так и воздействием внешних факторов (окружающая среда, повреждения, болезни), которые снижают потребительские свойства продуктов и приводят к уменьшению цены реализации. При этом общие коммерческие убытки могут быть сопоставимы с потерями от убыли массы и порчи [12].
В производственных условиях существуют несколько способов хранения фруктов: хранение на сырьевых площадках, в стационарных закрытых складах-хранилищах с искусственным охлаждением или без него, в холодильных камерах с регулируемой температурой и влажностью [13].
Все биохимические процессы во фруктах зависят от температуры. При высокой температуре повышается интенсивность дыхания, ускоряется обмен веществ, увеличиваются потеря влаги, витаминов, органических веществ [12].
Охлаждение продукции уменьшает естественную убыль веса и предотвращает «старение» фруктов.
Хранение при низких температурах замедляет развитие многих бактерий и грибов, но не исключает поражения продукции психрофильными микроорганизмами [11].
Для оптимального хранения растительного сырья в настоящее время используются технологии предусматривающие не только оптимальный температурно-влажностный режим, но и оптимальную концентрацию газовой среды.
Наиболее широко для хранения фруктов используются холодильники с регулируемой атмосферой [12].
Пониженное содержания кислорода в хранилище приводит к замедлению интенсивности дыхания фруктов, снижению скорости образования этилена, уменьшению степени окисления и разрушения растворимых пектинов. При этом замедляются процессы созревания, распада хлорофилла, изменения кислотного состава, структуры тканей, развития физиологических болезней и как следствие увеличивается продолжительность хранения [1].
Другим важным компонентом атмосферы, влияющим на хранение фруктов, является углекислый газ, который выделяется фруктами в результате дыхания и в повышенных концентрациях тормозит этот процесс. Для большинства фруктов оптимальная концентрация углекислого газа при хранении составляет от 0,5 до 5% [6].
В настоящее время для создания газовой среды и длительного хранения фруктов в регулируемой атмосфере применяются следующие технологии:
— ULO (Ultra Low Oxygen) — хранение с ультранизким содержанием кислорода в камере (менее 1-1,5%);
— RCA (Rapid Controlled Atmosphere) — технология быстрого снижения концентрации кислорода;
— ILOS (Initial Low Oxygen Stress) — сверхбыстрое снижение уровня кислорода в камере за короткий промежуток времени;
— LECA (Low Ethylene Controlled Atmosphere) — технология снижения уровня этилена в камере;
— DCA (Dynamic Controlled Atmosphere) — динамическая регулируемая атмосфера;
— CO2 shock treatment — технология шоковой обработки углекислым газом, с повышенным (до 30%) содержанием СО2 [14].
Широко распространена технология хранения растительного сырья с применением модифицированной газовой среды (МГС). Газовая среда создается путем применения упаковок из полиэтиленовой пленки с газоселективной мембраной за счет дыхания сырья (поглощение О2, выделение СО2) или упаковок из полимерных пленок барьерного типа [15].
Сырье укладывают в герметично закрываемую упаковочную тару, из полости которой удаляют воздух, а освободившееся пространство заполняют инертным газом и герметично закрывают. При этом в качестве инертного газа используют азот или углекислый газ, или их смесь [16].
Для увеличения срока хранения фруктов распространен способ применения озона с использованием озонаторов. Комплексное применение систем озонирования позволяет добиться значительного увеличения показателей сохранности продукции. Озон является эффективным дезинфектантом, угнетающим развитие бактериальных, грибных и вирусных патогенов, способствующий разложению этилена и дезодорации помещений, отрицательному воздействию на грызунов [17].
Обработку фруктов озоновоздушной смесью проводят трехкратно не менее трех часов. при температуре 12-18°С и относительной влажности 4080% до достижения концентрации 35 мг/м3. Обработку проводят в соответствии с длительностью хранения продукции [18-19].
Потребителями продукции биотехнологии являются преимущественно высокоразвитые страны: США, Канада, Япония, Европейский Союз, Китай, Индия, Бразилия. Однако США является лидером в области биотехнологий, на ее долю приходится около 40% объема мирового рынка [3].
Так, в США, учеными для борьбы с голубой плесенью на яблоках, были выделены штаммы Metschnikowia, в частности Metschnikowia pulcherrima, которые обладают антагонистической активностью в отношении Penicillium expansum. Данные штаммы особенно активны при холодильном хранении [20].
Для предотвращения фруктов от порчи, китайскими учеными запатентован способ обработки поверхности с использованием фенетилового спирта, выделяемого из культуры бактерий Loeckera apiculata[21].
Также, для увеличения сроков хранения и свежести плодов разработан препарат на основе штамма Rhodotorula mucilaginosa. Плоды помещают в бактериальную суспензию для пропитки в течение от 30 сек до 2 мин, затем извлекают непосредственно для выполнения сушки на воздухе, помещают в ящик, герметизируют и хранят при комнатной температуре или в холодильной камере [22].
Известен способ профилактики послеуборочных заболеваний плодов с использованием комбинации СВЧ и антагонистических дрожжей вида Сryptococcus laurentii или Rhodotorula glutinis. Плоды помещают в поле высокой частотности, затем погружают в раствор с биопрепаратом, сушат и хранят при комнатной температуре или в холодильных условиях [23].
Разработан способ обработки фруктов, при котором плоды обрабатывают жидкими растворами силиката калия или натрия, затем помещают в раствор антагонистических бактерий Laurentii cryptococcus[24].
С целью профилактики заболеваний фруктов при хранении, фруктв обрабатывают смесью бензотиадиазола и суспензии полученной из Cryptococcus laurentii [25].
Запатентован способ использования биологического фунгицида Cryptococcus laurentii в сочетании с боратом калия или натрия, для обработки винограда [26] .
В Китае был запатентован способ обработки фруктов при хранении использованием суспензии, полученной из дрожжевого штамма Кали ВАК Pichia (Pichiacaribbica). Плод помещают в суспензию, выдерживают, обсушивают и помещают в ящик, герметично закрывая пленкой. Данный метод особенно подходит для плодов груши, персика, клубники, яблок и других фруктов [27].
Наиболее известные биопрепараты, разработанные российскими учеными, приведены в таблице 1.
Таблица 1 — Характеристика биопрепаратов
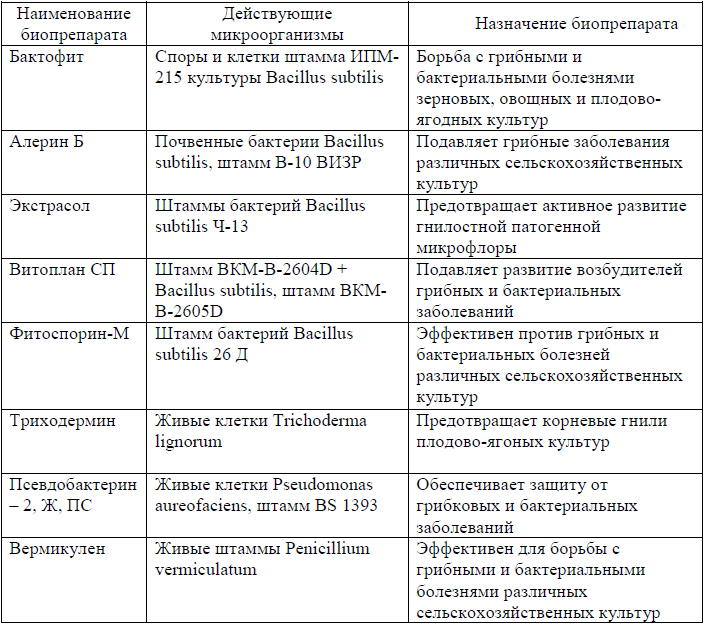
Российскими учеными выведен штамм бактерий Bacillus subtilis, который используют для защиты зерновых сельскохозяйственных культур, подсолнечника, винограда от фитопатогенных микроорганизмов, а плодоовощных культур от фитопатогенных бактерий. Штамм Bacillus subtilis выделен из черноземной почвы Республики Молдова. Способность штамма подавлять различную патогенную микрофлору приводит к увеличению урожайности разных видов сельскохозяйственных культур [28].
Для сохранения урожая плодов и овощей с минимальными потерями, разработан биопрепарат «Бактофит», для поверхностной обработки растительного сырья. В состав препарата входят споры и клетки культуры Bacillus subtilis, метаболиты, обладающие антагонистическими и антибиотическими свойствами (антибиотик, ферменты, гормоны), а также микроэлементы и инертные наполнители, обеспечивающие сохранность и стабильность препарата
«Бактофит» применяется для борьбы с грибковыми и бактериальными болезнями овощных, зерновых, цветочных и лекарственных культур, такими как, мучнистая роса томатов, огурцов, груш, яблонь, ложная мучнистая роса хмеля, корневые гнили, бактериозы капусты, фитофтороз картофеля и томатов, вертициллезный вилт хлопчатника. Препарат обладает иммуностимулирующим действием [29].
Препарат «Алирин-Б», на основе штамма Bacillus subtillis 10 (ВИЗР), обладает фунгицидной активностью, эффективно подавляет такие заболевания как корневые гнили, септориоз, ризоктониоз, фитофтороз, альтернариоз, церкоспороз, трахомикозное увядание, мучнистая роса, пероноспороз, парша, монилиоз, серая гниль, ржавчина [29].
«Фитоспорин-М» — промышленный бактериальный препарат нового поколения, биофунгицид с широким спектром и длительным действием. Основа «Фитомпорина» живая споровая бактериальная культура Bacillussubtilis. Препарат эффективен против грибных и бактериальных болезней различных сельскохозяйственных культур, а также повышает длительность хранения урожая [30].
Известен способ, при котором биопрепарат «Фитоспорин М», разводят водой, прошедшей обработку магнитным полем, данной суспензией обрабатывают продукцию перед закладкой на хранение. Сочетание биологического и физического метода, позволяет сократить потери растительного сырья в процессе хранения [9-10].
Защитный эффект биопрепаратов обуславливается способностью Bacillus subtilis к синтезу полиеновых антибиотиков, ингибирующих патогенную микрофлору и способных стимулировать развитие растений [30].
Российскими учеными был запатентован биопрепарат от фитопатогенов и нематодов на основе штамма гриба рода Trichoderma. Способ получения средства осуществляют путем приготовления посевного материала штамма гриба, приготовления препарата в жидкой либо сыпучей форме на основе посевного материала, а также перемешивания препарата с минеральным, органическим или бактериальным удобрением. Полученное в результате способа биологическое средство обладает высокой антагонистической активностью [31].Так, биопрепарат «Триходермин» на основе живых клеток Trichoderma lignorum, предотвращает корневые гнили овощных культур, табака и ярового ячменя, чёрной ножки, паршу, фитофтороз, аскохитоз.
«Псевдобактерин — 2», Ж, ПС обеспечивает защиту от грибковых и бактериальных заболеваний, повышает качество урожая. Основу препарата составляет живые клетки Pseudomonas aureofaciens [32].
Биопрепарат «Вермикулен» на основе штамма Penicillium vermiculatum применяется для борьбы с грибными и бактериальными болезнями различных сельскохозяйственных культур [33].
Также, российскими учеными разработан препарат, в виде сатурированного водного раствора, полученного из биомассы микромицета Pythium ultimum [34].
Обработка биопрепаратом «Экстрасол» перед закладкой на хранение предотвращает активное развитие гнилостной патогенной микрофлоры картофеля и овощей, препятствует ее проникновению вглубь тканей; повышает лежкость, сохранность питательных веществ и витаминов; не оказывает ослабляющего эффекта на естественный иммунитет растений.
Основу препарата составляют живые штаммы ризосферных, азотфиксирующих бактерий Bacillus subtilis Ч-13 [35].
Препарат используется для обработки сельхозпродукции, закладываемой на хранение, защищает растения от широкого спектра патогенных организмов, увеличивает урожайность и стимулирует рост растений. Обладает азотфиксирующими и фосфатмобилизующими свойствами, улучшает усвоение минеральных удобрений.
Препятствует развитию злаковой головни и ризоктониоза, фузариоза и фитофторы, септориоза и бурой ржавчины. Используют для профилактики мучнистой росы и пероноспороза, сдерживает большинство бактериальных инфекций на культурных посадках [35].
«Витоплан СП» — предназначен для предпосевной обработки семян, клубней и вегетирующих частей растений. Разработан на основе бактерииBacillus subtilis. Эффективно подавляет развитие возбудителей грибных и бактериальных заболеваний различных сельскохозяйственных культур [29].
Российскими учеными разработан препарат «Фитомаг», эффективно ингибирующий биосинтез этилена. Обработка препаратом обеспечивает защиту фруктов от преждевременного созревания, старения, пораженияфизиологическими и грибными болезнями, способствует продлению сроков хранения и сохранению товарного качества сырья. Для достижения максимально длительного хранения обработанные фрукты помещают в холодильные камеры [36-39].
Учеными Краснодарского научно-исследовательского института хранения и переработки сельскохозяйственной продукции, разработаны современные технологии хранения и оборудование для их реализации, базирующиеся на объективной оценке исходного физиологического состояния фруктов и овощей, а также обеспечивающие возможность длительного сохранения сельскохозяйственной продукции высокого качества при минимальных ее потерях:
— технология хранения скоропортящейся сельскохозяйственной продукции на основе создания защитных покрытий с бактерицидными и антиоксидантными свойствами, позволяющая снизить потери от естественной убыли и микробиальной порчи на 40 %, а также увеличить сроки хранения продукции в 1,5 -2раза [40];
— технология хранения фруктов и овощей в измененной газовой атмосфере в небольших по объему «замкнутых контурах» без применения дорогостоящих установок;
— сквозная аграрно-пищевая технология биологической защиты фруктов и овощей при производстве и хранении с применением биологических средств защиты растений (Фитоспорин-М, модифицированный Гуми) в сочетании с оптимальными температурно-влажностными режимами хранения, позволяющая увеличить выход стандартной продукции после хранения на 27,0 -27,8 % за счет повышения иммунитета;
— способ вакуумной обработки фруктов и овощей перед закладкой на хранение, позволяющий существенно изменять газообмен, интенсивность
дыхания, стимулировать реакции раневого биосинтеза и получать продукцию высокого качества [40-42];
— способ подавления патогенной микрофлоры овощей и фруктов электромагнитными полями крайне низких частот перед закладкой на хранение [19].
Запатентован способ защиты фруктов и ягод от порчи в период хранения с использованием комбинаций имазалила и соединений серебра, обеспечивающим усиленный биоцидный эффект [43].
Для снижения скорости гниения и увеличения срока реализации используют технологию обработки фруктов диоксидом серы в сочетании с хранением при низких температурах [44].
Рассмотренные технологии могут использоваться как самостоятельно, так и в сочетании друг с другом в зависимости от длительности хранения и требуемого срока реализации.
Перспективным направлением в хранении плодоовощного сырья является применение биологических средств защиты, на основе активных штаммов антагонистов.
Биопрепараты используют для борьбы с фитопатогенными организмами в послеуборочный период и при длительном холодильном хранении. Данная технология не создает угрозы нарушения экологического равновесия в биосфере, так как микроорганизмы, применяемые в качестве биопрепаратов, являются естественной микрофлорой окружающей среды [12].
Широко распространены биопрепараты на основе штаммов почвенных бактерий из группы Bacillus subtilis, такие как «Бактофит», «Алирин Б», «Витоплан СП» и «Экстрасол».
Препараты «Бактофит», «Алирин Б», «Фитоспорин М» и «Витоплан СП» применяют для борьбы с грибными и бактериальными заболеваниями зерновых, овощных и плодово-ягодных культур: мучнистая роса томатов, огурцов, груш, яблонь, корневые гнили, бактериозы капусты, фитофтороз картофеля и томатов, парша на поверхности фруктов, монилиоз, ржавчина.
Обработка препаратом «Экстрасол», перед закладкой на хранение предотвращает развитие гнилостной патогенной микрофлоры плодоовощного сырья, препятствует ее проникновению вглубь тканей; повышает лежкость, сохранность питательных веществ и витаминов; не оказывает ослабляющего эффекта на естественный иммунитет растений [41, 42, 45].
Совместное воздействие биологических, химических и/или физических факторов, является более эффективным способом обеспечения сохранности растительного сырья.
Известен способ, при котором биопрепарат «Фитоспорин М», разводят водой, прошедшей обработку магнитным полем, данной суспензией обрабатывают продукцию перед закладкой на хранение. Сочетание биологического и физического метода, позволяет сократить потери растительного сырья в процессе хранения [40, 42].
Запатентован способ обработки яблок, предусматривающий последовательное выдерживание в растворах перманганата калия, лимонной кислоты и суспензии препарата, полученного из биомассы микромицета Mortierella gamsiiс последующим ультрафиолетовым облучением [46].
Проведя анализ патентных источников, можно сделать вывод о том, что, существует большое количество запатентованных технологий хранения фруктов. Однако, несмотря на широкий ассортимент, актуален поиск новых методов, экономически и социально выгодных, а также обеспечивающих высокое качество растительной продукции.
Таким образом, использование биопрепаратов является наиболее прогрессивной технологией хранения плодоовощного сырья.
1.2 Характеристика бактерий Bacillus pumilus, Вacillus coagulans, Bacillus subtilis
Бактерии Вacillus coagulans – это грамположительный непатогенный, спорообразующий микроорганизм. Благодаря наличию плотной оболочки, эта бактерия не поддается разрушению ни воздействием высоких и низких температур, ни применением высоких концентраций сахара и соли[47-48].
Естественное место обитания Вacillus coagulans, это почва, которая в дальнейшем является источником распространения бактерий на консервируемое растительное сырье, вспомогательные материалы, а так же технологическое оборудование. Развитию термофильных микроорганизмовв консервируемом продукте способствует повышенная температура, используемая при производстве консервов, которая в свою очередь создает благоприятные условия для них [49].
Представители вида Вacillus coagulans являются возбудителями плоско-кислой порчи плодоовощных консервов. В основном данная порча возникает в низкокислотных консервах, у которых рН превышает 5,2. К таким консервам относятся: консервы из сахарной кукурузы, фасоли, зеленого горошка, пюреобразные консервы из тыквы и кабачков. Наблюдались случаи, когда термофильные бациллы способствовали порче мяса тушеного, гороха в томатной заливе, икры кабачковой и баклажанной [50-51].
Плоско-кислая порча проявляется небольшим разжижением прокисшего продукта, его расслоением, в продуктах пюреобразного типа наблюдается крупитчатость, при этом мутнеет жидкая часть продукта. Одним из основных показателей, который указывает на развитие в консервах кислотообразующих термофилов, это значительно пониженная у продукта рН величина. При плоско-кислой порче консервов нет никаких внешних признаков, указывающих на порчу продукта, так как при этом виде порчи вздутия банок не происходит [52-53].
Продукты при контаминации факультативными анаэробами Вacillus coagulans не имеют каких-либо внешних характеристик порчи. Реализации таких дефектных продуктов питания может привести к нежелательным судебным разбирательствам, поэтому возникает необходимость проведения микробиологического исследования на присутствие бактерий Bacillus coagulans в пищевых продуктах.
Проведя анализ литературных данных можно сделать вывод, что в Российской Федерации на данный момент для обнаружения в объектах санитарного надзора бактерий Вacillus coagulans отсутствуют методики с помощью применения бактериофагов.
На сегодняшний момент ряд исследователей выбрали объектом своего научного интереса бактерии Bacillus pumilus, что обусловлено способностью некоторых штаммов данного вида к продукции биологически активных веществ, которые находят свое применение в биотехнологической отрасли [54-58]. Литературные данные о возможности продуцировать вторичные метаболиты, имеющие выраженную антибактериальную активность и физиологически активные регуляторы роста растений делают бактерии Bacillus pumilus актуальными для разработки препаратов-стимуляторов роста растений и препаратов для биоконтроля [59-63]. Однако, есть сообщения ученых, где описаны патологические процессы у теплокровных, вызываемые Bacillus pumilus, например бактериемия, пищевых отравления, сепсис, карбункулоподобные поражений кожи [64-68].
Есть сообщения о Bacillus pumilus как о фитопатогенных бактериях, способных вызывать мягкую гниль у овощей, фруктов и технических культур (хлопчатника и льна) [69-72]. Однако в связи с повсеместным распространением бактерий Bacillus pumilus во внешней среде и традиционным отнесением к непатогенным, особого внимания к фактам о указанных выше поражениях растений не уделялось.
Нами не обнаружены публикации, описывающие механизмы патогенеза и изменение физиолого-биохимических свойств фитопатогенных представителей Bacillus pumilus в сравнении с почвеннымисапрофитами. Выделение бактерий Bacillus pumilus из объектов внешней среды, сельскохозяйственного сырья растительного происхожденияи продуктов питания с последующей идентификацией по авторской схеме позволит расширить информационную базу по данному вопросу.
B.А. Мирзоева(1959) в своих работах неоднократно подчеркивала существенную роль B. subtilis и В. pumilus в порче молочных продуктов, кондитерских изделий, сахарных сиропов, консервов, зерновых, хлебных и других продуктов[73]. Ее мнение разделяли также C.П. Аскалонов и А. И. Ильченко (1962), которые обращали внимание на то, что В. subtilis может обсеменять различные пищевые продукты (хлеб, мясо и др.), вызывая их порчу[74].
В. subtilis относится к микроорганизмам, вырабатывающим протеолитические ферменты, которые расщепляют белок до конечных продуктов, поэтому называется «микробом гниения». Процесс психрофильного поверхностного гниения протекает в 5 фаз и, как известно, сопровождается сменой микроорганизмов. В первой фазе очень медленно развиваются бактерии рода Bacillus (B. subtilis и В. pumilus)[74].
При нарушении санитарно-технического режима хранения зерна, муки, выпечки и реализации хлеба создаются условия для размножения картофельной палочки. Болезнь вызывают штаммы бактерий Bacillus subtilis и Bacillus pumilus, обладающие высокой протеолитической и амилолитической активностью. Их основная масса начинает накапливаться в зерне ещево время уборки, попадая в него с пылью, частицами почвы и из других источников, развивается в процессе приготовления хлеба и вызывает его порчу. Под действием высокоактивных ферментов – амилаз в хлебе увеличивается количество декстринов, придающих мякишу хлеба излишнюю липкость. Продукты распада белков, образующиеся в результате действия протеолитических ферментов, обладают резким специфическим запахом. Внешне картофельная болезнь хлеба характеризуется очаговым, влажным ослизнением мякиша с желтовато-коричневым цветом и гнилостным запахом. При разламывании хлеба видны тонкие тягучие нити. Употребление такого хлеба может привести к пищевому отравлению. Болезнь обнаруживается обыкновенно не раньше, чем через двое суток после выпечки хлеба. Бактерии Bacillus subtilis и Bacillus pumilusявляющиеся причиной этого заболевания хлеба, в огромном большинстве контаминируют тесто через зараженную муки; в других, более редких, случаях они могут попадать в тесто из загрязненной и зараженной ею хлебопекарной посуды[75-76].
Для развития бактерий необходимы следующие условия:
— достаточная влажность хлеба,
— длительность его хранения не менее 2 суток;
— достаточно высокая t° при хранении (не ниже 15°)[77].
Споровые бактерии, попадая в организмчеловека, способны вызывать очень серьезныенарушения функционирования иммунной системы, желудочно-кишечного тракта, печени,органов дыхания, нервной системы. Поэтомудаже если споровые бактерии не вызывают картофельной болезни хлеба, все же их наличие в готовых изделиях нежелательно [78].
До настоящего времени для зерна и мукине разработаны критерии качества по микробиологическим показателям. Однако из литературных источников известно, что качествомуки можно считать хорошим, если в ней содержание спорообразующих аэробных бактерий(САБ) B. subtilis – возбудителя картофельнойболезни хлеба не более 200 КОЕ/г (КОЕ – колониеобразующих единиц). Известно также, чтомука, содержащая до 10 КОЕ/г САБ, считаетсяслабо, до 100 КОЕ/г умеренно, более 1000 КОЕ/г сильно зараженной [79].
Микробиологическое исследование большого количества проб мясного фарша провела Е. Динчева (1970) в Болгарии. При исследовании более 200 партий фарша установлено, что общее количество бактерий колебалось в пределах 106 — 1010 м.к./г. После хранения фарша при температуре 4° С в течение 48 ч количество бактерий увеличивалось в два — восемь раз. Спорообразующие аэробные бактерии — преимущественно В.subtilis — pumilus, В. pseudoanthracis (31,5% проб) — обнаружены в трети проб [80].
В состав остаточной микрофлоры мясных и мясо-растительных консервов входят бактерии В. subtilis. Для выявления остаточной микрофлоры, способной развиваться, после стерилизации консервы подвергают косвенном) микробиологическом) контролю — 5- 10%-ной термостатной выдержке при 37°С в течение 10 сут. Если в консервах перед стерилизацией установлены повышенная общая микробная обсемененность, наличие спор анаэробных клостридий или термофильных аэробоввозбудителей плоскокислой порчи, то они подлежат 100%-ной термостатной выдержке. За это время сохранившие жизнеспособность споры микроорганизмов могут прорасти. Затем вегетативные формы их будут размножаться и вызовут порчу продукта, определяемую наружным осмотром (бомбаж или течь на лопнувших банках). Однако термостатная выдержка — недостаточный критерий для заключения о промышленной стерильности консервов. При длительном хранении консервов, подвергнутых термостатированию, иногда вновь выявляются бомбажные банки.Это объясняется, во-первых, тем, что температура термостатной выдержки (37°С) не является оптимальной для всех микроорганизмов остаточной микрофлоры консервов, среди которых много термофилов, активно проявляющих свою жизнедеятельность при более высоких температурах. Во-вторых, споры микроорганизмов, ослабленные стерилизацией, часто не успевают прорасти в течение 10 дней и проявляют свою жизнедеятельность значительно позже. Например, споры B. subtilis и В. pumilus споры прорастают при 37°С только после 20 — 27-дневной выдержки[81-82].
О выделении бактерий из кондитерских изделий, пищевых дрожжей, консервов, хлебо-булочных изделий и даже алкогольных напитков бактерии группы В. pumilus-subtilis сообщает Смирнов В.В. с соавт. (1982). Они отмечают, что иногда даже большие количества этих бактерий могут не менять ни вкуса, ни запаха, ни цвета указанных пищевых продуктов. Нередко спорообразующие аэробные бактерии определяются в порченых овощных и фруктовых консервах, и сахаре, кондитерских изделиях[83]. А.Ю. Жвирблянская и О. А. Бакушинская (1966) указывают на широкое распространение В. subtilis-pumilus в сахарном производстве[84].
Смирнов В.В. с соавт. (1982) изучал микрофлору испорченных консервов, включая слабокислые виды (консервированный зеленый горошек и кукуруза) и кислые (томаты, ананасы, персики и груши). Наиболее частой причиной порчи консервов являются термофильные спорообразующие аэробные и анаэробные бактерии и мезофильные бациллы, в их числе на первом месте В. subtilis, В. pumilus, В. polymyxa и В. macerans [85].
А. Я. Погодаева и Ч. Я. Овруцкая (1970) показали, что одной из причин, вызывающих порчу консервированных компотов, фруктовых и ягодных соков является инфицирование этих продуктов В. subtilis и В. pumilus. Для предотвращения порчи авторы рекомендуют термическую обработку не ниже чем при 100° С в течение 10 мин. Однако, присутствие в готовых консервах вышеназванных сапрофитных аэробных бацилл допускается при отсутствии бомбажа, сохранении нормальных органолептических показателей и нерарушенной герметичности банок [86].
Бактерии Bacillus subtilis – это контаминанты растительного сырья для производства косметических препаратов, к которым также относятся водно-спиртовые, пропиленгликолевые и масляные экстракты. Данное обстоятельство обуславливает необходимость поиска различных консервантов и их смесей при изготовлении и хранении разных типов растительных экстрактов [82].
Исследования Бурлаченко И.В. (2007) свидетельствуют, что бактерии вида Bacillus subtilis являются одним из основных контаминантов корма для молоди осетровых рыб. На метаболитическом уровне хроническая интоксикация, вызываемая вышеуказанными микроорганизмами, приводит к разнонаправленным нарушениям водного и липидного обмена, угнетению синтеза балка и повышенному расходу энергии на нейтрализацию токсического действия: а в поддерживающем обмене – к нарушениям соотношения в утилизации белков и липидов, резкому снижению жизнеспособности рыб, особенно в неблагоприятных условиях[87].
Промышленно-стерильными считают консервы, содержащие жизнеспособные клетки негазообразующих непатогенных и нетоксигенных аэробных бацилл В. subtilis, В. polymysa, В. cereus. В промышленно-стерильных консервах не должно содержаться патогенных и токсигенных микроорганизмов, а также возбудителей порчи консервов: термофильных бацилл и клостридий, газообразующих мезофильных бацилл и клостридий. Допустимое количество клеток микроорганизмов в 1 г консервируемого продукта, не нарушающее его микробиологической стабильности в процессе хранения и не представляющее опасности для здоровья человека, составляет 1:101-1:103[88].
Для выявления остаточной микрофлоры, способной развиваться, после стерилизации консервы подвергают косвенному микробиологическом) контролю – 5-10%-ной термостатной выдержке при 37°С в течение 10 сут. Если в консервах перед стерилизацией установлены повышенная общая микробная обсемененность, наличие спор анаэробных клостридий или термофильных аэробов возбудителей плоскокислой порчи, то они подлежат 100%-ной термостатной выдержке. За это время сохранившие жизнеспособность споры микроорганизмов могут прорасти. Затем вегетативные формы их будут размножаться и вызовут порчу продукта, определяемую наружным осмотром (бомбаж или течь на лопнувших банках). Однако термостатная выдержка — недостаточный критерий для заключения о промышленной стерильности консервов. При длительном хранении консервов, подвергнутых термостатированию, иногда вновь выявляются бомбажные банки. Это объясняется, во-первых, тем, что температура термостатной выдержки (37°С) не является оптимальной для всех микроорганизмов остаточной микрофлоры консервов, среди которых много термофилов, активно проявляющих свою жизнедеятельность при более высоких температурах. Во-вторых, споры микроорганизмов, ослабленные стерилизацией, часто неуспевают прорасти в течение 10 дней и проявляют свою жизнедеятельность значительно позже. Например, споры В. subtilis,В. polymyхa и В. pumilus иногда прорастают при 37°С только после 20-27-дневной выдержки [82, 89].
В природе наблюдается распространение в широком диапазоне бактерии рода Bacillus, особенно часто они встречаютсяв воздухе, воде и почве. Большая их роль заключается при минерализации органических соединений азота. Пищевые продукты служат хорошей питательной средой для этих микроорганизмов [90].
Будучи повсеместными в почве, воздухе и воде, они легко попадают в продукты питания. Количество Bacillus в пшенице, зерне и цельнозерновой муке составляет 106 КОЕ/г. Благодаря высокой устойчивости спор бацилл к нагреванию они могут выжить в процессе выпекания и поэтому могут быть обнаружены в хлебе и хлебобулочных изделиях. Бациллы часто присутствуют в микрофлоре молока, остаются после пастеризации и могут быть преобладающей микрофлорой в пастеризованных молочных продуктах [91-92].
Bacillus spp. являются основной микрофлорой соевых бобов и участвуют в брожении для приготовления соевых пищевых продуктов и приправ [93]. Bacillus subtilis и B. licheniformis являются доминирующими видами, и их количество в сброженных продуктах составляет 108 КОЕ/г [94]. В Японии чистая культура B. subtilis var. Натто используется для производства натто-популярной пищи, получаемой путем сбраживания вареных соевых бобов [95-96].
В южных почвах, где активно идут процессы нитрификации, преобладают Bacillus subtilis, Bacillus pumilus, Bacillus megaterium, Bacillus idosus и некоторые другие виды, легко усваивающие минеральные источники азота. Эти микроорганизмы в большом количестве содержатся в черноземе и каштановой почве. Они часто встречаются в бурых и сероземных почвах сухих степей, где численность их достигает приблизительно 10% к общему количеству бацилл. В почвах тайги и дерново-подзолистых почвах, где процессы минерализации протекают медленно, активного размножения этих бактерий не происходит и количество их не превышает 1%. Таким образом, численность бацилл в почвах может существенно изменяться, отражая состояние подвижного органического вещества, вследствие чего эти бактерии рассматриваются как индикаторы улучшенного азотного режима почвы[97-99].
Э.К. Африкян (1973) обнаружил определенную закономерность распространения в почве бактерий группы Bacillus subtilis-pumilus: по мере увеличения содержания в почве сенной и картофельной палочек количество клеток Bacillusmycoides уменьшается. Эту закономерность автор связывает со спецификой антагонистических взаимоотношений между указанными микроорганизмами. Однако такая разница в качественном составе бациллярных форм скорее объясняется особенностями их азотного питания. Как известно, одни виды бацилл используют более доступные формы азота, для развития других требуются некоторые аминокислоты и различные биотические факторы[100].
По данным P.Ammini с соавторами (2009), при исследовании прибрежной среды Кохинхинка в Индии были выделены бактерии Васillus pumilus в ассоциации с Bacillus cereus и Bacillus sphaericus. Идентификация проводилась на основании биохимических тестов. Установлено, что Васillus pumilus — самый преобладающий вид. Выделенные штаммы обладали ярко выраженными протеолитическими и липолитическими свойтвами. Впервые, было опредлено у выделенных штаммов Васillus pumilus наличие рвотного токсина cesB[101].
Статистические данные, полученные О.В. Пельц (2003) с соавт., говорят о том, что переход мукомольных производств в Российской Федерации на отечественную пшеницу, дал толчок для роста случаев возникновения картофельной болезни хлеба – процент нестандартных проб в 2003 году вырос, по сравнению с 2000 годом, на 8,8 %. Общеизвестно, что бактерии Васillus pumilus вместе с Bacillus subtilis входят в группу бацилл, вызывающих микробную порчу хлеба, называемую картофельной болезнью. Чаще ими поражаются хлебобулочные изделия из пшеничной муки, так как они имеют более низкую кислотность. Вышеназванные бациллы активно размножаются при 30 — 40 0С в зерне, муке, хлебе, что резко ухудшает их органолептические свойства. При помоле зерна бактерии попадают в муку [102].
Бактерии Васillus pumilus являются фитопатогенными бактериями,поражающими различные растения: лен, тыкву, кукурузу, свеклу, плоды апельсина, абрикоса, кабачков и других растений, клубни картофеля, семенники капусты, коробочки хлопчатника. Также известно, что бактерии Bacillus pumilus могут вызвать бактериоз початков кукурузы, при искусственном заражении ими происходило типичное побурение. Из загнивших плодов томатов были выделены штаммы спорообразующих бактерий относящихся к видам Bacillus subtilis и Bacillus pumilus [103-105].
Так, например, бактериоз початков курурузы, вызываемый Bacillus pumilus, проявляется в период молочной спелости. На коронке зерновок появляются вдавленные пятна бледно-серго цвета диаметром 2-3 мм. При усилении болезни пятна переходят в морщинистые язвы буровато-желтой окраски. В зависимости от сортовой окраски зерна интенсивоность цвета каймы вокруг пятна варьирует до темно-серого. Початки заражаются в поле, обычно путем переноса инфекции вредителями, переходящими с сорняков в фазе молочной спелости кукурузы. В основном в верхней части початка. Из-за развития болезни снижается лежкость початков, они быстро плесневеют, ухудшаются семенные качества зерновок [106].
BrownE.R. (1955) изучала микрофлору порченных консервов, включая слабокислые виды (консервированный зеленый горошек и кукуруза) и кислые (томаты, ананасы, персики и груши). Наиболее частой причиной порчи консервов и салатов являются термофильные спорообразующие аэробные и анаэробные бактерии и мезофильные бациллы, в их числе на первом месте Bacillus subtilis, Bacillus pumilus, Bacillus polymyxa и Bacillus macerans.
В.Б. Сбойчаков (2007) изучал микрофлору испорченных консервов, включая слабокислые виды (консервированный зеленый горошек и кукуруза) и кислые (томаты, ананасы, персики и груши)[99].
В мясо-растительных и мясных консервах значительная доля остаточной микрофлоры представлена термофильными спорообразующими бациллами: Васillus asterosporus, Васillus coagulans, Васillus thermoliquefaciens, Васillus polymyxa, Васillus stearothermophilus, Васillus aerothermophilus, и бациллами мезофильными Васillus pumilus, Васillus cereus, Васillus subtilis. Но в связи с низкой температурой хранения, отсутствием кислорода и высоким содержанием соли они не развиваются, а сохраняются в виде спор [107-108].
Так как споровые клетки бацилл В. subtilis способны выдерживать действие плотного дыма в течение 7 ч., их можно обнаружить на копченой рыбе. В икре даже после ее пастеризации чаще всего встречаются В. pumilus, В. туcoides, В. circulans.
Колбасы при нарушении условий хранения подвергаются различной порче. В результате деятельности В. subtilis, происходитскисание колбас; В. рапtotheuticus, разлагающие крахмал в условиях низкого парциального давления кислорода, существующего в колбасе, вызывают размягчение колбас;на поверхности колбас возможно появление темных пятен, которое обусловлено развитием В. coagulans, В. firmus, В. circulans, В. subtilis. Бактерии рода Bacillus могут попадать в консервы вместе со вспомогательными материалами (особенно сахарным песком, специями и томат-пастой) [109-111].
Плоско-кислая порча консервов чаще всего связана с воздействием Bacillus stearothermophilus и Bacillus coagulans. Споры вышеназванных микроорганизмов, обнаруженные в консервированных овощах и молочных консервах, могут прорастать при благоприятных условиях и стать причиной порчи эти продуктов. В результате этого рН изменяется, но бомбаж банок не происходит, как это случается при контаминации бактериями Clostridium thermosaccharolyticum [112].
В окружающей среде широко распространены бактерии вида Bacillus coagulans, они встречаются не только в почве и продуктах питания, но и арктических водах, горячих источниках, песке пустынь. Для их роста 65оС является оптимальной температурой. Продукты с повышенной кислотностью такие как, силос, консервированный томатный сок, антациды и лечебные крема, служат хорошей средой для данных контаминантов [113].
Таксономические исследования выявили значительное разнообразие среди этого вида. Declercketal провел полифазное таксономическое исследование 30 штаммов и обнаружил, что отдельные методы определения характеристик позволили выявить подгруппы штаммов, но эти внутривидовые группировки не были достаточно согласованными среди различных методов, чтобы поддержать предложение подвида, и при этом не было никаких особенностей предложить такое разделение. Данные о родстве ДНК-ДНК и сравнения последовательностей 16S рДНК подтвердили аккомодацию всех штаммов в одном виде.
Почва для Вacillus coagulans является естественным местом обитания, и служит фактором способствующим загрязнению растительного сырья, технологического оборудования и вспомогательных материалов. Повышенная температура, используемая при производстве консервов, создает в консервируемом продукте благоприятные условия для развития термофильных микроорганизмов [53].
Представители Вacillus coagulans являются возбудителем плоско-кислой порчи плодоовощных консервов, вызывают прокисание закусочных консервов, неконцентрированных томатопродуктов и других продуктов со значением рН равной 4,0-5,0. При этом пристеночное кольцо разделяет продукт на его границе с тарой, серовато-белый осадок наблюдается на дне банки, а так же возникает посторонний запах с лекарственным оттенком [116].
Имеются данные проведенных исследований на томатном соке, пораженного плоско-кислой порчей, исходя из них термоустойчивость бактерий, находящихся в этом соке при 94оС составляет 5-37 минут, при температуре 100оС сокращается и составляет 1-10 минут. Споры, содержащиеся в 1 мл в количестве 10000 имеют максимальную термоустойчивость при 121,1оС ниже 0,7 минут. Полученные данные, доказывают, что микроорганизмы, обладающие более высокой термоустойчивостью, которые вызывают плоское скисание, нельзя уничтожить, используя только прогревание томатного сока при 94-95оС, укупоривая его и выдерживая при этой температуре. Выдерживание сока в течение 3 минут, достаточное для его пастеризации перед охлаждением и после закатки, является не эффективным для уничтожения спор термоустойчивых, являющихся причиной скисания сока [81].
Низкокислотные консервы, у которых рН превышает 5,2, особенно подвержены плоско-кислой порчи. К таким консервам относятся: консервы из сахарной кукурузы, фасоли, зеленого горошка, пюреобразные консервы из тыквы и кабачков. Наблюдались случаи, когда термофильные бациллы способствовали порче мяса тушенного, икры кабачковой и баклажанной, в томатной заливе гороха. Плоско-кислая порча проявляется небольшим разжижением прокисшего продукта, его расслоением, в продуктах пюреобразного типа наблюдается крупитчатость, при этом мутнеет жидкая часть продукта. Одним из основных показателей, который указывает на развитие в консервах кислотообразующих термофилов, это значительно пониженная в продукте рН величина. Посев из испорченных консервов не всегда может содержать кислотообразующие бациллы, которые гибнут под влиянием продуктов полученных в результате метаболизма.
Порча такого типа в томатном соке проявляется запахом несвойственным ему и может присутствовать «медицинский» привкус (слабо-кислый, неприятный, прокисший, зависящий от степени порчи) [117].
Вздутия банок при плоско-кислой порче не происходит и какие-либо признаки порчи отсутствуют до вскрытия, что затрудняет быстрое определение порчи этого вида. Связано это с тем, что микроорганизм при своем росте не образует газ или его количество очень мало, что происходит всего лишь незначительное изменение вакуума. В таком случае испорченные банки не возможно отбраковать при определении вакуума или методами, основанными на прогреве, как осуществляют отбраковку некислотных овощных консервов/ Первым признаком указывающем на появление микроорганизма Вacillus coagulans является выраженный запах и привкус, затем изменение в цвете и нарастание кислотности. При росте этого микроорганизма в томатном соке pH падает с 4,5 до 3,5. Во многих районах Канады и США в последнее время были зафиксированы случаи, когда при выращивании томатов было обнаружено увеличение pH томатов превышающее значение 4,5, которые еще не подвергались обработке сырья. Такое значение pH считается установленным фактором, который способен влиять на способность бактерий прорастать и на их термоустойчивость. Термоустойчивость становится ниже, если pH снижается. Педерсон и Беккер изучили критическое значение pH для прорастания в томатном соке спор Вacillus coagulans и доказали, что для прорастания необходимо постепенное повышение pH и увеличение длительности прогрева. Возможность возникновения плоско-кислой порчи увеличивается, если у томатного сырья значения pH повышается, поэтому применение режимов более жестких становится необходимым [118-119].
Плоско-кислая порча для томатного сока с pH 4,35 и выше наиболее характерная, хотя были отмечены случаи, когда споры некоторых штаммов вызывали порчу сока с pH 4,1. Нок утверждает, что выделенный в Южной Африке штамм Вacillus coagulans, не подвергавшийся прогреву, прорастает в томатном соке с pH 4,28 [120].
Порча консервированных продуктов может возникать так же за счёт присутствия спорообразующих бактерии таких как, Bacillus subtilis и pumilus. При такой порче консервов возможенбомбаж банок и массовое распространение бактерий вышеназванных видов.
Обсемененность спорообразующими бактериями консервированных продуктов оказывает влияние на процент их порчи, особенно в овощных консервах обнаруживается такой показатель в связи с микрофлорой загрязненнойпочвой. Кислотоустойчивые и солестойкие (галофильные) формы, имеющие выраженные ферментативные свойства преобладают нередко среди них [121].
Содержание в промышленно-стерильных консервах возбудителей порчи консервов таких как, газообразующих мезофильных и термофильных бацилл, а так же патогенных и токсигенных микроорганизмов не допускается. В 1 грамме консервируемого продукта микроорганизмы в количестве 1:101-1:103 считаются допустимыми, в процессе хранения они должны обладать микробиологической стабильностью и не представлятьдля здоровья человека какой-либо опасности.
Порча пищевых продуктов сопровождается ферментативным распадомбелковых и липидных компонентов, при этом происходит образование вредных соединений. Порча кулинарных изделий и ряда продуктов может возникнуть из-за использования различных добавок в пищевой и консервной промышленности, например желатина и агара, которые только этому и способствуют [122].
Исключительная термоустойчивость спор Bacillus pumilus приводит к тому, что они сохраняют жизнеспособность в процессе выпечки хлеба. Под действием высокоактивных ферментов – амилаз в хлебе увеличивается количество декстринов, придающих мякишу хлеба излишнюю липкость. Продукты распада белков, образующиеся в результате действия протеолитических ферментов, обладают резким специфическим запахом. Внешне картофельная болезнь хлеба характеризуется очаговым, влажным ослизнением мякиша с желтовато-коричневым цветом и гнилостным запахом. При разламывании хлеба видны тонкие тягучие нити. Такой хлеб непригоден в пищу и на корм животным [124-126].
С целью обезвреживания зерновых культур в послеуборочный период на стадиях мукомольного и хлебопекарного производств используют для инактивации спор Bacillus pumilus и Bacillus subtilis химические (окислители, фумиганты, инактиваторы ферментов и микотоксинов), физические (термические и лучевые) и биологические (микробиологические) методы [127].
По литературным данным пропионаты кальция и натрия пропионат являются эффективным средством для инактивации бактерий Вacillusmesentericus. Данные химические соединения в настоящий момент активно используются в хлебобулочной промышленности всего мира для ликвидации картофельной болезнихлеба [128-130].
Я.П. Коломниковой (2009) установлено, что при внесении в замешиваемое тесто 6% к общей массе, муки, сброженной молочно-кислыми бактериями Str.lactis и Str.cremoris, и водно-медового экстракта из травы зверобоя, оказывается ингибирующее воздействие на возбудителей картофельной болезни хлеба — Bacillus subtilis и Bacillus pumilus — более чем в 100 раз, по сравнению с контролем. Тем самым предотвращается развитие заболевания, при сохранении высоких органолептических (вкус, цвет, аромат) и физико-химических (пористость, удельный объем) показателей качества изделий, при этом сокращается процесс приготовления хлебобулочных изделий из пшеничной муки на 60 мин [131].
Российскими исследователями было изучено противомикробное действие 52 различных видов меда, взятых со всех концов России. Результаты исследований показали, что мед обладает резко подчеркнутым противомикробным действием. При более высоких разбавлениях оказываемое действие бактериостатично, при более низких — бактерицидно. Противомикробные свойства меда направлены на грам-положительные кокки (стафилококки и стрептококки), бактерии (дифтерийный микроб) и бациллы (Васillis anthracis и Васillus pumilus) [132].
Установлено, что при попадании бактерий Вacillus pumilus в желудочно-кишечный тракт детей в возрасте до трех лет, бактерии быстро размножаются, в таких случаях выделяется большое количество газа, что приводит к метеоризму и интоксикации [133-135].
Р.Б. Раднаева (2008) изучала антагонистическое действие различных штаммов пропионовокислых бактерий на бактерии Вacillus pumilus. Установлено, что наибольший антагонистический эффект оказывают на Вacillusmesentericus штаммы пропионокислых бактерий Р. freudenreichiisubst. freudenreichiiAC2500 и Р. freudenreichii ВКПМ4544. Высокая антагонистическая активность культур объясняется действие бактериоцинов, образующихся при брожении [136].
Г.Г. Юсупова (2010) исследовала влияние электротермического воздействия на технологические свойства основного сырья и на развитие Bacillus subtilis и Bacillus pumilus при проведении пробной лабораторной выпечки. Для опыта были подобраны образцы муки, зараженные спорами бактерий Bacillus subtilis и Bacillus pumilus, с численностью возбудителей 3·103; 2·104 КОЕ/г. В результате электротермического воздействия энергией СВЧ-поля на споры Bacillus subtilis и Bacillus pumilus выявлено относительное обеззараживание при температуре нагрева 78-85 °С и режимах τ – 90; = 0,6-0,8 °С/с; хлеб, выпеченный из этой муки, оставался без признаков заболевания в течение 124 ч. Обработка при температуре 60-70 °С в режимах τ = 60-90 с; = 0,6-0,8 °С/с сводит инфекцию до безопасных пределов, хлеб в провокационных условиях оставался без признаков картофельной болезни [137].
В.П. Медведевым с сотр. (2010) был разработан экспресс-метод определения активности споровых бактерий Вacillus pumilus и Вacillussubtilisв хлебопекарном сырье (в пшеничной и овсяной муке, пшеничных отрубях, прессованных дрожжах и др.) и готовой зерномучной продукции. Он позволяет в течение 6 часов выявить активность споровых бактерий, вызывающих картофельную болезнь хлеба. Данный экспресс-метод диагностики картофельной болезни по активности споровых бактерий в хлебопекарном сырье и готовой продукции, результаты которого свидетельствуют о качественных показателях бактерий в протеолитическом отношении, не являются информативными в плане количественной оценки зараженности и также часто представляют искаженную картину о реальной степени зараженности сырья [138].
Для количественной оценки степени зараженности зерна пшеницы использовался хорошо зарекомендовавший себя метод мембранной фильтрации микроорганизмов Васillus pumilus на оборудовании фирмы Sartorius. Микробиологический контроль методом мембранной фильтрации в настоящее время широко применяется в пищевой промышленности, для мониторинга микробиологической обсемененности безалкогольных напитков и пива. Данный метод позволяет избегать предварительной сложной и трудоемкой подготовки, связанной с варкой питательных сред, сложной обработкой образцов, длительным культивированием, что позволяет сократить длительность анализа, проводить селективный анализ микроорганизмов, применять для широкого спектра хлебобулочных изделий. Метод стандартизирован в соответствии с международными требованиями, на его использование имеется разрешение МЗ РФ (№2000/373 от 04.08.2000 г.) [139].
А.А. Куриловой с сотр. (2006) была разработана питательная среда для культивирования сибиреязвенного микроба и близкородственных спорообразующих сапрофитов (Bacillus subtilis. Bacillus pumilus) Цель настоящего изобретения заключается в подборе качественной дешевой основы питательных сред растительного происхождения, которая бы обеспечивала накопительный эффект и снижение ее стоимости, а также упрощение способа приготовления. Питательная среда содержит патоку рафинадную, водопроводную воду, натрия хлорид и дрожжевой экстракт. Известная питательная среда следующего состава, г/л: 1% пептона, 0,5% х. ч. натрия хлорида, мясная вода — до 1 л, рН 7,3±0,1. Недостатком данной среды является использование дорогостоящих ингредиентов. Наиболее близкой к предлагаемому изобретению является питательная среда бульон Хоттингера, включающая, г/л: гидролизат говяжьего мяса, разведенный дистиллированной водой до 1 л с содержанием общего азота 250-300 мг % и аминного азота 30-130 мг %; натрия хлорида 5,0; натрия дигидрофосфата 0,3, рН 7,4-7,6. Недостатками данной среды являются высокая себестоимость и сложная технология приготовления, обусловливаемые тем, что основу среды составляют продукты животного происхождения [140].
1.3 Таксономия бактерии рода Bacillus
Бактерии рода Bacillus принадлежат к семейству Bacillaceae и включает в себя бактерии палочковидной формы, аэробно образующие споры, особенностьюкоторых является продуцирование каталазы, что отличает эти бациллы от представителей рода Clostridium [141].
Образование эндоспор и высокие адаптивные возможности способствуют их распространению в воздухе, воде, почве, а так же помогают участвовать в различных биологических процессах. Впищевых продукта, кормах, организме животных и человека бактерии рода Bacillus встречаются гораздо реже, связано это с тем, что они относятся к безвредным сапрофитам [142-143].
Изолированныемикробные культуры, например Bacillus subtilis и Bacillus mesentericus из организма больного или продуктов рассматриваются как контаминанты и не требуют детального их изучения, потому что конкретные случаи заболеваний чаще всего не связывают с этими бактериями. Однако особенно в последнее время возникают подтверждающие данные, указывающие на то, что бактерии рода Bacillus в значительных количествах обнаруживаются в пищеварительном тракте животных и человека, в пищевых продуктах, и являются причиной пищевых интоксикаций, сепсиса, энцефаломиелитов [144-146].
В классификации предложенной Фордомидет подразделение спорообразующихаэробных бактерий на 9 групп с 28 видами. Эта классификация главным образом построена на морфологических признаках и составляет основу разграничения бацилл, представленной в определителе Берджи в первых изданиях [147-148].
Образование ацетилметилкарбинола и способность ферментировать глюкозу, все это было положено в основу классификации Gibson. Потом было доказано, что это является несовпадением с общепринятым таксономическим делением, так как в xoдe эволюции механизмы брожения развивались независимо друг от друга в некоторых группах бактерий, а не по принципу деления на основе механизма углеводного обмена [149-150].
Изучение аэробных бацилл и их биологических свойств, методы исследования и условия выращивания бацилл, все это составляет основу классификации предложенной F.E. Clark, R.E. Gordon и N.R. Smith. В 7-м издании определителя Берджи отражена данная классификация, в которой описано 25 видов. Спорообразующие бактерии авторы классифицируют на три группы по соотношению вегетативных клеток и поперечника, и по форме спор [151-152].
При групповом и видовом разграничении в классификации спорообразующих бактерий, предложенной Н.А.Красильниковым, вышеназванные признаки стали первостепенными [153].
F. Lemille в своей работе предпринял попытку классификацию бактерий рода Bacillus усовершенствовать. Он с соавторами при изучении как музейных аэробных бацилл, так и выделенных использовали 64 биохимических теста. Спектр источников углерода был расширен, были добавлены тестына определение оксидазы, обнаружение триптофандезаминазы, галактозидазы и лизиндекарбоксилазы. Принцип идентификации F.E. Clark, R.E. Gordon и N.R. Smith был подтвержден благодаря схеме, предложенной для разграничения видов 1 морфологической группы [152, 154].
A.N. Barker и J. Wolf предложили для идентификации и разграничения бацилл схему на основе морфологических признаков таких как, наличие вакуолей и размеры клеток, а так же на основе биохимических признаков. Классификация W. Kundrat представляет собой разграничение на морфологические группы и разграничения видов по биохимическому принципу. К таким тестам относится определение способности культур к росту при 56,6оС, выявление аргиназы и тест на определение чувствительности к сульфаниламиду.
Некоторые виды можно разграничить по трем свойствам: наличие пектиназы, уреазы илецитиназы, этот принцип предложен в качестве дифференциально-диагностического признака в классификации J.C. Ottow.На основании отсутствия вышеназванных ферментов виды B. stearothermophilus, B. firmus, B. brevis и B. sphaericusобъединены в одну группу [155].
Согласно классификации, предложенной R. Gordon, виды рода Bacillus в соответствии с формой споры и раздуванием клетки при спорообразовании распределены в три морфологические группы.
Классификация бактерий по методике R.Gordon [152] состоитиз двух этапов. Первый этап представляет собой использование 18-ти признаков, благодаря емуидентифицируют штаммы бактерий рода Bacillus только наиболее типичные. Второй этаппомогает идентифицируемый штамм бактерий рода Bacillusотнестик одной из трех морфологических групп. Затем необходимо изучить изменчивость данного штамма под влиянием факторов внешней среды, биохимические и морфологические его свойства[152, 156].
Свойства выделенного штамма после первичной идентификации необходимо сравнить со свойствами других близких в фенотипическом отношении видов, использовав при этом специальные таблицы со всеми свойствами.
I группа содержит в определителе Bergey’s Manual описание 22 видов рода Bacillus, 26 видов относится ко II группе. I группа бацилл дифференцируется по следующим морфологическим признакам: соотношение размеров спор в клетках, расположение их иформа, образованиена средах с глюкозой газа и кислоты [157].
Виды близкие в фенотипическом отношении такие как: Bacillus licheniformis, Bacillus thuringirnsis, Bacillus megaterium, Bacillus anthracis, Bacillus cereus, Bacillus pumilus и Bacillus subtilis содержатся в определителе в таблице с дифференцирующими признаками [158].
Xu and Cote обнаружили, что Bacillus coagulans находятся ближе к штаммам Geobacillus, чем к другим видам Bacillus, Bacillus laevolacticus, сгруппированным с Virgibacillus pantothenticus, и Bacillus badius с Marinibacillus marinas, однако Bacillus circulans оставались разгруппированными [159].
1.4 Пищевой листериоз и фаги, спицифичные для Listeria monocytogenes
Listeria monocytogenes является основным этиологическим агентом для пищевого листериоза у людей от потребления готовых продуктов (RTE). По данным Центра по контролю и профилактике заболеваний, примерно 1600 человек переносят листериоз каждый год примерно 260 случаев заболеваний — смертельны. Этот высокий уровень смертности обязал Инспекцию и службы безопасности пищевых продуктов 3 августа 1999 года для своих инспекторов опубликовать Уведомление 23-99 «Инструкции по проверке и оценки L. monocytogenes». Согласно руководству FDA «Бактериальное аналитическое руководство» главы 10, L. monocytogenes в образцах продуктов RTE обнаруживается с помощью микробиологических тестов, qPCR, электрофореза с импульсным полем и других альтернативных методов. Chen с соавторами [159] разработали биосенсор работающий в реальном времени на основе специфических олигопептидов L. monocytogenes, с использованием модифицированных процедур биопэннинга. Таким образом, эти зонды могут использоваться для обнаружения в режиме реального времени L. monocytogenes в продуктах RTE, хранящихся при 4 градусах Цельсия, или в образцах / жидкостях, адаптированных к температуре человеческого тела.
Так же часто Listeria monocytogenes встречается в средах переработки морепродуктов, тем самым представляя собой проблему для предприятий по переработке морепродуктов. Поэтому тайские ученые [160] провели мониторинг распространенности и подтипового разнообразия L. monocytogenes вместе с фагами, которые специфичны для Listeria spp. («Listeria phages»). Это исследование предоставило знания об экологии бактерий и фагов на предприятиях пищевой промышленности. В работе было собрано в общей сложности 595 проб из сырья, готовых продуктов из морепродуктов и образцов окружающей среды из разных мест завода по переработке морепродуктов в течение 17 посещений в течение 1,5 лет. L monocytogenes и Listeria spp. были обнаружены в 22 (3,7%) и 43 (7,2%) образцах, тогда как 29 фагов Listeria были выделены из 9 (1,5%) фагоположительных образцов. Анализ ДНК-отпечатков изолятов L. monocytogenes выявил 11 профилей случайной амплифицированной полиморфной ДНК (RAPD) с двумя подтипами, которые часто встречались. Эти данные свидетельствуют о наличии фагов Listeria в тех же средах обработки морепродуктов, где был обнаружен разнообразный набор подтипов L monocytogenes. Это свидетельствует о том, что изоляты из этого завода по переработке морепродуктов принадлежат к эпидемиологически важным серотипам 1 / 2a и 4b, что может указывать на потенциальный риск для здоровья населения. Фаги были классифицированы в 9 групп по спектру литической активности. Большинство изолятов L monocytogenes с этого объекта были чувствительны к полученным фагам, но пять изолятов показали устойчивость к 12-20 фагам. Вариации в диапазоне фагов-хозяев среди фагов Listeria, выделенных с завода по переработке пищевых продуктов, могут влиять на присутствие разнообразного набора изолятов L. monocytogenes, полученных из одной и той же обрабатывающей среды.
ListShield ™ и PhageGuard Listex ™ — два примера препаратов фагов, которые направлены на уничтожение Listeria monocytogenes. Эти микроорганизмы можно найти в сырой или упакованной пище такие продукты, как свежий сом, мороженое, мягкие сыры и некоторые фрукты и овощи [161-162].
Листериоз обычно вызывается употреблением загрязненных продуктов. Симптомы включают в себя: лихорадку, диарею, спутанность сознания и судороги у большинства взрослых, но может привести к выкидышу или преждевременным родам у беременных [163]. Листериоз обычно лечится ампициллином или другими B-лактамами. Тем не менее, если у пациента аллергия на них, котримоксазол (комбинация триметоприма и сульфаметоксазола) – другой вариант терапии [164]. Из 202 штаммов Listeria monocytogenes, выделенных из проб пищи и окружающей среды, собранных во Франции в период с 1996 по 2006 год, только 4 штамма проявили устойчивость к антибиотикам. Один из штаммов был устойчив к триметоприму [164]. Но если химиотерапевтические препараты, такие как котримоксазол используются безответственно ген, который кодирует его устойчивость, может стать более распространенным. Использование PhageGuard Listex ™ на продуктах повышенного риска может увеличить продолжительность жизни котримоксазола, ограничивая инфекции и, следовательно, снизить вероятность развития случайной резистентности. Бактерии, патогенные для растений и других культур, также могут быть потенциально обработаны фагами. Фитопатогены могут оказывать разрушительное воздействие, как на небольшие продовольственные магазины, так и на мировую экономику. Тем не менее, генетических изменений, в бактериальных штаммы, заражающих одно растение, трудно выделить соответствующие фаги, необходимые для эффективной защиты растения [165]. Для полного контроля заболеваний обычно требуется комбинация фагов. Существуют и другие проблемы, препятствующие использованию фагов в больших масштабах для выращивания сельскохозяйственных культур. Одна из них заключается в их низкой жизнеспособности в филосфере и плохой способности проникать в бактерии. Было выявлено, что фаги чувствительны ко многим факторам окружающей среды, в том числе высоким температурам, изменения pH и осадкам [165]. Самые негативное же воздействие оказывает ультрафиолетовое излучение, исходящее от солнечного света. Было несколько попыток использования различных штаммов хантамоносов, которые заражают цитрусовые, грецкие орехи, помидоры и персиковые деревья [166]. В этих исследованиях эксперементально было установлено, что суспендирование фагов в обезжиренном молоке могут улучшить их стойкость [164]. В то время как фаговые коктейли были одобрены в западном мире для искоренения бактерии в пищевых продуктах, это не является достаточным и абсолютно безопасным чтобы применяться для лечения болезней у людей. Понятно, что это не простой процесс, и он займет некоторое время прежде чем FDA или другие государственные структуры одобрят его. Чтобы получить одобрение, FDA должно быть уверено, что известные и потенциальные риски препарата меньше преимуществ, которые он предоставляет пациенту [167]. Чтобы принять это решение, FDA принимает во внимание несколько вещей. Во-первых, они будут использовать доступные в настоящее время варианты лечения в качестве сравнения для потенциальных рисков. Далее группе, которая предлагает использование препарата необходимо представить как минимум два клинических испытания, которые хорошо продуманы и показать, что лечение является эффективным и не принесет больше вреда, чем пользы для пациентов. Наконец, должны быть созданы соответствующие инструкции лекарств, которые четко обозначают, как препарат повлияет на потребителя. Как правило, процесс рассмотрения занимает около 10 месяцев после того, как вся соответствующая информация предоставлена [167]. Хотя это может показаться простым, но в эти испытания разработаны для химических лекарственных препаратов и правила, касающиеся одобрения лекарственных средств, отражаются в стандарте [168]. Это создает проблему для фаговой терапии, потому что используемые коктейли фагов должны претерпеть некоторые изменения, чтобы лучше адаптироваться к бактериям-хозяевам, на которые направлено лечение. В связи с этим было предложено внести специальную поправку для фаговой терапии, которая предусматривает строгую систему мониторинга, которая будет оценивать развитие устойчивости к фагам [168]. В настоящее время единственное место, где пациенты, ищущие фаготерапию, могут получить лечение это Центр фаговой терапии Eliava в Тбилиси, Грузия. Эта организация рекламирует, что они могут успешно лечить различные бактериальные заболевания кожи, костей, глаз, мочевыводящих путей и желудочно-кишечные заболевания: расстройство раздраженного кишечника и бактериальный гастроэнтерит. Несмотря на регулярное использование фаговой терапии в Грузии, было опубликовано очень мало хорошо проведенных контролируемыех клинических исследований [169].
Чтобы бактериофаг был полезен для фаговой терапии, он должен быть изолирован из окружающей среды и иметь определенные характеристики. К ним относятся желательные характеристики, такие как относительно широкий диапазон штаммов-хозяев и отсутствие других характеристик, таких как перенос генов токсина и способность образовывать лизогенные культуры. В то время как фаги обычно выделяют а затем уже характеризуют, можно изменить процедуру выделения для смещения этого процесса в сторону выделения фагов с желаемыми характеристиками [170].
Растет применение бактериофагов в качестве противомикробных препаратов. Промышленное использование этих бактериальных вирусов требует производства больших количеств подходящих строго литических фагов, особенно для пищевых и сельскохозяйственных применений. Roy с соавторами [171] описали новый подход к производству фагов. Фаги H387 (Siphoviridae) и A511 (Myoviridae) они размножали раздельно с использованием клеток-хозяев Listeria ivanovii, иммобилизованных в альгинатных шариках. Та же партия альгинатных бусин может использоваться для четырех последовательных и эффективных возпроизводств фагов. Этот метод позволяет получать большие объемы лизатов фага высокого титра в непрерывных или полунепрерывных (кормовых) культурах.
Sword C. P., Pickett M. J. [172] выделяли бактериофаги Listeria monocytogenes и изучили возможность их использование в качестве диагностических инструментов и вспомогательных средств в эпидемиологических исследованиях. Возникновение лизогении исследовали на 123 штаммах выделенных от животных и людей по всему миру. Обычные процедуры для выделения фага были ненадежными с Listeria, так как лизогенные штаммы не всегда выделяют обнаруживаемое количество фага путем спонтанного высвобождения. Однако после воздействия ультрафиолетового излучения, такие штаммы были вынуждены производить фаговые частицы. Некоторые штаммы, которые не выделяют фаг, могут продуцировать вещества аналогичны колицинам после облучения. Литический спектр фагов 149 штаммов Listeria был изучен и подвергнут классификации. Почти все нетипичные штаммы бактерий были грубыми, подвергались диссоциации или были лизогенными. Восприимчивость к фагам, по-видимому, тесно связана с серологическим типом штамма, но не показывает никакой связи с источником или географическим местом происхождением. Эти исследования показали, что фаги Listeria могут быть использованы в качестве средства общей идентификации, а также в качестве замены или дополнения к серологическому типированию в эпидемиологических исследованиях.
Loessner M. J. была разработана схема типирования бактериофагов для дифференциации изолятов Listeria контаминирующих молочные продукты и другие пищевые продукты. Шестнадцать отобранных фагов, выделенных как из природных источников, так и из лизогенных штаммов, использовали для типирования и, согласно их литическому спектру, разделили на четыре группы. Авторы наблюдали 41 различный характер лизиса, при использовании набора из 57 определенных эталонных штаммов, представляющих 5 видов и 16 серотипов в дополнение к 454 изолятам Listeria преимущественно пищевого происхождения. В целом, типичность составила 84,5%; то есть штамм лизировался, по меньшей мере, одним фагом при 100-кратном обычном тестовом разведении. Штаммы, принадлежащие серовару 3, были в основном устойчивы к лизису используемыми фагами. Результаты были в высокой степени воспроизводимыми, что было определено в перепечатывании испытаний через несколько недель. Некоторые фаги, выделенные из источников окружающей среды, показали более широкий литический спектр, чем те, которые были выделены из лизогенных штаммов. В соответствии с этим, фаги были отнесены к разным кластерам в разработанной карте связей. Видовая специфичность и сероварная специфичность литической реакции не обнаружены. Ни один из фагов не был способен лизировать штаммы Listeria grayi, Listeria murrayi или Jonesia denitrificans. Эта система типирования фагов может предоставлять важную информацию для средств распознавания и устранения источников загрязнения Listeria spp. в рамках молочного производства [173].
Listeria monocytogenes пищевой патоген, имеющий важное значение для общественного здравоохранения в течение многих лет и вызывает особую озабоченность у групп населения высокого риска. Производители продуктов питания сталкиваются с постоянной проблемой в предотвращении проникновения L. monocytogenes в среду производства продуктов питания (FPE) из-за повсеместного распространения микроорганизма. В дополнение к этому способность штаммов L. monocytogenes к колонизации FPE может привести к повторному выявлениию L. monocytogenes при эпиднадзоре FPE. Загрязнение пищевых продуктов, представляет большую экономическую нагрузку для промышленности и вредит компаниям. Плохо сконструированное оборудование, изношенное или поврежденное оборудование могут привести точкам образования биопленок Listeria, где традиционные процедуры очистки и дезинфекции могут быть недостаточными. Gray J. A. et al. рассмотрел новые методы биоконтроля L. monocytogenes для FPE, апредназначенные уменьшить перекрестное загрязнение пищи [174].
Бактериофаги в течение многих лет использовались в качестве медицинских средств, благодаря их способности инфицировать и лизировать специфические бактерии. Эндолизины, гидролитические ферменты бактериофагов, ответственные за разрушение клеточной стенки грамположительных бактерий, изучаются как метод биоконтроля для сохранения продуктов питания, а также в области нанотехнологий и медицинских технологий.
Gutiérrez D. изучал эффективность нескольких продуктов, предназначенных для снижения риска заражения пищевых продуктов патогенными бактериями. ListShield (TM) и Listex (TM) P100 — это препараты бактериофага, направленные на борьбу с Listeria monocytogenes в пищевой промышленности. Для оценки эффективности этих продуктов на основе фагов против штаммов L. monocytogenes пищевого происхождения, авторы рассмотрели как препараты справляются с удалением биопленок L. monocytogenes и ингибируют рост в испанской сушеной ветчине. Установили, что ListShield (TM) эффективен и лизирует 100% исследованных штаммов L. monocytogenes, тогда как Listex (TM) P100 лизировал только 64% тех же штаммов. Согласно рекомендациям производителей, ListShield (TM) использовался в более низкой концентрации, чем Listex (TM) P100. Несмотря на эти различия, оба продукта были эффективны при удалении 72 биопленок, полученных на поверхностях из нержавеющей стали, при помощи большинства анализируемых штаммов после 4-часовой обработки при 12 ° С. Оценка продуктов на основе фага как средств деконтаминации в сушеной ветчине показала, что применение Listex (TM) P100 привело к уменьшению загрязнения L. monocytogenes, ниже предела обнаружения (<10 КОЕ / см (2)) через 24 часа при 4 градусы C и 12 градусов C. Обработка ListShield (TM) показала аналогичные результаты, за исключением образцов с высоким уровнем загрязнения (10 (5) КОЕ / см (2)), в которых было достигнуто снижение на 3,5 log единиц после 14 дней инкубации при 4 ° С. Напротив, антибактериальная активность ListShield (TM) уменьшалась в образцах, хранящихся при 12 ° С, хотя полное удаление бактерий наблюдалось после 8 дней обработки в низкоконцентрированных образцах (10 ( 3) КОЕ / см (2)) [175].
Все эти результаты полученные учеными свидетельствуют о том, что продукты на основе фага могут быть полезны для биоконтроля L. monocytogenes на поверхностях контакта с пищевыми продуктами и при деконтаминации сушеных ветчин.
Свежие сыры, такие как Queso Fresco (QF), были связаны с многочисленными вспышками листериоза в Соединенных Штатах. Испанские ученые [24] изучали эффективность Listeria phage endolysin PlyP100 в QF, а также потенциальную синергию между PlyP100 и низином. PlyP100 показал хорошие результаты независимо от изменения размера инокулята L. monocytogenes в QF, и когда размер инокуляции составлял 1 log CFU / г, никакого восстановления патогенов после обогащения сыра не наблюдалось. PlyP100 был стабильным в QF в течение 28 дней хранения в условиях холодильника. Только PlyP100 проявлял сильный листериостатический эффект в QF, в то время как низин сам по себе неэффективен для контроля возбудителя в QF во время холодного хранения. Комбинация низина и PlyP100 показала сильную синергию в QF после 4 недель хранения охлажденных продуктов. Авторы рекомендуют использование PlyP100 в сочетании с низином в качестве эффективной меры контроля L. monocytogenes в QF [176].
Биосохранение — это метод продления срока хранения продуктов питания с использованием естественной или контролируемой микробиоты или противомикробных препаратов. Продукты ферментации, а также полезные бактерии, как правило, выбираются в этом процессе для контроля порчи и выведения патогена в неактивное состояние. Особый интерес для этих целей представляютмолочнокислые бактерии (ЛАБ) и их метаболиты. Они способны проявлять антимикробные свойства и полезны для придания уникального вкуса и текстуры пищевым продуктам. Основными соединениями, продуцируемыми LAB, являются бактериоцин, органические кислоты и перекись водорода. Бактериоцин представляет собой пептиды или белки с антимикробной активностью. На основании размера, структуры и посттрансляционной модификации бактериоцин разделен на четыре разных класса. Из-за нетоксичных, неиммуногенных, термостойких характеристик и широкой бактерицидной активности бактериоциты LAB считаются хорошими биологически консервирующими агентами. Наиболее распространенным бактриоцином LAB является низин, который имеет более широкие области применения в пищевой промышленности и одобрен Управлением по контролю за продуктами и лекарствами (FDA). Низин и другие бактериоцины используются в овощных продуктах, молочной и мясной промышленности. Помимо метаболитов LAB, бактериофаги и эндолизины имеют многообещающую роль в пищевой промышленности, сохранении и безопасности продуктов. Бактериоцины и эндолизины хорошо подходят для рекомбинации ДНК и создания сильнодействующих вариантов с расширенным спектром активности. Однако генетически модифицированные бактериофаги также могут быть полезны в биосохранении.
Vonasek E. L. с савторами оценивал комбинацию съедобных покрытий с бактериофагами T7 на сохранность целых и срезанных продуктов. В этой оценке фаги, покрывающую свежую продукцию с использованием изолята пищевого сывороточного белка (WPI), сравнивали с фагами в комбинации с водной суспензией (контрольное покрытие). В целом, результаты показали, что покрытие продуктов смесью фагов и изолята пищевого сывороточного белка WPI обеспечивает фаговую нагрузку, стабильность и противомикробную активность поверхностей по сравнению с контрольным покрытием и поэтому может рассматриваться как эффективный подход для обработки свежих продуктов бактериофагами [177].
Adebola O с соавторами исследовали комбинацию бактериофага и тринатрийфосфата (TSP) для инактивации Listeria monocytogenes, инокулированных на свежих срезах. Свежий разрезанный томат и арбуз, инокулированный коктейлем L. monocytogenes log 10 (7) КОЕ / г, обрабатывали только бактериофагом Listex P100 (10 (8) ПФУ / г) и в комбинации с TSP при 10, 30 и 60 мг / м1 с использованием хлора при 200 мг / л в качестве контроля. Обработанные образцы хранили при 4 и 10 ° С в течение 6 дней. Оценивали влияние обработки на рН и цвет обработанных образцов. Только фаговая обработка (p <0,05) уменьшала L. monocytogenes на свежесрезанных томатах примерно на 0,5 и 0,6 log CFU / мл, а на свежей резанной дыне — на 1,30 и 1,49 log CFU / m1 при 4 и 10 градусах C соответственно. Добавление фага-TSP при дозе 10 мг / мл было эффективным только на резанной дыне, но фаг- TSP при 30 и 60 мг / мл приблизительно снижал содержание листерий на томатах на 1 -2 логарифма, а на дыне — на 2 -5 логорифмов при 4 и 10 градусов C соответственно. Обработка хлором показала снижение на 1-2 логорифма. Авторы заключили, что комбинация Phage-TSP могла бы служить эффективным инструментом для борьбы с листериями в свежих продуктах [178].
Помимо простого обеспечения барьера между пищевыми продуктами и внешними загрязняющими веществами, активные технологии упаковки направлены на подавление выживания и роста патогенов в упакованной среде. Бактериофаги могут применяться в качестве направленных противомикробных препаратов, но их еще не получалось интегрировать в активную упаковку без серьезной потери активности. Radford D. разработали два ксантоновых покрытия на основе бактериофага на пленке полимолочной кислоты (PLA), которая значительно ингибирует рост Salmonella typhimurium и Listeria monocytogenes в культуре (P <0,01) и значительно снижает выживаемость и рост разнообразных коктейлей Salmonella sp. и L. monocytogenes соответственно на предварительно обработанной нарезанной грудке индейки в течение 30 дней анаэробной упаковки при 4 или 10 градусов C (P <0,05). Предлагаемы подход может быть использован для разработки упаковки, ингибирующей другие значительные патогены пищевого происхождения [179].
1.5 Характеристика бактериофагов и область их применения
Бактериофаг – это вирус бактерии, вызывающий в определенных условиях лизис своего хозяина.
Бактериофаги были обнаружены Frederick W. в Великобритании (1915 г.) и Félix d’Hérelle во Франции (1917 г.). D’Hérelle ввел термин «бактериофаг», что означает «пожиратель бактерий», чтобы описать бактерицидную способность агента. Бактериофаги также заражают одноклеточные прокариотические организмы, известные как археи [180].
Существуют тысячи разновидностей фагов, каждый из которых может заразить только один тип или несколько типов бактерий или архей. Фаги классифицируются по ряду семейств вирусов; некоторые примеры включают Inoviridae, Microviridae, Rudiviridae и Tectiviridae. Как и все вирусы, фаги являются простыми организмами, которые состоят из ядра генетического материала (нуклеиновой кислоты), окруженного капсидом белка. Нуклеиновая кислота может представлять собой либо ДНК, либо РНК и может быть двухцепочечной или одноцепочечной.
Во время заражения фаг прикрепляется к бактерии и вставляет свой генетический материал в клетку. После этого фаг обычно следует одному из двух жизненных циклов, литическому (вирулентному) или лизогенному (умеренному). Литические фаги захватывают механизм клетки, чтобы сделать компоненты фага. Затем они разрушают или лизируют клетку, высвобождая новые частицы фага. Лизогенные фаги включают свою нуклеиновую кислоту в хромосому клетки-хозяина и реплицируются с ней как единое целое, не разрушая клетку. При определенных условиях лизогенные фаги можно индуцировать, следуя литическому циклу [181-182].
Другие жизненные циклы, включая псевдолизогенез и хроническую инфекцию, также существуют. При псевдолизогении бактериофаг проникает в клетку, но не использует механизм репликации клеток и не интегрируется стабильно в геном хозяина. Псевдолизогенез возникает, когда клетка-хозяин сталкивается с неблагоприятными условиями роста и, по-видимому, играет важную роль в выживании фага, обеспечивая сохранение генома фага до тех пор, пока условия роста хозяина снова не станут выгодными. При хронической инфекции новые фаговые частицы образуются непрерывно в течение длительных периодов времени, но без явного уничтожения клеток [183].
В 1980-х году американский биохимик George P. Smith разработал технологию, известную как фаговый дисплей, которая позволяла генерировать инженерные белки. Такие белки были получены путем слияния чужеродных или сконструированных фрагментов ДНК в ген фага III. Ген III кодирует белок, экспрессируемый на поверхности вириона фага. Таким образом, слитые белки гена III, поглощенные фагами, были обнаружены на поверхностях частиц вириона. Затем исследователи использовали антитела, разработанные для распознавания фрагмента чужеродного белка, для очистки культур слитых фагов, тем самым эффективно амплифицируя последовательность чужеродного гена для дальнейшего изучения. Британский биохимик Gregory P. Winter впоследствии усовершенствовал технологию фагового дисплея для разработки белков человеческих антител. Такие белки могут быть использованы для лечения заболеваний у людей с меньшим риском индукции потенциально опасных иммунных реакций по сравнению с предыдущими терапевтическими антителами, полученными от животных. За свои открытия, связанные с фаговым дисплеем, Smith и Winter были удостоены доли Нобелевской премии по химии 2018 года [184].
Явление лизиса (распада) микробной клетки известно давно. Различные физические и химические факторы могут поспособствовать этому явлению. На определенном этапе развития может происходить распад микробной клетки как физиологический нормальный процесс ее старения. Но, не смотря на это, существует принципиальное различие между распадом клетки, который вызван бактериофагами, и распадом, вызванным химическими факторами. Бактериофаг в первом случае, вызывающий лизис начинает размножаться, а при распаде клетки под влиянием химических и физических факторов такой процесс не происходит [185].
Усовершенствованиедля электронной микроскопии методов изготовления препаратов и использование современных микроскопов электронного типа, позволили изучить тонкую структуру фагов более детально. Доказано, что разные фаги друг от друга могут отличаться не только повеличине, форме, сложности своей организации, а так же и по химическому составу [186].
Классификация фагов, разработанная Бредли представляет собой: фаги палочковидные или нитевидные (F); фаги без отростка с одной головкой (E);, состоящие фаги из головки, с небольшими выступами (D); фаги с головкойотростками короткого типа (C); фаги с головкой и длинным отростком, чехол которого сокращаться не может (B); фаги с головкой, длинным отростком и сокращающимся чехлом (A) [187-188].
Разделить фаги в порядке усложнения их структурына пять основных групп было предложено Тихоненко А.С. Первая группа представляет собой нитевидной формы фаги; вторая – фаги сферической формы и мелкого размера; третья – фаги, схвостовым отростком, четко выраженным и небольшого размера; четвертая –фаги булавовидные, с длинным отростком не способным сокращаться; пятая – булавовидные, ДНК-содержащие фаги, отросток которых мощный и сложного строения.
Было доказано, что фаги, лизирующие микроорганизмы различных групп, могут обладать идентичными свойствами по своей морфологии. Так же фаги, активные против одной и той же культуры, могут резко различаться по своей структуре [189].
Одним из опознавательных признаков для классификации фага является морфология его негативных колоний, нов некоторых случаях это характерный признак, который с другими признаками коррелирует. Примером являетсяисследование С.Н. Золотухина по изучению протейных фагов. Оказалось, что эти фаги, имели не только различную форму негативных колоний, но и отличались также по устойчивости к воздействию хлороформа [190].
Подобные результаты были получены ранее Рапопорт Л.Г. и Колядицкой Л.С., которые при выделении линии дизентерийного фага, использовали не только морфологию колоний, но и оценивалидругие свойства фага [191].
Совместное существование бактериофага, который является составной частью развивающейся бактериальной клетки и бактерии, называется лизогенией. При этом процессе в состав хромосомы бактерии включается нуклеиновая кислота бактериофага и воспроизводится вместе с ней. В результате образуются белки, придающие бактерии-хозяину новые свойства такие как, чувствительность к другим бактериофагам или антибиотикам, изменение вирулентности.
Изучением лизогенности занимался А. Львов. Он проводил исследования на бактериофаге Bacillus megaterium и доказал экспериментальным путем, что лизогенность является наследуемым бактериальным признаком. Было установлено, что из лизогенной клетки выделяется инфекционный фаг только в момент ее разрыва. Из этого был сделан вывод, что размножающиеся особи,не выделяющие фаг могутсуществоватьв популяции лизогенного штамма, а так же могут быть отдельные бактерии, которые подвергаются лизису, освобождая при этом значительное количество зрелых фаговых частиц [192].
Помимо истинной лизогении, существует псевдолизогения, которая представляет собой сосуществование вирулентного фага с генетически чувствительными бактериями, временно проявляющими фенотипическую устойчивость к этому фагу.
Габрилович И.М. наблюдал псевдолизогению у некоторых бактериальных штаммов, зараженных вирулентным фагом. Данные штаммы являлись носителями вирулентного фага. При этом они состояли из резистентных и чувствительных бактерий, при размножении в которых сохранялсяфаг.
Изменчивостьрезистентных вариантов может способствовать возникновению чувствительных особей, которые могут отделяться от них в процессе размножения. При осуществление пересева такой культуры, переносят некоторое число чувствительных особей и сам бактериофаг [193].
Пассирование культур через среды, содержащие антифаговую сыворотку, могут быть применены для дифференциации истинной лизогении от псевдолизогении. Благодаря этому внеклеточный фаг будет удален.
Фаг в лизогенной бактерии находится в особой форме, Львов называл его пробактериофагом или профагом, потому что он отличался от вегетативного и зрелого фага. Такой фаг имеет специфическую структуру, которая способна сохранять его генетическую информацию. Благодаря этому фаг внедряется в наследственный аппарат бактерии, котораяв свою очередь становится лизогенной. Следовательно, профаг можно считать фактором наследственного признака лизогении. Связь, возникающая между бактерией и профагом,считается тесной. Благодаря этомупроцессу по сравнению со свободными частицами фага, находит отражение в изменении точки термической гибели соответствующих профагов.
Бактериофаги обладаютантигенными свойствами, как и другие белковые тела. Послевведения кроликам парентеральнофагов в многократном количестве в виде фильтратов, особенно с высоким титром –1010-1011 м.к./мл,были полученысыворотки со специфическими антитела к определенным фагам. В свою очередь антитела с соответствующими фагами могут давать серологические реакции такие как, связывания компонента, преципитации, агглютинации, а также способствовать нейтрализации литической активности фагов. Антифаговые сыворотки в разведении 1:100 считаются высокоактивными и могут инактивировать до 99% корпускул добавленного фага в течение одной минуты [194].
Антифаговые сыворотки являются строго специфичными и ими могут нейтрализоваться только приготовленные к ним фаги, или фаги в антигенном отношении родственные им. При серологической классификации фагов часто используют вышеназванное свойство сыворотки. Среди фагов, поражающих разные виды бактерийи среди фагов, паразитирующих на одном бактериальном хозяине,могут возникатьантигенные различия.
Нейтрализация литической активности фагов,вызванная антифаговой сывороткой, связана с антителами против белков фаговых отростков, которые являются ответственными за адсорбцию фага на бактериальных клетках. Нечувствительным к действию нейтрализующих антител становится тот фаг, который необратимо адсорбировался на бактерии.Явление устранения из смеси с бактериями неадсорбированных частиц фага, положено в основу использования антифаговых сывороток.
Фаги по сравнению с бактериями обладают наибольшей устойчивостью ко многим факторам внешней среды, и характеризуется различными показателями.
Бульон, сыворотка и другие жидкости, богатые белковыми веществами, способствуют высокой устойчивости фагов к неблагоприятным воздействиям. Фаголизаты, хранящиеся в пробирках или колбах, способны сохранять свою активность в течение нескольких месяцев, как на холоде, так и при комнатной температуре. В запаянных ампулах способны хранится до 5-13 лет. Фаги способны выдерживать лиофильное высушивание. Менее устойчивымифаги становятся в безбелковых синтетических средах и физиологическом растворе натрия хлорида, что приводит их кбыстрой инактивации при комнатной температуре. Резкое повышение устойчивости фагов происходит при добавлении двухвалентных ионов Ca++ или Mn++ (в концентрации 10-3) к солевым растворам.
Очень низкие температуры не оказывают губительного действия на фаги, благодаря этому при повторном замораживании и отстаивании фаги не снижают свою активность. Фаги по сравнению с хозяевами-бактерий обладают наибольшей устойчивостью к высоким температурам. Большинство фагов при щелочной реакции способны выдерживать нагревание 70-75оС в течение 10-30 минут.Рожистый бактериофаг,например, выдерживает до 8 часов нагревание при 70оС, до 2часов при 75оС, при 80оС до 20 минут, а при 100оС фаги подвергаются быстрой инактивации. Так же существуют фаги, которые почти не выдерживают нагревания. Поэтому рекомендуется хранить фаголизаты в холодильнике [195].
В отличие от бактерий, бактериофаги обладают устойчивостью к большинству дезинфицирующих веществ. В течение 3-7 дней фаги способны сохранятся в 1,5% растворе лизола, 0,5% растворе сулемы и 0,5-1% растворе фенола. Быстрой инактивации фаги подвергаются при воздействии 1% формалина.
Большинство фагов обладают устойчивостью к хлороформу. Фаги, содержащие липиды, являются чувствительными к сернокислому эфиру, толуолу, хлороформу, но зато они обладают значительной устойчивостью к хинозолу и этиловому спирту. Фенол (до 0,25%),хинозол (до 0,01%) и мертиолят (до 1:10000) применяют для консервирования фагофильтратов. В 50% глицерине фаги погибают [196].
Бактериальные вирусы, используемые как модель при изучении молекулярной биологии и ее основных вопросов, находятся в центре внимания и с их помощью задачи современной биологии могут быть решены. Фаги спорообразующих аэробных бактерий являются одним из наиболее перспективных объектов для проведения исследований.
Лизис бактерии является главным признаком воздействия фага на данную бактерию и сопровождается выходом новых вирионов фага в имеющуюся среду.
При нанесение на поверхность бактериального газона находящегося в виде сплошного слоя на поверхности агара, фага в небольшом количестве, наблюдается образование лизиса клеток локальных участков негативных колоний или«бляшек», при этом каждая содержит вирионов-потомков в количестве 107-109 в одной фаговой частице [197].
При характеристике вирусов бактериального происхождения важным признаком является морфология бляшки, которая характерна для данного фага. Эта характеристика часто служила до внедрения электронной микроскопии в практику одним из ведущих тестов для опознавания вириона. В дальнейшем было установлено, что в зависимости от ряда факторов, изменяться величина негативных колоний. Такими факторами являются: размер вириона фага, концентрация агара, свойства индикаторной культуры, рН питательной среды, температура, скорость репликации и адсорбции.
При изучении свойств фагов спорообразующих аэробных бактерий распространение в широком диапазоне получили мутанты бацилл имеющие дефекты в споруляции и аспорогенные штаммы.
Бациллярные фаги формируют негативные колонии, которые можно разделить на следующие 4 группы:
— cleargreat(cg) – круглые,прозрачные, крупные негативные колонии с равными краями;
— clearsmalle(cs)– негативные прозрачные колонии мелкого размера;
— target-like(tl) –мутные негативные колонии;
— clearcenterwithperipheraering(cr) – крупные с прозрачным центром негативные колонии, обладающие выраженной периферической зоной неполного лизиса [198].
Кольцеобразные бляшки могут возникать при волновом измерении скорости роста бактерий.
Формирование сходных по морфологиинегативных колоний может быть связано с фагами различных аэробных видов бацилл, которые имеют различное происхождение, в свою очередь бактериальные вирусы аналогичного происхождения и одного вида способны формировать формынегативных колоний различного вида [199].
Для обнаружения возбудителей инфекционных болезней в пищевых продуктах существует ускоренный метод с помощь специальных индикаторных фагов, называемый фагоиндикацией бактерий. Фагоиндикация микробовоснованна на выраженной избирательности литического действия фагов в отношении определенных видов бактерий и обладает простым количественным учетом бактериофага. Благодаря этому этот метод получил название реакции нарастания титра фага (РНФ).
Реакция нарастания титра фага представляет собой исследование заключающиеся в том, что объект, который исследуют на наличие определенного вида микробов, вносят в соответствующую питательную среду, добавляют туда индикаторный бактериофаг в точно учтенном количестве и инкубируютв течение нескольких часов в термостате.Если в исследуемом материаледействительно содержатся гомологичные бактерии, то индикаторный фаг специфически адсорбируется на них. В результате чего фагпроявлется фаговая инфекция и происходит лизис с последующим выходом новых вирионов фага в эту среду. Если в исследуемой смеси титр индикаторного фага по сравнению с контролем увеличивается в несколько раз (в 5-10), то это указывает на наличие во взятом материале для исследования соответствующего микроба [200].
Индикаторный бактериофаг благодаря своей высокой специфичности в исследуемой смеси не реагирует на присутствие посторонней микрофлоры, поэтому без выделения его в чистой культуре можно проводить индикацию того или иного возбудителя.
КatzhesonH. для обнаружения в бобах некоторых фитопатогенных бактерий, использовал принцип нарастания титра фага .
Гольдфарб Д.М. обосновал теоретически и отработал практически метод РНФ, который считаетсяпри индикации патогенных бактерий весьма ценным. Разработанные им общие положения об индикаторных фагах считаются очень важными при постановке РНФ. Индикаторный бактериофаг должен обладать такими свойствами, как высокая вирулентность; точный лимитированный диапазон литического действия; выраженнаяспособность адсорбции, высокая урожайность и латентный период должен быть коротким. При адсорбции небольшого количества корпускул фага на бактериальной клетке, чтобы не произошел лизис бактерии извне, бактриофаг должен иметь высокий показатель эффективной множественности. Существует различные способы модификаций РНФ, которые позволяютсъэкономить материалы и упрощают определение титра фага [201].
В настоящее время для эпидемиологического обследования стали использовать методы фагового типирования. Благодаря этому методу микробы можно подразделить на большое число стабильных практически типов, так же данный метод является практически простым и дает отчетливые результаты, совпадающие с данными эпидемиологического обследования.
В 1938 году Иени Креджи предложили для дифференцирования брюшнотифозных штаммов бактерий различного происхождения метод фаготипирования.
Фаготипированиепо современной схеме основано на двух различных способах. Первый способ представляет собой дифференциацию штаммов по их чувствительности к стандартным препаратам специфических бактериофагов в определенном разведении. Таким образом типируют патогенные серотипы кишечных палочек, брюшнотифозные, паратифозные А и В микробы, золотистые плазмокоагулирующие стафилококки, дизентерийные бактерии Зонне [202-203].
В 1932 году Барнетом был предложен второй способ и детально разработан Бойдом, который назвал его «прямым типированием бактерий». При этом способе штаммы разделяют на фаготипы по свойствам умеренных фагов (диапазону литической активности, серологии и т.д.) выделенных из них. Таким способом подразделяют стафилококки, некоторые виды сальмонелл и другие микробы [200].
Кац-Чернохвостова Л.Я. со сотрудниками доказали целесообразность фаготипирования бактерий для лабораторной диагностики брюшного тифа ускоренного типа и для совершенствования обследования эпидемиологического вида. Применение бактериофагов для диагностики инфекционных заболеваний сталоперспективным, когда произошло открытие брюшнотифозных бактерий [202].
Попытки фаготипирования патогенных бактерий разных видов стали осуществляться, после опубликования первых работ Иена и Креджи. Многие авторыприменяли методику Креджи и Феликса, добавив в нее ряд модификаций. Типировали обычно фаги, которые были изолированы из лизогенных культурвыделения животных и людей, а так же сточных вод. Чаще всего это были О-фаги, различающиесяпроисхождением и антигенной структурой. Очень редкополучалось выделять наборы единых серологических адаптированных фагов, которые были подобны фагам Vi-IIбрюшнотифозным. Были проведены попытки провести дифференциацию культур с помощью латентных фагов и изучения их свойств, которые были выделены из них [200].
На новые рубежи вышли исследования современного типа, посвященные обнаружению бактерий рода Bacillus и их идентификации. Доказано, что люминесцентная микроскопия позволяет обнаружить специфические споры Bacillus как с помощью меченных очищенных пептидов, так как и с помощью пептид-экспонирующихмеченных фаговых частицы. Частица нитчатого фага обладает сложной структурой, которая мешает эффективному связыванию некоторых типов спор с поверхностью, из-за этого возможность прямого использования рекомбинантных фаговых частиц ограничивается [204].
Глава II. Результаты исследований
2.1 Материалы и методы исследований
Научная литература, посвященная исследованиям бактериофагов, была проанализирована формально-логическими методами. В работе использованы микробиологические, иммунохимические, молекулярно-генетические и статистические методы исследования [205-232].
Объекты исследования
В работе были использованы культуры бактерий, выделенные из проб плодоовощной и растительной продукции, приобретенной на продовольственном рынке Ульяновской области (таблица 2).
Таблица 2 – Культуры бактерий, использованные в НИР
| Название культуры (вид) | Количество штаммов | Объект выделения |
| Bacillus mesentericus (pumilus) | 74 | музей кафедры МВЭ и ВСЭ ФГБОУ ВО Ульяновский ГАУ и выделены самостоятельно |
| Bacillus subtilis | 56 | музей кафедры МВЭ и ВСЭ ФГБОУ ВО Ульяновский ГАУ и выделены самостоятельно |
| Bacillus coagulans | 40 | музей кафедры МВЭ и ВСЭ ФГБОУ ВО Ульяновский ГАУ и выделены самостоятельно |
| Yersinia enterocolitica | 38 | музей кафедры МВЭ и ВСЭ ФГБОУ ВО Ульяновский ГАУ и выделены самостоятельно |
| Bacillus mycoides | 12 | музей кафедры МВЭ и ВСЭ ФГБОУ ВО Ульяновский ГАУ |
| Bacillus cereus | 106 | музей кафедры МВЭ и ВСЭ ФГБОУ ВО Ульяновский ГАУ |
| Bacillus megaterium | 8 | музей кафедры МВЭ и ВСЭ ФГБОУ ВО Ульяновский ГАУ |
| Bacillus anthracis | 11 | музей кафедры МВЭ и ВСЭ ФГБОУ ВО Ульяновский ГАУ |
| Bacillus thuringiensis | 3 | музей кафедры МВЭ и ВСЭ ФГБОУ ВО Ульяновский ГАУ |
| Paenibacillus polimixa | 3 | музей кафедры МВЭ и ВСЭ ФГБОУ ВО Ульяновский ГАУ |
| Paenibacillus larvae | 3 | музей кафедры МВЭ и ВСЭ ФГБОУ ВО Ульяновский ГАУ |
| Listeria monocytogenes | 55 | музей кафедры МВЭ и ВСЭ ФГБОУ ВО Ульяновский ГАУ |
| Listeria ivanovii | 2 | музей кафедры МВЭ и ВСЭ ФГБОУ ВО Ульяновский ГАУ |
| Providenvia spp | 5 | музей кафедры МВЭ и ВСЭ ФГБОУ ВО Ульяновский ГАУ |
| Morganella spp | 6 | музей кафедры МВЭ и ВСЭ ФГБОУ ВО Ульяновский ГАУ |
продолжение таблицы 2
| Название культуры (вид) | Количество штаммов | Объект выделения |
| Escherichia spp | 8 | музей кафедры МВЭ и ВСЭ ФГБОУ ВО Ульяновский ГАУ |
| Enterobacter spp. | 18 | музей кафедры МВЭ и ВСЭ ФГБОУ ВО Ульяновский ГАУ |
| Klebsiella spp. | 6 | музей кафедры МВЭ и ВСЭ ФГБОУ ВО Ульяновский ГАУ |
| Salmonella spp. | 8 | музей кафедры МВЭ и ВСЭ ФГБОУ ВО Ульяновский ГАУ |
| Staphylococcus spp. | 12 | музей кафедры МВЭ и ВСЭ ФГБОУ ВО Ульяновский ГАУ |
| Streptococcus spp. | 13 | музей кафедры МВЭ и ВСЭ ФГБОУ ВО Ульяновский ГАУ |
| Yersinia ruckeri | 1 | музей кафедры МВЭ и ВСЭ ФГБОУ ВО Ульяновский ГАУ |
Все культуры обладали типовыми свойствами и хранились при температуре 2-4 0С в столбике 0,7 % мясо-пептонного агара. В исследованиях использовали 20±2 часовые культуры микроорганизмов (температура культивирования 28±1 0С и 36±10С).
Объектами дляизучения ареала распространения бактерий Bacillus coagulans были 385 проб: 57 проб специй, 65 проб свежих томатов, 96 проб овощных и рыбных консервов, 30 проб различных овощных культур, 68 проб почвы и 69 проб других объектов окружающей среды (речная вода, сточные воды, снег).
На наличие бактериальной контаминации Bacillus pumilus и Bacillus subtilis было исследовано 542 пробы, из которых сформировали три группы образов: первая – это 55 проб хлеба из муки пшеничной высшего и первого сортов, 40 проб муки пшеничной высшего и первого сортов; вторая — 90 проб пряностей и специй, 54 пробы томатов, 34 пробы огурцов, 44 пробы картофеля, 15 проб цуккини; третья – 210 проб почвы различного хозяйственного значения Приволжского Федерального округа. Для исследований отбирали пробы плодоовоощной продукции с признаками бактериоза; из 55 проб хлеба 8 было с признаками «картофельной болезни хлеба».
Объектами для выделения бактерий Y. enterocolitica и Listeria monocitogenes было 88 проб пищевого сырья и продуктов растительного происхождения.
Для выделения бактериофагов из объектов внешней среды было отобрано 200 проб почвы и сточных вод из овцеводческого хозяйства Астраханской области неблагополучного по листериозу; 48 проб (почвы, сточных вод) были отобраны с учетом анализа распространения листериозной инфекции в Ульяновской области согласно разработанному кадастру.
Штаммы бактериофагов – 13 изолятов бактериофагов Bacillus coagulans, 22 изолята бактериофагов Bacillus pumilus, 22 изолята бактериофагов Bacillus subtilis,5 изолятов Listeria monocitogenes и 5 изолятов Yersinia enterocolitica. выделенные из объектов фитосанитарного надзора.
Бактериологическая схема идентификации бактерий Bacillus pumilus,Bacillus subtilis, Bacillus coagulans разрабатывалась с учетом биологических характеристик представителей рода Bacillus, описанных в «Bergey’s Manual of Systematics of Archaea and Bacteria» (2015) [227]. Эталонныемикроорганизмы – B. pumilus 66; B. coagulans 566, B. coagulans 732, B. coagulans 948, B. coagulans 2770, B. coagulans 3042, B. coagulans 4521, B. coagulans 6668, B. coagulans 10268, B. coagulans 10468, B. coagulans 10473, B. subtilis 6633 получены в лиофилизированном виде из музея НИИЦМиБ ФГБОУ ВО Ульяновский ГАУ.
Питательные среды: питательный бульон ТУ 10-02-02-789-176-94 (ООО «БиоКомпас-С», РФ), эмульсия яичного желтка («HiMedia», Индия), среда Мосселя (MYP-агар) (ФБУН ГНЦ ПМБ, РФ); питательный агар для культивирования микроорганизмов сухой (ГРМ-агар) ТУ 9398-020-78095326-2006 (ФБУН ГНЦ ПМБ, РФ); Микро-ГРАМ-НИЦФ набор реагентов для окраски микроорганизмов по методу Грама ТУ 9398-002-39484474-2002 (ЗАО НИЦФ, РФ); среды Гисса с бромкрезоловым пурпурным; с арабинозой с индикатором ВР (с глюкозой); среда Гисса с маннозой БТН, с галактозой БНТ,раффинозой БНТ (ООО «Биотехновация», РФ); агар маннито-солевой (среда № 10) (Соnda, Испания), среда Гисса с салицином, с ксилозой, с лактозой, с мальтозой, с рамнозой, с сорбитом («HiMedia», Индия), среда Кларка (ООО «БиоКомпас-С», РФ), Urea Agar Base (Christensen) («HiMedia», Индия), Urea 40% («HiMedia», Индия); NutrientGelatin («HiMedia», Индия); нитратный агар («HiMedia», Индия); среда № 7 ISP тирозиновый агар («HiMedia», Индия); CornMealPeptoneYeastAgar («HiMedia», Индия);ArginineDihydrolaseBroth(«HiMedia», Индия); цитратный агар Симмонса (ФГУП «НПО Микроген», РФ); BloodAgarBase («HiMedia», Индия);2% мясо-пептонный агар с глюкозой, хромогенный агар уриселект 4 (Bio-Rad, США), желточный агар с крахмалом и бриллиантовым зеленым (Bile Salts Brilliant Green Starch Agar, производства Himedia, Индия), Cetrimide Agar Basec селективной добавкой (Nalidixic Selective Supplement Cetrimide Agar Base производства Himedia, Индия), среда Эндо (ГНЦ прикладной микробиологии, г. Оболенск), реда Симмонса (ГНЦ прикладной микробиологии, г. Оболенск), агар бактериологический, пептон сухой ферментативный, экстракт дрожжевой, хлорид бария, хлорид натрия, сульфат магния, гидрофосфат калия двузамещенный, глюкоза, бромтимоловый синий, желатин, перекись водорода, N-N-диметил-пара-фенилен-диамид, диски с антибиотиками, набор окраски по Граму, вазелиновое масло; агар — агар (AgarAgar, TMMedia, Rajasthan, India); Палкам агар (Listeria identification Agar base (PALCAM) TMMedia, Rajasthan, India); Оксфорд агар (Listeri aOxford Medium Base, India); Оксфордский агар с селективной добавкой (Oxsoid, Англия); полужидкий агар (Listeria Motility Medium, India); хромогенный агар (Chromogenic Listeria Agar Base TM Media, Rajasthan, India); И-бульон, Ирсиния агар (Оболенск).
Реактивы: водный раствор малахитовой зелени, сульфаниловая кислота, альфа-нафтиламиновый реактив, уксусная кислота, перекись водорода 3 % (ООО Росбио), 0,6 % спиртовой раствор α-нафтола, йод кристаллический CAS 7553-56-2 (производство Чили), 0,25%-ный водный раствор основного фуксина, натрий хлористый (хч) (АО ЛенРеактив, РФ), 0,1 % водный раствор Конго красного (АО ЛенРеактив, РФ),карбоксиметилцеллюлоза (КМЦ) (ФКП «Комбинат «Каменский», РФ),1 М раствор CaCl2, фосфатный буфер (ОАО «Агат-Мед», РФ), Твин — 80 бактериологический («HiMedia», Индия), PectinDipecta (Agdia),натрий хлорид, слабощелочной фосфатный буфер (pH-7,6). Картофель, молоко цельное,яйцо куриное диетическое, стерильная дефибринированная кровь барана.
Оборудование: холодильники бытовые, ультратермостаты УТ-15У4,2; термостаты ТС-80М-2; микроскопы МБИ-3; лупа бинокулярная МБС-9, мембранные фильтры фирмы Millipore (filtertype: 0,22 µm GV); центрифуги лабораторные ОПн-8УХЛ4,2 и ЦЛС-3; бактерицидная лампа, 80 % энергии которой приходится на длину волны 2537 Ǻ; лабораторные весы; автоклавы; шуттель-аппарат; сушильный шкаф; машина для изготовления ватных пробок; водяная баня; колбы мерные емкостью 50-1000 см3; пипетки пастеровские, пипетки мерные на 1,0-10,0 см3; флаконы емкостью 50-200 см3; стекла покровные, стекла предметные; чашки Петри; пробирки; термометры ртутные; фарфоровая ступка с пестиком, спиртовая горелка; бактериологические петли.
Исследования проводились на кафедре микробиологии, вирусологии, эпизоотологии и ветеринарно-санитарной экспертизы ФГБОУ ВО Ульяновский ГАУ.
Выделение и изучение биологических свойств фагов проводили по методам Э. Каттера, С.Н. Золотухина [197, 200]. Литическую активность определяли по методам Грациа и Аппельману. Конструирование биопрепарата проводили по методу С.Н. Золотухина [197].
Лабораторные животные
В экспериментах in vivo в качестве модельных животных использовали белых аутбредных (беспородных) мышей (самцы/самки, 18–21 г). Все закупленные животные прошли карантин в виварии в соответствии с СП № 2.2.1. 3218-14 [235].
Пищевая продукция
Определение биологической эффективности биопрепарата проводили на товарном картофеле сорта Ласунок, томатах сорта Премиум F1, листовом салате сорта Тайфун, яблоках сорта Айдарен на искусственном инфекционном фоне в условиях лаборатории (бактериологического бокса). Для эксперимента подготавливали куски массой от 1 г до 10 г путем разрезания с помощью стерильного ножа на стерильной разделочной доске в лабораторных условиях. Образцы предварительно подвергали деконтаминации в 70% спирте, а затем отмывали от последнего 0,9% раствором хлорида натрия. Контаминировали. Для оценки эффективности литического действия бактериофагов на поверхности продукции в лабораторных условиях использовались кусочки 5×5 см.
Методы бактериологического исследования
Приготовление и стерилизация питательных сред ГОСТ Р 51446-99 [226]. Приготовление разведений и суспензий – ГОСТ Р 51426-99 [225]. Посев на питательные среды согласно ГОСТ Р 26670-91 [217]. Отбор и подготовку лабораторных проб проводили ГОСТ 26669-85 [216], ГОСТ 26668-85 [223]. Контроль разработанных питательных сред проводили согласно МУК 4.2.2316-08 «Методы контроля бактериологических питательных сред» [222].
Методы выделения бактериофагов из окружающей среды
Выделение бактериофагов и изучение их биологических свойств проводили методами, предложенными М. Адамсом и Д.М. Гольдфарбом, отработанными и модифицированными сотрудниками ФГБОУ ВО Ульяновский ГАУ [82, 93-94, 105, 115, 143, 180-182, 190-192, 198, 203-204, 212].
Выделение бактериофага методом обогащения с «подсевом»
Жидкие и твердые образцы засевали в мясо-пептонный бульон (МПБ).
Одновременно с исследуемым материалом в питательную среду вносили 0,2– 0,5 мл суточной бульонной культуры бактерий, гомологичных выделяемому фагу. Для контроля культуру бактерий, применяемую для обогащения, засевали в стерильную питательную среду. Емкости с посевами ставили в термостат при температуре, оптимальной для роста культуры, на 18–24 ч. После инкубации из опытной и контрольной пробирок брали по нескольку миллилитров жидкости и фильтровали через бактериальные фильтры. Полученный фильтрат исследовали на присутствие бактериофага, гомологичного бактериям, примененным для обогащения.
Сущность данного метода заключается в предварительном обогащении исследуемого материала клетками того микроорганизма, к которому ищем бактериофаг. Бактерии, внесенные в исследуемый материал, начинают размножаться, и вместе с ними увеличивается количество фага.
Обнаружение бактериофага на плотных питательных средах по методуОтто
1,5% мясопептонный агар разливали в чашки Петри. После застывания питательную среду засевали 16–18-часовой бульонной культурой бактерий, гомологичных искомому фагу. Для получения сплошного роста 2–3 капли культуры наносили на чашку и растирали шпателем равномерно по всей ее поверхности. Спустя 5–10 мин после посева на подсушенную поверхность питательной среды наносили каплями исследуемый фильтрат. После того как жидкость впиталась в среду, чашки переворачивали вверх дном и ставили в термостат при оптимальной температуре роста микроорганизмов на 18–24 ч. Учет результатов: доказательством наличия бактериофага служит полное отсутствие роста культуры в месте попадания капли фильтрата (активный бактериофаг) или появление в этом участке мелких стерильных пятен – колоний бактериофага.
Обнаружение бактериофага на плотных питательных средах двуслойнымметодом Грациа
1,5% МПА разливали в чашки Петри в количестве 25–30 мл (первый слой). После застывания среды чашки ставили в термостат на 1½–2 ч для подсыхания. В пробирку с 2,5 мл 0,7% расплавленного и остуженного до 4 ![]() C агара вносили 1 мл исследуемого фильтрата и 0,2 мл суточной культуры, соответствующей искомому фагу. Содержимое пробирок быстро перемешивали, чтобы не произошло затвердевания агара, и выливали на чашку вторым слоем. После того, как агар застывал, посев ставили в термостат при оптимальной температуре роста микроорганизмов. Результат учитывали через 16–18 ч инкубации в термостате. Присутствие бактериофага определяли по наличию прозрачных пятен, хорошо видимых на матовом фоне роста бактерий.
C агара вносили 1 мл исследуемого фильтрата и 0,2 мл суточной культуры, соответствующей искомому фагу. Содержимое пробирок быстро перемешивали, чтобы не произошло затвердевания агара, и выливали на чашку вторым слоем. После того, как агар застывал, посев ставили в термостат при оптимальной температуре роста микроорганизмов. Результат учитывали через 16–18 ч инкубации в термостате. Присутствие бактериофага определяли по наличию прозрачных пятен, хорошо видимых на матовом фоне роста бактерий.
Подтверждение отсутствия умеренных бактериофагов в потенциальных бактериях-хозяевах
Отобранные как индикаторные, бактерии предварительно, до выделения к ним бактериофагов из объектов окружающей среды, были проверены в тесте по индукции профага с помощью митомицина С и УФО. В результате проведенных исследований отобранные штаммы бактерий были закреплены в качестве клеток-хозяев и использовались в дальнейшем для выделения бактериофагов и получения фаголизатов с высоким титром фаговых частиц.
Изолирование бактериофагов, активных в отношении определенного спектра бактерий-мишеней
Выделение и изучение биологических свойств фагов проводили по методам, предложенным Д.М. Гольдфарбом [195], определения титра фаговых частиц и морфологии негативных колоний — по методу Грациа, с учетом температурных режимов оптимальных для культивирования отобранных бактерий-хозяев.
Для выделения бактериофагов из сточных вод исследуемые образцы объемом 15 мл засевали в колбу с МПБ в объеме 50 мл, внося при этом по 0,2 мл (полная петля) суточной бактериальной культуры. После инкубирования из колбы брали 10 мл жидкости и помещали в стерильную пробирку. Затем, с целью освобождения от посторонней микрофлоры, материал центрифугировали в течение 30 мин при 5000 об/мин, надосадочную жидкость отбирали и фильтровали через мембранные фильтры с диаметром пор 0,22 мкм. Присутствие бактериофага определяли по наличию прозрачных пятен (бляшек, негативных колоний), хорошо видимых на матовом фоне роста бактерий.
В случае положительного результата негативные колонии или участок лизиса пересевали с помощью бактериологической петли в МПБ с соответствующей индикаторной культурой. Для этого в две пробирки с 4,5 мл МПБ добавляли стерильной пипеткой по 0,2 мл суточной бульонной индикаторной культуры, в одну из которых пересевали негативную колонию соответствующего бактериофага, вторая пробирка служила контролем. Определяющим моментом являлось просветление бульона в опытной пробирке и выраженное помутнение среды в контроле. После чего содержимое опытной пробирки с целью освобождения от бактериального дебриса центрифугировали в течение 30 мин при 5000 об/мин, надосадочную жидкость отбирали и фильтровали через мембранные фильтры с диаметром пор 0,22 мкм.
Определение титра литической активности бактериофагов
После выделения бактериофага необходимо определить его количественное соотношение, или титр фага. Для титрования бактериофага предложены различные методы, однако наибольшее распространение из них получили способ титрования фага в жидкой питательной среде, предложенный Аппельманом, и метод агаровых слоев, разработанный Грациа.
Титрование бактериофага в жидкой питательной среде по методуАппельмана
Метод основан на внесении различных количеств титруемого бактериофага в питательный бульон, засеянный одной и той же дозой бактериальной культуры, чувствительной к данному фагу. Для этого брали 10 пробирок с 4,5 мл МПБ в каждой. В первую пробирку вносили 0,5 мл исследуемого фага, содержимое пробирки тщательно перемешивали. Из первой пробирки 0,5 мл переносили во вторую и т.д. до получения ряда последовательных 10-кратных разведений фага (10-1 -10-10). В каждую пробирку приготовленного ряда вносили по 0,03 мл взвеси суточной агаровой культуры бактерий, содержащей 109 микробных клеток в 1 мл по стандарту мутности (10 МЕ), чувствительной к данному фагу. Для контроля брали 2 пробирки с МПБ, в одну из которых вносят 0,5 мл исследуемого фага (контроль на стерильность фильтрата фаголизата), в другую пробирку 0,03 мл микробной культуры (контроль культуры). Все пробирки помещали в термостат при оптимальной температуре роста микроорганизмов на 18 ч. Результат определяли по отсутствию видимого роста бактерий в присутствии бактериофага. Активность (силу литической активности или специфическую активность, но не титр) бактериофага обозначают отрицательной степенью десяти, где степень указывает последнее разведение бактериофага, в котором рост индикаторной культуры визуально не наблюдался.
Титрование бактериофага методом агаровых слоев (метод Грациа)
Этот метод основан на внесении различных разведений титруемого бактериофага в соответствующую культуру бактерий и посеве на плотную питательную среду с целью получения негативных колоний бактериофага. Накануне опыта готовили питательные среды. В чашки Петри разливали 1,5% МПА по 25 мл среды. Среду в чашках подсушивали в термостате до полного удаления конденсата. Агар должен быть абсолютно сухим, так как даже незначительное увлажнение может изменить количественные показатели содержания частиц фага в исследуемой жидкости. Брали 0,7% МПА в пробирках по 2,5 мл в каждой, расплавляли его на водяной бане и охлаждали до 48–50 °С. Из жидкости, содержащей титруемый бактериофаг, готовили в пробирках ряд последовательных разведений (как в методе Аппельмана). Затем в пробирку с 0,7% МПА вносили 1 мл соответствующего разведения исследуемого бактериофага, слегка перемешивали, добавляли 0,1–0,2 мл 109 культуры, чувствительной к бактериофагу, опять слегка перемешивали и содержимое пробирки выливали в чашку с МПА (вторым слоем). Смесь равномерно распределяли по поверхности агара и оставляли чашку в горизонтальном положении на 40–50 мин, то есть до полного охлаждения агара. Затем чашки слегка подсушивали и инкубировали в термостате при оптимальной температуре роста микроорганизмов в течение 18–20 ч. На фоне равномерного роста микробов отмечались пятна, где рост отсутствовал (полный лизис). При большом количестве бактериофага наступал лизис микроорганизмов на всей поверхности агара. Когда количество фаговых частиц невелико, то участков лизиса мало, и можно рассчитать количество бляшкообразующих единиц (БОЕ) фага в 1 мл препарата, допуская, что каждый участок лизиса образовывался в результате действия одной частицы фага. Допустим, что на агаре в чашке имелось 30 пятен лизиса (колоний фага) при исследовании фильтрата в разведении 10-7. Следовательно, титр фага будет равен 3×10-8, т.е. в 1 мл фага содержится 3×108 БОЕ.
Определение спектра литической активности бактериофагов
Спектр литической активности бактериофагов оценивали методом нанесения фага (spot-тест) на газон бактериальной культуры. В чашки Петри разливали 1,5% МПА. После застывания и подсушивания агара на чашки Петри наносили по 0,1 мл 16–18-часовой бульонной культуры микроорганизмов, растирали шпателем по всей поверхности чашки, чтобы получить равномерный сплошной рост культуры. После того, как культура впиталась и чашки подсохли, на них каплями (spot-тест) наносили бактериофаги. После того, как жидкость впиталась в среду, чашки переворачивали вверх дном и ставили в термостат при оптимальной температуре роста культуры на 18–24 ч. На следующие сутки производили учет результатов – наличие или отсутствие «пятна лизиса».
Получение фаговой биомассы с высоким титром фаговых частиц
Фаговую биомассу с высокой литической активностью получали методом выращивания на плотных питательных средах (Патент РФ №2525141 «Способ получения бактериофага») [235]. Он включает следующие этапы:
1-й этап – это получение ночной (18-часовой) культуры штамма-хозяина. Бактериальную культуру, выросшую на плотной питательной среде, микробиологической петлей засевают в МПБ, разлитый по 4,5 мл из расчета одна пробирка на одну матрасную колбу. Посеянные таким образом индикаторные штаммы культивируют в термостате 18 ч.
2-й этап – нанесение штамма-хозяина на поверхность плотной питательной среды.
В матрасные колбы с плотным питательным агаром вносят 18-часовую культуру штамма-хозяина. Распределяют культуру по всей поверхности питательной среды, создавая монослой. Стерильной микробиологической пипеткой удаляют лишнюю жидкость. Культивируют в течение 3,5 ч при оптимальной температуре для роста культуры штамма-хозяина.
3-й этап – нанесение маточного штамма бактериофага.
В образовавшийся таким образом газон культуры вносят шприцем или стерильной микробиологической пипеткой 2 мл одноименного (маточного) бактериофага в титре 106–107 БОЕ/мл. Соотношение посевной культуры и бактериофага составляет 100 к 1, т.е. на 100 бактериальных клеток – 1 частица бактериофага. Покачивающим движением распределяют бактериофаг так, чтобы он тонким слоем покрыл всю поверхность газона бактериальной культуры. И опять отбирают стерильной пипеткой лишнюю жидкость. Инкубируют в термостате 13–15 ч при оптимальной температуре для роста культуры штамма-хозяина и одноименного бактериофага.
4-й этап – сбор бактериофага.
В матрас в асептических условиях вносят физиологический раствор с рН 7,0–7,2 в количестве 0,04–0,045 мл на 1 см2 (9 мл на один матрас). Плавным покачивающим движением производят смыв фага с поверхности питательного агара. Стерильной микробиологической пипеткой собирают жидкую фракцию и переносят в стерильные центрифужные пробирки. Эта фракция состоит из бактериофага, обломков бактериальных клеток, живых нелизированных клеток штамма-хозяина. Для освобождения фаголизата от нелизированных бактерий в пробирки добавляют хлороформ из расчета 1/10. Экспонируют полученную суспензию 30 мин при непрерывном шуттелировании, центрифугируют 30 мин при 5000–6000 об/мин. Собирают полученный супернатант в стерильную емкость.
5-й этап – очистка и контроль фаголизата.
Полученный таким образом фаголизат стерилизуют фильтрацией через фильтр с диаметром пор 0,22 мкм.
Методы оценки стабильности бактериофагов к воздействию агрессивных факторов
Устойчивость бактериофагов-кандидатов к повышенным температурам
Степень устойчивости бактериофагов к воздействию высокой температуры проводили следующим способом: исследуемые бактериофаги разводили 1:10 в МПБ (рН 7,2–7,4) для того, чтобы получить бактериофаг определенной концентрации. Затем пробирки с фагами прогревали на водяной бане и термостате «Гном» в диапазоне измеряемой температуры с определенным интервалом в течение заданного промежутка времени. Параллельно титровали контроль – фаголизат без прогревания и охлаждения. Количество негативных колоний определяли методом агаровых слоев по Грациа.
Устойчивость бактериофагов к воздействию трихлорметана
Трихлорметан является недорогим и доступным средством, не всегда убивающим бактериофаговые частицы, которое используется для освобождения фаголизата от жизнеспособных микроорганизмов. Определение чувствительности бактериофагов к данному химическому веществу проводили методом обработки фаговой суспензии трихлорметаном в соотношении 1:10 при постоянном перемешивании. Для этого брали по 3 пробирки с 4,5 мл МПБ, в каждую вносили по 0,2 мл испытываемого бактериофага и 0,2 мл бактериальной культуры, чувствительной к данному фагу (индикаторная культура). Пробирки культивировали при 37 ºС 18–20 ч. Затем в каждую пробирку добавляли по 0,5 мл трихлорметана. Время экспозиции с трихлорметаном при непрерывном встряхивании соответственно: 1-я пробирка – 15 мин; 2-я пробирка – 30 мин; 3-я пробирка – 45 мин. Полученную смесь откручивали на центрифуге 30 мин при 5000 об/мин. Собирали супернатант. Активность бактериофага определяли по методу Грациа. Контролем служил стерильный фильтрат фаголизата, полученный с использованием бактериальных фильтров.
Определение параметров инфекционного процесса в системе фаг — клетка для бактериофагов, входящих в состав технологического вспомогательного средства
Адсорбция
Экспоненциально растущие бактериальные клетки смешивали с бактериофагом (множественность инфицирования (MOI) = 0,001) и инкубировали при комнатной температуре. Образцы (100 мкл) отбирали через 1, 2, 3, 4, 5, 10, 15, 20, 25, 30 мин, смешивали с 850 мкл SM-буфера и 50 мкл хлороформа. После центрифугирования надосадочную жидкость титровали для определения неадсорбированных или обратимо адсорбированных фагов через разные временные интервалы. Количественно адсорбцию выражали константой скорости адсорбции (k), измеряемой в мл/мин:
K = 2,3/(B×t)× log(P0/P) (1)
где P0 – титр фага, определенный при времени 0;
P – титр фага, неадсорбированного на поверхности бактериальной клетки за время t;
B – титр бактерий в начальный момент в 1 мл, t – время в минутах.
Латентный период и выход фаговых частиц определяли следующим образом. 50 мл бактериальных клеток инкубировали до экспоненциальной стадии роста (OD600 = 0,3), далее 20 мл полученной жидкой бактериальной культуры центрифугировали при 4 °С, 5 мин, 7000 g. Осадок ресуспендировали в 0,5 мл свежего Luria-Bertani (LB) бульона и смешивали с бактериофагом таким образом, что MOI = 0,01. Смесь бактериофага и бактериальных клеток инкубировали 5 мин при температуре 37 °С. Неадсорбированные фаги удаляли путем центрифугирования в течение 2 мин при 13000 g. Осадок ресуспендировали в 10 мл предварительно подогретого LB. Образцы отбирали через 5–10-минутные интервалы в течение 2 ч и немедленно титровали. Выход бактериофага определяли как отношение максимального количества высвободившихся фаговых частиц в конце размножения к количеству фаговых частиц во время латентного периода.
Определение частоты возникновения фагорезистентных бактериальных мутантов
На поверхность 1,5% питательной среды в чашке Петри наносили 0,1 мл бактериофага с титром не менее 109 БОЕ/мл и равномерно распределяли шпателем до полного впитывания фага. Затем на поверхность агара с фагом наносили 0,1 мл бактериальной культуры, подращенной до 108 КОЕ/мл, и растирали по поверхности чашки шпателем. Чашки инкубировали при оптимальной температуре роста бактерий в течение 24 ч. В результате заражения чувствительных клеток бактерий фагом происходит лизис клеток, а на поверхности агаризованной среды образуются колонии только тех клеток бактерий, которые являются фагорезистентными мутантами.
Частоту возникновения фагорезистентных мутантов определяли как отношение количества фагорезистентных клонов к количеству жизнеспособных клеток бактерий в 1 мл среды.
Полногеномное секвенирование ДНК бактериофагов
Секвенирование ДНК бактериофагов
Для получения полногеномных нуклеотидных последовательностей выделенных бактериофагов и подтверждения отсутствия лизогении штаммахозяина использовали метод метагеномного секвенирования вирусов.
Использованный метод включал в себя следующие этапы:
- очистка фаголизата от бактериальной ДНК;
- выделение ДНК бактериофага;
- создание библиотек случайных фрагментов (фрагментация ДНК, выбор фракции фрагментов необходимой длины и лигирование адаптерных последовательностей);
- клональная амплификация библиотек;
- непосредственно секвенирование;
- анализ данных методами биоинформатики. Получение препаратов ДНК бактериофагов
Фаголизаты, содержащие исследуемые бактериофаги в титре не ниже 109 БОЕ/мл, пропускали через стерильную фильтрующую шприцевую насадку Millex-GP с диаметром пор 0,22 мкм (Merck Millipore, США), после чего обрабатывали ферментом DNase I (NEB, США). Выделение ДНК бактериофагов проводили при помощи набора К-Сорб (ООО «НПФ Синтол», Россия) согласно протоколу производителя.
Подготовка к секвенированию и непосредственно секвенирование.
Нуклеотидные последовательности исследуемых бактериофагов проводили при помощи одного из методов секвенирования второго поколения, а именно полупроводникового секвенирования на платформе Ion Torrent (Thermo Fisher Scientific, США). Метод полупроводникового секвенирования основан на связи химической и цифровой информации (рН секвенирование). Процесс основан на детекции протонов, которые получаются при синтезе цепи ДНК как побочный продукт. Как следствие, рН раствора меняется, что можно детектировать и таким образом различать нуклеотиды.
Как и другие методы высокопроизводительного секвенирования (highthroughput sequencing; в англоязычной литературе чаще употребляется термин «next generation sequencing», сокращенно NGS), данный метод позволяет секвенировать несколько образцов ДНК одновременно. Поэтому для секвенирования ДНК, выделенной из каждого фаголизата, готовили баркодированные библиотеки случайных фрагментов. Выделенную ДНК предварительно фрагментировали ультразвуком при помощи прибора Bioruptor UCD-200 (Diagenode, Бельгия). Библиотеки случайных фрагментов для последующего секвенирования готовили при помощи набора реагентов NEBNext (NEB, США) согласно протоколу производителя с использованием стандартных баркодов Ion Xpress TM Barcode Adaptors Kit (Thermo Fisher Scientific, США).
Все работы по получению ДНК бактериофагов и приготовлению баркодированных библиотек случайных фрагментов проводили с использованием методических подходов, исключающих перекрестную контаминацию образцов. Оценку распределения длин фрагментов библиотек и их концентрацию проводили с использованием прибора Bioanalyzer 2100 и набора реагентов Agilent High Sensitivity DNA Kit (Agilent Technologies, США) согласно протоколу производителя.
Клональную амплификацию библиотек, которые были предварительно эквимолярно пулированы, проводили с использованием набора Ion PI Template OT2 200 Kit v3 (Thermo Fisher Scientific, США) согласно протоколу производителя.
Непосредственно секвенирование проводили при помощи набора реагентов Ion PI Sequencing 200 Kit v3 на чипе Ion PI Chip Kit v2 секвенатора Ion Proton (Thermo Fisher Scientific, США) согласно протоколу производителя.
Биоинформатический анализ нуклеотидных последовательностей бактериофагов
В ходе биоинформатического анализа проводили фильтрацию качества прочтений. Для сборки фаговых геномов de novo использовали риды с качеством прочтения нуклеотидов не ниже Q20 и длиной не менее 50 оснований. Сборку геномов осуществляли с использованием программного обеспечения Newbler (Roche/454 GS-FLX). Сравнение собранных геномов бактериофагов с геномами известных аннотированных бактериофагов проводили при помощи алгоритма blast (http://blast.ncbi.nlm.nih.gov/Blast.cgi) и баз данных нуклеотидных последовательностей NCBI (Национальный центр биотехнологической информации, США). Визуализацию выравнивания собранных нами геномов с известными проводили с использованием программного обеспечения BLAST Ring Image Generator (BRIG).
Поиск открытых рамок считывания проводили при помощи программного обеспечения UGENE (Унипро, Россия). Прогноз типа жизненного цикла бактериофага (умеренный или вирулентный) проводили при помощи программы PHACTS (San Diego State University, США). Подтверждение вирулентности или определение потенциально умеренного бактериофага проводили в ходе определения соответственно отсутствия или наличия генов, кодирующих известные интегразы, репрессоры транскрипции или их гомологи при помощи алгоритма blastp (http://blast.ncbi.nlm.nih.gov/Blast.cgi). Визуализацию аннотированного генома проводили с использованием программного обеспечения BASys (Bacterial Annotation System) (https://www.basys.ca).
Оценка параметров микробиологической безопасности пищевого сырья и продуктов питания (количество мезофильных аэробных и факультативно анаэробных микроорганизмов (КМАФАнМ) и L. monocytogenes)
КМАФАнМ определяли согласно ГОСТ 10444. 15-94 [215]. Из навески продукта подготовили исходное и ряд десятикратных разведений согласно ГОСТ 26669-85 [216]. Из каждого разведения вносили по 1 мл в 2 параллельные чашки Петри. Затем посевы заливали МПА, ожидали, когда чашечки подсохнут, и помещали в термостат при температуре 30 °C на 72 ч. После инкубирования подсчитывали количество колоний на чашках Петри. Результаты подсчета количества колоний пересчитывали на 1 г продукта по ГОСТ 26670-91 [217]. Бактерии Listeria monocytogenes выявляли по ГОСТ 32031-2012 [218] из серийных разведений образца (1:10).
Статистические методы обработки данных
Статистическую обработку результатов (вычисление средних арифметических значений и стандартного отклонения) проводили с использованием статистических ресурсов программы Microsoft Excel 2016.
2.2 Результаты собственных исследований
2.2.1. БактерииBacillus coagulans и специфичные им бактериофаги
2.2.1.1 Выделение бактерий Bacillus coagulans и изучение их идентификация
Для выделения культуры сначала необходимо было сделать разведение проб в мясопептонном бульоне (МПБ) в соотношение 1:10, т.е. брали навески весом по 5 г. (для жидкой фракции по 5 мл) и добавляли их в колбы с 50 мл МПБ. Полученные колбы культивировали в термостате при температуре 37оС в течение 24 часов. «Чистую культуру» выделяли методом Дригальского, для этого из вышеназванных разведений проб делали посев штрихом на мясопептонный агар (МПА), засеянные чашки ставили в термостат вверх дном. Через 24 часа должны были наблюдать на чашках рост слизистых матовых колоний серо-белого цвета с морщинистой поверхностью и волнистым краем. На рисунке 1 показан рост референс-штамма Bacillus coagulans 566, на рисунке 2 – выделенной нами бациллярной культуры.Для дальнейших исследований с чашек Петри было взято по 1-2 типичных колоний для изучаемых бактерий, которые высевали в пробирки с МПБ, ставили в термостат на 24 часа. На следующий день из этих пробирок (рис. 3) делали посев штрихом на чашку Петри с МПА и культивировали в условиях термостата 24 часа. Затем выделенные культуры пересевали для хранения в пробирки с мясопептонным агаром и культивировали в термостате 21±3 часа. В результате 47 культур, выделенные нами, мы отнесли предварительно к роду Bacillus.Нами установлено, чтореференс-штаммы Bacillus coagulans и 47 культур, выделенные нами из объектов санитарного надзора, это грамположительные палочки (рис. 4-6).
Дальнейшие исследования были посвящены изучению роста выделенных культур на плотных (мясопептонный агар) и жидких (мясопептонный бульон) питательных средах. На МПА были обнаружены мелкие сероватые колонии с плотным центром и неровными краями, и матовые, слизистые колониис волнистыми краями, с морщинистой поверхностью, серо-белого цвета (рис. 2).

Рисунок 1 – Рост референс-штамма Bacillus coagulans 566 на МПА

Рисунок 2 – Бациллярная культура выделенная из пробы № 5

Рисунок 3 – Бациллярная культура при росте на МПБ
Рисунок 4 – Референс-штамм Bacilluscoagulans566 окрашенный по Граму
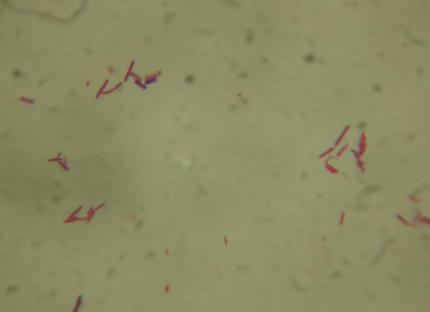
Рисунок 5 – Культура № 5 и № 24
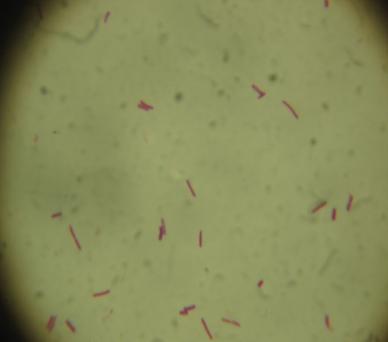
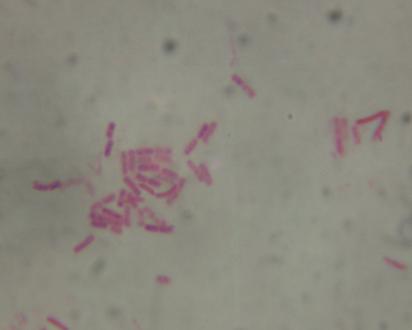
Рисунок 6 – Культура № 286 и № 384
Культуры на МПБ образуют осадок плотного типа и белого цвета, при встряхивании который поднимается в виде спирали, так же наблюдалось образование нежной пленки, которая покрывала частично поверхность питательной среды (рис. 3).
Для изучения биохимических свойств референс-штаммов Bacillus coagulans и выделенных штаммов бактерий рода Bacillus использовали схему Gordon [152].
Подвижность микроорганизмов изучали в пробирках с полужидким агаром (0,45-0,75% агара), для этого культуры высевали «уколом» в столбик агара. В результате наблюдали, что в столбике полужидкого агара было выраженное помутнение, распространяющееся равномерно по всей толщине среды, это указывало на то, что микроорганизм обладает подвижностью (рис. 7). Нами было установлено, что референс-штаммы Bacillus coagulans и все выделенные нами культуры подвижны.
Продукцию каталазы изучалина чашках Петри, для этого культуры высевали на агар и через 22±2 часа после культивирования, на выросшие колонии капали 10% H2O2. О наличии каталазы свидетельствовали пузырьки газа, образовавшиеся вместе нанесения перекиси водорода (рис. 8).
Способность к разжижению желатина определяли посевом культур «уколом» в мясопептонную желатину.
Гидролиз крахмала наблюдали на картофельном агаре, культуры высевали штрихом на картофельный агар в чашках Петри, выдерживали в термостате и через 24 часа заливали Люголевым раствором. Если вокруг посевов наблюдались светлые зоны, то это указывало на гидролиз крахмала (рис. 9).
Изучали продукцию летициназы, для этого культуры высевали на бульон с яичным желтком, положительная реакция проявлялась появлением беловатой мути и всплывающим хлопьям. В нашем случае реакция отрицательная, что характерно для бактерий вида Bacillus coagulans.
Для определения образованияиндола, сероводорода иаммиака культуры засевали в пробирки с МПБ, и под пробку пробирок помещали индикаторные бумажки. Если появлялся малиновый или сиреневый цвет на бумажке, различной интенсивности, то это указывало на образованиеиндола (рис. 10), почернение индикаторной полоски говорило о том, что имеется сероводород(рис. 11), бумажка при образовании аммиака обретала красный цвет (рис. 12).
На анаэробном агаре изучали рост культур в анаэробных условиях. Бактериологической петлейзасевали «уколом» суточную бульонную культурув столбик среды. По всей длине укола рост культуры свидетельствовал об анаэробном росте (рис. 7).
Реакцией Фогес-Проскауэра (в модификации Барита) определяли в среде ацетон, который является промежуточным продуктом при распаде глюкозы. Для постановки реакции культуры высевали на среду Кларка и выдерживали в термостате 3 суток при 37оС. Затем в чистую пробирку переносили 1 мл культуральной жидкости, добавляли туда же 0,6 мл α-нафтола (5% раствор в абсолютном спирте) и 0,2 мл 40% КОН, хорошо взбалтывали. Положительнымрезультатом реакции было розовое окрашивание проявляющиеся через 2-5 мин. Об отрицательной реакции судили, если раствор принимал цвет меди (рис. 13).
Результаты проведенных исследований представлены в таблице 3.
Рассматривали наличие роста бактерий на солевом (5, 7, 9, 10, 12, 15, 17, 20%) и глюкозном (2, 5, 7, 10, 12, 15, 17, 19, 21%) бульоне. Появление осадка в пробирке указывало на положительную реакцию. Результаты исследований представлены на рисунках 14 и 15, и в таблицах 4 и 5.
В качестве дополнительного теста для дифференциации выделенных бактерий использовали среды Гисса. Изученные биохимические свойства бацилл выделенных нами и штаммов бактерий:B. coagulans 566, B. coagulans 732, B. coagulans 948, B. coagulans 2770, B. coagulans 3042, B. coagulans 4521, B. coagulans 6668, B. coagulans 10268, B. coagulans 10468, B. coagulans 10473, B. anthracis 34 F2, B. megaterium 182, B. pumilus 66, полученных из музея кафедры МВЭ и ВСЭ УлГАУ были сравнены между собой. Биохимические свойства представленыв таблице 3 и на рисунках 16-18.

Рисунок 7 – Рост выделенныхкультурв полужидком агаре
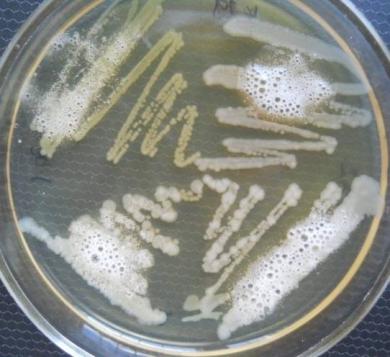
Рисунок 8 – Результаты изучения способности выделенных культур продуцировать каталазу

Рисунок 9 – Положительный результат изучения способности культур
B. coagulans 566 и B. coagulans 10468 гидролизировать крахмал

Рисунок 10 – Положительная реакция на определение индола

Рисунок 11 – Присутствиев культуре сероводорода

Рисунок 12 – Положительная реакция на определение аммиака

Рисунок 13 – Реакция Фогес-Проскауэра: положительная реакцияслева и отрицательная реакция справа

Рисунок 14 – Отрицательная (слева) и положительная (справа)
реакция на солевом бульоне

Рисунок 15 – Положительная реакция на глюкозном бульоне
Таблица 3–Характеристика свойств референс-штаммов и выделенных бактерий
| Название
культуры |
Свойства | |||||||||
| Подвижность | Каталаза | Разжижение желатины | Гидролиз крахмала | Продукция летициназы | Индол | Сероводород | Аммиак | Анаэробный рост | Реакция Фогес-Проскауэра | |
| B. coag. 566 | + | + | — | + | — | — | + | — | + | + |
| B. coag. 732 | + | + | — | + | — | — | + | — | + | + |
| B. coag. 948 | + | + | — | + | — | — | + | — | + | + |
| B. coag. 2770 | + | + | — | + | — | — | + | — | + | + |
| B. coag. 3042 | + | + | — | + | — | — | + | — | + | + |
| B. coag. 4521 | + | + | — | + | — | — | + | — | + | + |
| B. coag. 6668 | + | + | — | + | — | — | + | — | + | + |
| B. coag. 10268 | + | + | — | + | — | — | + | — | + | + |
| B. coag. 10468 | + | + | — | + | — | — | + | — | + | + |
| B. coag. 10473 | + | + | — | + | — | — | + | — | + | + |
| B. cer. 8035 | + | + | + | + | + | — | + | + | + | + |
| B. meg. 182 | + | + | + | + | — | — | — | + | — | — |
| B. mes. 66 | + | + | + | — | — | — | — | — | — | + |
| 5 | + | + | — | + | — | — | + | — | + | + |
| 10 | + | + | — | + | — | — | + | — | + | + |
| 12 | + | + | — | + | — | — | + | — | + | + |
| 16 | + | + | — | + | — | — | + | — | + | + |
| 24 | + | + | — | + | — | — | + | — | + | + |
| 28 | + | + | — | + | — | — | + | — | + | + |
| 33 | + | + | — | + | — | — | + | — | + | + |
| 37 | + | + | — | + | — | — | + | — | + | + |
| 39 | + | + | — | + | — | — | + | — | + | + |
| 40 | + | + | — | + | — | — | + | — | + | + |
| 44 | + | + | — | + | — | — | + | — | + | + |
| 49 | + | + | — | + | — | — | + | — | + | + |
| 51 | + | + | — | + | — | — | + | — | + | + |
| 57 | + | + | — | + | — | — | + | — | + | + |
| 62 | + | + | — | + | — | — | + | — | + | + |
| 66 | + | + | — | + | — | — | + | — | + | + |
| 67 | + | + | — | + | — | — | + | — | + | + |
| 78 | + | + | — | + | — | — | + | — | + | + |
| 88 | — | — | + | — | + | + | + | — | — | — |
| 90 | + | + | — | + | — | — | + | — | + | + |
| 92 | + | + | — | + | — | — | + | — | + | + |
| 104 | + | + | — | + | — | — | + | — | + | + |
| 115 | + | + | — | + | — | — | + | — | + | + |
| 121 | + | — | + | — | + | — | — | — | — | — |
| 126 | + | + | — | + | — | — | + | — | + | + |
Продолжение таблицы 3
| 138 | + | + | — | + | — | — | + | — | + | + |
| 144 | + | — | + | — | + | — | — | — | — | + |
| 152 | — | — | + | — | — | — | — | — | — | — |
| 159 | + | + | — | + | — | — | + | — | + | + |
| 161 | — | — | + | — | + | + | — | — | — | + |
| 170 | + | + | — | + | — | — | + | — | + | + |
| 172 | + | + | — | + | — | — | + | — | + | + |
| 191 | + | + | — | + | — | — | + | — | + | + |
| 200 | — | — | + | — | + | — | — | — | — | + |
| 203 | — | — | + | + | + | — | — | — | + | — |
| 214 | + | + | — | + | — | — | + | — | + | + |
| 225 | + | + | — | + | — | — | + | — | + | + |
| 236 | + | + | — | + | — | — | + | — | + | + |
| 247 | + | + | — | + | — | — | + | — | + | + |
| 253 | + | + | — | + | — | — | + | — | + | + |
| 264 | + | + | — | + | — | — | + | — | + | + |
| 286 | + | + | — | + | — | — | + | — | + | + |
| 308 | + | + | — | + | — | — | + | — | + | + |
| 322 | + | + | — | + | — | — | + | — | + | + |
| 343 | + | + | — | + | — | — | + | — | + | + |
| 384 | + | + | — | + | — | — | + | — | + | + |
| 385 | + | + | — | + | — | — | + | — | + | + |
Таблица 4 – Учет результатов роста на солевом бульоне
| Название
культуры |
Концентрация соли, % | ||||||||
| 2 | 5 | 7 | 9 | 10 | 12 | 15 | 17 | 20 | |
| B. coag.566 | + | + | + | + | + | — | — | — | — |
| B. coag.732 | + | + | + | + | — | — | — | — | — |
| B. coag.948 | + | + | + | + | — | — | — | — | — |
| B. coag. 2770 | + | + | + | — | — | — | — | — | — |
| B. coag. 3042 | + | + | + | — | — | — | — | — | — |
| B. coag. 4521 | + | + | + | — | — | — | — | — | — |
| B. coag. 6668 | + | + | + | — | — | — | — | — | — |
| B. coag. 10268 | + | + | + | + | + | — | — | — | — |
| B. coag. 10468 | + | + | + | + | + | — | — | — | — |
| B. coag. 10473 | + | + | + | + | + | — | — | — | — |
| B. cer. 8035 | + | + | + | — | — | — | — | — | — |
| B. meg. 182 | + | + | + | — | — | — | — | — | — |
| B. mes. 66 | + | + | + | + | + | — | — | — | — |
| 5 | + | + | + | + | + | — | — | — | — |
| 10 | + | + | + | + | + | — | — | — | — |
| 12 | + | + | + | + | + | — | — | — | — |
| 16 | + | + | + | + | + | — | — | — | — |
| 24 | + | + | + | + | + | — | — | — | — |
| 28 | + | + | + | + | + | — | — | — | — |
| 33 | + | + | + | + | + | — | — | — | — |
| 37 | + | + | + | + | + | — | — | — | — |
Продолжение таблицы 4
| 39 | + | + | + | + | + | — | — | — | — |
| 40 | + | + | + | + | + | — | — | — | — |
| 44 | + | + | + | + | + | — | — | — | — |
| 49 | + | + | + | + | + | — | — | — | — |
| 51 | + | + | + | + | + | — | — | — | — |
| 57 | + | + | + | + | + | — | — | — | — |
| 62 | + | + | + | + | + | — | — | — | — |
| 66 | + | + | + | + | + | — | — | — | — |
| 67 | + | + | + | + | + | — | — | — | — |
| 78 | + | + | + | + | + | — | — | — | — |
| 88 | + | + | — | — | — | — | — | — | — |
| 90 | + | + | + | + | + | — | — | — | — |
| 92 | + | + | + | + | + | — | — | — | — |
| 104 | + | + | + | + | + | — | — | — | — |
| 115 | + | + | + | + | + | — | — | — | — |
| 121 | + | + | + | — | — | — | — | — | — |
| 126 | + | + | + | + | + | — | — | — | — |
| 138 | + | + | + | — | — | — | — | — | — |
| 144 | + | + | — | — | — | — | — | — | — |
| 152 | + | + | + | + | — | — | — | — | — |
| 159 | + | + | + | + | + | — | — | — | — |
| 161 | + | — | — | — | — | — | — | — | — |
| 170 | + | + | + | + | + | — | — | — | — |
| 172 | + | + | + | + | + | — | — | — | — |
| 191 | + | + | + | + | + | — | — | — | — |
| 200 | + | + | — | — | — | — | — | — | — |
| 203 | + | + | + | — | — | — | — | — | — |
| 214 | + | + | + | + | + | — | — | — | — |
| 225 | + | + | + | — | — | — | — | — | — |
| 236 | + | + | + | + | + | — | — | — | — |
| 247 | + | + | + | + | + | — | — | — | — |
| 253 | + | + | + | + | + | — | — | — | — |
| 264 | + | + | + | + | + | — | — | — | — |
| 286 | + | + | + | + | + | — | — | — | — |
| 308 | + | + | + | + | + | — | — | — | — |
| 322 | + | + | + | + | — | — | — | — | — |
| 343 | + | + | + | + | — | — | — | — | — |
| 384 | + | + | + | + | + | — | — | — | — |
| 385 | + | + | + | + | + | — | — | — | — |
Таблица 5 – Учет результатов роста на глюкозном бульоне
| Название
культуры |
Концентрация сахара, % | ||||||||
| 2 | 5 | 7 | 10 | 12 | 15 | 17 | 19 | 21 | |
| B. coag. 566 | + | + | + | + | + | + | + | + | + |
| B. coag. 732 | + | + | + | + | + | + | + | + | + |
| B. coag. 948 | + | + | + | + | + | + | + | + | + |
| B. coag. 2770 | + | + | + | + | + | + | + | + | + |
Продолжение таблицы 5
| B. coag. 3042 | + | + | + | + | + | + | + | + | + |
| B. coag. 4521 | + | + | + | + | + | + | + | + | + |
| B. coag. 6668 | + | + | + | + | + | + | + | + | + |
| B. coag. 10268 | + | + | + | + | + | + | + | + | + |
| B. coag. 10468 | + | + | + | + | + | + | + | + | + |
| B. coag. 10473 | + | + | + | + | + | + | + | + | + |
| B. cer. 8035 | + | + | + | + | + | + | + | + | + |
| B. meg. 182 | + | + | + | + | + | + | + | + | + |
| B. mes. 66 | + | + | + | + | + | + | + | + | + |
| 5 | + | + | + | + | + | + | + | + | + |
| 10 | + | + | + | + | + | + | + | + | + |
| 12 | + | + | + | + | + | + | + | + | + |
| 16 | + | + | + | + | + | + | + | + | + |
| 24 | + | + | + | + | + | + | + | + | + |
| 28 | + | + | + | + | + | + | + | + | + |
| 33 | + | + | + | + | + | + | + | + | + |
| 37 | + | + | + | + | + | + | + | + | + |
| 39 | + | + | + | + | + | + | + | + | + |
| 40 | + | + | + | + | + | + | + | + | + |
| 44 | + | + | + | + | + | + | + | + | + |
| 49 | + | + | + | + | + | + | + | + | + |
| 51 | + | + | + | + | + | + | + | + | + |
| 57 | + | + | + | + | + | + | + | + | + |
| 62 | + | + | + | + | + | + | + | + | + |
| 66 | + | + | + | + | + | + | + | + | + |
| 67 | + | + | + | + | + | + | + | + | + |
| 78 | + | + | + | + | + | + | + | + | + |
| 88 | + | + | + | — | — | — | — | — | — |
| 90 | + | + | + | + | + | + | + | + | + |
| 92 | + | + | + | + | + | + | + | + | + |
| 104 | + | + | + | + | + | + | + | + | + |
| 115 | + | + | + | + | + | + | + | + | + |
| 121 | + | + | + | + | + | — | — | — | — |
| 126 | + | + | + | + | + | + | + | + | + |
| 138 | + | + | + | + | + | + | + | + | + |
| 144 | + | + | — | — | — | — | — | — | — |
| 152 | + | + | + | + | + | — | — | — | — |
| 159 | + | + | + | + | + | + | + | + | + |
| 161 | + | + | + | + | + | + | + | — | — |
| 170 | + | + | + | + | + | + | + | + | + |
| 172 | + | + | + | + | + | + | + | + | + |
| 191 | + | + | + | + | + | + | + | + | + |
| 200 | + | + | + | + | + | — | — | — | — |
| 203 | + | + | + | + | — | — | — | — | — |
| 214 | + | + | + | + | + | + | + | + | + |
| 225 | + | + | + | + | + | + | + | + | + |
| 236 | + | + | + | + | + | + | + | + | + |
| 247 | + | + | + | + | + | + | + | + | + |
| 253 | + | + | + | + | + | + | + | + | + |
| 264 | + | + | + | + | + | + | + | + | + |
| 286 | + | + | + | + | + | + | + | + | + |
| 308 | + | + | + | + | + | + | + | + | + |
| 322 | + | + | + | + | + | + | + | + | + |
| 343 | + | + | + | + | + | + | + | + | + |
| 384 | + | + | + | + | + | + | + | + | + |
| 385 | + | + | + | + | + | + | + | + | + |
Таблица 6 – Биохимические свойства референс-штаммов и выделенных бактерий
| Название
культуры |
Сахароза | D-Глюкоза | L-Арабиноза | D-Маннит | D-Манноза | D-Ксилоза | Дульцит | Лактоза | Мальтоза | Рамноза |
| B. coag. 566 | + | + | + | — | + | + | — | — | + | + |
| B. coag. 732 | + | + | + | — | + | + | — | — | + | + |
| B. coag. 948 | + | + | + | — | + | + | — | — | + | + |
| B. coag. 2770 | + | + | + | — | + | + | — | — | + | + |
| B. coag. 3042 | + | + | + | — | + | + | — | — | + | + |
| B. coag. 4521 | + | + | + | — | + | + | — | — | + | + |
| B. coag. 6668 | + | + | + | — | + | + | — | — | + | + |
| B. coag. 10268 | + | + | + | — | + | + | — | — | + | + |
| B. coag. 10468 | + | + | + | — | + | + | — | — | + | + |
| B. coag. 10473 | + | + | + | — | + | + | — | — | + | + |
| B. cer. 8035 | + | + | — | — | — | — | — | — | + | — |
| B. meg. 182 | + | + | + | + | — | + | — | + | + | — |
| B. mes. 66 | + | + | + | + | + | + | — | — | — | — |
| 5 | + | + | + | — | + | + | — | — | + | + |
| 10 | + | + | + | — | + | + | — | — | + | + |
| 12 | + | + | + | — | + | + | — | — | + | + |
| 16 | + | + | + | — | + | + | — | — | + | + |
| 24 | + | + | + | — | + | + | — | — | + | + |
| 28 | + | + | + | — | + | + | — | — | + | + |
| 33 | + | + | + | — | + | + | — | — | + | + |
| 37 | + | + | + | — | + | + | — | — | + | + |
| 39 | + | + | + | — | + | + | — | — | + | + |
| 40 | + | + | + | — | + | + | — | — | + | + |
| 44 | + | + | + | — | + | + | — | — | + | + |
| 49 | + | + | + | — | + | + | — | — | + | + |
| 51 | + | + | + | — | + | + | — | — | + | + |
| 57 | + | + | + | — | + | + | — | — | + | + |
| 62 | + | + | + | — | + | + | — | — | + | + |
| 66 | + | + | + | — | + | + | — | — | + | + |
| 67 | + | + | + | — | + | + | — | — | + | + |
| 78 | + | + | + | — | + | + | — | — | + | + |
| 88 | — | + | — | + | — | + | + | + | — | — |
Продолжение таблицы 6
| 90 | + | + | + | — | + | + | — | — | + | + |
| 92 | + | + | + | — | + | + | — | — | + | + |
| 104 | + | + | + | — | + | + | — | — | + | + |
| 115 | + | + | + | — | + | + | — | — | + | + |
| 121 | + | + | — | — | — | — | + | — | — | — |
| 126 | + | + | + | — | + | + | — | — | + | + |
| 138 | + | + | + | — | + | + | — | — | + | + |
| 144 | — | — | — | + | — | — | + | — | — | + |
| 152 | + | — | — | — | — | — | + | + | — | — |
| 159 | + | + | + | — | + | + | — | — | + | + |
| 161 | — | — | — | + | + | + | + | — | — | — |
| 170 | + | + | + | — | + | + | — | — | + | + |
| 172 | + | + | + | — | + | + | — | — | + | + |
| 191 | + | + | + | — | + | + | — | — | + | + |
| 200 | — | — | — | + | + | — | + | — | — | — |
| 203 | + | — | — | + | — | — | — | — | — | — |
| 214 | + | + | + | — | + | + | — | — | + | + |
| 225 | + | + | + | — | + | + | — | — | + | + |
| 236 | + | + | + | — | + | + | — | — | + | + |
| 247 | + | + | + | — | + | + | — | — | + | + |
| 253 | + | + | + | — | + | + | — | — | + | + |
| 264 | + | + | + | — | + | + | — | — | + | + |
| 286 | + | + | + | — | + | + | — | — | + | + |
| 308 | + | + | + | — | + | + | — | — | + | + |
| 322 | + | + | + | — | + | + | — | — | + | + |
| 343 | + | + | + | — | + | + | — | — | + | + |
| 384 | + | + | + | — | + | + | — | — | + | + |
| 385 | + | + | + | — | + | + | — | — | + | + |
Примечания «+»– ферментация сахара с образованием газа и кислоты;
«-» –результат отрицательный.

Рисунок 16 – ФерментацияD-глюкозы

Рисунок 17 – Отсутствие ферментации лактозы

Рисунок 18 – Ферментация рамнозы
Данные проведенных исследований получились следующие: культуры, выделенные нами, это спорообразующие, подвижные, не образующие капсул, палочкообразныебациллы. При росте на МПА были обнаружены мелкие сероватые колонии с плотным центром и неровными краями, и матовые, слизистые колонии с волнистыми краями, с морщинистой поверхностью, серо-белого цвета. Бациллы на МПБ образуют осадок плотного типа и белого цвета, при встряхивании который поднимается в виде спирали, так же наблюдалось образование нежной пленки, которая покрывала частично поверхность питательной среды. Температура 37оС считается для роста выделенных бацилл оптимальной. Так же культуры вызывают гидролиз крахмала и продуцируют каталазу, обладают ростом в анаэробных условиях. Сероводород выделятся в большом количестве при разложении белков. Проявляют положительную реакцию Фогес-Проскауэра. Способны расти на 10% солевом бульоне и 21% глюкозном бульоне.
Доказано экспериментальным путем, что музейные штаммы бактерий B. coagulans 566, B. coagulans 732, B. coagulans 948, B. coagulans 2770, B. coagulans 3042, B. coagulans 4521, B. coagulans 6668, B. coagulans 10268, B. coagulans 10468, B. coagulans 10473 и выделенные нами культуры бацилл обладают аналогичными биологическими свойствами (таб. 7).
На основании тестов схемы Gordona [152] и дополнительных биохимических тестов мы утверждаем, что из 47 выделенных нами культур только 40 относятся к виду Bacillus coagulans.Результаты представлены в таблицах 8, 9 и отражены на рисунке 19.
Таблица 7 – Сводные данные основных свойств бактерий Bacillus coagulans, анализируемые для внутриродовой дифференциации [226]
| Характеристика | Сводные данные об основных свойствах бактерий по «Bergey’sManualofSystematicsofArchaeaandBacteria» | Результаты собственных исследований | |||
| B. coagulans | 10 референс-штаммов
B. coagulans |
47 штаммов выделенных культур | |||
| пигментация | — | — | — | ||
| подвижность | + | + | + | ||
| диаметр клетки > 1 мкм | — | — | — | ||
| окраска по Граму | Гр+ | Гр+ | Гр+ | ||
| форма спор | эллипсовидная | эллипсовидная | |||
| каталаза | + | 10 | 40 | ||
| рост в анаэробных условиях | + | 10 | 41 | ||
| Фогес-Проскауэр | d | 10 | 43 | ||
| Кислота из | |||||
| сахарозы | d | 10 | 43 | ||
| L-арабинозы | d | 10 | 40 | ||
| D-глюкозы | + | 10 | 42 | ||
| D-маннозы | + | 10 | 42 | ||
| D-ксилозы | d | 10 | 42 | ||
| лактозы | d | — | 2 | ||
| мальтозы | + | 10 | 40 | ||
| рамнозы | d | 10 | 41 | ||
| D-маннита | — | — | 5 | ||
| дульцита | — | — | 6 | ||
| Гидролиз | |||||
| крахмала | + | 10 | 41 | ||
| Утилизация | |||||
| желатиназная активность | d | — | 7 | ||
| лецитиназная активность | — | — | 6 | ||
| Рост на МПА в присутствии NaCl | |||||
| 2 % | + | 10 | 47 | ||
| 5 % | — | 10 | 46 | ||
| 7 % | — | 10 | 43 | ||
| 10% | — | 4 | 36 | ||
Примечание «+» – положительный результат,
«-» – отрицательный результат,
«d» – вариабельный результат,
« » – данные отсутствуют.
Таблица 8 – Сводная таблица культур выделенныхиз объектовсанитарного надзора
| № культуры | Название пробы | Материал для выделения | |
| 1 | 5 | Специи:
|
|
| 2 | 10 | Специи:
|
|
| 3 | 12 | Специи:
|
|
| 4 | 16 | Специи:
|
|
| 5 | 24 | Почваааразличного хозяйственногоа значенияа (Ульяновская область, р.п. Глотовка):
|
|
Продолжение таблицы 8
| 6 | 28 | Овощныеа консервы (томатный сок) домашнегоааприготовления | |
| 7 | 33 | Почваа различногоа хозяйственногоаазначения (Ульяновская область, г. Инза):
|
|
| 8 | 37 | Почваа различногоаахозяйственного значенияа (Ульяновская область, г. Сенгилей):
|
|
| 9 | 39 | Почва различного хозяйственного значения (Ульяновская область, р.п. Ишеевка):
|
|
| 10 | 40 | Почва различного хозяйственного значения (Ульяновская область, р.п. Кузоватово) | |
| 11 | 44 | Почва различного хозяйственного значения (Ульяновская область, р.п. Радищево) | |
| 12 | 49 | Специи:
|
|
| 13 | 51 | Рыбные консервы:
|
|
| 14 | 57 | Маринованныеа помидорыадомашнего априготовления | |
| 15 | 62 | Почваа различногоаахозяйственного азначения (Ульяновская область, р.п. Старая Кулатка) | |
| 16 | 66 | Почва различного хозяйственного значения (Ульяновская область, р.п. Павловка) | |
| 17 | 67 | Почва различного хозяйственного значения (Ульяновская область, р.п. Николаевка) | |
| 18 | 78 | Овощныеааконсервы адомашнего приготовления на основе томатногоа сока | |
| 19 | 90 | Снег проба № 2 (Чердаклинский район, п. Октябрьский, территория кафедры микробиологии) | |
| 20 | 92 | Капуста с признаками порчи | |
| 21 | 104 | Морковьс признаками порчи | |
| 22 | 115 | Специи: Мята перечная | |
| 23 | 126 | Какао:
|
|
| 24 | 138 | Специи:
|
|
| 25 | 159 | Специи:
|
|
| 26 | 170 | Свежий томат с признаками порчи | |
| 27 | 172 | Почва (Астраханская область, Икрянинский район, р.п. Красные Баррикады) | |
| 28 | 191 | Почва (Оренбургская область, Первомайский район, с. Мирошкино) | |
| 29 | 214 | Почва (Самарская область, Елховский район, с. Березовка) | |
| 30 | 225 | Почва (Республика Татарстан, Алькеевский район) | |
| 31 | 236 | Почва (Ульяновская область, р.п. Ишеевка) | |
| 32 | 247 | Картофель («Лента гипермаркет») | |
| 33 | 253 | Морковь (Магазин «Магнит») | |
| 34 | 264 | Почва (Чердаклинский район, п. Октябрьский, возле кафедры микробиологии) | |
| 35 | 286 | Томатная паста «Каждый день» | |
| 36 | 308 | Кетчуп «Спело Зрело» | |
| 37 | 322 | Свежий томат с признаками порчи | |
| 38 | 343 | Свежий томат с признаками порчи | |
| 39 | 384 | Свежий болгарский перец с признаками порчи | |
| 40 | 385 | Сок с мякотью. Мультиовощной со свеклой «Сады Придонья» (с признаками порчи) | |
Таблица 9 – Наименование источников выделения штаммов бактерий Bacillus coagulans
| №
п/п |
Источники авыделения | Количество аобразцов | Количество авыделенных штаммов бактерий
Bacillus coagulans |
| 1 | Специи | 57 | 9 |
| 2 | Свежие томаты | 65 | 3 |
| 3 | Овощные и рыбные консервы | 96 | 7 |
| 4 | Овощные культуры | 30 | 5 |
| 5 | Почва | 68 | 15 |
| 6 | Другие объекты окружающей среды | 69 | 1 |
| Итого: | 385 | 40 | |
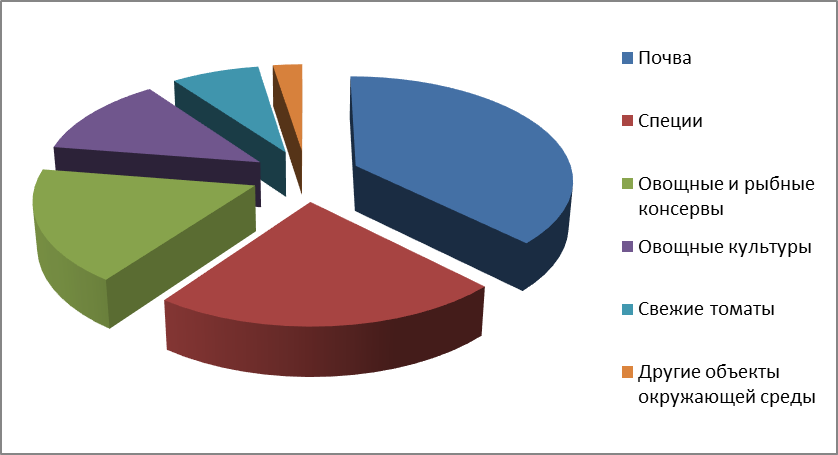
Рисунок 19 – Источники выделения штаммов бактерий Bacillus coagulans
2.2.1.2 Выделение и селекция бактериофагов, специфичных для бактерий Bacillus coagulans
Второй этап исследований заключался в выделение бактериофагов Bacillus coagulans. Для проведения исследований использовали 385 проб различного вида такие как, пробы почвы, воды и пищевые продукты. Метод исследований — выделение бактериофага методом обогащения с «подсевом». Зона лизиса, присутсвующая на газонах культур B. coagulans указывала, что в исследуемом материале присутствует бактериофаг (рис. 22-24).13 изолятов фагов, выделенные нами из 385 проб различного вида, были специфичными для бактерий Bacillus coagulans (таб. 11).
Селекцию выделенных бактериофагов проводили с помощью классического метода [197] и метода смывов фагов с «дорожки»[197, 200]. Прозрачная среда должна наблюдаться в опытной пробирке, которая отличается от контрольной так же и отсутствием пленки на поверхности среды (рис. 25).Классическим методом было селекционированно 5 бактериофагов, а методом с помощью смывов 8, при этом установлено, что в обоих случаях для появления пленки требовалось 6 часов инкубирования в условиях термостата при температуре 36±1оС. Оптимальное соотношение бактериофага и индикаторного штамма B. coagulans определяли с помощью различных соотношений фага и культуры: 1:1, 1:2, 1:3, 1:4 и 1:5.
Таблица 11–Характеристика выделенных фагов бактерий Bacilluscoagulans
| №\№ | Название бактериофага | Индикаторная культура | Наименование объекта выделения |
| 1 | Phagum B.c. 1 УГСХА | B. coagulans566 | Проба № 144 – Свекла из Старомайнского района |
| B. coagulans732 | |||
| B. coagulans948 | |||
| B. coagulans10468 | |||
| 2 | Phagum B.c. 2 УГСХА | B. coagulans 10473 | Проба № 172 – Почва (Астраханская область, Икрянинский район, р.п. Красные Баррикады) |
| 3 | Phagum B.c. 3 УГСХА | B. coagulans566 | Проба № 191 – Почва (Оренбургская область, Первомайский район, с. Мирошкино) |
| B. coagulans 10473 | |||
| 4 | Phagum B.c. 4 УГСХА | B. coagulans566 | Проба № 203 – Морковь (Старомайнский район) |
| B. coagulans732 | |||
| B. coagulans948 | |||
| B. coagulans10468 | |||
| 5 | Phagum B.c. 5 УГСХА | B. coagulans 566 | Проба № 214 – Почва (Самарская область, Елховский район, с. Березовка) |
| 6 | Phagum B.c. 6 УГСХА | B. coagulans 566 | Проба № 225 – Почва (Республика Татарстан, Алькеевский район) |
| B. coagulans 10468 | |||
| B. coagulans 10473 | |||
| 7 | Phagum B.c. 7 УГСХА | B. coagulans566 | Проба № 236 – Почва (Ульяновская область, р.п. Ишеевка) |
| B. coagulans10468 | |||
| B. coagulans10473 | |||
| 8 | Phagum B.c. 8 УГСХА | B. coagulans566 | Проба № 264 – Почва (Чердаклинский район, п. Октябрьский, возле кафедры микробиологии) |
| B. coagulans732 | |||
| B. coagulans 948 | |||
| B. coagulans 10468 | |||
| 9 | Phagum B.c. 9 УГСХА | B. coagulans10468 | Проба № 286 – Томатная паста «Каждый день» (с признаками порчи) |
| 10 | Phagum B.c. 10 УГСХА | B. coagulans 10268 | Проба № 322 – Свежий томат с признаками порчи |
| B. coagulans 2770 | |||
| 11 | Phagum B.c. 11 УГСХА | B. coagulans 10268 | Проба № 343 – Свежий томат с признаками порчи |
| B. coagulans 2770 | |||
| 12 | Phagum B.c. 12 УГСХА | B. coagulans566 | Проба № 384 – Свежий болгарский перец с признаками порчи |
| B. coagulans732 | |||
| 13 | Phagum B.c. 13 УГСХА | B. coagulans 732 | Проба № 385 – Сок с мякотью. Мультиовощной со свеклой «Сады Придонья» (с признаками порчи) |
| B. coagulans 10468 | |||
| B. coagulans 10268 | |||
| B. coagulans 10473 | |||
| B. coagulans 4521 |
В результате проведенных исследований было установлено, что оптимальное соотношение составляет 1:1, т.е. 0,2 мл бактериофага и 0,2 мл индикаторной культуры B. coagulans.
Температурные показатели культивирования бактериофагов определяли следующим образом: в пробирку с 4,5 мл МПБ (pH 7,4-7,6) вносили 0,2 мл бактериофага и 0,2 мл суточной культуры штамма B. coagulans. Параллельно ставился контроль (0,2 мл суточной культуры штамма B. coagulans). Пробирки культивировали в термостате при различных температурных режимах от 21оС до 37оС с шагом 2оС до появления в контрольной пробирке пленки на поверхности среды. Если в опытной пробирке наблюдалось помутнение среды, то это указывало на отсутствие лизиса, просветление среды в сравнении с контролем означало, что происходит лизис культуры (табл. 12).
Таблица 12 – Температурные показатели культивирования бактериофагов
| Фаг | Температура культивирования фага | ||||||||
| 21°С | 23°С | 25°С | 27°С | 29°С | 31°С | 33°С | 35°С | 37°С | |
| Phagum B.c. 1 УГСХА | — | — | — | — | + | + | + | + | + |
| Phagum B.c. 2 УГСХА | — | — | — | — | + | + | + | + | + |
| Phagum B.c. 3 УГСХА | — | — | — | — | + | + | + | + | + |
| Phagum B.c. 4 УГСХА | — | — | — | — | + | + | + | + | + |
| Phagum B.c. 5 УГСХА | — | — | — | — | + | + | + | + | + |
| Phagum B.c. 6 УГСХА | — | — | — | — | + | + | + | + | + |
| Phagum B.c. 7 УГСХА | — | — | — | — | + | + | + | + | + |
| Phagum B.c. 8 УГСХА | — | — | — | — | + | + | + | + | + |
| Phagum B.c. 9 УГСХА | — | — | — | — | + | + | + | + | + |
| Phagum B.c. 10 УГСХА | — | — | — | — | + | + | + | + | + |
| Phagum B.c. 11 УГСХА | — | — | — | — | + | + | + | + | + |
| Phagum B.c. 12 УГСХА | — | — | — | — | + | + | + | + | + |
| Phagum B.c. 13 УГСХА | — | — | — | — | + | + | + | + | + |
Примечание «+» – лизис культуры, «-» – отсутствие лизиса культуры
Доказано экспериментальным путем, что для культивирования фагов оптимальный диапазон температуры составляет 29-37 оС, нами решено инкубировать бактериофаги при температуре 37оС. Используемые нами для исследований штаммы B. coagulans, которые являются индикаторными, хранятся на полужидком МПА (рН 7,2-7,4) в стерильных пробирках с содержанием 0,3% бактериологического агара, 2-4оС является температурным режимом, каждые 4 месяца осуществляется их пересев.
Рисунок 22 – Выявление бактериофага Phagum B.c. 1 УГСХА
на газоне культуры B. coagulans566
Рисунок 23 – Выявление бактериофага Phagum B.c. 7 УГСХА
на газоне культуры B. coagulans 10473
Рисунок 24 – Выявление бактериофага Phagum B.c. 11 УГСХА
на газоне культуры B. coagulans10268

Рисунок 25 – Рост выделенного бактериофага (слева) и культуры Bacilluscoagulans566 (справа) на мясопептонном бульоне

Рисунок 26–Бактериофаг очищенный мембранным фильтром
фирмы Millipore 0,22 µm GV

Рисунок 27 –Бактериофаги укупоренные во флаконы
После того как каждый фаголизат (13 штук) отпасировали десятикратной серии пассажей на индикаторной культуре, отфильтровали их через фильтры мембранные фирмы Millipore 0,22 µm GV (рисунок 25), провели укупоривание во флаконы стерильные и только тогда уже помещали их на хранение без введения консервантов при низкой температуре (4-6оС) (рисунок 27).
Из селекционированных бактериофагов Bacillus coagulans нужно было отобрать фаг, который мог бы служить в качестве компонента биопрепарата на основе фага, который в свою очередь можно было применять для индикации и идентификации бактерий Bacillus coagulans при исследовании этих бактерий в пищевом сырье и продуктах питания. Для этого нам необходимо было изучить биологические свойства фагов, которым, и посвящены наши следующие исследования.
2.2.1.3 Изучение основных биологических свойств выделенных фагов бактерий Bacillus coagulans
Для отбора фагов с наилучшими характеристиками необходимо было изучить основные биологические свойства, такие как:
- морфология негативных колоний бактериофагов;
- литическая активность бактериофагов бактерий Bacillus coagulans;
- спектр литической активности бактериофагов;
- специфичность действия бактериофагов.
Нами установлено, что выделенные бактериофаги имели схожие негативные колонии диаметром 1-4 мм, округлой формы, без вторичного роста, с прозрачными центрами и зонами неполного лизиса (рис. 28).
Максимальное разведение фага, способного на жидкой или плотной среде вызывать лизис бактериальной культуры, называется литической активностью этого бактериофага. Для более достоверной оценки литической активности фага определяют количество активных корпускул фага в единице объема. У селекционированных бактериофагов бактерий B. coagulans литическую активность определяли методами Аппельмана и Грациа [200].
Результаты проведенных исследований, представленные в таблице 13.
Таблица 13 – Литическая активность селекционированных бактериофагов
| № п/п | Фагиа | Литическая аактивность | |
| по аАппельману (степень разведения) | по аГрациа (БОЕ/мл) | ||
| 1 | Phagum B.c. 1 УГСХА | 10-9 | 2,0+0,1×108 |
| 2 | Phagum B.c. 2 УГСХА | 10-8 | 4,0+0,1×108 |
| 3 | Phagum B.c. 3 УГСХА | 10-9 | 7,0+0,1×108 |
| 4 | Phagum B.c. 4 УГСХА | 10-10 | 2,0+0,1×109 |
| 5 | Phagum B.c. 5 УГСХА | 10-8 | 3,0+0,1×109 |
| 6 | Phagum B.c. 6 УГСХА | 10-9 | 2,0+0,1×1010 |
| 7 | Phagum B.c. 7 УГСХА | 10-8 | 6,0+0,1×109 |
| 8 | Phagum B.c. 8 УГСХА | 10-9 | 4,0+0,1×108 |
| 9 | Phagum B.c. 9 УГСХА | 10-8 | 8,0+0,1×107 |
| 10 | Phagum B.c. 10 УГСХА | 10-7 | 9,0+0,1×107 |
| 11 | Phagum B.c. 11 УГСХА | 10-9 | 4,0+0,1×1010 |
| 12 | Phagum B.c. 12 УГСХА | 10-10 | 1,0+0,1×109 |
| 13 | Phagum B.c. 13 УГСХА | 10-8 | 6,0+0,1×107 |
Полученные данные свидетельствуют о том, что бактериофаги Bacilluscoagulans, выделенные нами, имеют различную активность,показатели которойвыявленыпо Аппельману в диапазонеот 10-7 до 10-10; а по Грация диапазон составляет от 6,0+0,1×107 до 4,0+0,1×1010 (БОЕ/мл) (рис. 28-29).
Диапазон лизиса фагом гомологичных ему бактерий называется спектром литической активности этого бактериофага, который применяют для их идентификации и считают характерной чертой бактериофагов [200].
В своих исследованиях мы использовали 10 референс-штаммов и 40 полевых штаммов бактерий B. coagulans. Для изучения диапазона литической активности бактериофагов мы использовали метод нанесения фага на газон индикаторной культуры «стекающей каплей». Появление прозрачной зоны лизиса на газоне индикаторной культуры B. coagulans свидетельствовало о положительном результате (рис. 30). Результаты проведенных исследований отражены в таблице 14. Спектр литической активности фагов был у всех различный. Минимальный процент лизируемых культур B. coagulans составил 66%, максимальный – 92%.
Биопрепарат для индикации и идентификации бактерий B. coagulans должен содержать бактериофаг, который обладает специфичностью в пределах вида.
Таблица 14 – Спектр литической аактивности фагов по отношению к
штаммам Bacillus coagulans
| №
п/п |
Название фагаа | Количество штаммоваBacillus coagulans в эксперименте | Количество лизируемыхаштаммоваBacillus coagulans | Процент лизируемыхаштаммоваBacillus coagulans, % |
| 1 | Phagum B.c. 1 УГСХА | 50 | 40 | 80 |
| 2 | Phagum B.c. 2 УГСХА | 50 | 35 | 70 |
| 3 | Phagum B.c. 3 УГСХА | 50 | 38 | 76 |
| 4 | Phagum B.c. 4 УГСХА | 50 | 41 | 82 |
| 5 | Phagum B.c. 5 УГСХА | 50 | 33 | 66 |
| 6 | Phagum B.c. 6 УГСХА | 50 | 39 | 78 |
| 7 | Phagum B.c. 7 УГСХА | 50 | 37 | 74 |
| 8 | Phagum B.c. 8 УГСХА | 50 | 42 | 84 |
| 9 | Phagum B.c. 9 УГСХА | 50 | 36 | 72 |
| 10 | Phagum B.c. 10 УГСХА | 50 | 38 | 76 |
| 11 | Phagum B.c. 11 УГСХА | 50 | 46 | 92 |
| 12 | Phagum B.c. 12 УГСХА | 50 | 40 | 80 |
| 13 | Phagum B.c. 13 УГСХА | 50 | 43 | 86 |
Выделенные13 изолятов бактериофагов Bacillus coagulans подвергали исследованию по изучению специфичности на культурах гомологичного рода: B.pumilus, B. subtilis, B. аnthracis, B. thuringiensis, B. mycoides, B. cereus, B.megaterium. Исследования проводили, используя метод Отто «стекающая капля».
В ходе эксперимента было установлено, что селекционированные нами бактериофаги, благодаря своей строгой специфичности в пределах вида Bacillus coagulans, могут составлять биопрепарат, который можно будет применять для индикации и идентификации этих бактерий.
Очистка бактериофагов от бактериальных клеток является важным моментом, для этого можно использовать три разных способа, это очистка фагов с помощью прогревания на водяной бане, обработка хлороформом (трихлорметаном) или фильтрацией с применением мембранных фильтров.
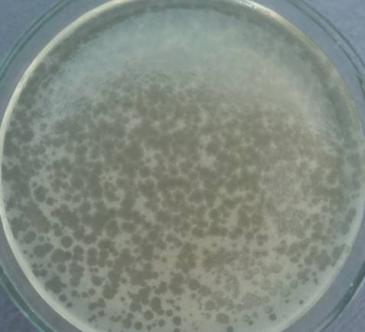
Рисунок 28 – Морфология бляшкообразующих единиц
бактериофага Phagum B.c. 11 УГСХА

Рисунок 29 – Определение литической активности по Грациа
бактериофага Phagum B.c. 3 УГСХА
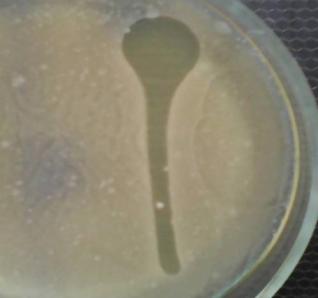
Рисунок 30 – Зонаа лизиса культуры Bacillus coagulans 566 (слева) и культуры Bacillus coagulansа 732 (справа) при взаимодействии с фагом PhagumB.c. 12 УГСХА
Высокая температура является хорошим способом инактивации фаголизатов от бактерий и является важным технологическим параметром для отбора бактериофагов для индикации и идентификации бактерий [200].
Устойчивость индикаторных культур B. coagulans и выделенных бактериофагов к высоким температурам определяли в диапазоне 57-90оС в течение 30 минут. Результаты исследований представлены в таблице 15.
Таблица 15 – Устойчивость индикаторных акультур B. coagulans и селекционированныха бактериофагов к воздействиюа высоких температур
| Название
исследуемого аагента |
Показатель атемпературы, оС | |||||||||||
| 57 | 60 | 63 | 66 | 69 | 72 | 75 | 78 | 81 | 84 | 87 | 90 | |
| Индикаторная культура | ||||||||||||
| B. coagulans 566 | + | + | + | + | + | + | + | + | + | + | + | + |
| B. coagulans 732 | + | + | + | + | + | + | + | + | + | + | + | + |
| B. coagulans 948 | + | + | + | + | + | + | + | + | + | + | + | + |
| B. coagulans 2770 | + | + | + | + | + | + | + | + | + | + | + | + |
| B. coagulans 3042 | + | + | + | + | + | + | + | + | + | + | + | + |
| B. coagulans 4521 | + | + | + | + | + | + | + | + | + | + | + | + |
| B. coagulans 6668 | + | + | + | + | + | + | + | + | + | + | + | + |
| B. coagulans 10268 | + | + | + | + | + | + | + | + | + | + | + | + |
| B. coagulans 10468 | + | + | + | + | + | + | + | + | + | + | + | + |
| B. coagulans 10473 | + | + | + | + | + | + | + | + | + | + | + | + |
| Бактериофаги | ||||||||||||
| Phagum B.c. 1 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| Phagum B.c. 2 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| Phagum B.c. 3 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| Phagum B.c. 4 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| Phagum B.c. 5 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| Phagum B.c. 6 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| Phagum B.c. 7 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| Phagum B.c. 8 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| Phagum B.c. 9 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| Phagum B.c. 10 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| Phagum B.c. 11 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| Phagum B.c. 12 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| Phagum B.c. 13 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
Примечание – «+» — положительный результат–наличие БОЕ на газоне индикатрной культуры;
«-» — отрицательный результат – отсутствие БОЕ на газоне индикатрной культуры.
В результате было установлено, что индикаторные культурыB. coagulans и селекционированные бактериофаги выдерживают воздействие высоких температур до 90оС, это указывает на то, что данный способ очистки фагов от бактериальной культуры не даст положительный результат.
Хлороформ(трихлорметан) является хорошим средством химического происхождения, который можно использовать для освобождения от жизнеспособных бактерий фаголизата. Связано это с тем, что в отличии от бактериальной клетки, бактериофаги обладают наибольшей устойчивостью к его воздействию. Чувствительность индикаторных штаммов бактериофагов определяли воздействием на них хлороформа (трихлорметана) в соотношении 1:10, при этом в течение 5-35 минут проводили постоянное встряхивании с 5-минутным интервалом.
Таблица 16 – Определение устойчивости аиндикаторных культур B. coagulans и селекционированных афагов к воздействию хлороформаа (трихлорметана)
| Название
исследуемого аагента |
Временной интервал воздействия трихлорметана, минут | ||||||
| 5 | 10 | 15 | 20 | 25 | 30 | 35 | |
| Индикаторная культура | |||||||
| B. coagulans 566 | + | — | — | — | — | — | — |
| B. coagulans 732 | + | — | — | — | — | — | — |
| B. coagulans 948 | + | — | — | — | — | — | — |
| B. coagulans 2770 | + | — | — | — | — | — | — |
| B. coagulans 3042 | + | — | — | — | — | — | — |
| B. coagulans 4521 | + | — | — | — | — | — | — |
| B. coagulans 6668 | + | — | — | — | — | — | — |
| B. coagulans 10268 | + | — | — | — | — | — | — |
| B. coagulans 10468 | + | — | — | — | — | — | — |
| B. coagulans 10473 | + | — | — | — | — | — | — |
| Бактериофаги | |||||||
| Phagum B.c. 1 УГСХА | — | — | — | — | — | — | — |
| Phagum B.c. 2 УГСХА | — | — | — | — | — | — | — |
| Phagum B.c. 3 УГСХА | + | + | + | — | — | — | — |
| Phagum B.c. 4 УГСХА | + | + | + | — | — | — | — |
| Phagum B.c. 5 УГСХА | + | + | + | — | — | — | — |
| Phagum B.c. 6 УГСХА | + | + | + | — | — | — | — |
| Phagum B.c. 7 УГСХА | + | + | + | — | — | — | — |
| Phagum B.c. 8 УГСХА | + | + | + | — | — | — | — |
| Phagum B.c. 9 УГСХА | + | + | + | — | — | — | — |
| Phagum B.c. 10 УГСХА | + | + | + | — | — | — | — |
| Phagum B.c. 11 УГСХА | + | + | + | — | — | — | — |
| Phagum B.c. 12 УГСХА | + | + | + | — | — | — | — |
| Phagum B.c. 13 УГСХА | + | + | + | — | — | — | — |
Примечание – «+» — положительный результат–наличие БОЕ на газоне индикатрной культуры;
«-» — отрицательный результат – отсутствие БОЕ на газоне индикатрной культуры.
В проведенных опытах установлено, что индикаторные культуры B. сoagulans выдерживают воздействие хлороформа (трихлорметана) только при пятиминутной экспозиции, фаги Phagum B.c. 1 УГСХА и Phagum B.c. 2 УГСХА оказались вообще не устойчивы к воздействию трихлорметана, а остальные фаги устойчивы к его воздействию при временной экспозиции 5-15 мин. Бактериофаги можно было быочищать таким способ, но из-за того, что на это уходит много материалов и времени, данный метод лучше заменить наиболее выгодным и быстрым.
Следующий способ очистки от бактериальных клеток осуществляли фильтрацией фагов B. coagulans мембранными фильтрами Millipore0,22 µm GV, после чего по методике Золотухина проводили их пассаж [197]. Установлено, что благодаря такому способу очистки бактериофаг становится прозрачным и затрачивается меньше времени на его обработку (рис. 26).
Проанализировав проведенные исследования, становится ясно, что для очистки фаголизатов от бактерий Bacillus coagulans, лучше использовать мембранные фильтры фирмы Millipore 0,22 µmGV, в связи с их быстрой постановкой и эффективным результатом, в отличие от применения материалоемких и трудоемких способов химического или физического типа [197].
Бактериофаг Phagum B.c. 11 УГСХА был отобран для конструирования экспериментального биопрепарата, в связи тем, что из всех выделенных фагов, он один обладал наибольшим спектром литического действия и характеризовался высоким титром литической активности.
Следующий этап исследований заключался в проведении опытов по изучению у бактериофага Phagum B.c. 11 УГСХА, укупоренного во флакон, изменения литической активности при хранении в течение 12 месяцев в условиях холодильника.Этот показатель имеет большую значимость при разработке биопрепарата и его технологических параметров, так как с момента наработки фага начинает исчисляться срок годности вплоть до его укупоривания в герметично закрытые флаконы.
Для постановки опыта использовали методику определения активности по классической схеме по Грациа методом агаровых слоев. Исследования обрабатывали статистическим методом, при этом троекратно проводили опыт для получения достоверных данных. Предварительно на мясопептонном бульоне выращивалииндикаторные штаммы Bacillus coagulans в течение 21±3 часов. Учет результатов проведенного опыта проводили через 21±3 часов культивирования при 35±2оС. Результаты исследований представлены в таблице 17.
Таблица 17 – Изменение литической аактивности фаговапри хранение
| Временной интервал | Бактериальная культура / название фага |
| Bacillus coagulans 10268 / Phagum B.c. 11 УГСХА | |
| Литическая активность, БОЕ/мл | |
| момент аукупоривания | 4,0+0,1×1010 |
| 3 месяца | 4,0+0,1×1010 |
| 6 месяцев | 6,0+0,1×109 |
Установлено, что у исследуемого бактериофага Phagum B.c. 11 УГСХА литическая активность в течение 3 месяцевоставалась без изменений4,0+0,1×1010 БОЕ/мл, спустя 6 месяцевпоказатель составил 6,0+0,1×109БОЕ/мл.
Было выяснено, что пассирование с помощью 7 пассажей бактериофага Phagum B.c. 11 УГСХА на штамме бактерии Bacillus coagulans 10268 с использованием метода агаровых слоев, восстанавливает на 1 порядоклитическую активность этого бактериофага.
2.2.1.4. Исследование взаимодействия фаг-хозяин и определение факторов, оказывающих влияние на данный процесс
Большое значение имеет при исследовании вирусов бактерий изучение специфичности начальных этапов взаимодействия фага с клеткой. В результате ферментно-субстратной связи происходит узнавание рецепторов клетки фагом. Специфичность бактериофагов в определенной мере условно зависит от химического строения рецепторов клетки и собственно строения самого фага. При этом для одних рецепторовнужнаболее сложная структура организации отростка фаговой частицы, для других менее сложная. Одна и та же клетка бактериальная может содержать рецепторы для нескольких фагов различных между собой, в свою очередь которые обладают способностью соединяться только с рецепторами, которые для конкретного фага являются определенными.
Используя метод, основанный на определение количества корпускул неадсорбированного фага в смеси бактерия-фаг, изучали адсорбцию выделенного и селекционированного бактериофага при взаимодействии его с культурой клетка-хозяина.
Экспоненциально растущую бактериальную клетку Bacillus coagulans 10268 мы смешивали с бактериофагом Phagum B.c. 11 УГСХА (множественность инфицирования (MOI) = 0,001) и выдерживали при комнатной температуре. Образцы (100 мкл) отбирали через 1, 2, 3, 4, 5, 10, 15, 20, 25, 30 мин, смешивали с 850 мкл SM-буфера и 50 мкл трихлорметана. Затем осуществляли центрифугирование, брали надосадочную жидкость и титровали для определения неадсорбированного или обратимо адсорбированногобактериофага через разные временные интервалы.
Количественно адсорбцию выражали константой скорости адсорбции (k), измеряемой в мл/мин. Для конкретной смеси (фаг + клетка-хозяина) в зависимости от процента максимальной ее адсорбции устанавливали время адсорбции фага (таб. 18).
Таблица 18–Результаты изучения скорости адсорбции фагаPhagum B.c. 11 УГСХАна клетке индикаторной культуры Bacillus coagulans 10268
| Название фага и микроорганизма | Время адсорбции максимального количества фага (мин) | Количество фага до адсорбции
(по показателю негативных колоний) M±m |
Количество неадсорбированного фага (по показателю бляшкообразующих единиц) M±m | Процент адсорбции (%) |
| Phagum B.c. 11 УГСХА / Bacillus coagulans 10268 | 5 | 40,0+0,1×109 | 22,3±1,1 | 44,4 |
| 6 | 32,1±0,9 | 20,0 | ||
| Константа скорости адсорбции К = 4,4 см 3/мин-1 | ||||
В результате проведенных исследований было установлено, что бактериофаг PhagumB.c. 11 УГСХА имел показатель скорости адсорбции (таб. 18): равный К = 4,4 см3/мин-1.
В предварительном опыте параллельного титрования эмбихина на фаге и на соответствующем бактериальном хозяине Phagum B.c. 11 УГСХА и Bacillus coagulans 10268 была установлена рабочая доза препарата, которая выражается количеством, способным за 5 минут в 0,9 мл физиологического раствора при 36±1оС инактивировать 90-95% фага при его исходной концентрации n х 1010 частиц в 1 мл. В результате проведенного эксперимента, мы определили, что рабочая доза эмбихина составляет 7γ, т.е. среднеезначение двух последних эффективных доз. Основной опыт проводили только после определения рабочей дозы. Результаты исследований отражены в таблицах 19, 20.
Таблица 19– Изучение латентного периода и урожайностибактериофага Phagum B.c. 11 УГСХА
| Время
начала опыта |
Число негативных колоний фага при высеве из 4-ой пробирки
M±m |
Число негативных колоний фага при высеве из 5-ой пробирки
M±m |
| 15 | 45,4±3,0 | |
| 17 | 47,3±2,7 | |
| 20 | 51,2±3,1 | |
| 25 | 54,6±2,2 | |
| 27 | 57,0±1,4 | 26,2±1,3 |
| 29 | Стерильное пятно | 27,1±1,1 |
| 30 | Сливной рост негативных колоний | 29,2±2,2 |
| 35 | Лизис | 30,5±1,2 |
| 40 | 32,4±0,6 | |
| 45 | 34,1±1,2 | |
| 50 | 37,4±0,7 | |
| 55 | 39,1±1,3 | |
| 60 | 40,3±2,2 |
Таблица 20 – Показатели урожайности, латентного периода и скорости адсорбции бактериофага Phagum B.c. 11 УГСХА
| Изучаемый показатель | Бактериофаг
PhagumB.c. 11 УГСХА |
| Средняя урожайность, вирусных частиц на микробную клетку | 71,7 |
| Латентный период, минут | 25 |
| Константа скорости адсорбции, см 3/мин-1 | 4,4 |
Установлено, что латентный период внутриклеточного развития Phagum B.c. 11 УГСХА и Bacillus coagulans 10268 равен 25-26 минут (таб. 19). На чашках Петри среднее количество негативных колоний при высеве с 15 по 25 минуту опыта из 4-ой пробирки составляет 51,1, а при высеве из пятой пробирки с 40 по 60 минуту равно 36,66. Средняя урожайность бактериофага PhagumB.c. 11 УГСХА равна 3666:51,1=71,7 вирусных частиц на одну микробную клетку Bacillus coagulans 10268.
2.2.2. Бактерии Bacillus pumilus и специфичные им бактериофаги
2.2.2.1 Выделение бактерий Bacillus pumilus и их идентификация
Первый этап исследований был связан с подбором питательной среды для первого блока исследований, посвященного изолированию бактериальных культур и возможной идентификации. В качестве селективной среды мы использовали Cereus Selective Agar (MYP-agar), позволяющая провести первичную селекцию выделенных бактерий по устойчивости к полимиксину и дифференцировать по манниту, так как «Bergey’s Manual of Systematics of Archaea and Bacteria» не указывает детального метода для выделения и идентификации представителей вида Bacillus pumilus [226]. Единственными рекомендациями для исследователей был временной фактор (24-72 часа) и температура культивирования (t = 37 0С) разведения взвеси почвы. Согласно литературным данным группа «Bacillus subtilis» включает 8 видов: B.subtilis, B. amiloliguefaciens, B. atrophaens, B. licheniformis, B. mojavensis, B. pumilus, B. sonorensis, B. vallismortis [226]. С учетом изучения биологических свойств Bacillus pumilus, указанных в вышеназванном справочнике, нами был произведен отбор тестов для идентификации бактерий на основании их групповой принадлежности (группа «Bacillus subtilis») и интерпретации результатов (для некоторых из рекомендуемых для рода Bacillusтестов не указаны результаты дифференциации).
Основная схема исследований представлена на рисунке 31. Согласно подобранным нами бактериологическим тестам можно идентифицировать бактерии Bacillus pumilus в течение десяти дней (рисунок 32-34). Особенностей при подготовке пробы к исследованиям не было: объект гомогенизировали (за исключением проб муки), далее навеску вносили в стерильный мясо-пептонный бульон в соотношении 1:10, посевы термостатировали (t = 36±1 0С) 20±4 часа. Проведенные нами эксперименты показали, что термостатирование в течение 48-72 часов проб почвы увеличивает время исследований, не повышая эффективность исследований. Этап подращивания необходим для активизации процесса вегетации споровых клеток. На плотной питательной среде бактерии эталонные штаммы Bacillus pumilus формировали морщинистые, неправильной формы колонии с неровными краями.
Основной объем исследований начинался с четвертого дня исследований и включал изучение биохимических свойств выделенной культуры в течение 6 последующих дней. Длительность исследований связана с учетом показателя желатиназной активности. Анализируя данные по исследованиям в области фитопатологии, одним из факторов, формирующих фитопатогенные свойства бактерий, является продукция тех ферментов, которые разрушают компоненты клеточной стенки растений [50, 77]. Поэтому при изучении физиолого-биохимическихсвойств бактерий Bacillus pumilus мы посчитали целесообразным использовать еще тесты, ориентированные на определение продукции пектат-лиаз, целлюлозолитической и липолитической активности. Вышеназванные показатели мы определяли для всех выделенных культур, независимо от группы объекта выделения.
Определение целлюлозолитической активности – посев выделенных культур «медальонами» на поверхность глюкозо-солевой среды с содержанием 0,2 % карбоксиметилцеллюлозы (КМЦ). Время культивирования посевов – 72-120 часов. По истечение времени инкубирования посевов на поверхность среды на 10 минут наносили 0,1 % водный раствор Конго красного. Далее краситель сливали, а чашки несколько раз промывают 8 % раствором NaCl с целью удаления Конго красного. О продукции целлюлаз свидетельствовали светлые зон вокруг колоний.
Изучение пектолитической активности: на поверхность агаризованной, содержащей ионы Ca2+, наслаивали 4,0 мл 1 % раствора полипектата натрия. После его полимеризации на поверхность образовавшегося геля «медальонами» засевали выделенные культуры. Продукция пептат-лиаз выделенными культурами визуально регистрировалась как разжижение полипектатного геля вокруг колоний бактерий через 72-96 часов культивирования.
С учетом рекомендаций «Bergey’s Manual of Systematics of Archaea and Bacteriа» (2015) [226], подвергая анализу следующие биологические характеристики выделенных штаммов бактерий:окраска по Граму, форма эндоспоры, подвижность и наличие пигмента, возможности роста в аэробных/анаэробных условиях, продукция каталазы, особенности биохимической активности и наличиефитопатогенных свойств, выделенные нами 74 штамма бактерии были отнесены к группе «Bacillus subtilis» и типированы как Bacillus pumilus.Экспериментально нами было установлено, что все выделенные культуры практически не отличаются друг от друга по большинству анализируемых показателей (таблица 21).Однако, те штаммы, которые были изолированы из объектов первой и второй группы (зерномучной и плодоовощной продукции) и проявляли повышенную целлюлозолитическую активность, в отличие от части бактерий, изолированных из проб почвы.
Продукция пектат-лиаз установлена нами у всех выделенных нами штаммов Bacillus pumilus. Необходимо также отметить, что пектолитическая активность у изолированных штаммов явно регистрировалась только через 72-96 часов в виде ореолов вокруг колоний бактерий.
Анализ воздействия неблагоприятных факторовна выделенные бактерии показал, что все изолированные штаммы проявляли способность к росту на МПА, содержащем 10 % р-р NaClи при понижении температуры культивирования (зафиксирован рост при t +10 °С).
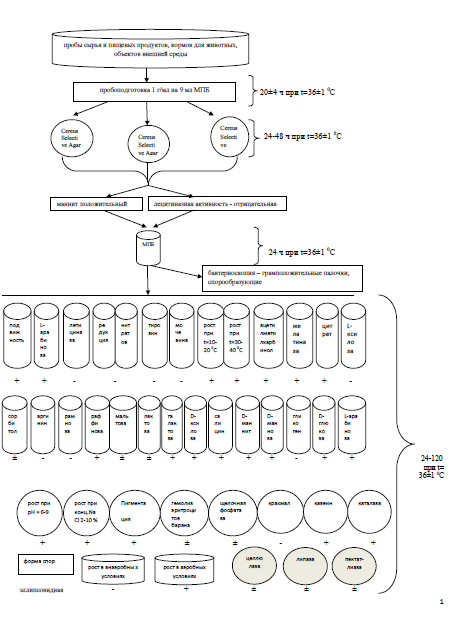
Рисунок 31 – Разработанная схема выделения и идентификации бактерий Bacillus pumilus, основанная изучении бактериологических характеристик
Определение липолитической активности проводили на МПА, обогащенных маслами. Об активности фермента судили по наличию зоны просветления вокруг колонии бактерий.
Таблица 21– Сводная таблица с информацией об основных свойствах бактерий Bacillus pumilus (по литературным данным [226] и результаты собственных исследований)
| Характеристика | Данныеобосновныхсвойствахбактерийпо«Bergey’sManualofSystematicsofArchaeaandBacteria» | Результаты исследований 74 штаммов, выделенных в экспериментах | ||||
| B.subtilis | B.pumilus | + | — | ± | ||
| пигментация | + | — | 4 | 70 | ||
| подвижность | + | + | 74 | |||
| диаметр клетки > 1 мкм | — | — | 74 | |||
| окраска по Граму | Гр+ | Гр+ | Гр+ | |||
| форма спор
эллипсовидная цилиндрическая |
+
+ |
+
+ |
эллипсовидная
цилиндрическая |
|||
| каталаза | + | + | 74 | |||
| рост в анаэробных условиях | — | — | 74 | |||
| рост в аэробных условиях | + | + | 74 | |||
| Кислота из | ||||||
| L-арабинозы | + | + | 74 | |||
| D-глюкозы | + | + | 74 | |||
| гликогена | + | — | 74 | |||
| D-маннита | + | + | 74 | |||
| D-маннозы | + | + | 74 | |||
| салицина | + | + | 74 | |||
| D-ксилозы | + | + | 74 | |||
| галактозы | d | + | 74 | |||
| лактозы | d | d | 63 | 4 | 7 | |
| мальтозы | + | d | 57 | 6 | 11 | |
| раффинозы | + | + | 74 | |||
| рамнозы | — | — | 74 | |||
| сорбитола | + | d | 54 | 8 | 12 | |
| L-ксилозы | — | — | 74 | |||
| Гидролиз | ||||||
| казеина | казеина | казеина | казеина | казеина | казеина | |
| крахмала | крахмала | крахмала | крахмала | крахмала | крахмала | |
| тирозина | тирозина | тирозина | тирозина | тирозина | тирозина | |
| мочевины | мочевины | мочевины | мочевины | мочевины | мочевины | |
Продолжение таблицы 21
| Иные биохимические свойства | |||||
| утилизация цитрата | + | + | 74 | ||
| гемолитическая активность | 12 | 36 | 26 | ||
| желатиназная активность | + | + | 74 | ||
| лецитиназная активность | — | — | 74 | ||
| щелочная фосфатаза | 31 | 20 | 23 | ||
| ацетил-метилкарбинол | + | + | 74 | ||
| аргининдегидролаза | — | — | 74 | ||
| редукция нитратов до нитритов | + | — | 74 | ||
| пектолитичес
кая активность |
59 | 9 | 16 | ||
| липолитичес
кая активность |
74 | ||||
| целлюлозолитическая активность | 52 | 22 | |||
| Рост на МПА в присутствии NaCl | |||||
| 2 % | + | + | 74 | ||
| 5 % | + | + | 74 | ||
| 7 % | + | + | 74 | ||
| 10 % | d | + | 74 | ||
| Рост на МПА при рН | |||||
| 6,0 | + | + | 74 | ||
| 7,0 | + | + | 74 | ||
| 8,0 | + | + | 74 | ||
| 9,0 | + | 74 | |||
| Рост при температуре культивирования | |||||
| 100С | d | + | 74 | ||
| 200С | + | + | 74 | ||
| 300С | + | + | 74 | ||
| 400С | + | + | 74 | ||
Примечание – «+» — положительный результат, «-» — отрицательный результат,
«d» — вариабельный результат, « » — данные отсутствуют.

Рисунок 32 –Рост бактерий рода Bacillus на мясо-пептонном бульоне

Рисунок 33 – Изучение способности утилизировать цитрат выделенными бактериями рода Bacillus

Рисунок 34 –Изучение выделения кислоты D-глюкозы выделенными бактериями рода Bacillus
Полученные результаты исследований по изучению биологических свойств выделенных нами бактерий в основном не критично расходятся с паспортными данными эталонного штамма Bacillus pumilus 66, учитывая полиморфизм биохимических свойств бактерий рода Bacillus.
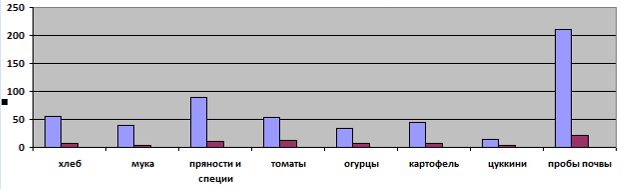
Рисунок 35 – Результаты исследований по изучению ареала распространения бактерий Bacillus pumilus
Таблица 22 –Ареал распространения изолированных штаммов бактерий Bacilluspumilus
| №
п/п |
объекты выделения | количество | % | |
| исследованных образцов | штаммов бактерий идентифицированных как Bacillus pumilus | |||
| группа I | ||||
| 1 | хлеб из пшеничной муки | 55 | 8 | 14,5 |
| 2 | мука пшеничная | 40 | 4 | 10,0 |
| итого по группе | 95 | 12 | 12,6 | |
| группа II | ||||
| 1 | пряности и специи | 90 | 10 | 11,1 |
| 2 | томаты | 54 | 12 | 22,2 |
| 3 | огурцы | 34 | 8 | 23,5 |
| 4 | картофель | 44 | 7 | 15,9 |
| 5 | цуккини | 15 | 3 | 20,0 |
| итого по группе | 237 | 40 | 16,8 | |
| группа III | ||||
| 1 | пробы почвы | 210 | 22 | 10,5 |
| Итого: | 542 | 74 | 13,7 | |
Из 542 проб объектов ветеринарно-санитарного надзора и окружающей среды было выделено 74 штамма, которые были отнесены виду Bacilluspumilus.Результаты исследований представлены в таблице 2 и графически изображены на рисунке 35.
Полученные нами данные не расходятся со сведениями других авторов [236-238]. Сформированная коллекция полевых штаммов бактерий Bacillus pumilus лиофилизирована и в дальнейшем была использована в качестве панели индикаторных штаммов при выделении специфических бактериофагов. В результате проведенных исследований установлено, что из 542 проб было изолировано 74 культуры, которые были типированы как Bacillus pumilus. Основу бактериологической схемы выделения и идентификации составили рекомендации «Bergey’s Manual of Systematics of Archaea and Bacteriа» (2015) [226]. Установлено, что изоляты бактерии Bacillus pumilus представляют относительно однородную группу по фенотипу. Однако отмечено, что целлюлолитическая активность фиксировалась у штаммов, выделенных из первой и второй групп проб (зерномучные товары) и (плодоовощные товары), но отсутствовала у 22 почвенных изолятов, выделенных из третьей группы проб. Совокупный процент контаминации 542 объектов исследований, зарегистрированный нами, составил 13,7 %, из них процент обсеменения зерномучных товаров – 12,6 %, плодоовощных товаров – 16,8 % и проб почвы – 10,5 %. При идентификации бактерий рода Bacillus и Вacillus pumilus, в частности, необходимо уделять особое внимание ферментативной активности гидролаз и характеристике целлюлозолитической активности, продукции пектат-лиаз и липаз, что позволит проводить условную дифференциацию штаммов, вызывающих бактериозы растений от почвенных сапрофитов, вызывающих патологии теплокровных.
2.2.2.2. Выделение, селекция бактериофагов Вacillus pumilus и изучение их биологических свойств
Следующим этапом наших исследований было выделение фагов бактерий Вacillus pumilus. В первой серии опытов использовали методику, предложенную С. Лурия, Д. Дарнеллом (1970) в модификации А.Г. Шестакова (2009), для выделения бактериофагов Вacillus pumilus из бактерий без воздействия на них индуцирующего фактора. При изучении явления бактериофагии исследователи обратили внимание на то, что иногда встречаются культуры микроорганизмов, которые содержат фаги, хотя на эти культуры фагами и не воздействовали. Явление фагоносительства получило название лизогении.Оно было описано одним из основоположников учения о бактериофагах — Д’Эреллем, который считал, что такие культуры загрязняются фагом извне [201].
В результате проведенных исследований на каждом из имеющихся 74 штаммов Вacillus pumilus было установлено, что выделение бактериофагов из культур бактерий, без воздействия на них индуцирующего фактора не приводило к проявлению свободного фага. Мы пытались бациллярную клетку экспериментально сделать лизогенной. Такой эксперимент помог бы нам выяснить механизмы процесса, благодаря которому клетка становится лизогенной.
Известно, что при воздействии на клетку умеренным фагом часть популяции клеток лизируется, а другая часть становится лизогенной. При этом фаг адсорбируется клеткой, и его нуклеиновая кислота проникает внутрь клетки. Однако, в отличие от продуктивной инфекции, вызываемой вирулентным фагом, при лизогенизадии нуклеиновая кислота фага связывается с ядерным аппаратом клетки (хромосомой) и остается в ней в виде профага [195].
Образование лизогенными культурами зрелых частиц фага получило название спонтанной индукции. Количество лизируемых клеток и количество образовавшихся зрелых частиц фага зависят от особенностей данной культуры и условий выращивания. В то же время количество клеток, освобождающих фаги, может быть резко увеличено при воздействии на лизогенную культуру некоторыми физическими и химическими факторами, получившими название индуцирующих. При индукции некоторых лизогенных культур удавалось вызывать образование зрелых частиц фага почти у всех клеток. К индуцирующим агентам относятся ультрафиолетовые (УФ), рентгеновские и гамма-излучения, перекиси, азотистый иприт и его гомологи, этиленимин, урацил, многие антибиотики. Наиболее эффективные и широко применяемые индуцирующие факторы — УФ-лучи и антибиотик митомицин С [200].
Во второй серии опытов на культуры Вacillus pumilus, исследуемые как «лизогенные», мы воздействовали индуцирующим фактором. Хотя лизогения широко распространена среди всех систематических групп микроорганизмов, нам не удалось выявить профаг у исследуемых культур Вacillus pumilus.Не исключено, что явление лизогении является одним из механизмов защиты бактериальной клетки от фаговой инфекции, выработанным клеткой в процессе длительной эволюции. Лизогенизация в известной степени биологически выгодна, как клетке, так и фагу. Клетка при лизогенизации становится устойчивой не только к данному фагу, но и к родственным ему фагам и, кроме того, приобретает дополнительные свойства.
В наших исследованиях не удалось выделить фаги бактерий Вacillus pumilus, то есть мы не обнаружили перехода профага в свободный фаг у имеющихся штаммов бацилл по вышеизложенным методикам, поэтому дальнейшие исследования были посвящены выделению бактериофагов изобъектов внешней среды. По литературным данным, наиболее эффективно в качестве источника выделения бактерий рода Bacillus, использовать пробы почвы, так как они являются почвенными сапрофитами [189, 227].
При исследовании 88 проб почвы различного хозяйственного назначения двух областей Приволжского федерального округа, нам удалось выделить 22 изолята фагов бактерий Bacillus pumilus. Результаты исследований представлены в таблице 23. Изоляты фагов на газоне индикаторной культуры образовывали зону лизиса (рисунок 36), с которой делался смыв стерильным МПБ, далее он центрифугировался и использовался в качестве маточного фага для первого пассажа.
Селекцию фагов проводили десятикратным пассированием изолированных негативных колоний на мясо-пептонном агаре с перевиванием на мясо-пептонный бульон, подбирая визаульно время пассажа. Также осуществляли подбор количественных соотношений фаг: культура. Результаты представлены в таблице 23.
Очистка фагов Вacillus pumilus от бактериальных клеток осуществлялась нами методом фильтрации с использованием мембранных фильтров (filtertype: 0, 45 и 0,22 µm GV).Изучение устойчивости индикаторных культур Вacillus pumilus и селекционированных бактериофагов к воздействию температуры в диапазоне от +57 до +90 0С в течение 30 минути трихлорметана в соотношении 1:10 в течение 5-35 минут показало, что все изучаемые изоляты фагов устойчивы к воздействию температурного фактора и имеют различную степень устойчивости к трихлорметану (таблицы 24 и 25). Таким образом, только мембранная фильтрация может быть использована как универсальный метод для инактивации индикаторной культуры при наработке бактериофагов. После проведения десятикратной серии пассажей каждого из 22 фаголизатов на индикаторной культуре, мы укупоривали их в стерильные флаконы и хранили при низкой температуре (4-6 °С) без введения консервантов.
Морфология бяшкообразующих единиц изолятов фагов представлена в таблице 26 и на рисунках 37-39.
Важнейшей характеристикой фага, входящего в состав биопрепарата, является его специфичность в пределах вида. Полученные результаты (таблица 28) свидетельствуют, что выделенные и селекционированные нами бактериофаги,строго специфичны в пределах вида Bacillus pumilus и могут быть компонентами биопрепарата.
Таблица 23 — Подбор количественных соотношений выделенных фагов и
индикаторных культур и технологические параметры их культивирования
| № | Название фага / индикаторная бактериальная культура | Технологические параметры культивирования | Оптимальное количественное соотношение выделенного бактериофага и 18±2 часовой индикаторной культуры при концентрации микробных клеток равной nх108(КОЕ/мл) | |
| временной интервал, ч | температурный режим, 0С | |||
| 1 | Bacillus pumilus 1/ FBm– 1 УГСХА | 6,0 | 36±1 | 0,2 мл / 0,2 мл |
| 2 | Bacillus pumilus 6/ FBm– 2 УГСХА | 6,5 | 36±1 | 0,3 мл / 0,3 мл |
| 3 | Bacillus pumilus 66/ FBm – 3 УГСХА | 6,0 | 36±1 | 0,2 мл / 0,2 мл |
| 4 | Bacillus pumilus 66/ FBm– 4 УГСХА | 6,0 | 36±1 | 0,2 мл / 0,3 мл |
| 5 | Bacillus pumilus 5/ FBm– 5 УГСХА | 6,0 | 36±1 | 0,2 мл / 0,2 мл |
| 6 | Bacillus pumilus 44/ FBm– 6 УГСХА | 6,0 | 36±1 | 0,2 мл / 0,2 мл |
| 7 | Bacillus pumilus 7/ FBm– 7 УГСХА | 6,5 | 36±1 | 0,3 мл / 0,2 мл |
| 8 | Bacillus pumilus 2/ FBm– 8 УГСХА | 6,0 | 36±1 | 0,2 мл / 0,2 мл |
| 9 | Bacillus pumilus 9/ FBm– 9 УГСХА | 6,0 | 36±1 | 0,3 мл / 0,3 мл |
| 10 | Bacillus pumilus 66/ FBm– 10 УГСХА | 6,0 | 36±1 | 0,2 мл / 0,2 мл |
| 11 | Bacillus pumilus 44/ FBm– 11 УГСХА | 6,0 | 36±1 | 0,4 мл / 0,2 мл |
| 12 | Bacillus pumilus 12/ FBm– 12 УГСХА | 6,5 | 36±1 | 0,3 мл / 0,2 мл |
| 13 | Bacillus pumilus 13/ FBm– 13 УГСХА | 6,0 | 36±1 | 0,2 мл / 0,2 мл |
| 14 | Bacillus pumilus 3/ FBm– 14 УГСХА | 6,0 | 36±1 | 0,4 мл / 0,3 мл |
| 15 | Bacillus pumilus 15/ FBm– 15 УГСХА | 6,0 | 36±1 | 0,2 мл / 0,2 мл |
| 16 | Bacillus pumilus 6/ FBm– 16 УГСХА | 6,0 | 36±1 | 0,3 мл / 0,3 мл |
| 17 | Bacillus pumilus 17/ Bm– 17 УГСХА | 6,5 | 36±1 | 0,2 мл / 0,2 мл |
| 18 | Bacillus pumilus 4/ FBm–18УГСХА | 6,0 | 36±1 | 0,2 мл / 0,2 мл |
Продолжение таблицы 23
| 19 | Bacillus pumilus 9/ FBm– 19 УГСХА | 6,0 | 36±1 | 0,2 мл / 0,2 мл |
| 20 | Bacillus pumilus 20/ FBm– 20 УГСХА | 6,0 | 36±1 | 0,2 мл / 0,3 мл |
| 21 | Bacillus pumilus 66/ FBm– 66УГСХА | 6,0 | 36±1 | 0,2 мл / 0,2 мл |
| 22 | Bacillus pumilus 44/ FBm – 44 УГСХА | 6,5 | 36±1 | 0,3 мл / 0,2 мл |
Таблица 24 – Устойчивость индикаторных акультур Вacillus pumilus и селекционированныха бактериофагов к воздействиюа высоких температур
| Название
исследуемого аагента |
Показатель атемпературы, оС | |||||||||||
| 57 | 60 | 63 | 66 | 69 | 72 | 75 | 78 | 81 | 84 | 87 | 90 | |
| Индикаторные культуры | ||||||||||||
| Bacilluspumilus 66 | + | + | + | + | + | + | + | + | + | + | + | + |
| Bacilluspumilus (полевые штаммы в количестве 73 культуры) | + | + | + | + | + | + | + | + | + | + | + | + |
| Бактериофаги | ||||||||||||
| FBm– 1 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBm– 2 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBm – 3 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBm– 4 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBm– 5 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBm– 6 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBm– 7 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBm– 8 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBm– 9 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBm– 10 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBm– 11 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBm– 12 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBm– 13 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBm– 14 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBm– 15 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBm– 16 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| Bm– 17 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBm–18УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBm– 19 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBm– 20 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBm– 66УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBm – 44УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
Примечание – «+» — положительный результат–наличие БОЕ на газоне индикатрной культуры; «-» — отрицательный результат – отсутствие БОЕ на газоне индикатрной культуры.
Таблица 25 – Определение устойчивости аиндикаторных культур Вacillus pumilus и селекционированных афагов к воздействию хлороформаа (трихлорметана)
| Название
исследуемого аагента |
Временной интервал воздействия трихлорметана, минут | ||||||
| 5 | 10 | 15 | 20 | 25 | 30 | 35 | |
| Индикаторная культура | |||||||
| Bacillus pumilus 66 | + | + | — | — | — | — | — |
| Bacillus pumilus (полевые штаммы в количестве 73 культуры) | + | + | — | — | — | — | — |
| Бактериофаги | |||||||
| FBm– 1 УГСХА | + | + | + | + | — | — | — |
| FBm– 2 УГСХА | + | + | + | + | — | — | — |
| FBm – 3 УГСХА | + | + | + | — | — | — | — |
| FBm– 4 УГСХА | + | + | + | + | + | — | — |
| FBm– 5 УГСХА | + | + | + | — | — | — | — |
| FBm– 6 УГСХА | + | + | + | + | — | — | — |
| FBm– 7 УГСХА | + | + | + | + | — | — | — |
| FBm– 8 УГСХА | + | + | + | + | + | — | — |
| FBm– 9 УГСХА | + | + | + | + | + | — | — |
| FBm– 10 УГСХА | + | + | + | + | + | — | — |
| FBm– 11 УГСХА | + | + | + | + | + | — | — |
| FBm– 12 УГСХА | + | + | + | + | + | — | — |
| FBm– 13 УГСХА | + | + | + | — | — | — | — |
| FBm– 14 УГСХА | + | + | + | — | — | — | — |
| FBm– 15 УГСХА | + | + | + | + | + | — | — |
| FBm– 16 УГСХА | + | + | + | + | — | — | — |
| Bm– 17 УГСХА | + | + | + | + | + | — | — |
| FBm–18УГСХА | + | + | + | + | + | — | — |
| FBm– 19 УГСХА | + | + | + | + | — | — | — |
| FBm– 20 УГСХА | + | + | + | + | + | — | — |
| FBm– 66УГСХА | + | + | + | + | + | — | — |
| FBm – 44УГСХА | + | + | + | + | + | — | — |
Примечание – «+» — положительный результат–наличие БОЕ на газоне индикатрной культуры;
«-» — отрицательный результат – отсутствие БОЕ на газоне индикатрной культуры.
Таблица 26– Характеристика выделенных фагов бактерий Bacillus pumilus
| № п/п | Описание морфология бляшкообразующих единиц | Название бактериофага |
| 1 тип | Прозрачные негативные колонии округлой формы1,5 ±0,5 мм в диаметре | FBm– 1 УГСХАFBm– 4 УГСХА
FBm– 6 УГСХАFBm– 9 УГСХА FBm– 10 УГСХАFBm– 11 УГСХА FBm– 13 УГСХАFBm– 15 УГСХА FBm– 17 УГСХАFBm– 18 УГСХА FBm– 19 УГСХАFBm– 66 УГСХА |
| 2 тип | Прозрачные негативные колонии округлой формы 2,0±1,0 мм в диаметре | FBm– 2 УГСХАFBm– 3 УГСХА
FBm– 5 УГСХАFBm– 8 УГСХА FBm– 12 УГСХАFBm– 14 УГСХА FBm– 16 УГСХАFBm– 20 УГСХА FBm– 44 УГСХА |
Рисунок 36 – Зона лизиса на газоне культуры Bacillus pumilus
Рисунок 37 — Морфология негативных колоний фага FBm-3 УГСХА
Рисунок 38 — Морфология негативных колоний фага FBm-19 УГСХА

Рисунок 39 – Зона лизиса культуры Bacillus pumilus 66 при взаимодействии с фагомFBm-3 УГСХА

Рисунок 40 — Зона лизиса культуры Bacillus pumilus 7 при взаимодействии с фагомBm-3 УГСХА
Литическую активность выделенных бактериофагов оценивали по их способности вызывать лизис бактериальной культуры на плотной питательной среде методом агаровых слоев. Эталонные культуры бактерий Bacillus pumilus выращивали на мясо-пептонном бульоне в течение 18 часов.
Учет результатов проводили через 18 часов инкубирования посевов в термостате при 36±1 °С, используя формулу:
Х = Y х N, (1)
где Y – количество негативных колоний фага, выросших на чашке Петри,
N – фактор разведения.
Результаты проведенных исследований, представленные в таблице 27, свидетельствуют о том, что выделенные бактериофаги Bacillus pumilus обладали различной активностью. Ее показатели были выявлены в диапазоне от (1,0±0,1)х106 до (4,0±0,3)х109БОЕ/мл. Наиболее высокой активностью обладал фагFBm–8 УГСХА –(4,0±0,3)х109БОЕ/мл.
Важной характеристикой выделенных фагов Bacillus pumilus является диапазон их действия на штаммы бактерий в пределах вида. Для изучения спектра литического действия селекционированных фагов использовали 74 штамма бактерий Bacillus pumilus, выделенных нами их проб пищевого сырья и продуктов питания и полученных из музея НИИЦМБ ФГБОУ ВО Ульяновский ГАУ. Исследования проводили методом нанесения фага на газон бактериальной культуры методом «стекающая капля» (рисунок 40). Экспериментальным путем установлено, что изучаемые специфичные бактериофаги имеют различный диапазон действия по отношению к 74 изучаемым штаммам Bacillus pumilus. Опыты демонстрируют, что наиболее широким спектром литического действия по отношению к изучаемым культурам обладаетизолят фага FBm–8 УГСХА, совокупный процент лизиса составил 89,2 % (таблица 28).
Таблица 27– Литическая активность бактериофагов Bacillus pumilus
| №
п/п |
Название бактериофага | Литическая активность (титр) | |
| титрование в МПБ, степень разведения | метод диффузии в мягком слое двуслойного МПА, БОЕ/мл | ||
| 1 | FBm– 1 УГСХА | 10-7 | (1,8±0,2)х108 |
| 2 | FBm– 2 УГСХА | 10-6 | (2,6±1,1)х107 |
| 3 | FBm – 3 УГСХА | 10-8 | (1,5±0,1)х109 |
| 4 | FBm– 4 УГСХА | 10-7 | (1,0±0,4)х106 |
| 5 | FBm– 5 УГСХА | 10-7 | (3,2±1,2)х108 |
| 6 | FBm– 6 УГСХА | 10-7 | (4,9±0,3)х108 |
| 7 | FBm– 7 УГСХА | 10-7 | (8,1±0,7)х108 |
| 8 | FBm– 8 УГСХА | 10-8 | (4,0±0,3)х109 |
| 9 | FBm– 9 УГСХА | 10-5 | (6,8±0,5)х106 |
| 10 | FBm– 10 УГСХА | 10-6 | (9,0±1,5)х107 |
| 11 | FBm– 11 УГСХА | 10-7 | (4,6±1,0)х108 |
| 12 | FBm– 12 УГСХА | 10-7 | (3,5±0,9)х108 |
| 13 | FBm– 13 УГСХА | 10-8 | (4,2±1,1)х109 |
| 14 | FBm– 14 УГСХА | 10-8 | (9,4±0,5)х109 |
| 15 | FBm– 15 УГСХА | 10-8 | (5,3±0,6)х109 |
| 16 | FBm– 16 УГСХА | 10-6 | (3,2±0,8)х107 |
| 17 | Bm– 17 УГСХА | 10-8 | (1,2±0,1)х109 |
| 18 | FBm–18УГСХА | 10-9 | (7,5±0,7)х107 |
| 19 | FBm– 19 УГСХА | 10-5 | (4,2±1,3)х106 |
| 20 | FBm– 20 УГСХА | 10-7 | (5,4±1,1)х108 |
| 21 | FBm– 66УГСХА | 10-7 | (3,2±0,5)х108 |
| 22 | FBm – 44УГСХА | 10-8 | (2,8±0,2)х109 |
Для конструирования биопрепарата намвыбран бактериофаг FBm–8 серии УГСХА, которыйхарактеризовалсявысоким титром литической активности и максимально широким спектром литического действия.
Последующие эксперименты были направлены на изучение изменения литической активности укупоренногово флаконы бактериофага FBm–8 серии УГСХА, хранящегося в условиях холодильника в течение 12 месяцев.
Так как для разработки технологических параметров изготовления биопрепарата на основе фагаFBm–8 серии УГСХА это необходимо, потому что хрок годности биопрепарат начинает исчисляться с момента наработки фага и его укупоривания в герметично закрытые флаконы.
Таблица 28– Результаты изучения специфичности бактериофагов Bacillus pumilus
| №
п/п |
Бактериофаги | Виды бактерий | Процент лизированных культур | ||||||||||
| Bacillus pumilus | Bacillus megaterium | Bacilluscereus | Bacillus mycoides | Bacillus anthracis | Bacillus subtilis | Bacillus thuringiensis | Paenibacillus polimixa | Paenibacillus larvae | Listeria monocytogenes | Listeria ivanovii | |||
| Кол-во испытан-
ных штаммов |
74 | 8 | 106 | 12 | 11 | 56 | 3 | 2 | 2 | 55 | 2 | ||
| FBm– 1 УГСХА | +/34 | – | – | – | – | – | – | – | – | – | – | 45,9 | |
| FBm– 2 УГСХА | +/57 | – | – | – | – | – | – | – | – | – | – | 77,1 | |
| FBm – 3 УГСХА | +/23 | – | – | – | – | – | – | – | – | – | – | 31,1 | |
| FBm– 4 УГСХА | +/19 | – | – | – | – | – | – | – | – | – | – | 25,7 | |
| FBm– 5 УГСХА | +/47 | – | – | – | – | – | – | – | – | – | – | 63,5 | |
| FBm– 6 УГСХА | +/51 | – | – | – | – | – | – | – | – | – | – | 68,9 | |
| FBm– 7 УГСХА | +/12 | – | – | – | – | – | – | – | – | – | – | 16,2 | |
| FBm– 8 УГСХА | +/66 | – | – | – | – | – | – | – | – | – | – | 89,2 | |
| FBm– 9 УГСХА | +/31 | – | – | – | – | – | – | – | – | – | – | 41,9 | |
| FBm– 10 УГСХА | +/44 | – | – | – | – | – | – | – | – | – | – | 59,5 | |
| FBm– 11 УГСХА | +/21 | – | – | – | – | – | – | – | – | – | – | 28,4 | |
| FBm– 12 УГСХА | +/15 | – | – | – | – | – | – | – | – | – | – | 20,3 | |
| FBm– 13 УГСХА | +/48 | – | – | – | – | – | – | – | – | – | – | 64,9 | |
| FBm– 14 УГСХА | +/53 | – | – | – | – | – | – | – | – | – | – | 71,6 | |
| FBm– 15 УГСХА | +/60 | – | – | – | – | – | – | – | – | – | – | 81,1 | |
| FBm– 16 УГСХА | +/27 | – | – | – | – | – | – | – | – | – | – | 36,5 | |
| Bm– 17 УГСХА | +/33 | – | – | – | – | – | – | – | – | – | – | 44,6 | |
| FBm–18УГСХА | +/39 | – | – | – | – | – | – | – | – | – | – | 52,7 | |
| FBm– 19 УГСХА | +/52 | – | – | – | – | – | – | – | – | – | – | 70,3 | |
| FBm– 20 УГСХА | +/17 | – | – | – | – | – | – | – | – | – | – | 22,9 | |
| FBm– 66УГСХА | +/34 | – | – | – | – | – | – | – | – | – | – | 45,9 | |
| FBm – 44УГСХА | +/49 | – | – | – | – | – | – | – | – | – | – | 66,2 | |
Показатель литической активности фагов при хранении определяется по классической методике определения активности методом агаровых слоев по Грациа. Результаты исследований представлены в таблице 29. Опытным путем установлено, что в течение 3 месяцев показатель литической активности исследуемого бактериофага FBm–8 УГСХА оставался без изменений, (4,0±0,3)х109БОЕ/мл. Через 6 месяцев литическая активность снижалась и составила (1,9±0,4)х108, через 9 месяцев – (1,1±0,2)х108 БОЕ/мл.
Экспериментально установлено, что пассирование бактериофага на исходном штамме бактерий Bacillus pumilus 2 в течение 7 пассажей методом агаровых слоев восстанавливает литическую активность на 1 порядок.
Таблица 29 – Изменение литической активности фагаFВm-8 серии УГСХА
при хранении
| Бактериальная культура
Bacillus pumilus/ название фага |
Временной интервал | Литическая активность, БОЕ/мл |
| Bacillus pumilus 2/ FBm– 8
УГСХА |
момент укупоривания | (4,0±0,3)х109 |
| 3 месяца | (4,0±0,3)х109 | |
| 6 месяцев | (1,9±0,4)х108 | |
| 9 месяцев | (1,1±0,2)х108 |
Изменение литической активности фага FBm–8 серии УГСХА в диапазоне 108-109не является притическим при конструировании биопрепарата и не отразится на его способности лизировать культуры Bacillus pumilus плодоовощной продукции при проведении исследований.
2.2.2.3. Изучение взаимодействия фаг-хозяин для FBm– 8 УГСХА – Bacillus pumilus 2 и определение факторов, казывающих влияние на данный процесс
Экспоненциально растущую бактериальную клетку Bacillus pumilus 2 мы смешивали с бактериофагом FBm–8 серии УГСХА (множественность инфицирования (MOI) = 0,001) и выдерживали при комнатной температуре. Образцы (100 мкл) отбирали через 1, 2, 3, 4, 5, 10, 15, 20, 25, 30 мин, смешивали с 850 мкл SM-буфера и 50 мкл трихлорметана. Затем осуществляли центрифугирование, брали надосадочную жидкость и титровали для определения неадсорбированного или обратимо адсорбированногобактериофага через разные временные интервалы.
Количественно адсорбцию выражали константой скорости адсорбции (k), измеряемой в мл/мин. Для конкретной смеси (фаг + клетка-хозяина) в зависимости от процента максимальной ее адсорбции устанавливали время адсорбции фага (таблица 30).
Таблица 30–Результаты изучения скорости адсорбции фагаFBm–8 серии УГСХА на клетке индикаторной культуры Bacillus pumilus 2
| Название фага и микроорганизма | Время адсорбции максимального количества фага (мин) | Количество фага до адсорбции
(по показателю негативных колоний) M±m |
Количество неадсорбированного фага (по показателю бляшкообразующих единиц) M±m | Процент адсорбции (%) |
| FBm– 8
УГСХА/ Bacillus pumilus 2 |
5 | 40±3 | 19,2±0,7 | 48,0 |
| 6 | 28,1±0,5 | 70,3 | ||
| Константа скорости адсорбции К = 4,2 см 3/мин-1 | ||||
В результате проведенных исследований было установлено, что бактериофаг FBm–8 серии УГСХАимел показатель скорости адсорбции равный К = 4,2 см3/мин-1.
В предварительном опыте параллельного титрования эмбихина на фаге и соответствующем бактериальном хозяине (FBm – 8 УГСХА – Bacillus pumilus 2) была установлена рабочая доза препарата, которая выражается количеством, способным за 5 минут в 0,9 мл физиологического раствора при 36±1оС инактивировать 90-95% фага при его исходной n х 109 БОЕ/мл. В результате проведенного эксперимента, мы определили, что рабочая доза эмбихина составляет 7γ, т.е. среднеезначение двух последних эффективных доз. Основной опыт проводили только после определения рабочей дозы. Результаты исследований отражены в таблицах 31-32.
Таблица 31– Изучение латентного периода и урожайности бактериофага FBm–8 серии УГСХА
| Время
начала опыта |
Число негативных колоний фага при высеве из 4-ой пробирки
M±m |
Число негативных колоний фага при высеве из 5-ой пробирки
M±m |
| 15 | 25,5±2,0 | |
| 17 | 27,4±1,7 | |
| 20 | 31,3±2,1 | |
| 25 | 34,7±3,2 | |
| 27 | 40,0±3,0 | 3,9±0,3 |
| 29 | Стерильное пятно | 4,1±0,4 |
| 30 | Сливной рост негативных колоний | 5,2±0,2 |
| 35 | Лизис | 5,5±0,3 |
| 40 | 6,4±0,6 | |
| 45 | 6,9±0,2 | |
| 50 | 7,4±0,4 | |
| 55 | 9,1±0,3 | |
| 60 | 10,3±0,2 |
Таблица 32 – Показатели урожайности, латентного периода и скорости адсорбции бактериофага FBm–8 серии УГСХА
| Изучаемый показатель | Бактериофаг
FBm–8 серии УГСХА |
| Средняя урожайность, вирусных частиц на микробную клетку | 21,9 |
| Латентный период, минут | 25 |
| Константа скорости адсорбции, см 3/мин-1 | 4,2 |
Установлено, что латентный период внутриклеточного развития FBm– 8 УГСХА и Bacillus pumilus 2 равен 25-26 минут (таблица 32). На чашках Петри среднее количество негативных колоний при высеве с 15 по 25 минуту опыта из 4-ой пробирки составляет 29,8, а при высеве из пятой пробирки с 40 по 60 минуту равно 6,54. Средняя урожайность бактериофага FBm– 8 УГСХА равна 654:29,8=21,9 вирусных частиц на одну микробную клетку Bacillus pumilus 2.
2.2.3. Бактерии Bacillus subtilis и специфичные им бактериофаги
2.2.3.1 Выделение бактерий Bacillus subtilis и их идентификация
По литературным данным группа «Bacillus subtilis» включает 8 видов: B.subtilis, B. pumilus, B. amiloliguefaciens, B. atrophaens, B. licheniformis, B. mojavensis, B. pumilus, B. sonorensis, B. vallismortis [226]. Учитывая это факт, в качестве селективной среды нами применялся Cereus Selective Agar (MYP-agar), который дает возможность осуществлять первичную селекцию выделенных бацилл по устойчивости к полимиксину и дифференцировать по манниту. «Bergey’s Manual of Systematics of Archaea and Bacteria» для выделения бактерий Bacillus subtilis рекомендует соотношение 1:5 пробы и стерильной воды и прогревание взвесей при 80 0Св течение 10 минут и посев на триптозный кровяной агар [226]. Рекомендуемая температура культивирования посевов (t = 370С) в течение 48 часов. Анализ данныхуказанного выше справочника, позволил нам сформировать комплекс бактериологических тестов для идентификации бактерий Bacillus subtilis на основании их групповой принадлежности (группа «Bacillus subtilis») и интерпретации результатов (для некоторых из рекомендуемых для рода Bacillus тестов не указаны результаты дифференциации).
Основная схема бактериологической идентификации представлена на рисунке 41. Окончательный результат исследований возможно получить в течение десяти дней. Особенностей при подготовке пробы к исследованиям не было: объект гомогенизировали (за исключением проб муки), далее навеску вносили в стерильный мясо-пептонный бульон в соотношении 1:10, посевы термостатировали (t = 36±1 0С) 20±4 часа. Проведенные нами эксперименты показали, что термостатирование в течение 48-72 часов проб почвы увеличивает время исследований, не повышая эффективность исследований. Этап подращивания необходим для активизации процесса вегетации споровых клеток. На плотной питательной среде Cereus Selective Agar (MYP-agar) эталонный штамм Bacillus subtilis 6633 формировал колонии неправильной формы с неровными краями.
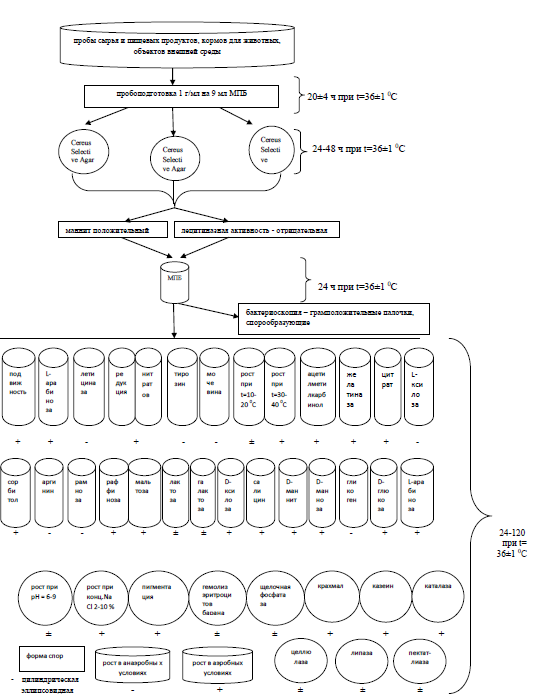
Рисунок 41 – Разработанная схема выделения и идентификации бактерий Bacillus subtilis, основанная изучении бактериологических характеристик
Изучение биохимических свойств выделенной культуры в максимальном объеме по авторской схеме начинается с четвертого дня исследований и включает фиксацию результатов в течение шести последующих дней. Максимально увеличивает время исследований определение показателя желатиназной активности.
Научные исследования в области фитопатологии свидетельствуют о том, что одним из факторов, формирующих фитопатогенные свойства бактерий, является продукция ферментов, разрушающих компоненты клеточной стенки растений [238]. Поэтому при разработке бактериологической схемы выделения и идентификации бактерий Bacillus subtilis мы посчиталинеобходимым добавить тесты, ориентированные на определение продукции пектат-лиаз, целлюлозолитической и липолитической активности. Данные показатели рекомендуется определять независимо от группы объекта выделения.
С учетом рекомендаций «Bergey’s Manual of Systematics of Archaea and Bacteriа» (2015) [226], подвергая анализу следующие биологические характеристики выделенных штаммов бактерий: окраска по Граму, форма эндоспоры, подвижность и наличие пигмента, возможности роста в аэробных/анаэробных условиях, продукция каталазы, особенности биохимической активности и наличиефитопатогенных свойств, выделенные нами 56 штаммов бактерии были отнесены к группе «Bacillus subtilis» и типированы как Bacillus subtilis. Определено, что все выделенные культуры практически не отличаются друг от друга по большинству анализируемых показателей (таблица 33). Ферментаттивная активность целлюзазного комплекса наблюдалась у 50 бактериальных штаммов, выделенных нами.
Продукция пектат-лиаз установлена нами у всех выделенных нами штаммов Bacillus subtilis через 72-96 часов культивирования в виде ореолов вокруг колоний бактерий.
Анализ воздействия неблагоприятных факторовна выделенные бактерии показал, что все изолированные штаммы проявляли способность к росту на МПА, содержащем 7 % р-р NaCl(на МПА, содержащем 10 % NaClрост зафиксирован у 31 штаммов) и при понижении температуры культивирования (зафиксирован рост при t +10 °С у 44 бактериальных штаммов).
Определение липолитической активности проводили на МПА, обогащенном маслами. Об активности фермента судили по наличию зоны просветления вокруг колонии бактерий.
Таблица 33 – Сводная таблица с информацией об основных свойствах бактерий Bacillus subtilis (по литературным данным [226] и результаты собственных исследований)
| Характеристика | Данныеобосновныхсвойствахбактерийпо«Bergey’sManualofSystematicsofArchaeaandBacteria» | Результаты исследований 74 штаммов, выделенных в экспериментах | |||
| B.subtilis | B.pumilus | + | — | ± | |
| пигментация | + | — | 21 | 14 | |
| подвижность | + | + | 56 | ||
| диаметр клетки > 1 мкм | — | — | 56 | ||
| окраска по Граму | Гр+ | Гр+ | Гр+ | ||
| форма спор
эллипсовидная цилиндрическая |
+
+ |
+
+ |
эллипсовидная
цилиндрическая |
||
| каталаза | + | + | 56 | ||
| рост в анаэробных условиях | — | — | 56 | ||
| рост в аэробных условиях | + | + | 56 | ||
| Кислота из | |||||
| L-арабинозы | + | + | 56 | ||
| D-глюкозы | + | + | 56 | ||
| гликогена | + | — | 56 | ||
| D-маннита | + | + | 56 | ||
| D-маннозы | + | + | 56 | ||
| салицина | + | + | 56 | ||
| D-ксилозы | + | + | 56 | ||
| галактозы | d | + | 39 | 15 | 2 |
| лактозы | d | d | 35 | 8 | 13 |
| мальтозы | + | d | 56 | ||
| раффинозы | + | + | 56 | ||
| рамнозы | — | — | 56 | ||
| сорбитола | + | d | 56 | ||
| L-ксилозы | — | — | 56 | ||
| Гидролиз | |||||
| казеина | казеина | казеина | казеина | казеина | казеина |
| крахмала | крахмала | крахмала | крахмала | крахмала | крахмала |
| тирозина | тирозина | тирозина | тирозина | тирозина | тирозина |
| мочевины | мочевины | мочевины | мочевины | мочевины | мочевины |
Продолжение таблицы 33
| Иные биохимические свойства | |||||
| утилизация цитрата | + | + | 56 | ||
| гемолитическая активность | 8 | 23 | 25 | ||
| желатиназная активность | + | + | 56 | ||
| лецитиназная активность | — | — | — | 56 | |
| щелочная фосфатаза | 22 | 23 | 11 | ||
| ацетил-метилкарбинол | + | + | 56 | ||
| аргининдегидролаза | — | — | 56 | ||
| редукция нитратов до нитритов | + | — | 56 | ||
| пектолитичес
кая активность |
56 | ||||
| липолитичес
кая активность |
47 | 9 | |||
| целлюлозолитическая активность | 50 | 6 | |||
| Рост на МПА в присутствии NaCl | |||||
| 2 % | + | + | 56 | ||
| 5 % | + | + | 56 | ||
| 7 % | + | + | 56 | ||
| 10 % | d | + | 31 | 25 | |
| Рост на МПА при рН | |||||
| 6,0 | + | + | 56 | ||
| 7,0 | + | + | 56 | ||
| 8,0 | + | + | 56 | ||
| 9,0 | + | 39 | 17 | ||
| Рост при температуре культивирования | |||||
| 100С | d | + | 44 | 12 | |
| 200С | + | + | 56 | ||
| 300С | + | + | 56 | ||
| 400С | + | + | 56 | ||
Примечание – «+» — положительный результат, «-» — отрицательный результат,
«d» — вариабельный результат, « » — данные отсутствуют.

Рисунок 42 – Определение наличия фермента каталазы у выделенных бактерий

Рисунок 43 – Изучение выделения кислоты из маннита выделенными бактериями: слева – незасеянная пробирка, далее – засеянные)
А Б
Рисунок 44 – Изучение выделения кислоты из мальтозы выделенными бактериями: слева – незасеянная пробирка, далее – засеянные)
Полученные результаты исследований по изучению биологических свойств выделенных нами бактерий (рис. 42-44) в основном не критично расходятся с паспортными данными эталонного штамма Bacillus subtilis 6633, учитывая полиморфизм биохимических свойств бактерий рода Bacillus.
Рисунок 45 – Результаты исследований по изучению ареала распространения бактерий Bacillus subtilis
Таблица 34 –Ареал распространения изолированных штаммов бактерий Bacillussubtilis
| №
п/п |
объекты выделения | количество | % | |
| исследованных образцов | штаммов бактерий идентифицированных как Bacillus subtilis | |||
| группа I | ||||
| 1 | хлеб из пшеничной муки | 25 | 1 | 4,0 |
| 2 | мука пшеничная | 40 | 4 | 10,0 |
| итого по группе | 65 | 5 | 7,7 | |
| группа II | ||||
| 1 | пряности и специи | 38 | 14 | 36,8 |
| 2 | томаты | 54 | 7 | 12,9 |
| 3 | огурцы | 34 | 6 | 17,6 |
| 4 | картофель | 44 | 3 | 6,8 |
| 5 | цуккини | 15 | 2 | 13,3 |
| итого по группе | 237 | 32 | 13,5 | |
| группа III | ||||
| 1 | пробы почвы | 210 | 19 | 9,1 |
| группа VI | ||||
| Итого: | 512 | 56 | 10,9 | |
Из 512 проб объектов ветеринарно-санитарного надзора и окружающей среды было выделено 56 штаммов, которые были отнесены виду Bacillus subtilis. Результаты исследований представлены в таблице 34 и графически изображены на рисунке 45.
Сформированная коллекция полевых штаммов бактерий Bacillus subtilis лиофилизирована и в дальнейшем была использована в качестве панели индикаторных штаммов при выделении специфических бактериофагов.
Совокупный процент контаминации 512 объектов ветеринарно-санитарного надзора, зарегистрированный нами, составил 10,9 %, из них процент обсеменения зерномучных товаров – 7,7 %, плодоовощных товаров – 13,5 % и проб почвы – 9,1 %. При бактериологической идентификации бактерий Bacillus subtilis считаем, что необходимо определять показатели целлюлазной и липазной ферментативной активности и продукции пектат-лиаз, что позволитдифференцировать штаммы Bacillus subtilis, вызывающих бактериозы растений
2.2.3.2. Выделение, селекция бактериофагов Bacillus subtilis и изучение их биологических свойств
Для выполнения цели исследований необходимо былосоздать коллекцию бактериофагов для возможности выбота производственно-перспективного, поэтому первым этапом нашей работы была попытка выделить фаги, специфичные для Bacillus subtilis из имеющихся 56 штаммов бактерий Bacillus subtilis, которые рассматривались нами как потенциально лизогенные.
В наших исследованиях нам не удалось обнаружить перехода профага в свободный фаг у анализируемой коллекции полевых штаммов Bacillus subtilis, поэтому дальнейшие исследования были посвящены выделению бактериофагов Bacillus subtilis из объектов внешней среды.
В результате исследований 10 проб сточных вод, 32 проб почвы и 40 проб пищевых продуктов нам удалось по указанной схеме выявить 22 изолята фагов.
Дальнейшей целью наших исследований было изучение следующих свойств выделенных фагов бактерий вида Bacillus subtilis:
— морфология негативных колоний (бляшкообразующих единиц),
— спектр литического действия,
— литическая активность.
Морфологию негативных колоний (бляшкообразующих единиц) выделенных бактериофагов изучали при посевах фагов методом агаровых слоев по Грациа. Учет проводили через 16 часа инкубации при температуре 36±10С.
Результаты исследований представлены в таблице 35.
Изучение морфологии негативных колоний выделенных бактериофагов показало, что их можно сгруппировать в два типа:
— 1 тип: прозрачные негативные колонии округлой формы, 1,0-2,5 мм в диаметре (фаги Bs-3, Bs-4, Bs-5, Bs-8, Bs-10, Bs-15, Bs-19, Bs-9, Bs-12, Bs-14, Bs-17, Bs-18, Bs-22 серии УГСХА) (рис. 2);
— 2 тип: прозрачные негативные колонии округлой формы, 2,6-4,0 мм в диаметре (фаги Bs-1, Bs-2, Bs-11, Bs-16, Bs-13, Bs-20, Bs-21 серии УГСХА) (рисунок 46).
Рисунок 46 — Наличие негативных колоний или зон лизиса фага Bs-22 серии УГСХАна газоне роста индикаторной культуры Bacillus subtilis 14
Таблица 35 — Морфология негативных колоний выделенных фагов бактерий вида Bacillus subtilis
| № | Бактериальная культура
Bacillus subtilis/ название фага |
Наличие негативных колоний или лизиса |
| 1. | Bacillussubtilis 61/ FBs-1 УГСХА | Прозрачные негативные колонии, округлой формы с ровными краями, 2,6-3,0 мм в диаметре |
| 2. | Bacillus subtilis 3/ FBs-2 УГСХА | Прозрачные негативные колонии, округлой формы с ровными краями, 3,0-4,0 мм в диаметре |
| 3. | Bacillus subtilis 3П/ FBs-3 УГСХА | Прозрачные негативные колонии, округлой формы с ровными краями, 1,0 мм в диаметре |
| 4. | Bacillus subtilis 98/ FBs-4 УГСХА | Прозрачные негативные колонии, округлой формы с ровными краями, 1,0-1,5 мм в диаметре |
| 5. | Bacillus subtilis 8/ FBs-5 УГСХА | Прозрачные негативные колонии, округлой формы с ровными краями, 0,5-1,0 мм в диаметре |
| Продолжение таблицы 35 | ||
| 6. | Bacillus subtilis 21/ FBs-6 УГСХА | Прозрачные негативные колонии, округлой формы с ровными краями, 1,0-1,3 мм в диаметре |
| 7. | Bacillus subtilis 17/ FBs-7 УГСХА | Прозрачные негативные колонии, округлой формы с ровными краями, 1,0-1,5 мм в диаметре |
| 8. | Bacillus subtilis 5/ FBs-8 УГСХА | Прозрачные негативные колонии, округлой формы с ровными краями, 1,0-1,5 мм в диаметре |
| 9. | Bacillus subtilis 16/ FBs-9 УГСХА | Прозрачные негативные колонии, округлой формы с ровными краями, 1,0 мм в диаметре |
| 10. | Bacillus subtilis 32/ FBs-10 УГСХА | Прозрачные негативные колонии, округлой формы с ровными краями, 1,0-1,5 мм в диаметре |
| 11. | Bacillus subtilis 10/ FBs-11 УГСХА | Прозрачные негативные колонии, округлой формы с ровными краями, 2,6-3,0 мм в диаметре |
| 12. | Bacillus subtilis 12/ FBs-12 УГСХА | Прозрачные негативные колонии, округлой формы с ровными краями, 1,0-1,5 мм в диаметре |
| 13. | Bacillus subtilis 26/ FBs-13 УГСХА | Прозрачные негативные колонии, округлой формы с ровными краями, с зоной неполного лизиса по периферии, 6,0-8,0 мм в диаметре |
| 14. | Bacillus subtilis 23/ FBs-14 УГСХА | Прозрачные негативные колонии, округлой формы с ровными краями, 1,0 мм в диаметре |
| 15. | Bacillus subtilis 12/ FBs-15 УГСХА | Прозрачные негативные колонии, округлой формы с ровными краями, 1,5 мм в диаметре |
| 16. | Bacillus subtilis 4/ FBs-16 УГСХА | Прозрачные негативные колонии, округлой формы с ровными краями, 2,6-3,0 мм в диаметре |
| 17. | Bacillus subtilis 19/ Bs-17 УГСХА | Прозрачные негативные колонии, округлой формы с ровными краями, 1,5 мм в диаметре |
| 18. | Bacillus subtilis 4/ Bs-18 УГСХА | Прозрачные негативные колонии, округлой формы с ровными краями, 1,0-1,5 мм в диаметре |
| 19. | Bacillus subtilis 31/ Bs-9 УГСХА | Прозрачные негативные колонии, округлой формы с ровными краями, 1,0-1,5 мм в диаметре |
| 20. | Bacillus subtilis 25/ Bs-20 УГСХА | Прозрачные негативные колонии, округлой формы с ровными краями, с зоной неполного лизиса по периферии, 3,0-3,5 мм в диаметре |
| № | Бактериальная культура
Bacillus subtilis/ название фага |
Наличие негативных колоний или лизиса |
| 21. | Bacillus subtilis 27/ FBs-21 УГСХА | Прозрачные негативные колонии, округлой формы с ровными краями, с зоной неполного лизиса по периферии, 2,6-3,0 мм в диаметре |
| 22. | Bacillus subtilis 14/ FBs -22 УГСХА | Прозрачные негативные колонии, округлой формы с ровными краями, 2,0-2,5 мм в диаметре |
Таблица 36–Подбор количественных соотношений выделенных фагов и
индикаторных культур и технологические параметры их культивирования
| № | Название фага / индикаторная бактериальная культура | Технологические параметры культивирования | Оптимальное количественное соотношение выделенного бактериофага и 18±2 часовой индикаторной культуры при концентрации микробных клеток равной nх108(КОЕ/мл) | |
| временной интервал, ч | температурный режим, 0С | |||
| 1 | Bacillus subtilis 61/ FBs-1 УГСХА | 6,0 | 36±1 | 0,2 мл / 0,2 мл |
| 2 | Bacillus subtilis 3/ FBs-2 УГСХА | 7,0 | 36±1 | 0,2 мл / 0,2 мл |
| 3 | Bacillus subtilis 3П/ FBs-3 УГСХА | 6,0 | 36±1 | 0,2 мл / 0,2 мл |
| 4 | Bacillus subtilis 98/ FBs-4 УГСХА | 6,0 | 36±1 | 0,2 мл / 0,2 мл |
| 5 | Bacillus subtilis 8/ FBs-5 УГСХА | 6,5 | 36±1 | 0,2 мл / 0,2 мл |
| 6 | Bacillus subtilis 21/ FBs-6 УГСХА | 6,0 | 36±1 | 0,3 мл / 0,3 мл |
| 7 | Bacillus subtilis 17/ FBs-7 УГСХА | 7,0 | 36±1 | 0,2 мл / 0,2 мл |
| 8 | Bacillus subtilis 5/ FBs-8 УГСХА | 6,0 | 36±1 | 0,2 мл / 0,2 мл |
| 9 | Bacillus subtilis 16/ FBs-9 УГСХА | 6,0 | 36±1 | 0,3 мл / 0,3 мл |
| 10 | Bacillus subtilis 32/ FBs-10 УГСХА | 6,5 | 36±1 | 0,2 мл / 0,2 мл |
| 11 | Bacillus subtilis 10/ FBs-11 УГСХА | 7,0 | 36±1 | 0,2 мл / 0,2 мл |
| 12 | Bacillus subtilis 12/ FBs-12 УГСХА | 6,0 | 36±1 | 0,2 мл / 0,2 мл |
| 13 | Bacillus subtilis 26/ FBs-13 УГСХА | 6,5 | 36±1 | 0,3 мл / 0,3 мл |
| 14 | Bacillus subtilis 23/ FBs-14 УГСХА | 7,0 | 36±1 | 0,2 мл / 0,2 мл |
| 15 | Bacillus subtilis 12/ FBs-15 УГСХА | 6,5 | 36±1 | 0,2 мл / 0,2 мл |
| 16 | Bacillus subtilis 4/ FBs-16 УГСХА | 6,0 | 36±1 | 0,2 мл / 0,2 мл |
| 17 | Bacillus subtilis 19/ FBs-17 УГСХА | 6,0 | 36±1 | 0,2 мл / 0,2 мл |
| 18 | Bacillus subtilis 4/ FBs-18 УГСХА | 6,5 | 36±1 | 0,3 мл / 0,3 мл |
| 19 | Bacillus subtilis 31/ FBs-9 УГСХА | 6,5 | 36±1 | 0,2 мл / 0,2 мл |
| 20 | Bacillus subtilis 25/ FBs-20 УГСХА | 6,0 | 36±1 | 0,2 мл / 0,2 мл |
| 21 | Bacillus subtilis 27/ FBs-21 УГСХА | 6,0 | 36±1 | 0,3мл / 0,3 мл |
| 22 | Bacillus subtilis 14/ FBs -22 УГСХА | 6,0 | 36±1 | 0,2мл / 0,2 мл |
Таблица 37 – Устойчивость индикаторных акультур Bacillus subtilis и селекционированныха бактериофагов к воздействиюа высоких температур
| Название
исследуемого аагента |
Показатель атемпературы, оС | |||||||||||
| 57 | 60 | 63 | 66 | 69 | 72 | 75 | 78 | 81 | 84 | 87 | 90 | |
| Индикаторные культуры | ||||||||||||
| Bacillus subtilis 6633 | + | + | + | + | + | + | + | + | + | + | + | + |
| Bacillus subtilis (полевые штаммы в количестве 56 культур) | + | + | + | + | + | + | + | + | + | + | + | + |
| Бактериофаги | ||||||||||||
| FBs– 1 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBs– 2 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBs– 3 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBs– 4 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBs– 5 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBs– 6 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBs– 7 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBs– 8 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBs– 9 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBs– 10 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBs– 11 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBs– 12 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBs– 13 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBs– 14 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBs– 15 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBs– 16 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBs– 17 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBs–18УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBs– 19 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBs– 20 УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBs– 21УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
| FBs– 22УГСХА | + | + | + | + | + | + | + | + | + | + | + | + |
Примечание – «+» — положительный результат–наличие БОЕ на газоне индикатрной культуры;
«-» — отрицательный результат – отсутствие БОЕ на газоне индикатрной культуры.
Таблица 38 – Определение устойчивости аиндикаторных культур Bacillus subtilis и селекционированных афагов к воздействию хлороформаа (трихлорметана)
| Название
исследуемого аагента |
Временной интервал воздействия трихлорметана, минут | ||||||
| 5 | 10 | 15 | 20 | 25 | 30 | 35 | |
| Индикаторная культура | |||||||
| Bacillus subtilis 6633 | + | + | — | — | — | — | — |
| Bacillus subtilis (полевые штаммы в количестве 56 культур) | + | + | — | — | — | — | — |
| Бактериофаги | |||||||
| FBs– 1 УГСХА | + | + | + | + | — | — | — |
| FBs– 2 УГСХА | + | + | + | + | — | — | — |
| FBs– 3 УГСХА | + | + | + | — | — | — | — |
| FBs– 4 УГСХА | + | + | + | + | + | — | — |
| FBs– 5 УГСХА | + | + | + | — | — | — | — |
| FBs– 6 УГСХА | + | + | + | + | — | — | — |
| FBs– 7 УГСХА | + | + | + | + | — | — | — |
| FBs– 8 УГСХА | + | + | + | + | + | — | — |
| FBs– 9 УГСХА | + | + | + | + | + | — | — |
| FBs– 10 УГСХА | + | + | + | + | + | — | — |
| FBs– 11 УГСХА | + | + | + | + | + | — | — |
| FBs– 12 УГСХА | + | + | + | + | + | — | — |
| FBs– 13 УГСХА | + | + | + | — | — | — | — |
| FBs– 14 УГСХА | + | + | + | — | — | — | — |
| FBs– 15 УГСХА | + | + | + | + | + | — | — |
| FBs– 16 УГСХА | + | + | + | + | — | — | — |
| FBs– 17 УГСХА | + | + | + | + | + | — | — |
| FBs–18УГСХА | + | + | + | + | + | — | — |
| FBs– 19 УГСХА | + | + | + | + | — | — | — |
| FBs– 20 УГСХА | + | + | + | + | + | — | — |
| FBs– 21УГСХА | + | + | + | + | + | — | — |
| FBs– 22УГСХА | + | + | + | + | + | — | — |
Примечание – «+» — положительный результат–наличие БОЕ на газоне индикатрной культуры;
«-» — отрицательный результат – отсутствие БОЕ на газоне индикатрной культуры.
Селекцию бактериофагов и повышение их литической активности проводили методом пассирования фага на индикаторной культуре с периодической отвивкой типичных негативных колоний. Параметры культивирования и оптимальное количественное соотношение выделенного бактериофага и 18±2 часовой индикаторной культуры при концентрации микробных клеток равной nх108(КОЕ/мл) отражены в таблице 36. Представленные данные свидетельствуют о том, что время пассажа находится во временных рамках 6,5±0,5 часа, количественное соотношение в среднем составляет 1:1.
При подборе эффективной методики для очистки бактериофага от индикаторной культуры мы использовали три приема: обработка трихлорметаном в соотношении 1:10 в течение 5-35 минут с интервалом в 5 минут, обработка прогреванием на водяной бане (температура 57-90 0С с интервалом в 3 градуса в течение 30 минут)
Спектр литической активности является одной из основных характеристик диагностического препарата фага. Определение спектра литической активности проводили методом нанесения фага на газон бактериальной культуры.
Для изучения спектра литической активности селекционированных нами 22 изолятов фагов было использовано 56 штаммов бактерий Bacillus subtilis.
Результаты исследований представлены в таблице 39.
Таблица 39– Литическая активность бактериофагов Bacillus subtilis
| №
п/п |
Название бактериофага | Литическая активность (титр) | |
| титрование в МПБ, степень разведения | метод диффузии в мягком слое двуслойного МПА, БОЕ/мл | ||
| 1 | FBs– 1 УГСХА | 10-6 | (3,5±0,6)х107 |
| 2 | FBs– 2 УГСХА | 10-7 | (1,0±0,3)х108 |
| 3 | FBs– 3 УГСХА | 10-6 | (2,2±0,2)х107 |
| 4 | FBs– 4 УГСХА | 10-7 | (2,4±0,1)х108 |
| 5 | FBs– 5 УГСХА | 10-6 | (2,0±0,2)х107 |
| 6 | FBs– 6 УГСХА | 10-7 | (6,0±0,5)х108 |
| 7 | FBs– 7 УГСХА | 10-6 | (4,0±0,3)х107 |
| 8 | FBs– 8 УГСХА | 10-5 | (1,7±0,4)х106 |
| 9 | FBs– 9 УГСХА | 10-6 | (2,4±0,6)х107 |
| 10 | FBs– 10 УГСХА | 10-7 | (3,0±0,3)х108 |
| 11 | FBs– 11 УГСХА | 10-7 | (1,0±0,2)х108 |
| 12 | FBs– 12 УГСХА | 10-6 | (4,0±0,5)х107 |
| 13 | FBs– 13 УГСХА | 10-8 | (2,8±0,6)х109 |
| 14 | FBs– 14 УГСХА | 10-7 | (2,4±0,3)х108 |
| 15 | FBs– 15 УГСХА | 10-6 | (4,0±0,4)х107 |
| 16 | FBs– 16 УГСХА | 10-8 | (8,0±0,6)х109 |
| 17 | FBs– 17 УГСХА | 10-6 | (1,5±0,4)х107 |
| 18 | FBs–18УГСХА | 10-7 | (5,1±0,7)х108 |
| 19 | FBs– 19 УГСХА | 10-6 | (3,0±0,3)х107 |
| 20 | FBs– 20 УГСХА | 10-6 | (1,2±0,1)х107 |
| 21 | FBs– 21УГСХА | 10-6 | (2,0±0,4)х107 |
| 22 | FBs– 22УГСХА | 10-7 | (3,4±0,4)х108 |
Для конструирования биопрепарата нам выбран бактериофагFBs–16серии УГСХА, которыйхарактеризовался высоким титром литической активности и максимально широким спектром литического действия.
Последующие эксперименты были направлены на изучение изменения литической активности укупоренногово флаконы бактериофага FBs–16УГСХА, хранящегося в условиях холодильника в течение 12 месяцев.
Так как для разработки технологических параметров изготовления биопрепарата на основе фагаFBs–16серии УГСХА это необходимо, потому что хрок годности биопрепарат начинает исчисляться с момента наработки фага и его укупоривания в герметично закрытые флаконы.
Таблица 40– Результаты изучения специфичности бактериофагов Bacillus subtilis
| №
п/п |
Бактериофаги | Виды бактерий | Процент лизированных культур | ||||||||||
| Bacilluss subtilis | Bacillus megaterium | Bacilluscereus | Bacillus mycoides | Bacillus anthracis | Bacilluspumilus | Bacillus thuringiensis | Paenibacillus polimixa | Paenibacillus larvae | Listeria monocytogenes | Listeria ivanovii | |||
| Кол-во испытан-
ных штаммов |
56 | 8 | 106 | 12 | 11 | 74 | 3 | 2 | 2 | 55 | 2 | ||
| FBs– 1 УГСХА | +/23 | – | – | – | – | – | – | – | – | – | – | 41,1 | |
| FBs– 2 УГСХА | +/31 | – | – | – | – | – | – | – | – | – | – | 55,4 | |
| FBs– 3 УГСХА | +/12 | – | – | – | – | – | – | – | – | – | – | 21,4 | |
| FBs– 4 УГСХА | +/17 | – | – | – | – | – | – | – | – | – | – | 30,3 | |
| FBs– 5 УГСХА | +/41 | – | – | – | – | – | – | – | – | – | – | 73,2 | |
| FBs– 6 УГСХА | +/22 | – | – | – | – | – | – | – | – | – | – | 39,3 | |
| FBs– 7 УГСХА | +/34 | – | – | – | – | – | – | – | – | – | – | 60,7 | |
| FBs– 8 УГСХА | +/28 | – | – | – | – | – | – | – | – | – | – | 50,0 | |
| FBs– 9 УГСХА | +/26 | – | – | – | – | – | – | – | – | – | – | 46,4 | |
| FBs– 10 УГСХА | +/43 | – | – | – | – | – | – | – | – | – | – | 76,8 | |
| FBs– 11 УГСХА | +/39 | – | – | – | – | – | – | – | – | – | – | 69,6 | |
| FBs– 12 УГСХА | +/25 | – | – | – | – | – | – | – | – | – | – | 44,6 | |
| FBs– 13 УГСХА | +/38 | – | – | – | – | – | – | – | – | – | – | 67,9 | |
| FBs– 14 УГСХА | +/17 | – | – | – | – | – | – | – | – | – | – | 30,3 | |
| FBs– 15 УГСХА | +/40 | – | – | – | – | – | – | – | – | – | – | 71,4 | |
| FBs– 16 УГСХА | +/54 | – | – | – | – | – | – | – | – | – | – | 96,4 | |
| FBs– 17 УГСХА | +/43 | – | – | – | – | – | – | – | – | – | – | 76,8 | |
| FBs–18УГСХА | +/31 | – | – | – | – | – | – | – | – | – | – | 55,4 | |
Продолжение таблицы 40
| FBs– 19 УГСХА | +/42 | – | – | – | – | – | – | – | – | – | – | 75,0 | |
| FBs– 20 УГСХА | +/39 | – | – | – | – | – | – | – | – | – | – | 69,6 | |
| FBs– 21УГСХА | +/41 | – | – | – | – | – | – | – | – | – | – | 73,2 | |
| FBs– 22УГСХА | +/19 | – | – | – | – | – | – | – | – | – | – | 33,9 |
Изменение значения литической активности бактериофагов при хранении определялось по классической методике — методом агаровых слоев по Грациа. Результаты исследований представлены в таблице 41. Опытным путем установлено, что в течение 3 месяцев показатель литической активности исследуемого бактериофага FBs–16УГСХА практически оставался без изменений, (8,0±0,6)х109БОЕ/мл. Через 6 месяцев литическая активность снижалась и составила (1,6±0,3)х108, через 9 месяцев – (0,9±0,2)х107БОЕ/мл.
Экспериментально установлено, что пассирование бактериофага на исходном штамме бактерий Bacillus subtilis 4 в течение 7 пассажей методом агаровых слоев восстанавливает литическую активность на 1 порядок.
Таблица 41 – Изменение литической активности фага FBs-16 УГСХА
при хранении
| Бактериальная культура
Bacillus subtilis / название фага |
Временной интервал | Литическая активность, БОЕ/мл |
| Bacillus subtilis 4/ FBs-16 УГСХА | момент укупоривания | (8,0±0,6)х109 |
| 3 месяца | (2,7±0,2)х109 | |
| 6 месяцев | (1,6±0,3)х108 | |
| 9 месяцев | (0,9±0,2)х108 |
Изменение литической активности фага FBs-16 УГСХАв диапазоне 108-109 не является критическим при конструировании биопрепарата и не отразится на его способности лизировать культуры Bacillus subtilis в плодоовощной продукции при проведении исследований.
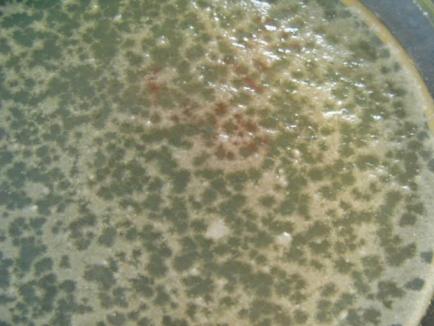
Рисунок 47 – Морфология негативных колоний фага FBs-15УлГАУ на индикаторной культуре Bacillus subtilis 12
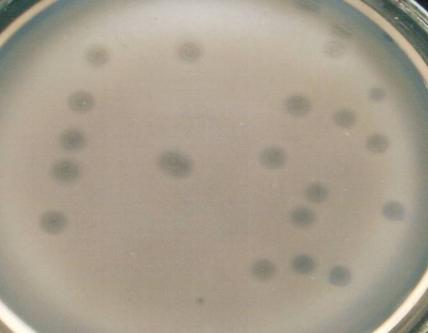
Рисунок 48 — Морфология негативных колоний фага FBs-13 УГСХА на индикаторной культуре Bacillus subtilis 12
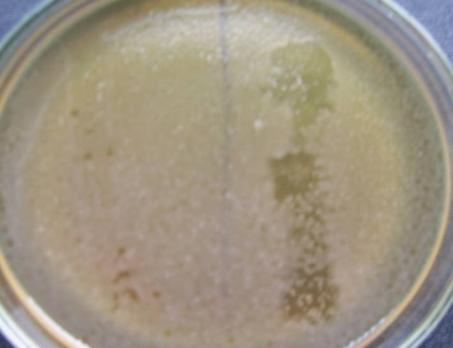
Рисунок 50 – Зона лизиса бактериофага FBs-13 УлГАУ на индикаторной культуре Bacillus subtilis 4, нанесенной газоном наМПА
2.2.3.3 Изучение взаимодействия фаг-хозяин для FBs– 16 УГСХА – Bacillus subtilis 4 и определение факторов, оказывающих влияние на данный процесс
Экспоненциально растущую бактериальную клетку Bacillus subtilis 4 мы смешивали с бактериофагом FBs–16 УГСХА (множественность инфицирования (MOI) = 0,001) и выдерживали при комнатной температуре. Образцы (100 мкл) отбирали через 1, 2, 3, 4, 5, 10, 15, 20, 25, 30 мин, смешивали с 850 мкл SM-буфера и 50 мкл трихлорметана. Затем осуществляли центрифугирование, брали надосадочную жидкость и титровали для определения неадсорбированного или обратимо адсорбированногобактериофага через разные временные интервалы.
Количественно адсорбцию выражали константой скорости адсорбции (k), измеряемой в мл/мин. Для конкретной смеси (фаг + клетка-хозяина) в зависимости от процента максимальной ее адсорбции устанавливали время адсорбции фага (таблица 42).
Таблица 42 – Результаты изучения скорости адсорбции фагаFBs–16 УГСХАна клетке индикаторной культуры Bacillus subtilis 4
| Название фага и микроорганизма | Время адсорбции максимального количества фага (мин) | Количество фага до адсорбции
(по показателю негативных колоний) M±m |
Количество неадсорбированного фага (по показателю бляшкообразующих единиц) M±m | Процент адсорбции (%) |
| FBs– 16
УГСХА/ Bacillus subtilis 4 |
5 | 80±6 | 54,3±0,9 | 32,1 |
| 6 | 19,3±0,7 | 75,9 | ||
| Константа скорости адсорбции К = 4,1 см 3/мин-1 | ||||
В результате проведенных исследований было установлено, что бактериофаг FBs–8 УГСХА имел показатель скорости адсорбции равный К = 4,1 см3/мин-1.
В предварительном опыте параллельного титрования эмбихина на фаге и соответствующем бактериальном хозяине (FBs – 16 УГСХА – Bacillus subtilis 4) была установлена рабочая доза препарата, которая выражается количеством, способным за 5 минут в 0,9 мл физиологического раствора при 36±1оС инактивировать 90-95% фага при его исходной концентрации n х 109БОЕ/мл. В результате проведенного эксперимента, мы определили, что рабочая доза эмбихина составляет 7γ, т.е. среднеезначение двух последних эффективных доз. Основной опыт проводили только после определения рабочей дозы. Результаты исследований отражены в таблицах 43-44.
Таблица 43 – Изучение латентного периода и урожайности бактериофага FBs–16 УГСХА
| Время
начала опыта |
Число негативных колоний фага при высеве из 4-ой пробирки
M±m |
Число негативных колоний фага при высеве из 5-ой пробирки
M±m |
| 15 | 18,4±3,2 | |
| 17 | 22,5±2,1 | |
| 20 | 36,4±3,3 | |
| 25 | 54,4±2,6 | |
| 27 | 80,0±6,0 | 7,9±0,5 |
| 29 | Стерильное пятно | 6,2±0,3 |
| 30 | Сливной рост негативных колоний | 6,0±0,1 |
| 35 | Лизис | 5,7±0,2 |
| 40 | 7,1±0,7 | |
| 45 | 7,0±0,5 | |
| 50 | 7,3±0,2 | |
| 55 | 8,4±0,5 | |
| 60 | 9,1±0,3 |
Таблица 44 – Показатели урожайности, латентного периода и скороcти адсорбции бактериофага FBs–16 УГСХА
| Изучаемый показатель | Бактериофаг
FBs–16 УГСХА |
| Средняя урожайность, вирусных частиц на микробную клетку | 16,99 |
| Латентный период, минут | 25 |
| Константа скорости адсорбции, см 3/мин-1 | 4,1 |
Установлено, что латентный период внутриклеточного развития FBs– 16 УГСХА и Bacillus subtilis 4 равен 25-26 минут (таблицы43-44). На чашках Петри среднее количество негативных колоний при высеве с 15 по 25 минуту опыта из 4-ой пробирки составляет 42,3, а при высеве из пятой пробирки с 40 по 60 минуту равно 7,19. Средняя урожайность бактериофага FBs– 16 УГСХА равна 719:42,3=16,99 вирусных частиц на одну микробную клетку Bacillus subtilis 4.
2.2.4. Бактерии Listeria monocytogenes и специфичные им бактериофаги
2.2.4.1 Выделение бактерий Listeria monocytogenes и их идентификация
Для поиска оптимального метода выделения листерий использовали пробы пищевых продуктов (листовой салат, зелень, яблоки, курица) и пробы почвы. Все исследуемые продукты находились в пределах срока годности, при осмотре упаковки, отклонений обнаружено не было.
Пробы отбирали асептическим способом, используя стерильные инструменты и посуду.
Выделение листерий проводили двумя способами
Выделение листерии из пищевого сырья и продуктов питания по Межгосударственному стандарту ГОСТ 32031-2012 [218]
Измельченные пробы по 1 грамму добавляли в 8 мл полуконцентрированного бульона Фразера (рисунок 51) (первичное обогащение анализируемой пробы в жидкой среде со сниженной концентрацией селективных компонентов) и инкубировали при температуре (30±1)°С в течение (24±2) ч. т.к. бактерии рода листерия в продукте могут находиться в небольшом количестве, очень часто на фоне значительного количества микроорганизмов других родов. Поэтому для выявления небольшого количества бактерий рода листерия, а также «поврежденных» клеток в пробе необходим этап селективного обогащения на среде с пониженной концентрацией селективных компонентов. Половина бульона Фразера содержит половину концентрации налидиксовой кислоты и акрифлавина по сравнению с бульоном Фразера.
При росте листерий на бульоне Фразера отмечается почернение среды. Результаты учитывали через 48 часов (рисунок 51).

Рисунок 51 – Исследуемые пробы через 48 часов (30±1) °С
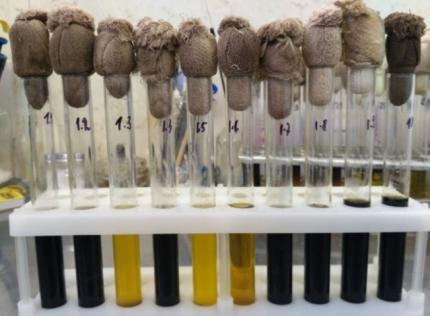
Рисунок 52 – Рост на бульоне Фразера через 24 часа (37±1) °С
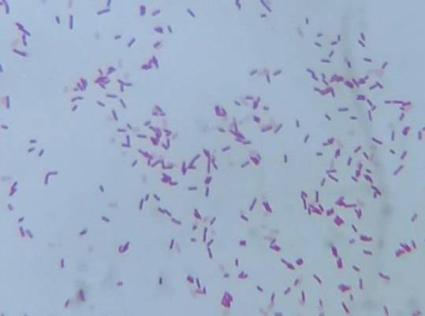
Рисунок 53 – Микроскопическая картина клеток, микроскоп «Биомед-6» увеличение 1000 крат
Следующим этапом было вторичное обогащение посевного материала. Через двое суток из полученных посевов отбирали по 1 мл суспензии и переносили в пробирки с содержанием 8 мл бульона Фразера с полной концентрацией селективных компонентов, далее ставили в термостат при температуре (37±1) °С на 24 часа.
Через двое суток наблюдали почернение среды (рисунок 52). Результаты представлены в таблице 45.
Таблица 45 – Изменение цвета среды на бульоне Фразера
| № пробы | Первичное обогащение | Вторичное обогащение | |
| 24 часа | 48 часов | 24 часа | |
| 1.1 | — | + | + |
| 1.2 | — | + | + |
| 1.3 | — | + | — |
| 1.4 | — | + | + |
| 1.5 | — | + | — |
| 1.6 | — | + | — |
| 1.7 | — | + | + |
| 1.8 | — | + | + |
| 1.9 | — | + | + |
| 1.10 | — | + | + |
Примечания:
«-» — почернение среды отсутствует
«+» — почернение среды
Пересевали исследуемый материал параллельно на две плотные селективные питательные среды – Оксфорд и хромогенный агары. Посевы культивировали при (37±1) °С в течение (24±3) ч.
Через сутки наблюдали рост на чашках Петри. Результаты представлены в таблице 46. В образце №1.3 на двух селективных средах выросли желтые глянцевые колонии, при окраске мазков по Граму и их микроскопировании были выявлены крупные грамположительные палочки. В пробах №1.9-№1.10 наблюдали рост росинчатых колоний голубого цвета на хромогенном агаре, на Оксфорд агаре — мелкие колонии, сероватые, окруженные черным ореолом.
В мазках из проб №1.9-№1.10, окрашенных по методу Грама, были обнаружены мелкие грамположительные палочки (рисунок 53).
Для дальнейшего типирования полученных после обогащения культур был выбран метод ПЦР в режиме реального времени и ПЦР с электрофоретической детекцией.
Таблица 46 – Рост на селективных средах при (37±1) °С в течение (24±3) ч.
| № пробы | Рост на Оксфорд агаре | Рост на хромогенном агаре |
| 1.1 | — | — |
| 1.2 | — | — |
| 1.3 | + | + |
| 1.4 | — | — |
| 1.5 | — | — |
| 1.6 | — | — |
| 1.7 | — | — |
| 1.8 | — | — |
| 1.9 | + | + |
| 1.10 | + | + |
ПЦР в режиме реального времени
Из суточных бульонных культур отбирали 1,5 мл бактериальной взвеси в одноразовые стерильные полипропиленовые пробирки. Центрифугировали при 13000 об/мин. и убирали надосадочную жидкость.
Для выделения ДНК использовали «ДНК–сорб–АМ» («ИнтеЛабСервис», Москва). Для начала к осадку в пробирку добавляли предварительно ресуспензированного сорбента 20 мкл и лизирующий раствор 150 мкл, полученную смесь встряхивали в вортексе в течение 3-5 сек., и инкубировали пробирки 20 мин при 50°C. Центрифугировали пробы при 13000 об/мин и убирали надосадочную жидкость при помощи вакуумного отсасывателя. Затем промывочными растворами №1 и №2 (200 мкл каждого) и 70% этанолом (раствор №3) промывали сорбент, каждый раз центрифугируя и убирая надосадочную жидкость. Осадок сорбента подсушивали при 50°С в течение 5-10 мин. В конце процедуры добавляли по 100 мкл буфера для элюции, встряхивали пробирку в вортексе в течение 5-10 сек и инкубировали 5 мин при 50°С. Затем центрифугировали 60 сек при 13000 об/мин. Полученный супернатант, содержащий ДНК сразу использовали в полимеразной цепной реакции.
Приготовление смеси для ПЦР
Постановку полимеразной цепной реакции проводили в микропробирках емкостью 0,2 мл.
Для амплификации в работе использовали «Набор реагентов для проведения ПЦР-РВ с Taq–ДНК–полимеразой и ингибирующими активность фермента антителами» (состав набора: дезоксинуклеозидтрифосфаты, 2.5 мМ, 500 мкл; 10–кратный ПЦР буфер, 500 мкл; МgCl2, 25 мМ, 500 мкл; Taq ДНК–полимераза с ингибирующими активность фермента антителами, 5 Е/мкл, 50 мкл; деионизированная вода, 2х1,7 мл.) («Синтол», Москва).
Состав смеси для проведения ПЦР:
˗ бидистилированная вода — 6,6 мкл
˗ 2,5Х буфер для ПЦР — 10 мкл
˗ MgCl2 (25 мМ) — 1 мкл
˗ dNTP (25 мМ) — 0,5 мкл
˗ Taq ДНК-полимераза — 0,2 мкл
˗ смесь праймеров и зонда (4 пкМ праймеров, 2 пкМ зонда) — 2,5 мкл
˗ ДНК — матрица — 5 мкл
Пробирки с готовой ПЦР-смесью встряхивали на смесителе, все капли со стенок осаждали центрифугированием в течение 5-10 сек.
Переносили пробы в амплификатор и проводили ПЦР в режиме реального времени при следующих температурных режимах:
• активация TaqF-полимеразы при 95°С — 5 мин.
• денатурация при 95°С-10 сек.
• отжиг при 57°C-20 сек. 30 циклов
• элонгация при 72°C-10 сек.
• элонгация при 72°C-2 мин.
Результаты интерпретировали на основании наличия (или отсутствия) пересечения кривой флюоресценции с установленной на соответствующем уровне (0,05) пороговой линией (treshhold) значения порогового цикла «Сt».
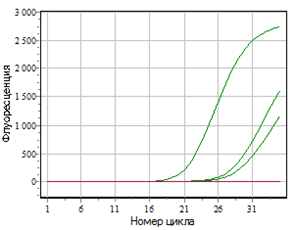
Рисунок 54 — Зависимость флуоресценции канала HEX от номера цикла при исследовании проб №1.9-№1.10 c праймерами для L.monocytogenes

К+
Проба 1.10
Проба 1.9
Рисунок 55 — Электрофореграмма ПЦР-продуктов из проб №1.9-№1.10

Рисунок 56 – Исследуемые пробы в бульоне Фразера
Образец считали отрицательным, если значение «Сt» по каналу Fam для L.ivanovii и по каналу Hex для L.monocytogenes отсутствовало (рисунок 54.
Метод классической полимеразной цепной реакции с электрофоретической детекцией
Анализ ПЦР-продуктов реакции осуществляли при помощи электрофореза. Электрофоретическую оценку проводили в 2%-ном агарозном геле, для приготовления которого смешивали 2 г. агарозы и 100 мл ТАЕ-буфера. Смесь помещали в микроволновую печь и доводили до кипения. Далее, в слегка охлажденную смесь добавляли 10 мкл 0,001 % бромистого этидия и тщательно перемешивали. Гель разливали в форму и устанавливали гребенки. В образовавшиеся в застывшем геле лунки вносили по 10 мкл ПЦР продуктов. Электрофорез проводили используя Трис-ацетатный буфер при напряжении 8 В/см длины геля в течение 40 минут.
Результаты электрофореза учитывали в ультрафиолетовом свете с длиной волны 254 нм. Амплифицированные фрагменты ДНК выявлялись в виде светящихся оранжевых полос в треках с исследуемыми образцами относительно фрагмента в пробе положительного контроля. После чего делали снимок с помощью системы визуализации (рисунок 55).
Выделение листерии из пищевого сырья и продуктов питания ускоренным методом (Васильев Д.А.) [239]
Исследуемые пробы измельчали и смешивали со средой накопления (бульон Фразера), в соотношении 1:8 (1 часть продукта и 8 частей среды). Полученную суспензию встряхивали в течение 1 минуты и помещали в термостат при (28±3) °С на 24-48 часов (рисунок 56).
Почернение среды, наблюдалось через 24 часа инкубирования во всех пробах (рисунок 57).
Через сутки 1 мл полученной бактериальной суспензии смешивали с 5 мл 0,3 % раствора КОН (растворенного в 5% NaCl), встряхивали и через минуту высевали на селективные среды — Оксфорд и хромогенный агары.
Посевы инкубировали при (37±1) °С в течение 24-48 часов.
Через 24 часа наблюдали рост на чашках Петри. В пробе №2.3 — зелено-голубые крупные колонии с шероховатой поверхностью. В пробах №2.6-№2.10 наблюдали рост росинчатых колоний голубого цвета на хромогенном агаре, на Оксфорд агаре выросли мелкие колонии, сероватые, окруженные черным ореолом с углубленным центром.
Результаты представлены в таблице 47.
Таблица 47 — Рост на селективных средах при (37±1) °С в течение (24±3) ч.
| № пробы | Рост на Оксфорд агаре | Рост на хромогенном агаре |
| 2.1 | — | — |
| 2.2 | — | — |
| 2.3 | + | + |
| 2.4 | — | — |
| 2.5 | — | — |
| 2.6 | — | + |
| 2.7 | — | — |
| 2.8 | — | — |
| 2.9 | + | + |
| 2.10 | + | + |
Примечания:
«-» — рост отсутствует
«+» — рост на чашках Петри
Следующим шагом было приготовление мазков идентичных колоний для окраски по методу Грама. В пробе №2.3 нами были обнаружены крупные грамположительные палочки (рисунок 58). В пробах №2.6-№2.10 нами были обнаружены грамположительные короткие палочки (рисунок 59).
Для точной идентификации культуры Listeria monocytogenes мы использовали метод ПЦР в режиме реального времени и классическую ПЦР с электрофоретической детекцией, как в первом случае, результаты представлены на рисунках 60-61.

Рисунок 57 – Исследуемые пробы через 24 ч (28±3)°С
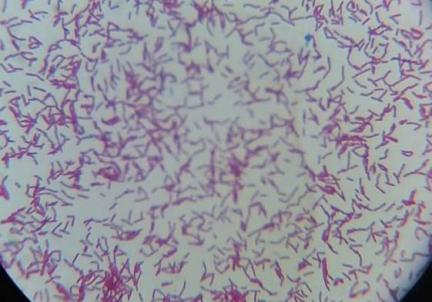
Рисунок 58 — Микроскопическая картина клеток пробы №2.3, микроскоп «Биомед-6» увеличение 1000 крат
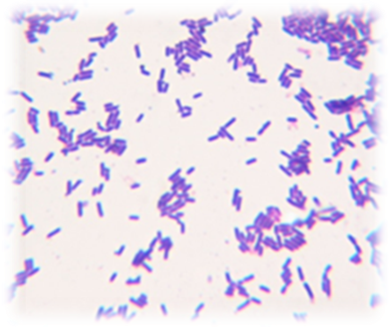
Рисунок 59 — Микроскопическая картина клеток пробы №2.7, микроскоп «Биомед-6» увеличение 1000 крат

К –
Проба 2.6
Проба 2.7
Проба 2.8
Проба 2.9
Проба 2.10
Рисунок 60 — Электрофореграмма ПЦР-продуктов из проб №2.6-№2.10
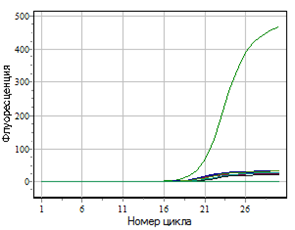
Рисунок 61 — Зависимость флуоресценции канала HEX от номера цикла при исследовании проб №2.6-№2.10 c праймерами для L.monocytogenes
Сравнительная оценка чувствительности использованных методов
Таблица 48 – Сравнение методов по времени постановки
| ГОСТ 32031-2012 Продукты пищевые. Методы выявления бактерий Listeria monocytogenes | Время и температура | Способ выделения листерий из пищевых продуктов // патент № 2068880 (автор Васильев Д.А.) | Время и температура |
| Первичное обогащение | 30°С
48 часов |
Изучаемый пищевой продукт + среда накопления | 28°С
24часа |
| Вторичное обогащение | (37±1) °С
48 часов |
1 мл полученной бактериальной суспензии + 5 мл 0,3% раствора КОН (растворенного в 5% NaCl) высевают параллельно на две плотные селективные среды | (37±1) °С
24 часа |
| Пересев посевного материала, параллельно на две плотные селективные среды | (37±1) °С
(24±3) ч. |
Всего 48 часов | |
| Всего 120 часов | |||
| Подращивание выделенных культур для дальнейшего типирования в течение 24 часов | |||
| Итого 144 часа | Итого 72 часа | ||
В таблице 48 представлены результаты сравнения затраченного времени на выделение листерий из пищевого сырья и продуктов питания с помощью двух апробованных методов. В ходе работы установлено, что способ выделения листерий по патенту № 2068880 сокращает время исследования в 2,5 раза и составляет 72 часа.
Так же в ходе работы мы установили, что чувствительность метода предложенного в ГОСТ 32031-2012 составляет 10000-100000 КОЕ в 1 мл.
Чувствительность способа выделения листерий из пищевых продуктов по патенту № 2068880 составила 10 КОЕ в 1мл.
Для точного типирования выделенных культур, предположительно, относящихся к виду Listeria monocytogenes, мы использовали метод ПЦР в режиме реального времени и ПЦР с электрофоретической детекцией, заменив им стандартные биохимические исследования. Это позволило сократить типирование культур до вида Listeria monocytogenes со 168 часов до 2,5-3 часов.
Таким образом, основываясь на проведенных исследованиях, можно сделать вывод, что оптимальной схемой для выделения листерий из пищевого сырья и продуктов питания будет комбинация методов бактериологического выделения (Способ выделения листерий из пищевых продуктов // патент № 2068880 (автор Васильев Д.А.)) [239] и ПЦР в режиме реального времени.
По предложенной схеме из 264 проб объектов ветеринарно-санитарного надзора, окружающей среды, пищевого сырья и продуктов пттания было выделено 2 штамма, которые были отнесены виду Listeria monocytogenes.
Рисунок 62 — Разработанная схема выделения и идентификации листерий из пищевого сырья и продуктов питания
2.2.4.2 Выделение, селекция листериозных бактериофагов и изучение их биологических свойств
Для выделения бактериофагов листерий из объектов внешней среды нами были получены 200 проб почвы и сточных вод из неблагополучных по листериозу овцеводческих хозяйств Астраханской области. Также мы осуществили забор 48 проб (почвы, сточных вод) ориентируясь на анализ распространения листериозной инфекции в Ульяновской области согласно кадастру, разработанному Меркуловым А.В. и Васильевым Д.А. в 2004 году.
На всех 248 пробах было апробировано 3 метода выделения бактериофагов: прямой метод выделения бактериофага из исследуемого материала, выделение бактериофага методом обогащения «без подсева», выделение бактериофага методом обогащения с «подсевом». В качестве индикаторных использовали 4 культуры: L.monocytogenes 139, L.monocytogenes 9-72, L.monocytogenes 9-127, L.monocytogenes 56.
Результаты представлены на рисунках 63-64.
 |
 |
| Рисунок 63 – Посев по Грациа при выделении бактериофага методом обогащения с «подсевом» из пробы Астрахань 114 на индикаторной культуре
L.monocytogenes 56 |
Рисунок 64 – Посев по Грациа при выделении бактериофага методом обогащения с «подсевом» из пробы Астрахань 114 на индикаторной культуре
L.monocytogenes 56 |
При выделении бактериофага методом обогащения с «подсевом» из пробы Астрахань 114 удалось выделить бактериофаг, однако, стабилизировать его и изучить его биологические свойства не удалось.
Выделение листериозных бактериофагов методом индукции митомицином С
Явление лизогении с помощью митомицина С устанавливали на следующих штаммах листериозных культур: L.monocytogenes 139, L.monocytogenes 766, L.monocytogenes 1196, L.monocytogenes 1213, L.monocytogenes 9-72, L.monocytogenes 9-127, L.monocytogenes 9-128, L.monocytogenes 9-130, L.monocytogenes 129, L.monocytogenes 17/57, L.monocytogenes МД, L.monocytogenes 39, L.monocytogenes 56, L.monocytogenes 122, L.monocytogenes 10522, L.monocytogenes ECDE, L.monocytogenes 35ц, L.monocytogenes C-52, L.monocytogenes 1324, L.monocytogenes I78П, L.monocytogenes C-670, L.monocytogenes 13МП, L.monocytogenes I9I3, L.monocytogenes 80П.
Митомицин С в этом случае является индукционным агентом химического происхождения. Антибиотик в количестве 0,5 мкг/мл засевали вместе с исследуемыми штаммами в пробирки со стерильным МПБ. После инкубации пробирок в течение 6 ч при 28 °С содержимое пробирок центрифугировали (3000 об./мин) и фильтровали через бактериальные фильтры с диаметром пор 0,2 мкм. Полученный фильтрат исследовали на наличие фага на индикаторных культурах L.monocytogenes 56, L.monocytogenes 9-72, L.monocytogenes 9-127, L.monocytogenes 139 модифицированным методом Отто. При использовании стандартной методики индикаторная культура засевается на МПА газоном с помощью шпателя, однако газон листериозных культур слишком слаб, чтобы в последующем установить на его поверхности наличие или отсутствие бактериофага. В связи с этим 16–18-часовую культуру листерий в количестве 1,0 засевали в 2,5 мл 0,65% МПА и выливали верхним слоем на МПА в чашки Петри. После застывания верхнего слоя, чашки делили на три сектора и наносили 20 мкл содержимого исследуемой пробирки, положительный и отрицательный контроли. После того как жидкость впиталась в среду, чашки переворачивали вверх дном и ставали в термостат при 28°С на 18–24 ч. При учете результатов доказательством наличия бактериофага служит полное отсутствие роста культуры в месте попадания капли фильтрата (активный бактериофаг) или появление в этом участке мелких стерильных пятен – колоний бактериофага. С помощью данного метода обнаружить листериозные бактериофаги нам не удалось.
Выделение листериозных бактериофагов методом индукции УФ лучами
В качестве индуцирующего агента физического происхождения использовали ультрафиолетовые лучи (УФ-лучи), источником которых служила ртутно-кварцевая лампа, дающая не менее 90 % излучаемой энергии в виде УФ-лучей с длиной волны 254 нм. Нами были подобраны и проверены 3 схемы выделения бактериофагов. В процессе работы некоторые параметры подбирались нами экспериментально, в частности это касается состава субстрата, расстояния до источника света и времени облучения.
Схема №1 – многократное облучение культур на МПА
Основываясь на литературных данных в данной схеме мы подвергали облучению газон культуры тест-штамма L.monocytogenes на мясопептонном агаре. После получасового подсушивания в термостате при температуре 37ºС на бактериальный газон в чашках Петри воздействовали УФ-лучами излучением с длиной волны 254 нм с расстояния 1,0 м в течение 5 минут.
Подвергнутую облучению чашку термостатировали 24 ч при температуре 38ºС. Через указанное время, чашку просматривали на наличие бактерий. На поверхности агара наблюдался рост отдельных колоний (рисунок 65-66). Затем при помощи шпателя Дригальского растирали выросшую бактериальную массу по поверхности среды до однородного слоя, после чего повторно облучали чашки с тест-штаммом, но уже в течение 10 минут с последующем инкубированием при вышеописанных условиях.

Рисунок 65 – Контроль 24-х часового бактериального газона
из тест-штамма L.monocytogenes – 766

Рисунок 66 – Рост отдельных колоний после воздействия на газон УФ-лучей с излучением 254 нм в течение 5 мин, при расстоянии 1 м до источника излучения




А Б В Г Д
Рисунок 67 – Наличие зоны лизиса выделенных листериозных бактериофагов серии УлГАУ (А — L.m 4, Б — L.m 1, В — L.m 6, Г — L.m 2, Д — L.m 12) на газоне индикаторных культур при нанесении фильтрата по методу Отто на мясопептонном агаре – время инкубирования в термостате 18 часов при температуре 28±1 0С
Действия повторяли в третий раз увеличивая время облучения еще на 5 минут и инкубировали чашки 24 ч при 28 ºС.
Затем содержимое чашек смывали с поверхности МПА при помощи стерильного МПБ или физраствора в количестве 5,0 мл, пропускали полученную суспензию через бактериальные фильтры (0,2 мкм) и исследовали фильтрат на наличие фаговых корпускул модифицированным методом Отто.
С помощью данной схемы выделить бактериофаги листерий нам не удалось.
Схема №2 – однократное облучение культур на МПА
Применяя данную схему, мы опирались на опыт Sword C. P. И Pickett M. J. Облучению подвергали свежеприготовленный газон на МПА приготовленный из выращенной в течении ночи при 37°С культуры тест-штамма L.monocytogenes, с использованием различной экспозиции (с): 20; 40; 60; 120; 180, при этом чашку с газоном помещали на расстоянии 45 см от источника света. Процедуру проводили в полумраке, чтобы избежать фотореактивации. Облученную таким образом чашку инкубировали при 28ºС в течение 18-24 ч, после чего проводили смыв культуры с поверхности агара стерильным МПБ, фильтровали полученную суспензию через бактериальный фильтр (0,2 мкм) в стерильную пробирку. Исследовали фильтрат на наличие фага модифицированным методом Отто.
С помощью данной схемы выделить бактериофаги листерий нам не удалось.
Схема №3 –облучение культур в фосфатном буфере
В данном случае качестве тест-штамма для оптимизации параметров индукции использовали штамм L.monocytogenes – 80П, индикаторным служил референс-штамм L.monocytogenes 56.
Облучению подвергали 4-х часовую бульонную культуру тест-штамма L.monocytogenes – 80П, выращенную при 37°С. Перед облучением бактерии разводили в слабощелочном фосфатном буфере (pH-7,6) в отношении 1:100. Разведенную бактериальную взвесь выливали в чашку Петри с таким расчетом, чтобы толщина облучаемого слоя не превышала 2 мм. Чашки с культурой помещали на расстоянии 40 см от источника излучения и облучали с экспозицией (с) – 20; 30; 40; 60.
Для более равномерного воздействия УФ-лучей на бактериальные клетки чашки во время облучения периодически покачивали. После облучения 50 мкл культуры вносили в мясопептонный бульон комнатной температуры. Облученные листериозные культуры инкубировали при 22°С в течение 16 часов, после чего полученные лизаты пропускали через бактериальные фильтры с диаметром пор 0,2 мкм, выдерживали сутки при комнатной температуре, а затем исследовали на присутствие в них бактериофага. Во время облучения, с целью предохранения обработанных культур от фотореактивации, все манипуляции проводили в затемненном помещении. Выявление индуцированных фагов проводили с индикаторным штаммом модифицированным методом Отто (рисунок 67). Учет результатов осуществляли после 18- часового инкубирования в термостате при 28±1˚С. Присутствие бактериофага, определяли по наличию участков лизиса на равномерном газоне культуры индикаторного штамма.
При отсутствии зон лизиса на фоне бактериального роста в первые сутки, наблюдение за посевами продолжали до 5 суток.
Фаголизаты, полученные после обработки лизогенных бактерий индуцирующими агентами, представляли собой смесь фаговых частиц, обладающих недостаточной активностью, в связи, с чем возникла необходимость получения чистых линий бактериальных вирусов. Выделение однородной популяции листериозных бактериофагов добивались при помощи метода непрерывного пассирования (6-10 пассажей) материала из изолированной колонии с индикаторной культурой на плотной питательной среде. Пассирование фагов продолжали до тех пор, пока на газоне чувствительной культуры не образовывались однородные по морфологии бляшкина протяжении 3-5 последовательных пассажей (рисунок 68).



А Б В Г Д
Рисунок 68 — Формирование негативных колоний выделенных листериозных бактериофагов серии УлГАУ на индикаторных культурах А) L.m 4, Б) L.m 1, В) L.m 6, Г) L.m 2, Д) L.m 12 – время термостатирования 18 часов при температуре 28±1 0С
С помощью предложенной методики было выделено пять листериозных бактериофага – L.m 1, L.m 2, L.m 4, L.m 6, L.m 12 серии УлГАУ. Негативные колонии, образуемые изучаемыми бактериофагами, имели различную морфологию (таблица 49).
Таблица 49 – Морфология бляшкообразующих единиц фагов Listeria
| № п/п | № фага | Колонии фага | Индикаторная культура |
| L.m 1 УлГАУ | Мелкие колонии, диаметром до 0,1, прозрачные, без зоны неполного лизиса | L.m 9-127 | |
| L.m 2 УлГАУ | Колонии диаметром 0,3-0,4, округлые, прозрачные, без зоны неполного лизиса | L.m 9-72 | |
| L.m 4 УлГАУ | Колонии диаметром 0,5-0,7, округлые, прозрачные, без зоны неполного лизиса | L.m 56 | |
| L.m 6 УлГАУ | Колонии диаметром 0,2-0,3, округлые с прозрачным центром и узкой зоной неполного лизиса | L.m 139 | |
| L.m 12 УлГАУ | Колонии диаметром 0,2-0,3, округлые, прозрачные, без зоны неполного лизиса | L.m 9-72 |
Концентрация листериозных бактериофагов. Размножение бактериофагов проводили на плотной питательной среде, фаг и культуру засевали методом агаровых слоев в таком отношении, при котором наблюдается сплошной лизис бактерий (1,0 мл кльтуры : 1,0 мл бактериофага), паролельно ставили контроль по модефицированнному методу стекающей каплей. Верхний слой агара, в котором сконцентрированы фаговые частицы, освободившиеся из клеток в результате лизиса, осторожно смывали стерильным мясопептонным бульоном из расчета 5,0 мл на одну чашку и переносили в стерильную пробирку. Содержимое пробирки ресуспендировали и оставляли на 30-40- минут при комнатной температуре, затем центрифугировали 20 минут при 3000 об/мин, что позволяло освободить фаголизат от крупных частичек агара. Для более полной очистки фагализата, от остатков агара и бактериальных клеток, жидкость повторно центрифугировали при 3000 об/мин 30 мин. С целью получения безбактериального лизата, последний подвергали стерилизующей фильтрации, пропуская с помощью фильтродержателей, через бактериальные мембранные фильтры «Millipore» с диаметром пор 0,22 мкм. Полученные таким образом листериозные бактериофаги, представляющие собой прозрачную желтую жидкость, выдерживали сутки при комнатной температуре, после чего хранили в условиях холодильника.
Литическую активность листериозных бактериофагов серии УлГАУ определяли методом титрования на жидкой среде (по Аппельману) и диффузии в верхнем слое полужидкого агара (методом агаровых слоев по A. Gratia). Посев последовательных разведений бактериофагов с целью повышения точности эксперимента проводили в трех повторностях. Результаты исследований отражены в таблице 50.
Таблица 50 – Литическая активность листериозных бактериофагов
| № | Название изучаемого биологического свойство бактериофага | Результат изучения характерных биологических свойств листериозных бактериофагов | ||||
| L.m 1 | L.m 2 | L.m 4 | L.m 6 | L.m 12 | ||
| 1 | Литическая активность, БОЕ(бляшкообразующих единиц) /мл (по методу агаровых слоев по Грациа) | 1,1±0,1×107 | 1,4±0,1×109 | 2,3±0,1×1010 | 2,2±0,1×108 | 3,2±0,1×107 |
| 2 | Литическая активность (по методу Аппельмана) | 10-6 | 10-8 | 10-9 | 10-7 | 10-6 |
| 3 | Спектр литического действия на культуре (по Отто) | + | +++ | +++ | ++ | ++ |
Специфичность и диапазон литического действия листериозных бактериофагов серии УлГАУ. Изучение специфичности выделенных бактериофагов серии УлГАУ Listeria проводили на культурах рода Listeria: L.monocytogenes, L.ivanovii, L.grayi, L.murrayi, L.innocua, L.seeligeri, L.welshimeri и культурах гетерологичных родов: Erysipelothrix insidiosa, Jonesia dentrificans, Staphylococcus aureus, Rhodococcus equi. Результаты представлены в таблице 51.
Таблица 51 – Диапазон литического действия листериозных бактериофагов серии УлГАУ
| Род (вид) бактерий | Кол-во исслед-ых штаммов | Бактериофаги | |||||||||
| L.m 1 | L. m 2 | L. m 4 | L. m 6 | L. m 12 | |||||||
| % лизируемых культур | Количество штаммов | % лизируемых культур | Количество штаммов | % лизируемых культур | Количество штаммов | % лизируемых культур | Количество штаммов | % лизируемых культур | Количество штаммов | ||
| Listeria spp | 53 | 30,2 | 16 | 49 | 26 | 86,8 | 46 | 54,7 | 29 | 35,8 | 19 |
| L.monocytogenes | 43 | 37,2 | 16 | 62,7 | 26 | 95 | 41 | 67,4 | 29 | 44 | 19 |
| L.ivanovii | 3 | – | 0 | – | 0 | 100 | 3 | – | 0 | – | 0 |
| L.innocua | 2 | – | 0 | – | 0 | – | 0 | – | 0 | – | 0 |
| L.seeligeri | 2 | – | 0 | – | 0 | 100 | 2 | – | 0 | – | 0 |
| L.welshimeri | 1 | – | 0 | – | 0 | – | 0 | – | 0 | – | 0 |
| L.murrayi | 1 | – | 0 | – | 0 | – | 0 | – | 0 | – | 0 |
| L.grayi | 1 | – | 0 | – | 0 | – | 0 | – | 0 | – | 0 |
| Erysipelothrix insidiosa | 1 | – | 0 | – | 0 | – | 0 | – | 0 | – | 0 |
| Jonesia dentrificans | 2 | – | 0 | – | 0 | – | 0 | – | 0 | – | 0 |
| Staphylococcus aureus | 4 | – | 0 | – | 0 | – | 0 | – | 0 | – | 0 |
| Rhodococcus equi | 1 | – | 0 | – | 0 | – | 0 | – | 0 | – | 0 |
Экспериментально установлено, что на чашках Петри, засеянных культурами гетерологичных родов зон лизиса, при нанесении выделенных и селекционированных нами фагов серии УлГАУ, при визуальном осмотре выявлено не было. Однако бактериофаг L.m 4 кроме культур L.monocytogenes, лизировал культуры других гемолитически активных видов листерий L.ivanovii и L.seeligeri.
Опираясь на морфологию негативных колоний и способность полученных бактериофагов к лизису листериозных культур 4 бактериофага мы отнесли к С-мутантам умеренных фагов. У фага L.m 4 УлГАУ отмечена литическая активность в отношении штамма-продуцента, на основании чего мы отнесли его к V-мутантам умеренных фагов. Спектр литического действия бактериофагов устанавливался на 53 культурах бактерий рода Listeria. Культуры для исследований готовили стандартным образом, исследования проводили модифицированным методом Отто. Бактериофаги для эксперимента культивировались на соответствующих индикаторных культурах. Полученные данные свидетельствуют о том, что диапазон литического действия выделенных и селекционированных листериозных бактериофагов серии УлГАУ находится в пределах от 30,2 % до 86,8% из числа всех исследованных культур бактерий рода Listeria. Если брать во внимание, только 43 культуры L.monocytogenes то спектр литического действия листериозных бактериофагов серии УлГАУ находится в пределах от 37,2% до 95%.
Влияние физических и химических факторов на бактериофаги серии УлГАУ. Нами была изучена устойчивость выделенных бактериофагов к воздействию температуры в диапазоне 50-90 0С с интервалом в 3 0С. Нагревание фага проводили на водяной бане в течение 30 минут. Установлено, что температура выше 58 0С резко снижает литическую активность фагов в среднем на 2-3 порядка. Температурный диапазон 63-67 0С не снизил титр фага, который был зафиксирован при 63 0С. При температуре выше 70 0С активность фага не проявлялась. Результаты исследований представлны в таблице 52.
Таблица 52 — Температурная устойчивость листериозных фагов
| № пп | Фаголизат | Воздействие температуры, ºС | ||||||||
| 56 | 58 | 60 | 63 | 65 | 68 | 70 | 75 | 80 | ||
| 1. | L.m 1 УлГАУ | + | + | + | + | + | + | — | — | — |
| 2. | L.m 2 УлГАУ | + | + | — | — | — | — | — | — | — |
| 3. | L.m 4 УлГАУ | + | + | + | — | — | — | — | — | — |
| 4. | L.m 6 УлГАУ | + | + | + | + | + | + | — | — | — |
| 5. | L.m 12 УлГАУ | + | + | — | — | — | — | — | — | — |
| Культура | ||||||||||
| 1. | L.m 9-127 | + | + | — | — | — | — | — | — | — |
| 2. | L.m 9-72 | + | + | — | — | — | — | — | — | — |
| 3. | L.m 56 | + | + | — | — | — | — | — | — | — |
| 4 | L.m 139 | + | + | — | — | — | — | — | — | — |
Для изучения влияния химических факторов на бактериофаги листерий использовали трихлорметан. Опытным путем нами установлено, что титр исследуемых бактериофагов снижался в пределах одного порядка при 40 минутном взаимодействии с трихлорметаном в соотношении 10:1. Результаты исследований представлны в таблице 53.
Таблица 53 — Устойчивость листериозных бактериофагов к воздействию трихлорметана
| № пп | Фаголизат | Временной интервал воздействия трихлорметана в концентрации 1:10, минут | |||||||
| 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | ||
| L.m 1 УлГАУ | + | + | + | + | + | + | + | + | |
| 2. | L.m 2 УлГАУ | + | + | + | + | + | + | + | + |
| 3. | L.m 4 УлГАУ | + | + | + | + | + | + | + | + |
| 4. | L.m 6 УлГАУ | + | + | + | + | + | + | + | + |
| 5. | L.m 12 УлГАУ | + | + | + | + | + | + | + | + |
| Культура | |||||||||
| 1. | L.m 9-127 | - | — | - | — | — | — | — | — |
| 2. | L.m 9-72 | — | — | — | — | — | — | — | — |
| 3. | L.m 56 | — | — | — | — | — | — | — | — |
| 4. | L.m 139 | ||||||||
Изменение титра листериозных фагов серии УлГАУ при хранении
Опытным путем нами установлено, что в течение 3 месяцев показатели литической активности исследуемого бактериофага снижались в пределах одного порядка. Последующие исследования свидетельствуют об относительно невысокой скорости снижения показателя литической активности в пределах 6 месяцев, пока велся мониторинг данного показателя. К окончанию анализируемого периода – 6 месяцев с момента укупоривания — нами было зафиксировано снижение титра фага на 1-2 порядка. Последующее 2-3 кратное пассирование бактериофагов на индикаторных культурах позволяло восстановить исходный титр фага, который был установлен при укупоривании в стерильные флаконы.
По совокупности изученных биологических свойств нами отобран бактериофаг L.m 4 УлГАУ, как наиболее перспективный фаг для биоконтроля L. monocytogenes в пищевом сырье и продуктах питания.
2.2.5. Бактерии Yersinia enterocolitica и специфичные им бактериофаги
2.2.5.1. Выделение Yersinia enterocolitica из окружающей среды и продуктов растительного происхождения
Yersinia enterocolitica — это желудочно-кишечный патоген, вызывающий иерсиниоз, заболевание, характеризующееся диареей, илеитом и брыжеечным лимфаденитом. Y. enterocolitica передается фекально-оральным путем при употреблении загрязненной пищи или воды. Было разработано несколько фенотипических и генотипических методов для надежного выявления Y. enterocolitica в пищевых продуктах []. Тем не менее, источник инфекции многих зарегистрированных пищевых вспышек остается неясным. Обнаружение этого патогена в продуктах питания является сложной задачей, так как он имеет сходство с другими кишечными бактериями. Присутствие других микроорганизмов в образцах пищи делает выявление, этого медленно растущего патогенна, еще более трудным. Поэтому в настоящее время основной упор делается на разработку чувствительных, быстрых и надежных методов, позволяющих быстро и экономически эффективно характеризовать образцы пищевых продуктов.
Целью исследований стало выделение Yersinia enterocolitica из окружающей среды, пищевых продуктов, животного и растительного сырья и разработка ускоренной бактериологической схемы их выделения.
Пробы продуктов растительного происхождения отбирали в количестве 25 г, измельчали предварительно прокипяченными ножницами на мелкие кусочки и вносили в колбы со 100 мл И-бульона, закрывали стерильными резиновыми пробками и тщательно встряхивали в течение 15 минут. После чего инкубировали колбы при температуре 32±1 о С в течении 24 часов.
После чего, культуры полученные в И-бульоне пересевали петлей, частыми широкими штрихами в отдельные чашки Петри с Ирсиния агаром по всей поверхности агара и инкубировали 24 часа при температуре 28 о С. Через сутки наблюдали рост на чашках Петри. Только содержимое 4 колб образовывали рост колоний диаметром от 0,5-1 мм, темно-зеленого цвета, округлые, глянцевые, цвет среды при этом не изменялся. Результаты представлены на рисунках 69-74. Другие пробы либо не давали роста вообще, либо образовываемые колонии не имели сходства с ростом Yersinia enterocolitica на Ирсиния агаре.
Далее типичные для Yersinia enterocolitica колонии с Ирсиния агара красили по Граму параллельно отсевая в бульон. Засеянные пробирки инкубировали при 37 о С в течении 24 часов для дальнейшего изучения морфологических, тинкториальных и биохимических свойств.
Культуры в мазках окрашенных по Грамму были представлены грамотрицательными палочками. Результаты представлены на рисунках 7-10. Для изучения биохимических свойств производили посевы на среды Гисса. Все штаммы ферментировали глюкозу, сахарозу, маннит, сорбит, мальтозу и не ферментировали лактозу. Результаты представлены в таблице 54.
 |
 |
 |
 |
||
| Рисунок 69 – рост пробы 3 на Ирсиния агаре | Рисунок 70 – рост пробы 7 на Ирсиния агаре | Рисунок 71 – рост пробы 8 на Ирсиния агаре | Рисунок 72 – рост пробы 16 на Ирсиния агаре | ||
 |
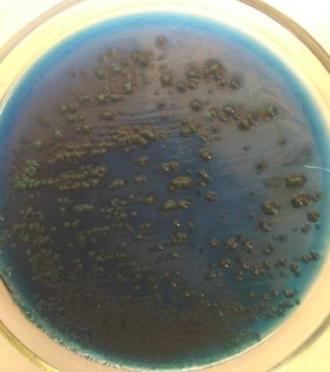 |
||||
| Рисунок 73 – рост пробы 18 на Ирсиния агаре | Рисунок 74– рост пробы 2 на Ирсиния агаре | ||||
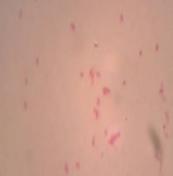 |
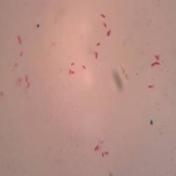 |
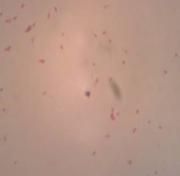 |
 |
||
| Рисунок 75 – микроскопическая картина культуры из пробы 3 | Рисунок 76 – микроскопическая картина культуры из пробы 7 | Рисунок 77 – микроскопическая картина культуры из пробы 8 | Рисунок 78 – микроскопическая картина культуры из пробы 16 | ||
Таблица 54 – Результаты ферментирования углеводов
| Углеводы | Проба №3 | Проба №7 | Проба №8 | Проба №16 |
| Лактоза | — | — | — | — |
| Глюкоза | + | + | + | + |
| Маннит | + | + | + | + |
| Сахароза | + | + | + | + |
| Сорбит | + | + | + | + |
| Мальтоза | + | + | + | + |
Таблица 55 – Результаты проведения энтеротеста
| Колонка | Тест | Проба №3 | Проба №7 | Проба №8 | Проба №16 |
| 1 | |||||
| H | Индол | — | — | — | — |
| G | Сероводород | — | — | — | — |
| F | Лизин | + | + | + | + |
| E | Орнитин | + | + | + | + |
| D | Уреаза | + | + | + | + |
| C | Аргинин | + | + | + | + |
| B | Цитрат Симмонса | + | + | + | + |
| A | Маллонат | + | + | + | + |
| 2 | |||||
| H | Фенилаланин | — | — | — | — |
| G | В-галактосидаза | + | + | + | + |
| F | Инозитол | — | — | — | — |
| E | Адонитол | — | — | — | — |
| D | Целлобиоза | + | + | + | + |
| C | Сахароза | + | + | + | + |
| B | Трегалоза | + | + | + | + |
| A | Маннитол | + | + | + | + |
| 3 | |||||
| H | Ацетоин | — | — | — | — |
| G | Эскулин | + | + | + | + |
| F | Сорбитол | + | + | + | + |
| E | Рамноза | — | — | — | — |
| D | Мелибиоза | — | — | — | — |
| C | Рафиноза | — | — | — | — |
| B | Дульцит | — | — | — | — |
| A | Глюкоза | + | + | + | + |
В набор Энтеротест 24 входят 40 отдельных стрипов, каждый из которых содержит 24 биохимических теста для. В таблице 55 и на рисунках 79-80 представлены результаты теста. В качестве контроля использовали стерильный бульон.
 |
 |
| Рисунок 79 – Контроль | Рисунок 80 – Результаты энтеротеста |
Рисунок 81 – Схема выделения и идентификации Y. enterocolitica
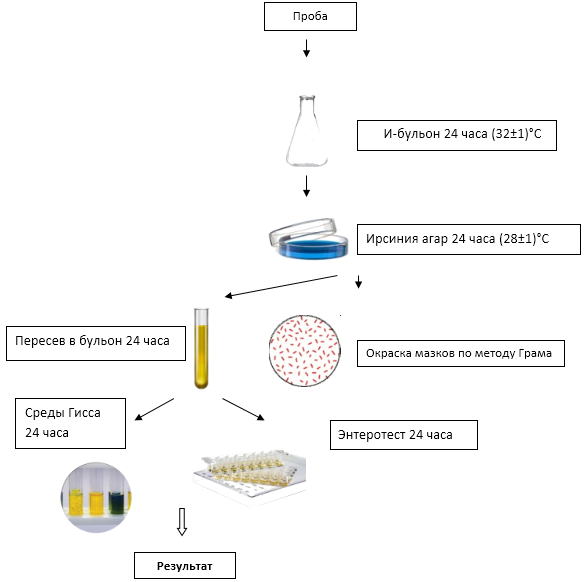
Таким образом, нами исследовано 20 проб пищевого сырья и продуктов растительного происхождения. На основании проведенных культуральных, морфологических и биохимических свойств установлено, что 4 выделенных штамма из проб №3, №7, №8, №16 принадлежат к бактериям вида Yersinia enterocolitica.
Для проведения дальнейших исследований по выделению Yersinia enterocolitica нами предложена схема, которая позволит выделить иерсинии без первичного холодового обогащения или использования метода «холодового шока» за 96 часов.
2.2.5.2. Выделение, селекция бактериофагов Y. enterocolitica и изучение их биологических свойств
При работе с индикаторными культурами первым шагом является проверка штаммов их на способность к лизогении, как к спонтанной (без индуцирующего агента) так в присутствии физических и химических индуцирующих факторов.
Для начала использовали методику, для выделения бактериофагов из бактерий вида Y. enterocolitica без воздействия на них индуцирующего фактора. В результате проведенных экспериментов свободного фага из культур бактерий вида Y. enterocolitica выявлено не было (таблица 56).
Далее на исследуемые культуры, воздействовали индуцирующим фактором. В качестве индуцирующих агентов использовали ультрафиолетовые лучи (УФ-лучи) и митомицин С.
Источником УФ-лучей служила ртутно-кварцевая лампа, дающая не менее 90 % излучаемой энергии, с длиной волны 254 нм. На суточные культуры Y. enterocolitica разведенные в фосфатном буфере в отношении 1:100 воздействовали УФ-лучами от 20 до 50 секунд с интервалами в 10 секунд. Облученные взвеси культур термостатировали, после чего смешивали со индикаторными штаммами в отношении 1:200, выдерживали в термостате в течение 18-20 часов при 28˚С, после чего фильтровали через бактериальные фильтры с диаметром пор 0,2 мкм. Полученный фильтрат исследовали на наличие фага культурах Y. enterocolitica методом Отто. В наших опытах установлено, что воздействии ультрафиолетовых лучей на бактерии Y. enterocolitica не приводило к появлению зон лизиса (таблица 57).
В качестве химического агента воздействия использовали митомицин С в дозе 0,5 мкг/мл. Исследуемые штаммы засевали в пробирки со стерильным МПБ, с содержанием 0,5 мкг/мл митомицина С. После инкубации пробирок в течение 6 ч при 28 °С содержимое пробирок центрифугировали (5000 об./мин) и фильтровали через бактериальные фильтры с диаметром пор 0,2 мкм. Суспензии индикаторных штаммов Y. enterocolitica наносили в объеме 0,5 мл на поверхность питательного агара в чашках Петри и втирали досуха шпателем. Чашки делили на 4 сектора, на которые наносили по 20 мкл содержимого пробирок. После инкубации чашек в течение 24 ч при 28 °С зон лизиса на бактериальном газоне обнаружено нами не было, что свидетельствует об отрицательном результате (таблица 57).
Анализируя полученные данные, можно утверждать, что мы не обнаружили явления выхода свободного фага и перехода профага в свободный фаг у имеющихся штаммов бактерий по данным схемам.
Таблица 56 — Исследование культур Y. enterocolitica на наличие профага с использованием индуцирующего фактора и без него
| № пп | Штаммы
Y. enterocolitica |
Наличие негативных колоний или лизиса | |||||
| Воздействие УФ-лучей | Воздействие митомицином С | Выделение свободного фага | |||||
| 20 сек | 30 сек | 40 сек | 50 сек | ||||
| 1 | Y. enterocolitica Ye – 3 | — | — | — | — | — | — |
| 2 | Y. enterocolitica Ye – 7 | — | — | — | — | — | — |
| 3 | Y. enterocolitica Ye – 8 | — | — | — | — | — | — |
| 4 | Y. enterocolitica Ye – 16 | — | — | — | — | — | — |
Далее наши исследования были направлены на выделение бактериофагов Y. enterocolitica из объектов внешней среды.
Жидкие пробы (бытовые сточные воды, воду открытых водоемов) фильтровали через бумажный фильтр для освобождения от механических примесей в случае необходимости. В 1,0 литровую колбу, содержащую стерильный, МПБ в количестве 0,5 литра, вносили 50,0 мл фильтрата либо навеску 50,0 г, в случаях исследования фекалий животных и проб почвы с выгульных площадок для животных и по 1,0 мл, индикаторных штаммов бактерий. Колбу инкубировали в термостате в течении 24 часов при 37°С. После этого содержимое колбы разливали в пробирки, центрифугировали при 3000 об/мин в течении 30 минут, шприцом отбирали надосадочную жидкость и фильтровали с помощью бактериального фильтра в стерильную пробирку. Фильтраты исследовали по методу Отто. Чашки помещали в термостат на 18-20 часов при 37°С. Наличие негативных колоний или зон лизиса на газоне роста индикаторной культуры свидетельствует о присутствии в исследуемом материале бактериофага (рисунок 81).

Рисунок 81 — Негативные колонии фага в зоне «стекающей капли».
При исследовании 30 проб объектов внешней среды удалось по указанной схеме выделить 5 изолятов фагов Y. enterocolitica.
Селекцию бактериофагов и повышение их литической активности проводили пассированием фага на индикаторной культуре по методике, описанной и использованной И.М. Габриловичем и С.Н. Золотухиным.
С зоны – изолированной негативной колонии бактериологической петлей брали материал и вносили в пробирку с 4,5 мл МПБ, туда же вносили 0,5 мл 16-18 часовой индикаторной культуры. В качестве контроля использовали стерильным МБП куда вносили 0,5 мл индикаторной культуры. Обе пробирки термостатировали при 37 0С. Время культивирования подбирали визуально в диапазоне от 4 до 7 часов с интервалом 30 минут. Ориентиром завершения пассажа было наличие роста (помутнение среды) в контрольной пробирке. Результаты исследований представлены в таблице 57.
Таблица 57 – Подбор оптимального времени пассирования ирсиниозных фагов на индикаторной культуре.
| № пп | Фаг | Время культивирования, ч | ||||||
| 4,0 | 4,5 | 5,0 | 5,5 | 6,0 | 6,5 | 7,0 | ||
| 1 | Yee7 | — | — | — | — | + | + | + |
| 2 | Yee12 | — | — | — | — | + | + | + |
| 3 | Yee14 | — | — | — | — | + | + | + |
| 4 | Yee17 | — | — | — | — | + | + | + |
| 5 | Yee21 | — | — | — | — | + | + | + |
Таким образом, 6 часов достаточно для культивирования выделенных фагов на индикаторных культурах Y. enterocolitica.
Следующим этапом работы служил подбор оптимального способа освобождения фаголизата от клеток индикаторной культуры.
Стандартно для этих целей применяют прогревание, обработку трихлорметаном или фильтрацию через бактериальные фильтры. Для установления чувствительности ил устойчивости фагов к воздействию трихлорметана и оценке возможности применения этого метода для инактивации бактериальных клеток обрабатывали фаголизат хлороформом в соотношении 10:1 при постоянном помешивании в течение 5 – 40 минут с 5 минутным интервалом. После чего устанавливали активность исследуемых фагов методом Отто. Наличие зон лизиса свидетельствовало об устойчивости фагов к воздействию хлороформа. Результаты представлены в таблице 58.
Таблица 58 — Устойчивость бактериофагов бактерий Y. enterocolitica к
воздействию трихлорметана
| № пп | Фаголизат | Временной интервал воздействия трихлорметана в концентрации 1:10, минут | |||||||
| 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | ||
| Yee7 | + | + | + | + | + | + | + | + | |
| 2. | Yee12 | + | + | + | + | + | + | + | + |
| 3. | Yee14 | + | + | + | + | + | + | + | + |
| 4. | Yee17 | + | + | + | + | + | + | + | + |
| 5. | Yee21 | + | + | + | + | + | + | + | + |
| Культура | |||||||||
| 1. | Y. enterocolitica Ye – 3 | - | — | - | — | — | — | — | — |
| 2. | Y. enterocolitica Ye – 7 | — | — | — | — | — | — | — | — |
| 3. | Y. enterocolitica Ye – 8 | — | — | — | — | — | — | — | — |
| 4 | Y. enterocolitica Ye – 16 | — | — | — | — | — | — | — | — |
В результате эксперимента установлено, что индикаторные культуры бактерий Y. enterocolitica не выдерживали воздействие трихлорметана даже при минимальной временной экспозиции, в то время как все 5 исследуемых фагов проявили выраженную устойчивость к воздействию хлороформа в течение 40 минут, что позволяет использовать данный способ для очистки ирсиниозных бактериофагов от индикаторных культур.
Следующим способом очистки фаголизата является его прогревание в течении фиксированного времени (30 минут), которое приводит к уничтожению бактерий и не влияет на литическую активность фагов.
Определение температурной устойчивости иерсиниозных фагов проводили по следующей схеме: 11 пробирок с фагом в разведении 1:10 с МПБ прогревали на водяной бане в течение 30 минут при температуре в интервале от 56 до 80 оС с шагом 2 – 3 оС. После прогревания активность бактериофага определяли по методу Отто на индикаторных культурах.
В результате исследований было установлено (табл. 59), что прогревание индикаторных культур в течение 30 минут при температуре 58 оС ведет к их полной инактивации, однако бактериофаги Yee12, Yee21 и Yee14 так же не обладают термостабильностью и погибают при воздействии температуры выше 60оС. В то время как тридцатиминутное воздействие на бактериофаги Yee7 и Yee17 даже температурой 70 оС оставляет их жизнеспособными.
Таблица 59 — Температурная устойчивость бактериофагов бактерий Y. enterocolitica
| № пп | Фаголизат | Воздействие температуры, ºС | ||||||||
| 56 | 58 | 60 | 63 | 65 | 68 | 70 | 75 | 80 | ||
| 1. | Yee7 | + | + | + | + | + | + | + | — | — |
| 2. | Yee12 | + | + | — | — | — | — | — | — | — |
| 3. | Yee14 | + | + | + | — | — | — | — | — | — |
| 4. | Yee17 | + | + | + | + | + | + | + | + | + |
| 5. | Yee21 | + | + | — | — | — | — | — | — | — |
| Культура | ||||||||||
| 1. | Y. enterocolitica Ye – 3 | + | — | — | — | — | — | — | — | — |
| 2. | Y. enterocolitica Ye – 7 | + | — | — | — | — | — | — | — | — |
| 3. | Y. enterocolitica Ye – 8 | + | — | — | — | — | — | — | — | — |
| 4. | Y. enterocolitica Ye – 16 | + | — | — | — | — | — | — | — | — |
В связи с полученными данными и отсутствием универсальной составляющей для всех выделенных ирсиниозных бактериофагов по показателю устойчивости к воздействию температуры, мы не можем рекомендовать этот способ как оптимальный. Воздействие на фаголизаты трихлорметаном являются эффективным способам очистки его от индикаторной культуры, однако время обработки и время подготовки к ней складывается в существенные временные затраты, поэтому в последующей работе для очистки фаголизатов мы использовали бактериальные фильтры с диаметром пор 0,2 мкм.
При установлении технологических параметров культивирования ириниозых фагов с индикаторной культурой обращали внимание на время (оптимальное время пассажа 6 часов) и температуру (оптимальная температура 36±1 оС) культивирования. Шестикратное пассирование фагов на индикаторной культуре при применении определенных параметров соотношения культуры и фага (таблица 60) в 4,5 мл стерильного МПБ, позволило нам получить достаточное количество фаголизата для исследований.
Таблица 60 – Подбор оптимального соотношения выделенных фагов и индикаторных культур и технологические параметры их культивирования
| № пп | Фаг | Технологические параметры культивирования | Оптимальное соотношение выделенного бактериофага и 18±2 часовой индикаторной культуры при концентрации микробных клеток равной не ниже n х106(КОЕ/мл) | |
| временной интервал, ч | температурный режим, 0С | |||
| 1. | Yee7 | 6 | 36±1 | 0,2 мл / 0,5 мл |
| 2. | Yee12 | 6 | 36±1 | 0,2 мл / 0,2 мл |
| 3. | Yee14 | 6 | 36±1 | 0,2 мл / 1,0 мл |
| 4. | Yee17 | 6 | 36±1 | 0,2 мл / 0,5 мл |
| 5. | Yee21 | 6 | 36±1 | 0,2 мл / 0,5 мл |
Очищенные фаголизаты хранили в условиях бытового холодильника при температуре 2-4 0С.
В результате исследований 30 проб объектов внешней среды удалось выделить 5 изолятов фагов активных в отношении бактерий Y. enterocolitica . Объектами выделения были сточные воды свиноводческих ферм и животноводческих комплексов, сточные воды канализации и фекалии животных.
Селекцию бактериофагов проводили пассированием изолированных негативных колоний на МПА с периодическим отвивкой их на МПБ. Оптимальное соотношение культивирования фаг/культура от 1:1 до 1:5 для разных фагов, время пассажа – 6 часов при температуре 36±1 0С. Для очистки фагов от бактериальных клеток применяли различные методы (обработка трихлорметаном, прогревание, фильтрация), но оптимальным посчитали фильтрацию через бактериальные фильтры с диаметром пор 0,2 мкм.
Морфология негативных колоний
Морфологию негативных колоний фагов изучали, при посевах фагов методом агаровых слоев. В пробирку с расплавленным 0,7% МПА вносили 1мл фага в разведении 109 и 0,5 мл индикаторной суточной бульонной культуры. Содержимое пробирки тщательно перемешивали и выливали на поверхность 1,5% МПА. После застывания агара чашки помещали в термостат. Учет производился спустя сутки после инкубации при температуре 37°С. Негативные колонии, образуемые изучаемым бактериофагами имеют различную морфологию. Результаты представлены, а таблице 61 и на рисунках 82-76.
Таблица 61 — Описание морфологии негативных колоний фагов Y. enterocolitica
| № фага | Колонии фага | Индикаторная культура |
| Yee7 | Колонии диаметром 0,7-0,8, с прозрачным центром и с широкой зоной неполного лизиса | Y. enterocolitica Ye – 3 |
| Yee12 | Колонии диаметром 1,0-1,5, прозрачные, без зоны неполного лизиса | Y. enterocolitica Ye – 8 |
| Yee14 | Колонии диаметром 0,5-0,7, прозрачные, с узкой зоной неполного лизиса | Y. enterocolitica Ye – 7 |
| Yee17 | Колонии диаметром 0,2-0,3, прозрачные, без зоны неполного лизиса | Y. enterocolitica Ye – 3 |
| Yee21 | Колонии диаметром 0,9-1,0 с прозрачным центром диаметром и узкой зоной неполного лизиса | Y. enterocolitica Ye – 16 |
 |
 |
| Рисунок 82 – Морфология негативных колоний ирсиниозного фага — Yee21 | Рисунок 83 – Морфология негативных колоний ирсиниозного фагаYee12 |
 |
 |
| Рисунок 84 – Морфология негативных колоний ирсиниозного фага Yee17 | Рисунок 85 – Морфология негативных колоний ирсиниозного фага Yee14 |
 |
Рисунок 86 – Морфология негативных колоний ирсиниозного фага Yee7 |
Определение литической активности ирсиниозных фагов
Литическая активность бактериофага оценивается по его способности вызывать лизис бактериальной культуры в жидких или на плотных питательных средах, выражается это максимальным разведением, в котором испытуемый бактериофаг проявил своё литическое действие.
Культуры бактерий вида Y. enterocolitica для определения литической активности бактериофагов, выращивали на стандартном мясопептонном бульоне в течение 18-20 часов. Литическую активность селекционированных бактериофагов определяли по методу Аппельмана и Грация. Результаты исследования литической активности выделенных фагов представлены в таблице 62. Активность исследуемых бактериофагов варьировала от 1,7±0,1×105 до 1,8±0,1×1010 корпускул в 1 мл.
Для повышения исходной литической активности выделенных ирсиниозных фагов мы использовали метод многократного пассирования фага с индикаторной культурой на плотной питательной среде. Этот метод отличается от методов селекции тем, что фаг засевается с культурой в максимальной концентрации (1,0 мл фага : 1,0 мл культуры) для получения тотального лизиса бактериального газона, смывается небольшим объемом жидкости (до 5,0 мл), после чего фаголизат очищается и манипуляции повторяются по вышеописанной схеме.
Таблица 62 — Литическая активность бактериофагов Y. enterocolitica
| № пп | Название фага | Активность по Аппельману | Активность по Грациа, корпускул в 1 мл |
| 1 | Yee7 | 10-3 | 2,1±0,1×107 |
| 2 | Yee12 | 10-6 | 1,8±0,1×1010 |
| 3 | Yee14 | 10-4 | 1,7±0,1×107 |
| 4 | Yee17 | 10-3 | 2,8±0,1×106 |
| 5 | Yee21 | 10-5 | 1,7±0,1×105 |
Таким образом, удалось повысить исходную литическую активность некоторых исследуемых фагов в среднем на 1-2 порядка. Результаты представлены в таблице 63.
Таблица 63 — Литическая активность бактериофагов Y. enterocolitica после применения метода концентрации
| № пп | Название фага | Индикаторная культура | Активность по Аппельману | Активность по Грациа, корпускул в 1 мл |
| 1 | Yee7 | Y. enterocolitica Ye – 3 | 10-7 | 1,2±0,1×108 |
| 2 | Yee12 | Y. enterocolitica Ye – 8 | 10-9 | 1,9±0,1×1010 |
| 3 | Yee14 | Y. enterocolitica Ye – 7 | 10-8 | 3,8±0,1×109 |
| 4 | Yee17 | Y. enterocolitica Ye – 3 | 10-6 | 2,8±0,1×108 |
| 5 | Yee21 | Y. enterocolitica Ye – 16 | 10-6 | 1,7±0,1×107 |
Диапазон литического действия исследуемых фагов Y. enterocolitica
Диапазон литического действия – это одна их характерных особенность штаммов фага. Для изучения спектра литической активности селекционированных фагов мы использовали 34 референс и полевых штаммов Y. enterocolitica из музея кафедры микробиологии, вирусологии, эпизоотологии и ВСЭ ФГБОУ ВО Ульяновского ГАУ и 3 штамма Y. enterocolitica выделенные нами самостоятельно в ходе исследований из объектов внесшей среды.
Определение этого показателя проводили методом нанесения фага на газон бактериальной культуры по методу Отто. На поверхность МПА в чашках Петри пипеткой наносили 1 мл суточной бульонной культуры исследуемых микроорганизмов. Затем равномерно распределяли по поверхности среды. Чашки ставили в термостат для подсушивания на 15-20 минут. На поверхность засеянной среды пипеткой наносили 1 каплю фага и наклоняли, чтобы капли стекли, а затем инкубировали при температуре 37°С, оценку результатов проводили через 18-20 часов. Результаты представлены в таблице 64 и на рисунке 87.
Бактериофаги активные в отношении Y. enterocolitica, обладает спектром действия от 32,4% до 91,9%. Совокупный процент лизиса всех 5 фагов составляет 100%.
Специфичность действия ирсиниозных бактериофагов
Видовая специфичность фагов используется в практике для дифференциации бактерий. Эта способность фагов определяется, прежде всего, их сродством к рецепторам лизируемых бактерий.

Рисунок 87 – Положительный результат при исследовании спектра литической активности ирсиниозного фага Yee14 на культуре Yersinia enterocolitica 45 УГСХА. Метод Отто.
Таблица 64 – Изучение спектра литического действия ирсиниозных бактериофагов
| № пп | Название культуры | Наличие лизиса на газоне культуры при нанесении фага | ||||
| Yee7 | Yee12 | Yee14 | Yee17 | Yee21 | ||
| 1. | Yersinia enterocolitica О 9 | — | + | + | + | — |
| 2. | Yersinia enterocolitica 09 | — | + | + | + | — |
| 3. | Yersinia enterocolitica О 9H | — | + | + | + | — |
| 4. | Yersinia enterocolitica 03 | + | — | + | — | — |
| 5. | Yersinia enterocolitica О 8 | + | + | + | — | — |
| 6. | Yersinia enterocolitica О 8S | + | + | + | — | — |
| 7. | Yersinia enterocolitica О 8R | + | + | + | — | + |
| 8. | Yersinia enterocolitica О 630 | + | — | + | — | — |
| 9. | Yersinia enterocolitica О 631 | + | — | + | — | — |
| 10. | Yersinia enterocolitica О 631R | + | — | + | — | — |
| 11. | Yersinia enterocolitica 0527 | — | — | + | + | + |
| 12. | Yersinia enterocolitica О 24R | + | + | + | + | + |
| 13. | Yersinia enterocolitica 1 УГСХА | + | — | + | — | — |
| 14. | Yersinia enterocolitica 2 УГСХА | + | + | + | — | — |
| 15. | Yersinia enterocolitica 3 УГСХА | — | — | + | + | + |
| 16. | Yersinia enterocolitica 5 УГСХА | — | + | + | — | — |
| 17. | Yersinia enterocolitica 6 УГСХА | + | — | + | — | — |
| 18. | Yersinia enterocolitica 12 УГСХА | — | — | + | + | + |
| 19. | Yersinia enterocolitica 14 УГСХА | + | + | — | — | — |
| 20. | Yersinia enterocolitica 18 УГСХА | + | + | + | + | + |
| 21. | Yersinia enterocolitica 22 УГСХА | + | — | + | — | — |
| 22. | Yersinia enterocolitica 27 УГСХА | — | + | + | — | + |
| 23. | Yersinia enterocolitica 28 УГСХА | + | + | + | — | + |
| 24. | Yersinia enterocolitica 34 УГСХА | — | — | + | — | — |
| 25. | Yersinia enterocolitica 35 УГСХА | + | + | + | — | — |
| 26. | Yersinia enterocolitica 36 УГСХА | + | — | + | — | + |
| 27. | Yersinia enterocolitica 41 УГСХА | — | — | — | + | — |
| 28. | Yersinia enterocolitica 44 УГСХА | + | + | + | — | + |
| 29. | Yersinia enterocolitica 45 УГСХА | + | — | + | — | — |
| 30. | Yersinia enterocolitica 47 УГСХА | + | + | + | — | — |
| 31. | Yersinia enterocolitica 58 УГСХА | — | — | + | — | + |
| 32. | Yersinia enterocolitica 59 УГСХА | + | + | + | + | + |
| 33. | Yersinia enterocolitica 62 УГСХА | + | + | + | — | — |
| 34. | Yersinia enterocolitica 63 УГСХА | — | — | — | + | — |
| 35. | Y. enterocolitica Ye – 3 | + | + | + | + | + |
| 36. | Y. enterocolitica Ye – 8 | + | + | + | — | + |
| 37. | Y. enterocolitica Ye – 7 | — | + | + | — | — |
| 38. | Y. enterocolitica Ye – 3 | — | + | + | + | — |
| Количество лизируемых культур | 24 | 21 | 34 | 12 | 14 | |
| Процент лизиса | 64,8 | 56,7 | 91,9 | 32,4 | 37,8 | |
Примечание: «+» — положительный результат
«-» — отрицательный результат
Определение видовой специфичности изучаемого бактериофага проводили на агаровых средах путём нанесения фага на газон гетерологичных культур по методу Отто.
При исследовании специфичности изучаемых фагов использовали следующие виды и роды бактерий: Yersinia pseudotuberculosis, Providenvia spp., Escherichia spp., Citrobacter spp., Enterobacter spp., Klebsiella spp., Salmonella spp., Proteus spp., Pseudomonas spp.
Установлено, что изучаемые ирсиниозные бактериофаги не лизировали ни одну из испытуемых 56 культур бактерий других родов и видов. На основании полученных результатов можно сделать вывод, что исследуемые фаги является специфичными к бактериям вида Y. enterocolitica и не активны в отношении других видов бактерий. Результаты представлены в таблице 65.
Таблица 65 – Результаты изучения специфичности ирсиниозных фагов
| № пп | Род бактерий | Кол-во штаммов | Бактериофаги | ||||
| Yee7 | Yee12 | Yee14 | Yee17 | Yee21 | |||
| Количество лизируемых штаммов | |||||||
| 1 | Yersinia pseudotuberculosis | 2 | — | — | — | — | — |
| 2 | Providenvia spp. | 2 | — | — | — | — | — |
| 3 | Escherichia spp. | 8 | — | — | — | — | — |
| 4 | Citrobacter spp. | 3 | — | — | — | — | — |
| 5 | Enterobacter spp. | 6 | — | — | — | — | — |
| 6 | Klebsiella spp. | 8 | — | — | — | — | — |
| 7 | Salmonella spp. | 4 | — | — | — | — | — |
| 8 | Proteus spp. | 20 | — | — | — | — | — |
| 9 | Pseudomonas spp. | 3 | — | — | — | — | — |
| 10 | Y. enterocolitica | 37 | 24 | 21 | 34 | 12 | 14 |
Примечание: «+» — лизис культуры;
«-» — отсутствие лизиса.
Изменение литической активности при хранении
В процессе изучения биологических свойств ирсиниозных бактериофагов, нами были исследованы изменения их литической активности при хранении. Для этого закрытые в стерильные флаконы без добавления консерванта бактериофаги хранили в условиях бытового холодильника (2-4 0С). Учет результатов проводили в течении 32 месяцев с интервалом 3 месяца. Результаты исследований представлены в таблице 66.
Таблица 66 – Изменение литической активности ирсиниозных бактериофагов при хранении
| № пп | Фаг | Литическая активность, БОЕ /мл (по Грациа) | |||
| перед закупориванием | через 1 месяц | через 3 месяца | |||
| 1 | Yee7 | 1,2±0,1×108 | 1,0±0,1×108 | 1,0±0,1×108 | |
| 2 | Yee12 | 1,9±0,1×1010 | 1,5±0,1×1010 | 1,2±0,1×1010 | |
| 3 | Yee14 | 3,8±0,1×109 | 3,6±0,1×109 | 3,5±0,1×109 | |
| 4 | Yee17 | 2,8±0,1×108 | 2,8±0,1×108 | 2,7±0,1×108 | |
| 5 | Yee21 | 1,7±0,1×107 | 1,6±0,1×107 | 1,5±0,1×107 | |
| Фаг | Литическая активность, БОЕ /мл (по Грациа) | ||||
| через 6 месяцев | через 9 месяца | через 12 месяцев | |||
| 6 | Yee7 | 0,9±0,1×108 | 0,6±0,1×108 | 0,6±0,1×108 | |
| 7 | Yee12 | 1,1±0,1×1010 | 0,8±0,1×1010 | 0,7±0,1×1010 | |
| 8 | Yee14 | 3,2±0,1×109 | 2,8±0,1×109 | 1,9±0,1×109 | |
| 9 | Yee17 | 2,5±0,1×108 | 2,3±0,1×108 | 1,7±0,1×108 | |
| 10 | Yee21 | 1,3±0,1×107 | 1,2±0,1×107 | 1,0±0,1×107 | |
| Фаг | Литическая активность, БОЕ /мл (по Грациа) | ||||
| через 15 месяцев | через 18 месяцев | через 21 месяц | |||
| 11 | Yee7 | 8,4±0,1×107 | 6,9±0,1×107 | 5,7±0,1×107 | |
| 12 | Yee12 | 7,1±0,1×109 | 6,7±0,1×109 | 5,4±0,1×109 | |
| 13 | Yee14 | 1,2±0,1×109 | 8,6±0,1×108 | 6,1±0,1×108 | |
| 14 | Yee17 | 1,5±0,1×108 | 0,9±0,1×108 | 6,3±0,1×107 | |
| 15 | Yee21 | 8,1±0,1×106 | 7,0±0,1×106 | 3,2±0,1×106 | |
| Фаг | Литическая активность, БОЕ /мл (по Грациа) | ||||
| через 24 месяца | через 28 месяцев | через 32 месяцев | |||
| 16 | Yee7 | 4,5±0,1×107 | 5,3±0,1×106 | 1,2±0,1×106 | |
| 17 | Yee12 | 3,2±0,1×109 | 8,8±0,1×108 | 4,7±0,1×108 | |
| 18 | Yee14 | 4,1±0,1×108 | 2,2±0,1×108 | 7,8±0,1×107 | |
| 19 | Yee17 | 4,6±0,1×107 | 2,3±0,1×107 | 1,3±0,1×107 | |
| 20 | Yee21 | 3,0±0,1×106 | 2,6±0,1×106 | 2,1±0,1×106 | |
Установлено, что в течение 32 месяцев показатели литической активности исследуемых бактериофагов снижались в среднем на 1-2 порядка. Последующее 3-5 кратное пассирование бактериофагов с индикаторными культурами на плотной питательной среде позволяло восстановить исходный титр фага, который был установлен при укупоривании в стерильные флаконы.
В результате проведенных исследований была создана коллекция из 5 вирулентных бактериофагов активных в отношении бактерий вида Y. enterocolitica, выделенных из объектов внешней среды. Бактериофаги охарактеризованы нами по биологическим свойствам, на основании результатов этих исследований для дальнейшей работы, как наиболее перспективные для конструирования терапевтического биопрепарата нами были отобраны фаги – Yee7, Yee12 и Yee14, которой присвоено название «серия УлГАУ».
2.2.5.3 Исследование взаимодействия выделенных бактериофагов с индикаторными культурами Y. enterocolitica
Адсорбцию выделенных и отобранных для дальнейших исследований ирсиниозных бактериофагов изучали при взаимодействии их с культурами клеток-хозяев по М. Адамсу. Этот метод, основан на исследовании количества корпускул неадсорбированного фага в смеси фаг-бактерия. В качестве бактериальных клеток-хозяев использовали индикаторные культуры бактерий Y. enterocolitica. Адсорбцию отобранных фагов Yee7, Yee12 и Yee14 изучали на клетках Y. enterocolitica Ye – 2 и Y. enterocolitica Ye – 3.
Бактериальные культуры в фазе экспоненциального роста смешивали с бактериофагом и инкубировали в термостате при 37ºС. Образцы (100 мкл) отбирали через 4, 5, 6, 7, 8, 9, 10 минут и переносили в пробирку со стерильным бульоном. Фаголизат очищали фильтрованием и титровали для определения неадсорбированных или обратимо адсорбированных фагов через разные временные интервалы. Количественно адсорбцию выражали константой скорости адсорбции (k), измеряемой в мл/мин:
K = 2,3/(B×t)× log(P0/P) (1)
где P0 – титр фага, определенный при времени 0;
P – титр фага, неадсорбированного на поверхности бактериальной клетки за время t;
B – титр бактерий в начальный момент в 1 мл,
t – время в минутах.
Время адсорбции для фага устанавливали в зависимости от процента максимальной адсорбции для конкретной смеси (фаг+клетка хозяина).
Установлено, что изучаемые бактериофаги имели разные значения константы скорости адсорбции.
Таким образом фаг Yee7 УлГАУ за 6 минут адсорбировался на клетках Y. enterocolitica Ye – 2 в количестве 70,3%, константа скорости адсорбции К= 4,04 см 3/мин-1 (таблица 67). Бактериофаг Yee12 УлГАУ за 8 минут адсорбировался на клетках Y. enterocolitica Ye – 3 в количестве 83,2%, константа скорости адсорбции К= 4,4 см 3/мин-1 (таблица 67). Фаг Yee14 УлГАУ за 7 минут адсорбировался на клетках Y. enterocolitica Ye – 2 в количестве 87,7%, константа скорости адсорбции 6,1 см 3/мин-1 (таблица 67).
Таблица 67 — Результаты опыта по изучению скорости адсорбции отобранных ирсиниозных бактериофагов на клетках индикаторных культур
| Фаг | Время
адсорбции максимального количества фага (мин) |
Количество фага до адсорбции
(по показателю бляшкообразующих единиц) M±m |
Количество
неадсорбированного фага (по показателю бляшкообразующих единиц) M±m |
Процент адсорбции
(%) |
| Yee7 УлГАУ | 5 | 89,4±5,0 | 34,4±2,0 | 63,3 |
| 6 | 26,6±1,5 | 70,3 | ||
| Константа скорости адсорбции К= 4,04 см 3/мин-1 | ||||
| Yee12 УлГАУ | 5 | 79,0±8,5 | 68,4±3,2 | 25,6 |
| 6 | 38,9±1,5 | 51,6 | ||
| 7 | 22,7±2,5 | 71,5 | ||
| 8 | 13,4±1,5 | 83,2 | ||
| Константа скорости адсорбции К= 4,4 см 3/мин-1 | ||||
| Yee14 УлГАУ | 5 | 85,1±1,8 | 64,5±3,2 | 10,2 |
| 6 | 55,9±2,3 | 33,4 | ||
| 7 | 10,0±1,0 | 87,7 | ||
| Константа скорости адсорбции К= 6,1 см 3/мин-1 | ||||
Для того чтобы определить длительность латентного периода и урожайность фагов применяли способ изучения одиночного цикла размножения фага без применения антифаговой сыворотки. В основу этого метода положена способность эмбихина избирательно инактивировать бактериофаги без повреждения бактерий. В предварительном опыте параллельного титрования эмбихина на исследуемых фагах Yee7, Yee12 и Yee14 соответствующих индикаторных штаммах Y. enterocolitica Ye – 2 и Y. enterocolitica Ye – 3 устанавливали рабочую дозу препарата, — то его количество, которое в 0,9 мл физиологического раствора способно за 5 минут при 37о инактивировать 90-95 % фага при исходной его концентрации 3-5х107 частиц в 1 мл. В то же время препарат в рабочей дозе в аналогичных условиях не должен оказывать антибактериального действия при контакте с 4х108 бактерий (таблица 68). Эксперементально установлено, что рабочая доза эмбихина была равна 7 γ, т.е. среднему из двух последних эффективных доз.
Таблица 68 – Определение рабочей дозы эмбихина
| Доза эмбихина в 0,9 мл физраствора | |||||
| 50 y | 25 y | 10 y | 5 y | Контроль | |
| Бактериофаг Yee7 и Y. enterocolitica Ye – 2 | |||||
| Количество бактерий при высеве 0,1 мл из соответствующего разведения | 219 | 298 | 384 | 408 | 522 |
| Количество негативных колоний фага при высеве 0,1 мл из соответствующего разведения | 0 | 0 | 13 | 164 | 1699 |
| Бактериофаг Yee12 и Y. enterocolitica Ye – 3 | |||||
| Количество бактерий при высеве 0,1 мл из соответствующего разведения | 301 | 372 | 433 | 490 | 587 |
| Количество негативных колоний фага при высеве 0,1 мл из соответствующего разведения | 0 | 0 | 9 | 157 | 1802 |
| Бактериофаг Yee14 и Y. enterocolitica Ye – 2 | |||||
| Количество бактерий при высеве 0,1 мл из соответствующего разведения | 348 | 419 | 543 | 605 | 663 |
| Количество негативных колоний фага при высеве 0,1 мл из соответствующего разведения | 0 | 0 | 4 | 134 | 1771 |
После определения рабочей дозы проводили основной опыт. Для этого к 0,9 мл бактериальной культуры, выращенные в мясопептонном бульоне и находящиеся в логарифмической фазе роста добавляли соответствующего бактериофага 0,1 мл, смесь инкубировали в термостате в течение 5 минут, а затем 0,1 мл переносили в 0,9 мл физиологического раствора с рабочей дозой эмбихина, предварительно прогретого в водяной бане при 36±1 0С.
После 5-минутной инкубации смеси при 36±1 0С опыт продолжали по методу Эллиса и Дельбрюка.
Затем из этой пробирки брали 0,1 см3 жидкости, которую вносили к 9,9 см3 бульона. Из четвертой пробирки брали 0,1 см3 жидкости и вносили в 9,9 см3 бульона (пятая пробирка). Получая такие разведения, стремились создать постоянную и наименьшую концентрацию частиц фага в четвертой пробирке и свести ее на нет в пятой с целью возможности подсчета колоний фага по окончании латентного периода.
Из 4 и 5 пробирок приготовленными разведениями через каждые 1-2 минуты брали по 0,1 см3 жидкости и засевали в две бактериологические чашки по методу агаровых слоев. Подсчет негативных колоний проводили после 16-18 часового инкубирования чашек при 36±1 °С. Результаты исследований отражены в таблицах 69-71.
Таблица 69 — Изучение латентного периода и урожайности бактериофага Yee7 УлГАУ
| Время
начала Опыта |
Число негативных колоний фага при высеве из 4-ой пробирки
M±m |
Число негативных колоний фага при высеве из 5-ой пробирки
M±m |
||
| 15 | 72,6±3,1 | |||
| 17 | 66,7±7,1 | |||
| 18 | 70,0±4.6 | |||
| 19 | 189,3±4,9 | 11,3±0,6 | ||
| 20 | Полосы лизиса | 87,0±7,2 | ||
| 21 | Лизис | 89,0±7,2 | ||
| 22 | 95,0±6,0 | |||
| 24 | 70,3±6,8 | |||
| 25 | 88,0±2,7 | |||
| 26 | 94,0±4,6 | |||
| 28 | 83,0±12,5 | |||
| 30 | 160,0±9,5 | |||
| 36 | 172,0±21,66 | |||
| 39 | 177,3±18,88 | |||
| 41 | 162,0±8,6 | |||
| 50 | 176,7±11,6 | |||
| 60 | 161,7±7,4 | |||
Таблица 70 — Изучение латентного периода и урожайности бактериофага Yee 12 УлГАУ
| Время
начала Опыта |
Число негативных колоний фага при высеве из 4-ой пробирки
M±m |
Число негативных колоний фага при высеве из 5-ой пробирки
M±m |
| 15 | 112,0±21,8 | |
| 20 | 106,0±5.5 | |
| 25 | 120,0±19,1 | |
| 30 | 119,0±1,0 | |
| 35 | 112,0±21,3 | |
| 40 | 117,3±12,9 | |
| 45 | 211,7±28,4 | 11,6±11,5 |
| 50 | 533,3±81,4 | 40,3±2,0 |
| 55 | Зона лизиса | 47,0±7,9 |
| 60 | Полоса лизиса | 64,3±64,3 |
| 65 | Лизис | 83,0±2,0 |
| 70 | 83,3±3,7 | |
| 75 | 80,7±7,6 | |
| 78 | 83,0±10,6 |
Таблица 71 — Изучение латентного периода и урожайности бактериофага Yee 14 УлГАУ
| Время
начала опыта |
Число негативных колоний фага при высеве из 4-ой пробирки
M±m |
Число негативных колоний фага при высеве из 5-ой пробирки
M±m |
| 15 | 120,7±3,2 | |
| 17 | 119,0±2,0 | |
| 19 | 119,7±3,1 | |
| 22 | 120,3±5,0 | |
| 25 | 120,0±3,0 | |
| 28 | 117,7±6,5 | |
| 30 | 119,7±7,3 | |
| 35 | 120,0±6,1 | |
| 38 | 120,0±2,6 | |
| 40 | 516,0±10,8 | 19,3±1,2 |
| 42 | 844,8±33,7 | 23,3±1,5 |
| 45 | 27,3±1,1 | |
| 49 | 60,3±7,8 | |
| 55 | 73,3±2,8 | |
| 60 | 65,3±5,5 | |
| 65 | 75,7±7,0 | |
| 68 | 76,3±2,5 | |
| 70 | 70,6±13,5 | |
| 75 | 99,6±13,3 | |
| 78 | 73,3±9,7 |
Латентный период внутриклеточного развития фага Yee 7 УлГАУ на клетках Y. enterocolitica Ye – 2 равен 19 минутам (таблица 69). Среднее количество негативных колоний на чашках при высеве из 4-ой пробирки с 15 по 18 минуту опыта равно 67,77, а при высеве с 32 по 60 минуту из пятой пробирки – 167,04. Средняя урожайность бактериофага Yee 7 УлГАУ равна равна 16704:69,77=239,4 вирусных частиц на одну микробную клетку Y. enterocolitica Ye – 2.
Латентный период внутриклеточного развития фага Yee-12 УлГАУ на клетках Y. enterocolitica Ye – 3 равен 44-45 минутам (таблица 70). Среднее количество негативных колоний на чашках при высеве из 4-ой пробирки с 15 по 40 минуту опыта равно 116,38, а при высеве с 50 по 78 минуту из пятой пробирки – 84,23. Средняя урожайность бактериофага Yee-12 УлГАУ равна 8423:116,38=72 вирусных частиц на одну микробную клетку Y. enterocolitica Ye – 3.
Латентный период внутриклеточного развития фага Yee-14 УлГАУ на клетках Y. enterocolitica Ye – 2 равен 39-40 минутам (таблица 71). Среднее количество негативных колоний на чашках при высеве из 4-ой пробирки с 15 по 38 минуту опыта равно 119,59, а при высеве с 49 по 78 минуту из пятой пробирки – 74,32. Средняя урожайность бактериофага Yee-14 равна 7432:119,59=62,14 вирусных частиц на одну микробную клетку Y. enterocolitica Ye – 2.
Таким образом, отобранный бактериофаг активные в отношении бактерий вида Y. enterocolitica – Yee-12 УлГАУ наиболее перспективный для конструирования биопрепарата.
2.2.6. Молекулярно-генетическая характеристика штаммов бактериофагов
Основной целью исследования геномов и протеомов выделенных бактериофагов было определение отсутствия локусов патогенности для возможности их дальнейшего использования при фагоиндикации бактериальных культур и санации объектов сельского хозяйства и животноводства.
Исходя из данной цели были определены следующие задачи:
- Исследование соответствия генома изучаемых бактериофагов данным секвенированных и депонированных в системе NCBI и определение возможных гомологов;
- Составление карты протеомов бактериофагов в соответствии с аннотированными геномами бактерий и вирусов на основе триплетной кодировки аминокислот;
- Исследование протеомов бактериофагов на предмет соответствия локусам патогенности;
- Составление филогенетической схемы каждого из протеомов исследуемых бактериофагов.
При решении первой задачи данные генетической последовательности каждого из исследуемых бактериофагов были сопоставлены с аннотированными данными системы NCBI.
Bacillus subtilis phage FBs-16 УГСХА
Нами были получены биоинформационные данные сиквенса Bacillus subtilis phage (FBs – 16 УГСХА):
Длина: 63216 bp
Содержание GC: 39,4 %
Молекулярный вес: 39 054 105, 42 Da
Молярность 1 мкг/мкл раствора: 0.03 мкм
Количество молекул в 1 мкг: 1.54 x 1010
А 260 из 1 мкг/мкл раствора после 100-кратного разведения: 0,261
При сравнительном анализе полного генома Bacillus subtilis phage FBc были получены результаты, представленные в таблице 72.
Таблица 72 – Сравнительный анализ генома Bacillus subtilis FBs – 16 УГСХА с данными геномов, представленных в системе NCBI
В результате сравнительного анализа генома Bacillus subtilis phage FBs – 16 УГСХА с аннотированными в системе NCBI была доказана его уникальность с наибольшим соответствием геному Bacillus phage BSP7 (87% идентичности).
Нами был проведен сравнительный анализ секвенированного генома Bacillus subtilis phage FBs – 16 УГСХА с эталонным геномом бациллярного бактериофага, представленного в системе NCBI. Наиболее близким по гомологии оказался геном Bacillus phage BSP7. Сравнительный анализ представлен на рисунках 88 и 89.
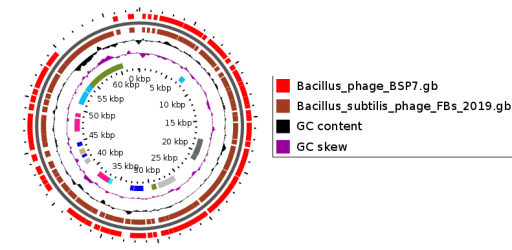
Рисунок 88 — Сравнительный анализ гомологии геномов исследуемого бактериофага Bacillus subtilis FBs-16 УГСХА и Bacillus phage BSP7
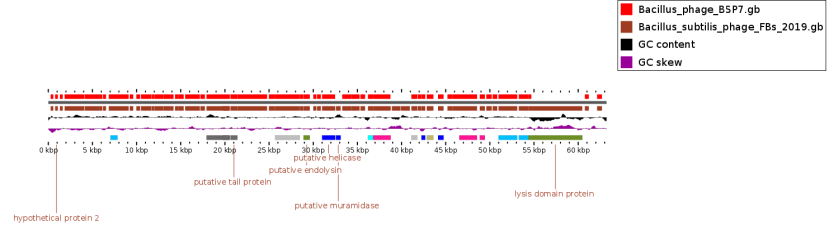
Рисунок 89 — Линейная диаграмма гомологии геномов исследуемого бактериофага Bacillus subtilis FBs-16 УГСХА и Bacillus phage BSP7
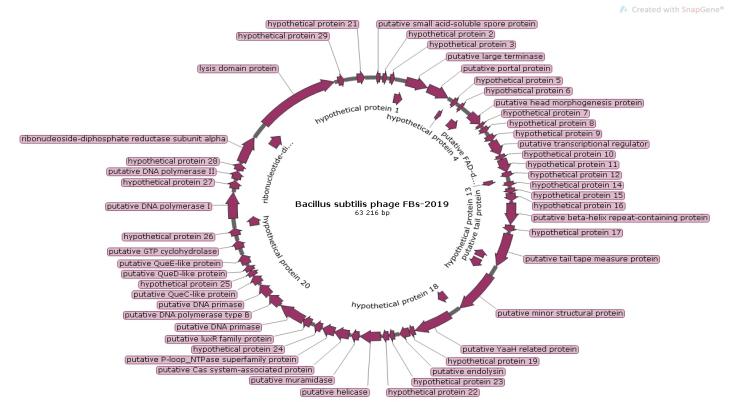
Рисунок 90 — Протеомная карта гомологии исследуемого бактериофага Bacillus subtilis FBs-16 УГСХА генетическим маркерам, аннотированным в системе NCBI
На основании генетических данных был проведен анализ протеома бактериофага Bacillus subtilis phage FBs-16 УГСХА. Результаты соответствия генома и протеома (на основе генетического кода аминокислот, характерного для бактерий и вирусов) представлены на рисунке 90 и таблице 73.
Таблица73 – Анализ состава протеома Bacillus subtilis phage FBs-16 УГСХА

Каждый из протеомных компонентов Bacillus subtilis phage FBs-16 УГСХА FBc был сопоставлен с аналогами и составлено его филогенетическое картирование для поиска подобия возможных локусов патогенности.
✓ putative small acid-soluble spore protein 260 .. 571 312 bp CDS
/product = putative small acid-soluble spore protein
/translation = MQEFRMEIARDLGLEEKVDDDGSFKNFTTAEVGSIGGEMSRRMIAMAQYAIVQRFEAGEQRLLPQELLPPQDQVRESTNTGNMTLHMTQSIDQSVRSSGQQLH*
103 amino acids = 11,6 kDa
✓ hypothetical protein 2 770 .. 1087 318 bp CDS
/product = hypothetical protein 2
/translation = MQKEKDFIRELAEYLSNDLSFECDQTSADDFEDVIEDFFKERPSTNMVIELEATADEFSTITTTNDETLLLETLGRVFEEGRYIYEETNLPFKATANRIYSRRGK*
105 amino acids = 12,3 kDa

✓ hypothetical protein 3 1305 .. 1643 339 bp CDS
/product = hypothetical protein 3
/translation = MIDDTYFSLGKVYGFSRKELLNFVNIVENAPFTKTVYKTQLSISRALLAVLFNSGMKRGEFFSQLEADRKTFNIHKGNNNVSAEIIRQYRERVGPFGLVAYTALVTQGKAWE*
112 amino acids = 12,8 kDa
✓ hypothetical protein 1 1849 .. 2547 699 bp CDS
/product = hypothetical protein 1
/translation = MEPKDLEKAIKKDENQVRTYLMRSKIAQSGYMEHVNEMIMANRTYQEVMDFLAKKGITVTPAQISKHKKMLPYIVENEPTPHEQSEIGLMENTRDRLIKYQEMTNVELAIETLQQVVKSSQIQAVNELWGEIIPQMIASVKLQVKERGDRLPFKDIIDSLDKVVKIARLLEDKATVIQASTVNGETQITHKHEHTIESIGDGTAESVSSAALEAMAKVNEALETYANQKQLN*
232 amino acids = 26,3 kDa
✓ putative large terminase 2504 .. 4096 1593 bp CDS
/product = putative large terminase
/translation = MRRWRPMLTKSNLTDQTDNPLVQEVMDKYLKEPKLIFKPSAEFFRDKMDAMTKEERIKLARANPIILAEYYLRPFNKQWNTDAEDYQYLLNQAVLENDLTIVHIPIEHGKSTWVSEVLPIWFLINDRNLRLALFSRTARQAERFGRRLMWHIEHNYRLKEDFGDYLKPGTEKWTQSEGFVERDPDRMTKDPTFQFLGVGGAVNGARLDIIICDDILDLTNSQSEVTRDNVHAWFTEMVLSRLVEGGRCMMVGTLQSRLDLYCQLSESPEFHYVHIKAVDEDRKTTLSRRWPFERLMKKKAAVGTVKFMKLFQNDRSAQTGRMLKPEWLNYYGRGSDSGYPVSLPPYEHMSIYIAIDPAIADKDFIEKLEKDDPDYFALCVGGWHDQSQRLFIIENFKARLTLIQQLQVITDYYERYRPIKVGIESVAYQKALAQASWALPSMIPVQEIKTHGGSGSKISRIEALGGHFETKRIWVHPSNDNLIDEYINYPDVAHDDVLDSTELLVRLIKDSPRRQPTEKESDILRSITLG*
530 amino acids = 61,8 kDa
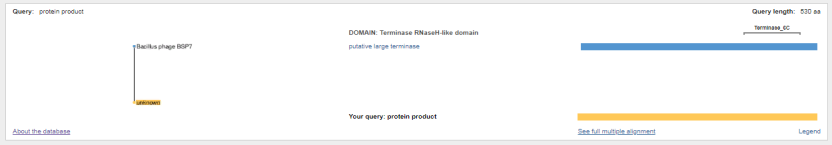
✓ putative portal protein 4150 .. 5796 1647 bp CDS
/product = putative portal protein
/translation = MAKLGNVTKPTLWNKVRTRITGEMSALRDRFSGLLTGRHSQSYTLDSSKVDYKLSRALYRNDAEGYKLGAGFAKPVIDTTVGFMGTPRWVSEDDGAQEVLDEHMERLRASMQKVNRNTLRDGDCFIRIFRKPIEEQVLYKTEKPQIDIKILPPNSVETLLNPENGHVMGYVVVTNITYTDADGKEKAYDIYEEITAQTIRKWYKGNDVPPEFKEITESNPQEETNKWGFVTILHWANEQEEDELYGRSDLEPLEPFLKAYHDVMLNSLKNNKMHAAPKLKLRVQDIAGFLKNNFGIDVNKLAAGEKPKISLGGSDMIILANENDEADYIQATSTMNDSATLLKFLYYCIVDVSQTPEFAFGTAVNSSKASVKEQMTPLQKKVDRKREMLEHNYKMLARMILCMYEKADLGLEKMTFSTFDTKLEWDMVVERDMAQEATALVNYINALNTGVTAGMVSLETAVDFLEKFIPNMLVFAGEEESEQQRILDGFKFLETVGKGPLHAMAMAEQQVFPDDDDENDESGKQQEKKVKEDAKKKNQKPTNSGGNS*
548 amino acids = 62,1 kDa
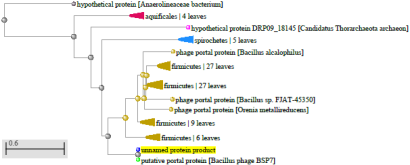
✓ hypothetical protein 4 5796 .. 6125 330 bp CDS
/product = hypothetical protein 4
/translation = METEYFGLNVSTYKSVYDSGQSVIIDIENWSDVDKVVHVKPFMITEDARLVDPDVYPFNLQVLAGSKDQAIFTTGDGGDIPTPGTYYFKLEVEGEGEFFFEQGIEIGLK*
109 amino acids = 12,2 kDa

✓ hypothetical protein 5 6194 .. 6544 351 bp CDS
/product = hypothetical protein 5
/translation = MATTAKTVYVTDQNYGKTPVYIATNENYINVTCTAEMGYPTGATTPTSKSGMSVTMYLQRYTSGSWKTIDSAGSKHLSSGSRVTNTFKNIAKKSTRMRVRCRFGNGQTFYSNTWTR*
116 amino acids = 12,9 kDa
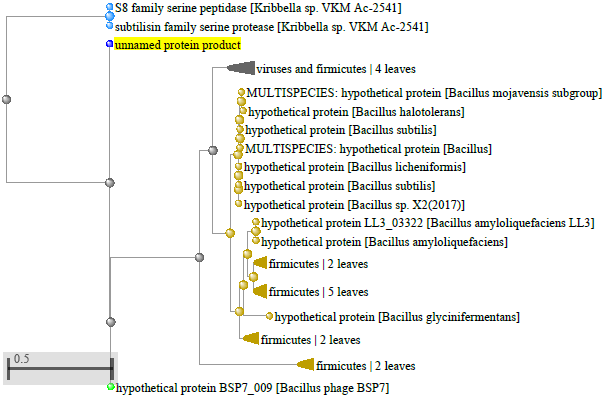
✓ hypothetical protein 6 6842 .. 7072 231 bp CDS
/product = hypothetical protein 6
/translation = MTKLMMMEFETIAADSGVVDIGIRYNTNNGSFEYVVEVAGQPEAIPSHEAVGILESVKWGMLSRGYTNDRKTDCNE*
76 amino acids = 8,4 kDa
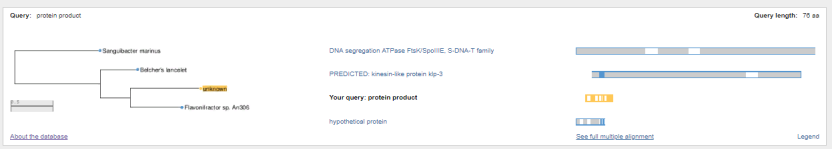
✓ putative FAD-dependent thymidylate synthase 7044 .. 7844 801 bp CDS
/product = putative FAD-dependent thymidylate synthase
/translation = MIEKQTVMNKGYVTLHEARGNDLSVVNAARVSYNKESHELTKKDEGLIRFLGRDGHTSPFRHSTMVFEVYAPLMVARQWWKYIIGSDHADQPFSNVDRMVGWNESSRRYISDEIEFVEVSPAEWRSAPANSKQGSGEPIDSEKGKEFTEMLESYQRTGLMAYESALENGIAPEQARLFLPAYGLFVRWRWHASLQGVCHFLYQRLKHDAQSEIRDYAEVVYVMAIKHFPNAVKAAVDTPIKQDKLLEHLRGLGIEDIDTFKEWQKY*
266 amino acids = 30,7 kDa
✓ putative head morphogenesis protein 7829 .. 8845 1017 bp CDS
/product = putative head morphogenesis protein
/translation = MAEILMADYNERHLKYARLSMEDIRKTMPPEYAKVMIQTRKELANLRVSNDKAIIALWEDAAVEVSKKIRKSNGLKKQHLRNVLLDILRELNKAYRDLMKTDLSEAIKLQYDFNRDIMWQITKSQPSVEKLISKAGLSHVYSGLADEAAKAFLARKTAGLTLSQRIWRNNQQAYSIILKLATTGDLSSYEMARALEKYLTKDASALTVGESKILMERFKGTLPKDIKYAAFRLARTEITNAFAQSTYSAGGKNPFYKGIEWRLSTAHRSSIQCACPGLVGFHAKGNEPDIPHPNCMCSQIPVLDEMKAATERAIRWVNDPSADGDMERWYQNVYLKGA*
338 amino acids = 38,3 kDa
✓ hypothetical protein 7 8848 .. 9099 252 bp CDS
/product = hypothetical protein 7
/translation = MGYNIFNDDNLPKGMNINFESLENPKKEGTEPMEFIDSRDYNIPKMVREKLEELPFKVRIKECKLEEGEDIITSLSLVIVVHN*
83 amino acids = 9,7 kDa
✓ hypothetical protein 8 9222 .. 9623 402 bp CDS
/product = hypothetical protein 8
/translation = MADYVRAEGTGGPYAPATRYNPYDVMARLSKVEQDIQNVPSDSQLKAVETIANEAKSLASTAKTTADDAKKTADTAEATANEAKKTADAAKTTADEAKKTADAANTQAKTNKTDIAKLAERVTTLENAGGETT*
133 amino acids = 13,9 kDa
✓ hypothetical protein 9 9959 .. 10 408 450 bp CDS
/product = hypothetical protein 9
/translation = MKKLLVSVCLLVMTFGTMLFTGGKEASAAYNRNCEASVSGISHSACWVKTDATYYSKRATSIDTKLYIKDSIPSKWWPQKVRTRLWKGGKVVKTSAATIAVPAGNNFVGNSRIGINKSMARGTYYIQGQWYKNGKWYAYQYSQPLYLTN*
149 amino acids = 16,7 kDa
✓ putative transcriptional regulator 10 498 .. 11 643 1146 bp CDS
/product = putative transcriptional regulator
/translation = MLTYGGDNMTWEEFLAKIQKYKDGATVTGEMETPGLSVGQAIKVDDIPLSPAVNYDQLTQDDNEPHEVVVEMPVGKSKRGWLYTEEAVKSIVKQVNEKTAAGFKGHQKAENVSTEFLDPATHWIGAKYDESAKKAYFRGYVDPKEKDLRRWIKSGRIKETSIFGQMQLKKVAGETHVVDCDLMSIDWTPLGRPGMKTQVVDVKIAGEMIEGGNENMNREELLAAIRKFLTENKVTARELAGEMDENFKQEIEAAESQLTNVAKTLGLAENATAEQIDAKLKELKALEEEKQEASKEELAQEVIKEKLPESQEAQELAGEMFVFTGETKEEIAGEMDSFLAKPAVKKLFDNLMTDSVASGRKDQRKKSNENSSLRTVRRSLY*
381 amino acids = 42,7 kDa
✓ hypothetical protein 10 11 670 .. 11 996 327 bp CDS
/product = hypothetical protein 10
/translation = MARVKVSDGKSVKVIADKDYMDGDFAFVSGFHGFVIGDTPSGDPLVINIEQSEFEFKLADVVTGDVIYFADGALTKDSDAEGAVPVLRASTDSDADDIAWGILLPQSV*
108 amino acids = 11,5 kDa
✓ hypothetical protein 11 12 023 .. 13 063 1041 bp CDS
/product = hypothetical protein 11
/translation = MGLKVTSINTLKEEARKRNFEGSVEAIYNKKRIEVPKKIINGEMETYELTKPIGEMLTSDQSAEELLKKVVLDVELGREEVPLLYKSIYRTIADRSLPKIIDATFAQRGVVIFTEWQEGEEIKFGALEAEQGPTARLTTYAAGFEYTEDMEEYNEAFSVQMLNQAFGEAYNALLNHIHLSPIFKHKYPEANTTEAVAEEHSMYQKEINTQRTIRNAIQAARQAGRNGTILLANSADQFQIEDAFKSYNVNATPFEPVSGIDEVIFYDGWTTTVGKKQYTYPGVPQGKVFLIRPKQGLIEFIKHDLITDAALGDLSRLVEAQIVARTRRGIYAAIEDNVQVINLPQS*
346 amino acids = 39,1 kDa
✓ hypothetical protein 12 13 078 .. 13 476 399 bp CDS
/product = hypothetical protein 12
/translation = MDMKALILRLRRAIDDRLPNDGTKPEYSDAELEAYLKEVNYNLDMAASNIWLEKASQLAPESSGFSSYSVAGESYTMADRTKAYDHAMAMYKLYRNRASSSVILPTQPADDNNKHCHRSGDISRLTQDKALW*
132 amino acids = 15,0 kDa
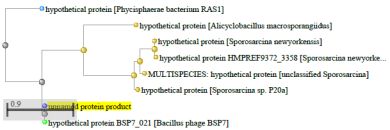
✓ hypothetical protein 13 13 470 .. 13 844 375 bp CDS
/product = hypothetical protein 13
/translation = MVDAQARRKHIAAVISFNPIKINITREVREEKDGAYDTREVSIPEQTVRIFQEKAAPAWEASEASQGRRQDYFMLVPFDGDVKADEYNRDNFECDLGSFRVNEVVPQVVKGILCGYQCYLEKVY*
124 amino acids = 14,3 kDa
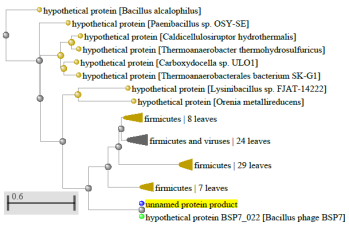
✓ hypothetical protein 14 13 846 .. 14 184 339 bp CDS
/product = hypothetical protein 14
/translation = MPRSINVGSRLNNYFNRKIAGLYGLAQNAAQQMEGQAKRKARWTDRTGNARQGLKGKVVKTNNMITIYLIHSVSYGIYLEKARSGKYAIIKPIFRANQSNVMSSLRRYWDNT*
112 amino acids = 12,8 kDa
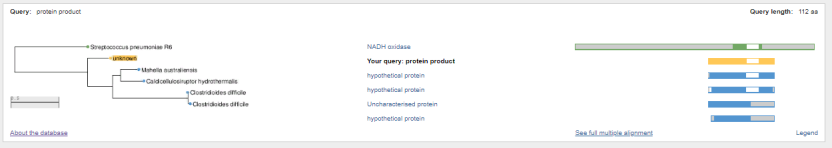
✓ hypothetical protein 15 14 349 .. 14 720 372 bp CDS
/product = hypothetical protein 15
/translation = MMRTAILKQLAKISNRPVYQAFMAPNNVKSPYFTVKMGTEAVDVTVRNAYDRYIEIWPYAKPDNFEILDQMFVEAYKALHQTDIQTDEGIFSLTYVNKGEDYLDTDLKLITNGPIEFEFNLIR*
123 amino acids = 14,3 kDa
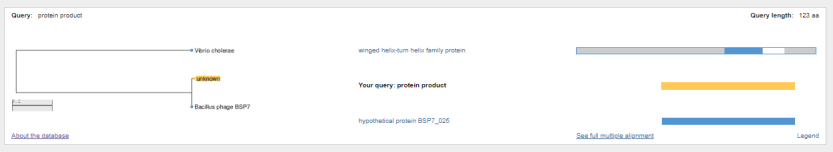
✓ hypothetical protein 16 14 732 .. 15 340 609 bp CDS
/product = hypothetical protein 16
/translation = MDQVKTGYLRGVRGALITALNEDGSEPSKPEKYWIDTAQEATVEAQVEEGESSSLRGGDRVLAQVEEDDTLTGVEIGFTNAKFDALATTIMAGGKLITETTGEEDSKVTTITGWEADMMSETSSKTPFLMEIYVQNYTAGGMKDGFVKVTIPYCTGTIPNLSYSDQEWATEEFTVKGKENATLNKPVSRKEFVASLPSEAKA*
202 amino acids = 21,9 kDa
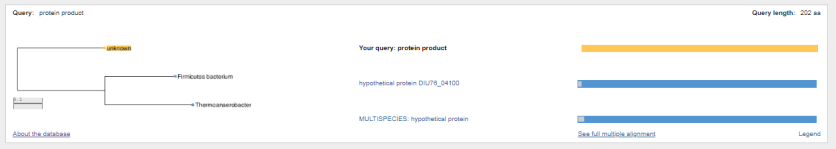
✓ putative beta-helix repeat-containing protein 15 499 .. 17 169 1671 bp CDS
/product = putative right-handed parallel beta-helix repeat-containing protein
/translation = MEYAKAEGYYKVTLPKGTYMIDGVNNAAKSPEIGAGIRVPGNLEIEITPDTTMKVKPNDSYGYTLFYVAPSEKNVKFSGGGYLIGERYEHDYSYQGKDGEKASHEWGFDIYFHGAHHGYVEQLKIINFTGDGIFLGAKGMIDYPGMEYNFCYDIHIKECFISNNRRNNISITAAEVVRVKDCIITKAGAEDGCAPRFGIDIEGYGEGTIDYEEIKDVLIEGCTFLENVNASVSNFNGYGVRIVNNEADHRINYGSGTDTIIADNTMIRTDGLNTAIQGDGTSAGQKGNNALVIGNTIKGFGKGIDVRGRGVSVIGNIITEMHEDAVGIITHIADSVLVAGNKVMDDHGTAYKIDQSTNVSFVGNEASQSKERGLDIFRSSSVRVQGFHTAEGYTGIRIQSSEVSFHDVEVDFVELENQSYGITFDAASKVDFNNVTVKKAKNLSILGTATDKRLVMKDVKIIESKYIVPVQITGGTKHFIDRLYITTLVSGGRGLNLINTDGTIVNGLQAFSASADASMSAPLVSTSAANTVLANSVYEGEPWMLDTDKRHNNLSI*
556 amino acids = 60,4 kDa
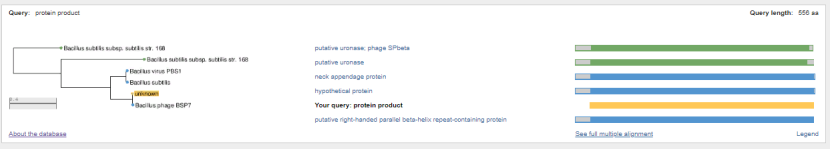
✓ hypothetical protein 17 17 234 .. 17 734 501 bp CDS
/product = hypothetical protein 17
/translation = MTKKPISLAELKQLAQGTLLDIPGFEDGQTITVRVKRVDVTAELASNDQLPTILQNTVIKEFEKGASEQSIQKKVENELQGDLSSLSQIAPMIDTMVRKALVEPTFEDFEKNYPLTMAQKMHIFGWLTEEVKSFRPSNNKSGKNKQHPNNRKNMGNKTQRTVHRNK*
166 amino acids = 18,8 kDa
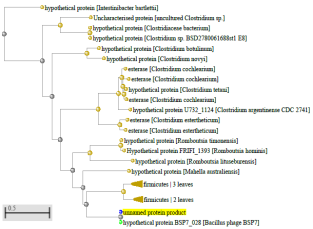
✓ putative tail tape measure protein 17 909 .. 20 560 2652 bp CDS
/product = putative tail tape measure protein
/translation = MAENLGSVYAEFRLAISNLRADVARANGMVNQLSNNVNRQLGQAGNNVSRNWKKIGATVTASGKAVSAFGATSLTGIGIAVKTAADFQSQMSRVKAISGASDAEFKQLNETAKYLGATTAFSAKQAGEGMEYLALAGWKTSDIIKAMPGMLDLAAAGNLDLARAADIVSDTMSAFGIEASQAGHAADVFAYAQANANTNVEQMGEAMKYAAPATNSLGWSLEDTAAAMMSLANSGLKGSIAGQAFSSSLTRLTKPTKAMSRVMEDLNLEFFNAKGEMKSMPEVVAELEKGTKGLTQEQRAAAITTLFGAEAYKHWAILLQDGSKNLQGYSDALKNSDGTAKDMAATMLDNLNGAIIMVKSALEGLAIALGEVLLPYLQSAAEKFAGFVSWLTQLPGPIKEFVMIGGTLVALLAAIVGPIMILVGMALPGLITAFTFVSGTVLPAVVAAAGPVIGIITVIAGLAALIYAAWQTNFGGFRDFVIQVWNAVVQKFNEVKEAVMPIISDLVSYIQERWKAIQPVVETVMNAFQQIIAFVLPFVYDTVMFYLNAAKDVFVGVFNLIAGVIKFFVALFTGDWKGMWEAVKQMLSGAVQAVWGLFKLWFIGKIVGIIGKFIGKGISLFTQFVGKVIGKITSWVSKMVSKFTSLVSKGVTKFSELRSKVVQFIVKMVTNAINKIRDFATKFVEKIKSAKDKVVEKFKDMAQQIPEKLRSIISTVTTVGVDIVKGIWSGIKSMAGWLGEKLIGFAKSAIPGPIAKALGIKSPSRVLAKTVGVHLPTGIAMGAEDVADKTFDDMSSNLSKRLTGAMQMRMDAKKIQADMELSPSVNNEQRVIQGTGTNIANYFTGPLIGSATVRSEQDIRAISQGLYKRIYGKNKAQGSVVPV
883 amino acids = 94,2 kDa
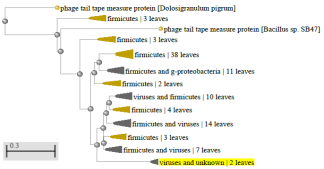
✓ 4a-hydroxytetrahydrobiopterin dehydratase 19 774 .. 20 424 651 bp CDS
/product = 4a-hydroxytetrahydrobiopterin dehydratase
/translation = MLVPVPCMTLCSLFTEGLNSISAWIFLASIRICIAPVRRLLKLLDMSSNVLSATSSAPMAIPVGKCTPTVLAKTLDGDLIPRAFAIGPGIADLAKPISFSPNHPAILLIPDQIPLTISTPTVVTVDMMDLSFSGICWAISLNFSTTLSLADLIFSTNLVAKSLILLIALVTILTMNWTTLLLSSLNLVTPLDTRDVNLETILDTQLVILPITLPTN*
216 amino acids = 23,1 kDa

✓ putative tail protein 20 619 .. 21 416 798 bp CDS
/product = putative tail protein
/translation = MSVRIWGSLPKDTYGINYRGKHSGKDFDMWLTKSPMDFLVESVDSIEDRPVADGMVDFGASLSARAFEFEFVIRAKNEAELRNKRRAIAAWLTPTKGLSTLWWDLEPDKYYTARRYSGAQNIEMEARQGKFTLEMIAPDPFAYDRNEEPVSFTSAGESSIENKGTEVSYPYVEITGTNTSGSIQITLADQLMEYKGSLNDTEKVVIDYDDMTVYKEASNGIRTNELNNTNNNFTTLPMGSSTVKVAVTGDASIGQITIKPRSRWY*
265 amino acids = 29,8 kDa
✓ putative minor structural protein 21 416 .. 24 778 3363 bp CDS
/product = putative minor structural protein
/translation = MAYPIITTLEQFSGMKSNGPATKGLWHLFDGTFDDDSGNGFHGKLKAGSLTPDGKGVIFTDGAYVDIPYEGAWVPNVEFEGDWEITDSNGYNGNNHSLRSKPMTPIAGQKQESRTKVTFDIPEGSGSGSPIPIRYIRNYLNGSSANVGSHWVEIQAINQSGKNVALNKKVNTSAGVTNSFYVTDGNTATTGYAAHVTSGEAWVEVDLGYVFETLKEIKMWHYYGDGRKYKRNRLEVSENGTDWVVLFDSSKNGEYAESSSGKSVAVPTGSASSLSFAYEVSSARDYGVLDVKLNGTSILTDSGFTGWKTFTKNLDPGSYTLEFIYSINGAGTADDDAAAYLGHLKVTAGGVTLLEEGFNNFESRSIIQNMTDWTIGGWIRPTAADLTPDYTIIATTRSGSGDNPVFHLALNKGIPHVRVYKSNIDQVTNSNVYGKPLVADQTYFIALSYSSTLKELHLTVNNETVQVPLSFNGDNGLNTTITNRPLSFGHMDGSYLYTGWMSDWFLEYKYTDAQELHELYNSVKDVVIYNIDFLTEPGSIRLAKDANDEYYNEGYYISPIVDLTNPFPELGKLIVRGEVPYGYTELSAETRTSADGINFSEWQPIDSAQKIHSPNRRYIQVRLTLISSNPNQTPVVDEITFEDTSADALVSNVKVVPRVYDNNGRLIANLNKLSSLILEDEVNGEETITFQMPMNAKAKELINEYRVDLLNVENKPYNRFYIRNISDVKENGKVKYREFLCEASWYSLSTKPMIDRMSFEDCYPDKPLRKALEKTGWTIGTIDSGFELRDYVVEDKKNPLEHIRGIQEVWGGDIVFDNVNKTVSLLNKNLDTGFSIRRRKNMRSIRREINTQGLITKLTPIGANDLSIASANDGVTYLENYSWFTERGLDYPVYETEWKDERFYNAYHLKEKGIEKLAKMSRPTVSYEIGLLDLSTQIEYSHEIPELRTEALIDDDDLGEVVKVKIVSRSLNLLNPMDTTLSLSNKIKELGDEGAAIAQEGESRLDDTDAVGKTEMQELMVFNYLMNSRADNGWTGWTRNGNISVDNNSGVSGHNAFKFIGSSNGIQELGQTIYPSTRDSYTLSAQIATEG
LKKYAGAQVGIKVVVTYDDDTTEEFFLEL*
1120 amino acids = 124,9 kDa
✓ hypothetical protein 18 24 974 .. 25 681 708 bp CDS
/product = hypothetical protein 18
/translation = MLNYDRMFKKISIGEENKNKKVKQVDFSVKMENAEGTMYVTDLQFQDGALLTGWEHNTGEMLTSPKTSHKRWYNSIIRGERAIVLPNEGNTMGYSNWTITADTDISPPSSVSNVYRGKNSFDFGMLFRTRNIKVKGNVKAGDVFKFYSNPMSTTKNGSYFGAYSGYFLGAPPKDMYYMLSIPGEQVAWDATSDERILPGMKDDEGNQILKPRTDKRMRVFIEVIPRDLQEGGKNL*
235 amino acids = 26,7 kDa
✓ putative YaaH related protein 25 678 .. 28 473 2796 bp CDS
/product = putative YaaH related protein
/translation = MNTMDLTGRKFYTWLYSSIAFDRIMEYGDRFTHVGIFKFLIDPDGTIHTIEGGYELDDTEWQNSGQQDSKVTTMHWKPSGGGIEYTRGTPEYEEYKAHWKQIKEKWPHIRMHITIKNDGARKIWESLGKNWVGTDGTPAQTKMVNEIRALLAEWDWIDGIDYDFERGAYCTVNQVLKVAQLGYNAAKEYNKYVNWCLPPMEGPGTPSWEAWCDYSQMHNYFDTAVIMSYAFAWSGSAPGPISPQWWMDEVYNYAYKVIPKNKLFLGIGGFGFRWNILQKQEQDDEGAYLAGYRGRSGGMSDWYSWMNAEYSHTDQYRGGAETQPYLPFAAYYDDTNHCPYMYLDIYDYLLSHDRENTNSDGPVSFAYNQGIPYAVTYGKRQAPKSMLFPDGITTRWVPALKDSNYSNKPPGAFYPRDTGISLKTPTSGEVQGVYSRSFVVQKSGTYKVVFYIIVPFFGKDKLHVEIDGKDYSFSKIPWYWQNRTGYQYYQIASLSLSAGEHTVVIKGPPDSSSAFVIEEIVVAPTFNNKFITGSLEYTAHLRKLKGWMHGQDHSKMPTDQYAHNNMFKPSAQVLRRVPDYHQIWPEDWRYRPAGTSSGNNYSAMLSYYDVFFNGAKVDSKSIYNAIKDVYPNPLVTASSGTVIALMQGGDFPSPHIRVQYSFSRSPGGNYGVIVGATDEKNFWMVQFIRPSTVKIFQCSNGTFTEKASGTVALESSTKMTCEVRVRNGIIKVYKGNSDISGTSAITKVVEYRAGITGGSIGFRTKDSAIESYLFSLSDAWRYSPRESYTVTIKDRSGRTLLAENSVGRINRRGVTYDSIFGSFTVNSDIEEDQTRDVLIPKDWDFYFPDNSVELPPGDYDVVYRADDIGVWMSAIYICDADGASIAYFNNSQTVIEFMNQAKYRWGLTGTGYWVLGNEDVSLFDQLPSHVK*
931 amino acids = 105,9 kDa
✓ hypothetical protein 19 28 490 .. 28 885 396 bp CDS
/product = hypothetical protein 19
/translation = MADRDANGGVHITLREIYDSVQNVDKSVRELQNRFEDVREQGEEIKQLKLELQAQTEKIQTTTTIANEAHAMSTKHDNNISWLWKTMVAAFLTAFITGIVGITVSVVKSSIEPKPSTEINVPANDKNPNNN*
131 amino acids = 14,6 kDa

✓ putative endolysin 28 898 .. 29 614 717 bp CDS
/product = putative endolysin
/translation = MTIVVLDPGHGGSDPGATGNGLKEKDLTLDIAKRTRDILEKEYSGVTVKMTRTGDTYPSLSERANYANRLNANLFVSIHINAGGGTGYEDYRFSSLSESSQTGKHQKTLHEAIYNKIKGYGIQDRGTKSANLAVLRETAMVAFLTENLFIDTSADAKLLKQSGFKQAVAQGHADGIAKILGLKKKGGGSKSEYYVVKSGDSLSRIAAAHKTTLSNLLKLNPQITNPDKIYVGQRIRVK*
238 amino acids = 25,7 kDa
✓ hypothetical protein 23 30 001 .. 30 360 360 bp CDS
/product = hypothetical protein 23
/translation = MSEVKKTTVLYEREQDGVAVKAIQEVREVLVKEAQPAVEAVEGDKEKGIAPVKAKEAKPAVYKDKKFYSITATVNDEVVTEEEGTAYRTTIARARKLFKEVYEAYGPKPEAKQEEAAAE*
119 amino acids = 13,2 kDa
✓ hypothetical protein 22 30 426 .. 30 866 441 bp CDS
/product = hypothetical protein 22
/translation = MRFYSYDPGKTTGWALFESDNLISAGESESWKDIRMQLDYDEVDFVLIEEFKLYPWKAKNKSWDTFPEIEVIGVIKEYCWYNGINVVKQLPNQKDFFDNKKLERLYGKIPSRHAKDAVRHGLIYLTFGEGKKIGLS
KDILRRSIEN*
146 amino acids = 17,2 kDa
✓ putative helicase 31 003 .. 32 478 1476 bp CDS
/product = putative helicase
/translation = MGITYYTDPKLSEWSYEQTLHNRKIARMKCIDDMTITIPYSDKLRKYQRVDVALMQKMKRLILGNEPGTGKTLESIAYCDLIEAKKILIVASKSLLGSWASEIEKWSSEPDYKIIPVDTTYKKKEKTNANLNEDHRFNIINYEMLRDRKGFPKLWSTKWDVVICDEAHRLKGRKSKQTDGASQLKTDSLILATGTWITNNHHEVFQLLQLLDPKRFTSYWQFVDRFCKTENNYFNEHAKDIVGTKNMKAYRYMMNPYLIQRKKKDVLTELPPVIHKQIPIEMTAYQNKHYKELFEDMMTMFENEELVVSPNVVSKYMRLRQVLLTPALLGGKDSTNKTDAVLDIIENTDDQIVVFSWFKGYIKHLETILTKKDISFRSIHGDIDSESRTKAADDFRNGKVKVMLGTIKAMSEGLNLQTASTMIFTDKSYVPADNEQAIARIDRLGQKRSPIIYHLKTVGTVEEIIDETLAKKQDIIDEASAIEEIIKKLAK*
491 amino acids = 56,9 kDa
✓ putative muramidase 32 559 .. 33 107 549 bp CDS
/product = putative muramidase
/translation = MEYDKGGGRVSGFRKYNSYYESMLDHARLLQTPRYASQLQNAKTFEDFARGIKAGGYATDPNYAGQLISIIKQNGLDKYDDGTPYTGEGSVPAGGGSDKRGIFTSVANGVIRALLILLAFVACVLFFAKAFPQVEATAKSGAKKVTKSSPRSKGYKKVKPKGGATNGGTTGTQTKRQVEASI*
182 amino acids = 19,4 kDa

✓ putative Cas system-associated protein 33 278 .. 34 354 1077 bp CDS
/product = putative Cas system-associated protein
/translation = MMAIFKDRVAIHTSDRKVFKRCRRKYWLSSKLQRGLQPKKPNNILWLGTGVHHALQMHYEGKEEIVTAFKKWANEEIARIQKQSGLWDAEKDSLFEAAKQGANLLKHYKEWASVEDNFEPYKMEVMFSLPITDPKGNPLTVIHPKNGNEVPVVYEGRFDGIVKDDMGHYWVLEHKTAKTFGDWDDKLDMDEQITSYIWAAEYLFDIPVEGVIYNGLRKKAPTKPQLLKSGKGLSKNKSIDTTYEVYLSSIMEHGFDPEDYQDILGILAAKGNKFFRREYIKRTPAEIEMCKEQVYHEAVDMISANYFYPNPNRDCGWDCDFSDVCVMMQNKADYESTLEAMFEPRTDEENEFEEKVGK*
358 amino acids = 41,7 kDa

✓ putative P-loop_NTPase superfamily protein 34 356 .. 35 255 900 bp CDS
/product = putative P-loop_NTPase superfamily protein
/translation = MPLKFGNTSNQSNNVPIDSNVSKEWLSTIIYGDPGAGKTYLMSTANHHPETGRIILLDVEGGKVTLEGLDVDFLEIETFQDLRDAIEFLQRYCHYRDIFFNDSADGSEKEKARLQLAALFKIKKKAEAEQFEPPLWYSVALDSLTETQKINMLEIMQAVVEENPDRDPDVPSMREWGKSGNQIRQVVRQIRGLKMHSFFLALPNIDKDEGTGKMEAVPSLPGKLAREVPGYVDIVGFLESKDDNGKFQNSLYVRPFNKHVALKDRTRSLGAGMTNPTIPKIFTKWQEAKQARKENKKDS*
299 amino acids = 33,9 kDa
✓ hypothetical protein 24 35 343 .. 35 879 537 bp CDS
/product = hypothetical protein 24
/translation = MGINLNFTGVETNSFDPIPKGTYHATIFEVQNQETKKGDPMLVFQFKIVEEKQNNRRAFLNHVIKPTTLWSLKNTLLAAGLSEEELDGELDLDLDDLCGRMVRIVIGHETYEGEVRDRVKRVLAPKPGFVAADDDSADKPKFDDEPSFEDDGEPQFEDDVADLTDTELPFDMDDEDDK*
178 amino acids = 20,2 kDa

✓ putative luxR family protein 36 191 .. 36 778 588 bp CDS
/product = putative luxR family protein
/translation = MRKHTRDKLEQVAELLNEGMPQKDIAEELGISESRVSSYKKQIKQLNLYEGEEDDIVAITLFPTRDTVDKLKEYGDPRRILNQIINDIVEGGIHIEYGHAIRDIKGLKNLDEVVSNPVEPVIISSRGELPENFKALIEDEPVSKEGDKRPSLNSNPADDPEPPKVCPECGEPNPTIFEDTMEYQCDNCLALESYK*
195 amino acids = 22,0 kDa
✓ putative DNA primase 36 789 .. 38 777 1989 bp CDS
/product = putative DNA primase
/translation = MLPYTKFYSKFVKLPKSDEVEVAIRCPFHNDSNPSLYINLQSGSWHCKSCDAGVDGGGHIADWLTEWFDIPLKEALKQKNVWDAQGDIKIPIDPQVVYNLHQNLVNDEKALKRFIQARGYDLNTIKEYMIGFEPDTGRYTFPVIGPRGDIINIRRYKMGAKKAKFINVKHALTLAKLWPLDEDFFNASWVVLFEGEPDTGLARQLGVPAMTSTGGAGSFPDGVAHYFRNKRVFICYDPDEAGQQGATRAAMAIRDEAKEVRIGKMPKDMDFTDFIMEGHTVEEFYSRVLAKSKVFEPPIKSEIDDSIETPTDFEPVSLTQATNNPGYNNKGVQLNVVVQGREGMPYSAPKTVKVSCPFYNPEATKCKDCMLANLTREQQEEGYDFHFNRSREVINFIDAPDDKVNAILKQSIGIPTNCHKPTIDTTEAYNIETLFIATEVAKFSNAITDDDMNAQKAYYIYESEHSPIKANKSYTLEAMRTTNPKDGSVIFVILGSKPLRSDIELFKPSAIELEDLKIFQPKPGQSVKEKMYEIAEDLSYHTRIWGRPELTIAYDLVYHSILRFHFQNKLQHRGYLELLVIGDTRTGKTETGSSLVEYYGQGDFIEGENTRLTGLTGTVTQLGGGQWSIVWGKFPLNDRRLLVVDEASGLETGISVSRSGRM*
662 amino acids = 74,7 kDa

✓ putative DNA polymerase type B 38 902 .. 39 897 996 bp CDS
/product = putative DNA polymerase type B
/translation = MQNALYGKFAMQRERIMYADISEGDKLEAEGHTVSEIIYDMNGIRMEFLEYDGYAKAEYIQPHISAYITSIARILLFKGLKYAHEKGILAYCDTDSCATTTKFPDKMVHDKEYGKWKLEGYVIEGLYFQPKMYAEKAINTDGEYEEVLRMKGVPKWVVEEQLDYNTFKKWYLQVKRGKAEIPIYKGGERVQKFLTKSKNNIEMNELAEMHKTINFAREQKRNIDLNKNTTSPLVRNDYGENKDEKSEYEFDEWYERLEEFNDDMNAVEELCMKFGKIQIPEKKQRKLYGLYKEYSSKAKAMCFSNEGLPIQDWCKKTGWDMKELLGELSFL*
331 amino acids = 39,0 kDa
✓ putative DNA primase 39 945 .. 40 943 999 bp CDS
/product = putative DNA primase
/translation = MYKRVYGRVWVRAKRAKDDWGQISGMRSRGIVEINKAKSDKAYARVRTIWISNPRAAKLMRDYDYGARAINDLIGRFEDVARLDFALGVGKDDIPQDIVNRDIVDLPQSPQTYTAELCQRLILWAWSRNATGRITLENDAVEFTREATLAILKQASHLGDLFEDAPVNLVERNSMKIKLARLSAACAARLFSTDEEMQKVIVTEEHVNFIAEFLIEQYSNKALDYRGLAQEAKRRHDVTPEQQAEIFRFFEMHENVIAELRKKTKPWTSNHVAEAAGIDIEEAKDIIAEMHRLDLIFDAKQGGVAYMMTHKWNTQLQLYERMSQEEREKIMK*
332 amino acids = 38,4 kDa
✓ putative QueC-like protein 41 114 .. 41 785 672 bp CDS
/product = putative QueC-like protein
/translation = MSKALVLLSGGMDSCTCAAIAKENHDEVHALNVFYGQRHAVEIESAKQITKALELDSYTELDLSDTFKNFKSALVLNAGIEVDDNQDKNSVGATYVPARNSILLSAAAGFADSKGYDVVYYGAHAEDHNSYPDCRPEYFYAMKEALRLGTDRGVVIEAPFIELHKSDIAKIGTELNVPFGLTHSCYRGERPACGTCPTCVVRLEAFKEAGLVDPLNYATDLNA*
223 amino acids = 24,3 kDa
✓ hypothetical protein 25 41 831 .. 42 235 405 bp CDS
/product = hypothetical protein 25
/translation = MAKSKRREIWLYERFEDLGDGGIKVHPHLYVCLSNEHPIGAGGVYPAKFVEDVYTSSAYQWRRIEQGEAFLKLHEGYYRYVNYSKRAIDQEWQRPVFASKKVNHPKHEHLLWSSFKNQLARYWDVQPRQMTLKF*
134 amino acids = 16,1 kDa
✓ putative QueD-like protein 42 249 .. 42 686 438 bp CDS
/product = putative QueD-like protein
/translation = MLQQFYPQPPAHPYVYELNKDMQFAAAHYVPHPSAGVCQNVHGHTYFVNVTIAGDHLDEAGFLINFKDIKKAVHGRFDHKILNADDAFNYEHGDGDIPSTEAVAQEIWYTIQDLLDKEGRNLKCLQVVVRETPTSYVIYRPNRES*
145 amino acids = 16,6 kDa
✓ putative QueE-like protein 42 856 .. 43 614 759 bp CDS
/product = putative QueE-like protein
/translation = MPVMEIFGPTIQGEGMVVGRKTMFVRTGGCDYSCAWCDSAFTWNGEEKATMMTAIEVFEQLADLGYVLNPKTGEHVMNFNHVTISGGNPALIGVPMEELIDMLQANNIEIGLETQGTFWKDWMYKVNDLTISPKPPSSKMVTDFDKLDAFMDKLYDYTADPYIADLHKFSLKVVVFDDADFEYAKKIHQRYPEVEFFVSVGNEDAKEEGDISGRLLKKLDWLWDKVLADPEMNDAKPLPQLHTLVFANKRSV*
252 amino acids = 28,6 kDa
✓ putative GTP cyclohydrolase 44 131 .. 44 763 633 bp CDS
/product = putative GTP cyclohydrolase
/translation = MLNNGYLTEKQIDKLNPITGPLSHDDIVWARQAMEGIEAIIKAAGDNPDRDGLLETPFRVFKAFMEYTKGYREDPKEHLKKSFDVDHDDIVLVKDIPFNSLCEHHFAPFFGKVHIAYIPSDKITGLSKFARLTDGYANRFQVQERLTQEIADAIQEVLEPKAVAVIVEGEHYCMCGRGVKKKGAVTVTSTMRGLFRENSDARAEILNLLK*
210 amino acids = 23,7 kDa
✓ hypothetical protein 26 45 195 .. 45 758 564 bp CDS
/product = hypothetical protein 26
/translation = MYDTIIVMGCDKTGKSTLINNLLSVPDIKTRFSVYKGNKMSSTKVAFDASMEVLNEHHNRSLLCDRFHFPDDMVYHPIFNTAPFPDDITQNYMERVLPILYKQRNTLIVYCYGNEDEVAERFKREGENLVSVDNIRDIMNNYIHWLKLLYDYFPIVILNSSYESKSDMFNKTMNAFYGNPVLGGHYK*
187 amino acids = 21,9 kDa

✓ hypothetical protein 20 45 755 .. 46 543 789 bp CDS
/product = hypothetical protein 20
/translation = MKLAVIPTWQRNDNELWKSESEIDLWLAQSDGIQMALTHLVENHFDYAVSMHKRSMKGDYIILDNSIVELGAAMSFGQVLQAATMISADEVVLPDVFYDSAATKQRVEETLDDYGKSNFKYMAVCHAENLNEFMNLFNWLNANDYIDTIGIPKCGLKDGTTREMVLNRIMVNRTADDKPIHLLGANGPESFRLPRKWREMIRSVDTVYPLWMAQHEEVLFPDTTFIKRPEGMVLHDTLGWGEGNKILYGMNNVAIVKGWLND*
262 amino acids = 30,0 kDa
✓ putative DNA polymerase I 46 536 .. 48 551 2016 bp CDS
/product = putative DNA polymerase I
/translation = MTDQHLQACKCDACPLKGYKENNQCLRLPLRESPVDIMVIGDSPIKTEVVHKEAFAGHGSTFFKKTLAAVVNSFNEKIEEPIKPKIHFTYSVLCQQKQEPPAGAIKACNDRLMTEIKVRKPKVIVALGNGAMKSLGHTRAGILDSRGSRKWDSRLNAYILATFHPQYVLQNTGVFETWTKDLEKALWMLKREPGKQFEPPKTKVDVIHHIPQAITFLRKLRAKKRKVASDIETRGFGFNYHALLCQGFTFKKGHAVVLAEEVINDPRIHVELKKTLESENIIWLYHNGKFDNKFYWAQYGIKARTDRDTMLMHYCIDVRKGTHDLEQVAMEYCDAEPWEHHAHKYVKESFADIPRPILYKYQGIDTDMTFRVHEELEKQFEAERRRGRKIDTLFKLLSRASNAYLRMELQGFKPDLKYVQQLTEEYEPALEQHMKDMEQLALESGWDPNEYAKWADIHKLKEWETKGKRAGKKKPGPTKKPTKFNPNSYMHIRYLLFGLWKVKPIMKKGKVSSDADSLQIYKDKLKDPIAIKFIDTKLAYAKDKKLYSTYVKGISKHINPITKRVHTTFKLHGTETGRLSSSEPNIHNIPRNSKIKNIFVADDNYILLQADYSQAELRVLAVESGDPWLQNVYLSGSDLHDQMSLQLYGENFTKEQRVRAKAVNFGIDLIS*
671 amino acids = 77,6 kDa
✓ hypothetical protein 27 48 858 .. 49 439 582 bp CDS
/product = hypothetical protein 27
/translation = MSISEARKLIRDWFAPQPLTEQFMKARREDPLYGRTYETPLGRIRPFGLVTEKNKNGVMNEAGNFPIQSTASDMTVWSVCELVEKFDALNEELGFEAARLVNTVHDSIIPEVYADEKIIKRVRDIMHETMESAGEILLNTEVPMKADFELGHRWGELYEFDFEGDSIVIHKKVNGEKIDIDFQTFMQEKKQAA*
193 amino acids = 22,2 kDa
✓ putative DNA polymerase II 49 601 .. 50 215 615 bp CDS
/product = putative DNA polymerase II
/translation = MKTNRVSMEMKFNTLKEIAKELNIKFNPIGLKKEELVKMINDEYKNQEEAQQQEVEAQQAKEAKEVEEAVNGKKKESKKETESARATKRAEEEKVVSTLLLDEEVKKNIAEAKTKADAIRALLNMGIERKYVAKVMNVRYQMVYQVQQRMLANERVKQLRDEARRHIDIIKNMDRQKAEEEFGEDLLAAYDKIVAEEAKKSEQE*
204 amino acids = 23,8 kDa
✓ hypothetical protein 28 50 315 .. 50 842 528 bp CDS
/product = hypothetical protein 28
/translation = METITNRRQRRKLKPWVRKALIGGAILFCCFIAFNQVDRMLARTNVNTENEKSLDRLAELKEKDGVEVSATGWDERKVQNMIHQMTHQKVEADQKWSSIEMTDERINTLLSVVEENDYDHGDVYKQILTRWAKGDFSQIVEDHNTIWSLQDGNVGKATGKLSASQEQRFINKYFR*
175 amino acids = 20,4 kDa
✓ ribonucleoside-diphosphate reductase subunit alpha 50 980 .. 53 103 2124 bp CDS
/product = ribonucleoside-diphosphate reductase subunit alpha
/translation = MILKSQENINREVPEPGWVKISSRVLMHKIMREVQEVRGFDYGDLYQSIVHNTEAGRYTEDILKSYSADEINELNKVIDPSRDDLFTYMGLSLLKSRYLARTGEKKPTELPQERWMVVAMYCLKDERENRLELVKTAYWGMSNMHFIMATPTLANAGKSYGQLASCFVDVMDDSLNDIYFQNTDSARLSKNGGGVGVYMGKIRSKGSTIKGFKGISTGMLPWARQLNNTAVSVDQLGQRQGSIVVWQDMWHRDIEKFLESKLNNGEEREKLHDLSIGVCIPDLFMIRAAKKQSWTLFDPYETREVMGFALEDFFDKKKLGKDEAPNKEDHAFSYHYLLCEQDERLELKKTVNAMDLYVRLATTAKETGYPYRFFRDTVNRMNPNKHCGIIYCSNLCCEIAQNLSATRFVKEFESADGRIVTFREPGDFVVCNLSSLNLKTIFSADDPAAILQKIVPVQMRMMDNVIDLNEGRIEVLQAEKTNRKYRATGAGTFGWHHLLAVLGIDWESEEAVKLAGDIQEQIAYYTIKASNTLAKERGAYPAFEGSDWHTGEYFDLRGYWEPEWLALRDEVQKFGMRNGYVMAVAPNASTAKIAGSTDGIDPIFGQIYTEEKKSSKTLVVTPDLNLRTLNYYKSGFAMDIDYSIRQNAARQKHVDQAISFNMYFPDGTTAGTIIKKDFMAWKLGFKTIYYTRSTSDKIPEGCITCAN*
707 amino acids = 80,6 kDa
✓ ribonucleotide-diphosphate reductase subunit beta 53 270 .. 54 373 1104 bp CDS
/product = ribonucleotide-diphosphate reductase subunit beta
/translation = MSLEQKMEAFRKAVPVVYLDERKILDPTAPDASTRIVNGESSNALDWNNVRLPWVYPMYKTLLANFWTPFEINLTHDIKDFANLELHEKEAFLSIYSLLRALDSMQTDYIMRTADYYTDSSIVALLAIVDQQEVVHNQSYDTIKAAVATLAEQEFSNNVWKTMPTLLERNEFISKGYDRAIKEATLDMLIQSLIYDVVLEGIFFYAGFAFFYDLMRNGKMVAAGTMINYINRDEQQHVRIFTEIYKQILIDFPEFDVPELKELGTEILREAANLEIAWANEIIGDKFATIDSEELAGYVRFMANVRAKQLQLPTPFERQETNPMSWIKVYEDTDMGKTDFFEQKVRNYKKASEGFNDVDSLNEGDLL*
367 amino acids = 42,5 kDa
✓ lysis domain protein 54 373 .. 60 471 6099 bp CDS
/product = lysis domain protein
/translation = MDLNKVYETQMAMRRRIIRERGIEWTDEQWMLQFLTCINEEVSEVRNELNWKHWKNHKDIDWSAVKEEITDVWIFLIELSISAGLYPEELEEIFYAKTAENHARQDGMPMRVLPKFVKNVGRSLGRSTASAFGDMMPSMKNSGIDSKNYIAEVYNSSREKVTPNEVKQTYIYKSGQQLINNAIRDLKSGNFYNKERQQQASNDSFKEMFGIDLDNLTNFEDQNKETTKEKDGKTIHNTSNNTQQNVFVNNSDPSTSKSIQQLTTISSSAMKMSHYNSSALSKQISTLIEFQHNNTNRFYTEMSSKMADITRDVSQMTGFLGVMAEVSVGGTRRTQGESMLATLLGLEGFSVSGMKDMYRKKYSNSTGGMKDTFNLVIKPYIDEVVANPIGALTKNAIKLALPRALKSAVGDMDQMFKFLPTMIQGKAKDWEGSDNVFKRNAAKIFGIDLKEDKGFNFSNYEKGKVAFDGVTRRSIVNVIPSLLSKILASVSNNSTHKEELIYDYDKGKFTTRKRVIKEMNSDIKNFTIDNYDLTNYKEQIARENQSKFSSSEELSAFMERVDKALLSMVKNSKMIHGNSKASDISEDEDVANAILNNFKGQTNANKSKYQYDLLSASKAYSDIYRRIEQNESFNNAFDMTKEERIFEPETNKEMARRVKTNIDRFFGVGQGPVENNMSKKNPLYWLTEGIKRVNGKTSEFFYGQDNNEYAYTRPQQPSSNQQNTVNRGSKIRDFASRVVNTGSNAISKLNTRNGLMPERRTSPSIPVISNTEDTSSNNTTRELSNLNQNIEEVNNEISGDRGITRSIFLLNRNIERNNRIMEGRNDEKTSSSTNSTAIRTTNVQNPDLSILPKINDNILHIIALLEAKFSGDGLPVGRIGKFKNIIGSYKDKTLNFFEKLFGRGRSNSGGFFSRTAEKVKGFIGMVFGNSGSRTSLLSKLFGGAMDSIRGANGRQSITSRLLGRDGIITKFVSGTLTTVLDVASKTIPKATKFAGEVTKGFLNFGKSAFSLILGAGKKGLDKAKELRSNRSASRAGRSGNRNIKGMRGLLGLLTSTTGSVIGGAGSLIGGSLSLGMRGISKVGDIASGIGNKLSGRKGHKKSKSSSNRRSFSMPDIIDRVFNRKSDSLHVFVDGGSLDKIREVVKVQTHISDGNSAVEQIAEFKKRRQNNENSLLQNLKGGRKKRNRNNLTGEQSSGGGFLSGTLSNIAGDIIGEVIGNKIAGRGGRDTGTRAGRRAGRRGIFGRIGGLFNRNRGGASEAIEGATDLAQNSTRMGRNQSTGRGIRGMFSRIGGGLSRLGGRGMAGIGALGAGAGLASGGAGVAQAATTGASATQAATTAAGASGVAGSASGGAKGLLRGAGTALRGAGRLAKFIPGVGLVATAGMGVMDAINGVQNANQIFGTEKATLGQKVSAGAGSVISGLTFGLADKEKVSKGIYGFGNKIKDFGSKALSTVKKNPLLLAGGIGGGLGLGALGLSKMFGKKEDEDQKRDAEKGENSKQPINKISAWVEKLGKFFSIGAGGTFFSGIWGMITGKTGGIFDKIGNWFKGLFGGGKDDSNSGGDSYTGKIGSGIGALAAKYESSGNAGTVANSSGDIGGQSFGKYQLARNTGSYKSFINKLSDYGHEDWEKQLKSAYNSTSQSAAVWKKIYKENPKEFEKVQDQYFADQYFRPAAGKIKSAIGLDVGKRSTAVQAVLLSTAVQHGTAGAVNVWKNALGSKANDMSDSEIINAVYKERAANNGMKYFPSSSAAIRKGVVNRFSREKKDALAMLAKDGGEKANTSSDSDKDTKDSSSTGSTASKVMNDRSQFYDNPFDSASSGGGYTNSTAGYDSAPSSSYKSIGGFSLGSSAGKALTSGSAYVANLLSTSDKAMGDLRWSIGNNTISKANSIKNNYLNSNSSSNPFSALGIGTGTTSNIKSTASSSLVSPLSSIPKLSSSSSESNTGSTITGNDFTEMLKNSDEIAQMQSILKQINENSKQGNSILAKMLEAIIDIRDNKSFGGTTVVNNTSSGSNYSSSSISPETDSMLKGY*
2032 amino acids = 219,1 kDa
✓ hypothetical protein 29 60 758 .. 61 204 447 bp CDS
/product = hypothetical protein 29
/translation = MKKVTMVLTCLTLVILGFVSVPKAEAAWSGWQSLTTGYTGRVYTDATTYTSRASTIDWKVEKKGSSKVYYTAKLYKWNNNGLVYTGQSAGGYFFYSTPLKSFSVPKARKATGNGGYQIKVELYNSYIKDKAHYKGTLNSSKFYITDGV*
148 amino acids = 16,5 kDa
✓ hypothetical protein 21 62 140 .. 62 694 555 bp CDS
/product = hypothetical protein 21
/translation = MTKLLTVAEFTKIEGNDKFNTPQKVNYAIRKQGAPFEEVEGKRMIDPEKWSEWAANADITTRKAKSSGETGEVSTGRIQRKTGVTEGEFLAWKSGMNNEKISAGKVVTNTASFASTMIDDCGINAPLSWGSIEKHIEDGKMMRVNYPEQLMYVLSKHYEGIGEPDTAKQLMTLYERHKTEEACV*
184 amino acids = 20,6 kDa
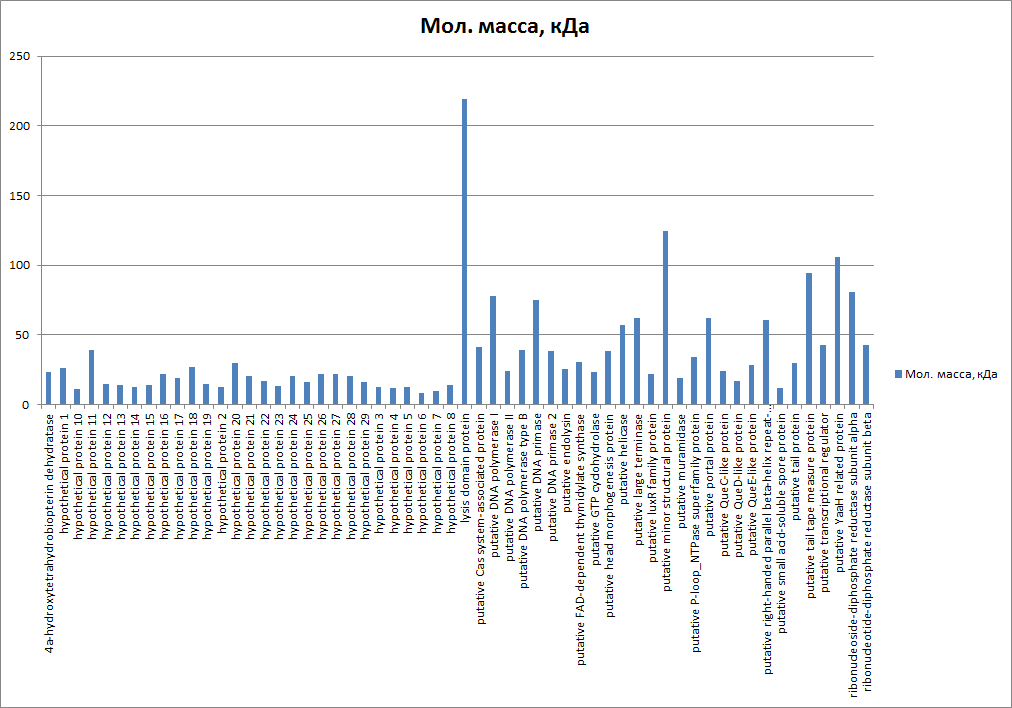
Рисунок 91 — Диаграмма распределения протеомов исследуемого бактериофага Bacillus subtilis phage FBs-16 УГСХА соответственно молекулярным массам
По проведенным исследованиям генетического и протеомного картирования Bacillus subtilis phage FBs-16 УГСХА локусов патогенности и их гомологов не выявлено.
Bacillus coagulans phage
Нами были получены биоинформационные данные сиквенса Bacillus coagulans phage Phagum B.c. 11 УГСХА:
Длина: 42609 bp
Содержание GC: 37,1 %
Молекулярный вес: 27 014 203,97 Da
Молярность 1 мкг/мкл раствора: 0.04 мкм
Количество молекул в 1 мкг: 2.23 x 1010
А 260 из 1 мкг/мкл раствора после 100-кратного разведения: 0,259
При сравнительном анализе полного генома Bacillus coagulans phage Phagum B.c. 11 УГСХА были получены результаты, представленные в табл. 3.
Таблица 74 – Сравнительный анализ генома Phagum B.c. 11 УГСХА с данными геномов, представленных в системе NCBI
В результате сравнительного анализа генома Bacillus coagulans phage Phagum B.c. 11 УГСХА с аннотированными в системе NCBI была доказана его уникальность с наибольшим соответствием геному Bacillus phage GIL16c (34% идентичности).
Нами был проведен сравнительный анализ секвенированного генома Bacillus coagulans phage Phagum B.c. 11 УГСХА с эталонным геномом бациллярного бактериофага, представленного в системе NCBI. Наиболее близким по гомологии оказался геном Bacillus phage GIL16c. Сравнительный анализ представлен на рисунках 92 и 93.
На основании генетических данных был проведен анализ протеома бактериофага coagulans phage. Результаты соответствия генома и протеома (на основе генетического кода аминокислот, характерного для бактерий и вирусов) представлены на рисунке 94 и в таблице 75.
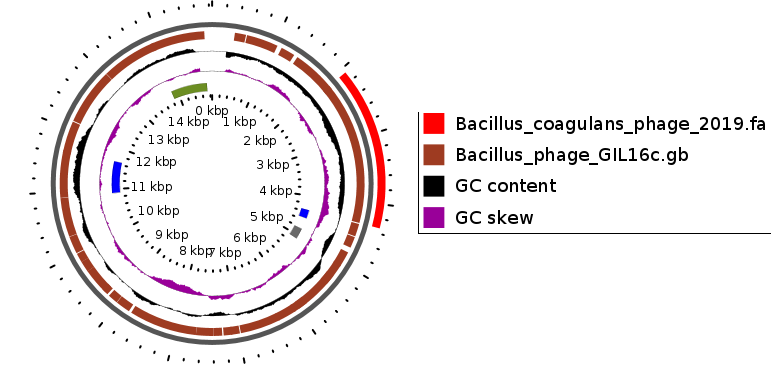
Рисунок 92 — Сравнительный анализ гомологии геномов исследуемого бактериофага Bacillus coagulans Phagum B.c. 11 УГСХА и Bacillus phage GIL16c
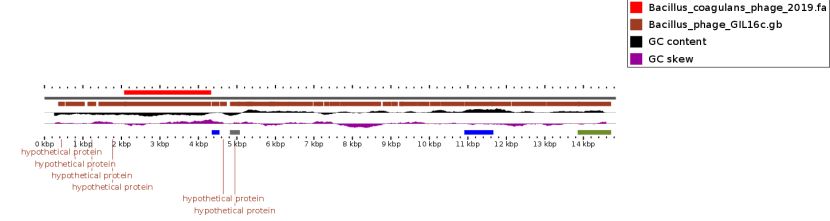
Рисунок 93 — Линейная диаграмма гомологии геномов исследуемого бактериофага Bacillus coagulans Phagum B.c. 11 УГСХА и Bacillus phage GIL16c
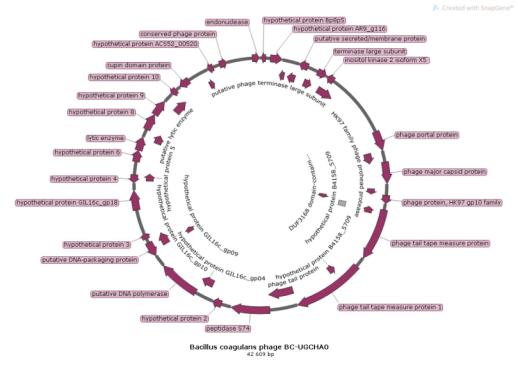
Рисунок 94 — Протеомная карта гомологии исследуемого бактериофага Bacillus coagulans Phagum B.c. 11 УГСХА генетическим маркерам, аннотированным в системе NCBI
Таблица 75 – Анализ состава протеома Bacillus coagulans Phagum B.c. 11 УГСХА
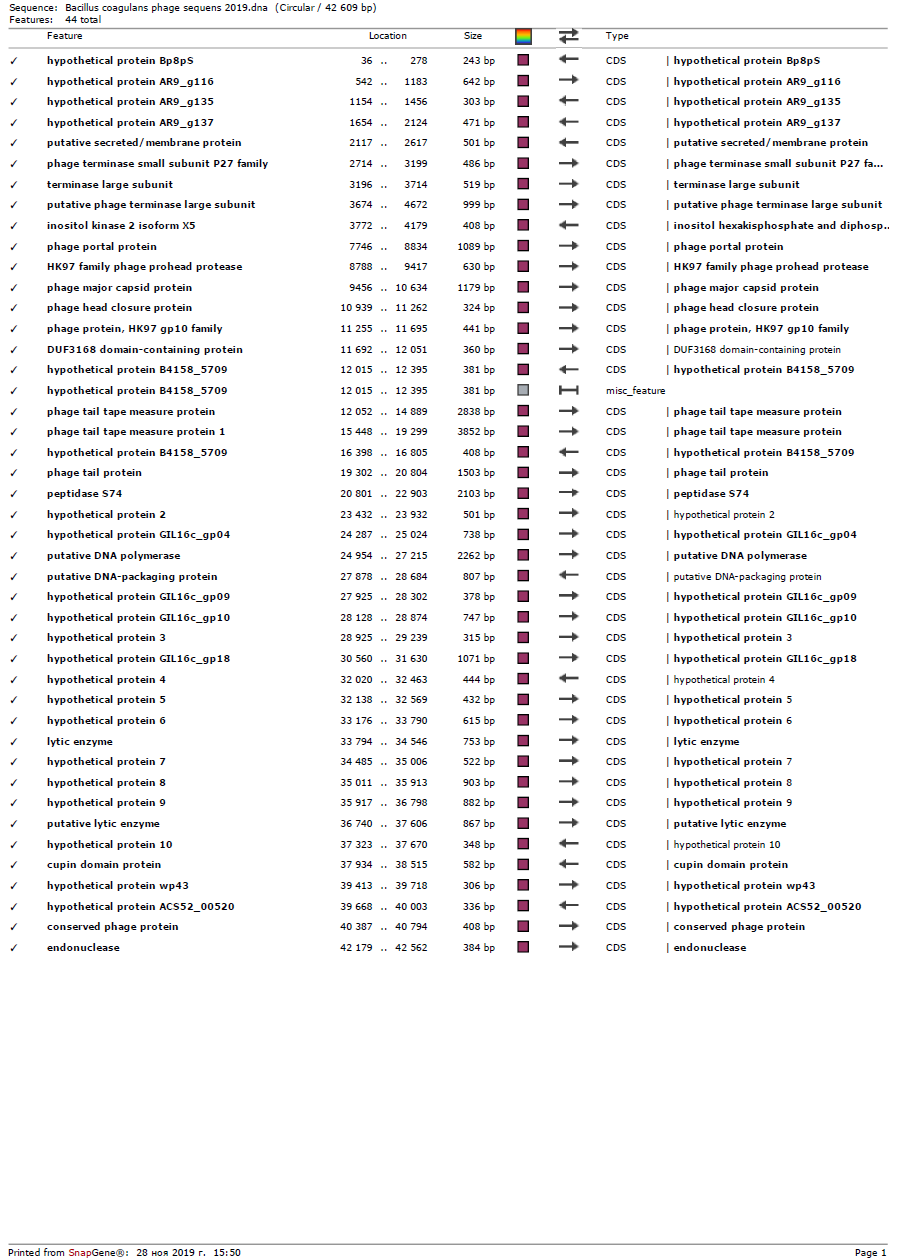
Каждый из протеомных компонентов Bacillus coagulans phage был сопоставлен с аналогами и составлено его филогенетическое картирование для поиска подобия возможных локусов патогенности.
✓ conserved phage protein 40 387 .. 40 794 408 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = conserved phage protein
/translation = VNHHLFNWLRDYQKLEEDIAYLEYNLDKTKAELRRWVSGDLREVRLTAESEGAKVENRIEAIEYELAHKMNDMYKLKKLISKFRGLENQILKLKYVDGMTLEEIAEAVNYSSSHIKKKHAELVRLIKFVEREGVI*
135 amino acids = 16,0 kDa
✓ cupin domain protein 37 934 .. 38 515 582 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = cupin domain protein
/translation = LDMQHIPRYYYQSQSPMDSIWNNNNWIYAWNPYYYNYNNNAWNRNRNPYCENVRLTDYGARPFVLNINQATKQNNTYRTAIWTGKNLQVTLMSINVGDDIGLEVHPTTDQFIRIEEGQGLVQMGDNKDKLDFQEMVYDDYAIMIPAGKWHNVINTGNTPLKIYAIYAPPEHPYGTVHETKAIAMSTEANRYYY*
193 amino acids = 22,7 kDa
✓ DUF3168 domain-containing protein 11 692 .. 12 051 360 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = DUF3168 domain-containing protein
/translation = VINLRPDILQALENDQELVSLLGGKRIYYRKAKKAEEFPRITYFELDNRPDGFADNQEIESEILFQVDVWAKSSTTAIHQKVNEIMKRIGFSRYAVADLYEEDTQIFHYAMRFAKGVEL*
119 amino acids = 13,9 kDa
✓ endonuclease 42 179 .. 42 562 384 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = endonuclease
/translation = MKKPLRPCCEFHCYNLTRERYCEEHRYKEKETQQDKNRYYDRFKRDKESTAFYRSKAWERLREQALMRDKGLCLHCKNNRKIKVADMVDHIIPIKVDPSLKLKLENLQSLCNPCHNRKTAEDKKKYG*
127 amino acids = 15,5 kDa

✓ HK97 family phage prohead protease 8788 .. 9417 630 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = HK97 family phage prohead protease
/translation = VILMEKSAKKEMKEIRALPMTIEVREVNEDEGKRTISGSIKYNNESAEMRDWWGDTFVEEIAEGAFDESLKVRDVVGLWSHDTSQVLGNTKSKTLRIENDKKELRFELDIPNTTVGNDAWELIKRGDVDGVSFGMKVTKDKWSSEERENGKLYKRSILNAELYEISPVAFPAYPTNEVSVRSLDDFKAGEKRVADEFRKRKLQIELELI*
209 amino acids = 24,1 kDa
✓ hypothetical protein 2 23 432 .. 23 932 501 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = hypothetical protein 2
/translation = MENNTKQLNNEVNEIAVVDEHVNTNDIVTVDKVSPSIFEADGAKDVFFSSIQSKDRKSAIKVYNAINSSENALADHRGEVLEITDMVAHAITLQDELTKEDVDALRVVLIDKNGKAYHAVSQGVVSSIQKIISIVGPAPWNEPLEIVPAEVKTRKGFKTLTLQLQG*
166 amino acids = 18,2 kDa
✓ hypothetical protein 3 28 925 .. 29 239 315 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = hypothetical protein 3
/translation = LTMSNTVLIRASRCIYSIPLDDWRTNWCPCLPKLDEWFVTIGEKYVVFEYGDICHRMDEHYFNTLLPRIPYSSRFKALRNGKGVLRTERSYSKKGMKKHASNPD*
104 amino acids = 12,3 kDa
✓ hypothetical protein 5 32 138 .. 32 569 432 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = hypothetical protein 5
/translation = VNNDAKGLTFLTLSLLFLWLVFDDFVGKKRLSKLAQMMTPDLSMPSPGEVAEKVVDGAKESVKETTKNTREAQKEADKKAGEILFEKPAKNEKDPKKKEVLERLSEQSKKRAETNAYKDKGWLGYSWEDLFEDTWGTVKGWFK*
143 amino acids = 16,3 kDa
✓ hypothetical protein 6 33 176 .. 33 790 615 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = hypothetical protein 6
/translation = MPEFERLDPPASGGSGGKHKPKFDKKQKMLLLGGGIAVVLVALFMNKAKHSGGSSQEAVEEELKDYYTNYPTLGSQNAVVQDGMNTLVGRQEELLNSILELQGKKDPAELTKIYVTFDNSDEALKRQQYLINSGASTTYVRKQFIKDGWAGAKDYYVVEAYGKDRQEMADLVKKGVQDKQWGGMEVGKVKTGDAPSYGAHSRSY*
204 amino acids = 22,5 kDa
✓ hypothetical protein 7 34 485 .. 35 006 522 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = hypothetical protein 7
/translation = VLRMAELQGLKLNDKLKQVYDKTLSLGLRFTSGYRPGSTGPSGRPDSHSQGMAMDFAGSKDKMDEFAKWAKTSPLFTEVLWQTAGHYDHVHVGWQEGKHQAGKMYVGDKTLIDRPTGDGGGALSTGTASPNSDKGFITSAFVGIVRAVMILVFLIVAVYFFFQAFPDIKVKVF*
173 amino acids = 18,9 kDa
✓ hypothetical protein 8 35 011 .. 35 913 903 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = hypothetical protein 8
/translation = LKNMLKDNTWREVTLTLPPKMAYTHHFIDTNPNHYDINNLSVATLYAGVRVLPSPREYELLVPGNGRNILARKEGSSQIQIYNDSADAARIILTSFNEPFNPAVLANSGSVAPISNGGGGVSDTVTVKGFTSALPAGNNNIGKVVVTEMPTIPIEFKTLPSGTNMIGNVGVTKLPPLAEGESHIGSVNVQGGVSISSMPPVQVTNDPVRASHFYFEAMIGTGNYVCNVGDVIKFSYLVNEGDTDLFLNFDDNTLNPNLLSGKNVTIRLKPGEQLSEFTRKANKITFVRQSGNGMVRLLGV*
300 amino acids = 32,3 kDa
✓ hypothetical protein 10 37 323 .. 37 670 348 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = hypothetical protein 10
/translation = MFHDINKIKKSHGINSTTLSYFTILLTKFHYPEILDSIYQLRLVLPLGFHSHLIGFYERSRLDKQSNIRDPVIFRLHVSLHPLTNQSCQSHRSSHGNICPLLRQVSPDSSSDLHL*
115 amino acids = 13,3 kDa

✓ hypothetical protein ACS52_00520 39 668 .. 40 003 336 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = hypothetical protein ACS52_00520
/translation = MIFRKLFPSQNKQSEKLIYSNFCSLLTFISLTSFMMTPLSTKSSSVLFKCLITSIIFSADSASMTASYIFNSVKVTLKVFILSTPFLQNKIFNKKLVIPLKTDVMFVVRSA*
111 amino acids = 12,6 kDa

✓ hypothetical protein AR9_g116 542 .. 1183 642 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = hypothetical protein AR9_g116
/translation = VTDFDTLLIDFNKKLMEDTKHNNNFFLKEDEDDDDVGMDSLEDLSVGHSNDPAHPEDETDSKSEETNDGNSPESLDGGDDNSNPSDGDTGDSDDQGDADSGDLDNEQDDSPTDNDKKLQLYKSYKTIYTSIDNFLDKVSSYKEYLDTEENKSKNYELVEYIEDKLYNLKDSTKIMLTDKIKTMDYEKVKTVFVYTKSEINLLVNLFNKFSSSK*
213 amino acids = 24,3 kDa

✓ hypothetical protein AR9_g135 1154 .. 1456 303 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = hypothetical protein AR9_g135
/translation = VNVRRLIMKEVYNLKDLAGQFFFGNIKNKEDLEQAIEGKYLFRKNKGISDVNNAIRKSIKNGRGKTELELDWLALYLNDVFKLDRRKNNCLLLGRRKFVK*
100 amino acids = 11,8 kDa
✓ hypothetical protein AR9_g137 1654 .. 2124 471 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = hypothetical protein AR9_g137
/translation = MRKIERISDEEMNMFIELYWKILNNAEAMAELDYHRKVNIIYNEGVRGIIDIDENKKQIWFRNDANDIEFRQEFYYTYEELKGEKYAQLQKEYILKKLSSKQIEALNKLLNNIKALNIPDTIVLKERGNWTGEFEILNDISYGDIWNFINLFKNNE*
156 amino acids = 18,9 kDa

✓ hypothetical protein B4158_5709 12 015 .. 12 395 381 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = hypothetical protein B4158_5709
/translation = LLYASFVEGFNLINIVFKDVPASDPLRPFCANTAKVVAVSLNVIPAPAATADEAESPYFNSLTSVAHFIHITFTAPSIFFTSVYLIADESSCKTFAYTRLSTPTVELILTTSPAIYNSTPFANLIA*
126 amino acids = 13,6 kDa

✓ hypothetical protein B4158_5709 16 398 .. 16 805 408 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = hypothetical protein B4158_5709
/translation = LLYASFVEGFNLINIVFKDVPASDPLRPFCANTAKVVAVSLNVIPAPAATADEAESPYFNSLTSVAEALAAPDKILAASATERWSALNAFRAVEAISAASPNSNSPAVAKLRAPANPPLIISCKLTPAFINSSIP*
135 amino acids = 14,0 kDa
✓ hypothetical protein Bp8pS 36 .. 278 243 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = hypothetical protein Bp8pS
/translation = MIQRVNSLEKSGIFSINLSSLEEWSFLIILNIPLVVLSTSVAKPSFNRKYSSLYESNSSCSTNNNDSYLDNILMYLLLIL*
80 amino acids = 9,1 kDa

✓ hypothetical protein GIL16c_gp04 24 287 .. 25 024 738 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = hypothetical protein GIL16c_gp04
/translation = MANKRLKKKLETKRKKSLLVSEGYSKKETKKLKGRELETVYKKKAHNRKNRERAREIANLARQWGLSPSKFNSWKKLLPEIERIKKEQDREAPFLVIYYQDFTGETDSKFIYDFKKRTNTRSRSQITRSIIGWLQNAQNKLFLGRVAMRIVPKRDVSKTNTLWKNHGYVKIYEGQGKELTKLLTAIETIMVGVYDVKDRDKYLKQLLNNLRSLPYKQAHRNANEIQKIYDTKSYTKESWDNDEYY*
245 amino acids = 29,3 kDa
✓ hypothetical protein GIL16c_gp09 27 925 .. 28 302 378 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = hypothetical protein GIL16c_gp09
/translation = MIQMTDMLKAIEENPFLLRFGDGQFFARKKNEEEEEEIEEVEEEEEEEEEKPKPKRKPKSKSEEEAPAWAQKLIDLVTPKVEEQQGTQKVPVPPKPKVEEDEEPEVEEVEETDKPKKQGFLSWFL*
125 amino acids = 14,7 kDa
✓ hypothetical protein GIL16c_gp10 28 128 .. 28 874 747 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = hypothetical protein GIL16c_gp10
/translation = MGTKADRPSNTESGGTTGNAKSTGTTEAKSRGRRGAGSGGSGGNGQAEETGLPKLVPVDVPGKEVELSGEEKKLEEKRKKDRERKARSRANTKSSPRSSGKSKAPSMEILQLKPILMTVSQMVATREGFEIWALSETEINTLCEPIENMLAKTAALEKVGENSDAIALAIACFTIFVPKFLMWNATRKQKKAQVVTNYAKSIQPTGNTGANKTGTTGASSGPSVGKPSTSSQAFSGELNQLIPASAPF*
248 amino acids = 26,1 kDa
✓ hypothetical protein GIL16c_gp18 30 560 .. 31 630 1071 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = hypothetical protein GIL16c_gp18
/translation = MAQQKEQYSPQQRAMIWATSTRQYKQTLPTQVVTQEGMTLDFTLPRARLLTKIMLHVKAVATLKSSSGNIQRDPMSPYGILRRVELNLNNGFSPYIVSGKELFMYNVLRNHPDVLLPGANKQYLNYVENVATTAGKDNEIQFTIPIPVSLNERDPVGMVMLQNNTANVNLSIAVDQLANAYKLNPSNNDQVIFKSMSITPEIETFSIPSIPGGQPDMSVLKLVQSKSDIFSGGGQNILKLNVGTIYRKLILYIEDLNGKPLEPKDFTGNMELVFNQADTPYNIKPEILVHESHSNLGYPLPPGMYCFDFSFQGVPNLGGSRDYVDTERLTEFWFRFSTQVGGKVTVVSETISRLQM*
356 amino acids = 39,9 kDa
✓ hypothetical protein wp43 39 413 .. 39 718 306 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = hypothetical protein wp43
/translation = MDMSLVGNLKELQEKAIDEKVLEFAEEMEIVITKSAASGYSGHRYKIHNENPNRHMMCSKIFIEKLQELLDGVKVEFKEEEKKNILGGSYYEHYIRFKWND*
101 amino acids = 11,9 kDa
✓ inositol kinase 2 isoform X5 3772 .. 4179 408 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = inositol hexakisphosphate and diphosphoinositol-pentakisphosphate kinase 2 isoform X5
/translation = MAIFSFKRASGINECCPTIKSPSSSIPTQPTLVKSVVIDKSPPIQRVAPEKSRVSTSHFCHFDISMYPLSFLSTQIFMFLVKKALIFSGLSRATFKSERIPSKPSSYVATIGFAFIQFDSSLISSFFSNSQIITK*
135 amino acids = 14,9 kDa

✓ lytic enzyme 33 794 .. 34 546 753 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = lytic enzyme
/translation = MALDVRPFINDAQRIQKETGIPASIILGQMVFESSGKNPGGMSGLAYNAKNLFGIKGVGPAGTHTVWSQEYDAGGGRVSGFRKYNSYYESMADHARLLQTPRYASQLKNAKTFEDFARGIKAGGYATDPNYAGQLISIIKQNGLDKYDDGTPYTGEGSVPAGGGSDKRGIFTSVANGVIRALLILLAFVVCVLFFAKAFPQVEATAKSGAKKVTKSSSRSRGYKKVKPKGGATNGGTTGTQTKRQVEASI*
250 amino acids = 26,5 kDa
✓ peptidase S74 20 801 .. 22 903 2103 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = peptidase S74
/translation = MRTPSGILHVVDFKTDQIVAAIQPEDYWDDKRHWELKNNIDMLDFTAFDGTDHAVTLQQQNLVLKEVRDGRIVPYVITETEKNSDKRSITTYASGAWIQIAKSGVIKPQRIESKTVNEFMDLALLGMKWQRGVTEYAGFHTMTIDEYMDSLTFLKKIASLFKLEIRYRVEIKGSKIIGWYVDMIQKRGHDTGKEIELGKDLVGVTRIEHTRNICTALVGFVKGEGDKVITIESINKGLPYIVDADAFQRWNEHGQHKFGFYTPETEELDMTPKRLLTLMEIELKKRVNSSISYEVEAQSIGRIFGLEHELINEGDTIKIKDTGFTPELYLEARVIAGDESFTDPTQDKYEFGDYREIVNQNEELRKIYNRILSSLGNKQEMIDQLDKLVNEANETASNAKKESEAAKALAEKVQENIKNNTVEIIESKNPPTTGLKPFKTLWRDISNGKPGILKIWTGTAWESVVPDVESVKKETLDQVNKDIESTKTELNQKVQEAQNQATGQFNEVKESLQGVSRTITNVENKQGEIDKKVTKFEQDSSGFKQSIEELTKKDGQITEKVNTIESTVEGTKKTISDVQQTTSDLKKTTTEIKEEAGKISEKLMSVETKVNSDKAGGRNLLLGSNVKYEKTDYLINQYSLTENFFAGEEYTFVIKGSVPQGQKFGIWQNGGSSNVGYATSVYANGITYVTFKAVAIMYLY*
700 amino acids = 79,2 kDa
✓ phage head closure protein 10 939 .. 11 262 324 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = phage head closure protein
/translation = MNPAKLDKRLTFQVKDENAKGPDGDPIDGYKDAFTVWGSFVYLKGRKYFEAAAANSEVQGETEIRNRDDVSADMKIKYKNVIYDIVSVIPTQDHTLLIMWKRGEMNG*
107 amino acids = 12,2 kDa
✓ phage major capsid protein 9456 .. 10 634 1179 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = phage major capsid protein
/translation = MSKELRELLAKLEGKKEEVRSLMGEDKVAEAEQMMEEVRSLQKKIDLQRSLDEAETEERNNGREVETRNVDGEMEYRDVFMKALRNKPLNAEEREFLEDDLEQRAMSGLTGEDGGLVIPQDIQTQINELARSFDALEQYVTVEPVRTRSGSRVLEKNSDMIPFAEITEMGEIPETDNPKFSNVQYAVKDRAGILPLSRSLLQDSDQNILKYVTKWLGKKSKVTRNVLILGVIEKLTKQAIKSLDDIKDVLNVKLDPAISPNAILLTNQDGFNYLDKLKDKDGKYILQSDPTQKNKKLFAGTNPVVVVSNRFLKSKGTTAKKAPLIIGDLKEAIVLFKREDMELASTDVGGKAFTRNTLDLRAIQRDDVQMWDNEAAVYGEIDLSAPVEQPQG*
392 amino acids = 44,2 kDa
✓ phage portal protein 7746 .. 8834 1089 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = phage portal protein
/translation = LKIYQEDEYGIQRGTKHYLNNLLRLRPNPYMSSMNFFGSLEAQKNLYGNSYANIEFDRKGKVQALWPIDASKVTVYIDDVGLLNSKTKMWYVVNTGGQQRVLKPEEILHFKNGITLDGLVGVPTMEYLKSTLENSASADKFINNFYKQGLQVKGLVQYVGDLNEDAKKVFRENFESMSSGLQNSHRIALMPVGYQFQPISLNMSDAQFLENTELTIRQIATAFGIKMHQLNDLSKATLNNIEQQQQQFYTDTLQATLTMYEQEMTYKLFLDSELDKGFYSKFNVDAILRADIKTRYEAYRTGIQGGFLKPNEARSKEDLPPEAGGDRLLVNGNMLPIDMAGQAYLKGGDTNGEVSKEGNEGN*
362 amino acids = 41,0 kDa
✓ phage protein, HK97 gp10 family 11 255 .. 11 695 441 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = phage protein, HK97 gp10 family
/translation = MADGIDLDLLGFDRLVTELDQMGLRGEKIEDKALAAGGEPIRKAIAERAPRSPSPKKRSKSEPWRTGQHGADQIKVTKAKLEGGIKTVKIGLNKADRSPWFYLKFHEWGTSKMPAHPFIEPGFNASKAEAVRAMTDILKNEMRLDL*
146 amino acids = 16,2 kDa
✓ phage tail protein 19 302 .. 20 804 1503 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = phage tail protein
/translation = VVSTLGKLSFTFNNIRKDYIQMLVGRKRPSWAPVKRRLVRVPHRAGALLLNTETEERRIDVPLVIKAKKDMADLQKLKEDLADWLYTEQPAELIFDDELDRTYLSLIDGSVDLDEIVNRGKGVITFVCPMPYKLGKINTHKFTQEWSTETTSYFTNKGSVEAPALIEMTVKKPSTFLDVWFGEYPHNRDYFRIGYPLTVEETTVQERERVMWDEMATPIGWTPVTGQFEEMKGTGSFKSRGGHALYCEDYGKETGFYGAIAKKNIPGGPLQDFEMEAWVTLKSKNISEMGRVEVLLLDETSNVISRINMNDLYATAEITRAHMTIGNSGTPNSFRKLVDTSGFYSTTFNQFRGRLRIARRGKVWSVYVAKFIDGTEKDGASLVERWIDETGNPMTERKIAQVMIAICKWDNHQPINEMQIDDLKIWKVNKVPSNAQPYIFDTGDKIVIDTEKSLVTINGEKAINIKEIFSNFPIVIRGENRIDIMPPDVNATISYRERYR*
500 amino acids = 57,3 kDa
✓ phage tail tape measure protein 12 052 .. 14 889 2838 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = phage tail tape measure protein
/translation = MAGEVVRISSTVGVDNLVYAKVLQDDSSAIKYTDVKKMEGAVKVIWIKCATDVRELKYGLSASSAVAAGAGMTFKDTATTLAVFAQNGLKGSDAGTSLKTMLMRLNPSTKEAYNKMRDLGLITYNAQAGFDFLVKNGIQPASRNVGDIEVALEQYVMKTEGVTKWNDKCDTTFRELATSSAFLSSKFYDQQGHIQSLENISGTLHESMKDLTDQQRSMALETLFGSDAVRGATILFKEGAKGVNEMWDSMSKVTAADVAATKIDTLKGRLTLLDSAFSTMKKTIGDALAPVVSVFVAGLQKLVDGFNSLPGPVQKAIAITGGIVLALTAVATAIGVVLAAFGMIASGIGSLSLALASVGGIAGIAAGAVGFLGSALAVLTGPIGLVAAALIGTGVVAYKAYQKATEDSIASVDRFATNTEGKVSSSTKKVLGEYFKLSDGIRQKLTEIRLNHEVITEEQSQKLIGQYDKLANTIIEKTNARQQKEIEGLKKFFADSYVLTAEEENKRIEQLNQHYEQEKLKTQEKENKIKEILQTAARENRELTTSERISLQALQDEMDRVAVEHMSKNQMEQKVILENMRVQASEISARQAAEVVENSAKARDKVIEDAKKTRDEKIAEAIRQRDENKTITADEANAIIAEAKRQYDSTVSTARDKHKEIVSEAKAQAGEHANQVDWETGQVKSKYQAMKDDVIRKMKEMWSDVTNKYEDMKNSASNKVEEIKNTVSRKFEEQKKAVTDKMSEIKSSIEDKWNTVEKFFSSINLRSIGKSIIEGLGKGIDDASGGLFSKAAEIASDIKKTISGALEINSPSKVMIPVGSAVPEGVGVGMDKGKRFVVDAAKNVVGTVKKQMGNMPSVFDFGFQTNQYSIPQNTFSDFSGYMQPQLSYNNPSMAKTIFPNRPGGEQELNLTVNMTNVLDGKELANGSYTYTTKLQNREQKRRAEF*
945 amino acids = 102,9 kDa
✓ phage tail tape measure protein 1 15 448 .. 19 299 3852 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = phage tail tape measure protein
/translation = MANEINNLVVRLSLDNVNFRQGISNSGRAVRTLQNELKSVSTGMGGFANASQQTQAKMNTLSRLIDAQKEKVKALRQAYDQNKAKLGENDAATQRYASQVNKAVADLNRFENELKQVNRQAEQKGMDKLNNSLKSLQAEFQSITTGMGGFSNATEQTRAKVDVLSRMVDKQKEKIRELQQAYNRAKTEEGEASQSAQRYAEQIHRATAELNRFETGLQQSNRELEQQGNRLLNFGNRMETLGNHLQNAGMQIGMVFGGMTYAIGRGLKSAITESMNFEQQMANVKAVSGSTGAEMKKLSELAVNMGETTKYSSVQAGQGIEELIKAGVSLQDIINGGLAGALNLATAGELELGEAAEIASTALNAFKADHLSVADAANILSGAANASATDVRELKYGLSASSAVAAGAGMTFKDTATTLAVFAQNGLKGSDAGTSLKTMLMRLNPSTKEAYNKMRDLGLITYNAQAGFDFLVKNGIQPASRNVGDIEVALEQYVMKTEGVTKWNDKCDTTFRELATSSAFLSSKFYDQQGHIQSLENISGTLHESMKDLTDQQRSMALETLFGSDAVRGATILFKEGAKGVNEMWDSMSKVTAADVAATKIDTLKGRLTLLDSAFSTMKKTIGDALAPVVSVFVAGLQKLVDGFNSLPGPVQKAIAITGGIVLALTAVATAIGVVLAAFGMIASGIGSLSLALASVGGIAGIAAGAVGFLGSALAVLTGPIGLVAAALIGTGVVAYKAYQKATEDSIASVDRFATNTEGKVSSSTKKVLGEYFKLSDGIRQKLTEIRLNHEVITEEQSQKLIGQYDKLANTIIEKTNARQQKEIEGLKKFFADSYVLTAEEENKRIEQLNQHYEQEKLKTQEKENKIKEILQTAARENRELTTSERISLQALQDEMDRVAVEHMSKNQMEQKVILENMRVQASEISARQAAEVVENSAKARDKVIEDAKKTRDEKIAEAIRQRDENKTITADEANAIIAEAKRQYDSTVSTARDKHKEIVSEAKAQAGEHANQVDWETGQVKSKYQAMKDDVIRKMKEMWSDVTNKYEDMKNSASNKVEEIKNTVSRKFEEQKKAVTDKMSEIKSSIEDKWNTVEKFFSSINLRSIGKSIIEGLGKGIDDASGGLFSKAAEIASDIKKTISGALEINSPSKVMIPVGSAVPEGVGVGMDKGKRFVVDAAKNVVGTVKKQMGNMPSVFDFGFQTNQYSIPQNTFSDFSGYMQPQLSYNNPSMAKTIFPNRPGGEQELNLTVNMTNVLDGKELANGSYTYTTKLQNREQKRRAEF*
1283 amino acids = 139,4 kDa
✓ phage terminase small subunit P27 family 2714 .. 3199 486 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = phage terminase small subunit P27 family
/translation = MAGRNKQPLSVIQGKGRSNHITKSEKNRREKQEEALRGHTDKIEAPSYLTAAQKKEFDTLAAELVRLKIFSNLDVDSLARYVDSKDQYIKMVRLLRKTKPSDDFKLYSQMQRSKNLLFNECRSSASDLGLTITSRLKLVIPEVDTSQQKQSEAQKRFGDRI*
161 amino acids = 18,5 kDa
✓ putative DNA polymerase 24 954 .. 27 215 2262 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = putative DNA polymerase
/translation = MRFRRYMILNHIRKKVGITMSTTNRKKRREIKLFTLDTETRGLDGDVFRIGLFDGKQYYTYTFADVLPVFEKYKAYDCHVYIHNLDFDLSKIIAELRDYEPTFNTSLFINGIVTFTASHIIVHDSFRLLPSSLENLCRDFDLLEGGKMDIVDYMEENNYGIYNVKNRKLNKRLTKGNFFTTVDKDDPVLCEYMEYDCRSLYKILEIVIGLSKLEVEQFINCPTTASLAKTVYKEQYKKDYKVAISTKQYNHKQLGKGLEAFIRKGYYGGRTEVFTPRIENGYHYDKNSLYPYVMKMAEMPVGYPNVLDNEEAELSFDLWKRRRYGAGFIHAKVHVPEDMYIPILPKKDYTGKLIFPVGKIEGVWTFPELALAEAEGCKIEKIESGVVFEKTAPVFREFISYFEEIKNTSKGAKRAFSKLMQNALYGKFAMQRERIMYADISERDKLEAEGHTVSEIIYDMNGIRMEFLEYDGYAMAEYIQPHISAYITSIARILLFKGLKYAHEKGILAYCDTDSCATTTKFPDKMVHDKEYGKWKLEGYVIEGLYFQPKMYAEKAINTDGEYEEVLRMKGVPKWVVEEQLDYNSFRKWYLQVKRGKAEIPIYKGGERVQKFLTKSKNNIEMNELAEMHKTINFAREQKRNIDLNKNITSPLVRNDYGENKDEKSEYEFDEWYERLEEFNDDMNAVEELCMKFGKIQIPEKKQRKLYGLYKEYSSKAKAMCFSNEGLPIQDWCKKTGWDMKELLGELSFL*
753 amino acids = ~88,5 kDa
✓ putative lytic enzyme 36 740 .. 37 606 867 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = putative lytic enzyme
/translation = MVTRTQQIPKSVAHGNVHIKGRKIRMGQLKTFHAGHNYFVTGAHANGYKEEVETRRVVQRIAELCEENGIHYAITTDNDGRTQRQNLNNIIANCNSHTRDRVDVAIHFNQATSEKGGVEVWYYDQYNLASKVSEAVAGALGIANRGAKQGKELAVLNGTNAPAILIEVAFLNNPGNMKAYEERFEAVCRAIVQSVTDVNLKNYQDLPVAKADKYYRVNFGDFDSFDWLAGVKKRVNEILPGHGCWIACLAGNAHRILLGDYGSREEAQAVIDRLNQEFPGSGIWLEEL*
288 amino acids = 32,1 kDa
✓ putative phage terminase large subunit 3674 .. 4672 999 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = putative phage terminase large subunit
/translation = VTTAGFDLSRPCYREYEYVSDILDPSKNVENDDYFVMICELEKNDDIKDESNWIKANPIVATYEEGLEGIRSDLKVALDRPEKMRAFLTKNMNIWVDKKDNGYMDMSKWQKCEVDTLDFSGATLWIGGDLSMTTDLTSVGWVGMDDEGDFIVGQHSFMPEARLKEKMAIDKVRYDLWAEQGYLTLTPGEMVDYTIVESWIENFSKDKEIQEFDYDKWNALHLAQNLENKGFVCVEIPQRIANLSIPTKNFREKVYEKKVKHNGDPVLFWALNNAVVKMDDQENIMISKKISKNRIDPAAAVLNAFARAMYGASVRFDVSEFANKDFLGKLWN*
332 amino acids = 38,3 kDa
✓ putative secreted/membrane protein 2117 .. 2617 501 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = putative secreted/membrane protein
/translation = LSHIPKRINKEKRKKKYKKLYYSILLFLIEKPCNFFYKKFQAFERKRYNKNKHKYYKLAVNEVISYIENVLVKYPSQGVELAISESNVDISLDEFFRFDFWRKKNKVSRKVYKYIIDKNKSFNDYGNDLIHMVVSYFNNNPYTNIEFDNKYNYWYITMKKEVVKNA*
166 amino acids = 20,4 kDa

✓ terminase large subunit 3196 .. 3714 519 bp CDS
/transl_table = 11 (Bacterial, Archaeal and Plant Plastid)
/product = terminase large subunit
/translation = MNWIMERVFAYCEDILNGKINSCKKHRWAIERFIRDYEECQSEDSPFYFDGEIAEDFYWFAKEFKHVEGILAGESVELTDFQLFLAANIFGFKKKINGARRFRKVFIQLARKNAKSQFLAIVAAFCTFLGDEKQRAYIAGWTRDQSSEVYEAVKTGISSSDNSWFRLIKTLL*
172 amino acids = 20,2 kDa
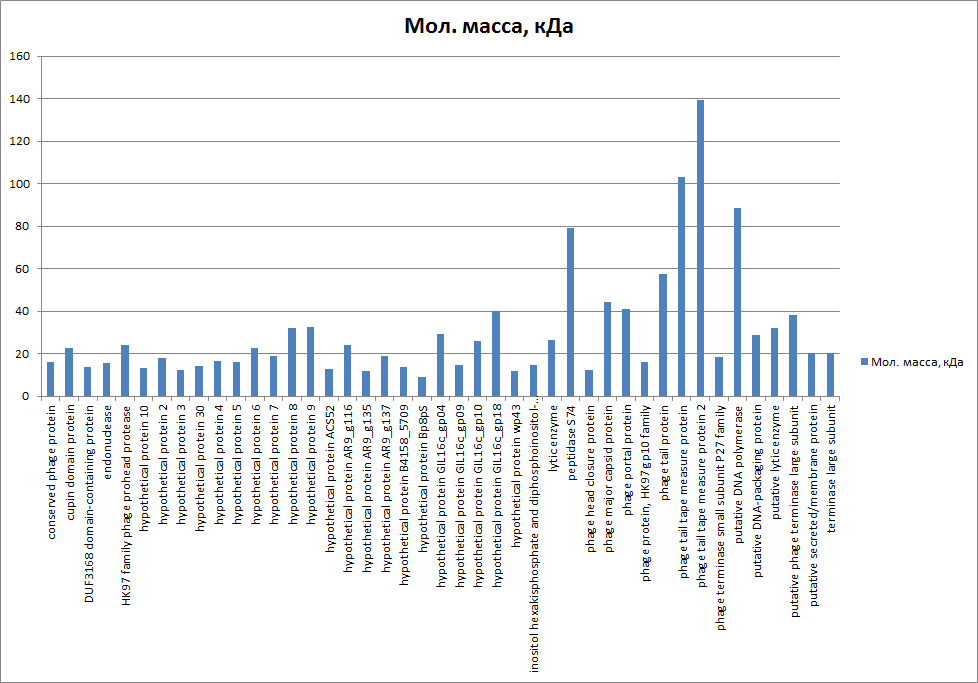
Рисунок 95 — Диаграмма распределения протеомов исследуемого бактериофага Bacillus coagulans phage B.c. 11 УГСХА соответственно молекулярным массам
По проведенным исследованиям генетического и протеомного картирования Bacillus coagulans phage B.c. 11 УГСХА локусов патогенности и их гомологов не выявлено
Bacillus pumilis phage FBm-8 УГСХА
Нами были получены биоинформационные данные сиквенса Bacillus pumilis phage FBm-8 УГСХА:
Длина: 50161 bp
Содержание GC: 41.7 %
Молекулярный вес: 30 990 001,26 Da
Молярность 1 мкг/мкл раствора: 0.03 мкм
Количество молекул в 1 мкг: 1.94 x 1010
А 260 из 1 мкг/мкл раствора после 100-кратного разведения: 0,261
При сравнительном анализе полного генома Bacillus pumilis phage FBm-8 УГСХА были получены результаты, представленные в таблице 76.
В результате сравнительного анализа генома Bacillus pumilis phage FBm с аннотированными в системе NCBI была доказана его уникальность с наибольшим соответствием геному Bacillus phage Riggi (96% идентичности).
Нами был проведен сравнительный анализ секвенированного генома Bacillus pumilis phage FBm с эталонным геномом бациллярного бактериофага, представленного в системе NCBI. Наиболее близким по гомологии оказался геном Bacillus phage Riggi. Сравнительный анализ представлен на рисунках 96 и 97.
Таблица 76 – Сравнительный анализ генома Bacillus pumilis phage FBm-8 УГСХА с данными геномов, представленных в системе NCBI
| Микроорганизм, фрагмент генома | Кол-во совпад. п.н. | Общее кол-во п.н. микроорганизма, фрагмента генома | % совпадения | E value | % идентичности фрагмента | Код микроорганизма в базе NCBI |
| Bacillus phage Riggi, complete genome | 43680 | 80487 | 96% | 0.0 | 95.82% | KF669659.1 |
| Bacillus phage Blastoid, complete genome | 21324 | 36701 | 83% | 0.0 | 82.07% | KF669648.1 |
| Bacillus phage Leo2, complete genome | 8938 | 34222 | 82% | 0.0 | 82.38% | KU836751.1 |
| Bacillus phage Taylor, complete genome | 8063 | 33320 | 74% | 0.0 | 80.99% | NC_041858.1 |
| Bacillus phage Eoghan, complete genome | 8063 | 33538 | 74% | 0.0 | 80.99% | KC330680.1 |
| Bacillus phage Glittering, complete genome | 5422 | 32440 | 75% | 0.0 | 83.42% | KF669651.1 |
| Bacillus phage Andromeda, complete genome | 5422 | 32310 | 74% | 0.0 | 83.42% | KC330684.1 |
| Bacillus phage Gemini, complete genome | 5064 | 32414 | 74% | 0.0 | 83.41% | KC330681.1 |
| Bacillus phage Curly, complete genome | 4889 | 33111 | 77% | 0.0 | 82.88% | KC330679.1 |
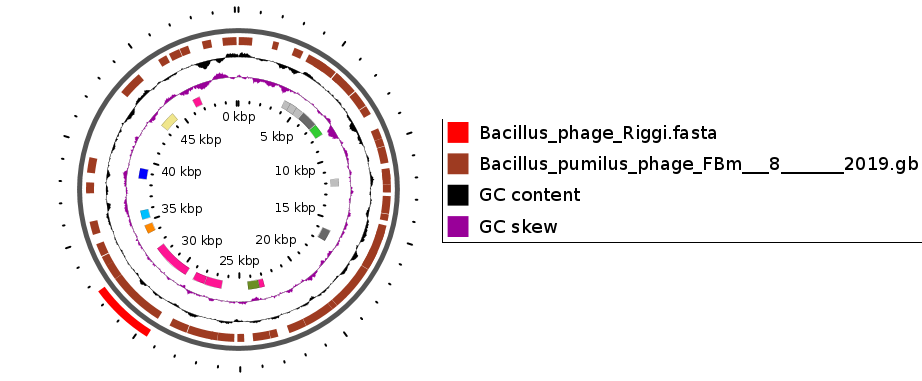
Рисунок 96 — Сравнительный анализ гомологии геномов исследуемого бактериофага Bacillus pumilis phage FBm-8 УГСХА и Bacillus phage Riggi
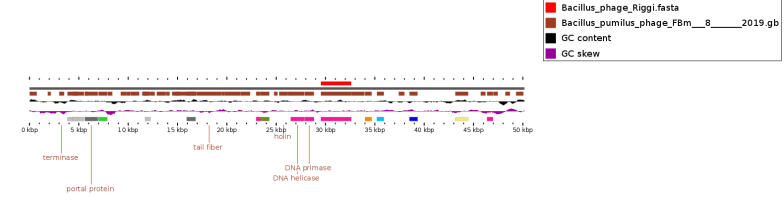
Рисунок 97 — Линейная диаграмма гомологии геномов исследуемого бактериофага Bacillus pumilis phage FBm-8 УГСХА и Bacillus phage Riggi
На основании генетических данных был проведен анализ протеома бактериофага Bacillus pumilis phage FBm. Результаты соответствия генома и протеома (на основе генетического кода аминокислот, характерного для бактерий и вирусов) представлены на рисунке 98 и таблице 77.
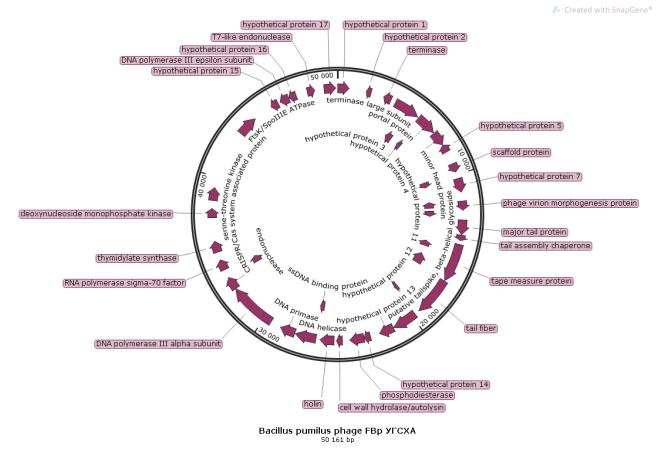
Рисунок 98 — Протеомная карта гомологии исследуемого бактериофага Bacillus pumilis phage FBm-8 УГСХА генетическим маркерам, аннотированным в системе NCBI
Таблица 77 – Анализ состава протеома Bacillus pumilis phage FBm-8 УГСХА
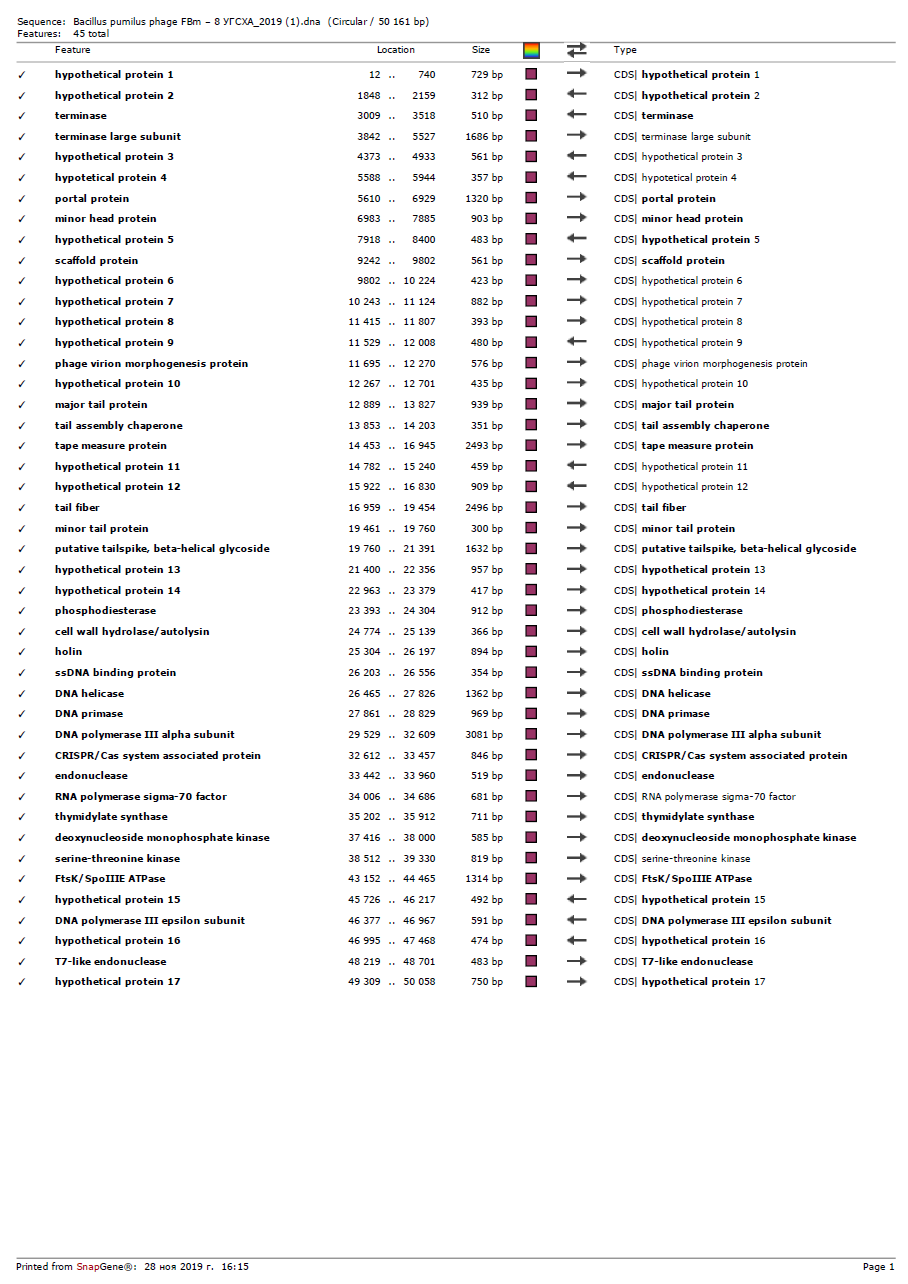
Каждый из протеомных компонентов Bacillus pumilis phage FBm 8 серии УГСХА был сопоставлен с аналогами и составлено его филогенетическое картирование для поиска подобия возможных локусов патогенности.
✓ hypothetical protein 1 12 .. 740 729 bp CDS
/product = hypothetical protein 1
/translation = MRSLPRYQTPVRIQGGIQMSKNWKDKDYEAKHEAEHIRRYIRKAKEDPEGAIQELNDMKYDKARIKKYELIKDLLKDVDIICGARIKNGRICSKPPVEGRTRCAAHGGNSPHPMSEEAKQRQLAHLNPRAHFVYGLYGGFTMTEHEDAFYIQMMNHYIPELDLDPINVLTLDRALRNFILNQRKEHADAGEAINGIQFDIDYDSKFLKFVQSLGMDRKFNISKEHKDNGATLSITDLFAGEE*
242 amino acids = 27,9 kDa
✓ hypothetical protein 2 1848 .. 2159 312 bp CDS
/product = hypothetical protein 2
/translation = MDNLVNNLDMIGAMFLCLLVIIFCICASVAFIVGTTRWIRKGKKPPCQHNLMVCDYKKIYDDDFTVGHQYLAACKKCGKTNWVSANYLNEMSQLGLYDKEAPK*
103 amino acids = 11,7 kDa

✓ terminase 3009 .. 3518 510 bp CDS
/product = terminase
/translation = MTRFVGYTSEEDILDFKVIGHIRVRDNPSELLCHKVEFTEDDIQLIYPVVFEGDEKDYLKNLYNQGIIIQITGFSQVNTEEATVMAVDEYKEFVGYTTQEEMDDVGYDGKTFAVWKKQRKGDTHKVQFYYKHFSTLIKTRPQELKDFEAGKDAFIKGYKRVTKLPKKYI*
169 amino acids = 19,9 kDa

✓ terminase large subunit 3842 .. 5527 1686 bp CDS
/product = terminase large subunit
/translation = MRDMTAEEIKRMRNVLSDPVGFTQKTGTVKGKPFSFDHRGHLYDVYRDKHPRIVIVAGRQVEKSETVNRLILFHGYTRAHTTITYTAPRNEQTTRFVNDRFRKSISNSNGGILEGDINKNRDAKTAIGLKNNTTYYFGSSWSDGDALRGISGDMVFFDEVQDIGQTAIESIEKSISHSEIQDPATEINGRCFYTGTPKQKGSYYDKVLWGNSDQKKWSVCCEQCGHEQFLSIKNIMVQNENQENERRYFGCLECKTELNRENGQWIKTRPNNKRYSGYLFNQLNMTWISANQIWHDYNNMDDMTFHNEVLGEFYSGDEQPLSYEDVLACTDKNLSLQDKCDIPTVMGIDYGSGGQSKTIITIGHETMHKGKKKLLIVHMESAPNMDTDTRIGYINSLKHKYNVQKINGDIGYGQYEGESFYAMYGREAISTRYVTYQTNPKKREIKDKFVLQVDRTFSMDSLIMAFKRGEIVIPYSDPEKVEPFFDHYTAIEAVYSESTHGTGRKRYDHRTPDDAFHSLNYVREGIFEINNKFEWDGAARDNWNEDKLLDHDIDLPSENEW*
561 amino acids = 64,9 kDa
✓ portal protein 5610 .. 6929 1320 bp CDS
/product = portal protein
/translation = MGFLDRFKRNKQQEETQKYNEELTELANSMFKEIALMKDTTGELPDQEDFNPTDFSLEVYDKMMTDGQVKSAIDMIKLSATAKGFTVTGDDEETKKYADFINENFEMIRGNMEDVIKEIMTALEYGYSCTEKVFEYKDGKIMLKKLKTLDPYSVAGKTDRFGDLMHVKQRIGSKTIKIPADKVLWYAHQKRFGNIYGQSRLRTVYKHWFIKDKMYRFANIAYERYGTPLLVGTVEDKNDVTDMTRLLKNINGMTGLGLSGGAKVEAIQTTNADFIGYIEHHDRKIMEALLVPPALLGLSRGQSGSYSLSSNQFDIFMIHLESIQRDIKSLIEEEIIRPLIDLNFPNVTKYPAFTFKPLADRDIDKLSNVFEKLISASVIAPEEEWLREELGFPVMSEEVRKSIEERKQKALEAFTPNDDSKGSDKKENGSQEDSNQEGK*
439 amino acids = 50,3 kDa
✓ minor head protein 6983 .. 7885 903 bp CDS
/product = minor head protein
/translation = MADSKKSINDMEALESAFLDKSQRLNKKRREQMIKRVEQVQEQLEYAFEHGNREQIDSIIDGLKIPSSKEWHKLLKNLVLKSIEGGAIRAQLEYEKLAQRTNFNESIDVTFALDWSLSLGGQALEYVLQYAYEIGVITEETVREQLRKTIIDSLESGDRGRDLIAKVIESVGFWMGEKHAETIARTETTKFYNAGKLARWLDPELDGFVVALQYDAITDNRTTDLCNELNGKIINVYNQDVIQQYTPPNHFNCRSQWLPVSKYEDYQENWIVAETPPSGFTHNVNLPSLLSSTGGIIKKN*
300 amino acids = 34,4 kDa
✓ hypothetical protein 5 7918 .. 8400 483 bp CDS
/product = hypothetical protein 5
/translation = MSKLKVIIIAFGVCLFLGALSSLFGGTTETAKPAEEPKKVETKKEQPEPAQTKSEPTEDQLKIVNESFSRIVNDSEGVISSIDLKDSGFVYVTVKESVWAVADESEKKSFLAGVQQRVKMSMSGANIVKPKDSVLTKFVNESGDVLAEKKLYGDNFKIKR*
160 amino acids = 17,5 kDa
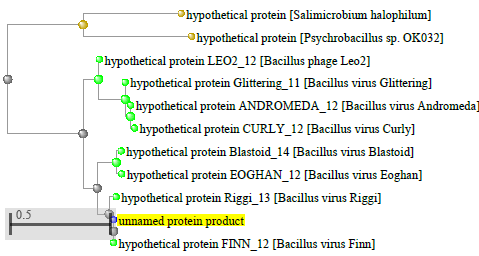
✓ scaffold protein 9242 .. 9802 561 bp CDS
/product = scaffold protein
/translation = MKKLSLGFYSKKDHQGNVKPSRIREVSIVAFPQVQGATLFKQEEPAKEEKLKMSKENQELSQEMIVQFEELNKRLAQQEAQIKTLSEAKLDSQIVKFTESKHIVPAQAEPLKALLSSMTDEQIEMFNEFMKHSAVVNFDEQGEFEGTDEKEEPASKLSPEDEEALKFYEQHVEQFGKGYSASKEVK*
186 amino acids = 21,3 kDa
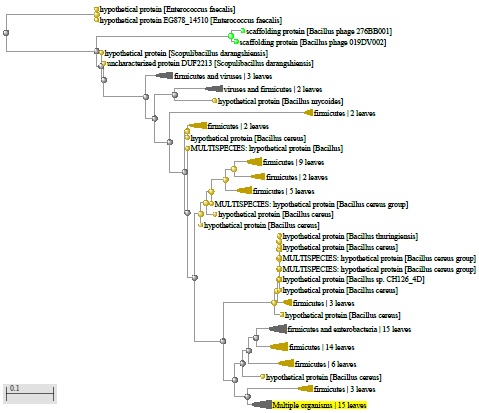
✓ hypothetical protein 6 9802 .. 10 224 423 bp CDS
/product = hypothetical protein 6
/translation = MAQNRVEVHIPHTAFFTFNVQAGQTLKVGDWVELSGDREVKAASSGSTKVVGMVYSGSVGIDGVNDGYKGDNKNVVTVVVNKPLVYAVVTDSAPVAAGDSLKVTSAKRVATLGETDTLDMKVGMAVTSGGTGEKIVILLG*
140 amino acids = 14,5 kDa
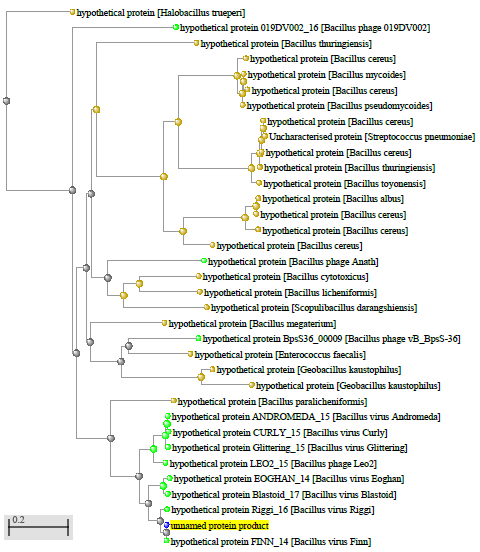
✓ hypothetical protein 7 10 243 .. 11 124 882 bp CDS
/product = hypothetical protein 7
/translation = MADFVLGQHPMLRKVFLDRRIKDFTDSQFVADQLFTGISVDALAIKFSQYDPETNDDGSMKLDDVPEVGEGSNYDRIGLTEAQKTALVKKYGLEFAVTEEMQKYGQTGQIERGLRRLATNIRGMVDEMAYQVATNGYTIGGGIQGLTKSGGFWNDTTDGAENMIADLVDAKMSLKKYGYEANTVVINPEQEAQFLKNKNIRDAFRQNNTDLVLLRGYLGDFMGLSFIVDSHFEADNALILEKKVIGDIADAEPLRTKTYNEDSNDRTIVRATRFTNAYLTDPKAVYLLKNLNN*
293 amino acids = 32,8 kDa
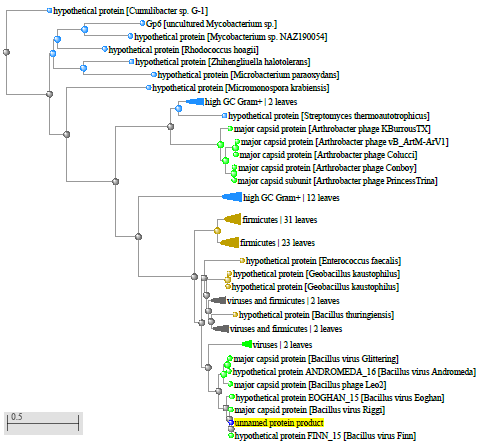
✓ hypothetical protein 8 11 415 .. 11 807 393 bp CDS
/product = hypothetical protein 8
/translation = MYATPADLRLVMNNLSKQVTDELLEKYILEASNYIDARLGVAYKTPFVVTPPIIHDIAVDLARFFFAEDAYTSQKPNLDEYYIKMKERIEEMLDGIINGVLVLDPDTKRPAGFATTTDGDQIFTLDQPEW*
130 amino acids = 14,8 kDa
✓ phage virion morphogenesis protein 11 695 .. 12 270 576 bp CDS
/product = phage virion morphogenesis protein
/translation = MASLTGSWCLILTQRDPLALLPQQTVIKSSLLINLSGDNMSNVNMMISVDLNNVPENLARAARQVSDFKIPLRQSAVYMEGSISRRFSSGGGSQGKWKRLSPATIRRHPHRSGGTPLSDTGRLKQSVTSGAVKQYSPKQLRYTLGANVKYAKVHNFGGGRIPARPFMYTDAKDRQEVVKIFTEFLRGVANQ*
191 amino acids = 21,1 kDa
✓ hypothetical protein 10 12 267 .. 12 701 435 bp CDS
/product = hypothetical protein 10
/translation = MSTLSIYTDIKNALRDQVSLHLQDTDYSNIDVFGEAYQDLTHFPAVTLEIKRRRKPIRGLGVRELQMDIDLWVYTNILDSQEAEEECLTLVDLVEQAIEADKSLGGVVDRIDINNDLNFGTVEYGENNFLQGAQIQFTAFKRVP*
144 amino acids = 16,4 kDa
✓ major tail protein 12 889 .. 13 827 939 bp CDS
/product = major tail protein
/translation = MASQSHGFDNTIVFGKETEFGVPAENSSYGSIGVIEEFSPEENRNIVARNSLGLRAPFSLRQGTNETDASISLAVQNGKPFAFALGHVTTVENPDVEGGYIHTIRPTRAGEQLPSFTAQNHNALLNWTRNYVGGKMDTATITASSDDAVTFESDILFATVEDSTEAPVPVVLDTENFFMFYEGFAELNNQPFADVTEFECEISNNLERRYTLNGKNRADRVQEGNLEITASLTVDLTSKDVYAQFANGEDLNMKLTLQDQYDENHKIVIELLGGKYDTNSISVTADALQEQELEAVFTDVVVTAYDTRPNLI*
312 amino acids = 34,4 kDa
✓ tail assembly chaperone 13 853 .. 14 203 351 bp CDS
/product = tail assembly chaperone
/translation = MDYLRKQSSQEITVLGRKITIEKPSFGENRKIINQSMKFNMETKQPEIDASLLGVLRAISIIKDWDLTDESGKKLPISLDTFDNVLDPDFASMMVDELGKIEENGYSQLSEEEKKQ*
116 amino acids = 13,3 kDa
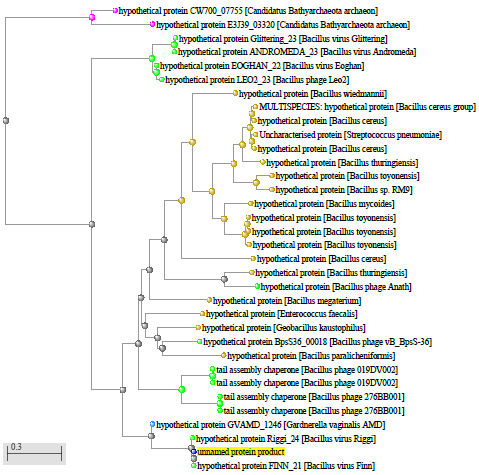
✓ tape measure protein 14 453 .. 16 945 2493 bp CDS
/product = tape measure protein
/translation = MALGGGNSIDILIRATDRASQVLNNVSNASKSLGDRMKNAQTGSMIFLGGLTALAGGALALTGGLVKTGIGFKAFKQNSLVAFTTMLGSAEKAQKHLDDMMKFAKSTPFAYPDLVTSSRNLVAFGFKAKETIPLMQTLGDVVAGIGGGNQELLNIVDIFGKMKAGGRASLEEINRLSDMGVPALAILGNQMGLTGSELREKISAGAIEANDAIEMLVDGMKNGTKGIQGETAKYGGMMAGLKGTFTGAMDSMKGAWRRAGDAMLDDALFEKLIDGVNWLTQQINKLPAVMTPVFSAINSGLDALIPMFQKAGDALANMSGDQVAATLFIIAGAITGAVVPAFVAMAASAWSAMAPLLPFIAVGAAVGAVAMVIYKNWSSISPVFASMWSVVQPVLQGLWQGFQKSAQLLMSWLMPAFEAFKSAITTIMPLLIAIGAALGIFLAVAVAVFNGVVAAVGPILTAIGNILNVVANVVMGVIALFTGDFSSAMSYFGKAWDNLVLAIMNIFKGLVNFFAGIWNTISGIFSSFGVSIGSIVISFVSNVLGFFKNLWNGAKSIFNNLKSSVISIVGGFISNVISKIVGFVSKIISNFVKMVTQSNQKFSSMASKVISIVTKFISSVIKFFTQLPSKIGSALASLGSKLMSVFTSAMGKGKSAVTKGISNIISAVKGWIGKFTSSGKGLLDAFTKGIKSGISGAIGAVKSGMSAIRKFLPFSPAKEGALSDLDKSGESFFPTWYEAALKKVRPMERAVGGAMSKVNDALNAEQGGMSLSAFSGGRTTITVVHRHEHDGTIKVNGDSGSQTLQMTGQEIMTRTENDIFSGLRTQVRKL*
830 amino acids = 86,8 kDa
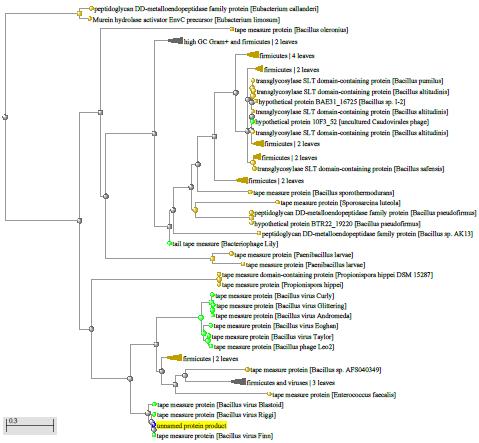
✓ tail fiber 16 959 .. 19 454 2496 bp CDS
/product = tail fiber
/translation = MAVKKFPIQWIGVYRADRNSYVGGNNIRVGGSADYQSYIGIPTAVRTAINTSRTSPKLRFVMNVTSGAEFDFGAHKETSNKASGKMPYYNYIGLHPIYGTGWRTTDLTSAFLPSYKNGSRQGIVIYGARNNSGQAYGKTGNSNEAYFEVEGTWNTPPTAPKITAPTSTTVATNSLQVKWNASSDPETATSELTYQVQIFNGSTWSSSVTTGKGVTSYSYNTSNMAETSSAQVRVRAYDGEDYSAWSTSPKFSVVKNLPPSKPTQLVPNGGRTIDRTESIRFTWKHNDDGVQAGFRIAWRTVSSSGEAGSWNYVNASGYRQSTNQYFDFAPNTFPAGKIEWRVSTMDQESLTSPWSDIQVFTAGIPSNAPIILSPEQSEIIPTSNITVTWSSINQRRYEVQIYDGSTQVYRKAETTTVKNAPIDFSLENNKTYRIRLRIADTQFDIWSEWSEITIQTNFIPPIKPDLSIESDEEGNTIIVSWTNDPPVTTEPINGVPTNGIVQNIQFSVNMNYTNNVDAGEIRTIYGTNAKVVAPSGITYEFTPETKQVSTGLEGTASTSTVDKAYLMFTGADPSRFSSEVVNETFYFRVVKFEDNQWYYNDNTQVWKPFDLYTDDFIIGDLKRTSTEIEGIEELNITGDLSTPVTSRVELYRRRFNSTVEGDWTLIRTGETNSSYTDYTPASGVTYEYYARAWGDNQSFSDSDIEEARIDFIHAYIHRSLVQSDFIVLRMSDERSEDIGRTGRFMSFAGREKPIYEYGYNTSKTVDVTWEVDTNEEYLNTVAFLTRKETFLYRDALGRRMFCIIDGSISVDDNLLSGCTFGVSLREVDFEE*
831 amino acids = 93,2 kDa
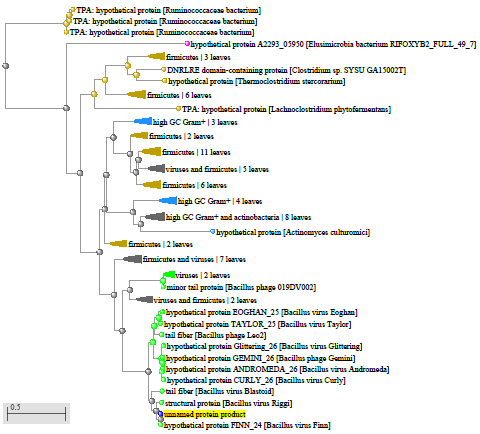
✓ minor tail protein 19 461 .. 19 760 300 bp CDS
/product = minor tail protein
/translation = MQDIARNGYSEEEIKKVLHGAYGNRAVRFRYDVLNNEDQKKDELTRVVSGSVNMSAFSTIKRTAKFTLQDEGMVVRDKQRPAIWRDYEGKTWDQLEEGI*
99 amino acids = 11,5 kDa
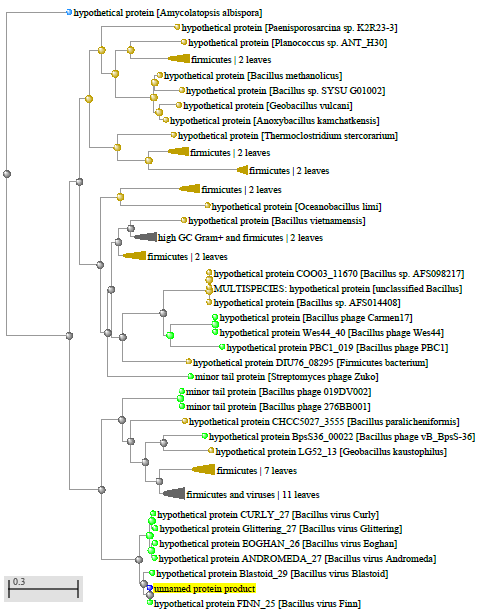
✓ putative tailspike, beta-helical glycoside 19 760 .. 21 391 1632 bp CDS
/product = putative tailspike, beta-helical glycoside
/translation = MGAKTSNYGFSLWDTGDRIEVTANEQTANWNALEDWIVKRNGYLVNAQGGYRLGSNGKPLVGDATNATLDDQPAIQAALTKCKDDGGGIVFLPAGNYALKNTCVIYSNTTFIMHPQARIYRNKANIGAFFRNGETGASYTGYNGHGNIHVIGGYLDGNIENYDYRFNFFSFGHGYNITFENIYMKDTQTYHAIEINSTNKAVFKNLTCDGYSLDSEFQQTTPNRKTEAIQIDGMYGQDVFGGFGAYDNTPCNDITIESCTFRNWNRGVGSHSSATGAHHRNIRVVNNHFENIEDIAVVSCMWDNAVIDSNTFQTVGGGVWLRVKDSTDATFGYVISNNTFRTVTLGTSARHAIRVSGQDDADTAFKLRTVSITGNTIENTTDTSIYVDRVWRTTITGNTINNATTSGIYVTGCEFGSISANTIISCGSYGIGLSGSNWFAINGNMVSNTDLSGIYLSNSKECAITGNTTRRNGIAGGDNQGIRLVSNSDGCTVTGNSHVSGSGEADRAILCSGSTKKNVTVGNNGGGKAITNNSTDGVSSGNL*
543 amino acids = 58,4 kDa
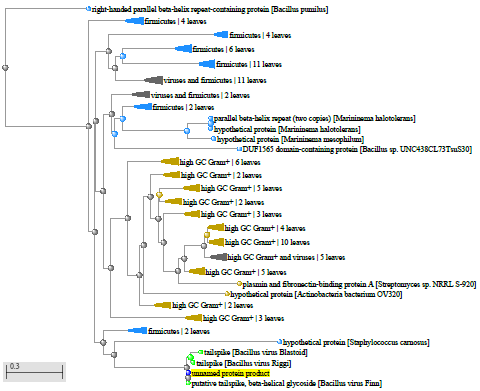
✓ hypothetical protein 13 21 400 .. 22 356 957 bp CDS
/product = hypothetical protein 13
/translation = MTMATLNDYMIFTETAIENKIDWLVDKIQPWVIFQMPDGGEIEFPLGIFHLSTPTRNDQNGNIYREVEAYDGLIVLDQDKFTDRYTIKSGTTYEKAVRDILKSAGISKINIEFTGNLNLTTDKEFDLGTSKLEAINELLTMTNNTPLWVDAYGYYITTPYKPPSEKVFDYTYDSRSLSIVMEDVEEEFDIFGVANSWVITVSNPEEAPLVARRVNNNPNSPTSTVNRKRTIVDFRELEEISSQAALEGMADRIAFEASQVYGKVKFETPIMPFHEYYDSIKLIYTPLDIDAVFSESSWEITLEAGATMKHEARRVIEI*
318 amino acids = 36,3 kDa
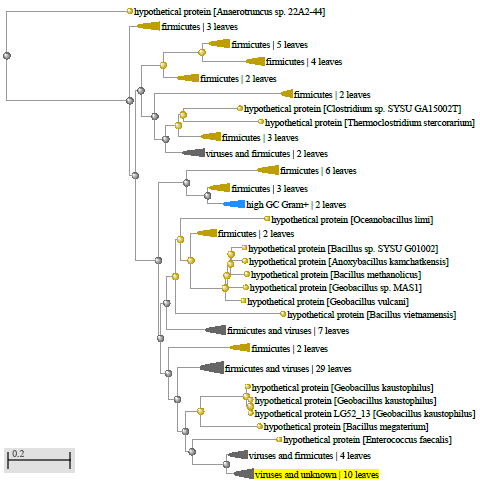
✓ hypothetical protein 14 22 963 .. 23 379 417 bp CDS
/product = hypothetical protein 14
/translation = MDVNTLMSIASKETVFAILFIILGAAVIRWVKTFIDQQREHSQEREQYIMEMHKKQLEELKEQAMHQRNDNRELLIEQRQSFDRREKDLLDNLKKNTRQLENISETLKDMKSDIVGLEDNLQTIWSELERKADRERIN*
138 amino acids = 16,6 kDa
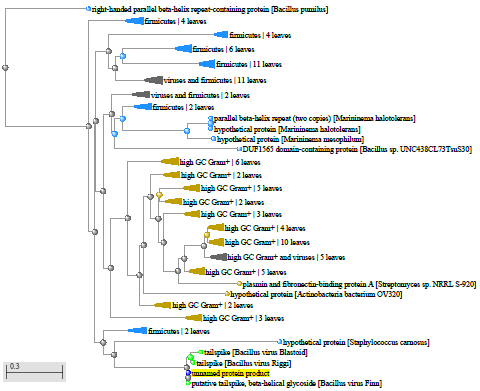
✓ phosphodiesterase 23 393 .. 24 304 912 bp CDS
/product = phosphodiesterase
/translation = MKKVTLDAGHGGKDSGAVGNGLKEKDLTLEIAKQTKSYLESNYSGVSVQLTRSTDKFIELPERAAIANKNKSDLFVSIHINSAGGTNGTGFETFTYNKLSAKSQTKSDQKVLHASILNEIASFGVSNRKEKADDLSVLRNTTMSAILTESLFINNPADAKLLKDPSFIKAVSVGHAKGIAKVLGLKAKKPPESPSKAPSQPSKPKGSTYKVQRGDTLYGIAKQHGMSVDDLKKLNSLKSDIIRVGQTLKVSNPIKVVVKTYKVQRGDTLYGIAKQHGTTVANIKKLNGLKSDLINIGDVLRVK*
303 amino acids = 32,6 kDa
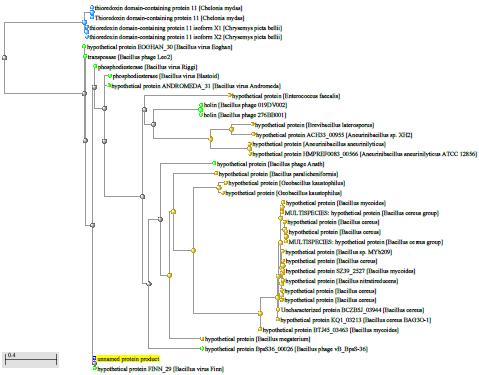
cell wall hydrolase/autolysin 24 774 .. 25 139 366 bp CDS
/product = cell wall hydrolase/autolysin
/translation = MEFKKGKSFKKLKTVKDFQTGEAEETLQKVTDEAINQYAEEVERAIEAEMLKVAKEYGYELPDEPTLEDFKQFNEQMKQDGFEIVLEQETKNDPSKEKYIYSVTISVKQIHTIIDFDIEEE*
121 amino acids = 14,2 kDa
✓ holin 25 304 .. 26 197 894 bp CDS
/product = holin
/translation = MTNAWGNLNFEDNNNGGSQKDIPPFMDIKLGDNKLRILDVAPHMYNEWYATQGNGGKGCGIPAFSEGDLLEKENRDFMAKKFKEADDMGLTEANGKKKQRSEFLKTEGYAKQPWGRRKDKAIIHVLDRSDGKVKLLDRTTGIFKQIQSLAVNPEYGDPREYDITITKVDEKGKGNFQDIKYTVMPARQNIPLTEAEKAAYEAAKVDLVELKTPNYTPEQALLIAKGKTFSEVLGNGAETPEQVTAGSNPDYLPKEENDSQVEPAPEVKEEQKPRVDEPADLGEEISQEELDAMFDEE*
297 amino acids = 33,3 kDa
✓ ssDNA binding protein 26 203 .. 26 556 354 bp CDS
/product = ssDNA binding protein
/translation = MLDVVRLREHYKNTVNVCHLQDDDIDNCLWMLTKSGLTYEMIYFGINYLGFSNMEALEESPEQVGANWQYIKAYYDLAKTKRGQTQKDGVQYDPKNKTERRDSPSWFREGIDQHYFE*
117 amino acids = 13,9 kDa
✓ DNA helicase 26 465 .. 27 826 1362 bp CDS
/product = DNA helicase
/translation = MVYSMTQKTKLKEEIHRHGSERALISTILSDPSQLILTKSMGLIPDMFAVDGHKFIYMALLHLYDKQAEIDPIAITNVFTDDRANEAINELGGIDYLESMARANVAPNTKMLVGQIIQASARRDVRGKALEIADRALKENDTPLDEYLSGVETEFRNIGLEYSVGQSVKKLGEGIKERMKERAKNPMDVIGIKTGWAPFDLAARGLVNGELTVVGARPKVGKSTVLLNWSKKICHDDGIPLLYIDTENYTHEQEDRLLSLISGVDHTEIENGQFAKDTFNGKAKDKLKAVAEATKVIESGNFYHVYLPFFTPEKIEHIVREYQINHGIKLVCFDYIKLPSSDSKLGDKEWQQLGYLTSKLKDLAGMTQLPIISAVQLNRSGNNDDASSDNIGGSDRILQLANRVCILRRTTPDEFTTTGASHMFKISDQRTGKPLDWTPVKSDGKTWRLDMIG*
453 amino acids = 50,6 kDa
✓ DNA primase 27 861 .. 28 829 969 bp CDS
/product = DNA primase
/translation = MRELISHYGGKPTGRGEIRSSCVCHGGDNPTAMVSNEQDKLFYCHTQGCSGDAFDLVMKTEECTFKEAAYKLAELFDVTVDWSNETIEERPHSEEARKFIERMMRKQDKKELPTFKMPRMKLAKVTSYRGYSQETISHWKFFLAKDGELQDRIIIPFEDVDNRLVGITGRATKADQQEKFMHRPRNLHTGFFLTGLGRSKKFLEEYGYTVKIVEGVFDCARWYDSGHKNVCAPIGVFFTEEHIEQLYKAGVIGLDFGFDNDPAGRNGIRRAIKRAKYKFDINVLVYPEGKDADDCTKEELDEVDKNKLPYKEWLKQFGEEME*
322 amino acids = 37,2 kDa
✓ DNA polymerase III alpha subunit 29 529 .. 32 609 3081 bp CDS
/product = DNA polymerase III alpha subunit
/translation = MCKVCFVQLHNHSCYSQRDAHSRIDKLIDKAIENKQKAIGLTDHGAMHGIPEFMNLAKEKGIKGIAGFEGYMTLGDKTDKTQKHYHQLLLAKNEVGFKNLMKLSSIGFIDGFHGRPRFGFDDLLEHSEGLVITSSCLAGAIPQAILEGEYKRAKTLIRMFNEFEDFYLEVQPTPMAEQKIVNDFLFKESIKEGVPLLATCDVHYVDQEDMTAHMGMLCLARKATMDDPPAYPSEESYWLKGSKQVFMDFISQGYPKDQVIEAMNNTGKVADKVDFELKKGKDLLPVFPLEGDRTSLKEIQAMIKDGLKRKIPVVTTTYVERVKFELGVISKKGYIDYFLIVADAIKWCKEQGILINFGRGSGAGSLIAYLMDITEVDPIKHGLFFERFLDISRQKMPDIDTDIQSERRHELFTYLKEKYGYDRVAQVTNYTKMSAKSAFKNSLMIHDIPFGKSQEITNLIPDNMLIEEVYKVVPKLAKMRKETIETKQGKRIPLEGVFKMAEAFEGVISNTSIHAGGILITPDELTNHFPLHGTKEETAVQWNKDDVEEMGGVKFDFLGLKTLSIVASCLESIKKETGEHLDIYEIARRADDPAIYERISKGLTSNSFQLNSSGMRDLCKQVQPTEFKHIVAINALYRPPALASGDTWRYANIKNGREEERYSHPEEKQITGETYGVITYQEHVMQLVHHFAGWDYGRGDKLRKMSAEQLEGIREEFLADCHANGYDSDDDQCGLYELWDRIVQYMGYGFNKSHGVAYSMLTYLTVYLEHYYPEHYMSAILTSKMSDQEVLAKVFQDIKRENFEVIAPDVNKSELSFVASQGKIIFPLGMINGVGETAVVELLKHRPFTSIDDVFERVNKRAVSKRAMKPLIFAGAFDSLHPDATRKEIYLKYLSLKKEPKKEIDKVIEMEWNENKMAEAEKELLGVYVTHNPMDKYHLKPWSSFPDGVRGAFTAGQISKVKAFNDKNGNRMAFASVDTQEGVRELVIFSYIYGANSDVIKKNKKVMAEGKRDGEKLIVDTIKELD*
1026 amino acids = 116,7 kDa
✓ CRISPR/Cas system associated protein 32 612 .. 33 457 846 bp CDS
/product = CRISPR/Cas system associated protein
/translation = MARTNYPLPRASYSQLNTFMSCPHEFYLTYIAGQRSNGNKYTIAGSNLHEVFEAHSRAQQNDKELSRRDMLKMYNKGVMQYDKSMFLDKSDFHKMYEKGVSAIDHFLEVYSNETAPCFVEREFVADIGEGIPIMKSFVDRIDGDKDDPSSWIVTDYKTGSNPKSKQYLSDDLQLGLYVAQIHSEFGAYPKAVQFYHPVIDKFQTAIHKGDGVYRFTNQRAPVVEFSVSDILVRTRLVVDAIVKAVEENHFPKNIRAFECKFCFKFQDGSCEPFKKTGWGAL*
281 amino acids = 32,3 kDa
✓ endonuclease 33 442 .. 33 960 519 bp CDS
/product = endonuclease
/translation = MGCTMKKRNSKYNASKTEVDGILFDSKAEAEFHLWLKEIQPFFGFTCELQPEYVLLGKTVKHGRTFNPIKYKADFLLRFPCGTELVIDVKGMLTPEFKLKEKLFFSKFDEELICVSKSNIDGGWIREPNLKHNRKIRKAVKEGDLKKVERLGNPLPDFKTELVSMFLSKMVD*
172 amino acids = 19,9 kDa
✓ RNA polymerase sigma-70 factor 34 006 .. 34 686 681 bp CDS
/product = RNA polymerase sigma-70 factor
/translation = MNSLRELDQFRAKISQKVAPIKRDQNRDRFLVGQFIRGMEEAGFELLKNYADVVSYIYNVPHKPKNRAGSTITIDWTFQDKEDLFQEILMHFFELCYEYDVTKGTFAALIIGKLHNKVYRSFFNAVADAKINERALPEGADFIDEVRSILNTEEDEREITPEVANLYAAFNSLTDLQKKVVNLVVIRGWTLKESADELGMSKQATRQAKERAIKNMREYLEGMELV*
226 amino acids = 26,2 kDa
✓ thymidylate synthase 35 202 .. 35 912 711 bp CDS
/product = thymidylate synthase
/translation = MTEKYERHIKVLDKGYVRYKDHMGSDLTVANAAKVSYHKESLELTEADVRLIKFLAREGHTSPFRHATLQLEMYAPLMVARQHWKYVVGSDHTMDAWNEGSRRYVNDDVEFYLPNIDEWRSAPENSKQGSGKPLPEEEGIILSENLWSHQMESLELYEDALEMGVCTEQARLFLPAYGLYVRYWWTGSLQSTCHFLAQRLEKDSQVEIQEYAKAVLIIAQELFPTAVEQFVKEDKS*
236 amino acids = 27,4 kDa
✓ deoxynucleoside monophosphate kinase 37 416 .. 38 000 585 bp CDS
/product = deoxynucleoside monophosphate kinase
/translation = MSIPLDMFYKSLPDIAFYGKRRAGKDEAAKILKNMGFLTYQISFGKHLKHHFHSTFPDIPMEPKPVKELIEYGQAMRKIDPDVWIKKAKTEAEHIRAFNNPRRSLINTDCRQQNEYDFLKEQGFIFVRIDSPESARVQRMINLGETVSPEYLNNETENTLDDFEYDYRITNNGTHKDFATEITELVYQIQGGKR*
194 amino acids = 22,7 kDa
✓ serine-threonine kinase 38 512 .. 39 330 819 bp CDS
/product = serine-threonine kinase
/translation = MREMAKHWETIIIMEDMTDLFSMEVEVLQGFDFTQEKLVEDYYEALCTGSKLDKFMKKHNLVHIGQGHFGEVFGLNDQLVIKLLHNCGEEMPDGYILSLLSDSDMTPNVYAYSDDIDQGFMIVDKVVGFNICDAMSSAPMTLEFDLDRQLDRIAKFFEECKRAEVMPADLHQANVMCDYSGNLMIVDVGCFEYGCFDPNSIETMWAYENAKWQMLSIAHQMDHVINKTPLKQIPDYIPQYLRWETETHGDFKSEVAKFLNEFEDHDKVGLPL*
272 amino acids = 31,5 kDa
✓ FtsK/SpoIIIE ATPase 43 152 .. 44 465 1314 bp CDS
/product = FtsK/SpoIIIE ATPase
/translation = MRWRIKGGMKMIIELLTCSAFGGLAATAFFKKNATVNDSQKINKIFTLSGLNVKDGDRVLTPQLVRKVNHSWGTEYKYRLPLGRSFQDFEQKVHVIQDGLNNRRSHFKPSDLKGVSLDRNFIQSLREVTRKRLSATKEVELSFDGLLSLKVYNEALPSHVEYSESGKEWSVPMGITRSSGSINHNFEAIPHMVIGGATRYGKSNLINGIITSLTRNNPDHVHFHLIDLKGGIELGAYENMSQTSSIAFEPEEALNTLKDAYEAMRGIQRALRAKGKKSVQEAGIKDRHFVIIDEVGELNPSEAVSKEERKIKEECQKYMSQIARLGAGLGFRQILATQYTTGDVIPRQCKQNSDAKVCFRVQSEVASRVTLDSSGAEKLPEIRGRALYQTADKRRTIQTYLIKPDQIKITIDKHYKEAEPIETNPETREHPVIIEEV*
437 amino acids = 49,3 kDa
✓ hypothetical protein 15 45 726 .. 46 217 492 bp CDS
/product = hypothetical protein 15
/translation = MALEVTSKQARAFRAFMASVEELPLQKKITEAVNKHGSFEGDLEYLNDLTIDDIITLVVTGDFRIVYTELEKHEYMLSALYLGEEAINELYAAYIIGLKNSNKFFGGTYDHPILDDKYIFVDNRQRPYSFPNQFQEEGKEYEYIHRFPNQMDDFEEFLIKRGL*
163 amino acids = 19,1 kDa

✓ DNA polymerase III epsilon subunit 46 377 .. 46 967 591 bp CDS
/product = DNA polymerase III epsilon subunit
/translation = MYTIIDFETTGLNHETEQVTEVGAMKFGSDGYLLDTFHRYVRLEPQRTLDPKITELTGITEDTLMRFGVAESTAMDGLSDFIGDDIIVAHFASFDLGFAYNYGIEAIPFLCTRSMFQLLHPNEKATLKNCMEFYGFEYVNAHRALNDVAMTGELLSMLIGTANEQGKKVMDFLNVMTEKEDRPLRFVPRGTNVIRL*
196 amino acids = 22,2 kDa
✓ hypothetical protein 16 46 995 .. 47 468 474 bp CDS
/product = hypothetical protein 16
/translation = MTYLEEVNGRSITVRNVEYTIEVLSAEEIDEMAGEEVFGLQSNKDAKIYLRDGMNDDRAEQTLIHELLHAMFFESGYIFDNQEQEEGIVNALSLVIHDMSVKGSLEIAFDDPFEFVVGEPKKADPDDPRFQPLGESPLTPKISFKDISLFPQPTFFL*
157 amino acids = 17,8 kDa
✓ T7-like endonuclease 48 219 .. 48 701 483 bp CDS
/product = T7-like endonuclease
/translation = MEYKQIKRVDNKYYLSGSSEEFNSFREAIKRAKALNRASKKESTNEYHKYWSHTLQKSFRSNWEIELAEMLTHLGIAYEYEPKRLYFPEGESYLPDFWLPDFECWIEVKGWLDPLSQKRMNLYRRHYKEPLLMWMKEERELCKENPKMLLSLIIGAIEGG*
160 amino acids = 19,4 kDa
✓ hypothetical protein 17 49 309 .. 50 058 750 bp CDS
/product = hypothetical protein 17
/translation = MWITPTPMRSLPRYQTPVRIQGGIQMSKNWKDKDYEAKHEAEHIRRYIRKAKEDPEGAIQELNDMKYDKARIKKYELIKDLLKDVDIICGARIKNGRICSKPPVEGRTRCAAHGGNSPHPMSEEAKQRQLAHLNPRAHFVYGLYGGFTMTEHEDAFYIQMMNHYIPELDLDPINVLTLDRALRNFILNQRKEHADAGEAINGIQFDIDYDSKFLKFVQSLGMDRKFNISKEHKDNGATLSITDLFAGEE*
249 amino acids = 28,8 kDa
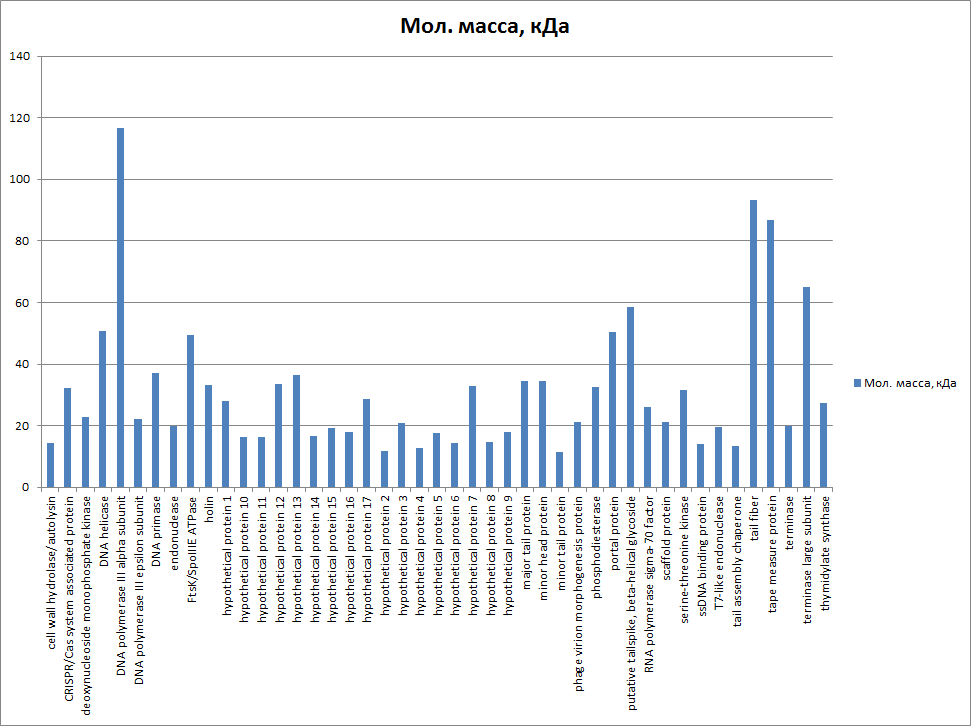
Рисунок 99 — Диаграмма распределения протеомов исследуемого бактериофага Bacillus pumilis phage FBm-8 УГСХА соответственно молекулярным массам
По проведенным исследованиям генетического и протеомного картирования Bacillus pumilis phage FBm 8 серии УГСХА локусов патогенности и их гомологов не выявлено.
Listeria monocytogenes phage FLm4 УлГАУ
Нами были получены биоинформационные данные сиквенса Listeria monocytogenes phage FLm4 УлГАУ:
Длина: 100101 bp
Содержание GC: 36.1 %
Молекулярный вес: 61 838 001,63 Da
Молярность 1 мкг/мкл раствора: 0.02 мкм
Количество молекул в 1 мкг: 9.74 x 109
А 260 из 1 мкг/мкл раствора после 100-кратного разведения: 0,260
При сравнительном анализе полного генома Listeria monocytogenes phage FLm4 УлГАУ были получены результаты, представленные в таблице 78.
Таблица 78 – Сравнительный анализ генома Listeria monocytogenes phage FL.m 4 УлГАУ с данными геномов, представленных в системе NCBI
В результате сравнительного анализа генома Listeria monocytogenes phage FLm4 УлГАУ с аннотированными в системе NCBI была доказана его уникальность с наибольшим соответствием геному Listeria phage LP-083-2 (Listeria monocytogenes phage FLm4 УлГАУ имеет геном на 45500 п.н. короче эталонного).
Нами был проведен сравнительный анализ секвенированного генома Listeria monocytogenes phage FLm4 УлГАУ с эталонным геномом бациллярного бактериофага, представленного в системе NCBI. Наиболее близким по гомологии оказался геном Listeria phage LP-083-2. Сравнительный анализ представлен на рисунках 100 и 101.
Рисунок 100 — Сравнительный анализ гомологии геномов исследуемого бактериофага Listeria monocytogenes phage FL.m 4 УлГАУ и Listeria phage LP-083-2
Рисунок 101 — Линейная диаграмма гомологии геномов исследуемого бактериофага Listeria monocytogenes phage FL.m 4 УлГАУ и Listeria phage LP-083-2
На основании генетических данных был проведен анализ протеома бактериофага Listeria monocytogenes phage FL.m 4 УлГАУ. Результаты соответствия генома и протеома (на основе генетического кода аминокислот, характерного для бактерий и вирусов) представлены на рисунке 102 и таблице 79.

Рисунок 102 — Протеомная карта гомологии исследуемого бактериофага Listeria monocytogenes phage FL.m 4 УлГАУ генетическим маркерам, аннотированным в системе NCBI
Каждый из протеомных компонентов Listeria monocytogenes phage FLm4 УлГАУ был сопоставлен с аналогами и составлено его филогенетическое картирование для поиска подобия возможных локусов патогенности.
Таблица 79 – Анализ состава протеома Listeria monocytogenes phage FL.m 4 УлГАУ

Продолжение таблицы 79
✓ hypothetical protein 1 81 .. 344 264 bp CDS
/product = hypothetical protein 1
/translation = MENQIVEYKKLTVQKIWRATKAQLVFEGARMDYARYLKMKKQGKEMGITVPKFTLKEMYQNRASMKRDELRKDMFLCLDILNDRVGK*
87 amino acids = 10,4 kDa

✓ hypothetical protein 2 428 .. 703 276 bp CDS
/product = hypothetical protein 2
/translation = MSKKNISISKMKELCQKEGSTFFEPSAMKFFGTKIVTKPKNNLFITEDLAKDHKTKKFTVRKFENGEVISVNGFLKYSSLAEAKEVLKTIL*
91 amino acids = 10,4 kDa

✓ hypothetical protein 3 779 .. 1231 453 bp CDS
/product = hypothetical protein 3
/translation = MADVFGYNDFLTEMGIKSVRGNATIEQLRQDSSYIVEDIKRAFNFKLYKNELTGENNMVNVTNKPLSLVVFLADNKSKVLFYDSVNFTSKKARDWKPFHAIFKNGKTYIVQDNSNFALTFVIKNGTIIKERKAPKNSGLIFLERLAEGDL*
150 amino acids = 17,1 kDa

✓ hypothetical protein 4 1386 .. 1865 480 bp CDS
/product = hypothetical protein 4
/translation = MKDYEVKRIETKEAKPFILGLHYAKRMPSVSYAFGIFLDNELLGICTIGKPASHSLCKGVCGEEYAYKVFELNRLCMKEKLEANVLSYFVSKVLKELKKENLILVSYADSGMNHAGYIYQATNWMYTGGNTECQIQKQKTCLSVLCWLFGLTVLQLNQD*
159 amino acids = 18,1 kDa
✓ hypothetical protein 5 2682 .. 3023 342 bp CDS
/product = hypothetical protein 5
/translation = MTVKTVYSPQLGYTYGNLEVEYADVKSFYGKAYFRNMHTDDHTHVYHLYSYDTLILEVVDGVVTAMTDDKTHYSMTTNRHINEFLAQYEDDYTGKLSKKELLEKAKNLGAVLV*
113 amino acids = 13,1 kDa
✓ hypothetical protein 6 3143 .. 3592 450 bp CDS
/product = hypothetical protein 6
/translation = MSTTAINKEIHAKGYKVTGTHQGYMAQINFDGTGNEFPLPATWEEFIETFKDGWDGTYEDEQAFFNDMQEVALEELLDELTDVFYNLDITAYDFTVDDVKKKVITLDKPTDREETEDLVQEFKATCFWNAVVEDDKVKVTIRNKNRAIS*
149 amino acids = 17,2 kDa
✓ hypothetical protein 7 3694 .. 4236 543 bp CDS
/product = hypothetical protein 7
/translation = MMTIEQKLAIITTMENAEGWDTDYPLPSLSKTVAVVNQLEEGASEVLIDGLTSEQLSYFVEQLEAYKLFTIRVETWRENHLRLYLKGVNTIEELAGIQQVKNKLECACEQLNDATSALGDILANEQLVIINAENFFLANNIEDIRKALNKTITKLARYNEALETNKEEIDKYIFKSKTKN*
180 amino acids = 20,5 kDa

✓ hypothetical protein 8 4261 .. 4539 279 bp CDS
/product = hypothetical protein 8
/translation = MTKTDIVLKKGKVKLVHTGGTFEASGYTFEYGGFSLFVRKLGKRWSVSELSTGRELSPYSEDTRKKAVDRVCRLIASHKQTVQKAVDKAEKI*
92 amino acids = 10,3 kDa

✓ hypothetical protein 9 5850 .. 6110 261 bp CDS
/product = hypothetical protein 9
/translation = MGVLGIVLVVLGNYYTMKGLAMSHKLSKDVASEEWMSEQFEDSIEGRIKLNNYARTTMNRSDYVFNKGMLLLFIGALLLIPLVTLI*
86 amino acids = 9,7 kDa
✓ gp110 6124 .. 6411 288 bp CDS
/product = gp110
/translation = MGLTLVNDDDKYLRAFKLDSFQSVKGIIYVYIVITPEVLTEYLSQSSEGQYFKSSKDYQVNVQELARWLKTSNRGFTETLSHNENIMASVGENNI*
95 amino acids = 10,9 kDa

✓ hypothetical protein 10 6566 .. 6838 273 bp CDS
/product = hypothetical protein 10
/translation = MNNNLNYWTDTLAINLAGLTLVEREEVTTQEALISEMYTRDLQANKPMFNNLLDNLEELNDKAREAHSEAFYHAVDAIISLWDGISKNTL*
90 amino acids = 10,3 kDa

✓ hypothetical protein 11 8008 .. 8316 309 bp CDS
/product = hypothetical protein 11
/translation = MVLIRIRIRKGGFNMKEKCSIEISYYNGEDKLTGKVVWVVLDKEEGIQFVLTEKPEDEYFVFDSEESAGIVGGLIRLRLACDNIEDDSPVTINYLKEEENNE*
102 amino acids = 11,7 kDa

✓ hypothetical protein 12 8309 .. 8800 492 bp CDS
/product = hypothetical protein 12
/translation = MNSWESILGLGSTHKMVIAQELVSFLYKENCDTTTLGENELFILKFLLDNKVEFNRKETYYGTTFYRGYTVTVNVRDSVLATIGKDIASVDKDEDKATPEAVSWLEVECCDILYEFLSTKLTAEKGSGRLSDTLKISRSYEEKVKGLEITITKTKVFNKLGGE*
163 amino acids = 18,4 kDa
✓ hypothetical protein 13 8803 .. 9309 507 bp CDS
/product = hypothetical protein 13
/translation = MKKSLWSTILEDTVLEDNNNSIAYASVVNTHRKFRRLLENEDYEATILRMLLERKQEIDGVFQSNVEFSPLSVRPSAPPVKERGYEIVIDVKSFVAEALDMPNDLDINLGINGFEPVFANMLQNYLNEKIFEENEVIYEFEGSTSVEQSIKVEGDGCIVVVKNITRTW*
168 amino acids = 19,3 kDa

✓ hypothetical protein 14 9320 .. 10 234 915 bp CDS
/product = hypothetical protein 14
/translation = MNRKTFRPSWLGEAYKGYIPPKNDFPVIRIKGDMVSWFTILLEQNEEFVREWMLKYKRTTRTKETGAHYIGDSDYSTYCVTTYLVTTRTASFNPKRLVIALFTKELALFSRESTSVTLIEENLNLNERITEYVEALSEYLESVGIFPFSLPSWCHPNYHYTYDGCRFTISKREREVISSTKMNLEEYNQHLLKSKGEKLMKVTQLETFNDFIDYMVKKNEEGWKWENKAPLVPASFNKWAMARDQTFIAKNFRNKVIYTVRVEDLDQTPTIVPYKADADWVGNLDPKEYEWETMKPKKVPISLD*
304 amino acids = 35,9 kDa
✓ hypothetical protein 15 10 368 .. 10 598 231 bp CDS
/product = hypothetical protein 15
/translation = MIDDITYKYFIFYEAEDKKYFLKSLTVVQDKIEPEWTENEPERAVIHKYNDLDRILGLVNDRIDKEARARHDMFLL*
76 amino acids = 9,3 kDa
✓ hypothetical protein 16 10 616 .. 10 906 291 bp CDS
/product = hypothetical protein 16
/translation = MILYGVSLYGEVTEWTTDKATANKWVDNAVQSIEDNDIDEDCYVILLRLDLEKLLYGTFDREVDLNDQLHDEATVLKELRWQVDEEGLYNIVEVAE*
96 amino acids = 11,2 kDa

✓ hypothetical protein 17 11 088 .. 11 435 348 bp CDS
/product = hypothetical protein 17
/translation = MEFKSVKEINTEISLLADKGGISDGSHTFEELYFHRMVLFATICNANHSKSWKSKKHEDGSMFDNYFIVGISTSKGMFSYHYHLDNWDYFSVPELEFAPTWDGHTANDVTRLLDI*
115 amino acids = 13,3 kDa
✓ hypothetical protein 18 11 467 .. 11 727 261 bp CDS
/product = hypothetical protein 18
/translation = MDLNKFLTEVDKVTSAYGEDANYEISFIREKYADLDEGAKQDCEETDFFEEVEYISQMQTGEDCFEGYIFRKIKNTDWCLCVTYAI*
86 amino acids = 10,1 kDa

✓ hypothetical protein 19 11 807 .. 12 139 333 bp CDS
/product = hypothetical protein 19
/translation = MIQAYRVRSQEDFVNLMVNLEKKDFKWYSGLPPLDGVYYRQNPDKDLASDSLLVVLNYEHRTIRYYTVANLREAYPLATIYTYTPSRTSKTNSVDGFTPTQLVYDEELYL*
110 amino acids = 13,0 kDa

✓ gp131 12 140 .. 12 535 396 bp CDS
/product = gp131
/translation = MYSTQLKALYMSFFVDFIYLIWYTSIINKGGVFMRLSLRNILEGFLLFCLALPPILAVMGFLLGIIWITFYFPMFGLAFWSILSACLVENLLEKWDNRKTLRIRNFSMWYVIALLIALTIIGIAILVLFLF*
131 amino acids = 15,3 kDa

✓ hypothetical protein 20 13 088 .. 13 447 360 bp CDS
/product = hypothetical protein 20
/translation = MLVSLTFLEVLLWVLTLLYFGMVICVLLSHLVTSVAYPESDGVASSFIDYSYLWGESDEMSKASTYKCYDHINYRKTSYFNPTYKSGEFLTSTEKVSKHKRKVFKNKQKVNLEEEEEEL*
119 amino acids = 13,9 kDa

✓ serine/threonine protein phosphatase 13 491 .. 14 198 708 bp CDS
/product = serine/threonine protein phosphatase
/translation = MLNNWDRDKQLLVLCGDYIDRGDESREVLDIICDLKMEYGDQVVVIRGNHDQMLLDFIEEEQNEYTINRWLASGGGNTLSSYFNNMPQEERSRHRLSSFYHFTSICIQKKYRHHIELLRASKPYYEFGDVLFTHAGIQSLYGEDWKKTTDHEFMWIRDWYKQENLTGKVIVFGHTPTCYLPFRDRNSSNFDVWVHDRKKLIGIDGGCCFEGQLNAITITNKGEFNIVEPIKQKIV*
235 amino acids = 27,7 kDa
✓ hypothetical protein 21 14 277 .. 14 597 321 bp CDS
/product = hypothetical protein 21
/translation = MSSFISQQPNGRYCRFSSVVDGVTHVNMTYEDYVNLLIENGRNKESAIETANEIMDRRLRPFIEVLEGMSTSNATIGQLVMEIRLMGYEGDLTSYIKGWKEEINFD*
106 amino acids = 12,2 kDa
✓ hypothetical protein 22 14 590 .. 14 898 309 bp CDS
/product = hypothetical protein 22
/translation = MNKFKKFERVQHRYNTSRGTIVGVIQGMTGMVAYEVARDNAEEGANMDFKDKTYEELLAKVRNNSAVTRKDLSTALWLYEKVKAENKRLKSTVKEETNIKNE*
102 amino acids = 11,8 kDa
✓ hypothetical protein 23 15 284 .. 15 568 285 bp CDS
/product = hypothetical protein 23
/translation = MVGTIKNVIAIMAIKTNEDVEAGKMTYGVENDEFGGLLLVPKKEVEVEVYTEEDFEEPKRENFEEMVKQVLAGTATDDENVTIKLLKEASVEGE*
94 amino acids = 10,5 kDa

✓ hypothetical protein 24 15 758 .. 16 039 282 bp CDS
/product = hypothetical protein 24
/translation = MKIYTSKLASLVRSKPTCSHVYIWEGTASKWKSIENTNIYTRDVLLVCKHCRGHKKEKQEALVSQKDKVVFRYSLADFVKVDPHEILEMEEEA*
93 amino acids = 10,8 kDa

✓ hypothetical protein 25 16 099 .. 16 323 225 bp CDS
/product = hypothetical protein 25
/translation = MVLLILQIYVAIYPLFLLLIYLESKDDSHDIKVTYLWNYYRNPISRFILRVSFITFLPLAVIAIFSAYGWEHLK*
74 amino acids = 8,9 kDa
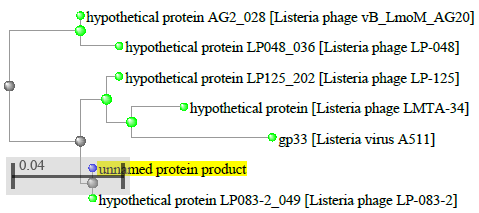
✓ hypothetical protein 26 16 324 .. 16 866 543 bp CDS
/product = hypothetical protein 26
/translation = MKFLEVISSKRKNSKLKEKEQKEIPYKNLKEYIVDAYEEQKKDKEAIKNITTELERVTSKLGKSVGEKSALEVVLGEKERQLRELQRVVGQMEEKEKEIETLKEDNTRLKGEACVLLKREESARSNLERTVKNEVYEENRRLHEELVAAIKDFVGNHKGNLAKKDLVAFLDNLSLKEDTK*
180 amino acids = 21,0 kDa
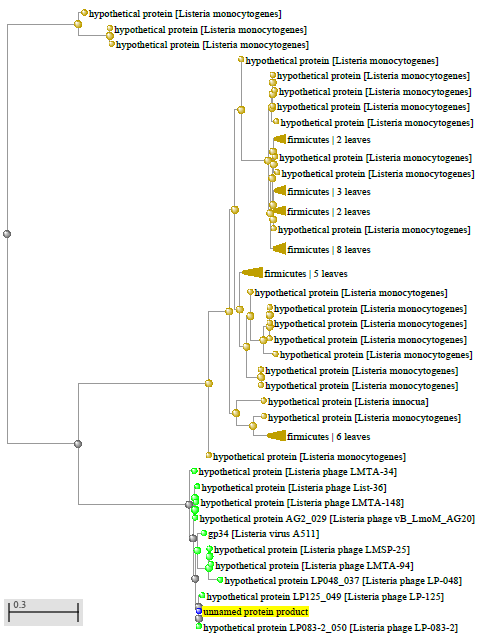
✓ hypothetical protein 27 16 863 .. 17 090 228 bp CDS
/product = hypothetical protein 27
/translation = MHYEGDESVECLQCNYDLDYDLYCKECDKTFTWEQITERDERELKAYEEFSRVTFTDSYYEEVNREIEAMKEEPK*
75 amino acids = 9,3 kDa

✓ hypothetical protein 28 17 093 .. 17 584 492 bp CDS
/product = hypothetical protein 28
/translation = MLDLPAESLKEFIWKNIEDEEYYLGVNKFYLEVYCHLMGVGTEENIKELVKRVTSGDTPEEVKQRAGILLGILTQKGIDSKEEAYFVKEIYPVIKEAVDPSNTYFLEESRDSFRRLAVRVDRLYYQKAIVYSVAFSRTVWYDSLSDMYADLAEKFDSISKGGR*
163 amino acids = 18,9 kDa

✓ hypothetical protein 29 17 686 .. 18 063 378 bp CDS
/product = hypothetical protein 29
/translation = MAKHKEYKNIPLVDIKDNTRMMNIYYRGIVEELNKKRIKDNYEKRDADNTSEEGNGTIWLPLIIVECKSSENPEERIQDIMPLVIEVVTEELGLKYSQFKLNDSIKIENVAGGILDGLGVKTNVS*
125 amino acids = 14,3 kDa

✓ hypothetical protein 30 18 065 .. 18 487 423 bp CDS
/product = hypothetical protein 30
/translation = MSKEYYVKYSSQEKNNCSVGTYTEVEELVKKYTKELELSFGSKTNPKVEFGELKPLVIKELSPFGFSVNTLDKLHKDNTKKEELLDYMVLSSKLYSDNSIKTVGFILFCFEEEINSIVPKEEQADFVKDFYKEIIGSEEE*
140 amino acids = 16,2 kDa

✓ hypothetical protein 31 18 552 .. 19 040 489 bp CDS
/product = hypothetical protein 31
/translation = MVKKRNMYVLRQKGFPYAYYTTSFIKNKRGTFVLNWEKVREPNQVRPLTSLTQARSIAEILNANIETILGGWEVDESWGATDYENKYVYVSYVQDDLSCTYAKTYLFSLDDSLLGKVAVGDFLYDSVKESIVKVRSVHADTSNLRYKGRTRKLKTRLPLKEE*
162 amino acids = 18,8 kDa

✓ DUF4379 domain-containing protein 19 046 .. 19 678 633 bp CDS
/product = DUF4379 domain-containing protein
/translation = MATKALKRGCIPISESHSSVLRKLWDYEKNNAIGIKPKNVSRGSDIKVWWKCKEHGSYQQSVKSKFVGFKSCPKCSSTVSKPNKIIAYYLKKAFPRIVLEKNIAGKRFDIYVPSVKLVVEYDGGRWHQNAEKDRQKCEHALNNKLNIIRIREGSCPDLNMDCVIKLQQDSRNRSPQYFVELEEAIKELLNLLGKDVSVNLSEDLPKILGG*
210 amino acids = 24,0 kDa
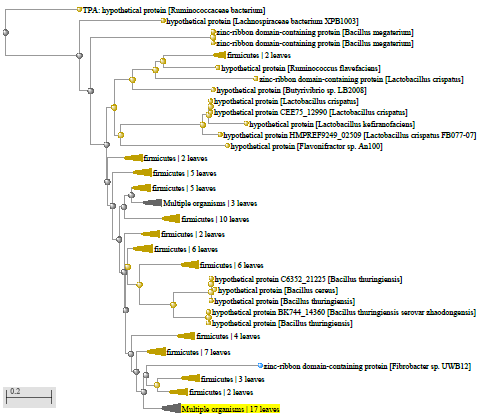
✓ hypothetical protein 32 19 868 .. 20 287 420 bp CDS
/product = hypothetical protein 32
/translation = MKKEIPTKCPLCKGDVKYTSNANLYGKEYGNGMCYMCTSCRASSGVVSLSSREPSSTISDKSMKILKKACYGLLDQASRSCHTDQDDIMEQLAVLMKVSVDDLFNWLTKGELLKATAILSDSDNFRRATNSNKRKFYGY*
139 amino acids = 15,5 kDa
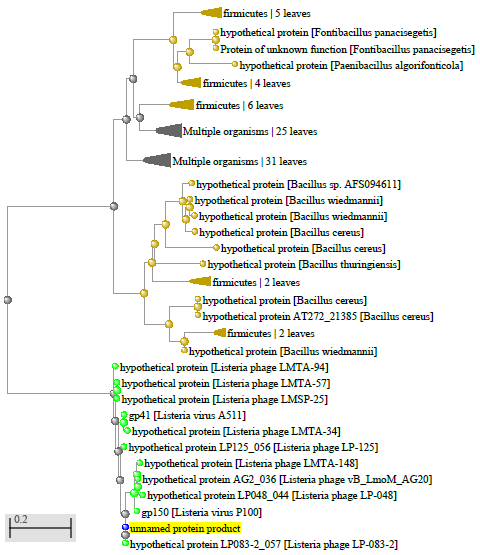
✓ putative phosphoesterase 20 460 .. 20 933 474 bp CDS
/product = putative phosphoesterase
/translation = MNSQFIIEWNDTVNDNDVVIFIGDFALGDEEKAVKIMNSLRGKKIIIRGNHDTRKKVNLYNSELCPSVVEVHDVGMIIHAYSVEFHFSHYPMELGCNKSRFNIHGHIHSKSSPSKDQINVGVDSDYMAGRLLIPLSTVISDARLKIKKYREETKLWD*
157 amino acids = 18,0 kDa
✓ putative RNA ligase 21 420 .. 22 361 942 bp CDS
/product = putative RNA ligase
/translation = MNRYRKIQRIGRAQQMAKTYTGEILILEKLDGSNASFFVEQLPDGSYVMRKFSRNIELDIPNEVGEVNTLSGFTTYIKDKVSIPDVVHSGLVNLTFFGEWLGSKKLNTPYKEQFRNNFYLFDVYNNAEGRYLPLDEVRSIAFTLNLPMPDMFYLGVFTDFDTVNKFVGQSRFTKETNEGEGIIVKFLDEVDIDGSQKLFKSVSPKHAERAQSRKREVKDLPESTEWIRQFVTEARVRKALQRLEEENTLPNLEFSNFSQLMKVVPSIVYDDIMSEESPDNLDFVYDEDTAKKSLGRSVPVHLREIILKVEDSK*
313 amino acids = 36,2 kDa
✓ hypothetical protein 33 22 375 .. 22 911 537 bp CDS
/product = hypothetical protein 33
/translation = MKLEEKDKGTSLVERVKESLIHARKSKSDFINVYQNLIARLDNMRVEVKVKSVSELTDEQVRQAVKQEVKQIGQQIDFARTESEADDLGMELSLLHEFLPYQETLPEAIKLEVDKVAKSLNIAIPAKGKDIGILINKVKEELLKEDTELDSKLMTTYIRTGELEPSNLDNISFKDLKF*
178 amino acids = 20,3 kDa

✓ DUF1768 domain containing protein 23 100 .. 23 603 504 bp CDS
/product = DUF1768 domain containing protein
/translation = MRDKYTFFWGKESPFSNWHPSIFSLEYKQEGKETNKSIMFHNAEQAFMYEKARLFNDELVASQILSVPNGDPKTVKSLGRKVRGFNEATWDDNKEAIVFVILMAKFSQNKNLKAKLEATKGTTLVEASPYDTIWGVGLRESDPRILNKDLWRGSNLLGKTLQRVRDN*
167 amino acids = 19,3 kDa
✓ tRNA-splicing ligase 23 921 .. 25 132 1212 bp CDS
/product = tRNA-splicing ligase
/translation = MIELLGRYNTAKVFTNEVEETAVGQVIELLSQEFVKGERIRFMPDIHAGKGCVVGTTMTYTNKVVPNLIGVDIGCGIRVTELDLEVNNTTLEKLDSVIKEFVPSGNSVRGVALNQEKVSKSLKNLTIYGNLKEEVKNRIALSEGTLGGGNHYIELGAYDGRIFLMTHTGSRNLGVQVAKTHQELAVKYCSNTEKPQELIRALKEQGREKDIQEELLRLKLSTAPFNKDLAYLDGKLVEDYLNDMAIAQKFAEDNRKAIHKVIMSKMGWENLVVSEFDSIHNYIDIPNKVIRKGATDASKGKQLVIPLNMRDGSIIATGKGNEDWNNSAPHGAGRVLSRSKAKETLEMEDFKNTMKDVWSSSVLESTLDEAPFAYKKKESILENITDTVDIDFIVKPIYNFKAH*
403 amino acids = 45,0 kDa
✓ hypothetical protein 34 25 882 .. 26 106 225 bp CDS
/product = hypothetical protein 34
/translation = MGIIITFILIFSYLYLAFLIEYNLVPIASNLLGRAGVSMPYVPKLKFLLSVKDTIMLLLVSLGICVLLVLPIIF*
74 amino acids = 8,2 kDa

✓ helix-turn-helix XRE-family like protein 26 120 .. 26 362 243 bp CDS
/product = helix-turn-helix XRE-family like protein
/translation = MTNKEDIGKVRNLRRIRENQQLSIRQLAQDLDVNYSLISYWETGKKFPRERNRVKLEKYFGVPSSELFKIDKHENSSLEE*
80 amino acids = 9,6 kDa
✓ DUF2828 domain containing protein 26 465 .. 27 988 1524 bp CDS
/product = DUF2828 domain containing protein
/translation = MSEFLNKLKEDTTLSKTEKGANTFSTTLDYNLDFFSRAGAMRDRTHDAKLLFKKAYIEDRELALKNLVHLRNIRLSGLGERAVYNESIKGLAELDLDTLIKFTEFMSEIGRWDDVVSLYRYSCETKNKVLTMVLVELISEQLELDKKNLKSDESISLLAKWLPSESSPNKEKKHTARDLSASLGYTSREYRKLLSALRAKLNLVETSLADKDYDTINFDKLPSRALFKYREAFRKHLPTSYEMFINRVNSTDKKLNASNIMPYELVKKYTVGGDWDDSVDDTVEATWKSLPNYVENMTRNAIVVSDVSGSMYGGAKEVSPMDVSISLGLYCAERLNGVFKDHFITFSSKPSLVHVPSELSLRERVSTAISSDWGMSTNLEAVFNLILNTATKSKLPQSELPTDIVIISDMEFDQCSSQKEDDDSSFYESMRHKFSKAGYLLPTVTFWNVNARNDNSPVRFSESGVALVSGITPTVFKHVMSLEKNTPKDFMVSVLRNEAYSFIDGIL*
507 amino acids = 57,5 kDa

✓ hypothetical protein 35 29 985 .. 30 392 408 bp CDS
/product = hypothetical protein 35
/translation = MSRSYKKTPKSKADWHSKETRLDKIRLNKLQRSRISREEHVPNGGFYRKLVFRTRHGKYLSFQQEMKEIESFIKHVERTTKPYLGNVVLPISTYYILRVHEYTLVSDKGIIVTDYYMNNYINSMMENWYRKNFRK*
135 amino acids = 16,5 kDa
✓ hypothetical protein 36 31 219 .. 31 590 372 bp CDS
/product = hypothetical protein 36
/translation = MYDNNYKHSKMKLQLYIPPFLNTEWYSIALASTYKNLLPIVLKLLFFILVAEKISHSRTGITYNRSKLIAYPMLELIAETNDEGYCKVKILAEYFVSLTQRSECRPVKSEVAGSNPAGYAFLF*
123 amino acids = 14,2 kDa
✓ DUF2829 domain containing protein 32 762 .. 33 037 276 bp CDS
/product = DUF2829 domain containing protein
/translation = MTFEEILPLIKKGKKASRTGWNGKDMFVVAQKGYPEGIPANKQTADAYELEEGALFKVEPYLQMRTATGSHVMWCISNLDVFANDWEVYNK*
91 amino acids = 10,3 kDa
✓ hypothetical protein 37 33 161 .. 33 592 432 bp CDS
/product = hypothetical protein 37
/translation = MDMLNQKNTSKKVKTSKFKESKEVRQFKKAMYRMEPLFFISTVKYRRKGKTQAIMEIAEEFGYSVIVSTKFQKTIFDKKYPNVKTISVDNSLAVSPLTDAPNDGYLVDGIDLQDLERIPPYLNIRGGFVISTHYANYYNVIKD*
143 amino acids = 16,6 kDa

✓ hypothetical protein 38 34 955 .. 35 191 237 bp CDS
/product = hypothetical protein 38
/translation = MARRQTVLELKTIAGDVFYLFSEDVFDTVTDPSTKLNSAVRGSELPFIKVRTTKALDGEEVYVNASLVVSYEKKFLDV*
78 amino acids = 8,8 kDa

✓ hypothetical protein 39 35 607 .. 35 951 345 bp CDS
/product = hypothetical protein 39
/translation = MKEYRDMLKVEFRDILRNFLSENREEYHIYFISRALSMGTLIGFDFGYFKVDEDDMVGKYLDLGSYGRIDFHLNFVTHYGRIVTPDYEDIIRNFLDNYPESSDVSEHIRKPYQK*
114 amino acids = 13,8 kDa
✓ hypothetical protein 40 35 967 .. 36 236 270 bp CDS
/product = hypothetical protein 40
/translation = MSIMFIAILASVLFQVGIFWTSYHVISDLQRHVSLGDIQGITQNFTLIIATFIAGVANIVLLMSLVYTFIIYFVIVVSFMVIVVVAWSM*
89 amino acids = 10,0 kDa

✓ hypothetical protein 41 36 331 .. 36 738 408 bp CDS
/product = hypothetical protein 41
/translation = MWNGGNIMNKPDKNFFMKMIIVILSGLLVLFVINLASIYFGYSPHVVATYFMTGGFIAYIVINLYDRIVFQKGSPREEREKQERQKIASRQKALESVVTQRLGIPIEELDLEVLIQMEKDLADKTAKGNKNEKTE*
135 amino acids = 15,5 kDa
✓ hypothetical protein 42 36 722 .. 36 994 273 bp CDS
/product = hypothetical protein 42
/translation = MKKLSRDEIKKRRKYFINEAKRVTHIRAGDRRIATGSRICTLCGRSLSSQKRSTGETFASVNHIHCYFNELLIVNLCEDATSCYRRHERS*
90 amino acids = 10,5 kDa
✓ hypothetical protein 42 37 000 .. 37 416 417 bp CDS
/product = hypothetical protein 42a
/translation = MNLDNIERNLSKKKTTGDAVKDEFNDMAMKLLAGFKADVSAGDKKLEDVADMARLLQTFIQVNKEDSGSGGTSTSLPELSSLQQEAITNQIKTESVVSGDKEQELVDLQDLANMTEEDVQRMIMDKEKAMNMENEETF*
138 amino acids = 15,3 kDa

✓ putative terminase, small subunit 37 416 .. 37 697 282 bp CDS
/product = putative terminase, small subunit
/translation = MDGNTLLKMAQETFQTENVTTEQLNYVLDMLTPSTYLLRNHKVRNHNITFSIANKSTEKAQAHRPWQPKIINDSHPNVAVIKSRQLGLKLAPL*
93 amino acids = 10,6 kDa
✓ terminase large subunit 38 047 .. 39 600 1554 bp CDS
/product = terminase large subunit
/translation = MGVGSMIHFADTHSYAAVKCLYTFPTGEQMRKFVQSRLDPVLESSYYSSILDKDNNSLNYKRIRNSHLYFRTSSKPGAVEGVDIDYLSMDEYDRVPVFSEASALESMASSPFKIVRRWSTPSAPGMGIHRLFENSDQHWYLHKCEKCNHWNQLDYEDYDSSSVEAGGNILCVNPQGVDTLAKTVVEGSFQFVCKKCGAPLDRWYNGEWVAKHPDRTKNGDGIRGYMISQMNAVWISADDLKRKELNSLSKQAFFNYTLGYPFEDAKLAVYSEDIIENPSPRVKVPMHSRGDYKYISVGIDWGNTHWVSVHGMTERGEIDLIRLFSVEKSRGVGNIESDLDKIILEVSMYNPDMIVADVGDSGNYVDKLVKHFGEDRVFGCIYKSSPKSTGQLKPQWNEAGNVVTVDKLMQNKRYIIEMKTKKVNFYSFIDPMLKLLVDHWRNVVIQDEEDEKDGTFYQVIGRRGDDHLAQASVYSFIGLDRLADMYLRGSKYEFNSTFVTSNYQDVSSTPPDIFSKY*
517 amino acids = 59,1 kDa
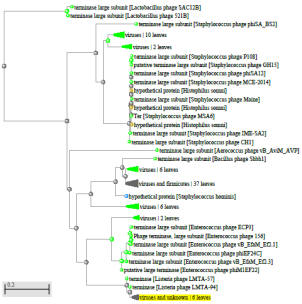
✓ hypothetical protein 43 39 699 .. 40 508 810 bp CDS
/product = hypothetical protein 43
/translation = MSIVKEDNSTVLPDSASISKGILRELTQESLQDYGEVIEKNDFLSREFKHIVSLYGFDDFYSLYAYADFCDTMSNLAIKGGNKDLSKLKKVKRTVMRNGKPTEMTFYESTTEEENKDKKEESNTKRQGVSTVSAKDLLAELLKSKGEPEKVTQLIKIILKFPDTPTNPKVSDYFYQLKDDSGEVVAVAGYSIGAQYVSLDFYTSNGSISGVASRAFFELLRIAIEKDLGAELNDEDNELAQVLFSKFNFQLDEGKQRVSARNLKKHFKG*
269 amino acids = 30,3 kDa
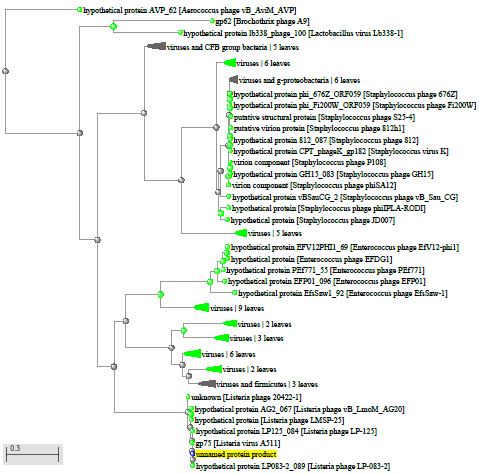
✓ hypothetical protein 44 40 700 .. 41 338 639 bp CDS
/product = hypothetical protein 44
/translation = MTIENTKTLEQTLNTVAEEKDYDLFLSTLAGVVKSLYKEYQFLRQDPAPEDKTSGNILIFQIFRGDPDGYAKDFDTLFKIAVDRNLEHRKISQKFFEWVEKGKFLELGDNIVISRDGTGVSSIVESVELKVFITFMTKSYAEEREDFLAKEKEKQEEAKKKEEERLALKEESYKSLGEATEMLNTLMEEQGVSPEELALALEQGKESYRNAR*
212 amino acids = 24,4 kDa
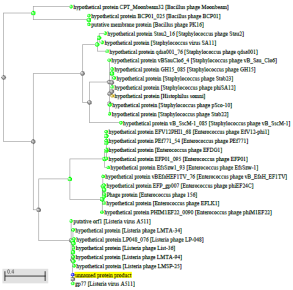
✓ hypothetical protein 45 41 328 .. 41 708 381 bp CDS
/product = hypothetical protein 45
/translation = MHDNEFEVPESVINASATPFEAPDRTKDTYQSSLKNWLDRVKSVGDAGMSREFVIRIPAKALEENNPEATLFLKQCNEIKRNPKCNLPIKIEKTVEKYKDKKHLMLDLVFTYSNKTDIDAVNSVIK*
126 amino acids = 14,4 kDa

✓ N-acetylmuramoyl-L-alanine amidase 41 772 .. 42 797 1026 bp CDS
/product = N-acetylmuramoyl-L-alanine amidase
/translation = MVKYTVENKIIAGLPKGKLKGANFVIAHETANSKSTIDNEVSYMTRNWKNAFVTHFVGGGGRVVQVANVNYVSWGAGQYANSYSYAQVELCRTSNATTFKKDYEVYCQLLVDLAKKAGIPITLDSGSKTSDKGIKSHKWVADKLGGTTHQDPYAYLSSWGISKAQFASDLAKVSGGGNTGTAPAKPSTPAPKPSTPSTNLDKLGLVDYMNAKKMDSSYSNRAKLAKQYGIANYSGTASQNTTLLSKIKGGAPKPSTPAPKPSTSTAKKIYFPPNKGNWSVYPTNKAPVKANAIGAINPTKFGGLTYTIQKDRGNGVYEIQTDQFGRVQVYGAPSTGAVIKK*
341 amino acids = 36,4 kDa
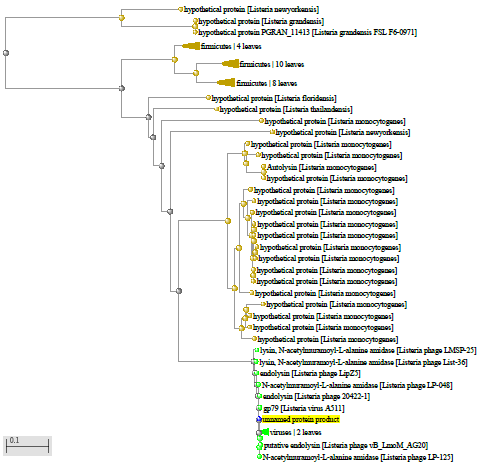
✓ 3D domain containing protein 42 970 .. 43 698 729 bp CDS
/product = 3D domain containing protein
/translation = MKKGSKIAIATVVAVLIVVTVSLGYHTVKLNETNEAKTEEVVKLKENISSVSKDLDNLGKEHEKKVSESEALKKDLDNKKKELEDKNKKEEQLKKEKEELQKQVSYKKSLKKKAVAENIPNATSSDKSTKTAESKGNGRSFNVEVTYYAIGDGFTPGVHTANGTNIKNTITTSEGHRIIAVDPSVIPMNSIVKVTTGNGESFVAKACDTGGAIKGNIIDILVEPSADIYQLGRTTGTVEIIG*
242 amino acids = 26,2 kDa
✓ hypothetical protein 46 gp 43 822 .. 44 121 300 bp CDS
/product = hypothetical protein 46 gp
/translation = MIIAIIITTFLIIYGIYSSRRKTSKSFRLVLRYAIMVVGLLIVYYLFQVSSIDIQQDFLQHLKTGGNGIEEVFFTNFFLIMVGAVGTLVVQLFQNRKKD*
99 amino acids = 11,4 kDa
✓ hypothetical protein 47 gp 44 204 .. 44 473 270 bp CDS
/product = hypothetical protein 47 gp
/translation = MVDYYESIGGSHVFVYAVMEGQKYRILGVLSTDEVLLLKRDLTLSKALYEDVMNSKKMFFYKEDSEKKKIKLTDEISKLEDKDSIIVYM*
89 amino acids = 10,4 kDa
✓ portal protein 44 616 .. 46 133 1518 bp CDS
/product = portal protein
/translation = MNNKEVAYSQPVIGSMSANPGFKTKPSIRNNQDLHGVLKKFGGNIILNAIINTRSNQVSMYCKPARHSEKGVGFEVRLKDLDKKPTSHDEATIKRIESFIEKTGIDNDINRDSFSSFVKKIVRDTYMYDQVNFEKVFNRNQNMVRFVAKDPTTIFFATTADGKIPDNGNRFVQVIDQKIVATFNAREMAFAVRNPRSDIYATGYGYPELEIALKQFIAHENTEAFNDRFFSHGGTTRGILQIKAAQQQSQHALEIFKREWKNSLSGINGSWQIPVVSAEDVKFVNMTPSARDMEFEKWLNYLINVISALYGIDPAEINIPNNGGATGSKGGSLNEGNSAEKNQASKNKGLQPLLGFIEDFINKHIVAEFGDKYTFQFVGGDIKSELESVKILAEKAKVAMTVNEVRKELNLPGDVIGGDIPLNGVIVQRIGQLMQQEQFEHEKQQSNLQMLQEQTGNRVSTDVEDIPDGKDTTGDIGKDGQRKDKDNANAGKQGMKGDKPNDWQT*
505 amino acids = 56,4 kDa
✓ prohead protease 46 256 .. 47 026 771 bp CDS
/product = prohead protease
/translation = MKIFVPIDIEGSLEKSHKGDDKDWYVKGYASTPALDLQGEMVNPAGIDIGYFVDNGYINFEHRQEPDYVVGVPTSNCYVDFQKGLFVEARLFKDNEHAQSMWKLANSISKTGIDRQLGFSIEGAIRKRNTDDSRIIEEVVIKNVAVTMNPANPEATWETFMKSWTTGHGTTPDTQVNAGALRRESLANSISVLASAYKISDPIEFDNLWKDVSKFLDEKGEYNENEAIVMLQLAKGVSRVSACESLMNRRKGKQNE*
256 amino acids = 28,7 kDa
✓ hypothetical protein 48 47 019 .. 47 921 903 bp CDS
/product = hypothetical protein 48
/translation = MNNSEEKFEDVLNEFGNTVEKDKEEISKSTEEKEEVTDINKDKKSEEETAEEEVTEAPEVDVAEDKEVSTETPEEESTSKSAKEEKKEKDSEEDKDEDENKKGKKDKKVKKEEDSKEEKTEKSDEEDSEEAVKNTNSDADIAGALNAVAKSYENVKESQREQNTTVERLEKNIGSLVSKLDSLVDLMSERVSKSVVEDIETLEGASEKAVGYVAKNVDSSVVEVIEGEETSKSVDVEVSPRDEFLANKSAFLESFEYASRNGAERRDLTDVRHAHGNITNDIASKADYNRVNDFMKKWSK*
300 amino acids = 33,8 kDa
✓ major capsid protein precursor 48 091 .. 49 497 1407 bp CDS
/product = major capsid protein precursor
/translation = MPKNNKEEEVKEVNLNSVQEDALKSFTTGYGITPDTQTDAGALRREFLDDQISMLTWTENDLTFYKDIAKKPATSTVAKYDVYMQHGKVGHTRFTREIGVAPVSDPNIRQKTVNMKFASDTKNISIAAGLVNNIQDPMQILTDDAIVNIAKTIEWASFFGDSDLSDSPEPQAGLEFDGLAKLINQDNVHDARGASLTESLLNQAAVMISKGYGTPTDAYMPVGVQADFVNQQLSKQTQLVRDNGNNVSVGFNIQGFHSARGFIKLHGSTVMENEQILDERILALPTAPQPAKVTATQEAGKKGQFRAEDLAAHEYKVVVSSDDAESIASEVATATVTAKDDGVKLEIELAPMYSSRPQFVSIYRKGAETGLFYLIARVPASKAENNVITFYDLNDSIPETVDVFVGEMSANVVHLFELLPMMRLPLAQINASVTFAVLWYGALALRAPKKWVRIRNVKYIPVKNVHSN*
468 amino acids = 51,5 kDa
✓ hypothetical protein 49 49 966 .. 50 847 882 bp CDS
/product = hypothetical protein 49
/translation = MYGGYEGQDSYEYPYSHGNPKHVEPEKVDEYVLSDYGWTAETIKAYMYGVRVVDPETGEEMGDTFYNHIIEVAVDKAEKELDIAILPRRESEHHDYNQTEFSSYMYTHVHKKPILQVDDLKLEMNGKAIYRYPANWWKVYCLAGHIELYPTALMQTSQSMTYDSVFGGYPQLAGTAPSIGRTYAPQMIHVEYIAGMLPRKRAGVSRDWEVPAALEQLVTKYALVEIFQVWGRLIIGAGIASRTLVYDGVSESIDTTQSAMYTGSAADIELINKDIDSLVAQLRSHFGINMIGL*
293 amino acids = 33,2 kDa
✓ hypothetical protein 50 50 865 .. 51 683 819 bp CDS
/product = hypothetical protein 50
/translation = MAEPTRFSSDTPIKNLTTQKVEYNISQHRKFIKDRSIHTLWERAYLCPCMNKSSGSADSSCQRCHGRGWAYLPAKPANMIIQGQEKGVTNTDLGLYDSGTAIGTNDFDARMAFRDRITVPDVKIGQSLIYSITESRQKRGIFLTYDVDTIDFITSMERELIEGKDYTFDKHSNKLFPDASLIGEVISLNVSVTLRYIVIDLLKESRYQYTTLNRTDPKFEQLPQKLLLKREDTIVLPEPFVLDADTETRVELVNDPKRKPRQQGGFYEGMFD*
272 amino acids = 31,2 kDa
✓ hypothetical protein 51 51 734 .. 52 300 567 bp CDS
/product = hypothetical protein 51
/translation = MRNMARAIESDVIATGAQEASRIPNVEIKIMPKYLEVTEKRMEKNGVIDLKPYFAKSNKKKWNQEGNWYLVIPIRLKTRDMSRKLYDDLRKQSSPPVGSSTTIVSDFLYDRRRTSPSVPSINYNPKSNNVTKKRISNSRTTYTVYRTVTAKSPANSWIVNRDRVNEEDMSKTMLDRIDRLMKWKLKNL*
188 amino acids = 22,0 kDa
✓ hypothetical protein 52 52 313 .. 53 152 840 bp CDS
/product = hypothetical protein 52
/translation = MPIPSLDSYVARRVRESLKIMLSECYIIEEALSDMDVEAKSNFMKTYCGDNPKKEIEVIYEFPQAKTSVDATYVIQLGGGSEDTKSIGGIEGTYEYKEDSLRKETVVATREGTELFLETKELIGSIEGIPNLSFSESDNKRIEGKRLYFSYEGNADIEGVSFDIIYTSKVDLESDPVGLKKGFTSRDNITVVGLSTNMDTARCLDAILKVILIIMRENLEEKSYYSLQTTQFSDMSPVIMGEEKPVFGRPVTMSYTISYTVDFNLVNQINKIIVQERNK*
279 amino acids = 31,5 kDa
✓ hypothetical protein 53 53 152 .. 53 472 321 bp CDS
/product = hypothetical protein 53
/translation = MAEKKEVTKEPIVDEVKVTKKNLKEPTTEENKVVKKKLKEEQTDTVEKVTTGYVHIDVFLGTAKPWYGLSEMQVQGFKSFMQGKQYQFGEQAFVPYLEKYLGREVK*
106 amino acids = 12,3 kDa
✓ tail sheath protein 53 476 .. 55 164 1689 bp CDS
/product = tail sheath protein
/translation = MAIEIYPRKPVSRPHTEISVDTSGIGGSSSGSEKILCLVGSATGGKPNAVYKVRNYSQAKSVFRSGELLDAIERAWNPGEGAGAGDILAMRVEEAKEATFEAEGVKVSSTIYGADANDIQVALEDNTITGTKRLSIVFAKERVNQVYDNLGNIFSIKYKGTEASATFTVAVDPVTFKATKLTLKAGDKTVKEYDLGSGAYAETNVLISDINNLPDFEAKFFPIGDKNLTTDNFDAQIDVDIKTKEAYVKAVGGDIEKQTAYNGYVDFEFDRSKEIANFPLTKLTGGDNGTIPESWADKFSYFANEGGYYLVPLTSKQAVHAEALQFVRDCSYNGNPMRVFVGGGIGESMEQLFTRAIGLQNERAGLIGFSGTVKMDDGRSLKMPGYMFAAQVAGLTCGLEIGEAITFKNIAIETLDTIYEGSQLDQLNESGIITAEFVRNRAVTNFRIVDDVTTFNDKTDPVKSEIGVGEANDFLVSELKISLDNEYIGTKIIDTSASLVKNFVQSFLDRKKLAKEIQDYSPEEVQVVIEGDVARISLTVFPIRSMKKIEVSLVYRQQILTA*
562 amino acids = 61,3 kDa
✓ tail tube protein 55 232 .. 55 654 423 bp CDS
/product = tail tube protein
/translation = MASVTNQTVHTGNTVYLMIKGKIVGRCQSASGERSYGTTGVYEIGSIMPQEHVYLKYEGSLTVDRLRMRKEDLAKLGITALGEDILKRDVIDIVMMDNTTKEVIIAYRGCSAETYNEEIKANEIVSESARFLYLSAANVK*
140 amino acids = 15,5 kDa
✓ tail tape measure protein 55 806 .. 56 249 444 bp CDS
/product = tail tape measure protein
/translation = MSEEQKVNEEQIEESKEKMLTKEDIDRINYEQQTKQKKTLDRIIKGVNDVWTHEYDFKELDLKFTIRLRAPNALEQATIQANREAYLKGTGALVSDYIYTIYHTLATIRTVGVDIPKELAEDDNIYNTAILYQIGRDFAEWLDTFRY*
147 amino acids = 17,3 kDa
✓ RNA polymerase 56 305 .. 56 904 600 bp CDS
/product = RNA polymerase
/translation = MWGIMKEFNVLPTDERFRALTEEQINFIYYNKERDYKEAERASRGVSMESEFEDYNSDDWWEASHEDFQAIQEGHDEDDIAQQVENMTSIEDQKRLRDRFQSHEEYEEFIRNGGKDTRQEMIDEHINNKLKELFADAEELNKQGLSKWGEVSEMTTIQEAVADELEELTSDSVKEAISMFEDDEVQVIPGQDEDDDFEI*
199 amino acids = 23,6 kDa
✓ putative tail lysin 57 047 .. 60 694 3648 bp CDS
/product = putative tail lysin
/translation = MDDIEGTNRKGASNFFTSSQKDIDNNIRAMREYVSLVNEVEKEMKNAQSSMSRSGNNEGVQKLIRDQQRLREEAEKTRKTFQDTTQNKTGSNAYLKDLLRDQKAYNDEIDEGTRRLKELKDLQRDVARTDSRLAARTRQATSSGNMNSQQAGTARSDLANKTAYMSQLQANQQRRDELRKGLESDQAKKRNLNANFRGNDQERQNELSALNHNIETRRKEIEALKELDSQINKTVSNMESYSNQLNNVNVKPDRNSWQGVAYERAPSIAMAALGGAGAIFGGLYAKGSSIKDQIRPDTISIGQRTGNYDFRSIRKQNEEVGMDRSLGYNAVDMIDFQNTYLSSAGFKNQKDLDAGTRQMAEGSRAVPVDKDSLNQFMGGLMTNGAVSGADQVKAVQQGFIGAVKASGMEGREKDQLKALEAMSTQTFAGRNGSNAELNNLLAIQSLFSSSGDRSMQGTAGAEALSSLDAGMKQSAYNPQARLLFGMGSEYQGVGGMYQVQGQMEKGLGDTDNLNRLLKFSAGAGRGKEEQKGYFKNMAENVFGTTLTNDQVDAMYKQVGSDGTIDKDKMKNIQSIIDGGKDGYDKNKKGYEDSKEATENASKAVTDKQATAMNDMGDIVRKLNSVLGGMPAPLYGLAAAAVAAAGALAMSGGMSILSGGIKGKLGKKFGGGIGKAGSSTVASAGAGAGASSTASKVFTNKTWGAGAEGATKASSGLSWGSKAMEGGISATKGLGGAGKLAQYGKGALKGLGPLGLLIGGGASIANIASAENKTEAIGEEAGGWGGAMGGAAGGAAIGAMFGGVGAIPGALIGGVLGGIGGSKVGKWAGGKIKSGWDSLWGGDKVDAAEINGTGGAKKAQTEKKTNMNGASMANSGVGTMLGNTVMPGVGGIIGGAIGGSGILEQLSKLTGIGRNAQEETSSGKQDEKDTVGKKATAEKERQSNTREEAANLSFYSKLLDRAEALLMQARNQNGLFGKEGLGTTATGSGGGDALNSGLNFLTDGKKWTNKDLTKHDLGSTIQGITADELDEWINSKAPEGSAMRGMGSTFLKAAQESGLDPRYLVSHAATETGWGTSNILKEKGNWFGIGAYDNSPMASAYKYGDKETGVVEGAKWIAENYYNKGQTTLESMRNNGGQHEYATDPNWDKTIASIMGGSEKYVQGKGASLTTSANITVNMNGDSSKDKKTAGKAVGDAVAKSYKEQSEFFSKQYKRT*
1215 amino acids = 127,9 kDa
✓ putative tail lysin 60 740 .. 63 127 2388 bp CDS
/product = putative tail lysine 2
/translation = MTTVKRMPEFDLKFVTEKNDYLIRYDARNPSSDTLAEKVISVTTKNAMSDDSAVFSIVVAGDTEWDKILDSNDVVILKIYPNLRVMMPDNVVVLVGLISEVRREGDYSNNSIIYRITGQSFAKSFMQFQLGVIQEVSVVITDIGWLPDSKADGVEFTGKTAAEIGKSITDRFKKYMKYNFNREYTMENFLDYSFSSWKDYEKLADPTPFINYEGSLKQLLDDVTAKPFNELFFESTSDEKCKMIMRRTPFNKEDWDKLPSYKISTEAVISDSLAKGDTEAYSIFNVTSGNMAGATSVDLNSFPQYHQALVDKYGYKKLEVDNRYLFESSTDGSSTTEKADVGSKEKTKTVITYSKFNSFMRSYTSDQVRMNQSSIAKSLVDSYDKLTTSQANQLLAKYSAVGAISEADFKKIVGDIAEGDNTGTATLDFDSVNSWFSLNYSSLSEVSTNRDATIKAFVKNFANTDEDQATKIVALYISSQGVMTKEKFDAIIKESTSSRTKDPDNTTGNSSSALQYFSKTIYNWYSENANFYAGDIKVIGSPVYRLGSKLLVEDKQQGDEWEFYIESVSHEYSYTAGYTTTLGVTRGLNNKGKDRFTHLWGKSSDFKGGLLGEKTSAELIQEAGSTSSGSDGSGDVSAPDVQGSDVAVAALRYGLAHKKPEKKSVYSFGGGRGSSNPMEGKEPYAMDCSSFVWWCYKACGVTLAGAQTQAILGDDRFNTVSSRGSKSKEIFKKMQVGDLVYFYDNNTHIGMYAGEGKFLGCNGDGSWDTNGGVQLKPMDSGYWWTQFQGHVIRFV*
795 amino acids = 88,4 kDa
✓ putative tail fiber 63 145 .. 64 677 1533 bp CDS
/product = putative tail fiber
/translation = MSDVESGAPRTQASLGSEWERVYKAGEKVDTIVLAQIIKVNYKYNTAEVMILKNKEVMSKSYISKGKFSAPLPQDFAGRTLEGLPYGQIKPIQEGAIVLIGFLNSKKDNPIILAVYGDSDVNNKLARTPYESADPLDPKLARINNQFFNLYPSLTYDNIDGDGNRISTYPGKTFSIMTSLINESSNISDSNNGTEYADLPESYYTDYKLIEPRSPLAPSMLFKHQGIRTLDGKEDNHLVTAFINTDGTTRLSFLNKVMNWRSYYEADTEGGQKFRLQRDSKVPNQGSIFSEFGLTKNGDFFIVNGNHKFEVRENGIFINDSALADDLGEVLEEIQNRILGINEEIANIIRMLDEIDVENLGKLFDRMTKVETDIISLRNDYKGIDSRVNDMSEDLNSLIKSFDNFKQTMSAYTEANTIRVTAIETATANNTVSIGNINNSITAIEQKNTAQDTKISSLESKVTSLETSNASLVTKVGELESDVTFLKAENIDLTNALAQLAERVTALENS*
510 amino acids = 56,8 kDa
✓ hypothetical protein 53 64 715 .. 65 428 714 bp CDS
/product = hypothetical protein 53
/translation = MPQADGKGGVLRRVAFQIGENKWYRFAINPGSYSFTGGQRVAVFKTKSLNVVEDFGRDIPTITFSGTTGLRKDSNGKTGADRLKELKKYIEDYADSAGNGNRPNTDLTFHNFTDDESYIVHLSPEAFKIERSAEKPLLYDYTITLVVLRDASQPDQGDIVDPDLGNKQPSIGDKTKDNDDVYGDVGGADKTPEANITGRIPLEVGGNGGGAVNPRTTGKAYSYGVDELKKQIGYGEG*
237 amino acids = 25,7 kDa
✓ hypothetical protein 54 65 415 .. 65 966 552 bp CDS
/product = hypothetical protein 54
/translation = MGRVNNMEVYQSSDLMRFITGLKVNPDNTIVVNILDQQSPFISRFYTPKLILSSLSVKLIPELQGVNIIQTNKALSKNTVTAKISASRLKIEAPYMYLIAQSIVMECFALIYSIEEKQDMLRYIEVGEVKQVRDNINYLADYLADKPEYSSIVTDLHDMEIAVGYIENQIPIIQREIRLNGSL*
183 amino acids = 20,9 kDa
✓ putative baseplate protein 65 953 .. 66 663 711 bp CDS
/product = putative baseplate protein
/translation = MARYKKHVVQYGDTMQSISQLETGSVGNWVDIVEYNKLKYPYIVQTNEERKENLESTVTIGDVIIIPVASDLTEIDPYALTNQDKNLIMSLALGRDLSMTSNQDYYNKRGTSDEILEIVANGKGDLATVDGVENLKQALIARLLTPKGALMLHPEYGSNLHKMFKKATHEQASLVDIEITKTLLLDGRVETVESLGYKVKEDVYVGKFLVTIESLQTAFEFVVQGDTTGSIILLDN*
236 amino acids = 26,3 kDa
✓ putative baseplate assembly protein 66 728 .. 67 723 996 bp CDS
/product = putative baseplate assembly protein
/translation = MINTSELNDFSVGSTILSILEAVSMELEQYYILSRENIVWGIQQGVFQAFDFFKREPKRAYGDVLIEFHSAVQSDVYIPKGTTFSSTINGYDQQFETVIDYYVPKDSILARVEVYCKVAGEIGNVPAGTINLIMNSVSNVKSVINESNFQTGTDEESLESVKNRFHAFVESRGRATVPAINYGTRLVEEVSGVYVKEYVGYVIVYAHDRNGNLSANIQDNIKIALEDYRPAGIKLDVKPVNKRLLPVEVTVTITNKNRIGDTLQAHIQGVITDYLNSMQVSNNLILSELIQIIMSIDDSLIYDCKIENFTENVIINSEDIIRAGEVKVNLK*
331 amino acids = 37,1 kDa
✓ hypothetical protein 55 68 167 .. 71 688 3522 bp CDS
/product = hypothetical protein 55
/translation = MGYYYRFAIIDVTIGRRFPLEVIDIINAFKPAGVKFYLTYDGSGEIDEENSIVELPPYSIEIETYQEVDILNGLNTTLHGHFTLGESNIVEGVILELFRTNRSPLNSNDVLSGSFNAGRRVYNLATIGDNSYKPTMSSLIGEIKNSFEELPEDFYVETNRLDDRFASIDMANNTQDTAFYFNMDLGTYINSNYAGYLAELAGSQIINRAHYVSLAKEPKLTVAFKAKISPANPVNYNIEGYDLVSKKWVVLETGAIAVEKKISQIPLGSLEDYLNSNYICFFRIVVKPKRETYSFELDYFELGFLNNFKEGEYTIKPFTGIVETYAELFGRVIEVPMYRIINSGTENIISKQGHIPVRYIRDTLEGGSTTNTANLWIEIQAKNKDNINVALNKPVYRPQAEPTNGNILLYPQFLNVGATYMNGKWRGKLTSGVNMAYTVDGVRTYGGNMNADGTYTVYIGNKVTSTSQKVVVEVYADTARTKLIDKASVPITNAGGGSPIEAITDGVISGSNEFYIAPTSAKYSVTVDLEATFVDLSEVRIWHYPTRTFKSVLTEVSADGINWTTIYNSAVDGTYLETSEGKAFPVPEMDLYGLKATPLTSVLAGSERQIVTFLDYKIEDFENPANTIENLNNDYFNAVWQDIDQLEEFVLGKFTILADVGSDGVLVNDWGLIEAKIPTGATAYQEADSRSELSSVYTVELTAGSHEVIMDVASKVVTTETVTLKTDYRVSNELTLEGLPTKIPVRYIRDSLWGGNSINTANHWVELQARDLKGDNVALNKKVVENNGVSLLSPENLMLESKTEITSATNNGYTFASDIAYIFDNYGVDKEYTISFDIKSTTVGTVTVYSRYKDEAKYSIGNKTVPVTTAYTRQQVVVTPTRNTAEQAKYAVSSILGFLNSTGAISTVKDIKISVGNISNMIWTPAPKDYSILTDGVTTSANGFLSGVNSLTIDLGSPRYDIDNITMWHYWQGAEPRYYKYVKLEVSADGVNWTTLFDSDVSGTYYETSGGKQVSVPAIKEYLKSTNAIFAPSVAGTGTFERVTEANGVSSIKVTPDTDKTARMYKFFGTSTDPNANSRDLLESGLTTTKKYTVAVSLKPQNNSSVILAVKDGSNTNIESGSLNIAKDVWTRVSYNVTLPATATDRLALCLYNANTGEYINYKDWSIKETMFP*
1173 amino acids = 129,8 kDa

✓ hypothetical protein 56 71 805 .. 72 326 522 bp CDS
/product = hypothetical protein 56
/translation = MAIATYNAHVYAALNLKSKVDTTFMAIGKTTAWTDETNPPEPDPNATGLTEVIGYKKLKTMSLCRPQRTGETPTLPTVSYGNKTWVLVPDAQAYTEGAKWLYCEAEFVGDELPVGTYRQVGVFTDLAPKSGVTKPNLLPSEVANVGVLQFFENKQFQNRTPQVTARERFVAEL*
173 amino acids = 19,1 kDa
✓ putative tail protein 72 460 .. 75 798 3339 bp CDS
/product = putative tail protein
/translation = MQSILHYYLKSVGDAVFSDGNMQTGMEFVLDNSGNLTVGDGQVYVEGKVRNFKKQTIKLNKIGREFVGVKVEQSIITADQDSSLLDQTAGVPSAFSKGADRLKETVVLTLDDPQSATIYQFDNGKLFVSSDNPEMTKINEILAERTYDESGSYRVNGFNMWTEPHPTDTSKIQLVIDTGRAYVLGYKVDKPTSTRIPLDKARDTRSVANEGQYYDTAVNRIKLGNSPVETVTRVTGQVQVPKEQVSRGSQSGGTDFLSRTSVFQIDRVWTENPTSGEVIKEYTQGTDFQLINGQAVSWAPNGAEPTAGATYYVSYRYNKSMVLNTDYKITIEGTGDTKTWYIDFSDMTGSKPIQQSLVNVDYNYYLARKDLIVLDRYGEVTVHKGQPDNLRLAEAPAQVDPSTLQIGVVTIYPESETASAMSFSVTRLSMADLQKMRTRIDNIEYNEAVNALDNPAMAGENPVTLRSVFSDGFISLDKYDSTHPDAIIAFSFEDAEITLPYQEVNKVVPKMLENASEAYVWGRLVSAPFTEEKTISQPFASEAMNVNPYNVFNKQGVITLTPSADNWIEEERVTVTQDEVKSYTVNRWWLHGGNYYSDEARYLHNNLALDAGQSWSGTPSQNKQVTGTTLTAGGQQTLESMIEFMRQIDIVVEGKNYLPNANNLYALFDGVRVPITPASGYRKGTDTGTLMANADGTVKGTITIPAGIRCGVREVTLRNADNLGISTFTAQGRKKTVQDIIIRTHVTANLYDPLAQSFQFTDDRVITSLGLHFASKDAGENNVIVQIRGMSDGGQPNKTIYAERVLTPAQVNVSADSSKETKVTFDDPIMCKAGQEYCIVIVTDSDSYTMWLGTRGKPRIDSPSDLITSNPYVQGVLFSSSNASTWTAHQDSDLKFNVYTAKFNEQAVLEFDTMKNVKVDRVVLMSTYLTPNNTGCIWDMKIVLDNEPTGVTVADKEWQPIGNYQDLDVEQLAREVKLRATFVANNYISPLLSLDDIMFAGFLTALKGSYVSRNINMTDSPYNTVKISYEAFLPANTTVKAQFSTDAGITWKDLMSTPVVTQQTADFYKYEYEEKVIQSGTYKGFKVRLNLASQNSFLRPRARRLMCLMKDE*
1112 amino acids = 123,7 kDa
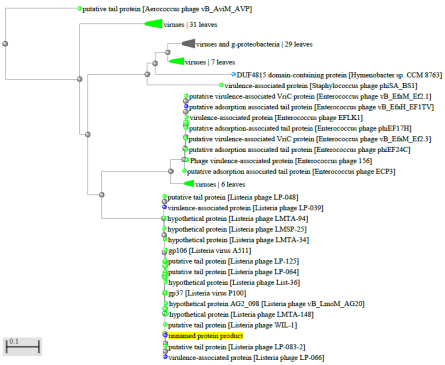
✓ hypothetical protein 57 76 416 .. 77 360 945 bp CDS
/product = hypothetical protein 57
/translation = MFATGTTGSYVGYRWISASSVSSWWTYENTLGSQAKADKALADGKTYTDSSVNSALQAIQNSAQMYKLTEDDGKPIDASAMATPPTSVASLTKTGIYYFTAAFGNTMPDTPCTGQPFWLVVLQHVTDNSISQSVTANTVAVERVVADRIITTLGVPSKWEYRAKASNFFFSASNSSRITLVSTQQNIITPNKFINNPGSLPLSAINPAITIPEDGMYHVMASLNINGILEKVYLVSELTLLINDVVHPATFGMVKTADNVNGQYSLAGNGIYQLKKGDKLKLRSYCNNMGNNPYLDVDKLYISVGKIADISLFK*
314 amino acids = 34,0 kDa
✓ hypothetical protein 58 77 368 .. 77 802 435 bp CDS
/product = hypothetical protein 58
/translation = MLRKEVTIMAEEKFSLDGRQYVTAVLYMYPNLDPQYDFGVVSSEGKVEAFEWHVKNITKPSIAQLDQAYKDYVKSIGSPSNPPALEPEVSKEASIGKILTEKFSALEEVNANMLLENLELQASLDKTKQQNSELVFELVDRGVL*
144 amino acids = 16,2 kDa
✓ putative UvsW helicase 78 037 .. 79 782 1746 bp CDS
/product = putative UvsW helicase
/translation = MRIVVDIMNTRVLFDKEEEAIKKRFLRDMHQKLGVKVDGFFFSPAYKSGHWDGIQDFYDFKTNTFPTGLLPQVQEILGAMQNDAVFQFEIIDDRPDPFLTVEDLDSEITLIGDDGGDIQLRDYQYDSVKSIIENYSGIINIATNGGKTEIASGIIQQILPHLESGERIAFFTHSSSIFNQSIDRIEKRLGIKVGRLGNGKKDIRQVTFVMIPTLTASLKDPEVGLKLTHKERVIKKLAKEVVPRFTMQKNHRKLLNIYIENNRPKNKVEEDIKARLEDLLYSCGTDSEVLMGLKGFNAEYEKIIEKKNKKLYDKNKQAREFLSSVSVMIADEAHHTSSETWYNSLMSCENAMYRVALTGSIDKENKMLWQRMQGVFGQITARTSNETLITLGHSAKPTIKIFPIKAPTDIENVDNYATAYEKGIVENDYRNLLIAKLAKMWYDKDKGVLIIVNRIEHGNRLSELLESLEVSHYFIHGDLDIDLREQQLQNMRDGKLKVMISTSIVDEGVDISGIDALILGAGGKSLRQTLQRVGRALRKKKQGENTCQVFDFKDMTHRFLLSHSDQRRQIYVDENFEIQDI*
581 amino acids = 66,5 kDa
✓ winged helix-turn-helix domain-containing protein 79 797 .. 81 437 1641 bp CDS
/product = winged helix-turn-helix domain-containing protein
/translation = MDLVYVGCQMEIGMRKGLRDFLVDVAKTAQQWGESVAMVTQKHSLAEQTGVNIRTVSRYIAELENKGIIKTEAKRGRNGGLVIMFNKNMVTFKLTDNPITSDSPDAIELRDRMFPKKNEDPNKEKRPRRTKEQMAEEKVLKNRKRSLNNELNDMLDDTLFPTEEIFNKTEEPERYFKAYLLSRMVNAYAYIYPTERELDMLSRGVQVEAEKARKNRVRAYSFNSLPARFFGTSQFTCYLKLQDLLEKENINPLSYLTVQFDYLDYRLDNSLGGTPLAYRGIPEANCLIGETAFSRYTSAKDFYTVMRGKNMLRTSTADVAFKGGKYPIVEALLHAYNVGKQDITALNQQIEDMKTQASVFHKSEALADFYETTKLLVEESALETNEKDELYKFVTEQVVLHSRKNAMSLSQQLLSFPLQIQRVRQTAELKGLDKKDYYTFVGNLEKQVKVSRNTFNSFTEKGKLLHESLEANSTFYSTIRMLGDYRGLTVNIPLLGEAIKKLGEEHIPLDSYGMLDITQVYDKYLTDLQMQEDEENYETPTSFIVK*
546 amino acids = 62,9 kDa

✓ helicase DnaB-like 81 962 .. 82 918 957 bp CDS
/product = helicase DnaB-like
/translation = MLQSIHQDKFSTGFTDLDVIAEGGIGRGELGLVIAPTGGGKTMWAVNQAKNYVAQGLNVLYVVLEERLERMILRFEQNMMGIPKSRLMPDNELDEEAFDKLQTIYDIKRKQGLGNLYIEKRMPQEVSPTMLEQIIVDASVRKGKHLDVVIIDYPDLMKNPHERDNSESRAGGKLYEEIRKLAQTYKFAGWVLSQVNRGGYSEDVLTAKSIEGSKQKLNAVEIAMTLNQKPIEFEKGFIRAYADKIRNNNGKSYNRMLSFKVVPETMTIRNITPDERVEHDMILNNLEEKEGRVFKNTKKATPDPQAVVDEVKALNSRL*
318 amino acids = 36,1 kDa
✓ exonuclease 83 032 .. 83 985 954 bp CDS
/product = exonuclease
/translation = MEVLQQVFDLARENKADIVFGGDLFHKRGAVDTRVLNHVFRVFERNTDIVVHLLRGNHDSFTNSMNTESSLETLRGLPNVEVYSNPSIVETEKYKLYMLPYGDEVQEMKDWINSLDIEAGKSNILVAHIGVEGALTGKGSHRLEGAFTTGDLRTSDFDVIALGHYHKRQLLLDIPNIFYGGNTIQNTFSDEGQEKGVWLIDCSDVKNTTSTFIPISSRKFITIDGDNIPDDIEELIEQGNFIRFIGSKEQAKKIDLYGEESTGIRVELRKEYTTDVRLGIDEKSSPEAISKAYAEKFSPSATSEIVECIKEALVREK*
317 amino acids = 35,7 kDa
putative exonuclease 84 080 .. 85 963 1884 bp CDS
/product = putative exonuclease
/translation = MFTFKKVKIKNFLSIKDMELNLDKQGLVLIEGKNKTNEAFKSNGAGKTSMIDAITYAIFGKTVGGLKSDSVVNNKEKKNTAVILDFEVDKNKYRIERYRKDKKEGNIVKLYQGKNNITKSTVDNTDKEILSLFGIDFNTYVNAIMYGQGDMPIFSQATDKGKKEILERITSIDIYQKAQEIAKEKVKEKQAEQQEIENELVKYDYELVAIDNLEEQEKENYKAVQQTIEGIQATLSVASTELENFMTEAYPKKAELENSIAQFVIPQVDNTKVNELRADLTEAEHKLLQINSIKEGFDRDLRKLAKDYENLSSSKICPTCGTDLGVDSEAHIAETKADIEKQMSVLGAKTHKILVALPSVNTTIESKKELVQQEIAKNEEIQRNYNQLVSTVRGYEQEVQQLENTKNSLEEKVASQQTYLSQVQSMPKPKSRDKDREEVHKKIEATKLQVLDKQKETEKYEEAVKAFSNAGIRSMVLDLVTPFLNEKANKYLTVLSGSDIEINFTTQVKNSKGELKDKFDIEIINGSGGSNYKANSAGEKKRIDLAISFAIQDLVMSKAELSTNIALYDECFDGLDSIGCENVITLLKERLETVSSIFVITHNENLKPLFEKVITVQKEDGVTTLIN*
627 amino acids = 70,8 kDa
✓ hypothetical protein 59 85 983 .. 86 573 591 bp CDS
/product = hypothetical protein 59
/translation = MKVKIMTEEKGVLTSEVSKRSTKKEAIYSANVFPISSLYKWYPFNTNYAYVVDKHGVYRLTELDDCIHTSYNLVSEEKAKLDPTKWHNKTVTQSNLLLCRLANKLGIKSIKDDFNQQDVENGFEVISTELAYIKEQATARCYGDKDVFERSELLKKSKEEREQAYFEYLTVEEVNFQYKLGELYAMLVLMRKVVNY*
196 amino acids = 22,9 kDa
✓ DNA primase 86 573 .. 87 634 1062 bp CDS
/product = DNA primase
/translation = MFLDYITSELGTHKDIGHELRFCCPFCGEDDYKFYVKVSGDKTEGLWHCKKCNEKGNPVTFVMKYLNINFKDALDILEVYDYEIDENSLSSRDVGVTEEEFLLILLKKSSEPEEVETSEEMTLTPPRLPTNFKRLADNMNNPEALPFLNYAHSRGITLDQLFLHNIGYVIEGQVEKVDGNMMTLRNHLVFLTHGNDGQYQYWNTRAITPMGIKAFNAPSKQDEYSKRTTVFNLNIAKNTPYVIVHEGVIDALTMGESGVATFGKQITREQIELLLNNVREDQPIYLFLDTEAYEVTTKIASSLYEKHKETYIVIHGDEDANDMGYEKSWDYLRNNSVRANEEGISIFLVSCIQ*
353 amino acids = 40,5 kDa
✓ putative deoxyuridine nucleotidohydrolase 87 729 .. 88 328 600 bp CDS
/product = putative deoxyuridine 5′-triphosphate nucleotidohydrolase
/translation = MPSQGYDNDVAFDLYTSEDAIICPDAVGATLIPTGLRTEFDPTKFGLFISPRSSIMNLPLTLANNTGIVEGTYRGGIGIPLKNTLSMTGFSDFALTWNPDKKVVERIPVEKLPTGKLRSAEKMFYTDQALLYDNTLPEELADQLFVTLVPTGTFFLPKGFRIMQAYLLPKYHLDLEKTDKLSDSPRGDKGFGSSGHGGK*
199 amino acids = 21,9 kDa
✓ hypothetical protein 60 88 546 .. 88 869 324 bp CDS
/product = hypothetical protein 60
/translation = MKDFTQYFKEVQDAQKREDSETVERLAVEYGDKTITYKELRHTLGSVLLPLIIGTMEINKQLADTSLDIVINMLEKENVLSEDTLIDLRQLITSMKQSVEGGEGENE*
107 amino acids = 12,2 kDa

✓ hypothetical protein 61 88 862 .. 89 284 423 bp CDS
/product = hypothetical protein 61
/translation = MSKEQKQLSKEDLTLWVNFVVTGKVEKGTEKQLNRISKREVSVGDVTTLIRALTSHHDAYISSLIEANSVLRVVMRDELNISEAQMDKALNTYKQQVGTALQKTHDAIMEKAQENVEFTEEELEVQKKLEEYDTKNKKEE*
140 amino acids = 16,1 kDa

✓ hypothetical protein 62 89 287 .. 89 907 621 bp CDS
/product = hypothetical protein 62
/translation = MASTGRGSQVKGSKFERETAKALSVWWGATFNRTPGSGGLKWAEENNVGGDIVAPPSAGFPFIVECKKHEGWTLDNVFLNTGEPKSWWKQVVSDATRTNKIPLLMFSRNRAKSFVMLPYDDLLYNVLRDKRSTVARTTVSFKNIREESVFYDVMVFTIEELTSFSPDFLREHYSKYNWDFFYKEVDENSVEDLETGIDKMLDNLEG*
206 amino acids = 23,6 kDa
✓ ribonucleotide reductase 90 004 .. 91 371 1368 bp CDS
/product = ribonucleotide reductase
/translation = MFGGISLTVIVKDNGSRKLPFEEDRLNRYLDNIKKEFPKLNIESYRKKAIHYILSKDEYSVDEMVDYLIREAESRVDVTTPEWEFFAARLYLQRLYKKASKNRFYDAIMKYGSYVGLHESLAQRGIYSVDILEKYSREELMEAETFIDSSKDLLFTYNGLYLLATRYLATDEDKKVFELPQERWLTIALFLMQDEKENRMKLVEEAYWALSNLYMTVATPTLANAGKVGGQLSSCFIDTVDDSLQGIYDSNTDVARVSKQGGGVGVYIGNVRSSGAPIRGVLGASGGTVPWIKQLNNTAVSVDQLGARKGAITVTLDVFHKDIEAFLDLRLNNGDQRLRAHDIFTSVSIPDLFMEAVENRGEWYLFDPYEVKQKKGWYLQDYYDKEKGSGLFREKYEELIQDGTISKKRVKALDIMKRIMISQLETGTPFMFYRDTVNRANPNSHAGMIYASNLC*
455 amino acids = 52,1 kDa
✓ ribonucleotide-diphosphate reductase subunit alpha 91 717 .. 92 613 897 bp CDS
/product = ribonucleotide-diphosphate reductase subunit alpha
/translation = MSATVVTEEIIDGDKIVVTKEAGDFVVCNLSSINLGSVFSEEDVINRLVTIQVRMLDNVIELNKLPVPQALITNQKYRAVGLGTFGWHHLLAKKGIHWDSEEATSFADSLYERIAFHTIEASMKLAEEKGAYPYFKDSSWDTGEYFSSRNYTSDTWVDLAKKVKEKGIRNGYLMAVAPNMSTAQIAGSTASIDPIYDSFYYEEKKDYRRPVIAPELNLNTYAFYKSAYKVNQIQSVKQNGKRQRHVDQAISFNFYVPSGIKASKLLELHTTAWSEGLKTTYYVRSNDIDVEECEWCSS*
298 amino acids = 33,8 kDa

✓ ribonucleotide-diphosphate reductase subunit beta 92 957 .. 93 820 864 bp CDS
/product = ribonucleotide-diphosphate reductase subunit beta
/translation = MKSDAKQYNHLSEEEKYAFDSIIGLLATLDSPQTRFIYNIAEYVSDASVHAITAIIAQQEAIHNESYSYVLASITNLQEQNRVFEEARTHPTIIKRNAPIMKSYDDFMNNKTPENMVKALVQSSILEGINFYSGFAYFYNLVRQNKMTGTGKIISFINRDELAHSKFISELIRAIVGENPELQTDELNDYVYASFRHAVELEQAWSSEVLQGIEGIDVEEMLDYVKYRANKMLGMLGLQPMYQGHTENSMTWIKAYADNFTETKTDFFEMRNSSYKKTNLDNGFDDL*
287 amino acids = 33,0 kDa
✓ flavodoxin 93 817 .. 94 269 453 bp CDS
/product = flavodoxin
/translation = MRVGILYSSLSGNTSELAQGIKDNLEKLAVEAESFHIEREDQMTNEVIPYLSNCDLIMVGTWTTDYGVIPEEMEEALEKYDYTWVDKPVAVFGTGETQWGMEYFCGANDKIAKKYHSPFDTLKIEQFIITEEQENKLLSWVTDIVKHWRE*
150 amino acids = 17,4 kDa
✓ hypothetical protein 63 94 272 .. 94 568 297 bp CDS
/product = hypothetical protein 63
/translation = MYELEKLLGKDKHGNQIRIGDRLSLQLDDGEYRECVVAVRKVNTIVLNPVALTSKSETVSVTGVFFVVTDPHTGEELPLLPKVDSNGVVDTQKAEIIL*
98 amino acids = 10,8 kDa

✓ hypothetical protein 65 95 431 .. 96 618 1188 bp CDS
/product = hypothetical protein 65
/translation = MVHLIEKLRLYKKPEEVVRGTSVKAQHIYVANDEAKSFSGAEKWAGTSAYTLTSKNEFTNVTIHSLDIRGEGGRAYQVTLNHDNNTYLCDLRETQLMETIRNVGIEAGGKLIGTYSFIADGSQKVLVRIGSDAYAKASEQAETKNKAKRIPKKELEVGGVYAPKATYLGTNDSLDLYIGDLYRNEIVDDNPWYRGYYERRIELGKRKKFSVSLNVALHEGQVCVPTYREAEIIPVFLTDDGVTSLNISNQLGRLSPRMDLKSSPNFFGKVGEAPEIKTTAEFLECLRRGLEARIEALPSKIEGNILKGNLRLQNVIPEMETILKLIGLNTTIEKPKYSASFVNKIKNIKYIVIAERNQKGTLTASESTDFHQFSRAFDDLMSNILEVIIVEEENN*
395 amino acids = 44,4 kDa
✓ ribose-phosphate pyrophosphokinase 96 627 .. 97 529 903 bp CDS
/product = ribose-phosphate pyrophosphokinase
/translation = MNGKKVHESTFPNGEINIMPDENLWVLEEEKAEITWQYSGNGAEDLLAVRLLVNSIREHNKKHNSINLTVLYMPYSRMDRLQGNQPFSLLEYFKMFPQVDKLEIVEPHSDVTGSIARKLIDSGTYYSERFATVEMLPEVLAEELSNTWWEPVLVYPDKGAKDRYDKLATDSDYSFRRATENRRVLFGNKVRDFDTGRIKSLELVGEPPTRKGWTAIIVDDLTSYGGTFVKTATEAIKLGASRVVLLVAHMEGSATKGELFESIDKVYTTNSMEASYTPEELKEVERYKKLGLLDVTNIIK*
300 amino acids = 34,2 kDa
✓ nicotinamide phosphoribosyltransferase 97 540 .. 99 333 1794 bp CDS
/product = nicotinamide phosphoribosyltransferase
/translation = MRKLNEISMLMSDCYKFGHMSLYPKGITQVYSTLVPRDNTYFFGGRTDKMVVFGYQMFVQRFLLEHFNKNFFELPIETVKEDYHYVVSNALGEKNARTEHIEALHKLGYLPIKVRALPEGTLVPMRVPVLTIENTHPDFAWLTNFLETVLLSQTFLPATVATTALEAKKIMTKYGEETCDNLDHIMFQGHDFSERGQHSNEASLLAGMGHLVNFAGSDTIQASVMAHNYYSADLEKELVLKSVTASEHSVMQSYGTDEVETFSTLIDNNPDGILSLVSDTYDYYGVLTEVLPKLKDKIMNRNGKLVIRPDSGNPVDIIAGRDYIEFGTNWFNYHITKENLVKAVTSRYEQSCSNKPLIGQRVDIVDYLNLFVDSDYIYNNDIVDREKKLVSGYYKVTLSAVFLGEDLCNQYKVDKLELEDYQPTPEDKGSLQLLWETFGGSVNEKGHKVLDEHIGLLYGEGIDLEMLEKIFTRMSEKGFASSNVVFGLGAYMYSFSLSRDSFAQAIKSQMVVINGEEKLIFKNPKTDTNHIKKSLKGRVCVTKKEGTYEVTDALTAKEEAKLENLNELNVIFEDGKLAHQDSFHTIRERLDREAKKY*
597 amino acids = 67,9 kDa
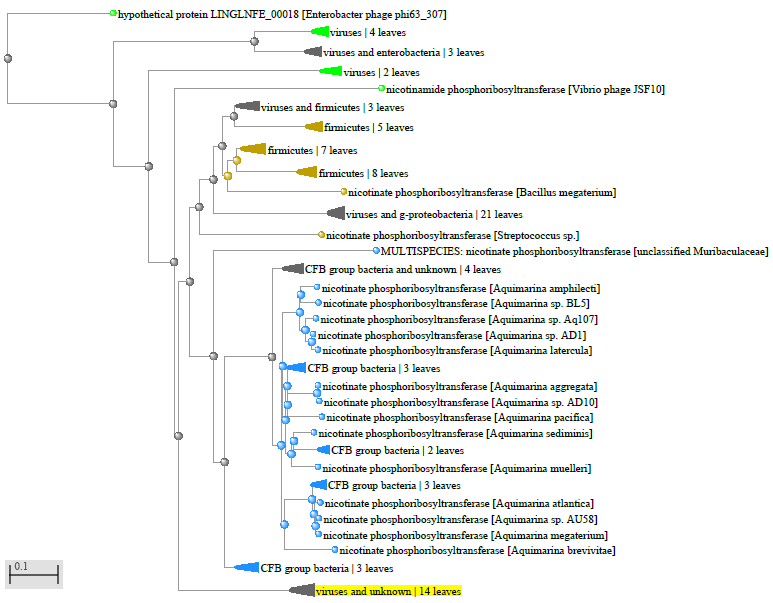
✓ PcfJ domain-containing protein 99 420 .. 8 690 bp CDS
/product = PcfJ domain-containing protein
/translation = MFYLLIKERKLRTSKNNMLDFLKEGEFVRAFGDLWYKKDKKLYNVTLKEIFDIYLELGVSMLEATMLAFSTKEGFSPKKYTLEDLKKEYGTNTIIDYTLPKNREDFVVDNTKSLPLLWDTYRSYMPRTQAEFHYKKPISKKVLKETWGHILDTGSLSEVRKKMVLGTTASIRGLRNSVSLSRIKTSGELTVTSAKMDFKTGVLTSVVKRAIVAEYELSANEYTVNFNQC*
229 amino acids = 26,5 kDa
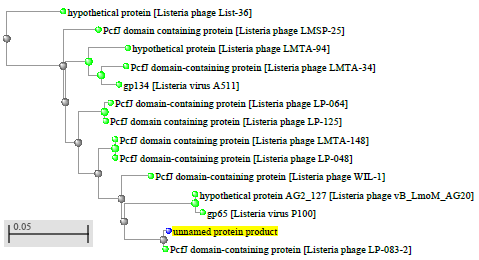
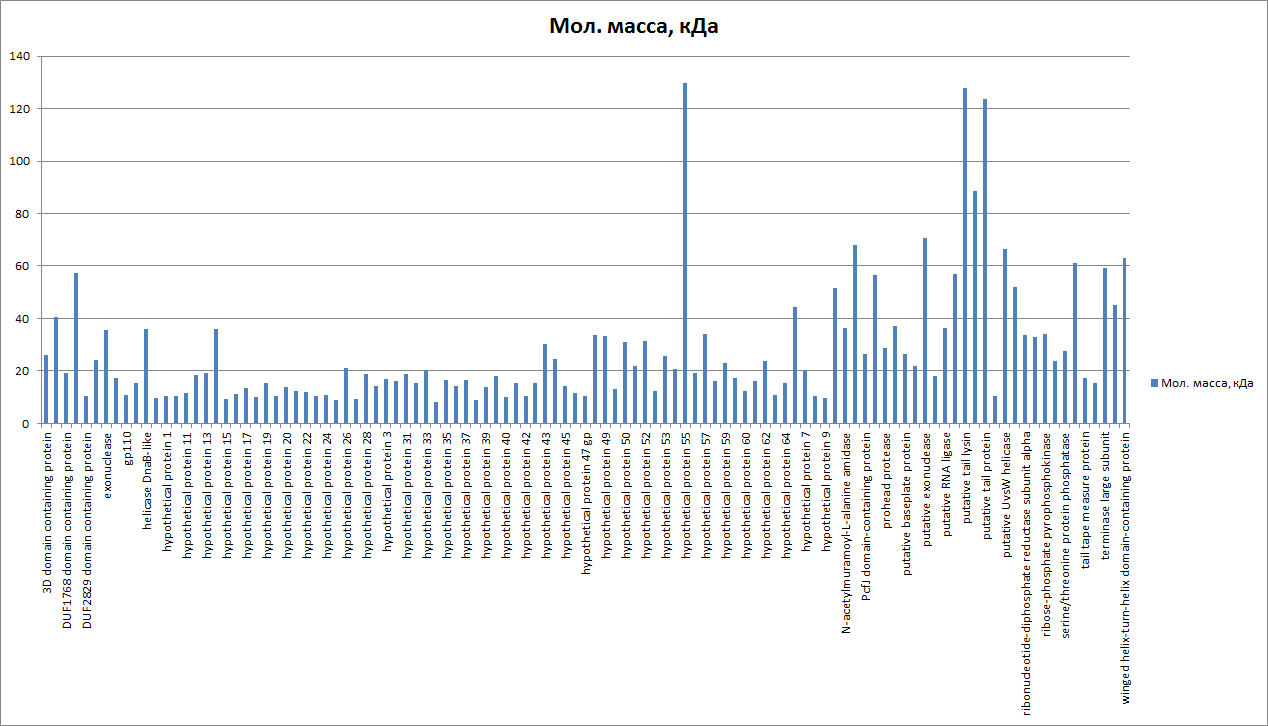
Рисунок 103 — Диаграмма распределения протеомов исследуемого бактериофага Listeria monocytogenes phage FL.m 4 УлГАУ соответственно молекулярным массам
По проведенным исследованиям генетического и протеомного картирования Listeria monocytogenes phage FL.m 4 УлГАУ локусов патогенности и их гомологов не выявлено.
Yersinia enterocolitica phage Ye. e – 12 УлГАУ
Нами были получены биоинформационные данные сиквенса Yersinia enterocolitica phage Ye. e – 12 УлГАУ: Длина: 41905 bp
Содержание GC: 44.3 %
Молекулярный вес: 25 890 402,16 Da
Молярность 1 мкг/мкл раствора: 0.04 мкм
Количество молекул в 1 мкг: 2.33 x 1010
А 260 из 1 мкг/мкл раствора после 100-кратного разведения: 0,262
При сравнительном анализе полного генома Yersinia enterocolitica phage Ye. e – 12 УлГАУ были получены результаты, представленные в таблице 80.
Таблица 80 – Сравнительный анализ генома Yersinia enterocolitica phage Ye.e – 12 УлГАУ с данными геномов, представленных в системе NCBI
| Микроорганизм, фрагмент генома | Кол-во совпад. п.н. | Общее кол-во п.н. микроорганизма, фрагмента генома | % совпадения | E value | % идентичности фрагмента | Код микроорганизма в базе NCBI |
| Bacteriophage PY54 complete genome | 41638 | 77482 | 100% | 0.0 | 100.00% | AJ564013.1 |
| Bacteriophage PY54 tel gene for protelomerase | 4015 | 4098 | 5% | 0.0 | 100.00% | AJ348844.1 |
| Yersinia similis strain 228, complete genome | 2632 | 2632 | 10% | 0.0 | 77.39% | CP007230.1 |
| Bacteriophage PY54 cos site | 928 | 928 | 1% | 0.0 | 100.00% | AJ348843.1 |
| Yersinia kristensenii strain ATCC BAA-2637 chromosome | 503 | 503 | 1% | 3E-136 | 83.49% | CP032482.1 |
| Yersinia pseudotuberculosis strain 1, complete genome | 416 | 416 | 1% | 4E-110 | 80.55% | CP009786.1 |
| Pragia fontium strain 24613, complete genome | 115 | 115 | 0% | 2E-19 | 85.98% | CP010423.1 |
| Yersinia enterocolitica (type O:5) YE53/03 complete genome | 102 | 102 | 0% | 1E-15 | 89.02% | HF571988.1 |
| Enterobacter sp. 638 chromosome, complete genome | 60.2 | 60.2 | 0% | 0.008 | 86.21% | CP000653.1 |
В результате сравнительного анализа генома Yersinia enterocolitica phage Ye.e – 12 УлГАУ с аннотированными в системе NCBI была доказана его уникальность с наибольшим соответствием геному Bacteriophage PY54 (Yersinia enterocolitica phage Ye.e – 12 УлГАУ имеет геном на 35577 п.н. короче эталонного).
Нами был проведен сравнительный анализ секвенированного генома Yersinia enterocolitica phage Ye.e – 12 УлГАУ с эталонным геномом бациллярного бактериофага, представленного в системе NCBI. Наиболее близким по гомологии оказался геном Bacteriophage PY54. Сравнительный анализ представлен на рисунок 104-105.
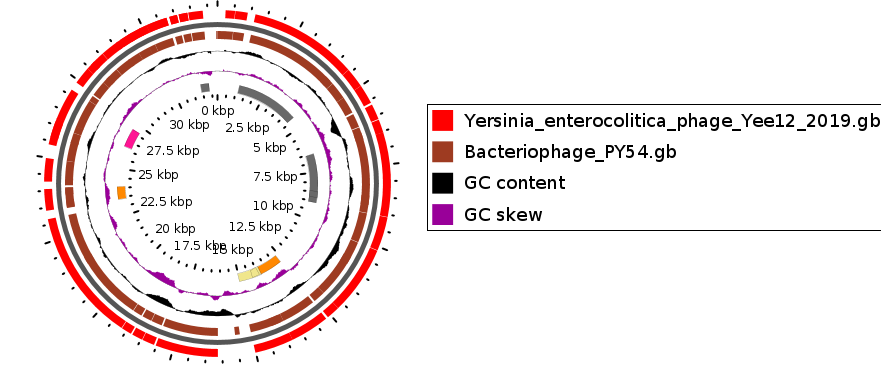
Рисунок 104 — Сравнительный анализ гомологии геномов исследуемого бактериофага Yersinia enterocolitica phage Ye.e – 12 УлГАУ и Bacteriophage PY54
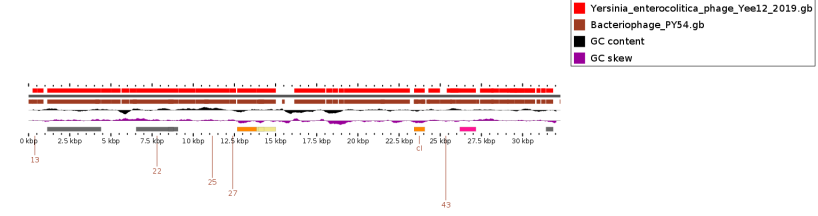
Рисунок 105 — Линейная диаграмма гомологии геномов исследуемого бактериофага Yersinia enterocolitica phage Ye.e – 12 УлГАУ и Bacteriophage PY54
На основании генетических данных был проведен анализ протеома бактериофага Yersinia enterocolitica phage Ye.e – 12 УлГАУ. Результаты соответствия генома и протеома (на основе генетического кода аминокислот, характерного для бактерий и вирусов) представлены на рисунке 106 и в таблице 81.
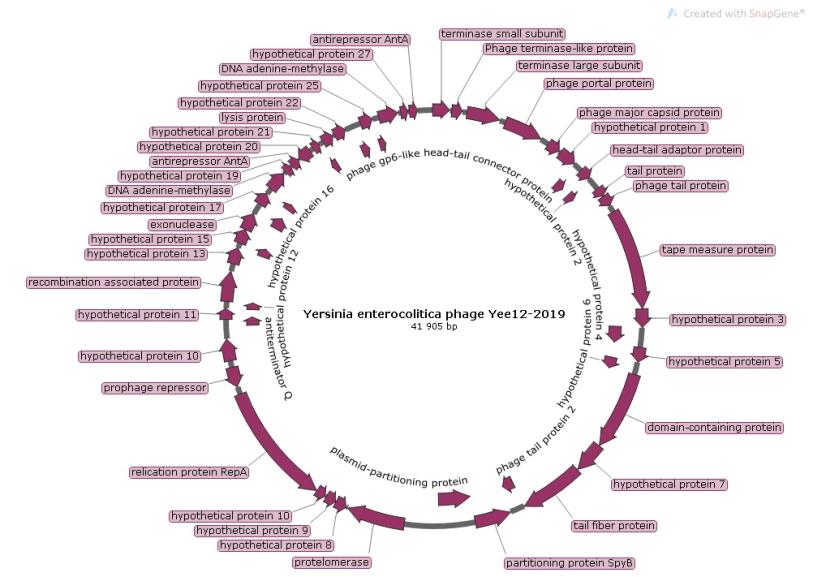
Рисунок 106 — Протеомная карта гомологии исследуемого бактериофага Yersinia enterocolitica phage Ye.e – 12 УлГАУ генетическим маркерам, аннотированным в системе NCBI
Каждый из протеомных компонентов Yersinia enterocolitica phage Yee12 был сопоставлен с аналогами и составлено его филогенетическое картирование для поиска подобия возможных локусов патогенности.
Таблица 81 – Анализ состава протеома Yersinia enterocolitica phage Ye.e – 12 УлГАУ

✓ Phage terminase-like protein 568 .. 906 339 bp CDS
/product = Phage terminase-like protein
/translation = MASYPNVNAAQQYARDILSGKILAGKYIKLACQRHLDDLKNSVNDKNYPYRFDRDLAERACCFVQLLPHSSGDLKGQKLKAEPWQLFIFSSIFGWVTKKGKKRRFGKTSARS*
112 amino acids = 12,8 kDa
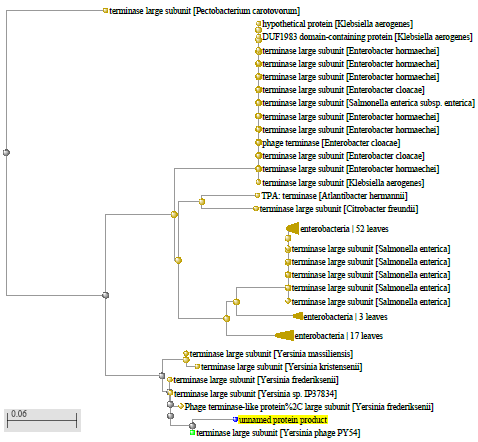
✓ terminase large subunit 1064 .. 2137 1074 bp CDS
/product = terminase large subunit
/translation = MTTGMGARSQPLTLIITTAGKDIESPCYDKDNEVKQCLDKMLPNERLFGMIYELDALDNWQDPCNLIKANPNLGVSVFYEDLVEKLHLAKTVPRMTNDIKTKHLNMWVSGKTAFFNMDHWAKAEDKNLKLSNFKGEESHLGLDLAAKLDLNAGVPVFTREIEGKRHYYCVGSKFWVPEDTVHSIDPKIAKTAKRYQKWVNMQWAGGSLLNDTDGAEADYREILASVIDMTERDGVRIASIPIDPTGATALSHELADNGFEPINIRQDFTNMSPPMKELEAALAGGRFHHDGNPILAWCISNVLGTFVPGSDDRVRPTKGDKQSKIDGATALLMAIGRAMLHGQDSSHSIYDNSDVTC*
357 amino acids = 39,6 kDa
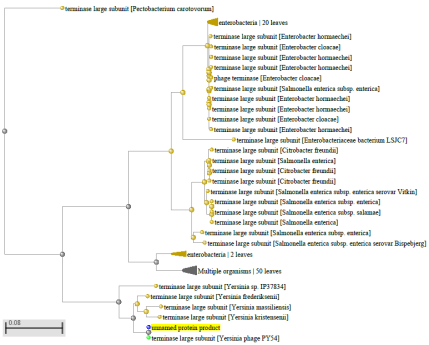
✓ phage portal protein 2328 .. 3587 1260 bp CDS
/product = phage portal protein
/translation = MFIPQFWKGRPSENRVNWQVVPGGMRSSSSQAGVIITPETALALSAVRACVTLLAESVAQLPCVLYRRTENGGREIAFDHPLHDLIRYQPNRKDTAFEYHEQTQGVLGLEGNSYSLIDRNGRGDITELIPINPHKVIVLKGPDGMPYYDIPSIGEILPMRMVHHIKSFSLDGYIGTSPIQTNPDVLGLGIAVEQHAAQVFARGTTMSGVIERPFEAKAIASQAAVDAILAKWTERYGGVRNAFSVGMLQEGMTYKQLSQDNEKAQLLQSRQYTVNEVCRLYKVPPHMIQDLQKSTNNNIEHQGLQYVIYTMLAILKRHESAMMRDLLLPSERRDFYIEFNVSSLLRGDQKSRYESYALGRQWGWLSVNDIRRMENLTPIPGGDKYLTPLNMVDSKALTGIGKATPQQLKDIEAILCTRN*
419 amino acids = 47,0 kDa
✓ phage major capsid protein 3885 .. 4289 405 bp CDS
/product = phage major capsid protein
/translation = MDSNSNMIRCGWGLSNRTYMTLFGLRDGNGNKVYPEMSQGILKGYPIQRTSAIPANLGDDGNESEIYFCDFNDVVIGEDGMMKVDFSTEATYKDADGQLVSAFARNQSLIRVVTEHDIGFRHPEGLVLGTGVIW*
134 amino acids = 14,8 kDa
✓ hypothetical protein 1 4355 .. 4921 567 bp CDS
/product = hypothetical protein 1
/translation = MTEPKKSNKAKATDVVDSKNPTGGNVNVESLVTDKSIDPVESLVASGALASTDPSIISTELDSPSPSVNAEKLVEVEPLVTTASLAPDEPLATANPLTTGDASDNDNDSGAGTMVPNEGNDVKISDQSNPQKKTIVIFLGPYQRYSRGDKAGFSADYAETLVARKIACWPKDFATKSKGNSHGYDFAI*
188 amino acids = 19,7 kDa
✓ phage gp6-like head-tail connector protein 4899 .. 5231 333 bp CDS
/product = phage gp6-like head-tail connector protein
/translation = MGMTSLSNVKTQLRLEEDFTEHDDFIESLIDAAQRSIERTYYCVLVDSQEALEKLPEGVRGFLIEPDTQLAARMMVAQWYLNPKGTSPDGDTPAQLGVEYLLFPLMEHTV*
110 amino acids = 12,5 kDa
✓ head-tail adaptor protein 5231 .. 5584 354 bp CDS
/product = head-tail adaptor protein
/translation = MSDKPLNPGDLNCRVILREVKSGRGPLGEVLPAAPVVMGKAWAKIEPISNRKIRSADQQQIVETCLFTLYPRRDISIDWQIVTTAGVFTVRVVDRVSHADRILITGEADIRHDRTEP*
117 amino acids = 13,1 kDa
✓ hypothetical protein 2 5523 .. 5789 267 bp CDS
/product = hypothetical protein 2
/translation = MPTEYLLLGRLTYAMIEQSLKSALERITGMNVYPLLLPDTELEGVTFQRISDPEIETGLVRTNLIDCRFQITIHLIDDYTRLVVLDFA*
88 amino acids = 10,1 kDa
✓ tail protein 6018 .. 6302 285 bp CDS
/product = tail protein
/translation = MGNRPKAVISVTIQPQDADIAVGDGLSLTVAATASNGASLSYQWQKDNVSIVGATSATYAKNNIAISDAGDYRVVISSVGLSSITSEKATVTIN*
94 amino acids = 9,6 kDa

✓ phage tail protein 6311 .. 6682 372 bp CDS
/product = phage tail protein
/translation = MPQTKPFDINALKSALLKPTNTAVQTELFGASVYIRRITGKELMDYDNAISEAQDKGDMTAISHVSLGLVLKALVNPDGSPIPKKLLPTVDELLTVHANPELMKAINKVKSHSLGTLEEAEKN*
123 amino acids = 13,4 kDa
✓ tape measure protein 6915 .. 10 178 3264 bp CDS
/product = tape measure protein
/translation = MGDVASLAVGLHLNAANFKSQLISAYSDARNQTQTFNRTAQQEAKKTAASFDQIGTSLTGLAGRIAGLAGVGISLGSLISINRQYGQSLSDLSAITGATGAELRKYDEAAQEMGRTTEYSASQAAESIKLMASAKPELMKTSEGLVTATKSALVLAQAAGTTLPDATRTLALSLNQFGAGAEQADRYINVLAAGAKYGSSEITDTADAIKNGGVAAAQAGIGFETLNAAIQVLAEREIKGGQAGTALRNVILTLEKGTDQSLKPSVVGLSQALENLSNKNLSTAQAVKLFNVENISAASILVDNRGKIKELVDELTGTNTAYEQASIRVNNLNGDLMGLTSAFEGMAIRVGQASGGTLRSGVQSATEAVNFLSDNFNTVANVALYTLLPVLSTKLTAGLRENISAWKDSYTAVKQAALQQKTTAQSSLEAALSTQRRTEVEAKFYHQMQQTNQLHGINVSYKEQLRTLYRQETEAVLAEAAAKRQLDAANRQLSFSSKAASVAGSLAAGAYSMIGGPVGAAMLAGSAVFYFHNQATQARKSALDLKDALIETTEALLQLSEKQLSVKAIDLTDQYQNQITQRNQVQKEILDADSRLSSLNSFDPFGQQKGVQEKKIRAIADLEAIDKGAQATKASLENTNKALEMIKAGHKPQTKKTTDGPATDKPVETPWSGTGSDDKGKKQAITQFAQLRREIELENLNSLNRIDIQEKQSLEKLIEAAKKASVSQVEIDQLSAQQSEKFSKERQKLAEQYSPTKALTRQAQEANDVMQGLYSRDLLSYQEYQQAKLKSDQEYTRQRLQAQADMASIPQINLAGEVDPVIRLQNQLAQQQALYEAYYADGLISKQRYEELMTAATNQSADQQKSAAIELYRNQSKLHALQMDLISNVGDRTANMITGILTGQQSFSQAMTNMANTIMDTVVKAFIQAQTQAIMFQMVSGATSMFGGGTSSTATSSAGGSGGMGMSTSWNSYVPGRATGGSVRGGSLYEMGELGIELLQSGGKNYVVPDRDGNVIPTNQLSSGNPSSGGNIIVHQTISISGNGDAALERAVSQAAEQGAKQGAAEARAEMMKDFRTNGPARRSLGV*
1087 amino acids = 115,8 kDa
✓ hypothetical protein 3 10 182 .. 10 778 597 bp CDS
/product = hypothetical protein 3
/translation = MAEILDWPKALTPSDMRIQMLSNSKVFESPFSGASQTVSSPGSRWIMTLTFKNRQDDEARALEALVAELDGVAGRVRLWDFARGGRSPAGTPIVSQAEQMGKMLSTRNWLPNRLVLRAGDYITVNDELKKVTQEVRSDLSGQAVIRFSPQLRWPPNAGAPIECRKPTGIFRLVDEKQGDFTRTPGIFHAVTLQFVEAF*
198 amino acids = 22,1 kDa
✓ hypothetical protein 4 10 778 .. 11 362 585 bp CDS
/product = hypothetical protein 4
/translation = MLAHPFSNAMIDYLSRPNVIPITAVRLDLVSGVVCAHTGVGPIVIGGETYLGVGIFAQIDEVTEQNGTSPSQLQIQVSGFETALLSTFTNERCRGRAVKVILAAMEDDGSIGVADLIYSGEIASANIEAGKKNVISILVTNRFERWQMALPNRFNEESHLVRAPGDHFFRYVAQMADRAIYWGSKKDAPVFVYK*
194 amino acids = 21,2 kDa
✓ hypothetical protein 5 11 423 .. 11 893 471 bp CDS
/product = hypothetical protein 5
/translation = MFDSGFFISPIFIIITMALLSFIILFFVIRFSVKSNDIIYLLQRILEQQINQNTNNEKKVMGNSNASEYAHTVFIDEALKITPKDLFKQSGDINISVVKGLINLRKGHINEMSKNYGDKRAAENDFDKIIENISRELTIENKKLFSMEYKEHLSDG*
156 amino acids = 18,0 kDa

✓ hypothetical protein 6 11 915 .. 12 316 402 bp CDS
/product = hypothetical protein 6
/translation = MRYPDWQKRLTHVLQAASERPFSWGENDCCLFAADCAFAICGIDPLAAYRGKYDSALSARKALLRGHGSIIGIFDSVFERVPLKLAQRGDIVVFSGEQGQTAGVIWGCQIWSTGEYGAGPTQVTAEVAWRVHG*
133 amino acids = 14,5 kDa
✓ domain-containing protein 12 309 .. 14 852 2544 bp CDS
/product = domain-containing protein
/translation = MGKVIVALAGAAMMAVGAITGNYYLIAAGMAMNTANQLLAKKPKIETYRDQSERKQMLRSAVAPENVVIGKTVVSGLLMFAEEEPGEQQDGEWVHLVIVLAGHPIDRIGRIWLGDDLISTFEDYATWELHNDRSTCDPFMLEKCPSWKEDMIGKGLAWLRVSLKFNAEKFPYGLPNIKAEVWGKKLYDPRTGMTEWSNNLALGVLDYYRSVLKVPDTEINWEQFKEAANICAELIVNPEEQYEARYTMNGSFDLSETPSSLLESMHLCCAGEPTYIAGQHGILVGAYYGPPQLTLNEHQMADSVQITTETSMRDATNAIYGTFVDWEQQSTKIDFTPVRVNEWIVEDGLEIKEDVDLRFIDTPYQAQRVANILLRRKRAGRVVVAKTNLSGYAYRPGAVIKLDMPSIGVKESESRVTGWRFSMTGGAELTLQEESAEFYDDAIGEPFTRPPFTQLPTGGPASPIGLQLLNETVGDIVQGVLAWTNIGSISYNNITVYHNDGAVVFTAQVPGNSLQLSGLPSGPYMAQVRAVSIIGIQSAPASISFVIEPPPVPVGVDVTAGNWSLILIPRFNGVTTIGTLCEFWYYTEDMLIDEVTTRAKFVGTGVSMSHSGLMQDTTYFYWVRGINSYGKSAFFRVEAKTTHDPSSIIELLDGEIGAEQLREELRKPLEETIDMWTAKVGNDHIAGGIGLTIETDDDGKERIKCIVDADIFAVVNRNANTNINPFVVKDGTIYINHLMADNAEFGAIISKYINVQHLVGTLIEGSTIKGSQITGTNIYGSTITGTTLNANTINGGSINIANLFRVDANGNIIMQATADTVGMKITNQTISVYRGPGDRAVALGWIG*
847 amino acids = 92,9 kDa
✓ hypothetical protein 7 14 863 .. 15 885 1023 bp CDS
/product = hypothetical protein 7
/translation = MGFYGLQIRPNDGGKEINITSGARAASYLGDFTPSFDDNGATVVQVQGLAAGAQMFVLPIRTAGVSTPPGSSTAITLAASSISISGNLVYIQLKGFNKNTDRNKRPVRFRTMQVMGATAGGNYGLALYDATNYSEINDAAISGACVWRGVVQIAPNWQVPGNVPFRESCTVFAHWDSGDVTLDFDETTKTISGWRRGGDIGVNQQNINITAYVCIFSNGAPQIPPVYGLAIWNRAGQCTFSSDNAPLLLRGTVGIQRVPGYYSGAPAGVGRMMVPLCRLGAHELRNSSNVMNYFAGIRMSGNAITAYLGRLNVNYIAVDNWIDFAITQLPLPVIDANDYF*
340 amino acids = 36,4 kDa
✓ tail fiber protein 15 898 .. 17 970 2073 bp CDS
/product = tail fiber protein
/translation = MSIKISGILPGPTGEPAAHIGITLRAIKTSLTVITTLESNSITGTDGAYSLNVEPGKYDVLLWVDGINARRVGTINVYSDSLPGTLNNFLTALREEDGTPEIILQLEQLRAEAVRAALEAKESKNEATQQAGIAISAADNAAQETAELIKAAVKEDADRAEAARYGAETAQSTVNTLAAEVARHHSEVGQLASAASNSAAEAASSSNSSAQSASESESSKNAAALSEQSALAGAEDAGNSATAAAGDKTAAKGFRDEAEEFAARAKASAESIDVSALEEQINQKVSQTEFDDTIADKASNQALTDGLATKASTQQLTDGLAGKLDKIGGTLTGPLILAGDATDQKGAVTKQQLDKSGGDYLLSFRLHTNRARIPAGYGAGDGQILTRAVWPDAWAAIDSGEVPLVSDAVWLSDVSKRGCYSTGDGSTTFRMPDYNGIQPGSIKAPYFRGDGGLTDGDVQSSALPNIKGTMTGGNAPATASGVFSLSGASSINGGAGSSFTARFGDVDFSAARYNPIYKDEVNEVRTNAVVGCYIIRLAGSYLNTGSIDAAALAASISALSARVGVLEAKSQLFTIMYPEGTPSSPYSFPVNTRRVYVNPFPGRVVKCVPEVYVNGAWGDPGWIYYYSTATAGSFGTAANQTDTLANIVVVSGTVSLSAASNTSGSPHNSNTSPTTALPLRIKVFTIDGGA*
690 amino acids = 71,1 kDa
✓ phage tail protein 2 17 970 .. 18 377 408 bp CDS
/product = phage tail protein 2
/translation = MFVYGLIGSNAQDEPLEAYLNIPAGWVFMINGRRPEDGINYYAGENGEWLVGPAPQVVQEMIIEATQKQIAALSYASDIIGAIADEIEGLEDSEEDVPDKLRTDLKAWKQYRVKVKNIDVSNAPNIEWPVPPEFF*
135 amino acids = 15,1 kDa
✓ partitioning protein SpyB 18 445 .. 19 626 1182 bp CDS
/product = partitioning protein SpyB
/translation = MKRAPVMKNAPKIEMNNATTVPAPGSVTRQPAAPAVSQLTSRVNAMTGNQITLSVCGRDVHFVLKTIPAERVNKATMVWCGNERDQELLTETALDDLIPSFKLSGQQNPAYGREVNGVIEVADGSRRRKTAIITKTDYRVLVGDLDEEQMAWLSQIGNDYRPTSAFERGQRYSRRLHNDFDGNVSKLAEAENISRKIIMRCIKTAELPREIIGLFPSPNELSARAGETLAKLFIDNEDAMYSFAQHLSKRKANGEIFNTEEIIDQLTAVAKKPKATTKVRSFGAGVTAKYRGDVVSISMKKAPEDLLKKIESLLEEHLKEQEEKTRSAVNDTFSEMESVVNCIKKAAKEEKYELPEGELLTMIPIARTIISTSENNDEAISKIKYEINERFIL*
393 amino acids = 43,9 kDa
✓ plasmid-partitioning protein 19 623 .. 20 792 1170 bp CDS
/product = plasmid-partitioning protein
/translation = MNLQSTLNSCIERGQTMTQAIARAQFGDDSPEARAITRRWGITEAAELVGVTPQTIRNGEDSGKLPPADMVTRGRVPQRAGYTIQQINDLRDHFGTRWKRPDGQDPVVLAIAAHKGGAYKTSTSVHTAQWLALQGLRVLLIDATDPQATASLYHGYVPDLHIHEDETLLPYYLGERDDAMYAIKPTCWPNLDIIPSCLAIHRIESELYPLHDAEKLPVAPHMMLRAAIESVWDSYDVVVLDSAPNLGIGTINVVCAADVIVVPTPAELYDYVSTLQFFTMLRDLMAGVDLGGFEPDVRVLITKFSNAVGSQSQWMDDHIRDAWGSMVLKEVVRVTDEVGKGQVRMRTVFEQAANQRSTPNAWRNAVAIWEPVCAEIYNRLIKPRWENLK*
389 amino acids = 43,4 kDa
✓ protelomerase 21 914 .. 23 800 1887 bp CDS
/product = protelomerase
/translation = MGYLLFLFGGVMKIHFRDLVSGLVKEIDEIEKSDRAQGDKTRRYQGAARKFKNAVFMDKRKYRGNGMKNRISLTTFNKYLSRARSRFEERLHHSFPQSIATISNKYPAFSEIIKDLDNRPAHEVRIKLKELITHLESGVNLLEKIGSLGKIKPSTAKKIVSLKKMYPSWANDLDTLISTEDATELQQKLEQGTDLLNALHSLKVNHEVMYALTMQPSDRAALKARHDAALHFKKRNIVPIDYPGYMQRMTDILHLPDIAFEDSMASLAPLAFALAAASGRRQIEILITGEFDAKNKSIIKFSGQAKKRMAVSGGHYEIYSLIDSELFIQRLEFLRSHSSILRLQNLEIAHDEHRTELSVINGFVAKPLNDAAKQFFVDDRRVFKDTRAIYARIAYEKWFRTDPRWAKCDEDVFFSELLGHDDPDTQLAYKQFKLVNFNPKWTPNISDENPRLAALQELDNDMPGLARGDAAVRIHEWVKEQLAQNPAAKITAYQIKKNLNCRNDLASRYMAWCADALGVVIGDDGQARPEELPPSLVLDINADDTDAEEDEIEEDFTDEEIDDTEFDVSDNASDEDKPEDKPRFAAPIRRSEDSWLIKFEFAGKQYSWEGNAESVIDAMKQAWTENME*
628 amino acids = 71,8 kDa
✓ hypothetical protein 8 23 854 .. 24 225 372 bp CDS
/product = hypothetical protein 8
/translation = MELLIMMNTRDVEKLDDHQLVDLKNKIENVIKGRESGPKVTTYYVTSCITDTMNFADINCAFRCLKWLSNDFIEYVNESTENMDFVNSCTGVAGVKFAVKEMTEAHFKIKQDEKYFDDIRFPE*
123 amino acids = 14,3 kDa
✓ hypothetical protein 9 24 238 .. 24 567 330 bp CDS
/product = hypothetical protein 9
/translation = MFYRRGWVQTLSPYKFKGILEDAGLKDPDVYKVMNIIFDDDDVRCCTYQLVDNSWIEKKDATFLQRLNRLWIVPLYMLTVPFQWLFRGKVGFNNESKIAAVFVKLTGLE*
109 amino acids = 12,9 kDa
✓ hypothetical protein 10 24 614 .. 24 925 312 bp CDS
/product = hypothetical protein 10
/translation = MGYKEMIKGFDLEQLENFHSVISGAIAEKKAEQTKIVWRVCDRWLCKGNFREEDYLKAVDFMAEKAKKAHEDLKDELIRSSRDLCFEIQIELVPISEYENWFK*
103 amino acids = 12,3 kDa
✓ relication protein RepA 24 941 .. 28 933 3993 bp CDS
/product = relication protein RepA
/translation = MKITDFYQHLFNSDPFALLDAAHSELASLAGSAGIDWNECSSEIQLTTSRGPSEKFTKYTGHAPAVTSPKLRGKVEIYSRLESTPDGIKYPFVNFVSKGADAGVWSGLQFLFAEYRRYKERTTGTTVPMTAKELERKQQAEAKRIEREEQKRVAELLNSQHRSADLQEYLEFLQKFADSPIEDGTHPYAIKKGISQILPMTNVRRVSVWDRGHNGDKLTRRECMAIPLSHIDGRFNGKIIGWQRIFSNGAKIQTRAVDMGAGPDAAAPFSGSCHIIGKLRGAERVCVVEGFATGASVYMAAKKRFDAVIVAVAANNVIKVVDQLNSLYPGIEIWCALDNDQKSAAEGKGNTGIKTGIDVIKKFPNVKCTRPLFNNDEKELSDFNDLFQAKGITETNRQLFATENRLKISGNIFDAELLALSVAPTAKQHRRAFSRQLTACIDAGMMLCPSKISPQELILLICAELKKLGADDAFKNTVISRVKRRFEQKCQNAQAFRSFSERITNAALRPDHITYKRFNTPQITPEVLAYIKSLRGPVIVRAGMGSGKSKHLLRPLMHAAERGVSVAHRVSLIGGLWDMMTRNDLGQRIKTDIVHYGDEGAKDIAPYASKATICINSTVKGCWRPLMTKHDFFGLDEATQGLRATLSGKAMAHPVDVFNRLIESIAMTDDHALLVDADASDILVDLCELALAKREQVGLSTWTQIHVVELPVDVTYEKDGKHQARRVFYTDTNRIITEILKAVETGEKFLLATDSTNFAEQLLLQLRDRWPEKKWLYVSQDMKQEQEVIDFTDAPNQLAPLYDGLIYSPAISSGVSIETPHFTRHFGSFCGQIVPSDAIQMLRRDRTATEFMVGLGQIPGRKEESAESIKRGFLQALLDTADINDEFTDAIFDGDRLSLGLADTTYVKLKFKIAGMEAKARNDFANNLICILHADGYKVCHLAENQQLSDEGKALRKNSKERVWDLTVLRHLEVETPSQEQREELLSKRSISEIEKAQLTRWEIEKELLLPVTEPTLKFIMDAGKKKLTLAELMTMDELTAARIDREQQAIVFTYQFKQNHRNEFVSITALNREQADEQFSKMQPQVTSFTVQTRPVMEVTQRTFASLHRKAARAYFSTCGIDPDTGKGEATQESMKAAMEQLMNKERAEEFNSVLRFGGYISQKGKPKRPETVFRQVCEAFGYSTDKRRLPRSQGLGYVWSITPESWSFIHDILAHRSAASLSFCNDKLEVPVAAEPDLTCGSDIDIRSQVGSLDNTAVTAISPIEEACAGLPIPLGWIRAALTLEEFKQLAMMPVRLIQATISGLYMSEHMDLLTAGQYAELKRLQAC*
1330 amino acids = 148,8 kDa
✓ prophage repressor 29 187 .. 29 834 648 bp CDS
/product = prophage repressor
/translation = MISTMKKRGDWLKERREELKALDKKRFSVRALAERVGITSAGVSHLENSNAMPALDLAFKLARELDRPIEWVLTGIGNYQQPGIPIIGTTLTGPNIEWLEKNGQGVNTLEFVDIRVPARRLYGLKVSNDASLPRYTEGEVLIADPDATPITGEEVVVITKNGDEPVIKVFASKRDNQVLLESADRKQRVIRDLDEIIVIHPIIFVAKYHTIKATI*
215 amino acids = 24,1 kDa
✓ hypothetical protein 10 30 057 .. 30 761 705 bp CDS
/product = hypothetical protein 10a
/translation = MNSKSKCVEDSSRITRCSGRMPDGGMMSKCQPRDTMSSVVIAATEQMLMQTGESCAHFATERLIPQLEAQGLIDIGTEGVTAETYIRWRSRCIKRTERVITGETSMPADWVITWMSALSEPYKGKCQQKIAALQDLMWIRLPSYTLHSTKSIEAEIDEITRKFGEVLMHAEPAHDGVYDCKDDKHALSRLQNRLFELCAYIKREIGNIESATGISPDVIQLAAQSPLRATTRGH*
234 amino acids = 26,2 kDa
✓ antiterminator Q 31 173 .. 31 475 303 bp CDS
/product = antiterminator Q
/translation = MSKKIKTLMQSLVWLSVQESKLITNRGVGKYDAADLSTLSGLSASNWNQNYQLRWFALLQIGAALDREALTHVEQAHRAEDSRESSLCGYADLSLSAGNA*
100 amino acids = 11,0 kDa
✓ hypothetical protein 11 31 387 .. 31 737 351 bp CDS
/product = hypothetical protein 11
/translation = MLNKPIEQRTAAKAVYADMPICLCQQVMRRKADPPRLLRSQARDEYLMYCPTCGFRTHPDWNKQAVISEWYGANRPGDQHIASLWIERYEQQQESLAVQRSNSCNSGTTVPQSEGS*
116 amino acids = 13,3 kDa
✓ hypothetical protein 12 31 740 .. 31 982 243 bp CDS
/product = hypothetical protein 12
/translation = MQTEPLVIGQRRDPLDPGADFSRNYLHTLLGGYGPKPKAQTVDVTPSKSTTPTKSQYETSMDRARKVVIKRQRRKCEGIA*
80 amino acids = 9,0 kDa
✓ recombination associated protein 31 964 .. 32 941 978 bp CDS
/product = recombination associated protein
/translation = MRGNSMKMFKTCFPYLTEIELPADMAELVEKKAFDGLTDSARSGFGWSKIVPDVRMIISDGRALLLYRKSERVENRAAVQQLVEERQKKAEENGIVVSDDLLREFEHTATNEIIRFAPLKTWSAYILICPVEKHIYVSAANAAKCEDALSLLRKTLGSLYATPWGFGGLEATVLSDHLSCEAGKTNYYPLPDSLIISPFGKTIFTGSDSSLKGTFDGVGINSPEAKSLISGMKIRSVEMAFVERPADGQLKNLAEFSLHIPANGNLHFKGYDYDNDERMSEEEADDAQHVYAVEMLLVASYTPQIMRNLATFFGVADDYNFMVQG*
325 amino acids = 36,2 kDa
✓ hypothetical protein 13 33 193 .. 33 720 528 bp CDS
/product = hypothetical protein 13
/translation = MLKTITAAPVERDSRGFWTHPDFFVPANGNEFGVEGEFDAWKAFNRVTGAIGWMECEENAEELQSAYDAGDCDLSMWQPTQPNGDGWFMVSIHDTEEGPVCIWLRPLECDPEALASHLELSHLEALKIALLNKHQAAVTAAHDYFSACDVGEERLFAAAIFERLRVATRKHVGDL*
175 amino acids = 19,5 kDa
✓ hypothetical protein 14 33 717 .. 34 016 300 bp CDS
/product = hypothetical protein 14
/translation = MSCGYQGYEFGGGYLDSQCIDGFLWDMDSGGVDSKGDTYLDFGGEIPCPDCNKNAWMAHYRADIIEIGQEQGFCGKPPKVLMYGGYPEVVRIDLELELA*
99 amino acids = 10,9 kDa
✓ hypothetical protein 15 33 881 .. 34 348 468 bp CDS
/product = hypothetical protein 15
/translation = MDGSLPRRHHRNRSRARLLRKTPKSVDVWRLPRGCTYRSGARASLAMKVIQWQTKGRVGVSSATMAAISLGLDKSFYSSHFSPPSDPADLSRCMFLVDEVPEIRDYFPTIAEKVPRFAGIIANWDEITTLLITECKRQDNRAPETFALMKKILGE*
155 amino acids = 17,6 kDa
✓ exonuclease 34 352 .. 34 924 573 bp CDS
/product = exonuclease
/translation = MNNLMVDLEAMGNKPSAPIVAIGAVFFEPTTGEIGPSFYTVVSLESEVALGAIPDASTILWWLNQSSEARAAITSDPNPINKALHDLTIFVATTSENSSKLSVWGNGASFDNVILRAAYERCQMPPCWFYSNDLDVRTMVSLGRAIGFDPKRDMPFDGERHNALADAIHQAKYVSAIYQRLVQTGGQNAK*
190 amino acids = 20,7 kDa
✓ hypothetical protein 16 34 848 .. 35 288 441 bp CDS
/product = hypothetical protein 16
/translation = MLFIRQNTFQLFTSGLYRLEARMLNSPLILIKATELIPCPFCSGPPVTFMCVREGLSYRPIFVPIDIVLPEDGALTKVNVFCHECGATSEEISGTLYSENDLVPLINEARAKWNLRDKRHIDLYQAAHQVNKTNYIDEFFGEKTAC*
146 amino acids = 16,6 kDa
✓ hypothetical protein 17 35 282 .. 35 692 411 bp CDS
/product = hypothetical protein 17
/translation = MLILMFTPGFSIKKGSFMGSDKPDMKMLSIRTPFGAIYWLSGKPTSVILDAARSSLNDPDWFIKNHYAVRQAKRRSSTTRHKEYLKAQDEAEKLYRSRIDELMNDKYQLEMKCREQARDILAYSRLVKGESDGTST*
136 amino acids = 15,7 kDa
✓ hypothetical protein 18 35 676 .. 35 906 231 bp CDS
/product = hypothetical protein 18
/translation = MEHQRETLMAMLARRSKNALNAGGDGFITAESLRFDVGLSTQAIRRYLDAATINGITEHRQAAAGRTHSYRPAKGK*
76 amino acids = 8,4 kDa
✓ DNA adenine-methylase 35 906 .. 36 538 633 bp CDS
/product = DNA adenine-methylase
/translation = MLLDHRSLTPAELRDIWQTDPRIAAGMFSLLRPCSIDGCASDSNHLLPHYFTREDNCLELDWHTETNQRGVEPAIYFNPPFSKEDANAAVPHNGMANFFKKARQQAEKGVYSQWLFRARPGEGWFPWYLASRIYFIVGRVAFVDASSGQLDNNQTENHAIAEFIPGNFPIMAAGLPLQRDALIAAGERLLEQQANHYAILSKRHEQLLGV*
210 amino acids = 23,8 kDa
✓ hypothetical protein 19 36 625 .. 36 861 237 bp CDS
/product = hypothetical protein 19
/translation = MRIEILFDEHSKVPVKTIEALRAEIEKKLTPLYPKFGLRIANSTSSIIQVSGTKNAAEHDEVISVIQGIWEDDSWIPA*
78 amino acids = 8,8 kDa
✓ antirepressor AntA 36 911 .. 37 174 264 bp CDS
/product = antirepressor AntA
/translation = MYKNKMSDNCQSETMASKLLELNALLQMVRRTLDSPDASIYIDEVVRLMNTASEMTVECEHIRQYMDTLIYQQNSKFYAKFNHSSAS*
87 amino acids = 10,1 kDa
✓ hypothetical protein 20 37 201 .. 37 635 435 bp CDS
/product = hypothetical protein 20
/translation = MFNYAVKLERDDDSGTFIVSCRDLPLLNSVGDSKEEALLEAVDGIVTALSIEIDERRPIPAASAPQAGEYVIALPVLVAMKAALHNAMIETGTRKADLARKLGQKAPQIDRLLDVEHSSKVETVELALHQLNKTVNVNIESHAR*
144 amino acids = 15,7 kDa
✓ hypothetical protein 21 37 782 .. 38 015 234 bp CDS
/product = hypothetical protein 21
/translation = MAPPSFCFLNGCPLRNQPPSKLTVFHIAPSFSYKNRINIKPPKHNIYVCKDNKNDSLNSWLYSFGEATVRVVEDYIE*
77 amino acids = 8,9 kDa
✓ lysis protein 38 160 .. 38 522 363 bp CDS
/product = lysis protein
/translation = MPPRIKKPCRHSGCAALTIDATGYCDKHKPEHASDGWKRHKPGQSRHERGYGRKWDLIRPRILMRDGYLCQDHRRRDIGVAATHVDHIIPKALGGTDDDDNLESLCARCHWKKTATERIK*
120 amino acids = 13,8 kDa
✓ hypothetical protein 22 38 591 .. 38 965 375 bp CDS
/product = hypothetical protein 22
/translation = MKKTFLALSMLALTGCDSASNVASKNLSTASDNFEIQRRFVFYNGITGDYIITIEGLCSKDNSSTERTLGVVCKTGPNQYKKQMLGLSDNVTWFMEQIDSVPVSEYHYRVIFRPSVIIPDVEIK*
124 amino acids = 13,9 kDa
✓ hypothetical protein 24 39 201 .. 39 494 294 bp CDS
/product = hypothetical protein 24
/translation = MCVREGLSYRPIFVPIDIVLPEDGALTKVNVFCHECGATSEEISGTLYSENDLVPLINEARAKWNLRDKRHIDLYQAAHQVNKTNYIDEFFGEKTAC*
97 amino acids = 11,0 kDa
✓ hypothetical protein 25 39 488 .. 39 898 411 bp CDS
/product = hypothetical protein 25
/translation = MLILMFTPGFSIKKGSFMGSDKPDMKMLSIRTPFGAIYWLSGKPTSVILDAARSSLNDPDWFIKNHYAVRQAKRRSSTTRHKEYLKAQDEAEKLYRSRIDELMNDKYQLEMKCREQARDILAYSRLVKGESDGTST*
136 amino acids = 15,7 kDa
✓ hypothetical protein 26 39 882 .. 40 112 231 bp CDS
/product = hypothetical protein 26
/translation = MEHQRETLMAMLARRSKNALNAGGDGFITAESLRFDVGLSTQAIRRYLDAATINGITEHRQAAAGRTHSYRPAKGK*
76 amino acids = 8,4 kDa
✓ DNA adenine-methylase 40 112 .. 40 744 633 bp CDS
/product = DNA adenine-methylase
/translation = MLLDHRSLTPAELRDIWQTDPRIAAGMFSLLRPCSIDGCASDSNHLLPHYFTREDNCLELDWHTETNQRGVEPAIYFNPPFSKEDANAAVPHNGMANFFKKARQQAEKGVYSQWLFRARPGEGWFPWYLASRIYFIVGRVAFVDASSGQLDNNQTENHAIAEFIPGNFPIMAAGLPLQRDALIAAGERLLEQQANHYAILSKRHEQLLGV*
210 amino acids = 23,8 kDa
✓ hypothetical protein 27 40 831 .. 41 067 237 bp CDS
/product = hypothetical protein 27
/translation = MRIEILFDEHSKVPVKTIEALRAEIEKKLTPLYPKFGLRIANSTSSIIQVSGTKNAAEHDEVISVIQGIWEDDSWIPA*
78 amino acids = 8,8 kDa
✓ terminase small subunit 41 861 .. 504 549 bp CDS
/product = terminase small subunit
/translation = MKFLKLGLIAPDLSIGRFLRACNKIFFFLHFLTFGVLPMSAGIRAPGGGAKPKNGVQQKGSVTRAVSPPDELMGEMAIDAWNRTIRILIKQGFEMQDCYLLMEYCNTVQILYDANLEIKNDGLSDETAAGGAKLGSAIKTRDKCISQLIRLSVVLRLDPTSRVRSDPPNKDKTPGQNEFNQF*
182 amino acids = 20,1 kDa
Рисунок 107 — Диаграмма распределения протеомов исследуемого бактериофага Yersinia enterocolitica phage Ye.e – 12 УлГАУ соответственно молекулярным массам
По проведенным исследованиям генетического и протеомного картирования Yersinia enterocolitica phage Ye.e – 12 УлГАУ локусов патогенности и их гомологов не выявлено.
Вывод: при анализе генетических и протеомных данных исследуемых бактериофагов FBs-16 УГСХА, FBm-8 УГСХА, Phagum B.c. 11 УГСХА, FL.m 4 УлГАУ, Ye. e – 12 УлГАУ локусов патогенности и их гомологов не выявлено, что свидетельствует о возможности их использования с целью создания нового высокоэффективного полифагового биопрепарата для опосредованного биопроцессинга (обработки плодоовощной продукции, способствующей увеличению сроков хранения), позволяющий элиминировать (разрушать) патогенные микроорганизмы, вызывающие не только ее порчу, но и пищевые отравления.
2.2.7. Оценка безопасности фагового биопрепарата на основе коктейля оригинальных вирулентных бактериофагов, активных в отношении бактерий-мишеней, вызывающих плодоовощной продукции
Проявление острого токсического действия коктейля бактериофагов оценивали согласно «Руководству по проведению доклинических исследований лекарственных средств (Иммунобиологические лекарственные препараты)» [240] у 10 здоровых белых мышей обоего пола массой 19–21 г после однократного внутрибрюшинного введения им 1 мл коктейля бактериофагов в течение 7 сут (таблица 82). Контрольные животные получали 0,9% раствор натрия хлорида по той же схеме.
На основе полученных данных можно говорить о том, что однократное введение максимально возможной дозы коктейля бактериофагов для животных не является токсичным.
Таблица 82 – Оценка острой токсичности коктейля бактериофагов на лабораторных животных
| Животные | Кол-во, шт. | Способ введения | Доза, мл/животное | Период наблюдения, сут | Индикаторный показатель
(гибель) |
Снижение веса |
| Мыши белые | 10 | в/в | 1 | 7 | нет | Не отмечено |
| Мыши белые
(контроль) |
3 | в/в | 1 | 7 | нет | Не отмечено |
Оценку хронической токсичности коктейля бактериофагов проводили согласно «Руководству по экспериментальному (доклиническому) изучению новых фармакологических веществ» [241]. Исследование осуществляли на 10 здоровых белых мышах обоего пола массой 19–22 г. Коктейль бактериофагов вводили животным внутрижелудочно по 0,5 мл 1 раз в день в течение 14 дней. Мышам из контрольной группы давали по 0,5 мл внутрижелудочно 0,9% раствора натрия хлорида также в течение 14 дней. У всех животных ежедневно регистрировали массу тела, наличие клинических симптомов общей интоксикации, а также возможную гибель (таблица 83).
На 15-е и 21-е сутки после введения коктейля из выделенных и селекционированных нами бактериофагов проводили макроскопическое исследования органов мышей после эвтаназии углекислым газом. Полученные результаты показали, что ежедневное внутрижелудочное введение исследуемого коктейля бактериофагов в течение 14 сут не приводило к гибели животных и не влияло на состояние их здоровья. Поведенческие реакции, внешний вид мышей, а также общий вес мышей в экспериментальной и контрольной группе не отличались. Вскрытие мышей на 1-е и 7-е сутки после окончания введения препарата показало отсутствие видимых изменений в органах брюшной и грудной полости, а также в головном мозге.
Таблица 83 – Схема эксперимента по изучению хронической токсичности коктейля бактериофагов на лабораторных животных (мышах)
| Тестируемый продукт | Кол-во животных | День эксперимента | Доза введения | Кол-во животных | ||
| всего | вскрыто | пало | ||||
| Коктейль фагов | 10 | 15 | 0,5 мл | 5 | 5 | 0 |
| 21 | 5 | 5 | 0 | |||
| Контроль (0,9% раствор натрия хлорида) | 4 | 15 | 0,5 мл | 2 | 2 | 0 |
| 21 | 2 | 2 | 0 | |||
Влияние фагового биопрепаората на бактериальную флору кишечника in vivo изучали на модели белых беспородных мышей (19–22 г). Препарат давали per os пяти животным в течение 10 суток. Контрольные животные (3 особи) препарат не получали. На начальные (до введения препарата), 4-е, 10-е и 14-е (через 4 дня после последнего введения препарата) сутки эксперимента у контрольных и опытных мышей отбирали фекалии для проведения бактериологического анализа. Состояние бактериальной микрофлоры кишечника животных оценивали по количеству клеток кишечной палочки, энтерококков, энтеробактера аэрогенес, клебсиелл, лактобацилл и бифидобактерий в 1 г фекалий. Суспензии, полученные из гомогенизированных в физиологическом растворе фекалий, титровали и высевали на соответствующие селективные питательные среды. При проведении данного исследования пользовались методикой постановки анализа на микробиоценоз кишечника. Результаты исследования представлены в таблице 84.
Таблица 84 – Микрофлора и вес белых беспородных мышей до, во время и после кормления коктейлем бактериофагов в течение 10 дней по 0,5 мл в день
| Мыши | Микроорганизмы | До кормле
ния |
4-й день | 10-й день | 14-й день |
| Опыт
(n=5) |
Кишечная палочка с нормальными ферментативными свойствами, КОЕ/г | 1,8х106±
1,1 |
4,1х105±
2,4** |
6,4х105
±1,3 |
5,9х10
±2,3* |
| Кишечная палочка лактозонегативная, КОЕ/г | 5,7х103±
1,3 |
3,6х104±
1,8** |
4,8х104
±2,7 |
3,9х104
±2,6* |
|
| Энтерококки, КОЕ/г | 5,8х104±
3,1 |
5,4х104±
3,2** |
5,1х106
2,3 |
4,3х105
±1,5* |
|
| Бифидобактерии, КОЕ/г | 7,6х105±
32,2 |
5,9х104±
2,1** |
4,1х103
±3,4 |
5,3х104
±3,7* |
|
| Лактобациллы, КОЕ/г | 5,7х104±
3,1 |
4,4х105±
0,7** |
3,5х105
±0,4 |
2,6х105
±1,2* |
|
| Вес, г | 19,6±1,6 | 19,8±1,5
** |
20,4±0,
2 |
19,9±1 ,
4* |
|
| Конт
роль (n=3) |
Кишечная палочка с нормальными ферментативными свойствами, КОЕ/г | 1,8х106±
0,4 |
1,7х106±
0,6** |
1,5х106
±0,8 |
2,1х106
±1,2* |
| Кишечная палочка лактозонегативная, КОЕ/г | 2,6х103±
1,4 |
2,7х104±
1,8** |
2,4х104
±0,6 |
2,9х104
±1,5* |
|
| Энтерококки, КОЕ/г | 4,1х104±
2,7 |
2,3х104±
1,3** |
3,7х105
±1,0 |
3,9х105
±1,4* |
|
| Бифидобактерии, КОЕ/г | 2,6х105±
1,5 |
7,3х104±
3,2** |
5,6х104
±0,6 |
6,7х104
±2,3* |
|
| Лактобациллы, КОЕ/г | 3,9х104±
0,8 |
2,7х105±
1,8** |
3,9х105
±1,4 |
4,9х105
±1,2* |
|
| Вес, г | 20,2±1,0 | 20,3±1,
** |
20,3±1,
1 |
20,6±1,
2* |
Примечание:* — р>0,05 относительно контроля;** р>0,05 относительно 14 дня корм.
Исходя из полученных данных, мы можем сделать вывод о том, что пероральное применение фаговогог биопрепарата в течение 10 сут не влияло на нормальную микрофлору кишечника мышей.
Кроме того, исследуемый коктейль бактериофагов не оказывал негативного воздействия на физическое состояние мышей: все опытные и контрольные животные имели здоровый вид и прибавляли в весе на протяжении всего эксперимента.
Таким образом, для деконтаминации изучаемого нами пищевого сырья нами были отобраны 5 производственно перспективных фагов характеризующихся широким суммарным спектром литической активности на сформированном банке бактериальных штаммов, высоким титром фаговых частиц (не ниже 107 БОЕ/мл) и предельно низким содержанием токсинов в фаголизате при культивировании по собственному модифицированному методу, устойчивых к агресивным факторам внешней среды (температуре, трихлорметану). Молекулярно–генетические исследования подтвердили вирулентность и оригинальность отобранных штаммов бактериофагов. В рамках доклинических исследований доказана безопасность коктейля бактериофагов в опытах по изучению острой и хронической (подострой) токсичности на лабораторных животных, показано также, что разработанная рецептура не влияет на нормальную микрофлору кишечника мышей.
2.2.8. Получение фагового биопрепарата и оценка его эффективности в прооцессе фаг — опосредованного биопроцессинга
Действующим веществом биопрепарата является смесь стерильных фильтратов фаголизатов, активных в отношении Bacillussubtilis, Bacillus coagulans, Bacillus pumilus, Listeria monocytogenes, Yersinia enterocolitica. Содержание видоспецифических активных бактериофагов в готовой форме продукта составляет 107 – 109 БОЕ/мл. Концентрация бактериофаговых частиц подобрана на основании данных зарубежной научной литературы и проведенных собственными силами лабораторных испытаний, экономической целесообразности с учетом последующего разведения для осуществления эффективного фаг-опосредованного биопроцессинга пищевых полуфабрикатов. В качестве вспомогательного компонента рецептуры был использован Equilibration Buffer, используемый как для смыва фаговых частиц с матраса, так и для осуществления процесса аффинной хроматографии. В таблице 85 приведена рецептура фагового биопрепарата.
Таблица 85 – Рецептура биопрепарата для деконтаминации пищевого сырья и готовых продуктов питания на основе бактериофагов
| Наименование компонента | Объем, мл |
| Equilibration Buffer
(20 mM Hepes, 150 mM NaCl, 0,1 mM CaCl2, pH 7.5) |
40 |
| Коктейль бактериофагов | 60 |
Фаговый биопрепарат средство фасуют в асептических условиях по 100 мл в стеклянные флаконы и закрывают резиновыми пробками с алюмириевыми фиксаторам, объемом 100±10 мл по ГОСТ Р 53416-2009.
2.2.9. Пилотная технология получения биопрепарата на основе бактериофагов
Согласно разработанной рецептуре, в процессе получения 10 экспериментально-производственных партий фагового биопрепарата была отработана пилотная технология производства, которая представляет собой следующую цепочку этапов:
1-й этап. Подготовка стартерных культур пары бактериофаг – штамм-хозяин.
Штаммы бактерий, используемые для наработки бактериофагов, лиофилизируют, используя сублимационную сушку CoolSafe110 FreezeDryer. Штаммы бактерий в соотношении 1:1 смешивают с защитной средой (сахароза 20 %, желатин 1 %), разливают во флаконы по 2 мл и высушивают в течение 12 ч при давлении ≤0,03 гПа и при постепенном повышении температуры от -50 до +20°С.
Фенотипически и молекулярно-генетически охарактеризованные штаммы бактериофагов лиофилизируют по схеме, соответствующей изложенной выше в отношении штаммов бактерий, используя следующую защитную среду: сахароза 20 %, желатин 8 %.
2-й этап. Подготовка помещения и оборудования
Перед началом дезинфекции проверяют эффективность вентиляционного оборудования и HEPA фильтров. Боксированное помещение и ламинар обрабатывают при помощи аламинола. Дезинфекцию оборудования, предназначенного для розлива и укупорки флаконов с ТВС, а также поддонов для флаконов и емкости для крышек, проводят 70 % раствором спирта.
3-й этап. Приготовление материалов
Перед стерилизацией осуществляют мойку стеклянной посуды. Стерилизацию лабораторной посуды осуществляют по следующему режиму: сухожаровой шкаф – 1 ч при 200 ºС. Стерилизацию емкостей большого объема и частей перистальтического насоса (силиконовый шланг) проводят в автоклаве под давлением пара 1,2 атмосферы и рабочей температуре 121 ºС, время стерилизации – 20 мин. Сухая стерилизация гамма-лучами пластиковых флаконов и крышек производится по контракту по следующей схеме: 18,5 кГр при скорости конвейера 3,0 см/сек.
4-й этап. Питательные среды
Разливают в литровые матрасы и стерилизуют при следующих режимах: под давлением 1,2 атмосферы и рабочей температуре 121 ºС.
5-й этап. Подготовка фаголизатов бактериофагов
Фаголизаты бактериофагов получали способом, запатентованным в РФ (патент №2525141) [235] – с учетом модификации, приведенной в разделе диссертации 2.4.3. 4,5 мл 18-часовой бактериальной культуры штамма-хозяина в титре 109 КОЕ/мл засевают в матрац для культивирования – скошенная плотная питательная среда толщиной слоя от 10 мм до 25 мм, культивируют в течение 3–3,5 ч при оптимальной температуре для роста культуры штаммахозяина, затем на полученный газон культуры штамма-хозяина засевают маточный бактериофаг в титре 106–107 БОЕ/мл, герметично закрывают сосуд для культивирования. Культивируют в течение 4–5 ч при оптимальной температуре для роста культуры штамма бактериофага и толщине слоя воздуха над поверхностью плотной питательной среды от 25 мм до 40 мм, получают фаголизат при суспендировании бактериофага с поверхности плотной питательной среды физиологическим раствором или буферным раствором с pH 7,0–7,2 в количестве 9–10 мл, отсасывают фаголизат в стерильную емкость, добавляют трихлорметан в количестве 1:10, выдерживают в течение 30 мин при непрерывном шуттелировании, центрифугируют в течение 30 мин при 5000 об./мин, отбирают надосадочную жидкость в стерильные пробирки и проверяют титр по Грациа. Полученные раздельно бактериофаги в титре не менее 1011 БОЕ/мл смешивают в стерильной емкости, в равных объемах.
6-й этап. Стерилизация фаголизата
Полученный коктейль фаголизатов фильтруют через мембранный фильтр 0,22 мкм.
7-й этап. Сведение компонентов фагового биопрепарата
Коктейль стерильных фильтратов фаголизатов с учетом конечного титра бактериофагов доводят до объема 100 мл, с помощью уравновешенного буфера (Hyglos) в стерильном флаконе.
8-й этап. Розлив
Асептический розлив и укупорка во флаконы по 100 мл с крышкой, содержащей контроль первого вскрытия.
9-й этап. Маркировка
Маркировка включает следующие сведения о продукте: наименование, указание «не для розничной продажи», наименование и местонахождение изготовителя, объем, дату изготовления и дату упаковывания, срок годности и условия хранения, номер партии. Критические контрольные точки на этапах созданияфагового биопрепарата:
- Контроль микробиологической чистоты флаконов и крышек для розлива. 5 флаконов из партии отбирают в боксе из двойного пакета. Заливают 10 мл стерильного МПБ (можно использовать LB-бульон, тиогликолевую среду). Флаконы закрывают, тщательно встряхивают, ставят в термостат при 37 ºС и 25 ºС на 48 ч. Затем, из каждого флакона, делают высев 0,1 мл на чашки с плотными питательными средами (кровяной агар, Сабуро) методом spot-теста. Инкубируют при 37 ºС 1 сутки на кровяном агаре и при 25 ºС – 3 суток на среде Сабуро. После инкубации контролируют наличие или отсутствие роста на чашках. Стерильным пинцетом выбирают 5 крышек из партии, замачивают в емкости с 250 мл стерильной жидкой питательной среды (МПБ, LB-бульон, тиогликолевая среда). Емкость закрывают, ставят в термостат при 37 ºС и 25 ºС на 48 ч, после чего повторяют методику высева и учета результатов в соответствие с процедурой, приведенной для флаконов.
- Контроль специфической активности фаголизатов. Специфическую активность фаголизатов оценивали по методу Грациа (таблица 86).
Таблица 86 – Контроль специфической активности фаголизатов
| Бактериофаг | Средний титр по 10 экспериментально производственным партиям, БОЕ/мл | Контрольные значения титра,
БОЕ/мл |
| FBs-16 УГСХА | 7,1×1012±1,4 | Не менее 1011 |
| FBm-8 УГСХА | 6,3×1012±1,3 | Не менее 1011 |
| Phagum B.c. 11 УГСХА | 5,2×1012±1,1 | Не менее 1011 |
| FL.m 4 УлГАУ | 4,4×1012±1,3 | Не менее 1011 |
| Ye. e – 12 УлГАУ | 5,3×1012±0,7 | Не менее 1011 |
- Контроль фаголизата на аномальную токсичность
Объем 1 мл фаголизата вводили внутрибрюшинно 5 здоровым мышам обоего пола. После введения фаголизата наблюдали за животным в течение 7 суток. Фаговый биопрепарат считается прошедшим испытание, если в течение предусмотренного срока наблюдения не погибнет ни одно из подопытных животных.
- Микробиологическая чистота фаголизата
Контролируемые по каждый партии продукта микробиологические показатели приведенные в ТР ТС 029/2012 [220] и указаны в таблице 87.
- Определение эндотоксина в фаговом биопрепарате
Определение уровня эндотоксина после рабочего разведения фагового биопрепарата (до титра каждого бактериофага 109 БОЕ/мл) определяли с помощью реакции гелирования лизата амебоцитов крови мечехвоста Limulus polyphemus (ЛАЛтест). Предельные значения уровня эндотоксина составляло не более 50 ЕЭ/мл.
Таблица 87 – Контроль микробиологической чистоты фаголизата
| Показатели | Результаты | Требования ТР ТС 029/2012 к ферментным препаратам |
| КМАФАнМ, КОЕ/мл, не более | 0 | 5×10 4 |
| БГКП в 0,1 мл | Не обнаружено | Не допускается |
| Сальмонеллы в 25 мл | Не обнаружено | Не допускается |
| E. coli в 25 мл | Не обнаружено | Не допускается |
Определение срока годности фагового биопрепарата
Необходимым этапом при конструировании рецептуры и разработке технологии получения фагового биопрепарата является определение срока годности готовой формы. Для этого образцы из 6 партий продукции хранили в течение 9 месяцев при температуре 4±2°С, периодически отбирая для контроля согласно ОФС.1.1.0004.15 Отбор проб «Государственная фармакопея Российской Федерации», XIII издание, том I, 2015 год [242]. В таблице 88 представлены данные по изучению стабильности специфической литической активности бактериофагов в разные сроки с момента выпуска продукции.
Таблица 88 – Стабильность специфической литической активности бактериофагов (по Грациа) при нормативном хранении фагового биопрепарата
| Бактериофаг | Титр бактериофагов БОЕ/мл | |||
| 1 мес. | 3 мес. | 6 мес. | 9 мес. | |
| FBs-16 УГСХА | 7,1×1012±1,4 | 6,9×1012±1,1 | 6,0×1012±1,2 | 5,8×1012±1,5 |
| FBm-8 УГСХА | 6,3×1012±1,3 | 6,0×1012±1,2 | 5,7×1012±1,1 | 5,3×1012±1,4 |
| Phagum B.c. 11 УГСХА | 5,2×1012±1,1 | 5,0×1012±1,2 | 4,6×1012±1,3 | 4,2×1012±1,0 |
| FL.m 4 УлГАУ | 4,4×1012±1,3 | 4,0×1012±1,1 | 3,5×1012±1,2 | 3,1×1012±1,0 |
| Ye. e – 12 УлГАУ | 5,3×1012±0,7 | 4,9×1012±0,5 | 4,3×1012±0,3 | 3,9×1012±0,1 |
Параметры микробиологической чистоты фагового биопрепарата экспериментально производственных серий соответствовали контрольным значениям приведенным в таблице 87. Результаты проведенной работы свидетельствуют о том, что в процессе хранения готового продукта при температуре 4±2°С активность всех бактериофагов не опускалась ниже нормативных значений в течение 6 месяцев + 50% установленного в ТУ срока годности (содержание БОЕ в 1 мл продукта более 109).
2.2.10. Оценка эффективности фагового биопрепарата для деконтаминации плодоовощной продукции
Следующий этап исследований – оценка эффективности сконструированного фагового биопрепарата. Определение биологической эффективности биопрепарата проводили на товарном картофеле сорта Ласунок, томатах сорта Премиум F1, листовом салате сорта Тайфун, яблоках сорта Айдарен на искусственном инфекционном фоне в условиях лаборатории (бактериологического бокса). Метод искусственного заражения предусматривал инокуляцию растений путем опрыскивания бактериальной суспензией 48-часовых культур Bacillus pumilus, Bacillus subtilis, Bacillus coagulans, Listeria monocitogenes, Yersinia enterocolitica с инфекционной нагрузкой 1×107–108 КОЕ/мл. Последние 2 вида микроорганизмов (Listeria monocitogenes, Yersinia enterocolitica) не вызывают поражение плодоовощной продукции, но согласно требованию технического задания включены в тему научно-исследовательской работы, как сапрофиты-возбудители пищевых инфекций человека. В каждом варианте было взято по 25 образцов. Контролем служили инокулированные плоды без обработки. Далее происходила обработка плодоовощной продукции 5% рабочим раствором биопрепарата на основе консорциума бактериофагов, из расчета расхода рабочей жидкости 6–8 мл/м3, согласно четырем вариантам:
В состав биопрепарата входят фаги, изолированные из почвы и пораженных плодов овощных культур, и отобранные методом селекции по признаку литической активности к бактериям Bacillus pumilus, Bacillus subtilis, Bacillus coagulans, Listeria monocitogenes, Yersinia enterocolitica. На основе отобранных вирусов создан консорциум бактериофагов в виде биопрепарата, а также проведена оценка их эффективности в лабораторных условиях.
Препарат является непатогенным и нетоксигенным, что дает возможность использовать его в открытом грунте.
Вариант — 1. Плоды, инокулированные Bacillus pumilus, Bacillus subtilis, Bacillus coagulans, Listeria monocitogenes, Yersinia enterocolitica и обработанные биопрепаратом при первых признаках порчи. Это примерно через 36-48 часов.
Вариант — 2. Плоды, предварительно обработанные биопрепаратом и через 8 часов инокулированные Bacillus pumilus, Bacillus subtilis, Bacillus coagulans, Listeria monocitogenes, Yersinia enterocolitica.
Вариант — 3. Плоды, инокулированные Bacillus pumilus, Bacillus subtilis, Bacillus coagulans, Listeria monocitogenes, Yersinia enterocolitica и обработанные биопрепаратом без наличия признаков порчи. Плоды погружались в раствор бактериофагового биопрепарата на 1-2 минуты (коктейль бактериофагов объемом 85 мл разводили в 10 литрах воды).
Вариант – 4. Плоды, инокулированные Bacillus pumilus, Bacillus subtilis, Bacillus coagulans, Listeria monocitogenes, Yersinia enterocolitica, без обработки биопрепаратом (контроль).
Наблюдения и учеты степени поражения растений болезнью проводили в динамике перед каждым очередным опрыскиванием. Биологическую эффективность биопрепарата – по снижению развития болезни в опытном варианте относительно контроля, выраженную в процентах. При проведении исследований руководствовались «Методическими указаниями по проведению регистрационных испытаний биопрепаратов для защиты растений от вредителей и болезней» [243].
Наблюдения за ростом и развитием растений показали, что первые признаки болезни во всех вариантах опыта проявились через 2 дня. Установлено, что однократная обработка плодов 5% рабочим раствором биопрепарата значительно снижает развитие порчи (таблицы 89-96). Элиминация более 70 % микроорганизмов с поверхности образцов подтверждалась при условии множественности инфицирования фаг–бактерия-хозяин не менее 100:1 и времени деконтаминации не менее 2 мин (использование метода погружения), при этом температурный режим мог варьировать от 2 до 25 °С.
Таблица 89 – Влияние биопрепарата на развитие порчи картофеля (искусственный инфекционный фон, сорт Ласунок, 2019)
| Варианты проведения испытаний биопрепарата | Развитие порчи (%) | ||||
| Перед 1-ой обработкой | Через 2 дня | Через 4 дня | Через 6 дней | Через 8 дней | |
| Биопрепарат (вариант 1) | 6,5 | 8,9 | 12,3 | 19,0 | 26,4 |
| Биопрепарат (вариант 2) | — | 6,3 | 11,8 | 18,3 | 27,8 |
| Биопрепарат (вариант 3) | — | — | — | — | — |
| Контроль (вариант 4) | — | 12,5 | 14,3 | 35,0 | 41,4 |
Таблица 90 — Показатели, характеризующие контаминацию опытных и контрольных проб картофеля 3 и 4 вариант эксперимента (искусственный инфекционный фон, сорт Ласунок, 2019)
Примечание: «I» — 4 вариант эксперимента, «II» — 3 вариант эксперимента
Таблица 91 – Влияние биопрепарата на развитие порчи томатов (искусственный инфекционный фон, сорт Премиум F1, 2019)
| Варианты проведения испытаний биопрепарата | Развитие порчи (%) | ||||
| Перед 1-ой обработкой | Через 2 дня | Через 4 дня | Через 6 дней | Через 8 дней | |
| Биопрепарат (вариант 1) | 9,1 | 26,6 | 31,3 | 34,0 | 46,4 |
| Биопрепарат (вариант 2) | — | 23,7 | 27,4 | 31,5 | 42,8 |
| Биопрепарат (вариант 3) | — | — | — | — | — |
| Контроль (вариант 4) | — | 39,7 | 48,2 | 54,1 | 41,4 |
Таблица 92 — Показатели, характеризующие контаминацию опытных и контрольных проб томатов 3 и 4 вариант эксперимента (искусственный инфекционный фон, сорт Премиум F1, 2019)
| Параметр | До обработки | 1 сутки | 2 сутки | 3 сутки | 4 сутки | 5 сутки | 6 сутки | 8 сутки | ||||||||
| I | II | I | II | I | II | I | II | I | II | I | II | I | II | I | II | |
| Listeria, КОЕ/25 г | нет | нет | нет | нет | нет | нет | нет | нет | нет | нет | нет | нет | нет | нет | нет | нет |
| Bacillus pumilus | 1·102 | 1·102 | 1·102 | 1·102 | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено |
| Bacillus subtilis | 1·102 | 1·102 | 1·102 | 1·102 | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено |
| Bacillus coagulans | 1·102 | 1·102 | 1·102 | 1·102 | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено |
| Yersinia enterocolitica | 1·102 | 1·102 | 1·102 | 1·102 | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено |
| ОМЧ, КОЕ/г | ≈107 | ≈107 | ≈107 | ≈107 | ≈107 | ≈107 | ≈107 | ≈107 | ≈108 | ≈107 | ≈1010 | ≈107 | ≈1010 | ≈107 | ≈1012 | ≈107 |
Примечание: «I» — 4 вариант эксперимента, «II» — 3 вариант эксперимента
Таблица 93 – Влияние биопрепарата на развитие порчи листового салата (искусственный инфекционный фон, сорт Тайфун)
| Варианты проведения испытаний биопрепарата | Развитие порчи (%) | |||
| Перед 1-ой обработкой | Через 2 дня | Через 4 дня | Через 6 дней | |
| Биопрепарат (вариант 1) | 7,2 | 20,9 | 30,7 | 32,8 |
| Биопрепарат (вариант 2) | — | 26,5 | 29,1 | 30,6 |
| Биопрепарат (вариант 3) | — | — | — | — |
| Контроль (вариант 4) | — | 38,3 | 57,2 | 84,1 |
Таблица 94 — Показатели, характеризующие контаминацию опытных и контрольных проб порчи листового салата 3 вариант эксперимента (искусственный инфекционный фон, сорт Тайфун)
| Параметр | До обработки | 1 сутки | 2 сутки | 3 сутки | 4 сутки | 5 сутки | 6 сутки | |||||||
| I | II | I | II | I | II | I | II | I | II | I | II | I | II | |
| Listeria, КОЕ/25 г | нет | нет | нет | нет | нет | нет | нет | нет | нет | нет | нет | нет | нет | нет |
| Bacillus pumilus | 1·102 | 1·102 | 1·102 | 1·102 | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено |
| Bacillus subtilis | 1·102 | 1·102 | 1·102 | 1·102 | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено |
| Bacillus coagulans | 1·102 | 1·102 | 1·102 | 1·102 | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено |
| Yersinia enterocolitica | 1·102 | 1·102 | 1·102 | 1·102 | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено |
| ОМЧ, КОЕ/г | ≈107 | ≈107 | ≈107 | ≈107 | ≈107 | ≈107 | ≈107 | ≈107 | ≈108 | ≈107 | ≈1010 | ≈107 | ≈1010 | ≈107 |
Примечание: «I» — 4 вариант эксперимента, «II» — 3 вариант эксперимента
Таблица 95 – Влияние биопрепарата на развитие порчи яблок (искусственный инфекционный фон, сорт Айдарен, 2019)
| Варианты проведения испытаний биопрепарата | Развитие порчи (%) | |||||
| Перед 1-ой обработкой | Через 2 дня | Через 4 дня | Через 6 дней | Через 8 дней | Через 10 дней | |
| Биопрепарат (вариант 1) | 2,8 | 5,9 | 7,7 | 17,8 | 26,1 | 29,8 |
| Биопрепарат (вариант 2) | — | 3,3 | 4,8 | 18,3 | 29,3 | 33,4 |
| Биопрепарат (вариант 3) | — | — | — | — | — | — |
| Контроль (вариант 4) | — | 6,5 | 9,6 | 21,0 | 41,4 | 59,2 |
Таблица 96 — Показатели, характеризующие контаминацию опытных и контрольных проб яблок 3 и 4 вариант эксперимента (искусственный инфекционный фон, сорт Айдарен, 2019)
| Параметр | До обработки | 1 сутки | 2 сутки | 3 сутки | 4 сутки | 5 сутки | 6 сутки | 8 сутки | 10сутки | |||||||||||||||||||||||||||
| I | II | I | II | I | II | I | II | I | II | I | II | I | II | I | II | I | II | |||||||||||||||||||
| Listeria, КОЕ/25 г | нет | нет | нет | нет | нет | нет | нет | нет | нет | нет | нет | нет | нет | нет | нет | нет | нет | нет | ||||||||||||||||||
| Bacillus pumilus | 1·102 | 1·102 | 1·102 | 1·102 | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | ||||||||||||||||||
| Bacillus subtilis | 1·102 | 1·102 | 1·102 | 1·102 | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | ||||||||||||||||||
| Bacillus coagulans | 1·102 | 1·102 | 1·102 | 1·102 | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | ||||||||||||||||||
| Yersinia enterocolitica | 1·102 | 1·102 | 1·102 | 1·102 | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | 1·102 | Роста не обнаружено | ||||||||||||||||||
| ОМЧ, КОЕ/г | ≈107 | ≈107 | ≈107 | ≈107 | ≈107 | ≈107 | ≈107 | ≈107 | ≈108 | ≈107 | ≈1010 | ≈107 | ≈1010 | ≈107 | ≈1012 | ≈107 | ≈1012 | ≈107 | ||||||||||||||||||

Рисунок 108 – Объекты исследований: А – яблоки сорта Айдарен, Б- салат листовой сорта Тайфун, В – картофель сорта ласунок, Г- томаты сорта Премиум F1
Установлено, что однократная обработка плодов 5% рабочим раствором биопрепарата (аэрозольно) из расчета расхода рабочей жидкости 6–8 мл/м3 снижает развитие порчи. Элиминация более 70 % микроорганизмов с поверхности образцов подтверждалась при условии множественности инфицирования фаг–бактерия-хозяин не менее 100:1 и времени деконтаминации более 2 мин (использование метода погружения), при этом температурный режим мог варьировать от 2 до 25 °С.
ЗАКЛЮЧЕНИЕ
Высокий интерес потребителей во всем мире к экологически чистым продуктам, развитие фермерского хозяйства, сопровождается ростом спроса на безопасные для экосистемы биологические средства защиты.
Исследования в области использования биопрепаратов для обработки продукции растениеводства, имеют высокую практическую значимость, так как позволяют обеспечить значительное сокращение потерь в процессе хранения.
Применение технологий обработки биопрепаратами является эффективным, экологически безопасным и экономичным способом снижения потерь при хранении, увеличения срока хранения и обеспечения качества продукции растениеводства.
Основной причиной потерь растительного сырья при хранении является микробиальная порча. Современные способы обработки сырья при хранении такие, как обработка химическими препаратами, искусственное охлаждение, озонирование, электромагнитное излучение и другие, предотвращают микробиальную порчу, но, в тоже время, уничтожают биологический барьер, препятствующий проникновению патогенных микроорганизмов, снижая естественный иммунитет растительного сырья.
Перспективным направлением в хранении растительного сырья является применение биологических средств защиты, на основе активных штаммов антагонистов патогенной микрофлоры. Биопрепараты используют для борьбы с фитопатогенными организмами в послеуборочный период и при длительном холодильном хранении. При этом не создается угрозы нарушения экологического равновесия в биосфере, так как микроорганизмы, применяемые в качестве биопрепаратов, являются естественной микрофлорой окружающей среды.
Цель работы — разработка фагового биопрепарата и методов фаг-опосредованного биопроцессинга (обработка бактериофагами) плодоовощной продукции с целью увеличения сроков хранения и профилактики пищевых отравлений.
Первый этап работы — выделение из плодоовощной продукции бактерий Bacillus pumilus, Bacillus subtilis, Bacillus coagulans, Listeria monocitogenes, Yersinia enterocolitica, вызывающих их порчу и пищевое отравление и их идентификация. С целью оптимизации процесса исследований нами были разработаны бактериологические схемы выделения и идентификации вышеназванных микроорганизмов. Также был использован метод идентификации ПЦР с электрофоретической детекцией. Из плодоовощной продукции и проб почвы было изолировано 74 культуры бактерий, типированых как Bacillus pumilus, 56 штаммов Bacillus subtilis, 40 штаммов Bacillus coagulans, 2 штамма — Listeria monocitogenes, 4 штамма Yersinia enterocolitica.
Далее из объектов фито-санитарного надзора было выделено и селекционировано 67 бактериофагов, активных в отношении Bacillus pumilus (22 изолята), Bacillus subtilis (22 изолята), Bacillus coagulans (13 изолятов), Listeria monocitogenes (5 изолятов), Yersinia enterocolitica (5 изолятов).
На следующем этапе нами были исследованы биологические свойства фагов-кандидатов: мы определяли спектр литической активности бактериофагов на сформированном банке бактериальных штаммов, проверяли их устойчивость к агрессивным факторам внешней среды, оценивали урожайность на жидких и плотных питательных средах, а также изучали параметры инфекционного процесса в системе фаг–клеткахозяин (время адсорбции, латентный период и выход фаговых частиц из одной бактериальной клетки). По результатам проведенных экспериментов было отобрано 5 производственно-перспективных фагов: FBs-16 УГСХА, FBm-8 УГСХА, Phagum B.c. 11 УГСХА, FL.m 4 УлГАУ, Ye.e – 12 УлГАУ, характеризующихся широким суммарным спектром литической активности на сформированном банке бактериальных штаммов – 100%, титром фаговых частиц в фаголизате не ниже 109 БОЕ/мл.
Основной целью исследования геномов и протеомов выделенных бактериофагов было определение отсутствия локусов патогенности для возможности их дальнейшего использования.
Исходя из данной цели были определены следующие задачи:
- исследование соответствия генома изучаемых бактериофагов данным секвенированных и депонированных в системе NCBI и определение возможных гомологов;
- составление карты протеомов бактериофагов в соответствии с аннотированными геномами бактерий и вирусов на основе триплетной кодировки аминокислот;
- исследование протеомов бактериофагов на предмет соответствия локусам патогенности;
- составление филогенетической схемы каждого из протеомов исследуемых бактериофагов.
При решении первой задачи данные генетической последовательности каждого из исследуемых бактериофагов были сопоставлены с аннотированными данными системы NCBI. При анализе полученных нами генетических и протеомных данных исследуемых бактериофагов FBs-16 УГСХА, FBm-8 УГСХА, Phagum B.c. 11 УГСХА, FL.m 4 УлГАУ, Ye. e – 12 УлГАУ локусов патогенности и их гомологов выявлено не было, что свидетельствует о возможности их использования с целью создания нового высокоэффективного полифагового биопрепарата для опосредованного биопроцессинга (обработки плодоовощной продукции, способствующей увеличению сроков хранения), позволяющий элиминировать (разрушать) патогенные микроорганизмы, вызывающие не только ее порчу, но и пищевые отравления.
В результате работы по третьей поставленной нами задаче мы установили, что, в качестве действующих веществ в готовую форму фагового биопрепарата объемом 100 мл были включены фаголизаты 5 перечисленных выше бактериофагов в титре не ниже 109 БОЕ/мл каждого, вспомогательным компонентом продукта выбран уравновешивающий буфер, обеспечивающий стабильность титра фаговых частиц при хранении в течение 6 месяцев при температуре от 2 до 8 °С. Готовый фаговый биопрепарат – это прозрачная жидкость от светло-желтого до желтого цвета, закрытая в стеклянные флаконы под резиновую пробку и алюминиевый колпачок объемом 100-500 мл, титр фага не менее 108 БОЕ/мл, условия хранения: 2-4 0С в течение 6 месяцев, относительная влажность воздуха 70-80 %, при транспортировании учитывать хрупкость упаковки.
Четвертый этап работы – это разработка пилотной технологии получения фагового биопрепарат в высоком титре, включающей несколько стадий:
— подготовка исходного сырья и материалов через наработку лиофилизированного посевного материала стартерных культур пары фаг-хозяин,
— получение отдельных фаголизатов,
— составление фагового коктейля,
— стерилизующая фильтрация;
— фасовка готовой формы во флаконы.
Контрольные мероприятия, в том числе оценка микробиологической чистоты и специфической активности фагосодержащего продукта, осуществлялись на каждой из основных технологических стадий.
Нами была проведена оценка безопасности фагового биопрепарата в опытах по изучению острой и хронической (подострой) токсичности на лабораторных животных. Установлено, что при однократном введении максимальной дозы исследуемого фагосодержащего продукта признаков интоксикации у мышей не наблюдалось.
Пятый этап – оценка эффективности сконструированного фагового биопрепарата. Определение биологической эффективности биопрепарата проводили на товарном картофеле сорта Ласунок, томатах сорта Премиум F1, листовом салате сорта Тайфун, яблоках сорта Айдарен на искусственном инфекционном фоне в условиях лаборатории (бактериологического бокса). Метод искусственного заражения предусматривал инокуляцию растений путем опрыскивания бактериальной суспензией 48-часовых культур Bacillus pumilus, Bacillus subtilis, Bacillus coagulans, Listeria monocitogenes, Yersinia enterocolitica с инфекционной нагрузкой 1×107–108 КОЕ/мл. В каждом варианте было взято по 25 образцов. Контролем служили инокулированные плоды без обработки. Далее происходила обработка плодоовощной продукции 5% рабочим раствором биопрепарата на основе консорциума бактериофагов, из расчета расхода рабочей жидкости 6–8 мл/м3, согласно четырем вариантам:
Вариант — 1. Плоды, инокулированные Bacillus pumilus, Bacillus subtilis, Bacillus coagulans, Listeria monocitogenes, Yersinia enterocolitica и обработанные биопрепаратом при первых признаках порчи. Это примерно через 36-48 часов.
Вариант — 2. Плоды, предварительно обработанные биопрепаратом и через 8 часов инокулированные Bacillus pumilus, Bacillus subtilis, Bacillus coagulans, Listeria monocitogenes, Yersinia enterocolitica.
Вариант — 3. Плоды, инокулированные Bacillus pumilus, Bacillus subtilis, Bacillus coagulans, Listeria monocitogenes, Yersinia enterocolitica и обработанные биопрепаратом без наличия признаков порчи. Плоды погружались в раствор бактериофагового биопрепарата на 1-2 минуты (коктейль бактериофагов объемом 85 мл разводили в 10 литрах воды).
Вариант – 4. Плоды, инокулированные Bacillus pumilus, Bacillus subtilis, Bacillus coagulans, Listeria monocitogenes, Yersinia enterocolitica, без обработки препаратом (контроль).
Установлено, что однократная обработка плодов 5% рабочим раствором биопрепарата снижает развитие порчи. Элиминация более 70 % микроорганизмов с поверхности образцов подтверждалась при условии множественности инфицирования фаг–бактерия-хозяин не менее 100:1 и времени деконтаминации не менее 2 мин (использование метода погружения), при этом температурный режим мог варьировать от 2 до 25 °С.
Сельскохозяйственным и перерабатывающим предприятиям предложен новый высокоэффективный полифаговый биопрепарат для опосредованного биопроцессинга (обработки плодоовощной продукции, способствующей увеличению сроков хранения), позволяющий элиминировать (разрушать) патогенные микроорганизмы, вызывающие не только ее порчу, но и пищевые отравления.
На основании полученных данных разработана нормативно-техническая документация по изготовлению и контролю экспериментальной серии полифагового биопрепарата и методические рекомендации по его применению в условиях производства.
СПИСОК ЛИТЕРАТУРНЫХ ИСТОЧНИКОВ
- Першакова, Т.В. Способы обеспечения стабильного качества растительного сырья в процессе хранения с применением биопрепаратов / Т.В. Першакова, В.В. Лисовой, Г.А. Купин, Е.Ю. Панасенко, Е.П. Викторова // Полиматический научный журнал Кубанского государственного аграрного университета (Научный журнал КубГАУ) [Электронный ресурс]. – 2016. – № 03 (117). Режим доступа: http://ej .kubagro.ru/2016/02/pdf/14.pdf.
- Неменущая, Л.А. Современные технологии хранения и переработки плодоовощной продукции / Л.А. Неменущая, Н.М. Степанищева, Д.М. Соломатин. – М.: ФГНУ «Росинформагротех», 2009. – 172 с.
- Комплексная программа развития биотехнологий в Российской Федерации на период до 2020 года [Электронный ресурс]. – утв. Правительством РФ от 24.04.2012 — № 1853п – П8. – Режим доступа: http://government.ru/media/files/41d4e85f0b854eb1b02d.pdf (20.07.2017).
- Пат. US 6991930, США, МПК C12N 1/14 A01N 63/04, Биологический контроль послеуборочной порчи фруктов с использованием штаммов вида Metschnikowia [Текст]/ Janisiewicz Wojciech, заявитель и патентообладатель The United States of America as represented by the Secretary of Agriculture — № 10140817; заявл. 09.05.2002;опубл. 31.01.2006.
- Simoes, M. Monitoring the effects of biocide treatment of Pseudomonas fluorescens formed under different flow regimes / M. Simoes, M. Pereira, M.J. Vieira // Water Sci. and Technol. – 2003. – Vol. 47. – P. 217–223.
- Государственная программа развития сельского хозяйства и регулирования рынков сельскохозяйственной продукции, сырья и продовольствия на 2013–2020 годы [Электронный ресурс]. – Постановление от 14.07.2012 – № 717. – Режим доступа: http://government.ru/programs/208/events/. (20.07.2017).
- Ткачев, А.Н. Результаты реализации в 2016 году государственной программы развития сельского хозяйства [Электронный ресурс]. – Доклад на заседании Правительства РФ от 27.04.2017 – №12. – Режим доступа: http://government.ru/meetings/27449/stenograms/#tkachev. (20.07.2017).
- Сельское хозяйство, агропромышленный и рыбохозяственный комплекс: некоторые важные результаты и показатели 2016г. [Электронный ресурс]. – Отчет Правительства РФ от 19.04.2017. – Режим доступа: http://government.ru/info/27222/ (20.07.2017).
- Лисовой, В.В. Технологии хранения сельскохозяйственной продукции растительного происхождения, разработанные учеными ФГБНУ КНИИХП / В.В. Лисовой, Е.П. Викторова, А.Н. Матвиенко // Сборник научных трудов к 85-летию ВНИХИ. – Москва, 2015. – С. 302 – 305.
- Першакова, Т. В. Современные технологии хранения фруктов /Т.В. Першакова, Д.В. Кабалина // Научный журнал КубГАУ — Scientific Journal of KubSAU. 2017. №131. URL: https://cyberleninka.ru/article/n/sovremennye-tehnologii-hraneniya-fruktov (дата обращения: 12.12.2019).
- Бутяйкин, В.В. Технология хранения и переработки сельскохозяйственной продукции / В.В. Бутяйкин — Саранск: МГУ им. Н.П. Огарева, 2012. — 161 с.
- Русанова, Л. А. Современные способы хранения плодов, овощей, ягод и винограда / Л.А. Русанова // Сфера услуг: инновации и качество. — 2013. — № 13 — 11 с.
- Матвиенко, А.Н. Технологии хранения фруктов и овощей для производства консервированной продукции / А. Н. Матвиенко, В. В. Лисовой, М. А. Казимирова, А. А. Схаляхов // Новые технологии. — 2014. — №1. — С. 22 — 28.
- Хранение в регулируемой атмосфере [Электронный ресурс]. — Режим доступа: http://www.infrost-agro.ru/keeping/regulate/ (24.04.2017).
- Шишкина, Н.С. Совершенствование технологии хранения плодоовощной продукции / Н.С. Шишкина // Сборник научных трудов к 85-летию ВНИХИ. — Москва, 2015. — С. 327-335.
- Пат. 2204924, Россия, МПК 7A 23L 7A 23B 7A 01F 7 A. Способ предотвращения от порчи пищевых продуктов [Текст] / Гаспарян А.Р., Горелик С.Л.; заявитель и патентообладатель Гаспарян А.Р., Горелик С.Л. — № 2000124370/13; заявл. 25.09.2000; опубл. 27.05.2003.
- Пугач, С.Г. Применение озона в хранении овощей и фруктов / С.Г. Пугач // Овощи и фрукты. — 2014. — № 12. — С. 56-60.
- Пат. 2400965 Россия, МПК А01Б25/00. Способ хранения растительных продуктов [Текст] / Жиляков Е.В., Голубева О.А.; заявитель и патентообладатель Жиляков Е В. — № 2009104264/12; заявл. 09.02.2009; опубл. 10.10.2010.
- Пат. 2525722 Россия, МПК A01F25/00, A23B7/152. Способ хранения сельскохозяйственной продукции [Текст] / Ханикян В.Л.; заявитель и патентообладатель Общество с ограниченной ответственностью «АлХиТех» (ООО «АлХиТех») — № 2013108726/13; заявл. 28.02.2013; опубл. 20.08.2014.
- Пат. CN102204588, Китай, МПК A23B 7/154, Способ применения фенетилового спирта для защиты от порчи фруктов и овощей [Текст]/ Long Chaoan Liu Pu, Cheng Yunjiang., заявитель и патентообладатель Huazhong Agricultural University — № 201110202427.6; заявл. 19.07.2011;опубл. 05.10.2011.
- Пат. CN101892167, Китай, МПК С12R 1/645 А23В 7/155 С12N 1/16, Rhodotorula mucilaginosa, их применение для профилактики и лечения послеуборочных заболеваний плодов и способ его использования [Текст]/ Zhang Hongyin, Huang Xingyi, Xu Zhanli, заявитель и патентообладатель Jiangsu University — № 201010198131.7; заявл. 10.06.2010; опубл. 24.11.2010.
- Пат. CN101697750, Китай, МПК A23B 7/155 A23B 7/16 A23B 7/015, Способ профилактики послеуборочных заболеваний плодов [Текст]/ Zhang Hongyin, Dong Ying, Ren Xiaofeng, заявитель и патентообладатель Jiangsu University — № 200910233684.9; заявл. 28.10.2009; опубл. 28.04.2010.
- Пат. CN1543796, Китай, МПК A01N 59/00 A01N 63/00, Способ профилактики и лечения послеуборочных заболеваний плодов и овощей с использование силиката натрий или силиката калия [Текст]/ Tian Shiping, Qin Guozheng, заявитель и патентообладатель Institute of Botany, Chinese Academy of Sciences- № 200310115337.9; заявл. 19.11.2003; опубл. 29.03.2006.
- Пат. CN102783518, Китай, МПК A23B 7/155, Способ профилактики и лечения заболеваний плодов перед хранением с применением диазосульфида и Cryptococcus laurentii [Текст]/ Zhang Hongyin, Sun Yu, Ren Xiaofeng, заявитель и патентообладатель Jiangsu University — № 200910233684.9; заявл. 15.08.2012; опубл. 21.11.2012.
- Пат. CN101491273, Китай, МПК A23B 7/153 A23B 7/157 A23B 7/155, Способ предотвращения послеуборочных заболеваний ягод винограда [Текст]/ Tian Shiping, Qin Guozheng, Chen Qiling, Xu Yong, заявитель и патентообладатель Institute of Botany, Chinese Academy of Sciences- № 200910078858.9; заявл. 04.03.2009; опубл. 29.07.2009.
- Пат. CN101899400, Китай, МПК C12N 1/16 A23B 7/155 C12R 1/84, Способ консервирования и хранения плодов с использованием Pichiacaribbica [Текст]/ Zhang Hongyin, Pang Shuixiu, Zhang Xiaoyun, Ren Xiaofeng, заявитель и патентообладатель Jiangsu University — № 201010198119.6; заявл. 10.06.2010; опубл. 01.12.2010.
- Пат. Ru 02259397, Российская Федерация, МПК 7C12N, 7A01C, 7C12N. Средство для защиты зерновых сельскохозяйственных культур, подсолнечника, винограда от фитопатогенных микроорганизмов, овощных культур от фитопатогенных бактерий [Текст]/ Хотянович А.В., Темнова О.В., Орлова Н.А., Быкова Н.В., Чеботарь В.К.; заявитель и патентообладатель Общество с ограниченной ответственностью «Бисолби-интер» — № 2003110469/13; заявл. 02.04.2003; опубл. 27.08.2005.
- Биологический фунгицид Бактофит [Электронный ресурс]. – Режим доступа: http://www.sibbio.ru/catalog/rastenievodstvo/baktofit/ (20.07.2017).
- Березина, Н. В., Механизм защитного действия современных препаративынх форм биопрепаратов ЗАО «Агробиотехнология» / Березина И.В., Морозов Д.О. // Теплицы России. 2006. — № 2. — С . 33 — 35. Пат. CN100337552,
- Антистрессовое высокоурожайное земледелие. Фитоспорин – М [Электронный ресурс]. – Режим доступа: http://bashinkom.ru/avz/3_4_1.php (20.07.2017).
- Пат. 2534213, Россия, МПК A01N 63/02 C12N 1/14, Способ получения биологического средства для защиты растений от фитопатогенов и нематод на основе штамма гриба рода Trihoderma и биологическое средство, полученное способом [Текст]/ Тазетдинова Д.И., Алимова Ф.К., заявитель и патентообладатель Тазетдинова Д.И., Алимова Ф.К. — № 2012109115/10; заявл. 12.03.2012; опубл. 27.11.2014.
- Биофунгицид Псевдобактерин – 2 [Электронный ресурс]. – Режим доступа: http://www.biotechagro.ru/products/pseudobacterin.php (20.07.2017).
- Маслиенко, Л.В. Вермикулен – перспективный микробиопрепарат полифункционального типа действия для защиты подсолнечника и других сельскохозяйственных культур от болезней / Л.В. Маслиенко // Масличные культуры. Научно-технический бюллетень ВНИИМК. – 2009. – № 2 (141). – С. 40-50.
- Пат. 02219702, Россия, МПК 7A23L 7 A, Способ обработки растениеводческой продукции перед закладкой на хранение [Текст]/ Квасенков О.И, заявитель и патентообладатель Всероссийский научно-исследовательский институт биологической защиты растений — № 2002117477/13; заявл. 02.07.2002; опубл. 27.12.2003.
- Чеботарь, В.К. Эффективность применения биопрепарата Экстрасол / В.К. Чеботарь, А.А. Завалин, Е.Н. Кипрушкина – М.: Издательство ВНИИА, 2007. – 216 с.
- Неменущая, Л.А. Современные технологии хранения и переработки плодоовощной продукции / Л.А. Неменущая, Н.М. Степанищева, Д.М. Соломатин. -М.: ФГНУ «Росинформагротех», 2009. — 172 с.
- Пат. 2525722 Россия, МПК A01F25/00, A23B7/152. Способ хранения сельскохозяйственной продукции [Текст] / Ханикян В.Л.; заявитель и патентообладатель Общество с ограниченной ответственностью «АлХиТех» (ООО «АлХиТех») — № 2013108726/13; заявл. 28.02.2013; опубл. 20.08.2014.
- Пат. CN100337552, Китай, МПК A23B 7/154, Способ консервирования и хранения плодов мушмулы [Текст] / Cai Chong, Chen Kunsong, заявитель и патентообладатель Zhejiang Univ. — № 200510050200.9; заявл. 22.06.2005; опубл. 21.12.2005.
- Пат. 2325810, Россия, МПК А23В 7/152, Способ хранения урожая плодоовощной и растениеводческой продукции [Текст] / Швец В.Ф., Гудковский В.А., Козловский Р.А., Кустов А.В., заявитель и патентообладатель Общество с ограниченной ответственностью «Фито-Маг» — №2006123022/13; заявл. 28.06.2006; опубл. 10.06.2008.
- Лисовой, В.В. Технологии хранения сельскохозяйственной продукции растительного происхождения, разработанные учеными ФГБНУ КНИИХП / В.В. Лисовой, Е.П. Викторова, А.Н. Матвиенко // Сборник научных трудов к 85-летию ВНИХИ. — Москва, 2015. — С. 302 — 305.
- Першакова, Т.В. Анализ способов обеспечения качества растительной продукции в процессе хранения / Т.В. Першакова, В.В. Лисовой, Г.А. Купин, В.Н. Алешин // Труды XIII международной научно-практической конференции «Пища. Экология. Качество». Красноярск, 2016. -С. 38 — 42.
- Першакова, Т.В. Способы обеспечения стабильного качества растительного сырья в процессе хранения с применением биопрепаратов / Т. В. Першакова, В.В. Лисовой, Г.А. Купин, Е.Ю. Панасенко, Е.П. Викторова // Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета (Научный журнал КубГАУ) [Электронный ресурс]. — 2016. — № 03 (117) — URL: http://ej.kubagro.ru/2016/03/pd f/33.pdf – дата обращения 12.09.2019.
- Пат. RU 2434382, Россия, МПК A01N 43/50 B27K 3/52 A01N 59/16 A01P 3/00 Комбинации имазалила и соединений серебра [Текст]/ ТИС А.П.М., Босселарсян П.Х., Билеманс Д.Л.Ж., заявитель и патентообладатель ЯНССЕН ФАРМАЦЕВТИКА Н.В. — № 2008139617/05; заявл. 20.04.2010; опубл. 27.11.2011.
- Пат. CN104798874, Китай, МПК A23B 7/153 A23B 7/157 A23B 7/04, Способ консервирования яблок [Текст]/ Rao Jingping, Ma Lihong, Zhao Yanhu,a Han Shoukun, заявитель и патентообладатель Northwest A&F University Shaanxi Huasheng (Group) Corp. — № 201510170176.6; заявл. 13.04.2015; опубл. 29.07.2015.
- Рекомендации по применению. Микробиологические препараты живых ризосфетных бактерий комплексного действия группы Экстрасол. ГНУ ВНИИ Россельхозакадемии, ООО « Бисолби Поволжье».
- Пат. 2322017, Россия, МПК A01F25/00, Способ подготовки к хранению яблок свежих специального назначения [Текст]/ Квасенков О.И., заявитель и патентообладатель Квасенков О.И. — № 2006132533/12; заявл. 12.09.2006; опубл. 20.04.2008.
- Лабинская, А.С. Общая и санитарная микробиология с техникой микробиологического исследования / А.С. Лабинская, Л.П. Ещина. — М.: Медицина, 2004. — с. 34-37.
- Bressuire-Isoard, C. Sporulation environment influences spore properties in Bacillus: evidence and insights on underlying molecular and physiological mechanisms / C. Bressuire-Isoard, V. Broussolle, F. Carlin . — FEMS Microbiology Reviews, Volume 42, Issue 5, 2018, p. 614–626.
- Keller, D. Bacillus coagulans as a probiotic [Text] / D. Keller, S. Farmer, A. McCartney, G. Gibson // Food Science and Technology Bulletin: Functional Foods. — 2010.- Vol. 7, N 7. — p. 103-109.
- Современная пищевая микробиология / Дж. М. Джей, М. Дж. Лёсснер, Д.А. Гольден. — пер. 7-го англ. изд. — 2-е изд. (эл.). — М.: БИНОМ. Лаборатория знаний, 2014. — с. 886.
- Su, F. Genomic analysis of thermophilic Bacillus coagulansstrains: efficient producers for platform biochemicals / F. Su,P. Xu. -Sci. Rep. 4, 3926; DOI:10.1038. — srep03926, 2014.
- Госманов, Р.Г. Санитарная микробиология [Электронный ресурс]: учебное пособие / Р.Г. Госманов, А.Х. Волков, А.К. Галиуллин, А.И. Ибрагимова.- Электрон. дан. — Санкт-Петербург: Лань, 2018. — с. 252 — Режим доступа: https://e.lanbook.com/book/103139– дата обращения 12.09.2019.
- Леонтьев, В.Н. Порча пищевых продуктов: виды, причины и способы предотвращения / В.Н. Леонтьев, Х.М. Элькаиб, А.Э. Эльхедми // Труды БГУ. — Т. 8, ч. 1. — 2013. — с. 125-130.
- Asha Poorna, C. Production of cellulase-free endoxylanase from novel alkalophilic thermotolerent Bacillus pumilus by solid-state fermentation and its application in wastepaper recycling / С. Asha Poorna, Р. Prema // Bioresource Technology — 2006. — Vol. 98, issue 3. — P. 485– 490.
- Purification and characterization of an extracellular alkaline serine protease with dehairing function from Bacillus pumilus / Q. Huang, Y. Peng, X. Li [et al.] // Current Microbiology. — 2003. — Vol. 46, issue 3. — P. 169 –173.
- Zang, H. A novel thermostable GH5_7 β-mannanase from Bacillus pumilus GBSW19 and its application in manno-oligosaccharides (MOS) production / H. Zang, S. Xie, H. Wu // Enzyme and Microbial Technology. — 2015. — Vol. 78. — P. 1-9.
- Balasubramanian, N. Bacillus pumilus S124A carboxymethyl cellulase; a thermo stable enzyme with a wide substrate spectrum utility / N. Balasubramanian, N. Simões // International Journal of Biological Macromolecules. — 2014. — Vol. 67. — P. 132–139.
- Efficient secretory production of CotA-laccase and its application in the decolorization and detoxification of industrial textile wastewater / Z.-B. Guan, Y. Shui, C. M. Song [et al.] // Environmental Science and Pollution Research. — Vol. 22, issue 12. — P. 9515–9523.
- Aunpad, R. Pumilicin 4, a novel bacteriocin with anti-MRSA and anti-VRE activity produced by newly isolated bacteria Bacillus pumilus strain WAPB4 / R. Aunpad, K. Na-Bangchang // Current Microbiology. — 2007. — Vol. 55, issue 4. — P. 308–313.
- The plant-growth-promoting rhizobacteria Bacillus pumilus and Bacillus licheniformis produce high amounts of physiologically active gibberellins / F. J. Gutiérrez-Mañero, B. Ramos-Solano, A. Probanza [et al.] // Physiologia Plantarum — 2001. — Vol. 111, issue 2. — P. 206 –211.
- Antibacterial metabolites and bacteriolytic enzymes produced by Bacillus pumilus during bacteriolysis of Arthrobacter citreus / C. Brack, A. Mikolasch, R. Schlueter [et al.] // Marine Biotechnology. — 2015. — Vol. 17, issue 3. — P. 290–304.
- Bentur, H. N. Central venous catheter infection with Bacillus pumilus in an immunocompetent child: a case report / H. N. Bentur, A. Dalzell, F. A. I. Riordan // Annals of Clinical Microbiology and Antimicrobials. — 2007. — Vol. 6. — P. 12.
- From, C. Food poisoning associated with pumilacidin-producing Bacillus pumilus in rice / C. From, V. Hormazabal, P. E. Granum // International Journal of Food Microbiology. — 2007. — Vol. 115, issue 3. — P. 319–324.
- Two cases of severe sepsis caused by Bacillus pumilus in neonatal infants / M. Kimouli, G. Vrioni, M. Papadopoulou [et al.] // International Journal of Medical Microbiology. — 2012. — Vol. 61. — P. 596 –599.
- Genome sequence of Bacillus pumilus strain bonn, isolated from an anthrax-like necrotic skin infection site of a child / G. Grass, G. Bierbaum, E. Molitor [et al.] // Genome Announcements. — 2016. — Vol. 4, issue 1. P. 1715-1741.
- Galal, A. A. Bacillus pumilus, a new pathogen on Mango plants / A. A. Galal, A. El-Bana, J. Janse // Egyptian Journal of Phytopathology. — 2006. — Vol. 34, № 1. — P. 17–29.
- Bathily, H. Bacillus pumilus a new pathogen on potato tubers in storage in Mali / H. Bathily, A. H. Babana, F. Samaké // African Journal of Microbiology Research. — 2010. — Vol. 4, issue 20. — P. 2067–2071.
- Kotan, R. Identification and pathogenicity of bacteria isolated from pome fruit trees in the Eastern Anatolia region of Turkey / R. Kotan, F. Sahin, A. Ala // Journal of Plant Diseases and Protection. — 2006. — Vol. 113, № 1. — P. 8–13.
- Евдокимова, О. В. Биохимическая и молекулярно-генетическая характеристика бактерий Bacillus pumilus, изолированных на территории Беларуси / О. В. Евдокимова, В. Е. Мямин, Л. Н. Валентович // Журнал Белорусского государственного университета. Биология. — 2018. — № 1. — С. 38–49.
- Gabr, M. R. Gabbage head rot due to sporeforming bacteria [Bacillus polymyxa and Bacillus pumilus; Egypt] / M. R. Gabr, A. A. Gazar // Annals of Agricultural Sciences. — 2012. — Vol. 28. — P. 1163–1185.
- Saleh, O.I. Bacillus pumilus, the cause of bacterial blotch of immature balady peach in Egypt / O. I. Saleh, P.-Y. Huang, J.-S. Huang // Journal of Phytopathology. — 1997. — Vol. 145. — P. 447– 453.
- Гигиеническая оценка контаминации муки возбудителями картофельной болезни / О. В. Пельц, Е. Я. Долгушина, Н. Н. Аксенова [и др.] // Медицина в Кузбассе, спецвыпуск. – 2003. — № 5. — С.74–75.
- Мирзоева, В.А. Бактерия группы сенной и картофельной палочек. – М.: Изд-во АН СССР, 1959. – 176 с.
- Асколонов, С.П. Пищевые заболевания, вызываемые спорообразующими бактериями Bacillus subtilis и Bacillus mesentericus. В кн.: Вопросы питания / С.П. Асколонов, А.И. Ильченко. – Киев: Госмедиздат УССР. – 1962. – С.226-229.
- Омельченко, В.Д. Зерна, поврежденные и испорченные микроорганизмами и самосогреванием как критерий санитарно-гигиенического состояния пшеницы и кукурузы / В.Д. Омельченко — Автореф. дисс. канд. техн. наук. — М., 1991. – 19 с.
- Пельц, О.В. Гигиеническая оценка контаминации муки возбудителями картофельной болезни / Пельц О.В., Долгушина Е.Я., Аксенова Н.Н., Ковалева Л.М., Костюкова Е.В. //Медицина в Кузбассе, спецвыпуск. – 2003, №5. – С.74-75.
- Витавская, А.В. Биологическая защита хлеба от картофельной болезни хлеба / А.В. Витавская, Г.Н. Дудикова, К.А. Тулемисова. – Алматы, 1998. – С. 432.
- Пучкова, Л.И. Технология хлеба / Л.И. Пучкова, Р.Д. Поландова, И.В. Матвеева – СПб.: ГИОРД, – 2005.
- Медведев, П.В. Оценка уровня зараженности зерна пшеницы различных природно-географических зон Оренбургской области возбудителями картофельной болезни хлеба / Медведев П.В., Степанов А.С., Федотов В.А. // Вестник ОГУ, № 2 (108) – Оренбург, 2010. – С. 114-118.
- Динчева, Е.Н. Микробиологическое изучение мясного фарша / Е.Н. Динчева //Науч. тр. Высш. ветеринарно-мед. ин-та. – 1970. – Т.22. – С.139-146.
- Затула, Д.Г. Влияние метаболитов споровых сапрофитных бактерий на организм человека и животных /Затула Д.Г., Резник С.Р. – Киев: Изд. «Наукова Думка», 1973. – С.75-98.
- Феоктистова, Н.А. Бактерии вида Bacillus mesentericus – возбудители пищевых отравлений / Феоктистова Н.А., Васильев Д.А., Юдина М.А. // Материалы III Международной научно-практической конференции молодых ученых «Молодежь и наука ХХI века» 23-26 ноября 2010 года. – Ульяновск, 2010. – Т.3. – С.82-85.
- Смирнов, В.В. Спорообразующие аэробные бактерии – продуценты биологически активных веществ / В.В. Смирнов, С.Р. Резник, И.А. Василевская. – Киев: Наукова Думка, 1982. – С.117-120.
- Жвирблянская, А.Ю. Микробиология в пищевой промышленности / Ю.А. Жвирблянская, О.А. Бакушинская. – М.: Пищевая промышленность, 1966. – С. 134.
- Золотухин, С.Н. Смешанная кишечная инфекция телят и поросят, вызываемая патогенными энтеробактериями / С.Н. Золотухин, Л.С. Каврук, Д.А. Васильев. – Ульяновск: Копиринг, 2005. − С.20–25.
- Погодаева, А.Я. Микрофлора, вызывающая порчу консервированных компотов и фруктово-ягодных соков из местного сырья / А.Я. Погодаева, Ч.Я. Овруцкая // Физиология и биохимия микробов. − Минск. Наука и техника, 1970. − С.116–120.
- Бурлаченко, И.В. Теоретические и прикладные аспекты повышения резистентности осетровых рыб в аквакультуре: дисс. док. биол. наук: 03.00.10. — Москва, 2007. – 319с. РГБ ОД, 71:07 – 3/190.
- Пивоваров, Ю.А. Распространение Bacillus cereus во внешней среде / Ю.А. Пивоваров, Р.С. Волкова, В.В. Шелакова // Актуальные вопросы гигиены. − Москва, 1970. − С.98–103.
- Петрова, Л.Н. Дифференциране на культури от род Bacillus изолирани от местних полуконсервов. // Ветеринарно-мед. науки. – 1975. – № 8. – 12 с.
- Ehrenberg, C.G. Physikalische Abhandlungen der Koeniglichen Akademie der Wissenschaften zu Berlin aus den Jahren 1833-1835 / C.G. Ehrenberg, 1835. — p. 145-336.
- Global food losses and food waste: extent, causes and prevention / J. Gustavsson [et al.]. — Rome : FAO, 2011. — p. 38.
- Timoney, J.F. Heavymetal and antibiotic resistance in the bacterial flora of Microbiol / J.F. Timoney, J. Port, J. Cites, J. Spanier, 1978. — 36. -N 3. — p. 465-472.
- Белова, К.В. Выделение бактерий рода Bacillus из объектов санитарного надзора / К.В. Белова, Н.А. Феоктистова // Актуальные проблемы инфекционной патологии и биотехнологии. Материалы VII-й Международной студенческой научной конференции. — том 1. — Ульяновск, 2015. — с. 21.
- Белова, К.В. Изучение тинкториальных свойств бактерий рода Bacillus, выделенных из объектов санитарного надзора / К.В. Белова, Н.А. Феоктистова // Актуальные проблемы инфекционной патологии и биотехнологии. Материалы VII-й Международной студенческой научной конференции. — том 1. — Ульяновск, 2015. — с. 21.
- Dancer, B.N. Production and possible function of serine protease during sporulation of Bacillus subtilis / B.N. Dancer, J.Mandelstam. — J. Bacterid, 1975. — 121. — N 2. -p. 406-410.
- Foster, T.L. Anaerobic utilization of phosphite and hypophosphite by Bacillus sp. / T.L. Foster, J. Winans, S.J. Helms. — Appl. and Environ. Microbiol., 1978. — 35. N 5. -p. 937-944.
- Clark, R. Speculations on the incidence of anthrax in bovines / R. Clark // J.S. Afr. vet. med. Assoc. − 1938. − V.9. − P.5–12.
- Мишустин, Е.Н. Почвенные типы и их микробное население / Е.Н. Мишустин // Известия Тимирязевской сельскохозяйственной академии. − 1974. − № 4. − С. 73–86.
- Сбойчаков, В.Б. Санитарная микробиология / В.Б. Сбойчаков. − М.: Изд. группа «ГЭОТАР-Медиа», 2007. − С. 98.
- Африкян, Э.К. Энтомопатогенные бактерии и их значение / Э.К. Африкян. − Ереван: Изд-во АН АрмССР, 1973. – С.418.
- Ammini, P. Biochemical and molecular characterization of Bacillus pumilus isolated from coastal environment in Cochin, India // Р. Ammini, К. Kiran, J. Jiya, J. Neetha, N. Santha // Braz. J. Microbiol. − 2009. − № 40 – Р.269–275.
- Koltukova, N.V. Various physico-chemical properties of the amylolytic complex from Bacillus mesentericus / N.V. Koltukova, А.А. Bondarchuk, Е.А. Kovalenko, E.I. Get’man // Prikl. Biokhim. Mikrobiol. − 1990. − № 26. − Р. 50.
- Denis, F. Les Bacillus de s milieu marin: Etude de 120 souches / F.Denis // C.R.Soc.biol. − 1971. − № 12. − P. 2404–2408
- Durand, M. Nutrition carbonee et etude taxonomique de Bacillus subtilis et. B. licheniformis / M. Durand // Can. J. Microbiol. − 1979. − V.24. − P.491–498.
- Феоктистова, Н.А., Васильев Д.А. Перспективы применения бациллярных фагов на пищевых и перерабатывающих производствах // Экологическая, продовольственная и медицинская безопасность человечества: материалы первого международного конгресса. − Москва, РЭА им. Плеханова, 2011. − С.123–126.
- Stoeva, S. Modification of a zinc proteinase from Bacillus mesentericus strain 76 by diethylpyrocarbonate / S. Stoeva // Int. J. Pept. Protein. Res. − 1991. − № 37. − Р.325.
- Никитина, Е.В. Микробиология: учебник / Е.В. Никитина, С.Н. Киямова, О.А. Решетник. — СПб.: ГИОРД, 2011.
- Mastroeni, P. Immunoelectrophoretic analysis of surface antigens in vegetative cells and spores of Bacillus cereus / P. Mastroeni // G. bacteriol. virol. et immunol, 1974. — V.67. — p. 180-184.
- Вербина, Н.М. Микробиология пищевых производств / Н.М. Вербина, Ю.В. Каптерева. — М.: Агропромиздат, 1988. — с. 256.
- Шахбанов, А.А. Образование спор у Вас. subtilis и изучение их ультраструктуры / А.А. Шахбанов. — Тр. ВНИИ вет. санитарии, 1970. — с. 9-11.
- Boeye, A. Numerical taxonomy of Bacillus isolates from North Sea sediments / A. Boeya // Int. J. Syst. Bacteriol, 1976. — V.26. — p. 427-441.
- Медицинская микробиология, вирусология и иммунология / Под ред. А.А. Воробьева. — 2-е изд., испр. и доп. — М.: ООО «Медицинское информационное агенство», 2008. — с. 704.
- LeMarrec, C. Biochemical and genetic characterization of coagulin, a new antilisterial bacteriocin in the pediocin family of bacteriocins, produced by Bacillus coagulans I4 / C. LeMarrec, B. Hyronimus, P. Bressollier, B. Verneuil, and M.C. Urdaci. 2000. — Appl. Environ. Microbiol. 66:5213-5220.
- Ротмистров, М.Н. Изменчивость Вас. mesentericus/ М.Н. Ротмистров, А.А. Рой, И.А.Василевская. — Микробиология, 1973. — № 5. — с. 882-887.
- Белова, К.В. Характеристика биологических свойств бактерий Bacillus coagulans / К.В. Белова, Н.А. Феоктистова // Актуальные проблемы инфекционной патологии и биотехнологии. Материалы VII-й Международной студенческой научной конференции. — том 2. — Ульяновск, 2015. — с.197.
- Мазохина-Поршнякова, Н.Н. Анализ и оценка качества консервов по микробиологическим показателям / Н.Н. Мазохина-Поршнякова. — М.: Пищевая промышленность, 1977. — с. 471.
- Мюллер, Г.М. Микробиология пищевых продуктов растительного происхождения. Пер с нем. / Г.М. Мюллер, П. Литц, Г. Мюнх. — М.: Пищевая промышленность, 1977. — с. 300.
- Keller, D. Bacillus coagulans as a probiotic [Text] / D. Keller, S. Farmer, A. McCartney, G. Gibson // Food Science and Technology Bulletin: Functional Foods. — 2010.- Vol. 7, N 7. — p. 103-109.
- LeMarrec, C. Biochemical and genetic characterization of coagulin, a new antilisterial bacteriocin in the pediocin family of bacteriocins, produced by Bacillus coagulans I4 / C. LeMarrec, B. Hyronimus, P. Bressollier, B. Verneuil, and M.C. Urdaci. 2000. — Appl. Environ. Microbiol. 66:5213-5220.
- Sulakvelidze, A. Bacteriophage therapy (minireview) / А. Sulakvelidze, Z. Alavidze, J.G. Morris // Antimicrob Agents Chemother. — 2001. — V. 45. — № 3. — р. 649-659.
- Тимофеева, А.Г. Азотное и углеродное питание почвенных спорообразующих бактерий / А.Г. Тимофеева // Тр. Ин-та микробиол. АН СССР. М., 1954. — вып. 3. — с. 98-107.
- Мазохина-Поршнякова, Н.Н. Анализ и оценка качества консервов по микробиологическим показателям / Н.Н. Мазохина-Поршнякова. — М.: Пищевая промышленность, 1977. — с. 471.
- Смирнов, В.В. Некоторые аспекты взаимодействия споровых аэробных бактерий с макроорганизмом / В.В. Смирнов, С.Р. Резник. — Микробиол. журн., 1980. — № 1. — с. 3-10.
- Омельченко, В.Д. Зерна, поврежденные и испорченные микроорганизмами и самосогреванием как критерий санитарно-гигиенического состояния пшеницы и кукурузы: автореф. дис. …канд. техн. наук: 03.00.04 / Омельченко Виктор Данилович. − М., 1992. − С. 19.
- Mc Clou, E.W. Studies on a lysogenic Bacillus strain. A bacteriophage specific for Bacillus antracis /E.W. Mc Clou //J.Hyg. Camb. − 1951. − V.49. − P.114–125.
- Mercier, P. Bacteriologie du sperme frais de larin: Etude preliminaire / P. Mercier // Prod. аnim. − 1990. − №3. − Р.215–221.
- Пучкова, Л.И. Технология хлеба / Л.И. Пучкова, Р.Д. Поландова, И.В. Матвеева. − СПб. ГИОРД, 2005. – С.65.
- Seo, G. A new factor from Bacillus mesentericus which promotes the growth of Bifidobacterium / G. Seo, Y. Akimoto, H. Hamashima, K. Masuda, K. Shiojima, C. Sakuma, M. Sasatsu, T. Arai // Microbios. − 2000. − № 101. − Р.105.
- Stoeva, S. Proteolytic specificity of the neutral zinc proteinase from Bacillus mesentericus strain 76 determined by digestion of an alpha-globin chain / S. Stoeva, T. Kleinschmidt // Biol. Chem. Hoppe. Seyler. − 1989. − № 10. − Р. 1139–1143.
- Suttle, C.A. Use jf uitrafiltration to isolate viruse from seawater which are pathogens of marine phytoplankton / C.A. Suttle, A. M. Chan // Appl. Environ Microbiol. – 1991. – Р.721–726.
- Коломникова, Я.П. Технологические приемы по предупреждению заболеваний хлебобулочных изделий / Я. П. Коломникова // Хлебопродукты. − 2009. − № 3. − С.51–53.
- Скокан, Л.Е. Микробиология основных видов сырья и полуфабрикатов в производстве кондитерских изделий / Скокан Л.Е., Жарикова Г.Г. − М.: ДеЛи Принт, 2006. − С.89-94.
- Malkov, S.V. Capacity of Bacillus mesentericus for certain kinds of genetic exchange / S.V. Malkov, A.A. Prozorov // Genetika. − 1983. − № 19. − Р. 1091.
- Miller, J. An Antibiotic from Bacillus mesentericus / J. Miller, D. Rowley // Br. J. Exp. Pathol. − 1948. – V.5. − Р.452–457.
- Tetart, F. Phylogeny of the major head tail genes of the wide-ranging / F Tetart, C. Desplats, M. Kutateladze et al // J. Bacteriol. − 2001. – Р.358–366.
- Раднаева, Р.Б. Разработка бактериального концентрата на основе пробиотических микроорганизмов для хлебопекарного производства: автореф. дис. …канд. биол. наук: 05.18.04 / Раднаева Раджана Баирована. − Улан-Удэ, 2008. − С. 6–7.
- Юсупова, Г.Г. Обеспечение микробиологической безопасности зерновых культур в технологиях производства муки и хлебобулочных изделий: автореф. дис. …докт. с/х. наук: 05.18.01/ Юсупова Галина Георгиевна. − Красноярск, 2010. — С. 19.
- Медведев, П.В. Оценка уровня зараженности зерна пшеницы различных природно-географических зон Оренбургской области возбудителями картофельной болезни хлеба / П.В. Медведев, А.С. Степанов, В.А. Федотов // Вестник Оренбурского государственного универсистета. − 2010. − № 2 (108). − С. 114–118.
- Крючков, А.Г. Основные принципы и методология агроэкологического районирования зерновых культур в степи Южного Урала / А.Г. Крючков // Вестник Российской академии сельскохозяйственных наук. − 2006. − С. 704.
- Курилова, А.А. Питательная среда (жидкая) для культивирования сибиреязвенного микроба и близкородственных сапрофитов / А.А. Курилова, Л.С. Катунина, О.В. Малецкая, О.Л. [и др.] // Патент РФ 2288950.
- Егоров, Н.С. Условия спорообразования у некоторых термофильных бацилл / Н.С. Егоров, Ж.К. Лория, С.Н. Выборных. — Науч. докл. высш. школы. Биол. науки, 1979. — № 9. — с. 77-81.
- Асеева, И.В. Строение и химический состав бактериальной клетки / И.В. Асеева. // В кн.: Жизнь растений. М.: Просвещение, 1973. — т. 1. — с. 186-190.
- Феоктистова, Н.А. Выделение и идентификация бактерий Bacillus cereus/ Н.А. Феоктистова, Д.А. Васильев, К.В. Маслюкова, Е.А. Ляшенко, А.И. Калдыркаев, С.Н. Золотухин, Н.И. Молофеева, Е.В. Сульдина // Естественные и технические науки. — 2018. — № 7 (121). — с. 28-33.
- Мюллер, Г.М. Микробиология пищевых продуктов растительного происхождения. Пер с нем. / Г.М. Мюллер, П. Литц, Г. Мюнх. — М.: Пищевая промышленность, 1977. — с. 300.
- Шахбанов, А.А. Образование спор у Вас. subtilis и изучение их ультраструктуры / А.А. Шахбанов. — Тр. ВНИИ вет. санитарии, 1970. — с. 9-11.
- Boeye, A. Numerical taxonomy of Bacillus isolates from North Sea sediments / A. Boeya // Int. J. Syst. Bacteriol, 1976. — V.26. — p. 427-441.
- Смирнов, В.В. Спорообразующие аэробные бактерии – продуценты биологически активных веществ / В.В. Смирнов, С.Р. Резник, И.А. Василевская. — Киев: Наукова Думка, 1982. — с. 117-120.
- Bergey’s Manual of Determinative Bacteriology / Bergey’s. — 8th ed. — Baltimore: Wiliams and Wrtkir VT Co, 1974.
- Сорокулова, И.Б. О пигментах, продуцируемых Вас. subtilisvar. niger 16к. / И.Б.Сорокулова, С.Р. Резник. — Приклад, биохимия и микробиология, 1979. — № 2. — с. 314-317.
- Bond, W.W. Termal profile of a Bacillus species (ATCC 27380) extremely resistant to dry heat / W.W. Bond, M.S. Favero. — Appl. Microbiol., 1975. — 29.-N 6. — p. 859-860.
- Клевакин, В. М. Санитарная микробиология пищевых продуктов / В.М. Клевакин, В.В. Карцев. — Л.: Медицина, 1986. — с. 34-45.
- Gordon, R. The genus Bacillus / R. Gordon // In Handb. Microbiol. Cleveland (Ohio), 1973. — V. 1. — p. 71-88.
- Красильников, Н.А. Микроорганизмы почвы и высшие растения / Издательство: АН СССР, 1958. — с. 466.
- Белова, К.В. Характеристика биологических свойств бактерий Bacillus coagulans / К.В. Белова, Н.А. Феоктистова // Актуальные проблемы инфекционной патологии и биотехнологии. Материалы VII-й Международной студенческой научной конференции. — том 2. — Ульяновск, 2015. — с.197.
- Gould, G.W. Germination of bacterial endospores and the development of new vegetative forms / G.W. Gould. — Biochem. Soc. Trans., 1973. — N 5. — p. 1023-1024.
- Ашмарин, И.П. Статистические методы в микробиологических исследованиях / И.П. Ашмарин, А.А. Воробьев. — М.: Медгиз, 1962. — с. 180.
- Ситник, И.О. Микробиология, вирусология, иммунология / И.О. Ситник, С.И. Климнюк, М.С. Творко. − Тернополь: Укрмедкнига, 1998. − С.354–358, 360–363.
- Оливери, С.А. Опыт применения РНФ в лабораторной диагностике кишечных инфекций / С.А. Оливери, М.А. Коростелева, Н.Г. Кострицкий // Кишечные инфекции, главным образом, дизентерия: материалы итоговой научно-практической конференции. − Киев, 1962. − C. 20–21.
- Isolation of Highly Selective Phage-Displayed Oligopeptide Probes for Detection of Listeria monocytogenes in Ready-to-eat Food / Chen, IH Xi, JG, Liu, YZ Du, ST, Horikawa, S, Huang, TS, Chin, BA, Suh, SJ // Conference on Sensing for Agriculture and Food Quality and Safety X, Orlando, FL, APR 17-18, 2018
- Longitudinal monitoring of Listeria monocytogenes and Listeriaphages in seafood processing environments in Thailand Author links open overlay panel Kitiya Vongkamjana Soottawat BenjakulaHue ThiKim VuabVarapornVuddhakulc Food Microbiology Volume 66. – 2017. — P. 11-19
- Listeria Solution. PhageGuard.
- Food Safety. Intralytix, Inc.
- 2017. Listeria (Listeriosis). Centers for Disease Control and Prevention. Centers for Disease Control and Prevention.
- Granier SA, Moubareck C, Colaneri C, Lemire A, Roussel S, Dao T-T, Courvalin P, Brisabois A. 2011. Antimicrobial resistance of Listeria monocytogenes isolates from food and the environment in France over a 10-Year period. Applied and Environmental Microbiology 77:2788–2790.
- Jones JB, Vallad GE, Iriarte FB, Obradović A, Wernsing MH, Jackson LE, Balogh B, Hong JC, Momol M. 2012. Considerations for using bacteriophages for plant disease control. Bacteriophage 2:208-214.
- Żaczek M, Weber-Dąbrowska B, Górski A. 2014. Phages in the global fruit and vegetable industry. Journal of Applied Microbiology 118:537–556.
- Center for Drug Evaluation and Research. Development & Approval Process (Drugs). U S Food and Drug Administration Home Page. Center for Biologics Evaluation and Research.
- Silk route to the acceptance and re-implementation of bacteriophage therap// Biotechnology Journal — 2016. – vol. 11. – P. 595–600.
- Birk T. C. Bacteriophage Isolation From Wastewater for Bacteria Pathogenic to Humans : дис. – 2018.
- Hyman P. Phages for Phage Therapy: Isolation, Characterization, and Host Range Breadth //Pharmaceuticals. – 2019. – Т. 12. – №. 1. – С. 35.
- Production of Bacteriophages by Listeria Cells Entrapped in Organic Polymers / B. Roy, C. Philippe, M.J. Loessner, J. Goulet, S. Moineau// Viruses. – 2018. – 10. – p. 324.
- Sword C. P., Pickett M. J. The isolation and characterization of bacteriophages from Listeria monocytogenes //Microbiology. – 1961. – Т. 25. – №. 2. – С. 241-248.
- Bacteriophage typing of Listeria species /Loessner M. J., Busse M. //Appl. Environ. Microbiol. – 1990. – Т. 56. – №. 6. – С. 1912-1918.
- Gray M.L. Killinger. Listeria monocytogenes and listeric infections. Bact Rev 1966; 30:309-82.
- Applicability of commercial phage-based products against Listeria monocytogenes for improvement of food safety in Spanish dry-cured ham and food contact surfaces /Gutiérrez D, Rodríguez-Rubio L, Fernández L, Martínez B, Rodríguez A, García P //Food Control. — 2017. – vol. 73. — P.1474–1482
- Antimicrobial behavior of phage endolysin PlyP100 and its synergy with nisin to control Listeria monocytogenes in Queso Fresco / L.A. Ibarra-Sánchez, M.L. Van Tassell, M.J. Miller// — Food microbiology, — Volume 72, — 2018. — P. 128-134
- Incorporating Phage Therapy into WPI Dip Coatings for Applications on Fresh Whole and Cut Fruit and Vegetable Surfaces /E. L. Vonasek , A. H. Choi , J. S. Jr, N. Nitin/ Food Science. — Volume 83.- Issue7. 2018, P.1871-1879
- Abedon, S.T. Phage therapy of pulmonary infections. Bacteriophage 2015, 5, e1020260.
- Radford D, Guild B, Strange P, Ahmed R, Lim LT, Balamurugan S. 2017. Characterization of antimicrobial properties of Salmonella phage Felix O1 and Listeria phage A511 embedded in xanthan coatings on Poly(lactic acid) films. Food Microbiol. 66: 117-128
- Feoktistova, N.A. Biological properties of anthrax bacteriophage / N.A. Feoktistova, D.A. Vasilyev, D.I. Klymushkin, S.N. Zolotukhin, А.L. Toigildin, I.А.Toigildinа, K.V. Belova // Asian Journal of Microbiology, Biotechnology & Environmental Sciences Paper. Vol 20, Issue 1, 2018. — p. 337-340.
- Садеева, Н.Т. Выделение фагов бактерий вида Bacillus cereus / Н.Т. Садеева, Н.А. Феоктистова, М.А. Юдина и др. // В сборнике: Актуальные проблемы инфекционной патологии и биотехнологии: материалы V-й Всероссийской (с международным участием) студенческой научной конференции.- Ульяновск: ГСХА, 2012. — с. 14-17.
- Феоктистова, Н.А. Перспективы применения бактериофагов рода Bacillus/ Н.А. Феоктистова, Д.А. Васильев, М.А. Юдина [и др.] // В сборнике: Настоящее и будущее биотехнологии в решении проблем экологии, медицины, сельского, лесного хозяйства и промышленности Научно-практический семинар с международным участием. — Ульяновск: УлГУ, 2011. — с. 136-139.
- Ревенко, И.П. Бактериофаги и их использование в ветеринарной практике/ И.П. Ревенко. — Киев: Урожай, 1978. — с. 41-88.
- Алешкин, А.В. Бактериофаги как пробиотики и средства деконтаминации пищевых продуктов / А.В. Алешкин, Н.В. Воложанцев, Э.А. Светоч [и др.] // Астраханский мед. журнал. — 2012. — №3 (7). — с. 31-39.
- Katzheson, H. Rapid phage plague count method for the detection of bacteria as applied to the demonsration of internalug borne bacterial infections of seed H. / Katzheson // J. Bact. — 1951. — №1. — p. 689.
- Смирнов, В.В. Методические рекомендации по выделению и идентификации бактерий рода Bacillus из организма человека и животных / В.В. Смирнов, С.Р. Резник, И.Б. Сорокулова. — Киев: Наукова думка, 1983. — с. 51.
- Алешкин, А.В. Лекции по исследованию и применению бактериофагов / А.В. Алешкин. — Ульяновск, УГСХА, 2016. — с.112.
- Beveridge, T.J. Uptake and retention of metals by cell walls of Bacillus subtilis/ T.J. Beveridge, R.G. Murray. — J. Bacteriol., 1976. — 127. -N 3. — p. 1502-1518.
- Русалеев, В.С. Фагочувствительность аэробных спорообразующих бактерий / В.С. Русалеев // Ветеринария. — 1990. — №8. — с. 29-30.
- Золотухин, С.Н. Создание и разработка схем применения диагностических биопрепаратов на основе выделенных и изученных бактериофагов энтеробактерий / С.Н. Золотухин. — Ульяновск, 2007. — с. 32.
- Алешкин, А.В. Инновационные направления использования бактериофагов в сфере санитарно-эпидемиологического благополучия населения Российской Федерации / А.В. Алешкин, Э.А. Светоч, Н.В. Воложанцев [и др.] // Бактериология.- 2016. — Том 1. — №1. — с. 22-31.
- Калдыркаев, А.И. Выделение бактериофагов вида Bacillus cereus / А.И. Калдыркаев, Н.А. Феоктистова, Г.Ф. Архипова // Актуальные проблемы инфекционной патологии ветеринарной медицины: материалы конференции молодых ученных. — Покров, 2009. — с.154-157.
- Ротмистров, М.Н. Изменчивость Вас. mesentericus/ М.Н. Ротмистров, А.А. Рой, И.А.Василевская. — Микробиология, 1973. — № 5. — с. 882-887.
- Львов, А. Природа размножения фага / А Львов. − М.: Мир,1956. − С.187.
- Гольдфарб, Д.М. Бактериофагия / Д.М. Гольдфарб. — М.: Медгиз, 1961. — с. 169-187.
- Современная пищевая микробиология / Дж. М. Джей, М. Дж. Лёсснер, Д.А. Гольден. — пер. 7-го англ. изд. — 2-е изд. (эл.). — М.: БИНОМ. Лаборатория знаний, 2014. — с. 886.
- Золотухин, С.Н. Создание и разработка схем применения диагностических биопрепаратов на основе выделенных и изученных бактериофагов энтеробактерий: автореф. дис. …докт. биол. наук: 03.00.07, 03.00.23 / Золотухин Сергей Николаевич. − Ульяновск, 2007. − С.32.
- Алешкин, А.В. Лекции по исследованию и применению бактериофагов / А.В. Алешкин. — Ульяновск, УГСХА, 2016. — с.112.
- Егоров, Н.С. Условия спорообразования у некоторых термофильных бацилл / Н.С. Егоров, Ж.К. Лория, С.Н. Выборных. — Науч. докл. высш. школы. Биол. науки, 1979. — № 9. — с. 77-81.
- Каттер, Э. Бактериофаги: биология и практическое применение / Э. Каттер, А. Сулаквелидзе; науч. ред. А.В. Летаров; [пер. с англ. Е. Е. Куликов и др.]. — Москва: Научный мир, 2012. — с. 636.
- Красильников, И.В. Препараты бактериофагов: краткий обзор современного состояния и перспектив развития / И.В. Красильников, К.А. Лыско, Е.В. Отрашевская [и др.] // Сибирский медицинский журнал. — Т. 26, №2, Выпуск 2. — 2011. — с. 33-37.
- Кац-Чернохвостова, Л.Я. Проблема фаготипирования брюшнотифозных и паратифозных микробов и ее эпидемиологическое значение / Л.Я. Кац-Чернохвостова // ЖМЭИ, 1947. — № 8. — с. 312-315.
- Мартынова, К.В. Выделение и идентификация бактерий Васillus coagulans из пищевого сырья и продуктов питания / К.В. Мартынова, Н.А. Феоктистова // Материалы IX Международной научно-практической конфе-ренции «Аграрная наука и образование на современном этапе развития: опыт, проблемы и пути их решения» посвящённой 75-летию Ульяновского государ-ственного аграрного университета имени П.А. Столыпина. Часть 2. — Ульяновск, 2018.
- Феоктистова, Н.А. Параметры реакции нарастания титра фага с сибиреязвенным бактериофагов / Н.А. Феоктистова, Е.И. Климушкин, Д.А. Васильев, К.В. Белова // Вестник ветеринарии. — 2015. — № 4 (75). — с. 47-51.
- Леонтьев, В. Н. Порча пищевых продуктов: виды, причины и способыпредотвращения / В. Н. Леонтьев, Х. М. Элькаиб, А. Э. Эльхедми (А. Э. А.Эльхедми) // Тр. Белорус.гос. ун-та. Сер.: Физиол., биохим. и молекуляр.основы функционирования биосистем.- 2013. — Т. 8, ч. 1. — с. 125-130.
- Медицинские лабораторные технологии: руководство по клинической лабораторной диагностике: в 2 томах. / [В.В. Алексеев и др.]: под ред. А.И. Карпищенко. – 3-е изд… перераб и доп. – Т.2 – М.:ГОЭТАР-Медиа, 2013.- 792с. — С. 422-423.
- Методические указания по лабораторной диагностике псевдомонозов рыб / Министерство сельского хозяйства и продовольствия Российской Федерации от 22 сентября 1998г.
- Методические указания по применению унифицированных микробиологических (бактериологических) методов исследования в клиникодиагностических лабораториях. Приложение № 1 к приказу МЗ СССР. – М.: Министерство здравоохранения СССР, 22.04.1985. – № 535. – 22 с.
- Методы лабораторных исследований и испытаний медико- профилактических дезинфекционных средств для оценки их эффективности и безопасности: Руководство. — М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2010. — 615 с.
- Мирошников, К.А. Молекулярно-биологические и генетические принципы селекции терапевтических бактериофагов бактерий родов Pseudomonas и Staphylococcus / К.А. Мирошников, Е.Е. Куликов, О.С. Дарбеева, К.А. Лыско, Г.М. Игнатьев // Прикладная биохимия и микробиология. — 2014. — Т. 50. — № 3. — С. 338.
- Мирошников, К.А. Геномика и протеомика литических бактериофагов Pseudomonas aeruginosa: автореф. дис. …докт. хим. наук: 03.01.04, 03.01.06 /Мирошников Константин Анатольевич. – Москва, 2013. – С.5 (169с).
- Феоктистова, Н.А. Бактериофаги рода Bacillus: биология и практическое применение / Н.А. Феоктистова, А.И. Калдыркаев, Д.А. Васильев [и др.]. – Ульяновск: 2017. – 112 c.
- Эльхедми, А. Э. (Эльхедми, А.Э.А.) Биопрепарат на основе бактериофагов для защиты порчи пищевых продуктов от бактерий рода Pseudomonas / А.Э. Эльхедми (А.Э.А. Эльхедми) // Техника и технология органических веществ: тез.докл. XI Междунар. науч.-техн. конф., Могилев.гос. ун-т продовольствия; ред.: А. В. Акулич [идр.]. — Могилев, 2017. — с. 141.
- Техэксперт. Гигиенические требования безопасности и пищевой ценности пищевых продуктов. Санитарные правила и нормы. СанПиН 2.3.2.1078-01. – URL: http://docs.cntd.ru/document/901806306 — дата обращения 12.09.2019.
- Техэксперт. ГОСТ 10444.15-94 Продукты пищевые. Методы определения количества мезофильных аэробных и факультативно-анаэробных микроорганизмов – URL: http://docs.cntd.ru/document/1200022648 — дата обращения 12.09.2019.
- Техэксперт. ГОСТ 26669-85 Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов – URL:. http://docs.cntd.ru/document/1200022785 — дата обращения 12.09.2019.
- Техэксперт. ГОСТ 26670-91 Продукты пищевые. Методы культивирования микроорганизмов – URL: http://docs.cntd.ru/document/1200021109 — дата обращения 12.09.2019.
- Техэксперт. ГОСТ 32031-2012 Продукты пищевые. Методы выявления бактерий Listeria monocytogenes – URL: http://docs.cntd.ru/document/1200105310 — дата обращения 12.09.2019.
- Техэксперт. Технический регламент Таможенного союза ТР ТС 021/2011 «О безопасности пищевой продукции» – URL: http://docs.cntd.ru/document/902320560 — дата обращения 12.09.2019.
- Техэксперт. ТР ТС 029/2012 Технический регламент Таможенного союза «Требования безопасности пищевых добавок, ароматизаторов и технологических вспомогательных средств» (с изменениями на 18 сентября 2014 года) – URL: http://docs.cntd.ru/document/902359401 — дата обращения 12.09.2019.
- Техэксперт. МУК 4.2.1847-04 «Санитарно-эпидемиологическая оценка обоснования сроков годности и условий хранения пищевых продуктов» – URL: ата обращения 12.09.2019.
- StandartGOST. МУК 4.2.2316-08 «Методы контроля бактериологических питательных сред» — URL: https://standartgost.ru/g/pkey-14293831170 — дата обращения 12.09.2019.
- StandartGOST. ГОСТ Р 26668-85 Продукты пищевые и вкусовые. Методы отбора проб для микробиологических анализов — URL: https://standartgost.ru/g/ГОСТ_Р_26668-85 — ата обращения 12.09.2019
- StandartGOST. ГОСТ Р 51426-99 Микробиология. Корма, комбикорма, комбикормовое сырье. Общее руководство по приготовлению разведений для микробиологических исследований — URL: https://standartgost.ru/g/ГОСТ_Р_51426-99 — ата обращения 12.09.2019.
- StandartGOST. ГОСТ 51446-99. Микробиология. Продукты пищевые. Общие правила микробиологических исследований — URL: https://standartgost.ru/g/ГОСТ_Р_51446-99 — дата обращения 12.09.2019.
- Bergey’s Manual of Systematics of Archaea and Bacteria / William B. Whitman, Paul DeVos, Jonsik Chun, Sveltlana Dedysh, Brian Hedlund, Peter Kämpfer, Fred Rainey, Martha Trujillo. — Hoboken, New Jersey: Wiley, 2015. – URL: https://onlinelibrary.wiley.com/doi/pdf/10.1002/9781118960608.gbm00530. – дата обращения 12.07.2018.
- Идентификация бактерий Bacillus cereus на основе их фенотипической характеристики / Д.А. Васильев, А.И. Калдыркаев, Н.А. Феоктистова [и др.]. – Ульяновск: НИИЦМиБ УлГСХА им. П.А. Столыпина, 2013. – С. 24.
- Еременко, Е.И. Группа бактерий «Bacillus cereus» — проблемы идентификации и таксономии/ Е.И. Еременко // Медицинский вестник Северного Кавказа. — 2008. — № 3. — С. 57–60.
- Slepecky, R.A. The Genus Bacillus-Nonmedical / R.A. Slepecky, H.T. Hemphill // Prokaryotes. – 2006. — № 4. – Р. 530–562.
- Efficient Isolation and Identification of Bacillus cereus / S. M. Tallent, K. M. Kotewicz, E. A. Strain, R. W. Bennett // Group Journal of AOAC International. – 2012. – Vol. 95. – №. 2. – Р. 446-451.
- Nature of polymorphisms in 16S-23S rRNA gene intergenic transcribed spacer fingerprinting of Bacillus and related genera / Daffonchio D., Cherif A., Brusetti L. [et al.] // Appl. Environ. Microbiol. — 2003; 69. – P. 5128-5137.
- Выделение бактериофагов бактерий рода Listeria / Д.А. Васильев, Е.Н. Ковалева, Е.В. Сульдина // Инфекция и иммунитет. – 2014. – сентябрь, специальный выпуск – С. 69-70.
- Выделение листериозных бактериофагов и изучение их основных биологических свойств / Е.В. Сульдина, Е.Н. Ковалева, Д.А. Васильев, Б.И. Шморгун // Аграрный научный журнал. 2015. № 3. С. 37-41.
- СП 2.2.1.3218-14 Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев) – URL: http://docs.cntd.ru/document/420219460 — дата обращения 21.11.2019.
- СПОСОБ ПОЛУЧЕНИЯ БАКТЕРИОФАГА Российский патент 2014 года по МПК C12N7/00 A61K35/76 RU 2 525 141 C / Киселева Ирина Анатольевна, Алешкин Андрей Владимирович, Верёвкин Владимир Васильевич, Светоч Эдуард Арсеньевич, Афанасьев Станислав Степанович, Рубальский Евгений Олегович, Рубальская Елена Евгеньевна, Рубальский Максим Олегович, Ефимова Ольга Григорьевна, Васильев Дмитрий Аркадьевич, Золотухин Сергей Николаевич.
- From, C. Food poisoning associated with pumilacidin-producing Bacillus pumilus in rice / C. From, V. Hormazabal, P. E. Granum // International Journal of Food Microbiology. — 2007. — Vol. 115, issue 3. — P. 319–324.
- Galal, A. A. Bacillus pumilus, a new pathogen on Mango plants / A. A. Galal, A. El-Bana, J. Janse // Egyptian Journal of Phytopathology. — 2006. — Vol. 34, № 1. — P. 17–29.
- Евдокимова, О. В. Биохимическая и молекулярно-генетическая характеристика бактерий Bacillus pumilus, изолированных на территории Беларуси / О. В. Евдокимова, В. Е. Мямин, Л. Н. Валентович // Журнал Белорусского государственного университета. Биология. — 2018. — № 1. — С. 38–49.
- СПОСОБ ВЫДЕЛЕНИЯ ЛИСТЕРИЙ ИЗ ПИЩЕВЫХ ПРОДУКТОВ RU 2 068 880 C1 МПК C12N 1/10(2006.01) C12R 1/90(2006.01) /Васильев Дмитрий Аркадьевич – URL: https://yandex.ru/patents/doc/RU2068880C1_19961110 — дата обращения 12.09.2019.
- Руководство по проведению доклинических исследований лекарственных средств (иммунобиологические лекарственные препараты). Часть вторая / Под ред. А.Н. Миронова. — М.: Гриф и К, 2013. — 536 с.
- Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ/ Р.У Хабриев и др. — М, Медицина, 2005. – 832с.
- Техэксперт. ОФС.1.1.0004.15 Отбор проб «Государственная фармакопея Российской Федерации», XIII издание, том I, 2015 год. – URL: http://docs.cntd.ru/document/420324463 — дата обращения 12.09.2019.
- Методические указания по проведению регистрационных испытаний биопрепаратов для защиты растений от вредителей и болезней / Л.И. Прищепа, Н.И. Микульская, Д.В. Войтко; РУП «Институт защиты растений». — Несвиж: Несвижская укр. типограф. им. С. Будного, 2008. — 56 с.
Приложения