Титульный лист и исполнители
РЕФЕРАТ
Отчет 151 с., 1 кн., 97 рис., 20 табл., 131 источн.
КЛОНОВЫЕ ПОДВОИ ЯБЛОНИ, СЕЛЕКЦИОННЫЙ ПРОЦЕСС, МОЛЕКУЛЯРНЫЕ МАРКЕРЫ, ЦЕЛЕВЫЕ ГЕНЫ, КУЛЬТУРА ТКАНИ, МАТОЧНИК, ПИТОМНИК, СОРТО-ПОДВОЙНЫЕ КОМБИНАЦИИ, ПРИВОЙ, САД КОНКУРСНОГО ИСПЫТАНИЯ
В ФГБОУ ВО Мичуринский ГАУ в 2019 г. продолжены многолетние селекционные исследования по созданию, изучению и выделению новых генотипов высокоадаптивных клоновых подвоев яблони с комплексом ценных хозяйственно-биологических показателей. Получено 899 гибридных семян. Генетическая коллекция пополнена 34 образцами рода Malus Mill.
Проведен скрининг генетической коллекции клоновых подвоев яблони методами молекулярно-генетического анализа. Наличие всех трех маркеров, обеспечивающей устойчивость к бактериальному ожогу, отмечено только у форм 62-396, 16-1 и 2-9-12. Среди изученных клоновых подвоев яблони ген Rvi6 устойчивости к парше не выявлен. Идентифицирован полный аллельный статус S-гена самонесовместимости яблони для форм ПБ, 83-1-15 и 2-12-10, у которых присутствуют аллели S1 и S3. Комбинаций с вариантом S2 не отмечено.
Оптимизированы приемы введения в стерильную культуру in vitro новых генотипов рода Malus Mill. Применение диссекции семядолей позволяет увеличить прорастание гибридных семян in vitro. Показатели эффективности микроразмножения клоновых подвоев яблони на питательных средах QL и MS существенно не отличаются. При укоренении в условиях in vitro клоновых подвоев яблони оптимальной является концентрация ИМК в питательной среде 0,5 мг/л. Отобраны генотипы клоновых подвоев с повышенной способностью к ризогенезу in vitro (2-9-102, 2-12-10) и с высокой регенерационной способностью (Парадизка Будаговского, 14-1, 16-1, 3-4-7, 2-12-10). Максимальная частота регенерации клоновых подвоев отмечена на питательной среде с добавлением 4,0-5,0 мг/л 6-БАП в сочетании с одним из ауксинов – ИМК, ИУК или 2,4-Д.
Разработана методика оценки экологической устойчивости мужского гаметофита генотипов рода Malus Mill. в экспериментально моделируемых условиях к изменению температурного режима при прорастании и гиперосмотическому стрессу.
Наибольшей побегообразовательной способностью маточных кустов характеризовались перспективные формы 2-3-14, 2-9-49, 2-9-96, 2-12-10, 2-12-15, 9-1-1, 9-1-4, 9-1-5. Наибольшая доля стандартных отводков (более 50% от общего количества) отмечена у форм 2-3-2, МБ, ПБ, 4-2-50, 9-1-9, 2-15-2, 2-9-94, 2-3-8. У клоновых подвоев выявлены различия по содержанию антоцианов в тканях листа и удельной доли флоэмы в побегах.
В питомнике впервые изучены СПК с участием колонновидных сортов яблони, привитых на новые перспективные клоновые подвои селекции Мичуринского ГАУ. К группе карликовых можно выделить перспективные клоновые подвои 2-9-90, 2-12-36, 9-1-1, 9-1-3, 9-1-4, 9-1-9.
В саду конкурсного испытания выраженными признаками карликовости и компактным габитусом кроны на уровне контрольного районированного подвоя 62-396 обладают деревья сорта Мелба, привитые на подвоях 2-14-2, 3-4-7, 2-3-49, а также СПК сорта Антоновка обыкновенная на клоновых подвоях 2-14-2, 2-3-49, 2-9-49. Деревья обоих сортов на подвое 2-14-2 характеризуются самой сдержанной силой роста и наименьшим объемом кроны на уровне контроля 62-396. Увеличение количества генеративных образований в сравнении с предыдущим сезоном у СПК сорта Антоновка обыкновенная зафиксировано в диапазоне 2,02-3,77 раз, Мелба – 2,86-6,13 раз. У обоих сортов наибольшее увеличение данного показателя отмечено у деревьев на подвое 2-3-49.
ПЕРЕЧЕНЬ СОКРАЩЕНИЙ И ОБОЗНАЧЕНИЙ
В настоящем отчете о НИР применяют следующие сокращения и обозначения:
СПК – сорто-подвойная комбинация.
П-К (полукарлики) – растения клоновых подвоев, обладающие полукарликовой силой роста.
К – карликовые по силе роста растения.
С-К (суперкарлики) – растения клоновых подвоев, обладающие наименьшей силой роста среди карликовых форм.
Мелба/54-118 – обозначение привойно-подвойной комбинации: сорт Мелба привит на клоновый подвой 54-118.
МБ – суперкарликовый клоновый подвой Малыш Будаговского (76-6-6)
ПБ – карликовый клоновый подвой Парадизка Будаговского (B9)
MS – питательная среда Мурасиге-Скуга.
QL – питательная среда Кворена-Лепуавра.
6-БАП – 6 бензиламинопурин.
ИУК – индолилуксусная кислота.
НУК – нафтилуксусная кислота.
ИМК – индолилмасляная кислота.
УЗ – ультразвук.
NaCl – хлорид натрия.
ВВЕДЕНИЕ
Яблоня является основной возделываемой плодовой культурой в России, что подтверждается как размером площадей выращивания данной культуры, так и суммарным сбором ее плодов. В современных условиях импортозамещения особое экономическое значение имеет создание на территории РФ новых высокоурожайных многолетних промышленных насаждений яблони с высокой рентабельностью. Яблоки, выращенные во многих регионах нашей страны, по качеству являются полностью конкурентоспособными как на внутреннем, так и внешнем рынках, однако средняя урожайность яблони в России существенно ниже, чем в некоторых европейских странах. Частично это связано с различием природно-климатических условий возделываемых территорий, однако при полном соблюдении технологии возделывания промышленных насаждений яблони потенциальные биологические возможности данной культуры позволяют стабильно выращивать 200-400 ц/га высококачественных плодов.
Высокие товарно-потребительские и экономические показатели промышленного интенсивного плодового сада возможны при выращивании слаборослых плодовых деревьев по уплотненным схемам размещения. Основой для такого интенсивного сада служат слаборослые клоновые подвои. Активная замена нерентабельных и технологически непригодных к массовому возделыванию сильнорослых насаждений яблони на новые интенсивные, адаптивные к условиям конкретного региона произрастания, будут способствовать существенному увеличению производства отечественных плодов.
В значительной мере расширение площадей садов яблони на клоновых подвоях в нашей стране сдерживается недостаточной изученностью подвоев и современных сорто-подвойных комбинаций в различных природно-климатических регионах садоводства с существенно различающимися условиями окружающей среды, в которых генотипы подвоев проявляют себя по-разному.
Целенаправленный выбор лучших генотипов клоновых подвоев яблони для каждой природно-климатической зоны является одним из главнейших факторов интенсификации садоводства. Для этого необходимы многолетние комплексные исследования новых перспективных генотипов клоновых подвоев яблони в экспериментальных и промышленных маточниках, питомниках и садах с использованием районированных и перспективных сортов для каждого региона. В связи с этим проблема селекции слаборослых клоновых подвоев яблони и их хозяйственно-биологической оценки в настоящее время имеет особую актуальность и значимость.
Для ускоренного получения и изучения ценных генотипов клоновых подвоев яблони и производственно-биологического испытания сорто-подвойных комбинаций, полученных на их основе, необходима разработка новых высокоэффективных методик оптимизации селекционного процесса. Широкие возможности для этого предоставляют современные молекулярно-генетические технологии анализа гибридных генотипов с целью идентификации локусов хозяйственно-значимых признаков и выделения источников ценных генов. Их наличие позволит более рационально планировать схемы гибридизации и значительно повысить выход ценных гибридных форм. Применение методов маркер-опосредованной селекции способствует значительному ускорению и повышению эффективности выделения целевых генотипов с искомыми генами и фенотипическими признаками. Технологии и приемы стерильной культуры in vitro позволяют сохранить и массово размножить ценный генотип, представленный единичным растением или даже гибридным семенем. Управление функциональной активностью пыльцы и выбор генотипов с ее стабильно высокой прорастаемостью в негативных природно-климатических условиях в качестве опылителей при гибридизации позволяет потенциально повысить эффективность искусственных скрещиваний и увеличить выход гибридных семян. Разработка и применение новых селекционных технологий в совокупности друг с другом будет способствовать многократному ускорению создания, испытания и выделения ценных форм растений, в том числе слаборослых клоновых подвоев яблони с комплексом ценных биологически и производственно-технологических показателей.
1 СОЗДАНИЕ ГИБРИДНОГО ФОНДА ЗИМОСТОЙКИХ СЛАБОРОСЛЫХ КЛОНОВЫХ ПОДВОЕВ ЯБЛОНИ
Цель исследований: создание нового гибридного фонда яблони в рамках продолжения многолетних селекционных исследований для последующего комплексного изучения и выделения новых форм слаборослых клоновых подвоев яблони, ценных по комплексу биологических и хозяйственно-технологических признаков.
Задачи исследований:
— увеличить количество единиц гибридного фонда яблони в селекционной школке посредством посева семян 2018 г. гибридизации;
— провести гибридизацию, получить и выделить гибридные семена;
— увеличить количество новых образцов генетической коллекции растений рода Malus Mill. в структурном подразделении ФГБОУ ВО Мичуринский ГАУ – НОЦ имени В.И. Будаговского для их дальнейшего изучения и использования в селекционном процессе.
Научная новизна и практическая значимость исследований
Уникальный гибридный фонд клоновых подвоев яблони селекции ФГБОУ ВО Мичуринский ГАУ увеличен посредством посева семян 2018 г. гибридизации в селекционной школке, а также путем получения и выделения гибридных семян от гибридизации 2019 г. для продолжения многолетних селекционных исследований. В селекционный процесс вовлечены новые гибриды и проведены межвидовые скрещивания для получения и последующего изучения гибридного фонда с целью выделения перспективных слаборослых клоновых подвоев яблони с комплексом значимых биологических признаков и ценных потребительских показателей. Впервые проведены скрещивания родительских форм с использованием двух отечественных сортов яблони колонновидного габитуса роста (Валюта, Московское ожерелье) и карликового клонового подвоя G16 селекции Женевской станции Корнеллского Университета (США, штат Нью-Йорк), полученного с участием природного вида – яблони обильноцветущей (M. floribunda Siebold ex Van Houtte). От данных скрещиваний получены гибридные семена. В дальнейшем среди гибридного потомства предполагается выявление генотипов клоновых подвоев с доминантным аллелем гена колонновидности Co и генами устойчивости от M. floribunda.
Объекты, условия и методика проведения исследований
В качестве биологических объектов исследования и выбора родительских форм при составлении гибридологических схем в 2019 г. были использованы произрастающие в гибридном саду генотипы клоновых подвоев яблони 1957-2005 годов гибридизации, полученные в Мичуринском ГАУ, а также отечественные колонновидные сорта яблони Валюта, Московское ожерелье, карликовый клоновый подвой G16 селекции Женевской станции Корнеллского Университета (США, штат Нью-Йорк) и две видовые формы – яблони Зибольда M. sieboldii (Rgl.) Rehd. и яблони сибирской M. baccata (L.) Borkh.
Статистическую обработку данных проводили в программной среде Microsoft Office Excel 2016.
Результаты исследований
Селекционная школка. В селекционной школке проведён посев гибридных семян 2018 года гибридизации.
В 2019 г. стратификацию гибридных семян проводили иным способом – их высевом в малообъемные контейнеры с торфяной сместью «Агробалт-С», предварительно обработанной в термошкафу в течение 1 ч при +150°С для ликвидации патогенных микроорганизмов и их спор, которые размещали в крупногабаритной климатической камере с микропроцессорным контролем температуры, находящейся в структурном подразделении ФГБОУ ВО Мичуринский ГАУ – Учебно-исследовательском тепличном комплексе (УИТК) «Роща». Данным способом 14-15 февраля 2019 г. было высеяно 8496 гибридных семян, полученных по схемам скрещивания: карлик х полукарлик, полукарлик х карлик, полукарлик х смесь пыльцы карликов, видовая форма х карлик, карлик х видовая форма, видовая форма х видовая форма, а также от гетероплоидных скрещиваний по схеме диплоид х тетраплоид с участием доноров нередуцированных гамет.
Контейнеры с субстратом и семенами выдерживали при температуре +1,5…+2,0°С, периодически увлажняя. Общая продолжительность стратификации гибридных семян в контейнерах до получения первых всходов семян составила 95–127 дней в зависимости от комбинации скрещивания. После массового появления проростков контейнеры переносили в крупногабаритную пленочную теплицу тоннельного типа и выдерживали их там в течение 10 дней при естественной температуре воздуха данного периода. Для предотвращения развития патогенных микроорганизмов и гибели проростков, контейнеры с ними поливали биопрепаратом «Триходермин», содержащим споры полезных грибов Trichoderma sp.
В селекционную школку, расположенную в структурном подразделении ФГБОУ ВО Мичуринский ГАУ – Научно-образовательном центре (НОЦ) имени В.И. Будаговского, в конце мая 2019 г. произвели посадку полученных гибридных проростков. Для их защиты на ранних стадиях роста и развития от неблагоприятных природно-климатических условий летнего периода (высокой температуры и сниженной относительной влажности воздуха) ряды растений закрывали смонтированной малообъемной каркасной теплицей, накрытой белым нетканом агроволокном марки «Спанбонд 60».
Всхожесть семян составила 76,4%, таким образом, весной 2019 г. после стратификации получен 6491 проросток, в течение сезона к окончанию вегетационного периода в селекционной школке отмечено 4287 гибридных растения (66,0% от высеянных проростков и 50,5% от исходного числа застратифицированных гибридных семян).
 |
 |
| а | б |
Рисунок 1 – Стратификация гибридных семян яблони в крупногабаритной климатической камере (а) с микропроцессорным контролем температуры (б)

Рисунок 2 – Высадка гибридных проростков яблони в селекционную школку
Гибридизация и получение гибридных семян. В 2019 г. гибридизацию проводили в двух гибридных садах – 2003-2008 гг. и 2015-2017 гг. посадки. В текущем году сложились крайне неблагоприятные условия для цветения деревьев яблони из-за сочетания комплекса факторов – периодичности плодоношения и низкой закладки плодовых образований после обильного плодоношения деревьев в предыдущем сезоне (2018 г.), а также неблагоприятные природно-климатические условия весеннего периода – обильные продолжительные осадки и пониженная температура воздуха (+10…+12°С), вследствие которых отмечено сильное намокание бутонов и пыльников с созревающей пыльцой. Вследствие этого, лёт пчел в саду был сильно затруднен, поэтому в вариантах с самоопылением генотипов завязываемость семян также оказалась низкой.
Тем не менее, часть деревьев яблони в гибридном саду зацвели и были использованы для гибридизации. Для получения гибридных генотипов слаборослых клоновых подвоев с ценными хозяйственно-биологическими признаками проведены скрещивания в 10 комбинациях (табл. 1), в том числе межвидовые с M. sieboldii (Rgl.) Rehd. и M. baccata (L.) Borkh., а также варианты с участием четырех отечественных сортов яблони колонновидного габитуса роста (Валюта, Московское ожерелье, Каскад, Корнет) и отборной формы 27-96(2), полученной с участием M. baccata (L.) Borkh. и имеющей ген колонновидности Co, а также карликового клонового подвоя G16 селекции Женевской станции Корнеллского Университета (США, штат Нью-Йорк), полученного с участием природного вида – яблони обильноцветущей (M. floribunda Siebold ex Van Houtte). В дальнейшем среди гибридного потомства предполагается выявление генотипов клоновых подвоев с доминантным аллелем гена колонновидности Co и генами устойчивости от M. floribunda. Также были собраны плоды от свободного опыления в 3 вариантах: новой подвойной формы 14-1 и видовых форм M. sieboldii (Rgl.) Rehd. и M. baccata (L.) Borkh. Данные родительские формы характеризуются высокой устойчивостью к ряду стрессоров, поэтому могут передать их гены гибридам, среди которых в дальнейшем будут отобраны слаборослые клоновые подвои, обладающим высокой зимостойкостью и комплексной устойчивостью к болезням.
Скрещивания родительских форм с использованием генотипов яблони колонновидного габитуса роста были проведены с подвойными формами селекции ФГБОУ ВО Мичуринский ГАУ впервые и в четырех комбинациях получены гибридные семена. Гибридизация с участием производной формы (подвоя G16) природного вида – яблони обильноцветущей (M. floribunda Siebold ex Van Houtte) также проведена с новыми подвойными формами впервые, в двух вариантах скрещиваний получены гибридные семена.
Таблица 1 – Комбинации скрещиваний генотипов яблони и эффективность гибридизации (2018 г.)
| №
п/п |
Комбинации родительских форм при гибридизации | Количество
опыленных цветков, шт. |
Кол-во
плодов, шт. |
Кол-во
семян, шт. |
Среднее
количество нормальных семян на 1 плод, шт. |
| 1 | G16 х 27-96(2) | 104 | 48 | 108 | 2,3 |
| 2 | Московское ожерелье х G16 | 48 | 12 | 17 | 1,4 |
| 3 | Московское ожерелье х 62-396 | 17 | 8 | 14 | 1,8 |
| 4 | Московское ожерелье х 2-12-15 | 162 | 43 | 62 | 1,4 |
| 5 | M. sieboldii х 76-3-6 | 118 | 84 | 87 | 1,0 |
| 6 | Валюта х 62-396 | 11 | — | — | — |
| 7 | Валюта х 2-12-15 | 7 | — | — | — |
| 8 | 57-491 х 85-11-9 | 14 | — | — | — |
| 9 | M. sieboldii х 60-160 | 22 | 1 | — | — |
| 10 | M. baccata х 2-12-15 | 18 | 1 | — | — |
| 11 | 14-1 св. опыление | — | 5 | 3 | 0,6 |
| 12 | M. sieboldii св. опыление | — | 168 | 294 | 1,8 |
| 13 | M. baccata св. опыление | — | 229 | 314 | 1,4 |
| Суммарно | 521 | 599
(197+402) |
899
(288+611) |
1,5 | |
Всего в схемах целенаправленной гибридизации был опылен 521 цветок, завязалось 197 плода, из которых выделено 288 семян. Собрано 402 плода от свободного опыления, из которых выделено 611 семян. Таким образом, общее количество полученных гибридных семян составило 899 шт. Вследствие сложного гибридного происхождения каждого из родительских генотипов клоновых подвоев и вариантов отдаленной гибридизации выход семян в расчете на 1 плод составил в условиях индуцированного аутбридинга от 1,0 до 2,3 шт., при естественной спонтанной гибридизации – 0,6-1,4 шт.
Расширение генетической коллекции рода Malus Mill. В 2019 г. генетическая коллекция ФГБОУ ВО Мичуринский ГАУ была пополнена 34 образцами рода Malus Mill. из коллекции Филиала Майкопская опытная станция Федерального исследовательского центра (ФИЦ) Всероссийский научно-исследовательский институт генетических ресурсов растений имени Н.И. Вавилова (ВИР), расположенного в поселке Подгорный Майкопского района Республики Адыгея.
Данные генотипы яблони являются генисточниками ценных биологических и товарно-потребительских свойств и относятся к двум группам растений – природным дикорастущим видам, представленные 29 образцами, и кребам-опылителям в виде 5 образцов (табл. 2).
Таблица 2 – Формы яблони с Майкопской опытной станции ВИР им. Н.И. Вавилова, взятые для расширения генетической коллекции растений рода Malus Mill. в структурном подразделении ФГБОУ ВО Мичуринский ГАУ – НОЦ имени В.И. Будаговского
| №
п/п |
Группа генетической коллекции растений рода Malus Mill. | Наименование генотипа
в соответствии с номером в каталоге коллекции |
Отечественное название генотипа |
| 1 | Дикорастущие природные виды и их гибриды | Malus purpurea 2392 | яблоня пурпурная |
| 2 | Malus purpurea var. pendula 2396 | яблоня пурпурная повислая (плакучая) | |
| 3 | M. floribunda 2346 | яблоня обильноцветущая | |
| 4 | Malus spectabilis 2415 | яблоня замечательная | |
| 5 | Malus robusta 43200 (=3268) | яблоня мощная, или ранетка пурпурная | |
| 6 | Malus pumila 2383 | яблоня низкая | |
| 7 | Malus baccata 2319 | яблоня сибирская, или ягодная | |
| 8 | Malus baccata var. coerulescens 2333 | яблоня сибирская, подвид coerulescens (синеватая) | |
| 9 | Malus prunifolia 2380 | яблоня сливолистная | |
| 10 | Malus coronaria 2336 | яблоня венечная | |
| 11 | Malus sylvestris 6144 | яблоня лесная | |
| 12 | Malus purpurea var. eleyi 2394 | яблоня пурпуровая Элея | |
| 13 | Malus cerasifera var. aurantiaca 2314 | яблоня вишнеплодная, подвид оранжевая | |
| 14 | Malus asiatica var. ringo fastigiata bifera | яблоня азиатская Ринго, подвид | |
| 15 | Malus ioensis 2352 | яблоня айовская | |
| 16 | Malus mandshurica 41277 | яблоня маньчжурская | |
| 17 | Malus sachalinensis 41275 | яблоня сахалинская | |
| 18 | Malus turkmenorum 13283 | яблоня турменов (туркменская) | |
| 19 | Malus orientalis 2339 | яблоня восточная | |
| 20 | Malus orientalis (из Адыгеи) 29483 | яблоня восточная | |
| 21 | Malus caspiriensis (полукультурка) 14943 | яблоня кашмирская | |
| 22 | Malus hubehensis 43206/1 | яблоня хубейская | |
| 23 | Malus niedzwetzkyana 2389 | яблоня Недзвецкого | |
| 24 | Malus niedzwetzkyana 29424 | яблоня Недзвецкого | |
| 25 | Malus sieversii 13275 | яблоня Сиверса | |
| 26 | Malus scheideckeri 2407 | яблоня Шейдекера | |
| 27 | Malus sargentii 2428 | яблоня Саржента | |
| 28 | Malus pallasiana 14957А | яблоня Палласа | |
| 29 | Malus sieboldii х Спартан | гибрид яблони Зибольда и сорта Спартан | |
| 30 | Кребы-опылители | Aurea (креб) 2315 | креб яблони золотистой |
| 31 | Serotina (креб Серотина) 2408 | креб яблони Серотина | |
| 32 | Malus zumi crab 41272 | креб яблони Цуми | |
| 33 | Моренго (креб) 2357 | креб яблони Моренго | |
| 34 | Ampl (креб) 2311 | креб яблони Ампл |
Черенки данных генотипов были заокулированы на подвои в августе 2019 г. в структурном подразделении ФГБОУ ВО Мичуринский ГАУ – НОЦ имени В.И. Будаговского. В дальнейшем планируется изучение данных новых образцов генетической коллекции растений яблони Мичуринского агроуниверситета методами молекулярно-генетического, морфометрического и цитоанатомического анализа для выделения ценных генотипов и их использования в селекционном процессе.
Выводы по главе 1
В текущем году было увеличено количество единиц гибридного фонда яблони в селекционной школке. Стратификация семян 2018 г. гибридизации впервые осуществлена новым способом – посредством их посева в малогабаритные контейнеры со стерильной торфосмесью и выдерживании в климатической камере с микропроцессорным контролем температуры при +1,5…+2,0°С. Это позволило значительно увеличить всхожесть гибридных семян до 76,4%. Таким образом, весной 2019 г. после стратификации получен 6491 проросток, в течение сезона к окончанию вегетационного периода в селекционной школке отмечено 4287 гибридных растения (66,0% от высеянных проростков и 50,5% от исходного числа застратифицированных гибридных семян). Впервые получены проростки и молодые растения, полученные от гетероплоидных скрещиваний доноров нередуцированных гамет с клоновыми подвоями яблони.
Для получения новых гибридных генотипов слаборослых клоновых подвоев яблони с ценными хозяйственно-биологическими признаками в мае 2019 г. были проведены скрещивания в 10 комбинациях и 3 вариантах свободного опыления. Впервые проведены скрещивания родительских форм с использованием генотипов яблони колонновидного габитуса роста (с геном Co) и производной формы (подвоя G16) природного вида – яблони обильноцветущей (M. floribunda Siebold ex Van Houtte). Общее количество полученных гибридных семян составило 899 шт.
В 2019 г. генетическая коллекция ФГБОУ ВО Мичуринский ГАУ была пополнена 34 образцами рода Malus Mill. из коллекции Филиала Майкопская опытная станция ФИЦ Всероссийский научно-исследовательский институт генетических ресурсов растений имени Н.И. Вавилова. Черенки данных форм были заокулированы на подвои в структурном подразделении ФГБОУ ВО Мичуринский ГАУ – НОЦ имени В.И. Будаговского для их дальнейшего изучения и использования в селекционном процессе.
2 СОВЕРШЕНСТВОВАНИЕ МЕТОДИК ИНТЕНСИФИКАЦИИ СЕЛЕКЦИОННОГО ПРОЦЕССА
2.1 Идентификация целевых генов у генотипов клоновых подвоев с помощью молекулярно-генетического анализа
Цель исследований: скрининг генетической коллекции клоновых подвоев яблони методами молекулярно-генетического анализа для идентификации генотипов-источников целевых генов – устойчивости к бактериальному ожогу и парше яблони, самонесовместимости яблони при самоопылении.
Задачи исследований:
— пополнить коллекцию ДНК новыми образцами клоновых подвоев яблони;
— провести скрининг генетической коллекции клоновых подвоев яблони для поиска локусов количественных признаков (QTL) генов устойчивости к бактериальному ожогу яблони методами молекулярно-генетического анализа и микробиологической диагностики;
— провести анализ генетической коллекции клоновых подвоев яблони для поиска генисточников устойчивости к парше яблони;
— провести апробацию существующих молекулярных маркеров генов самонесовместимости яблони при опылении;
— выделенить генотипы клоновых подвоев, являющихся носителями целевых генов, для их дальнейшей реомендации к использованию в селекционном процессе в качестве родительских форм.
Научная новизна и практическая значимость исследований
Впервые получены экспериментальные данные по идентификации генов устойчивости отечественных клоновых подвоев яблони к бактериальному ожогу с использованием молекулярных маркеров, а также отобраны генисточники устойчивости к парше среди исходных форм клоновых подвоев яблони. Впервые среди генотипов отечественных клоновых подвоев яблони апробированы ДНК-маркеры генов самонесовместимости яблони, оценена их возможности использования в селекционном процессе и выделены эффективные молекулярные маркеры.
Полученные данные об особенностях распространения генов резистентности к патогенам и самонесоместимостив коллекции клоновых подвоев яблони позволят более рационально составлять схемы гибридизации и подбирать родительские формы, что значительно ускорит селекционный процесс и снизит материальные и трудозатраты при оценке полученного гибридного материала.
Объекты, условия и методика проведения исследований
Биологическими объектами исследования послужили формы клоновых подвоев яблони из коллекции ФГБОУ ВО Мичуринский ГАУ. Всего было проанализировано 34 генотипа рода Malus Mill.
Выделение геномной ДНК
Для выделения ДНК брали молодые, здоровые листья яблони с верхушечной части побега по одному образцу для каждой формы.
Экстрагирование ДНК было проведено по протоколу, предложенному Эдвардсом [30] в собственной модификации [31] с применением очистки от полифенольных соединений хлоридом лития.
Полимеразная цепная реакция
Амплификацию проводили в приборе SimpliAmp производства фирмы «Applied Biosystems» или ДТ-Прайм фирмы «ДНК-технология».
Реакционная смесь для ПЦР со всеми используемыми праймерами объемом 15 мкл содержала: 20 нг ДНК, 1,5 мМ dNTP, 2,5 мМ MgSO4, 10 пМ каждого праймера, 1 ед. Taq-полимеразы и 10х стандартного ПЦР-буфера.
Для анализа коллекции нами был проведен поиск наиболее продуктивных маркеров гена Rvi6 в литературных источниках. Для определения его наличия использован маркер VfC полученный на основе исследования первичной последовательности гомологичных членов HcrVf семьи, расположенных в Vf локусе первой хромосомы (Afunian et al., 2004).
Для идентификации гена Rvi6 использовали ПЦР с праймерами VfC1 и VfC2 (табл. 3). Амплификацию проводили в режиме: +94°C – 4 мин., 30 циклов: +940C – 1 мин., +58°C – 1 мин., +72°C – 1 мин.; +72°C – 7 мин. [32].
Локусы количественных признаков (QTL) устойчивости к бактериальному ожогу анализировали с использованием трех молекулярных маркеров: двух SCAR-маркеров AE10-375, GE-8019 и одного SSR-маркера CH-F7-FB1 [1].
Гены самонесовместимости яблони S1-S3 анализировали с использованием следующих ДНК-маркеров: Md-S1, Md-S2 и Md-S3 [2].
Таблица 3 – Характеристика праймеров и параметров ПЦР для идентификации генов целевых признаков
| № | Название | Последовательность | Температура отжига, °С | Оригинальный автор |
| 1 | VfC | F GGTTTCCAAAGTCCAATTCC3
R CGTTAGCATTTTGAGTTGAC |
60 | Afunian et al., 2004 |
| 2 | Md-S1 | F ATATTGTAAGGCACCGCCATATCAT
R GGTTCTGTATTGGGGAAGACGCACAA |
60 | Broothaerts, 2003 |
| 3 | Md-S2 | F GTTCAAACGTGACTTATGCG
R GGTTTGGTTCCTTACCATGG |
60 | |
| 4 | Md-S3 | F CAAACGATAACAAATCTTAC
R TATATGGAAATCACCATTCG |
57 | |
| 5 | AE10-375 | F CTAAGCGCACGTTCTCC
R CTGAAGCGCATCATTTCTGATAG |
55 | Khan et al., 2007 |
| 6 | GE-8019 | F TTGAGACCGATTTTCGTGTG
R TCTCTCCCAGAGCTTCATTGT |
55 | |
| 7 | CH-F7-Fb1 | F AGCCAGATCACATGTTTTCATC
R ACAACGGCCACCAGTTTATC |
60 |
После амплификации образцы разделяли путем электрофореза в 2%-ном агарозном геле, затем анализировали в ультрафиолетовом свете и фотографировали с использованием цифровой фотокамеры.
Искусственное заражение
Изучение подвойных форм яблони по признаку устойчивости к бактериальному ожогу проводили с использованием искусственного заражения суспензией бактерии E. amylovora из коллекции ФГБУ «ВНИИКР». Обработке подвергали листья в условиях влажной камеры. Искусственное заражение проводили путем поранения листьев иглой, инфицированной бактериальной суспензией (метод «аппликатора»), или срезания черешка с частью листовой пластинки инфицированными ножницами (метод «ножниц»). Опытные образцы инкубировали при температуре +22°С (рис. 3).
 |
 |
| а | б |
Рисунок 3 – Особенности развития некрозов при искусственном заражении методом «ножниц» (а) и методом «аппликатора» (б)
Перед заражением побегов растения яблони высаживали в горшки объемом 3л с нейтральным торфом и культивировали при постоянной температуре +17°С при естественном освещении до распускания почек (рис. 4). Почки обрабатывали бактериальной суспензией и по мере развития из них побегов отмечали длину участка, охваченного некрозом.

Рисунок 4 – Растения, высаженные для искусственного заражения, в теплице ФГБУ «ВНИИКР»
Оценку влияния метаболитов бактерии на растение-хозяина проводили с использованием в качестве селектирующего агента культурального фильтрата бактерии E. amylovora, которую выращивали на жидкой питательной среде Чапека в течение месяца с последующей её стерилизацией, путем пропускания через мембранный фильтр «Millipore» с диаметром пор 0,22 μm (производитель – Франция). Для определения характера воздействия фильтрата культуральной жидкости бактерии на растение-хозяина листья микрорастений яблони помещали на поверхность питательной среды MS, содержащей бактериальные метаболиты, с соблюдением правил стерильности. В качастве опытных были взяты варианты с концентрацией фильтрата культуральной жидкости бактерии 5%, 10% и 20%.
Оценку поражения растительных тканей и ранжирование сортов по степени устойчивости к метаболитам бактерии проводили по пятибалльной шкале согласно общепринятым методикам [3-5, 27-29].
2.1.1 Скрининг генетической коллекции клоновых подвоев яблони для поиска локусов количественных признаков (QTL) генов устойчивости к бактериальному ожогу яблони
Бактериальный ожог плодовых культур – одно из опаснейших заболеваний яблони и других растений сем. Розоцветные, вызывается бактерией Erwinia amylovora. Более чем в 40 странах оно является карантинным и представляет серьезную угрозу плодовым насаждениям. Заболевание поражает все части растения – цветки, побеги, кору ветвей и штамба, корневую систему, вызывая гибель растения.
E. amylovora – грамотрицательная патогенная бактерия имеющая тип патогенности III (T3SS), доставляющий эффекторные белки (PAI1) в организм хозяина. T3SS кодируются кластером генов гиперчувствительного ответа и патогенности (называемых генами hrp), которые контролируют способность патогена вызывать заболевание у восприимчивых растений-хозяев и вызывать гиперчувствительный ответ (HR) как у устойчивых, так и неустойчивых растений [6].
Основной стратегией борьбы с болезнью остается полное уничтожение сада, обработка медьсодержащими и другими пестицидами, а в некоторых странах – растворами антибиотиков. Однако широкое использование таких препаратов вызывает появление новых рас бактерии, устойчивых к препаратам [7]. Наиболее приоритетным и экологичным направлением является возделывание устойчивых сортов и подвоев яблони.
Проведенные за последние несколько лет исследования Яблони домашней (Malus domestica Borkh.) не позволили идентифицировать отдельные гены, контролирующие моногенную устойчивость. Но наличие насыщенных генетических карт позволило найти ряд локусов количественных признаков (QTL), связанных с устойчивостью к бактериальному ожогу [1, 8-15]. Для этого растения генотипируют с использованием молекулярных маркеров и проводят фенотипирование для выявления взаимосвязи между маркером и признаком. Значительные ассоциации между признаками и маркерами свидетельствуют о том, что эти маркеры расположены рядом с QTL [6].
Большая часть устойчивых форм сосредоточена среди дикорастущих форм яблони. Высокая устойчивость отмечена у двух видов – M. robusta 5 (QTL идентифицирован на 3-й хромосоме) и M. fusca (QTL идентифицирован на 10 хромосоме). Фенотипическое проявление признака в зависимости от наличия QTL у этих видов составляет 80% и 60% соответственно. Однако проявление высокой устойчивости характерно по отношению к отдельным местным штаммам возбудителя [7, 16]. Низкая восприимчивость к заболеванию отмечена также и у других видов: M. baccata [16], M. robusta var. persicifolia и M. sieversii [17].
В 2005 году Календж и коллеги определили основные QTL, связанные с резистентностью к бактериальному ожогу, которые локализованы на 7 хромосоме у сорта Фиеста, который коррелирует с фенотипическим проявлением признака на 34,3-46,6% [18]. Аналогичные результаты были получены при анализе сеянцев, полученных от скрещивания сортов Fiesta и Discovery. В этом исследовании QTL идентифицирован также на 7-й хромосоме, а уровень фенотипической изменчивости соответствовал предыдущим исследованиям и составил 37,5-38,6%. На основании этих данных в 2007 году были созданы два доминантных SCAR-маркера. Маркеры AE10-375 и GE-8019 фланкируют участок хромосомы 7 где расположен QTL. Кроме того, для точной идентификации локуса устойчивости был разработан микросателлитный маркер CH-F7-Fb1, локализованный внутри QTL. Данные маркеры могут успешно применятся для маркер-опосредованной селекции яблони [1].
Большинство исследований сосредоточены на оценке устойчивости сортов яблони [1, 16, 18, 19]. Незначительная часть работ сосредоточена на изучении клоновых подвоев яблони. Однако они являются составляющей частью привойно-подвойной комбинации и играют значительную роль в создании устойчивого растения яблони. Поэтому выбор подвоя и знания о степени его восприимчивости к болезни – один из важных факторов предотвращения распространения инфекции.
Особенно опасно развитие заболевания в садах на карликовых подвоях, что связано с высокой плотностью насаждения и интенсивным распространением болезни [20]. Кроме того, многие карликовые подвои восприимчивы к возбудителю. В регионах значительно подверженных заболеванию существуют рекомендации против определенных комбинаций сорта и подвоя [21].
Проведен ряд работ по изучению устойчивости подвоев яблони, а также их комбинации с сортами [20, 22-24]. Установлено, что значительная часть наиболее распространенных клоновых подвоев (М9, М26, серия Р, серия Ottava) восприимчивы к болезни. Это относится как к отдельному растению подвоя, так и привойно-подвойной комбинации [21, 23, 25].
Однако незначительно уделено внимание подвоям российской селекции. Отсутствуют отечественные исследования по данной тематике, в том числе и по молекулярной диагностики и скринингу коллекций. Из всего многообразия существующего сортимента клоновых подвоев российской селекции наиболее изученным остается В9. В литературе его устойчивость к бактериальному ожогу оценивают неоднозначно. При заражении в искусственных условиях В9 показывает высокую восприимчивость к патогену. Однако в полевых условиях и в сорто-подвойных комбинациях он проявляет значительную устойчивость, которая возрастает с возрастом растения. Возможно, что подвой В9 обладает иными механизмами сопротивления возбудителю, которые еще не выявлены или устойчивость имеет сложный полигенный характер [22, 26].
Целью данного исследования было изучение коллекции клоновых подвоев яблони Мичуринского ГАУ с использованием молекулярным маркеров для идентификации QTL устойчивости к бактериальному ожогу.
Для проведения анализа были использованы ранее созданные маркеры для идентификации FBF7 QTL [1]. Авторы оригинальной статьи провели анализ стабильности действия этого QTL на контрастных формах с различной степенью устойчивости, которая проверялась путем инокуляции возбудителем болезни. Было установлено, что генотипы, которые несут оба маркера, были более устойчивыми, чем те у которых они отсутствуют. Воспроизводимость полученных результатов дает возможность использовать их для отбора генисточников и создания новых генотипов, устойчивых к заболеванию, методом маркер-опосредованной селекции.
Для всех исследуемых нами образцов из коллекции Мичуринского ГАУ получены четкие воспроизводимые фрагменты.
Всего было проанализировано 20 генотипов яблони (табл. 4).
В результате идентификации маркера GE-8019 получен фрагмент размером 397 п.н. (рис. 5), что соответствует ожидаемому результату. В качестве контроля использовали сорт яблони Remo, наличие фрагмента у которого, определено в оригинальной работе.
Наличие маркера АЕ10-375 характеризуется присутствием фрагмента размером 375 п.н. при амплификации ДНК (рис. 6).
Таблица 4 – Результаты анализа FBF7 QTL у клоновых подвоев яблони
| №
п/п |
Генотип | GE-8019
397 п.н. |
АЕ10-375
375 п.н. |
CH-F7-FB1 | |
| 174 п.н. | 210 п.н. | ||||
| 1 | 87-7-12 | 0 | 0 | 1 | 0 |
| 2 | 76-3-6 | 0 | 0 | 1 | 0 |
| 3 | 70-20-20 | 0 | 0 | 1 | 0 |
| 4 | ПБ | 0 | 0 | 1 | 0 |
| 5 | 57-491 | 0 | 0 | 1 | 0 |
| 6 | 71-7-22 | 0 | 0 | 1 | 0 |
| 7 | МБ | 0 | 0 | 1 | 0 |
| 8 | 54-118 | 0 | 0 | 1 | 0 |
| 9 | 62-396 | 1 | 1 | 1 | 0 |
| 10 | 83-1-15 | 0 | 0 | 1 | 0 |
| 11 | 2-12-10 | 0 | 0 | 1 | 0 |
| 12 | 2-15-2 | 0 | 1 | 1 | 0 |
| 13 | 3-4-7 | 0 | 1 | 1 | 0 |
| 14 | 14-1 | 0 | 1 | 0 | 1 |
| 15 | 4-6-5 | 0 | 1 | 1 | 0 |
| 16 | 2-9-12 | 1 | 1 | 1 | 0 |
| 17 | M. sieboldii | 0 | 1 | 1 | 0 |
| 18 | 16-1 | 1 | 1 | 1 | 0 |
| 19 | G16 | 0 | 0 | 1 | 0 |
| 20 | 70-20-21 | 0 | 0 | 1 | 1 |
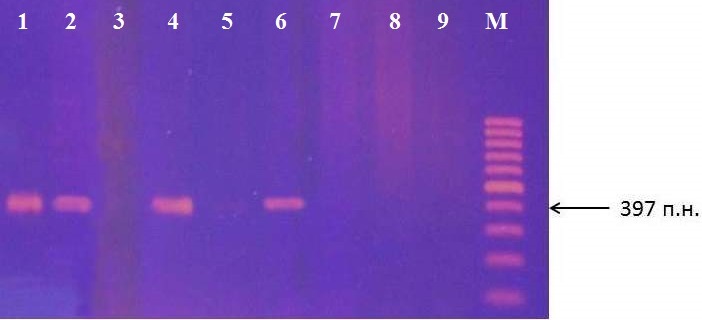
Рисунок 5 – Идентификация маркера GE-8019 у клоновых подвоев яблони: 1 – сорт Remo; 2 – 62-396; 3 – 54-118; 4 – 2-9-12; 5 – 14-1; 6 – 16-1; 7 – 87-7-12; 8 – 76-3-6; 9 – 70-20-20; М – маркер молекулярного размера (100 п.н.)
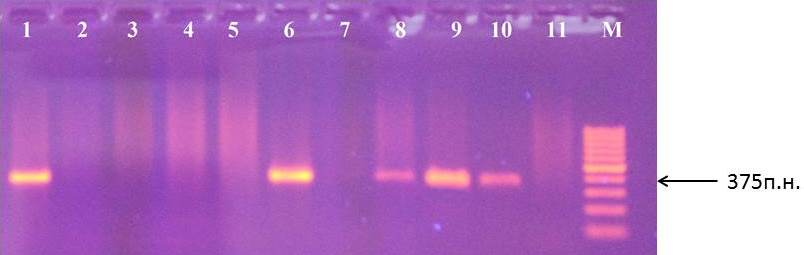
Рисунок 6 – Идентификация маркера АЕ10-375 у клоновых подвоев яблони: 1 – сорт Remo; 2 – 87-7-12; 3 – 76-3-6; 4 – 70-20-20; 5 – ПБ; 6 – 62-396; 7 – 83-1-15; 8 – 2-15-2; 9 – 3-4-7; 10 – 14-1; 11 – 70-20-21; М – маркер молекулярного размера (100 п.н.)
Наличие третьего микросателлитного маркера CH-F7-FB1 характеризуется амплификацией фрагментов ДНК размерами 174 п.н. или 210 п.н. (рис. 7).
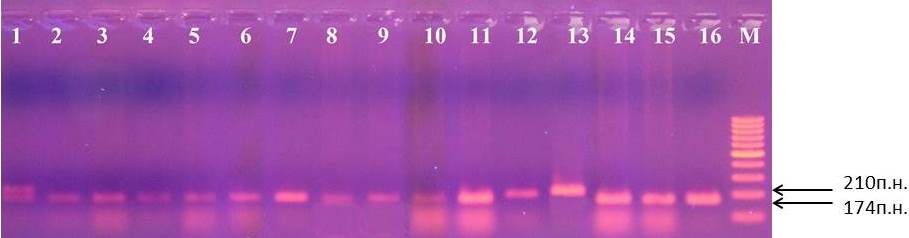
Рисунок 7 – Идентификация маркера CH-F7-FB1 у клоновых подвоев яблони: 1 – 70-20-21; 2 – G16; 3 – 16-1; 4 – 2-9-12; 5 – 4-6-5; 6 – 2-15-2; 7 – 2-12-10; 8 – 62-396; 9 – 54-118; 10 – МБ; 11 – 71-7-22; 12 – 57-491; 13 – 14-1; 14 – ПБ; 15 – 3-4-7; 16 – 70-20-20; М – маркер молекулярного размера (100 п.н.)
Наличие FBF7 QTL в генотипе яблони характеризует наличие минимум двух маркеров GE-8019 и АЕ10-375. Они фланкируют область генома в которой расположен локус количественных признаков. Маркер CH-F7-FB1 расположен внутри анализируемого QTL и является дополнительным маркером, что подтверждает точность идентификации. Наличие всех трех маркеров предполагает наличие устойчивости к бактериальному ожогу [1].
Анализ полученных данных позволил выявить различные комбинации исследуемых маркеров, что не совпадает с данными из оригинальной статьи. Наличие всех трех маркеров отмечено только у форм 62-396, 16-1 и 2-9-12. У остальных генотипов не выявлено маркера GE-8019. При этом второй фланкирующий маркер АЕ10-375 идентифицирован у восьми форм клоновых подвоев. Микросателлитный локус CH-F7-FB1 присутствует у всех исследуемых подвоев. Однако здесь отмечен полиморфизм. У большинства генотипов присутствует фрагмент 174 п.н., но у двух из 20 форм выявлен фрагмент 210 п.н. Клоновый подвой 70-20-21 является гетерозиготным по этому локусу, т.к. у него амплифицировались оба фрагмента. В предыдущих работах таких генотипов не встречалось. В анализируемой коллекции также отмечены образцы, имеющие только микросателлит: 70-20-21, G16, 2-12-10, 83-1-15, 54-118, МБ, 71-7-22, 57-491, ПБ, 70-20-20, 76-3-6, 87-7-12.
В целом о наличии QTL устойчивости к бактериальному ожогу позволяет говорить только наличие обоих маркеров, фланкирующих локус. Влияние только одного маркера ранее не было изучено [1, 16, 18] и требует проведения дальнейших исследований по поиску дополнительных маркеров. Полученные нами данные анализа клоновых подвоев не всегда совпадают с оригинальными. Возможно, это связано с тем, что данная система маркеров была разработана на основе анализа генома культурных сортов. Большинство анализируемых нами клоновых подвоев являются производными дикорастущих видов яблони, вероятно имеющих иной механизм устойчивости. Поэтому для поиска генисточников данного признака требуется дальнейшие исследования с использованием других систем маркирования QTL или разработка новых ДНК-маркеров с привлечением данных по сиквенированию широкого спектра геномов яблони, включая геномы дикорастущих видов.
Для оценки степени проявления признака устойчивости к бактериальному ожогу у клоновых подвоев яблони были проведены исследования с использованием различных способов искусственного заражения растений в лабораторных условиях. Были сопоставлены результаты молекулярного анализа и восприимчивости растений к возбудителю заболевания и его метаболитам. Работа проведена совместно с ФГБУ «Всероссийский центр карантина растений» (ФГБУ «ВНИИКР»).
В результате проведенных исследований было выявлено, что результаты молекулярно-генетического анализа в большей степени согласуются с данными полученными на основании заражения побегов яблони суспензией E. amylovora, а также изучения устойчивости тканей листа к метаболитам патогена в условиях in vitro.
Метод искусственного заражения суспензией бактерии не всегда дает достоверную информацию об устойчивости исследуемых генотипов, так как на процесс заражения растительных тканей, развитие патогена и синтез метаболитов в них, влияет множество факторов: температурный режим, влажность, общий микробный фон, степень зрелости тканей, физиологическое состояние растения-хозяина и патогена и др.
Так по данным опытов с искусственным заражением листьев суспензией E. amylovora формы 70-20-20 (без исследуемых фрагментов), 54-118, 70-20-21, МБ, 57-491, 76-3-6, ПБ (с локусами CH-F7-FB1 174 п.н. и/или 210 п.н.), 14-1 и M. sieboldii (с локусами АЕ10-375 и CH-F7-FB1 174 п.н.), а также 62-396 (с локусами GE-8019, АЕ10-375 и CH-F7-FB1 174 п.н.) попали в группу с низкой степенью некрозности листьев до 1 балла (табл. 5).
Таблица 5 – Ранжирование сортов и подвойных форм яблони по степени некрозности листьев, зараженных суспензией E. amylovora методом «ножниц»
| 0 – 1,0 балл | 1,1 – 2,0 балла | 2,1 – 3,0 балла |
| M. sieboldii
62-396 54-118 70-20-21 МБ 14-1 Мелба 70-20-20 57-491 76-3-6 |
87-7-12
Богатырь Антоновка |
83-1-15 |
Симптомы болезни на листьях при заражении методом «аппликатора» развивались слабо, что не дало четкой картины и возможности ранжировать генотипы по степени устойчивости к E. amylovora.
При заражении побегов патогенной бактерией наблюдалось распространение некроза от его вершины к основанию. Наибольшая длина пораженного участка была отмечена у форм 70-20-20 (без исследуемых фрагментов), МБ и 54-118 (с локусом CH-F7-FB1) и в среднем составила 4,8 см, 5,6 см и 6,8 см соответственно. У генотипа 62-396 (с локусами GE-8019, АЕ10-375 и CH-F7-FB1) степень некрозности побега была ниже – на уровне 4,0 см (рис. 8).
Клоновый подвой 57-491 только с локусом CH-F7-FB1 174 п.н. имел наименьшее значение длины некроза побега. Такое неоднозначной распределение значений вероятно связано со сложной генетической структурой устойчивости к бактериальному ожогу у яблони и проявления данного признака.
Дифференциация сортов по признаку устойчивости к метаболитам бактерии E. amylovora была отмечена на среде с содержанием фильтрата культуральной жидкости бактерии 20%. Различия между другими вариантами опыта были в пределах ошибки среднего значения (рис. 9).
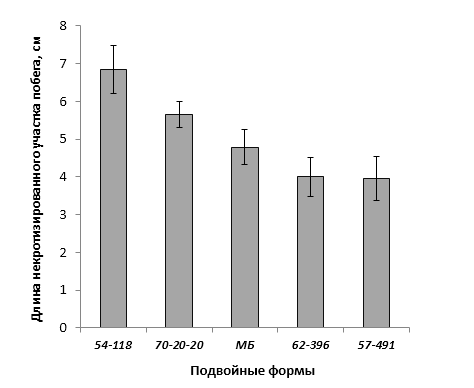
Рисунок 8 – Длина некротизированного участка побега после искусственного заражения суспензией E. amylovora
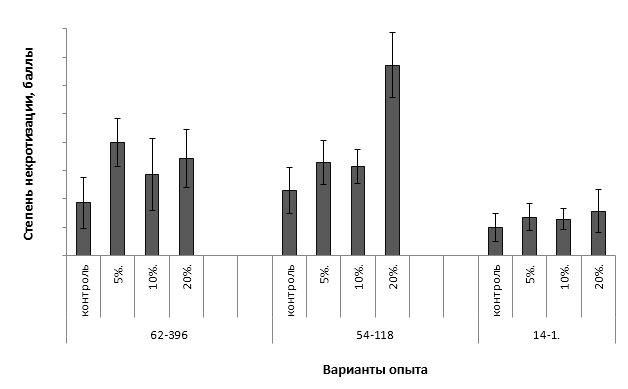
Рисунок 9 – Степень некротизации листовых эксплантов подвойных форм яблони на средах с различным содержанием метаболитов E. amylovora
Среди исследуемых подвойных форм генотип 54-118 проявил себя как неустойчивый. У него был отмечен высокий балл поражения листовых эксплантов, превышающий контрольное значение более чем в 3 раза.
У форм 62-396 и 14-1 на средах с токсином отмечался более высокая степень некрозности по сравнению с контролем, но данная реакция скорее всего связана с действием неспецифических токсических метаболитов бактерии E. amylovora.
Таким образом, проведенные исследования свидетельствуют о том, что наличие локусов АЕ10-375 и CH-F7-FB1 у исследуемых подвойных форм обеспечивает фенотипическое проявление признака устойчивости к E. amylovora.
2.1.2 Идентификация генисточников устойчивости к парше яблони
Эффективным повышением конкурентоспособности отрасли садоводства является ее переход к современным интенсивным технологиям возделывания плодовых растений. Интенсивное садоводство позволяет максимально использовать земельные ресурсы для получения высоких урожаев. При этом необходимо учитывать как сортовую специфичность возделываемых культур, так и генетические особенности используемых подвоев.
Для интенсивных насаждений яблони наиболее перспективно использование клоновых подвоев. Возделывание садов на таких подвоях имеет ряд преимуществ, а именно: раннее вступление в плодоношение, быстрое наращивание урожая, более удобные способы механизации и ухода за растениями, а также высокая окупаемость затрат [27].
Одной из важнейших характеристик посадочного материала яблони является устойчивость к неблагоприятным биотическим и абиотическим стрессорам. Современные технологии садоводства требуют использовать подвойные формы с высокой степенью устойчивости к основным возбудителям заболеваний.
Самой распространенной болезнью яблони является парша, вызываемая грибом Venturia inaequalis (Cocke) Wint. В питомниках и маточных насаждениях из-за развития болезни не всегда удается вырастить стандартные подвои, так как загущенное расположение растений в школке ведет к массовому поражению паршой, в связи с этим происходит ухудшение состояние подвоев вплоть до их полной гибели. В связи с этим отбор устойчивых к парше подвоев яблони весьма актуален [27].
Существующий сортимент клоновых подвоев яблони характеризуется значительным разнообразием и вариабельностью; при этом генетические аспекты формирования важнейших признаков подвойных форм, особенно отечественной селекции, изучены недостаточно, что затрудняет целенаправленное конструирование новых генотипов с заданными параметрами признаков.
Современные методы молекулярной биологии существенно пополнили методы селекции растений. Широкое распространение получил метод молекулярных маркеров.
У яблони было выявлено более 20 основных генов устойчивости к парше. Они отмечены как у различных сортов, так и у дикорастущих сородичей. Из всех этих генов Rvi6, полученный из Malus floribunda, наиболее широко используется в различных селекционных программах. Полигенная устойчивость на основе QTL также характерна для яблони. Молекулярные маркеры, связанные с большинством основных генов устойчивости к парше, были идентифицированы, и их положение было картировано в различных группах сцепления [9, 32-42]. Активно ведутся работы по изучению генетических коллекций и созданию резистентных сортов яблони в различных странах: Франции [43], Испании [44], Иране [45, 46], Беларуси [47, 48], России [49-53].
Незначительно уделяется внимание изучению устойчивости клоновых подвоев яблони на генетическом уровне. При этом такие сведения могут быть актуальны для селекционера. Создание устойчивых форм подвоев является актуальным при стремительно изменяющемся инфекционном фоне и появлении новых рас возбудителей. Интерес представляет и создание сортоподвойной комбинации полностью иммунной к парше.
Целью нашей работы был анализ генетической коллекции клоновых подвоев яблони селекции Мичуринского ГАУ с использованием молекулярного маркера гена устойчивости к парше.
Для выявления распространения гена в анализируемой коллекции сортов и форм яблони применяли STS-маркер VfC, разработанный Afunian M.R. Он разработан на основе консервативных последовательностей HcrVf паралогов и является внутригенным. Надежность его высока, так как рекомбинация между геном и маркером отсутствует [32]. Данный маркер очень часто применяется для анализа генетических коллекций и маркер-опосредованной селекции [43, 45, 46, 48, 49].
Всего в работе было проанализировано 32 генотипа клоновых подвоев яблони (табл. 6).
При проведении реакции с праймерами VfC1 и VfC2 амплифицируются три фрагмента, которые соответствуют участкам генов Vfa1, Vfa2 и Vfa4 размерами 646, 484 и 286 п.н. соответственно (рис. 10) [32]. Большинство исследований показывают, что непосредственно геном Rvi6 (Vf), ответственным за устойчивость к заболеванию паршой, является ген Vfa4 [32, 54].
Таблица 6 – Результаты анализа гена Rvi6 у клоновых подвоев яблони
(1 – наличие аллеля, 0 – отсутствие аллеля)
| №
п/п |
Генотип | Размер фрагмента, п.н. | ||
| 484 | 646 | 400 | ||
| 1 | 87-7-12 | 1 | 1 | 1 |
| 2 | 76-3-6 | 1 | 1 | 0 |
| 3 | 70-20-20 | 1 | 1 | 0 |
| 4 | ПБ | 1 | 1 | 0 |
| 5 | 57-491 | 1 | 1 | 0 |
| 6 | 71-7-22 | 1 | 1 | 0 |
| 7 | МБ | 0 | 1 | 0 |
| 8 | 54-118 | 1 | 1 | 0 |
| 9 | 62-396 | 1 | 1 | 0 |
| 10 | 83-1-15 | 0 | 1 | 0 |
| 11 | 2-12-10 | 1 | 1 | 0 |
| 12 | 2-15-2 | 1 | 1 | 0 |
| 13 | 3-4-7 | 1 | 1 | 0 |
| 14 | 14-1 | 1 | 1 | 1 |
| 15 | 4-6-5 | 1 | 1 | 1 |
| 16 | 2-9-102 | 1 | 1 | 0 |
| 17 | 76-1 | 1 | 1 | 0 |
| 18 | G16 | 1 | 1 | 0 |
| 19 | 70-20-21 | 1 | 1 | 0 |
| 20 | 2-12-15 | 1 | 1 | 0 |
| 21 | 2-9-49 | 1 | 1 | 0 |
| 22 | 2-3-49 | 1 | 0 | 0 |
| 23 | 9-1-9 | 1 | 0 | 0 |
| 24 | 9-1-2 | 0 | 1 | 0 |
| 25 | 9-1-1 | 1 | 0 | 0 |
| 26 | 9-1-3 | 1 | 1 | 0 |
| 27 | 4-2-5 | 1 | 0 | 0 |
| 28 | 5-21-27 | 1 | 1 | 0 |
| 29 | 9-1-4 | 1 | 1 | 0 |
| 30 | 9-1-5 | 1 | 1 | 0 |
| 31 | 2-3-8 | 1 | 1 | 0 |
| 32 | 2-3-17 | 1 | 1 | 0 |
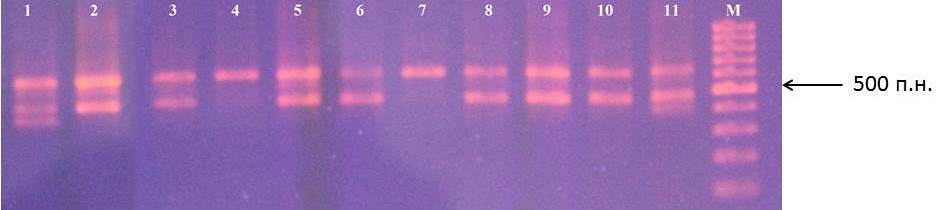
Рисунок 10 – Идентификация гена Rvi6 у клоновых подвоев яблони: 1 – 87-7-12; 2 – 70-20-20; 3 – ПБ; 4 – 2-3-49; 5 – 57-491; 6 – 71-7-22; 7 – 9-1-9; 8 – 2-9-49; 9 – 2-15-15; 10 – 16-1; 11 – 14-1; М – маркер молекулярного размера (100 п.н.)
Фрагменты геновVfa1, Vfa2 присутствуют у большинства исследуемых образцов. Данные гены экспрессируются только в молодых листьях. Во взрослом состоянии в листьях экспрессируется лишь ген Vfa4 [32]. Наличие фрагмента гена Vfa4, а, следовательно, и гена Rvi6, идентифицировано у анализируемых образцов клоновых подвоев яблони не было. Практически у всех форм подвоев (29 образцов) выявлено наличие фрагмента размером 646 п.н. (Vfa1). Для 28 образцов характерно наличие фрагмента размером 484 п.н. (Vfa2). Отмечены генотипы с идентифицированным только одним фрагментом. Так фрагмент 646 п.н. присутствует только у подвоев МБ, 83-1-15 и 9-1-2, а у подвоев 2-3-49, 9-1-9, 9-1-1, 4-2-5 удалось обнаружить только фрагмент 484 п.н. Кроме того у исследуемых образцов идентифицированы и иные фрагменты, не отмеченные в предыдущих работах. Так у клоновых подвоев 87-7-12, 14-1 и 4-6-5 присутствует фрагмент, ориентировочный размер которого 400 п.н. Возможно он является еще одним локусом гена Rvi. Однако это требует дальнейшего проведения исследований.
Анализ коллекции показал отсутствие гена Rvi6 у клоновых подвоев яблони. У всех исследуемых образцов нет фрагмента размером 286 п.н., что соответствует искомому гену.
Таким образом, проведенные исследования не выявили генисточники признака устойчивости к парше у клоновых подвоев яблони. Ген Rvi6 у анализируемых форм не был выявлен.
2.1.3 Апробация существующих молекулярных маркеров генов самонесовместимости яблони и оценка их возможности использования в селекционном процессе
В селекционной работе высокую актуальность имеет вопрос подбора родительских пар и их совместимости. От этого зависит успешность гибридизации и количество полученных гибридных форм.
Все цветковые растения можно разделить на две группы: самосовместимые – это растения-самоопылители и некоторые перекрестно опыляемые растения и самонесовместимые, перекрестно опыляемые растения.
Самонесовместимость при опылении – важнейший механизм, предотвращающий самооплодотворение покрытосеменных растений. Генетический контроль этого явления изучается более 70 лет, однако, из-за высокой вариабельности систем между таксонами и трудоёмкости опытов точные данные о числе генов и аллелей самонесовместимости, а также характере их взаимодействия для большинства видов и родов растений до сих пор неизвестны. Несмотря на прогресс последних лет, достигнутый с помощью молекулярных методов, классические методы генетического анализа остаются адекватными в изучении систем самонесовместимости. В изучении генетики многолетних, с длительным ювенильным периодом, растений имеется сложность – невозможно в разумные сроки получать самоопылённые линии, гибриды второго и даже первого поколения в специально поставленных скрещиваниях [55, 56].
Яблоня относится к самонесовместимым растениям. Для нее характерна гомоморфная гаметофитная самонесовместимость. Этот тип самонесовместимости характеризуется однородностью популяции в отношении морфологических признаков цветка и наличием генетической системы, контролирующей прорастание пыльцы и рост пыльцевых трубок в тканях пестика таким образом, что пыльца сорта – перекрёстноопылителя получает преимущество при оплодотворении по сравнению с собственной [55].
Самонесовместимость яблони детерменируется мультиаллельным локусом S, локализованном на 17-й хромосоме [57]. Разнообразие по S-аллелям отмечено как для культурных сортов, так и для дикорастущих видов [58].
Генетический механизм самонесовместимости основан на взаимодействии S-локуса пыльцы одного растения и S-локуса пестика другого. Если гаплотип пыльцы совпадает с гаплотипом пестика, то пыльца распознается как собственная и отклоняется. При этом включается ген S пестика, кодирующий рибонуклеазу (S-РНКазу) и несколько гомологичных SFBB (S locus F-box brothers) генов пыльцы, кодирующих особые белки (F-box proteins), специфическое взаимодействие которых при совпадении аллельных вариантов блокирует прорастание пыльцы на рыльце пестика, препятствуя тем самым самоопылению. Несовместимая пыльца воспринимается как цитотоксин и прорастание ее прекращается [1, 59, 60, 65].
В зависимости от комбинации S-аллелей сорта яблони могут быть полностью несовместимыми, полусовместимыми или полностью совместимыми [61]. Полная несовместимость возникает, когда S-аллели между родителями идентичны; полусовместимость возникает, когда один S-аллель отличается; и полная совместимость происходит, когда оба S-аллеля различаются [61]. К настоящему времени для яблони идентифицировано около 50 S-аллелей (S1—S47) [57].
Для большинства известных аллелей гена S разработаны и апробированы молекулярные маркеры, которые успешно можно применять для селекционной работы и анализа генетических коллекций. Основная работа по изучению разнообразия яблони по данному гену выполнена на сортовых коллекциях. Так Ларсеном была проанализирована коллекция большинства европейских сортов (432 генотипа) с использованием ранее созданных молекулярных маркеров, а также разработана собственная система мультиплексной ПЦР для скрининга [57]. Аллели S1—S28 анализированы у наиболее распространенных и редких европейских сортов яблони Брутхарстом [2]. Есть исследования подтверждающие сцепленное наследование отдельных аллелей генов S с геном устойчивости к парше Rvi5, что имеет значение для селекционной работы и пирамидирования генов [62].
Значительное внимание уделяется изучению дикорастущих видов Malus Mill. [58]. Наиболее изучены M. sieversii и M. sylvestris, как ближайшие предки современных сортов [57, 60].
Изучены и отечественные коллекции сортов яблони [4, 52, 63].
Недостаточно исследований, посвященных анализу генов самонесовместимости у клоновых подвоев яблони. Однако это является важным аспектом в селекционной работе, например, при подборе родительских пар. Кроме того, знания об аллельном составе генов S позволит оценить филогенетические отношения подвоев, сортов и дикорастущих видов рода Malus, что связано с высоким полиморфизмом гена самонесовместимости.
Целью нашей работы была оценка существующей системы молекулярных маркеров гена самонесовместимости и возможность использования ее в селекционной работе по созданию новых форм клоновых подвоев яблони.
Чаще всего для анализа генетических коллекций рода Malus и идентификации гена самонесовместимости используют ДНК-маркеры, разработанные Broothaerts [2]. Эти маркеры мы применяли для анализа коллекции клоновых подвоев яблони.
В рамках исследований был проведен поиск аллелей S1—S3 в коллекции клоновых подвоев яблони. Анализ литературы показал, что эти аллели являются наиболее распространенными у представителей рода Malus [2, 4, 58].
В геноме изученных клоновых подвоев отмечены все три типа целевых аллеля (табл. 7).
Таблица 7 – Распределение аллелей генов самонесовместимости у клоновых подвоев яблони (1 – наличие аллеля, 0 – отсутствие аллеля)
| №
п/п |
Генотип | S1
(530 п.н.) |
S2
(449 п.н.) |
S3
(500 п.н.) |
| 1 | 76-3-6 | 1 | 0 | 0 |
| 2 | 70-20-20 | 0 | 0 | 0 |
| 3 | ПБ | 1 | 0 | 1 |
| 4 | 57-491 | 0 | 0 | 0 |
| 5 | 71-7-22 | 0 | 1 | 0 |
| 6 | МБ | 0 | 0 | 1 |
| 7 | 54-118 | 0 | 0 | 1 |
| 8 | 62-396 | 1 | 0 | 0 |
| 9 | 83-1-15 | 1 | 0 | 1 |
| 10 | 2-12-10 | 1 | 0 | 1 |
| 11 | 2-15-2 | 1 | 0 | 0 |
| 12 | 3-4-7 | 0 | 0 | 0 |
| 13 | 14-1 | 0 | 0 | 1 |
| 14 | 4-6-5 | 0 | 0 | 0 |
| 15 | 2-9-102 | 0 | 1 | 0 |
| 16 | 76-1 | 0 | 0 | 0 |
| 17 | G16 | 0 | 1 | 0 |
| 18 | 70-20-21 | 0 | 0 | 0 |
| 19 | 76-3-6 | 0 | 0 | 0 |
| 20 | 2-12-15 | 0 | 1 | 0 |
| 21 | 2-15-15 | 0 | 0 | 0 |
| 22 | 2-3-49 | 0 | 0 | 0 |
| 23 | 9-1-9 | 0 | 0 | 0 |
| 24 | 9-1-2 | 0 | 0 | 0 |
| 25 | 9-1-1 | 0 | 0 | 0 |
| 26 | 9-1-3 | 0 | 0 | 0 |
| 27 | 4-2-5 | 0 | 0 | 0 |
| 28 | 5-21-27 | 0 | 0 | 0 |
| 29 | 9-1-4 | 0 | 0 | 0 |
| 30 | 9-1-5 | 0 | 0 | 0 |
| 31 | 2-3-8 | 0 | 0 | 0 |
| 32 | 2-3-17 | 1 | 0 | 0 |
| 33 | 2-9-49 | 0 | 1 | 0 |
| 34 | 87-7-12 | 0 | 0 | 0 |
На рисунках 11-12 представлены результаты идентификации аллеей S2 и S3 в геноме подвоев яблони.
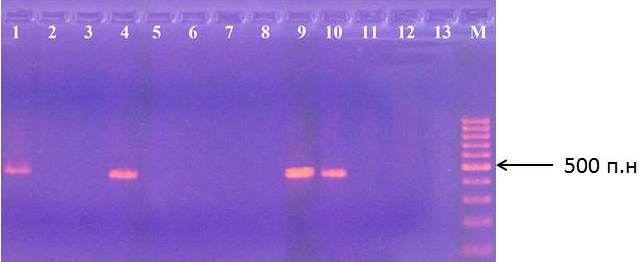
Рисунок 11 – Идентификация аллеля S2 у клоновых подвоев яблони: 1 – сорт Golden Delicious; 2 – ПБ; 3 – 57-491; 4 – 71-7-22; 5 – 2-15-2; 6 – 3-4-7; 7 – 14-1; 8 – 4-6-5; 9 – 2-9-102; 10 – G16; 11 – 2-15-15; 12 – 2-3-49; 13 – 9-1-9; М – маркер молекулярного размера
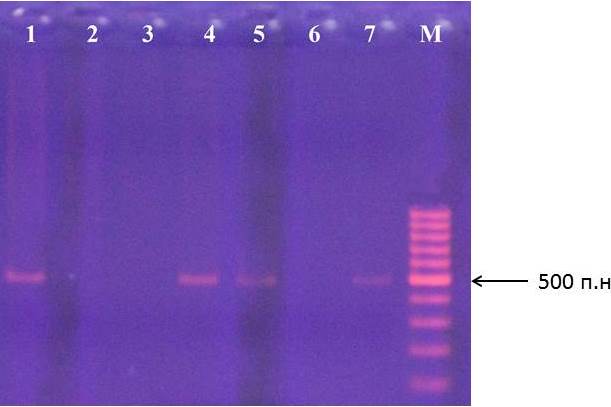
Рисунок 12 – Идентификация аллеля S3 у клоновых подвоев яблони: 1 – сорт Golden Delicious; 2 – 57-491, 3 – 71-7-22, 4 – ПБ, 5 – 54-118, 6 – 62-396, 7 – 83-1-15, М – маркер молекулярного размера
В качестве стандарта наличия аллелей S2 и S3 и протекании реакции использовали сорт Golden Delicious, аллельный состав S-локуса которого определен ранее. Стандартом по аллелю S1 был сорт Fuji.
Как видно из таблицы 7, частота встречаемости аллелей примерно одинакова. Аллель S1 идентифицирован у 7 (20,6%) форм подвоев, S3 у 6 (17,6%), а S2 только у 4 (11,8%). Выявлен полный аллельный статус S-гена для форм ПБ, 83-1-15 и 2-12-10, у которых присутствуют аллели S1 и S3.
Комбинаций с вариантом S2 не отмечено. Для 16 генотипов не было идентифицировано ни одного из анализируемых аллелей, что требует проведение дополнительных исследований по другим S-аллелям.
Анализ происхождения подвойных форм позволяет предположить появление аллелей в анализируемых генотипах. У формы 54-118 отмечен только аллель S3. Подвой 83-1-15 получен отбором из комбинации скрещивания 64-143 х 54-118 [64]. Он является уже гетерозиготным и имеет генотип S1/S3, что указывает на гомозиготность второй родительской формы 64-143 по аллелю S1. Одинаковые аллели имеют подвои 62-396 и Парадизка Будаговского (ПБ). При этом ПБ является одной из родительских форм 62-396 (ПБ х 13-14).
Проведенные исследования позволили оценить молекулярные маркеры для возможности их использования в маркер-опосредованной селекции клоновых подвоев яблони. С их помощью был проведен анализ разнообразия клоновых подвоев яблони из коллекции Мичуринского ГАУ по отдельным аллелям гена самонесовместимости S. Благодаря полученным данным появляется возможность прогнозировать степень совместимости родительских форм при планировании комбинаций скрещивания. Выявлены три генотипа, имеющих одинаковый аллельный состав. Их использования в гибридных комбинациях будет вызывать затруднение в получении потомства из-за совпадения аллелей. Однако необходимо проведение дальнейшего молекулярно-генетического анализа по идентификации других известных аллелей гена самонесовместимости, что обусловлено большим разнообразием исследуемого гена.
Выводы по разделу 2.1 главы 2
Наличие локусов АЕ10-375 и CH-F7-FB1 у исследуемых подвойных форм обеспечивает фенотипическое проявление признака устойчивости к возбудителю бактериального ожога E. amylovora.
Среди изученных клоновых подвоев яблони ген Rvi6 устойчивости к парше не был выявлен.
Частота встречаемости аллелей гена самонесовместимости яблони при опылении примерно одинакова. Аллель S1 идентифицирован у 7 (20,6%) форм подвоев, S3 у 6 (17,6%), а S2 только у 4 (11,8%). Выявлен полный аллельный статус S-гена для форм ПБ, 83-1-15 и 2-12-10, у которых присутствуют аллели S1 и S3. Комбинаций с вариантом S2 не отмечено.
2.2 Разработка методик микроклонального размножения и регенерации адвентивных побегов новых генотипов клоновых подвоев яблони из соматических тканей
Современные интенсивные технологии возделывания плодовых и ягодных культур требуют большого количества высококачественного посадочного материала. Удовлетворить эти потребности может широкое внедрение новых технологий производства оздоровленного высококачественного посадочного материала. Получение здоровых растений-регенерантов из культивируемых in vitro верхушечных меристем является наиболее эффективным методом оздоровления от вирусов, хотя и не обеспечивает полного освобождения от них.
Метод клонального микроразмножения растений является неотъемлемой частью комплекса работ, направленных на получение оздоровленного посадочного материала через культуру апикальных меристем с применением термо- и хемотерапии. Он применяется также для ускоренного размножения ценных генотипов, в том числе, нетрадиционных садовых культур, новых перспективных сортов, гибридов на базе даже единичных исходных экземпляров. Без него невозможно проведение фундаментальных исследований по тканевой селекции и генетической инженерии растений.
В настоящее время этот метод широко используется в производстве посадочного материала сельскохозяйственных культур, для размножения культур промышленного цветоводства, тропических и субтропических растений, плодовых и ягодных культур, древесных растений [66-70].
Важнейшей задачей селекции сельскохозяйственных растений, в том числе и плодовых, является создание высокопродуктивных сортов, устойчивых к абиотическим и биотическим стрессовым факторам среды. Биотехнологические методы способствуют решению многих вопросов селекции растений и повышению эффективности растениеводства. Одним из таких методов является клеточная селекция, которая позволяет получать генотипы с повышенной резистентностью к засухе, засолению почв, экстремальным температурам, солям тяжелых металлов, болезням и некоторым другим факторам. При разработке таких клеточных технологий важно создать адекватную селективную систему для скрининга генотипов с желаемыми свойствами, подобрать оптимальный объект для селекции in vitro, питательные среды, условия для регенерации растений из устойчивых клеток и многое другое. На сегодняшний день не существует единых методических подходов, приемлемых для разных стрессовых факторов и разных видов растений. Особенно это касается многолетних плодовых культур, по которым практически нет полноценных методик тканевой селекции. Существует много теоретических и методологических проблем, с которыми сталкиваются исследователи при создании адекватных селективных систем на устойчивость к абиотическим факторам среды, в особенности при работе с многолетними древесными культурами. В литературе имеются различные данные, касающиеся используемых биотехнологических объектов и критериев отбора in vitro, особенностей селективных схем, длительности действия селективного фактора и др. [71, 72]. Подавляющее большинство работ выполнено на зерновых и технических культурах. Это определяет несомненную новизну и актуальность проводимых исследований.
Разработка эффективных методов регенерации адвентивных побегов из изолированных соматических тканей растений лежит в основе всех биотехнологических протоколов, направленных на усовершенствование сортов плодовых и ягодных культур. Важнейшими факторами, ответственными за эффективность морфогенеза, можно назвать генотип растения-донора, минеральный и гормональный состав среды регенерации и физиологическое состояние эксплантат [73, 74]. Применение дополнительных приемов, в том числе по предварительной подготовке эксплантов, направлено на повышение эффективности каллусообразования и органогенеза.
Высокую эффективность биотехнологических методов в селекции обеспечивает интеграция методических приемов по созданию новых генотипов с возможностями метода клонального микроразмножения растений, что в итоге значительно ускоряет селекционный процесс и делает его направленным.
Для плодовых древесных культур работы по усовершенствованию хозяйственно-ценных генотипов методами биотехнологии крайне немногочисленны. Это связано, главным образом, с трудностями индукции морфогенеза из клеток и тканей, прошедших длительное культивирование in vitro. Этим обусловлена актуальность работы по разработке эффективных методов культивирования и регенерации адвентивных побегов из изолированных соматических тканей клоновых подвоев яблони.
Таким образом, введение в культуру тканей лучших районированных слаборослых клоновых форм подвоев яблони, изучение их биологических особенностей в культуре in vitro, разработка методов индукции морфогенеза из изолированных соматических тканей, является обязательным этапом работ, направленных на получение улучшенных сомаклональных вариантов клоновых форм подвоев яблони.
Цель исследований: Оптимизировать методику клонального микроразмножения новых перспективных форм клоновых подвоев яблони селекции Мичуринского ГАУ. Провести скрининг морфогенетического потенциала новых форм клоновых подвоев на средах регенерации при культивировании листовых дисков и оценить действие селективного агента – хлорида натрия на растительные ткани в условиях in vitro.
Задачи исследований:
- Ввести в культуру изолированные зародыши гибридного потомства Malus sieboldii Rehd.
- Оптимизировать методику ускоренного размножения клоновых подвоев яблони селекции Мичуринского ГАУ в культуре in vitro и получить достаточное количество растительного материала, необходимого для проведения дальнейшей научно-исследовательской работы. Оптимизировать состав сред размножения и укоренения;
3. Оптимизировать состав сред для индукции каллусогенеза и регенерации адвентивных побегов клоновых подвоев яблони из листовых дисков.
4. Выявить генотипы с высокой регенерационной способностью, как варианты форм для дальнейшей работы по сомаклональной изменчивости клоновых подвоев яблони.
5. Изучить устойчивость к хлоридному засолению слаборослых клоновых подвоев яблони при культивировании на питательных средах, содержащих селективный агент NaCl в концентрации 0,2-1,2%.
Объекты, условия и методика проведения исследований
Биологическими объектами исследования служили районированные и новые клоновые подвои яблони селекции Мичуринского ГАУ: 54-118, 62-396, 57-545, 98-7-7, 2-12-10, 2-15-2, Парадизка Будаговского (ПБ), 2-14-2, 3-4-7, 2-3-49, 2-9-49, 2-9-102, 2-15-15, гибридные формы, полученные при спонтанном аутбридинге M. sieboldii, а также гибридные семена, полученные в результате направленных скрещиваний (комбинация 1 – Malus sieboldii x Малыш Будаговского; 2 – M. sieboldii x 60-160; 3 – M. sieboldii x 76-3-6).
Культивирование in vitro изолированных тканей клоновых подвоев яблони проводили согласно общепринятым рекомендациям [73] и использовали собственные варианты биотехнологических методик [97].
На этапе введения семена выделяли из созревших плодов, предварительно выдержанных 2-3 месяца при температуре +4°С.
Для стерилизации эксплантов использовали следующие схемы:
- Промышленный дезинфектант «Белизна» (NaOCl·5H2O – натрий хлорноватистокислый) / дистиллированная вода (1:1). Экспозиция 5 минут. Трёхкратная промывка автоклавированной дистиллированной водой (вариант 1, контроль);
- Препарат «Экоцид С» (1,0%), экспозиция 50 минут. Промышленный дезинфектант «Белизна» / дистиллированная вода (1:1). Экспозиция 5 минут. Трёхкратная промывка автоклавированной дистиллированной водой (вариант 2).
- Препарат «БиоПаг С» (0,4%), экспозиция 50 минут. Промышленный дезинфектант «Белизна» / дистиллированная вода (1:1). Экспозиция 5 минут. Трёхкратная промывка автоклавированной дистиллированной водой (вариант 3).
Для культивирования семян на этапе введения использовали минеральную основу питательной среды MS (Murashige, Skoog, 1962) с добавлением 0,5 мг/л 6-бензиламинопурина (6-БАП) и 0,1 мг/л β-индолилуксусной кислоты (ИУК). После посадки на питательную среду семена переносили в условия культуральной комнаты с температурой 24±2°С, освещенностью 2000-2500 люкс и фотопериодом 16 ч день/8 ч ночь.
На этапе микроразмножения использовали регуляторы роста растений: 6-бензиламинопурин (6-БАП) – 0,25-1,0 мг/л, гибберелловую кислоту (ГК) – 0,25-0,5 мг/л, β-индолил-3-масляную кислоту (ИМК) – 0,05-0,2 мг/л, β-индолилуксусную кислоту (ИУК) – 0,5-0,2 мг/л или α-нафтил-1-уксусную кислоту (НУК), а также комплекс витаминов по Мурасиге-Скугу.
Микрочеренки длиной более 1,5 см использовали для укоренения на оптимальных для каждой формы питательных средах. На этапе укоренения микрочеренков концентрацию макросолей и сахарозы снижали вдвое, в среду добавляли ИМК или ИУК в концентрации 0,5-1,0 мг/л. Растения культивировали при температуре 26±2°С и 8-часовом световом дне.
В опытах по индукции морфогенеза из изолированных тканей эксплантами служили высечки 4-5 верхних листьев с хорошо развитых побегов со среды размножения. Каждый лист нарезали поперечно центральной жилке на 2-3 кусочка площадью 0,5-1,0 см2. Культивировали высечки листовых пластинок в виде равнобедренного треугольника с черешками и средние части листовых пластинок.
Листовые диски помещали на питательные среды регенерации на основе питательной среды MS [75] с добавлением витаминов по Мурасиге-Скугу, глюкозы – 30 г/л, 6-БАП в концентрации 0,4-0,5 мг/л и ИУК, ИМК, НУК или 2,4-дихлорфеноксиуксусной кислоты (2,4-Д) в концентрации 0,5 мг/л. В опытах по регенерации листовые диски культивировали в темноте, при температуре 24°С. Эксперименты продолжались в течение 3-3,5 месяцев (3 пассажа по 4-5 недель каждый). Регенерировавшие побеги срезали с листовых пластинок и доращивали по стандартной схеме клонального микроразмножения растений.
2.2.1 Разработка методики микроклонального размножения новых генотипов клоновых подвоев яблони для их оздоровления от патогенной микробиоты
Введение в культуру гибридного потомства Malus sieboldii
Одними из видов растений-доноров хозяйственно-ценных признаков при получении подвойных форм является Malus sieboldii Rehd. Для селекции клоновых подвоев яблони в последние десятилетия возникает проблема получения форм, устойчивых к негативным биотическим факторам с повышенной солеустойчивостью.
Malus sieboldii относится к роду Malus, секции Sorbomalus, серии Toringonae (Rehd.) [76]. Тип серии: Malus sieboldii (Regel) Rehd. Серия Toringonae представлена одним полиморфным видом – М. toringo, который включает две экологически и морфологически обособленных разновидности. Malus toringo Siebold впервые была описана немецким ботаником-японологом П. Зибольдом (Р.F. Siebold, 1796-1866) по экземплярам, интродуцированным в 1856 г. из Японии [76].
Поскольку данный вид эволюционно старый и достаточно полиморфный, то периодически в литературе появляются противоречивые данные о цитогенетических особенностях его представителей. Вопрос о плоидности M. sieboldii остаётся открытым до настоящего времени. По данным L. Guo-lu, L. Xiao-lin [77, 78], эндемичный вид Китая является триплоидом (2n=51), а материнские клетки пыльцы (МКП) в мейозе содержат помимо бивалентов униваленты и триваленты. Позднее L. Guo-lu с коллегами [78] подтвердил наличие у M. sieboldii в соматических тканях 51 хромосомы и предположил, что этот вид является сегментарным аллотриплоидом. По данным Olden E.J. и Koch A. [79], апомиктичные формы M. sieboldii являются тетраплоидами (2n=68).
В исследовании Z. Jimei, S. Gardiner, M. Lay-Yee (1995) кариотипирование подвоя яблони А 106, который является отборной формой M. sieboldii Rehd., показало наличие диплоидной (2n=34) соматической ткани, и 17 бивалентов при синапсисе в мейозе. В связи с таким полиморфизмом, получение гибридного потомства у некоторых форм M. sieboldii может быть осложнено и требует дополнительно применения разных методов получения гибридного потомства, в первую очередь культуры ткани. В связи с этим, нашей задачей являлась оптимизация методов культуры зародышей для получения межвидовых гибридов Malus sieboldii Rehd.
Эффективность введения зависит от календарных сроков проведения работ, типа эксплантов, степени лигнификации растительного материала, а также от выбора стерилизующего агента и экспозиции стерилизации.
По данным М.А. Костюк, Л.Л. Бунцевич [80], наибольшая эффективность от стерилизации достигается при обработке эксплантов йодидом ртути. Выход жизнеспособных эксплантов составляет 82%, гибель от инфекции – 8%, некроз – 10%. При обработке 10% раствором «Белизны» выход жизнеспособных эксплантов снижается на 15% и составляет 67%, увеличивается гибель от инфекции (17%), повышается некроз эксплантов на 16%.
Е.Н. Беседина, Л.Л. Бунцевич [81] рекомендуют считать сроком введения эксплантов в культуру in vitro для подвоев яблони, когда они находятся в фазе распускания почек (для нашей зоны – конец марта-апрель), и в фазе интенсивного роста побегов (для нашей зоны май – июнь). При введении эксплантов в культуру они использовали высокотоксичный стерилизатор сулему, бытовой препарат «Белизна» в соотношении 1:2, а также фосфопаг. Наиболее подходила для культивирования подвоев яблони в их опытах среда с минеральным составом по прописи Мурасиге-Скуга, но при этом агар-агар был заменен на картофельный крахмал.
После введения гибридных семян M. sieboldii в стерильные условия наличие грибной инфекции зафиксировали на 5 сутки после посадки. Бактериальная инфекция проявилась на 10 сутки и в течении последующих 20 суток выявляли отдельные экспланты с признаками заражения.
В течение 4 недель из 130 гибридных семян (в трёх комбинациях) проросло только 2 шт. в комбинации Malus sieboldii x Малыш Будаговского. После указанного продолжительного этапа культивирования все возможные варианты экзогенной инфекции проявились (табл. 8).
В результате применения разных способов стерилизации установили, что дополнительная обработка препаратами «Экоцид С» и «БиоПаг» способствует увеличению доли стерильных эксплантов от 7,1% до 61,5% по сравнению с контролем. Наилучший вариант применения данных препаратов зафиксировали в гибридной комбинации Malus sieboldii x 76-3-6 (табл. 8).
Поскольку материнским растением во всех комбинациях скрещивания был один и тот же генотип – форма яблони Зибольда, то морфологические и биохимические особенности плодов были также одинаковыми для развития и накопления экзо- и эндогенной инфекции. В результате оценки стерилизации эксплантов во всех комбинациях скрещивания удалось подтвердить эффективность предложенных схем. Наилучшие результаты получены при сочетании препаратов «Экоцид С» (1,0%, 50 мин.) и «Белизна» (50%, 5 мин.).
Таблица 8 – Эффективность стерилизации гибридных семян M. sieboldii в зависимости от комбинации скрещивания
| Вариант стерилизации | Стерильные экспланты, % | Инфицированные экспланты, % | ||
| инфицированных от общего количества эксплантов, % | из них с
бактериальной инфекцией |
из них с
грибной инфекцией |
||
| Malus sieboldii x Малыш Будаговского | ||||
| 1 | 61,5 | 38,5 | 60,0 | 40,0 |
| 2 | 94,4 | 5,6 | 0 | 100 |
| 3 | 94,1 | 5,9 | 100 | 0 |
| Malus sieboldii x 60-160 | ||||
| 1 | 92,9 | 7,1 | 100 | 0 |
| 2 | 100 | 0 | ||
| 3 | 54,5 | 45,5 | 80 | 20 |
| Malus sieboldii x 76-3-6 | ||||
| 1 | 30,8 | 69,2 | 0 | 100 |
| 2 | 92,3 | 7,7 | 100 | 0 |
| 3 | 92,3 | 7,7 | 100 | 0 |
При использовании в качестве предобработки препарата «Экоцид С» зараженность составила 2,4% бактериальной и 2,3% грибной инфекции. «БиоПаг» снижает инфекцию до 12,2% и 2,4% соответственно.
Через 4 недели культивирования, после набухания семян, скальпелем отрезали примерно 1/3 семени со стороны семядолей. Через 4 суток после диссекции стерильные семена начали прорастать (рис. 13 в, г). В некоторых случаях образовывался только корень или побег, но затем в течении 2-3 недель формировалось полноценное растение.
Поскольку одной из задач исследований является получение краснолистных «маркерных» гибридных генотипов, то на этапе прорастания и развития зародышей произвели отбор данных форм. Так, на начальных этапах развития семян можно было фиксировать пигментированный корень (рис. 13, е) или в некоторых случаях каллусную ткань (рис. 13 ж, з). Через 14 дней культивирования семян после диссекции семядолей установили, что этот прием позволяет получить до 65,3% гибридных растений (максимально в комбинации Malus sieboldii x Малыш Будаговского) (рис. 14). Проросшие семена без диссекции служили контролем (4,2%). Наименьшее количество развивающихся зародышей зафиксировали в комбинации Malus sieboldii x 76-3-6 (55,0%), при полном отсутствии их развития в контроле (рис. 14).
 |
 |
| а | б |
 |
 |
| в | г |
 |
 |
| д | е |
 |
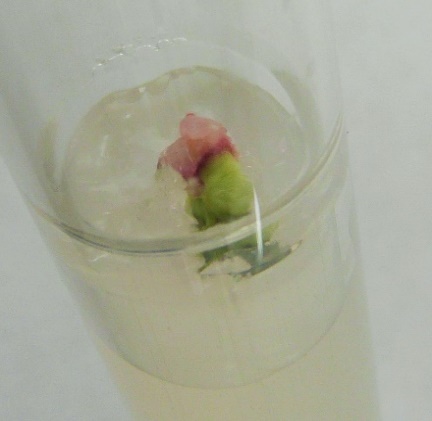 |
| ж | з |
| Рисунок 13 – Развитие гибридных зародышей Malus sieboldii на искусственной питательной среде после диссекции семядолей: а, б – семена после усечения дистальной части семядолей; в, г – прорастающие семена; д, е – формирование корней; ж, з – образование пигментированного каллуса | |
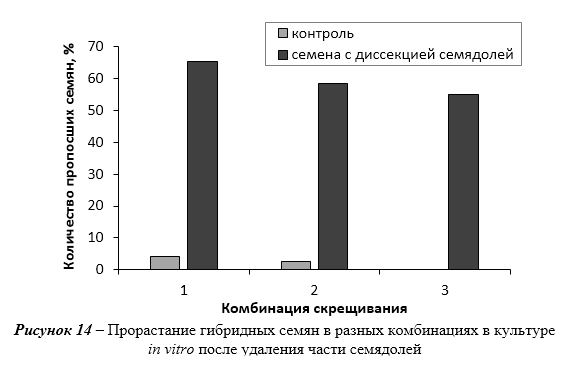 |
|
Анализ окраски полученных гибридных растений показал, что во всех трёх комбинациях образовались побеги как с антоциановой окраской, так и без антоциановой окраски (рис. 15). Расщепление составило 1:1.
Таким образом, установлено, что дополнительная предобработка препаратами «Экоцид С» (1,0%) и «БиоПаг» (0,4%) в течении 50 минут способствует получению стерильных эксплантов до 61,5% по сравнению с контролем. Применение диссекции семядолей гибридных семян позволяет получить в условиях in vitro до 65,3% гибридных растений по сравнению с 4,2% в контроле.
 |
 |
| а | б |
Рисунок 15 – Развитие гибридных растений Malus sieboldii с корнями и побегами на 20 сутки после диссекции семядолей: а – зеленолистная форма; б – краснолистная форма
Оптимизация методики клонального микроразмножения клоновых подвоев яблони
По литературным данным, клональное микроразмножение яблони можно осуществлять на разных питательных средах, в частности на средах Мурасиге-Скуга [75], Линсмайера-Скуга [82], Кворина-Лепуавра [83], Woody Plant Medium [84] и DKW [85-88]. В ходе исследований показано, что пролиферация побегов яблони происходит на большинстве изученных сред, однако на эффективность этого процесса (коэффициент пролиферации, размер побегов и их пригодность для последующего укоренения) влияет как минеральный и гормональный состав среды, так и морфобиологические особенности размножаемого сорта [85-88]. Поэтому оптимальный подбор состава среды применительно к особенностям конкретной формы является важным этапом разработки методики клонального микроразмножения сортов и подвоев яблони.
В результате проведенных ранее нами исследований было установлено, что для клонального микроразмножения клоновых подвоев яблони наиболее эффективно использовать среды Мурасиге-Скуга [75] и Кворина-Лепуавра [83]. Показано, что коэффициент размножения побегов клоновых подвоев яблони зависит, прежде всего, от генотипа и концентрации регуляторов роста в питательной среде.
Современное промышленное размножение плодовых культур в условиях in vitro невозможно без грамотного применения регуляторов роста. Отношение растений к типу, концентрации и способу применения экзогенного регулятора неоднозначно и требует уточнения для каждого конкретного случая.
В результате проведенных исследований изучена способность подвойных форм яблони к размножению в условиях in vitro при различных концентрациях 6-бензиламинопурина (6-БАП), гибберелловой кислотой (ГК) и одного из ауксинов в питательной среде. Показано, что для оптимального размножения достаточно использовать 6-бензиламинопурин в концентрации 0,5-1,0 мг/л. Этот синтетический цитокинин обеспечивает достаточно высокий коэффициент пролиферации побегов и их нормальное развитие in vitro. Использование более высоких концентраций БАП (свыше 3,0 мг/л) на этапе пролиферации приводит к формированию эксплантов с очень короткими побегами красноватого цвета, которые не пригодны для укоренения.
Ряд авторов считают, что для микроразмножения плодовых древесных культур целесообразно применять цитокинины и ауксины совместно. Например, D. Dunstan et al. (1985) показали, что микрорастения клонового подвоя яблони М4 на этапах введения в культуру и собственно микроразмножения образуют максимальное количество хорошо развитых побегов на среде, содержащей 1,15 мг/л БАП и 0,15-0,20 мг/л ИМК.
В наших исследованиях при концентрации 1,0 мг/л 6-бензиламинопурина (6-БАП) в сочетании с 0,5 мг/л гибберелловой кислоты (ГК) и 0,2 мг/л β-индолил-3-масляной кислоты (ИМК) на питательной среде MS средний коэффициент размножения у изучаемых подвойных форм составил: у ПБ 3,3; 2-15-2 – 3,0; 54-118 – 2,9; средняя длина побегов у ПБ –1,6 см, 2-15-2 – 1,8 см, 54-118 – 2,8 см. При снижении концентрации 6-БАП до 0,5 мг/л, в сочетании с 0,25 мг/л ГК и 0,1 мг/л, коэффициент размножения подвоя ПБ оказался равен 3,7 (при средней длине побегов 2,5 см); у подвоя 2-15-2 – 3,1 (длина побегов 2,5 см); у подвоя 54-118 – 3,2 (длина побегов 2,8 см). Побеги ровные, хорошо развиты, листовая пластинка большая, листья тёмно-зелёного цвета.
Коэффициент размножения на питательной среде QL при концентрации 6-БАП 0,5-1,0 мг/л составил у подвойных форм: ПБ – от 3,6 до 3,8; 2-15-2 – от 3,0 до 3,7; 54-118 – от 2,7 до 3,4. Длина побегов варьировала у ПБ в диапазоне от 1,7 до 2,0 см; у 2-15-2 – от 1,8 до 2,6 см; 54-118 – от 2,0 до 2,4 см. Побеги были более тонкие, вытянутые, листовые пластинки среднего размера, светло-зеленого цвета. Стабильно высоким коэффициентом размножения (4,5-5,7 новых побега за пассаж) характеризуются клоновые подвои Парадизка Будаговского, 54-118, 62-396, 98-7-7.
Модификация состава питательной среды по содержанию регуляторов роста не показала четкой зависимости коэффициента размножения от сочетания регуляторов роста (рис. 16). Для ряда генотипов максимальный коэффициент размножения получен на средах с ИУК. Добавление гибберелловой кислоты не влияло существенным образом на прирост побегов (рис. 17), но в некоторых случаях снижало их коэффициент размножения (рис. 16).
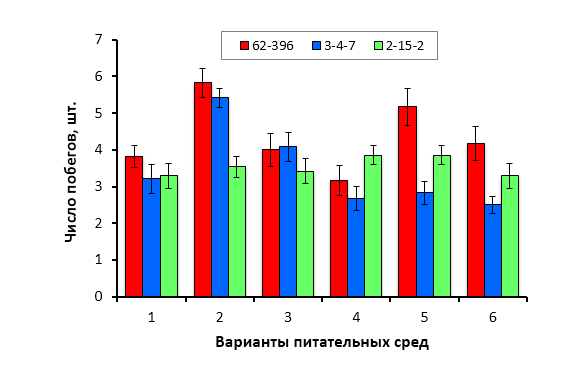
Рисунок 16 – Эффективность размножения клоновых подвоев яблони на средах с разным гормональным составом: 1 – 6-БАП – 0,5; ИМК — 0,1 мг/л; 2 – 6-БАП – 0,5, ИУК – 0,1 мг/л; 3 – 6-БАП – 0,5; НУК – 0,1 мг/л; 4 – 6-БАП – 0,5; ГК – 0,25; ИМК – 0,1 мг/л; 5 – 6-БАП – 0,5; ГК – 0,25; ИУК – 0,1 мг/л; 6 – 6-БАП – 0,5 мг/л; ГК – 0,25; НУК – 0,1 мг/л
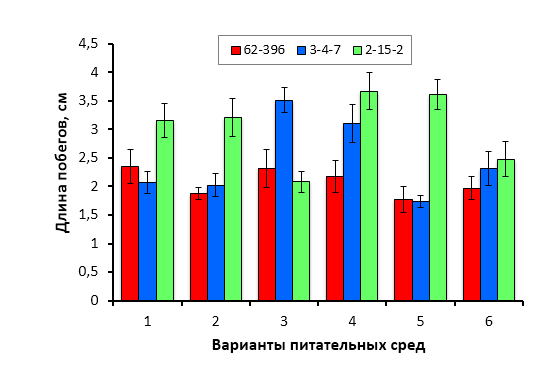
Рисунок 17 – Прирост побегов клоновых подвоев яблони на средах с разным гормональным составом: 1 – 6-БАП – 0,5; ИМК — 0,1 мг/л; 2 – 6-БАП – 0,5, ИУК – 0,1 мг/л; 3 – 6-БАП – 0,5; НУК – 0,1 мг/л; 4 – 6-БАП – 0,5; ГК – 0,25; ИМК – 0,1 мг/л; 5 – 6-БАП – 0,5; ГК – 0,25; ИУК – 0,1 мг/л; 6 – 6-БАП – 0,5 мг/л; ГК – 0,25; НУК – 0,1 мг/л
Интенсивность роста побегов также в значительной степени определялась генетическими особенностями культивируемого подвоя. Так, краснолистный подвой 98-7-7, при достаточно высоком коэффициенте размножения, отличался пониженной силой роста, формируя конгломераты побегов длиной 0,4-0,8 см на средах разного гормонального состава. Наоборот, клоновые подвои Парадизка Будаговского, 3-4-7 и 62-396 при высоком коэффициенте размножения формировали хорошо развитые побеги длиной 2,0-3,5 см (рис. 18). В целом, новые формы клоновых подвоев яблони селекции Мичуринского ГАУ достаточно успешно размножались в условиях in vitro (рис. 18). Для оптимального развития побегов требовались регулярные пересадки эксплантов на свежие среды – не реже, чем в 1,5-2 месяца. Перед этапом укоренения образовавшиеся конгломераты разделяли на отдельные побеги длиной 1,5-3,0 см и высаживали их на среды ризогенеза.
Важнейшим этапом исследований является изучение способности клоновых подвоев яблони к ризогенезу. Развитие корневой системы клоновых подвоев – один из важнейших критериев, обуславливающих хозяйственную ценность генотипа. Подбор стимуляторов роста является одним из важных факторов, обеспечивающих индукцию ризогенеза [89, 90]. При укоренении в условиях in vitro клоновых подвоев яблони оптимальной является концентрация ИМК в питательной среде 0,5 мг/л. При данной концентрации частота укоренения черенков генотипов 62-396, 2-12-10, 3-4-7, 16-1 составила от 86,3 до 100%.
В то же время отобраны генотипы, которые укоренялись с высокой эффективностью при концентрации ИМК в среде 0,25 мг/л и на средах без регуляторов роста. Форма 2-9-49 укоренялась на 95,5%, форма 2-12-10 на 90,1% на среде с 0,25 мг/л ИМК, тогда как контрольный подвой 62-396 на этой среде укоренился только на 75,8%. Более 90% черенков подвойной формы 2-9-102 и 84% микрочеренков формы 2-12-10 укоренялось даже без обработки стимулятором ризогенеза. Частота укоренения контрольного подвоя 62-396 варьировала от 75 до 78%.
Применение на этапе ризогенеза других ауксинов не изменило существенным образом показатели ризогенеза. Генотипы с высокой способностью к укоренению микрочеренков формировали развитую корневую систему как при использовании ИМК, так и ИУК и НУК (рис. 19).
Мы не рекомендуем использовать для укоренения подвоев яблони НУК, так как даже 0,125-0,25 мг/л этого ауксина вызывало образование каллуса на срезах побегов, а избыточное содержание этого ауксина в питательной среде (0,5-1,0 мг/л) приводит к интенсивному каллусообразованию, нарушению структуры корней и частичному оводнению побегов.
 |
 |
||
| 2-14-2 | 3-4-7 | ||
 |
 |
||
| 2-15-2 | 62-396 | ||
 |
 |
||
| Парадизка Будаговского | 98-7-7 | ||
| Рисунок 18 – Размножение клоновых подвоев яблони на среде QL при
концентрации 6-БАП 1 мг/л в сочетании с 0,5 мг/л ГК и 0,1 мг/л ИМК |
|||
 |
 |
||
| ИМК 0,125 мг/л | ИМК 0,25 мг/л | ||
 |
 |
||
| ИМК 0,25 мг/л | ИУК 0,125 мг/л | ||
 |
 |
||
| ИУК 0,25 мг/л | ИУК 0,5 мг/л | ||
 |
 |
||
| НУК 0,125 мг/л | НУК 0,25 мг/л | ||
| Рисунок 19 – Развитие корневой системы у микрочеренков клонового
подвоя яблони 2-15-2 на питательных средах с разными ауксинами |
|||
2.2.2 Разработка методики регенерации адвентивных побегов клоновых подвоев яблони из соматических тканей и приемов тканевой селекции
Эффективность морфогенеза из соматических тканей определяется комплексом факторов: генотипом растения, минеральным и гормональным составом среды, составом и количеством сахаров в средах регенерации, типом и происхождением экспланта, его ориентацией на питательной среде, температурой, световым режимом культивирования и другими факторами [97, 98].
Каллусные культуры наиболее часто используют для клеточной селекции растений. Используя систему in vitro, можно эмпирически реализовать тотипотентность клетки высшего растения индукцией в каллусе или культивируемых тканях цепи событий, связанных с образованием меристематических очагов. Однако даже в максимально оптимизированной системе лишь одна клетка из 400-1000 становится на путь регенерации. У многолетних древесных культур далеко не каждый орган или участок ткани проявляет тотипотентность in vitro [91]. В значительной степени это зависит от генотипических особенностей растения, возраста и состояния экспланта.
В наших исследованиях оптимизация ряда факторов, имеющих важное влияние на регенерацию – состава среды, регуляторов роста растений и предварительной обработки эксплантов – позволила повысить эффективность регенерации побегов из листовых эксплантов клоновых подвоев яблони. Оптимальное соотношение цитокинин : ауксин в питательной среде в наших опытах составило 10:1. Установлено, что у клоновых подвоев яблони может иметь место как регенерация через стадию каллусообразования, так и прямая регененерация адвентивных побегов из соматических тканей лишь с незначительным образованием каллуса. Каллусы с высоким морфогенетическим потенциалом полупрозрачные, светло-кремовые, бежевые или желтоватые, компактные, структурированные (рис. 20). Адвентивные побеги регенерируют и при образовании плотного, беловатого, опушенного каллуса, а также напрямую из тканей листовых пластинок, часто на черешках листьев (рис. 21).
Поскольку для растения in vivo каллус – это группа клеток, возникающая при травмах и защищающая место поранения (раневая паренхима), в которой накапливаются питательные вещества для регенерации анатомических структур или утраченного органа, интенсивность каллусообразования in vitro можно повысить, увеличивая раневую поверхность изолированного органа. Регенерация также часто происходит в месте среза экспланта. Некоторые экспланты нечувствительны к обработке регуляторами роста, если они не разделены на части или не повреждены. Небольшие листовые пластинки можно помещать на среду регенерации целиком. Однако большинство исследователей, работающих с плодовыми и ягодными культурами, рекомендуют делать надрезы на листовых пластинках или брать высечки листьев. Фрагментация молодых развернутых листьев Malus на 14 секций повышала способность листовых тканей к образованию адвентивных побегов и эмбриоподобных структур [92]. Поперечные надрезы эксплантов Torenia fournieri значительно увеличили образование почек в пределах площади радиусом 0,5 см от места поранения [93].
 |
 |
| Рисунок 20 – Регенерация адвентивных побегов клонового подвоя 54-118 на среде МS с 5,0 мг/л 6-БАП и 0,5 мг/л ИУК | Рисунок 21 – Регенерация адвентивных побегов клонового подвоя Парадизка Будаговского на среде МS с 5,0 мг/л 6-БАП и 0,5 мг/л ИМК |
Наши исследования показали, что при культивировании целых листовых пластинок каллус образуется только на срезах черешков. Нанесение дополнительных поранений как скальпелем, так и обработкой ультразвуком достаточной мощности, существенно повышало частоту каллусообразования (рис. 22).
 |
 |
| а | б |
| Рисунок 22 – Каллусообразование и регенерация адвентивных побегов на листовых пластинках клонового подвоя яблони 15-2-2: а – целые листовые пластинки; б – листовые пластинки с насечками поперечно центральной жилке | |
Для проведения работ по тканевой селекции необходима разработка методик регенерации адвентивных побегов из каллусной ткани. Задача усложняется резким снижением морфогенетической активности каллуса древесных культур при длительном пассировании на питательных средах. Скрининг морфогенетического потенциала клоновых подвоев яблони показал, что разные формы существенно отличаются по способности к регенерации адвентивных побегов из изолированных соматических тканей и каллуса (рис. 23).
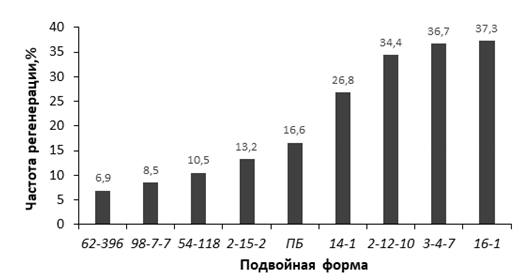
Рисунок 23 – Эффективность регенерации адвентивных побегов
подвойных форм яблони за I пассаж
В результате проведенных исследований выделены подвои Парадизка Будаговского, 2-12-10, 3-4-7, 14-1, 16-1, которые по частоте регенерации адвентивных побегов из листовых дисков в 2-4 раза превосходили контрольную форму 62-396 (рис. 23, 24).
 |
 |
|
| а | б | |
| Рисунок 24 – Регенерация адвентивных побегов клоновых подвоев яблони
на листовых дисках: а) форма 3-4-7; б) форма 14-1 |
||
Тип используемого экзогенного ауксина был основным фактором, определяющими тип регенерации. Для изучаемых подвоев характерна прямая регенерация непосредственно из тканей листовой пластинки при использовании в качестве ауксина ИМК. Наиболее интенсивное каллусообразование наблюдается при использовании в качестве ауксина НУК и 2,4-Д. Применение 2,4-Д приводит к обильному образованию и активному росту светло-кремового полупрозрачного каллуса с явно выраженной морфогенной активностью. На средах с НУК массово образуется неморфогенный каллус.
Максимальная частота регенерации для большинства генотипов достигнута на средах с ИУК и 2,4-Д. При пассировании листовых высечек с образовавшимся на них каллусом на средах с этими ауксинами частота регенерации ряда форм подвоев достигала 70-80%. На одном экспланте формировался один или несколько очагов регенерации, и общее число побегов-регенерантов на регенерирующий диск могло доходить до 7-9. Как правило, на высечках оснований листьев с черешками образовывалось больше регенерантов, чем на высечках средней части листовых пластинок (рис. 25).
Максимально выраженным морфогенетическим потенциалом характеризовались формы 14-1 и 16-1. Регенерационные процессы в культуре каллуса данных генотипов продолжались длительное время (рис. 26), что делает их весьма перспективными для разработки методик тканевой селекции яблони.
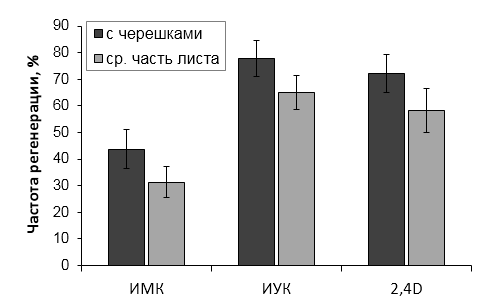
Рисунок 25 – Эффективность регенерации адвентивных побегов
подвойной формы 3-4-7 на питательных средах с разными ауксинами
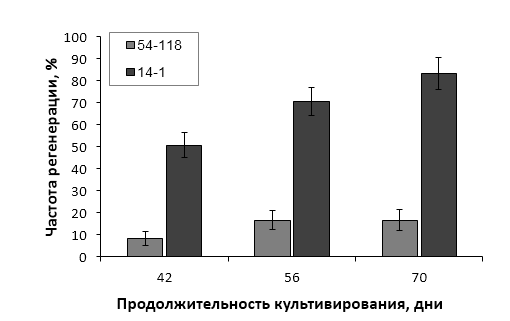
Рисунок 26 – Эффективность регенерации адвентивных побегов подвойных форм яблони из листовых дисков в зависимости от генотипа и продолжительности культивирования
Изучение влияния селективного агента, моделирующего анионное засоление, на рост и развитие растений клоновых подвоев яблони в условиях in vitro
Засоление почв наносит вред сельскому хозяйству больше, чем засуха или морозы. Даже при слабом засолении потери урожайности достигают 20%, на сильно засоленных землях они составляют 70-80% [94, 95].
Д.Г. Шорников [96], Н.А. Егорова [71] отмечали, что солеустойчивость плодовых культур зависит от способности растений противостоять засолению почвы, не снижая интенсивности течения основных физиологических процессов.
В результате наших исследований установлено отрицательное действие хлорида натрия в питательной среде на эффективность размножения и состояние культивируемых микропобегов. Анализируя влияние разных концентраций хлорида натрия в питательной среде, определи степень селективного давления NaCl на растительные ткани подвойных форм яблони: ПБ, 62-396,54-118, 2-12-10, 2-15-2, 3-4-7, 14-1, 16-1.
По результатам наших данных негативное влияние засоления проявлялось уже при содержании NaCl в среде 0,2%, на большинстве форм наблюдали снижение коэффициента размножения и интенсивности роста побегов. Отрицательное действие хлорида натрия становилось все более выраженным при повышении концентрации NaCl (рис. 27-29). При концентрации NaCl 0,6 % если в первые дни культивирования и происходило образование новых побегов, то в дальнейшем они не росли, деформировались, обесцвечивались и некротизировали. При дальнейшем повышении концентрации NaCl в питательной среде негативное влияние усиливалось.
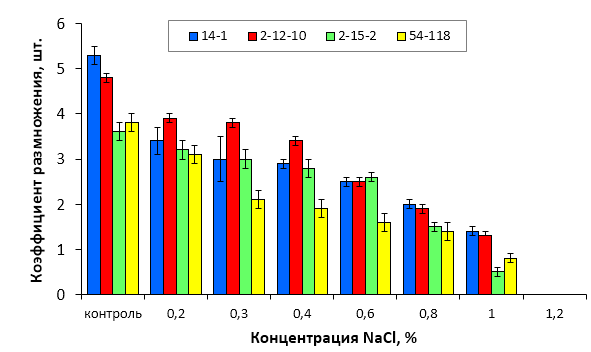 |
| Рисунок 27 – Влияние концентрации хлорида натрия в питательной среде на коэффициент размножения клоновых подвоев яблони |
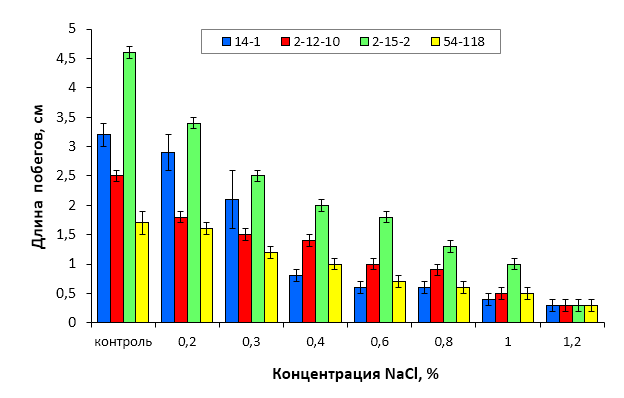 |
|||
| Рисунок 28 – Влияние концентрации хлорида натрия в питательной среде на рост побегов клоновых подвоев яблони | |||
 |
 |
 |
|
| а | б | в | |
 |
 |
 |
|
| г | д | е | |
 |
 |
 |
|
| ё | ж | з | |
 |
 |
 |
|
| и | к | л | |
| Рисунок 29 – Влияние селективного фактора на экспланты подвойных форм яблони: а – 2-15-2 (контроль); б – 2-15-2 с добавлением 0,6% NaCl; в – 2-15-2 (0,8% NaCl); г – 3-4-7 (контроль); д – 3-4-7 (0,6% NaCl); е – 3-4-7 (0,8% NaCl); ё – 14-1 (контроль); ж – 14-1 (0,6% NaCl); з –14-1 (0,8% NaCl); и – 2-12-10 (контроль); к – 2-12-10 (0,6% NaCl); л – 2-12-10 (0,8% NaCl) | |||
Отмечены генотипические различия изучаемых подвоев по устойчивости к хлоридному засолению среды. При повышении концентрации NaCl от 0,8 до 1,0 % экспланты подвоев ПБ, 62-396, 54-118 практически полностью некротизировали, тогда как экспланты подвойных форм 2-12-10, 2-15-2, 3-4-7, 14-1, 16-1 сохраняли жизнеспособность без размножения. При концентрации NaCl 1,2% экспланты всех изучаемых подвойных форм яблони полностью некротизируют.
При пересадке на питательную среду без добавления хлорида натрия экспланты более устойчивых форм частично восстанавливали жизнеспособность (рис. 30).
Таким образом, в качестве селективного агента на солеустойчивость для получения сомаклональных вариантов в условиях in vitro при культивировании каллусных тканей рекомендуется использовать NaCl в концентрации 0,6-0,9%, что позволит отобрать каллусы, сохранившие рост при селективном давлении и получить из них регенеранты с потенциальной устойчивостью к хлоридному засолению.
 |
 |
 |
| а | б | в |
 |
 |
 |
| г | д | е |
| Рисунок 30 – Развитие подвойных форм яблони при пересадке на контрольную питательную среду (без NaCl): а, б, в – 2-12-10; г – 62-396; д – 2-15-2; е – 3-4-7 | ||
Выводы по разделу 2.2 главы 2
Оптимизированы приемы введения в стерильную культуру in vitro новых генотипов рода Malus Mill. Дополнительная предобработка эксплантов на этапе введения препаратами «Экоцид С» (1,0%) и «БиоПаг» (0,4%) в течении 50 минут способствует получению стерильных эксплантов до 61,5% по сравнению с контролем. Применение диссекции семядолей позволяет увеличить прорастание гибридных семян in vitro до 65,3 по сравнению с 4,2% в контроле. Расщепление гибридных семян в комбинациях M. sieboldii x Малыш Будаговского, M. sieboldii x 60-160, M. sieboldii x 76-3-6 по признаку антоциановой окраски составляет 1:1.
Показатели эффективности микроразмножения клоновых подвоев яблони, полученные на питательной среде QL, существенным образом не отличаются от показателей, полученных на среде MS. Для оптимального размножения достаточно использовать 6-бензиламинопурин в концентрации 0,5-1,0 мг/л. На средах с более низким содержанием экзогенных регуляторов роста длина побегов больше.
При укоренении в условиях in vitro клоновых подвоев яблони оптимальной является концентрация ИМК в питательной среде 0,5 мг/л. При данной концентрации частота укоренения микрочеренков генотипов 62-396, 2-12-10, 3-4-7, 16-1 составила от 86,3 до 100%.
Отобраны генотипы клоновых подвоев с повышенной способностью к ризогенезу in vitro (2-9-102, 2-12-10), которые с высокой эффективностью (80-90%) укореняются и на средах без регуляторов роста.
Выявлены генотипы клоновых подвоев с высокой регенерационной способностью in vitro (Парадизка Будаговского, 14-1, 16-1, 3-4-7, 2-12-10), которые по частоте регенерации адвентивных побегов из листовых дисков в 2-4 раза превосходят контрольную форму 62-396. Эти формы перспективны для разработки методик тканевой селекции яблони.
Максимальная частота регенерации клоновых подвоев яблони отмечена на питательной среде с добавлением 4,0-5,0 мг/л 6-БАП в сочетании с одним из ауксинов – ИМК, ИУК или 2,4-Д. Оптимальное соотношение цитокинин : ауксин в питательной среде составило 10:1.
В результате исследований установили, что устойчивость растений к хлоридному засолению зависит от особенностей генотипа. В качестве селективного агента на солеустойчивость для получения сомаклональных вариантов в условиях in vitro эффективным является использование концентрации NaCl в диапазоне 0,6-0,8%. После пересадки эксплантов клоновых подвоев на питательную среду без добавления хлорида натрия все побеги восстанавливали жизнеспособность.
2.3 Разработка методики оценки экологической устойчивости мужского гаметофита генотипов рода Malus L. в экспериментально моделируемых условиях
В современных изменяющихся природно-климатических условиях большое значение имеет исследование потенциала устойчивости генотипов растений к негативным факторам окружающей среды для выявления форм с высокой степенью адаптации. Нестабильный температурный режим в зимний период, летние засухи, загрязнение почв, действие комплекса болезней и вредителей приводят к угнетению процессов жизнедеятельности растений.
Жизненный цикл всех покрытосеменных растений состоит из чередования двух поколений – гаметофита и спорофита. Мужской гаметофит представлен пыльцевым зерном, женский – зародышевым мешком. Неблагоприятные условия окружающей среды отрицательно сказываются на функциональной активности обоих поколений растительного организма, однако большинство научных исследований посвящено изучению спорофита, как преобладающей стадии, при недостаточном объеме сведений о гаметофитном поколении. В связи с этим экспериментальное изучение устойчивости мужского гаметофита плодовых и ягодных растений к негативным природно-климатическим условиям является весьма актуальной научной задачей.
Формирование мужского гаметофита может происходить в неблагоприятных природно-климатических условиях (заморозки, сильные суточные колебания температур, недостаточное водообеспечение растения, загрязнение почв токсичными ксенобиотиками). При более раннем и продолжительном действии негативных условий окружающей среды на микроспорогенез у многих культур отмечено увеличение количества и спектра нарушений мейоза и тетрадогенеза.
Колебания температуры воздуха оказывают существенное влияние на рост пыльцевых трубок как в условиях in vitro, так и in vivo. Поздневесенние заморозки способны нарушить нормальное протекание процессов опыления и оплодотворения у растений.
Воздействие высоких температур в период прорастания пыльцы отмечается реже, в целом эта проблема наиболее значима для поздноцветущих видов растений. Пыльца более чувствительна к высоким температурам, чем женская репродуктивная сфера растений, о чем может свидетельствовать отсутствие оплодотворения в условиях высокотемпературного стресса [99]. Современные исследования показывают, что высокие температуры вызывают нарушения микро- и мегаспорогенеза, приводя к снижению завязывания плодов; при этом термоустойчивость пыльцы играет главную роль в оплодотворении [100, 101].
Пыльца растений очень чувствительна к изменению водного режима – как динамики уровня внутриклеточной оводненности, так и относительной влажности воздуха. Для ветроопыляемых растений способность пыльцы к частичному обезвоживанию способствует уменьшению массы пыльцевых зерен и их лучшему распространению на дальние расстояния [102, 103]. Для пыльцы плодовых культур, как и других энтомофильных растений, фактор ее веса не является решающим для успешного опыления.
Пыльца в зависимости от вида по-разному реагирует на пониженную влажность воздуха. Выявлена положительная корреляция между жизнеспособностью пыльцевых зерен и их толерантностью к высушиванию. Установлены видовые различия в восстановлении оводненности пыльцевых зерен – регидратации. Обезвоживание пыльцы приводит к потере целостности мембраны. В норме регидратация пыльцевых зерен во влажной атмосфере вызывает мембранную реорганизацию и восстановление осмотического потенциала, являющихся необходимым условием для прорастания мужского гаметофита [104].
В целом, изменение водного режима пыльцевых зерен более существенно сказывается на их жизнеспособности, чем влияние положительных температур. В природных условиях колебания температуры обычно сопровождаются водно-осмотическим стрессом, негативное воздействие которого может быть ошибочно трактовано действием температуры. Сочетание высокой температуры воздуха и низкой относительной влажности приводит к значительному снижению прорастаемости пыльцы, вплоть до ее гибели. Использование низкотемпературных режимов важно в технологиях долговременного хранения пыльцы, в которых влажность может управляться независимо [105]. Жизнеспособность пыльцы зависит не только от минимальной относительной влажности воздуха, но и от динамики влажности в течение всего периода жизненного цикла пыльцевого зерна.
Уровень загрязненности окружающей среды химическими поллютантами существенно влияет на степень фертильности и жизнеспособности пыльцы многих видов растений, поэтому данные морфофизиологические показатели пыльцевых зерен могут служить маркерными признаками при биоиндикации территорий [106].
Экспериментальное изучение стрессоустойчивости мужского гаметофита возможно при моделировании негативных условий в условиях in vitro. Метод исследования прорастаемости пыльцы на искусственной питательной среде в лабораторных исследованиях in vitro широко распространен. В ряде исследований [107] показано, что жизнеспособность пыльцы в условиях in vitro существенно выше, чем in vivo.
Экспериментально установлено, что отбор между генотипами по морфологическим параметрам пыльцевых зёрен (выровненности) лучше проводить в оптимальных условиях, а по уровню жизнеспособности – в экстремальных условиях. На примере моркови показано, что гаметофитный отбор по выровненности и конкурентной способности пыльцы эффективен при отборе биотипов с повышенной адаптивной способностью в сортовой популяции [108].
Комплексная оценка стрессоустойчивости мужского гаметофита в дальнейшем позволит сформулировать конкретные рекомендации по гаметной селекции плодовых и ягодных культур и способам повышения физиологической активности пыльцевых зерен для успешного оплодотворения при негативном действии абиотических и биотических факторов. В данном направлении как отечественные, так и мировые исследования проводятся в основном для мужского гаметофита зерновых, овощных и технических культур [109-114], а также методам их гаметной селекции [115-117]. Для плодовых и ягодных культур подобные эксперименты ранее не проводились, имеются лишь фрагментарные сведения о стрессоустойчивости их пыльцы.
Экспериментальное моделирование условий прорастания пыльцы in vitro позволяет оперативно и объективно анализировать степень устойчивости мужского гаметофита к температуре окружающей среды.
Изменение водного режима при опылении у многих видов растений приводит к значительному снижению проросшей пыльцы. В настоящее время для плодовых культур недостаточно сведений о степени устойчивости мужского гаметофита к осмотическому стрессу, что требует расширения исследований в данном направлении.
Цель исследований: Разработка методики оценки экологической устойчивости мужского гаметофита генотипов рода Malus Mill. в экспериментально моделируемых условиях и выделение форм яблони с высокой функциональной активностью пыльцы при действии абиотических стрессоров.
Задачи исследований:
— изучить действие дестабилизирующих абиотических (пониженные и повышенные положительные температуры, гиперосмотический шок) и биотических (токсичные метаболиты фитопатогенных микроорганизмов) факторов на прорастаемость пыльцы генотипов яблони;
— выделить формы яблони с высокой функциональной активностью пыльцы при действии абиотических и биотических стрессоров.
Научная новизна и практическая значимость исследований
Разработана методика оценки экологической устойчивости мужского гаметофита генотипов рода Malus L. в экспериментально моделируемых условиях. Выделены форм яблони с высокой функциональной активностью пыльцы при действии абиотических стрессоров. Это позволит использовать их в качестве эффективных опылителей при составлении схем гибридизации и выборе родительских форм, что может способствовать успешному процессу оплодотворения в неблагоприятных условиях весеннего периода и потенциальному увеличению выхода гибридных семян.
Объекты, условия и методика проведения исследований
Биологическими объектами исследования служили формы клоновых подвоев яблони из коллекции ФГБОУ ВО Мичуринский ГАУ, у которых предварительно выделяли и затем изучали пыльцу, которая представляет собой гаплоидную стадию жизненного цикла растения – мужской гаметофит.
Анализ функциональной активности мужского гаметофита осуществляли по модернизированной методике Д.А. Транковского, учитывая показатели прорастаемости пыльцевых зерен на искусственной питательной среде в условиях in vitro, в большинстве методик называемой также жизнеспособностью пыльцы [118]. Жизнеспособность пыльцы определяли как количество проросших пыльцевых зерен к общему количеству пыльцы на просмотренных полях зрения препарата. Данный параметр анализировали, подсчитывая 5-7 полей зрения при среднем увеличении микроскопа (200x). Созревшие пыльники с пыльцой предварительно выделяли из распускающихся бутонов, подсушивали в течение суток, а затем хранили в пузырьках в эксикаторе (над обезвоженным хлоридом кальция, влажность воздуха около 20-25%) общим сроком 10 суток для всей серии экспериментов.
Контрольная питательная среда для всех опытов содержала по массе 1% агара, 10% сахарозы, 0,001% борной кислоты. Предметные стекла с посевом пыльцы помещали в закрытые чашки Петри с увлажненной фильтровальной бумагой и культивировали в течение 3 ч в биологическом термостате в темноте при оптимальной температуре прорастания +25°C.
Анализ терморезистентности мужского гаметофита. Выбор экспериментальных температурных режимов культивирования мужского гаметофита in vitro согласован с многолетними климатическими данными региона исследований.
Плодовые культуры в условиях Центрально-Черноземного региона цветут в первой половине мая. Данный период характеризуется значительными колебаниями температуры воздуха по годам (рис. 31). Так, за период 2005-2016 гг. первая половина мая характеризовалась среднесуточной температурой воздуха +14,4°С, изменяясь от +8,5°С до +19,3°С. Минимальные значения температуры воздуха данного периода в указанные годы варьировали в пределах -0,4°… +7,9°С; максимальные +21,1°…+30,3°С.
Период проведения исследований мужского гаметофита в 2019 г. характеризовался умеренными значениями – среднесуточной температурой воздуха +13,7°С, изменяющейся в интервале +4,9…+21,8°С.
Рисунок 31 – Среднесуточная температура воздуха с 1 по 15 мая за период 2005-2015 гг. (по данным http://rp5.ru/Архив_погоды_в_Мичуринске, дата обращения 24.03.2019)
Результаты рекогносцировочных исследований показали, что оптимальной температурой для прорастания пыльцы in vitro большинства генотипов плодовых культур является +25°С. Она была выбрана в качестве контрольной при определении способности пыльцевых зерен к прорастанию при температуре +16°С, приблизительно соответствующей среднему значению первой половины мая, и максимально зарегистрированной в месте проведения исследований +31°С в период цветения и опыления растений (рис. 31). Также следует учитывать, что все плодовые и ягодные культуры – перекрестноопыляемые энтомофильные растения, зависимые в период цветения от лёта насекомых, в первую очередь медоносных пчел Apis mellifera L. В весенне-летний период доминирующими фактором лётной активности медоносных пчел является температура при меньшем значении освещенности: так, при яркой освещенности и низкой температуре от +6° до +8°С пчёлы не вылетают. В условиях юга России в годы с холодной весной при низкой температуре воздуха (+15°…+17°С) в апреле–мае пыльцесобирательная активность пчел значительно снижена, а максимальный сбор пыльцы и нектара осуществляется ими при средней температуре воздуха +22…+28°С [119]. При температуре ниже +12°С пыльцесобирательная активность пчел прекращается (Еськов, 1990).
При экспериментальном изучении термоустойчивости мужского гаметофита чашки Петри с препаратами пыльцы культивировали в термостате при температурах +16°С и +31°С в течение 3 ч, контроль выдерживали при +25°С.
Анализ устойчивости мужского гаметофита в условиях действия гиперосмотического стресса. В качестве осмотически активных нетоксичных соединений, не выполняющих для клеток трофической функции, исследованы растворы глицерина (массовой долей 5, 10, 15, 20%).
Предметные стекла с посевом пыльцы на селективную и контрольную питательные среды помещали в закрытые чашки Петри и культивировали в термостате в течение 3 ч при t=+25°C.
Статистический анализ экспериментальных данных. Для объективного сравнительного анализа стрессоустойчивости мужского гаметофита проводили расчет коэффициента действия – стимулирования или ингибирования, как отношение показателей жизнеспособной пыльцы на селективной среде к контролю: при его положительных значениях отмечается стимулирующий эффект прорастания пыльцы, при отрицательных – ингибирование.
Статистическую обработку полученных экспериментальных данных осуществляли методами описательной статистики, регрессионного и дисперсионного анализов в программной среде Microsoft Office Excel 2016.
Результаты исследований
Температурный режим
Анализ терморезистентности пыльцы сортов яблони. В результате анализа степени терморезистентности мужского гаметофита яблони отмечено существенное влияние генотипического фактора при всех экспериментальных температурных режимах (рис. 32).
Рисунок 32 – Влияние температуры на способность пыльцы
генотипов рода Malus Mill. к прорастанию in vitro
Наибольшей стабильностью показателя жизнеспособности пыльцы, отмеченной в диапазоне 7,9-8,8%, отличался сорт Успенское, у которого не выявлено достоверных различий при действии трех температур. Только для данного сорта общий коэффициент действия температурного фактора оказался положительным (+2,2). У сорта Былина выявлено ингибирование прорастания пыльцы только температурой +16°С – в 2,7 раза. Для сортов яблони Топаз и Либерти характерно существенное снижение количества пыльцевых трубок как при действии пониженной, так и повышенной температур – соответственно в 2,5-2,6 и 1,4-1,7 раз. Как следствие, сорта Топаз и Либерти отличаются высокими отрицательными интегральными коэффициентами действия температурного фактора на уровне -4,0 и -4,2 (рис. 33).
Рисунок 33 – Степень действия температурного фактора на удельную прорастаемость in vitro пыльцы отечественных и зарубежных сортов яблони
Выявлены положительные корреляции между абсолютными показателями жизнеспособности пыльцы генотипов яблони при моделируемых температурах: пониженной и контрольной +0,72; повышенной и контрольной +0,99; между дестабилизирующими температурами +16°С и +31°С на уровне +0,69.
Наибольшее влияние на величину общего коэффициента действия температурного фактора при прорастании мужского гаметофита яблони оказывает коэффициент действия пониженной температуры (высокая положительная корреляционная связь значений на уровне +0,90); при меньшей значимости коэффициента ингибирования повышенной температурой (+0,86). Корреляция показателей коэффициентов действия пониженной и повышенной температуры у изученной выборки генотипов яблони составляет +0,56.
Анализ терморезистентности пыльцы клоновых подвоев яблони. Для выявления степени терморезистентности мужского гаметофита у клоновых подвоев яблони изучена его жизнеспособность в условиях экспериментального действия in vitro пониженной (+16°С) и повышенной (+31°С) положительных температур (рис. 34). В результате, у большинства форм отметили большее ингибирование функциональной активности пыльцы в диапазоне 1,1-12,1 раз, вызванное действием пониженной температуры. В то же время в условиях повышенной температуры (+31°С) среди изученных форм отмечено менее выраженное ингибирование прорастаемости пыльцы относительно контроля – максимум в 3,5 раза у формы 76-4-4 (рис. 35).
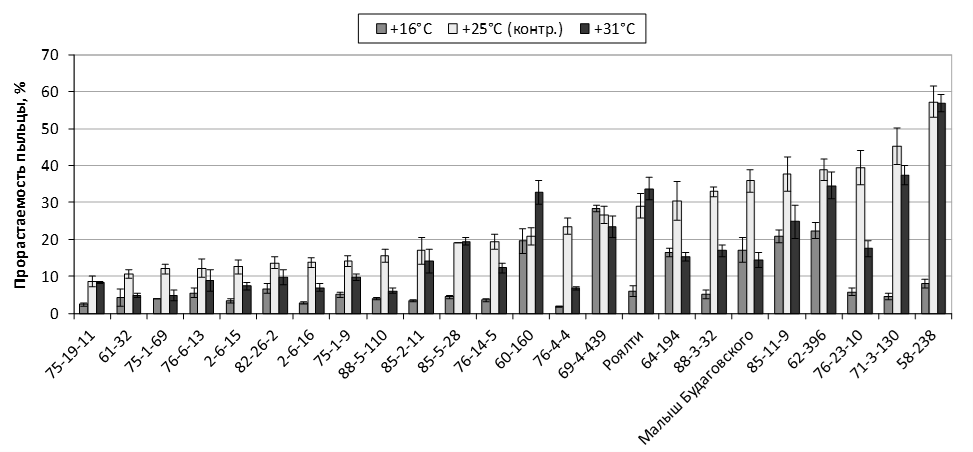
Рисунок 34 – Прорастаемость пыльцы генотипов яблони в условиях экспериментального действия in vitro пониженной (+16°С) и повышенной (+31°С) положительных температур
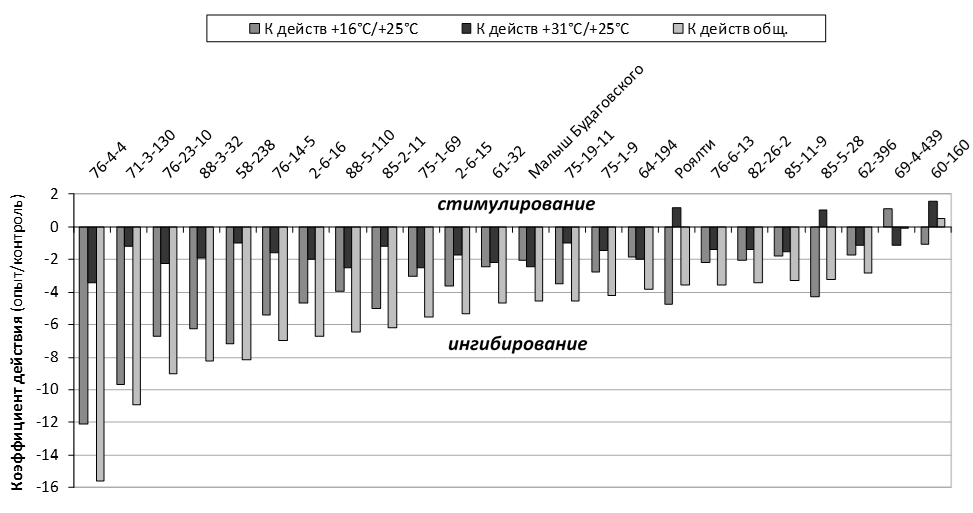
Рисунок 35 – Влияние экспериментального действия in vitro пониженной (+16°С) и повышенной (+31°С) положительных температур на удельную прорастаемость пыльцы генотипов яблони (относительно контроля)
Наибольшая функциональная активность пыльцевых зерен в условиях интегрального действия температурного стресса отмечена у подвоев 60-160, 62-396, 69-4-439 с общим коэффициентом действия в диапазоне -2,9…0,5. Наибольшее ингибирование прорастаемости пыльцы в 10,9-15,6 раз под влиянием неблагоприятных температур отмечено у форм 71-3-130 и 76-4-4.
Полученные данные позволяют создать дифференцированную картину термоустойчивости мужского гаметофита генотипов рода Malus Mill. для выделения высокоустойчивых по данному показателю форм с функционально активной пыльцой.
Гиперосмотический стресс
Анализ осморезистентности пыльцы сортов яблони. При приготовлении селективных питательных сред для проращивания пыльцевых зерен in vitro в качестве нетоксичного осмотика без трофической функции был выбран глицерин.
Выбор моно-, ди- и полисахаридов, также являющихся нетоксичными осмотиками, не является оптимальным, так как они в составе питательной среды выполняют трофическую функцию и будут искажать результаты прорастаемости пыльцы.
Было изучено действие его четырех концентраций – 5, 10, 15, 20% на динамику прорастаемости пыльцы яблони. Установлено, что с увеличением содержания глицерина в питательной среде, прорастаемость пыльцевых зерен снижается (рис. 36). При этом его концентрация, равная 15%, в достаточной степени ингибирует функциональную активность пыльцы, но не снижает ее полностью, поэтому подходит для использования в качестве селективной, позволяющей дифференцировать генотипы по степени устойчивости к гиперосмотическому стрессу.
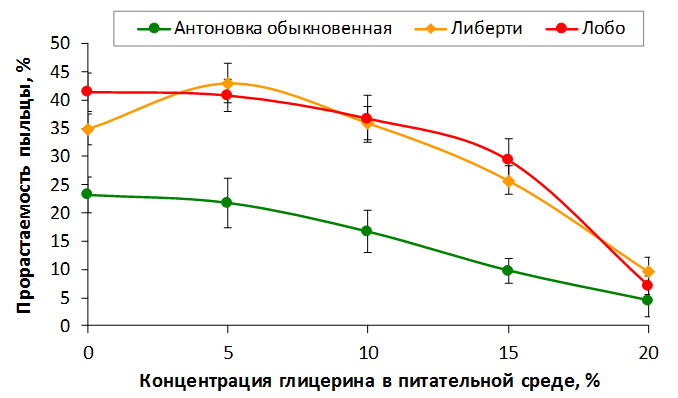
Рисунок 36 – Динамика прорастаемости пыльцы сортов яблони в зависимости от концентрации глицерина в селективной питательной среде
Также было изучено реакция пыльцы генотипов на единую селективную питательную среду, содержащую 15% глицерина. У сортов яблони Былина, Успенское и Либерти отмечено снижение прорастаемости пыльцы на селективной среде с 15%-ным раствором глицерина в 1,3-1,4 раза. Однако сорт Топаз в условиях действия экспериментального гиперосмотического стресса характеризовался увеличением количества проросших пыльцевых зерен в 2,1 раза – с исходных 17,8% до 37,8% (рис. 37), что вероятно, может быть вызвано более высоким осмотическим потенциалом его мужского гаметофита при росте пыльцевой трубки.
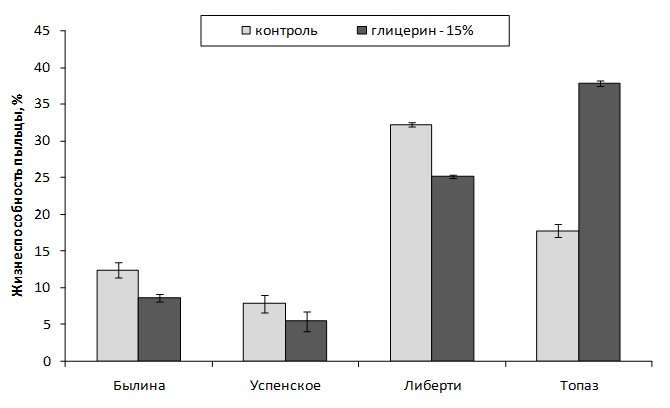
Рисунок 37 – Влияние осмотического стресса, индуцированного 15%-ным раствором глицерина, на способность пыльцы генотипов рода Malus L. к прорастанию in vitro
Анализ осморезистентности пыльцы клоновых подвоев яблони. В экспериментальных условиях in vitro было исследовано влияние селективной питательной среды с глицерином на степень прорастаемости пыльцы генотипов клоновых подвоев яблони (рис. 38).
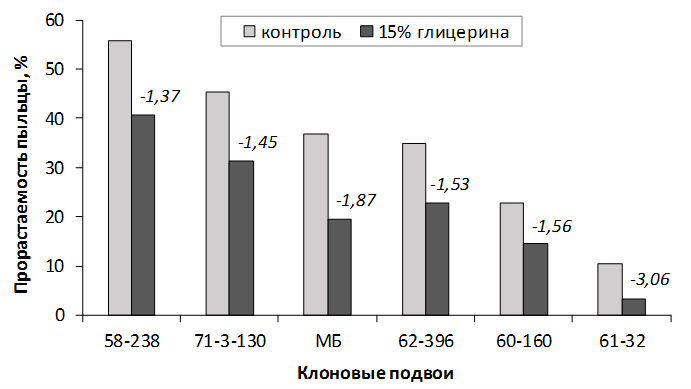
Рисунок 38 – Влияние генотипа на уровень прорастаемости пыльцы клоновых подвоев яблони при действии 15% глицерина в составе селективной питательной среды
Установлено 1,37-…3,06-кратное снижение прорастаемости пыльцы подвоев на питательной среде с 15% глицерина. Наибольшей устойчивостью в данных условиях отличались формы 58-238 и 71-3-150, при высокой прорастаемости пыльцы и в контроле.
Выводы по разделу 2.3 главы 2
Разработана методика оценки экологической устойчивости мужского гаметофита генотипов рода Malus L. в экспериментально моделируемых условиях к негативному действию природно-климатических факторов – изменению температурного режима при прорастании и гиперосмотическому стрессу. Для каждого из стрессовых факторов установлены оптимальные режимы в рамках эксперимента.
Установлено снижение прорастаемости мужского гаметофита на статистически достоверном уровне при действии температур +16…+17°C и +31°C, что отражает реальные климатические условия и рекомендуется использовать для имитации температурного стресса при лабораторном методе определения функциональной активности пыльцы. Наибольшая функциональная активность пыльцевых зерен в условиях интегрального действия температурного стресса отмечена у подвоев 60-160, 62-396, 69-4-439 с общим коэффициентом действия в диапазоне -2,9…0,5.
Для имитации осмотического стресса in vitro при прорастании пыльцы предложена селективная питательная среда на основе контрольной с добавлением 15% глицерина в базовые компоненты (1% агара, 10% сахарозы, 0,001% борной кислоты). Выбор моно-, ди- и полисахаридов, также являющихся нетоксичными осмотиками, не является оптимальным, так как они в составе питательной среды выполняют трофическую функцию и будут искажать результаты прорастаемости пыльцы.
На основании проведенных исследований выделены генотипы яблони, пыльца которых характеризуется наибольшей устойчивостью к действию моделируемых стрессоров. В дальнейшем это позволит использовать их в качестве эффективных опылителей при составлении схем гибридизации и выборе родительских форм, что может способствовать успешному процессу оплодотворения в неблагоприятных условиях весеннего периода и потенциальному увеличению выхода гибридных семян.
3 ОЦЕНКА СЛАБОРОСЛЫХ КЛОНОВЫХ ПОДВОЕВ ЯБЛОНИ В МАТОЧНИКЕ КОНКУРСНОГО ИСПЫТАНИЯ
Цель исследований: сравнительная оценка новых слаборослых клоновых подвоев яблони в условиях маточника и выделение перспективных форм для передачи на изучение в питомник и сад.
Задачи исследований:
— изучить основные производственно-биологические признаки новых вегетативно размножаемых подвоев (зимостойкости; устойчивости к болезням и вредителям; предварительной оценки силы роста; способности к укоренению; побегопроизводительной способности маточных кустов и выхода стандартного материала отводков; склонности к ветвлению);
— провести цитоанатомический анализ проводящих тканей побегов коллекции генотипов клоновых подвоев яблони;
— выделение перспективных форм клоновых подвоев яблони с высокими производственными показателями в маточнике.
Научная новизна и практическая значимость
Проведены многолетние сравнительные исследования хозяйственно-биологических признаков новых форм клоновых подвоев яблони 2002-2009 годов гибридизации в маточнике конкурсного изучения. Впервые проведен цитоанатомический анализ проводящих тканей побегов коллекции отечественных генотипов клоновых подвоев яблони для дальнейшей разработки методики предварительной экспресс-диагностики карликовых форм. Дифференцированы генотипы клоновых подвоев яблони по количественному содержанию пигментов в тканях листьев.
Объекты и методы исследований
В качестве биологических объектов использовали гибридные формы 2002 и последующих годов гибридизации. Маточник конкурсного изучения был заложен весной 2015 г., затем он ежегодно пополнялся новыми формами. Всего в 2019 г. в маточнике конкурсного испытания на изучении было 43 генотипа селекции ФГБОУ ВО Мичуринский ГАУ 2002-2009 гг. гибридизации, а также подвои 1957-1987 гг. гибридизации (34 формы), 1 форма Оренбургской ОССиВ (Урал 5) и 2 формы дагестанских селекционеров (К-1 и Б-7-35).
Методика проведения исследований составлена с учетом «Методики государственного сортоиспытания» [121], «Программы и методики селекции плодовых, ягодных и орехоплодных культур» [122], «Программы и методики сортоизучения плодовых, ягодных и орехоплодных культур [29], «Методики изучения подвоев плодовых культур» [123], методик, разработанных сотрудниками кафедры плодоводства [124-128]. Исследования проводили в трехкратной повторности по 10 растений. Формы в ряду чередуются по наличию антоциановой окраски листьев и коры побегов (зеленолистные, краснолистные и т.д.). Контролем в опытах служили районированные подвои – карликовой силы роста 62-396 и полукарликовой – 54-118.
Предварительную оценку силы роста определяли по прочности древесины при отделении отводков. Все изучаемые формы по прочности древесины были разделены на 3 группы: карлики, полукарлики и среднерослые. При оценке этого показателя учитывали результаты исследований В.И. Будаговского [124], М.Л. Филипповой [128], В.А. Коровина [129], Л.И. Лотовой [130]. По данному признаку подвои были распределены на три группы: 1 – подвои с ломкой древесиной и гладким, без волокон изломом;
2 – подвои с прочной древесиной, побеги которых на изломе сильно волокнистые; 3 – формы промежуточные, со среднеломкой древесиной, на поверхности излома имеющие небольшое количество волокон.
Поражаемость болезнями и вредителями учитывали в августе, когда наиболее заметны проявления имеющихся заболеваний и вредителей. Определение развития болезней, проводили согласно «Программе и методике сортоизучения плодовых, ягодных и орехоплодных культур» [29].
Оценку заселения растений вредителями и поражения вредителями и болезнями проводили по 5-ти бальной шкале:
0 – поражение отсутствует (иммунитет);
1 – поражено до 1% органов или площади листа, поверхности побегов (высокая устойчивость);
2 – поражено 1-10% органов или их поверхности (повышенная устойчивость);
3 – поражено 11-25% органов или их поверхности (средняя устойчивость);
4 – поражено 26-50% органов или их поверхности (повышенная восприимчивость);
5 – поражено свыше 50% органов или их поверхности (высокая восприимчивость).
Ветвление отводков учитывали по методике, предложенной М.Л. Филипповой [128].
Степень вызревания побегов определяли перед отделением отводков визуально и оценивали по пятибалльной шкале:
1 – рост продолжается;
2 – рост прекратился, но верхушки побегов на значительном протяжении имеют травянистое состояние;
3 – рост прекратился, но верхушки побегов имеют травянистое состояние на небольшую длину (2-3 междоузлия);
4 – верхушечные почки слабо оформились, верхушки побегов полностью не одревеснели;
5 – рост прекратился, верхушечные почки оформились, побеги вызрели.
Ранжирование отводков после их отделения с маточных кустов осуществляли по методике В.И. Будаговского [124] с учетом предложенного им подразделения на 5 групп:
1) стандартные отводки (балл укоренения 3-5, диаметр условной корневой шейки 5-10 мм);
2) черенки (балл укоренения 1-2, диаметр условной корневой шейки 5-10 мм и более);
3) недогон, хорошо укоренившийся (балл укоренения 3-5, диаметр условной корневой шейки менее 5 мм);
4) недогон, плохо укоренившийся (балл укоренения 1-2, диаметр условной корневой шейки менее 5 мм);
5) переросшие отводки (укоренение 3-5 баллов, диаметр условной корневой шейки более 11 мм).
Результаты исследований
Все плодовые и ягодные культуры различаются по способности противостоять различным вредным организмам. Это может быть либо иммунитет (невосприимчивость к возбудителям заболеваний или неповреждаемость вредителями) или устойчивость, которая может варьировать в широком диапазоне – от высокой устойчивости (почти иммунитета) до сильной восприимчивости. Относительная устойчивость к вредителям выражается в непривлекательности генотипа для вредителя, в неблагоприятном воздействии, в выносливости к повреждениям или в их сочетании.
В условиях средней полосы России наибольший вред в маточниках из болезней приносить парша. Возбудителем парши являются сумчатые грибы Venturia inaequalis Wint. из порядка Sphaeriales. Из вредителей наибольший вред маточнику в условиях средней полосы России наносит серая яблонная тля (Dysaphis anthricsci Born.) и зелёная яблонная тля (Aphis pomi Deg.).
В связи с повышенной температурой летнего периода 2019 г. и низкой относительной влажностью воздуха симптомов парши на листьях изучаемых клоновых подвоев обнаружено не было. Почти все формы в той или иной степени были заселены серой и зеленой яблонной тлей, но при этом степень поражения у большинства генотипов составила менее 1,0 балла. На уровне 1,0 балла тлей была заселена форма 5-21-93. Филлостиктозом на 0,7-1,1 балла были поражены формы 2-12-15, 2-12-36, а полное отсутствие симптомов поражения (0 баллов) отмечено у подвоев 2-9-56, 2-9-90, 2-9-94, 2-9-96, 4-2-50, 9-1-1, 9-1-3.
Состояние растений после перезимовки определяли путем осмотра в начале мая маточных кустов, оставленных с осени с неотделенными отводками. При этом оценивали состояние их побегов по 5-бальной шкале в соответствии с пробуждаемостью почек и отмиранием тканей. Повреждения коры, камбия и древесины выявляли на косых срезах побегов в зоне от их вершины до условной корневой шейки, т.к. у однолетних побегов два особо уязвимых места – верхняя часть и зона на уровне почвы или снегового покрова. В целом, большинство подвоев характеризовались высокой полевой устойчивостью к повреждениям зимнего период. Незначительными повреждениями тканей верхушки побегов (не более 0,5 баллов) характеризовались формы 2-9-56, 2-9-77, 2-3-44, 2-3-17, 4-2-3.
Немаловажное значение для оценки качества подвойного посадочного материала имеет наличие разветвлений на побеге, так как при использовании конкретной формы в производстве эта биологическая особенность будет затруднять культивирование в питомнике и вносить дополнительные материальные затраты на борьбу с ней. Изучаемые подвои по данному показателю распределили на 2 группы: слабоветвящиеся (1-15% ветвящихся от общего выхода отводков, в зоне окулировки до 2 разветвлений) и средневетвящиеся (16-30% ветвистых побегов, в зоне окулировки 2-3 разветвления).
В 2019 г. группа слабоветвящихся подвоев объединила 91,7% общего количества изучаемых генотипов. В группу средневетвящихся отнесены генотипы 2-12-10, 3-10-3, 5-27-1, что составило 8,2% среди всех изученных генотипов. Сильноветвящихся подвойных форм выявлено не было.
Перед отделением отводков измеряли высоту кустов. В сравнении с вегетационными периодами 2017 и 2018 гг. в текущем 2019 г. высота побегов маточных кустов практически у всех форм оказалась сниженной, что можно связать со сложившимися неблагоприятными климатическими условиями большей части летнего периода. Несмотря на спринклерное орошение маточника, относительная влажность воздуха была значительно снижена, а средняя температура соответствующих летних месяцев, наоборот, оказалась повышенной. В связи с этим показатели продуктивности маточных растений оказались сниженными (рис. 39). Высотой куста в маточнике менее 60 см отличалась формы 9-1-1, 9-1-2, 9-1-3, 9-1-4, 2-3-14, 2-9-49, 2-15-2, 2-15-15, 5-28-11. Наиболее высокими маточными кустами (более 100 см) отличались подвои 3-4-7 и 54-118.
При этом различия между генотипами по высоте куста в 2019 г. оказались менее выражены, что на вариационной кривой отражено в виде отсутствия локальных максимумов, наблюдаемых ранее в 2018 и 2017 гг. (рис. 40).
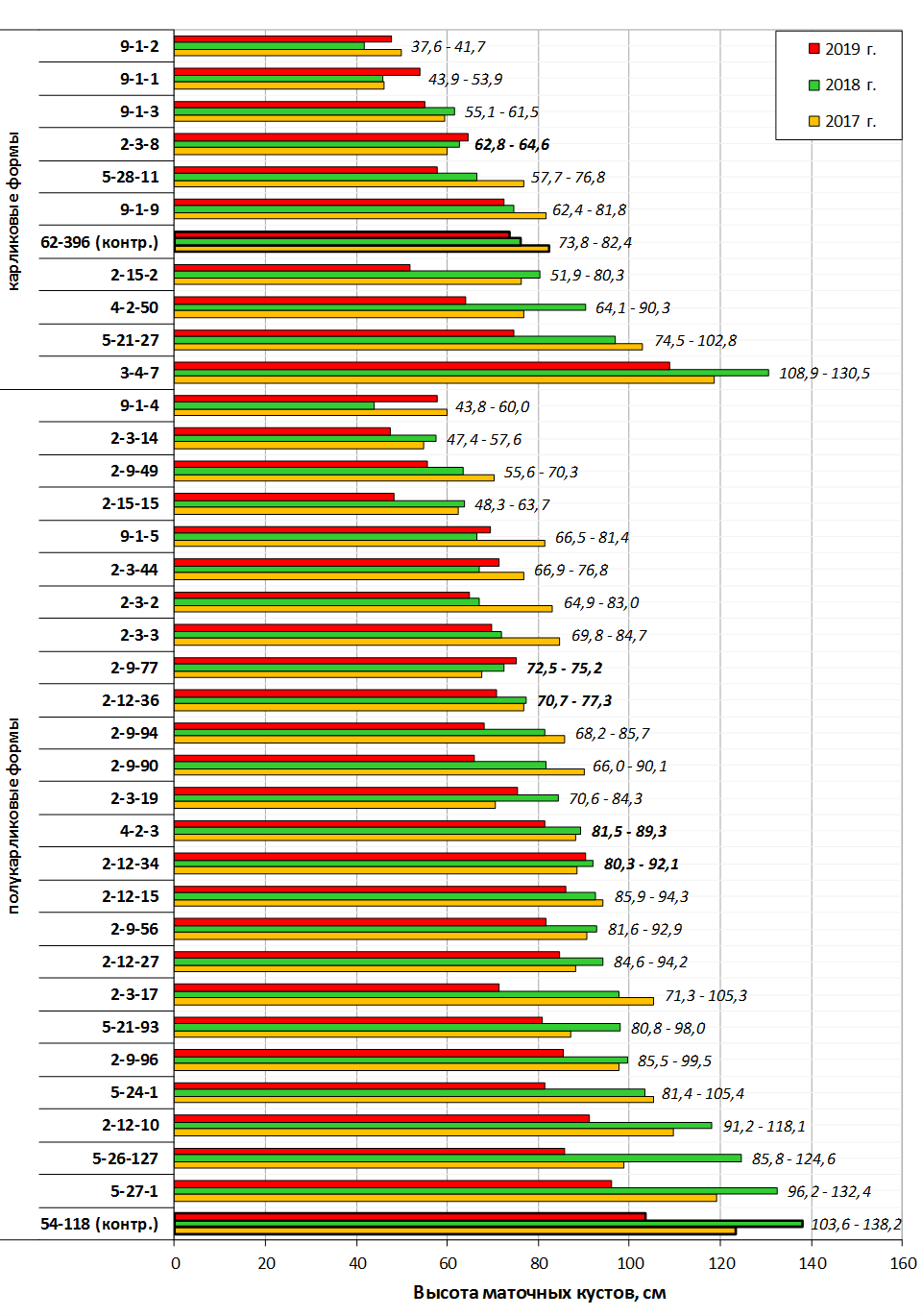
сильный рост
Рисунок 39 – Вариабельность силы роста маточных кустов у новых генотипов клоновых подвоев яблони селекции ФГБОУ ВО Мичуринский ГАУ в 2019 г. в сравнении с сезонами 2017-2018 гг. (цифрами указан диапазон варьирования признака за три года)
средний
рост
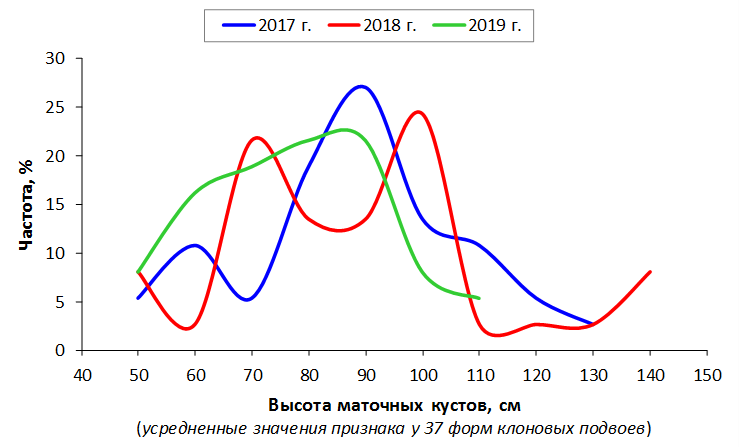
Рисунок 40 – Динамика силы роста маточных кустов коллекции генотипов клоновых подвоев яблони селекции ФГБОУ ВО Мичуринский ГАУ за 2017-2019 г.
Также экспериментально были изучены биометрические показатели развития во второй сезон вегетации неотделенных отводков, оставленных на части маточных кустов у всех генотипов. У подвойных форм 2-12-27, 2-9-90, 2-15-15, 5-24-1, 2-12-10, 5-28-11, 4-2-50 прирост побегов во второй год оказался минимальным (менее 5% от их исходной высоты). Наибольший прирост побегов (более 50%) отмечен у форм 9-1-3, 9-1-4. На второй год в маточнике отмечено значительное увеличение образования боковых разветвлений побегов (рис. 41). При этом четкой закономерности увеличения высоты побегов у групп карликовых и полукарликовых подвоев выявлено не было.
В 2019 году к середине октября практически все изучаемые подвойные формы закончили ростовые процессы и сформировали верхушечную почку. На 4,5-4,8 балла вызрели побеги форм 2-3-17, 2-9-94, 3-10-3.
При отделении отводков подсчитывали средний балл укоренения. По среднему значению укореняемости в маточнике конкурсного испытания (выше 3,8 баллов) отмечены карликовые подвои яблони 2-15-2, 4-2-50, 5-28-11, 9-1-9; полукарликовые формы 2-3-3, 2-9-56, 2-9-90, 2-12-27, 2-15-15, 4-2-3, 5-21-93, 9-1-4, 9-1-5. В целом, у отдельных генотипов выход стандартных отводков оказался значительно ниже общей побегообразовательной способности куста (рис. 43-50). Среднее количество стандартных отводков у большинства изученных подвойных форм составило 3-5 шт., что отражено и на общей вариационной кривой данного показателя (рис. 43-45). При этом между общей побегообразовательной способностью маточного куста и количеством стандартных отводков у изученных форм установлена высокая положительная корреляция на уровне +0,83 (рис. 46).
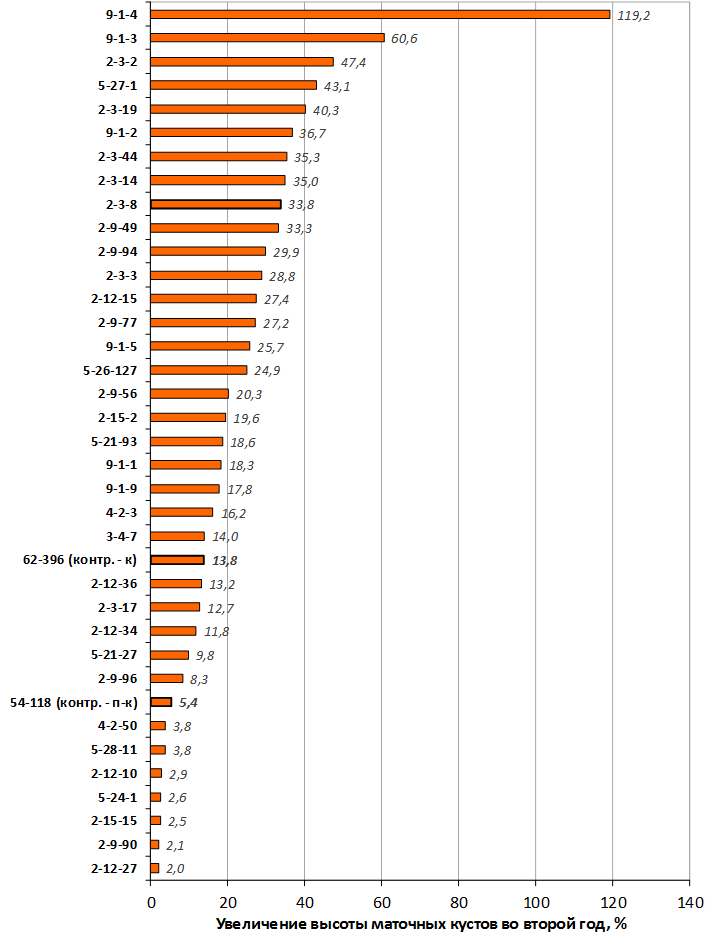
Рисунок 41 – Динамика силы роста неотделенных отводков маточных кустов коллекции генотипов клоновых подвоев яблони селекции ФГБОУ ВО Мичуринский ГАУ за второй год вегетации
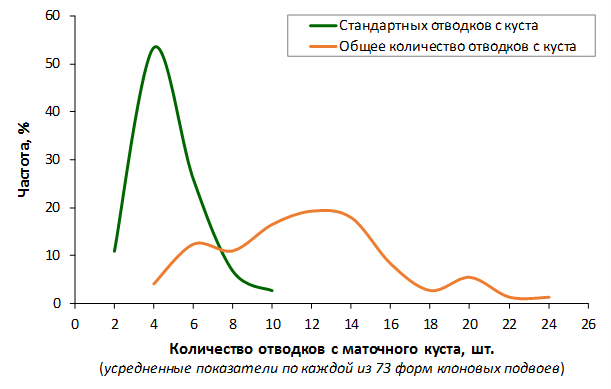
Рисунок 43 – Вариабельность продуктивности маточных кустов коллекции генотипов клоновых подвоев яблони селекции ФГБОУ ВО Мичуринский ГАУ в 2019 г.
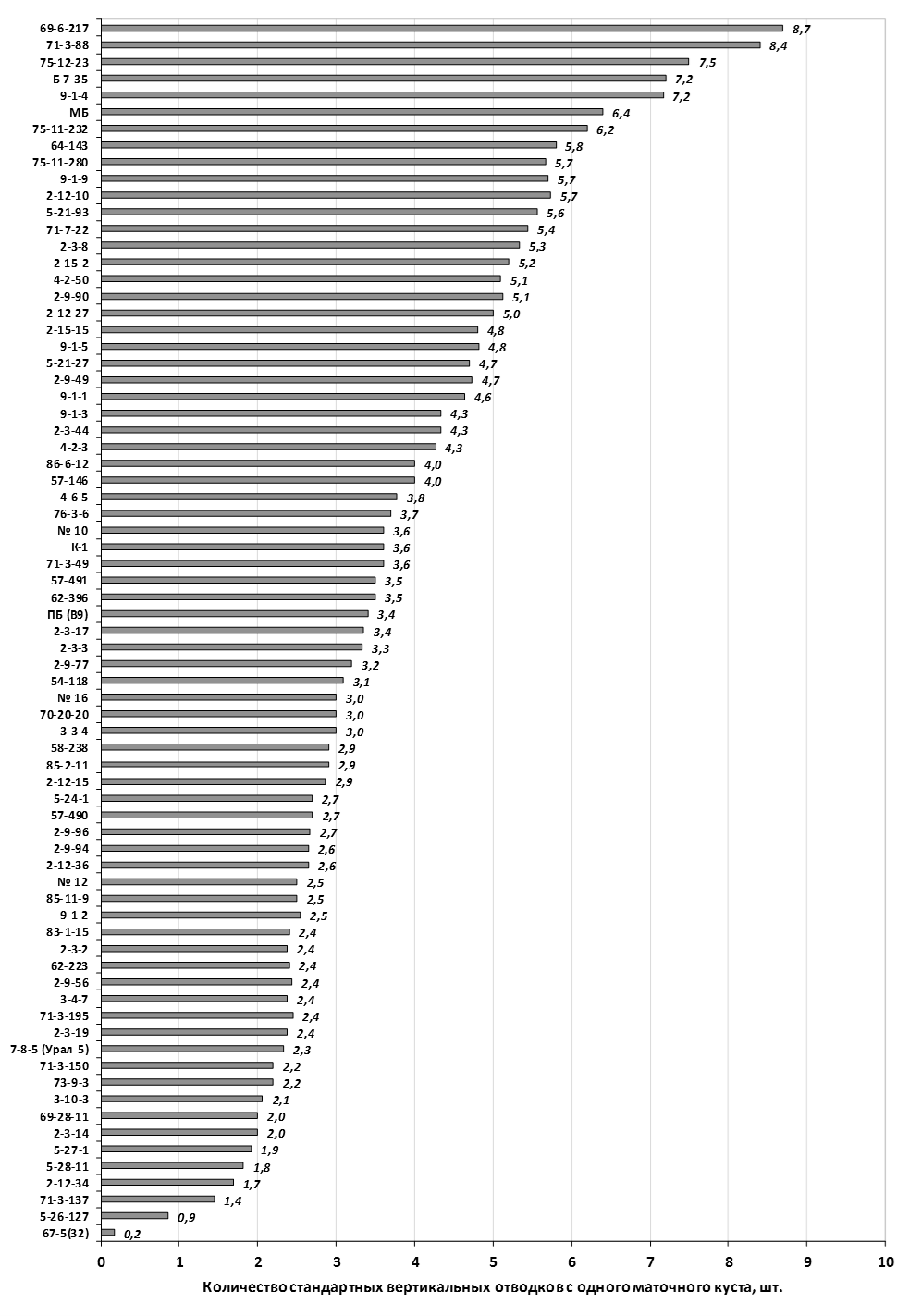
Рисунок 44 – Производственная характеристика перспективных и районированных клоновых подвоев яблони в маточнике конкурсного изучения (2019 г.)
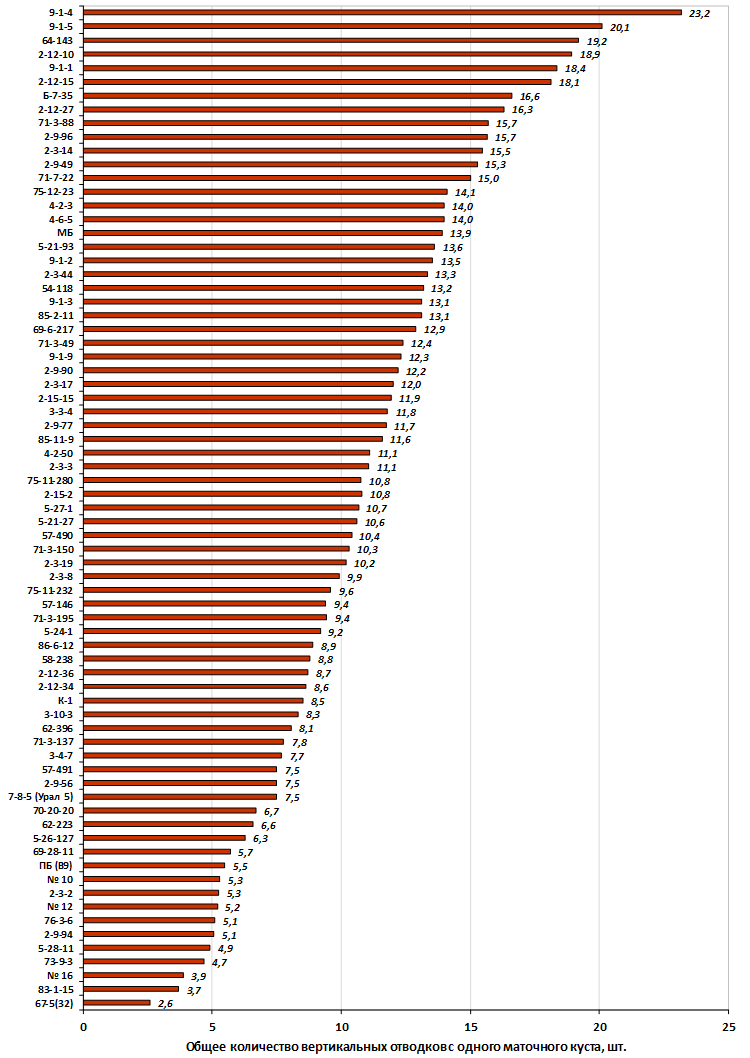
Рисунок 45 – Побегообразовательная способность маточных кустов перспективных и районированных клоновых подвоев яблони в маточнике конкурсного изучения (2019 г.)
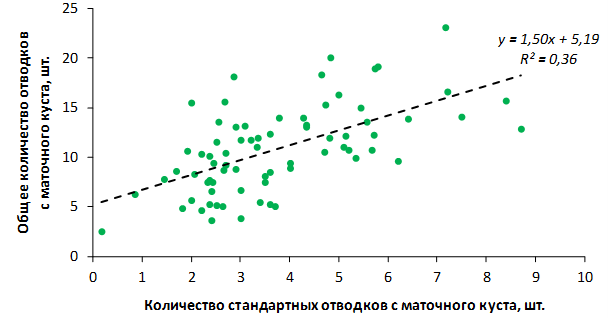
Рисунок 46 – Взаимосвязь выхода стандартных отводков и общей побегообразовательной способности маточных кустов коллекции клоновых подвоев яблони (2019 г.)
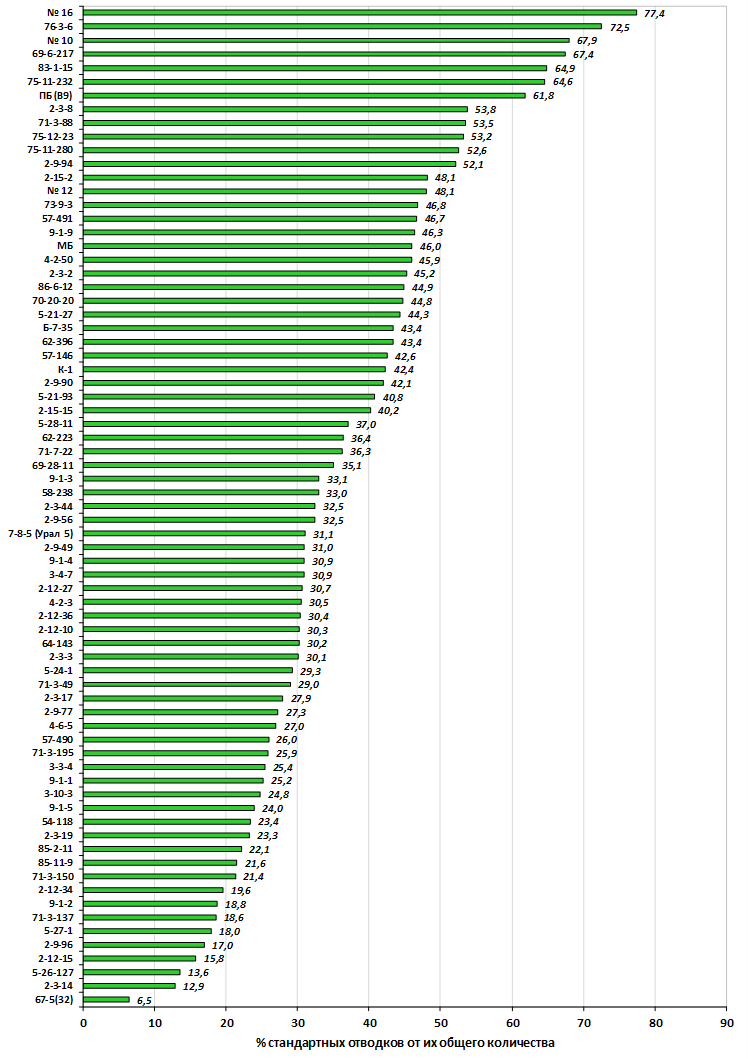
Рисунок 47 – Удельный выход стандартных отводков перспективных и районированных клоновых подвоев яблони в маточнике конкурсного изучения (2019 г.)
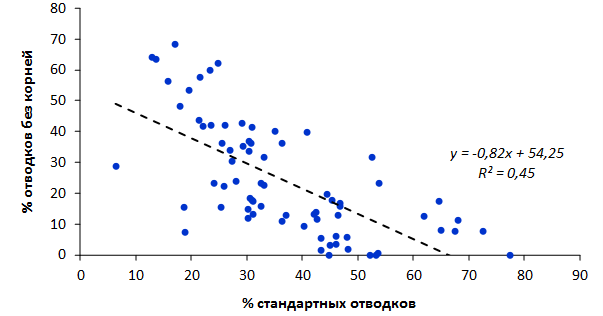
Рисунок 48 – Взаимосвязь выхода стандартных и неукорененных отводков с маточных кустов перспективных и районированных клоновых подвоев яблони (2019 г.)
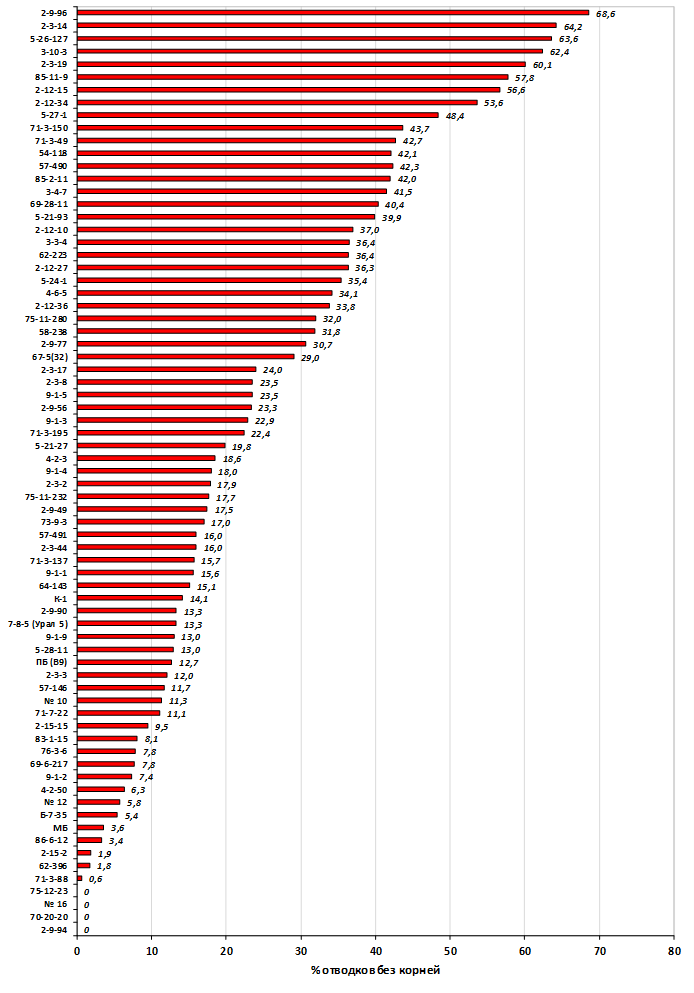
Рисунок 49 – Доля неукоренившихся отводков перспективных и районированных клоновых подвоев яблони в маточнике конкурсного изучения (2019 г.)
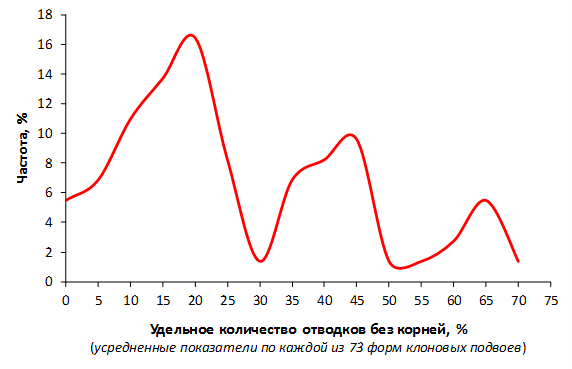
Рисунок 50 – Вариабельность доли неукоренившихся отводков у коллекции перспективных и районированных клоновых подвоев яблони в маточнике конкурсного изучения (2019 г.)
Побегопроизводительность маточных кустов определяли путем деления всей суммы отводков на число учетных маточных растений. Наибольшей побегообразовательной способностью маточных кустов (более 15 отводков) характеризовались перспективные формы 2-3-14, 2-9-49, 2-9-96, 2-12-10, 2-12-15, 9-1-1, 9-1-4, 9-1-5. Наибольшая доля стандартных отводков (около 50% и более от общего количества) отмечена у форм 2-3-2, МБ, ПБ, 4-2-50, 9-1-9, 2-15-2, 2-9-94, 2-3-8. Между выходом стандартных отводков с куста и средним баллом их укоренения по генотипам подвоев установлена корреляция +0,72.
Наличие более 50% неукоренившихся отводков отмечено у форм 2-12-34, 2-12-15, 85-11-9, 2-3-19, 3-10-3, 5-26-127, 2-3-14, 2-9-96. У подвоев Малыш Будаговского (МБ), 2-9-94, 2-15-2, 62-396 отводков без корней выявлено не более 5% от их общего количества на маточном кусте. По удельному количеству неукорененных отводков все генотипы оказались четко дифференцированы на три группы, что иллюстрируется вариационной кривой значений данного показателя (рис. 50).
Диагностика содержания пигментов в листьях клоновых подвоев яблони
Наличие пигментов в клетках листовой пластинки играет огромную роль в их функционировании. Наибольшее значение среди них имеет хлорофилл, участвующий в преобразовании неорганических соединений в органические в процессе реакций фотосинтеза. Важную роль играют также пигменты группы каротиноидов и антоцианов, выполняющие защитные функции при действии неблагоприятных факторов внешней среды. Большинство клоновых подвоев яблони селекции Мичуринского ГАУ вследствие своего уникального происхождения характеризуются антоциановой пигментацией листьев и древесины побегов. Поэтому биохимический анализ тканей листьев на содержание пигментов основных групп имеет важное значение для понимания механизмов продуктивности и устойчивости их отдельных генотипов.
Пробы листьев отбирали во второй половине июня, в дневное время. Для определения содержания пигментов в клетках листовых пластинок клоновых подвоев яблони навеску листьев (0,1 г) измельчали в гомогенизаторе с помощью стальных шариков, затем экстрагировали 96%-ным этанолом и фильтровали. Полученные 40 мл фильтрата использовали для количественного анализа. Оптическую плотность полученных вытяжек пигментов определяли с помощью спектрофотометра BIO-RAD SmartSpecPlus при длинах волн 665, 649, 440 и 453 нм (для этилового спирта), используя кюветы с толщиной поглощающего слоя 10 мм. При длине волны 665 нм по оптической плотности в вытяжке определяют содержание хлорофилла a, 649 нм – хлорофилла b, 440 нм – каротиноидов, 453 нм – антоцианов.
Концентрацию (С) хлорофиллов а, b и каротиноидов рассчитывали по уравнениям Винтерманс и Де Мотс для этанола:
Ca = 13,70 × Е665 – 5,76 × Е649
Cb = 25,80 × Е649 – 7,60 × Е665
Ck = 4,7 × Е440 – 0,27 × C(a+b)
где Ca, Cb, Ck – концентрации хлорофиллов a, b и каротиноидов соответственно, мг/дм3;
C(a+b) – суммарная концентрация хлорофиллов a и b в вытяжке, мг/дм3;
Е665, Е649, Е440 – оптическая плотность вытяжки при длине волн 665, 649, 440 нм соответственно (при толщине поглощающего слоя – 10 мм).
Содержание пигментов в сырой массе исследуемого объекта А (в %) вычисляли по формуле:
| A = | c ∙ V |
| m ∙ 10 |
где с – концентрация соответствующего пигмента в вытяжке, мг/дм3;
V – объем вытяжки, дм3;
m – масса навески исследуемого объекта, г.
Содержание пигментов в пересчете на абсолютно сухой исследуемый объект B (в %) определяли по формуле:
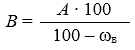
где ![]() массовая доля влаги в исследуемом образце, %.
массовая доля влаги в исследуемом образце, %.
Содержание суммы антоцианов X (в %) в пересчете на цианидин-3,5-дигликозид в абсолютном сухом сырье вычисляют по формуле:

где D – оптическая плотность испытуемого раствора;
453 – удельный показатель поглощения цианидин-3,5-дигликозида в 1%-ном растворе хлористоводородной кислоты;
m – масса навески листьев (в граммах);
W – потеря в массе при высушивании навески листьев (в %).
В результате проведенных исследований были установлены различия на достоверном уровне по содержанию антоцианов у краснолистных и зеленолистных подвойных форм.
По сумме хлорофиллов в тканях листовой пластинки клоновые подвои в целом превосходят рассмотренные сорта яблони, а по содержанию каротиноидов примерно соответствуют им. По наибольшему уровню хлорофиллов отличаются подвои 76-3-6, 54-118 и 57-490 (табл. 9). Кроме различного уровня содержания антоцианов, других существенных различий в концентрации пигментов у краснолистных и зеленолистных клоновых подвоев не выявлено.
Таблица 9 – Содержание пигментов в тканях листовой пластинки клоновых подвоев яблони в сравнении с районированными сортами
| Генотип | Хлорофилл а, мг/дм3 | Хлорофилл b,
мг/дм3 |
Сумма хлорофиллов (а+b), мг/дм3 | Каротиноиды,
мг/дм3 |
Антоцианы, % |
| Сорта яблони | |||||
| Антоновка | 4,90 | 1,06 | 5,96 | 2,32 | 2,76 |
| Богатырь | 5,53 | 1,59 | 7,12 | 2,02 | 2,65 |
| Мелба | 4,17 | 0,70 | 4,86 | 1,63 | 1,44 |
| Клоновые подвои яблони | |||||
| 54-118 | 7,58 | 2,87 | 10,45 | 2,31 | 7,51 |
| 57-223 | 6,91 | 2,58 | 9,50 | 2,06 | 7,77 |
| 57-490 | 9,30 | 2,51 | 11,80 | 3,05 | 6,71 |
| 57-491 | 7,58 | 2,01 | 9,59 | 2,40 | 4,09 |
| 62-396 | 6,18 | 2,43 | 8,61 | 1,85 | 7,06 |
| 67-5(32) | 6,99 | 1,66 | 8,65 | 2,29 | 3,38 |
| 70-20-20 | 6,12 | 1,44 | 7,56 | 2,10 | 5,02 |
| 76-3-6 | 7,11 | 5,37 | 12,48 | 1,36 | 8,81 |
| 2-9-102 | 5,39 | 1,33 | 6,72 | 1,86 | 4,97 |
| 3-4̵-7 | 5,86 | 2,56 | 8,42 | 1,72 | 8,92 |
| 4̵-6-5 | 5,58 | 1,36 | 6,94 | 1,87 | 3,47 |
| 62-223 | 8,02 | 1,54 | 9,56 | 2,76 | 1,97 |
| 70-20-21 | 7,36 | 2,20 | 9,56 | 2,39 | 3,74 |
| 71-3-150 | 6,55 | 1,59 | 8,14 | 2,24 | 1,32 |
| 86-6-12 | 7,17 | 2,74 | 9,90 | 1,97 | 3,89 |
| 2-3-49 | 6,40 | 2,42 | 8,82 | 1,82 | 3,27 |
| 5-21-27 | 6,24 | 1,71 | 7,96 | 2,09 | 2,65 |
| НСР05 | 0,82 | 0,21 | 0,98 | 0,16 | 0,23 |
Примечание: полужирным шрифтом выделены генотипы краснолистных клоновых подвоев яблони и содержание у них антоцианов в листьях
Анализ цитоанатомических особенностей однолетних вертикальных
отводков коллекции генотипов клоновых подвоев яблони
В результате проведенных цитоанатомических исследований было установлено, что однолетние вертикальные отводки клоновых подвоев яблони отличаются по степени развития и соотношению проводящих тканей побега – флоэмы и ксилемы.
Расчет удельной доли каждой из двух данных типов проводящих тканей в стеблевой части побега и их соотношение проводили с помощью двух способов.
Первоначально на поперечном срезе одревесневшей стеблевой части побега производили раздельный подсчет длин радиусов соответствующих проводящих тканей, а также фиксировали общий радиус каждого анализируемого среза побега (рис. 51).
Рисунок 51 – Выполнение измерений тканей при изучении поперечных срезов вертикальных отводков клоновых подвоев яблони
Измерение радиуса сердцевины побега R3 не проводили, а рассчитывали его по формуле:
R3 = R – R1 – R2,
где R1 – фрагмент радиуса флоэмы, R2 – фрагмент радиуса ксилемы.
Расчет площади каждой ткани на срезе побега производили по формуле площади окружности S = πR2.
Общую площадь среза рассчитывали по формуле:
Sсреза = πR2.
Площадь флоэмы рассчитывали по формуле:
Sфлоэмы = πR2 – π(R2 + R3)2.
Площадь ксилемы рассчитывали по формуле:
Sксилемы = πR22 – πR32.
Общую площадь проводящих тканей у каждого генотипа клонового подвоя яблони вычисляли как сумму площадей ксилемы и флоэмы.
Удельную долю флоэмы на срезе побега рассчитывали как отношение показателей Sфлоэмы / Sсреза, ксилемы – соответственного Sксилемы / Sсреза.
Все расчеты результатов цитоанатомического анализа побегов производили в программной среде Microsoft Office Excel 2016, а затем с его помощью визуализировали их в форме соответствующих диаграмм для упрощения сравнительной оценки генотипов по данным показателям.
Соотношение удельной доли ксилемы и флоэмы на поперечном сечении стеблевой части побега, рассчитанное по площади данных тканей значительно выше, чем при анализе длины фрагментов радиусов тканей, что подтверждается соответствующими коэффициентами корреляции, равными -0,76 и -0,49. Отрицательный характер корреляции отражает взаимосвязь развития проводящих тканей в побеге – при большей доле ксилемы площадь элементов флоэмы сокращается, и наоборот (рис. 52).
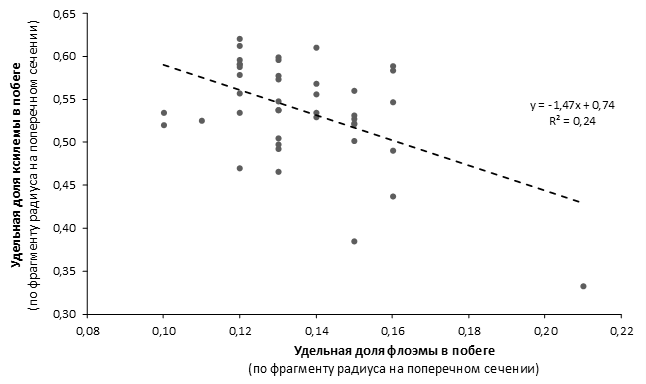
а
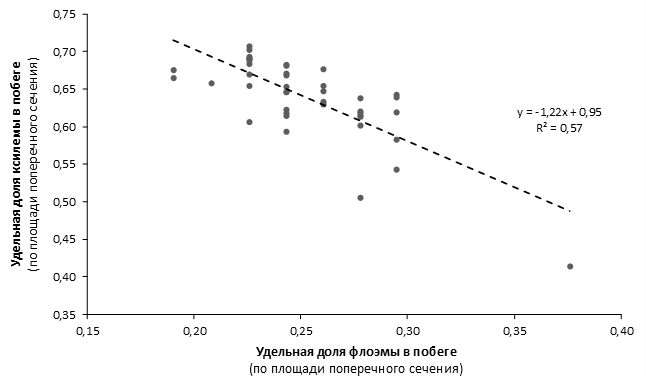
б
Рисунок 52 – Соотношение удельной доли ксилемы и флоэмы в вертикальных отводках клоновых подвоев яблони в зависимости от способов расчета: а – по длине фрагментов радиусов тканей на поперечном сечении побега; б – по площади тканей на поперечном сечении побега
В результате проведенного цитоанатомического анализа установлено, что суммарная удельная доля проводящих тканей в стеблевой части побега клоновых подвоев яблони в основном зависит от степени развития ксилемы, коэффициент корреляции данных показателей составляет +0,79. Между соотношением показателей площади ксилемы к флоэме на срезе побега и суммарной удельной доли проводящих тканей корреляции высокого уровня не выявлено (+0,50).
Сравнительный анализ двух способов расчета соотношений ксилемы к флоэме в вертикальных отводках коллекции 42 генотипов клоновых подвоев яблони различного эколого-географического происхождения показал высокую положительную корреляцию значений показателя, полученных с помощью двух данных способов, на уровне +0,96 (рис. 53). Это позволяет рекомендовать анализ соотношений проводящих тканей в побеге по длине фрагментов их радиусов как более простой по математическим расчетам способ, пригодный для предварительной экспресс-диагностики. Вычисление соотношений флоэмы и ксилемы тканей в побеге по величине их площади на поперечном сечении стеблевой части побега является более точным способом анализа цитоанатомических особенностей вертикальных отводков различных генотипов клоновых подвоев яблони (рис. 54-57).
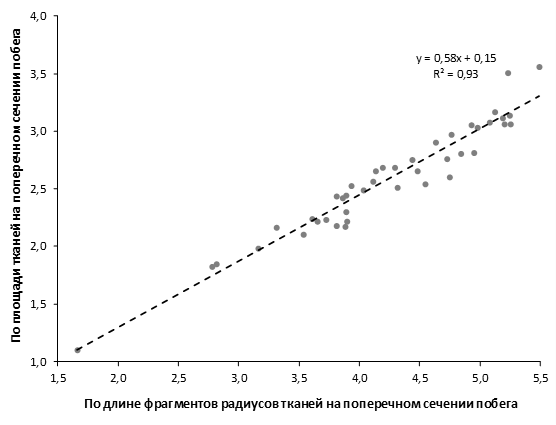
Рисунок 53 – Сравнительный анализ двух способов расчета соотношений ксилемы к флоэме в вертикальных отводках клоновых подвоев яблони
Удельная доля флоэмы в вертикальных отводках клоновых подвоев яблони, рассчитанная по ее площади на поперечном сечении побега, оказалась наибольшей (0,29, или 29%) у слаборослых форм селекции Мичуринского ГАУ 2-3-3, 2-3-17, 2-9-49, 2-15-15, МБ, а максимальное значение данного показателя (0,38) отмечено у суперкарликового подвоя ПБ-4 (рис. 56).
У подвойных форм 2-3-3, 2-3-19, 2-15-15 удельная доля проводящих тканей (флоэмы и ксилемы) в вертикальных отводках клоновых подвоев яблони оказалась наибольшей – 94% от общей площади поперечного сечения побега (рис. 57). У карликовой формы 3-4-7 и суперкарликового подвоя ПБ-4 доля проводящих тканей оказалась наименьшей (менее 80%).

Рисунок 54 – Соотношение ксилемы к флоэме в вертикальных отводках клоновых подвоев яблони, рассчитанное по длине фрагментов радиусов тканей на поперечном сечении побега
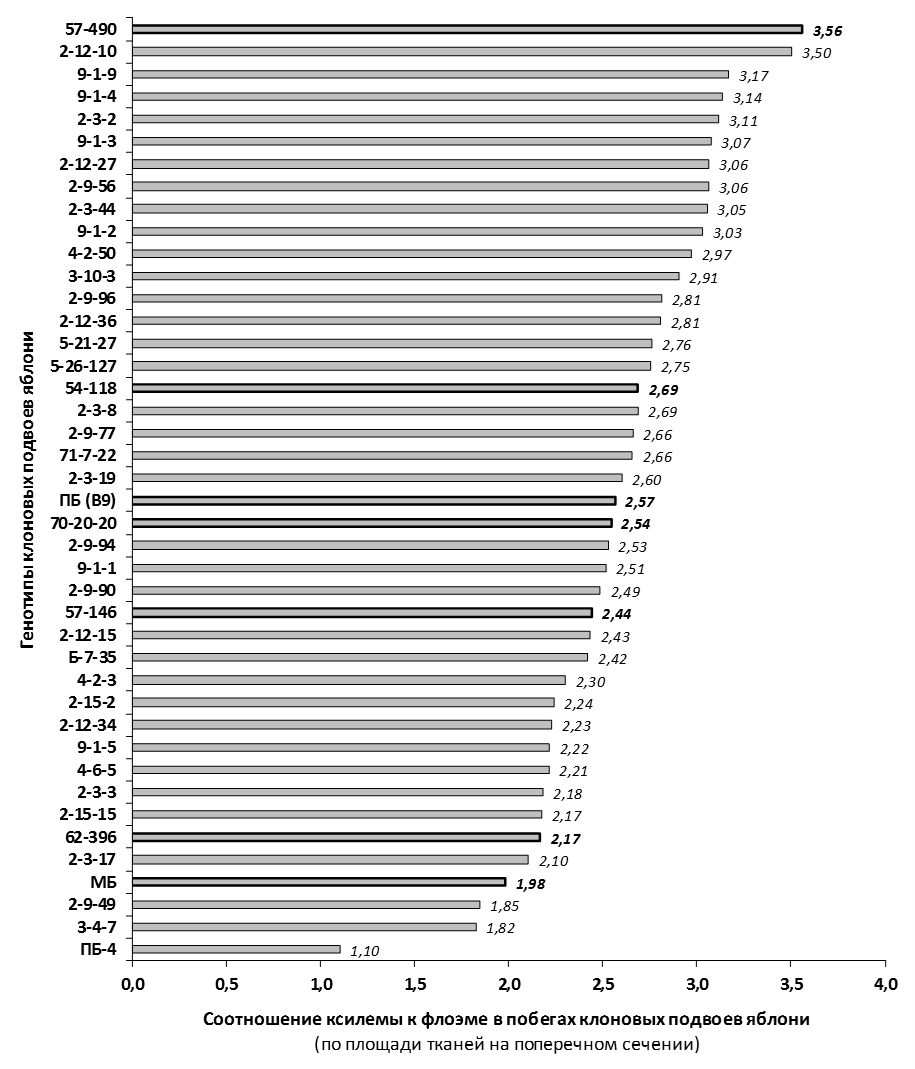
Рисунок 55 – Соотношение ксилемы к флоэме в вертикальных отводках клоновых подвоев яблони, рассчитанное по площади тканей на поперечном сечении побега

Рисунок 56 – Удельная доля флоэмы в вертикальных отводках клоновых подвоев яблони, рассчитанная по ее площади на поперечном сечении побега
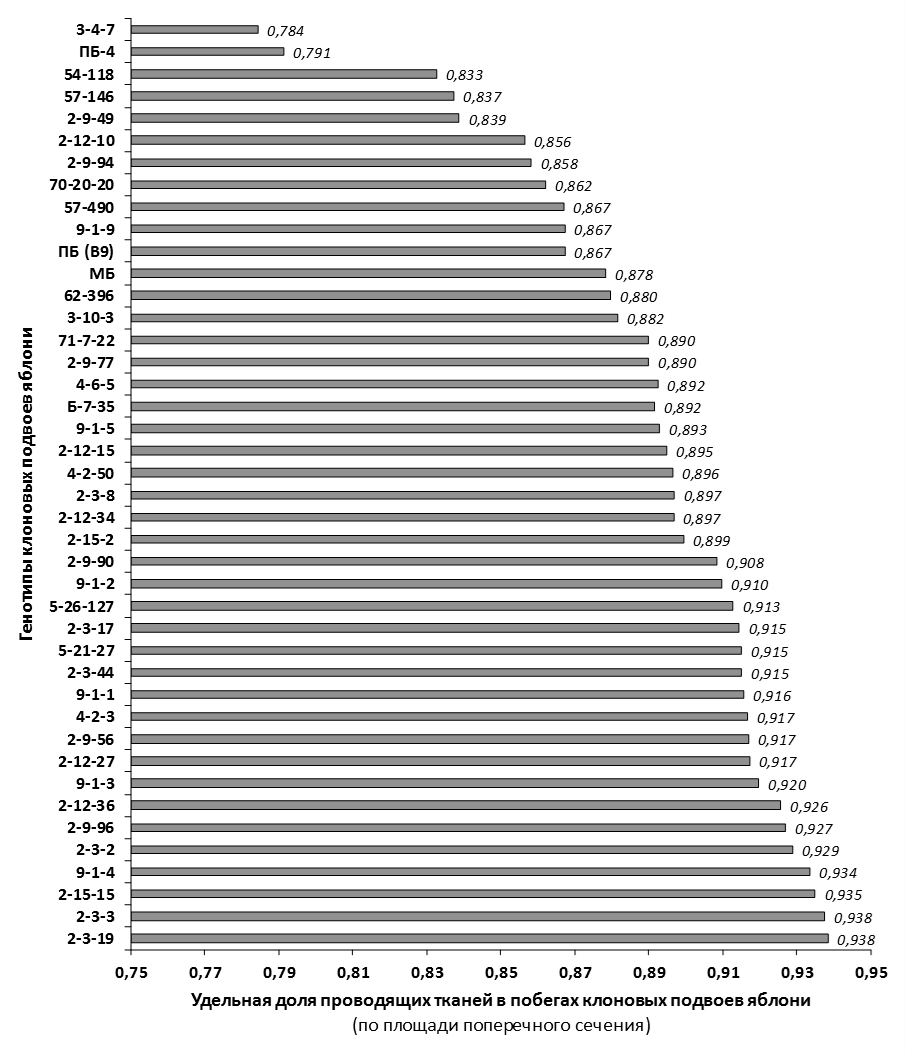
Рисунок 57 – Удельная доля проводящих тканей (флоэмы и ксилемы) в вертикальных отводках клоновых подвоев яблони, рассчитанная по сумме их площадей на поперечном сечении побега
Выводы по главе 3
Наибольшей побегообразовательной способностью маточных кустов (более 15 отводков) характеризовались перспективные формы 2-3-14, 2-9-49, 2-9-96, 2-12-10, 2-12-15, 9-1-1, 9-1-4, 9-1-5. Наибольшая доля стандартных отводков (около 50% и более от общего количества) отмечена у форм 2-3-2, МБ, ПБ, 4-2-50, 9-1-9, 2-15-2, 2-9-94, 2-3-8. Между выходом стандартных отводков с куста и средним баллом их укоренения по генотипам подвоев установлена корреляция +0,72.
По сумме хлорофиллов в тканях листовой пластинки клоновые подвои в целом превосходят рассмотренные сорта яблони, а по содержанию каротиноидов примерно соответствуют им. По наибольшему уровню хлорофиллов отличаются подвои 76-3-6, 54-118 и 57-490. Кроме различного уровня содержания антоцианов, других существенных различий в концентрации пигментов у краснолистных и зеленолистных клоновых подвоев не выявлено.
Суммарная доля проводящих тканей в стеблевой части побега клоновых подвоев яблони в основном зависит от степени развития ксилемы, коэффициент корреляции данных показателей составляет +0,79. Удельная доля флоэмы в вертикальных отводках клоновых подвоев яблони, рассчитанная по ее площади на поперечном сечении побега, оказалась наибольшей (29%) у слаборослых форм селекции Мичуринского ГАУ 2-3-3, 2-3-17, 2-9-49, 2-15-15, МБ, а максимальное значение данного показателя (38%) отмечено у суперкарликового подвоя ПБ-4. У подвойных форм 2-3-3, 2-3-19, 2-15-15 удельная доля обеих проводящих тканей (флоэмы и ксилемы) в вертикальных отводках клоновых подвоев яблони оказалась наибольшей – 94% от общей площади поперечного сечения побега.
4 ОЦЕНКА ПЕРСПЕКТИВНЫХ СОРТО-ПОДВОЙНЫХ КОМБИНАЦИЙ ЯБЛОНИ В ПИТОМНИКЕ КОНКУРСНОГО ИСПЫТАНИЯ
Цель исследований: оценка перспективных сорто-подвойных комбинаций яблони в условиях трех полей питомника конкурсного испытания и выделение лучших форм клоновых подвоев яблони селекции Мичуринского ГАУ для дальнейшего изучения в конкурсном саду.
Задачи исследований:
— провести оценку перспективных сорто-подвойных комбинаций яблони в условиях питомника конкурсного испытания по комплексу значимых биологических признаков и высоких производственных показателей;
— исследованы новые сорто-подвойные комбинации яблони колонновидного габитуса кроны по комплексу биологических и хозяйственно-ценных признаков в сравнении 2-го и 3-го полей питомника
— определить динамику изменения биометрических показателей сорто-подвойных комбинаций на основе перспективных клоновых подвоев во втором и третьем полях питомника;
— по показателям в питомнике выделить лучшие формы клоновых подвоев яблони для дальнейшего изучения в саду конкурсного испытания.
Научная новизна и практическая значимость: в условиях питомника конкурсного испытания проведена оценка новых перспективных сорто-подвойных комбинаций яблони, в том числе с участием четырех отечественных колонновидных сортов, по влиянию привойного и подвойного компонентов и выделены лучшие формы клоновых подвоев яблони, рекомендуемые для дальнейшего изучения в саду конкурсного испытания.
Объекты, условия и методика проведения исследований
Питомник конкурсного изучения, в котором проведены исследования, расположен в структурном подразделении ФГБОУ ВО Мичуринский ГАУ – Научно-образовательном центре (НОЦ) имени В.И. Будаговского и служит для ежегодного исследования перспективных генотипов клоновых подвоев при получении высококачественного посадочного материала яблони.
В 2019 г. в первом поле питомника было изучено 38 подвойных форм яблони селекции Мичуринского ГАУ 2002-2009 гг. гибридизации, во втором и третьем полях – 23 генотипа. Контролем служили подвои 54-118 (полукарликовой силы роста) и 62-396 (карликовой силы роста).
При изучении коллекции клоновых подвоев яблони учитывали следующие хозяйственно-биологические показатели: приживаемость отводков, процент подошедших к окулировке подвоев, приживаемость «глазков» после окулировки, сохранность окулянтов в зимний период, удельный выход и развитие однолетних саженцев по результатам осенней ревизии, удельный выход и развитие двухлетних саженцев по результатам осенней ревизии.
Исследования проводили с учетом «Методики государственного сортоиспытания» [121], «Программы и методики селекции плодовых, ягодных и орехоплодных культур» [24], методики изучения подвоев плодовых культур [123], методики выявления сортов интенсивного типа [131], а также методик, разработанных сотрудниками кафедры плодоводства Мичуринского ГАУ [124-126]. Статистическую обработку полученных данных проводили в программной среде Microsoft Office Excel 2016.
Результаты исследований
Изучаемые клоновые подвои яблони на первом поле питомника характеризовались высокой приживаемостью после посадки. После высадки отделенных стандартных укорененных отводков весной в первое поле питомника в среднем по генотипам в среднем прижилось 90,8%, из них в свою очередь 94,7% затем оказались пригодными к окулировке. От исходного количества высаженных подвоев пригодных к окулировке по изучаемым генотипам в июле 2019 г. в среднем отмечено 86,0%. Доля подвоев с прижившимися щитками («глазками») после окулировки составила 97,4% от заокулированных и 83,8% от исходного количества высаженных подвоев. Нибольшей приживаемостью окулянтов в первом поле питомника выше контольного уровня (более 92,3%) характеризовались подвои 9-1-3, 2-9-90, 4-2-50, 2-3-44, 9-1-2, 2-12-36, 4-2-3 (табл. 10).
Таблица 10 – Показатели первого поля питомника (2019 г.)
| №
п/п |
Подвой | Высажено,
шт. |
Прижившихся подвоев, | Пригодных к окулировке | С прижившимися глазками | ||||
| шт. | % | шт. | % от
жив. |
шт. | % от прижив. | % от высаж. | |||
| 9-1-3 | 91 | 89 | 97,8 | 89 | 100 | 89 | 100 | 97,8 | |
| 2-9-90 | 101 | 101 | 100 | 101 | 100 | 98 | 97,0 | 97,0 | |
| 4-2-50 | 57 | 55 | 96,5 | 55 | 100 | 55 | 100 | 96,5 | |
| 2-3-44 | 44 | 43 | 97,7 | 43 | 100 | 42 | 97,7 | 95,5 | |
| 9-1-2 | 71 | 69 | 97,2 | 67 | 97,1 | 67 | 100 | 94,4 | |
| 2-12-36 | 66 | 64 | 97,0 | 62 | 97,0 | 62 | 100 | 93,9 | |
| 4-2-3 | 70 | 69 | 98,6 | 67 | 97,1 | 66 | 98,5 | 92,3 | |
| 62-396 | 78 | 77 | 98,7 | 75 | 97,4 | 72 | 96,0 | 92,3 | |
| 54-118 | 51 | 51 | 100 | 48 | 94,1 | 47 | 97,9 | 92,2 | |
| 2-9-94 | 60 | 57 | 95,0 | 55 | 96,5 | 55 | 100 | 91,7 | |
| 4-6-5 | 57 | 54 | 94,7 | 53 | 98,1 | 52 | 98,1 | 91,2 | |
| 9-1-9 | 89 | 88 | 98,9 | 82 | 93,2 | 81 | 98,8 | 91,0 | |
| 2-15-15 | 121 | 119 | 98,3 | 113 | 94,9 | 110 | 97,3 | 90,9 | |
| 2-3-2 | 32 | 32 | 100 | 31 | 93,7 | 29 | 93,5 | 90,6 | |
| 9-1-5 | 87 | 84 | 96,6 | 81 | 96,4 | 78 | 96,3 | 89,7 | |
| 9-1-4 | 55 | 50 | 90,9 | 50 | 100 | 49 | 98,0 | 89,1 | |
| 2-3-14 | 70 | 67 | 95,7 | 63 | 94,0 | 62 | 98,4 | 88,6 | |
| 2-3-17 | 61 | 59 | 96,7 | 53 | 89,8 | 53 | 100 | 86,9 | |
| 2-15-2 | 118 | 109 | 92,4 | 103 | 94,5 | 102 | 99,0 | 86,4 | |
| 3-3-4 | 57 | 54 | 94,7 | 53 | 98,1 | 49 | 92,4 | 86,0 | |
| 5-28-11 | 75 | 70 | 93,3 | 65 | 92,8 | 64 | 98,5 | 85,3 | |
| 2-12-34 | 47 | 44 | 93,6 | 43 | 97,8 | 40 | 93,0 | 85,1 | |
| 2-9-56 | 61 | 61 | 100 | 54 | 88,5 | 51 | 94,4 | 83,6 | |
| 2-9-96 | 23 | 21 | 91,3 | 20 | 95,2 | 19 | 95,0 | 82,6 | |
| 2-12-15 | 78 | 71 | 91,0 | 65 | 91,5 | 64 | 98,5 | 82,1 | |
| 2-3-3 | 96 | 85 | 88,5 | 78 | 91,8 | 77 | 98,7 | 80,2 | |
| 2-12-10 | 98 | 91 | 92,9 | 84 | 92,3 | 78 | 92,8 | 80,0 | |
| 9-1-1 | 102 | 87 | 85,3 | 84 | 96,6 | 78 | 92,8 | 76,5 | |
| 2-9-77 | 98 | 80 | 81,6 | 78 | 97,5 | 74 | 94,9 | 75,5 | |
| 2-3-8 | 65 | 59 | 90,8 | 51 | 86,4 | 49 | 96,0 | 75,4 | |
| 5-21-93 | 50 | 38 | 76,0 | 37 | 97,4 | 37 | 100 | 74,0 | |
| 5-21-93 | 50 | 38 | 76,0 | 37 | 97,4 | 37 | 100 | 74,0 | |
| 2-9-49 | 101 | 88 | 87,1 | 75 | 85,2 | 71 | 94,7 | 70,3 | |
| 3-4-7 | 40 | 28 | 70,0 | 27 | 96,4 | 27 | 100 | 67,5 | |
| 3-10-3 | 90 | 60 | 66,7 | 60 | 100 | 60 | 100 | 66,7 | |
| 2-12-27 | 67 | 46 | 68,6 | 44 | 95,6 | 44 | 100 | 65,7 | |
| 5-21-27 | 34 | 34 | 100 | 21 | 61,4 | 21 | 100 | 61,8 | |
| 5-26-127 | 20 | 12 | 86,0 | 12 | 100 | 11 | 91,7 | 55,0 | |
| 5-27-1 | 46 | 28 | 60,9 | 25 | 89,3 | 24 | 96,0 | 52,2 | |
| Итого | 2677 | 2432 | 90,8 | 2304 | 94,7 | 2244 | 97,4 | 83,8 | |
Продолжение табл. 10
В питомнике выход двухлетних саженцев яблони составил с среднем по сортам 86,3%. Наибольший выход на уровне 94,5% отмечен у саженцев сорта Синап орловский, а наименьший (74,1%) – у сорта Мелба (табл. 11).
Таблица 11 – Выход двухлетних саженцев яблони по сортам в питомнике (по окончании вегетационного периода 2019 г.)
| Сорт | Заокулировано подвоев, шт. | Количество
двухлетних саженцев, шт. |
Выход двухлетних
саженцев от кол-ва заокулированных, % |
| Синап орловский | 73 | 69 | 94,5 |
| Спартан | 31 | 29 | 93,5 |
| Медуница | 222 | 200 | 90,1 |
| Корнет (колонновидный) | 71 | 62,0 | 87,3 |
| Лобо | 45 | 39 | 86,7 |
| Подарок Графскому | 43 | 36 | 83,7 |
| Антоновка обыкновенная | 253 | 208 | 82,2 |
| Каскад (колонновидный) | 78 | 64 | 82,1 |
| Московское ожерелье (колонн.) | 103 | 83 | 80,6 |
| Жигулевское | 48 | 38 | 79,2 |
| Валюта (колонновидный) | 83 | 63,0 | 75,9 |
| Мелба | 112 | 83 | 74,1 |
| Всего | 1069 | 923 | 86,3 |
Изучение сорто-подвойных комбинаций сортов яблони колонновидного габитуса кроны на клоновых подвоях различной силы роста во втором и третьем полях питомника
В результате проведенных исследований изучены СПК четырех отечественных колонновидных сортов яблони на новых перспективных клоновых подвоях различной силы роста селекции Мичуринского ГАУ. Выявлена значительная вариабельность биометрических показателей растений, вызванная взаимным влиянием компонентов прививки (табл. 12-15).
Максимальные корреляции между сопряженными морфометрическими признаками саженцев отмечены в третьем поле питомника, где в наибольшей степени проявляются генотипические особенности как подвойного, так и привойного (сортового) компонентов прививки.
У двулетних саженцев отмечены положительные корреляции высокого уровня (у сорта Каскад – также и среднего уровня) по следующим парам биометрических показателей:
— между соответствующими значениями высоты саженца и диаметра его штамба у СПК с участием сорта Московское ожерелье – на уровне +0,93; Валюта +0,90; Каскад +0,81; Корнет +0,79;
— между высотой саженца и количества его листьев – у сорта Московское ожерелье +0,94; Валюта +0,89; Каскад +0,62; Корнет +0,80;
— между диаметром штамба саженца и количеством его листьев – у сорта Московское ожерелье +0,97; Валюта +0,89; Каскад +0,85; Корнет +0,97;
— между высотой саженца и площадью его листового аппарата – у сорта Московское ожерелье +0,88; Валюта +0,80; Каскад +0,58; Корнет +0,82.
— между диаметром штамба саженца и площадью его листового аппарата – у сорта Московское ожерелье +0,80; Валюта +0,92; Каскад +0,64; Корнет +0,92;
— между количеством листьев на саженце и суммарной площадью его потенциальной фотосинтезирующей поверхности – у сорта Московское ожерелье +0,81; Валюта +0,82; Каскад +0,78; Корнет +0,90.
Для проведения более эффективного сравнительного количественного анализа степени развития саженцев различных СПК в питомнике, нами был предложен и рассчитывался показатель, условно названный коэффициентом роста. Для однолетних саженцев он определялся как произведение высоты растения (в см) и диаметра штамба его привойного компонента в 3 см выше уровня прививки (в мм). Для двулетних саженцев определяли два различных варианта коэффициента роста:
1) с учетом только высоты растения и диаметра его штамба, рассчитываемый аналогично однолетним саженцам;
2) кроме высоты растения дополнительно учитывали величину его суммарного прироста во второй год, т.е. при формировании боковых разветвлений в третьем поле питомника. Во втором случае общую длину однолетней и двулетней древесины саженца суммировали и умножали на диаметр штамба его привойного компонента.
Первый способ расчета коэффициента роста растений яблони в третьем поле питомника более прост в использовании, а второй способ точнее, поскольку позволяет в ряде анализов учитывать суммарную площадь листьев, образующихся на боковых разветвлениях и составляющих общую фотосинтетическую поверхность двулетнего саженца.
Различие динамики обоих коэффициентов роста у двулетних саженцев яблони колонновидной изучаемых СПК отмечено у сорта Московское ожерелье в диапазоне 1,28 – 2,22 раз, Валюта 1,18 – 2,08 раз, Каскад 1,17 – 1,79 раз, Корнет 1,34 – 1,50 раз. При этом корреляции между значениями динамики обоих коэффициентов роста у СПК четырех данных сортов яблони колонновидной составили +0,67…+0,99 (рис. 58-61).
Таблица 12 – Морфометрические показатели саженцев яблони колонновидной сорта Московское ожерелье на клоновых подвоях различной силы роста во втором и третьем полях питомника
| Клоновый подвой | Высота
саженца, см |
Диаметр штамба, мм | Длина боковых разветвлений, см | Количество листьев, шт. | Листовая
поверхность, см2 |
| 62-396 (контр. – к) | 97,9 ± 3,1
47,0 ± 8,4 |
17,1 ± 0,5
9,0 ± ,6 |
65,7 ± 3,8
– |
168,4 ± 8,4
36,3 ± 2,7 |
2720,5 ± 132,4
1318,9 ± 96,8 |
| 54-118 (контр. – п/к) | 106,7 ± 1,7
64,8 ± 6,3 |
17,9 ± 0,9
9,5 ± 0,5 |
109,5 ± 4,5
– |
172,6 ± 9,2
39,0 ± 4,2 |
3091,3 ± 128,7
1216,4 ± 130,5 |
| 2-3-3 | 105,8 ± 1,2
68,0 ± 0,4 |
17,9 ± 0,9
11,4 ± 0,4 |
129,0 ± 20,1
– |
169,6 ± 12,3
48,2 ± 1,3 |
1890,8 ± 106,4
1925,6 ± 52,7 |
| 2-3-14 | 95,8 ± 3,4
69,6 ± 1,4 |
17,4 ± 0,5
11,8 ± 0,6 |
36,4 ± 2,8
– |
171,6 ± 7,8
50,8 ± 2,7 |
2670,4 ± 121,4
1897,4 ± 101,9 |
| 2-9-77 | 100,0 ± 2,6
71,6 ± 1,0 |
16,2 ± 0,8
12,2 ± 0,8 |
53,4 ± 17,1
– |
152,8 ± 8,1
44,4 ± 1,4 |
2357,9 ± 124,7
1637,0 ± 50,3 |
| 2-9-90 | 67,2 ± 2,6
47,6 ± 8,6 |
13,9 ± 0,6
8,6 ± 0,6 |
19,4 ± 5,4
– |
109,6 ± 12,3
40,6 ± 1,7 |
1550,9 ± 174,1
1173,8 ± 49,7 |
| 2-12-15 | 77,6 ± 5,3
56,0 ± 1,7 |
14,8 ± 1,1
9,2 ± 0,4 |
56,8 ± 8,5
– |
116,4 ± 8,4
41,6 ± 1,9 |
2209,2 ± 158,9
1388,2 ± 63,0 |
| 2-12-36 | 79,8 ± 2,3
49,0 ± 3,4 |
16,0 ± 0,6
9,0 ± 0,9 |
29,2 ± 8,1
– |
136,0 ± 11,8
42,8 ± 2,1 |
1324,7 ± 115,1
1099,6 ± 52,9 |
Примечание: в знаменателе дроби указаны показатели однолетних саженцев (во втором поле питомника), в числителе – показатели двулетних саженцев (в третьем поле питомника)
Таблица 13 – Морфометрические показатели саженцев яблони колонновидной сорта Валюта на клоновых подвоях различной силы роста во втором и третьем полях питомника
| Клоновый подвой | Высота
саженца, см |
Диаметр штамба, мм | Длина боковых разветвлений, см | Количество листьев, шт. | Листовая
поверхность, см2 |
| 62-396 (контр. – к) | 123,7 ± 2,6
53,8 ± 2,1 |
17,3 ± 0,6
10,0 ± 0,9 |
72,1 ± 11,4
– |
189,4 ± 5,8
32,5 ± 1,2 |
2517,4 ± 108,9
1175,2 ± 43,0 |
| 54-118 (контр. – п/к) | 134,8 ± 2,5
71,2 ± 1,9 |
18,7 ± 1,3
9,6 ± 0,5 |
119,4 ± 16,8
– |
238,1 ± 9,2
41,2 ± 0,9 |
2901,2 ± 150,4
1337,8 ± 27,9 |
| 2-3-3 | 133,0 ± 2,4
92,6 ± 4,3 |
18,9 ± 1,6
13,6 ± 0,9 |
117,8 ± 27,2
– |
243,2 ± 23,1
48,2 ± 0,8 |
2794,0 ± 265,8
2037,4 ± 33,8 |
| 2-3-14 | 104,6 ± 2,4
80,0 ± 4,3 |
15,4 ± 0,3
10,6 ± 0,4 |
107,8 ± 16,0
– |
183,8 ± 20,8
41,6 ± 1,5 |
2229,5 ± 252,4
1724,3 ± 60,9 |
| 2-9-77 | 88,8 ± 4,0
67,8 ± 2,5 |
15,7 ± 0,5
11,4 ± 0,4 |
95,8 ± 6,1
– |
187,2 ± 10,0
40,0 ± 1,1 |
2720,5 ± 145,1
1460,0 ± 41,6 |
| 2-9-90 | 66,8 ± 1,5
44,8 ± 2,1 |
11,2 ± 0,7
8,0 ± 0,3 |
12,2 ± 1,7
– |
100,6 ± 9,0
30,8 ± 1,1 |
827,0 ± 73,7
748,8 ± 27,1 |
| 2-12-36 | 90,8 ± 6,5
60,2 ± 2,4 |
14,0 ± 0,9
9,8 ± 0,5 |
43,0 ± 10,4
– |
141,2 ± 15,1
38,2 ± 1,2 |
1485,3 ± 159,2
1111,4 ± 36,1 |
| 215-2 | 113,2 ± 4,3
83,6 ± 4,3 |
14,7 ± 0,7
11,4 ± 0,6 |
54,8 ± 14,4
– |
172,2 ± 17,6
41,0 ± 1,3 |
2480,3 ± 253,4
1636,7 ± 52,1 |
| 2-15-15 | 121,8 ± 2,7
84,6 ± 2,1 |
19,3 ± 0,6
12,4 ± 0,2 |
70,8 ± 16,8
– |
199,6 ± 6,5
42,6 ± 1,6 |
3558,6 ± 116,0
1822,4 ± 67,1 |
| 34-7 | 101,6 ± 6,2
75,4 ± 2,2 |
14,1 ± 0,6
10,2 ± 0,6 |
85,8 ± 6,6
– |
186,8± 11,6
41,0 ± 1,14 |
1926,5 ± 119,1
1356,7 ± 37,7 |
Примечание: в таблицах 12-15 в знаменателе дроби указаны показатели однолетних саженцев (во втором поле питомника), в числителе – показатели двулетних саженцев (в третьем поле питомника)
У двухлетних СПК отмечено увеличение коэффициента их роста, одновременно сопровождающееся снижением удельной листовой поверхности побегов в диапазоне 1,02-2,76 раз, что связано с уменьшением площади листьев во второй сезон, а также увеличением количества однолетних разветвлений (рис. 58-61).
По биометрическим показателям роста и развития саженцев колонновидных сортов яблони в условиях второго и третьего полей питомника наиболее сдержанным ростом характеризовались СПК с участием клоновых подвоев 2-9-90, 2-12-36, в отдельных случаях – 2-9-77, 2-15-2, 3-4-7.
Таблица 14 – Морфометрические показатели саженцев яблони колонновидной сорта Каскад на клоновых подвоях различной силы роста во втором и третьем полях питомника
| Клоновый подвой | Высота
саженца, см |
Диаметр штамба, мм | Длина боковых разветвлений, см | Количество листьев, шт. | Листовая
поверхность, см2 |
| 62-396 (контр. – к) | 92,1 ± 1,6
65,6 ± 2,6 |
16,8 ± 0,4
10,0 ± 1,1 |
54,8 ± 5,7
– |
128,0 ± 9,8
38,2 ± 2,2 |
3128,0 ± 168,7
1277,4 ± 73,6 |
| 54-118 (контр. – п/к) | 95,7 ± 1,8
68,9 ± 2,1 |
19,1 ± 0,6
11,8 ± 1,0 |
71,4 ± 6,2
– |
131,4 ± 10,1
40,9 ± 2,7 |
3097,2 ± 157,6
1492,8 ± 89,2 |
| 2-3-3 | 94,2 ± 2,7
64,6 ± 0,9 |
18,4 ± 0,5
12,6 ± 0,9 |
70,0 ± 11,4
– |
124,4 ± 9,9
40,0 ± 1,3 |
2719,9 ± 217,4
2249,2 ± 71,1 |
| 2-9-77 | 90,8 ± 1,5
59,8 ± 1,7 |
16,3 ± 0,4
10,6 ± 0,4 |
47,4 ± 6,0
– |
122,0 ± 10,8
33,8 ± 0,8 |
2719,9 ± 295,7
1631,5 ± 38,6 |
| 2-9-90 | 63,0 ± 0,7
37,6 ± 1,0 |
13,1 ± 0,4
8,0 ± 0,3 |
10,6 ± 0,2
– |
89,8 ± 7,4
28,8 ± 0,7 |
1661,4 ± 137,6
1248,5 ± 31,9 |
| 2-12-15 | 89,8 ± 5,5
56,6 ± 3,0 |
17,1 ± 1,4
9,8 ± 0,6 |
73,6 ± 10,9
– |
126,4 ± 10,8
36,2 ± 1,3 |
2160,8 ± 185,4
2061,6 ± 75,1 |
| 2-12-36 | 76,4 ± 2,6
55,8 ± 2,7 |
17,5 ± 0,7
10,8 ± 0,6 |
38,0 ± 10,4
– |
141,8 ± 13,7
33,4 ± 0,7 |
3263,0 ± 315,1
1296,0 ± 29,0 |
Таблица 15 – Морфометрические показатели саженцев яблони колонновидной сорта Корнет на клоновых подвоях различной силы роста во втором и третьем полях питомника
| Клоновый подвой | Высота
саженца, см |
Диаметр штамба, мм | Длина боковых разветвлений, см | Количество листьев, шт. | Листовая
поверхность, см2 |
| 62-396 (контр. – к) | 122,4 ± 2,8
60,5 ± 3,6 |
18,7 ± 0,4
9,8 ± 0,6 |
51,8 ± 9,4
– |
241,0 ± 10,2
35,0 ± 1,7 |
3088,4 ± 140,7
1273,0 ± 61,2 |
| 54-118 (контр. – п/к) | 133,6 ± 2,1
74,4 ± 4,3 |
20,1 ± 0,5
10,0 ± 0,8 |
65,1 ± 8,2
– |
261,0 ± 11,8
46,8 ± 1,8 |
3504,8 ± 132,4
1509,8 ± 59,0 |
| 2-3-3 | 134,6 ± 5,1
98,0 ± 6,4 |
19,9 ± 1,2
14,6 ± 1,3 |
64,8 ± 16,4
– |
250,6 ± 9,1
53,4 ± 1,7 |
3143,4 ± 114,5
1964,1 ± 61,1 |
| 2-9-77 | 113,6 ± 2,2
79,2 ± 3,0 |
17,1 ± 0,7
10,8 ± 0,4 |
47,6 ± 11,1
– |
188,8 ± 20,1
47,0 ± 1,4 |
3032,6 ± 322,2
1830,7 ± 53,7 |
| 2-15-2 | 115,6 ± 7,4
93,2 ± 1,2 |
19,0 ± 0,8
13,2 ± 0,6 |
50,4 ± 10,4
– |
244,8 ± 14,7
55,6 ± 2,3 |
3144,0 ± 188,6
2120,6 ± 87,5 |
| 2-12-36 | 86,8 ± 1,7
63,0 ± 2,5 |
15,6 ± 1,0
10,0 ± ,4 |
43,2 ± 10,3
– |
176,0 ± 14,6
42,0 ± 2,3 |
2153,6 ± 178,1
1270,9 ± 70,0 |
| 2-15-15 | 133,0 ± 2,3
98,2 ± 4,6 |
19,1 ± 0,4
12,8 ± 0,4 |
55,4 ± 9,1
– |
259,8 ± 19,8
54,2 ± 1,7 |
3495,4 ± 266,8
1859,6 ± 59,8 |
| 3-4-7 | 113,8 ± 8,6
78,3 ± 5,4 |
14,9 ± 0,7
11,5 ± 1,3 |
40,5 ± 15,5
– |
167,8 ± 12,7
50,3 ± 1,9 |
2174,9 ± 165,0
1456,8 ± 54,7 |
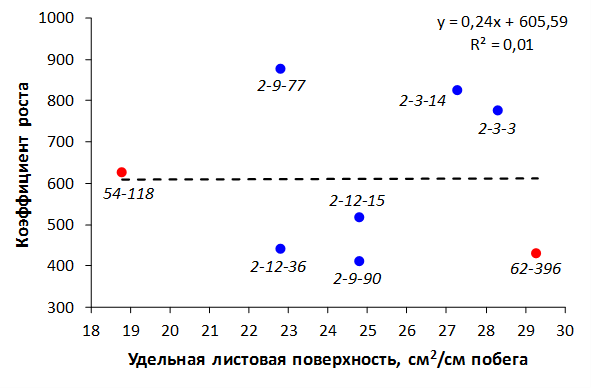
а
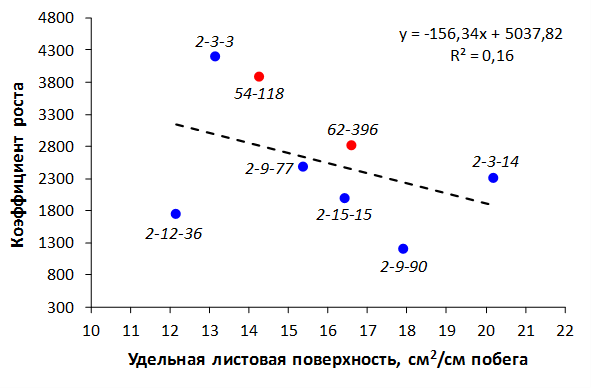
б
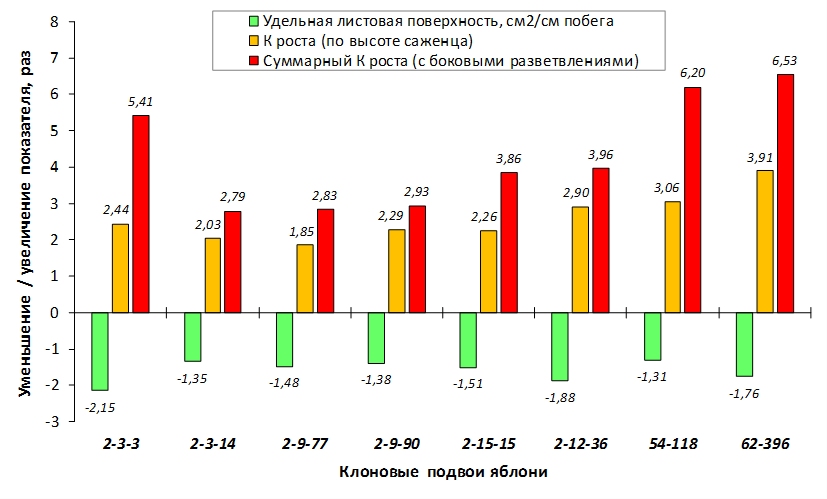
в
Рисунок 58 – Сравнительный анализ роста растений и развития листового аппарата однолетних (а) и двулетних (б) саженцев СПК сорта Московское ожерелье и их динамики (в) в третьем поле питомника в сравнении с показателями второго поля
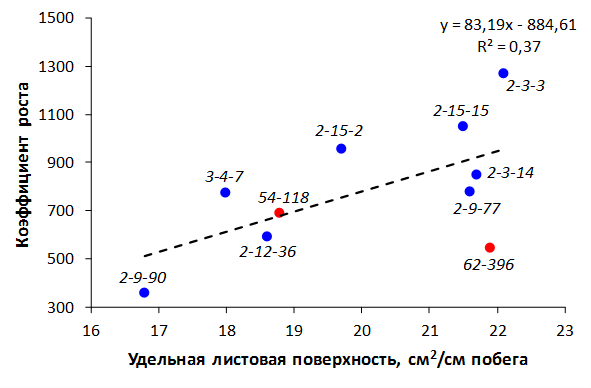
а
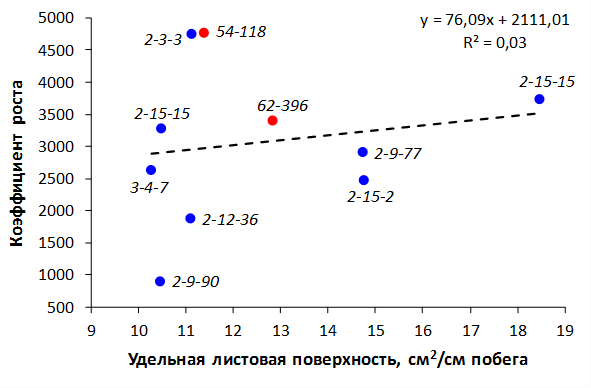
б
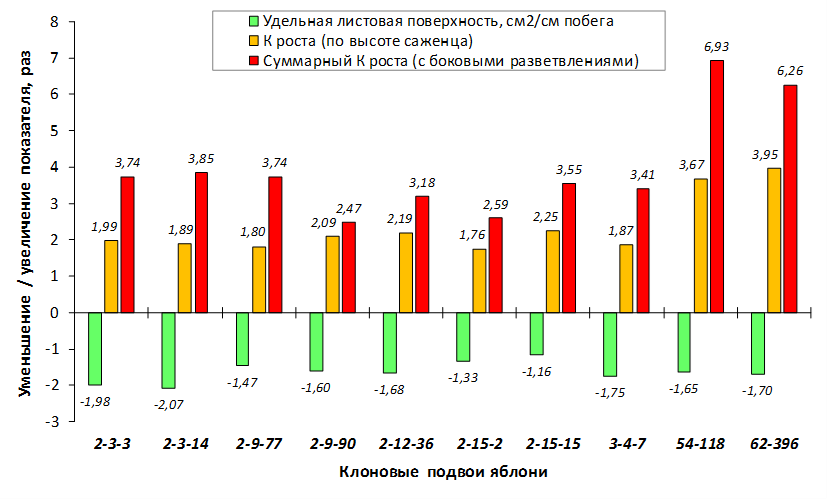
в
Рисунок 59 – Сравнительный анализ роста растений и развития листового аппарата однолетних (а) и двулетних (б) саженцев СПК сорта Валюта и их динамики (в) в третьем поле питомника в сравнении с показателями второго поля
а
б
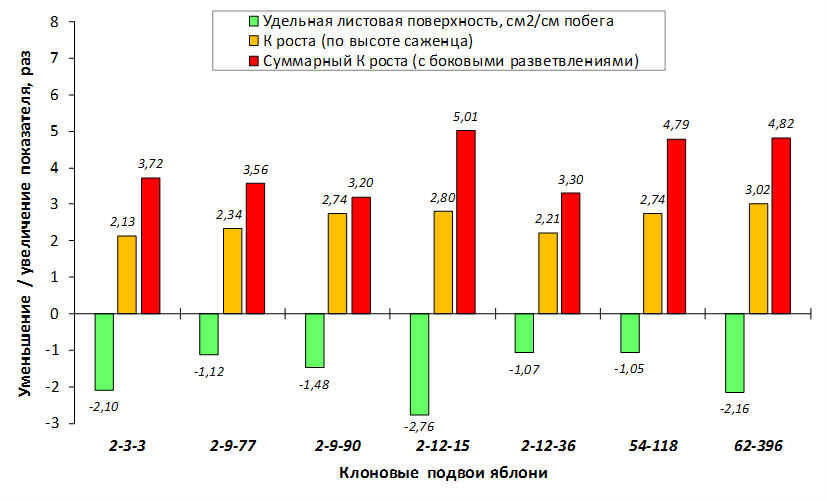
в
Рисунок 60 – Сравнительный анализ роста растений и развития листового аппарата однолетних (а) и двулетних (б) саженцев СПК сорта Каскад и их динамики (в) в третьем поле питомника в сравнении с показателями второго поля
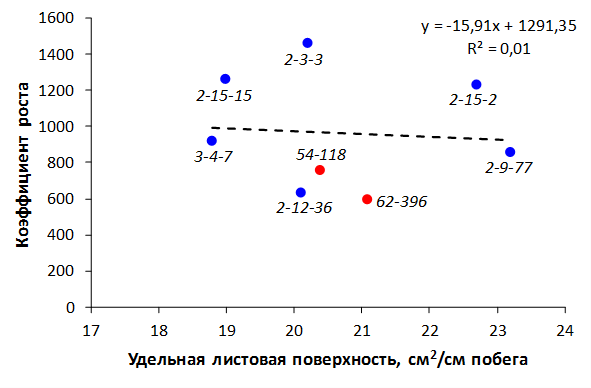
а
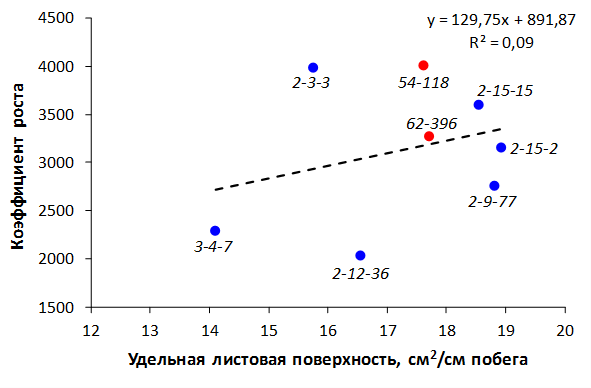
б
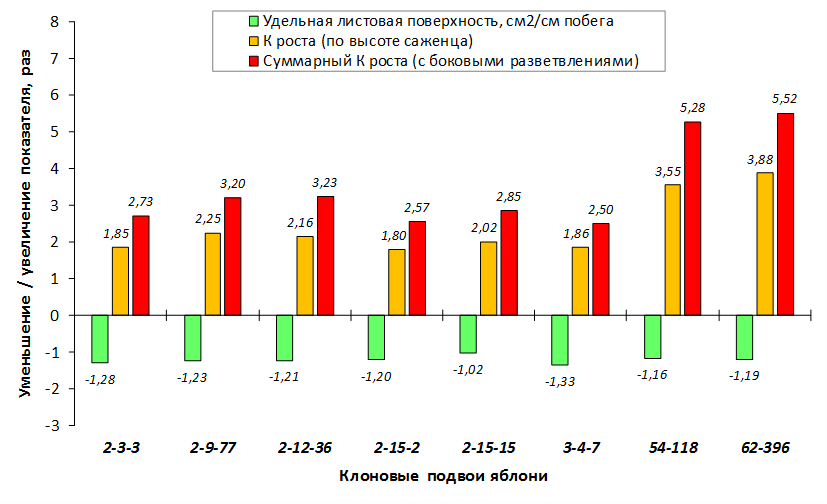
в
Рисунок 61 – Сравнительный анализ роста растений и развития листового аппарата однолетних (а) и двулетних (б) саженцев СПК сорта Корнет и их динамики (в) в третьем поле питомника в сравнении с показателями второго поля
Изучение сорто-подвойных комбинаций сортов яблони традиционного (неколонновидного) габитуса кроны на клоновых подвоях различной силы роста в третьем поле питомника и динамика их развития в сравнении с показателями второго поля питомника
Также было проведено аналогичное изучение СПК сортов яблони традиционного (неколонновидного) габитуса кроны с анализом динамики показателей саженцев второго и третьего полей питомника. В результате была установлена значительная вариабельность биометрических параметров роста и развития растений различных СПК, что вызвано взаимных влиянием подвойного и привойного (сортового) компонентов привики и определяемое их генотипами (табл. 16-18).
Наименьшим ростом в питомнике характеризовались СПК с участием клоновых подвоев 9-1-1, 9-1-3, 9-1-4, 9-1-9. В связи с засушливыми условиями летнего периода 2019 г. и связанной с ними низкой относительной влажностью воздуха, показатели саженцев на контрольных подфоях 62-396 и 54-118 оказались сходными, но у последнего все же оказались более выражены боковые однолетние разветвления саженцев и увеличена площадь листовой поверхности. Установлены положительные корреляции среднего уровня между высотой двухлетнего саженца и диаметром его штамба у СПК одного сорта: Мелба +0,71; Антоновка +0,59; Синап орловский +0,62.
Таблица 16 – Морфометрические показатели двулетних саженцев яблони сорта Мелба на клоновых подвоях различной силы роста (2019 г.)
| Сорто-подвойные
комбинации |
Высота
саженца, см |
Диаметр штамба, мм | Количество листьев, шт. | Листовая
поверхность, см2 |
| Мелба/9-1-9 | 108,4 ± 3,5 | 12,6 ± 0,5 | 105,0 ± 5,4 | 2133,9 ± 109,4 |
| Мелба/9-1-1 | 117,0 ± 2,4 | 12,1 ± 0,3 | 136,2 ± 4,4 | 3196,5 ± 103,2 |
| Мелба/9-1-3 | 123,6 ± 4,6 | 13,6 ± 0,6 | 134,6 ± 10,5 | 3173,8 ± 247,1 |
| Мелба/5-24-1 | 132,6 ± 2,7 | 16,4 ± 1,1 | 133,6 ± 12,0 | 3184,8 ± 286,6 |
| Мелба/54-118
(контроль – п/к) |
133,4 ± 4,3 | 17,5 ± 0,5 | 144,4 ± 2,8 | 4181,7 ± 82,2 |
| Мелба/9-1-4 | 135,2 ± 7,6 | 14,6 ± 0,7 | 143,8 ± 6,4 | 4248,8 ± 190,4 |
| Мелба /62-396
(контроль – к) |
134,0 ± 4,4 | 15,5 ± 0,9 | 164,0 ± 13,3 | 4842,1 ± 393,8 |
| Мелба/9-1-5 | 135,8 ± 2,5 | 14,7 ± 0,4 | 135,4 ± 7,1 | 3613,4 ± 188,8 |
| Мелба/9-1-2 | 137,4 ± 4,3 | 13,8 ± 0,4 | 158,6 ± 2,4 | 4298,5 ± 63,9 |
| Мелба/5-21-27 | 138,8 ± 3,4 | 16,9 ± 0,5 | 142,0 ± 5,9 | 3248,8 ± 134,4 |
| Мелба/4-2-50 | 141,2 ± 2,4 | 16,1 ± 0,5 | 144,4 ± 4,2 | 3592,0 ± 69,9 |
| Мелба/5-21-93 | 142,6 ± 3,8 | 21,1 ± 0,8 | 179,2 ± 14,3 | 4994,3 ± 398,9 |
Таблица 17 – Морфометрические показатели двулетних саженцев яблони сорта Антоновка обыкновенная на клоновых подвоях различной силы роста (2019 г.)
| Сорто-подвойные
комбинации |
Высота
саженца, см |
Диаметр штамба, мм | Количество листьев, шт. | Листовая
поверхность, см2 |
| Антоновка обыкн./9-1-9 | 99,4 ± 2,7 | 12,9 ± 0,4 | 71,2 ± 0,9 | 1856,6 ± 136,3 |
| Антоновка обыкн./9-1-1 | 102,8 ± 1,0 | 11,1 ± 0,3 | 78,8 ± 4,5 | 2304,2 ± 130,6 |
| Антоновка обыкн./54-118 (контроль – п/к) | 107,4 ± 1,4 | 14,8 ± 0,3 | 108,6 ± 4,0 | 2794,3 ± 102,8 |
| Антоновка обыкн./9-1-3 | 108,8 ± 3,1 | 12,9 ± 0,8 | 73,6 ± 3,9 | 1874,3 ± 99,2 |
| Антоновка обыкн./9-1-4 | 111,2 ± 5,0 | 13,4 ± 0,5 | 86,8 ± 3,5 | 2773,5 ± 111,3 |
| Антоновка обыкн./62-396
(контроль – к) |
111,6 ± 2,3 | 13,5 ± 0,5 | 99,0 ± 13,4 | 3024,2 ± 408,3 |
| Антоновка обыкн./5-21-27 | 113,2 ± 2,9 | 15,5 ± 0,6 | 88,4 ± 2,7 | 2574,1 ± 77,4 |
| Антоновка обыкн./5-24-1 | 115,6 ± 2,2 | 15,3 ± 0,8 | 108,2 ± 5,5 | 3108,4 ± 157,7 |
| Антоновка обыкн./9-1-5 | 118,0 ± 4,2 | 13,7 ± 0,5 | 88,0 ± 3,5 | 2791,0 ± 112,1 |
| Антоновка обыкн./9-1-2 | 122,8 ± 2,2 | 12,4 ± 0,2 | 94,8 ± 3,9 | 3170,0 ± 130,1 |
| Антоновка обыкн./4-2-50 | 123,0 ± 2,2 | 14,8 ± 0,9 | 114,2 ± 12,9 | 2900,3 ± 327,7 |
| Антоновка обыкн./5-21-93 | 124,0 ± 1,9 | 18,9 ± 1,1 | 118,0 ± 8,2 | 3328,8 ± 230,2 |
Таблица 18 – Морфометрические показатели двулетних саженцев яблони сорта Синап орловский на клоновых подвоях различной силы роста (2019 г.)
| Сорто-подвойные
комбинации |
Высота
саженца, см |
Диаметр штамба, мм | Количество листьев, шт. | Листовая
поверхность, см2 |
| Синап орловский/9-1-9 | 103,0 ± 4,5 | 12,7 ± 0,5 | 57,8 ± 4,7 | 1410,6 ± 115,9 |
| Синап орловский/9-1-1 | 109,0 ± 2,1 | 13,3 ± 0,7 | 81,8 ± 9,5 | 2304,3 ± 266,3 |
| Синап орловский/9-1-3 | 113,2 ± 4,9 | 12,7 ± 0,5 | 73,2 ± 4,2 | 1844,9 ± 105,3 |
| Синап орловский/54-118 (контроль – п/к) | 116,4 ± 0,8 | 16,7 ± 0,4 | 101,4 ± 3,1 | 3276,2 ± 99,9 |
| Синап орловский/62-396 (контроль – к) | 123,4 ± 2,5 | 16,0 ± 0,4 | 95,0 ± 5,1 | 2869,0 ± 154,0 |
| Синап орловский/9-1-2 | 129,2 ± 4,5 | 13,8 ± 0,5 | 84,4 ± 4,4 | 2307,8 ± 120,0 |
| Синап орловский/9-1-5 | 132,8 ± 4,2 | 16,4 ± 1,0 | 88,0 ± 5,4 | 2613,2 ± 160,2 |
Корреляция высоты двухлетнего саженца и суммарной длины его боковых разветвлений составила у СПК сорта Мелба +0,80; Антоновка +0,74; Синап орловский +0,53. Также отмечены положительные корреляции высокого уровня между величиной показателей диаметра штамба двухлетнего саженца и суммарной длины его боковых разветвлений в третьем поле питомника, которые составили у СПК сорта Мелба +0,82; Антоновка +0,87; Синап орловский +0,86.
Корреляция значений высоты двухлетнего саженца и площади его листовой поверхности составила у СПК сорта Мелба +0,72; Антоновка +0,73; Синап орловский +0,53.
Между значениями диаметра штамба двухлетнего саженца и площади его листовой поверхности выявлены положительные корреляции среднего и высокого уровня – у СПК сорта Мелба +0,58; Антоновка +0,46; Синап орловский +0,90.
Кроме анализа абсолютных значений биометрических показателей роста и развития растений в питомнике, вычисляли также их удельные показатели.
Для двулетних саженцев яблони традиционных районированных сортов аналогично определяли два различных варианта коэффициента роста:
1) с учетом только высоты растения и диаметра его штамба, рассчитываемый аналогично однолетним саженцам;
2) кроме высоты растения дополнительно учитывали величину его суммарного прироста во второй год, т.е. при формировании боковых разветвлений в третьем поле питомника. Во втором случае общую длину однолетней и двулетней древесины саженца суммировали и умножали на диаметр штамба его привойного компонента. Данный показатель мы назвали суммарный коэффициент роста, рассчитывали его указанным способом и применяли для большинства сравнительных анализов СПК в третьем поле питомника.
Сравнительный анализ двух способов расчета коэффициента роста двулетних саженцев яблони (только с учетом высоты и с вычислением суммарного длины прироста) позволил установить высокую положительную корреляцию между ними у соответствующих СПК всех трех изучаемых сортов: Мелба на уровне +0,96; Антоновка обыкновенная +0,86; Синап орловский +0,89. Наиболее сдержанным сортом характеризуются СПК данных сортов, привитых на экспериментальные формы клоновых подвоев 9-1-1, 9-1-3 и 9-1-9, что позволяет предварительно отнести их к группе карликовых. Также следует учитывать, что дифференциация показателей у разных СПК значительно выше при анализе суммарного коэффициента роста, рассчитанного с учетом прироста (боковых разветвлений) в третьем поле питомника (рис. 62, 63). Эффективность анализа СПК по суммарному коэффициенту роста у сорта Мелба выше в 1,89 раза при различии минимального и максимального значений по двум способам в 3,22 и 1,70 раз; у сорта Антоновка обыкновенная – выше в 1,46 раза (2,08/1,42); Синап орловский – выше в 1,64 раза (2,74/1,67).
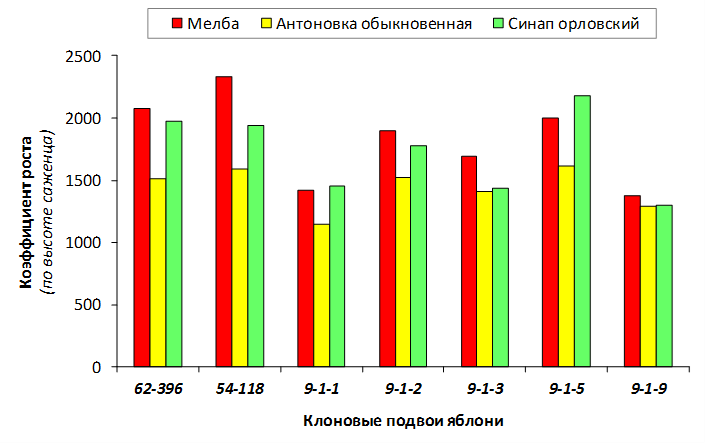
Рисунок 62 – Сравнительный анализ влияния привойного и подвойного компонента на величину коэффициента роста двулетнего саженца, рассчитываемого только с учетом его высоты и диаметра штамба
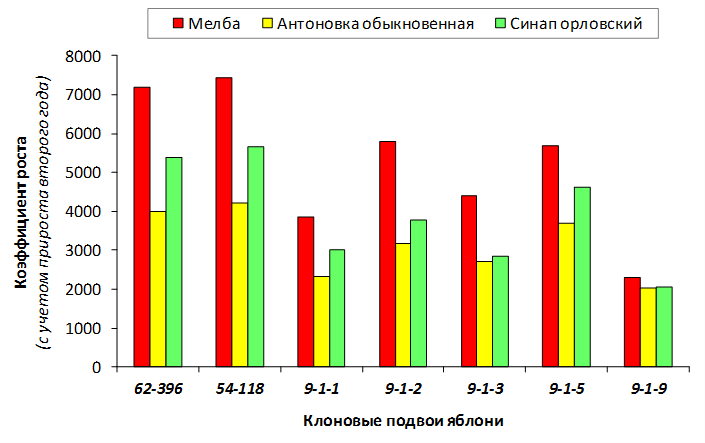
Рисунок 63 – Сравнительный анализ влияния привойного и подвойного компонента на величину суммарного коэффициента роста двулетнего саженца, рассчитываемого с учетом суммарной величины прироста первого и второго года и диаметра штамба
Увеличение эффективности анализа СПК по суммарному коэффициенту роста связано со значительным формированием боковых разветвлений у саженцев в третьем поле питомника. При анализе длины однолетних боковых приростов у двулетних саженцев яблони, привитых на изучаемые экспериментальные клоновые подвои различной силы роста, между показателями данного признака у трех сортов отмечена высокая положительная корреляция на уровне +0,80…0,97 (рис. 64). Это свидетельствует о большей роли генотипа клонового подвоя в регулировании степени развития побегов саженца, чем влияния привойного компонента – сорта. Тем не менее, выращивая в питомнике посадочный материал, следует учитывать и различную силу роста сортов яблони, определяемую генотипом, поэтому варианты СПК «сильнорослый сорт на карликовом подвое» и «сорт со сдержанным ростом на полукарликовом подвое» могут быть близки по значению отдельных морфологических показателей (высоте саженцев, диаметру их штамба, суммарной длине боковых приростов и др.). В данном случае, различия между подобными СПК с сочетанием компонентов прививки различного сила роста проявятся в дальнейшем в саду – в первую очередь, при закладке плодовых образований, скороплодности и урожайности.
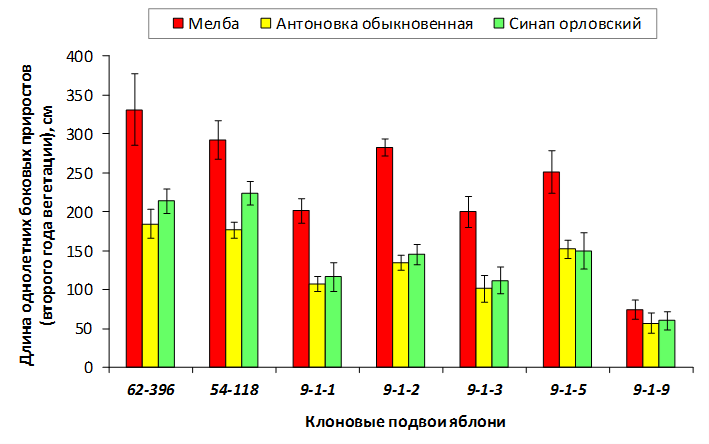
а
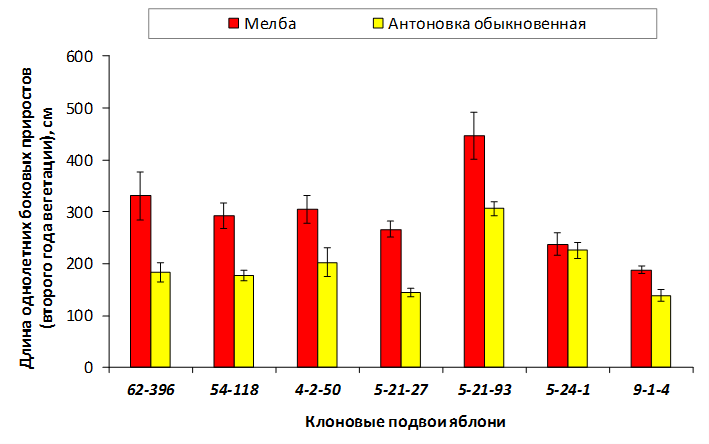
б
Рисунок 64 – Сравнительный анализ степени развития однолетних боковых приростов в третьем поле питомнике у СПК на основе клоновых подвоев различной силы роста
При росте и развитии саженцев в третьем поле питомника происходит существенное увеличение их размеров, количества и длины боковых разветвлений, а также площади фотосинтезирующей поверхности. В зависимости от генотипа привойного и подвойного компонентов различия СПК по величине формирования удельной листовой поверхности, рассчитываемой на 1 см побега, максимально составляли 1,46 раза по всем трем сортам в пределах подвоя, а у СПК одного сорта – 1,50 раза (рис. 65). При этом двулетние саженцы сортов Мелба, Антоновка обыкновенная и Синап орловский на контрольном полукарликовом подвое по величине удельной листовой поверхности различались между собой не более, чем на 2,1%.
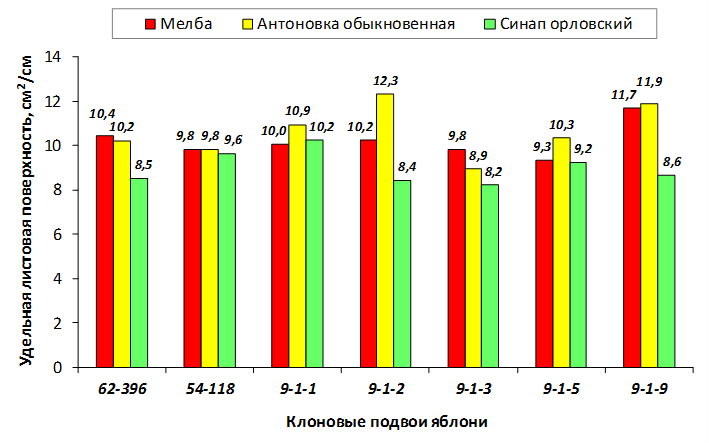
Рисунок 65 – Вариабельность величины удельной листовой поверхности у СПК, привитых на клоновые подвои различной силы роста
Также был проведен сравнительный анализ показателей суммарного коэффициента роста и формирующейся удельной листовой поверхности у двулетних саженцев яблони. В результате между данными морфофункциональными признаками растений отмечена отрицательная корреляция среднего уровня: у сорта Мелба на уровне -0,54; Антоновка обыкновенная -0,78 (рис. 66-68). Это связано с тем, что за счет увеличения общей длины боковых приростов, формируемых в третьем поле питомника, и длины междоузлий происходит уменьшение рассчитываемого отношения площади листовой поверхности к длине побегов.
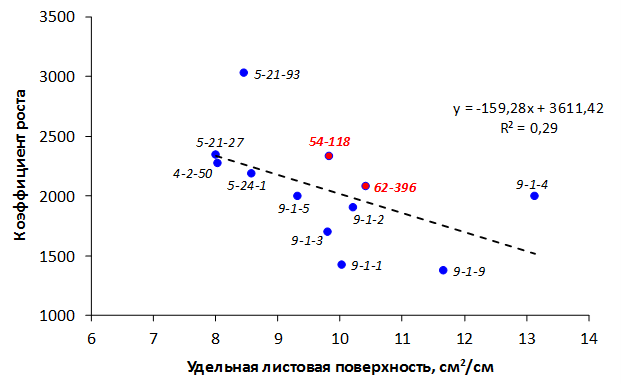
Рисунок 66 – Взаимосвязь показателей диаметра штамба и удельной листовой поверхности у двулетних саженцев сорта Мелба, привитых на клоновые подвои различной силы роста
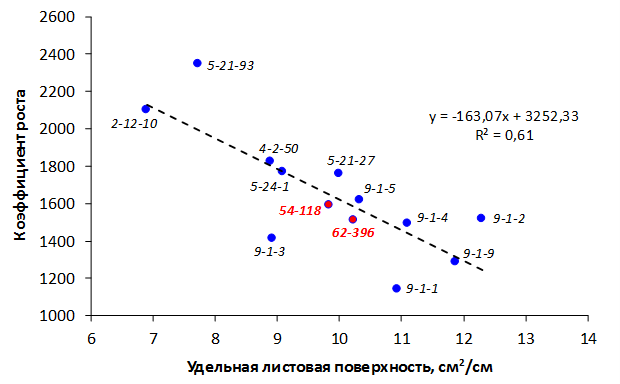
Рисунок 67 – Взаимосвязь показателей диаметра штамба и удельной листовой поверхности у двулетних саженцев сорта Антоновка обыкновенная, привитых на клоновые подвои различной силы роста
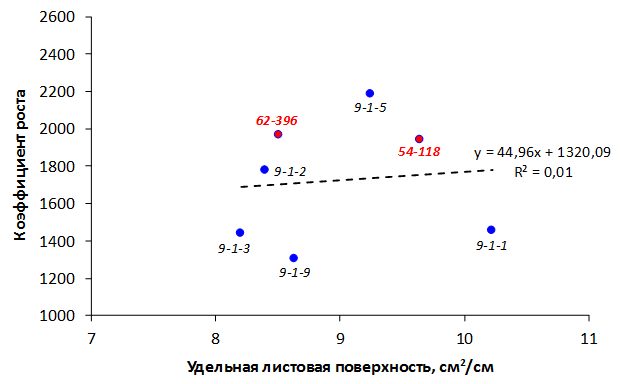
Рисунок 68 – Взаимосвязь показателей диаметра штамба и удельной листовой поверхности у двулетних саженцев сорта Синап орловский, привитых на клоновые подвои различной силы роста
Другим важным морфологическим показателем при анализе степени развития саженцев разных СПК является диаметр их штамба.
По окончании вегетационного периода во втором поле питомника между показателями диаметра штамба и удельной листовой поверхности растений не выявлено корреляций высокого уровня, для однолетних саженцев изучаемых СПК ее значения составили лишь +0,12…+0,34 (рис. 69-71).
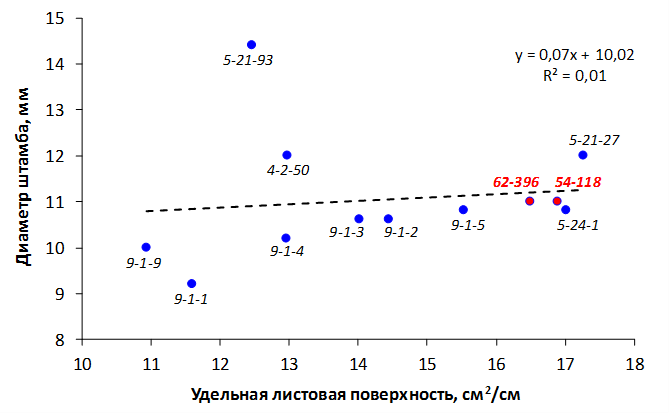
а
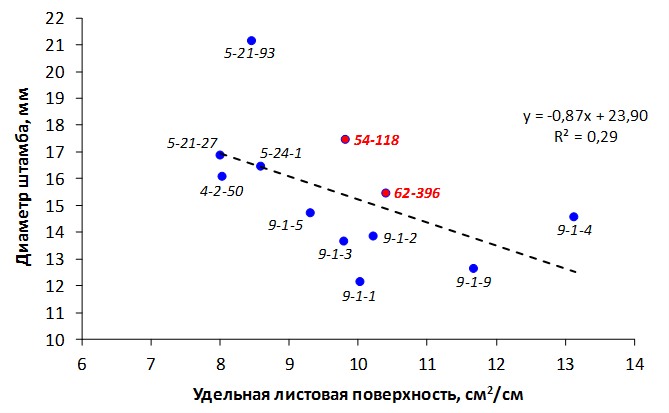
б
Рисунок 69 – Взаимосвязь показателей диаметра штамба и удельной листовой поверхности у однолетних (а) и двулетних (б) саженцев сорта Мелба, привитых на клоновые подвои различной силы роста
В условиях третьего поля питомника для СПК сортов Мелба и Антоновка обыкновенная отмечена отрицательная корреляция показателей диаметра штамба и удельной листовой поверхности – соответственно среднего (-0,53) и высокого (-0,80) уровней. Это выражается в увеличении удельной листовой поверхности у саженцев на более слаборослых подвоях, в том числе за счет укороченных междоузлий на побегах и соответственно наличия большего количества листьев. У СПК с участием сортов Мелба и Антоновка обыкновенная данная закономерность прослеживается наиболее отчетливо, позволяя выделить карликовые подвойные формы 9-1-1, 9-1-2, 9-1-4, 9-1-9, способствующие увеличению удельной листовой поверхности у саженцев в третьем поле питомника (рис. 69, 70). У СПК сорта Синап орловский данная закономерность выражена слабее из-за меньшей вариабельности развития листового аппарата в расчете на длину побегов, однако карликовая форма 9-1-1 также дифференцирована (рис. 71).
Наибольшая динамика увеличения диаметра штамба отмечена у СПК сорта Синап орловский на уровне 2,04-2,56 раз. У СПК сортов Мелба и Антоновка обыкновенная утолщение штамба происходило сходными темпами, выявленными на уровне 1,26-1,59 и 1,25-1,68 раз соответственно (рис. 69-71, б).
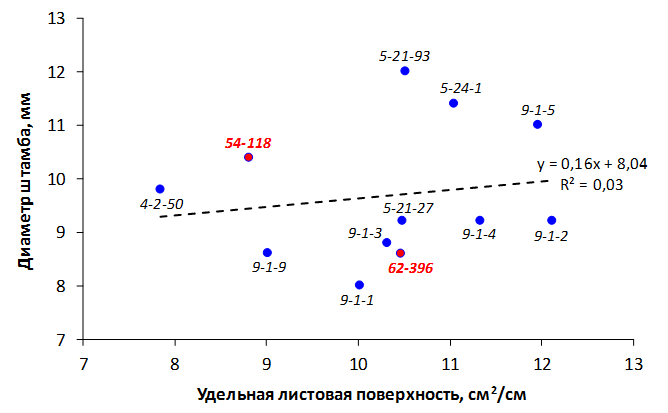
а
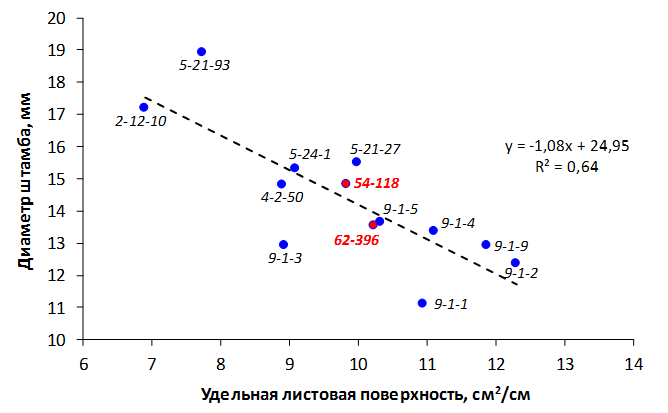
б
Рисунок 70 – Взаимосвязь показателей диаметра штамба и удельной листовой поверхности у однолетних (а) и двулетних (б) саженцев сорта Антоновка обыкновенная, привитых на клоновые подвои различной силы роста
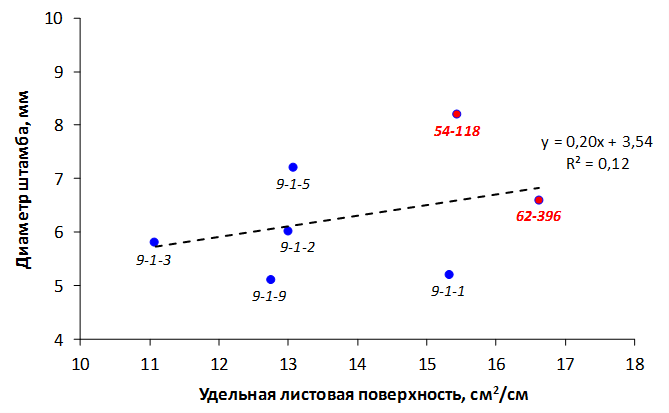
а
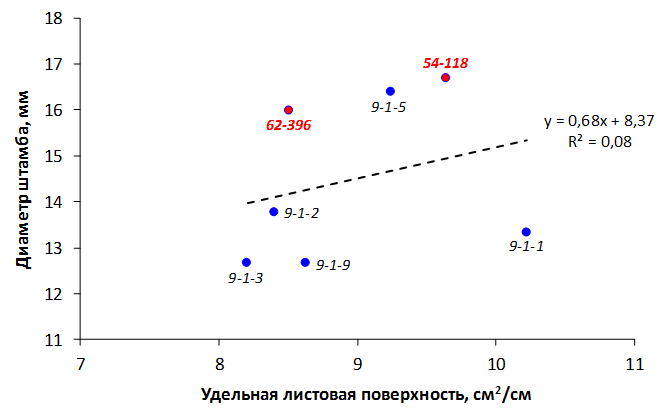
б
Рисунок 71 – Взаимосвязь показателей диаметра штамба и удельной листовой поверхности у однолетних (а) и двулетних (б) саженцев сорта Синап орловский, привитых на клоновые подвои различной силы роста
Проанализирована динамика показателей развития растений изучаемых СПК сортов яблони стандартного габитуса кроны в третьем поле питомника (2019 г.) в сравнении с их предыдущим вегетационным периодом во втором поле питомника в 2018 г. (рис. 72-74). Изменение величины биометрических показателей двухлетних саженцев было вызвано взаимным генотипическим влиянием обоих компонентов прививки – клонового подвоя и привоя (сорта).
Наибольшая динамика увеличения суммарной площади листьев выявлена у СПК сорта Антоновка обыкновенная в диапазоне 2,22-4,04 раз, а наименьшая – у сорта Синап орловский на уровне 1,28-1,90 раз. У СПК сорта Мелба увеличение абсолютной листовой поверхности растений занимало промежуточное положение в интервале 1,34-2,72 раз (рис. 72-74, б).
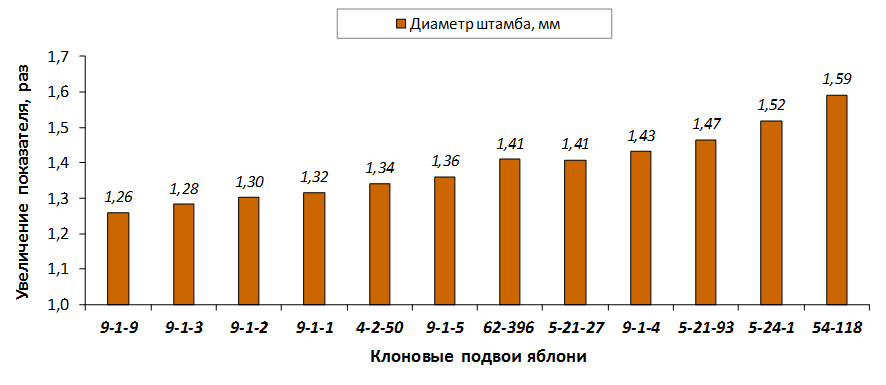
а
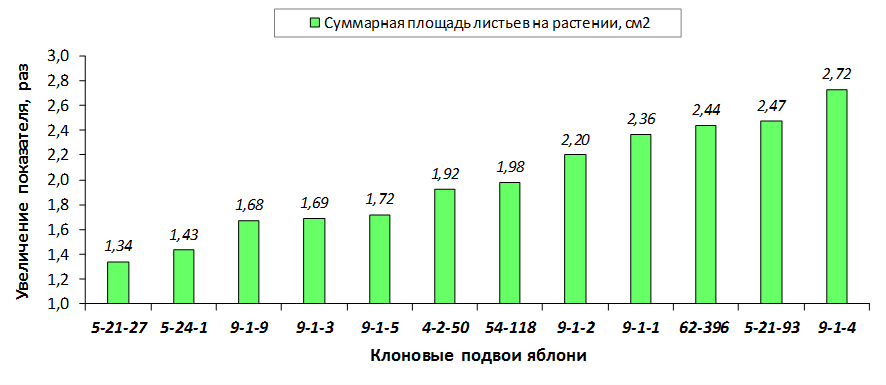
б
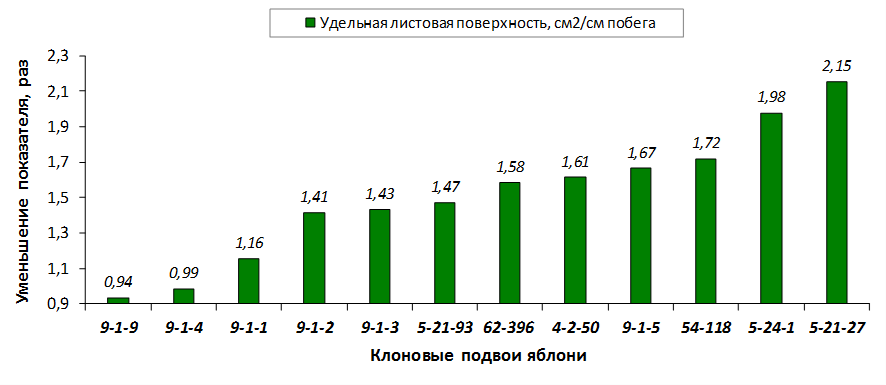
в
Рисунок 72 – Динамика показателей двухлетних саженцев яблони сорта Мелба, привитых на клоновых подвоях различной силы роста, в сравнении с показателями второго поля питомника (2018-2019 гг.)
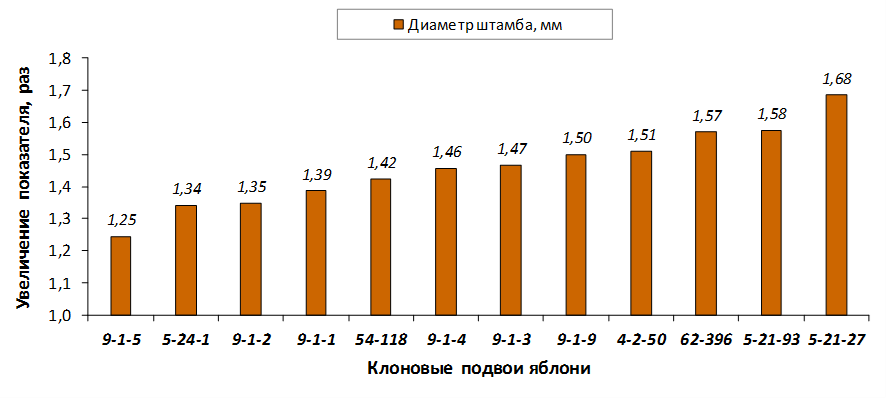
а
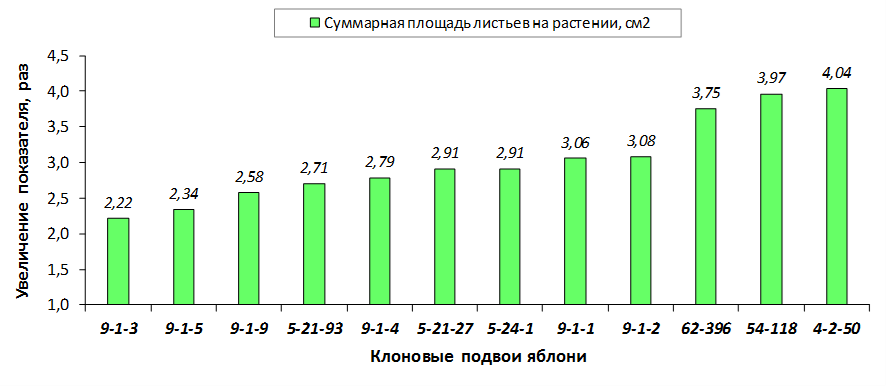
б
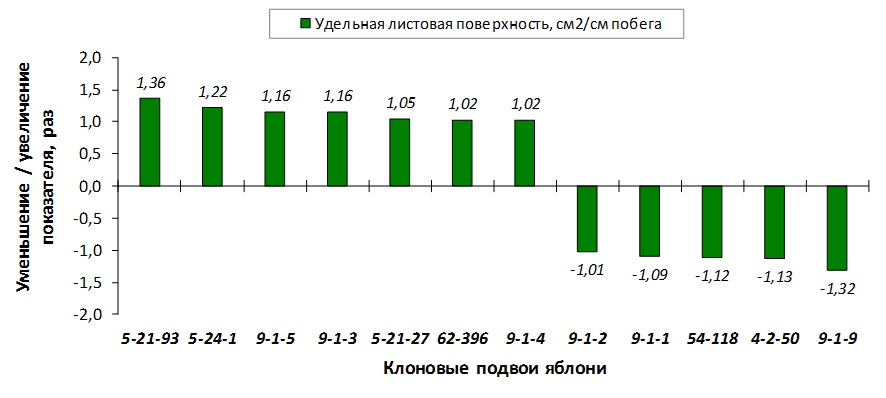
в
Рисунок 73 – Динамика показателей двухлетних саженцев яблони сорта Антоновка обыкновенная, привитых на клоновых подвоях различной силы роста, в сравнении с показателями второго поля питомника (2018-2019 гг.)
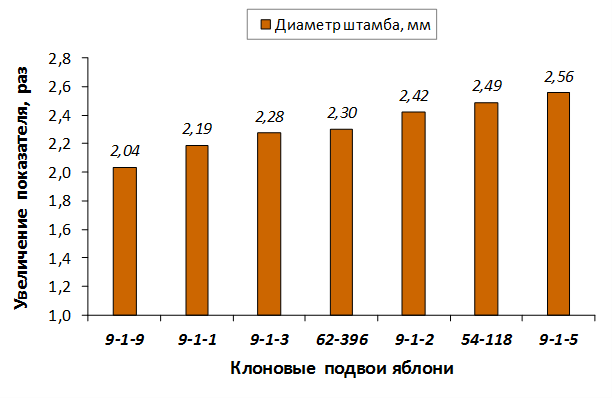
а
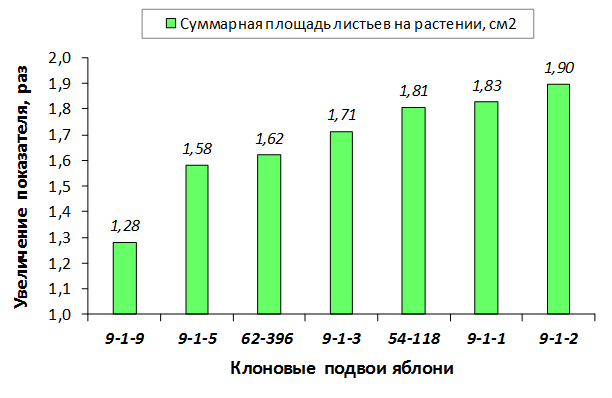
б
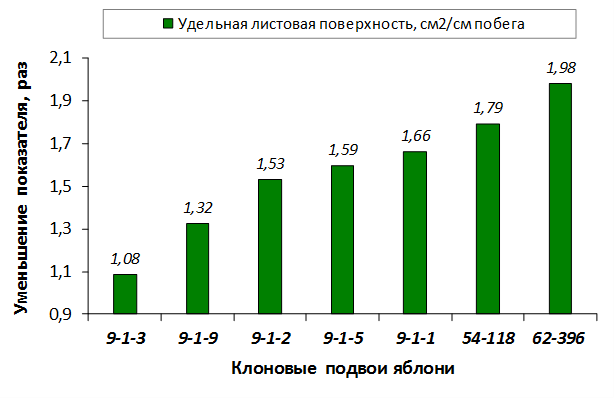
в
Рисунок 74 – Динамика показателей двухлетних саженцев яблони сорта Синап орловский, привитых на клоновых подвоях различной силы роста, в сравнении с показателями второго поля питомника (2018-2019 гг.)
В то же время, в отличие от наблюдаемого в третьем поле питомника увеличения абсолютной поверхности суммарного листового аппарата растений яблони, одновременно установлена тенденция уменьшения удельной листовой поверхности на единицу длины побега у двухлетних саженцев яблони в сравнении с однолетними, что связано с массовым формированием однолетних боковых разветвлений у изучаемых СПК в третьем поле питомника. Максимальная динамика уменьшения удельной листовой поверхности установлена у СПК Мелба/5-21-27 на уровне 2,15 раз; в то время как у отдельных СПК сорта Антоновка обыкновенная отмечена обратная тенденция увеличения данного показателя на 2-36% (рис. 72-74, в).
Выводы по главе 4
Впервые изучены СПК с участием отечественных колонновидных сортов яблони, привитых на новые перспективные клоновые подвои селекции Мичуринского ГАУ. Максимальные корреляции между сопряженными морфометрическими признаками саженцев отмечены в третьем поле питомника, где в наибольшей степени проявляются генотипические особенности как подвойного, так и привойного (сортового) компонентов прививки. У двулетних саженцев яблони колонновидной отмечены положительные корреляции высокого уровня (у сорта Каскад – также и среднего уровня) по следующим парам биометрических показателей: между высотой саженца и диаметром его штамба, высотой саженца и количеством его листьев, диаметром штамба саженца и количеством его листьев, высотой саженца и площадью его листового аппарата, диаметром штамба саженца и площадью его листового аппарата, количеством листьев на саженце и суммарной площадью его потенциальной фотосинтезирующей поверхности.
При анализе длины однолетних боковых приростов у двулетних саженцев традиционных сортов яблони (колонновидного габитуса роста), привитых на изучаемые экспериментальные клоновые подвои различной силы роста, между показателями данного признака у трех сортов отмечена высокая положительная корреляция на уровне +0,80…0,97. Это свидетельствует о преобладающей роли генотипа клонового подвоя в регулировании степени развития побегов саженца, чем влияния привойного компонента – сорта.
При росте и развитии саженцев в третьем поле питомника происходит существенное увеличение их размеров, количества и длины боковых разветвлений, а также площади фотосинтезирующей поверхности.
Также в третьем поле питомника отмечено увеличение удельной листовой поверхности у саженцев на более слаборослых подвоях, в том числе за счет укороченных междоузлий на побегах и соответственно наличия большего количества листьев.
В зависимости от генотипа привойного и подвойного компонентов различия СПК по величине формирования удельной листовой поверхности, рассчитываемой на 1 см побега, максимально составили 1,46 раза по всем трем сортам в пределах одного подвойного компонента, а у СПК одного сорта – 1,50 раза. Установлена тенденция уменьшения удельной листовой поверхности на единицу длины побега у двухлетних саженцев яблони в сравнении с однолетними. Максимальная динамика уменьшения удельной листовой поверхности установлена у СПК Мелба/5-21-27 на уровне 2,15 раз.
К группе карликовых по результатам изучения СПК в питомнике можно выделить перспективные клоновые подвои 2-9-90, 2-12-36, 9-1-1, 9-1-3, 9-1-4, 9-1-9. В дальнейшем эти генотипы планируется изучить в саду конкурсного испытания по комплексу ценных хозяйственно-биологических и производственно-технологических признаков.
5 КОМПЛЕКСНАЯ ОЦЕНКА СОРТО-ПОДВОЙНЫХ КОМБИНАЦИЙ ЯБЛОНИ В САДУ КОНКУРСНОГО ИСПЫТАНИЯ
Цель исследований: изучение основных биометрических показателей привойно-подвойных комбинаций яблони, влияющих на формирование продуктивности, для выделения новых подвойных форм, пригодных к возделыванию в промышленных насаждениях.
Задачи исследований:
— определить влияние перспективных форм клоновых подвоев на силу роста плодового дерева и габитус его кроны;
— провести анализ особенностей роста побегов, расположенных на несущих ветвях кроны, у конкретных сорто-подвойных комбинаций яблони;
— провести оценку урожайности сорто-подвойных форм яблони;
— провести анализ многолетней динамики роста изучаемых показателей.
Научная новизна и практическая значимость исследований
Впервые проведено многолетнее изучение динамики ценных биологических и хозяйственно-технологических количественных показателей сортов яблони летнего и осеннего сроков созревания на новых перспективных подвоях разной силы роста. Изученные особенности указывают на возможность использования ряда подвоев для возделывания в промышленных насаждениях садах интенсивного типа. Экспериментально установлен характер влияния новых форм слаборослых клоновых подвоев селекции Мичуринского ГАУ на хозяйственно-ценные признаки растений яблони и биологические закономерности их изменения.
Объекты, условия и методика проведения исследований
Исследования сорто-подвойных комбинаций яблони проведены в саду конкурсного испытания, расположенном в структурном подразделении ФГБОУ ВО Мичуринский ГАУ – Научно-образовательном центре (НОЦ) имени В.И. Будаговского. Схема посадки растений 5х3м (667 шт./га). Залужение междурядий чересполосное, чередующееся с черным паром. Агротехника стандартная.
Объектом исследования являлись 19 сорто-подвойных комбинаций яблони, полученных с участием 11 перспективных подвойных форм селекции Мичуринского ГАУ. Привоем служили районированные сорта яблони – Мелба (летнего срока созревания плодов) и Антоновка обыкновенная (осеннего срока созревания плодов).
Основные учеты и наблюдения осуществлялись в соответствии с «Программой и методикой сортоизучения плодовых, ягодных и орехоплодных культур» (г. Орел, 1999), «Методикой учетов и наблюдений в опытах с плодовыми и ягодными культурами» (г. Киев, 1987), «Изучением коллекции семечковых культур и выявление сортов интенсивного типа» (1986).
Результаты исследований
Влияние подвойной формы на силу ростовые показатели кроны является его важнейшей характеристикой. Проведена сравнительная оценка биометрических показателей надземной части деревьев яблони различных СПК в саду конкурсного испытания по окончании вегетационного периода 2019 г. (табл. 19, рис. 75-77).
Таблица 19 – Биометрические показатели роста и развития деревьев сорто-подвойных комбинаций яблони в саду конкурсного испытания по окончании вегетационного периода 2019 г.
| Клоновый подвой | Высота, см | Объем кроны, м3 | Диаметр штамба, мм |
| Сорт Антоновка обыкновенная | |||
| 2-14-2 | 195,0 ± 8,2 | 1,10 ± 0,12 | 46,0 ± 1,8 |
| 62-296 (контроль – к) | 213,8 ± 7,2 | 1,36 ± 0,14 | 38,3 ± 1,7 |
| 2-3-49 | 235,0 ± 7,6 | 2,06 ± 0,19 | 53,2 ± 1,8 |
| 2-9-49 | 238,5 ± 5,1 | 1,72 ± 0,15 | 58,0 ± 1,5 |
| 54-118 (контроль – п/к) | 266,5 ± 3,3 | 3,01 ± 0,26 | 59,0 ± 1,8 |
| 2-15-2 | 268,0 ± 4,6 | 2,83 ± 0,40 | 62,0 ± 2,3 |
| 2-15-15 | 277,2 ± 7,3 | 3,28 ± 0,47 | 64,7 ± 1,6 |
| 4-6-5 | 299,5 ± 2,8 | 3,59 ± 0,29 | 66,1 ± 1,3 |
| Сорт Мелба | |||
| 2-14-2 | 208,5 ± 14,2 | 1,35 ± 0,22 | 37,3 ± 5,1 |
| 3-4-7 | 225,5 ± 3,4 | 2,08 ± 0,19 | 43,4 ± 1,3 |
| 2-3-49 | 233,5 ± 5,5 | 2,92 ± 0,32 | 52,7 ± 2,1 |
| 62-396 (контроль – к) | 247,5 ± 7,2 | 2,31 ± 0,18 | 42,1 ± 2,5 |
| 83-1-15 | 249,5 ± 4,4 | 3,59 ± 0,21 | 52,3 ± 1,4 |
| 2-9-49 | 252,5 ± 7,1 | 2,35 ± 0,09 | 58,6 ± 1,4 |
| 2-12-10 | 264,0 ± 12,1 | 2,22 ± 0,48 | 48,1 ± 5,5 |
| 54-118 (контроль – п/к) | 267,5 ± 4,3 | 2,26 ± 0,11 | 57,8 ± 1,4 |
| 2-15-2 | 276,0 ± 4,8 | 4,17 ± 0,43 | 63,4 ± 2,9 |
| 2-15-15 | 283,5 ± 7,6 | 3,44 ± 0,35 | 60,4 ± 1,9 |
| 4-6-5 | 308,0 ± 4,4 | 4,77 ± 0,34 | 72,7 ± 1,7 |
| НСР05 | 3,2 | 0,21 | 3,5 |
Различия между минимальными и максимальными показателями у СПК сорта Антоновка обыкновенная составили по высоте дерева 1,54 раза, по объему кроны – 3,26 раза, по диаметру штамба – 1,44 раза. У СПК сорта Мелба соответствующая разница по высоте дерева 1,48-кратная, по объему кроны – 3,53-кратная, по диаметру штамба – 1,95-кратная.
Между всеми парами исследованных биометрических показателей надземной части деревьев СПК яблони на клоновых подвоях различной силы роста установлены высокие положительные корреляции (рис. 75-77). У обоих сортов яблони ее значение на уровне +0,78…0,98 выявлено между высотой дерева и объемом его кроны, между высотой дерева и диаметром штамба коэффициент корреляции составил +0,88…0,89, а между объемом кроны и диаметром штамба +0,85…0,87.
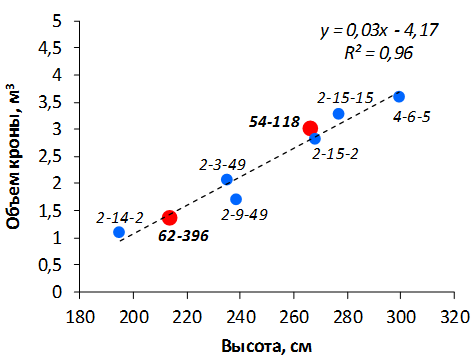 |
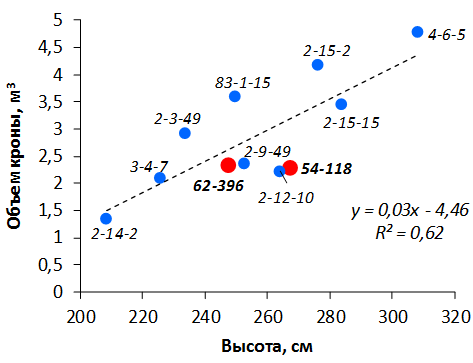 |
| а | б |
Рисунок 75 – Взаимосвязь высоты дерева и объема его кроны у сорто-подвойных комбинаций яблони на клоновых подвоях различной силы роста в условиях сада конкурсного испытания (по окончанию вегетационного периода 2019 г.): а – сорт Антоновка обыкновенная, б – сорт Мелба
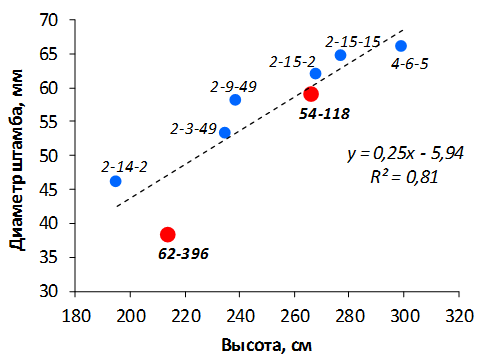 |
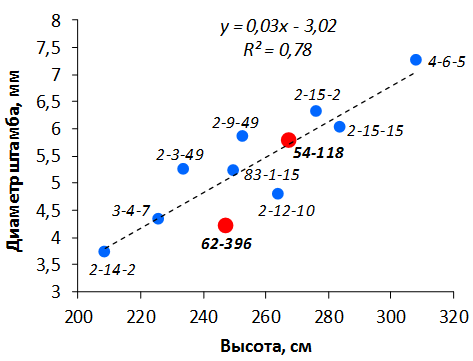 |
| а | б |
Рисунок 76 – Взаимосвязь высоты дерева и диаметра его штамба у сорто-подвойных комбинаций яблони на клоновых подвоях различной силы роста в условиях сада конкурсного испытания (по окончанию вегетационного периода 2019 г.): а – сорт Антоновка обыкновенная, б – сорт Мелба
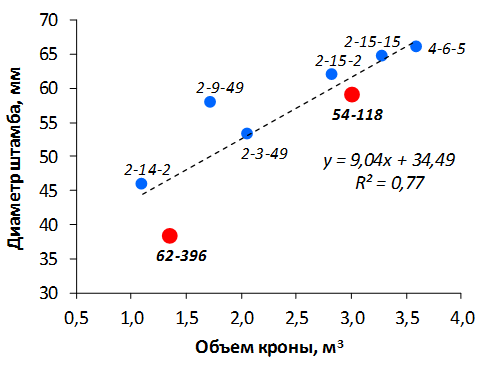 |
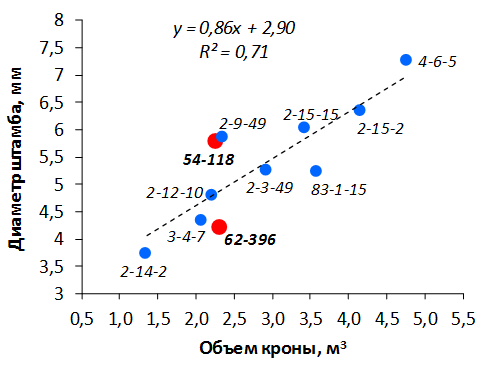 |
| а | б |
Рисунок 77 – Взаимосвязь диаметра штамба дерева и объема его кроны у сорто-подвойных комбинаций яблони на клоновых подвоях различной силы роста в условиях сада конкурсного испытания (по окончанию вегетационного периода 2019 г.): а – сорт Антоновка обыкновенная, б – сорт Мелба
Анализ всех морфологических показателей надземной части деревьев показывает, что выраженными признаками карликовости и компактным габитусом кроны на уровне контрольного районированного подвоя 62-396 обладают деревья сорта Мелба, привитые на подвоях 2-14-2, 3-4-7, 2-3-49, а также СПК сорта Антоновка обыкновенная на клоновых подвоях 2-14-2, 2-3-49, 2-9-49. Деревья обоих сортов на подвое 2-14-2 характеризуются самой сдержанной силой роста и наименьшим объемом кроны на уровне контроля 62-396. Биометрические показатели роста надземной части деревьев на уровне полукарликового / среднерослого подвоя 54-118 отмечены у подвойных форм 2-15-2 и 2-15-15. Промежуточное положение между показателями деревьев на контрольных подвоях занимают СПК с участием экспериментальных подвойных форм 83-1-15 и 2-12-10. Наиболее сильный рост отмечен у СПК с участием подвоя 4-6-5, высота деревьев которых у сорта Антоновка обыкновенная достигает 3 м, а у сорта Мелба немного превышает ее.
При изучении многолетней динамики увеличения размеров надземной части деревьев на клоновых подвоях различной силы роста в условиях сада конкурсного испытания установлено, что наибольший прирост соответствующих показателей у сортов Антоновка обыкновенная и Мелба происходил в 2018 году, а в сезоне-2019 темпы прироста побегов немного снизились (рис. 78-83).
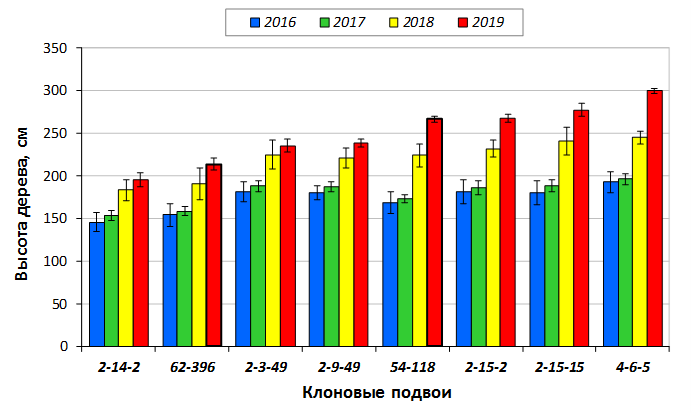
Рисунок 78 – Многолетняя динамика увеличения высоты деревьев сорта Антоновка обыкновенная на клоновых подвоях различной силы роста
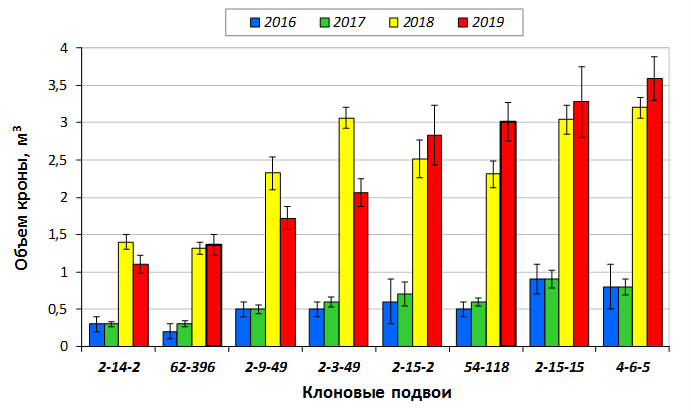
Рисунок 79 – Многолетняя динамика увеличения объема кроны деревьев сорта Антоновка обыкновенная на клоновых подвоях различной силы роста
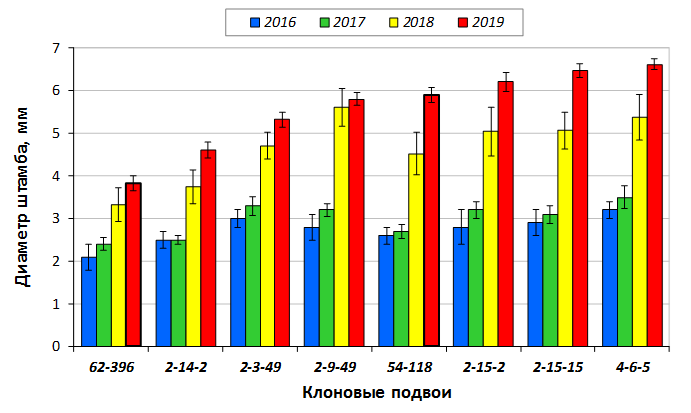
Рисунок 80 – Многолетняя динамика увеличения диаметра штамба деревьев сорта Антоновка обыкновенная на клоновых подвоях различной силы роста
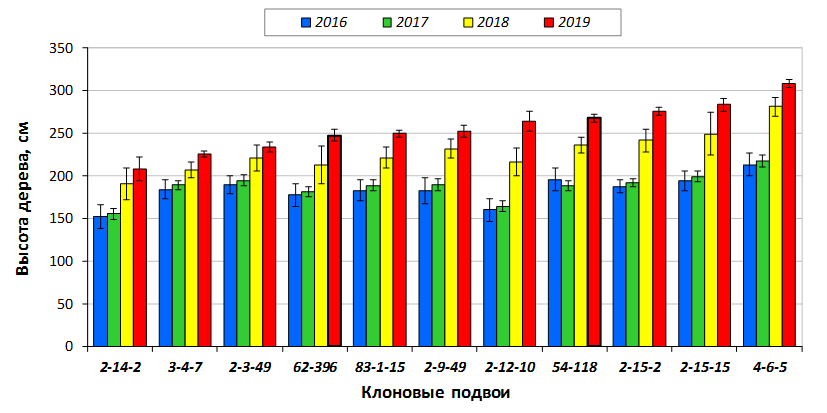
Рисунок 81 – Многолетняя динамика увеличения высоты деревьев сорта Мелба на клоновых подвоях различной силы роста
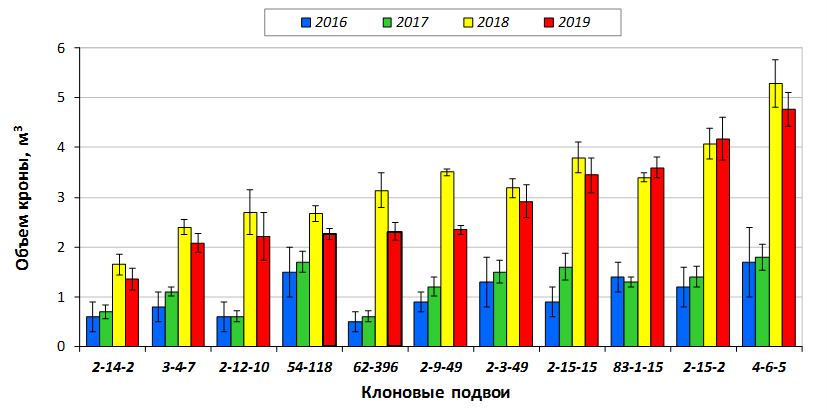
Рисунок 82 – Многолетняя динамика увеличения объема кроны деревьев сорта Мелба на клоновых подвоях различной силы роста
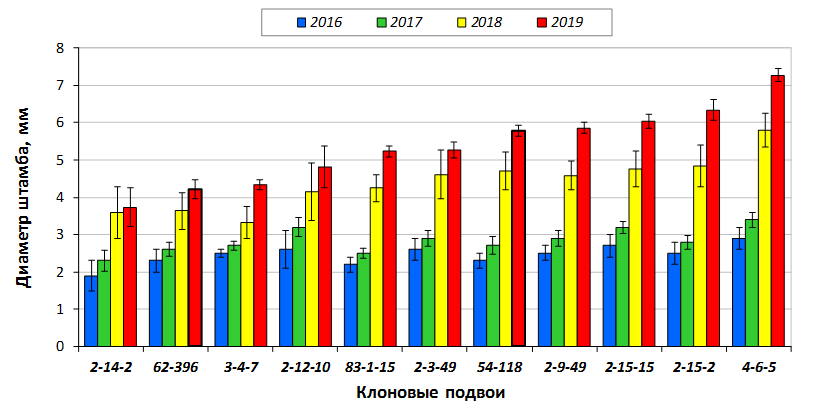
Рисунок 83 – Многолетняя динамика увеличения диаметра штамба деревьев сорта Мелба на клоновых подвоях различной силы роста
В условиях 2019 г. отмечена вариабельность объема кроны деревьев яблони в условиях сада конкурсного испытания (рис. 84). Различие между минимальным и максимальным значениями данного признака у СПК сорта Антоновка обыкновенная – 3,26-кратное (1,10–3,59 м3), Мелба – 3,53-кратное (1,35–4,77 м3). При этом между сортами корреляция составила +0,80.
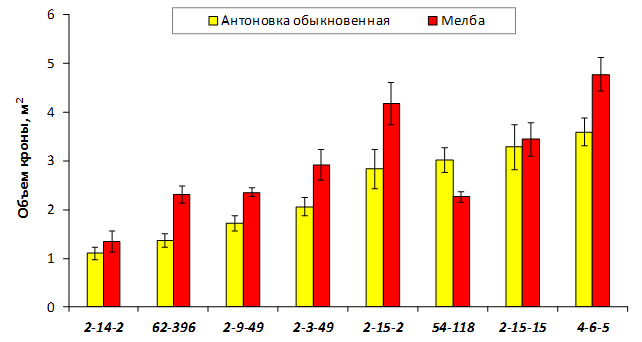
Рисунок 84 – Влияние генотипа подвойного и привойного компонентов на вариабельность объема кроны деревьев яблони в условиях сада
Увеличение биометрических показателей надземной части деревьев за 2019 г. в сравнении с предыдущим сезоном с СПК сорта Антоновка обыкновенная отмечено по высоте дерева в 1,04-1,22 раз, по объему кроны в 0,67-1,30 раз, по диаметру штамба в 1,04-1,31 раз. У СПК сорта Мелба отмечены практически аналогичные показатели: увеличение высоты дерева в интервале от 1,05 до 1,22 раз, объема кроны в 0,67-1,06 раз, диаметра штамба в 1,04-1,31 раз. На уровне контрольного карликового подвоя 62-396 наименьший прирост высоты и штамба деревьев различных СПК за 2019 г. отмечен у экспериментальных подвоев 2-14-2, 2-3-49, 2-9-49 (рис. 85-86).
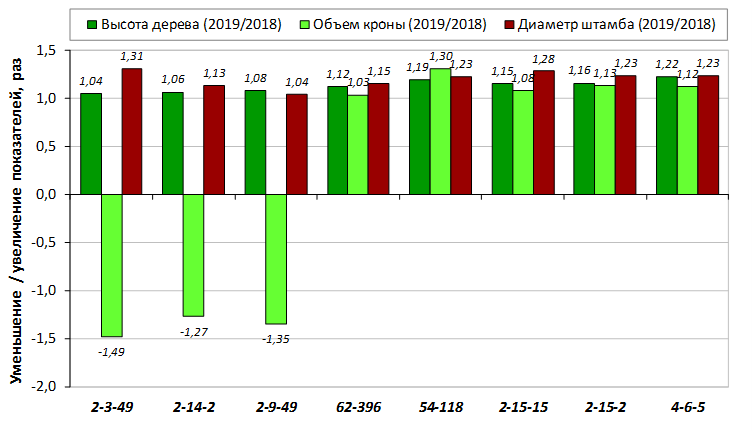
Рисунок 85 – Интенсивность увеличения показателей надземной части деревьев сорта Антоновка обыкновенная на клоновых подвоях различной силы роста в условиях сада конкурсного испытания в 2019 г. в сравнении с предыдущим сезоном
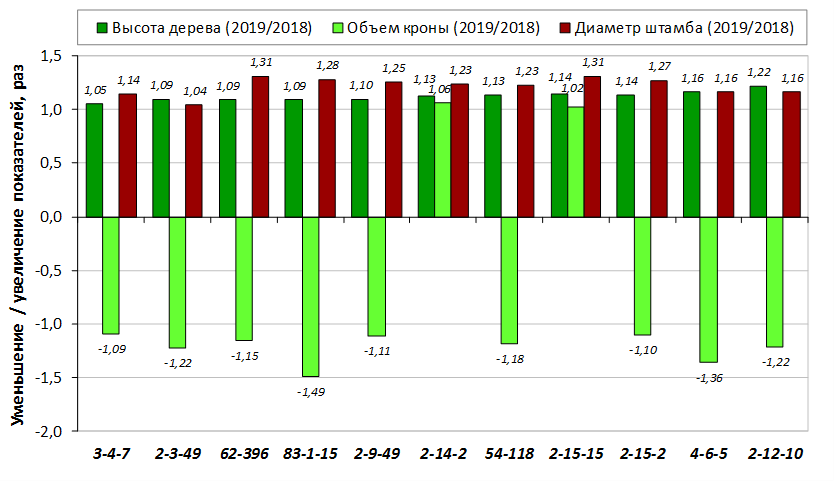
Рисунок 86 – Интенсивность увеличения показателей надземной части деревьев сорта Мелба на клоновых подвоях различной силы роста в условиях сада конкурсного испытания в 2019 г. в сравнении с предыдущим сезоном
Существенного увеличения объема кроны деревьев в текущем году не наблюдалось, что обусловлено снижением темпа роста их вегетативных органов и увеличения прироста генеративных образований. Снижение объема кроны деревьев, наблюдаемое у ряда СПК по окончанию вегетационного периода 2019 г. в сравнении с предыдущим годом, связано с проведением регулярной обрезки (с удалением длинных внешних боковых приростов) и последующим развитием разветвлений внутри кроны, не влияющих на увеличение ее объема.
Другим важным учетным показателем деревьев в саду является формируемая ими площадь листового аппарата. По окончании вегетационного периода 2019 г. у СПК сорта Антоновка обыкновенная данный признак изменялся в диапазоне 623 – 1117 см2 в расчете на 1 м однолетнего прироста, у СПК сорта Мелба – от 791 до 1086 см2/м. При этом минимальное значение удельной площади листового аппарата отмечено у деревьев обоих сортов на экспериментальном карликовом подвое 2-14-2, а наибольший показатель по данному признаку – на полукарликовом районированном подвое 54-118. Различие между минимальным и максимальным значениями данного признака у СПК сорта Антоновка обыкновенная – 1,79-кратное, Мелба – 1,37-кратное (рис. 87). При этом корреляция значений удельной листовой поверхности у соответствующих СПК двух данных сортов составила +0,71.
Рисунок 87 – Влияние генотипа подвойного и привойного компонентов на величину удельной листовой поверхности деревьев яблони в условиях сада (2019 г.)
При этом отмечено варьирование площади листовой пластинки у СПК на клоновых подвоях различной силы роста, даже в случае единого привойного компонента (сорта). Различие между минимальным и максимальным значениями площади листовой пластинки у СПК сорта Антоновка обыкновенная – 1,72-кратное, Мелба – 1,47-кратное (рис. 88). По длине междоузлий на однолетних приростах различие между минимальным и максимальным значениями у СПК сорта Антоновка обыкновенная составило 10,5%, Мелба – 35,5% при корреляции между сортами +0,71. Корреляция между высотой деревьев различных СПК и длиной междоузлий составила у сорта Антоновка обыкновенная +0,55, Мелба +0,57. У деревьев на карликовых подвоях отмечена наименьшая длина междоузлий на однолетних приростах, что способствует у данных СПК увеличению количества листьев на единицу длины побегов и соответственно удельной листовой поверхности.
Рисунок 88 – Влияние генотипа подвойного и привойного компонентов на вариабельность площади листовой пластинки деревьев яблони в условиях сада (2019 г.)
Изучение особенностей биометрических показателей деревьев СПК яблони показало, что плотность обрастания скелетных ветвей плодовыми образованиями по окончанию вегетационного периода 2019 г. у сорта Мелба оказалась значительно выше, чем у сорта Антоновка обыкновенная, что связано с генотипическими особенностями (табл. 20).
Таблица 20 – Плотность обрастания несущих ветвей сорто-подвойных
комбинаций яблони в саду конкурсного испытания
| Клоновый подвой | Длина междоузлий, см | Количество боковых разветвлений, шт. на 1 м скелетной ветви | Количество плодовых образований, шт.на 1 м скелетной ветви |
| Сорт Антоновка обыкновенная | |||
| 62-396 (контр. – к) | 3,8 | 29,6 ± 2,7 | 23,0 ± 2,1 |
| 54-118 (контр. – п-к) | 3,8 | 37,6 ± 4,3 | 24,4 ± 3,4 |
| 2-15-15 | 4,1 | 40,9 ± 3,2 | 25,4 ± 2,8 |
| 2-14-2 | 4,0 | 41,7 ± 4,1 | 29,0 ± 3,2 |
| 2-15-2 | 4,2 | 40,7 ± 3,3 | 29,7 ± 3,4 |
| 4-6-5 | 4,2 | 41,6 ± 3,4 | 31,5 ± 4,1 |
| 2-9-49 | 4,0 | 46,7 ± 3,9 | 31,6 ± 3,1 |
| 2-3-49 | 3,8 | 51,9 ± 4,1 | 37,7 ± 3,2 |
| НСР05 | 0,2 | 1,8 | 1,3 |
| Сорт Мелба | |||
| 2-15-15 | 3,6 | 42,6 ± 1,2 | 38,2 ± 1,1 |
| 2-15-2 | 3,5 | 50,9 ± 3,7 | 40,2 ± 4,5 |
| 54-118 (контр. – п-к) | 3,3 | 48,6 ± 2,7 | 42,6 ± 3,1 |
| 4-6-5 | 4,2 | 46,3 ± 1,7 | 44,3 ± 2,3 |
| 2-12-10 | 3,5 | 53,6 ± 1,9 | 46,8 ± 1,9 |
| 2-3-49 | 3,6 | 56,4 ± 3,3 | 47,0 ± 2,8 |
| 3-4-7 | 3,7 | 56,0 ± 3,4 | 49,1 ± 3,2 |
| 62-396 (контр. – к) | 3,5 | 55,6 ± 5,2 | 49,4 ± 5,4 |
| 83-1-15 | 3,3 | 63,7 ± 4,5 | 53,3 ± 4,4 |
| 2-14-2 | 3,4 | 63,6 ± 6,5 | 54,9 ± 6,2 |
| 2-3-49 | 3,1 | 72,3 ± 6,1 | 60,9 ± 5,8 |
| НСР05 | 0,2 | 2,2 | 1,9 |
У деревьев сорта Мелба плотность обрастания плодовыми образованиями свыше 60 шт. на 1 м скелетной ветви отмечена на подвойных формах 2-14-2, 83-1-15, 2-3-49; более 50 шт./м – у СПК с участием подвоев 2-15-2, 2-12-10, 3-4-7, 2-3-49. По данному показателю у сорта Антоновка обыкновенная выделяются подвойные формы 2-9-49, 4-6-5 и 2-3-49, плотность обрастания плодовыми образованиями на 1 м ветви у данных СПК составила более 30 шт. Различие между минимальным и максимальным значениями данного признака у СПК сорта Антоновка обыкновенная – 1,64-кратное (23,0-37,7 шт./м), Мелба – 1,59-кратное (38,2-60,9 шт./м). При этом между сортами корреляция значений данного показателя составила +0,62.
По количеству заложенных боковых разветвлений различие между минимальным и максимальным значениями у СПК сорта Антоновка обыкновенная – 1,75-кратное (29,6-51,9 шт./м), Мелба – 1,70-кратное (42,6-72,3 шт./м). При этом между сортами корреляция значений данного показателя составила +0,42.
Между соответствующими значениями количества плодовых образований и боковых разветвлений у СПК в пределах каждого сорта выявлены положительные корреляции высокого уровня: у сорта Антоновка обыкновенная +0,90, Мелба на уровне +0,96. Вариабельность компонентов плодоношения связана с генотипическим влиянием подвоев различной силы роста.
По окончанию вегетационного периода 2019 г. отмечена вариабельность количества заложенных плодовых образований деревьев яблони в саду конкурсного испытания (рис. 90-92).
Рисунок 89 – Влияние генотипа подвойного и привойного компонентов на вариабельность количества плодовых образований деревьев яблони в условиях сада (за 2019 г.)
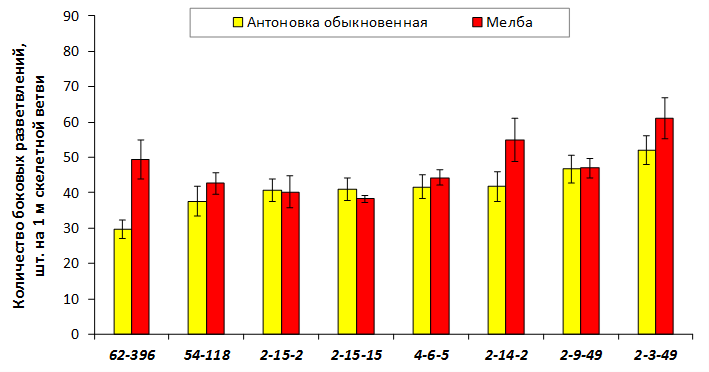
Рисунок 90 – Влияние генотипа подвойного и привойного компонентов на вариабельность удельного количества боковых разветвлений деревьев яблони в условиях сада (за 2019 г.)
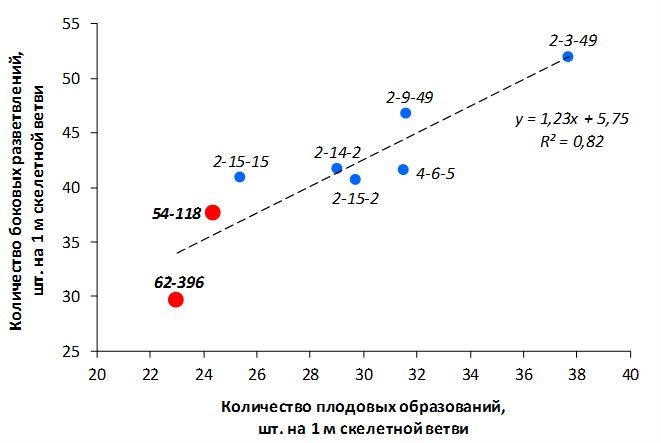
Рисунок 91 – Влияния клонового подвоя на биометрические показатели плодоношения у СПК сорта Антоновка обыкновенная (2019 г.)
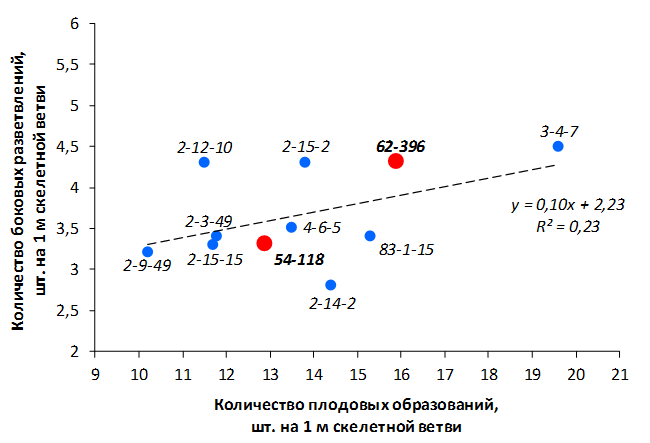
Рисунок 92 – Влияния клонового подвоя на биометрические показатели плодоношения у СПК сорта Мелба (2019 г.)
При изучении многолетней динамики увеличения количества плодовых образований у деревьев на клоновых подвоях различной силы роста в условиях сада конкурсного испытания, наибольший прирост показателя у СПК сортов Антоновка обыкновенная и Мелба отмечен в 2019 году в сравнении с предшествующими сезонами (рис. 93, 94).
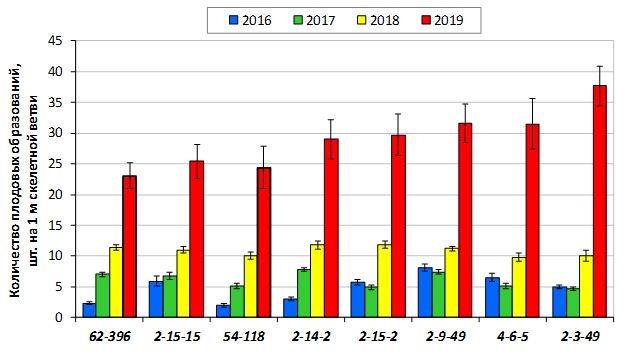
Рисунок 93 – Многолетняя динамика увеличения удельного количества плодовых образований у деревьев сорта Мелба на клоновых подвоях различной силы роста в условиях сада конкурсного испытания (2014 г. закладки).
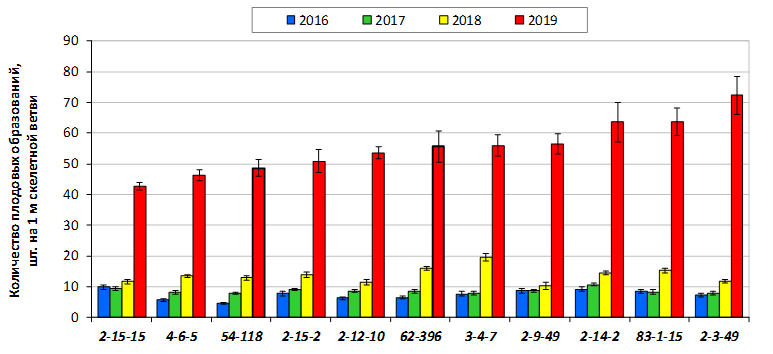
Рисунок 94 – Многолетняя динамика увеличения удельного количества плодовых образований у деревьев сорта Мелба на клоновых подвоях различной силы роста в условиях сада конкурсного испытания (2014 г. закладки).
У СПК сортов Антоновка обыкновенная и Мелба в течение вегетационного периода 2019 г. отмечено существенное увеличение количества плодовых образований деревьев, сформированных в сравнении с предыдущим сезоном. Частично это оказалось связано с наблюдаемой периодичностью плодоношения деревьев яблони и сложившими неблагоприятными природными условиями. В 2018 г. были отмечены высокие показатели цветения и плодоношения большинства СПК изучаемых деревьев, что способствовало снижению процента закладки плодовых образований у них на следующий сезон. В свою очередь, в 2019 г. вследствие сложившихся неблагоприятных климатических условий в первой половине мая (продолжительные осадки и понижение температуры воздуха) оказалось затруднено опыление пчелами малочисленных распустивших цветков. Как следствие, плодоношение в сезоне 2019 г. полностью отсутствовало.
При сравнении предыдущего сезона-2018 с 2017 г. увеличение количества генеративных образований у СПК сорта Антоновка обыкновенная зафиксировано в диапазоне 1,51-2,43 раз, а наибольший прирост данного показателя в том сезоне отмечен у форм 2-3-49 и 2-15-2 (рис. 95, а). У сорта Мелба на разных клоновых подвоях в 2018 г. увеличение количества плодовых образований на деревьях в сравнении с предыдущим сезоном отмечено в диапазоне 1,17-2,48 раз, наибольший прирост данного показателя отмечен у формы 3-4-7 (рис. 95, б). В сезоне-2019 увеличение количества генеративных образований у СПК сорта Антоновка обыкновенная зафиксировано в диапазоне 2,02-3,77 раз, Мелба – 2,86-6,13 раз. У обоих сортов наибольшее увеличение данного показателя отмечено у деревьев на подвое 2-3-49 (рис. 96-97).
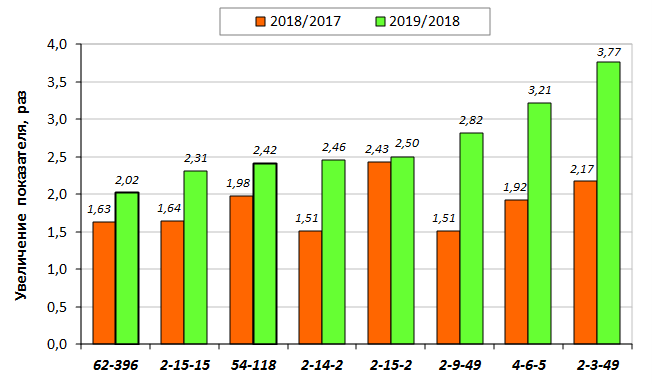
а
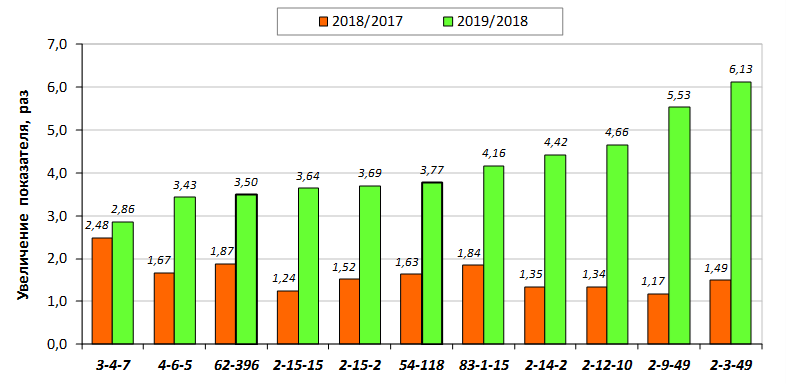
б
Рисунок 95 – Интенсивность увеличения количества плодовых образований у деревьев сорта Антоновка обыкновенная (а) и Мелба (б) на клоновых подвоях различной силы роста в условиях сада конкурсного испытания в сравнении с предыдущим сезоном
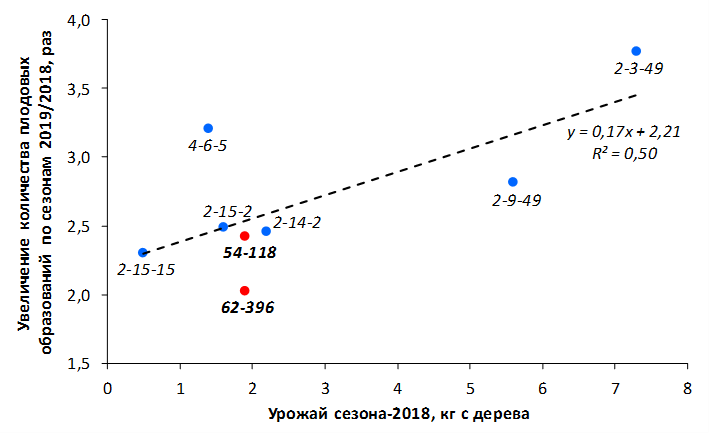
а
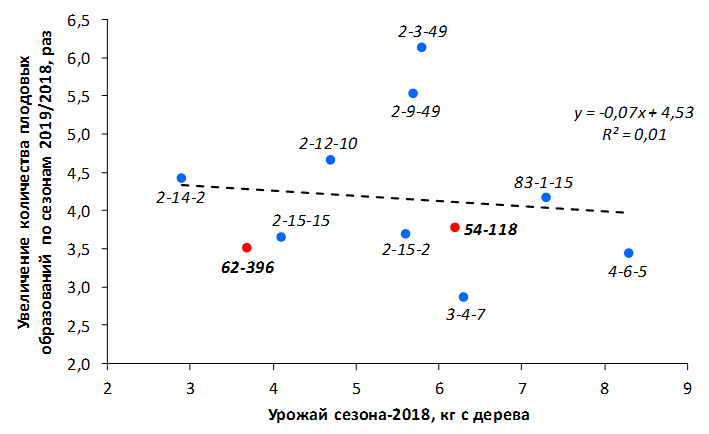
б
Рисунок 96 – Взаимосвязь урожая сезона-2018 и увеличения количества плодовых образований в 2019 г. у деревьев сорта Антоновка обыкновенная (а) и Мелба (б) на клоновых подвоях различной силы роста в условиях сада конкурсного испытания
Для выявления карликовых клоновых подвоев среди новых испытываемых форм в условиях сада следует также проводить анализ показателей объема кроны и количества закладываемых плодовых образований. От сильнорослых к слаборослым подвойным формам у различных СПК будет прослеживаться отрицательная корреляция данных признаков.
а
б
Рисунок 97 – Взаимосвязь урожая сезона-2018 и увеличения количества плодовых образований в 2019 г. у деревьев сорта Антоновка обыкновенная (а) и Мелба (б) на клоновых подвоях различной силы роста в условиях сада конкурсного испытания
Выводы по главе 5
По окончанию вегетационного периода 2019 г. в саду конкурсного испытания различия между минимальными и максимальными показателями у СПК сорта Антоновка обыкновенная составили по высоте дерева 1,54 раза, по объему кроны – 3,26 раза, по диаметру штамба – 1,44 раза. У СПК сорта Мелба соответствующая разница по высоте дерева 1,48-кратная, по объему кроны – 3,53-кратная, по диаметру штамба – 1,95-кратная. Между всеми парами исследованных биометрических показателей надземной части деревьев СПК яблони на клоновых подвоях различной силы роста установлены высокие положительные корреляции. У обоих сортов яблони ее значение на уровне +0,78…0,98 выявлено между высотой дерева и объемом его кроны, между высотой дерева и диаметром штамба коэффициент корреляции составил +0,88…0,89, а между объемом кроны и диаметром штамба +0,85…0,87. Выраженными признаками карликовости и компактным габитусом кроны на уровне контрольного районированного подвоя 62-396 обладают деревья сорта Мелба, привитые на подвоях 2-14-2, 3-4-7, 2-3-49, а также СПК сорта Антоновка обыкновенная на клоновых подвоях 2-14-2, 2-3-49, 2-9-49. Деревья обоих сортов на подвое 2-14-2 характеризуются самой сдержанной силой роста и наименьшим объемом кроны на уровне контроля 62-396.
Увеличение количества генеративных образований в сравнении с предыдущим сезоном у СПК сорта Антоновка обыкновенная зафиксировано в диапазоне 2,02-3,77 раз, Мелба – 2,86-6,13 раз. У обоих сортов наибольшее увеличение данного показателя отмечено у деревьев на подвое 2-3-49. По плотности обрастания плодовыми образованиями скелетных ветвей различие между минимальным и максимальным значениями у СПК сорта Антоновка обыкновенная – 1,64-кратное (23,0-37,7 шт./м), Мелба – 1,59-кратное (38,2-60,9 шт./м). При этом между сортами корреляция значений данного показателя составила +0,62.
ЗАКЛЮЧЕНИЕ
В текущем году было увеличено количество единиц гибридного фонда яблони в селекционной школке. Весной 2019 г. после стратификации получен 6491 проросток, в течение сезона к окончанию вегетационного периода в селекционной школке отмечено 4287 гибридных растения (66,0% от высеянных проростков и 50,5% от исходного числа застратифицированных гибридных семян). Впервые получены проростки и молодые растения, полученные от гетероплоидных скрещиваний доноров нередуцированных гамет с клоновыми подвоями яблони.
Впервые проведены скрещивания с использованием генотипов яблони колонновидного габитуса роста (с геном Co) и производной (подвоя G16) природного вида – яблони обильноцветущей (M. floribunda Siebold ex Van Houtte). Общее количество полученных гибридных семян составило 899 шт.
В 2019 г. генетическая коллекция ФГБОУ ВО Мичуринский ГАУ была пополнена 34 образцами рода Malus Mill. из коллекции Филиала Майкопская опытная станция ФИЦ Всероссийский научно-исследовательский институт генетических ресурсов растений имени Н.И. Вавилова.
В результате исследований для идентификации генотипов-источников целевых генов был проведен скрининг генетической коллекции клоновых подвоев яблони методами молекулярно-генетического анализа. Установлено, что наличие локусов АЕ10-375 и CH-F7-FB1 у исследуемых подвойных форм обеспечивает фенотипическое проявление признака устойчивости к возбудителю бактериального ожога E. amylovora. Наличие FBF7 QTL в генотипе яблони характеризует наличие минимум двух маркеров GE-8019 и АЕ10-375. Маркер CH-F7-FB1 расположен внутри анализируемого QTL и является дополнительным маркером, что подтверждает точность идентификации. Наличие всех трех маркеров предполагает устойчивость к бактериальному ожогу и среди изученных клоновых подвоев отмечено только у форм 62-396, 16-1 и 2-9-12. У остальных генотипов не выявлено маркера GE-8019.
Среди изученных клоновых подвоев яблони ген Rvi6 устойчивости к парше не был выявлен.
Частота встречаемости аллелей гена самонесовместимости яблони при опылении примерно одинакова. Аллель S1 идентифицирован у 7 (20,6%) форм подвоев, S3 у 6 (17,6%), а S2 только у 4 (11,8%). Выявлен полный аллельный статус S-гена для форм ПБ, 83-1-15 и 2-12-10, у которых присутствуют аллели S1 и S3. Комбинаций с вариантом S2 не отмечено. Необходимо проведение дальнейшего молекулярно-генетического анализа по идентификации других известных аллелей гена самонесовместимости, что обусловлено большим разнообразием исследуемого гена.
Оптимизированы приемы введения в стерильную культуру in vitro новых генотипов рода Malus Mill. Дополнительная предобработка эксплантов на этапе введения препаратами «Экоцид С» (1,0%) и «БиоПаг» (0,4%) в течении 50 минут способствует получению стерильных эксплантов до 61,5% по сравнению с контролем. Применение диссекции семядолей позволяет увеличить прорастание гибридных семян in vitro до 65,3 по сравнению с 4,2% в контроле. Расщепление гибридных семян в комбинациях M. sieboldii x Малыш Будаговского, M. sieboldii x 60-160, M. sieboldii x 76-3-6 по признаку антоциановой окраски составляет 1:1.
Показатели эффективности микроразмножения клоновых подвоев яблони, полученные на питательной среде QL, существенным образом не отличаются от показателей, полученных на среде MS. Для оптимального размножения достаточно использовать 6-бензиламинопурин в концентрации 0,5-1,0 мг/л. На средах с более низким содержанием экзогенных регуляторов роста длина побегов больше.
При укоренении в условиях in vitro клоновых подвоев яблони оптимальной является концентрация ИМК в питательной среде 0,5 мг/л. При данной концентрации частота укоренения микрочеренков генотипов 62-396, 2-12-10, 3-4-7, 16-1 составила от 86,3 до 100%. Отобраны генотипы клоновых подвоев с повышенной способностью к ризогенезу in vitro (2-9-102, 2-12-10), которые с высокой эффективностью (80-90%) укореняются и на средах без регуляторов роста.
Выявлены генотипы клоновых подвоев с высокой регенерационной способностью in vitro (Парадизка Будаговского, 14-1, 16-1, 3-4-7, 2-12-10), которые по частоте регенерации адвентивных побегов из листовых дисков в 2-4 раза превосходят контрольную форму 62-396. Эти формы перспективны для разработки методик тканевой селекции яблони. Максимальная частота регенерации клоновых подвоев яблони отмечена на питательной среде с добавлением 4,0-5,0 мг/л 6-БАП в сочетании с одним из ауксинов – ИМК, ИУК или 2,4-Д. Оптимальное соотношение цитокинин : ауксин в питательной среде составило 10:1.
В результате исследований установили, что устойчивость растений к анионному засолению зависит от особенностей генотипа. В качестве селективного агента на солеустойчивость для получения сомаклональных вариантов в условиях in vitro эффективным является использование концентрации NaCl в диапазоне 0,6-0,8%. После пересадки эксплантов клоновых подвоев на питательную среду без добавления хлорида натрия все побеги восстанавливали жизнеспособност
Разработана методика оценки экологической устойчивости мужского гаметофита генотипов рода Malus Mill. в экспериментально моделируемых условиях к негативному действию природно-климатических факторов – изменению температурного режима при прорастании и гиперосмотическому стрессу. Установлено снижение прорастаемости мужского гаметофита на статистически достоверном уровне при действии температур +16°C и +31°C. Наибольшая функциональная активность пыльцевых зерен в условиях интегрального действия температурного стресса отмечена у подвоев 60-160, 62-396, 69-4-439. Для имитации осмотического стресса in vitro при прорастании пыльцы предложена селективная питательная среда с добавлением 15% глицерина в базовые компоненты (1% агара, 10% сахарозы, 0,001% борной кислоты).
Наибольшей побегообразовательной способностью маточных кустов (более 15 отводков) характеризовались перспективные формы 2-3-14, 2-9-49, 2-9-96, 2-12-10, 2-12-15, 9-1-1, 9-1-4, 9-1-5. Наибольшая доля стандартных отводков (около 50% и более от общего количества) отмечена у форм 2-3-2, МБ, ПБ, 4-2-50, 9-1-9, 2-15-2, 2-9-94, 2-3-8. Между выходом стандартных отводков с куста и средним баллом их укоренения по генотипам подвоев установлена корреляция +0,72.
По сумме хлорофиллов в тканях листовой пластинки клоновые подвои в целом превосходят рассмотренные сорта яблони, а по содержанию каротиноидов примерно соответствуют им. Кроме различного уровня содержания антоцианов, других существенных различий в концентрации пигментов у краснолистных и зеленолистных клоновых подвоев не выявлено.Высокой концентрацией хлорофиллов отличаются подвои 76-3-6, 54-118 и 57-490.
Доля проводящих тканей в стеблевой части побега клоновых подвоев яблони в основном зависит от степени развития ксилемы (коэффициент корреляции +0,79). Удельная доля флоэмы в отводках клоновых подвоев яблони, рассчитанная по ее площади на поперечном сечении побега, оказалась наибольшей (29%) у слаборослых форм селекции Мичуринского ГАУ 2-3-3, 2-3-17, 2-9-49, 2-15-15, МБ, при максимальном значении показателя (38%) у суперкарликового подвоя ПБ-4. У подвойных форм 2-3-3, 2-3-19, 2-15-15 удельная доля обеих проводящих тканей (флоэмы и ксилемы) в вертикальных отводках клоновых подвоев яблони оказалась наибольшей – 94% от общей площади поперечного сечения побега
В питомнике впервые изучены СПК с участием колонновидных сортов яблони, привитых на новые перспективные клоновые подвои селекции Мичуринского ГАУ. Максимальные корреляции между сопряженными морфометрическими признаками саженцев отмечены в третьем поле питомника, где в наибольшей степени проявляются генотипические особенности как подвойного, так и привойного компонентов прививки. Отмечено увеличение удельной листовой поверхности двулетних саженцев на более слаборослых подвоях, в том числе за счет укороченных междоузлий на побегах и увеличенного количества листьев. К группе карликовых по результатам изучения СПК в питомнике можно выделить перспективные клоновые подвои 2-9-90, 2-12-36, 9-1-1, 9-1-3, 9-1-4, 9-1-9.
В конце 2019 г. в саду конкурсного испытания различия между минимальными и максимальными показателями у СПК сорта Антоновка обыкновенная составили по высоте дерева 1,54 раза, по объему кроны – 3,26 раза, по диаметру штамба – 1,44 раза. У СПК сорта Мелба соответствующая разница по высоте дерева 1,48-кратная, по объему кроны – 3,53-кратная, по диаметру штамба – 1,95-кратная. Между всеми парами исследованных биометрических показателей надземной части деревьев СПК яблони на клоновых подвоях различной силы роста установлены высокие положительные корреляции. У обоих сортов яблони ее значение на уровне +0,78…0,98 выявлено между высотой дерева и объемом его кроны, между высотой дерева и диаметром штамба коэффициент корреляции составил +0,88…0,89, а между объемом кроны и диаметром штамба +0,85…0,87. Выраженными признаками карликовости и компактным габитусом кроны на уровне контрольного районированного подвоя 62-396 обладают деревья сорта Мелба, привитые на подвоях 2-14-2, 3-4-7, 2-3-49, а также СПК сорта Антоновка обыкновенная на клоновых подвоях 2-14-2, 2-3-49, 2-9-49. Деревья обоих сортов на подвое 2-14-2 характеризуются самой сдержанной силой роста и наименьшим объемом кроны на уровне контроля 62-396.
Увеличение количества генеративных образований в сравнении с предыдущим сезоном у СПК сорта Антоновка обыкновенная зафиксировано в диапазоне 2,02-3,77 раз, Мелба – 2,86-6,13 раз. У обоих сортов наибольшее увеличение данного показателя отмечено у деревьев на подвое 2-3-49. По плотности обрастания плодовыми образованиями скелетных ветвей различие между минимальным и максимальным значениями у СПК сорта Антоновка обыкновенная – 1,64-кратное (23,0-37,7 шт./м), Мелба – 1,59-кратное (38,2-60,9 шт./м). При этом между сортами корреляция значений данного показателя составила +0,62.
СПИСОК ЛИТЕРАТУРЫ
1. Khan M. A., Durel C. E., Duffy B., Drouet D., Kellerhals M., Gessler C., Patocchi A. Development of molecular markers linked to the ‘Fiesta’linkage group 7 major QTL for fire blight resistance and their application for marker-assisted selection // Genome. – 2007. – V. 50. – № 6. – Р. 568-577.
2. Broothaerts Wim. New findings in apple S-genotype analysis resolve previous confusion and request the re-numbering of some S-alleles // TAG. Theoretical and applied genetics. Theoretische und angewandte Genetik. – 2003. – Т. 106. 703-14. 10.1007/s00122-002-1120-0.
3. Козловская З.А., Кондратенок Ю.Г., Гашенко Т.А., Ярмолич, С.А. Выявление новых комплексных источников устойчивости к болезням яблони с использованием молекулярных методов в Беларуси // Садоводство и виноградарство. – 2018. – Т. 5. – С. 23-29.
4. Лыжин А.С., Савельева Н.Н. Генотипирование сортов яблони по аллелям S-локуса (самонесовместимость) // Инновационная наука. – 2016. – №. 8-3.
5. Малецкий С.И. Гены самонесовместимости контролируют у цветковых растений перекрёстное оплодотворение // Соросовский образовательный журнал. – 1996. – №. 12. – С. 19.
6. Khan, M.A., Y. Zhao, and S.S. Korban. Molecular mechanisms of pathogenesis and resistance to the bacterial pathogen Erwinia amylovora, causal agent of fire blight disease in Rosaceae. Plant Mol. Biol. Rep. – 2012. – V. 30: P. 247-260. doi:10.1007/s11105-011-0334-1.
7. Emeriewen O.F., Richter K., Piazza S., Micheletti D., Broggini G.A., Berner T., Peil A. Towards map-based cloning of FB_Mfu10: identification of a receptor-like kinase candidate gene underlying the Malus fusca fire blight resistance locus on linkage group 10 //Molecular breeding. – 2018. – V. 38. – №. 8. – С. 106.
8. Maliepaard, C., Alston, F., van Arkel, G. Aligning male and female linkage maps of apple (Malus pumila Mill.) using multi-allelic markers // Theor. Appl. Genet. – 1998, V. 97. – P.60-73. – doi:10.1007/s001220050867
9. Liebhard R. Creating a saturated reference map for the apple (Malus domestica Borkh.) genome / R. Liebhard, B. Koller, L. Gianfranceschi, C. Gessler // Theor Appl Genet. – 2003. – V. 106. – P. 1497-1508.
10. Liebhard R.B., Koller L. Gianfranceschi C. Gessler Creating a saturated reference map for the apple (Malus domestica Borkh.) genome // Theor Appl Genet. – 2003. – V. 106. – P. 1497-1508.
11. Liebhard R. Development and characterisation of 140 new microsatellites in apple (Malus x domestica Borkh.) / R. Liebhard, L. Gianfranceschi, B. Koller, C.D. Ryder, R. Tarchini, E. Van De Weg, C. Gessler // Molecular Breeding. – 2002. – V. 10. – P. 217-241.
12. Baldo A., Norelli J.L., Farrell R.E., Bassett C.L., Aldwinckle H.S., Malnoy M. Identification of genes differentially expressed during interaction of resistant and susceptible apple cultivars (Malus× domestica) with Erwinia amylovora // BMC plant biology. – 2010. – V. 10. – № 1. – P. 1.
13. Kost T. D. Functionality of the FB_MR5 fire blight resistance gene of Malus x robusta 5: diss. – ETH Zurich, 2016.
14. Wöhner T.W., Flachowsky H., Richter K., Garcia-Libreros T., Trognitz F., Hanke M.V., Peil A. QTL mapping of fire blight resistance in Malus× robusta 5 after inoculation with different strains of Erwinia amylovora // Molecular breeding. – 2014. – V. 34. – №. 1. – P. 217-230.
15. Flachowsky H., Richter K., Garcia-Libreros T., Celton J.M., Gardiner S., Horner M., Bus V. Confirmation of the fire blight QTL of Malus× robusta 5 on linkage group 3 // XI International Workshop on Fire Blight. – 2007. – V. 793. – P. 297-303.
16. Peil A., Wöhner T., Hanke M.V., Flachowsky H., Richter K., Wensing A., Kilian A. Comparative mapping of fire blight resistance in Malus // XIII International Workshop on Fire Blight 1056. – 2013. – С. 47-51.
17. Fazio G., Aldwinckle H., Robinson T. Unique characteristics of Geneva apple rootstocks // New York Fruit Quarterly. – 2013. V.21. P.25-28.
18. Calenge F., Drouet D., Denance C., Van de Weg W.E., Brisset M.N., Paulin J.P., Durel C. E. Identification of a major QTL together with several minor additive or epistatic QTLs for resistance to fire blight in apple in two related progenies // Theoretical and Applied Genetics. – 2005. – V. 111. – № 1. – P. 128-135.
19. Baumgartner I.O., Patocchi A., Frey J.E., Peil A., Kellerhals M. Breeding elite lines of apple carrying pyramided homozygous resistance genes against apple scab and resistance against powdery mildew and fire blight // Plant Mol. Biol. Rep. – 2015. – V. 33. – P. 1573-1583.
20. Jensen P.J., Halbrendt N., Fazio G., Makalowska I., Altman N., Praul C., Maximova S.N., Ngugi H.K., Crassweller R.M., Travis J.W., McNellis T.W. Rootstock-regulated gene expression patterns associated with fire blight resistance in apple // BMC genomics. – 2012. – V. 13. – № 1. – P. 9.
21. Wilcox W.F. Fire blight fact sheet. 1994. [http://www.nysipm.cornell.edu/ factsheets/treefruit/diseases/fb/fb.pdf].
22. Russo N.L., Robinson T.L., Fazio G., Aldwinckle H.S. Fire blight resistance of Budagovsky 9 apple rootstock // Plant Disease. – 2008. – V. 92. – № 3. – P. 385-391.
23. Kviklys D., Kviklienė N., Bite A., Lepsis J., Univer T., Univer N., Buskienė L. Baltic fruit rootstock studies: evaluation of 12 apple rootstocks in North-East Europe // Horticultural Science. – 2012. – V. 39. – №. 1. – С. 1-7.
24. Pfeiffer D.P., Bergh J.C., Frank D.L., Hooks C.R.R., Peck G.M., Walsh C.S., Yoder K.S., Biggs A.R., Kotcon J.B., Derr J.F., Chandran R.S., Weaver M.J., Brown A., Parkhurst J. // 2014 spray bulletin for commercial tree fruit growers. Virginia, West Virginia, and Maryland cooperative extension. Virginia Cooperation Extension Publisher. P. 456-419.
25. Cline J.A., Hunter D.M., Bonn W.G., Bijl M. Resistance of the Vineland series of apple rootstocks to fire blight caused by Erwinia amylovora // Journal of the American Pomological Society. – 2001. – Т. 55. – №. 4. – С. 218.
26. Norelli J.L., Jones A.L., Aldwinckle H.S. Fire blight management in the twenty-first century: using new technologies that enhance host resistance in apple // Plant Disease. – 2003. – V. 87. – № 7. – P. 756-765.
27. Методы экспериментальной микологии: Справочник / И.А. Дудка, С. П. Вассер, И.А. Элланская, З.Э. Коваль и др. – Киев: Наукова думка, 1982. – 551 с.
28. Теппер Е.З. Практикум по микробиологии / Е.З. Теппер, В.К. Шильникова, Г.И. Переверзева; под ред. В.К. Шильниковой. – М.: Дрофа, 2004. – 256 с.
29. Программа и методика сортоизучения плодовых, ягодных и орехоплодных культур / Под ред. Е. Н. Седова, Т. П. Огольцовой. – Орел: Изд-во Всероссийского научно-исследовательского института селекции плодовых культур, 1999. – 608 с.
30. Edwards K., Johnstone C., Thompson C. A simple and rapid method for the preparation of plant genomic DNA for PCR analysis // Nucleic Acids Res. 1991 Mar 25. Vol. 19(6). P. 1349. doi: 10.1093/nar/19.6.1349. PMID: 2030957; PMCID: PMC333874.
31. Шамшин И.Н., Кудрявцев А.М., Савельев Н.И. Создание генетических паспортов сортов яблони на основе анализа полиморфизма микросателлитных локусов генома: методика / И.Н. Шамшин, А.М. Кудрявцев, Н.И. Савельев. – Мичуринск, 2013. – 44 с.
32. Afunian M.R. Hunter Linkage of Vfa4 in Malus х domestica and Malus floribunda with Vf resistance to the apple scab pathogen Venturia inaequalis / M.R. Afunian, P.H. Goodwin and D.M. // Plant Pathology. – 2004. – V. 53. – P. 461-467.
33. Boudichevskaia A., Flachowsky H., Peil A., Fischer C., Dunemann F. Development of a multiallelic SCAR marker for the scab resistance gene Vr1/Vh4/Vx from R12740-7A apple and its utility for molecular breeding // Tree Genetics & Genomes. – 2006. – V. 2. – № 4. – С. 186-195.
34. Gardiner S.E. A detailed linkage map around an apple scab resistance gene demonstrates that two disease resistance classes both carry the Vf gene / S.E. Gardiner, H.C.M. Bassett, D.A.M. Noiton, V.G. Bus, M.E. Hofstee, A.G. White, R.D. Ball, R.L.S. Forster, E.H.A. Rikkerink // Theor.Appl.Genet. – 1996. – V. 93. – P. 485-493.
35. Gygax M. Molecular markers linked to the apple scab resistance gene Vbj derived from Malus baccata jackii / M. Gygax, L. Gianfranceschi, R. Liebhard, M. Kellerhals, C. Gessler, A. Patocchi // Theor Appl Genet. – 2004. – V. 109. – Р. 1702-1709.
36. Hemmat M., Weeden N.F., Brown S.K. Mapping and evaluation of Malus× domestica microsatellites in apple and pear //Journal of the American Society for Horticultural Science. – 2003. – Т. 128. – №. 4. – С. 515-520.
37. Khajuria Y. P., Kaul, S., Wani, A. A., & Dhar, M. K. Genetics of resistance in apple against Venturia inaequalis (Wint.) Cke // Tree genetics & genomes. – 2018. – V.14. – № 2. – P. 16.
38. Patocchi A., Bigler B., Koller B., Kellerhals M., Gessler C. Vr 2: a new apple scab resistance gene // Theoretical and Applied Genetics. – 2004. – V. 109. – № 5. – P. 1087-1092.
39. Patocchi A., Walser M., Tartarini S., Broggini G.A., Gennari F., Sansavini S., Gessler C. Identification by genome scanning approach (GSA) of a microsatellite tightly associated with the apple scab resistance gene Vm //Genome. – 2005. – V. 48. – №. 4. – P. 630-636.
40. Sansavini S., Tartarini S., Gennari F., Barbieri M. Scab (Venturia inaequalis) resistance in apple: the Vf-gene and polygenic resistance in the breeding strategy at DCA-Bologna // International Symposium on Apple Breeding for Scab Resistance №595. – 2000. – P. 29-32.
41. Soriano J.M. Identification and mapping of the novel apple scab resistance gene Vd3 / J.M. Soriano, S.G. Joshi, M. van Kaauwen, Y. Noordijk, R. Groenwold, B. Henken, W.E. van de Weg, H.J. Schouten // Tree Genetics & Genomes. – 2009. – V. 5. – Р. 475-482.
42. Tartarini S., Gianfranceschi L., Sansavini S., Gessler C. Development of reliable PCR markers for the selection of the Vf gene conferring scab resistance in apple // Plant breeding. – 1999. – V. 118. – № 2. – P. 183-186.
43. Caffier V., Didelot F., Pumo B., Causeur D., Durel C.E., Parisi L. Aggressiveness of eight Venturia inaequalis isolates virulent or avirulent to the major resistance gene Rvi6 on a non‐Rvi6 apple cultivar // Plant pathology. – 2010. – Т. 59. – №. 6. – P. 1072-1080.
44. Martínez-Bilbao A., Ortiz-Barredo A., Montesinos E., Murillo J. Venturia inaequalis resistance in local Spanish cider apple germplasm under controlled and field conditions // Euphytica. – 2012. – V. 188. – № 2. – P. 273-283.
45. Choupannejad R., Sharifnabi B., Bahar M., Talebi M. Searching for resistance genes to Venturia inaequalis in wild and domestic apples in Iran // Scientia Horticulturae. – 2018. – V. 232. – P. 107-111.
46. Talaie A., Fattahi R., Hajnajari H., Oraguzie N.C., Wiedow C., Gardiner S.E., Zamani Z. The role of Iran (Persia) in apple (Malus× domestica Borkh.) domestication, evolution and migration via the silk trade route // International Symposium on Molecular Markers in Horticulture №859. – 2009. – С. 229-236.
47. Урбанович О.Ю. Оценка генетического разнообразия генофонда плодовых культур и разработка методов ДНК-идентификации и генотипирования сортов и видов // Научные труды СКЗНИИСиВ. – 2015. – Т. 7. – С. 15-19.
48. Козловская З.А., Кондратенок Ю.Г., Гашенко Т.А., Ярмолич, С.А. Выявление новых комплексных источников устойчивости к болезням яблони с использованием молекулярных методов в Беларуси // Садоводство и виноградарство. – 2018. – Т. 5. – С. 23-29.
49. Савельев Н.И., Савельева Н.Н. Перспективные иммунные к парше сорта яблони для промышленного садоводства // Вестник Российской академии сельскохозяйственных наук. – 2014. – №. 2. – С. 42-44.
50. Савельева Н.Н. Генетический потенциал исходных форм яблони для создания устойчивых к парше и интенсивных колонновидных сортов: автореф. дисс. докт. биол. наук. – Мичуринск, 2015. – 47 с.
51. Седов Е.Н., Седышева, Г.А., Жданов В.В., Ульяновская Е.В., Серова З.М. Результаты селекции иммунных к парше триплоидных сортов яблони // Вестник ВОГиС. – 2009. – Т. 13. – №. 4. – С. 785-792.
52. Супрун И.И., Токмаков С.В., Рисованная В.И., Володин, В.А., Щербатко В.Д. Идентификация генов устойчивости яблони к мучнистой росе Pl1 и Pl2 и парше Vf и Vm у сортов яблони из коллекций генетических ресурсов крымского полуострова // Научные труды Государственного научного учреждения Северо-Кавказского зонального научно-исследовательского института садоводства и виноградарства Российской академии сельскохозяйственных наук. – 2015. – Т. 7. – С. 15-19.
53. Шамшин И.Н., Савельев Н.И., Кудрявцев А.М. Применение молекулярных маркеров для идентификации генотипов яблони с геном устойчивости к парше // Плодоводство и ягодоводство России: сб. науч. работ – 2011. – Т. 26. – С. 126-129.
54. Xu M.L., Korban S.S. Sauration mapping of the apple scab resistance gene Vf using AFLP markers // Theor. Appl. Genet. – 2000. – V. 101. – P. 844-851.
55. Молодцов М. А. Диагностика самоопыляемости сортов яблони по содержанию флавоноидов в репродуктивных структурах цветков: дисс. … канд. с-х. наук. – Мичуринск, 2014. –118 с.
56. Супрун И.И., Токмаков, С.В., Степанов, И.В., Иванова, А.М. Разработка мультиплексного набора для маркерной селекции яблони на устойчивость к парше // Научные труды Государственного научного учреждения Северо-Кавказского зонального научно-исследовательского института садоводства и виноградарства Российской академии сельскохозяйственных наук. – 2017. – Т. 12. – С. 26-30.
57. Larsen, B., Orgaard, M., Toldam-Andersen, T.B., Pedersen, C. A high-throughput method for genotyping SRNase alleles in apple // Mol. Breeding. – 2016. – V. 36(3). – P. 1-10.
58. Hegedűs A. Review of the self-incompatibility in apple (Malus x domestica Borkh., syn.: Malus pumila Mill.) // International Journal of Horticultural Science. – 2006. – V. 12. – № 2. – P. 31-36.
59. Minamikawa, M., Kakui, H., Wang, S., Kotoda, N., Kikuchi, S., Koba, T., Sassa H. Apple S locus region represents a large cluster of related, polymorphic and pollen-specific F-box genes // Plant Mol Biol, 2010. – V. 74. – P. 143-154.
60. Sheick R.B, Serra S., De Franceschi P., Dondini L., Musacchi S. Characterization of a novel self-incompatibility allele in Malus and S-genotyping of select crabapple cultivars // Scientia horticulturae. – 2018. – V. 240. – P. 186-195.
61. Schneider D., Stern R.A., Goldway M. A comparison between semi-and fully compatible apple pollinators grown under suboptimal pollination conditions // HortScience. – 2005. – V. 40. – № 5. – P. 1280-1282.
62. De Franceschi P., Cova V., Tartarini S., Dondini L. Characterization of a new apple S-RNase allele and its linkage with the Rvi5 gene for scab resistance // Molecular breeding. – 2016. – V. 36. – №. 1. – P. 7.
63. Супрун И.И., Степанов И.В., Токмаков С.В. Молекулярно-генетические аспекты самонесовместимости яблони // Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета. – 2012. – №. 80.
64. Соломатин Н.М. Генофонд вегетативно размножаемых форм яблони для улучшения сортимента подвоев, сырьевых и декоративных сортов в условиях ЦЧР: дисс. … докт. с-х. наук. – М., 2018.
65. Okada, K., Moriya, S., Haji, T., Abe, K. Isolation and characterization of multiple F-box genes linked to the S9- and S10-RNAse in apple (Malus × domestica Borkh.) // Plant reproduction, 2013. – V. 26(2). – P. 101-111.
66. Высоцкий В.А. Клональное микроразмножение плодовых растений и декоративных кустарников // Микроразмножение и оздоровление растений в промышленном плодоводстве и цветоводстве: Сб. научн. тр. ВНИИС им. И.В. Мичурина. – Мичуринск, 1989. – С. 3-8.
67. Высоцкий В.А. Некоторые итоги и перспективы использования методов культуры изолированных тканей и органов в садоводстве// История, современность и перспективы развития садоводства России: Матер. междунар. конф., Москва, 15-17 ноября 2000 г. – М., 2000. – С. 163-191.
68. Вечернина Н.А. Методы биотехнологии в селекции, размножении и сохранении генофонда растений: монография. – Барнаул, 2004. – 205 с.
69. Калашникова Е.А., Родин А.Р. Получение посадочного материала древесных, цветочных и травянистых растений с использованием методов клеточной и генной инженерии: Учебное пособие / Изд. 2, исп. и доп. – М.: МГУЛ, 2007. – 73 с.
70. Муратова С.А., Ю.В. Хорошкова Клональное микроразмножение растений – перспективный метод современного питомниководства //Основы повышения продуктивности агроценозов. – Мичуринск: Изд-во ООО «БиС», 2015. – С. 367-373.
71. Егорова, Н.А. Исследование устойчивости к солевому стрессу каллюсных культур эфиромасленной герани // Физиология и биохимия культурных растений. – 2009. – Т. 41. – № 6. – С. 523-530.
72. Соловых Н.В., Тарабрин А.Ю. Тканевая селекция земляники на устойчивость к комплексу грибных патогенов // Рекомендации по клональному микроразмножению плодовых и ягодных культур для специальности №030500.02 «Агрономия». – Воронеж, 2004. – 29 с.
73. Бутенко Р.Г. Индукция морфогенеза в культуре тканей растений // Гормональная регуляция онтогенеза растений. – М.: Наука, 1984. – С. 42-54.
74. Бутенко Р.Г. Биология клеток высших растений in vitro и биотехнология на их основе: Учебное пособие. – М.: ФБК-ПРЕСС, 1999. – 160 с.
75. Murashige T., Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue cultures // Physiol. Plant. – 1962. – V. 15. – №95. – P. 473-497.
76. Лангенфельд T.В. Яблоня. Морфология, эволюция, филогения, география, систематика. – Рига: Зинатне, 1991. – 234 c.
77. Guo Q., Yu Y., He Q., Li X., Liang G. AFLP analysis of four wild Malus Mill. // Acta Horticulturae. – 2007. – 760. – P.131-136.
78. Guo-lu L., Xiao-lin L. Chromosome studies of species of Malus Mill. // Acta Phytotaxonomica Sinica. – 1993. – V. 31 (3). – P. 236-251.
79. Oldén, E. J., Koch, A. Stone fruits, root-stocks and strawberries // Institute of Fruit and Berry Breeding. Report on activities in the year. – 1961. – P. 16-24.
80. Костюк М.А., Л.Л. Бунцевич Стерилизация эксплантов в технологии производства оздоровленного посадочного материала сливы домашней // Плодоводство и виноградарство Юга России. – № 44 (02), 2017. – С. 186-194.
81. Беседина Е.Н., Бунцевич Л.Л. Усовершенствования технологии клонального микроразмножения подвоев яблони на этапе введения в культуру in vitro // Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета. – 2015. – № 111. – С. 1716-1734.
82. Linsmaier E., Skoog F. Organic growth factor regularments of tobacco tissue culture // Physiol. Plant., 1965. – Vol. 18. – No. 1. – P. 100-127.
83. Quoirin M., Lepoivre P. Improved medium for in vitro culture of Prunus sp. // Acta Hortic. – 1977. – V. 78. – P. 437-442.
84. Lloyd G.B., McCown B.H. Commercially feasible micropropagation of mountain laurel (Kalmia latifolia) by use of shoot tip culture // Comb. Proc. Intl. Plant. Propagators Soc. – 1980. – V. 30. – P. 421-427.
85. Джафарова, В.Е. Особенности микроклонального развития яблони с геном Vf и возможности индуцирования полиплоидных меристем в условиях in vitro // Современное садоводство. – 2013. [Электронный ресурс]. – Режим доступа /http://e-koncept.ru›2013/53091.
86. Матушкина О.В., Пронина И.Н. Технология клонального микроразмножения яблони и груши (методические рекомендации) // Труды Всероссийского научно-исследовательского института садоводства им. И.В. Мичурина. Научные основы садоводства: Сб. науч. тр. – Воронеж. Кварта, 2005. – С.141-154.
87. Матушкина О.В., Пронина И.Н. Особенности клонального размножения яблони и груши. – Мичуринск-наукоград РФ. – 2008. – 32 с.
88. Mohammad Amiri E., Elahinia Ameneh Optimization of medium composition for apple rootstocks // Afr. J. Biotechnol. – 2011. – P. 3594-3601.
89. Деменко, В.И. Укоренение – ключевой этап размножения растений in vitro / В.И. Деменко, К.А. Шестибратов, В.Г. Лебедев // Известия ТСХА. – 2010. – Вып. 1. – С. 73-85.
90. Туровская Н.И. Регулирование процесса ризогенеза при микроразмножении яблони // Микроразмножение и оздоровление растений в промышленном плодоводстве и цветоводстве. – Мичуринск, 1989. − С. 8-13.
91. Bonga J.M., Klimaszewska K.K., von Aderkas P. Recalcitrance in clonal propagation, in particular of conifers // Plant. Cell Tiss. Organ. Cult. – 2010. – V. 100. – P. 241-254.
92. Welander M. Plant regeneration from leaf and stem segments of shoots raised in vitro from mature apple trees // J. Plant Physiol. – 1988. – V. 132. – P. 738-744.
93. Norizaku T., Tanimoto S., Harada H. Effects of wounding on adventitous bud formation in Torenia fournieri stem segments cultured in vitro // J. Exp. Bot. – 1985. – V. 36 – P. 841-847.
94. Андреева Ю.А. Солеустойчивость сортов яровой мягкой пшеницы в степной зоне Северного Казахстана: дис… на соискание учёной степени канд. с.-х. наук. – Кокшетау, 2015. – 127 c.
95. Reza Bahmani Effects of Salinity on In vitro Shoot Proliferation and Rooting of Apple Rootstock MM.106 / Reza Bahmani, Mansour Gholami, Ali-Akbar Mozafari, Raof Alivaisi // World Applied Sciences Journal. – 2012. – V. 17. – Is. 3. – P 292-295.
96. Шорников Д.Г. Совершенствование технологии размножения редких садовых растений в культуре in vitro и оценка их потенциала устойчивости к абиотическим стрессорам: дис… на соискание учёной степени канд. с.-х. наук. – Мичуринск, 2008. – 192 с.
97. Муратова С.А. Размножение садовых культур in vitro: методические рекомендации / С.А. Муратова, Д.Г. Шорников, М.Б. Янковская. – РАСХН, ВНИИГиСПР им. И.В. Мичурина. – Мичуринск-наукоград РФ: ОАО «Тамбовская типография «Пролетарский светоч», 2008. – 68 с.
98. Муратова С.А. Биотехнологические аспекты размножения плодовых и ягодных культур // Сборник научных трудов Государственного Никитского ботанического сада. – 2017. – № 144, вып. 2. – С. 84-89.
99. Weaver M.L. Influence of temperature and water status on pollen viability in bean / M.L. Weaver, H. Timm // Journal of American Society of Horticultural Science. – 1988. – Vol. 113. – P. 13-15.
100. Cross R.H. Heatstress effects on reproduction and seed set in Linum usitatissimum L. (flax) / R.H. Cross, S.A.B. Mc Kay, A.G. Mc Hughen, P.C. Bonham-Smith // Plant, Cell and Environment. – 2003. – Vol. 26. – P. 1013-1020.
101. Young L.W. High temperature stress of Brassica napus during flowering reduces micro- and megagametophyte fertility, induces fruit abortion, and disrupts seed production / L.W. Young, R.W. Wilen, P.C. Bonham-Smith // Journal of Experimental Botany – 2004. – Vol. 55. – P. 485-495.
102. Dowding P. Wind pollination mechanisms and aerobiology // Int. Rev. Cytol. – 1987. – Vol. 107. – P. 421-438.
103. Aylor D.E. Rate of dehydration of corn (Zea mays L.) pollen in the air // Journal of Experimental Botany. – 2003. – Vol. 54, №391. – P. 2307-2312.
104. Corbet S.A. Pollination and the weather // Israel Journal of Botany. – 1990. – Vol. 39. – P. 13-30.
105. Brown A.P., Dyer A.F. Effects of low temperature storage on the pollen of Brassica rapa (syn. B. campestris), B. oleracea and B. napus // Euphytica. – 1991. – Vol. 51. – P. 215-218.
106. Викулов С.В., Шабанова Е.В. Индикация загрязнения окружающей среды с помощью пыльцы рябины обыкновенной // Вестник ТГУ. – 2007. – Т. 12, вып. 6. – С. 687-688.
107. Srinivasan A. Cold tolerance during early reproductive growth of chickpea (Cicer arietinum L.): genetic variation in gamete development and function / A. Srinivasan, N.P. Saxena, C. Johansen // Field Crops Research. – 1999. – Vol. 60. – P. 209-222.
108. Сенин И.В. Особенности спорофитного и гаметофитного отбора на семенниках моркови: Автореф. дис. … канд. с.-х. наук. – М., 1996. – 25 с.
109. Лях В.А. Влияние высокой температуры на жизнеспособность пыльцы кукурузы / В.А. Лях, А.Н. Кравченко, А.И. Сорока, Е.Н. Дрючила // Известия АН МССР. Серия биол. и хим. наук. – 1988. – №2. – С. 15-20.
110. Sukhvibul, N. Effect of temperature on pollen germination, tube growth and seed development in mango (Mangifera indica L.) / N. Sukhvibul, S.E. Hetherington, A.W. Whiley, M.K. Smith, V. Vithanage // Acta Hortic. – 2000. – V. 509. – P. 609-616.
111. Tuinstra M.R. Estimation of Pollen Viability in Grain Sorghum / M.R. Tuinstra, J. Wedel // Crop Science. – 2000. – Vol. 40, №4. – P. 968-970.
112. Kakani V.G. Differences in in vitro Pollen Germination and Pollen Tube Growth of Cotton Cultivars in Response to High Temperature / V.G. Kakani, K.R. Reddy, S. Koti, T.P. Wallace, P.V.V. Prasad, V.R. Reddy, D. Zhao // Annals of Botany. – 2005. – Vol. 96, Iss. 1. – P. 59-67.
113. Hedhly A. The Effect of Temperature on Pollen Germination, Pollen Tube Growth, and Stigmatic Receptivity in Peach / A. Hedhly, J.I. Hormaza, M. Herrero // Plant. Biol. – 2005. – Vol.7. – P. 476-483.
114. Singh S.K. Assessment of Cold and Heat Tolerance of Winter-grown Canola (Brassica napus L.) Cultivars by Pollen-based Parameters / S.K. Singh, V.G. Kakani, D. Brand, B. Baldwin, K.R. Reddy // J. Agronomy & Crop Science. – 2008. – Vol. 194. – P. 225-236.
115. Кравченко А.Н. Методы гаметной и зиготной селекции томата / А.Н. Кравченко, В.А. Лях, Л.Г. Тодераш, Т.И. Салтанович, М.К. Паскал. – Кишинев: Штиинца, 1988. – 152 с.
116. Кравченко А.Н. Методы гаметной селекции растений: Методические рекомендации / А.Н. Кравченко, В.А. Лях, Л.Г. Тодераш, Т.И. Салтанович, М.К. Паскал, А.И. Духовный. – Кишинев: Штиинца, 1990. – 48 с.
117. Hormaza J.I., Herrero M. Pollen selection // Theor. Appl. Genet. – 1992. – Vol. 83. – P. 663-672.
118. Паушева З.П. Практикум по цитологии растений. – Изд. 2-е, перераб. и доп. – М.: Колос, 1974. – 288 с.
119. Морева Л.Я. Экологические особенности пчелы медоносной (Apis mellifera L.) на юге России: Дис. … доктора биол. наук. – Ставрополь, 2006. – 47 с.
120. Еськов Е.К. Экология медоносной пчелы. – М.: Росагропромиздат, 1990. – 221 с.
121. Методика Государственного сортоиспытания сельскохозяйственных культур. Вып. V. Плодовые, ягодные, субтропические, цитрусовые, орехоплодные культуры, виноград и чай. – М.: Колос, 1970. – 160 с.
122. Программа и методика селекции плодовых, ягодных и орехоплодных культур / Науч. ред. Г.А. Лобанов. – Мичуринск, 1980. – 531 с.
123. Методика учетов и наблюдений в опытах с плодовыми и ягодными культурами: Метод. рекомендации / Укр. с.-х. акад. – Киев, 1987. – 69 с.
124. Будаговский В.И. Карликовые подвои для яблони. – М.: Сельхоз-гиз, 1959. – 352 с.
125. Будаговский В.И. Культура слаборослых плодовых деревьев. – М.: Колос, 1976. – 304 с.
126. Будаговский В.И. Промышленная культура карликовых плодовых деревьев. – М., 1963. – 382 с.
127. Коровин В.А. Совместимость привоя и подвоя яблони. – М.: Колос, 1979. – 127 с.
128. Филиппова М.Л. Клоновые подвои яблони в отводочном маточнике: Дисс. … канд. с.-х. наук. – Мичуринск, 1988. – 158 с.
129. Коровин В.А. Отбор клоновых подвоев яблони для средней зоны РСФСР: дис. канд. с.-х. наук. – Мичуринск, 1961. – 168 с.
130. Лотова Л.И. Некоторые данные об анатомии карликовых подвоев яблони // Вестник Московского университета. – Серия 16: Биология. – №2. – М.: Изд-во Моск. ун-та, 1957. – С. 59-65.
131. Изучение коллекции семечковых культур и выявление сортов интенсивного типа: Метод. указания / ВАСХНИЛ, ВНИИ растениеводства им. Н.И. Вавилова. – Сост. Я.С. Нестеров. – Л., Изд-во ВИР, 1986. – 160 с.
