Титульный лист и исполнители
РЕФЕРАТ
Отчет 40 с., 1 кн., 18 рис., 4 табл., 25 источн., 3 прил.
Мясная продукция, незаявленные компоненты, фальсификация, ПЦР, гистологический метод, методы окрашивания, ядра клеток, немышечные компоненты, МОРФОМЕТРИЯ
Объектом исследования являются пробы мышечной ткани убойных животных и птиц, а также мясные продукты: фарш, колбасные и ветчинно-штучные изделия.
Цель работы ‒ разработка и обоснование применения наиболее эффективных гистологических методов исследования для выявления незаявленных компонентов в мясной продукции, которые можно было бы применять при положительных результатах ПЦР-анализа.
В процессе работы проводились экспериментальные исследования отдельных образцов говядины, свинины, мышечной ткани птиц и мясной продукции классическим гистологическим методом, методом полимеразной цепной реакции, а также с помощью экспресс метода изготовления нативных препаратов.
В результате исследования впервые были применены гистологические методы исследования и экспресс-метод изготовления микропрепаратов для идентификации мяса убойных животных и птицы с учетом: расположения ядер в мышечных волокнах, толщины эндомизия, морфометрии мышечных волокон различного вида мяса.
Степень внедрения ‒ имеется положительное решение о проведение предварительной экспертизы по выдаче патента на изобретение.
Эффективность исследований подтверждена значительным объемом проведенных исследований (69 проб: свинины – 12 пробы; говядины – 15; баранины – 8; мяса лося – 4; нутрии – 4; цыплят-бройлеров – 5; индеек – 7; мясо медведя — 3; рыбы – 11) и методами вариационной статистики.
Разработанные рекомендации используются в работе ГБУ Нижегородской области «Областная ветеринарная лаборатория» и Тамбовском областном ГБУ «Тамбовская областная ветеринарная лаборатория», а также в учебном процессе в ФГБОУ ВО СПбГУВМ.
ВВЕДЕНИЕ
На сегодняшний день потребление мяса и мясных продуктов увеличилось. Рынок мясных изделий изобилует не только разнообразием ассортимента, но цен на эти товары. Такое большое количество мясной продукции требует качественного контроля, потому что, как показывают данные многих исследований, случаи фальсификации мясных продуктов встречаются достаточно часто. Производители могут использовать в приготовлении продукта более дешевое мясо других животных, субпродукты, низкосортное мясо, животный или растительный белок. Все это может негативно повлиять на качество выпускаемой продукции [1].
Для осуществления контроля безопасности и качества мяса и мясной продукции действующее российское законодательство предусматривает ряд методов и методик, устанавливающих доброкачественность пищевой продукции и безопасность ее использования на всех этапах обращения [2].
В соответствии с Указом Президента Российской Федерации «Об утверждении Доктрины продовольственной безопасности Российской Федерации» (№120 от 30 января 2010 года) и Государственной программой развития сельского хозяйства и регулирования рынков сельскохозяйственной продукции, сырья и продовольствия, утвержденной Постановлением Правительства № 717 от 14.07.2012 года (в редакции от 08.02.2019 года № 98) – подпрограмма «Развитие отраслей агропромышленного комплекса (срок реализации 01.01.2019-31.12.2025)» продовольственная безопасность является необходимым условием повышения качества жизни граждан [3].
Видовая принадлежность продукции значима не только в плане безопасности, но и в этическом отношении к потребителям. Так, под видом кролика могут реализовать мясо кошки, баранины — мясо собаки. Достаточно часто в мясных продуктах (ветчино-штучные изделия из прессованного мяса, колбасные изделия, фарш) говядина заменяется (подсортовывается, фальсифицируется) свининой или более дешевым мясом птиц, субпродуктами или отходами мясного производства (хрящи, мясная обрезь, пищеводы и т.п.). В такой ситуации количественные показатели пищевого состава (белки, жиры, углеводы) будут оставаться в пределах заявленных критериев, однако качество такого продукта и его физиологическая ценность значительно снижаются [4, 5].
В случае замены одного вида сырья другим стандартные общепринятые методы исследования оказываются неэффективными в выявлении фальсификаций.
В настоящее время для видовой идентификации применяют такие аналитические методы, как масс-спектрометрический анализ [6], фракционное разделение экстрактов мышечной ткани посредством газовой хроматографии [7], иммунодиффузия [8] и др. Однако все они основаны на анализе белков или не разрушенных тканевых структур и их применение невозможно при оценке переработанных продуктов, подвергшихся механической или термической обработке, влекущей дегенеративные клеточные изменения.
В последние годы у нас в стране, как и за рубежом, широко применяют метод полимеразной цепной реакции (ПЦР-анализ) для установления состава мясной продукции: мясо в блоках, фарш, полуфабрикаты, колбасные изделия и т.д. [9, 10, 11].
Однако, все чаще возникают спорные ситуации, связанные с применением ПЦР-анализа, обусловленные высокой чувствительностью и возможностью репликации ничтожно малых объемов биологического материала.
Для ПЦР-анализа видового состава продукции используется качественный, а не количественный метод. Чувствительность метода крайне высока, практически двух молекул достаточно, чтобы определить наличие ДНК любого ингредиента, находящегося на производстве.
В развитых странах идентификация незаявленного сырьевого компонента до 1% считается технически неустранимой примесью. На одном оборудовании изготавливается широкий ассортимент продукции с разным сырьевым составом. В связи с этим сырье, вспомогательные материалы могут содержать незаявленный компонент.
При этом, недостаточно осуществлять мойку и санитарную обработку оборудования — полностью исключить «чужую» ДНК гарантировано можно только при обработке концентрированной соляной кислотой. Так, например, у нас в РФ в соответствии с ТР ТС 022/2011 «Пищевая продукция в части ее маркировки» установлен предел, определяющий наличие ГМО в продукте (не более 0,9%) [12]. И такой же предел должен быть установлен в части наличия ДНК (https://meat-expert.ru/articles/178-postoronnie-dnk-est-a-esli-naydu © Независимый портал для специалистов мясной индустрии «Мясной Эксперт»)
Обнаружение незаявленных в маркировке компонентов, но не использованных и, соответственно, не заявленных на этикетке производителем при изготовлении конкретного пищевого продукта, но имеющихся в наличии на предприятии для производства других продуктов не должно привлекать за собой обвинение в изготовлении фальсифицированной продукции.
Однако это может быть намеренное нарушение, когда недобросовестные производители заменяют дорогое мясное сырье более дешевым (например, вместо говядины добавляют курицу).
Метод полимеразной цепной реакции (ПЦР) – высокоточный метод молекулярно-генетической диагностики позволяет проводить исследование многокомпонентных смесей и продуктов, прошедших термическую обработку. Но положительные результаты, полученные в результате применения такого качественного метода, не являются неоспоримым доказательством фальсификации, а лишь являются предпосылкой для проведения комплексного исследования продукции.
Гистологический метод позволяет определить основные компоненты исходного сырьевого продукта, его структуру, дифференцировать специфические особенности тканевых элементов, а главное – определить соотношение компонентов в продукте. В последнее время он широко используется в лабораторных исследованиях пищевых продуктов и даже разработаны с этой целью рекомендации [13].
На сегодняшний день основной вектор исследований направлен на микроструктурные изменения в мясе и мясных продуктах в зависимости от породы, технологии и условий содержания животных, а также условий хранения и термического состояния мяса [14, 15, 16, 17, 18, 19]. Однако в них не отражены критерии, позволяющие определять видовую принадлежность мясных изделий [1, 20].
Также много работ посвящено исследованию фальсификации мясной продукции растительными компонентами [4].
Наиболее оптимальным, на наш взгляд, при положительных ПЦР- реакциях на наличие незаявленных компонентов и в спорных ситуациях в качестве арбитражного метода применять гистологические методы исследования мясных продуктов. Данное направление перспективно и требует разностороннего изучения.
1 ОСНОВНАЯ ЧАСТЬ ОТЧЕТА О НИР
1.1 Материал и методы исследований
Материалом для исследования служила мясная продукция: охлажденное мясо (говядина, свинина, мясо курицы, а также смесь мышечных волокон в соотношении 10%, 20% и 50% в различных сочетаниях); полуфабрикаты (куриный, свиной, говяжий и смешанный фарш) и готовые мясные изделия (производственная продукция).
Отбор проб мяса (в том числе для изготовления фарша с различным процентным соотношением компонентов) осуществляли из грудного отруба свинины [21], говядины [22] и мясо грудки кур [23]. Данные отруба характеризуются высокой биологической ценностью (таблица 1).
Таблица 1 — Показатели содержания жира, белка и энергетической ценности грудного отруба свинины, говядины и грудки кур согласно ГОСТ
| Вид мяса | Показатели на 100 г мяса | ||
| Жир, г | Белок, г | Энергетическая ценность, ккал | |
| Говядина | 10,4-18,9 | 15,9-18,0 | 157,2 — 242,1 |
| Свинина | 17,9 | 18,1 | 233,5 |
| Мясо кур | 5-9 | не менее 17 — 21 | 130-150 |
Для оценки чувствительности и специфичности метода ПЦР-анализа для идентификации ДНК животного происхождения трех видов (крупного рогатого скота, свиньи, курицы) в зависимости от вида исследуемой биологической ткани, способа обработки продукции (механическая, термическая, химическая), а также пригодности метода для анализа смешанных продуктов (имеющих в составе два и более видовых источника) были отобраны пробы.
Пробы подразделяли на следующие категории: сырой продукт с разными концентрациями компонентов 20%, 50%, 80% курицы, говядины и свинины, отпечатки с пленки для упаковки, без обработки и после механической и химической обработке (70% спиртом).
Для определения видовой принадлежности ДНК методом ПЦР разработаны отечественные тест-системы (СИНТОЛ, ВЕТФАКТОР, г. Москва):
— Тест-система «ПЦР-КУРИЦА-ФАКТОР» (ВЕТФАКТОР, г. Москва) для определения видовой принадлежности тканей курицы в соответствии с инструкцией изготовителя.
— Тест-система «ПЦР-СВИНИНА-ФАКТОР» (ВЕТФАКТОР, г. Москва) для определения видовой принадлежности тканей свинины в соответствии с инструкцией изготовителя.
В тест-системах применяется ВКО (внутренний контрольный образец), который добавляется на этапе выделения ДНК и позволяет исключить ошибки исследователя при постановке реакции.
Процесс амплификации проводили в приборе для ПЦР-РВ LightCicler 96 (Roche) .
Поместили стрипы для ПЦР в амплификатор по заданной топологии и запустили программу амплификации для одновременной детекции. Использовали следующие температурные параметры: 95оС — 5 мин. — 1цикл. Последующие 40 циклов 950С в течение 10 сек., 600С-20сек, 720С- 20 сек.
Изготовление гистологических препаратов проводили в соответствии с ГОСТ 19496-2013 «Мясо и мясные продукты. Метод гистологического исследования» [24].
Производился отбор материла с полной маркировкой, подготавливались образцы размером 1,5х1,5х0,5 см, которые сразу фиксировали в 10% нейтральном формалине в течение 24-48 часов. Фиксированные образцы подвергали промыванию в проточной воде для удаления избытков формалина. Далее проводили в несколько этапов обезвоживание, помещая исследуемый материал в концентрированный изопропиловый спирт. Затем мясные изделия уплотняли в гомогенизированной парафиновой среде для гистологической заливки Гистомикс и заключали в парафиновые блоки.
Из каждого образца получали гистологические срезы толщиной 5-7 мкм, которые изготавливали на ротационном микротоме Ротмик-2. В дальнейшем их закрепляли на предметных стеклах и окрашивали.
А) При проведении микроструктурных исследований применяли такие гистологические красители, как гематоксилин и эозин, позволяющие выявить основные тканевые и клеточные структурные элементы.
Этапы окрашивания:
1. Депарафинизация срезов в ксилоле (2 раза по 4 мин.);
2. Регидратация в 96% этиловом спирте (2 раза по 4 мин.), дистиллированная вода (5-7 мин.);
3. Окрашивание гематоксилином Майера (5 мин.), промывание срезов в проточной воде;
4. Окрашивание водным раствором эозина (5 мин.), промывание в проточной воде;
5. Дегидратация в 96% этиловом спирте (2 раза по 4 мин.);
6. Просветление срезов в ксилоле (2 раза по 4 мин.);
7. Заключение срезов под покровное стекло с помощью монтирующей среды.
Б) Также для дифференциации коллагеновых волокон и других компонентов соединительной ткани использовали краситель Перльс Ван Гизон (раствор калия ферроцианида, пикрофуксин по Ван Гизону).
Описание метода:
1. Депарафинизация срезов в ксилоле (2 раза по 4 мин.);
2. Регидратация в 96% этиловом спирте (2 раза по 4 мин.), дистиллированная вода (5-7 мин.);
3. Помещаем срезы в раствор калия ферроцианида (20 мин.), после тщательно промываем в дистиллированной воде;
4. Наносим на срезы пикрофуксин по Ван Гизону (10 мин.), промываем в дистиллированной воде;
5. Регидратируем в этиловом спирте возрастающей концентрации, просветляем срезы в ксилоле и производим заключение срезов под покровное стекло с помощью монтирующей среды.
Изучение гистологических препаратов и их фотографирование проводили на световом микроскопе ЛОМО МИКМЕД-5 с использованием камеры ЛОМО МС-3. Применяли окуляр х10 и объективы с 10-, 20- и 40-кратным увеличением.
Для морфометрии использовали по 10 предметных стекол от одного животного. Для статистической обработки полученных данных делали по 50 измерений по каждому показателю, далее вычисляли среднюю арифметическую (М), ошибку средней арифметической (±m). Полученные данные подвергались биометрической обработке с вычислением критерия достоверности по Стьюденту (t).
Необходимо отметить, что особенности морфологии и микроструктуры тканей зависят не только от вида животного, но и от породы, возраста, условий выращивания и кормления. Поэтому при исследовании учитывали наиболее типичные характеристики тканей, присутствующие во всех препаратах одного вида животных.
В ходе микроскопии гистологических препаратов исследовали:
— форму, диаметр мышечных волокон, их расположение в пучке;
— толщину и структуру соединительнотканных оболочек (эндомизия, перимизия, эпимизия);
— форму и расположение ядер мышечных волокон (миосимпластов);
— наличие фиброцитов и липоцитов;
— структуру первичных, вторичных и третичных мышечных пучков.
В качестве экспресс-метода изучения микроструктуры мышечных волокон в нативных препаратах мяса применяли изготовление раздавленных тонких проб между стеклами компрессориума и окрашивания их гематоксилин-эозином [25].
Из образца мяса отбирали пробу массой 20 грамм. Изогнутыми ножницами, направляя их лезвия выпуклой стороной наружу, делали 5 тонких срезов по ходу мышечных волокон размером 1 см длиной и 2 мм толщиной. Далее раскладывали их при помощи препаровальных игл на нижнем стекле компрессориума. Аккуратно накрывали срезы верхним стеклом, фиксировали винтами, раздавливали мышечные срезы для просмотра структуры мышц в световом луче микроскопа.
Далее раздавленные срезы осторожно снимали препаровальными иглами и помещали их на дно фарфоровой чашки, где подвергали их окраске гематоксилином и эозином. Сначала в фарфоровую чашку со срезами добавляли 3-4 капли квасцового гематоксилина Эрлиха и выдерживали в течение 3-4 минут. Далее промывали срезы в воде в течение 2 минут до обесцвечивания смываемой воды и для наиболее полного удаления гематоксилина срезы опускали в 1% раствор соляной кислоты до появления слабо-розовой окраски, затем помещали их в 1% раствор аммиака до синего окрашивания жидкости и промывали водой в течение 2 мин. Затем мышечные срезы обрабатывали 1% водно-спиртовым раствором эозина в течение 1 мин и вновь промывали водой.
После этого окрашенные срезы при помощи препаровальных игл, разравнивая, по одному помещали на нижнее стекло компрессориума, на срезы добавляли по 1 капле 50% водного раствора глицерина и фиксировали мышечную ткань верхним стеклом, слегка придавливая его, и закручивая винтами. Подготовленный таким образом микропрепарат доступен для микроскопии и оценки структуры элементов мышечных волокон.
Мышечные срезы из мяса птицы окрашивали смесью красителей, состоящей из 1% спиртового раствора метиленового синего, 1% спиртового раствора эозина и водного раствора метиленового синего с бурой в течение 30 минут, после чего промывали водой до обесцвечивания смываемой жидкости.
2 Результаты исследований
2.1 Оценка чувствительности и специфичности метода ПЦР для видовой идентификации говядины, свинины и курицы
Результаты исследования ПЦР-анализа проб мяса различных видов животных показал, что во всех пробах пищевых продуктов, независимо от вида обработки, наблюдалась 100%-ная амплификация соответствующего вида с применением тест-систем «ПЦР-КУРИЦА-ФАКТОР» (рисунок 1) и «ПЦР-СВИНИНА-ФАКТОР» (рисунок 2).
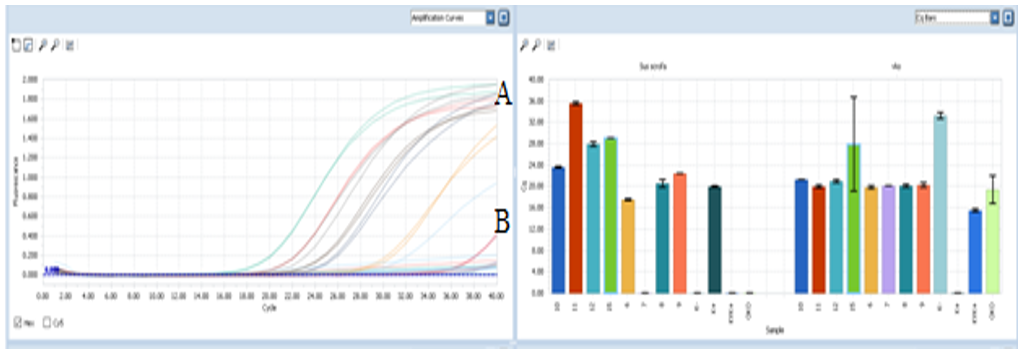
Рисунок 1. — Графики анализа результатов амплификации специфического участка ДНК свинины, курицы, говядины и анализ результатов амплификации ВКО (А- сырой продукт с разными концентрациями компонентов; В- отпечатки с пленки для упаковки, без обработки и после механической и химической обработке)
Результаты интерпретируются на основании наличия (или отсутствия) пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией, что определяет наличие (или отсутствие) для данной пробы ДНК значения порогового цикла Ct. Результат ПЦР-исследования считается достоверным, если получены правильные результаты для положительного и отрицательного контроля. По окончании ПЦР-анализа происходит автоматическая генерация отчетов с информацией о наличии или отсутствии искомых возбудителей.
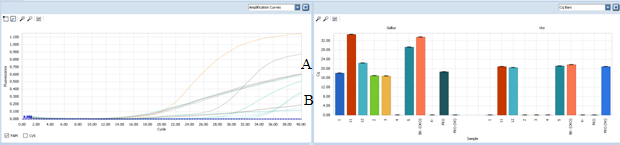
Рисунок 2. — Графики анализа результатов амплификации специфического участка ДНК свинины, курицы, говядины и анализ результатов амплификации ВКО (А- сырой продукт с разными концентрациями компонентов; В- отпечатки с пленки для упаковки, без обработки и после механической и химической обработке)
Таким образом, в ходе исследований установлено, что применяемый метод характеризуется высокой чувствительностью и специфичностью, подходит для видовой идентификации пищевых продуктов различного происхождения. С его помощью можно определить ДНК вида независимо от способа переработки продукции. Кроме этого, метод можно применять для анализа продуктов, имеющих в составе два или более видовых источника независимо от процента содержания.
2.2 Определение наиболее эффективного метода гистологического исследования для выявления незаявленных компонентов в мясной продукции
При исследовании препаратов куриного мяса под микроскопом были выявлены следующие микроструктурные особенности. Поперечнополосатая мышечная ткань составляет основу мяса. Помимо мышечных волокон, в нее также входят элементы соединительной ткани и жировой ткани (рисунок 3).
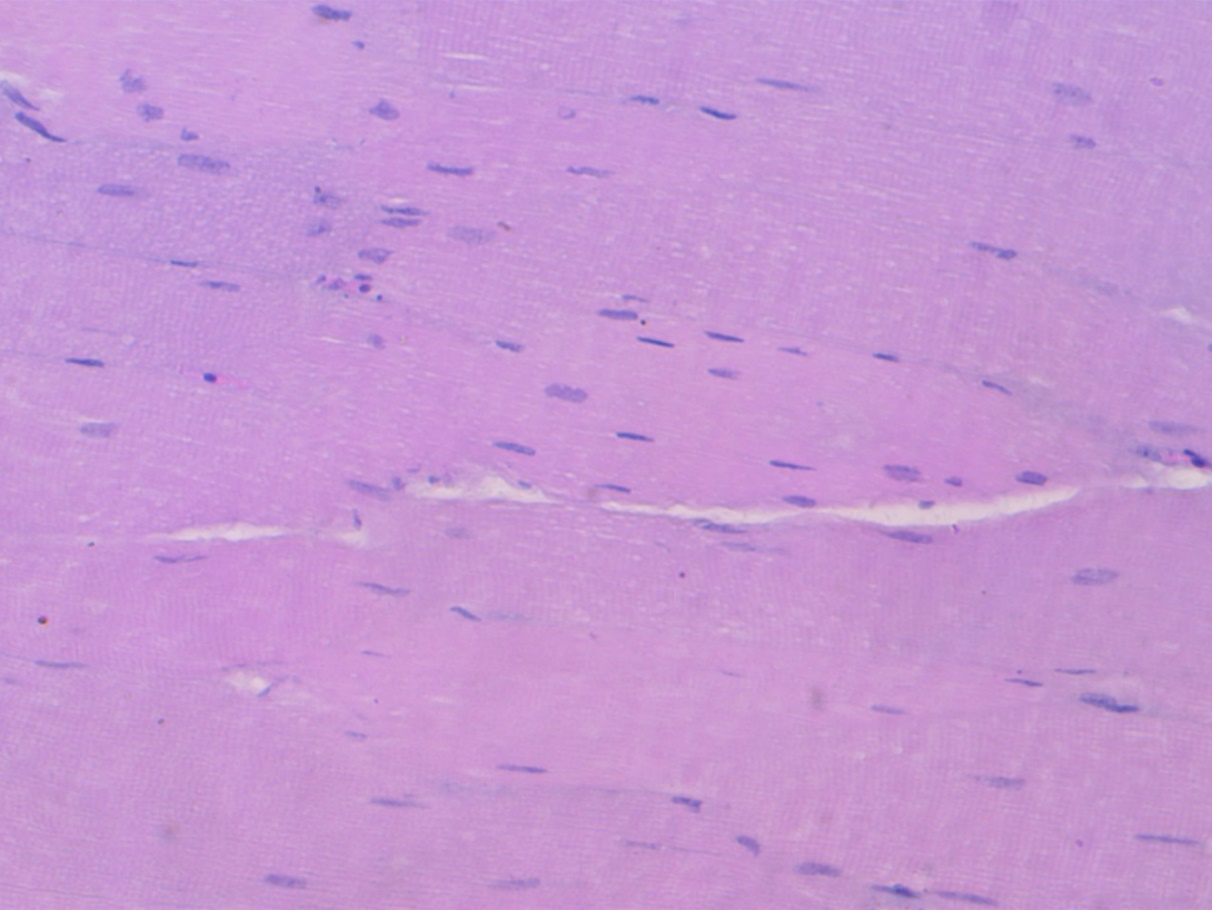
Рисунок 3 – Продольные срезы поперечнополосатой мышечной ткани птиц. Окраска гематоксилин-эозин. Объектив х10, окуляр х10
Скелетная мышечная ткань птиц имеет сходное строение с мясом крупного рогатого скота и свиньи. Однако в мышечных волокнах птиц ядра располагаются не только на периферии, но и имеют центральное расположение.
Помимо мышечных волокон, в мясо также входят элементы соединительной и жировой тканей. Мышечные волокна округлой формы, с ярко выраженной поперечной исчерченностью, хорошо визуализируемой на продольных срезах.
Диаметр волокон колеблется от 20 до 40 мкм с преобладанием средних значений указанного диапазона (таблица 2).
Таблица 2 — Морфометрические показатели структур поперечнополосатой мышечной ткани птиц (Мm)
| Вид мяса | Диаметр мышечных волокон, мкм | Ширина соединительнотканных прослоек, мкм | ||
| Эндомизий | Перимизий | Эпимизий | ||
| Мясо птицы | 35±0,67 | 4,7±0,02 | 6,1±0,1 | 9,8±0,03 |
В поверхностном слое мышц пучки тонкие. В глубоколежащих слоях количество волокон в одном пучке увеличивается, мышечные пучки становятся крупнее, плотнее прилегают друг к другу.
Ядра миосимпластов овальной формы, хорошо заметны как на продольных, так и на поперечных срезах. Расположены ядра не только по периферии, под сарколеммой, но и по всей толщине мышечного волокна. Расположение ядер по всей саркоплазме является характерной отличительной особенностью миосимпластов птиц. По этому признаку их мясо легко отличить от мяса млекопитающих.
Между пучками первого (эндомизий), второго и третьего порядка расположена рыхлая волокнистая соединительная ткань, с участками разрастания в местах расположения нервных волокон, кровеносных и лимфатических сосудов (рисунок 4).
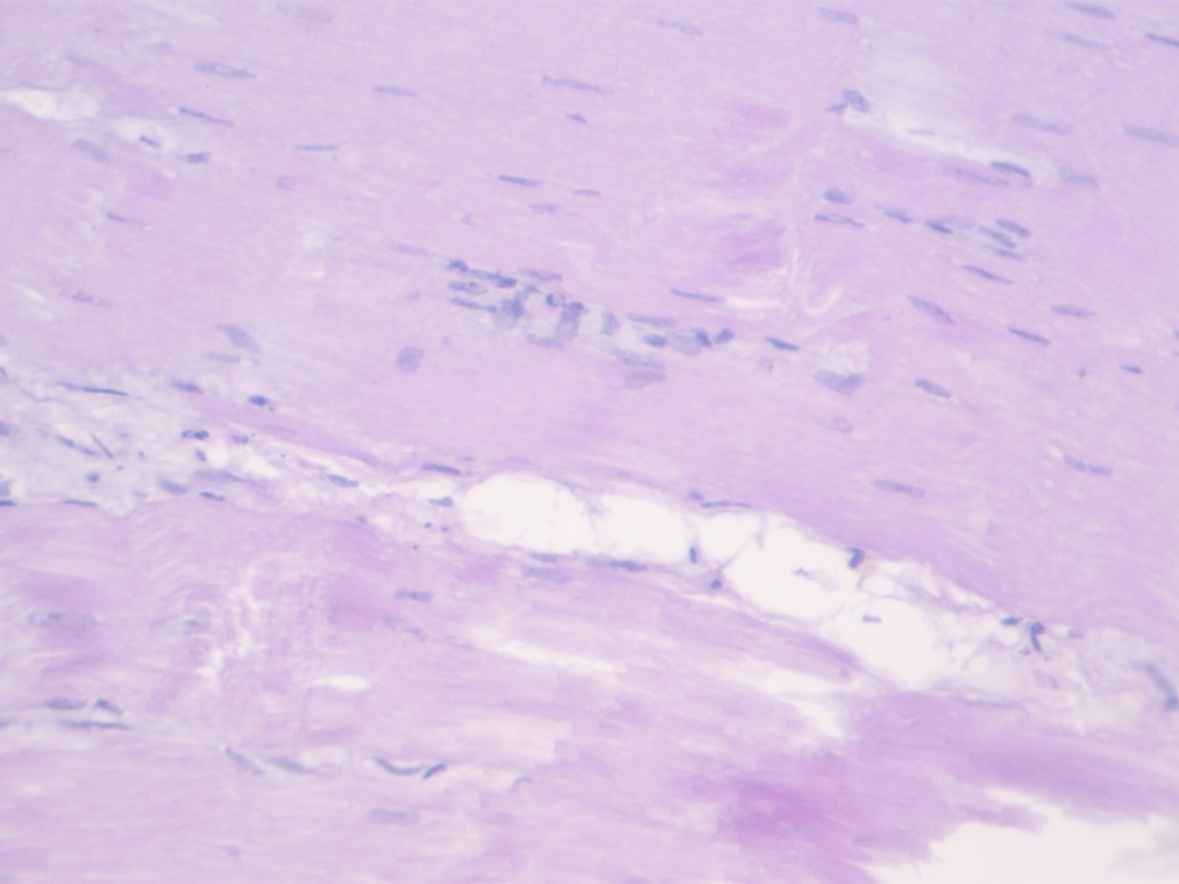
Рисунок 4 – Продольный срез поперечнополосатой мышечной ткани мяса курицы. Окраска гематоксилин-эозин. Объектив х20, окуляр х10
Между пучками 2 и 3 порядка в небольшом количестве встречаются жировые клетки (липоциты). В перимизии и эпимизии можно видеть эластические и коллагеновые волокна.
При исследовании гистоструктуры говядины средний диаметр мышечного волокна составлял 60-100 мкм (таблица 3), с преобладанием более широких миосимпластов (таблица 3).
Таблица 3 — Морфометрические показатели структур поперечнополосатой мышечной ткани крупного рогатого скота (Мm)
| Вид мяса | Диаметр мышечных волокон, мкм | Ширина соединительнотканных прослоек, мкм | ||
| Эндомизий | Перимизий | Эпимизий | ||
| Говядина | 90,2±1,2 | 19,1±0,01* | 21,3±0,03** | 26,4±0,02* |
где *р<0,05 и **р<0,001 — статистически значимые отличия от контроля
Мышцы крупного рогатого скота по сравнению с мышцами свиньи, отличаются большим диаметром первичных пучков и большим содержанием в них мышечных волокон. Первичные мышечные пучки плотно упакованы. (рисунок 5).

Рисунок 5 – Продольные срезы поперечнополосатой мышечной ткани птиц. Окраска гематоксилин-эозин. Объектив х10, окуляр х10
Форма овально-полигональная (рисунок 6), отчетливо видна поперечная исчерченность на продольных срезах с более широкими чередующимися светлыми и темными полосами. Эндомизий тонкий, с небольшими разрастаниями в местах прохождения кровеносных сосудов и нервных волокон.
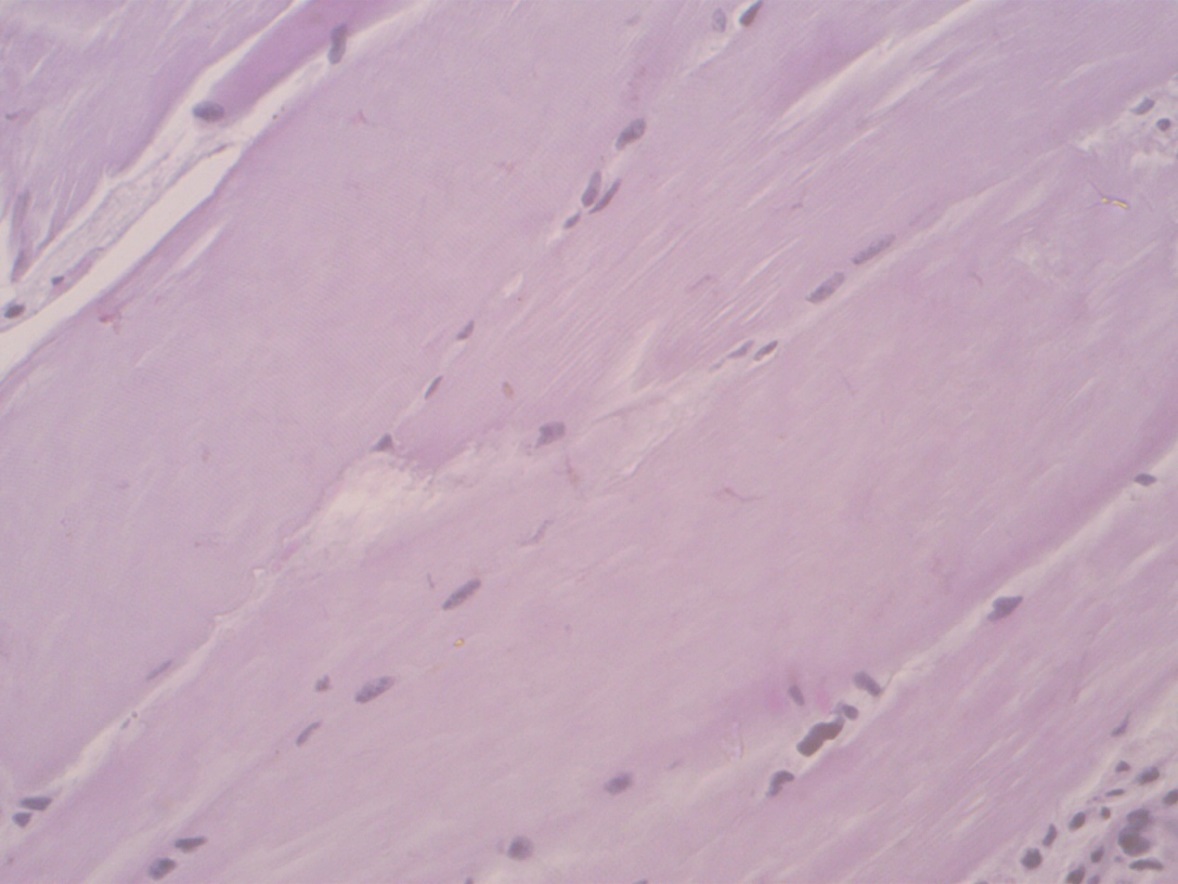
Рисунок 6 – Продольный срез поперечнополосатой мышечной ткани крупного рогатого скота. Окраска гематоксилин-эозин.
Объектив 40, окуляр х10
Жировые клетки между первичными пучками встречаются в малом количестве либо в виде небольших скоплений (рисунок 7).
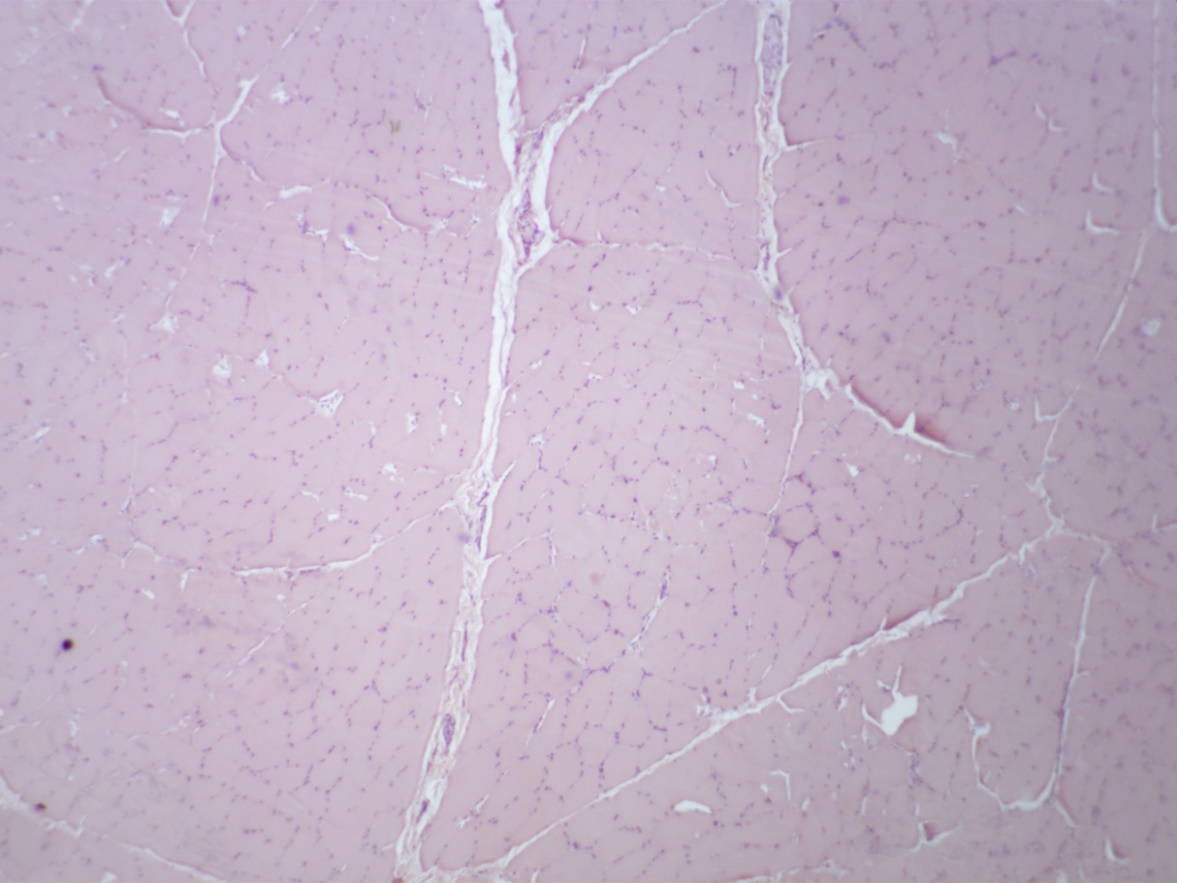
Рисунок 7 – Поперечный срез проб говядины. Окраска гематоксилин-эозин. Объектив 4, окуляр х10
Толщина соединительнотканных перегородок вторичных и третичных пучков увеличивается. Однако, прослойки перимизия плотнее, чем в мышцах свиньи. В перимизии имеются скопления жировых клеток, наибольшее количество которой представлено в эпимизии. По сравнению с липоцитами в перимизии свиньи жировые клетки имеют меньший диаметр. Ядра мышечных волокон крупные, имеют форму сильно вытянутого веретена, расположены непосредственно под сарколеммой по оси волокна (рисунок 8).
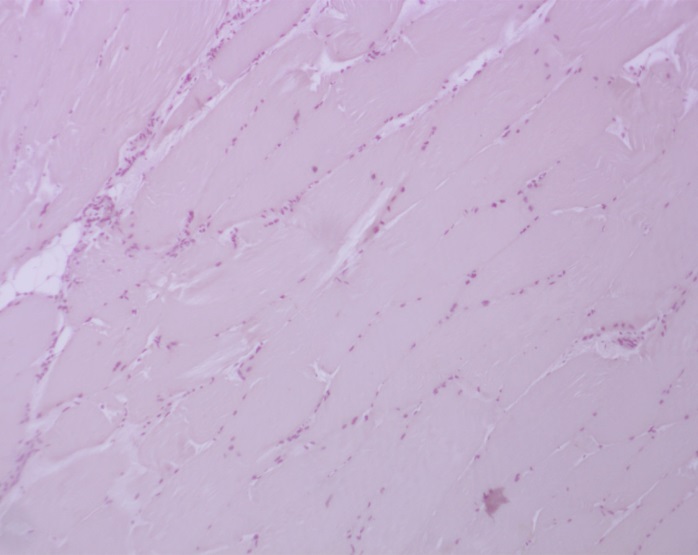
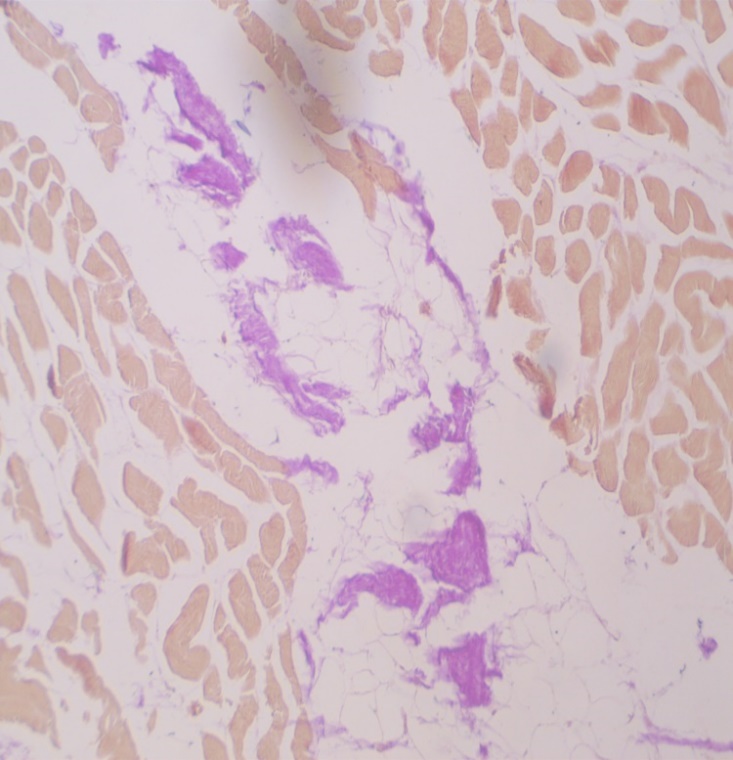
А
Б
Рисунок 8 – Продольный срез проб говядины. Окраска гематоксилин-эозин (А) и Перльс Ван-Гизон (Б). Объектив х10, окуляр х10
В некоторых образцах при гистологическом исследовании охлажденной говядины было определено, что ранее она подвергалась заморозке. (рисунок 9).
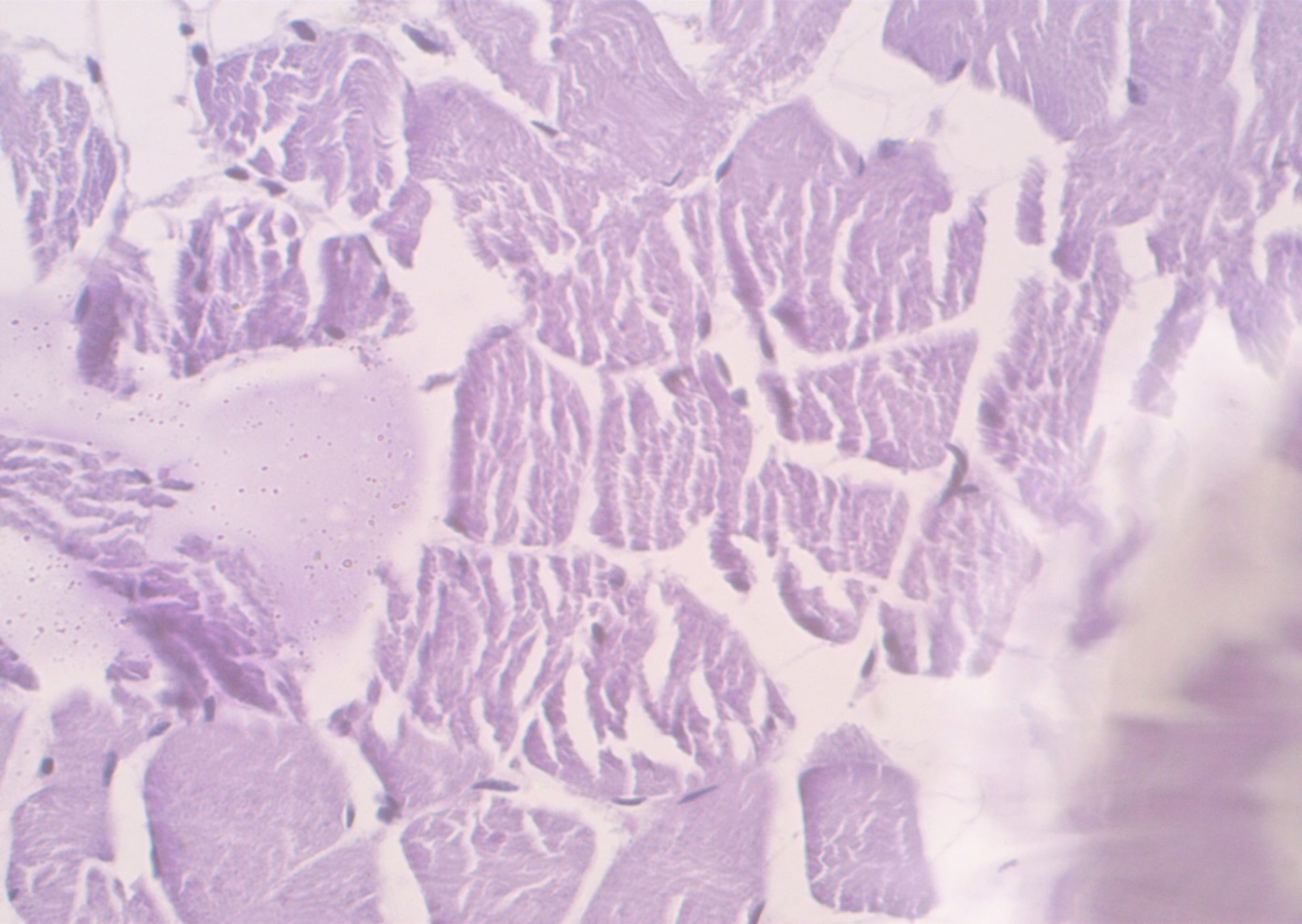
2
1
Рисунок 9 – Поперечный (1) и косой (2) срезы поперечнополосатой мышечной ткани говядины. Окраска гематоксилин-эозин.
Объектив х10, окуляр х10
При замораживании и хранении появляются кристаллы льда. Они могут располагаться как между мышечными волокнами, так и внутри них. Их наличие приводит к разной степени разрушению сарколеммы, что позволяет определить, таким образом, качество и технологические свойства мясного сырья. Также при исследовании охлажденной говядины встречались случаи выявления цист паразитов среди пучков мышечных волокон (рисунок 10)
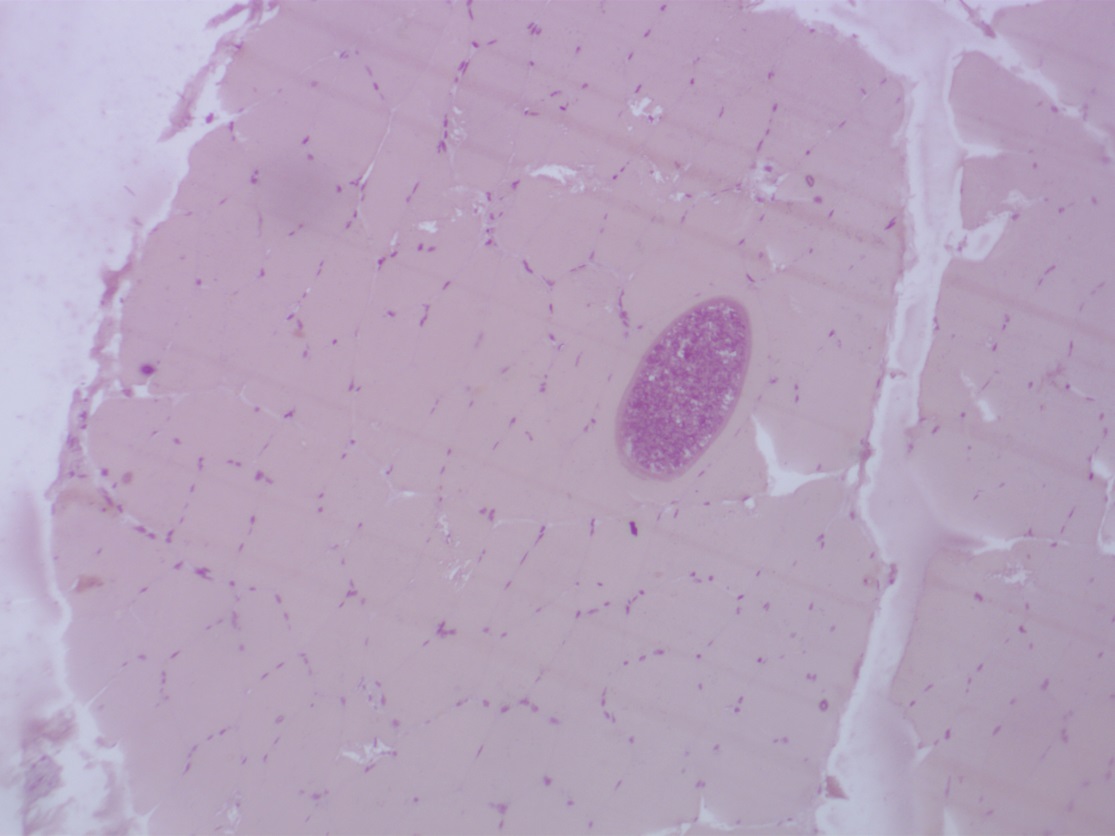
Рисунок 10 – Поперечный срез поперечнополосатой мышечной ткани говядины с цистами паразитов. Окраска гематоксилин-эозин.
Объектив х4, окуляр х10
В гистопрепаратах из скелетной мускулатуры свиньи определяли следующие видовые отличия. Диаметр мышечных волокон значительно больше, чем у кур, от 40 до 70 мкм (таблица 3).
Таблица 4 — Морфометрические показатели структур поперечнополосатой мышечной ткани свиньи (Мm)
| Вид мяса | Диаметр мышечных волокон, мкм | Ширина соединительнотканных прослоек, мкм | ||
| Эндомизий | Перимизий | Эпимизий | ||
| Свинина | 54,6±0,2 | 15,3±0,07* | 17,1±0,05** | 20,4±0,08* |
где *р<0,05 и **р<0,001 — статистически значимые отличия от контроля
Волокна имеют полигонально-округлую форму. На продольных срезах четко различима поперечная исчерченность. Крупные, плотно окрашенные ядра веретенообразной формы расположены по периферии волокон (рисунок 11). Мышечные волокна прилегают менее плотно, чем у кур. Мышцы отличаются сравнительно тонким эндомизием. В эндомизии присутствуют скопления липоцитов, фиброцитов, мелких кровеносных сосудов.
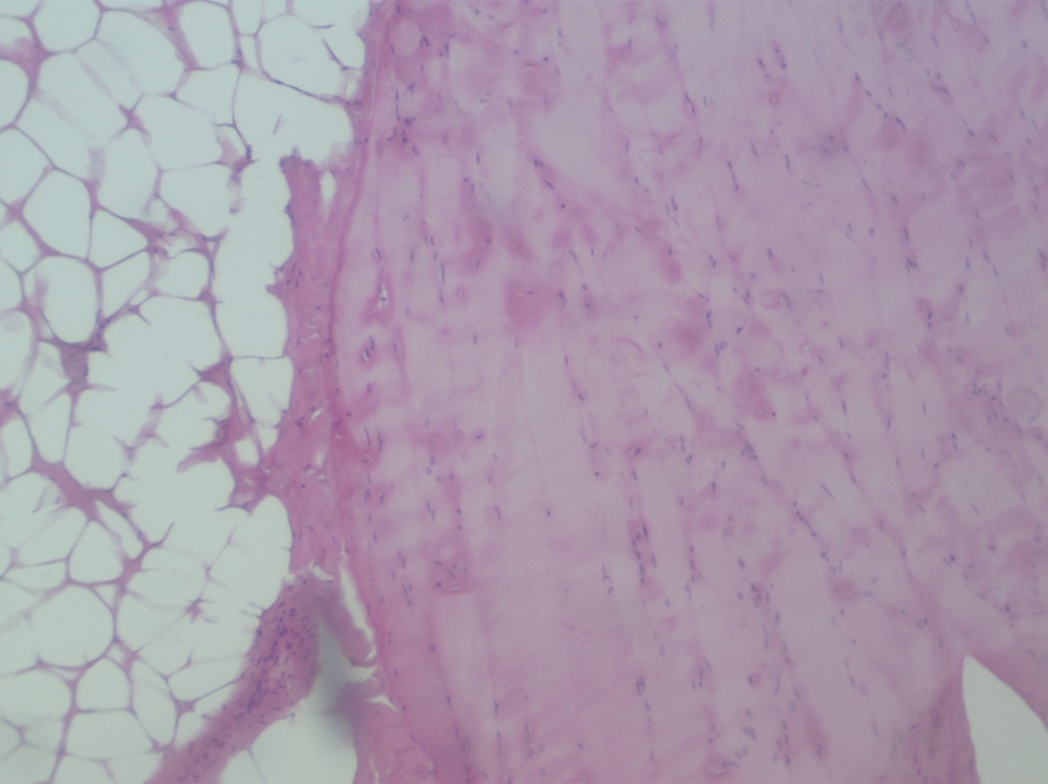
Рисунок 11 – Продольный срез поперечнополосатой мышечной ткани свиньи. Окраска гематоксилин-эозин. Объектив х4, окуляр х10
Вторичные и третичные пучки еще больше разрежены, между ними находится хорошо выраженный перимизий из рыхлой волокнистой соединительной ткани с большим содержанием жировой ткани, коллагеновых и эластических волокон (рисунок 12).
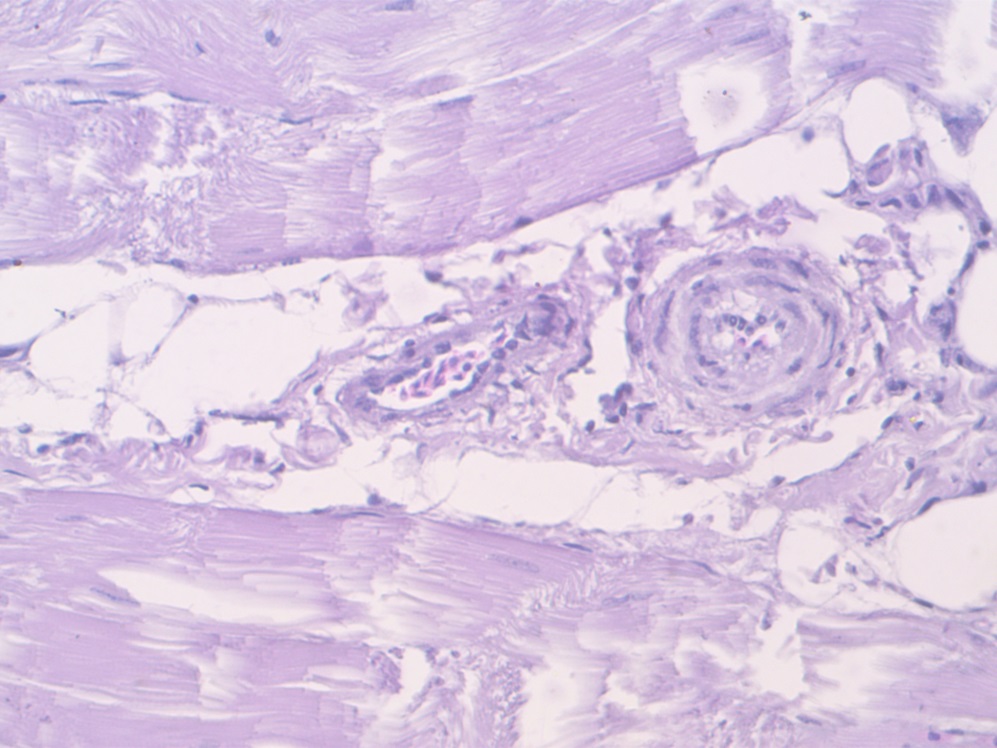
Рисунок 12 – Продольный срез проб свинины (перимизий). Окраска гематоксилин-эозин. Объектив х4, окуляр х10
Количество жировых прослоек увеличено, они почти полностью заполняют пространство между пучками. Также в перимизии хорошо заметны коллагеновые и эластические волокна разного диаметра.
Согласно плану исследований, нами была проведена подсортовка мышечных волокон говядины куриными в соотношениях 10%, 20% и 50%. Из средних проб изготовлены гистологические препараты для микроструктурных исследований.
Результаты исследований показали, что при 10% подсортовке дифференцировать миосимпласты говядины от мышечных волокон куриного мяса достаточно сложно в связи с незначительным их количеством. А при содержании в мясном продукте 20% и более процентов куриного мяса можно достоверно дифференцировать мышечные волокна крупного рогатого скота и птиц. Данные приведены на рисунке 13.
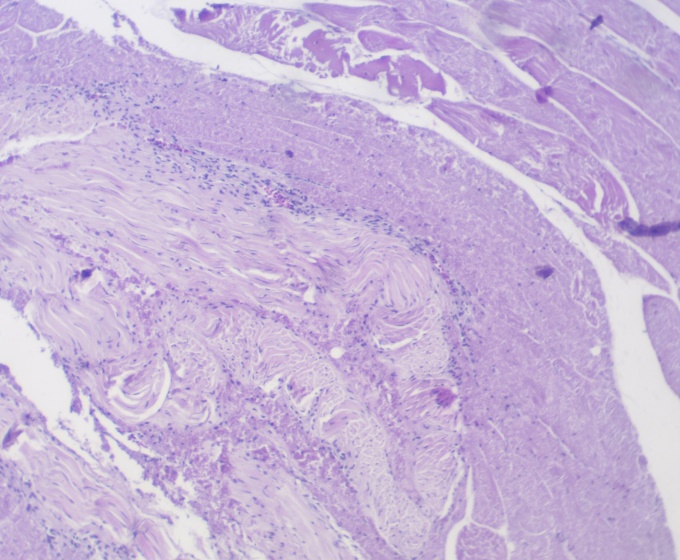
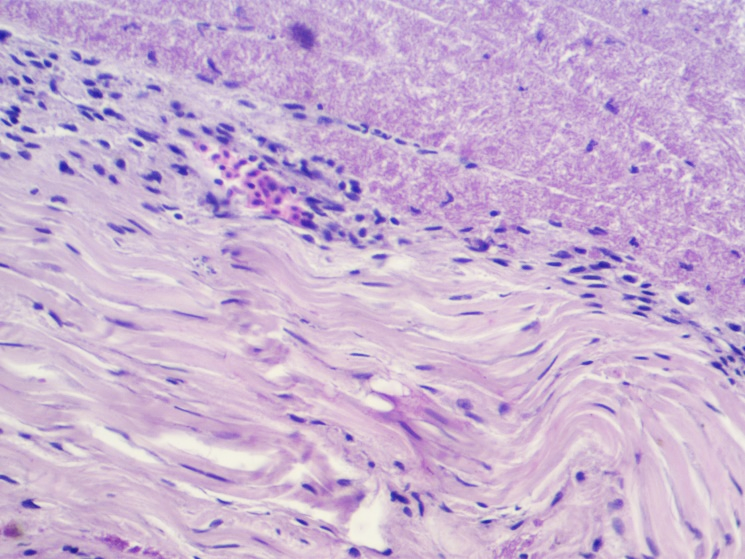
Б
А
Рисунок 13 – Гистосрез проб мясного продукта из говядины с мясом кур (20%). Пунктиром указан участок подсортовки куриным мясом. Окраска гематоксилин-эозин. А- объектив х4, окуляр х10, Б — объектив х40, окуляр х10.
Как видно на рисунке 13, мышечные волокна кур отличаются более светлым окрасом, длинными пучками мышечных волокон и слаборазвитым эндомизием. Скелетная мускулатура крупного рогатого скота характеризуется формированием крупных пучков и периферическим расположением ядер миосимпластов.
Нами были проведены также исследования мясного фарша. При микроструктурном исследовании в говяжьем и курином фарше на срезе наблюдается различная ориентация элементов мышечных волокон (поперечная и продольная), что обусловлено процессом измельчения сырья.
Анализ результатов световой микроскопии фарша из говядины и мяса кур показал, что они состоят преимущественно из фрагментов мышечной ткани, включающих в себя мышечные волокна, мышечные пучки первого и второго порядков, а также объединяющие их в единое целое элементы соединительнотканной стромы.
Встречаются случаи замены основных мясных компонентов полуфабрикатов на субпродукты, мясо птиц и другие.
Так, например, в исследуемом говяжьем фарше обнаруживались дополнительные элементы, не заявленные в составе: мясо птицы, железистые внутренние органы, концевые отделы которых отчетливо визуализируются в препаратах (рисунок 14).
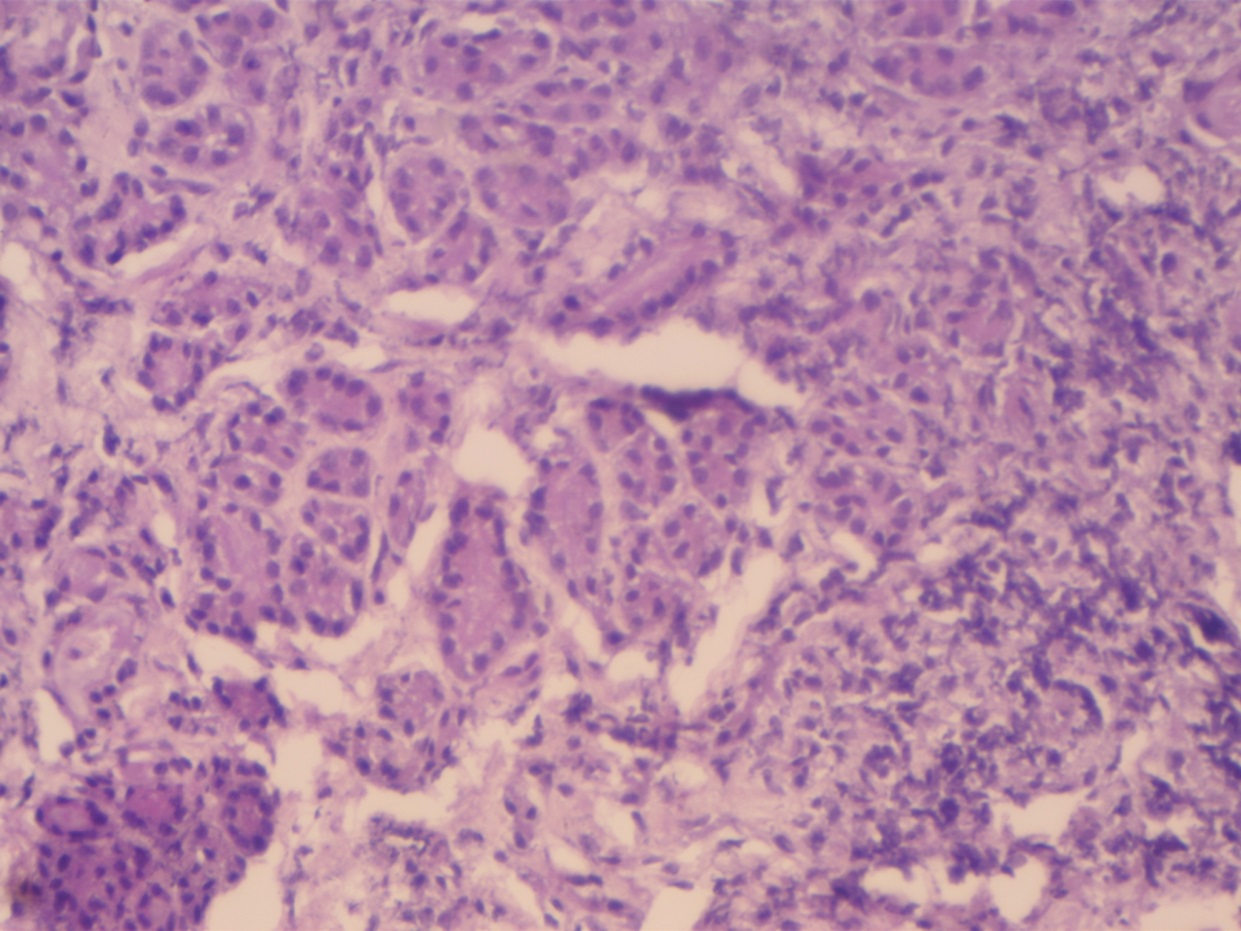
Рисунок 14 – Гистосрез компонентов говяжьего фарша с концевыми отделами желез. Окраска гематоксилин-эозин. Объектив х4, окуляр х10
В курином фарше в значительной мере в качестве дополнительных компонентов выявляются субпродукты (печень), элементы хрящевой ткани, которые также не были заявлены в составе. Полуфабрикат содержит в небольшом количестве измельченные фрагменты жировой ткани, выявляемые в виде отдельных липоцитов и их групп небольшого размера (рисунок 15). Общая архитектоника жировой ткани сохранена, ее микроструктура характеризуется умеренными признаками деструкции в результате технологической обработки.
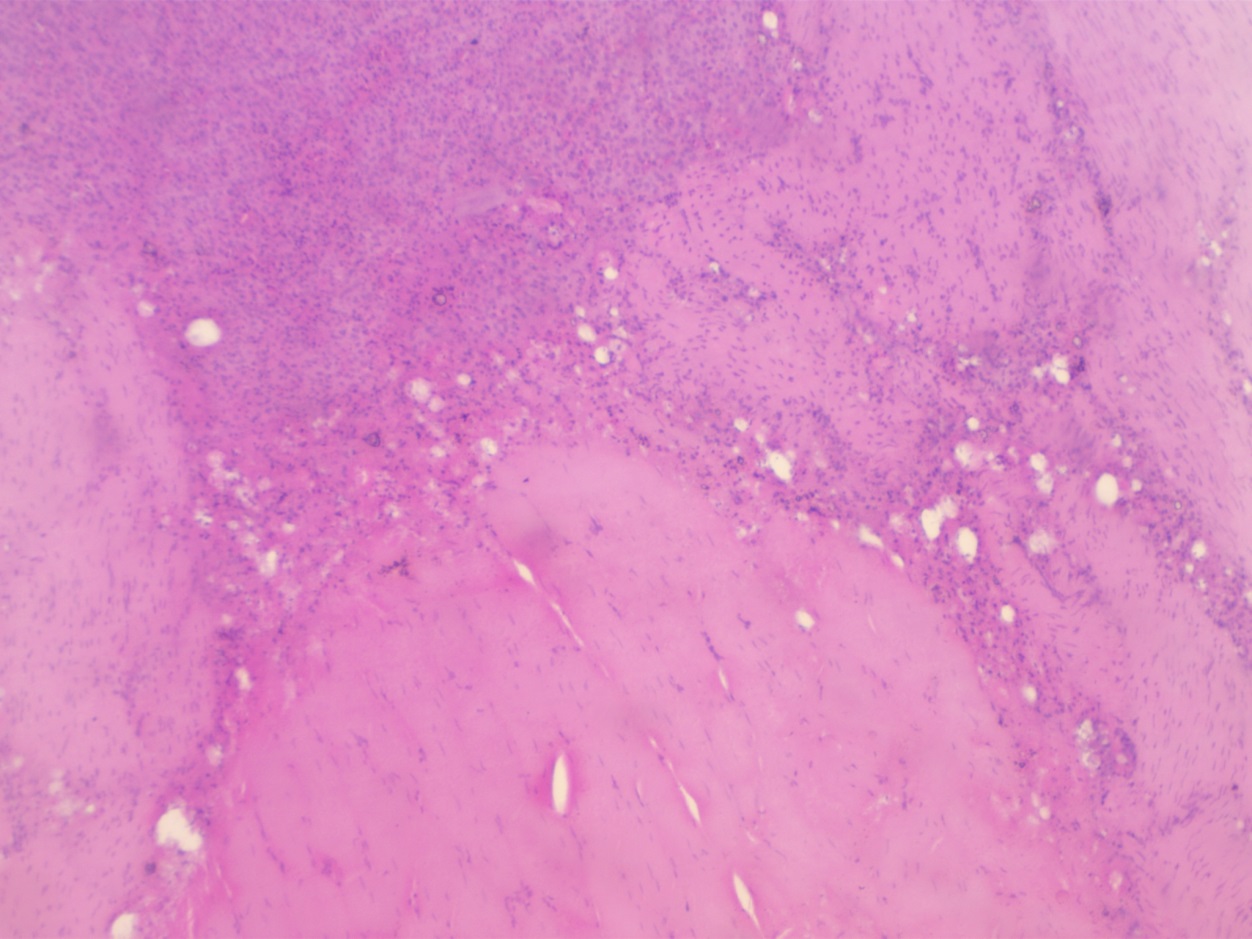
Б
А
Рисунок 15 – Гистосрез компонентов куриного фарша: волокна поперечнополосатой мышечной ткани (А), участок тканей печени (Б). Окраска гематоксилин-эозин. Объектив х4, окуляр х10
В то же время процесс механической обработки мяса привел к уменьшению его пористости по сравнению с исходным состоянием мясного сырья. На фоне типичной линейной формы мышечных волокон можно обнаружить и преобладающие волнистые структуры, деформированные в ходе технологического воздействия при изготовлении фарша. Часть мышечных волокон при этом фрагментируется на отрезки различной длины (рисунок 16).
![]()
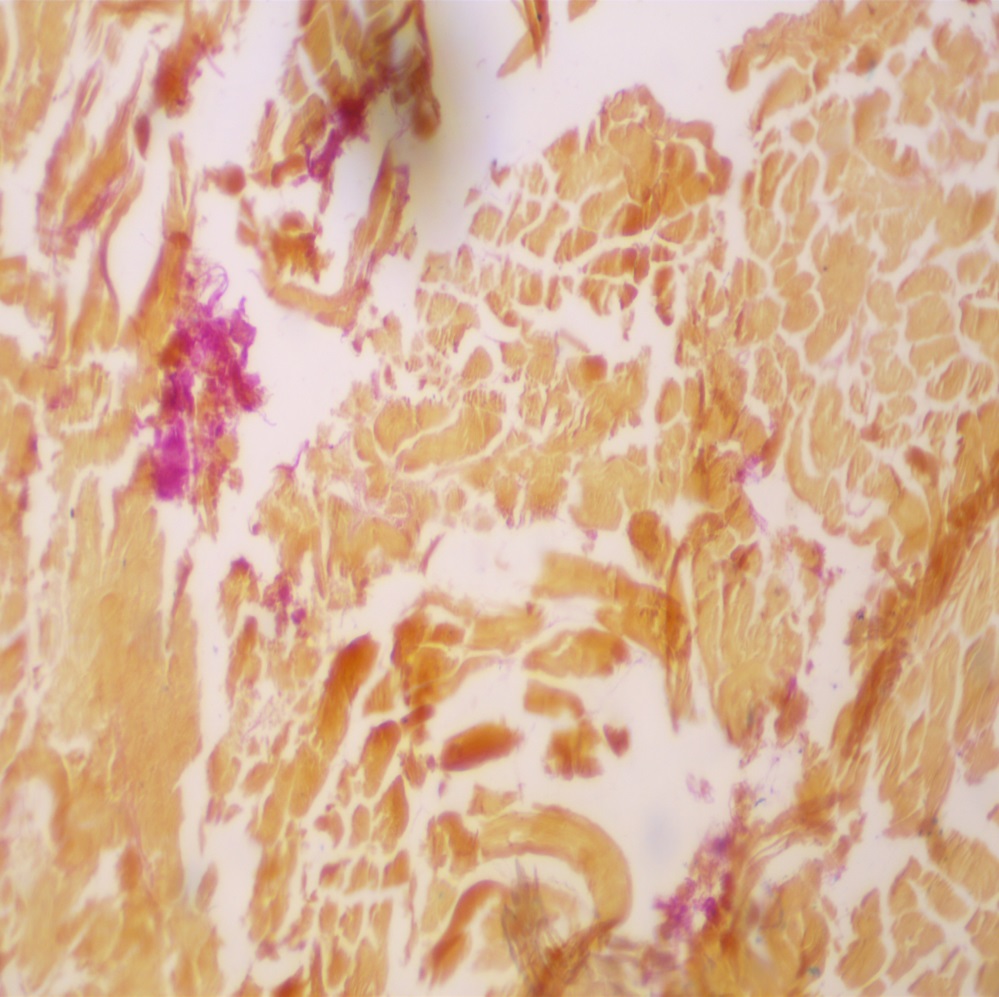
Рисунок 16 – Гистосрез компонентов говяжьего фарша: деформация мышечных волокон. Окраска Перльс Ван-Гизон.
Объектив х10, окуляр х10
Более высокое увеличение (х 40) структуры образцов показало, что компоновка отдельных волокон в первичном пучке умеренно рыхлая с узким светлым пространством в области эндомизия. Хорошо различима граница между отдельными мышечными волокнами, представленная эндомизием и двумя сарколеммами соседних мышечных волокон. Ядра клеток вытянуто-овальные с достаточно четко выделяющимся хроматином.
При гистологическом исследовании полукопченых колбасных изделий в основном выявляются фрагменты мышечной ткани мелкого и среднего размеров с выраженной деструкцией, поскольку в процессе технологической обработки колбас происходят механические воздействия на элементы мышечной ткани. Поперечнополосатая исчерченность в некоторых фрагментах частично сохранена (рисунок 17).
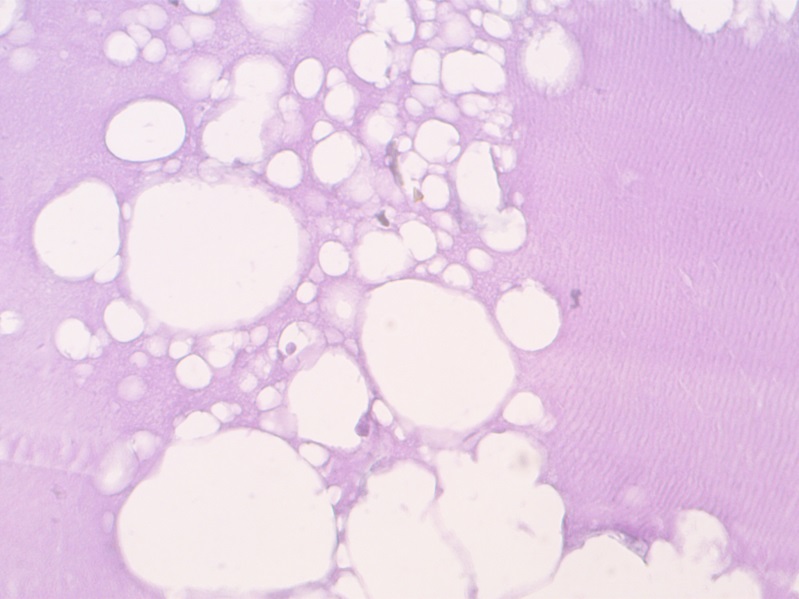
Рисунок 17 – Гистосрез полукопченой колбасы: жировая ткань, элементы гомогенизированных мышечных волокон с сохраняющейся поперченой исчерченностью. Окраска гематоксилин-эозин. Объектив х10, окуляр х10
Жировая ткань преобладает над поперечнополосатой мускулатурой (рисунок 18).
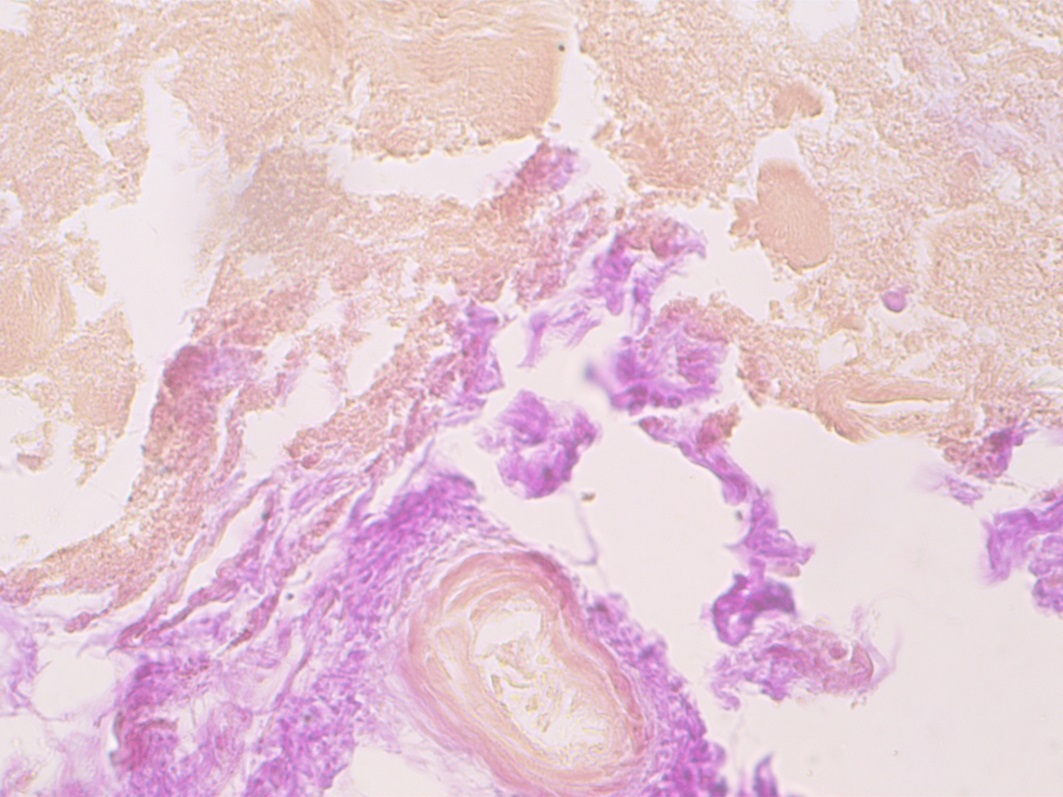
Рисунок 18 – Гистосрез полукопченой колбасы: элементы гомогенизированных мышечных волокон, коллагеновые, эластические волокна. Окраска Перльс Ван-Гизон. Объектив х10, окуляр х10
Встречаются коллагеновые и эластические волокна. Наблюдается набухание мышечных волокон, их фрагментация и частично гомогенизация при распаде ядерных структур и сократительных фибриллярных белковых комплексов.
Таким образом, при гистологическом исследовании скелетной мускулатуры трех видов животных отмечены значительные отличия в микроструктуре скелетной ткани. Мышечную ткань курицы можно идентифицировать по таким признакам, как овальная форма волокон на поперечном срезе, расположение ядер миоцитов как под сарколеммой, так и в центре, плотное расположение первичных пучков мышечных волокон, отсутствие липоцитов в эндомизии.
Скелетные мышцы крупного рогатого скота имеют наибольший средний диаметр мышечного волокна. В первичном пучке волокна плотно прилегают друг к другу. Тонкий эндомизий содержит незначительное количество жировой ткани. Ядра миоцитов располагаются под сарколеммой вдоль мышечного волокна.
Для мышечной ткани свиней более характерна полигонально-округлая форма волокон, тонкий эндомизий, большое количество жировой ткани во всех соединительнотканных прослойках. Ядра миоцитов располагаются под сарколеммой вдоль мышечного волокна. Мышечные волокна прилегают не плотно друг к другу.
ЗАКЛЮЧЕНИЕ
В настоящее время нет универсальной методики, позволяющей однозначно интерпретировать результаты определения качественного и количественного состава мышечной ткани в готовых мясных продуктах и применение незаявленных компонентов, используемых в мясном производстве. На фоне усложняющейся рецептуры, существующие стандартизированные методики не способны полностью разложить состав пищевого продукта на его компоненты. В связи с этим необходимо использовать комплекс диагностических исследований.
Метод полимеразной цепной реакции (ПЦР) – высокоточный метод молекулярно-генетической диагностики позволяет проводить исследование многокомпонентных смесей и продуктов, прошедших термическую обработку. Но положительные результаты, полученные в результате применения такого качественного метода, не являются неоспоримым доказательством фальсификации, а лишь являются предпосылкой для проведения комплексного исследования продукции.
Морфометрические методы исследования позволяют при достаточном объеме исследований установить закономерность. Диаметр мышечных волокон мяса птиц колеблется от 20 до 40 мкм при толщине эндомизия 4,7±0,02 мкм, у крупного рогатого скота – от 60 до 100 мкм при достоверной (р<0,001) толщине межволокнистой соединительнотканной прослойки 19,1±0,01 мкм, а у свиней соответственно 54,6±0,2 мкм и 15,3±0,07мкм.
Мышечную ткань курицы, как наиболее доступного мясного компонента, который чаще всего используется для фальсификации мясных продуктов, можно идентифицировать по таким признакам, как овальная форма волокон на поперечном срезе, расположение ядер миоцитов как под сарколеммой, так и в центре, плотное расположение первичных пучков мышечных волокон, отсутствием липоцитов в эндомизии. Однако, необходимо указать, что проведенные нами исследование показали, что обнаружить данную фальсификацию возможно при содержании 20 и более процентов незаявленного мяса.
Применение окраски по Перльс Ван-Гизону позволяет увеличить контрастность препарата и установить соотношение мышечной и соединительной ткани, как одного из критериев дифференцировки вида мяса (по степени развитости эндомизия и перимизия)
Таким образом, выявленные отличия в структуре мышечной ткани позволяют использовать гистологический метод для видовой идентификации мясного сырья и выявлять фальсифицированную мясную продукцию.
Разработанные нами методические рекомендации можно применять при ветеринарно-санитарной экспертизе мясных продуктов с целью выявления незаявленных компонентов.
Данная тема актуальна как в научном, так и практическом плане и требует дальнейшего детального глубокого изучения.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1. Mkrtchyan M., Safronov D., Tokarev A., Makavchik S., Orlova D. Determination the quality of meat, manufactured meat, and meat products via the histological method// International Transaction Journal of Engineering, Management and Applied Sciences and Technologies. – 2020. – Vol. 11. No 15. P. 11A15J.
2. Технический регламент Таможенного союза «О безопасности мяса и мясной продукции» (ТР ТС 034/2013). — URL: http://docs.cntd.ru/document/499050564. (дата обращения: 31.01.2021).
3. Доктрина продовольственной безопасности Российской Федерации, утв. Указом Президента Российской Федерации от 30.01.2010 г. № 120. — URL: http://docs.cntd.ru/document/902195504. (дата обращения: 31.01.2021).
4. Хвыля, С.И., Пчелкина В.А, Бурлакова С.С. Применение гистологического анализа при исследовании мясного сырья и готовых продуктов // Техника и технология пищевых производств – №3. – 2012. – С. 1-
5. Малышева Е.С., Овчаренко Н.Д., Мезенцев С.В. Оценка видовой принадлежности мышечной ткани на основе микроструктурного анализа // Вестник Алтайского государственного аграрного университета. – № 4 (126). – 2015. – С. 84-887
6. Taylor, A. et al. Extraction and ESI-CID-Ms/Ms analysis of myoglobins fran different meat species/ Taylor A. et al. // Food Sci. &Techn. Tod. -2000. — v. 69. — № 1. — p. 8186.
7. Helle, N. et al. Methods of allocation DNA from chicken./ Helle N. et al. // Arch. Fur Lebensmittelhygiene, 1996. — v. 3. — № 2. — p. 48-51.
8. Черняева, М.Н. Анализ видовой принадлежности мяса и мясопродуктов /Черняева М.Н. //Ветеринария. — 2001. — № 6. — с. 47-50.
9. Parson W., Pegoraro K., Niederstatter H., Foger M. and Steinlechner M. Species identification by means of the cytochrome b gene // International Journal of Legal Medicine. — 2004. – V. 114. — No 1-2. –P. 23-28.
10. Lipp M, Shillito R, Giroux R, Spiegelhalter F, Charlton S, Pinero D, Song P. Polymerase chain reaction technology as analytical tool in agricultural biotechnology // JAOAC Int. 2005, Jan-Feb. — 88(1):136-55.
11. Бондаренко, Н.Н. Определение видовой принадлежности мяса с помощью метода ДНК-диагностики / Н.Н. Бондаренко, Н.В. Меренкова, А.В. Пахомов, Г.И. Огурева // Ветеринарная патология. – № 3. – 2018. – С. 28-34/
12. Технический регламент Таможенного союза. Пищевая продукция в части ее маркировки. ТР ТС 022/2011. — URL: https://sudact.ru/law/reshenie-komissii-tamozhennogo-soiuza-ot-09122011-n_3/tr-ts-0222011/
13. Хвыля С.И., Пчелкина В.А. Стандартизованные гистологические методы исследования мяса и мясных продуктов // Мясная индустрия. — 2013. — № 7. — С. 28-31.
14. Малышева, Е.С. Влияние возраста на технологические и микроструктурные характеристики говядины на примере крупного рогатого скота черно-пестрой породы / Е.С. Малышева// Вестник Алтайского государственного аграрного университета. – № 7 (105). – 2013. – С. 97-100
15. Orlova D.A., Kalyuzhnaya T.V., Tokarev A.N., Smirnov A.V., Smolkina A.S., Morphological features of the meat of various species of animals in assessing the thermal state. Indo American Journal of Pharmaceutical Sciences. — 2019. — Vol. 6. No 6, P. 11756-11760.
16. Kalyuzhnaya T., Orlova D., Tokarev A., Kuznetsov Yu., Development of an algorithm for identifying the thermal state of meat and fish raw materials.// International Journal of Recent Technology and Engineering. — 2019. — V. 8. No 4. P. 7952-7954.
17. Токарев А.Н., Лашкова В.А., Орлова Д.А., Калюжная Т.В. Сравнение микрокартины мышечных волокон охлажденного и замороженного мяса птицы // Международный вестник ветеринарии. — 2019. — № 4. — С. 101-105.
18. Tokarev A., Lashkova V., Orlova D.A., Kalyuzhnaya T., Drozd A. A new express method for determination of the thermal state of poultry meat.// International Transaction Journal of Engineering, Management and Applied Sciences and Technologies. — 2019. — V. 10. No 14. P. 188.
19. Kalyuzhnaya T., Karpenko L., Orlova D., Drozd A., Urban V. An express assessment method for meat quality and safety// International Transaction Journal of Engineering, Management and Applied Sciences and Technologies. — 2020. — V. 11. No 1. P. 11A01H.
20. Мкртчян М.Э., Сафронов Д.И. Гистологический метод для оценки качества мясных изделий // Современные проблемы пищевой безопасности: материалы международной научной конференции. – СПб, 2020. – С. 122-125.
21. ГОСТ 31778-2012 «Мясо. Разделка свинины на отрубы. Технические условия» — М.: «Стандартинформ», 2014 — 16 стр.
22. ГОСТ 31797-2012 «Мясо. Разделка говядины на отрубы» М.: «Стандартинформ», 2019 — 12 стр.
23. ГОСТ 13962-2013 «Мясо кур (тушки кур, цыплят-бройлеров и их части). Технические условия» — М.: «Стандартинформ», 2016 — 10 стр
24. ГОСТ 19496-2013 «Мясо и мясные продукты. Метод гистологического исследования» — М.: «Стандартинформ», 2014 — 12 стр.
25. Патент RU 2714044 C1, 11.02.2020.
