Титульный лист и исполнители
РЕФЕРАТ
Отчет 146 с., 2 ч., 9 табл., 32 рис., 165 источн., 5 прил.
НОДУЛЯРНЫЙ ДЕРМАТИТ, ТРАНСФЕР-ФАКТОР, КРУПНЫЙ РОГАТЫЙ СКОТ, АБОРТЫ, ЭМБРИОНАЛЬНАЯ СМЕРТНОСТЬ, ИММУНИТЕТ
Объект исследования:трансфер-фактор, специфичный к нодулярному дерматиту крупного рогатого скота.
Целью работы: изучение влияния препарата трансфер-фактора на формирование иммунитета против нодулярного дерматита.
Для определения эффективности использования трансфер-фактора при профилактике и лечении нодулярного дерматита у крупного рогатого скота молочного и мясного направления продуктивности были использованы биохимические, иммунологические и ультразвуковые методы исследования.
В ходе исследований был получен специфический к нодулярному дерматиту трансфер-фактор, безопасный для крупного рогатого скота.
Полученный препарат обладает иммуностимулирующим и иммуномодулирующим эффектами, увеличивая титр антител после вакцинации и количество серопозитивных животных (у молочных пород), также стимулируя клеточное звено иммунитета у животных молочных и мясных пород. Применение трансфер-фактора при вакцинации животных позволило сократить случаи абортов и эмбриональной смертности у животных молочной породы на 14%, у мясной на 11%.
При лечении животных с помощью препарата скорость выздоровления сократилась на 2 дня, использование трансфер-фактора позволяет профилактировать гибель животных.
Экономическая эффективность при вакцинации животных против нодулярного дерматита на 1 рубль затрат у животных молочной породы составила 188,52 рублей, у животных мясной породы 208,73 рублей.
Результаты работы внедрены на сельскохозяйственных предприятиях и используются при вакцинации животных против нодулярного дерматита.
Перечень сокращений и обозначений
В настоящем отчете о НИР применяют следующие сокращения и обозначения:
TF – трансфер-фактор
TNF – фактор некроза опухолей
IL– интерлейкин
DLE – диализат экстракта лейкоцитов
ТФ – трансфер-фактор
ЗУД – заразный узелковый дерматит
КРС – крупный рогатый скот
ИФА – иммуноферментный анализ
ПЦР – полимеразная цепная реакция
В связи с приграничным расположением Челябинской области с Республикой Казахстан, наличием международных пунктов пропуска с республиками средней Азии, перевозкой грузов и живых животных из ранее зафиксированных очагов на Северном Кавказе, Ставропольском крае существует угроза массовой эпизоотии нодулярного дерматита крупного рогатого скота среди восприимчивого поголовья в Челябинской области.
Для профилактики данного заболевания биологическая промышленность предлагает ряд вакцин: Люмпивакс (производство Кения и ЮАР), вакцина против оспы овец и коз. Использование вакцин дает только 60-70% защищенности поголовья.
Применение препаратов стимулирует не только образование иммунитета, но и многочисленные осложнения у животных в виде сыпей и язв на кожном покрове, абортов, эмбриональной смертности. Особенно это ярко проявляется при вакцинации животных со скрытым течением болезни.
Применение вакцин не останавливает эпизоотический процесс в виду хронического течения заболевания и возможности переноса возбудителя дикими животными, кровососущими насекомыми, автомобильным транспортом.
С целью разработки эффективных методов лечения и профилактики необходимо провести исследование по изучению влияния препарата Трансфер-фактора на формирование иммунитета против нодулярного дерматита.
В задачи исследования входило:
1.Изучить эффективность использования трансфер-фактора при вакцинопрофилактике нодулярного дерматита крупного рогатого скота.
2. Изучить эффективность использования трансфер-фактора при лечении животных, больных нодулярным дерматитом.
3. Изучить эффективность использования трансфер-фактора при профилактике осложнений нодулярного дерматита в виде абортов и эмбриональной смертности.
Используя ранее установленные и подтвержденные клинически эффективные дозы трансфер-фактора (Пат. 2705571 Рос. Федерация МПК A61K 35/14 (2015.01)A61P 37/02 (2006.01) Способ профилактики и лечения нодулярного дерматита у крупного рогатого скота. / С.Р. Слободянский, П.Н. Щербаков, Т.Б. Щербакова, П.В. Бурков, Р.С. Карипов ФГБОУ ВО «Южно-Уральский государственный аграрный университет». — № 2019104319; заявл. 15.02.2019 ![]() ; опубл. 08.11.2019, Бюл. № 31. – 6 с.) будет изучена эффективность специфического трансфер-фактора при лечении и профилактике нодулярного дерматита крупного рогатого скота в условиях предприятий молочного и мясного направления продуктивности, на которые возможен занос возбудителя инфекции.
; опубл. 08.11.2019, Бюл. № 31. – 6 с.) будет изучена эффективность специфического трансфер-фактора при лечении и профилактике нодулярного дерматита крупного рогатого скота в условиях предприятий молочного и мясного направления продуктивности, на которые возможен занос возбудителя инфекции.
Объект исследования:трансфер-фактор, специфичный к нодулярному дерматиту крупного рогатого скота.
1. Обзор литературы
1.1. Нодулярный дерматит крупного рогатого скота
Поданным Sprygin A, Pestova Y. et al. (2019) нодулярный дерматит это вирусное трансграничное заболевание, эндемичное по всей Африке и имеющее большое экономическое значение, которое поражает крупный рогатый скот и домашних водяных буйволов. С 2012 года болезнь быстро и широко распространилась по регионам Ближнего Востока и Балкан (MercierA., ArsevskaE. etal., 2018; TuppurainenE.S., OuraC.A., 2012; TasioudiK.E., AntoniouS.E., etal., 2016; CasalJ., AllepuzA.etal., 2018; Hunter P., Wallace D., 2001; Saegerman C., Bertagnoli S., etal., 2019;Ochwo S., VanderWaal K., etal., 2019; Sameea Yousefi P., Mardani K., etal., 2016; Al-Salihi K.A., Hassan I.Q., 2015; MachadoG., KorennoyF., etal., 2019; Tuppurainen E.S.M., Antoniou S.E., etal., 2018; Kasem S., Saleh M., etal., 2016), на Южном Кавказе и в некоторых частях Российской Федерации. Заболевание способно появиться в течение нескольких сотен километров от мест первоначальной (очаговой) вспышки в короткие сроки. Распространение LSDV на большие расстояния, по-видимому, происходит через перемещение инфицированных животных, но отчетливые сезонные закономерности указывают на то, что передача вируса членистоногими, скорее всего, ответственна за быстрое и агрессивное распространение болезни на короткие расстояния. На сегодняшний день наиболее вероятными переносчиками болезни являются кровососущие членистоногие, такие как стабильные мухи (Stomoxys calcitrans), комары (Aedes aegypti) и твердые клещи (виды Rhipicephalus и Amblyomma). Новые данные свидетельствуют о том, что вездесущая синантропная комнатная муха Musca domestica также может играть роль в передаче заболевания.
Aleksandr K., Olga B., etal. (2020) впервые приводят доказательства косвенной передачи в контактном режиме для встречающегося в природе рекомбинантного ЗУД, выделенного в полевых условиях. В помещении, защищенном от насекомых, они получили убедительные доказательства того, что новый штамм ЗУД может передаваться контактировавшим с ним животным.
Первые уведомления о неизвестном заболевании крупного рогатого скота появились в сентябре-октябре 2015 года в Северо-Кавказском регионе России (Республика Северная Осетия-Алания). Клинические признаки включали водянистые выделения из глаз, апатию, анорексию, обильную саливацию, хромоту и узелковые поражения кожи. Геном каприпоксвируса был обнаружен методом ПЦР в реальном времени в образцах тканей больных животных. Этиологический агент был выделен в первичных культурах клеток семенников ягненка и семенников коз, а также в непрерывной культуре клеток MDBK. Дальнейшее секвенирование гена GPCR и филогенетический анализ показали тесную генетическую связь изолированного каприпоксвируса с группой вируса нодулярного дерматита (Salnikov N., Usadov T., etal., 2018).
Изолят вируса ЗУД SERBIA / Bujanovac / 2016 состоит из 150 661 нуклеотида и на 99,95% идентичен штамму Neethling Warmbaths LW, выделенному в Южной Африке в 1999 году. Это первый полный геном ЗУД, определенный в Сербии, а также на Балканах (Toplak I., Petrović T., etal., 2017).
Данные по поражению ЗУД в период с июля 2012 года по сентябрь 2018 года на Балканах, Кавказе и Ближнем Востоке были получены из Глобальной информационной системы по болезням животных (EMPRES-i) ФАО из Системы уведомления о болезнях животных Европейской комиссии (ADNS).и дополнен данными официальных ветеринарных служб некоторых стран. За этот период пострадали 7 593 населенных пункта из 22 стран. За этот период более 46 000 голов крупного рогатого скота были клинически поражены ЛСД, 3700 животных погибли и 17 500 были забиты из-за политики выбраковки, чтобы остановить распространение болезни. Большинство вспышек произошло в 2016 г., с мая по ноябрь. Пострадавший регион был разделен на сетку ячеек 10 × 10 км, и мы применили модель пространственной регрессии для анализа связи между зарегистрированными вспышками ЗСД и климатическими переменными, растительным покровом и плотностью скота. Результаты показали большие различия в шансах быть ЗУД-положительными из-за типа земного покрова: вероятность того, что ячейка будет ЗУД-положительной, увеличивалась в районах, в основном покрытых пахотными землями, лугами или кустарниками. Шансы были также увеличены для более высокой плотности скота, а также для территорий с более высокой средней годовой температурой и более высоким дневным диапазоном температур (Allepuz A., Casal J., Beltrán-Alcrudo D., 2019).
Пространственно-временной анализ показал, что спорадические вспышки ЗУД имеют тенденцию происходить как внутри, так и за пределами эндемичных районов (Ochwo S., VanderWaal K., etal., 2018).
На территории Российской Федерации вирус нодулярного дерматита впервые появился в 2015 году. Наибольшая частота вспышек наблюдалась в республиках Чечня (108), Калмыкия (57) и Ингушетия (35). Образцы, взятые у инфицированного крупного рогатого скота, были подвергнуты ПЦР-анализу, который выявил геном вируса наиболее часто в узелках кожи (78%), мазках из носа (23,4%), крови (13%) и сыворотках (14,5%) (SpryginA., ArtyuchovaE. etal., 2018).
На основе данных EuropeanFoodSafetyAuthority (2018, 2019), собранных в пострадавших и подверженных риску странах Юго-Восточной Европы в 2016 и 2017 годах, количество зарегистрированных вспышек снизилось с 7 483 в 2016 году до 385 в 2017 году. Случаи заболевания зарегистрированы в основном в Албании в районах, где вакцинация не была завершена. Только две и четыре вспышки были зарегистрированы в Греции и в бывшей югославской Республике Македонии в 2017 году, соответственно, где коллективный иммунитет, достигнутый с помощью вакцинации, значительно снизил дальнейшее распространение болезни. Для устранения ЗУД необходимы 4- и 3-летние кампании вакцинации (EuropeanFoodSafetyAuthority, 2018).
Molini U., Aikukutu G. et al. (2018) указывают, что секвенированные изоляты LSDV из Намибии были идентичны изолятам LSDV, идентифицированным ранее в Буркина-Фасо, Египте, Греции, Нигере, Сербии и Южной Африке.
Для борьбы с LSDV коммерчески доступны только живые аттенуированные вакцины, но в настоящее время они не разрешены в Европейском Союзе. Более того, эти штаммы вакцинного вируса могут вызывать серьезные побочные эффекты с клиническими признаками, сходными с инфекциями, вызванными вирулентным вирусом (MöllerJ., MoritzT. etal., 2019).
Узелки на коже и неподвижные повреждения являются значительными клиническими признаками, наблюдаемыми у всех КРС с подозрением на нодулярный дерматит (ZeedanG.S.G., MahmoudA.H.etal., 2019).
При вспышке ЗУД в Омане в 2009 году у крупного рогатого скота голштино-фризской породы клинические признаки были гораздо более серьезными, чем у местных пород, и характеризовались множественными кожными узелками, покрывающими шею, спину, промежность, хвост, конечности и половые органы. У пораженных животных также наблюдалась хромота, истощение и прекращение молочной продуктивности. Отек конечностей и грудины, а также увеличение поверхностных лимфатических узлов были очень заметными (Tageldin M.H., Wallace D.B. etal., 2014).
При анализе вирусов – возбудителей ЗУД SameeaYousefiP., Dalir-NaghadehB.etal. (2018) указывают, что идентифицированные LSDV были тесно связаны друг с другом и имели высокую гомологию с другими изолятами LSDV из Африки.
Hansen S., Pessôa R., Nascimento A. et al. (2019) при анализе вторичных инфекций, сопровождающих ЗУД установили, что ими являются 98 видов, большинство из которых принадлежат к типу Proteobacteria, за которыми следуют Firmicutes, Actinobacteria и Bacteroidetes.
ЗУД был впервые зарегистрирован в Индии с 7,1% заболеваемости крупного рогатого скота. Обычно клиническими проявлениями болезни являются лихорадка, анорексия и характерные узелки на коже, слизистой оболочке рта, ноздрей, вымени, половых органов, прямой кишки, снижение выработки молока, аборты, бесплодие и иногда смерть (GuptaT., PatialV. etal., 2020).
Системные эффекты включают гипертермию, анорексию, дисгалактию и пневмонию; Поражения часто обнаруживаются во рту и верхних дыхательных путях. Тяжесть болезни значительно варьируется между породами и линиями крупного рогатого скота. Многие животные в течение нескольких месяцев страдают от сильного истощения и потери продуктивности. Поражения кожи приводят к необратимому повреждению шкур (Davies F.G., 1991).
Как правило, поголовье крупного рогатого скота с большим количеством взрослых животных, живущее во влажных районах, подвергается наибольшему риску заражения ЗУД (MollaW., FrankenaK., etal., 2018).
Современные вакцины для защиты крупного рогатого скота отЗУД на основе живых аттенуированных штаммов полевых изолятов, пассированных культурой клеток, что приводит к случайным мутациям. Хотя эти вакцины обычно эффективны, они могут иметь недостатки, в том числе реакции в месте инъекции и / или ограниченную иммуногенность (KaraP.D., MatherA.S., etal., 2018).
Gubbins S., Stegeman A., et al. (2020), Sohier C., Haegeman A. et al. (2019) показывают, что в большинстве случаев передача происходит на короткие расстояния (<5 км), но с заметной вероятностью передачи на большие расстояния, существуют доказательства сезонных колебаний силы инфекции, связанной с температурой, возможно, из-за ее влияния на относительную численность стабильной мухи Stomoxys calcitrans.
Saegerman C., Bertagnoli S. et al. (2020) установили, что дезинсекция грузовиков, перевозящих живых животных, была важна для снижения риска распространения ЗУД.
По данным EuropeanFoodSafetyAuthority (2017) большая часть распространения ЗУД происходит на относительно небольшом расстоянии, примерно от 10 до 20 км, а скорость распространения, по оценкам, в основном достигает 2 км / день, что согласуется с векторной картиной распространения ЗУД. Близость к затронутым фермам, высокие температуры и связанное с этим изобилие переносчиков были одними из основных факторов риска распространения ЗУД. Через несколько месяцев по крайней мере, 90% популяции животных были вакцинированы живой гомологичной вакциной против ЗУД в Юго-Восточной Европе. Там, где был достигнут почти полный охват вакцинацией, о новых вспышках не сообщалось.
Параметр скорости передачи ЗУД между животными составлял 0,072 в день в системе растениеводства и животноводства, тогда как скорость передачи в интенсивной производственной системе составляла 0,076 в день (MollaW., FrankenaK., 2017).
Исследованиями ErsterO., RubinsteinM.G., etal. (2019) установлено, что ген LSDV126 играет важную роль в способности вирусов каприпокса инфицировать крупный рогатый скот.
По данным Şevik M., Avci O. etal. (2016) нуклеиновая кислота ЗУД была обнаружена во всех образцах, полученных от клинически инфицированного крупного рогатого скота. Результаты биохимического анализа сыворотки крови показали, что концентрации аспартатаминотрансферазы, щелочной фосфатазы, общего белка и креатинина в сыворотке крови инфицированных животных заметно повышались. Однако по другим оцениваемым биохимическим параметрам значимых различий не было. Результаты настоящего исследования предполагают, что во время инфекции ЗУД возникают нарушения функции печени и почек. Эти данные могут помочь в разработке эффективных стратегий лечения инфекции ЗУД.
При гематологической оценке среднее количество лейкоцитов, лимфоцитов, эозинофилов, эритроцитов и тромбоцитов, а также средний уровень гемоглобина у инфицированных животных были значительно ниже, чем в контрольной группе. Биохимические эксперименты показали, что сывороточная глюкоза, общий и прямой билирубин, аспартатаминотрансфераза, активность креатинфосфокиназы в инфицированной группе была значительно повышена. ЗУД также вызвал значительное снижение уровней сывороточного креатинина, альбумина и железа. В целом, ЗУД был связан с общим снижением количества различных типов клеток крови и значительными изменениями биохимического профиля сыворотки. Эти изменения могут быть связаны с воспалительными процессами и повреждениями различных органов, особенно печени (Jalali S.M., Rasooli A. etal., 2017).
Neamat-AllahA.N. (2015) при клиническом обследовании животных во время вспышки ЗУД обнаружил тельца интрацитоплазматических включений при гистопатологическом исследовании. Иммунологические исследования выявили значительное снижение скорости трансформации лимфоцитов,% фагоцитов и% гибели, которое было отмечено в течение 2 недель после инфицирования. ЗУД привел к незначительной гемограмме через 1 (й) -2 (й) день после заражения, в то время как макроцитарная гипохромная анемия в течение 10-14 (й) дней после заражения. Лейкопения и лимфопения регистрировались на 1 (й) -2 (й) день после заражения, а на 10-14 (й) день — гранулоцитарный лейкоцитоз. Биохимический анализ выявил гипопротеинемию, гипоальбуминемию, и гиперглобулинемия, особенно гамма-глобулины. Наблюдалось значительное повышение сывороточной активности аланинаминотрансферазы, активности аспартатаминотрансферазы, уровня креатинина, азота мочевины в крови и креатинфосфокиназы.
Abutarbush S.M. (2015) отмечает, что у инфицированных животных лейкоцитопения обнаружена у 8,7%, лейкоцитоз — у 18,2% пораженного КРС. Снижение гематокрита наблюдалось у 18,3%. У наиболее пораженного крупного рогатого скота был снижен средний корпускулярный объем (43,7%), средний корпускулярный гемоглобин (14,3%) и средняя концентрация корпускулярного гемоглобина (11,5%). У всего крупного рогатого скота с аномальным количеством тромбоцитов была тромбоцитопения. Гиперфибриногенемия, гиперпротеинемия и гиперальбуминемия были обнаружены у 69%, 59,6% и 37,2% пораженного скота соответственно. Снижение концентрации креатинина отмечалось у 65,8%. Гиперкалиемия и гиперхлоремия выявлены у 9,6% и 10,4% пораженного КРС соответственно.
По данным AbdallahF.M., ElDamatyH.M., KotbG.F. (2018) характерные кожные узелки, покрывающие всю неповрежденную кожу, а также лимфаденопатия были значимыми клиническими признаками во всех подозреваемых случаях ЗУД. Выделение вируса нодулярного дерматита в куриных эмбрионах выявило характерные очаговые белые ямки, рассредоточенные по хориоаллантоисным мембранам. Гистопатологическое исследование показало характерные эозинофильные интрацитоплазматические включения внутри воспалительной клеточной инфильтрации.Филогенетический анализ показал, что изоляты вируса были сгруппированы вместе с другими африканскими и европейскими штаммами вируса нодулярного дерматита.Кроме того, изоляты ЗУД имеют уникальную сигнатуру ЗУД (A11, T12, T34, S99 и P199).
Исследованиями Bedeković T., Šimić I., Krešić N., Lojkić I. (2018) установлено присутствие вирусных частиц вакцины в молоке, узелках на коже, крови и мазках из носа в семи из восьми стад. Присутствие вирусного генома было обнаружено у пяти коров от 10 до 21 дня после вакцинации. Вирус был успешно выделен на клеточной культуре от 10 до 21 дня после вакцинации от трех животных.
Использование живых аттенуированных вирусов в качестве вакцин во время активной вспышки нодулярного дерматита создает потенциальную почву для коинфекции хозяев и появления штамма, сочетающего генетические фрагменты как родительской вакцины, так и полевых штаммов (Sprygin A., Babin Y., etal., 2018).
Изучая иммуногеные свойства вакцины против нодулярного дерматита Douglass N., Van Der Walt A.etal. (2019) установили, что вакцина против вируса ЗУД, Herbivac LS, партия 008, отличается от штамма вакцины Neethling в локусе, кодирующем гомолог супероксиддисмутазы (SOD). Присутствие гомолога SOD, будь то полноразмерное (как в Herbivac LS) или усеченное (как в Neethling), может повлиять на иммуногенность вакцины.
При исследовании эффективности вакцины против оспы овец, также применяемой противЗУД Abutarbush S.M. (2014), Abutarbush S.M., Tuppurainen E.S.M. (2018) наблюдали снижение общей молочной продуктивности через неделю после вакцинации, а к пятой неделе эксперимента оно вернулось к уровням до вакцинации. Клинические побочные эффекты наблюдались у пяти животных, которые принадлежали только к группе, получившей в десять раз дозу вакцины. Наблюдаемые побочные эффекты включали лихорадку, снижение потребления корма и производства молока, а также поражения кожи. Узелки на коже появились между 7 и 17 днями после вакцинации и оставались в течение 11-17 дней. Системные реакции, вероятно, были связаны с более высокими дозами, и весь пораженный рогатый скот выздоровел без каких-либо осложнений. Животные, получившие самую высокую дозу (в десять раз превышающую дозу для овец), показали лучший гуморальный ответ.
Все штаммы каприпоксвируса, исследованные до сих пор, антигенно неотличимы, и выздоровление от инфекции одним штаммом обеспечивает иммунитет против всех других штаммов. Из-за этой антигенной гомологии среди всех штаммов существует возможность использования одного вакцинного штамма для защиты КРС и МРС (KitchingRP., 2003).
При обследовании и аутопсии у животных с генерализованным заболеванием Kononov A., Prutnikov P., etal. (2019) наблюдали кожные поражения; заметно увеличенные лимфатические узлы; и поражения легких, трахеи и яичек; тогда как у субклинических больных животных наблюдались только увеличенные лимфатические узлы и лихорадка. Для обоих случаев болезни тестирование мяса с помощью ПЦР и выделения вируса показало, что мясо не содержало живого вируса или вирусного генома, тогда как у крупного рогатого скота с генерализованным заболеванием мясо с крупной патологией, физически связанной под местом поражения кожи, было положительным. При субклинической инфекции только увеличенные лимфатические узлы несли инфекционный вирус, в то время как другие внутренние органы, исследованные при обоих типах проявлений болезни, были отрицательными, за исключением яичек. Результаты демонстрируют, что клинически и субклинически инфицированные животные являются резервуарами живых ЗУД в лимфатических узлах и яичках, в то время как мясо при обоих типах инфекции не переносит живой вирус, и риск передачи через этот продукт кажется очень низким. Обнаружение вируса ЗУД в тканях яичек у субклинических больных животных вызывает озабоченность из-за возможности распространения инфекции через зараженную сперму (Givens MD, 2018). Причем выделение вируса с семенной жидкостью происходит в течение длительного периода времени, даже когда очевидные клинические признаки заболевания больше не проявлялись (Irons P.C., Tuppurainen E.S., Venter E.H., 2005).
Поданным Annandale C.H., Smuts M.P. et al. (2018) трипсин снижает вирусную нагрузку и исключил вирус ЗУД из образца спермы, но сильно повлиял на её качество.
Согласно исследованиям AgianniotakiE.I., BabiukS., etal. (2018) значительное количество телят не было защищено материнскими антителами против нодулярного дерматита после возраста 3 месяца и, вероятно, даже после возраста 2 месяцев.
Alexander S., Olga B., et al. (2019) была разработана тест-система для ПЦР-анализа на основе целевой области ЗУД044, которая предлагает уникальный идентификационный локус для облегчения чувствительного и специфического обнаружения всех известных на сегодняшний день изолятов вируса. Эффективность усиления, определенная для пяти порядков величины, составила 93%, при этом стандартное отклонение оставалось в диапазоне 0,11-0,23. Оценка повторяемости анализа в три разных дня показала, что вариабельность между запусками варьировалась от 0,83 до 1,22 в пяти повторениях в трех циклах. Этот новый скрининговый анализ предлагается как быстрый, эффективный и чувствительный инструмент, который можно использовать в базовых или прикладных надзорных исследованиях независимо от генотипа. Кроме того, анализ можно использовать для рутинного лабораторного тестирования образцов животных во время программ ликвидации ЗУД.
По данным Manić M., Stojiljković M., etal. (2016) в ответ на эпизоотию ЗУД в Сербии торговля и перемещение животных были запрещены, полный убой, дезинфекция, дезинсекция и вакцинация всей популяции крупного рогатого скота с использованием гомологичной живой аттенуированной вакцины Neethling (Южная Африка). Через полтора месяца после завершения кампании вакцинации эпизоотия ЗУД была остановлена, и с тех пор не было зарегистрировано ни одного нового случая.
При изучении эффективности использования разных реакций для диагностики ЗУД Milovanović M., Dietze K., etal. (2019), HaegemanA., DeLeeuwI., etal. (2020), установили, что из всех использованных тестов коммерчески доступный ELISA оказался наиболее полезным для высокопроизводительного анализа по сравнению с ВН или ИФА.
Abutarbush S.M., Hananeh W.M. et al. (2016) сообщили о неблагоприятных клинических признаках после введения вакцины против ЗУД в Иордании. Продолжительность между введением вакцины и появлением неблагоприятных клинических признаков варьировала от 1 до 20 дней. Клинические признаки были аналогичны тем, которые наблюдались в естественных случаях нодулярного дерматита. В основном это были лихорадка, снижение потребления корма, снижение выработки молока и кожные узелки различного размера (от нескольких миллиметров до примерно 2 см в диаметре), которые можно было увидеть на любом участке тела (голова, шея, туловище, промежность), вымени и/или сосках. Первоначально узелки были приподнятыми и твердыми, а затем образовали сухие струпья, которые можно было снять с кожи. Характерный вид глубокого проникновения поражений наблюдался редко, и большинство поражений были поверхностными. У некоторых животных увеличились лимфатические узлы, а у нескольких беременных произошел аборт. Процент пораженного крупного рогатого скота варьировал от 0,3 до 25%. Лихорадка, снижение потребления корма и снижение удоя наблюдались у 83,9, 85,7 и 94,6% крупного рогатого скота на пораженных фермах, соответственно. У всех пораженных КРС наблюдались узелки кожи по всему телу, в то время как 33,9 и 7. 1% пострадавших хозяйств сообщили о узелковых поражениях на вымени и сосках соответственно. О случаях смерти от побочных реакций на вакцину не сообщалось. Продолжительность (курс) клинических признаков варьировала от 3 до 20 дней. В этом исследовании фермеры использовали два типа ЗУД-вакцин. Первая представляла собой вакцину против вируса оспы овец, полученную из изолята RM65 (Jovivac, производства Jordan Bioindustries Center (JOVAC)), а вторая — немаркированной вакцины, которая позже была идентифицирована с помощью ПЦР как штамм вируса ЗУД. Образцы крови и кожи, собранные у крупного рогатого скота, вакцинированного вакциной ЗУД, были положительными на ЗУД с использованием как общих, так и видоспецифичных праймеров ПЦР, тогда как образцы крови крупного рогатого скота, вакцинированного вакциной Jovivac, были отрицательными.
При патологоанатомическом исследовании случаев ЗУД выявляются узелковые образования в верхних отделах пищеварительной системы (9,86%), рубце (2,82%), верхние дыхательные пути (7,04%) и легкие (4,23%). Гистопатологический анализ узелковой биопсии кожи показал отек, гиперемию, акантоз, тяжелую отечную дегенерацию и гиперкератоз эпидермиса; тогда как в дерме наблюдаются инфильтрация мононуклеарных клеток, тельца включения и васкулит (GharbanH.A.J., Al-ShaeliS.J.J.etal., 2019).
Sanz-Bernardo B., Haga I.R., et al. (2020) сообщают, что при экспериментальном заражении вирусом ЗУД через 7 дней после инокуляции у 2 из 4 голов крупного рогатого скота развились мультифокальные кожные узелки, характерные для ЗУД. Некоторые поражения имели таргетоидный вид. Гистологически межклеточный и внутриклеточный отек присутствовал в эпидермисе некоторых узелков. В кератиноцитах были обнаружены единичные внутрицитоплазматические тельца включения. В дерме наблюдались более серьезные и стойкие изменения с выраженным гистиоцитарным воспалением и некротическим фибриноидным васкулитом дермальных сосудов, особенно глубокого кожного сплетения. Хронические поражения состояли из некроза на всю толщину дермы и эпидермиса. Поражения других органов тела не были основной особенностью ЗУД, что подчеркивает сильный кожный тропизм этого вируса. Иммуногистохимия и электронная микроскопия идентифицировали гистиоциты и фибробласты, инфицированные ЗУД, в кожных узелках пораженного крупного рогатого скота.
При использовании в вакцине оспенного вируса, полученного и изученного в Кении (KS1 O-180) Molla W., Frankena K.etal. (2017) установили, что она неэффективна для защиты популяций крупного рогатого скота отЗУД ни за счет прямой клинической защиты, ни за счет снижения передачи.
1.2. Состав и свойства трансфер-фактора
Фактор переноса (TF) состоит из пептидов-мессенджеров, продуцируемых активированными Т-лимфоцитами как часть клеточного иммунитета, и он действует в девственных лимфоцитах через индукторы, супрессоры и специфические антигены ТФ.TF не является иммуногенным, поскольку он не является видоспецифичным, поскольку содержит консенсусную последовательность аминокислот LLYAQDL / VEDN.TF, выделенный из лейкоцитов, может передавать иммунитет от человека другому виду. Экстракты TF являются сложными, содержащими более 200 молекул с молекулярной массой от 1 до 20 кДа. Антиген-специфические факторы переноса (STF) имеют молекулярные массы от 3,5 до 5 кДа. TF прост в приготовлении и хорошо переносится. Он не содержит антигенов HL-A против потенциальных рецепторов и может использоваться в качестве адъювантной терапии при нескольких заболеваниях (Sánchez-GonzálezD.J., Sosa-LunaC.A., Vásquez-MoctezumaI., 2011; RainerH., MoserK., 1977).
Трансфер-фактор (ТФ) термостабилен при минус 20°C, но инактивируется при 56°С в течение 30 мин (Кашкин К.П., 1984; Кетлинский С.А. и др., 1992; Мац А.Н., 2001; Медведев Ю.А. и др., 1999; Lawrence H.S. etal., 1996).
По мнению KirkpatrickC.H. (1993), MazaheriM.R., HamblinA.S., ZuckermanA.J. (1977), WarrenS.L. (1977), GrobPJ, ReymondJFetal. (1975) факторы переноса — это молекулы, которые «обучают» реципиентов выражать клеточный иммунитет. Этот эффект является антигенспецифичным. Наиболее последовательное воздействие факторов переноса на иммунную систему — это экспрессия гиперчувствительности замедленного типа и выработка лимфокинов, таких как фактор, ингибирующий миграцию макрофагов (MIF), который, вероятно, идентичен гамма-интерферону в ответ на воздействие антигена. Факторы переноса связываются с антигенами иммунологически специфическим образом. Это открытие позволило нам выделить отдельные факторы переноса из смесей, которые содержат несколько факторов переноса. Эта реакционная способность, вероятно, объясняет специфичность отдельных факторов переноса, и она предоставила метод очистки отдельных факторов переноса до кажущейся однородности. Очищенные материалы являются иммунологически активными и антигенспецифичными. Они имеют молекулярную массу около 5000 Да и, по-видимому, полностью состоят из аминокислот. Факторы переноса, по-видимому, предлагают новое средство молекулярной иммунотерапии для определенных пациентов с дефектом клеточного иммунитета.
Современные данные свидетельствуют о том, что передача иммунологически специфической информации молекулами фактора переноса требует взаимодействия с клеткой, которая была генетически запрограммирована, чтобы быть антиген-реактивной, но во время взаимодействия не заправлена. Контакт с молекулами фактора переноса позволит наивному реципиенту при первом столкновении с антигеном дать вторичный, а не первичный иммунологический ответ. Таким образом, необходимы молекулы фактора переноса для каждой антигенной детерминанты. Факторы переноса, полученные от животных или людей, способны переносить специфичность антигена через видовой барьер. Даже у примитивных видов есть клетки, из которых можно получить факторы переноса. Следовательно, молекулы хорошо сохраняются, и разумно предположить, что они важны для нормального иммунологического функционирования. Предлагаемые механизмы действия должны объяснять тот факт, что факторы переноса, полученные из клеток животных с высоким уровнем ответа, способны переносить отсроченную гиперчувствительность к животным с низким уровнем ответа, тогда как обратное неверно. Молекулы фактора переноса, вероятно, взаимодействуют с вариабельными областями альфа- и / или бета-цепи рецепторов Т-клеток, чтобы изменить их авидность и сродство к антигену таким образом, который в противном случае произошел бы только после столкновения с антигеном (DwyerJ.M., 1996).
Трансфер-фактор способен запускать передачу иммунной реактивности в короткий промежуток времени, возможно в первые 2-3 часа после парентерального применения (Лутфуллин А.М., Бобкова Е.В., 1990; Медведев Ю.А и др., 1991; Поздняков В.И., Мац А.Н. и др., 1987).
Alvarez T.L. et al. (1996), Rozzo S.J. et al. (1992) дают простое объяснение механизма действия ТФ: белки препарата своими С-концевыми участками связываются с хелперными клетками, цитотоксическими лимфоцитами и CD8 Т-клетками, которые приобретают способность отвечать на антигенную стимуляцию, находясь в неактивном состоянии.
KirkpatrickC.H. (1996) установил отсутствие разницы в эффекте при пероральном или подкожном путях введения ТФ.
Общая концентрация белка во всех проанализированных TF составляет менее 0,2 мг / мл (Guidos-Fogelbach G.A. etal., 2016).
LengH.X., LiuW.M., ZhuZ.G., HanL.Q. (2004) при сравнении минерального состава тимопептида и ТФ установили, что содержание Zn и Co в тимопептиде было ниже, чем в факторе переноса; содержание Cu, Fe, Mn и Ni в тимопептиде было выше, чем в факторе переноса. Что касается Zn, Cu, Mn и Co, то между двумя препаратами биологического типа была значительная разница (P<0,01). Для Fe и Ni была большая разница (Q<0,05).
RozzoS.J., MerrymanC.F., KirkpatrickC.H. (1988) установили, что продукция фактора переноса регулируется генами Ir, а иммунологическая активность фактора переноса — нет.
При получении ТФ против золотистого стафилококка концентрация полипептида составляла 2,26 ± 0,27 мг / мл, а рибоза — 0,684 ± 0,094 мг / мл. Частота фагоцитоза и стерилизации в группе ТФ составила 70,9 ± 12,4% и 62,1 ± 12,2% соответственно, и по сравнению с группой неспецифического фактора переноса не было значимых различий (P = 0,074 и 0,069 соответственно) , Кожа была воспалена и на месте инъекции образовались отмеченные узелки у мышей группы STF, а не NTF и контрольных групп. Коэффициент выживаемости в группе специфического ТФ был значительно выше, чем коэффициент выживаемости в группах не специфического (P = 0,024) (ZhouJ., KongC.Etal., 2015).
VezendiS., SchröderI. (1989) неоднократно лечили 59 пациентов с грудным саркоидозом с фактором переноса (TF) с 1976. Они использовали эту терапию с TF из лимфоцитов миндалин человека из-за неэффективности лечения кортикостероидами из-за побочных эффектов кортикостероидов, и в качестве первичной терапии TF, и для тестирования препарата TF животного из лимфоцитов миндалин свиньи (TFp).
Препаратом, содержащим ТФ является Трансферон (Transferon).
Исследованиями Medina-RiveroE. etal. (2016) установлено, что экстракт диализата лейкоцитов – ТФ — (Transferon) содержит 17 протеиногенных аминокислот, причем глицин занимает 18% от всего содержания молекул. Кроме того, исходя из электрофоретической миграции, пептидные популяции демонстрировали молекулярную массу около 10 кДа.
Medina-Rivero E. et al. (2014) при анализе 10 партий препарата Transferon установили, что все они имели хроматографический профиль, характеризуемый 8 основными пиками и диапазоном молекулярной массы от 17,0 до 0,2 кДа. Была отмечена высокая однородность между партиями в отношении времени удерживания и процентной доли площади, варьирующихся менее чем на 0,2% и 30% соответственно, и контрольная диаграмма находилась в пределах 3 стандартных отклонений. Чтобы проанализировать биологическую активность партий, мы изучили способность Transferon стимулировать выработку IFN-γinvitro. Transferon последовательно индуцировал продукцию IFN-γ в клетках Jurkat, демонстрируя, что этот метод может быть включен в качестве этапа контроля качества при выпуске партий Transferon.
Трансферон — сложный препарат на основе смеси низкомолекулярных пептидов. Это биотерапевтическое средство используется в качестве соадъюванта в клинических испытаниях нескольких заболеваний, включая вирусные инфекции и аллергии. Учитывая, что макрофаги играют ключевую роль в распознавании патогенов, фагоцитозе, процессинге и презентации антигенов, Jiménez-UribeA.P.etal. (2019) оценили влияние Transferon на фенотип и функцию макрофагоподобных клеток, происходящих из моноцитов THP-1. Поверхностную экспрессию CD80 и CD86 определяли с помощью проточной цитометрии и уровней IL-1β, TNF-α и IL-6 методом ИФА. Один только Transferon не изменял стационарное состояние PMA-дифференцированных макрофагоподобных клеток THP-1. Напротив, одновременная стимуляция клеток Transferon и LPS вызвала значительное увеличение экспрессии CD80 (P ≤ 0,001) и CD86 (P ≤ 0,001), а также продукции IL-6 (P ≤ 0,05) по сравнению с LPS контроль. Экспрессия CD80 и продукция IL-6 показали положительную корреляцию (r = 0,6, P ≤ 0,05) в клетках, подвергнутых воздействию Transferon® и LPS. Результаты показывают, что введение Трансферона® вызывает экспрессию костимулирующих молекул и секрецию цитокинов в LPS-активированных макрофагах.
Carballo-UicabG. etal. (2019) разработали и утвердили анализ пролиферации с использованием клеток Jurkat, подвергшихся воздействию азатиоприна, который предназначен для определения эффективности Transferonв соответствии с международными рекомендациями для фармацевтических препаратов. Анализ показал линейный отклик (от 2,5 до 40 мкг /мл), коэффициенты вариации от 0,7 до 13,6% продемонстрировали, что метод является точным, в то время как r2 = 0,97 между номинальными и измеренными значениями, полученными из линейной дилюционной линейности, показали, что метод является точным. Исследователи также продемонстрировали, что реакция клеточной пролиферации специфична для Transferon и не индуцируется ни его носителем, ни другими смесями пептидного комплекса (ацетат глатирамера или гидролизованный коллаген).
Ramírez-Ramírez D. et al. (2016) изучили способность ТФ стимулировать пополнение функциональных лимфоидных линий из клеток CD34 +. Результаты предполагают, что ТФ увеличивает их дифференцировку в направлении заметной CD56 + CD16 + CD11c + NK-подобной клеточной популяции, обладающей такими свойствами, как продуцирование IFNy, цитотоксичность опухолевых клеток и способность индуцировать пролиферацию γδT-лимфоцитов. Следует отметить, что системы с длительным контролем кокультуры продемонстрировали эффект ТФ-стромальных клеток, предоставляя NK-предшественникам сигналы для перепроизводства этого подмножества клеток. Таким образом, посредством прямого воздействия на клетки-предшественники и посредством активации и ремоделирования поддерживающей гематопоэтической микросреды, ТФ может способствовать устойчивому врожденному иммунному ответу, способствуя возникающему лимфопоэзу функциональныхCD11c + NK-клеток частично связанным с TLR образом.
По данным RifkindD. etal. (1977) диализируемый фактор переноса был получен из селезенок мышей CF1, активно сенсибилизированных убитым антигеном Coccidioides immitis. Фактор переноса вводили нормальным мышам либо внутрибрюшинно, либо в задние лапки. Мышей-реципиентов тестировали на реактивность к кокцидиоидному антигену и к антигену Candida albicans с помощью теста на набухание подушечки. Фактор переноса придает антигенспецифическую реактивность нормальным мышам-реципиентам при введении внутрибрюшинным путем и с помощью подушечки лап. Эта способность фактора переноса была разрушена предварительной обработкой in vitro димеризованной рибонуклеазой A, ферментом, активным против двухцепочечной, а также одноцепочечной рибонуклеиновой кислоты. Напротив, мономерная рибонуклеаза А, которая активна против только одноцепочечной рибонуклеиновой кислоты в условиях, используемых здесь, не влияла на фактор переноса. Эти данные свидетельствуют о том, что мышиный фактор переноса содержит рибонуклеотиды, которые необходимы для иммунологической активности. Кроме того, данные согласуются с выдвинутой другими гипотезой о том, что рибонуклеотиды могут иметь двухцепочечные или одноконтурные конфигурации.
Экстракты диализируемых лейкоцитов человека (DLE) представляют собой гетерогенные смеси низкомолекулярных пептидов, которые высвобождаются при разрушении лейкоцитов периферической крови от здоровых доноров. Мексиканские специалисты Salinas-JazmínN., Estrada-ParraS., Becerril-GarcíaM.A., etal. (2015) при экстрагировании лейкоцитов получили препарат Трансферон. Данный препарата увеличил выживаемость мышей при их заражении вирусом герпеса. При этом у животных повышался уровень ИФН-γ и снижалась концентрация ИЛ-6 и ФНО-α.
При изготовлении ТФ (STF), специфичного к сперматозоиду человека (HSA) для изготовления противоспермальной противозачаточной вакцины ZhouJ., KongC., YuanZ., etal. (2013) получили следующие результаты: концентрация полипептида составляла 2,34 ± 0,31 мг / мл, а рибоза — 0,717 ± 0,043 мг / мл. Индекс стимуляции для теста пролиферации лимфоцитов составлял 1,84, а коэффициент ингибирования адгезии лейкоцитов составлял 37,7%. Была выявлена статистически значимая разница между культуральными лимфоцитами с HSA-STF и не-HSA-STF для γ -IFN и IL-21 (P<0,05), но не было статистической значимости для IL-4 (P> 0,05).
Фактор переноса был широко изучен на людях, но удовлетворительная модель субпатриата не была установлена. Используя мышей BALB / c, иммунизированных полным адъювантом Фрейнда, WilliamsM.E. и KauffmanC.A. (1980) показали, что низкомолекулярное вещество, полученное из разрушенных клеток селезенки, передало чувствительность к очищенному производному белка (PPD) неиммунизированным реципиентным мышам BALB / c. Передача была подтверждена набуханием лапки в PPDinvivo и превращением лимфоцитов селезенки в PPDinvitro. У реципиентов фактора переноса была отмечена обратная корреляция между ответом лимфоцитов селезенки на PPD и конканавалином А. Материал, полученный из селезенки мышей BALB / c, обработанных физиологическим раствором, не переносил чувствительность к PPD у мышей-реципиентов.
SalamanM.R. (1978) получали диализируемый фактор переноса (TF) из клеток лейкоцитов доноров с известной клеточно-опосредованной реактивностью к туберкулину (PPD), стрептококковому белку (SKSD) и анатоксину дифтерии (DT). Исследовано влияние таких препаратов на трансформацию этими антигенами лимфоцитов от туберкулино-негативных доноров. Трансформацию определяли как включение меченного тритием тимидина. Концентрации SKSD и DT были скорректированы для разных доноров лимфоцитов, чтобы в отсутствие TF получить низкий показатель трансформации (менее чем в 10 раз), сравнимый с показателем, полученным при PPD. TF от туберкулин-положительных доноров стимулировал антиген-индуцированную трансформацию в среднем приблизительно в 2 раза, тогда как TF от туберкулин-отрицательных доноров обычно оказывал незначительный эффект. Это было так не для PPD в качестве антигена, но также для SKSD и DT, и чувствительность донора TF к SKSDDT не была определяющим фактором. TF также часто усиливал фоновую трансформацию в отсутствие антигена. Несмотря на небольшой эффект, эта способность имела тенденцию отражать активность TF в присутствии антигена. Делается вывод, что ни вся, ни какая-либо значимая часть этого усиления трансформации не может быть отнесена к антигенспецифическому фактору. Туберкулин-позитивные доноры, по-видимому, дают более высокий уровень неспецифического фактора, и обсуждаются возможные причины этого. Фактор, активный в трансформации, может быть ответственным за феномен TFinvivo.
ТФ, полученныйLiC., HuangL., etal. (2010) к вирусу гриппа представляет собой небольшую молекулярную смесь, которая полностью или частично состоит из полипептидов и полинуклеозидов. Более того, биологическая активность факторов переноса подтверждена тестом на розетки и специфическим кожным тестом.
ВопытахSimonM.R.etal. (1977) пять беспородных собак были сенсибилизированы к туберкулопротеину с помощью адъюванта Фрейнда, что было определено по реакциям на кожные пробы на туберкулин и культурам лимфоцитов in vitro. Эти животные служили донорами крови для производства фактора переноса. Девять беспородных собак получали однократные дозы фактора переноса, который был специфичным для туберкулина. Успешный перенос чувствительности к туберкулину, измеренный с помощью трансформации лимфоцитов, был достигнут у пяти из девяти животных. Культуры собачьих лимфоцитов часто демонстрируют относительно низкую трансформацию в митогены по сравнению с реакциями, отмеченными у других животных. Диссоциация между реакцией кожного теста и трансформацией лимфоцитов in vitro в туберкулопротеин была отмечена у двух из девяти животных. Увеличение трансформации лимфоцитов в фитохемагглютинин наблюдалось у трех из девяти животных-реципиентов после введения фактора переноса. Успешный перенос от животного, сенсибилизированного предшествующим введением фактора переноса, был достигнут в одном случае.
KirkpatrickC.H. (2000) очищал факторы переноса бычьего и мышиного происхождения с помощью аффинной хроматографии и высокоэффективной жидкостной хроматографии. Расщепленные цианогенбромидом были секвенированы. Оценивали свойства явно консервативной последовательности на экспрессию гиперчувствительности замедленного типа реципиентами трансфер-фактора. Новая аминокислотная последовательность LLYAQDL / VEDN была идентифицирована в каждом из семи препаратов фактора переноса. Эти пептиды не будут передавать экспрессию гиперчувствительности замедленного типа реципиентам, что указывает на то, что их недостаточно для экспрессии специфичности или иммунологических свойств нативных факторов переноса. Однако введение пептидов реципиентам нативных факторов переноса блокировало экспрессию у реципиентов гиперчувствительности замедленного типа. Пептиды не оказывали иммуносупрессивного действия. Эти данные позволяют предположить, что пептиды могут представлять собой часть факторов переноса, которая связывается с «клетками-мишенями» для факторов переноса. Идентификация этих клеток поможет определить механизмы действия трансфер-факторов.
Активность, подобную фактору переноса, была полученаDunnickW.A. (1977) с помощью хроматографии на сефадексе G-25 лизатов лейкоцитов иммунной свинки. Этот выделенный материал приводит к антиген-зависимому ингибированию миграции и поглощению тимидина неиммунными лимфоидными клетками. Испытания «фактора переноса» у морских свинок, иммунизированных либо овальбумином, либо бычьим гамма-глобулином, продемонстрировали донорскую специфичность активности invitro. Активность чувствительна к теплу (56 градусов С), щелочи (0,5 М гидроксид натрия), проназе и фосфодиэстеразе. Восприимчивость к проназе блокируется трейсилолом, ингибитором протеазы; восприимчивость фосфодиэстеразы не блокируется traysylol. Фактор морской свинки дополнительно очищали путем обработки щелочной фосфатазой. Хроматография на сефадексе G-25 и хроматография на DEAE-целлюлозе. Конечный продукт, активный invitro, составляет около 0,03% клеточного материала, поглощающего свет с длиной волны 260 нм, и содержит полимеризованные амины и фосфаты. Гель-электрофорез флурареактивных компонентов предполагает ограниченную гетерогенность материала, очищенного DEAE-целлюлозой. Эти данные согласуются с активной молекулой «фактора переноса», включающей как пептидные, так и фосфатсодержащие компоненты.
Целью исследований OjedaM.O. etal. (2005) было выяснить, 1) модулирует ли экстракт диализируемых лейкоцитов (DLE) продукцию провоспалительных цитокинов в лейкоцитах, активированных компонентами бактериальной клеточной стенки: липополисахаридом (LPS), липотейхоевой кислотой (LTA) и пептидогликаном (PGN); 2) влияние DLE на LPS-стимулированные эндотелиальные клетки; и 3) связано ли регуляторное действие DLE с медиаторами воспаления с модуляцией Toll-подобных рецепторов (TLR), сигнальных путей NF-kappaB и cAMP. Были получены следующие результаты: добавление DLE к лейкоцитам, стимулированным компонентами клеточной стенки, подавляло выработку TNF-альфа. Однако DLE индуцировал высвобождение IL-8 в моноцитах и увеличивал продукцию IL-6 и IL-8 активированными моноцитами и эндотелиальными клетками. Кроме того, DLE индуцировал экспрессию TLR2 и TLR4 и увеличивал уровни цАМФ, тогда как активность NF-kappaB ингибировалась.
Существование иммунопотенцирующих факторов, способных индуцировать бластогенез, хемотаксис и ингибировать миграцию лейкоцитов, было исследованоArala-ChavesM.P.etal. (1982) в спиртовых осадках различных партий экстрактов диализированных лейкоцитов (DLE). Их получали либо из свежих лейкоцитов из большого пула лейкоцитарных оболочек, полученных из всей крови, взятой у здоровых доноров с нерелевантной чувствительностью к антигенам (DLE-NS), либо из аналогичных лейкоцитов, которые инкубировали в течение 19 часов для продукции интерферона (DLE-NS- Я). Альтернативно, те же факторы были исследованы на партии DLE, полученной от донора, чрезвычайно чувствительного к антигену Candida (C-DLE-CS). Было отмечено, что все три партии содержали одинаковое количество специфических или неспецифических иммунологических факторов. Сходство интенсивности специфических факторов между так называемыми неспецифическими партиями (DLE-NS и DLE-NS-I) и конкретной серией (C-DLE-CS) интерпретировалось как результат случайного отбора доноров.для подготовки неспецифических партий, которые, следовательно, содержат рандомизированные релевантные особенности. Поэтому постулируется, что партии DLE, которые представляют собой большие отходы лейкоцитов, используемых для производства интерферона, могут быть полезным инструментом для целей двойной слепой терапии DLE.
При изучении образования антител к овоальбумину при совместном применении препарата Трансферон AvilaS., Muñoz-GarcíaL., Vázquez-LeyvaS., etal. (2017) определили в сыворотке крови только антитела (IgG) против овоальбумина. Трансферон не вызывает генерацию специфических антител против его компонентов в этой модели, независимо от адъюванта и пути введения. Эти результаты подтверждают безопасность Трансферона, подтверждая его неспособность индуцировать гуморальный иммунитет в этой модели на животных.
Для повышения иммуногенности препарата Transferon®Mellado-SánchezG., Lázaro-RodríguezJ.J., AvilaS., etal. (2019) проводили химическое конъюгирование пептидов Transferon® с белками-носителями и использование модели кролика. Биоконъюгаты были получены с гемоцианином LimpetKeyhole (KLH) или бычьим сывороточным альбумином (BSA) через белки-носители, активированные малеимидом. Мышей BALB / c и новозеландских кроликов иммунизировали Трансфероном®, конъюгированным с ГЛУ или неконъюгированным Трансфероном®. Животные, которые были иммунизированы конъюгатом Трансферон®, показали значительную продукцию антител, о чем свидетельствует распознавание конъюгата Трансферон-БСА в анализах ELISA. Кроме того, кролики показали более высокие титры антител по сравнению с мышами. Ни мыши, ни кролики не вырабатывали антитела при иммунизации неконъюгированным Трансфероном®. Интересно, что кроличьи антитела были способны частично блокировать выработку IL-2 в клетках Jurkat после костимуляции с Transferon®. В заключение, возможно выявить специфические и функциональные антитела против hDLE с различными потенциальными применениями в течение жизненного цикла продукта.
ПоданнымCriswell B.S., South M.A. et al. (1975) после повторных инъекций ТФ при электронной микроскопии был обнаружен новый тип лимфоцитов. Новый тип клеток напоминал более нормальный лимфоцит. Он имел более высокую плотность цитоплазматического материала по сравнению с клетками до введения фактора переноса. Он был меньше по размеру с некоторыми агрегированными рибосомами, имел обнаруживаемые количества грубого эндоплазматического ретикулума и больше интактных ядерных мембран. Этот новый тип лимфоцитов может представлять собой небольшую популяцию В-лимфоцитов, возможно, стимулируемую Т-клетками, сделанную иммунокомпетентной с помощью фактора переноса.
1.3. Использование трансфер-фактора при профилактике и лечении болезней
Впервые препарат фактора переноса был применен в 1970 году у больного с симптомом Вискотта-Олдрича. Исследователи подтвердили улучшение состояния больных уже после двух инъекций (Levin A.S. etal., 1970; Levin A.S. etal., 1972; Levin A.S. etal., 1973).
При определенных ситуациях у пациентов с невозможностью применения других терапевтических средств (лекарственная устойчивость при туберкулезе, использование иммунодепрессантов при трансплантации органов оправдано использование препаратов с активностью трансфер-фактора (Arala-Chaves V.P., Sousa M., 1974).
Использование не специфического ТФ для лечения хронического вирусного гепатита дало разные результаты (Tong et al., 1976; Jain et al., 1977; Shulman и др., 1979; Tong et al., 1976). Однако, ТФ полученный из лейкоцитов пациентов, переживших острый вирусный гепатит типа B, и реплицированный in vitro в лимфобластоиде LDV/7, показал высокую клиническую эффективность, вызывая частое улучшение состояние больных пациентов, которое оценивалось по нескольким биохимическим параметрам сыворотки крови и биопсии печени (Pizza et al., 1979; Roda et al., 1985).
Высокая эффективность ТФ, как специфического, так и не специфического была доказана при профилактике и лечении герпесных инфекций у человека и животных (Khan et al., 1975; Khan et al., 1981; Dwyer, 1983; Viza et al., 1983; Rosenfeld et al., 1984; Pizza et al., 1996b; Meduri et al., 1996; Estrada-ParraS. et al., 1995). Стоит отметить обычное отсутствие побочных эффектов, поскольку пациенты в обоих исследованиях получали лечение и находились под очень долгим наблюдением (Meduri etal., 1996; Pizzaetal., 1996). Viza et al. (1986) отмечают, что эффект при использовании ТФ для лечения инфекции зависит от получаемой дозы препарата.
Steele и др. (1980) доказали эффективность ТФ при профилактике и лечении ветряной оспы у детей.
Estrada-Parra et al. (1998) сравнили эффективность ТФ и ацикловира у 28 пациентов с острой инфекцией ветряной оспы. ТФ был приготовлен из лейкоцитов 1000 здоровых доноров крови и был применен 14 пациентам, тогда как еще 14 лечились ацикловиром. Пациенты с ТФ имели статистически значимое уменьшение продолжительности болезни по сравнению с группой ацикловира. Кроме того, было повышение уровня CD4 лимфоцитов, интерферона γ и соотношение CD4/CD8 в группе, получавшей ТФ, в отличие отпациентам с ацикловиром, у которых данных изменений не было.
Jones et al. (1981) описали эффект перорального применения ТФ при лечении цитомегаловирусной инфекции. В результате лечения исчезли клинические признаки заболевания и развилась полноценная антиген-специфическая реакция. Исследованиями Nkrumah et al. (1985) установлено, что инъекция ТФ у пациента с выраженной лимфаденопатией и и спленомегалией привела к выздоровлению с исчезновением клинических признаков заболевания.
В исследовании Neequaye et al. (1990) установлено, что у пациентов с инфекцией, вызванной вирусом Эпштейна-Барра ТФ может быть использован для профилактики рецидивов заболевания.
При комбинированном лечении пациентов с раком шейки матки (вирус папилломы человека) Wagner et al., (1987) совмещали терапию ТФ с облучением . Исследователями установлено, что у 16,1% пациентов в группе с ТФ-терапией произошли рецидивы, в контрольной группе рецидивы заболевания наблюдались у 39; пациентов.
Положительное влияние ТФ при лейшманиозе установили Sharma et al. (1979) и Delgado et al. (1981). Louie E, Borkowsky W, Klesius PH, et al. (1987), McMeekingetal., (1990) добилисьулучшениясостоянияздоровьяпациентовскриптоспоридиозом, используяТФ, полученныйизлимфоцитовлимфатическихузловтелят, иммунизированныхкриптоспоридиями.
Положительного влияния ТФ на иммунный ответ мышей, инфицированных Echinococcus multilocularis, и леченных альбендазолом не наблюдалось (Dvoroznáková и др., 2009).
Masi et al. (1996) сообщили о значительном клиническом улучшении у всех, кроме одного, из пятнадцати пролеченных пациентов, инфицированных Candida, ими также показано, что Candida-специфический ТФ увеличивает иммунную реактивность пациентов к антигенам.
Используя ТФ, Graybilletal. (1973) вылечили трех пациентов с прогрессирующим кокцидиоидомиком.
Мексиканская группа исследователей показали, что прилечение мышей, инфицированных Mycobacterium tuberculosis, мышиноспецифическим туберкулезом, ТФ восстановил экспрессию цитокинового паттерна Th1 и привёл к подавлению размножения бактерий, значительному увеличению выживаемости животных (Fabre et al., 2004 г.). При объединении ТФ с обычной химиотерапией, он показал синергетический эффект, приводя к значительно более быстрому устранению нагрузки легочных бактерий, чем одна химиотерапия.
В двух сообщениях описывается влияние ТФ на пневмонию Mycobacterium fortuitum, резистентную к терапии антибиотиками (Wilson et al., 1982) и лекарственно-устойчивой инфекции Mycobacterium xenopi (Dwyer et al., 1983). Антиген-специфический ТФ, приготовленный из лейкоцитов трех доноров с высокой реактивностью к Mycobacterium xenopi, вводили пациенту, страдающему деструктивной легочной инфекцией этим микроорганизмом. Антигенспецифический вызвал быстрое и длительное улучшение как легочного заболевания, так и иммунологического статуса пациента, а также восстановление реактивности кожной пробы к антигену M. xenopi.
Willeford B.V. et al. (2017) при исследовании профилактического эффекта ТФ при сальмонеллезе на лабораторных животных установили, что мыши, получавшие 5 мг ТФ погибали в 7% случаев заражения. В то время летальность у животных без ТФ составляла 73%. ТФ вызывал увеличение концентрации IL-6 в 26 раз и иINF-γ в 77 раз.
Castrejón Vázquez M.I. et al. (2019) после применения ТФ больным с сепсисом наблюдали снижение количества С-реактивного белка увеличение общего количества лимфоцитов и снижение общего количества нейтрофилов через 72 часа после введения. Применение ТФ вызывало более высокую выживаемость пациентов с сепсисом.
Hernández-EsquivelM.A.etal. (2018) использовали клетки эпителия простаты мыши, трансформированные v-Src (PEC-Src), которые воспроизводят транскрипционные профили в PCa человека, могут быть выращены у иммунокомпетентных мышей и постоянно образуют метастазы в кости и мозг. InvitroTransferon не вызывал цитотоксичность и не изменял миграцию/инвазию клеток PEC-Src.InvivoTransferonTM уменьшал метастазирование после внутрисердечной инъекции PEC-Src и ингибировал рост опухоли подкожных изотрансплантатов. Противоопухолевый эффект Transferon коррелировал с изменениями в инфильтрации опухоли, повышенными концентрациями IL-12 и CXCL1 в сыворотке и снижением уровней VEGF. Результаты исследователей предполагают, что противоопухолевый эффект, вызываемый Transferon, обусловлен его иммуномодулирующей активностью, а не прямым воздействием на раковые клетки, и указывают на то, что Transferon может быть полезен в качестве адъювантной терапии у пациентов с PCa.
Целью исследования Acosta-RiosM.P., Sauer-RamírezE., Castro-MuñozL.J., etal. (2017) была оценка клинических, гистопатологических и иммунохимических изменений, вызванных лечением диализируемым экстрактом лейкоцитов (DLE) у пациентов с хроническим цервицитом, ассоциированным с инфекцией HPV. Пятьдесят четыре мексиканских пациентки с диагнозом хронический цервицит, цервикальная интраэпителиальная неоплазия 1 степени (CIN 1) и ВПЧ-инфекция были разделены на две группы: пациенты, получавшие плацебо, и пациенты, получавшие DLE. Клинические и кольпоскопические оценки проводились до и после лечения. Биопсия шейки матки была получена для анализа гистопатологических особенностей и определения местных иммунологических изменений с помощью иммуногистохимического анализа. У пациентов, получавших плацебо, не было значительных изменений в оцененных параметрах. Интересно, что у пациентов, получавших DLE, клинические проявления цервицита уменьшились, и 89% из них перенесли кольпоскопические поражения. Гистологический анализ биопсий у пациентов, получавших DLE, показал уменьшение инфильтрата лейкоцитов. Иммунохимические анализы показали повышенную экспрессию TGF-β, тогда как экспрессия IFN-γ, PCNA и IL-32 снизилась. Наши результаты показывают, что DLE может стимулировать врожденный иммунитет слизистой шейки матки, уменьшая хронический цервицит у пациентов, инфицированных ВПЧ.
Pérez-Martínez P.I., Rojas-Espinosa O. et al. (2020) исследовали, могут ли очищенные омега-ненасыщенные жирные кислоты (ω-UFAs) и экстракты диализуемых лейкоцитов (ТФ) предотвращать развитие артрита в модели коллаген-индуцированного артрита (CIA) у мышей. Они также исследовали, были ли вовлечены в процесс транскрипционный фактор NF-κB и воспаление NLRP3, и была ли их активность модулирована лечением. Развитие артрита оценивалось в течение 84 дней после лечения ничем, дексаметазоном, DLE, докозагексаеновой кислотой, арахидоновой кислотой и олеиновой кислотой. Прогрессирование CIA контролировали путем оценки клинических проявлений, воспалительных изменений и гистологических изменений в суставных тканях подушечек. Как ТФ, так и ω-UFA приводили к почти полному ингибированию воспалительной гистопатологии CIA, и это сопровождалось ингибированием NF-kB и ингибированием активации NLRP3. Эти данные свидетельствуют о том, что ω-УФА и DLE могут иметь NF-κB в качестве общей мишени и что они могут использоваться в качестве вспомогательных лекарственных средств при лечении артрита.
WilsonG.B., PoindexterC., FortJ.D., LuddenK.D. (1988) факторы переноса (TF) получали из молозива и молока крупного рогатого скота, предварительно иммунизированных антигенами, полученными из Coccidioidesimmitis, инфекционного вируса ринотрахеита крупного рогатого скота, или из вирусных агентов, ответственных за птичью ньюкаслскую болезнь, ларинготрахеит или инфекционную бурсальную болезнь. Способность бычьегоTF передавать специфическую клеточно-опосредованную иммунную чувствительность заметно ксеногенным видам изучали с использованием специфических свободных от патогенов (SPF) и стандартных коммерческих (SC) цыплят в качестве модельных реципиентов. Клеточно-опосредованная иммунная реактивность была задокументирована с использованием одного или нескольких из следующих параметров для каждого изученного антигена (организма): (а) анализ ингибирования миграции лейкоцитов (гетерофилов) кур invitro; (б) замедленная реактивность; или (c) защита от клинического заболевания. TF курицы, полученные из селезенки иммунных доноров, оценивались параллельно с TF быка в отдельных сравнительных исследованиях. Бычий TF также называют индуктором специфического иммунитета, и было обнаружено, что куриный TF инициирует антигенспецифический клеточный иммунитет denovo у ранее неиммунных цыплят SPF, а также у цыплят SC, несмотря на присутствие материнских приобретенных гуморальных антител которая может служить «барьером» для иммунизации кур SC, когда коммерчески доступные вакцины вводятся парентеральными путями. TF крупного рогатого скота, специфичный для вируса ларинготрахеита или вируса инфекционной бурсальной болезни, обеспечивает защиту, равную той, которая установлена для коммерчески доступных вакцин. Действие ТФ крупного рогатого скота было быстрым (менее суток) и относительно длительным, по крайней мере, 35 дней.
Steele R.W., Sieger B.E. et al. (1976) описывают следующий клинический случай. Женщина, у которой диссеминированный кокцидиоидомикоз развился с культурально-позитивным менингитом во время ее третьего триместра беременности, лечилась амфотерицином В, а затем фактором переноса, полученным из периферических лимфоцитов ее отца. Клинический ответ и иммунологические данные invivo и invitro показали, что этот фактор переноса вносил значительный вклад в ее выживание, тогда как предыдущая терапия с фактором переноса от неродственного донора обеспечивала только временную иммунологическую реактивность. Этот опыт свидетельствует о том, что фактор переноса, полученный от родственного донора с положительными ответами на C. immitis, может быть более эффективным, чем фактор, полученный от неродственного донора.
Fabre R.A., Pérez T.M., Aguilar L.D., et al. (2004) при заражении мышей BALB / c через трахею MycobacteriumtuberculosisH37Rv установил, что при лечении животных различными дозами TF (одна инъекция в неделю), полученными из клеток селезенки, происходило восстановление экспрессии цитокинов Th-1, TNF-альфа и iNOS, вызывая ингибирование пролиферации бактерий и значительное увеличение DTH и выживаемости. Этот положительный эффект зависел от дозы. Интересно, что мышиный TF в сочетании с обычной химиотерапией оказывал синергетический эффект, вызывая значительно более быстрое устранение бактериальных нагрузок в легких, чем одна химиотерапия.
Fuentes-Castro B.E. et al. (2017) использовали ТФ, полученный из лимфоидной ткани крокодила при лечении мышей, зараженных Toxoplasmagondii (штамм ME-49). По сравнению с контрольной группой мышей мыши, инфицированные T. gondii и получавшие DLE, показали меньшее повреждение тканей, главным образом на кишечном, селезеночном и печеночном уровнях. Кроме того, наблюдался больший процент выживаемости и значительное снижение паразитарной нагрузки в головном мозге.
Orozco T.T. et al. (2004), Flores Sandoval G., Gómez Vera J., Orea Solano M., et al. (2005) при лечении пациентов с атопическим дерматитом наблюдали снижение уровня IgE относительно базальной величины. У пациентов наблюдалось увеличение нейтрофилов и лейкоцитов после лечения; Однако это не было значимым (р = 0,46). Эозинофилы были значительно снижены (р = 0,01).
По данным VettoR.M., BurgerD.R. etal. (1976) тридцать пять безнадежно больных раком, получали лечение с помощью трансфер-фактора. Трансфер-фактор получали от родственников пациентов и вводили с 14 дневными интервалами. У 13 пациентов произошла регрессия опухоли (1), купировались метастазы (14) или ослабли болевые симптом (14).
Espinosa Padilla S.E., Orozco S., Plaza A., et al. (2009) установили, что трансфер-фактор способствует снижению дозы ингаляционных глюкокортикоидов у пациентов с аллергическим ринитом.
Grimová J., Pokorná D. Et al. (1985) сообщают, что, трансфер-фактор, введенный в количестве 200 мкг (аналог 10 ‘лейкоцитов) 3 раза в неделю, смог полностью предотвратить развитие адъювантного артрита. В период максимального развития адъювантного артрита симптомы наблюдались у контрольных крыс, которых не лечили фактором переноса (на 21-й день после полного применения адъювантов Фрейнда), тогда как у крыс, получавших фактор переноса, опухание лап не было продемонстрировано, и подвижность была так же, как и у здоровых. У этих животных также не было признаков поражения костей.
Устойчивость к заражению TrichostrongyluscolubriformisRossJ.G., HallidayW.G. (1982) изучали на беспородных штаммах морских свинок. Резистентность была достигнута при предыдущих инфекциях 50 или 100 инфекционных личинок и при внутрибрюшинном, внутримышечном и подкожном введении диализированного фактора переноса, полученного от свиней-гунек, инфицированных T. colubriformis, путем внутрибрюшинного введения фактора переноса, приготовленного из крови овец, зараженных Т colubriformis и в одном из трех случаев с использованием фактора переноса, полученного от морских свинок, которые не были заражены T. colubriformis. Никакой значимой резистентности не было перенесено введением антигена, полученного из взрослого T. colubriformis, или с помощью фактора переноса без диализа, или с помощью диализного фактора переноса, полученного из ткани морской свинки, инфицированной T. colubriformis, которая хранилась в течение нескольких месяцев при — 20 градусах.
По данным HunterA.R., MacKenzieG., RossJ.G. (1983) значительное снижение интенсивности инвазии было достигнуто у ягнят, получавших диализированный фактор переноса и зараженных 10 000 личинками Haemonchus contortus, по сравнению с контрольными животными. Фактор переноса без диализа из того же пула лейкоцитов не давал защиты, но был успешным в снижении интенсивности инвазии при введении после первичной инфекции 1000 личинок H. contortus с последующим заражением 10000 личинок.
EspañolT., PadullesJ., PratsJ. (1977) описывают клинические случаи лечения нейробластомы у детей фактором переноса от матери. Условия для пациентов были: более 2 лет, плохой ответ на химиотерапию и / или часть опухоли не были удалены. От 3 до 5 доз фактора переноса вводили 3 пациентам 2 1/2, 4 и 6 лет. Одна доза была взята из 400 мл крови и приготовлена, как описано в литературе. Пациенты оставались без метастазирования более 1 года после лечения.
Tsangetal. (1983) в опытах на животных показал, что ТФ может снизить метастазирование опухоли (20% против 100% в контроле) и повысить выживаемость животных (смертность в опытной группе 60%, в контрольной – 100%).
При сенсибилизации организма донора антигенами меланомы и получения из их крови ТФ SpitlerL.E. etal. (1973), SpitlerL.E. etal. (1976) наблюдали регрессию метастазов у 20% больных людей.
Положительное влияние ТФ при терапии злокачественной меланомы 2 стадии также отмечает Burkowski R.M., Deondhar S., Helwett J.S. (1983).
Эксперименты, проведенныеLikholetovS.M., Prokof’evaE.I., RogozhkinaN.M. (1978) на нелинейных мышах, продемонстрировали возможность передачи интактным реципиентом отсроченной гиперчувствительности посредством фактора переноса Лоуренса от мышей, иммунизированных Coccidioides immitis. Фактор переноса, вводимый за 48 часов до интраназальной инфекции, защищал мышей от смертельной дозы кокцидиоидов. Это указывало на то, что при кокцидиоидозе возможно перенести отсроченную гиперчувствительность и клеточный иммунитет с фактором переноса.
Xu Y., Zhang Q. et al. (2013) установили, что ТФ против гепатита B кур обладают антиген-специфической клеточной иммунной активностью гепатита B и могут значительно усиливать специфические клеточные иммунные ответы
Oettgen H. etal. (1974) исследовали возможность применения ТФ при лечении рака молочной железы. Пептиды получали от доноров, которые были сенсибилизированы антигенами опухоли. У пациентов наблюдалось замедление роста опухоли и улучшение общего клинического состояния.
J. Silvaetal. (1976) при одновременном использовании ТФ, полученного от подготовленных доноров, одновременно с вакциной против туберкулезаотмечали у 16 больных замедление метастазирования опухоли.
Хороший эффект получен от применения ТФ при ювенильном артрите (Kassetal., 1974) и болезни Крона (Asquith P.Etal., 1975).
2. Собственные исследования и их результаты
2.1. Материалы и методы исследования
Эксперименты проведены с соблюдением требований, изложенных в директивах ЕС (86/609/ЕЕС) и Хельсинкской декларации. Исследования по определению эффективности применения трансфер-фактора при вакцинации животных проводили на базе ООО «Агрофирма «Магнезит» Саткинского района и ООО «Агрофирма «Калиинская» Брединского района Челябинской области. На предприятиях по принципу пар-аналогов было сформировано 3 группы телок черно-пестрой и герефордской породы по 5 голов в каждой. Все животные были привиты против нодулярного дерматита вирусвакциной против оспы овец и заразного узелкового дерматита КРС культуральной сухой «ШипПокс-ЛСД вак». Животным второй опытной группы одновременно с вакциной применили препарат «Интерферон-Б» в дозе 1 мл на 10 кг живой массы подкожно, животным третьей группы в первый и второй день применили трансфер-фактор в дозе 1,5 (до 12 месячного возраста) или 6 (старше 12 месячного возраста) мл на голову подкожно, двукратно с интервалом 24 часа. Также животным второй и третьей группы применили препарат «Айсидивит» в дозе 5 мл на голову внутримышечно.После вакцинации за всеми животными вели клиническое наблюдение, в том числе проводили двукратное ежедневное измерение температуры на протяжении 3 дней.
Для оценки эффективности применения специфического трансфер-фактора при профилактике абортов и эмбриональной смертности препарат инъецировали коровам перед искусственным осеменением в дозе 6 мл подкожно двукратно с интервалом 24 часа.
Беременность и особенности строения и состояние полового аппарата, а также эффективность проведенного лечения определяли ректальным исследованием комиссионно через 2-3 месяца после осеменения, а также с помощью переносного УЗИ – сканера Драмински производства Польша через 35-40 дней после осеменения.
Дляполучение трансфер-фактора из крови животных их подвергли вакцинации вакциной против нодулярного дерматита крупного рогатого скота, оспы овец и коз по следующей схеме:
1. Животных подвергли проверке на туберкулез аллергической пробой с ППД туберкулином, бруцеллез и лейкоз с помощью серологических реакций.
2. Отрицательно реагирующих животных вакцинировали против нодулярного дерматита трехкратно, с интервалом 15 дней в одной, двух и четырехкратной дозе.
3. Через 15 дней после последней иммунизации был произведен забор крови для выделения ТФ.
Для иммунизации использовали вирусвакцину против оспы овец и ЗУД КРС культуральную сухую «ШипПокс-ЛСД вак».
Трансфер-фактор получали по методике, предложенной Г. Фримелем.
Кровь отбирают в стерильных условиях и разделяют на порции по 20 мл (на каждые 100 мл крови добавляют 500 ME гепарина). Кровь разливают в стерильные пробирки (25х155 мм), добавляют 2 мл раствора декстрана 250 (60 г/л) в 0,15 М NaCI или раствор инфуколла. Пробирки закрывают, несколько раз встряхивают и инкубируют при 37°С. Эритроциты осаждаются в течение 30-45 мин. Желтоватый или слегка красноватый слой надосадочной жидкости переносят при помощи пастеровской пипетки в конические центрифужные пробирки. Закрытые пробирки центрифугируют в течение 10 мин при 1500g. Плазму осторожно сливают. Осевшие лейкоциты образуют слой над осадкой эритроцитов.
Осадок состоит из 70% из лимфоцитов. Самая нижняя часть конуса пробирки заполнена эритроцитами. На слой лейкоцитов наслаивают 0,1 мл стерильного апирогенного 0,15 М раствора NaCI. Кончик пастеровской пипетки осторожно проводят сквозь слой раствора соли и осторожно отсасывают лейкоциты в виде суспензии в изотоническом растворе NaCI. Можно объединять полученные суспензии лейкоцитов. Для получения диализата необходимо полное разрушение лейкоцитов. Оно достигается 10-кратным замораживанием и оттаиванием суспензии. Пробирки с суспензией клеток замораживают смесью сухого льда с этанолом, а размораживают на водяной бане при 37°С. Процесс повторяют до тех пор, пока жидкость не станет вязкой. При полном разрушении лейкоцитов высвобождается ДНК, делающая раствор чрезвычайно вязким и затрудняющая его дальнейшую обработку. Для деполимеризации ДНК в раствор вносят несколько кристаллов ДНКазы и небольшое количество ионов Mg2+ (несколько кристаллов MgSO4). Гидролиз протекает в течение 30 мин при 37 °С.
Если ДНКазу, которая отличается чрезвычайной стабильностью, добавлять прямо к суспензии лейкоцитов, то деполимеризация ДНК происходит в процессе замораживания и оттаивания и не требует дополнительной инкубации. Для удаления высокомолекулярных компонентов проводят диализ. Обработанный ДНКазой экстракт лейкоцитов осторожно переносят в завязанный с одного конца диализный мешок, стараясь не испачкать экстрактом наружный слой мешка, после чего его завязывают, ополаскивают стерильным апирогенным изотоническим раствором NaCI и переносят мешок в стерильный сосуд с дистиллированной водой. На 0,1 мл экстракта используют 5 мл дистиллированной воды. Диализ проходит в течение 24 ч при 4°С.
Полученный диализат растворяли в стерильной физиологическом растворе, консервированном фенолом до 0,5%-ной концентрации.
Для определения качества полученного препарата трансфер-фактора использовали реакцию бласттрансформации лейкоцитов (РБТЛ). Реакция РБТЛ для определения физиологической активности (пролиферативного потенциала) клеток на неспецифические активаторы и на специфические антигены имеет большое значение для оценки иммунного статуса, аутоиммунных и аллергических заболеваний, для трансплантационной иммунологии – подбора донора и реципиента и т.д. Подбирая различные митогены и оптимальные условия проведения реакции, можно в принципе дать количественную оценку Т- и В-лимфоцитов в общей популяции. Принцип реакции бласттрансформации (РБТЛ) – активация лимфоцитов под влиянием стимулов с последующей трансформацией их в бласты (большие делящиеся клетки). В качестве активаторов РБТЛ обычно используются ФГА (фитогемагглютинат), конкавалин (КонА), митоген лаконоса (МЛ), бактериальные полисахариды, ферменты, аллергены и др. Для оптимального протекания РБТЛ целесообразно применение нескольких доз стимулятора (оптимальной, низкой и высокой) и разное время культивирования.
Техника постановки анализа. В стерильные пенициллиновые пузырьки вносят реактивы для контрольной (1) и опытной (2) серий. Контроль (1): 4 мл среды 199 или Игла, 1 мл инактивированной сыворотки крупного рогатого скота, 0,25 мл среды 199 или Игла; 0,1 мл гепаринизированной крови животного. Опыт (2): 4 мл среды 199 или Игла; 1мл инактивированной крови крупного рогатого скота; 0,25 мл разведенной вакцины против нодулярного дерматита; 0,1 мл гепаринизированной крови животного. Пенициллиновые пузырьки закрыть стерильными резиновыми пробками и культивировать четверо суток при 37 ºС в термостате. Учет результатов 1. Собрать содержимое пузырьков в пробирки и центрифугировать 10 мин при 1000 об/мин. 2. Удалить супернатант. Осадок ресуспендировать в 10 мл 10 %-ной уксусной кислоты и повторить центрифугирование (10 мин при 1000 об/мин). 3. Удалить супернатант. Осадок ресуспендировать, добавить каплю метанола. 4. Приготовить мазки. Высушить на воздухе. Красить по Романовскому – Гимзе. 5. Просчитать процент бластов на 100 – 200 лимфоцитов.
Стерильность полученного трансфер-фактора изучали согласно ГОСТ 28085 «Препараты биологические. Метод бактериологического контроля и стерильности». Исследование проводили методом посевов на следующие питательные среды: МПА, МПБ, ТГС, агар Сабуро.
Определение безвредности специфического трансфер-фактора проводили согласно «Методическим указаниям по определению токсических веществ, препаратов, применяемых в ветеринарии и животноводстве», утвержденных Министерством здравоохранения СССР, ВАСХНИЛ, Главным управлением ветеринарии Госагропрома СССР.
После вакцинации за всеми животными вели клиническое наблюдение, в том числе проводили двукратное ежедневное измерение температуры на протяжении 3 дней.
У животных до применения вакцины был произведен забор крови для биохимического и серологического исследования; забор крови повторили через 28 дней после начала эксперимента.
В крови определяли следующие показатели:
1. Щелочная фосфатаза.
Принцип метода: Щелочная фосфатаза (ЩФ) в сыворотке определяется путем измерения скорости гидролиза эфира фосфорной кислоты – п-нитрофенилфосфата.
| п-Нитрофенилфосфат ————> п-нитрофенол + Н3РО4 |
Скорость гидролиза субстрата прямо пропорциональна активности ЩФ в пробе и измеряется спектрофотометрически при длине волны 405 нм.
2. Билирубин.
Принцип. Под действием НС1 разрывается тетрапирроловая связь билирубина и образуется два дипиррола, которые диазотируются диазобензосульфа- новой кислотой с образованием розово-фиолетового азобилирубина.
3. Холестерин.
Холестерин определяли по Ильку, при помощи набора «БИО-ЛА-ТЕСТ». Холестерин в присутствии уксусной и серной кислот дает изумрудно-зеленое окрашивание, интенсивность которого прямо пропорциональна концентрации.
4. Общий белок — колориметрическим методом с помощью набора реактивов «Клинитест- ОБ».
Метод основан на способности белков с ионами меди в щелочной среде образовывать комплексные соединения фиолетового цвета. Интенсивность окраски пропорциональна концентрации белка в исследуемой пробе. Концентрацию белка рассчитывали по формуле:
где Е1 – экстинция опытной пробы;
Е2 – экстинция калибровочной пробы;
60 – концентрация белка в калибраторе.
5. Глюкоза.
Глюкозооксидазный метод определения глюкозы в крови основан на реакции окисления глюкозы в присутствии фермента глюкозооксидазы с образованием перекиси водорода, которая в свою очередь в присутствии пероксидазы окисляет ортотолидин с образованием окрашенных продуктов; о концентрации глюкозы сулят по количеству окрашенных продуктов. Глюкоза в присутствии фермента глюкозооксидазы окисляется кислородом воздуха с образованием в ходе реакции перекиси водорода. Перекись водорода в присутствии фермента пероксидазы окисляет ортотолуидин образованием окрашенного соединения, интенсивность окраски которого пропорциональна содержанию глюкозы.
6. Альбумины.
Альбумины крови определяли по реакции с бромкрезоловым зеленым с помощью набора реагентов «Клини Тест – Альбумин». Метод основан на взаимодействии альбуминов с бромкрезоловым зелёным в слабокислой среде в присутствии детергента, что сопровождается образованием окрашенного соединения синего цвета, интенсивность окраски которого пропорциональна концентрации альбуминов. Концентрацию альбуминов рассчитывали по формуле:
![]()
где: Е1– экстинция опытной пробы;
Е2 – экстинция калибровочной пробы; 60 – концентрация белка в калибраторе.
7. Креатинин.
Принцип метода. В щелочной среде пикриновая кислота взаимодействует с креатинином с образованием оранжево-красной окраски (реакция Яффе-образование таутомера пикрата креатинина), которую измеряют фотометрически.Определение в сыворотке крови проводят после депротеинизирования. Определение не совсем специфично, интерферируют вещества с активной метиленовой группой и некоторые восстанавливающие вещества, например глюкоза, ацетон, ацетоуксусная и пировиноградная кислоты.
8. Содержание гемоглобина – гемоглобинцианидным методом, суть которого состоит в том, что гемоглобин при взаимодействии с ацетоангидрином образует окрашенный гемоглобинцианид, интенсивность окраски которого пропорциональна содержанию гемоглобина.
9. Количество эритроцитов и лейкоцитов определяли путем подсчета клеток крови. Эритроцитов в пяти больших квадратах в камере Горяева под микроскопом при увеличении в 40 раз с разведением кровив 2000 раз 0,98%-ным раствором натрия хлорида. Лейкоцитов в пяти полосках при разведении в 20 раз жидкостью Тюрка.
10. Белковые фракции – нефелометрическим экспресс-методом, основанным на способности отдельных фракций белка осаждаться фосфатами определенной концентрации. По степени мутности растворов колориметрически судят о концентрации белков в исследуемой пробе.
Для определения показателей неспецифического клеточного иммунитета определяли фагоцитарную активность лейкоцитов.
Содержание антител в сыворотке крови определяли непрямым двойным антиген-иммуноферментным анализом для выявления антител против каприпоксвирусов (CPV), включая вирусы lumpy skin disease (нодулярный дерматит), оспы овец (SPPV) и оспы коз (GTPV) в сыворотке или плазме крови крупного рогатого скота. Диагностический набор разработан фирмой IDvet.
Описание и принцип действия
Лунки микропланшета покрыты очищенным антигеном CPV.
При внесении в лунки микропланшета исследуемых образцов, антитела анти- CPV, если они присутствуют, связываются на твердой фазе с антигенами, образуя комплексы антиген-антитело.
После этапа промывки, в лунки вносится конъюгат, меченный пероксидазой HRP. Он фиксируется со свободными участками анти-CPV антител сыворотки.
Избыток конъюгата удаляется промывкой, затем вносится раствор субстрата (ТМВ).
Полученная окраска зависит от количества специфических антител, присутствующих в образце для тестирования:
При наличии антител раствор имеет синий цвет, который становится желтым после добавления стоп-реагента;
При отсутствии антител раствор не окрашивается.
Процедура анализа
Все реагенты набора перед использованием должны иметь комнатную температуру 21 С0 (±5°С) и однородность (переворачиванием флакона перед применением или перемешиванием с помощью вортекса).
1. Внести:
50 мкл Буферного раствора 19 в каждую лунку.
50 мкл Отрицательного контроля в лунки А1 иВ1.
50 мкл Положительного контроля в лунки С1 и D1.
50 мкл каждого испытываемого образца в оставшиеся лунки
2. Закрыть микропланшет и инкубировать 90 ± 9 мин при температуре 21 «С (+ 5°С).
3. Опустошить лунки. Промыть микропланшет 5 раз Промывочным раствором, внося 300 мкл в каждую лунку. Избегать высыхания лунок между этапами промывки.
4.Подготовить Конъюгат (1Х) разведением концентрата конъюгата (10Х) Буферным раствором 12 в соотношении 1/10
5. Внести 100 мкл Конъюгата1Х в каждую лунку.
6. Закрыть микропланшет и инкубировать 30 ± 3 мин при температуре 21 °С (± 5°С).
7. Опустошить лунки. Промыть микропланшет 5 раз Промывочным раствором, внося 300 мкл в каждую лунку. Избегать высыхания лунок между этапами промывки.
8. Внести 100 мкл Субстратного раствора в каждую лунку.
9. Закрыть микропланшет и инкубировать 15 мин ± 2 мин при температуре 21°С (± 5°С) в темноте.
10. Внести 100 мкл Стоп-реагента в каждую лунку для остановки реакции в том же порядке, как в п.8.
11. Измерить оптическую плотность (ОП) при длине волны 450 нм.
Оптическую плотность раствора измеряют фотометрически при длине волны 450 нм.
Для каждой исследуемой пробы расчитывается процентное значение S/P (S/P%):
S/P % =(ОПобразец- ОПк / ОПк+ — ОПК-)х 100
Результаты анализа образцов, имеющие S/P%:
-меньший 30 % считается отрицательным;
-больший или равный 30 % считается положительным.
До начала, через 7 и 14 дней после начала эксперимента у животных были взяты смывы из влагалища для обнаружения вирусного вакцинного антигена. Поскольку для иммунизации животных использовали вакцину против оспы овец и коз, то для ПЦР диагностики применяли набор реагентов «ПЦР-ОСПА-ФАКТОР» для выявления ДНК вируса оспы овец и коз в биологическом материале методом ПЦР-РВ.
Набор предназначен для выявления ДНК вируса возбудителя оспы овец и коз в биологическом материале (содержимое везикул, пустул, папулы и оспенные корки, фрагменты тканей, кожных покровов, легких, лимфатических узлов) методом амплификации ДНК с флуоресцентной детекцией в режиме «реального времени».
Принцип действия. Набор реагентов позволяет специфически амплифицировать фрагмент генома вирусов оспы овец и коз и ДНК внутреннего положительного контроля (бактериофага Т4) в мультиплексной полимеразной цепной реакции. Детекция продуктов амплификации осуществляется в режиме реального времени с использованием принципа выщепления флуоресцентной метки на 5′ конце олигонуклеотидного зонда.
Полученные данные – кривые накопления флуоресцентного сигнала анализируются с помощью программного обеспечения используемого прибора для проведения ПЦР в режиме «реального времени» в соответствии с инструкцией производителя к прибору и в соответствии с инструкцией. Учет результатов ПЦР-анализа проводится по наличию или отсутствию пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией (что соответствует наличию или отсутствию значения порогового цикла «Ct» для исследуемого образца). Результат считается достоверным в случае корректного прохождения положительных и отрицательных контролей амплификации и экстракции ДНК.
Появление любого значения Ct в таблице результатов для отрицательного контроля этапа экстракции ВК- (на канале JOE(HEX)/Yellow) и для отрицательного контроля этапа ПЦР К- (на любом из каналов) свидетельствует о наличии контаминации реактивов или образцов. В этом случае результаты анализа для всех проб считаются недействительными. Требуется повторить анализ всех проб, а также предпринять меры по выявлению и ликвидации источника контаминации. Образцы, для которых по каналу FAM/Green значение Сt отсутствует или превышает 35 цикл (и при этом по каналу JOE(HEX)/Yellow отсутствует значение Сt) требуют повторного проведения исследования с этапа ПЦР. Задержка в значениях пороговых циклов для исследуемых образцов на канале FAM/Green указывает на присутствие ингибиторов в пробе(ах) или на ошибки при экстракции ДНК или при постановке реакции. Требуется провести исследование, начиная с этапа экстракции ДНК. Образец считается положительным (ДНК вируса оспы присутствует) если наблюдается экспоненциальный рост сигнала на канале JOE(HEX)/Yellow, при этом значения Сt контрольных образцов находятся в пределах нормы. Если для исследуемого образца по каналу JOE(HEX)/Yellow значение Сt определяется позднее 35 цикла при корректном прохождении положительных и отрицательных контролей – он считается спорным и исследуется повторно с этапа выделения ДНК.
2.2. Изучение органолептических свойств, активности и параметров безопасности специфического трансфер-фактора
Таблица 1. Органолептические показатели специфического трансфер-фактора
| Наименование показателя | Характеристика и норма |
| Внешний вид, цвет | Прозрачная, слегка опалесцирующая жидкость.Допускается незначительный осадок. |
| Наличие посторонних примесей, неразбива-ющегося осадка | Не допускается |
При исследовании стерильности роста колоний микроорганизмов на питательных средах не обнаружено.
При постановке реакции бласттрансформации лейкоцитов и учете количества бластных клеток в контроле их не обнаружили, в опыте их количество было 65% от общего числа подсчитанных лейкоцитов.
В виде того, что препарат специфического трансфер-фактора является лекарственным веществом, полученным из лейкоцитов животных, при его производстве используются химические реактивы и ферменты необходимо изучение некоторых параметров острой токсичности.
Острую токсичность препарата изучали на белых мышах массой 20-22 г. Им препарат вводили в максимальных дозах для животных до 12 и животных старше 12 месяцев: 1,5 и 6 мл подкожно. Контрольным животным проводили инъекции физиологического раствора в тех же дозах. Количество животных в опытных и контрольных группах составляло 10 голов на каждый способ введения препарата. При этом повреждающего действия на организм животных не наблюдалось.
Из-за не обнаружения токсического воздействия препарата трансфер-фактора на организм при однократном применении дальнейшие исследования токсичности проводили путем 3-х кратных инъекций с интервалом 6 часов в течении 24 часов наблюдения в аналогичных дозировках.
За мышами обеих групп наблюдали в течении 14 дней, отмечая клинические признаки отравления и гибели. В результате признаков отравления не наблюдалось, потребление корма, количество актов дефекации и мочеотделения не изменилось. Двигательная активность была сохранена, животные адекватно отвечали на внешние раздражения. Кожа естественного слабо-розового цвета, волосяной покров гладкий, прочной удерживается в луковицах. Слизистые оболочки ровные, с умеренным количество слизи, естественный блеск сохранен.
После наблюдения всех опытных животных умерщвляли декапитацией и проводили вскрытие и морфологическое исследование органов. При патологоанатомическом вскрытии различий в строении и патологических изменений во внутренних органах особей опытных и контрольных групп обнаружено не было. Положение органов грудной и брюшной полостей правильное, постороннего содержимого нет. Серозные покровы органов, плевра и брюшина прозрачные, гладкие, блестящие. Слизистые оболочки трубчатых органов (пищевод, желудок, тонкий и толстый отдел кишечника; слизистая оболочка ротовой полости, гортань, трахея и бронхи) бледно-розовые, гладкие, блестящие, собраны в легко расправляющиеся складки. Содержимое органов пищеварения (желудка и тонкого отдела кишечника) пастообразное; содержимое толстого кишечника оформленное в каловые массы специфической формы. Брыжеечные, бронхиальные лимфатические узлы у мышей в объеме не увеличены, сочные на разрезе, деление на корковое и мозговое вещество выражено четко. Печень в размерах не увеличена, края заострены, окраска органа равномерная, паренхима на разрезе не выбухает, желчный пузырь умеренного наполнения. Сердце конусовидной формы, сердечная сорочка конусовидной формы, гладкая, блестящая, прозрачная. Анатомическое деление органа на слои выражено хорошо. Эпикард гладкий, блестящий. Поверхность эндокарда гладкая, блестящая, смыкание сердечных клапанов полное. Селезенка в объеме не увеличена, упругая, пульпа не выбухает. Почки в размерах на увеличены, паренхима светло-коричневого цвета, не выбухает на разрезе, проходимость мочеточников сохранена.
При микроскопическом изучении органов не выявлено отличий в строении и развитии клеток.Под микроскопом структура органов и тканей соответствует видовой норме здоровых животных как в паренхиматозных (печень, почки, сердце, селезенка и лимфатические узлы), так и в трубчатых (пищевод, желудок, тонкий и толстый отделы кишечника) органах. Патологических изменений, характеризующих дистрофию, атрофию, некроз и воспаление, гипертрофические и гиперплазические процессы, не обнаружено. Патологических отложений в виде солей, пигментов также не обнаружено.
Таким образом, специфический трансфер-фактор, применяемый в лечебно-профилактических мероприятиях при нодулярном дерматите, не обладает токсичностью и безопасен для животных.
2.3. Клинические, биохимические и иммунологические изменения у животных молочного направления продуктивности после применения трансфер-фактора при профилактике нодулярного дерматита
При клиническом осмотре всех вакцинированных животных не было обнаружено каких-либо клинических признаков реактогенности вакцины. У животных не отмечалось угнетения, отказа от корма и воды. Положение тела в пространстве естественное, реакция на внешние раздражители адекватная. Видимые слизистые оболочки носа, конъюнктивы, половой системы умеренно влажные, бледно-розового цвета. У одной телки второй опытной группы наблюдалось незначительной угнетение и припухлость на месте инъекции вакцины, которая исчезла на третий день после вакцинации (рисунок 1).
Рисунок 1. Припухлость на месте инъекции вакцины.
Результаты измерения температуры животных опытных групп приведены на рисунке 2.
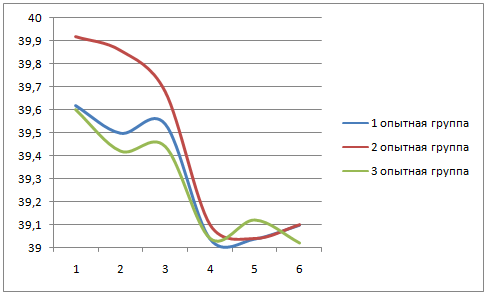
Рисунок 2. Результаты измерения температуры животных.
Измерениями установлено, что вакцинация не вызывает повышения температуры тела животных. Напротив, на протяжении шести измерений произошло снижение температуры тела телок на 0,6-0,9 градуса. При этом необходимо отметить, что наибольшая разница в температуре наблюдалась в группе животных, которым вместе с вакциной был применен Интерферон-Б.
Поскольку вирус оспы овец и коз является эпителиотропным, возможно его выделение через половые пути самок после вакцинации, что в некоторых случаях может обуславливать осложнения после вакцинации в виде абортов и эмбриональной смертности. При этом по нашим наблюдениям у абортов наблюдаются аналогичные нодулярному дерматиту патологоанатомические признаки.
Результаты изучения возможности выделения вируса через слизистые оболочки половых путей приведены в таблице 2.
Таблица 2. Изучение выделения вируса оспы овец и коз через слизистые оболочки половых путей телок
| Период контроля | 1 опытная группа | 2 опытная группа | 3 опытная группа |
| До вакцинации | Вирус оспы овец и коз не обнаружен | Вирус оспы овец и коз не обнаружен | Вирус оспы овец и коз не обнаружен |
| 7 день после вакцинации | Вирус оспы овец и коз не обнаружен | Вирус оспы овец и коз не обнаружен | Вирус оспы овец и коз не обнаружен |
| 14 день после вакцинации | Вирус оспы овец и коз не обнаружен | Вирус оспы овец и коз не обнаружен | Вирус оспы овец и коз не обнаружен |
Данные таблицы 2 свидетельствуют об отсутствии антигенов вакцины в организме животных до вакцинации и их выделения через половые пути животных
Контакт организма животных с вакциной, целью которого является выработка иммунитета, сопровождается не только иммунологическими реакциями, но и глубокими изменениями со стороны гомеостаза внутренней среды. При этом вырабатываются продукты обмена веществ, которые могут оказать негативное влияние на организм животного, порой даже большее, чем сами антигены вакцины. Обеззараживание значительного количества токсических веществ происходит в печени. В таблице 3 приведены данные о влиянии вакцинации против нодулярного дерматита на некоторые биохимические показатели сыворотки крови, характеризующие состояние печени животных.
Таблица 3. Влияние вакцинации животных на некоторые биохимические показатели сыворотки крови
| Показатель | 1 опытная группа | 2 опытная группа | 3 опытная группа | |||
| до вакцинации | после вакцинации | до вакцинации | после вакцинации | до вакцинации | после вакцинации | |
| Активность щелочной фосфатазы, Ед/л | 122,9±13,6 | 130,3±8,9 | 125,3±7,8 | 103,9±11,1 | 101,3±13,2 | 86,0±16,1 |
| Билирубин, мкмоль/л | 3,3±1,1 | 4,6±0,6 | 2,7±0,6 | 5,4±1,1 | 4,1±0,8 | 4,4±0,2 |
| Холестерин, ммоль/л | 1,86±0,09 | 2,22±0,03** | 2,22±0,13 | 2,25±0,09 | 1,83±0,14 | 1,73±0,24 |
** — р<0,01
Данные исследований свидетельствуют о том, что вакцинация животных против нодулярного дерматита без применения иммуностимуляторов вызывает поражение печени у животных. Так, по сравнению с первоначальными наблюдениями, активность щелочной фосфатазы у животных выросла на 6%, содержание билирубина на 39,3%, холестерина на 19,9% (р<0,01). Во второй опытной группе активность щелочной фосфатазы снизилась на 17,1%, содержание билирубина увеличилось на 96%, содержание холестерина увеличилось на 1,4%. В третьей опытной группе активность щелочной фосфатазы по сравнению с первоначальным показателем снизилась на 15,1%, содержание билирубина возросло лишь на 8,4%, а содержание холестерина уменьшилось на 5,5%.
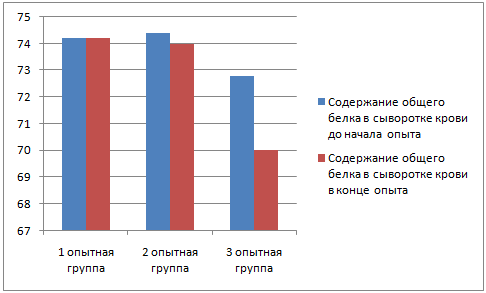
Рисунок 3. Содержание общего белка в сыворотке крови.
Согласно рисунка3 количество общего белка в сыворотке крови у животных первой опытной группы не изменилось, во второй группе оно снизилось на 0,6%, в третьей на 3,8%.
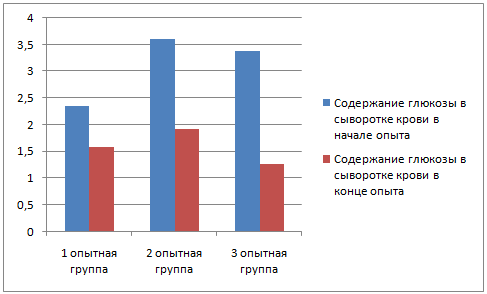
Рисунок 4. Содержание глюкозы в сыворотке крови.
В ходе эксперимента произошло снижение количества глюкозы в сыворотке крови у животных. В первой опытной группе ее содержание уменьшилось на 32,8%, во второй на 47% (р<0,05), в третьей на 63%.
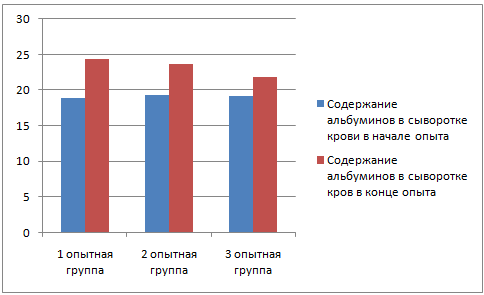
Рисунок 5. Содержание альбуминов в сыворотке крови.
Согласно данным рисунка 5 в крови у животных произошло увеличение количества альбуминов. Так, в первой опытной группе их количество возросло на 29% (р<0,01), во второй на 22% (р<0,05), в третьей на 14%.
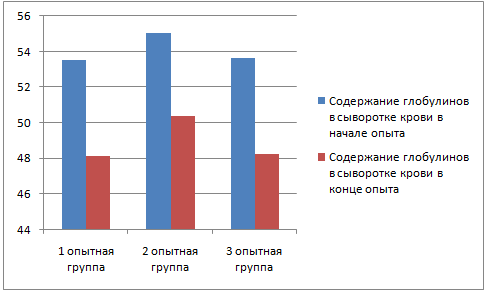
Рисунок 6. Содержание глобулинов в сыворотке крови.
Одновременно с увеличением содержание альбуминов в сыворотке крови произошло снижение количества глобулинов. В первой опытной группе их содержание снизилось на 10,1% (р<0,05), во второй на 8,5%, в третьей на 10,1%.
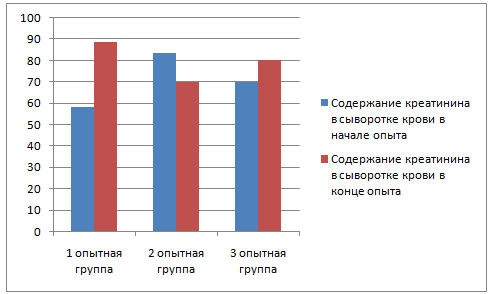
Рисунок 7. Содержание креатинина в сыворотке крови.
В ходе эксперимента в крови у животных первой и третьей опытных групп возросло содержание креатинина на 52% (р<0,01) и 15%. У животных второй опытной группы содержание креатинина снизилось на 16,4%.
При оценке состояния гуморального иммунитета у животных всех опытных групп не выявлен прирост титра антител к вирусу нодулярного дерматита. Однако, вакцинация животных положительно сказалась на таком показателе клеточного иммунитета у животных, как фагоцитарная активность лейкоцитов крови. Результаты ее изучения отражены в таблице 4.
Таблица 4. Фагоцитарная активность лейкоцитов крови животных
| Первая опытная группа | Вторая опытная группа | Третья опытная группа | |||
| Фагоцитарная активность в начале опыта, % | Фагоцитарная активность в конце опыта, % | Фагоцитарная активность в начале опыта, % | Фагоцитарная активность в конце опыта, % | Фагоцитарная активность в начале опыта, % | Фагоцитарная активность в конце опыта, % |
| 38,4 | 42,9 | 38,4 | 44,7 | 37,8 | 45,1 |
Прирост фагоцитарной активности лейкоцитов крови в первой опытной группе составил 11,7% (р<0,001), во второй 16,4% (р<0,001), в третьей 19,3% (р<0,001).
2.4. Клинические, биохимические и иммунологические изменения у животных мясного направления продуктивности после применения трансфер-фактора при профилактике нодулярного дерматита
При клиническом наблюдении за животными после вакцинации не было обнаружено каких-либо клинических признаков реактогенности вакцины. У животных не было состояния угнетения нервной системы, отказа от приема корма и воды. Положение тела в пространстве естественное, реакция на внешние раздражители адекватная, двигательная активность и поведенческие реакции телок адекватны времени суток и физиологическому состоянию. Видимые слизистые оболочки носа, конъюнктивы, половой системы умеренно влажные, бледно-розового цвета.
На рисунке 8 представлены результаты измерения температуры тела животных.
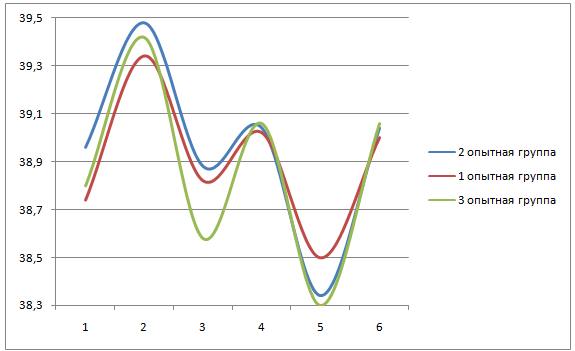
Рисунок. 8. Колебания температуры тела телок после вакцинации
Данные рисунка свидетельствуют об одинаковой тенденции в колебаниях температуры тела животных на протяжении шести измерений. Наибольшее увеличение температуры тела у животных было во второй опытной группе, где для стимуляции иммунного ответа применялся интерферон. Причем, данные изменения наблюдались на протяжении четырех измерений. Наиболее низкие значения температуры тела животных были в третьей опытной группе (трансфер-фактор) через 36 и 60 часов после начала опыта.
Для исключения абортов, вызванных вакцинаций животных была изучена возможность выделения вируса через половые пути животных. Результаты эксперимента отражены в таблице 5.
Таблица 5.Наличие вакцинного вируса в смывах из влагалища животных
| Период контроля | 1 опытная группа | 2 опытная группа | 3 опытная группа |
| До вакцинации | Вакцинный вирус не обнаружен | Вакцинный вирус не обнаружен | Вакцинный вирус не обнаружен |
| 7 день после вакцинации | Вакцинный вирус не обнаружен | Вакцинный вирус не обнаружен | Вакцинный вирус не обнаружен |
| 14 день после вакцинации | Вакцинный вирус не обнаружен | Вакцинный вирус не обнаружен | Вакцинный вирус не обнаружен |
Данные таблицы 5 свидетельствуют об отсутствии антигенов вакцины в организме животных до вакцинации и их выделения через половые пути животных после иммунизации.
Иммунный ответ организма животных после вакцинации сопровождается глубокими биохимическими изменениями со стороны всех органов и тканей, накоплением продуктов метаболизма и токсических веществ. Основную роль в обеззараживании вредных веществ играет печень. В связи с этим были изучены некоторые биохимические изменения в сыворотке крови, характеризующие функцию данного органа. Наглядно они представлены на рисунках 9, 10 и 11.
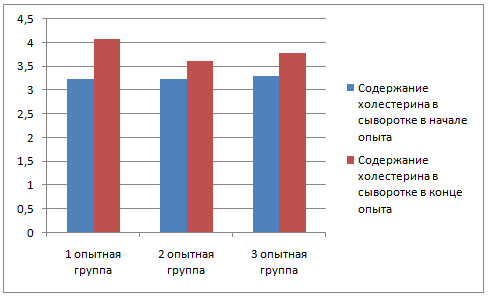
Рисунок 9. Содержание холестерина в сыворотке крови.
Установлено, что по сравнению с первоначальными наблюдениями в сыворотке крови животных первой опытной группы количество холестерина возросло на 26,3% (p<0.01), во второй опытной группе на 12,0%, в третьейна 14,0%.
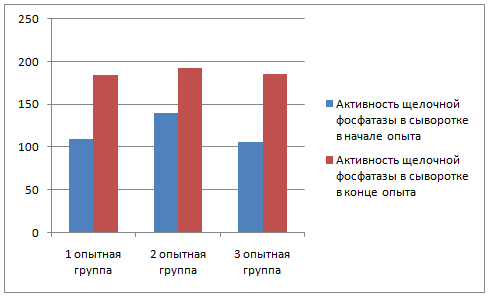
Рисунок 10. Активность щелочной фосфатазы в сыворотке крови.
В результате эксперимента активность щелочной фосфатазы в первой группе увеличилась на 69,3% (р<0,01), во второй на 38,4% (р<0,05), в третьей на 76,0% (р<0,01).
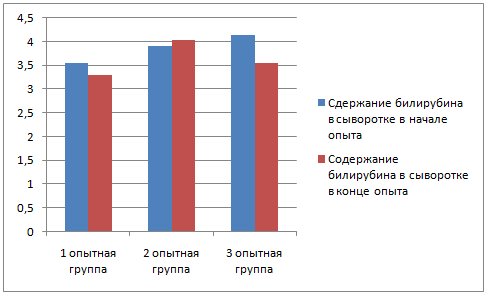
Рисунок 11. Содержание билирубина в сыворотке крови.
Согласно данным рисунка 11 в первой и третьей опытной группах произошло снижение содержания билирубина на 7,0% и 14,0% соответственно. Во второй опытной группе содержание билирубина увеличилось на 3,0%.
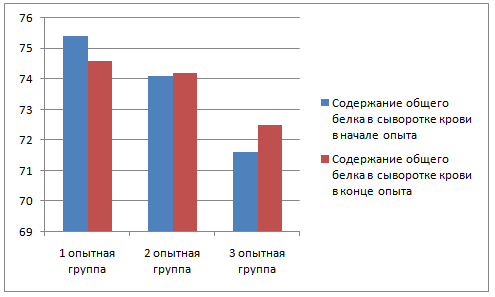
Рисунок 12. Содержание общего белка в сыворотке крови.
Согласно рисунка12 установлено, что содержание общего белка в первой опытной группе снизилось к концу эксперимента на 1,0%, во второй группе выросло на 0,1%, в третьей опытной группе увеличилось на 1,3%.
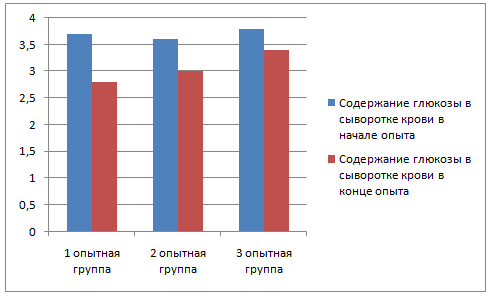
Рисунок 13. Содержание глюкозы в сыворотке крови.
Согласно данным рисунка 13 на протяжении опыта произошло снижение содержания глюкозы в сыворотке крови у животных всех опытных группы: в первой опытной группе оно составило 24,3% (р<0,05), во второй 16,7% (р<0,05), в третьей 10,5% (р<0,05).
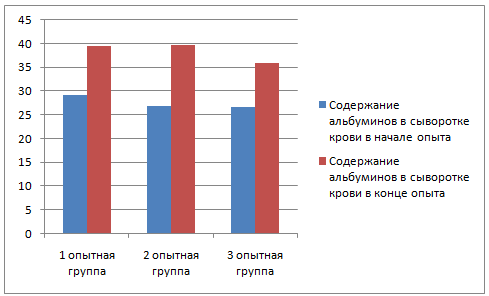
Рисунок 14. Содержание альбуминов в сыворотке крови.
На протяжении эксперимента произошло увеличение количества альбуминов в сыворотке крови у животных. В первой опытной группе их количество увеличилось на 35,3% (р<0,001), во второй опытной группе на 48,1% (р<0,001), в третьей группе на 35,3% (р<0,01).
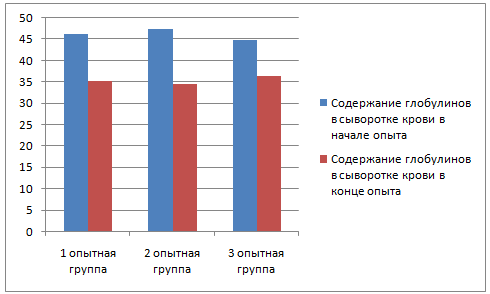
Рисунок 15. Содержание глобулинов в сыворотке крови.
Согласной данных рисунка 15 в период наблюдений произошло снижении концентрации глобулинов в сыворотке крови у животных. В первой группе оно составило 24,0% (р<0,01), во второй 27,2% (р<0,01), в третьей 18,7%.
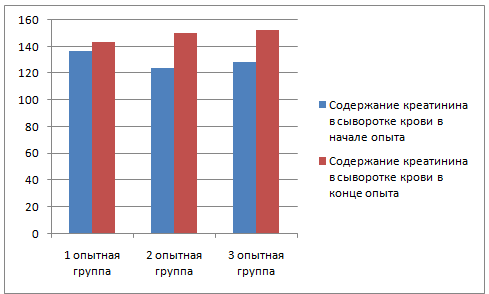
Рисунок 16. Содержание креатинина в сыворотке крови.
На протяжении опыта выросло содержание креатинина в сыворотке кров у животных всех группе. В первой группе его количество увеличилось на 4,8%, во второй на 21,3% (р<0,01), в третьей содержание креатинина увеличилось на 18,2% (р<0,05).
Основная цель вакцинации животных против инфекционных заболеваний – это создание напряженного иммунитета. В таблице 6 приведены результаты иммунизации животных. Результаты сравнивались внутри опытных групп.
Таблица 6. Эффективность вакцинации животных против нодулярного дерматита
| Первая опытная группа | Вторая опытная группа | Третья опытная группа | |||
| Прирост антител, % | Серопозитивные животные, % | Прирост антител, % | Серопозитивные животные, % | Прирост антител, % | Серопозитивные животные, % |
| 60,8% | 40,0 | 47,0% | 60,0 | 72,4%* | 80,0 |
* — р<0,05
В результате изучения формирования иммунитета у животных установлено, что вакцинация позволяет создать напряженный иммунитет у животных. Наибольший прирост антител был в третьей опытной группе – 72,4% (р<0,05). Также в третьей опытной группе было наибольшее количество серопозитивных животных 80,0%. Наименьший прирост антител был во второй опытной группе 47,0%, однако в ней количество серопозитивных животных было 60,0%, что на 20% большей, чем в первой, где прирост антител в сыворотке крови составил 60,8%.
Для оценки состояния клеточного иммунитета изучали фагоцитарную активность лейкоцитов крови животных. Результаты приведены в таблице 7.
Таблица 7. Фагоцитарная активность лейкоцитов крови животных
| Первая опытная группа | Вторая опытная группа | Третья опытная группа | |||
| Фагоцитарная активность в начале опыта, % | Фагоцитарная активность в конце опыта, % | Фагоцитарная активность в начале опыта, % | Фагоцитарная активность в конце опыта, % | Фагоцитарная активность в начале опыта, % | Фагоцитарная активность в конце опыта, % |
| 38,3 | 42,4 | 38,8 | 42,9 | 38,7 | 45,4 |
Данные таблицы 7 свидетельствуют о стимулирующем влиянии вакцинации животных против нодулярного дерматита на клеточное звено иммунитета. Так в первой опытной группы произошел прирост фагоцитарной активности лейкоцитов крови на 10,7% (р<0,05), во второй группе на 10,1% (р<0,01), в третьей группе прирост активности был самым максимальным и составил 17,3% (р<0,001).
2.5. Характеристика случаев абортов после вакцинации животных
При визуальном наблюдении у коров с абортами наблюдался отек вульвы, слизистые истечения с прожилками гноя и хлопьями.
Слизистая оболочка преддверия и влагалища гиперемирована, отечная, влажная; влагалищная часть шейки матки увеличена, ярко-розового цвета, цервикальный канал приоткрыт. При ректальном исследовании отмечали пониженную ригидность или гипотонию матки, утолщение стенок и слабую сплюснутость ее рогов. Яичники часто в состоянии гипофункции, иногда регистрировали персистенцию или гипоплазию желтого тела.
Аборт плоды со сроком беременности 1-2 месяца не отличались от таковых при обычной эмбриональной смертности. Цельность их нарушена не была, плод располагался в плодных оболочках. Плодные оболочки прозрачные, гладкие, околоплодные воды прозрачные, однородные, студенистой консистенции. Размеры и внутреннее строение плода соответствуют сроку стельности 1,5 месяца. Задержания плодных оболочек в половых путях коров на таком сроке беременности не наблюдалось.
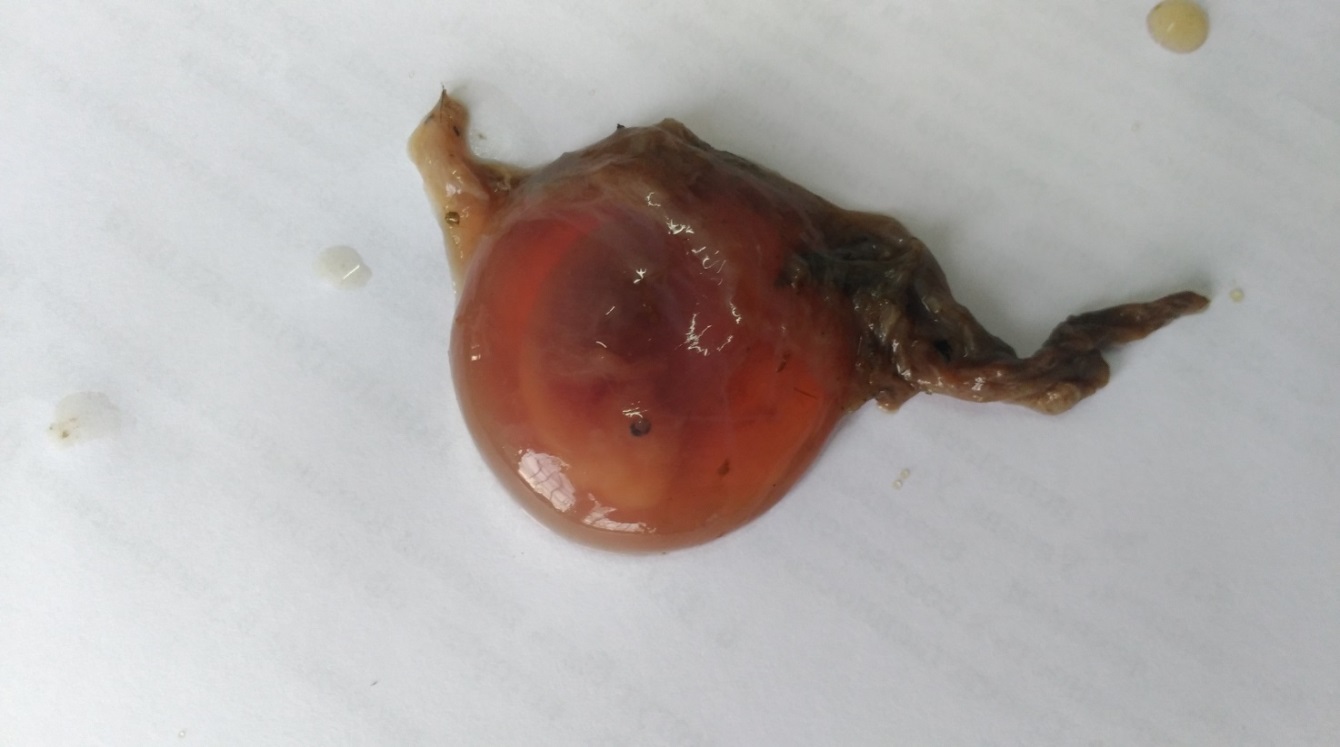
Рисунок 17. Аборт-плод 1,5 мес. в плодных оболочках.
Рисунок 18. Аборт-плод 1,5 мес. без плодных оболочек.
При абортах у животных на более ранних сроках стельности патологических изменений и нарушений в строении плодов не наблюдалось. Положение внутренних органов у абортов правильное, развитие и состояние соответствуют сроку стельности 3 месяца.
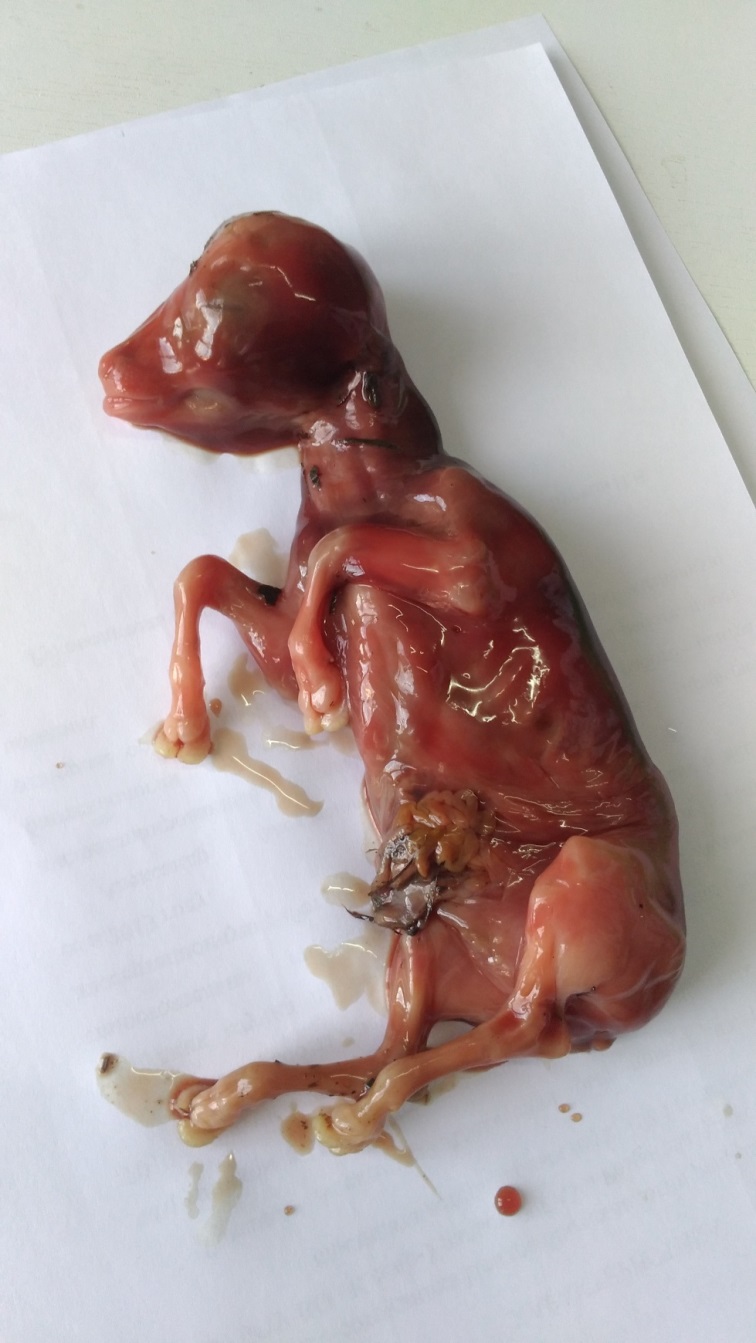
Рисунок 19. Аборт-плод, 4 месяца.
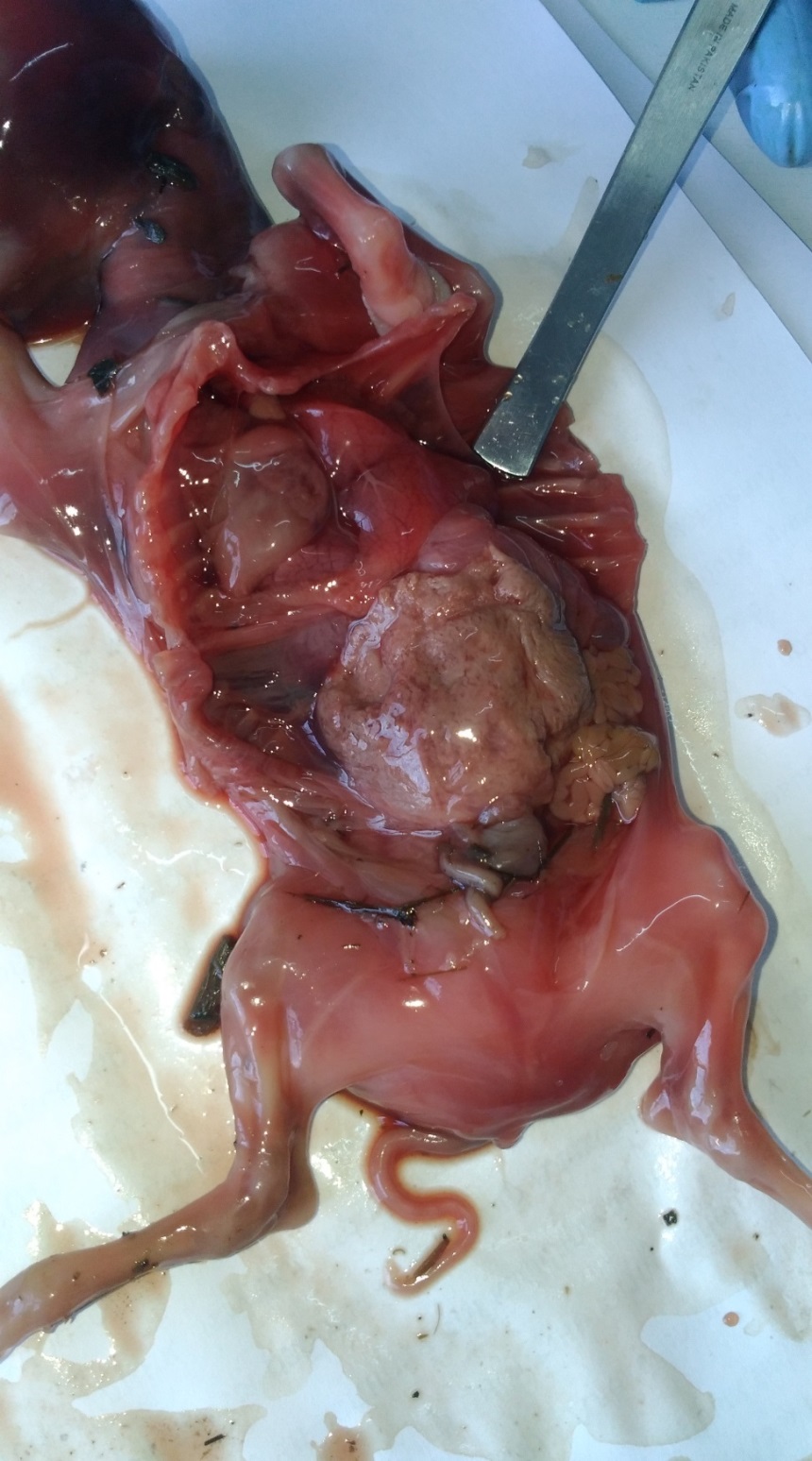
Рисунок 20. Состояние органов грудной и брюшной полостей аборт-плода, 4 месяца.
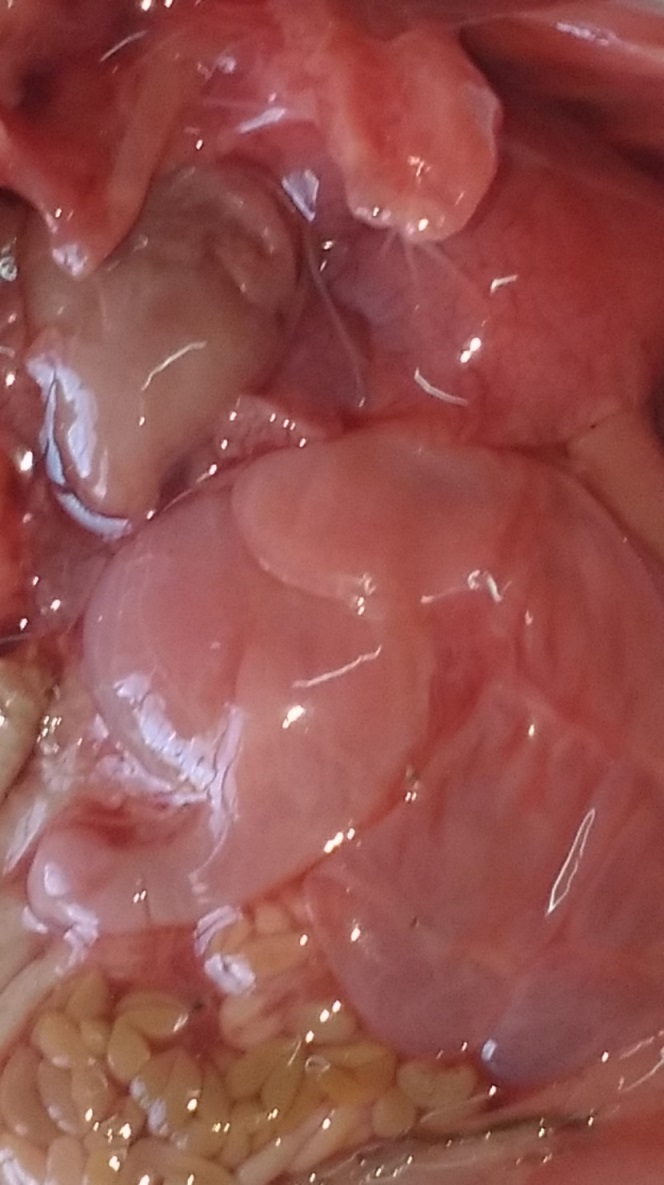
Рисунок 21. Отечность внутренних органов аборт-плода
При патологоанатомическом вскрытии 4-5 месячных аборт-плодов наиболее яркие изменения отмечаются на кожных покровах. У плодов наблюдаются различного размера от горошины до лесного ореха нодулы, При этом, некоторые из них сохраняют целостность анатомического строения, содержат значительное количество полупрозрачного водянистого содержимого. Вскрывшиеся образования имеют ровные края и гладкое дно (рисунок 22).
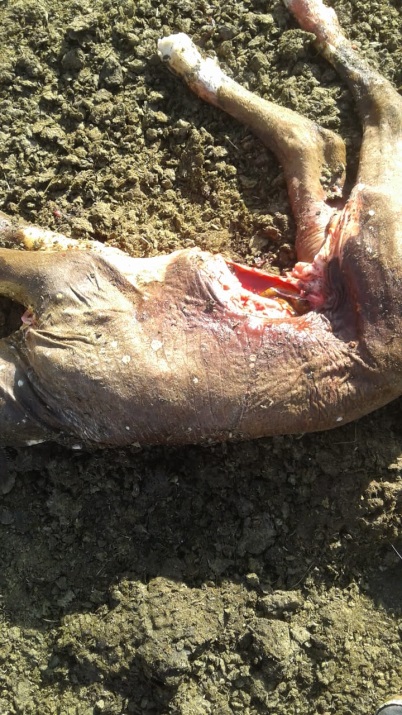
Рисунок 22. Аборт плод. Нодулы на кожных покровах.
Также для таких аборт-плодов характеры отеки подкожной клетчатки, скопление в брюшной и грудной полостях жидкости буро-красного цвета с фибрином, кровоизлияния на слизистых и серозных оболочках, зернистая дистрофия и некротические очаги в печени. Как правило у абортировавших коров наблюдались задержания последов.
После вынужденного убоя при наружном и внутреннем осмотре матка слегка увеличена, цвет органа розовый с желтоватым оттенком цвета, дряблой консистенции, стенки утолщены. В полости матки иногда небольшое количество экссудата, поверхность эндометрия светло-розовая, тусклая. Отдельные участки слизистой оболочки матки гиперемированы, на карункулах имеются остатки плаценты. Яичники, как правило, в размерах не увеличены, гладкие, упругой консистенции. Фолликулы не обнаруживаются. В правом или левом яичнике как правило обнаруживаются желтые тела, порой занимающие весь объем органа.
2.6. Эффективность использования трансфер-фактора при профилактике абортов и эмбриональной смертности
Для повышения эффективности мероприятий у животных контрольных и опытных групп рацион кормления был сбалансирован по основным питательным веществам, кроме того в него был введен специальный премикс, повышающий фертильность животных Минвит-6.
Минвит-6 содержит все необходимые микро- и макроэлементы, стимулирует рост и размножением микрофлоры рубца, стабилизирует метаболизм, профилактирует возникновение кетозов, повышает фертильность коров. В состав кормовой добавки входят все необходимые микроэлементы в органической форме, что стимулирует иммунитет у животных и инволюционные процессы в половых органах. В качестве гепатопротектора представлен пропиленгликоль, пропионат аммония, карнитин, метионин и ниацин. Для стимуляции переваривания кормов и профилактики расстройств желудочно-кишечного тракта в добавку введен пробиотик. В премик также входят витамины. Норма ввода МИНВИТа-6 от 250 г на голову в сутки.
Половая охота у животных при искусственном осеменении характеризовалась повышением двигательной активности, частым мычанием, снижением молочной продуктивности, покраснением и набуханием половых гут, выделением из них прозрачной, а затем мутноватой слизи.
При ректальном исследовании матка коров имела повышенную регидность, рога и межроговая борозда при поглаживании хорошо прощупывались, выделение слизи при этом увеличивалось. В правом или левом яичнике при ректальной пальпации хорошо отличался доминантный фолликул, представляющий собой тонкостенный пузырек, размером 0,8-1,5 см. Стенки фолликула флюктуировали при пальпации. В некоторых случаях наблюдалась овуляция и овуляционная ямка.
Коров черно-пестрой (молочной породы) осеменяли двукратно, с интервалом 12 часов ректо-цервикальным способом. После осеменения для контроля за овуляцией производили внутримышечную инъекцию препарата гонадотропинрелизинггормона «Сурфагон».
Учет случаев эмбриональной смертности проводили из времени прихода животных в охоту после искусственного осеменения, поскольку считается, что при осеменении животных оплодотворение происходит в 90-100% случаев.
После осеменения за животными вели наблюдение на предмет прихода в охоту через 18-21 день.
Таблица 8. Показатели эффективности осеменения коров
| Группа животных | Количество голов | Стельных после 1 осеменения | Стельных после 2 осеменения | Стельных после третьего осеменения | |||
| голов | % | голов | % | голов | % | ||
| Контрольная | 200 | 130 | 65 | 17 | 8,5 | 25 | 12,5 |
| Опытная | 200 | 155 | 77,5 | 30 | 15 | 15 | 7,5 |
Согласно данным таблицы в контрольной группе не произошло плодотворного оплодотворения у 28 коров, эмбриональная смертность составила 14% (произошли аборты у трех голов), в опытной группе стали стельными все животные.
Осеменение коров герефордской (мясной породы) проводили после предварительной синхронизации охоты с использованием следующей схемы: 1, 3 и 5 дни синхронизации инъекции 4%-ного масляного раствора прогестерона внутримышечно по 4 мл, 7 день 2 мл препарата ПГФ-вейкс внутримышечно. Животных осеменяли через 60 часов после последней инъекции, однократно. После осеменения для контроля за овуляцией производили внутримышечную инъекцию препарата гонадотропинрелизинггормона «Сурфагон». Через 40 дней после искусственного осеменения к коровам запускали быков-производителей на 60 дней. Результаты осеменения животных отражены в таблице 9.
Таблица 9. Показатели эффективности осеменения животных
| Группа животных | Количество голов | Стельные животные | |
| голов | % | ||
| Контрольная | 200 | 178 | 89 |
| Опытная | 200 | 200 | 100 |
В контрольной группе плодотворное осеменение произошло лишь у 178 животных, эмбриональная смертность составила 11%, в опытной группе стельными стали 100% коров.
При ультразвуковом исследовании не установлено породных отличий в случаях эмбриональной смертности. Как правило, гибель эмбриона начинается с уменьшения количества околоплодных вод и последующего рассасывания зародыша (рисунки23, 24, 25, 26).
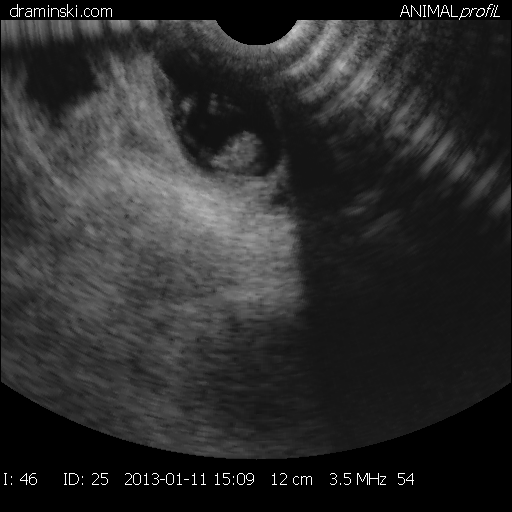
Рисунок 23. Снижение количества околоплодных вод в роге матки. Срок стельности 1,5 месяца.
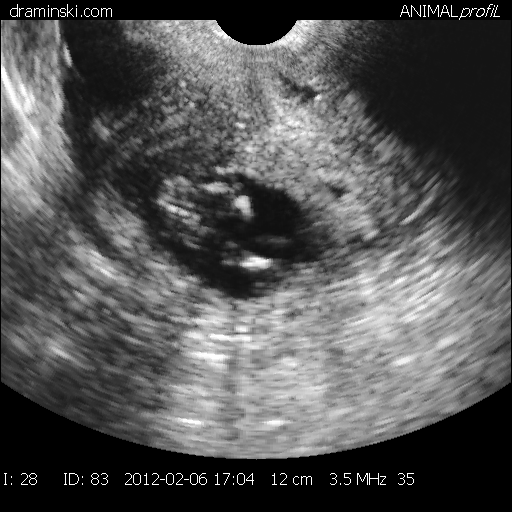
Рисунок 24. Снижение количества околоплодных вод в роге матки. Срок стельности 2,5 месяца.
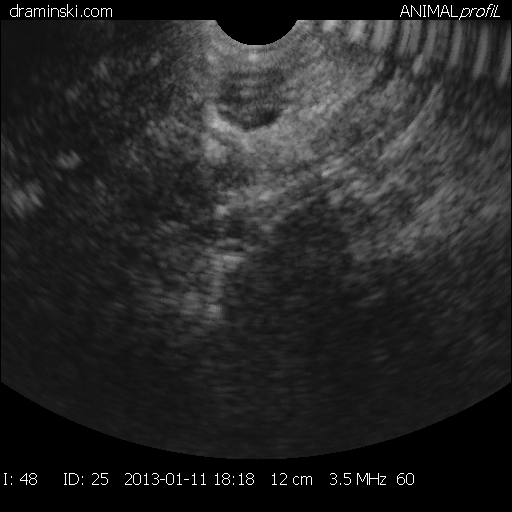
Рисунок 25. Гибель и рассасывание эмбриона. Срок стельности 2 месяца.
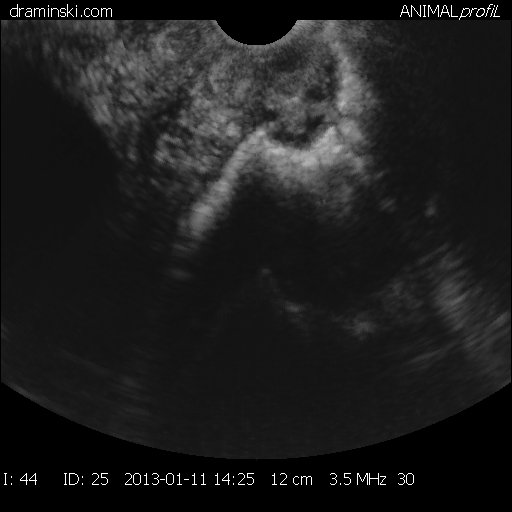
Рисунок 26. Гибель и рассасывание эмбриона. Срок стельности 2,5 месяца.
2.7. Использование трансфер-фактора при лечении животных, больных нодулярным дерматитом
В неблагополучном пункте стадо, состоящее из 40 голов крупного рогатого скота, разделили на две группы по 20 животных в каждой: контрольную и опытную. В каждой группе было обнаружено по 3 животных с признаками нодулярного дерматита: лихорадка, отказ от корма, угнетение. Всех животных привили вирусвакцинойпротив оспы овец и заразного узелкового дерматита КРС культуральной сухой «ШипПокс-ЛСД вак». Вакцину применяли согласно наставлению. Коровам опытной группы дополнительно внутримышечно произвели инъекцию трансфер-фактора в объеме 6 мл на голову двукратно с интервалом 24 часа. Животным всех групп оказывали симптоматическое лечение препаратом «Бициллин-5» в дозе 10000 Ед/кг массы тела. В течении трех недель наблюдения за животными в контрольной группе число случаев заболевания животных составило 8, в опытной – 1 голова. В контрольной группе впри осложнении заболевания были вынужденно убиты 4 животных. Убоя животных в опытной группе не проводили. В опытной группе выздоровление ранее заболевших животных и вновь заболевших животных происходило на 5-6 сутки после вакцинации и применения трансфер-фактора. При этом прекращался рост и увеличение числа пузырьков, они исчезали без вскрытия. В контрольной группе выздоровление животных сопровождалось вскрытием пузырьков и нагноением раны. Выздоровление наступало на 7-8 день.
Этапы развития болезни и выздоровления животных отображены на рисунках 27, 28, 29.
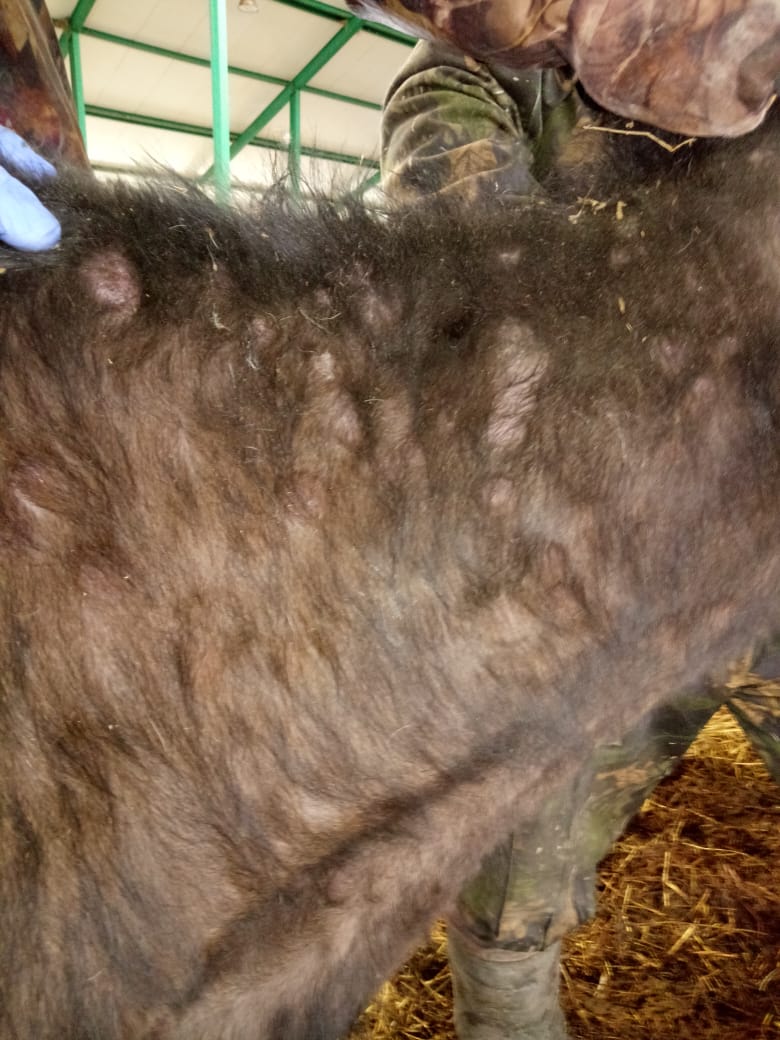
Рисунок 27. Образование нодул (узелков) под кожей.

Рисунок 28. Вскрытие нодул и образование язв.
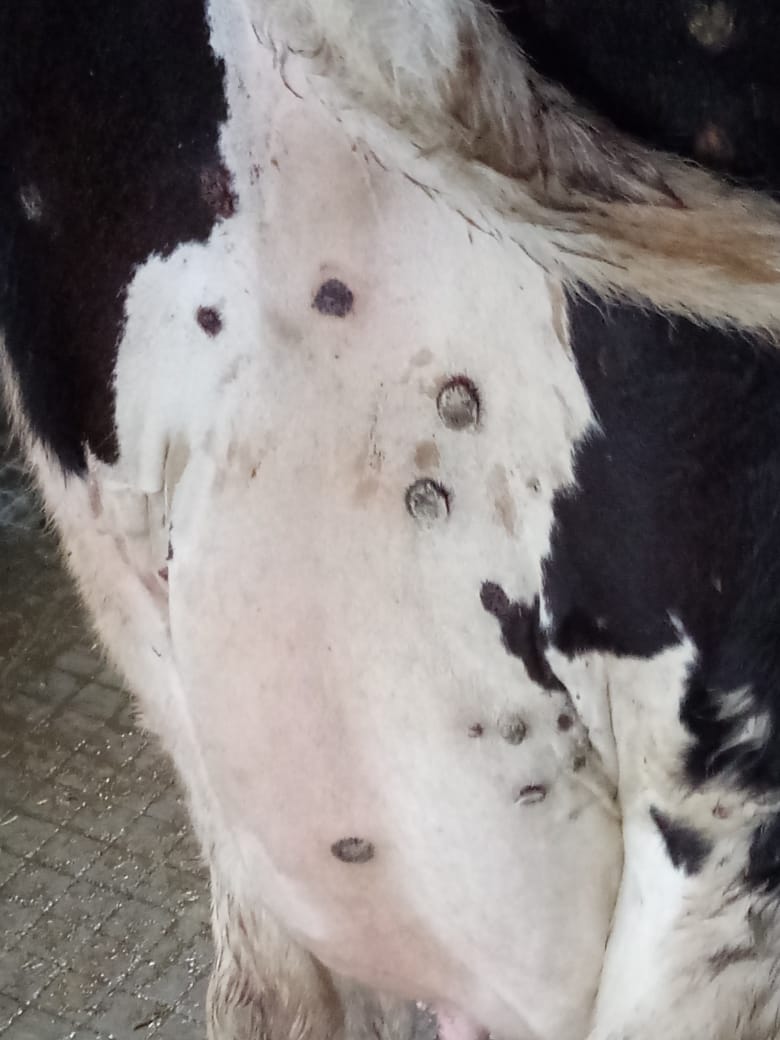
Рисунок 29. Рубцевание и заживление нодул.
В случае вынужденного забоя и снятия шкуры с животного были обнаружены характерные патологоанатомические изменения в подкожной клетчатке, представляющие собой кровоизлияния с углубленным более светлым дном и красными краями (рисунок 30).
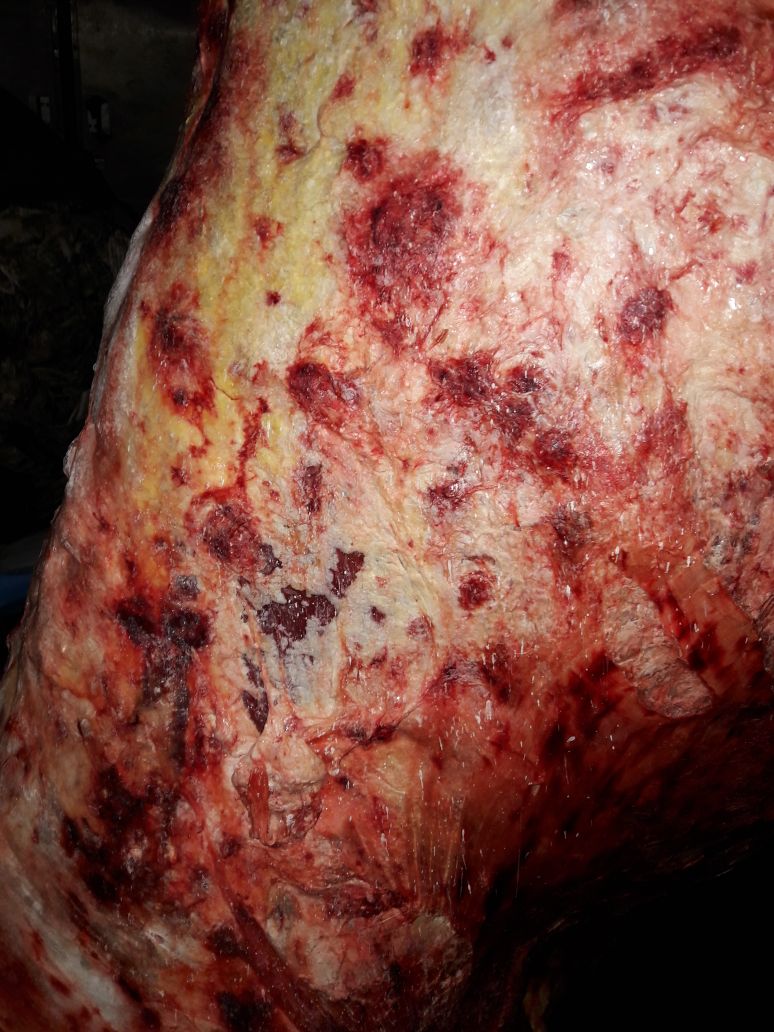
Рисунок 30. Кровоизлияния в подкожной клетчатке вынужденно убитого животного.
Влияние использования трансфер-фактора при лечении нодулярного дерматита крупного рогатого скота на некоторые показатели гомеостаза животных
На рисунке 31 представлено влияние трансфер-фактора на некоторые показатели дыхательной функции крови животных.
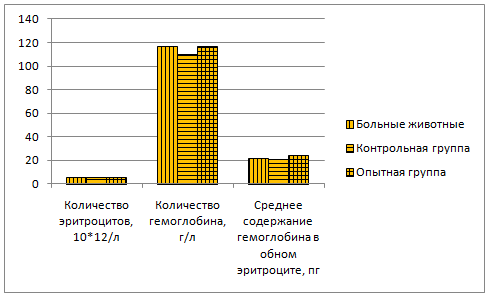
Рисунок 31. Состояние дыхательной функции крови животных.
Согласно данныхрисунка 31 следует, что у животных контрольной группы посравнению с больными количество эритроцитов увеличилось на 3,7%, количество гемоглобина снизилось на 6%, среднее содержание гемоглобина в одном эритроците уменьшилосьна 7,4%.
При использовании для лечения трансфер-факторасодержание красных клеток кровиуменьшилось на 7,4%, количество гемоглобина увеличилось на 0,5%, среднее содержание гемоглобина в одном эритроците возросло на 10,5%, соответственно.
Показатели белкового профиля сыворотки крови отражены нарисунке 32.
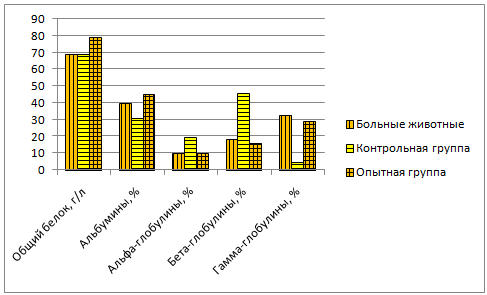
Рисунок 32. Белковый профиль сыворотки крови животных.
Данные рисунка32 свидетельствуют об увеличении содержания общего белка в крови животных опытной группы на 14,5% (Р<0,05) после терапии трансфер-фактором. Концентрация общего белка у животных контрольной группы за период опыта не изменилась. У животных контрольной группы произошло увеличение содержания альфа-глобулинов на 93,9% (Р<0,05), на 2% увеличились альфа-глобулины в опытной группе. Также необходимо отметить, что в контрольной группе животных бета-глобулины увеличились в 1,5 раза (Р<0,05) по сравнению с верхней границей физиологической нормы, а концентрация гамма-глобулинов наоборот снизилась на 85,4% (Р<0,05).
2.8. Экономическая эффективность мероприятий
Экономический эффект применения трансфер-фактора выражается в дополнительно полученной продукции – молодняке крупного рогатого скота молочного и мясного направления продуктивности.
Стоимость теленка молочной породы при рождении определяется по формуле:
Ст=3,61*Ц,
стоимость теленка мясной породы при рождении определяется по формуле:
Ст=0,88*Ц
где 3,61 – количество молока (ц), которое можно получить за счет кормов, расходуемых на образование 1 головы приплода молочных пород; 0,88 – прирост живой массы мясного скота (ц), который можно получить за счет кормов, расходуемых на образование 1 головы приплода мясных пород; Ц – цена реализации 1 ц молока базисной жирности или цена реализации 1 ц живой массы крупного рогатого скота, р.
Стоимость теленка черно-пестрой породы составила 3,61*2250=8122,5 рублей.
Стоимость всех дополнительно полученных телят составила 28*8122,5=227430,0 рублей.
Стоимость трансфер-фактора на одну голову 6 рублей, на 200 опытных голов 1200 рублей.
Таким образом, экономическая эффективность на 1 рубль затрат составила (227430-1200)/1200= 188,52 рублей.
Стоимость теленка герефордской породы составила 0,88*13000=11440 рублей.
Стоимость всех дополнительно полученных телят составила 22*11440=251680,0 рублей.
Стоимость трансфер-фактора на одну голову 6 рублей, на 200 опытных голов 1200 рублей.
Таким образом, экономическая эффективность на 1 рубль затрат составила (251680-1200)/1200=208,73 рублей.
Заключение
В соответствии с тематическим планом-заданием на выполнение научно-исследовательских работфедеральным государственным бюджетным образовательным учреждением высшего образования«Южно-Уральский государственный аграрный университет»по заказу Минсельхоза России за счет средств федерального бюджета в 2020 годуцелью работы служила оценка эффективности применения специфического трансфер-фактора при лечении и профилактике нодулярного дерматита и его осложнений у крупного рогатого скота.
В ходе исследований предложена методика получения специфического трансфер-фактора для профилаткики и лечения нодулярного дерматита и его осложнений в виде абортов и эмбриональной смертности у крупного рогатого скота молочного и мясного направления продуктивности. Для получения трансфер-фактора была использована вирусвакцина против оспы овец и заразного узелкового дерматита крупного рогатого скота культуральную сухую «ШипПокс-ЛСД вак», которую для усиления активности препарата применяли животным-донорам крови трехкратно, с интервалом 15 дней в одной, двух и четырехкратной дозе. При оценке полученного специфического трансфер-фактора установлена его высокая активность в реакции бласттрансформации лейкоцитов – 65% бластных клеток от общего количества лейкоцитов.
При изучении параметров безопасности трансфер-фактора установлено, что препарат является не токсичным, не вызывает побочных реакций и безопасен для животных.
Клиническими исследованиями применения трансфер-фактора при вакцинации животных против нодулярного дерматита установлено, что применение трансфер-фактора не вызывает существенного изменения температуры тела у животных после вакцинации. У животных молочной породы препарат позволяет избежать изменений на месте применения вакцины.
При изучении биохимических показателей сыворотки крови нашими исследованиями установлено, что вакцинация животных молочной породы против нодулярного дерматита вызывает поражения печени, что проявляется в увеличении уровня билирубина, холестерина и активности щелочной фосфатазы в сыворотке крови. Применение препарата совместно с гепатопротектером (препарат Айсидивит) позволяет уменьшить негативное воздействие вакцинации на печень животных. Так, по сравнению с первоначальными наблюдениями в контрольной группе активность щелочной фосфатазы у животных выросла на 6%, содержание билирубина на 39,3%, холестерина на 19,9% (р<0,01). В опытной группе активность щелочной фосфатазы по сравнению с первоначальным показателем снизилась на 15,1%, содержание билирубина возросло лишь на 8,4%, а содержание холестерина уменьшилось на 5,5%.
У животных мясной породы комбинированное применение трансфер-фактора и препарата Айсидивит также снизило отрицательное воздействие вакцинации на печень животных (произошло наибольшее количественное снижение билирубина в сыворотке крови на 14%).
Вакцинация животных против нодулярного дерматита вызывает увеличение титров антител только у животных мясной породы. При этом проявляется как иммуностимулирующий эффект – происходит увеличение прироста антител на 72,4% в опытной группе, против 60,8% в контрольной, так и иммуномодулирующий эффект – происходит увеличение количества серопозитивных животных 80% в опытной группе и 40% в контрольной группе.
И у молочных и у мясных пород животных при применении препарата происходит стимуляция клеточного звена иммунитета. Это проявляется в увеличении фагоцитарной активности лейкоцитов крови животных. У животных молочной породы она увеличивается на 19,3% в опыте, против 11,7% в контроле. У животных мясной породы увеличение произошло соответственно на 17,3% и 10,7%.
При изучении возможности выделения антигена вакцины через половые пути самок после вакцинации как возможной причины абортов у животных установлено, что вирус в половых путях обнаруживается.
Применение трансфер-фактора при вакцинации животных позволило сократить случаи абортов и эмбриональной смертности у животных молочной породы на 14%, у мясной на 11%.
При ультразвуковом исследовании не установлено породных отличий в случаях эмбриональной смертности. Как правило, гибель эмбриона начинается с уменьшения количества околоплодных вод и последующего рассасывания зародыша.
При изучении использования трансфер-фактора при лечении животных, больных нодулярным дерматитом установлено, что в опытной группе срок выздоровления составляет 5-6 дней, в контрольной 7-8 дней. При этом использование трансфер-фактора позволяет профилактировать гибель животных. При изучении некоторых биохимических и гематологических параметров крови животных установлено, что применение трансфер-фактора позволяет стимулировать дыхательную функцию крови и белковый обмен.
Экономическая эффективность применения трансфер-фактора при вакцинации животных против нодулярного дерматита на 1 рубль затрат у животных молочной породы составила 188,52 рублей, у животных мясной породы 208,73 рублей.
При вакцинопрофилактике нодулярного дерматита у животных рекомендуем для повышения уровня иммунного ответа, снижения количества абортов и эмбриональной смертности рекомендуем использовать специфический трансфер-фактор, полученный из крови животных в дозе 1,5 мл для животных до 12 месячного возраста и 6 мл для животных старше 12 месяцев, двукратно с интервалом 24 часа. Для повышения эффективности вакцинации рекомендуем использовать витаминный препарат Айсидивит. В случае возникновения заболевания животных нодулярным дерматитом рекомендуем использовать трансфер-фактор при лечении больных с одновременной вакцинацией.
