Титульный лист и исполнители
РЕФЕРАТ
Отчет 23 с.,7рис., 11 табл., 13источн.
ПРОДУКТИВНОСТЬ СЕЛЬСКОХОЗЯЙСТВЕННОЙ ПТИЦЫ, ОДНОНУКЛЕОТИДНЫЙ ПОЛИМОРФИЗМ, ЭКСПРЕССИЯ ГЕНОВ, ДНК-МАРКЕРЫ
Цель – создание современных методов селекции сельскохозяйственной птицы с использованием ДНК-маркеров хозяйственно-полезных признаков.
Экспериментальные исследования проведены в международной лаборатории молекулярной генетики и геномики сельскохозяйственной птицы на базе кафедры зоогигиены и птицеводства им А.К. Даниловой и в условиях селекционно-генетического центра «Смена», Московской области.
Исследования выполнены на линейной птице кросса «Смена-8» линий Б7 быстрооперяющиеся, Б7 медленнооперяющиеся, а также Б6.
Выполнен сбор индивидуальных показателей по мясной продуктивности птицы в возрасте 40 суток по живой массе, конверсии корма и яичной продуктивности до 30-ти недельного возраста.
Выделена ДНК из крови и РНК из тканей птицы, выявлены и проанализированы полиморфизмы в генах мясной и яичной продуктивности: гена рецептора дофамина, гена миостатина MSTN или GDF-8, гена пролактина PRL, гена рецептора пролактина PRLR, гена гормона роста GH, гена проопиомеланокортина.
Установлено распределение аллелей и генотипов по каждой линии по каждому полиморфизму.
Проанализирована связь между каждым полиморфизмом и признаками продуктивности птицы.
ВВЕДЕНИЕ
Новые методы молекулярной биологии позволяют обнаруживать полиморфизм локусов кодируемых белками генов, связанных с продуктивными признаками животных и птиц. Эти локусы могут быть использованы в качестве молекулярных маркеров в программах селекции для улучшения определенных признаков [3]. Наибольший интерес для выявления взаимосвязи различных генов с хозяйственно-полезными признаками представляют варианты генетического полиморфизма, находящихся в генах и регуляторных областях (QTL регионы) и отвечающих за определенный признак. Использование генетического полиморфизма генов, отвечающих за продуктивность, может повысить интенсивность селекции и раскрыть генетический потенциал птиц. Использование молекулярных маркеров в современной генетике позволяет значительно ускорить процесс селекции в сельском хозяйстве, как в животноводстве, так и в птицеводстве [1].
В основе геномной селекции лежит изучение полиморфизма целевых генов, аллельные варианты которых связаны с продуктивными качествами животных. Аллельные варианты функциональных генов возникают в результате различных модификаций нуклеотидного состава, таких как точечные мутации (SNP), инсерции / делеции участков на 10-20 пар нуклеотидов или микросателлиты (повторы по 5-7 п.н.). Наиболее интересен поиск полиморфизма в генах, которые кодируют регуляторные белки, участвующие в контроле роста и дифференцировки, в частности гормоны. В свою очередь физиологический эффект любого гормона напрямую зависит от его рецептора, что определяет целесообразность изучения полиморфизма генов, кодирующих как сами гормоны, так и их рецепторы [4].
ДНК-маркеры – это полиморфные участки ДНК с неизвестными функциями, но с известной позицией в хромосоме. Преимущество ДНК-маркеров в том, что изменения в последовательности ДНК являются первопричиной всех последующих изменений организма. Кроме того, они обеспечивают возможность анализа любых последовательностей генома, а не только белок-кодирующих [5].
В селекционных программах кроссов российской селекции пока нет ДНК-маркеров для повышения экономически значимых признаков. Поэтому разработка ДНК-маркеров, связанных с конкретными признаками позволит повысить точность оценки, эфективность селекции, а также проводить отбор всех особей по признакам характерным для особей одного пола. Например, качество и количество спермопродукции, яйценоскость, масса яйца.
1 Материал и методы исследований
Оценка особей по фенотипу проведена в птичниках «Селекционно-генетического центра «Смена» на птице линий Б6, Б7 быстро- и медленнооперяющейся. Была проведена фенотипическая оценка по признакам живой массы, развитию грудных и бедренных мышц (балльная оценка), возрасту снесения первого яйца, массе яйца в 26 недель, яйценоскости к 30-недельному возрасту.
Тотальная РНК была выделена из тканей грудных мышц исследуемых кур. Для выделения использовали набор RNeasyMidiKit (Quiagen, Германия). Выделение проводили при использовании автоматической станции QIAcubeconnect, предназначенной для выделения нуклеиновых кислот и белков. Качество выделенной тотальной РНК контролировали количественно с помощью прибора Qubit 3.0.
Геномная ДНК была извлечена из образцов крови (0,9 мл крови), отобранных путем взятия пробы из подкрыльцовой вены от кур исходных линий кросса «Смена-8» – Б6, Б7м/о, Б7б/о. Кровь помещали в пробирки с 10% антикоагулянтом цитратом натрия и хранили при -20 °С.
Выделение ДНКиз крови на приборе QIACubeconnect проводили с использованием набора DneazyBloodandTissueKit (Quiagen, Германия) в автоматическом режиме.
Классическая ПЦР проводилась на амплификаторе «MiniAmpThermalCycler» (TermoFisherScientific), в пробирках для ПЦР объемом 0,2 мл.Последовательность праймеров для каждого полиморфизма приведена в таблице 1.
Таблица 1 –Праймеры исследуемых генов и их температура отжига
| Ген | Праймер | Маркер | Температура отжига | Размер цепочки |
| MST2109 | F: AACCAATCGTCGGTTTTGAC
R: CGTTCTCTGTGGGCTGACTA |
SNPG/A | 62C | 260/297 |
| MST 2244 | F: TAGTCAGCCCACAGAGAACG
R: CGAAAGCAGCAGGGTTGTTA |
SNP C/G | 62C | 320 |
| PRL2402 | F: AGAGGCAGCCCAGGCATTTTAC
R: CCTGGGTCTGGTTTGGAAATT |
SNP С/Т | 62C | 442 |
| Рецептор дофамина D2 | F:TGCACTTCAATCCTTCCCAGCTT
R: TTGCGCTGCCCATTGACCA |
InDel | 64°С | 187/165 |
| PRL индел | F: GGTGGGTGAAGAGACAAGGA
R: TGCTGAGTATGGCTGGATGT |
InDel | 60°С | 154/130 |
Продолжение таблицы 1
| GH 1 интрон | F: ATCC-CCAGGCAAACATCCTC
R: CCTCGACATCCAGCTCACAT |
SNP | 55°С | 776 |
| POMC | F: ATGCGGGGCGCGCGCTGTGCC
R: ATGCGGGGTGCGCTGTGCC |
BHQ С/Т | 60°С | 90 |
Состав реакционной смеси:
- 2,5 мкл 10-кратного реакционного буфера;
- 2,5 мклdNTP;
- По 1 мкл каждого праймера;
- 0,3 мкл полимеразы;
- 15,7 мкл воды свободной от нуклеаз;
- 2 мкл геномной ДНК.
Режим амплификации (35 циклов):
- Прединкубация 94ºС – 5 мин;
- Денатурация 94ºС – 30 сек;
- Отжиг праймеров – t приведена в таблице 1 – 45 секунд;
- Элонгация 72ºС – 60 секунд;
- Окончательная элонгация 72ºС – 10 минут
Детекция инсерции/делеции проводилась сразу после амплификации таргетного участка;
Для детекции однонуклеотидного полиморфизма было необходимо провести рестрикцию – разрезание эндонуклеазой рестрикции в месте узнавания;
Рестрикция проводилась в термостате Гном:
- Состав реакционной смеси:
- 2 мкл 10-кратного буфера
- 0,5 – 2 мкл рестриктазы
- 7-10 мкл – исследуемой ДНК
- 15-18 мкл – Н2О без нуклеаз
Режим рестрикции:
- Инкубация – 37ºС – 4,5-6 часов
- Температурная инактивация – 65ºС 20 минут
- Охлаждение – 18ºС
Детекция полиморфизмов проводилась в 1-3% агарозном геле с ТВЕ-буфером и бромистым этидием при напряжении 150 В в течение 40 минут. Использовали маркер, позволяющий оценить длину фрагментов ДНК на геле – «100+ bp DNA Ladder» (Евроген, Россия). Гель-документация и обработка проводили на оборудовании Bio-RadGeldoc.
Частоты встречаемости генотипов были рассчитаны по формуле (1)
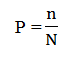 |
(1) |
где n – число встречаемости особей с определенным генотипом,
N – общее число выборки.
Частоты встречаемости аллелей по формуле (2):
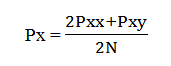 |
(2) |
2 Результаты исследований методов селекции сельскохозяйственной птицы и их обсуждение
Нами были изучены полиморфизмы генов, связанных с продуктивными признаками на предмет их наличия у линейной птицы кросса «Смена-8», а также распределение аллелей и связь полиморфизма с хозяйственно-полезными признаками.
Ген GDF-8 (MSTN) или миостатин является членом трансформирующего фактора роста-бета и оказываетнегативное воздействие на рост скелетной мускулатурыу позвоночных животных ичеловека. Ген миостатина у кур, расположенный на хромосоме 7, успешно секвенирован и состоит из 3 экзонов и 2 интронов. Однонуклеотидные замены обнаружены в разных участках этого гена, а основная работа ведется в направлении поиска взаимосвязей хозяйственно-полезных признаков и отдельных замен. В дальнейшем эти маркеры могут служить помощниками в отборе птицы для дальнейшего разведения с целью закрепления желательных генотипов [6].
Изучали полиморфизмы данного гена в двух локусах.
Для определения ОНП в локусе 2109 в гене миостатина после амплификации проводили реакцию рестрикции с использованием рестриктазы HpaII, а в локусе 2244 использовали рестриктазу Hinp I.
Частоты генотипов и аллелей по двум ОНП гена миостатина представлены в таблице 2.
Анализ ассоциации генетического маркера в гене миостатина в локусе 2109 с признаками мясной продуктивности у кур исходных линий кросса «Смена-8» представлен в таблице 3.
Таблица 2 – Частоты аллелей и генотипов полиморфизмов гена миостатина у кур исходных линий кросса «Смена-8»
| SNP | Генотип | Частота генотипов | Аллели | Частота аллелей |
| Б6 | ||||
| MSTN 2109 | AA | 0,39 | A | 0,61 |
| АG | 0,44 | — | — | |
| GG | 0,17 | G | 0,39 | |
| MSTN 2244 | CC | 0,17 | C | 0,39 |
| CG | 0,44 | — | — | |
| GG | 0,39 | T | 0,61 | |
| Б7 б/о | ||||
| MSTN 2109 | AA | 0,39 | A | 0,61 |
| АG | 0,44 | — | — | |
| GG | 0,17 | G | 0,39 | |
| MSTN 2244 | CC | 0,11 | C | 0,31 |
| CG | 0,39 | — | — | |
| GG | 0,50 | T | 0,69 | |
| Б7 м/о | ||||
| MSTN 2109 | AA | 0,50 | A | 0,69 |
| АG | 0,39 | — | — | |
| GG | 0,11 | G | 0,31 | |
| MSTN 2244 | CC | 0,06 | C | 0,25 |
| CG | 0,39 | — | — | |
| GG | 0,56 | T | 0,75 | |
Таблица 3– Анализ ассоциации генетического маркера в гене миостатина(локус 2109) с признаками мясной продуктивности (Xm)
| Линия | Генотип | Живая масса в 40 дней, г | Коэффициент конверсии корма | Оценка развития груди, балл | Оценка развития бедра, балл |
| Б6 | AA
АG GG |
2358,0 31,1*
2297,5 34,6* 2326,729,1 |
1,790,02*
1,810,03* 1,860,02* |
4,60,1
4,40,1 3,80,2 |
2,0 0,0
2,10,1 2,0 0,1 |
| Б7 б/о | AA
АG GG |
2197,151,4
2241,353,0 2116,747,0 |
1,810,06*
1,810,09 1,760,06* |
4,50,1
4,40,1 4,20,2 |
2,0 0,0
2,10,1 2,0 0,0 |
| Б7 м/о | AA
АG GG |
2148,961,3
1997,942,2 2095,0 15,1 |
1,830,1*
1,840,1 2,05 0,1* |
4,30,1
4,10,1 3,80,3 |
2,2 0,1
2,0 0,0 2,1 0,1 |
| * – p<0,05 | |||||
По замене в гене миостатина(локус 2109) у кур линий Б6 и Б7 б/о наблюдалось преобладание генотипа АG – частота его встречаемости у обеих линий составила 0,44, тогда как у кур линии Б7 м/о преобладает генотип AA с частотой 0,5. Аллель A у всех линий встречался наиболее часто. Наименее встречаемым генотипом у всех линий оказался генотип GG, его частота встречаемости не превысила значение 0,17. При анализе связи генотипов по замене в гене миостатина с мясной продуктивностью кур было выявлено, что наиболее желательным генотипом у кур линий Б6 и Б7 м/о является генотип AA, а у линии Б7 б/о – генотип АG. Наблюдается смещение в частотах аллелей в сторону преимущественного распространения аллеля A.
В исследованиях Н. В. Дементьевой связи генотипов по однонуклеотидным заменам в гене миостатина (локус 2109) с показателями живой массы у популяции кур линии Б5 породы корниш кросса «Смена-8» было выявлено следующее: наиболее встречаемым генотипом по замене в гене миостатина оказался генотип AG (частота встречаемости 0,57), наименее встречаемым – GG (0,08), преобладал аллель A (0,63), наиболее желательным генотипом оказался генотип AA, вследствие чего отмечалось смещение в частотах аллелей в сторону преимущественного распространения аллеляA в изучаемой популяции [2].
Из мышечной ткани кур трех линий была выделена РНК и исследован уровень экспрессии гена миостатина. Проведен анализ генетического маркера миостатина (локус 2109) и экспрессии данного гена, рассчитанной по методу ΔСt[11]. (таблица 4). В качестве референсного гена использовали ген TBP (TATA-BindProtein).
Таблица 4– Анализ ассоциации генетического маркера в гене миостатина(2109 G/A) с экспрессией гена миостатина (ΔСt=CtTBP-CtMSTN)
| Линия | Генотип | ||
| АА | GA | GG | |
| Б6 | 2,23 0,43 | 3,29 0,44 | 2,82 0,59 |
| Б7 б/о | 2,90 0,26 | 2,58 0,28 | 2,95 0,79 |
| Б7 м/о | 3,64 0,40 | 3,38 0,30 | 4,09 0,17 |
Приведенный анализ ассоциации различных генотипов в локусе 2109 гена миостатина никакой достоверной связи не выявил. Однако для селекционных целей наиболее удобным инструментом отбора является именно полиморфизм, а не экспрессия, так как этот метод не требует эвтаназии птицы.
На основании приведенной информации, можно рассматривать полиморфизм гена миостатина локус 2109 в качестве ДНК маркера признака бальной оценки развития груди.
На рисунке 1 приведена детекция полиморфизма в гене миостатина локус 2244.
Рисунок 1– Детекция полиморфизма в гене миостатина локус 2244
Анализ ассоциации генетического маркера в генемиостатиналокус 2244 с признаками мясной продуктивности у кур исходных линий кросса «Смена-8» представлен в таблице5.
Таблица 5– Анализ ассоциации генетического маркера в гене миостатина(локус 2244) с признаками мясной продуктивности (Xm)
| Линия | Генотип | Живая масса в 40 дней, г | Коэффициент конверсии корма | Оценка развития груди, балл | Оценка развития бедра, балл |
| Б6 | СС
СG GG |
2264,3 43,3*
2376,3 36,5* 2336,7 12,0 |
1,850,02
1,790,02 1,850,05 |
4,250,20*
4,380,15 4,500,29* |
2,000,03
2,130,10 2,000,02 |
| Б7 б/о | СС
СG GG |
2197,1 51,4
2241,3 53,0 2116,7 47,0 |
1,780,06
1,810,09 1,810,06 |
4,250,23*
4,290,17 4,500,17* |
2,000,03
2,030,10 2,090,04 |
| Б7 м/о | СС
СG GG |
2148,9 61,3
1997,9 42,2 2095 15,0 |
1,870,10
1,840,08 1,860,06 |
4,020,07*
4,070,06 4,250,15* |
2,040,08
2,010,01 2,150,03 |
| * – p<0,05 | |||||
Установлено, что по полиморфизму в локусе 2244 генамиостатинау всех изученных линий кур наблюдалось преобладание генотипа GG – частота его встречаемости составила 0,29-0,56. Наименее встречаемым генотипом у всех линий оказался генотип CC, его частота встречаемости не превысила значение 0,17. При анализе связи генотипов по замене в гене миостатина с мясной продуктивностью кур было выявлено, что наиболее желательным генотипом у кур является генотип GG (таблица 5).
В таблице 6 приведены данные по экспрессии гена миостатина в соответствии с генотипами полиморфизма в локусе 2244.
Таблица 6 – Анализ ассоциации генетического маркера в гене миостатина (2244 С/G) с экспрессией гена миостатина (dCt=CtTBP-CtMSTN)
| Линия | Генотип | ||
| СС | СG | GG | |
| Б6 | 2,81 0,50 | 3,56 0,35 | 1,93 0,31 |
| Б7 б/о | 3,67 0,36 | 2,40 0,23 | 2,85 0,20 |
| Б7 м/о | 3,81 0,40 | 3,38 0,30 | 3,71 0,32 |
Анализ связи данного полиморфизма с экспрессией гена миостатина не выявил прямой связи, однако замечено, что птица, имеющая аллель G имеет ниже значение dCt (Ct TBP-CtMSTN), что означает более высокую экспрессию этого гена.
Считаем, что возможно рассматривать полиморфизм гена миостатина локус 2244 в качестве ДНК маркера признака бальной оценки развития груди, однако у таких кур наблюдается высокий уровень затрат корма на килограмм привеса живой массы.
Ген рецептора дофамина у млекопитающих играет важную роль в функцииэндокринной системы, как рецептор сильного нейромедиатора. Было отмечено, что некоторые полиморфизмы этого гена играют большую роль в инстинкте насиживания и могут применяться для успешной отбраковки кур со склонностью к насиживанию[13]. Однако позже была установлена высокая связь между этим геном и живой массой птицы [12].
Ген рецептора дофаминаD2 находится в 24 хромосоме и имеет длину 22 894 п.н., в составе гена находятся четыре экзона и два интрона. Инсерция/делециярасположена в5’-фланкирующей области и состоит из 22 п.н. Для идентификации маркера в гене D2 осуществляли электрофорез в 2% агарозном геле при 110В на протяжении 40 минут.
В случае разрезания рестриктазой на участки с небольшой разницей (15-25 п.н.) или для детекцииинсерций длинойдо 25 пар нуклеотидов можно использовать биоанализаторBioanalyzer 2100 (AgilentTechnologies) на основе микрофлюидной технологии, обеспечивающей высокую точность результатов при минимальных объемах исследуемого образца. В системе используется два принципа анализа: электрофореза и проточной цитометрии. На рисунке 2 приведен пример анализа индела в гене DRD2 на Bioanalizer 2100.
Рисунок 2– Анализ инсерции/делеции в гене DRD2 на биоанализаторе
(L – маркер длин, проба 1, 2, 11 — гетерозигота ID; 3, 8, 9, 10 – гомозикота DD; 7 – гомозигота II)
На рисунке 2 видна четкая дифференцировка по длине участков ДНК. При повышении концентрации агарозного геля на обычном горизонтальном электрофорезе четкость разделения улучшается. Поэтому при отсутствии цифрового оборудования, для детекции полиморфизма на электрофорезе возможно повысить концентрацию геля до 4 – 7%, но в этом случае его хрупкость повышается и возникает опасность его повреждения при переносе в ванну для электрофореза.
Анализ частот аллелей и их связь с продуктивными признаками приведены в таблицах 7 и 8 и на рисунке 3.
Таблица 7– Частоты аллелей и генотипов у кур разных линий кросса «Смена – 8» по маркеру гена DRD2
| Линия | Частоты генотипов | Частоты аллелей | |||
| II | ID | DD | I | D | |
| Б6 | 0,389 | 0,333 | 0,278 | 0,555 | 0,444 |
| Б7б/о | 0,167 | 0,389 | 0,444 | 0,389 | 0,611 |
| Б7 м/о | 0,222 | 0,333 | 0,444 | 0,444 | 0,555 |
У кур линии Б6 (порода корниш) -преобладает аллель I(инсерция), а у кур линии Б7 (порода плимутрок) преобладает аллель D (делеция).
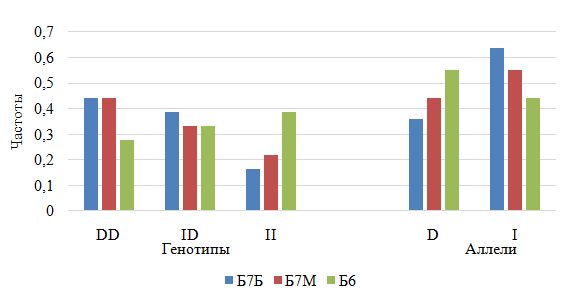
Рисунок 3– Распределение частот генотипов и аллелей по гену дофаминового рецептора D2 влиниях кросса «Смена-8»: Б6, Б7Б и Б7М (соответственно быстро- и медленнооперяющаяся группы линии Б7)
Таблица 8–Анализ ассоциации генетического маркера в гене DRD2 с признаками мясной продуктивности у кур разных линий кросса «Смена – 8»
| Линия | Генотип | Живая масса в 40 суток, г | Коэффициент конверсии корма | Оценка развития груди (балл) | Оценка развития бедра (балл) | |
| Б6 | DD
ID II |
2386,0 52,4*
2306,720,4 2300,050,9* |
1,830,03
1,790,02 1,840,03 |
4,30,12
4,420,27 4,360,14 |
2,00,0
2,00,0 2,00,1 |
|
| Б7 б/о | DD
ID II |
2256,361,4*
2185,728,0* 2103,348,4* |
1,770,04
1,820,04 1,850,013 |
4,50,2
4,40,1 4,30,2 |
2,00,2
2,10,1 2,00,3 |
|
| Б7 м/о | DD
ID II |
2119,453,4*
2050,0 72,8* 2065,0 52,4 |
1,870,1
1,880,1 1.81 0,1 |
4,30,2
4,10,2 4,00,1 |
2,10,1
2,10,1 2,00,1 |
|
| * – p<0,05 | ||||||
Как следует из результатов таблицы 8, куры, гомозиготные по делеции(генотип DD),имели более высокую живую массу в 40 суток по сравнению с курами, имеющими аллель инсерции.
В наших исследованиях на птице трех линий кросса «Смена-8» установлена связь между живой массой в 40 суток и генотипом по инсерции в регуляторном участке гена дофаминового рецептора D2. При этом показатели живой массы у цыплят с генотипом DD (гомозигота по делеции) достоверно отличались от птицы двух других генотипов – гетерозигот ID и гомозигот II по инсерции (рисунок 3). Правда, частота встречаемости генотипа DD в трех линиях кросса «Смена-8» была в пределах 28–44%, что может ограничивать возможности выбраковки гетерозиготных особей и гомозиготных по инсерции кур, особенно у линии Б6.
Пролактин – один из важнейших гормонов, регулирующих активность репродуктивной системы у птицы. Он относится к пептидным гормонам, синтезируется лактотрофными клетками аденогипофиза. У птиц принимает непосредственное участие в регуляции проявления насиживания и интенсивности яйценоскости. [6, 9] Ген пролактина (PRL) включает 5 экзонов и 4 интрона, общая длина – 6 140п.н., находится на 2-й хромосоме. Показан полиморфизм по наличию инсерции в промоторном участке гена, а также несколько SNP [8, 10].
Для определения ОНП в гене пролактина после амплификации проводили реакцию рестрикции с использованием рестриктазы AluI.Детекция однонуклеотидного полиморфизма в гене пролактина приведена на рисунке 4.
.
Рисунок 4– Детекция однонуклеотидного полиморфизма в гене пролактина локус 2402 при помощи 2% агарозного геля
В таблице 9 приведены данные по генотипам (локус 2402) и яичной продуктивности кур трех линий кросса Смена-8.
Таблица 9– Анализ ассоциации однонуклеотидного полиморфизма в гене пролактина (локус 2402) с признаками яичной продуктивности (Xm)
| Линия | Генотип | Частота встречаемости | Половая зрелость, суток | Масса яйца в 26 недель, г | Количество яиц к 30 нед. жизни, шт |
| Б6 | CC
CT TT |
0,056
0,556 0,389 |
185,0 1,4
184,2 1,7 186,6 3,1 |
67,2 3,3*
52,8 4,2* 61,9 3,7 |
17,2 1,3*
12,8 2,2* 11,9 2,6* |
| Б7 б/о | CC
CT TT |
0,111
0,389 0,500 |
177,02,7*
181,23,4 185,14,5* |
67,311,5
68,90,9* 57,44,1* |
26,5 2,5*
22,1 3,9 21,1 4,4* |
| Б7 м/о | CC
CT TT |
0,056
0,611 0,333 |
182,12,1
180,23,1* 192,2 3,4* |
51,23,2*
59,3 1,4* 61,42,1* |
24,1 2,1
25,8 3,2* 17,7 2,7* |
| * – p<0,05 | |||||
Из представленных данных следует, что по замене в гене пролактина у кур линий Б6 и Б7 м/о наблюдалось преобладание генотипа CT с частотой встречаемости у Б6 – 0,55, а у Б7 м/о – 0,61. У кур линии Б7 б/о преобладает генотип TT с частотой встречаемости 0,5. У кур всех линий по данной замене аллель T встречался чаще, чем аллель С. Генотип CC у всех линий встречался очень редко, частота встречаемости которого не превысила значение 0,11. При анализе связи генотипов по замене в гене пролактина с яичной продуктивностью кур наиболее желательным генотипом у линий Б6 и Б7 б/о оказался генотип CC, а у линии Б7 м/о – генотип CT. Наблюдается смещение в частотах аллелей в сторону преимущественного распространения аллеля C.
В исследованиях Р. А. Кулибабы связи генотипов по однонуклеотидной замене в гене пролактина с показателями яичной продуктивности кур полтавской глинистой породы было установлено, что наиболее встречаемым генотипом по замене в гене пролактина оказался генотип CT (частота встречаемости 0,52), наименее встречаемым – CC (0,11), преобладал аллель T (0,628), наиболее желательным генотипом оказался генотип CC, вследствие чего отмечалось смещение в частотах аллелей в сторону преимущественного распространения аллеляC в изучаемой популяции [4].
Для определения наличия инсерции в гене пролактина использовали праймер позволяющий амплифицировать участок размером 334 п.н. (356 п.н. с инсерцией) и проводили электрофорез в 3% агарозном геле с напряжением 110 В 35 минут (рисунок 5).
Риснуок 5 –Детекция гена пролактина (IndelPRL)c помощью ПЦР-ПДРФ
В таблице 10 приведены данные по наличию инсерции/делеции (I/D) в гене пролактина и яичной продуктивности кур кросса Смена-8.
Таблица 10 – Анализ ассоциации генетического маркера в гене пролактина (PRL Indel) с признаками продуктивности у кур разных линий кросса «Смена – 8»
| Линия | Генотип | Частота встречаемости генотипа | Живая масса в 40 суток, г | Половая зрелость, дн | Яйценоскость до 30 нед возраста, шт |
| Б6 | DD
ID II |
0,333
0,555 0,111 |
2360,0 50,6*
2335,0 18,0 2180,0 15,0* |
188,3 3,0
181,9 1,5 192,0 7,0 |
11,3 3,0
13,9 1,9 10,5 6,5 |
| Б7 б/о | DD
ID |
0,666
0,333 |
2191,7 34,4
2226,7 71,8 |
182,6 3,3
182,7 4,8 |
21,4 3,5
23,5 4,8 |
| Б7 м/о | DD
ID |
0,500
0,500 |
2123,3 55,2
2045,0 51,2 |
191,9 2,6
176,6 2,2 |
16,8 2,6
29,2 2,3 |
| * – p<0,05 | |||||
В исследованиях на шелковых курах генотипиндел-индел (II) оказался предпочтительным по живой массе среди кур в возрасте 300 дней [12]. В наших исследованиях напротив генотип II оказался худшим по живой массе в 40 дней у линейной птицы «Смена-8». Наиболее предпочтительным для отбора считаем генотипы ID и DD. В группе изученных кур линии Б7 быстро и медленнооперяемых не встретился генотип II, но возможно наличие кур этого генотипа в небольшом количестве или появление их в следующих генерациях. (таблица 10)
Гормон роста относится к классу полипептидных гормонов с широким спектром функций, синтезируемый гипофизом. Принимает непосредственное участие в регуляции роста, дифференцировке различных типов тканей организма старении и размножении. Ген гормона роста (GH) расположен на 27 хромосоме, состоит из 5 экзонов и 4 интронов. Общая длина гена 4350 п.н.
Для определения ОНП в гене гормона роста (GH1) после амплификации проводили реакцию рестрикции с использованием рестриктазыMspI. На рисунке 6 приведена детекция полиморфизма в первом интроне гена. Амплифицируется участок длиной 776 п.н. После рестрикции на электрофорезе имеются 3 мономорфных участка и 1, 2 или 3 полиморфных (генотипы А, В, С).
Рисунок 6 –Детекция ОНП в гене гормона роста (GH) первый интрон(АА – 9, 16; АС – 1, 4, 5, 7, 10, 13, 14, 16, 17; ВС – 3, 8, 12, 15; СС – 2, 6, 11, 18)
В таблице 11 приведено сопоставление генотипа полиморфизма в первом интроне гормона роста (GH), мясной и яичной продуктивности кур трех линий кросса Смена-8.
Таблица 11 –Анализ ассоциации генетического маркера в гене гормона роста (GH) с признаком продуктивности у кур разных линий кросса «Смена – 8»
| Линия | Генотип | Частота генотипа | Живая масса в 40 дней, г | Половая зрелость, сут | Масса яйца в 26 недель, г | Яйценоскость к 30 нед, шт |
| Б6 | AA
AC BC CC |
0,111
0,333 0,389 0,167 |
2330,0 63,4
2308,0 72,8* 2378,0 52,4 2236,7 49,1* |
185,5 3,6
184,2 2,8 185,6 4,3 186,0 3,7 |
50,6 1,4*
57,8 2,1* 50,3 0,9 54,1 1,1 |
17,2 2,1*
16,5 1,3 11,0 2,7* 8,4 3,1* |
| Б7 м/о | AA
AC BC CC |
0,222
0,278 0,333 0,167 |
2035,0 56,4*
2045,7 42,4 2073,3 50,9 2236,7 45,7* |
181,8 4,2
183,4 3,7 179,5 3,5 198,3 5,3 |
57,3 1,9
53,7 2,7* 62,7 4,1* 58,8 0,6 |
29,0 3,2*
25,6 1,3* 24,0 2,1 8,7 3,3* |
| Б7 б/о | AA
AC BC CC |
0,167
0,222 0,444 0,167 |
2153,3 61,4*
2314,2 28,0* 2162,9 48,4 2163,3 52,1 |
187,7 4,1
191,2 5,4 175,9 3,5 179,0 2,9 |
57,5 2,7
65,0 4,4* 57,3 2,2 56,9 1,1* |
29,6 2,2*
26,3 0,8* 19,7 3,3* 16,4 2,1* |
| * – p<0,05 | ||||||
В изученных линиях кур кросса «Смена-8» присутствовала птица четырех генотипов. Наиболее часто встречающиеся особи гетерозиготы АС и ВС. В наших исследованиях птица, имеющая аллель А в гомозиготном или гетерозиготном состоянии, показала наивысшую яйценоскость за первые 30 недель жизни. Этот аллель может являться ДНК маркером раннего разноса птицы. В исследованиях китайских ученых [14] указывается, что генотип СС наиболее присущ аборигенным породам. В наших исследованиях такой птицы было мало и у нее была низкая продуктивность.
Проопиомеланокортин (POMC) является членом семейства прогормонов и выполняет важные функции в ответ на стресс, в пигментации кожи, терморегуляции и репродукции. Предполагается, что гипоталамо-гипофизарно-гонадная ось является основным регулятором репродуктивной эндокринной системы и репродуктивных функций домашней птицы. Поэтому большое внимание уделяется изучению генов-кандидатов, связанных с размножением кур, именно на основе гипоталамо-гипофизарно-гонадной оси [5].
Анализ однонуклеотидного полиморфизма в генеPOMC локус 1140 (замена T на C)на линейных курах кросса бройлеров «Смена-8» (ФГБУ «Селекционно-генетический центр «Смена») показал, что аллель T (дикая разновидность генома)присутствовал в единственном числе в линии Б7 медленнооперяемой. То есть данная точечная мутация практически полностью вытеснила дикий генотип (рисунок 7).
Рисунок 7 –Детекция ОНП в генепроопиомеланокортина (POMC) локус 1140
Результаты исследований на местных китайских курах породы Zhenning [6] указывают на то, что полиморфизмы гена POMC связаны с хозяйственно полезными признаками у бройлеров. В частности, на основе ассоциативного анализа было показано, что ОНП в локусе 1140 этого гена был связан с яйценоскостью, оплодотворенностью, выводом цыплят и выводимостью (P <0,05). Именно эти признаки представляют наибольшую проблему в селекции линейных кур современных кроссов мясного направления продуктивности, так как отбор на скорость роста привел к снижению этих показателей.
Использование генетических маркеров очевидно будет способствовать выявлению и впоследствии отбору особей с желательными генотипами, что, в свою очередь, позволит повысить интенсивность разведения тех особей, которые отличаются наиболее ценными качествами. Это даст возможность лучше проводить селекционную работу со стадом для планирования его структуры и повышения продуктивности птицы, а также значительно повысит точность селекционной работы и позволит максимально раскрыть генетический потенциал особей.
ЗАКЛЮЧЕНИЕ
Выявлена достоверная связь между живой массой цыплят в возрасте 40 суток и наличием делеции в гене DRD2 в линии Б7 быстрооперяющейся; конверсией корма за 40 дней откорма и однонуклеотидным полиморфизмом (ОНП) в гене миостатина (2109); балльной оценкой развития груди и ОНП в гене миостатина (2244); возрастом снесения первого яйца и делецией в гене пролактина у линий Б6 и Б7 медленнооперяющейся; количеством снесенных яиц за первые 6 недель продуктивности и ОНП в гене пролактина (2402) и гене гормона роста (1 экзон).
Проведен анализ связи между наличием ДНК-маркера и экспрессией гена миостатина локусы 2109 и 2244.Корреляция между ДНК маркерами и экспрессией не превысила 0,25.
Изыскание ДНК-маркеров, связанных с конкретными хозяйственно-ценными признаками позволит повысить точность оценки и эффективность селекции птицы.
Разработаны «Методические рекомендации по поиску ассоциаций ДНК-маркеров с хозяйственно-полезными признаками у сельскохозяйственной птицы».
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
- Алтухов Ю.П. Салменкова Е.А. Полиморфизм ДНК в популяционной генетике // Генетика. – 2002. — Т.38 – С. 1173-1195.
- Дементьева Н.В.,Митрофанова О.В. и др. Скорость роста и продуктивность бройлерного кросса кур с разными полиморфными типами гена миостатина // Вавиловский журнал генетики и селекции. – 2016. — Т. 20(1) – С. 39-43.
- Кочиш И.И., Смоленский В.И., Щербатов В.И. Биология и патология сельскохозяйственной птицы. – М.: «Сельскохозяйственные технологии», 2018. – 386с.
- Кулибаба Р. А. Полиморфизм генов гормона роста, рецептора гормона роста, пролактина и рецептора пролактина в связи с яичной продуктивностью у кур породы полтавская глинистая // Сельскохозяйственная биология. – 2015. — Т. 50(2). – С. 198-207.
- Мамонтова Т.В.Айбазов М.М. Генетические маркеры в селекции животных: опыт и перспективы // Сельскохозяйственный журнал.– 2016. — Т. 9 (2). – С. 480-484.
- Митрофанова О. В.,Дементьева Н. В. и др.Связь генотипов по однонуклеотидным заменам в гене миостатина с показателями живой массы у кур Юрловской голосистой породы // Генетика и разведение сельскохозяйственных птиц. – 2015. — Т.1. – С. 39-42.
- JiangR.-S.,XuG.-Y., ZhangX.-Q. Associationofpolymorphismsforprolactinandprolactinreceptorgeneswithbroodytraitsinchickens // Poultry Science. – 2005. – V. 84. – P. 839 – 845.
- Jiang R.-S., Xu G.-Y., Zhang X.-Q., Leung F.C.C., Zhang X. Polymorphisms of flanking region of chicken prolactin gene // Domestic Animal Endocrinology. – 2006. — 30.– P. 1-16/
- CuiJ.-X., Du H.-L., Liang Y., Deng X.-M., Li N., Zhang X.-Q. Association of polymorphisms in the promoter region of chicken prolactin with egg production // Poult. Sci. – 2006 – 85. – P. 26-31.
- Ip S.C.Y., Zhang X., Leung F.C. Genomic growth hormone gene polymorphisms in na-tive Chinese chickens // Exp. Biol. Med. – 2001 – 226(5) –P. 458-462.
- Liang Y. Polymorphisms of 5’ flanking region of chicken prolactin gene / Y. Liang, J. Cui, G. Yang // Domestic Animal Endocrinology. – 2006. – V. 30. – P. 1–16.
- Rahman Met al. Relationships between the production traits and three Candidate Genes in the prolactin In/Del x In/Del Population of Silkie Fowl // Japanese Journal of poultry Science, 2014, 51: 138-143.
- Xu H.P. et al. The dopamine D2 receptor gene polymorphisms associated with chicken broodiness // Poultry Science. – 2010. – Mar: 89(3). – P.428-38.
