Титульный лист и исполнители
РЕФЕРАТ
Отчет 143 с., 5 табл., 26 рис., 104 источника литературы.
СКОТОВОДСТВО, СТРУКТУРА ГЕНОФОНДА, МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ, МУТАЦИИ, МАРКЕР, ГЕН, ИДЕНТИФИКАЦИЯ, ГЕНОТИПИРОВАНИЕ, АЛЛЕЛИ, СЕЛЕКЦИЯ, ОДНОНУКЛЕОТИДНЫЕ ПОЛИМОРФИЗМЫ (SNP), ДОСТОВЕРНОСТЬ ПРОИСХОЖДЕНИЯ, НАСЛЕДУЕМЫЕ ЗАБОЛЕВАНИЯ, ПРОДУКТИВНОСТЬ, ЛАКТАЦИЯ, ПЛОДОВИТОСТЬ, ВОСПРОИЗВОДСТВО, ПАНЕЛЬ TRUSEQ BOVINE PARENTAGE SEQUENCING PANEL ILLUMINA (США), БИОИНФОРМАЦИОННЫЙ АНАЛИЗ, ПРОГРАММНЫЙ ПРОДУКТ, ИНТЕРФЕЙС, ПРЕДСТАВЛЕНИЕ,
2D-ДИАГРАММА («КОВЁР»), ИНФОРМАЦИОННЫЕ СИСТЕМЫ
Целью работы было создание рекомендации для внедрения в хозяйствах края разработок по проведению генетического анализа поголовья на современном уровне в соответствии с рекомендациями Международного общества по изучению генетики животных (ISAG), в том числе для создания устойчивого селекционного ядра; проведение анализа статистически достоверной группы животных молочного направления продуктивности суммарным количеством до 300 гол., а также анализа используемых в хозяйстве лидере отросли генотипов спермодоз, используемых для получения потомства; использовать для анализа результаты таргетного секвенирования с использованием панели TruSeq Bovine Parentage Sequencing Panel фирмы Illumina (США);разработка программного продукта, результатом применения которого будет выстраивание ранжированного списка наиболее предпочтительных быков-производителей, относительно индивидуальных генетических характеристик матери;применить данный программный продукт в тестовом режиме в хозяйстве-лидере отросли для максимально эффективного индивидуального подбора отца-производителя.
За отчетный период методом таргетного секвенирования с использованием панели TruSeq Bovine Parentage Sequencing Panel Illumina (США) проведено генотипирование модельных групп КРС (условно низкопродуктивной, высокопродуктивной) и группы телок в возрасте 4,5 мес с неисследованным уровнем продуктивности до начала первой лактации. Исследовано в общей сложности 300 гол. КРС голштинской породы. Для каждого животного определено значение более 250-ти однонуклеотидных замен (SNP), отвечающих за достоверность происхождения и родства, а также за проявление генетическинаследуемых заболеваний и факторов продуктивности.
В соответствии с техническим заданием разработаны две компьютерные программы (продукта). Программные продукты полностью работоспособны
и протестированы на реальных экспериментальных базах данных. Программа «Just Append Cows» предназначена для обработки файлов первичных данных секвенирования на приборе MiSeq (Illumina) и формирования индивидуальных генетических паспортов каждого исследованного животного. Программа «Covers» позволяет на основе первичных данных секвенирования сформировать цветную 2D-диаграмму, позволяющую оперативно оценить генетические характеристики и аллельную структуру модельных групп КРС и стада в целом. Описываемая программа дает возможность также вызвать интерактивные окна с описанием соответствующих болезней или факторов продуктивности.
Кроме того, данный тип графического представления данных секвенирования КРС с использованием панели TruSeq Bovine Parentage Sequencing Panel Illumina (США) предложен нами впервые и не имеет российских и зарубежных аналогов.
За отчетный период все исследованные в рамках проекта животные паспортизированы в полном объеме и построены 2D-диаграммы, графически отражающие аллельные профили всего стада КРС. Использование обеих программных продуктов позволяет произвести индивидуальный подбор спермодоз при искусственном осеменении с учетом более 250-ти SNP и дать рекомендации на основе комплексных генетических исследований поголовья для обоснованного формирования устойчивого племенного ядра хозяйства.
ВВЕДЕНИЕ
Таргетное секвенирование, лежащее в основе конкретной технической реализации, примененной нами, дает возможность остановить внимание на конкретных участках (областях) генома или отдельных генов. Этот метод применяется в том случае, когда у изучаемого животного подозревается наличие какого-либо генетического заболевания, для которого известны гены или конкретные мутации, а также с целью генетической паспортизации конкретных животных и установления представленности различных аллелей в определенном стаде или группе животных. Аналогично, путем сложных вычислений и статистического анализа полностью секвенированных геномов, проводится поиск однонуклеотидных полиморфизмов (Single nucleotide polymorphism, SNP), не связанных непосредственно с проявлением в фенотипе, но используемых для доказательства достоверности происхождения/родства.
В случае таргетного секвенирования нет необходимости исследовать все гены, достаточно установить структуру только одного гена или некоторых его участков, так называемых горячих точек, где наличие мутации наиболее вероятно. Как правило, для достижения большинства текущих задач современного товарного животноводства необходимо ответить на ограниченное число вопросов, наиболее честно возникающих у специалистов хозяйств, специализирующихся на производстве молока или мяса. К этим вопросам, прежде всего, относится степень гетерозиготности/гомозиготности стада (близость родства, которая может привести к увеличению представленности генетических отклонений и уродств), наличие генетически наследуемых заболеваний или генов, повышающих предрасположенность к болезням, наличие вариантов генов, отвечающих за экономически значимые признаки.Причем в этом случае исследуемые варианты аллелей, как правило, не связаны с развитием патологического состояния, являются вариантами нормы, просто те или иные замены в кодируемых такими генами белках, являются более предпочтительными у пород мясного направления селекции, а другие варианты генов более предпочтительны для коров молочного направления селекции.
Из имеющихся на рынке коммерчески доступных решений для осуществления таргетного секвенирования КРС в практических целях наиболее применима, по нашему мнению, панель TruSeq Bovine Parentage Sequencing Panel (Illumina, США).
Вместе с тем, выбором платформы для исследования признаков и нахождения конкретных SNP, позволяющих доказать степень родства, достоверность происхождения, наличие или отсутствие генетических заболеваний, а также установить тип аллелей, отвечающих за реализацию экономически значимых признаков не ограничиваются запросы хозяйств. Необходимо также разработать программные продукты, которые с одной стороны позволили бы оперативно получить генетический паспорт животного с перечислением всех установленных SNP, с другой представить полученный массив экспериментальных данных в виде понятном специалисту хозяйства, визуализированном до степени возможности наглядного и интуитивно понятного использования. Такую задачу решает разработанный нами программный продукт, позволяющий генерировать цветовые 2D-диаграммы, визуализирующий распределение гомозигот по алельным и доменантным признакам, а также гетерозигот в исследуемом стаде
с произвольным количеством голов. Это позволяет специалисту с первого взгляда оценить степень присутствия нежелательных или, наоборот, желательных генетических вариантов и вести мероприятия по осеменению, опираясь на эти данные. Так, сопоставление графических профилей генотипов животных, отраженных в 2D-диаграмме группы телок с графическим представлением по генотипам отдельных образцов спермодоз, позволяет подобрать оптимальное сочетание аллелей предков и исключить или свести к минимуму вероятность закрепления в ядре стада наследственных заболеваний. Этот подход не является чем-то абсолютно новым, более того, в последние годы подобного рода услуги активно рекламируются для человека. Этичность такого «генетически детерминированного» подбора пар в случае людей спорна, однако в ветеринарии она становится, и станет в ближайшем будущем «золотым стандартом». Наша работа, выполненная в продолжении годичного периода, всего лишь позволяет оптимизировать и автоматизировать анализ первичных данных секвенирорвания
с использованием панели TruSeq Bovine Parentage Sequencing Panel, а разработанные программные продукты предназначены для генерации генетических паспортов животных единого образца (содержащих информацию о 265 отдельных SNP) и визуализации данных при помощи построения цветовых 2D-диаграмм, которые могут быть использованы, в том числе и для быстрого подбора оптимальной спермодозы при искусственном осемениеии/оплодотвуорении.
1 ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
1.1 Генетические особенности высокопродуктивного крупного рогатого скота
Главными элементами интенсификации в скотоводстве являются полноценное кормление животных, качественное преобразование стад и пород путем проведения систематической селекционно-племенной работы (Дунин И. М., Амерханов Х. А., 2017; Иванова И. П. [и др.], 2018).
Целенаправленная селекционная работа в молочном скотоводстве повлияла на усиление процессов интенсификации отрасли (Чинаров В. И., 2019).
В связи с продолжающимся сокращением численности коров встал вопрос
о выборе пород для интенсивного разведения, обеспечивающих высокую эффективность производства продукции, при сохранении способности к расширенному воспроизводству (Чинаров В. И., 2019). В условиях интенсивного молочного скотоводства особое значение приобретает получение и племенное использование высокопродуктивных животных, характеризующих потенциальные возможности и качества породы: генетические, хозяйственно-полезные, биологические, племенные (Татаркина Н. И., 2017).
В Российской Федерации, в общей численности крупного рогатого скота, ведущее положение занимают 3 породы: черно-пестрая – 54 %; голштинская –
14 %, айрширская – 3 %. Племенное поголовье коров всех пород составляет
15,1 % в их общем поголовье (Шеметюк С. А. [и др.], 2019).
В Краснодарском крае, в общей численности племенного крупного рогатого скота, ведущее положение занимают 3 породы: голштинская – 74,7 %, айрширская – 13,6 %; красная степная – 5,5 %. Племенное поголовье коров составляет 11,5 % от общего племенного поголовья голштинской породы в стране. При этом в племзаводе АО фирма «Агрокомплекс» им. Н.И. Ткачева – 66,3 %; ПАО «Родина» Каневского района и АОА «Агрокомплекс «Павловский» Павловского района соответственно по 9,2–9,4 %, разводится основная часть высокопродуктивного поголовья. Продуктивность дойного поголовья голштинской породы по краю превышает общероссийский показательна 4,3% и составляет 8944 кг.
Племенные хозяйства служат основой высокопродуктивного животноводства, главная задача которого заключается в производстве наибольшего количества продукции (молока, мяса и др.) высокого качества при наименьших затратах труда и средств (Щербакова Н. А. [и др.], 2020).
Увеличение в структуре поголовья доли высокопродуктивных молочных пород привело, с одной стороны, к резкому наращиванию продуктивности, а с другой – к снижению экономической эффективности ведения отрасли и, как следствие, к ее стагнации. В связи с этим изучение их племенных качеств и хозяйственно-полезных признаков является актуальным (Чинаров В. И., 2019).
За последние десятилетия во многих странах (в том числе Республике Беларусь), при значительно увеличении продуктивности коров, сократился срок продуктивного использования коров до 2,5–2,8 лактации, что недостаточно для полной реализации генетического потенциала животных, который раскрывается только на 5–6-й лактации (Казаровец Н. В. [и др.], 2019).
Высокопродуктивные коровы имеют большое значение в совершенствовании породы, поэтому изучение их молочной продуктивности с дочерями в конкретном стаде позволяет повысить результативность селекционно-племенной работы (Холодова Л. В. [и др.], 2019). Это высказывание поддерживается и другими учеными, считающим, что для эффективного управления селекционным процессом необходима полная, качественная и надежная информация, как об отдельном животном, так и о породе в целом. (Абугалиев С., Шамшидин А., 2012).
О высокой ценности животных, говорит тот факт, что на выставке «Звезды Подмосковья» в 2018 г., телка по кличке Майна-М была продана за 120 тыс. руб. финальная цена в полтора раза превысила стартовую. Это результат целенаправленной селекции в ОАО «Московское» по племенной работе»: отец телки знаменитый бык-производитель «улучшатель удоя», компонентов молока, экстерьера потомства, носителя бета казеина А2А2.
В Московской области по итогам 2018 года лучшей коровой (инвентарный номер 13078577) признано животное с продуктивностью за 305 дней по второй лактации – 16085 кг молока, содержание жира – 3,73 %, белка –
3,28 % (Жаров И. Н. [и др.], 2018).
ВНИИ племенного дела в «Базу данных по национальному генофонду сельскохозяйственных животных – племенного КРС молочного направления продуктивности» за 2019 г. по Краснодарскому краю внесло корову-рекордистку голштинской породы с инвентарным номером 13142, принадлежащую племзаводу «Родина» Каневского района с показателями продуктивности за 305 дней лактации – 16130 кг молока, производства жира молока – 634 кг, производство молочного белка – 490 кг.
После проведения экспертной оценки поголовья, представляемого на ведущей российской выставке племенных животных ученые: И. Н. Янчуков,
А. И. Ермилов, А. А. Ермилов (2018) отмечают, что в условиях Российской Федерации у разводимого скота необходимо на перспективу улучшать все показатели молочной продуктивности и тип телосложения. С таким мнением согласен В. П. Кононов (2013), отмечающий, что особенностью голштинской породы является сформированная, в процессе селекции, ярко выраженная лактационная функция, которая обуславливается изменениями в интенсивности обмена веществ. Как показал опыт изучения голштинизации в Краснодарском крае, процесс поглощение ведущей мировой породой не всегда в лучшую сторону, меняет биологические и хозяйственно-полезные признаки скота относительно материнской породы (Кузнецов А. В., 2019).
При этом основная задача, стоящая при отборе нужных генотипов – это оценка племенной ценности животных, способствующая повышению генетического потенциала продуктивных показателей у последующего поколения (Сатыгул С. Ш. [и др.], 2009; Шамшидин А. С. [и др.], 2017).
Изучение в 2016-2017 г. взаимосвязей между уровнем продуктивности и выживаемости маточного поголовья выявило антагонизм между этими показателями, который возник по двум основным причинам: односторонняя селекция на продуктивность, и нарушения в кормления (отсутствие мульти факториальных систем питания, адекватного функциональным возможностям организма в конкретной технологической среде). Ряд авторов сходятся во мнении, что снижение продолжительности хозяйственного использования животных с высокой долей кровности по голштинской породе связано с несоответствием потребностей животных, с уровнем кормления и недостаточным контролем за состоянием стада. (Новак И. В., 2016).
Сегодня широкомасштабное поглощение местных пород коммерческими,
в том числе голштинской, продолжается. При этом помесные популяции сохраняют местные названия в то время как генетическими они таковыми уже не являются. Зарубежные ученые считают, смесь европейского и восточно-азиатского крупного рогатого скота является уникальной по сравнению с другими североамериканскими породами (Decker J. E., Taylor J. F, Kantanen J., Millbrooke A., 2016).
Теоретический анализ выживаемости с использованием функции Гомпертца данных коров выявил положительную взаимосвязь между средней длительностью хозяйственного использования и величиной, обратной интенсивности выбытия за первую лактацию. Установлено, что динамика надоев за 305-дн. лактации, в ряду последовательных лактаций детерминирована сочетанием значений двух параметров: потенциала продуктивности (тыс. кг) и потенциала жизнеспособности (относительная величина, отражающая темп возрастного снижения степени реализации потенциала продуктивности) (Черепанов Г. Г. [и др.], 2017).
В хозяйствах Уральского региона анализ сокращения сроков хозяйственного использования коров показал, что животные выбывали в основном по причинам заболевания конечностей (27,5 %), вымени (13,6 %) и патологии воспроизводительной системы (17,3 %). Также большое количество коров выбраковывается из-за низкой продуктивности (Лоретц О. Г., 2014).
В связи с этим А. В. Кузнецов (2019) эффективность коровы за оцениваемую лактацию предлагает рассчитывать по формуле 1:
эффективность коровы за 305 дн. лактации = [(выход молочного жира за 305 дн, кг + выход молочного белка за 305 дн, кг) / живая масса, кг] × 1000 ……(1)
Исследованиями коров с продуктивностью более 8000 кг молока за лактацию племзавода «ФГУП ПЗ» Учхоз ГАУСЗ», было доказано, что продуктивность коров-рекордисток по второй лактации более высокая, чем от полновозрастных коров. С экономической точки зрения повышение продуктивности коров до
8,9 тыс. кг увеличивает уровень рентабельности, только при полноценном сбалансированном кормлении высокопродуктивных коров (Татаркина Н. И., 2017).
Отбором, проведенным на высокопродуктивных коров-первотелок уральского типа, в Свердловской области, была выделена группа с продуктивностью 10747 кг молока, с жирномолочностью 3,80 %, содержанием белка 3,25 %. В результате исследований данной группы установлено, что с увеличением молочной продуктивности коров от 10433 до 13356 кг молока, жирномолочность первотелок достоверно снижается от 3,81 до 3,77 %, соответственно белковомолочность повышается от 3,25 до 3,37 %. Анализ конституциональных особенностей коров-первотелок группы доказывает, что с увеличением молочности животных, пропорционально улучшаются значения промеров статей экстерьера исследуемого поголовья (Лешонок О. И., 2018).
При создании семейств в племенном заводе «Орошаемое» Нижневолжского региона было установлено что возможно создать такие группы животных, но они отличаются или высокой молочностью коров потомков от 7,5–
8,5 тыс. кг молока, или высокой массовой долей жира молока 3,6–3,92 % (Коханов М. А., Коханов А. П., 2014).
По убеждению В. С. Матюкова, Я. А. Жарикова, Н.А Зиновьевьевой (2018) голштинскую породу в течение более двух столетий интенсивно и целенаправленно отбирали по молочной продуктивности в условиях стабильного и достаточного сбалансированного кормления. Отсюда ее более крупные размеры, специфический эндокринный статус, бедность мускулатуры, нежность костяка, и др. благодаря которым голштинская корова способна на единицу массы потребить большое количество корма и превратить его в питательные вещества в молоко.
В условиях Западной Сибири, при формировании селекционной группы коров рекомендовано отбирать животных, крепкого телосложения, при отсутствии пороков, с молочной продуктивностью, превышающей среднее по стаду: по удою – на 27 %, массовой доле жира и белка – на 0,08 и 0,03 % соответственно. Наличие достаточного количества маточного поголовья в селекционной группе необходимо для получения и выращивания ценного племенного материала, так как обуславливает увеличение уровня продуктивности в последующих поколениях (ИвановаИ. П., ТроценкоИ. В., БорисенкоС. В., 2018).
Учитывая уникальную высокую продуктивность молочного стада проблема получения высокопродуктивных коров интересует в настоящее время широкий круг специалистов – биологов, генетиков, зоотехников-селекционеров. Общеизвестно, что при современной, особенно крупномасштабной селекции, эффект на 80–90 % зависит от быков-производителей (Стрекозов Н. И. [и др.], 2012).
В работах Уральских ученых отмечается, что интенсивность отбора и скоростью ремонта стада, рост продуктивности у дочерей, напрямую связан с показателем продуктивного долголетия коров. Для этого в селекционной работе желательно использовать быков-производителей, потомство которых отличается более высоким сроком продуктивной жизни и лучшими адаптационными качествами с параметром «продуктивное долголетие» (ЛоретцО. Г., 2014).
Понятие племенной ценности в мире не является универсальным. В разных странах в него вкладывают разный смысл, базирующийся на местных условиях, рынке и традициях. За различными селекционными индексами скрываются различные стратегии и цели разведения. Для повышения уровня продуктивности без потерь плодовитости и здоровья необходимо подходить к выбору производителей осмысленно и ответственно, уделяя серьезное внимание прямым показателям здоровья, воспроизводства и продуктивного долголетия, и в меньшей степени – выставочному экстерьеру. Селекция крупного рогатого скота на современных комплексах с инновационными технологиями доения (Тяпугин Е. А. [и др.], 2014).
Нужно вооружиться пониманием, как правильно пользоваться ключевым инструментом современной селекционно-племенной работы, и тогда рекламные каталоги с колонками «непонятных» цифр действительно окажут помощь в эффективном подборе быка, а красивые фотографии животных в них не станут единственным доводом в пользу приобретения дорого семени от производителя, не являющимся оптимальным выбором для российских условий производства.Достичь улучшения поголовья без потерь в функциональности — значит увеличить рентабельность производства, ведь производителю важно не «молоко любой ценой», а молоко обеспечивающее максимально возможную прибыль (Стрекозов Н. И. [и др.], 2012).
При подборе быков-производителей необходимо учитывать проявление полового диморфизма, так как наблюдается следующая закономерность, чем выше этот показатель, тем выше воспроизводительная способность спермы выше (6,5–14,2 %); интенсивность роста потомства (2–20 %) (Goncharenko I., Vinnichuk D., 2015).
В хозяйствах Ставропольского края широкое внедрение в систему воспроизводства сексированного семени быков голштинской породы, позволило увеличить количества рождаемых тёлочек от собственного высокопродуктивного маточного поголовья и дополнительно получить 889,9 тыс. руб. (Ковалева Г. П.[и др.], 2018).
Признание ведущей роли отца в генетическом совершенствовании стада не снижает значения отбора, так как его генотип реализуется в потомстве через подбор. Отбор является первоначальной фазой селекции, а подбор пар из числа отобранных маток и производителей с целью получения от них более высокопродуктивного потомства – вторым, завершающим этапом селекции (Лоскутов С. И. [и др.], 2015).
Многие понимают все сложности, связанные с изучением генетической природы, в том числек и за счет инбридинга, так как результаты его использования
в практике животноводства обычно очень противоречивые. Однако И. Ю. Подречнева (2016) отмечает, что из 254 исследованных высокопродуктивных животных 26 % получены с применением инбридинга. В связи с этим, отмечает этот же автор, для получения коров с высокой молочной продуктивностью в повторный подбор необходимо назначать быков с высокой племенной ценностью.
Происхождение быков-производителей, занимающих в рейтинге TPI голштинской ассоциации Америки – лидирующее положение говорит о постоянном использовании кросса линий за рубежом. Использование этих быков ведет к значительному увеличению генетического потенциала, но при этом снижается генетическое разнообразие. Эффект гетерозиса проявляется не только
в увеличении продуктивности, но и в более ярком выражении линейных признаков экстерьера коров первотелок (Крысова Е. В., 2018).
При изучении эффективности подбора родительских пар установлено, влияние отцов на признак белковомолочности в несколько раз превышает влияние матерей, так как 80% производителей увеличили удой, 60% – массовую долю жира и 71 % – долю белка. Дочери быков (100 %) превышают стандарты породы (2010 г.) по удою, массовой доле жира, и только 20 % соответствует требованиям по массовой доле белка (Прищеп Е. А.[и др.], 2019).
Эти же авторы рекомендуют проводить сравнение дочерей с показателями их матерей, при этом вести отбор за первую лактацию, и считают это наиболее эффективным.
В племзаводе «Пушкинское» от коров черно-пестрой породы с использованием быков голштинской канадской и местной селекции получено поголовье, с продуктивностью свыше 7,0 тыс. кг молока за лактацию, позволяющее выделить его как новый тип Нижегородского высокопродуктивного скота (Воробьева Н. В., Комиссарова Т. Н., Шишкин А. В., 2016).
Путем сравнения адаптивных способностей голштинского скота при интродукции в хозяйства предгорной зоны (ООО «Агроконцерн «Золотой колос», ООО «Союз-Агро») Кабардино-Балкарской Республики, было установлено что у коров отечественной и американской селекции, в сравнении с местной породой, наблюдался интенсивный фагоцитоз: у нетелей – 4,9–7,7 %, у первотелок – 2,6–3,8 %. Они превосходили по удою: за первую лактацию на 2227 кг, во вторую – на 2465 кг. Выход молочного жира и белка оказался выше в группах американского происхождения на 47,9–74,8 кг, количество молочного белка – на 41,0–63,3 кг. Все это свидетельствует о достаточно успешной акклиматизации голштинского скота отечественной и американской селекции в условиях республики (Улимбашев М. Б., Алагирова Ж. Т., 2016).
Таким образом, установлено, что проблема повышения эффективности молочного скотоводства приобрела большую актуальность в связи с негативной тенденцией по сокращению поголовья коров и объемов производства молока. Только изучение генотипа высокопродуктивных животных, характеристика их генетических, племенных качеств и нормы реакции на влияние условий среды, позволит формировать высокопродуктивное потомство (Баранова Н. С., Баранов А. В., ПодречневаИ. Ю., 2017).
Для этого все шире разрабатываются внедряются современные методы исследований молекулярно-биологических механизмов проявления генотипической информации, заложенной в животных.
1.2 Молекулярно-биологические маркеры в животноводстве
Генофонд крупного рогатого скота в Российской Федерации до 2005 г. исследовался в основном за счет использования ЕАВ-локуса групп крови в качестве генетического маркера. Как показывает динамика, сравнения с 1998 годом, произошло сокращение числа аллелей на 68 видов. При этом наблюдалась увеличение гомозиготности на 1 %, и сходство с голштинской породой до rm = 0,862. Наряду с повышением молочной продуктивности, до 9200 кг молока за стандартную лактацию, улучшением экстерьера и морфофункциональных свойств вымени коров
в племенных заводах удалось сохранить признаки исходной черно-пестрой породы хозяйства, характеризующейся аллелями: B1G2KO4Y2E’3O’; B1G2KO4Y2; D’E’3F’2; B1G2KO4E’1G’J’1K’O’G’’; B2O1Y2O’; B2O1Y2P’2Q’; B1T1E, 3F’2; B2P2T1A; 1D’G’I’O’; B2T2A’1D’’; P1E’4, P1I’’; Q, Y1A’1Y’; B’E’3F’2G’; D’O’ (Попов Н. А., Марзанова Л. К., 2016).
Подобная тенденция, хотя и менее заметная прослеживается при изучении маркерных аллелей родоначальниц высокопродуктивных семейства. Выявлено, что высокая молочная продуктивность отмечена у коров, гомозиготных по аллелю ЕАВ-локуса B1O3Y2A2’E3’G’P’Q’Y’ и низкая – у гомозиготных по аллелю «b». Ряд ценных аллелей: B1I1T1A1’P’; E3’G”; G2О’; G2E3’F2’O’; О1
и В2Р2Т2Р’, не имеет широкого распространения у коров заводских семейств. Для оптимизации системы подбора с использованием ЕАВ-локуса групп крови в качестве генетического маркера, предлагаются варианты АВ/ВВ, АВ/АВ, ВС/АА, АВ/СD и АВ/ВС (Баранова Н. С., Баранов А. В., Подречнева И. Ю., 2017).
Исследованиями установлено, что за три последних поколения у коров активной части популяции холмогорского скота, значительно изменилась генетическая структура ЕАВ-локуса. Стали реже встречаться типичные аллели: А’О’; Е2’G’G’; Q’E2Q и О2. Наиболее сильное влияние на изменение широты генетической изменчивости в маточных стадах оказывают используемые производители (Прожерин В. П., Ялуга В. Л., СельковаИ. В., Степанова Л. И.. 2018).
В. С. Матюков, Я. А. Жариков, Н.А. Зиновьева (2018) считают, что скрещивание с голштинами меняет межлокусные комбинации генов.
Ряд авторов отмечают, что данное обстоятельство весьма важно с позиции рационального использования генофонда. Для сохранения изменчивости крупного рогатого скота требуется построение собственной генетической и генеалогической структуры, обеспечение безопасности разведения отечественной популяции пород из-за распространения наследственных болезней, поддержание уровня индивидуальной и групповой гетерозиготности.
Сужение аллелофонда связано с поглотительным скрещиванием местного маточного поголовья с быками голштинской породы, и импортом быков-производителей, маток.
Широкое использование голштинского скота в Российской Федерации привело к повышению молочной продуктивности и улучшению технологических качеств молочного скота. Однако были выявлены определенные проблемы с состоянием здоровья и адаптацией импортных животных. Высокая молочная продуктивность неизбежно приводит к ослаблению иммунитета, фертильности, уменьшению способности противостоять стрессу. Восприимчивость высокопродуктивных коров ко многим заболеваниям в конечном итоге снижает продуктивность, плодовитость и срок хозяйственного использования.
Генетическое улучшение пород молочного направления продуктивности
в значительной степени осуществляется за счет интенсивного использования глубокозамороженной спермы наиболее ценных быков-производителей.
Основную долю (68 %) в породной структуре стада быков молочного направления, принадлежащей АО «Головного центра по воспроизводству», составляют производители голштинской породы. По результатам генетической экспертизы на быков-производителей выдаются генетические паспорта с указанием аттестации на десятки моногенных заболеваний, летальных гаплотипов
и носительство генов, отвечающих за хозяйственно-полезные признаки (ШеметюкС. А., Турбина И. С., Гуськова И. С., Комбарова Н. А., 2019).
По сообщениям сотрудников отдела молекулярной биологии Испытательного центра ФГБУ «ВГНКИ» в условиях оптимизированного ПЦР, электрофоретической детекции и пиросеквенирования коротких фрагментов генома (в областях значимых мутаций), были изучены образцы животных различных пород. Установлено что в голштинской породе в 6 % случаев обнаружена мутация дефицита холестерина (HCD), 3 % – мутация комплексного порока позвоночника (CVM); в 1 % – мутации дефицита XI фактора свертываемости крови (FXID)
и брахиспинального синдрома (BY); 0,8 % – дефицита адгезии лейкоцитов (BLAD) (Сайфиев А. А., 2018).
Отделом молекулярной биологии разработаны методические рекомендации по молекулярно-генетической идентификации мутаций, в которых предлагается исследовать 18 различных мутаций. Ведется разработка методик для выявления наследственных патологий, в том числе арахномелии (A), тромбопатии (TP), субфертильности быков (BMS) и врожденного дефицита цинка (ZDL) (ВГНКИ, 2019).
Кроме вышеперечисленных показателей предлагается тестирование на носительство мутаций, ассоциированных с субфертильностью быков (BMS), тромбопатией (TP), дефицит-цинка-подобным синдромом (ZDL), арахномелией (A) (DairyNews.ru, 2019).
Эпигенетические исследования становятся все более значимыми для понимания механизмов наследования, так как изучает наследуемые изменения экспрессии (активности) генов, а не модификации самого генетического кода (Magee D.A. [и др.], 2010).
В качестве генетических маркеров нашли применение различные микросателлитные ДНК. Их число у различных видов достигает сотен. Интерес к использованию сателлитной ДНК для маркирования хромосом связан с тем, что ее выделение и идентификация более просты в сравнении с выделением и идентификацией ДНК структурных генов, при этом для отдельных классов сателлитов характерны как их хромосомная специфичность, так и специфичность локализации на хромосоме. В силу высокого полиморфизма они могут быть использованы наряду с группами крови в системах идентификации происхождения животных (МаринченкоТ. Е., КорольковаА. П., ГорячеваА. В., 2019).
1.3 Генофонд популяции с использованием однонуклеотидного полиморфизма (SNP)
В Соединенных Штатах Америки и подобным образом в ряде других стран, установили стандартные системы для ДНК-профилирования последовательностей повторов, тем самым скомбинирован с получением единой системы индексации ДНК (CODIS), которая служит в качестве лабораторного стандарта для ДНК-профилирования (Стефенс К. М. [и др.], 2019).
В настоящее время создание собственных наборов SNP (Single Nucleotide Polymorphism), основанных и установленных для отечественной популяции соотношений между фенотипами и генотипом, позволят повысить точность прогнозов по признакам (Федоренко В. Ф. [и др.], 2018).
Высокая достоверность и специфичность ДНК анализа может быть достигнута при использовании любых видов биологического материала: кровь, слюна, волосы, сперма, образцы мягких тканей. Для анализа микросателлитов требуется очень малое количество крови и какой-либо ткани организма, поэтому возможно прижизненное взятие образцов. Микросателлиты одинаковы
у близких видов,что позволяет использовать одни и те же праймеры и сходные протоколы анализа.
В настоящее время микросателлитные ДНК-маркерные системы находят применение при решении различных фундаментальных и прикладных задач сельскохозяйственной биологии и биотехнологии таких как геномное картирование, характеристика генетической структуры популяции и степени инбредности, оценка генетических расстояний между линиями, породами и популяциями, филогенетические исследования, контроль происхождения (ЭрнстЛ. К., ЗиновьеваН. А., 2008; Guichoux E. [и др.], 2011).
Таким образом, технология ДНК-анализа микросателлитов становится незаменимым инструментом для решения задач селекции и целенаправленного повышения продуктивных качеств выращиваемых животных и является «золотым» стандартом современной-молекулярно-генетической идентификации животных, рекомендованным Международным обществом по изучению генетики животных (ISAG) .
Первым шагом геномной селекции является установление взаимосвязей между отдельными SNP (однонуклеотидными заменами) или гаплотипам и фенотипом. Для этого создается референтная популяция животных (и коров и быков). Далее на основании данных референтной популяции рассчитывается относительная племенная ценность по конкретным признакам для любого животного. Теоретически эта методика позволяет среди большого количества молодых животных отобрать лучших и оставить их для получения следующей генерации племенного скота. Точность такого прогноза составляет по большинству признаков 65–67 % (ChenZh.[etal.], 2013; Федоренко В. Ф. [и др.], 2018).
Для ее проведения используются три перспективных, для практической селекции, подхода: GAS-селекция, MAS-селекция, GS-селекция. Когда в качестве маркеров используют SNP, селекция носит название GS (genomic selection) (СмарагдовМ. Г., 2009).
В рамках GS-селекции определяют генотип, считая, что каждый маркер — это QTL (quantitative trait loci) и вычисляют влияние всех маркеров одновременно по их вкладу в генетическую составляющую.
Широко используемая технология анализа микро- и мини-сателлитов ДНК, позволяет получить данные о генетическом расстоянии между отдельными популяциями крупного рогатого скота, уровне гетерозиготности, определять достоверность происхождения на уровне 100 % надежности и регистрировать истинную кровность (или уровень инбридинга) не по теоретическим расчетам, используя данные о происхождении, а по содержанию генетического материала того или иного предка.
Использование ДНК-технологий позволяет значительно повысить эффективность селекционно-племенной работы по генетически обусловленным качественным характеристикам молока для производства специализированных видов продукции, сокращая расходы и время для достижения целей. Выявление предпочтительных вариантов генов позволяет проводить селекцию по генотипу.
Применяемым сегодня способом диагностики гаплотипов фертильности HH1, HH2, HH3, HH4, HH5 является использование кастомных (смоделированных пользователем) биочипов, используемых для полногеномного сканирования SNP. Проведение ДНК-диагностики данным способом требует наличия дорогостоящего оборудования и, кроме того, сопряжено с высокой стоимостью биочипов. Если для проведения комплексной ДНК-диагностики (геномная оценка + исследование на наличие нескольких генетических аномалий) такой способ является экономически оправданным, то для массового скрининга гаплотипов в популяциях крупного рогатого скота необходима разработка простых, относительно дешевых тест-систем, не требующих использования дорогостоящего оборудования. Их применение позволит определять статус животных на носительство наследственных аномалий, дать характеристику их распространения в российских популяциях голштинского и голштинизированного скота и разработать программы, направленные на элиминацию генетических дефектов в популяциях племенных животных (РоманенковаО. С., 2016).
С расшифровкой последовательности полного генома крупного рогатого скота стало возможным прослеживать историю происхождения пород и оценивать генетические связи между современными породами, основываясь на результатах полногеномного скрининга SNP-маркеров.
Были проведены исследования коммерческих и локальных пород в Европе, Северной Америке, Азии и Африке на полногеномном уровне. Однако генетические различия, связи и популяционно-генетическая структура российских пород скота остаются малоизученными. Исследование генетического разнообразия и популяционной структуры пяти российских пород скота на основании полногеномного полиморфизма единичных нуклеотидов (SNP), полученного
с использованием Illumina Bovine SNP50 BeadChip («Illumina Inc.», США) являются наиболее перспективными (Зиновьева Н. А., Донцев А. В., Сермягин А. А., ВиммерсК., РейдерХ., СолкнерзЙ., ДенисковаТ.Е., БремГ., 2016).
1.4 Полиморфизм сочетания аллелей в генах и их воздействие на продуктивность
Генетический полиморфизм – это состояние, при котором наблюдается длительное разнообразие генов, но при этом частота наиболее редко встречающегося гена в популяции больше одного процента. Поддержание его происходит за счет постоянной мутации генов, а также их постоянной рекомбинации. Согласно исследованиям, которые провели ученые, генетический полиморфизм получил широкое распространение, так как комбинаций гена может быть несколько миллионов (Сатыгул С. Ш. [и др.], 2009; Hirano T. [и др.], 2012; Zhang Y.[et al.], 2015; Лихоман А. В. [и др.], 2016).
Исследование полиморфизма, частот распространения отдельных вариантов белков, их сочетаемости в генотипах, в популяциях, влияния разных условий среды содержания животных на разные генотипы по полиморфным белкам, открывает новые перспективы в области понимания целого ряда теоретических и практических проблем генетики сельскохозяйственных животных, и роли экологических условий в формировании генофонда видов (Kataria R.S. [и др.], 2011; КадиевА. К., 2013).
В настоящее время в селекционно работе с высокопродуктивным молочным скотом главное внимание уделяется признакам продуктивности, тогда как вопросы сопротивляемости организма неблагоприятным факторам внешней среды и их влияние на продуктивность остаются малоизученными.
Частым явлением в высокопродуктивных стадах стало увеличение сервис-периода за счет ранней эмбриональной смертности. Одной из причин этого являются генетические нарушения. В настоящее время у разных пород крупного рогатого скота обнаружены мутации и гаплотипы, связанные с гибелью эмбриона. Сбои эмбрионального развития могут возникать на любом сроке гестации, в зависимости от конкретной мутации. На практике это проявляется именно
с увеличением сервис-периода и нерегулярными циклами с большими перерывами между осеменениями у коров. Для уменьшения риска рождения потомства
с генетическими заболеваниями, а также снижения эмбриональной смертности необходимо контролировать наличие быков – носителей в популяции (Ескин Г. В., ТурбинаИ. С., ГуськоваС. В., 2018).
Низкие продолжительность жизни и пожизненная плодовитость голштинской породы не позволяют вести расширенное воспроизводство стада за счет собственного ремонта и массовый отбор по матерям, поскольку для ремонта стада в племенное ядро необходимо выделить все наличное маточное поголовье.
Фактическая работа по выявлению носителей мутаций и их удалению из популяции проводится только в отношении быков-производителей на отечественных предприятиях по искусственному осеменению, исключительно силами самих станций (Федоренко В. Ф. [и др.], 2018).
В настоящее время рост генетического потенциала поголовья крупного рогатого скота, в большинстве хозяйств России, обеспечивается путем разработки индивидуальных планов подборки пар быков к маточному поголовью (Сакса И., 2018).
По данным ленинградских ученых, при совершенствовании стад с удоем 8000-12000 кг молока в год на одну корову, наилучшие результаты, получены от производителей, имеющих высокую геномную оценку.
В исследовании маточного поголовья голштинской породы в Белгородской области установлено, что молоко коров генотипов ВВ и АВ по κ-казеину имело лучшие показатели сыропригодности в сравнении с молоком от гомозиготных носительниц А-аллеля κ-казеина: выход сырного зерна был выше на 13–17 %.
В популяции высокопродуктивного маточного поголовья установлена низкая (8,5 %) доля животных гомозиготных по аллелю В гена κ-казеина при высокой доле гетерозигот (44,7 %) и гомозигот АА (46,9 %). При генотипировании быков (n = 84) выявлено, что гомозиготными по желательным аллелям κ-казеина было 7,1 % животных, по β-казеину – 22,6 %. Дефицит отечественных быков голштинской породы по желательным генотипам на сегодняшний день может быть компенсирован импортом спермы быков из стран, в которых селекция проводится не только по β- и κ-казеинам, но и в целом по сыропригодности. Высокая доля (38,8 %) гомозиготных коров по аллелю А2 при наличии значительного по численности поголовья позволяет сформировать из них специализированное стадо для производства «гипоаллергенного» молока. Значительная доля гетерозиготных генотипов по κ-казеину дает возможность создавать группы коров с аллелем В гена κ-казеина по результатам генотипирования и получать «улучшенное» молоко для сыроделия (ПогребнякВ. А., КолбасА. В., МорковкинаН. А., 2019).
Мониторинг по генам молочных белков в селекционной группе голштинизированной холмогорской породы скота архангельской популяции показал изменения генетической структуры по пяти генам молочных белков и гормонов (CSN3, LGB, PRL, GH, LEP), и лептина (SNP:R25C, Y7F, A80V) напрямую связанных с показателями молочной продуктивности.Отмечается, что выявление предпочтительных с точки зрения селекции вариантов вышеуказанных генов, дополнительно к традиционному отбору животных, может быть направлено на разработку новой системы отбора и подбора животных на генетическом уровне, с планированием получения через заказное спаривание быков следующей генерации с заданными генотипами (Багаль И. Е., 2018; Кононова Л. В., Шарко Г. Н., МачульскаяЕ. В., 2018).
Генетические маркеры, позволяющие животному показывать высокую продуктивность в одних условиях, могут не соответствовать маркерам, работающим в других. В настоящий момент точность прогноза племенной ценности по большинству признаков составляет 72%. Это значит, что дочери конкретного быка превзойдут дочерей других быков с вероятностью 72%. Кроме того, существует определенный риск отбраковки быков с выдающимися генетическими характеристиками как «неперспективных». Подобные случаи нередки
в мировой практике (Маринченко Т. Е., Королькова А. П., Горячева А. В., 2019).
Поиск методов повышения мясной продуктивности в настоящее носит первостепенное значение для разведения крупного рогатого скота. Изучение полиморфизма гена кальпаина – CAPN1, способствует выявлению животных
с желательным генотипом СС, ассоциированного с повышенной нежностью мяса. Плейотропный эффект генов кальпаин-кальпастатиновой системы проявляется в отношении количественных признаков животного и характеристик мышечной ткани. В исследовании анализ связи однонуклеотидных полиморфизмов CAPN316 и CAST282 генов кальпаина и кальпастатина с количественными признаками животных — динамикой массы тела проведен. В Харьковской области установлено, что частоты аллелей С и G полиморфного варианта CAPN316 составили 0,404 и 0,586, CAST282 – 0,788 и 0,212 и большое влияние генотипа СС по CAPN316 на массу тела в возрасте трех (F = 3,57; h2 = 46%) и четырех лет (F = 3,70; h2 = 47%), и генотипа CG по CAST282 в возрасте 15 мес (F = 3,29; h2 = 43%). Влияние аллелей C гена кальпаина и кальпастатина на прирост живой массы увеличивается после двухлетнего возраста, когда снижается экспрессия генов, регулирующих процессы роста и развития в раннем возрасте. Отбор животных в возрасте до двух лет с целью улучшения качества мяса не приведет к значимому уменьшению их массы тела (Лысенко Н. Г.[и др.], 2016; ШаркоИ. Н., АбрамоваО. И., СилкинаС. Ф., 2018).
Оценка данных литературы по проблеме лейкоза крупного рогатого скота с позиции специалистов по трансграничным вирусным инфекциям и генетического полиморфизма, свидетельствует о существовании четкой взаимосвязи проявления вируса и генофонда скота (МищенкоВ. А., ПетроваО.Н., Караулов А.К., МищенкоА.В., 2018).
Полученные данные могут быть использованы для выявления перспективных животных, позволяют осуществлять более тонкий анализ потенциала животного. На основе полученных данных открыта возможность дальнейшего генетического совершенствования породы в направлении повышения продуктивности и технологических свойств молока (Bonilla C.A. [и др.], 2010).
Таким образом, ДНК-диагностика по определению полиморфизма генов дает возможность корректировать изменение частот встречаемости тех или иных аллелей и генотипов в популяции путём определенного отбора и подбора пар для селекционного процесса (Кононова Л. В., Шарко Г. Н., Мачульская Е. В., 2018).
1.5 Типы полиморфизма ДНК
В связи с развитием методов молекулярно-генетического анализа за прошедшие десятилетия было доказано, что до трети локусов эукариотического генома представлены аллельными вариантами со средней гетерозиготностью на особь вплоть до 12 % и более (Brookes, A.J., 1999). В природных популяциях эта изменчивость постоянно поддерживается c помощью известных микроэволюционных факторов – мутациями, миграцией генов, случайным генетическим дрейфом и естественным отбором. Генетический полиморфизм может быть выявлен на фенотипическом, биохимическом, хромосомном, молекулярном уровнях.
В случае молекулярно-генетического полиморфизма речь идет об изменениях в структуре ДНК, обусловленных различными типами мутаций: точечными мутациями, делециями и инсерциями от одного до большего числа нуклеотидов. Схема образования гаплотипов в случае нарушения аллельного равновесия на примере единичных точечных мутаций на локусе одной хромосомы показана на рисунке 1.
После открытия явления полиморфизма ДНК в середине 80-х годов для создания насыщенных генетических карт и маркирования QTL появился новый класс генетических маркеров. Огромную роль в их появлении сыграло развитие методов клонирования и рестрикции генов. Но открытие полимеразной цепной реакции (ПЦР) имело решающее значение. Суть метода состоит в том, что предназначенный для амплификации участок ДНК служит матрицей для синтеза in vitro комплементарной последовательности. Реакция катализируется Taq-полимеразой в присутствии двух олигонуклеотидных праймеров, комплементарных к последовательностям, окружающим анализируемый фрагмент. Число анализируемых фрагментов ДНК в каждом цикле удваивается, и после 30 циклов репликации количество исходной ДНК увеличивается в миллион раз.
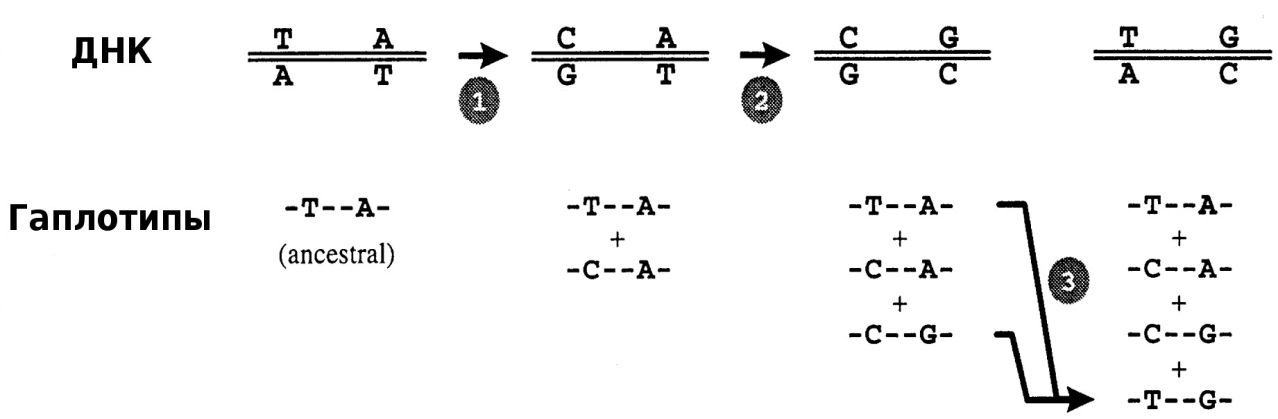
Рисунок 1 – Схема образования гаплотипов:
1 – точечная замена T↔C и образование 2-го возможного гаплотипа; 2 – точечная замена A↔G и образование 3-го возможного гаплотипа; 3 – вариант меойтической
рекомбинации, приводящей к образованию четырех гаплотипов [5]
Поскольку преобладающая часть эукариотического генома не вовлечена
в какие-либо известные и важные функции, соответствующие участки некодирующей ДНК обнаруживают уровни полиморфизма, многократно превосходящие данные, которые известны о полиморфизме генов. В случае структурных генов, которые колируют белки, изменения в структуре ДНК могут обуславливать изменения в аминокислотных последовательностях белков, и как следствие нарушения действия генов. Так, например, точечные мутации могут приводить
к появлению стоп-кодона в кодирующей последовательности, приводя к остановке трансляции и образованию белков с нарушениями их функциональности. Точечные мутации также могут приводить к замене одного аминокислотного остатка на другой, изменяя тем самым структуру молекулы белка, а, следовательно, и его функцию. Как и в случае обрыва белковой цепи, это может приводить к различным генетическим заболеваниям.
Основные типы полиморфизмов ДНК эукариотических геномов представлены в таблице 1 (Алтухов Ю. П., Салменкова Е. А., 2002).
1.5.1 Рестрикционные фрагменты ДНК
Геномная ДНК эукариот имеет существенные размеры, в частности, геном коровы составляет 3,1 млрд пар оснований (Van Eenennaam A. L., Weigel K. A., Young A. E., Cleveland M. A., Dekkers J. C. M., 2014).Сайт-специфические ДНК-эндонуклеазы – это бактериальные ферменты, расщепляющие ДНК по определенным последовательностям, называемым сайтами узнавания. Наиболее известными среди этих ферментов являются эндонуклеазы рестрикции II типа, первая из которых (HindII) была обнаружена 45 лет назад, и которые сыграли большую роль в развитии генной инженерии, поскольку их использование позволило специфично проводить фрагментацию протяженных геномных ДНК.
А затем клонировать участки генома в различные векторные конструкции (цит. по Алтухову Ю. П., Салменковой Е. А., 2002). Эти эндонуклеазы вступают в реакцию лишь со специфическими состоящими из 4–6 пар оснований, деметилированными участками ДНК – сайтами узнавания, которые в гомологичных бактериальных ДНК защищены метильными группами.
Таблица 1 – Типы полиморфизма ДНК
| Характер изменчивости |
Причина возникновения полиморфизма |
Методы выявления |
| 1 | 2 | 3 |
| Полиморфизм длины рестрикционных фрагментов (RFLP) |
Нуклеотидные различия в сайтах рестрикции |
Разрезание цепи ДНК с помощью рестриктаз, электрофорез продуктов рестрикции, их визуализация |
| Минисателлиты, варьирующее число тандемных повторов (VNTR) |
Варьирующее число тандемно повторенных нуклеотидных последовательностей с размером повтора 10–100 нуклеотидов |
Разрезание цепи ДНК с помощью рестриктаз, электрофорез, Саузерн-блоттинг со специфической пробой к повторяющейся последовательности. Полилокусные пробы комплементарны к часто встречающимся в геноме повторам, однолокусные – к уникальным повторам |
| Микросателлиты, простые тандемные повторы (STR), простые нуклеотидныеповторы (SSR) |
Варьирующее число тандемно повторенных коротких нуклеотидных последовательностей с размером повтора 1–6 нуклеотидов |
ПЦР-амплификация с праймерами, комплементарными уникальным последовательностям, фланкирующим семейство повторов, электрофорез продуктов |
| Продолжение таблицы 1 | ||
| 1 | 2 | 3 |
| Полиморфизм фрагментов ДНК, амплифицированных с произвольными праймерами (RAPD) |
Нуклеотидные различия в сайтах связывания с праймерами |
ПЦР-амплификация случайных сегментов ДНК с использованием 10–20 членных нуклеотидных праймеров с произвольной нуклеотидной последовательностью, электрофорез продуктов амплификации |
| Полиморфизм длины амплифицированных фрагментов (AFLP) |
Нуклеотидные различия в сайтах рестрикции и фланкирующих их областях |
Рестрикция с помощью двух рестриктаз, действующих на частые и редкие сайты рестрикции, присоединение олигонуклеотидных адаптеров, ПЦР-амплификация, электрофорез |
| Однонуклеотидный полиморфизм (SNP) |
Замены отдельных нуклеотидов в последовательности ДНК | Гибридизация меченых ПЦР-продуктов с микропанелями ДНК-проб для выявления вариантов, ДНК-чипы, Секвенирование ДНК-проб (фрагментов, полногеномное) |
Несмотря на то, что развитие ПЦР-технологий и методов полногеномного секвенирования несколько снизило интерес к использованию ферментов рестрикции, их значимость для научно-практических исследований остается высокой. Они находят широкое применение в полногеномном поиске молекулярных маркеров для исследований в области популяционной и адаптационной генетики. Геномы эукариот могут различаться по нескольким миллионам нуклеотидов, часть из которых входит в сайты узнавания коммерчески доступных ферментов. Как известно, полиморфизм ДНК вызывается несколькими причинами: либо точечными заменами, либо ошибками при репликации ДНК в виде инсерций или делеций протяженностью от одного до тысяч нуклеотидов. Все изменения в первичной структуре ДНК ведут к изменениям в длине фрагментов, образующихся под действием рестриктаз.
Сравнение секвенированных рестрикционных фрагментов из различных популяций организмов позволяет легко выявлять фрагменты, свойственные лишь одной из исследуемых групп и тем самым обнаружить нуклеотидные различия. При этом фрагменты используются в качестве простейших генетических маркеров. Основанный на этом подходе метод анализа получил название RFLP (Restriction Fragment Length Polymorphism).
Смесь фрагментов ДНК разделяют электрофорезом в агарозном или полиакриламидном геле и идентифицируют с помощью метки с последующей авторадиографией. Метод малоэффективен для разделения множества фрагментов. Для избирательного выявления в геле каких-либо определенных фрагментов ДНК используется гибридизация со специфической пробой методом Саузерна. Такая проба представляет нуклеотидную последовательность, комплементарную исследуемой области и снабженную радиоактивной или флуоресцентной меткой. Благодаря метке нужный фрагмент специфично визуализируется.
Первоначально для гибридизации с фрагментами ДНК, полученными
в результате действия рестриктаз, использовались универсальные мультилокусные пробы, которые содержали структуры, часто встречающиеся в геноме
в виде семейств многочисленных повторов. При использовании таких проб
в геле выявляется одновременно много сходных локусов, находящихся в гетерозиготном состоянии из-за большого числа аллелей. Эти сложные картины фрагментов ДНК, специфичные для отдельных особей, получили название «ДНК-фингерпринтов» или «фингерпринтов».
Несмотря на то, что было проведено несколько исследований на растениях с целью выявления QTL посредством сцепления с RFLP-маркерами (Paterson A. H., Lander E. S., Hewitt J. D., Paterson S., Lincoln S. E., Tanksley S. D., 1988), эти маркеры оказались не очень полиморфными у домашних животных.
1.5.2 Мини- и микросателлиты
С 1969 г. было известно, что ДНК высших организмов содержит много повторяющихся фрагментов. В 1989 г. сразу несколько лабораторий независимо друг от друга обнаружили, что короткие последовательности повторяющихся ДНК были полиморфными в отношении числа повторяющихся ДНК. Наиболее распространенной из этих повторяющихся последовательностей является poly-[TG], которая, как было установлено, очень часто встречаетсяу всех высших видов (цит. по ВеллеруДж. И., 2018).
Геном сельскохозяйственных животных насыщен (до 30 %) такого рода повторами, называемыми короткими тандемными (Shot Tandem Repeats – STR) или простыми структурными повторами (Single Sequence Repeats – SSR). Помимо выше упомянутого [TG]n, повторяющейся единицей может быть, например, мононуклеотид [A]n или динуклеотид [AC]n (Ellegren H., 2004; Mason, A.S., 2015). Но повторяющейся единицей может быть и тринуклеотид, и тетра, и т. д. Очень частов одном и том же локусе на разных хромосомах присутствует разное количество таких повторов. Количество аллелей может быть значительно больше за счет изменения числа повторов «n» (см. таблицу 2). Следует отметить, что хотя каждый из таких локусов отличается в своих аллелях числом повторов, нуклеотидные последовательности по краям этих повторов для одинаковых локусов одинаковы. И если такой повтор попадает между двумя соседними сайтами какой-либо рестриктазы, то длины полученных рестрикционных фрагментов для разных аллелей будут различаться (Zane L., Bargelloni L., Patarnello T., 2002).
Особое внимание исследователей в семействах тандемных повторовв качестве генетических маркеров получили минисателлиты, состоящие из повторяющихся копий («мотива») длиной от 9–10 до сотни нуклеотидов каждая,
и микросателлиты, повторяющиеся копии которых обычно имеют длину от 1 до 4, иногда 6 нуклеотидов. Минисателлитный локус может насчитывать от двух до нескольких сотен повторов, микросателлитный локус – от 10 до 100 повторов. Эти маркеры – кодоминантные, т. е. гетерозиготный генотип всегда отличается от любой гомозиготы. Кроме того, микросателлиты почти всегда полиаллельны, т. е. в популяциях всегда присутствует более двух аллелей. Высокополиморфный характер и менделевский тип наследования делает микросателлиты идеальными ДНК-маркерами сельскохозяйственных животных.
Высокая достоверность и специфичность ДНК анализа может быть достигнута при использовании любых видов биологического материала: кровь, слюна, волосы, сперма, образцы мягких тканей. Для анализа микросателлитов требуется очень малое количество крови и какой-либо ткани организма, поэтому возможно прижизненное взятие образцов. Микросателлиты одинаковы
у близких видов. Что позволяет использовать одни и те же праймерыи сходные протоколы анализа.
В настоящее время микросателлитные ДНК-маркерные системы находят применение при решении различных фундаментальных и прикладных задач сельскохозяйственной биологии и биотехнологии таких как геномное картирование, характеристика генетической структуры популяции и степени инбредности, оценка генетических расстояний между линиями, породами и популяциями, филогенетические исследования, контроль происхождения (Эрнст Л. К., Зиновьева Н. А., 2008; Guichoux E., Lagache L., WagnerS., ChaumellP., LegerP., LepaisO.,LepoittevinC., MalausaT., RevardelE., SalinF., PetitR. J., 2011). Таким образом, технология ДНК-анализа микросателлитов становится незаменимым инструментом для решения задач селекции и целенаправленного повышения продуктивных качеств выращиваемых животных и является «золотым» стандартом современной-молекулярно-генетической идентификации животных, рекомендованным Международным обществом по изучению генетики животных (ISAG).
Наиболее распространенным методом анализа SSR является метод ПЦР,
с использованием праймеров, комплементарных уникальным последовательностям (доменам), которыми фланкирован каждый микросателлитный локус. Использование ПЦР для анализа микросателлитных локусов впервые было предложено в 1989 г. для анализа [CA]n[GT]n, которые являются одним из наиболее встречаемых мотивов повторов в геномной ДНК человека (Weber J. L., May P. E., 1989). Разделение продуктов амплификации проводили электрофорезом в полиакриламидном геле, что позволило резко повысить чувствительность и скорость анализа по сравнению с методами, основанными на гибридизации геномных блотов.
В настоящее время стандартной методикой анализа ДНК-микросателлитов с известными фланкирующими последовательностями является мультиплексный ПЦР с последующим разделением продуктов амплификации методом капиллярного электрофореза и их одновременной лазерной детекцией. Она отвечает современным требованиям молекулярно-генетического анализа: высокая информативность анализа, минимальные сроки исследования, простота проведения и низкая себестоимость исследования.
В практической части настоящей работы будут использоваться готовые отечественные современные решения для всех этапов генетического анализа. Компания «Гордиз» на сегодняшний день является единственным российским производителем продукции для молекулярно-генетической идентификации животных на основе микросателлитных маркеров ДНК (набор «COrDIS Cattle»).
ISAG в качестве стандартных маркеров рекомендовало использовать
11 локусов: ETH3, INRA023, TGLA227, TGLA126, TGLA122, SPS115, ETH225, TGLA53, BM2113, BM1824, ETH10. Кроме того, в набор фирмы Гордиз для определения молекулярно-генетической характеристики крупного рогатого скота с целью анализа родства и ДНК-индивидуализации животных на основе мультиплексного ПЦР-анализа локусов, содержащих STR, входят три дополнительных высокополиморфных микросателлитных локуса: CSSM66, ILSTS006
и CSRM60 (таблица 2).
Таблица 2 – Описание микросателлитных маркеров
| Название локуса |
Хромосомная локализация | Нуклеотидная последовательность единицы повтора |
| 1 | 2 | 3 |
| Основные | ||
| ETH3 | D19S2 | (GT)nAC(GT)6 |
| INRA023 | D3S10 | (AC)n |
| TGLA227 | D18S1 | (TG)n |
| TGLA126 | D20S1 | (TG)n |
| TGLA122 | D21S6 | (AC)n(AT)n |
| SPS115 | D15 | (CA)nTA(CA)6 |
| ETH225 | D9S2 | (TG)4CG(TG)(CA)n |
| TGLA53 | D16S3 | (TG)6CG(TG)4(TA)n |
| BM2113 | D2S26 | (CA)n |
| BM1824 | D1S34 | (GT)n |
| ETH10 | D5S3 | (AC)n |
| Продолжение таблицы 2 | ||
| 1 | 2 | 3 |
| Дополнительные | ||
| CSSM66 | D14S31 | (AC)n |
| ILSTS006 | D7S8 | (GT)n |
| CSRM60 | D10S5 | (AC)n |
В стандартном наборе праймеры для ПЦР подбираются с учетом проведения амплификации всех 14-ти локусов в одной пробирке. Размер всех амплифицируемых ПЦР продуктов< 320 пар нуклеотидов (с учетом всех известных аллелей). Анализ результатов ПЦР обычно проводится методом капиллярного электрофореза с использованием автоматических генетических анализаторов
с лазериндуцированной флуоресцентной детекцией. В наборе COrDIS Cattle используется пять флуоресцентных красителей, характеризующихся разными длинами волн эмиссии для возможности одновременной детекции в разных каналах флуоресценции. Праймеры мечены четырьмя флуоресцентными красителями, детектируемыми в каналах Blue, Green, Yellow, Red. Стандарт длины S450 мечен пятым, флуоресцентным красителем и детектируетсяв отдельном канале Orange одновременно с продуктами ПЦР. С использованием этих реагентов для получения полного STR-профиля образца достаточно 0,2 нанограмм. Оптимальное количество – 0,5 нанограмм.
RAPD, AFLP. В отличие от микросателлитов или однолокусных минисателлитов, с помощью которых исследуются отдельные локусы генома, маркеры, обозначаемые как RAPD (Random Amplified Polymorphic DNA)и AFLP (Amplified Fragment Length Polymorphism), позволяют исследовать геном в целом, получая соответствующие фингерпринты.
Для анализа RAPD используют 10–20-членные нуклеотидные праймеры
с произвольно выбранными последовательностями. С их помощью амплифицируют анонимные участки ДНК, после чего амплифицированные фрагменты анализируют с помощью гель-электрофореза. Число и размер фрагментов зависят от длины и структуры произвольно выбранных праймеров. Комплементарные сайты связывания праймеров случайно распределены по геному, а полиморфизм в таких сайтах выражается в присутствии или отсутствиив геле соответствующих фрагментов (Алтухов Ю. П., Салменкова Е. А., 2002).
Метод AFLP основан на избирательной амплификации рестрикционных фрагментов геномной ДНК и их анализе. Фрагментацию ДНК обычно проводят двумя рестриктазами. Образующиеся «липкие» концы связывают с олигонуклеотидными адаптерами, которые и служат мишенью для отжига праймеров. Тем самым достигается избирательная амплификация только тех фрагментов, рестрикционные сайты которых фланкированы комплементарными нуклеотидами (Алтухов Ю. П., Салменкова Е. А., 2002; Grover A., Sharma P.C., 2016). Как и в случае метода RAPD полиморфизм фингерпринта проявляется в наличии или отсутствия конкретных полос в геле, но в отличие от RAPD обладает очень хорошей воспроизводимостью.
1.5.3 Полиморфизм единичного нуклеотидного сайта
SNP (Single Nucleotide Polymorphism) как новый тип маркеров стал использоваться в 1995 г. (цит. по BrookesA.J., 1999). SNP обычно определяют как местоположение пары оснований ДНК, в которой частота появления наиболее распространенного основания пары ниже 99 %. В отличие от микросателлитов, которые имеют несколько аллелей, SNP, как правило, являются диаллельными, но гораздо более распространены во всем геноме, с оценочной частотой одного SNP на 300–500 пар оснований. В популяциях человека различия в нуклеотидной последовательности любых двух случайно выбранных особей встречаются с частотой примерно 1 на 1000 кб (BrookesA.J., 1999). Таким образом, SNP могут быть найдены в геномных областях, бедных микросателлитами. Вероятно, большинство полиморфизмов возникло в результате мутаций, закрепившихся в популяции. Наиболее часто встречающийся SNP – вариация оснований одного типа, т. е. пуринов или пиримидинов. SNP с аллелями пурин/пиримидин встречаются значительно реже. Частота встречаемости разных типов
в геноме человека описывается следующим соотношением: A/G – 63 %, A/C – 17 %, G/C – 8 %, A/T – 4 %. На оставшиеся вставки и делеции приходится 8 % (Miller R. D.,Taillon-MillerP., KwokP.-Y., 2001).
Наибольший практический интерес представляют полиморфизмы, лежащие в пределах кодирующих областей генома. SNP, находящиеся в них, могут быть ассоциированы с определенными фенотипами, в частности, связанные
с индивидуальной предрасположенностью к заболеваниям, с устойчивостью
к воздействию окружающей среды и лекарственных препаратов или с биохимическим профилем. Особенности последовательности четырех нуклеотидов
в нетранскрибируемых регионах ДНК могут отражать различия между отдельными животными, популяциями и породами. SNP более стабильны, чем микросателлиты и имеют более низкую частоту мутации. В 2001 г. были впервые описаны условия генотипирования большого числа особей по любым SNP,
а также методы вычислений, которые в будущем позволили автоматизировать процесс генотипирования (Ranade K., Chang M. S., Ting G. T., Pei D., Hsiao C. F., Olivier M., Pesich R., HebertJ., ChenY.-D., DzauV. J., CurbD., OlshenR., Rish N., CoxD. R., BotsteinD., 2001). Все вышесказанное объясняет появление огромного числа методов детекции SNP.
1.5.4 Методы детекции SNP
В самом простом случае для детекции SNP можно использовать две пары праймеров. В каждой паре один из праймеров общий для двух аллелей, другой – комплементарный только данному аллелю. Вариабельный нуклеотид располагается в 3′-концевой позиции аллель-специфичных праймеров. ПЦР для каждой пары проводят в отдельных пробирках (Кофиади И. А., Ребриков Д. В., 2006). Основной недостаток подхода в том, что поскольку анализ идет в различных пробирках, необходима четкая стандартизация исходного количества ДНК.
Проведение реакции в одной пробирке исключает ошибки смешивания реактивов и обеспечивает наличие конкуренции на стадии отжига, чтов свою очередь ведет к лучшему разрешению аллелей.
Существует несколько подходов проведения аллель-специфичной ПЦР
в одной пробирке, схемы метода проведения которой изображены на рисунках 2–6 (Кофиади И. А., Ребриков Д. В., 2006).
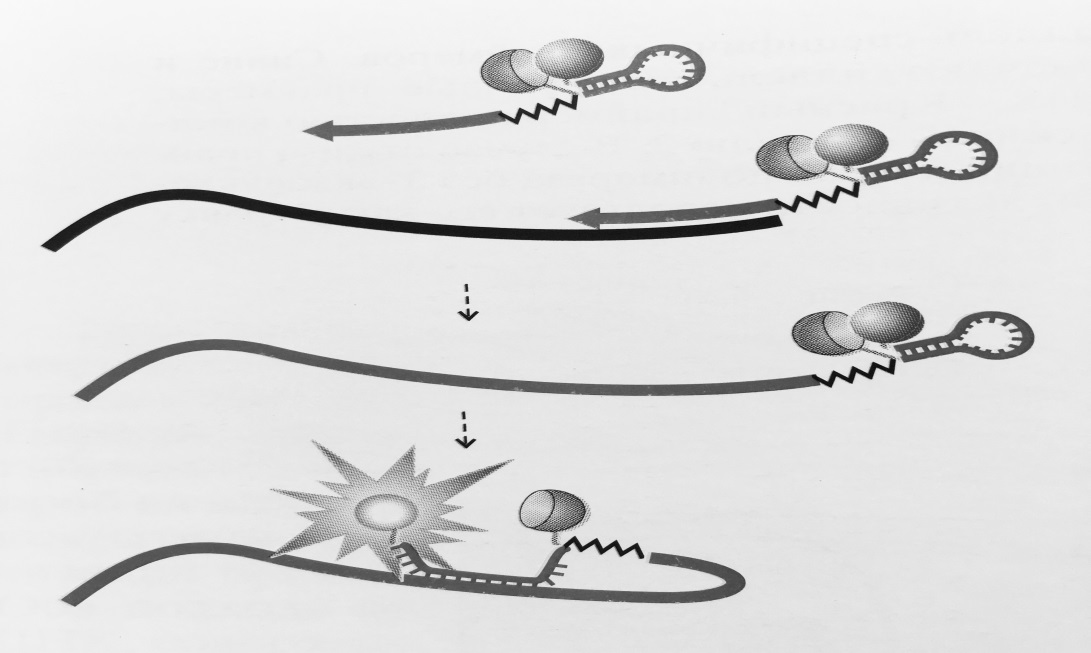
Рисунок 2 – Схема работы праймеров-«скорпионов»:
5′-концевая адаптерная часть праймера отделена от 3′-концевой аллель-специфичной части препятствующим синтезу второй цепи ДНКблокатором (обозначен ломаной линией).
При амплификации адаптерсвободного праймера формирует шпилечную структуру со сближеннымфлуорофором и гасителем. Поскольку петлевая часть адаптеракомплементарна внутренней части амплифицируемого фрагмента, после встраивания в ДНК адаптер
гибридизуется с фрагментом, приводяк разобщению флуорофора и гасителя и возрастанию флуоресценции
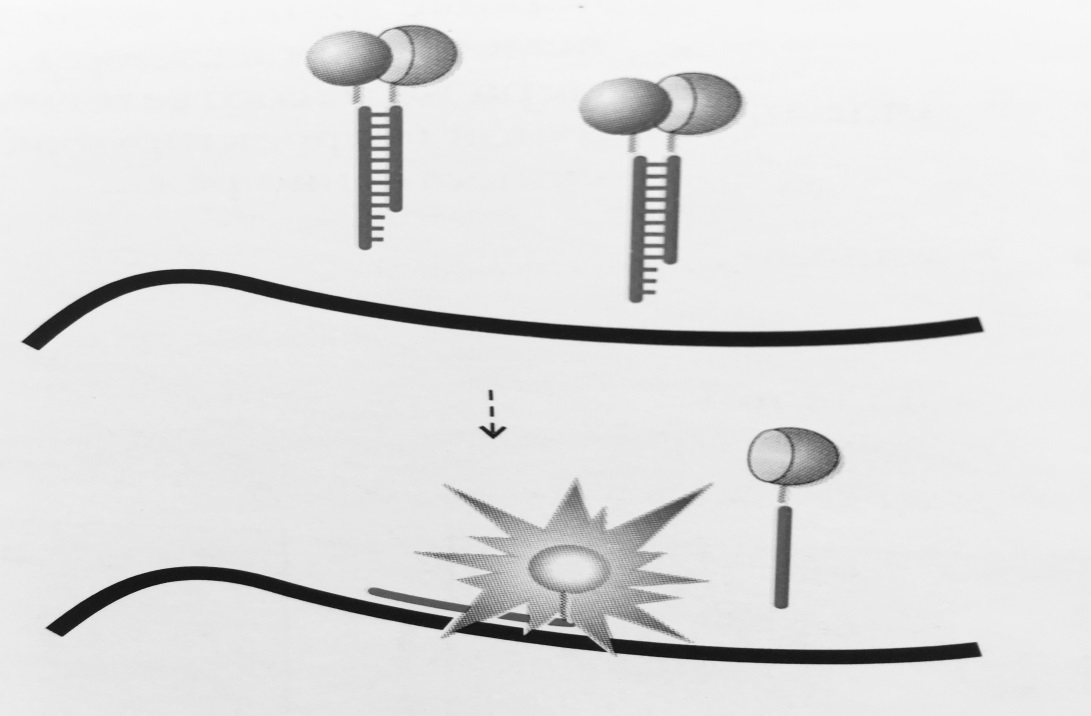
Рисунок 3 – Схема работы «вытесняющей пробы»:
Флуорофор и гаситель флуоресценции расположены на комплементарных нуклеотидах
так, что при образовании дуплекса они оказываются сближенными. В случае образования
специфичного продукта ПЦР часть проб гибридизуется с продуктом реакции,
приводя к увеличению уровня флуоресценции
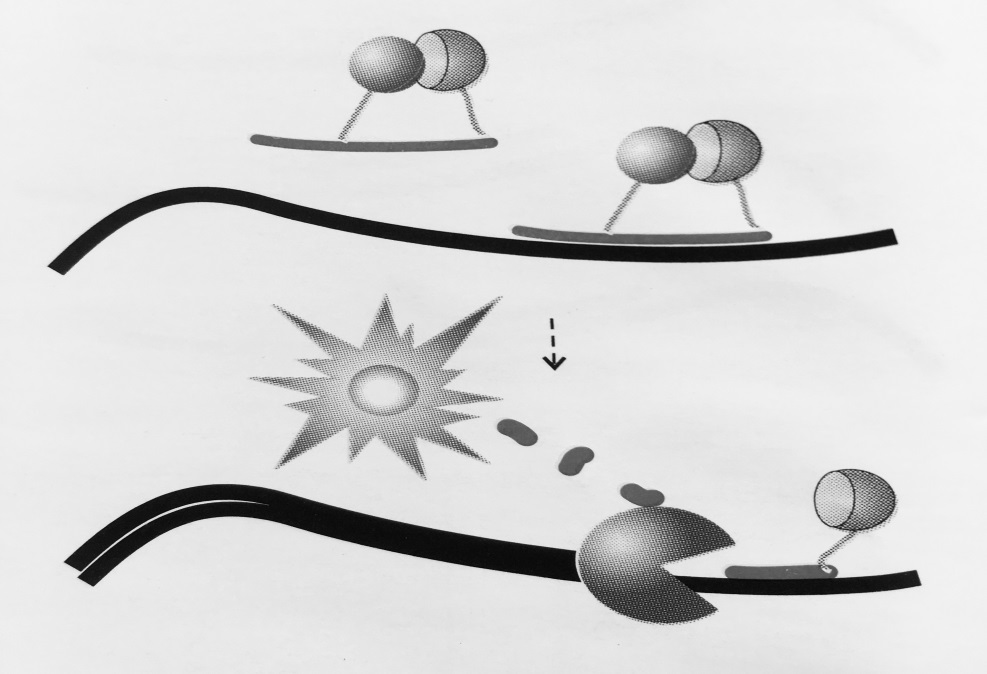
Рисунок 4 – Схема работы «разрушающей пробы»:
Пробы несут флуорофор и гаситель флуоресценции. Пока проба находится в растворе
за счет близкого расположения гаситель поглощает энергию флуорофора. В случае отжига
на специфический продукт реакции проба разрушается за счет 5′- экзонуклеазной активности полимеразы, что ведет к разобщению флуорофора и гасителя. Интенсивность сигнала
возрастает с каждым циклом ПЦР, пропорционально накоплению ампликонов
Рисунок 5 – Схема работы «молекулярных маячков»:
Пробы несут короткий инвертированный концевой повтор, по краям которого расположены флуорофор и гаситель флуоресценции. В растворе проба формирует шпилечную структуру,
в которой флуорофор и гаситель сближены. При отжиге на специфический продукт реакции проба «разворачивается», что ведет к разобщению флуорофора и гасителя и повышению уровня флуоресценции

Рисунок 6 – Схема работы «примыкающих проб»:
Система состоит их двух нуклеотидов, гибридизующихся на матрицу рядом. Один из
нуклеотидов несет флуорофор-донор, другой флуорофор-акцептор. Акцептор может
эффективно поглощать энергию, излучаемую донором. При образовании специфичного
продукта реакции олигонуклеотиды гибридизуются рядом, что ведет к эффективному
переносу энергии с донора на акцептор, а накопление продукта реакции амплификации
регистрируют по увеличению флуоресценции акцептора
Использование детектирующих амплификаторов для оценки количества продуктов накопления ПЦР имеет неоспоримые преимущества для разработки систем детекции SNP, позволяя упростить подбор условий реакции и, что самое главное, работать практически с любыми стартовыми количествами ДНК. Практически для любого из вышеупомянутых подходов требуется стандартное оборудование для ПЦР и возможность получения меченых нуклеотидов. Однако они являются относительно низкопропускными и позволяют силами одного сотрудника проводить анализ лишь нескольких сотен полиморфизмов в день, что не позволяет их использовать для широкомасштабного скрининга SNP на уровне целого генома (Кофиади И. А., Ребриков Д. В., 2006).
Платформы для одновременного и высокопроизводительного генотипирования сотен и даже сотен тысяч SNP разработаны несколькими кампаниями.
К 2008 г. затраты на генотипирование были снижены до уровня ниже 0,01 долл. за генотип. Сейчас стоимость такого рода анализа составляет приблизительно 0,0002 долл. за генотип (Веллер Дж. И., 2018). В настоящее время ведущей технологией высокопроизводительного SNP-генотипирования является «Infinium HD assay» (https://support.illumina.com/downloads/ infinium_hd_ultra_assay_
protocol_guide_11328087_b.html). По этой технологии были разработаны чипы средней плотности «BeadChips», включающие 50–60 тыс. маркеров для всех основных сельскохозяйственных животных. Был разработан чип «BovineHD BeadChip» (Illumina, Сан-Диего, Калифорния), который включает в себя
777 тыс. SNP, охватывающих весь геном КРС. Теперь доступен и чип для курицы, включающий более 580 тыс. маркеров (Веллер Дж. И., 2018). Для других основных сельскохозяйственных видов разрабатываются маркерные чипы высокой плотности, включающие более 500 тыс. маркеров.
1.6 Генетическое маркирование экономически важных признаков молочного скота
Гены-кандидаты маркеров экономически важных признаков, как правило, отбирают для исследования на основании их потенциальной способности влиять на интересующий фенотип. Критерии отбора включают влияние на физиологические процессы, место в метаболических путях и локализацию уже описанных QTLs. За последнее время было опубликовано много исследований по поиску QTLs с фенотипическими проявлениями: удой (М), выход молочного белка (Р), содержание белка в молоке (%Р), выход молочного жира (F), количество соматических клеток в молоке (SCS) и мастита (MST). Например, в работах (Смарагдов М. Г., 2006; Maiorano A., Lourenco D., Tsuruta S., Ospina A., Stafuzza N., Masuda Y., Filho A., Cyrillo J., Curi R., Silva J., 2018; Mokhber M., Moradi-Shahrbarak M., Sadeghi M., Moradi-Shahrbarak H., Stella A., Nicolzzi E., Rahmaninia J., Williams J.L., 2018) собраны все доступные сведения о локализации QTLs в аутосомах КРС. По данным 869 публикаций в настоящее время
в различных породах и популяциях КРС выявлено 116067 QTLs (https://www.animalgenom.org; обращение 13.11.2018).
Расчеты свидетельствуют, что каждый показатель молока КРС могут контролироваться вплоть до 100 QTLs (Hayes B., Goddard M.E., 2001). Причем
17 % этих локусов – мажорные, т. е. дающие существенный вклад (0,2–0,6)
в фенотипическую вариансу. Остальные являются умеренными и минорными. Большинство мажорных QTLs уже выявлено. 15 важнейших из них перечислены в таблице 3 (https://www.animalgenom.org).
Таблица 3 – Важнейшие экономически важные признаки КРС и количество определяющих их мажорных генетических локусов
| Признак | Число идентифицированных QTLs |
| Возраст полового созревания | 10545 |
| Окружность вымени | 10435 |
| Процентное содержание жира | 6652 |
| Выход жирного молока | 5489 |
| Процентное содержание каппа-казеина | 4784 |
| Процентное содержание нормальной спермы | 3596 |
| Легкость отела | 3540 |
| Процентное содержание молока | 3540 |
| Процентное содержание гликозилированной формы каппа-казеина | 2753 |
| Процентное содержание негликозилированной формы каппа-казеина | 2542 |
| Non return rate | 2419 |
| Продолжительность использования коров | 2233 |
| Выход молока | 2037 |
| Интервал между первой и последней лактацией | 1900 |
| Эффективность осеменения | 1705 |
Процедура анализа включает в себя взятие биологического материала (кровь, семя, волосы, выщипы), выделение ДНК, генотипирование на чипах, т. е. идентификация SNP, которые достоверно коррелируют с хозяйственно полезными признаками, и статистический анализ полученных данных (Лукъянов К. И., Солошенко В. А., Клименюк И. И., Юдин Н. С., 2015; Смарагдов М. Г., 2009).
Для оценки на уровень продуктивности того или иного признака необходимо разработать специальную математическую модель влияния каждого полиморфизма. Разрабатывают такую модель на стандартной или референсной популяции. Референсная популяция – это группа животных одной породы, оцененных по качеству потомства и по данным SNP-генотипирования. Эти животные должны иметь достоверные значения индексной оценки по селекционным признакам. Точность геномных оценок возрастает при увеличении объема референсной выборки (Лукъянов К. И., Солошенко В. А., Клименюк И. И., Юдин Н. С., 2015).
Для отбора QTL с использованием GS-моделей можно использовать несколько математических подходов. Очень подробно они изложены в работах (Веллер Дж. И., 2018; Смарагдов М. Г., 2009; Wiggans G. R., Cole J. B., Hubbard S. M., Sonstegard T. S., 2017). Если коротко, то:
1) каждый маркер – это QTL. Вычисляют одновременно влияние всех маркеров одновременно по их вкладу в генетическую вариансу. Этот подход предполагает, что каждый полиморфизм возникает один раз и существуетв коммерческих популяциях животных в масштабе всей популяции. Варианса каждого маркера зависит от неравновесности по сцеплению «LD» (Linkage Disequilibrium), мерой которой служит r2 – квадрат коэффициента корреляции между локусами. LD измеряется между каждой парой локусов.
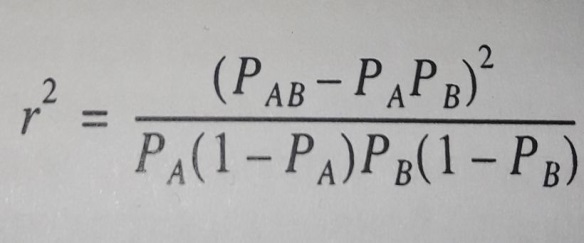
Рисунок 7 – Формула вычисления квадрата корреляции двух аллелей
для расчета LD, где РАВ – частота гаплотипа АВ, РА частота аллеля А,
РВ – аллеля В (Смарагдов М. Г., 2009)
Чем больше расстояние между маркером и QTL, тем меньше r2. При расстоянии между локусами 50 т.п.о. для голштинской породы КРС он составляет 0,35 (Смарагдов М. Г., 2009; McKay S. D., SchnabelR. D., MurdochB. M., MatukumalliL., AertsJ., CoppietersW., CrewsD., NetoE., GillC., GaoC., MannenH., StothardP., WangZ., TassellC., WilliamsJ., TaylorJ., MooreS., 2007). Этот подход предполагает, что гаплотипы между парами локусов известны точно. Для особей, гетерозиготных для обоих локусов, гаплотипы можно определить однозначно, только если соответствующая родословная генотипирована для обоих локусов. Существует большое количество литературы для определения гаплотипов более сложных родословных, например (Веллер Дж. И., 2018; Weng Z., Zhang Zh., Zhang Q., He S., Ding X., 2013);
2) SNP конструируется из нескольких гаплотипов. В этом случае увеличивается LD между гаплотипом и QTL и, следовательно, величина вариансы QTL. При этом уменьшается точность определения каждого гаплотипа;
3) вместилищем всех QTL является гамета, эффекты которой в будущем определяют через маркеры. Анализ сцепления аллелей с QTLs прослеживают через родословные животных с помощью расчета вероятностей при условии, что любые два маркера идентичны по происхождению IBD (Identity By Descent) от общего предка в родословной.
Учитывая выгоды, получаемые от популяции внутри страны, программы разведения КРС на основе GS отличаются от большинства других экономических проектов тремя аспектами (Веллер Дж. И., 2018):
1. В связи с биологическими ограничениями, особенно относительно длительным интервалом между поколениями, программу разведения можно оценить только после длительного периода времени.
2. Генетические маркеры, как правило, одновременно определяют множество признаков.
3. В отличие от других агротехнических достижений, генетические тренды являются устойчивыми. Они «не изнашиваются», их техническое обслуживание не требует дополнительных инвестиций.
Основополагающие работы по результатам геномной селекции были осуществлены Мовиссеном с соавторами, в которых были проведены оценки распределения QTLs от эффектов маркеров и показана множественная их зависимость от используемых математических моделей (Meuwissen T. H., Hayes B. J., Goddart M. E., 2001; Meuwissen T. H., KarlsenA., LienS., OlsakerI., GoddardM. E., 2002; MeuwissenT. H., Goddard M. E., 2004).Кроме того, коммерческие популяции КРС находятся между экстремальными состояниями, поскольку снижение генетического разнообразия всегда компенсируется увеличением количества мутаций, т. е. увеличением полиморфизма ДНК.
Все предыдущие разделы касались методов определения фактических полиморфизмов, ответственных за наблюдаемую генетическую вариантность
в количественных экономически важных признаках КРС. Они включеныв программы отбора в качестве фиксированных эффектов. С появлением технологии ZFN, TALEN и CRISPR/Cas9 фактически стало возможным изменять тип эмбрионов. Эти технологии теперь позволяют модифицировать эпигеном целого локуса для изменения регуляторных путей, что, в конечном счете, приведет
к значительным изменениям фенотипа животного. Однаков настоящее время применение этих технологий для сельскохозяйственных животных вызывает большие этические возражения.
2 МАТЕРИАЛЫ И МЕТОДЫ
2.1 Выделение геномной ДНК и создание библиотек для секвенирования с использованием панели TruSeq Bovine Parentage Sequencing Panel Illumina
Выделение тотальной геномной ДНК производилось из образцов цельной крови коров по ранее освоенным методикам. В частности использовались наборы ДНК-ЭКСТРАН-1 («Синтол», Россия) и К-сорб («Синтол», Россия).
2.1.1 Выделение ДНК набором ДНК-ЭКСТРАН-1 («Синтол», Россия)
Примечание:
– для выделения следует использовать цельную кровь с антикоагулянтами;
– если в лизирующем растворе № 2 есть осадок, раствор следует прогреть при 60 °С в течение 15–30 мин до растворения осадка;
– если после лизиса с лизирующим буфером № 2 не происходит выпадение белого осадка и активного помутнения раствора, следует охладить раствор во льду в течении1–5 мин.
Протокол:
1. В чистые пробирки объемом 1,5 мл внести по 300 мкл цельной крови.
2. В пробирки с образцами добавить по 900 мкл лизирующего буфера № 1.
3. Содержимое пробирок тщательно перемешать переворачиванием, избегая образования пены.
4. Инкубировать образцы при комнатной температуре в течение 10 мин, периодически перемешивая их переворачиванием.
5. Центрифугировать пробирки 2 мин при 1300 об./мин.
6. Убрать супернатант, оставив в пробирке ~20 мкл надосадочной
жидкости.
7. Ресуспендировать осадок на вортексе.
8. Добавить в пробирки по 300 мкл лизирующего буфера № 2 и 10 мкл протеиназы К.
9. Перемешать содержимое пробирок на вортексе.
10. Инкубировать образцы при температуре 65 °С до полного растворения осадка.
11. Охладить пробирки во льду 3–5 мин.
12. Сбросить пробирки на центрифуге.
13. К лизату добавить 100 мкл осаждающего раствора № 1. Убедиться в образовании белого осадка, если осадок не образуется – дополнительно охладить образец во льду в течение минуты.
14. Перемешать содержимое пробирок на вортексе.
15. Центрифугировать пробирки 2 мин при 13000 об./мин.
16. Супернатант перенести в чистые, объемом 1,5 мл пробирки и подписать.
17. Добавить к супернатанту осаждающий раствор № 2 и перемешать переворачиванием до конденсации видимого осадка ДНК (12–15 раз).
18. Центрифугировать смесь № 2 мин при 13000 об./мин.
19. Очень осторожно удалить супернатант, отслеживая положение осадка.
20. К осадку добавить 400 мкл промывающего раствора.
21. Тщательно перемешать содержимое пробирки, переворачивая ее
(10–15 раз).
22. Центрифугировать содержимое пробирки 2 мин при 13000 об./мин.
23. Тщательно, с максимальной осторожностью удалить супернатант, отслеживая положение осадка.
24. Оставить пробирки открытыми (в штативе) в чистом, работающем ПЦР-боксе для просушки при комнатной температуре до полного испарения жидкости.
25. Внести в пробирки по 50 мкл элюирующего раствора.
26. Тщательно перемешать содержимое пробирок на вортексе.
27. Инкубировать пробирки в термостате 5 мин при температуре 60 °С, после чего остудить их при комнатной температуре и снова перемешать на вортексе.
28. Кратковременно центрифугировать пробирки для удаления раствора ДНК со стенок и крышки пробирки.
29. Полученный раствор ДНК можно использовать немедленно или оставить для кратковременного (до двух недель) хранения при плюс 4–8 °С либо долговременного хранения при минус 20 °С.
2.1.2 Выделение ДНК набором К-сорб («Синтол», Россия)
1. Перед началом работы сделать аликвоту элюирующего буфера требуемого объема (от 50 до 120 мкл на образец).
2. Внести во все пробирки для исследуемых образцов и тщательно перемешать:
– 400–500 мкл физиологического раствора;
– 200 мкл лизирующего буфера (раствор №2);
– 10 мкл протеиназы К (хранение при минус 20°С);
– 10 мкл 1M раствора DTT.
3. Приготовить и внести в пробирки образцы, которые готовятся путем иссечения фрагмента марли с предварительно нанесенной на нее и высушенной кровью, площадь фрагмента – от 0,3 до 1 см2.
4. Тщательно перемешать содержимое пробирок.
5. Термостатировать пробирки при 65°С в течение 1–2 ч.
6. По окончании термостатирования извлечь пробирки с образцами из термостата, перевести его на 70°С, поставить в него пробирки с аликвотами элюирующего буфера (до окончания выделения).
7. Выполнить краткосрочное центрифугирование пробирки с образцами для удаления испарений и капель со дна крышки и стенок, минимальная длительность центрифугирования при максимальном числе оборотов в минуту.
8. В каждую пробирку внести по 200 мкл осаждающего раствора. Тщательно перемешать. Выполнить краткосрочное центрифугирование.
9. Жидкость из пробирок перенести в колонки К-сорб. Центрифугировать колонки минуту при 8.000 rpm. По окончанию центрифугирования проконтролировать полное прохождение элюента через колонку. В случае неполного прохождения увеличить время центрифугирования и/или число оборотов.
10. Элюат удалить из пробирок-коллекторов в контейнер для жидких медицинских отходов. Колонки вернуть в пробирки-коллекторы.
11. Внести в колонки по 400 мкл промывочного раствора № 1. Центрифугировать минуту при 8.000 rpm, удалить элюат, колонки вернуть в пробирки-коллекторы.
12. Внести в колонки по 400 мкл промывочного раствора № 2. Центрифугировать минуту при 8.000 rpm, удалить элюат, колонки вернуть в пробирки-коллекторы.
13. Внести в колонки по 200 мкл промывочного раствора № 2. Центрифугировать 2 мин при 13.000 rpm (или при максимальном числе оборотов центрифуги).
14. Перенести колонки в чистые пробирки. Центрифугировать 3 мин при 13.000 rpm (или при максимальном числе оборотов центрифуги).
15. Перенести колонки в чистые пробирки.
16. Внести в каждую колонку требуемую аликвоту элюирующего буфера, прогретого до 70ºС. Пробирки брать из термостата по мере расходования предыдущих.
17. Инкубировать колонки под элюирующим буфером 3–5 мин при комнатной температуре в горизонтальном положении.
18. Центрифугировать минуту при 8.000 rpm.
19. По окончании центрифугирования проконтролировать полноту прохождения элюирующего буфера во всех пробирках. Колонки поместить в пакет для твердых медицинских отходов. Пробирки маркировать с указанием данных образца и даты выделения.
20. Полученные образцы ДНК хранить при 4–8°С (до одной недели). При более длительном сроке хранениятемпература должна быть минус 20°С.
2.1.3 Протокол для фрагментации дцДНК и приготовления NSG-библиотек из 5–500 нг очищенной дцДНК
Исходный материал: 5–500 нг очищенной дцДНК (например, бактериальной геномной ДНК или геномной ДНК человека).
1. Фрагментация дцДНК.
В ПЦР-пробирку, установленную на лед, внести следующие компоненты:
| Компонент | Объем, мкл |
| 10x SD-буфер | 2,5 |
| MgCl2 (50 мМ) | 1,75 |
| дцДНК (50–500 нг) | 1–5 |
| Смесь ферментов для фрагментации (SDpol+ДНКаза I) | 1 |
| ddH2O | До 25 |
Инкубировать в ПЦР-амплификаторе в следующем режиме:
| Температура, оС | Время |
| 30 | 10–60*мин |
| 70 | 20 мин |
2. Лигирование индексированных вилочковых адаптеров с фрагментированной ДНК.
В пробирку с фрагментированной ДНК добавляют следующие компоненты, и перемешивают их встряхиванием:
| Компонент | Объем, мкл |
| Фрагментированная дцДНК | 25 |
| 10x T4 лигазный буфер | 5 |
| Индексированные вилочковые адаптеры* (12,5 мкM) | 2 |
| ddH2O | 16 |
| T4 ДНК-лигаза (5 Ед/мкл) | 2 |
Инкубировать лигазную смесь (50 мкл) в течение 20 мин при комнатной температуре. После инкубации развести лигазную смесь 0,1х ТЕ-буфером до конечного объема 100 мкл. Образцы на этом этапе можно заморозить для хранения приминус 20°C.
*В наборе используются индексированные адаптеры Illumina. Набор содержит следующие адаптеры:
| № | Индекс Illumina |
Структура |
| 1 | Universal | 5’AATGATACGGCGACCACCGAGATCTACACTCTTTCCCTACACGACGCTCTTCCGATC*T |
| 2 | Index 2 | 5’PGATCGGAAGAGCACACGTCTGAACTCCAGTCACCGATGTATCTCGTATGCCGTCTTCTGCTTG |
| 3 | Index 3 | 5’PGATCGGAAGAGCACACGTCTGAACTCCAGTCACTTAGGCATCTCGTATGCCGTCTTCTGCTTG |
| 4 | Index 4 | 5’PGATCGGAAGAGCACACGTCTGAACTCCAGTCACTGACCAATCTCGTATGCCGTCTTCTGCTTG |
| 5 | Index 5 | 5’PGATCGGAAGAGCACACGTCTGAACTCCAGTCACACAGTGATCTCGTATGCCGTCTTCTGCTTG |
| 6 | Index 6 | 5’PGATCGGAAGAGCACACGTCTGAACTCCAGTCACGCCAATATCTCGTATGCCGTCTTCTGCTTG |
| 7 | Index 9 | 5’PGATCGGAAGAGCACACGTCTGAACTCCAGTCACGATCAGATCTCGTATGCCGTCTTCTGCTTG |
| 8 | Index 10 | 5’PGATCGGAAGAGCACACGTCTGAACTCCAGTCACTAGCTTATCTCGTATGCCGTCTTCTGCTTG |
| 9 | Index 11 | 5’PGATCGGAAGAGCACACGTCTGAACTCCAGTCACGGCTACATCTCGTATGCCGTCTTCTGCTTG |
| 10 | Index 12 | 5’PGATCGGAAGAGCACACGTCTGAACTCCAGTCACCTTGTAATCTCGTATGCCGTCTTCTGCTTG |
| 11 | Index 14 | 5’PGATCGGAAGAGCACACGTCTGAACTCCAGTCACAGTTCCGTATCTCGTATGCCGTCTTCTGCTTG |
| 12 | Index 15 | 5’PGATCGGAAGAGCACACGTCTGAACTCCAGTCACATGTCAGAATCTCGTATGCCGTCTTCTGCTTG |
| 13 | Index 16 | 5’PGATCGGAAGAGCACACGTCTGAACTCCAGTCACCCGTCCCGATCTCGTATGCCGTCTTCTGCTTG |
3. Очистка ДНК, лигированной с адаптерами.
Необходимо дать шарикам AMPureXP прогреться до комнатной температуры не менее 30 мин перед использованием. Для ресуспендирования встряхнуть шарики AMPureXP на вортексе.
Добавить 80 мкл (0,8X) ресуспендированных шариков к реакции лигирования адаптеров. Хорошо перемешать пипетированием по меньшей мере 10 раз. Манипуляции следует проводить осторожно, чтобы исключить всю жидкость из наконечника во время последнего смешивания. Также можно воспользоваться смешивание на вортексе в течение 3–5 с. Если после центрифугирования
образцы центрифугируются, необходимо остановить центрифугирование до того, как шарики начнут оседать.
Инкубировать образцы на столе не менее 5 мин при комнатной температуре.
Чтобы отделить шарики от супернатанта, планшет/пробирки помещают на соответствующую магнитную подставку. При необходимости образец центрифугируют, чтобы собрать жидкость со стенок лунки пробирки или планшета перед постановкой на магнитную подставку.Через 5 мин (или когда раствор станет прозрачным) удаляют супернатант. Это действие надо проводить осторожно, чтобы не потревожить шарики, содержащие целевую ДНК.
Добавить 200 мкл 80%-го свежеприготовленного этанола в пробирку/планшет, находящиеся в магнитной подставке. Инкубировать при комнатной температуре в течение 30 с, а затем осторожно удалить и отбросить супернатант.
Повторяют эту стадию промывки один раз, чтобы получить в итоге две стадии промывки. Обязательно удаляют всю видимую жидкость после второй промывки. При необходимости, кратковременно центрифугируйте пробирку/планшет, поместите обратно на магнит и удалите следы этанола с помощью автоматического дозатора на 20 мкл. Это действие надо проводить осторожно, чтобы не потревожить шарики, содержащие целевую ДНК.
Высушить шарики на воздухе до 5 мин, пока пробирка/планшет находятся на магнитной подставке с открытой крышкой.
Внимание: важно не пересушивать шарики! Это может привести к снижению выделения ДНК-мишени. Образцы следует элюировать, когда шарики остаются темно-коричневого цвета и выглядят блестящими, но при этом вся видимая жидкость испарилась. Когда шарики становятся светло-коричневыми,
и их поверхность начинает покрываться трещинами, они являются уже пересушенными.
Снимите пробирку/планшет с магнитной подставки. Элюируйте ДНК-мишень с шариков, добавляя 22–23 мкл 10 мМ Трис-HCl или 0,1XTE. Хорошо перемешайте суспензию пипетированием 10 раз или встряхиванием на вортексе. Инкубируйте суспензию не менее 2 мин при комнатной температуре. При необходимости шарики можно центрифугировать в течение короткого времени, чтобы собрать жидкость со стенок пробирки или лунок планшета, прежде чем поставить их обратно на магнитную подставку.
Поместите пробирку/планшет на магнитную подставку. Через 5 мин (или когда раствор станет прозрачным) перенести 20 мкл образца в новую ПЦР-пробирку для амплификации.
Примечание: образцы можно хранить приминус 20 °C.
4. ПЦР-амплификация лигированной ДНК адаптера.
Вновую ПЦР-пробирку обавить следующие компоненты:
| Компонент | Объем, мкл |
| ДНК, лигированная с адаптерами | 20 |
| Смесь праймеров для ПЦР* (20 мкM– по 10 мкМ каждого праймера) |
4 |
| 10xSD-буфер | 5 |
| MgCl2 (50 мM) | 3,5 |
| Смесь ферментов для амплификации (20 Ед/мкл) | 1 |
| ddH2O | 16,5 |
| Примечание: * – ПЦР-праймеры:P5.2_PCR 5’ AATGATACGGCGACCACCGA 3’; P7.1_PCR 5’ CAAGCAGAAGACGGCATACGAGAT 3’ | |
Смешать компоненты быстрым встряхиванием на вортексе и сбросить капли центрифугированием. Поместить пробирку в термоциклер и провести ПЦР-амплификации с использованием следующих условий циклов:
| Температура, оС | Время, с | Циклы |
| 94 | 120 | 1 |
| 95 | 20 | 5–12** |
| 62 | 20 | |
| 68 | 45 | |
| 68 | 45 | 1 |
| 4 | ∞ | |
| Примечание: ** – количество циклов ПЦР следует выбирать, исходя из количества введенной ДНК. Число циклов должно быть достаточно большим, чтобы обеспечить достаточное количество фрагментов библиотеки для успешного секвенирования, но также должно быть достаточно низким, чтобы избежать появления артефактов вследствие ПЦР и избыточной амплификации (появления высокомолекулярных фрагментов на Биоаналайзере). |
||
Рекомендованное количество циклов ПЦР приведено ниже. Его можно использовать в качестве отправной точки для определения числа циклов ПЦР, наилучшего для приготовления образцов библиотек ДНК.
| Количество исходной ДНК, нг | Число циклов ПЦР, требуемое для выхода библиотеки примерно 250–500 нг |
| ≥ 250 | 5 |
| 200 | 6 |
| 100 | 7 |
| 40–50 | 8–9 |
| 20 | 10 |
| 10 | 11 |
| 5 | 12 |
5. Очистка ПЦР-реакции.
Необходимо дать шарикам AMPureXP прогреться до комнатной температуры не менее 30 мин перед использованием. Для ресуспендирования встряхнуть шарики AMPureXP на вортексе.
Добавить 45 мкл (0,9X) ресуспендированных шариков к ПЦР-реакции. Хорошо перемешать с пипетированием по меньшей мере 10 раз. Манипуляции следует проводить осторожно, чтобы исключить всю жидкость из наконечника во время последнего смешивания. Также можно использоваться смешивание на вортексе в течение 3–5 с. Если после центрифугирования образцы центрифугируются, необходимо остановить центрифугирование до того, как шарики начнут оседать.
Инкубировать образцы на столе не менее 5 мин при комнатной температуре.
Чтобы отделить шарики от супернатанта, планшет/пробирки помещают на соответствующую магнитную подставку. При необходимости образец центрифугируют, чтобы собрать жидкость со стенок лунки пробирки или планшета перед постановкой на магнитную подставку.Через 5 мин (или когда раствор станет прозрачным) удаляют супернатант. Это действие надо проводить осторожно, чтобы не потревожить шарики, содержащие целевую ДНК.
Добавить 200 мкл 80%-го свежеприготовленного этанола в пробирку/планшет, находящиеся в магнитной подставке. Инкубируют при комнатной температуре в течение 30 с, а затем осторожно удаляют и отбрасывают супернатант.
Повторяют эту стадию промывки один раз, чтобы получить в итоге две стадии промывки. Обязательно удаляют всю видимую жидкость после второй промывки. При необходимости, кратковременно центрифугируют пробирку/планшет, помещая обратно на магнит и удаляя следы этанола с помощью автоматического дозатора на 20 мкл. Это действие надо проводить осторожно, чтобы не потревожить шарики, содержащие целевую ДНК.
Высушить шарики на воздухе до 5 мин, пока пробирка/планшет находятся на магнитной подставке с открытой крышкой.
Внимание: важно не пересушивать шарики! Это может привести к снижению выделения ДНК-мишени. Образцы следует элюировать, когда шарики остаются темно-коричневого цвета и выглядят блестящими, но при этом видно, что вся видимая жидкость испарилась. Когда шарики становятся светло-коричневыми, и их поверхность начинает покрываться трещинами, они являются уже пересушенными.
Снимите пробирку/планшет с магнитной подставки. Элюируйте ДНК-мишень с шариков, добавляя 32–33 мкл 0,1XTE. Хорошо перемешайте суспензию пипетированием 10 раз или встряхиванием на вортексе. Инкубируйте суспензию не менее 2 мин при комнатной температуре. При необходимости шарики можно центрифугировать в течение короткого времени, чтобы собрать жидкость со стенок пробирки или лунок планшета, прежде чем поставить их обратно на магнитную подставку.
Поместите пробирку/планшет на магнитную подставку. Через 5 мин (или когда раствор станет прозрачным) перенести 30 мкл в новую ПЦР-пробирку для хранения при минус 20°C.
Далее необходимо проверить распределение фрагментов библиотеки (например, с использованием Agilent Bioanalyzer High Sensitivity DNA chip).
2.1.4 Измерение концентрации ДНК с помощью PicoGreen dsDNA Assay Kit
В ходе работы не следует использовать для раствора стеклянную посуду.
Подготовка красителя:
Перед началом работы следует дать реагенту Quant-iT™ PicoGreen® нагреться до комнатной температуры, прежде чем открывать пробирку с ним. Для наилучшего результата раствор необходимо использовать в течение нескольких часов после приготовления. Приготовленный раствор с красителем следует защищать от света (поместив его в темное место или накрыв фольгой).
- Проверить корректность установки даты и времени в приборе («Settings» → «Instrument settings» →«Date/Time»). При необходимости установить верные значения.
- В чистую, объемом 15 мл пробирку внести 1005 мкл 20х TE буфера.
- Добавить в пробирку 19095 мкл Н2О, а также 101 мкл красителя.
- Тщательно перемешать.
- Приготовить контрольную ДНК для построения кривой (0 и 100 нг в 5 мкл):
- внести в пробирку на 0,2 мл 8 мкл 1хТЕ буфера;
- добавить 2 мкл контрольной ДНК из набора (100нг/мкл). Хорошо перемешать пипетированием;
- подготовить две оптически прозрачные пробирки объемом 0,5 мл;
- одну подписать как К1, другую – К2;
- в К1 внести 200 мкл раствора для измерения концентрации;
- в К2 внести 195 мкл раствора для измерения и 5 мкл разведенной контрольной ДНК (из шага b).
- Внести по 195 мкл в оптически прозрачные пробирки объемом 0,5 мл.
- Добавить в каждую пробирку по 5 мкл соответствующей коровьей ДНК.
- В пробирку К1внести 5 мкл раствора ДНК второго разведения
(38 + 2 мкл). - В пробирку К2 внести 5 мкл раствора ДНК первого разведения (8 + 2 мкл).
- Включить прибор, подключить его к компьютеру.
- Выбрать на первом экране программу PicoGreen.
- Произвести измерения.
2.1.5 Подготовка библиотеки к нанесению в картридже
После объединения образцов измерить концентрацию ДНК.
Произвести пересчет массовой концентрации в молярность:http://molbiol.ru/scripts/01_07.html (программа выдает данные в пикомолях, необходимо пересчитать в наномоли).
Далеенеобходимоследоватьинструкциям Protocol A из«MiSeq System Denature and Dilute Libraries Guide».
2.1.6 Разведение щелочи (NaOH)
К 100 мкл стокового раствора (10М) добавить 900 мкл Н2О.
К отобранным 200 мкл полученного раствора (1N NaOH) добавить
800 мкл Н2О.
В результате получится 1 мл 0,2N NaOH.
2.1.7 Денатурация библиотеки
1. В микроцентрифужной пробирке смешать следующие объемы.
- 4 нM библиотека (5 мкл);
- 0,2N NaOH (5 мкл).
2. Перемешать кратким встряхиванием на вортексе и центрифугировать при 280×g в течение минуты.
3. Инкубировать при комнатной температуре в течение 5 мин.
4. В пробирку, содержащую денатурированную библиотеку, добавить
990 мкл холодного НТ1-буфера.
5. В результате получается 1 мл денатурированной библиотеки с концентрацией 20 пМ.
6. Нанести в картридж 600 мкл.
2.2 Перечень однонуклеотидных полиморфизмов (SNP), входящих в использованную панель TruSeq Bovine Parentage Sequencing Panel
Все исследуемые SNP можно разделить на Блок 1 и Блок 2.
Блок 1. Родство и достоверность происхождения (200 SNP)
Исходя из рекомендаций Международного общества по изучению генетики животных (ISAG), по каждому животному определяются важные индивидуальные мутации. Достоверность происхождения контролируется по 200 SNP.
Блок 2. Генетически наследуемые заболевания (53 SNP)
В таблице 4 приведен подробный перечень SNP, которые были использованы нами для характеристики исследуемых экспериментальных стад.
Таблица 4 – Исследованные мутации
| № п/п | Идентификатор SNP | Значение замены | Сочетание аллелей | ||
| позитивно | нейтрально (носительство) |
негативно | |||
| 1 | 2 | 3 | 4 | 5 | 6 |
| 201 | _SNPchr19_27956790 | Мутация в белке, продукте гена SHBG, связывающем и транспортирующем стероидные половые гормоны. Ассоциирована с потерей плодовитости, связаннымс гаплотипом MH1 и эмбриональной смертностью | C/C | C/T | T/T |
| 202 | _SNPchr26_36951321 | Мышечная аномалия переднего пояса у КРС – аутосомно-рецессивное расстройство | C/C | C/T | T/T |
| 203 | _SNPchr6_89169686 | Синдром легочной гипоплазии и анасарка (РНА) – редкая врожденная аномалия у крупного рогатого скота, которая характеризуется водянкой плода, включая сильный подкожный отек (anasarca) и неразвитые или слабо сформированные легкие (легочная гипоплазия) | A/A | A/G | G/G |
| Продолжение таблицы 4 | |||||
| 1 | 2 | 3 | 4 | 5 | 6 |
| 204 | FBN1_SNPchr10_62054844 | Синдром Марфана (MFS) – наследственное аутосомно-доминантное заболевание крупного рогатого скота, связанное с мутацией в гене FBN1 10 хромосомы Вos taurus | G/G | A/G
A/A |
|
| 205 | FBN1_SNPchr10_62141461 | Синдром Марфана (MFS) – наследственное аутосомно-доминантное заболевание. Патологические процессы развиваются в сердечно-сосудистой и костно-мышечной системах, глазах, коже и кожных покровах | G/G | A/G
A/A |
|
| 206 | _SNPchr7_17645428 | Мутация, вызывающая нейропатическую гидроцефалию (NH). Большинство случаев NH приводят к ранним абортам. NH телят, которые рождаются намного меньшим весом для регистрационного возраста | A/A | A/G | G/G |
| 207 | _SNPchr8_108833985 | Кератоконъюктивит – быстрораспространяющаяся, доброкачественно протекающая болезнь животных различных видов, вызываемая риккетсиоподобными микроорганизмами. С каждым аллелем ‘G’ животное уменьшает свой риск заражения на 8–13 %. Таким образом, животное, которое является гомозиготным G/G аллелей, имеет риск инфицирования меньше на 16– 26 % по сравнению с гомозиготой A/A |
G/G | A/G | A/A |
| 209 | ASS1_SNPchr11_100802781 | Цитруллинемия – это аутосомно-рецессивное расстройство, которое для животных является летальным в раннем постнатальном периоде | C/C | C/T | T/T |
| 210 | CWC15_SNPchr15_15707169 | Гаплотип джерсейского скота (JH1). Аутосомно-рецессивная смертельная мутация гомолога CWC15 (гомолог сплайсосома-ассоциированного белка CWC15) на хромосоме 15 | C/C | C/T | T/T |
| 211 | LRP4_SNPchr15_77667135 | Синдактилия (мулья нога). Во многих странах у многих пород крупного рогатого скота сообщалось о синдактилии. Однако большая часть документации связана с ее появлением у голштинской породы, разводимой в Америке | C/C | C/T | T/T |
| Продолжение таблицы 4 | |||||
| 1 | 2 | 3 | 4 | 5 | 6 |
| 212 | LRP4_SNPchr15_77675440+LRP4_SNPchr15_77675516+LRP4_SNPchr15_77675517 | Множественные мутации в гене белка 4, связанным с рецептором LDL. Синдактилия (мулья нога). Пораженный крупный рогатый скот может иметь 1–4 объединенных копыта, проявляет разную степень хромоты, имеет высокую ступенчатую походку и медленно ходит | G/G | G/A | A/A |
| 213 | LRP4_SNPchr15_77682052 | Мутация обнаружена в гене белка 4, связанным с рецептором LDL. Сопровождается синдактилией (нога мула) | G/G | G/A | A/A |
| 214 | LRP4_SNPchr15_77686731 | Мутация обнаружена в гене белка 4, связанным с рецептором LDL. Сопровождается синдактилией (нога мула) | G/G | G/A | A/A |
| 217 | GART_SNPchr1_1277227 | Гаплотип голштинского скота (HH4). Повышенная вероятность эмбриональной и постэмбриональной смертности | A/A | A/C | C/C |
| 218 | ITGB2_SNPchr1_145114963 | Синдром врожденного иммунодефицита (Bovine Leukocyte Adgesion Defiency, BLAD) | T/T | T/C | C/C |
| 219 | CLCN7_SNPchr25_1137017+CLCN7_SNPchr25_1137019 | Остеопетроз (OS) – заболевание костей, приводящее к тяжелым нарушениям в организме животного. Дефект активности остеокластов приводит к образованию чрезмерно хрупких костей. Больные телята рождаются, как правило, раньше срока мертвыми. Заболевание имеет аутосомно-рецессивный тип наследования | G/G | G/T | T/T |
| 220 | COL7A1_SNPchr22_51873390 | Буллезный эпидермолиз (БЭ) – наследственное буллезное заболевание животных, характеризующееся крайней хрупкостью кожии слизистых оболочек при механическом воздействии | C/C | C/T | T/T |
| 221 | FECH_SNPchr24_57298883 | Врожденная эритропоэтическая протопорфирия – генетическое заболевание, приводящее к тяжелой форме фотосенсибилизации (повышенной чувствительности организма, чаще кожи к свету). Кроме боязни света у животных наблюдается повреждение кожи и слизистых оболочек, иногда случаются припадки и судороги |
G/G | G/T | T/T |
| Продолжение таблицы 4 | |||||
| 1 | 2 | 3 | 4 | 5 | 6 |
| 223 | FANCI_SNPchr21_21184873 | Синдром брахиспина (BS) – редкий рецессивный генетический дефект молочного голштинского крупного рогатого скота. Риск эмбриональной смертности | T/T | T/C | C/C |
| 225 | ATP2A1_SNPchr25_26197204 | Врожденная мышечная дистония 1-го и 2-го типов – наследственное заболевание с аутосомно-рецессивным типом наследования, широко распространенное в бельгийской голубой породе. У всех телят с CMD наблюдаются генерализованные мышечные контрактуры (непроизвольное обширное напряжение мышц), нарушение глотания, высокая степень утомляемости, длительные мышечные спазмы | C/C | C/A | A/A |
| 226 | ATP2A1_SNPchr25_26197429 | Врожденная мышечная дистония 1-го и 2-го типов | C/C | C/A | A/A |
| 227 | ATP2A1_SNPchr25_26198573 | Врожденная мышечная дистония 1-го и 2-го типов | C/C | C/T | T/T |
| 229 | SLC6A5_SNPchr29_24610561 | Врожденная мышечная дистония 1-го и 2-го типов | A/A | A/G | G/G |
| 230 | SLC37A2_SNPchr29_28879810 | Аборт из-за гаплотипа MH2 у Bos taurus |
T/T | T/C | C/C |
| 231 | PYGM_SNPchr29_43611783 | Гликогенное заболевание (V). Наследственное заболеваниес аутосомно-рецессивным типом наследования | G/G | G/A | A/A |
| 235 | KRT5_SNPchr5_27545478 | Врожденный буллезный эпидермолиз – наследственное заболевание, которое характеризуется преимущественно хрупкостью и другими дефектами кожи и слизистых оболочек. Может наблюдаться деформация и отслоение копыт. Пораженные телята чаще всего погибают в возрасте 1–4 нед. Буллезный эпидермолиз распространенв голштинской породе КРС |
G/G | G/A | A/A |
| 236 | APAF1_SNPchr5_63150400 | Гаплотип (HH1), связанный с эмбриональной смертностью. Гаплотип HH1, связанный с эмбриональной смертностью на разных сроках стельности, картирован на 5-й хромосоме | C/C | C/T | T/T |
| Продолжение таблицы 4 | |||||
| 1 | 2 | 3 | 4 | 5 | 6 |
| 237 | HEPHL1_SNPchr29_695072 | Гипотрихоз. У крупного рогатого скота с мутацией в гене HEPHL1 отсутствуют волосяной покров при рождении частично или по всему телу: часто грудь, шеяи ноги. Пострадавшие животные более чувствительны к окружающей среде, кожным инфекциям, вредителям, солнечным ожогам, холодовому стрессу | T/T | T/A | A/A |
| 238 | IFNGR2_SNPchr1_1390292 | Мутация в гене IFNGR2 ассоциирована с туберкулезом. Дефектыв IFNGR2 являются причиной менделевской восприимчивостик микобактериальному заболеванию (MSMD), также известному как семейная диссеминированная атипичная микобактериальная инфекция. MSMD представляет собой генетически гетерогенное заболевание с аутосомно-рецессивным, аутосомно-доминантным или X-связанным наследованием | G/G | G/A | A/A |
| 239 | KDM2B_SNPchr17_56010031 | ДисплазияPaunch Calf Syndrome. Телята обычно мертворожденны, имеют аномальное развитие нескольких органов, лицевые деформации и расширенный желудок, наполненный жидкости. У некоторых пораженных телят также есть выступающий языки расщепленное нёбо | G/G | G/A | A/A |
| 240 | KDSR_SNPchr24_62138835 | Спинальная мышечная атрофия (SMA). Относится к нейродегенеративным заболеваниям. Причиной болезни является мутация в гене KDSR, кодирующем 3-кетодигидросфингозинредуктазу, которая катализирует важнейшие процессы в метаболизме гликосфинголипидов | C/C | C/T | T/T |
| 241 | KRT74_SNPchr5_27490704 | Мутация в гене кератин 74. Аутосомно-доминантная патология волосяного покрова животного (ADWH), также связана с мутацией гена KRT74 – это редкое заболевание, характеризующееся плотно скрученными волосами | C/C | C/T | T/T |
| Продолжение таблицы 4 | |||||
| 1 | 2 | 3 | 4 | 5 | 6 |
| 245 | LYST_SNPchr28_8508619 | Синдром Чедиак-Хигаси (CHS) представляет собой аутосомно-рецессивное расстройство, которое поражает несколько видов, включая мышей, людей и крупный рогатый скот.Вызывает нарушение работы белка регулятора транспорта лизосом, что приводит к изменениям в размере, структуре и функции лизосом | T/T | T/C | C/C |
| 246 | MFN2_SNPchr16_42562057 | Aксонопатия. Телята часто имеют широкую постановку ног и начинают терять контроль над задними лапами в возрасте 1 мес, в дальнейшем они не могут стоять. Хотя болезнь не смертельна, пораженные телята, как правило, подвергаются эвтаназии в возрасте 10 мес |
C/C | C/T | T/T |
| 247 | MITF_SNPchr22_31746502 | Синдром белого симментала (GWFS) – аутосомально-доминантное генетическое заболевание, которое характеризуется гипопигментацией, гетерохромией радужки, дефектами оболочки глаз и двусторонней потерей слуха | C/C | C/A
A/A |
|
| 248 | MAN2B1_SNPchr7_13956640 | Маннозидоз – это рецессивное генетическое заболевание, связанное с нарушением работы лизосомальной альфа-маннозидазы – низкоспецифичной экзогликозидазы, основная функция которой – деградация гликопротеинов | G/G | G/A | A/A |
| 249 | MAN2B1_SNPchr7_13957949 | Маннозидоз. AM_961 (обнаружена в линиях Angus и Murray Grey): |
T/T | T/C | C/C |
| 250 | MITF_SNPchr22_31769189 | Синдром белого симментала (GWFS) – аутосомально-доминантное генетическое заболевание, которое характеризуется гипопигментацией, гетерохромией радужки, дефектами оболочки глаз и двусторонней потерей слуха | T/T | T/A
A/A |
|
| 251 | OPA3_SNPchr18_53546443 | Кардиомиопатии – тяжелые дегенеративные заболевания миокарда, которые приводят к сердечной недостаточности. В течение последних трех десятилетий дилатационная кардиомиопатия быков (BDCMP) получила широкое распространение в голштинской и симментальской породах крупного рогатого скота | G/G | G/A | A/A |
| Продолжение таблицы 4 | |||||
| 1 | 2 | 3 | 4 | 5 | 6 |
| 252 | GLRA1_SNPchr7_65080197 | Врожденный миоклонус – это наследственное аутосомно-рецессивное заболевание, которое ранее было известно, как нейроаксиальный отек. У животных с ICM наблюдается аномальная реакция на различные тактильные, зрительные и слуховые раздражители в виде гиперестезии и миоклонических судорог скелетных мышц | G/G | G/T | T/T |
| 253 | PLD4_SNPchr21_71001232 | Врожденный дефицит цинка (ZDL).Это заболевание характеризуется нарушением функции иммунной системы, замедлением роста и кожными изменениями, вследствие нарушения абсорбции цинка в кишечнике | G/G | G/A | A/A |
| 254 | RASGRP2_SNPchr29_43599204 | Тромбопатия – генетическое заболевание, связанное с нарушением свертываемости крови, происходящим в результате блокировки высвобождения АДФ из тромбоцитов. У больных животных количество тромбоцитов находится в норме, но их функция нарушена, что приводит к нарушению свертываемости крoви | A/A | A/G | G/G |
| 255 | RNF11_SNPchr3_95601697 | Карликовость. Мутация в гене RNF11 (ассоциирована с нарушением регуляции белкового комплекса А20, что приводит к различным патологиям роста и развития) | A/A | A/G | G/G |
| 256 | SLC35A3_SNPchr3_43412427 | Комплексный порок позвоночника (CVM) – сложный тератологический синдром телят голштинской породы, заключающийся, прежде всего, в выкидышах, преждевременных родах, мертворождении или смерти телят в первые дни жизни, а значит увеличивающий смертность молодняка и воспроизводительные способности скота. Самым ярким проявлением этой аномалии, о чем говорит уже само ее название, являются многочисленные уродства скелета. Cмертность на стадии эмбриона | G/G | G/T | T/T |
| Продолжение таблицы 4 | |||||
| 1 | 2 | 3 | 4 | 5 | 6 |
| 257 | SLC39A4_SNPchr14_1723331 | Акродерматит энтеропатический. Заболевание, обусловленное нарушением всасываемости в кишечнике за счет дефицита цинка и отсутствия фермента олигопептидазы. Мутации в гене SLC39A4 приводят к дефициту протеина, ответственного за всасывание цинка, что ведет к грубому изменению метаболизма цинка | G/G | G/A | A/A |
| 258 | IARS_SNPchr8_85341291 | Перинатальный синдром слабого теленка. Соответствует понятию «физиологическая незрелость» новорожденных (иногда называют «синдром слабых телят»). У таких животных снижен мышечный тонус, тормозится реализация позы стояния (они не могут подняться на ноги в течение первых двух часов после рождения), сосательный рефлекс появляется с запозданием и слабо выражен, отмечают безучастное отношение к окружающему, сгорбленную позу | C/C | C/G | G/G |
| 259 | SMC2_SNPchr8_95410507 | Голштинский гаплотип НН3. Оказывает влияние на процент успешных осеменений (с наступлением стельности) и ассоциирован с эмбриональной и ранней постэмбриональной смертностью | T/T | T/C | C/C |
| 260 | SPAST_SNPchr11_14760164 | Спинальная демиелинизация (SDM). Нейродегенаритивное заболевание характеризуется патологическими изменениями миелиновой оболочки спинного мозга. Болезнь связана с нарушением работы белка спастина, которое приводит к потере АТФазной активности этого белка | G/G | G/A | A/A |
| 261 | TG_SNPchr14_9487659 | Врожденный зоб щитовидной железы (CG) – это аутосомно-рецессивное наследственное заболевание, вызванное мутацией в гене TG, который кодирует белок тиреоглобулин. CG является первым генетическим заболеванием среди всех доместицированных видов животных, для которых была описана молекулярно-генетическая природа | G/G | G/A | A/A |
| Продолжение таблицы 4 | |||||
| 1 | 2 | 3 | 4 | 5 | 6 |
| 262 | TYRP1_SNPchr8_31711945 | Глазокожный альбинизм | G/G | G/A | A/A |
| 263 | UBE3B_SNPchr17_65921497 | Мутация в гене UBE3B – убиквитин-белковой лигазы E3B | C/C | C/T | T/T |
| 264 | UMPS_SNPchr1_69756880 | Дефицитуридинмонофосфатсинтетазы (Deficiency of Uridine-5-Monophosphate Synthase, DUMPS).
DUMPS – это наследственное летальное аутосомно-рецессивное заболевание в голштинской популяции, приводящее к ранней эмбриональной смертности на стадии имплантации эмбриона в матку. Это связано с нарушением синтеза уридин-монофосфата в организме, который является одним из ключевых элементов при синтезе de novo пиримидиновых нуклеотидных оснований. Смертность эмбриона наступает примерно на 40 день после оплодотворения |
C/C | C/T | T/T |
| 265 | F8_SNPchrX_38971744 | Гемофилия А (FVIIID; OMIA 000437-9913) представляет собой нарушение свертываемости крови, описанное как у человека, так и у многих видов домашних животных (лошадей, овец), в том числе у крупного рогатого скота. Заболевание связано с дефицитом фактора VIII свертывания крови – плазменного гликопротеина, ген которого расположен на Х хромосоме |
A/A | A/T | T/T |
В первом столбце указан порядковый номер SNP на панели. Во втором столбце приведено наименование однонуклеотидного полиморфизма (SNP) (например, для SNP с порядковым номером 2 – это «ARS-BFGL-BAC-19454» (один из 100 дополнительно введенных в целях более точного определения родства полиморфизм), а для SNP с порядковым номером 265 – это «F8_SNPchrX_38971744» (мутация, приводящая к развитию гемофилии А, дефицит фактора VIII свертываемости крови). В столбце 3 описано влияние замены на физиологическое состояние индивида, т. е. дана информация о генетически наследуемом признаке или заболевании, с которым ассоциирован данный однонуклеотидный полиморфизм (так для SNP с порядковым номером 265 – «F8_SNPchrX_38971744», в таблице это гемофилия А).
В четвертом столбце указан конкретный нуклеотид аллеля, представленный в качестве референсного (наиболее представленного) для соответствующего SNP в базах данных (так, для SNP № 2 «ARS-BFGL-BAC-19454» – это цитозин – С), а в пятом столбце указаны альтернативные аллели в соответствующей популяции (или возможные, помимо референсного), в случае «ARS-BFGL-BAC-19454» – это тимин.
3 НОВЫЙ МЕТОД ДНК-ДИАГНОСТИКИ КРУПНОГО РОГАТОГО СКОТА НА ОСНОВЕ БИОЧИПОВ «TRUSEQ BOVINE PARENTAGE SEQUENCING PANEL»
Современное животноводство, используя самые последние достижения фундаментальных биологических наук, в том числе и генетики, позволяет добиваться увеличения эффективности разведения животных. Идентификация генов, которые определяют то или иное развитие количественных признаков, а также их мутаций, поиск молекулярно-генетических маркеров, тесно сцепленных с ними, является
в настоящее время предметом интенсивных исследований.
В настоящее время, разработан уникальный метод анализа, отвечающий мировым стандартам – ДНК-диагностики крупного рогатого скота на основе панели (биочипа) «TruSeq Bovine Parentage Sequencing Panel». Метод дает возможность одновременного анализа 263 аллельных вариантов генов-маркеров патологий, признаков продуктивности и устойчивости к заболеваниям. Его отличительной особенностью является высокая точность генотипирования и надежность.
Исходя из рекомендаций Международного общества по изучению генетики животных (ISAG), по каждому животному определяются важные индивидуальные мутации (SNP/варианты – singlenucleotidepolymorphism – однонуклеотидных полиморфизмов). Достоверность происхождения контролируется по 200 SNP. Ассоциированных с заболеваниями и продуктивностью замен будет определено 48, в том числе гаплотипы фертильности – 12; летальные наследуемые заболевания (цитруллинемия, врожденная мышечная дистония, кардиомиопатия и т. д.) – 17; нелетальные неблагоприятные состояния (синдром Марфана, протопорфирия, гемофилия А и т. д.) – 19; признаки продуктивности – 15 (фертильность быков – 1; рост и развитие животного – 4; качество мяса – 4;
качество молока – 6).
3.1 Мутация в половом стероидсвязывающем
глобулин гене (Sex Hormone-Binding Globulin, SHBG)
Номер на панели биочипа – 202. SNPchr19_27956790. Мутация в половом стероидсвязывающем глобулин гене (Sex hormone-binding globulin, SHBG), расположенном на 19 хромосоме быков.
SHBG является транспортером андрогена, который регулирует скорость метаболизма в плазме стероидных гормонов, контролируя их концентрацию (Fritz S. [et al.], 2013). Существует много примеров эмбриональной летальности, связаннойс дефицитом ферментов, участвующих в синтезе половых стероидов или их рецепторов, что указывает на то, что эти гормоны играют существенную роль в процессе развития (Khatib H. [et al.], 2009). Кроме того, отсутствие белка S – одного из двух известных паралогов SHBG – вызывает эмбриональную летальную коагулопатию и сосудистый дисгенез (Khatib H. [et al.], 2009). В совокупности эти наблюдения подтверждают возможную связь между дефицитом SHBG и потерей плодовитости, связанным с гаплотипом MH1. Данная мутация (g.27956790C > T) вводит преждевременный стоп-кодон в половом стероидсвязывающем глобулине, что приводит к потере приблизительно 90 % этого белка (SHBG p.Q52X). Ниже представлены последовательности праймеров, используемые для генотипирования SHBG: g.27956790C > T мутации на бычьей хромосоме 19 и валидации путем секвенирования ампликона с мутацией SHBG: g.27956790C > T. Этот единичный нуклеотидный вариант был генотипирован с использованиемполиморфизма длин рестрикционных фрагментов (ПДРФ) – PCRRestrictionsFragmentLengthPolymorphism. Даны праймерные пары, размер ампликона 137 пар оснований (bp) и температуре отжига 63 °C (AT). Нуклеотид T заменяется на G (жирным шрифтом и скобками) в ходе ПЦР несоответствия, чтобы создать сайт рестрикции BsmFI:
| Forward primer (5’–3’) |
|---|
| CCTGCTCTGCACCTCAGCAGTGGTCC[G]GGA |
| Reverse primer (5’–3’) |
| AGCTGATGGAGAGAGGGTGA |
Ниже представлена хроматограмма для SHBG: g.27956790C > T мутации гомозиготной мутированной коровы и ее гетерозиготного родителя:
3.2 Мышечная аномалия передних конечностей у КРС
Номер на панели биочипа – 203. SNPchr26_36951321. Мышечная аномалия передних конечностей у КРС (Forelimb-girdlemuscularanomaly).
Мышечная аномалия передних конечностей – это аутосомно-рецессивное расстройство Японской черной породы коров, характеризующееся тремором, астазией и аномальной формой плеч. Патологическое исследование пораженных животных выявляет гипоплазию мышц передних конечностей с уменьшенным диаметром мышечных волокон. За эту аномалию ответственна мутация g.36951321C > T на 26 хромосоме. Анализ гаплотипов с использованием дополнительных маркеров в этом регионе уточнил критический участок локуса интервалом 3,5 Мб на хромосоме 26 между BM4505и MOK2602. Путем сравнительного картографирования выявлены несколько потенциальных генов-кандидатов для мутаций, включая NRAP, PDZD8и HSPA12A, которые связаны с мышечной функцией (Masoudi A.A., Uchida K., Yokouchi K., Miyadera K., OgawaH., SugimotoY., KuniedaT., 2007).
3.3 Синдром легочной гипоплазии и анасарка (РНА)
Номер на панели биочипа – 204. SNPchr6_89169686. Синдром легочной гипоплазии и анасарка (РНА).
Синдром легочной гипоплазии и анасарка (PHA, OMIA 001562–9913, Online Mendelian Inheritance in Animals) – редкая врожденная аномалия
у крупного рогатого скота, которая характеризуется водянкой плода, включая сильный подкожный отек (anasarca) и неразвитые или слабо сформированные легкие (легочная гипоплазия) (Whitlock B. K., Coffman E. A., 2015).
Эмбриональная водянка определяется как чрезмерное скопление жидкости внутри внесосудистых отделений плода и полостей тела. Ранее случаи (РНА) отмечались у пород крупного рогатого скота, таких как австралийских Декстер, Галловейская, Мейн-Анжу и Шоргорн.
Гипоплазия легкого и его долей – порок, при котором имеется одновременное недоразвитие бронхов и легочной паренхимы. Выделяют простую
и кистозную формы гипоплазии. При простой гипоплазии имеется равномерное недоразвитие легкого, отдельных его долей или сегментов. При кистозной гипоплазии недоразвитие легкого или его долей сопровождается кистозным перерождением респираторного отдела легкого.
3.4 Мутация, ассоциированная с синдромом Марфана (MFS)
Номер на панели биочипа – 205. FBN1_SNPchr10_62054844;
206. FBN1_SNPchr10_62141461. Мутация, ассоциированная с синдромом
Марфана (MFS).
Синдром Марфана (MFS) – наследственное аутосомно-доминантное заболевание крупного рогатого скота, связанное с мутацией в гене FBN1 10хромосомы Вostaurus. Одной из причин СМ – аутосомно-доминантного заболевания соединительной ткани – являются мутации в гене фибриллина-1 (cтарт 61876888, стоп 62142761), аномалия которого способствует избыточной активации трансформирующего ростового фактора-β (TGF–β). Увеличенная активность TGF–β может способствовать мультисистемному проявлению патологического процесса, включая развитие миксоматозных изменений атриовентрикулярных клапанов, аневризмы и расслоения аорты, гипермобильности суставов.
Синдром Марфана у КРС обладает всеми клиническими и патологическими признаками аналогичного заболевания человека. Патологические процессы развиваются в сердечно-сосудистой и костно-мышечной системах, глазах, коже и кожных покровах – аневризма аорты, пролапс митрального клапана, суставная гипермобильность, деформация передней грудной клетки, деформация позвоночного столба и многие другие (Hirano T., Matsuhashi T., Kobayashi N., Watanabe T., Sugimoto Y., 2012).
Картирование.кДНК-последовательность гена FBN1 крупного рогатого скота была охарактеризована, а гибрид соматической клетки – к синтаксической группе U5, что соответствует хромосоме BTA10 (Potter K. A., Besser T. E., 1994). Этот результат подтвержден путем сопоставления связей SNP в гене FBN1 с хромосомой BTA10, «10 см от BM888 (LOD = 4,88) и 14 см от INRA096 (LOD = 3,77)».
Молекулярная основа: путем секвенирования кДНК почти определенного сравнительного гена-кандидата (на основе гомологичной человеческой мутации), а именно FBN1, у пораженных телят породы Лимузин (SingletonC., MitchellA.L., ByersP. H., PotterK. A., Pace J. M., 2005) обнаружил причинную мутацию в этой породе как переход 3598G > A в экзоне 29, что привело к возможной замене глутаминовой кислоты лизином в положении 1200 в качестве причины этого синдрома.
Известно о мутации «G > A на сайте интрон-крекинга intron64 (c.8227-1G > A)» как причинной для болезни Марфана на японском черном скоте. «Мутация вызывает 1-базовое смещение сайта accepter-сплайсинга интрона 64 в направлении 3′ и делецию 1-бета в обработанной мРНК. Эта делеция с 1 базой создает преждевременный терминальный кодон и более короткий фибриллин на
125 аминокислот – 1 из мутантной мРНК».
3.5 Мутация, вызывающая нейропатическую гидроцефалию (NH)
Номер на панели биочипа – 207. SNPchr7_17645428. Мутация, вызывающая нейропатическую гидроцефалию (NH).
Нейропатическая гидроцефалия (NH) является генетическим заболеванием крупного рогатого скота во всем мире. В последние годы заболевание чаще всего выявлялось в абердин-ангуской породе. Одна мутация, вызывающая NH у абердин-ангусского крупного рогатого скота, была широко распространена во всем мире за последнее десятилетие у потомков GAR Precision 1680, популярного AI производителя во многих мраморных линиях абердин-ангуссов. Предполагается, что NH-мутация произошла как спонтанная мутация в GAR Precision 1680. Большинство случаев NH приводят к ранним абортам. NH телят, которые рождаются намного меньшим весом для регистрационного возраста (вес при рождении < 15 кг). Череп значительно увеличен. Кости черепа неправильны и выглядят как свободно организованные костные пластины, которые разваливаются при открытии полости. Полость черепа заполнена жидкостью,
и никакая узнаваемая ткань головного мозга не проявляется. Спинной канал также расширен и не наблюдается спинной ткани.
Этиология болезни, которая встречается преимущественно у крупного рогатого скота абердин-ангусской породы, не полностью понята. В пораженных стадах абердин-ангуссов одновременный артрогрирозный мультиплекс (AM) распространен просто потому, что GAR Precision 1680 также был носителем отдельной мутации, ответственной за AM, унаследовав мутацию AM от его отца. Внутриматочные вирусные инфекции у плода также были инкриминированы
в АМ, включая вирус Акабана, вирусную диарею крупного рогатого скота, вирус Шмалленберга, вирус кэш-долины и синий язык (Herder V. [et al.], 2012). Телята, пораженные мутацией абердин-ангусса, как правило, мертворожденные. Большинство из них умирают на ранней стадии беременности и резорбируются, но пропорция может сохраниться до поздней беременности, что приводит к мертворождению теленка с небольшим размером тела и небольшими часто артрогрипозными конечностями, но с увеличенной головкой (так называемая «водная голова»). Некоторые пораженные телята могут родиться живыми
и проявлять неврологические признаки торможения головного мозга, включая депрессию, слабость, плохой рефлекс сосания, опущенные уши и голову, слепоту, спазм конечностей, дрожь головы, опоясывание и судороги (Buck B.C.
[et al.], 2009). Напротив, телята абердин-ангуссов с генетической формой АМ обычно являются мертворожденными.
3.6 Кератоконъюнктивит
Номер на панели биочипа – 208. SNPchr8_108833985. Кератоконъюнктивит.
Кератоконъюнктивит – быстро распространяющаяся, доброкачественно протекающая болезнь животных различных видов, вызываемая риккетсиподобными микроорганизмами – Chlamydo-zoon cojunctivae. Инфекционный бычий кератоконъюнктивит, также называемый синдромом красных глаз, вызван прежде всего бактерией Moraxella bovis. Мухи, высокие сорняки и травы могут воздействовать на раздражение глаз и распространять болезнь от одного животного к другому. С каждым аллелем ‘G’ животное уменьшает свой риск заражения pinkeye на 8–13 %. Таким образом, животное, которое является гомозиготным для аллелей, имеет риск инфицирования розоватым белком на 16–26 % (Kataria R. S., Tait R. G., Kumar D., Ortega M. A., Rodiguez J., Reecy J. M., 2011). Это заболевание может привести к снижению веса. Если оба глаза заражены
и нелечены, то животное может стать слепым. Породы, которые не имеют пигмента на их веках, таких как герефордская и шаролезская, более восприимчивы к инфекции розового глаза. Заболевание вызывает воспаление роговицы (прозрачный наружный слой) и onjunctiva (розовая мембрана, выстилающая веки) глаза. Если его не лечить, это вызовет изъязвление, которое выглядит как отверстие в роговице. После лечения они могут казаться облачным синим или иметь белый шрам.
За заболевание ответствененTLR4 (Toll-LikeReceptor 4). Он расположен на 8 хромосоме: g.108833985A>G, с.94-24A>G, rs8193046.
Фланкирующая последовательность(Whittier W. D., Currin J. F., Currin N., 2009):
GGTTGACTGGTCTCTTTGCTCGTCCCAGTAGCCTCCAAGGCTGTAGTCTAGGAGAGGAGAGTTGCTTGGAAGTCTGCTAAGGTGCATGCAGGAAGACACC[A/G]CATCTAATATCTAATCATTTCAGGTTGTTCCTAACATTAGTTACCAGTGCATGGAGCTGAATCTCTACAAAATCCCCGACAACATCCCCATATCAACCAA.
3.7 Мутация в гене АТФ-связывающего кассетный член 2 подсемейства G (ATP Binding Cassette Subfamily G Member 2)
Номер на панели биочипа – 209. ABCG2_SNPchr6_38027010. Мутация
в гене АТФ-связывающего кассетный член 2 подсемейства G (ATP Binding Cassette Subfamily G Member 2).
Связанный с мембраной белок, кодируемый этим геном, включен в суперсемейство АТФ-связывающих кассетных (АВС) транспортеров. Белки ABC переносят различные молекулы через экстра- и внутриклеточные мембраны. Гены ABC делятся на семь различных подсемейств (ABC1, MDR / TAP, MRP, ALD, OABP, GCN20, White). Этот белок является членом подсемейства White. В качестве альтернативы, называемой белком устойчивостик раку молочной железы, этот белок функционирует как транспортер ксенобиотиков, который может играть роль в устойчивости к множественным лекарственным средствам, к химиотерапевтическим агентам, включая аналоги митоксантрона и камптотецина. Ранние наблюдения за значительной опосредованной ABCG2 резистентностью к антрациклинам впоследствии были связаны с мутациями, встречающимися
in vitro, но не в природе или в клинике.
Значительная экспрессия этого белка наблюдалась в плаценте (https://www.ncbi.nlm.nih.gov/gene?Db=gene&Cmd=ShowDetailView&TermToSearch=9429),и было показано, что она играет роль в защите плода от ксенобиотиков в материнском кровообращении (Vlaming M. L., Lagas J. S., Schinkel A. H., 2009).Так, транспортер играет защитную роль в блокировании абсорбции на апикальной мембране кишечника, а также на бартере крови-яичка, гематоэнцефалический барьер (Vlaming M. L., Lagas J. S., Schinkel A. H., 2009)и мембраны гемопоэтического предшественника и других стеблей клетки. На апикальных мембранах печени и почек он усиливает экскрецию ксенобиотиков. В лактирующей молочной железе он играет роль в выделении витаминов, таких как рибофлавин и биотин, в молоко (Vlaming M. L., Lagas J. S., Schinkel A. H., 2009). В почках и желудочно-кишечном тракте он играет роль в экскреции урата.
3.8 Цетруллинемия (Citrullinaemia, СТ)
Номер на панели биочипа – 210. ASS1_SNPchr11_100802781. Цетруллинемия (Citrullinaemia, СТ).
Цитруллинемия – это аутосомно-рецессивное расстройство, которое для животных является летальным в раннем постнатальном периоде. Больные ВС телята рождаются нормальными, но через несколько дней (до 7) умирают. Это заболевание вызвано дефицитом аргининосукцинатсинтетазы (ASS) – фермента цикла мочевинообразования. Пониженный уровень экспрессии белка ASS ведет к повышению уровня цитруллина в крови, в тканях и накоплению аммиака в мозге больных телят. Впервые ВС была обнаружена в Австралии, где один из 250 рожденных телят был предположительно болен и более 10 % животных фризской породы были носителями данного заболевания (Hagemoser W. A., Roth J. A., Lofstedt J., Fagerland J., 1983).
Родоначальником BC считается канадский бык-производитель Linmack Kriss King (Grupe S., Diet G., Schwerin M., 1996).
Молекулярные причины заболевания телят ВС были выяснены в 1989 г.
(у человека цитруллинемия стала известна гораздо раньше) (Gerbens F., Rettenberger G.,LenstraJ.A., VeerkampJ. H., Те PasM. F., 1997). Для определения полной нуклеотидной последовательности гена ASS, тотальная мРНК была выделена из печени больных телят, синтез кДНК осуществлялся с помощью обратной транскриптазы. Было проанализировано несколько клонов и показано, что по сравнению со здоровыми заболевшие животные в исследуемом гене несут две мутации С → Т в 86 и 175 кодонах. Первая замена превращает кодирующий триплет аргинина (CGA/Arg) в стоп-кодон (TGA/STOP). В нуклеотидной последовательности укороченной формы гена исчезает сайт узнавания рестриктазой AvaII и синтезируется укороченная форма фермента, не имеющая физиологической активности. Вторая мутация является молчащей, но в нуклеотидной последовательности гена ASS заболевших животных исчезает сайт узнавания рестриктазой DdeI.
Поскольку все идентифицированные мутации находились в области экзонов, для идентификации локусов, содержащих вышеупомянутые замены, были разработаны две системы праймеров (I, II соответственно), позволяющие амплифицировать исследуемые фрагменты по матрице геномной ДНК (Gerbens F., Rettenberger G.,LenstraJ.A., VeerkampJ. H., Те PasM. F., 1997):
| forASS 5’-GTGTTCATTGAGGACATC-3’;
revASS 5’-CCGTGAGACACATACTTG-3’ (I). |
| forASS 5’-CAACATGGAATCCCCGTC-3’;
revASS 5’-CTGATATGCATCAGGTTC-3’ (II). |
Сравнительный рестрикционный анализ полученных фрагментов позволяет однозначно установить носителей ВС.
До настоящего времени многие протоколы генотипирования крупного рогатого скота по ASS-гену ведутся с использованием системы (I) (Gerbens F., Rettenberger G.,LenstraJ.A., VeerkampJ. H., Те PasM. F., 1997; McClure M., Kim E., Bickhart D., Null D., Cooper T., Cole J., Wig-gans G., Ajmone-Marsan P., Colli L., Santus E., Liu G. E., Schroeder S., MatukumalliL., VanTassellC., SonstegardT., 2013).
В некоторых случаях, как например для увеличения специфичности связывания с геномной ДНК, в используемых праймерах наращивают количество нуклеотидных фрагментов (Sonstegard T. S., Cole J. B., VanRadenP. M., VanTassellC. P., NullD. J., SchroederS. G., BickhartD., McClure M. C., 2013):
| forASS 5’-GGCCAGGGACCGTGTTCATTGAGGACATC-3’;
revASS 5’-TTCCTGGGACCCCGTGAGACACATACTTG-3’. |
3.9 Гаплотип джерсейского скота (JH1)
Номер на панели биочипа – 211. CWC15_SNPchr15_15707169. Гаплотип джерсейского скота (JH1).
Аутосомно-рецессивная смертельная мутация гомолога CWC15 (гомолог сплайсосома-ассоциированного белка CWC15) на хромосоме 15: g.15707169C>T, c.163C>T, p.Arg55X. Используя данные генотипа от десятков тысяч североамериканских голштейнов и крупного рогатого скота Брауна, каждый из которых генотипирован приблизительно 50 тыс. SNP на BovineSNP50 BeadChip
(VanRaden P. M., Olson K. M., Null D. J., Hutchison J. L., 2011) выявил пять новых рецессивных смертельных гаплотипов путем поиска общих гаплотипов, которые никогда не гомозиготы у живых животных. Один из этих гаплотипов встречается только в Трициклах и (по соглашению, предложенному коллективом по разведению) P. M. VanRaden с соавторами(2011) назвал его JH1, где
J обозначает Джерси и H – для гаплотипа. Он отображает хромосому BTA15 на 13–18 Мб (сборка генома UMD 3.0).
T. S. Sonstegardссоавторами(SonstegardT. S., ColeJ. B., VanRadenP. M., VanTassellC. P., NullD. J., SchroederS. G., BickhartD., McClure M. C., 2013) исследовал смертельный гаплотип Джерси,а именно гаплотип JH1 на хромосоме BTA15. Они сначала уточнили гаплотип «в 15-маркерное окно (15,162,470 до 15,949,175)», а затем получили целую геномную последовательность от
11 быков, несущих этот гаплотип. Анализ последовательности этих носителей
в области кандидата выявил «SNP с высоким коэффициентом усиления при останове», расположенный в позиции 15707,169 на БТА 15. Этот SNP-переход С-Т-T приводит к тому, что аргинин превращается в стоп-кодон в экзоне 3 CWC15, гомолог белка CWC15 бычьего белка с ассоциированным с spliceosome белком. Эта бессмысличная мутация уменьшила бы размер белка CWC15 из 231 аминокислоты длиной до 54 аминокислот. Сохраненный домен NCBI для поиска на белковом продукте CWC15 крупного рогатого скота показывает, что этот усеченный белок не будет иметь сохраненный домен Cwf_Cwc_15 (pfam04889), присутствующий в дикой природе».
Фланкирующая последовательность мутации:
AATTGTCTTCCATTACTACAGCTGTGTGTTTTTTAGAAGTGACTTTGCCTTGTCTTGTTTCTACTTTAGACAGACCACTCAGGATGCCCCTGAAGAGGTT[C/T]GAAACCGTGACTTCAGGAGAGAGTTGGAGGAGAGAGAGAGAGCTGCTGCAAGAGAAAAAAACAGAGATCGGCCAACCCGAGGTACCAATACTATCTTAGA.
3.10 Синдактилия (мулья нога)
Номер на панели биочипа – 212. LRP4_SNPchr15_77667135. Синдактилия (мулья нога).
Во многих странах у многих пород крупного рогатого скота сообщалось о синдактилии. Однако большая часть документации связана с ее появлением у голштинской породы, разводимой в Америке. Так, обнаружен бык-производитель более 600000 телят, который впоследствии был признан носителем заболевания. Возможность того, что искусственный отбор в пользу гетерозигот способствовал неприемлемо высокой частоте заболевания. Тесты на потомство мужчин были основным средством идентификации носителей до тех пор, пока С. Charlier с соавторами использовал геномный набор ДНК-маркеров
в исследовании, чтобы показать, что рассматриваемый ген расположен на хромосоме 15. Мутация возникает в гене белка 4, связанным с рецептором LDL. Подобная мутация также называется синдактилией, что означает «соединенный палец», сплетенное копыто сливается. Пораженный крупный рогатый скот может иметь 1–4 объединенных копыта, проявляет разную степень хромоты, имеет высокую ступенчатую походку и медленно ходит.
С. Charlier с соавторами провел сканирование генома с 213 микросателлитными маркерами, генотипированными только на 12 синдактильных (ноги мула) животных и на пуле ДНК из 10 несвязанных незараженных животных из той же породы. Сопоставление идентичности по происхождению («поиск общих гомозиготных гаплотипов среди животных с патологией») определило один регион на каждых трех хромосомах как значительный. Генотипирование еще 29 животных из той же родословной, за которой следует обычный анализ сцепления, отображает беспорядок на теломерный конец хромосомы BTA15.
В ходе широкомасштабного изучения гаплотипов BovineSNP50 BeadChip, которые являются общими, но не гомозиготными, P. M. VanRaden (VanRaden P. M., Olson K. M., Null D. J., Hutchison J. L., 2011) сопоставил это расстройство с BTA15 при 76–82 Мб (сборка генома UMD 3.0), что согласуется с результатами С. Charlier с соавторами.
А. Duchesne (Duchesne А., Gautier M., Chadi S., Grohs C., Floriot S., Gallard Y., Caste G., Ducos A., Eggen A., 2006) определили неконсервативную замену CpG / ApT в экзоне 33 (C4863A, G4864T) гена LRP4 крупного рогатого скота, который отлично отделен от беспорядка в голштинской родословной.
E. B. Johnson (Johnson E. B., Steffen D. J., Lynch K. W., Herz J., 2006) сообщили о другой мутации в одном и том же генеу крупного рогатого скота Ангусской породы: «переход от G к A на первом нуклеотиде в сайте донора сплайса интрона 37 полностью отключает этот сайт сплайсинга. Аномальное сращивание, вызванное этой мутацией, предсказывает генерация дисфункционального мембранно-закрепленного рецептора, лишенного нормального цитоплазматического домена.
3.11 Множественные мутации в гене белка 4, связанном с рецептором LDL
Номер на панели биочипа – 213. LRP4_SNPchr15_77675440 + LRP4_SNPchr15_77675516 + LRP4_SNPchr15_77675517. Множественные мутации в гене белка 4, связанным с рецептором LDL.
Множественные мутации в гене белка 4, связанным с рецептором LDL на хромосоме 15, также называются Синдактилией, или «соединенный палец», сплетенное копыто сливается. Пораженный крупный рогатый скот может иметь 1–4 объединенных копыта, проявляет разную степень хромоты, имеет высокую ступенчатую походку и медленно ходит.
Номер на панели биочипа – 214. LRP4_SNPchr15_77682052. Мутация обнаружена в гене белка 4, связанным с рецептором LDL.
Мутация обнаружена в гене белка 4, связанным с рецептором LDL на хромосоме 15 и найдена в родословной скрещивания (Simmental × Charolais × Holstein) – 15: g.77682052G>A, c.3571G>C, p.Gly1199Ser. Сопровождается синдактилией (нога мула) (Johnson E. B., Steffen D. J., Lynch K. W., Herz J., 2006).
Фланкирующая последовательность мутации:
AGGAACTGTGGGAGGAACCAGCTATTACCGTCTCTTGCCCAGGTTCATGTACTGGACGGACTGGGGGGAGCATGCCAAGTTGGAGCGGTCTGGGATGGAC[G/A]GCTCCGACCGCGCCGTGCTCATCAACAGCAACCTCGGGTGGCCCAACGGACTGACTGTGGACAAGGCCAGCTCCCAGCTGCTCTGGGCTGACGCCCACAC.
Номер на панели биочипа – 215. LRP4_SNPchr15_77686731. Мутация обнаружена в гене белка 4, связанным с рецептором LDL.
Мутация обнаружена в гене белка 4, связанным с рецептором LDL на хромосоме 15: g.77686731G>A, c.2719G>A, p.Gly907Arg. Она обнаружена в линии Simmental. Сопровождается синдактилией (мулья нога).
Фланкирующая последовательность мутации:
GCCTGCCTGAGTAAGTGCCCCAGACTGACCCCTGTTCCCCTCCCGTTCCCGGGGCTCAGAGTTGCCCACCTGCTCCCCTCTCGACTTTCACTGTGACAAC[G/A]GCAAATGTATCCGCCGCTCCTGGGTGTGCGACGGGGACAACGACTGTGAGGATGACTCGGACGAGCAGGACTGTCGTGAGTGCTGGGCGGGGCTGGGCGG.
3.12 Коричневый цвет шерсти
Номер на панели биочипа – 216. MC1R_SNPchr18_14757910 + MC1R_SNPchr18_14757912 + MC1R_InDelchr18_14757924.Коричневый цвет шерсти.
Четыре аллеля гена MC1R являются доминирующими черными (MC1R_Ed), черным / красным (MC1R_Ebr), красным диким типом (MC1R_E +) и рецессивным красным (MC1R_e). Доминантный черный (Ed) главенствует над тремя другими аллелями, а животные с Ed – черно-белые. Черный / красный, также известный как Telstar (Ebr), приводит к красному цвету при рождении, который меняется на черный в молодом возрасте. При E + животное может быть почти любого цвета, поскольку другие гены диктуют цвет окраски.
Две копии рецессивной красной (e) аллели приводят к красному цвету. Порядок доминирования – Ed > Ebr > E + > e.
Ген MC1R контролирует производство черного и красного пигментов
у крупного рогатого скота. Гольштинский крупный рогатый скот имеет еще один аллель, доминантный красный, в гене COPA, который перекрывает MC1R и производит доминирующий красный пигмент. Если животное гомозиготно как для Ed, так и для е аллелей, он считается гомозиготным по его фенотипу. Это связано с тем, что аллель e вызывает потерю функции гена посредством делеции. Именно она вызывает сдвиг рамки и преждевременный стоп-кодон при аминокислоте 15.
T. G. Berryere (Berryere T. G., Schmutz S. M., Schimpf R. J., Cowan C. M., Potter J., 2003) использовали восемь микросателлитов BTA8 для сопоставления гена TYRP1 крупного рогатого скота с BTA8. Затем они проверили связь между геном TRYP1 крупного рогатого скота и локусом dun в разных породах. Единственной породой, в которой была совместная сегрегация – Декстер. Зная, что ген TYRP1 у крупного рогатого скота Dexter является сильным позиционным геном-кандидатом для фенотипа dun, T. G. Berryere показал, что коричневый цвет у крупного рогатого скота Декстер обусловлен гомозиготностью (замена аминокислоты H434Y в TYRP1 из-за «изменения C-T в нуклеотиде 1300 в экзоне 7» гена TYRP1).
3.13 Субфертильность быков (BMS)
Номер на панели биочипа – 217. TMEM95_SNPchr19_27689622. Субфертильность быков (BMS).
В настоящее время, искусственное осеменение получило повсеместное распространение. С целью увеличения репродуктивного успеха, только проверенные в лаборатории образцы спермы могут быть использованы для осеменения. Тем не менее, было установлено, что дефицит трансмембранного белка 95 (TMEM95) у КРС серьезно снижает эффективность осеменения, но при этом не влияет на качество спермы. Дефицит обусловлен мутацией в гене TMEM95, приводящей к потере функции в трансмембранной области белка, и, как следствие,
к снижению процента успешного осеменения до 1,7 %.
Из исследования (Pausch H., Kölle S., Wurmser C., Schwarzenbacher H., Emmerling R., Jansen S., Trottmann M., Fuerst C., Götz K.U., Fries R., 2014) известно, что «данные повторного секвенирования цельного генома у 43 животных выявили потенциальную мутацию (rs378652941, c.483C > A, p.Cys161X)
в трансмембранном белке 95, кодирующем ген TMEM95, который впоследствии был подтвержден. Иммуногистохимические исследования показали, что TMEM95 находится на поверхности сперматозоидов фертильных животных, тогда как отсутствует в сперматозоидах субфертильных животных. Только «1,7 % из 35671 осеменения» были успешными у быков, гомозиготных по мутации.
3.14 Гаплотип голштинского скота (HH4)
Номер на панели биочипа – 218. GART_SNPchr1_1277227. Гаплотип голштинского скота (HH4).
Гаплотип HH4 встречается с частотой 3,6 % у взрослого крупного рогатого скота 47878 особей породы Гольштейн, отобранного для исследования (Fritz S. [et al.], 2013), но никогда не встречается у гомозигот. Для восьми из девяти гаплотипов, которые оказывают значительное влияние на скорость отела S. Fritz с соавторами (2013) искал мутации через анализ полногеномной последовательности от 25 Holstein, 11 Montbéliarde и девяти нормандских быков, которые внесли большой вклад в их породу. В частности, они отфильтровывались «для мутаций, которые были (а) расположены на «плюс» или «минус» 6 Мб от обнаруженного гаплотипа (б), переносимого в гетерозиготном состоянии быками-носителями, и (с) отсутствовали у не-несущих быков из трех пород», а затем исследовали выявленные полиморфизмы для их вероятного влияния на структуру и функцию белка. Для HH4 S. Fritz с соавторами (2013) убедительно доказал причинную мутацию кандидата, а именно мутацию (g.1277227A.C, сборку генома UMD 3.1) в гене GART (который кодирует глицинамид рибонуклеотидтранзилазу), что приводит к p.N290T.
3.15 Синдром врожденного иммунодефицита (Bovine Leukocyte Adgesion Defiency, BLAD)
Номер на панели биочипа – 219. SNPchr1_145114963. Синдром врожденного иммунодефицита (BovineLeukocyteAdgesionDefiency, BLAD).
Одну из важнейших групп лейкоцитов составляют фагоцитирующие клетки. Они способны связывать микроорганизмы на своей поверхности, а затем поглощать и уничтожать их. Эта функция основана на неспецифичных механизмах распознавания и связывания микробных продуктов с поверхностными рецепторами адгезии, и является основой организации первой линии защиты организма против инфекции – врожденного иммунитета (Кощаев А. Г., Гугушвили В. М., 2014).
На своей поверхности лейкоциты имеют ряд структурно и функционально подобных гликопротеинов, объединенных в семейство β2-интегринов (синоним CD18), причем их экспрессия определяет клеточную специфичность лейкоцитов.
Впервые дефицит адгезии лейкоцитов был обнаружен в США в 1983 г.
у телят голштинской породы. Гены, кодирующие CD18 здорового и абнормального быков, были отсеквенированы. Молекулярной основой возникновения BLAD является миссенс-мутация (аденина на гуанин) в кодирующей части гена
в положении 383, приводящая к появлению белка, у которогов положении 128 экстраклеточной области рецептора вместо аспарагиновой кислоты появляется глицин (D128G). Другая обнаруженная мутация (цитозина на тимин) в положении 775 в случае BLAD является молчащей (Komisarek J., 2010). Поскольку при замене аденина изменяются сайты узнавания рестриктазами TagI или HaeIII, сравнительный рестрикционный анализ амплифицированных продуктов ПЦР участков гена CD18 у больных (BL) и здоровых (TL) животных позволяет однозначно определить носителей этой мутации. Несколько вариантов ДНК-диагностики разработано для этих целей, но все они включают амплифицирование участка (100–400 п. о.), включающего в себя положение 383 структурной части гена CD18, расположенного на одной хромосоме, с помощью различных вариантов праймеров, например (Koshchaev A. G., Shchukina I. V., Koshchaeva O. V., 2016):
| forCD18 5’ – GTTGCGTTCAACGTGACCTT-3’;
revCD18 5’ – GAGTAGGAGAGGTCCATCAGGTA-3’. |
Синдром BLAD – наследственное заболевание, распространенное у скота голштинской породы (в среднем до 15 %). Организм животных, несущих
в своем генотипе мутантный аллель, в гомозиготном состоянии не способен противостоять вирусным и бактериальным инфекциям, что приводит к снижению иммунитета животных и заканчивается летальным исходом в первые месяцы постнатального развития.
У гетерозиготных (CD18TLBL) клинических проявлений не выявлено. При скрещивании скрытых носителей только 25 % стельностей заканчивается рождением потомства, свободного от мутации. Анализ данных показывает, что если на первом этапе поток мутантных генов в популяции идет, в основном, через быков-производителей, глубокозамороженную сперму и трансплантацию эмбрионов, то дальнейшее его распространение связано с использованием гетерозиготных быкопроизводящих коров. Наибольшее распространение синдром BLAD получил в Дании. Носители этой мутации выявлены в ряде других стран.
В связи с этим были разработаны национальные программы по выявлению быков гетерозиготных носителей BLAD-синдрома. Задача селекционно-генетического мониторинга – не допустить к разведению гетерозиготных носителей мутации. Международными племенными службами введены обязательные проверки производителей на данный генетический дефект и записьв родословные племенных каталогов носителей данной мутации (Komisarek J., 2010).
3.16 Остеопетроз (OS), или Мраморная болезнь кости
Номер на панели биочипа – 220. CLCN7_SNPchr25_1137017 + CLCN7_SNPchr25_1137019.Остеопетроз (OS), мраморная болезнь кости.
Остеопетроз – заболевание костей, приводящее к тяжелым нарушениям в организме животного. Дефект активности остеокластов приводит к образованию чрезмерно хрупких костей. Больные телята рождаются, как правило, раньше срока мертвыми. Часто наблюдается уменьшенный размер тела, плоский череп, короткая нижняя челюсть. Заболевание имеет аутосомно-рецессивный тип наследования, мутация была описана в 2010 г. у крупного рогатого скота абердин-ангусской породы и представляет собой делецию в гене SLC4A2 (25 хромосомы), кодирующем мембранный транспортный белок (Meyers S. N., Mcdaneld T. G., Swist S. L., Marron B. M., Steffen D. J., O’Toole D., O’Connell J. R., Beever J. E., Sonstegard T. S., Smith T. P., 2010).
Фланкирующие последовательности мутации:
CGTCAGCCCGGCCGCTCAGATTTTCCTGGCCGCGGGTTTGGGGAAGGGAAGCACTAAGACTGCCCCCAGGGCAGAACCTCGGGGTTTCTGTGCCCCCTCCT[CCCCGGGCGTCACGTGCCCCTCCCCCAG…2784bp….GGAGGATGAACTCCACCGCA/]CCCTGGGCGTGGAGCGGTTTGAGGAGATCCTTCAGGAGGCGGGGTCCCGAGGAGGGGAGGAGCTCGGCCGCAGCTACGGGGAGGAAGACTTTGAATGTGA.
3.17 Дистрофический эпидермолиз (Dystrophic Epidermolysis Bullosa, DEB)
Номер на панели биочипа – 221. COL7A1_SNPchr22_51873390. Дистрофический эпидермолиз (Dystrophic Epidermolysis Bullosa, DEB).
Буллезный эпидермолиз (БЭ) – наследственное буллезное заболевание животных, характеризующееся крайней хрупкостью кожи и слизистых оболочек при механическом воздействии. Основной особенностью БЭ у людейи животных является формирование пузырей и язв после незначительной механической травмы. Буллезный эпидермолиз обусловлен мутациями в гене COL7A1
(22: g.51873390C > T, c.4756C > T, p.Arg1586X), кодирующем структурные белки цитоскелета кератиноцитов базального слоя или зоны базальной мембраны. В зависимости от ультраструктурного уровня расщепления тканей БЭ подразделяют на три обширные категории: простой буллезный эпидермолиз (epidermolysis bullosa simplex), соединительный буллезный эпидермолиз и дистрофический буллезный эпидермолиз. У всех видов животных, кроме буйволов с простым БЭ, образуются множественные язвы на деснах, твердом и мягком нёбе, слизистой оболочке губ, щек и спинке языка. Дистрофия или отсутствие ногтей соответствует деформации и отслоению копыт у копытных животных.
Кожные и слизистые оболочки пораженных животных очень хрупкие, что позволяет легко их разрывать, особенно вокруг морды, рта, фетлокови копыт. Некоторые демонстрируют большую потерю кожи или волдырей вокруг фетлоков и морды. Хотя они не смертельны, пораженные животные обычно гуманно подвергаются эвтаназии из-за степени поражения кожи (Menoud А., Welle M., Tetens J., Lichtner P., Drogemuller C., 2012).
Фланкирующие последовательности мутации:
GGTGACAGTTGTGTCCCCTGACTTCTGATCCTTCCTTCCACAGGGCTCACCTGGCTTGGCTCTTCCTGGAGACCCTGGCCCCAAGGGAGACCCTGGAGGC[C/T]GAGTGCGTAAATGTGGGGAAGGGGAATGTGACAGAAAGAGATGGGATGGTGCCTGGGAGCCCCAACTAAGTCCTGTCCCTCCTCCCCATGCCCTGCAGGG.
3.18 Врожденная эритропоэтическая протопорфирия (PT)
Номер на панели биочипа – 222. FECH_SNPchr24_57298883. Врожденная эритропоэтическая протопорфирия (PT).
Врожденная эритропоэтическая протопорфирия – генетическое заболевание, приводящее к тяжелой форме фотосенсибилизации (повышенной чувствительности организма, чаще кожи к свету). Кроме боязни света у животных наблюдается повреждение кожи и слизистых оболочек, иногда случаются припадки и судороги. Протопорфирия вызвана дефицитом активности феррохелатазы, которая катализирует заключительный этап в пути биосинтеза гема. Нарушение работы фермента приводит к накоплению предшественника гема – протопорфирина – в крови и тканях животного. Протопорфирин обладает фотореактивными свойствами, что и приводит к фоточувствитель ности (Jenkins M. M., Leboeuf R. D., Ruth G. R., Bloomer J. R., 1998). Накопление протопрфирина может также приводить к прогрессирующему повреждению печени. Впервые врожденная эритропоэтическая протопорфирия была описана в 1977 г. в США. Наибольшее распространение заболевание получило в популяции лимузинской породы. Исследования показали, что заболевание передается по аутосомно-рецессивному типу наследования. В 1998 г. была выявлена казуальная мутация, в гене фермента феррохелатазы FECH. Точечная мутация в гене FECH приводит к замене стоп кодона на лейцин (TGA → TTA), в результате чего синтезируется дефектный белок на 27 аминокислот длиннее нормального (Mcaloon C. G., Doherty M. L., O’Neill H., Badminton M., Ryan E. G., 2015).
Фланкирующие последовательности мутации
TCCAAGGAGCGCTGCTCCACACAGCTGACTCTGAGCTGTCCGCTCTGCGTGAACCCCACCTGCAGGGAGACCAAATCCTTCTTCACCAGCCAGCAGCTGT[G/T]ACCCTGGCGGCACGCCGCTGGGAGGTGCGCGTGCCCGCCTCCCGACACCTCCGAGGAGGAGGAGGGCGCATCCGGCCGTTAGGGAGGAGGTTACATCCGT.
3.19 Ген диацилглицерол-ацилтрансферазы-1 (DGAT1)
Номер на панели биочипа – 223. DGAT1_SNPchr14_1802265. Ген диацилглицерол-ацилтрансферазы-1 (DGAT1).
Ген DGAT1 – микросомальный энзим, катализирующий последний этап синтеза триглицеридов. Ген DGAT1 участвует в обмене жирных кислот, его А-аллель ассоциирован с более низким содержанием стеариновой кислоты и предпочтительнее для получения высококачественного мяса. Известно, что неконсервативная замена К232А (лизина на аланин) в последовательности гена DGAT1, снижает содержание жира в молоке коров. При этом K-аллель, содержащий лизин в 232 положении, является наиболее желательным, поскольку несущие его коровы производят более жирное молоко, по сравнению с коровами несущими A-аллель,
в 232 положении которого располагается аланин (ZhangY., FanX., SunD., Wang Y., YuY., XieY., ZhangS., ZhangY., 2012).
DGAT1-1: 5/-ccgcttgctcgtagctttcgaaggtaacgc-3/
и DGAT1-2: 5/-ccgcttgctcgtagctttggcaggtaacaa-3/.
Для определения аллельного полиморфизма гена DGAT1 по вариантам А
и К применяют эндонуклеазу рестрикции TaqI.
3.20 Синдром брахиспина (Brachyspina Syndromе, BS)
Номер на панели биочипа – 224. FANCI_SNPchr21_21184873. Синдром брахиспина (Brachyspina Syndromе, BS).
Синдром брахиспина (BS) – редкий рецессивный генетический дефект молочного голштинского крупного рогатого скота. Впервые был обнаружен
в Дании (Charlier C., Agerholm J.S., Coppieters W., Karlskov-MortensenP., LiW., JongG., FasquelleC., KarimL., CireraS., CambisanoN., AharizN., MullaartE., GeorgesM., FredholmM., 2012).Основной экономический урон от мутации BS проявляется через влияние на частоту эмбриональной смертности потомства (плодовитость) – один из наиболее важных экономических показателей в животноводстве (Charlier C., Agerholm J.S., Coppieters W., Karlskov-MortensenP., LiW., JongG., FasquelleC., KarimL., CireraS., CambisanoN., AharizN., Mullaart E., GeorgesM., FredholmM., 2012). Заболевание наследуется по аутосомно-рецессивному типу. Пораженные животные характеризуются малой массой тела, пороками позвоночника, проявляющимися заметным укорочением позвоночного столба, и длинными и тонкими конечностями. Кроме того, у заболевших животных отмечается брахигнатия, сопровождающаяся пороками внутренних органов (сердце, почки, половые органы).
С введением высокопроизводительных методов секвенирования нового поколения (NGS) стало возможным одновременное определение геномов нескольких представителей домашних животных. В 2012 г. с использованием методов NGS стало возможным определить нуклеотидную последовательность участка ДНК (ген FANCI, анемия Фанкони, группа комплеменции I), делеция которого (3329 п. о.) аннотирована как причина возникновения мутантного аллеля у крупного рогатого скота голштин-фризской породы (Gill J.L. [at al.], 2012).
Частота встречаемости болезни достигает 7,2 %. Было показано, что делеция нескольких экзонов (25, 26 и 27) приводит к экспрессии укороченной формы белка, не имеющего функциональной активности (Bonilla C. A., Rubio M. S., Sifuentes A. M., Parra-Bracamonte G. M., Arellano V. W., Mendez M. R. D., Berruecos J. M., Ortiz R., 2010).
При определении BS для амплификации фрагмента, содержащего мутацию, используются праймеры:
| 5’-GCTCAAGTAGTTAGTTGCTCCACTG-3’; |
| 5’-ATAAATAAATAAAGCAGGATGCTGAAA-3’. |
В этих условиях только один фрагмент гена размером 3738 п. о. амплифицируется у здоровых животных. Появление дополнительного фрагмента размером в 409 п. о. свидетельствует о носительстве BS.
3.21 Синдромом рыбного запаха
Номер на панели биочипа – 225. FMO3_SNPchr16_39523051. Синдромом рыбного запаха.
Мутация в гене FMO3, ассоциированная с рыбным запахом молока (Fishy Off-Flavor). Рыбный запах молока, или триметиламинурия, – моногенное заболевание, которое связано с нарушением органолептических качеств молока
и появлением рыбного послевкусия при употреблении молока от коров, больных этим заболеванием. Впервые это заболевание было описанов 1999 г. для человека. Для больного был характерен специфический рыбный запах кожи. Такой запах возникал в результате чрезмерного накопления диметиламина
в крови и лимфе больных. Молеклярно-генетическая причина такого заболевания заключалась в мутации гена FMO3, который кодирует флавин содержащуюмонооксигеназу 3, основная фнукция которого исление диметиламина.
В 2002 г. аналогичная мутация была обнаружена в шведском красном скоте, который образовался в результате скрещивания шведского красно-белого скота
с животными айрширской породы. В популяции шведского красного скота частота встречаемости мутантного аллеля гена FMO3 достигает 14 %.
Родоначальника этой мутации обнаружить не удалось, но известно, что корнями он уходит в айрширскую пород.
Рыбный запах коровьего молока характеризуется отчетливым, неприятным вкусом и запахом, напоминающим гнилую рыбу. В 2003 г. исследования показали, что врожденная ошибка метаболизма вызывает этот эффект. Было показано, что мутация, вызывающая Fishy Off-Flavor в молоке, на удивление распространена у одной породы крупного рогатого скота. Шведский университет сельскохозяйственных наук разработал тест на синдром Fishodorу крупного рогатого скота.
3.22 Врожденная мышечная дистония 1-го и 2-го типов
(Congenital Muscular Dystonia, CMD1 и CMD2)
Номер на панели биочипа – 226; 227; 228; 230. SLC6A5_SNPchr29_24610561. ATP2A1_SNPchr25_26198573,ATP2A1_SNPchr25_26197204, ATP2A1_SNPchr25_
26197429.Врожденная мышечная дистония 1-го и 2-го типов (CongenitalMuscularDystonia, CMD1 и CMD2).
Врожденная мышечная дистония – наследственное заболевание с аутосомно-рецессивным типом наследования, широко распространенное в бельгийской голубой породе. У всех телят с CMD наблюдаются генерализованные мышечные контрактуры (непроизвольное обширное напряжение мышц), нарушение глотания, высокая степень утомляемости, длительные мышечные спазмы. Больные животные, как правило, умирают в течение нескольких часов или нескольких недель после рождения. В 2008 г. были выявлены ключевые мутации, связанные с CMD в генах ATP2A1 и SLC6A5 [84]. Белок гена ATP2A1 участвует в транспорте кальция. Мутация приводит к замене аминокислоты в 14 экзоне гена. Причиной CMD2 является мутация, приводящаяк замене аминокислоты
в третьем трансмембранном домене гена SLC6A5, кодирующего транспортер глицина 2 – GlyT2 (Gill J.L. [at al.], 2012).
Фланкирующие последовательности мутации:
GCGAGTGGGCACCACCCGGGTGCCCATGACAGGGCCGGTGAAGGAGAAGATTCTGTCGGTGATCAAAGAGTGGGGTACTGGCCGGGACACCCTG[C/T]GCTGCCTGGCGCTGGCCACTCGGGACACCCCCCCCAAGCGAGAGGAGATGGTCCTGGATGACTCTACCAAGTTCATGGAGTACGAG.
3.23 Мутации в гене гормона роста
Номер на панели биочипа – 229. GH1_SNPchr19_48768774 + SNPchr19_48768834. Мутации в гене гормона роста.
Мутации в гене гормона роста на 19 хромосоме. Два аллеля гена гормона роста влияют на молочные свойства.
GH_2141: «G’- аллель ассоциируется с пониженным выходом молочного белка и выходом жира.
GH_2291: «C’ -аллель связан с увеличением урожайности молока, жировым процентом и процентом белка [62].
GH_2141 19: g.48768916C > G, c.457C > G, p.Leu153Val, rs41923484.
Фланкирующиепоследовательностимутации:
CCGTAGTTCTTGAGCAGCGCGTCGTCACTGCGCATGTTTGTGTCAAATTTGTCATAGGTCTGCTTGAGGATCTGCCCAGCCCGGGGGGTGCCATCTTCCA[C/G]CTCCTGCCAAGGGAGGGAGAGACAGAGAGGCCGAAGGGCCCTCAGGAGCAGCTCCCTCCTGCCCGCTCCATTTTCCACCCTCCCCTACAGGCTTGGAGAA.
GH_2291 19: g.48768766A > C, c.607A > C, rs109 191047.
Фланкирующиепоследовательностимутации:
CAAATTTGACACAAACATGCGCAGTGACGACGCGCTGCTCAAGAACTACGGTCTGCTCTCCTGCTTCCGGAAGGACCTGCATAAGACGGAGACGTACTG[A/C]GGGTCATGAAGTGCCGCCGCTTCGGGGAGGCCAGCTGTGCCTTCTAGTTGCCAGCCATCTGTTGTTGCCCCTCCCCCGTGCCTTCCTTGACCCTGGAAG.
3.24 Аборт из-за монбельярдского гаплотипа 2 (MH2) у Bos Taurus
Номер на панели биочипа – 231. SLC37A2_SNPchr29_28879810. Аборт из-за гаплотипа MH2 у BosTaurus.
Монбельярдский гаплотип 2 (МН2) был идентифицирован на 29 хромосоме. Более детальное изучение этого гаплотипа показало, что молекулярно-генетические причины смертности эмбрионов, гомозиготных по этому гаплотипу, заключаются в появлении мутации в гене SLC37A2 (solute carrier family 37 (glucose-6-phosphate transporter), member 2), который кодирует одноименный белок транспортер (Fritz S. [et al.], 2013). Причина смертности эмбриона заключается в фундаментальных нарушениях функций клеточных мембран. Частота встречаемости этой мутации в популяции породы монбельярд достигает 7 %.
29: g.24610495T>C, c.809T>C, p.Leu270Pro.
Фланкирующие последовательности мутации:
ATGCTGGCTCTGGCAGGGTTGCCCATCTTCTTCCTAGAGGTGTCCCTGGGCCAGTTTGCCAGCCAGGGGCCGGTGTCTGTGTGGAAGGCCATCCCAGCCC[T/C]GCAAGGTGAGTGCTTCCTGCTTCCCAGCTGCCTCAGCCCTTCCCTGCCCTCTCTGGCACCAAAGGGCCCCAGGGAGTGAGACCTGCTTCTGTGATTGGGA.
3.25 Гликогенное заболевание (V)
Номер на панели биочипа – 232. PYGM_SNPchr29_43611783. Гликогенное заболевание (V).
Как сообщается в исследовании (Angelos S., Valberg S. J., Smith B. P., Mcquarrie P. S., Shanske S., Tsujino S., Dimauro S., Cardinet G. H., 1995), у шести телят из одного стада Шароле было диагностировано данное заболевание после того, как один из них был представлен в Ветеринарный медицинский учебный госпиталь Школы ветеринарной медицины при Калифорнийском университете в Дэвисе.У отца и дамбы каждого из шести телят был общий предок. Данные согласуются с аутосомно-рецессивным наследованием. Клонированием и секвенированием очень вероятного сравнительного кандидата-гена (на основе гомологичного человеческого расстройства). Было показано, что заболевание
у этого шаролевого скота связано с миссенсовой мутацией в кодоне 489 гена для миофосфорилазы PYGM phosphorylase, glycogen, muscle (Cítek J., Rehout V., Vecerek L., Hájková J., 2007).
3.26 Увеличенная мускулатура
Номер на панели биочипа – 233. MSTN_SNPchr2_6213980; 234.MSTN_SNPchr2_6215942 и 235. MSTN_SNPchr2_6218499. Увеличенная мускулатура.
Увеличенная мускулатура – это признак, вызванный мутациями в гене миостатина (MSTN), ранее называемом GDF8. Миостатин – ингибитор мышечного роста. Любые мутации в этом гене приводят к ухудшению его регуляторной функции и, соответственно, к увеличению развития мышцы. В породе Бельгийская голубая мутация в этом гене приводит к чрезвычайной мышечной гипертрофии, в других европейских породах (Пьедмонтезская, Каролас и Мен-Анджой – Maine-Anjou) также показано наличие мутаций, повреждающих, но не выключающих работу гена и приводящих к умеренной гипертрофии мышц (Kambadur R., Sharma M., Smith T. P. L., Bass J. J., 1997). Существует множество аллелей миостатина.
Q204X, E226X, E291X, C313Y, nt419, 821del11 – приводят к двойной мускулатуре (гиперплазии), увеличению веса при рождении, увеличению нежности мяса.
F94L, S105C, and D182N – ответственны за увеличение мышечной массы и уменьшение внутримышечного жира, без изменений веса рождаемого теленка (Dierks C., Eder J., Glatzer S., Lehner S., Distl O., 2014).
Мутация MYO_F94L (Found in Angus and Limousin lineages)
2: g.6213980A > C, c.282C > A, p.Phe94Leu, rs110065568.
Фланкирующаяпоследовательностьмутации:
TCAGTAAACTTCGCCTGGAAACAGCTCCTAACATCAGCAAAGATGCTATCAGACAACTTTTGCCCAAGGCTCCTCCACTCCTGGAACTGATTGATCAGTT[C/A]GATGTCCAGAGAGATGCCAGCAGTGACGGCTCCTTGGAAGACGATGACTACCACGCCAGGACGGAAACGGTCATTACCATGCCCACGGAGTGTGAGTAGT.
Мутация MYO_C313Y (Found in Gasconne, Piedmontese and Parthenise lineages)
2: g.6218499G > A, c.938G > A, p.Cyc313Tyr.
Фланкирующаяпоследовательностьмутации:
CGATGCTGTCGTTACCCTCTAACTGTGGATTTTGAAGCTTTTGGATGGGATTGGATTATTGCACCTAAAAGATATAAGGCCAATTACTGCTCTGGAGAAT[A/G]TGAATTTGTATTTTTGCAAAAGTATCCTCATACCCATCTTGTGCACCAAGCAAACCCCAGAGGTTCAGCCGGCCCCTGCTGTACTCCTACAAAGATGTCT.
Мутация MYO_Q204X (Found in Blonde d’Aquitaine, Charolaise, Charolais and Limousin lineages)
2: g.6216138C > T, c.610C > T, p.Gln204X, rs110344317.
Фланкирующаяпоследовательностьмутации:
TGTGCAAATCCTGAGACTCATCAAACCCATGAAAGACGGTACAAGGTATACTGGAATCCGATCTCTGAAACTTGACATGAACCCAGGCACTGGTATTTGG[C/T]AGAGCATTGATGTGAAGACAGTGTTGCAGAACTGGCTCAAACAACCTGAATCCAACTTAGGCATTGAAATCAAAGCTTTAGATGAGAATGGCCATGATCT.
Мутация MYO_S105C (Found in Parthenaise lineages)
2: g.6214012C > G, c.314C > G, p.Ser105Cys.
Фланкирующаяпоследовательностьмутации:
ATCAGCAAAGATGCTATCAGACAACTTTTGCCCAAGGCTCCTCCACTCCTGGAACTGATTGATCAGTTCGATGTCCAGAGAGATGCCAGCAGTGACGGCT[C/G]CTTGGAAGACGATGACTACCACGCCAGGACGGAAACGGTCATTACCATGCCCACGGAGTGTGAGTAGTCCTGCTGGTGCAGAGCAACGACTCTGCTGACT.
3.27 Врожденный буллезный эпидермолиз (EB)
Номер на панели биочипа – 236. KRT5_SNPchr5_27545478. Врожденный буллезный эпидермолиз (EB).
Врожденный буллезный эпидермолиз – наследственное заболевание, которое характеризуется преимущественно хрупкостью и другими дефектами кожи и слизистых оболочек. Может наблюдаться деформация и отслоение копыт. Пораженные телята чаще всего погибают в возрасте 1–4 нед. В 2005 г. была выявлена мутация, связанная с EB в гене KRT5 (Foster A. P., Skuse A. M., Higgins R. J., Barrett D. C., Philbey A. W., Thomson J. R., ThompsonH., FraserM. A., BowdenP. E., DayM. J., 2010; Medeiros G. X., Riet-Correa F., 2015). Данный ген отвечает за синтез кератина 5, образующего нити цитоскелета базальных эпителиальных клеток. Одного мутантного аллеля достаточно, чтобы вызвать заболевание, что говорит об аутосомно-доминантном типе наследования. Буллезный эпидермолиз распространен в голштинской породе КРС.
3.28 Гаплотип (HH1), связанный с эмбриональной смертностью
Номер на панели биочипа – 237. APAF1_SNPchr5_63150400. Гаплотип (HH1), связанный с эмбриональной смертностью.
Гаплотип HH1, связанный с эмбриональной смертностью на разных сроках стельности, картирован на 5-й хромосоме в области 58–66 Mb. Установлено, что причиной снижения фертильности, ассоциированной с HH1, служит нонсенс-мутация C → T в гене фактора 1, активирующего апоптотические протеазы (ApoptoticPeptidase-ActivatingFactor 1 – APAF1), приводящая к замене GlnStop в позиции 579 аминокислотной последовательности (Adams H.A., 2012). Функциональный пептид APAF1 инициирует апоптоз и необходим для нормального эмбрионального развития.
Ген APAF1 (ApoptoticPeptidaseActivatingFactor 1) расположен на 5 хромосоме 5: g.6315040C>T, c.1741C>T, p.Gln579X, rs448942533.
Фланкирующая последовательность мутации:
GGAGTTTTTATCTTTAAATGGACATCTTCTTGGACGACAGCCATTTCCTAATATTGTGCAACTGGGCCTCTGTGAACTGGAAACTTCAGAGGTTTATCGG[C/T]AAGCTAAGCTGCAGGCCAAGCAGGAGGTCGATAACGGAATGCTTTACCTGGAGTGGGTGTAAGTAGGTTAGGAGAGAAACCAGAGGGAGCAGAGCGCTGA.
P. M. VanRaden (VanRaden P. M., Olson K. M., Null D. J., Hutchison J. L., 2011) выявил пять новых рецессивных смертельных гаплотипов путем поиска общих гаплотипов, которые никогда не гомозиготы у живых животных. Три из этих гаплотипов встречаются только у голштейнов, и они были названы HH1, HH2 и HH3, где первый H обозначает Гольштейн, а второй – для гаплотипа. HH1сопоставляется с хромосомой BTA5, на уровне 58–66Mb (сборка генома UMD 3.0).
3.29 Гипотрихоз
Номер на панели биочипа – 238. HEPHL1_SNPchr29_695072. Гипотрихоз.
У крупного рогатого скота с мутацией в гене HEPHL1 отсутствуют волосяной покров при рождении частично или по всему телу: часто грудь, шея и ноги. Пострадавшие животные более чувствительны к окружающей среде, кожным инфекциям, вредителям, солнечным ожогам, холодовому стрессу (Marron B., Bever J.E., 2012).
3.30 Мутация в гене IFNGR2 ассоциирована с туберкулезом
Номер на панели биочипа – 239. IFNGR2_SNPchr1_1390292. Мутация
в гене IFNGR2 ассоциирована с туберкулезом.
Ген FNGR2 кодирует фрагмент клеточного рецептора к гамма-интерферону, нелигандсвязывающую бета-цепь рецептора гамма-интерферона. Интерферон-гамма-рецептор является гетеродимером IFNGR1 и IFNGR2. Дефекты
в IFNGR2 являются причиной менделевской восприимчивости к микобактериальному заболеванию (MSMD), также известному как семейная диссеминированная атипичная микобактериальная инфекция.
MSMD представляет собой генетически гетерогенное заболевание с аутосомно-рецессивным, аутосомно-доминантным или X-связанным наследованием.
3.31 Paunch Calf Syndrome
Номер на панели биочипа – 240. KDM2B_SNPchr17_56010031. PaunchCalfSyndrome.
Такая патология связана с мутацией гена KDM2B (Lysine (K)- Specific Demethylase 2B), расположенном на 17 хромосоме (Singleton A. C., Mitchell A. L., Byers P. H., Potter K. A., Pace J. M., 2005).
17: g.56010031, c.2503G > A, p.Asp835Asn.
Фланкирующая последовательность мутации:
TTCTTGGTGGGGCTGGGTGTGGAGGGGACCAAATCCCGCGACCCCTGGGAGCAAGCTTTGCATCTTTTCTTTCCCATGACAGCTAAAACCTGGCAAAGAA[G/A]ATAAGCTTTTCAGGAAAAAGGTACCATCTCCCACCCACCCCCTGCCCCTGTCCCAGAACCTCTCTTGGGGCAGTAGTCTTAGGCTGGAGGGTAGGAGGCC.
Телята обычно мертворожденные, имеют аномальное развитие нескольких органов, лицевые деформации и расширенный желудок, наполненный жидкости. У некоторых пораженных телят также есть выступающий языки расщепленное нёбо. У телят с такой патологией сильное растяжение брюшной полости, подкожный отек, асцит, лобулированная твердая печеньс двумя небольшими (5 и 10 мм) заполненными кровью кистами, небольшим (1 см) дефектом предсердной перегородки, небольшим сокращением лицаи двусторонним экзофтальмом (Toolan D. P., McelroyM. C., FlynnP., WeldR., McclureM., SheehanM., 2014).
3.32 Спинальная мышечная атрофия (SMA)
Номер на панели биочипа – 241. KDSR_SNPchr24_62138835. Спинальная мышечная атрофия (SMA).
Относится к нейродегенеративным заболеваниям. Причиной болезни является мутация в гене KDSR, кодирующем 3-кетодигидросфингозинредуктазу, которая катализирует важнейшие процессы в метаболизме гликосфинголипидов.
KDSR (3-KetodihydrosphingosineReductase) (Производственные отчеты по движению скота и птицы «Агро-объединения ”Кубань”» за 2014 год).
24: g.62138835C > T, g.490C > T, p.Ala164Thr.
Фланкирующаяпоследовательностьмутации:
GAAGACGCTCTTACCTCCATCTGCAAAGCCTCCGCAAGTCCCCTGAGGGCGAACTTGGATGAAGAGTATGCTGTGTAACCAAACAGGCCCAGCTGCCCGG[T/C]CTGGGAAGACACGAAGACGACCCTGCCCATGCGGCGTTCCTTCATGGTGGCGATCACCGCCCGGCTGGGGTACACGCTGCCCAGGTAGTTGATGCTCATC.
Телятачастоумираютотпневмонииввозрастеотшестидовосьминедель. Рождаются они нормальными, но начинают проявлять симптомы SMA в возрасте от трех до шести недель, что характеризуется потерей силыи равновесия в задних ногах. По мере прогрессирования болезни они становятся слабее, теряют вес. Как только у них появляются признаки тяжелого дыхания, смерть обычно происходит через пару дней. Причиной смерти является пневмония
в возрасте от шести до восьми недель.
Это нейродегенеративное заболевание вызывает потерю моторных нейронов, прогрессирующую слабость, снижение спинальных рефлексови потерю баланса в ногах. Терминальные стадии характеризуются тяжелой мускульной атрофией, квадрипарезом и корневой ретенцией. Бронхопневмония является часто осложняющим фактором заболевания (http://www.brownswissusa.com/
Portals/0/Documents/Abnormality%20Pamphlet.pdf [Accessed 6/12/2011 2011]).
3.33 Мутация в гене кератин 74
Номер на панели биочипа – 242. KRT74_SNPchr5_27490704. Мутация
в гене кератин 74.
KRT74 представляет собой ген, кодирующий белок Кератин 74. Ген располагается на пятой хромосоме Chromosome 5 – AC_000162.1. Такое заболевание, как гипотрихоз, связано с мутацией гена KRT74 (Zimin A.V. [et al.], 2009).
Аутосомно-доминантная патология волосяного покрова животного (ADWH), также связана с мутацией гена KRT74 – это редкое заболевание, характеризующееся плотно скрученными волосами. Была обнаружена гетерозиготная мутация p.Asn148Lys в мотиве инициации спирали гена кератина
74 (KRT74) у животного с ADWH. KRT74 кодирует специфический эпителиальный (мягкий) кератин 74 с внутренней корневой оболочкой (IRS). Показано, что мутантный белок K74 приводит к нарушению образования кератинового промежуточного волокна в культивируемых клетках, скорее всего, с доминантно-негативным образом. Идентифицирована гетерозиготная мутация p.Glu440Lys, в соседнем гене Krt71.
3.34 Гены признаков молочной продуктивности
Номер на панели биочипа – 243. CSN1S1_SNPchr6_87157909. Белок Alpha-S1-casein гена CSN1S1; 244. CSN1S2_SNPchr6_87266177. Белок Alpha-S2-casein гена CSN1S2; 245. LALBA_SNPchr5_31348380. Белок Alpha-lactalbumin гена LALBA. Гены признаков молочной продуктивности.
Казеины относятся к семейству фосфопротеинов и составляют примерно 80 % белков молока КРС и формируют в молоке агрегаты известные как «казеиновые мицеллы», в которых молекулы каппа-казеина играют роль стабилизации структуры мицелл. Каппа-казеин кодируется геном CSN3. Всего было идентифицировано 13 аллелей этого гена, из которых наибольшее практическое применение имеют аллели A и В.
Ген CSN3 – один из немногих известных генов, однозначно связанных
с признаками белковомолочности и технологическими свойствами молока.
В-аллель гена каппа-казеина ассоциирован с более высоким выходом творога
и сыра, а также с лучшими коагуляционными свойствами молока. Практика показывает, что высококачественные твердые сыры могут быть изготовлены только из молока, полученного от коров, имеющих генотип ВВ каппа-казеина. Бета-казеин второй по частоте встречаемости в молоке. Ген бета-казеина имеет 12 вариантов, среди которых вариант А1 и А2 наиболее часто встречается. Отличаются варианты А1 и А2 бета-казеина заменой в гене, благодаря которой А1 содержит аминокислоту гистидин в 67-й позиции, тогда как А2 содержит пролин (Szyda J. [et al.], 2011).
Многочисленные исследования в разных странах показали, что белок, образующийся при расщеплении А1 бета-казеина в ЖКТ, может быть одним из факторов развития детского аутизма, приводить к задержке психомоторного развития и нарушениям мышечного тонуса.
С точки зрения производства продуктов питания накопленных данных уже достаточно для того, чтобы задуматься об изменении требования к молоку-сырью или по крайней мере, предоставить потребителю выбор – приобретать молочные продукты, произведенные из молока с бета-казеином только А2 или из смеси молока с бета-казеином А1 и А2.
Лактоглобулин аллельный вариант гена белка лактоглобулина А ассоциирован с более высокими удоями и более высоким уровнем белка в молоке.
В то время как аллельный вариант В ассоциирован с более высоким содержанием белка в молоке и улучшением способности к сычужному свертыванию. Именно аллельный вариант гена В предпочтителен для сыроварения.
Ген бета-лактоглобулина – второй по значимости генетический маркер молочной продуктивности и технологических свойств молока: аллель BLGB связана с высоким содержанием казеиновых белков, большим процентом жира
и лучшими параметрами казеинового коагулянта. Наличие в генотипе животного аллеля BLGА ассоциировано с высоким содержанием сывороточных белков и более высоким общим удоем. Лактоглобулин Бета имеет 8 аллелей: A, B, C, D, H, I, J и W. Генотипы BLGBB и BLGAB оказывают положительное влияние на химический состав и технологические свойства молока. Ген альфа-лактоальбумин играет функциональную роль в изменении объема синтезируемого молока.
Анализ результатов исследований, проведенных российскими и зарубежными учеными, показал, что животные с генотипом LALBAAA превосходят по уровню удоя животных с генотипом LALBABB (Braunschweig M.H., Leeb T., 2006). Идентификацию аллельного полиморфизма BLG по точечной замене
в нуклеотидной последовательности в экзоне 4 предложил J. F. Medrano в 1990 г.
LGB (Beta-Lactoglobulin) also referred to as PAEP (Progestagen -Associated Endometrial Protein). 11: g.103301489C > A.c.-215C > A.
Фланкирующаяпоследовательностьмутации:
TTCCTGGCGCTGGCAGCCAGCCTGGACCCAGAGCCTGGACACCCCCTGCGCCCCCACTTCTGGGGCGTACCAGGAACCGTCCAGGCCCAGAGGGGGCCTT[C/A]CTGCTTGGCCTCGAATGGAAGAAGGCCTCCTATTGTCCTCGTAGAGGAAGCAACCCCAGGGCCCAAGGATAGGCCAGGGGGGATTCGGGGAACCGCGTGG.
11: g.103302553G > C, c.181G > C, p.Glu61Gln, rs211077340.
Фланкирующаяпоследовательностьмутации:
CCCTCCCCAGGTGGCGGGGACTTGGTACTCCTTGGCCATGGCGGCCAGCGACATCTCCCTGCTGGACGCCCAGAGTGCCCCCCTGAGAGTGTATGTGGAG[G/C]AGCTGAAGCCCACCCCTGAGGGCGACCTGGAGATCCTGCTGCAGAAATGGTGGGCGTCCCCCCCAAAAAAAGCATGGAACCCCCACTCCCCAGGGATATG.
11: g.103302586, c.214A > C, p.Ile72Leu, rs209252315.
Фланкирующаяпоследовательностьмутации:
GGCCATGGCGGCCAGCGACATCTCCCTGCTGGACGCCCAGAGTGCCCCCCTGAGAGTGTATGTGGAGGAGCTGAAGCCCACCCCTGAGGGCGACCTGGAG[A/C]TCCTGCTGCAGAAATGGTGGGCGTCCCCCCCAAAAAAAGCATGGAACCCCCACTCCCCAGGGATATGGACCCCCCCGGGGTGGGGTGCAGGAGGGACCAG.
11: g.103302597G > T, c.225G > T, p.Gln75His, rs210096472.
Фланкирующаяпоследовательностьмутации:
CCAGCGACATCTCCCTGCTGGACGCCCAGAGTGCCCCCCTGAGAGTGTATGTGGAGGAGCTGAAGCCCACCCCTGAGGGCGACCTGGAGATCCTGCTGCA[G/T]AAATGGTGGGCGTCCCCCCCAAAAAAAGCATGGAACCCCCACTCCCCAGGGATATGGACCCCCCCGGGGTGGGGTGCAGGAGGGACCAGGGCCCCAGGGC.
11: g.103303473C > T, c.237C > T, p.Asn79Asn, rs110180463.
Фланкирующаяпоследовательностьмутации:
CAGCCCCTCCTGGGGCCGCCTTCTGCCCCTGGCCCTCAGTTCATCCTGATGAAAATGGTCCATGCCCGTGGCTCAGAAAGCAGCTGTCTTTCAGGGAGAA[C/T]GGTGAGTGTGCTCAGAAGAAGATCATTGCAGAAAAAACCAAGATCCCTGCGGTGTTCAAGATCGATGGTGAGTGCTGGGTCCCCAGGGGACGCCCACCAC.
11: g.103303475G > A, c.239G > A, p.Gly80Asp, rs110180463.
Фланкирующаяпоследовательностьмутации:
GCCCCTCCTGGGGCCGCCTTCTGCCCCTGGCCCTCAGTTCATCCTGATGAAAATGGTCCATGCCCGTGGCTCAGAAAGCAGCTGTCTTTCAGGGAGAACG[G/A]TGAGTGTGCTCAGAAGAAGATCATTGCAGAAAAAACCAAGATCCCTGCGGTGTTCAAGATCGATGGTGAGTGCTGGGTCCCCAGGGGACGCCCACCACCC.
11: g.103303494G > C, c.258G > C, p.Lys86Asn.
Фланкирующаяпоследовательностьмутации:
TCTGCCCCTGGCCCTCAGTTCATCCTGATGAAAATGGTCCATGCCCGTGGCTCAGAAAGCAGCTGTCTTTCAGGGAGAACGGTGAGTGTGCTCAGAAGAA[G/C]ATCATTGCAGAAAAAACCAAGATCCCTGCGGTGTTCAAGATCGATGGTGAGTGCTGGGTCCCCAGGGGACGCCCACCACCCCCCAGGGACTGTGGGCAGG.
11: g.103304727A > G, c.371A > G, p.Glu124Gly.
Фланкирующаяпоследовательностьмутации:
GAACTCACTTTCCTCCTGTCTTGATCTCTACCAGCCTTGAACGAGAACAAAGTCCTTGTGCTGGACACCGACTACAAAAAGTACCTGCTCTTCTGCATGG[A/G]GAACAGTGCTGAGCCCGAGCAAAGCCTGGTCTGCCAGTGCCTGGGTGGGTGCCAACCCTGGCTGCCCAGGGAGACCAGCTGTGTGGTCCTCGCTGCAACG.
11: g.103304757T > C, c.401T > C, p.Val134Ala, rs109625649.
Фланкирующаяпоследовательностьмутации:
CCAGCCTTGAACGAGAACAAAGTCCTTGTGCTGGACACCGACTACAAAAAGTACCTGCTCTTCTGCATGGAGAACAGTGCTGAGCCCGAGCAAAGCCTGG[T/C]CTGCCAGTGCCTGGGTGGGTGCCAACCCTGGCTGCCCAGGGAGACCAGCTGTGTGGTCCTCGCTGCAACGGGGCCGGGGGGGACGGTGGGAGCAGGGAGC.
11: g.103305456C > T, c.425C > T, p.Pro142Leu.
Фланкирующаяпоследовательностьмутации:
GGCCAAGGGGGAAGGGCAGGTGTGCTGGAGGCCAAGGCAGACCTGCACACCACCCTGGAGAGCAGGGGTTGACCCCGTCCCGGCCCCACAGTCAGGACCC[C/T]GGAGGTGGACGACGAGGCCCTGGAGAAATTCGACAAAGCCCTCAAGGCCCTGCCCATGCACATCCGGCTGTCCTTCAACCCAACCCAGCTGGAGGGTGAG.
3.35 Синдром Чедиака-Хигаши (Chediak Higashi Syndrome)
Номер на панели биочипа – 246. LYST_SNPchr28_8508619. Синдром Чедиака-Хигаши (ChediakHigashiSyndrome).
Считается, что мутация в гене LYST на 28 хромосоме 28: g.8508619A > G, c.6044A > G, p.His2015Arg вызывает нарушение работы белка регулятора транспорта лизосом, что приводит к изменениям в размере, структуре и функции лизосом.
Синдром Чедиак-Хигаси (CHS) представляет собой аутосомно-рецессивное расстройство, которое поражает несколько видов, включая мышей, людей
и крупный рогатый скот. Доказательства, основанные на клинических характеристиках и генетике соматических клеток, показывают, что мутации в общем гене вызывают CHS у трех видов. Локус CHS на хромосоме человека 1 и хромосоме мыши 13 кодирует регулятор лизосомальной торговли, ранее известный как LYST, теперь известный как CHS1, и дефектен у пациентов с CHS и бежевыми мышами соответственно. Мы сопоставили локус CHS с проксимальной областью бычьей хромосомы 28 с помощью анализа сцепления с использованием микросателлитных маркеров, ранее отображенных на эту хромосому. Кроме того, мы идентифицировали мутантную мутацию A:T → G:C, которая приводит к замене гистидина остатком аргинина на кодоне 2015 гена CHS1. Эта мутация является наиболее вероятной причиной CHS у крупного рогатого скота Вагью (Abdeen A., Sonoda H., Kobayashi I., Kitahara G., Ikeda M., 2013).
Фланкирующаяпоследовательностьмутации:
CACAAAGAGGGGCAGCTTATATCCATGCCCCAAGAGGTTTGTAGATCCTTTGTGAAAAATACAGCAGAACTCCTTGGATCTCCTCCGGATTTGGAATTATTGACGATTATCTTCAATTTCCTTTTAGCAGTTC[A/G]TCCTCCTACTAATACTTATGTTTGTCACAACCCCACAAACTTCTATTTTTCTTTGCACATAGATGGCAAGATCTTTCAGGAAAAAGTACAATCAATCATGTACTTG.
3.36 Aксонопатия
Номер на панели биочипа – 247. MFN2_SNPchr16_42562057. Aксонопатия.
Этот ген MFN2 (Mitofusin 2) находится на 16 хромосоме, кодирует белок митохондриальной мембраны, который участвует в митохондриальном слиянии и способствует поддержанию и функционированию сети митохондрий. Этот белок участвует в регуляции пролиферации клеток гладких мышц сосудов, и он может играть роль в патофизиологии ожирения. Мутации в этом гене вызывают болезнь Шарко-Мари-Зуба типа 2А2 и наследственную моторную и сенсорную невропатию VI, которые являются одновременно нарушениями периферической нервной системы. Дефекты этого гена также были связаны с ранним началом инсульта.
Телята часто имеют широкую постановку ног и начинают терять контроль над задними лапами в возрасте 1 мес, в дальнейшем они не могут стоять. Хотя болезнь не смертельна, пораженные телята, как правило, подвергаются эвтаназии в возрасте 10 мес.
Замена C → T в экзоне 20 вызывает дефект сплайсинга, который приводит к частичному удерживанию интрона 19 и вводит преждевременный стоп-кодон. У животных есть спинальная атаксия, парапарез с атаксией тазовой конечности. Рассеянные вырожденные аксоны наблюдаются в остальных участках белого вещества спинного мозга, в белом веществе головного мозга и в бедренном нерве (Drogemuller C. [et al.], 2011; Shen T., Zheng M., Cao C., Chen C., Tang J., Zhang W., Cheng H., Chen K. H., Xiao R. P., 2007).
16: g.42562057C>T, c.2229C>T.
Фланкирующая последовательность мутации:
CCGGTAGAACGCTTGGCAGGTTACGCCACGGCTAGTTATCAGCTCTTGCCACTACAAGGTAACCTTTTCTCTGCAGGAATAAAGCCGGCTGGTTGGACAG[C/T]GAACTCAACATGTTCACCCACCAGTACCTGCAGCCCAGCAGATAGTGGGCACCCGGAGCCGGACCCCCTGTGGGGAGGACAGTGCTGCGAGCGCGGGGGG.
3.37 Синдром белого симментала (GWFS)
Номер на панели биочипа – 248. MITF_SNPchr22_31746502; 251. MITF_SNPchr22_31769189. Синдром белого симментала (GWFS).
Цвет шерсти у млекопитающих определяется большим количеством генов. По оценкам, ~ 300 локусов влияют на фенотипы цвета шерсти с участием более 150 генов. Синдром белого симментала (GWFS) – аутосомально-доминантное генетическое заболевание, которое характеризуется гипопигментацией, гетерохромией радужки, дефектами оболочки глаз и двусторонней потерей слуха.
В основе этого заболевания лежит мутация в гене MITF, расположенном на 22 хромосоме (melanogenesisassociatedtranscriptionfactor.Chromosome 22, AC_000179.1 (31733024..31961855, complement) (http://omia.angis.org.au).
Продукт гена MITF вовлечен в миграции меланобластов образующихся
в нервном гребне зародышей на всей поверхности тела. Нарушение хода миграции приводит к ряду наследственных заболеваний, таким как синдром Ваарденбурга и частичный альбинизм у человека, и синдром белого симментала
у крупного рогатого скота (Markakis M. N., Soedring V. E., Dantzer V., Christensen K., Anistoroaei R., 2014).
Генетические основы синдрома белого симментала были описаны в 2011 г.(Philipp U., Lupp B., Mömke S., SteinV., TipoldA., EuleJ.C., RehageJ., Distl O. A., 2011). Клиническими проявлениями у животных являются чисто-белый цвет шерсти, розовая кожа без каких-либо темных пятен или призрачных узоров, желто-белые копыта, белые рога, беспигментные веки, ресницы
и конъюнктивальные мембраны. Также описаны случаи гетерохромии радужки, характеризующиеся цветом бледно-голубым в центральной части радужки
и белым по направлению к периферии. Важным клиническим проявлением
у животных является двусторонняя потеря слуха.
Мутация гена MITF R210I была идентифицирована внутри связанного
с микрофтальмой транскрипционного фактора (MITF) как ответственного за этот синдром. Белок, кодируемый этим геном, представляет собой фактор транскрипции, который содержит как основные структурные особенности спиральной спирали, так и спиральную структуру. Закодированный белок регулирует развитие меланоцитов и отвечает за специфическую для пигментных клеток транскрипцию генов фермента меланогенеза. Гетерозиготные мутации в этом гене вызывают слухо-пигментные синдромы. Мутация расположена в высококонсервативной основной области белка и вызывает негативно-доминирующий эффект.
3.38 Маннозидоз
Номер на панели биочипа – 249. MAN2B1_SNPchr7_13956640. Маннозидоз.
Маннозидоз – это рецессивное генетическое заболевание, связанное
с нарушением работы лизосомальной альфа-маннозидазы – низкоспецифичной экзогликозидазы, основная функция которой – деградация гликопротеинов. Этот фермент кодируется геном MAN2B1. Нарушение работы этого фермента приводит к глобальным патологиям метаболизма у КРС. Среди животных галловейской породы распространена альфа-форма этого заболевания. Молекулярно-генетические причины а-маннозидоза связаны с мутацией в этом гене, что приводит к нарушению правильной работы кодируемого им белка. Для животных, гомозиготных по этой мутации, характерна ранняя неонатальная смертность, у родившихся животных наблюдается атоксия, тремор головы, повышенная агрессия и нарушения роста и развития. Большая часть таких животных умирает в первый год жизни (Tollersrud O.K., Berg T., Healy P., Evjen G., Ramachandran U., Nilssen O., 1997).
ГенMAN2B1 (MannosidaseAlphaClass 2bMember 1). Существует две мутации гена MAN2B1 AM_662 (обнаружена в линиях Galloway):
7: g.13956640G > A, c.662G > A, p.Arg221His.
Фланкирующаяпоследовательностьмутации:
CCGGTCCCTTATGCATCCTGCCCTCTCTTGTTCTCCCATCCCACTCGTCATCCCTCCCCATCTCCAGATGGGTTTTGACGGCTTCTTCTTTGGAC[G/A]CCTGGATTATCAAGACAAGAAGGTGCGGAAAAAGACGCTGCAGATGGAGCAGGTGTGGCGGGCCAGCACCAGCCTGAAACCTCCCACTGCCGACC.
Номернапанелибиочипа – 250. MAN2B1_SNPchr7_13957949. Маннозидоз.
AM_961 (обнаруженавлиниях Angus and Murray Grey):
7: g.13957949, c.961T > C, p.Phe321Leu.
Фланкирующаяпоследовательностьмутации:
ACAGGGGTGGGCCAGGACACCCTAGCCTTAGGATACCCCCATCTTGCCTGCAGGGTAAGCTCTACCGCACCAAACACACTGTGATGACCATGGGCTCAGAC[T/C]TCCAGTACGAGAATGCCAACACGTGGTTCAAAAATCTTGACAAGCTCATCCAGTTGGTCAATGCCCAGGTGAGTGTGCCTGCCCCGTGGGCACTT.
3.39 Мутация в гене OPA3 (внешний регулятор метаболизма липидов митохондриальной мембраны)
Номер на панели биочипа – 252. OPA3_SNPchr18_53546443. Мутация
в гене OPA3 (внешний регулятор метаболизма липидов митохондриальной мембраны).
Кардиомиопатии – тяжелые дегенеративные заболевания миокарда, которые приводят к сердечной недостаточности. В течение последних трех десятилетий дилатационная кардиомиопатия быков (BDCMP) получила широкое распространение в голштинскойи симментальской породах крупного рогатого скота.
Дилатационная кардиомиопатия начинает прогрессировать обычнов возрасте от 2 до 4 лет. Сердце больных животных увеличивается, нарушается механизм сокращения сердечной мышцы и животное умирает в результате тяжелой сердечной недостаточности. Клиническими признаками заболевания являются заторы яремной вены, отек грудной клетки и абдукция (отведение в сторону) передних конечностей. BDCMP – генетическое заболевание, которое наследуется по аутосомно-рецессивному типу. В 2011 г. группа ученых из Бернского университета нашла казуальную мутацию в гене ОРА3, ассоциированную с этим заболеванием. Ген OPA3 расположен на 18 хромосоме и кодирует белок внутренней мембраны митохондрий. Есть сведения, что этот белок вовлечен в регуляцию морфологии митохондрий (Owczarek-Lipska M. [et al.], 2011; Zimin A.V. [et al.], 2009; Horiuchi N. [et al.], 2015).
3.40 Врожденный миоклонус
Номер на панели биочипа – 253. GLRA1_SNPchr7_65080197. Врожденный миоклонус.
Врожденный миоклонус – это наследственное аутосомно-рецессивное заболевание, которое ранее было известно, как нейроаксиальный отек. У животных с ICM наблюдается аномальная реакция на различные тактильные, зрительные и слуховые раздражители в виде гиперестезии и миоклонических судорог скелетных мышц. Врожденный миоклонус вызван несинонимичной мутацией во 2 экзоне гена GLRA, который кодирует a1-субъединицу глицинового рецептора (Windsor P., Kessell A., Finnie J., 2011). Мутация приводит к нарушению стрихнин-связывающего сайта глицинового рецептора, что приводит к потере иммунореактивности клеток. Впервые это заболевание было описано
в 2001 г. учеными из Австралии на поголовье животных породы герефорд.
В рамках дальнейших исследований носители этого заболевания были обнаружены в поголовье КРС голштинской породы. Пострадавшие животные часто кажутся нормальными, но имеют спонтанные мышечные спазмы и жесткость всего тела в ответ на стимуляцию. Хотя подобные патологии и не смертельны, пораженные телята обычно подвергаются эвтаназии.
Ген GLRA1 (GlycineReceptor, Alpha 1) находится на 7 хромосоме:
7: g.65080197C > A, c.156C > A, p.Tyr52X.
Фланкирующаяпоследовательностьмутации:
AGTCTTGCTGCTTCCAAGGAGGCTGAAGCTGCTCGGTCTGCTTCCAAGCCCATGTCACCGTCCGATTTCCTGGATAAACTCATGGGGAGGACTTCTGGATA[C/A]GACGCCAGGATCAGGCCCAATTTCAAAGGTAGATAATCTTGCCTTTCAGAGCCCCAGGGATCTGCTTTCCCAGATTGTGGCAGCAAGCCCACTGAATTGT.
3.41 Врожденный дефицит цинка (ZDL)
Номер на панели биочипа – 254. PLD4_SNPchr21_71001232. Врожденный дефицит цинка (ZDL).
Это заболевание характеризуется нарушением функции иммунной системы, замедлением роста и кожными изменениями, вследствие нарушения абсорбции цинка в кишечнике. Больные животные рождаются без видимых клинических симптомов, первые поражения кожи возникают в возрасте от четырех до восьми недель. Нарушение иммунной системы делает животных более восприимчивыми к инфекциям и приводит к увеличению числа случаев заражения такими распространенными заболеваниями как энтерит и пневмония. Дополнительное введение цинка улучшает клинические симптомы животных, однако, при отсутствии лечения, ZDL летален. Причиной врожденного дефицита цинка в симментальской породе является мутация в гене фосфолипазы PLD4.
3.42 Тромбопатия (TP)
Номер на панели биочипа – 255. RASGRP2_SNPchr29_43599204. Тромбопатия (TP).
Тромбопатия – генетическое заболевание, связанное с нарушением свертываемости крови, происходящим в результате блокировки высвобождения АДФ из тромбоцитов. У больных животных количество тромбоцитов находится в норме, но их функция нарушена, что приводит к нарушению свертываемости крoви. Хотя общее состояние гомозиготных животных может быть без патологий, мелкие травмы могут вызвать кровотечения и смерть в результате потери крови.Частота мутации внутри симментальской породыв гене RASGRP2, приводящей к развитию тромбопатии, составляет 7–8 % (Boudreaux M. K., Schmutz S. M., French P. S., 2007).
У пострадавшего крупного рогатого скота наблюдаются легкие и сильные кровотечения, включая носовое кровотечение, десневое кровотечениеи гематурию. Тяжелые случаи, когда животное может истекать кровью от рутинных процедур: отторжение, выпадение хвоста и прививки. Несмотря на то, что количество тромбоцитов в норме, реакция агрегации тромбоцитов на аденозиндифосфат (АДФ) или фактор активации тромбоцитов (PAF16) сильно снижается.
Ген RASGRP2 (RASGuanylReleasingProtein 2) располагается на 29 хромосоме [69]: 29 :g.43599204A>G,c.701A>G,p.Leu234Pro, rs385444696.
Фланкирующая последовательность мутации:
TCTCCTTGAGGCGGGAGATGGAGCTGTGGCTCAGGCCCCCAACCACTGCCATCAGCGTGTTGAAATTCTGCAGGTGCAGG[A/G]GTTCCTGGGGGACAAATGGGGAGAGAGGAGGCAGTGAGTCACTGAGTGGGCCCAGAATTTGGCCCAGCTTTTCTGGGAA.
3.43 Карликовость. Мутация в гене RNF11
Номер на панели биочипа – 256. RNF11_SNPchr3_95601697. Карликовость. Мутация в гене RNF11 (ассоциирована с нарушением регуляции белкового комплекса А20, что приводит к различным патологиям роста и развития).
Эта мутация была идентифицирована на 3 хромосоме у животных бельгийской голубой породы КРС. Исследователями было установлено, что данная мутация встречается примерно у 26 % животных этой породы. Животные, гомозиготные по этой мутации, погибают в раннем возрасте в связис множественными аномалиями роста и развития организма.
Животные с этой патологией внешне кажутся нормальными при рождении, но страдают от сильного замедления роста через 6 мес, у них узкий череп
и очень волосатая голова. Примерно одна треть пораженных животных умирает от инфекций до 6-месячного возраста из-за скомпрометированной резистентности к патогенам. Мутацияприводиткпотереэкзона 2 (Sartelet A., Druet T., Michaux C., Fasquelle C., Geron S., Tamma N., Zhang Z., Coppieters W., Georges M., Charlier C., 2012).
Ген RNF11 (RingFingerProtein 11) расположен на 3 хромосоме
3: g.95601696A>G, c.124-2A>G.
Фланкирующая последовательность мутации:
AGGTCCCCTCCTCAGCCCAAAAAGGAAGAAACAAAAGGAAAACATTACCTAGAAAACAGATTTTTTAAAAAATAATTAATTTCTCCATTTTAAAAAATTT[A/G]GGAACAAGTTCCAGTTCCGGTCTATCATCCAACACCTAGCCAGACTCGCCTAGCAACTCAGCTGACTGAAGAGGAACAAATTAGGATAGCTCAAAGAATA.
3.44 Комплексный порок позвоночника (CVM)
Номер на панели биочипа – 257. SLC35A3_SNPchr3_43412427. Комплексный порок позвоночника (CVM).
Комплексный порок позвоночника – сложный тератологический синдром телят голштинской породы, заключающийся, прежде всего, в выкидышах, преждевременных родах, мертворождении или смерти телят в первые дни жизни, а значит увеличивающий смертность молодняка и воспроизводительные способности скота. Самым ярким проявлением этой аномалии, о чем говорит уже само ее название, являются многочисленные уродства скелета. Cмертность на стадии эмбриона.Носители данной мутации также распространены в популяциях голштинской и черно-пестрой породы всего мира (Thomsen B., Horn P., Panitz F., Bendixen E., Petersen A. H., Holm L. E., Nielsen V. H., Agerholm J. S., Arnbjerg J., Bendixen C., 2006). Мутация содержится в гене SLC35A3 [SOLUTECARRIERFAMILY 35 (UDP-N-ACETYLGLUCOSAMINETRANSPORTER), MEMBER 3], расположенном на 3 хромосоме
3: g.43412427, c.559G > T, p.Val180Phe, rs438228855.
Фланкирующаяпоследовательностьмутации:
TAAACTTGTGTTGTTTCTTTTTGTTCAGTGGCCCTCAGATTCTCAAGAGCTTAATTCTAAGGAACTTTCAGCTGGCTCACAATTTGTAGGTCTCATGGCA[G/T]TTCTCACAGCATGTTTTTCCAGTGGCTTTGCTGGGGTTTACTTTGAGAAAATCTTAAAAGAAACCAAACAATCAGTGTGGATAAGAAACATTCAACTTGG.
Для мутации G>T в гене SLC35A3, которая вызывает болезнь комплексной перестройки позвонков (CVM), «G» является аллелем, который имеет большинство животных, а «T» является аллелем, вызывающим заболевание. Животные, имеющие CVM, будут гомозиготными (имеют две копии) для аллеля ‘T’.
3.45 Акродерматит энтеропатический
Номер на панели биочипа – 258. SLC39A4_SNPchr14_1723331. Акродерматитэнтеропатический.
Мутацииявгене SLC39A4(SOLUTE CARRIER FAMILY 39 (ZINC TRANSPORTER, MEMBER 4).Расположен на хромосоме 8 в регионе 8q24.3, состоит из 12 экзонов.
Заболевание, обусловленное нарушением всасываемости в кишечнике за счет дефицита цинка и отсутствия фермента олигопептидазы. Мутации в гене SLC39A4 приводят к дефициту протеина, ответственного за всасывание цинка, что ведет к грубому изменению метаболизма цинка (Tammen I., Cook R. W., Gitschier J., Nicholas F. W., Raadsma H. W., 2002; Yuzbasiyan-Gurkan V., Bartlett E., 2006).
Первые признаки заболевания возникают у телят при рождении. Характерны изменения кожных покровов. Сыпь симметричная, вокруг глаз, в аногенитальной области, в области ягодиц, разгибательных поверхностей коленных
и локтевых суставов. Она полиморфная, вначале эритематозная, везикуло-пустулезная или буллезная, постепенно сливающаяся в крупные мокнущие, эрозированные очаги, покрывающиеся корками серозного или серозно-гнойного характера. Почти у всех больных в зонах поражения обнаруживаются признаки вторичной гноеродной инфекции (Tammen I., Cavanagh J. A. L., Cook R. W., Harper P. A. W., Raadsma H. W., Nicholas F. W., 1999). Около 97 % больных имеют паронихии. Почти постоянным признаком является алопеция разной степени выраженности, нередко тотальная. В результате развивающегося иммунодефицита на коже, слизистых и в кишечнике появляются кокки, грибы рода Candida, простейшие.
Одновременно с кожными проявлениями (иногда раньше) у 91 % больных появляется диарея разной степени выраженности. Стул обильный, пенистый, желто-серого цвета (стеаторея).
3.46 Перинатальный синдром слабого теленка
Номер на панели биочипа – 259. IARS_SNPchr8_85341291. Перинатальный синдром слабого теленка.
Соответствует понятию «физиологическая незрелость» новорожденных (иногда называют «синдром слабых телят»). У таких животных снижен мышечный тонус, тормозится реализация позы стояния (они не могут подняться на ноги в течение первых двух часов после рождения), сосательный рефлекс появляется с запозданием и слабо выражен, отмечают безучастное отношение
к окружающему, сгорбленную позу. Масса тела новорожденного молодняка на 10–30 % меньше нормы, температура снижена на 0,5–1 °С, дистальные участки конечностей холодные. Дыхание поверхностное, неравномерное. Сердечный толчок пальпируется с обеих сторон грудной клетки, тоны сердца ослаблены. При анализе крови выявляют низкие показатели обмена веществ, ацидоз, снижение уровня иммуноглобулинов, гемоглобина, эритроцитов, лейкоцитов.
Мутация в гене IARS (isoleucyl-tRNA synthetase) расположена на 8 хромосоме: AC_000165.1 (85350141..85268884) (Hirano T., Matsuhashi T., Takeda K., Hara H., Kobayashi N., Kita K., Sugimoto Y., HanzawaK., 2016; HiranoT., NishimuraS., HaraH., SugimotoY., HanzawaK., 2017).
3.47 Голштинский гаплотип НН3
Номер на панели биочипа – 260. SMC2_SNPchr8_95410507. Голштинский гаплотип НН3.
Гаплотип – это последовательность нуклеотидов, расположенная в одной хромосоме и передаваемая от родителей к детям без изменений. Если внутри гаплотипа происходит мутация (замена нуклеотидов, выпадение фрагмента или встраивание нового участка), то образуется новый гаплотип. Потомок может получить от предка только одну копию гаплотипа.
Для проявления отрицательного влияния гаплотипа потомок должен получить две одинаковые копии участка ДНК: одну – от отца, другую – от матери. По принятой номенклатуре наименование гаплотипа состоит из двух латинских букв и порядкового номера. Первая буква обозначает породу, вторая – Н
от haplotype.
В голштинской породе в настоящее время регистрируется 10 гаплотипов фертильности (HCD, HH0, HH1, HH2, HH3, HH4, HH5, HHB, HHC, HHD), оказывающих влияние на процент успешных осеменений (с наступлением стельности) и/или ассоциированных с эмбриональной и ранней постэмбриональной смертностью на различных стадиях и встречающихся с частотой от 0,01 до 2,95 %.
Гаплотип HH3, с которым связана эмбриональная смертность до 60-х суток стельности, картирован на 8-й хромосоме на участке 90–95 Mb. По уточненным данным, область локализации HH3 – 94–96 Mb, установлена его ассоциация
с мутацией в гене структурной поддержки хромосом 2 (StructuralMaintenanceOfChromosomes 2 – SMC2). Причина HH3 – несинонимичная замена Т → С
в позиции 24-го экзона в гене SMC2, приводящая к аминокислотной замене
Phe → Ser в положении 1135 в НТФазном домене кодируемого белка (Zhang Y.
[et al.], 2015; Bruford M. W., Bradley D. G., 2003).
Ген SMC2 (Structural Maintenance of Chromosomes 2)
8: g.95410507, c.3404T > C, p.Phe1135Ser, rs456206907.
Фланкирующаяпоследовательностьмутации:
CTCCTTTTCAAACCTGCCCCAATCTACATCCTGGATGAGGTCGATGCAGCCCTGGATCTTTCTCATACTCAGAATATTGGACATATGCTACGTACTCATT[T/C]CACACATTCTCAGGTAAGAACCAAAAAGAGCCTCAGAATAGTTCTAGGATTTGTTTTTCTAAAACTATTCTTTAGTAATGGTCAGTATATATAAGGAATT.
3.48 Спинальная демиелинизация (SDM)
Номер на панели биочипа – 261. SPAST_SNPchr11_14760164. Спинальная демиелинизация (SDM).
Нейродегенаритивное заболевание характеризуется патологическими изменениями миелиновой оболочки спинного мозга. Болезнь связана с нарушением работы белка спастина, которое приводит к потере АТФазной активности этого белка.
3.49 Врожденный зоб щитовидной железы (CG)
Номер на панели биочипа – 262. TG_SNPchr14_9487659. Врожденный зоб щитовидной железы (CG).
Врожденный зоб щитовидной железы (CG) – это аутосомно-рецессивное наследственное заболевание, вызванное мутацией в гене TG, который кодирует белок тиреоглобулин. CG является первым генетическим заболеванием среди всех доместицированных видов животных, для которых была описана молекулярно-генетическая природа.Казуальная мутация была идентифицирована
у животных породы африкандер бельгийскими и южноафриканскими учеными в 1987 г. (RickettsM.H. [et al.], 1987).
Симптомами данного заболевания является увеличение щитовидной железы, приводящее к сильному отеку в передней части шеи. В связи с нарушением работы щитовидной железы, у животных наблюдаются аномалии развития внутренних органов, что приводит к смерти животного в первые годы жизни (http://omia.angis.org.au).
Наследственный зоб щитовидной железы был обнаружен не только
у КРС, но и у многих других видов домашних животных (собак, домашних котов, овец, коз, куриц и др.). Кроме того, исследование CG у КРС помогло открытию и изучению первой мутации гена TG у человека. Одним из самых ярких симптомов врожденного зоба щитовидной железы у КРС является сильный отек в передней части шеи (Nicholas F.W., Hobbs M., 2014).
3.50 Глазокожный альбинизм
Номер на панели биочипа – 263. TYRP1_SNPchr8_31711945. Глазокожный альбинизм.
Ген TYRP1 кодирует тирозиназа-связанный белок 1, меланосомальный фермент, который принадлежит к тирозиназному семейству и играет важную роль в пути биосинтеза меланина – вещества, которое придает коже, волосам
и глазам свой цвет. Он также обнаруживается в светочувствительной ткани
в задней части глаза (сетчатке), где он играет роль в нормальном зрении. Дефекты в этом гене являются причиной рыжего глазокожного альбинизмаи глазокожного альбинизма типа III (Berryere T. G., Schmutz S. M., Schimpf R. J., Cowan C. M., Potter J., 2003). Исследования показывают, что этот фермент может помочь стабилизировать тирозиназу, которая ответственна за первую стадию производства меланина. Связанный с тирозиназой белок 1 также может помочь определить форму меланосом, которые являются структурами в меланоцитах.
3.51 Мутация в гене UBE3B – убиквитин-белковой лигазы E3B
Номер на панели биочипа – 264. UBE3B_SNPchr17_65921497. Мутация
в гене UBE3B – убиквитин-белковой лигазы E3B.
Модификация белков убиквитином является важным клеточным механизмом для нацеливания на аномальные или короткоживущие белки для деградации. Убиквитинилирование включает по меньшей мере три класса ферментов: E1 убиквитин-активирующие ферменты, E2-убиквитин-конъюгирующие ферменты и E3-убиквитин-белковые лигазы. Этот ген кодирует член семейства E3 убиквитин-конъюгирующих ферментов, который забирает убиквитин из E2-убиквитин-конъюгирующего фермента и переносит убиквитин на целевые субстраты. Термин HECT (гомология к E6-AP C-концу) в С-конце более длинной изоформы этого белка является каталитическим сайтом переноса убиквитина и образует комплекс с конъюгатами E2. Поэтому более короткие изоформы этого белка, которые не имеют С-концевого домена HECT, вряд ли связывают ферменты Е2. В качестве альтернативы для этого гена были идентифицированы варианты сращивания транскриптов, кодирующие различные изоформы.
Заболеванием, связанным с мутацией в гене UBE3B, является синдром Кауфмана.
3.52 Дефицитуридинмонофосфатсинтетазы (Deficiency of Uridine-5-Monophosphate Synthase, DUMPS)
Номер на панели биочипа – 265. UMPS_SNPchr1_69756880. Дефицитуридинмонофосфатсинтетазы (Deficiency of Uridine-5-Monophosphate Synthase, DUMPS).
DUMPS – это наследственное летальное аутосомно-рецессивное заболевание в голштинской популяции, приводящее к ранней эмбриональной смертности на стадии имплантации эмбриона в матку. Это связано с нарушением синтеза уридин-монофосфата в организме, который является одним из ключевых элементов при синтезе de novo пиримидиновых нуклеотидных оснований. Смертность эмбриона наступает примерно на 40 день после оплодотворения.
Методика ДНК-диагностики носительства DUMPS была разработана
и введена Б. Швенгером в 1993 г. (Nasreen F. [et al.], 2012; Dennis J.A. [et al.], 1989) и до сих пор используется практически без изменений. Дифференциация аллелей осуществляется с помощью ПЦР с использованием праймеров:
| forUMPS 5’-GCAAATGGCTGAAGAACATTCTG-3’ |
| revUMPS 5’-GCTTCTAACTGAACTCCTCGAGT-3’ |
Поскольку при замене цитозина исчезает сайт узнавания рестриктазой AvaI, идентификация нерасщепленного амплифицированного ПЦР-продукта локуса гена UMPS позволяет однозначно определить носителей этой мутации.
Учитывая низкую племенную ценность гетерозиготных быков с этой аномалией, своевременная диагностика и выбраковка животных племенного материала могут позволить элиминировать DUMPS и направленно формировать группы для воспроизводства животных.
Мутация в гене UMPS (UridineMonophosphateSynthetase), расположенном на 1 хромосоме
1: g.69756880C > T, c.1213C > T, p.Arg405X.
Фланкирующая последовательность мутации:
TGTGGTTAACTGCTGTCTTGTCATCTGTTGATTACATTCCATTCAGGTGCAAATGGCTGAAGAACATTCTGAATTTGTGATTGGTTTTATTTCTGGCTCC[C/T]GAGTAAGCATGAAACCAGAATTTCTTCACTTGACTCCAGGAGTTCAGTTAGAAGCAGGAGGTAAGCCTATTGATTGGTAATGATTCCTCTAAAATGCTGC.
3.53 Гемофилия А (FVIIID)
Номер на панели биочипа – 266. F8_SNPchrX_38971744. Гемофилия А (FVIIID).
Гемофилия А (FVIIID; OMIA 000437-9913) представляет собой нарушение свертываемости крови, описанное как у человека, так и у многих видов домашних животных (лошадей, овец), в том числе у крупного рогатого скота (Moritomo Y., Shimojo K., Miyadera K., Khalaj M., Asano Y., Kunieda T., Ogawa H., 2008).
Заболевание связано сдефицитом фактора VIII свертывания крови – плазменного гликопротеина, ген которого расположен на Х хромосоме (Khalaj M., Abbasi A.R., Shimojo K., Moritomo Y., Yoneda K., Kunieda T., 2009). Таким образом, дефицит фактора VIII – Х-сцепленное рецессивное наследственное заболевание, в то время как большинство наследственных заболеваний, связанных
с факторами свертываемости, являются аутосомно-рецессивными заболеваниями (Moritomo Y., Shimojo K., Miyadera K., Khalaj M., Asano Y., Kunieda T., Ogawa H., 2008).
У животных, страдающих дефицитом фактора VIII, наблюдаются внезапные подкожные и внутримышечные кровоизлияния, кровотечения, обширные гематомы(Moritomo Y., Shimojo K., Miyadera K., Khalaj M., Asano Y., Kunieda T., Ogawa H., 2008). В 2009 г. учеными из Японии была найдена казуальная мутация, ассоциированная с этим заболеванием. Казуальная мутация представляет собой однонуклеотидную замену А/Т в гене F8 (http://omia.angis.org.au). Мутация AC_000187.1 (38838455..38982287) в конечном итоге приводит к замене аминокислоты лейцин на гистидин в домене C1 фактора VIII свертывания крови, что приводит к изменению структуры и функции белка (Moritomo Y., Shimojo K., MiyaderaK., Khalaj M., Asano Y., Kunieda T., Ogawa H., 2008).
4 ВЫБОР ПЛАТФОРМЫ ДЛЯ РЕАЛИЗАЦИИ ИССЛЕДОВАНИЯ. ОПИСАНИЕ ПАНЕЛИT ruSeq Bovine Parentage Sequencing Panel (Illumina, США)
Идентификация животных играет ключевую роль в государственной сельскохозяйственной политике, позволяя управлять выплатами субсидий, перемещением скота, составлением графиков испытаний и борьбы с болезнями. Достижения в области геномики крупного рогатого скота позволили использовать врожденную генетическую изменчивость для уникальной идентификации отдельных животных с помощью профилирования ДНК, во многом благодаря тому, что было получено в области генотипирования человека за последние
20 лет. Тест на ДНК-профилирование, основанный на маркерах биаллельных однонуклеотидных полиморфизмах (SNP), обеспечивает значительные преимущества по сравнению с текущими отраслевыми тестами на основе стандартных коротких тандемных повторов (STR), его легче анализировать и интерпретировать.
Выявление и регистрация скота и контроль его перемещения является важной частью сельскохозяйственной политики национальных правительств. Такие схемы лежат в основе борьбы с болезнями, управления грантами и субсидиями, обеспечения гигиены пищевых продуктов и безопасности, все это облегчает отзыв продукции при необходимости.
В результате этих преимуществ, а также в ответ на основные проблемы со здоровьем животных, такие как BSE (губчатая энцефалопатия) и ящур, которые влияют на домашний скот, производителей и потребителей, во многих странах развитого мира приняли национальные базы данных, основанные на пронумерованных ушных бирках, для регистрации личности и перемещений крупного рогатого скота (Buick W., 2004;Houston R., 2001).
Глобализация торговли также усилила аргументы в пользу улучшения отслеживания животных. Современные потребители, сталкивающиеся с расширением выбора из нескольких источников, могут также столкнуться с повышенными рисками в результате повышенной вероятности химического (атогенного) загрязнения пищевых продуктов (Caporale V., Giovannini A., Di Francesco C., Calistri P., 2001;McKean J.D., 2001). Такие кризисы могут поставить под угрозу экономическое благополучие агропродовольственных отраслей, а также повлиять на здоровье и доверие потребителей. Кризис БФБ 1990-х гг. наглядно продемонстрировал это, и показал, что действия одного государства могут негативно повлиять на общественное здоровье других (McGrann J., Wiseman H., 2001).
В свете потенциальных опасностей, о которых говорилось выше, Европейский союз (ЕС) принял Директиву Совета 92/102/EEC, в которой говорится, что все коровы в государствах-членах должны быть идентифицированы с помощью ушной бирки с уникальным идентификационным кодом (Ammendrup S., Fussel A.E., 2001).Более расширенные правила Совета 1760/2000 (Regulation (EC) № 1760/2000, 2000) и ст. 18 правила 178/2002 (Council Regulation (EC) № 178/2002, 2002) устанавливают необходимость для государств-членов контролировать регистрацию и отслеживание крупного рогатого скота через компьютеризированную базу данных, основанную на системе с двумя ушными бирками. Эти расширенные правила отслеживаемости также распространяются на продукты, полученные от животного после убоя, гарантируя возможность отследить партию мяса вплоть до происхождения животного с помощью маркировки на тушах, отрубах и упаковке. Эти правила были разработаны для обеспечения того, чтобы полная прослеживаемость животных и мяса была «установлена на всех этапах производства, обработки и распределения».
Дальнейшая разработка схем меток может включать использование электронных идентификационных устройств, таких как метки радиочастотной идентификации (RFID), рубцовые болюсы и инъекционные транспондеры, которые автоматизируют считывание идентификационных данных животных, тем самым уменьшая ошибки перевода (Ribo O., Korn C., Meloni U., Cropper M., De Winne P., Cuypers M., 2001).
Недавний отчет ЕС об использовании электронной идентификации в агропродовольственной промышленности (проект IDEA – IDentification Electronique des Animaux; http://idea.jrc.it/), хотя и приветствовал способность таких систем улучшать управление сельским хозяйством, тем не менее подтвердил, что предпочтительный вариант – ушные бирки RFID – все еще страдает от той же случайной потери меток и проблем с мошеннической перестановкой, которыми страдают традиционные схемы (Report From The Commission To The Council And The European Parliament, 2005).
Неправильная идентификация животных в результате потери метки имеет серьезные эпидемиологические последствия и проблемы с трекингом, которые могут привести к дорогостоящим последствиям для производителей. Степень потерь метки и отрицательное влияние этого на способность восстановить правильный идентификатор были определены в недавнем исследовании на активно размножаемых буйволах, которое показало, что среднее время сохранения ушной метки составляет 272 дня (Fosgate G.T., Adesiyun A.A., Hird D.W., 2006). Аналогичным образом, недостатки в маркировке мяса на скотобойнях и в торговых точках приводят к потере коррекции между номерами партий и образцов. В недавнем исследовании с использованием типирования ДНК было показано, что 2% случайно выбранных образцов из меченых тушек в скотобойне не соответствовали профилям животных, от которых они якобы исходили. Этот показатель увеличивался до 3%, когда отбор проб проводился в торговой точке (Capoferri R., Bongioni G., Galli A., Aleandri R., 2006).
Корень этих проблем в обычных и электронных системах мечения/маркировки возникает из-за их зависимости от методов, с помощью которых отслеживают устройства, прикрепленные к животным и их продуктам, но не самих животных или продуктов. Тем не менее, профилирование ДНК, которое использует неизменные биологические свойства отдельных животных для получения уникального идентификатора, предлагает потенциальное решение для научной проверки идентичности животных (Pettitt R.G., 2001). В настоящее время не существует технологии, позволяющей считывать профили ДНК в режиме реального времени, в отличие от меток и ярлыков. Это ограничивает использование профилирования по ДНК в качестве основного идентификатора животных и производных пищевых продуктов. Тем не менее, несмотря на эти ограничения, профилирование по ДНК можно эффективно использовать в ретроспективных аудитах для проверки идентичности и качества меток для обеспечения существующих технологий отслеживания мяса (Cunningham E.P., Meghen C.M. , 2001; Pettitt R.G., 2001; Raspor P., 2004). Дополнительное преимущество проверки происхождения на основе ДНК делает ее мощным методом проверки информации из базы данных по национальным стадам.
4.1 ДНК-маркеры и ДНК-профилирование
Уровень полиморфной изменчивости, наблюдаемый для бычьих коротких тандемных повторов (STR), позволяет использовать относительно немного локусов для идентификации крупного рогатого скота и определения его происхождения (Glowatzki-Mullis M. L., Gaillard C., Wigger G., Fries R., 1995; Heyen D. W., Beever J. E., Da Y., Evert R. E., Green C., Bates S. R., Ziegle J. S., Lewin H. A., 1997).
Несколько хорошо определенных панелей STR для крупного рогатого скота имеются в продаже. Одна такая 11-маркерная панель была одобрена Международным обществом генетики животных (ISAG) для использования племенными сообществами для регистрации племенных быков, телок и их потомства.
Одиночные нуклеотидные полиморфизмы (SNP) представляют собой гораздо более простую форму вариации ДНК, чем микросателлиты, включая изменение одного нуклеотида в одной позиции генетического кода. Это отсутствие разнообразия делает маркеры SNP менее информативными, чем микросателлиты.
В результате, одиночные SNP нельзя использовать для профилирования индивидуумов.Тем не менее, генотипирование нескольких SNP может решить эту проблему (Werner F. A. O., Durstewitz G., Habermann F. A., Thaller G., Kramer W., Kollers S., Buitkamp J., Georges M., Brem G., Mosner J., Fries R., 2004).
Генотипирование с использованием SNP также имеет явные преимущества перед генотипированием с помощью STR. Из-за своего меньшего размера они менее подвержены мутациям в гаметах,и поэтому не имеют проблемы потери идентичности при смене поколений, которые могут влиять на анализ с использованием STR, поскольку они мутируют между поколениями (Werner F. A. O., Durstewitz G., Habermann F.A., Thaller G., Kramer W., Kollers S., Buitkamp J., Georges M., Brem G., Mosner J., Fries R., 2004). SNP также являются более надежными при их интерпретации/анализе по сравнению с STR (Krawczak M., 1999), и они могут быть генотипированы с помощью различных методов с высокой пропускной способностью на различных платформах, многие из которых могут быть автоматизированы с экономией при масштабировании (Kruglyak L., 1997). С появлением постоянно улучшающихся технологий генотипирования (Kim S., Misra A., 2007) в последнее время стало привлекательным создание системы профилирования ДНК на основе SNP для идентификации крупного рогатого скота. Для этой цели недавно были собраны две панели SNP (Heaton M. P., Harhay G. P., Bennett G. L., Stone R. T., Grosse W. M., Casas E., Keele J. W., Smith T. P. L., Chitkon-McKown C. G., Laegreid W. W., 2002; Werner F. A. O., Durstewitz G., Habermann F.A., Thaller G., Kramer W., Kollers S., Buitkamp J., Georges M., Brem G., Mosner J., Fries R., 2004).
TruSeq Bovine Parentage Sequencing Panel – это ценное решение для тестирования родства для нескольких пород мясного и молочного скота. В данном анализе предлагается больше информации в одном анализе, чем в одном только тесте родства, благодаря чему сервисные лаборатории могут использовать панель секвенирования TruSeq Bovine для получения более информированных рекомендаций по управлению стадом.
4.2 Преимущества
Расширенное содержание повышает ценность –панель включает в себя все рекомендуемые материалы от Международного общества генетики животных (ISAG), а также связанные с заболеваниями и экономически важные признаки.
Надежный анализ лимитирует затраты – интеллектуальный дизайн контента, высокая точность и надежность исключают необходимость в дорогостоящем многократном или повторном тестировании.
Интуитивно понятное программное обеспечение упрощает анализ интерпретации данных – программное обеспечение автоматически преобразует результаты секвенирования в генетический профиль без необходимости экспертизы в области биоинформатики.
Хотя микросателлиты или короткие тандемные повторы (STR) являлись предпочтительными генетическими маркерами для контроля происхождения
у крупного рогатого скота, мировая индустрия переходит к методам на основе однонуклеотидных полиморфизмов – SNP (ISAG cattle core and additional SNP panel 2013). SNP обладают рядом преимуществ (Allen A. R. [et al.], 2010; Fernández M.E. [et al.], 2013; Schütz E., Brenig B., 2015):
- низкая частота мутаций между поколениями;
- надежная интерпретация данных;
- совместимость с автоматизированным, высокопроизводительным
анализом; - подходит для стандартизированного представления результатов генотипирования.
В панели TruSeq Bovine Parentage используется проверенная технология секвенирования следующего поколения Illumina (NGS), обеспечивающая точные результаты генотипирования для определения происхождения на основе SNP. Оптимизированный рабочий процесс, включая подготовку библиотеки посредством анализа данных, повышает эффективность. Высокая точностьи надежность уменьшают необходимость повторного тестирования, помогая лимитировать расходы. В панели TruSeq Bovine объединены SNP для определения происхождения и добавлено генотипирование биологически значимых признаков в едином тесте.
Разработанная учеными Illumina в соответствии с рекомендациями ISAG, панель секвенирования коров TruSeq Bovine содержит 263 гена. Они охватывают весь рекомендуемый ISAG контент и дополнительные экономически ценные и связанные с заболеванием маркеры (таблица 4).
4.3 Панель SNP, используемая для оценки происхождения
Международное общество генетики животных (ISAG) создало набор однонуклеотидных полиморфизмов (SNP) для тестирования происхождения (родства) крупного рогатого скота – Bos taurus, который следует использовать на международном уровне, чтобы сделать результаты сопоставимыми между лабораториями. Панель состоит из 100 основных SNP и дополнительного набора из 100 маркеров (CMMPT 2012). SNP в основной панели были отобраны преимущественно на основе данных по европейским тауринным породам и, таким образом, могут не быть идеальными для установления родства в родословно родственных породах (Lachance J., Tishkoff S. A. , 2013; Strucken E., Gudex B., Ferdosi M., Lee H., Song K., Gibson J, Kelly M., Piper E., Porto-Neto L., Lee S. H., Gondro C., 2014). Для решения этой проблемы
в ISAG была предложена дополнительная маркерная панель для увеличения мощности исключения в индиковых и синтетических породах, и эти породы были добавлены в сравнительные тесты общества (http://www.isag.us/
comptest.asp?autotry=true&ULnotkn=true).
Таблица 5 – Содержимое панели секвенирования TruSeq Bovine
| Описание | Число SNP |
| SNP, используемые для оценки происхождения | |
| Основная панель SNP для оценки происхождения согласно ISAG (ISAGCoreSNPTargets) |
100 |
| Дополнительная панель SNP для оценки происхождения согласно ISAG (ISAG Additional SNP Targets) | 100 |
| Вариантные мишени, ассоциированные с генетическими нарушениями/заболеваниями |
|
| Пренатальные/перинатальные смертельные заболевания (HH1, HH3, HH4, MH1 и т. д.) | 12 |
| Постнатальные смертельные заболевания (цитруллинемия, врожденная мышечная дистония, кардиомиопатия, миоклонус и т. д.) |
17 |
| Нелетальные патологии, ухудшающие состояние (синдром Марфана, сращение пальцев, протопорфирия, гемофилия A и т. д.) |
19 |
| Вариантные мишени, ассоциированные с экономически ценными признаками |
|
| Мужская фертильность | 1 |
| Высота в холке и внешний вид | 4 |
| Качество мяса | 4 |
| Качество молока | 6 |
| Общее количество SNP/вариантных мишеней | 263 |
4.4 SNP, ассоциированные с генетическими нарушениями/заболеваниями
Пренатальная/перинатальная смертность
Аборты, происходящие во время поздней беременности, приводят к значительным экономическим потерям. Оценка стоимости аборта для производителя варьировалась от 90 до 1900 долл. США (De Vries A., 2006; Hovingh E., 2009; Peter A.T., 2000) в зависимости от времени аборта, различий в прогнозируемой производительности коров, а также решениях о разведении и замене. Для голштинской породы известно несколько рецессивных патологических аномалий, связанных с гибелью и абортом плода, и отдельных локусов, которые снижают жизнеспособность эмбрионов или раннее развитие плода у крупного рогатого скота. Одной из распространенных генетических аномалий, вызывающих аборт у коров голштинской породы, является сложный порок позвоночника – CVM (Agerholm J.S., Bendixen C., Andersen O., Arnbjerg J., 2001). CVM вызывает пороки развития во время средней и поздней беременности, хотя некоторые беременности достигают срока и приводят к мертворождению.
Недавно генотипирование сотен тысяч животных в популярных молочных породах США с использованием панелей однонуклеотидного полиморфизма (SNP) по всему геному дало возможность найти области генома с несбалансированным H-W равновесием. Отсутствие ожидаемых гомозиготных гаплотипов в геномной области может быть связано с пагубными последствиями для развития плода и может вызвать аборт и мертворождение у голштинского крупного рогатого скота (Glusman G., Cox H.C., Roach J.C., 2014; VanRaden P.M., Olson K.M., Null D.J., Hutchison J.L., 2011)].В 2011 г. три летальных гаплотипа, влияющих на развитие плода у крупного рогатого скота голштинской породы, были идентифицированы и локализованы на бычьих хромосомах 5 (HH1),
1 (HH2) и 8 (HH3) (VanRaden P.M., Olson K.M., Null D.J., Hutchison J.L., 2011). Два года спустя во всем мире было зарегистрировано 14 дополнительных летальных гаплотипов (HH4–HH17) у крупного рогатого скота голштинской породы, и тем временем некоторые из них были разрешены на молекулярном уровне, то есть HH1 (APAF1) и HH3 (SMC2), HH4 (GART) и HH5 (TFB1M).
Большинство рецессивных генов, связанных со снижением фертильности
и потерями беременности у крупного рогатого скота, весьма трудно обнаружить, и они передаются без обнаружения, поэтому они не включены в список факторов, ведущих к абортам. HH1 приводит к абортам в течение всего периода беременности, но HH3 приводит к потере эмбриона вскоре после зачатия (VanRaden P.M., O’Connell J.R., Wiggans G.R., Weigel K.A., 2011). В случае
с HH1,потеря фертильности на 34, 51 и 63 % связана с этим гаплотипом и происходит через 60, 100 и 140 дней после оплодотворения, соответственно. Для HH2 – 56% связаны с этим гаплотипом и происходят через 60 дней после оплодотворения и 94% – через 100 дней. Для HH3 потерей фертильности на
93% связана с этим гаплотипом и происходят через 60 дней после оплодотворения (Norman H. D., Miller R. H., Wright J. R., Hutchison J. L., Olson K. M., 2012).
HH1 был картирован в бычьей хромосоме 5 (BTA5), на 58–66Mb (сборка генома UMD 3.0). Используя секвенирование всего генома быка Arlinda Chief из фермы Pawnee Farm (родился в 1962 г. и был одним из самых плодовитых быков в истории разведения голштинов) и трех его сыновей, Адамс с соавторами в 2016 г. идентифицировали причинную нонсенс-мутацию (p.Q579X) в факторе 1, активирующем апоптотическую протеазу (APAF1) в HH1 (Adams H.A., Sonstegard T.S., VanRaden P.M., Null D.J., Van Tassell C.P., Larkin D.M., Lewin H.A., 2016). Предполагается, что эта мутация отрезает 670 аминокислот (53,7%) в белке APAF1, которые включают домен WD40 – критический для межбелковых взаимодействий. Белок, кодируемый APAF1, является центральным элементом апоптотического каскада, опосредованного цитохромом С (Apweiler R., Bairoch A., Wu C.H., Barker W.C., Boeckmann B., Ferro S., Gasteiger E., Huang H., Lopez R., Magrane M., Martin M.J., Natale D.A., O’Donovan C., Redaschi N., Yeh L.S., 2004), и напрямую связан с нарушениями развития и нейродегенеративными заболеваниями (Blake J.A., Bult C.J., Kadin J. A., Richardson J. E., Eppig J. T., 2011; Honarpour N., Gilbert S. L., Lahn B. T.,Wang X., Herz J., 2001). Экспрессия APAF1 во время мышиного развития начинается на ранних стадиях в различных эмбриональных тканях и имеет важное значение для развития центральной нервной системы. Гомозиготный по нокаутному аллелю гена APAF1 у мышей приводит к эмбриональной летальности
к 16,5-му дню, а у APAF1-дефицитных мышей обнаруживается чрезмерный рост головного мозга и черепно-лицевые пороки развития (Honarpour N., Gilbert S.L., Lahn B.., Wang X., Herz J., 2001; Müller M., Berger J., Gersdorff N., Cecconi F., Herken R., Quondamatteo F., 2005).
Гомозиготность по этому аллелю приводит к самопроизвольному аборту
и, следовательно, к снижению фертильности у быков-носителей, если они спариваются с коровами-носителями, потому что функциональный пептид APAF1 необходим для развития эмбрионов. По оценкам, спонтанные аборты, вызванные этой мутацией во всем мире, за последние 35 лет составили 525000, что составляет около 420 млн долл. убытков. После генотипирования 246773 голштинов было обнаружено, что 5299 коров являлись гетерозиготами по APAF1, и не было обнаружено гомозиготных коров по этой мутации, поэтому частота носителей мутации APAF1 составила 2,1% (Adams H.A., Sonstegard T.S., VanRaden P.M., Null D.J., Van Tassell C.P., Larkin D.M., Lewin H.A., 2016).
HH2. В 2014 г. МакКлюр с соавторами уточнили картирование гаплотипа HH2 на BTA1 с 94860836 до 96553339 (UMD3.1) (McClure M.C., Bickhart D., Null D., Vanraden P., Xu L., Wiggans G., Liu G., Schroeder S., Glasscock J., Armstrong J., Cole J.B., Van Tassell C.P., Sonstegard T.S., 2014). В обширном исследовании, включающем захват экзома и секвенирование следующего поколения, МакКлюр с соавторами не смогли обнаружить какой-либо потенциально причинный вариант для гаплотипа HH2. Эффекты фертильности для HH2 были в значительной степени подтверждены путем сравнения нормальных показателей зачатия для голштинов (31%) с частотой спаривания гетерозиготных быков с дочерями гетерозиготных быков (VanRaden P.M., Olson K.M., Null D.J., Hutchison J.L., 2011). Показатели зачатия носителей HH2 были ниже среднего. Большинство потерь эмбрионов для HH2 происходило до 100-го дня беременности (VanRaden P.M., Olson K.M., Null D.J., Hutchison J.L., 2011).Частота мертворождения для HH2 была невысока, но все-таки незначительно выше обычной.Бык-основатель гаплотипа HH2 был прослежен по происхождению до отца по имени Willowholme Mark Anthony (McClure M.C., Bickhart D., Null D., Vanraden P., Xu L., Wiggans G., Liu G., Schroeder S., Glasscock J., Armstrong J., Cole J.B., Van Tassell C.P., Sonstegard T.S., 2014).
HH3.В своей статье от 2014 г. МакКлюр с соавторами также уточнили картирование гаплотипа HH3 на BTA8 с 95,057,877 до 95,468,310 (UMD3.1) (McClure M. C., Bickhart D., Null D., Vanraden P., Xu L., Wiggans G., Liu G., Schroeder S., Glasscock J., Armstrong J., Cole J. B., Van Tassell C. P., Sonstegard T. S., 2014).Кроме того, в своей статье Детуайлер с совторами заявили, что в проекте, включающем 1000 бычьих геномов, в качестве носителя гаплотипа HH3 был идентифицирован один бык (Daetwyler H. D., Capitan A., Pausch H., Stothard P., van Binsbergen R., Brøndum R. F., Liao X., Djari A., Rodriguez S. C., Grohs C., Esquerré D., Bouchez O., Rossignol M. N., Klopp C., Rocha D., Fritz S., Eggen A., Bowman P. J., Coote D., Chamberlain A. J., Anderson C., Van Tassell C. P., Hulsegge I., Goddard M. E., Guldbrandtsen B., Lund M. S., Veerkamp R. F., Boichard D. A., Fries R., Hayes B. J., 2014). С использованием методик экзомного захвата и секвенирования следующего поколения, МакКлюр с соавторами установили, что данная мутация представляла SNP-замену (T/C) в 24 экзоне гена структурной сохранности хромосом 2 (SMC2). Для подтверждения этого, мутация была генотипирована путем секвенирования панели геномов 10 известных носителей HH3; все они были гетерозиготными по мутации, подтверждая связь между областью HH3 и аллелем g.95410507C. Из-за жизненно важной роли SMC2 в репарации ДНК и конденсации хромосом во время клеточного деления, эта мутация вызывает ненейтральную и непереносимую заменув НТФ-азном домене кодируемого белка из-за смены аминокислоты с фенилаланина на серин.
Кроме того, 5606 голштинских особей были генотипированы по мутации T>C с использованием стандартизированного метода Illumina BeadChip, и не было выявлено ни одного индивида с генотипом CC, что подтверждает гипотезу, что эта мутация вызывает эмбриональную летальность. Более того, частота зачатия была ниже, чем частота зачатия у здоровых голштинов (31%), при спаривании гетерозиготных быков HH3 с дочерями гетерозиготных быков. Большинство потерь зачатия для HH3 происходило до 60 дней (VanRaden P.M., Olson K.M., Null D.J., Hutchison J.L., 2011).Бык-основатель для HH3 был прослежен до производителей по имени Glendell Arlinda Chief и Gray View Skyliner (McClure M.C., Bickhart D., Null D., Vanraden P., Xu L., Wiggans G., Liu G., Schroeder S., Glasscock J., Armstrong J., Cole J.B., Van Tassell C.P., Sonstegard T.S., 2014).
HH4.Фритц с соавторами в 2013 г. локализовали HH4 на BTA1 в области 1,9–3,3 Мб (сборка генома UMD 3.1) и предоставили значительные доказательства возможной причинной мутации в гене GART, который кодирует глицинамид рибонуклеотидтрансформазу, что привело к p.N290T (Fritz S., Capitan A., Djari A., Rodriguez S.C., Barbat A., Baur A., Grohs C., Weiss B., Boussaha M., Esquerré D., Klopp C., Rocha D., Boichard D., 2013). Было предсказано, что две мутации, связанные с HH4, приводят к патологии: трансверсия А-С в положении g.1277227A.C и переход G-A в положении g.2490314G.A на BTA1. Первая из них приводит к замене аспарагина в предполагаемом сайте связывания марганца треонином (p.N290T) в белке GART. Аспарагин-290 полностью консервативен среди эукариот, что доказывает ключевую роль этой аминокислоты
в функционировании GART. Кроме того, GART жизненно важен для биосинтеза пуринов de novo, которые являются важными элементами ДНК и РНК. Поэтому, ожидается, что потеря функции GART приведет к гибели эмбриона на ранних стадиях эмбриональной жизни. Эти данные убедительно подтверждают потенциальную роль мутации в GART (p.N290T) в снижении фертильности, наблюдаемой при спаривании между носителями HH4 и дочерями носителей HH4 (Fritz S., Capitan A., Djari A., Rodriguez S.C., Barbat A., Baur A., Grohs C., Weiss B., Boussaha M., Esquerré D., Klopp C., Rocha D., Boichard D., 2013).Вторая мутация – g.2490314G.A – приводит к замене цистеина на тирозин в остатке 13 гомолога A белка кинетохоры MIS18 (S. pombe) (MIS18A p.C13Y) (Fritz S., Capitan A., Djari A., Rodriguez S.C., Barbat A., Baur A., Grohs C., Weiss B., Boussaha M., Esquerré D., Klopp C., Rocha D., Boichard D., 2013).Хотя гомозиготный по нокаутному аллелю MIS18A является летальным на стадии эмбриона у мышей (Kim I.S., Lee M., Park K.C., Jeon Y., Park J.H., Hwang E.J., Jeon T.I., Ko S., Lee H., Baek S.H., Kim K.I., 2012), и хотя эта мутация, как было предсказано, является вредной в соответствии с SIFT и Polyphen для функции белка человека, менее вероятно, что эта мутация отвечает за данный фенотип, поскольку остаток 13 и соседняя аминокислотная последовательность имеют слабую консервативность у плацентарных млекопитающих (Fritz S., Capitan A., Djari A., Rodriguez S.C., Barbat A., Baur A., Grohs C., Weiss B., Boussaha M., Esquerré D., Klopp C., Rocha D., Boichard D., 2013).
Генотипирование 72 производителей-быков, представляющих все гаплотипы с частотой выше 1%, выявило, что мутация g.1277227A.C была связана только с гаплотипом HH4, тогда как мутация g.2490314G.A могла быть связана с другими гаплотипами. Последующее генотипирование четырех животных, которые были составными гетерозиготами по гаплотипам, связанным
с g.2490314G.A, подтвердило их гомозиготность и определенно исключило эту кандидатурную мутацию.
HH5.С использованием стратегии, аналогичной стратегии ванРадена
и его соавторов(VanRaden P.M., O’Connell J.R., Wiggans G.R., Weigel K.A., 2011), Купером с соавторами был выделен гаплотип HH5, связанный со сниженной рождаемостью, который находится на 92350052–93910957 п.н. на BTA9 (Cole J. B., VanRaden P. M., Null D. J., Hutchison J. L., Cooper T. A., Hubbard S. M., 2015; Cooper T.A., Wiggans G.R., Null D.J., Hutchison J.L., 2013).Шульц с соавторами определили вероятную причину этого гаплотипа – мутацию в виде делеции 138kb, охватывающей от 93233 до 93371 kb на BTA9, содержащую только диметиладенозинтрансферазу 1 (TFB1M) (Schütz E., Wehrhahn C., Wanjek M., Bortfeld R., Wemheuer W.E., Beck J., Brenig B., 2016). Края делеции фланкированы бычьими длинными вкрапленными ядерными элементами Bov-B (вышеделеции) и L1ME3 (ниже делеции), что позволяет предположить, что гомологичная рекомбинация ответственна за это событие. TFB1M необходима для синтеза и функционирования малой рибосомальной субъединицы митохондрий. Связь этой делеции с данным гаплотипом подтверждается тем фактом, что гомозиготные мыши, нокаутированные по TFB1M, нежизнеспособны
и гибнут на стадии эмбриона. Летальность мышей HH5 – TFB1M-/- демонстрирует эмбриональную гибель на 8,5 день (Metodiev M.D., Lesko N., Park C.B., Camara Y., Shi Y., Wibom R., Hultenby K., Gustafsson C.M., Larsson N.G., 2009).
Кроме того, клеточный нокаут подтвердил серьезное летальное воздействие на клетки млекопитающих вследствие полной потери трансляции белка
в митохондриях (Metodiev M.D., Lesko N., Park C.B., Camara Y., Shi Y., Wibom R., Hultenby K., Gustafsson C.M., Larsson N.G., 2009). Шульц с соавторамипроверили имеет ли делеция TFB1M ко-доминантный эффект у крупного рогатого скота-носителя in vivo, для этого соотношение митохондриальной ДНК
к ядерной ДНК было определено с помощью ddPCR в ДНК, выделенной из лейкоцитов у случайным образом выбранных представителей крупного рогатого скота. По данному параметру не наблюдалось существенной разницы между носителями и диким типом, что предполагает рецессивный эффект, который согласуется с фенотипом животных-носителей, у которых не наблюдается каких-либо заметных отклонений. Учитывая тот факт, что никакой другой ген не находится в делетированном участке, вместе с вышеупомянутыми данными
и высокой сегрегацией по данным HH5, эти результаты могут служить доказательством того, что эта делеция является причиной HH5 (Schütz E., Wehrhahn C., Wanjek M., Bortfeld R., Wemheuer W.E., Beck J., Brenig B., 2016).Бык-основатель HH5 восходит к Thornlea Texal Supreme, родившемуся в 1957 г. Частота гетерозиготных носителей составляет примерно 4–5% в европейской
и североамериканской фризской популяции голштинов, и приводит к преждевременному прерыванию беременности до 60-го дня беременности (Schütz E., Wehrhahn C., Wanjek M., Bortfeld R., Wemheuer W.E., Beck J., Brenig B., 2016).
Частое использование определенных производителей и их потомков в современном скотоводстве несет риск появления генетических нарушений в популяции в течение короткого периода времени. Было показано, что после выявления причинной мутации генотипирование очень эффективно устраняет патологических носителей в популяции. За последнее время с использованием большого массива данных по SNP у коров голштинской породы были обнаружены несколько гаплотипов, связанных с летальными фенотипами, и для некоторых из них были определены гены, вызывающие данные гаплотипы. Одной из эффективных стратегий в случае определенных рецессивных мутаций является обнаружение носителей с целью их исключения из размножающейся популяции или применении различных стратегий спаривания для контроля распространения нежелательных аллелей внутри популяции или сохранения их частот на низких уровнях.
5 РАЗРАБОТКА ПРОГРАММНЫХ ПРОДУКТОВ
5.1 Информационная система «Анализ аллельной структуры поголовья и генетической идентификации
сельскохозяйственных животных»
Разработанная нами информационная система (ИС) предназначена для анализа аллельной структуры поголовья и генетической идентификации сельскохозяйственных животных, и реализована в виде веб-приложения с базой данных.
Основным модулем ИС является конструктор генов, который позволяет определить категории и возможные значения для генов, предоставляя универсальный инструмент для создания любого исследуемого набора. Для гена реализован следующий набор полей: наименование, код, описание, тип значения, номер хромосомы, позиция, плюс/минус цепь, признак, OMIA, значение – A, C, G, T, T|A, none (рисунок 8).
Рисунок 8 – Редактор справочника генов
Категории генов могут быть определены произвольно, в зависимости от задачи. Формирование справочника категорий производится с помощью редактора категорий (рисунок 9).
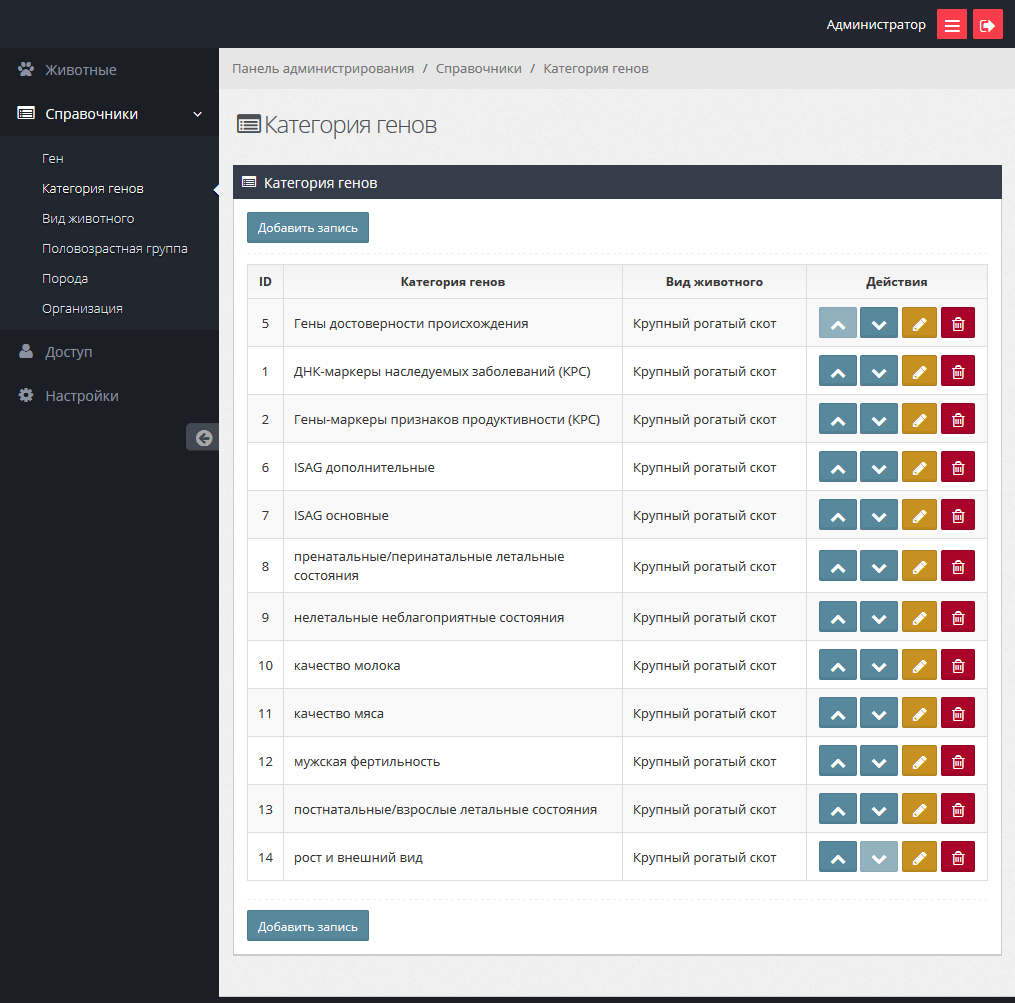
Рисунок 9 – Справочник категорий
Для каждого животного предусмотрено ведение карточки, содержащей основные идентификационные сведения, данные о происхождении и принадлежности. Конструктор позволяет определить категории и возможные значения для генов, предоставляя универсальный инструмент для создания любого исследуемого набора.
Для идентификации животного и определения его принадлежности используется справочник организаций, позволяющий задать различные характеристики: наименование, страна, регион и др. (рисунок 10).
Для всех полей (если применимо) используется валидация данных и автодополнение при вводе.
В информационной системе используется управление пользователями на основе ролей. Основной функционал модуля позволяет выполнять активацию/деактивацию администратором, смену пароля, назначения роли администратором. Предусмотрены две основные роли: «Оператор» – ввод данных животных для своей организации (выбрана по умолчанию в поле «Принадлежность») и «Администратор» – ввод/редактирование справочников, ввод данных животных для любой организации, ввод генетической информации, управление пользователями, печать генетического паспорта.
Рисунок 10 – Формирование карточки организации
Простой и дружественный интерфейс обеспечивает возможность ввода данных исследований в карточку животного (рисунок 11). Предусмотрено формирование генетического паспорта на основе выбранных данных в формате pdf.
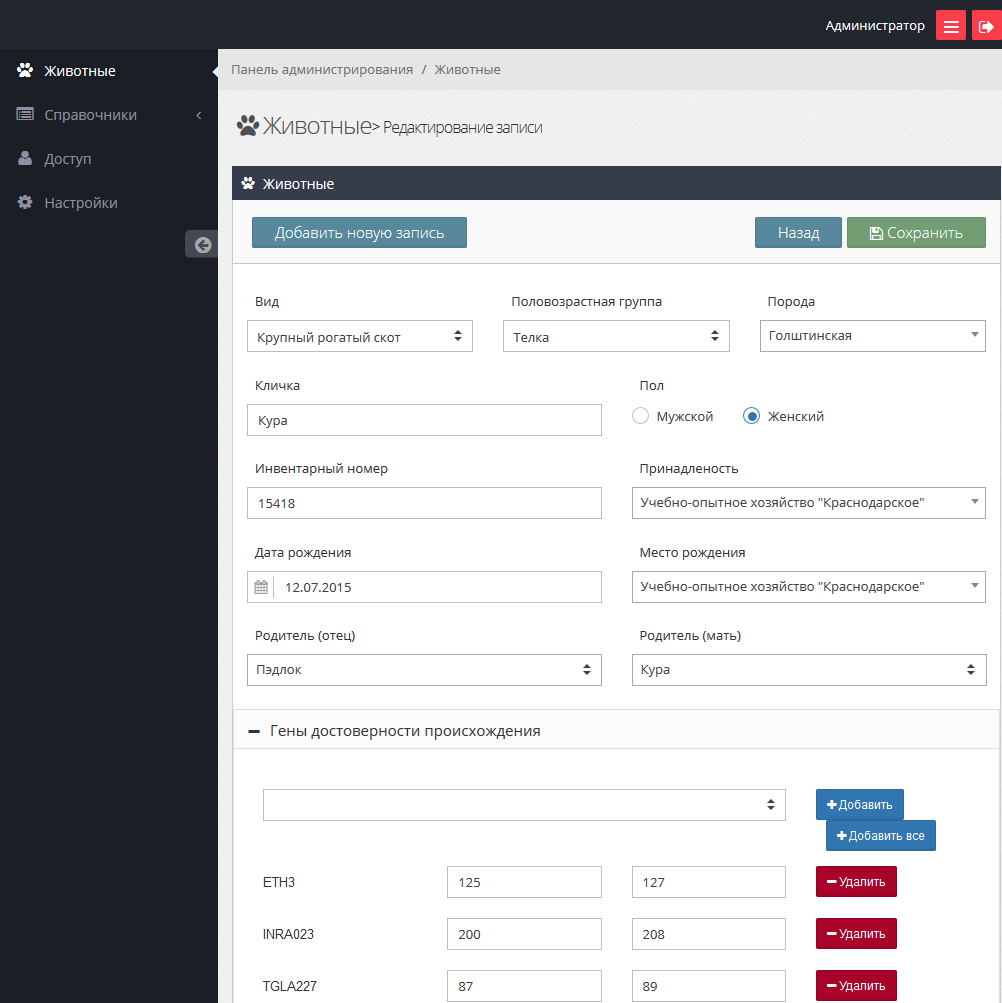 Рисунок 11– Карточка животного
Рисунок 11– Карточка животного
Паспорт формируется в формате pdf и содержит следующие блоки.
1. Блок организации (наименование организации, в которой проводится анализ, адрес, телефон).
2. Блок заголовка (Генетический паспорт животного / DNA GENOTYPE CERTIFICATE).
3. Блок лаборатории (наименование лаборатории, выдавшей паспорт).
4. Блок организации принадлежности (название и адрес организации, которой принадлежит животное).
5. Блок исследуемого животного (порода, возраст, пол, инвентарный номер/кличка, дата рождения).
6. Таблица достоверности происхождения (маркер, аллель 1, аллель 2).
7. Таблица генетических аномалий (код гена, значение).
8. Таблица генов маркеров признаков продуктивности (код гена, значение).
9. Блок описания оборудования, на котором проводился анализ.
10. Блок подписи (дата проведения анализа, ответственный исполнитель, Ф. И. О. исполнителя, его данные – ученая степень, звание, если применимо).
Информационная система реализована на языке программирования
PHP 7.1, использует систему управления базой данных MySQL 5.5.
5.2 Программные продукты: Covers(«Ковер») и JustAppendCows
Прибор для высокопроизводительного секвенирования MiSeq (Illumina, США) за один цикл работы (запуск) с использованием панели TruSeq Bovine Parentage Sequencing Panel Illumina способен обработать до 96 образцов ДНК-материала. В итоге, на выходе прибор генерирует CSV-файл объемом примерно 1,03 Мб, который включает себя 25440 строк данных, в случае обработки
96 образцов генетического материала– библиотеки полногеномной ДНК КРС. Соответственно, время обработки такого объема информации вручную будет нерационально велико, особенно, если необходимо получить на выходе сразу несколько документов, к примеру, и индивидуальные паспорта, и 2D-диаграмму (ковер) для всего стада.
Данная работа занимает слишком много человеко-часов и является экономически невыгодной, так как для того, чтобы обрабатывать предложенный объем данных в сутки (время берется с учетом максимальной суточной производительности работы прибора в размере 96 образцов), потребуется около 30 специально обученных работников.
Таким образом, в целях рационализации экономических затрат и человеческих ресурсов, возникает необходимость в разработке комплекса программного обеспечения, которое сможет выполнять необходимые аналитические задачи
и автоматизировать документооборот компании.
Что касается основных целей, которые предъявляются будущему программному продукту, то их можно выделить в следующий список:
- мультисистемность;
- высокая скорость работы;
- гибкость настройки;
- удобство для пользователя.
Требование мультисистемности выражается в том, что программный комплекс должен запускаться на электронно-вычислительных машинах с любой современной операционной системой и при условии того, что ЭВМ может не обладать большой вычислительной мощностью. Для этого на перспективу поставлены задачи по переносу пакета ПО в web-интерфейс с целью обеспечить вышеперечисленные требования. Выбор такого подхода обусловлен тем, что для работы с wed-интерфейсом нет необходимости установки на вычислительную машину каких-либо дополнительных программ, пакетов или сред визуализации, так как браузер присутствует в списке базового оборудования в любой современной операционной системе, будь то системы семейства Windows или же ОС, в основе которых лежит Linux-подобная система, к примеру,MacOS.
Высокая скорость работы необходима для того, чтобы не возникало очереди при обработке данных, которая может повлечь простои в работе всей фирмы, и соответственно, негативно отразиться на ее экономической картине.
Гибкость настройки необходима для того, чтобы пользователям не было необходимости изучать структуру программы и саму среду программирования. То есть пользователи, у которых есть доступ к файлам, могут изменять, к примеру, структуру паспорта или ковра, просто меняя исходный Excel файл, при учете согласования этих изменений с программистом, таким образом, им нет необходимости разбираться в структуре программы и каким-либо образом изменять исходный код, что также поможет избежать ненужных задержек при ежедневной эксплуатации программного пакета.
Ну,и наконец, продукт должен быть удобен для рядового пользователя,
с таким условием, чтобы человеку не пришлось специально переобучаться для работы с ним. Это достигается, опять же, за счет введения в будущем web-интерфейса с выверенным UI дизайном, который позволит выполнять необходимые цели уже после получаса инструктажа.
Теперь остановимся на задачах с точки зрения программиста.
Для начала, при разработке программы необходимо учитывать то, что ей необходимо взаимодействовать с пакетами MSOffice, а именно с MicrosoftExcel, так как шаблоны как для паспорта, так и для ковра создавались именно
в MSExcel и имеют соответствующий формат «.xlsx».
Также, одним из требований было то, что результирующие файлы, получаемые в итоге, также должны быть «.xlsx»и «.pdf», что также означает, что программный код должен быть написан с учетом поддержки MSExcel.
Еще одним требованием является то, что программа не должна слишком перегружать ресурсы вычислительной машины промежуточными данными, так как предполагается ее дальнейшее использование в Web-интерфейсе, где перегрузка хостинга данными будет вести к неминуемому снижению скорости работы программы или даже непредвиденным ошибкам переполнения выделенной памяти. Для этого было принято решение сохранять промежуточные данные также в формате «.xlsx» c последующим удалением их после целевой отработки.
В качестве следующего требования выделялось то, что программному обеспечению предстоит работать с «.csv»форматом, для которого необходимы специфические библиотеки, таким образом, был выбран язык программирования Python 3.6 с библиотекой Pandas, так как данная библиотека оптимально подходит как для работы с «.csv»форматом, так и для обработки данных, получаемых из таких файлов посредством встроенной в нее структуры DataFrame. Данная структура представляет собой особый вид массивов, отличительной чертой которого является его автоматическая нумерация по строкам и озаглавливание по столбцам.
Данные особенности также крайне необходимы, когда дело доходит до занесения результирующихDataFrame-массивов на лист рабочей книги Excel.
Для обеспечения гибкости настройки файлы-шаблоны всегда доступны
к редактированию пользователям, у которых есть на это доступ, так как программа при каждом своем запуске заново инициализирует шаблон, что позволяет изменять результирующие файлы согласно требованиям практически мгновенно при необходимости и без прямого участия программиста.
Для обеспечения удобства использования уже на данном этапе применен вывод некоторой информации о ходе работы программы в консоль, что позволяет пользователю отслеживать прогресс обработки данных, а также пользователь в консоли сам может вводить определенные данные, такие как порода коровы, ее возраст и т. д., что позволяет ему лишний раз не редактировать результирующий файл, и соответственно, экономить время.
Нами был проведен анализ рынка программного обеспечения, распространяемого открыто по свободной лицензии, ограниченной лицензии и иным формам приобретения. Производился поиск программы или программного пакета, которые удовлетворяли бы цели и задачи, выдвигаемые к ним, такие как мультисистемность, высокая скорость работы, гибкость настройки. Также немаловажным являлось то, что софт предполагалось использовать в узкоспециализированной предметной области и, поэтому он должен быть разработан с учетом требований данной отрасли.
В результате анализа рынка было принято решение создать оригинальный (самостоятельно разработанный) комплекс программ, так как адекватные альтернативы попросту отсутствуют в свободном доступе или же не подходят под требования, предъявляемые программам.
Также немаловажным фактором является то, что в команде работают вместе специалисты в области генной инженерии и программирования, что позволяет обеспечить диалог, в результате которого программный продукт пишется
в соответствии с учетом всех требований генной инженерии. Также тесный диалог между программистом и специалистами в области генотипирования обеспечивает более глубокое понимание целей и задач, выдвигаемых программному продукту. Так как программист находится непосредственно внутри группы разработчиков, он может изменять и добавлять функциональность программ в соответствии с требованиями, избегая взаимодействия между предприятием-заказчиком и предприятием-исполнителем, тем самым сокращая время исполнения поставленных задач.
На данный момент в лаборатории имеются две программы.
Первая программа имеет рабочее название «JustAppendCows» и находится в полностью рабочем состоянии, ее актуальная версия 2.0. Данный программный продукт отвечает за автоматизированное создание паспортов на каждое конкретное животное в стаде.
Вторая программа имеет рабочее название «Covers» и также находится
в полностью рабочем состоянии, ее актуальная версия 1.1. Данный программный продукт отвечает за анализ генетических показателей каждой отдельной особи в стаде и сведения полученной информации в общую наглядную таблицу, цветную 2D-диаграмму, так называемый «ковер».
Для разработки комплекта программного обеспечения была выбрана среда Python актуальной версии 3.6.
Python – современный язык программирования, имеющий возможность работать на всех актуальных операционных системах для персональных компьютеров. Язык программирования Python находится в стадии разработки чуть более 20 лет. На сегодняшний день параллельно активно используется две версии языка – более старая версия 2 и современная версия (третья). Версия 2 более не развивается, но до сих пор еще используется, поскольку очень много программного обеспечения и библиотек разработано именно для этой версии.
Между версиями есть существенная несовместимость, в том числе в синтаксисе команд ввода-вывода (программа на языке Python 2-й версии может не работать в 3-й версии и наоборот), но в целом они очень похожи. В случае
с разработкой описанных выше продуктов было принято решение использовать именно третью версию, она является актуальной, и соответственно, будет обновляться и поддерживаться разработчиком, а также только с ней работают актуальные версии необходимых в разработке библиотек.
Python – современный универсальный интерпретируемый язык программирования. Особенностями его являются кроссплатформенность, современность, наличие обширной встроенной библиотеки и множества сторонних библиотек.
Одной из ключевых особенностей выбора данного языка являлась его гибкость. С одной стороны, Python является объектно-ориентированным языком. Вся мощь объектно-ориентированного подхода доступна при разработке на Python.С другой стороны, язык Python не вынуждает программиста всегда использовать ООП.
Ключевой особенностью, из-за которой был выбран именно этот язык, является то, что код выполняется (интерпретируется) из исходного текста, без предварительного перевода в машинный код. Код, написанный на компилируемых языках, типа C++, сначала переводятся в машинный код.
Принято считать, что интерпретируемые языки программирования работают медленнее, чем компилируемые – из-за того, что трансляция осуществляется не сразу. Но отладка и написание кода происходит быстрее, потому что не нужно ожидать, пока компилятор закончит работать.
Python работает как интерпретируемый, его код перед выполнением компилируется. Многие его компоненты работают на полной скорости компьютера, поскольку написаны они на языке С.
Данная особенность крайне важна, так как планируется дальнейший перевод программного комплекса на web-платформу, где интерпретируемость является необходимым условием.
В качестве дистрибутива было принято решение об использовании пакета Anaconda.
Anaconda – дистрибутив языка программирования Python, в который входит набор популярных свободных библиотек, позволяющих, в том числе, производит работу с данными. Основная особенность Anaconda– поставка единым согласованным комплектом наиболее необходимых библиотек и модулей (таких как NumPy, SciPy, Pandas и др.) с разрешением возникающих зависимостей и конфликтов, которые могут возникать при одиночной установке. По состоянию на 2019 г. Anacondaсодержит более 1,5 тыс. модулей.
Основной особенностью дистрибутива является оригинальный менеджер разрешения зависимостей conda с графическим интерфейсом Anaconda Navigator, которые позволяет отказаться от стандартных менеджеров пакетов для Python, таких, как pip, к примеру. Дистрибутив скачивается единожды,
и вся последующая конфигурация, в том числе установка дополнительных модулей, возможна без подключения к сети Интернет. Кроме того, обеспечивается возможность ведения нескольких изолированных сред с раздельным разрешением версионных зависимостей в каждой.
В качестве среды разработки была выбрана IDESpyder, так как она имеет ряд преимуществ и удобна для проектирования и написания программного кода.
Spyder (ранее Pydee) – свободная среда разработки для Python. Она входит в стандартный пакет Anaconda, является кроссплатформенной и доступна для Windows, Linux и MacOS. Название Spyder расшифровывается как Scientific PYthon Development EnviRonment, что в переводе означает «научная среда разработки для Python». Данная среда разработки создавалась для научных расчетов, и в этой сфере она действительно удобна.
Spyder является высокопроизводительной и дружелюбной по отношению
к разработчику интерактивной средой разработки для языка программирования Python с продвинутыми возможностями редактирования, интерактивного тестирования, отладки и интроспекции.
Также Spyderпредставляет из себя часть модуля spyderlib для Python, являющегося совокупностью мощных виджетов на PyQt4, таких как редактор кода, консоль Python (при необходимости доступная для встраивания в приложения), редактор списков/кортежей и массивов Pandas.
При разработке пакета программного обеспечения, используются следующие библиотеки: Pandas, Openpyxl, os, Datetame.
Выбор данного перечня библиотек обусловлен задачами, которые предъявляются к программам. Перечисленные библиотеки, с точки зрения разработчика, наиболее оптимально подходят для их выполнения. Ниже приведена краткая характеристика каждой из них и указаны особенности, которые послужили причиной их выбора.
Библиотека os включает в себя множество функций для работы с операционной системой, причем их поведение, как правило, не зависит от ОС, что позволяет сделать программу универсальной и переносимой. В данном случае библиотека os отвечает за работу с директориями, а конкретно за удаление при необходимости временных файлов, в которых хранятся неупорядоченные данные по каждому конкретному образцу.
Библиотека DateTime представляет собой классы для обработки времени
и даты различными способами. Эта библиотека выполняет задачу получения актуальной даты, которая в дальнейшем интегрируется в документ с целью уменьшить ручную работу, выполняемую пользователем.
Pandas является программной библиотекой на языке Python для обработки и анализа данных. Работа Pandas с данными строится поверх библиотеки NumPy, являющейся инструментом более низкого уровня. Предоставляет специальные структуры данных, такие как DataFrame, и операции для манипулирования ими. Корректное использование библиотеки Pandas вкупе с другими использованными библиотеками обеспечивается пакетом Anaconda.
Основной областью применения данной библиотеки является обеспечение работы в рамках языка программирования Python в целях сбора (очистки), анализа и моделирования данных, без необходимости перехода на более ориентированные для данных целей языки, такие как R и Octave.
В данной библиотеке одной из ключевых особенностей является использование объектов DataFrame, необходимых для манипулирования индексированными массивами двумерных данных. В концепции рассматриваемой программы объекты DataFrame играют ведущую роль, в связи с этим использование библиотеки Pandas является необходимым.
Также данная библиотека позволяет реализовать удобную и мало затратную с точки зрения ресурсов обработку и редактирование DataFrame-объектов, что позволяет быстро и качественно интегрировать данные объекты на Excel-листы.
Не стоит забывать, что данная библиотека также помогает преобразовывать CSV-данные в DataFrame массивы, и обеспечивает дальнейшую корректную работу с ними.
Библиотека Openpyxl предназначена для того, чтобы обеспечивать возможность чтения и редактирования файлов Excel-форматов, таких как «.xlsx», «.xlsm», «.xltx»и др.
Целью обеих программ является создание результирующих документов
в формате «.xlsx»по заранее созданному шаблону, таким образом, для выполнения этих целей была выбрана именно библиотека Openpyxl, так как она наиболее точно подходила для реализации поставленной задачи.
Данная библиотека отвечает за загрузку в память программы файла-шаблона и последующее заполнение шаблона необходимыми данными, чтобы на выходе получать необходимые результирующие документы, будь то генетический паспорт или ковер (2D-диаграмма) для всего стада.
Блок-схемы программы Just Append Cows
На рисунках 12–14 представлена полная блок-схема программы, которая реализует обработку данных для создания паспортов для каждого определенного животного. Данная блок схема включает в себя описание вспомогательных
и главной функций.
Рассмотрим первую вспомогательную функцию report. Данная функция необходима для корректного заполнения результирующего документа для каждой конкретной особи. На вход функции поступают три DataFrame (на схеме df1, df2, df3), которые являются массивами данных блоков SNP для каждой конкретной особи. Так, df1 отвечает за блок 200 SNP«Родство и достоверность происхождения», df2 – за блок 53 SNP«Генетически наследуемые заболевания», df3 – за блок 12 SNP«Экономически значимые признаки». Данные DataFrame уже являются упорядоченными и отсортированными согласно спецификации, так как формирование паспорта происходит на финальной стадии работы программы. Также на вход в функцию поступает переменная idat, которая является идентификатором очередного образца, для которого формируется документ.
При вызове функции report происходит инициализация функции, далее
в переменную shablrep заносится путь, по которому программа определяет директорию, в которой хранится шаблон паспорта, после этого в переменной filenamer описывается соответствующая папка, в которой хранятся все паспорта для стада и формируется имя файла для каждой конкретной особи. После этого происходит инициализация переменной wb с помощью библиотеки openpyxl. Данная переменная является интерпретированной для работы в PythonExcel-книгой, а в переменной ws указывается на каком именно листе будет производится работа с этой самой книгой. Далее идут три цикла занесения данных на лист. Они подобны друг другу, опишем первый, в остальных меняются лишь некоторые переменные и их значения.
Для начала переменной d1 присваиваются значения df1-массива с указанием того, что эти значения будут занесены на лист. Далее следует цикл, суть которого заключается в том, что мы берем все строки со стартовой (в данном случае это двадцать девятая строка, согласно шаблона), далее мы заносим в эту строку в каждый столбец со стартового (в данном случае это второй столбец, согласно шаблона) и заносим поочередно в каждую ячейку строки значения, где номер прохода соответствует номеру строки в переменной d1. Так, к примеру, в двадцать девятую строку заносится первая строка массива, в тридцатую вторая и так до окончания массива.
Как уже говорилось выше, два следующих цикла идентичны, меняются только значения (d2 присваиваются значения df2, стартовая строка у второго блока 234-ая, d3 присваиваются значения df3, стартовая строка у третьего блока 292-ая).
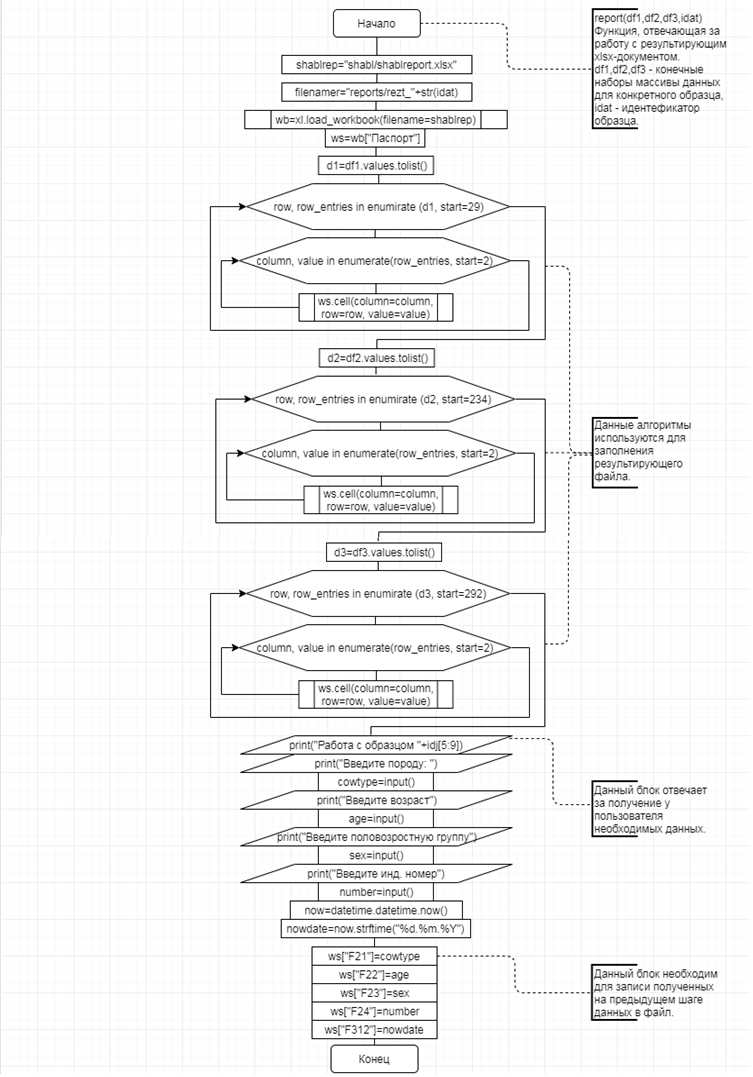
Рисунок 12 – Блок-схема реализации первой вспомогательной функции report
Далее следует блок, который отвечает за запрашивание у пользователя через консоль необходимых для окончательного формирования паспорта данных, таких как порода, возраст, половозрастная группа, идентификационный номер и занесения их в паспорт. Для начала в консоли пишется номер очередного образца, для которого происходит создание паспорта, а потом последовательно запрашиваются при помощи консоли необходимые данные. Также
в данном блоке определяется дата формирования паспорта, она автоматически получается из системного времени с помощью библиотеки datetime. Полученные данные заносятся в соответствующие переменные: cowtype, sex, age, number, nowdate.
После этого следует блок записи этих данных на Excel-лист в тех местах, где это необходимо согласно требованиям.
На этом функция report завершает свою работу.
Рассмотрим работу вспомогательной функции sort, которая отвечает за сортировку данных каждого конкретного образца по блокам, при этом в каждом блоке происходит распределение по порядку, который необходим для занесения этих данных в результирующий документ.
Функция получает на вход идентификатор очередного образца (inpdata). Далее происходит инициализация переменных shabl1, shabl2, shabl3, в которые заносятся пути расположения шаблонов, согласно которым происходит сортировка данных. Далее происходит чтение временного файла, в котором находятся данные для очередного образца, представляющие собой массив из 265 строк в произвольном порядке, так как прибор для секвенирования заранее не упорядочивает их. Данные из временного файла заносятся в переменную dfdata. После этого происходит чтение файлов шаблонов – dfshabl1, dfshabl2, dfshabl3 для первого, второго и третьего блоков соответственно.
После получения всех необходимых данных, в переменные a, b, d заносятся размеры блоков (200, 53 и 12 строк соответственно), а в переменную b заносится размер всего массива данных (265 строк). После этого можно приступать к циклам сортировки.
Все три алгоритма сортировки работают аналогичным способом, поэтому будет описан принцип работы алгоритма для сортировки и заполнения массива первого шаблона, в остальных циклах меняются лишь некоторые переменные.
Внешний цикл алгоритма отвечает за последовательный построчный перебор DataFrame-массива первого шаблона. Перебирается i от 0 до 264, при этом на каждом проходе переменной ind присваивается значение, соответствующее i-ому наименованию маркера первого шаблона. Внутри этого цикла происходит построчный перебор исходного массива данных, притом при каждом проходе переменной prov присваивается значение, соответствующее j-ому наименованию маркера исходного набора данных. Далее проверяется, равна ли переменная ind переменной prov, и если да, то в массив шаблона с очередным наименованием маркера вносятся значения соответствующего маркера из исходного массива данных. Цикл устроен таким образом, что на каждом очередном проходе для строки шаблона подыскивается соответствующая строка в исходном массиве, таким образом, на выходе получается DF-массив dfshabl1, который уже упорядочен, так как за основу его взят массив из шаблона, и заполнен соответствующими данными из исходного массива.
Для остальных двух циклов меняются лишь величина внешних проходов согласно размерности шаблонных массивов (вместо а подставляется c и d)
и сами шаблонные массивы (вместо dfshabl1 подставляется dfshabl2 и dfshabl3).
Далее происходит вызов функции report, суть и цели которой описаны выше, в которую отправляются полученные заполненные массивы dfshabl1, dfshabl2, dfshabl3 и идентификатор очередного образца inpdata.
Далее рассмотрим главную функцию программы. Блок-схема этой функции представлена на рисунках 13а и 13б. При запуске программы происходит инициализация данной функции, другими словами, данная функция срабатывает при запуске программы, и в ней уже происходит вызов вспомогательных функций, рассмотренных выше. В программе, отвечающей за генерацию паспортов, используются следующие библиотеки: Pandas, Openpyxl, os, Datetame.
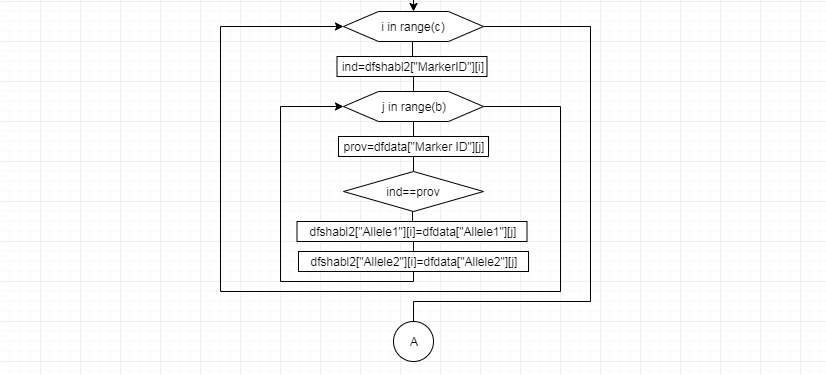
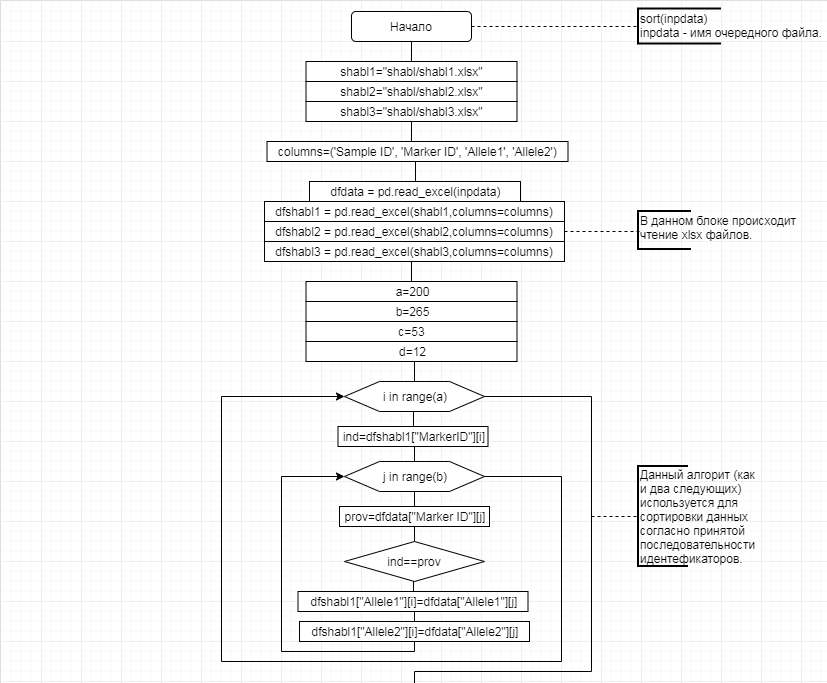
Рисунок 13а – Блок-схема главной функции программы Just Append Cows
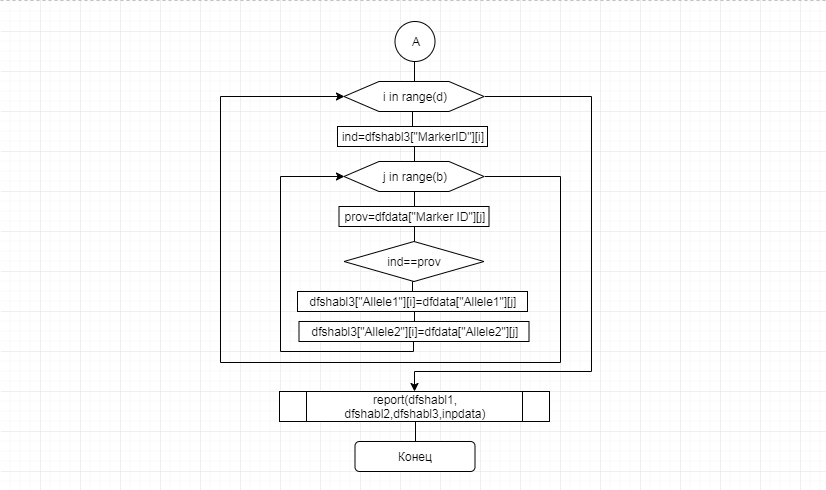
Рисунок 13б (продолжение 13а) – Блок-схема главной функции программы
Just Append Cows
Pandas – программная библиотека на языке Pythonдля обработки и анализа данных. Работа Pandas с данными строится поверх библиотеки NumPy, являющейся инструментом более низкого уровня. Предоставляет специальные структуры данных, такие как DataFrame, и операции для манипулирования ими.
Основная область применения – обеспечение работы в рамках языка программирования Python в целях сбора (очистки), анализа и моделирования данных, без необходимости перехода на более ориентированные для данных целей языки, такие, как R и Octave.
В данной библиотеке одной из ключевых особенностей является использование объектов DataFrame, необходимых для манипулирования индексированными массивами двумерных данных. В концепции рассматриваемой программы объекты DataFrame играют ведущую роль, соответственно, по этой причине использование библиотеки Pandas является необходимым.
Также данная библиотека позволяет реализовать удобную и мало затратную с точки зрения ресурсов работу с DataFrame объектами, что позволяет быстро и качественно интегрировать данные объекты на Excel-листы.
Не стоит забывать, что данная библиотека также помогает преобразовывать CSV-данные в DataFrame массивы и обеспечивает дальнейшую корректную работу с ними.
Библиотека Openpyxl необходима для того, чтобы читать и редактировать файлы Excel-форматов, таких как «.xlsx», «.xlsm»,«.xltx» и др.
Целью программы является создание результирующих документов в формате «.xlsx», причем по определенному шаблону, таким образом, для выполнения этих целей была выбрана именно библиотека Openpyxl, так как она наиболее точно подходила под выдвигаемые требования.
Данная библиотека отвечает за загрузку в память программы файла-шаблона и последующее его заполнение необходимыми данными, чтобы на выходе получить заполненный паспорт для каждого образца в соответствии с требованиями.
Библиотека os включает в себя множество функций для работы с операционной системой, причем их поведение, как правило, не зависит от ОС, что позволяет сделать программу универсальной и переносимой. В данной программе библиотека os отвечает за работу с директориями, а конкретно за удаление при необходимости временных файлов, в которых хранятся неупорядоченные данные по каждому конкретному образцу.
Библиотека DateTime представляет собой классы для обработки времени
и даты различными способами. Нас в данной библиотеке интересует именно дата, а точнее получение актуальной даты для занесения ее в определенную ячейку результирующего документа.
После инициализации главной функции и подключения необходимых библиотек, пользователю предлагается в консоли ввести имя «.csv» файла, который он получил в результате работы прибора для секвенирования. Важно заметить, что для обеспечения корректности работы программы имя файла вводится без расширения и сам файл должен находится в корневой папке с исполняемым «.py» файлом.
Далее в переменной on происходит преобразование введенного пользователем имени файла в необходимы для дальнейшей работы формат, а после этого происходит открытие файла и запись данных из него в переменную df. После этого мы имеем DataFrame массив, хранимый в переменной df, с которым уже
и будет производится дальнейшая обработка.
В переменной filename инициализируется имя первого временного файла,
в который будут занесены данные о первом образце. Далее инициализируется список filenames, который включает в себя информацию обо всех временных файлах, сгенерированных программой. В данный список заносится имя первого файла, хранимое в переменной filename.
В переменной last хранится индекс последней строки, или, другими словами, строковая размерность массива df. Далее инициализируется переменная listzn, в которую заносится пустой объект DataFrame. Данный объект будет использоваться для накопления данных о каждом очередном образце, с целью последующего занесения этих данных в соответствующий временный файл. Вначале в listzn заносится значение первой строки из переменной df. Этот шаг необходим для корректной работы цикла в дальнейшем. Далее создается переменная t, которая также необходима для корректной работы цикла.
После этого в цикле, который поочередно отрабатывает все строки массива df, происходит сортировка данных по образцам и сохранение их во временных файлах. Алгоритм сортировки в цикле построен по принципу сравнения с предыдущим (именно поэтому были манипуляции с listzn и создание переменной t). Если очередная строка массива df равна предыдущей, то эта строка заносится в массив listzn в строку с номером t, где t является счетчиком. Если же очередная строка не совпадает с предыдущей, это означает, что получена вся информация по данному образцу. При этом массив listzn сохраняется во временный файл с необходимым именем, после чего массив обнуляется и на место его первой строки заносится не совпавшая строка, таким образом, происходит формирование массива, содержащего информацию о следующем образце. Также происходит присвоение нового значения переменной filename, так как это уже будет новый временный файл с данными о следующем образце. Новое значение filename добавляется в список filenames. После завершения работы цикла записывается последний временный файл с соответствующим именем.
Далее происходит преобразование каждого временного файла с помощью функции sort, в которую поочередно передаются все файлы, которые сгенерировала программа. Имена данных файлов располагаются в списке filenames.
В конце пользователю предлагается выбрать, необходимо ли удалять временные файлы. В случае, если нет необходимости, программа завершает работу, а ином случае, программа удаляет все временные файлы из списка filenames с помощью функции remove из библиотеки os (рисунок 10).
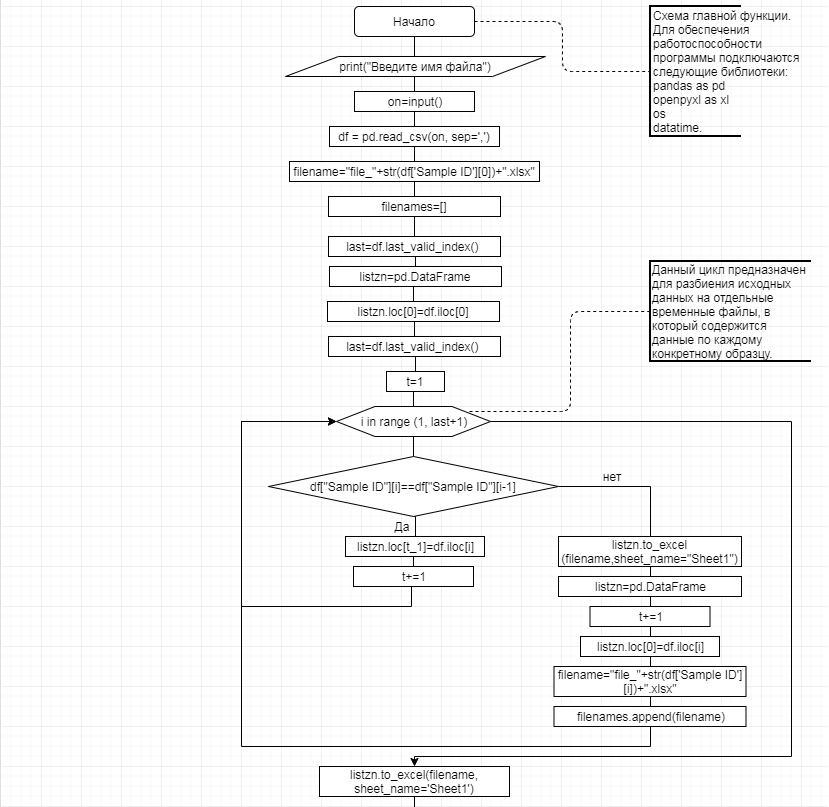
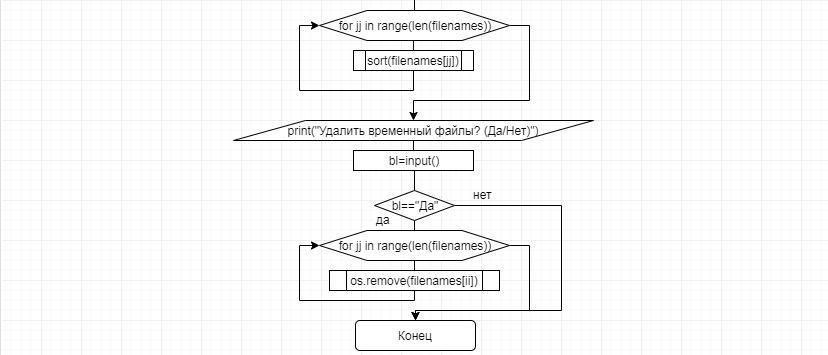
Рисунок 14– Блок-схема функций завершающих генерацию генетического
паспорта программой Just Append Cows
Блок-схемы программы Covers для генерации
цветной 2D-диаграммы («ковра»)
На рисунках 11–13 представлена полная блок-схема программы, которая реализует анализ данных для генерации 2D-диаграммы («ковра») для экспериментальных групп животных. Данная блок схема включает в себя описание вспомогательных и главной функций.
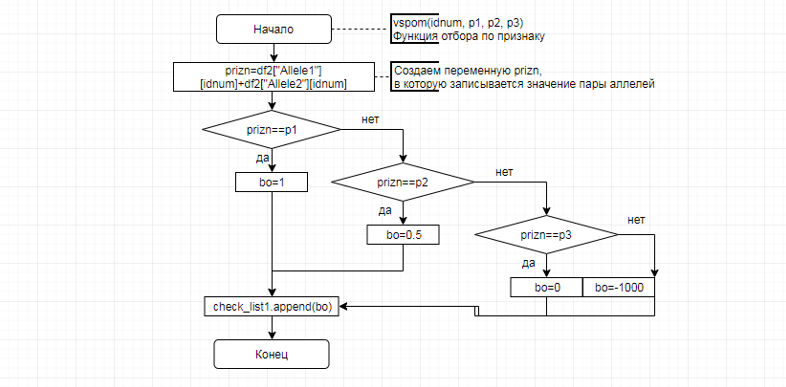
Рисунок 11 – Блок-схема реализации вспомогательной функции vspom1
Рассмотрим вспомогательную функцию vspom. Данная функция предназначения для анализа пары аллелей определенного признака, присвоения им условного коэффициента (веса) и сохранения информации о результате в список. При вызове функции в нее передается информация о номере строки, в которой располагается необходимый для анализа признак. Номер строки обозначен в функции vspom в качестве переменной idnum. Также в функцию передаются сочетания аллелей для анализа, где p1 – это оптимальное сочетание, p2 – серединное сочетание, p3 – негативное сочетание. Стоит отметить, что данная функция предназначена только для работы со вторым блоком «Генетически наследуемые заболевания», данные о котором после сортировки попадают
в DataFrame массив df2.
После инициализации функции и передачи в нее необходимых атрибутов, начинается ее работа. В начале в переменную prizn заносится значение сочетания аллелей Allele1 и Allele2 для рассматриваемого признака. Далее прописывается несколько условий. Если сочетание аллелей равно переменной p1, т. е. совпадает с оптимальным сочетанием, то переменной bo присваивается условный коэффициент оптимальности, который в данном случае равен единице.
Если сочетание аллелей не равно значению переменной p1, то проверяется, равен ли оно значению p2, т. е. совпадает ли с серединным сочетанием. Если обнаружено равенство, то переменной bo присваивается условный коэффициент оптимальности, который в данном случае равен 0,5.
Если сочетание аллелей не равно значению переменной p1 и переменной p2, то проверяется, равен ли оно значению p3, т. е. совпадает ли с негативным сочетанием. Если обнаружено равенство, то переменной bo присваивается условный коэффициент оптимальности, который в данном случае равен нулю.
В противном случае, если сочетание аллелей не равно ни одному из сочетаний, переменной bo присваивается значение «-1000», что означает, что для данного образца (или для всего стада) отсутствует условие для поиска конкретной болезни по данному признаку.
После анализа сочетания аллелей переменная bo заносится в список check_list1, в котором сохраняются все значения переменных bo для очередного образца. Список check_list1 используется для хранения аналитических коэффициентов для второго блока «Генетически наследуемые заболевания».
Рассмотрим вспомогательную функцию vspom2 (рисунок 12). Данная функция предназначена для анализа пары аллелей определенного признака, присвоения им условного коэффициента (веса) и сохранения информации о результате в список. При вызове функции в нее передается информация о номере строки, в которой располагается необходимый для анализа признак. Номер строки обозначен в функции vspom2 в качестве переменной idnum. Также
в функцию передаются сочетания аллелей для анализа, где p1 – это оптимальное сочетание, p2 – серединное сочетание, p3 – негативное сочетание. Стоит отметить, что данная функция предназначена только для работы с третьим блоком «Экономически значимые признаки», данные о котором после сортировки попадают в DataFrame массив df3.
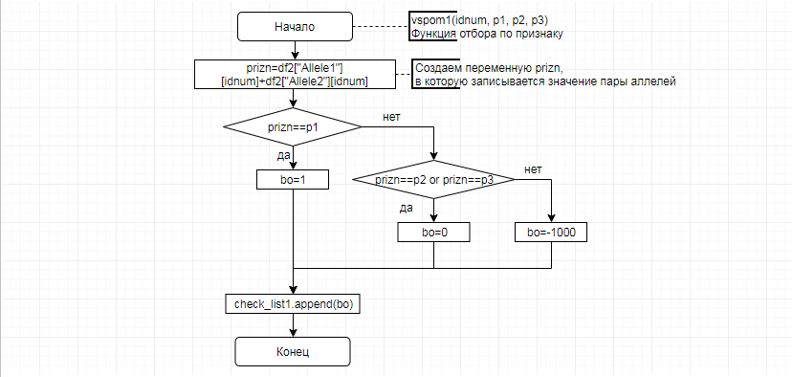
Рисунок 12 – Блок-схема реализации вспомогательной функции vspom2
После инициализации функции и передачи в нее необходимых атрибутов начинается ее работа. В начале в переменную prizn заносится значение сочетание аллелей Allele1 и Allele2 для рассматриваемого признака. Далее прописывается несколько условий. Если сочетание аллелей равно переменной p1, т. е. совпадает с оптимальным сочетанием, то переменной bo присваивается условный коэффициент оптимальности, который в данном случае равен единице.
Если сочетание аллелей не равно значению переменной p1, то проверяется, равен ли оно значению p2, т. е. совпадает ли с серединным сочетанием. Если обнаружено равенство, то переменной bo присваивается условный коэффициент оптимальности, который в данном случае равен 0,5.
Если сочетание аллелей не равно значению переменной p1 и переменной p2, то проверяется, равен ли оно значению p3, т. е. совпадает ли с негативным сочетанием. Если обнаружено равенство, то переменной bo присваивается условный коэффициент оптимальности, который в данном случае равен нулю.
В противном случае, если сочетание аллелей не равно ни одному из сочетаний, переменной bo присваивается значение «-1000», что означает, что для данного образца (или для всего стада) отсутствует условие для поиска конкретной болезни по данному признаку.
После анализа сочетания аллелей переменная bo заносится в список check_list2, в котором сохраняются все значения переменных bo для очередного образца. Список check_list2 используется для хранения аналитических коэффициентов для второго блока «Экономически значимые признаки».
Рассмотрим вспомогательную функцию vspom3 (рисунок 13). Данная функция предназначения для анализа пары аллелей определенного признака, присвоения им условного коэффициента (веса) и сохранения информации о результате в список. При вызове функции, в нее передается информация о номере строки, в которой располагается необходимый для анализа признак. Номер строки обозначен в функции vspom3 в качестве переменной idnum. Также
в функцию передаются сочетания аллелей для анализа, где p1 – это оптимальное сочетание, p2 и p3 – серединное сочетание. Стоит отметить, что данная функция предназначена только для работы с третьим блоком «Экономически значимые признаки», данные о котором после сортировки попадают в DataFrame массив df3.
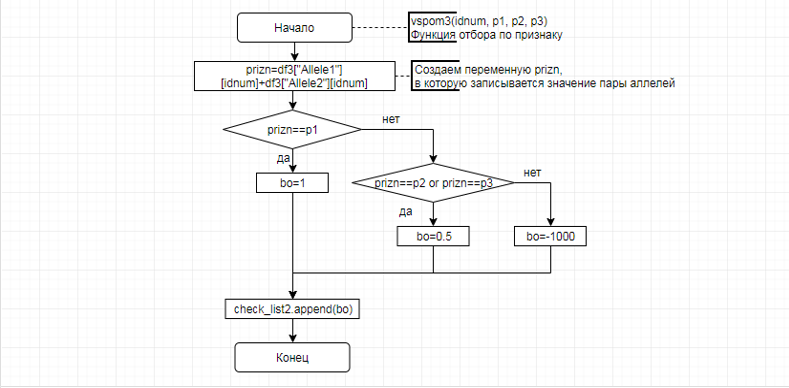
Рисунок 13 – Блок-схема реализации функции vspom3
После инициализации функции и передачи в нее необходимых атрибутов начинается ее работа. В начале в переменную prizn заносится значение сочетание аллелей Allele1 и Allele2 для рассматриваемого признака. Далее прописывается несколько условий. Если сочетание аллелей равно переменной p1, т. е. совпадает с оптимальным сочетанием, то переменной bo присваивается условный коэффициент оптимальности, который в данном случае равен единице.
Если сочетание аллелей не равно значению переменной p1, то проверяется, равен ли оно значению p2 или p3, т. е. совпадает ли с серединным сочетанием. Если обнаружено равенство, то переменной bo присваивается условный коэффициент оптимальности, который в данном случае равен 0,5.
В противном случае, если сочетание аллелей не равно ни одному из сочетаний, переменной bo присваивается значение «-1000», что означает, что для данного образца (или для всего стада) сочетания для анализа по данному признаку.
После анализа сочетания аллелей переменная bo заносится в список check_list2, в котором сохраняются все значения переменных bo для очередного образца. Список check_list2 используется для хранения аналитических коэффициентов для третьего блока «Экономически значимые признаки».
Рассмотрим функцию bol (рисунок 14). Функция предназначена для проведения анализа данных по каждому образцу и занесения полученной информации в массивы dff1 и dff2 для последующей генерации ковра для всего стада.
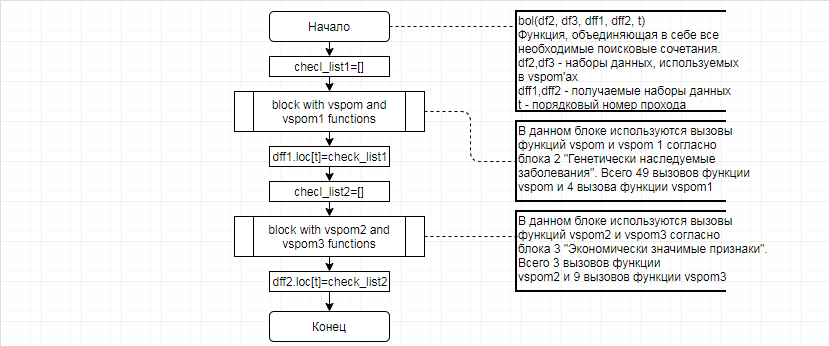
Рисунок 14 – Блок-схема реализации завершения функции bol
Функция получает на вход массивы df2 и df3, в которых содержатся данные о признаках, отсортированные в соответствии с установленным шаблоном, также в функцию передаются массивы dff1 и dff2, которые содержат в себе результаты аналитики в виде коэффициентов для всего стада, причем массив dff1 содержит информацию об анализе блока 53SNP, а dff2 – информацию об анализе блока 12SNP.
Стоит заметить, что признаки находятся в определенной последовательности, так как массив df2 и df3 уже отсортирован в соответствии с установленным шаблоном, поэтому допустимо использовать индексы строк, так как они привязаны к признакам, т. е. вне зависимости от исходного массива, содержащего информацию о стаде, в каждой строке всегда будет один и тот же заранее известный признак.
После инициализации функции и передачи в нее необходимых атрибутов она начинает свою работу. Вначале происходит очистка списка check_list1,
в который будет сохранятся результат анализа для каждой особи. Далее идет блок с вызовами функций vspom и vspom1, которые отвечают за обработку данных второго блока 53SNP. В каждую функцию vspom или vspom1 передается индекс строки, в которой находятся данные о признаке, анализ которого проводится и сочетания аллелей согласно интерпретатору. Всего происходит 49 вызовов функции vspom и четыре вызова функции vspom1, в итоге все 53 признака в блоке анализируются. После анализа список check_list1 добавляется
в итоговый массив dff1 в строку под индексом t, где t – это номер прохода (очередного образца).
Далее происходит очистка списка check_list2, в который будет сохранятся результат анализа для каждой особи. Далее идет блок с вызовами функций vspom2 и vspom3, которые отвечают за обработку данных второго блока 12SNP. В каждую функцию vspom2 или vspom3 передается индекс строки, в которой находятся данные о признаке, анализ которого проводится и сочетания аллелей согласно интерпретатору. Всего происходит три вызова функции vspom2
и девять вызовов функции vspom3, в итоге все 12 признаков в блоке анализируются. После анализа список check_list2 добавляется в итоговый массив dff2
в строку под индексом t, где t – это номер прохода (очередного образца).
После этого функция завершает свою работу.
Рассмотрим работу вспомогательной функции sort (рисунок 15), которая отвечает за сортировку данных каждого конкретного образца по блокам, при этом в каждом блоке происходит распределение по порядку, который необходим для занесения этих данных в результирующий документ.
Функция получает на вход идентификатор очередного образца (inpdata),
а также DataFrame массивы dff1, dff2, dff3, которые содержат информацию
о результатах анализа для всего стада и переменную t, содержащую информацию о номере итерации, происходящей в главной функции. Далее происходит инициализация переменных shabl2, shabl3, в которые заносятся пути расположения шаблонов, согласно которым происходит сортировка данных. Далее совершается чтение временного файла, в котором находятся данные для очередного образца, представляющие собой массив из 265 строк в произвольном порядке, так как прибор для секвенирования заранее не упорядочивает их. Данные из временного файла заносятся в переменную dfdata. После этого происходит чтение файлов шаблонов dfshabl2, dfshabl3 для второго и третьего блоков соответственно.
Далее происходит служебное дублирование переменных dff1, dff2 и t, необходимое для дальнейшей корректной работы программы на этапе вызова функции.
После получения всех необходимых данных, в переменные b, d заносятся размеры блоков (53 и 12 строк соответственно), а в переменную b заносится размер всего массива данных (265 строк). После этого можно приступать
к циклам сортировки.
Оба алгоритма сортировки работают аналогичным способом, поэтому будет описан принцип работы алгоритма для сортировки и заполнения массива второго шаблона, в остальных циклах меняются лишь некоторые переменные.
Внешний цикл алгоритма отвечает за последовательный построчный перебор DataFrame-массива первого шаблона. Перебирается i от 0 до 264, при этом на каждом проходе переменной ind присваивается значение, соответствующее i-ому наименованию маркера первого шаблона.
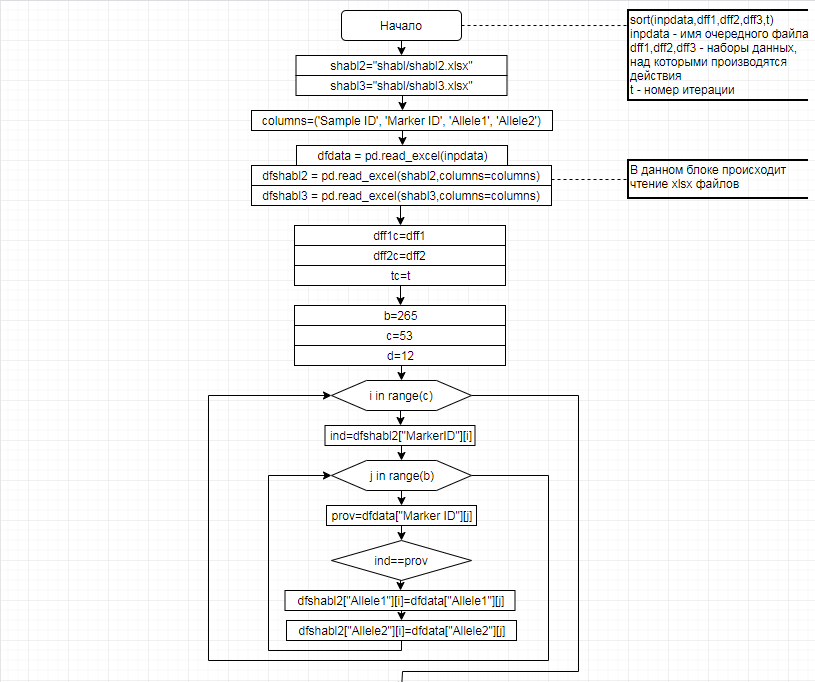
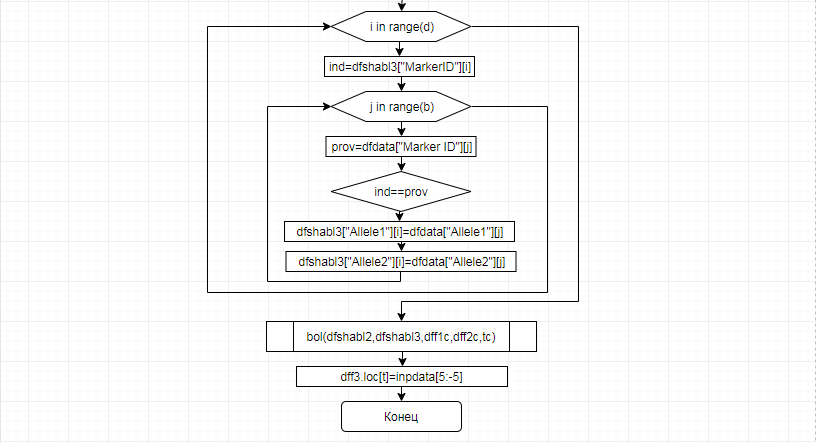
Рисунок 15 – Блок-схема реализации функции sort
Внутри этого цикла происходит построчный перебор исходного массива данных, притом при каждом проходе переменной prov присваивается значение, соответствующее j-ому наименованию маркера исходного набора данных. Далее проверяется, равна ли переменная ind переменной prov, и если да, то в массив шаблона с очередным наименованием маркера вносятся значения соответствующего маркера из исходного массива данных. Цикл устроен таким образом, что на каждом очередном проходе для строки шаблона подыскивается соответствующая строка в исходном массиве, таким образом, на выходе получается
DF-массив dfshabl2, который уже упорядочен, так как за основу его взят массив из шаблона, и заполнен соответствующими данными из исходного массива.
Для второго цикла меняются лишь величина внешних проходов согласно размерности шаблонных массивов (d вместо c) и сам шаблонный массив (вместо dfshabl2 подставляется dfshabl3).
Далее происходит вызов функции bol, суть и цели которой описаны выше,
в которую передаются полученные заполненные массивы dfshabl2, dfshabl3, результирующие массивы dff1 и dff2 и переменную t, содержащую номер итерации.
В массив dff3 заносится имя очередного образца, данный массив далее будет необходим при переносе данных ковра на Excel-лист.
Далее рассмотрим главную функцию программы. Блок-схема этой функции представлена на рисунках 16а–16в. При запуске программы происходит инициализация данной функции, другими словами, данная функция срабатывает при запуске программы, и в ней уже происходит вызов вспомогательных функций, рассмотренных выше. В программе, отвечающей за генерацию паспортов, используются следующие библиотеки: Pandas, Openpyxl, os, Datetame.
Pandas – программная библиотека на языке Python для обработки и анализа данных. Работа Pandas с данными строится поверх библиотеки NumPy, являющейся инструментом более низкого уровня. Предоставляет специальные структуры данных, такие как DataFrame, и операции для манипулирования ими. Основной областью применения библиотеки является обеспечение работы в рамках языка программирования Python в целях сбора (очистки), анализа и моделирования данных, без необходимости перехода на более ориентированные для данных целей языки, такие, как R и Octave.
В данной библиотеке одной из ключевых особенностей является использование объектов DataFrame, необходимых для манипулирования индексированными массивами двумерных данных. В концепции рассматриваемой программы объекты DataFrame играют ведущую роль, соответственно, по этой причине использование библиотеки Pandas является необходимым.
Также данная библиотека позволяет реализовать удобную и малозатратную с точки зрения ресурсов работу с DataFrame-объектами, что позволяет быстро и качественно интегрировать данные объекты на Excel-листы.
Не стоит забывать, что данная библиотека также помогает преобразовывать CSV-данные в DataFrame-массивы и обеспечивает дальнейшую корректную работу с ними.
Библиотека Openpyxl необходима для того, чтобы читать и редактировать файлы Excel-форматов, таких как «.xlsx», «.xlsm», «.xltx»и др.
Целью программы является создание результирующих документов в формате «.xlsx», причем по определенному шаблону, таким образом, для выполнения этих целей была выбрана именно библиотека Openpyxl, так как она наиболее точно подходила под выдвигаемые требования.
Данная библиотека отвечает за загрузку в память программы файла-шаблона и последующее заполнение шаблона необходимыми данными, чтобы на выходе получить заполненный паспорт для каждого образца в соответствии с требованиями.
Библиотека os включает в себя множество функций для работы с операционной системой, причем их поведение, как правило, не зависит от ОС, что позволяет сделать программу универсальной и переносимой. В данной программе библиотека os отвечает за работу с директориями, а конкретно за удаление при необходимости временных файлов, в которых хранятся неупорядоченные данные по каждому конкретному образцу.
После инициализации главной функции и подключения необходимых библиотек, создаются три пустых DataFrame-массива, которые впоследствии будут нести в себе информацию об анализе для стада в целом и использоваться для построения ковра.
После этого пользователю предлагается в консоли ввести имя «.csv»файла, который он получил в результате работы прибора для секвенирования. Важно заметить, что для обеспечения корректности работы программы имя файла вводится без расширения и сам файл должен находится в корневой папке с исполняемым «.py» файлом.
Далее в переменной on происходит преобразование введенного пользователем имени файла в необходимы для дальнейшей работы формат, а после этого происходит открытие файла и запись данных из него в переменную df.
Вследствии чего мы имеем DataFrame массив, хранимый в переменной df, с которым уже и будет производиться дальнейшая обработка.
В переменной filename инициализируется имя первого временного файла,
в который будут занесены данные о первом образце. Далее инициализируется список filenames, который включает в себя информацию обо всех временных файлах, сгенерированных программой. В данный список заносится имя первого файла, хранимое в переменной filename.
В переменной last хранится индекс последней строки, или, другими словами, строковая размерность массива df. Далее инициализируется переменная listzn, в которую заносится пустой объект DataFrame. Данный объект будет использоваться для накопления данных о каждом очередном образце, с целью последующего занесения этих данных в соответствующий временный файл. Вначале в listzn заносится значение первой строки из переменной df. Этот шаг необходим для корректной работы цикла в дальнейшем. Далее создается переменная t, которая также необходима для корректной работы цикла.
После этого в цикле, который поочередно отрабатывает все строки массива df, происходит сортировка данных по образцам и сохранение их во временных файлах. Алгоритм сортировки в цикле построен по принципу сравнения
с предыдущим (именно поэтому были манипуляции с listzn и создание переменной t). Если очередная строка массива df равна предыдущей, то эта строка заносится в массив listzn в строку с номером t_1, где t_1 является счетчиком. Если же очередная строка не совпадает с предыдущей, это означает, что получена вся информация по данному образцу. При этом массив listzn сохраняется во временный файл с необходимым именем, после чего массив обнуляется и на место его первой строки заносится не совпавшая строка, таким образом, происходит формирование массива, содержащего информацию о следующем образце. Также происходит присвоение нового значения переменной filename, так как это уже будет новый временный файл с данными о следующем образце. Новое значение filename добавляется в список filenames. После завершения работы цикла записывается последний временный файл с соответствующим именем.
Далее происходит преобразование каждого временного файла с помощью функции sort, в которую поочередно передаются все файлы, которые сгенерировала программа. Имена данных файлов располагаются в списке filenames.
После разбиения исходного массива df на временные файлы можно приступать к анализу данных. Для обеспечения вывода информации о прогрессе работы программы объявляются переменные prog и rg. В качестве счетчика объявляется переменная nmb.
Далее следует цикл, который обрабатывает поштучно каждый временный файл, вызывает функцию, анализирующую полученную информацию из этого файла, и графически выводит прогресс выполнения.
Работа алгоритма заключается в том, что он извлекает имя очередного временного файла, передает это имя, а также массивы df1, df2, df3 и значение счетчика в функцию sort, принцип работы которой описан выше. После этого
к счетчику прибавляется единица, выводится в консоль состояние прогресса анализа и удаляется очередной, уже отработанный, временный файл.
Следующим шагом работы программы является открытие шаблона ковра посредством функции openpyxl и указание листа, на который будут заносиьтся данные.
После выполнения цикла анализа в программе имеется три итоговых массива df1, df2 и df3, которые далее следует перенести на лист результирующего документа.
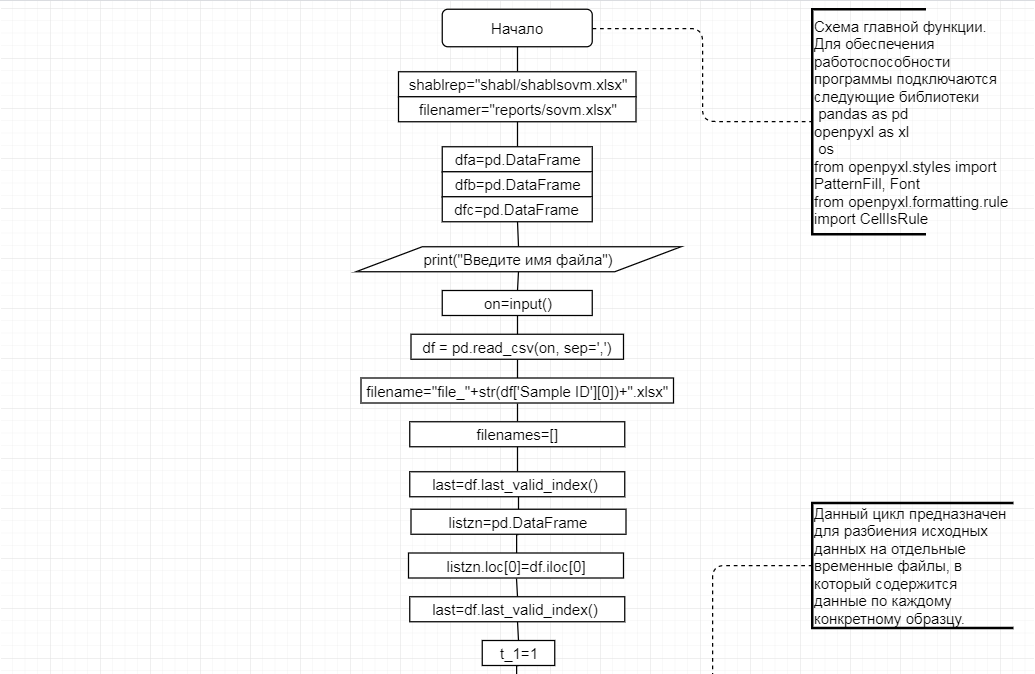
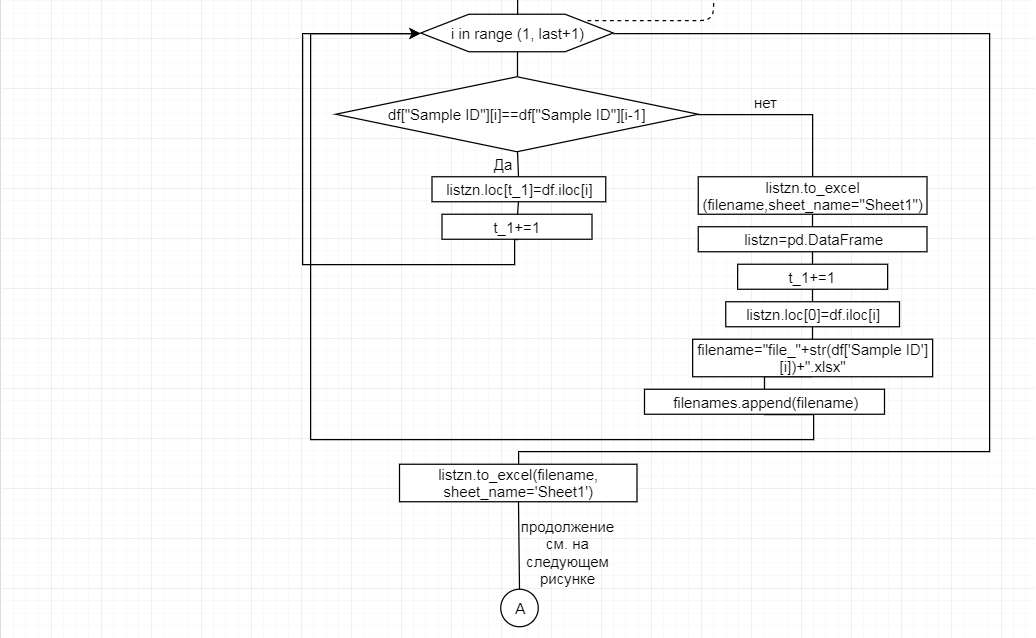
Рисунок 16а – Блок-схема реализации главной функции программы Covers
для генерации цветной 2D-диаграммы («ковра»)
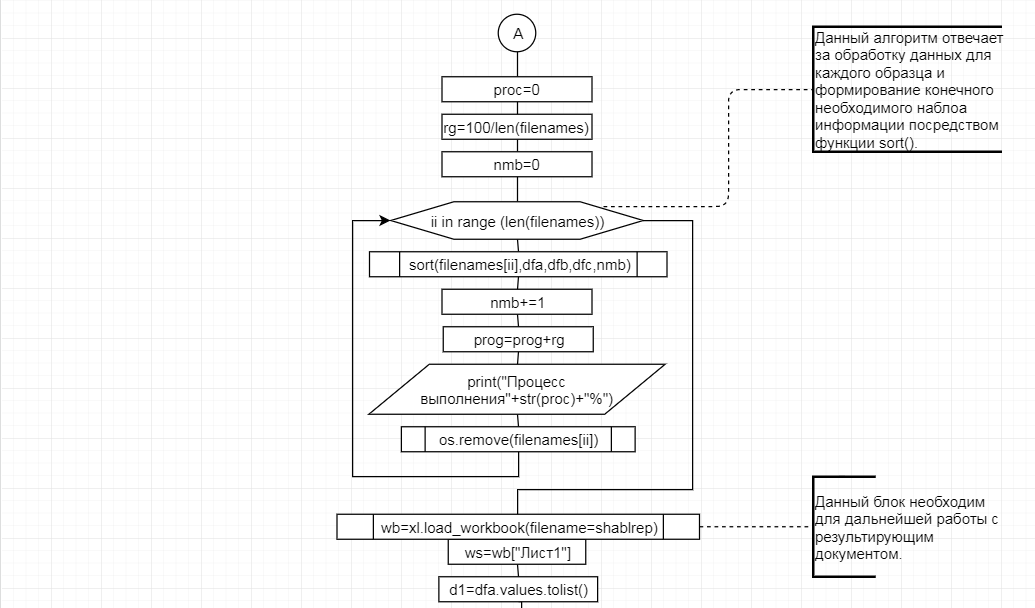
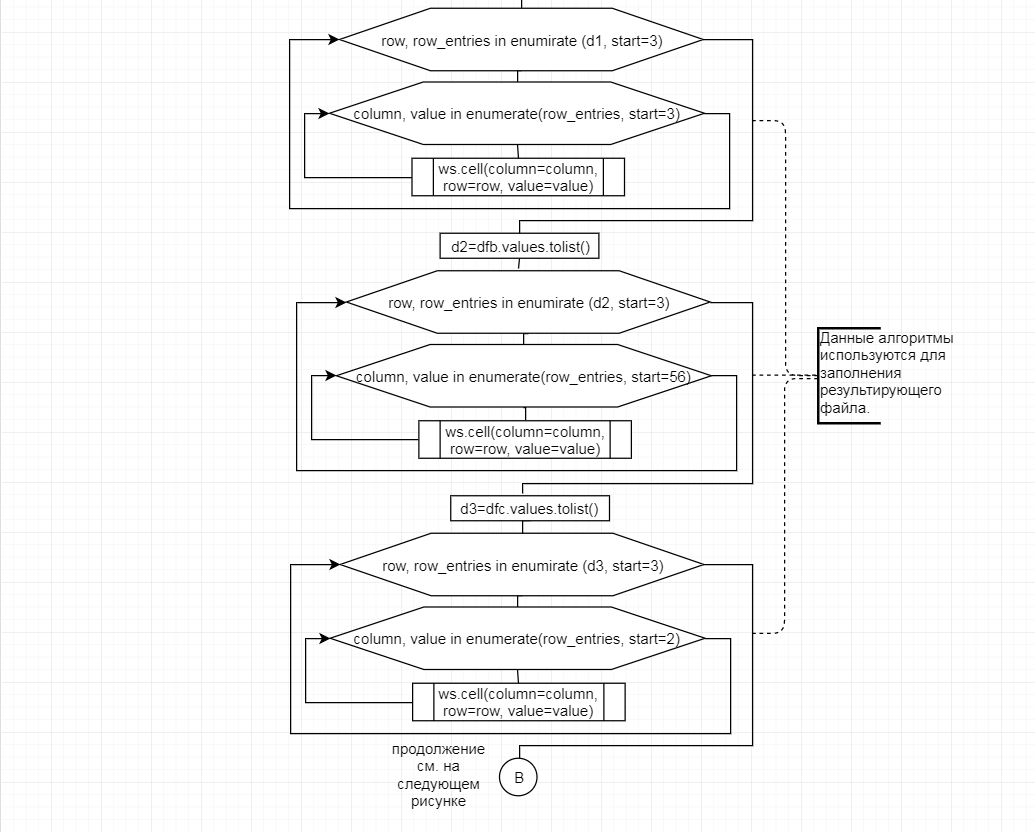
Рисунок 16б (продолжение) – Блок-схема реализации главной функции
программы Covers для генерации цветной 2D-диаграммы («ковра»)
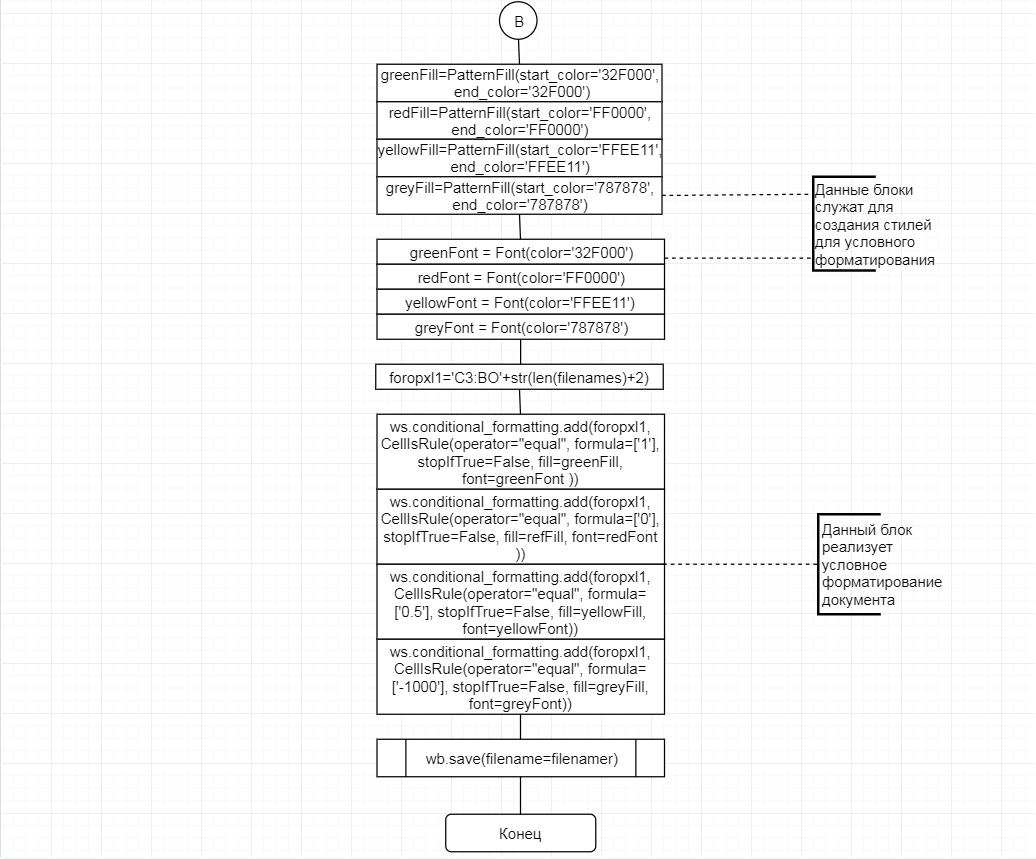
Рисунок 16в (продолжение) – Блок-схема реализации главной функции
программы Covers для генерации цветной 2D-диаграммы («ковра»)
Для этого используются три идентичных цикла, в которых изменяются лишь имена и значения некоторых переменных, опишем первый цикл.
Для начала переменной d1 присваиваются значения df1-масиива с указанием того, что эти значения будут занесены на лист. Далее из переменной d1 построчно извлекается информация, затем строки делятся на ячейки (по четыре ячейки в каждой строке) и значения этих ячеек заносятся на Excel-лист в строку, начиная со стартовой (в данном случае с третьей) и в столбец, начиная со стартового (в данном случае третий).
В остальных циклах меняется соответственно исходные массивы и переменные, в которые они загружаются для занесения (d2 для df2, d3 для df3),
а также стартовая строка для массива d2.
Далее в результирующем документе необходимо выделить строки с соответствующим значением требуемыми цветами согласно техническому заданию. Для этого в библиотеке openpyxl предусмотрены модули, позволяющие внутри программы указать стили и условия для условного форматирования.
Для этого необходимо создать стили заливки и текста, которые будут далее применяться при условном форматировании, за что и отвечают два блока создания стилей для заливки (четыре функции PatternFill) и цвета текста (четыре функции Font), в которых указываются необходимые атрибуты.
Далее указывается область, к которой будет применяться условное форматирование, причем область может быть с любым размером строк согласно исходному количеству образов, что сделано для более гибкой работы программы с разными размерами стада.
После этого применяется условное форматирование для указанной области согласно указанных стилей.
Для ячеек, где сочетание аллелей положительно, т. е. их значение равно единице, используется зеленый цвет заливки (код цвета 32F000).
Для ячеек, где сочетание аллелей отрицательно, т. е. их значение равно нулю, используется красный цвет заливки (код цвета FF0000).
Для ячеек, где сочетание аллелей нейтрально, т. е. их значение равно 0,5, используется желтый цвет заливки (код цвета FFEE11).
Для ячеек, где сочетание аллелей не определенно, используется серый цвет заливки (код цвета 787878).
После выполнения условного форматирования результирующий документ сохраняется, и программа завершает свою работу.
4.2.3 Обеспечение диалога программ Just Append Cows
и Covers с пользователем
4.2.3.1 Обеспечение диалога программы Just Append Cows
(генерация генетических паспортов)
Для обеспечения диалога с пользователем в программе предусмотрен вывод графической информации. Для начала программа запрашивает у пользователя имя файла, в котором содержится исходные результаты секвенирования для стада. Имя файла должно вводиться без расширения. В данном случае исходным будет файл с именем «group1.csv» (также предусмотрен вариант программы для работы с «.xlsx» файлами). Пример запроса имени файла представлен на рисунке 17.

Рисунок 17 – Пример запроса имени файла
Далее программа с помощью консольного интерфейса будет уведомлять пользователя о состоянии выполнения обработки данных и создания временных файлов для каждого конкретного образца (рисунок 18).

Рисунок 18– Пример уведомления пользователя о состоянии выполнения
обработки данных и создания временных файлов для каждого
конкретного образца
После разбиения исходного файла по образцам и создания временных файлов программа приступает к сортировке данных и созданию паспортов. Так как для заполнения паспорта необходимы помимо результатов секвенирования такие данные, как порода, возраст, половозрастная группа и идентификационный номер, то пользователю будет предложено ввести требуемые данные последовательно для каждого указанного образца (рисунок 19).

Рисунок 19 – Окно заполнения сопутствующих данных по животному
После генерации результирующих документов по каждому образцу пользователю будет предложено удалить временные файлы. Допустимые варианты ответа: Да, Нет (без учета регистра) (рисунок 20).
![]()
Рисунок 20 – Диалоговое окно выбора решения о удалении
или сохранении временных файлов
В конце работы программа уведомить пользователя о своем состоянии,
а также о месте расположении результирующих документов (рисунок 21).
![]()
Рисунок 21 – Финальное диалоговое окно программы Just Append Cows
4.2.3.2 Обеспечение диалога программы Covers («Ковра»)
(генерация цветной 2D-диаграммы)
Для обеспечения диалога с пользователем в программе предусмотрен вывод графической информации. Для начала программа запрашивает у пользователя имя файла, в котором содержится исходные результаты секвенирования для стада. Имя файла должно вводится без расширения. В данном случае исходным будет файл с именем group1.csv (также предусмотрен вариант программы для работы с .xlsx файлами). Пример запроса имени файла представлен на рисунке 22.

Рисунок 22 – Начальное диалоговое окно программы Covers
Далее программа с помощью консольного интерфейса будет уведомлять пользователя о состоянии выполнения обработки данных и создания временных файлов для каждого конкретного образца (рисунок 23).

Рисунок 23 – Диалоговое окно уведомления о состоянии выполнения
обработки данных и создания временных файлов для каждого
конкретного образца
После этого программа приступает к анализу полученных данных и занесению его результатов в конечный массив. Для удобства использования также предусмотрено уведомление пользователя о ходе выполнения анализа (рисунок 24).
Рисунок 24 – Диалоговое окно уведомления о ходе выполнения анализа
После заполнения результирующих массивов, происходит запись их в результирующий файл, и применяется к нему условное форматирование. После выполнения этих действий программа уведомляет пользователя о завершении своей работы, а также указывает расположение конечного файла (рисунок 25).
![]()
Рисунок 25 – Диалоговое окно уведомления о завершении своей работы,
а также указывает расположение конечного файла
4.2.3.3 Описание исходного Excel-файла для программы Covers
С целью унификации результирующих документов было принято решение разработать общий шаблон для генерации 2D-диаграмм («генетического ковра»), в котором бы содержалась информация о результатах анализа всего стада, а также некоторая справочная информация для обеспечения более удобной дальнейшей работы с документом.
В итоге был реализован шаблонный документ в формате Excel-книги, который включает в себя два листа, на одном из которых отображаются визуализированные цветами данные, а на втором содержится таблица с интерпретацией и кратким описанием каждого признака.
Информация на первом листе представлена в виде таблицы. Все признаки были сгруппированы по блокам и упорядочены. В шапке таблицы присутствуют подписи блоков. Для каждого признака выделен свой столбец, для удобства реализованы ссылки на лист со справочной информацией, т. е. при клике на любой из признаков, пользователю будет предоставлена справочная информация по конкретному признаку, которая включает в себя его порядковый номер, идентификатор SNP, краткое описание, а также сочетания пар аллелей и их расшифровка (является ли сочетание позитивным, нейтральным или негативным).
Каждому образцу соответствует отдельная строка, в которой указывается его номер, а также результаты его анализа.
С целью более удобного и наглядного представления данных к таблице внутри программы применяется условное форматирование, согласно которому ячейки с позитивным прогностическим сочетанием аллелей выделяются зеленым цветом, ячейки с нейтральным прогностическим сочетанием аллелей – желтым цветом, ячейки с негативным прогностическим сочетанием аллелей – красным цветом, ячейки с неопределенным прогностическим сочетанием аллелей – серым цветом.
Пример ковра для 15 образцов можно увидеть на рисунке ниже (рисунок 26).
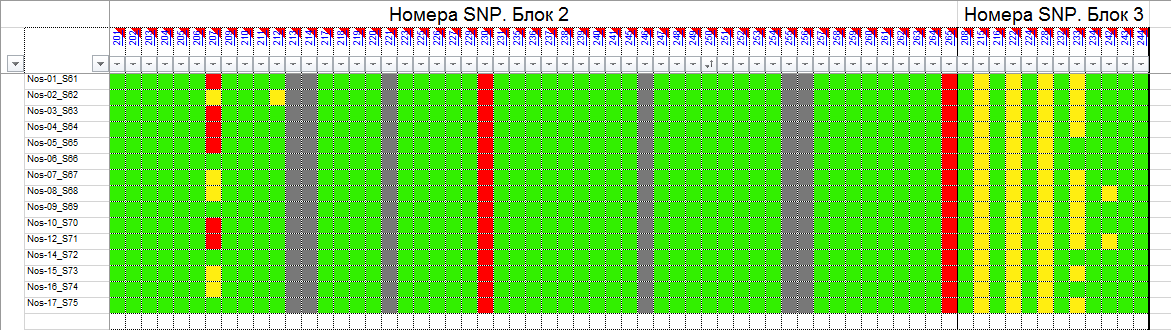
Рисунок 26 – Пример 2D-диаграммы («ковра») для 15 образцов (животных)
ВЫВОДЫ
1. Методом таргетного секвенирования на приборе MiSeq проведено исследование более 300 образцов (цельная кровь и спермодозы) биоптантов КРС с целью определения конкретных значений SNP из списка входящих в коммерчески доступную панель TruSeq Bovine Parentage Sequencing Panel Illumina (США).
2. Создана и проверена на материале первичных экспериментальных данных секвенирования работоспособная программа (программный продукт)
Just Append Cows – для генерации генетического паспорта животного.
3. Создана и проверена на материале первичных экспериментальных данных секвенирования работоспособная программа (программный продукт) Covers («Ковер») – для генерации цветной 2D-диаграммы, описывающей распределение гомозигот и гетерозигот в аллельном спектре произвольной экспериментальной группы животных. Данная программа может быть использована для сопоставления данных представленности аллелей у родительской пары
и подбора оптимального донора для искуственного осеменения.
4. С применением программы Just Append Cows проведена паспортизация экспериментальныхгруппы животных общей численностью более 300.
5. На полученном оригинальном экспериментальном материале продемонстрирована применимость программы Covers для генерации цветной 2D-диаграммы и контроля аллельного спектра групп, а также оптимизации сравнительного подбора спермодоз быка определенного генотипа для конкретной коровы при искусственном осеменении.
