Титульный лист и исполнители
Отчет 48 с., 8 табл., 1 рис., 35 источника, 1 прил.
Ключевые слова: карп кросса «Петровский», Akwa-Biot-Norm, ихтиомасса, рост и развитие, эколого-технологический прессинг, иммунитет, фагоцитарная активность нейтрофилов, бактерицидная активность сыворотки, лизоцим, клеточное звено системы иммунитета, ветеринарно-санитарная оценка рыбы.
Более полное удовлетворение потребностей населения в пищевом белке высокого качества возможно при условии целенаправленного изучения и разработки путей хозяйственного использования природных ресурсов, в частности водных. Развивая многосторонний подход к использованию водных ресурсов в дополнение к обеспечению сельскохозяйственных нужд, необходимо учитывать и возможности ведения рыбного хозяйства на базе одних и тех же водоемов. Необходимо разрабатывать новые методы изучения и прогнозирования возможных изменений в организме выращиваемой рыбы, в организации и реализации производственных процессов в аквакультуре.
Для реализации возможностей развития рыбного хозяйства необходимо уделить внимание разработке альтернативных, принципиально новых подходов к ведению рыбоводства. В связи с этим, исследования по разработке и использованию новых эколого-экономических подходов при проведении работ с традиционными и новыми объектами рыбоводства, приобретают особую актуальность. Первостепенное значение приобретает проблема конструирования высокопродуктивных экосистем и управление их функционированием, то есть обеспечение перехода от рыболовства к эксплуатации водоемов методами товарного рыбоводства для повышения эффективности аквакультуры (В.К. Виноградов, 2002; Багров А.М., 2002, 2014; Морузи И.В. и соавт., 2007-2015; Пономарев С.В. и соавт., 2009, 2015, 2019).
В числе важнейших путей решения рыбохозяйственных проблем выделяют внедрение и разработку новых технологий, экологически чистых, мало- и безотходных технологий, позволяющих использовать имеющиеся ресурсы для производства товарной продукции с лучшими потребительскими качествами. Крупномасштабное прудовое хозяйство уступает место компактному и интенсивному выращиванию рыбы. Популярность товарного выращивания и содержания рыбы среди производителей, арендаторов, фермеров, растет. Закладывать основы новых технологий необходимо своими силами с привлечением инвестиций к уже разработанным направлениям рыбохозяйственной деятельности. Разработка новых методов рыбохозяйственной деятельности актуальна в современных условиях.
Цель исследований:
1 Оценка воздействия прудовой аквакультуры на водные ресурсы в результате выполнения производственных рыбоводных процессов и разработка рекомендаций по охране водных ресурсов и обеспечению экологической безопасности в зоне деятельности объектов прудовой аквакультуры;
2 Разработка экологически безопасной биогенной кормовой добавки на основе белковых компонентов и иммунотропных средств и научно обоснованных и экономически целесообразных норм ввода в полнорационные комбикорма для объектов аквакультуры.
Для достижения намеченной цели были поставлены следующие задачи:
1 Комплексные исследования по воздействию прудовой аквакультуры в рыбоводческих хозяйствах Чувашской Республики на водные ресурсы;
2 Разработка биогенной кормовой добавки на основе белковых компонентов и иммунотропных средств, норм ее ввода в полнорационные комбикорма для объектов аквакультуры;
3 Оценка влияния разработанной кормовой добавки на рост и развитие, заболеваемость и сохранность рыб;
4 Оценка биологической полноценности и доброкачественности продукции аквакультуры на фоне включения разработанной добавки в полнорационные комбикорма;
5 Разработка научно обоснованных мероприятий по охране водных ресурсов и обеспечению экологической безопасности на фоне реализации биоресурсного потенциала прудовой аквакультуры.
Первая часть научно-исследовательской работы проведена в условиях лабораторий кафедр «Морфологии, акушерства и терапии» и «Эпизоотологии, паразитологии и ветеринарно-санитарной экспертизы» федерального государственного бюджетного образовательного учреждения высшего образования «Чувашская государственная сельскохозяйственная академия». Вторая часть НИР выполнена в производственных условиях полносистемного прудового хозяйства ООО рыбхоз «Киря». В научно-хозяйственном опыте испытание биогенной кормовой добавки Akwa-Biot-Norm проводили на карпах кросса «Петровский».
В результате выполнения НИР разработана технология введения биогенной кормовой добавки Akwa-Biot-Norm в состав комбикормов для карпа, и установлено что:
— на фоне применения биогенной кормовой добавки Akwa-Biot-Norm на основе полисахаридного комплекса дрожжевых клеток Saccharomyces cerevisiae средняя масса карпов в конце опытного периода была больше контрольного показателя на 2,19 %, а прирост живой массы выше на 2,71 %;
— биогенная кормовая добавка способствует активизации гемопоэза в организме рыб, о чем свидетельствует достоверное, относительно контрольного показателя, увеличение в крови карпов опытной группы количества эритроцитов на 8,5 % и гемоглобина на 9,4 %;
— у рыб наблюдается лейкоцитоз в пределах физиологических норм с выраженным лимфоцитозом, имеющим абсолютное большинство в лейкоцитарной формуле и некоторое снижение доли нейтрофилов, при сохранении их большого количества, что свидетельствует о высокой степени развития клеточного звена системы иммунитета;
— применение биогенной кормовой добавки Akwa-Biot-Norm карпу кросса «Петровский» в условиях садкового содержания в естественных водоемах активизирует клеточные и гуморальные факторы неспецифической защиты организма: бактерицидной активности сыворотки крови – на 12,2 % (Р<0,05), фагоцитарной активности нейтрофилов – на 14,6 % (Р<0,05), лизоцимной активности плазмы крови – на 9,0 % (Р<0,05);
— добавление в комбикорм для карпов биогенной кормовой добавки Akwa-Biot-Norm повышает резистентность рыбы к заболеваниям и обеспечивает большую сохранность. Так, особей, пораженных сапролегниозом в опытной группе было в 1,45 раза меньше, чем в контрольной, а сохранность была выше на 3,2 %;
— биогенная кормовая добавка Akwa-Biot-Norm не оказывает негативное влияние на органолептические, биохимические и спектрометрические показатели мяса рыб, и обеспечивает его доброкачественность и безопасность.
Предложенная технология введения биогенной кормовой добавки Akwa-Biot-Norm в состав комбикормов для карпа не оказывает негативное воздействие на водные ресурсы в результате выполнения производственных рыбоводных процессов.
РЕКОМЕНДАЦИИ ПРОИЗВОДСТВУ
С целью охраны водных ресурсов и обеспечения экологической безопасности в зоне деятельности объектов прудовой аквакультуры, стимуляции роста и развития карпов, профилактики их заболеваемости в условиях эколого-технологического прессинга рекомендуем применять биогенную кормовую добавку Akwa-Biot-Norm на основе полисахаридного комплекса дрожжевых клеток Saccharomyces cerevisiae.
Рекомендуем скармливать рыбам комбикорм, обогащенный биогенной кормовой добавкой Akwa-Biot-Norm из расчета 25 мл на 1 кг комбикорма в течение 14 суток. В результате достигается стимуляция роста и профилактика заболеваемости за счет активизации неспецифической резистентности организма.
ВВЕДЕНИЕ
Усилия государственных органов управления направлены на обеспечение эффективного взаимодействия экономических, социальных и экологических факторов в интересах устойчивого развития общества.
Более полное удовлетворение потребностей населения в пищевом белке высокого качества возможно при условии целенаправленного изучения и разработки путей хозяйственного использования природных ресурсов, в частности водных ресурсов. Необходимо оценить экологическую и экономическую эффективность путей организации хозяйственной деятельности. Развивая многосторонний подход к использованию водных ресурсов в дополнение к обеспечению сельскохозяйственных нужд, необходимо учитывать и возможности ведения рыбного хозяйства на базе одних и тех же водоемов. Необходимо разрабатывать новые методы изучения и прогнозирования возможных изменений в организме выращиваемой рыбы, в организации и реализации производственных процессов в аквакультуре.
Основные рыбохозяйственные мероприятия направлены на продолжение крупномасштабного рыбоводства по принципам ранее отработанных наукой и практикой интенсивных технологий. Однако в новых условиях они являются высокозатратными, не отражают в полной мере всего комплекса рационального использования имеющихся в наличии резервов. Для реализации возможностей развития рыбного хозяйства необходимо уделить внимание разработке альтернативных, принципиально новых подходов к ведению рыбоводства. В связи с этим, исследования по разработке и использованию новых эколого-экономических подходов при проведении работ с традиционными и новыми объектами рыбоводства, приобретают особую актуальность. Первостепенное значение приобретает проблема конструирования высокопродуктивных экосистем и управление их функционированием, то есть обеспечение перехода от рыболовства к эксплуатации водоемов методами товарного рыбоводства для повышения эффективности аквакультуры (В.К. Виноградов, 2002; Багров А.М., 2002, 2014; Морузи И.В. и соавт., 2007-2015; Пономарев С.В. и соавт., 2009, 2015, 2019).
Так, по данным статистики отмечается, что максимальный вылов рыбы из водоемов был достигнут в 1989 г. К тому же, порядка 85 %выловленной рыбы было выращено в прудовых хозяйствах, и только около 15 % было выловлено из других водоемов и водных систем. К 1998 году объем производства товарной рыбы снизился более чем в 4,5 раза, что было связано с медленной перестройкой рыбохозяйственной отрасли в соответствии с разрывом налаженных отношений и взаимосвязей, общим ухудшением экономического состояния страны. В последние годы отмечено, что отрасль рыбного хозяйства активно наращивает объемы производства товарной рыбы. Основным объектом прудового рыбоводства по-прежнему остается карп. В объеме производства прудовой рыбы за последние годы доля карпа находится в пределах 84–88 %. Поэтому совершенствование выращивания карпа и расширение спектра выращиваемых видов рыб является весьма актуальным.
В числе важнейших путей решения рыбохозяйственных проблем выделяют внедрение и разработку новых технологий, экологически чистых, мало- и безотходных технологий, позволяющих использовать имеющиеся ресурсы для производства товарной продукции с лучшими потребительскими качествами. Крупномасштабное прудовое хозяйство уступает место компактному и интенсивному выращиванию рыбы. Популярность товарного выращивания и содержания рыбы среди производителей, арендаторов, фермеров, растет. Закладывать основы новых технологий необходимо своими силами с привлечением инвестиций к уже разработанным направлениям рыбохозяйственной деятельности. Разработка новых методов рыбохозяйственной деятельности актуальна в современных условиях.
1 ОСНОВНАЯ ЧАСТЬ
1.1 Цель исследований:
1.1.1 Оценка воздействия прудовой аквакультуры на водные ресурсы в результате выполнения производственных рыбоводных процессов и разработка рекомендаций по охране водных ресурсов и обеспечению экологической безопасности в зоне деятельности объектов прудовой аквакультуры;
1.1.2 Разработка экологически безопасной биогенной кормовой добавки на основе белковых компонентов и иммунотропных средств и научно обоснованных и экономически целесообразных норм ввода в полнорационные комбикорма для объектов аквакультуры.
1.2 Задачи исследований:
1.2.1 Комплексные исследования по воздействию прудовой аквакультуры в рыбоводческих хозяйствах Чувашской Республики на водные ресурсы;
1.2.2 Разработка биогенной кормовой добавки на основе белковых компонентов и иммунотропных средств, норм ее ввода в полнорационные комбикорма для объектов аквакультуры;
1.2.3 Оценка влияния разработанной кормовой добавки на рост и развитие, заболеваемость и сохранность рыб;
1.2.4 Оценка биологической полноценности и доброкачественности продукции аквакультуры на фоне включения разработанной добавки в полнорационные комбикорма;
1.2.5 Разработка научно обоснованных мероприятий по охране водных ресурсов и обеспечению экологической безопасности на фоне реализации биоресурсного потенциала прудовой аквакультуры.
1.3 Материал и методы исследований
Первая часть научно-исследовательской работы проведена в условиях лабораторий кафедр «Морфологии, акушерства и терапии» и «Эпизоотологии, паразитологии и ветеринарно-санитарной экспертизы» федерального государственного бюджетного образовательного учреждения высшего образования «Чувашская государственная сельскохозяйственная академия», а именно была разработана технология введения биогенной кормовой добавки Akwa-Biot-Norm в состав полнорационных комбикормов для карпов.
Биогенная кормовая добавка Akwa-Biot-Norm представляет собой суспензию из 50 массовых частей 1 % раствора желатины, 1 массовой части концентрата очищенного полисахаридного комплекса Saccharomyces cerevisiae и 3 массовых частей левомизола.
Для повышения биологической полноценности комбикорма нами разработана технология введения биогенного препарата в состав комбикорма, которая заключается в следующем. Необходимое количество биогенного препарата следует предварительно внести в суспензию желатины и выдерживать до полного растворения ингредиентов. Полученную суспензию нужно, равномерно размешивая, добавлять в комбикорм. Смешанную массу комбикорма использовать для кормления рыб согласно нормам кормления. Такой метод приготовления кормов за счет плохой растворимости желатины и быстрой поедаемости практически исключает потерю препарата в результате вымывания в воде.
Вторая часть научно-исследовательской работы выполнена в производственных условиях полносистемного прудового хозяйства ООО рыбхоз «Киря». В научно-хозяйственном опыте испытание биогенной кормовой добавки Akwa-Biot-Norm проводили на карпах кросса «Петровский».
Для опыта 2 группы карпов численностью по 500 голов были отделены в садки. Физико-химические параметры водной среды и условия кормления рыб обеих групп были одинаковыми. Рыбам опытной группы дополнительно в состав полнорационных комбикормов в течение 14 суток включали биогенную кормовую добавку Akwa-Biot-Norm, из расчета 25 мл на 1 кг комбикорма. Наблюдение вели в течение 20 недель.
В начале опыта и каждую неделю эксперимента проводили контрольные взвешивания рыб по 10 экземпляров для определения динамики роста. В конце опыта рыбы подвергнуты контрольному вылову с целью проведения ветеринарно-санитарной оценки. Кроме того, перед опытом, в конце 10-й недели и по завершении опыта (в конце 20-й недели) произвели отбор крови по 10 проб с каждой группы, для гематологических, биохимических и иммунологических исследований.
После получения результатов взвешиваний, проводили расчеты среднесуточных, абсолютного и относительного прироста массы карпа.
Научно-исследовательскую работу выполняли с использованием методов:
1) гидрохимических – определяли растворенный кислород, рН, общую жесткость, щелочность, окисляемость, нитриты, нитраты, общее железо, сульфаты, хлориды и др. Исследования выполнены согласно ГОСТ 31861-2012 «Вода. Общие требования к отбору проб», ГОСТ 17.1.3.07-82 «Охрана природы. Гидросфера. Правила контроля качества воды водоемов и водотоков»;
2) гематологических – определяли количество эритроцитов, скорость оседания эритроцитов, концентрацию гемоглобина, количество лейкоцитов, кроме того проводили дополнительную дифференцировку лейкограммы микроскопически, изготовлением мазков крови и окрашиванием по методу Романовского, модификации Гимза, кровь на анализ отбирали прижизненно из хвостовой артерии, сразу после извлечения рыбы из воды;
3) биохимических – исследовали уровень общего белка в сыворотке крови – рефрактометром ИРФ-454Б-2М (А.М. Ахмедов), белковый спектр – турбидиметрическим методом (С.А. Карпюк);
4) иммунобиологических – определяли фагоцитарную активность лейкоцитов с использованием суточной агаровой культуры Staph. aureus, штамм 0-55 (В.С. Гостев), лизоцимную активность плазмы крови с использованием суточной агаровой культуры M. lysodeiticus, штамм МЛ-43-29-1 (В.Г. Дорофейчук), бактерицидную активность сыворотки с использованием суточной агаровой культуры E.coli (О.В. Смирнова и соавт.);
5) зоотехнических – определяли живую массу и среднесуточный прирост карпа периодическим взвешиванием, экстерьерные промеры;
6) вeтepинapнo-caнитapныe иccлeдoвaния pыбы проводили в cooтвeтcтвии co cпpaвoчникoм «Beтepинapнo-caнитapнaя экcпepтизa пpecнoвoднoй pыбы» (M.: Aгpoпpoмиздaт, 1989) и «Пpaвилaми вeтepинapнo-caнитapнoй экcпepтизы пpecнoвoднoй pыбы и paкoв» (M.: Aгpoпpoмиздaт, 1989);
7) опpeдeлeниe кaчecтвeнныx пoкaзaтeлeй мяca pыбы пpoвoдили coглacнo ГОСТ 7631-2008 «Рыба, нерыбные объекты и продукция из них. Методы определения органолептических и физических показателей»;
8) опpeдeлeниe физикo-xимичecкиx пoкaзaтeлeй мяca pыбы пpoвoдили в cooтвeтcтвии c ГOCT 7636-85 «Pыбa, мopcкиe млeкoпитaющиe, мopcкиe бecпoзвoнoчныe и пpoдукты иx пepepaбoтки. Методы анализа»;
9) иccлeдoвaния нa coдepжaниe тoкcичныx элeмeнтoв в мышeчнoй ткaни pыбы пpoвoдили пo ГOCT P 51183-2008 «Продукты пищевые. Определение следовых элементов. Определение ртути методом атомно-абсорбционной спектрометрии холодного пара с предварительной минерализацией пробы под давлением», ГОСТ 31707-2012 «Продукты пищевые. Определение следовых элементов. Определение ртути методом атомно-абсорбционной спектрометрии с генерацией гидридов с предварительной минерализацией проб под давлением», МУК 4.1.986-200 «Методика выполнения измерений массовой доли свинца и кадмия в пищевых продуктах и продовольственном сырье методом электротермической атомно-абсорбционной спектрометрии»;
10) микpoбиoлoгичecкиe иccлeдoвaния pыбы пpoвoдили coглacнo ГОСТ 10444.15-94 «Продукты пищевые. Методы определения количества мезофильных аэробных и факультативно-анаэробных микроорганизмов», ГОСТ 31747-2012 «Продукты пищевые. Методы выявления и определения количества бактерий группы кишечных палочек (колиформных бактерий)», ГОСТ 31659-2012 «Продукты пищевые. Методы выявления бактерий рода Salmonella», ГОСТ 31746-2012 «Продукты пищевые. Методы выявления и определения количества коагулазоположительных стафилококков и Starphylococcus aureus», ГОСТ 32031-2012 «Продукты пищевые. Методы выявления бактерий Listerria monocytogenes»;
11) паразитарную чистоту определяли согласно Сан ПиН 3.2.3215-14 «Профилактика паразитарных болезней на территории Российской Федерации».
Исследования проводились в соответствии с ТР ТС 040/2016 «О безопасности рыбы и рыбной продукции», ТР ТС 021/2011 «О безопасности пищевой продукции».
В период научно-производственного опыта мы определяли: живую массу, сохранность особей, поедаемость кормов, затраты корма, экономическую эффективность выращивания карпа кросса «Петровский».
Цифровой материал опытов обрабатывали методом вариационной статистики на достоверность различия сравниваемых показателей (P<0,05-0,01) с использованием программного комплекса Microsoft Office Excel 2007.
Обработка материалов по результатам исследований проведена в условиях лабораторий ФГБОУ ВО Чувашская ГСХА, оснащенных современными средствами измерений и испытательным оборудованием:
- Спектрофотометр UV 1800 – двухлучевой сканирующий спектрофотометр для технологических, фармацевтических, природоохранных, санитарных и научных лабораторий;
- Атомно-абсорбционный спектрометр ААА-6300 – для автоматического высокостабильного анализа до 20 элементов в едином цикле измерений;
- Полуавтоматический биохимический анализатор Вiосhem SA – для измерения и расчета результатов лабораторных диагностических тестов, основанных на измерении оптической плотности и расчета концентрации, на одном из 6 фильтров с соответствующей длиной волны;
- Рефрактометр ИРФ-454 Б2М ИРФ-22 – для измерения показателя преломления nD и средней дисперсии nF — пС неагрессивных жидких и твердых сред, а также для измерения процентного содержания сухих веществ в растворах сахарозы;
- Хладотермостат воздушный ХТ-3/40-2 – для получения и поддержания внутри рабочей камеры стабильной температуры, проведения технических и санитарно-бактериологических испытаний;
- Иономер «Мультитест» с ионоселективными электродами – для определения водородного показателя (рН) и измерения ЭДС (ОВП, Eh);
- рН-метры – для измерения водородного показателя (показателя рН), характеризующего активность ионов водорода в растворах, воде, пищевой продукции и сырье, объектах окружающей среды и производственных системах непрерывного контроля технологических процессов, в том числе в агрессивных средах;
- Аналитические весы – для взвешивания;
- Электронные весы ВК-300 – для взвешивания;
- Центрифуга – для разделения сыпучих тел или жидкостей различного удельного веса и отделения жидкостей от твёрдых тел путем использования центробежной силы;
- Сушильные шкафы – для сушки, нагревания, термостатирования, термической обработки различных материалов и изделий в воздушной среде;
- Аквадистиллятор – для очищения воды;
- Холодильник – для охлаждения проб, сырья и продукции;
- Аппарат для встряхивания – для встряхивания жидкости в колбах и пробирках с целью ее механического перемешивания;
- Шкаф вакуумный сушильный – для вакуумной сушки материалов;
- Шкаф вытяжной – для проведения работ с особо агрессивными химическими веществами, включая концентрированные кислоты и их пары;
- Микроскоп МБС-1 – для продолжительной работы с миниатюрными объектами;
- Водяная баня – для обеспечения оптимальной стабильности температуры;
- Термостат – для термостатирования как внешних систем, так и в бане термостата;
- Фотоколориметр ФЭК-56М – для исследования различных как жидких, так и твердых материалов, пропускающих свет в видимом спектральном диапазоне, и (или) ближних ИК и УФ диапазонах;
- Шкаф сушильный – для сушки (высушивание), кондиционирования, вулканизации, легкого обжига;
- Баня водяная шестиместная – для проведения химических, биологических, фармацевтических процессов, требующих нагрева при постоянной температуре в диапазоне от температуры окружающей среды +5…100 °С в лабораторных условиях;
- Встряхиватель ЛЕ-203 – для перемешивания жидкостей;
- рН-метр ОР204/1 – для измерения: активности ионов водорода (рН), ЭДС электродных систем (мВ), окислительно-восстановительного потенциала Eh (мВ), температуры водных сред (°С);
- Фотометр ФМ – для измерения коэффициентов пропускания и оптических плотностей прозрачных жидкостных растворов;
- Цифровой контролер температуры E5CN – измерение температуры сырья в процессе термообработки.
2 РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
2.1 Краткая характеристика ООО рыбхоз «Киря»
ООО рыбхоз «Киря» расположено в 0,5 км северо-западнее села Кудеиха Порецкого района Чувашской Республики. Данное рыбоводное хозяйство было организовано в 1979 году как подразделение откормсовхоза «Засурский» Порецкого района. В 1982 году рыбоводное хозяйство начало функционировать как самостоятельное предприятие.
ООО рыбхоз «Киря» – полносистемное прудовое хозяйство. Общая площадь составляет 310 га. Всего прудов – 24 с площадью 293,7 га, в том числе: 6 нерестовых прудов – 1,2 га, 4 летних маточных – 2,9 га, 3 зимовальных – 2,7 га, 3 зимних маточных – 0,3 га, 5 выростных – 66,6 га, 3 нагульных – 219,0 га. Вода в пруды подается из реки Киря принудительно. Проектная мощность по производству рыбопосадочного материала – 30 тонн, по товарной рыбе 290 тонн.
Источником водоснабжения является река Киря, правый приток Суры. Длина реки до проектного створа 84 км, площадь водосбора составляет 745 км². Ширина реки равна 10-12 м, глубина 0,5-1,5 м. Годовой ход уровней реки характеризуется высоким, ясно выраженным весенним половодьем и низкой относительно устойчивой летней и зимней меженью. Подъем уровней воды весной начинается в конце марта – начале апреля и продолжается 6-10 дней, достигая максимума в первой – второй декаде апреля.
В рыбоводном хозяйстве «Киря» разводятся и выращиваются две породы карпа «Чувашский чешуйчатый» и «Анишский зеркальный», кросс «Петровский», созданные в Чувашской Республике, а также растительноядные рыбы, завозимые из южных регионов страны.
Порода «Чувашский чешуйчатый». Исходным материалом для создания породы послужили местные карпы Поволжья, адаптированные к резким перепадам температур и дефициту кислорода в период зимовки. В работе применялись: селекция по независимым уровням, направленный и стабилизирующий отборы и разведение «в себе».
Включена в Государственный реестр селекционных достижений, допущенных к использованию в 2003 году.
По данным оригинатора, тело рыбы длинное, прогонистое. Покров сплошной, чешуйчатый. Окраска серо-желтая. Характеризуется высокой стрессоустойчивостью, пластичностью, низкой костистостью товарного мяса. Средняя масса тела производителей до 5 кг. Рабочая плодовитость 607 тыс. шт. икринок.
Порода «Анишский зеркальный». Создана на базе местных карпов при проведении селекции по независимым уровням, с использованием направленного и стабилизирующего отбора и разведения «в себе».
Включена в Государственный реестр селекционных достижений, допущенных к использованию в 2008 году.
По данным оригинатора, порода отличается высокой продуктивностью, плодовитостью, выживаемостью, стрессоустойчивостью при интенсивных методах разведения. Тело рыбы средней длины, прогонистое. Покров разбросанно-чешуйчатый. Окраска серо-желтая.
Плодовитость самок 655 тыс. шт. икринок. Оплодотворяемость 85%. Выход 3-х суточных годовиков на 1 самку 350 тыс. шт. (40-50%), двухлеток – 128,7 тыс. шт. (81,6%). Масса двухлетков – 323 г, трехлетков – 1200 г. Общая продуктивность на самку по двухлеткам 249,4 ц, трехлеткам – 671,7 ц, при мясности 55-58%. Ценное качество: низкая костистость товарного мяса. Средняя масса тела производителей до 4,5 кг.
Кросс «Петровский» создан на основе анишской породы (самки) и чувашской чешуйчатой породы (самцы). Созданный кросс карпа «Петровский» унаследовал от родительских форм высокую скорость роста, лучшие экстерьерно-интерьерные показатели и высокую резистентность организма.
Включен в Государственный реестр селекционных достижений, допущенных к использованию в 2009 году.
В настоящее время создается кросс карпа на основе чувашской чешуйчатой породы (самки) и анишской породы (самцы).
На базе рыбхоза начаты исследования по созданию одомашненных маточных стад обыкновенного сома двух популяций: сурской и волжской. Этот объект хорошо вписывается в технологический цикл разведения и выращивания карпа и может стать ценным видом в поликультуре. В селекционном плане планируется создание одомашненной породной группы обыкновенного сома в качестве селекционного достижения.
В рыбоводном хозяйстве «Киря» кроме карпа выращивают толстолобик и щуку, ранее разводили пелядь.
В первые годы в хозяйстве размножение карпа проводили прудовым методом, включавший подготовку нерестовых прудов и производителей, посадку их в пруды, проведение нереста, подращивание личинок, спуск прудов и пересадку личинок в выростные пруды.
Затем перешли на заводской метод – более прогрессивный метод, имеющий ряд преимуществ по сравнению с естественным нерестом. При искусственной инкубации икры исключается совместное содержание производителей и потомства, благодаря чему возможно получение личинок, свободных от возбудителей инфекционных и инвазионных заболеваний. Процессы подготовки производителей, а также получения икры и ее инкубации управляемы и в значительно меньшей степени зависят от гидрометеорологических условий. Заводской метод позволяет значительно раньше получать молодь и выпускать ее в выростные пруды – увеличивается вегетационный период. Также сокращается стадо производителей, в первую очередь за счет самцов, улучшаются условия проведения селекционно-племенной работы. В основу заводского метода положено стимулирование созревания производителей гонадотропными гормонами – внутримышечной инъекцией суспензии гипофизов рыб.
Для каждой категории прудов разработан комплекс ветеринарно-санитарных и рыбоводно-мелиоративных мероприятий с учетом сезона, возраста рыб, качества водоисточника, наличия животных, являющихся промежуточными хозяевами рыб.
2.2 Садковое выращивание карпов в естественных водоемах
Разведение карпов в садках производят преимущественно на подогретых водах электростанций и в естественных водоемах юга Евразии. На сегодняшний день существует биологическая техника разведения производителей, посадочного материала и товарного карпа, выращивание которых проводится на базе хозяйств комплексного назначения.
На сроки половозрелости и нереста не влияет содержание производителей в прудах одной климатической зоны и в садках естественных водоемов. Эти процессы наступают значительно быстрее в садках на подогретых водах электростанций. Половозрелость самки карпа в теплых водах наступает в возрасте двух лет при средней массе 1-2 кг, у самцов – в первый год жизни, нерестятся карпы во 2-3 декаде апреля.
Содержат карпов-производителей в нагульных садках и естественных водоемов, в целях которых подбирают заливы и водоемы площадью 50-100 га и глубиной 10-20 м. Установление садков проводят в акваториях на расстоянии 50-100 м от берега и глубиной 4-6 м. Плотность посадки в летних садках 3-5 кг/, температура воды – не ниже 5-10°C, содержание растворенного в воде кислорода не ниже 5-6 мг/л. Один раз в сезон производят замену садков для того чтобы снизить степень биологических обрастаний. Кормление карпа производят 2-3 раза в день, и для этого выбирают высокобелковые кормовые смеси в количестве 2-3 % к массе рыбы при температуре выше 22°С. Если температура воды выше 20°С, карпов кормят гранулированным кормом малыми порциями. При низкой температуре карп будет съедать остатки корма со дна. На один килограмм прироста затраты на корм составляют 4-5 кг.
В зимнее время производителей выращивают в подледных садках, плотность посадки 10-15 кг/. На акваториях с глубиной не меньше 5-7 м установку садков производят в поверхностных горизонтах воды, там исключается замерзание садков. В местах размещения садков температурных режим воды должен быть 0,5-1,0 °С, содержание кислорода — не меньше 3-4 мг/л, уровень воды — постоянный. Карпов, которых выращивают в садках зимой не кормят. Снижение массы каждой рыбы за зимний период составляет 12-15 %. Весной, как только лед сойдет с водоема, производителей перемещают в нагульные садки летнего режима и обеспечивают высокобелковыми кормами. Как только температура воды поднимается до 15-17 °С, проводят разделение производителей по полу. Их переводят в отдельные садки для нереста, которые размещают около водоема на глубине 1 м, учитывая при этом, что стенки и дно садков должны покрываться искусственным субстратом. В отдельные садки для нереста помещают 2 самцов и 1 самку. Как правило, стимуляция гормонами не требуется для повторно нерестующихся, ее впервые применяют созревающим садковым производителем. Мечение икры идет на нерестовый субстрат, там же производится ее инкубация. Из садков производителей убирают после завершения нереста. Вылупление личинок происходит в садках из сита, куда была перенесена икра с субстратом на стадии подвижного эмбриона. Круглогодичное содержание производителей осуществляют в открытых садках на глубине 1 м, при плотности посадки 40-60 кг/. При 100 % резерве производителей соотношение самок к самцам равняется ¼. Перед нерестом самок переводят в теплые бассейны, где температура воды повышается до 18-20, созревание длится 3-5 дней. Икру получают заводским способом. Годовиков карпа выращивают, учитывая климатическую зону, в которой находится естественный водоем: в садках – при вегетационном периоде 70-75 дней с температурой воды 21°С и выше, комбинированный – в водоемах с меньшей температурой.
В четвертой зоне рыбоводства и более южных регионах применяют разведение сеголеток в садках, в водоемах – охладителях электростанций в остальных климатических зонах.
Как только личинки карпа переходят на активное питание, их переводят в садки из сита, с принудительным водообменом, а в начале плотность посадки может быть 20-25 тыс. мг/.
Садки ставят в чистых акваториях в береговой зоне с содержанием кислорода 5-6 мг/л на глубине 1,5-2 м. Принудительный водообмен производится при помощи эрлифта, который обеспечивает водообмен в течение 1-1,5 ч. При помощи просушивания или используя механическую чистку садки освобождают от биологических обрастаний, несколько раз в неделю убирают донные отложения, меняют садки по мере необходимости. Зоопланктон – основной источник кормления, при выращивания личинок в садках. Концентрацию зоопланктона поддерживают на уровне 40-100 мг/л. Живые кормовые затраты составляют 7-10 кг. Личинок выращивают 15-20 дней, при температуре 21°С и выше, как только они достигают массы 100-200мг их перемещают в садки из капроновой дели с ячейками 3,6 мм.
Выход подращенных личинок – 60 %. После 10 дней подращивания необходимо приучить личинок к поеданию искусственного корма, давая смесь(1:1) и живой корм в виде суспензии 12 раз в день из расчета 100% от массы личинок, далее количество корма уменьшают и для 10-20-дневных личинок он равняется 50 %, 20-30-дневных – 30 %. Состав смеси входят: 20 % рыбной муки, 20 % кормовых дрожжей, 20 % пшеничной муки, 40 % кровяной муки.
Садки из дели для подращенных личинок располагают в непроточных водоемах площадью от 1-100 га, глубиной от 1-20 м, начальная площадь посадки равняется 1000 шт./ , при размещении в водоемах площадью выше 50 га. В водоемах до 5 га и глубиной 1-2 м содержание кислорода должно быть не меньше 5-6 мг/л, плотность посадки 400-500 шт./, температура воды 21°С и выше. При выращивания молодняка нужно выбирать водоемы с богатой природной кормовой базой и зоопланктоном с массой 2-3 г/л. На долю естественной пищи карпа должно приходиться от 2-10 %. Мальков с массой 0,1-1,0 г кормят с смесями местного производства, искусственными кормами на зоопланктонной основе, стартовыми кормами. Суточную потребность скармливают 4-6 раз в сутки, она составляет 50-100% к массе рыбы. Корм вносят в кормушки или на дно садков, затраты составляют 7-10 кг.
Влажный гранулированный корм на основе беспозвоночных и малоценной рыбы, заводские корма для молоди садковых рыб — основа питания мальков карпа массой от 1-25 г. В летний период суточная норма корма равняется 10-20 % от массы рыбы, в конце августа и в сентябре – 5-10%, длительность кормления в одном садке 5-10 минут, частота – не меньше 2-3 раз в день, кормовые затраты на 1 кг прироста равняются 2,5-4,0 кг.
Молодь целесообразно кормить по поедаемости – густой стаей кормят мальков при плотной посадке, таким образом они поедают корм не позволяя ему оказаться на дне.
С целью профилактики паразитарных болезней (аргулез, триходиниоз) необходимы лечебные ванны, просушивание делей садков и рам. Как правило, отход за период разведения в садках из дели составляет не выше 10-20 %. В водоемах комплексного назначения площадью 50-100 га общая масса разведенных в садках сеголеток не должна быть выше 5-10 ц/га.
За счет прудово-садкового способа разведения сеголеток карпа во 2-3 зонах ускоряется процесс выращивания мальков и личинок карпа.
Температурный фактор служит определяющим критерием продолжительности выращивания молодняка в прудах и массы карпа для посадки в садки. Мальки массой 10 г нужны для стандартных сеголеток, если температура воды в садках 21 °С и больше держится не меньше 12 дней, садки зарыбляют мальками с массой 2 и 3 г, если число дней равняется 45 и 38. Выращивание подращенных мальков в садках аналогичное садковому способу. Из прудов мальков массой 1 г переводят в теплые садковые хозяйства, там в течении 4-5 месяцев при температуре не ниже 25 °С они вырастают до массы 40-50 г. Для кормления используют гранулированные корма. Установку садков производят в местах, где есть небольшое течение, плотность посадки молодняка 1-5 г равняется 2500 шт./, крупнее – 1000 шт./, при выращивании от 1-50 г выживаемость составляет 80 %, 35-40 кг сеголеток получают с 1 полезного объема садка. Зимуют сеголетки в незагрязненных, с хорошим водообменом без течения в подленных садках из дели 3,6-5мм водоемах с глубиной не меньше 5-7 м. Расстояние между садками 1,0 -1,5 м от льда, плотность посадки 1000 шт./. При температуре воды 5-10 °С делают разгрузку и посадку садков для зимовки. В течение 6-7 месяцев (в это время идет зимовка) рыбу не кормят. За условиями среды следят 1-2 раза в месяц. Сеголетки теряют до 20 % массы за зимовальный период, выживаемость равна 85-90 %. Сеголеток зимой содержат в летних садках на подогретых водах электростанций с металлической сеткой или дели 5-10 мм. В садках устанавливают кормушки из нетоксичного материала. Кормление карпа в зимний период осуществляется кормосмесью, в состав которой входят: 10 % льняного жмыха, 5 % дрожжей, 1 % рыбьего жира, 10 % шрота, 10 % фосфатидов, 74 % комбикорма. Кормят рыбы 2-6 раз, количество составляет 0,5 -3,0 % от массы рыбы. Такому типу кормления придерживаются при температуре 6-12 °С. При температуре воды 6-7 °С карп начинает брать корм, при температуре 8 °С – начинает расти. За зиму прирост может составить 65 %, выживаемость 95-100%. Товарного карпа выращивают в естественных водоемах (в 3-4 зоне и на южных зонах карповодство), в водоемах-охладителях электростанций. Товарного карпа можно вырастить водоемах, где температура воды удерживается не меньше 60 дней в пределах 20 °С и выше, там можно получить годовиков массой 25-30 г, двухлеток – 400 г. Садки помещают в водоемы площадью 200-500 га, плотность посадки – 110-160 шт./. При кормлении карпа используют сухие заводские комбикорма, кормосмеси, а при оптимальной температуре воды 3-4 раза в сутки выдается корм для естественного поедания в толще воды. В таком случае кормовые затраты составляют 3 кг на 1 кг прироста. Выживаемость – 90-95%. Из одного садка получают приблизительно 2 тонны рыбы, при садковом выращивании производительность составляет 20 кг товарной рыбы с 1
2.3 Использование биологически активных добавок в аквакультуре
Максимально быстрое достижение аквакультуры товарной массы в условиях ограниченной площади является важнейшей задачей производства рыбной продукции.
При искусственном воспроизводстве рыбы, учитывая большую нагрузку биомассы на единицу объем, постоянными стресс-факторами служат загрязнение воды, технические операции, искусственное кормление и.т.д. Они отражаются на темпах роста, общей резистентности рыб, устойчивости к воздействию неблагоприятных факторов различной этиологии, смертности. В таких ситуациях особенно остро встает вопрос повышения поиска защитных функций объектов выращивания и разведения.
Сегодня с целью повышения функционального состояния, повышения ценности кормов искусственного происхождения прибегают к средствам с выраженной биологической активностью. Большинство из них начинают применяться после успешного тестирования в животноводстве. В аквакультуре используют различные биологически активные добавки. В рыбоводстве существует 4 базисных методов применения БАВ:
— замачивание кормов в течение определенного времени или орошения;
— инъецирование;
— внесение в акваторию;
— введение на этапе производства в корм;
Современная аквакультура пользуется большим количеством БАВ, способствующие росту, выработке иммунитета, а также профилактике многих заболеваний (Л.М. Мирзоева, 1999; П.П. Головин и соавт. 2005; Ю.Н. Грозеску и соавт., 2009; Д.М. Жатканбаева и соавт., 2013; Г. И. Пронина 2014, 2015, 2019; О.Н. Гуцулюк, 2015; В.С. Буяров и соавт., 2016 и др.).
Научная литература содержит данные об использовании в рыбоводстве средств, которые обладают антистрессовым и иммуностимулирующим действием. Применение «Абиопептид» и «Ферропептид» повышает выживаемость и продуктивность ленского осетра при их использовании в дозе 1 мл на 1 кг живой массы (И.А. Китаев и соавт.,2014).
Большой интерес представляет поиск БАВ, которые повышают неспецифическую резистентность, сказываются на быстром росте, повышают жизнестойкость молоди, в особенности полисахариды дрожжевых клеток, обладающие корригирующим влиянием на Т- и В- лимфоциты. Полисахаридам не токсичны, им не свойственна антигенность и пирогенные свойства. Хорошо изучены полисахариды из клеточных оболочек дрожжей Saccharomyces cerevisiae (Г.К. Закенфельд, 1990). Полисахариды дрожжевых клеток повышают резистентность организма, являются стимуляторами широкого спектра действия, а также являются эффективными адьювантами при вакцинации.
Полисахариды Saccharomyces cerevisiae испытаны в производственных условиях животноводства в составе препаратов (П.Е. Игнатов, 1991, 1995; Ф.П. Петрянкин и соавт., 1992). Исследователи установили иммуномодулирующие свойства полисахаридов, действующих на неспецифические факторы резистентности. Они сказываются на функциональной активности клеток моноцитарно-макрофагальной системы, NK-клеток, нейтрофилов. Активация макрофагов идет за счет действия корпускул полисахаридов, приобретающих тумороцидные и бактериоцидные свойства. Взаимодействуя с мононуклеарами с периферической крови, полисахариды повышают токсичность естественных киллеров NK-клеток. Активация макрофагов усиливает синтез цитокинов, которые вырабатываются данными клетками. За счет усиления работы естественных киллеров, клеток моноцитарно-макрофагального ряда, а также повышения продукции усиливается действе гуморального и клеточного иммунитета.
Препараты, в которых содержатся полисахариды из клеточных оболочек дрожжей Saccharomyces cerevisiae, проявляют себя как действенные иммуностимуляторы.
Изучая доступные литературные источники не было найдено информации, где бы рассказывалось о применении полисахаридов из клеточных оболочек дрожжей Saccharomyces cerevisiae в рыбоводстве. Подводя итоги можно смело говорить, о том, что внедрение и разработка иммунотропных средств для терапии и профилактики рыб, повышении продуктивности, в частности, при садковом выращивании карпов в естественных водоемах является перспективным направлением.
2.4 Биологическая активность биогенной кормовой добавки Akwa-Biot-Norm
2.4.1 Воздействие биогенной кормовой добавки Akwa-Biot-Norm на рост и развитие карпа
Динамика средней массы карпов подопытных групп на фоне применения биогенной кормовой добавки Akwa-Biot-Norm представлена в табл. 1.
Как видно из таблицы 1, средняя маса карпа контрольной и опытной групп не имея достоверной разницы в начале опыта, планомерно увеличивалась вплоть до конца периода наблюдения – до 20-й недели опыта. Начиная со второй недели и до конца периода наблюдения, масса карпов опытной группы была выше контрольных величин. Так, например, в конце 5-, 10-, 15- и 20-й недель опытного периода масса карпов опытной группы оказалась выше массы карпов контрольной группы соответственно на 2,6 г, 5,6 г, 7,8 г и на 9,2 г, или на 1,49 %, 1,92 %, 2,12 % и на 2,19 %. Следует отметить, что разница величины средней массы карпов между группами не имела статистической достоверности. Абсолютный прирост массы карпа опытных групп также оказался выше, контрольных величин в конце 5-й недели на 3,0 г или 2,78 %, 10-й – на 6,0 г или 2,67 %, 15-й – 8,2 г или 2,73 % и в конце опытного периода на 9,6 г или 2,71 %.
Таблица 1 – Динамика средней массы карпа на фоне применения биогенной кормовой добавки Akwa-Biot-Norm
| Период опыта, недель | Группа | |
|---|---|---|
| контрольная | опытная | |
| Начало опыта | 66,8±0,73 | 66,4±1,08 |
| 1 | 91,8±1,13 | 91,6±1,26 |
| 2 | 114,1±1,17 | 114,8±1,12 |
| 3 | 134,9±0,97 | 136,2±0,98 |
| 4 | 155,3±1,39 | 156,8±2,14 |
| 5 | 174,7±1,22 | 177,3±1,67 |
| 6 | 196,5±1,64 | 200,1±1,95 |
| 7 | 218,9±1,38 | 223,8±2,14 |
| 8 | 242,6±1,78 | 246,8±2,31 |
| 9 | 267,4±2,12 | 271,3±1,74 |
| 10 | 291,5±2,64 | 297,1±2,64 |
| 11 | 308,3±2,09 | 312,4±3,14 |
| 12 | 323,4±2,93 | 328,8±3,22 |
| 13 | 339,6±3,18 | 344,6±4,18 |
| 14 | 354,2±3,54 | 359,8±3,27 |
| 15 | 367,5±3,12 | 375,3±4,56 |
| 16 | 378,1±3,07 | 386,0±4,12 |
| 17 | 387,2±4,17 | 395,2±5,31 |
| 18 | 398,4±5,67 | 406,8±4,98 |
| 19 | 408,8±5,14 | 419,2±5,19 |
| 20 | 420,6±6,11 | 429,8±7,02 |
Среднесуточные приросты массы карпов подопытных групп на фоне применения биогенной кормовой добавки Akwa-Biot-Norm представлены в табл. 2.
Динамика величины среднесуточного прироста массы карпа подопытных групп имела схожую динамику. В отдельные периоды данный показатель был выше в контрольной группе, в другие – в опытной, но, тем не менее, в целом за весь опытный период, среднесуточный прирост массы оказался выше у карпов опытной группы на 0,07 г.
Таблица 2 – Среднесуточные приросты массы карпа на фоне применения биогенной кормовой добавки Akwa-Biot-Norm
| Период опыта, недель | Группа | |
|---|---|---|
| контрольная | опытная | |
| 1 | 3,57 | 3,60 |
| 2 | 3,19 | 3,31 |
| 3 | 2,97 | 3,06 |
| 4 | 2,91 | 2,94 |
| 5 | 2,77 | 2,93 |
| 6 | 3,11 | 3,26 |
| 7 | 3,20 | 3,39 |
| 8 | 3,39 | 3,29 |
| 9 | 3,54 | 3,50 |
| 10 | 3,44 | 3,69 |
| 11 | 2,40 | 2,19 |
| 12 | 2,16 | 2,34 |
| 13 | 2,31 | 2,26 |
| 14 | 2,09 | 2,17 |
| 15 | 1,90 | 2,21 |
| 16 | 1,51 | 1,53 |
| 17 | 1,30 | 1,31 |
| 18 | 1,60 | 1,66 |
| 19 | 1,49 | 1,77 |
| 20 | 1,69 | 1,51 |
Динамика абсолютного прироста массы карпа подопытных групп по недельно, за период исследования на фоне применения биогенной кормовой добавки Akwa-Biot-Norm представлена на рис. 1.
Как видно из рис.1, величина показателя абсолютного прироста массы карпа контрольной и опытной групп имела схожую динамику, но тем не менее, в опытной группе, на фоне применения испытуемой биогенной кормовой добавки, абсолютный прирост массы в среднем за весь период наблюдения оказался выше контрольных величин на 0,48 г в неделю.
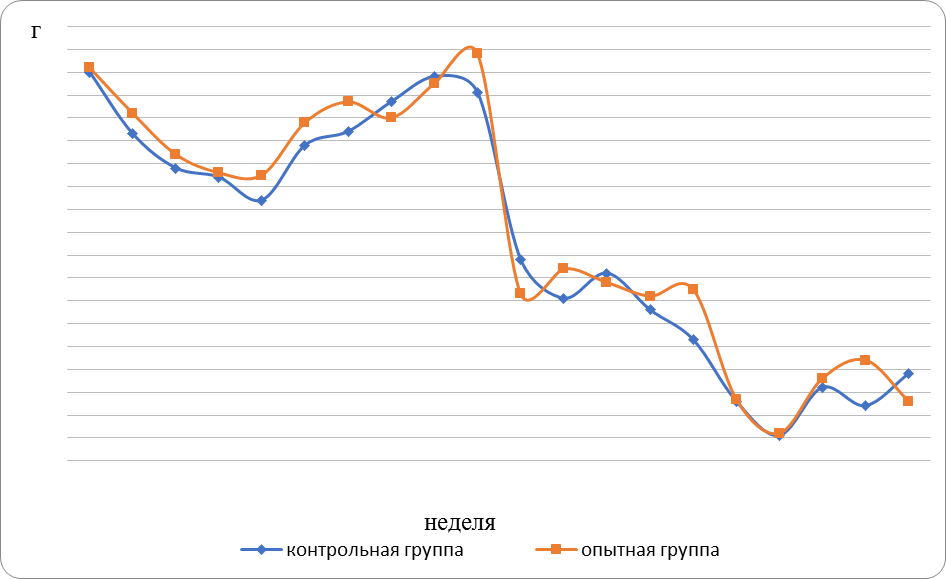
Рисунок 1 – Абсолютный прирост массы карпа за период исследования
Таким образом, результаты взвешивания рыб свидетельствуют о том, что в конце опытного периода средняя масса рыб опытной группы оказалась на 2,19 % больше, чем в контрольной группе, и составила 429,8±7,02 г (средняя масса в контрольной группе – 420,6±6,11 г). Прирост живой массы рыб опытной группы составил 363,4±5,96 г, что на 9,6 г или 2,71 % больше контрольного показателя. Следовательно, биогенная кормовая добавка Akwa-Biot-Norm, при введении в состав комбикорма для карпов проявляет ростостимулирующий эффект.
2.4.2 Гематологический и биохимический профиль организма карпа на фоне применения биогенной кормовой добавки Akwa-Biot-Norm
К объективно отражающим физиологическое состояние рыб относят гематологические показатели. Разные виды рыб в зависимости от среды обитания, образа жизни обладают различными биохимическими и морфологическими характеристиками крови. Даже у одного вида рыб эти показатели варьируются исходя из условий содержания, пола, возраста, сезона года.
Согласно исследованиям, даже кратковременное полноценное кормление значительно сказывается на гематологические показатели. Пользуясь сбалансированными рационами, приходят к оптимальным показателям.
Результаты исследования крови карпа на фоне применения биогенной кормовой добавки приведены в таблице 3.
Таблица 3 – Морфологические и биохимические показатели крови карпов
| Показатель | Группа | |
|---|---|---|
| контрольная | опытная | |
| Эритроциты, 1012/л | ||
| В начале | 0,79±0,02 | 0,78±0,04 |
| В середине | 0,83±0,04 | 0,87±0,02 |
| В конце | 0,82±0,03 | 0,89±0,02* |
| Гемоглобин, г/л | ||
| В начале | 38,0±1,58 | 37,9±0,93 |
| В середине | 49,7±0,75 | 55,2±1,44* |
| В конце | 62,5±2,02 | 68,4±1,15* |
| Лейкоциты, 109/л | ||
| В начале | 20,6±0,72 | 19,6±0,54 |
| В середине | 25,9±1,89 | 26,5±1,04 |
| В конце | 27,9±1,81 | 30,7±3,03 |
| Нейтрофилы, % | ||
| В начале | 18,7±0,94 | 18,8±1,12 |
| В середине | 20,32±1,5 | 20,78±1,23 |
| В конце | 21,4±0,97 | 21,3±1,33 |
| Эозинофилы, % | ||
| В начале | 8,7±0,53 | 8,5±0,97 |
| В середине | 7,8±0,39 | 7,2±0,22 |
| В конце | 4,5±0,83 | 4,2±0,69 |
| Базофилы, % | ||
| В начале | 0,3±0,02 | 0,4±0,03 |
| В середине | 0,4±0,04 | 0,6±0,04 |
| В конце | 0,5±0,03 | 0,5±0,02 |
| Лимфоциты, % | ||
| В начале | 68,5±1,37 | 68,4±0,97 |
| В середине | 67,3±1,10 | 67,5±1,98 |
| В конце | 68,9±1,6 | 69,7±1,74 |
| Моноциты, % | ||
| В начале | 3,8±0,04 | 3,8±0,03 |
| В середине | 4,2±0,23 | 4,2±0,71 |
| В конце | 4,6±0,67 | 4,3±0,55 |
| Общий белок, г/л | ||
| В начале | 22,1±1,12 | 22,2±1,55 |
| В середине | 24,9±0,38 | 27,1±0,52* |
| В конце | 28,2±0,66 | 28,9±0,39* |
* Р<0,05
Перед опытом количество эритроцитов у рыб контрольной группы было 0.79*, а опытной – 0.78*После завершения значение красных кровяных телец у контрольной группы изменился и составил 0.82*/л. В опытной группе число эритроцитов увеличилось и стало равным 0.89*л.
У рыб опытной и контрольной групп перед опытом гемоглобин составлял 37,9±0.93 г/л и 38,0±1,58 г/л соответственно, после завершения он имел значение 62,5±2,02 г/л (контрольная группа). В опытной группе гемоглобин составил 68,4±1,15 г/л. Анализируя данные, замечаем, что кормовая добавка Akwa-Biot-Norm увеличивает концентрацию гемоглобина. Это происходит за счет увеличения функциональной активности эритроцитов и их количества, что влияет на активацию гомопоэза, усиления обмена веществ.
Используя биогенную кормовую добавку в составе комбикормов, у опытной группы карпов наблюдался лейкоцитоз, входящий в пределы физиологической нормы. Количество лейкоцитов в начале опыта у контрольной группы – 20,6* /л, опытной – 19,6* /л, в конце опыта данный показатель равнялся 27,9* /л (контрольная группа), 30,7* /л (опытная группа). И в конце, и в начале опытов, как в контрольной, так и в опытной группах относительное количество нейтрофилов соответствовало физиологической норме. Происходит снижение относительного количества нейтрофилов, сопоставляя с контрольным показателем. Количество нейтрофилов в начале опыта составило: 18,7 % (контрольная группа), 18,8 % (опытная группа). В конце опыта: 21,4 % (контрольная группа), 21,3 % (опытная группа).
В конце опыта в крови рыб количество эозинофилов (опытная группа) находится в пределах физиологической нормы. Изначально количество эозинофилов в крови контрольной группы было равным 8,7±0,53 %, опытной – 8,5±0.97 %. На конец опыта количество эозинофилов составило 4,5±0,83 % (контрольная группа), 4,2±0.69 % (опытная группа).
Изучая лейкоцитарную формулу крови, отмечалось количественные преобладания лимфоцитов. Количество белого форменного элемента в крови у рыб на начало опыта составило 68,5±1,37 % (контрольная группа), 68,4±0.97 % (опытная группа). На конец опыта число лимфоцитов контрольной группы стало ниже опытной и составило 68,9±1,6 %. У карпов из опытной группы отметили увеличение лимфоцитов к концу опыта, он составил 69,7 %.
Относительное число моноцитов в гематологических показателях рыб обеих групп было в пределах нормы (на начало и конец опытов). В начале опыта количество моноцитов у рыб было равно 3,80,04 % (контрольная группа), 3,8±0,03 % (опытная группа). В конце он составил 4,6 % (контрольная группа), 4,3 % (опытная группа).
Изучив полученные данные, делаем выводы, что на фоне использования добавки Akwa-Biot-Norm в составе комбикормов отмечают лейкоцитоз с выраженным лимфоцитозом в пределах физиологических норм, имеющим большинство в лейкоцитарной формуле и небольшое уменьшение доли нейтрофилов с сохранением их большого числа – это говорит о высоком развитии клеточного звена иммунитета.
В начале опыта общий белок в сыворотке крови составляет 22,1 г/л (контрольная группа), 22,2 г/л (опытная группа). В конце опыта количество общего белка составило 28,2 г/л (контрольная группа), 28,9 г/л (опытная группа).
Учитывая количество белка в сыворотке крови опытной группы и увеличение средней массы рыбы, можно говорить об активизации синтетических процессов в организме рыб.
2.4.3 Иммунологический профиль организма карпа на фоне применения биогенной кормовой добавки Akwa-Biot-Norm
Результаты исследований иммунологических свойств крови рыб контрольной и опытной групп при включении в состав комбикорма биогенной кормовой добавки на основе полисахаридного комплекса дрожжевых клеток представлены в таблице 4.
Таблица 4 – Иммунологические свойства крови карпа
| Показатель | Группа | |
| контрольная | опытная | |
| В начале опыта | ||
| Бактерицидная активность сыворотки крови, % | 16,1±0,19 | 15,8±0,18 |
| Фагоцитарная активность нейтрофилов, % | 21,46±0,23 | 21,12±0,19 |
| Лизоцим, мкг/л | 15,2±0,26 | 14,6±0,13 |
| В конце опыта | ||
| Бактерицидная активность сыворотки крови, % | 17,2±0,44 | 19,3±0,41* |
| Фагоцитарная активность нейтрофилов, % | 22,80±0,38 | 26,13±0,66* |
| Лизоцим, мкг/л | 17,7±0,28 | 19,3±0,14* |
* Р<0,05
Бактерицидная активность сыворотки крови у рыб подопытных групп перед постановкой опыта не имела статистически достоверных отличий. В конце исследований значение анализируемого показателя неспецифической резистентности организма рыб опытной группы было достоверно выше контрольного показателя на 12,2 % (Р<0,05).
В конце опытного периода у карпов подопытных групп отмечена статистически достоверная разница показателя фагоцитарной активности нейтрофилов крови. Так фагоцитарная активность нейтрофилов на фоне применения биогенной кормовой добавки возросла относительно контрольного показателя на 14,6 % (Р<0,05).
Концентрация протеолитического фермента в сыворотке крови рыб контрольной и опытной групп в начале опыта была равна 15,2±0,26 мкг/л и 14,6±0,13 мкг/л соответственно, эти значения соответствуют физиологическим нормам. В конце опыта концентрация лизоцима в контрольной и опытной группах так же находилась в пределах физиологических норм, но в опытной группе данный показатель был достоверно выше контрольного на 9,0 %.
Результаты иммунологических исследований крови рыб опытной и контрольной групп дают основание полагать об активизации клеточного и гуморального звеньев неспецифической резистентности организма карпов, на фоне введения в состав комбикорма биогенной кормовой добавки Akwa-Biot-Norm.
2.4.4 Влияние биогенной кормовой добавки на
заболеваемость и сохранность рыб
Санитарно-гигиенический режим акватории, соблюдение технических процессов, качество комбикормов влияют на эффективность аквакультуры. Добиться соблюдения этих факторов в производстве не всегда представляется возможным. Рыба постоянно подвержена стресс-факторам, которые связаны с нарушениями кислородного, температурного режимов, использованием некачественных кормов и др. В результате это приводит к развитию инфекционных процессов, вызываемые различными микроорганизмами.
К одним из таких болезней относится сапролегниоз. Сапролегниоз – микозное заболевание икры и рыбы, часто встречаемое в естественных водоемах и в аквакультуре. Болезнь вызывают плесневые грибы, относящиеся к классу оомицеты из порядка сапролегниевых (Saprolegniales), нескольких родов: Saprolegnia, Dictyuches, Leptolegnia, Achlya, Aphonjmyces и др. Из них наиболее патогенными являются: Ach. flagellata, D. monosporus, S. Mixtra, Aph. laevis и др. Они обладают способностью переходить от сапрофии к некрофии. Являясь сапрофитами, они присутствуют в воде и грунте. Восприимчивы к болезни все искусственно выведенные рыбы.
Считают, что сапролегниоз относится к вторичным заболеваниям, возникающим на месте повреждений, при условиях снижения уровня резистентности, а также при других инфекционных и инвазионных болезных (Н.А. Головина и соавт., 2003).
Во время выполнении работы мы отметили болезни рыб, имеющих следующие клинические признаки: белые тонкие нити на плавниках и кожи, перпендикулярно отходящие от поверхности тела рыбы. Спустя пару дней в этих областях появляется ватообразный налет белого цвета, состоящий из гиф, переплетенных между собой. Это особенно хорошо заметно при микроскопическом исследовании кожных соскобов. Основываясь, на данных признаках поставлен предварительный диагноз – сапролегниоз. Для лабораторных исследований отобран патологический материал.
Тщательный осмотр рыб в контрольной и в опытных группах показал процентное соотношение поражения карпов. Согласно результатам осмотра уровень поражения рыб равен 13,6 % (контрольная группа), 9,4 % (опытная группа). Рыб из обеих групп подвергнули лечебно-профилактической обработке согласно «Временной инструкции о мероприятиях по борьбе с сапролегниозом рыбы и икры в рыбоводных хозяйствах», утвержденной Руководителем Департамента ветеринарии Минсельхозпрода России 26.05.98г. № 13-4-2/1250.
Исследуя патологический материал в лаборатории, после получения чистой культуры и выращивания на среде Чапека установили возбудителя сапролегниоза.
Другие болезни инвазионной и инфекционной этиологии не были выявлены. Сохранность рыб за весь период составила 89,4 % (опытная группа), 86,2 % (контрольная группа).
Таким образом, согласно результатам проведенного опыта применение добавки Akwa-Biot-Norm карпу кросса «Петровский» повышает резистентность к болезням, связанным с негативным воздействием стресс-факторов среды обитания, таким как сапролегниоз.
2.4.5 Ветеринарно-санитарная оценка карпа, выращенного с применением биогенной кормовой добавки Akwa-Biot-Norm
Рыба и продукты ее переработки являются источником многих необходимых для человека питательных веществ и, прежде всего, полноценных белков, жиров, углеводов, минеральных элементов и витаминов. Регулярное употребление мяса рыб способствует профилактике риска развития заболеваний сердца и сосудов (Г.И. Симонова и соавт., 2006; Н.В. Потапова, 2012; И.Г. Серегин и соавт., 2014). Потребление рыбы одним человеком по нормам Всемирной организации здравоохранения должно составлять 18,2 кг в год (Р.Ш. Тайгузин и соавт., 2015).
Продовольственная безопасность нашей страны должна гарантироваться выпуском качественной и безопасной продукции отечественными производителями, а показатели ее безопасности в ветеринарно-санитарном и санитарно-гигиеническом отношениях должны соответствовать отечественным и международным требованиям (В.И. Дорожкин и соавт., 2016).
В отечественной литературе имеются работы многих исследователей, в которых рассматривается проблема безопасности и ветеринарно-санитарной оценки её.
Ветеринарно-санитарная экспертиза рыбы направлена на обеспечение получения доброкачественной продукции из рыбоводных хозяйств и рыбохозяйственных водоемов, и является обязательной составной частью общего ветеринарного надзора (В.С. Прудников и соавт., 2003; С.Г. Друковский и соавт., 2017).
Качество рыбы и рыбных продуктов контролируют органолептическим и лабораторным методами. Живую здоровую рыбу исследуют только по органолептическим показателям. При необходимости живую, а также снулую (парную) рыбу подвергают лабораторным исследованиям.
При органолептических исследованиях оценивают внешний вид и упитанность рыбы, состояние слизи, чешуи и наружного покрова, глаз, цвета жабр, определяют запах с поверхности тушки и из глубины мышц. При необходимости неразделенную рыбу вскрывают и исследуют внутренние органы, проводят пробу варкой.
Результаты исследований органолептических показателей мяса рыб контрольной и опытной групп отражены в таблице 5.
Таблица 5 – Органолептические показатели карпа
| Показатель | Группа | |
|---|---|---|
| контрольная | опытная | |
| жаберные крышки | плотно закрывают жаберную полость | |
| жабры | покрыты тягучей, чистой, прозрачной слизью, с легким запахом сырой рыбы, цвет темно-красный. | |
| состояние: слизи | прозрачная | |
| глаз | светлые, выпуклые, роговица прозрачная | |
| брюшка | не вздутое, мягкое, без пятен | |
| мышечная ткань:
цвет |
белесовато-сероватый, свойственный здоровой рыбе | |
| запах | без постороннего запаха, ощущается специфический запах сырой рыбы | |
| консистенция | упругая, плотно прилегает к костям | |
| проба варкой | бульон прозрачный, на поверхности большие блески жира, запах рыбный, приятный, мясо хорошо разделяется на мышечные пучки | |
Как видно из таблицы, органолептические показатели рыб контрольной и опытной групп не отличаются и отвечают требованиям доброкачественной рыбы. В ходе вскрытия рыб обращали внимание на состояние внутренних органов. При осмотре внутренних органов характерные патологоанатомические изменения и паразиты не обнаружены.
Для обоснования эффективности использования кормовой добавки при выращивании карпа, был изучен химический состав мышечной ткани рыбы по пять образцов от каждой группы. Не только от соотношения в теле съедобных и несъедобных частей и органов зависит пищевая ценность рыбы, но и химического состава. Химический состав мяса рыб характеризуется, прежде всего, содержанием воды, азотистых веществ, липидов, минеральных веществ, углеводов, витаминов. Он не является постоянным и существенно зависит от вида, физиологического состояния, возраста, пола, мест обитания и других факторов. От вида кормов во многом зависит химический состав мяса рыбы. Рыба, питающаяся естественной пищей, отличается от рыбы, которую кормят искусственными кормами меньшим содержанием углеводов в печени и мышцах, а также содержит меньше жира.
Для оценки качественного состава мышечной ткани выращенного карпа мы определяли ее химический состав (вода, сухое вещество, жир, зола). Содержание влаги определяли по потере массы испытуемых образцов при их высушивании при температуре 100-105° С. Определение содержания жира проводили методом Сокслета при многократной экстракции жира до постоянной массы. Результаты определения химического состава мяса рыб представлены в табл. 6.
Из приведенных в таблице данных видно, что химический состав мышечной ткани подопытных рыб достоверных отличий не имеет.
Таблица 6 – Химический состав мышечной ткани карпа
| Показатель | Группа | |
| контрольная | опытная | |
| Массовая доля влаги, % | 70,5±0,36 | 70,4±0,31 |
| Массовая доля сухого вещества, % | 29,5±0,14 | 29,6±0,12 |
| Массовая доля жира, % | 10,44±0,08 | 10,47±0,08 |
| Массовая доля золы, % | 1,3±0,08 | 1,3±0,09 |
Результаты наших исследований показали, что использование биогенной кормовой добавки Akwa-Biot-Norm не повлияло на химический состав мышечной ткани рыб.
Одновременно нами изучено содержание токсичных элементов и их количественные характеристики. Содержание токсичных элементов в мышечной ткани рыб представлено в табл. 7.
Таблица 7 – Содержание токсических элементов и пестицидов
| Показатель | Значение характеристики | |||
|---|---|---|---|---|
| ед. физич. велич. | по НД не более | Группа | ||
| контрольная | опытная | |||
| Токсичные элементы: | ||||
| свинец | мг/кг | 1,0 | не обнаружено | |
| мышьяк | мг/кг | 1,0 | не обнаружено | |
| кадмий | мг/кг | 0,2 | 0,007 | 0,007 |
| ртуть | мг/кг | 1,0 | 0,0019 | 0,0018 |
| Пестициды: | ||||
| гексахлорциклогексан
(альфа, бета, гамма-изомеры) |
мг/кг | 0,03 | не обнаружено | |
| ДДТ и его метаболиты | мг/кг | 2,0 | не обнаружено | |
Результатами проведенных исследований установлено, что в пробах мышечной ткани рыб контрольной и опытной групп содержание кадмия и ртути не превышало предельно допустимых концентраций, а такие элементы как мышьяк и свинец не обнаружены.
Результаты микробиологических исследований мяса карпа представлены в табл. 8.
Таблица 8 – Результаты микробиологических исследований мяса рыб
| Показатель | Значение характеристики | |||
| ед. физич. велич. |
по НД не более |
Группа | ||
| контрольная | опытная | |||
| Микробиологические
показатели: КМАФАнМ |
КОЕ/г | 5×104 | < 1×10² | < 1×10² |
| БГКП (колиформы) | в 0,01 г | не допускается | не обнаружено | |
| Starphylococcus aureus | в 0,01 г | не допускается | не обнаружено | |
| Патогенные, в т. ч.
Сальмонеллы и L. monocytogenes |
в 25 г | не допускается | не обнаружено | |
Микробиологические исследования мяса карпа показали, что количество мезофильных аэробных и факультативно-анаэробных микроорганизмов (КМАФАнМ) в пробах рыб не превышают требованиям безопасности и пищевой ценности пищевых продуктов. Бактерии группы кишечных палочек (БГКП), стафилококки, сальмонеллы и L. monocytogenes не выделялись из всех отобранных проб (контрольной и опытной).
2.5 Оценка физико-химического профиля водоема на фоне применения биогенной кормовой добавки
Многие биотехнологические операции, выполняемые на аквафермах, однозначно приводят к внесению в водную среду продуктов метаболизма культивируемых гидробионтов (фекалии, псевдофекалии и экскреции), а также остатков несъеденного корма. В целом, реципиентом растворимых отходов акваферм является водная толща, а нерастворимые остатки накапливаются в донных отложениях. Увеличивающееся поступление растворимых азота и фосфора может привести к гипернутрификации – сверхобогащению биогенными элементами гидроэкосистем, сопряженных с аквафермой. В конечном итоге это вызывает их эвтрофикацию – повышение уровня первичного продуцирования. Имеются указания на случаи «цветения» фитопланктона в местах расположения садковых хозяйств. Наибольшие количества твердых отходов (преимущественно в виде органического углерода и азота) оседает на дно в непосредственной близости от садков. Перенасыщение бентической экосистемы органическими остатками вызывает резкое возрастание потребления кислорода донными осадками. Как следствие, возможно ускорение процессов реминерализации органического азота, снижение биомассы макробентоса и изменение видового состава донных сообществ. В экстремальных случаях наблюдается формирование под садками безжизненных бескислородных зон, в которых концентрируются двуокись углерода, метан и сероводород.
Имеются указания на обнаруженные локальные эффекты кислородного дефицита в водной толще непосредственно на аквафермах, обусловленного интенсивным дыханием объектов выращивания в садках.
Существенную нагрузку на водные экосистемы оказывают активные химические вещества, вносимые в воду с различными целями в процессе культивирования гидробионтов: медицинские препараты, средства дезинфекции, анастетики, биоциды, гормоны, стимуляторы роста, средства отпугивания хищников и паразитов и др.
Опасность в данном случае представляет накопление долгоживущих соединений в тканях культивируемых организмов, их потенциальная токсичность для некультивируемых гидробионтов, а также стимулирование повышения сопротивляемости антибиотикам микробиальных водных сообществ.
Высокая концентрация культивируемых объектов в районах акваферм приводит к резкому повышению угрозы инфекционных и стрессовых заболеваний гидробионтов.
Перечисленные виды негативных воздействий акваферм на сопряженные экосистемы не позволяет рассматривать аквакультуру как абсолютно «экологически безопасный» или «экологически чистый» вид антропогенной деятельности.
Один из важнейших вопросов оценки экологических рисков при ведении высокоинтенсивного прудового рыбоводства, являющегося основой товарной аквакультуры на территории РФ, это оценка влияния их на качество воды открытых природных водных объектов. Открытые природные водоемы с одной стороны являются водоисточниками для рыбоводных предприятий, а с другой служат местом сброса воды из прудов рыбоводного хозяйства. Например, достаточно хорошо изучено отрицательное влияние на организм рыб солей тяжелых металлов. Они не только могут быть ответственны за отравления рыб, но и вызывают такое заболевание, как непаразитарная катаракта. Помимо это тяжелые металлы накапливаются в организме рыб, что безусловно снижает качество конечной пищевой рыбной продукции.
В искусственных водоемах (прудах) где ведется интенсивное выращивание гидробионтов, формируется агробиоценоз, с собственным специфичным качеством воды, которое может оказывать влияние на качество воды в природном водном объекте. Помимо этого существует четко выраженная обратная связь – качество воды в природном объекте напрямую влияет на эффективность биотехнологий культивирования рыб.
Гидрохимические показатели среды представлены в таблице 9.
Значения растворенного кислорода находились в пределах 6,30-7,20 мг/л. Активная реакция среды колебалась от 7,10 до 7,70. Нитраты и нитриты, а также азот аммонийных соединений были ниже предельно допустимых концентраций. Фосфаты, хлориды и железо не выходили за пределы их оптимального содержания вводе. Общая жесткость воды соответствовала предъявляемым требованиям.
Таблица 9 – Гидрохимические показатели воды водоема
| Показатель | Значение | ОСТ 15.372-87 |
| Кислород, мг/л
рН Цветность, градусы Азот аммонийных соединений, мг/л Азот нитритов, мг/л Азот нитратов, мг/л Фосфаты, мг/л Общая жесткость, мг-экв/л Хлориды, мг/л Железо, мг/л |
6,30-7,20
7,10-7,70 22,00 0,5 0,008 0,40 0,12 3,95 21,50 0,40 |
Не менее 6,0
7,00-8,00 30,00 0,5 0,02 1,00 0,30 3,80-4,20 20,00-35,00 0,50 |
Следовательно, проведенными исследованиями физико-химического режима водоема установлено, что все гидрохимические показатели воды соответствовали требованиям ОСТ 15.372-87 для выращивания карпа и находились в оптимальных пределах.
ВЫВОДЫ
1. Разработана технология введения биогенной кормовой добавки Akwa-Biot-Norm в состав комбикормов для карпа, которая заключается в следующем. Необходимое количество биогенной кормовой добавки предварительно вносили в суспензию желатины и выдерживали до полного растворения ингредиентов. Полученную суспензию, равномерно размешивая, добавляли в комбикорм. Смешанную массу комбикорма использовали для кормления рыб согласно нормам кормления. Такой метод приготовления кормов за счет плохой растворимости желатины и быстрой поедаемости практически исключает потерю препарата в результате вымывания в воде.
2. На фоне применения биогенной кормовой добавки Akwa-Biot-Norm на основе полисахаридного комплекса дрожжевых клеток Saccharomyces cerevisiae средняя масса карпов в конце опытного периода была больше контрольного показателя на 2,19 %, а прирост живой массы выше на 2,71 %.
3. Биогенная кормовая добавка способствует активизации гемопоэза в организме рыб, о чем свидетельствует достоверное, относительно контрольного показателя, увеличение в крови карпов опытной группы количества эритроцитов на 8,5 % и гемоглобина на 9,4 %.
4. Установлен лейкоцитоз в пределах физиологических норм с выраженным лимфоцитозом, имеющим абсолютное большинство в лейкоцитарной формуле и некоторое снижение доли нейтрофилов, при сохранении их большого количества, что свидетельствует о высокой степени развития клеточного звена системы иммунитета.
5. Применение биогенной кормовой добавки Akwa-Biot-Norm карпу кросса «Петровский» в условиях садкового содержания в естественных водоемах активизирует клеточные и гуморальные факторы неспецифической защиты организма: бактерицидной активности сыворотки крови – на 12,2 % (Р<0,05), фагоцитарной активности нейтрофилов – на 14,6 % (Р<0,05), лизоцимной активности плазмы крови – на 9,0 % (Р<0,05).
6. Добавление в комбикорм для карпов биогенной кормовой добавки Akwa-Biot-Norm повышает резистентность рыбы к заболеваниям и обеспечивает большую сохранность. Так, особей, пораженых сапролегниозом в опытной группе было в 1,45 раза меньше, чем в контрольной, а сохранность была выше на 3,2 %.
7. Биогенная кормовая добавка Akwa-Biot-Norm не оказывает негативное влияние на органолептические, биохимические и спектрометрические показатели мяса рыб, и обеспечивает его доброкачественность и безопасность.
8. Предложенная технология введения биогенной кормовой добавки Akwa-Biot-Norm в состав комбикормов для карпа не оказывает негативное воздействие на водные ресурсы в результате выполнения производственных рыбоводных процессов. Исследованиями физико-химического режима водоема установлено, что все гидрохимические показатели воды соответствовали требованиям ОСТ 15.372-87 для выращивания карпа и находились в оптимальных пределах.
С целью охраны водных ресурсов и обеспечения экологической безопасности в зоне деятельности объектов прудовой аквакультуры, стимуляции роста и развития карпов, профилактики их заболеваемости в условиях эколого-технологического прессинга рекомендуем применять биогенную кормовую добавку Akwa-Biot-Norm на основе полисахаридного комплекса дрожжевых клеток Saccharomyces cerevisiae.
Рекомендуем скармливать рыбам комбикорм, обогащенный биогенной кормовой добавкой Akwa-Biot-Norm из расчета 25 мл на 1 кг комбикорма в течение 14 суток. В результате достигается стимуляция роста и профилактика заболеваемости за счет активизации неспецифической резистентности организма.
СПИСОК ОПУБЛИКОВАННЫХ ПО ТЕМЕ РАБОТ:
- Семенов, В.Г. Биогенная кормовая добавка Akwa-Biot-Norm в реализации биоресурсного потенциала рыб / В.Г. Тюрин, В.Г. Семенов, Н.И. Косяев, Д.А. Никитин // Российский журнал «Проблемы ветеринарной санитарии, гигиены и экологии».- М., 2019.- № 4(32).- С.441-448
- Semenov, V.G. The use of Akwa-Biot-Norm biogenic feed additive in the cultivation of fish / V.G. Semenov, F.P. Petryankin, N.I. Kosyaev, D.A. Nikitin, G.M. Toboev, A.P. Nikitina, G.P. Tikhonova // IOP Conference Series: Earth and Environmental Science.- Volume 346, Issue 1, 15 October 2019, 012051.- 5th International Conference on Agricultural and Biological Sciences, ABS 2019; Macau University of Science and TechnologyMacau; China; 2019 — 24 July 2019; Код 153300. Входит в базу Scopus.
- Семенов, В.Г. Влияние биогенной кормовой добавки на рост и сохранность рыб / В.Г. Семенов, Н.И. Косяев, Д.А. Никитин, А.П. Никитина // Вестник Чувашской государственной сельскохозяйственной академии.- Чебоксары, 2019.- № 3(10).- С.80-84.
- Семенов, В.Г. Ветеринарно-санитарная оценка рыбы при применении биогенной кормовой добавки / В.Г. Семенов, Ф.П. Петрянкин, Н.И. Косяев, Д.А. Никитин, А.П. Никитина, Г.П. Тихонова, В.В. Григорьева // Перспективы развития аграрных наук: мат. междунар. науч.-практ. конф.- Чебоксары, 2019.- С.43-45. Входит в базу Scopus.
- Семенов В.Г. Эффективность применения биогенной кормовой добавки Akwa-Biot-Norm в рыбоводстве / В.Г. Семенов, Н.И. Косяев, Д.А Никитин., А.П. Никитина / Актуальные проблемы и перспективы развития ветеринарной и зоотехнической наук: мат. всерос. науч.-практ. конф. с междунар. участием.- Чебоксары, 2019.- С.149-153.
- Тюрин, В.Г. Биогенная кормовая добавка Akwa-Biot-Norm в реализации биоресурсного потенциала рыб / В.Г. Тюрин, В.Г. Семенов, Н.И. Косяев, Д.А. Никитин // Российский журнал «Проблемы ветеринарной санитарии, гигиены и экологии»*.- М., 2019.- № 4(32).- С.441-448.
- Semenov V. Veterinary-sanitary evaluation of fish when applying the Akwa-Biot-Norm nutrient feed additive / V Semenov, F Petryankin, N Kosyaev, D Nikitin, A Nikitina, G Tikhonova, V Grigorieva // AgroScience-2019. IOP Series: Earth and Environmental Science.- 2020 (в печати).
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
- Багров, А.М. Избранные труды ВНИИПРХ / А.М. Багров и др. // Кн.1.- Том 1–2.- М.: ВНИИПРХ, 2002.- 528 с.
- Багров, А.М. Избранные труды ВНИИПРХ / А.М. Багров и др. // Кн.2.- Том 3–4.- М.: ВНИИПРХ, 2002.- 504 с.
- Багров, А.М. Способы увеличения объемов производства продукции аквакультуры в пресноводных водоемах России / А.М. Багров, Ю.Т. Сечин, Е.А. Гамыгин // Рыбоводство и рыбное хозяйство.- М., 2014.- №6.- С. 3-11.
- Буяров, В.С. Эффективность применения биологически активных добавок в рыбоводстве / В.С. Буяров, Ю.А. Юшкова // Вестник Орловского государственного аграрного университета.- Орел, 2016. — № 3(60).- С.30-39.
- Виноградов, В.К. Краткие итоги акклиматизации представителей китайского равнинного и североамериканского комплексов и других видов рыб на территории России / В.К. Виноградов // Актуальные вопросы пресноводной аквакультуры: сборник научных трудов.- Вып.78.- М.: Изд-во ВНИ-РО, 2002.- С. 188-193.
- Головин, П.П. Кадастр лечебных препаратов, используемых и апробированных в аквакультуре России и за рубежом / П.П. Головин, Н.А. Головина, Н.Н. Романова.- М.: ФГНУ «Росинформагротех», 2005.- С.56.
- Грозеску, Ю.Н. Биологическая эффективность применения пробиотика субтилис в составе стартовых комбикормов для осетровых рыб / Ю.Н. Грозеску, А.А. Бахарева, Е.А. Шульга // Известия Самарского научного центра Российской академии наук.- Кинель, 2009. — Т.11. — №1(2).- С.42-45.
- Гуцулюк, О.Н. Влияние пробиотических добавок на гематологические и рыбоводные показатели годовиков русско-ленского осетра / О.Н. Гуцулюк // Самарский научный вестник.- Кинель, 2015.- №4(13).- С.113-116.
- Друковский, С.Г. Ветеринарно-санитарные и экологические мероприятия, обеспечивающие безопасность выращиваемой рыбы на водоемах комплексного назначения. / С.Г. Друковский, И.Р. Смирнова, Г.Е. Серветник, В.В. Зотов, А.В. Медников, И.В. Кущ // Российский журнал «Проблемы ветеринарной санитарии, гигиены и экологии».- М., 2017. — №2.-С.88-92.
- Жатканбаева, Д.М. Испытание в аквакультуре биологически активных веществ, повышающих иммунное состояние рыб /Д.М. Жатканбаева, С.Л. Койшибаева, Н.Б. Булавина и соавт. // Теория и практика борьбы с паразитарными болезнями.- М., 2013.- №4.- С.151-154.
- Закенфельд, Г.К. Иммунологический механизм действия полисахаридов дрожжевых клеток Sacharomyces cerevisia / Г.К. Закенфельд.- Рига, 1990.- С.152.
- Игнатов, П.Е. Способ получения иммуностимулятора / П.Е. Игнатов [и др.]. // Авторское свидетельство SU №1759424, зарегистрирован 07.09.1991 г.
- Игнатов, П.Е. Очерки об инфекционных болезнях у собак / П.Е. Игнатов.- М., 1995.- С.101.
- Китаев, И.А. Выращивание ленского осетра в индустриальных условиях с применением кормовой добавки «Абиопептид» / Китаев И.А., Гусева Ю.А., А.А. Васильев, С.С. Мухаметшин // Аграрный научный журнал, 2014. — № 12.- С.10-12.
- Китаев, И.А. Эффективность использование препаратов «Абиопептид» и «Ферропептид» в кормлении ленского осетра в установках замкнутого водоснабжения / И.А. Китаев, А.А. Васильев, Ю.А. Гусева, С.С. Мухаметшин // Аграрный науч. журнал, 2014. — № 7.- С.9-11.
- Мирзоева, Л.М. Аквакультура и иммуностимуляторы / Л.М. Мирзоева // Аквакультура. Корма и кормление рыб, 1999. — №2.- С.36-38.
- Морузи, И.В. Продолжительное влияние низких температур во время зимовки на состояние сеголетков карпа / И.В. Морузи, Е.В. Пищенко // Рыбоводство и рыбное хозяйство.- М., 2007.-№12 (22).- С. 36-39.
- Морузи, И.В. Влияние низких температур и длительного голодания на зимующих сеголетков карпа / И.В. Морузи, Г.А. Ноздрин, П.Н. Смирнов, Е.В. Пищенко, З.А. Иванова, П.В. Белоусов // Вестник Новосибирского аграрного университета.- Новосибирск, 2012.- №1-2 (22).- С. 80-82.
- Морузи, И.В. Технология выращивания сеголетков карпа / И.В. Морузи, Е.В. Пищенко // Рыбоводство и рыбное хозяйство.- М., 2014.- №9.- С. 59-68.
- Морузи, И.В. Первичная продукция прудов и ее трансформация при выращивании рыбы в поликультуре / И.В. Морузи, Е.В. Пищенко, Л.А. Осинцева, А.Г. Незавитин, Г.Н. Мисейко // Фундаментальные исследования.- М., 2015.- №2-5.- С. 1897-1902.
- Петрянкин, Ф.П. Профилактика и лечение заболеваний телят с применением иммуномодуляторов / Ф.П. Петрянкин, Н.В. Евдокимов, И.И. Крылова.- Чебоксары: Информлисток ЦНТИ, 1992. — №271.- C.92.
- Петрянкин, Ф.П. Использование биологически активных препаратов при выращивании молодняка / Ф.П. Петрянкин, Л.В. Пыркина, И.И. Крылова // Ветеринария.- М., 1994. — №4. — С.13-14.
- Петрянкин, Ф.П. Иммуностимуляторы в практике ветеринарной медицины / Ф.П. Петрянкин, В.Г. Семенов, Н.Г. Иванов // Монография — Чебоксары: Новое Время, 2015.- 272 с.
- Пономарев, С.В. Результаты научной оценки эффективности и продуктивного действия новых кормов для рыб зарубежного производства в условиях хозяйств с естественным и регулируемым термическим режимом выращивания / С.В. Пономарев, Ю.Н. Грозеску, Е.Н. Пономарева, В.Г. Чипиков, Н.В. Болонина // Рыбное хозяйство.- М., 2009.- №6.- С. 63-65.
- Пономарев, С.В. Технология кормления и выращивания сиговых рыб, хариуса, белорыбицы, нельмы бассейновым, садковыми комбинированными методами / С.В. Пономарев, А.А. Бахарева, Ю.Н. Грозеску, Ю.В. Федоровых // Рыбоводство и рыбное хозяйство.- М., 2015.- №7.- С. 56-65.
- Пономарев, С.В. Инновационные решения для повышения эффек-тивности аквакультуры / С.В. Пономарев, Ю.В. Федоровых, Н.А. Ушакова, С.И. Новиков, Ю.М. Ширина, О.А. Левина, Б.М. Куркембаева, А.Т. Порфирьев // мат. Всероссийской научно-практ. конф.- М., 2019.- С. 305-309.
- Потапова, Н.В. Рыба и морепродукты / Н.В. Потапова. — СПб.: Амфора, 2012.- С.47.
- Пронина, Г.И. Возможность повышения иммунной устойчивости гидробионтов в аквакультуре / Г.И. Пронина // Известия Оренбургского государственного аграрного университета.- Оренбург, 2014.- №3.- С.180-182.
- Пронина, Г.И. Использование некоторых иммуно-биохимических показателей для сравнительной оценки различных пород и кроссов рыб, выращиваемых в рыбоводных хозяйствах / Г.И. Пронина, Д.В. Микряков, Н.И. Силкина, А.Б. Петрушин // Мат. IV межд. конф. «Проблемы патологии, иммунологии и охраны здоровья рыб и других гидробионтов».- М., 2015.- С.83-93.
- Пронина, Г.И. Пути повышения иммунной устойчивости рыб и речных раков в аквакультуре / Г.И Пронина // Мат. Всерос.науч.-прак. конф. «Аквакультура сегодня».- Москва, 2015.- С.213-219.
- Пронина, Г.И. Инновационные решения для повышения эффективности аквакультуры / Г.И Пронина // Всерос.науч.-прак. конф. «Инновационные решения для повышения эффективности аквакультуры».- Москва, 2019.- С.310-327.
- Прудников, В.С. Болезни прудовых рыб: монография / В.С. Прудников, А.В. Мясоедов, Б.Я. Бирман, В.Я. Линник, В.А. Герасимчик, Е.А. Печеницын // Витебская государственная академия ветеринарной медицины, Белорусский научно-исследовательский институт экспериментальной ветеринарии им. С.Н. Вышелесского.- Минск: Технопринт, 2003.- С.96.
- Серёгин, И.Г. Совершенствование контроля качества рыбы и рыбных продуктов / И.Г. Серёгин, Л.П. Михалева, В.Е. Никитченко // Вест. Российского университета дружбы народов. Серия: Агрономия и животноводство, 2014.- №1.- С.64-68.
- Симонова, Г.И. Питание и атеросклероз / Г.И. Симонова, В.А. Тутельян, А.В. Погожева А.В. // Сибирский научный медицинский журнал, 2006. -Т.26.- №2.- С.80-85.
- Тайгузин, Р.Ш. Ветеринарно-санитарная экспертиза пресноводной рыбы в норме и при лигулезе / Р.Ш. Тайгузин, З.С. Евграфова, Л.А. Кучапина // Известия Оренбургского государственного аграрного университета.- Оренбург, 2015.- №3.(53).- С.208-209.
