Титульный лист и исполнители
РЕФЕРАТ
Отчет 200 с., 1 кн., 89 рис., 26 табл., 192 источн., 3 прил.
ИНДУСТРИАЛЬНАЯ АКВАКУЛЬТУРА, АФРИКАНСКИЙ КЛАРИЕВЫЙ СОМ, ИКОРНОЕ ПРОИЗВОДСТВО, ГОРМОНАЛЬНЫЕ ИНДУКТОРЫ, СХЕМЫ ГОРМОНАЛЬНОЙ СТИМУЛЯЦИИ, ВСЕСЕЗОННАЯ РЕПРОДУКЦИЯ, ЖИВЫЕ СТАРТОВЫЕ КОРМА, СПОРОВЫЕ ФОРМЫ ПРОБИОТИКОВ, АДАПТОГЕНЫ, ВЫЖИВАЕМОСТЬ.
Объектом исследований является африканский клариевый сом
Цель исследований: разработка комплексной биотехнологии всесезонного икорного производства параллельно процессу выращивания товарной рыбы в УЗВ.
Проведены гистологические и цитологические исследования динамики полового созревания самок по степени зрелости их гонад и половых продуктов для оценки икорной продуктивности на разных этапах онтогенеза и определения стартового возраста самок, позволяющего использовать их в качестве доноров икры.
Установлены биологические закономерности, регламентирующие кратность получения икры, временные интервалы ее созревания, обоснована продолжительность восстановительного периода самок после отдачи икры.
Получен новый пищевой продукт диетического питания – икра африканского клариевого сома.
Исследованы особенности сезонной динамики икорной продуктивности и расшифрованы механизмы, позволяющие регулировать ее в период спада гормональной активности в осенне-зимний сезон. Разработаны новые подходы в репродуктивной биотехнологии на основе использования адаптогенов, позволяющих успешно пройти критические стадии эмбриогенеза, повысить естественную резистентность и адаптационную пластичность на ранних этапах постнатального онтогенеза. Обосновано использование модифицированных кормов на основе споровых форм пробиотиков — антагонистов патогенов. Гистологические исследования подтвердили оздоравливающее влияние пробиотика споротермина на органы пищеварительной системы сома. Дана сравнительная оценка скорости роста и особенностей развития генераций клариевого сома репродуцированных в разные сезоны года и определены оптимальные периоды для получения генераций с наиболее высокой скоростью роста. Разработана и внедрена технология культивирования живых стартовых кормов для рыб – науплий артемии, обогащенных адаптогенами и витаминами.
Исследования показали, что икра и мясо африканского сома обладают высокой пищевой ценностью, сожержат полный спектр незаменимых аминокислот и полиненасыщенных жирных кислот и могут быть рекомендованы в качестве продукта питания для профилактики сердечно-сосудистых заболеваний.
Согласно экспертному заключению ОГБУ «Симбирский референтный центр ветеринарии и безопасности продовольствия»; выращенная нами рыба является безопасным, экологически чистым продуктом и отвечает всем требованиям ГОСТ 814-96, ТР ТС 021/2011 Технический регламент Таможенного союза «О безопасности пищевой продукции», ТР ЕАЭС 040/2016 Технический регламент Евразийского экономического союза «О безопасности рыбы и рыбной продукции».
Разработанная технология внедрена в Ульяновской области в Майнском районе в Крестьянском фермерском хозяйстве Исакова М. В.
Проект награжден Золотой медалью и дипломом на Российской агропромышленной выставке «Золотая осень 2019», организованнной Министерством сельского хозяйства Российской Федерации на базе ВДНХ. 9-12 октября 2019 г.
В настоящем отчете о НИР применяют следующие термины с соответствующими определениями.
Адаптогены — фармакологическая группа препаратов природного или искусственного происхождения, способных повышать неспецифическую сопротивляемость организма к широкому спектру вредных воздействий физической, химической и биологической природы
Аквакультура — разведение и выращивание водных организмов (рыб, ракообразных, моллюсков, водорослей) в естественных и искусственных водоёмах, а также на специально созданных морских плантациях.
Африканский клариевый сом — или мраморный клариевый сом, или нильский клариас (лат. Clarias gariepinus) обитает по всей Африке, включая водоёмы Сахары, в бассейне реки Иордан, в Южной и в Юго-Восточной Азии.
Гаметы или половые клетки, — репродуктивные клетки, имеющие гаплоидный (одинарный) набор хромосом и участвующие, в частности, в половом размножении. При слиянии двух гамет в половом процессе образуется зигота…
Гаметогенез или предзародышевое развитие — процесс образования половых клеток, или гамет. Поскольку в ходе гаметогенеза специализация яйцеклеток и сперматозоидов происходит в разных направлениях, обычно выделяют оогенез и сперматогенез.
Гонады — (половые железы, репродуктивные железы) — органы животных, продуцирующие половые клетки — гаметы. Женские гонады называются яичниками, мужские — семенниками.
Гипофиз — мозговой придаток в форме округлого образования, расположенного на нижней поверхности головного мозга в костном кармане, называемом турецким седлом, вырабатывает гормоны, влияющие на рост, обмен веществ и репродуктивную функцию. Является центральным органом эндокринной системы;
Гормо́ны — биологически активные вещества органической природы, вырабатывающиеся в специализированных клетках желёз внутренней секреции (эндокринные железы), поступающие в кровь, связывающиеся с рецепторами клеток-мишеней и оказывающие регулирующее влияние на обмен веществ и физиологические функции. Гормоны служат гуморальными (переносимыми с кровью) регуляторами определённых процессов в различных органах
Гормональный индуктор — регулятор, стимулирующий выработку гормонов
Икра — это яйца самок рыб, земноводных, моллюсков, иглокожих. Неоплодотворённую икру используют как пищевой продукт, употребляя её как в сыром, так и в приготовленном виде. Яйца (икринки) развиваются в парных яичниках (гонадах) самок
Иркутин — адаптоген широкого спектра действия, способствует повышению устойчивости организмов к болезням, восстановлению естественного иммунитета. При действии на животных это проявляется в повышении продуктивности: большей оплодотворяемости и рождаемости, выживаемости приплода, увеличению скорости наращивания биомассы
Искусственное оплодотворение икры – смешивание икры и спермы для обеспечения необходимого контакта между ними. Оплодотворение – слияние ядер мужской и женской половых клеток
Культивирование — разведение, выращивание клеток, тканей, микроорганизмов, животных или органов в искусственных условиях
Половые гормоны (гонадостероиды) — гормоны, обеспечивающие развитие и функционирование живых организмов по мужскому или женскому типу
Пробиотик — живые микроорганизмы, приносящие пользу хозяину при введении в адекватных количествах; это микроорганизмы, использующихся в терапевтических целях
Предличинка — свободный эмбрион, выклюнувшийся из икринки и продолжающий нести в себе ряд черт эмбрионального строения органов дыхания, кровообращения, пищеварения. Питается за счет желточного мешка
Личинка — фаза жизненного цикла ряда животных
Регенерация — (восстановление) — способность живых организмов со временем восстанавливать повреждённые ткани, а иногда и целые потерянные органы
Нерестин 7А — синтетический препарат, не относящийся к группе гонадотропинов, его применение основано на стимуляции собственной гонадотропной системы активными рилизинг-факторами и модификаторами рецепторов аденогипофиза
Сперматогенез — развитие мужских половых клеток (сперматозоидов), происходящее под регулирующим воздействием гормонов. Одна из форм гаметогенеза
Споротермин — пробиотическая кормовая добавка, стимулирующая рост сельскохозяйственных животных на основе культур жизнеспособных микроорганизмов Bacillus subtilis и Bacillus Licheniformis КОЕ/г, не менее 3х10/9
Сурфагон — гормональное средство, индуктор полового цикла, синтетический аналог люлиберина, гормональный регулятор, стимулирующий секрецию гипофизарных гонадотропинов лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона
Ооциты — это клетки женского организма, способствующие реализации репродуктивной функции.
Репродукция в биологии — воспроизведение организмами себе подобных.
Яйцеклетка (ооцит) — женская гамета людей, животных, высших растений, а также многих водорослей и других протистов, которым свойственна оогамия.
Актуальность темы исследований. Аквакультура — одно из основных направлений, обеспечивающих продовольственную безопасность страны. Развитие аквакультуры решает важнейшие общегосударственные задачи: обеспечивает население рыбой и другими гидробионтами, снижает импортозависимость, сохраняет запасы водных биоресурсов и биоразнообразие. Стратегией научно-технологического развития Российской Федерации предусмотрен переход к высокопродуктивному и экологически чистому агро- и аквахозяйству.
Мировая аквакультура существенно видоизменилась, в развитых странах она все больше становится ориентированной на высокотехнологичные методы рыборазведения. Индустриальная аквакультура, с ее круглогодичным циклом выращивания рыбы в условиях высокой плотности посадки, способна в короткие сроки насытить внутренний рынок рыбной продукцией. Внедрение инноваций в эту сферу аграрного производства позволит существенно повысить ее результативность.
Сегодня, по данным официальной статистики, среднее потребление рыбы на душу населения в России в 2,5 раза ниже, чем в Европейских странах [1]. До введения санкций Евросоюза доля импортной рыбопродукции на Российском рынке составляла 38%, а в мегаполисах достигала 60%. Общеизвестно, что основными странами-импортерами свежей и охлажденной рыбы в Российскую Федерацию являлись Норвегия, Нидерланды, Дания, Польша, Финляндия.
В настоящее время из-за режима санкций в России, отрезанной от Европейского рыбного рынка, ситуация усугубилась. На этом фоне рыбопотребление катастрофически снижается. По данным интернет источников, в 2015 г. рыбопотребление в РФ упало на 12,5%, а в 2016 г. сразу на 50%, т.е. среднедушевое потребление рыбы снизилось на 11,5 кг [2]. По данным Информагентства по рыболовству, реальное потребление рыбы на душу населения за последние три года в России упало до 12 кг [2, 3, 4].
В этих условиях, развитие отечественной аквакультуры является актуальной общегосударственной задачей. Для ее решения Министерством сельского хозяйства РФ была разработана отраслевая программа «Развитие товарной аквакультуры (товарного рыбоводства) в Российской Федерации на 2015–2020 годы», в которой отмечено, что «…обеспечению прироста производства продукции аквакультуры будет способствовать комплекс корректирующих мероприятий», в числе которых «..проведение научных исследований в области товарной аквакультуры..» [5]. Последний тезис вполне обоснован — развитие отечественной аквакультуры напрямую связано с инновациями, которые всегда являются продуктом научных исследований.
Чтобы переломить ситуацию в отечественной индустриальной аквакультуре, необходимы фундаментальные исследования в области биологии высокотехнологичных и коммерчески ценных видов рыб, разведение которых способно обеспечить прогресс в развитии отрасли.
Разработка и ускоренное внедрение научно-обоснованных инновационных индустриальных биотехнологий производства быстрорастущей деликатесной рыбы, разработанных на основе новых фундаментальных знаний о биологии рыб в индустриальных системах рыборазведения, позволит решить проблему наполнения регионального рыбного рынка [6-8].
В настоящее время из всех объектов аквакультуры России самым быстрорастущим видом рыбы является африканский клариевый сом (Clarias gariepinus). В нашей стране эту рыбу выращивают в Курской, Липецкой, Московской, Ленинградской, Воронежской, Саратовской, Самарской, Ульяновской областях, в Краснодарском крае [9-14].
Африканский клариевый сом — широко распространенный объект товарного рыбоводства в Нидерландах (основной экспортер рыбы этого вида), Польше, Германии, Чехии, Италии, США, Китае, Тайланде, Бразилии, Кении, на Филиппинах и еще в целом ряде стран [15-24].
Уникальная скорость роста африканского сома позволяет из личинки за 6 месяцев вырастить товарную рыбу [25-27]. В качестве объекта индустриальной аквакультуры этот вид рыб в России проходит апробацию с 1994 года [28-30].
Для товарного производства африканского клариевого сома за рубежом и у нас в стране производятся специализированные комбикорма компаниями Aller Aqua (Дания), Coppens (Нидерланды), Аquarex (Россия), Лимкорм (Россия). На этих комбикормах в условиях индустриальной аквакультуры сомы показывают высокие темпы роста, достигая в течение полугода массы 1,0-1,5 кг. [31-37].
Клариевый сом обладает всеми качествами, чтобы стать одним из ведущих объектов отечественной индустриальной аквакультуры, в России интерес к нему неизменно растет. Этот высокопродуктивный вид рыбы не только обладает деликатесным мясом, но и характеризуется высокой выносливостью: он переносит высокий уровень загрязнения среды обитания, пониженное содержание кислорода благодаря наличию внешнего органа дыхания.
Возвращаясь к африканскому клариевому сому, следует отметить, что, по общему мнению, потенциал продуктивности этого объекта рыборазведения в отечественной индустриальной аквакультуре реализован не в полной мере. Для полной реализации генетического потенциала продуктивных показателей представителей этого вида необходимы знания об особенностях его онтогенеза, эйдэкологии, регуляции физиологических процессов, гормональной регуляции овогенеза, нормы и патологии половых клеток, адаптивной нормы овогенеза, фертильности, гипофизарно-овариального механизма, цикличности репродуктивной функции и др. Необходимость в этих знаниях актуализировалась при развитии современной высокотехнологичной индустриальной аквакультуры.
В искусственно-созданных высокотехнологичных индустриальных системах рыборазведения биология рыб претерпевает существенные изменения. В частности, в такой среде рыба утрачивает способность к естественному размножению, поскольку ее половые продукты в полной мере не созревают, достигая только преднерестовой зрелости [37, 38]. В этой ситуации важно знать, как это хроническое состояние напряжения репродуктивной системы, влияет на качество и количество половых продуктов самцов и самок и соответственно на качество и количество продуцируемой икры и потомства. Таких исследований по клариевому сому не проводилось, они проводились у осетровых, которые не относятся к категории рыб с многопорционным нерестом.
В частности, для осетровых было показано, что в условиях напряженного функционирования репродуктивной системы существенно изменяется гаметогенез, качественные и количественные характеристики половых продуктов (икры) самок [39].
При разработке икорно-товарного производства клариевого сома, вопрос о регуляторных механизмах функционирования репродуктивной системы в условиях напряженного овогенеза имеет важное значение, поскольку самок клариевого сома планируется эксплуатировать в режиме доноров икры несколько лет подряд. Этот вопрос важен также для репродуктивной биотехнологии, требующей высококачественной икры от самок маточного стада. Нельзя исключить, что у рыб, как и у млекопитающих, может наблюдаться срыв адаптации, который выражается в патологии, утрате оплодотворяющей способности гамет, яловости.
Решение этого вопроса существенным образом повлияет на технологию икорного производства, режимы эксплуатации, схемы гормональной стимуляции, объемы получаемой икры, периодичность ее получения.
Поскольку в условиях искусственного разведения половые продукты естественным образом не созревают — для каждого цикла репродукции необходима гормональная стимуляция [37, 40]. В настоящее время сложно ответить, не наступает ли с течением времени резистентности к препаратам, стимулирующим созревание гонад [40].
Исследований в этом направлении не проводилось. Возможно, поэтому икорного производства африканского клариаса до сих пор не существует, хотя биологические особенности этого вида рыб свидетельствует о возможности реализации этой идеи [41].
В настоящее время в литературных источниках нет единого мнения о сроках полового созревания африканского клариевого сома. На этот счет существуют взаимоисключающие точки зрения. Согласно Е. Адамеку [42], известному польскому специалисту в области аквакультуры, половое созревание африканского сома у самок наступает в возрасте 6-7 месяцев, а у самцов — в возрасте от полутора до двух лет. По данным российских исследователей половое созревание в искусственных условиях, а следовательно, и возможность использования половых продуктов самцов и самок в искусственном воспроизводстве по данным одних авторов наступает в возрасте 4-6 месяцев при наборе веса 400-600 г. [43], по данным других авторов в возрасте 11-13 месяцев [44], по данным третьей группы исследователей — в возрасте 6 месяцев по достижении массы 200 г и более [45]. Данные противоречивы.
Для африканского сома в природной среде характерна сезонность размножения [46]. У представителей этого вида в естественной среде обитания содержание гонадотропного гормона в гипофизе имеет сезонную динамику, в зимний период гормональный уровень в 4-6 раз ниже, чем летом [46]. Сохраняется ли та же закономерность при разведении в искусственной среде, нивелирующей действие природных факторов, — не известно.
Известно, что каждый преднерестовый стресс влияет на репродуктивную функцию рыб [35, 37, 46, 47], каждое ручное сцеживание икры травмирует самку и после этой процедуры у нее развивается воспалительный процесс [48, 49]. В этой ситуации важно знать, каким по продолжительности должен быть восстановительный период перед последующим использованием доноров икры. До настоящего времени ответа на этот вопрос не было.
Обобщая и акцентируя внимание на основных моментах, следует отметить, что в настоящее время в литературных источниках отсутствуют сведения о пределах толерантности гифофизарно-овариального механизма, о том с какой интенсивностью и частотой можно воздействовать на гаметогенез, чтобы получая икру-сырец и икру для воспроизводства не вызвать истощения и срыва адаптации репродуктивной системы. Все эти вопросы требуют изучения.
Обобщая результаты анализа изученности решаемой проблемы можно заключить, что для успешного развития икорно-товарного производства на настоящий момент нет ответа на целый ряд фундаментальных вопросов, касающихся биологии развития и экологии африканского клариевого сома в условиях индустриальных технологий разведения.
Основная цель реализации проекта – разработка комплексной биотехнологии всесезонного икорного производства параллельно процессу выращивания товарной рыбы в УЗВ.
Задачи:
1) разработка технологии всесезонного получения икры клариевого сома параллельно процессу выращивания товарной рыбы;
2) определение сроков и кратности всесезонного получения икры, исследование динамики полового созревания самок и самцов для осуществления репродуктивной биотехнологии и технологии получения икры;
3) разработка технологических подходов повышающих выход личинок, снижающих уровень аномалий развития, предотвращающих каннибализм и болезни рыб, основанных на использовании адаптогенов и пробиотиков;
4) теоретическое обоснование влияния адаптогенов и пробиотиков на критические стадии развития в эмбриогенезе клариевого сома ;
5) разработка модифицированных кормов, содержащих споровые формы микроорганизмов — антагонистов патогенов;
6) конструирование живых стартовых кормов (науплий артемии) с заданными свойствами для выращивания предличинок и личинок клариаса;
7) оптимизация температурного режима и гидрохимических параметров по показателям: рН, общей минерализации, содержанию кислорода, содержанию нитратов, нитритов, аммиака и других составляющих;
8) обоснование нормативов по выращиванию малька до стадии товарной рыбы на основе оценки: скорости роста, сохранности, уровня каннибализма, устойчивости к заболеваниям, адаптационной пластичности к факторам среды, стрессоустойчивости, выживаемости в условиях высокой плотности посадки;
9) сформировать маточное стадо из генетически ценных производителей, потомство которых демонстрирует выдающуюся скорость роста;
10) дать научно-обоснованную оценку перспектив развития комплексной индустриальной аквакультуры африканского клариевого сома, сочетающей икорное производство с производством товарной рыбы.
Новизна научных исследований. Выдвинута и впервые реализована идея разработки технологии икорного производства параллельно производству товарной рыбы, основанной на фундаментальных исследованиях биологии и экологии африканского клариевого сома (Сlarias gariepinus) в условиях высокотехнологичной индустриальной аквакультуры.
Известно, что условия искусственного рыборазведения, во многом нивелирующие влияние внешней среды, существенно влияют на биологические процессы в организме рыб. Для того, чтобы создать такое икорно-товарное производство необходимы фундаментальные знания биологии рыб, видоизменяющихся в условиях индустриальной аквакультуры.
В частности, в искусственных условиях половое созревание рыб наступает гораздо быстрее, чем в естественной среде, многократно ускоряются процессы наращивания массы тела и развития органов, существенные изменения претерпевает эндокринная система, высокие плотности посадки усиливают влияние биотических факторов, повышая уровень гормонов стресса до критического уровня. Хронический избыток гормонов стресса вызывает снижение мышечной массы, повышает уровень жира, снижает естественную резистентность.
До настоящего времени биология рыб в условиях высокотехнологичной индустриальной аквакультуры мало изучена. Фундаментальные исследования в области биологии африканского клариевого сома в условиях индустриальной аквакультуры позволят выйти на новый уровень научно-обоснованной регуляции биологических процессов, обеспечив наиболее полную реализацию генетического потенциала продуктивности этого вида. Развитие высокотехнологичной индустриальной аквакультуры африканского клариевого сома в направлении икорно-товарного производства актуализирует фундаментальные исследования в области репродуктивной биологии, эндокринологии и экологии этого вида рыб.
Научная новизна. Нами, при проведении исследований впервые показано, что репродукцию клариевого сома и получение икры сырца можно осуществлять круглогодично, а не только в период естественного нереста рыб этого вида. Для реализации проекта круглогодичного получения икры-сырца разработана биотехнология гормональной стимуляции искусственного нереста, имеющая специфические особенности в зависимости от сезона. Впервые показано, что применение в репродуктивном процессе адаптогенов и пробиотиков повышает выход личинок, снижает уровень аномалий развития, предотвращает каннибализм и болезни рыб.
Введение в среду культивирования живых стартовых кормов — науплий артемии пробиотика споротермина, адаптогена трекрезана, и витаминов позволило получить корма с заданными свойствами для выращивания предличинок клариевого сома.
Использование пробиотика «споротермин» позволило разработать модифицированные корма, содержащие споровые формы микроорганизмов — антагонистов патогенов рыб, которые в желудочно-кишечном тракте переходят в вегетативную форму, оптимизируя кишечный микробиоценоз.
Теоретическая и практическая значимость. Полученные нами результаты исследования репродуктивной биологии и гипофизарно-овариального механизма клариевого сома в онтогенезе вносят вклад в разработку научно-обоснованной технологии круглогодичного производства икры и всесезонного нереста, которые будут востребованы в рыбоводных хозяйствах, выращивающих африканского клариевого сома.
Разработана технология искусственного всесезонного нереста африканского клариевого сома. Она обеспечивает круглогодичное многопорционное получение икры самок клариевого сома параллельно процессу выращивания товарной рыбы.
Разработаны методрекомендации по развитию комплексного икорного производства параллельно процессу выращивания товарной рыбы.
Разработана методология эффективного использования адаптогенов при выращивании африканкого клариевого сома на разных этапах онтогенеза. Показано, что адаптогены позитивно влияют на критические стадии эмбриогенеза клариевого сома, существенно снижая уровень аномалий развития.
Разработана методология использования пробиотиков — антагонистов патогенов, препятствующих развитию инфекционных болезней и обеспечивающих экологическую чистоту рыбы.
Сформировано маточное стадо африканского клариевого сома из выдающихся по показателям роста и продуктивности самок, проверенных по качеству потомства.
Степень разработанности темы исследования. До настоящего времени икорного производства африканского клариевого сома не существовало, но в России уже свыше десяти лет существует икорное производство при выращивании осетровых [50]. Из-за высокой стоимости и спроса на черную икру такое производство в аквакультуре осетровых хорошо развито и является экономически эффективным.
Клариевый сом имеет мелкую, вкусную икру темно-зеленого, почти черного цвета. Биологической особенностью этого вида является многопорционный нерест, а это значит, что икру самок африканского клариевого сома можно получать несколько раз. Теоретические расчеты, основанные на особенностях репродуктивной системы этих рыб, показывают, что в течении года от взрослой самки африканского клариаса можно получить более килограмма икры. Основываясь на вышеизложенном можно заключить, что тема производства икры-сырца клариевого сома относится к категории неразработанных, в то время как товарное выращивание клариевого сома – достаточно хорошо разработано.
Уровень значимости исследования для региона. Физиологическая норма потребления рыбы для населения России по нормативам РАН, составляет 23,7 кг. Рассмотрим, как реализуется этот норматив на конкретном примере Ульяновской области. Статистические данные свидетельствуют, что потребление рыбы в последние годы на душу населения в Ульяновской области не превышало 9 кг. В других регионах Поволжского Федерального округа: в Самарской области-13,4 кг, Пензенской — 11,9 кг, Саратовской -11,3 кг [3].
В последнее десятилетие, состояние Волги в зоне Симбирского Поволжья, и других рек и водоемов Ульяновской области и смежных областей внушает опасение. Рыба из таких водоемов не безопасна для употребления.
На территории нашего региона пастбищная аквакультура развита слабо, а индустриальная аквакультура, способная в короткие сроки решить проблему насыщения регионального рынка рыбной продукцией, к сожалению, пока не получила распространения.
Узкий круг хозяйств, занимающихся пастбищным рыборазведением – это не более 11 фермерских хозяйств, несмотря на то, что на территории Ульяновской области расположено 1223 озера, около 900 прудов и водохранилищ. В плане производства рыбы, существующие фермерские хозяйства не способны удовлетворить спрос даже местных муниципальных рынков.
Очевидно, что изменить ситуацию способно внедрение высокотехнологичной индустриальной аквакультуры, основанной на интенсивных биотехнологиях выращивания рыбы в условиях высокой плотности посадки, высшей формой которых являются установки замкнутого водоснабжения. Эти технологии позволяют выращивать многие виды рыбы независимо от природно-климатических условий всесезонно и повсеместно, за счет управления факторами среды обитания и независимо от климатической зоны.
Индустриальная аквакультура в Ульяновской области в настоящее время переживает начальный этап своего становления и остро нуждается в методическом сопровождении и инновационных технологиях, позволяющих повысить эффективность рыбоводства.
По состоянию на 2019 г. Лаборатории экспериментальной биологии и аквакультуры Ульяновского ГАУ является единственной действующей демонстрационной площадкой высокотехнологичной индустриальной аквакультуры, использующей инновационные технологии рыборазведения.
В ходе реализации проекта разработана технология всесезонного нереста и круглогодичного получения икры клариевого сома параллельно процессу выращивания товарной рыбы в мини — УЗВ, которая уже внедрена в Ульяновской области в Майнском районе в Крестьянском фермерском хозяйстве Исакова М. В. и будет передана для реализации в другие фермерские рыбоводческие хозяйства Ульяновской области. Коллектив лаборатории ведет большую работу по популяризации аквакультуры: среди специалистов сельского хозяйства, предпринимателей, фермеров, выпускников школ, всех слоев населения, круглогодично проводя на своей базе экскурсии и семинары.
Сотрудники лаборатории обучают и консультируют фермеров и предпринимателей, которые делают первые шаги в направлении развития индустриальной аквакультуры африканского клариевого сома. По состоянию на 2019 г. в Ульяновской области в стадии формирования три фермерских хозяйства, специализирующихся на индустриальном разведении африканского клариевого сома, на базе которых уже сейчас внедряются элементы технологий, разрабатываемых нашим коллективом.
1 Объекты, материалы и методы исследования
Исследования проводились на базе Лаборатории экспериментальной биологии и аквакультуры Ульяновского государственного аграрного университета имени П.А. Столыпина во все сезоны 2019 г. Объектом исследования являлись самцы и самки африканского клариевого сома на разных этапах онтогенеза.
1.1 Гормональная стимуляция и получение зрелых половых продуктов
Исследования проводились на базе Лаборатории экспериментальной биологии и аквакультуры Ульяновского государственного аграрного университета. Объектом исследования являлись половозрелые самки и самцы клариевого сома весом 1,2-1,7 кг.
Самцов и самок для получения зрелых половых продуктов гормонально стимулировали сурфагоном в сочетании с эглонилом. Два миллилитра жидкого эглонила, с содержанием активного вещества 50 мг вводили во флакон с 10 мл сурфагона, содержащего 5 мкг активного вещества в 1 мл. Для гормональной стимуляции использовали 1,5 мл смеси на 1 кг веса рыбы.
Сурфагон — синтетический аналог люлиберина, гормональный регулятор, стимулирующий секрецию гипофизарных гонадотропинов — лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона. Через 11-12 часов после гормональной стимуляции самки, как правило, были готовы к отдаче икры. В это время из брюшка самки начинали вытекать икринки. Стадию зрелости икры определяли цитологически. По внешним признакам также можно отличить зрелую икру, при созревании гонад ооциты прозрачные, вытекают по одному и не слипаются друг с другом в комок.
У самцов клариевого сома созревание гонад можно определить только инвазивным методом, поскольку спермии при искусственном разведении у них самопроизвольно не вытекают. Чтобы выделить зрелые сперматозоиды, проводилась полная или частичная резекция семенников. После проведенной операции брюшко самцов зашивали хирургическим швом. Извлеченные тестикулы диспергировали чтобы выделить сперматозоиды.
1.2 Оценка зрелости гонад
Оценка зрелости гонад проводилась по шкале Киселевича, согласно которой существует пять стадий зрелости — с I по V и отдельно VI стадия, именуемая как «отнерестившиеся» особи.
Стадия I (ювенальная) — неполовозрелые особи – juvenales. Половые железы неразвиты, плотно прилегают к внутренней стороне стенок тела (по бокам и ниже плавательного пузыря) и представлены длинными узкими шнурами или лентами, по которым нельзя визуально определить пол; просматриваются зоны протоплазматического роста, рассредоточенные между многочисленными оогониями.
Стадия II — созревающие особи или развивающиеся половые продукты после икрометания. Половые железы начали развиваться; на шнурах образуются затемненные утолщения, в которых уже узнаются яичники и семенники. Икринки настолько мелки, что не видны невооруженным глазом. Яичники от семенников (молок) в этот период отличаются тем, что вдоль первых по стороне, обращенной к середине тела, проходит довольно толстый кровеносный сосуд.
Стадия III — особи, у которых половые железы еще далеки от зрелости, но достаточно развиты. Яичники значительно увеличились в размерах, заполняют от 1/3 до 1/2 всей брюшной полости и наполнены мелкими непрозрачными, белесоватыми икринками, ясно различимыми невооруженным глазом. При разрезе яичника икринки трудно отрываются от внутренних перегородок органа, всегда образуют комки по несколько штук вместе.
Стадия IV — особи, у которых половые органы достигли почти максимального развития. Яичники очень велики и заполняют до 2/3 всей брюшной полости. Икринки крупные, прозрачные и при надавливании вытекают. При разрезе яичника и скоблении разреза ножницами икринки соскабливаются поодиночке.
Стадия V — текучие особи. Икра и молоки настолько зрелы, что свободно вытекают не каплями, а струей при самом легком надавливании. Если держать рыбу в вертикальном положении за голову и потряхивать ее, то икра и молоки свободно вытекают.
Стадия VI — отнерестившиеся особи. На этой стадии половые продукты выметаны. Яичники и семенники очень малы, дряблые, воспалены, темно-красного цвета. Нередко в яичнике остается небольшое количество мелких икринок, которые претерпевают жировое перерождение и рассасываются. Через несколько дней воспаление проходит, и половые железы переходят в стадию II, а затем и в стадию III.
1.3 Искусственнное оплодотворение
Искусственное оплодотворение проводили «сухим» способом без использования воды. Для этого сцеженную в стерильную посуду икру орошали смешанной спермой двух самцов из расчета 4 мл спермы на 200-250г икры; затем перемешивали в течение одной минуты, после чего добавляли 200-250 мл воды и еще осторожно перемешивали в течение пяти минут.
Сразу после оплодотворения для устранения патогенной и условно-патогенной микробиоты и повышения неспецифической резистентности будущих личинок оплодотворенную икру промывали в течение получаса растворами, содержащими адаптоген трекрезан в дозе 1 мг/л и пробиотик споротермин в дозе 40 мг/л, при температуре 280С. Инкубацию оплодотворенной икры клариевых сомов проводили на сетке с проточной водой или в аппарате Вейса при температуре воды 28-290С. Среда инкубации также содержала адаптоген трекрезан в дозе 1 мг/л и пробиотик споротермин в дозе 40 мг/л. Содержание кислорода не опускалось ниже 90%. Затем отбирали пробы икры, в которых оценивали долю оплодотворившихся ооцитов.
Качество оплодотворения оценивалась как соотношение в общей массе икры нормально развивающейся, не развивающейся или ложно развивающейся. Морфологический анализ оплодотворенных ооцитов и эмбрионов проводили под бинокуляром Микромед-2 при увеличении: 10х, 20х. Учет выживаемости личинок проводили в первую неделю после выклева.
1.4 Инкубация оплодотворенной икры и культивирование предличинок
Инкубацию оплодотворенной икры клариевых сомов проводили на металлических сетках или в аппарате Вейса при температуре воды 280С и содержании кислорода не менее 90%.; в среду инкубации вводили адаптоген в дозе 1,0 мг/л, скорость протока воды составляла 3 л/мин. Через сутки начиналось вылупление предличинок, которое продолжалось несколько часов. По количеству погибших эмбрионов оставшихся на сетке, рассчитывали долю вылупивщихся предличинок.
На 3 сутки после вылупления у личинок рассасывался желточный мешок, они переходили на активное питание и превращались в личинки. Личинок начинали кормить живыми стартовыми кормами — науплиями артемии каждые 2 часа. Такой тип кормления выдерживали в течение первой недели, а стартовые комбикорма начинали вводить в рацион с четвертых суток кормления.
1.5 Применение адаптогена и пробиотика при выращивании личинок
Начиная с перехода на активное питание в течение последующих 30 суток наблюдали за ростом и развитием личинок, вводя в воду аквариумов адаптоген трекрезан в дозе 1 мг/л., пробиотик 40 мг/л. Стартовые корма рассыпали тонким слоем на бумажной подстилке на столе и орошали раствором адаптогена — 1 г/л, пробиотика — 4 г/л.
Рыбу взвешивали, измеряли ее длину, под бинокуляром исследовали аномалии развития. По проценту гибели определяли выживаемость личинок. Взвешивание осуществляли на электронных весах в начале и в конце опыта. На основании полученных данных рассчитывали абсолютный и среднесуточный прирост веса в опытной и контрольной группах, коэффициент массонакопления.
Относительную скорость роста Cw в % определяли по формуле:
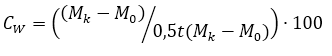
где
Мк— масса рыбы конечная, г;
М0— масса рыбы начальная, г;
t – период времени, сут.
Оценку абсолютного прироста проводили по формуле:
![]()
где
Мк – масса рыбы конечная, г;
М0— масса рыбы начальная, г.
Коэффициент массонакопления Kм определяли по формуле:
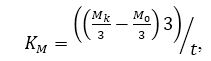
где
Мк — конечная масса, г;
М0-начальная масса;
t — период времени, сут.
С контрольной группой проводились все те же процедуры, что и с опытной, только без использования адаптогена. По остальным параметрам группа контроля ничем не отличалась от экспериментальной.
Эффективность применения адаптогена трекрезана оценивали по показателям оплодотворяемоти ооцитов (%), по выклеву предличинок (%), по количеству аномалий в развитии эмбрионов (%), по выживаемости личинок, по приросту веса. Учет выживаемости личинок проводили в первую неделю после выклева. Опыты проводили в 3-кратной повторности.
1.6 Микробиологическое исследование икры
Для микробиологических исследований пробы икры и сперматозоидов отбирались у пяти самок и пяти самцов в стерильные емкости стерильными инструментами. Определение численности и выделение патогенных и условно-патогенных бактерий проводили в течение первых двух часов после отбора проб.
Для оценки морфологических, культуральных и биохимических свойств бактерий были проведены посевы на плотные питательные среды общего назначения (МПА). Посевы выполнялись в трехкратной повторности. В качестве специальной питательной среды для бактерий, не растущих на простых средах, использовали кровяной агар. Кровяной агар использовали для выявления гемолитических свойств бактерий. Микроорганизмы, проявляющие гемолитическую активность, способны разрушать клетки крови – эритроциты. Для селективного выделения грибов была использована среда Сабуро. Для выделения и дифференциации энтеробактерий использовали элективную среду Эндо. В качестве селективной питательной среды для выделения шигелл и сальмонелл использовали Агар Плоскирева-ГРМ. Колонии бактерий, ферментирующих лактозу окрашиваются в бруснично-красный цвет; колонии бактерий, не ферментирующих лактозу, остаются бесцветными. Идентификацию микроорганизмов производили при помощи определителя Берджи [14]. При бактериологическом исследовании устанавливали численность микроорганизмов в поле зрения микроскопа методом бактериоскопии и общее количество микрофлоры в 1 г икры. Выделяли следующие градации роста микроорганизмов: сливной рост — 108 клеток в 1 г материала, массивный рост — 107 клеток, умеренный рост — 105 клеток, скудный рост — 104 клеток.
1.7 Оценка реакции системы белой крови на пробиотик споротермин
Изучалось влияние пробиотика «споротермин» на лейкограмму крови африканского клариевого сома. Рыба содержалась в бассейнах, оснащенных фильтрами на кварцевом песке; объем бассейна 3,8 м3, глубина — 85 см. Содержание кислорода составляло 70-90%. Суточная смена воды была не менее 25%. Схема опыта представлена на рисунке 1.
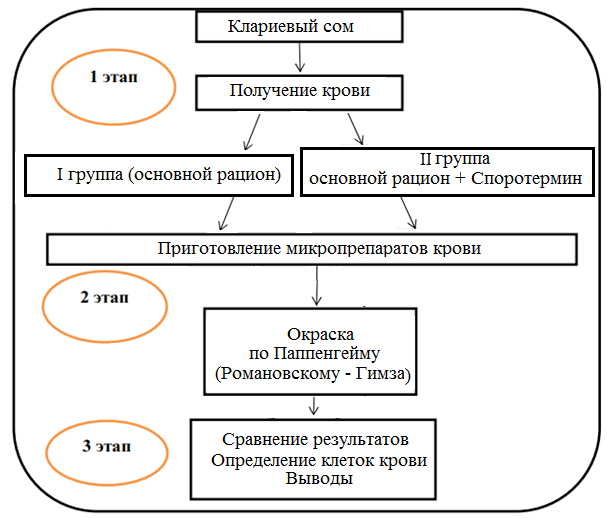
Рисунок 1 — Схема исследований
Объектами исследования являлись 200 особей клариевого сома. Для проведения опытов были сформированы 2 группы по 100 особей в каждой, не отличающиеся по физиологическому состоянию и возрасту. При кормлении использовали экструдированные корма.
Первая группа получала основной рацион, второй группе дополнительно вводили «Споротермин» с кормами и в воду из расчета 1 г на 500 л.
После завершения опыта производили убой, чтобы получить кровь для анализа. Мазки крови готовили на чисто вымытых предметных стеклах, которые хранились в смеси этилового эфира и этилового спирта 1:1. Мазки окрашивали по Паппенгейму, промывали дистиллированной водой, высушивали на воздухе, а затем просматривали в световой микроскоп. В мазках производился подсчет всех групп лейкоцитов в пересчете на 100 клеток, чтобы расшифровать лейкоформулу, отражающую процентное соотношение между отдельными видами лейкоцитов. Клетки классифицировали в соответствии с их описанием [10, 11].
1.8 Культивирование живых стартовых кормов — науплий артемии
Объектом исследования являлись половые продукты A. salina на стадии яйца (цисты), вылупившиеся науплии, артемии ювенильной стадии онтогенеза и половозрелые артемии.
Для управления онтогенезом A. salina мы проводили активацию сухих яиц вымораживанием. Яйца артемии в течение месяца выдерживали при
-220С в камере холодильника. Перед процедурой инкубации, яйца в течение двух часов выдерживали при комнатной температуре и проверяли их доброкачественность, просматривая под четырехкратным увеличением светового микроскопа.
Доброкачественные яйца сохраняли целостность структуры, неповрежденную оболочку без вмятин и выпуклостей. Эти признаки свидетельствовали о хорошей сохранности яиц. Для инкубации использовали навески яиц массой 200 мг, которые в дальнейшем использовали на один литр культуральной среды. Производили подсчет количества яиц в навеске.
Для инкубации яиц артемий использовали аппарат Вейса. В качестве культуральной среды использовали 3% раствор NaCI. Для его приготовления использовали NaCI марки ХЧ. В колбы аппарата Вейса заливали по три литра рабочего раствора NaCI.
Поддерживали температуру культуральной среды на уровне 25-260С, рН -7.5-8.0, обеспечивали интенсивное освещение, высокий уровень насыщения среды кислородом. В колбе Вейса обеспечивали хорошую аэрацию среды, используя сильный ток воздуха и подбирая эффективный распылитель. В таких условиях происходило постоянное перемешивание яиц, они не оседали ни на дно, ни на стенки сосуда. Аэрация воды была круглосуточной и выключалась только в период кормления артемий. В наших исследованиях плотность популяции артемий была не высокой, во избежание развития патогенной микрофлоры, и составляла в среднем четыре тысячи особей на литр.
Для кормления науплий артемий использовали таблетированный препарат спирулины. Перед кормлением его предварительно растирали в ступке в мелкодисперсный порошок, который при кормлении рассыпали по поверхности воды. На третьи сутки культивирования артемий переходили к трехкратному кормлению. Ход культивирования контролировали каждые восемь часов под микроскопом. При этом оценивали состояние артемий на всех стадиях онтогенеза, отмечали характерные черты метаморфоза, производили промеры тела и его частей с помощью окуляр-микрометра.
1.9 Оценка ростовых процессов по экстерьерным и интерьерным показателям
Исследования проводились на мальках 9, 11, 13 и 15 недельного возраста, полученнох в результате искусственного нереста от собственных самцов и самок в результате экстракорпорального оплодотворения икры горомонально-стимулированной самки спермой двух гормонально стимулированных самцов. Кормление осуществляли специализированными гранулированными кормами, подбирая фракции, соответствующие этапам их онтогенеза. Гидрохимические показатели воды в бассейнах контролировали ежедневно раз в сутки, своевременно корректируя, чтобы они не превышали допустимых норм.
Объем выборки составил 450 особей. Экспериментальное поголовье содержалось в бассейне объемом 6 м3. На всех этапах онтогенеза мальков африканского клариевого сома контролировали массу и длину тела. Детальные морфометрические исследования проводились во временном интервале 9-15 недель. Для этого, начиная с 9 недельного возраста, каждые две недели отлавливали по 50 особей, у которых проводили промеры экстерьерных и интерьерных показателей.
У сомов определялись следующие экстерьерные показатели: длина тела рыб, малая длина, длина головы (малая и большая), ширина головы, длина рыла, длина заглазничного отдела головы, высота тела, ширина тела, обхват тела, длина хвостового стебля, высота хвостового стебля.
У сомов также исследовались интерьерные показатели: общая масса рыбы, масса порки, головы, тушки, жабр и наджаберного органа, сердца, плавников, почек, селезенки, печени, внутреннего жира, кишечника, желудка, гонад, кожи, костей, филе.
Для этого каждую особь вскрывали, разрезая от анального отверстия до жаберных крышек, а затем вырезали часть боковой стенки вдоль боковой линии до конца первого разреза. Поэтапно извлекали внутренние органы и взвешивали их абсолютную массу.
Препарирование начинали с сердца, рассекая перикардиальную полость, и надрезая в районе соединения с брюшной аортой и венозного синуса.
Затем идентифицировали гонады, которые распределялись по бокам кишечника, и отделяли их в зоне полового отверстия.
Далее препарировали органы пищеварения. Путем надрезов в области глотки и анального отверстия, извлекали пищевод, желудок, кишечник с поджелудочной железой, печень и селезенку.
Для вычленения печени отсекали ее от желчных протоков и перерезав соединительную ткань на кишечнике. Препарированная печень у африканского клариевого сома имеет нечеткую лопастную форму и отчасти покрывает органы пищеварения сбоку.
Селезенка у африканского клариаса легко идентифицируется, она имеет коричнево-бордовый цвет и округло-овальную форму; она свободно отделяется пинцетом от двенадцатиперстной кишки.
Для получения желудка и кишечника пищеварительный тракт двумя пинцетами расправляли по всей длине. Удаляли ножницами соединительную ткань по всей длине пищеварительного тракта, затем пинцетом осторожно снимали внутренний жир.
Плотно прижимая пищеварительный тракт ко дну кюветы, проводя тыльной стороной скальпеля сверху вниз два или три раза, удаляли содержимое желудка и кишечника, а затем отрезали желудок от кишечника.
Почки темно-бордового цвета расположены вдоль позвоночника двумя тяжами. Это наиболее трудно препарируемый орган. Почки препарировали, отчленяя скальпелем от мышц и соскабливая их.
Голову отделяли соответствующими ножницами, при этом производили поперечный разрез сразу за головным отделом, отрезая от туловища. Кости черепа у африканского клариевого сома очень прочные.
Чтобы извлечь жабры у сома отрезали жаберную крышку в нижней части головы рыбы. После этого жабры были хорошо видны и доступны для препарирования. Вслед за жабрами извлекали наджаберный орган [12].
Каждый из органов осушали фильтровальной бумагой, измеряли и взвешивали на электронных весах для определения абсолютной массы.
По окончании исследований проводили биометрическую обработку данных общепринятыми методами. Достоверность различий определяли по критерию Стьюдента.
1.10 Оптимизация гидрохимического режима
Объектом исследования являлась рыба в возрасте четырех с половиной месяцев (18 недель). Для проведения исследований были сформированы 2 группы рыб по 100 особей в каждой. Рыба была расселена в два бассейна. В бассейне, в котором содержалась контрольная группа, микроорганизмы — нитрификаторы не применялись. Продолжительность наблюдений составляла 30 суток.
Контрольные замеры гидрохимических показателей воды проводили ежедневно после кормления с часовым интервалом в течение 7 часов, в соответствии с особенностями пищеварения рыб. Содержание кислорода и температуру воды определяли с помощью прибора Оксиметра AZ8401. Значения pН и остальные гидрохимические показатели определяли с помощью химических реактивов фирмы Tetra.
Оптимизацию гидрохимического режима проводили с использованием препарата Sera Bio Nitrivec, который расщепляет аммоний отходов жизнедеятельности рыб в нитриты, переводит нитриты в нитраты.
Препарат «Nitrivec» – представляет собой культуру микроорганизмов, способных в фильтрах и рыбоводных модулях сформировать микробиоценоз, обеспечивающий нитрогенный цикл.
Экспериментальной группе в водную среду вводили 20 мл «Nitrivec» на каждые 100 л воды; при каждой смене воды вводили дополнительно по 10 мл препарата «Nitrivec» на каждые 100 л воды. В процессе наблюдений фиксировали поведенческие реакции рыб и состояние их кожных покровов.
1.11 Статистическая обработка результатов исследования
Статистический анализ данных, полученных в результате экспериментов и наблюдений, проводился с использованием стандартной биометрии.
Определение средней арифметической проводилось по формуле:
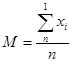 ,
,
где:
![]() — средняя арифметическая;
— средняя арифметическая;
![]() — значения вариант;
— значения вариант;
![]() — количество наблюдений.
— количество наблюдений.
Среднее квадратическое отклонение ![]() рассчитывалось по формуле:
рассчитывалось по формуле:
![]() .
.
Ошибка средней арифметической m рассчитывалась по формуле:
![]()
Для определения статистической значимости различий средних величин двух выборок использовался критерий Стьюдента tst. Для расчета критерия использовалось выражение:
![]() .
.
Расчетное значение tp сравнивалось с табличным значением критерия tst при выбранном уровне доверительной вероятности р≤0,05 и числе степеней свободы i. Eсли рассчитанное значение критерия tp < tst то различия считаются статистически недостоверными.
2 Результаты собственных исследований
2.1 Фундаментальные основы технологии производства икры африканского клариевого сома при выращивании товарной рыбы
Для решения поставленной цели был реализован комплекс задач, включающих разработку технологии всесезонного получения икры клариевого сом, исследование периодичности созревания икры и частоты ее получения, исследование динамики полового созревания самок и самцов для репродуктивной биотехнологии и технологии производства икры.
Были проведены исследования: динамики полового созревания самок (подраздел 2.1.1), их икорной продуктивности в возрасте от 1 года до 4 лет (подраздел 2.1.2), динамики полового созревания самцов (подраздел 2.1.3), их способности к репаративной регенерации семенников (подраздел 2.1.4). Также были проведены исследования, продемонстрировавшие возможность прижизненного получения зрелых половых продуктов самцов для искусственного оплодотворения (подраздел 2.1.5), результативность использования различных индукторов гаметогенеза (подраздел 2.1.6), возможность круглогодичного получения овулировавшей икры клариевого сома параллельно процессу выращивания товарной рыбы (подраздел 2.1.7).
2.1.1 Оценка динамики полового созревания самок для их использования в воспроизводстве и получении икры — сырца.
Для решения первой из поставленных задач, ориентированной на разработку технологии всесезонного получения икры клариевого сома параллельно процессу выращивания товарной рыбы проводились исследования развития и становления репродуктивной функции у самок этого вида рыб в условиях индустриальной аквакультуры.
На первом этапе работы изучалась динамика полового созревания самок африканского клариевого сома и оценивался стартовый возраст их возможного использования в репродуктивном процессе и в процессе получения икры-сырца для пищевых целей.
В ходе исследований использовались методы: гормональной стимуляции созревания гонад, экстракорпорального оплодотворения, инкубации эмбрионов.
Проводился мониторинг роста и развития по размерно-весовым показателям, проводилась оценка фертильности, контроль количества, качества и зрелости половых продуктов, исследовались этапы эмбрионального развития икры и средовых факторов, определяющих это развитие.
Для выявления сроков полового созревания клариевого сома и готовности к технологической отдаче икры, осуществлялись цитологические и гистологические исследования гонад у разновозрастных групп самцов и самок, начиная с ранних этапов онтогенеза.
Оценка зрелости гонад проводилась по шкале Киселевича, согласно которой существует пять стадий зрелости — с I по V и отдельно VI стадия, именуемая как «отнерестившиеся» особи.
Чтобы выявить динамику и сроки полового созревания самок мы проводили цитологические и гистологические исследования гонад. Исследования гонад включали: измерение размеров ооцитов с помощью окуляр-микрометра, микроскопические исследования морфологии и особенностей строения ооцитов, оценку степени их зрелости и насыщения желтком, характер распределения желтка, особенности локализации ядра, состояние оболочек.
В ходе работы определяли несколько показателей плодовитости: индивидуальную плодовитость, умножая число ооцитов в 1 г на массу гонад; относительную плодовитость (ОП) — как количество яйцеклеток, приходящееся на единицу массы тела самки; рабочую плодовитость, которую рассчитывали как количество икринок, полученных от одной самки при сцеживании икры при искусственном нересте. Процедура сцеживания икры представлена на рисунке 2.
Полученная искусственным путем овулировавшая икра не вся пригодна к оплодотворению.

Рисунок 2 — Сцеживание созревшей икры
По средней плодовитости самок определяли количество самцов, необходимых для искусственного оплодотворения.
Характеристика степени развития гонад самок имеет теоретическое и практическое значение при оценке готовности яичников к нересту.
Процесс развития женской воспроизводительной системы включает формирование половой железы — яичника (гонадогенез) и превращение первоначально недифференцированных клеток в зрелые женские половые клетки – гаметы (гаметогенез).
Исследование развития половой системы сомов начинали в 10-недельном возрасте (2,5 месяца). Средний вес сомов в этот период составлял 43,5±4,5 г. По результатам наших исследований половые железы в этом возрасте неразвиты, плотно прилегают к внутренней стороне стенок тела и представлены длинными узкими шнурами или лентами, по которым еще нельзя визуально определить пол.
Вскрытие брюшной полости сомов 12-недельного возраста (3 месяца) и 14-недельного возраста (3,5 месяца), достигших массы 64±5,2 г и 85±5,9 г соответственно, показало, что половые железы самок слабо развиты и представлены тонкими прозрачно-стекловидными тяжами. Морфологически уже в этом возрасте можно отличить самок от самцов. В возрасте 3-4 месяцев яичники соответствовали I стадии зрелости — стадии неполовозрелых особей. При микроскопии просматривались ооциты протоплазматического роста, расположенные между многочисленными оогониями. На I стадии зрелости диаметр ооцитов составлял 0,16±0,01 мм, а масса 0,52±0,02 мг. С возрастом самок в процессе созревания гонад увеличивался диаметр ооцитов и их масса(рисунок 3). 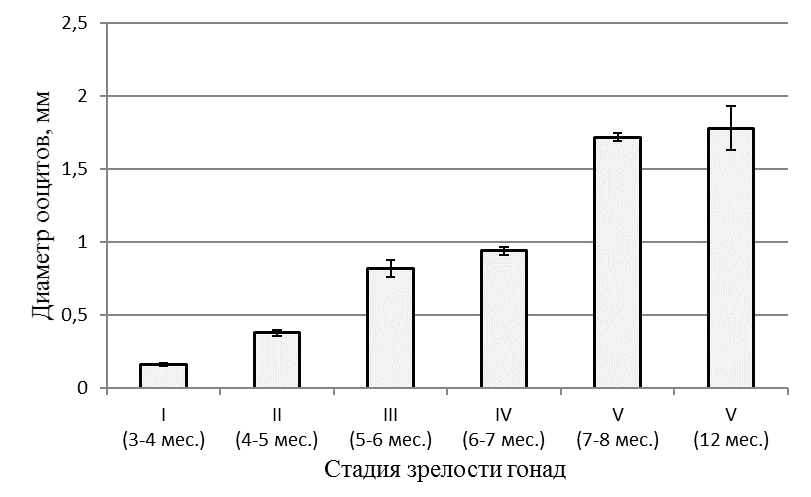
Рисунок 3 — Диаметр ооцитов на разных стадиях созревания гонад
В возрасте 17 недель (4 месяца) вес клариевых сомов варьировал от 111±12,2 г до 206,3±16,7 г. Гонады в этой весо-возрастной категории были еще более продвинуты в своем развитии. При массе порки 99,4±6,7 г гонадосоматический индекс составлял 0,05%. На «шнурах» образовались затемненные утолщения, в которых уже возможно было определить яичники и семенники. Икринки были очень мелкие и просматривались только под микроскопом. Развитие гонад соответствовало стадии II — созревающие особи. При этом диаметр ооцитов составлял в среднем 0,38±0,02 мм, а их масса — 0,89±0,02 мг (рисунок 4). Ооциты были прозрачными, не насыщенными желтком, стадия виттелогенеза не была завершена. Таким образом, в возрасте 4–5 месяцев отмечалась II стадия развития гонад, которая во многом определялась массой особи.
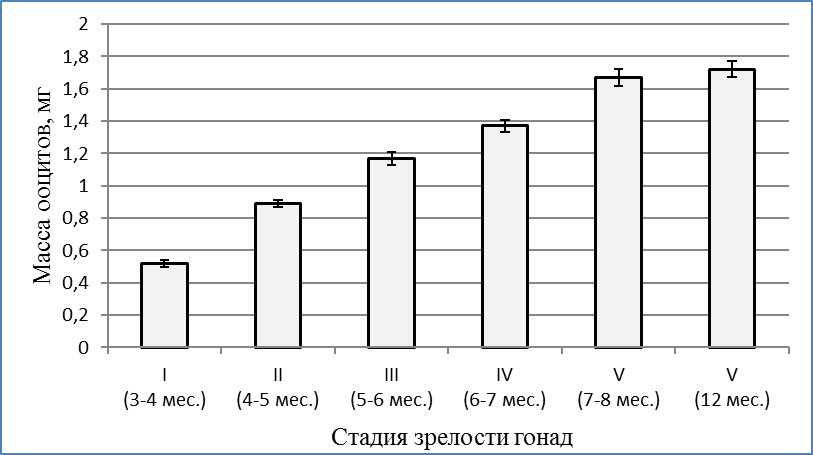
Рисунок 4 — Масса ооцитов на разных стадиях созревания гонад
В возрасте 5 месяцев самки имели массу 580±95 г. Развитие яичников цитологически и гистологически соответствовало III стадии по Киселевичу. Яйцеклетки на III стадии зрелости были существенно увеличены в диаметре до 0,82±0,06 мм, а их масса возрастала до 1,17±0,04 мг. Морфологически и гистологически гонады все еще далеки от зрелости, но они гораздо более развиты, чем на предыдущей стадии. Яичники заполняют от 1/3 брюшной полости и наполнены мелкими непрозрачными, белесоватыми икринками, ясно различимыми невооруженным глазом. При разрезе яичника, икринки при попытке соскоблить их от стенок яичника отрываются от них с трудом, образуют комок, слипаясь вместе по несколько штук. При весе порки самок 490±46г гонадосоматический индекс составлял 4,1%. Абсолютная индивидуальная плодовитость самок в этот период не превышала 22000 ооцитов. В яичниках обнаруживались ооциты разных размеров от 0,5 мм до 1,04 мм. Средний размер ооцитов составил 0,82±0,06 мм. Икринки в этот период бледно-зеленого цвета; желтка, образующего на фото зоны бурого цвета, незначительное количество; в более крупных ооцитах присутствуют вкрапления желтка в центре. В возрасте 6 месяцев самки клариевых сомов достигали товарной массы 726,6±33,4 г.
В период интенсивного развития половой системы они в росте сильно отставали от самцов, в среднем на 180-200 г. В этом возрасте стадию развития яичников определяли как переходную от III к IV. Яичники были значительно увеличены в размерах и заполняли до 2/3 всей брюшной полости. Икринки крупные, прозрачные и при надавливании вытекали. При разрезе яичника и соскабливании икринки отделялись поодиночке и группами. Гонадосоматический индекс возрастал до 6,3% (рисунок 5).
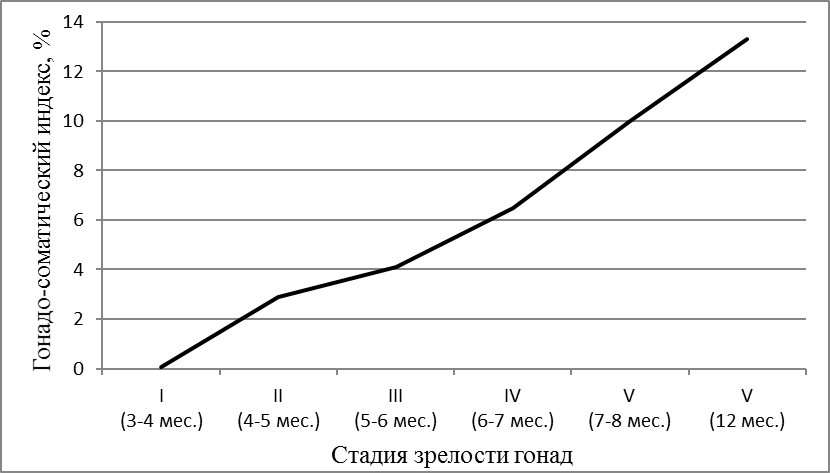
Рисунок 5 — Гонадосоматический индекс в зависимости от возраста самок
Абсолютная индивидуальная плодовитость самок не превышала 40000 ооцитов. В яичниках обнаруживались ооциты дефинитивных размеров 0,94±0,03 мм и массой 1,37±0,04 мг (рисунок 3). Микроскопические исследования ооцитов показали, что они насыщены желтком бурого цвета и близки зрелым. Желток в 70% ооцитов был рассредоточен по всей клетке, а у 30% был сконцентрирован на вегетативном полюсе. Поляризации ядра в ооцитах на этой стадии еще не обнаруживалось.
По достижении самками 8 месячного возраста их репродуктивную систему можно считать сформированной. По морфологическим и гистологическим критериям самки в этом возрасте уже готовы к нересту. Размер икры составлял 1,72±0,03 мм при массе 1,67±0,05 мг. Икра имела темно-зеленый цвет. В возрасте 7-8 месяцев при весе порки 975±73 г гонадосоматический индекс самок все еще был низким и не превышал 6,8% (рисунок 5). Абсолютная индивидуальная плодовитость самок не превышала 50000 ооцитов. Ооциты были дефинитивных размеров, насыщены желтком за исключением узкого слоя пристеночных вакуолей и тонкого слоя цитоплазмы вокруг ядра. Ядро в большинстве ооцитов располагалось на анимальном полюсе.
В возрасте 8 месяцев свыше 80% самок африканского клариевого сома достигли товарной массы от 900 до 1100 г, яичники были достаточно развиты и соответствовали IV стадии зрелости. Однако, получить икру от самок в возрасте 8 месяцев после гормональной стимуляции удавалось только в небольшом количестве, о чем свидетельствовала и величина гонадосоматического индекса.
В возрасте 10-12 месяцев при весе порки самок 1280±195 гр коэффициент зрелости яичников колебался в широких пределах от 7,4 до 14%. Минимальная индивидуальная плодовитость самок в этом возрасте превышала 58000 ооцитов. Самок подвергали гормональной стимуляции сурфагоном. После стимуляции искусственного нереста от самок весом 1000-1200 г в 12-месячном возрасте в первой порции получали в среднем 150 г зрелой икры, максимум — 250 г (рисунок 6).
Состояние зрелости яичников, подвергнутых гормональной индукции соответствовало V (наивысшей стадии зрелости — текучие особи). Цвет икры после овуляции был темно-зеленый. Число ооцитов в 1 г икры составляло 956±93 клеток, показатель рабочей плодовитости превышал 80000 ооцитов.
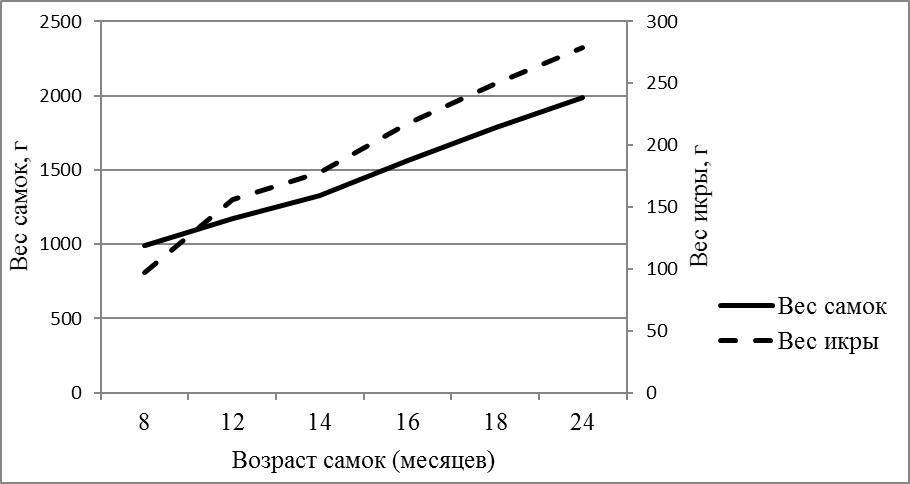
Рисунок 6 — Масса и икорная продуктивность самок в зависимости от возраста
Микроскопия ооцитов показала, что они зрелые, насыщены желтком бурого цвета, который локализован в большинстве ооцитов на вегетативном полюсе; в 93% ядро ооцитов было смещено к анимальному полюсу в район микропиле, вокруг ооцитов просматривалась блестящая оболочка. Ооциты достигали дефинитивных размеров, их средний диаметр составлял 1,78±0,15 мм. Поскольку самки клариевых сомов относятся к порционно-нерестящимся видам, у которых яйцеклетки созревают также порционно, размер ооцитов в яичниках варьировал в пределах от 1,6 до 2,3мм.
Таким образом, в возрасте 10-12 месяцев при весе более 1000 г самок африканских клариевых сомов можно использовать в репродуктивных технологиях и эксплуатировать в режиме доноров икры, отбирая наиболее плодовитых в маточное стадо. Как показали исследования, количество и качество икры самок зависело не только от их возраста, но и от их массы. По мере полового созревания отмечался рост гонадосоматического индекса и абсолютной индивидуальной плодовитости рыбы.
Обобщая полученные результаты, следует отметить, что гонадосоматический индекс в 3-4 месяца составлял всего 0,05%, в 4-5 месяцев — 2,9%, в 6-7 месяцев – 6,5%, в 7-8 месяцев – 10%, а в 12 месяцев — 13,3% , т.е. в процессе созревания возрос более, чем в 260 раз. Столь высокий уровень генеративного обмена сказывался на весо-ростовых показателях самок. Они в период полового созревания отставали в росте и наборе массы от самцов. Масса ооцитов в 3-4 месяца составляла 0,52±0,02 мг, в 7-8 мес. — 1,67±0,05, а в 12 месяцев достигла 1,72±0,05 мг, т.е. возрастала более чем в 3,3 раза в процессе созревания гонад.
Проведенные нами исследования показали, что отбор самок в маточное стадо можно осуществлять начиная с 6-месячного возраста. Основным критерием отбора в этом возрасте являлась скорость роста. Фотография самок маточного стада приведена на рисунке 7.

Рисунок 7 — Самки маточного стада
В маточное стадо в полугодовалом возрасте отбирались самки массой более 1 кг. Мониторинг показал, что самки первого года по массе достоверно отставали от самцов в среднем на 20%. Поэтому самки, достигшие за пол — года веса 1 кг и более, демонстрировали выдающуюся скорость роста. На следующем этапе отбора основным критерием при прочих равных условиях являлась икорная продуктивность. Маточное стадо содержалось при температуре воды — 260 С.
2.1.2 Икорная продуктивность самок в возрасте до 4 лет
Исследование икорной продуктивности в первый год жизни самок показало, что самый низкий процент оплодотворения и выхода предличинок наблюдался у впервые нерестящихся самок. Первый нерест мы проводили в 8-месячном возрасте. Для гормональной стимуляции использовали сурфагон из расчета 5-7 мкг/кг веса, усиленный эглонилом (из расчета 1 мл эглонила на 5 мл сурфагона).
С увеличением массы самок во время второго нереста, который проводился в годовалом возрасте процент оплодотворения икры достоверно увеличивался в 1,8 раз по сравнению с впервые нерестящимися самками (Р<0,05). Ястыки самок годовалого возраста приведены на рисунке 8. Вес самок второго года жизни в среднем достигал 2000 г и 85% из них давали выраженный ответ на гормональную стимуляцию оогенеза (таблица 1).

Рисунок 8 — Ястыки гормонально-индуцированных самок в годовалом возрасте
В ходе исследований было установлено, что самки клариевого сома хорошо адаптируются к условиям искусственного разведения. После первого успешного нереста при правильно организованной преднерестовой подготовке можно добиться 80-85% готовности к отдаче икры от числа гормонально-индуцированных самок при стимуляции сурфагоном.
Полученные результаты свидетельствуют, что для впервые нерестящихся самок характерны невысокие репродуктивные показатели (таблица 1). С увеличением массы и возраста самок достоверно возрастала средняя масса полученной икры. Увеличение количества икры отражало рост коэффициента зрелости гонад, т.е. гонадосоматического индекса. Наиболее высоких значений он достигал в 18 месячном возрасте.
Таблица 1 — Репродуктивные характеристики самок в возрасте до 2 лет
| Показатели | Масса тела самок (г) в зависимости от возраста | |||||
| Возраст, мес. | 8 мес. | 12 мес. | 14 мес. | 16 мес. | 18 мес. | 24 мес. |
| Разброс по массе в возрастной группе, г | 800-1185 | 900-1450 | 1000 — 1650 | 1200-1920 | 1400-2170 | 1600-2400 |
| Средняя масса самок в группе, г | 992,5±191,1 | 1175,8±273,2 | 1330±325,7 | 1565±364,3 | 1784±382,5 | 1989,5±387,0 |
| Средняя масса порции икры , г | 97,5±54,4 | 156,38±58,4 | 178,22±59,4 | 217,8±65,6 | 249,8±70,5 | 278,5±78,4 |
| Гонадосоматичес-кий индекс, % | >10 | >13,3 | >13,4 | >13,8 | >14,0 | >14,0 |
| Рабочая плодовитость, шт. | 78487,5 | 152577 | 169620 | 188397 | 216250 | 240902 |
| Оплодотворяе-мость икры, % | 51±7,6 | 91,8±5,3 | 93,7±5,9 | 95,6±3,7 | 95,9±2,7 | 97±1,6 |
| Выход предличинок, % | 35,7±5,0 | 45,6±6,2 | 50,8±7,3 | 72±9,0 | 75,4±9,5 | 80,7±9,8 |
Показатели роста оплодотворяемости икры достигали максимума в возрасте 18 месяцев. Выход предличинок по отношению к количеству икры, заложенной на инкубацию, достоверно возрастал с увеличением массы тела самок.
Самки 8-10 месяцев продуцировали икру в количестве 7-11% от массы тела, что свидетельствовало об их недостаточной готовности к нересту. Более высокий репродуктивный потенциал отмечался у самок в возрасте старше года. В этом возрасте самки продуцировали 14-20% икры от массы тела. Известно, что икорная продуктивность тесно коррелирует с массой тела рыб. Коэффициент корреляции между этими признаками обычно превышает 0,6-0,8. Процедура сцеживания икры приведена на рисунке 9.
Гистологические исследования яичников показали, что годовалые самки в полной мере являлись половозрелыми особями. При оценке качества ооцитов клариевых сомов маточного стада в возрасте до 2 лет каких-либо отклонений обнаружено не было. Ооциты были дефинитивных размеров, в полной мере зрелые и готовы к оплодотворению. Оболочки ооцитов были сформированы без каких-либо нарушений, размерный состав клеток отвечал биологическим особенностям данного вида, в цитоплазме не отмечено аномальных включений. Икра имела темно-зеленый цвет.

Рисунок 9 — Сцеживание овулировавшей икры
Рост плодовитости в возрастном аспекте связан со способностью продуцировать большее количество яйцеклеток на единицу массу тела. Поэтому возрастает общий объем икры, а, следовательно, возрастает абсолютная рабочая плодовитость. Увеличение плодовитости самок не сказывалось отрицательно на качестве икры.
Важно установить возраст полового созревания самок, на основании которого можно было определить стартовый возраст получения икры для пищевых целей и для размножения.
Результаты исследований показали, что к 8 месяцам половая система самок достигала зрелости, самки были способны к воспроизводству потомства. Однако, их репродуктивные показатели в этот период, в частности икорная продуктивность, были очень низкими. После достижения половой зрелости самок (в 8 месячном возрасте) репродуктивные показатели в дальнейшем с возрастом продолжали расти.
Икорная продуктивность достигала наивысших значений в 18-24 месячном возрасте и зависела от массы самок. Размер и масса ооцитов в этот период достигали дефинитивных размеров.
Рабочая плодовитость и гонадосоматический индекс самок в возрасте от 12 до 24 месяцев также продолжали расти. Возраст 12 месяцев можно считать оптимальным в технологии получения икры-сырца для пищевых целей.
Вес самок клариевых сомов в начале третьего года жизни перешагнул через 2000 г. Гонадосоматический индекс самок клариевых сомов превышал 14%. Показатели рабочей плодовитости и оплодотворяемости икры у самок третьего года эксплуатации были на высоком уровне (таблица 2).
Таблица 2 — Репродуктивные характеристики самок от 2 до 3 лет
| Показатели | Масса тела самок (г) в зависимости от возраста | ||||
| Возраст, мес. | 28 мес. | 30 мес. | 32 мес. | 34 мес. | 36 мес. |
| Разброс по массе в возрастной группе, г | 1900-2700 | 2000-2800 | 2150-3000 | 2200-3200 | 2500-3500 |
| Средняя масса самок в группе, г | 2284,8±410,3 | 2410±400,3 | 2532±457,5 | 2730±491,5 | 2950±550,5 |
| Средняя масса икры, г | 297±86,9 | 313,3±88,4 | 326,6±96,7 | 352,2±95,9 | 383,5±99,1 |
| Гонадосоматический индекс, % | 15 | 16 | 16 | 16 | 15 |
| Рабочая плодовитость, шт. | 256905 | 271004 | 280470 | 296145 | 290090 |
| Оплодотворяемость икры, % | 96,8±1,4 | 95,7±1,6 | 91,6±3,2 | 90,9±5,5 | 89,1±7,2 |
| Выход предличинок, % | 75,6±9,2 | 70,8±8,3 | 72±8,1 | 78,4±8,2 | 78,8±7,9 |
В возрасте от 2 до 3 лет при температуре содержания не ниже 260С свыше 80% самок после первой инъекции в сезон нереста отвечали на гормональную стимуляцию и демонстрировали высокие репродуктивные показатели, такие как масса икры, ее оплодотворяемость, выход предличинок. Рабочая плодовитость в этот период колебалась от 250 до 290 тыс. шт. яйцеклеток.
Вес самок четвертого года жизни превышал трехкилограммовый рубеж. Гонадосоматический индекс в этом возрасте уже не рос с весом рыбы, т.к. у самок отмечалось ожирение. Большая часть их брюшка была заполнена жиром. Рабочая плодовитость продолжала расти и демонстрировала высокие показатели оплодотворяемости ооцитов и выхода предличинок (таблица 3).
Таблица 3 — Репродуктивные характеристики самок в возрасте от 3 до 4 лет
| Показатели | Масса тела самок (г) в зависимости от возраста | ||||
| Возраст, мес. | 38 мес. | 40 мес. | 42 мес. | 44 мес. | 48 мес. |
| Разброс по массе в возрастной группе, г | 2600-3700 | 2700-3800 | 2800-3900 | 2950-4000 | 3090-4200 |
| Средняя масса самок в группе, г | 3154,6±545,5 | 3255±550,3 | 3354±557,3 | 3450±560,5 | 3650±563,5 |
| Средняя масса икры, г | 410±101,9 | 423,2±109,4 | 436,0±119,7 | 448,5±121,5 | 474,5±126,1 |
| Гонадосомати-ческий индекс, % | 15 | 15 | 15 | 15 | 15 |
| Рабочая плодовитость, шт. | 330050 | 340515 | 350980 | 361042 | 381972 |
| Оплодотворяе-мость икры, % | 89,8±9,3 | 88,7±10,4 | 89,5±8,7 | 89,6±10,0 | 89,1±9,7 |
| Выход предличинок, % | 78,6±8,9 | 76,8±7,6 | 75,3±7,5 | 75,4±6,9 | 75,3±1,4 |
Для африканского сома в природной среде характерна сезонность размножения. У представителей этого вида в естественной среде обитания содержание гонадотропного гормона в гипофизах имеет сезонную динамику, в зимний период гормональный уровень в 4-6 раз ниже, чем летом. Сохраняется ли та же закономерность при разведении в искусственной среде, нивелирующей действие природных факторов, — пока не известно.
2.1.3 Динамика полового созревания самцов
На данном этапе работы проводились исследования развития гонад самцов африканского клариевого сома, начиная с ранних этапов постэмбрионального онтогенеза.
У клариевых сомов, начиная с 2 месячного возраста, определяли стадии зрелости гонад, используя шкалу Киселевича. Гонадосоматический индекс определяли как отношение массы семенников к массе тела рыбы, выражая в процентах; также определяли качество спермы, выражая в баллах [51].
В наших экспериментах самцы африканского клариевого сома за девять месяцев выращивания набирали среднюю массу 997±149,6 г (рисунок 10). Динамика роста сомов представлена на рисунке 11.

Рисунок 10 — Внешний вид клариевого сома 9 месячного возраста
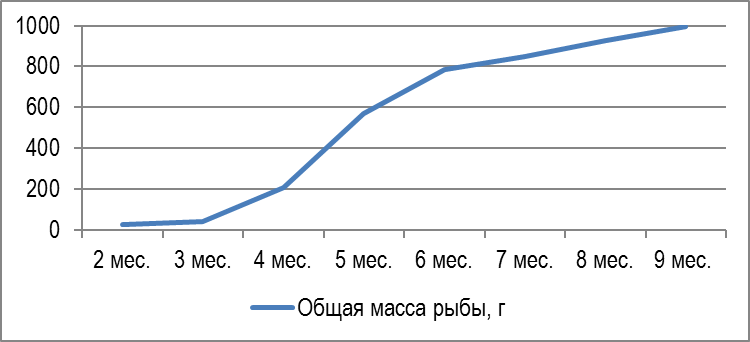
Рисунок 11 — Динамика роста Сlarias gariepinus
При вскрытии в двухмесячном возрасте масса гонад у самцов составляла 0,07 г. В течение последующих семи месяцев гонады самцов интенсивно развивались.
В девятимесячном возрасте семенники достигли веса 9-10 г. Кривая динамики роста гонад представлена на рисунке 12.
В возрасте 2-3 месяцев степень зрелости гонад соответствовала I стадии по шкале Киселевича. В этом возрасте при вскрытии семенники у сомов визуально плохо различимы, поскольку не развиты. У клариевых сомов первыми признаками анатомической дифференциации пола являются особенности расположения кровеносных сосудов: у самцов крупные кровеносные сосуды проходят в дорзальном участке железы, а у самок – по центру.
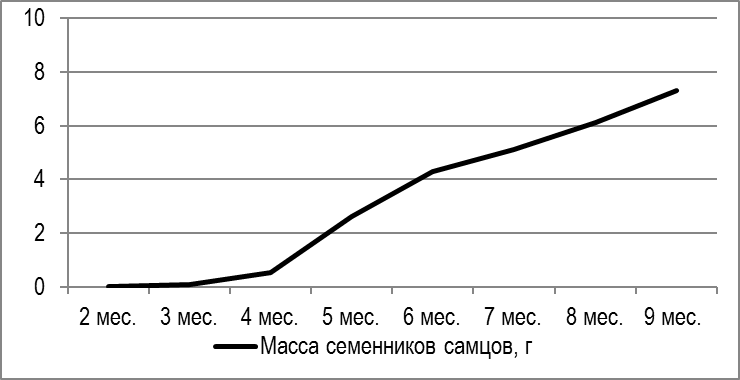
Рисунок 12 — Динамика созревания гонад самцов Сlarias gariepinus
Внешние половые отличия самцов и самок африканского клариевого сома начинали проявляться в возрасте 2,5-3 месяцев (рисунки 13, 14). Отличительным признаком самок являлось наличие маленькой округлой урогенитальной папиллы (рисунок 13); у самцов папилла имела удлиненный и заостренный вид (рисунок 14).
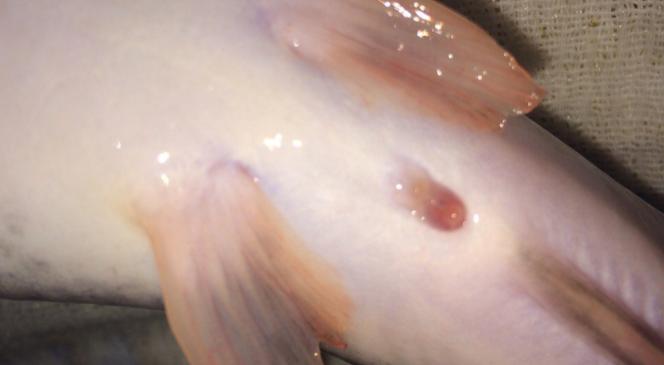
Рисунок — 13 Урогенитальная папилла самок
В возрасте 3,5 месяца в брюшной полости самцов можно обнаружить розетку с множеством выростов в виде лепестков. Это образование внешне напоминает щупальца кальмара. У самок этого образования ни в раннем, ни в зрелом возрасте обнаружено не было. Поэтому мы с полным основанием полагаем, что это образование составляет часть половой системы самцов.
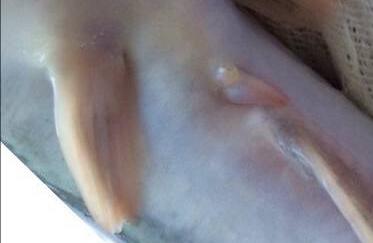
Рисунок 14 — Урогенитальная папилла самцов
В возрасте 3,5-4 месяцев у африканского клариаса семенники по своему развитию в полной мере соответствовали II стадии по шкале Киселевича. На шнурах сформировались затемненные утолщения, в которых можно идентифицировать семенники.
В возрасте 5-6 месяцев семенники характеризовались III стадией развития. Семенники имели более расширенную переднюю часть и сужались в задней части. Поверхность их была розоватая, но при надавливании и разрезании из семенника жидкие молоки не выделялись.
Хорошо развиты гонады у 9 месячных самцов. Их гонады соответствовали IV стадии зрелости. Семенники достигли максимальных размеров, однако гонады не были зрелыми. Они были прозрачными и при разрезе не выделяли спермы молочного цвета.
Исследование гонадосоматического индекса показало, что в онтогенезе отмечается плавный поступательный рост этого показателя. Гонадосоматический индекс самцов 3-х месячного возраста средней биомассой 43,3±8,6 г составлял 0,16%, у самцов 4-х месячного возраста средней биомассой 210±42,1 г он возрос до 0,25%, у самцов 5 месячного возраста массой 567,4±113,4 г составлял 0,45%, у самцов 6 месячного возраста массой 786±117,9 г — был на уровне 0,54%, у самцов 7 месячного возраста массой 850±127,5 г — 0,72%, у самцов 8 месячного возраста массой 926,6±139,4 г — 0,87%, у самцов 8 месячного возраста массой 997±149,6 г — 0,93% (рисунок 15).
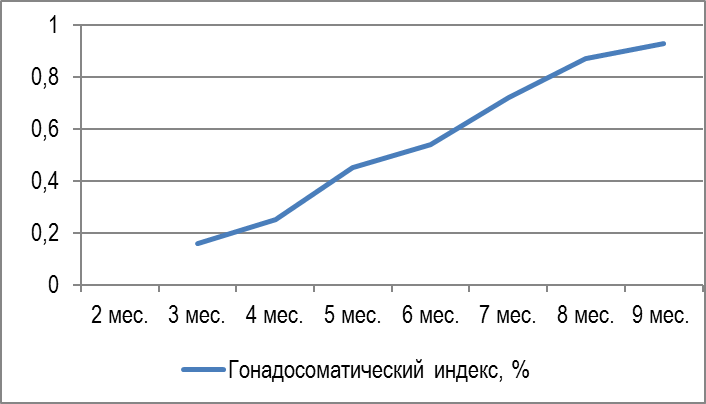
Рисунок 15 — Динамика изменения гонадосоматического индекса
У полутора — двухгодовалых самцов весом более полутора килограмм, подвергнутых гормональной индукции, масса семенников увеличивалась в несколько раз и достигала 18-23 г. Показатели гонадосоматического индекса возрастали до 1,35% (рисунок 16). Стадия зрелости гонад соответствовала IV-V по шкале Киселевича.

Рисунок 16 — Семенники половозрелых сломов
Семенники у самцов в связи с образованием большого количества сперматозоидов приобретали молочно-белый цвет. Сперматозоиды африканского клариевого сома являются очень мелкими клетками. Согласно полученным результатам, наиболее выраженный ответ на гормональную стимуляцию дают самцы, достигшие двухлетнего возраста.
Для получения семенников у самцов клариаса вскрывали брюшную полость. Присутствие зрелой спермы в молоках определяли по белому, непрозрачному, молочному цвету. Незрелые молоки у самцов были меньше в объеме и имели прозрачный цвет.
Концентрация спермиев в единице объема эякулята возрастала с возрастом. Так концентрация спермиев у самцов клариевых сомов 9-месячного возраста составляла 18,9 млрд./см3, в возрасте 1,5 года — 55,6 млрд./см3; а у двухлетних самцов — 65,7 млрд./см3.
При определении соотношения живых и мёртвых спермиев установили, что у самцов клариевых сомов 9-месячного возраста большая часть эякулята характеризовалась оценкой в 4 балла, в возрасте 1,5 года — в 5 баллов; и у двухлетних самцов — в 5 баллов.
У самцов клариевых сомов 9-месячного возраста сперма имела оплодотворяющую способность на уровне 60±1,5%. От полуторогодовалых самцов получали сперму с высокой оплодотворяющей способностью — 90,7±2,7%. У двухлетних самцов активность спермиев была наивысшей и характеризовалась наиболее высокой оплодотворяющей способностью (95,7±3,2%).
Полученные нами результаты позволяют прийти к заключению, что для проведения искусственного нереста в условиях индустриальной аквакультуры целесообразно использовать двухлетних самцов, дающих выраженный ответ на гормональную стимуляцию сперматогенеза.
2.1.4 Оценка способности к репаративной регенерации гонад у самцов
Семенники африканского клариевого сома парные, подразделяющиеся на левый и правый. Гонады симметричны, но у ряда особей правый семенник более развит. По форме каждый из семенников представлял собой сильно вытянутое бобовидное тело, которое из-за наличия на внешней поверхности каждого из семенников выступов и впадин напоминает формой гребень петуха (рисунок 17).
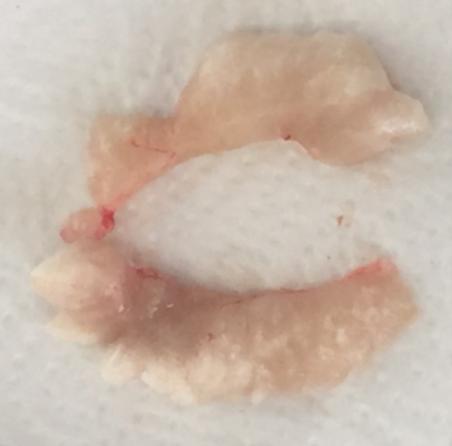
Рисунок 17 — Внешний вид гормонально-индуцированных семенников
Согласно теории Геодакяна [52], все парные органы, в том числе и семенники, функционально симметричны, т.е. каждый из них выполняет одни и те же функции. У африканского клариевого сома семенники циприноидные. В семенниках этого типа семенные канальцы пронизывают их в различных плоскостях. На поперечных гистологических срезах каждого из семенников просматриваются структуры неправильной формы.
Прижизненное вскрытие годовалых самцов показало, что их гонады в процессе созревания претерпели существенное развитие. Длина семенников колебалась в пределах 3,2- 5,7 см.
У ряда самцов была произведена полная резекция семенников в целях организации искусственного нереста. Полученные гонады взвешивались. Вес гормонально-индуцированных семенников у годовалых самцов варьировал в широком интервале (рисунок 18).

Рисунок 18 — Семенники годовалых самцов
Вскрытие самцов, достигших возраста 2 лет, показало, что их семенники (рисунок 19), по сравнению с годовалыми самцами продолжили рост в размерно-весовом отношении. У самцов двухлеток, которые не подвергались гормональной индукции, длина семенников в наших условиях содержания колебалась в интервале 4,2-7,6 см, при ширине 0,7 – 2,2 см.
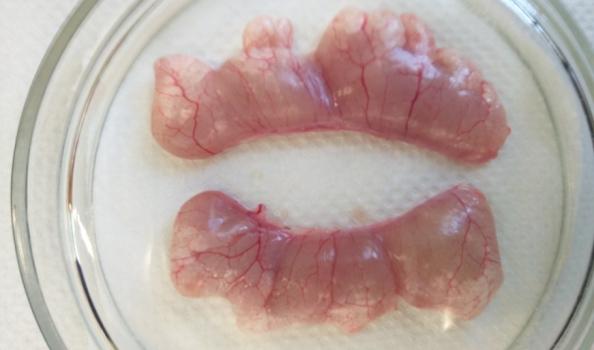
Рисунок 19 — Семенники двухлетних самцов
Симметричные исследования были проведены с такими же возрастными группами самцов, подвергнутыми перед вскрытием брюшной полости гормональной стимуляции. Вес гонад у гормонально индуцированных самцов тех же возрастных групп показал, что они по своим весовым характеристикам в ряде случаев в 2-3 раза превышали семенники интактных самцов (рисунок 20). При этом, вариабельность показателей в этой группе была высокой и превышала 50 %. Результаты исследования динамики роста веса семенников приведены на рисунке 20.
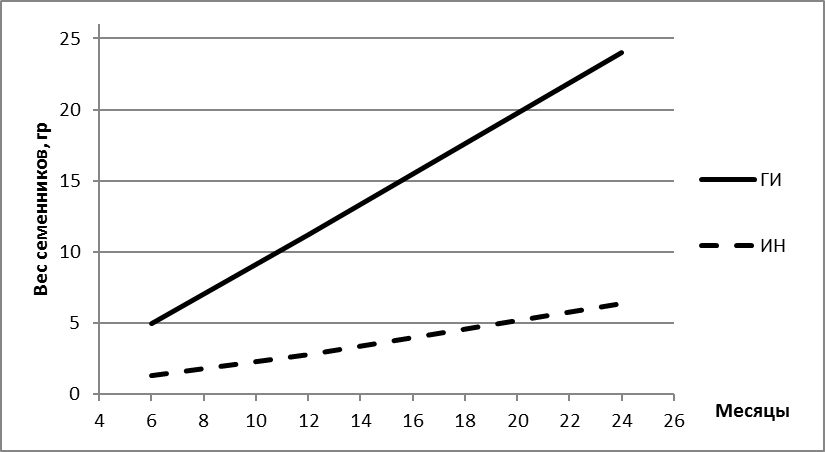
Рисунок 20 — Возрастная динамика массы гонад у интактных и гормонально-индуцированных самцов
Также было показано, что в сезон естественного нереста у всех самцов проявляется выраженный ответ на гормональную стимуляции. Однако при этом отмечались индивидуальные особенности его проявления.
На фотографиях, приведенных на рисунке 21, отражены семенники полугодовалых и десятимесячных гормонально-индуцированных самцов. Полное половое созревание у интактных самцов клариевого сома наступает в возрасте полутора лет. Однако, на практике используют гормональную стимуляцию и индуцируют созревание гонад раньше, как правило уже в возрасте года. Полученные при этом сперматозоиды зрелые и обладают хорошей оплодотворяющей способностью.
Для исследования гонад в 6 месячном и 10 месячном возрасте были выбраны самцы приблизительно равного веса, т.к. вполне понятно, что у более крупных самцов и гонады будут крупнее. Чтобы оценить влияние возрастного фактора в развитии гонад оценивался вес семенников у самцов равного веса в 6 месячном и 10 месячном возрасте. Результаты представлены на рисунке 21.
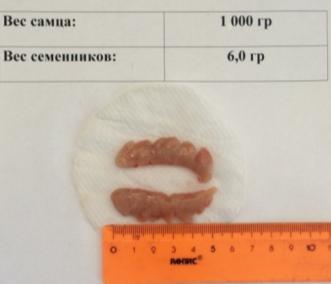 а)
а)  б)
б)
а) в возрасте 6 месяцев; б) в возрасте 10 месяцев
Рисунок 21 — Семенники гормонально индуцированных самцов
В двухлетнем возрасте семенники клариевого сома хорошо развиты и дают хороший ответ на гормональную стимуляцию. В этом возрасте семенники после гормональной стимуляции весят более 23 г, от каждого самца в этот период можно получить более 10 мл спермы (рисунок 22).
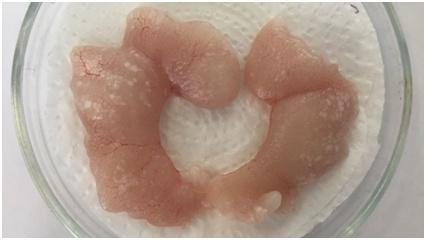
Рисунок 22 — Семенники гормонально-индуцированных двухлетних самцов
На следующем этапе работы исследовалась способность африканского клариевого сома к регенерации гонад. Регенерация открывает перспективы неоднократного использования самцов в направленном селекционном процессе.
Известно, что в организме рыб существуют центры регенерации. В норме в организме непрерывно осуществляется физиологическая регенерации, при которой утраченные клетки полностью замещаются вновь образованными в полной мере обеспечивая и их специализацию, и количество [53-55]. Способность к физиологической регенерации у рыб во многом зависит как от состояния самого организма, так и от экологических условий среды обитания (абиотических и биотических факторов) [54, 45]. В нашей работе мы рассматривали не физиологическую, а репаративную регенерацию.
Репаративная регенерация выходит за рамки физиологической. Ее механизм включается при разрушении клеток, тканей или органов под действием повреждающих агентов или факторов среды. Она может быть полной или неполной. Под полной регенерацией понимают замещение поврежденной структуры идентичной в полном соответствии с утраченной. Как правило, это возможно при сохранении нервных и сосудистых структур. При неполной регенерации, которая возникает в случае обширных поражений, дефект чаще всего замещается соединительной тканью.
Различные ткани восстанавливаются с различной скоростью. Принято считать, что эпителиальная и железистая ткани восстанавливаются быстро, а хрящевая и нервная для своего восстановления требуют гораздо больше времени. Восстановление, как и любой другой процесс, зависит от состояния организма, возраста и факторов внешней среды. У молодых особей процессы регенерации протекают более активно и быстрее, чем у рыб старших возрастов[53, 55].
В процессе работы с африканским клариевым сомом мы неоднократно убеждались, что у этого вида рыб высокая регенерационная способность свойственна плавникам, усам, кожному покрову, а также жабрам. В частности при аэромонозе и грибковой инфекции полная регенерация этих органов на фоне лечения занимала 2-3 недели. При проведении полостных операций, хирургический шов на брюшной стороне по истечении 2 месяцев практически не отслеживался.
В наших исследованиях у интактных клариевых сомов, которые не подвергались гормональной стимуляции, при вскрытии, как правило, обнаруживалась симметрия семенников. Однако, эта закономерность не всегда проявлялась у гормонально-индуцированных самцов. По размеру и весу правый и левый гормонально-индуцированные семенники в ряде случаев были не симметричны. Как правило, правый семенник превалировал в размерно-весовом отношении над левым (рисунки 23, 24).
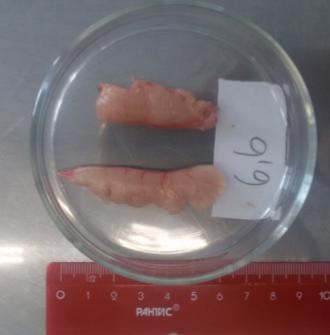
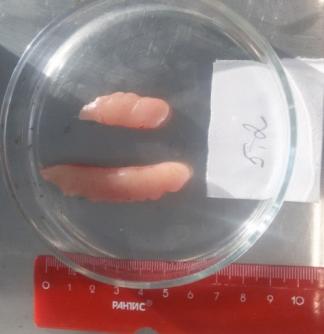
Рисунок 23 — Морфология гонад после органотипической регенерации у гормонально не индуцированных самцов
После резекции семенников их регенерация проходила в ряде случаев синхронно, а в ряде случаев асинхронно. Один из семенников, как правило, левый отставал в развитии. Он регенерировал частично, оставаясь через 6 месяцев и через год в усеченном виде (рисунки 23, 24). В левом семеннике не отмечалось полной органотипической регенерации. В этих случаях реституции, подразумевавшей полное замещение дефекта, не наблюдалось.
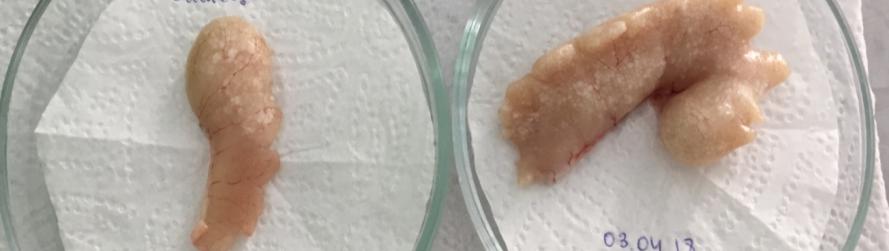
Рисунок 24 — Асимметричная органотипическая регенерация
Однако, в большинстве случаев регенерировавшие семенники демонстрировали симметричный ответ на гормональную стимуляцию пропорционально увеличиваясь в размерно-весовом отношении.
Африканский клариевый сом — теплолюбивая рыба, температурный фактор играет решающую роль во всех физиологических процессах представителей этого вида. В тех случаях, когда температура среды обитания клариевого сома опускалась до уровня 20ºС, рост и развитие семенников тормозилось. При таких температурах статистически-достоверного увеличения ростовых и весовых показателей семенников не было отмечено. Очевидно, содержание в условиях температур, выходивших за пределы оптимума, приводило к нарушению физиологических процессов, регулирующих генеративный обмен.
В заключение следует отметить, что африканский клариевый сом демонстрирует высокую регенерационную способность. Этот объект аквакультуры хорошо переносит хирургические операции. У клариевого сома после полостных операций в течение двух месяцев на брюшной стороне исчезают внешние проявления хирургического шва.
Операции по частичной резекции семенников показали, что африканский клариевый сом демонстрирует высокую способность к регенерации. Полноценное восстановление семенников завершалось в течение года, однако в ходе регенерации правый и левый семенники восстанавливались не симметрично.
Как правило, при сохранении функциональной симметрии внешне семенники после восстановления отличались по размерно-весовым параметрам. Хорошая регенерационная способность клариевого сома позволяет использовать самцов этого вида после резекции семенников в селекционном процессе неоднократно.
Проведенные исследования показали, что у самцов африканского клариевого сома гонады ципроидного типа, функционально симметричные. В процессе полового созревания рост и развитие гонад характеризуется плавной нарастающей динамикой. После частичной резекции гонад африканский клариевый сом демонстрирует хорошую способность к их репаративной регенерации, результат которой зависит от факторов среды. Регенерировавшие семенники демонстрировали хороший ответ на гормональную стимуляцию, в той же мере, что и семенники, не подвергавшиеся резекции.
Концентрация спермиев в единице объема эякулята возрастала с возрастом. Так, концентрация спермиев у самцов клариевых сомов 9-месячного возраста составляла 18,9 млрд./см3, в возрасте 1,5 года — 55,6 млрд./см3; а у двухлетних самцов — 65,7 млрд./см3.
При исследовании соотношения живых и мёртвых спермиев установили, что у самцов клариевых сомов 9-месячного возраста после гормональной стимуляции сперма оценивалась в 4 балла, в возрасте 1,5 года — в 5 баллов; и у двухлетних самцов — в 5 баллов.
При исследовании оплодотворяющей способности спермы было показано, что у самцов клариевых сомов в возрасте 9 месяцев сперма имела показатель оплодотворяемости на уровне 60±1,5%.
По истечении нескольких месяцев от полуторогодовалых самцов получали сперму с более высокой оплодотворяющей способностью. При ее использовании оплодотворяемость икры достигала 90,7±2,7%. У двухлетних самцов активность спермиев имела самую высокую бальную оценку. Оплодотворяющая способность спермы в этот период составляла 95,7±3,2%.
Полученные нами результаты позволяют прийти к заключению, что созревание половой системы самцов происходит в течение первого года жизни и характеризуется нарастающей динамикой гонадосоматического индекса, ростом концентрации спермы и оплодотворяющей способности гамет вплоть до двухгодовалого возраста. Поэтому для проведения искусственного нереста в условиях индустриальной аквакультуры целесообразно использовать самцов полуторогодовалого возраста и старше, дающих выраженный ответ на гормональную стимуляцию, обеспечивающую созревание гонад и высокую концентрацию спермы.
В литературных источниках [56-57] и интернет-форумах, в том числе посвященных получению зрелых половых продуктов африканского клариевого сома, повсеместно отмечается, что самцы быстрее самок отвечают на гормональную стимуляцию. Однако эта закономерность сохраняется только в сезон естественного нереста. В остальные сезоны: весенний, зимний и осенний такой закономерности не наблюдается.
В рекомендациях по использованию производимого в России препарата для стимуляции искусственного нереста — нерестина 7А декларируется использование для стимуляции самцов только половинной дозы препарата. Вне сезона нереста такая стимуляция не имела никакого эффекта. Приходилось не уменьшать, а удваивать обычную дозировку препарата. Зато в сезон естественного нереста уже через 11-12 часов после введения нерестина гонады самцов созревали, а у самок самотеком выделялась зрелая икра [58,59]. В зависимости от веса самок в годовалом возрасте от них можно было получить от 180 до 250 г икры. По внешнему виду икра сома в общей массе имеет интенсивный темно-зеленый цвет (рисунок 25).

Рисунок 25 — Сцеженная овулировавшая икра гормонально-стимулированных самок
Исследуя влияние гормонального индуктора — сурфагона, в межнерестовый период на самцов, удалось установить, что у них также как и при использовании нерестина созревания гонад через 12 часов не наступало. Поэтому самцов сурфагоном также приходилось стимулировать дважды.
В период естественного нереста под действием сурфагона самцы сомов и других видов рыб [57, 60, 61] под действием гормональных индукторов, как правило, созревали быстрее самок.
Поэтому данные, полученные нами, свидетельствуют о более высокой толерантности самцов клариевого сома, по сравнению с самками, по отношению к гормональной стимуляции в межнерестовый период.
2.1.5 Инвазивный метод прижизненного получения зрелых половых продуктов самцов для искусственного оплодотворения
В репродуктивной биотехнологии самцов клариевого сома до настоящего времени использовали однократно, поскольку для извлечения зрелых половых продуктов их необходимо было забить. Это разовое использование самцов не позволяло вести селекцию по отцовской линии. Необходимо было разработать метод, позволяющий использовать генетически выдающихся особей неоднократно.
Основной проблемой использования самцов является то, что у них в условиях индустриальной аквакультуры половые продукты естественным путем не созревают. Обеспечить созревание гонад и спермиев позволяет гормональная стимуляция. Однако и после гормональной стимуляции зрелая сперма самопроизвольно не выбрасывается. Получить ее можно только при диспергировании семенников, извлеченных из забитой рыбы.
Чтобы использовать генетически ценных самцов неоднократно, нами был разработан инвазивный метод прижизненного получения спермы самцов. Метод заключается в хирургической операции по резекции семенников с последующим зашиванием брюшной полости. Ввиду высокой регенерационной способности шов быстро заживает и уже через 2 месяца на месте операции ее следов не остается.
В нерестовый период для гормональной индукции использовали сурфагон, усиленный эглонилом из расчета 5-7 мкг сурфагона+5 мг эглонила на 1 кг веса самцов — однократно. В межсезонье применялась двукратная стимуляция самцов сурфагоном с эглонилом, который использовался в качестве успокаивающего средства. Она давала, как правило, хороший результат. Самцы, стимулированные по этой схеме, не болели. Через 24 часа после начала гормональных инъекций самцам проводили щадящую (частичную) резекцию семенников.
Суть метода инвазивного прижизненного получения зрелых половых продуктов самцов заключалась в следующем: самцов гормонально индуцировали, а затем проводили хирургическую операцию (рисунки 26-28), ход которой описан ниже.
Для проведения операции по извлечению семенников самцов клариаса отлавливали из бассейна, обертывали мягкой влажной тканью, оставляя зону брюшного разреза свободной. Самцы под действием эглонила до и во время операции вели себя спокойно. Рыба размещалась на операционном столе брюшком вверх, ассистент фиксировал руками головной и прихвостовой отделы. Брюшко в операционной зоне обрабатывалось раствором хлоргексидина. Оттягивая кожу в зоне будущего разреза, хирургическими ножницами делали прокол, а затем разрез длиной 3-5 см по белой линии живота не затрагивая анального отверстия, от брюшных плавников в направлении головы, (рисунок 26).
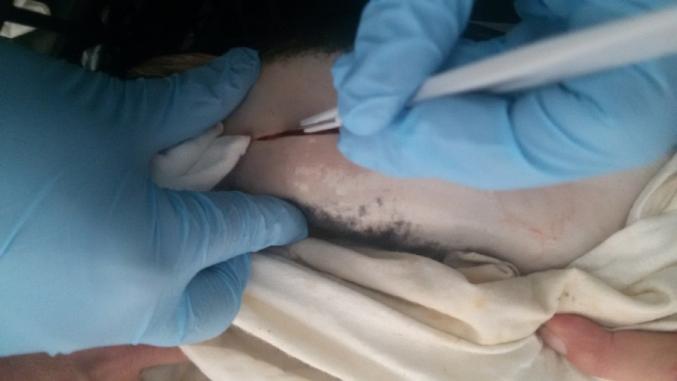
Рисунок 26 — Первый этап операции – разрез по белой линии живота
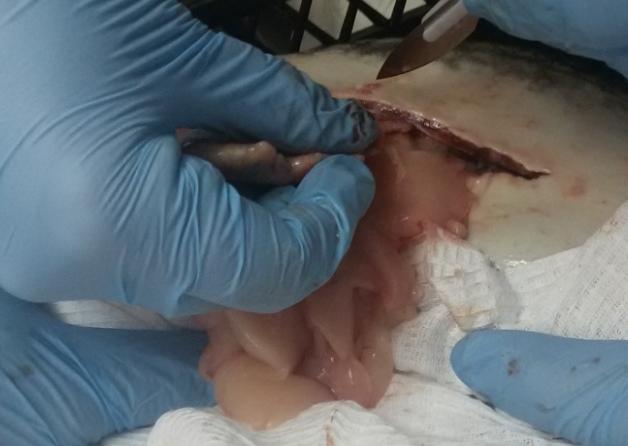
Рисунок 27 — Разрез брюшной полости, извлечение жировых отложений
Под ними глубже можно обнаружить вытянутые семенники (рисунок 28).
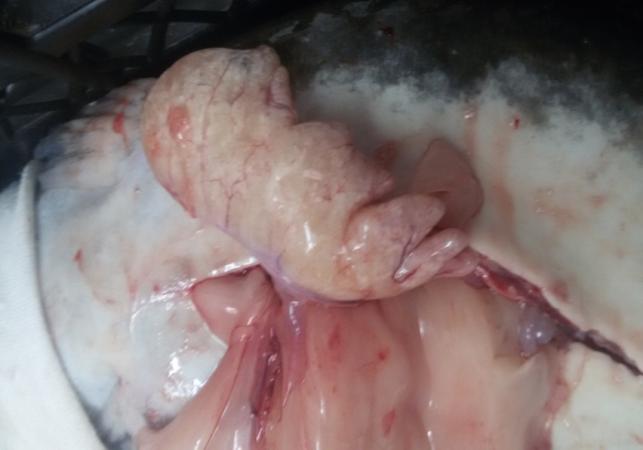
Рисунок 28 — Извлечение семенника из брюшной полости на поверхность
Незрелые семенники плоские, блестящие, розовые, плотные как бы восковые. Созревшие семенники вспухшие, длинные, матовые, бежевого цвета с тонким сосудистым рисунком, многократно увеличены в размерах, залегают не глубоко. Их невозможно спутать с другими органами из-за их специфической гребенчато-лопастной формы. Также невозможно спутать зрелые и не зрелые семенники. Различия очевидны (рисунки 29, 30).

Рисунок 29 — Незрелые семенники вместе с остальными элементами половой системы клариевого сома.
Отступив от основания семенников около сантиметра, накладывали лигатуру, осуществляли резекцию, извлекая семенники (рисунок 30).
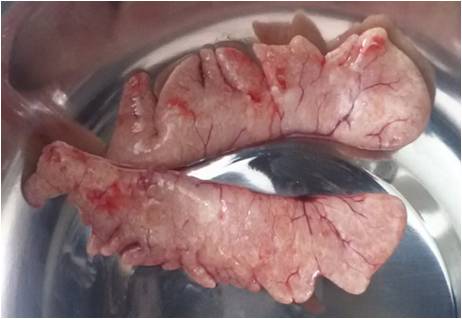
Рисунок 30 — Зрелые, гормонально-индуцированные семенники после резекции
После резекции внутренние органы клариевого сома возвращали в брюшную полость. Брюшко зашивали хирургическим швом (рисунок 31). Для зашивания послеоперационной раны использовали стерильный шовный материал. Швы накладывали от центра разреза к его краям с интервалом 0,5 см. Края разреза стыковали, сопоставляя их и выравнивая.
Первый из швов накладывали в центре разреза и двигались по направлению к краям (рисунок 31).

Рисунок 31 — Наложение хирургических швов после извлечения семенников
Шов обрабатывали хлоргексидином (рисунок 32). Прооперированных самцов выдерживали 3 часа в растворе метилтиониния хлорида из расчета 1 мл 1% маточного раствора разведенного в 10 л воды. Прооперированных самцов не менее трех суток содержали в отдельном садке.
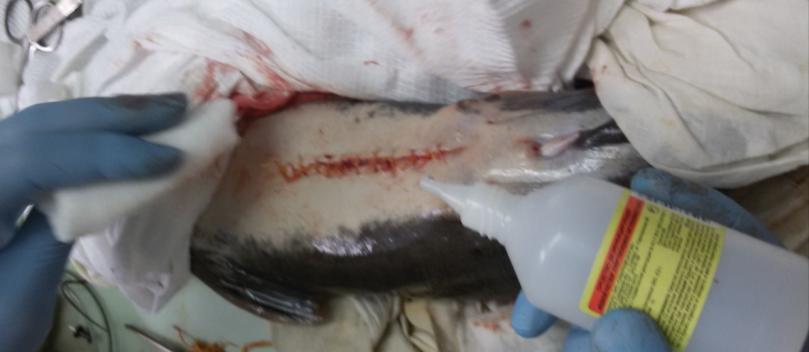
Рисунок 32 — Обработка хирургических швов хлоргексидином
Полученные семенники диспергировали (измельчали ножницами) и протирали через ситечко, чтобы получить сперму для оплодотворения (рисунок 33). Качество спермы определяли по проценту живых, активно двигающихся клеток.
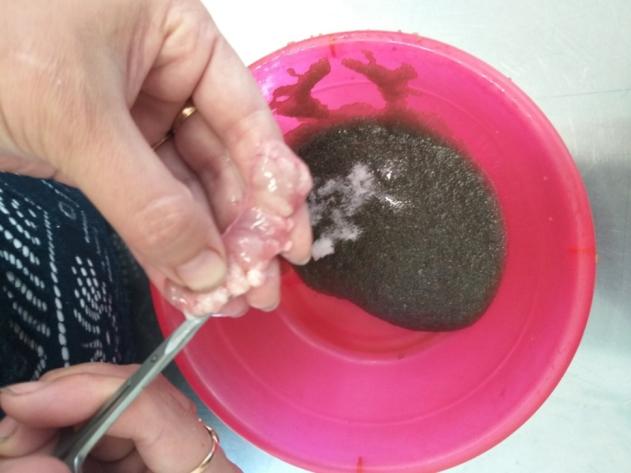
Рисунок 33 — Вскрытие семенников и получение спермы для искусственного оплодотворения овулировавшей икры
В том случае, если семенники необходимо было хранить, на отрезанный конец извлеченного семенника также накладывалась лигатура, чтобы сперма из него преждевременно не вытекала. После этого семенник тщательно осушали стерильной салфеткой и оставляли чашке Петри на фильтровальной бумаге. Закрытую чашку Петри с семенниками помещали в холодильник и хранили от 12 до 24 часов при температуре 20С. Проведенные исследования показали, что при правильном хранении семенников в холодильнике качество спермы в течение суток практически не изменяется.
В заключении следует отметить, что в число важнейших факторов, стимулирующих развитие индустриальной аквакультуры, входит селекционно-племенная работа, ориентированная на получение рыбы с высоким потенциалом продуктивности и воспроизводства. Чтобы повысить эффективность селекционно-племенной работы была разработана методика прижизненного получения спермопродукции, позволяющая использовать выдающихся по скорости роста самцов, оцененных по качеству потомства не менее чем в трех циклах воспроизводства.
Разработка новых технологических подходов, являющихся результатом наших исследований, позволяет использовать генетический материал высокоценных в племенном отношении самцов не однократно, а в нескольких репродуктивных циклах. Внедрение представленных разработок в практику аквакультуры позволит поднять результативность селекционно-племенной работы на новый уровень и открывает перспективы новых исследований.
2.1.6 Индукторы гаметогенеза африканского клариевого сома
Фундаментальные исследования закономерностей размножения и развития рыб не только вносят вклад в развитие ихтиологии но и способствуют решению проблем отечественного рыбоводства. Новые знания о воспроизводстве рыб являются фундаментальной основой биотехнологии разведения коммерчески ценных видов в индустриальной аквакультуре [62-64].
Принято считать, что в условиях индустриальной аквакультуры рыба постоянно находится в преднерестовом состоянии. Переход в нерестовое состояние происходит под действием вырабатываемого в гипофизе и эпифизе рыб гонадотропного гормона, воздействующего на гонады рыб, интерстициальные ткани которых вырабатывают половые гормоны [63, 64]. Гонадотропный гормон стимулирует фолликулярные клетки, выделяющие вещества, приводящие к созреванию ооцитов и сперматозоидов. При этом в организме рыб происходит физиологическая перестройка, сутью которой является интенсификация процессов генеративного обмена. В половых железах созревают половые клетки, рыба переходит в нерестовое состояние, вступая в размножение [65-67]. В этих физиологических процессах важная роль принадлежит факторам среды, которые в свою очередь создают предпосылки «нерестовой ситуации» [65-67].
Африканский клариевый сом широко распространенный объект рыборазведения во многих странах [68-71]. В странах Африки и Азии для гормональной стимуляции нереста используются гипофизы, извлеченные из черепной коробки убитой рыбы [70-71]. В условиях искусственного разведения, для получения зрелых половых клеток самцов, африканского клариевого сома повсеместно используют однократно [65, 66,.71]. После гормональной стимуляции самцов забивают, извлекают семенники, измельчают их, протирают через сито, чтобы извлечь сперматозоиды для экстракорпорального оплодотворения [65-66]. Маточные селекционные стада в этих странах не создаются.
Высокотехнологичная индустриальная аквакультура на основе УЗВ, позволяющая ускорить сроки наращивания биомассы рыб, в этих странах не практикуется. Практикуется пастбищное, садковое рыборазведение или же рыборазведение в бетонных бункерах [68-71].
В развитых европейских странах — Голландии, Венгрии, Польше, Чехии, Германии, а также в США и Канаде, при разведении африканского клариевого сома наиболее часто практикуется использование высокотехнологичной индустриальной аквакультуры на основе установок замкнутого водоснабжения (УЗВ) [72].
Для проведения гормональной стимуляции овогенеза и сперматогенеза в европейских странах большей частью используются гормональные химические препараты такие как «дагин» (Израиль), «оворел» (Венгрия), а в России — нерестин. Это является шагом вперед по сравнению с методом гипофизарных инъекций. Повсеместно самцов клариевого сома в репродуктивном процессе используют однократно, забивая их ради извлечения гормонально индуцированных семенников [72].
Плюсом европейской индустриальной аквакультуры является создание маточных селекционных стад. Это позволяет вести селекционную работу по материнской линии для сохранения генетического разнообразия африканского клариевого сома.
Сохранение внутривидового генетического разнообразия имеет важное значение для развития высокотехнологичной индустриальной аквакультуры, в которой рыбы из поколения в поколение выращиваются в искусственных условиях [72]. Для поддержания такого разнообразия необходимо постоянное обновление генетического материала. Это возможно если использовать самцов или самок из неродственных популяций.
Криоконсервация половых клеток рыб для сохранения их генетических ресурсов практически не развита [73]. Поэтому использование генетически ценного племенного материала самцов в рыбоводстве затруднено.
В своей работе мы, используя индукторы сперматогенеза, пытались получить зрелые гонады клариевого сома и исследовать возможность хранения спермы, которую было бы можно транспортировать на длительные расстояния без дорогостоящей криоконсервации с сохранением оплодотворяющей способности.
Целью данного этапа работы были сравнительные исследования влияния индукторов гаметогенеза, отличающихся механизмом действия, на созревание гонад и жизнеспособность спермы африканского клариевого сома в процессе хранения.
Объектом исследования являлись половозрелые самцы африканского клариевого сома весом 1,5-1,7 кг.
Всего было сформировано три группы самцов, по 10 особей в каждой, у которых проводилась стимуляция созревания гонад препаратами, отличавшимися механизмом действия.
Одну из групп самцов стимулировали хорионическим гонадотропином (ХГЧ). ХГЧ — гонадотропный гормон, вырабатываемый плацентой, оказывает гонадотропное действие, у самцов увеличивает вес семенников за счет разрастания интерстициальной ткани, стимулирует сперматогенез и продукцию половых стероидов. Рекомендуемая FAO дозировка хорионического гонадотропина составляет 2-4 тыс. МЕ/кг. Нами использовалась дозировка 3,5 тыс. МЕ/ кг, двукратно с интервалом 12 часов (рисунок 34).
Вторую группу самцов стимулировали нерестином 7А. Препараты серии Нерестин не содержат гормонов и гормоноподобных веществ, состоят из безвредных синтетических компонентов, поставляются в стерильной форме, готовой для внутримышечного или внутриполостного введения, обладают стандартной активностью. Применение основано на стимуляции собственной гонадотропной системы физиологически подготовленных рыб суперактивными рилизинг-факторами и модификаторами рецепторов аденогипофиза. Нерестины — это не гонадотропные, а гипофизарные препараты. Препарат «Нерестин-7А» применяли для самцов в дозе – 0,2 мл/кг (рисунок 34).
Третью группу самцов стимулировали сурфагоном. Сурфагон – синтетический аналог люлиберина. При введении в организм выполняет функции гормонального регулятора, стимулирует секрецию гипофизарных гонадотропинов лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ) спустя 2 — 3 часа после инъекции (рисунок 34).


Рисунок 34 — Препараты, используемые для стимуляции искусственного нереста
Сурфагон пятидесятикратно превосходит по активности люлиберин, конкурентно связываясь с рецепторами клеток передней доли гипофиза, вызывает, как и другие аналоги ГнРГ, кратковременное повышение уровня половых гормонов в крови. Препарат выводится из организма с мочой через 4-5 часов. На 1 кг веса рыбы вводили 1 мл сурфагона и 5 мг эглонила. Эглонил использовали в качестве препарата, демонстрировавшего у рыб седативный эффект.
После стимуляции у самцов хирургическим методом вскрывали брюшную полость и извлекали многократно увеличенные в размерах гормонально индуцированные семенники. Африканский клариевый сом обладает высокой регенерационной способностью, полостные операции переносит хорошо, проявляет при этом 100% выживаемость.
Извлеченные гонады отмывали в 0,6 % растворе NaCI, а затем в хлоргексидине, поверхность тщательно осушали фильтровальной бумагой; семенники взвешивали и помещали в чашки Петри. Сперматозоиды для исследования получали проколом цельных семенников тонкой иглой с использованием инсулинового шприца, под микроскопом исследовали их активность, выражая результат в процентах. Микроскопия проводилась в капле воды, поскольку вода является активатом спермы при оплодотворении. Жизнеспособность оценивалась сразу после извлечения гонад, а затем через 12, 24 и 48 часов хранения семенников при температуре +20С.
Следуя традициям европейской аквакультуры, мы в целях сохранения генетического разнообразия сформировали собственное селекционное маточное стадо из генетически неродственных особей и отдельно группу самцов с выдающейся скоростью роста, а также провели исследования по изучению выживаемости половых клеток при хранении. Эта технология позволит осуществлять транспортировку спермы рыб для использования в искусственном оплодотворении in vitro. Это имеет большое значения для селекции рыб и расширения генетического разнообразия в популяциях африканского клариевого сома.
При проведении исследований использовались самцы, репродуцированные и выращенные до половозрелого состояния в течении нескольких поколений в условиях бассейновой аквакультуры.
После процедуры стимуляции созревания гонад с использованием индукторов сперматогенеза у самцов вскрывали брюшную полость, семенники удаляли, после чего рыб вновь зашивали. Ввиду высокой регенерационной способности, по истечении двух месяцев, послеоперационных следов на рыбе не оставалось.
На рисунке 35 приведен внешний вид семенников африканского сома перед закладкой на хранение. На рисунке 36 изображены семенники, полученные при стимуляции самцов: а) — сурфагоном, б) — ХГЧ, в) — нерестином.
 |
 |
| Рисунок 35 — Внешний вид семенников африканского сома перед закладкой на хранение | Рисунок 36 — Семенники, полученные при стимуляции самцов: а) — сурфагоном, б) — ХГЧ, в) — нерестином |
Результаты наших исследований показали, что использование препаратов — индукторов гаметогенеза, отличающихся механизмом действия, оказало не равнозначный по степени выраженности эффект. Наиболее выраженный эффект стимуляции оказал сурфагон, семенники у самцов, индуцированных сурфагоном, характеризовались большей массой, чем при использовании двух других препаратов (рисунок 36). Стабильные результаты, судя по массе, с наименьшим размахом максимальных и минимальных значений веса гонад показал препарат нерестин.
Использование ХГЧ, судя по морфологии и массе семенников, также индуцировало гаметогенез, но применительно к нашему объекту исследования — африканскому клариевому сому, в меньшей степени, чем нерестин и сурфагон (рисунок 37).
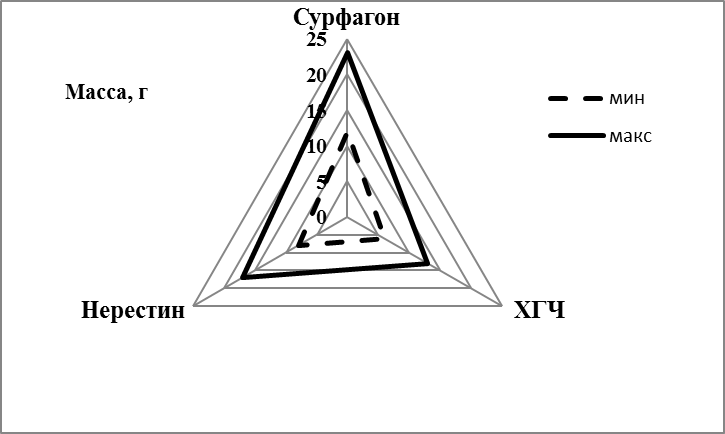
Рисунок 37 — Сравнительная оценка массы гонад самцов при использовании индукторов гаметогенеза, отличающихся механизмом действия
На следующем этапе работы мы исследовали жизнеспособность спермиев, полученных с помощью трех разных гормональных индукторов при различных сроках хранения в цельных семенниках. Исследования по выживаемости спермиев имеют важное значение для развития селекционной работы и сохранения генетического разнообразия в рыбоводстве.
Извлеченные семенники тщательно промывали в хлоргексидине. Антисептик хлоргексидин активен в отношении грамотрицательных и грамположительных бактерий, дрожжей, дерматофитов и липофильных вирусов, сохраняет активность в присутствии примесей крови и органических веществ, дезинфицирует ткани, не вызывая их повреждения. Именно эти свойства хлоргексидина были необходимы при обработке семенников, закладываемых на хранение. Каждые 12 часов из семенников, хранящихся в холодильнике при температуре +20С, инсулиновым шприцом отбирали пробы спермы на анализ.
Проведенные нами исследования по микроскопии хранящейся спермы показали, что при хранении в первые 12 часов и в течении суток изменения в жизнеспособности спермы минимальные (таблица 4). Следовательно, при необходимости, генетический материал самцов африканского клариевого сома в селекционных целях можно транспортировать без снижения жизнеспособности половых клеток в течение суток с момента резекции семенников.
Позитивным моментом использованной нами технологии, по сравнению с существующими аналогами, является то, что мы ушли от жестокой процедуры извлечения гипофизов, практикуемой в странах Африки, Азии, в ряде Европейских стран и в России. Мы также ушли от использования дорогостоящих импортных гормональных препаратов, использовав в своей технологии дешевые отечественные аналоги: ветеринарной препарат сурфагон, хорионичексий гонадотропин человека и разработанный в Пущино синтетический препарат — нерестин. Доза нерестина в несколько раз дешевле импортных аналогов.
Таблица 4 — Сравнительная оценка качества гонад самцов при использовании индукторов гаметогенеза, отличающихся механизмом действия
| Характеристические параметры | Экспериментальные группы самцов | ||
| 1- ХГЧ | 2- сурфагон | 3-нерестин | |
| Количество самцов в группе, (n) | 10 | 10 | 10 |
| Доля подвижных спермиев, (%) | 100 | 100 | 100 |
| Доля подвижных спермиев ч/з 12 ч | 89 — 100 | 97- 100 | 95 — 100 |
| Доля подвижных спермиев ч/з 24 ч. | 75 — 89 | 89 — 94 | 87 — 90 |
| Доля подвижных спермиев ч/з 48 ч | 20-30 | 35-40 | 25 — 30 |
Схемы с использованием сурфагона в отечественной практике существуют, но мало востребованы, поскольку часто провоцировали гормональный шок из-за использования на практике высоких доз. Введение в схему стимуляции атипичного нейролептика эглонила позволило в 2-3 раза снизить дозу сурфагона, устранило гормональный шок и оказало седативное действие на самцов. Использование эглонила также устранило гормональную агрессию рыб.
Разработанная нами технология получения и хранения половых продуктов африканского клариевого сома в семенниках, по ряду технологических решений намного проще и дешевле криоконсервации и дает новый импульс развитию рыборазведения этого высокоиндустриального вида.
Обобщая результаты, следует отметить, что в ходе исследований были использованы три индуктора гаметогенеза: хорионический гонадотропин, нерестин 7А и сурфагон, усиленный эглонилом.
Хорионический гонадотропин (ХГ) — гонадотропный гормон, вырабатываемый плацентой, обладает гонадотропным действием, увеличивает вес семенников за счет разрастания интерстициальной ткани, стимулирует сперматогенез и продукцию половых стероидов.
Нерестин 7А, является синтетическим препаратом, не относящимся к группе гонадотропинов, его применение основано на стимуляции собственной гонадотропной системы активными рилизинг-факторами и модификаторами рецепторов аденогипофиза.
Сурфагон – синтетический аналог люлиберина, гормональный регулятор, стимулирующий секрецию гипофизарных гонадотропинов лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона.
Использованные нами гормональные индукторы, отличающиеся механизмом действия, продемонстрировали разный по силе воздействия стимулирующий эффект. Наиболее выраженный эффект индукции созревания половых клеток самцов был получен при использовании сурфагона, усиленного эглонилом.
Было показано, что независимо от выбора индуктора гаметогенеза хранение половых клеток в семенниках при температуре +20С обеспечивает сохранность спермиев и их жизнеспособность более 24 ч.
Остановившись на сурфагоне как основном индукторе гаметогенеза, который мы будем использовать в воспроизводстве африканского клариевого сома мы попытались выявить зависимость «доза-эффект». С этой целью апробировали различные дозировки сурфагона и 2 усилителя действия. Один из них – традиционно испольуемый в фермерском рыбоводстве — раунатин и второй, ранее никогда не использованный в репродукции клариевого сома атипичный нейролептик – эглонил. Результаты исследований приведены в таблице 5.
Таблица 5 — Результативность стимуляции искусственного нереста
| № опыта | Температура воды | Соотношение самок и самцов | Схема гормональной стимуляции | Дозировка сурфагона, | Дозировкаэглонила, | Доля самцов с гормональным шоком | Доля самцов с созревшими семенниками, | Коэффи-циент зрелости половых продук-тов самок, | Доля фер-тиль-ной икры, |
| (0С) | мкг/кг | мг/кг | % | % | % | % | |||
| 1 | 28-30 | 2/4 | Сурфагон+
раунатин (6мг) |
5 | — | 33,0 | 50,0 | 12,0 | 45 |
| 2 | 28-30 | 2/4 | Сурфагон+
эглонил |
5 | 10 | 16,6 | 75,0 | 15,0 | 64 |
| 3 | 29-30 | 2/4 | Сурфагон+
эглонил |
7,5 | 20 | 16,6 | 75,0 | 16,6 | 72 |
| 4 | 28-30 | 2/6 | Сурфагон+
эглонил |
10 | 20 | 25,0 | 66,6 | 15,3 | 60 |
При проведении гормональной стимуляции самцы и самки клариевого сома в случае использования больших доз гормонов испытывают гормональный шок. Внешние проявления шока выражаются в капилляротоксикозе, изъязвлении кожных покровов в местах введения гормонов, в обесцвечивании и размягчении лучей спинного плавника. Первыми внешними признаками гормонального шока являлась кожная визуализация сосудистого рисунка. Вздуваясь, сосуды выступали на поверхность, и весь сосудистый рисунок был легко читаем через кожу. В основном, такая реакция была характерна для самцов, редко встречалась у самок. Очень редко при использовании высоких доз гормонов у самок отмечался разрыв гонад, рыба гибла.
Смертность, как крайнее проявление гормонального шока, была характерна только для самцов. При вскрытии таких особей отмечался отек внутренних органов, сопровождавшийся точечными кровоизлияниями.
Самцы с выраженным гормональным шоком после резекции семенников требовали отдельного содержания, лечения, затрат на лекарства. Актуальность проблемы сохранения генетически-ценного селекционного материала побудила нас разработать методику лечения последствий гормонального шока.
В течение первых трех дней после операции проводили инъекции дексаметазона (таблица 6). Для лечения изъязвлений кожи использовали актовегин, мильгамму. Все препараты вводили раз в сутки. Чтобы рыба во время процедур вела себя спокойно, ей накануне вводили эглонил в дозе 10 мг/кг.
Таблица 6 — Препараты и схема лечения осложнений гормонального шока
| Препарат | 1 сутки | 2 сутки | 3 сутки | 4 сутки | 5 сутки | |
| Дексаметазон, мг
(в инъекциях, мл) |
0,1 | 0,15 | 0,1 | — | — | |
| Актовегин 40 мг/мл,
(в инъекциях, мл) |
0,3 | 0,3 | 0,3 | 0,3 | 0,3 | |
| Мильгамма, мл/кг
(в инъекциях) |
0,2 | 0,2 | 0,2 | 0,2 | 0,2 | |
| Адаптоген Иркутин 1 г/100 л (в воду бассейна) | + | + | + | + | + | |
| Метилтиониния хлорид
1 мл 1% на 10 л H2O (ванночки) |
3 ч | 3 ч | 3 ч | 3 ч | 3 ч | |
| Хлоргексидин 0,05 %
(примочки) |
15 мин | 15 мин | 15 мин | 15 мин | 15 мин | |
В случае присоединения инфекции использовали аппликации с хлоргексидином на места поражения, ванночки с метиленовым синим, в которых пораженная рыба выдерживалась 3 часа. Признаки излечения можно было наблюдать уже на 3-4-е сутки, а полное выздоровление, как правило, наступало в течение недели. Самцы хорошо переносили все процедуры и не проявляли признаков беспокойства, если их голову предварительно обертывали мягкой, влажной, непрозрачной тканью.
Через сутки после гормональной стимуляции и извлечения половых продуктов самцы и самки меняли мраморную окраску на черную, которая держалась от двух недель до месяца. Поэтому рыбу, прошедшую процедуры искусственного нереста по ее окраске было легко отследить на массиве всей популяции.
Гормональная двухкомпонентная система (сурфагон+эглонил), использованная нами, для стимуляции искусственного нереста африканского клариевого сома, как свидетельствуют данные литературных источников, ранее не использовалась и является новой.
Лечение последствий гормонального шока актуально только для самцов с выдающимися показателями продуктивности, в остальных случаях это не актуально и не стоит дополнительных материальных затрат.
2.1.7 Прижизненное круглогодичное получение икры клариевого сома параллельно процессу выращивания товарной рыбы
Основным препятствием развития аквакультуры клариевого сома является его повышенные требования к температурному фактору. Поддержание оптимальной для клариевого сома температуры в осенне-зимний период требует дополнительных энергозатрат [2, 3, 5]. Высокую скорость роста клариевый сом демонстрирует при температуре среды 26 °С и выше. Для размножения представителям этого вида необходимы еще более высокие температуры.
Есть основания полагать, что наиболее эффективно африканский клариевый сом может быть использован как объект икорно-товарного производства. Икра клариевого сома не уступает по своим вкусовым качествам икре других более востребованных в пищевом отношении видов. Однако, до настоящего времени икорного производства клариевого сома в России не существует. Препятствует организации такого производства недостаточная изученность биологии представителей этого вида как рыбы с многопорционным нерестом.
В литературных источниках широко распространено мнение, что рыба в условиях искусственного разведения постоянно находится в преднерестовом состоянии. Полученные нами предварительные результаты по организации искусственного нереста африканского сома свидетельствуют о необоснованности этого тезиса, в отношении представителей данного вида. Важнейшую роль в этом процессе играет температура воды. Это ведущий фактор подготовки к нересту. Практические наблюдения показывают, что если температура содержания снижается до 220С и это совпадает по времени с окончанием нерестового периода, у самок запускается процесс резорбции икры, при снижении температуры содержания ниже 200С значительная часть самок становится яловыми.
Резорбция ооцитов после нереста – это естественный физиологический процесс, а в неблагоприятных условиях среды – это один из механизмов адаптации. У отнерестившихся самок лопнувшие и опустевшие фолликулы, остаточная икра рассасываются.
Резорбция – процесс необратимый и видоспецифический. Продолжительность резорбции у разных видов рыб варьирует от 1 месяца до полутора лет. Скорость резорбции зависит от температуры, чем выше температура воды, тем быстрее он протекает. При длительном воздействии температур ниже оптимальных самки становятся бесплодными и не на один год.
Исследование икорной продуктивности самок проводились в весенний и осенний периоды. Полученные результаты свидетельствовали, что уровень икорной продуктивности самок африканского клариевого сома весной значительно выше, чем в осенний период (рисунок 38). Икорная продуктивность самок имела четко выраженную сезонную динамику. Этот показатель, как свидетельствовали результаты, во многом зависел от продолжительности преднерестовой подготовки. Наиболее четко это проявлялось в осенний период.
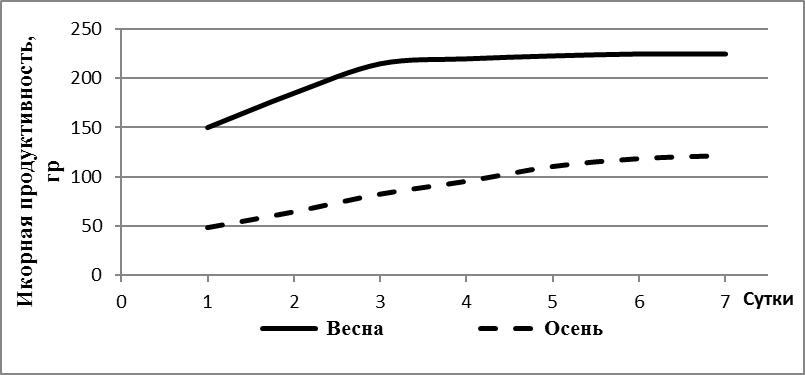
Рисунок 38 — Сезонные отличия икорной продуктивности самок в зависимости от продолжительности преднерестовой подготовки
Было установлено, что икорная продуктивность самок в весенний период почти в 2,5 раза превышала этот показатель в осенний период и зависела от продолжительности преднерестовой подготовки.
Продолжительность необходимой преднерестовой подготовки в осенний период также практически в два раза превышала продолжительность в весенний период. Для успешной реализации искусственного нереста в зимний период была необходима 6 -7 дневная преднерестовая подготовка. Икорная продуктивность тесно коррелирует с массой тела рыб. Коэффициент корреляции между этими признаками обычно превышает 0,6-0,8.
Расчет коэффициентов зрелости гонад также подтвердил факт достоверных сезонных отличий. Величина коэффициента зрелости всесезонно зависела от продолжительности преднерестовой подготовки. Результаты исследований отражены на рисунке 39.
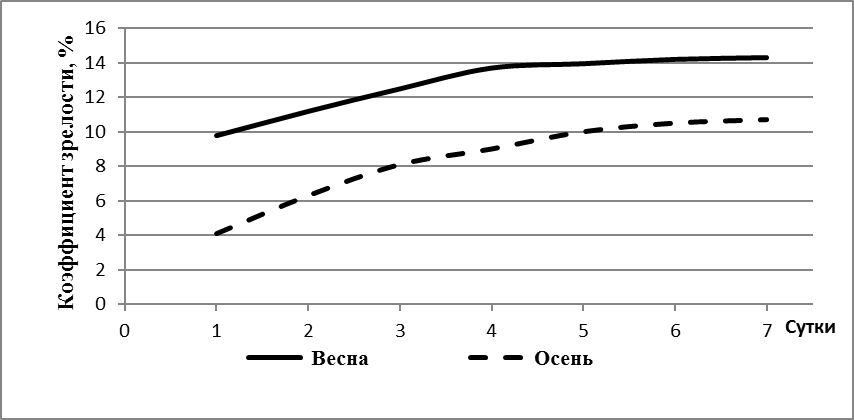
Рисунок 39 — Коэффициент зрелости гонад самок в весенний и осенний сезоны в зависимости от сроков преднерестовой подготовки
Было установлено, что в весенний период для успешного созревания гонад под действием сурфагона достаточно трехсуточной преднерестовой подготовки (рисунок 39). В осенний период значимость преднерестовой подготовки возрастала. Для подготовки самок к искусственному нересту в осенний период необходима минимум 7 дневная подготовка. Кривая развития гонад достигает своего максимума только на 6-7 сутки. Результаты исследований представлены на рисунок 39.
Продолжительность периода преднерестовой подготовки самцов в разные сезоны продемонстрирована на рисунке 40. Проведенные исследования показали, что у самцов, также как и у самок в ходе искусственного нереста проявляются сезонные отличия в развитии гонад под действием гормональных препаратов. В весенний период самцам достаточно непродолжительной преднерестовой подготовки для развития гонад под действием гормональной стимуляции. В осенний период, для реализации искусственного нереста необходима более продолжительная по времени преднерестовая подготовка (рисунок 40).
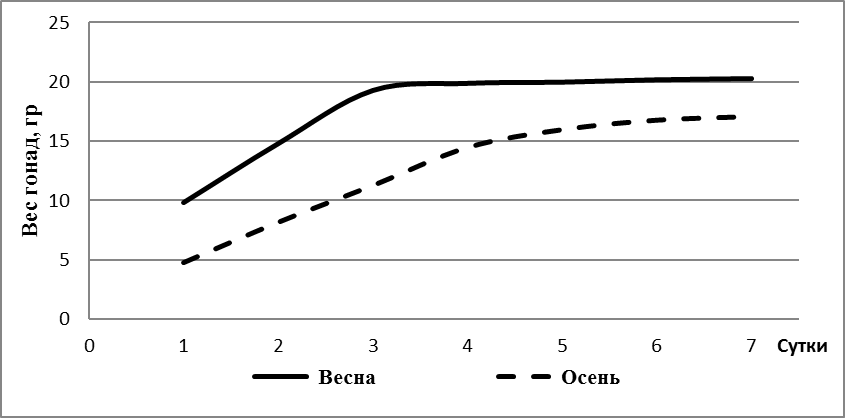
Рисунок 40 — Сезонные показатели развития гонад самцов в зависимости от продолжительности преднерестовой подготовки
Обнаружив сезонные отличия генеративных процессов, которые, как нам казалось, должны нивелироваться в условиях искусственного разведения, мы задались вопросом, существуют ли отличия в динамике роста и развития генераций, полученных в весенний и осенний периоды.
Поэтому на следующем этапе работы были проведены исследования динамики роста личинок и мальков, репродуцированных весной и осенью (рисунок 41).
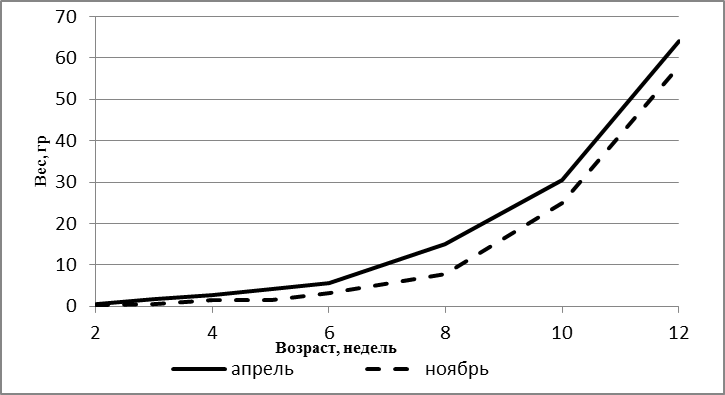
Рисунок 41 — Динамика роста мальков весенней и осенней генераций
Сравнительный анализ роста генераций личинок и мальков, репродуцированных в разные сезоны показал, что весенняя генерация опережала осеннюю в скорости роста во все исследованные периоды раннего онтогенеза.
Очевидно, это обусловлено более высокой интенсивностью физиологических процессов в весенний период и продолжительностью светового периода, что способствовало более быстрому набору веса.
Полученные нами результаты свидетельствовали, что готовность к воспроизводству в условиях искусственного разведения также зависит от сезона, как и в природной среде. В частности, опыт получения личинок и малька клариевого сома в зимний период свидетельствовал о необходимости проведения длительной преднерестовой подготовки.
Исследования, проведенные весной, в третьей декаде апреля, показали, что период подготовки в это время года к искусственному нересту может быть непродолжительным. Срок подготовки к проведению искусственного нереста у самок составляет не менее трех суток, у самцов – сутки при температуре содержания в преднерестовый период не ниже 26°С.
Исследования по стимуляции искусственного нереста, проведенные в осенний период показали, что минимальный срок подготовки в этот период составляли 7 суток у самок, и 3 суток у самцов. В зимний период уровень ответа на гормональную стимуляцию самый низкий.
В период преднерестовой подготовки, предшествующей гормональной стимуляции, необходимо было поднять температуру воды до 28°С, на фоне которой гормональные инъекции были эффективными. Собственный практический опыт показал, что быстрый подъем температуры до 28°С вызывает у самцов и самок температурный шок, в результате которого рыба сбрасывает в воду большое количество слизи с кожных покровов, а ее плавники на концах белеют и размягчаются, утрачивая защитную слизь. На фоне температурного шока вероятность заболевания аэромонозом или сапролегниозом в этот период резко возрастает. Избежать последствий температурного шока позволяет медленный подъем температуры со скоростью 1 градус каждые 12 часов и использование адаптогена трекрезана в дозе 4 мг на 1 л воды.
Исследование результативности гормональной стимуляции нереста самок в зависимости от сроков преднерестовой подготовки показало, что вес гонад самок зависит от ее продолжительности в разные сезоны. Уровень икорной продуктивности имеет сезонную динамику также как и коэффициент зрелости гонад.
В весенний период самки находятся в преднерестовом состоянии и дают быстрый ответ на гормональную стимуляцию, порции получаемой икры при весеннем искусственном нересте в два раза больше, чем в осенний период.
В осенний период все самки в условиях искусственного разведения не были готовы ответить на гормональную стимуляцию, при суточной преднерестовой подготовке. В весенний период при суточной преднерестовой подготовке все самки клариевого сома были готовы к отдаче икры, если температурный режим их содержания в преднерестовый период был на уровне 26°С. Медленный подъем температуры в течение суток на 2°С и стимуляция сурфагоном обеспечивали получение зрелой икры.
Однако двухсуточная и трехсуточная преднерестовая подготовка в весенний период была более эффективной, чем суточная, что выражалось в большем количестве полученной икры. Во все сезоны использовали схему гормональной стимуляции, основанную на однократной инъекции сурфагона в сочетании с эглонилом.
Если самки содержались при температуре, сниженнной до 20°С, генеративный обмен нарушался. Для африканского клариевого сома эта температура выходила за пределы оптимального диапазона температур, рыба плохо потребляла корм, была мало подвижна. В этих условиях даже семидневная преднерестовая подготовка не давала результата. Вскрытие таких самок, не ответивших на гормональную стимуляцию, демонстрировало атрофию гонад. Вес гонад у таких самок, независимо от их возраста и веса, едва достигал 6-8 г. Вес гонад самцов не превышал 2 г.
Полученные нами результаты имеют практическую значимость при организации икорного производства африканского клариевого сома. В частности, было показано, что икорная продуктивность самок клариевого сома имеет выраженную сезонную динамику. Установлено, что икорная продуктивность самок африканского клариевого сома, характеризующегося многопорционным нерестом, в ноябре снижается в два с половиной раза, по сравнению с весенним периодом, и зависит от продолжительности преднерестовой подготовки.
Также было установлено, что продолжительность преднерестовой подготовки играет решающую роль в реализации искусственного нереста, особенно в осенний период. Основное в преднерестовой подготовке – плавный подъем температуры среды до 28-29°С с интервалом 1°С за 12 часов.
В условиях УЗВ в осенний период требуется длительная, как минимум недельная, преднерестовая подготовка, для успешного гормонально-индуцированного созревания гонад. Если температура выращивания клариевого сома в донерестовый период была ниже 250С, продолжительность преднерестовой подготовки удлинялась, минимум в два раза.
Не менее важнуя роль абиотические факторы играют в ростовых процессах. Было показано, что весенняя и осенняя генерации клариевого сома на этапе постэмбрионального онтогенеза имеют отличительные особенности. Рост и развитие весенней генерации при соблюдении температурного режима 26°С происходит опережающими темпами по сравнению с осенней. Очевидно, температурный фактор не является единственным абиотическим фактором среды, играющим важную роль в процессах роста и развития африканского клариевого сома.
Развитие гонад самцов также характеризуется сезонной динамикой. В осенний период продолжительность преднерестовой подготовки, необходимой для созревания гонад самцов, требует в два раза больше времени, чем в весенний период. При несоблюдении условий преднерестовой подготовки гонады самцов и самок, несмотря на гормональную стимуляцию, не созревают.
При содержании самцов и самок при температуре воды 20°С и ниже они надолго становятся яловыми. В этот период рыба после двухнедельной или даже месячной преднерестовой подготовки на гормональную стимуляцию – не отвечает. Для того чтобы вернуть репродуктивную способность, рыбу необходимо длительное время, возможно не один сезон, содержать при температуре не ниже 260С. Продолжительность восстановительного периода у самок составляет не менее года, у отдельных особей затягивается еще на более длительный срок.
2.2 Разработка технологических подходов, повышающих выход личинок, снижающих уровень аномалий развития, предотвращающих каннибализм и болезни рыб, на основе использования адаптогенов и пробиотиков
Негативным фактором современного рыбоводства является высокая смертность рыб на ранних этапах онтогенеза. Причиной гибели рыб зачастую является хронический стресс, неизбежный в условиях искусственного разведении. При стрессе генеративный обмен нарушается, концентрация стероидных гормонов в организме по мере истощения — снижается, это тормозит созревание гонад и ухудшает качество половых продуктов рыб. По статистике в условиях рыбоводных заводов России у 70-80 % неоплодотворенной икры отмечается деформация икринок, их оболочек, тенденция к снижению дефинитивных размеров ооцитов в связи с уменьшением количества белка в отдельно взятой икринке [72]. У 50 % мальков регистрируются аномалии развития органов обоняния, нарушения в строении глаз, редукция или недоразвитие жаберных крышек, передней части головы, усиков, пищеварительного тракта и т. д. [72].
Эмбриональный и личиночный этапы в жизненном цикле рыб является наиболее уязвимым звеном. Именно на этапах оплодотворения, эмбрионального, личиночного онтогенеза отмечается наиболее высокий уровень смертности. Поиск факторов снижения уровня смертности на ранних этапах онтогенеза при искусственном разведении рыб, заставил нас обратиться к теории адаптогенов и феномену «состояния неспецифически повышенной сопротивляемости», которое возникает в организме под действием адаптогенов.
2.2.1 Повышение неспецифической резистентности и адаптационной пластичности клариевого сома на ранних стадиях онтогенеза за счет использования адаптогенов
Для управления реализацией генетического потенциала продуктивности африканского клариевого сома необходимы фундаментальные знания онтогенеза, экологии, регуляции физиологических процессов, гормональной регуляции овогенеза, цикличности репродуктивной функции, адаптационной пластичности гипофизарно-овариального механизма, нормы и патологии половых клеток при искусственном разведении. Пока таких знаний накоплено недостаточно.
Известно, что клариевый сом имеет многопорционный нерест и может производить икру несколько раз в год. Икра этого вида мелкая, имеет интенсивный темно-зеленый цвет, обладает высокой пищевой ценностью, имеет хороший вкус и может быть востребованным продуктом питания [73].
Периодичность созревания икры Clarias gariepinus в условиях индустриального разведения не изучена, недостаточно знаний о факторах, определяющих ее качественные и количественные характеристики. Для африканского клариевого сома в природной среде характерна сезонность размножения. У представителей этого вида в естественной среде обитания содержание гонадотропного гормона в гипофизах имеет сезонную динамику. В зимний период гормональный уровень снижается в 4-6 раз, по сравнению с летним периодом. Сохраняется ли та же закономерность при разведении в искусственной среде, нивелирующей действие природных факторов, — не известно.
Известно, что постоянное напряжение репродуктивной системы влияет на качество и количество половых клеток самцов и самок и, соответственно, на качество и количество продуцируемой икры и потомства. Таких исследований у у африканского клариевого сома не проводилось, они проводились у осетровых, которые не относятся к категории рыб, характеризующихся многопорционным нерестом.
В частности, для осетровых было показано, что в условиях напряженного функционирования репродуктивной системы существенно изменяется гаметогенез, ухудшаются качественные и количественные характеристики икры самок [74].
Нельзя исключить, что у рыб, как и у млекопитающих, может наблюдаться срыв адаптации, который выражается в патологии и утрате оплодотворяющей способности половых клеток из-за истощения репродуктивной системы.
Исследований в этом направлении не проводилось. Поэтому изучение влияния биологически активных веществ на репродуктивный процесс с целью его совершенствования авляется актуальным и содержит элементы новизны.
Данный раздел нашей работы посвящен поиску возможных путей расширения адаптационной пластичности африканского клариевого сома при разведении в условиях высокотехнологичной аквакультуры. С этой целью мы использовали адаптогены. Уместно коснуться теоретической основы их применения.
Концепция адаптогенов разработана в Росссии Н.В. Лазаревым во второй половине ХХ века. Она лежит в основе современной адаптивной медицины [75, 76]. Адаптогены — препараты растительной, химической и биологической природы, создающие в организме «состояние неспецифически повышенной сопротивляемости» — СНПС [77, 78].
Известно, что в состоянии СНПС, вызванном введением адаптогенов, организм защищен от физических и химических повреждений, вирусных заболеваний [75, 79]. Были расшифрованы молекулярные механизмы действия адаптогенов на организм человека и животных, и они широко востребованы в медицине и других областях [80]. Адаптогены повышают иммунитет, увеличивают выносливость, оптимизируют функции основных систем организма, обладают антиоксидантными свойствами, стимулируют регенераторные процессы; обеспечивают профилактику болезней и увеличивают продолжительность жизни [76].
Адаптоген трекрезан является универсальным адаптогеном широкого спектра действия, который рекомендован к использованию в животноводстве. Производители препарата изучали влияние трекрезана на аквариумных рыб. Препарат повышал резистентность рыбы на всех стадиях развития к длительному действию различных неблагоприятных факторов: пониженной и повышенной температуре, пониженному содержанию кислорода, присутствию в воде токсинов, несбалансированности кормов и т.д.
Трекрезан повышает усвоение метионина, который участвует в образовании гормонов передней доли гипофиза, предотвращает задержку роста, регулирует липидный обмен. Применение трекрезана, по мнению производителей препарата, позволяет получить дополнительный прирост массы и повысить выживаемость, стимулирует репродуктивную функцию, снижает негативные эффекты применения различных препаратов, повышает адаптационную пластичность рыбы в условиях стресса, при изменении водного режима или же кормления.
Целью данного этапа работы была оценка результативности использования трекрезана для повышения резистентности и расширения адаптационной пластичности африканского клариевого сома на начальных стадиях онтогенеза в условиях высокотехнологичной индустриальной аквакультуры .
На первом этапе проводилась оценка влияния адаптогена на оплодотворяемость икры. Было установлено, что в экспериментальной группе на фоне трекрезана показатель оплодотворяемости составил 86,33±4,6% и был выше, чем в контрольной, где составил 65,67±4,96%. Однако, статистическая обработка результатов показала, что разница по оплодотворяемости между опытной и контрольной группами была не достоверной. Результаты представлены на рисунке 42.
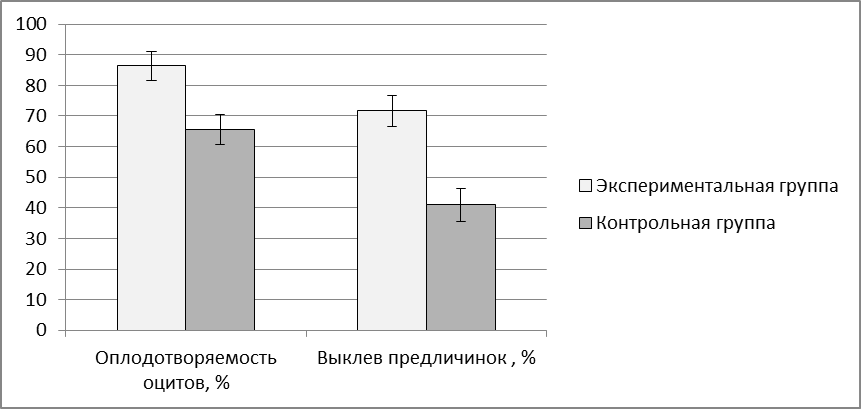
Рисунок 42 — Влияние адаптогена на оплодотворяемость и выклев предличинок
При культивировании оплодотворенной икры в норме какая-то часть эмбрионов погибает. В наших опытах наибольшая смертность эмбрионов наблюдалась в контрольной группе. В этой группе выклев предличинок был низким и составил 41,0±5,34%. В опытной группе этот показатель был значительно выше — 71,67±5,03 %. Результаты представлены на рисунке 42.
Повышение жизнеспособности эмбрионов и выклева предличинок в опытной группе свидетельствовало о позитивном влиянии адаптогена на эмбриональный онтогенез африканского клариевого сома.
В ходе роста личинок мы выявляли аномалии развития, учитывая число нормально и аномально развивающихся форм. В опытной группе, в корма которой и в воду вводили адаптоген, число нормально развивающихся особей составило 89,33±3,89%. В контрольной группе у личинок, полученных из ооцитов и эмбрионов, не обработанных адаптогеном, доля нормальных форм составляла 70,0±2,12%. В основном мы наблюдали аномалии развития позвоночника, жабр, глаз.
Важным показателем резистентности и адаптационной пластичности организма является выживаемость личинок. Было установлено, что на фоне применения адаптогена выживаемость личинок достигала 90,67±2,86, в то же время в контрольной группе выживаемость составляла 75,33±1,78. Результаты исследований представлены на рисунке 43.
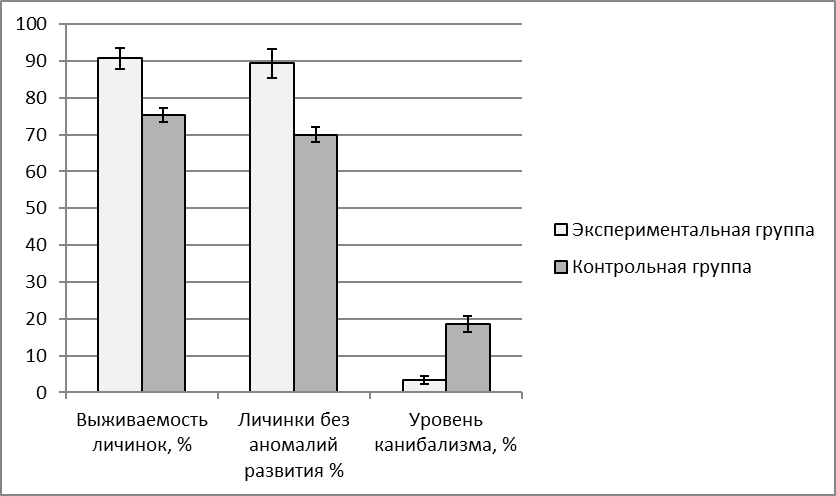
Рисунок 43 — Выживаемость, уровень аномалий и каннибализма личинок клариевого сома в присутствии адаптогена
Одной из негативных особенностей африканского сома является агрессивность по отношению к представителям собственного вида. В ходе наблюдений было отмечено, что в опытной группе, получавшей адаптоген, мы практически избавились от каннибализма. Этот негативный фактор рыборазведения удалось свести до 3,33±1,08%. В контрольной группе без адаптогена он достигал 18,67±6,34%.
Повышение жизнеспособности эмбрионов в опытной группе и снижение уровня отклонений в развитии зародышей африканского сома мы связываем с улучшением биологических свойств оплодотворенной икры после ее обработки адаптогеном в период набухания, при культивировании, а также с повышением адаптационной пластичности развивающихся эмбрионов.
На следующем этапе исследований мы проводили наблюдение за ростом и развитием личинок. После рассасывания желточного мешка личинки африканского сома переходили на экзогенное питание. В качестве живых стартовых кормов в первую неделю выращивания мы использовали науплий артемии (nauplius Artemia salina), через неделю после перехода на экзогенное питание, мы переводили личинок на кормление «стартовыми» комбикормами, соответствовавшими их возрасту и размеру. Все корма предварительно обогащали трекрезаном.
Адаптоген добавляли в дозе 0,4 г/кг корма. В корма для контрольной группы адаптоген не вводили.
Для оценки эффективности воздействия адаптогена в процессе выращивания личинок африканского клариевого сома исследовали показатели абсолютного и среднесуточного прироста биомассы.
При исследовании весовых показателей было установлено, что через 30 суток выращивания в опытной группе усредненная масса личинки составила 3,90±0,21% г и была в 2 раза выше, чем в контрольной группе. Результаты исследований представлены в таблице 7.
Таблица 7 — Влияние адаптогена на рост личинок африканского клариевого сома, (M±m, n=100)
| Показатели | Адаптоген | Контроль |
| Средняя масса личинки на начало опыта, г | 0,05±0,04 | 0,05±0,04 |
| Средняя масса личинки на конец опыта, г | 3,90±0,21 | 1,90 ±0,20 |
| Абсолютный прирост, г | 3,85 | 1,85 |
| Среднесуточный прирост, г | 0,13 | 0,06 |
Использованный нами в опытах адаптоген трекрезан — синтетический аналог природного женьшеня, показал хорошие результаты в процессе культивирования эмбрионов, повысил выклев предличинок, их выживаемость, снизил уровень аномалий развития и каннибализма, свойственного личинкам африканского клариевого сома.
Как показали исследования, применение адаптогена позитивно повлияло на рост и развитие личинок. За 30 суток опыта при выращивании личинок с использованием трекрезана, у них в два раза быстрее произошел прирост биомассы, чем в контрольной группе.
Действующее вещество трекрезана — производное феноксиуксусной кислоты, синтетический аналог природных адаптогенов Panax ginseng and Rhodiola rosea. Продукт безопасен, не вызывает нежелательных побочных эффектов, не обладает кумулятивным эффектом. Действующее вещество не является ни антибиотиком, ни гормоном и не загрязняет окружающую среду.
К числу основных свойств адаптогенов относится их безвредность, способность к воздействию лишь на функционально измененном фоне, их свойство вводить организм в состояние неспецифической повышенной сопротивляемости, воздействовать независимо от направленности сдвигов и тем сильнее, чем глубже изменения. Несмотря на все свои позитивные свойства адаптогены до настоящего времени не нашли применения в рыбоводстве. Полученные нами результаты являются новыми и позволяют рекомендовать использование адаптогенов на ранних этапах онтогенеза в индустриальной аквакультуре .
Подытоживая результаты данного раздела исследованний необходимо отметить, что применение адаптогена трекрезана оказало позитивное влияние на процесс культивирования эмбрионов, поскольку выклев предличинок возрос на 30,67%, выживаемость личинок на 15,34%, уровень аномалий развития снизился на 19,33%, а уровень каннибализма в среднем на 15,34.%.
Применение трекрезана позитивно повлияло на рост и развитие личинок. При выращивании личинок в среде с адаптогеном, и с использованием кормов, обогащенных трекрезаном их абсолютный и среднесуточный прирост в два раза превысил эти показатели у личинок, выращиваемых без адаптогена.
2.2.2 Реакция системы белой крови африканского клариевого сома на пробиотик «споротермин»
Для того чтобы индустриальное рыбоводство было рентабельным и приносило доход, необходимо обеспечить высокий уровень выживаемости рыбы [81, 82]. Однако в условиях высокой плотности посадки это представляет значительную проблему. Чем выше плотность посадки, тем больше микробное загрязнение среды обитания рыб патогенной микробиотой. Болезни рыб в условиях индустриальной аквакультуры имеют стремительное развитие и поражают, как правило, все поголовье. Важная роль в решении этой проблемы принадлежит мониторингу здоровья популяции. Важно выбрать наиболее информативные индикаторные показатели состояния здоровья популяции, которые можно было бы отслеживать в реальном времени. Практика показывает, что в этом плане информативна лейкограмма. Все группы лейкоцитов как по отдельности, так и в совокупности выполняют функции защиты организма от чужеродного вторжения, являясь иммунокомпетентными клетками. При этом, разные группы лейкоцитов: базофилы, эозинофилы, моноциты, лимфоциты и нейтрофилы выполняют свои специфические функции. Использование метода лейкограммы, как средства мониторинга эпизоотической ситуации, позволит значительно снизить уровень потерь.
К сожалению, лейкоцитарные формулы многих видов рыб в настоящее время недостаточно изучены. Еще менее изучены лейкоцитарные формулы гибридных видов рыб. В частности, лейкограмма африканского клариевого сома, распространенного в аквакультуре РФ, в настоящее время не расшифрована из-за недосточного внимания к этой проблеме.
Между тем, разведение клариевого сома [83, 84] сулит большие выгоды, поскольку у этого вида затраты корма на 1 кг продукции, как правило, не превышают 1,0-1.1 кг. Выносливость этого вида позволяет выращивать его в условиях высокой плотности посадки.
Практика показывает, что такое существенное изменение экологических условий среды обитания вызывает хронический стресс у рыбы, сказывающийся на ее иммунной системе и приводит к повышению восприимчивости к заболеваниям. В такой ситуации использование лейкограмм позволяет визуализировать и осознать формирующуюся проблему уже на начальных ее этапах.
Для оздоровления среды обитания рыб в последнее время стали использовать хорошо зарекомендовавшие себя в животноводстве пробиотики. Однако до сих пор широкого распространения в аквакультуре пробиотики не получили.
Современные пробиотики, не наносящие ущерба организму животных, рассматривают как альтернативу антибиотикам. Введение пробиотиков в среду обитания или же в корма рыб коренным образом изменяет водный микробиоценоз и микробиоценоз кишечника рыб. Являясь антагонистами патогенной и условно-патогеннной микробиоты, пробиотики качественно и количественно улучшают микробиологические показатели воды и не только. В частности, пробиотики в составе кормов оптимизируют кишечный микробиоценоз.
В своих исследованиях мы использовали пробиотик последнего поколения «Споротермин» [85]. «Споротермин» — это препарат, который создан на основе спорообразующих бактерий Bacillus subtilis и Bacillus licheniformis. Споротермин состоит полностью из споровых форм, которые выживают в кислой среде желудка, а затем в кишечнике прорастают и размножают. Бактерии В. subtilis и В. Licheniformis характеризуются высокой антагонистической активностью к различным группам патогенных и условно-патогенных микроорганизмов, они способны восстанавливать и оптимизировать кишечный микробиоценоз, повышая иммунитет рыб. Применение споротермина позволяет отказаться в рыбоводстве от использования антибиотиков [86, 87].
Необходимым условием успешного ведения индустриального рыбоводства является контроль физиологического состояния популяции. Как известно, с этой целью используют кровь, поскольку это наиболее чувствительная и лабильная система организма, отвечающая на изменение любых экзогенных факторов среды и эндогенных процессов в организме. Так как в настоящее время влияние споротермина на иммунную систему организма изучено недостаточно, исследование картины белой крови могло бы внести существенный вклад в решение этой проблемы [88, 89].
Как уже отмечалось выше, лейкоцитарная формула крови африканского клариевого сома, выращиваемого в России, несмотря на то, что это достаточно распространенный в аквакультуре вид, не исследована. Данных о структуре лейкограммы африканского клариевого сома в доступных литературных источниках обнаружено не было.
У рыб в лейкограмме присутствуют следующие виды лейкоцитов: лимфоциты, моноциты, базофилы, нейтрофилы, эозинофилы и полиморфноядерные лейкоциты [90-92].
Лимфоциты — у этой группы клеток почти весь объем занят фиолетовым ядром, окруженным тонким ободком голубой цитоплазмы.
Наиболее крупными клетками лейкоцитарного ряда являются моноциты, для них характерна вакуолизированная без зернистости цитоплазма, в которую погружено бобовидное ядро, всегда смещенное относительно центра клетки [93].
Нейтрофилы характеризуются круглыми формами, цитоплазмой фиолетово-розового цвета, по возрастному критерию подразделяются на миелоциты, юные, палочкоядерные и сегментоядерные зрелые формы, в зависимости от возраста имеют сначала овальное, затем палочковидное, с возрастом — сегментированное ядро.
Эозинофилы — клетки похожие на нейтрофилы, но их невозможно спутать ввиду розовой зернистости цитоплазмы.
Базофилы среди остальных клеток лейкоцитарного ряда можно отличить по фиолетовой зернистости цитоплазмы.
Гранулоциты, макрофаги относятся к категории полиморфноядерных клеток размером до 14 мкм, характеризующихся подковообразным, разделенным на сегменты ядром, погруженным в гранулированную цитоплазму.
Проведенные нами исследования лейкоцитарной формулы африканского клариевого сома показали, что его лейкограмма относится к лимфоидному типу (рисунок 44). Это характерно для костистых рыб [94].
В лейкограмме популяции, обследованных нами африканских клариевых сомов уровень лимфоцитов достигал 78,33%. По своей сути лимфоциты выполняют клиринговую функцию за счет выявления, распознавания и уничтожения всего чужеродного в организме; они также обеспечивают иммунный ответ, его регуляцию и иммунную память.
Известно, что помимо защитной функции, которую выполняют лейкоциты, они играют важную роль в обмене веществ. В лейкограмме процентное соотношение различных типов лейкоцитов отражает не только их клеточный иммунитет, но и является характеристикой физиологического состояния организма рыб.
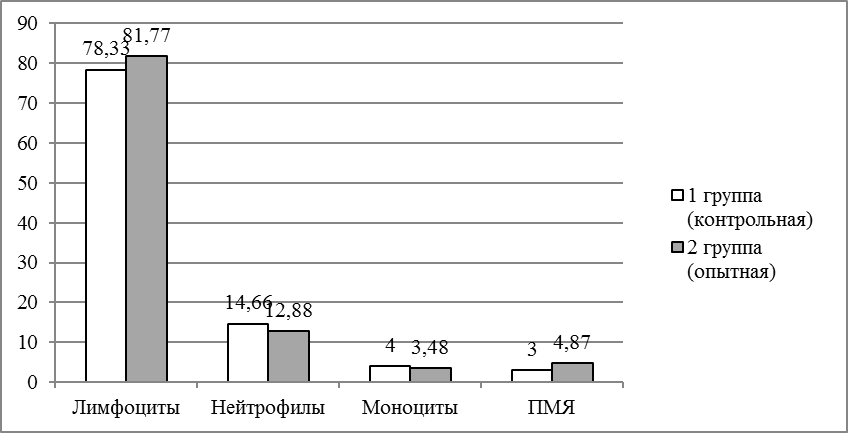
Рисунок 44 — Структура лейкоцитарной формулы клариевого сома
Данные наших исследований (рисунки 45-51) показали, что количество лимфоцитов в опытной группе больше на 4,5%.
Рисунок 45 — Мазок крови клариевого сома (1 – полиморфноядерный эозинофил; 2 – нейтрофил сегментоядерный; 3 – лимфоцит)
Можно предположить, что у рыб второй опытной группы, получавшей в качестве добавок пробиотик, часть защитной функции организма выполняют анаэробные бактерии Bacillus subtilis и Bacillus licheniformis, подавляющие широкий спектр грамположительных и грамотрицательных бактерий.
Рисунок 46 — Мазок крови с полиморноядерным базофилом (1); лимфоцитом (2); моноцитом (3)
Лимфоциты благодаря специальным участкам рецепторов, которые активируются при контакте с антигеном, производят защитные антитела, которые осуществляют иммунную память. Эти функции осуществляют специализированные формы лимфоцитов.
Рисунок 47 – Мазок крови клариевого сома, содержащий полиморфноядерные метамиелоциты 1-4
Моноциты по сравнению с другими лейкоцитами проявляют высокую фагоцитарную активность к продуктам распада клеток и тканей, они также способны нейтрализовать действие токсинов. В нашем эксперименте было показано, что на фоне пробиотика количество моноцитов у рыб по сравнению с контролем снижается. Вероятно, это перераспределение в сторону снижения количества моноцитов обусловлено тем, что на фоне пробиотика уровень бактериального загрязнения среды обитания рыб многократно ниже, поэтому потребность в клетках этой группы имеет тенденцию к снижению.
Рисунок 48 — Мазок крови клариевого сома с сегментоядерным нейтрофилом в поле зрения
Нейтрофилы свою биологическую роль реализуют, осуществляя защиту организма от токсинов и бактерий. Эти лейкоцитарные клетки обладают способностью проникать сквозь стенки капилляров в межтканевые пространства для осуществления фагоцитоза. Результаты наших исследований свидетельствуют, что на фоне пробиотика потребность в клетках этой группы также имеет тенденцию к снижению. Разница между опытом и контролем составляла 13,22%.
Рисунок 49 – Мазок крови клариевого сома демонстрирующий 1 – лимфоцит; 2 – полиморфноядерный базофил
Прослеживая судьбу полиморфноядерных клеток, следует отметить, что на фоне пробиотика доля метамиелоцитов, нейтрофильных и эозинофильных миелоцитов в лейкограмме возрастала.
Рисунок 50 — Мазок крови клариевого сома с лимфоцитом (1) и моноцитом -2 в поле зрения
На лейкопоэз, а, следовательно, и на структуру лейкограммы, большое влияние оказывает температурный фактор. Как известно, для такой теплолюбивой рыбы, как клариевый сом, температурный оптимум составляет 26ºС. Колебания температуры в ту или иную сторону оказывают влияние на соотношение различных групп лейкоцитов в лейкограмме.
Поэтому в своих исследованиях мы обеспечивали температурный оптимум. В лейкограмме из гранулоцитов больший процент приходился на нейтрофилы и псевдоэозинофилы.
Необходимо отметить, что, по нашим наблюдениям, стабилизация лейкоцитарной формулы гибридных форм африканского клариевого сома происходит уже на первом году жизни, после этого морфология различных групп лейкоцитов остается неизменной и не зависит от возраста рыбы.
В ходе исследований было установлено, что сом — типичный представитель лейкоформулы лимфоидного типа. В лейкоформуле популяции сомов, выращенных в отсутствии пробиотика, на долю лимфоцитов приходилось около 78,33%. У рыб, выращенных в присутствии «споротермина», количество лимфоцитов на 4,5% выше.
Рисунок 51 — Мазок крови клариевого сома с лимфоцитом в поле зрения
Рыба, выращенная в среде с пробиотиком, на протяжении всего периода выращивания ничем не болела. Можно предполагать, что у рыб, потребляющих «споротермин», часть защитной функции организма выполняют анаэробные бактерии Bacillus subtilis и Bacillus licheniformis, подавляющие широкий спектр грамположительных и грамотрицательных бактерий. На фоне пробиотика возросла также доля полиморфноядерных форменных элементов за счет снижения доли моноцитов и нейтрофилов. Пробиотики противодействуют развитию патогенной и условно-патогенной микробиоты, позитивно воздействуют на организм, оптимизируя его микробиоценоз. Они являются альтернативой антибиотикам и безопасны для человека. Назначение пробиотика «Споротермин» заключается в повышении иммунитета, снижении риска заболеваний и в оздоровлении организма рыб. Африканский клариевый сом, выращенный в среде с пробиотиком, является продуктом здорового питания, содержащим жизненно необходимые организму человека компоненты.
2.2.3 Оздоровления микробиоценоза овулировавшей и оплодотворенной икры с использованием пробиотиков и адаптогенов
Развитие индустриальной аквакультуры африканского клариевого сома предполагает разработку новых, более совершенных подходов в выращивании рыбы, основанных на экологически чистых технологиях. Для этого необходимы микробиологические исследования, направленные на исследование микробного пейзажа среды обитания рыб, закономерностей формирования микробиоценозов и механизмов их функционирования.
Основными факторами передачи инфекции в аквакультуре является вода, контаминированный инвентарь, корма, но главным источником является сама рыба, которая выделяет продукты своего метаболизма в водную среду, формируя высокий уровень органического загрязнения, способствующего развитию патогенной и условно-патогенной микробиоты [95, 96].
При инкубации оплодотворенной икры африканских клариевых сомов определенная доля эмбрионов через несколько часов после оплодотворения останавливается в развитии. Погибшая икра или оболочки икры подвергаются процессам разложения. Патогенные бактерии, заселяя оболочку эмбриона, в последующем колонизируют кишечник личинок. У личинок в кишечнике нарушается структура естественного микробиоценоза, за счет смещения в сторону патогенной и условно-патогенной микробиоты. На этом фоне у личинок рыб, начиная с раннего постэмбрионального онтогенеза, развиваются инфекционные заболевания. Чтобы сформировать или оптимизировать кишечный нормоценоз, повысить иммунитет и, в конечном счете, добиться повышения жизнеспособности и сохранности рыбы в процессе выращивания используют пробиотики и адаптогены [97-103].
Целью работы данного этапа исследований была оценка перспектив использования пробиотика споротермина и адаптогена трекрезана для повышения выживаемости личинок африканского клариевого сома за счет оптимизации структуры кишечного микробиоценоза и повышения естественной резистентности.
Пробиотик споротермин — это препарат, который создан на основе спорообразующих бактерий Bacillus subtilis и Bacillus licheniformis, число которых не менее 3-5×109 КОЕ/г. Он применяется для повышения иммунитета, снижения отрицательного воздействия стресс-факторов, профилактики и лечения инфекционных заболеваний, для нормализации микробного баланса в пищеварительном тракте у рыб. Споротермин является антагонистом патогенов и позиционируется как современная альтернатива антибиотикам. Этот препарат обладает иммунномодулирующим действием. Споротермин разработан производственным объединения ВетСельхоз (г. Москва), представляет собой однородный мелкодисперсный порошок от белого до кремового цвета со слабовыраженным молочным запахом [104].
Адаптоген трекрезан является универсальным адаптогеном широкого спектра действия, повышает устойчивость рыбы на всех стадиях развития к длительному действию различных неблагоприятных факторов. Действующим веществом адаптогена трекрезан является производное феноксиуксусной кислоты, синтетический аналог природных адаптогенов (женьшеня, аралии, элеутерококка, родиолы розовой). Продукт безопасен, не вызывает нежелательных побочных эффектов, не накапливается в организме и получаемой продукции, обладает высокой иммунотропной активностью [101,105]. Трекрезан выпускается в виде порошка, расфасованного в полиэтиленовые запаянные пакеты по 0,1, 0,5 и 1,0 кг.
При инкубации оплодотворенной икры через нестерильную поверхность происходит обсеменение эмбрионов условно-патогенной и патогенной микрофлорой. Обработка икры бактерицидными химическими препаратами, предотвращающими обсеменение, в том числе антибиотиками, способствует снижению естественной резистентности будущих личинок [98].
На первом этапе работы мы исследовали микробный пейзаж свежеполученных интактных половых клеток самок и самцов.
Результаты бактериологических исследований показали присутствие в микробиоценозе свежеполученной интактной икры самок клариевого сома условно-патогенных бактерий Сitrobacter freundii (семейство Enterobacteriaceae) и Enterococcus faecalis (семейство Enterococcaceae). На питательных средах наблюдали сливной рост бактерий (до 108 клеток) (рисунок 52).
Патогенные формы бактерий рода Citrobacter — возбудители гастроэнтеритов и пищевых токсикоинфекций у рыб обычно вызывают заболевания в ассоциации с другими бактериями. C. freundii — грамотрицательные факультативные анаэробы, характеризующиеся прямыми палочковидными формами, обладают достаточной подвижностью, и спор не образуют [95,106].
Энтерококки принято считать показателями свежего «фекального загрязнения». E. faecalis морфологически характеризуются как округлые, немного вытянутые с заостренными концами кокки. Как правило, они располагаются попарно или в коротких цепочках [95, 106].
В норме для микробиоценоза икры рыб бактерии группы кишечной палочки не характерны. В биотехнологии искусственного размножения африканского клариевого сома в условиях бассейновой аквакультуры икру от самок получают путем сцеживания. По нашему мнению, обсеменение происходит именно на этом этапе [107].
При микробиологической оценке зрелых спермиев, необработанных пробиотическим препаратом и адаптогеном, также была выделена E. faecalis. На питательных средах наблюдали сливной рост бактерий (108 клеток), как и при посеве с икры. Очевидно обсеменение семенников бактериями E. faecalis происходит на этапе их извлечения из брюшной полости [108-109].
В икре и в сперме, обработанных пробиотиком и адаптогеном, а также в воде, в которой проходила инкубация икры на фоне пробиотиков и адаптогенов, также были обнаружены бактерии вида E. faecalis, но их количество было значительно ниже. На питательных средах наблюдали скудный рост бактерий (104 клеток) (рисунок 53).
 |
 |
| Рисунок 52 — Посев с интактной икры (сливной рост бактерий 108 клеток) на кровяном агаре | Рисунок 53 Посев из воды при инкубации икры на фоне пробиотиков и адаптогенов (скудный рост бактерий 104 клеток) на кровяном агаре |
В двух параллельно проведенных экспериментах: при обработке половых продуктов адаптогеном и пробиотическим препаратом, и без их использования, оплодотворение икры клариевых сомов прошло успешно.
Исследование качества оплодотворения на фоне обработки препаратами показало, что показатель выклева предличинок был высокий и составил 75%. При оценке качества оплодотворения икры без использования адаптогена и пробиотика наблюдали, что значительная часть развивающейся икры уже после 8 часов инкубации гибла и выглядела побелевшей. В конечном итоге показатель выклева предличинок в контроле был достоверно ниже на 30-40%, по сравнению с оплодотворенной икрой, для инкубации которой использовали и пробиотик и адаптоген.
Учет выживаемости предличинок (рисунки 53, 54) проводили в первую неделю после выклева. Выживаемость предличинок клариевых сомов, обработанных пробиотиком и адаптогеном, была высокой, на уровне 90% от числа вылупившихся. Выживаемость личинок, полученных без использования пробиотика и адаптогена, была ниже на 30%.
 |
 |
| Рисунок 53 — Предличинка клариевого сома с желточным мешком, первый час после выклева Ув. 10x | Рисунок 54 — Личинка клариевого сома при переходе на экзогенное питание — 72 часа после выклева Ув. 10x |
Пробиотики в современной аквакультуре являются альтернативой антибиотикам. Но, в отличие от антибиотиков, они не оказывают негативного влияния на организм рыб на всех этапах их онтогенеза. В наших исследованиях примененение адаптогена трекрезана и пробиотика споротермина повысило выклев предличинок и выживаемость личинок. Применение пробиотика споротермина и адаптогена трекрезана оказало оздоравливающее действие на организм рыб, повысив их неспецифическую резистентность на этапах эмбрионального и раннего постэмбрионального онтогенеза.
В икре, сперме, а также в воде, в которой проходила инкубация икры, после использования пробиотика споротермина количество бактерий вида
E. faecalis существенно снизилось. На питательных средах отмечался их скудный рост -104 клеток. Таким образом, использование пробиотика споротермина снизило уровень условно-патогенной микробиоты на четыре порядка. Полученные нами результаты свидетельствовали, что использование пробиотика споротермина изменило структуру микробиоценоза среды обитания рыб, снизив в нем долю условно-патогенной микробиоты.
Использование адаптогена трекрезана оказало иммуномодулирующий эффект, что выразилось в повышении выживаемость предличинок и личинок клариевого сома. Очевидно, свой вклад в повышение выживаемости личинок внес и споротермин, который в соответствии со своим прямым назначением оптимизировал структуру кишечного микробиоценоза.
В заключение необходимо отметить, что при исследовании микробиоценоза оплодотворенной икры и роли условно-патогенной микробиоты в его формировании были выявлены условно-патогенные бактерии Сitrobacter freundii (семейство Enterobacteriaceae) и Enterococcus faecalis (семейство Enterococcaceae). Использование пробиотика споротермина и адаптогена трекрезана для оптимизации кишечного нормоценоза, повышения иммунитета и, в конечном счете, жизнеспособности и сохранности рыбы в процессе ее выращивания дало хорошие результаты. Это снизило бакобсемененность икры и существенно повысило выход и выживаемость личинок.
Полученные результаты позволяют заключить, что применение споротермина и трекрезана дает хороший эффект и может быть успешно использовано в условиях индустриальной аквакультуры.
2.2.4 Пробиотики и адаптогены в лечении аэромоноза африканского клариевого сома
Африканский клариевый сом имеет специфические особенности — у него отсутствует чешуя, он имеет тонкую и нежную кожу. Именно поэтому аэромоноз клариевого сома можно выявить на начальных этапах, пока заболевание еще не приняло тяжелую форму.
Первые признаки заболевания в популяции африканского сома были выявлены нами после переохлаждения рыбы, вызванного аварийным снижением температуры в рыбоводных бассейнах. Спустя неделю проявились первые симптомы заболевания.
При осмотре всей всего поголовья рыб включавшего 536 особей, у 147 были обнаружены кровоизлияния на коже и плавниках, пузыри, наполненные жидкостью (рисунок 55а), редуцированные красные усы (рисунок 55б), изъязвления с серовато-белым ободком по краям (рисунок 55в), помутнение глаз (рисунки 55а,в), гиперемия анального кольца, разрушение плавников (рисунок 55), асцит, язвы хвостового стебля. Предварительным диагнозом, который требовал лабораторного подтверждения, был аэромоноз.

а) |

б) |

в) |
| Рисунок 55 — Внешние проявления аэромоноза у клариевого сома | ||
Все особи, обнаружившие признаки заболевания, были изолированы от остального поголовья.
В результате патологоанатомических исследований погибшей рыбы были отмечены следующие изменения: геморрагическое воспаление кишечника, печень темно-серой окраски, желчный пузырь переполненный желчью, увеличенная селезенка, брюшная полость наполнена кровянистой жидкостью. Проведенные микробиологические исследования подтвердили предварительный диагноз. Таким образом, диагноз аэромоноз был подтвержден комплексно на основании клинических проявлений, эпизоотологических данных, патологоанатомических и бактериологических исследований.
Основным методом лечения аэромоноза на сегодня является антибиотикотерапия.
В связи с этим, на следующем этапе нашей работы стояла задача подобрать не только препарат, но и наиболее эффективную схему лечения аэромоноза. Известно, что аэромонады чувствительны к таким препаратам, как ципрофлоксацин, хлорамфеникол, левомицетин, синтомицин, тетрациклин, однако в литературе нет сравнительной оценки эффективности их использования для лечения аэромоноза.
Наше внимание привлек новый препарат антибак, разработанный научно-внедренческим центром «Агроветзащита». Антибак — препарат из группы фторхинолонов, содержащий в качестве действующего вещества ципрофлоксацин. Ципрофлоксацин — препарат широкого спектра действия. Он ингибирует фермент ДНК-гиразу бактерий, вследствие чего нарушаются репликация ДНК и синтез клеточных белков бактерий. Экспериментально доказано, что ципрофлоксацин активен в отношении широкого спектра грамотрицательных аэробных бактерий: Escherichia coli, Salmonella spp., Shigella spp., Citrobacter spp., Klebsiella spp., Enterobacter spp., Proteus mirabilis, Proteus vulgaris, Serratia marcescens, Hafnia alvei, Edwardsiella tarda, Providencia spp., Morganella morganii, Vibrio spp., Yersinia spp., Haemophilus spp., Pseudomonas aeruginosa, Moraxella catarrhalis, Aeromonas spp., Pasteurella multocida, Plesiomonas shigelloides, Campylobacter jejuni, Neisseria spp.; внутриклеточных возбудителей: Legionella pneumophila, Brucella spp., Chlamydia trachomatis, Listeria monocytogenes, Mycobacterium tuberculosis, Mycobacterium kansasii, Mycobacterium avium-intracellulare; грамположительных аэробных бактерий: Staphylococcus spp. (Staphylococcus aureus, Staphylococcus haemolyticus, Staphylococcus hominis, Staphylococcus saprophyticus), Streptococcus spp. (Streptococcus pyogenes, Streptococcus agalactiae).
В последнее время в ветеринарии в качестве альтернативы антибиотикам стали использовать пробиотики [110-111]. Наш выбор остановился на пробиотике споротермине, который содержит лиофилизированные споры культур Bacillus subtilis и Bacillus licheniformis. В желудке споровые формы бактерии этого вида не погибают, поскольку обладают высокой устойчивостью к воздействию желудочного сока. В тонком и толстом отделе кишечника они трансформируются в вегетативную форму, размножаются и продуцируют биологически активные вещества, подавляющие рост и развитие патогенной и условно-патогенной микрофлоры за счет выработки полиеновых антибиотиков — бацитрацинов и лихениформинов. Применение споротермина восстанавливает численность лакто- и бифидобактерий, кишечной палочки и др. организмов, входящих в нормоценоз желудочно-кишечного тракта, элиминируя из него патогены как непосредственно путем конкурентного вытеснения, так и через стимуляцию иммунитета [111-112].
Споротермин эффективен в отношении широкого спектра микроорганизмов, вызывающих инфекционные заболевания человека и животных: Staphylococcus aureus, Escherichia coli, Salmonella enteritidis, Salmonella sp., Salmonella choleraesuis, Pseudomonas aeruginosa, Proteus vulgaris, Candida albicans, Klebsiella pneumonia, Citrobacter freundii, Morganella morganii, Yersinia enterocolitica, Shigella sonnei, Enterobacter agglomerans и др. [112].
Также в схеме лечения были использованы адаптогены, в частности адаптоген иркутин. Адаптоге́ны, по определению, фармакологическая группа препаратов природного или искусственного происхождения, способных повышать неспецифическую сопротивляемость организма к широкому спектру вредных воздействий физической, химической и биологической природы [113-115]. Адаптоген иркутин (трекрезан) обладает широким спектром действия и является универсальным.
Иркутин — (резацин, трекрезан) синтезирован в Иркутском институте органической химии. По данным производителей, препарат не проявляет гонадотоксического, эмбриотоксического, мутагенного, тератогенного, канцерогенного и аллергенного действия, не обладает кумулятивным эффектом.
Помимо неспецифической резистентности иркутин повышает адаптивный потенциал к длительному действию неблагоприятных факторов на всех стадиях онтогенеза рыб. Он эффективен при пониженной и повышенной температуре, пониженном содержании кислорода, присутствии в воде токсинов, несбалансированности кормов и др. Использованные нами схемы лечения аэромоноза приведены в таблице 8, результаты проведенного лечения отражены в таблице 9.
Таблица 8 — Схемы терапии аэромоноза у африканского клариевого сома
| Схема №1 | Схема №2 | Схема №3 | Схема №4 |
| Корма фирмы AQUAREX
Антибак 100 NaCI – 40 г на 100 л |
1 г антибaкa 500 на 40 л вoды, выдерживание в течение 5 часов в растворе антибиотика | 1 г антибaкa 500 на 40 л вoды, выдерживание в течение 5 часов в растворе антибиотика, затем
2 г пробиотика споротермин на 1 кг корма адаптоген «Иркутин» 100 мг на 1 кг корма |
1 г антибaкa 500 на 40 л вoды, выдерживание в течение 5 часов в растворе антибиотика, затем
2 г пробиотика споротермин на 1 кг корма |
При использовании в бассейновой аквакультуре для лечения аэромоноза кормов, содержащих антибиотик в конечном счете был получен позитивный результат, но с точки зрения эффективности лечения, первая схема была наименее эффективной, т.к. больная рыба не потребляла корма в количестве, достаточном для результативного лечения. Из 30 особей в этой экспериментальной группе выжило 60%, а процесс окончательного исчезновения внешних проявлений инфекции у остальной части больной рыбы был растянутым.
Таблица 9 — Эффективность применения различных схем лечения при аэромонозе клариевого сома
| Опытные группы | Количество погибших особей | Остановка гибели рыб, сут. | Полная регенерация поврежденных участков кожи, сут. |
| №1 антибиотик с кормом | 11 | 12 | 30 |
| №2 антибиотик в воде | 6 | 5 | 24 |
| №3 антибиотик в воде, затем + пробиотик+адаптоген | 1 | 3 | 15 |
| №4 антибиотик, затем + пробиотик | 2 | 3 | 18 |
Во второй опытной группе, где использовали ванны с антибиотиком, доля выжившей рыбы была выше и составила 80%. Процесс полного исчезновения внешних проявлений болезни был короче. На третьей неделе при использовании ванн с антибиотиком у сомов начали отрастать новые усики, язвы на теле рыб затянулись, деформированные плавники постепенно восстанавливались.
Картина развития процесса лечения в 3 и 4 группах значительно отличалась от первых двух. В этих схемах лечения был использованы пробиотик споротермин и адаптоген иркутин. Для лечения рыбы в третьей опытной группе использовали и пробиотик, и адаптоген. Применение пробиотика и антибиотика в схемах лечения было разнесено во времени. В этой группе состояние рыбы уже через трое суток лечения визуально значительно отличалось от первых двух. Рыба, собираясь в стаю, активно реагировала и хорошо потребляла корма. Изъязвления и геморрагические зоны на теле рыбы также сокращались значительно быстрее, чем в первых двух группах. В третьей группе внешние проявления заболевания исчезли быстрее, чем в других группах.
В четвертой опытной группе наряду с антибиотиком в виде ванн был использован пробиотик споротермин. Результаты лечения в четвертой группе существенно отличались в лучшую сторону по сравнению с первыми двумя группами. Однако, они уступали результатам лечения в третьей опытной группе, где наряду с пробиотиком был использован адаптоген, за счет которого процесс элиминации внешних признаков заболевания был наиболее быстрым, синхронным и очевидным на массиве всей популяции (таблица 9). На рисунке 56 приведен пример деструкции усов клариевого сома у больной рыбы. На рисунке 57 приведен пример начальных этапов регенерации усов сома в процессе лечения аэромоноза.

Рисунок 56 — Деструкция усов сома |

Рисунок 57 — Регенерация усов сома |
Мы также сочли необходимым оценить эффективность лечения по критерию наращивания биомассы. Оценка среднего прироста массы за 30 суток эксперимента в пересчете на 1 особь показала, что наиболее высокий прирост массы был отмечен в 3 группе, которая получала в составе кормов и пробиотик споротермин и адаптоген иркутин. Для рыб 4 экспериментальной группы, получавшей споротермин, также был характерен значительный прирост биомассы, однако показатели были ниже, чем в 3 группе. В группах, не получавших пробиотик и адаптоген в кормах и в воду, прирост биомассы был незначительным (рисунок 58).
Рисунок 58 — Прирост биомассы рыбы в экспериментальных группах (в пересчете на 1 особь)
Как показали наблюдения, решающую роль в эффективности лечения аэромоноза играли первые 3 суток. В ходе нашего эксперимента, использовав несколько схем лечения, мы пришли к заключению, что наиболее результативно в схеме лечения использовать антибиотики в виде ванн, после чего рыба получала пробиотики и адаптогены в кормах и в воде. Ванны с антибиотиком были разнесены во времени и чередовадись с пробиотиками и адаптагеном.
Использование кормов, содержащих антибиотик, на стадии развития процесса малоэффективно, т.к. больная рыба снижает потребление кормов до минимума. Применение кормов с антибиотиками целесообразно в профилактических целях или при самых первых признаках развития патологического процесса, пока рыба еще не отказалась от кормов. Очевидно, что использование ванн с антибиотиком более надежно гарантирует его поступление во все органы и ткани.
Нами также были предприняты попытки лечения наиболее тяжелых случаев заболевания (рисунки 59-61). Для этих целей применяли индивидуальное лечение с использованием примочек марганцево-кислого калия.

Рисунок 59 — Разрушение хвостовой части тела сома

Рисунок 60 — Лечебные примочки с KnO4

Рисунок 61 — Регенерация в зоне хвостового стебля у африканского клариевого сома после лечения
Лечебные примочки сочетали с лечением по схеме 3, которая предусматривала выдерживание в растворе антибиотика и кормление кормами с пробиотиком и адаптогеном. Регенерация пораженных участков кожного покрова при применении лечебных примочек с раствором перманганата калия происходила успешно.
В заключение следует отметить, что африканский клариевый сом проявляет исключительную живучесть даже при сильных поражениях тела аэроионозом. Примером может быть полное разрушение хвостовой части, приведенное на рисунке 59. В результате проведенного нами лечения антибиотиком и KnO4, чередующимся с использованием пробиотика и адаптогена хвостовая часть у рыбы польностью регенерировала.
Инфекционные болезни рыб наносят огромный ущерб индустриальной аквакультуре, резко снижая ее результативность. Основным средством борьбы с инфекционными болезнями рыб в аквакультуре долгое время считалась антибиотикотерапия. Развитие отечественной биотехнологии показало, что удачной альтернативой антибиотикам могут стать пробиотики, не причиняющие вреда рыбе. В нашей работе мы использовали пробиотик споротермин в сочетании с адаптогеном иркутином.
Было установлено, что применение кормов с антибиотиком для лечения уже развившегося заболевания малоэффективно. Корма с антибиотиком целесообразно использовать в профилактических целях.
Как показали результаты исследований, включение в состав корма и в состав воды пробиотика споротермина и адаптогена иркутина сыграло решающую роль в остановке инфекции, сократило падеж, значительно сократило сроки выздоровления рыбы, обеспечило наращивание ее массы. Схема лечения, сочетавшая ванны с антибиотиком и корма, содержавшие адаптогены и пробиотики, применение которых было разнесено по времени, оказалась наиболее эффективной.
2.3 Апробация модифицированных кормов, содержащих споровые формы микроорганизмов — антагонистов патогенов
К числу основных задач, решаемых в индустриальной аквакультуре можно отнести разработку методов регулирования роста и размножения рыб [116]. Успехи, достигнутые в повышении продуктивности индустриальной аквакультуры, обусловлены применением специализированных кормов [117-121]. Нельзя не отметить, что в последнее десятилетие в этой области достигнут значительный прогресс благодаря успехам в области исследований физиологических основ кормления рыб. Современные специализированные корма высокопитательны, сбалансированы не только по белку, углеводам и другим компонентам, но также содержат необходимые организму рыб витамины, микроэлементы, антибиотики. Они в полной мере способны обеспечить быстрый рост и развитие рыбы [122-126].
Современные корма адаптированы к каждому из этапов онтогенеза рыб. В возрастном аспекте они характеризуются разной размерностью гранул, ориентированы на удовлетворение физиологических потребностей каждой возрастной группы, рассчитаны по кратности применения.
Однако, даже эти специализированные корма не в полной мере потребляются рыбой. Это обусловлено не только физиологическим состоянием гидробионтов, но и зависит от качества каждой из партий кормов, иногда из-за издержек рецептуры [122, 123]. Неполное потребление кормов также обусловлено нарушениями в нормировании и технологии скармливания. Рекомендации по использованию тех или иных специализированных кормов ориентируют на некую среднюю экспертную потребляемость корма, которая не учитывает биотические и абиотические факторы среды обитания рыб. Между тем, конкретные экологические условия во многом определяют потребность в кормах [125-127]. В частности у теплолюбивых рыб, таких как африканский клариевый сом, важную роль играет температурный фактор. Даже минимальное отклонение температуры на 1-20С от оптимальной снижает потребление корма этим теплолюбивым видом рыб [116]. Не менее важное значение имеет плотность посадки, гидрохимические показатели воды, уровень органического загрязнения в среде содержания рыб [126-127].
В результате вносится либо недостаточное, либо избыточное количество корма. В первом случае рыба плохо набирает вес, во втором случае это приводит к загрязнению бассейнов органикой, образующейся при разложении кормов и выделении продуктов метаболизма, трансформирующихся в токсичные для рыб нитриты и нитраты [122-123]. В таком случае возникает парадоксальная ситуация, когда при избыточном количестве вносимого комбикорма рыба голодает.
Выбор кормов определяет качество выращиваемой рыбы. Несбалансированное кормление не только приводит к снижению темпа роста, но и сказывается на выживаемости рыбы и ее восприимчивости к инфекциям.
Успехи, достигнутые в современной физиологии рыб, позволяют конструировать высокоспециализированные корма, учитывающие и видовую принадлежность рыб и стадии их онтогенеза. Производители современных кормов обогащают их комплексом витаминов, микроэлементов и других веществ, играющих важную роль в метаболических процессах. В последнее время пристальное внимание уделяется перспективам использования пробиотиков в составе кормов. В своей работе мы изучали применение пробиотика споротермин, который вводили в корма.
У сельскохозяйственных животных, по данным производителя, скармливание пробиотика споротермина улучшает перевариваемость питательных веществ и усвояемость азота, кальция и фосфора, гематологические показатели и обмен веществ. Применение споротермина в рыбоводстве ранее не изучалось.
Целью данного этапа исследований была сравнительная оценка различных способов введения в организм рыб пробиотика «споротермин» для повышения интенсивности роста и сохранности рыбы.
Исследовались ростовые и рыбоводные показатели молоди сомов при выращивании в условиях бассейнового содержания при эндогенном и экзогеннном использовании пробиотика споротермин. Оценивалось влияние пробиотика на гематологические показатели крови сомов, выращенных при различных способах его введения в организм. Осуществлялся поиск наиболее эффективного способа введения в организм пробиотика споротермина.
В качестве объекта исследования была выбрана молодь клариевого сома, возраст на начало опыта составлял 30 дней. Опыт продолжался 2,5 месяца. Для эксперимента рыбу разделили на 4 группы по 50 особей в каждой, группы были распределены в аквариумы объемом 500 литров, функционирование которых осуществлялось в автономном режиме. Температуру воды во всех аквариумах поддерживали на одинаковом уровне — 26º С, содержание кислорода в воде было на уровне 4 мг/л.
Во всех опытных и контрольной группах кормление рыбы осуществляли экструдированным кормом Aqarex. Кормление осуществляли с учетом размера гранул корма в соответствии с возрастом и массой рыбы. Кормление опытных групп проводилось вручную, периодичность кормления составляла 3 часа. Строго велся учет кормов отдельно по каждой группе рыбы при каждом кормлении для определения затрат на 1кг прироста. Для каждой группы были разработаны разные способы введения пробиотика споротермина (таблица 10).
Как видно из таблицы 10, молодь в первой контрольной группе получала стандартный корм. В опытных группах к основному рациону разными способами добавлялся споротермин. Второй группе скармливали корм, который орошали раствором пробиотика в количестве 0,2% от массы корма. Третьей опытной группе пробиотик вносили в водную среду в количестве 4 г на 100 л воды. Четвертой группе скармливали орошенный раствором пробиотика корм, а также вносили споротермин в водную среду. Кормление осуществлялось 8 раз в сутки. Температуру, кислород и рН измеряли три раза в сутки. Контролируемые гидрохимические показатели находились в пределах, допустимых для выращивания клариевого сома. Контроль и измерение содержания биогенных элементов в воде проводили с помощью экспресс-наборов фирмы Tetra.
Таблица 10 — Схема, структура и содержание опыта (75 дней)
| Характеристика способов введения пробиотика «споротернмин» | |||
| 1 группа
(Контроль) |
2 группа
(С кормом) |
3 группа
(В водной среде) |
4 группа
(С кормом + в водной среде) |
| Основной рацион (ОР) | ОР + Споротермин 0,2% от массы корма | ОР + Споротермин в количестве 4 г на 100 л воды | ОР + Споротермин 0,2% от массы корма + Споротермин в количестве 4 г на 100 л воды |
Для характеристики интенсивности роста рыбы определяли показатели абсолютного прироста биомассы каждой из популяционных групп, среднесуточный прирост биомассы, удельную скорость роста (среднесуточный прирост, %). Помимо этого, определяли показатели выживаемости рыбы.
Гематологические показатели определяли в начале и в конце эксперимента с использованием биохимического автоматического анализатора Express Plus (Chiron Diagnostics) и автоматизированного гематологического анализатора «Sysmex КХ-21». Пробы крови у рыб на анализ брали из хвостовой артерии путем каудоэктомии.
В условиях повышенного органического загрязнения, характерного для индустриальной аквакультуры, приходится искать пути восполнения дефицита полезной микробиоты. Это можно осуществить с помощью пробиотиков. Поэтому в настоящее время к современным кормам необходимо предъявлять требования не только в плане сбалансированности по основным питательным элементам, витаминам микроэлементам и др, но по наличию в их составе пробиотиков. Общеизвестно, что пробиотики положительно влияют на продуктивность, рост, развитие и устойчивость к стрессам и заболеваниям рыб, у ряда фирм пробиотики все же применяются в кормах в качестве микробиологических добавок. Однако корма для рыб, содержащие пробиотики, в действительности — большая редкость, поскольку микроорганизмы гибнут при высоких температурах в ходе сушки кормов. В своих исследованиях мы апробировали пробиотик споротермин, содержащий устойчивые споровые формы микроорганизмов, чтобы оценить перспективы его применения для выращивания рыбы в условиях индустриальной аквакультуры.
На протяжении всего периода исследований на фоне пробиотика рыба в экспериментальных группах не болела, отличалась хорошим аппетитом и приростом биомассы. Основные рыбоводно-биологические показатели выращивания молоди клариевого сома с использованием пробиотика споротермина приведены в таблица 11.
Таблица 11- Основные показатели выращивания молоди африканского клариевого сома на фоне пробиотика споротермина
| Показатель | Экспериментальные группы | |||
| 1 группа
(Контроль) |
2 группа | 3 группа | 4 группа | |
| Начальная биомасса рыбы в бассейне, г. | 2165 | 2130 | 2205 | 2170 |
| Конечная биомасса рыбы в бассейне, г. | 15355 | 17120 | 17560 | 19105 |
| Абсолютный прирост массы рыбы в бассейне, г. | 13190 | 14990 | 15355 | 16935 |
| Начальная средняя длина особи, см. | 17,3 ± 0,05 | 16,5 ± 0,19 | 16,9 ± 0,15 | 17,1 ± 0,21 |
| Конечная средняя длина особи, см. | 33,0 ± 1,06 | 35,3 ± 1,15 | 36,0 ± 1,09 | 38,0 ± 1,3 |
| Удельная скорость роста, Cw% | 2,01 | 2,08 | 2,07 | 2,12 |
| Среднесуточный прирост, г. | 3,51 | 3,99 | 4,09 | 4,52 |
Экспериментальные группы были сформированы так, чтобы на начало эксперимента биомасса рыбы в каждом из экспериментальных бассейнов практически не отличалась. В контрольной группе абсолютный прирост биомассы по сравнению с остальными группами был минимальным. Во всех группах с использования пробиотика прирост биомассы был существенно больше, чем в контроле. Наиболее высокие показатели прироста биомасссы и темпов роста молоди были получены в 4 опытной группе, в которой пробиотик задавался с кормами и добавлялся в воду. В этой группе абсолютный прирост массы в пересчете на 1 особь за период эксперимента составил 338,7 г, что на 28% процентов выше, чем в контроле.
В контрольной группе и во 2 группе в ходе эксперимента отмечался отход молоди. В этих группах процент выживаемости составил 97% и 99% соответственно. Отход молоди можно объяснить стрессом и повреждениями, вызванным манипуляциями по отлову, сортировке, взвешиванию и пересадке рыбы для проведения эксперимента. Выживаемость молоди в 3 и 4 экспериментальных группах составила 100%. Нельзя исключить, что это обусловлено снижением стресс-реакции за счет присутствия споротермина непосредственно в среде обитания рыб и при его сочетанном введении.
Результаты наших исследований свидетельствуют, что пробиотик споротермин оказал позитивное влияние на рост и выживаемость рыб на начальных этапах онтогенеза клариевого сома. Выраженный эффект от применения пробиотика проявлялся в группах где он вводился с кормами или же в воду, но наиболее эффективным оказался способ сочетанного введения пробиотика эндогенно и экзогенно, т.е. и в воду и с кормами.
На следующем этапе работы нами была проведена оценка влияния пробиотика на ряд гематологических показателей крови с учетом способа введения споротермина.
В ихтиологии для характеристики физиологического состоянии рыб используются исследования крови, поскольку она наиболее чувствительно реагирует на изменение физиологического состояния рыб. Однако широкого распространения этот метод в практическом рыбоводстве пока не получил. Исследования крови рыб в настоящее время, к сожалению, фрагментарны и не обобщены. Границы нормы зачастую не определены. Поэтому трудно сформировать четкие представления о показателях гемостаза в норме, о значениях показателей, при которых достигается оптимальное состояние равновесия организма с окружающей средой. Учитывая вышеизложенное, исследования крови рыб актуальны и своевременны.
Общеизвестно, что при заболеваниях рыб процентное соотношение отдельных форм лейкоцитов изменяется. В красной крови также изменяется содержание общего количества эритроцитов и гемоглобина. Показателем состояния организма рыб также является скорость оседания эритроцитов (СОЭ). Известно, что этот показатель при патологических процессах значительно возрастает. Как правило, содержание эритроцитов и гемоглобина при патологических процессах снижается. Поэтому гематологические показатели, такие, как лейкоциты, гемоглобин, эритроциты, СОЭ используют как индикаторные при оценке физиологического состояния рыб.
Результаты исследования гематологических показателей молоди клариевого сома на фоне использования пробиотика споротермина приведены в таблице 12.
Исследования, проведенные по завершении опыта, показали, что в экспериментальных группах на фоне пробиотика гематологические показатели изменились. Возросло количество гемоглобина, которого в норме должно быть более 7 г %, снизился уровень СОЭ, который в норме не должен превышать 10-20 мм/ч и оптимизировался процент лимфоцитов в лейкоцитарной формуле. В контрольной группе изменений за период опыта не произошло.
Таблица 12 — Сравнительная оценка гематологических показателей молоди клариевого сома на фоне введения пробиотика споротермина
| Опытные группы | Гематологические показатели | ||
| Гемоглобин, г% | СОЭ, мм/ч | Лимфоциты, % | |
| Показатели на начало опыта | 8,2 – 8,4 | 15 — 20 | 92-96 |
| 1 группа (Контроль) | 8,3 – 8,4 | 16 -19 | 93-96 |
| 2 группа | 8,5 — 9,2 | 14 — 16 | 90-92 |
| З группа | 8,9 – 9,6 | 11 — 13 | 88-92 |
| 4 группа | 10,3 – 11,4 | 9 — 11 | 86-88 |
Наиболее выраженные изменения отмечены в 4 группе, которая получала пробиотик с основным рационом и в водную среду.
Известно, что лейкоцитарная формула у сомов лимфоидного типа, в ней превалируют лимфоциты. Доля этих форменных элементов является индикатором патологического процесса. Изучение лейкограммы показало, что повышенное на начало опыта количество лимфоцитов, которое было характерно для всех экспериментальных групп, на фоне применения пробиотика за 75 суток опыта прогрессивно снизилось.
На следующем этапе нашей работы мы исследовали показатели сыворотки крови, в частности, такие как глюкоза, общий белок, альбумин, ферменты: аланиновую аминотрансферазу, амилазу, чтобы иметь представление, как они изменяются под действием пробиотика. Результаты исследований приведены в таблица 13.
Таблица 13 — Показатели сыворотки крови клариевого сома
| Показатели | 1 группа (Контроль) | 2 группа | 3 группа | 4 группа |
| Общий белок, г/л | 32,6+0,9 | 34,8+1,4 | 35,2+1,3 | 37,5+1,2 |
| Альбумин, г/л | 12,6+0,9 | 14,1+0,8 | 15,3+0,9 | 17,2+0,7 |
| АЛТ, ед./л | 18,5+2,1 | 16,7+1,7 | 15,4+1,1 | 12,2+0,9 |
| Глюкоза, ммоль/л | 5,0+0,4 | 5,2+0,3 | 5,2+0,3 | 5,6+0,1 |
| Амилаза, ед./л | 16,3+2,1 | 19,2+1,2 | 19,6+0,9 | 18,84+1,1 |
Как видно из полученных результатов, уровень общего белка в 4 опытной группе, которой вводили пробиотик с основным рационом и в водную среду, достоверно превышал его содержание в контрольной группе (p≤0,05).
Уровень активности аланинаминотрансферазы (АЛТ) в экспериментальных группах 3 и 4, в конце опыта прогрессивно снижался. Это снижение наиболее выраженно в 4 группе, уровень АЛТ был достоверно ниже по отношению к контрольной группе (p≤0,05). Пробиотик споротермин содержит бактерии, которые, колонизируя кишечник рыб, не только поддерживают его нормоценоз, но и являются источником пищеварительных ферментов. На фоне споротермина в пищеварительном тракте рыб лучше переваривается углеводистая часть рациона, очевидно, этим можно объяснить некоторое повышение уровня глюкозы.
Высокий уровень активности амилазы в организме молодых особей клариевого сома во всех опытных группах свидетельствует об интенсификации углеводного обмена. В итоге можно отметить, что пробиотик споротермин стимулирует биосинтез белка, повышает уровень глюкозы, интенсифицирует активность ферментов. На фоне споротермина оптимизируются показатели белкового и углеводного обмена.
Обобщая, необходимо отметить, что эндогенное и экзогенное введение пробиотика споротермина оказывает позитивное влияние на уровень гемоглобина, СОЭ, количество лимфоцитов, показатели углеводного и белкового обмена, активность ферментов, а в конечном итоге на выживаемость, ростовые характеристики рыб и скорость наращивания биомассы. Происходит это за счет нормализации кишечного микробиоценоза рыб и улучшения экологического состояния среды обитания, в результате подавления пробиотиком роста в водной среде патогенных и условно-патогенных микроорганизмов, снижающих естественную резистентность рыб. Наиболее выраженное позитивное влияние «споротермина» на организм рыб отмечалось в группе, в которой осуществлялось сочетанное эндогенное и экзогенное введение пробиотика. Полученные нами результаты позволяют рекомендовать пробиотик «споротермин» в качестве эффективной пробиотической добавки, которую целесообразно включать в состав кормов для рыб. Также в условиях индустриальной аквакультуры можно рекомендовать внесение споротермина в воду для того, чтобы обеспечить наиболее полную реализацию генетического потенциала продуктивности рыб.
В итоге можно констатировать, что пробиотик споротермин оказывает положительное влияние на основные гематологические и биохимические показатели крови клариевого сома. Показатели роста, развития и выживаемости молоди клариевого сома свидетельствуют о высокой эффективности споротермина при эндогенном и экзогенном способах введения. Наиболее эффективным способом применения пробиотика является его сочетанное введение с кормами и путем прямого добавления в воду.
2.4 Культивирование живых стартовых кормов для рыб
Аквакультура остро нуждается в высококачественных живых стартовых кормах, к числу которых относят науплии артемий.
Науплии артемий считаются лучшим живым стартовым кормом для личинок рыб благодаря их высокой пищевой ценности, мягкому и тонкому наружному покрову, малому размеру [128]. Большую востребованность науплий артемии в аквакультуре обеспечили ее биологические особенности: быстрый рост, высокая плодовитость, способность продуцировать цисты, которые можно заготавливать, хранить, транспортировать и активировать развитие по мере надобности.
Артемия салина (Artemia salina, Linnaeus 1785) жаброногое ракообразное, широко распространенное в соленых водных экосистемах. Под влиянием факторов среды обитания A. salina образует различные морфологические расы. Расы отличаются длиной, соотношением частей тела и морфологическими особенностями. [128].
При воспроизводстве рыбы в условиях бассейновой аквакультуры на начальных этапах постнатального онтогенеза личинок, только что вылупившихся из икринок рыб кормят живыми науплиями артемий, которые прекрасно усваиваются и не имеют конкурентов по питательной ценности.
Для получения высокоценных стартовых кормов необходимо отрегулировать технологию культивирования науплий артемий, предварительно синхронизировав этот процесс по времени с искусственным нерестом рыбы.
В своей работе мы, основываясь на данных литературных источников по биологии и экологии A. salina, попытались воссоздать близкие к оптимальным технологические параметры культивирования артемий, учитывающие их физиологические особенности [128-130].
Целью рабты было исследование факторов, регулирующих стадии онтогенеза артемий в условиях искусственного разведения.
На первом этапе исследований важно было определить с какой из экологических морф A. salina мы работаем. По фенотипическим признакам яиц идентификация невозможна, поскольку яйца артемий разных экоморф практически не отличаются. Различия проявляются в ходе онтогенеза, на разных его стадиях. В ходе культивирования яиц артемий мы установили, что в процессе индивидуального развития рачки продемонстрировали морфологические особенности, свойственные морфе var. principalis, которая предпочитает среду с невысоким уровнем солености.
У представителей этой морфы фурка хорошо развита, явно отчленена от последнего сегмента брюшка и несет большое число длинных щетинок [128]. Длина тела половозрелой артемии, исследуемой нами морфы, в среднем составляла 21 мм.
На втором этапе работы исследовали синхронность метаморфоза артемий в культуральной среде, параметры которой, как мы полагаем, были близки к оптимальным.
В используемой для культивирования 200 мг навеске производился подсчет яиц. В среднем в 200 мг навеске содержалось 3995,0±13,8 цист. Минимальное и максимальное количество яиц в такой навеске существенно не отличалось. Минимальное количество яиц в 200 мг навеске составляло 3968 штук, а максимальное – 4028 штук.
Артемии обладают широкой экологической валентностью по отношению к солености воды, и колебания солености воды в пределах от 3 до 60% на выходе науплий достоверно не сказываются [128].
Мы в своих исследованиях в качестве культуральной среды использовали 3% раствор хлористого натрия. Через сутки после закладки яиц артемий в аппарат Вейса выклев науплий составил более 65±3,8%, их размеры варьировали от 0,3 до 0,4 мм. Через 48 часов после закладки цист артемий в аппарат Вейса выклев науплий составил 80±4,5%. Через 72 часа после закладки цист артемий в аппарат Вейса выклев науплий практически завершился и составил 98±2%.
По данным литературных источников высококачественные яйца имеют высокую синхронность развития, а выход науплий от первой до последней в этом случае происходит в течение 8 часов [128].
Анализ результатов культивирования показал, что мы имеем яйца артемий низкого качества, которые в дальнейшем не могут быть эффективно использованы в технологии получения стартовых кормов.
Некачественные яйца порождают массу технологических проблем, затрудняя отбор науплий первой стадии онтогенеза, стимулируя высокую кумулятивную бактериальную обсемененность стартовых кормов из-за растянутости асинхронного внутрипопуляционного онтогенеза, а также заранее программируют 40% перерасход стартовых кормов.
Весь этот перечень проблем привел нас к заключению, что в условиях бассейновой аквакультуры, для обеспечения личинок и мальков высококачественным стартовым кормом необходимо иметь собственное производство яиц (цист) артемий. Потеря энергии роста на начальных этапах онтогенеза рыб — это запрограммированное снижение эффективности производства товарной рыбы.
Наши исследования процесса культивирования науплий показали, что процесс развития сохранял свою асинхронность и на ΙΙ стадии метанауплиусов и на последующих этапах онтогенеза. Первая линька была отмечена на третьи сутки после выклева науплий. В течение последующих 7-10 дней жизни рачки проходили ΙΙΙ и ΙV стадии, различающиеся степенью сегментации тела, преобразованием второй пары антенн и появлением грудных ножек. Поскольку выклев науплий был не равномерным, на третий, четвертый и пятый день в культуральной среде наблюдали артемий на разных этапах онтогенеза. Нам необходимо было добиться минимум 90% синхронизации развития популяции.
На следующем этапе работы стояла задача получить науплии артемий, отделив их от бактериально обсемененных пустых оболочек цист. Для этого использовали следующий технологический прием: в колбах аппарата Вейса, в которых культивировали артемий, прекращали аэрацию среды при этом пустые оболочки цист поднимались вверх, а невылупившиеся яйца опускались на дно. Науплии плавали в толще воды и были активны.
Подытоживая этот раздел работы, сопоставляя данные наблюдений за живыми организмами в процессе культивирования, можно заключить, что при условии хорошего качества яиц, эффективность выклева науплий зависит от способов активизации яиц, температуры, аэрации, освещенности и бактериальной обсемененности.
На следующем этапе для получения живого стартового корма науплии процеживали через сито, а затем отмывали несколько раз пресной водой. В пресной воде науплии сохраняли подвижность недолго, максимум в течение часа, поэтому их сразу после промывки скармливали малькам.
Известно, что наибольшую пищевую ценность науплии имеют сразу после их выклева; после того как личинки артемии проходят стадию линьки, они утрачивают большую часть своей пищевой ценности и трудно усваиваются мальками. Первые 6-8 часов жизни науплии не питаются, а используют собственные ресурсы организма. Для кормления личинок рыб, которое производится после рассасывания желточного мешка, метанауплии не пригодны [128].
Проведенные нами исследования показали, что в искусственных условиях, используя возможности аппарата Вейса, можно получать, качественный биоматериал науплий артемий, обеспечив им условия культивирования близкие к условиям их естественной среды обитания. При кормлении мальков рыб науплиями часто отмечается перенос патогенной микрофлоры, обитающей на пустых оболочках яиц, на мальков рыб. В своих исследованиях мы пытались уйти от интенсивного развития микрофлоры двумя путями; за счет снижения плотности популяции артемий и за счет своевременного удаления из культуральной среды мертвых пустых оболочек методом флотации.
2.5 Разработка нормативов по выращиванию малька до стадии товарной рыбы на основе оценки: скорости роста, сохранности, уровня каннибализма, устойчивости к заболеваниям, адаптационной пластичности, стрессоустойчивости и выживаемости
2.5.1 Динамика роста и развития генераций африканского клариевого сома, репродуцированных в разные сезоны
В индустриальной аквакультуре важное значение имеет биологический контроль физиологических процессов и росто-весовых характеристик на всех этапах выращивания рыбы [131-137].
У всех видов рыб условия среды обитания и пищевые ресурсы определяют скорость роста, полового созревания и плодовитости. В индустриальной аквакультуре условия среды обитания и кормления четко регулируются человеком [132, 133, 138-145].
В индустриальной аквакультуре выращивание товарной рыбы из личинок — это сложный многоступенчатый процесс. Задержка скорости роста на одном из этапов онтогенеза приводит к снижению рентабельности производства и неоправданным затратам повышая себестоимость продукта и его реализационную цену [135,136, 144].
Большое значение для прогнозирования имеет характер взаимоотношений между ростом и половым созреванием рыб. Условия, благоприятные для роста рыбы, не всегда оказываются благоприятными для ее полового созревания, и, наоборот, условия оптимальные для полового созревания, могут оказаться неблагоприятными для роста. Проблема конкурентных отношений между пластической и генеративной формами обмена актуальна для рыбоводства [134, 140-142].
Исследования проводились на генерациях африканского клариевого сома, полученных в весенний и осенний сезоны в результате искусственного оплодотворения икры гормонально-индуцированных самок спермой гормонально-индуцированных самцов. Продолжительность выращивания сомов до стадии товарной рыбы составляла 6 месяцев (24 недели).
Выделяли следующие периоды онтогенеза у сомов: предличинка – двое — трое суток; личинки – 3-4 недели (20-30 суток); малек – 6 недель (40 суток); молодь – 7 недель (50 суток); товарная рыба – 7 недель (50 суток).
Первая генерация клариевого сома, которая подвергалась исследованию, была получена в первой декаде мая. Экспериментальные исследования этой популяции начались в двухнедельном возрасте. Период наблюдений за этой популяцией начинался в мае, был продолжен в летние месяцы и завершался в сентябре.
Вторая генерация африканского клариевого сома была получена в третьей декаде ноября. Начальные периоды онтогенеза ноябрьской популяции сомов пришлись на зимний и весенний месяцы, и завершились в мае.
И весенняя и осенняя генерации содержались в бассейнах объемом 3,5 м3, каждая из популяций была представлена 450 особями.
Проводили ежедневный контроль гидрохимических показателей (водородный показатель, содержание кислорода, аммонийный азот, нитраты, нитриты). Превышения допустимых нормативов по этим показателям не наблюдалось. В бассейнах поддерживали оптимальную температуру воды 24- 260С.
На начальных этапах онтогенеза (со второго дня после вылупления) личинки сомов получали стартовые живые корма — науплиусы Artemia salina собственного производства. Начиная со второй недели онтогенеза, постепенно вводили в рацион сбалансированные заводские комбикорма фирмы Aquarex марки Сом. Суточная норма корма при выращивании клариевого сома составляла около 5-6 % от биомассы содержащейся рыбы. Кормление осуществляли каждые два часа 12 раз в сутки, разовая норма внесения составляла 1,2 % от исходной массы содержавшейся рыбы. Корма предварительно обрабатывали адаптогеном «Иркутин» (трекрезан). Применение адаптогена позволило обеспечить сохранность рыб и получить дополнительный прирост биомассы (на 20-25%).
Наблюдения и контрольные взвешивания проводили с личиночного возраста на электронных весах марки Bl-320H. Сортировку сомов на группы по размерно-весовым параметрам проводили в конце каждого из выше обозначенных периодов онтогенеза. Достоверность различий определяли по критерию Стьюдента.
По результатам наших исследований, на третьи сутки онтогенеза желточный мешок личинок сомов рассасывался, и они переходили на экзогенное питание. Средняя масса личинки на этом этапе онтогенеза составляла в среднем 0,02 г. Цикл выращивания сомов из личинок до стадии товарной рыбы должен завершаться в возрасте 23-24 недель.
На начальном этапе вскармливания в период становления пищевого поведения отмечалась выраженная внутрипопуляционная конкуренция за пищевые ресурсы.
Первое взвешивание личинок осуществлялось в двухнедельном возрасте. Уже на этом этапе онтогенеза мы выявили наряду с явным опережающим ростом одной части генерации резкое отставание в размерно-весовых показателях другой части. В каждой из генераций африканского клариевого сома, с позиций этологии, выстраивалась четкая иерархия взаимоотношений. Уже с самых ранних этапов онтогенеза проявлялось доминирование определенной группы особей, которое сохранялась в течение всего периода выращивания. В процессе становления иерархии происходило выделение группы наиболее сильных, быстрорастущих и жизнеспособных рыб, что обеспечивало им преимущество в системе биотических взаимоотношений, а также в процессе естественного и искусственного отбора. В популяции четко прослеживалось деление по скорости роста. Доля особей со стремительным ростом, превосходящим среднюю по популяции в 3-4 раза, составляла около 5%. Высокую скорость роста, превосходящую среднюю по популяции в два раза, демонстрировали около 25 % особей. Основная часть популяции — около 50% характеризовалась средней скоростью роста. Остальные 20% популяции в разной степени отставали по скорости роста от средней. Особи-доминанты в 2-4 раза превосходили по скорости роста остальную часть популяции.
Для снижения внутригруппового напряжения на всех этапах выращивания, как майской генерации, так и ноябрьской генерации сомов, мы проводили комплекс мер. В первую очередь, это касалось сортировки по росто-весовым характеристикам, которая проводилась раз в две недели. Отстающую в росте часть популяции отсаживали отдельно, чтобы снизить конкуренцию за кормовые ресурсы. Но внутри новых, вновь образованных групп через две недели устанавливалась та же иерархия отношений с выделением доминантной группы особей, что выражалось в неравномерном росте.
Сортировка — это обычное технологическое мероприятие при разведении африканских клариевых сомов, резко повышающее эффективность выращивания и снижающее уровень каннибализма, традиционного для представителей этого вида.
Выращивание сомов на этапе личиночного развития и на последующих этапах производили с использованием адаптогена «Иркутин», который позволил свести на нет каннибализм и поднять привесы на 20% при использовании препарата в концентрации 3-4 мг на 1 литр в среде содержания рыб. По нашим наблюдениям, использование адаптогена «Иркутин» (трекрезан) в кормах и в среде обитания снизило агрессивное поведение доминантных особей, устранило каннибализм и стабилизировало рост и развитие рыбы.
Параллельно проводились сравнительные исследования наращивания биомассы сомов, репродуцированных в разные сезоны года. Контрольные взвешивания экспериментального поголовья проводили каждые две недели.
Первая популяция личинок сомов была выведена в первой декаде мая. Размах по массе при контрольном взвешивании двухнедельных личинок составил 0,3-0,9 г. Среди популяции личинок доминировали по скорости роста 5% сомов и имели массу 0,7-0,9 г, около 30% имели массу тела 0,5-0,6 г. и характеризовались высокой скоростью роста. Основная часть популяции — 65% личинок сомов имели массу тела 0,2-0,3 г. Наиболее мелкие особи подвергались нападению со стороны доминирующих рыб.
Ко времени завершения первого периода развития (3-х недельный возраст) масса личинок майской популяции составила 1,7±0,04 г. Размах веса был очень широким и составлял 1,3-10 г.
Личинки сомов, репродуцированных в ноябре, уже с первых дней жизни проявляли достоверно более низкую скорость роста. В возрасте 3-х недель их масса составляла 0,68±0,05 г. Вес личинок варьировал в пределах 0,2-1,23 г. Таким образом, личинки весенней популяции весили к концу личиночного периода в 1,5 раза больше, чем личинки осенней популяции (p≤0,05). За личиночный период онтогенеза биомасса сомов возросла в среднем в 2,8 раза. Скорость роста весенней и осенней популяции сомов в сравнительном аспекте в личиночный период показана на рисунке 62.
Стадия выращивания мальков у сомов продолжается около шести недель (40 суток). Весенняя популяция сомов проходила эту стадию с конца мая по июнь, когда продолжительность светового дня достигала своего максимума.
У осенней популяции этот этап выращивания пришелся на самые холодные месяцы с самой низкой продолжительностью светового дня — декабрь и январь. К десятинедельному возрасту, мальки весенней генерации весили 43,5±4,5г. Индивидуальные значения массы значительно варьировали. Мальки ноябрьской генерации отставали по скорости роста от майской в 1,8 раза (p≤0,05) и весили в возрасте 10 недель 24,7±2,9 г. Вес ноябрьских мальков в возрасте 10 недель отличался небольшим разбросом и колебался в пределах 32-37 г.
Рисунок 62 — Сравнительные показатели наращивания биомассы на личиночном этапе
После завершения личиночного периода, на мальковом этапе выращивания, масса рыб возросла в среднем в 10 раз (рисунок 63).
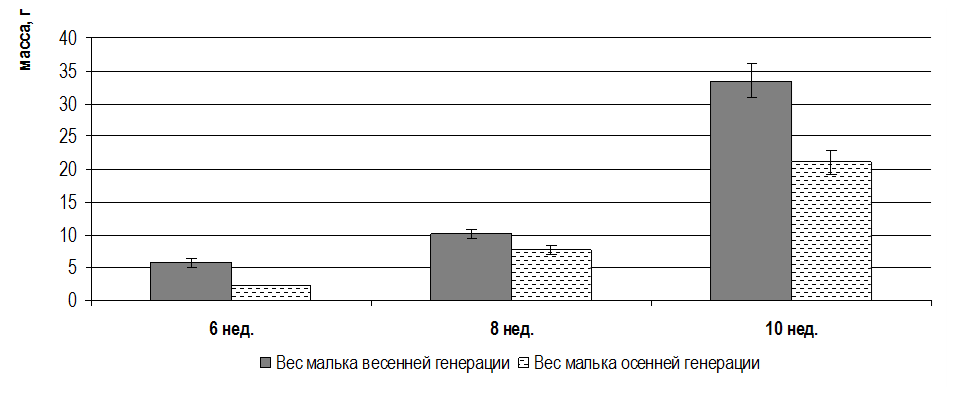
Рисунок 63 Сравнительные показатели наращивания биомассы на этапе малька
Этап выращивания молоди в онтогенезе сомов продолжается условно 7 недель и составлял 50 суток. Завершался этот период, когда сомы достигали 17-недельного возраста. У майской популяции сомов рост и развитие рыбы на стадии молоди проходило с июля по первую декаду августа. У ноябрьской популяции рост и развитие молоди приходилось на февраль — первую декаду марта. Общая тенденция опережающего роста майской генерации, по сравнению с ноябрьской, у молоди хорошо прослеживалась. Контрольные взвешивания особей майской генерации показали, что в возрасте 17-недель их вес составлял 206,3±16,7 г. Размах изменчивости признака был очень высоким (от 50 до 430 г). Вес ноябрьской генерации в тот же возрастной период был в 1,7 раза ниже и составлял 119,0±9,0 г (p≤0,05). Вариабельность веса молоди осенней генерации в возрасте 17 недель колебалась от 41,7 до 232 г.
На этапе выращивания молоди, вес особей весенней генерации возрос в среднем в 3,2 раза, а в осенней в 2,3 раза (p≤0,05) (рисунок 64).
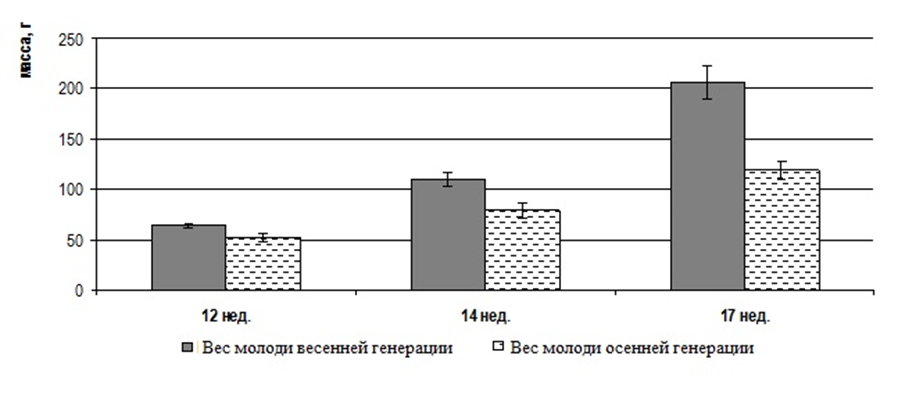
Рисунок 64 — Сравнительные показатели наращивания биомассы на этапе молоди
После завершения выращивания молоди наступает этап выращивания из нее товарной рыбы. И хоть такое деление на этапы условно, им удобно пользоваться, чтобы можно было сравнивать полученные результаты с результатами других исследователей. Выращивание товарной рыбы условно составляет 7-8 недель. При соблюдении технологии и поддержании оптимальных температурных и гидрохимических режимов сомы наращивают массу до 900-1500 г.
У весенней генерации сомов этап выращивания товарной рыбы пришелся на август и сентябрь. В возрасте 23 недель сомы весенней генерации набрали биомассу 926,6±33,4 г. При этом, минимальный вес рыбы в этот период составлял 640 г, а максимальный 1300 г. За семь недель выращивания товарной рыбы вес сомов возрос в среднем в 2,8 раза. Таким образом, в возрасте 23 недель сомы весенней генерации нарастили необходимую, в соответствии с требованием технологии массу, а цикл выращивания рыбы завершился в плановые сроки.
Для сомов осенней генерации сроки выращивания удлинились. В плановые сроки в возрасте 23 недель биомасса сомов осенней генерации составляла 625±37,8 г, что на 300-400 г ниже показателей, которые проявила весенняя генерация. Популяция сомов осенней генерации достигла показателей весенней генерации на три недели позже, т.е. в возрасте 26 недель, когда они достигли массы 933 ±49,8 г (рисунок 65).
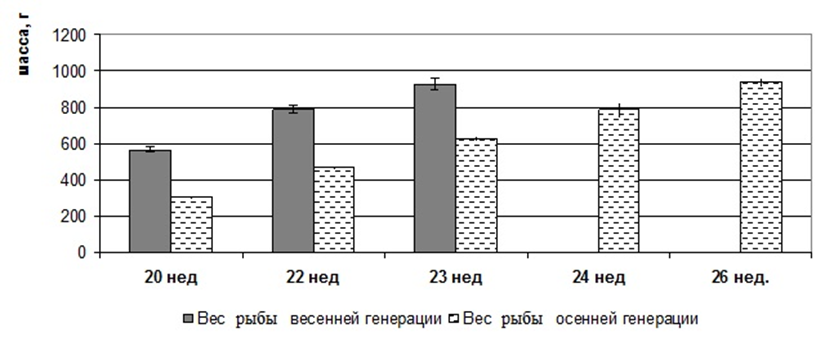
Рисунок 65 — Вес рыбы весенней и осенней генераций на заключительном этапе выращивания
В заключении следует отметить, что размах весовых показателей в популяции сомов весенней генерации в ходе выращивания был высоким по сравнению с популяцией сомов осенней генерации. Полученные нами результаты свидетельствуют, что с экономической точки зрения выращивание рыбы, репродуцированной в осенний или зимний периоды, более затратно. Это касается расхода кормов, поскольку кормление вместо 23 недель растягивалось до 26 и энергозатратно, поскольку клариевый сом — теплолюбивая рыба. В зимний период его выращивание сопряжено с дополнительным подогревом бассейнов. Экономически выгоднее репродуцировать африканского клариевого с целью выращивания товарной рыбы в весенне-летний периоды.
Можно предполагать, что снижение уровня пластического обмена, обеспечивающего соматический рост, в популяции сомов, репродуцированных в осенний период, связано с низкой продолжительностью светового периода, поскольку все остальные абиотические факторы среды в условиях искусственного разведения были стабилизированы.
В итоге можно констатировать, что биомасса сомов за цикл выращивания от личинки до товарной рыбы за 23 недели возросла в среднем в 2000 раз. Популяция сомов весенней генерации в течение 23 недель набрала товарную массу 933±29,8 г (от 900 до 1300 г), что согласуется с темпами роста африканского сома. Сроки выращивания ноябрьской популяции сомов до товарных размеров удлинились на три недели. Товарной массы сомы ноябрьской генерации достигли только в 26 недель, причем снижение темпа роста осенней популяции сомов произошло на личиночной стадии и продолжилось на стадии малька.
Следующая серия опытов была заложена в летний период. Мы подняли температуру выращивания сома на 10С и содержали рыбу при температуре воды — 27 ° и плотности посадки 100 особей/м3.
На этом этапе оценивалась эффективность использования корма, рассчитывался коэффициент массонакопления. Скорость и интенсивность роста африканского сома представлена на рисунке 66 и в таблице 14.
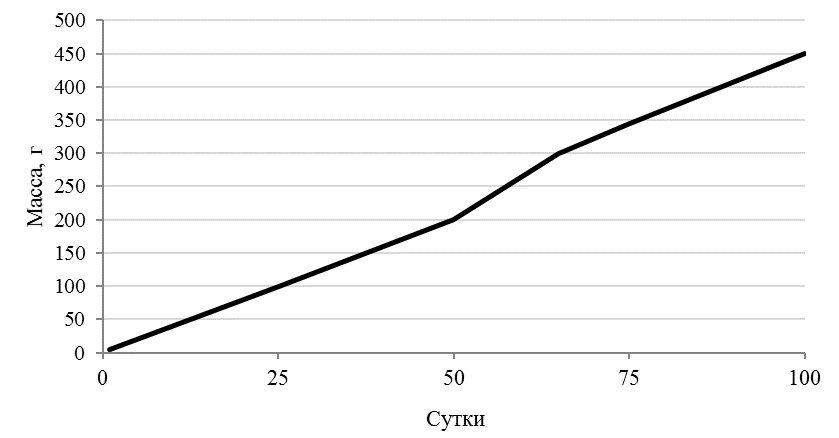
Рисунок 66 – Динамика изменения живой массы рыбы
Таблица 14 – Интенсивность роста сома
| Показатели | Периоды роста (к-во суток) | |||
| 0-25 | 25-50 | 50-75 | 75-100 | |
| Среднесуточный прирост, г | 2,8 | 4 | 6 | 6 |
| Относительная скорость роста, % | 1,7 | 0,3 | 0,17 | 0,07 |
| Абсолютный прирост, г | 70 | 100 | 150 | 200 |
| Коэффициент массонакопления, Км | 0,127 | 0,154 | 0,123 | 0,073 |
Наиболее высокая скорость роста при температуре содержания 270С у сомов была отмечена в период с 50 по 100 сутки. Среднесуточный прирост по мере увеличения средней массы рыбы так же увеличивался, наибольшая величина среднесуточного прироста отмечалась в период с 50 по 75 сутки и составила 6 г/сут.
Что касается относительной скорости роста, то этот показатель снижался по мере увеличения массы рыбы. Максимальные значения относительной скорости роста зафиксированы в период первых 25 суток наблюдения (1,7 %), минимальные значения относительной скорости роста клариевых сомов были получены на заключительном этапе нашего наблюдения (0,07 %).
Проанализировав коэффициент массонакопления, можно сделать вывод, что максимальный рост сомов был отмечен в период с 25 по 50 сутки (0,154), минимальные показатели роста рыбы пришлись на конец наблюдений и составили 0,073.
Полученная в результате наблюдений величина Км равная 0,154 говорит о высоких потенциальных возможностях роста Clarias gariepinus. По этому показателю он превосходит многие объекты аквакультуры, как традиционные виды – осетровые и форель, так и относительно новые объекты аквакультуры – тиляпию, угорь.
Скорость роста рыб тесно связана с эффективностью использования корма. Показатели суточного рациона и затрат корма представлены в таблице 15.
Таблица 15 — Показатели эффективности использования корма
| Показатели | Периоды роста (к-во суток) | |||
| 0-25 | 25-50 | 50-75 | 75-100 | |
| Величина суточного рациона, % | 2,37 | 2,28 | 1,69 | 1,1 |
| Затраты корма, кг/кг | 0,75 | 0,84 | 0,98 | 1,18 |
Из таблицы 15 видно, что на протяжении всего периода наблюдения потребление сомами корма имело выраженную динамику. Максимальные значения отмечались в первой половине опыта (1-50 сутки) и составляли 2,37-2,28 % от массы тела рыбы, в дальнейшем по мере роста рыбы величина суточного рациона постепенно снижалась до 1,1 % от массы рыбы.
Показатель эффективности использования корма снижался по мере роста рыбы. На начальном этапе опыта, в первые 25 суток затрачивалось – 0,75 кг корма в пересчете на 1 кг прироста, в последующее время затраты корма постоянно росли и на заключительном этапе опыта достигли 1,18 кг на кг прироста. Величина коэффициента массонакопления — 0,154 говорит о высоком потенциале роста рыбы.
2.5.2 Прогностическая оценка ростовых процессов по экстерьерным и интерьерным показателям
Важнейшим критерием выбора объекта рыборазведения является способность к быстрому достижению товарной массы[146-149]. Важную роль в оценке перспектив рыборазведения играет прогнозирование.
В условиях индустриальной аквакультуры физиологическому состоянию рыбы уделяют пристальное внимание, поскольку условия среды ее обитания регулируются человеком. Существует ряд унифицированных, недорогих и доступных для быстрого определения показателей, которые могут достоверно информировать о характере процессов роста и развития рыбы. В первую очередь — это экстерьерные и интерьерные ростовые и весовые морфологические признаки.
Основным показателем эффективности процесса является скорость наращивания биомассы. Поэтому важен биологический контроль параметров, характеризующих рост и развитие рыбы на ранних этапах онтогенеза [146-148]. Чем раньше будет сформирована прогностическая оценка ростовых процессов и набора товарной массы, тем эффективнее будут мероприятия, стимулирующие их течение. Наиболее информативны в этом плане морфологические интерьерные и экстерьерные показатели. К их числу относятся такие экстерьерные показатели, как длина тела рыб, малая длина, высота тела, обхват тела, ширина тела, длина хвостового стебля, длина головы большая и малая, размеры предглазничного и заглазничного отделов.
На основании морфометрии этих отделов рассчитываются экстерьерные индексы. В той же мере информативна и морфометрия интерьерных показателей, таких, как общая масса, масса порки, тушки головы, масса внутренних органов. Признаки, которые можно выразить в единицах веса, длины или объема называют пластическими.
В ходе нашей работы осуществлялась морфометрия пластических экстерьерных показателей рыб; исследовалась возрастная динамика экстерьерных показателей; проводилась морфометрия пластических интерьерных показателей рыб; исследовалась возрастная динамика интерьерных показателей рыбы; обосновывались критерии прогностической оценки роста и развития.
Наши исследования проводились на рыбе 9, 11, 13 и 15 недельного возраста, полученной в результате искусственного нереста от собственных самцов и самок в условиях индустриальной аквакультуры [150-154]. Потомство получено в результате экстракорпорального оплодотворения икры горомонально-стимулированной самки спермой двух гормонально стимулированных самцов [150-154-160]. Кормление осуществляли специализированными гранулированными кормами, подбирая фракции, соответствующие этапам их онтогенеза [146, 148, 156]. Гидрохимические показатели воды в бассейнах контролировали ежедневно раз в сутки, своевременно корректируя, чтобы они не превышали допустимых норм.
В бассейне объемом 6 м3 содержалась популяция сомов в количестве 450 особей. Наблюдения за ней велись с личиночного возраста. На всех этапах онтогенеза мальков африканского клариевого сома контролировали массу и длину тела.
По результатам проведенных исследований нами было выявлено, что длина тела клариевого сома в возрасте девяти недель составляла 7,5-15,5 см, в возрасте 11 недель составляла 16,0-19,5 см, в 13 недель — 20-27 см, в 15 недель — свыше 30-39,5 см.
Сводные результаты исследования экстерьерных показателей молоди клариевого сома и их динамики во все возрастные периоды отражены в таблицах 16 и 17.
Таблица 16 — Экстерьерные показатели сомов на 9-11 неделях развития
| Возраст | 9 недель | 11 недель | ||||
| Параметр | M±m | Ϭ | Cv | M±m | Ϭ | Cv |
| Длина тела рыбы (L), см | 13,2 ± 0,79 | 2,39 | 18,09 | 17,3 ± 0,25 | 1,04 | 6,00 |
| Малая длина (l), см | 9,57 ± 0,86 | 2,59 | 27,08 | 12,8 ± 0,29 | 1,17 | 9,09 |
| Длина головы малая, см | 2,35 ± 0,15 | 0,47 | 20,18 | 3,37 ± 0,16 | 0,66 | 19,52 |
| Длина головы большая, см | 3,72 ± 0,19 | 0,54 | 14,45 | 4,48 ± 0,12 | 0,50 | 11,19 |
| Ширина головы, см | 2,26 ± 0,06 | 0,21 | 9,14 | 2,68 ± 0,12 | 0,45 | 16,83 |
| Длина рыла, см | 1,17 ± 0,21 | 0,63 | 53,91 | 1,29 ± 0,20 | 0,75 | 57,76 |
| Диаметр глаза, см | 0,35 ± 0,04 | 0,14 | 40,96 | 0,52 ± 0,08 | 0,32 | 62,11 |
| Длина рыла предглазничный отдел, см | 1,12 ± 0,17 | 0,54 | 47,95 | 0,91 ± 0,08 | 0,36 | 39,14 |
| Заглазничный отдел головы, см | 2,32 ± 0,27 | 0,81 | 35,06 | 2,13 ± 0,09 | 0,39 | 18,28 |
| Высоты тела, см | 1,93 ± 0,09 | 0,29 | 15,26 | 2,46 ± 0,10 | 0,41 | 16,54 |
| Ширина тела, см | 2,27 ± 0,07 | 0,22 | 9,53 | 2,54 ± 0,14 | 0,59 | 23,24 |
| Обхват тела, см | 4,54 ± 0,61 | 1,84 | 40,54 | 6,95 ± 0,32 | 1,30 | 18,72 |
| Длина хвостового стебля, см | 4,73 ± 0,90 | 2,70 | 57,11 | 6,50 ± 0,90 | 3,64 | 55,95 |
| Высота хвостового стебля, см | 1,2 ± 0,14 | 0,44 | 36,43 | 1,15 ± 0,11 | 0,42 | 36,22 |
| Длина желудка, см | 0,91 ± 0,17 | 0,46 | 50,54 | 1,55 ± 0,23 | 0,85 | 54,71 |
| Длина кишечника, см | 10,2 ± 1,83 | 5,19 | 50,58 | 10,7 ± 1,22 | 4,89 | 45,69 |
Разность достоверна при p< 0,05.
В таблицах приведены средние значения признака и коэффициенты вариации. Как известно, при коэффициенте вариации менее 10% — степень рассеивания данных незначительна, от 10 до 20% — средняя, больше 20, но меньше 33% — значительная. Если коэффициент вариации больше 33%, — совокупность неоднородна. Мы основывались на том, что для однородной совокупности расчетные значения средних величин значимы, а для неоднородной они не значимы и не характеризуют совокупность из-за высокого разброса значений признака.
Таблица 17 — Экстерьерные показатели сомов на 13-15 неделе развития
| Возраст | 13 недель | 15 недель | ||||
| Параметр | M±m | Ϭ | Cv | M±m | Ϭ | Cv |
| Длина тела рыбы (L), см | 22,1 ± 0,70 | 2,43 | 10,94 | 33,0 ± 1,06 | 3,02 | 9,12 |
| Малая длина (l), см | 16,5 ± 0,44 | 1,53 | 9,27 | 23,3 ± 0,97 | 2,77 | 11,88 |
| Длина головы малая, см | 4,61 ± 0,37 | 1,31 | 28,37 | 6,77 ± 0,55 | 1,56 | 23,07 |
| Длина головы большая,см | 6,40 ± 0,44 | 1,39 | 21,74 | 8,55 ± 0,27 | 0,77 | 8,98 |
| Ширина головы, см | 3,66 ± 0,20 | 0,71 | 19,22 | 5,56 ± 0,41 | 1,17 | 21,08 |
| Длина рыла, см | 1,53 ± 0,14 | 0,40 | 26,09 | 2,28 ± 0,16 | 0,39 | 17,21 |
| Диаметр глаза, см | 0,43 ± 0,02 | 0,08 | 17,44 | 0,61 ± 0,03 | 0,09 | 15,18 |
| Длина рыла предглазничный отдел, см | 1,69 ± 0,23 | 0,79 | 46,65 | 1,9 ± 0,11 | 0,22 | 11,77 |
| Заглазничный отдел головы, см | 3,00 ± 0,33 | 1,18 | 39,09 | 4,84 ± 0,52 | 1,49 | 30,74 |
| Высоты тела, см | 3 ± 0,16 | 0,57 | 18,86 | 4,91 ± 0,39 | 1,12 | 22,73 |
| Ширина тела, см | 3,08 ± 0,19 | 0,68 | 22,06 | 4,47 ± 0,25 | 0,71 | 15,90 |
| Обхват тела, см | 8,94 ± 0,34 | 1,18 | 13,19 | 13 ± 1,17 | 3,32 | 25,51 |
| Длина хвостового стебля, см | 7,73 ± 1,26 | 4,37 | 56,48 | 8,38 ± 1,88 | 5,32 | 63,41 |
| Высота хвостового стебля, см | 1,65 ± 0,23 | 0,83 | 49,96 | 2,88 ± 0,33 | 0,96 | 33,27 |
| Длина желудка, см | 1,66 ± 0,19 | 0,62 | 37,27 | 3,58 ± 1,02 | 2,29 | 63,89 |
| Длина кишечника, см | 9,63 ± 1,28 | 4,07 | 42,29 | 17,0 ± 2,68 | 6,00 | 35,14 |
Разность достоверна при p< 0,05.
Полученные нами данные свидетельствуют, что один из основных экстерьерных показателей – «длина рыбы» и его средние по популяции во все возрастные периоды значимы на массиве всей совокупности. Наиболее вариабелен этот морфологический признак в возрасте 9 недель. Коэффициент вариации в этой возрастной группе составил 18,09%, что свидетельствует о среднем уровне разброса в популяции в данной возрастной категории. Такой показатель, как длина рыбы, с переходом в следующие возрастные группы 11-15 недель, судя по степени рассеивания данных, практически не превышает 10% на массиве всей популяции. Он достаточно однороден и характеризует популяцию в целом (таблицы 16, 17). Аналогично ведет себя и такой морфологический признак, как малая длина рыбы. Для него характерны те же тенденции. Средние значения, рассчитанные по этим признакам, значимы и действительно характеризуют популяцию как однородную.
Рассматривая морфологические характеристики головы, такие, как длина головы большая и малая, ширина головы, учитывая степень рассеивания данных, также можно заключить, что во все исследованные возрастные периоды их средние характеризуют популяцию в целом, поскольку степень рассеивания данных ниже средней или на среднем уровне.
При исследовании таких характеристических параметров как длина рыла, предглазничного отдела, диаметр глаза, следует отметить, что по этим признакам полученные средние величины, характеризующие признак, не позволяют судить о состоянии популяции в целом, поскольку коэффициенты вариации свидетельствуют в пользу значительной степени рассеивания данных в такие возрастные периоды как 9 и 11 недель. В более позднем возрасте у сомов степень рассеивания данных по этим морфологически признакам не достигает среднего уровня, судя по величине коэффициента вариации, вычисленные средние этих морфологических параметров в 13 и 15 недельном возрасте также отражают состояние в популяции в целом.
Анализ таких морфологических признаков, как высота тела, ширина тела, обхват тела, показал, что полученные нами средние значения первых двух признаков информативны в отношении популяции в целом во все возрастные периоды, а расчетное среднее значение (М) по такому параметру, как обхват тела у сомов в возрасте 9 недель из-за высокой степени рассеивания данных не может быть информативным в отношении всей популяции.
Средние значения таких показателей, как длина и высота хвостового стебля, длина желудка, кишечника не показательны для популяции в целом, поскольку коэффициенты вариации этих признаков составляют от 35 до 63%, что свидетельствует о высокой неоднородности этих признаков во все возрастные периоды от 9 до 15 недель.
Сводные результаты исследования динамики интерьерных показателей молоди клариевого сома отражены в таблицах 18, 19.
Основным характеристическим показателем эффективности выращивания рыбы в условиях индустриальной аквакультуры является ее масса. По результатам наших исследований, общая масса тела рыбы в возрасте 9 недель составляла в среднем 26 г, прирост биомассы рыбы за 2 недели составил 17,3 г, за 2 последующие недели 63,17 г, с 13-ой по 15 недели прирост был наиболее значим и составил 200,81, при этом рыба достигла веса 307,38 г в возрасте 15 недель.
Произведенный расчет коэффициента вариации показал, что эти величины действительно являются характерными для популяции в целом во все возрастные периоды поскольку, максимальное значение коэффициента вариации по этому признаку было не намного выше 20%, что свидетельствует об однородности популяции по этому интерьерному признаку (таблицы 18, 19).
Работа сердца осуществляет кровообращение у рыб, обеспечивая организм кислородом и питательными веществами. Величина сердца рыб напрямую связана с интенсивностью обменных процессов в организме. Сердце рыб относительно небольшое и слабое, частота сердечных сокращений 18-30 ударов в минуту. Оно значительно меньше и слабее, чем у наземных позвоночных. Теоретически, масса сердца у рыб в среднем не превышает 1% от общей массы рыб, при размахе колебаний от 0,3 до 2,5%, в зависимости от вида рыб, что согласуется с нашими данными (таблицах 18, 19).
Таблица 18. Интерьерные показатели сомов на 9-11 неделях развития
| Возраст | 9 недель | 11 недель | ||||
| Параметр | M±m | Ϭ | Cv | M±m | Ϭ | Cv |
| Общая масса рыбы, г | 26,0 ± 1,33 | 4,00 | 15,38 | 43,3 ± 2,66 | 10,33 | 23,81 |
| Сердце, г | 0,31 ± 0,02 | 0,08 | 24,25 | 0,39 ± 0,02 | 0,10 | 25,44 |
| Масса гонад (самки), г | 0,63 ± 0,03 | 0,06 | 10,00 | 2,4 ± 0,19 | 0,54 | 22,70 |
| Масса гонад (самцы), г | 0,29 ± 0,02 | 0,07 | 22,04 | 0,83 ± 0,04 | 0,12 | 14,89 |
| Печень, г | 0,15 ± 0,01 | 0,04 | 25,68 | 0,41 ± 0,02 | 0,08 | 20,25 |
| Желчный пузырь, г | 0,12 ± 0,00 | 0,03 | 23,82 | 0,19 ± 0,01 | 0,06 | 29,23 |
| Селезенка, г | 0,13 ± 0,01 | 0,04 | 28,71 | 0,23 ± 0,01 | 0,06 | 24,87 |
| Желудок, г | 0,52 ± 0,05 | 0,15 | 29,27 | 1,06 ± 0,07 | 0,28 | 26,01 |
| Кишечник, г | 0,22 ± 0,02 | 0,07 | 29,70 | 0,70 ± 0,06 | 0,22 | 31,71 |
| Почки, г | 0,19 ± 0,01 | 0,05 | 25,81 | 0,63 ± 0,03 | 0,11 | 18,02 |
| Голова, г | 7,09 ± 0,36 | 1,09 | 15,31 | 12,6 ± 0,96 | 3,73 | 29,60 |
| Жабры и наджаберный аппарат, г | 1,45 ± 0,13 | 0,41 | 28,39 | 2,36 ± 0,19 | 0,77 | 32,58 |
| Порка, г | 22,4 ± 1,34 | 4,03 | 17,95 | 37,7 ± 2,61 | 9,78 | 25,89 |
| Тушка, г | 15,1 ± 0,77 | 2,34 | 15,47 | 26,7 ± 2,02 | 7,84 | 29,35 |
| Филе, г | 8,56 ± 0,91 | 2,75 | 32,09 | 14,0 ± 0,93 | 3,63 | 25,77 |
| Плавники, г | 0,67 ± 0,05 | 0,16 | 23,53 | 1,24 ± 0,10 | 0,41 | 33,08 |
| Кожа, г | 1,82 ± 0,16 | 0,50 | 27,74 | 4,12 ± 0,33 | 1,26 | 30,46 |
| Кости, г | 2,64 ± 0,27 | 0,81 | 30,72 | 4,14 ± 0,29 | 1,15 | 27,67 |
| Внутренний жир, г | 0,50 ± 0,06 | 0,18 | 36,15 | 0,94 ± 0,11 | 0,40 | 42,04 |
Полученные нами результаты свидетельствуют, что за период шестинедельных наблюдений масса сердца возросла в 9 раз с 0,31 г до 2,75 г. При этом, период с 9 до 11 недель характеризовался незначительным приростом биомассы. Выраженное наращивание массы сердца сомов происходило с разной интенсивностью с 11 по 13 и с 13 по 15 недели.
Таблица 19 — Интерьерные показатели сомов на 13-15 неделях развития
| Возраст | 13 недель | 15 недель | ||||
| Параметр | M±m | Ϭ | Cv | M±m | Ϭ | Cv |
| Общая масса рыбы, г | 106, ± 6,19 | 21,47 | 20,15 | 307, ± 17,1 | 45,40 | 14,77 |
| Сердце, г | 1,76 ± 0,10 | 0,36 | 20,23 | 2,75 ± 0,20 | 0,45 | 16,38 |
| Масса гонад (самка), г | 5,81 ± 0,69 | 1,70 | 29,26 | 16,6 ± 3,01 | 6,74 | 40,42 |
| Масса гонад (самцов), г | 1,14 ± 0,05 | 0,13 | 11,56 | 2,02 ± 0,12 | 0,17 | 8,57 |
| Печень, г | 0,84 ± 0,05 | 0,20 | 23,66 | 2,31 ± 0,22 | 0,51 | 22,05 |
| Желчный пузырь, г | 0,34 ± 0,05 | 0,13 | 38,60 | 0,34 ± 0,04 | 0,10 | 30,07 |
| Селезенка, г | 0,33 ± 0,02 | 0,09 | 27,77 | 0,91 ± 0,06 | 0,16 | 17,06 |
| Желудок, г | 1,75 ± 0,14 | 0,46 | 26,01 | 2,69 ± 0,09 | 0,23 | 8,46 |
| Кишечник, г | 1,69 ± 0,15 | 0,43 | 25,50 | 2,48 ± 0,23 | 0,53 | 21,22 |
| Почки, г | 1,46 ± 0,08 | 0,29 | 19,90 | 2,6 ± 0,19 | 0,39 | 14,96 |
| Голова («большая»), г | 24,0 ± 2,76 | 9,58 | 39,83 | 77,9 ± 5,42 | 14,35 | 18,42 |
| Жабры и наджаберный аппарат, г | 4,75 ± 0,24 | 0,86 | 18,16 | 12,4 ± 0,66 | 1,75 | 14,00 |
| Порка, г | 84,4 ± 4,91 | 17,02 | 20,16 | 263, ± 20,4 | 54,04 | 20,52 |
| Тушка, г | 55,1 ± 5,51 | 18,29 | 33,17 | 191, ± 11,1 | 29,46 | 15,37 |
| Филе, г | 29,8 ± 2,43 | 8,44 | 28,24 | 104, ± 12,0 | 31,81 | 30,35 |
| Плавники, г | 2,36 ± 0,21 | 0,74 | 31,33 | 6,39 ± 0,76 | 2,04 | 31,86 |
| Кожа, г | 5,52 ± 0,48 | 1,67 | 30,18 | 21,9 ± 3,22 | 8,54 | 38,94 |
| Кости, г | 9,19 ± 0,59 | 2,07 | 22,48 | 38,8 ± 3,25 | 8,60 | 22,15 |
| Внутренний жир, г | 3,81 ± 0,15 | 0,49 | 12,82 | 12,3 ± 0,88 | 2,34 | 18,96 |
Гонады. На 9-11 неделе степень зрелости гонад соответствовала 1-2 стадии по шкале Г.В. Никольского [157]. Половые железы самцов были мелкими, но на гонадах уже были заметны утолщения; половой диморфизм был хорошо выражен, яичники и семенники были различимы и отличались размерами на всех стадиях исследования. В возрасте 13-15 недель у африканского сома половые продукты по своему развитию в полной мере соответствовали второй стадии по шкале Г.В. Никольского, на 15 неделе проявлялись признаки начальных этапов третьей стадии. По поводу возраста созревания половых продуктов африканского клариевого сома в литературе нет единой точки зрения. На собственном опыте мы убедились, что в условиях искусственного разведения у африканского клариевого сома половые продукты — икра и спермии без гормональной стимуляции не созревают. Вопрос о том, с какого возраста этого вида рыбы гормональная стимуляция искусственного нереста эффективна до сих пор дискутируется. Ряд исследователей считает, что для этого возраст клариаса должен быть более года, а вес самцов и самок должен быть не менее 1,5-2,0 кг. По данным других источников, созревание наступает значительно раньше. В наших условиях нам удавалось получить зрелые половые продукты у самцов и самок весом около 900 г в возрасте не менее восьми месяцев. Полученные результаты согласуются с данными других исследователей [158-160].
Полученные нами результаты показали, что у африканского клариаса за шестинедельный период наблюдений масса гонад самцов возрастала в 7 раз (таблицы 18, 19). Если сравнивать самцов и самок, необходимо отметить, что в возрасте 15 недель усредненные показатели массы гонад самцов в 8 раз меньше таковых у самок. За шесть недель наблюдения у самок масса гонад возросла в 26 раз. Наиболее интенсивное развитие гонад происходило в период 13-15 недель синхронно у самцов и самок. Исследование динамики коэффициентов вариации по данному показателю свидетельствует, что с возрастом самок в популяции нарастает неоднородность и, очевидно, формируются популяционные группы, отличающиеся скоростью развития гонад. В частности, в 9 недельном возрасте степень рассеивания данных в популяции по весу гонад самок была незначительной, в 11 недельном возрасте возросла в 2 раза, в 13 недельном стала значительной, а в 15 недельном возрасте – полученные нами данные характеризуют популяцию как неоднородную. Выявленная неоднородность может объясняться генетической неоднородностью популяции сомов, которая была получена в результате оплодотворения икры одной самки спермиями от двух самцов.
Процессы, протекавшие в популяции самцов, выглядели иначе. В возрасте 9 недель, когда гонады соответствовали первой стадии зрелости, степень рассеивания данных по этому показателю превышала средний уровень (таблицы 18, 19). Но на протяжении последующих, наблюдаемых нами этапов онтогенеза, коэффициент вариации, как мера рассеивания данных по этому признаку, прогрессивно снижался. Очевидно, процессы созревания семенников синхронизировались, поскольку коэффициент вариации был ниже 10%, и популяция была однородной по этому признаку (таблицы 18, 19).
Печень. По данным литературных источников размеры печени рыбы существенно меняются в зависимости от условий окружающей среды. Это объясняется тем, что печень депонирует гликоген, жир и в благоприятных условиях может увеличиваться в размерах за счет накопления этих веществ, а в неблагоприятных – уменьшаться. В естественной среде этот процесс имеет сезонную динамику, он также зависит от возраста, физиологического состояния, кормовой базы. Динамика прироста массы печени за период наблюдения была неравномерной (таблицы 18, 19). За первые две недели опыта прирост составил 0,26 г, с 11 по 13 недели – 0,43 г, за две последние — 1,47 г. Следовательно, интенсивность роста печени по мере роста и развития организма сомов в исследованный нами период имела нарастающую динамику. Следует отметить, что величина коэффициента вариации была во все периоды значительной, однако не превышала предела (>33%), за которым популяцию можно было бы считать неоднородной по этому морфометрическому показателю (таблицы 18, 19).
Селезенка. Селезенка у рыб обеспечивает эритропоэз и лимфогранулопоэз. Для рыб характерен интенсивный гемопоэз, в его обеспечении кроме селезенки участвуют также почки, сердце и жабры. Особенностью молодых эритроцитов рыб является их способность к фагоцитозу. Селезенка также несет иммунную функцию, она осуществляет иммунный ответ, синтезирует специфические антитела, благодаря чему распознаются чужеродные антигены в организме. Селезенка также осуществляет элиминацию старых эритроцитов и лейкоцитов. Селезенка играет важную роль в обмене тромбоцитов. Динамика развития селезенки сома в возрастном аспекте неравномерна. На этапе 9-11 и 11-13 недель прирост ее массы составлял чуть более 0,1 г. в то время, как в период с 13 по 15 неделю прирост биомассы резко интенсифицировался и составил 0,58 г. Величина коэффициента вариации для всех этапов развития селезенки сомов была чуть выше 20% и ни разу не превысила 30% уровень. Следовательно, по этому морфометрическому параметру популяция однородна, а средние, рассчитанные для популяции, значимы и характеризуют совокупность в целом.
Почки. Основные функции почек у рыб – фильтрационная, выделительная и кроветворная, поскольку у рыб отсутствует красный костный мозг. Причем кроветворная функция доминирует над выделительной. По результатам наших исследований, почки по сравнению с развитием и наращиванием биомассы других внутренних органов рыб характеризуются более равномерной динамикой. Расчетные коэффициенты вариации по этому морфофизиологическому признаку приближаются к величине, свидетельствующей о среднем уровне рассеивания данных во все возрастные периоды, поэтому популяцию по данному признаку можно считать однородной.
Жабры. Основной функцией жабр долго считался газообмен, но на сегодня хорошо известно, что эндотелий кровеносной системы жабр и синцитий участвует в кроветворении, а канадские исследователи — Peter Rombough и Clarice Fu установили, что жабры поддерживают солевой гомеостаз в организме, в первую очередь — обмен ионов натрия, обеспечивая химический баланс с внешней средой [158-160]. Развитие жабер и наджаберного органа, судя по динамике наращивания биомассы этих органов, в наших исследованиях происходило достаточно равномерно, а расчетные значения коэффициентов вариации показали, что популяция по этому параметру в возрасте 9-11 недель может считаться однородной.
В итоге важно отметить, что в своих исследованиях мы пытались выявить доступные для определения морфологические признаки африканского клариевого сома, которые можно было бы использовать для прогностической оценки скорости роста и наращивания биомассы при производстве товарной рыбы.
Было показано, что такие экстерьерные морфологические признаки, как длина рыбы, высота и ширина тела информативны в отношении популяции в целом, поскольку имеют выраженную синхронность и направленность изменений во все возрастные периоды.
Экстерьерные морфологические признаки: обхват тела, длина и высота хвостового стебля, длина желудка и кишечника не показательны для популяции в целом, имеют значительный внутрипопуляционный разброс, и не могут быть рекомендованы в качестве прогностических.
В числе информативных интерьерных морфологических признаков можно назвать массу тела, сердца, семенников, селезенки, печени и почек. Однако получение интерьерных показателей более трудоемко и требует забоя рыбы, поэтому при формировании прогностической оценки роста и развития африканского клариевого сома целесообразно ориентироваться на экстерьерные параметры, учитывая их достаточно высокую информативность.
2.5.3 Перспективы повышения оплодотворяемости, выхода и выживаемости предличинок и личинок за счет снижения уровня аномалий развития и эмбриональной смертности
В условиях индустриальной аквакультуры рыба постоянно находится в состоянии хронического стресса, поскольку искусственные условия радикально отличаются от ее естественной среды обитания. В условиях постоянного напряжения всех систем физиологическое состояние рыб часто отклоняется от нормы, что негативно сказывается на качестве потомства [161]
Одним из выходов из создавшегося положения является поиск эффективных средств и веществ, повышающих адаптивные возможности организма. К числу таких биостимуляторов, обладающих широким спектром действия, относится адаптоген трекрезан, которой разработан в Иркутском Институте органической химии СО РАН и для животных производится под товарной маркой «иркутин». Действующим веществом препарата является производное феноксиуксусной кислоты – крезацин.
Трекрезан — синтетический аналог природных адаптогенов (женьшеня, родиолы розовой). Этот адаптоген не накапливается в организме и получаемой продукции, не вызывает нежелательных побочных эффектов, он безопасен [162, 163].
Трекрезан безопасен для рыб, даже в концентрациях от 500 до 2500 мг/л он не оказывает на них токсического действия. В рекомендациях по использованию иркутина его применяют индивидуальным или групповым способом, вводят в комбикорм или добавляют в резервуары с рыбой [164].
В своих исследованиях мы использовали трекрезан, (который поступает в продажу под маркой «Иркутин») для обработки икры перед и в процессе оплодотворения. Свежеполученная икра африканских клариевых сомов обрабатывалась в процессе экстракорпорального оплодотворения и последующего промывания уже оплодотворенной икры растворами адаптогена «Иркутин» в различных дозировках.
Время экспозиции в водном растворе препарата «Иркутин» составляло 20 минут. Для промывания оплодотворенной икры самок клариевого сома использовали следующие концентрации препарата: 0,5 мг/л; 1 мг/л; 2,5 мг/л; 5 мг/л; 10 мг/л. Для контроля мы обрабатывали икру водой без биостимулятора. Эффект применения адаптогена «Иркутин» оценивали по репродуктивным показателям: процент оплодотворенных яйцеклеток клариаса (%), выход предличинок (%), аномалии на эмбриональном этапе развития (%). Достоверность различий определяли по критерию Стьюденту при уровне значимости p≤0,05.
В результате исследований установили, что оптимальная концентрация «Иркутина» для обработки икры при экстракорпоральном оплодотворении составляет 1 мг/л. Процент оплодотворения при обработке икры адаптогеном в дозе 1 мг/л был достоверно выше, чем в дозе 0,5 мг/л (p≤0,05). Обе дозировки давали более высокий результат, чем в контрольной группе.
При обработке свежеполученных ооцитов водным раствором адаптогена «Иркутин» в концентрации 1 мг/л процент оплодотворенных ооцитов составил 93±1,3%. При обработке икры растворами адаптогена «Иркутин» в более высоких концентрациях, а именно 2,5 мг/л; 5 мг/л; 10 мг/л достоверных различий по проценту оплодотворенных ооцитов не выявили. Выживаемость культивируемых эмбрионов в опытной группе была достоверно выше, чем в контроле (p≤0,05).
В ходе исследований мы констатировали периоды наибольшей смертности в эмбриональный период онтогенеза клариевого сома. Наибольшая гибель эмбрионов отмечалась на начальных и завершающих этапах гаструляции; в период закладки сердечнососудистой системы и на стадии выклева предличинок. Результаты представлены в таблице 20.
Таблица 20 — Показатели смертности эмбрионов при обработке икры адаптогеном «Иркутин» (1 мг/л)
| Показатели | Опытная группа | Контроль |
| Начальный этап гаструляции, % | 6,5±2,4 | 12,0±3,5 |
| Завершающий этап гаструляции, % | 8,1±2,8 | 15,5±3,8 |
| Стадия закладки органов и нейруляции, % | 2,0±0,5 | 8,1±2,5 |
| Стадия образования органов ССС, % | 3,0±1,2 | 10,4±2,8 |
| Стадия выклева из ооцитов, % | 5,4±2,7 | 13,7±3,7 |
* р≤0,05
В контрольном варианте выход предличинок из ооцитов составил 40,3%, в опытной группе этот показатель был достоверно выше и составил 75% (p≤0,05). Результаты представлены в таблице 21.
Таблица 21 — Показатели качества ооцитов и предличинок африканского клариевого сома после обработки икры адаптогеном «Иркутин» (1 мг/л)
| Показатели | Опытная группа | Контроль |
| Процент оплодотворенных ооцитов, % | 93±1,3 | 71±3,3 |
| Выход предличинок из ооцитов, % | 75±4,9 | 40,3±4,6 |
| Личинки с аномалиями, % | 4,8±0,49 | 20±3,5 |
Высокая выживаемость эмбрионов рыб при обработке икры адаптогеном свидетельствует и об улучшении ее качества на стадии экстракорпорального оплодотворения и о хороших адаптивных возможностях предличинок, полученных из нее.
Исследование аномалий развития на этапе эмбрионального онтогенеза позволило установить, что доля нормально развивающихся эмбрионов в опытной группе при обработке адаптогеном достоверно превышала этот показатель в контрольной группе. Результаты представлены в таблице 22.
При обработке свежеполученной икры самок клариевого сома адаптогеном снизился уровень эмбриональной гибели, аномалий развития, возрос выход предличинок и их сохранность, значительно повысились адаптивные способности личинок клариевого сома, полученных из икры, обработанной адаптогеном.
Таблица 22 — Уровень аномалий эмбрионального развития при использовании адаптогена «Иркутин» (1 мг/л)
| Показатели | Опытная группа | Контроль |
| Нарушения на стадии гаструлы, % | 3,3±0,58 | 7,1±1, 3 |
| Аномалии в развитии головы, % | 4,2±0,72 | 6,3±0,89 |
* р≤0,05
Результаты приведенных исследований показали, что использование адаптогенов чрезвычайно полезно для получения полноценных и устойчивых к неблагоприятным факторам окружающей среды личинок рыб.
2.6 Оптимизация гидрохимического режима при выращивании клариевого сома
Индустриальные системы рыборазведения основаны на управлении факторами среды в искусственно-созданных условиях. Поддержание гидрохимических параметров, обеспечивающих создание оптимальных условий для жизнедеятельности гидробионтов, обеспечивает успех в процессе производства товарной рыбы [165, 166].
Успех индустриального рыборазведения в первую очередь определяется гидрохимическим режимом, под которым понимают состояние водного объекта, проявляющееся в изменении химического состава воды [165].
Суммарное содержание в воде аммиака и иона аммония является
важнейшим рыбоводным показателем. Аммиак (NH3), который является продуктом метаболизма рыб, обладает острой токсичностью, и наносит непоправимый ущерб организму рыб. Ионизированная форма аммиака -– ион аммония (NH4+) – нарушает физиологические процессы при хроническом воздействии. Его токсичность особенно выражена при низких значениях жесткости воды. Суммарный показатель (NH3 и NH4+) при искусственном содержании рыб является важнейшим фактором, ограничивающим плотность посадки рыб. Изменение этих гидрохимических показателей воды в бассейне служит индикатором состояния рыб.
Основной целью исследований была оценка эффективности использо-
вания микроорганизмов-нитрификаторов при выращивании клариевого сома в условиях индустриальной аквакультуры.
В ходе исследований заболеваний и гибели экспериментального поголовья не регистрировалось. В опытной группе, где в воду добавляли препарат Sera Bio Nitrivec (нитрификатор) рыбы чувствовали себя гораздо лучше, были активными, проявляли повышенный интерес к кормам, плавники их были расправлены, покровы тела были гладкими и естественного цвета.
В контрольной группе, в которой не использовались микроорганизмы — нитрификаторы, можно было отметить некоторое отставание в темпах роста рыб, что было обусловлено нестабильностью пищевого поведения. Очевидно, это связано с более высоким, чем в экспериментальной группе содержанием в среде обитания рыб продуктов азотистого обмена.
С повышением таких показателей как аммиак и аммоний, нитриты и нитраты у рыб контрольной группы отмечалось снижение аппетита и подвижности, изменялись поведенческие реакции.
Наблюдения за гидрохимическим режимом в обоих бассейнах показали, что на протяжении всего эксперимента качество воды соответствовало технологическим нормативам, тем не менее, фиксировались некоторые отличия. Усредненные показатели гидрохимического режима в бассейнах за исследуемый период представлены в таблице 23.
Таблица 23 — Характеристика гидрохимическогог режима
| Показатели в контрольной группе | Временные интервалы после кормления, час. | НОРМА | ||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | ||
| Температура воды | 26 | 26 | 26 | 26 | 26 | 26 | 26 | 26 |
| Ph | 7,0 | 7,5 | 7,5 | 8,0 | 8,0 | 8,3 | 8,5 | 7,0 |
| Аммиак и аммоний | 0 | 0,5 | 1 | 1 | 1,5 | 2,0 | 3,8 | до 4 мг/л |
| Нитриты | 0 | 0,05 | 0,1 | 0,2 | 0,25 | 0,25 | 0,25 | 0,1-0,2 м г/л |
| Нитраты | 0 | 3 | 5 | 5 | 8 | 10 | 15 | до 20 мг/л |
| Карбонатная жесткость воды
(в каплях) |
11 | 9 | 11 | 10 | 10 | 9 | 10 | до 15 кап.-средняя жесткость; до 11 кап- не жесткая |
| Показатели в опытной группе на фоне нитрифи-каторов | Временные интервалы после кормления, час. | НОРМА | ||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | ||
| Температура воды | 26 | 26 | 26 | 26 | 26 | 26 | 26 | 26 |
| Ph | 7,0 | 7,0 | 7,0 | 7,5 | 7,5 | 7,5 | 7,5 | 7,0 |
| Аммиак и аммоний | 0 | 0 | 0 | 0,5 | 0,5 | 1,0 | 2,0 | до 4 мг/л |
| Нитриты | 0 | 0,05 | 0,05 | 0,05 | 0,1 | 0,15 | 0,2 | 0,1-0,2 мг/л |
| Нитраты | 0 | 0 | 2 | 2 | 4 | 4 | 5 | до 20 мг/л |
| Карбонатная жесткость воды
(в каплях) |
10 | 9 | 8 | 9 | 10 | 10 | 10 | до 15 кап.-средняя жесткость; до 11 кап- не жесткая |
Представленные в таблице результаты демонстрируют, как изменяются гидрохимические показатели воды в опытной группе на фоне использования культур микроорганизмов — нитрификаторов. Изменение показателей NH3/NH4+, нитратов и нитритов на протяжении 7 часов после кормления происходило в обеих экспериментальных чашах, но в контрольной группе рост показателей был значительно выше. В контрольной группе концентрация свободного аммиака повышалась от 0,1 до 2,5 мг/л, а в опытной группе не превышала 2,0 мг/л. Использование культур микроорганизмов — нитрификаторов существенно снижало содержание токсичных продуктов азотистого обмена в среде обитания рыб. На фоне использования нитрификаторов возросла скорость роста, повысилась поедаемость кормов и активность рыб. Очевидно, что колебание уровней аммиак/аммоний, нитриты, нитраты даже в пределах допустимых границ оказывает существенное влияние на ростовые характеристики и поведенческие реакции клариевого сома.
Значение водородного показателя (pH) за время исследования в опытной группе на фоне нитрификаторов колебалась в пределах от 7,0 до 7,5. Динамика водородного показателя в контрольной группе имела тенденцию к повышению до 8,5.
В итоге необходимо подчеркнуть, что оптимизация условий среды за счет использования культур микроорганизмов — нитрификаторов позволяет обеспечить поддержание важнейших гидрохимических параметров, таких как содержание аммиака/аммония, нитритов, нитратов на оптимальном уровне.
Это создает комфортные условия в среде обитания рыб, стимулирует физиологические процессы, нормализует пищевые поведенческие реакции. Результаты наших исследований свидетельствуют, что препарат Sera Bio Nitrivec может быть эффективно использован в условиях индустриальной аквакультуры африканского клариевого сома для снижения уровня токсичных метаболитов азотистого обмена.
2.7 Применение адаптогенов для снижения каннибализма личинок
Среди сдерживающих факторов развития индустриальной аквакультуры африканского клариевого сома выделяют каннибализм, который характерен для C. gariepinus на разных этапах развития, но наиболее сильно проявляется в раннем онтогенезе. По данным литературных источников каннибализм в раннем онтогенезе может колебаться от 5 до 50%.
Среди основных причин каннибализма в аквакультуре выделяют: дефицит пищевых ресурсов, высокую плотность посадки, реже изменение физико-химических свойств воды. Для устранения проблемы каннибализма в бассейновой аквакультуре, необходимо учитывать фактор питания и физиологические особенности личинок клариевого сома.
Цель данного этапа исследований заключалась в поисках путей минимизации уровня каннибализма личинок клариевого сома. Для этого необходимо было провести сравнительную оценку выживаемости личинок клариевого сома на фоне адаптогена и без него и оценить уровень каннибализма. В качестве адаптогена использовался трекрезан, который выпоускается под торговой маркой «иркутин» и является синтетическим аналогом родеолы розовой и женьшеня.
Продолжительность применения адаптогена составила 30 дней, в конце опыта нами был проведен контрольный подсчет и взвешивание личинок клариевого сома. Процент отхода личинок рассчитывали путем отнесения числа погибших к числу участвующих в эксперименте, которых принимали за 100%, результаты представлены на рисунке 67.
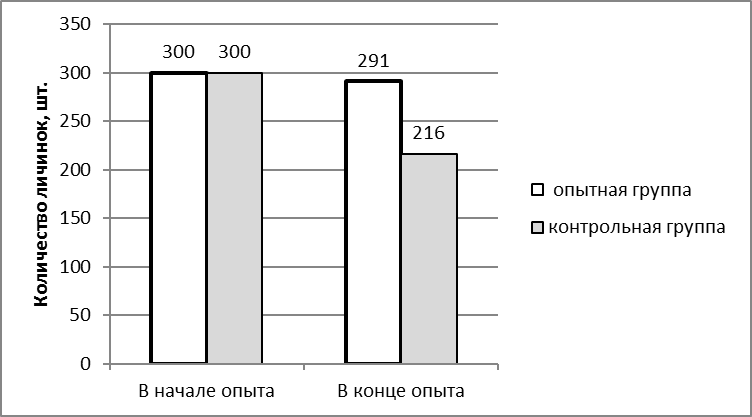
Рисунок 67 — Сохранность личинок при использовании адаптогена
Анализ диаграммы по выжившим личинкам в опытных группах показал, что наиболее высокий отход наблюдался в контрольной группе, где он составил 28%. В опытной группе, где применялся адаптоген «Иркутин», отход личинок был незначительным и составил 3%.
Отход молоди в начале эксперимента наблюдался в обеих группах, возможно, это связано со стрессом и повреждениями, вызванным манипуляциями по отлову, сортировке, взвешиванию и пересадке личинок для проведения эксперимента.
Наблюдения в ходе эксперимента показали, что затем в опытной группе гибель личинок на фоне адаптогена прекратилась, а в контрольной продолжилась. На протяжении всего опыта из резервуара, где содержалась личинки контрольной группы, периодически извлекали останки поврежденных погибших особей (рисунок 68).
Результаты наших исследований свидетельствуют о том, что использование адаптогена в совокупности со сбалансированным регулярным кормлением личинок клариевого сома позволило практически ликвидировать в экспериментальной группе каннибализм.

Рисунок 68 — Поврежденная личинка клариевого сома контрольной группы
При культивировании личинок клариевого сома следует учитывать фактор каннибализма, поскольку он может существенно сократить количество рыбы в новой генерации. Полученные нами результаты позволяют рекомендовать адаптоген трекрезан в качестве препарата, который целесообразно включать в состав кормов для рыб, чтобы снизить уровень каннибализма, повысить сохранность и выживаемость рыбы в индустриальной аквакультуре.
2.8 Принципы формирования маточного стада. Оценка самок по качеству потомства.
По достижению рыбой возраста 2,5-3 месяца уже можно отличить самок от самцов по характерному для клариевого сома признаку – форме половой папиллы. У самцов она заостренная, а у самок округлая. Маточное стадо формируется из особей, характеризующихся высокой скоростью наращивания биомассы, т.е. из самок, значительно опережающих в своем росте сверстниц.
Отобранные самки распределялись в бассейны объемом по 3-5 м3. С учетом биологических особенностей сомовых, их рекомендовано выращивать в затемненных рыбоводных емкостях, конструктивные особенности которых не позволяют рыбам выпрыгивать. Высокий уровень освещенности провоцирует агрессию самок. Температурный режим воды в бассейне должен поддерживаться на уровне 26°С, что является важным условием для развития гонад самок в течение всего года. При снижении температуры содержания — схемы гормональной стимуляции усложняются.
В зависимости от мощности УЗВ, для круглогодичной технологии получения икры обязательно ежегодное пополнение маточного поголовья из ремонтного молодняка в количестве 30%. При производстве икры рекомендуется содержать 2 маточных стада, одно из которых, находится в работе, другое выдерживается в контролируемых условиях для последующего использования. В случае нехватки маточного поголовья, его пополнение можно производить самками из товарной группы, обладающими повышеннной скоростью наращивания биомассы. При этом необходимо учесть, что стартовая масса самок, которых целесообразно использовать для производства икры не должна быть меньше 1 кг.
В настоящее время в России генофонд африканского клариевого сома сформирован множеством генетически разнородных популяций, которые имеют существенные фенотипические и генотипические различия, поскольку селекционный материал поступал из географически изолированных мест обитания: Польши, Германии, Нидерландов, Израиля, Египта и др. , а туда соответственно из стран Азии, Африки и Латинской Америки.
В нашей лаборатории мы выращиваем африканского клариевого сома, являющегося носителем генофонда популяций из Нидерландов и Польши. Эти популяции отличаются и фенотипически и генотипически.
Для разведения мы приобретали посадочных материал — мальков африканского клариевого сома (из Московской области), который был закуплен ранее в Нидерландах, а также из Краснодарского края, куда посадочный материал поступил из Польши. При внешнем осмотре потомства этих двух генетически разнородных популяций были обнаружены четкие фенотипические различия, которые выражались в окраске внешних покровов. Популяция из Нидерландов имела интенсивный мраморный серо-синий окрас внешних покровов, а популяция из Польши характеризовалась мраморной зеленовато-коричневой окраской. Популяция, закупленная в Нидерландах, имела розоватый цвет мяса, а закупленная в Польше, имела белый цвет мяса. В своих исследованиях мы сравнивали эти популяции по одному из признаков продуктивности — скорости роста. Скорость роста важнейший критерий, по которому осуществляется отбор для разведения рыбы в индустриальной аквакультуре.
Мы проводили сравнительную оценку скорости роста этих двух генетически разнородных, географически разобщенных популяций африканского клариевого сома в условиях индустриальной аквакультуры. Для исследования отобрали двух половозрелых самок полуторагодовалого возраста, характеризовавшихся наиболее высокой скоростью роста.
Первая самки (самка №1) являлась носителем генофонда популяции африканского сома, разводимого в Нидерландах. Генотип второй самки (самка №2) отражал особенности генофонда польской популяции. Для получения потомства использовали двух генетически родственных самцов, закупленных в Украине. Самок и самцов готовили в течение трех дней для проведения искусственного нереста при температуре 28ºС. Гормональную стимуляцию проводили с использованием сурфагона в дозе 5-7 мг/кг веса рыбы, используя эглонил в качестве средства, снижающего гормональный стресс.
От первой самки весом 1,702 кг после гормональной стимуляции было получено 320 г икры V стадии зрелости по Киселевичу. При легком надавливании на брюшко икра свободно вытекала. Цвет живой икры после овуляции был темно зеленым. Показатель зрелости яичников составил 18,8%. Рабочая плодовитость составила 276,8 тыс. ооцитов. Биологический контроль качества икры показал, что ооциты достигли дефинитивных размеров, средний диаметр ооцитов составил 1,75±0,14 мм. Показатели оплодотворяемости икры и выхода предличинок были на высоком уровне — 97±2,3 % и 80,7±2,0 % соответственно.
Масса второй самки маточного стада составила 1665 г. После гормональной стимуляции от самки было получено 250 г икры, яичники соответствовали V стадии зрелости (текучие особи), по шкале Киселевича. Цвет икры был темно-зеленый. Показатель зрелости яичников составил 15%.
Показатель рабочей плодовитости составил 265,3 тыс. ооцитов. Ооциты были созревшие, достигли дефинитивных размеров (1,96±0,3 мм). Показатель оплодотворяемости икры составил 96,8%. Показатель выхода предличинок был на уровне 76%. Вторая племенная самка по репродуктивным показателям не уступала первой.
Вес самцов, используемых для проведения искусственного нереста, составлял 0.995 кг и 1,035 кг. После проведенной гормональной стимуляции созревания гонад масса их семенников достигла 13 г и 12,5 г соответственно, семенники были зрелые молочно-белого цвета. Сперма была густой, концентрация спермиев составила соответственно 59,5 млрд./см3 и 61,8 млрд./см3. Всего было получено 7,2 мл спермы, которую разделили на 2 равные порции.
Подвижность спермы оценили в 5 баллов (max) по шкале Персова. Смешанной спермой обоих самцов проводили экстракорпоральное оплодотворение икры обеих самок.
После оплодотворения икры проводили культивирование эмбрионов до стадии предличинок, доращивали до личиночной стадии и проводили сравнительные исследования скорости роста двух генераций, полученных от генетически неродственных самок.
Продолжительность выращивания сомов от личинки до товарной рыбы обычно составляет 6 месяцев (24 недели), за это время рыба должна набрать массу 0,9-1,5 кг. Выделяют следующие периоды онтогенеза у сомов: — предличинка — двое-трое суток; — личинка — последующие 3-4 недели; — малек — последующие 6 недель; молодь – последующие 7 недель — товарная рыба — последующие 7 недель.
Обе генерации личинок, полученных от генетически неродственных самок, содержались в разных бассейнах объемом 3,8 м3, каждая была представлена 500 особями. Бассейновое разведение традиционно для африканского клариевого сома [167-168].
Проводили ежедневный контроль гидрохимических показателей (водородный показатель, содержание кислорода, аммонийный азот, нитраты, нитриты), превышения допустимых нормативов по этим показателям не наблюдалось. В бассейнах поддерживали оптимальную температуру воды — 26ºС.
На начальных этапах онтогенеза (со второго дня после вылупления) личинки сомов получали стартовые живые корма собственного производства — науплии Artemia salina [169-170]. Начиная со второй недели онтогенеза, постепенно вводили в рацион сбалансированные заводские комбикорма фирмы Aquarex марки Сом с диаметром гранул в соответствии с возрастом.
На начальном этапе суточная норма кормов при выращивании клариевого сома ориентировочно составляла 5-6 % от массы рыбы, и зависела от их поедаемости. Кормление организовали каждые два часа 12 раз в сутки. Наблюдения и контрольные взвешивания проводили с личиночного возраста на электронных весах марки Bl-320H. Сортировку сомов на группы по размерно-весовым параметрам проводили в конце каждого из выше обозначенных периодов онтогенеза.
Средняя масса личинки на начальном этапе онтогенеза составляла в среднем 0,02 г. С самых ранних этапов онтогенеза в каждой генерации формировалась четкая иерархия взаимоотношений. Это выражалось в доминировании определенной группы быстрорастущих особей и сохранялось в течение всего периода выращивания. В процессе становления иерархии происходило выделение группы наиболее сильных и жизнеспособных особей, что обеспечивало им преимущество в конкуренции за пищевые ресурсы, а также в ходе отбора. Доминирующая группа проявляла агрессивное поведение по отношению к остальным особям популяции, создавая им условия хронического стресса.
В обеих генерациях четко прослеживалось деление по скорости роста. Доля особей со стремительным ростом, превосходящим среднюю по популяции в 3-4 раза, составляла около 5%. Высокую скорость роста, превосходящую среднюю по популяции в два раза, демонстрировали около 25 % особей. Основная часть выборки — около 50% — характеризовалась средней скоростью роста. Остальные 20% популяции в разной степени отставали по скорости роста от средней. Доминирующая группа особей в несколько раз превосходила по скорости роста остальную часть выборки.
Для снижения внутрипопуляционного напряжения на всех этапах выращивания обеих генераций мы проводили комплекс профилактических мероприятий. В первую очередь это касалось сортировки по весу, которая проводилась раз в две недели. Отстающую в росте часть популяции отсаживали отдельно, чтобы снизить уровень каннибализма и конкуренцию за пищевые ресурсы. Сортировка давала эффект, но внутри вновь сформированных групп уже через две недели устанавливалась та же иерархия отношений с выделением доминантной группы особей, которая характеризовалась опережающим ростом.
Сортировка является обязательным технологическим мероприятием, повышающим эффективность выращивания при разведении африканских клариевых сомов и снижающим уровень каннибализма, традиционного для представителей этого вида [171]. Для снижения внутрипопуляционного напряжения и каннибализма использовали адаптоген — трекрезан. По нашим наблюдениям использование адаптогена в кормах и в среде обитания снизило агрессивное поведение доминантных особей, устранило каннибализм и стабилизировало рост и развитие рыбы.
Контрольные взвешивания экспериментального поголовья проводили каждые две недели.
При контрольном взвешивании двухнедельных личинок первой самки их вес составлял 0,3-0.9 г. Доминировали по скорости роста в среднем 5% личинок, они имели массу 0,7-0,9 г, 30% личинок имели массу тела 0,5-0,6 г. и характеризовались высокой скоростью роста. Основная часть популяции — 65% личинок сомов имели массу тела 0,2-0,3 г. Наиболее мелкие особи подвергались нападению со стороны доминирующих рыб. Ко времени завершения первого периода развития (3-х недельный возраст) масса личинок, полученных от первой самки, достигала 1,7±0,49 г. Размах веса составлял 1,30-2,55 г.
Личинки, репродуцированные второй самкой, уже с первых дней жизни проявили достоверно более низкую скорость роста. В возрасте 3-х недель их масса составляла 0,68±0,17 г. Вес личинок варьировал в пределах 0,33 — 1,03 г.
Таким образом, потомство, полученное от самки нидерландской популяции, весило к концу личиночного периода в 2,5 раза больше (рисунок 69), чем потомство краснодарской самки. За личиночный период онтогенеза вес у потомков самки нидерландской популяции возрос в среднем в 85 раз, а потомков польской популяции в 34 раза.
Следующая стадия развития — стадия мальков у сомов продолжается около шести недель (40 суток). К десятинедельному возрасту мальки нидерландской генерации весили 45,5±10,62 г. Их вес варьировал в пределах 21,7 — 65,3 г. Генерация мальков польского происхождения отставала по скорости роста в 2,2 раза (p≤0,05), и весила в возрасте 10 недель – 20,7±6,8 г.
Рисунок 69 — Скорость роста личинок генетически разнородных самок на ранних этапах онтогенеза
Вес мальков в возрасте 10 недель колебался в пределах 12,2 — 37,2 г. В период малькового этапа онтогенеза масса рыб возросла в среднем в 26,7 раз (p≤0,05) в потомстве самки нидерландской популяции и в 30,44 раза в потомстве самки польской популяции, результаты представлены на рисунке 70.
Продолжительность этапа выращивания молоди сомов продолжается условно 7 недель или 50 суток. Завершается этот период, когда сомы достигали 17-недельного возраста. Общая тенденция опережающего роста нидерландской генерации четко прослеживалась и при выращивании молоди. Контрольные взвешивания молоди показали, что в возрасте 17-недель средний вес особи составлял 269,3±81.01 г. Размах изменчивости признака был высоким от 99,7 до 315 г. Вес молоди польской генерации в тот же возрастной период был в 1,7 раза ниже и составлял 104,5±22,01 г (p≤0,05). Вариабельность веса молоди от второй самки в возрасте 17 недель колебалась от 61,7 до 169 г.
Рисунок 70 — Скорость роста мальков генетически разнородных самок на 6-10 неделях выращивания
На этапе выращивания молоди, вес мальков Нидерландской генерации возрос в среднем в 5,92 раза, а вес мальков польской генерации — в 5,05 раза (p≤0,05). Результаты представлены на рисунке 71.
Рисунок 71 — Скорость роста молоди генетически разнородных самок на 12-17 неделях выращивания
После завершения выращивания молоди наступает этап выращивания товарной рыбы. И хоть такое деление на этапы условно, им удобно пользоваться в целях сравнения собственных результатов с результатами других исследователей. Выращивание товарной рыбы условно составляет 7-8 недель. При соблюдении технологии и поддержании оптимальных температурных и гидрохимических режимов в этот период сомы набирают массу 0,9-1,5 кг.
В возрасте 23 недель особи нидерландской генерации набрали массу 0,986±1,635 кг. При этом минимальный вес рыбы в этот период составлял 740 г, а максимальный 1210 г. За период выращивания товарной рыбы вес сомов возрос в среднем в 3,66 раза (p≤0,05). Таким образом, в возрасте 23 недель сомы нидерландской генерации нарастили необходимую товарную массу. За полный цикл выращивания от личинки до товарной рыбы их масса возросла в среднем в 2000 раз.
Выращивание товарной рыбы польской генерации до массы 1 кг и более было растянуто во времени. В плановые сроки в возрасте 23 недель масса сомов польской генерации составляла 601,3±105,3 г, что на 300-400 г ниже показателей нидерландской генерации. За период товарного выращивания средний вес особей польской генерации возрос в 5.75 раза. Особи польской генерации достигли килограммовых показателей на три недели позже установленных сроков, т.е. в возрасте 26 недель. В эти сроки потомство самки польского происхождения набрало массу 933±299,8 г. В конечном итоге за 6 месяцев выращивания в возрасте 23 недель разница в весе потомства генетически разнородных самок составила 39%. В разные периоды онтогенеза она колебалась от 17,5% до 61,2% (рисунок 72).
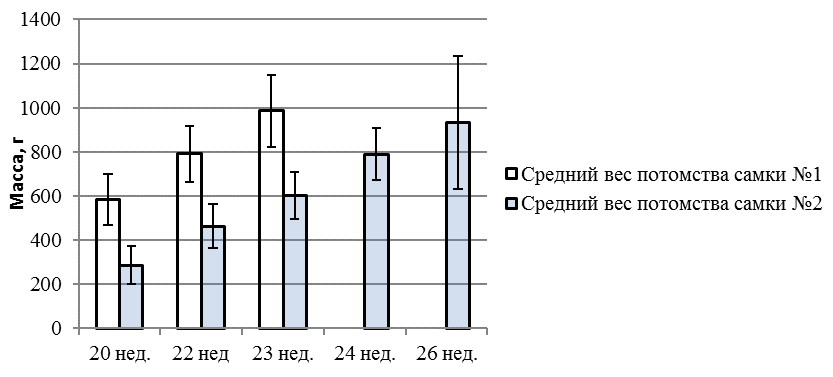
Рисунок 72 — Скорость роста потомства генетически разнородных самок на этапе доращивания — 20-26 недель
Полученные нами результаты показывают, что скорость роста генерации из Нидерландов достоверно выше скорости роста генерации из Польши. В обеих популяциях внутригрупповая изменчивость по весовым показателям в разные периоды роста существенно различалась. В частности, наиболее высокий уровень внутрипопуляционной изменчивости прослеживался на 3 неделе роста, что соответствовало завершающему этапу личиночного онтогенеза, а также на 10 (завершающей) неделе малькового этапа выращивания. Самая высокая вариабельность веса была отмечена на стадии выращивания молоди. Полученные результаты свидетельствовали в пользу эффективности селекционного отбора по этому признаку. Менее выражена была вариабельность веса на стадии выращивания товарной рыбы.
Выборочные вскрытия экспериментального поголовья обеих генераций показали, что более быстрые показатели роста тормозят генеративный обмен, конкурируя с показателями развития их репродуктивной системы. Самая высокая скорость роста была свойственна самкам и самцам, у которых репродуктивная система была слабо развита или запаздывала в своем развитии. Большие объемы исследуемых выборок позволяют нам сделать вывод, что показатели роста у африканского клариевого сома генетически детерминированы и определяются материнским генотипом. Прогнозировать эффективность и продолжительность периода выращивания товарной рыбы можно уже с самых ранних этапов постнатального онтогенеза, равно как и делать заключение о племенной ценности самок по скорости роста их потомства. Результаты исследований показывают, что генетический потенциал скорости роста африканского клариевого сома в высокотехнологичной индустриальной аквакультуре в настоящее время до конца не раскрыт.
2.9 Технология всесезонного получения икры клариевого сома
Количество икры, которое можно сцедить у самок африканского сома за один раз составляет в среднем 15 — 20% от массы тела. Поскольку африканский клариевый сом обладает многопорционным нерестом, икру от одних и тех же самок сома можно получать в сезон нереста не один раз, а многократно. Согласно литературным данным при выращивании в оптимальном температурном режиме у клариевого сома утрачивается сезонность размножения, и производители могут быть готовы к нересту круглый год. Но по результатам наших исследований гормональный фон самок во все сезоны не стабилен, что отражается на подготовке самки к нересту. В связи с этим была разработана технология круглогодичного получения икры клариевого сома, вне зависимости от сезона нереста. В основе технологиизаложен календарь эксплуатации самок (таблица 24).
На протяжении периода с мая по сентябрь предварительная подготовка самок клариевого сома осуществляется в течение 3 суток, иньецирование самок проводится однократно препаратом Сурфагон в дозе 5 мкг/кг (1мл) в сочетании с эглонилом 10 мг/кг (0,2 мл), температурный режим в этот период 28-290С.
Таблица 24 — Календарь эксплуатации самок при круглогодичном получении икры
| Сезоны года | Месяцы года | Условия преднерестовой подготовки | Кратность иньецирова-ния | Схема иньецирования | Темпера-турный режим | Время созре-вания самок | Работа с самками не ответившими на стимуляцию |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Лето | Июнь
Июль Август |
За трое суток до иньекции отсадить в отдельную емкость, медленнно поднять температуру до 290 С, не кормить до отдачи икры | Однократно | Сурфагон в дозе 5-7 мкг/кг (1мл) в сочетании с эглонилом 10мг/кг (0,2 мл) | 28-29°С | 10- 11ч. | доколоть ацетонированным гипофизом клариаса в дозе 1 гипофиз на самку, температура 29°С, смотреть через 4-5ч. |
| Осень | Сентябрь | За трое суток до иньекции отсадить в отдельную емкость, не кормить до отдачи икры | Однократно | Сурфагон в дозе 5-7 мкг/кг (1мл) в сочетании с эглонилом 10мг/кг (0,2 мл) | 28-29°С | 11- 12ч. | доколоть ацетонированным гипофизом клариаса в дозе 1 гипофиз на самку, повысить температуру до 29°С, смотреть через 5-6ч. |
| Октябрь | За неделю до иньекции отсадить в отдельную емкость,медленнно повысить температуру на 2 градуса, задавать корм обогащенный витаминами и адаптогеном «Иркутин» добавление в воду (1-5 мг/л), за 2 суток до иньекции отменить кормление | Однократно | Сурфагон в дозе 5-7 мкг/кг (1мл) в сочетании с эглонилом 10мг/кг (0,2 мл) | 28-29°С | 11- 12ч. | доколоть ацетонированным гипофизом клариаса в дозе 1 гипофиз на самку, температура 29°С, смотреть через 5-6ч. | |
| Ноябрь | За неделю до иньекции отсадить в отдельную емкость, медленнно поднять темпера-туру на 2 градуса, задавать корм обогащенный витаминами и адаптогеном «Иркутин» добавление в воду (1-5 мг/л), за 2-3 суток до иньекции отменить кормление до отдачи икры | Двукратно | Предварительная иньекция:
препарат «Нерестин – 7А» в дозе 0,5 мл/кг Разрешающая иньекция: через 12 часов Сурфагон в дозе 5-7 мкг/кг (1мл) в сочетании с эглонилом 10мг/кг (0,2 мл) |
28-29°С | После разрешающей иньекции11- 12ч | доколоть ацетонированным гипофизом клариаса в дозе 1 гипофиз на самку, температура 29°С, смотреть через 5-6ч. |
Продолжение таблицы 24
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Зима | Декабрь | За 2 недели до иньекции отсадить в отдельную емкость, повысить температуру на 2-3 градуса, задавать корм обогащенный витаминами и адаптогеном «Иркутин» -добавление в воду 1-5 мг/л, за 2-3 суток до иньекции отменить кормление, которое возобновить только после получения икры. | Двукратно | Предварительная иньекция: препарат «Нерестин – 7А» в дозе 0,5 мл/кг
Разрешающая иньекция:через 12 часов Сурфагон в дозе 5-7 мкг/кг (1мл) в сочетании с эглонилом 10мг/кг (0,2 мл) |
28-29°С | После разрешающей иньекции12- 14ч | доколоть ацетонированным гипофизом клариаса в дозе 1 гипофиз на самку, температура 29°С, смотреть через 5-6ч. |
| Январь | Проводить иньецирование самок не рекомендуется,
задавать корм обогащенный витаминами и адаптогеном «Иркутин». |
— | — | — | — | — | |
| Февраль | Проводить иньецирование самок не рекомендуется, задавать корм обогащенный витаминами и адаптогеном «Иркутин» . | — | — | — | — | — |
Продолжение таблицы 24
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Весна | Март | За 2 недели до иньекции отсадить в отдельную емкость,медленнно повысить температуру с 260С до 28-290С, задавать корм обогащенный витаминами и адаптогеном «Иркутин», за 2 суток до иньекции прекратить кормление | Двукратно | Предварительная иньекция: Инъецирование самок проводится двукрат-но; первая иньекция препаратом «Нерестин – 7А» в дозе 0,5 мл/кг. Через 11 часов, стимуляция сурфа-гоном в дозе 5-7 мкг/кг (1-1,2мл) в сочетании с эглонилом 10мг/кг (0,2 мл), осмотр самки проводят через 11-12 ч.; температура 28-29°С. | 28-29°С | После разрешающей иньекции11- 12ч | доколоть ацетонированным гипофизом клариаса в дозе 1 гипофиз на самку, температура 29°С, смотреть через 5-6ч. |
| Апрель | За неделю до иньекции отсадить в отдельную емкость, медленно повысить температуру на 2 градуса, задавать корм обогащенный витаминами и адаптогеном «Иркутин», за 2 суток до иньекции прекратить кормить. | Двукратно | Предварительная иньекция: препарат «Нерестин – 7»в дозе 0,5 мл/кг
Разрешающая иньекция: через 12 часов суспензтей гипофиза в дозе 1 гипофиз на 1 кг. веса самки, повысить температуру до 29°С |
28-29°С | После разрешаю-щей иньекции11- 12ч | доколоть Сурфагоном в дозе 5 мкг/кг (1мл) в сочетании с эглонилом 10мг/кг (0,2 мл), осмотр самки через 6-7ч. | |
| Май | За трое суток до иньекции отсадить в отдельную емкость,медленно поднять температуру до 28-290С за 2 суток не кормить до получения икры | Однократно | Сурфагон в дозе 5-7 мкг/кг (1мл) в сочетании с эглонилом 10мг/кг (0,2 мл) | 28-29°С | 11- 12ч. | доколоть ацетонированным гипофизом в дозе 1 гипофиз на самку, температура 29°С, смотреть через 5-6ч. |
В случае, если самки не демонстрируют признаков созревания по этой схеме гормональной стимуляции, дополнительно используют ацетонированный гипофиз клариаса из расчета 1 гипофиз на особь, температуру стабилизируют на уровне 290С, контрольный осмотр проводят через 4-5ч.
В октябре перед инъецированием самок проводят предварительную подготовку, за неделю до иньекции их отсаживают в отдельную емкость, медленно повышают температуру на 2-3 градуса до 28-290С, задают корм, обогащенный витаминами и адаптогеном трекрезаном («иркутин»).
За 2-3 суток до гормональной иньекции кормление прекращают. Инъецирование самок проводится однократно препаратом сурфагон в дозе 5 мкг/кг (1мл) в сочетании с эглонилом 10мг/кг (0,2 мл), температурный режим стабилизируют на уровне 28-29°С.
В ноябре и декабре предварительная подготовка занимает 1 и 2 недели соответственно, самок отсаживают в отдельную емкость, повышают температуру на 2 градуса, корм задается обогащенный витаминами, пробиотиками и адаптогеном «Иркутин». Инъецирование самок проводится двукратно: предварительная иньекция препаратом «Нерестин – 7А» (рис.1) в дозе 0,5 мл/кг и через 12 часов разрешающая сурфагоном в дозе 5 мкг/кг (1мл) в сочетании с эглонилом 10мг/кг (0,2 мл). Самок, не ответивших на гормональную стимуляцию, докалывают ацетонированным гипофизом клариаса в дозе 1 гипофиз на самку, температуру повышают до 290С, контрольный осмотр проводят через 5-6 ч.
В январе и феврале проводить гормональную стимуляцию самок клариевого сома с целью получения икры из-за резкого снижения уровня половых гормонов не рекомендуется. Проводят подготовку самок к весеннему нересту, задавая корма обогащенные витаминами и адаптогеном «Иркутин».
Рисунок 73 — Препарат «Нерестин -7а», г.Пущино, РФ
Наиболее сильным гормональным стимулятором оогенеза является гипофиз. Его выделяют из свежей рыбы и используют в тех случаях, когда икру необходимо получить вне сезона нереста, а стимуляция сурфогоном или нерестином, а в ряде случаев и сразу двумя этими препаратами, — не дала результатов.
Процедура извлечения гипофиза из черепной коробки поэтапно приведена в заключительной части подраздела. Гипофизы целесообразно заготавливать в нерестовый период, отмывать в ацетоне, высушивать и хранить ацетонированные гипофизы в холодильнике в замороженном состоянии.
На протяжении периода с мая по сентябрь предварительной подготовки самок клариевого сом, если они содержались при температуре не ниже 260С, как правило, не требуется, гормональную стимуляцию самок проводят однократно препаратом сурфагоном в дозе 5-7 мкг/кг (1мл) в сочетании с эглонилом 10мг/кг (0,2 мл), температуру воды медленно поднимают до 28-290С.
В редких случаях, из-за индивидуальных особенностей самок, если они не подают признаков созревания, их стимулируют ацетонированным гипофизом из расчета 1 гипофиз на самку при температуре 28-29°С, контрольный осмотр проводят через 4-6ч.
В октябре перед гормональной стимуляцией самок проводят предварительную подготовку. За неделю до иньекции отсаживают самок, которых содержали при температуре 260С в отдельную емкость, медленнно поднимают температуру на 2 градуса, задают корма, обогащенные витаминами и адаптогеном «Иркутин». Адаптоген «Иркутин» — высокоэффективное средство с широким спектром адаптогенного и терапевтического действия. Препарат обладает выраженным иммуностимулирующим, противотоксичным, анаболическим действием, повышает устойчивость к заболеваниям, стимулирует факторы естественного иммунитета. За сутки-двое до иньекции кормление прекращают. Инъецирование самок проводится однократно препаратом сурфагоном в дозе 5-7 мкг/кг (1мл) в сочетании с эглонилом 10мг/кг (0,2 мл), температурный режим поднимают до 280С.
В ноябре и декабре предварительная подготовка занимает 1 и 2 недели соответственно, самок отсаживают в отдельную емкость, поднимают температуру на 20С, задают корм, обогащенный витаминами и адаптогеном «Иркутин». Инъецирование самок проводится двукратно: предварительная иньекция препаратом «Нерестин – 7» в дозе 0,5 мл/кг и через 12 часов разрешающая сурфагоном в дозе 5-7 мкг/кг (1мл) в сочетании с эглонилом 10мг/кг (0,2 мл). Самок, не ответивших на гормональную стимуляцию докалывают ацетонированным гипофизом в дозе 1 гипофиз на самку, температуру повышают до 290С, контрольный осмотр проводят через 5-6ч.
В январе и феврале проводить гормональную стимуляцию самок клариевого сома с целью получения икры не рекомендуется. Однако при увеличении дозы гипофарных инъекций ряд самок отвечает созреванием икры. В этот период, в основном, проводят подготовку самок к весеннему нересту, задавая корма обогащенные витаминами, пробиотиками и адаптогеном трекрезаном («Иркутин»).
Предварительная подготовка в марте и апреле проходит при повышении температуры на 2-3 градуса. Уровень половых гормонов в крови самок в зимний период снижен в 4 раза, с началом весны он постепенно нарастает. Температуру постепенно поднимают до 290С.
Инъецирование самок проводится двукратно, предварительная иньекция препаратом «Нерестин – 7А» в дозе 0,5 мл/кг. Через 11 часов самок, стимулируют сурфагоном в дозе 5-7 мкг/кг (1-1,2мл) в сочетании с эглонилом 10мг/кг (0,2 мл), осмотр самок проводят через 11ч. Для самок, не ответивших на стимуляцию сурфагоном, дополнительно используется инъекция гипофиза в дозе 1 гипофиз на 1-1.5 кг веса самки.
Препараты нерестин 7А, сурфагон, и суспензия гипофиза воздействуют на разные звенья репродуктивной системы, поэтому их комплексное использование дает хороший эффект даже в самых сложных случаях, гарантированно обеспечивая получение икры. Однако гипофиз и нерестин — это дорогостояшие препараты. Для получения 1 гипофиза необходимо пожертвовать жизнью одной рыбы. Доза нерестина стоит на порядок дороже сурфагона. Нерести игипофиз используются только в коайних случаях. Наиболее экономичный вариант — это сурфагон с эглонилом.
— Заготовка гипофизов
Процессы созревания регулируются гормонами гипофиза, щитовидной железы и гонад под общим контролем гипофиза. Гипофиз — нижний мозговой придаток, имеющий вид маленькой луковички, сидящей на нижней поверхности мозга позади скрещения зрительных нервов.
Нецелесообразно получать гипофизы от неполовозрелых (или, наоборот, слишком старых) рыб; не подходят и только что отнерестившиеся или больные рыбы. Оптимальным периодом для заготовки гипофиза является период естественного нереста. Поэтому гипофизы африканского клариевого сома в наших широтах лучше всего заготавливать с мая по сентябрь.
Для заготовки гипофизов используют живую рыбу. Но могут быть с успехом использованы гипофизы от свежезамороженной рыбы. Перед заготовкой гипофизов у живого клариевого сома отрезают черепную коробку и оставляют на 30 минут для обескровливания.
Последовательность пошаговых действий по извлечению гипофиза у клариевого сома представлена на рисунке 74.
Голова клариевого сома рассекается на две части вдоль ротовой полости, для работы понадобиться верхняя часть черепной коробки. У клариевого сома гипофиз расположен в костном углублении и закрыт плотной соединительной пленкой. Эту пленку нужно удалить вместе с наджаберным органом, характерным для данного вида рыб. Далее удаляют костную перегородку и затем извлекают гипофиз. Гипофиз извлекают осторожно, чтобы не нарушить его целостности.
Извлеченный гипофиз освобождают от покрывающей соединительной пленки, осторожно подхватывают снизу и погружают в химически чистый ацетон. Ацетон должен полностью покрывать гипофизы. В этой предварительной порции ацетона гипофизы выдерживают для обезжиривания около 1 ч. Затем ацетон сливают, а гипофизы помещают в склянку, в которой объем ацетона должен минимум в 10 раз превышать объем помещенных гипофизов. Эту порцию ацетона называют первой. При этом применяют свежий, ранее не использованный, химически чистый, безводный ацетон. Через 12 ч первую порцию ацетона вновь сливают и заменяют новой порцией чистого ацетона. Во второй порции ацетона гипофизы выдерживают 6-8 ч, затем извлекают и раскладывают на фильтровальную бумагу для обсыхания.
Сушат препараты, при комнатной температуре не допуская попадания прямых солнечных лучей. Ни в коем случае нельзя подогревать гипофизы, так как при этом разрушается гонадотропный гормон.
Высушенные гипофизы укладывают в сухие, герметически закрывающиеся пробирки с указанием даты сбора. Хранят гипофизы в морозильной камере. После использования части гипофизов, пробирки с оставшимися гипофизами вновь герметично закрывают. Открывать пробирки с гипофизами можно только в сухих помещениях. Нельзя открывать пробирки с гипофизами во влажных помещениях, напитавшись влагой гипофиз может испортиться.
Хранить гипофизы свыше двух лет не желательно. При проведении гипофизарных инъекций доза вводимого препарата, количество инъекций и продолжительность созревания самок во многом зависят от температуры воды и степени их зрелости.
 |
 |
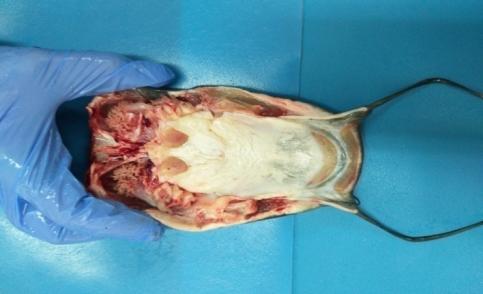 |
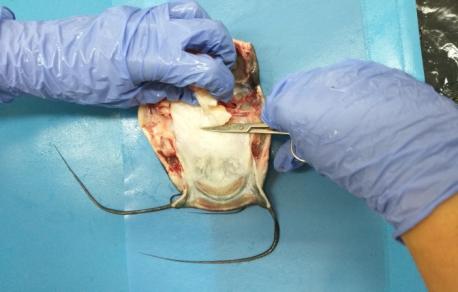 |
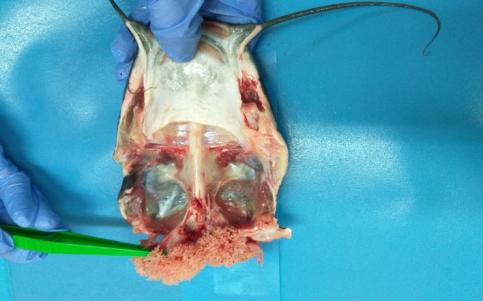 |
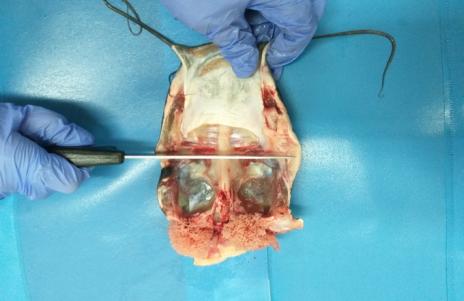 |
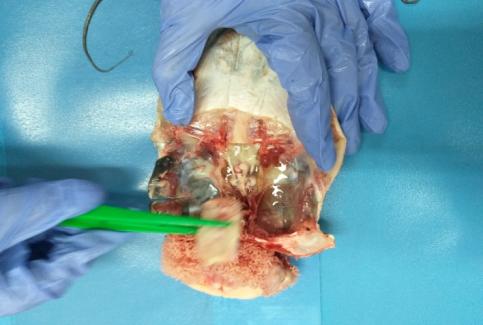 |
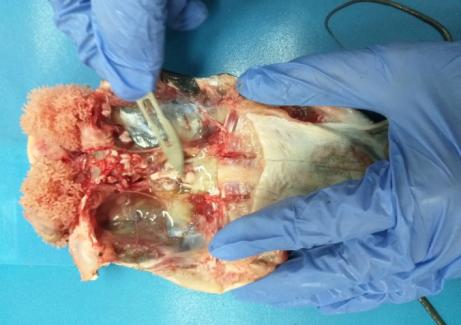 |
Рисунок 74 — Пошаговые фотографии извлечения гипофиза клариевого сома
— Приготовление гипофизарных суспензий из свежеполученных и ацетонированных гипофизов
Свежеполученные гипофизы сначала помещают в стерильную фарфоровую ступку и тщательно растирают пестиком до гомогенного состояния, а затем разбавляют стерильным 0,6-0,9% раствором хлористого натрия.
Ацетонированные гипофизы также растирают в стерильной ступке до порошкообразного состояния. Затем шприцом добавляют 0,5 мл солевого раствора (6,5 г химически чистого хлористого натрия на 1 л дистиллированной воды) и продолжают растирать гипофизы до получения однородной массы, после чего добавляют в ступку солевой раствор до расчетного объема, как правило, до 1.0-1.5 мл. Необходимые материалы для приготовления гипофизных суспензий представлены на рисунке 75.
Рисунок 75 — Необходимые материалы для приготовления гипофизарной суспензии
Количество вводимой рыбе суспензии зависит от дозы ацетонированного гипофиза, поэтому, обычно один гипофиз для приготовления суспензиии разбавляют 1,0 мл раствора. Этого количества обычно достаточно для стимуляции одной самки, если она по весу не превышает 2 кг. Для крупной рыбы дозу гипофиза необходимо увеличивать.
2.10 Содержание жирных кислот и аминокислот в мясе и икре в нерестовый период
Мясо рыбы по пищевой и биологической ценности является одним из наиболее востребованных продуктов питания. Это обусловлено тем, что оно содержит значительное количество биологически активных веществ: полиненасыщенных жирных кислот, незаменимых аминокислот, ферментов, витаминов [173].
В большинстве своем мясо рыбы является естественным источником ненасыщенных жирных кислот, что делает его весьма ценной составляющей противосклеротической диеты. Знание химического состава рыб необходимо в целях рационального использования рыбных ресурсов в пищевых, лечебных и других целях.
В сравнительном аспекте по химическому составу мясо рыбы характеризуется значительными отличиями от мяса продуктивных животных. Пищевая ценность мяса рыб определяется видовыми характеристиками, образом жизни (пелагические, донные, проходные, полупроходные), средой обитания (морские, пресноводные), особенностями метаболизма, полом, возрастом, физиологическим состоянием рыбы и другими факторами [174, 175].
Химический состав мяса рыб обусловлен особенностями их годового цикла, который в зависимости от видовой принадлежности и условий разведения подразделяют на определенные периоды (преднерестовый нагул, нерест, посленерестовый нагул).
Таким образом, необходимо отметить, что в различные периоды жизненного цикла химический состав мышечной ткани рыб подвержен значительным колебаниям. Иногда эти изменения могут быть весьма значительными. В связи с этим, по мнению ряда авторов, отмечается изменение пищевой ценности рыбы [173, 176]. Поэтому важно знать периоды наиболее высокой пищевой ценности при выращивании товарной рыбы в УЗВ. Именно в эти периоды необходимо завершать цикл выращивания и переходить к реализации живой рыбы потребителю. Поскольку мы ориентированы на сочетание процессов получения икры при выращивании товарной рыбы, важно знать, как икорное производство сказывается на пищевой ценности рыбы.
Наиболее постоянной величиной является суммарное содержание влаги и жира в мясе рыб различных видов.
Белок мяса рыбы включает в себя все незаменимые аминокислоты, этим определяется особая ценность рыбы, как одного из наиболее высококачественных источников белкового питания.
Одним из наиболее важных компонентов питательности и энергетической ценности рыбы является жир. Согласно литературным данным, этот показатель варьирует в достаточно широких пределах по сравнению с другими составляющими. Например, если содержание сырого протеина в филе рыб разных видов изменяется в пределах 6…28%, то содержание сырого жира имеет более широкий диапазон колебания между предельными величинами: от 0,1 до 67%.
Такая вариабельность может быть обусловлена различными факторами: видовыми различиями рыб, обеспеченностью кормовыми ресурсами, особенностями обмена веществ, полом, возрастом, физиологическим состоянием и другими причинами.
При этом, зачастую одноименные рыбы, выловленные в разных акваториях, имеют разную жирность, обусловленную как особенностями кормообеспечения, так и абиотическими факторами среды, например, температурой воды. Научно доказано, что чем ниже ее температура, тем больше содержание жира в мышечной ткани рыбы.
С увеличением размера и возраста рыбы количество жира в ней также увеличивается.
Преднерестовый период в большинстве своем характеризуется резким снижением жира в мышечной ткани рыб. Это обусловлено тем, что большая его часть накапливается в половых продуктах, главным образом, в икре. Причем, у самцов содержание жира подвержено меньшим колебаниям, чем у самок, так как в гонадах самцов его гораздо меньше.
В зависимости от содержания жира в мышцах рыб их условно подразделяют на четыре группы:
— нежирные (тощие) – до 2% жира (тресковые, окуневые, щука, горбылевые, зубатка синяя и многие другие океанические рыбы);
— среднежирные – от 2 до 6% жира (зубатка полосатая, зубатка пятнистая, многие карповые, некоторые лососевые, большинство камбаловых, сом и др.);
— жирные – от 6 до 20% жира (большинство осетровых, европейские и дальневосточные лососевые, а также другие);
— очень жирные – более 20% жира (угорь, минога, шемая, рыбец азовский, хамса, крупные сельди и др.) [177, 178].
Наряду с этим прослеживается следующая закономерность: чем жирнее рыба, тем меньше в ее тканях воды.
Объектом данного раздела исследований являлись самки африканского клариевого сома. Для анализа нами было отобрано по 10 проб икры и мяса.
Анализ химического состава мяса и икры рыбы проводили в соответствии с ГОСТ 7636-85. Содержание влаги исследовали методом испарения. Количество белка определяли методом Кьельдаля, определение золы проводилось путем сжигания в фарфоровом тигле. Содержание жира определяли в аппарате Сокслета. Фракционный состав липидов определяли методом хроматографии в тонком слое силикагеля. Массовая доля аминокислот определялась методом капиллярного электрофореза на системе «Капель 105М» в соответствии с адаптированной методикой.
Было установлено, что содержание жира в мясе африканского сома составляет 6,1%, поэтому этот вид можно отнести к жирным сортам рыб.
Исследования содержания жира мы проводили в нерестовый период. Известно, что за период нереста рыба теряет до 30 % всех питательных веществ. Метаболизм в этот период переключается на репродукцию. Пищевая полноценность после нереста восстанавливается у различных видов рыб в разные сроки. В среднем на это необходимо от 20 до 60 суток. Содержание жира в икре африканского клариевого сома в период нереста составляло 16,58 + 0,31% (рисунок 76).
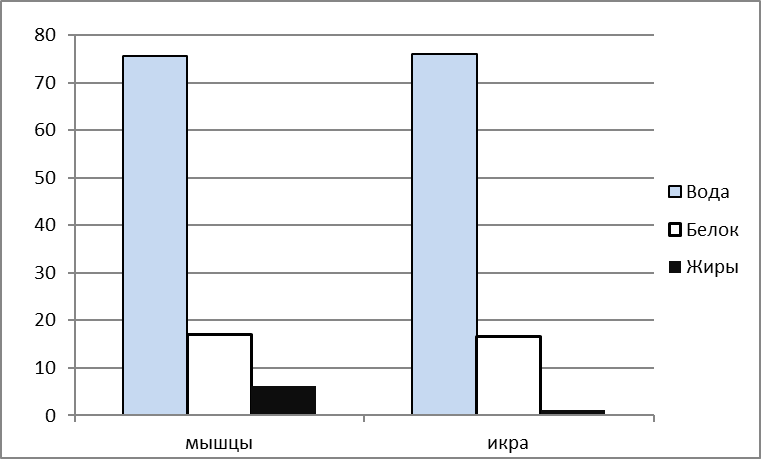
Рисунок 76 — Химический состав мяса и икры самок клариевого сома в период нереста
Необходимо отметить, что липидам гидробионтов присущи специфические особенности, что кардинально отличает их от липидов растений и животных. Липиды рыб характеризуются преобладанием в них лабильных высоконенасыщенных жирных кислот.
Результаты анализа жирнокислотного состава мышц и икры самок африканского клариевого сома показали, что во всех образцах зарегистрировано высокое содержание линолевой кислоты, которая относится к незаменимым жирным кислотам.
Мышцы африканского клариаса содержат 23,3%, а икра 15,2% линолевой кислоты. Необходимо отметить, что содержание линолевой кислоты в икре африканского клариевого сома превышает аналогичный показатель икры и мышечной ткани горбуши. В икре горбуши содержится 2,3% линолевой кислоты. Это в семь раз меньше, чем в икре клариевого сома (рисунок 77).
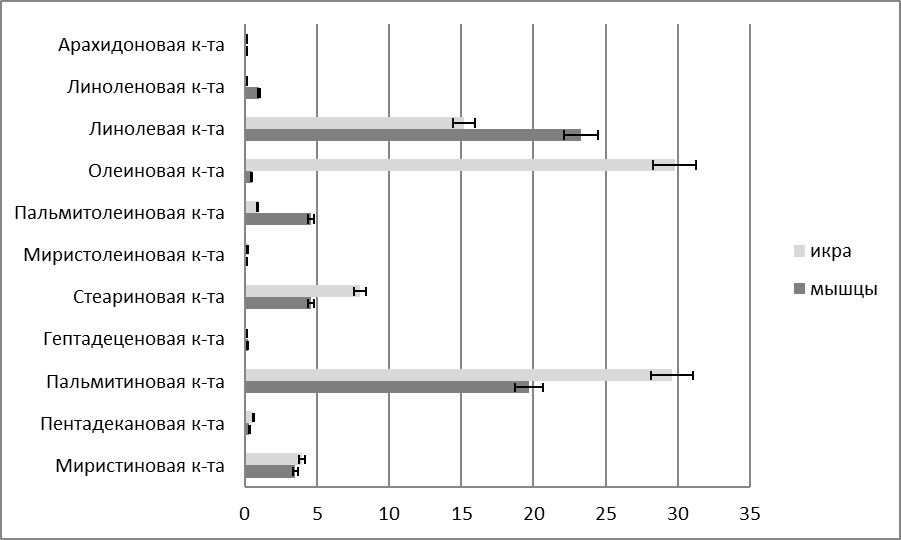
Рисунок 77- Содержание жирных кислот в мясе и икре африканского клариевого сома
В икре африканского клариевого сома содержится значительное количество олеиновой кислоты — 29,8%. Для сравнения в икре горбуши (красной икре) эта кислота содержится в количестве 21,7%, а в икре минтая – 15,03%.
Нами был проведен анализ сбалансированности жирно-кислотного состава икры и мяса африканского клариевого сома.
Согласно рекомендациям института питания РАМН, оптимальное соотношение омега-6 и омега-3 составляет (9…10:1).
Нами были получены следующие результаты. Соотношение омега-6 и омега-3 в икре африканского клариевого сома составило 50:1, в мышцах – 7:1 (рисунок 78).
Таким образом, икра африканского клариевого сома обладает сбалансированным жирно-кислотным составом. Использование ее в качестве функционального продукта питания позволит полностью удовлетворить потребность организма в полиненасыщенных жирных кислотах, профилактировать заболевания сердечно-сосудистой системы, тем самым, улучшить качество жизни населения.
Полученные нами результаты исследования химического состава мышц и икры африканского клариевого сома свидетельствуют о высокой пищевой ценности представителей этого вида рыб. Мышцы и икра клариевого сома содержат весь спектр аминокислот, в том числе в достаточном количестве незаменимые аминокислоты.
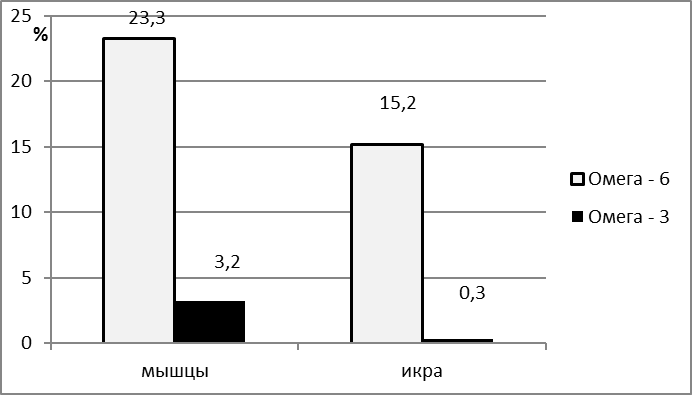
Рисунок 78 — Содержание омега-3 и омега-6 жирных кислот в мышцах и икре африканского сома
Исследования жирнокислотного состава мышц и икры также подтвердили высокую пищевую ценность африканского сома, позволяющего отнести его к продуктам функционального питания, снижающих риск сердечно-сосудистых заболеваний.
Линолевая кислота играет чрезвычайно важную роль в обеспечении физиологических процессов человека. Она не вырабатывается в организме, следовательно, ее источником для человека являются продукты питания. Чрезвычайная важность этой кислоты определяется в первую очередь тем, что она участвует в формировании фосфолипидов клеточных мембран [173].
Регулярное поступление линолевой кислоты в организм снижает риск сердечно-сосудистых заболеваний. Согласно исследованиям, проведенным Институтом питания РАМН, более 80% населения РФ испытывают недостаток в данной кислоте, что ведет к тромбозу коронарных сосудов. Исследования, проведенные в Японии, выявили, что повышенное потребление линолевой кислоты, относящейся к классу омега-3-полиненасыщенных жирных кислот, связано с уменьшением уровня маркеров воспаления, таких как C-реактивный белок [177-179].
Научно доказано, что линолевая кислота оказывает долгосрочное положительное влияние на профилактику сахарного диабета второго типа [180-182].
Олеиновая кислота может синтезироваться организмом в клетках печени, а может поступать в организм с продуктами питания. Она является одной из самых легко усвояемых организмом человека.
Олеиновая кислота выполняет две жизненно важные функции:
— энергетическую (выделяет энергию при распаде);
— пластическую (принимает участие в построении биологических мембран, из которых состоит скелет растительных и животных клеток).
Олеиновая кислота имеет еще одно название — «Омега-9». Биологическое значение этой кислоты для организма человека заключается в том, что ее потребление препятствует развитию атеросклеротических бляшек на стенки кровеносных сосудов. При этом, сводится к минимуму риск развития атеросклероза, инфаркта миокарда или инсульта. Олеиновая кислота оказывает влияние на регуляцию нервной, эндокринной и пищеварительной систем, поддерживает иммунитет и улучшает усвоение глюкозы, что снижает риск развития гипергликемии. По результатам исследований американских ученых, Омега-9 является одним из самых мощных средств в борьбе с раком молочной железы [177-179]. Недостаток олеиновой кислоты может вызвать развитие артроза и артрита.
На рисунке 79 представлены результаты исследования аминокислотного состава икры и мяса африканского клариевого сома.
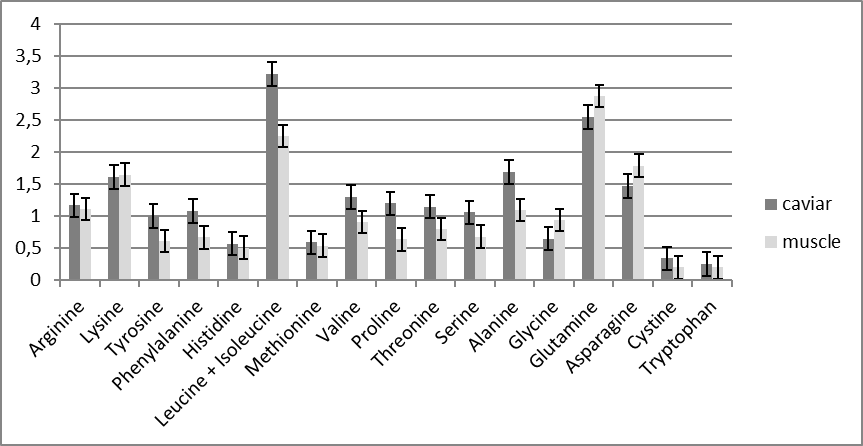
Рисунок 79 — Аминокислотный состав икры и мышечной ткани африканского клариевого сома в нерестовый период
В ходе анализа аминокислотного состава икры и мяса африканского клариевого сома нами получены следующие результаты: как икра, так и мышечная ткань африканского клариевого сома содержит все незаменимые аминокислоты.
В исследованных пробах икры и мяса африканского клариевого сома доминирующую позицию в количественном отношении занимали аминокислоты лейцин+изолейцин (3,22 и 22,5%) и глутамин (2,55 и 2,88%) соответственно.
Из незаменимых аминокислот в икре и мясе африканского сома меньше других представлен триптофан — 0,25 и 0,2% соответственно. Триптофан играет важную биологическую роль в организме человека. Он принимает участие в синтезе серотонина, являющегося одним из важнейших нейромедиаторов, что делает крайне необходимым его поступление в организм при депрессии, бессоннице.
Полученные нами результаты исследования химического состава мышц и икры африканского клариевого сома свидетельствуют о высокой пищевой ценности представителей этого вида рыб. Мышцы и икра клариевого сома содержат весь спектр аминокислот, в том числе в достаточном количестве незаменимые аминокислоты.
На основании проведенных исследований мы пришли к выводу, что в период нереста, когда превалирует генеративный обмен, пищевая ценности клариевого сома не снижается. Результаты наших исследований имеют важное значение для развития икорного производства африканского клариевого сома и дают ответ на вопрос, можно ли получать икру без ущерба для параллельного производства товарной рыбы.
Полученные нами результаты свидетельствуют, что использование самок африканского сома в качестве продуцентов икры-сырца не сказывается на качестве мяса производимой рыбы. Вполне понятно, что нерест видоизменяет обмен веществ, придавая ему специфические особенности. Однако пищевая ценность товарной рыбы в этот период остается высокой. Можно сделать заключение, что и в нерестовый период клариевый сом является продуктом питания функционального назначения по содержанию незаменимых жирных кислот и незаменимых аминокислот.
По содержанию жира в мышцах и икре африканского клариевого сома этот вид можно к жирным сортам рыб.
Мышцы африканского клариевого сома богаты полиненасыщенной линолевой жирной кислотой, а икра олеиновой (Омега-9) кислотой.
Икра африканского клариевого сома обладает сбалансированным жирно-кислотным составом, что позволяет использовать его в профилактических целях, для лечебного питания как продукт функционального назначения, обогащенный омега -9, омега- 6 и омега — 3 жирными кислотами.
Проведенные исследования показали, что по химическому составу мясо африканского клариевого сома относится к категории деликатесных продуктов, которые могут успешно использоваться в диетическом и детском питании.
2.11 Гистологическая характеристика кишечника африканского сома на фоне использования пробиотика «споротермин»
В индустриальной аквакультуре продукты метаболизма рыб постоянно поступают в среду обитания создавая высокий уровень органического загрязнения. Это способствует развитию условно-патогеннной и патогенной микробиоты, которая проникает через жабры в кровь рыб и инфицирует внутренние органы.
В настоящее время для оздоровления рыбы используют пробиотики, содержащие живую микробиоту. Использование пробиотиков направлено на профилактику и лечение заболеваний, связанных с коррекцией микроценоза кишечника рыб. Пробиотики увеличивают устойчивость организма рыб к патогенным микроорганизмам; улучшают работу пищеварительной системы за счет дополнительной выработки ферментов в желудочно-кишечном тракте [119, 183, 184]; регулируя микробиоценоз желудочно-кишечного тракта, способствуют усвоению питательных веществ, снижают кормозатраты за счет более эффективного усвоения кормов [162]. В целом пробиотики оказывают противоинфекционное, иммунномодулирющее воздействие на организм, препятствуя проникновению в организм патогенной микробиоты, обеспечивают защиту от негативных воздействий окружающей среды [185, 186]. Под действием пробиотиков происходит стимуляция моторики кишечника, улучшаются его экскреторные функции [187-189]. Штаммы бактерий, входящие в состав пробиотика, вступают во взаимосвязь с бактериями кишечника, способствуя выделению метаболитов, которые позитивно влияют на иммунитет, пищеварительную и гормональную системы [190, 191].
К числу пробиотиков последнего поколения относится «Споротермин», содержащий в своем составе споровые формы бактерий Bacillus subtilis и Bacillus licheniformis. Пробиотик «споротермин» оптимизирует обмен веществ рыб, снабжая биологически активными и строительными веществами, способствует качественному перевариванию пищи. «Споротермин» показал эффективность в отношении широкого спектра микроорганизмов, вызывающих инфекционные заболевания рыб [78, 162].
Использование пробиотика «споротермин» в составе комбикормов при выращивании клариевых сомов в условиях индустриальной аквакультуры позволяет снизить уровень условно-патогенной микрофлоры в органах и тканях рыб, избежать повышенной бакобсемененности рыб.
Целью данного этапа исследований являлось определение гистологических особенностей кишечника африканского клариевого сома (Clarias gariepinus) на фоне использования пробиотика «Споротермин» при выращивании в индустриальной аквакультуре.
Материалом для исследования послужили самки африканских клариевых сомов (Clarias gariepinus). Рыба содержалась в автономных рыбоводных модулях объемом 3м3. Температура воды во всех бассейнах поддерживалась на уровне 26ºС, содержание кислорода в воде было не ниже 4 мг/л. Рыбам экспериментальной группы задавался пробиотик «споротермин», который из расчета 4г на 1кг вводили в корма.
Забор материала проводили в 10% нейтральный забуференный формалин. Изготовление срезов проводили стандартным методом [192], препараты окрашивали гематоксилином Майера-эозином и покрывали монтирующей средой Sub-X Mounting medium (Leica, США). Анализ гистологической структуры, документирование проводили с помощью исследовательского моторизованного универсального микроскопа Axio Imager.M2 (Carl Zeiss, Германия) в комплекте: цветная цифровая камера AxioCam высокого разрешения HRc; программное обеспечение для анализа и обработки информации ZEN pro.
Для оценки гистологических особенностей кишечника самок африканского клариевого сома (Clarias gariepinus), выращенных с использованием пробиотика «Споротермин» (эксперимент) и без него (контроль), изготавливали гистопрепараты и производили их изучение.
Строение стенки кишечника африканского клариевого сома (Clarias gariepinus) у экспериментальных особей показало, что на препаратах определяется (рисунок 80) внутренняя слизистая оболочка (lamina propria mucosae), которая представлена рыхлой соединительной тканью с кровеносными сосудами капиллярного типа. Снаружи (рисунок 80) оболочка покрыта покровным эпителием – однорядным многослойным. В состав эпителия входят высокопризматические основные клетки – энтероциты (рисунок 81), железистые бакаловидные клетки (рисунок 81), а также базальные клетки (рисунок 81) относящиеся к камбиальному типу клеток, способные к активной пролиферации являясь источником высокодифференцированной популяции (дифферона) как основных, так и специализированных цитотипов ворсинки и крипты.
Четко выявляется мышечный слой (рисунок 80), разделяющий собственно слизистую оболочку и подслизистый слой. Подслизистый слой (tela submucosa) (рисунок 80) также представлен рыхлой неоформленной соединительной тканью с большим количеством кровеносных и лимфатических сосудов различного калибра.
Рисунок 80 — Строение стенки кишечника африканского клариевого сома (Clarias gariepinus). Эксперимент. Окраска – гематоксилин-эозин. Увеличение окуляр х10 объектив х10
Под подслизистой оболочкой лежат два мышечных слоя (tunica muscularis) – один слой располагается циркулярно (внутренний), другой наружный в котором гладкомышечные волокна лежат продольно (рисунок 80).
Снаружи стенка кишечника покрыта серозной оболочкой (tunica serosa) (рисунок 80).
Структурно-функциональная единица система «ворсинка-крипта», представлена ворсинками большой протяженностью, разветвленными и заполняющими большую часть просвета кишечника, большая часть ворсинок соединяется друг с другом. Соотношение «ворсинка-крипта» 1:6.
Вдоль всей протяженности ворсинки четко прослеживается полярность в расположении эпителиоцитов с различной степенью дифференцировки – у основания базальные (камбиальные) эпителиоциты, далее малодифференцированные, ближе к вершине ворсинки отмечаются высокодиффероенцированные энтероциты с центральным расположением ядра в цитоплазме на апикальной поверхности отмечается слой микроворсинок, среди энтероцитов высокопризматической морфологии отмечаются железистые клетки (слизистые, бакаловидные). На дне крипты расположены в небольшом количестве железистые клетки с гранулами в цитоплазме, а также призматической формы эпителиоциты. Также в пределах эпителиального пласта отмечаются редкие лимфоциты.
У контрольных особей африканского клариевого сома (Clarias gariepinus), которых выращивали без пробиотика, отмечается общая тенденция в изменении слизистой кишечника, которая проявляется в истончении ворсинок, уменьшении их протяженности и ветвления. Мало контактов между ворсинками. А также общим является деструкция строения самих ворсинок. В некоторых случаях истончается, а в других проявляется отек собственно слизистой. Проявляется отек мышечного слоя стенки кишечника и серозной оболочки (рисунки 82, 83, 85). Тем не менее, отмечаются участки на препарате или у отдельных особей с относительно сохранной структурой слизистой кишечника (рисунок 84).
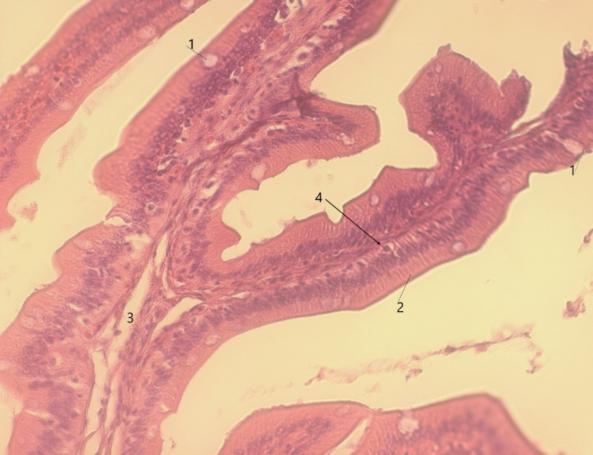
Рисунок 81 — Строение структурно-функциональной единицы стенки кишечника «ворсинка-крипта» африканского клариевого сома (Clarias gariepinus). Ветвление и соединение ворсинок, щеточная каемка. Эксперимент. Окраска – гематоксилин-эозин. Увеличение окуляр х10 объектив х63. 1 – бокаловидные железистые клетки; 2 – высокопризматические дифференцированные энтероциты; 3 – собственно слизистая оболочка; 4 – базальные (камбиальные клетки)
Проведенные нами исследования наглядно демонстрируют, что использование пробиотика «Споротермин» при выращивании африканского клариевого сома в условиях высокотехнологичной индустриальной аквакультуры демонстрирует неоспоримый позитивный эффект. В контрольной группе сомов, которая выращивалась без пробиотика, при гистологических исследованиях была выявлена множественная патология желудочно-кишечного тракта. Патологические изменения затронули мышечный слоя стенки кишечника, серозную оболочку, ворсинки.
Выявленные патологические изменения свидетельствуют, что состояние желудочно-кишечного тракта рыб в индустриальной аквакультуре, в которой не используют пробиотики, не позволяет осуществлять полноценное пищеварение и всасывание питательных веществ. Такая рыба медленно растет, медленно набирает вес и плохо потребляет пищу.
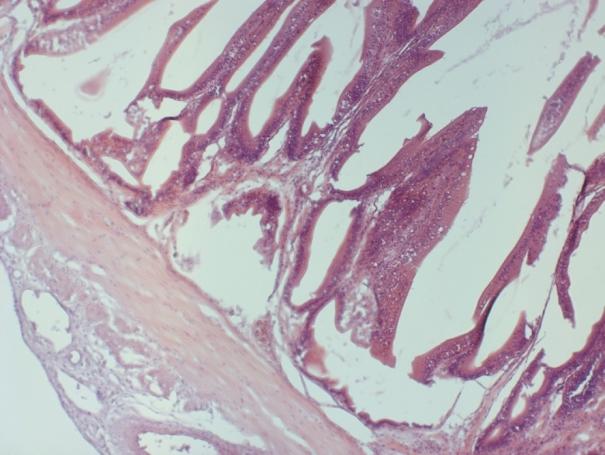
Рисунок 82 — Строение стенки кишечника африканского клариевого сома (Clarias gariepinus). Контрольная группа. Окраска – гематоксилин-эозин. Увеличение окуляр х10 объектив х10. Истончение, укорочение и уменьшение ветвления ворсинок, деструкция ворсинок. Отек мышечного слоя
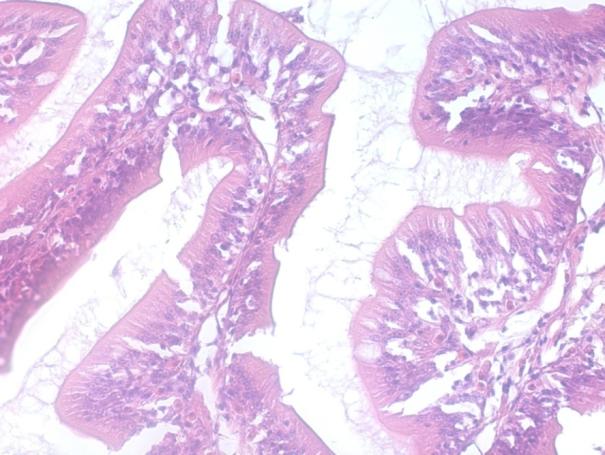
Рисунок 83 — Строение стенки кишечника африканского клариевого сома (Clarias gariepinus). Контрольная группа. Окраска – гематоксилин-эозин. Увеличение окуляр х10 объектив х40. Деструкция ворсинок. Отек собственно слизистой оболочки.
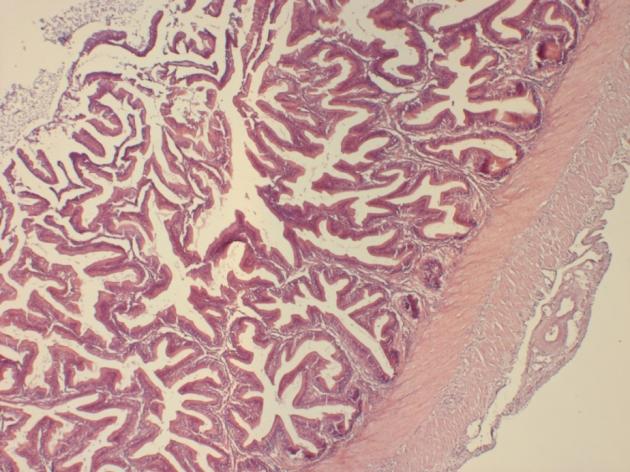
Рисунок 84 — Строение стенки желудка кишечника африканского клариевого сома (Clarias gariepinus). Контрольная группа. Окраска – гематоксилин-эозин. Увеличение окуляр х10 объектив х10. Относительно сохранная слизистая оболочка кишечника.
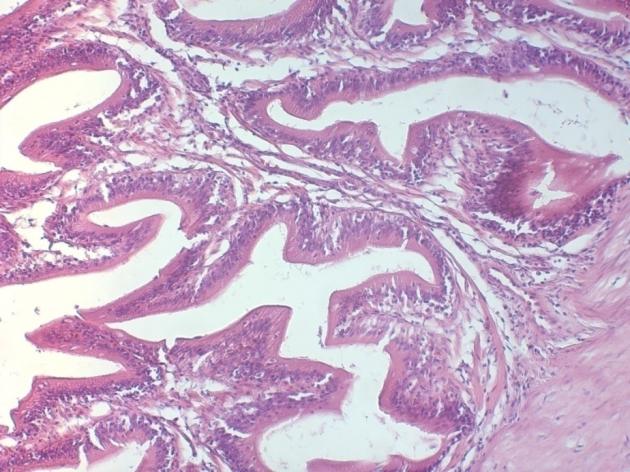
Рисунок 85 — Строение стенки кишечника африканского клариевого сома (Clarias gariepinus). Контрольная группа. Окраска – гематоксилин-эозин. Увеличение окуляр х10 объектив х20. Укорочение и деструкция ворсинок.
У рыб, выращиваемых без пробиотика, выявлены изменения слизистой кишечника, истончение ворсинок, уменьшение их протяженности и ветвления, снижение числа контактов между ними и деструкция самих ворсинок. Отмечается отек мышечного слоя стенки кишечника и серозной оболочки.
Проведённые исследования показали эффективность применения пробиотика «споротермин» для профилактики нарушений в пищеварительной системе африканского сома. Бактерии Bacillus subtilis и Bacillus licheniformis, входящие в состав пробиотика «Споротермин», за счет восстановления равновесия в кишечном нормоценозе снижается количество условно-патогенных и патогенных микроорганизмов, вызывающих патологические изменения тканей кишечника.
В итоге гистологические исследования кишечника африканского клариевого сома (Clarias gariepinus) показали, что пробиотик «споротермин» снижает уровень патологических изменений в клетках и тканях кишечника африканского клариевого сома (Clarias gariepinus).
2.12 Экономическая эффективность от внедрения результатов разработки
Разработанная нами технология производства икры африканского клариевого сома параллельно процессу выращивания товарной рыбы была внедрена в КФХ Исакова М.В. Результаты внедрения показали, что производство дополнительного продукта — икры при выращивании товарной рыбы требует минимальных затрат и позволяет за короткие сроки резко повысить рентабельность хозяйства, поскольку в стоимостном выражении 1 кг икры на более чем на порядок дороже 1 кг мяса рыбы.
Внедрение предложенной нами технологии в К(Ф)Х Исакова М.В. позволило повысить экономические показатели индустриальной аквакультуры при выращивании африканского клариевого сома за счет производства икры.
До внедрения нашей технологии общая выручка в расчете на 1000 особей при одногодичном цикле производства составляла 350 тыс. руб. при затратах 164 тыс. руб. (таблица 25). При внедрении нашей технологии общая выручка в расчете на 1000 особей за счет производства икры возросла до 734 тыс. руб. при затратах 170 тыс. руб. Таким образом, при одногодичном цикле выращивания товарной рыбы за счет производства икры прибыль от реализации продукции возросла почти в 3 раза.
Анализируя таблицу можно отметить, что рентабельность производства продукции в первый год выращивания клариевого сома с применением нашей технологии при двукратном получении икры оставляет свыше 330 %.
Таблица 25 — Экономическая эффективность икорно-товарного производства африканского сома в условиях крестьянского фермерского хозяйства Исакова М. В. В Ульяновской области при одногодичном цикле выращивания рыбы
| Показатель | Результат произ-водства товарной рыбы при одного-дичном цикле | Результат при внедре-нии производства икры при одногодичном цикле производства |
| Количество рыб, шт. | 1000 | 1000 |
| Стоимость рыбопосадочного материала, при собственном воспроизводстве, тыс. руб. | 0 | 0 |
| Стоимость 1 кг комбикорма, руб. | 64 | 64 |
| Скормлено комбикорма на группу, кг | 1000 | 1000 |
| Стоимость комбикорма всего, тыс. руб. | 64 | 64 |
| Производственные затраты, тыс. руб. | 100 | 100 |
| Кратность получения икры, в год | — | 2 |
| Затраты на гормональную стимуляцию 1 самки для созревания икры, тыс. руб. | — | 0,003 |
| Общие затраты на двукратную гормональную стимуляцию, тыс. руб. | 0 | 6 |
| Затраты всего, тыс.руб. | 164 | 170 |
| Средняя масса 1 рыбы в конце периода выращивания, кг | 1,400 | 1,400 |
| Масса товарной рыбы 1000 шт в конце периода выращивания, кг | 1400 | 1400 |
| Себестоимость 1 кг рыбы, тыс. руб. | 0,117 | 0,121 |
| Реализационная цена 1 кг рыбы, тыс. руб. | 0,250 | 0,250 |
| Выручка от реализации рыбы, тыс. руб. | 350 | 350 |
| Средняя порция икры от одной самки в первый год выращивания, кг | 0 | 0,160 |
| Количество икры при двукратном получении икры, кг | 0 | 0,320 |
| Количество полученной икры от 1000 самок, кг | 0 | 320 |
| Реализационная цена икры 1 кг, тыс. руб | — | 1,2 |
| Выручка от реализации икры 1000 самок при двукратной отдаче, тыс. руб. | — | 384 |
| Выручка от реализации всей продукции, тыс. руб. | 350 | 734 |
| Прибыль от реализации всей продукции за два года, тыс.руб.
(в пересчете на 1 тыс. самок) |
186 | 564 |
| Рентабельность, % | 113% | 331% |
При двухгодичном цикле выращивания сомов до 2-х лет (в первый год — двукратное получение икры, реализации товарной рыбы нет; во второй год трехкратное получение икры и реализация товарной рыбы) прибыль за два года, в расчете на 1000 особей, составила 1461 тыс. руб. (таблица 26).
Таблица 26 — Экономическая эффективность выращивания клариевого сома в условиях крестьянского (фермерского) хозяйства «Исаков М. В.» при двухгодичном цикле выращивания рыбы
| Показатель | Результаты производства товарной рыбы при двухгодичном цикле | Результаты внедрения наукоемкой технологии при двухгодичном цикле выращивания рыбы | ||
| 2 год | 1 год | 2 год | за два года | |
| Количество рыб, шт. | 1000 | 1000 | 1000 | 1000 |
| Стоимость рыбопосадочного материала, тыс. руб. | — | — | — | |
| Стоимость 1 кг комбикорма, руб. | 64 | 64 | 64 | |
| Скормлено комбикорма на группу, кг | 2000 | 1000 | 1000 | 2000 |
| Стоимость комбикорма всего, тыс. руб. | 128 | 64 | 64 | 128 |
| Производственные затраты, тыс. руб. | 200 | 100 | 100 | 200 |
| Затраты на гормональную стимуляцию 1 самки для созревания икры, тыс. руб. | 0 | 0,03 | 0,03 | |
| Кратность получения икры, в год | 0 | 2 | 3 | 5 |
| Общие затраты на гормональную стимуляцию, тыс. руб. | 0 | 6 | 9 | 15 |
| Затраты всего, тыс.руб. | 328 | 170 | 173 | 343 |
| Средняя масса рыбы в конце периода выращивания, кг | 2,800 | 1,400 | 2,800 | 2800 |
| Масса товарной рыбы в конце периода выращивания, кг | 2800 | 1400 | 2800 | 2800 |
| Себестоимость 1 кг рыбы, тыс. руб. | 0,117 | 0,123 | ||
| Реализационная цена 1 кг рыбы, тыс. руб. | 0,25 | — | 0,25 | 0,25 |
| Выручка от реализации рыбы, тыс. руб. | 700 | 0 | 700 | 700 |
| Средняя порция икры от одной самки, кг | 0 | 0,16 | 0,20 | |
| Количество полученной икры, кг | 0 | 320 | 600 | 920 |
| Реализационная цена икры 1 кг, тыс. руб | — | 1,2 | 1,2 | 1,2 |
| Выручка от реализации икры, тыс. руб. | 0 | 384 | 720 | 1104 |
| Выручка от реализации всей продукции, тыс. руб. | 700 | 1804 | ||
| Прибыль от реализации всей продукции за два года, тыс.руб.
(в пересчете на 1 тыс. самок) |
372 | 1461 | ||
| Рентабельность, % | 113 | 426 | ||
Поэтому инновационная технология икорного производства параллельно процессу выращивания товарной рыбы повышает эффективность производства продукции по отношению к традиционной схеме, предусматривающей выращивание только товарной рыбы.
ЗАКЛЮЧЕНИЕ
Проведенные нами исследования позволили разработать инновационную биотехнологию икорного производства африканского клариевого сома, адаптированную к высокотехнологичной индустриальной аквакультуре. Исследования проводились по заданию Министерства сельского хозяйства РФ. Цель работы – достигнута, поставленные задачи – решены.
Технология является наукоемким продуктом, основанным на фундаментальных исследованиях в области биологии, физиологии и экологии африканского клариевого сома.
Необходимо отметить основные результаты:
— Получен новый пищевой продукт диетического питания – икра африканского клариевого сома.
— Проведены гистологические и цитологические исследования динамики полового созревания самок по степени зрелости их гонад и половых продуктов для оценки икорной продуктивности на разных этапах онтогенеза и определения стартового возраста самок, позволяющего использовать их в качестве доноров икры.
— Установлены биологические закономерности, регламентирующие кратность получения икры, временные интервалы ее созревания, обоснована продолжительность восстановительного периода самок после отдачи икры.
— Исследованы особенности сезонной динамики икорной продуктивности и расшифрованы механизмы, позволяющие регулировать ее в период спада гормональной активности в осенне-зимний сезон.
— Разработаны новые подходы в репродуктивной биотехнологии на основе использования адаптогенов, позволяющих успешно пройти критические стадии эмбриогенеза, повысить естественную резистентность и адаптационную пластичность на ранних этапах постнатального онтогенеза
— Обосновано использование кормов, модифицированных споровыми формами пробиотиков — антагонистов патогенов. Получены результаты позитивного влияния пробиотика на гистологические особенности органов пищеварения рыб.
— Дана сравнительная оценка скорости роста и особенностей развития генераций клариевого сома репродуцированных в разные сезоны года и определены оптимальные периоды для получения генераций с наиболее высокой скоростью роста.
— Разработана и внедрена технология культивирования живых стартовых кормов для рыб – науплий артемии, обогащенных адаптогенами и витаминами.
— Показано, что икра и мышцы африканского клариевого сома обладают высокой пищевой ценностью и содержат полный спектр незаменимых аминокислот и незаменимых полиненасыщенных жирных кислот.
Научно-технологическая новизна разработки. До настоящего времени в России и за рубежом икорного производства африканского клариевого сома не существовало. Идея реального создания такого производства генерирована и воплощена нашим авторским коллективом.
Африканский клариевый сом в естественной среде обитания относится к числу рыб с многопорционным нерестом. Поэтому теоретически получать икру у этого вида рыб можно несколько раз в сезон нереста. Однако, в условиях искусственного разведения африканский сом утрачивает способность к естественному размножению. Нам необходимо было подобрать гормональные индукторы, позволяющие вызвать у него искусственный нерест. Для этого были разработаны схемы преднерестовой подготовки и гомональной стимуляции нереста. С их помощью удалось получить зрелую, готовую для оплодотворения икру африканского клариевого сома.
Далее мы предприняли попытку расширить естественные биологические границы, чтобы получать икру не только в сезон нереста, а круглогодично. Так была разработана технология всесезонного производства икры африканского клариевого сома, основанная на особенностях преднерестовой подготовки и гормональных индукторах гаметогенеза. Для ее реализации были необходимы фундаментальные знания об особенностях биологии и репродуктивной биотехнологии клариевого сома в условиях ндустриальной аквакультуры.
Проведенные исследования доказали возможность неоднократного получения икры самок параллельно процессу выращивания товарной рыбы. Было показано, что разработанные нами схемы преднерестовой подготовки и гормональной стимуляции позволяют получать икру не только в сезон нереста, а круглогодично.
Исследования показали, что икру у такого вида рыб как африканский клариевый сом можно получать, используя технологию искусственного нереста с периодичностью 1 раз в 3-4 месяца.
Сравнительные исследования эффективности гормональных индукторов позволили установить, что наиболее дешевым и эффективным индуктором гаметогенеза является сурфагон, усиленный эглонилом. В наиболее сложных случаях в зимний период в качестве гормонального индуктора необходимо использовать гипофиз.
Нами был установлен стартовый возраст самок для производства икры. Показано, что по достижении 8 месячного возраста самки готовы к отдаче икры, однако их гонадосоматический индекс в этом возрасте недостаточно высокий. Поэтому в качестве продуцентов икры самок целесообразно использовать не ранее возраста 9-12 месяцев, когда их гонадосоматический индекс возрастает до 15-20%. Впервые показано, что период восстановления репродуктивной системы самок после отдачи икры под действием гормональных индукторов занимает не менее трех месяцев.
Установлено, что температурный минимум содержания самок, используемых для круглогодичного получения икры, составляет 260С. Понижение температуры содержания снижает интенсивность ответа на гормональные стимуляторы, снижая количество и качество продуцируемой икры; выращивание самок при температуре ниже 230С, исключает возможность производства икры африканского клариевого сома.
В процессе выполнения исследований нами попутно был разработан метод 48 часового хранения спермы африканского клариевого сома.
Проект актуален для Ульяновского региона, имеет региональную значимость, поскольку потребление рыбы и рыбных продуктов в Ульяновской области в последние годы составляет 9 кг/ год на душу населения, что едва достигает 40% от физиологической нормы и ниже, чем в остальных областях Приволжского административного округа.
Технология всесезонной репродукции и получения икры-сырца африканского клариевого сома заслуживает расширенного внедрения в рыбоводных хозяйствах, специализирующихся на выращивании африканского клариевого сома.
Конкурентоспособность на внутреннем и внешних рынках.
В настоящее время технологии круглогодичного получения икры в мировой практике индустриальной аквакультуры отсутствуют. Также в мировой практике отсутствует технология получения икры африканского клариевого сома в пищевых целях. Существует опыт производства икры осетровых, но только в период нереста. Поэтому наша разработка является принципиально новой и конкурентоспособной как на внутреннем, так и на внешнем рынке.
Как показали наши исследования икра африканского клариевого сома, как и мышечные ткани рыбы, по содержанию белка соответствуют требованиям белкового продукта, который содержит весь спектр незаменимых аминокислот. Икра клариевого сома также богата моно- и полиненасыщенными жирными кислотами, в том числе незаменимыми. Химический состав икры позволяет отнести ее к категории продуктов диетического и лечебного питания.
Снижение капиталовложений и расходов на производство продукции. Всесезонное производство товарной икры параллельно процессу выращивания рыбы значительно снижает капиталовложения и расходы на производство товарной рыбы, поскольку известно, что стоимость 1 кг икры — сырца на порядок выше стоимости 1 кг рыбы. В нашей технологии производство икры параллельно процессу производства товарной рыбы не требует дополнительных капиталовложений.
Направления практического использования разработки. Разработанная технология, как показали результаты ее внедрения, может быть успешно реализована в фермерских хозяйствах и других хозяйствах индустриальной аквакультуры, специализирующихся на выращивании африканского клариевого сома.
Коммерческий потенциал разработки. Коммерческий потенциал разработки выражается в экономических показателях, характеризующих уровень производственной готовности и коммерческого риска освоения разработки, степень промышленной применимости, направления и способы использования, универсальность применения.
Разработанная технология обладает высокой коммерческой привлекательностью для хозяйств, специализирующихся на аквакультуре африканского клариевого сома. Выигрышными позициями проекта являются его конкурентоспособность, производственная готовность и наличие значительного потенциала для расширения рыночного сегмента за счет появления нового продукта питания — икры африканского клариевого сома.
Повышение качества продукции, рациональность и экологическая безопасность. Наша технология позволяет в процессе производства товарной рыбы — африканского клариевого сома без существенных дополнительных затрат, осуществлять производство товарной икры круглогодично с интервалом 3-4 месяца. Экологическая безопасность продукта обеспечивается постоянным контролем гидрохомического режима и использованием при выращивании рыбы пробиотика «споротермина» и адаптогена «иркутина».
Финансово-экономическая эффективность от внедрения в производство. Внедрение инновационной технологии всесезонного получения икры африканского клариевого сома в период первого года выращивания повышает рентабельность производства продукции в 2,25 раза.
Выращиваемая нами рыба по всем показателям соответствует требованиям безопасного, экологически чистого продукта. Это подтверждено экспертным заключением «ОГБУ «Симбирский референтный центр ветеринарии и безопасности продовольствия»; выращенная рыба является безопасным продуктом питания и соответствует всем требованиям ГОСТ 814-96, ТР ТС 021/2011 Технический регламент Таможенного союза «О безопасности пищевой продукции», ТР ЕАЭС 040/2016 Технический регламент Евразийского экономического союза «О безопасности рыбы и рыбной продукции» (приложение А).
Разработанная технология внедрена в Ульяновской области в Майнском районе в Крестьянском фермерском хозяйстве Исакова М. В. (приложение Б).
Проект награжден МСХ РФ Золотой медалью и дипломом на Российской агропромышленной выставке «Золотая осень 2019», Москва, ВДНХ. 9-12 октября 2019 г (приложение В).
Разработанная нами технология демонстрировалась 3 августа 2019 г заместителю министра сельского хозяйства РФ Максиму Увайдову (рисунок 86), летом 2019 г. Главному Федеральному инспектору по Ульяновской области Сергею Валенкову (рисунок 87), осенью 2019 г — первому вице-президенту РАН, А.В Адрианову (рисунок 88); неоднократно на разных этапах разработки губернатору Ульновской области С.И. Морозову, министру агропромышленного комплекса и развития сельских территорий Ульяновской области Михаилу Семенкину (рисунок 89).

Рисунок 86 — Демонстрация технологии икорного производства Заместителю Министра сельского хозяйства Российской Федерации Максиму Увайдову в августе 2019 г.

Рисунок 87 — Демонстрация икорного производства Главному федеральному инспектору по Ульяновской области Сергею Валенкову летом 2019 г.

Рисунок 88 — 18.11.2019 г. Визит в лабораторию Экспериментальной биологии и аквакультуры первого вице-президента РАН А.В Адрианова — руководителя Национального научного центра морской биологии им. А.В.Жирмунского ДВО РАН, председателя экспертного совета РАН, председателя Комитета РАН по Программе ООН по окружающей среде, вице-президента Всероссийского гидробиологического общества при РАН.

Рисунок 89 — Губернатор Ульяновской области Сергей Морозов, министр агропромышленного комплекса Ульяновской области Михаил Семенкин, директор Департамента ветеринарии. — главный ветеринарный инспекторУльяновской области Нина Пелевина неоднократно посещали Лабораторию экспериментальной биологии и аквакультуры и знакомились с результатами ее работы.
Список использованных источников
1.http://dvrb2014.ru/files/rybopotreblenie.pdf.
2. Стратегия развития аквакультуры в Российской Федерации на период до 2020 года. 10.09.2007, в последней редакции 2010 г.)
3.https://www.fishnet.ru/news/rynok/66261.html
4.http://fishkamchatka.ru/articles/russia/22329/?month=10&year=2012
5.Приказ Министерства сельского хозяйства РФ № 10 от 16.01.2015 «Об утверждении отраслевой программы «Развитие товарной аквакультуры (товарного рыбоводства) в Российской Федерации на 2015–2020 годы»
6. Серветник Г. Е. Стратегия развития рыбоводства в АПК /Г.Е. Серветник // Достижения науки и техники АПК. 2008. № 10. С. 40–42.
7 Матишов Г.Г. Инновационные технологии аквакультуры Юга России / Г.Г. Матишов, С.В. Пономарёв, Ю.М. Баканева// справочник под ред. С.В. Пономарёва – Ростов: Изд-во ЮНЦ РАН, 2013. – 224 с. – ISBN 978-5-4358-0053-1.
8. Скляров В. Я. Аквакультура юга России, перспективы развития / В. Я. Скляров, Л. Г. Бондаренко, Ю. И. Коваленко, В. И. Петрашов, А. В. Каширин, Е. Н. Черных //Тр. ВНИРО. 2013. Т. 150. С. 50–56.
9. Мельников Е.А Африканский сом — перспективный объект аквакультуры в средней полосе России/Е.А.Мельченков, В.В.Приз, Е.А. Чертихина, Т.А.Канидьева//Рыбное хозяйство. 2008. № 6. С. 72-77.
10. Артеменков Д.В. Сравнительная характеристика роста сомообразных рыб Silurus glanis и Clarias gariepinus/ Д.В. Артеменков, Г.И. Пронина, А.Б. Петрушин, Г.А. Волошин/Рыбоводство и рыбное хозяйство. 2017. №2 (134). С. 14-19.
11.Власов В. А. Сом клариевый (африканский) (Clarias gariepinus, Burchell) (биология, воспроизводство, выращивание): Моногр. М.: ФГБНУ «Росинформагротех», 2017. — 128 с.
12.Никифоров А.И. Интегрированные системы в мировой аквакультуре/ А.И.Никифоров, Д.К.Круглова, Я.С. Савцова// Рыбоводство и рыбное хозяйство. 2017. №8 (139). С. 65-72.
13.Власов В.А. Воспроизводство и выращивание клариевого сома (Clarias gariepinus) в установках с замкнутым водообеспечением/В.А.Власов, А.П.Завьялов//Зоотехния. 2014. № 12. С. 22-24.
14.Артемов Р.В. Исследование биологической ценности и функционально-технологических свойств перспективных объектов аквакультуры/ Р.В.Артемов, М.В.Арнаутов, А.В.Артемов, Е.С.Коноваленко// Рыбное хозяйство. 2016. № 1. С. 74-77.
15. Мибуро З. Состояние и перспективы развития рыбного хозяйства в республике Бурунди/ З. Мибуро// В сборнике: Международная научная конференция научно-педагогических работников Астраханского государственного технического университета (60-я НПР) Материалы конференции. ФГБОУ ВО «Астраханский государственный технический университет». 2016. С. 17-18.
16. Hollaender setzen Hoffnungen auf Wels//Fischer & Teichwirt. -1991. -N 5. -S.20.
17. Britz P.J. The utility of homoplastic pituitary glands for spawning induction of the African catfish (Clarias gariepinus) in commercial aquaculture in Africa//Water SA. -1991. -Vol.17. -N 3 July. -P.237-241.
18. Artificial Reproduction of African Catfish Clarias gariepinus at Umoja Fish Farm Uganda 2008 from Will Leschen//https://vimeo.com/16890394
19. Гордеев А.В. Выращивание в УЗВ африканского сома Clarias gariepinus /А.В.Гордеев, В.А.Власов, А.П. Завьялов// Зоокультура и биологические ресурсы. Материалы научно-практической конференции. — М.: Товарищество научных изданий КМК, 2005. -С.33-34.
20. Гамачкова Н.Я. Опыт выращивания нового интродуцированного вида — африканского сома (Clarias gariepinus) в Чешской Республике / Н.Я. Гамачкова, Я. Коуржил// Первый конгресс ихтиологов России. Тезисы докладов (Астрахань, сентябрь 1997 г.). — М.: Изд-во ВНИРО, 1997. -С.270-271.
21. Варди Л. Аквакультура в Венгрии / Л.Варди //Холодноводная аквакультура: старт в XXI век. Международный симпозиум. Материалы. (8-13 сент. 2003 г., Санкт-Петербург). -М.: ФГНУ «Росинформагротех», 2003. -С.12-13.
22. http://aquavitro.org/2016/02/20/afrikanskij-klarievyj-som/
23. Rui Rosa. Nutritional quality of African catfish Clarias gariepinus (Burchell, 1822): a positive criterion for the future development of the European production of Siluroidei / Rosa Rui, Bandarra Narcisa M., Nunes Maria Leonor // International Journal of Food Science and Technology. 2007. Vol. 42, iss. 3. P. 342–351.
24.Бхуджела Р. Аквакультура в странах Азии /Р.Бхуджела// Комбикорма. 2015. № 9. С. 28-30.
25. Ковалев К. В. Технологические аспекты выращивания клариевого сома (Clarias gariepinus) в рыбоводной установке с замкнутым циклом водообеспечения (УЗВ): автореф. дис. … канд. с.-х. наук) / К. В. Ковалев. М., 2006. 21 с.
26. Артеменков Д. В. Выращивание клариевого сома (Сlarias gariepinus) на комбикормах с добавками пробиотика «Субтилис» в условиях УЗВ: автореф. дис. … канд. с.-х. наук / Д. В. Артеменков. М., 2013. 23 с.
27. Филатов В. И. Технологические аспекты выращивания африканского сома Сlarias gariepinus в условиях замкнутого цикла водообеспечения /В. И. Филатов, Е. А. Мельченков, В. В. Приз, В. А. Слепнев // Рыбное хозяйство. 2012. № 4. 2012. С. 88–91.
28.Севрюков В.Н. Первый опыт промышленного культивирования клариевого сома/ В.Н.Севрюков, В.В.Семьянихин, А.В.Лабенец // Ресурсосберегающие технологии в аквакультуре. Второй международный симпозиум. Материалы докладов. -Краснодар, 1999. -С.92-93.
29. Подушка С.Б. Клариевый сом и его использование в рыбоводстве/ С.Б. Подушка// Состояние и перспективы развития фермерского рыбоводства аридной зоны. Тезисы докладов международной научной конференции (6-8 июня 2006 г., Азов). — Ростов-на-Дону. — 2006. — С. 71-74.).
30. Устинов А.С.Эффективные технологии производства живой рыбы в г. Липецке/А.С. Устинов//Ресурсосберегающие технологии в аквакультуре. Второй международный симпозиум. Материалы докладов. — Краснодар, 1999. -С.108-109.
31 Власов В.А. Какие комбикорма лучше усваивает клариевый сом / В. А. Власов // Комбикорма. 2012. № 5. С. 67–69.
32.Власов В. А. Использование пробиотика «Субтилис» в качестве добавки в комбикорм при выращивании клариевого сома (Сlarias gariepinus) / В. А. Власов, Д. А. Артеменков, В. В. Панасенко // Рыбное хозяйство 2012. № 5. С. 89–93.
33. Казакова Л. Х. Обмен макроэлементов у клариевого сома (Clarias gariepinus (Burshell, 1822) при разных источниках экзогенного кальция: автореф. дис. … канд. биол. наук / Л. Х. Казакова. М., 2009. 23 с.
34. . Osibona A. O. Proximate composition and fatty acids profile of the African Catfish Clarias Gariepinus / A. O. Osibona, K. Kusemiju, G. R. Akande // Journal of Life and Physical Sciences, acta SATECH. 2009. Vol. 3, iss. 1. P. 89–94.
35.Viveen W.E.A.R. Hractical manual for the culture of the african catfish (Clarias gariepinus) / W.E.A.R. Viveen, C.J.J.Richter, P.G.W.J.van Oordt// vi, -94 p., Appendix 1-8. Netherlands.
36. Артеменков Д.В. Выращивание клариевого сома (Сlarias gariepinus) на комбикормах с добавками пробиотика субтилис в условиях УЗВ/ Д.В.Артеменков// Автореферат диссертации на соискание ученой степени кандидата сельскохозяйственных наук. Москва, 2013.
37. Романова Е.М. Инвазивный метод прижизненного получения половых продуктов африканского клариевого сома для экстракорпорального оплодотворения/Е.М.Романова, В.Н.Любомирова, Д.С.Игнаткин, В.В.Романов, М.Э.Мухитова, Д.Ю.Акимов// В сборнике: Водные биоресурсы, аквакультура и экология водоемов V Балтийский морской форум. Всероссийская научная конференция. Труды. 2017. С. 141-146.
38.Hollaender setzen Hoffnungen auf Wels//Fischer & Teichwirt. -1991. -N 5. -S.20.
39. Филиппова О.П. Влияние продолжительности межнерестового интервала на продукционные характеристики производителей гибридов белуги Huso huso L. и стерляди Acipenser ruthenus L. /О.П.Филиппова, А.С.Сафронов, С.Е.Зуевский, К.В. Дудин// Актуальные вопросы рыбного хозяйства и аквакультуры бассейнов южных морей России Материалы Международной научной конференции г. Ростов-на-Дону 1–3 октября 2014 г. Ростов-на-Дону Издательство ЮНЦ РАН 2014. С. 37-43.
40. Ярмош В.В. Влияние гормональных препаратов на созревание половых продуктов клариевого сома (Clarias gariepinus b.,1868)/ В.В.Ярмош, А.В.Астренков, А.В.Козырь, Т.В.Масайло// Веснiк Палескага дзяржаўнага унiверсiтэта. Серыя прыродазнаўчых навук. 2017. № 2. С. 99-104.
41. Подушка С.Б. Выращивание клариевых сомов ради икры// С.Б. Подушка// В сборнике: континентальная аквакультура: ответ вызовам времени 2016. С. 250-252.
42. Е. Адамек . https://aquafeed.ru/statie/63
43.Шумейко Д.В., Подготовка производителей африканского клариевого сома (Clarias gariepinus) к нересту/Д.В. Шумейко, Н.М.Цымбал, Д.А.Одина//В сборнике: Роль инноваций в трансформации современной науки. Сборник статей Международной научно-практической конференции. 2016. С. 127-132.
44.http://kfhouse.ru/teoreticheskie_i_prakticheskie_aspekty_vyraschivaniya_afrikanskogo_klarievogo_soma/
45. Власов В.А. Воспроизводство и выращивание клариевого сома (Clarias gariepinus) в установках с замкнутым водообеспечением/ В.А. Власов, А.П.Завьялов//Зоотехния. 2014. № 12. С. 22-24.
46. Artificial Reproduction of African Catfish Clarias gariepinus at Umoja Fish Farm Uganda 2008 from Will Leschen//https://vimeo.com/16890394 (дата обращения: 19.08.2015)
47.Huisman E.A. Reproduction, grow, health control and aquacultural potential of the African catfish, Clarias gariepinus (Burchell 1822)/ E.A.Huisman, C.J.J.Richter //Aquaculture. -1987. -V.63. -N 1-4. -P.1-14.
48.Романова Е.М.Биологический контроль фертильности самок клариевого сома в бассейновой аквакультуре /Е.М.Романова, В.Н.
Любомирова, М.Э.Мухитова //Вестник Ульяновской государственной сельскохозяйственной академии. 2016. № 3. С. 78-84.
49.Романова, Е.М. Искусственное воспроизводство африканского сома с использованием гормональной стимуляции./Е.М. Романова, Е.В. Федорова, Э.Р. Камалетдинова //Зоотехния. -2014. -№10 -С 31 -32.
50.Подушка С.Б. 10 лет икорно-товарному осетроводству России /С.Б.Подушка, М.А.Теркулов//В сборнике: Инновационные технологии в пищевой промышленности: Наука, образование и производство. Международная научно-техническая конференция. 2013. С. 117-118.
51. Казаков Р.В. Методы оценки половых клеток рыб: рыбоводная оценка спермы/ Р.В. Казаков, А.Н. Образцов// Обзорная информация. — Сер. марикультура. ВНИЭРХ. — 1990. — № 4. — С. 1-54.
52. Геодакян В.А. Эволюционные теории асимметризации организмов, мозга и тела /В.А.Геодакян// Успехи физиологических наук, 2005. 36 № 1. С. 24-53.
53. Шандарин И.Н. Ген AG1 необходим для регенерации плавников у рыбы Danio rerio /И.Н.Шандарин, А.С.Иванова, А.А.Минин, М.Б.Терешина, А.Г.Зарайский// Биоорганическая химия. 2015. Т. 41. № 4. С. 427.
54. Никофорова А.И. Особенности репаративного восстановления плавников многоперовых рыб (Polypteridae, Actinopterygii) /А.И.Никифорова, В.А.Голиченков// Онтогенез. 2012. Т. 43. №2. С. 136.
55. Антонова Е.И. Стромально-паренхимные проявления регенерации печени рыб Carassius auratus gibelio после гипертермии /Е.И.Антонова// Морфологические ведомости. 2008. Т. 1. № 1-2. С. 8-11.
56. Романова Е.М. Пробиотики и адаптогены в лечении аэромоноза африканского клариевого сома /Е.М.Романова, В.Н.Любомирова, Л.А.Шадыева, Т.М.Шленкина// Вестник Ульяновской государственной сельскохозяйственной академии. 2017. № 4 (40). С. 86-93.
57. Derbalah A. Micro-morphological investigation of the skin of the larval and adult stages of the african catfish (Clarias gariepinus) /A.Derbalah et al.// Alexandria journal of veterinary sciences. 2017. Vol. 53. P. 1-10.
58. Власов В.А. Выращивание клариевого сома (Clarias gariepinus, Burchell) при различных условиях содержания и кормления /В.А.Власов// Рыбоводство и рыбное хозяйство. 2014. № 5. С. 23-32.
59. Романова Е.М. Репродуктивная биотехнология африканского клариевого сома /Е.М.Романова, В.Н.Любомирова, М.Э.Мухитова, В.В.Романов, Л.А.Шадыева, Т.М.Шленкина, И.С.Галушко// Рыбоводство и рыбное хозяйство. 2017. № 12 (143). С. 49-57.
60. Власов В. А. Выращивание клариевого сома (Clarias gariepinus, Burchell) при различных условиях содержания и кормления // Состояние и перспективы развития пресноводной аквакультуры : междунар. Науч.-практ. Конф., Москва, 5-6 февр. 2013 г.:докл. Москва: РГАУ МСХА им. К.А. Тимирязева, 2013. С. 141—150.
61. Ola-Oladimeji F.A. Morphological characterization of wild and cultured clarias gariepinus (Burchell 1822) using principal component and cluster analyses / Ola-Oladimeji F. A. еt al. // not. Sci. Biol. 2016. Vol. 8, iss. 4. P. 428—436.
62.Okomoda V. T., Chong Chu Koh I., Shahreza S. Md. A simple technique for accurate estimation of fertilization rate with specific application to Clarias gariepinus (Burchell, 1822) // Aquaculture Research. 2017. P. 1—6.
63.Cloning, localization and differential expression of Neuropeptide-Y during early brain development and gonadal recrudescence in the catfish, Clarias gariepinus / Cheni-Chery Sudhakumari et al. // General and Comparative Endocrinology. 2017. Vol. 251. P. 54—65.
64.El-Hawarry W. N., Abd El-Rahman S. H., Shourbela R. M. Breeding response and larval quality of African catfish (Clarias gariepinus, Burchell 1822) using different hormones/hormonal analogues with dopamine antagonist // Egyptian Journal of Aquatic Research. 2016. Vol. 42, iss. 2. P. 231—239.
65.Романова Е.М. Ииновационные подходы в получении половых продуктов африканского клариевого сома в бассейновой аквакультуре /Е.М.Романова, В.Н.Любомирова, В.В.Романов, М.Э. Мухитова// Вестник Ульяновской государственной сельскохозяйственной академии. 2017. № 3 (39). С. 88-96.
66.Романова Е.М. Искусственное воспроизводство африканского сома с использованием гормональной стимуляции /Е.М. Романова, Е.В. Федорова, Э.Р. Камалетдинова// Зоотехния. 2014. № 10. С. 31-32.
67. Gadisa Natea. Spawning response of African catfish (Clarias gariepinus (Burchell 1822), Claridae: Teleost) exposed to different piscine pituitary and synthetic hormone / Gadisa Natea et al. // International Journal of Fisheries and Aquatic Studies. 2017. Vol. 5, iss. 2. P. 264—269.
68.Бондаренко А. Б., Сычев Г. А., Приз В. В. Клариевый сом в России и за рубежом. Перспективы его внедрения для тепловодных хозяйств России // Сборник научных трудов ВНИИПРХ. 2005. Вып. 80. С. 213—218.
69.Sueman M. A., Solomon R. J. Effect of stocking on the growth and survval of Claas gaepnus grown in plasc tanks // Diect Res. J. Vet. Med. Anim. Sci. 2017. Vol. 2, iss. 3. P. 82—92.
70.Hecht T., Oellermann L., Verheust L. Perspecves on clariid catfish culture in Africa // Aquatic Living Resources. 1996. Vol.9,iss.5.P.197—206.
71.Курбанов А. Р., Камилов Б. Г. Разведение африканского сома Clarias gariepinus в условиях Узбекистана. Ташкент: Навруз, 2017. 52 с.
72.Пономарева Е.Н, Сорокина М.Н. Использование витаминов для повышения резистентности осетровых рыб в раннем онтогенезе. Вестник Астраханского государственного технического университета. 2004. № 2 (21). С. 67-73.
73.Подушка С.В. Выращивание клариевых сомов ради икры. В сборнике: континентальная аквакультура: ответ вызовам времени. 2016. С. 250-252.
74 Филипова О.Р., Сафронов А.С., Зуевский С.Е., Дудин К.В. Влияние продолжительности межнерестового интервала на продукционные характеристики производителей гибридов белуги Huso huso L. и стерляди Acipenser ruthenus L. Актуальные вопросы рыбного хозяйства и аквакультуры бассейнов южных морей России Материалы Международной научной конференции г. Ростов-на-Дону 1–3 октября 2014 г. Ростов-на-Дону Издательство ЮНЦ РАН 2014. С. 37-43.
75 Shikov, A.N., Pozharitskaya, O.N., Makarov, V.G. Adaptogens: past, today and future. Clinical pharmacology and drug therapy reviews. 2017. Т. 15. № s1. С. 64.
76 Kuchta, K., Cameron, S., Rausch, H., 2017. Tthe russian “adaptogen” concept and the japanese “hozai” concept — a comparison. Clinical pharmacology and drug therapy reviews. Т. 15. № s1. С. 37.
77. Ivanišová, E. and Kačániová, M., Plant adaptogens: an important source of bioactive compounds. Bioactive compounds: sources, properties and applications. 2017. С. 91-144.
78. Романов В.В., Романова Е.М. Любомирова В.Н., Мухитова М.Э., Конструирование функционального рыбного продукта в условиях индустриальной аквакультуры. Вестник Ульяновской государственной сельскохозяйственной академии. 2018. № 1 (41). С. 151-156.
79. Solodkova, O.A., Zenkina, V.G., Influence of adaptogens on the morphofunctional state of adrenal glands in stress. European journal of natural history. 2018. № 4. С. 72-75.
80. Panossian, A., Understanding adaptogenic activity: specificity of the pharmacological action of adaptogens and other phytochemicals. Annals of the New York academy of sciences. 2017. Т. 1401. № 1. С. 49-64.
81. Алиев А.Б. Анализ современного состояния товарной аквакультуры/ А,Б. Алиев, Б.И. Шихшабекова, А.Д. Гусейнов, И.В. Мусаева, Е.М. Алиева, А.Р. Шихшабеков// Проблемы развития АПК региона. 2017. Т.3.№3(31). С. 102-106.
82. Романова, Е.М. Инновационные технологии производства продуктов функционального назначения в индустриальной аквакультуре / Е.М. Романова, В.В. Романов, В.Н. Любомирова, М.Э. Мухитова, Л.А. Шадыева, Т.М. Шленкина, И.С. Галушко. //Рыбоводство и рыбное хозяйство. 2018. № 5 (148). С. 54-59.
83. Мухитова, М.Э. Сравнительные исследования роста и развития популяций африканского клариевого сома, репродуцированных в разные сезоны / М.Э. Мухитова, Е.М. Романова, В.Н. Любомирова, В.В. Романов. //Вестник Ульяновской государственной сельскохозяйственной академии. 2018. Т. 42. № 2. С. 193-198.
84. Пронина, Г.И. Физиолого – иммунологическая оценка культивируемых гидробионтов: карпа, сома обыкновенного, речных раков. Автореф. Дисс….док. биол. Каук. М.: РГАУ МСХА им. К.А. Тимирязева. 2012. 36 с.
85. Юрина, Н.А. Использование кормовых добавок «Споротермин» и «Ковелос» в рационах молодняка сельскохозяйственных животных /Н.А. Юрина, З.В. Псхациева, С.И. Кононенко, Н.Н. Есауленко, В.В. Ерохин, В.А. Баранников //Современные технологии сельскохозяйственного производства и приоритетные направления развития аграрной науки. Материалы международной научно-практической конференции. В 4-х томах. — 2014. — С. 263 — 264.
86. Romanova, E.M. Biology of reproduction of catfish (Clarias gariepinus, burchell, 1822) in high-tech industrial aquaculture /E.M. Romanova, V.N. Lyubomirova, V.N. Lyubomirova, V.V. Romanov, M.E. Mukhitova, T.M. Shlenkina, L.A. Shadyeva, I.S. Galushko. //Journal of Fundamental and Applied Sciences. 2018. Т. 10. № 5S. С. 1116-1129.
87. Котова, Е.А. Пробиотики в аквакультуре /Е.А. Котова, Н.А. Пышманцева, Д.В. Осепчук, А.А. Пышманцева, Л.Н. Тхакушинова //Сборник научных трудов Всероссийского научно – исследовательского института овцеводства и козоводства. – 2012. – Том 3, № 1-1. – С 100-103.
88. Иванова, Н.Т. Атлас клеток крови рыб. М.: Легкая и пищевая промышленность. 1982. 184с.
89. Федоненко, Е.В. Особенности лейкоцитарной формулы у некоторых карповых рыб Запорожского Водохранилища (Украина) /Е.В. Федоненко, Т.С. Шарамок, Т.В. Ананьева//Труды ВНИРО. 2017. Т. 167. С. 59-65.
90. Микряков, В.Р. Применение интегральных показателей структуры лейкоцитов для изучения реакции иммунной системы рыб на токсиканты /В.Р. Микряков, В.Г. Терещенко, Д.В. Микряков, Л.В. Балабанов //Биология внутренних вод. 2002. №4. С. 84-88.
91. Нгуен Тхи Хонг Ван. Морфологические особенности кровяных клеток европейского окуня (Perca fluviatilis) в искусственных условиях /Нгуен Тхи Хонг Ван, С.В. Пономарев, Ю.В. Федоровых, Б.У. Дорджиев //Вестник астраханского государственного технического университета. Серия: рыбное хозяйство. 2017.№3. С. 106-112.
92. Абдуллаева, Н.М. Анализ лейкограммы осетровых рыб (Acipenser baerii (brandt) и A. gueldenstaedtii (brandt)), выращенных в искусственных водоемах //Н.М. Абдуллаева, М.М. Габибов, П.А. Асадулаева, М.Г. Рамазанова//Биология внутренних вод. 2015. №4. С. 92.
93. Микряков, В.Р. Реакция лейкоцитов стерляди Acipenser ruthenus на гормониндуцируемый стресс /Микряков, В.Р Л.В. Балабанова, Д.В. Микряков// Вопросы ихтиологии. 2009. Т. 49.№4. С. 554-557.
94.Яхненко, В.М. Особенности состава и структуры клеток крови рыб пелагиали и прибрежья озера Байкал /В.М. Яхненко, И.В. Клименков //Известия Российской академии наук. Серия биологическая. 2009.№1. С. 46-54.
95.Ларцева Л.В. Микрофлора рыб и других гидробионтов/ Л.В. Ларцева, О.В. Обухова, И.А. Лисицкая// — Астрахань: ИД «Астраханский университет». — 2008. — 108 с.
96. Извекова Г.И. Симбионтная микрофлора рыб различных экологических групп/ Г.И. Извекова, Е.И.Извеков, А.О. Плотников// Известия Российской академии наук. Серия биологическая. — 2007. — № 6. — С. 728-737.
97.Бурлаченко И.В. Применение пробиотиков на ранних стадиях развития ленского осетра/ И.В. Бурлаченко, Е.В. Малик // Ветеринария. — 2007. — № 3. — С. 47-51.
98.Котова Е.А. Пробиотики в аквакультуре / Е.А. Котова, Н.А. Пышманцева, Д.В. Осепчук, А.А. Пышманцева, Л.Н. Тхакушинова// Сб. научных трудов Всероссийского научно-исследовательского института овцеводства и козоводства. — 2012. — Том 3, № 1-1. — С. 100 — 103.
99.Романова Е.М. Инновационные технологии производства продуктов функционального назначения в индустриальной аквакультуре/ Е.М. Романова, В.В. Романов, В.Н. Любомирова, М.Э. Мухитова, Л.А. Шадыева, Т.М. Шленкина, И.С. Галушко// Рыбоводство и рыбное хозяйство. — 2018. — №5(148). — С. 54-59.
100.Ткачева И.В. Пробиотик как иммуномодулятор/ И.В. Ткачева, Н.Н. Тищенко// Труды Кубанского государственного аграрного университета. — 2017. — № 64. — С. 188-191.
101.Тихонова Е.М. Адаптогены в регуляции обмена веществ/ Е.М. Тихонова, И.В. Лунегова, А.Ю. Нечаев// Мат-лы IV Междунар. конгресса ветеринарных фармакологов и токсикологов: Эффективные и безопасные лекарственные средства в ветеринарии. — 2016. — С. 189 — 191.
102. Abdul Kader Mohideen M. Effect of Probiotic Bacteria on the Growth rate of Fresh Water Fish, Catla catla/ Abdul Kader Mohideen M., Mohan T., Peer Mohamed S., Hussain M. //International Journal of Biological Technology. — 2010. – 113-117 р.
103.Chaucheyras F. Probiotics in animal nutrition and health/ F. Chaucheyras, H. Durand// Lallemand Animal Nutrition, Blagnac, — France. — 2010. — Mar; 1(1): – 3-9 р.
104.Юрина Н.А. Использование кормовых добавок «Споротермин» и «Ковелос» в рационах молодняка сельскохозяйственных животных / Н.А. Юрина, З.В. Псхациева, С.И. Кононенко, Н.Н. Есауленко, В.В. Ерохин, В.А. Баранников// Мат-лы междунар. научно-практ. конф.: Современные технологии сельскохозяйственного производства и приоритетные направления развития аграрной науки. — 2014. — С. 263 — 264.
105. http://www.irkutin.ru/zhivotnye/ryba/
106. Хоулт Д. Определитель бактерий Берджи/ Д. Хоулт, Н. Криг — В 2 т. М.: Мир, 1997. — 799 с.
107. Romanova E.M. Biology of reproduction of catfish (Clarias Gariepinus, Burchell, 1822) in high-tech industrial aquaculture/ E.M. Romanova, V.N. Lyubomirova, V.V. Romanov, M.E. Mukhitova, T.M. Shlenkina, L.A. Shadyeva, I.S. Galushko// Journal of Fundamental and Applied Sciences. — 2018. — Т. 10. — № 5S. — С. 1116-1129.
108.МУК 4.2.1 884-04 Санитарно-микробиологический и санитарно паразитологический анализ воды поверхностных водоемов – Режим доступа: https://znaytovar.ru/gost/2/MUK_42188404_Sanitarnomikrobio.html
109.Приказ №535 от 22 апреля 1985 года «Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений» – Режим доступа: http://docs.cntd.ru/document/420245293
110.Юхименко, Л.Н. Перспективы использования суболина для коррекции микрофлоры кишечника рыб и профилактики БГС / Л.Н. Юхименко, Л.И. Бычкова // Проблемы охраны здоровья рыб в аквакультуре. Тезисы научно-технической конференции. – Москва, 2005. — С. 133-136.
111. Пробиотики в аквакультуре/ Е.А. Котова, Н.А. Пышманцева, Д.В. Осепчук, А.А. Пышманцева, Л.Н. Тхакушинова // Сборник научных трудов Всероссийского научно-исследовательского института овцеводства и козоводства. — 2012. — Том 3, № 1-1. — С. 100-103.
112. Использование кормовых добавок «Споротермин» и «Ковелос» в рационах молодняка сельскохозяйственных животных / Н.А. Юрина, З.В. Псхациева, С.И. Кононенко, Н.Н. Есауленко, В.В. Ерохин, В.А. Бараников // Современные технологии сельскохозяйственного производства и приоритетные направления развития аграрной науки. Материалы международной научно-практической конференции.– Донской ГАУ, 2014. — С. 263-264.
113.Ромашов, К.Б. Адаптогены как компенсаторный фактор отрицательного энергетического баланса /Ромашов К.Б., Лунегова И.В., Нечаев А.Ю. // Материалы IV-гo Международного конгресса ветеринарных фармакологов и токсикологов «Эффективные и безопасные лекарственные средства в ветеринарии». — Санкт-Петербург: Санкт-Петербургская государственная академия ветеринарной медицины, 2016. — С. 154-156.
114.Дейнекина, О.Г. Эффективность применения новых адаптогенов при стрессе у животных / О.Г. Дейнекина // Современные проблемы ветеринарной практики в АПК. Материалы Всероссийской научно-практической Интернет-конференции практикующих специалистов. – Ставрополь: Ставропольский государственный аграрный университет,
2016. — С. 281-282.
115.Тихонова, Е.М. Адаптогены в регуляции обмена веществ / Е.М. Тихонова, И.В. Лунегова, А.Ю. Нечаев // Эффективные и безопасные лекарственные средства в ветеринарии. Материалы IV-гo Международного конгресса ветеринарных фармакологов и токсикологов.– Санкт-Петербург: СанктПетербургская государственная академия ветеринарной медицины, 2016. — С. 189-191.
116.Буяров В.С. Эффективность применения биологически активных добавок в рыбоводстве /В.С.Буяров, Ю.А.Юшкова// Вестник Орловского государственного аграрного университета. 2016. № 3 (60). С. 30-39.
117.Иванова А.Б Перспективы применения бактериальных препаратов и пробиотиков в рыбоводстве/ А.Б. Иванова, Б.Г. Сариев, Г.А. Ноздрин, И.В.Морузи, Ю.С.Аликин //Вестник Новосибирского государственного аграрного университета. 2012. № 2-2 (23). С. 58-61
118.Романов В.В. Конструирование функционального рыбного продукта в условиях индустриальной аквакультуры /В.В.Романов, Е.М.Романова, В.Н.Любомирова, М.Э.Мухитова// Вестник Ульяновской государственной сельскохозяйственной академии. 2018. № 1 (41). С. 151-156.
119.Жандалгарова А.Д. Использование пробиотических препаратов с иммуномодулирующим действием в кормах для осетровых рыб при садковом выращивании/А.Д.Жандалгарова, А.В.Поляков, А.А.Бахарева, Ю.Н.Грозеску// Известия Самарского научного центра Российской академии наук. 2018. Т. 20. № 2. С. 107-111.
121.Яворская Т.А. Пробиотики в аквакультуре /Т.А.Яворская// Молодежный научный вестник. 2017.№ 11 (24). С. 18-25.
122. Paningrahi A. Microbial intervention for better fish health in aquaculture: the Indian scenario/ Paningrahi A, Azad IS// Fish Physiol Biochem. 2007;33:429e440.
123. Klewicki R Antagonistic activity of lactic acid bacteria as probiotics against selected bacteria of the Enterobaceriacae family in the presence of polyols and their galactosyl derivatives/ R. Klewicki, E. Klewicka// Biotechnol Lett. 2004; 26:317e320.
124.Ouwehand AC, Salminen S, Isolauri E. Probiotics: an overview of beneficial effects. Antonie Van Leewenhoek. 2002;82:279e289.
125.Wang YB, Xu ZR. Effect of probiotics for common carp (Cyprinus carpio) based on growth performance and digestive enzyme activities. Anim Feed Sci Technol. 2006;127:283e292.
126. Paningrahi A, Azad IS. Microbial intervention for better fish health in aquaculture: the Indian scenario. Fish Physiol Biochem. 2007;33:429e440.
127.Cabello FC. Heavy use of prophylactic antibiotics in aquaculture: a growing problem for human and animal health and for the environment. Environ Microbiol.- 2006.-8:1137e1144.
128.Coutteau P. Manual on the production and use of live food for aquaculture. //P. Coutteau, Lavens P. Microalgae, P. Sorgeloos// FAO Fisheries Technical Pa-per. – №. 361. – Rome, FAO. – 1996. – P. 10 – 13.
129.Krishnika A., Ramasamy P. Effect of water exchange to eliminate Vibrio sp. during the naupliar development of Artemia franciscanа/ A. Krishnika, P. Ramasamy// J. Fish. Aquat. Sc. – 2012. – 7. – P. 205 – 214.
130.Olsen A.I. Effects of short term feeding of microalgae on the bacterial flora associated with juvenile Artemia franciscana/ A.I. Olsen, Y. Olsen, Y. Attramadal// Aquaculture. – 2000. – 190. – P. 11–25.
131.Власов В. А. Выращивание клариевого сома (Clarias gariepinus Burchell) при различных условиях содержания и кормления// Состояние и перспективы развития пресноводной аквакультуры: Междунар. науч.-практ. конф., Москва, 5-6 февр. 2013 г.: докл. Москва: РГАУ МСХА им. К.А. Тимирязева, 2013. — С. 141-150.
132.Левина О.А. Опыт использования комбикормов с различной нормой содержания протеина при выращивании молоди африканского клариевого сома (Сlarias gariepinus) в условиях установки замкнутого водоснабжения/О.А. Левина, С.В. Пономарёв, М.А. Корчунова, Ю.В. Фёдоровых, Ю.М. Баканёва// Вестник Астраханского государственного технического университета. Серия: Рыбное хозяйство. — 2015. — № 3. — С. 93-101.
133.Артеменков Д. В. Сравнительная характеристика роста сомообразных рыб Silurus glanis и Clarias gariepinus/ Д. В. Артеменков// Рыбоводство и рыбное хозяйство. — 2017. — № 2. — С. 14-19.
134.Романова Е.М. Репродуктивная биотехнология африканского клариевого сома/ Е.М. Романова, В.Н. Любомирова, М.Э. Мухитова, В.В. Романов, Л.А. Шадыева, Т.М. Шленкина, И.С. Галушко// Рыбоводство и рыбное хозяйство. — 2017. — №12(143).- С. 49-57.
135.Шумак В.В. Моделирование роста клариевого сома в аквакультуре/ В.В. Шумак, С.В. Торганов// Известия Санкт-Петербургского государственного аграрного университета. — 2016. — № 44. — С. 120-127.
136.Мухитова М.Э. Прогностические критерии роста и развития африканского клариевого сома в условиях бассейновой аквакультуры/ М.Э. Мухитова, В.В. Романов, Е.М. Романова, В.Н. Любомирова// Вестник Ульяновской государственной сельскохозяйственной академии — №3(39) – 2017. – С. 70-78.
137.Васильев А.А. Резервы повышения рыбопродуктивности/ А.А.Васильев , В.В. Кияшко, С.А. Маспанова //Аграрный научный журнал. — 2013.- № 2.- С. 14-16.
138.Стратегия развития аквакультуры в Российской Федерации на период до 2020 года (утв. Минсельхозом РФ 10.09.2007). Режим доступа: http://www.mcx.ru/documents/document/show/12208.77.htm.
139.Effect of phytase supplementation on the growth, mineral composition and phosphorus digestibility of African Catfish (Clarias gariepinus) juveniles/ Orisasona O. et al.// Animal Research International. — 2017. — Vol. 14, iss. 2. — P. 2741-2750.
140.Effect of fish vitellogenin on the growth of juvenile catfish, Clarias gariepinus (Burchell, 1822) / Subir Kumar Juin et al. // Aquaculture Reports. — 2017. — Vol. 7. — P. 16-26.
141.Effect of different fertilization and egg de-adhesion methods on hatching and survival of Clarias gariepinus (Burchell 1822) fry/ Kareem O. K. et al. // Journal of FisheriesSciences.com. — 2017. — Vol. 11, iss. 1. — P. 21-27.
142. Complete replacement of fish meal by other animal protein sources on growth performance of Clarias gariepinus fingerlings/ Djissou A. S. M. et al.// Int. Aquat. Res. — 2016. — Vol. 8, iss. 4. — P. 333-341.
143. Changes in nutritional values induced by butachlor in juvenile diploid and triploid Clarias gariepinus/ Karami A. et al.// Int. J. Environ. Sci. Technol. -2017. — P. 1- 12.
144. Comparative studies of nutrient composition of wild caught and pond reared african catfish, Clarias gariepinus/ Ukagwu J. I. et al.// International Journal of Research in Applied, Natural and Social Sciences. — 2017. — Vol. 5, iss. 7. — P. 63-68.
145.Effects of storage conditions on quality characteristics of commercial aquafeeds and growth of African catfish Clarias gariepinus/ Solomon S. G. et al.// Journal of Fisheries. — 2016. — Vol. 74. — P. 30-37.
146. Голенева О.М. Интенсивность роста клариевых сомов в зависимости от освещенности и питания рыбы/ О.М. Голенева, Е.М. Романова//Мат-лы междунар. научно-практ. конф.: Глобализация науки: проблемы и перспективы. — Уфа,02 июня 2015 г. — 2015. — С. 16-19.
147. Голенева О.М. Влияние стресс-факторов на потребление корма африканскими сомами/ О.М. Голенева, Е.М.Романова, Э.Р. Камалетдинова// Мат-лы междунар. научно-практ. конф.: Перспективы и достижения в производстве и переработке сельскохозяйственной продукции. — 2015. — С. 246-250.
148.Камалетдинова Э.Р. Влияние состава кормов на качество воды в бассейновой аквакультуре Clarias gariepinus/ Э.Р.Камалетдинова, О.С.Шумихина, Е.М.Романова, В.Н. Любомирова // Сб. научных трудов «Научная интеграция», Москва, 01-29января 2016г. — Изд-во Научный центр «Олимп»- Астрахань, 2016. -С. 954-956.
149.Романова Е.М. Биологический контроль окружающей среды в зонах повышенной антропогенной нагрузки// Е.М. Романова, Д.С. Игнаткин, В.В. Романов, Л.А. Шадыева, Т.М. Шленкина. Ульяновск, 2015. — 240 с.
150.Романова Е.М Искусственное воспроизводство африканского сома с использованием гормональной стимуляции /Е.М.Романова, Е.В.Федорова, Э.Р. Камалетдинова// Зоотехния. — 2014.- №10. — С. 31-32.
151.Романова Е.М. Биологический контроль фертильности самок клариевого сома в бассейновой аквакультуре/ Е.М.Романова, В.Н. Любомирова, М.Э. Мухитова// Вестник Ульяновской государственной сельскохозяйственной академии. — 2016.- №3. — С. 78-84.
152.Любомирова В.Н. Сравнительная характеристика плодовитости самок клариевого сома, выращенных при разных температурных режимах/
В.Н. Любомирова, Е.М. Романова, В.В. Романов, Э.Р. Камалетдинова, Е.В. Любомиров//Научно-методический электронный журнал — Концепт. — 2016. — Т. 26. — С. 1011-1015.
153.Романова Е.М. Гормональная стимуляция в биотехнологиях искусственного нереста быстрорастущих видов рыб/ Е.М.Романова, В.Н. Любомирова, В.В. Романов, Э.Р. Камалетдинова//Научно-методический электронный журнал Концепт. — 2016. — Т. 26. — С. 1036-1040.
154.Камалетдинова Э.Р. Поиск эффективных препаратов для стимуляции репродуктивной функции Clarias gariepinus/ Э.Р.Камалетдинова, Е.М.Романова// Сб.к науч. трудов по итогам междунар. научно-практ. конф.: Инновационные технологии в области естественных и математических наук — 2016. — С. 20-23.
155.Шленкина Т.М. Индексы характеризующие экстерьер рыбы
/Т.М. Шленкина, А.К Шленкин// Научно-методический электронный журнал концепт. 2016. Т. 26. С. 406-410.
156.Мухитова М.Э. Проблемы культивирования стартовых живых кормов для аквакультуры/ М.Э. Мухитова, Е.М. Романова, В.Н. Любомирова, В.В. Романов, Т.М. Шленкина, Л.А. Шадыева//Международный научно-исследовательский журнал. — 2017. —№1-2(55). — С. 13-15.
157.Пряхин Ю.В. Методы рыбохозяйственных исследований / Ю.В. Пряхин, В.А. Шкицкий — Краснодар, 2006 – 214 с.
158. Rombough PJ Partitioning of oxygen uptake between the gills and skin in fish larvae: a novel method for estimating cutaneous oxygen uptake. /PJ Rombough — Journal of experimental biology, 1998 — jeb.biologists.org – P. 1763-1769.
159.Brauner CJ Ontogeny and paleophysiology of the gill: new insights from larval and air-breathing fish / CJ Brauner, PJ Rombough — Respiratory physiology & neurobiology, 2012 – Elsevier – P. 293-300.
160.Peng C. Neuroendocrine regulation of growth hormone secretion and growth in fish /C. Peng, R. Peter — Zoological studies-taipei — 1997 — P.79-89.
161.Мухитова М.Э. Сравнительные исследования роста и развития популяций африканского клариевого сома, репродуцированных в разные сезоны/ М.Э. Мухитова, Е.М. Романова, В.Н. Любомирова, В.В. Романов// Вестник Ульяновской государственной сельскохозяйственной академии. — 2018. — Т. 42. — № 2. — С. 193-198
162.Романова Е.М. Пробиотики и адаптогены в лечении аэромоноза африканского клариевого сома/ Е.М. Романова, В.Н. Любомирова, Л.А. Шадыева, Т.М. Шленкина//Вестник Ульяновской государственной сельскохозяйственной академии. — 2017. — № 4(40). — С. 86-93.
163.Романов В.В. Конструирование функционального рыбного продукта в условиях индустриальной аквакультуры/ Романов В.В., Романова Е.М., Любомирова В.Н., Мухитова М.Э.// Вестник Ульяновской государственной сельскохозяйственной академии. — 2018. — № 1(41). — С. 151-156.
164. http://www.irkutin.ru/zhivotnye/ryba/
165. Камалетдинова Э.Р. Влияние состава кормов на качество воды в бассейновой аквакультуре Clarias gariepinus/Э.Р.Камалетдинова, О.С.Шумихина, Е.М.Романова, В.Н.Любомирова// Сб. научных трудов «Научная интеграция», Москва, 01-29января 2016г. — Изд-во Научный центр «Олимп»- Астрахань, 2016. -С. 954-956.
166. Orisasona O. Effect of phytase supplementation on the growth, mineral composition and phosphorus digestibility of african catfish (Clarias gariepinus) juveniles/ Orisasona O. et al.// Animal Research International. — 2017. — Vol. 14, iss. 2. — P. 2741-2750.
167.Weyl O.L.F.A review of clarias gariepinus invasions in brazil and South Africa /Weyl O.L.F., Ellender B.R., Vitule J.R.S., Daga V.S.//Journal of fish biology. 2016 Т. 89 № 1 С. 386-402.
168.Suleiman M.A. Effect of stocking on the growth and survival of Clarias gariepinus grown in plastic tanks/ M.A. Suleiman, R.J. Solomon// Direct Res. J. Vet. Med. Anim. Sci. — 2017 — Vol. 2, iss. 3.- P. 82-92.
169. Kawamura G. Food colour preference of hatchery-reared juveniles of african catfish clarias gariepinus/G.Kawamura, M.F.B.Asmad, L.-S.Lim, T.U.Bagarinao// Applied animal behaviour science. 2017 Т. 196 С. 119-122.
170. Bwala R.Ovoviviparously produced artemia nauplii are a suitable live food source for the larvae of the African catfish (Clarias gariepinus: Burchell, 1822)/ R.Bwala, K.Salie, G.Van Stappen// Aquaculture Research. 2018 Т. 49 № 10 С. 3319-3328
171. Solomon S.G. Growth response and aggressive behaviour of Clarias gariepinus fingerlings reared at different photoperiods in a water re-circulatory system/S.G.Solomon, V.T.Okomoda// Livestock research for rural development. 2012 Т. 24 № 11.
172. Sallehudin M.F Aggressive behavior of African catfish Clarias gariepinus juveniles under different light intensities and light wavelengths//M.F.Sallehudin, N.A.Yusoff, N.H.Tan, S.Saad, Y Mukai. Malaysian applied biology. 2017 Т. 46 № 4 С. 7-13.
173.Awaiss A. Feeding sequences (rotifer and dry diet), survival, growth and biochemical composition of african catfish, Clarias Gariepinus Burchell (pisces: Clariidae), larvae/A. Awaiss, Kestemont P.//Aquaculture Research. 1998. Т. 29. № 10. С. 731-741.
174.Makhutova O.N. Characteristics of fatty acid composition of gammarus lacustris inhabiting lakes with and without fish / O.N. Makhutova, G.S. Kalachova, M.I. Gladyshev, T.A. Sharapova, S.P. Shulepina // Doklady Biochemistry and Biophysics. — 2016. — Т. 466. № 1. — С. 20-22.
175.Memon N.N. A comparison of proximate composition and fatty acid profile of indus river fish species /N.N. Memon, F.N. Talpur, M.I. Bhanger // International Journal of Food Properties. 2010. Т. 13. № 2. С. 328-337.
176. Bayir A. Fatty acid composition in some selected marine fish species living in turkish waters/A. Bayir, H.I. Haliloǧlu, A.N. Sirkecioǧlu, N.M. Aras//Journal of the Science of Food and Agriculture. 2006. Т. 86. № 1. С. 163-168.
177. Barbosa R.G. The chemical composition of different edible locations (central and edge muscles) of flat fish (lepidorhombus whiffiagonis) / R.G. Barbosa, R. Fett, M. Trigo, S.P. Aubourg, R. Prego // International Journal of Food Science & Technology. 2018. Т. 53. № 2. С. 271-281.
178. Гадзаонов Р.Х. Химический состав мяса карповой рыбы и его органолептические показатели после кормления каныгой / Р.Х. Гадзаонов, А.Р. Габеева, Б.С. Никколова//Известия Горского государственного аграрного университета. 2015. Т. 52. № 2. С. 115-119.
179. Korzhavin A.V. Characteristics of chemical composition and fish population of small rivers South Khanty-Mansiysk Autonomous Region / A.V. Korzhavin, E.I. Popova, E.S. Zemtsova, A.Ju. Tokarjova, A.A. Chemagin, I.A. Cherkashina // In the World of Scientific Discoveries, Series B. 2013. Т. 1. № 1. С. 74-83.
180. Патент № 2524358 Российская Федерация, МПК A23L 1/29, A23L 1/325, A23L 1/303. Функциональный пищевой ингредиент с заданным липидным профилем: заявл. 24.07.2012: опубл. 27.07.2014 / Тутельян В.А., Кочеткова А.А., Смирнова Е.А., Королева О.В., Николаев И.В., Шинкарев С.М.: заявитель Федеральное государственное бюджетное учреждение «Научно-исследовательский институт питания РАМН» Российской академии медицинских наук (ФГБУ «НИИ питания» РАМН). — 5 с.
181. Szabó A. Effects of dietary vegetable oil supplementation on fillet quality traits, chemical and fatty acid composition of african catfish (Clarias Gariepinus) / A. Szabó, R. Romvári, T. Molnár, L. Locsmándi, G. Bázár, P. Horn, C. Hancz, L. Szathmári, E. Molnár // Archiv fur Tierzucht. 2009. Т. 52. № 3. С. 321-333.
182. Stancheva M. Fatty acid composition of fish species from the Bulgarian black sea / M. Stancheva, A. Merdzhanova, L. Makedonski // Acta Medica Bulgarica. 2011. Т. 38. № 1. С. 26-33.
183. Ткачева И.В. Экономическая целесообразность применения пробиотиков при выращивания карпа /И.В. Ткачева // Эффективное животноводство. 2017. №4 (134). С. 24-26.
184. Лазовская, А.Л. Споровые пробиотики в сельском хозяйстве /А.Л. Лазовская, З.Г. Воробьева, К.Н. Слинина, М.А. Кульчицкая // Успехи современной биологии. 2013. Т. 133. №2. С. 133-140.
185. Kesarcodi-Watson, A. Probiotics in aquaculture: The need, principles and mechanisms of action and screening processes/ А. Kesarcodi-Watson, H. Kaspar, M.J. Lategan, L. Gibson // Aquaculture. 2008. Т. 274. № 1. С. 1-14.
186. (9.) Das, S. Prospects of using marine Actinobacteria as probiotics in aquaculture/S. Das, L. Adams, C. Burke//Applied microbiology and biotechnology. 2008. Т. 81. № 3. С. 419-429.
187. Zorriehzahra, M.J. Probiotics as beneficial microbes in aquaculture: an update on their multiple modes of action: A review/ M.J Zorriehzahra, M. Adel, S.T. Delshad, R. Tiwari, K. Karthik, K. Dhama, C.C. Lazado // Veterinary quarterly. 2016. Т. 36. № 4. С. 228-241.
188. Hai, N.V. The use of probiotics in aquaculture/ N.V. Hai // Journal of applied microbiology. 2015. Т. 119. № 4. С. 917-935.
189. Kuebutornye, F.K.A. A review on the application of Bacillus as probiotics in aquaculture/ F.K.A. Kuebutornye, E.D. Abarike, Y. Lu // Fish & shellfish immunology. 2019. Т. 87. С. 820-828.
190. Soltani, M. Genus bacillus, promising probiotics in aquaculture: aquatic animal origin, bio-active components, bioremediation and efficacy in fish and shellfish / M. Soltani, A.J. Lymbery, K. Ghosh, S.H. Hoseinifar, V. Kumar, S. Roy, E. Ringø // Reviews in fisheries science and aquaculture. 2019. — Т. 27. — №3. С. 331-379.
191. Desriac, F. Exploring the hologenome concept in marine bivalvia: haemolymph microbiota as a pertinent source of probiotics for aquaculture / F. Desriac, P. Le Chevalier B. Brillet, I. Leguerinel, Y. Fleury, B. Thuillier C. Paillard// Fems microbiology letters. 2014. Т. 350. №1. С. 107-111.
192. Коржевский, Д.Э. Основы гистологической техники. — СПб.: Спец.Лит. 2010. — 95 с.
