Титульный лист и исполнители
Реферат
Отчет содержит: 3 раздела,56 страницы, 5 таблиц, 8 рисунков, 61 литературных источников.
В настоящее время вопрос восстановления почвенного плодородия в нашей стране стоит особенно остро. За последние 20-25 лет отмечено снижение содержания гумуса по стране на 0,4 % на площади, превышающей 20 млн. га. Для обеспечения бездефицитного баланса гумуса в пахотных почвах России требуется ежегодно 1,5 млрд. тонн органических удобрений в пересчете на подстилочный навоз. Основными видами органических удобрений являются навоз, помет и различные компосты на их основе. Несмотря на высокую питательную ценность навоза и помета объемы использования органических удобрений остаются низкими(менее 1т/га или 10 % от потребности) и не обеспечивают даже простое воспроизводство плодородия пашни. Внесение навоза и помета опасно в связи с наличием возбудителей инфекционных и инвазионных заболеваний человека и животных,нативный навоз содержат семена сорняков, отличаются высоким содержанием аммиака, сероводорода, фенола, меркаптана, солей тяжёлых металлов и других опасных веществ[1].
Цель работы: разработка биотехнологических способов обезвреживания и переработки навоза и помета, а также очистки и детоксикации сточных вод животноводческих ферм и птицеводческих хозяйств.с получением практически ценных продуктов, обеспечивающих повышение урожайности полевых и кормовых культур, их фунгицидную и бактерицидную защиту.
Результаты исследования имеют практическую значимость позволяют повысить эффективность использования органических удобрений, сократить дефицит гумуса и в конечном итоги повысить урожайность возделываемых культур .
Ключевые слова: животноводческие стоки, навоз, биотехнологическая подготовка, аборигенные микроорганизмы, консорциум.
Введение
В настоящее время вопрос восстановления почвенного плодородия в нашей стране стоит особенно остро. По данным Министерства сельского хозяйства Российской Федерации, за последние 5 лет вынесено из почвсельскохозяйственных культур в 2,5 раза больше питательных веществ, чем было внесено. За последние 20-25 лет отмечено снижение содержания гумуса по стране на 0,4 % на площади, превышающей 20 млн. га. В большинстве пахотных почв России сложился отрицательный баланс гумуса. Ежегодные потери гумуса в РФ достигают 0,62 т/га, или 81,4 млн т. Наибольшие потери гумуса наблюдаются в республиках, краях и областях, расположенных в степной зоне. Пашня, расположенная в степной зоне, ежегодно теряет 0,8–1,0 т/ га гумуса [2]. Установлено, что снижение содержания в почве гумуса только на один процент приводит к снижению урожайности сельскохозяйственных культур на 0,5 ц/га зерновых единиц. Следовательно, ежегодный недобор урожая может составлять не менее 40 млн. тонн зерновых единиц. По расчетам Почвенного института им. В.В. Докучаева, ВИУА, ЦИНАО, ВНИПТИОУ, ВНИИЗиЗПЭ для обеспечения бездефицитного баланса гумуса в пахотных почвах России требуется ежегодно 1,5 млрд. тонн органических удобрений в пересчете на подстилочный навоз.
По данным ФГНУ «Росинформагротех» общее количество отходов в АПК достигает 1500 млн.т., из них сельскохозяйственных отходов — 630-650 млн т. отходы лесо- и деревообработки — 700 млн т., отходы пищевых и пищеперерабатывающих — в среднем 30 млн т в год [3]. Основными видами органических удобрений используемых в сельскохозяйственном производстве являются навоз, помет и различные компосты на их основе. Выход в России навоза и помета во всех категориях хозяйств в пересчете на подстилочный навоз в настоящее время составляет 294 млн. т., или 211 млн. т в пересчете на подстилочный навоз. Навоз содержит большое количество биогенных веществ, которые определяют его как ценное органическое удобрение. Так навоз крупного рогатого скота содержит от 4 до 23% сухого вещества, из них азота – от 2,4 – 6,5 кг/т, фосфора от 0,4 до 1,8 кг/т, калия – от 2,0 до 5,8 кг/т, магния от 0,2 до 0,6 кг/т навоза; свиной навоз от 5 до 25% сухого вещества, в том числе азота – от 6 до 6,8 кг/т, фосфора – от 0,6 до 2,1 кг/т, калия – от 1,7 до 3,6 кг/т, магния – от 0,3 до 0,7 кг/т; птичий помет содержит от 23 до 68% сухого вещества, в том числе азота — от 9,6 до 23 кг/т помета, фосфора — от 2,4 до 12 кг/т, калия – от 3,8 до 11,6 кг/т, магния – от 1,2 до 2,2 кг/т.. Несмотря на высокую питательную ценность навоза и помета объемы использования органических удобрений остаются низкими и не обеспечивают даже простое воспроизводство плодородия пашни. Ежегодное внесение органических удобрений за последние годы составляет менее 1т/га или 10 % от потребности [4]. Внесение навоза и помета в свежем виде в почву без предварительной обработки опасно связи с наличием возбудителей свыше 100 видов инфекционных и инвазионных заболеваний человека и животных (ящур, бруцеллёз, сибирская язва, лептоспироз и др.), яиц гельминтов, плесеней, медикаментозных препаратов [5]. Навоз и помет имеют, как правило, высокую влажность, неприятный запах, содержат семена сорных растений, отличаются высоким содержанием аммиака, сероводорода, фенола, меркаптана, солей тяжёлых металлов и других опасных веществ [6]. Таким образом, являясь ценным органическим удобрением, использование навоза без предварительной подготовки представляет серьезную экологическую опасность для окружающей среды, животных и людей. Ввиду несовершенства технологий, особенно при бесподстилочном способе содержания животных, часть навоза и помета разбавляется водой в 12-14 раз, что значительно осложняет и обработку и транспортировку этих отходов.Дополнительных емкостей, хранилищ, очистных сооружений для сбора и переработки жидких стоков. В результате навоз и помет на фермах накапливается, занимает большие площади, загрязняя грунтовые воды и атмосферу. Неиспользованный навоз и помет сбрасывают в овраги, спускают в водоемы, захоранивают [7]. Перспективными направлениями по утилизации и обезвреживанию отходов животноводства и птицеводства являются развитие российских биотехнологий аэробного и анаэробного биотермического компостирования, при использовании которых отходы органического происхождения обезвреживаются и превращаются в ценное органическое удобрение (биогумус, компост), а также получение биогаза, твердого топлива и производство строительных изделий [8].
Целью работы явилось разработка биотехнологических способов обезвреживания и переработки навоза и помета, а также очистки и детоксикации сточных вод животноводческих ферм и птицеводческих хозяйств с получением практически ценных продуктов, обеспечивающих повышение урожайности полевых и кормовых культур, их фунгицидную и бактерицидную защиту.
Задачами исследований явилось:
- Выделить наиболее активные деструкторы высокомолекулярных органических соединений из числа аборигенной микрофлоры навоза и помета, провести их идентификацию;
- Подобрать условия для роста и развития штаммов –деструкторов в условиях непрерывного потока и разработать двух стадийную технологию очистки стоков животноводческих ферм с получением практически ценных продуктов.
- Подбор микроорганизмов из числа аборигенной микрофлоры или интродуцированных штаммов для ускорения утилизации, переработки и обезвреживания навоза и помета и получению органический продуктов, обладающих свойством удобрения.
I Обзор литературы
1.1 Современное состояние использования органических удобрений.
Согласно данным FAOSTAT, объем внесенных удобрений на основе животного сырья в мире вырос с 26,7 млн. тонн в 2013 году до 27,6 млн. тонн в 2016 году. Согласно данных Росстата, в России в 2018 году сельскохозяйственными организациями было внесено 68,8 тыс. тонн органических удобрений, что на 23,5 % по сравнению с 2013 годом. Из общего объема используемых органических удобрений наибольшая доля приходится на зерновые и зернобобовые культуры (без кукурузы) — 45-50 %. и кормовые культуры — около 30 % от всего объема органических удобрений. Под подсолнечник вносилось чуть более 4-6 % , сахарную свёклу 3 %, картофель около 1-1,5 %, под овощи и бахчевые культуры – менее 0,5 % (рисунок 1).
В 2017 году наибольшая доля внесения органических удобрений приходится на Центральный федеральный округ – 37 % от всего объема органических удобрений в России. На втором месте Приволжский федеральный округ – 24 %. На третьем месте находится Северо-Кавказский федеральный округ – 13 % (рисунок 2).
В Центральном ФО, лидере по внесению органических удобрений, за период 2013-2017 гг. наблюдается наращивание объемов внесения сельскохозяйственными организациями органических удобрений. В 2014 году показатель составил 23 235 тыс. тонн, что на 18,3 % больше, чем в 2013 году (19 647 тыс. тонн). В 2015 году этот показатель остался практически на уровне 2014 года (+0,03 %, 23 242 тыс. тонн). В 2016 году в Центральном федеральном округе объем внесения органических удобрений замедлился на 0,5 % (23 117 тыс. тонн).
На следующий год произошло увеличение объемов внесения на 7,2 % (24 773 тыс. тонн). Следует отметить, что в 2016 году только Приволжский федеральный округ, Уральский федеральный округ и Дальневосточный федеральный округ сократили объемы внесения органических удобрений в 2017 году на 2%, 2 % и 0,7 % соответственно).
Рисунок 1 Внесено сельскохозяйственными организациями органических удобрений по видам сельскохозяйственных культур в 2013-2017 гг., тыс. т
В остальных округах показатель незначительно увеличился: Северо-Западный (+0,7 %), Южный ФО (+0,4 %), Северо-Кавказский ФО (+0,3 %), Сибирский ФО (+0,3 %) (рисунок 2).
В 2017 году наибольшая доля вносимых удобрений пришлась на Белгородскую область – 13,6 %, опередившую Ставропольский край, который по результатам спустился на вторую строчку – 12,8 %. На третьем месте находится Воронежская область – 7,7 % (рисунок 2).
Приведенные выше данные свидетельствуют о том, что несмотря на увеличение объемов использования органических удобрений, значительное количество отходов животноводства и птицеводства остается невостребованным и требует соответствующей подготовки к применению в качестве удобрения.
Рисунок 2 Внесено сельскохозяйственными организациями органических удобрений в регионах РФ, тыс. т
1.2 Проблемы и пути утилизации и переработки твердых и жидких отходов животноводства и птицеводства
На крупных фермах Российской Федерации ежегодно образуется 200-250 млн.т навоза и 20-25 млн.т помета, жидких стоков в совокупности достигают 700-800 млн. т приводит к накоплению больших запасов навоза и помета.
В соответствии с Федеральным классификационным каталогом отходов навоз классифицируется следующим образом: навоз КРС перепревший (хранение не менее шести месяцев) – V класс опасности; навоз КРС свежий – IV класс опасности; навоз от свиней свежий – III класс опасности; навоз от свиней перепревший (хранение не менее одного года) – IV класс опасности. Птичий помет рассматривается как токсичные отходы производства III класса опасности [9]. Основными направлениями утилизации твердых и жидких отходов животноводства и птицеводства является использование в качестве органического удобрения. Ранее, когда концентрация скота и птицы на единицу земельных угодий была очень низкой, навоз и помет накапливали около фермы или вывозили на поля, где он постепенно превращался в перегной [10].В почве навоз и помет разлагаются медленно. Избыточное количество навоза и помета нарушает структуру почвенного сообщества и подавляет активность почвенной микрофлоры, поэтому для безущербной утилизации навоза необходимы большие земельные площади. Транспортировка на дальние расстояния, как правило, экономически не оправдана, требует значительного количества техники, затрат труда и денежных средств и не окупается прибавками к урожаю. что ограничивает его применение [11].
Остановимся поподробнее на некоторых методах получения удобрений из навоза и помета:
1.3 Сушка и гранулирование помета
Эффективным способом сохранения питательных веществ помета является его термическая обработка. Сушка помета при температуре 600-800° уничтожает возбудителей болезней и семена сорняков [12], [13]. Снижение влажности с 75-80 % до 20-25 % уменьшает массу конечного продукта в 3-4 раза. Высушенный помет представляет собой высококонцентрированное органическое удобрение, лишенное зловонного запаха, с благоприятными физическими свойствами. Высокотемпературная сушка также имеет недостатки: термически высушенный навоз и птичий помет может содержать канцерогенные вещества, при сушке наблюдаются значительные потери питательных веществ, высоки затраты на энергоносители. Учитывая, что рыночная цена продуктов из переработанных продуктов низкая, использование сушки – чаще всего нерентабельный метод. Российские ученые института машиноведения РАН создали технологию получения органического удобрения из птичьего помета Гуано путем низкотемпературного обезвоживания помета в вакууме. Однако, при низкотемпературной сушке получают обезвоженный, но не полностью обеззараженный продукт. В нем сохраняются некоторые патогенные микроорганизмы и семена сорных растений [14].Такой продукт нежелательно использовать на полях в качестве удобрения. Кроме того, установки для низкотемпературной сушки сложны в изготовлении, дороги для приобретения, и неэкономичны в эксплуатации. В нашей стране и за рубежом для сушки навоза и помета в основном используются вращающиеся барабанные сушилки. Технологические схемы и. компоновка оборудования этих сушилок отличаются типами топок, барабанов, конструкциями пылеулавливающих устройств. Барабанные сушилки экономичны по расходу тепла и энергии, а также имеют сравнительно большую производительность [15].
1.4 Сушка навоза и помета энергией сверх высокой частоты (СВЧ)
Монолаков В.А. в соавторстве (1995), предложил способ производства сухого птичьего помета воздействием на птичий помет (сырой) электромагнитным излучением на сверх высокой частоте (СВЧ) с одновременной обдувкой горячим воздухом в ограниченном пространстве (рисунок 3). Особенность нагрева СВЧ — близость или совпадение резонансной частоты электромагнитного поля, возбужденного в камерах СВЧ — установках. Вследствие чего происходит быстрое нагревание материала по всему объему, и сильнее нагреваются те участки, где влажность сырья выше. Более сухие места нагреваются медленнее, происходит своеобразное регулирование нагрева. Процесс сушки идет при сравнительно низких температурах порядка 80-120°С, благодаря чему в помете полностью сохраняются все питательные вещества, включая аминокислоты. Кроме того, при указанном виде сушки достигается стерилизующий эффект готовой продукции, что обусловлено, как термическим действием энергии СВЧ, так и нарушением электромагнитного равновесия микробной клетки, находящейся в высушиваемом материале [16]. Установка сушки на СВЧ содержит: СВЧ — камеру, источники излучения, конвейер, герметичные загрузочные и накопительные бункеры, системы подачи горячего воздуха и сырья. Использование герметичных, загрузочных и накопительных бункеров, исключает паразитное СВЧ — излучение в окружающую среду. Однако, стоимость СВЧ -генераторов сравнительно высока. Поэтому способ пока не получил широкого применения.
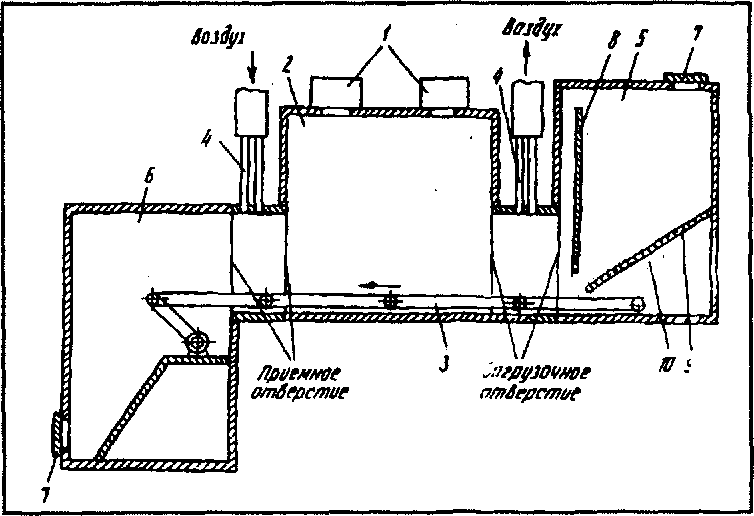
Рисунок 3 Способ производства сухого органического удобрения в СВЧ камере: 1 — излучатель СВЧ — энергии; 2 -СВЧ камера; 3 — конвейер; 4 -трубки для подачи и откачки воздуха; 5 — загрузочный бункер; 6 — накопительный бункер; 7 — люк для загрузки сырья и выемки продукта; 8 — заслонка; 9 -виброполка; 10-вибратор.
Компанией «ЛЕСИНТЕХ», которая была создана в 2006 г. разработана технология и оборудование, позволяющие без перенастройки получать из навоза и помета на одном оборудовании продукт, который может быть использован как топливо, почвообразующее удобрение и добавка к корму крупного рогатого скота и рыб. Технология компании «ЛЕСИНТЕХ» сводится к следующему: Условно технологический цикл разделяется на 3 участка.
1. Приём, складирование, подготовка и подача сырья.
2. Участок сушки – сушка и обеззараживания сырья, и очистка выбросов.
3. Участок гранулирования – получение готовых гранул, фасовка, упаковка.
Высокотемпературная сушка также имеет недостатки: термически высушенный навоз и птичий помет может содержать канцерогенные вещества, при сушке наблюдаются значительные потери питательных веществ, высоки затраты на энергоносители. Учитывая, что рыночная цена продуктов из переработанных продуктов низкая, использование сушки – чаще всего нерентабельный метод [17].
1.5 Производство микроэлементсодержащего органического удобрения
Существуют и другие способы переработки навоза и птичьего помета. Удобрения производят с любым набором макро- и микроэлементов, их можно использовать под любые сельскохозяйственные культуры и на любых почвах, при этом прирост урожайности составляет 20-25 %[18]. Исследованиями ученых Всероссийского научно-исследовательского и проектно-технологического института химизации сельского хозяйства доказана перспективность производства органических удобрений на основе навоза и птичьего помета, древесных опилок, торфа, лигнина и других местных органических компонентов. Использование полученных удобрений (50 т/га) в районах Севера позволяет увеличить урожайность картофеля с 7,2 до 17,1 т/га (или в 2,4 раза), рапса — с 12,5 до 18,4 т/га, или на 47,2 % [19]. Например, потери азота при длительном хранении птичьего помета можно предотвратить, если химически связывать выделяемый аммиак при помощи порошковидного суперфосфата, фосфоритной муки и фосфогипса. Так, на Томилинском птицеводческом производственном объединении Люберецкого района Московской области отработали технологии приготовления компостов с различным соотношением торфа, помета и фосфогипса. Оптимальной оказалась технология, предусматривающая соотношение торфа к помету 1:2с добавлением 10 % фосфогипса. Эта технология позволяет сэкономить торф и улучшить физические свойства компоста. Благоприятное действие фосфогипса объясняется тем, что сера, входящая в его состав, связывает выделяющийся аммиачный азот в сульфат аммония [20].
1.6 Биоконверсия отходов животноводства и птицеводства
Экологически и экономически более эффективно использование биотехнологических методов.
Отдельное место среди технологических схем переработки и утилизации навоза занимают биореакторы (биостанции), или биогазовые установки. Они представляют собой комплекс по переработке навоза, помета и навозной жижи, вырабатывающий электричество, тепло и высококачественные органические удобрения. После очищения биогаза получается биометан, который может быть использован для освещения, отопления и заправки автомобилей. Возле биогазовых установок выгодно ставить теплицы. Однако стоит отметить, что биогазовые установки не нашли широкого применения в России, что связано с их высокой стоимостью. Так, средняя стоимость биогазовой станции зарубежного производства под ключ составляет 2,5-4 млн. € за 1 МВт Возможна комплектация биогазовой установки линией сушки и фасовки удобрений (плюс 25%). Для производства биометана (аналог природного газа), годного для заправки в автомобили или подачи в газовую сеть, установка оснащается системой очистки (плюс 25–30% от базовой комплектации) [21]. Кроме того, доказано, что устанавливать биогазовую установку экономически целесообразно лишь на крупных животноводческих и птицеводческих хозяйствах с численностью животных или птиц более 10 тыс. голов [22], [23] .
1.7 Аэробные методы ферментации навоза и помета
В результате получают удобрения со свойствами, отличными от свойств исходных материалов. В частности компостирование навоза и помета с торфом, древесными опилками, соломой, сапропелем, почвой резко снижает потери азота. При этом значительно уменьшается неприятный запах и загрязнение окружающей среды [24],[25].
Компостирование – это экзотермический процесс биохимического окисления, в котором органический субстрат подвергается аэробной деструкции специфической популяцией микроорганизмов в определенных условиях. Компосты, как правило, состоят из двух основных компонентов, неодинаковых по степени устойчивости к разложению микроорганизмами. Один из них – легкоразлагающийся компонент – это птичий помет (или навоз и т.д.) – который богат питательными веществами, преимущественно азотсодержащими, микрофлорой. Другой компонент — торф, лигнин, солома, опилки и т.д. – обладает высокой влагоемкостью, содержит преимущественно сложные полисахариды и слабо разлагается в природе. Компостированием получают ценные для сельского хозяйства органические удобрения и средства, улучшающие структуру почвы. Большое распространение получило получение искусственной почвы с помощью компостирования и её использование в биоинтенсивном земледелии. Компосты можно использовать для выращивания грибов, в качестве основного удобрения на огородах, садовых участках. Тепло, выделяемое при компостировании, можно применять для нагрева воздуха и воды до температуры 50-55 0С и отопления парников [26].
В зависимости от составляющих компонентов можно выделить следующие виды компостов: торфонавозные, торфожижевые, сборные (приготовленные из твердых бытовых и промышленных отходов), навозно-почвенные, торфопометные, пометноопилочные, пометнолигниновые, пометопочвенные и другие [27]. Длительность компостирования зависит от климата, продолжительности хранения компостной массы, влажности, условий аэрации. Полевое компостирование в кучах и буртах требует больших площадей и длится в зависимости от биодоступности субстрата, применяемой механизации и системы аэрации от 3 недель до 1, 5 лет. В крупных масштабах этот метод невозможно применять вблизи населенных пунктов. По окончании компостирования степень переработки органического вещества составляет 40-60%, влажность массы снижается до 25-50%, зольность увеличивается до 25-70% и существенно уменьшается её объем, а оставшийся органический субстрат претерпевает физические и химические превращения, сопровождающиеся образованием гумифицированного конечного продукта. Выделяют 4 стадии компостирования.
I стадия — мезофильная (развиваются мезофильные микроорганизмы, температура внутри смеси начинает постепенно повышаться с 10-15 до 30-40 0С); II стадия – термофильная (температура смеси достигает 40-450С), когда начинают развиваться термофилы и температура продолжает возрастать, достигая максимальных значений 70-800С). Из-за протекания процессов аммонификации рН начинает повышаться. Условия, благоприятные для развития термофильных бактерий сохраняются недолго, термофильные бактерии спорулируют и в таком состоянии сохраняют жизнеспособность. Скорость окисления начинает падать, рН убывать, но все еще остается щелочным. III стадия – остывания. По мере остывания сначала начинают восстанавливаться популяции спорообразующих бактерий, актиномицетов и грибов. Бурно развиваются актиномицеты, которые выделяют антибиотики, подавляющие микобактерии и гнилостные бактерии, сохранившиеся после термостадии, что способствует обеззараживанию компостированного материала. Продолжительность первых трех стадий составляет несколько суток и недель. IV стадия – созревание. На этой заключительной стадии наблюдается дефицит питательных веществ, смена доминирующей микрофлоры приводит к лизису части микробных клеток, появляются почвенные животные. Идет образование гумусового вещества. Продолжительность последней четвертой стадии длится несколько месяцев. При соблюдении технологии получают биогумус хорошего качества; органические вещества – 25-80%; углерод – 8-50%; азот – 0,4 – 3,5%; фосфор – 0,1-1,6%; калий – 0,4 -1,6%; кальций в виде CaO – 0,7-1,5%; рН компоста – 6,5 – 7,5%. Ускоряют переработку помета штаммы бактерий или грибков под общим названием «эффективные микроорганизмы» — это микроорганизмы, выделенные из компоста или специально селекционированные штаммы-деструкторы на основе термофильных актиномицетов, бактерий, грибов. Добавки на основе аборигенной микрофлоры получают методом накопительных культур на компостируемых субстратах, например, в аппаратах с принудительным перемешиванием и аэрацией. Полученную закваску вносят в основную компостную массу. Добавление стартовых культур может сократить сроки компостирования до 4-15 суток [28], [29]. В институте сельскохозяйственной микробиологии (г. Санкт-Петербург) под руководством И.А. Архипченко была разработана технология переработки бесподстилочного помета (навоза), основанная на микробио-трансформации исходного отхода в гранулированные биоудобрения. Результаты исследований, проведенных в с 1996 года по 2003 год, свидетельствуют, что получаемые удобрения (бамил, омуг, пудрет, экуд) по действию на продуктивность растений и агрохимические свойства почвы существенно превосходят действие традиционных органических и минеральных удобрений [30].
В настоящее время на российском рынке представлен достаточно широкий круг различного рода биоактиваторов и ферментных препаратов, предназначенных для глубокой переработки навоза и биологической очистки сточных вод и отстойников на свинофермах. Среди наиболее известных можно отметить такие, как Липастар, Микрозим, Оксидол, Водограй, Абсолют-Агро, Тамир и другие [31].
Применение биоактиваторов способствует снижению затрат на откачку и/или перемешивание навоза, сокращению сроков его обеззараживания и созревания в хранилищах, улучшению усвоения питательных веществ растениями, сохранению содержания азота на безопасном для растений и почвы уровне, снижению количества выбросов cероводорода и аммиака в атмосферу, уменьшению неприятного запаха и количества мух в стойлах. Все большее распространение приобретают комплексные технологии переработки свиного навоза. Одной из них является технология «Биохлев», представляющая собой комплекс анаэробных и аэробных бактерий для переработки навоза и прочих продуктов жизнедеятельности животных, производимая английской компанией Bio-SystemsEurope [32].
Механизированным компостированием (в биореакторах, биотуннелях, ферментационных барабанах, траншеях) можно уменьшить сроки компостирования до 2-3 недель и даже 2-7 суток. Объемы биореакторов для компостирования достигают 100-500 м3, производительность от 0,5 до 300 т компоста в сутки. В комплекты оборудования таких систем входят контейнеровозы, погрузчики, транспортеры, прессы, барабанные грохоты, магнитные сепараторы, установки для измельчения отходов, смесители, биофильтры или компостные фильтры для рыхления и перемешивания, компостной массы грейферного, лопастного, шнейкового и других типов. Компостирование с использованием механизированных технологий проводится в два этапа: первый – ускоренное разложение органического материала в условиях контролируемой температуры, влажности, аэрации; второй – дозревание полученной компостной массы в течение 3-4 недель в буртах или штабелях на площадках или в реакторах, где она стабилизируется, обеззараживается и высушивается. Однако процесс компостирования помета как способ его утилизации имеет ряд недостатков. Компостирование обычно связано с добавлением большого количества органических и минеральных веществ, что весьма трудоемко, требует соответствующей механизации и большого количества транспортных средств. Кроме того, компостирование не исключает возможность распространения различных заболеваний, загрязнения грунтовых вод и окружающей территории. Недостатком механизированных технологий компостирования – высокая стоимость сооружений, в 5-10 раз превышающая стоимость сооружений для компостирования в штабелях, сложность эксплуатации. Затраты электроэнергии на приготовление 1 т продукта составляет 20-200 кВт*ч. Цена высококачественного компоста составляет 30-50 долл. За 1 т сухой массы [33].
Известен такой способ переработки навоза как вермикомпостирование, основанный на способности дождевых червей потреблять любые органические отходы, выделяя при этом ценнейшее гумусодержащее удобрение [34]. Многочисленные исследования проведенные за рубежом показывают, что применение технологии переработки навоза с помощью дождевых червей имеет ряд преимуществ перед традиционной технологией утилизации органосодержащих отходов, а именно: гранулированные гумусодержащее удобрения как продукт жизнедеятельности вермикультуры превосходит навоз и компосты по содержанию гумуса в 4…8 раз, причем характерной особенностью является небольшой разрыв в показателях отношения С:N, это в 2-3 раза выше чем у компостов традиционного способа приготовления [35].
Большое количество гуминовых кислот в вермикомпост вызвано повышенной ферментативной активностью, в частности по пероксидазе и полифенолоксидаз. Пероксидазы окисляют органическое вещество за счет кислорода, перекиси водорода или органических перекисей образующихся в результате жизнедеятельности микроорганизмов. Полифенолоксидаза катализируют окисление фенолов в присутствии кислорода воздуха, их активность отражает интенсивность процессов образования гумусовых соединений [36].
Повышение активности нитратедуктазы, в свою очередь способствует снижению содержания нитратов в растениях при применении в качестве удобрения биогумуса [37]. Кроме того, вермикомпост представляет собой структурные отдельности, прочные и водостойкие, т.к. в кишечнике червей происходят процессы полимеризации продуктов распада органического вещества и формируются молекулы гуминовых кислот. Эти молекулы образуют комплексные соединения с минеральными компонентами (прежде всего с биогенным кальцитом), что позволяет долго сохраняться в виде стойких образований [38]. Это дает возможность использовать биогумус для улучшения агрофизических свойств почв, предназначенных для выращивания сельскохозяйственных культур и совмещать посев с внесением биогумуса или вермикомпост сеялками.
Одна из отличительных особенностей биогумуса или вермикомпост в том, что он не содержит жизнеспособных семян сорных растений, в навозе и компосте традиционного приготовления количество сорняков достигает нескольких миллионов в одной тонне. При неправильном хранении количество жизнеспособных семян в бурте за летний период может возрасти в 10-15 раз за счет вторичного засорения [39], [40]. После вермикомпостирование то есть прохождения материала через мускулистый желудок и кишечник червей, семена перетираются с частицами песка повреждается семенная оболочка и они теряют жизнеспособность.
Из одной тонны органосодержащих отходов при переработке ее червями получается 100 кг биомассы червей и 600 кг гумусового удобрения, с более высокой питательной ценностью, чем навоз. В связи с этим можно выделить еще один положительный момент в сравнении с другими способами приготовления компостов — это меньшие нормы внесения, что безусловно экономически более выгодно. Численность полезных микроорганизмов в биогумус выше, чем у исходных компостов. Состав микрофлоры зависит от состава пищи, как уже было сказано выше, влияет на многие свойства вермикомпостов [41]. Известно, что микроорганизмы, грибы, актиномицеты закрепляют химические элементы вермикомпост [42]. Анализ микробиологических свойств готового вермикомпост, показал, что это — продукт с достаточно стабильным микробным сообществом. При естественной влажности (около 74%) он характеризуется определенной пропорцией микробной биомассы: 63-71% — грибной мицелий; 21-28% — споры грибов и дрожжеподобные организмы; 5,6-6,7% — бактерии; 2,3-3,2% — мицелии актиномицетов. В отличие от исходного субстрата и навоза в вермикоспосте снижается доля грибного мицелия, но возрастает доля функционально активного мицелия актиномицетов; в группе бактерий доминируют представители актиномицетов. Среди грибов преобладают активные целлюлозоразрушающие виды, которые не токсичны и не патогенны для растений, а напротив обладают антагонистическим эффектом по отношению к фитопатогенным микроорганизмам [43].
Таким образом, вермикомпост или биогумус превосходит по многим параметрам традиционные органические удобрения, а реутилизация органических отходов с помощью вермикультуры позволяет решить следующие проблемы:
— комплексную утилизацию сельскохозяйственных отходов органосодержащих отходов;
— получение ценного органического удобрения биогумуса и кормового белка в виде биомассы червя;
— получение экологически чистой сельскохозяйственной продукции и повышение урожайности;
— получить экономический эффект от применения биогумуса в связи с небольшими дозами внесения, продолжительностью действия и быстрыми темпами прироста биомассы.
Метод вермикомпостирования вышел на волну популярности из-за активного развития органического земледелия в мире.
Евросоюз активно продвигает органическое сельское хозяйство, оно является юридически определенной и сертифицированной устойчивой системой производства продовольственной продукции с доказанными преимуществами для окружающей среды и благополучия животных, а также устоявшейся и прибыльной для фермеров, переработчиков и розничной торговли. Ассоциация органического сельского хозяйства IFOAM EU предполагает, что, как минимум, 20% сельхоз площадей в Европе перейдет на этот тип хозяйствования. Однако этот способ утилизации больше подходит для фермерских хозяйств и хозяйств с небольшим выходом навоза
1.8 Пути подготовки и утилизации стоков животноводческих и птицеводческих предприятий
Сточные воды животноводческих комплексов отличаются высокой концентрацией веществ во взвешенном и растворенном состоянии и высоким бактериальным обсеменением, в частности, возбудители бруцеллеза жизнеспособны в жидком навозе 108-174 суток, сальмонеллеза – 90-160, рожи свиней 92-157, ящура 42-192, туберкулеза 457 суток; яйца аскарид – свыше 6 месяцев. С повышением влажности навоза и особенно попадании его в почву возбудители инфекций сохраняемость продлевается. Поэтому использование необеззараженных навоза и стоков опасно в эпизоотическом и эпидемическом отношении сальмонеллы, возбудители туберкулеза и других инфекций. В связи с этим, сточные воды представляют эпидемиологическую опасность и могут быть использованы для орошения сельскохозяйственных угодий только после карантина, который длится от 6 до 12 месяцев. Современные промышленные технологии производства животноводческой продукции предусматривают безподстилочное содержание животных и широкое применение гидравлических систем навозоудаления. Это приводит к накоплению в хозяйствах больших объемов жидкого навоза и стоков, которые из-за отсутствия безопасных способов обработки и утилизации создают угрозу возникновения эпизоотий и загрязнения окружающей среды [44].
Навозные и пометные стоки отличаются высоким показателем БПК5 — от 7200 до 13600 мг/л. Этот показатель свидетельствует о высокой удобрительной ценности навозных стоков. При внесении навозных стоков на полях достигается полная переработка их в биомассу сельскохозяйственных растений. Этому способствует микрофлора, почва и солнечная энергия. Исследованиями установлено, что при инфильтрации жидкой фракции навозных стоков через почвенный слой толщиной 50 см степень очистки достигает 99% .
Из существующих способов обеззараживания животноводческих стоков – химический, физических, биологических. Последнему уделяется все большее внимание.
Из новых промышленных технологий переработки жидкого навоза применяется анаэробная биоконверсия в биоэнергетических установках, в которой использован многолетний опыт анаэробного сбраживания осадков отстойников и избыточного или аэротенков очистных сооружений коммунальных стоков. Процесс анаэробного сбраживания стоков животноводческих и птицеводческих ферм и в метантенке ведется при избыточном давлении биогаза от 0,2 – 0,4 Мпа. Число биореакторов должно быть не менее двух, что обеспечит оптимальные условия для анаэробной ферментации жидкого навоза и позволит при возникновении эпизоотий инфекционных болезней животных перевести работу метантенков с проточного на цикличный термофильный режим. Анаэробную ферментацию осуществлять в биоэнергетических установках при термофильном режиме работы метантенков (53-56°С) с выдерживанием в них навоза в течении трех суток без добавления свежих порций необработанной массы. Метантенки работают в термофильном режиме поочередно. Чтобы обеспечить шестисуточное карантинирования навоза на очистных сооружениях при наличии двух и более метантенков или других сооружений (биофильтров, аэротенков, отстойников, накопителей), нужно учитывать продолжительность прохождения массы последовательно по всем этапам обработки. В технологиях с одним метантенком для шестисуточного карантинирования (а в случае эпизоотий и обеззараживания) жидкого навоза на очистных сооружениях навозонакопители должны быть рассчитаны на шестисуточный объем получаемых органических удобрений. При выдерживании жидкого навоза с рН 8,0 – 8,5 в анаэробных условиях с температурой 36-38°С обеззараживание достигается через 10-15 суток при контаминации его неспорообразующей патогенной микрофлорой, контролируемой по выживаемости бактерий группы кишечной палочки и стафилококкам, и 20 суток при наличии возбудителя туберкулеза. При выдерживании его с температурой 40-42°С для обеззараживания от аспорогенной микрофлоры необходимо 7-9 сут. При попадании инфицированного переброженного навоза в фермерские накопители обработанную массу нужно выдерживать в секциях навозохранилищ 6 месяцев [45].Из аэробных способов переработки и утилизации жидких отходов животноводства и птицеводства, обеспечивающих получение обеззараженных органических удобрений, получили распространение: сооружения полной биологической очистки, на которых проходит биоокисление в искусственных условиях на биофильтрах, в аэротенках, в биологических прудах. Полного обеззараживания стоков система рыбоводно-биологических прудов не обеспечивает и на случай эпизоотий предусмотрено длительное выдерживание стоков в отстойниках – накопителям с последующим использованием по принятой технологии очистки [46]. Таким образом, специфичность сточных вод животноводческих и птицеводческих хозяйств ограничивает использование традиционных методов очистки и ставит задачу совершенствовать существующие и изыскивать новые методы и схемы очистки и обеззараживания [47]. Для выхода из этой тупиковой ситуации Е.Г. Борисенко еще в конце 70-х годов прошлого века была предложена схема двухстадийной микробной биоконверсии свиноводческих стоков — выращивание дрожжей на первой стадии и доочистка активным илом [48].
II Материал и методы исследований
2.1 Селекция аборигенных микроорганизмов свиного навоза и птичьего помета проводилась в несколько этапов:
2.1.1 Объектами исследований служили выделенные селекционным путем накопительные и чистые культуры микроорганизмов, выделенные из загрязненных свежим свиным навозом и птичьим пометом почв: птицефабрика ОАО «Спутник» Соль-Илецкого района Оренбургской области и свиноферме хозяйства ООО «СГЦ «Вишневский» Сакмарского района Оренбургской области.
2.1.2 Выделение чистых культур, изучение морфологических, культуральных и биохимических свойств. Идентификация микроорганизмов.
Для получения изолированных колоний использовали метод последовательных разведений, для этого стерильную водопроводную воду разливали стерильной пипеткой по 9 мл в стерильные пробирки. Затем переносили стерильной пипеткой 1 мл исследуемого материала в пробирку с 9 мл стерильной водопроводной воды. Если исследуемый материал (почва) уже был разведен в 100 раз, получали разведение 1:103. Суспензию этого разведения тщательно перемешивали с помощью новой стерильной пипетки, вбирая в пипетку и выпуская из нее полученную взвесь. Эту процедуру повторяли 3-5 раз, что обеспечивало перемешивание суспензии и уменьшало адсорбцию клеток на стенках пипетки. Затем этой же пипеткой взяли 1 мл полученного разведения и перенесли его во вторую пробирку – это разведение 1:104. Аналогичным способом готовили и последующие разведения. Выделение накопительных культур микроорганизмов получали рассевом разведений накопительных культур на чашках Петри с элективными агаризованными средами [49] , где в качестве источника углерода использовали 1% свиного навоза или 1% птичьего помета. В качестве исходной суспензии использовали 1 мл накопительной культуры в 100 мл стерильной среды. Далее наносили 0.1 мл разведенной культуры на поверхность среды в чашках Петри и затем равномерно распределяли шпателем по чашке, стараясь покрыть всю ее поверхность. Чашку закрывали крышкой, на крышке делали надпись, характеризующую данное испытание. Далее чашку не помещали в термостат, где выдерживали для инкубирования микроорганизмов при температуре 26-28оС в течение 3 и 7 суток. Для каждого разведения микроорганизмов проводили три параллельных посева и инкубирования. После окончания инкубирования чашки вынимали из термостата и помещали вверх дном для счета колоний визуально. По числу колоний, выросших на среде трех чашек для одного разведения, рассчитывали среднее арифметическое значение, которое принимали как основную исходную величину для дальнейшего расчета. Число колоний, выросших на среде каждой из трех чашек не должно отличаться от среднего арифметического значения более чем на 10% относительных, рассчитанных и округленных до целого числа. Чистые культуры получали рассевом разведений накопительных культур. В качестве исходной суспензии использовали 1 мл накопительной культуры в 100 мл стерильной среды. Далее наносили 0.1 мл разведенной культуры на поверхность среды в чашках Петри и затем равномерно распределяли шпателем по чашке, стараясь покрыть всю ее поверхность. Далее чашку, не переворачивая, помещали в термостат, где выдерживали для инкубирования микроорганизмов при температуре 26-28оС в течение 3 и 7 суток. Для каждого разведения микроорганизмов проводили три параллельных посева и инкубирования. После окончания инкубирования чашки вынимали из термостата и помещали вверх дном для счета колоний визуально. По числу колоний, выросших на среде трех чашек для одного разведения, рассчитывали среднее арифметическое значение, которое принимали как основную исходную величину для дальнейшего расчета. Число колоний, выросших на среде каждой из трех чашек не должно отличаться от среднего арифметического значения более чем на 10% относительных, рассчитанных и округленных до целого числа.
Микроскопированием определили морфологические особенности микроорганизмов. При изучении морфологии бактерий учитывали: форму клеток (кокк, палочка и т.д.); характер взаимного расположения; размеры клеток; наличие спор; капсул; подвижность; окраска по Граму.
Изучение культуральных свойств проводили по характеру роста на плотных и жидких питательных средах. Описание поверхностных колоний, выросших на плотных питательных средах проводили по следующим признакам: а) форма колонии (округлая, неправильная, ризоидной и т.д.); б) поверхность колоний (гладкая, бугристая, морщинистая, блестящая; в) профиль (плоский, выпуклый, кратерообразный и т.д.); г) цвет колонии; д) размер (диаметр) колонии измеряется с помощью линейки; е) край колонии (ровный, волнистый, зубчатый, бахромчатый); ж) структура (мелко-, крупнозернистая, однородная); з) консистенция (мягкая, плотная, слизистая, тягучая). При росте культуры на скошенном агар-агаре: а) рост (пышный, скудный, умеренный); б) характер налета колонии (сплошной, диффузный); в) характер края штриха (ровный, волнистый); г) поверхность штриха (блестящая, матовая, мучнистая); д) профиль штриха (плоский, выпуклый); е) консистенция культуры (сочная, сухая, слизистая); ж) оптические признаки штриха (прозрачная, полупрозрачная, непрозрачная); з) цвет налета и изменение окраски среды. При росте культуры на жидких средах: а) интенсивность роста; б) характер (муть, осадок, пленка); в) мутность среды и степень мутности; г) характер осадка; д) характер пленки (гладкая, сухая, морщинистая, плотная); е) появление запаха и изменение цвета среды. Изучение биохимических свойств проводили с учетом способности ферментации углеводов на цветных средах Гисса, восстановления нитратов, характера роста на желатине. Для определения ферментации углеводов готовили среды Гисса: к 100 мл дистиллированной воды прибавляли 1 г пептона и 0,5 г NаС1. Растворяли при нагревании воды в течение нескольких минут, фильтровали через бумажный фильтр до совершенно прозрачного раствора, устанавливали рН= 7,0-7,4, а затем прибавляли 0,5-1,0 г одного из углеводов и индикатор Андреде в количестве 1 мл на 100 мл среды. Готовую среду разливали по 3 мл в пробирки, стерилизовали вместе с поплавками, расположенными запаянным концом вверх текучим паром три дня подряд по 30 минут, при 112 °С. Среды Гисса имеют соломенно-зеленый цвет (рН= 7,0-7,2). В результате роста бактерий, сопровождающегося расщеплением углеводов с образованием кислых продуктов распада, цвет среды меняется. Образование газа в среде определяли по наличию пузырьков в поплавке. Для выяснения способности восстанавливать нитраты делали посев в МПБ с 0,1% нитратом калия. Через несколько дней определяли наличие нитратов реактивом Гисса и наличие аммиака – реактивом Несслера. При малом содержании аммиака окраска желтая, при значительном оранжево-желтая, при большом – красно-бурая. Для определения нитратов реактив Гисса употребляли в сухом виде. На каплю, культуры скальпелем насыпали немного реактива. Окраска менялась до густо-малинового цвета сразу при большом количестве нитратов и постепенно – при малых количествах. Определение сероводорода проводили на плотной среде следующего состава: к 1 л стерильного 1,7—2 %-ного МПА добавляли сернокислое железо (FeSO4) — 0,2, гипосульфит (тиосульфат Na2S2O3) натрия -0,3, глюкозу -1 г, индикатор фенолрот водный 0,3 %-ный -12 мл. Среду разливали в стерильные пробирки по 5-6 мл, стерилизовали текучим паром 20 мин. Перед употреблением среду расплавляли и охлаждали в наклонном положении пробирки. Посев делали на скошенную поверхность агар-агара, а затем уколом в нижнюю часть столбика среды. При наличии сероводорода под действием растущей бактериальной культуры столбик среды краснеет, нижняя часть окрашивается в черный цвет. Протеолитическую способность – на желатиновой среде. Делали посев уколом в столбик МПЖ, после чего пробирки инкубировали в термостате, при температуре 28-30 °С. На другой день помещали пробирки на 60 минут в холодильник и отмечали наличие разжижения и его характер:1) равномерное, начиная с поверхности (строгие аэробы); 2) кратеровидное, воронковидное, реповидное (менее строгие аэробы);3) мешковидное (факультативное, анаэробы); 4) пузыревидный рост в глубине среды (строгие анаэробы). Использование органических соединений азота. Индол устанавливали с помощью реактива Эрлиха: в пробирку с 5 мл 2-3-суточной бульонной культуры бактерий добавляли 2 мл эфира, содержимое встряхивали и дали отстояться. Затем под слой эфира пастеровской пипеткой подслаивали 0,5-1 мл реактива Эрлиха. При наличии индола в течение 3—5 мин на границе между эфиром и бульонной культурой образовывался интенсивно-розовое кольцо [50]. Молекулярно-биохимическую идентификацию штаммов микроорганизмов проводили с использованием полимеразной цепной реакции по видоспецифическому гену штамм. Выделение ДНК и ПЦР анализ проводили согласно [51]. Построение древа родства RibosomalDatabaseProjectII [52] .
2.1.3 Выращивание отобранных чистых культур аборигенных микроорганизмов проводили в режиме накопительной биомассы с применением проточной системы культивирования, работающей в режиме хемостата, также методом твердофазного культивирования [53].
2.2 Использование для обезвреживания и утилизации свиного навоза и птичьего помета интродукции специальных штаммов-деструктов.
-
-
- Объектами исследований служили:
-
1. Штамм бактерии Bacillussubtilis 534 (депонирован в ВКМ Института биохимии и физиологии микроорганизмов РАН под номером В1666 D). Посевной материал штамма бактерии Васillussubtilis 534 выращивали на известной питательной среде, разработанной для данного штамма [54]: (в %): калий фосфорно-кислый однозамещенный 0,2-0,4, сульфат аммония — 0,1-0,3, цитрат натрия — 0,2-0,4, цитрат аммония -,03%% 0,5, глутаминовая кислота — 0,2-0,4, молочная кислота — 0,5-1,5, диализат дрожжей — 5,0-9,0, сернокислое железо — 0,00005-0, 00015, сернокислый магний — 0,0025-0,0075, лактат кальция — 0,0005-0,0015, глюкоза — 0,3-0,5, картофельно-глицериновый бульон — 20-30, остальное – вода. В качестве воды мы использовали, разведенную в 2 раза сточную воду птицефабрики состав которой представлен в таблице 2.
2.Штамм Hypomycesrosellus КМ- 400 хранится в музее чистых культур кафедры микробиологии Биологического факультета МГУ им.М.В.Ломоносова как продуцент протеолитических ферментов и антибиотически активного препарата антибактериального и фунгицидного спектров действия. Выращивание штамма проводили на ранее разработанной питательной среде [55]. в ферментерах мешалочного типа емкостью 10 л с подачей воздуха с подачей воздуха 0,2-0,4 л/л в мин., при перемешивании 300 об/мин. в течение 48-72 часов при температуре 25-260 С. Состав питательных сред и способ культивирования гриба описаны ранее [55]. В качестве индуктора синтеза ферментов вносили навоз свиной или куриный помет в количестве 1%.
2.2.2 Определение физиологически активных соединений, образуемых интродуцированными штаммами в лабораторных условиях.
Амилолитическуюи протеолитическую активности определяли согласно [56]. В качестве тест – микроорганизмов использовали бактериальные и дрожжевые культуры: Escherichiacoli К12 (АТСС 25922), Escherichiacoli 354, StaphylococcusaureusP 209 (ATCC 6538- 452, Pseudomonasaeruginosa (АТСС 27853), Pseudomonasfluorescens ВКПМ №В-350, Pseudomonasputida КМ МГУ №95, Candidaalbicans (получены с кафедры микробиологии и заразных болезней ФГБОУ ВО «Оренбургский государственный аграрный университет») и фитопатогенные грибы: Alternariatenius, Moniliafructigena, Botrytiscinerea, Rhizoctoniasolani, Fusariumroseus, Fusariumoxysporum, Helmintosporumsativum, Microsporumcanis, Mucorsp., Candidaalbicans, Pucciniagraminis, Cladobotriumcladobotrium из музея чистых культур кафедры микробиологии Биологического факультета МГУ им. М.В.Ломоносова.
2.2.3 Определение веса сухой биомассы. Этот метод широко применяется для оценки роста микроорганизмов в жидких питательных средах. Мицелий с колбы, содержащей 100 мл культуральной жидкости, перемешивали и фильтровали в воронке через бумажный фильтр, предварительно доведенный до постоянного веса. Осадок троекратно промывали дистиллированной водой. Фильтр с мицелием доводили до постоянного веса в сушильном шкафу при t=1050C и охлаждали 2 часа при комнатной температуре. Вес сухой биомассы ( г/100 мл ): M = (A-B) 100/V, где A – вес фильтра с мицелием, г. B — вес фильтра без с мицелия, г. V – объем культуральной жидкости при фильтровании, мл.
Количественное определение белка по методу Лоури. Основан на измерении интенсивности окраски раствора, в котором осуществляется цветная реакция на белок (реакция Фолина) с тирозиновым и цистеиновым радикалами белковой молекулы, состоящая в восстановлении смеси фосфорно-вольфрамовой и фосфорно-молибденовой кислот (реактив Фолина) с образованием комплексного соединения синего цвета. Указанной реакции восстановления способствуют комплексные соединения меди, возникшие при взаимодействии белка со щелочным раствором медного купороса. Реакция Фолина очень чувствительна, поэтому метод Лоури позволяет вести определения в сильно разбавленных растворах. Перед проведением определения смешивали 49 мл раствора A с 1 мл раствора B. К 1 мл исследуемого белкового раствора, содержащего от 10 до 100 мг белка, добавляли 4 мл смеси растворов A и B. Встряхивали и оставляли на 10 минут при комнатной температуре. Затем быстро приливали из пипетки 0.2 мл реактива Фолина, энергично перемешивали и оставляли на 30 минут для развития окраски. При этом желтая окраска постепенно переходит в синюю. Оптическую плотность раствора измеряли на фотоэлектроколориметре при 750 нм в кюветах с толщиной слоя в 1 см. Содержание белка в испытуемой пробе устанавливали по калибровочной кривой, построенной заранее по раствору чистого белка с точно известной концентрации, в данном случае альбумину. Для этого готовили серию растворов альбумина с содержанием от 20 до 400 мг в 1 мл. [57].
2.2.4 Обезвреживание и переработку жидкой, полужидкой и твердой фаз навоза и помета проводили с использованием интродукции штаммов деструкторов на территориях животноводческого и птицеводческого хозяйств. Для этого твердую фракцию навоза или птичьего помета предварительно отделяли от жидкой путем центрифугирования и каждую фракцию обрабатывали путем распыления суспензии биомассы интродуцируемого штамма микроорганизмов концентрацией 2*105-2*106 микробных тел/мл на 1 тонну навоза или помета. Жидкую фракцию периодически переносили в специальную емкость, оборудованную тонкослойным отстойником, где в течение 1 часа отставляли отстаиваться. Осветленную часть дренажной воды далее с помощью насоса переносили в аэробный биореактор и засевали посевной культурой интродуцированного штамма с титром 108кл/мл. Полужидкую (влажность 90-93%) и твердую (влажность 75-80%) фракции птичьего помета с общим микробным числом (ОМЧ) 9*106 КОЕ/мл и коли-титром равном ≥0,001 мл обрабатывали суспензией культуры активного из расчета 1 млрд клеток на 1 т птичьего помета на площадке, оборудованной снизу каналами для подачи воздуха. Под воздействием воздуха, поступающего снизу в твердую фракцию помета, происходил рост штаммов и синтез гидролитических ферментов и антимикробных веществ, подавляющих болезнетворные микроорганизмы птичьего помета. В таком виде твердую фракцию помета, периодически переворачивая, подвергали компостированию при участии аборигенной микрофлоры. Процесс компостирования вели при контроле температуры и определенной влажности бурта и в конце ферментации наблюдали снижение аммиачного запаха, изменение цвета и агрегатного состояния содержимого буртов.
2.3. Влияния полученных органических продуктов на урожайность и качество ячменя и нута.
Объектами исследований являлись районированный сорт нута «Краснокутский-36» и ячмень яровой селекции Оренбургского государственного аграрного университета.Полевые опыты с использованием органических продуктов на основе полученных нами продуктов будут заложены в мае месяце 2021 года на учебно-опытном участке Оренбургского государственного аграрного университета. Влияние предпосевной обработки семян на всхожесть, энергию прорастания и биометрические показатели семян нута и ячменя определяли согласно [58].
Все опыты проводили в трехкратной повторности. Результаты обрабатывали статистически [59].
III Результаты и обсуждение
Использование способов очистки навозо- и пометсодержащих сточных вод и переработки навоза/птичьего помета с внесением культур микроорганизмов в условиях контролируемой температуры, влажности и аэрации с участием аборигенной микрофлоры позволяет получать эффективные биоудобрения, кормовые добавки и значительно сократить сроки обеззараживания навоза- и пометосодержащих масс.
Одной из задач нашего исследования являлось выделение из загрязненных свиным навозом и птичьим пометом грунтов наиболее активных штаммов микроорганизмов, способных использовать навоз или помет в качестве единственного источника углерода и энергии. В процессе работы было выделено около 100 накопительных культур на питательных средах, содержащих 1% свиного навоза и 1% птичьего помета, в которых регистрировался рост представителей следующих родов. Результаты позволили выделить следующие бактерии, обладающие способностью утилизировать навоз и помет: Pseudomonas, Proteus, Enterococcus, Micrococcus, Bacillus, Xanthomonas, Rhodococcus, Stenotrophomonas, Lactococcus, Lactobacillus и микроскопические грибы рода Penicillium, Mucor, Aspergillus(таблица 1). При выращивании в режиме глубинного культивирования в хемостатедо снижения концентрации загрязняющих веществ уровня ниже ПДК, оставались лишь виды, совмещающие высокую скорость размножения с высокой биопродуктивностью. Таким образом, из 100 микробных культур, в которых был зарегистрирован рост, утилизация и обезвреживание свиного помета и навоза было отобрано первоначально 10-12 наиболее активных культур, а затем отобраны только 2 наиболее активные культуры, имеющие высокую скорость размножения и наибольшую продуктивность. В дальней работе была проведена их идентификация до вида с использованием метода полимеразной цепной реакции.
Таблица 1
Накопительные культуры почвенных микроорганизмов, утилизирующих отходы животноводства
| Микроорганизмы | Титр КОЕ/мл | |
| Куриный помет | Свиной навоз | |
| Бактерии | ||
| 1 Pseudomonas | (1,6±0,1)*105 | (7,6±0,7)*106 |
| 2 Xanthomonas | (1,5±0,5)*105 | (3,5±0,5)*106 |
| 3 Zoogloea | (1,0±0,4)*105 | (4,5±0,5)*106 |
| 4 Proteus | (4,5±0,2)*105 | (4,0±0,5)*107 |
| 5 Bacillus | (6,3±0,7)*107 | (8,5±0,1)*107 |
Список использованных источников литературы
1. Микробиологические риски в промышленном птицеводстве и животноводстве /В.И. Фисинин, В.И. Трухачев, И.П. Салеева, В.Д. Морозов, Е.В. Журавчук, Р.О. Колесникова, А.В. Иванов //Сельскохозяйст.биология. – 2018. – Т. 53. — № 6. – С. 1120 – 1130.
2. Рациональное природопользование и кормопроизводство в сельском хозяйстве России / В. М.Косолапов, И. А.Трофимов, Л. С.Трофимова, Е. П.Яковлева.– М.: РАН, 2018. – 132 с.
3. Справочная книга по органическим удобрениям. –Владимир:ВНИПТИОУ, 2001.– 495 с.
4. Инновационные технологии производства биотоплива второго поколения: науч. изд./В.Ф. Федоренко, Д.С.Буклагин, А.Н.Зазуля, И.Г. Голубев и др. – М.: ФГНУ «Росинформагротех», 2009. – 68 с.).
5. Лукин, С.М. Биологизация земледелия – научная и технологическая основа экологически устойчивого сельского хозяйства/С.М. Лукин, И.В. Русакова //Сборник научных трудов Всероссийской научно-практической конференции с международным участием «Экологически устойчивое земледелие: состояние, проблемы и пути их решения»:. – ВНИИОУ – филиал ФГБНУ «Верхневолжский ФАНЦ», 22-24 июня 2018 г. Иваново: ПресСто, 2018. С.- 3-10
6. Структура условно-патогенной микрофлоры на животноводческих предприятиях различного профиля / И.М.Донник, А.Г.Исаева, Н.Б.Мусихина, К.В.Моисеева, А.А.Гордеев // Ветеринария Кубани. — 2019.- № 5.- С.50 -53.
7. Воздействие пометохранилища бывшей птицефабрики «Снежная» Мурманской области на поверхностные воды / Е.В.Левин, Р.Ф.Сагитов, Т.А. Гамм, В.Д.Баширов, Р.Н.Касимов, С.П.Василевская, А.Д. Буракаева //Известия Оренбургского государственного аграрного университета. — 2017.- № 3(65).- С. 210-212.
8.Суржко, О. А. Экологическая безопасность при переработке и утилизацииконцентрированных по биогенным элементам жидких отходов промышленных пред-приятий: монография /О. А. Суржко, М. А. Куликова //Юж.-Рос. гос.техн. ун-т (НПИ). — Новочеркасск: ЮРГТУ (НПИ), 2011. – 140 с.
9. Стратегия развития промышленности по обработке, утилизации и обезвреживанию отходов производства и потребления на период до 2023 года. //Распоряжение ПравительстваРоссийской Федерации от 25.01.2018 года № 84-p, Москва.
10. Приказ Федеральной службы понадзору в сфере природопользования от 22.05.2017 №242.
11. Дабахова, Е.В. Эколого-агрохимическая оценка применения различных систем удобрения на светло-серой лесной почве автореф. дис. … канд. с.-х. наук / Елена Владимировна Дабахова.-М.: ВНИИ«Анроэкоинформ», 1998. -21 с.
12. Запевалов, М. В. Переработка птичьего помета с получением электрической, тепловой энергии и комплексного органоминерального удобрения / М. В. Запевалов // Вестник ЧГАА. 2014. — №1.– С. 4549.
13. Щеткин, Б.Н. Утилизация отходов птицеводства — решение проблем экологической безопасности и ресурсосбережения / Б.Н. Щеткин. -Пермь: ОГУП «Соликамская типография»,2002.-135с.
14. Щеткин, Б.Н. Утилизация отходов птицефабрик и получение чистого высокоэффективного удобрения /Б.Н. Щеткин. -Калининград: Вестник Балтийского научного центра РАЕН, 2002. — №7. — с.34-35.
15. Оценка прямоточного и промышленного способов сушки птичьего помета в барабанных сушильных установках В.И./ Малофеев В.И. и др//Эффективные приемы технологии в птицепроизводетве. — М, 1974.-с.80-83
16. Автоматизация процессов сушки в промышленности и сельском хозяйстве //под ред. А.М. Берлинера.- М: Машиздат, 1961.-291с.
17. Щеткин, Б.Н. Птичий помет и технологии его переработки в высокоэффективные удобрения /Б.Н. Щеткин. -Санкт-Петербург: Издательство СПбГАУ,2000.-256с.
18.Щеткин, Б.Н. Экологически чистая технология приготовления компостов с использованием термического воздействия /Б.Н. Щеткин //Актуальные проблемы инженерного обеспечения АПК. Сборник материалов международной научной конференции. — Ярославль.: ЯГСХА, 2004.-Ч. З.- С.34-35.
19. Малофеев, В.М. Органические удобрения: способы подготовки и внесения / В.М. Малофеев. -М.: Знание, 1988 г.-160c.
20. Мерзлая, Г.Е. Биологические факторы в системах удобрения / Г.Е. Мерзлая //Агрохимия.-2017.-№ 10. — С. 24 — 36.
21.Эффективность длительного применения органических и минеральных удобрений на дерново-подзолистой легкосуглинистой почве / Г.Е. Мерзлая, Г.А.Зябкина, Т.П. Фомкина //Агрохимия. -2012. — № 2.-С. 37-36.
22.Бирюков, К. Н. Использование биоценозов для обеззараживания органических отходов животноводства при анаэробной ферментации / К.Н. Бирюков // Ветеринария. — 2017. — № 6 . — С. 35-38.
23. Суржко, О. А. Экологическая безопасность при переработке и утилизацииконцентрированных по биогенным элементам жидких отходов промышленных предприятий: монография /. А. Суржко, М. А. Куликова //Юж.-Рос. гос.техн. ун-т (НПИ). -Новочеркасск: ЮРГТУ (НПИ), 2011. – 140 с.
24. Образование биогаза микробными сообществами при разложении целлюлозы и пищнвых отходов /Е.А.Цавкелова, М.А.Егорова, Е.В.Петрова, А.И.Нетрусов//Прикладная биохимия и микробиология. — 2012.- Т.48.- №4.-С.412-424.
25. Лысенко, В.П. Перспективные технологии переработки помета путем ферментации под влиянием присутствующих в помете микроорганизмов / В.П. Лысенко //Птицеводство. — 2011.- №1.- С.52-54
26. Бондаренко, А. М. Теоретико-технологические подходы к переработке жидких органических отходов /А. М. Бондаренко, Л. С. Качанова // Известия Оренбургского государственного аграрного университета. — 2017. — № 6 (68). — С. 114-117.
27. Способ приготовления компоста /В.Н.Афанасьев, В.В.Миллер,И.А. Архипченко, О.Я.Вайнберг, Т.Л.Клявина, Н.С.Федорова, Г.М.Юрина, 1988. — заявка № 1371960,опубл. бюл.5.
28. Лысенко, В.П. Биопрепараты для компостирования птичьего помёта / В.П. Лысенко, Г.Е. Мерзлая, Р.А.Афанасьев //Птицеводство. — 2014.- № 3. — С. 39–44.
29.Кутровский, В.Н. Биоконверсия отходов агропромышленного комплекса / В.Н. Кутровский, О.Д.Сидоренко.- М.:НИИСХ ЦРНЗ, 2009.- 160 с.
30. Зеников, В. И. Методика расчета состава смеси при компостировании / В. И. Зеников //Вестник Российской сельскохозяйственной науки. — 2016. — № 1. — С. 47-48.
31.Получение высококачественных биокомпостов / И.А.Архипченко, О.В.Орлова, Ю.М.Лихачев, М.Я.Федашко //Экология и промышленность России. — 2000.- № 7.- С.16 – 22.
32. Кулинич, О. А. Биодеструктор свиного навоза. МикрозимВэйстТрит — биотехнология очистки, обезвреживания и деодоризации свиных стоков / О. А. Кулинич, В. В. Ларченко // Свиноводство. — 2016. — № 2. — С. 38-40.
33. Сидоренко, О. Д. Использование продуктов биоконверсии отходов животноводства в качестве органических удобрений (концепция) / О.Д. Сидоренко // Агрохимия. — 2018. — № 4. — С. 36-.
34. Орлова О.В. Биоорганические добавки для ускорения дозревания компоста из ТБО / О.В. Орлова, Н.А. Петухова, И.А.Архипченко //Экология и промышленность России. — 2008.- №10.- С.38 – 40.
35. Fester, C.F. Organic amendment effects on physical and chemical properties of a sands Jail / C.F. Fester // Soil Sc. Soc. American .– 1990.- №5.- P.827-831.
36.Азимов, Д.А. Биогумус позволит оздоровить почву и повысить урожай / Д.А. Азимов //Земледелие. — №7.- 1991. — С.22.
37. Мозженин, Н.М. Стимуляция образования физиологически активных веществ в почве органическими удобрениями / Н.М. Мозженин//Использование торфа и торфяников в сельском хозяйстве Западной Сибири. — Новосибирск, 1985.- с.55-61.
38. Умпелев, В.Л. Ферментативная активность вермикомпоста /В.Л. Успелов, Н.А.Сафронова //Ивано-Франковск ЦНТИ ассоциации «Биоконверсия», 1993.- с.13.
39. Пономарева, С.И. Скорость образования в почве кальцита дождевыми червями / С.И. Пономарева //Доклад ы АН СССР.- 1948.- Т.61.- №3.- с.505-507.
40.Касатиков, В.А. Эффективность действия вермикомпоста на агробиологические свойства почвы / В.А. Касатиков, М.Е.Кравченко, С.М.Куленичев //Тез. доклад II конгресса «Биоконверсия органических отходов народного хозяйства и охрана окружающей среды Ивано-Франковск. — 1992.-с.71.
41. Обезвреживание навоза от жизнеспособных семян сорняков / В.А.Андреев, А.В.Быкова, П.Д. Попов.- М.: Росагропромиздат, 1988.- 40 с.
42. Терещенко, Н.Н. Качественный состав микроорганизмов и сапрофитов в вермикоспосте разной биотехнологии / Н.Н. Терещенко, В.Н.Гучак //Проблемы экологии в сельском хозяйств. – 1993. -Ч.I.- С.31-33.
43.Слободян, В.А. Влияние вермикомпоста на микробиологические процессы в почве / В.А. Слободян, Н.С. Слободян//Химия в сельском хозяйстве. -1994.- №4.- С.8.
44. Васильев В.А. Органические удобрения в интенсивном земледелии / В.А. Васильев,И.И. Лукьяненко, В.Г.Минеев.- М:. Колос, 1984.- С.309.
45. Архипченко, И.А. Микробиологические основы безотходной технологии переработки стоков свинооткормочных комплексов. автореф…докт.биол.наук / Ирина Александровна Архипченко. -Ленинград, 1991.- 350 с.
46. Ильин, С.Н. Ресурсосберегающая технология переработки свиного навоза с получением биогаза: автореф. дис. … канд. техн. Наук/ Сергей Николаевич Ильин.- Улан-Удэ, 2005. — 23 с.
47.ПоздняковВ.М. Оптимизация биоценозов активного ила очистных сооружений животноводческих комплексов для снижения антропогенной нагрузки на водные экосистемы. дисс….. канд. биол. наук / Виктор Михайлович Поздняков .- Москва, 2000. – 239 с.
48. Очистка сточных вод промышленных животноводческих комплексов/ В.Ю.Трекало,А.Н. Волкова, А.И.Лукин, Н.Б.Федотова, В.И.Яковлев //Химия и технология воды.-1985.-Т.7.- № 2.- С.72-74.
49.Борисенко, Е.Г. Разработка комплексной технологии белковых препаратов на основе нетрадиционного сырья / Е.Г. Борисенко.- М.- 1990.- 474 с.
50. Егоров, Н.С. Основы учения об антибиотиках / Н.С. Егоров. М.: Наука, 2004.-528 с.
51. Практикум по микробиологии: учебн. пособ. для студ. высш. учеб. заведений /Нетрусов А.И., Захарчук Л.М. и др. под ред. НетрусоваА.И. Москва: Академия, 2005.– 608с.
52. Irmis, M. A Guide to methods and applications /M.Irmis, D.Gelfand, J. Sninsky//PCR Protocols.- 1998.-P.14-15
53.Pavlicek, A., et al. Fre-Tree-freeware program for construction of phylogenetic trees on the basis of distance data and bootstrap jackknife analysis of tree robustness / A. Pavlicek. //Application in the RAPD analysis of genus Frenkelia Folia Biol (Praha).-1999.- V. 45(3).-P. 97–99/
54. Твердофазное и поверхностно-мембранное жидкостное культивирование микромицетов, особенности их развития и образования ферментов /А.А.Осмоловский, Н. А. Баранова, В. Г. Крейер, Н.С. Егоров//Прикладная биохимия и микробиология. -2014.- Т.50.- №3.-С. 245 — 255.
55. Никитенко, М.В. Препарат споробактерин жидкий / М.В. Никитенко, В.И.Никитенко //Патент РФ №2217154. — 27.11.2003.
56. Буракаева, А.Д. Микофильные грибы — продуценты практически важных продуктов: монография / А.Д. Буракаева.-Оренбург: Экспресс-печать, 2013. –160с.
57. Manachini, P.L. TermostablealkalineproteaseprodacedbyBacillustermoruber-newspeclesofBacillus / P.L. Manachiniт, M.G. Fortina, C. Parini // Appl.Microbiol.Biotechnol.-1988. — № 28(4/6).-P. 409 – 413.
58.Филиппович, Ю.Б. Практикумпообщейбиохимии /Ю.Б. Филиппович, Т.А. Егорова, Г.А. Севастьянова. – Москва: Просвещение,1982.- 179 с.
59. Рогожин, В. В. Практикум по физиологии и биохимии растений: учеб. пособие / В.В. Рогожин, Рогожина Т.В. — СПб: ГИОРД, 2013.-352 с.
60. Доспехов, Б.А. Методика полевого опыта (с основами статистической обработки результатов исследований) /Б.А. Доспехов.-М.: Книга по требованию, 2012.-352с.
61. Жданов, П.И. Биологический и эпизоотологический аспекты производства и применения нового пробиотика из бактерий рода Bacillus в свиноводстве, автореф. дисс. докт. ветер. наук / Петр Иванович Жданов, 1997.-30 с.
Список опубликованных работ по теме исследования
Scopus
1. Буракаева, А.Д. Перспективы использования штаммов родаHypomyces для получения вермикомпостов с фунгицидными и ростстимулирующими свойствами /А. Д. Буракаева, Г.В. Петрова // Биотехнология. – 2020 (подана).
2. Петрова, Г.В. Разработка органо-биологической системы удобрения на основе птичьего помета, повышающая плодородие черноземов южных и продуктивность культур полевого севооборота /Г.В.Петрова, А.Д.Буракаева, С.В. Сорокун, //Доклады Российской академии сельскохозяйственных наук.- 2020 (подана ).
RCSI
- Петрова, Г.В. Получение органического продукта, обладающего свойством биоудобрения путем биоконверсии птичьего помета / Г.В. Петрова, А.Д. Буракаева, С.В. Сорокун//Вестник КрасГАУ. — 2020.- №12 (165).- С.90-95. DOI:10.36718/1819-4036-2020-12-90-95.
- Петрова, Г.В. Утилизация отходов свинооткормочного комплекса с получением высокоэффективного органического удобрения/ Г.В. Петрова, А.М. Русанов, А.Д.Буракаева//Почвоведение. — 2020( подана).
- Петрова, Г.В. Применение СВЧ-излучений для обеззараживания птичьего помета / Г.В. Петрова, А.Д. Буракаева, С.В. Сорокун // Известия ОГАУ. -2020.- №5 (85).- С.145-148.
Участие в конференциях
- Петрова, Г.В. Проблемы утилизации стоков предприятий мясопереработки/ Г.В. Петрова // Материалы Международного научно-практического форума «ASU SciTechForum 2020», 12-13 ноября 2020 г. в Алтайском государственном университете (г. Барнаул, Россия).
- Петрова, Г.В. Проблемы утилизации отходов птицеводства»/Г.В. Петрова. — ЦПО «Парадигма.83-ая международная форум «Обращение с органическими отходами. Опыт и перспективы». — 20-21 октября 2020 г. — Москва.
Заявки на патент
1.Петрова, Г.В. Применение штамма Bacillussubtilis 534 для обеззараживания и утилизации помета с получением органического продукта, обладающего свойством удобрения /Г.В. Петрова, А.Д.Буракаева, С.В. Сорокун. — Заявка на изобретение № 2020131900 от 05.05. 2020.
2.Буракаева, А.Д. Способ получения биоудобрения, обладающего фунгицидными свойствами /А.Д. Буракаева, Г.В. Петрова. — Заявка на изобретение. — 2020, подана.
