Титульный лист и исполнители
Реферат
молодняк крупного рогатого скота, гомогенат трутневого расплода, естественная резистентность, продуктивность, сохранность
Отчет включает 91 страницу, 22 рисунка, 20 таблиц, 51 литературный источник.
Объектами исследований являлись молодняк овец на откорме, молодняк крупного рогатого скота, баранина, телятина, кровь животных
Цель исследований:
Разработка и внедрение биостимулятора на основе гомогената трутневого расплода в практику органического животноводства с целью повышения естественной резистентности и продуктивности откормочного молодняка крупного рогатого скота
Задачи:
— разработать способ защиты гомогената трутневого расплода от избыточного распада рубцовой микрофлорой;
— создать новый биологически активный стимулирующий препарат на основе гомогената трутневого расплода для молодняка на откорме крупного рогатого скота;
— изучить влияние полученного защищенного препарата на мясную продуктивность и физиолого-биохимический статус откормочного молодняка КРС в производственных условиях ООО «Красная Горка» Колышлейского района Пензенской области;
— определить экономическую эффективность применения разработанного биостимулирующего препарата в практике животноводства;
— разработать технические условия на биостимулятор на основе трутневого расплода для молодняка крупного рогатого скота;
— разработать научно-практические рекомендации по применению биостимулирующего препарата для повышения продуктивных параметров откормочного молодняка крупного рогатого скота;
— подать заявку на патент на изобретение.
Разработан инновационный продукт, который позволил снизить себестоимость производства животноводческой продукции. Биостимулятор позволит повысить среднесуточные приросты откормочного молодняка на 12-14% и снизить себестоимость продукции на 5-7%. Животноводческим предприятиям мясного направлений будет рекомендована биостимулирующая кормовая добавка на основе трутневого расплода для повышения продуктивности животных.
Введение
В настоящее время одной из первоочередных задач, стоящих перед сельскохозяйственными работниками Российской Федерации, является увеличение производства высококачественной, конкурентоспособной продукции животноводства [].
Развитие крупного рогатого скотоводства мясного направления является одним из важнейших в системе взглядов долгосрочного социально-экономического развития России до 2020 года, которой предусмотрено к 2020 году увеличить производство мяса в 1,7 раза, молока — на 27%; что позволит обеспечить уровень душевого потребления мяса и молока в соответствии с рекомендуемой рациональной нормой (молока 360 кг, говядины 32-34 кг).
Обеспечение качественными и полноценными продуктами питания населения остается актуальной проблемой в мире/ В последние годы особый интерес вызывают функциональные и интерактивные материалы нового поколения, разработанные на основе природных компонентов, которые больше отвечают физиологическим потребностям живых организмов, лучше усваиваются ими и обеспечивают эффективную адресную доставку питательных вещества [].
Важной задачей науки является разработка, испытание, апробация биологически активных добавок, биогенных стимуляторов и выдача рекомендаций по применению безопасных для экологии препаратов, натуральных метаболитов, комплексных соединений, активно воздействующих на формирование продуктивных свойств животных. Эффект биологических стимуляторов обусловлен их регулирующим влиянием на интенсивность обменных процессов и усилением функционального состояния органов и систем [].
Большинство применяемых биопрепаратов не обладают энергетическими свойствами, но заметно стимулируют важные физиологические функции животных, что способствует увеличению продуктивности и повышению их общей сопротивляемости заболеваниям [].
Эффективное влияние биогенных стимуляторов на животных проявляется разнообразно (от коррекции иммунитета организма до гормональной и ферментативной систем молодняка сельскохозяйственных животных). Воздействуя положительно на организм при выращивании молодняка животных, они понижают кормовые затраты, уменьшают сроки выращивания, позволяют сохранить поголовье, что оказывает хорошее влияние на уровень рентабельности отрасли [].
В настоящее время в зооветеринарной практике для стимуляции откорма, проявляющейся в энергии роста и развития, повышению естественной резистентности и сохранности молодняка, результативности осеменения широко используются биологически активная яичная масса, стимулятор эмбриональный, комплексный иммунный модулятор, стимулятор из трутневого расплода пчел и стимулятор из взрослых трутней [].
Новые биологические препараты должны пройти широкую апробацию на различных видах животных, с целью выявления наиболее результативных вариантов дозы и кратности их применения. Поэтому данные исследования имеют большую актуальность.
1. Обзор литературы
1.1 Развитие мясного скотоводства
Крупный рогатый скот мясного направления продуктивности имеет рад преимуществ таких, как выносливость и неприхотливость к условиям жизни, хорошо адаптируются к разным условиям окружающей среды. Эта способность выработалась у них потому, что животные находились долгое время в неблагоприятных условиях кормления и содержания. Их организм выработал такие адаптивные способности, как накапливать при благоприятных условиях жизненно необходимые питательные вещества и расходовать их экономно в течение зимних периодов до пастбищного сезона. Крупный рогатый скот мясного направления также к началу зимних периодов обрастает волосяным покровом и консолидирует подкожные жировые отложения для того, чтобы выжить при неблагоприятных погодных условиях, связанных с морозами и ветрами, что позволяет сооружать экономически более выгодные облегчённые постройки для мясных пород крупного рогатого скота.
В связи с этим были приняты меры государственной поддержки и из средств федерального бюджета в рамках Госпрограммы выделены средства в размере 5,43 млрд. рублей в 2014 году, которые обеспечили дальнейшее развитие данной отрасли, стабильное увеличение поголовья специализированных мясных пород крупного рогатого скота и помесных животных. Поэтому в последние годы возникла острая необходимость в развитии мясного скотоводства, а также связанная с обеспечением производства говядины в продовольственной безопасности РФ.
Крупный рогатый скот всегда имел для отрасли сельского хозяйства России поистине многопрофильное значение, который давал такие важнейших продукты, как молоко, мясо и шкуры. В современных условиях под влиянием научно-технического прогресса стало экономически целесообразным разделение специализированных мясного и молочного скотоводства, как двух самостоятельных подотраслей животноводства [].
Скотоводство мясного направления продуктивности является специализированной подотраслью, которая производит высокого качества говядину и тяжелое кожевенное сырьё. Данная отрасль позволяет получать говядину от чистопородных и помесных (с молочными и комбинированными) животных специализированных мясных пород.
Говядина от этого скота специализированных мясных пород, обладает высокими кулинарными качествами за счёт вкусовых и питательными свойств. Это мясо является наиболее ценным продуктом в питании людей потому, что данному мясному скоту свойственен определённый обмен веществ, дающий мясную продуктивность высокого качества. Это связано с отложением сала в толще мышечной ткани, получившее название внутримускульное сало. Такое внутримускульное сало придаёт мясу «мраморный» вид, а по вкусовым качествам — высокую сочность и нежность. Все эти качества позволяют оценивать его высоко и пользуются большим спросом у покупателей [].Поэтому ключевым моментом в развитии мясного крупного рогатого скотоводства были приняты две отраслевые целевые программы по развитию молочного и мясного скотоводства в России на период 2009-2012 гг. Для этого есть все объективные возможности: обширные естественные кормовые угодья (сенокосы и пастбища) регионально адаптированные интенсивно-
пастбищными технологиями содержания животных; стартовое поголовье маточного стада мясного и молочного направления для создания специализированных мясных ферм племенного скота и, особенно, товарного.
Следует отметить, что от скота молочных пород, выращенного по интенсивной технологии, получают не менее тяжеловесную тушу. Однако сало этих животных откладывается с наружной поверхности туши в виде полива, а на внутренних частях туши — в виде крупных включений в толщу мышечной ткани. Такое сало, как правило, в процессе кулинарной обработки обрезают и удаляют.
Потребление мяса и мясопродуктов является одним из основных показателей качества жизни населения. В соответствии с научно обоснованными нормами рациона человеку необходимо 82 кг мяса в год. Из них — 39 % говядины; 34 % свинины; 5% баранины; 20% птицы; 2 % мяса прочих видов [].
Говядина является незаменимым продуктом питания для человека потому, что перевариваемость и усвояемость её ценных компонентов на 95% относят к диетическому продукту. При этом предпочитается говядина, получаемая от крупного рогатого скота мясного направления продуктивности потому, что считается самой вкусной и ценной продукцией [].
Важным условием успешного развития специализированного мясного скотоводства является формирование рынка высококачественной говядины (так называемого «мраморного» мяса) в свежем, то есть в незамороженном и не переработанном виде). Применяя разработанную под руководством академика РАСХН И.Ф. Горлова технологию производства «мраморной» говядины, рассчитанную на поголовье мясного скота в первую очередь отечественных пород, можно сделать вывод о том, что наилучший результат по формированию «мраморного» мяса был получен от бычков калмыцкой породы. Формирование «мраморности» в возрасте 17 месяцев у них завершено. У животных симментальской породы к 17-месячному возрасту «мраморность» мяса отсутствовала, однако, они характеризовались наилучшей развитостью мускулатуры. У бычков казахской белоголовой породы формирование «мраморности» продолжалось [].
В настоящее время в России осталось немного сельскохозяйственных предприятий, занимающихся разведением крупного рогатого скота мясных пород и помесных животных. В основном в нашей стране сельхозпредприятия отдают предпочтение развитию отрасли молочного скотоводства. Как мы уже отмечали выше, важной задачей аграрного сектора экономики является развитие отрасли мясного скотоводства на инновационной основе.
Инновационная стратегия развития мясного скотоводства включает несколько важных направлений: развитие племенной базы специализированных пород для получения достаточного поголовья высококлассных быков производителей и телок для чистопородных и товарных стад; создание товарных стад для получения молодняка, откорм которого дает высококачественную мясную продукцию; организация кормовой базы и кормления мясного скота; внедрение прогрессивной технологии по выращиванию и содержанию животных.
В программе на период 2013 — 2020 годы по развитию сельского хозяйства и регулирования рынков сельскохозяйственной продукции, сырья и продовольствия, принятой на государственном уровне, необходимо решение следующих задач:
— для устранения дефицита и практики массовой закупки животных за границей необходимо повышение генетического потенциала отечественной племенной базы мясного скотоводства на основе создания в регионах сети племенных центров мирового уровня по выведению мясных пород скота;
— обновление существующих предприятий по откорму скота и создание в регионах сети откормочных площадок промышленного типа,
соответствующих требованиям времени, с постановочным числом скотомест не менее 5 млн. голов;
— внедрение новых ресурсосберегающих технологий производства говядины, переход на технологию ее глубокой переработки, повышение ассортимента расфасованных полуфабрикатов и так далее.
Инновационное развитие мясного скотоводства определяется прогрессивной технологией, включающей в первую очередь использование адаптированных к природным условиям специализированных мясных пород и их помесей. Вторым важным элементом в технологии мясного скотоводства является воспроизводство и выращивание телят на подсосе, а третьим — доращивание молодняка после отъема от матери и получение достаточного поголовья ремонтных телок. И последние — организация интенсивного откорма. Эти элементы и составляют единый производственный процесс, обеспечивающий использование генетического потенциала мясных животных и экономическую эффективность отрасли [].
В настоящее время наблюдается устойчивое устремление к росту численности поголовья мясного крупного рогатого скота, созданию новых крестьянских (фермерских) хозяйств, комплексов по откорму животных на основе интенсификации. Реализуется положительная сторона новых производственных отношений на основе частного предпринимательства. Увеличение производства мяса с целью удовлетворения потребности населения в этом продукте питания является важнейшей народнохозяйственной задачей. Основным фактором ее решения является научно-обоснованный подбор пород и технологий выращивания молодняка. [].
В основе улучшения качества говядины главная роль отводится породам крупного рогатого мясного скота, обладающим желательными убойными качествами в соотношении съедобных и несъедобных частей, определяющих коэффициент мясности в туше, лучшими показателями качества мяса, кулинарными достоинствами говядины (казахская белоголовая, калмыцкая, симментальская) [].
Основными задачами, стоящими сейчас перед мясным скотоводством, являются: внедрение низкозатратных технологий, решение множества вопросов, связанных с воспроизводством стада, создание культурных пастбищ, интенсивное использование высокопродуктивных быков-производителей/
В основе технологии производства говядины лежат биологические процессы, определяющие рост и развитие молодняка мясного скота. С начала зарождения и рождения живого организма происходит увеличение количества клеток, массы и размеров органов и тканей, их процесса возникновения различий между однородными клетками и последующей специализацией [].
На рост и развитие живого организма влияют многочисленные внутренние (генетические) и внешние (негенетические) факторы, проявляющиеся в пренатальный и постнатальный периоды развития организма [].
Так, в пренатальный период: — генотип, внутриматочное окружение, размеры и возраст матери, её кормление, многоплодие, окружающая температура.
В постнатальный подсосный период — генотип, вес при рождении, молочность матери, её возраст, возраст при отъёме, а в период после отъёма -помимо генотипа и пола, возраст при отъёме, кормление, климат, адаптация, содержание.
В технологии промышленного выращивания мясного скота изучение этих факторов имеет важное значение, связанное с разведением, содержанием и кормлением животных [].
В скотоводстве, специализирующемся на производстве мяса, первостепенное значение имеет выбор породы, приспособленной к конкретной природно-климатической зоне и экономическим условиям, а также пол, который влияет на химический состав мяса туши. [].
Кастрированные бычки и тёлки значительно отличаются от некастрированных по показателям мясной продуктивности и качеству мяса [].
Рост последних более интенсивный. В 15-18-месячном возрасте их живая масса на 10-12% и более превосходят кастратов, а телок — на 15-20%. Кроме этого мясо у некастрированных бычков получается более постное, а затраты кормов на прирост меньше. Длительно
сохраняя напряжённый рост бычков надо интенсивно кормить до более высокой упитанности в отличие от кастратов и телок, которые начинают раньше откладывать жир, снижая прирост мышечной ткани и оплату корма. Поэтому живую массу в конце откорма нужно планировать дифференцированно с учетом пола и породы животных (телки в возрасте 1820 месяцев, должны весить 360-420 кг в зависимости от породы, кастраты 400-480 кг, бычки 420-500 кг, а для крупных пород — симментальская, помеси с шароле и лимузинами — 550-600 кг). При этих весовых кондициях получаются туши с хорошими убойными и качественными показателями мяса [].
1.2 Основные аспекты развития мясного овцеводства в России
Овцеводство и продукция этой отрасли в России всегда были востребованы. Масштабное изучение состояния и перспектив вопросов овцеводческого направления, основная роль проверки которых возлагалась на надзорные подразделения сельскохозяйственного профиля по всей площади Российских губерний и изданные в конце восемнадцатого века, доводят до нас сведения, что овец романовской породы содержали, разводили и совершенствовали методом народной селекции в Ярославском уезде, изначально крестьянских хозяйствах, а затем, самых лучших особей уже разводили в своих хозяйствах помещики; овец же тонкорунных пород (мериносных) примерно в это же время начали разводить в сельхозпредприятиях нечерноземной зоны России, в таких губерниях как: Рязанская, Орловская, Тульская. В этих же областях и в этот же период некоторые владельцы поместий уже были заинтересованы в приобретении мясных пород овец, которые широко были распространены в Великобритании. По сельскохозяйственной переписи на начальный период 1913 года в Центральной нечерноземной зоне России (Рязанская, Тульская, Курская, Орловская, Тамбовская, Воронежская области) было сосредоточено достаточно высокое поголовье овец, исчисляемая 6945,4 тысячами. В основном эти животные были представлены аборигенными длиннотощехвостыми овцами, из которых в последствии сложились локальные породы, такие как, волошская, пырка, русская длиннотощехвостая, михновская и др. В этой связи цель и задачи овцеводческой отрасли главным образом состояли в том, чтобы как можно полнее использовать генетические возможности овец, доминирующим направлением которых являются потребительские качества получаемой от них продукции.
Увеличение и производство баранины в Российских регионах за последние годы, после того как в девяностых начался резкий спад овцеводческой отрасли и, в частности, поголовья овец, в некоторых краевых зонах страны овцепоголовье пошло на увеличение. В ранжировке востребования баранины в Российской Федерации наибольший объем принадлежит парному или охлажденному мясу, а импортопоставки, сопровождаются только охлажденным или замороженным. На сегодняшний день ведущими районами, где достаточно хорошо развито овцеводство и сосредоточено самое большое поголовье овец, являются Республика Калмыкия, Дагестан, Ставропольский край. При этом, необходимо отметить, что отрасль в основном специализируется на производстве мяса баранины, так как доля ее потребления высока, поэтому она более востребована. В России производство баранины осуществляется, главным образом, за счет крестьянских подворий, фермерских хозяйств и более крупных предприятий. Импортирование бараньего мяса (баранины и ягнятины) в Россию в период с 2010 до 2015 года достигло 89,3 тыс. т общей суммой 223,5 млн долл. Такие страны, как Австралия и Новая Зеландия лидируют в поставках бараньего мяса. Кроме этих стран в Российскую Федерацию поставщиками баранины являются Уругвай, Молдавия и некоторые другие страны.
При зарождении в России мясного и мясошерстного направления в овцеводстве, а происходило это в начале 19 века, из Европы было закуплено около 160 тыс. иностранных пород овец. Благодаря новым ввезенным породам в нашей стране селекционерам успешно удалось создать новые отечественные породы овец мясного и мясошерстного направления. К большому огорчению, многие из выведенных в то время пород совсем утеряны, а если и остались в чистоте, то в очень мизерном количестве. Все это, во-первых, связано с тем, что природно-климатические условия нашей страны резко отличаются от очень специфического английского климата. Во-вторых, для того чтобы удачно реализовать генетический потенциал английских овец мясных пород для них необходимо создать условия интенсивного кормления, что не всегда могут обеспечить условия наших хозяйств. Представляется целесообразным разработать специальную программу или проект по развитию мясного овцеводства для всех регионов Российской Федерации. Поэтому правильное применение
прогрессивных технологий предусматривающих выращивание овец мясного типа и направленных на получение качественной молодой баранины, а также параллельно с этим получение продуктов убоя будет обеспечивать стабильное развитие мясного овцеводства в нашей стране.
Таким образом, важнейшей задачей является создание в России базы современного и очень востребованного на данный момент мясного овцеводства, при этом особое значение необходимо уделить мясосальной эдильбаевской породе овец. В ней сочетаются такие уникальные возможности, как хорошая скороспелость, неприхотливость в кормлении, полиэстричность, высокая резистентность к заболеваниям. При этом все свои лучшие качества она твердо передаёт по наследству и хорошо разводится в суровых условиях обитания при примитивной селекции и самых простых и доступных технологиях. Благодаря высокой мясной и сальной продуктивности эдильбаевская порода получила международное признание.
Анализ проведенных А.И. Любимовым, А.А. Фалалеевым и С.Ю. Стройновой (2013) исследований показал, что за период от рождения до 4-месячного возраста эдильбаевские ягнята превосходят собственную массу тела: баранчики — в 5,5 раза, ярочки — 5,6 раза, а абсолютный прирост живой массы и среднесуточный прирост по группе баранчиков составил 26,3 кг и 219 г, по ярочкам, соответственно, 24,0 кг и 200 г. Наибольший среднесуточный прирост в группе баранчиков за 120 дней составил 225 г, наименьший — 208 г, в группе ярочек — 217 г и 183 г соответственно.
А.М. Давлетовой в соавторстве (2018) была выполнена исследовательская работа на ягнятах эдильбаевской породы. По результатам эксперимента было установлено, что полученный молодняк обладает присущими мясосальным овцам телосложением и хорошей скороспелостью. При убое в 4,5 месяца от всех вариантов подбора получены тушки массой 15,7-17,1 кг без учета массы курдюка, с преимуществом в пользу потомства от баранов брликского типа, при этом также следует отметить, что показатели мясности потомства от баранов суюндукского типа были несколько ниже.
А.В. Молчанов и М.А. Егоров (2008) в своей работе указывают на эффективность производства ягнятины от овец эдильбаевской породы.
Ю.А. Юлдашбаев и др. (2010) ведут речь о том, что в аспекте развития мясного овцеводства на первые позиции значимости выходит опять мясосальное овцеводство, роль и значение которого до конца еще не оценены.
О рациональном использовании овец эдильбаевской породы в Воронежской области повествуют В.И. Котарев, А.Г. Ульянов и Е.М. Шаталова (2015).
Среди курдючных грубошерстных овец мясо сального направления продуктивности эдильбаевская порода по мнению Ю.А. Юлдашбаева и др. (2015) более предпочтительна. Так как по скороспелости и мясной продуктивности она смело может конкурировать с самыми лучшими английскими скороспелыми культурными мясошерстными породами. Необходимо отметить, что эдильбаевские овцы обладают как широкой экологической валентностью, так и хорошей приспособленностью к разным климатическим зонам.
Ученые Оренбургского аграрного университета провели исследования по улучшению мясности и качественных характеристик баранины, полученной от эдильбаевских овец. При этом они в очередной раз подтвердили, что эти овцы необычайно скороспелы. По их данным через 13 суток после появления на свет ягнята эдильбаевской породы удваивают свою живую массу, через 37 суток живая масса у них повышается уже в 4 раза, а через 888 суток (примерно 2,5 года) аж в 78 раз (Давлетова А.М., Косилов В.И., 2013).
Обобщая изложенный А.М. Давлетовой и В.И. Косиловым (2013) материал, необходимо отметить, что молодняк эдильбаевской породы овец при достижении 1,5 летнего возраста имеет 65 и 83 % массы тела от массы взрослых животных, баранов и овцематок, соответственно.
В принципе похожие результаты по эдильбаевской породе овец получены К.С. Ирзагалиевым, М.К. Куспановым (2000), В.И. Косиловым и др. (2016): «В среднем живая масса баранов данной породы достигает 110-120 кг, лучших доходит до 162 кг, маток — 75-77 кг, лучших — 126 кг. Живая масса молодняка в возрасте 1,5 лет составляет 90-92 % от живой массы взрослых животных, а ягнят в
4-5-месячном возрасте — 52-54 %. Убойный выход взрослых валухов на нагуле составляет 52-55 % при общей массе мяса и жира 35-40 кг. Матки характеризуются достаточной молочностью, обеспечивающей интенсивный рост, развитие ягнят и их скороспелость».
Интенсивная технология выращивания ягнят на мясные цели представлена таким важным звеном, как ранний отъем молодых животных от матерей в возрасте 4-4,5 месяцев. Все это способствует тому, что во-первых можно уплотнить ягнение маток, что позволит их более интенсивнее использовать, а во-вторых получить гораздо больший выход поголовья, и в конечном итоге значительно повысить производство молодой баранины [].
Таким образом, на настоящий момент наметился некоторый рост поголовья овец в России. Этот рост в основном идет за счет грубошерстных пород, и на первом месте среди них стоит эдильбаевская.
1.3 Стимулирующее действие кормовых добавок на организм сельскохозяйственных животных для повышения их продуктивности
Для обеспечения продовольственной безопасности страны в целом и конкретных регионов, в частности улучшения обеспечения населения ценными продуктами питания, перерабатывающей промышленности — сырьем, в ближайшие годы предстоит существенно увеличить производство мяса, молока и других продуктов животноводства. Для достижения данной цели необходимо существенно повысить наследственную продуктивность животных, что возможно только при полноценном кормлении. Общеизвестно, что основа укрепления кормовой базы — значительное повышение урожайности кормовых культур, сенокосов и пастбищ. Наряду с этим необходимо резко снизить потери питательных веществ при заготовке и хранении кормов, так как в настоящее время при выполнении данных процессов теряется почти треть выращенного урожая. Поэтому неудивительно, что проблема сохранения и повышения качества кормов стала одной из актуальных задач современного агропромышленного комплекса. Стоит отметить, что только за счет улучшения качества всех видов кормов, снижения потерь сахара, протеина, каротина и других питательных веществ можно значительно увеличить производство продуктов животноводства и повысить рентабельность отраслей. Интенсивное животноводство немыслимо без прочной кормовой базы и полноценных кормов [].
Однако порой практически невозможно обеспечить высокую продуктивность животных только за счет кормов собственного производства. В них часто в недостаточном количестве содержится протеин, незаменимые аминокислоты, минеральные вещества и витамины. Использование несбалансированных рационах приводит к снижению продуктивности животных, перерасходу кормов на единицу продукции, повышению и ее себестоимости и, в конечном счете, к снижению эффективности отраслей. Для интенсификации производства продукции животноводства, разведение высокопродуктивных животных необходимых обязательно использовать кормовые добавки, содержащие различные питательные и биологически активные вещества, которые смогут обогатить рацион питания. Многочисленными опытами доказано, что это позволит существенно повысить эффективность использования питательных веществ кормов и уровень продуктивности животных. В качестве кормовых добавок используются только те препараты, которые апробированы и разрешены Главным управлением ветеринарии МСХ РФ. Новые кормовые добавки испытывают в производственных условиях и внедряют в практику животноводства в соответствии с «Положением о порядке апробации новых ветеринарных препаратов». В последние годы появилась полезная информация по использованию пробиотиков, мультиэнзимных композиций ферментных препаратов, природных источников биологически активных веществ и нетрадиционных кормовых добавок, применение которых должно быть основано на знании об их физиологических и биологических свойствах, о нормах и способах их использования в животноводстве. Правильное применение различных кормовых добавок и комплекса биологически активных веществ, количество которых постоянно увеличивается, является одним из важных факторов повышения продуктивности животных, снижения расхода кормов на единицу продукции и повышения эффективности отрасли [].
На современном этапе экономического развития страны, для того чтобы отечественное животноводство стало рентабельным, конкурентоспособным и обеспечивало продовольственную независимость, необходимо добиться его высокой продуктивности. При промышленном ведении животноводства обеспечение животных кормами высокого качества и оптимальными кормовыми добавками является важной задачей организации высокорентабельного производства требует больших финансовых средств, которые не всегда окупаются произведенной продукцией. Решение данной задачи заключается в замене импортных дорогих кормовых добавок на аналоги из местного сырья, обладающих уникальными ионообменными и сорбентными свойствами, возможностью оптимизации минерального питания, способностью выведения из организма радионуклидов и солей тяжелых металлов.
В настоящее время создаются инновационные скотоводческие предприятия молочного направления благодаря использованию современного оборудования, совершенствованию кормовой базы и более полному раскрытию генетического потенциала продуктивных животных, комплексное решение которых позволит увеличить производство молока до уровня мировых стандартов [].
Отдельные исследователи отмечают, что организация полноценного сбалансированного кормления животных являются одним из факторов повышения продуктивности дойных коров. Установлено, что продуктивность коров на 40-50% зависит от обеспеченности энергией, на 30-50% протеином и на 10-20% — биологически активными веществами (витамины, макро-, микроэлементы и др.)
В течение производственного цикла не всегда удается организовать полноценное кормление высокопродуктивных животных, что в свою очередь приводит к необходимости восполнения рационов кормления различными доступными, экономически эффективными и экологически безвредными кормовыми добавками/
Как дефицит, так и перенасыщение основных элементов в рационе коров приводит к ослаблению здоровья и конституции, глубоким нарушениям обмена веществ, снижению продуктивности и биологической полноценности молока как продукта питания населения [].
Важным резервом увеличения энергии роста и развития, повышения мясных и откормочных качеств молодняка является использование в животноводстве разнообразных биогенных стимуляторов. Их применение снижает затраты кормов на единицу прироста, улучшает конверсию корма и обмен веществ, а также повышает естественную резистентность организма животных [].
В связи с разнообразностью действия известных биостимуляторов, наибольший интерес представляют тканевые препараты — как наиболее универсальные и эффективные иммуностимулирующие средства/
Многие препараты, обладающие стимулирующим действием, несмотря на свою широкую известность, остаются недоступными для большинства животноводов, или используются ими весьма ограниченно. Это обусловлено многими причинами: в некоторых случаях недостаточностью эффективностью препаратов, ограниченной направленностью действующего начала, в других — высокой стоимостью или сложностью технологии производства.
В.А. Погодаев, Е.А. Киц, Е.А. Моренко (2003-2005) разработали и экспериментально апробировали новый комплексный биологически активный препарат, обладающий свойствами иммуномодулятора — КИМ (комплексный иммунный модулятор). В 100 мл препарата входит: 20 мл биологически активной яичной массы; 79,7 мл раствора хлорида натрия 0,9%; 0,3 мл фенола.
Известно, что в период интенсивного роста организма образуется большое число новых белковых клеток, которые синтезируются из низкомолекулярных предшественников (аминокислот). Кроме этого, не участвующие в биосинтезе аминокислоты подвергаются в первую очередь реакциям дезаминирования (отщепления аминогрупп) и трансаминирования, а также реакциям превращения по карбоксильным и боковым группам.
Представленный препарат можно рекомендовать для тканевой терапии, белковой гидролизатотерапии неспецифической протеинотерапии.
Кроме этого, содержащиеся в препарате КИМ гормоны позволяют применять его и для органотерапии. Предлагаемый ими комплексный иммунный модулятор (КИМ) по сравнению с прототипами обладает эффектом тканевой терапии, белковой гидролизатотерапией, органотерапией, неспецифической протеинотерапией, а также бактерицидным эффектом. Способ приготовления позволяет не только получить препарат с эффектом тканевой и других видов терапии, но и позволяет сохранить полезные свойства яйца: высокий аминокислотный состав, витамины и гормоны, высокие иммунные показатели, активизацию уровня метаболизма [].
При промышленной технологии содержания животных, защитные силы их организма угнетаются различными неблагоприятными факторами. Поэтому при различных перегруппировках, в период адаптации животных к новым условиям содержания, а так же при комплектации комплексов сборным поголовьем, возникает необходимость стимуляции естественной резистентности у больших групп животных. Эффективным способом этого является распыление в воздухе помещения аэрозолей физиологичных и экологически безопасных стимулирующих препаратов, обладающих невысокой стоимостью. В качестве таких биостимуляторов могут использоваться некоторые малотоксичные, физиологически активные растительные средства. К ним следует отнести аэрозоли препарата из зверобоя, представляющие собой комплекс биологически активных веществ, извлеченных из воздушно-сухой массы растения путем многократной водно-щелочной термальной экстракции.
Иммуномодуляторы по химическому составу являются чаще всего полипептидами, полисахаридами. Их действующим началом являются цитомедины, биогенные стимуляторы, витамины, аминокислоты и т.д. Максимальное количество этих элементов в подобных препаратах обусловлено подбором оптимального по своим исходным свойствам субстрата, а так же рациональной технологией его обработки. Подобные
меры обеспечивают экономическую эффективность и доступность препарата. На практике установлено, что использование иммуностимуляторов дает положительный результат лишь в тех случаях, когда они поступают строго дозировано и в определенные сроки [].
Многочисленными исследованиями установлено, что биогенные стимуляторы в соответствующих дозах активизируют физиологические процессы в организме животных. Поэтому при их использовании ускоряется рост животных, повышается масса тела, отмечается заметная устойчивость ко многим заболеваниям.
Наиболее широко применение биогенные стимуляторы нашли в свиноводстве. В связи с этим, они с успехом применяются для стимуляции роста. В.И. Корольков (1959) был одним из первых, кто начал применять тканевые препараты для стимуляции роста здоровых животных.
С.С. Назаров (1960), использовал тканевый препарат из селезенки крупного рогатого скота для увеличения роста и улучшения развития ослабленных поросят. Препарат оказывал положительное влияние. Поросята опытной группы показывали среднесуточный привес на 40 г больше, чем животные в контрольной группе. У животных опытной группы резко сократились желудочно-кишечные заболевания, практически отсутствовал падеж. Автор пришел к выводу, что биостимуляторы способствуют улучшению роста и развитию поросят, повышают устойчивость их организма к различным заболеваниям.
Использование тканевых препаратов, как биологических стимуляторов, способствует более высокому синтезу белка в организме свиней и меньшему отложению жира при их откорме.
Е. Фарбер (1963) агаро-тканевый препарат М.А. Макарова назвал «чудо-препаратом». Опыт проводился на 1485 свиньях, при этом среднесуточные приросты в среднем составили 418 г, а в контрольной группе — всего 305 г. Затраты кормов на килограмм прироста в опытной группе
составили 5 кормовых единиц, а в контрольной — 6 кормовых единиц.
Применение агаро-тканевого препарата М.А. Макарова стимулирует рост и увеличивает массу отставших в росте подсвинков. У животных после введения препарата улучшается аппетит. Заметно повышалась подвижность, кожа постепенно становилась бело-розовой, повысилась упитанность. За два месяца откорма подопытные животные весили на 11,7 кг больше, чем контрольные (Куприянов C.B., 2009).
Исследованиями В.В. Масанской (1990) установлено, что применение тканевых препаратов при откорме свиней позволяет повысить среднесуточные приросты на 8-17%, при этом снижая затраты кормов на образование 1 кг прироста на 0,35-0,87 кормовой единицы и сократить сроки мясного откорма на 5-13 дней. Наибольший эффект получен от применения агаро-тканевого препарата.
В.В. Василисын (1975), изучая влияние на организм свиней стимуляторов комплексного применения, вводимых с кормами и в виде подкожной инъекции, пришел к выводу о нецелесообразности использования агаро-тканевого препарата и органопрепарата ГПС параллельно с препаратом ПВ-1. Это, в значительной степени, приводит к торможению роста и снижению среднесуточных приростов у животных.
В своих опытах О.В. Пономарев (2003) установил, что поросята-отъемыши, стимулируемые препаратами СТЭМБ и БАЯМ, превосходят аналогов контрольной группы в возрасте 4-х месяцев по живой массе на 0,77 — 3,1 кг, а по сохранности поросят — на 3,4 — 6,7%. Так же, в итоге повышаются и воспроизводственные качества свинок.
Применение тканевых препаратов при искусственном осеменении свиней, как отмечали A.A. Акатов, М.А. Макаров, Е.В. Волохин (1963), способствует повышению их оплодотворяемости. Это объясняется раздражающим влиянием продуктов жизнедеятельности и ферментативного распада клеток на подбугорье, а через него и на секреторную функцию гипофиза. В результате действия тканевых препаратов на нервную систему, у животных усиливается гонадотропная функция гипофиза, повышается чувствительность матки и влагалища к гормонам яичников.
В своих исследованиях В.А. Медведский (1998) установил, что половая зрелость у животных, при использовании тканевых препаратов, наступала значительно раньше. Так у свинок, получавших препарат из печени, первая течка наступала на 34 дня раньше; у свиноматок, которым методом инъекций вводили плаценту — на 46 дней раньше, чем в контрольной группе.
В.А. Алексеев, Ф.Н. Петрякин, Л.В. Пыркина (1997) в качестве стимулятора использовали препарат «Терпенол» — хвойная мука. В результате проведенных научно-производственных экспериментов было установлено, что применение «Терпенола» оказывало положительное воздействие на качество получаемого приплода и сохранность поросят. Свиноматки опытной группы имели большую молочность на 22,1% по отношению к контрольной группе. Процент мертворождаемости в контроле составил 6,4%, а в опыте — 2,8%. Поросята, полученные от свиноматок опытных групп, отличались более высокими среднесуточными приростами и к 2-х месячному возрасту достигали веса в 20,4 кг, что составило 111,5% по отношению к контрольной группе. Наряду с повышением динамики роста, поросята опытных групп имели более высокую сохранность — 90,6% контрольная группа и 95,8% — в опыте.
Э.Е. Острикова (2001) подчеркивает, что применение тканевых стимуляторов позволяет получить потомство менее чувствительное к стрессам, у которого на 7-й день после воздействия стресс-фактора все гематологические и биохимические показатели приходят в норму, а у поросят, полученных без стимуляции, это происходит только на 14-й день.
По данным Л.А. Михайловой (1992) определенные предпосылки для увеличения количества получаемой мясной продукции, дает применение биостимуляторов обладающих гормональной активностью. Наиболее широкое применение имеет стимулятор «Доксан». При имплантации животным, этот препарат (стандартная доза 36 мг действующего вещества), повышает среднесуточные приросты на 10-20% и увеличивает конверсию кормов на 7-11%.
В конце прошлого века достижения в области органической химии позволили рекомендовать животноводческой отрасли применение экологически чистого препарата, входящего в систему биохимических процессов организма животного — янтарную кислоту (сукцинат).
По данным Л.А. Бахиревой (1996), в результате длительного применения препарата янтарной кислоты (ЯК-85) ремонтным свинкам, снижаются сроки наступления половозрелости на 8 дней, при этом оплодотворяемость увеличивается на 9,3%. Скармливание биостимулятора супоросным свинкам выявило избирательное действие применяемых препаратов на репродуктивную функцию животных. Таким образом, дифференцируя введение препаратов супоросным свиноматкам, можно управлять их воспроизводительной функцией.
В своих опытах Н.С. Васильева (1966), изучая влияние препаратов янтарной кислоты на рост, развитие и профилактику алиментарной анемии поросят установила, что использование сукцината супоросным свиноматкам, а так же, дальнейшее применение гемовита на поросятах, повышает содержание гемоглобина и эритроцитов в крови животных на 8,3-30,0% и 6,4-39,5%.
При этом, сохранность и живая масса животных возрастает на 2,88,0% и 9,3-22,3% соответственно.
Многие исследования Н.С. Гегамяна и Л.К. Эрнста (2003) посвящены вопросам ростостимулирования и прироста живой массы, проводимые на взрослых животных при использовании в качестве стимулятора -хлорнокислого магния (ХКМ-300). Авторы установили положительный ростостимулирующий эффект данного препарата. При 30-ти дневной подкормке препаратом ХКМ-300 ремонтных свинок, прирост живой массы увеличился на 4,4%, а у взрослых свиноматок — на 1,0% по сравнению с контролем. Затраты кормов на единицу прироста живой массы в контрольной группе превосходили опытные на 26,3% и 18,2% соответственно.
По данным Л. А. Коростылевой (2001), полученным в ходе экспериментальных исследований, препарат «Доксан», в дозе 2,2 мг на 1 кг живой массы, при однократном введении обладает ярко выраженным ростостимулирующим действием, обеспечивая увеличение живой массы свиней на откорме — на 12%, при уровне среднесуточного прироста — 631 г.
Препарат «Доксан-М» в дозе 2,0 мг и сульфат магния в дозе 122 мг на 1 кг живой массы превосходит по продуктивному действию «Доксан» и обладает более выраженным ростостимулирующим эффектом, обеспечивая повышение живой массы на 25,4%.
Р.Г. Попов (2000) установил, что использование ферментативной добавки «Порзим 8Р-100» при откорме свиней, оказывает положительное влияние на качество мяса. Процентное содержание мяса в туше свиней ДМ-1 было на 4,45%, у свиней СМ-1 — на 5,66% выше по сравнению с контрольными группами. Введение ферментативной добавки оказывало заметное положительное влияние на химический состав мяса и сала свиней пород ДМ-1 и СМ-1.
Как сообщают С. Тойгильдин, С. Лифанова (2011) перспективным направлением для повышения продуктивности коров и улучшения их воспроизводительных функций является использование комплексного витаминного препарата «Карток». Использование витаминизированного препарата, содержащего р — каротин и а — токоферол, способствовало более интенсивному обмену веществ, что благоприятно отразилось на процессе молокообразования.
В своих исследованиях А. Кайдулина, В. Королев, А. Струк, Р.Полетаев (2010) испытали ростстимулирующий препарат САТ-СОМ. Результаты исследований показали, что использование препарата в практике животноводства способствовало повышению мясной продуктивности бычков и улучшению качества говядины. У бычков повысилась убойная масса на 14,2 %, убойный выход — на 2,17%, индекс мясности — на 13,2%, содержание жира-на 0,41%.
Г. М. Маннов и Н.И. Серков (1959), применяя тканевые взвеси на молодняке крупного рогатого скота, получили превышение прироста подопытных животных по сравнению с контрольными на 20 — 25%. При этом производилась 4-5- кратная инъекция эмульсии селезенки с 5 — 7-дневными интервалами.
И. А. Калашник (1960) указывает, что особенно эффективным является применение биогенных стимуляторов для животных, отставших в росте. У них увеличение прироста достигает 60% и более по сравнению с контрольными. Введение телятам экстракта из печени и семенников крупного рогатого скота в дозе 5 мл на инъекцию вызывало повышение живой массы телят по сравнению с контрольными на 12% и более.
В Белорусском научно-исследовательском институте животноводства был проведен опыт по применению АБК на поголовье телят черно-пестрой породы. Препарат АБК вводили через рот в течение трех дней, по 3 раза в день, по 80 на каждую дачу. Среднесуточный прирост телок опытной группы на протяжении первого месяца после введения был на 32% выше по сравнению с телками контрольной группы. Последействие препарата сказалось и в последующий месяц — среднесуточный прирост опытных телок был выше на 23% по сравнению с контрольными (Заболотный И. И., 1964).
Как отмечают K.M. Солнцев, В.А. Сапунов, Ф.И. Салтыков, Ю.Н. Николаева (1963) стимулятором для молодняка крупного рогатого скота является ПАБК, которая не только предупреждает токсическую диспепсию, но и способствует значительному увеличению прироста животных. В совхозе
«Годовково» Московской области в результате применения ПАБК новорожденным телятам 3 раза в день по 40 — 50 мл получено превышение среднесуточного прироста на 29,4% по сравнению с контрольной группой.
В самый ранний период жизни молодняка благоприятное действие на него оказывает также ПАБК, которая представляет собой сочетание ацидофильной культуры, оказывающей благоприятное действие, на пищеварительный аппарат, и комплекс витаминов группы В.
И.И. Заболотный (1964), указывая на эффективность применения ПАБК, отмечает, что этот препарат является высокоэффективным средством, профилактирующим возникновение диспепсических поносов, анемии и нервных расстройств у поросят. Введение препарата супоросным маткам оказывает влияние на увеличение приплода и стимулирует рост молодняка.
Н.И. Мжельский (1982), указывая на результативность применения ПАБК в животноводстве как средства увеличения мяса, отмечает положительное влияние ее на приплод. В совхозе «Головково» Московской области они скармливали ПАБК с кормом супоросным маткам за 30 дней до опороса 3 раза в день по 50 мл, а затем в такой же дозе на протяжении 5 дней до опороса и 5 дней после опороса. В результате у подопытных маток родились здоровые поросята, имеющие более высокую живую массу.
При двукратном введении биостимулятора с интервалом в 7 дней интенсивность откорма повышается до 35 дней. За это время повышение среднесуточного привеса опытных свиней по сравнению с контрольными на 35-й день составляет 238 г. При трехкратном введении биостимулятора с промежутками в 14 дней после второго среднесуточная разница между привесами свиней опытной и контрольной групп при средних приростах 483 и 229 г составляет 254 г.
В своих исследованиях X. Ишмуратов, В. Косолапов, В. Косолапова (2006) по использованию тканевых препаратов для стимуляции прироста при откорме животных также указывают, что 2 — 3-кратное введение препарата с
интервалом до двух недель обеспечивает увеличение прироста опытных животных по сравнению с контрольными на 10 — 25%.
А.И. Тишковым (1983) проведены опыты по использованию тканевых препаратов на свиньях. Препарат из селезенки вводили через 6 дней по 5 мл на инъекцию. Среднесуточный прирост свиней опытной группы составил 475,2 г, контрольной— 381,6 г. Увеличение прироста в опытной группе по сравнению с контрольной составляет 24,9 %. За 36 дней опыта от 184 свиней дополнительно получено 620 кг свинины. Среди первоочередных проблем поставленных государством перед агропромышленным комплексом стоит задача увеличения производства высококачественных продуктов животноводства.
Научно-технический прогресс в сельскохозяйственном производстве привел к тому, что многие звенья в технологии выращивания и содержания животных пришли в противоречие с их физиологическими особенностями, возникшими и закрепившимися в процессе эволюции. В настоящее время многие животные находятся под воздействием во много раз больших стрессовых факторов, чем их предки. Это отражается на их плодовитости, откорме и развитии, что в дальнейшем может привести к гибели животного (КовальчуковаМ., 1978).
Проблема повышения защитных сил организма животных, сопротивляемости отдельным факторам внешней среды, повышения функциональной деятельности различных систем организма животного, является актуальной общебиологической проблемой (Монастырев А., Киселев М., Тихонов С.. 2007).
Исследования последних лет свидетельствуют о все возрастающем интересе ученых и практических специалистов ветеринарии и зоотехнии к использованию живых микроорганизмов как биологических регуляторов метаболических процессов в организме животных (Якушкин И.В., 2002).
P.M. Полковников и Л.Т. Туренкова (2000) на основе исследований и теории В.П. Филатова разработали биостимулятор «плацента активное начало» (ПАН) из женской плаценты. Новая разработанная технология производства препарата позволяет стабилизировать его биологический состав, повышать его биологическую активность за счет содержащихся в нем активных биологических веществ, а так же увеличить сроки хранения и область применения.
Экономическая эффективность производственного применения тканевых препаратов по откорму крупного рогатого скота в двух колхозах Одесской области выявилось в следующих показателях. Колхоз «Прогресс» за 60 дней откорма получил среднее повышение привеса животных опытной группы по сравнению с контрольными по 8,4 кг, или 17,3% на голову; средний прирост за время опыта составил 56,9 кг. В колхозе «Дружба» за 30 дней опыта при среднем привесе животных опытной группы 25,2 кг повышение составило 5,4 кг на голову, или 26,8%. Тканевый препарат вводили по 10 мг на инъекцию, с промежутками через 5 дней. За 10 дней до снятия с откорма введение препарата прекращали. С учетом того, что забою на мясо подвергается не менее 50% поголовья приплода крупного рогатого скота, рациональное применение биостимуляторов при нормальном кормлении даст дополнительно тонны мяса и соответствующее повышение дохода хозяйства (Суржикова Е.С., Абакин С.С., 2009).
A.И. Клименко, Р.В. Клименко, Р.В. Харченко, Г.А. Харченко (2008) в своих исследованиях показали, что от свиней II, III, IV групп, стимулируемых комплексным иммунным модулятором КИМ за 120 дней откорма удалось получить туши на 7,52, 11,34, 11,93 кг больше чем от аналогов контрольной группы. Они же отличались и более высокой убойной массой и убойным выходом. По убойной массе они превосходили I контрольную группу на 8,95, 12,25, 13,97 кг, а по убойному выходу на 0,7; 1,17; 1,58 % соответственно.
B. А. Погодаев и Б. А. Айсанова (2010) провели научно-производственный опыт в СХА (колхозе) «Кубань» Карачаево-Черкесской Республики на бычках красной степной породы. Было установлено, что абсолютный прирост живой массы у животных, где применялся комплексный иммунный модулятор КИМ, был выше на 6,7 кг, среднесуточный прирост на 112 г и относительный прирост живой массы за период на 4,5% по сравнению с животными контрольной группы.
Хорошим стимулятором роста и развития животных является лечебная сыворотка Н.Г. Беленького (ЛСБ). Кроме того, для ускорения роста животных Н. Г. Беленьким предложен белковый препарат растин, состоящий из ростовых веществ, выделяемых из эмбриональной ткани сельскохозяйственных животных. Растин вводится внутримышечно в дозе 0,1 мл на 1 кг живой массы. Рекомендуется ввести откармливаемым животным по 3 — 4 инъекции с промежутками 2-3 суток, повторить их через 25 — 30 дней (Королев В., 2007).
Одним из перспективных направлений считается применение в животноводстве бета-аденергических агонистов. Они стимулируют прирост массы скелетной мускулатуры (Moloney А.Р., Alten P., Ross D.B., 1990).
Как сообщают A.B. Погодаев, В.А. Погодаев, А.Д. Пешков (2009) негативное влияние технологических факторов современных промышленных систем выращивания в свиноводстве может быть нивелировано применениям биогенных стимуляторов, усиливающих физиологические процессы, активизирующие функциональные резервы, потенциально имеющиеся в организме. Научно-производственный опыт проводился на свиноводческом комплексе «Полюс» ОАО РАПП «Кавказ-мясо» КЧР в 2008-2009 гг. В опыте использовали биологические стимуляторы СИТР — созданный на основе трутневого расплода и CT — из взрослых трутневых особей. Установлено, что подножная трехкратная инъекция биогенных стимуляторов СИТР и CT с интервалом в 7 суток положительно влияет на морфологический состав крови. При этом повышается количество эритроцитов, гемоглобина, лейкоцитов, что благотворно влияет на обмен веществ в организме подсвинков и в конечном итоге более высокий их рост и развитие.
Таким образом, биогенные стимуляторы обладают способностью стимулировать ряд жизненно важных функций организма, вследствие чего происходят изменения обменных и энергетических процессов в организме животного, что обеспечивает их воздействие на ферментативные и другие системы (Головин А.В, Красовский A.C., Могиленец О.Н., 2008).
Грамотное и своевременное применение тех, или иных стимуляторов, в сочетании с полноценным кормлением и правильным содержанием животных, является большим дополнительным резервом для повышения продуктивности и рентабельности животноводства.
1.4 Физиологи-биохимические свойства трутневого расплода для организма животных и человека
Россия — одна из стран с развитым пчеловодством и определенными традициями, сложившимися в этой отрасли сельскохозяйственного производства. В последние десятилетия в ряде государств стали применять нетрадиционный продукт пчеловодства -трутневый расплод. Интерес к этому новому продукту появился и у нас в России [].
Пчелиная семья — представляет собой сложную 1 целостную биологическую и хозяйственную единицу. Трутни в ней являются временными особями, что связано с ограниченной их функцией только спаривания с маткой. Массово трутни выводятся, как правило, весной или в первой половине лета, однако трутнёвый расплод в активный период пчеловодческого сезона в определенном количестве имеется во всех пчелиных семьях.
На количество выращиваемого пчелами трутневого расплода влияют несколько основных факторов: период активного сезона и состояние пчелиной семьи (число пчел, соотношение взрослых особей и расплода); возраст и происхождение матки; наличие и уровень среднесуточного сбора нектара и пыльцы пчелами; уровень обеспеченности семьи белковым кормом; объем гнезда и число сотов в нем с трутневыми ячейками. Ограничение выращивания пчелами трутневого расплода связано прежде всего с тем, что и личинки, и взрослые трутни потребляют много корма. Например, при недостатке пыльцы в природе и скудных запасах перги в гнезде пчелы достоверно меньше или вовсе не выращивают трутней либо изгоняют их даже среди лета, так как для последних при этом требуется в пять раз больше корма, чем для такого же количества рабочих пчел.
На выращивание расплода 1 тыс. трутней расходуется 750 г меда и 450 г пыльцы, и это же число трутней за свою жизнь потребляет еще 6,32 кг меда. Количество трутневого расплода зависит от силы семьи и за сезон приближается к 9 тыс. Несложные подсчеты наводят на мысль, что рабочие пчелы только и заняты тем, что кормят трутней, а пчеловоды недобирают с каждого улья более фляги меда. Как-то в Ялте я видел, как пчеловод на своей пасеке паяльной лампой, можно сказать огнем и мечом, уничтожал эту голодную рать. Однако опыты Д.Аллена (1958) показали, что пчелы собирают одинаковое количество меда в ульях с ограниченным и неограниченным количеством трутней. Ф.Руттнер (1982) сделал из этого вывод о том, что их присутствие стимулирует сбор меда. К тому же далеко не весь расплод превращается в половозрелых трутней. Многие особи погибают в первые дни жизни.
Самка клеща варроа более охотно посещает ячейки с трутневым расплодом. Появился даже метод борьбы с заклещенностью, основанный на его уничтожении. Когда срезают трутневой расплод, то среди нескольких свободных от клещей ячеек попадаются и отдельные заклещенные. Чтобы не распространять болезнь, все трутневые срезки закапывают в землю, отправляют на перетопку, сжигают. В большинстве случаев пчеловоды даже не подозревают, с каким ценным кладом они расстаются, ведь вместе с шелухой выбрасывается и зерно.
В семидневном возрасте трутневые личинки содержат в своем теле: жира 22,2%, гликогена 24,5%, азота 6,2% (в основном азота белка и свободных аминокислот) (А.М.Рямова, 1975).
Согласно В.Г.Голоскову и П.К.Пименову (1972), семидневные личинки содержат в 100 г сырого материала: кобальта 2,5 мкг, марганца 14, меди 1, молибдена 4, никеля 7, бора 4 мкг. Живому организму крайне необходимы эти ферментообразующие элементы. Их отсутствие в пище сопряжено с возникновением тяжелых заболеваний. Так, недостаток кобальта приводит к грибковым заболеваниям, дряблости кожи; марганца — к дистрофии, потере веса; меди — к анемии, выпадению волос, депрессии, нарушению пигментации кожи, низкому гемоглобину; молибдена — к заболеваниям печени и почек; бора — к нарушению нормального роста и развития организма, остеопорозу, деминерализации костей.
Микроэлементы также входят и в состав витаминов или активизируют их. В отсутствие определенных витаминов в организме можно легко убедиться по следующим признакам: недостаток каротина вызывает предрасположение к экземе; витамина D — к потливости; В2 — к сухости и синюшности губ, трещинам в уголках рта, себорейному дерматиту носогубных складок; РР — к сухости и бледности губ, шелушению кожи, особенно на тыльной поверхности кистей рук и шеи, пигментации; В3, В6 и Н — к дерматитам; С — к синюшности губ, ушей, ногтей, бледности и сухости кожи. С помощью трутневого расплода нельзя полностью удовлетворить суточную потребность человека в микроэлементах, так как в основном они поступают в организм с пищей. Однако его употребление устраняет дефицит микроэлементов в организме человека и способствует профилактике перечисленных заболеваний, поскольку в нем они содержатся в сбалансированном соотношении для живого организма.
Г.А.Григорян (1972) установил, что в гемолимфе личинок присутствуют все заменимые и незаменимые аминокислоты. Наибольшая доля приходится на аспаргиновую кислоту — 48,4 мг%; глицин — 49,1; тирозин — 52,9; аргинин — 26,1; лизин — 23,6; пролин — 21,4 мг%. А.Г.Маннапов и др. (2005) доказали, что больше всего в трутневом расплоде содержится глютаминовой кислоты, а аспарагиновой и изолейциновой меньше. В организме человека эти аминокислоты стимулируют работу иммунной системы. Помимо того, аргинин используют при лечении заболеваний печени; тирозин улучшает память; лизин защищает от вирусов герпеса, способствует выработке гормонов, ферментов, антител. Аспаргиновая кислота играет весьма существенную роль в обмене веществ и особенно быстро подвергается окислительному дезаминированию.
Во многих странах трутневые личинки применяют как лечебное средство и деликатесный высококалорийный продукт питания. Л.Г.Чугунова, Л.А.Бурмистрова, А.Н.Рябков (1999) считают возможным использовать их гомогенат для лечения заболеваний щитовидной железы. А.Н.Бушученко и В.Р.Пепенин рекомендуют употреблять смесь трутневого расплода с медом (по 12–15 г за 20–30 мин до еды) для улучшения умственной и физической активности, усиления потенции, нормализации сна. А.Г.Бачинский и А.Н.Децина (1998) используют его как составную часть различных косметических кремов. А.И.Черкасова и др. (2005) отмечают эффективность порошков на основе личинок трутней, маток и пчел при лечении туберкулеза.
Некоторые пчеловоды убедились в лечебных, биостимулирующих и тонизирующих свойствах личинок. Одни вытряхивают шестидневных личинок на противень, разминают ложкой, смешивают с водой (1 столовая ложка на 1 стакан воды) и пьют сладковатую жидкость молочного цвета. Другие готовят лекарство впрок: в пол-литровую банку зрелого меда кладут шестидневные личинки (20–30 шт.), разминают и тщательно смешивают с медом. Хранят смесь в темном прохладном месте или холодильнике. При недомоганиях употребляют по 1 столовой ложке 3 раза в день за 30 мин до еды, запивая водой комнатной температуры. Иногда трутневой расплод жарят на сливочном или подсолнечном масле и принимают по 1 столовой ложке.
В.И.Лебедев и М.А.Легович (2002) отбирают трутневой расплод на десятые—двенадцатые сутки после откладки маткой яиц — перед появлением зачатков глаз, ног, крыльев в виде фиолетовых пятен. Восковую печатку они осторожно срезают ножом, трутней из рамок извлекают на медогонке. Измельченные личинки растирают со смесью лактозы и глюкозы, которую берут в одинаковом соотношении по массе. К 1 части трутневого гомогената добавляют 6 частей смеси сахаров. Полученную массу сушат в течение 3 мес при 4–6°С. Готовый продукт может храниться 3 года при комнатной температуре.
Р.Ю. Павлюк и др. к порошку из гомогената трутневых личинок добавляют прополис и пыльцу, что увеличивает срок его хранения в 2 раза. Они рекомендуют гомогенат для лечения сердечно-сосудистых заболеваний, повышения работоспособности и иммунитета.
И.А.Прохода (1996) сообщает, что биологическая активность трутневого гомогената сохраняется в течение двух лет при консервировании сахарной пудрой или медом.
Количество трутневого расплода в улье зависит от времени сезона, силы семьи, возраста матки и породы пчел. По данным В.И.Лебедева и М.А.Легович, кавказянки выращивают трутней в 1,72 раза больше, чем среднерусские, и в 1,36 раза больше, чем итальянские пчелы.
Масса одной трутневой личинки перед запечатыванием — около 370 мг (по другим данным — 344 мг). Масса 9 тыс. личинок трутней, выращиваемых за сезон сильной семьей, — 3,3 кг. Этого достаточно для приготовления 330 кг меда, содержащего 1% биологически активной добавки. Принимать его следует по 1 столовой ложке 3 раза в день за 30 мин до еды. Такое количество соответствует приему трех личинок в одни сутки. Естественно, оставлять пчел без трутневого расплода нельзя, поэтому практический сбор гомогената с одного улья составляет около 1 кг. Для приготовления спиртовой настойки берут 60 личинок в возрасте 6 дней (примерно 20 г), добавляют к ним 100 мл спирта, настаивают в темном месте 7–9 дней и фильтруют. Принимают по 30–40 капель в 20–30 мл воды 3 раза в день за 20 мин до еды. В качестве стабилизатора (антиокислителя) можно добавить к настойке 15 капель спиртового раствора прополиса и хранить настойку в холодильнике.
Высокая природная биологическая активность трутневого расплода обусловлена уникальным сочетанием компонентов, обладающих определенными , биологическими свойствами (Н.В. Илиешиу, 1983;
Л.А.Бурмистрова, 1999; Н.Н.Асафова и др., 2001). Расплод идеально соответствует организму человека, содержит естественные гормоны: тестостерон, прогестерон и эстрадиол, которые не вызывают нарушения гормонального статуса, а оказывают стимулирующее влияние на эндокринную систему, восстанавливают функции яичников, способствуют омоложению организма, восстанавливают обмен веществ и питание тканей, способствуют нормализации артериального давления, снижают уровень холестерина в крови, способствуют ускоренному восстановлению биохимических и массометрических характеристик семенников и предстательной железы,, являясь стимулятором центральных механизмов регуляции образования андрогенов, повышают физическую работоспособность, способствуют восстановлению нарушенной половой функции у мужчин, и повышению полового влечения. Трутнёвый расплод эффективен в комплексной терапии сердечнососудистых заболеваний [].
Все технологические процессы по производству и сбору личинок трутней и приготовлению гомогената должны совершаться в максимально короткие сроки, так как расплод проходит определенные стадии развития, а после отбора его из сота подвержен воздействию окружающей среды и быстро портится: по мере окисления изменяется его цвет — становится сначала серым, потом чернеет, появляется кислый запах, прогорклый’ вкус [].
Поэтому трутнёвый расплод необходимо стабилизировать для сохранения его качества. Установлено, что адсорбция и лиофилизация являются эффективными способами сохранения количественного содержания компонентов и биологической активности трутнёвого расплода [].
2. Собственные исследования
2.1 Материалы и методы исследований
В рамках исследований по данной тематике проведены один научный и один научно-производственный эксперимент. Первый эксперимент проводился в условиях вивария университета на баранчиках цигайской породы и на бычках на откорме в условия ООО «Красная Горка» Колышлейского района Пензенской области.
Для выполнения поставленных задач в условиях вивария были сформированы две группы животных одинакового веса и возраста. Выбор баранчиков был обусловлен тем, что они относятся к жвачным и могут быть использованы в качестве модельных животных. Полученные результаты на баранчиках можно использовать для прогноза на бычках на откорме. Баранчики были отобраны в четырех месячном возрасте с фермы ООО «Биокор-С», который имеет статус племенного (рис. 1). Из имеющегося большого массива животных нами били отобраны 20 голов животных весом 21 кг и перевезены в условия вивария университета.

Рисунок 1 — Племенная ферма ООО «Биокор-С»
В каждой группе находилось по 10 голов. Содержали молодняк по две головы в каждом загоне. Применяли зимний рацион, который состоял из сена смешанных злаковых трав и комбикорма. Рецепт комбикорма представлен в таблице 1.
Таблица 1 — Рецепт комбикорма для откормочных баранчиков
| Иградиенты | Кол-во, г | К.ед | Обменная энергия, МДж | Сухое вещ-во, г | Сырой протеин, г | Переваримый протеин, г | Са,г | Р, г |
| Ячмень | 40 | 0,046 | 0,448 | 34,0 | 4,52 | 3,40 | 0,08 | 0,16 |
| Овес | 40 | 0,04 | 0,378 | 32,0 | 4,32 | 3,16 | 0,06 | 0,14 |
| Горох | 9,0 | 0,011 | 0,114 | 8,5 | 2,2 | 1,92 | 0,02 | 0,04 |
| Жмых льна | 9,4 | 0,012 | 0,103 | 8,0 | 3,4 | 2,8 | 0,03 | 0,09 |
| Соль | 1,0 | |||||||
| Минеральный премикс | 0,1 | |||||||
| Кормовая добавка | 0,5 | 0,0005 | 0,098 | 0,28 | 0,36 | 0,25 | 0,03 | 0,01 |
| Итого | 100 | 0,109 | 1,14 | 82,78 | 14,8 | 11,53 | 0,3 | 0,44 |
Кормовая добавка представляет собой смесь кукурузы, обработанной барогидротермическим способом и защищенного жира (кальциевая соль жирных кислот растительных масел).
Отличительной особенностью кормовой добавки является то, что животным опытной группы на взорванную кукурузу наносили гомогенат трутневого расплода и полученный комплекс защищали от избыточного распада микроорганизмами рубца защищенным жиром (технология получения описана далее).
Рацион для животных был рассчитан на баранчиков 4-5 месячного возраста с живой массой 24-30 кг и для получения среднесуточного прироста 170-180 граммов.
Таблица 2 — Среднесуточный рацион для откормочных баранчиков
| Компоненты | Контроль | Опыт |
| Сено злаковое смешанное, кг | 1,0 | 1,0 |
| Комбикорм, кг | 0,55 | 0,55 |
| В 1 кг содержится | ||
| Кормовых единиц | 1,1 | 1,1 |
| Обменной энергии, МДж | 12,9 | 12,9 |
| Сухое вещество, кг | 1,3 | 1,3 |
| Сырой протеин, г | 172,5 | 172,5 |
| Переваримый протеин, г | 105,5 | 105,5 |
| Соль, г | 5,5 | 5,5 |
| Са, г | 7,65 | 7,65 |
| Р, г | 4,2 | 4,2 |
| Гомогенат трутневого расплода в составе кормовой добавки, мг | — | 100,0 |
Длительность эксперимента на баранчиках составлял 60 суток. В начале эксперимента на 30 и 60 сутки были отобраны образцы крови для биохимических анализов.

Рисунок 2 – Взятие крови у ягнят в период эксперимента
Определяли следующие биохимические показатели:
Биохимические – содержание гормона тестостерона в сыворотке крови животных; содержание общего белка, альбумина, мочевины, глюкозы, общего холестерина, аспартатаминотрансферазы, аланинаминотрансферазы, общего билирубина, креатинина, липазы, кальция, магния, меди, калия, натрия.
Гематологические – лейкограмма; количество лейкоцитов в 1 л крови; количество эритроцитов в 1 л крови, количество тромбоцитов в 1 л крови содержание гемоглобина.
Зоотехнические – живая масса; абсолютный, относительный и среднесуточный приросты живой массы, убойный выход молодняка овец, площадь мышечного глазка, индекс мясности.
Лабораторные исследования проводились в межфакультетской биохимической лаборатории по описанными ниже методам:
Определение общего белка в сыворотке крови
Для определения общего белка использовали биуретовый метод, основанный на так называемой «цветной биуретовой реакции», в ходе которой белки реагируют в щелочной среде с сульфатом меди с образованием соединений, окрашенных в фиолетовый цвет, интенсивность окраски зависит от концентрации общего белка в плазме.
Для опытной пробы к 0,1 мл плазмы прибавляли 5 мл рабочего раствора биуретового реактива и смешивали, избегая образования пены. Для холостой пробы использовали дистиллированную воду, для калибровочной – раствор калибратора. Выдерживали при комнатной температуре (20-250С) 30 минут. Пробы фотометрировали против контрольной (холостой) пробы при длине волны 540 нм в кювете с толщиной поглощающего слоя 1 см не позже, чем через час после начала инкубации.
Концентрацию общего белка (С) рассчитывали в г/л по формуле 1:
(1)
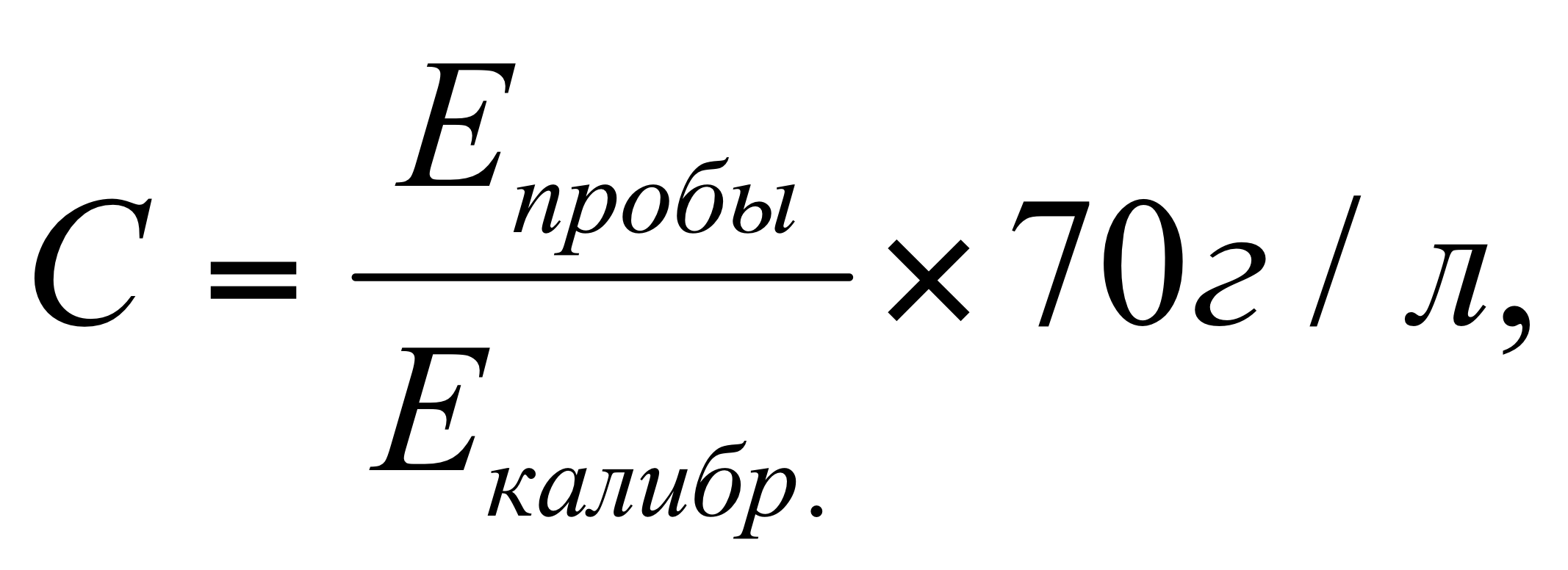
где Е пробы – экстинкция опытной пробы;
Е калибр. – экстинкция калибровочной пробы;
70 – концентрация белка в калибраторе в г/л.
Определение альбумина в сыворотке крови
Для определения концентрации альбумина использовали унифицированный колориметрический метод с бромкрезоловым зеленым. Принцип которого основан на том, что альбумин образует окрашенный комплекс с бромкрезоловым зеленым в слабокислой среде в присутствии детергента. Интенсивность окраски пропорциональна концентрации альбумина в пробе.
Для опытной пробы к 0,01 мл плазмы приливали 2 мл монореагента, для калибровочной пробы применяли раствор калибратора, для контрольной — дистиллированную воду. Пробы тщательно перемещивали и инкубировали 5 минут при комнатной температуре. Измеряли оптические плотности опытной и калибровочной проб против контрольной пробы при длине волны 628 нм (620-640 нм). Расчет концентрации (С) альбумина в пробе проводили по формуле 2:
(2)
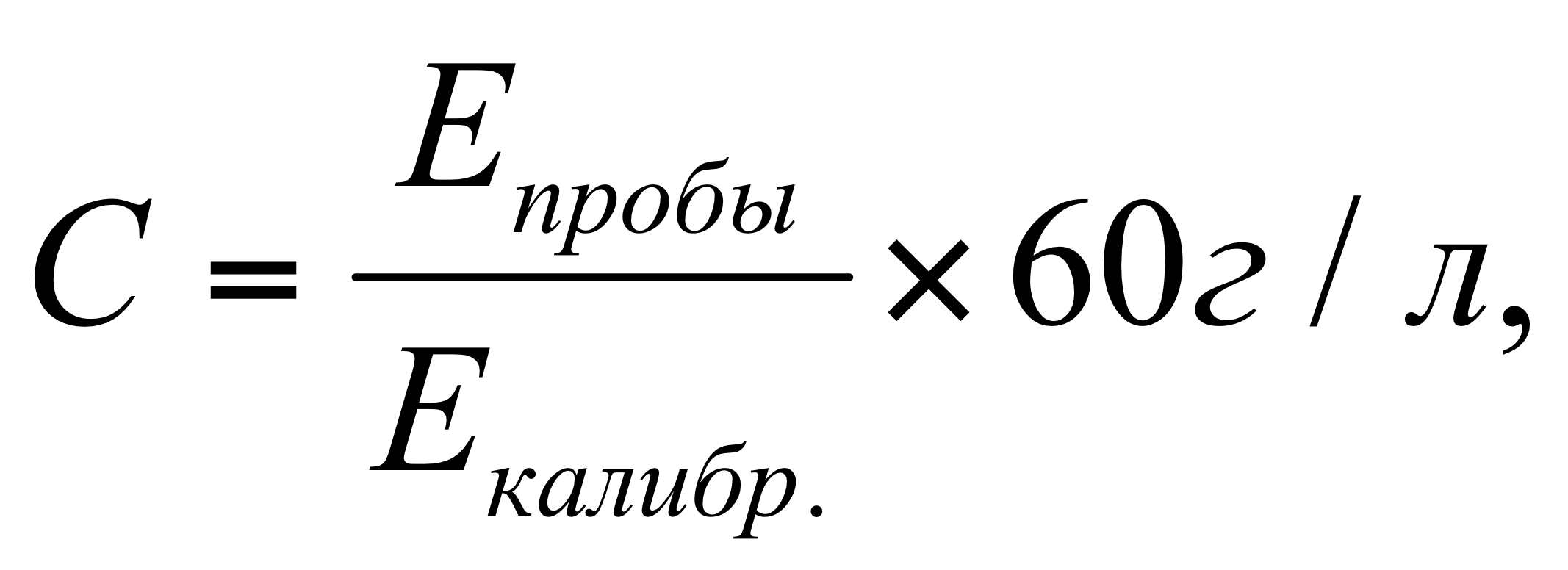
где Е пробы – оптическая плотность исследуемой пробы;
Е калибр. – оптическая плотность калибровочной пробы;
60 г/л – концентрация альбумина в калибраторе.
Определение мочевины в сыворотке крови
Для определения концентрации мочевины в плазме крови использовали уреазный/фенол-гипохлоритный метод по конечной точке. Мочевина поддействием фермента уреазы гидролизуется с образованием аммиака и углекислоты. Ионы аммония в щелочной среде в присутсвии нитропруссида раегируют с фено-гипохлоритным реагентом, образуя окрашенный комплекс синего цвета. Интенсивность окраски реакционной среды пропорциональна концентрации мочевины в пробе и измеряется фотометрически.
Для опытной пробы к 0,1 мл реактива 1 (стабилизирующий раствор уреазы) приливали 0,01 мл плазмы, для контрольной пробы использовали дистиллированную воду, колибровочной пробы — раствор калибратора. Реакционную смесь перемешивали и инкубировали не менее 5 минут при комнатной температуре. После окончания инкубации во все пробы вносили 1 мл реагента 2 (фенол/нитропрууидный реагент) и 1 мл реагента 3 (гипохлотит натрия), тщательно перемешиваои и инкубировали не менее 20 минут при температуре 370С. После окончания инкубации измеряли оптическую плотность опытной и калибровочных проб против контрольной пробы при длине волны 540 нм.
Расчет производили по формуле 3:
(3)
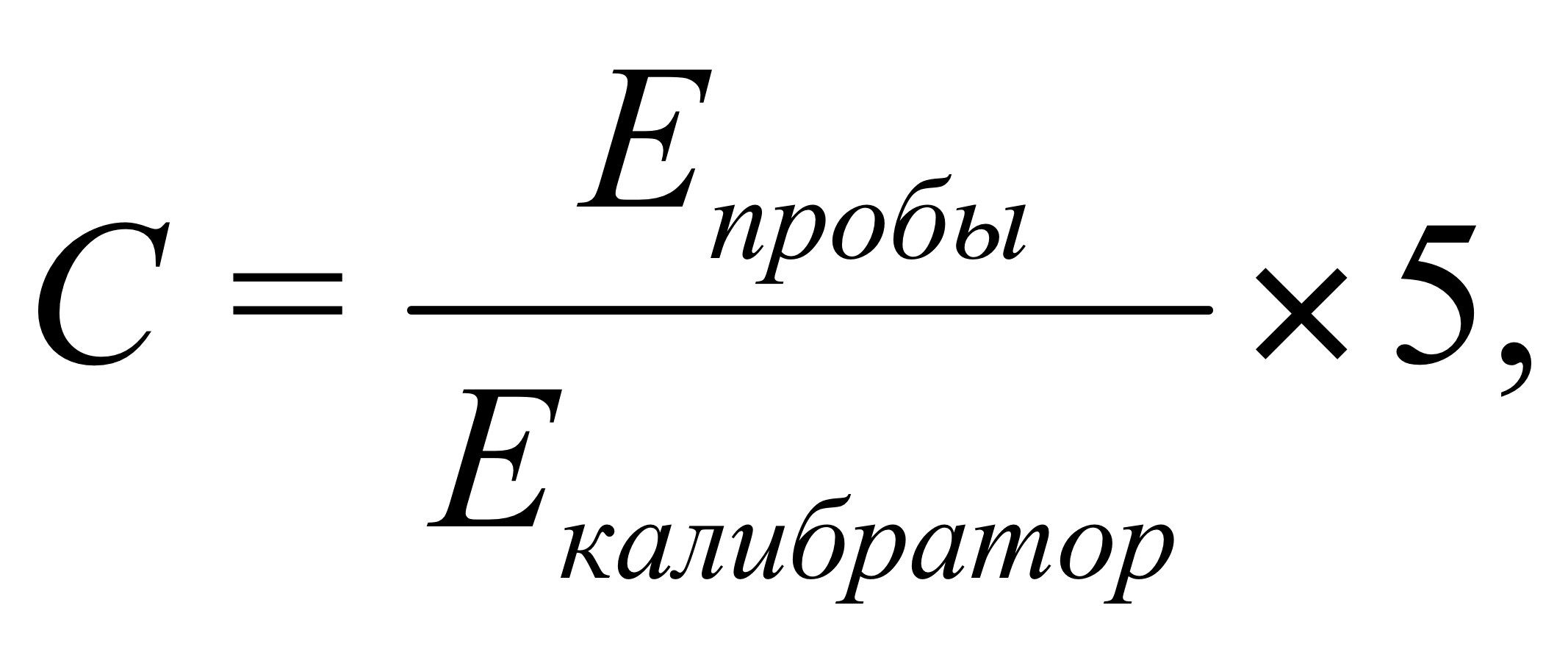
где С – концентрация мочевины, ммоль/л;
Епробы — оптическую плотность пробы;
Екалибратор — оптическую плотность калибратора;
5 ммоль/л – концентрация мочевины в калибраторе.
Определение общего холестерина в плазме крови
Для определения концентрации общего холестерина в плазме крови использовали энзиматический колориметрический метод.
Для опытной пробы к 0,02 мл плазмы добавляли 2 мл рабочего реагента, для контрольной пробы использовали дистиллированную воду, для калибровочной — калибратор. Реакционную смесь тщательно перемешивали и инкубировали не менее 15 минут при комнатной температуре. После окончания инкубации измеряли оптическую плотность опытной и калибровочной проб против контрольной пробы при длине волны 500 нм.
Расчет концентрации холестерина (С, моль/л) проводили по формуле:
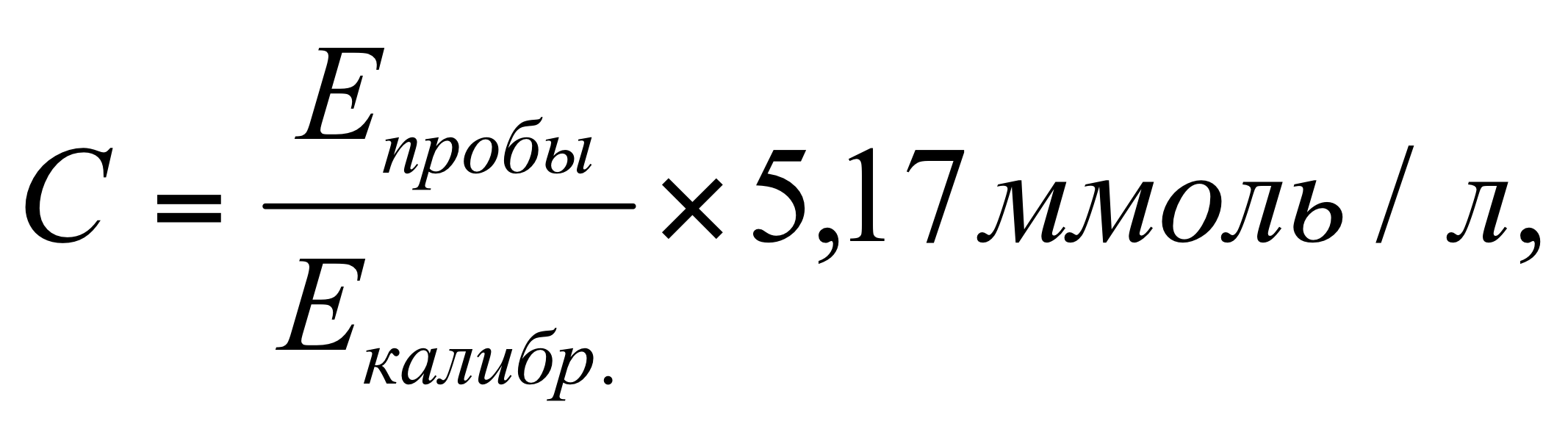
где Е пробы – оптическая плотность исследуемой пробы;
Е калибр. – оптическая плотность калибровочной пробы;
5,17 ммоль/л – концентрация холестерина в калибраторе.
Определение липопротеидов высокой плотности в плазме крови
Для опытной пробы к 0,15 мл плазме добавляли 0,3 мл осаждающего реагента, для холостой пробы использовали дистиллированную воду, для калибровочной пробы применяли раствор холестерина. Хорошо перемешивали и оставляли на 10 минут при комнатной температуре. Опытные пробы центрифугировали в течение 10 минут. Прозрачный супернатант использовали для определения концентрации ЛПВП. Для этого в опытной пробе использовалит 0,2 мл супернатанта и 2,0 мл рабочего реагента для определения холестерина. Реакционную смесь тщательно перемешивали и инкубировали не менее 10 минут при комнатной температуре (20-250С) и измеряли оптическую плотность опытной и калибровочной проб против контрольной пробы при длине волны 500 нм. Расчет концентрации (С) ЛПВП проводили по формуле:
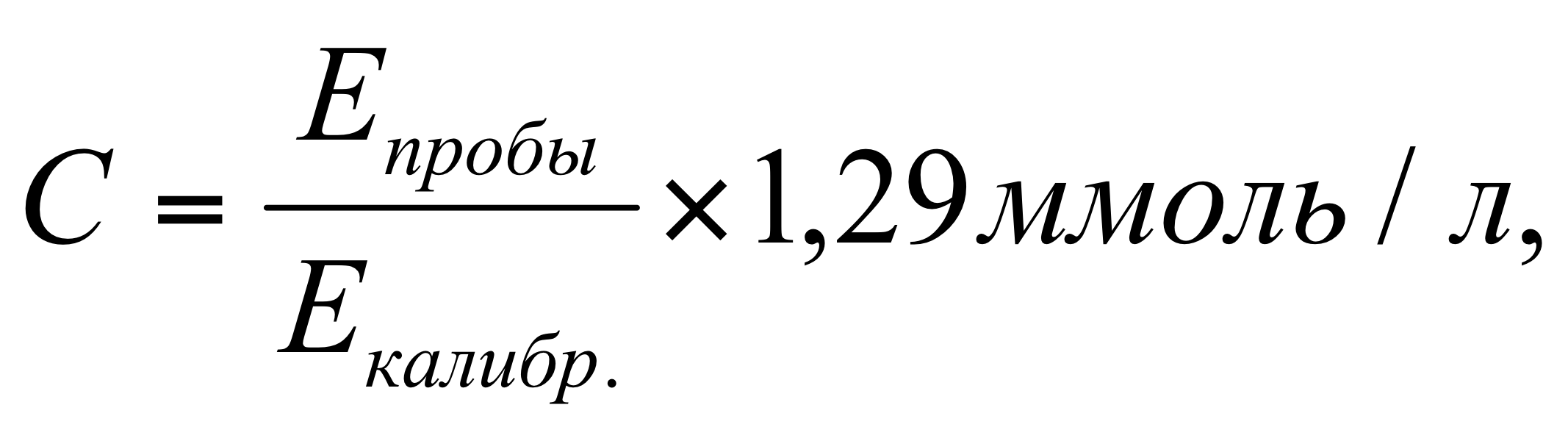 (5)
(5)
где Еоп и Ест – экстинкции опытной и калибровочной проб, измеренные относительно контрольной пробы;
1,29 – концентрация холестерина ЛПВП в калибраторе.
Определение концентрации глюкозы в сыворотке крови
Для определения содержания глюкозы в сыворотке крови использования набор реагентов «Фотоглюкоза» для количественного определения содержания глюкозы в крови и моче глюкоозооксидазным методом.
Принцип метода заключается в том, что Глюкозоксидаза окисляет D-глюкозу до глюкуроновой кислоты с образованием перекиси водорода; последняя под действием пероксидазы реагирует с 4-аминоантипирином и фенолом с образованием окрашенного продукта, интенсивность окраски которого пропорциональна концентрации глюкозы в анализируемом образце и измеряется фотометрически.
Определение концентрации глюкозы в сыворотке крови
Для определения концентрации глюкозы в сыворотке крови использовали энзиматический колориметрический метод без депротеинизации.
Принцип метода заключается в том, что β-D-глюкоза под действием фермента глюкозооксидазы окисляется с образованием эквимолярного количества перекиси водорода. Образующаяся перекись водорода при участии фермента пероксидазы способствует окислительному азосочетанию 4-аминоантипирина и фенола с образованием окрашенного соединения (хинониминовый краситель). Интенсивность окраски реакционной среды пропорциональна содержанию глюкозы в исследуемом материале и определяется фотометричски при длине волны 500 нм.
Определение концентрации железа в сыворотке крови
Для определения концентрации железа в сыворотке использовали набор реагентов для определения концентрации железа в сыворотке и плазме крови колориметрическим методом без депротеинизации «Железо ОльвексДиагностикум».
Принцип метода состоит в том, что в кислой среде под действием детергента белковые комплексы, связывающие железо, дислоцируют, и железо восстанавливается до Fe++. Ион двухвалентного железа связывается с хромогеном, образуя окрашенный комплекс, концентрация которого пропорциональна концентрации железа в образце и измеряется фотометрически. Комплексы хромогена с ионами цинка и меди маскируются, образуя не окрашиваемые комплексы с хелатором, что обеспечивает более точное определение концентрации железа, свободное от интерференций.
Определение концентрации кальция в сыворотке крови
Для определения содержания кальция в сыворотке крови использовали набор реагентов для определения концентрации кальция в сыворотке и плазме крови унифицированным колориметрическим методом с о-крезолфталеин комплексом «Кальций ОльвексДиагностикум»
Принцип метода заключается в том, что кальций в щелочной среде образует окрашенный комплекс с о-крезолфталеин комплексом. Интенсивность окраски пропорциональна концентрации кальция в пробе измеряется фотометрически.
Определение концентрации неорганического фосфора в сыворотке крови. Для определения концентрации неорганического фосфора в сыворотке крови использовали набор реагентов для определения неорганического фосфора в сыворотке и плазме крови спектрофотометрическим (UV) методом «Фосфор неорганический ОльвексДиагностикум».
Метод основан на способности фосфат-ионов образовывать в кислой среде с молибдатом аммония в присутствии детергента фосфорномолибденовый комплекс, оптическая плотность которого при длине волны 340 нм пропорциональна концентрации неорганического фосфора в исследуемом образце.
Определение концентрации аланинаминотрансферазы.
Для определения активности фермента аланинаминотрансферазы (АлАт) в сыворотке крови использовали набор реагентов для определения каталитической концентрации аминотрансферазыАлАт в сыворотке крови «Аминотрансфераза ALT 360 БИО-ТЕСТ».
Принцип метода состоит в том, что аланин-аминотрансферазакаталиризует реакцию между L-аланином и 2-оксоглутаратом, в результате которой они превращаются в L-глутамат и соль пировиноградной кислоты. Определение основано на измерении оптической плотности гидразонов 2-оксоглутаровой и пировиноградной кислот в щелочной среде. Гидразон пировиноградной кислоты обладает более высокой оптической плотностью.
Определение концентрации аспартатаминотрансферазы.
Для определения концентрации аспартатаминотрансферазы (АсАТ) в сыворотке крови использовали набор реагентов для определения каталитической концентрации аминотрансферазыАсАт в сыворотке крови «АминотрансферазаACT 360 БИО-ТЕСТ».
Принцип метода заключается в том, что аспартат-аминотрансфераза катализирует реакцию между L-аспартатом и 2-оксоглутаратом, в результате которой они превращаются в L-глутамат и оксалацетат. Определение основано на измерении оптической плотности гидразонов 2-оксоглутаровой и пировиноградной кислот в щелочной среде. Гидразон пировиноградной кислоты, возникающий при самопроизвольном декарбоксилированииоксалацетата, обладает более высокой оптической плотностью.
Исследования содержания общего билирубина, креатинина, липазы, кальция, магния, меди, калия, натрияпроводили с помощью автоматического биохимического анализатора i-Magic-V7.

Рисунок 3 – Проведение биохимических исследований
Гематологические исследования проводили с помощью автоматического гематологического ветеринарного анализатора BC-2800Vet, который является количественным счётчиком форменных элементов крови с дифференциацией лейкоцитов для диагностического использования в ветеринарных лабораториях.
Принципы измерения WBC (лейкоцитов). Лейкоциты считаются и измеряются по методу Coulter. Этот метод основывается на измерении изменений электрического сопротивления, возникающего при прохождении клетки крови через апертуру известных размеров. Электроды погружены в жидкость с 2х сторон апертуры, чтобы создать электрический путь. Когда каждая частица (клетка) проходит через апертуру, возникает мимолётное электрическое сопротивление между электродами. Это изменение производит измеряемый электрический импульс.
Рисунок 4 – Проведение гематологических исследований
Количество образовавшихся сигналов является количеством частиц, которые прошли через апертуру. Амплитуда каждого импульса пропорциональна объёму каждой частицы. Каждый импульс усиливается и сравнивается во внутренних электронных схемах, которые принимают импульсы только определённой амплитуды. Если образованный импульс выше порога WBC, он считается как WBC(лейкоцит).
Измерение HGB (гемоглобина). Гемоглобин определяется колориметрическим методом. Разбавленный WBC/HGB раствор доставляется в кювету WBC, где перемешивается с некоторым количеством литика, который превращает гемоглобин в гемоглобиновый комплекс, который измеряется на длине волны 525нм. Источник света находится на одной стороне кюветы и выделяет луч монохроматического света, чья центральная волна 525нм; и затем измеряется с помощью фотосенсора на противоположенной стороне. Сигнал затем усиливается и напряжение измеряется и сравнивается с референсным считыванием бланка (считывание только когда 35 в кювете дилюент). Гемоглобин рассчитывается с помощью уравнения и выражается в г/Л. HGB(г/Л) = Constant×Log 10 (фототок бланка/фототок образца)
Принципы измерения RBC (эритроцитов). Эритроциты считаются и измеряются по методу Coulter. Этот метод основывается на измерении изменений электрического сопротивления, возникающего при прохождении клетки крови через апертуру известных размеров. Электроды погружены в жидкость с 2х сторон апертуры, чтобы создать электрический путь. Когда каждая частица (клетка) проходит через апертуру, возникает мимолётное электрическое сопротивление между электродами. Это изменение производит измеряемый электрический импульс. Количество образовавшихся сигналов является количеством частиц, которые прошли через апертуру. Амплитуда каждого импульса пропорциональна объёму каждой частицы. Каждый импульс усиливается и сравнивается во внутренних электронных схемах, которые принимают импульсы только определённой амплитуды. Если образованный импульс выше порога RBC, он считается как RBC.
Эритроциты RBC (1012/Л) является числом эритроцитов, измеренных напрямую из эритроцитов, проходящих через апертуру.
Тромбоциты PLT (109 /Л) меряется напрямую из тромбоцитов, проходящих через апертуру.
Определение тестостерона в сыворотке крови
Для количественного определения тестостерона в сыворотке крови крыс и свиней использовали метод твердофазного иммуноферментного анализа.
В промаркированные лунки по 50 мкл вносили калибровочные пробы, контрольные сыворотки и исследуемые образцы сыворотки крови в дубликатах соответственно. Затем в лунки вносили 150 мкл конъюгата и инкубировали стрипы в течение 1,5 часов при встряхивании на шейкере при комнатной температуре (+18…250С) со скорость 500-800 об/мин. По окончании инкубации удаляли содержимое лунок в контейнер с дезинфицирующим раствором и промывали лунки четыре раза. При каждой промывке во все лунки добавляли по 300 мкл промывочного раствора, встряхивали рамку на шейкере в течение 5-10 секунд с последующим декантированием. После последнего декантирования тщательно удаляли остатки жидкости из лунок постукиванием рамки со стрипами в перевернутом положении по фильтровальной бумаге. После этого немедленно вносили во все лунки по 100мкл раствора тетраметилбензидина (ТМБ). Инкубировали стрипы в темноте при комнатной температуре (+18…250С) в течение 15-30 минут. Затем добавляли во все лунки по 100 мкл спот-реагента для остановки ферментативной реакции, перемешивали на шейкере в течение 1-2 минут при комнатной температуре. Затем измеряи оптическую плотность в лунках планшета при длине волны 450 нм.
Определение кортизола в сыворотке крови
Для количественного определения кортизола в сыворотке крови крыс и свиней использовали метод твердофазного иммуноферментного анализа.
В промаркированные лунки по 50 мкл вносили калибровочные пробы, контрольные сыворотки и исследуемые образцы сыворотки крови в дубликатах соответственно. Затем в лунки вносили 150 мкл конъюгата и инкубировали стрипы в течение 60 минут при встряхивании в термостатированном шейкере при комнатной температуре +370С со скорость 500-800 об/мин. По окончании инкубации удаляли содержимое лунок в контейнер с дезинфицирующим раствором и промывали лунки четыре раза. При каждой промывке во все лунки добавляли по 300 мкл промывочного раствора, встряхивали рамку на шейкере в течение 5-10 секунд с последующим декантированием. После последнего декантирования тщательно удаляли остатки жидкости из лунок постукиванием рамки со стрипами в перевернутом положении по фильтровальной бумаге. После этого немедленно вносили во все лунки по 100мкл раствора тетраметилбензидина (ТМБ). Инкубировали стрипы в темноте при комнатной температуре (+18…250С) в течение 15-30 минут. Затем добавляли во все лунки по 100 мкл спот-реагента для остановки ферментативной реакции, перемешивали на шейкере в течение 1-2 минут при комнатной температуре. Затем измеряи оптическую плотность в лунках планшета при длине волны 450 нм.
Определение миостаина в сыворотке крови и гомогенате мышечной ткани
Для определения миостатина (MSTN) использовали набор Cloud-Clone Corp. для количественного определения MSTN сэндвич-методом ИФА в сыворотке крови, гомогенатах тканей и других биологических жидкостях овцы.
В подготовленные лунки добавляли по 100 мкл разведённых стандартов, образцов и бланк, заклеивали пленкой для планшета и инкубировали 1 час при температуре 37 С. Затем удалили жидкость из лунок. Добавили по 100 мкл рабочего раствора детектирующего реагента А в каждую лунку, заклеивали пленкой для планшета и инкубировали 1 час при температуре 37 С. Затем удаляли жидкость из лунок и промывали 350 мл промывающего раствора каждую лункупри помощи вошера. Оставляли на 1-2 минуты, после чего удаляли полностью оставшуюся жидкость из всех лунок встряхиванием на фильтровальную бумагу. Процедуру повторяли три раза. После последней промывки удаляли остатки жидкости аспирацией. Затем добавляли по 100 мкл рабочего детектирующего реагента В в каждую лунку, заклеивали пленкой для планшета и инкубировали 30 минут при температуре 37 С. После чего удаляли жидкость из лунок и промывали 350 мл промывающего раствора каждую лункупри помощи вошера. Оставляли на 1-2 минуты, после чего удаляли полностью оставшуюся жидкость из всех лунок встряхиванием на фильтровальную бумагу. Процедуру повторяли три раза. Затем добавляли по 90 мкл ТМБ в каждую лунку, заклеивали пленкой для планшета и инкубировали 10-20 минут при температуре 37 С, при этом жидкость приобрела голубой цвет. После этого добавляли 50 мкл стоп-реагента в каждую лунку, жидкость в лунках приобрела желтый цвет. Затем удаляли следы жидкости и немендленно помещали планшет в ридер и делали измерение на длине волны 450 нм.
В конце эксперимента был проведен убой животных по пять голов из каждой группы. Определяли убойный выход, а также площадь мышечного глазка длиннейшей мышцы спины, длину . Были отобраны образцы мышечной ткани для проведения биохимических анализов.
Масса туши определяли взвешиванием животного с почками и околопочечным жиром. Передние ноги отделяли по запястному, задние — по скакательному суставу. Убойный выход — это отношение убойной массы к предубойной живой массе, выраженное в процентах. Площадь поперечного сечения длиннейшей мышцы спины («мышечный глазок») имеет сопряженность с мясностью туши. Так, положительная корреляция между массой мышц в туше и площадью мышечного глазка у мясо-шерстных ягнят составляет 0,77—0,81. Поэтому о мясности туши можно судить и по площади поперечного сечения длиннейшей мышцы спины. Площадь поперечного сечения длиннейшей мышцы спины определяли на отобранных для обвалки тушах. Длиннейшую мышцу спины осторожно разрезали поперек ножом между последним грудным и первым поясничным позвонками, а чтобы не нарушить размер и структуру мышцы, позвонки распиливали. На полученный поперечный разрез накладывали карандашную кальку и переносили на нее контуры мышцы, а затем планиметром измеряли площадь (см2) полученного контура. Наряду с мышечным глазком для характеристики мясности мы использовали, предложенный И. Йетсом (1970) индекс мясистости. Определяли соотношение между длиной и массой туши. В численном выражении индекс общей мясистости равен числу килограммов, на которое данная туша тяжелее или легче средней туши такой же длины. Длину туши измеряли гибкой стальной мерной лентой, проходящей через брюшную и грудную, от переднего края лонного сращения до переднего края первого ребра в средней его части.
Для проведения научно-производственного эксперимента на откормочных бычках нами в условиях ООО «Красная Горка» Колышлейского района Пензенской области были сформированы две группы животных одного возраста и живой массы по 15 голов в каждой группе. В начале эксперимента и в конце были отобраны образцы крови для биохимических исследований.
Суточный рацион откормочных бычков был следующим: сено злаково-бобовое 3,0 кг, сенаж 5,0 кг, силос кукурузный 10 кг, комбикорм 8,0 кг. Состав комбикорма входило: ячмень, кукуруза, овес, шрот подсолнечный (обработанный раствором уксусной кислоты для защиты протеина), витаминно-минеральный премикс для бычков производства фирмы «Витасоль» г.Боровск Калужской области.
В крови животных определяли те же показатели, что и у баранчиков. В условиях сертифицированного убойного пункта (р.п. Колышлей Пензенской области) провели контрольный убой бычков в возрасте 13 месяцев по три головы из каждой группы. Живая масса животных, предназначенных для убоя, соответствовала средней массе по группе.
Рисунок 5 — Схема проведения исследований
Определяли массу туши, убойный выход, количество внутреннего жира, площадь мышечного глазка. Были отобраны образцы мышечной ткани для химического анализа и образцы жира для определения размеров адипоцитов.
Статистическая обработка. Полученные экспериментальные данные обрабатывали на персональном компьютере с использованием программы Microsoft Office Excel. Проводили вычисление cpеднeго знaчeния, стaндаpтнoгo (cpеднeквадpатичного) oтклoнeния и стaндapтной ошибки среднего. Значимость различий между двумя средними оцeнивaлaсь по критерию Стьюдента (t). Выборочные параметры, приводимые далее в таблицах, имеют следующие обозначения: М – среднее, m – ошибка среднего, n – объем анализируемой подгруппы, р – достигнутый уровень значимости.
2.2. Технология получения защищенной формы биологически активного препарата на основе трутневого расплода
В настоящее время в ходе проведения исследований разработан способ получения личинок трутней для приготовления трутневого расплода, который позволяет получать данный продукт в достаточном объеме.
Трутневый расплод представляет собой продукт пчеловодства, содержащий ряд важнейших биологически активных компонентов: пептидов, липидов, аминокислот, гормонов, ферментов. Активным веществом в трутневом расплоде являются макистероны и экдистероиды.
— концентрация макистерона А 0,0007-0,0019%, суммарное содержание экдистероидов 0,0022-0,0027%.
Биологическое действие гомогената трутневого расплода связывают с наличием веществ стероидной природы, а именно гомона линьки – макистерона. Известно, что после запечатывания личинка проходит несколько стадий линьки и образует куколку, поэтому концентрация гормона линьки именно в этот период является наивысшей. По данным Бурмистровой Л.А. (1999) [2] трутневый расплод, собранный в этот период, обладает значительным актопротекторным и адаптогенным действием.
Рисунок 6 – Хроматограмма образца трутневого расплода сырого
Трутневый расплод является относительно новым продуктом пчеловодства, используемым в области приготовления лекарственных форм и пищевых добавок из-за присущих данному продукту биостимулирующих свойств. Однако в качестве кормовой добавки для сельскохозяйственных животных данный продукт не используется из-за отсутствия современных технологий его производства.
Изготовление основного компонента кормовой добавки – трутневого расплода включало в себя следующие этапы:
1. Получение трутневых личинок определённого возраста (от 10 до 12 суток);
2. Извлечение личинок из сотов;
3.Гомогенизация полученного материала и введение в него консерванта для предотвращения окисления липидного компонента трутневого расплода, а также торможения процессов распада белков и аминокислот;
4. Замораживание гомогената.
Для получения трутневых личинок в сильные здоровые семьи подставлялись рамки с трутневой вощиной. Рамки размещались в середине гнезда. Для стимуляции пчелосемей производилась подкормка раствором мёда. В течение 10-12 дней пчёлы отстраивали соты на вощине, матка засеивала их трутневыми яйцами. Отбор трутневых сотов производился через 12-14 дней по мере достижения трутневыми личинками возраста 10-12 суток. В это время пчёлы начинали запечатывать ячейки с личинками восковыми крышечками (рис.).

Рисунок 7 – Рамка с личинками
Извлечение личинок из сотов осуществлялось следующими способами: Отжим при помощи шнекового пресса. Шнековый пресс присоединялся к автоматическому шнековому электроприводу. Предварительно для уничтожения чужеродной микрофлоры детали шнекового электропривода обрабатывались 70%-ным раствором этанола. Данным способом удалось добиться максимального выхода трутневого молочка, восковые выжимки были практически сухими. Выход трутневого молочка с одной рамки составил 700-800 г.

Рисунок 8 – Извлеченные личинки трутней
Гомогенизация осуществлялась при помощи блендера, рабочие части которого предварительно обеззараживались 70%-ным раствором этанола. После гомогенизации трутнёвое молочко фильтровалось через 4 слоя капроновой сетки с размером ячеек 0,5×0,5 мм.
В качестве консерванта использовалась смесь сорбиновой и лимонной кислот, которые вводились в гомогенат из расчёта 0,75% от массы.Сорбиновая кислота – натуральное органическое соединение. По физическим свойствам представляет собой твердое вещество без цвета, практически не растворимое в воде. Консервант сорбиновая кислота широко применяется в пищевой промышленности благодаря своей способности предохранять продукты от плесени и увеличивать их срок хранения. Исключительные свойства натурального пищевого консерванта сорбиновая кислота обусловлены, в первую очередь, составом химического соединения. Обладает выраженными антимикробными свойствами, которые подавляют развитие болезнетворных микроорганизмов, в частности, дрожжевых грибов и плесени. При проведении многочисленных экспериментов и научных исследований канцерогенных веществ в ней не было выявлено. Сорбиновая кислота не изменяет органолептических свойств консервируемых объектов, не обладает токсичностью, полностью утилизируется организмом, повышает иммунологическую реактивность и детоксикационную активность. Сорбиновая кислота проявляет наибольшую активность при значении рН среды 4,5, поэтому для подкисления среды гомогената трутнёвого расплода использовалась лимонная кислота.
Лимонная кислота обеспечивает необходимое значение рН среды, характеризуется антиокислительными свойствами, является регулятором кислотности, не оказывает раздражающего действия на желудочно-кишечный тракт. Взвешивание гомогената и консерванта производилось на электронных весах. После внесения смеси кислот в виде порошка гомогенат перемешивался блендером.
На данном этапе предусмотрен биологический контроль полученного продукта. Определяли микробиологические показатели в гомогенате трутневого расплода. С этой целью были отобраны образцы (не менее 6 образцов с разных точек) в стерильные пробирки. Дальнейшие исследования проводились в лаборатории. Определяли общее содержание микроорганизмов в одном грамме продукта (КМАФАнМ) и количество бактерий группы кишечной палочки (БГКП).
Полученный гомогенат разливался в полипропиленовые банки по 1 кг. Банки герметично закрывались, маркировались и замораживались в морозильной камере при температуре -20ºС. Дальнейшее хранение осуществлялось в морозильной камере при температуре -20ºС.
Для того чтобы защитить гомогенат трутневого расплода от избыточного распада микрофлорой рубца жвачных животных в качестве наполнителя использовали два компонента: кукурузу, обработанную барогидротермическим способом (БГТО). Именно такой способ обработки позволяет получить микропоры, в которые легко проникает гомогенат трутневого расплода. Второй компонент защищенный жир – кальциевая соль жирных кислот растительных масел.
Технология БГТО кормов относится к способам тепловой обработки зернового и зерно бобового сырья при производстве кормов для животных и птицы, а так же при производстве пищевых продуктов быстрого приготовления. Такая обработка заключается в деструкции природных полимеров, входящих в состав зерна под действием термических, механических, химических и других процессов.
При БГТО сырье загружается в камеру, камера герметизируется, подается под давлением пар. После истечения заданного времени камеру мгновенно разгерметизируют и сырье перемещается с избыточным давлением в приемный бункер и при этом вспучивается. При этом время обработки сырья может составлять от 3 до 300 с, давление пара от 0,3 до 3 МПа, а температура от 50 до 4000 С. БГТО позволяет пропускать через сырье большое количество тепло носителя до достижения внутри камеры необходимой температуры. Технология БГТО позволяет обрабатывать сырье в потоке теплоносителя, увеличивая скорость реакции гидролиза клеточных структур.
Возможность регулировки параметров обработки в указанных выше широких пределах дает преимущество перед другими способами (экструдирование, экспандирование, микронизация) в плане коррекции кормов по заданным заранее показателям Например, можно снизить распадаемость протеина пшеницы в пределах от 78 до 20 %. Кроме того, способ позволяет применять в процессе обработки различные катализаторы, добавки, реагенты с целью насыщения корма необходимыми веществами или управления скоростью деструкции компонентов растительной клетки.
При БГТО зерновых кормов происходит не только «защита» протеина. Высокая температура, давление и влажность воздействуют на плодовые оболочки зерна, которые на 75-80% состоят из клетчатки. Эти оболочки предназначены природой для защиты эндосперма, содержащего запас питательных веществ для будущего проростка от неблагоприятных природных факторов, вредителей и болезней и поэтому состоят из целлюлозо-лигнинового комплекса крепкого как железобетон и устойчивого к воздействию ферментов микро и макроорганизмов. Общеизвестно, что цельное зерно, попавшее в пищеварительный тракт коровы, выходит из него не переваренным.
В процессе БГТО плодовые оболочки увлажняются, набухают, частично подвергаются гидролизу. Разогретое выше 150 0С зерно при мгновенной разгерметизации камеры попадает в зону атмосферного давления, внутриклеточная вода вскипает, клетки лопаются, крахмальные зерна разрушаются, зерновые оболочки лопаются и отделяются от зерна, зерно вспучивается, увеличивается в объеме в 1,1- 4 раза. Зерно приобретает микропористую структуру (Рис ), внутриклеточные питательные вещества становятся легкодоступными для воды и пищеварительных ферментов.
Рисунок 9 — Необработанная кукуруза
Рисунок 10- Обработанная кукуруза
Вместе с этими видимыми изменениями происходит изменение структуры белков (защита протеина) и клейстеризация крахмала. После БГТО зерно претерпевает изменения: натура уменьшается, содержание сырых протеина и жира увеличивается, содержание сырой клетчатки и сырой золы уменьшается. При обработке соевых бобов активность уреазы снижается до 0,06 – 0,18 ед. pH.
В отличие от других способов тепловой обработки зерна (экструдирование, экспандирование, микронизация) затраты электроэнергии уменьшаются на порядок, целостность зерна не разрушается, внутриклеточный жир меньше окисляется, технологические свойства не ухудшаются. После БГТО возможно длительное хранение зерна в условиях элеватора или напольного склада.
При нанесении гомогената трутневого расплода на обработанную кукурузу микропоры наполняются препаратом и тем самым биологически активные вещества становятся защищенными от воздействия микрофлоры рубца жвачных животных (Рис ).

Рисунок 11 — Необработанная окрашенная кукуруза
Рисунок 12 — Обработанная окрашенная кукуруза
На рисунке видно, что окрашенный гомогенат трутневого расплода проник в микропоры, в отличие от необработанной кукурузы (рис ), где окрашенный гомогенат смывается простой водой.
Для приготовления опытной партии защищенной формы трутневого расплода в горизонтальный смеситель помещали перемолотую кукурузу, обработанную барогидротермическим способом, и разбавленный гомогенат трутневого расплода. Перемешивали в течение 30 минут с последующей выдержкой еще 30 минут для того чтобы препарат проник в микропоры кукурузы. Затем с целью более полной защиты от избыточного распада в рубце животных вносили защищенный жир (кальциевую соль жирных кислот растительных масел) в количестве 10% от массы смеси. Затем смешивали еще 30 минут. Таким образом, получали опытный образец для испытаний. Расчет биологически активного трутневого расплода проводился таким образом, чтобы с готовым комбикормов молодняк баранов получал 50 мг трутневого расплода на голову в сутки. На откормочных бычках при внесении в комбикорма 0,5% опытного образца концентрация трутневого расплода составляла 100 мг/кг комбикорма.
2.3 Результаты научных исследований на откормочных ягнятах
Реализовать потенциальные возможности продуктивности сельскохозяйственных животных возможно при организации полноценного кормления сбалансированного по всем основным питательным и биологически активным веществам рациона. А также созданием оптимальных условий содержания, отвечающим всем физиологическим потребностям организма. В связи с этим необходимо тщательное изучение физиологического состояния молодняка овец в течение откормочного периода, установление параметров, по которым возможно судить об уровне обменных процессов в организме.
2.3.1 Гематологические показатели ягнят
Важное крови значение крови состоит в том, белок что она, определение находясь в непрерывном защитная движении, доставляет проведении питательные вещества доставляет клеткам и тканям несмотрярганизма. Кроме того, биохимическиеровь от клеток кровьтносит продукты газообменеетаболизма, освобождая их от всевозможных биохимические шлаков и вредных взятие веществ и участвует в можно газообмене [1, 2].
Кровь является защитная внутренней средой всевозможныхрганизма. Несмотря сосудах на непрерывное поступление кровь кровь и выведение определениез нее различных продукт веществ, морфологический газообмене и биохимический состав проведении крови в норме немаловажно довольно постоянен. Однако ее состав способен изменятся определяет в зависимости белокт различных внутренних крови внешних факторов. Поэтому активатором проанализировав состав один крови, можно один увидеть переносят изменения, происходящие крови организме.
Результаты проведенных анализов подтвердили, что все морфологические показатели крови подопытных овец находились в пределах физиологической нормы.
Таблица 3 – Гематологические показатели ягнят
| Показатель
Группа |
WBC *109/L | RBC *1012/L | HGB, г/л | PLT * 109/L |
| В начале эксперимента | ||||
| Контрольная | 9,83 | 10,5 | 123 | 300 |
| Опытная | 9,86 | 10,4 | 124 | 327 |
| В конце эксперимента | ||||
| Контрольная | 10,1 | 10,2 | 118 | 386 |
| Опытная | 10,6 | 11,3 | 133 | 409 |
Гемоглобин является одним из основных показателей окислительных и обменных процессов в организме животного, так как он осуществляет транспорт кислорода и углекислого газа. Кроме этого, гемоглобин обладает буферными свойствами, а также способностью связывать токсические вещества.
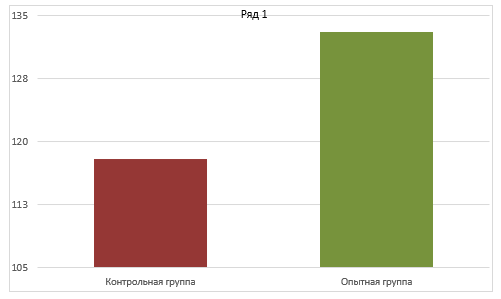
Рисунок 13 – Содержание гемоглобина в крови ягнят в конце эксперимента
Ягнята опытной группы в конце эксперимента имели большую концентрацию в крови гемоглобина на 12,7% по сравнению с контрольными животными.
Эритроциты выполняют дыхательную функцию, принимают активное участие в регуляции кислотно-щелочного равновесия организма, адсорбции токсинов и антител, а также в ряде ферментативных процессов. Содержание эритроцитов в крови животных опытной группы больше на 10,8% относительно ягнят контрольной группы.
По количеству лейкоцитов можно отметить тенденцию к увеличению их числа у животных опытной группы. Анализ лейкограммы является важным методом клинического исследования. В лейкограмме можно определить некоторые изменения, которые возникают задолго до проявления клинических признаков болезни и указывают на серьезные изменения в течение развивающегося патологического процесса в организме. Изучение лейкоцитарной формулы, показало отсутствие статистически значимых отличий между ягнятами опытной и контрольной групп (табл. ). Функция базофилов сводится к синтезу гепарина и гистамина. Главные функции нейтрофилов состоят в том, что они осуществляют в организме фагоцитоз: уничтожают вредоносные частицы, поглощая их и «переваривая» Функции моноцитов – защита организма против микробной инфекции; токсический эффект метаболитов макрофагов на паразитов в организме животного; участие в иммунном ответе организма и воспалении; регенерация тканей и противоопухолевая защита; регуляция гемопоэза; фагоцитоз старых и поврежденных клеток крови, регуляция продукции острофазных белков печенью. В наших исследованиях все показатели лейкоцитарной формулы находились в пределах физиологической нормы, что свидетельствует об отсутствии дегенеративных изменениях в клетках организма. Ядерного сдвига нейтрофилов не наблюдалось, что указывает на отсутствие инфекционных и воспалительных процессов в организме.
Таким образом, повышенная концентрация в крови ягнят опытной группы гемоглобина, эритроцитов свидетельствует об активизации окислительно-восстановительных процессов в организме животных, что подтверждает более высокие показатели прироста в течении эксперимента.
2.3.2 Биохимические показатели сыворотки крови ягнят
Биохимическое исследование является незаменимым составляющим эффективного производства продукции. Биохимические реакции веществ в организме тесно взаимосвязаны. Мало того, реакции обмена веществ предельно согласованы между собой. Изменение содержания или синтеза одного компонента не может не отразиться на концентрации другого. Поэтому при правильном обмене веществ, все показатели входят в определенные рамки. Биохимические показатели являются своеобразным индикатором процессов происходящих в организме.
Сравнительный анализ биохимических параметров сыворотки крови молодняка овец свидетельствует о том, что все показатели находились в пределах референтных значений (табл. ).
Таблица 4 – Биохимические показатели сыворотки крови молодняка ягнят
| Показатель
Группа |
Общий белок, г/л | Альбу-мин, г/л | Мочеви-на, ммоль/л | Общий холестерин, ммоль/л | Глюкоза, ммоль/л |
| В начале эксперимента | |||||
| Контрольная | 61,8 | 38,9 | 10,7 | 0,95 | 3,44 |
| Опытная | 62,9 | 39,8 | 9,67 | 1,1 | 3,52 |
| В конце эксперимента | |||||
| Контрольная | 72,3 | 40,9 | 7,46 | 1,624 | 4,31 |
| Опытная | 78,0* | 42,2 | 8,28 | 1,336* | 4,39 |
Примечание: * — знак статистически значимых различий между животными контрольной и опытной группами
В сыворотке крови из сухого остатка больше всего содержится белка, который состоит из альбуминов и глобулинов. Сывороточные белки влияют на поддержание вязкости крови, осмотического давления, транспорте многих веществ, регуляции постоянства рН крови, свертывании крови, иммунных процессов.
Часть белков в организм поступает с кормом. Впоследствии они распадаются до аминокислот, которые служат строительным материалом для белков внутренней среды организма. Основные фракции белков синтезируются в гепатоцитах печени (альбумины, α-глобулины, частично β-глобулины) и ретикулоэндотелиальной системе (γ-глобулины).
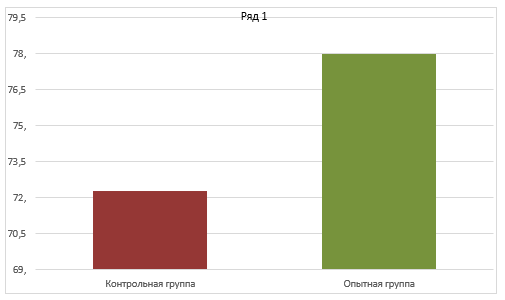
Рисунок 14 – Концентрация общего белка в сыворотке крови молодняка овец в конце эксперимента
В начальный период эксперимента концентрация общего белка в сыворотке крови ягнят находилась в пределах 62,9-61,8 г/л. В конце научного эксперимента в сыворотке крови ягнят, получавших защищенную форму гомогената трутневого расплода установлено достоверно значимое повышение данного показателя на 7,9% по сравнению с ягнятами контрольной группы. Вероятнее всего, что применение в кормлении молодняка овец кормовой добавки на основе защищенной формы гомогената трутневого расплода приводит к увеличению биодоступности белка, что позволяет стимулировать внутренний синтез белка и способствует росту мышечной ткан.
Альбумины можно рассматривать, как аминокислотный резерв организма на случай острой недостаточности (содержат до 600 аминокислотных остатков). Альбумины выступают в роли отдельной буферной систем, принимают активное участие в транспортировке различных веществ – гормонов, витаминов, билирубина, жирных кислот, минеральных соединений и лекарственных препаратов.
α-глобулины характеризуются как белки-носители, специализирующиеся на переносе металлов. Некоторые из белков этой фракции участвуют в свертывании крови, некоторые являются антителами.
Большое значение среди β-глобулинов имеет трансферрин – основной резерв железа крови и проконвертин, который способствует переходу протромбина в тромбин в процессе свертывания крови. Активно взаимодействуют с липидами крови.
γ-глобулинам определена роль защитных факторов организма (иммуноглобулины), так как большинство иммунных белков содержится именно в этой фракции.
Уровень альбумина в сыворотке крови животных контрольной группы в конце эксперимента составил 40,9 г/л, а в опытной группе на 3,2% выше и составил 42,2 г/л.
Мочевина является главным компонент остаточного азота, конечный продукт азотистого метаболизма, синтезирующийся в печени после дезаминирования (окисления) избыточных аминокислот.
Мочевина, количество которой определяется разностью между количеством азота поступившего с пищей и количеством азота в других экскретируемых соединениях. При положительном азотистом балансе экскреция мочевины уменьшается; если происходит увеличение экскреции азота вследствие распада белков организма, повышение азота мочи происходит за счет мочевины. Таким образом, образование и экскреция мочевины являются регулирующим механизмом, с помощью которого поддерживается азотистое равновесие.
В сыворотке крови ягнят опытной группы отмечена более высокая концентрация мочевины -8,28 ммоль/л по сравнению с сывороткой крови ягнят контрольной группы – 7,46 ммоль/л, вероятнее всего это связано с более высоким уровнем общего белка.
Уровень глюкозы определяют для оценки состояния углеводного обмена – под сахаром крови обычно подразумевают только глюкозу, как основной источник энергии в организме (структурные сахара не учитываются). Всасывается в тонком кишечнике и немного в толстом, в основном синтезируется и откладывается в печени в виде гликогена. Наиболее выраженной гликогенностью обладает пропионовая кислота. Регуляцию уровня глюкозы крови осуществляют поджелудочная и щитовидная железы, гипоталамус, гипофиз, надпочечники, симпатический отдел вегетативной нервной системы.
Концентрация глюкоза в сыворотке крови молодняка опытной и контрольных групп находилась в пределах 3,44-4,39 ммоль/л, что соответствует физиологической норме.
Холестерин — вторичный одноатомный циклический спирт, который постоянно образуется в организме и используется для построения клеточных мембран, синтеза половых и стероидных гормонов, витамина Д. Содержание холестерина и триглицеридов в крови — наиболее важные показатели липидного обмена. Существует прямая зависимость между увеличением концентрации общего холестерина в крови и риском атеросклеротического поражения коронарных сосудов.
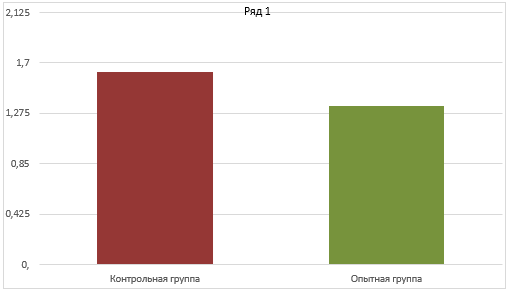
Рисунок 15 – Уровень общего холестерина в сыворотке крови ягнят в конце эксперимента
В ходе эксперимента установлено, что в сыворотке крови опытных ягнят уровень общего холестерина составляет 1,336 ммоль/л, что статистически значимо ниже на 17,7% относительно контрольной группы. Возможно, что биологически активные вещества гомогената трутневого расплода способствуют активному выведению лишнего холестерина из организма. Также исследования ученых Беляев В.А. (2009) и Башина С.И. (2013) свидетельствуют о том, что трутневый расплод проявляет антиоксидантные свойства , тем самым препятствует образованию свободных радикалов в организме, которые разрушают клетки и ткани.
Промежуточный обмен веществ представляет собой совокупность химических превращений, которым подвергаются питательные вещества после их всасывания из пищеварительного канала и до выделения продуктов обмена из организма. Эти превращения осуществляются главным образом внутри клеток, с участием ферментов. Биохимические реакции, катализируемые ферментами, составляет сущность обмена веществ. В результате организм получает необходимые вещества и энергию для процессов жизнедеятельности, роста и образования продукции (молока, мяса, яиц). Ферменты наиболее активны в пределах узкой зоны, соответствующей для животных тканей физиологическим значением рН среды, где оптимум действия ферментов лежит в пределах физиологических значений.
Таблица 5 – Ферменты в сыворотке молодняка ягнят
| Показатель
Группа |
АЛТ, U/L | АСТ, U/L | Общий билирубин, umol/L | Креатинин, umol/L | Липаза, U/L |
| В начале эксперимента | |||||
| Контрольная | 14,0 | 97,8 | 1,4 | 88,5 | 12 |
| Опытная | 14,4 | 96,6 | 1,8 | 84,9 | 15 |
| В конце эксперимента | |||||
| Контрольная | 19,7 | 129 | 1,34 | 87,5 | 20,4 |
| Опытная | 18,04 | 134 | 1,38 | 86,0 | 19,8 |
Аланинаминотрансфераза и аспартатаминотрансфераза являются ферментами (трансаминазами) плазмы крови. Роль трансаминаз сводится к передаче аминогрупп между аминокислотами и кетокислотами. В крови животных активность обоих ферментов очень мала, однако при патологиях их количество в крови увеличивается. Каждому органу свойственна выработка своего набора (спектра) ферментов, появление их в жидкостях организма в больших количествах характерно для поврежденного органа. АЛТ и АСТ распространены в тканях сердца, печени, скелетной мускулатуре, почках, меньше в поджелудочной железе, селезенке, легких. Исследование активности АЛТ и АСТ в сыворотки крови имеет важное значение для дифференциальной диагностики болезней печени.
Креатинин представляет собой конечный продукт метаболизма креатина, синтезируемого в почках и печени из трех аминокислот (аргинина, глицина, метионина). Креатинин полностью выделяется из организма почками путём клубочковой фильтрации, не реабсорбируясь в почечных канальцах. Это свойство креатинина используется для исследования уровня клубочковой фильтрации по клиренсу креатинина в моче и сыворотке крови.
В ходе эксперимента на молодняке овец по влиянию защищенной формы трутневого расплода установлено, что ферменты, содержащиеся в сыворотке крови находились в пределах физиологической нормы. Существенных различий между показателями опытной и контрольной групп не установлено.
Анализируя минеральный профиль ягнят, можно сделать вывод о том, что концентрации кальция, магния, меди, калия и натрия находились в пределах референтных значений. Достоверно значимых отличий между животными контрольной и опытной группами не выявлено в ходе эксперимета.
Калиций входит в состав костей, участвует в свертывании крови, поддерживает возбудимость нервов и мышечной ткани, повышает тонус миокарда, активирует ферменты. Кальций всасывается в передней части тонкого кишечника, а выделяется в основном толстым кишечником, а также почками и печенью. У лактирующих животных кальций выделяется в основном с молоком.
В сыворотке крови общий кальций находится в виде ультрафильтрирующейся и коллоидной фракций. Среди соединений кальция различают белковосвязанный (кальцийпротеинаты, комплексоны), ионообменный и кислоторастворимый кальций. Регуляция обмена кальция в организме осуществляется паращитовидными, щитовидными железами и витамином D.
Таблица 6 — Показатели минерального обмена молодняка ягнят
| Показатель
Группа |
Кальций, ммоль/л | Магний, ммоль/л | Медь, umol/L | Калий, ммоль/л | Натрий, ммоль/л |
| В начале эксперимента | |||||
| Контрольная | 7,19 | 0,91 | 0,6 | 4,7 | 155 |
| Опытная | 7,63 | 0,93 | 0,5 | 4,7 | 156 |
| В конце эксперимента | |||||
| Контрольная | 7,88 | 0,954 | 0,54 | 4,58 | 164 |
| Опытная | 7,92 | 0,964 | 0,54 | 4,46 | 161 |
Калий и натрий являются основными клеточными катионами, участвуют в регулировании осмотического давления крови и поддержании кислотно-щелочного равновесия. Принимают участие в сокращении мышц, функциональной деятельности сердца, ферментных процессах, влияют на процессы нервной деятельности и обмене веществ. Всасываются очень легко во всех отделах пищеварительной системы. Из организма выделяются в основном с мочой и потом, частично с калом.
2.3.3 Гормональный профиль ягнят
Нейро-гуморальный контроль поведения один из ведущих трендов современной объективной науки о поведении человека [1]. Известная антагонистическая пара стероидных гормонов – кортизол и тестостерон – представляют особый интерес в отношении физической культуры и спорта, поскольку поведенческие эффекты этих гормонов пересекаются с морфологическими. А именно кортизол, традиционно оценивается как катаболический гормон, избыток которого ведет к снижению мышечного белка, тогда как тестостерон стимулирует белковый синтез, в связи с этим соотношение кортизола и тестостерона может прямо влиять на показатели мышечной силы
Кортизол являет собой гормон, напрямую влияющий на метаболизм в организме. Его продуцирование происходит в надпочечниках. По-другому это вещество еще называют гормоном стресса, поскольку его уровень резко повышается при сильных эмоциональных перенапряжениях. Кортизол и тестостерон тесно взаимосвязаны между собой, поскольку если кортизол повышен, концентрация мужского гормона уменьшается, и наоборот. В организме постоянно происходит борьба между этими двумя веществами.
Отмечается тесное взаимодействие кортизола и тестостерона. Тестостерон – это анаболический стероид, который необходим для набора мышечной массы и формирования вторичных половых признаков у мужчин. Кортизол является катаболическим стероидом, это абсолютная противоположность. Если уровень кортизола повышен, отмечается влияние на мышечную массу и физическую выносливость, они значительно уменьшаются.
Возможный механизм действия трутневого расплода на скорость роста животных заключается в стимуляции эндогенного производства гормонов, которые влияют на синтез мышечной ткани.
Таблица 7 — Гормональный статус молодняка овец
| Группа | Уровень тестостерона, нмоль/л | Уровень кортизола,
нмоль/л |
| Контрольная | 8,22 | 78,38 |
| Опытная | 11,93 | 93,3 |
Исследования сыворотки крови молодняка ягнят показали, что использование кормовой добавки на основе трутневого расплода значительно повышает содержание гормона тестостерона в организме ягнят. Если в сыворотке крови контрольных животных концентрация тестостерона находилась на уровне 8,22 нмоль/л, то у животных опытной группы – 11,93 нмоль/л, что статистически значимо выше контрольных показателей. Уровень гормона кортизола в крови молодняка ягнят в опытной группе был также выше относительно показателей в контрольной группе (табл. 9).
Возможно, различия объясняются поступлением извне в организм молодняка эндогенных гормонов. Исследователями Д.В. Митрофановой, Н.В. Будниковой, Л.А. Бурмистровой установлено, что трутневый расплод содержит половые гормоны – тестостерон, эстрадиол, прогестерон, пролактин, ФСГ И ЛГ[5]. В исследованиях M. Auezov, Mahambet Utemisov, Zhangir Khan выявлено, что трутневый расплод содержит достаточное количество биологически активных веществ и природных гормонов, которые не вызывают существенных изменений гормонального статуса животных[7].
2.3.4 Содержание миостатина в сыворотке крови и гомогетате мышечной ткани ягнят
Одним из основных направлений селекционной работы в животноводстве является улучшение мясных качеств откормочных животных и повышение выхода мяса. Для решения этой задачи наряду с традиционной селекцией всё большее применение находят методы маркерной селекции, предусматривающей использование в селекционных программах ДНК-маркеров, напрямую или косвенно связанных с QTL мясной продуктивности.
Миостатин (GDF8, авторы – R. Kambadur et al., 1997, L. Grobet et al., 1998) – ингибитор мышечного роста. Любые мутации в этом гене приводят к ухудшению его регуляторной функции и, соответственно, к увеличению развития мышцы[14].
Современное животноводство, используя самые последние достижения фундаментальных биологических наук, в том числе и генетики, позволяет добиваться увеличения эффективности разведения животных. Количественные признаки животных, такие как состав молока, качество туши мяса, плодовитость, сопротивляемость или чувствительность к инфекциям в большинстве своем являются полигенными признаками, результатом взаимодействия многих генов[35].
Влияние факторов окружающей среды модифицирует фенотипическую ценность данного признака. Введение в широких масштабах искусственного оплодотворения скота создало условия для передачи хозяйственно ценных генов, в частности, обуславливающих высокую молочную и мясную продуктивность. Идентификация генов, которые определяют то или иное развитие количественных признаков (главные гены количественных признаков – QTL – Quantitative Trait Loci), а также их мутаций, поиск молекулярно-генетических маркеров, тесно сцепленных с ними, является в настоящее время предметом интенсивных исследований [7].
Белок миостатин, кодируемый геном миостатина (MSTN), является одним из важнейших факторов в поддержании равновесия сложных биохимических процессов, обеспечивающих белковый обмен и связанные с ним процессы формообразования скелетных мышц [45]. Его функция заключается в торможении прироста мышечной массы. При блокировании действия миостатина наблюдается увеличение мышечной массы и повышение силовых характеристик скелетных мышц [41]. Изменения в нуклеотидной последовательности гена MSTN способны приводить к изменению уровня активности кодируемого белка. Доказательством этого служат результаты экспериментов по геномному редактированию. Так в 2015 году сиспользованием ZFN технологии (Zinc finger nucleases technology) был заблокирован участок во втором экзоне MSTN свиней, что позволило получить нуль-мутантов погену MSTN. Такие поросята отличались более раз-витой мускулатурой при меньшем количестве жира. Интересным является тот факт, что 20% мутантных свиней имели один добавочный грудной позвонок [46].
Среди мутаций сельскохозяйственных животных особый интерес привлекает мутация, обеспечивающая аномальное развитие мышечной массы – миостатин-mh. Тривиальное название мутации «двойной мускул» (синонимы: доппельлендеры, double-muscling, двойные мышцы, мышечная гипертрофия, мышечная суперплазмия и др.). Данная мутация рецессивна и ассоциирована с действием гена MSTN. Физиологическая сущность мутации миостатин-mh состоит в преодолении генетического контроля за гипертрофированным ростом мышечноймассы. Мутация миостатин-mh-0 на 20% увеличивает мышечную массу. В новых условиях использования организма домашних животных, как мини-биофабрики по биосинтезу мышечного белка, внедрение данной мутации в систему разведения отдельных пород не только возможно, но может являться важным селекционным достижением [44].
Первым и пока уникальным генетически модифицированным животным, одобренным для потребления человеком, является трансгенный лосось с перенесённым геном гормона роста, который показал более чем двукратное увеличение скорости роста [43]. Аналогичная цель была достигнута у млекопитающих за счёт увеличения активности секретируемого белка миостатина, продукта одноимённого гена MSTN, оказывающего отрицательное влияние на развитие мышечной массы. Несколько встречающихся в природе аллелей гена миостатина были отредактированы у животных разных видов, в том числе и свиней, с использованием технологии CRISPR [47].
CRISPR это иммунная система бактерий, защищающая их от чужеродных вирусов. Впервые она была обнаружена у Escherichia coli в конце 1980-х годов. Японские учёные заметили, что в геноме бактерии присутствуют повторяющиеся последовательности, разделенные спейсерами – уникальными участками ДНК. И только в 1992 году Франциско Мохика назвал их CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats ‒ сгруппированные короткие палиндромные повторы, разделенные промежутками). Далее генетики выяснили, что CRISPR связаны с выработкой комплекса белков, названных Cas, которые узнают проникший в клетку бактерии вирус и вырезают кусок чужеродной ДНК и вставляют его в кассету CRISPR. Если клетка вновь встречается с идентичным вирусом, система CRISPR/Cas9 с легкостью помогает побороть инфекцию [42].
Белок миостатин, кодируемый геном миостатина (MSTN), является одним из важнейших факторов в поддержании равновесия сложных биохимических процессов, обеспечивающих белковый обмен и связанные с ним процессы формообразования скелетных мышц [45]. Его функция заключается в торможении прироста мышечной массы.
В начале эксперимента концентрация миостатина у ягнят опытной и контрольной групп находилась практически на одном уровне и колебалась в пределах 0,901-0,958 нг/мл.
Таблица 8 — Концентрация мистатина в сыворотке крови молодняка овец
| Группа | Уровень миостатина, нг/мл |
| В начале эксперимента | |
| Контрольная | 0,901 |
| Опытная | 0,958 |
| В конце эксперимента | |
| Контрольная | 0,873 |
| Опытная | 0,631 |
В сыворотке крови животных, которые получали кормовую добавку на основе трутневого расплода составил 0,631 нг/мл, в то время как у животных, получавших основной рацион данный показатели находится на уровне 0,873нг/мл (рис. 1).
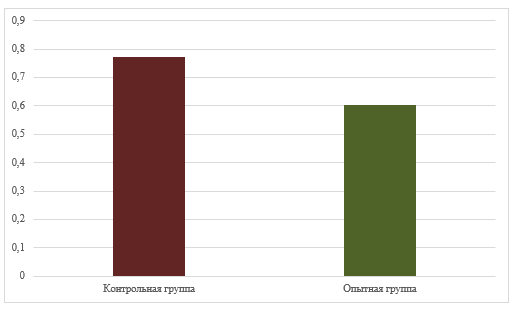
Рисунок 16 — Концентрация миостатина в сыворотке крови молодняка ягнят в конце эксперимента
Уровень миостатина в гомогенате мышечной ткани ягнят опытной группы составил 3,12 нг/мл, в то время как у животных контрольной группы данный показатели находится на уровне 4,85 нг/мл (рис. ).
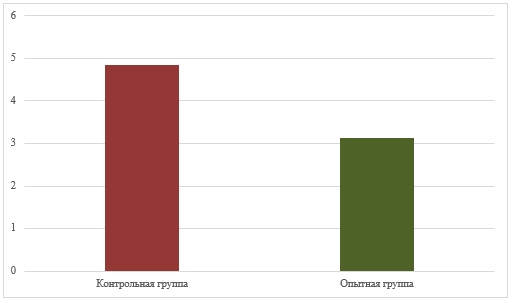
Рисунок 17 — Концентрация миостатина в мышечной ткани
Можно предположить, что трутневый расплод содержит биологически активные вещества, которые подавляют синтез миостатина, что способствует развитию мышечной ткани у молодняка свиней опытной группы.
2.3.5 Продуктивные показатели ягнят
Мясность – важнейший хозяйственный признак животного, характеризующий его развитие. Становится очевидным, что более выгодно выращивать животных с потенциально высокой мясностью, то есть таких, которые быстро наращивают мышечную массу при минимальных затратах питательных веществ на единицу прироста. Мясная продуктивность зависит от многих факторов: породы, пола, возраста, физиологического состояния, условий кормления и содержания []. В трудах Дж. Хэммонда изучено формирование мясной продуктивности мелкого рогатого скота. По мере увеличения живой массы и возраста молодняка замедляется синтез тканей, повышается расход кормов на получение прироста, изменяется химический и морфологический состав тела (Гуткин, С.С., Сиратзетдинов, Ф.Х., 2001; Забелина, М.В., 2006).
При формировании групп ягнят первоначальная живая масса в опытной группе составила 22,55 кг, в контрольной группе – 22,57 кг. Взвешивание ягнят в ходе эксперимента в возрасте …… дней отметилась тенденция к увеличению данного показателя в опытной группе. Так живая масса опытных ягнят составила 28,1 кг, а у контрольных животных – 27,3 кг. В конце эксперимента установлено, что живой вес ягнят, получавших основной рацион составил 31,4 кг, а у ягнят, получавших гомогенат трутневого расплода — 32,84 кг, что на 4,6% выше контрольных значений.
Среднесуточный прирост у животных опытной группы составил 173,63 г, а у ягнят контрольной группы — 147,78 г, что на 14,9 % ниже показателей в опытной группе.
Показатель убойной массы в опытной группе составил 12,65 кг, что на 11,45 % выше относительно контрольных значений.
Одним из основных показателей качества туш является площадь мышечного глазка. Площадь поперечного сечения длиннейшей мышцы спины («мышечный глазок») имеет сопряженность с мясностью туши. Так, положительная корреляция между массой мышц в туше и площадью мышечного глазка у мясо-шерстных ягнят составляет 0,77—0,81. Поэтому о мясности туши можно судить и по площади поперечного сечения длиннейшей мышцы спины. Площадь поперечного сечения длиннейшей мышцы спины определяют на отобранных для обвалки тушах.
Длиннейшую мышцу спины осторожно разрезают поперек ножом между последним грудным и первым поясничным позвонками, а чтобы не нарушить размер и структуру мышцы, позвонки распиливают. На полученный поперечный разрез накладывают карандашную кальку (или пергамент) и переносят на нее контуры мышцы, а затем планиметром измеряют площадь (см2) полученного контура.
Таблица 9 — Живая масса и среднесуточные приросты экспериментальных животных
| Показатель | Перво-начальный вес | Взвешивание первое | Средне-
суточный прирост |
Взвешивание второе | Средне-суточный прирост | Разница | Разница за весь период | Среднесуточный прирост | Убойная масса, кг |
| Опытная группа | |||||||||
| Среднее | 22,55 | 28.1 | 185 | 32,84 | 160,0 | 4,7 | 10,42 | 173,63 | 12,65 |
| Контрольная группа | |||||||||
| Среднее | 22,57 | 27.3 | 158,5 | 31,4 | 136,65 | 4,1 | 8,87 | 147,78 | 11,35 |
| Процент от контроля среднее | 99,91 | 102,9 | 116,71 | 104,6 | 117,1 | 114,6 | 117,47 | 117,5 | 111,45 |


ОПЫТ КОНТРОЛЬ
Рисунок 18 — Туши ягнят (опыт -контроль)
Результаты наших исследований показывают, что трутневый расплод существенно влияет на исследуемые показатели.
Таблица 10 — Показатели площади мышечного глазка
| Группы | Показатели | |
| Площадь мышечного глазка, см² | Длина туловища, см | |
| Контрольная | 11,89 | 57 |
| Опытная | 13,57 | 60 |
В группе ягнят, получавших гомогенат трутневого расплода площадь мышечного глазка составила 13,57 см2, что на 14,13% больше по сравнению с данным показателем в контрольной группе. Толщина жира над мышечным глазком в контрольной группе составила 3,5-5 мм, а в опытной группе 2,5-3 мм. Длина туловища в опытной группе превышала на 5,2% показатели в контрольной группе.
ОПЫТ КОНТРОЛЬ
Рисунок 19 — Площадь мышечного глазка туш ягнят
Полученные результаты доказывают, что использование гомогената трутневого расплода в кормление откормочных ягнят усиливает рост мышечной ткани, способствует повышению продуктивных показателей, что свидетельствует о проявлении анаболического действия гомогената трутневого расплода на организм животных.
Анализ химического состава мышечной ткани показывает, что трутневый расплод не повлиял на содержания воды, однако достоверно снизил содержание жира в мышечной ткани.
2.3.6 Органолептическая оценка мяса ягнят
Органолептический анализ мяса ягнят показал, что при скармливании гомогената трутневого расплода установлено, что мясо ягнят опытной группы имеет более светлый цвет по сравнению с контрольными образцами. Мясо, полученное от контрольных животных более темного цвета, запах и вкус приятные, но более резко выраженные по сравнению с опытом. Данные полученные в результате органолептической оценки представлены в таблице 11.
Таблица-11 Органолептическая оценка мяса ягнят
| Показатель | Характеристика | |
| Опытная группа | Контрольная группа | |
| Внешний вид | Светлого нежно-розового цвета, жировые прожилки белые их количество незначительное. Имееет корочку подсыхания | Темно-розового цвета, жировые прожилки белые. Имеет корочку подсыхания |
| Консистенция мышечной ткани | Мясо упругое и эластичное, при надавливании пальцем ямка быстро восстанавливается | Мясо упругое и эластичное, при надавливании пальцем ямка быстро восстанавливается |
| Запах (аромат) | Запах свойственный данному мясу, без признаков затхлости. | Запах свойственный данному мясу, без признаков затхлости. |
| Состояние жира | Белый, цвет, консистенция плотная, запах осаливания и прогоркания отсутствует | Белый цвет, консистенция плотная, запах осаливания и прогоркания отсутствует |
| Мышцы на разрезе | Слегка влажные, светло нежно-розового цвета | Слегка влажные, нежно-розового цвета |
| Прозрачность и аромат бульона | Более светлый, прозрачный, ароматный свойственный свежему бульону | Более темный, прозрачный, ароматный свойственный свежему бульону |
Проба варкой, является одним из самых часто используемых методов для определения свежести мяса. Для получения однородной пробы каждый образец был отдельно пропущен через мясорубку для получения фарша. 20 г полученного фарша поместили в коническую колбу вместимостью 100 см и залили 60 см дистиллированной воды, тщательно перемешали, закрыли часовым стеклом и поставили в кипящую водяную баню до нагревания. Запах мясного бульона был определен в процессе нагревания до 83 °С. Затем 20 мл бульона налили в мерный цилиндр вместимостью 25 см для установиления прозрачности бульона визуально.

Рисунок 20 — Исследования мяса пробой варкой в лаборатории

КОНТРОЛЬ ОПЫТ
Рисунок 3-Сравнение образцов мяса бараничиков
В результате органолептических исследований бульона установлены незначительные отличия опытных и контрольных образцов. Бульон опытного образца имел светло-серый цвет, а бульон контрольного образца серого цвета. Аромат бульона обоих образцов был насыщен и приятен. Вкусовые качества преобладали у опытного образца: вкус мягкий, оставляющий приятное послевкусие.
Таким образом, анализ качества мяса баранчиков показал, что скармливание кормовой добавки на основе трутневого расплода способствует улучшению органолептических показателей мяса ягнят.
2.4 Результаты научных исследований на молодняке крупного рогатого скота на откорме
Кровь является одной из главнейших связующих систем целостного организма. Она обеспечивает питание и дыхание всех органов и тканей, снабжает их необходимыми ферментами, гормонами, медиаторами и другими гуморальными веществами, без которых нормальное функционирование организма невозможно. У здоровых животных при нормальных физиологических условиях существует постоянство химико-морфологического состава и физико-химических свойств крови. Кроветворные органы чувствительно реагируют на различные физиологические и, в особенности на патологические, воздействия на организм изменением картины крови. Поэтому исследование крови имеет большое диагностическое значение.
2.4.1 Гематологические показатели телят
Важнейшую роль в организме животного выполняют форменные элементы крови ( табл.) Основную часть форменных элементов крови составляют эритроциты. Обладая большой удельной поверхностью, эритроциты могут адсорбировать на себе многочисленные органические и неорганические вещества, в том числе и транспортировать их по тканям. Основная функция эритроцитов дыхательная, она неразрывно связана со свойствами содержащегося в них белка гемоглобина.
В ходе научно-производственного эксперимента уровень эритроцитов в крови животных опытной группы составил 9,67 *1012/L, что на 11,0% выше относительно показателей в контрольной группе.
Таблица 12 – Гематологические показатели телят
| Показатель
Группа |
WBC *109/L | RBC *1012/L | HGB, г/л | PLT * 109/L |
| Контрольная | 9,51 | 8,71 | 114 | 527 |
| Опытная | 10,33 | 9,67 | 121 | 604 |
Полученный цифровой материал в результате эксперимента на откормочных бычка, свидетельствует о том, что уровень гемоглобина у молодняка КРС в опытной группе на 6,14% выше по сравнению с данным показателям у животных контрольной группы.
2.4.2 Биохимические показатели в сыворотке крови телят
Биохимические показатели в сыворотке крови животных в большей степени отражают уровень кормления и обменные процессы, что при правильном понимании физиологических изменений становятся твердым основанием для принятия производственных решений.
Уровень содержания общего белка в крови является надёжным показателем обеспеченности организма мономерами нутриентов, особенно протеиногенными аминокислотами. Достаточно изучен вопрос о том, что при неудовлетворительном содержании белка в рационе в первую очередь гидрализуются плазменные белки (особенно альбумины), далее белки печени и мышечной массы. Содержание белков и аминокислот в плазме крови примерно соответствует их концентрационному фону в тканях и органах. Отсюда следует, что увеличение содержания белка в плазме крови индикаторно отражает повышение белковой массы в периферических тканях соответственно и интенсивность белкового обмена.
При изучении белкового состава сыворотки крови установлено, что концентрация общего белка в сыворотке телят опытной группы составил 70,2 г/л, что на 15,1% больше по сравнению с данным показателя у контрольных телят.
Таблица 13 – Биохимические показатели сыворотки крови телят
| Показатель
Группа |
Общий белок, г/л | Альбу-мин, г/л | Мочеви-на, ммоль/л | Общий холестерин, ммоль/л | Глюкоза, ммоль/л |
| Контрольная | 61,0 | 34,5 | 1,06 | 3,99 | 4,15 |
| Опытная | 70,2* | 37,1 | 3,02* | 2,48* | 5,27 |
Примечание: * — знак статистически значимых различий между животными контрольной и опытной группами
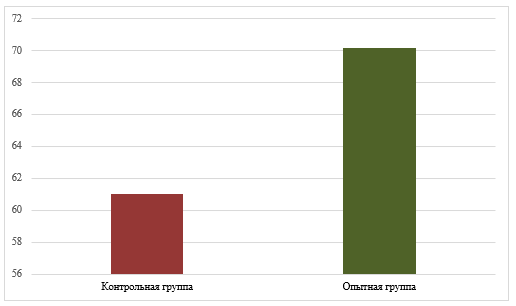
Рисунок 21 – Концентрация общего белка в сыворотке крови телят
Основными показателями, характеризующими обмен белков в организме, являются низкомолекулярные азотистые вещества или небелковые азотистые комплексы крови. Как известно, независимо от состояния организма в нём непрерывно происходят одновременно процессы синтеза и распада тканевых белков. Исход этих противоположно направленных процессов зависит от состояния их скоростей. При одинаковых скоростях наблюдается динамическое равновесие, когда же скорость синтеза превышает скорость распада, происхо- 71 71 дит увеличение массы белка, при обратном соотношении наблюдается её уменьшение. Поскольку синтез молекул белка в тканях организма происходит, главным образом, из свободных аминокислот, им отводится центральное место в белковом метаболизме. Важно подчеркнуть, что половина азота, выводимого из организма превращается в мочевину в результате процессов трансреаминирования. В связи с этим, существует прямая зависимость между активностью аланин- и аспартатаминотрансфераз и ферментами, участвующими в образовании конечного продукта азотистого обмена мочевины. Поэтому о характере метаболизма азота в организме животных можно судить лишь сопоставляя данные по активности ферментных систем, катализирующих процессы катаболизма аминокислот и образование мочевины с содержанием сопряжённых с ними азотистых метаболитов в тканях и органах. Основными являются азот аминный и азот мочевины. Компонентом остаточного азота является креатинин. Он представляет собой конечный продукт креатина и характеризует мышечную массу, так как увеличение креатина, а следовательно, и креатинина коррелирует с ростом мышечной ткани. Креатинин образуется после трансфосфорилирования креатинфосфата, необходимого для ресинтеза АТФ в цитоплазме миоцитов.
Мочевина как завершённый обезвреженный продукт орнитинового цикла гепатоцитов образуется из аммиака и монооксида углерода в матриксе митохондрий. Уровень мочевины в крови показывает интенсивность дезаминирования аминокислот в тканях и органах, биохимическую налаженность связывания аммиака в клетке аспаргиновой, глутаминовой и α-кетоглутаровой кислот с дальнейшим диффундированием через межклеточную жидкость в кровь в систему обезвреживания гепатоцитов.
По результатам исследований содержание мочевины в сывортке крови контрольных животных составил 1,06 ммоль/л, а в крови животных опытной группы – 3,02 ммоль/л.
Также установлено, что в сыворотке телят, получавших гомогенат трутневого расплода концентрация общего холестерина на 37% относительно показателей откормочных бычков, получавших основной рацион..
Глюкоза обнаруживается в тканях животных не только в свободной форме, но и в составе полисахаридов, фосфорных эфиров, глюколипидов и т.д. Клетки печени и мышечной ткани поглощают из крови большее количество глюкозы, чем это необходимо для непосредственных нужд. Избыточное количество глюкозы откладывается в виде гликогена. При достаточном количестве гликогена клетки печени превращают избыток глюкозы в жиры, которые также откладываются в качестве запасных веществ в различных частях организма. Сравнительно постоянная концентрация глюкозы в крови является результатом 74 74 выхода глюкозы из крови в клетки различных тканей и её использование в различных метаболических путях. Распад глюкозы может совершаться тремя путями, ответвлениями которых является синтез и катаболизм липидов и белков. Концентрация глюкозы в сыворотке крови откормочных бычков опытной группы составил 5,27 ммоль/л, а у животных контрольной группы 4,15 ммоль/л.
Известно, что многочисленные сопряжённые биохимические процессы в организме протекают при самом активном участии ферментов, обуславливающих не только направление, скорость течения биохимических реакций, но и создающие своей лабильностью возможность адаптации процессов обмена веществ к условиям внешней среды. Большая роль в процессах обмена белков, протекающих в организме животных, принадлежит ферментам переаминирования. Аминотрансферазы заслуживают особого внимания, поскольку они играют ведущую роль в клеточном метаболизме. Они участвуют в реакциях ферментативного переноса NH2-групп между аминокислотами и соответствующими кетокислотами, стоящими на стыке путей обмена азотистых веществ, углеводов и жиров. Статистически значимых различий между показателями ферментов у животных опытной и контрольных групп не выявлено.
Таблица 14 – Ферменты в сыворотке крови телят
| Показатель
Группа |
АЛТ, U/L | АСТ, U/L | Общий билирубин, umol/L | Креатинин, umol/L | Липаза, U/L |
| Контрольная | 28,3 | 86,3 | 1,61 | 111 | 21,1 |
| Опытная | 32,0 | 101 | 2,54 | 106 | 21,5 |
Минеральные вещества – непременные структурные компоненты живого организма. Встречаются они в виде неорганических солей в протоплазме, ядрах клеток, форменных элементах крови. В сыворотке крови они связаны с белками или представлены малодиссоциирущими небелковыми комплексами и ионами. Последние принимают деятельное участие в межуточном обмене, синтезе молочной кислоты, замедляют действие токсинов и т.д. Эта особенность минеральных веществ отображает их многостороннее физиолого-биологическое значение в организме
Таблица 15 — Показатели минерального обмена телят
| Показатель
Группа |
Кальций, ммоль/л | Магний, ммоль/л | Медь, umol/L | Калий, ммоль/л | Натрий, ммоль/л |
| Контрольная | 6,91 | 0,998 | 0,513 | 4,64 | 151 |
| Опытная | 6,36 | 0,968 | 0,514 | 4,44 | 133 |
Проведённые исследования показали, что показатели минерального обмена крови телят находились в пределах физиологической нормы, что говорит о клиническом здоровье экспериментального молодняка.
2.4.3 Гормональный профиль телят
Рост, развитие и продуктивность животных в значительной степени зависят от функциональной активности желез внутренней секреции, иммунной системы.
Большое значение в данном случае, как основного регулятора, имеет определение функциональных резервов желез внутренней секреции в разные периоды онтогенеза и связь этих показателей с молочной продуктивностью у разных пород крупного рогатого скота и их разнопродуктивных групп.
Известно также, что эндокринная и иммунная системы сильно подвержены не только генетическому влиянию, но и экзогенным факторам (сезон года, качество и уровень питания и т.д.). Кроме того, эти системы подвержены и различным эндогенным факторам, прежде всего, периоду онтогенеза и физиологическому состоянию организма. Применение гомогената трутневого расплода в кормлении телят повлияло на концентрацию тестостерона и кортизола в сыворотке крови животных (табл. ).
Таблица 16 — Гормональный статус телят
| Группа | Уровень тестостерона, нмоль/л | Уровень кортизола,
нмоль/л |
| Контрольная | 38,85 | 9,86 |
| Опытная | 27,00 | 12,47 |
Исследования сыворотки крови молодняка телят показали, что использование трутневого расплода в кормлении животных снижает содержание гормона тестостерона в организме откормочных бычков. Возможно, это связано с тем, что трутневый расплод содержит гормоноподобные вещества, которые организм животного использует взамен собственных гормонов, в свою очередь снижаю концентрацию тестостерона в крови. Уровень гормона кортизола в крови молодняка бычков в опытной группе был также несколько выше относительно показателей в контрольной группе.
2.4.4 Морфологические изменения органов откормочных бычков при введении в рацион защищенной формы трутневого расплода
Морфологические изменения определяли после убоя бычков в возрасте 13 месяцев. Осмотр внутренних органов не показал отклонений от нормы: края печени острые, паренхима вишнево-красного цвета, плотная, очаги некроза или абсцессов не обнаружены. Сердце в норме. Легочная ткань упругая, без кровоизлияний и отечности. Трахеи и бронхи чистые. Селезенка без патологических изменений. Почки обычных размеров без видимой патологии. Серозные оболочки органов желудочно-кишечного тракта без очагов воспалений и гемморагий, слизистые оболочки серовато-розового цвета. Лимфоузлы также не имели видимой патологии, на разрезе сероватого цвета без кровоизлияний. Вместе с тем, морфологические исследования внутренних органов и эндокринных желез у подопытных животных показали наличие активной гиперемии, расширение клубочковой зоны и мозгового слоя в надпочечниках, увеличение числа и размеров островков Лангерганса в поджелудочной железе, дегенерацию части проксимальных канальцев почки, повышение числа мелких фолликул в щитовидной железе. Все это свидетельствует о нормальном протекании процессов в этих органах и тканях, а также об усилении кровотока и расширении капилляров, что способствует повышению доли мышечных волокон, обеспечивающих рост мышечной ткани и снижению уровня жировой ткани.
Это подтверждают данные результатов контрольного убоя и химического состава мышечной ткани (табл.).
Таблица 17 — Химический состав мышечной ткани 13 — месячных бычков, %
| Группы животных | Сухое в-во | Белок | Жир | Зола |
| длиннейшая мышца спины | ||||
| Контрольная | 25,00+0,09 | 19,81+0,33 | 1,46+0,01 | 1,22+0,04 |
| Опытная | 24,52+2,1 | 20,39+0,08 | 1,07+0,08 | 1,15+0,11 |
| % к контролю | 98,1 | 102,9 | 73,2 | 94,3 |
| средняя проба мышечной ткани | ||||
| Контрольная | 27,08+0,88 | 20,27+0,20 | 1,64+0,07 | 1,14+0,10 |
| Опытная* | 26,26+0,29 | 20,84+0,00 | 1,35+0,18 | 0,86+0,05 |
| % к контролю | 97,0 | 102,8 | 82,3 | 75,4 |
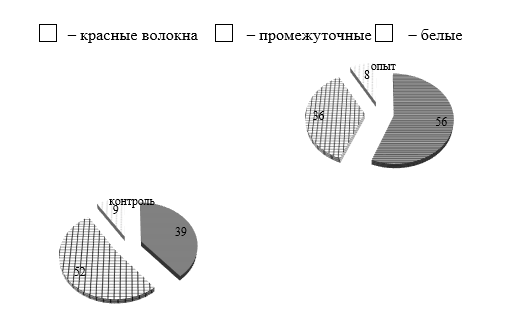
Рисунок 22 — Соотношение мышечных волокон в длиннейшей мышце спины бычков, %
Использование защищенной формы трутневого расплода в кормлении половозрелых откормочных бычков повысило отложение мышечной ткани с большим содержанием в ней белков. По органолептическим показателям мясо бычков отвечало всем требованиям, предъявляемым к свежему доброкачественному мясу. При дегустационной оценке установлено, что мясо и бульон от животных опытной и контрольной групп имели идентичные органолептические и вкусовые качества. Проведенные морфологические исследования мышечной и жировой тканей выявили некоторые изменения соотношения типов мышечных волокон. У опытных животных в 13-месячном возрасте преобладал белый тип мышечных волокон, превышение контроля составило 41,6%.
Результаты определения соотношений размерных классов адипоцитов в подкожном жировом депо бычков свидетельствуют об усилении процессов липолиза, что, вероятнее всего, обеспечивает энергией процессы, происходящие в мышечной ткани (табл. ).
Таблица 18 — Влияние защищенной формы трутневого расплода на соотношение размерных классов адипоцитов подкожного жирового депо бычков, %
| Размер адипоцитов | Группы | |
| Контроль | Опыт | |
| < 20 мкм | 20,0 | 35,2 |
| 20-70 мкм | 52,3 | 41,2 |
| 70-120 мкм | 27,3 | 23,2 |
| > 120 мкм | 0,7 | – |
Увеличение числа адипоцитов мелких размерных классов (до 20 мкм) и уменьшение содержания средних (до 20-70 мкм ) и крупных (до 70-120 мкм) подтверждают использование липидов, т.к. полученные соотношения размерных классов адипоцитов указывают на торможение процессов накопления липидов в клетках жирового депо.
Таким образом, включение в рацион половозрелых откормочных бычков защищенной формы трутневого расплода способствует увеличению массы мышечной ткани с одновременным уменьшением размеров адипоцитов в жировой ткани и с небольшим снижением как жира в мышечной ткани, так и абдоминального жира.
2.4.5 Влияние биологически активных соединений защищенной формы трутневого расплода на продуктивные качества животных
Многогранные полезные свойства гомогената трутневого расплода как компонента кормов еще недостаточно изучены. Однако установлено, что входящие в состав трутневого расплода макистерон А и экдистероиды обладают гормоноподобными свойствами по типу стероидных гормонов ( ).
Добавка к рациону гомогената трутневого расплода к рациону откормочных свинок, выращенных на ячменно-пшеничном рационе, позволила достоверно повысить прирост живой массы животных и повысить показатели мясной продуктивности ( наши исследования и на отчет прошлых годов).
При применении защищенной формы трутневого расплода в кормлении половозрелых откормочных бычков нами установлен анаболический эффект и способность кормовой добавки повышать скорость роста бычков (табл.).
Таблица 19 — Интенсивность роста половозрелых бычков, получавших кормовую добавку на основе защищенной формы трутневого расплода
| Показатели | Возраст, месяцы | Всего за период опыта | |||
| 11 | 12 | 13 | |||
| Контрольная группа | |||||
| Живая масса, кг | 284,3 | 314,3 | 344,5 | ||
| Абсолютный прирост, кг | 30,0 | 30,4 | 60,4 | ||
| Среднесуточный прирост, г | 1000+76 | 979+83 | 989+38 | ||
| Потреблено корма, к.ед. | 482,5 | ||||
| Затраты корма, к.ед/кг прироста | 7,99 | ||||
| Опытная группа | |||||
| Живая масса, кг | 294,0 | 329,0 | 362,0 | ||
| Абсолютный прирост, кг | 35,0 | 33,0 | 68,0 | ||
| Среднесуточные приросты, г | 1165+66 | 1064+40 | 1114+33 | ||
| % к контролю по среднесуточному приросту | 116,5 | 108,6 | 112,6 | ||
| Затраты корма, к.ед/кг прироста | 7,10 | ||||
Положительный эффект наблюдался в превышении абсолютного прироста живой массы к контролю, затраты корма снизились на 11,1 %. Отмечено улучшение убойных качеств туши (табл. 4). Больший выход мяса , большая площадь мышечного глазка (на 17,1 %).
Таблица 20 — Результаты контрольного убоя и обвалки туши половозрастных бычков при использовании защищенной формы трутневого расплода
| Показатели | Группы | % к контролю | |
| контроль | опыт | ||
| Живая масса, кг | 345+18 | 362+5 | 104,9 |
| Масса туши, кг | 171+7 | 182+7 | 106,4 |
| Убойный выход туши, % | 50,1+0,7 | 50,3+1,2 | 100,4 |
| Масса внутреннего жира, кг | 5,8+1,1 | 6,0+1,0 | 103,4 |
| Площадь мышечного глазка, см2 | 67,9+4,7 | 79,5+4,1 | 117,1 |
Исследования, проведенные на откормочных бычках показали, что использование защищенной формы трутневого расплода в кормление животных, благодаря анаболическим, антиоксидантным и адаптогенным свойствам, позволяет увеличить прирост живой массы бычков на откорме на 12,6 %, улучшить мясную продуктивность и снизить затраты кормов на кг прироста.
Выводы
1. В результате применения защищенной формы трутневого расплода в кормлении ягнят установлено повышение концентрации в крови ягнят опытной группы гемоглобина, эритроцитов, что свидетельствует об активизации окислительно-восстановительных процессов в организме животных, что подтверждается более высокие показатели прироста в течении эксперимента.
2. В конце научного эксперимента в сыворотке крови ягнят, получавших защищенную форму гомогената трутневого расплода установлено достоверно значимое повышение данного показателя на 7,9% по сравнению с ягнятами контрольной группы и статистически значимое снижение уровня общего холестерина на 17,7% относительно значений в контрольной группе.
3. Исследования сыворотки крови молодняка ягнят показали, что использование кормовой добавки на основе трутневого расплода значительно повышает содержание гормона тестостерона в организме ягнят: концентрация тестостерона находилась на уровне 8,22 нмоль/л, то у животных опытной группы – 11,93 нмоль/л, что статистически значимо выше контрольных показателей.
4. Уровень миостатина в гомогенате мышечной ткани ягнят опытной группы составил 3,12 нг/мл, в то время как у животных контрольной группы данный показатели находится на уровне 4,85 нг/мл. В сыворотке крови опытных ягнят установлено снижение уровня миостатина на 27,7% относительно контрольных значений, что говорит о содержании в трутневом расплоде биологически активных вещест, способных блокировать данный белок, тем самым способствуя росту мышечной ткани.
5. Среднесуточный прирост у ягнят опытной группы составил 173,63 г, а у ягнят контрольной группы — 147,78 г, что на 14,9 % ниже показателей в опытной группе. Показатель убойной массы откормочного молодняка овец в опытной группе составил 12,65 кг, что на 11,45 % выше относительно контрольных значений. В группе ягнят, получавших гомогенат трутневого расплода площадь мышечного глазка составила 13,57 см2, что на 14,13% больше по сравнению с данным показателем в контрольной группе. Толщина жира над мышечным глазком в контрольной группе составила 3,5-5 мм, а в опытной группе 2,5-3 мм.
6. При изучении белкового состава сыворотки крови установлено, что концентрация общего белка в сыворотке телят опытной группы составил 70,2 г/л, что на 15,1% больше по сравнению с данным показателя у контрольных телят.
7. Использование защищенной формы трутневого расплода в кормлении половозрелых откормочных бычков повысило отложение мышечной ткани с большим содержанием в ней белков. По органолептическим показателям мясо бычков отвечало всем требованиям, предъявляемым к свежему доброкачественному мясу. У опытных животных в 13-месячном возрасте преобладал белый тип мышечных волокон, превышение контроля составило 41,6%.
8. Увеличение числа адипоцитов мелких размерных классов (до 20 мкм) и уменьшение содержания средних (до 20-70 мкм ) и крупных (до 70-120 мкм) подтверждают использование липидов, т.к. полученные соотношения размерных классов адипоцитов указывают на торможение процессов накопления липидов в клетках жирового депо.
9. Полученные результаты доказывают, что использование гомогената трутневого расплода в кормление откормочных ягнят и телят усиливает рост мышечной ткани, способствует повышению продуктивных показателей, что свидетельствует о проявлении анаболических, антиоксидатных и адаптогенных свойств защищенной формы гомогената трутневого расплода на организм животных.
Список литературы
- Абдуллаев, Г.Г. Возродить былую славу лезгинских овец / Г.Г. Абдуллаев // Овцеводство. – 1990. – №3. – С. 26-27. с.
- Авдалян, Я. Откормочные и мясные качества бычков Воронежского типа красно-пестрой породы разных линий / Я. Авдалян, И. Зизюков, Н. Щегольков // Молочное и мясное скотоводство. – 2012. — №5. – С. 23-24.
- Алагирова, Ж.Т. Адаптивные способности голштинского скота отечественной и американской селекции при их интродукции в Кабардино-балкарскую республику: автореф. дис. … канд. биол. наук: 06.02.07. / Ж.Т. Алагирова. — Дубровицы, 2016. — 19 с.
- Амерханов, Х. Генетические ресурсы мясного скота в Российской Федерации / Х. Амерханов, Ф. Каюмов // Молочное и мясное скотоводство. – 2011. — №1. – С. 3-6.
- Амирова, П.Х. Гематологические показатели ярок различного происхождения / П.Х. Амирова, И.С. Исмаилов, В.А. Кущенко // Овцы, козы, шерстяное дело. – 2010. – №3. – С. 53-55.
- Афанасьева, Е. Мясная продуктивность черно-пестрых бычков при выращивании в облегченном помещении и открытой площадке и откорме до живой массы 550 кг / Е. Афанасьева, Г. Легошин, А. Мамонов и др. // Молочное и мясное скотоводство. – 2013. — №6. – С. 6-7.
- Баева Е.В. Состояние клеточного иммунитета при стрессовании молодняка крупного рогатого скота // С.-х. биология. 1992. — №6. — С. 115-120.
- Беломытцев, Е. Связь технологии откорма с продуктивностью бычков и качеством мяса / Е. Беломытцев, Н. Дагаева // Молочное и мясное скотоводство. – 1991. — №5. – С. 40-42.
- Бельков, Г.И. Совершенствование технологии мясного скотоводства. Индустриализация производства мяса / Г.И. Бельков, В.А. Черников. – М.: Агропромиздат, 1987. – С.93-100
- Биркалова Е.И. Особенности формирования мясной продуктивности и качественных показателей мяса молодняка русских длиннотощехвостых овец в зависимости от пола и возраста:дис. … канд. с.-х. наук: 06.02.10 / Е.И. Биркалова. — Саратов, 2016. – 156
- Боряев Г.И., Блинохватов А.Ф., Невитов М.Н. Влияние различных соединений селена на иммунный статус ягнят в послеотельный период // Овцы, козы, шерстное дело. 1998. — № 2. — с. 43-45.
- Будникова, Н.В. Биологически активные соединения в трутневом расплоде / Н.В. Будникова // Пчеловодство. – 2009. — №6. — С.52-53
- Вершинин, А.С. Мясная продуктивность козлов – кастратов советской шерстяной породы / А.С. Вершинин, А.Н. Антонов, Г.Б. Цыденов // Овцы, козы, шерстяное дело. – 2007. – №2 – С. 18-19
- Голубков, А.И. Мясные качества симментальских бычков различных генотипов в Республике Хакасия / А.И. Голубков, М.М. Никитина // Сборник научных трудов по материалам международной научнопрактической конференции «Повышение конкурентоспособности животноводства и актуальные проблемы его научного обеспечения». – Ставрополь, 2014. – С. 189-192
- Горлов И.Ф. Влияние технологических приемов выращивания на иммунное состояние организма телят // Технология производства и перераб. продукции животновод. Волгоград, 1996. — С. 139-143.
- Горлов, И.Ф. Синтез и качественные показатели жировой ткани в организме бычков калмыцкой породы разных типов телосложения / И.Ф. Горлов, А.К. Натыров, Б.К. Болаев, М.Е. Спивак // Известия Нижневолжского агроуниверситетского комплекса. – 2015. — №3 (39). – С. 102-105
- Горлов, И.Ф. Системные технологии производства животноводческой продукции, как основа повышения конкурентоспособности АПК / И.Ф. Горлов // Актуальные проблемы развития агропромышленного комплекса Юга России: матер. междунар. науч.-практич. конф. – Элиста: Издательство КГУ, 2009. – С. 13-16
- Горожанкина, Л.А. Содержание метионина в пищевых белках / Л.А. Горожанкина // Значение белка в питании здорового и больного человека. – М.: Медгиз,1959. – С. 21-27.
- Давлетова, А.М. Убойные показатели баранчиков эдильбаевских овец / А.М. Давлетова, В.И. Косилов // Овцы, козы, шерстяное дело. – 2013. – №3. – С. 11-12
- Данкверт, А.Г. История племенного животноводства России / А.Г. Данкверт, С.А. Данкверт. – М.: Арбат Информ, 2004. – 328 с.
- Данкверт, С.А. Производство мяса в мире / С.А. Данкверт, А.М. Холманов, О.Ю. Осадчая. – Москва: Экономика, 2016. – 495с.
- Еременко, В.И. Гормональный статус, показатели обмена веществ и резистентность у крупного рогатого скота разных пород в онтогенезе
- Забелина, М.В. Мясные качества и оптимизация сроков убоя баранчиков аборигенных пород / М.В. Забелина // Вестник Российской академии сельскохозяйственных наук. – 2006. – №.6 – С. 61-62.
- Землянова Ю.В. Опыт применения трутневого расплода в экспериментах и клинических испытаниях:итоги и перспективы / Ю.В. Землянова, В.П. Чижов, Г.И. Боряев, Е.В. Здоровьева, Е.В. Перунова, А.В. Баулин, Е.Е. Пономарева // Мат. Междунар. научно-практ. конф. «Modern trends in reproduction of livestock animals (Современные аспекты воспроизводства сельскохозяйственных животных».- Пенза:РИО ПГСХА, 2015. – С. 86-91
- Зоранян, В.А. Проблема сохранения и целенаправленного использования генетических ресурсов заводских и эндемических пород животных и их диких сородичей / В.А. Зоранян, В.А. Абромян, С. В. Зоранян // Эколого – генетические проблемы животноводства и экологически безопасные технологии производства продуктов питания: тезисы докл. Междунар. научн. – практ. конф. – Дубровицы, 1998 – С. 68-69.
- Кистанова, Е.К. Влияние трутневого расплода на физиолого-биохимический статус молодняка свиней /Е.К. Кистанова, Е.В. Здоровьева, Г.И. Боряев, О.Г. Катаев, Г.М. Мелоян // Нива Поволжья. – 2016. — №4. – С. 24-29
- Клос Ю.С. Динамика содержания общего белка и его фракций в сыворотке крови холостых, суягных и лактирующих овцематок // С.-х. биология. -1990.-№4.-С. 48-51.
- Кононенко, С.И. Актуальные проблемы организации кормления в современных условиях / С.И. Кононенко // Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета. – 2016. — №115. – С. 951-980
- Кононенко, С.И. Инновации в организации кормления / С.И. Кононенко // Известия Горского государственного аграрного университета. – 2014. – Т. 51, № 2. – С. 94-98.
- Кот М.М., Булатов Р.И. Некоторые показатели углеводно-жирового обмена у ярославского скота в онтогенезе // Докл. Тимирязев, с.-х. акад. 1972. -Вып. 185.-С. 27-34.
- Кочкаров, Р.Х. Оплата корма приростом живой массы ярками советской мясошёрстной породы / Р.Х. Кочкаров // Овцы, козы, шерстяное дело. – 2009. – С. 66-67.
- Лазарян, Д.С. Таблетки «Апилар» на основе трутневого расплода, обладающие анаболическим, актопротекторным действием // Патент №2233666. — 2004
- Миронова, И.В. Характеристика мясной продукции молодняка черно-пестрой породы и ее помесей с салерсами / И.В. Миронова, Д.Р. Гильманов // Вестник Башкирского государственного аграрного университета. – 2013. — №2 (26). – С. 45-49.
- Митрофанова, Д.В. Гормоны трутневого расплода медоносных пчел разного возраста / Д.В.Митрофанов, Н.В.Будникова, Л.А.Бурмистрова //Пчеловодство. – 2015. — №7. — С.58-59
- Мунгин, В.В. Влияние уровня жира в рационах на мясную продуктивность молодняка овец / В.В. Мунгин, С. А. Лапшин, П.М. Стрелков // Проблемы отрасли овцеводства и перспективы её развития в Среднем Поволжье: матер. науч. – практич. конф. Пенза. – 2001. – С. 60-61.
- Нормы и рационы кормления сельскохозяйственных животных. Справочное пособие: 3-е издание переработанное и дополненное // Под ред. А.П. Калашникова, В.И. Фисинина, В.В. Щеглова, Н.И. Клеймёнова. – Москва. – Колос, 2003. – С. 76-77; 80-124.
- Палфий Ф.Ю., Якимчук Л.Л. Повышение использования питательных веществ жвачными животными // Науч.основы полноцен. кормения с.-х. животных. М. — 1986. — С. 9-14.
- Панин, В.А. Повышение эффективности производства мяса и молока за счет рационального использования породных ресурсов лучших зарубежных и отечественных пород крупного рогатого скота: автореф. дис. … докт. с.-х. наук: 06.02.10 / Панин Виктор Алексеевич. – Оренбург, 2013. – 34 С
- Прохода, И.А. Получение апидобовок из личинок пчел / И.А. Прохода//Пчеловодство. – 2009. — №8. — С.48-49
- Рахимжанов, Б. Белковый и аминокислотный состав сыворотки крови овец в зависимости от возраста и физиологического состояния организма / Б. Рахимжанов // Вестник сельскохозяйственной науки Казахстана. – 1981. – №2. – С. 30-33.
- Трухачев, В.И. Мясной рынок России: анализ состояния и перспективы развития / В.И. Трухачев, М.Г. Лещева, Ю.А. Юлдашбаев // Достижения науки и техники АПК. – 2012. — №11. – С. 3-9
- у: автореф. дис. … д-ра биол. наук: 03.00.13 / В.И. Еременко. — Боровск, 2001. — 43 с.
- Ульянов, А.Н. К проблеме сохранения генофонда стад овец кубанского заводского типа породы линкольн / А.Н. Ульянов, А.Я Куликова // Овцы, козы, шерстяное дело. – 2016. – №1. – С. 17-20
- Эльжироков З.Л. Эффективность выращивания бычков симментальской породы в условиях различных технологий производства говядины: дис. … канд.с.-х. наук: 06.02.10. / З.Л. Эльжирокова. — Нальчик, 2017. — 182 с.
- Auezov, M. Improving Reproductive Qualities of Pigs Using the Drone Brood Homogenate / M. Auezov, M. Utemisov, Z. Khan // Bolatovna et al. Biol Med (Aligarh). – 2015. — № 7(2).
- Bass, J.J. Plasma concentration of FSH and LH in entire and castrated prepubertal bull calves treated with Gn – Rh / J.J. Bass, A.S. McNeilly, H.E. Moreton // J.Reprod. Fertil., 1999, 57(1): 219-222.
- Brandstetter, A.M. Effects of muscle type castration, age, and compensatory growth rate on androgen receptor mRNA expression in bovine skeletal myscle / A.M. Brandstetter, M.W. Pfaffl, J.F. Hocguette // J.Anim Sci.,2000, 78(3): 629-637.
- Brandstetter, A.M. Effects of muscle type castration, age, and compensatory growth rate on androgen receptor mRNA expression in bovine skeletal myscle / A.M. Brandstetter, M.W. Pfaffl, J.F. Hocguette // J.Anim Sci.,2000, 78(3): 629-637.
- Hrassningg, N. Differences in the drone and worker physiology in honeybees (Apis mellifera) / N. Hrassningg, R. Crailsheim //Apidologie. – 2005. — №36. – Р. 255-277.
- Notten, D.R. Effects of ewe breed and management sustem on efficiency of lamb production: II Lamb growth survival and carcass caracteristics / D.R. Notten, R.F. Kelly // J. Anim. Sci. – 1991. – №69. – P. 22-23
- Zemp, М. Swiss Genetics / M. Zemp, A. Aebi. – Switzerland. Naturally: Worldwide successful, 2007. – 20р
