Титульный лист и исполнители
Реферат
Отчет 117 с., 18 табл., 33 рис., 326 источников, 1 приложение.
ЛЕЙКОЗ КРУПНОГО РОГАТОГО СКОТА, НАСЛЕДСТВЕННОСТЬ, СЕЛЬСКОХОЗЯЙСТВЕННЫЕ ЖИВОТНЫЕ, ИЗМЕНЧИВОСТЬ, ЛАБОРАТОРНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ ЛЕЙКОЗА, ТРАНСПЛАНТАЦИЯ ЭМБРИОНОВ, МЕРЫ БОРЬБЫ С ЛЕЙКОЗОМ, ПРОДУКТИВНОСТЬ
Настоящий проект, в рамках которого проводятся исследования, направлен на разработку биотехнологических методов ранней диагностики провируса лейкоза крупного рогатого скота с учетом географических и техногенных зон для геномного редактирования здорового поголовья крупного рогатого скота в России (для ликвидации лейкоза на животноводческих предприятиях Кемеровской области).
В процессе выполнения НИР были проведены следующие работы: проведен аналитический обзор современной научно-технической литературы, затрагивающей проблему; изучена наследственная детерминация устойчивости к вирусу лейкоза и генотипическое разнообразие в популяциях с учетом возраста и физиологического состояния КРС; определено и оценено влияние условий содержания на инфицированность и заболеваемость ВЛКРС; выявлена особенность полиморфизма гена ВЛКРС Кемеровской области, проведен анализ и оценка генетической структуры КРС по локусу гена вируса лейкоза; разработаны биотехнологические методы ранней диагностики провируса лейкоза КРС с учетом географических и техногенных зон для геномного редактирования здорового поголовья КРС; создана электронная база данных эпизоотической ситуации по лейкозу КРС в Кемеровской области.
На основе результатов исследования разработан регламент ранней диагностики провируса лейкоза крупного рогатого скота.
Термины и определения
Антигены – вещества, которые воспринимаются организмом как чужеродные и вызывают специфический иммунный ответ.
Антитела – специфические белки, иммуноглобулины, образующиеся в организме под воздействием антигена и обладающие свойством специфически с ним связываться и отличающиеся от обычных глобулинов наличием активного центра.
Бактериофаг – вирус бактерий, вызывающий лизис микробных клеток.
Биопроба (биологическая проба) – общее наименование методов исследования, основанных на заражении лабораторных животных или введении им биологических препаратов; применяется для диагностики инфекционных заболеваний, идентификации патогенных микроорганизмов и контроля исследуемого материала.
Вакцина – препарат из ослабленных живых или мертвых микроорганизмов, отдельных антигенных компонентов микробных клеток и продуктов жизнедеятельности этих организмов, применяемый для иммунизации человека и животных с профилактической или лечебной целями.
Вакцины живые – приготовленные из живых (ослабленных, аттенуированных) штаммов микроорганизмов.
Вирулентность – степень болезнетворности (патогенности) данного инфекционного агента (штамма микроба или вируса).
Вирус – неклеточная форма жизни, имеющая предельно упрощенную структуру — ДНК и/или РНК и оболочка — способная проникать в живую клетку и размножаться внутри нее.
Вирусемия – состояние, при котором вирусы находятся в крови.
Дифференциальная диагностика – способ диагностики, исключающий не подходящие по каким-либо фактам или симптомам заболевания, возможные у больного, что, в конечном счёте, должно свести диагноз к единственно вероятной болезни.
Иммуноглобулин – белок-глобулин, выполняющий функции антитела.
Колостральный иммунитет – иммунитет, передающийся с материнским молоком.
Ретровирусы – семейство РНК-содержащих вирусов.
Перечень сокращений и обозначений
ВЛКРС – вирус лейкоза крупного рогатого скота
ДНК – дезоксирибонуклеиновая кислота
ИФА – Иммуноферментный анализ
РИД – реакция иммунодиффузии в геле агара
РИП – реакция иммунного прилипания
ПЦР – полимеразная цепная реакция
РСК – сложная серологическая реакция
ФГБУ – федеральное государственное бюджетное учреждение
ООО – общество с ограниченной ответственностью
КРС – крупный рогатый скот
МЭБ – Международное эпизоотическое бюро (Всемирная организация по охране здоровья животных)
ФИТЦ – флуоресцеин изотиоцианат гидроксиксантеновый краситель, флуорохром
1 Аналитический обзор современной научно-технической, нормативной, методической литературы, затрагивающей научно-техническую проблему, исследуемую в рамках НИР
1.1 Причины возникновения лейкоза крупного рогатого скота, биологические свойства возбудителя.
Лейкоз крупного рогатого скота – хроническая злокачественная вирусная болезнь, которая характеризуется пролиферацией кроветворной и лимфоидной ткани (лимфоцитозом), формированием аномальных очагов кроветворения и нарушением формирования крови клеток крови (анаплазией), летальным исходом. При лейкозе КРС пролиферативные процессы преобладают над процессами нормальной дифференцировки клеток крови [71].
Этиологию лейкоза изучали ученые многих стран в течение многих десятилетий, и только лишь в 1969 г. J. Miller с группой ученых выявили вирус лейкоза крупного рогатого скота. Однако, следует заметить, что фундаментальное исследование лейкоза осуществили российские исследователи. В.П. Шишковым в 1988 г. была выдвинута вирусоиммуногеннная теория этиологии и патогенеза, которая до наших дней подтверждается многочисленными исследованиями отечественных и зарубежных ученых [8, 19, 44].
Некоторые исследователи [19] считают, что лейкоз КРС – неконтагиозная инфекция и, при абсолютном соблюдении ветеринарно-санитарных и зоогигиенических правил, возможно совместное содержание больных и здоровых животных.
Основной целью селекционеров всегда была высокая продуктивность коров, которая в результате увеличивалась в ущерб иммунитета животных. Увеличивая надои при скрещивании черно-пестрой, а также красной пород КРС, повысился и процент заболевания лейкозом. Чаще всего эти породы КРС заболевают лейкозом. У диких животных лейкоз поражает не более 5 процентов особей. В Россию лейкоз КРС мог попасть вместе завозом высокопродуктивного скота. Считается что в нашей стране возникновение лейкоза связано с завозом из Германии племенного скота на территории Западной Сибири, Калининградской, Московской, Ленинградской областей в 1940, 1945-1947 гг. [50]. В дальнейшем лейкоз в наших хозяйствах распространился повсеместно. Подтвердить научно эту гипотезу в 40-ые годы было невозможно, так как сам вирус был описан только в 1969 г. Официально лейкоз в СССР получил признание с 1965 г. Именно тогда появилась и официальная первая инструкция по борьбе с ним [150].
Лейкоз динамично захватывает первенство среди заразных заболеваний КРС – приблизительно 65,8 процентов (2016 г.) [24].
1.2 Биологические свойства возбудителя
Возбудителеь лейкоза крупного рогатого скота – РНК- содержащий вирус, семейства Retroviridae рода Deltaretrovirus, специфической особенностью ретровирусов является то, что в чаще всего они не порождают гибели зараженной клетки, а постоянно стимулируют её, побуждая к делению и активизации.
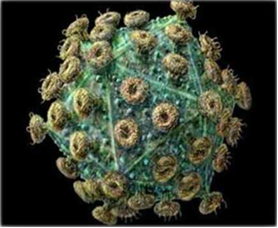
Рисунок 1 – Внешний вид вируса лейкоза КРС [50]
Основная мишень (рисунок 2 [50] ВЛКРС – В-лимфоцит. В-лимфоцит –предшественник плазматической клетки, которая формирует иммуноглобулины, защищающие организм от всевозможных антигенов, в т.ч. инфекционного характера.
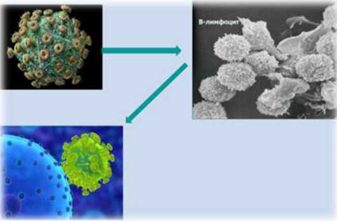
Рисунок 2 – Вирус лейкоза крупного рогатого скота
Все ретровирусы, в т.ч. и ВЛКРС, имеют следующие характерные признаки и свойства (рисунок 3 [50]). Вирион – частица округлой формы; состоит из сердцевины (белок р24), внутренней белковой мембраны и наружной гликолипидной оболочки, на поверхности которой наблюдаются выступы (белок gp51 и gp30); в сердцевине сконцентрирован геном вируса в виде нити РНК, которая формирует комплекс, заключающийся из 2-х одинаковых субъединиц; в сердцевине сконцентрировано более десятка ферментов, в том числе обратная транскриптаза, которая осуществляет воспроизведение (репликация) вирусной РНК.
Присутствие двух биологических форм – вирусной (геном представлен РНК) и провирусной (геном представлен ДНК); подвержены нередким генетическим модификациям за счет рекомбинаций.
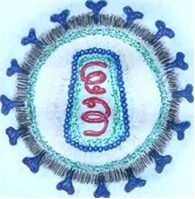
Рисунок 3 – Пример ретровируса
Стадии Репликация вируса (рисунок 4 [50]):
1) 1-я стадия — адсорбция через характерные рецепторы, процесс захвата внешнего материала клеткой, осуществляемый путём образования мембранных везикул (эндоцитоз) и сборка ДНК-провируса (2 нити) с применением обратной транскриптазы и РНК вируса;
2) 2-я стадия – перенос в ядро клетки-хозяина и объединение ДНК-провируса с клеточной ДНК;
3) 3-я стадия – синтез РНК вируса с применением клеточной РНК- полимеразы и ДНК-провируса в качестве матрицы (транскрипция).
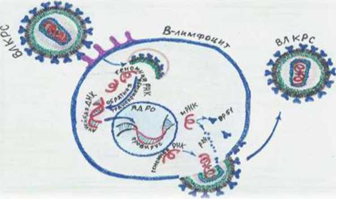
Рисунок 4 – Репликация вируса
Ученые предполагали, что вирус лейкоза влияет только на В-лимфоциты, тем не менее было обнаружено, что при прямом контакте с зараженным крупным рогатым скотом или при заражении в эксперименте, вирус лейкоза КРС может заражать овец, коз, буйволов, кроликов, свиней, обезьян и человека.
Установлено что:
• у 74 процентов людей, работающих на фермах, неблагополучных по лейкозу обнаружены антитела к ВЛКРС;
• человек, имеющий контакт с инфицированным ВЛКРС мясом очень часто заболевает миелоидной лейкемией;
• между степенью заболеваемости крупного рогатого скота лейкозом и степенью заболеваемости человека острой лимфоидной лейкемией имеется прямая коррелятивная связь [стратегический продукт 2016].
По современной классификации этот возбудитель относится к подсемейству Gammaherpesvirinae семейству Retroviridae. Вирусы обладают тропизмом к В- или Т-лимфоцитам.
Обнаружена корреляция между обусловленными аллелями генов ГКГ и устойчивостью или восприимчивостью к болезням, в том числе и к лейкозу КРС [21]. Метод ДНК-типирования животных может быть применен для генотипирования быков – производителей по аллелям BoLA-DRB3 для того, чтобы уменьшить в популяциях КРС распространение аллелей, определяющих чувствительность к лейкозу [57]. Генетически предрасположен ВЛКРС скот черно-пестрой и красной степной пород, а устойчивыми к заболеванию являются животные симментальской, швицкой, красной горбатовской, ярославской и костромской пород [8, 42, 44, 51].
Изучению полиморфизма ВЛКРС в различных регионах России и за рубежом посвящено значительное количество публикаций [57, 10, 11, 21, 41, 140]. Сотрудниками Всероссийского научно-исследовательского института экспериментальной ветеринарии проведен анализ крови 169 серопозитивных нетелей, коров и телочек с разной степенью зараженности из в хозяйствах Камчатского края, Смоленской, Ростовской, Рязанской, Пензенской и Ярославской областей [10]. В результате анализа генетического разнообразия ВЛКРС обнаружены 4 генотипа возбудителя (1, 2, 4 и 7 генотипов). Возбудитель 1 генотипа был обнаружен в семи; 2 генотипа — в десяти; 4 генотипа – семидесяти девяти и 7 генотипа – пяти процентах проб. Причем выявлено, что генетический полиморфизм может сказываться на показателях исследований. В последнее время появились сообщения, в частности М.И. Гулюкина, Н.Г. Козыревой, Л.А. Ивановой и др. (2016), что имеющаяся филогенетическая классификация ВЛКРС увеличилась уже до 9 генотипов [10, 140]. Это определяет необходимость проработки имеющихся и разработки новых средств и методов диагностики лейкоза КРС с учетом новых данных о возбудителе инфекции.
Обобщенные сотрудниками ФГБУ «ВНИИЗЖ» данные о генетическом полиморфизме вируса лейкоза КРС, выделенного в разных регионах России на 01.07.2017, приведены в таблице 1.
Таблица 1 – Данные о генетическом полиморфизме вируса лейкоза КРС на территории Российской Федерации [48]
| № | Субъекты РФ | Генотипы вируса лейкоза | ||||||
| 1 | 2 | 4 | 6 | 7 | 8 | |||
| 1 | Ставрополье | 2 | « | « | + | + | « | « |
| 2 | Камчатка | 1 | — | — | — | — | + | — |
| 3 | Татарстан | 3 | — | — | + | — | + | + |
| 4 | Ярославская область | 1 | + | — | — | — | — | — |
| 5 | Смоленская область | 1 | — | — | + | — | — | — |
| 6 | Ростовская | 3 | + | + | + | — | — | — |
| 7 | Рязанская | 2 | — | + | + | — | — | — |
| 8 | Пензенская
области |
2 | — | — | + | — | + | — |
| Итого | 15 | 2
(13,3%) |
2
(13,3%) |
6
(40%) |
1
(6,7%) |
3
(20%) |
1
(6,7%) |
|
Анализируя данные в таблицы 1 можно сделать вывод, что основная часть изолятов возбудителя лейкоза КРС относится к бельгийско-французской подгруппе, что соответствует 4 генотипу вируса. Характеристика генотипического разнообразия и молекулярно-генетической структуры ВЛКРС могут быть использованы при изучении эпизоотических особенностей (источника инфекции, механизмов и путей распространения возбудителя [30, 66].
1.3 Патогенез
Патогенез при лейкозе КРС обусловлен монотропизмом возбудителя к тканям органов кроветворения и состоянием иммунитета животного. Взаимодействие микро- и микроорганизма при лейкозах – это сложный процесс, который зависит от вирусных и клеточных генов, а также от состояния ферментной системы. Вирус лейкоза, находящийся в клетке, не порождает ее гибели (остается латентным), а приводит к срыву процесса созревания и дифференциации клеток кроветворных органов, что определяет диффузную инфильтрацию органов данными клетками или их злокачественное перерождение [8, 44].
Факторы, которые влияют на соотношение титра специфических антител и количества провируса в крови, пока неизвестны [21]. Огромную роль играет гликозилированный белок gp51, который кодируется геном env, содержащий конформационные и линейные эпитопы, на развитие иммунного ответа при лейкозе КРС. Их структура различается у вирусов, выделенных на различных территориях [68]. Ген env, поверхностный белок gp51, трансмембранный белок gp30 и гликопротеиды играют основную роль в морфогенезе вирионов.
Ретровирусы вызывают лейкемию в тех случаях, когда провирус подсоединяется к хромосомной ДНК поблизости значимых для клетки регуляторных генов (онкогенов). Объединение провирусной ДНК активизирует клеточные онкогены, повергая их к неуправляемому росту и размножению зараженных клеток костного мозга. Однако не всякая интеграция провируса завершаеется формированием клинически выраженной болезни. Однако любая интеграция в геном – это бессрочное инфицирование. Возможна передача провирусной формы по наследству. При исследованиях лейкоза человека, установлено, что при заболевании по меньшей мере одного из членов семьи, заболевание непременно проявится у детей, внуков или правнуков [50].
Имеются сообщения Н.З. Хазипова, Р.Р.Вафина, А.Ю. Шаевой (2013), G.C. Buehring, H.M. Shen, H.M. Jensen et al. (2014) о том, что изменение клеток при воздействии вируса лейкоза выражает действительный риск развития онкологических заболеваний людей [65, 78].
Итак, в чувствительный организм вирус лейкоза попадает в 2-х конфигурациях: инфекционной и провирусной (в виде ДНК инфицированного лимфоцита). При инфекционной – так как возбудитель обладает лимфотропностью, он за счет гликопротеида gp51 заражает В-лимфоцит нового обладателя, где сначала накапливается в цитоплазматических вакуолях, размножается путем почкования от цитоплазматических мембран, а затем встраивается в клеточную ДНК. При провирусной форме – сразу интегрирется в генетический аппарат клетки-хозяина [50].
Инфицированные лимфоциты могут передавать вирусный геном потомству во время размножения [50].
Пока вирус находится за пределами хромосомного аппарата клетки, заражение является скрытым (латентным), обнаруживается лишь только серологическими или вирусологическими исследованиями. При изменении генетической структуры латентная стадия переходит в гематологическую, а далее в клиническую, опухолевую форму болезни[50].
При лейкозе происходит нарушение нормального процесса роста клеток (пролиферация) и дифференциации лимфоидных клеток и их активности. При развитии патологического процесса наблюдают нарушения и стороны В-лимфоцитов, и стороны нейтрофилов, в которых начинают превалировать клетки со сниженной функциональной активностью [50].
У зараженных животных срывается гормональный статус, который играет существенную роль в адаптационно-компенсаторных механизмах. Таким образом, в патогенезе лейкоза доказано решающее этиологическое значение вируса лейкоза КРС при возникновении гемобластозов.
Установлена более сформулированная генетическая стабильность некоторых пород и линий животных к вирусу лейкоза КРС [44,57].
1.4 Эпизоотологические особенности лейкоза крупного рогатого скота
В представленном ниже материале из аналитического обзора ученых ВНИИЗЖ В.А. Мищенко, О.Н. Петровой, А.К. Караулова, А.В. Мищенко за 2018 г. [48] предложена оценка литературных данных по проблеме лейкоза крупного рогатого скота специалистов по трансграничным вирусным инфекциям и проведен анализ эпизоотической ситуации.
Инфекционный процесс при лейкозе крупного рогатого скота характеризуется стадийностью. В патогенезе лейкоза различают следующие стадии развития лейкоза:
*инкубационная – с момента заражения вирусом до появления антител к возбудителю);
*бессимптомная инфекция – от момента появления антител до обнаружения гематологических изменений;
*гематологическая –показателем которой является персистентный лимфоцитоз;
*стадия опухолевого проявления [3,53].
Крупный рогатый скот, зараженный вирусом лейкемии в течение длительного времени, иногда в течение всего периода использования, может быть бессимптомным носителем вируса, и только в 5-10 % случаев лейкемия возникает [10, 57]. Эти данные подтверждают ветеринары, которые отмечают наличие антител к вирусу лейкоза до окончания жизни коров, то есть в течение 3-7 лет лактации. Объяснение этих фактов было предоставлено некоторыми исследователями, которые сообщили, что бывший вирус, внедренный в геном клетки-хозяина, по-прежнему не может получить эффект специфических противовирусных антител и что он может действовать на протяжении всей жизни животного[8].
Источником инфекции являются больные животные на всех стадиях инфекционного процесса. Вирусы проникают в организм через кишечник или пенетрацию лимфоцитов в кишечнике, заражая лимфоциты, содержащие вирус лейкоза. Экспериментально установлено, что для заражения молочных коров вирусом лейкемии достаточно ввести в организм 2 500 инфицированных лейкоцитов. Для заражения животных достаточно 0,5 микро-крови (0,0005 мл), зараженной вирусом лейкемии [26]. Факторами передачи вируса являются: кровь, молоко и другие материалы, содержащие лимфоидные клетки животных, инфицированные вирусом лейкоза крупного рогатого скота.
Пути распространения и механизм передачи возбудителя лейкоза – в стадии эмбрионального развития (пренатальный период) и период после рождения (постнатальный период). Вирус лейкоза может передаться от матери плоду через плаценту (трансплацентарно) во второй половине стельности. Большинство исследователей считают, что внутриутробная передача вируса лейкоза не превышает 2-10 процентов. Некоторые ученые полагают, что лейкоз в чаще всего имеет вертикальный путь передачи [14, 19].
Другая часть исследователей утверждает, что вертикальный путь передачи вируса не оказывает значительного воздействия на эпизоотический процесс. А основным в эпизоотическом процессе при лейкозе является горизонтальный путь передачи возбудителя [8, 71, 28].
В то время как, в молоке и молозиве больных коров содержится вирус, инфекционное заболевание новорожденных телят в природных условиях передается не часто, по сравнению заражением при контакте. В зависимости от наличия антител в молозиве, колостральный иммунитет исчезает в течение 2-4 месяцев [39, 16]. При нарушении ветеринарно-санитарных норм лейкоз может распространяться ятрогенным путем [26]. Как один из факторов, распространения вируса лейкоза КРС, рассматривают повышенная чувствительность животных к инфекционным болезням, в частности к лейкозу, с повышением величины молочной продуктивности [19, 18]. Здоровые животные заражаются от инфицированных вирусом лейкоза коров (быков) при контакте в скотных дворах, выгульных площадках, на пастбищах, а также при несоблюдении правил асептики при зооветеринарных операциях (взятие крови, инокуляция лекарственных веществ, вакцин и сывороток, удаление рогов, мечение, искусственное осеменение, родовспоможение, ректальное исследование), скармливание необеззараженного сборного молока и т.д.) [26, 18].
Распространение и ущерб: лейкоз крупного рогатого скота распространен во многих станах мира, в том числе: в Российской Федерации, Австралии, Канаде, США, Болгарии, Хорватии, Эстонии, Латвии, Польше, Дании, Румынии, Украине, Казахстане и ряде других стран [4, 7, 20,17, 19, 24, 31, 42, 40, 58, 43, 123, 124, 70, 72, 86]. В США лейкоз не считается серьезным заболеванием. По официальным данным, 80 процентов всего поголовья крупного рогатого скота США заражено вирусом лейкоза, около 38 процентов хозяйств мясного и 84 процента хозяйств молочного скотоводства США неблагополучны по лейкозу [61].
Распространенность вируса лейкоза на территории отдельных субъектов (регионов) и напряженность эпизоотической ситуации может оцениваться по степени инфицирования животных [3]. В таблице 2 приведены данные на 01.01.2014 г. об инфицированности вирусом лейкозом КРС в субъектах Российской Федерации.
Таблица 2 – Инфицированность стад вирусом лейкоза КРС в субъектах Российской Федерации [48]
| № | Инфецированность, % | Кол-во субъектов |
| 1 | До 10 | 53 |
| 2 | До 30 | 15 |
| 3 | Больше 30 | 1 (Нижегородская область) |
В результаты эпизоотологического мониторинга неблагополучных по ВЛКРС хозяйств были сделаны выводы, что существенными причинами возникновения и распространения лейкоза в Ставропольском крае являются:
*отсутствие во многих хозяйствах производственной ветеринарной службы;
* передержка больного скота без должной изоляции;
*слабое финансовое положение многих хозяйств;
*отсутствие региональной программы борьбы с лейкозом КРС [1]. Ниже приведены сроки эксплуатации (лактации) здоровых коров и инфицированных вирусом лейкоза животных (таблица 3).
Таблица 3 – Характеристика сроков хозяйственного использования коров [48]
| Порода | Срок эксплуатации, год | Разница,
год |
|
| Интактные коровы | Инфицированные коровы | ||
| Черно-пестр. | 5,30 | 3,51 | 1,79 |
| Черно-пестр. | 2,74 | 1,95 | 0,79 |
| Ярославск. | 8,0 | 5,66 | 2,34 |
| Черно-пестр. х ярослав. | 8,0 | 5,66 | 2,34 |
Характеристика воспроизводства инфицированных вирусом лейкоза коров представлена в таблице 4.
Таблица 4 – Характеристика воспроизводства инфицированных вирусом лейкоза коров (дней) [48]
| Порода | Сервис — период | Сервис- период | Разница |
| Интактные коровы | Инфицированные коровы | ||
| Черно-пестр. | 155,6 | 172,1 | 16,5 |
| Черно-пестр. | 96,3 | 121,5 | 25,2 |
| Ярославск. | 146,1 | 155,1 | 9,0 |
| Черно-пестр. х ярославск. | 189,0 | 206,0 | 17,0 |
В Российской Федерации треть поголовья крупного рогатого скота заражена лейкозом. В 2016 году лейкоз диагностировался в 68 субъектах Российской Федерации [15, 24]. Наибольший ущерб лейкоз наносит племенным хозяйствам, так как при проведении противоэпизоотических мероприятий происходит уничтожение генофонда пород [15, 42, 55].
Инфицированные вирусом лейкоза животные, по сравнению с интактными животными, имеют более короткий срок хозяйственного использования и меньшую (на 10-12,7 %) продуктивность, а также они более восприимчивы к инфекционным болезням и имеют нарушения воспроизводительной функции [1].
Профилактические вакцинации и паразитарные болезни существенно влияют на развитие инфекционного процесса при лейкозе. Нематодозы, цестодозы и пироплазмидозы, а также чрезмерная иммунизация скота против аденовироза, парагриппа-3, рота-, коронавирусной инфекции, вирусной диареи, колибактериоза и клебсиеллёза форсируют течение инфекционного процесса, а, следовательно, переход болезни из латентной (бессимптомной) стадии в гематологическую или даже клиническую стадию [50].
1.5 Биологическая безопасность молока и мяса
Ущерб, причиненный лейкозом крупного рогатого скота, — это не получение качественных молочных и мясных продуктов, преждевременный отбраковка и убой коров с лейкозом; убой быков-производителей, стоимость обеззараживания (пастеризации) молока, поскольку сырое молоко запрещено продавать, утилизация трупов больных животных, не поступление молодняка, утрата его воспроизводственной ценности и ограничение сбыта, перевод племенных животных в товарную категорию, стоимость проведения ветеринарных и ветеринарно-технических мероприятий и санитарно-гигиенических мероприятий, стоимость мер по борьбе с лейкозом.
У животных с лейкозом, с более короткий срок хозяйственного использования и минимальной (10-12,7 %) продуктивностью по сравнению с интактными, они более чувствительны к инфекционным заболеваниям и имеют репродуктивные нарушения [1].
Установлено, что молоко и мясо от больных лейкозом животных содержат метаболиты триптофана, лизина и других циклических аминокислот, имеющих выраженные канцерогенные свойства, и, следовательно, могут быть опасны для человека [32, 68, 26, 16]. М.И. Гулюкиным, Н.Г. Козыревой, Л.А. Ивановой и др. (2015) в эксперименте выявлена межвидовая передача ВЛКРС [35].
Имеющимися «Правилами профилактики и борьбы с лейкозом КРС» (1999) [47] предложено непременно выбраковывать и сдавать на убой больных лейкозом коров, из-за чего хозяйства несут значительные экономические потери. Сюда относятся: неполное использование продуктивных (молоко) и репродуктивных функции (приплод) из-за ранней выбраковки животных. При убое больных животных туши с пораженными органами утилизируют, что причиняет огромный ущерб производителям. Употребление мяса от больных лейкозом животных запрещено. При приемке на мясокомбинате животные, выбракованные из-за лейкоза КРС, оформляют как вынужденный убой. При ветеринарно-санитарной экспертизе туш все пораженные лимфатические узлы и внутренние органы утилизируют, а органы без поражений употребляют в зависимости от результатов бактериологического исследования. По результатам статистического учета мясоперерабатывающих предприятий стоимость продукции, полученной от больного лейкозом КРС и подвергнутой санитарной переработке, ниже в среднем на 25 % от стоимости продукции здоровых животных [60].
До настоящего времени социальная значимость вируса лейкоза крупного рогатого скота не доказана, но известно, что этот возбудитель и вирус Т-клеточного лейкоза человека входят в один и тот же род по существующей классификации вирусов. Эпизодов заражения человека вирусом лейкоза КРС не зафиксировано, тем не менее, возможность рекомбинации между вирусом лейкоза КРС и вирусом Т-клеточного лейкоза человека не исключена [11].
Особую актуальность в современных экологических условиях приобретают вопросы биологической безопасности и питательной ценности продуктов, в том числе и животного происхождения [26].
Обнаружено, что факторами передачи служат молоко и мясо инфицированных вирусом лейкоза животных содержащих вирус. Туши и молоко больных и инфицированных вирусом лейкоза животных имеют высокую степень обсеменённости микробами, а биохимические и органолептические показатели их имеют значительные отклонения от нормы, в том числе являются токсичными для человека.
Согласно «Правилам профилактики и борьбы с лейкозом КРС» (1999) [47] молоко от больных лейкозом животных запрещено для питания, молоко от коров-вирусоносителей разрешено к переработке после пастеризации, а туши инфицированных животных, при отсутствии видимых изменений, направляются на реализацию без ограничений.
Продукты больных лейкозом животных – молоко и мясо – содержат вредные метаболиты триптофана, лизина и других циклических аминокислот, обладающих выраженными канцерогенными свойствами, и, следовательно, являются экологически опасными для человека [68]. Однако в некоторых странах (США) среди скота мясных пород проблема ликвидации лейкоза не стоит так остро из-за коротких сроков откорма и последующего убоя животных [58]. До настоящего времени нет доказательств, что вирус лейкоза крупного рогатого скота причиняет вред здоровью человека [12], но… «…считается, что вирус лейкоза коров не вызывает лейкоза у человека, то есть обладает видовой специфичностью», – полагает доктор ветеринарных наук, ректор Казанской ГАВМ Р.Х. Равилов. – Хотя есть научные работы, говорящие об обратном. У больных лейкозом людей был найден провирус (остатки) лейкоза КРС. Однако большинство специалистов сейчас считают, что пить такое молоко после пастеризации можно. «У меня как потребителя страха нет. Но детям давать его все-таки не рекомендуется. Дам ли я такое молоко своему ребенку? Если у меня будет выбор, конечно, нет» [152].
У инфицированного и больного лейкозом крупного рогатого скота иммунный ответ на инактивированные противовирусные вакцины ниже, чем у здоровых коров. Это подтверждается и результатами эпизоотологических исследований, проведенных в 2010-2013 гг., заболевания ящуром многократно вакцинированных коров. Сотрудниками ФГБУ «ВНИИЗЖ» установлено, что в большинстве случаев эти животные были инфицированы вирусом лейкоза [48].
1.6 Течение, клинические признаки
Лейкоз характеризуется длительным латентным периодом (инкубационный период), в течение которого в крови обнаруживаются ВЛКРС и антитела. В случае самопроизвольной инфекции этот период длится от 2 до 6 лет. Инкубационный период (до изменения периферической крови) при экспериментальной инфекции у КРС составил 60-75 дней. Клинические проявления зависят от участия в патологическом процессе органов–лимфатических узлов, селезенки, сычужных ферментов, сердца, почек, половых органов и др. Инфекционный процесс лейкоза развивается медленно и незаметно. В развитии лейкозного процесса у крупного рогатого скота выделяют четыре стадии: доклиническую, начальную (доклиническую), расширенную (клиническую и гематологическую) и конечную или терминальную (онкологическую) стадии, которые сопровождают друг друга [44].
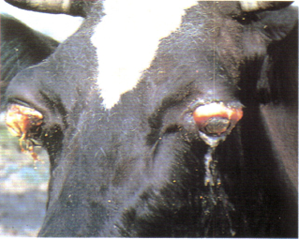
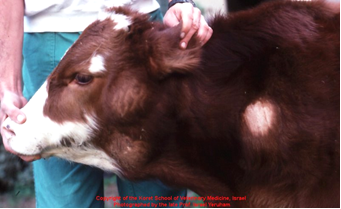
Предлейкозную стадию выявляют серологическими и вирусологическими исследованиями, при этом никаких гематологических изменений нет [46, 54]. При начальной стадии лейкоза отмечают количественные и качественные сдвиги в составе клеток крови: увеличивается число лейкоцитов, повышается процент лимфоцитов, появляются малодифференцированные, незрелые, разной величины, патологические формы клеток. Развернутая стадия характеризуется кроме гематологических сдвигов клиническими признаками: ухудшается общее состояние, снижаются удои, наблюдается истощение [60], ослабление работы сердца, часто обнаруживают увеличение лимфатических узлов (они безболезненны, подвижны, эластичны). Внутренние лимфатические узлы поражаются чаще поверхностных. При терминальной стадии инфекции болезнь развивается быстро, отмечается истощение кроветворных органов, сопровождающееся блокадой иммунной системы и гибелью животного. У молодняка (4-12 месяцев) ЭЛКРС встречается в 3 формах: мультицентрической (лимфосаркома), тимусной (опухолевидное разрастание в нижней части шеи) и кожной (кожный лейкоз), протекающей с развитием инфильтративных разрастаний в коже [151] (рисунок 5-9).
Конечная стадия – самая заметная. Именно на ней начинается снижение продуктивности и воспроизводительной функции [60], а в кроветворных органах и во внутренних органах (лимфатические узлы, селезенка, сычуг, сердце, почки и другие органы) заметны нарушения функционального состояния и появление злокачественных образований [150].
 |
 |
| Рисунок 5 – Измененный лимфатический узел молочной | Рисунок 6 – Увеличение предлопаточного лимфатического узла у коровы |
 |
 |
| Рисунок 7 – Увеличение лимфатических узлов, отек в области подгрудка | Рисунок 8 – Лимфосаркома, экзофтальм |
 |
|
| Рисунок 9 – Увеличение лимфатических узлов, отек в области межчелюстного пространства | |
1.7 Патологоанатомические изменения
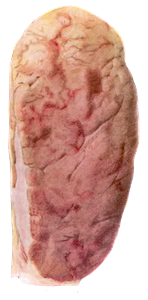
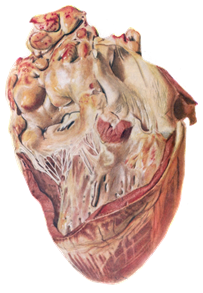
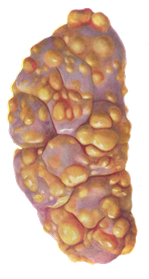
При патологоанатомическом проведении исследования трупов животных, павших от лейкоза, обнаруживают увеличенные лимфатические узлы, особенно средостенные и брыжеечные, которые не спаяны между собой. Поверхность разреза их саловидная, рисунок строения немного или вообще отсутствует. Селезенка увеличена в размерах (от 48 до 100 см). На разрезе красного цвета, сочная, зернистая. Увеличенные фолликулы возвышаются над поверхностью разреза. Изменений в почках нет. Однако иногда выражена сероватая бугристость от 1 до 5 мм и более (рисунок 10).
Гистологическое исследование выявляет генерализованный диффузный лейкоз инфильтрат во всех органах кроветворения: костном мозге, селезенке, лимфатических узлах, а также в бляшках Пейера и изолированных фолликулах кишечника, печени, почек, сердца, легких [22].
В Российской Федерации система по диагностике, мерам борьбы и профилактики регламентирована «Правилами по профилактике и борьбе с лейкозом крупного рогатого скота» (1999) [47]. Диагностические исследования на лейкоз проводят серологическими, гематологическим, молекулярно-биологическим, клиническим, патоморфологическим методами и методом биопробы. Клинические признаки проявляются, как правило, к концу болезни, поэтому в диагностике заболевания они имеют лишь вспомогательное значение.
 |
 |
 |
| а | б | в |
а – измененный лимфатический узел КРС, б – опухолевидные лейкозные разращения в сердце КРС, в – опухолевидные лейкозные разращения в почке КРС
Рисунок 10 – Патологоанатомическое исследование трупов животных
Животное считают больным лейкозом при наличии одного из следующих показателей:
*клинических признаков болезни,
*положительных результатов гематологических исследований,
*выявление у павшего (убитого) животного типичных патологоанатомических изменений,
*при положительном результате гистологического исследования патологического материала.
1.8 Серологический метод исследования
Основу прижизненной диагностики лейкоза крупного рогатого скота составляет серологический метод исследования – реакция диффузной преципитации (РДП), иначе называемая реакцией иммунодиффузии в геле агара (РИД), а также иммуноферментный анализ (ИФА). Из числа положительно реагирующих в РИД и ИФА животных (инфицированных ВЛКРС) с помощью гематологического метода выявляют больных (гематологически больных) лейкозом [50, 43].
Реакция иммунодиффузии (РИД). Сущность метода состоит в том, что в сыворотке крови животных обнаруживаются специфические преципитирующие антитела к антигенам ВЛКРС. Специфические антитела появляются в крови через 2-8 недель после заражения животного ВЛКРС и сохраняются в организме пожизненно, т. к. однажды проникнув в организм, вирус лейкоза его не покидает. Первое серологическое исследование крупного рогатого скота на лейкоз проводят в 6-месячном возрасте, а последующие через каждые 6 месяцев. В оздоравливаемых хозяйствах с уровнем инфицированности до 30%, молодняк и взрослый скот исследуют через каждые 3 месяца. При этом пробы крови для исследований берут не ранее чем через 30-45 суток после введения животным вакцин, аллергенов и противопаразитарных препаратов, а у стельных животных — за 30 суток до отела или через 30 суток после него. РИД является высокоспецифичным методом, но имеет один недостаток-низкий предел чувствительности, поэтому в РИД могут не обнаруживаться животные с низким титром противовирусных антител. Это состояние может быть на ранних стадиях инфекционного процесса или при иммунодефицитах (краткосрочных или длительных), вызванных применением вакцин, аллергенов,паразитарных инфекций, введением противопаразитарных препаратов или препаратов с иммуносупрессивным действием.) [50].
Иммуноферментный метод (ИФА). Суть метода заключается в том, что при использовании ферментативно-маркированных антител или антигенов в качестве индикатора такой реакции визуализируются антиген-антитело-иммунные комплексы. ИФА позволяет обнаружить антитела в количестве 10… В 100 раз меньше, чем может быть обнаружен Рид, т. е. чувствительность этого метода значительно превосходит метод иммунофузии. Исследование имеет два варианта-скрининг-тест и подтверждающий тест (VeriTest). Скрининговые тесты используются для крупномасштабных (скрининговых) исследований, а подтверждающие тесты используются для подтверждения положительных результатов, поскольку скрининговые тесты могут обнаруживать ложноположительных животных, у которых вырабатываются перекрестные реактивные антитела, связанные с другой (не лейкозной) патологией [150, 221].
Исходя из вышеизложенного, рекомендуется проводить серологические исследования в оздоровительных хозяйствах по следующему алгоритму.
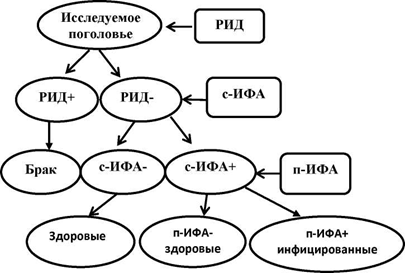
Рисунок 11 – Алгоритм исследований на лейкоз с использованием ИФА [50]
Отрицательные результаты в РИД, должны быть перепроверены в скрининговом ИФА (с-ИФА), а отрицательные реакции крупного рогатого скота считаются свободными от VL (здоровыми). Животные с положительными реакциями в ИФА перепроверяются при подтверждении ИФА (п-ИФА), животные с отрицательными реакциями считаются коровами без ВЛ, а животные с положительными реакциями заражаются. ИФА может стать основным методом борьбы с эпидемической ситуацией в фермерских хозяйствах. Следует отметить, что при финансовой возможности вместо скрининга ИФА можно сразу использовать подтверждение ИФА (VeriTest), что сокращает количество необходимых анализов и упрощает алгоритм исследования [120, 225].
1.9 Гематологический метод исследования
Метод заключается в подсчете абсолютного количества лейкоцитов в единице объема крови (1 мкл) и относительного количества лимфоцитов в лейкоформуле. Результаты гематологических исследований оценивают по так называемому «лейкозному ключу» и морфологическому характеру клеток крови согласно «Методических указаний по диагностике лейкоза крупного рогатого скота» (2000) (таблица 5).
Таблица 5 – Количество лейкоцитов и лимфоцитов в 1 мкл крови крупного рогатого скота («лейкозный ключ»)
| Возраст животного | Здоровые | Подозрительные по заболеванию | Больные лейкозом | |
| количество лейкоцитов в 1 мкл | процент лимфоцитов | (абсолют. количество лимфоцитов в 1 мкл) | (абсолютное количество лимфоцитов в 1 мкл) | |
| 1 — 2 г | до 12000 | до 75 | 9000 — 11000 | <11000 |
| 2 — 4 г | до 11000 | до 70 | 8000 — 10000 | <10000 |
| 4 — 6 л | до 10000 | до 65 | 6500 — 9000 | < 9000 |
| старше 6 лет | до 9000 | до 60 | 5500 — 8000 | < 8000 |
Согласно «Методических указаний по диагностике лейкоза крупного рогатого скота» (2000), если количество лейкоцитов в образце крови животного будет больше числа, указанного в графе 2 таблицы, а индекс абсолютного числа лимфоцитов будет находиться в пределах числа, указанного в графе 3 таблицы, то животное оценивается как подозрительное на лейкоз (±) и через 1-2 месяца проводится дальнейшее гематологическое исследование (определение лейкоцитарной формулы). Если диагноз подтвердится снова, они считаются больными. Если количество лейкоцитов и лимфоцитов в образце крови животного выше, чем указано в графах 2, 3 и 4, то животное оценивается как больное лейкозом (+).
Гематологическому исследованию подвергают животных, в сыворотке крови, которых серологическим методом (РИД, ИФА) обнаружены специфические антитела к ВЛКРС. Гематологические исследования позволяют выявлять больных животных, а также проводить дифференциальную диагностику форм и стадий болезни [50].
1.10 Полимеразная цепная реакция
Выявление вируса лейкоза крупного рогатого скота с помощью полимеразной цепной реакции (ПЦР). ВЛ крупного рогатого скота чаще всего встречается в копиях ДНК организма хозяина (экс-вирус), встроенных в геном клетки-хозяина. При небольшом количестве инфицированных клеток также редко образуются специфические антитела, что делает невозможным выявление инфицированных животных серологическими методами. Однако это делается молекулярно-биологическими методами, в частности методом полимеразной цепной реакции (ПЦР). Геномная ДНК, извлеченная из крови животных, использовалась для обнаружения протовируса с помощью ПЦР. В результате ПЦР определенные вирусоспецифические фрагменты выделенной ДНК амплифицируются (размножаются) в количестве, достаточном для ее визуального определения. Данный метод позволяет обнаружить вирусные фрагменты ДНК, извлеченные из 10 лимфоцитов инфицированных животных, а также фон балластной ДНК из 40 тысяч клеток. ПЦР может даже обнаружить деградированные нуклеиновые кислоты в следовых количествах. Таким образом, в отличие от серологических методов, позволяющих определить наличие возбудителя в организме по специфическим антителам, метод ПЦР непосредственно выявляет возбудителя. Метод ПЦР может быть использован как для диагностики лейкоза крупного рогатого скота, так и для серологических методов, а также для подтверждающих тестов [50]. Полимеразная цепная реакция ограничена высокими затратами на исследования [165].
Подводя итоги возможности конкретного метода лабораторной диагностики лейкоза, следует отметить, что гематологические методы (подсчет лимфоцитов) можно применять только через 1,5-2 дня после заражения; Рид (иммунофузионная реакция в геле) — через 4-8 недель после заражения; ИФА (иммуноанализ-ИФА-тест) — через 2-4 недели после заражения; ПЦР (молекулярно-биологический метод) — с первых дней после заражения [51,256, 291].
1.11 Биологическая проба
Обнаружение инфицированных животных методом биологической пробы. Метод основан на восприимчивости животных к гетерогенам типа BLV. Когда овцам или кроликам вводят лейкоциты крупного рогатого скота, инфицированные лейкозом, они развивают инфекцию, которая сопровождается специфическими осажденными антителами в крови, которые обнаруживаются через 14-30 дней после заражения иммунодиффузионной реакцией [50].
Серопозитивное животное считают больным лейкозом при обнаружении у него одного из следующих показателей:
— положительных результатов гематологических исследований на лейкоз;
— клинических признаков болезни;
— патологоанатомических изменений, характерных для лейкоза;
— положительного результата гистологического исследования патологического материала на лейкоз у павшего или убитого животного.
Если эти исследования проводятся до или после 30 дней, результаты гематологических исследований следует считать достоверными:
— отел;
— введение аллергенов (вакцины, сыворотки, антигельминтики и др.);
— проведение кровавых хирургических операций[141,188].
У животных в возрасте 6 месяцев, сыворотка которых дала положительную реакцию на избавление от лейкоза или ИФА, но не имела клинических и гематологических изменений, характерных для лейкоза, была оценена как бессимптомная инфекция ВЛКРС у животных. Это животное считается источником вируса лейкоза крупного рогатого скота и учитывается при организации противоолейкозных мероприятий.
Животные с гематологическими изменениями или клиническими признаками считаются больными животными [191].
Дифференциальная диагностика при лейкозе крупного рогатого скота должна учитывать ряд хронических инфекционных заболеваний крупного рогатого скота (актиномикоз, туберкулез, парасимпатия, бруцеллез), а также ряд неинфекционных заболеваний (гепатит, цирроз, амилоидодистрофия и другие заболевания печени) [62, 224].
1.12 Профилактика лейкоза
Согласно «Правил по профилактике и борьбе с лейкозом крупного рогатого скота» (1999) [47] общие мероприятия по профилактике лейкоза крупного рогатого скота включают в себя соблюдение ветеринарно-санитарных требований при содержании, кормлении и ветеринарном обслуживании животных. Продажу, сдачу на убой, выгон, размещение на пастбищах и все другие перемещения и перегруппировки животных, реализацию животноводческой продукции проводят только с разрешения ветеринарных специалистов. Осуществляют карантинирование в течение 30 дней вновь поступивших животных для проведения клинического осмотра, серологического и гематологического исследований.
Контроль за благополучием поголовья скота осуществляют на основании показателей послеубойной экспертизы на мясокомбинатах; данных экспертизы при внутрихозяйственном убое животных, вскрытиях трупов животных; результатов плановых серологических и гематологических исследований на лейкоз; результатов контрольного убоя животных с повышенным уровнем лимфоцитов в крови и патоморфологических исследований биоматериалов. Лечение крупного рогатого скота, больного лейкозом не разработано.
1.13 Анализ ветеринарной отчетности
Согласно «Правил по профилактике и борьбе с лейкозом крупного рогатого скота» (1999) хозяйства, в которых установлено заболевание животных лейкозом, объявляют неблагополучными и вводят в них комплекс ограничений, препятствующих распространению инфекции. Одновременно утверждают комплексный план оздоровления неблагополучного хозяйства, фермы, стада [47].
Согласно «Правил по профилактике и борьбе с лейкозом крупного рогатого скота» (1999) по результатам серологического исследования, полученным перед началом оздоровительных мероприятий, определяют различные варианты борьбы с лейкозом. Хозяйства, в том числе ЛПХ, считают оздоровленными после вывода всех больных и инфицированных животных и получения двух подряд, с интервалом 3 месяцев, отрицательных результатов при серологическом исследовании всего поголовья животных старше 6-месячного возраста, а также выполнения мер по санаций помещений и территории ферм [47].
Анализ ветеринарной отчетности по числу неблагополучных территорий и числу зараженных и заболевших лейкозом КРС животных за последние 14 лет свидетельствует о том, что помимо определенной тенденции на снижение числа зараженных и заболевших лейкозом КРС животных с 2010г. идет увеличение по числу выявленных неблагополучных районов.
Это привело к тому, что в 2013 году 69 регионов Российской Федерации оказались в невыгодном положении по отношению к этому заболеванию. Если брать неблагоприятные территории в случае субъектов, то большинство зараженных животных выявляются в Центральном федеральном округе (35 %), а также в Приволжском и Северо-Кавказском федеральных округах.
Если говорить о цифрах, то в Центральном федеральном округе в 2013 году. Болеют более 13 тыс. голов крупного рогатого скота (выявленные больные гематологически), в Приволжском федеральном округе-11 тыс. голов. В среднем по данным статистической ветеринарной отчетности, представленной Государственной ветеринарной службой Российской Федерации в 2013 году. По данным гематологии зарегистрировано около 40 тысяч больных животных [56].
В РФ по данным В. Борового, 2015 существуют субъекты, в которых за последние годы имеется тенденция на усиление числа серопозитивных и гематологических больных животных (Московская, Амурская, Брянская области, Забайкальский край, Республика Татарстан).
И.М. Донник, И.А. Шкуратова, А.Т. Татарчук и др. [2014] сообщают о том, что данные ветеринарной отчетности не воссоздают подлинной эпизоотической ситуации по лейкозу. Так, в некоторых регионах не проводятся диагностические исследования животных на лейкоз при присутствии показаний или не целиком захватывают животных в неблагополучных по лейкозу хозяйствах. Таким образом, на основании предоставленных данных по обнаружению неблагополучных пунктов, по мнению В. Борового [6] говорить об улучшении эпизоотической ситуации по лейкозу КРС в ближайшие 2-3 года не приходится.
Однако по данным того же автора В. Борового, 2015 [6] есть субъекты, которые добились определенных положительных результатов в борьбе с лейкозом, например, Ленинградская, Белгородская, Новгородская и др., где несомненно отмечается тенденция на уменьшение как количества проявляемых серопозитивных животных, так и численность гематологических больных.
Рассмотрение результатов ветеринарной статистики Государственного управления ветеринарии РФ свидетельствует на обширное распространение инфекции, порождаемой вирусом лейкоза крупного рогатого скота (ВЛКРС), во многих субъектах РФ.
Сложная эпидемическая ситуация с лейкозом крупного рогатого скота в этих регионах оказывает серьезное сдерживающее воздействие на животноводство, поэтому необходимо усилить борьбу с этим заболеванием.
В последние годы на основе результатов исследований различных заболеваний у крупного рогатого скота был опубликован ряд статей.
В то же время, несмотря на несомненные успехи в изучении атеросклеротического процесса этого инфекционного заболевания, исследования в этой области остаются недостаточными. Более полное знание эпидемического процесса может обеспечить разработку и внедрение научно обоснованной системы профилактики лейкозов и восстановления крупного рогатого скота с учетом напряженности эпидемической инфекции и региональных технических особенностей молочного скотоводства[49].
В ряде регионов России, таких как Вологодская, Ленинградская, Свердловская области, Республика Саха (Якутия) и Ханты-Мансийский автономный округ, при эффективной научной поддержке были достигнуты хорошие результаты, организованы и проведены научно-исследовательские работы.
2 Результаты проведенных исследований и их анализ
2.1 Определение и оценка влияния условий содержания на инфицированность и заболеваемость ВЛКРС
С целью изучения степени инфицирования и эффективности профилактических мероприятий изучены эпидемиологические особенности лейкоза крупного рогатого скота в Кемеровской области. Согласно O.В. Морозова (2015) с помощью диагностических тестов на лейкемию (РИД) выявила более 143 тысяч животных, несущих вирус за 7 лет, что составляет 7,7 % от общего числа. Самый высокий процент носителей ВЛКРС был обнаружен у телок до спаривания (14.31 %), самый низкий -у телок в возрасте 6-12 месяцев (9,7 %). Кроме того, за этот период было проведено 297 377 гематологических исследований, что привело к выявлению 4,625 животных на гематологической стадии заболевания, что в среднем составило 1,76±0,30 % от числа исследований.
Инфицированность крупного рогатого скота вирусом лейкоза по данным О.В. Морозовой (2015) в Кемеровской области за 2007-2013 годы равномерно понижается. Так, наибольшее число животных-вирусоносителей установлено в 2007 году (9,9 %), наименьшее — в 2013 году (5,6 %). В тоже время по данным гематологических исследований в Кемеровской области наблюдался рост количества больных животных с 2007 по 2011 год (от 1,5 % до 3,2 %) со значительным уменьшением их числа в 2012 и 2013 годах (соответственно: 1,0 и 1,4 %).
Несмотря на положительные изменения, анализ эпидемиологических данных в различных регионах Кемеровской области показал, что в регионе, где выявлены животные-носители ВЛКР, нет ни одного хозяйства.
В Крапивинском, Ижморском, Юргинском, Мариинском и Тяжинском районах за 7 лет уровень инфицирования ВЛКРС в среднем превышает 10 %. В Новокузнецком, Беловском, Ленинско-Кузнецком и Яшкинском районах, а также по результатам исследований Кемеровской МВЛ общая скорость передачи вируса у крупного рогатого скота за эти годы составила менее 5 %. Самый высокий уровень в Ижорском районе составил 26%, самый низкий-1,95% в Новокузнецком районе.
Средний процент выявленных на гематологической стадии заболевания за 7 лет был самым высоким в ленинско-Кузнецком (4,24 %), Беловском (3,8 %) и Юргинском (3,3 %) районах, самым низким в Мариинском (0,11 %), Ижморском (0,27 %) и Прокопьевском (0,57 %) районах.
Таким образом, анализ результатов серологических и гематологических исследований, проведенных в Кемеровской области в период с 2007 по 2013 год, показал, что, несмотря на снижение количества изолированных животных, несущих вирус, по данным О.В. Морозовой (2015), район лейкемии крупного рогатого скота. По данным статистической отчетности Управления ветеринарии Кемеровской области, была прослежена определенная динамика выделения РИД+ крупного рогатого скота (таблица 6).
Таблица 6 – Выделение РИД (+) крупного рогатого скота в Кемеровской области в зависимости от способа содержания (по всем районам области)
| Район | Коровы | Нетели | Телки 6-16 мес. | ||||||
| голов | РИД (+) | голов | РИД (+) | голов | РИД (+) | ||||
| голов | % | голов | % | голов | % | ||||
| 2016 год (привязное) | |||||||||
| Беловс
кий |
800 | 77 | 2,46 | 60 | 7 | 2,5 | 0 | 0 | 0 |
| Ижморс
кий |
2012 | 937 | 46,6 | 10 | 2 | 20 | 0 | 0 | 0 |
| Кемеровский | 4778 | 192 | 4,0 | 810 | 0 | 0 | 4256 | 26 | 0,6 |
| Крапивинский | 3261 | 638 | 19,7 | 625 | 87 | 13,9 | 0 | 0 | 0 |
| Новокузнецкий | 3769 | 0 | 0 | 767 | 0 | 0 | 0 | 0 | 0 |
| Прокопьевский | 991 | 138 | 13,9 | 356 | 0 | 0 | 585 | 40 | 6,8 |
| Промышленновс
кий |
2882 | 2383 | 83 | 524 | 14 | 3 | 2069 | 675 | 33 |
| Тисульс
кий |
723 | 420 | 58 | 76 | 25 | 32 | 1082 | 180 | 16 |
| Топкинс
кий |
2593 | 254 | 20 | 561 | 95 | 16 | 1336 | 259 | 19,3 |
| Тяжинс
кий |
2130 | 1485 | 70 | 377 | 92 | 27 | 0 | 0 | 0 |
| Чебулин
ский |
322 | 2323 | 71 | 744 | 0 | 0 | 0 | 0 | 0 |
| Юргин
ский |
7565 | 1301 | 17,2 | 1046 | 49 | 4,7 | 3585 | 141 | 4 |
| Яйс
кий |
995 | 405 | 40,7 | 119 | 71 | 59,7 | 0 | 0 | 0 |
Продолжение таблицы 6
| Район | Коровы | Нетели | Телки 6-16 мес. | ||||||
| голов | РИД (+) | голов | РИД (+) | голов | РИД (+) | ||||
| голов | % | голов | % | голов | % | ||||
| Яшкинс
кий |
3900 | 287 | 7,4 | 871 | 3 | 0,3 | 2913 | 2 | 0,1 |
| Итого | 36721 | 10840 | 29,5 | 6946 | 445 | 6,4 | 15826 | 1323 | 8,4 |
| 2016 год (безпривязное) | |||||||||
| Беловс
кий |
0 | 0 | 0 | 92 | 24 | 6,23 | 612 | 85 | 9,03 |
| Ижморс
кий |
0 | 0 | 0 | 698 | 101 | 14,5 | 1755 | 201 | 11,5 |
| Кемеровс
кий |
2600 | 0 | 0 | 441 | 0 | 0 | 1222 | 0 | 0 |
| Крапивинский | 421 | 178 | 42,3 | 74 | 23 | 31,1 | 2928 | 152 | 5,2 |
| Новокузнецкий | 0 | 0 | 0 | 0 | 0 | 0 | 4553 | 18 | 0,4 |
| Прокопьевский | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Промышленновский | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Тисульс
кий |
70 | 58 | 82 | 0 | 0 | 0 | 0 | 0 | 0 |
| Топкинс
кий |
0 | 0 | 0 | 103 | 0 | 0 | 62 | 12 | 0,19 |
| Тяжинс
кий |
0 | 0 | 0 | 589 | 130 | 22 | 1347 | 510 | 38 |
| Чебулинс
кий |
0 | 0 | 0 | 0 | 0 | 0 | 576 | 73 | 12 |
| Юргинс
кий |
0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Яйс
кий |
0 | 0 | 0 | 84 | 3 | 3,6 | 3769 | 951 | 25,2 |
| Яшкинс
кий |
200 | 78 | 39,0 | 26 | 0 | 0 | 135 | 0 | 0 |
| Итого | 3291 | 314 | 9,5 | 2107 | 281 | 13,3 | 16959 | 2002 | 11,8 |
| 2017 год (привязное) | |||||||||
| Беловс
кий |
800 | 65 | 2,47 | 43 | 2 | 1 | 0 | 0 | 0 |
| Ижморс
кий |
2333 | 1121 | 48,0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Кемеровс
кий |
6100 | 177 | 6 | 390 | 0 | 0 | 2758 | 5 | 0,1 |
Продолжение таблицы 6
| Район | Коровы | Нетели | Телки 6-16 мес. | ||||||
| голов | РИД (+) | голов | РИД (+) | голов | РИД (+) | ||||
| голов | % | голов | % | голов | % | ||||
| Крапивинский | 3567 | 636 | 17,8 | 900 | 112 | 12,4 | 0 | 0 | 0 |
| Новокузнецкий | 3977 | 0 | 0 | 1262 | 0 | 0 | 0 | 0 | 0 |
| Прокопьевский | 826 | 134 | 16,2 | 346 | 43 | 1,4 | 424 | 13 | 3,1 |
| Промышленнов
ский |
2547 | 2198 | 86 | 260 | 128 | 49 | 2197 | 704 | 32 |
| Тисульс
кий |
866 | 484 | 55,9 | 136 | 0 | 0,01 | 1497 | 177 | 11 |
| Топкинс
кий |
3849 | 1114 | 28 | 492 | 118 | 23 | 1292 | 140 | 10,8 |
| Тяжинс
кий |
2032 | 1242 | 61 | 0 | 0 | 0 | 0 | 0 | 0 |
| Чебулин
ский |
6236 | 3517 | 56 | 163 | 42 | 16 | 0 | 0 | 0 |
| Юргинс
кий |
7178 | 1056 | 14,7 | 1589 | 50 | 3,2 | 5203 | 293 | 5,6 |
| Яйс
кий |
2309 | 1296 | 56,1 | 108 | 7 | 6 | 0 | 0 | 0 |
| Яшкин
ский |
3924 | 289 | 7,4 | 838 | 2 | 0,2 | 2737 | 4 | 0,2 |
| Итого | 46544 | 13329 | 28,6 | 6527 | 504 | 7,7 | 16108 | 1336 | 8,3 |
| 2017 год (беспривязное) | |||||||||
| Беловс
кий |
0 | 0 | 0 | 102 | 32 | 15,3 | 456 | 106 | 9,4 |
| Ижморский | 0 | 0 | 0 | 1055 | 90 | 8,5 | 1439 | 206 | 14,3 |
| Кемеров
ский |
2000 | 59 | 0 | 210 | 0 | 0 | 1500 | 0 | 0 |
| Крапивинский | 371 | 167 | 45,0 | 173 | 5 | 2,9 | 2436 | 220 | 9,0 |
| Новокузнецкий | 0 | 0 | 0 | 0 | 0 | 0 | 4442 | 32 | 0,7 |
| Прокопьевский | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Промышленновский | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Тисуль
ский |
162 | 95 | 58,6 | 0 | 0 | 0 | 7 | 0 | 0 |
Продолжение таблицы 6
| Район | Коровы | Нетели | Телки 6-16 мес. | ||||||
| голов | РИД (+) | голов | РИД (+) | голов | РИД (+) | ||||
| голов | % | голов | % | голов | % | ||||
| Топкинс
кий |
313 | 79 | 25 | 115 | 42 | 35 | 248 | 141 | 58 |
| Тяжинс
кий |
0 | 0 | 0 | 600 | 95 | 16 | 1152 | 244 | 21 |
| Чебулинский | 0 | 0 | 0 | 0 | 0 | 0 | 5570 | 1299 | 23 |
| Юргинс
кий |
0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Яйс
кий |
0 | 0 | 0 | 75 | 2 | 2,7 | 3440 | 1048 | 30,5 |
| Яшкинс
кий |
200 | 75 | 37,5 | 23 | 0 | 0 | 121 | 0 | 0 |
| Итого | 3046 | 475 | 15,6 | 2353 | 266 | 11,3 | 20811 | 3296 | 15,8 |
| 2018 год (привязное) | |||||||||
| Беловс
кий |
775 | 16 | 2,46 | 60 | 0 | 0 | 0 | 0 | 0 |
| Ижморс
кий |
1260 | 580 | 46,0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Кемеровс
кий |
3286 | 7 | 0 | 357 | 0 | 0 | 1153 | 1 | 0,1 |
| Крапивинский | 3945 | 548 | 13,9 | 1085 | 205 | 18,9 | 0 | 0 | 0 |
| Новокузнецкий | 2386 | 0 | 0 | 659 | 0 | 0 | 0 | 0 | 0 |
| Прокопьевский | 661 | 0 | 0 | 299 | 13 | 4,4 | 601 | 15 | 2,5 |
| Промышленновский | 1647 | 1459 | 89 | 495 | 121 | 24 | 1536 | 539 | 35 |
| Тисульс
кий |
435 | 31 | 7 | 64 | 0 | 0 | 450 | 235 | 52 |
| Топкинс
кий |
1545 | 724 | 46 | 259 | 79 | 30 | 490 | 87 | 17,7 |
| Тяжинс
кий |
589 | 423 | 72 | 0 | 0 | 0 | 0 | 0 | 0 |
| Чебулинс
кий |
470 | 129 | 27 | 419 | 83 | 19 | 0 | 0 | 0 |
| Юргинс
кий |
3305 | 254 | 7 | 2698 | 227 | 8 | 470 | 49 | 10 |
Продолжение таблицы 6
| Район | Коровы | Нетели | Телки 6-16 мес. | ||||||
| голов | РИД (+) | голов | РИД (+) | голов | РИД (+) | ||||
| голов | % | голов | % | голов | % | ||||
| Яйс
кий |
1561 | 727 | 46,6 | 167 | 59 | 35,3 | 292 | 24 | 8,2 |
| Яшкин
ский |
3638 | 129 | 3,5 | 666 | 1 | 0,2 | 2463 | 2 | 0,1 |
| Итого | 25503 | 5027 | 19,7 | 7228 | 788 | 10,9 | 7455 | 952 | 12.8 |
| 2018 год (привязное) | |||||||||
| Беловс
кий |
0 | 0 | 0 | 91 | 5 | 4,35 | 474 | 98 | 9,42 |
| Ижморский | 0 | 0 | 0 | 536 | 29 | 5,4 | 1305 | 181 | 13,9 |
| Кемеровс
кий |
849 | 12 | 1.4 | 184 | 0 | 0 | 637 | 48 | 7,5 |
| Крапивинский | 0 | 0 | 0 | 0 | 0 | 0 | 2660 | 564 | 21,2 |
| Новокузнецкий | 0 | 0 | 0 | 0 | 0 | 0 | 2922 | 20 | 0,7 |
| Прокопьевский | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Промышленновский | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Тисульс
кий |
0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Топкинс
кий |
343 | 110 | 32 | 44 | 30 | 68 | 167 | 85 | 50,8 |
| Тяжинс
кий |
0 | 0 | 0 | 36 | 124 | 37 | 449 | 170 | 38 |
| Чебулинс
кий |
0 | 0 | 0 | 0 | 0 | 0 | 1228 | 123 | 10 |
| Юргинс
кий |
0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Яйс
кий |
0 | 0 | 0 | 52 | 24 | 46 | 1375 | 326 | 23,7 |
| Яшкинс
кий |
110 | 35 | 31,8 | 7 | 0 | 0 | 49 | 3 | 6,1 |
| Итого | 1302 | 157 | 12,1 | 950 | 212 | 22,3 | 11266 | 1618 | 14,4 |
Анализ данных таблицы 6 показал, что при беспривязном содержании животных процент РИД+ был в пределах: коровы 9,5 (2016 г) – 15,6 % (2017); нетели 13,3 (2016) – 11,3 % (2017); телки 11,8 (2016) – 15,8 % (2017). При привязном содержании коров процент РИД (+) животных составил: коровы от 28,6 (2017) до 19,7 % (2018-за полугодие); нетели от 7,7 (2017) до 10,9 % (2018); телки соответственно 8,3-12,8 %. То есть, тенденция к повышению числа РИД+ животных прослеживается только у коров при привязном содержании.
2.2 Создание электронной базы данных эпизоотической ситуации по лейкозу КРС в Кемеровской области
2.2.1 Принцип формирования и пополнения компьютерной базы данных для применения в среде ГИС (QGIS) на примере лейкоза КРС
Основываясь на эпизоотологических данных, создаем атрибутивные таблицы ветеринарно значимой информации (рисунок 10) для последующего нанесения на интерактивную карту и визуализации на примере распространения лейкоза КРС.
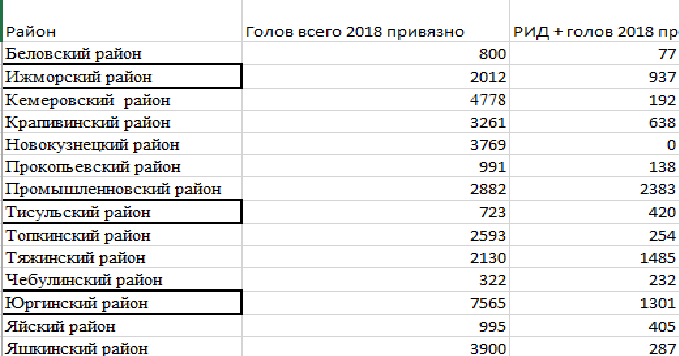
Рисунок 10 – Ввод данных в таблицу
Карта распространения РИД (+) поголовья по районам Кемеровской области
Для визуализации данных таблицы 5 посредством свободного программного обеспечения (СПО) QuantumGIS создана карта распространения РИД (+) поголовья по районам Кемеровской области выглядит следующим образом (рисунок 11).
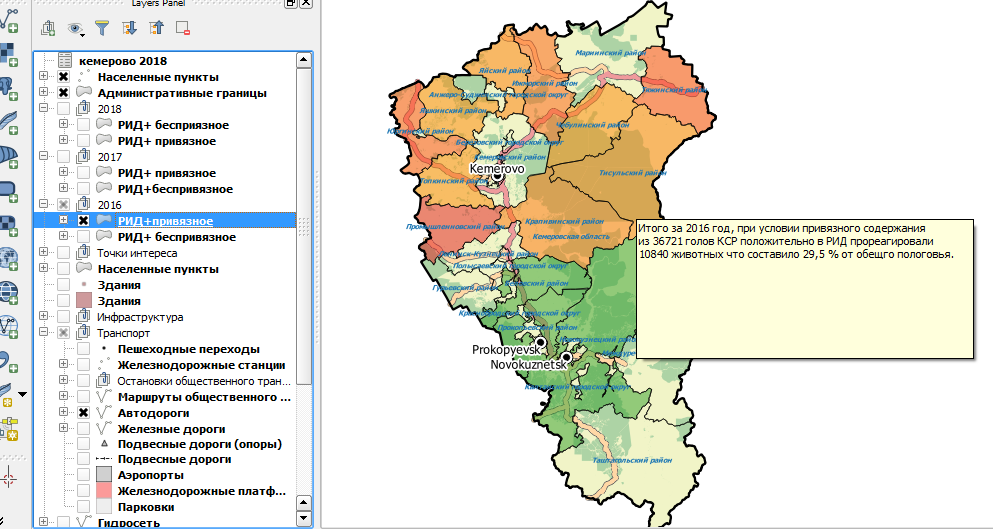
Рисунок 11 – Распространение РИД (+) поголовья по районам Кемеровской области среди коров в 2016 году с учетом привязного содержания
На карте рисунка 11 представлен градиент отдельных районов Кемеровской области по запросу «Распространенность РИД (+) реакций среди коров в 2016 году с учетом привязного содержания». Для наглядного сравнения ниже (рисунок 12) представлена карта с градиентом по запросу «Распространенность РИД (+) реакций среди коров в 2016 году с учетом беспривязного содержания»
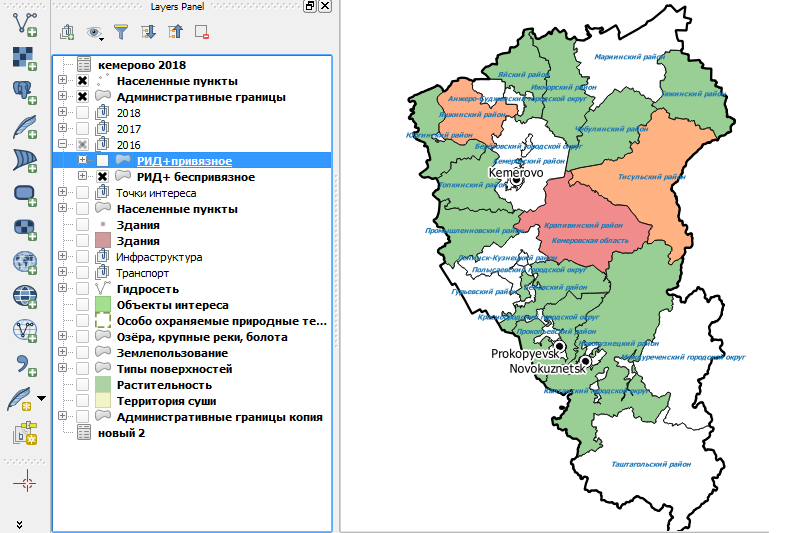
Рисунок 12 – Распространение РИД (+) поголовья по районам Кемеровской области среди коров в 2016 году с учетом беспривязного содержания
Уже в 2018 году при исследованиях в РИД стад с беспривязным содержанием положительно реагирующего поголовья практически не выявляли, что видно из материалов карты (рисунок 13) с соответствующим запросом, представленной ниже.
Готовый макет с легендой и произвольной формой отчета представляет собой карту с легендой выбранного масштаба на белом фоне (рисунок 14).
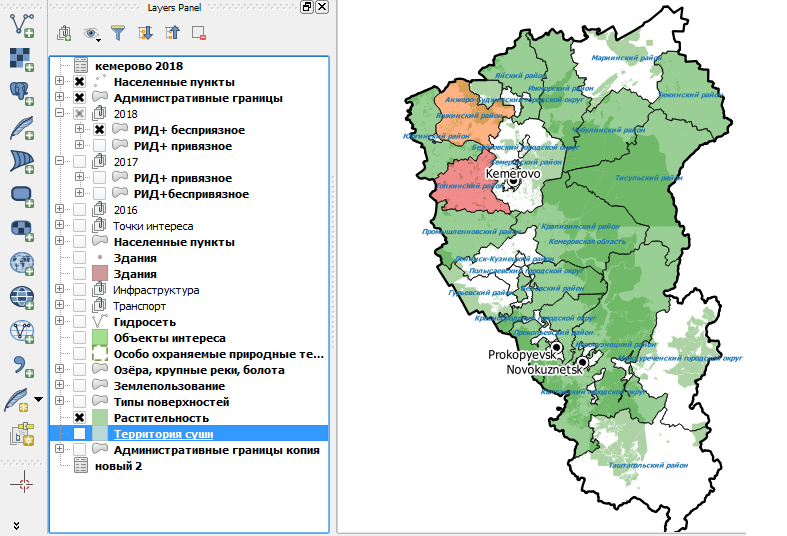
Рисунок 13 – Распространение РИД (+) поголовья по районам Кемеровской области среди коров в 2018 году с учетом беспривязного содержания
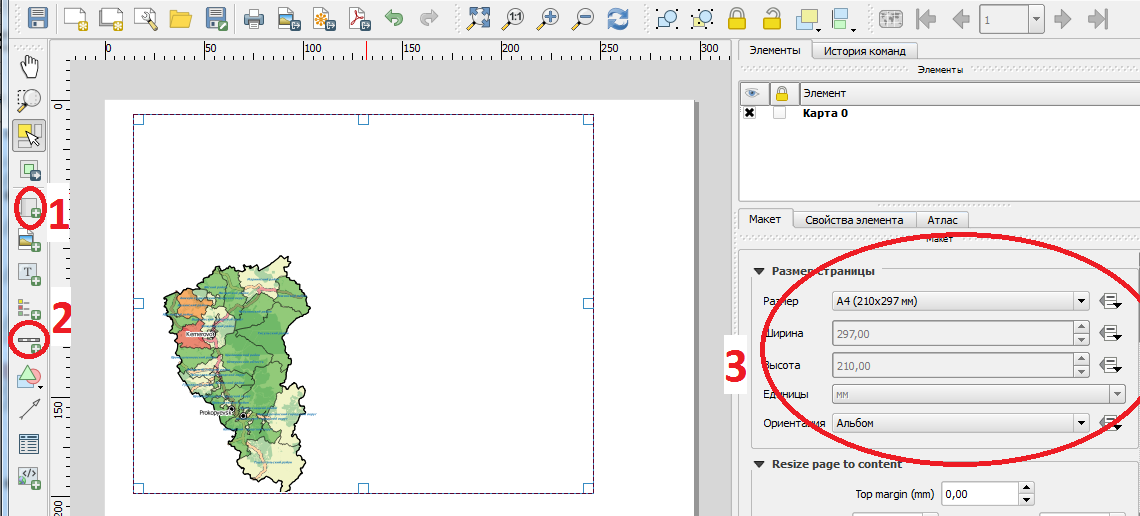
Рисунок 14 – Алгоритм создания печатного макета карты
Анализируя эпизоотическую ситуацию по лейкозу крупного рогатого скота в Кемеровской области, следует отметить, что уровень интенсивности лейкозной эпизоотии в различных районах значительно различался. Эпизоотическую ситуацию, оцененную в период широкомасштабных серологических исследований в 2016г., проводимых в животноводческих хозяйствах области, можно представить пот зонам (рисунок 15): районы с сильной, значительной и умеренной эпизоотической напряженностью по лейкозу КРС.
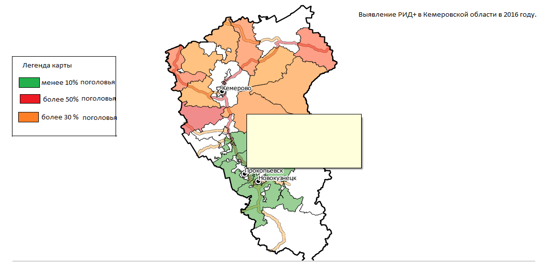
Рисунок 15 – Карта эпизоотической напряженности по лейкозу крупного рогатого скота в районах Кемеровской области — 2016 г.
Принципы создания базы данных с последующей их визуализацией с помощью прикладных картографических программ аналогичны на моделях любых инфекционных/инвазионных болезней. Предлагаемый алгоритм работы с данным программным обеспечением Qgis 12.2 Lyon позволяет моделировать развитие эпизоотической ситуации на примере любой болезни, как по лейкозу КРС или по АЧС, так и по другим нозологическим единицам.
2.2.2 Принципы формирования и пополнения компьютерной базы данных на основе компонентов пакета LibreOffice
Опираясь на опыт оздоровления Ленинградской области от вируса лейкоза крупного рогатого скота (ВЛКРС), нами создана единая Система мониторинга для организации сбора, обработки, хранения, анализа и картографического представления ветеринарно значимой информации с использованием современных информационных технологий. Это многофункциональная компьютерная Система мониторинга ветеринарного благополучия регионов, с наложением геоинформационных данных территориальной приуроченности по той или иной инфекции (в том числе по лейкозу крупного рогатого скота).
Для корректной работы Системы мониторинга по лейкозу крупного рогатого скота, необходимо, прежде всего создать и наполнить базу данных по хозяйствам Кемеровской области, учитывая крупные и небольшие хозяйства.
За основу работы по визуализации ветеринарной отчетности в разрезе лет на территории Кемеровской области взяты компьютерные базы данных на основе компонентов пакета LibreOffice, которые выгодно отличаются от других баз данных простотой использования и уровнем защиты от вредоносного программного обеспечения (ПО) [36,37,38].
Использование базы данных включает в себя следующую последовательность:
- формирование таблиц
- внесение в таблицы имеющихся в наличии данных ветеринарной отчетности,
- извлечение нужных отдельных данных,
- применение данных в текущем запросе.
При запуске LibreOffice Base автоматически открывается Мастер баз данных (рисунок 16), предлагающий создать новую БД, либо открыть существующую. Выберем пункт «Создать новую базу данных» и нажмем на кнопку «Далее»

Рисунок 16 – Рабочая среда Ubuntu, база данных на основе на основе компонентах пакета LibreOffice
На втором этапе Мастер предлагает два варианта: открыть базу данных для редактирования или сразу приступить к созданию таблиц. Оставим настройки по умолчанию и нажмём кнопку «Готово» (рисунок 17).
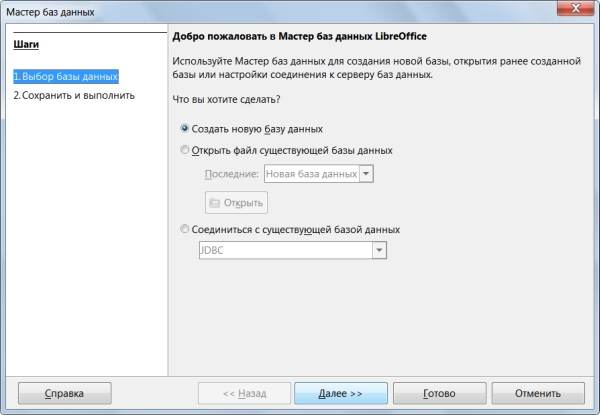
Рисунок 17 — Мастер баз данных LibreOffice, этап 1
Рисунок 18 – Мастер баз данных LibreOffice, этап 2
Теперь СУБД предложит нам сохранить нашу базу данных. Выбираем нужную папку, в которой будет храниться база, и даём ей название. В качестве примера мы создадим базу данных хозяйств Промышленновского района. Поэтому назовём её «База данных хозяйств» (рисунок 19):
Рисунок 19 – Пример создания базы данных в LibreOffice Base сохраняются в формате .odb
После того, как создан новый файл базы данных, редактор откроет основное рабочее окно СУБД. Здесь можно работать с таблицами, запросами, формами и отчётами, создавать, редактировать и управлять ими. Каждую из этих форм можно создавать в двух режимах:
1) с помощью мастера (для начинающих),
2) в режиме дизайна (для опытных пользователей).
Для начала создадим таблицы. Чтобы воспользоваться помощью Мастера таблиц, щёлкнем на кнопке Таблицы в окне База данных, а в окне Задачи выберем «Использовать мастер для создания таблицы» (рисунок 20).

Рисунок 20 – Пример создания таблицы
Чтобы поле попало в структуру формируемой таблицы, его нужно выделить, а затем щелкнуть по кнопке « ».
Для нашей таблицы выберем следующие поля (рисунок 21):
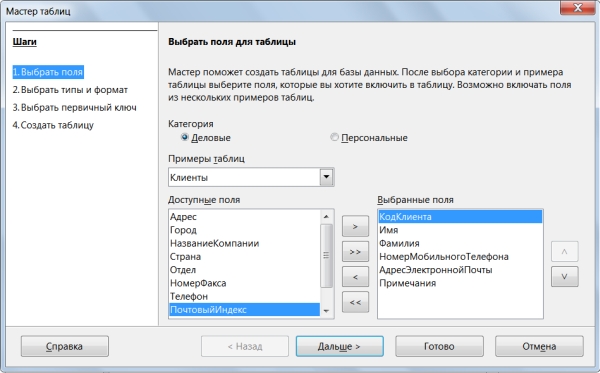
Рисунок 21 – Настройка поля таблицы
В качестве примера введём несколько строчек (рисунок 22) в нашу таблицу:

Рисунок 22 – Ввод данных в таблицу
В открывшемся окне нужно сначала добавить таблицы кнопка Добавить таблицы на панели инструментов, либо аналогичный пункт в меню Вставить – в окне со списком таблиц выбираем нужную и нажимаем кнопку Добавить.
Внесенная информация хранится в базе данных LibreOffice в виде таблицы и может быть легко экспортирована для создания резервных копий.
База данных обеспечивает архивацию данных в аутентичной форме и возможность сохранения результатов их трактовки различными экспертами. Структура базы данных обеспечивает фиксацию в электронной форме результатов поэтапной обработки первичных материалов.
Она учитывает специфику информации, которая представлена данными разного типа, касающейся различных аспектов изучения животных, в отдельности и в их сложных связях. С целью обеспечения аккумуляции ранее накопленной информации, преемственности исследовательского процесса были разработаны специальные средства, обеспечивающие как анализ ранее обобщенных данных, так и обработку единичных (необобщенных) данных, поступающих в ходе текущих полевых исследований. Средствами базы данных может осуществляться комплексная обработка необходимых сведений [36,37,38].
База данных составлена при помощи компонентов пакета LibreOffice и представляет собой совокупность таблиц, форм, запросов и отчетов. Впервые показана возможность на модели лейкоза крупного рогатого скота усовершенствовать систему эпизоотологического мониторинга посредством LibreOffice, а также Qgis 12.2 Lyon.
Импорт данных из электронной таблицы в векторный слой QuantumGIS
Первичные данные, создаваемые в электронной таблице, обязательно должны иметь столбцы с географическими координатами в формате «градусы/доли градусов» (пример показан на рисунок 23, столбцы ш (широта) и д (долгота) содержат координаты).
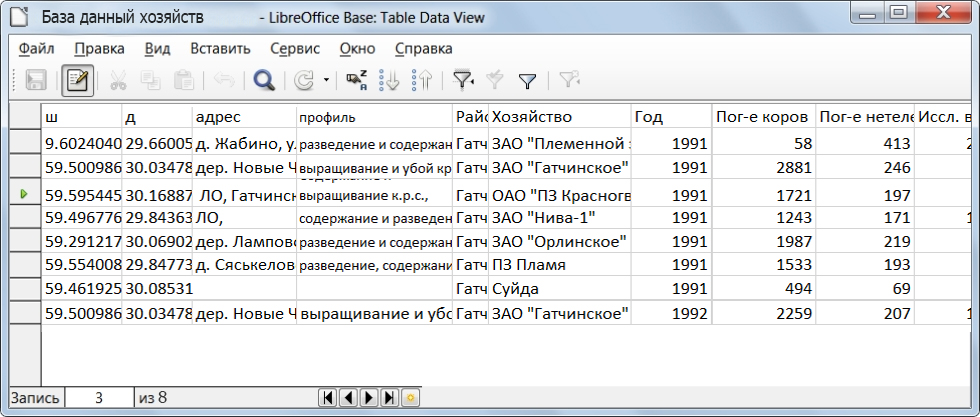
Рисунок 23 – Пример первичных данных в электронной таблице
Данные из электронной таблицы экспортируются в формат CSV (Comma Separated Values), причем для импорта в QuantumGIS предпочтительным разделителем поля является символ «;», а символов разделителей текста быть не должно.
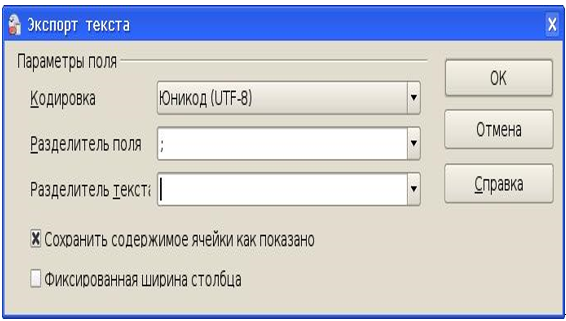
Рисунок 24 – Настройка фильтра экспорта в CSV из ЭТ
Получившийся текстовый файл теперь является основой для создания векторного (точечного) слоя [36].
Для этого в QuantumGIS выбирается команда «Слой/Добавить слой из текста с разделителями» (предварительно нужно проверить, что модуль расширения «Текст с разделителями» установлен и подключен», а затем в диалоговом окне настраиваются параметры импорта данных.
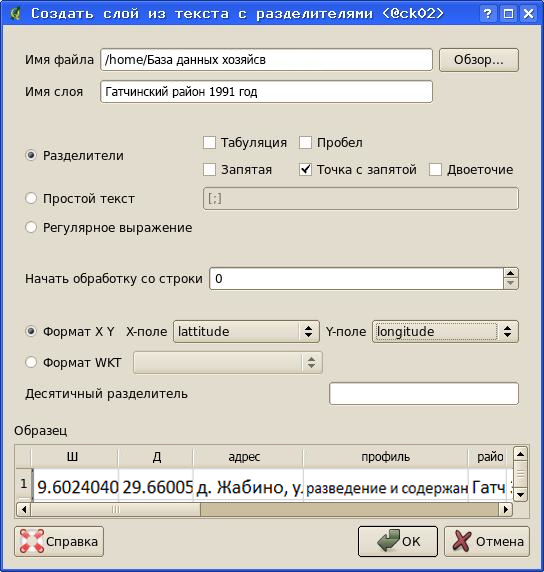
Рисунок 25 – Диалог импорта данных из текстового файла в QuantumGIS
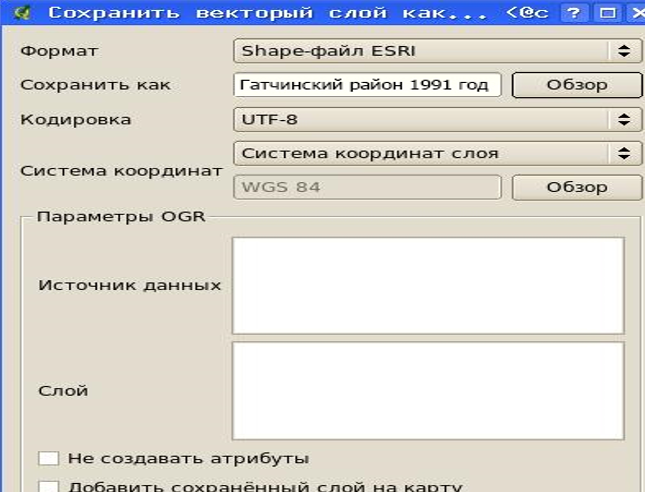
Рисунок 26 – Сохранение импортированных данных в shape-файл
В результате импорта создается слой с указанным именем, который следует сохранить как shape-файл на АРМ пользователя.
Практическое применение визуализации данных ветеринарной отчетности
Разработанный нами совместно с учеными Санкт-Петербургской академии ветеринарной медицины набор программного обеспечения (базы данных на основе LibreOffice для работы в Qgis 12.2 Lyon, его компоненты, модули и плагины) позволит её пользователю без особых знаний языков программирования:
- Увеличить эффективность сбора, хранения и визуализации данных ветеринарной отчетности в разрезе лет.
- Уменьшить трудоёмкость обработки данных ветеринарной отчетности.
- Объединить информационные потоки ветеринарных станций в единую систему эпизоотологического мониторинга.
- Увеличить эффективность противоэпизоотических мероприятий.
На основании расчета экономической эффективности использования программных продуктов ГИС (базы данных на основе LibreOffice для работы в Qgis 12.2 Lyon, его компонентов, модулей и плагинов) был вычислен период окупаемости внедрения для анализа эпизоотической ситуации на модели лейкоза крупного рогатого скота который составляет 2-3 месяца.
По итогам работ разработана визуализированная технология компьютерного эпизоотологического картографирования на модели лейкоза крупного рогатого скота в Кемеровской области с применением свободного программного обеспечения ГИС.
Разработанная геоинформационная Система мониторинга лейкоза крупного рогатого скота включает в себя формирование и пополнение компьютерной базы данных на основе компонентов пакета LibreOffice с их обработкой в бесплатной геоинформационной системой Qgis 12.2 Lyon и решает задачи визуализации и обработки ветеринарно значимой информации.
При создании эпизоотологической карты использована свободная геоинформационная система (Qgis), свободная картографическая база данных (OSM), дополненная эпизоотологической картографической базой данных, которая формирует отдельные информационные слои, наложенные на картографическую основу OSM. Все формы анализа, расчетов и визуализация данных, включая зонирование территорий, обеспечивается математическим аппаратом свободной аналитической системы Grass, под управлением свободной оболочки Qgis.
Разработанный алгоритм применения геоинформационных технологий в эпизоотологическом мониторинге и надзоре за лейкозом крупного рогатого скота в Кемеровской области позволяет объединять информационные потоки ветеринарных станций в единую систему эпизоотологического мониторинга с периодом окупаемости от внедрения используемых программных продуктов ГИС около 2-3 месяцев.
2.3 Разработка биотехнологических методов ранней диагностики провируса лейкоза крупного рогатого скота с учетом географических и техногенных зон для геномного редактирования здорового поголовья крупного рогатого скота
2.3.1 Сравнительный анализ исследований серологическим и молекулярно-генетическим методами
19 мая 2019 года в 2-х хозяйствах Кемеровской области ИП «Зинченко В.Д. глава КФХ» ферма № 1 с. Сидоренково и ферма № 2 с. Поморцево, Беловского района и ООО «Горскино» Гурьевского района, было отобрано 200 проб цельной крови от коров черно-пестрой породы, в возрасте 4-5 лет.
В ИП «Зинченко В.Д. глава КФХ» ферма № 1 исследовали кровь у животных серопозитивных; ферма № 2 серонегативных особей. ООО «Горскино» является неблагополучным по лейкозу с поражением поголовья более 30 %.
Пробы сыворотки крови были исследованы на наличие антител к вирусу лейкоза в реакции иммунодиффузии (РИД) в районных лабораториях Кемеровской области, с помощью наборов для серологической диагностики лейкоза крупного рогатого скота, производитель ФКП «Курская биофабрика – фирма «БИОК».
Исследования на выявление ДНК провируса лейкоза крупного рогатого скота (Bovine leucosis virus, BLV) проводились в научно-исследовательской лаборатории «Биохимических, молекулярно-генетических исследований и селекции сельскохозяйственных животных» при применении наборов производства «ВЕТ ФАКТОР».
Выделение нуклеиновых кислот проводили набором реагентов для экстрации ДНК/РНК из биологического материала «ДНК/РНК-С-ФАКТОР» («ВЕТ ФАКТОР», Россия) согласно инструкции по применению.
Общий объем реакционной смеси составил 25 мкл, в том числе 10 мкл выделенной ДНК-пробы.
Непосредственно полимеразную цепную реакции (ПЦР) с флуоресцентной детекцией в режиме реального времени проводили на ДНК-Амплификатор CFX96 Touch Real Time System (производства Bio-Rad, США) при температурно-временном режиме:
- Начальная денатурация 95 оС – 5 минут;
- 10 циклов (денатурация 95 оС – 30 секунд, отжиг 60 оС – 30 секунд, элонгация 72 оС – 30 секунд
- 35 циклов (денатурация 95 оС – 10 секунд, отжиг 56 оС – 20 секунд, элонгация 72 оС – 20 секунд.
- Детекция проводилась на этапе отжига праймеров.
Учет результатов ПЦР-анализа проводили (согласно инструкции) по наличию или отсутствию пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией (что соответствует наличию или отсутствию значения порогового цикла «Ct» для исследуемого образца) (таблица 7).
Таблица 7 – Результаты исследований методами РИД И ПЦР
| № п\п | Инв. № | Результат ПЦР | Результаты РИД | |
| ООО «Горскино» | ||||
| 1 | 899 | отрицательно | положительно | |
| 2 | 650 | отрицательно | положительно | |
| 3 | 77 | отрицательно | положительно | |
| 4 | 301615 | отрицательно | положительно | |
| 5 | 360 | отрицательно | положительно | |
| 6 | 242 | отрицательно | положительно | |
| 7 | 1015 | положительно | положительно | |
| 8 | 3032 | отрицательно | положительно | |
| 9 | 2467 | положительно | положительно | |
| 10 | 428 | положительно | положительно | |
| 11 | 51 | отрицательно | положительно | |
| 12 | 133 | отрицательно | положительно | |
| 13 | 28 | отрицательно | положительно | |
| 14 | 1560 | отрицательно | положительно | |
| 15 | 277 | отрицательно | положительно | |
| 16 | 439 | отрицательно | положительно | |
| 17 | 2604 | положительно | положительно | |
| 18 | 470 | положительно | положительно | |
| 19 | 101 | отрицательно | положительно | |
| 20 | 1808 | отрицательно | положительно | |
| 21 | 100 | отрицательно | положительно | |
| 22 | 30 | отрицательно | положительно | |
| 23 | 702 | отрицательно | положительно | |
| 24 | 31 | отрицательно | положительно | |
| 25 | 740 | положительно | положительно | |
| 26 | 228 | отрицательно | положительно | |
| 27 | 1208 | положительно | положительно | |
| 28 | 372 | положительно | положительно | |
| 29 | 70 | положительно | положительно | |
| 30 | 732 | отрицательно | положительно | |
| 31 | 539 | отрицательно | положительно | |
| 32 | 301793 | отрицательно | положительно | |
| 33 | 5718 | положительно | положительно | |
| 34 | 285 | положительно | положительно | |
| 35 | 3107 | отрицательно | положительно | |
Продолжение таблицы 7
| № п\п | Инв. № | Результат ПЦР | Результаты РИД | |
| 36 | 462 | отрицательно | положительно | |
| 37 | 1640 | отрицательно | положительно | |
| 38 | 1650 | отрицательно | положительно | |
| 39 | 270 | положительно | положительно | |
| 40 | 281 | положительно | положительно | |
| 41 | 804 | отрицательно | положительно | |
| 42 | 351 | положительно | положительно | |
| 43 | 58 | положительно | положительно | |
| 44 | 803 | отрицательно | положительно | |
| 45 | 1076 | положительно | положительно | |
| 46 | 2688 | положительно | положительно | |
| 47 | 52 | положительно | положительно | |
| 48 | 7 | отрицательно | положительно | |
| 49 | 2157 | положительно | положительно | |
| 50 | 564 | положительно | положительно | |
| 51 | 68 | отрицательно | положительно | |
| 52 | 2460 | отрицательно | положительно | |
| 53 | 550 | отрицательно | положительно | |
| 54 | 543 | отрицательно | положительно | |
| 55 | 5740 | отрицательно | положительно | |
| 56 | 396 | отрицательно | положительно | |
| 57 | 408 | положительно | положительно | |
| 58 | 46 | отрицательно | положительно | |
| 59 | 1855 | отрицательно | положительно | |
| 60 | 1257 | отрицательно | положительно | |
| 61 | 828 | положительно | положительно | |
| 62 | 64 | отрицательно | положительно | |
| 63 | 39 | отрицательно | положительно | |
| 64 | 369 | положительно | положительно | |
| 65 | 301907 | отрицательно | положительно | |
| 66 | 732 | отрицательно | положительно | |
| 67 | 426 | отрицательно | положительно | |
| 68 | 94 | отрицательно | положительно | |
| 69 | 1644 | положительно | положительно | |
| 70 | 626 | положительно | положительно | |
| ИП «Зинченко В.Д. глава КФХ» ферма № 1
с. Сидоренково |
||||
| 71 | 3353 | отрицательно | положительно | |
| 72 | 242 | отрицательно | положительно | |
| 73 | 676 | отрицательно | положительно | |
| 74 | 18 | отрицательно | положительно | |
| 75 | 99 | отрицательно | положительно | |
| 76 | 1085 | отрицательно | положительно | |
| 77 | 1094 | отрицательно | положительно | |
| 78 | 121 | отрицательно | положительно | |
| 79 | 2135 | отрицательно | положительно | |
| 80 | 4613 | отрицательно | положительно | |
| 81 | 1048 | отрицательно | положительно | |
Продолжение таблицы 7
| № п\п | Инв. № | Результат ПЦР | Результаты РИД |
| 82 | 92 | отрицательно | положительно |
| 83 | 3345 | отрицательно | положительно |
| 84 | 4484 | отрицательно | положительно |
| 85 | 904 | отрицательно | положительно |
| 86 | 330 | отрицательно | положительно |
| 87 | 917 | отрицательно | положительно |
| 88 | 46 | отрицательно | положительно |
| 89 | 3386 | отрицательно | положительно |
| 90 | 1099 | отрицательно | положительно |
| 91 | 130 | положительно | положительно |
| 92 | 555 | положительно | положительно |
| 93 | 3455 | положительно | положительно |
| 94 | 4586 | отрицательно | положительно |
| 95 | 4539 | отрицательно | положительно |
| 96 | 892 | отрицательно | положительно |
| 97 | 783 | отрицательно | положительно |
| 98 | 2262 | отрицательно | положительно |
| 99 | 5663 | отрицательно | положительно |
| 100 | 234 | отрицательно | положительно |
| 101 | 15 | положительно | положительно |
| 102 | 4635 | положительно | положительно |
| 103 | 140 | положительно | положительно |
| 104 | 4637 | положительно | положительно |
| 105 | 933 | положительно | положительно |
| 106 | 932 | положительно | положительно |
| 107 | 122 | положительно | положительно |
| 108 | 962 | положительно | положительно |
| 109 | 953 | положительно | положительно |
| 110 | 944 | положительно | положительно |
| 111 | 4477 | отрицательно | положительно |
| 112 | 172 | положительно | положительно |
| 113 | 4613 | положительно | положительно |
| 114 | 4518 | положительно | положительно |
| 115 | 3309 | положительно | положительно |
| 116 | 196 | положительно | положительно |
| 117 | 2349 | положительно | положительно |
| 118 | 130 | положительно | положительно |
| 119 | 4 | положительно | положительно |
| 120 | 3425 | положительно | положительно |
| 121 | 3405 | положительно | положительно |
| 122 | 3342 | отрицательно | положительно |
| 123 | 904 | отрицательно | положительно |
| 124 | 218 | отрицательно | положительно |
| 125 | 823 | отрицательно | положительно |
| 126 | 810 | отрицательно | положительно |
| 127 | 2241 | отрицательно | положительно |
| 128 | б\н | отрицательно | положительно |
| 129 | 33 | отрицательно | положительно |
Продолжение таблицы 7
| № п\п | Инв. № | Результат ПЦР | Результаты РИД |
| 130 | 853 | отрицательно | положительно |
| 131 | 4560 | положительно | положительно |
| 132 | 4530 | положительно | положительно |
| 133 | 4451 | положительно | положительно |
| 134 | 888 | положительно | положительно |
| 135 | 778 | положительно | положительно |
| ИП «Зинченко В.Д. глава КФХ» № 2 с. Поморцево, | |||
| 136 | 3345 | отрицательно | отрицательно |
| 137 | 3355 | отрицательно | отрицательно |
| 138 | 3384 | отрицательно | отрицательно |
| 139 | 3400 | отрицательно | отрицательно |
| 140 | 3332 | отрицательно | отрицательно |
| 141 | 3500 | отрицательно | отрицательно |
| 142 | 3339 | отрицательно | отрицательно |
| 143 | 3238 | отрицательно | отрицательно |
| 144 | 3333 | отрицательно | отрицательно |
| 145 | 3445 | отрицательно | отрицательно |
| 146 | 3311 | отрицательно | отрицательно |
| 147 | 5163 | отрицательно | отрицательно |
| 148 | 632 | отрицательно | отрицательно |
| 149 | 626 | отрицательно | отрицательно |
| 150 | 4495 | отрицательно | отрицательно |
| 151 | 4551 | отрицательно | отрицательно |
| 152 | 4672 | отрицательно | отрицательно |
| 153 | 4561 | отрицательно | отрицательно |
| 154 | 4624 | отрицательно | отрицательно |
| 155 | 5732 | отрицательно | отрицательно |
| 156 | 5737 | отрицательно | отрицательно |
| 157 | 5096 | отрицательно | отрицательно |
| 158 | 5111 | отрицательно | отрицательно |
| 159 | 5104 | отрицательно | отрицательно |
| 160 | 6886 | отрицательно | отрицательно |
| 161 | 681 | отрицательно | отрицательно |
| 162 | 6103 | отрицательно | отрицательно |
| 163 | 697 | отрицательно | отрицательно |
| 164 | 631 | отрицательно | отрицательно |
| 165 | 2106 | отрицательно | отрицательно |
| 166 | 2165 | отрицательно | отрицательно |
| 167 | 2203 | отрицательно | отрицательно |
| 168 | 2262 | отрицательно | отрицательно |
| 169 | 3327 | отрицательно | отрицательно |
| 170 | 5138 | отрицательно | отрицательно |
| 171 | 5171 | отрицательно | отрицательно |
| 172 | 601 | отрицательно | отрицательно |
| 173 | 644 | отрицательно | отрицательно |
| 174 | 687 | отрицательно | отрицательно |
| 175 | 148 | отрицательно | отрицательно |
| 176 | 285 | отрицательно | отрицательно |
Продолжение таблицы 7
| № п\п | Инв. № | Результат ПЦР | Результаты РИД |
| 177 | 3610 | отрицательно | отрицательно |
| 178 | 2224 | отрицательно | отрицательно |
| 179 | 75 | отрицательно | отрицательно |
| 180 | 1080 | отрицательно | отрицательно |
| 181 | 69 | отрицательно | отрицательно |
| 182 | 206 | отрицательно | отрицательно |
| 183 | 3611 | отрицательно | отрицательно |
| 184 | 157 | отрицательно | отрицательно |
| 185 | 372 | положительно | отрицательно |
| 186 | 3309 | положительно | отрицательно |
| 187 | 2281 | положительно | отрицательно |
| 188 | 142 | положительно | отрицательно |
| 189 | 2369 | положительно | отрицательно |
| 190 | 3435 | положительно | отрицательно |
| 191 | 4666 | положительно | отрицательно |
| 192 | 4641 | положительно | отрицательно |
| 193 | 616 | положительно | отрицательно |
| 194 | 6913 | положительно | отрицательно |
| 195 | 689 | положительно | отрицательно |
| 196 | 658 | отрицательно | отрицательно |
| 197 | 663 | отрицательно | отрицательно |
| 198 | 611 | отрицательно | отрицательно |
| 199 | 694 | отрицательно | отрицательно |
| 200 | 6110 | отрицательно | отрицательно |
положительно – положительный результат
отрицательно – отрицательный результат
При исследовании 200 проб цельной крови в 64 пробах выявлена ДНК провируса лейкоза, что составило 32 % от числа исследованных образцов.
Таблица 8 – Результаты исследований методами РДП и ПЦР по хозяйствам
| Хозяйство | Всего
проб |
ПЦР – пол. «+» | РИД – пол. «+» | РИД – пол. «+»
ПЦР – отр. «-» |
РИД – отр. «-»
ПЦР – пол. «+» |
| ООО «Горскино» | 70 | 25 (36%) | 70 (100%) | 45 (64%) | 0 (0%) |
| ИП «Зинченко В.Д. глава КФХ» ферма № 1 с. Сидоренково | 65 | 28 (43%) | 65 (100%) | 37(57%) | 0 (0%) |
| ИП «Зинченко В.Д. глава КФХ» ферма № 2 с. Поморцево | 65 | 11(17%) | 0 (0%) | 0 (0) | 11 (17%) |
| Всего | 200 | 64(32%) | 135 (67,5%) | 82(41%) | 11(5,5%) |
Количество ПЦР отрицательных животных к РИД положительным составляет 41 %, что может свидетельствовать о вероятно, того что, не смотря на высокую чувствительность и специфичность ПЦР, в развитии лейкозного процесса бывают такие периоды, когда уровень провирусной ДНК минимален. В этих случаях РИД оказывается более информативна.
В тоже время при проведении исследований ДНК провируса лейкоза крупного рогатого скота была обнаружена в 11 пробах крови, взятых от РИД негативных животных. При проведении оздоровительных мероприятий это имеет большое значение, так как не дожидаясь выработки антител, можно и нужно удалять животных из стада на много раньше, что за собой повлечет более ускоренное проведение данных мероприятий.
2.3.2 Определение наличия ДНК провируса лейкоза крупного рогатого скота методом ПЦР в режиме реальном времени
Так как вирус лейкоза может передаваться через плаценту (трансплацентарно) с зараженными лимфоцитами матери преодолевая плацентарный барьер, то по некоторым данным, около 20 % телят, зараженных вирусом ВЛКРС от матерей, могут рождаться инфицированными.
Программы оздоровления хозяйств от лейкоза созданы на основе применении диагностики серологических методов (РИД и ИФА), предупреждение контакта животных, свободных от вируса лейкоза крупного рогатого скота.
Перспективной в этом направлении является полимеразная цепная реакция (ПЦР), позволяющая выявить провирусную РНК в крови животного.
С помощью ПЦР можно выявить провирус лейкоза КРС. Итог анализа не зависит от возраста и состояния животного, поэтому ПЦР можно использовать для разделения телят на инфицированных и здоровых в возрасте от 14 дней до 5 месяцев (в этом возрасте применять РИД не имеет смысла).
Процент инфицированных телят к 3-месячному возрасту, по данным ПЦР, практически соответствует проценту РИД-позитивных особей, но в более позднем возрасте (к 3 годам). По-видимому, это свидетельствует о том, что заражение животных происходит в раннем возрасте (трансплацентарно и до 3 месяцев), а первые иммунологические признаки болезни появляются после первой лактации. Таким образом, если в первые недели жизни методом ПЦР разделить телочек на носителей провируса и здоровых, то оздоровить хозяйство можно значительно быстрее.
Исследования на выявление ДНК провируса лейкоза у телят с 14- дневного (Bovine leucosis virus, BLV) проводились в научно-исследовательской лаборатории «Биохимических, молекулярно-генетических исследований и селекции сельскохозяйственных животных» при применении наборов производства «ВЕТ ФАКТОР».
Выделение нуклеиновых кислот проводили набором реагентов для экстрации ДНК/РНК из биологического материала «ДНК/РНК-С-ФАКТОР» («ВЕТ ФАКТОР», Россия) согласно инструкции по применению.
Общий объем реакционной смеси составил 25 мкл, в том числе 10 мкл выделенной ДНК-пробы.
Непосредственно полимеразную цепную реакции (ПЦР) с флуоресцентной детекцией в режиме реального времени проводили на ДНК-Амплификатор CFX96 Touch Real Time System (производства Bio-Rad, США) при температурно-временном режиме:
1. Начальная денатурация 95 0С – 5 минут;
2. 10 циклов (денатурация 95 оС – 30 сек., отжиг 60 оС – 30 сек., элонгация 72 оС – 30 сек.)
3. 35 циклов (денатурация 95 оС – 10 сек., отжиг 56 оС – 20 сек., элонгация 72 оС – 20 сек.) Детекция проводилась на этапе отжига праймеров.
Учет результатов ПЦР-анализа проводили по наличию или отсутствию пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией (что соответствует наличию или отсутствию значения порогового цикла «Ct» для исследуемого образца) (таблица 9).
Таблица 9 – Результаты исследований методом ПЦР по хозяйствам
| Хозяйство | Всего проб | ПЦР – пол. «+» |
| ИП «Зинченко В.Д. глава КФХ» ферма № 1
с. Сидоренково |
6 | 2 (33,3%) |
| ИП «Зинченко В.Д. глава КФХ» ферма № 2
с. Поморцево |
6 | — |
| Всего | 12 | 12(33,3%) |
При исследовании 12 проб цельной крови от телят 14-дневного возраста в 2 пробах выявлена ДНК провируса лейкоза, что составило 33,3 % от числа исследованных образцов.
2.4 Изучение наследственной детерминации устойчивости к вирусу лейкоза и генотипическое разнообразие в популяциях с учетом возраста и физиологического состояния крупного рогатого скота
2.4.1 Наследственная детерминация устойчивости крупного рогатого скота Кузбасса к вирусу лейкоза и генотипическое разнообразиев популяциях с учетом физиологического состояния животных
Объект исследований – коровы черно-пестрой породы двух хозяйств Кемеровской области: ООО «Горскино» Гурьевского района и ИП Зинченко (ферма № 1 с. Сидоренково и ферма № 2 с. Поморцево) Беловского района.
Материалом для изучения полиморфизма гена BoLA-DRB3 послужила кровь животных (коров) черно-пестрой породы. Для исследований была отобрана кровь 200 голов. Идентифицировать аллели гена BoLA-DRB3 удалось у 187 голов (таблица 10).
Таблица 10 – Выборка коров
| Порода | Хозяйство | Статус поголовья | Количество, голов |
| Черно-пестрая | ООО «Горскино», ИП Зинченко -ферма № 1 с. Сидоренково | Больные животные | 122 |
| ИП Зинченко -ферма № 2 с. Поморцево | Здоровые животные | 65 | |
| ИТОГО | 187 | ||
Исследовались две популяции коров в зависимости от физиологического состояния – здоровое поголовье и поголовье животных, пораженных вирусом бычьего лейкоза.
Диагностирование заболевания лейкозом устанавливалось на основании эпизоотологических, клинических и результатов лабораторных исследований. Исследования проведены на базе научно-исследовательской лаборатории «Биохимических, молекулярно-генетических исследований и селекции сельскохозяйственных животных» ФГБОУ ВО Кемеровская государственная сельскохозяйственная академия в 2019 году.
Генотипирование крупного рогатого скота по локусам BoLA DRB3 производилось по образцам крови методами полимеразной цепной реакции (ПЦР) с последующим анализом полиморфизма длин фрагментов рестрикции (ПДРФ) в условиях лаборатории ООО «Мой ген» (г. Москва).
Определение частот аллелей проводилось с учетом количества гомозигот и гетерозигот по соответствующему аллелю по формуле 1:
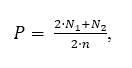 |
(1) |
где N1 и N2 – соответственно, количество гомозигот и гетерозигот для исследуемого аллеля;
n – объем выборки.
Статистическую ошибку для частоты аллеля определяли по формуле 2:
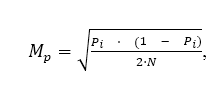 |
(2) |
где Pi – частота аллеля;
N – количество животных.
Для биометрического анализа данных использовали приложение MS Exel (Microsoft office).
Аллельный полиморфизм гена BoLA DRB3
Лейкоз крупного рогатого скота является одним из основных заболеваний, распространенных на животноводческих предприятиях большинства регионов России [1, 6, 9].
Современные ДНК-технологии, получившие широкое распространение в животноводстве в развитых странах мира, способствуют развитию геномной селекции и направленной селекционно-племенной работе с сельскохозяйственными животными. Генетическая экспертиза животных в настоящее время является важнейшим элементом селекционной работы при совершенствовании и разведении высокопродуктивного скота [19, 22, 23, 25, 26]. Молекулярно-генетический анализ генома для определения наличия или отсутствия хозяйственно — ценных признаков у исследуемого животного, позволяет осуществлять его оценку как по параметрам продуктивности, так на устойчивость к заболеваниям [20, 21, 24, 27].
Многочисленные исследования, проведенные на большом поголовье животных в ряде стран мира, позволили установить более частое проявление лейкоза в потомстве одних и тех же быков, что вполне может указывать на генетическую составляющую в распространении заболевания вируса лейкоза крупного рогатого скота. Исследователи отмечают существующую связь между определенными аллелями гена BOLA-DRB-3 главного комплекса гистосовместимости и восприимчивостью к лейкозу [11, 14, 15, 17, 20, 28, 29]. Также установлено, что восприимчивость животного, как правило, связана с его повышенной продуктивностью — у высокопродуктивных животных преобладают аллели чувствительности к ВЛ КРС [2, 4, 5, 9, 10, 15].
Ген BoLa-DRB3 Bos taurus отличается высоким аллельным полиморфизмом. На сегодняшний день известно о 119 его аллельных вариантах. Одни аллели этого гена ассоциированы с устойчивостью к заболеванию лейкозом, другие – с восприимчивостью к этому заболеванию, третьи же не имеет ассоциативных связей с заболеванием животных лейкозом (нейтральные аллели).
Многочисленными исследованиями доказана связь аллелей 0902, 2701, 2702, 2703, 2704, 2705, 2706, 0701 с устойчивостью животных к заболеванию лейкозом и связь аллелей 1201, 1501, 1502, 1101, 0101, 0102 с восприимчивостью к этому заболеванию [3].
Для научного исследования была отобрана группа животных черно-пестрой породы крупного рогатого скота, разводимого в условиях Кемеровской области, в количестве 187 голов коров.
В результате исследования животных на носительство аллелей гена BoLa-DRB3 было идентифицировано 55 аллельных вариантов исследуемого гена.
Наличие большого количества аллельных вариантов обусловлено формированием породы и согласуется с данными многих авторов [2, 3, 7, 8, 12-16, 18, 28, 29].
Из аллелей, ассоциированных с устойчивостью к лейкозу, выявлены 4 варианта – 0701, 0902, 2701 и 2703 (в 2018 году было выявлено меньше вариаций — 3 аллеля – 0701, 0902, 2703). Из аллелей, ассоциированных с восприимчивостью к лейкозу, — 4 варианта – 0101, 1101, 1201 и 1501 (в 2018 году были те же 4 аллели: 0101, 1101, 1201 и 1501). Остальные определенные аллели относятся к нейтральным, то есть связь между их наличием в генотипе животного и устойчивостью либо восприимчивостью к заболеванию лейкозом не доказана – 0103, 0201, 0401, 0501, 0601, 0801, 1001, 1002, 1103, 1202, 1301, 1302, 1504, 1505, 1601, 1602, 1701, 1801, 1901, 1902, 2002, 2101, 2201, 2601, 2707, 2801, 2802, 3101, 3103, 3501, 3601, 3801, 4001, 4401, 5101, 5701, 5702, 5801, 6101, 6401, 6601, 6701, 6801, 7001, 14011, 20012, 46011.
Частота встречаемости различных вариантов аллелей представлена в таблицах 11-13.
Таблица 11 – Частота встречаемости у исследуемого поголовья аллелей гена BoLa-DRB3, ассоциированных с устойчивостью к лейкозу
| Аллель | Количество носителей | Число аллелей | Частота встречаемости |
| 0701 | 17 | 17 | 0,04545+0,010770 |
| 0902 | 15 | 21 | 0,05615+0,011904 |
| 2701 | 1 | 1 | 0,00267+0,002665 |
| 2703 | 4 | 4 | 0,01070+0,005320 |
| Итого | 37 | 43 | 0,11497+0,016492 |
В изучаемой популяции частота встречаемости устойчивых к вирусу лейкоза аллелей составила 11,5 %. Наибольшее распространение имеет аллель 0902 – 5,62 %. Следует отметить, что только эта аллель из группы устойчивости к лейкозу встречается в генотипе животных популяции крупного рогатого скота, разводимого в Кузбассе, в гомозиготном состоянии
Таблица 12 – Частота встречаемости у исследуемого поголовья аллелей гена BoLa-DRB3, ассоциированных с восприимчивостью к лейкозу
| Аллель | Количество носителей | Число аллелей | Частота встречаемости |
| 0101 | 26 | 26 | 0,06952+0,013149 |
| 1101 | 58 | 59 | 0,15775+0,018847 |
| 1201 | 25 | 25 | 0,06684+0,012911 |
| 1501 | 56 | 58 | 0,15508+0,018716 |
| Итого | 165 | 168 | 0,44919+0,025720 |
Частота аллелей, имеющих связь с чувствительностью коров к вирусу бычьего лейкоза, в исследуемой популяции составила 44,9 %. Все четыре идентифицированных аллеля чувствительности к лейкозу имеют частоту распространения более 5 %. При этом наиболее часто встречаются аллели 1101 – 15,8 % и 1501 – 15,5 % — как в гетерозиготном, так и в гомозиготном состоянии.
Таблица 13 – Частота встречаемости у исследуемого поголовья аллелей гена BoLa-DRB3, нейтральных по отношению к вирусу лейкоза
| Аллель | Количество носителей | Число аллелей | Частота встречаемости |
| 0103 | 1 | 1 | 0,00267+0,002665 |
| 0201 | 2 | 2 | 0,00535+0,003768 |
| 0401 | 1 | 1 | 0,00267+0,002665 |
| 0501 | 1 | 1 | 0,00267+0,002665 |
| 0601 | 28 | 29 | 0,07754+0,013828 |
| 0801 | 6 | 6 | 0,01604+0,006488 |
| 1001 | 13 | 13 | 0,03476+0,009471 |
| 1002 | 3 | 3 | 0,00802+0,004604 |
| 1103 | 3 | 3 | 0,00802+0,004604 |
| 1202 | 1 | 1 | 0,00267+0,002665 |
| 1301 | 1 | 1 | 0,00267+0,002665 |
| 1302 | 2 | 2 | 0,00535+0,003768 |
| 1504 | 4 | 4 | 0,01070+0,005320 |
| 1505 | 1 | 1 | 0,00267+0,002665 |
| 1601 | 2 | 2 | 0,00535+0,003768 |
| 1602 | 2 | 2 | 0,00535+0,003768 |
| 1701 | 1 | 1 | 0,00267+0,002665 |
| 1801 | 27 | 27 | 0,07219+0,013379 |
| 1901 | 2 | 2 | 0,00535+0,003768 |
| 1902 | 3 | 3 | 0,00802+0,004604 |
| 2002 | 1 | 1 | 0,00267+0,002665 |
| 2101 | 2 | 2 | 0,00535+0,003768 |
| 2201 | 1 | 1 | 0,00267+0,002665 |
| 2601 | 4 | 4 | 0,01070+0,005320 |
| 2707 | 1 | 1 | 0,00267+0,002665 |
| 2801 | 1 | 1 | 0,00267+0,002665 |
| 2802 | 1 | 1 | 0,00267+0,002665 |
| 3101 | 3 | 3 | 0,00802+0,004604 |
| 3103 | 3 | 3 | 0,00802+0,004604 |
| 3501 | 1 | 1 | 0,00267+0,002665 |
| 3601 | 2 | 2 | 0,00535+0,003768 |
| 3801 | 1 | 1 | 0,00267+0,002665 |
| 4001 | 1 | 1 | 0,00267+0,002665 |
| 4401 | 1 | 1 | 0,00267+0,002665 |
Продолжение таблицы 13
| Аллель | Количество носителей | Число аллелей | Частота встраиваемости |
| 5101 | 2 | 2 | 0,00535+0,003768 |
| 5701 | 1 | 1 | 0,00267+0,002665 |
| 5702 | 2 | 2 | 0,00535+0,003768 |
| 5801 | 1 | 1 | 0,00267+0,002665 |
| 6101 | 1 | 1 | 0,00267+0,002665 |
| 6401 | 1 | 1 | 0,00267+0,002665 |
| 6601 | 1 | 1 | 0,00267+0,002665 |
| 6701 | 3 | 3 | 0,00802+0,004604 |
| 6801 | 2 | 2 | 0,00535+0,003768 |
| 7001 | 3 | 3 | 0,00802+0,004604 |
| 14011 | 14 | 14 | 0,03743+0,009813 |
| 20012 | 1 | 1 | 0,00267+0,002665 |
| 46011 | 3 | 3 | 0,00802+0,004604 |
| Итого | 162 | 163 | 0,43576+0,025640 |
Наибольший полиморфизм отмечен по нейтральным аллелям гена BoLa-DRB3 – 47 вариантов. В целом их частота составила 43,6 %. Наибольшее распространение имеют аллели 0601 – 7,8 % и 1801 – 7,2 %. Остальные варианты составляют менее 5 % частоты каждый.
В целом по изучаемой группе коров совокупная частота нейтральных аллелей составила 43,6 %, аллелей, ассоциированных с устойчивостью к заболеванию лейкозом – 11,5 % и аллелей, ассоциированных с восприимчивостью к заболеванию лейкозом – 44,9 % (рисунок 27).
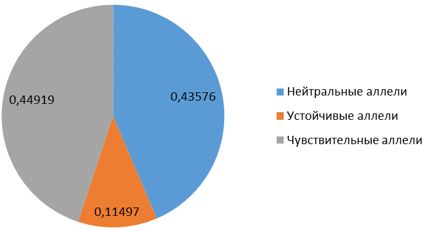
Рисунок 27 – Распределение частот аллелей
С частотой встречаемости более 5 % выявлено 7 аллелей гена BoLa-DRB3. Из них два аллеля нейтральных — 0601 — 7,8 % и 1801 – 7,2 %, один аллель, ассоциированный с устойчивостью к лейкозу — 0902 – 5,6 %, а остальные 4 аллеля (0101, 1101, 1201 и 1501) ассоциированы с чувствительностью к лейкозу – их частота колеблется от 6,7 до 15,8 %.
Таким образом, в изучаемой группе наблюдается преимущественное распределение аллелей, связанных с восприимчивостью к заболеванию лейкозом и нейтральных – 88,5 %, причем аллели чувствительности преобладают – 44,9 % против 43,6% нейтральных. Частота же желательных аллелей, связанных с устойчивостью к заболеванию лейкозом, составляет всего 11,5 %.
2.4.2 Распределения генотипов по гену BoLA-DRB3 в популяции черно-пестрой породы крупного рогатого скота Кемеровской области
У исследуемого поголовья крупного рогатого скота черно-пестрой породы наблюдается высокий уровень разнообразия генотипов – всего было выявлено 84 варианта различных сочетаний аллелей (таблица 14). Констатируемая ситуация объясняется тем, что полиморфизм гена поддерживается на уровне популяции. Индивидуум может быть носителем только двух аллелей определенного гена. В популяции же набор аллелей может быть очень разнообразным, а их разнообразное сочетание ведет к огромному многообразию генотипов.
Таблица 14 – Разнообразие генотипов и их частота (%)
| № п/п | Генотип | Обозначение генотипа | Все поголовье | |
| голов | частота | |||
| 1 | 1504 / 1701 | Н/Н | 1 | 0,53 |
| 2 | 0601 / 1411 | Н/Н | 1 | 0,53 |
| 3 | 1901 / 3101 | Н/Н | 1 | 0,53 |
| 4 | 1504 / 2201 | Н/Н | 1 | 0,53 |
| 5 | 0601 / 1504 | Н/Н | 1 | 0,53 |
| 6 | 1001 / 1301 | Н/Н | 1 | 0,53 |
| 7 | 5801 / 6801 | Н/Н | 1 | 0,53 |
| 8 | 1001 / 1103 | Н/Н | 1 | 0,53 |
| 9 | 1001 / 4401 | Н/Н | 1 | 0,53 |
| 10 | 1801 / 1901 | Н/Н | 1 | 0,53 |
| 11 | 5701 / 6801 | Н/Н | 1 | 0,53 |
| 12 | 1602 / 6101 | Н/Н | 1 | 0,53 |
| 13 | 1505 / 6601 | Н/Н | 1 | 0,53 |
Продолжение таблицы 14
| № п/п | Генотип | Обозначение генотипа | Все поголовье | |
| голов | частота | |||
| 14 | 0103 / 0201 | Н/Н | 1 | 0,53 |
| 15 | 3103 / 6701 | Н/Н | 1 | 0,53 |
| 16 | 3101 / 6701 | Н/Н | 1 | 0,53 |
| 17 | 1001 / 0801 | Н/Н | 1 | 0,53 |
| 18 | 1103 / 1801 | Н/Н | 1 | 0,53 |
| 19 | 1001 / 5702 | Н/Н | 1 | 0,53 |
| 20 | 1801 / 6701 | Н/Н | 1 | 0,53 |
| 21 | 1103 / 3601 | Н/Н | 1 | 0,53 |
| 22 | 0401 / 1801 | Н/Н | 1 | 0,53 |
| 23 | 1202 / 1902 | Н/Н | 1 | 0,53 |
| 24 | 0601 / 0601 | Н/Н | 1 | 0,53 |
| 25 | 0601 / 2802 | Н/Н | 1 | 0,53 |
| 26 | 1201 / 1602 | Ч/Н | 1 | 0,53 |
| 27 | 1501 / 2801 | Ч/Н | 1 | 0,53 |
| 28 | 1201 / 1302 | Ч/Н | 1 | 0,53 |
| 29 | 1201 / 5702 | Ч/Н | 1 | 0,53 |
| 30 | 1101 / 20012 | Ч/Н | 1 | 0,53 |
| 31 | 1101 / 0501 | Ч/Н | 1 | 0,53 |
| 32 | 1101 / 3501 | Ч/Н | 1 | 0,53 |
| 33 | 1201 / 2707 | Ч/Н | 1 | 0,53 |
| 34 | 1101 / 1001 | Ч/Н | 1 | 0,53 |
| 35 | 0101 / 1302 | Ч/Н | 1 | 0,53 |
| 36 | 1501 / 3801 | Ч/Н | 1 | 0,53 |
| 37 | 0101 / 0201 | Ч/Н | 1 | 0,53 |
| 38 | 0101 / 5101 | Ч/Н | 1 | 0,53 |
| 39 | 1501 / 2601 | Ч/Н | 1 | 0,53 |
| 40 | 1201 / 6401 | Ч/Н | 1 | 0,53 |
| 41 | 1201 / 4001 | Ч/Н | 1 | 0,53 |
| 42 | 1201 / 3103 | Ч/Н | 1 | 0,53 |
| 43 | 1201 / 3101 | Ч/Н | 1 | 0,53 |
| 44 | 1101 / 3601 | Ч/Н | 1 | 0,53 |
| 45 | 1101 / 1101 | Ч/Ч | 1 | 0,53 |
| 46 | 0902 / 2703 | У/У | 1 | 0,53 |
| 47 | 0701 / 2703 | У/У | 1 | 0,53 |
| 48 | 0701 / 0902 | У/У | 1 | 0,53 |
| 49 | 0701 / 1101 | У/Ч | 1 | 0,53 |
| 50 | 0902 / 1101 | У/Ч | 1 | 0,53 |
| 51 | 0701 / 0101 | У/Ч | 1 | 0,53 |
| 52 | 2701 / 1501 | У/Ч | 1 | 0,53 |
| 53 | 0902 / 1501 | У/Ч | 1 | 0,53 |
| 54 | 2703 / 3103 | У/Н | 1 | 0,53 |
Продолжение таблицы 14
| № п/п | Генотип | Обозначение генотипа | Все поголовье | |
| голов | частота | |||
| 55 | 0902 / 1002 | У/Н | 1 | 0,53 |
| 56 | 0701 / 2002 | У/Н | 1 | 0,53 |
| 57 | 2703 / 1002 | У/Н | 1 | 0,53 |
| 58 | 0701 / 1002 | У/Н | 1 | 0,53 |
| 59 | 0701 / 1504 | У/Н | 1 | 0,53 |
| 60 | 0902 / 14011 | У/Н | 1 | 0,53 |
| 61 | 0701 / 1801 | У/Н | 1 | 0,53 |
| 62 | 0701 / 5101 | У/Н | 1 | 0,53 |
| 63 | 0601 / 2101 | Н/Н | 2 | 1,07 |
| 64 | 1601 / 0601 | Н/Н | 2 | 1,07 |
| 65 | 1001 / 1801 | Н/Н | 2 | 1,07 |
| 66 | 0101 / 1001 | Ч/Н | 2 | 1,07 |
| 67 | 1201 / 1902 | Ч/Н | 2 | 1,07 |
| 68 | 1201 / 0801 | Ч/Н | 2 | 1,07 |
| 69 | 0101 / 1101 | Ч/Ч | 2 | 1,07 |
| 70 | 1501 / 1501 | Ч/Ч | 2 | 1,07 |
| 71 | 1101 / 1201 | Ч/Ч | 2 | 1,07 |
| 72 | 2601 / 7001 | Н/Н | 3 | 1,60 |
| 73 | 0801 / 46011 | Н/Н | 3 | 1,60 |
| 74 | 1101 / 14011 | Ч/Н | 3 | 1,60 |
| 75 | 0902 / 1001 | У/Н | 3 | 1,60 |
| 76 | 1201 / 1501 | Ч/Ч | 4 | 2,15 |
| 77 | 0902 / 0902 | У/У | 6 | 3,22 |
| 78 | 1201 / 0601 | Ч/Н | 7 | 3,75 |
| 79 | 0701 / 1501 | У/Ч | 8 | 4,28 |
| 80 | 1501 / 14011 | Ч/Н | 9 | 4,81 |
| 81 | 1101 / 1501 | Ч/Ч | 10 | 5,35 |
| 82 | 1101 / 0601 | Ч/Н | 13 | 6,95 |
| 83 | 0101 / 1501 | Ч/Ч | 18 | 9,63 |
| 84 | 1101 / 1801 | Ч/Н | 20 | 10,70 |
Примечание: У – аллель устойчивости к лейкозу; Н – нейтральная аллель; Ч – аллель восприимчивости к лейкозу.
Из 84 генотипов 62 были представлены в единичном экземпляре и 9 имели по два животных. Преобладающие генотипы выявит трудно. С частотой больше 5% представлены генотипы 1101 / 1801 (Ч/Н) – 10,70 %, 0101 / 1501 (Ч/Ч) – 9,63 %; 1101 / 0601 (Ч/Н) – 6,95 % и 1101 / 1501 (Ч/Ч) — 5,35 %.
Таким образом, в стаде преобладают генотипы, несущие в своем составе аллель чувствительности к лейкозу.
При изучении популяции на устойчивость или восприимчивость к вирусу бычьего лейкоза особое внимание необходимо уделять распределению генотипов.
Все имеющиеся в исследуемой популяции генотипы исходя из функциональной значимости аллелей были разбиты на группы: чувствительности / чувствительности (ЧЧ), устoйчивoсти / устoйчивoсти (УУ), нейтральный / нейтральный (НН), устoйчивoсти / нейтрaльный (УH), чувствительности / нейтральный (ЧН) и устойчивости / чувствительности (УЧ). Генотипы первых трех групп теоретически должны обеспечивать устойчивость к лейкозу крупного рогатого скота.
На рисунке 28 представлено распределение частот групп генотипов животных черно-пестрой породы, разводимых в условиях Кузбасса.
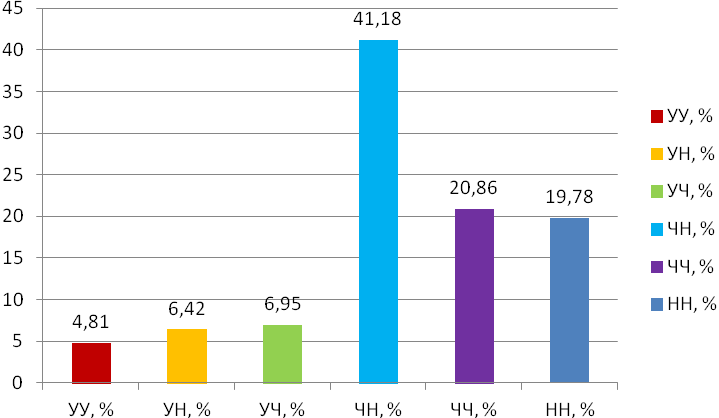
Рисунок 28 – Частота генотипов по функциональным группам аллелей, %
В исследуемой популяции коров черно-пестрой породы частота генотипов устойчивости к Bovine leucosis virus составляет в целом 18,18 %, а генотипов, не несущих аллели устойчивости и несущих аллели восприимчивости и, – 62,04 %, т.е. выше в 3,4 раза.
Наиболее часто встречается в рамках одного генотипа сочетание аллеля, обусловливающего чувствительность к лейкозу, и нейтрального аллеля – 41,18 %, а также coчетание двух аллeлeй, обусловливающих восприимчивость к вирусу лейкозу – 20,86 % и нейтральных – 19,78 %.
Таким образом, в изучаемой популяции черно-пестрого скота Кемеровской области преобладают BoLA-DRB3-генотипы, ассоциированные с восприимчивостью к лейкозу крупного рогатого скота.
2.4.3 Полиморфизм гена BoLA-DRB3 в зависимости от физиологического состояния животных, разводимых в условиях Кузбасса
Аллельный полиморфизм гена BoLA-DRB3 в исследуемой выборке здоровых коров представлен 19 аллелями, больных лейкозом животных – 49 аллелями.
Частота встречаемости различных вариантов аллелей у здоровых и больных лейкозом животных черно-пестрой породы представлена в таблицах 6-8.
Из аллелей, ассоциированных с устойчивостью к бычьему лейкозу, у здорового поголовья выявлен только один вариант – 0902 с частотой 9,23 % (таблица 15, рисунок 29).
Таблица 15 – Частота аллелей гена BoLa-DRB3, ассоциированных с устойчивостью к Bovine leucosis virus, у здоровых и больных лейкозом коров
| Аллель | Статус аллели | Частота встречаемости | ||
| все поголовье | больные животные | здоровые животные | ||
| 0701 | У | 0,04545+0,010770 | 0,06967+0,016297 | — |
| 0902 | У | 0,05615+0,011904 | 0,03689+0,012066 | 0,09231+0,025387 |
| 2701 | У | 0,00267+0,002665 | 0,00410+0,004087 | — |
| 2703 | У | 0,01070+0,005320 | 0,01639+0,008124 | — |
| Итого | 0,11497+0,016492 | 0,12705+0,021319 | 0,09231+0,025387 | |
В выборке больных лейкозом животных определены четыре варианта таких аллелей – 0701, 0902, 2701 и 2703 с частотой встречаемости 6,97; 3,69, 0,41 и 1,64 % соответственно. Суммарная частота аллелей составила 12,75 %. Так как частота встречаемости аллелей в группе больных животных очень мала, ее можно отнести к статистической погрешности. По аллелю 0902 необходимо отметить, что в выборке здоровых животных его частота в 2,5 раза выше, чем в выборке животных, больных лейкозом – 9,23 против 3,69 %.
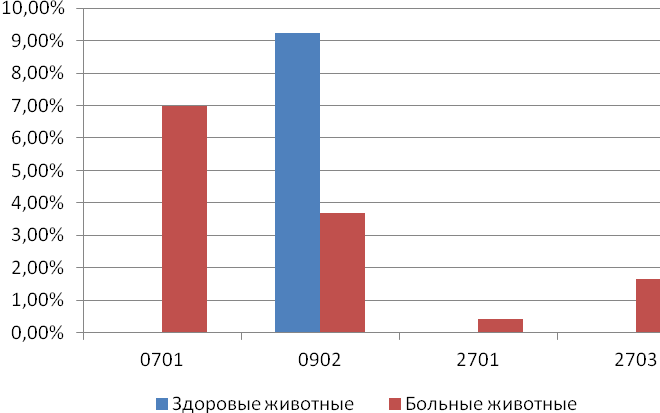
Рисунок 29 – Частота аллелей гена BoLa-DRB3, ассоциированных с устойчивостью к Bovine leucosis virus, у животных разного физиологического состояния
Аналогичная картина по частоте аллелей устойчивости к Bovine leucosis virus в группах здоровых и больных животных наблюдалась и в исследованиях 2018 года. Данный факт говорит о присутствии аллелей устойчивости в генотипе животных, при этом полного доминирования этих аллелей над другими в генотипе в данной популяции не наблюдается.
Из аллелей, ассоциированных с восприимчивостью к лейкозу, были определены 4 варианта: 0101,1101,1201 и 1501 (таблица 16). При этом частота их встречаемости в выборке здоровых животных составила, соответственно, 7,79; 10,66; 6,56; и 20,90 %, в выборке больных лейкозом животных – 5,39; 25,39; 6,92 и 5,39 % соответственно. В группе больных животных преобладает распространение аллеля 1501, а в группе здоровых особей – аллеля 1101. В целом частота встречаемости аллелей чувствительности к вирусу бычьего лейкоза несколько выше в группе больных животных (рисунок 30).
Таблица 16 – Частота аллелей гена BoLa-DRB3, ассоциированных с чувствительностью к Bovine leucosis virus, у здоровых и больных лейкозом коров
| Аллель | Статус аллели | Частота встречаемости | ||
| все поголовье | больные животные | здоровые животные | ||
| 0101 | В | 0,06952+0,013149 | 0,07787+0,017152 | 0,05385+0,019796 |
| 1101 | В | 0,15775+0,018847 | 0,10656+0,019751 | 0,25385+0,038171 |
| 1201 | В | 0,06684+0,012911 | 0,06557+0,015846 | 0,06923+0,022262 |
| 1501 | В | 0,15508+0,018716 | 0,20902+0,026029 | 0,05385+0,019796 |
| Итого | 0,44919+0,025720 | 0,45902+0,031901 | 0,43077+0,043430 | |
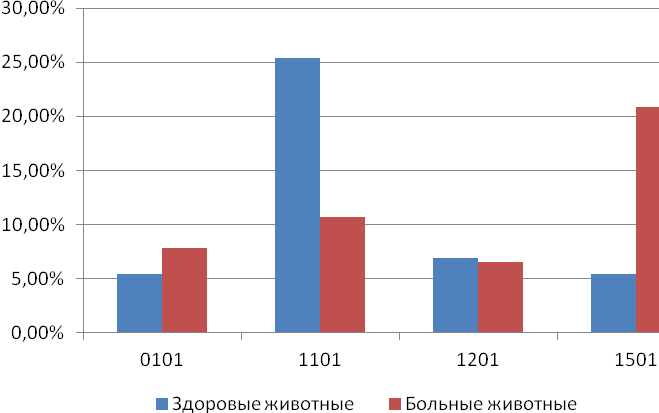
Рисунок 30 – Частота аллелей гена BoLa-DRB3, обусловливающих чувствительность к Bovine leucosis virus, у животных разного физиологического состояния
Таким образом, анализ распространения аллелей восприимчивости к лейкозу крупного рогатого скота в группах животных говорит о насыщенности популяции данными вариантами аллелей и возможности их дальнейшего распространения в потомстве при разведении здоровых животных, что повышает вероятность появления в популяции черно-пестрой породы Кузбасса гомозиготных восприимчивых генотипов.
Остальные идентифицированные аллели относятся к нейтральным (таблица 17, рисунок 31). При этом суммарная частота их в выборке здоровых животных составила 47,69 %, в выборке больных лейкозом животных – 41,39 %.
Таблица 17 – Частота нейтральных аллелей гена BoLa-DRB3 у здоровых и больных лейкозом коров
| Аллель | Статус аллели | Частота встречаемости | ||
| все поголовье | больные животные | здоровые животные | ||
| 0103 | Н | 0,00267+0,002665 | 0,00410+0,004087 | — |
| 0201 | Н | 0,00535+0,003768 | 0,00820+0,005771 | — |
| 0401 | Н | 0,00267+0,002665 | — | 0,00769+0,007655 |
| 0501 | Н | 0,00267+0,002665 | 0,00410+0,004087 | — |
| 0601 | Н | 0,07754+0,013828 | 0,01639+0,008124 | 0,19231+0,034566 |
| 0801 | Н | 0,01604+0,006488 | 0,02459+0,009915 | — |
Продолжение таблицы 17
| Аллель | Статус аллели | Частота встречаемости | ||
| все поголовье | больные животные | здоровые животные | ||
| 1001 | Н | 0,03476+0,009471 | 0,04918+0,013842 | 0,00769+0,007655 |
| 1002 | Н | 0,00802+0,004604 | 0,01230+0,007050 | — |
| 1103 | Н | 0,00802+0,004604 | 0,00410+0,004087 | 0,01538+0,010789 |
| 1202 | Н | 0,00267+0,002665 | — | 0,00769+0,007655 |
| 1301 | Н | 0,00267+0,002665 | 0,00410+0,004087 | — |
| 1302 | Н | 0,00535+0,003768 | 0,00820+0,005771 | — |
| 1504 | Н | 0,01070+0,005320 | 0,01639+0,008124 | — |
| 1505 | Н | 0,00267+0,002665 | 0,00410+0,004087 | — |
| 1601 | Н | 0,00535+0,003768 | — | 0,01538+0,010789 |
| 1602 | Н | 0,00535+0,003768 | 0,00820+0,005771 | — |
| 1701 | Н | 0,00267+0,002665 | 0,00410+0,004087 | — |
| 1801 | Н | 0,07219+0,013379 | 0,02049+0,009066 | 0,16923+0,032885 |
| 1901 | Н | 0,00535+0,003768 | 0,00820+0,005771 | — |
| 1902 | Н | 0,00802+0,004604 | 0,00820+0,005771 | 0,00769+0,007655 |
| 2002 | Н | 0,00267+0,002665 | 0,00410+0,004087 | — |
| 2101 | Н | 0,00535+0,003768 | — | 0,01538+0,010789 |
| 2201 | Н | 0,00267+0,002665 | 0,00410+0,004087 | — |
| 2601 | Н | 0,01070+0,005320 | 0,01639+0,008124 | — |
| 2707 | Н | 0,00267+0,002665 | 0,00410+0,004087 | — |
| 2801 | Н | 0,00267+0,002665 | 0,00410+0,004087 | — |
| 2802 | Н | 0,00267+0,002665 | — | 0,00769+0,007655 |
| 3101 | Н | 0,00802+0,004604 | 0,01230+0,007050 | — |
| 3103 | Н | 0,00802+0,004604 | 0,01230+0,007050 | — |
| 3501 | Н | 0,00267+0,002665 | 0,00410+0,004087 | — |
| 3601 | Н | 0,00535+0,003768 | — | 0,01538+0,010789 |
| 3801 | Н | 0,00267+0,002665 | 0,00410+0,004087 | — |
| 4001 | Н | 0,00267+0,002665 | 0,00410+0,004087 | — |
| 4401 | Н | 0,00267+0,002665 | 0,00410+0,004087 | — |
| 5101 | Н | 0,00535+0,003768 | 0,00820+0,005771 | — |
| 5701 | Н | 0,00267+0,002665 | 0,00410+0,004087 | — |
| 5702 | Н | 0,00535+0,003768 | 0,00410+0,004087 | 0,00769+0,007655 |
| 5801 | Н | 0,00267+0,002665 | 0,00410+0,004087 | — |
| 6101 | Н | 0,00267+0,002665 | 0,00410+0,004087 | — |
| 6401 | Н | 0,00267+0,002665 | 0,00410+0,004087 | — |
Продолжение таблицы 17
| Аллель | Статус аллели | Частота встречаемости | ||
| все поголовье | больные животные | здоровые животные | ||
| 6601 | Н | 0,00267+0,002665 | 0,00410+0,004087 | — |
| 6701 | Н | 0,00802+0,004604 | 0,00820+0,005771 | 0,00769+0,007655 |
| 6801 | Н | 0,00535+0,003768 | 0,00820+0,005771 | — |
| 7001 | Н | 0,00802+0,004604 | 0,01230+0,007050 | — |
| 14011 | Н | 0,03743+0,009813 | 0,05738+0,014886 | — |
| 20012 | Н | 0,00267+0,002665 | 0,00410+0,004087 | — |
| 46011 | Н | 0,00802+0,004604 | 0,01230+0,007050 | — |
| Итого | 0,43576+0,025640 | 0,41393+0,031531 | 0,47692+0,013805 | |
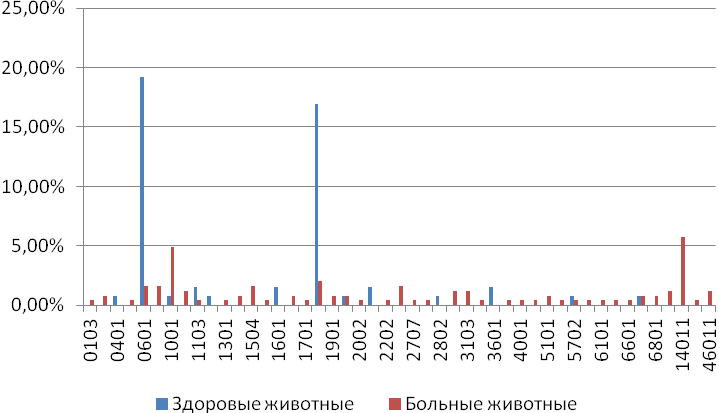
Рисунок 31 – Частота нейтральных аллелей гена BoLa-DRB3
Распределение аллелей в целом по изучаемым группам представлено на рисунке 32.
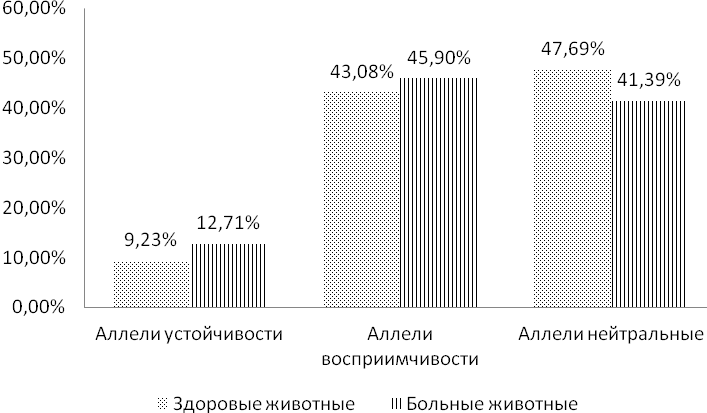
Рисунок 32– Частота аллелей в зависимости от физиологического состояния животных, %
По суммарному распределению частот аллелей разного статуса между группами здоровых и больных лейкозом животных фактической разницы не отмечено. То есть популяция насыщена разными по статусу аллелями гена BoLA-DRB3 примерно пропорционально. Это говорит о необходимости разработки селекционной программы с целью насыщения геномов популяции черно-пестрого скота Кемеровской области аллелями, ассоциированными с устойчивостью к заболеванию лейкозом.
При оценке генетической структуры популяции большее значение имеет частота встречаемости гомозиготных и гетерозиготных организмов.
В таблице 18 и на рисунке 33 представлены распределения частот групп генотипов больных и здоровых животных.
Таблица 18 – Распределение частот групп генотипов, %
| № п/п | Генотип | Обозначение генотипа | Все поголовье | Больные лейкозом коровы | Здоровые коровы |
| 1 | 1504 / 1701 | Н/Н | 0,53 | 0,82 | — |
| 2 | 1001 / 4401 | Н/Н | 0,53 | 0,82 | — |
| 3 | 1801 / 1901 | Н/Н | 0,53 | 0,82 | — |
| 4 | 5701 / 6801 | Н/Н | 0,53 | 0,82 | — |
| 5 | 1602 / 6101 | Н/Н | 0,53 | 0,82 | — |
| 6 | 1505 / 6601 | Н/Н | 0,53 | 0,82 | — |
| 7 | 0601 / 1411 | Н/Н | 0,53 | 0,82 | — |
Продолжение таблицы 18
| № п/п | Генотип | Обозначение генотипа | Все поголовье | Больные лейкозом коровы | Здоровые коровы |
| 8 | 1901 / 3101 | Н/Н | 0,53 | 0,82 | — |
| 9 | 1504 / 2201 | Н/Н | 0,53 | 0,82 | — |
| 10 | 0601 / 1504 | Н/Н | 0,53 | 0,82 | — |
| 11 | 1001 / 1301 | Н/Н | 0,53 | 0,82 | — |
| 12 | 5801 / 6801 | Н/Н | 0,53 | 0,82 | — |
| 13 | 1001 / 1103 | Н/Н | 0,53 | 0,82 | — |
| 14 | 0103 / 0201 | Н/Н | 0,53 | 0,82 | — |
| 15 | 3103 / 6701 | Н/Н | 0,53 | 0,82 | — |
| 16 | 3101 / 6701 | Н/Н | 0,53 | 0,82 | — |
| 17 | 1001 / 0801 | Н/Н | 0,53 | 0,82 | — |
| 18 | 1103 / 1801 | Н/Н | 0,53 | — | 1,54 |
| 19 | 1001 / 5702 | Н/Н | 0,53 | — | 1,54 |
| 20 | 1801 / 6701 | Н/Н | 0,53 | — | 1,54 |
| 21 | 1103 / 3601 | Н/Н | 0,53 | — | 1,54 |
| 22 | 0401 / 1801 | Н/Н | 0,53 | — | 1,54 |
| 23 | 1202 / 1902 | Н/Н | 0,53 | — | 1,54 |
| 24 | 0601 / 0601 | Н/Н | 0,53 | — | 1,54 |
| 25 | 0601 / 2802 | Н/Н | 0,53 | — | 1,54 |
| 26 | 1201 / 1602 | Ч/Н | 0,53 | 0,82 | — |
| 27 | 1501 / 2801 | Ч/Н | 0,53 | 0,82 | — |
| 28 | 1201 / 1302 | Ч/Н | 0,53 | 0,82 | — |
| 29 | 1201 / 5702 | Ч/Н | 0,53 | 0,82 | — |
| 30 | 1101 / 20012 | Ч/Н | 0,53 | 0,82 | — |
| 31 | 1101 / 0501 | Ч/Н | 0,53 | 0,82 | — |
| 32 | 1101 / 3501 | Ч/Н | 0,53 | 0,82 | — |
| 33 | 1201 / 2707 | Ч/Н | 0,53 | 0,82 | — |
| 34 | 1101 / 1001 | Ч/Н | 0,53 | 0,82 | — |
| 35 | 0101 / 1302 | Ч/Н | 0,53 | 0,82 | — |
| 36 | 1501 / 3801 | Ч/Н | 0,53 | 0,82 | — |
| 37 | 0101 / 0201 | Ч/Н | 0,53 | 0,82 | — |
| 38 | 0101 / 5101 | Ч/Н | 0,53 | 0,82 | — |
| 39 | 1501 / 2601 | Ч/Н | 0,53 | 0,82 | — |
| 40 | 1201 / 6401 | Ч/Н | 0,53 | 0,82 | — |
| 41 | 1201 / 4001 | Ч/Н | 0,53 | 0,82 | — |
Продолжение таблицы 18
| № п/п | Генотип | Обозначение генотипа | Все поголовье | Больные лейкозом коровы | Здоровые коровы |
| 42 | 1201 / 3103 | Ч/Н | 0,53 | 0,82 | — |
| 43 | 1201 / 3101 | Ч/Н | 0,53 | 0,82 | — |
| 44 | 1101 / 3601 | Ч/Н | 0,53 | — | 1,54 |
| 45 | 1101 / 1101 | Ч/Ч | 0,53 | 0,82 | — |
| 46 | 0902 / 2703 | У/У | 0,53 | 0,82 | — |
| 47 | 0701 / 2703 | У/У | 0,53 | 0,82 | — |
| 48 | 0701 / 0902 | У/У | 0,53 | 0,82 | — |
| 49 | 0701 / 1101 | У/Ч | 0,53 | 0,82 | — |
| 50 | 0902 / 1101 | У/Ч | 0,53 | 0,82 | — |
| 51 | 0701 / 0101 | У/Ч | 0,53 | 0,82 | — |
| 52 | 2701 / 1501 | У/Ч | 0,53 | 0,82 | — |
| 53 | 0902 / 1501 | У/Ч | 0,53 | 0,82 | — |
| 54 | 2703 / 3103 | У/Н | 0,53 | 0,82 | — |
| 55 | 0902 / 1002 | У/Н | 0,53 | 0,82 | — |
| 56 | 0701 / 2002 | У/Н | 0,53 | 0,82 | — |
| 57 | 2703 / 1002 | У/Н | 0,53 | 0,82 | — |
| 58 | 0701 / 1002 | У/Н | 0,53 | 0,82 | — |
| 59 | 0701 / 1504 | У/Н | 0,53 | 0,82 | — |
| 60 | 0902 / 14011 | У/Н | 0,53 | 0,82 | — |
| 61 | 0701 / 1801 | У/Н | 0,53 | 0,82 | — |
| 62 | 0701 / 5101 | У/Н | 0,53 | 0,82 | — |
| 63 | 0601 / 2101 | Н/Н | 1,07 | — | 3,08 |
| 64 | 1601 / 0601 | Н/Н | 1,07 | — | 3,08 |
| 65 | 1001 / 1801 | Н/Н | 1,07 | 1,64 | — |
| 66 | 0101 / 1001 | Ч/Н | 1,07 | 1,64 | — |
| 67 | 1201 / 1902 | Ч/Н | 1,07 | 1,64 | — |
| 68 | 1201 / 0801 | Ч/Н | 1,07 | 1,64 | — |
| 69 | 0101 / 1101 | Ч/Ч | 1,07 | 1,64 | — |
| 70 | 1501 / 1501 | Ч/Ч | 1,07 | 1,64 | — |
| 71 | 1101 / 1201 | Ч/Ч | 1,07 | — | 3,08 |
| 72 | 2601 / 7001 | Н/Н | 1,60 | 2,46 | — |
| 73 | 0801 / 46011 | Н/Н | 1,60 | 2,46 | — |
| 74 | 1101 / 14011 | Ч/Н | 1,60 | 2,46 | — |
| 75 | 0902 / 1001 | У/Н | 1,60 | 2,46 | — |
Продолжение таблицы 18
| № п/п | Генотип | Обозначение генотипа | Все поголовье | Больные лейкозом коровы | Здоровые коровы |
| 76 | 1201 / 1501 | Ч/Ч | 2,15 | 2,46 | — |
| 77 | 0902 / 0902 | У/У | 3,22 | — | 9,23 |
| 78 | 1201 / 0601 | Ч/Н | 3,75 | — | 10,77 |
| 79 | 0701 / 1501 | У/Ч | 4,28 | 6,56 | — |
| 80 | 1501 / 14011 | Ч/Н | 4,81 | 7,38 | — |
| 81 | 1101 / 1501 | Ч/Ч | 5,35 | 8,20 | — |
| 82 | 1101 / 0601 | Ч/Н | 6,95 | 1,64 | 16,92 |
| 83 | 0101 / 1501 | Ч/Ч | 9,63 | 9,02 | 10,77 |
| 84 | 1101 / 1801 | Ч/Н | 10,70 | 0,82 | 29,23 |
Статистически значимое значение в группе здоровых животных имеют генотипы 0902 / 0902 (УУ), 1201 / 0601 (ЧН), 1101 / 0601 (ЧН), 0101 / 1501 (ЧЧ) и 1101 / 1801 (ЧН). Для группы больных коров такими являются генотипы 0701 / 1501 (УЧ), 1501 / 14011 (ЧН), 1101 / 1501 (ЧЧ) и 0101 / 1501 (ЧЧ).
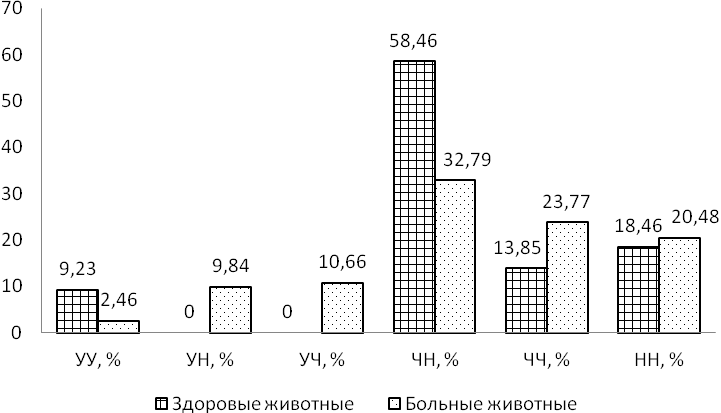
Рисунок 33 – Частота генотипов по группам животных разного физиологического состояния, %
Частота встречаемости генотипов устойчивости в группе здоровых животных составила 9,23 %, а среди больных лейкозом – 22,96 %.
Таким образом, в изучаемой популяции черно-пестрого скота Кемеровской области преобладают BoLA-DRB3-аллели и генотипы, обусловливающие восприимчивость к вирусу бычьего лейкоза. При этом гомозиготные устойчивые к лейкозу генотипы 0902 / 0902 встречаются только в группе здоровых особей.
2.5 Выявление особенности полиморфизма гена вируса лейкоза в стадах крупного рогатого скота Кемеровской области. Проведение анализа и оценки генетической структуры крупного рогатого скота по локусу гена вируса лейкоза
Генотипическое разнообразие ВЛКРС изучали методом генотипирования генов провирусной ДНК – env и tax.
Генотипирование по гену env проводили «nested» ПЦР по методу, описанному Licursi et al. (2002), с последующим ПДРФ анализом с использованием рестриктаз HAEIII, BCL I. Нукелеотидная последовательность генома провирусной ДНК была получена из GeneBank (Acc.num.AF033818).
Структура олигонуклеотидных праймеров для изучения области gp51 гена env ВЛКРС взята из статьи М. Licursi et al. (2002).
Внешние праймеры (фрагмент 598 п.н.):
env5032 (5´-TCTGTGCCAAGTCTCCCAGATA-3´)
env5099 (5´-CCCACAAGGGCGGCGCCGGTTT-3´)
Внутренние праймеры (фрагмент 444 п.н.):
env5521 (5´-GCGAGGCCGGGTCCAGAGCTGG-3´)
env5608 (5´-AACAACAACCTCTGGGAAGGGT-3´)
Полимеразную цепную реакцию (ПЦР) проводили в 25 мкл реакционной смеси, содержащей 2,5 мкл буфера (65мМ трис- HCl (pH 8,9), 1,5 мМ MgCl2, 16мМ (NH4)2SO4, 0,5 % Твин-20 (ИЦиГ, г. Новосибирск), 2,5 мкл 0,5 мМ смеси дезоксинуклеотидтрифосфатов («СибЭнзим» г. Новосибирск), по 0,5 мкл праймеров и 1,5 ед. активности Taq-ДНК-полимеразы (ИЦиГ, г. Новосибирск). Геномную ДНК использовали в различной концентрации от 0,1 мкг/мл до 0,5 мкг/мл в реакционной смеси. Смесь помещали в амплификатор Eppendorf «Mastercycler Gradient».
Все ампликоны (по 5-10 мкл от пробы) анализировали с помощью электрофореза в 1,5-2 % агарозном (горизонтальный) геле (AGAROSE, ICN Biomedicals inc) с последующим окрашиванием в растворе бромистого этидия с концентрацией 1 мг/мл (Т. Маниатис и соавт., 1984). В качестве маркера молекулярного веса использовали 100 bp («СибЭнзим» г. Новосибирск).
Генотипирование по гену tax проводили методом ПЦР-ПДРФ с использованием рестриктазы HAE III. Для поиска консервативных последовательностей фланкирующих ген проводили сравнительный анализ 6 вариантов последовательности гена, представленных в Gene Bank (Acc.num.AF033818 AF257515, AY189715, AY189716 AY189717, AY189718). Структуру праймеров оптимизировали с использованием программ Oligo (www.oligo.net) и Vector NTI 5.2 (http://www.invitrogen.com)
Прямой праймер tax6985 (5`-AAGCTCTTCGGGATCCATTACCTG-3`)
Обратный праймер tax 8059(5GGATTCTAGCCACCAGCTGCCGTC-3`)
Олигонуклеотидные праймеры синтезировали с помощью компьютерной программы Oligo version 3.0 (www.oligo.net) на автоматическом синтезаторе ASM 102 (фирма «Биосет») в лаборатории химического синтеза ФГУН ГНЦ «Вектор» (рук. Ю.Горбунов).
Выбор оптимального режима амплификации проводили, исходя из длины амплифицируемого фрагмента Т0 отж. после проведения температурного градиента. Стадии начальной денатурации (2 мин. при 94ºC) и конечной полимеризации (3 мин. при 72ºC) были обязательными в каждом варианте амплификации. Количество циклов подбирали эмпирически для наиболее высокого выхода специфичного ампликона при минимальном содержании неспецифических фрагментов. Смесь помещали в амплификатор Eppendorf «Mastercycler Gradient». ПЦР проводили в 25 мкл реакционной смеси, которую помещали в амплификатор с заданной программой температурно-временных циклов: Тден94 ºC – 2 мин; (Тден 95 ºC – 0,2 мин, Тотж64 ºC, Тэлон 72 ºC – 0,5 мин) – 29 циклов, Тэлон 72 ºC – 3 мин.
Рестрикционный анализ (для ПДРФ) проводили в стандартных условиях. Продукты рестрикции анализировали электрофоретически в 6-10% полиакриламидном или 1,5-2 % агарозном геле и тестировали в УФ-свете с помощью прибора УФ – трансиллюминатора УВТ-1 («Biokom», г. Москва).
- В выборке, состоящей из 187 коров черно-пестрой породы, разводимых в условиях Кемеровской области, выявлено 55 аллельных вариантов. В группе здоровых особей — 19 вариантов и в группе больных животных 49 вариантов аллелей.
- Совокупная частота нейтральных аллелей в изучаемой выборке составила 43,6 %, аллелей устойчивости к заболеванию лейкозом – 11,5 % и аллелей восприимчивости к вирусу лейкоза – 44,9 %.
- Из аллелей, ассоциированных с устойчивостью к лейкозу, выявлено 4 варианта – 0701, 0902, 2701 и 2703. Из аллелей, ассоциированных с восприимчивостью к лейкозу, — 4 варианта: 0101,1101,1201 и 1501. Остальные определенные аллели (47 вариантов) относятся к нейтральным.
- Из аллелей, ассоциированных с устойчивостью к лейкозу, у здорового поголовья выявлен только один вариант – 0902 с частотой 9,23 %. В выборке больных лейкозом животных определены четыре варианта таких аллелей – 0701, 0902, 2701 и 2703 с частотой встречаемости 6,97; 3,69; 0,41 и 1,64 % соответственно. Суммарная частота аллелей в выборке больных животных составила 12,75 %. Необходимо отметить, что частота встречаемости аллеля 0902 в выборке здоровых животных в 2,5 раза выше, чем в выборке животных, больных лейкозом – 9,23 против 3,69%.
- Частота аллелей, ассоциированных с восприимчивостью к лейкозу, в группе больных животных составила 45,90 %, в группе здоровых особей – 43,08 %. При этом все четыре идентифицированных аллели были зафиксированы в разных по физиологическому состоянию коров группах. В группе здоровых животных наибольшей частотой характеризуется аллель 1101 (25,4 %), в группе больных лейкозом коров – аллель 1501 (20,9 %).
- Суммарная частота нейтральных аллелей в выборке здоровых животных составила 47,69 %, в выборке больных лейкозом животных – 41,39 %.
- Исследуемое поголовье крупного рогатого скота черно-пестрой породы характеризуется высоким уровнем полиморфизма генотипов – всего было выявлено 84 варианта различных сочетаний аллелей. С частотой больше 5 % представлены только генотипы 1101 / 1801 (10,70%), 0101 / 1501 (9,63 %), 1101 / 0601 (6,95 %) и 1101 / 1501 (5,35 %). В группе больных лейкозом животных пятипроцентный порог частоты встречаемости преодолели четыре генотипа: 0701 / 1501 (6,56 %), 1501 / 14011 (7,38 %), 1101 / 1501 (8,20 %), 0101 / 1501 (9,02 %). У здоровых особей черно-пестрого скота таких генотипов пять: 0902 / 0902 (9,23 %), 1201 / 0601 (10,77 %), 1101 / 0601 (16,92 %), 0101 / 1501 (10,77 %) и 1101 / 1801 (29,23 %). При этом два из них встречались только у здорового поголовья – 0902 / 0902 и 1201 / 0601.
- Частота генотипов, обусловливающих устойчивость к лейкозу, составляет 18,18 %, а генотипов, связанных с восприимчивостью и не несущих аллели устойчивости, — 62,04 %.
- В рамках одного генотипа наиболее часто встречаются сочетание аллеля восприимчивости к лейкозу и нейтрального аллеля – 41,18 %, а также сочетание двух аллелей, обусловливающих восприимчивость животного к лейкозу – 20,86 % и двух нейтральных аллелей – 19,78 %. Среди здоровых и больных лейкозом животных частота встречаемости генотипов устойчивости составила соответственно 9,23 % и 22,96 %.
- Предположительно, для популяции черно-пестрой породы крупного рогатого скота Кемеровской области аллелями устойчивости к вирусу бычьего лейкоза являются, кроме общепризнанных, и такие варианты, как 1801 и 0601.
- По результатам выполненных работ разработан регламент ранней диагностики провируса лейкоза крупного рогатого скота (приложение А).
Заключение
В настоящее время для воспроизводства стада крупного рогатого скота широко используют семя быков-производителей, оцененных по комплексу признаков, в том числе и по молекулярно-генетическим маркером и, в частности, на полиморфизм гена BoLA-DRB3. Но, как известно, наследственная информация в равной степени передается потомкам как от отца, так и от матери. Поэтому оценка маточного поголовья крупного рогатого скота по генам-маркерам, в том числе и по гену устойчивости к лейкозу, имеет большое значение для успешной селекционной работы. Путем грамотной оценки, отбора и подбора животных можно не только увеличить уровень продуктивных качеств животных, но и провести оздоровление стада.
Анализ полученных данных дал возможность оценить полиморфизм гена BoLA-DRB3 черно-пестрой породы крупного рогатого скота Кемеровской области. В целом, исследуемая популяция характеризуются высоким уровнем полиморфизма данного гена.
Поголовье крупного рогатого скота Кузбасса имеет довольно высокий уровень аллелей и генотипов чувствительности, поэтому обладает незначительной генетической устойчивостью к вирусу лейкоза.
Проведенные исследования подтвердили особенность генетической структуры популяции черно-пестрой породы крупного рогатого скота, разводимой в Кемеровской области, обнаруженные в ходе исследования поголовья в 2018 году. И позволили сделать предположение, что аллели 1806 и 0601 для данной популяции являются не нейтральными, а ассоциированы с устойчивостью к бычьему лейкозу. Гомозиготный устойчивый к вирусу лейкоза генотип 0902 / 0902 является предпочтительным для селекции на устойчивость к этому заболеванию.
Полученные результаты позволят эффективнее вести селекцию крупного рогатого скота черно-пестрой породы.
Для повышения наследственной детерминации популяции черно-пестрого породы крупного рогатого скота Кузбасса к Bovine leucosis virus предлагается:
– за счет использования в разведении носителей гомозиготных генотипов насыщать популяцию аллелями гена BoLA-DRB3, обусловливающими устойчивость к вирусу лейкоза КРС;
— при селекции крупного рогатого скота в условиях Кузбасса с целью повышения устойчивости поголовья к вирусу бычьего лейкоза для воспроизводства предпочтительно отбирать ремонтный молодняк с гомозиготным генотипом 0902 / 0902.
— анализ полученных данных дает основание предполагать, что для изучаемой популяции аллелями устойчивости являются и такие варианты как 1801 и 0601.
Список использованных источников
- Абакин, С.С. Оценка хозяйственно-полезных качеств коров молочных пород, инфицированных вирусом лейкоза КРС в хозяйствах Ставропольского края / С.С. Абакин, Е.С. Суржикова, В.А. Оробец// Вестник АПК Ставрополья. – 2017. – №1(25). – С.63-66.
- Анализ эпизоотической ситуации по лейкозу КРС в Российской Федерации за 2014г. / М.И. Гулюкин, Л.А. Иванова, Н.Г. Козырева и др. //Материалы научно-практ. конф. «Реализация достижений вет. науки для обеспечения вет. санитарного и эпизоотического благополучия животноводства Брянской области в современных условиях. – Брянск, 2015. – С.78-89.
- Анализ эпизоотической ситуации по лейкозу крупного рогатого скота в Смоленской области / Н.И. Целуева, И.М. Кугелев, Н.Г. Мясников и др. //Ветеринария. –2017. – №10. – С.11-14.
- Апалькин, В.А. Лейкоз крупного рогатого скота / СПб.: Петролазер, 2005. –105 с.
- Баймышев, Х.Б. Сравнительная оценка эффективности использования методов РИД и ПЦР при диагностике лейкоза крупного рогатого скота / Х.Б. Баймышев, В.В. Землянкин // Известия Самарской государственной сельскохозяйственной академии. – 2009. – Вып.1. – С. 28-30.
- Белоусова, Р.В. Практикум по ветеринарной вирусологии / Р.В. Белоусова, Н.И. Троценко, Э.А. Преображенская // М.: КолосС, 2006. – 248 с.
- Белявская, В.А. Возможности и ограничения использования ПЦР в диагностике и генотипировании вируса лейкоза крупного рогатого скота / В.А. Белявская // Сб.: Актуальные вопросы зоотехнической науки и практики как основа улучшения продуктивных качеств и здоровья сельскохозяйственных животных. – Ставрополь, 2003. – С. 275-278.
- Будчанов, Ю.И. Реакции, основанные на взаимодействии антигена с антителом: учебно-методические рекомендации / Ю.И. Будчанов // Тверь, 2012. – 33 с.
- Будулов, Н.Р. Динамика распространения лейкоза крупного рогатого скота в Республике Дагестан / Н.Р. Будулов, Э.М. Шихрагимов, Ю.С. Салихов //Ветеринария и кормление. – 2017. – № 5. – С.23-25.
- Вангели, С.В. Сравнительная морфологическая характеристика клеточных линий ЛЭК-ВИЭВ-90 и FLK-BLV, хронически инфицированных вирусом лейкоза крупного рогатого скота / С.В. Вангели // Ветеринария и кормление. – 2015.– № 1. – С. 19-22.
- Вангели, С.В. Методы диагностики лейкоза крупного рогатого скота /С.В.Вангели // Wschodnioeuropejskie Czasopismo Naukowe (East European Scientific Journal) Nauki veterinarnі. – 2016. – №8. –С. 91-94.
- Верховский, О.А. Лейкоз крупного рогатого скота //Руководство по вирусологии: Вирусы и вирусные инфекции человека и животных / под ред. Акад. РАН Д.К. Львова. – М.: Медицинское информационное агентство. –2013. – С.869-873.
- Власенко, В.С. Лейкоз крупного рогатого скота в Омской области и его взаимосвязь с циклами солнечной активности / В.С. Власенко, Е.С. Борисов, В.П. Плащенко В.П. // Вестник Омского ГАУ. – 2017. – № 2 (26). – С.85-90.
- Влияние физиологического и имунобиологического статуса КРС на уровень поствакцинального иммунитета / В.А. Мищенко, А.В. Кононов, А.В. Мищенко и др. // Ветеринария Кубани. – 2008. – № 2. –С. 5-8.
- Галеев, Р.Ф. Диагностика и профилактика лейкоза КРС / Р.Ф. Галеев, А.А. Руденко, Ф.Р. Валиев // Практик. 2003. – № 5-6. – С. 44-48.
- Генетический полиморфизм вируса лейкоза КРС на территории Российской Федерации / М.И. Гулюкин, Н.Г. Козырева, Л.А. Иванова и др. // Рос. С.-х. наука. – 2016 – № 5. – С.56-59.
- Вафин, Р.Р. Генотипическая идентификация вируса бычьего лейкоза / Р.Р. Вафин, Н.З. Хазипов, А.Ю. Шаева // Молекулярная генетика, микробиология и вирусология. – 2014. – № 4. – С.34-40.
- Генетическая идентификация изолятов вирусов лейкоза КРС, выявленных в хозяйствах Республики Татарстан / А.Ю. Шаева, Р.Р. Вафин, Н.З. Хазипов и др. // Ученые записки КГАВМ. – 2011. – Т. 208. – С.330-337.
- Генджиева, О.Б. Эпизоотология лейкоза в мясном скотоводстве / О.Б. Генджиев, М.И. Гулюкин // Ветеринария. – 2012. – №7. – С.23-26.
- Глазунов, Ю.В. Ретроспективный анализ эпизоотической ситуации по лейкозу крупного рогатого скота в Северном Зауралье / Ю.В. Глазунов // Ветеринария и кормление. –2014.– №3. – С. 14-15.
- Глазунов, Ю.В. Сравнительная оценка методов прижизненной диагностики и эпизоотическая ситуация по лейкозу крупного рогатого скота в Тюменской области / Ю.В. Глазунов, Я.А. Кабицкая, И.В. Плотников // Вестник АПК Ставрополья. – 2017. – №2(26). – С.63-68.
- Гладырь, Е.А. Разработка и экспериментальная апробация высокочувствительной тест-системы диагностики вируса лейкоза крупного рогатого скота / Е.А. Гладырь // Школа-практикум «Методы исследований в биотехнологии сельскохозяйственных животных». – ВИЖ. – 2005. – С.18-22.
- Гладырь, Е.А. Создание и экспериментальная апробация высокочувствительной тест-системы диагностики вируса лейкоза крупного рогатого скота / Е.А. Гладырь, Н.А. Зиновьева, А.А. Ермилов // Ветеринарная патология. – 2006. – № 3. – С.87-90.
- Генотипирование изолятов вируса лейкоза КРС, распространенного на территории Калмыкии / М.И. Гулюкин, Л.А. Иванова, Л.Б. Генджиева. и др. // Ветеринария Кубани. – 2012. – № 4. – С.4-7.
- Гулюкин, М.И. Основные тенденции в организации и проведении противолейкозных мероприятий / М.И. Гулюкин // Труды ВИЭВ. – М. – 1999. – Т.72. – С. 16 –22.
- Гулюкин, М.И. Разработка эффективных мероприятий против лейкоза крупного рогатого скота/ М.И. Гулюкин, Л.А. Иванова, Н.В. Замараева // Ветеринария. – 2002. – № 12. – С. 3-8.
- Гулюкин, М.И. Особенности инфекционного процесса, индуцированного вирусом лейкоза крупного рогатого скота / М.И. Гулюкин // Ветеринарный консультант. – 2008. – № 19. – С.7-8.
- Джаилиди, Г.А. Обеспечение эпизоотического благополучия – основная задача государственной ветеринарной службы Кубани/ Г.А.Джаилиди, Р.А. Кривонос, Е.В.Якубенко // Ветеринария Кубани. – 2014. – №1. – С.3-5.
- Джапаралиев Н.Т. Применение серологических методов и ПЦР для обнаружения вируса лейкоза крупного рогатого скота в образцах крови, молока и носовых истечений / Н.Т. Джапаралиев, Л.Б. Прохватилова, А.И. Ломакин // Достижения молодых ученых – в ветеринарную практику (Материалы конференции молодых ученых). Владимир: ОКНИИиМС, ВНИИЗЖ. – 2000. – С.127-131.
- Джупина С.И. Эпизоотический процесс лейкоза КРС и перспективы девастации возбудителя этой инфекции / С.И. Джупина // Ветеринарная патология. –2014. – №1. –С.98-100.
- Динамика распространения лейкоза КРС в Республике Дагестан / Н.Р. Будулов, Э.М. Шихрагимов, Ю.С. Салихов и др. // Ветеринария и кормление. –2017. –№ 5. – С.23-25.
- ДНК-полиморфизм гена BoLA-DRB3 у крупного рогатого скота в связи с устойчивостью и восприимчивостью к лейкозу / Г.Е. Сулимова, И.Г. Удина Г.О. Шайхаев, И.А. Захаров // Генетика. –1995. –Т. 31, №9. – С.1294-1299.
- Донник, И.М. Качественная характеристика молозива здорового и инфицированного вирусом лейкоза поголовья коров/ И.М. Донник, М.В. Петропавловский // Ветеринария Кубани. – 2015. – № 4. – С.15-16.
- Донник, И.М. Эпизоотическая обстановка по лейкозу КРС в Краснодарском крае/ И.М. Донник, С.В. Тихонов // Ветеринария Кубани. –2013. – №3. – С.19-21.
- Донник, И.М. Профилактика лейкоза крупного рогатого скота в племенных хозяйствах Краснодарского края // И.М. Донник, С.В. Тихонов // Ветеринария Кубани. – 2013. – № 5. – С.8-10.
- Иванова, Л.А. Опыт применения иммуноферментного анализа для выявления антител к вирусу лейкоза на заключительном этапе оздоровления / Л.А. Иванова // Бюл. ВИЭВ. – 1999. – Т. 72. – С. 202-209.
- Иванов, О.В. Современный взгляд на проблему лейкоза крупного рогатого скота / О.В. Иванов, О.Ю. Иванова, Т.И. Брезгинова // Аграрный сборник Верхневолжья. – 2016. – №1 – С.33-44.
- Идентификация нового генотипа вируса лейкоза КРС / А.Ю. Шаева, З.Р. Гараева, Р.Р. Вафин и др. // Ученые записки КГАВМ. – 2012. – Т. 211. – С.192-197.
- Изучение эпигенетических факторов предрасположенности к лейкозу крупного рогатого скота / С.Н. Магер, М.Н. Амироков, В.В. Храмцов, Н.Г. Двоеглазов // Вестник НГАУ. – 2011. – № 3 (19). – С. 100-103.
- Изучение особенностей клинико-гематологического проявления лейкоза в зависимости от мутационных изменений в генотипе BLV / С.С. Абакин, Т.В. Красовская, Д.Г. Пономаренко и др. // Вестник АПК Ставрополья. – 2016. – № 1(21). – С.55-60.
- Козырева, Н.Г. Распространение лейкоза крупного рогатого скота и генетические варианты возбудителя на территории животноводческих хозяйств Центрального федерального округа Российской Федерации / Н.Г. Козырева, М.И. Гулюкин // Ветеринария Кубани. – 2017. – № 6. – С.4-9.
- Красникова, Е.С. Биологическая безопасность продукции животных, инфицированных вирусами энзоотического лейкоза и иммунодефицита КРС / Е.С. Красникова // Вестник ветеринарии. – 2014. – № 2(69). – С.85-87.
- Ковалюк Н.В. Методы диагностики лейкоза крупного рогатого скота: учебное пособие / Н.В. Ковалюк. – Краснодар – 2012. – 39с.
- Козырева, Н.Г. Анализ генетического разнообразия вируса лейкоза крупного рогатого скота: автореф. дис… канд. биол. наук: 03.01.06 / Н.Г. Козырева. – Москва, 2013. – 19 с.
- Козырева, Н.Г. Тест-система для выявления ДНК провируса ВЛКРС инфекции методом полимеразной цепной реакции в режиме реального времени / Н.Г. Козырева, Л.А. Иванова, Т.В. Степанова // Ветеринария и кормление – 2013. – № 4. – С.45-46.
- Козырева, Н.Г. Мониторинг эпизоотической ситуации и применение молекулярно-генетической диагностики в оздоровительных мероприятиях лейкоза крупного рогатого скота / Г.Г. Козырева, Л.А. Иванова, Т.В. Степанова // Достижения науки и техники АПК. – 2014. – №1. – С. 47-51.
- Лейкоз крупного рогатого скота – болезнь управляемая / М.И. Гулюкин, А.А. Стекольников, В.А. Кузьмин и др. // Ветеринария. – 2013. – № 9. – С.9-13.
- Лейкоз КРС, основные направления его профилактики и оздоровления /Ю.Х. Бахтахунов, С.Б. Маманова, А.Б. Бижанов и др. // Проблемы теории и практики современной ветеринарной науки: сб. науч. тр. / Казах.НИВИ. – Алматы, 2016. – Т. 62. – С.42-51.
- Логинов, С.И. Эколого-эпизоотологический анализ совокупного риска развития лейкоза крупного рогатого скота / С.И. Логинов // Вестник НГАУ. – 2015. – № 4(37). – С.114-120.
- Логинов, С.И. Опыт оздоровления неблагополучного по лейкозу крупного рогатого скота сельхозпредприятия / С.И. Логинов // Вестник НГАУ. – 2014. – № 4 (33). – С.141-145.
- Логинов, С.И. Эколого-эпизоотологический анализ факторов риска развития лейкоза крупного рогатого скота / С.И. Логинов, А.Г. Незавитин // Достижения науки и техники АПК. – 2015. –Т. 29. – № 12.– С. 100-103.
- Лиманский А.П. Молекулярно – генетические методы – основа программ по искоренению лейкоза крупного рогатого скота / А.П. Лиманский, О.Ю. Лиманская // Биотехнология. – 2001. – № 3. – С. 40-50.
- Лиманский, А.П. Типирование вируса лейкоза крупного рогатого скота, циркулирующего в Украине / А. П. Лиманский, L. Geue, О.Ю. Лиманская // Вопросы вирусологии. – 2004. – Т. 49. – № 1.– С. 39–44.
- Мадисон В. Лейкоз: пустые страшилки или общегосударственная проблема? // Животноводство России. – 2006. – № 9. – С. 2-8.
- Мальцева Н.А. Лейкоз крупного рогатого скота / Автореф дис. … д-ра биологических наук / Н.А. Мальцева. – Новочеркасск, 2002. – 45с.
- Мальцева, Н.А. ПЦР-диагностика лейкоза крупного рогатого скота/ Н.А. Мальцева, Г.О. Шайхаев, А.Г. Ирский // Ветеринарная патология. – 2003. – № 1. – С.129-131.
- Мальцева, Н.А. Развитие и внедрение новых биотехнологий при разработке диагностических и профилактических приемов в сфере решения проблемы лейкоза КРС Материалы II региональной научной конференци «Студенческая наука – экономике России» Северо-Кавказский государственный технический университет. – 2004. С. 20- 22.
- Макаров, В.В. Эпизоотологические перспективы лейкоза крупного рогатого скота / В.В. Макаров, Д.П. Гринишин // Вестник Российской академии сельскохозяйственных наук. – 2005. – № 2. – С. 70-73
- Маркарян, А.Ю. Подход к подбору ДНК-мишени к тест-системе ПЦР для выявления провируса лейкоза КРС / А.Ю. Маркарян // Вопросы нормативно-правового регулирования в ветеринарии. – 2015. – № 2. – С. 56-58.
- Морозова, О.В. Функциональное состояние Т-лимфоцитов в оценке стад крупного рогатого скота при лейкозе / Автореф дис. … канд. вет. наук Алтайский ГАУ. – Барнаул, 2016. – 32 с.
- Мурватуллоев, С.А. Влияние природно-хозяйственных и техногенных факторов на эпизоотологию и характер проявления лейкоза КРС: автореф. дис. … д-р вет. наук: 16.00.03 / Мурватуллоев Сангимурод Акобирович. – Москва, 1998. – 49 с.
- Межвидовая передача вируса лейкоза КРС в эксперименте / М.И. Гулюкин, Н.Г. Козырева, Л.А. Иванова и др. // Вопросы вирусологии. – 2015. –Т. 60, №5. – С.32-37.
- Мищенко, В.А. Особенности иммунодефицитов у КРС / В.А. Мищенко, Н.А. Яременко, А.В. Мищенко // Ветеринария. – 2007. – № 11. –С. 17-20.
- Мищенко, А.В. Полевая эффективность противовирусных вакцин для коров, инфицируемых вирусом лейкоза / А.В. Мищенко, В.В. Думова, В.А. Мищенко // Ветеринарная медицина. – 2011. – Т.95. – С.214-215.
- Молекулярно-генетическая структура вируса лейкоза КРС, циркулирующего на территории Ростовской области / М.И. Гулюкин, Н.Г. Козырева, Т.В. Степанова и др. // Труды ВИЭВ. – 2015. – Т. 79. – С. 137-146.
- Молоко как объект иммунологической диагностики лейкоза крупного рогатого скота / А.С. Петренко, Г.Б. Алексеева, В.А. Прискока и др. // Ученые записки УО ВГАВМ. – 2016. – Т.52. – № 3. – С.69-74.
- Молочная продуктивность коров в зависимости от инфицированности вирусом лейкоза и генотипа BolA-DRB3 / Е.А. Гладырь, Н.А. Зиновьева, А.С.Быкова и др. // Достижение науки и техники АПК. –2012. – № 8. – С. 46-49.
- Мониторинг эпизоотической ситуации и применение молекулярно-генетической диагностики в оздоровительных мероприятиях при лейкозе КРС / Н.Г. Козырева, Л.А. Иванова, Т.В. Степанова, М.И. Гулюкин // Достижение науки и техники АПК. – 2014. –№1. – С.47-51.
- Мониторинг и сравнительный анализ эпизоотической ситуации по лейкозу крупного рогатого скота в Самарской области / Т.В. Дюльдина, Т.Ю. Беспалова, О.В. Кустикова и др. // Ветеринария Кубани. – 2017. – № 5. – С. 12-14.
- Мониторинг эпизоотической ситуации по лейкозу крупного рогатого скота в товарных и племенных хозяйствах Российской Федерации за 2014 и 2015 годы / М.И. Гулюкин, И.И. Барабанов, Л.А. Иванова и др. //Ветеринария и кормление. – 2016. – № 4. – С. 5-41.
- Мельникова, В.М. Эффективность оздоровительных мероприятий при лейкозе крупного рогатого скота в экологически неблагополучных территориях Среднего Урала: автореф. дис. … канд. вет. наук. / Мельникова В.М. – Барнаул, 2001. –23 с.
- Мустафаев, А.Р. Анализ эпизоотической ситуации по лейкозу крупного рогатого скота в Республике Дагестан / А.Р. Мустафаев, М.И. Гулюкин, Х.М. Гайдарбекова // Ветеринария и кормление. – 2017. – № 5. –С. 25-27.
- Надточей, Г.А. Смешанные инфекции РНК-содержащих вирусов, в перевиваемых культурах клеток ЛЭК-ВИЭВ-90 и FLK-BLV Материалы международной научно-проктической конференции «Научные перспективы XXI века» / Г.А. Надточей, С.В. Вангели. – Екатеринбург, 2015. – № 4 (11). –С. 163-167.
- Нахмансон В.М. Влияние генетических факторов на возникновение и развитие лейкозов / В.М. Нахмансон // Лейкозы и злокачественные опухоли животных. М.: Колос. –1977. – С. 78-85.
- Нахмансон, В.М. Эпизоотология лейкоза крупного рогатого скота меры борьбы с ним / В.М. Нахмансон, Е.А. Дун // Итоги науки и техники. – 1986. – С.146-149.
- Новосельцев, Г.Г. Особенности проявления энзоотического лейкоза у крупного рогатого скота и совершенствование противоэпизоотических мероприятий: автореф. дис. … канд. вет. наук / Г.Г. Новосельцев. – Ставрополь, 2012. – 23с.
- Оптимизация способов определения противовирусных антител в молозиве и молоке коров / М.Ю. Киселев, В.В. Думова, А.В. Мищенко и др. // Ветеринария и кормление. – 2011. – № 6. – С.24-25.
- Особенности распределения антигенов BolA-A и аллелей гена BolA-DRB3 у черно-пестрого скота в связи с ассоциацией с лейкозом / Л.К. Эрнст и др. // Генетика. – 1997. – Т. 33, №1. – С.87-95.
- Петропавловский, М.В. Эффективность диагностических тестов в выявлении вируса лейкоза крупного рогатого скота в оздоравливаемых от лейкоза стадах: автореф. дис. … канд. вет. наук: 06.02.02 / М.В. Петропавловский. – Екатеринбург, 2010. – 23с.
- Полевая эффективность противовирусных вакцин для КРС / В.А. Мищенко, Д.К. Павлов, А.В. Кононов и др. // Вет. патология. – 2007. –№ 2. – С. 235-238.
- Петров, Н.И. Диагностика и меры борьбы с лейкозом крупного рогатого скота / Н.И. Петров // Материалы Всероссийского совещания-семинара. – Брянск, 2004. – С. 104-106.
- Разъяснения Россельхознадзора положения Решения о регионализации по лейкозу КРС: новости, 4 сентября 2017 г. – URL: http://www.fsps.ru/fsps/news/22667.html
- Распространение вируса лейкоза крупного рогатого скота у коров черно-пестрой породы с разной молочной продуктивностью / Н.А. Зиновьева, Е.А.Гладырь, И.В. Виноградов и др. // Сельскохозяйственная биология. – 2012. – № 6. – С. 49-55.
- Смирнова, В.Н. К вопросу о токсичности молока коров, больных лейкозом / В.Н. Смирнова // Сб.: Актуальные вопросы диагностики, профилактики и борьбы с лейкозами сельскохозяйственных животных и птиц. – Екатеринбург, 2000. – С. 240-242.
- Сивков, Г.С. Изучение роли иксодовых клещей в передаче вируса лейкоза крупного рогатого скота / Г.С. Сивков // Ветеринария. – 2009. – № 12. – С. 14-17.
- Симонян, Г.А. Разработка и совершенствование оздоровительных противолейкозных мероприятий / Г.А. Симонян // Ветеринария. – 2007. – № 7. – С. 3-7.
- Симонян, Г.А. Лейкоз крупного рогатого скота. Причины возникновения и пути передачи возбудителя болезни. Ч.2. / Г.А. Симонян // Farm Animals. – 2016. – №1 (11). – С.26-28.
- Симонян, Г.А. Дифференциальная диагностика различных форм гемобластозов / Г.А. Симонян // Ветеринария. – 2013. – № 9. – С.21-25.
- Симонян, Г.А. Методы диагностики и борьбы с устранением экономического ущерба при лейкозе крупного рогатого скота / Г.А. Симонян // Труды ВИЭВ. – 2016. – Т. 79. – С. 267-275.
- Система индивидуальных ветеринарных и зоотехнических мероприятий по оздоровлению неблагополучных хозяйств от лейкоза на примере Тюменской области / А.В. Лысов, М.В. Петропавловский, А.С. Кривоногова и др. // Вопросы нормативно-правового регулирования в ветеринарии. – 2017. – № 3. – С. 40-43.
- Смирнов, Ю.П. Развитие лейкозного процесса у инфицированных ВЛКРС коров в зависимости от их возраста / Ю.П. Смирнов // Ветеринария. –1999. – № 12. – С. 15-17.
- Смирнов, Ю.П. Влияние лейкоза на молочную продуктивность коров / Ю.П. Смирнов // Молочное и мясное скотоводство. – 1999. – № 4. – С. 25-28.
- Смирнов, Ю.П. Основные пути распространения лейкоза / Ю.П. Смирнов // Ветеринарная газета. – 1999. – № 4. – С. 3-4.
- Смирнов, П.Н. Лейкоз крупного рогатого скота: проблемы и их решение на уровне субъекта Федерации / Ю.П. Смирнов // Ветеринария Кубани. – 2007. – № 4. – С. 4-7.
- Смирнова, В.Н. Ветеринарно – санитарная оценка мяса при лейкозе крупного рогатого скота / Ю.П. Смирнов // Сб.: Актуальные вопросы диагностики, профилактики и борьбы с лейкозами сельскохозяйственных животных и птиц. – Екатеринбург, 2000. – С. 236-239.
- Смирнова, В.Н. Ветеринарно – санитарная оценка мяса при лейкозе крупного рогатого скота / Ю.П. Смирнов // Сб.: Актуальные вопросы диагностики, профилактики и борьбы с лейкозами сельскохозяйственных животных и птиц. – Екатеринбург, 2000. – С. 236-239.
- Смирнова, В.Н. К вопросу о токсичности молока коров, больных лейкозом / В.Н. Смирнова // Сб.: Актуальные вопросы диагностики, профилактики и борьбы с лейкозами сельскохозяйственных животных и птиц. – Екатеринбург, 2000. – С. 240-242.
- Степанова, Т.В. Анализ экономического ущерба при заболевании лейкозом крупного рогатого скота в период с 2010 по 2014 годы в Российской Федерации / Т.В. Степанова // Russian J. Agricultural and Socio Economic Sciences (RJOAS). – 2016. – № 8(56). – Р. 49-56.
- Семёнова, М.Е. Молекулярно-генетическая характеристика изолятов вируса лейкоза крупного рогатого скота, идентифицированных в Камско-Устьинском районе Республики Татарстан/ М.Е. Семёнова, Т.Х. Фаизов, К.В. Усольцев // Ветеринарный врач. – 2014. – № 1. – С. 29-32.
- Стаффорд, В.В. Гистологическая диагностика / В.В. Стаффорд // Сборник научных трудов Всероссийского научно-исследовательского института овцеводства и козоводства. – 2015. –Т.1. –№ 8. – С. 523-552.
- Стратегический продукт // Farm Animals. – 2016. – № 1(11). – С.4-5.
- Чичинина, С.В. Возможности и ограничения использования полимеразной цепной реакции в диагностике вируса лейкоза крупного рогатого скота/ С.В. Чичинина, В.В. Храмцов, Е.А. Дурыманова // Вестник РАСХН. – 2006. – № 6. – С. 71-73.
- Филогенетический анализ вирусов лейкоза КРС, циркулирующих в Московской, Калужской и Ростовской областях / Н.Ф. Ломакина, М.И. Гулюкин, Л.А. Иванова и др. // Сборник науч. тр. – Екатеринбург, 2010. – С. 161-166.
- Эпизоотологические аспекты лейкоза КРС в Краснодарском крае / И.М Донник, Г.А. Джаилиди, Е.В. Якубенко и др. // Ветеринария Кубани. –2014. – № 2. – С. 5-18.
- Эпизоотическая ситуация по лейкозу крупного рогатого скота в Удмурдской Республике в 2011-2015 гг. / Г.Н. Бурдов, Н.Н. Котельников, С.Г. Явкин и др. // Ветеринария. – 2017. – № 8. – С. 4-8.
- Целуева Н.И. Эпизоотическая ситуация по лейкозу КРС в Смоленской области / Н.И. Целуева, Н.Г. Мясникова // Ветеринария. – 2016. – № 9. – С.10-12.
- Правила по профилактике и борьбе с лейкозом крупного рогатого скота (приказ МСХ и П №359 от 11.05.1999 г., зарегистрированы в Минюсте ВФ 04.06.1999г №1799).
- Технический регламент на молоко и молочную продукцию (Федеральный закон РФ от 12.06. 2008 г., № 88-ФЗ
- Технический регламент Таможенного союза «О безопасности пищевой и молочной продукции (ТР ТС 033/2013)», принят Решением Евразийской экономической комиссии от 09.10.2013г. №67.
- Технический регламент Таможенного союза «О безопасности пищевой продукции (ТР ТС021/2011) утвержден решением комиссии Таможенного
- D’Angelino, J.L. Epidemiological study of enzootic bovine leukosis in Brazil / J.L. D’Angelino, M. Garcia, E.H. Birgel // Trop. Anim. Health Prod. – 1998. – V. 30. – P. 13-15.
- Altreuther, G. Morphologic and functional changes in bovine monocytes infected in vitro with the bovine leukaemia virus / G. Altreuther, L. Llames, S. Neuenschwander // Scand. J. Immunol. – 2001. – V. 54. – P. 459-469.
- Anderson, L. Candidate-based proteomics in the search for biomarkers of cardiovascular disease / L. Anderson // J. Physiol. – 2005. – V. 563.1. – P. 2360.
- Avidan, O. The processivity and fidelity of DNA synthesis exhibited by the reverse transcriptase of bovine leukemia virus / O. Avidan, M.E. Meer, I. Oz, A. Hizi // Eur. J. Biochem. – 2002. – V. 269. – P. 859-867.
- Beier, D. Identification of different BLV provirus isolates by PCR, RFLPA and DNA sequencing / D. Beier, P. Blankenstein, O. Marquardt // Berl. Munch. Tierarztl. Wochenschr. – 2001. – V. 114. – P. 252-256
- Bondzio, A. Involvement of intracellular Ca2+ in the regulation of bovine leukemia virus expression / A. Bondzio, A. Abraham-Podgornik, P. Blankenstein // Biol. Chem. – 2001. – V. 382. – P. 407-416.
- Buehring, G.C. Humans have antibodies reactive with bovine leukemia virus / G.C. Buehring, S.M. Philpott, K.Y. Choi // AIDS Res. Hum. Retrovir. – 2003. – V. 19. – P. 1105-1113.
- Burmeister, T. No genetic evidence for involvement of deltaretroviruses in adult patients with precursor and mature T-cell neoplasms / T. Burmeister, S. Schwartz, M. Hummel // Retrovirology. – 2007. – V. 4. – P. 11-11.
- Debacq, C. Reduced proviral loads during primo-infection of sheep by bovine leukemia virus attenuated mutants / C. Debacq, M.T. Sanchez Alcaraz, F. Mortreux // Retro virology. – 2004. – V. 1. – P. 31-31.
- Domenech, A. In vitro infection of cells of the monocytic/macrophage lineage with bovine leukaemia virus / A. Domenech, J. Goyache, L. Llames // J. Gen. Virol. – 2000. – V. 81. – P. 109-118.
- Dube, S. The complete genomic sequence of an in vivo low replicating BLV strain / S. Dube, L. Abbott, D.K. Dube // Virol. J. – 2009. – V. 6. – P. 120-120.
- Dube, S. The complete genomic sequence of a BLV strain from a Holstein cow from Argentina / S. Dube, G. Dolcini, L. Abbott // Virology. – 2000. – V. 277. – P. 379-386.
- Ferens, W.A. Intestinal Shiga toxin-producing Escherichia coli bacteria mitigate bovine leukemia virus infection in experimentally infected sheep / W.A. Ferens, R. Cobbold, C.J. Hovde // Infect. Immun. – 2006. – V. 74. – P. 2906-2916.
- Fulton, B.E. Jr. Dissemination of bovine leukemia virus-infected cells from a newly infected sheep lymph node / B.E. Fulton, M. Portella, K. Radke // J. Virol. – 2006. – V. 80. – P. 7873-7884.
- Hamilton, V.T. Translocation of the B cell receptor to lipid rafts is inhibited in B cells from BLV-infected, persistent lymphocytosis cattle / V.T. Hamilton, D.M. Stone, G.H. Cantor // Virology. – 2003. – V. 315. – P. 135-147.
- Jimba, M. BLV-CoCoMo-Qpcr: quantitation of bovine leukemia virus proviral load using the CoCoMo algorithm / M. Jimba, S.N. Takeshima, K. Matoba // Retrovirology. – 2010. – V. 7. – P. 91-91.
- Juliarena, M.A. Determination of proviral load in bovine leukemia virus-infected cattle with and without lymphocytosis / M.A. Juliarena, S.E. Gutierrez, C. Ceriani // Am. J. Vet. Res. – 2007. – V. 68. – P. 1220-1225.
- Capecchi M.R. // Nat. Rev. Genet. 2005. V. 6. № 6. P. 507–512.
- Kabeya, H. Host immune responses in the course of bovine leukemia virus infection / H. Kabeya, K. Ohashi, M. Onuma // J. Vet. Med. Sci. – 2001. – V. 63.-P. 703-708.
- Kerkhofs, P. Long-term protection against bovine leukaemia virus replication in cattle and sheep / P. Kerkhofs, J.S. Gatot, K. Knapen // J. Gen. Virol. – 2000. – V. 81. – P. 957-963.
- Kim Y.G., Cha J., Chandrasegaran S. // Proc. Natl. Acad. Sci.USA. – 1996. – V. 93. – № 3. – P. 1156-1160.
- Kohara, J. Experimental transmission of Bovine leukemia virus in cattle via rectal palpation / J. Kohara, S. Konnai, M. Onuma // Jpn. J. Vet. Res. – 2006. –V. 54. – P. 25-30.
- Konnai, S. The rapid quantitative analysis of bovine cytokine genes by realtime RT-PCR / S. Konnai, T. Usui, K. Ohashi // Vet. Microbiol. – 2003. – V. 94. – P. 283-294.
- Lefebvre, L. Subcellular localization of the bovine leukemia virus R3 and G4 accessory proteins / L. Lefebvre, V. Ciminale, A. Vanderplasschen // J. Virol. – 2002. – V. 76. – P. 7843-7854.
- Licursi, M. Pro virus variants of bovine leukemia virus in naturally infected cattle from Argentina and Japan / M. Licursi, Y. Inoshima, D. Wu // Vet. Microbiol. – 2003. – V. 96. – P. 17-23.
- Enzootic bovine leucosis // OIE. Manual of Diagnostic Test and Vaccines for Terrestrial Animal. – Paris, 2012. – V.1. – P.721-732.
- Enzootic bovine leuсosis / EFSA J. – 2015. – Р.4188.
- Gagnon C.A. Detection of bovine lymphotropic herpesvirus DNA in Tissues of bovine fetus / G.A. Gagnon, O. Allam, R. Drolet // Canad. Vet. J. – 2010. – V.51. – P. 1021-1022.
- Mansky, L.M. The primary nucleotide sequence of the bovine leukemia virus RNA packaging signal can influence efficient RNA packaging and virus replication / L.M. Mansky, L.C. Gajary // Virology. 2002. – V. 301. – P. 272-280.
- McGirr, K.M. Tax and Rex sequences of bovine leukaemia virus from globally diverse isolates: Rex amino acid sequence more variable than Tax / K.M. McGirr, G.C. Buehring // J. Vet. Med. B. Infect. Dis. Vet. Public Health. – 2005. – V. 52. – P. 8-16.
- Meas, S. Vertical transmission of bovine leukemia virus and bovine immunodeficiency virus in dairy cattle herds / S. Meas, T. Usui, K. Ohashi // Vet. Microbiol. – 2002. – V. 84. – P. 275-282.
- Merezak, C. Inhibition of histone deacetylases induces bovine leukemia virus expression in vitro and in vivo / C. Merezak, M. Reichert, C. Van Lint // J. Virol. – 2002. – V. 76. – P. 5034-5042.
- Monti, G. Genetic diversity and spread of bovine leukaemia virus isolates in Argentine dairy cattle / G. Monti, R. Schrijver, D. Beier // Arch. Virol. – 2005. –V. 150. – P. 443-458.
- Moratorio, G. Phylogenetic analysis of bovine leukemia virus / G. Moratorio, S. Fischer, G. Obal // Unpublished data. – 2013.
- Morcock, D.R. Fluorescence and nucleic acid binding properties of bovine leukemia virus nucleocapsid protein / D.R. Morcock, S. Katakam, B.P. Kane // Biophys. Chem. – 2002. – V. 97. – P. 203-212.
- Motton, D.D. Bovine leukemia virus alters growth properties and casein synthesis in mammary epithelial cells / D.D. Motton, G.C. Buehring // J. Dairy Sci. – 2003. – V. 86. – P. 2826-2838.
- Moules, V. Fate of premalignant clones during the asymptomatic phase preceding lymphoid malignancy / V. Moules, C. Pomier, D. Sibon // Cancer Res. – 2005. – V. 65. – P. 1234-1243.
- Murakami, K. The recent prevalence of bovine leukemia virus (BLV) infection among Japanese cattle / K. Murakami, S. Kobayashi, M. Konishi // Vet. Microbiol. – 2011. – V. 148. – P. 84-88.
- Mechanisms of leukemogenesis induced by bovine leukemia virus: prospects for novel anti-retroviral therapies in human / N. Gillet, A. Florins, M. Boxus et al. // Retrovirology. – 2007. – V.16. – P. 4-18.
- Meas, S. Vertical transmission of bovine leukemia virus and bovine immunodeficiency virus in dairy cattle herds / S. Meas, T. Usui, K. Ohashi // Vet. Microbiol. – 2002. – V. 84. – P. 275-282.
- Novel gammaherpesvirus function encoded by bovine herpesvirus 6 (bovine lymphotropic virus) / J. Jia, G.Delhon, E. Talman et al. // J. Gen. Virol. – 2014. – V.95. – P. 1740-1798.
- Oltenacu, P.A.The impact of genetic selection for increased milk yield on the welfare of dairy cows / P.A. Oltenacu, D.M. Broom // Universities Federation for Animal Welfare The Old School. – Brewhouse Hill, Wheathampstead, Hertfordshire AL4 8AN, UK Animal Welfare. – 2010. – №19(S). – Р. 39-49.
- Otachel-Hawranek, J. Eradication of enzootic bovine leukosis in dairy cattle from the lower Silesia region / J. Otachel-Hawranek // Bull. Vet. Inst. Pulawy. – 2007. – V. 51. – P. 465-469.
- Ott, S.L. Association between bovine-leukosis virus seroprevalence and herdlevel productivity on US dairy farms / S.L. Ott, R. Johnson, S.J. Wells // Prev. Vet. Med. – 2003. – V. 61. – P. 249-262.
- OIE. Terrestrial Animal Health Code. – Paris, 2016.
- Seguence variability of bovine leukemia virus env gene and its relevance to the structure and antigenicity of the glycoproteins / R.Z. Mamoun, M. Morisson, N. Rebeyrotte et al. // J.Virol. – 1990. – V.64, N 9. – P. 4180-4188.
- Suh, G.H. Establishment of a bovine leukemia virus-free dairy herd in Korea / G.H. Suh, J.C. Lee, C.Y. Lee // J. Vet. Sci. – 2005. – V. 6. – P. 227-230.
- OIE. Manual of Diagnostic Test and Vaccines for Terrestrial Animal. V.1. – Paris, 2016. – P. 667-670.
- OIE. Terrestrial Animal Health Code. – Paris, 2016.
- Trainin, Z. The direct and indirect economic impacts of bovine leukemia virus infection on dairy cattle / Z. Trainin, J. Brenner // Isr. J. Vet. Med. – 2005. –V. 60. – P. 90-105.
- Van den Heuvel, M.J. Isolation of a bovine plasma fibronectin-containing complex which inhibits the expression of bovine leukemia virus p24 / M.J. Van den Heuvel, B.J. Jefferson, R.M. Jacobs // J. Virol. – 2005. – V. 79. – P. 8164-8170.
- Rama, G. Development of a real time PCR assay using SYBR Green chemistry for bovine leukemia virus detection / G. Rama, G. Moratorio, G. Greif // Retro virology. – 2011. – V. 8. – A17.
- Detection of a novel bovine limphotropicherpesvirus / J. Rovnak, S. Quaokenbush, R. Reyes. et al. // J.Virol. – 1998. – V.72, N 5. – P. 4237-4242.
- Jacobs, R.M. Production and related variables in bovine leukaemia virus-infected cows / R.M. Jacobs, J.L. Heeney, M.A. Godkin // Vet. Res. Commun. – 1991. – V. 15. – P. 463-474.
- Philpott, S.M. Defective DNA repair in cells with human T-cell leukemia/bovine leukemia viruses: role of tax gene / S.M. Philpott, G.C. Buehring // J. Natl. Cancer Inst. – 1999. – V. 91. – P. 933-942.
- Polanski, M.A list of candidate cancer biomarkers for targeted proteomics / M. Polanski, N.L. Anderson // Biomark. Insights. – 2007. – V. 1. – P. 1-48.
- Pucci, S. Modulation of different clusterin isoforms in human colon tumorigenesis / S. Pucci, E. Bonanno, F. Pichiorri // Oncogene. – 2004. – V. 23. – P. 2298-2304.
- Rama, G. Development of a real time PCR assay using SYBR Green chemistry for bovine leukemia virus detection / G. Rama, G. Moratorio, G. Greif // Retro virology. – 2011. – V. 8. – A17.
- Reichert, M. Protective effects of a live attenuated bovine leukaemia virus vaccine with deletion in the R3 and G4 genes / M. Reichert, G.H. Cantor, L.Willems // J. Gen. Virol. – 2000. – V. 81. – P. 965-969.
- Rhodes, J.K. Economic implications of bovine leukemia virus infection in mid-Atlantic dairy herds / J.K. Rhodes, K.D. Pelzer, Y.J. Johnson // J. Am. Vet. Med. Assoc. – 2003. – V. 223. – P. 346-352.
- Richardson, S.J. Cell and molecular biology of transthyretin and thyroid hormones / S.J. Richardson // Int. Rev. Cytol. – 2007. – V. 258. – P. 137-193.
- Rizzi, F. Targeting Clusterin in prostate cancer / F. Rizzi, S.Bettuzzi // J. Physiol. Pharmacol. – 2008. – V. 59. – P. 265-274.
- Rizzi, F. The clusterin paradigm in prostate and breast carcinogenesis / F. Rizzi, S. Bettuzzi // Endocr. Relat. Cancer. – 2010. – V. 17. – P. R1-R17.
- Rola, M. The detection of bovine leukemia virus pro viral DNA by PCR-ELISA / M. Rola, J. Kuzmak // J. Virol. Methods. – 2002. – V. 99. – P. 33-40.
- Srinivas, P.R. Proteomics in early detection of cancer / P.R. Srinivas, S. Srivastava, S. Hanash // Clinical Chemistry. – 2001. – V. 47. – P. 1901-1911.
- Srinivas, P.R. Proteomics for cancer biomarker discovery / P.R. Srinivas, M. Verma, Y. Zhao // Clinical Chemistry. – 2002. – V. 48. – P. 1160-1169.
- Stone, D.M. CD4 T lymphocyte activation in BLV-induced persistent B lymphocytosis in cattle / D.M. Stone, L.K. Norton, J.C. Chambers // Clin. Immunol. – 2000. – V. 96. – P. 280-288.
- Suh, G.H. Establishment of a bovine leukemia virus-free dairy herd in Korea / G.H. Suh, J.C. Lee, C.Y. Lee // J. Vet. Sci. – 2005. – V. 6. – P. 227-230.
- Suzuki, T. Evaluation of the delta subunit of bovine adaptor protein complex 3 as a receptor for bovine leukaemia virus / T. Suzuki, Y. Matsubara, H. Kitani // J. Gen. Virol. – 2003. – V. 84. – P. 1309-1316.
- Tajima, S. Induction of expression of bovine leukemia virus (BLV) in blood taken from BLV-infected cows without removal of plasma / S. Tajima, Y. Aida // Microbes Infect. – 2005. – V. 7. – P. 1211-1216.
- Tajima, S. Mutant tax protein from bovine leukemia virus with enhanced ability to activate the expression of c-fos / S. Tajima, Y. Aida // J. Virol. – 2002. –V. 76. – P. 2557-2562.
- Takahashi, M. Involvement of bovine leukemia virus in induction and inhibition of apoptosis / M. Takahashi, S. Tajima, K. Okada // Microbes Infect. – 2005. – V. 7. – P. 19-28.
- Tanaka, A.S. Targeted rearrangement of a chromosomal repeat sequence by transfection of a homologous DNA sequence using purified integrase / A.S. Tanaka, K. Komuro // Gene Ther. 2005. – V. 12. – P. 783-794.
- Taniguchi, Y. Silencing of human T-cell leukemia virus type I gene transcription by epigenetic mechanisms / Y. Taniguchi, K. Nosaka, J. Yasunaga // Retrovirology. – 2005. – V. 2. – P. 64-64.
- Trainin, Z. The direct and indirect economic impacts of bovine leukemia virus infection on dairy cattle / Z. Trainin, J. Brenner // Isr. J. Vet. Med. – 2005. –V. 60. – P. 90-105.
- Trougakos, LP. Clusterin/apolipoprotein J in human ageing and cancer / I.P. Trougakos, E.S. Gonos // Int. J. Biochem. Cell Biol. – 2002. – V. 34. – P. 1430-1448.
- Usui, T. Protective effects of vaccination with bovine leukemia virus (BLV) Tax DNA against BLV infection in sheep / T. Usui, S. Konnai, S. Tajima // J. Vet. Med. Sci. – 2003. – V. 65. – P. 1201-1205.
- Van den Heuvel, M.J. Isolation of a bovine plasma fibronectin-containing complex which inhibits the expression of bovine leukemia virus p24 / M.J. Van den Heuvel, B.J. Jefferson, R.M. Jacobs // J. Virol. – 2005. – V. 79. – P. 8164-8170.
- Wu, D. In vivo transcription of bovine leukemia virus and bovine immunodeficiency-like virus / D. Wu, K. Murakami, A. Morooka // Virus Res. – 2003. – V. 97. – P. 81-87.
- Zanotti, G. Plasma retinol-binding protein: structure and interactions with retinol, retinoids, and transthyretin / G. Zanotti, R. Berni // Vitam. Horm. – 2004. –V. 69. – P. 271-295.
- Zellweger, T. Enhanced radiosensitivity in prostate cancer by inhibition of the cell survival protein clusterin / T. Zellweger, K. Chi, H. Miyake // Clin. Cancer Res. – 2002. – V. 8. – P. 3276-3284.
- Zhao, T.M. Quantification of HTLV-I proviral load in experimentally infected rabbits / T.M. Zhao, B. Hague, D.L. Caudell // Retrovirology. – 2005. – V. 2. – P. 34-34.
- Bibikova M., Golic M., Golic K.G., Carroll D. // Genetics. – 2002. – V. 161, № 3. – P. 1169-1175.
- Townsend J.A., Wright D.A., Winfrei R.J., Fu F., Maeder M.L., Joung J.K., Voytas D.F. // Nature. – 2009. – V. 459, № 7245. – P. 442-445.
- Zhang F., Maeder M.L., Unger-Wallace E., Hoshaw J.P., Reyon D., Christian M., Li X., Pierick C.J., Dobbs D., Peterson T., et al.// Proc. Natl. Acad. Sci. USA. 2010. V. 107. № 26. P. 12028-12033.
- Torikai H., Reik A., Liu P.Q., Zhou Y., Zhang L., Maiti S., HulsH., Miller J.C., Kebriaei P., Rabinovitch B., et al. // Blood. – 2012. – V. 119, № 24. – P. 5697-5705.
- Provasi E., Genovese P., Lombardo A., Magnani Z., Liu P.Q.,Reik A., Chu V., Paschon D.E., Zhang L., Kuball J., et al. //Nat. Med. – 2012. – V. 18, № 5. – P. 807-815.
- Lombardo A., Cesana D., Genovese P., Di Stefano B., Provasi E., Colombo D.F., Neri M., Magnani Z., Cantore A., Lo Riso P.,et al. // Nat. Methods. 2011. V. 8. № 10. P. 861–869.
- Becker M. // Nat. Methods. 2012. V. 9. № 1. P. 1.
- Schornack S., Meyer A., Romer P., Jordan T., Lahaye T. // J. Plant Physiol. – 2006. – V. 163, № 3. – P. 256–272.
- Romer P., Hahn S., Jordan T., Strauss T., Bonas U., Lahaye T. // Science. – 2007. – V. 318, № 5850. – P. 645–648.
- Boch J., Scholze H., Schornack S., Landgraf A., Hahn S., Kay S., Lahaye T., Nickstandt A., Bonas U., et al. // Science. 2009. V. 326. № 5959. P. 1509–1512.
- Moscou M.J., Bogdanove A.J. // Science. 2009. V. 326.№ 5959. P. 1501.
- Lamb B.M., Mercer A.C., Barbas C.F. // Nucleic Acids Res.2013. V. 41.
- Christian M., Cermak T., Doyle E.L., Schmidt C., Zhang F., Hummel A., Bogdanove A.J., Voytas D.F. // Genetics. – 2010. –V. 186, № 2. – P. 757-761.
- Cong L., Zhou R., Kuo Y.C., Cunniff М.М., Zhang F. // Nat.Commun. – 2012. – V. 3. – P. 968.
- Christian M.L., Demorest Z.L., Starker C.G., Osborn M.J.,Nyquist M.D., Zhang Y., Carlson D.F., Bradley P., Bogdanove A.J., Voytas D.F. // PloS One. – 2012. – V. 7, № 9. – E45383.
- Streubel J., Blucher C., Landgraf A., Boch J. // Nat. Biotechnol. 2012. V. 30. № 7. P. 593–595.
- Mak A.N., Bradley P., Cernadas R.A., Bogdanove A.J., Stoddard B.L. // Science. 2012. V. 335. № 6069. P. 716–719.
- Ishino Y., Shinagawa H., Makino K., Amemura M., Nakata A. // J. Bacteriol. 1987. V. 169. № 2. P. 5429–5433.
- Haft D.H., Selengut J., Mongodin E.F., Nelson K.E. // PloS Comput. Biol. – 2005. – V. 1, № 6. – E60
- Bolotin A., Quinguis B., Sorokin A., Ehrlich S.D. //Microbiology. – 2005. – V. 151. – P. 2551-2561.
- Mojica F.J., Diez-Villasenor C., Garcia-Martinez J., Soria E. //J. Mol. Evol. – 2005. – V. 60. – № 2. – P. 174-182.
- Pourcel C., Salvignol G., Vergnaud G. // Microbiology. – 2005. – V. 151. – P. 653–663.
- Barrangou R., Flemaux C., Deveau H., Richards M., Boyaval P., Moineau S., Romero D.A., Horvath P. // Science. – 2007. – V. 315, № 5819. – P. 1709-1712.
- Grissa I., Vergnaud G., Pourcel C. // BMC Bioinformatics. – 2007. – V. 8. – P. 172.
- Makarova K.S., Haft D.H., Barrangou R., Brouns S.J., Charpentier E., Horvath P., Moineau S., Mojica F.J., Wolf Y.I.,Yakunin A.F., et al. // Nat. Rev. Microbiol. – 2011. – V. 9, № 6.
- Mojica F.J., Diez-Villasenor C., Garcia-Martinez J.,Almendros C.//Microbiology. – 2009. – V. 155. – P. 733-740.
- Swarts D.C., Mosterd C., van Passel M.W., Brouns S.J. //PloS One. – 2012. – V. 7, № 4. – E35888.
- Hale C.R., Majumdar S., Elmore J., Pfister N., Compton M.,Olson S., Resch A.M., Glover C.V., Graveley B.R., Tern R.M. //Mol. Cell. – 2012. – V. 45, № 3. – P. 292–302.
- Hale C.R., Majumdar S., Elmore J., Pfister N., Compton M.,Olson S., Resch A.M., Glover C.V., Graveley B.R., Tern R.M. //Mol. Cell. – 2012. – V. 45, № 3. – P. 292–302.
- Lillestol R.K., Shah S.A., Brugger K., Redder P., Phan H.,Christiansen J., Garrett R.A. // Mol. Microbiol. – 2009. – V. 72, № 1. – P. 259-272.
- Carte J., Wang R., Li H., Terns R.M., Terns M.P. // Genes. Dev. – 2008. – V. 22, № 24. – P. 3489-3496.
- Haurwitz R.E., Jinek M., Wiedenheft B., Zhou K., Doudna J.A. // Science. – 2010. – V. 329, № 5997. – P. 1355-1358.
- Gesner E.M., Schellenberg M.J., Garside E.L., George M.M., Macmillan A.M. // Nat. Struct. Mol. Biol. – 2011. – V. 18, № 6. – P. 688-692.
- Richter H., Zoephel J., Schermuly J., Maticzka D., Backofen R., Randau L. // Nucleic Acids Res. – 2012. – V. 40, № 19. – P. 9887-9896.
- Sashital D.G., Jinek M., Doudna J.A. // Nat. Struct. Mol. Biol. – 2011. – V. 18, № 6. – P. 680-687.
- Hale C.R., Zhao P., Olson S., Duff M.O., Graveley B.R., Wells L., Terns R.M., Terns M.P. // Cell. – 2009. – V. 139, № 5. – P. 945-956.
- Makarova K.S., Grishin N.V., Shabalina S.A., Wolf Y.I., Koonin E.V. // Biol. Direct. – 2006. – V. 1. – P. 7.
- Marraffini L.A., Sontheimer E.J. // Nature. – 2010. – V. 463, № 7280. – P. 568-571.
- Bondy-Denomy J., Pawluk A., Maxwell K.L., Davidson A.R. // Nature. 2013. V. 493. № 7432. P. 429–432.
- Makarova K.S., Aravind L., Wolf Y.I., Koonin E.V. // Biol.Direct. 2011. V. 6. P. 38.
- Sapranauskas R., Gasiunas G., Fremaux C., Barrangou R., Horvath P., Siksnys V. // Nucleic Acids Res. 2011. V. 39. № 21. P. 9275–9282.
- Jinek M., Chylinski K., Fonfara I., Hauer M., Doudna J.A., Charpentier E. // Science. 2012. V. 337. № 6096. P. 816–821.
- Deltcheva E., Chylinski K., Sharma C.M., Gonzales K., Chao Y., Pirzada Z.A., Eckert M.R., Vogel J., Charpentier E. // Nature. 2011. V. 471. № 7340. P. 602–607. 45. Mussolino C., Cathomen T. // Curr. Opin. Biotechnol. 2012. V. 23. № 5. P. 644–650.
- Cong L., Ran F.A., Cox D., Lin S., Barretto R., Habib N., Hsu P.D., Wu X., Jiang W., Marraffini L.A., et al. // Science. 2013. V. 339. № 6121. P. 819–823.
- Hsu P.D., Scott D.A., Weinstein J.A., Ran F.A., Konermann S., Agarwala V., Li Y., Fine E.J., Wu X., Shalem O., et al. // Nat. Biotechnol. 2013. V. 31. № 9. P. 827–832.
- Jiang W., Bikard D., Cox D., Zhang F., Marraffini L.A. // Nat. Biotechnol. 2013. V. 31. № 3. P. 233–239.
- Fu Y., Foden J.A., Khayter C., Maeder M.L., Reyon D., Joung J.K., Sander J.D. // Nat. Biotechnol. 2013. V. 31. № 9. P. 822–826.
- Mali P., Aach J., Stranges P.B., Esvelt K.M., Moosburner M., Kosuri S., Yang L., Church G.M. // Nat. Biotechnol. 2013. V. 31. № 9. P. 833–838.
- Ran F.A., Hsu P.D., Lin C., Gootenberg J.S., Konermann S., Trevino A.E., Scott D.A., Inoue A., Matoba S., Zhang Y. // Cell. 2013. V. 154. № 6. P. 1380–1389.
- Gasiunas G., Barrangou R., Horvath P., Siksnys V. // Proc. Natl. Acad. Sci. USA. 2012. V. 109. № 39. P. 2579–2586.
- Gasiunas G., Barrangou R., Horvath P., Siksnys V. // Proc. Natl. Acad. Sci. USA. 2012. V. 109. № 39. P. 2579–2586.
- Dianov G.L., Hubscher U. // Nucleic Acids Res. – 2013. – V. 41, № 6. – P. 3483-3490.
- Doyle E.L., Booher N.J., Standage D.S., Voytas D.F., BrendelV.P., Vandyk J.K., Bogdanove A.J. // Nucleic Acids Res. – 2012. – V. 40. P. W117-122.
- D’Angelino, J.L. Epidemiological study of enzootic bovine leukosis in Brazil / J.L. D’Angelino, M. Garcia, E.H. Birgel // Trop. Anim. Health Prod. – 1998. – V. 30. – P. 13-15.
- Altreuther, G. Morphologic and functional changes in bovine monocytes infected in vitro with the bovine leukaemia virus / G. Altreuther, L. Llames, S. Neuenschwander // Scand. J. Immunol. – 2001. – V. 54. – P. 459-469.
- Anderson, L. Candidate-based proteomics in the search for biomarkers of cardiovascular disease / L. Anderson // J. Physiol. – 2005. – V. 563.1. – P. 2360.
- Avidan, O. The processivity and fidelity of DNA synthesis exhibited by the reverse transcriptase of bovine leukemia virus / O. Avidan, M.E. Meer, I. Oz // Eur. J. Biochem. – 2002. – V. 269. – P. 859-867.
- Beier, D. Identification of different BLV provirus isolates by PCR, RFLPA and DNA sequencing / D. Beier, P. Blankenstein, O. Marquardt // Berl. Munch. Tierarztl. Wochenschr. – 2001. – V. 114. – P. 252-256.
- Bondzio, A. Involvement of intracellular Ca2+ in the regulation of bovine leukemia virus expression / A. Bondzio, A. Abraham-Podgornik, P. Blankenstein, // Biol. Chem. – 2001. – V. 382. – P. 407-416.
- Buehring, G.C. Humans have antibodies reactive with bovine leukemia virus / G.C. Buehring, S.M. Philpott, K.Y. Choi // AIDS Res. Hum. Retrovir. – 2003. – V. 19. – P. 1105-1113.
- Burmeister, T. No genetic evidence for involvement of deltaretroviruses in adult patients with precursor and mature T-cell neoplasms / T. Burmeister, S. Schwartz, M. Hummel // Retrovirology. – 2007. – V. 4. – P. 11-11.
- Debacq, C. Reduced proviral loads during primo-infection of sheep by bovine leukemia virus attenuated mutants / C. Debacq, M.T. Sanchez Alcaraz, F. Mortreux // Retro virology. – 2004. – V. 1. – P. 31-31.
- Domenech, A. In vitro infection of cells of the monocytic/macrophage lineage with bovine leukaemia virus / A. Domenech, J. Goyache, L. Llames // J. Gen. Virol. – 2000. – V. 81. – P. 109118.
- Dube, S. The complete genomic sequence of an in vivo low replicating BLV strain / S. Dube, L. Abbott, D.K. Dube // Virol. J. – 2009. – V. 6. – P. 120-120.
- Dube, S. The complete genomic sequence of a BLV strain from a Holstein cow from Argentina / S. Dube, G. Dolcini, L. Abbott // Virology. – 2000. – V. 277. – P. 379-386.
- Ferens, W.A. Intestinal Shiga toxin-producing Escherichia coli bacteria mitigate bovine leukemia virus infection in experimentally infected sheep / W.A. Ferens, R. Cobbold, C.J. Hovde // Infect. Immun. – 2006. – V. 74. – P. 2906-2916.
- Fulton, B.E. Jr. Dissemination of bovine leukemia virus-infected cells from a newly infected sheep lymph node / B.E. Fulton, M. Portella, K. Radke // J. Virol. 2006. – V. 80. – P. 7873-7884.
- Hamilton, V.T. Translocation of the B cell receptor to lipid rafts is inhibited in B cells from BLV-infected, persistent lymphocytosis cattle / V.T. Hamilton, D.M. Stone, G.H. Cantor // Virology. – 2003. – V. 315. – P. 135-147.
- Jimba, M. BLV-CoCoMo-Qpcr: quantitation of bovine leukemia virus proviral load using the CoCoMo algorithm / M. Jimba, S.N. Takeshima, K. Matoba // Retrovirology. – 2010. – V. 7. – P. 91-91.
- Juliarena, M.A. Determination of proviral load in bovine leukemia virus-infected cattle with and without lymphocytosis / M.A. Juliarena, S.E. Gutierrez, C. Ceriani // Am. J. Vet. Res. – 2007. – V. 68. – P. 1220-1225.
- Kabeya, H. Host immune responses in the course of bovine leukemia virus infection / H. Kabeya, K. Ohashi, M. Onuma // J. Vet. Med. Sci. – 2001. – V. 63. –P. 703-708.
- Kerkhofs, P. Long-term protection against bovine leukaemia virus replication in cattle and sheep / P. Kerkhofs, J.S. Gatot, K. Knapen, M. Mammerickx, A. Burny, D. Portetelle, L. Willems, R. Kettmann // J. Gen. Virol. 2000. – V. 81. – P. 957-963.
- Kohara, J. Experimental transmission of Bovine leukemia virus in cattle via rectal palpation / J. Kohara, S. Konnai, M. Onuma // Jpn. J. Vet. Res. 2006. –V. 54.-P. 25-30.
- Konnai, S. The rapid quantitative analysis of bovine cytokine genes by realtime RT-PCR / S. Konnai, T. Usui, K. Ohashi // Vet. Microbiol. – 2003. – V. 94. – P. 283-294.
- Lefebvre, L. Subcellular localization of the bovine leukemia virus R3 and G4 accessory proteins / L. Lefebvre, V. Ciminale, A. Vanderplasschen // J. Virol. – 2002. – V. 76. – P. 7843-7854.
- Licursi, M. Pro virus variants of bovine leukemia virus in naturally infected cattle from Argentina and Japan / M. Licursi, Y. Inoshima, D. Wu // Vet. Microbiol. – 2003. – V. 96. – P. 17-23.
- Enzootic bovine leucosis // OIE. Manual of Diagnostic Test and Vaccines for Terrestrial Animal. – Paris, 2012. – Vol.1. – P.721-732.
- Enzootic bovine leuсosis / EFSA J. – 2015. – Р.4188.
- Gagnon C.A. Detection of bovine lymphotropic herpesvirus DNA in Tissues of bovine fetus / G.A. Gagnon, O. Allam, R. Drolet // Canad. Vet. J. – 2010. – V.51. – P. 1021-1022.
- Mansky, L.M. The primary nucleotide sequence of the bovine leukemia virus RNA packaging signal can influence efficient RNA packaging and virus replication / L.M. Mansky, L.C. Gajary // Virology. 2002. – V. 301. – P. 272-280.
- McGirr, K.M. Tax and Rex sequences of bovine leukaemia virus from globally diverse isolates: Rex amino acid sequence more variable than Tax / K.M. McGirr, G.C. Buehring // J. Vet. Med. B. Infect. Dis. Vet. Public Health. – 2005. – V. 52. – P. 8-16.
- Meas, S. Vertical transmission of bovine leukemia virus and bovine immunodeficiency virus in dairy cattle herds / S. Meas, T. Usui, K. Ohashi // Vet. Microbiol. – 2002. – V. 84. – P. 275-282.
- Merezak, C. Inhibition of histone deacetylases induces bovine leukemia virus expression in vitro and in vivo / C. Merezak, M. Reichert, C. Van Lint // J. Virol. – 2002. – V. 76. – P. 5034-5042.
- Monti, G. Genetic diversity and spread of bovine leukaemia virus isolates in Argentine dairy cattle / G. Monti, R. Schrijver, D. Beier // Arch. Virol. – 2005. –V. 150. – P. 443-458.
- Moratorio, G. Phylogenetic analysis of bovine leukemia virus / G. Moratorio, S. Fischer, G. Obal // Unpublished data. – 2013.
- Morcock, D.R. Fluorescence and nucleic acid binding properties of bovine leukemia virus nucleocapsid protein / D.R. Morcock, S. Katakam, B.P. Kane // Biophys. Chem. – 2002. – V. 97. – P. 203-212.
- Motton, D.D. Bovine leukemia virus alters growth properties and casein synthesis in mammary epithelial cells / D.D. Motton, G.C. Buehring // J. Dairy Sci. – 2003. – V. 86. – P. 2826-2838.
- Moules, V. Fate of premalignant clones during the asymptomatic phase preceding lymphoid malignancy / V. Moules, C. Pomier, D. Sibon // Cancer Res. –2005. – V. 65. – P. 1234-1243.
- Murakami, K. The recent prevalence of bovine leukemia virus (BLV) infection among Japanese cattle / K. Murakami, S. Kobayashi, M. Konishi // Vet. Microbiol. – 2011. – V. 148. – P. 84-88.
- Murakami, K. The recent prevalence of bovine leukemia virus (BLV) infection among Japanese cattle / K. Murakami, S. Kobayashi, M. Konishi // Vet. Microbiol. – 2011. – V. 148. – P. 84-88.
- Mechanisms of leukemogenesis induced by bovine leukemia virus: prospects for novel anti-retroviral therapies in human / N. Gillet, A. Florins, M. Boxus et al. // Retrovirology. – 2007. –V.16. – P. 4-18.
- Meas, S. Vertical transmission of bovine leukemia virus and bovine immunodeficiency virus in dairy cattle herds / S. Meas, T. Usui, K. Ohashi // Vet. Microbiol. – 2002. – V. 84. – P. 275-282.
- Novel gammaherpesvirus function encoded by bovine herpesvirus 6 (bovine lymphotropic virus) / J. Jia, G.Delhon, E. Talman et al. // J. Gen. Virol. – 2014. – V.95. – P. 1740-1798.
- Oltenacu, P.A. The impact of genetic selection for increased milk yield on the welfare of dairy cows / P.A. Oltenacu, D.M. Broom // Universities Federation for Animal Welfare The Old School. – Brewhouse Hill, Wheathampstead, Hertfordshire AL4 8AN, UK Animal Welfare. – 2010. – № 19(S). – Р. 39-49.
- Otachel-Hawranek, J. Eradication of enzootic bovine leukosis in dairy cattle from the lower Silesia region / J. Otachel-Hawranek // Bull. Vet. Inst. Pulawy. – 2007. – V. 51. – P. 465-469.
- Ott, S.L. Association between bovine-leukosis virus seroprevalence and herdlevel productivity on US dairy farms / S.L. Ott, R. Johnson, S.J. Wells // Prev. Vet. Med. – 2003. – V. 61. – P. 249-262.
- OIE. Terrestrial Animal Health Code. – Paris, 2016.
- Seguence variability of bovine leukemia virus env gene and its relevance to the structure and antigenicity of the glycoproteins / R.Z. Mamoun, M. Morisson, N. Rebeyrotte et al. // J.Virol. – 1990. – V.64, N 9. – P. 4180-4188.
- Suh, G.H. Establishment of a bovine leukemia virus-free dairy herd in Korea / G.H. Suh, J.C. Lee, C.Y. Lee // J. Vet. Sci. – 2005. – V. 6. – P. 227-230.
- OIE. Manual of Diagnostic Test and Vaccines for Terrestrial Animal. V.1.– Paris, 2016. – P. 667-670.
- OIE. Terrestrial Animal Health Code. – Paris, 2016.
- Trainin, Z. The direct and indirect economic impacts of bovine leukemia virus infection on dairy cattle / Z. Trainin, J. Brenner // Isr. J. Vet. Med. – 2005. –V. 60. – P. 90-105.
- Van den Heuvel, M.J. Isolation of a bovine plasma fibronectin-containing complex which inhibits the expression of bovine leukemia virus p24 / M.J. Van den Heuvel, B.J. Jefferson, R.M. Jacobs // J. Virol. – 2005. – V. 79. – P. 8164-8170.
- Rama, G. Development of a real time PCR assay using SYBR Green chemistry for bovine leukemia virus detection / G. Rama, G. Moratorio, G. Greif // Retro virology. – 2011. – V. 8. – A17.
- Detection of a novel bovine limphotropicherpesvirus / J. Rovnak, S. Quaokenbush, R. Reyes. et al. // J.Virol. – 1998. – V.72, N 5. – P.4237-4242.
- Jacobs, R.M. Production and related variables in bovine leukaemia virus-infected cows / R.M. Jacobs, J.L. Heeney, M.A. Godkin // Vet. Res. Commun. – 1991. – V. 15. – P. 463-474.
- Philpott, S.M. Defective DNA repair in cells with human T-cell leukemia/bovine leukemia viruses: role of tax gene / S.M. Philpott, G.C. Buehring // J. Natl. Cancer Inst. – 1999. – V. 91. – P. 933-942.
- Polanski, M.A list of candidate cancer biomarkers for targeted proteomics / M. Polanski, N.L. Anderson // Biomark. Insights. 2007. – V. 1. – P. 1-48.
- Pucci, S. Modulation of different clusterin isoforms in human colon tumorigenesis / S. Pucci, E. Bonanno, F. Pichiorri // Oncogene. – 2004. – V. 23. – P. 2298-2304.
- Rama, G. Development of a real time PCR assay using SYBR Green chemistry for bovine leukemia virus detection / G. Rama, G. Moratorio, G. Greif // Retro virology. – 2011. – V. 8. – A17.
- Reichert, M. Protective effects of a live attenuated bovine leukaemia virus vaccine with deletion in the R3 and G4 genes / M. Reichert, G.H. Cantor, L.Willems // J. Gen. Virol. – 2000. – V. 81. – P. 965-969.
- Rhodes, J.K. Economic implications of bovine leukemia virus infection in mid-Atlantic dairy herds / J.K. Rhodes, K.D. Pelzer, Y.J. Johnson // J. Am. Vet. Med. Assoc. – 2003. – V. 223. – P. 346-352.
- Richardson, S.J. Cell and molecular biology of transthyretin and thyroid hormones / S.J. Richardson // Int. Rev. Cytol. – 2007. – V. 258. – P. 137-193.
- Rizzi, F. Targeting Clusterin in prostate cancer / F. Rizzi, S.Bettuzzi // J. Physiol. Pharmacol. – 2008. – V. 59. – P. 265-274.
- Rizzi, F. The clusterin paradigm in prostate and breast carcinogenesis / F. Rizzi, S. Bettuzzi // Endocr. Relat. Cancer. – 2010. – V. 17. – P. R1-R17.
- Rola, M. The detection of bovine leukemia virus pro viral DNA by PCR-ELISA / M. Rola, J. Kuzmak // J. Virol. Methods. – 2002. – V. 99. – P. 33-40.
- Srinivas, P.R. Proteomics in early detection of cancer / P.R. Srinivas, S. Srivastava, S. Hanash // Clinical Chemistry. – 2001. – V. 47. – P. 1901-1911.
- Srinivas, P.R. Proteomics for cancer biomarker discovery / P.R. Srinivas, M. Verma, Y. Zhao // Clinical Chemistry. – 2002. – V. 48. – P. 1160-1169.
- Stone, D.M. CD4 T lymphocyte activation in BLV-induced persistent B lymphocytosis in cattle / D.M. Stone, L.K. Norton, J.C. Chambers // Clin. Immunol. – 2000. – V. 96. – P. 280-288.
- Suh, G.H. Establishment of a bovine leukemia virus-free dairy herd in Korea / G.H. Suh, J.C. Lee, C.Y. Lee // J. Vet. Sci. – 2005. – V. 6. – P. 227-230.
- Suzuki, T. Evaluation of the delta subunit of bovine adaptor protein complex 3 as a receptor for bovine leukaemia virus / T. Suzuki, Y. Matsubara, H. Kitani // J. Gen. Virol. – 2003. – V. 84. – P. 1309-1316.
- Tajima, S. Induction of expression of bovine leukemia virus (BLV) in blood taken from BLV-infected cows without removal of plasma / S. Tajima, Y. Aida // Microbes Infect. – 2005. – V. 7. – P. 1211-1216.
- Tajima, S. Mutant tax protein from bovine leukemia virus with enhanced ability to activate the expression of c-fos / S. Tajima, Y. Aida // J. Virol. – 2002. –V. 76. – P. 2557-2562.
- Takahashi, M. Involvement of bovine leukemia virus in induction and inhibition of apoptosis / M. Takahashi, S. Tajima, K. Okada // Microbes Infect. – 2005. – V. 7. – P. 19-28.
- Tanaka, A.S. Targeted rearrangement of a chromosomal repeat sequence by transfection of a homologous DNA sequence using purified integrase / A.S. Tanaka, K. Komuro // Gene Ther. – 2005. – V. 12. – P. 783-794.
- Taniguchi, Y. Silencing of human T-cell leukemia virus type I gene transcription by epigenetic mechanisms / Y. Taniguchi, K. Nosaka, J. Yasunaga // Retrovirology. – 2005. – V. 2. – P. 64-64.
- Trainin, Z. The direct and indirect economic impacts of bovine leukemia virus infection on dairy cattle / Z. Trainin, J. Brenner // Isr. J. Vet. Med. – 2005. –V. 60. – P. 90-105.
- Trougakos, LP. Clusterin/apolipoprotein J in human ageing and cancer / I.P. Trougakos, E.S. Gonos // Int. J. Biochem. Cell Biol. – 2002. – V. 34. – P. 1430-1448.
- Usui, T. Protective effects of vaccination with bovine leukemia virus (BLV) Tax DNA against BLV infection in sheep / T. Usui, S. Konnai, S. Tajima // J. Vet. Med. Sci. – 2003. – V. 65. –P. 1201-1205.
- Van den Heuvel, M.J. Isolation of a bovine plasma fibronectin-containing complex which inhibits the expression of bovine leukemia virus p24 / M.J. Van den Heuvel, B.J. Jefferson, R.M. Jacobs // J. Virol. – 2005. – V. 79. – P. 8164-8170.
- Wu, D. In vivo transcription of bovine leukemia virus and bovine immunodeficiency-like virus / D. Wu, K. Murakami, A. Morooka // Virus Res. – 2003. – V. 97. – P. 81-87.
- Zanotti, G. Plasma retinol-binding protein: structure and interactions with retinol, retinoids, and transthyretin / G. Zanotti, R. Berni // Vitam. Horm. – 2004. –V. 69. – P. 271-295.
- Zellweger, T. Enhanced radiosensitivity in prostate cancer by inhibition of the cell survival protein clusterin / T. Zellweger, K. Chi, H. Miyake // Clin. Cancer Res. – 2002. – V. 8. – P. 3276-3284.
- Zhao, T.M. Quantification of HTLV-I proviral load in experimentally infected rabbits / T.M. Zhao, B. Hague, D.L. Caudell // Retrovirology. – 2005. – V. 2. – P. 34-34.
