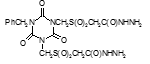
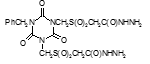
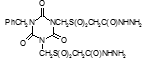
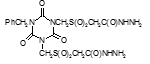
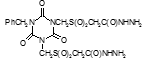
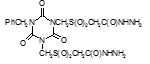
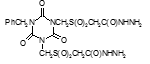
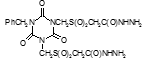
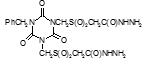
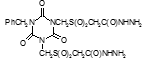
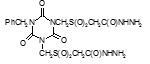
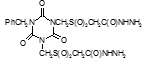
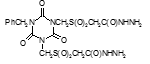
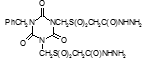
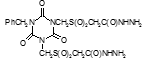
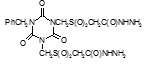
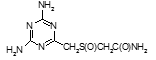Титульный лист и исполнители
Реферат
Общий объем отчета — 161 стр., количество книг отчета — 1, иллюстраций — 6, таблиц — 53, использованных источников -110.
Ключевые слова: туберкулез крупного рогатого скота, картограмма, фармако-токсикологические свойства, противотуберкулезная активность, химиопрофилактика
Цель работы: изыскание новых средств и методов профилактики туберкулеза молодняка крупного рогатого скота в неблагополучных по данному заболеванию хозяйствах.
Методы или методология проведения работы. Исследования проведены
с использованием эпизоотологических, клинических, патоморфологических, микробиологических, гематологических, биохимических, фармакологических и токсикологических методов исследования.
Результаты работы и их новизна: впервые проведен ретроспективный анализ эпизоотической ситуации по туберкулезу крупного рогатого скота в Республике Татарстан в период с 1960 по 2016 годы, установлены коэффициент заболеваемости и цикличность возникновения новых очагов туберкулезной инфекции, составлена картограмма и определен нозоареал болезни в республике.
Определены туберкулостатические свойства и минимальные ингибирующие концентрации для ряда новых препаратов: соли бис(оксиметил)фосфиновой кислоты с гидразидом изоникотиновой кислоты (Тубофен), 45-ти соединений относящихся к изоциануратам, 3-х — относящихся к триазинам, 34-х – относящихся к α,ω – бис(амидо- и гидразидометилсульфинил- и сульфонил)алканам
Впервые изучена специфическая химиопрофилактическая и химиотерапевтическая активность Тубофена, Линарола и Линарола Ф-1 на экспериментальной модели туберкулеза у белых мышей и морских свинок, установлены дозы и схема их применения. В производственных условиях доказана их химиопрофилактическая активность в отношении микобактерий туберкулеза у молодняка крупного рогатого скота.
Область применения результатов: оздоровление неблагополучных по туберкулезу крупного рогатого скота животноводческих предприятий.
Рекомендации по внедрению результатов НИР: практическая значимость проведенных исследований состоит в разработке новых противотуберкулезных препаратов, которые позволят повысить устойчивость телят к заражению микобактериями туберкулёза и предупредить развитие туберкулёзного процесса у инфицированных животных.
Рекомендации по внедрению результатов НИР: практическая значимость проведенных исследований состоит в разработке новых противотуберкулезных препаратов, которые позволят повысить устойчивость телят к заражению микобактериями туберкулёза и предупредить развитие туберкулёзного процесса у инфицированных животных.
Экономическая эффективность или значимость работы: применение нового противотуберкулезного препарата позволит сократить сроки оздоровления хозяйств, длительно неблагополучных по туберкулезу крупного рогатого скота, даст возможность гарантированно выращивать на таких фермах телят, полученных от реагирующих на туберкулин коров, обеспечит снижение затрат на ликвидацию туберкулеза.
Прогнозные предположения о развитии объекта исследования: дальнейшие исследования будут направлены на изучение, в производственных условиях профилактической эффективности нового антимикобактериального препарата на телятах, в неблагополучных по туберкулезу крупного рогатого скота хозяйствах.
Работа выполнялась на основании Тематического план-задания на выполнение научно-исследовательских работ федеральным государственным бюджетным образовательным учреждением высшего образования «Казанская государственная академия ветеринарной медицины им. Н.Э. Баумана» по заказу Минсельхоза России за счет федерального бюджета в 2019 году.
Перечень сокращений и Обозначений
В настоящем отчете о НИР применяют следующие сокращения и обозначения.
РФ Российская Федерация
РТ Республика Татарстан
ВОЗ Всемирная организация здравоохранения
МЗ Министерство здравоохранения
МЭБ Международное эпизоотическое бюро
НБ неблагополучный пункт
МБТ микобактерии туберкулеза
МИК минимальная ингибирующая концентрация
КОЕ колониеобразующие единицы
МЛУ множественная лекарственная устойчивость
ШЛУ широкая лекарственная устойчивость
ЛД50 среднесмертельная доза
МПД максимально переносимая доза
СОЭ скорость оседания эритроцитов
АЛТ аланинаминотрансфераза
АСТ аспартатаминотрансфераза
ГИНК гидразид изоникотиновой кислоты
РЭС ретикуло-эндотелиальная система
РСЛЛ реакция специфического лизиса лейкоцитов
МПБ мясо-пептонный бульон
КРС крупный рогатый скот
ВВЕДЕНИЕ
Распространение туберкулезной инфекции в длительно неблагополучных стадах, настолько своеобразно, что принятые в практике меры приводят не к ликвидации туберкулеза, а лишь к ослаблению эпизоотической напряженности инфекции. Новые случаи заболевания животных туберкулезом заставляют держать подобное хозяйство, как неблагополучное, на особом режиме, в течение длительного времени, а в дальнейшем вынуждают применять более решительные меры, включая единовременную полную замену всего восприимчивого поголовья (Александров Н.А. и соавт., 1974, 1975, Сафин М.А. и соавт., 1992; Хазипов Н.З. и соавт., 1997; Баратов М.О. и соавт., 2007).
Переход на интенсивные методы ведения животноводства также создает новые проблемы и вызывает настоятельную необходимость разработки комплексных систем борьбы с туберкулезом, так как простыми методами добиться положительных успехов в условиях интенсификации и укрупнения хозяйств уже труднее. В этих условиях для борьбы с туберкулезом крупного рогатого скота необходимо эпизоотологическое обоснование, использование всех средств и методов, имеющихся в нашем распоряжении (Джупина С.И., 1985, 1986, 1987; Смолянинов Ю.И. с соавт., 1986; Коромыслов Г.Ф., 1982, 1983; Урбан В.П., 1983; Косилов И.А. с соавт., 1987; Хайкин Б.Я., 1988; Сафин М.А. с соавт., 2002; Сатторов С.Ф., 2012; Ощепков В.Г. с соавт., 2013).
В подобных ситуациях верный путь к оздоровлению хозяйств — изыскание более эффективных методов борьбы, с включением в комплекс общих санитарно-оздоровительных мер и средств химиопрофилактики (Ротов В.И. и соавт., 1964; Хайкин Б.Я. и соавт., 1983; Донченко Н.А., 2008; Баратов М.О., 2017).
Открытие противотуберкулезных химиопрепаратов, обладающих бактериостатическими и бактерицидными свойствами, расширило возможности для борьбы с туберкулезом и успешно используется во всех странах мира для лечения и профилактики туберкулеза у людей (Рабухин А.Е., 1970; Шебанов Ф.В., 1976; Фисенко В., 2006; Морозова Т.И. и соавт., 2013; Ким М.Е. и соавт., 2016).
Внедрению химиопрофилактики в ветеринарную практику первоначально мешали дефицит противотуберкулёзных препаратов и их дороговизна. Однако, с тех пор как выяснилось, что профилактический эффект достигается от сравнительно малых доз, внимание к этим средствам усилилось (Ротов В.И., 1964, 1974; Хайкин Б.Я., 1976).
Опыты по использованию изониазида для профилактики туберкулёза крупного рогатого скота были проведены вначале за границей, а затем в нашей стране. Так, Moretti B., Pedini B. (1953), Bartmann K. (1958), Rosati T. (1959), Badiali L. (1962) провели опыты на телятах, содержащихся совместно с туберкулёзными коровами, у которых было доказано выделение возбудителей туберкулёза во внешнюю среду. При этом телятам внутримышечно вводили изониазид в дозе 10 мг/кг массы. При туберкулинизации телят и последующем убое было установлено наличие туберкулёзной инфекции у тех животных, которые не получали изониазида, и отсутствие туберкулёза у тех, которым вводили изониазид.
Опыты по химиопрофилактике туберкулёза с помощью применения изониазида в дозе 4 мг/кг в течение двух месяцев провёл Rosati T. (1957) на 4 телятах, два из них получали препарат, а два были в контроле. Все телята содержались в контакте с коровами – бактериовыделителями. Через два месяца животные, не получавшие изониазид, дали положительные туберкулиновые реакции, а животные, которым вводили препарат, реагировали на туберкулин отрицательно. При вскрытии и проведении биопробы на морских свинках туберкулёз был обнаружен только у контрольных животных.
По сообщению Kleeberg H. (1959) при даче изониазида 110 телятам, размещённым в скотном дворе среди туберкулёзных животных, получил отрицательные туберкулиновые пробы у всех подопытных телят. В 1967 году автор провёл опыт на 7000 головах крупного рогатого скота, среди которых 30% положительно реагировали на туберкулин. Через 7 – 10 месяцев непрерывной дачи изониазида различным группам скота в дозах 10 – 20 мг/кг массы тела большинство ранее реагирующих животных (75%) утратили чувствительность к туберкулину. Распространение инфекции прекратилось в стадах через 2 месяца после дачи препарата.
О производственном применении изониазида при оздоровлении крупного рогатого скота от туберкулёза в Чехословакии сообщил Straka I. (1968). В крупном промышленном хозяйстве телятам перорально задавали препарат в дозе 10 мг/кг в течение 2 месяцев после рождения, при этом до 20 дневного возраста телята содержались совместно с туберкулёзными коровами. В этих условиях из 375 телят, которым давали препарат, 92,4% оказались здоровыми. В контрольной группе туберкулёзом заболело 44% телят.
С начала 60-х годов прошлого столетия и в последующие годы, в ветеринарной практике с целью химиопрофилактики туберкулеза сельскохозяйственных животных в нашей стране начато испытание изониазида, как одного из наиболее эффективных и обладающих высокой бактериостатической активностью туберкулостатиков, широко применяемого во фтизиатрии (Смирнов Г.А., 1969; Ротов В.И. и соавт., 1978; Хайкин Б.Я. и соавт., 1983). Изониазид, являясь наиболее эффективным синтетическим противотуберкулезным препаратом, отличается хорошей переносимостью при лечении больных туберкулезом людей (Васильев Н.А. с соавт., 1990; Перельман М.И. с соавт., 1990, 2004; Ушакова В.А., 2007; Израилова Г.Г., 2011).
Благодаря свойствам высокой бактериостатической и бактерицидной активности, способности проникать в клетки поражённых тканей и органов, отсутствие кумуляции и способности угнетать общую и специфическую резистентность организма, изониазид привлёк пристальное внимание ветеринарных учёных разных стран, которые использовали и используют его в экспериментах по разработке новых методов профилактики и лечения заразных и незаразных заболеваний сельскохозяйственных животных.
В нашей стране первые опыты по применению изониазида для профилактики туберкулёза телят провёл Андрущенко В.А. (1962, 1969). На 353 подопытных и 276 контрольных телятах показана его высокая профилактическая эффективность. Среди подопытных животных заболело 3,9%, а среди контрольных – 34,4%.
Ротов В.И., Богаевский В.М., Рубан М.Д. (1964), для профилактики туберкулёза использовали фтивазид, изониазид и ПАСК в дозах от 5 до 25 мг/кг массы. Дачу химиопрепаратов и заражение животных микобактериями бычьего вида проводили перорально через каждые 3 дня из расчета 1 мг/кг микобактерий бычьего вида. Опыты проводили в течение 5,5 месяцев. Подопытные и контрольные животные подвергались аллергическим исследованиям и контрольному убою. Все подопытные телята не реагировали на туберкулин, а у контрольных животных были выраженные положительные туберкулиновые реакции. При убое через 70, 115 и 160 суток после начала опыта у контрольных животных туберкулёз был подтверждён патологоанотомически, бактериологически и биопробой. У подопытных животных этими же методами туберкулёз не был установлен. При этом была показана высокая эффективность как комбинированного применения различных бактериостатических препаратов (фтивазид, тубазид, ПАСК), так и применение одного изониазида для профилактики заболевания животных туберкулёзом.
Ротов В.И. (1974, 1978) сообщил об оздоровлении 150 хозяйств в 6 областях УССР с использованием туберкулостатических препаратов.
О целесообразности химиопрофилактики у телят старшего возраста в случае опасности их заражения при контакте с неблагополучными по туберкулёзу животными сообщил Калишин Н.М. (1966).
Учитывая положительные результаты экспериментальных исследований в ряде неблагополучных по туберкулезу крупного рогатого скота регионах страны, в системе оздоровительных мероприятий стали широко применять химиопрофилактику (Ли А.Б. с соавт., 1985; Хазипов Н.З., 1985; Гуркин А.В., 1986).
Так, в Кустанайской области (Казахстан) только в период с 1974 по 1979 годы практикуя химиопрофилактику изониазидом, выращено более 42,6 тысяч здоровых телок и оздоровлено 12 крупных совхозов (Пионтковский В.И., 1980; Новак Д.Д., 1983).
За 1976 – 1982 годы в Северном Казахстане химиопрофилактикой тубазидом в системе оздоровительных мероприятий было охвачено 305,4 тысячи телок, выращено 180 тысяч здоровых коров и нетелей, что способствовало оздоровлению 30 крупных длительно неблагополучных по туберкулезу хозяйств. В технологии специализированных ферм по изолированному выращиванию ремонтных телок, в условиях повсеместного эпизоотического неблагополучия по туберкулезу крупного рогатого скота, химиопрофилактика туберкулеза, как вынужденное дополнительное мероприятие, позволила в 95,01 – 99,8% случаев вырастить здоровых ремонтных телок, полученных от коров неблагополучных стад, в том числе и от реагирующих на туберкулин (Пионтковский В.И., Сафин М.А., 1984).
В 1977 – 1979 годах в Омской области при использовании в общем комплексе противотуберкулезных мероприятий тубазида, путем скармливания и подкожной инъекции в виде 20% эмульсии на рыбьем жире, оздоровлено от туберкулеза 7 хозяйств (Крюков С.Я., 1980).
В неблагополучных по туберкулезу хозяйствах Украины в течение 7 лет применения химиопрофилактики заболевания тубазидной и тубазидно-стрептомициновой эмульсией на витаминизированном кашалотовом жире и рафинированном подсолнечном масле было охвачено свыше 200 тысяч голов крупного рогатого скота, в результате чего оздоровлено 50 хозяйств, в которых через 6 лет не отмечено рецидивов туберкулеза (Дидовец С.Р. с соавт., 1980).
Ли А.Б. (1980) использовал изониазид в дозах 5 и 10 мг/кг для оздоровления ферм крупного рогатого скота, неблагополучных по туберкулёзу в Узбекистане. Химиопрофилактика успешно проводилась на 11000 голов крупного рогатого скота.
Химиопрофлактику туберкулёза при выращивании молодняка, полученного от реагирующих на туберкулин коров в Казахстане, успешно проводили Баранников В.М., Кусаинова К.Т., Баркитова К.Е. (1980). Указанные авторы в эксперименте на 116 подопытных и 104 контрольных животных показали высокую профилактическую эффективность изониазида при туберкулёзе молодняка крупного рогатого скота.
В хозяйствах Ростовской области, неблагополучных по туберкулёзу крупного рогатого скота, Гуркин А.В. (1980) использовал изониазид в дозах 0,6 г на животное (до 10 мг/кг массы). В опытах находилось 1447 животных различных возрастов, которым вводили препарат перорально и подкожно. Установлено, что его применение снижало заболеваемость животных туберкулёзом по сравнению с контролем от 1,8 до 8,6 раза.
Кравец А.Т., Хайкин Б.Я. и др. (1986) утверждают, что при применении тубазидной эмульсии на рыбьем жире при двукратном подкожном введении в течение месяца предохранило от туберкулеза 60% телят, зараженных микобактериями туберкулеза бычьего вида. Во всех случаях и при любом методе введения доза тубазида должна быть не менее 10 мг на 1 кг массы животного. Проведенные ими исследования показали, что тубазид лучше применять в длительно неблагополучных по туберкулезу крупного рогатого скота хозяйствах, курсами по 2,5 – 3 месяца и с такими же интервалами между ними до получения двух отрицательных результатов исследования. Применение препарата как профилактического средства в системе противотуберкулезных мероприятий, позволило им оздоровить от туберкулеза ряд хозяйств Омской области с тяжелой эпизоотической обстановкой.
Смолянинов Ю.И. и Кощеев Н.Н. (2001) в экспериментальных условиях установили 100% профилактический эффект применения изониазида в контролируемом опыте с предварительным 3-х кратным заражением возбудителем туберкулёза бычьего вида телят в двухнедельном возрасте. Заболевших животных, профилактируемых изониазидом в течение 45 дней после экспериментального заражения, не было и через 7 месяцев. Но в условиях производства эффективность изониазида оказалась несколько ниже. Это, по их мнению, связано с некоторыми условиями. Так, в хозяйствах с высокой степенью распространения туберкулёза среди всех возрастных групп животных (более 50%), опытные телята содержались не изолированно, а совместно с животными отделений, где проводились опыты. Такое содержание не исключало заражение телят возбудителем туберкулёза от больных животных, и после прекращения курса химиопрофилактики. После окончания курса химиопрофилактики прекращается и защитное действие изониазида и происходит перезаражение большинства животных. Поэтому в данной категории хозяйств среди животных, профилактируемых только изониазидом, в течение 35 дней заболело до 62,5%, а в контрольных – 78%. В то же время в хозяйствах с незначительным распространением туберкулёза (до 10%) заболеваемость в аналогичных группах составляла 1,5 – 2%. При условии изолированного содержания профилактируемых изониазидом телят, исключающего повторного заражения туберкулёзом, исследователи получали 100% профилактический эффект, при заболеваемости в контрольных группах от 8 до 10%.
В свою очередь Хайкин Б.Я., Литовченко А.Н. и другие (1990) при исследовании нового противотуберкулёзного препарата отметили, что при экспериментальном туберкулёзе телят, изониазид в дозах 25 – 50 мг/кг, задаваемый перорально в течение 60 дней, 4 раза в неделю, оказался менее активным и не предотвратил развитие патологического процесса туберкулёзного характера.
При туберкулезе животных испытаны различные способы введения в организм противотуберкулезных препаратов. С целью профилактики туберкулеза у телят раннего возраста тубазид рекомендовано вводить per os с молоком или водой, а животным старших возрастных групп – с комбикормом или в составе кормовых гранул (Кравец А.Т. с соавт., 1979; Ли А.Б., 1980, 1985).
Наряду с пероральным способом применения изониазида в чистом виде, были предложены туберкулостатические препараты для подкожного введения: тубазид в 20% водном растворе, тубазидно-стрептомициновая суспензия на рыбьем жире, пролонгированные формы на полимерной основе (Чепуров К.Л., 1978; Показий А.Г., 1987; Давыдова Т.Н. с соавт., 1990; Донченко Н.А., 2008). Кроме того, Зининой Н.Н. (1991) были предприняты попытки аэрозольного применения водных растворов изониазида при экспериментальном туберкулезе морских свинок.
По данным Щелканова К.Г. и Аверихина А.И. (1986), тубазид, применяемый телятам подкожно в виде эмульсии из расчета 10 мг сухого вещества на 1 кг массы тела, 1 или 2 раза в месяц, не предохраняет животных от заражения туберкулезом. Противоположный результат показал опыт по применению телятам тубазида в виде порошка, которые ежедневно с молоком получали препарат в дозе по 0,2 г. При вскрытии телят через 7 месяцев после заражения во внутренних органах и лимфатических узлах туберкулезных изменений не установлено. Отмечена лишь незначительная гиперемия подчелюстных, заглоточных, бронхиальных и брыжеечных лимфатических узлов. Авторы утверждают, что тубазид применяемый в виде порошка из расчета 10 мг сухого вещества на 1 кг живой массы, ежедневно, в течение 1,5 месяцев, предохраняет животных от заражения туберкулезом.
По заключению ряда исследователей (Алюшин М.Т. с соавт., 1974; Ветра Ф.Я. с соавт., 1981), дальнейшее совершенствование химиопрофилактики туберкулеза животных возможно с использованием пролонгированных форм изониазида, присоединенного к полимерам, увеличения периода между введениями препарата и повышения их активности путем различных комбинаций.
На основании вышеизложенного, были предложены препаративные формы на пролонгированной основе для профилактики туберкулеза сельскохозяйственных животных. Так, для профилактики туберкулеза у телят разработан препарат Альдозон – аналог изониазида, синтезированный на углеродной матрице. Препарат оказался высокоактивным in vitro и in vivo, и значительно менее токсичным, чем изониазид, что позволило расширить диапазон его терапевтического действия, не опасаясь побочных реакций со стороны макроорганизма (Приймак А.А., 1987; Власова Е.Е. с соавт., 1988).
На полимерной основе изониазида был синтезирован и противотуберкулезный препарат Ветизон, не обладающий эмбриотоксическим и тератогенным действием на организм самок белых крыс и развитие плода (Давыдова Т.Н., 1989, 1990).
Увенчались успехом попытки использования при туберкулезе крупного рогатого скота комбинированного и последовательного метода использования химиопрофилактических средств и вакцины БЦЖ (Хайкин Б.Я., 1980; Кравец А.Т. с соавт., 1980; Кощеев Н.Н., 1989, 2000; Жумаш А.С. с соавт., 1995, 2006; Прокопьева Н.И. с соавт., 2006).
Так, Кощеев Н.Н. (1989) и Кушалиев К.Ж. (1993), исследуя последовательное применение изониазида и вакцины БЦЖ, отмечали полную защиту телят от заражения высоковирулентной культурой возбудителя туберкулеза бычьего вида. Новорожденные телята в возрасте 10 – 15 дней получали с молоком изониазид один раз в сутки, в дозе 10 мг/кг массы животного в течение 35 дней. Через 10 дней после прекращения дачи изониазида телят вакцинировали вакциной ВЦЖ. По истечению 14 месяцев в неблагополучном хозяйстве с заболеваемостью туберкулезом до 5% всех возрастных групп животных, данный метод позволил защитить от заражения всех опытных телят. При этом в контрольной группе заболело 5,3% животных. В длительно неблагополучном хозяйстве с заболеваемостью туберкулезом более 50% коров и молодняка, метод последовательного применения изониазида и вакцины БЦЖ обеспечил защиту от заражения 77% телят, при этом в контрольной группе заболело 78% животных.
Несмотря на то, что большинство исследований было направлено на усовершенствование мер профилактики туберкулеза у крупного рогатого скота, положительные результаты использования изониазида как химиопрофилактического средства получены и в свиноводстве (Василенко К.Ф., 1975, 1983), мараловодстве (Капустин Л.А., 1969, 1970; Омарбеков Е.О. 1972), пушном звероводстве (Хайкин Б.Я., 1970, 1973), птицеводстве (Воробьев А.Н., 1973; Емельянов В.А., 1976).
Как химиотерапевтическое средство изониазид применяли и при лечении респираторных заболеваний. Наиболее обстоятельные исследования по определению эффективности изониазида при бронхопневмонии телят провели Мустакимов Р.Г., Марантиди А.Г. (1979). Авторы испытали эффективность применения изониазида в сравнении с другими лекарственными средствами при лечении серозно-катаральной и катарально-гнойной пневмоний и установили высокий процент выздоровления (98,7 — 100) при всех способах лечения, в том числе с применением изониазида.
Результаты химиопрофилактики неспецифических бронхопневмоний у телят изониазидом, путём групповой дачи его внутрь в дозе 25 мг/кг массы 1 раз в неделю с 1 по 60 день жизни, в сравнении с новарсенолом показали, что заболеваемость телят сокращается в 1,7 раза, а по сравнению с чистым контролем – в 2,2 раза. При этом изониазид не оказывал тормозящего или стимулирующего влияния на рост и развитие телят, однако, способствует достоверному повышению содержания белка, глобулинов, каротина и витамина С. Литвенко В.В. (1982) при респираторных болезнях рекомендует телятам изониазид в дозе 15 мг/кг.
В большинстве своем препаративные формы противотуберкулезных средств, синтезированы на основе гидразида изоникотиновой кислоты (ГИНК) и поэтому в определенной степени являются токсичными для организма человека и животных, вызывая функциональные и морфологические нарушения в органах и тканях (Лысов А.В. с осавт., 2006; Васильева О.А с соавт., 2008; Овчаренко Л.П. с соавт., 2009; Гриценко Н.С. с соавт., 2009; Израилова Г.Г., 2011). В связи с этим, поиск новых противотуберкулезных препаратов, а также средств и методов снижающих токсические свойства препаратов, весьма актуальны и в настоящее время (Донченко Н.А., 2003, 2008; Бочарова И.В., 2014).
С целью снижения токсичности в 1990 году Гладких С.П. (цит. по Мишиной А.В. с соавт., 2012) синтезирован новый препарат – феназид, который представляет собой хелатный комплекс двухвалентного железа и изониазида. При этом, благодаря блокаде хелатного центра молекулой железа, феназид окисляется в крови и не метаболизируется в печени, как изониазид. Феназид полностью лишен гепатотоксических побочных эффектов, практически не вызывает ангио- и нейротоксических осложнений и с успехом применяется в РФ у больных туберкулезом с сопутствующей патологией печени, сердечно-сосудистой и нервной системы, а также у больных пожилого и старческого возраста (Мишин В.Ю., 2007; Хаертынова И.М., 2008).
Как аналоги изониазида также были синтезированы метазид и фтивазид, которые по сравнению с изониазидом, медленнее всасываются из желудочно-кишечного тракта и при их применении создается несколько меньшая концентрация ГИНК в крови. Применяют их при впервые выявленном туберкулезе легких внутрь, в комбинации с другими основными препаратами, в том числе при непереносимости изониазида, как альтернативные препараты (Мишин В.Ю. с соавт., 2007).
На основе изониазида был синтезирован туберкулостатический ветеринарный препарат пролонгированного действия – ниазон, который представляет собой прозрачный, вязкий водный раствор, в состав которого входят изониазид, гидразон изониазида, полимер – пролонгатор метилцеллюлоза, стабилизатор трилон-Б, антимикробные вещества и вода для инъекций (Донченко Н.А., 2008). Препарат, по данным авторов, не обладает эмбриотоксическим, тератогенным, мутагенным, гонадотоксическим, и аллергизирующим действием, не угнетает аллергическую активность к туберкулину и стабилен при хранении в течение года. Применение ниазона в системе оздоровительных мероприятий при туберкулезе крупного рогатого скота по схеме 20 мл/кг живой массы подкожно, 4 раза каждые 10 дней, а затем ежемесячно, до прекращения выявления реагирующих на туберкулин животных, позволяет оздоровить стадо в течение 12 -16 месяцев (Дончеко Н.А. с соавт., 2001, 2002).
Таким образом, приведенные экспериментальные и производственные материалы показали, что в условиях промышленного развития животноводства, когда существующие методы ликвидации туберкулеза бывают недостаточно эффективны, четкая и обоснованная система химиопрофилактики в общем оздоровительном комплексе, может способствовать получению высокого профилактического эффекта в борьбе с туберкулезом крупного рогатого скота.
В настоящее время существует широкий арсенал противотуберкулезных средств для профилактики туберкулеза и лечения, больных данным заболеванием людей и животных, однако они не отвечают современным требованиям из-за высокой токсичности, длительного курса применения, образовавшейся лекарственной устойчивости к ним у микобактерий и дороговизны [Визель А.А., 1998]. Поэтому поиск, создание новых фармацевтических препаратов, обладающих антимикобактериальными свойствами и позволяющих повысить эффект химиопрофилактики и химиотерапии туберкулеза, остается весьма актуальной задачей.
Целью работы явилось изыскание новых средств и методов профилактики туберкулеза молодняка крупного рогатого скота в неблагополучных по данному заболеванию хозяйствах.
Для достижения поставленной цели были определены следующие задачи:
- Провести анализ эпизоотической ситуации по туберкулезу крупного рогатого скота в Республике Татарстан.
- Определить минимальную ингибирующую концентрацию синтезированных препаратов в отношении микобактерий туберкулеза.
- Изучить противомикробную и фунгистатическую активность «соединений – лидеров».
- Определить дозы и изучить профилактическую эффективность исследуемых препаратов на экспериментальной модели туберкулеза.
- Изучить в производственных условиях профилактическую эффективность исследуемых препаратов на телятах при туберкулезе крупного рогатого скота.
- Разработать научно-обоснованную систему профилактических противоэпизоотических мероприятий при туберкулезе крупного рогатого скота с использованием предложенных препаратов.
1. Основная часть отчета о НИР
1.1 МАТЕРИАЛЫ И МЕТОДЫ ИСЛЕДОВАНИЯ
Работа выполнена на кафедре эпизоотологии и паразитологии ФГБОУ ВО «Казанская государственная академия ветеринарной медицины имени Н.Э. Баумана».
Объектами исследования являлись статистико–эпизоотологическая информация, лабораторные животные и молодняк крупного рогатого скота сельскохозяйственных предприятий республики, патологический материал (кровь, паренхиматозные органы, лимфатические узлы), синтезированные противотуберкулезные препараты.
В опытах было использовано 210 белых мышей, 383 белые крысы, 16 кроликов, 143 морских свинок и 129 телят. Животные для опытов подбирались по принципу аналогов, с учётом пола, породы, возраста и живой массы тела (Западнюк И.П. и др., 1974). Группы опытных и контрольных животных содержали с соблюдением правил, норм кормления, ухода и гуманного обращения, согласно ветеринарно-санитарным требованиям (Приказ Минздравсоцразвития РФ от 23.08.2010 г., № 708н «Об утверждении Правил лабораторной практики»).
Мониторинг эпизоотической ситуации по туберкулезу крупного рогатого скота в республике, проводился путем изучения ветеринарной отчетности Главного управления ветеринарии Кабинета Министров Республики Татарстан. Анализ собранной информации осуществлялся согласно методическим указаниям и учебным пособиям по порядку проведения эпизоотологического исследования сельскохозяйственных предприятий (Джупина С.И., 1991; Кисленко В.Н., 2000; Бакулов И.А. и др., 2008).
Определение минимальной ингибирующей концентрации исследуемых химических соединений в отношении микобактерий туберкулеза проводили в опытах in vitro, используя методы последовательных серийных разведений (Першин Г.Н., 1971) и вертикальной диффузии на плотной питательной среде «Новая», а также стандартную радиометрическую ростовую систему BACTEC MGIT 960 (Becton Dickinson).
Лекарственную устойчивость микобактерий к исследуемым препаратам проводили, используя метод абсолютных концентраций на среде Левенштейна – Йенсена, согласно приказа МЗ РФ №109 от 21.03.2003 г.
Оценку спектра действия, степени антибактериальной и фунгистатической активности синтезированных противотуберкулезных препаратов Тубофена, Аликона, Линарола и Линарола Ф-1 проводили согласно «Руководству по экспериментальному изучению новых фармакологических веществ» под редакцией Хабриева Р.У. (2005).
Общетоксическое действие изучаемых средств определяли на лабораторных животных согласно «Методических указаний по доклиническому изучению общетоксического действия лекарственных препаратов» (утверждены Фармакологическим комитетом МЗ СССР 1985 г.).
Гематологические исследования проводили общепринятыми методами (Кудрявцев А.А. и др., 1969; Меньшиков В.В., 1987). Биохимические исследования крови, проводили с использованием биохимического анализатора Selectra Junior. Для определения количества альбуминов и глобулинов крови использовали устройство для электрофореза сыворотки крови УЭФ – 01 «Астра».
Эмбриотоксическое и тератогенное действия препаратов оценивали в соответствии с «Методическими указаниями по изучению эмбриотоксического действия фармакологических веществ и влияния их на репродуктивную функцию» (утверждены МЗ СССР 14.03.1986 г.).
Для изучения хронической токсичности препаратов использовали «Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ» под редакцией Хабриева Р.У. (2005).
Для изучения специфической антимикобактериальной активности и определения профилактических доз, синтезированных химических соединений на заражённых лабораторных животных, воспроизводили экспериментальный туберкулёз морских свинок, по методике Першина Г.Н. (1971).
Аллергические исследования морских свинок и крупного рогатого скота, проводили в соответствии с «Наставлением по диагностике туберкулеза животных» (утвержденным Департаментом ветеринарии Минсельхоза РФ 18.11.2002 г.) и «Инструкцией по применению туберкулина очищенного (ППД) для млекопитающих, стандартного раствора» (утв. Зам. руководителя Россельхознадзора РФ 30.09.2011 г.).
Для проведения патоморфологических и гистологических исследований кусочки печени, селезёнки, почек, легких и сердца фиксировали в 10%-ном нейтральном формалине и этанол-формалине. Уплотнение фиксированного материала проводили путем заливки в парафин и изготавливали гистологические срезы толщиной 5 – 10 мкм, которые окрашивали гематоксилином и эозином (Меркулов Г.А., 1969; Хонин Г.А., Барашкова С.А. и др., 2004).
Бактериоскопические и бактериологические исследования патологического материала от зараженных животных, проводили в соответствии с рекомендациями по «Лабораторной диагностике туберкулеза» (разработанными Всесоюзным научно-исследовательским институтом бруцеллеза и туберкулеза животных) и «Наставлением по диагностике туберкулеза животных» (утвержденным Департаментом ветеринарии Минсельхоза РФ 18.11.2002 г.).
Изучение профилактической противотуберкулезной эффективности Линарола Ф-1 проводили на новорожденных телятах, 3 — 12 дневного возраста, полученных от не реагирующих и реагирующих на туберкулин коров из хозяйств Республики Татарстан неблагополучных по туберкулезу.
Статистическую обработку цифрового экспериментального материала проводили в программе «Microsoft Excel XP», по показателям средних значений (M±m). Достоверность устанавливали по методу Стьюдента-Фишера.
1.2. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
1.2.1 Эпизоотическая ситуация по туберкулезу крупного рогатого скота в Республике Татарстан
В результате проведенного мониторинга и анализа эпизоотической ситуации по туберкулезу крупного рогатого скота в Республике Татарстан было установлено, что в прошлом многие районы республики в той или иной степени, были неблагополучны по туберкулезу. Широкие аллергические исследования скота на туберкулез начаты в республике в 1934 году, тогда было исследовано 150370, а в 1935 году – 223383 животных. Установлен туберкулез в 355 селениях. Значительное количество неблагополучных пунктов по туберкулезу крупного рогатого скота было выявлено и в последующие годы. В это время аллергический метод диагностики еще слабо внедрялся в ветеринарную практику, поэтому официальная статистика не отражала истинной эпизоотической обстановки по туберкулезу крупного рогатого скота в Татарской АССР. Но и эти неполные данные свидетельствуют о широком распространении инфекции.
Отечественная война нанесла серьезный ущерб ветеринарно-санитарному состоянию общественного животноводства. За четыре года войны, туберкулинизации было подвергнуто всего 625896 животных. Причем наибольшее количество реагирующих животных (5100 голов) было выделено в 1945 году.
В послевоенные годы шло нарастание количества выявляемых неблагополучных пунктов. Так, на 1 января 1949 года в республике зарегистрировалось 380 неблагополучных пунктов, а в течение года вновь было выявлено 318. Ежегодно на передержке в хозяйствах оставался больной туберкулезом скот, достигая в отдельные годы 43,7% (1955 г.), 46% (1958г.). Из общего количества исследованных животных до 1963 года в среднем 25% положительно реагирующего скота оставалось на следующий год в зимних помещениях без надлежащей изоляции.
Таким образом, причинами распространения туберкулеза крупного рогатого скота явилось: отсутствие изоляторов, отвечающих ветеринарно-санитарным требованиям; передвижение скота без учета эпизоотической обстановки; использование для пополнения стада молодняка, полученного от больных животных; плохая санация животноводческих помещений и территории ферм.
В дальнейшем борьба с туберкулезом крупного рогатого скота в регионе шла с переменным успехом. В этот период эпизоотическая обстановка по туберкулезу крупного рогатого скота в республике оставалась напряженной. Давность и множественность очагов инфекции, а также систематическое инфицирование животных, в силу нарушения хозяйствами профилактических мер снижали эффективность проводимых оздоровительных мероприятий.
За 40 лет (с 1960 по 2000 годы) было оздоровлено 726 неблагополучных по туберкулезу крупного рогатого скота пунктов, в которых заболело 130479 животных. Наиболее тяжелым, в эпизоотическом плане, для республики был период с 1960 по 1975 годы. В указанный период по республике в целом состояло на учете ежегодно более 50 неблагополучных пунктов. Кроме того, к указанному количеству неблагополучных пунктов ежегодно добавлялись новые пункты (рисунок 1).
Как видно из рисунка 1, наблюдалась цикличность возникновения новых очагов туберкулезной инфекции, которая регистрировалась с интервалами 5-7 лет. Линия многолетнего тренда неблагополучия крупного рогатого скота по туберкулезу, т.е. общая однонаправленная тенденция изменения интенсивности эпизоотического процесса в республике, стремилась к убыванию.
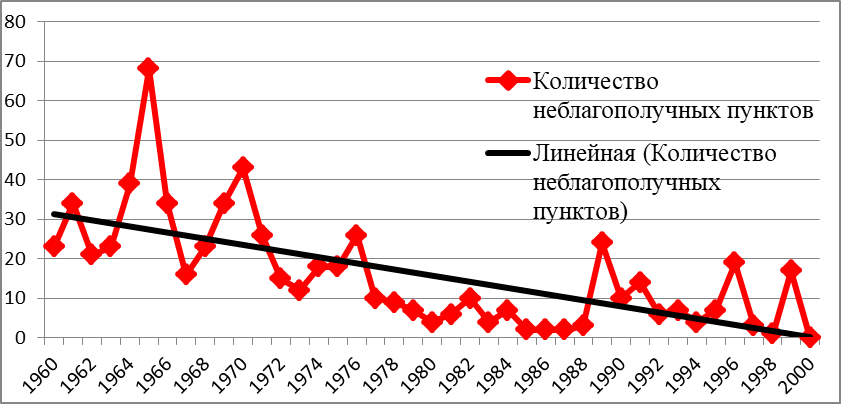
Рисунок 1 — Ежегодная динамика регистрации первичных неблагополучных пунктов по туберкулезу КРС в РТ (1960-2000 гг.)
Максимальное количество неблагополучных пунктов по туберкулезу крупного рогатого скота было выявлено в 1965 и 1966 годах. К началу 1966 года в 20 из 36 районов РТ было 138 неблагополучных пунктов. В течение года было оздоровлено от туберкулеза 54 пункта, вновь выявлено — 34, в которых заболело 10248 животных, т.е. 1,5% к числу исследованных. Таким образом, только за 2 года (1965 — 1966 гг.), было выявлено порядка 20498 больных животных, что по «нынешним меркам» может сравняться с поголовьем скота 2 – 3 районов республики.
Из года в год в неблагополучных хозяйствах оставалось на передержке довольно большое количество больного скота. Он размещался в совершенно не отвечающих санитарным требованиям изоляторах. Следует отметить, что к концу 1987 года эпизоотическая ситуация становится менее напряженной. Так, за этот год было выявлено всего 2 неблагополучных пункта, оздоровлено 7. Впервые на начало 1988 года не осталось на передержке больного скота и не было ни одного неблагополучного по туберкулезу пункта. Этот период характеризовался успешным осуществлением комплекса противотуберкулезных мероприятий.
Однако в течение 1988 года вновь появилось 3 неблагополучных пункта, которые явились началом нового роста количества неблагополучных пунктов и реагирующего на туберкулин скота. Если на начало 1991 года оставалось 13 неблагополучных пунктов, то к 1 января 1995 года их уже стало 21, в 1997 – 31, а вот к 2000 году — осталось 18.
Многолетние наблюдения за распространением туберкулеза крупного рогатого скота в республике позволили прийти к выводу о недостаточной эффективности проводимых противотуберкулезных мероприятий, объективному течению эпизоотического процесса. Несмотря на весьма успешное проведение оздоровительных мероприятий, эпизоотическая ситуация по туберкулезу оставалась стабильно неблагополучной, появилась проблема длительно неблагополучных хозяйств, где туберкулез регистрировался стационарно по 10-15 лет, оздоровить такие предприятия общепринятыми методами не удавалось.
В период с 1995 по 2000 годы были усилены профилактические мероприятия по охране благополучных хозяйств от заноса в них туберкулезной инфекции, строго осуществлялись мероприятия по своевременному и полному выявлению и удалению из стада больных и инфицированных животных. Все ранее неблагополучные пункты по туберкулезу крупного рогатого скота находились под строжайшим ветеринарным контролем, особенно хозяйства Бавлинского, Верхнеуслонского, Дрожжановского, Камско-Устьинского, Муслюмовского, Новошешминского и Черемшанского районов РТ, где туберкулез имел значительное распространение, а в ряде хозяйствах на протяжении десятка лет регистрировался стационарно. В хозяйствах, длительно неблагополучных, с сильным поражением скота туберкулезом более эффективным оказалась полная замена маточного поголовья здоровым молодняком. В результате проведенной ветеринарной службой республики работы к 2000 году были оздоровлены последние 18 неблагополучных по туберкулезу пунктов, новых пунктов в этот год выявлено не было.
В период с 2000 по 2018 годы борьба с туберкулезом крупного рогатого скота в РТ шла с переменным успехом. На основании результатов эпизоотологического мониторинга туберкулеза крупного рогатого скота в РТ, в период с 2000 по 2018 годы, нами построена эпизоотическая кривая, отображающая годовые изменения динамики эпизоотического процесса при данном заболевании, как отражение изменения числа новых неблагополучных пунктов за исследуемый период (инцидентность), рисунок 2.
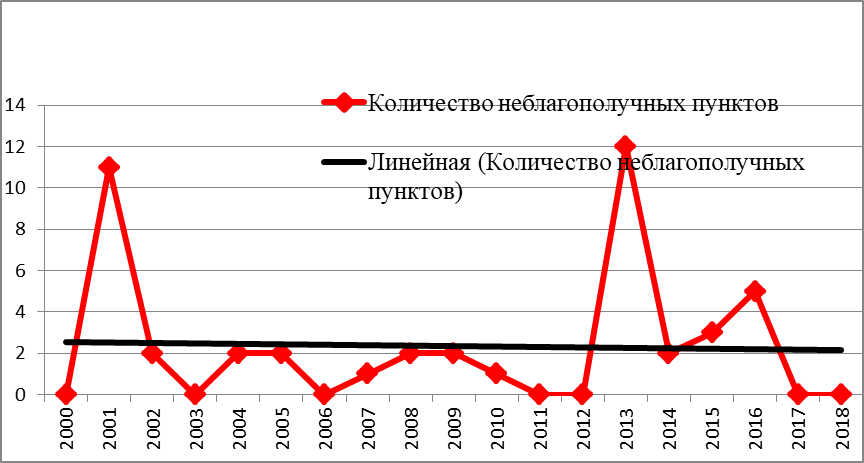
Рисунок 2 — Ежегодная динамика регистрации первичных неблагополучных пунктов по туберкулезу КРС в РТ (2000-2018 гг.).
По результатам, отраженным на рисунке 2, видно, что эпизоотическая ситуация по туберкулезу крупного рогатого скота, в сравнении с предыдущим периодом исследования (1960-2000 гг.), значительно улучшилась. За 18 лет наблюдения в республике выявлено 45 неблагополучных пунктов. Из 43 районов республики туберкулез регистрировался только в 16. Максимальное количество неблагополучных пунктов было зарегистрировано в 2001 и 2013 годы, в которые выявлено 11 и 12 пунктов, соответственно. По количеству первичных неблагополучных пунктов, «лидером» оказался Черемшанский район, в котором за 18 лет было выявлено 9 очагов инфекции, причем 8 из них было зарегистрировано в 2013 году.
За исследуемый период были годы, когда новые неблагополучные пункты по туберкулезу крупного рогатого скота в республике не регистрировались (2000, 2003, 2006, 2011 и 2012 годы), однако и в это время оставались неблагополучные хозяйства, в которых заболевание было зарегистрировано ранее.
Как видно из рисунка 2, эпизоотическая кривая за период наблюдения имеет весьма широкую амплитуду. Линия многолетнего тренда, т.е. общая однонаправленная тенденция изменения эпизоотического процесса (неблагополучия) при туберкулезе КРС в республике, имеет небольшую склонность к убыванию. Это может быть обусловлено целым рядом факторов: неудовлетворительным осуществлением общих противоэпизоотических и ветеринарно-санитарных мероприятий; нарушением в проведении специальных противоэпизоотических мероприятий; неконтролируемым завозом племенного молодняка из неблагополучных по данному заболеванию регионов; запоздалой диагностикой туберкулеза и несвоевременным проведением противотуберкулезных мероприятий.
В результате изучения динамики количества неблагополучных по туберкулезу крупного рогатого скота пунктов в республике за период с 2000 по 2018 годы, нами составлена карта территориального расположения неблагополучных по данному заболеванию пунктов, с целью определения нозоареала болезни (рисунок 3).
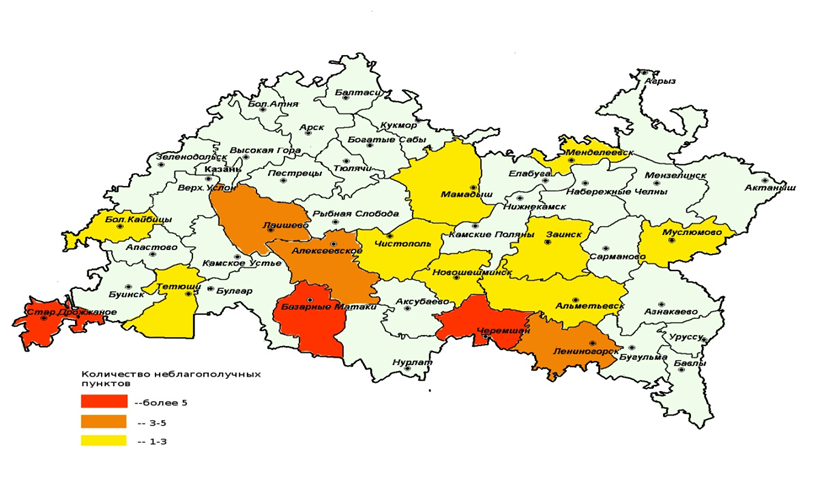
Рисунок 3 — Картограмма эпизоотической ситуации по туберкулезу КРС в районах РТ за период с 2000 по 2018 годы.
В результате анализа этой картограммы, нами установлено, что неблагополучные по туберкулезу пункты территориально приурочены к определенной местности: т.е. расположились в основном на юге, и разрозненно (небольшими группами – «очагами») в центральной части республики.
Так, в районах Предволжья и Предкамья (Арский, Атнинский, Балтасинский, Высокогорский, Зеленодольский, Кукморский, Сабинский, Тюлячинский и др.) заболевание скота протекает в виде энзоотии или проявляется спорадически, в таких хозяйствах после удаления выявленных больных животных достигается полное оздоровление стад и редко когда наблюдаются рецидивы болезни.
Более тяжелое по широте охвата поголовья и количеству неблагополучных пунктов течение туберкулезной инфекции наблюдается в Заволжье и Закамье. Это Алькеевский, Алексеевский, Дрожжановский, Лениногорский, Черемшанский, Чистопольский и другие районы. В указанных зонах регистрируется выраженная мозаичность поражения отдельных территорий и животноводческих ферм. Проведение оздоровительных мер в ряде хозяйств этой зоны связано с большими усилиями и значительными затратами. Именно здесь ранее имелись стационарные неблагополучные пункты и, как правило, в оздоровленных от туберкулеза хозяйствах через 3-5 лет вновь регистрировались рецидивы болезни.
Таким образом, туберкулез крупного рогатого скота в Республике Татарстан носит стационарный характер, линия многолетнего тренда имеет тенденцию к снижению. За 40 лет (1960-2000 годы) было оздоровлено 726 неблагополучных по туберкулезу крупного рогатого скота пунктов. В период с 2000 по 2016 годы выявлено 45 новых эпизоотических очагов в 16 из 43 районов республики. В районах Предволжья и Предкамья инфекция протекает в виде энзоотии или проявляется спорадически. Более интенсивное по широте охвата поголовья и количеству неблагополучных пунктов течение эпизоотического процесса наблюдается в районах Заволжья и Закамья, именно здесь ранее имелись стационарные неблагополучные пункты и, как правило, в оздоровленных от туберкулеза хозяйствах через 3-5 лет вновь регистрировались рецидивы болезни.
В течение последних десятилетий в РТ проводится большая работа по изучению и совершенствованию диагностики туберкулеза животных. Ветеринарными специалистами ведется постоянная работа по недопущению заноса возбудителя туберкулеза в стада животных и обеспечение их благополучия, проводится постоянный ветеринарный надзор за перегруппировками, поступлением и выбытием скота, выполнением в хозяйствах ветеринарно-санитарных правил.
1.2.2 Определение туберкулостатической активности Тубофена, изоциануратов, триазинов и α,ω – бис(амидо- и гидразидометилсульфинил- и сульфонил)алканов
1.2.2.1 Определение туберкулостатической активности Тубофена
Туберкулостатическая активность Тубофена была изучена in vitro на 3 видах микобактерий туберкулёза (музейных штаммах: Mycobacterium bovis (штамм 14), Mycobacterium tuberculosis (штамм Н37Rv) и Mycobacterium fortuitum) в концентрации препаратов от 10 до 0,018 мкг/мл. В качестве дополнительного контроля, исследовали также и туберкулостатик первого ряда — изониазид.
Минимальную ингибирующую концентрацию Тубофена изучали используя метод последовательных серийных разведений по общепринятой в бактериологии методике (Першин Г.Н., 1971). Для этого в пробирках, подлежащих посеву, готовили двукратные разведения препаратов, предварительно растворяя их в 960 спирте из расчета 10 мг препарата в 10 мл спирта (разведение 1:1000). Далее растворы с препаратами в количестве 0,1 мл вносили в 9,9 мл питательной среды Сотона и получали первое разведение 1:100000, являющееся исходным. Путем последовательного переноса 5 мл жидкости из предыдущей пробирки в последующую, содержащую 5 мл питательной среды Сотона, готовили следующие разведения препаратов: 5,0; 2,5; 1,25; 0,6; 0,3; 0,15; 0,075; 0,037 и 0,018 мкг/мл. Параллельно этому готовили аналогичные разведения препаратов со средой Сотона, содержащей 1 мл лошадиной сыворотки.
Тест культуры стандартизировали по стандарту БЦЖ, содержащему 5 мг бацилл в 1 мл. Полученную взвесь разводили средой Сотона 1:10 и использовали для дальнейших посевов, путём внесения 0,2 мл разведенной взвеси (0,1 мг бацилл) в каждую опытную пробирку. За титр активности изучаемого вещества принимали то его наибольшее разведение, или ту наименьшую концентрацию, которые полностью подавляли рост микобактерий туберкулёза.
Оценка ростовых свойств микобактерий определялась по количеству выросших колоний, которая обозначалась в в крестах по схеме, предложенной Першиным Г.Н.: обильный рост (+++); глубинный рост штаммов менее обилен, осадок меньших размеров, комочки культуры меньше чем в контроле (++); глубинный рост в виде слабозаметного осадка, зерна мелкие в небольшом количестве (+); полный бактерицидный эффект, когда засеянная культура не даёт роста (-).
Результаты исследования бактериостатической активности противотуберкулёзных препаратов отражены в таблице 6. Из данных таблицы 6 видно, что бактериостатическая активность тубофена высока и не уступает таковой изониазида. Тубофен в концентрации 0,075 мкг/мл оказывал полное бактериостатическое действие на штамм 14 М.bovis и штамм Н37Rv M. tuberculosis как на чистой питательной среде, так и с добавлением в неё лошадиной сыворотки.
Концентрации Тубофена 0,037 и 0,018 мкг/мл с теми же штаммами, на среде Сотона и среде Сотона, содержащей раствор лошадиной сыворотки, оказывали лишь частичное подавление размножения микобактерий туберкулёза в виде слабо заметного осадка с мелкими зернами.
В свою очередь, изониазид оказывал полное бактериостатическое действие на штамм 14 М. bovis и штамм Н37Rv M. tuberculosis только при концентрации препарата 0,15 мкг/мл среды. Причем штамм Н37Rv M. tuberculosis оказался более устойчив к изониазиду, чем штамм 14 М. bovis, и в концентрации 0,037 мкг/мл рост культур микобактерий туберкулёза практически не отличался от таковых в контрольных пробирках как на среде Сотона, так и с добавлением в неё лошадиной сыворотки. Концентрации изониазида 0,075; 0,037 и 0,018 мкг/мл на среде Сотона и среде Сотона, содержащей лошадиную сыворотку, оказывали лишь частичное подавление размножения микобактерий туберкулёза штамма 14.
Атипичные микобактерии М. fortuitum, оказались не чувствительны к испытуемым препаратам даже в концентрациях 10 мкг/мл. В контрольных посевах рост тест культур был обильный, характерный для каждого вида микобактерий.
Таблица 1 — Показатели туберкулостатической активности Тубофена in vitro
| Наименование препарата | Тест-
культура |
Наличие cыворотки | Минимальная концентрация препаратов, мкг/мл | Контроль | |||||||||
| 10 | 5 | 2,5 | 1,25 | 0,6 | 0,3 | 0,15 | 0,075 | 0,037 | 0,018 | ||||
| Тубофен | M.bovis
штамм 14 |
— | — | — | — | — | — | — | — | —* | + | ++ | +++ |
| Тубофен | + | — | — | — | — | — | — | — | —* | + | ++ | +++ | |
| Изониазид | — | — | — | — | — | — | — | —* | + | + | ++ | +++ | |
| Изониазид | + | — | — | — | — | — | — | —* | + | + | ++ | +++ | |
| Тубофен | M.tuber-
culosis штамм H37Rv |
— | — | — | — | — | — | — | — | —* | + | ++ | +++ |
| Тубофен | + | — | — | — | — | — | — | — | —* | + | ++ | +++ | |
| Изониазид | — | — | — | — | — | — | — | —* | + | ++ | ++ | +++ | |
| Изониазид | + | — | — | — | — | — | — | —* | + | ++ | ++ | +++ | |
| Тубофен | M.fortu-
itum |
— | +++ | +++ | +++ | +++ | +++ | +++ | +++ | +++ | +++ | +++ | +++ |
| Тубофен | + | +++ | +++ | +++ | +++ | +++ | +++ | +++ | +++ | +++ | +++ | +++ | |
| Изониазид | — | +++ | +++ | +++ | +++ | +++ | +++ | +++ | +++ | +++ | +++ | +++ | |
| Изониазид | + | +++ | +++ | +++ | +++ | +++ | +++ | +++ | +++ | +++ | +++ | +++ | |
Примечание: * – титр активности.
1.2.3 Оценка бактерицидных свойств Тубофена
С целью изучения бактерицидного действия Тубофена, также использовали метод последовательных серийных разведений. Взвесь микобактерий туберкулёза штамма 14, стандартизированную по стандарту БЦЖ вносили в пробирки с питательной средой Сотона, содержащие различные концентрации Тубофена. Пробирки помещали в термостат, при температуре 370С и через 1, 3, 6, 24 часа и 2, 5 и 8 суток содержимое бактериальных пробирок переносили в центрифужные пробирки и центрифугировали при 3000 оборотов в минуту, в течение 15 минут. Осадок после удаления физиологического раствора пересевали в 2 пробирки со средой Левенштейна-Йенсена. Посев выдерживали в термостате при температуре 370С в течение 2,5 месяцев. Отсутствие в этот срок колоний микобактерий туберкулёза свидетельствовало о бактерицидном действии соответствующих концентраций Тубофена.
Результаты исследования бактерицидной активности Тубофена отражены в таблице 2. Из данных таблицы 2 видно, что препарат в минимальной концентрации – 0,75 мкг/мл оказывает полное бактерицидное действие на штамм 14 микобактерий туберкулёза бычьего вида, только при максимальном времени контакта – 8 суток. При воздействии на штамм микобактерий минимальной концентрации Тубофена в течение 5 суток, на питательной среде Левенштейна-Йенсена обнаруживались лишь единичные колонии (частичный бактерицидный эффект). Частичное бактерицидное действие Тубофена впервые начало проявляться через 6 часов контакта препарата со штаммом микобактерий туберкулёза в концентрациях 50,0; 25,0 и 12,5 мкг/мл. Полная гибель всех микобактерий туберкулёза бычьего вида наступала через 5 суток при концентрации препарата 6,2 мкг/мл. При максимальном сроке экспозиции Тубофена с микобактериями туберкулёза (8 суток), отмечалось выраженное бактерицидное действие препарата во всех экспериментальных концентрациях. Во всех контрольных пробирках отмечался сплошной рост микобактерий туберкулёза бычьего вида.
Таблица 2 — Показатели бактерицидной активности Тубофена in vitro
| Время контакта культуры и препарата | Разведение препарата, мкг/мл | Контроль | ||||||
| 50 | 25 | 12,5 | 6,2 | 3,1 | 1,5 | 0,75 | ||
| 1 час | ++++ | ++++ | ++++ | ++++ | ++++ | ++++ | ++++ | ++++ |
| 3 часа | ++++ | ++++ | ++++ | ++++ | ++++ | ++++ | ++++ | ++++ |
| 6 часов | +++ | +++ | +++ | ++++ | ++++ | ++++ | ++++ | ++++ |
| 24 часа | — | ++ | +++ | +++ | ++++ | ++++ | ++++ | ++++ |
| 2 суток | — | — | + | ++ | +++ | +++ | ++++ | ++++ |
| 5 суток | — | — | — | — | + | ++ | ++ | ++++ |
| 8 суток | — | — | — | — | — | — | — | ++++ |
Условные обозначения: — отсутствие роста;
+ — от 1 до 10 колоний;
++ — от 11 до 30 колоний;
+++ — от 31 до 100 колоний;
++++ — сплошной рост.
1.2.4 Определение туберкулостатической активности изоциануратов
Изучение туберкулостатической активности изоциануратов в отношении микобактерий туберкулеза штамма H37Rv проводили, используя стандартную радиометрическую ростовую систему BACTEC MGIT 960 (Becton Dickinson).
Содержимое пробирки MGIT – это питательный бульон, благодаря которому достигается ускоренный рост микобактерий. Пробирка содержит 7 мл стерильного питательного бульона Мидлбрук 7Н9, в который перед использованием вносится обогатительная добавка ВАСТЕС MGIT OADC (олеиновая кислота, альбумин, декстроза и каталаза). Для предотвращения контаминации добавляли MGIT PANTA.
Кроме жидкой среды, в пробирке содержится бескислородный флюорохром — трис-4,7–дифенил–1,10–фенантролин пентагидрат хлорида рутения, помещенный на дно пробирки и покрытый силиконом. Во время бактериального роста внутри пробирки происходит поглощение свободного кислорода и его замещение углекислым газом. По мере расходования свободного кислорода прекращается ингибирование флюорохрома. Флюоресценция становится видимой при облучении пробирки УФ светом и автоматически регистрируется фотодатчиками, встроенными в прибор. Интенсивность свечения прямо пропорциональна уровню расходования кислорода активно делящимися клетками в среде. Детекция роста микобактериальных культур проводится каждый час с помощью программного обеспечения Epicenter (BD, USA) и регистрируется в единицах роста (GU) или в относительных единицах флюоресценции (ОЕФ).
Система BACTEC MGIT 960 расценивает пробирку как положительную, если количество живых микроорганизмов в ней достигло 100 000 на 1 мл среды (GU > 75). Пробирка инкубировалась при температуре 37 0С с последующим анализом.
Для определения минимальной ингибирующей концентрации 45 исследуемых химических соединений, относящихся к изоциануратам, в отношении микобактерий туберкулеза, готовили их исходные растворы в диметилсульфоксиде (ДМСО) и добавляли в пробирки MGIT в количествах, обеспечивающих получение конечных концентраций 50,0; 25,0; 10,0; 5,0; 1,0; 0,5; 0,1 и 0,05 мкг/мл среды. В виду дороговизны проводимых исследований 20 химических веществ под номерами с 26 по 46 исследовали лишь в минимальных концентрациях – 0,1 и 0,05 мкг/мл среды.
Культуру микобактерий туберкулеза штамма H37Rv, выращенную на плотной яичной среде, растирали в пробирке и суспензировали в 0,9% стерильном растворе поваренной соли. Через 20 минут после отстаивания взвесь микроорганизмов отбирали пипеткой и переносили в другую пробирку. Необходимую оптическую плотность, соответствующую 5-му стандарту мутности (в 1 мл суспензии, соответствующей пятому стандарту оптической плотности, содержится 5×108 микробных тел) получали добавлением в пробирку физиологического раствора. Стандартизированную суспензию микобактерий добавляли в среду из расчета 0,2 мл на одну пробирку.
Для сравнения проводили аналогичные исследования с туберкулостатиком первого ряда – изониазидом. В качестве контроля использовали:
1 — среды без добавления штамма микобактерий туберкулеза, но с добавлением 0,2 мл физиологического раствора – контроль №1;
2 — среды без добавления испытуемых соединений, но с добавлением растворителя (диметилсульфоксида) и штамма микобактерий туберкулеза – контроль №2;
3 — среды без добавления испытуемых соединений и растворителя (диметилсульфоксида), но с добавлением суспензии микобактерий туберкулеза штамма H37Rv – контроль №3.
Все пробирки инкубировали при 37ºС в приборе. Наличие или отсутствия роста микобактерий прибор регистрировал ежедневно в течение 11 суток. Если в указанный период роста микобактерий не отмечалось, то наблюдения проводили до 21 суток. Некоторые концентрации химических соединений для большей достоверности исследовали повторно. Минимальную ингибирующую концентрацию (МИК) синтезированных соединений определяли по результатам исследования на Bactec MGIT 960 как наименьшую концентрацию, которая сдерживала рост микобактерий на сутки по сравнению с контрольными пробирками.
Все выросшие культуры были подвергнуты контролю на видовую специфичность. Для контроля специфичности роста культуры микобактерий осуществляли визуальный просмотр положительных пробирок (среда прозрачная, на дне пробирки зернистость или облако культуры) и микроскопию по Цилю-Нильсену. Во всех положительных образцах был подтвержден рост культуры микобактерий туберкулезного комплекса. При посеве осадка на кровяной агар рост культуры через сутки инкубации не визуализировался, что свидетельствовало об отсутствии в пробирке посторонней микрофлоры. Подтверждение или отсутствие роста культуры микобактерий туберкулеза и отсутствие контаминации неспецифической микрофлорой позволило считать результаты эксперимента адекватными.
Результаты анализа антимикобактериального действия исследуемых изоциануратов на приборе Bactec MGIT 960 приведены в таблице 3.
Из таблицы 3 следует, что большинство испытанных химических соединений обладают бактериостатическим действием в отношении микобактерий туберкулеза. Однако не все испытуемые соединения оказывают выраженное и продолжительное ингибирующее действие. Так, химические соединения под номерами 1, 2, 6, 8, 12, 16, 18, и 19 оказывали лишь частичное бактериостатическое действие на штамм микобактерий лишь в больших концентрациях – 50 мкг/мл среды в течение 4 суток. На 5 сутки эксперимента отмечался резкий и обильный рост микобактерий туберкулеза.
Таблица 3 — Изучение туберкулостатической активности изоциануратов в относительных единицах флуоресценции (ОЕФ), с использованием стандартной радиометрической ростовой системы Bactec MGIT 960
Примечание: * — радиометрическая ростовая система BACTEC MGIT 960 сигнализирует о выраженном росте микобактерий туберкулеза, проба оценивается как положительная и мониторинг прекращается.
Химические соединения под номерами 3, 4, 5, 13, 15, 17, 20, 21 и 24 оказывали бактериостатическое действие на микобактерии туберкулеза только при высоких концентрациях испытуемых веществ в питательной среде (50, 25 и 10 мкг/мл). В малых концентрациях (1, 0,5 и 0,1 мкг/мл) отмечался обильный рост микобактерий туберкулеза уже на 4 — 5 сутки исследований.
В свою очередь, химические соединения под номерами 9, 10, 11, 14, 22, 23, 25, 29, 31, 32, 34, 35, 40, 42, 45 и 46 оказали выраженное и продолжительное ингибирующее действие в отношении микобактерий туберкулеза даже в небольших концентрациях – 0,1 мкг/мл среды.
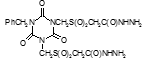
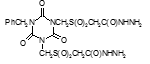
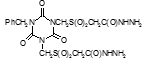
Например, соединение № 46 – 1-5-(карбазоилметилсульфинил)-пентил)-3,5-диметилизоцианурат (названный авторами — Линарол) проявил наиболее выраженное бактериостатическое действие на микобактерии туберкулеза в концентрации 0,1 мкг/мл среды и полностью подавил рост возбудителей туберкулеза в течение 6 суток. На 7 сутки уровень роста микобактерий достиг отметки 1 ОЕФ и к окончанию опыта оставался на уровне 2 ОЕФ. Даже в концентрации 0,05 мкг/мл среды данное соединение оказывало частичное ингибирующее действие на микобактерии туберкулеза. В течение первых 2 суток рост микобактерий составил 1, на 3 сутки — 15, на 6 — 32 и на 8 – 48 ОЕФ.
Изониазид в аналогичной концентрации (0,1 мкг/мл среды) сдерживал рост культуры возбудителя туберкулеза лишь в течение 2 суток. На 3 сутки рост микобактерий штамма H37Rv в этих пробирках достиг отметки 25 ОЕФ и в последующие сроки наблюдения увеличивался, пока на 4 сутки не достиг отметки 50 ОЕФ.
В контрольных пробирках №1 (среды без добавления штамма микобактерий туберкулеза, но с добавлением 0,2 мл физиологического раствора) роста микобактерий туберкулеза не отмечалось. В контрольных пробирках №2 (среды без добавления испытуемых соединений, но с добавлением растворителя (диметилсульфоксида) и штамма микобактерий туберкулеза) рост культуры на 3 сутки исследований достиг 116 ОЕФ. В контрольных пробирках №3 (среды без добавления испытуемых соединений и растворителя (диметилсульфоксида), но с добавлением суспензии микобактерий туберкулеза штамма H37Rv) отмечался обильный рост микобактерий, который на 3 сутки достигал отметки 216 ОЕФ.
Таким образом, большинство исследованных соединений, относящихся к изоциануратам, обладают выраженными бактериостатическими свойствами в отношении микобактерий туберкулеза штамма H37Rv, а некоторые из них, например 1-5-(карбазоилметилсульфинил)-пентил)-3,5-диметилизоцианурат (Линарол) проявляют свою антимикобактериальную активность на уровне туберкулостатика первого ряда – изониазида.
1.2.5 Определение туберкулостатической активности триазинов
Изучение туберкулостатичской активности триазинов в отношении микобактерий туберкулеза штамма H37Rv проводили, используя стандартную радиометрическую ростовую систему BACTEC MGIT 960 (Becton Dickinson).
Для определения минимальной ингибирующей концентрации 3 исследуемых химических соединений, относящихся к триазинам, в отношении микобактерий туберкулеза, готовили их исходные растворы в диметилсульфоксиде (ДМСО) и добавляли в пробирки MGIT в количествах, обеспечивающих получение конечных концентраций 0,1 мкг/мл среды, в виду дороговизны проводимых исследований. Культуру микобактерий туберкулеза штамма H37Rv, соответствующую 5-му стандарту мутности добавляли в среду из расчета 0,2 мл на одну пробирку.
Для сравнения проводили аналогичные исследования с туберкулостатиком первого ряда – изониазидом. В качестве контроля использовали:
- среды без добавления штамма микобактерий туберкулеза, но с добавлением 0,2 мл физиологического раствора – контроль №1;
- среды без добавления испытуемых соединений, но с добавлением растворителя (диметилсульфоксида) и штамма микобактерий туберкулеза – контроль №2;
- среды без добавления испытуемых соединений и растворителя (диметилсульфоксида), но с добавлением суспензии микобактерий туберкулеза штамма H37Rv – контроль №3.
Все пробирки инкубировали при 37Сº в приборе. Наличие или отсутствия роста микобактерий прибор регистрировал ежедневно в течение 11 суток. Если в указанный период роста микобактерий не отмечалось, то наблюдения проводили до 21 суток.
Некоторые концентрации химических соединений для большей достоверности исследовали повторно. Минимальную ингибирующую концентрацию (МИК) синтезированных соединений определяли по результатам исследования на Bactec MGIT 960 как наименьшую концентрацию, которая сдерживала рост микобактерий на сутки по сравнению с контрольными пробирками.
Все выросшие культуры были подвергнуты контролю на видовую специфичность, как это было описано в предыдущем разделе работы.
Результаты анализа туберкулостатического действия триазинов в отношении микобактерий туберкулеза на приборе Bactec MGIT 960 приведены в таблице 4.
Из таблицы 4 следует, что все испытанные химические соединения обладают выраженным бактериостатическим действием в отношении микобактерий туберкулеза в достаточно низкой концентрации – 0,1 мкг/мл среды. Однако, соединение под №1 обладает более выраженным бактериостатическим эффектом в отношении микобактерий туберкулеза, по сравнению с соединениями под номерами 2 и 3.
Соединение №1, которое представляет собой 2,4-диамино-6-(карбамоилметилсульфинилметил)-1,3,5-триазин (названный авторами — Аликон) полностью подавлял рост микобактерий туберкулеза в течение 4 суток. На 5 сутки уровень роста микобактерий достигал отметки 35 ОЕФ и к окончанию опыта оставался на уровне37 ОЕФ.
Таблица 4 — Изучение туберкулостатической активности триазинов в относительных единицах флуоресценции (ОЕФ), с использованием стандартной радиометрической ростовой системы Bactec MGIT 960
Примечание: * — радиометрическая ростовая система BACTEC MGIT 960 сигнализирует о выраженном росте микобактерий туберкулеза, проба оценивается как положительная и мониторинг прекращается
Изониазид в аналогичной концентрации (0,1 мкг/мл среды) сдерживал рост культуры возбудителя туберкулеза лишь в течение 2 суток. На 3 сутки рост микобактерий штамма H37Rv в этих пробирках достиг отметки 25 ОЕФ и в последующие сроки наблюдения увеличивался, пока на 6 сутки не достиг отметки 89 ОЕФ.
В контрольных пробирках №1 (среды без добавления штамма микобактерий туберкулеза, но с добавлением 0,2 мл физиологического раствора) роста микобактерий туберкулеза не отмечалось.
В контрольных пробирках №2 (среды без добавления испытуемых соединений, но с добавлением растворителя (диметилсульфоксида) и штамма микобактерий туберкулеза) рост культуры на 3 сутки исследований достиг 116 ОЕФ.
В контрольных пробирках №3 (среды без добавления испытуемых соединений и растворителя (диметилсульфоксида), но с добавлением суспензии микобактерий туберкулеза штамма H37Rv) отмечался обильный рост микобактерий, который на 3 сутки достигал отметки 216 ОЕФ.
Таким образом, установлено, что 3 исследованных химических соединения, относящиеся к триазинам, обладают выраженными бактериостатическими свойствами в отношении микобактерий туберкулеза штамма H37Rv.
1.2.6 Определение туберкулостатической активности α, ω – бис(амидо- и гидразидометилсульфинил- и сульфонил) алканов
Изучение туберкулостатической активности 34 синтезированных α, ω – бис (амидо- и гидразидометилсульфинил- и сульфонил)алканов в отношении микобактерий туберкулеза штамма H37Rv проводили, используя метод вертикальной диффузии на плотной питательной среде «Новая».
Питательную среду разливали в пробирки по 5 мл, свертывая в наклонном положении таким образом, чтобы ½ часть дна пробирки оставалась свободной. Свернутую среду засевали по 0,2 мл взвеси микобактерий туберкулеза (МБТ) штамма H37Rv, разведенного по 5-му стандарту мутности, и в наклонном положении помещали в термостат на 24 часа для выращивания МБТ.
Через сутки пробирки ставили в вертикальное положение и по свободному краю закапывали по 0,3 мл субстанции соединений в исследуемых концентрациях: 12,5; 6,2; 3,1; 1,5; 0,6; 0,3, 0,1 мкг/мл. Затем пробирки помещали в термостат при температуре 370С и инкубировали в течение 10 суток.
Оценку роста МБТ проводили по стандартной методике, где появление зон задержки роста МБТ (более 10 мм) свидетельствовало о наличии туберкулостатических свойств в исследуемой концентрации соединений. Величина зоны задержки роста МБТ (в мм) пропорциональна степени туберкулостатической активности соединений. Задержка роста 100 мм и более расценивается как полная задержка роста МБТ.
В качестве контроля проводили аналогичные исследования с туберкулостатиком первого ряда – изониазидом.
Все выросшие культуры были подвергнуты контролю на видовую специфичность, как это было описано в предыдущих разделах.
Результаты изучения минимальной ингибирующей концентрации (МИК) в отношении микобактерий туберкулеза 34 химических соединений, относящихся к α, ω – бис(амидо- и гидразидометилсульфинил- и сульфонил) алканам, приведены в таблице 5.
По данным таблицы 5, самую высокую бактериостатическую активность в отношении штамма H37Rv проявило соединение (1.3) – названное авторами Линарол Ф-1, минимальная ингибирующая концентрация (МИК) которого составила 0,3 мкг/мл.
В контрольных пробирках, содержащих изониазид, во всех исследуемых концентрациях отмечалось наличие зон задержки роста МБТ, поэтому МИК данного препарата составила 0,1 мкг/мл среды.
Высокую бактериостатическую активность с МИК 0,6 мкг/мл проявили соединения 1.9, 1.11, 1.13, 1.15, 1.31, 1.33 и 1.34. Соединение 1.22 проявило достаточно хорошую активность с МИК 1,5 мкг/мл. Остальные соединения этого ряда задерживали рост микобактерий туберкулеза в минимальной ингибирующей концентрации 12,5 мкг/мл.
Таким образом, все 34 исследованных химических соединения, относящиеся к α, ω – бис(амидо- и гидразидометилсульфинил- и сульфонил) алканам, обладают выраженными бактериостатическими свойствами в отношении микобактерий туберкулеза штамма H37 Rv, а соединение 1.3 (Линарол Ф-1), которое представляет собой 1,4-Бис(амидометилсульфинил)бутан, по своим туберкулостатическим свойствам оказалось близким к туберкулостатику первого ряда – изониазиду, с минимальной ингибирующей концентрацией – 0,3 мкг/мл среды.
Таблица 5 — Изучение МИК в отношении МБТ α, ω – бис (амидо- и гидразидометилсульфинил- и сульфонил) алканов
| № соединения | Исследуемые концентрации, мкг/мл | МИК, мкг/мл | ||||||
| 12,5 | 6,2 | 3,1 | 1,2 | 0,6 | 0,3 | 0,1 | ||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 1.1 | +* | ++* | ++ | ++ | ++ | ++ | ++ | 12,5 |
| 1.2 | + | ++ | ++ | ++ | ++ | ++ | ++ | 12,5 |
| 1.3 | -* | — | — | + | + | + | ++ | 0,3 |
| 1.4 | + | ++ | ++ | ++ | ++ | ++ | ++ | 12,5 |
| 1.5 | + | ++ | ++ | ++ | ++ | ++ | ++ | 12,5 |
| 1.6 | + | ++ | ++ | ++ | ++ | ++ | ++ | 12,5 |
| 1.7 | + | ++ | ++ | ++ | ++ | ++ | ++ | 12,5 |
| 1.8 | + | ++ | ++ | ++ | ++ | ++ | ++ | 12,5 |
| 1.9 | — | + | + | + | + | ++ | ++ | 0,6 |
| 1.10 | + | ++ | ++ | ++ | ++ | ++ | ++ | 12,5 |
| 1.11 | — | + | + | + | + | ++ | ++ | 0,6 |
| 1.12 | + | ++ | ++ | ++ | ++ | ++ | ++ | 12,5 |
| 1.13 | — | — | + | + | + | ++ | ++ | 0,6 |
| 1.14 | + | ++ | ++ | ++ | ++ | ++ | ++ | 12,5 |
| 1.15 | — | + | + | + | + | ++ | ++ | 0,6 |
| 1.16 | + | ++ | ++ | ++ | ++ | ++ | ++ | 12,5 |
| 1.17 | + | ++ | ++ | ++ | ++ | ++ | ++ | 12,5 |
| 1.18 | + | ++ | ++ | ++ | ++ | ++ | ++ | 12,5 |
| 1.19 | + | ++ | ++ | ++ | ++ | ++ | ++ | 12,5 |
| 1.20 | + | ++ | ++ | ++ | ++ | ++ | ++ | 12,5 |
| 1.21 | + | ++ | ++ | ++ | ++ | ++ | ++ | 12,5 |
| 1.22 | — | + | + | + | ++ | ++ | ++ | 1,2 |
| 1.23 | + | ++ | ++ | ++ | ++ | ++ | ++ | 12,5 |
| 1.24 | + | ++ | ++ | ++ | ++ | ++ | ++ | 12,5 |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 1.25 | + | ++ | ++ | ++ | ++ | ++ | ++ | 12,5 |
| 1.26 | + | ++ | ++ | ++ | ++ | ++ | ++ | 12,5 |
| 1.27 | + | ++ | ++ | ++ | ++ | ++ | ++ | 12,5 |
| 1.28 | + | ++ | ++ | ++ | ++ | ++ | ++ | 12,5 |
| 1.29 | + | ++ | ++ | ++ | ++ | ++ | ++ | 12,5 |
| 1.30 | + | ++ | ++ | ++ | ++ | ++ | ++ | 12,5 |
| 1.31 | — | + | + | + | + | ++ | ++ | 0,6 |
| 1.32 | + | ++ | ++ | ++ | ++ | ++ | ++ | 12,5 |
| 1.33 | — | — | + | + | + | ++ | ++ | 0,6 |
| 1.34 | — | + | + | + | + | ++ | ++ | 0,6 |
| Контроль
(изониазид) |
— | — | — | + | + | + | + | 0,1 |
Примечание: «++» — колонии МБТ без зон задержки роста;
«+» — наличие зон задержки роста МБТ более 10 мм;
«-» — полная задержка роста МБТ (100 мм и более).
1.2.7 Определение лекарственной устойчивости микобактерий туберкулеза к Тубофену, Линаролу, Аликону и Линаролу Ф-1
Эффективность любого противотуберкулезного препарата оценивают не только по наличию бактерицидной и бактериостатической активности, но и по способности предотвращать развитие лекарственной устойчивости. Поэтому целью наших исследований было выяснение влияния синтезированных препаратов на лекарственную чувствительность различных штаммов микобактерий.
Чувствительность микроорганизмов к исследуемым препаратам проводили в сравнительном аспекте по отношению к уже известным и используемым в медицинской практике противотуберкулезным препаратам: изониазид, рифампицин, офлоксацин, стрептомицин, этамбутол, этионамид и разные их сочетания.
Лекарственную устойчивость микобактерий к вышеперечисленным препаратам определяли методом абсолютных концентраций на среде Левенштейна – Йенсена без содержания в ней крахмала согласно приказа МЗ РФ №109 от 21.03.2003. Тубофен, Аликон, Линарол и Линарол-Ф1 разводили согласно прописи изониазида. В питательную среду непосредственно перед свертыванием добавляли рабочие разведения данного вещества. Расчеты производили с учетом процента активности препарата.
Для определения эффективности действия препаратов использовали бактериальные суспензии:
- культуры микобактерий туберкулеза штамма Н37Rv;
- культуры микобактерий туберкулеза штамма M. bovis 14;
- культуры клинического штамма микобактерий туберкулеза с множественной лекарственной устойчивостью (МЛУ);
- культуры микобактерий туберкулеза М. terrae;
- культуры микобактерий туберкулеза М. avium;
- культуры микобактерий выделенного от инфицированного крупного рогатого скота (M. bovis).
Выросшие на плотной питательной среде культуры микобактерий снимали лопаточкой и помещали в толстостенную стеклянную пробирку. Тщательно растирали стеклянной палочкой и постепенно добавляли стерильный физиологический раствор. Полученную суспензию переносили в стерильную пробирку. Культуры стандартизировали по оптическому стандарту мутности №5. Затем брали по 1 мл приготовленных суспензий, разводили их в 10 раз стерильным физиологическим раствором. Посев на среды производился из этих суспензий, которые вносили по 0,2 мл в пробирку с питательной средой. Все пробирки культивировали при 370С, в течение 4 недель при обязательном еженедельном просмотре. Результаты определения лекарственной устойчивости учитывали на 21 день после посева. При скудном росте в контрольной пробирке все посевы с добавлением препаратов оставляли еще на 3-4 недели в термостате до получения выраженного роста в контроле.
Культуру считали чувствительной к данной концентрации препарата, если в пробирке со средой, содержащей препарат, выросло менее 20 колоний, при обильном ее росте в контроле. Культуру считали устойчивой к той концентрации препарата, которая содержится в данной пробирке, если в пробирке со средой выросло более 20 колоний, при обильном ее росте в контроле.
Результаты определения лекарственной устойчивости микобактерий к испытуемым препаратам отражены в таблице 6.
В результате проведенных исследований установлено, что изучаемые противотуберкулезные препараты – Линарол, Аликон и Линарол Ф-1 проявили выраженное бактериостатическое действие на микобактерии туберкулеза штаммов Н37Rv, M. bovis 14, культуру клинического штамма микобактерий туберкулеза с множественной лекарственной устойчивостью и культуру микобактерий, выделенную от инфицированного крупного рогатого скота в концентрациях 10 мкг/мл среды.
Таблица 6 — Определение лекарственной устойчивости микобактерий туберкулеза к исследуемым соединениям
| Концентрации
препаратов: |
Рост колоний микобактерий туберкулеза | |||||
| H37Rv | M.bovis 14 | МЛУ (клин. шт.) | М.avium | М.terrae | M.bovis
от КРС |
|
| Изониазид 1 мкг/мл | -* | — | +* | + | + | — |
| Изониазид
10 мкг/мл |
— | — | + | + | + | — |
| Рифампицин
40 мкг/мл |
— | — | + | не проводилось | не проводилось | — |
| Рифампицин
80 мкг/мл |
— | — | + | не проводилось | не проводилось | — |
| Изониазид
(10 мкг/мл) + рифампицин (40 мкг/мл) |
— | — | — | не проводилось | не проводилось | — |
| Офлоксацин
10 мкг/мл |
— | — | + | не проводилось | не проводилось | — |
| Стрептомицин
10 мкг/мл |
— | — | + | не проводилось | не проводилось | — |
| Стрептомицин
25 мкг/мл |
— | — | + | не проводилось | не проводилось | — |
| Этамбутол
2 мкг/мл |
— | — | + | не проводилось | не проводилось | — |
| Этамбутол
5 мкг/мл |
— | — | + | не проводилось | не проводилось | — |
| Этионамид
30 мкг/мл |
— | — | + | не проводилось | не проводилось | — |
| Этионамид
50 мкг/мл |
— | — | + | не проводилось | не проводилось | — |
| Тубофен 10мкг/мл | — | — | + | + | + | — |
| Линарол
10 мкг/мл |
— | — | 10 колоний | + | + | — |
| Аликон
10 мкг/мл |
— | — | 10 колоний | + | + | — |
| Линарол Ф-1
10 мкг/мл |
— | — | 1 — 5 колоний | + | + | — |
| Контроль (среда, без препаратов) | + | + | + | + | + | + |
Примечание: «-» — отсутствие роста (менее 20 колоний);
«+» — наличие роста микобактерий (более 20 колоний).
Тубофен в концентрации 10 мг/мл среды проявил свое бактериостатическое действие лишь в отношении референтных штаммов (Н37Rv, M. bovis 14) и культуру микобактерий, выделенную от крупного рогатого скота. Культура клинического штамма с множественной лекарственной устойчивостью оказалась резистентной к данному препарату в исследованной дозе, так как в опытных пробирках со средой отмечали наличие роста более 35 колоний.
Концентрации изониазида, рифампицина, офлоксацина, стрептомицина, этамбутола, этионамида и их различные сочетания вели себя согласно литературным данным — штамм Н37Rv и M. bovis 14 был чувствителен ко всем концентрациям этих препаратов при положительном контроле.
Штамм микобактерий туберкулеза с множественной лекарственной устойчивостью проявил свою резистентность ко всем исследуемым препаратам, кроме Аликона, Линарола и Линарола Ф-1 в концентрациях 10 мкг/мл среды, а также изониазида в сочетании с рифампицином (изониазид в концентрации 10 мкг/мл и рифампицин в концентрации 40 мкг/мл среды).
Штаммы M. avium и М. terrae оказались не чувствительными к синтезированным соединениям в концентрациях 10 мкг/мл среды.
Штамм, выделенный от инфицированного крупного рогатого скота, оказался чувствительным ко всем исследуемым в опыте препаратам в различных их концентрациях.
В контроле, к 21 дню исследования, отмечался обильный рост микобактерий туберкулеза всех исследуемых штаммов, кроме микобактерий, выделенных от крупного рогатого скота, рост которых проявился только на 40 – 50 сутки.
Таким образом, проведенное исследование показало, что новые туберкулостатики Линарол, Аликон и Линарол Ф-1 обладают выраженным бактериостатическим действием на референтные и лекарственно — устойчивый штаммы микобактерий.
1.2.8 Определение противомикробной и фунгистатической активности Тубофена, Аликона, Линарола и Линарола Ф-1
Оценку спектра действия и степени антибактериальной и фунгистатической активности синтезированных противотуберкулезных препаратов Тубофена, Аликона, Линарола и Линарола Ф-1 проводили согласно «Руководству по экспериментальному изучению новых фармакологических веществ» под редакцией Хабриева Р.У. (2005), в отношение 3-х бактериальных штаммов (Staphylococcus aureus 209p, Escherichia colli F-50, Bacillus cereus 8035) и 3-х грибов (Candida albicans 855-653, Trichophyton mentagrophytes — 1773, Aspergillus niger BKMF-1119).
Определение спектра антибактериального действия туберкулостатиков проводили методом двукратных серийных разведений на жидкой питательной среде – МПБ (мясо-пептонный бульон). Для этого в чашках Петри, подлежащих посеву, готовили двукратные разведения препаратов, предварительно растворяя их в стерильной дистиллированной воде, из расчета 10 мг препарата в 10 мл воды (разведение 1:1000).
Растворы с испытуемыми соединениями в количестве 0,1 мл вносили в 9,9 мл МПБ и получали первое разведение 1:100000, являющееся исходным. Путем последовательного переноса 5 мл жидкости из предыдущей пробирки в последующую, содержащую 5 мл МПБ, готовили разведения препаратов в концентрациях: 5,0; 2,5; 1,25 и 0,6 мкг/мл среды.
Контролем служил МПБ без добавления испытуемых соединений.
Для посева использовали взвесь суточной бульонной культуры тест-штаммов Staphylococcus aureus 209p, Escherichia colli F50 и Bacillus cereus 8035, которые из расчета 105 КОЕ/мл в объеме 0,2 мл добавляли в каждую пробирку с разведения испытуемых препаратов.
Пробирки инкубировали в термостате при температуре 37°С, в течение 18-24 часов. Результаты оценивали визуально, определяя наличие или отсутствие роста в среде, содержащей различные концентрации испытуемых соединений. Минимальную ингибирующую концентрацию (МИК) препаратов, определяли по последней пробирке ряда с задержкой роста (прозрачный бульон) того или иного штамма бактерий.
Изучение противогрибковой (фунгистатической) активности испытуемых фармакологических веществ проводили аналогично определению спектра антибактериального действия – методом двукратных серийных разведений в жидкой среде Сабуро.
Инокулят для засева готовили путем смыва культур 3-х микроскопических грибов Candida albicans 855-653, Trichophyton mentagrophytes — 1773, Aspergillus niger BKMF-1119, которые брали в жидкой среде Сабуро, значительной мутности. Оттитрованной пипеткой, содержащей 25 капель в 1 мл, вносили по одной капле взвеси культур в каждую пробирку с разведенными препаратами, включая контрольную. После засева штатив встряхивали и помещали в термостат на 14 суток, при температуре 27°С.
Результаты изучения противомикробной и фунгистатической активности испытуемых соединений отражены в таблице 7.
Таблица 7 — Результаты изучения противомикробной и фунгистатической активности Тубофена, Аликона, Линарола и Линарола-Ф1
| Препарат | Конц.,
мкг/мл |
Культуры микроорганизмов: | |||||
| St.aureus
209р |
E.coli
F50 |
B.cereus
8035 |
Candida albicans | Tr. men-tagrophytes | Asp. niger | ||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Тубофен | 5 | + | + | + | + | + | + |
| 2,5 | + | + | + | + | + | + | |
| 1,25 | + | + | + | + | + | + | |
| 0,6 | + | + | + | + | + | + | |
| Аликон | 5 | + | + | + | + | + | + |
| 2,5 | + | + | + | + | + | + | |
| 1,25 | + | + | + | + | + | + | |
| 0,6 | + | + | + | + | + | + | |
| Линарол | 5 | + | + | + | + | + | + |
| 2,5 | + | + | + | + | + | + | |
| 1,25 | + | + | + | + | + | + | |
| 0,6 | + | + | + | + | + | + | |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Линарол Ф-1 | 5 | + | + | + | + | + | + |
| 2,5 | + | + | + | + | + | + | |
| 1,25 | + | + | + | + | + | + | |
| 0,6 | + | + | + | + | + | + | |
| Контроль | — | + | + | + | + | + | + |
Примечание: «+» — рост культуры; «—» — засеянная культура не дает роста.
По результатам исследований, отраженных в таблице 7, выяснилось, что ни одно из четырех соединений, ни в одной из использованных концентраций (5,0; 2,5; 1,25 и 0,6 мг/мл среды) не проявило выраженного антибактериального и фунгистатического действия в отношении тестируемых культур и рост их в опытных пробирках не отличался от таковых в контрольных. На основании проведенного исследования установили, что синтезируемые препараты: Тубофен, Аликон, Линарол и Линарол Ф-1 обладают избирательным антибактериальным действием, только в отношении микобактерий туберкулеза.
1.2.9 Изучение фармако-токсикологических свойств Тубофена.
1.2.9.1 Определение параметров острой токсичности Тубофена на белых мышах.
Опыты были проведены на 24 белых мышах массой 20-25 г. Препарат вводили в желудок с помощью металлического зонда с оливой, надетого на шприц, по схеме приведённой в таблице 8.
Таблица 8 — Результаты исследования острой токсичности Тубофена на белых мышах
| Группа животных | Доза препарата, мг/кг | Количество мышей | Число мышей: | % гибели | |
| погибших | выживших | ||||
| 1 | 400 | 6 | 0 | 6 | — |
| 2 | 600 | 6 | 2 | 4 | 33 |
| 3 | 800 | 6 | 5 | 1 | 83 |
| 4 | 1000 | 6 | 6 | 0 | 100 |
При пероральном введении препарата в дозе 400 мг/кг массы тела видимых изменений в поведении и общем состоянии белых мышей не наблюдалось. В дальнейшем, по мере увеличения дозы вводимого препарата на 200 мг/кг живой массы, в каждой последующей группе происходило угнетение животных. При дозе 600 мг/кг погибли две мыши, при дозе 800 мг/кг – 5, при дозе 1000 мг/кг – все мыши.
Параметры острой токсичности Тубофена при внутрижелудочном введении белым мышам составили: максимально переносимая доза (МПД) – 400 мг/кг; среднесмертельная доза (ЛД50) — 668±63 мг/кг; доверительный интервал генеральной (ДИГ) средней ЛД50 — 668 (538÷798) мг/кг; ЛД100 — 1000 мг/кг. График определения токсичности препарата представлен на рисунке 4.
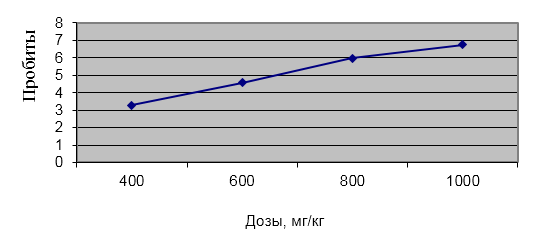
Рисунок 4 — Характеристическая кривая токсичности Тубофена для белых мышей при пероральном введении
Установлено, что в соответствии с «Гигиенической классификацией пестицидов по основным параметрам вредности» (Медведь Л.И., Каган Ю.С., Спыну Е.И., 1968), Тубофен, является веществом обладающим средней токсичностью. По степени опасности III класс, опасные химические вещества (ГОСТ 12.1.007.76).
1.2.9.2 Определение параметров острой токсичности Тубофена на белых крысах
Опыты были проведены на 36 белых крысах массой 190-260 г. Препарат вводили в желудок с помощью металлического зонда с оливой, надетого на шприц, по схеме, приведённой в таблице 9.
Таблица 9 — Результаты исследования острой токсичности Тубофена на белых крысах
| Группа животных | Доза препарата, мг/кг | Количество крыс | Число крыс | % гибели | |
| погибших | выживших | ||||
| 1 | 4500 | 6 | 0 | 6 | — |
| 2 | 5000 | 6 | 1 | 5 | 16 |
| 3 | 5500 | 6 | 3 | 3 | 50 |
| 4 | 6000 | 6 | 4 | 2 | 66 |
| 5 | 6500 | 6 | 5 | 1 | 83 |
| 6 | 7000 | 6 | 6 | 0 | 100 |
Параметры токсичности препарата для белых крыс составили: максимально переносимая доза – 4500 мг/кг; среднесмертельная доза (ЛД50) — 5675±245 мг/кг; доверительный интервал генеральной средней ЛД50 — 5675 (5195÷6155) мг/кг; ЛД100 — 7000 мг/кг. График определения токсичности Тубофена на белых крысах представлен на рисунке 5.
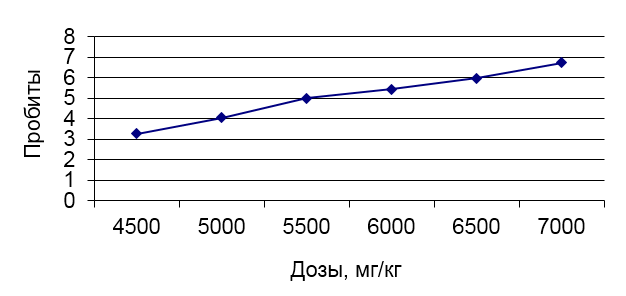
Рисунок 5 — Характеристическая кривая токсичности тубофена для белых крыс при пероральном введении
Установлено, что в соответствии с «Гигиенической классификацией пестицидов по основным параметрам вредности» (Медведь Л.И., Каган Ю.С., Спыну Е.И., 1968), Тубофен, является малотоксичным соединением. По степени опасности IV класс, незначительно опасные химические вещества (ГОСТ 12.1.007.76).
1.2.9.3 Изучение субхронической токсичности и кумулятивныхсвойств Тубофена
Для изучения кумулятивных свойств препарата использовали субхронический тест по Lim R. и др. (1961). Субхроническую токсичность изучали на 20 белых крысах живой массой 150 г, которых поделили на 2 группы по 10 животных в каждой. Животным первой опытной группы в течение 26 дней ежедневно задавали препарат. Для этого в течение первых четырёх суток внутрижелудочно, атравматическим металлическим зондом, вводили исследуемый препарат в дозе 1/20 от ранее установленной однократной дозы ЛД50 – 283,75 мг/кг массы тела. Затем, через каждые 4 дня, прежнюю дозу препарата увеличивали в 1,5 раза, и так до окончания опыта, т.е. до гибели всех опытных крыс. Животным контрольной группы в аналогичных дозах вводили дистиллированную воду. Результаты исследования по определению кумулятивных свойств Тубофена отражены в таблице 10.
Таблица 10 — Результаты исследования по определению кумулятивных свойств Тубофена
| Длительность
наблюдения, сут. |
Ежедневно вводимая доза, мг/кг | Суммарная доза за 4 сут., мг/кг | Суммарная доза, мг/кг |
| 1-4 | 283,75 | 1135 | 1135 |
| 5-8 | 425,6 | 1702,5 | 2837,5 |
| 9-12 | 638,4 | 2553,6 | 5391,1 |
| 13-16 | 957,6 | 3830,4 | 9221,4 |
| 17-20 | 1436,4 | 5745,6 | 14967 |
| 21-24 | 2154,6 | 8618,4 | 23585,4 |
| 25 | 3231,9 | — | 26617,3 |
В течение определения субхронической токсичности Тубофена на белых крысах, проводилось взвешивание животных до начала опыта, далее на 5, 10, 15, 20 и 25 сутки, с целью определения воздействия данного препарата на показатели привеса. Полученные результаты приведены в таблице 11.
Таблица 11 — Изменение средней массы белых крыс при многократном применении Тубофена
| Группы животных | Показатели | Длительность наблюдения, сутки | |||||
| до опыта | 5 | 10 | 15 | 20 | 25 | ||
| Опытная | M±m | 150,0 ±0,59 | 150,9 ±0,31 | 151,9 ±0,34* | 152,7 ±0,30* | 148,7 ±0,42* | 140,75 ±0,59* |
| % изменения | 100 | +0,6 | +1,26 | +1,8 | -0,86 | -6,16 | |
| Контроль-ная | M±m | 150,5 ±0,50 | 151,5 ±0,34 | 153,6 ±0,37 | 155,6 ±0,33 | 158,9 ±0,56 | 161,2 ±0,4 |
| % изменения | 100 | +0,66 | +2,06 | +3,38 | +6,24 | +7,1 | |
Примечание: * — р < 0,01.
Из таблицы 11 видно, что по окончании опыта отмечается уменьшение живой массы опытной группы животных до 6,16%, в то время как в контрольной группе животных происходило увеличение живой массы белых крыс на 7,1%.
Согласно проведенным подсчетам установлено, что среднесмертельная доза испытуемого препарата при многократном введении дробных доз белым крысам составила 26817,3 мг/кг живой массы.
Коэффициент кумуляции Тубофена составил 4,72. По принятой в настоящее время классификации (Медведь Л.И., Каган Ю.С., Спыну Е.И., 1968), препарат соответствует веществам обладающим умеренной кумуляцией.
1.2.9.4 Гематологические и биохимические показатели крови белых крыс после длительного применения Тубофена
По окончании определения субхронической токсичности препарата на 20 белых крысах, произвели исследование гематологических и некоторых биохимических показателей крови, которые представлены в таблице 12.
Из данных таблицы видно, что количество эритроцитов за период применения препарата в подопытной группе животных незначительно снижается на 3% с 8,12±0,07 х1012 /л, до 7,88±0,08 х1012 /л, в то время как в контрольной группе животных количество возросло на 2,5 %, с 8,2±0,08 х1012 /л, до 8,41±0,08 х1012 /л.
Таблица 12 — Изменение гематологических и биохимических показателей крови белых крыс после длительного применения Тубофена
| Наименование
показателей |
До начала опыта | После окончания опыта | ||
| контрольная
группа |
опытная группа | контрольная
группа |
опытная группа | |
| Эритроциты, ×1012/л | 8,2±0,08 | 8,12±0,07* | 8,41±0,08 | 7,88±0,08* |
| Лейкоциты,×109/л | 10,04±0,18 | 10,16±0,20 | 9,88±0,15 | 9,36±0,15 |
| Гемаглобин, г/л | 131,4±1,96 | 128,6±3,31 | 133,4±2,42 | 117,4±2,94 |
| Общий белок, г/л | 64,4±1,35 | 63,6±1,52 | 65,44±1,88 | 60,08±2,02* |
| Глюкоза, моль/л | 53,4±2,14 | 53,8±1,64 | 53,12±2,08 | 50,84±1,80* |
Примечание: * — р < 0,01.
Содержание лейкоцитов в опытной группе животных также уменьшается на 7,87%, с 10,16±0,20 х109 /л, до 9,36±0,15 х109 /л, а в контрольной группе варьирует в пределах от 10,04±0,18 х109 /л, до 9,88±0,15 х109 /л. Уровень гемоглобина крови у опытной группы животных снижается на 8,7%, с 128±3,31 г/л, до 117,4±2,94 г/л, у контрольной группы животных увеличивается на 1,52%, с 131,4±1,96 г/л, до 133,4±2,42 г/л. Содержание общего белка в сыворотке крови опытной группы животных незначительно снижено и составляет 60,08±2,02 г/л, в то время как у контрольной группы крыс, получавших новый препарат, содержание общего белка в сыворотке крови составило 65,44±1,88 г/л. Содержание глюкозы в крови крыс опытной группы также незначительно снижено и составляет 50,84±1,80 г/л, в то время как в контрольной группе животных её содержание варьирует в пределах 53,12±2,08 г/л.
1.2.9.5 Изучение аллергенных свойств Тубофена
Изучение аллергенных свойств Тубофена проводили на 24 морских свинках, массой 250 – 300 г, разделённых на 2 опытных и одну контрольную группы, по 8 животных в каждой. Животных опытных групп сенсибилизировали, вводя однократно в кожу наружной поверхности уха, ближе к его основанию 50 (I опытная группа) и 200 мкг на животное (II опытная группа) изучаемый препарат в объёме 0,1 мл. В качестве растворителя применяли физиологический раствор. Контрольным животным вводили в том же объёме растворитель. Выявление сенсибилизации проводили через 8 дней с помощью реакции специфического лизиса лейкоцитов крови (РСЛЛ). Результаты исследования аллергенных свойств препарата представлены в таблице 13.
Таблица 13 — Результаты исследования аллергенных свойств Тубофена в опыте на морских свинках
| Группы животных: | Количество лейкоцитов при различных дозах сенсибилизации, (х109/л) |
| I опытная группа | 8,3±0,04 |
| II опытная группа | 8,27±0,06 |
| Контрольная группа | 8,4±0,04 |
Из данных таблицы следует, что показатель РСЛЛ у животных первой опытной группы, сенсибилизированных Тубофеном в дозе 50 мкг на животное, составил 1,19%, а у второй опытной группы, сенсибилизированной препаратом в дозе 200 мкг на животное – 2,23%. Поэтому РСЛЛ расценивали как отрицательную, так как показатель лизиса лейкоцитов у обеих групп подопытных животных был менее 9%. Анализ проведённых исследований показал, что Тубофен при внутрикожной сенсибилизации морских свинок, не обладет аллергенными свойствами.
1.2.9.6 Оценка потенциальной опасности проявления эмбриотоксических и тератогенных свойств Тубофена
Изучение эмбриотоксических и тератогенных свойств Тубофена было проведено на 20 беспородных самках белых крыс половозрелого возраста, живой массой 180 – 230 г. животные были разделены на 2 группы, по 10 крыс в каждой. Первая опытная группа получала препарат внутрижелудочно, в дозе составляющей 1/20 от среднесмертельной дозы – 283, 75 мг/кг массы тела, в течение 20 дней. Вторая, контрольная группа в аналогичных дозах получала растворитель (дистиллированную воду). Результаты экспериментов представлены в таблице 14.
Таблица 14 — Показатели эмбриотоксической активности Тубофена
| Показатели: | Контрольная группа | Опытная группа |
| Количество крыс в группе | 5 | 5 |
| Количество жёлтых тел в яичниках | 53 | 51 |
| Количество мест имплантации | 51 | 48 |
| Количество живых плодов | 49 | 45 |
| Количество мёртвых плодов | — | — |
| Предимплантационная гибель зигот, % | 3,77±0,70 | 5,9±0,23* |
| Постимплантационная гибель эмбрионов, % | 3,92±0,85 | 6,25±1,00* |
| Общая эмбриональная смертность, % | 7,55±0,96 | 11,8±1,30 |
| Масса плода, г | 2,87±0,09 | 2,86±0,11 |
| Длина планцеты, см | 1,29±0,01 | 1,28±0,01 |
| Краниокаудальные размеры плода, см | 3,07±0,04 | 3,06±0,01 |
Примечание: * — р < 0,01.
Анализ проведённых исследований показал, что Тубофен не влияет на репродуктивные качества крыс. Показатели пред- и постимплантационной гибели у опытных и контрольных животных практически не отличались. При этом количество жёлтых тел и мест имплантации в группах, примерно было равным и не отличалось более чем на 5,8%.
Вскрытие самок белых крыс на 20 сутки беременности показало практически равное количество живых и мертвых плодов в обеих группах.
Изучение нарушений эмбрионального развития, проявляющихся в постнатальном периоде, проводили на 5 крысах, от которых было получено потомство. За 3 – 4 дня до родов самки были подсажены по одной в клетку. Крысят от опытных и контрольных самок периодически взвешивали, регистрировали сроки покрытия шерстью, время отлипания ушей, а также сроки прозрения и прорезывания резцов.
Анализ полученных результатов показал, что Тубофен не влияет на массу тела и продолжительность беременности самок опытной группы (таблица 15).
Таблица 15 — Изменение массы тела и продолжительность беременности крыс при внутрижелудочном введении Тубофена
| Показатели: | Группы животных: | |
| контрольная | опытная | |
| Масса тела беременных крыс, г
(в % к исходной) |
107,2±0,7 | 106,4±0,3 |
| на 6-й день, г | 121,7±0,9 | 122,7±1,3 |
| на 15-й день, г | 142,3±1,8 | 144,7±2,1 |
| Продолжительность беременности, дн | 23,2±0,2 | 23,0±0,4 |
Также существенно не менялись показатели постнатальной смертности и прироста массы тела крысят за первые 4 недели их жизни (таблица 16).
Таблица 16 — Показатели развития потомства белых крыс
| Наименование показателей: | Группы животных: | |
| контрольная | опытная | |
| Число родившихся крысят | 48 | 46 |
| Мёртворождения, % | 0,2±0,2 | 0,4±0,2 |
| Масса тела крысят, г:
Новорожденные |
5,3±0,1 | 5,1±0,06 |
| 3-й день | 7,2±0,2 | 7,0±0,1 |
| 5-й день | 9,4±0,08 | 9,3±0,05 |
| 14-й день | 16,8±0,3 | 16,6±0,08 |
| 20-й день | 22,5±0,6 | 22,1±0,4 |
| 28-й день | 31,6±0,5 | 29,3±0,8* |
| Срок отлипания ушей, дни | 6,7±0,6 | 6,3±0,3 |
| Срок опушения, дни | 8,22±0,03 | 8,1±0,2 |
| Срок прозрения, дни | 15,7±0,5 | 15,3±0,4 |
| Срок прорезывания резцов, дни | 9,2±0,3 | 9,1±0,2 |
| Постнатальная смертность к 21 дню, % | 4,44±0,6 | 6,06±1,3 |
Примечание: * — р < 0,01.
Таким образом, основные показатели, указывающие на эмбриотоксическое и тератогенное действие препарата у подопытных и контрольных животных, были в близких пределах и свидетельствовали об отсутствии эмбриотоксического и тератогенного действия Тубофена.
1.2.10 Изучение фармако-токсикологических свойств Аликона
1.2.10.1 Определение параметров острой токсичности Аликона
Перед постановкой опытов для изучения общетоксического действия Аликона животные выдерживались на 2-х недельном карантине, кормление проводили согласно принятым в зоотехнии нормам.
Острую токсичность определяли на белых нелинейных мышах массой тела 18-20 г, белых нелинейных крысах, массой тела 180-200 г, подобранных по принципу аналогов.
Препарат испытывали в дозах 1000,1200,1400,1600,1800 и 2000 мг/кг массы тела, с шагом дозы 200 мг, при однократном введении в желудок в виде суспензии с дистиллированной водой с помощью металлического зонда с оливой надетого на шприц. При этом объём вводимой суспензии не превышало белым мышам — 0,5 мл, белым крысам — 5 мл. Контрольная группа животных получала соответствующий объём воды. За животными вели наблюдение в течение 14 суток. Регистрировали выживаемость животных, клиническую картину, поведение, поедаемость корма, в конце наблюдения проводили диагностическое вскрытие. В результате определяли среднесмертельную (ЛД50) или максимально введенную дозу. Результаты исследования острой токсичности Аликона на белых мышах отражены в таблице 17.
Таблица 17 — Результаты исследования острой токсичности Аликона
| Группа животных | Доза препарата, мг/кг | Количество мышей | Число мышей | % гибели | |
| погибших | выживших | ||||
| 1 | 1000 | 10 | 0 | 10 | — |
| 2 | 1200 | 10 | 0 | 10 | — |
| 3 | 1400 | 10 | 0 | 10 | — |
| 4 | 1600 | 10 | 0 | 10 | — |
| 5 | 1800 | 10 | 0 | 10 | — |
| 6 | 2000 | 10 | 0 | 10 | — |
| Контроль | дист. вода | 10 | 0 | 10 | — |
Из результатов, отраженных в таблице 22 видно, что однократное внутрижелудочное введение исследуемого вещества в вышеуказанных дозах не вызвало гибели белых мышей и белых крыс в течение 14 суток. Клиническая картина, поедаемость корма, поведение животных не отличалось от контрольной группы. При диагностическом вскрытии животных на 14 сутки видимых изменений в органах и тканях не обнаружено.
В дозах, более вышеуказанных, введение препарата было невозможно, ввиду его нерастворимости в воде. В связи с тем, что гибели опытных животных за период наблюдения не отмечалось, расчет среднесмертельной дозы (ЛД50), ЛД16, ЛД84 не представлялся возможным. Для дальнейших исследований, согласно «Методическим указаниям по изучению общетоксического действия фармакологических веществ» была взята доза 2000 мг/кг массы тела как максимально возможная для введения.
Таким образом, исследуемое химическое соединение, согласно ГОСТ 12.1.007.76, относится к IV классу (незначительно опасные химические вещества).
Однако, дальнейшие токсикологические и бактериологические исследования химических соединений данной группы противотуберкулезных препаратов были прекращены, по 3-м основным причинам:
- Трудности синтеза химических соединений, производных триазина, в больших количествах;
- Плохая растворимость синтезированных соединений в воде, что ухудшает биодоступность;
- Относительная дороговизна реактивов.
1.2.11 Изучение фармако-токсикологических свойств Линарола
1.2.11.1 Определение параметров острой токсичности Линарола
Животные поступали из вивария при ФГБОУ ВО Казанская ГАВМ, перед постановкой опытов животные выдерживались на 2-х недельном карантине, кормление проводили согласно принятым в зоотехнии нормам.
Острую токсичность определяли на белых нелинейных мышах массой тела 18-20 г и белых нелинейных крысах массой тела 180-200 г, подобранных по принципу аналогов. Для этого было сформировано 7 групп животных (6 опытных и 1 контрольная), по 10 особей в каждой.
Линарол испытывали в дозах 1500, 2000, 2500, 3000, 3500 и 4000 мг/кг массы тела, с шагом дозы 500 мг, при однократном введении в желудок в виде суспензии с дистиллированной водой с помощью атравматичного зонда. При этом объём вводимой суспензии не превышало белым мышам — 0,5 мл, белым крысам — 5 мл. Контрольная группа животных получала соответствующий объём воды. За животными вели наблюдение в течение 14 суток. Регистрировали выживаемость животных, клиническую картину, поведение, поедаемость корма, в конце наблюдения проводили диагностическое вскрытие. В результате определяли среднесмертельную (ЛД50) или максимально вводимую дозу. Результаты исследования острой токсичности Линарола на белых мышах отражены в таблице 18.
Таблица 18 — Результаты исследования острой токсичности Линарола
| Группа животных | Доза препарата, мг/кг | Количество мышей | Число мышей | % гибели | |
| погибших | выживших | ||||
| 1 | 1500 | 10 | 0 | 10 | — |
| 2 | 2000 | 10 | 0 | 10 | — |
| 3 | 2500 | 10 | 0 | 10 | — |
| 4 | 3000 | 10 | 0 | 10 | — |
| 5 | 3500 | 10 | 0 | 10 | — |
| 6 | 4000 | 10 | 0 | 10 | — |
| Контроль | Дист. вода | 10 | 0 | 10 | — |
Результаты изучения острой токсичности на белых мышах и крысах показали, что ни одна испытуемая доза Линарола не вызвала гибели животных. В дозах более вышеуказанных, введение оказалось невозможно, ввиду нерастворимости препарата в воде. Однако следует отметить, что у животных 4, 5 и 6 опытных групп, в течение 20-30 минут после введения Линарола отмечалось незначительное угнетение общего состояния. Спустя вышеуказанное время, их состояние нормализовалось и не отличалось от животных контрольной группы, которым вводили соответствующий объём воды. При диагностическом вскрытии на 14 сутки животных опытных и контрольной групп видимых изменений в органах и тканях не обнаружено.
В связи с тем, что гибели опытных животных за период наблюдения не отмечалось, расчет среднесмертельной дозы (ЛД50), ЛД16, ЛД64 не представлялся возможным и для дальнейших исследований, согласно «Методическим указаниям по изучению общетоксического действия фармакологических веществ» была использована доза — 4000 мг/кг массы тела, как максимально возможная для введения.
Таким образом, исследуемый препарат Линарол, согласно ГОСТ 12.1.007.76, относится к IV классу (малоопасные вещества).
1.2.11.2 Изучение субхронической токсичности и кумулятивных свойств Линарола
Кумуляцию изучали методом субхронической токсичности по Lim R. et al. (1961). Для этого было сформировано 2 группы белых крыс по 10 особей (5 самок и 5 самцов) в каждой. Первой группе животных вводили Линарол внутрижелудочно с помощью атравматичного зонда в дозе 1/10 от максимально вводимой. Контрольной группе вводили внутрижелудочно аналогичное количество воды. Введение препарата проводили ежедневно, каждые 4 дня дозу увеличивали в 1,5 раза. Опыт продолжался 28 дней. Результаты исследований приведены в таблице 19.
Из результатов, отраженных в таблице 19, видно, что за весь период опыта гибели подопытных крыс не наблюдалось Первые клинические признаки, в виде незначительного угнетения наблюдали с 17 сут эксперимента, непосредственно после введения препарата, спустя 1,0 — 1,5 часа общее состояние животных становилось удовлетворительным, они поедали корм и пили воду. Подобную картину наблюдали до конца опыта.
Таблица 19 — Кумулятивные свойства Линарола
| Дни введения | Ежедневная доза, мг/кг | Суммарная доза за 4 дня, мг/кг | Суммарная доза, мг/кг | Количество павших животных |
| 1-4 | 400 | 1600 | 1600 | 0 |
| 5-8 | 600 | 2400 | 4000 | 0 |
| 9-12 | 900 | 3600 | 7600 | 0 |
| 13-16 | 1350 | 5400 | 13000 | 0 |
| 17-20 | 2025 | 8100 | 21000 | 0 |
| 21-24 | 3037 | 12148 | 33248 | 0 |
| 25-28 | 4556 | 18224 | 51472 | 0 |
Применение рекомендуемой формулы для подсчёта коэффициента кумуляции, согласно методике, не представлялось возможным, поэтому можно заключить о слабовыраженных кумулятивных свойствах препарата.
1.2.11.3 Изучение местно-раздражающего действия Линарола
Для изучения местного раздражающего действия Линарола на кожу использовали 8 белых кроликов. За день до проведения опыта участки кожи в области спины 5×5см с двух сторон от позвоночника тщательно выстригали. Препарат в виде кашицы, смешанной с дистиллированной водой, наносили на кожу с одной стороны позвоночного столба из расчета 20 мг/см2, контролем служила противоположная сторона, где была нанесена дистиллированная вода. Для исключения слизывания, на кроликов надевали пластиковые воротники. Экспозиция составляла 4 часа, после чего остатки препарата удаляли с помощью тёплой воды с мылом.
Реакцию кожи регистрировали через 1 и 16 часов после однократной аппликации и оценивали в сравнении с симметричным участком кожи того же животного, где была нанесена дистиллированная вода. Оценку эритемы проводили визуально и оценивали в баллах. Оценку отёка кожи животного определяли путём измерения толщины кожной складки при помощи кутиметра (в мм). Оценку степени эритемы суммировали для каждого животного, после чего вычисляли среднюю оценку выраженности раздражающего эффекта для группы экспериментальных животных.
Степень выраженности раздражающего действия вещества на кожу кроликов определяли согласно принятой классификации (МУ №2163-80, Минздрав СССР). Результаты исследования раздражающего действия Линарола на кожу кроликов отражены в таблице 20.
Таблица 20 — Результаты исследования раздражающего действия Линарола на кожу кроликов
| Время исследования, ч | Степень эритемы, баллы | Интенсивность отёка, баллы | Суммарный балл раздражения | Степень выраженности раздражающего действия |
| 1 | 0,125 | 0,062 | 0,187 | отсутствие раздражающего действия |
| 16 | 0 | 0 | 0 | отсутствие раздражающего действия |
Из результатов, отраженных в таблице 20, следует, что в указанные периоды исследования после нанесения препарата на кожу кроликов каких-либо функциональных нарушений кожи (отек, трещины, изъязвления, изменения температуры кожи) не отмечалось.
При изучении местного раздражающего действия препарата на слизистую глаза кроликов порошок сорбента наносили в левый конъюнктивальный мешок в количестве 50 мг. Правый глаз опытных животных служил контролем. После внесения препарата на минуту прижимали слезоносовой канал у внутреннего угла глаза. Регистрацию изменений слизистой оболочки глаза, склеры, роговицы проводили ежедневно в течение 14 дней. Влияние Линарола на слизистые оболочки глаз выражалось гиперемией и инъецированием сосудов конъюнктивы, которое проходили через 8-12 часов. Изъязвления конъюнктивы, рубцовых изменений век, помутнения роговицы не регистрировали.
Таким образом, в результате проведенного исследования установлено, что Линарол не обладает местно-раздражающим действием на кожу и конъюнктиву глаза.
1.2.11.4 Изучение влияния Линарола на антитоксическую функцию печени
Изучение влияния Линарола на антитоксическую функцию печени проводили, используя методику Розина Д.Г. (1964). В основе данной методике лежит способность различных препаратов влиять на продолжительность сна животных, вызванного гексеналом, который инактивируется в печени.
Для проведения эксперимента было отобрано 5 групп белых крыс, 4 опытные и 1 контрольная, по 10 голов в каждой. Группы подбирались по принципу аналогов, и каждая группа состояла из 5 самок и 5 самцов. Четырем опытным группам животных перед началом исследования внутрижелудочно, с помощью атравматического зонда с оливой, вводили Линарол в дозе 1/10 от максимально вводимой (400 мг/кг массы), а крысам контрольной группы внутрижелудочно вводили только растворитель (дистиллированную воду).
Раствор гексенала готовили непосредственно перед употреблением и инъецировали внутрибрюшинно в дозе 60 мг/кг массы тела через 1, 2, 5 и 24 часа после введения Линарола. Продолжительность сна белых крыс выражали в минутах, которые отсчитывали с момента принятия ими «бокового положения», до первых попыток изменить его. Результаты исследования представлены в таблице 21.
Таблица 21 — Продолжительность гексиналового сна белых крыс (в минутах) при внутрижелудочном введении Линарола
| Группа животных | Доза препарата, мг/кг | Продолжительность интервала (в часах), через который вводили гексенал | |||
| 1 | 2 | 5 | 24 | ||
| Опытная | 400 | 26,75±3,76 | 27,57±3,74* | 25,5±2,55 | 24,75±3,69 |
| Контрольная | — | 26,29±4,61 | 26,29±4,61 | 26,29±4,61 | 26,29±4,61 |
Примечание: * — р > 0,05.
Из данных таблицы видно, что инъекция гексенала после внутрижелудочного введения Линарола через 1, 2, 5 и 24 часа не приводила к достоверному увеличению продолжительности сна подопытных крыс, по сравнению с контрольными животными.
На основании проведенных исследований можно сделать заключение, что исследуемый препарат не влияет на антитоксическую функцию печени.
1.2.11.5 Гематологические и биохимические показатели крови белых крыс после длительного применения Линарола
Опыты проводили в условиях вивария ФГБОУ ВО Казанская ГАВМ и клинико-диагностической лаборатории №1 ГАУЗ «Республиканский клинический противотуберкулезный диспансер». Влияние Линарола на гематологические и биохимические показатели при внутрижелудочном введении в дозе 1/20 от ЛД50 (200 мг/кг массы тела животного), изучали на 20 белых беспородных крысах обоего пола массой 190 – 210 грамм.
Животные были разделены на группы, по 10 голов в каждой. Первая группа была опытной, в течение 30 суток животным внутрижелудочно вводили Линарол, а вторая – контрольной, которая получала растворитель – дистиллированную воду. Процедуры выполняли ежедневно, однократно, в течение 30 суток. Забор крови проводили до начала эксперимента, на 10, 20 и 30 сутки наблюдения.
Кровь для гематологических и биохимических исследований у крыс брали из сосудов хвоста. Гематологические и исследования проводили общепринятыми методами (Кудрявцев А.А. и др., 1969; Меньшиков В.В., 1987). Биохимические исследования крови, а в частности определение количества глюкозы, общего белка, АЛТ, АСТ, мочевины и креатинина проводили с использованием биохимического анализатора Selectra Junior. Для определения количества альбуминов и глобулинов крови использовали устройство для электрофореза сыворотки крови УЭФ – 01 «Астра». Цифровые данные эксперимента представлены в таблице 22 и 23.
Введение Линарола белым крысам в течение 30 суток перорально, в дозе 200 мг/кг массы тела, существенно не повлияло на гематологические показатели крови (таблица 27). Отмечалось лишь незначительное уменьшение количества эритроцитов, которое оставалось в пределах физиологической нормы.
Достоверно увеличивалось в пределах верхних границ допустимой нормы количество лимфоцитов с 52,82,41% в начале эксперимента, до 67,22,46 % на 20 сутки применения препарата и уменьшилось до 612,37 % на 30 сутки. По остальным показателям лейкоформула не отличалась от таковой у контрольной группы.
Из исследованных биохимических показателей (таблица 23) достоверно, практически в 2 раза, на 20 сутки эксперимента, уменьшалось содержание АСТ с 141,427,03 до 63,610,3 МЕ/л и глобулинов с 40,662,24 до 23,062,2 г/л в сыворотке крови опытной группы, что может говорить о повреждении препаратом печени, однако эти показатели на 30 сутки исследования повысились и составили 96,212,11 МЕ/л и 27,021,13 г/л соответственно.
Содержание АЛТ также незначительно уменьшалось с 57,22,53 МЕ/л до начала эксперимента, до 31,62,95 МЕ/л на 10 сутки, а затем вновь увеличивалось в пределах физиологической нормы, до 44,87,05 МЕ/л на 30 сутки исследований. Кроме того, количественное содержание альбулинов в крови на 30 сутки после применения препарата даже повысилось и составило 33,722,21 г/л, что на 4,18 г/л больше, чем в контрольной группе.
По остальным биохимическим показателям крови (мочевина, креатинин, глюкоза, общий белок) существенных различий от контрольной группы ни в один из периодов исследований (10, 20 и 30 сутки) мы не наблюдали.
Таблица 22 — Гематологические показатели у белых крыс при внутрижелудочном применение Линарола в дозе 1/20 от ЛД50 (200 мг/кг массы тела) в течение 30 суток
| Наименование показателей | Исходные данные | На 10 сут. | На 20 сут. | На 30 сут. | ||||
| контроль | опыт | контроль | опыт | контроль | опыт | контроль | опыт | |
| Эритроциты
(1012/л) |
5,420,24 | 5,880,6 | 5,640,25 | 5,140,39 | 5,540,25 | 4,610,18 | 5,440,25 | 4,920,31 |
| Лейкоциты
(109/л) |
6,860,42 | 5,51,11 | 6,620,4 | 7,380,66 | 6,380,34 | 6,80,46 | 6,160,33 | 5,740,51 |
| Палочкоядерные
(%) |
6,60,57 | 6,21,19 | 6,40,57 | 80,94 | 6,80,42 | 5,20,82 | 6,40,57 | 51,27 |
| Сегментоядерные (%) | 23,83,07 | 29,83,7 | 26,22,27 | 23,83,19 | 25,81,52 | 253,22 | 26,82,22 | 301,62 |
| Эозинофилы (%) | 0,40,27 | 10,87 | 0,40,27 | 0,20,22 | 0,60,27 | 0,20,22 | 0,40,27 | 0,60,45 |
| Базофилы (%) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Моноциты (%) | 2,40,45 | 1,80,42 | 2,80,65 | 5,40,84 | 2,20,65 | 2,40,57 | 2,40,57 | 3,20,65 |
| Лимфоциты (%) | 53,43,58 | 52,82,41 | 54,64,13 | 62,63,91 | 52,82,86 | 67,22,46 | 53,62,84 | 612,37 |
Примечание: — Р 0,05.
Таблица 23 — Биохимические показатели у белых крыс при внутрижелудочном применение Линарола в дозе 1/20 от ЛД50 (200 мг/кг массы тела) в течение 30 суток
| Наименование показателей | Исходные данные | На 10 сут. | На 20 сут. | На 30 сут. | ||||
| контроль | опыт | контроль | опыт | контроль | опыт | контроль | опыт | |
| Глюкоза
(ммоль/л) |
6,50,29 | 5,660,77 | 6,720,45 | 6,840,38 | 6,140,44 | 5,240,42 | 6,260,32 | 4,820,86 |
| АЛТ (МЕ/л) | 58,64,04 | 57,22,53 | 62,23,97 | 31,62,95 | 55,83,31 | 44,84,17 | 58,83,8 | 44,87,05 |
| АСТ (МЕ/л) | 139,213,56 | 141,427,03 | 1364,83 | 77,84,72 | 137,84,77 | 63,610,3 | 140,45,26 | 96,212,11 |
| Общий белок (г/л) | 66,42,38 | 68,062,14 | 68,72,06 | 65,042,29 | 66,83,07 | 55,21,52 | 63,082,85 | 60,742,39 |
| Альбумины (г/л) | 30,940,87 | 29,540,84 | 29,480,84 | 32,920,55 | 28,380,43 | 32,140,84 | 30,020,57 | 33,722,21 |
| Глобулины (г/л) | 41,221,29 | 40,662,24 | 42,361,12 | 32,182,47 | 41,780,89 | 23,062,2 | 40,780,9 | 27,021,1 |
| Креатинин
(ммоль/л) |
0,0490,01 | 0,0480,01 | 0,0490,01 | 0,050,01 | 0,050,01 | 0,0520,01 | 0,0510,01 | 0,0530,01 |
| Мочевина (моль/л) | 4,40,25 | 4,620,42 | 4,260,26 | 4,10,19 | 4,320,22 | 4,260,28 | 4,180,11 | 3,840,22 |
Примечание: — Р 0,05; — Р 0,001.
Таким образом, проведенные нами исследования позволяют утверждать, что ежедневное, пероральное введение Линарола белым крысам в дозе 1/20 от ЛД50 (200 мг/кг массы тела), в течение 30 суток, существенно не повлияло на гематологические и биохимические показатели крови животных, даже в такой высокой дозе, с учетом продолжительного его применения.
1.2.12 Изучение фармако-токсикологических свойств Линарола Ф-1
1.2.12.1 Определение параметров острой токсичности Линарола Ф-1 на белых мышах
Опыты были проведены на 30 белых мышах массой 17-20 г. Препарат вводили в желудок с помощью металлического зонда с оливой, надетого на шприц, по схеме, приведённой в таблице 24.
Таблица 24 — Результаты исследования острой токсичности Линарола Ф-1 на белых мышах
| Группа животных | Доза препарата, мг/кг | Количество мышей | Число мышей: | % гибели | |
| погибших | выживших | ||||
| 1 | 300 | 5 | 0 | 5 | 0 |
| 2 | 500 | 5 | 0 | 5 | 0 |
| 3 | 700 | 5 | 2 | 3 | 40 |
| 4 | 900 | 5 | 3 | 2 | 60 |
| 5 | 1100 | 5 | 5 | 0 | 100 |
| Контроль | дист. вода | 5 | — | 5 | 0 |
При пероральном введении препарата в дозе 300 мг/кг массы тела видимых изменений в поведении и общем состоянии белых мышей не наблюдалось, при дозе 500 мг/кг отмечалось небольшое угнетение опытных животных, которое прозодило через 30-40 минут после введения. В дальнейшем, по мере увеличения дозы вводимого препарата на 200 мг/кг живой массы, в каждой последующей группе происходило угнетение животных. При дозе 700 мг/кг массы, через 48 часов погибли две мыши, при дозе 900 мг/кг через 3-4 часа после введения погибло– 3 мыши, а при дозе 1100 мг/кг в течение 2-3 часов – все мыши опытной группы.
В контрольной группе животных получавших растворитель препарата – дистиллированную воду, гибели не отмечалось.
Мыши 3 и 4 опытных групп перенёсших интоксикацию, в дальнейшем оставались живыми и визуально не отличались от контрольных. При патологоанатомическом вскрытии павших животных отмечали незначительные изменения на слизистой желудочно-кишечного тракта в виде гиперемии.
Таким образом, в результате проведенного исследования установлено, что максимально переносимая доза Линарола Ф-1 для белых мышей составила 500 мг/кг массы тела. Проведя расчет средней смертельной дозы, установили, что ЛД50 препарата равна 800 мг/кг, ЛД100 — 1100 мг/кг массы тела.
В соответствии с «Гигиенической классификацией пестицидов по основным параметрам вредности» (Медведь Л.И., Каган Ю.С., Спыну Е.И., 1968), Линарол Ф-1, является веществом обладающим средней токсичностью. По степени опасности III класс, опасные химические вещества (ГОСТ 12.1.007.76).
1.2.12.1 Определение параметров острой токсичности Линарола Ф-1 на белых крысах
Опыты были проведены на 30 белых крысах, массой 190-260 г. Препарат вводили в желудок с помощью металлического зонда с оливой, надетого на шприц, по схеме приведённой в таблице 25.
Результаты исследования показали, что при дозах 2000, 2500 и 3000 мг/кг массы тела, гибель подопытных крыс не происходила, клинические признаки отравления не наблюдались.
Таблица 25 — Результаты исследования острой токсичности Линарола Ф-1 на белых крысах
| Группа животных | Доза препарата, мг/кг | Количество крыс | Число крыс | % гибели | |
| Погибших | выживших | ||||
| 1 | 2000 | 6 | 0 | 0 | — |
| 2 | 2500 | 6 | 0 | 0 | — |
| 3 | 3000 | 6 | 0 | 0 | — |
| 4 | 3500 | 6 | 0 | 0 | — |
| 5 | 4000 | 6 | 0 | 0 | — |
У крыс, которым препарат вводили в дозе 3500 и 4000 мг/кг массы тела, клинические признаки появлялись спустя 10-15 минут после введения и характеризовались незначительным угнетением и отказом от корма, которое исчезало спустя 4-5 часов. Ни в одной из исследованных групп животных гибели не отмечалось. Внешне животные не отличались от животных контрольной группы.
Вводить соединение в больших дозах больше, чем 4000 мг/кг массы тела, не представлялось возможным, поскольку более высокая концентрация препарата не растворялась в растворителе (дистиллированной воде), а выпадала в осадок.
При патологоанатомическом вскрытии только у животных 4 и 5 опытных групп, получавших препарат в дозах 3500 и 4000 мг/кг массы тела, отмечали незначительные изменения на слизистой желудочно-кишечного тракта в виде гиперемии. У первых трех опытных групп макроскопических изменений во внутренних органах и тканях не отмечали.
Результаты эксперимента позволяют утверждать следующее:
- Параметры токсичности препарата для белых крыс: максимально переносимую и среднесмертельную дозы (ЛД50) установить не удалось, так как химическое соединение в дозах более 4000 мг/кг массы тела, не растворялось в растворителе (дистиллированной воде) и соответственно вводить препарат в таких дозах внутрижелудочно не представлялось возможным.
- Установлена максимально вводимая доза препарата для белых крыс – 4000 мг/кг массы тела.
- В соответствии с «Гигиенической классификацией пестицидов по основным параметрам вредности» (Медведь Л.И., Каган Ю.С., Спыну Е.И., 1968), Линарол Ф-1, является малотоксичным соединением для белых крыс. По степени опасности IV класс, незначительно опасные химические вещества (ГОСТ 12.1.007.76).
1.2.12.2 Изучение местно-раздражающего действия Линарола Ф-1
Степень выраженности раздражающего действия вещества на кожу кроликов определяли согласно принятой классификации (МУ №2163-80, Минздрав СССР). Результаты исследования раздражающего действия Линарола Ф-1 на кожу кроликов отражены в таблице 26.
Таблица 26 — Результаты исследования раздражающего действия Линарола Ф-1 на кожу кроликов
| Время исследования, часы | Степень эритемы, баллы | Интенсивность отёка, баллы | Суммарный балл раздражения | Степень выраженности раздражающего действия |
| 1 | 0,15 | 0,08 | 0,23 | отсутствие раздражающего
действия |
| 16 | 0 | 0 | 0 | отсутствие
раздражающего действия |
Из результатов, отраженных в таблице 26, следует, что в указанные периоды исследования после нанесения препарата на кожу кроликов каких-либо функциональных нарушений кожи (отек, трещины, изъязвления, изменения температуры кожи) не отмечалось.
Влияние Линарола-Ф1 на слизистые оболочки глаз выражалось гиперемией и инъецированием сосудов конъюнктивы, которое проходило через 1-2 часа, изъязвления конъюнктивы, рубцовых изменений век, помутнения роговицы не регистрировали.
Таким образом, препарат не обладает местно-раздражающим действием на кожу и конъюнктиву.
1.2.12.3 Изучение хронической токсичности Линарола Ф-1
Для изучения хронической токсичности использовали «Руководство по экспериментальному изучению новых фармакологических веществ» под редакцией Хабриева Р.У. (2005). Хроническую токсичность препарата изучали в трех дозах. При выборе доз руководствовались результатами, полученными при исследовании острой токсичности. Высшая доза – 200 мг/кг массы тела, рассчитана с учетом ЛД50 (1/20 от ЛД50), минимальная доза — 10 мг/кг, близка к терапевтической, третья доза – 100 мг/кг, являлась промежуточной.
Эксперимент проводился на самцах белых нелинейных крыс массой 250-300 г. Были сформированы четыре группы животных – три опытные и одна контрольная, по 5 голов в каждой. Опытным группам животных, препарат вводили в желудок с помощью металлического зонда с оливой, надетого на шприц, ежедневно, в течение 60 суток, причем: 1-ой опытной группе Линарол Ф-1 вводили в дозе 10 мг/кг массы тела; 2-ой опытной группе, в дозе 100 мг/кг массы тела; 3-й опытной группе, в дозе 200 мг/кг массы тела; 4-ой контрольной группе в аналогичных дозах вводили дистиллированную воду.
Установлено, что в течение первых 14 дней введения Линарола Ф-1 клинические признаки проявления интоксикации организма белых крыс отсутствовали и слабое их проявление, в виде незначительного угнетения общего состояния и частичного отказа от корма, отмечалось после 15 суток с начала опыта у животных третьей опытной группы, получавших препарат в дозе 200 мг/кг массы тела. Через 10-15 минут после дачи препарата дыхание животных 3-ей опытной группы становилось частым, животные были малоподвижными. Такое состояние наблюдалось в течение 1-2 часов после введения препарата. На 35 — 40 сутки с момента введения препарата в дозе 200 мг/кг массы тела у животных 3-ей опытной группы отмечалось незначительное угнетение, малоподвижность, исхудание и взъерошенность шерсти, которые не исчезали до окончания эксперимента.
Состояние животных первой и второй опытных групп, получавших препарат в дозах 10 и 100 мг/кг массы тела, в течение 60 суток, не отличалось от такового у контрольной группы.
В период определения хронической токсичности препарата на белых крысах проводилось взвешивание животных до начала опыта, далее на 20, 40 и 60 сутки, с целью определения воздействия Линарола Ф-1 на показатели привеса. Полученные результаты приведены в таблице 27.
Таблица 27 — Динамика массы тела белых крыс после внутрижелудочного введения Линарола Ф-1 в течение 60 суток
| Группы животных (доза) | Вес белых крыс, грамм | |||
| до начала опыта | через 20 суток | через 40 суток | по окончанию опыта (60 суток) | |
| I опытная (10 мг/кг) | 243±7,83 | 246,4±8,95 | 248,8±8,95 | 257,4±9,22 |
| II опытная (100 мг/кг) | 263±7,04 | 267,8±6,94 | 263,8±6,94 | 264±6,79 |
| III опытная (200 мг/кг) | 280±6,71 | 273,6±7,77 | 265±8,14 | 260,4±7,25* |
| Контрольная (дист.вода) | 273,8±7,94 | 278,6±7,36 | 285,6±6,97 | 293±7,61 |
Примечание: * — р ≤ 0,05.
Из таблицы 27 видно, что по окончании эксперимента масса тела у животных первой опытной группы, получавших Линарол Ф-1 в дозе 10 мг/кг, увеличилась в среднем на 6% и практически не отличалась по привесам от контрольной группы.
Вес животных второй опытной группы к окончанию эксперимента, не изменился, а у третьей опытной группы, получавших препарат в дозе 200 мг/кг массы тела, уменьшился на 7%, что свидетельствует о токсическом влиянии препарата в указанных дозах.
По окончании опыта всех животных подвергали эвтаназии, путем декапитации. При патологоанатомическом исследовании внутренних органов животных опытных групп, ни водном случае не выявили видимых макроскопических изменений.
1.2.12.4 Гематологические и биохимические показателии крови белых крыс после длительного применения Линарола Ф-1
У экспериментальных животных по окончании эксперимента (60 суток) брали кровь и из показателей гемограммы определяли гемоглобин, количество лейкоцитов и эритроцитов, а также лейкоцитарную формулу, используя общепринятые методы исследования (Меньшиков В.В., 1987г.). Результаты исследования сравнивали с показателями животных контрольной группы. Результаты исследования приведены в таблице 28.
Таблица 28 — Гематологические показатели белых крыс, после 60-дневного введения Линарола Ф-1
| Показатели | Группы животных (доза) | |||
| Контрольная (дист.вода) | I опытная
(10 мг/кг) |
II опытная (100 мг/кг) | III опытная (200 мг/кг) | |
| 1 | 2 | 3 | 4 | 5 |
| Эритроциты
(1012/л) |
6,64±0,51 | 5,91±0,29 | 7,98±0,19 | 7,58±0,19 |
| Лейкоциты
(109/л) |
5,58±0,45 | 4,44±0,61 | 5,32±0,75 | 7,5±0,86 |
| Палочкоядерные
(%) |
0,4±0,27 | 0,6±0,27 | 0,6±0,27 | 1,4±0,84 |
| Сегментоядерные
(%) |
15,4±2,02 | 13,4±1,35 | 19,2±1,39 | 15±0,79 |
| Эозинофилы (%) | 0,6±0,27 | 0 | 1±0,87 | 0,2±0,22 |
| Базофилы (%) | 0 | 0 | 0 | 0,2±0,22 |
| Моноциты (%) | 7±0,61 | 5,6±0,57 | 8,2±0,55 | 8,4±1,35 |
| Лимфоциты (%) | 75,8±3,44 | 78,8±1,67 | 71±1,94 | 76±2,65 |
Примечание: — Р 0,05.
По результатам, отраженным в таблице 28, видно, что введение препарата белым крысам в течение 60 суток перорально, в дозах 10, 100 и 200 мг/кг массы тела, существенно не повлияло на гематологические показатели крови и не отличалось от таковой у контрольной группы. Лишь достоверно увеличивалось в пределах верхних границ допустимой нормы количество лимфоцитов у животных третьей опытной группы, получавших препарат в дозе 200 мг/кг массы тела, что говорит о воспалительном процессе, происходящем в организме, которое может быть связано длительным раздражением и травмами пищевода зондом при введении препарата.
Характер воздействия исследуемого соединения на биохимические показатели, определяемые в сыворотке крови белых крыс, представлены в таблице 29.
Таблица 29 — Биохимические показатели белых крыс, после 60-дневного введения Линарола Ф-1
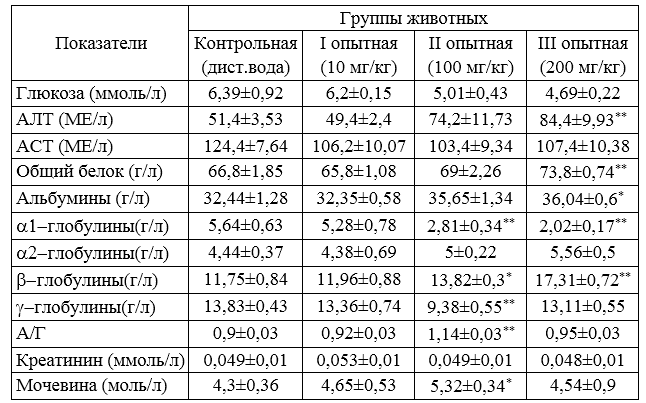
Примечание: — Р 0,05; — Р 0,01.
Из таблицы 29 следует, что животных первой опытной группы, получавших препарат, в дозе 10 мг/кг массы тела, в течение 60 суток, биохимические показатели крови практически не отличались от таковых у контрольной группы.
У белых крыс второй опытной группы, получавших препарат в дозе 100 мг/кг массы тела, в сравнении с животными контрольной группы, достоверно изменялись показания глобулинов. Так количество ![]() глобулинов было меньше практически в два раза: 5,64 г/л у контрольной группы и 2,81 г/л у опытной, количество
глобулинов было меньше практически в два раза: 5,64 г/л у контрольной группы и 2,81 г/л у опытной, количество ![]() глобулинов так же снижалось и составило 13,83 г/л и 9,38 г/л соответственно, хотя этот показатель в третьей опытной группе, где животные получали препарат в дозе 200 мг/кг массы тела был в норме и не отличался от такового в контрольной группе. Количество же
глобулинов так же снижалось и составило 13,83 г/л и 9,38 г/л соответственно, хотя этот показатель в третьей опытной группе, где животные получали препарат в дозе 200 мг/кг массы тела был в норме и не отличался от такового в контрольной группе. Количество же ![]() глобулинов, наоборот незначительно увеличилось (11,75 г/л у контрольной группы и 13,82 г/л у опытной).
глобулинов, наоборот незначительно увеличилось (11,75 г/л у контрольной группы и 13,82 г/л у опытной).
Основные изменения биохимических показателей сыворотки крови белых крыс отмечались при введении соединения в дозе 200 мг/кг массы тела. Так, в частности, отмечалось достоверное увеличение на 61%, по сравнению с контрольной группой, аланинааминотрансферазы (АЛТ). Синтез данного фермента происходит внутриклеточно, наиболее высокая активность выявляется в печени и почках, и в кровь его поступает ограниченное количество. Поэтому повышенное содержание АЛТ свидетельствует о наличии ряда отклонений, связанных с разрушением органов, которое и приводит к резкому выбросу в кровь фермента. Кроме того, достоверно увеличивалось на 10% содержание общего белка и на 47% глобулинов. По остальным биохимическим показателям, отраженным в таблице 35, третья опытная группа животных не отличалась от таковых в контрольной группе.
Проведенные экспериментальные исследования Линарола Ф-1 показали, что внутрижелудочное, ежедневное введение препарата, в дозах 10, 100 и 200 мг/кг массы тела, в течение 60 суток, ни в одном случае не привело к гибели белых крыс, однако вес в опытной группе, получавшей препарат в дозе 200 мг/кг массы, к окончанию эксперимента снижался на 7%, тогда как в контрольной группе этот показатель увеличивался на 7%.
Исходя из вышеизложенного, можно сделать вывод, что препарат не обладает выраженной хронической токсичностью в дозах 10 и 100 мг/кг массы тела, при ежедневном введении, в течение 60 суток.
Исследования периферической крови животных, получавших препарат в дозах 10, 100 и 200 мг/кг массы тела, в течение 60 суток, показало, что Линарол Ф-1 не влияет на гематологические показатели белых крыс.
Введение препарата в дозах 10 и 100 мг/кг массы тела, в течение 60 суток не повлияло на биохимические показатели сыворотки крови опытных животных и практически не отличалось от таковых у контрольной группы. В то же время, введение препарата в дозе 200 мг/кг массы тела, в течение 60 суток привело к достоверному увеличению количества АЛТ, общего белка и ![]() глобулинов, что свидетельствует о наличии ряда отклонений, связанных с нарушением работы печени и обмена веществ в организме.
глобулинов, что свидетельствует о наличии ряда отклонений, связанных с нарушением работы печени и обмена веществ в организме.
1.2.12.5 Изучение эмбриотоксических и тератогенных свойств Линарола Ф-1 на белых крысах
Опыты по изучению влияния Линарола Ф-1 на эмбриональное развитие и генеративную функцию яичников животных, проведены на 20 половозрелых самках белых крысах, массой 190 — 250 грамм, которые были разделены на 2 группы, по 10 животных в каждой. Первая опытная группа получала препарат внутрижелудочно, в дозе 1/10 от максимально вводимой (400 мг/кг массы тела), в течение всей беременности, а вторая — контрольная группа в аналогичных дозах растворитель (дистиллированную воду).
Результаты исследования эмбриотоксической активности Линарола Ф-1 представлены в таблице 30.
Таблица 30 — Показатели эмбриотоксической активности Линарола Ф-1
на белых крысах
| Показатели: | Группы животных | |
| контрольная | опытная | |
| 1 | 2 | 3 |
| Количество крыс в группе | 5 | 5 |
| Количество желтых тел в яичниках | 58 | 55 |
| Количество мест имплантации | 55 | 52 |
| Количество живых плодов | 53 | 50 |
| Количество мертвых плодов | — | — |
| Предимплантационная гибель зигот, % | 8,680,54 | 9,340,12 |
| Постимплантационная гибель эмбрионов, % | 5,170,72 | 6,170,66 |
| Общая эмбриональная смертность, % | 13,851,26 | 15,510,78 |
| Масса плода, г | 2,950,03 | 2,880,04* |
| Длина плаценты, см | 1,270,04 | 1,250,02 |
| Краниокаудальные размеры плода, см | 3,120,04 | 3,080,03 |
Примечание: * — р0,05
Анализ проведённых исследований (таблица 30) показал, что Линарол Ф-1 не влияет на репродуктивные качества крыс. Показатели пред- и постимплантационной гибели у опытных и контрольных животных практически не отличались. При этом количество жёлтых тел и мест имплантации в группах, примерно было равным и не отличалось более чем на 1%.
Вскрытие самок белых крыс на 20 сутки беременности, показало практически равное количество живых и мертвых плодов в обеих группах. Общая эмбриональная смертность в группе, получавшей препарат Линарол Ф-1, больше на 1,66%, чем в контрольной.
Краниокаудальный размер плодов белых крыс как в контрольной, так и в опытной группах были примерно одинаковыми и составили 3,120,04 см и 3,080,03 см, соответственно. Масса плодов крыс между контрольной и опытной группами существенно не отличались и были равны 2,950,03 г и 2,880,04 г, соответственно.
Изучение тератогенного действия препарата при внешнем осмотре извлечённых из матки плодов животных опытной и контрольной групп, видимых морфологических изменений не наблюдалось. В ходе исследования состояния внутренних органов плодов методом Вильсона, аномалий развития, а также нарушение их топографии не установлено.
По мере приготовления препаратов плодов по методу Даусона проводили их визуальное изучение под бинокулярной лупой. В результате чего было установлено, что топография костных и хрящевых закладок в скелете плодов опытной группы не нарушается. Нарушений в оссификации костей черепа, плечевого, тазового пояса конечностей и отклонений в строении скелета, также не установлено.
Изучение нарушений эмбрионального развития, проявляющихся в постнатальном периоде, проводили на 5 крысах, от которых было получено потомство. Анализ полученных результатов показал, что препарат не влияет на массу тела и продолжительность беременности самок опытной группы (таблица 31).
Таблица 31 — Изменение массы тела и продолжительность беременности крыс при внутрижелудочном введении Линарола Ф-1 в течение всей беременности
| Показатели: | Группы животных | |
| контрольная | опытная | |
| Масса тела беременных крыс, г | 177,92,81 | 186,32,47* |
| На 6-е сутки, г | 191,02,27 | 198,72,05 |
| На 15-е сутки, г | 210,72,52 | 217,32,26 |
| Продолжительность беременности, дни | 22,60,17 | 22,80,14 |
Примечание: * — р0,05.
Результаты изучения постнатального развития потомства самок белых крыс при внутрижелудочном введении Линарола Ф-1 в течение всей беременности, представлены в таблице 32.
Из полученных данных видно, что мертворожденных крыс в опытной группе не наблюдалось. Показатели динамики массы тела новорожденных крысят от опытных животных на 1, 3, 5, 14, 20 и 28 сутки жизни не имели значительных изменений по отношению к группе биологического контроля. Также существенно не отличались от контроля такие показатели, как срок отлипания ушей, срок опушения, сроки прозрения и прорезывания резцов. Постнатальная смертность в опытной группе была на 0,34% больше, чем в контрольной группе.
Таблица 32 — Показатели развития потомства белых крыс при внутрижелудочном введении Линарола Ф-1, в течение всей беременности в дозе 400 мг/кг массы тела
| Показатели: | Группы животных | |
| контрольная | опытная | |
| 1 | 2 | 3 |
| Число родившихся крысят | 54 | 55 |
| Мертворождения, % | 0 | 0 |
| Масса тела крысят, г:
новорожденные |
5,120,06 | 5,220,08 |
| на 3-и сутки | 7,000,05 | 7,10,07* |
| 5-е сутки | 9,270,07 | 9,340,08 |
| 14-е сутки | 16,760,1 | 16,970,13 |
| 20-е сутки | 22,630,12 | 22,930,07 |
| 28-е сутки | 30,90,44 | 31,460,31 |
| Срок отлипания ушей, дни | 6,430,32 | 6,140,28 |
| 1 | 2 | 3 |
| Срок опушения, дни | 8,570,32 | 8,140,28 |
| Срок прозрения, дни | 15,570,22 | 15,140,15 |
| Срок прорезывания резцов, дни | 9,290,2 | 9,140,15 |
| Постнатальная смертность к 21 дню, % | 1,100,82 | 1,440,75 |
Примечание: * — р0,05.
Таким образом, в результате проведенных исследований установлено, что препарат Линарол Ф-1, при внутрижелудочном введении, в дозе 1/10 от максимально (400 мг/кг массы тела), в течение всей беременности белым крысам, не обладает эмбриотоксическим и тератогенным действиями.
1.2.12.6 Изучение фармакокинетики Линарола Ф-1
Опыты были проведены на 27 крысах-самцах линии Вистар с массой 180-220 грамм. Животных содержали в условиях лабораторного вивария, на стандартной диете со свободным доступом к воде и пище.
Для изучения фармакокинетики [3Н- G]-Линарола Ф-1 в плазме крови экспериментальных животных и процесса распределения его по органам и тканям использовали метод количественного определения с использованием радиоизотопной метки, для чего предварительно осуществляли химический синтез по вводу трития в структуру препарата. Радиоактивный препарат обладал следующими характеристиками: а) молярная радиоактивность 1200 Ки/моль; б) объемная радиоактивность 500 uКи/мл; в) радиохимическая чистота более 94%.
[3Н- G]-Линарол Ф-1 вводили крысам однократно внутрибрюшинно в дозе 20 мг/кг. Содержание меченых продуктов определяли в плазме крови и лёгких через 1/12; 1/6; 1/4; 1/2; 1.0; 8.0; 18,0; 24 и 96 часов после введения препарата. Крыс умерщвляли методом декапитации. На каждую дискретную точку было взято по 3 животных.
Кровь центрифугировали при 3000 об/мин в течение 10 минут с последующим выделением плазмы. Образцы ткани лёгких крыс предварительно взвешивали на электронных весах, после чего проводили их гомогенизацию в дистиллированной воде с помощью гомогенизатора Поттера. В пробирки, содержащие по 0,3 мл плазмы крови или гомогенаты, разбавленные в 6 раз раствором хлористого натрия (0,9%), добавляли по 1,5 мл 96% муравьиной кислоты. Далее содержимое пробирок нагревали на кипящей водяной бане до полного гидролиза в течение 1 часа.
Измерение радиоактивности проводили с помощью жидкостно- сцинтилляционного счетчика TriCarb TR290. Подготовленные биологические образцы в объеме 300 мкл суспензий вносили в сцинтилляционные флаконы, содержащие 20 мл сцинтилляционного коктейля «OptiPhase ‘HiSafe’3», выдерживали 2 часа в темноте, после чего помещали в счетчик. Определение уровня радиоактивности (число распадов в минуту, DPM) и эффективности счёта проводили с помощью программы MULTICALC. Эффективность счета в данных условиях составила 33-38%.
Количественное определение Линарола Ф-1 в биопробах проводили методом абсолютной калибровки. Калибровочная кривая была построена при измерении радиоактивности известного количества меченого [3Н- G]-Линарола Ф-1. Построенный калибровочный график описывается линейным уравнением вида: у = Ах+В, где А =3,18*10 -4 В = 4,49*10 -3; коэффициент корреляции г = 0,9999. Минимально определяемая концентрация [3H-G]-Линарола Ф-1 0,02 мкг/мл.
Расчет количественного содержания [3Н- G]-Линарол Ф-1 а в биопробах проводили по формуле: С = ДРМ × Срсо / ДРМрсо × Vnp, где:
ДРМ- число распадов [3Н- G]-Линарола Ф-1 в минуту;
ДРМрсо — число распадов стандартного образца [3H-G]- Линарола Ф-1;
Срсо — концентрация раствора стандартного образца [3H-G]- Линарола Ф-1, мкг/мл и мкг/г;
Vnp — объем биологического материала, взятого на анализ, мл.
Полученные цифровые данные подвергали математической статистической обработке. Фармакокинетические параметры [3H-G]-Линарола Ф-1 в биофазе рассчитывали с использованием программ «Comstat» и “M-ind”. Расчет коэффициента распределения [3Н- G]-Линарола Ф-1 в органах и тканях крыс проводили по следующей формуле: АUСорган/АUС плазма крови.
Фармакокинетические параметры, используемые для интерпретации экспериментальных данных:
- AUC0-t (мкг/мл×ч) — площадь под фармакокинетической кривой (площадь под кривой концентрация лекарственного вещества — время) после введения крысам. AUC0-t рассчитывается от момента введения до бесконечности времени;
- Тmах (ч) — время достижения максимальной концентрации препарата в плазме крови после перорального введения;
- Сmах (мкг/мл) — максимальная концентрация лекарственного вещества (ЛВ) в плазме крови после перорального введения;
- Cmax/AUC (ч-1)- параметр, характеризующий скорость всасывания препарата в системный кровоток;
- MRT (ч) — среднее время пребывания ЛВ в организме;
- t1/2el (ч) — период, за который выводится половина введенной и всосавшейся дозы ЛВ;
- fT — тканевая доступность, рассчитывается по формуле: fT = AUCT 0-t / AUCP 0-t, где AUCT 0-t — AUC в ткани, AUCP 0-t— AUC в плазме крови.
Полученные экспериментальные данные были подвергнуты математической статистической обработке с помощью программы «Excel v.7.0». В таблицах представлены средние арифметические значения величин (M) и стандартная ошибка среднего арифметического (m).
Меченный тритием Линарол Ф-1 был получен с использованием реакции высокотемпературного твердофазного каталитического изотопного обмена (ВТКИО). Хроматографическая очистка была выполнена на колонке Kromasil Cl8 150×8 мм в градиенте метанола в присутствии 0,1% гептафтормасляной кислоты.
Результаты измерения концентраций меченой субстанции в плазме крови крыс в различные промежутки времени представлены в таблице 33.
Таблица 33 — Концентрации меченой субстанции в плазме крови белых крыс (мкг/мл плазмы)
| Опытные
животные |
Сроки исследования | ||||||||
| 5 мин. | 10 мин. | 15 мин. | 30 мин. | 60 мин. | 8 ч. | 18 ч. | 1 сут. | 4 сут. | |
| №1 | 0,89 | 14,39 | 22,46 | 16,50 | 16,84 | 13,45 | 9,256 | 9,83 | 6,44 |
| №2 | 0,93 | 15,74 | 22,25 | 20,56 | 14,80 | 12,31 | 10,66 | 9,08 | 6,38 |
| №3 | 0,99 | 17,32 | 19,78 | 18,25 | 13,67 | 15,48 | 11,28 | 11,35 | 5,85 |
| M | 0,94 | 15,82 | 21,5 | 18,44 | 15,11 | 13,76 | 10,40 | 10,09 | 6,23 |
| m | 0,03 | 0,85 | 0,86 | 1,18 | 0,93 | 0,92 | 0,6 | 0,67 | 0,19 |
Результаты измерения концентраций меченой субстанции в ткани лёгких крыс в различные промежутки времени представлены в таблице 34.
Таблица 34 — Концентрации меченой субстанции в ткани лёгких белых крыс (мкг/мл ткани)
| Опытные животные | Сроки исследования | ||||||||
| 5 мин. | 10 мин. | 15 мин. | 30 мин. | 60 мин. | 8 ч. | 18 ч. | 1 сут. | 4 сут. | |
| 1 | 0,69 | 16,53 | 19,91 | 17,23 | 14,61 | 11,27 | 9,038 | 8,47 | 5,59 |
| 2 | 0,70 | 17,98 | 19,16 | 17,94 | 11,11 | 10,46 | 10,46 | 7,66 | 5,33 |
| 3 | 0,76 | 19,98 | 17,28 | 18,03 | 11,74 | 12,76 | 11,34 | 9,41 | 4,68 |
| M | 0,72 | 18,17 | 18,79 | 17,6 | 12,49 | 11,5 | 10,27 | 8,52 | 5,20 |
| m | 0,02 | 1,00 | 0,78 | 0,25 | 1,08 | 0,67 | 0,67 | 0,50 | 0,27 |
В ткани легких концентрацция меченой субстанции нарастает так же быстро, как и в крови, выходя на максимальное плато (18 мкг/г ткани) на 10-15 минуте после введения вещества. К концу 4-х суток уровень меченой субстанции снижался до значения 5 мкг/г ткани.
Рассчитанные показатели фармакокинетики [3Н-G]-Линарола Ф-1 отражены в таблице 35.
Таблица 35 — Показатели фармакокинетики [3Н-G]-Линарола Ф-1
| Объект | t1/2abs (час) | t1/2e11 (час) | t1/2e12 (час) | MRT (час) | Vd1 (л/кг) | Vd2 (л/кг) | Tmax (час) | Cmax (мкг/мл(г) | AUC0→t (мкг/мл(г)×час) | fT (%) |
| Плазма | 0,17 | 0,31 | 87,36 | 125,6 | 0,36 | 1,16 | 0,25 | 21,5 | 21,50 | — |
| Легкие | — | 0,28 | 110,63 | 158,8 | — | — | 0,25 | 18,8 | 18,79 | 100 |
Из результатов, отраженных в таблице 35, видно, что препарат быстро всасывается из брюшной полости в кровь со скоростью абсорбции 0,17 часов (t1/2abs) и достигает максимальной концентрации (Tmax) в плазме крови и легких через 0,25 часов. Значения максимальной концентрации вещества (Cmax) составляли: в плазме крови — 21,50 мкг/мл, в легких — 18,8 мкг/г. В дальнейшем кинетическая кривая для [3Н-G]-Линарола Ф-1, как в плазме крови, так и в легких описывается 2-х камерной моделью, что видно из рисунка 6 (а и б).
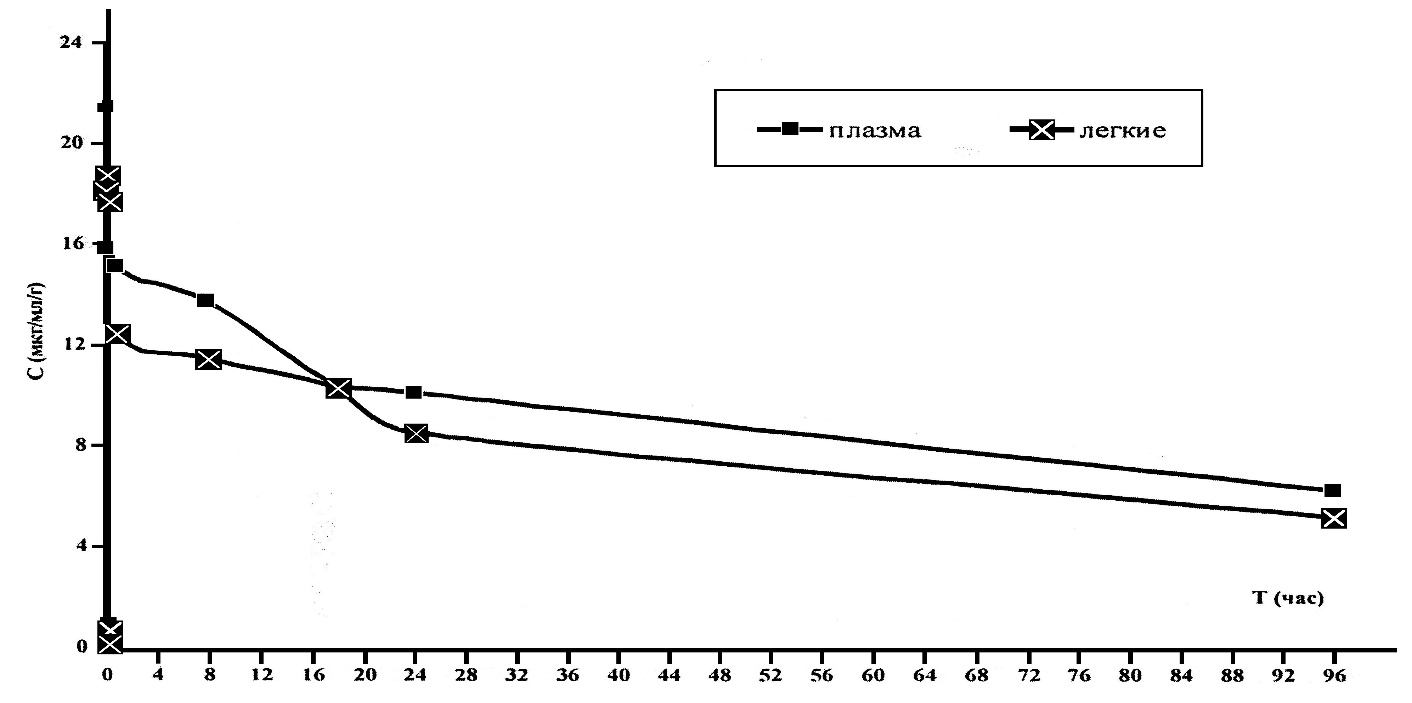
3а
3б

Рисунок 6 а и б — Кинетические кривые для [3Н- G]-Линарола Ф-1 в плазме крови и легких крыс после его внутрибрюшинного введения в дозе 20 мг/кг (а — натуральная шкала, б — полулогарифмическая шкала)
Так, полупериод элиминации вещества в плазме крови во 2-ой фазе (t1/2e12) в 281 раз выше по сравнению с 1 фазой элиминации (t1/2e11), а для легких — в 395 раз. Объем распределения [3Н- G]-Линарола Ф-1 (Vd2) во 2-ой камере (в периферических органах и тканях) также в 3,2 раза выше по сравнению с 1- ой центральной камерой (0,36), о чем свидетельствует значение тканевого проникновения Линарола Ф-1 в легкие (fТ -100%).
Таким образом, при изучении фармакокинетики [3Н- G]-Линарола Ф-1 установлено, что уровни концентраций субстанции в плазме крови белых крыс при однократном, внутрибрюшинном введении его в дозе 20 мг/кг массы тела, быстро возрастают к 15 минуте после введения до 22 мкг/мл, после чего плавно уменьшаются до 6 мкг/мл к концу 4-х суток. В легких всасывание меченой субстанции происходит так же быстро, как и в крови, выходя на максимальное плато (18 мкг/г ткани) на 10-30 минуте после введения вещества. К концу 4-х суток уровень меченой субстанции снижается до значения 5 мкг/г ткани.
В результате чего, Линарол Ф-1 по данным предварительных фармакокинетических исследований можно отнести к долгоживущим химическим веществам с хорошей способностью проникновения в легочную ткань, что имеет важное фармакологическое значение при профилактики и терапии легочных форм туберкулеза.
1.2.13 Изучение противотуберкулезной активности Тубофена in vivo
1.2.13.1 Изучение профилактической активности Тубофена на экспериментальной модели туберкулеза морских свинок
Для проведения эксперимента использовали 56 морских свинок, весом 350-400 грамм, которых разделили на 8 групп. Из них 6 групп опытные, по 8 животных в каждой, и 2 контрольные, по 4 животных в каждой.
После адаптации морских свинок к условиям вивария, провели исследование их на туберкулез путем внутрикожного введения 0,1 мл ППД туберкулина для млекопитающих (стандартный раствор). Реакцию учитывали через 24 часа после введения аллергена. Морские свинки не реагировали на туберкулин.
Затем животных 6-ти опытных и одной контрольной групп заражали 20 дневной оттитрованной культурой возбудителя туберкулеза бычьего вида (штамм 14). Бактериальную массу, из расчета 0,15 мг на животное вводили под кожу правой паховой области в 0,5 мл физиологического раствора.
Химиопрофилактику туберкулеза морских свинок начали производить на следующий день после заражения. Животным шести контрольных групп, перорально, с помощью атравматического зонда с оливой, надетого на шприц, ежедневно вводили растворы Тубофена и изониазида. Причем, морские свинки первой подопытной группы получали Тубофен в дозе 20 мг/кг массы, второй – 10 мг/кг массы, третьей – 5 мг/кг массы, четвертой – 2,5 мг/кг массы, пятой – 1 мг/кг массы и животные шестой группы получали изониазид в дозе – 10 мг/кг массы. Животные 7 и 8 контрольных групп получали ежедневно, перорально растворитель (дистиллированную воду).
Опыт продолжался 60 дней. За животными вели клинические наблюдения, проводили гематологические исследования, а также аллергические исследования на туберкулез.
Схема испытания Тубофена и изониазида отражена в таблице 36.
Таблица 36 — Схема испытания профилактической активности Тубофена на экспериментальной модели туберкулеза морских свинок
С целью уточнения динамики развития туберкулезных изменений в организме зараженных животных на 30 день после заражения и по окончании срока химиопрофилактики (60 дней), провели контрольный убой морских свинок. Результаты исследования профилактических свойств Тубофена и изониазида при экспериментальном туберкулезе морских свинок, отражены в таблице 37.
Из полученных данных видно, что за время проведения опыта все животные 1, 2, 3, 4 и 6 опытных групп выжили, в то время как 3 морские свинки из 5-ой опытной, получавшие Тубофен в дозе 1 мг/кг массы, и все животные 7-ой контрольной группы (зараженные, не профилактируемые туберкулостатиками) погибли.
В результате проведенных аллергических исследований морских свинок установлено, что животные 1, 2, 3 и 6 опытных групп не реагировали на введение туберкулина ни через 30 дней, ни через 60 дней после заражения их микобактериями туберкулеза бычьего вида. Отрицательный результат аллергических исследований также отмечался у животных 8 группы (интактные).
Таблица 37 — Результаты испытания химиопрофилактической активности Тубофена при экспериментальном туберкулезе морских свинок
| Группы
животных |
Препарат | Суточная доза, мг/кг | Исход | Результат аллергического исследования | Средний индекс поражения органов и высеваемости микобактерий | Средний общий индекс поражения и высеваемости микобактерий | ||||||||
| погибло | выжило | до заражения | После заражения через | Место заражения | Лимф. узлы | Регионарн.
лимф. узел |
Легкие | Печень | Селезенка | |||||
| 30 дн | 60 дн | |||||||||||||
| I | Тубофен | 20 | — | 8 | — | — | — | 0 | 0 | 01/02 | 0/0 | 0/0 | 0/0 | 0/0 |
| II | Тубофен | 10 | — | 8 | — | — | — | 0 | 0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 |
| III | Тубофен | 5 | — | 8 | — | — | — | 0 | 0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 |
| IV | Тубофен | 2,5 | — | 8 | — | + | + | 0,83 | 1 | 1,3/2,16 | 1,16/1,83 | 1,5/1,5 | 0,66/1,16 | 6,45/6,65 |
| V | Тубофен | 1 | 3 | 5 | — | + | + | 1,3 | 2,8 | 3,3/3,16 | 3/2,8 | 3,5/3,5 | 3,16/3 | 17,06/12,46 |
| VI | Изониазид | 10 | — | 8 | — | — | — | 0 | 0 | 0,37/0 | 0/0 | 0/0 | 0/0 | 0,37/0 |
| VII | Контроль (зараженные) | — | 4 | — | — | + | + | 1,3 | 3,3 | 4,0/3,6 | 3,6/3 | 4/3,6 | 4/2,6 | 20,2/12,8 |
| VIII | Контроль, (интактные) | — | — | 4 | — | — | — | 0 | 0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 |
Примечание: 1 – индекс поражения органов;
2 – индекс высеваемости микобактерий.
У морских свинок 4 и 5 групп, получавших Тубофен в дозах 2, 5 и 1 мг/кг массы, а также у животных 7-ой контрольной группы, через 30 и 60 дней после заражения наблюдалось резко выраженная аллергическая реакция в местах введения ППД туберкулина для млекопитающих (стандартный раствор), которая проявлялась в виде гиперемии кожи в местах введения аллергена и образования уплотненной припухлости, диаметром более 5 мм.
При контрольном убое двух морских свинок из 1, 2, 3 и 6 контрольных групп через 30 дней после заражения во внутренних органах и тканях патологических изменений характерных для туберкулеза не обнаружено. При лабораторном исследовании патологического материала от животных данных групп выделить исходную культуру микобактерий туберкулеза не удалось.
У морских свинок 4-ой опытной группы отмечались единичные туберкулезные очажки в печени и легких, а также увеличение регионарных лимфатических узлов до размеров крупной горошины в местах заражения животных микобактериями туберкулеза. У животных 5-ой подопытной и 7-ой контрольных групп через 30 дней после заражения отмечали резкое увеличение объема печени и селезенки, содержащие в себе множественные туберкулезные очажки. В легких также отмечались единичные бугорковые высыпания. Регионарные лимфатические узлы были увеличены и достигали размеров фасоли. При лабораторном исследовании патологического материала от животных 4 и 5 подопытных групп, а также от 7-ой контрольной группы, получен положительный результат, от всех животных была выделена исходная культура микобактерий туберкулеза.
Всех животных контрольных и опытных групп, прошедших курс химиопрофилактики (60 дней), подвергали убою. На основании патологоанатомических и бактериологических исследований установили средний общий индекс поражения органов и высеваемости микобактерий туберкулеза. У первых трех подопытных групп, получавших Тубофен в дозах 5, 10 и 20 мг/кг массы, а также у 8-ой контрольной интактной группы, этот индекс равнялся 0/0. При исследовании патологического материала от 4-ой подопытной группы животных, получавших Тубофен в дозе 2,5 мг/кг массы, средний общий индекс поражения органов и высеваемости микобактерий составил 6,45/6,65, у 5-ой подопытной группы животных, получавших Тубофен в дозе 1 мг/кг массы, этот показатель оказался выше (17,06/12,46) и практически достигал таковой у 7-ой контрольной группы (20,2/12,8).
При исследовании патологического материала от 6-ой подопытной группы морских свинок, получавших изониазид в дозе 10 мг/кг массы, у 2 из 8 животных отмечалось значительное увеличение регионарных правых паховых лимфатических узлов. Однако, при посеве последних на питательную среду Левенштейна-Йенсена роста микобактерий туберкулеза не отмечалось, и средний общий индекс поражения органов и высеваемость микобактерий у морских свинок данной группы составил 0,37/0.
Таким образом, проведенные исследования свидетельствуют, что Тубофен проявил достаточно высокий профилактический эффект и обладает выраженными туберкулостатическими свойствами в дозах 5, 10 и 20 мг/кг массы животного. Вместе с тем, изониазид в дозе 10 мг/кг массы оказался менее активным и в 2 из 8 случаев экспериментального туберкулеза у морских свинок не достаточно полно проявил профилактический эффект.
1.2.13.2 Влияние Тубофена на гематологические показатели морских свинок при химиопрофилактике туберкулеза
Для проведения опыта использовали 56 морских свинок, которые находились в эксперименте по изучению активности Тубофена при экспериментальной модели туберкулеза. Кровь брали перед заражением животных микобактериями, а также через 30 суток и после окончания курса химиопрофилактики (60 суток).
Результаты исследования влияния Тубофена на гематологические показатели морских свинок при химиопрофилактике туберкулеза представлены в таблице 38.
Таблица 38 — Гематологические показатели морских свинок при химиопрофилактике туберкулеза различными дозами Тубофена
| Группы
животных |
До начала курса химиопрофилактики | Через 30 дней | Через 60 дней | ||||||
| Эритроциты
(×1012/л) |
Лейкоциты
(×109/л) |
Гемоглобин
(г/л) |
Эритроциты
(×1012/л) |
Лейкоциты
(×109/л) |
Гемоглобин
(г/л) |
Эритроциты
(×1012/л) |
Лейкоциты
(×109/л) |
Гемоглобин
(г/л) |
|
| I | 5,24±0,3* | 8,4±0,97 | 12,5±0,5 | 5,93±0,34* | 8,96±0,48** | 12,52±0,54 | 6,35±0,21 | 9,02±0,52 | 13,66±0,32 |
| II | 6,02±0,44 | 9 ±0,93* | 13,56±0,48 | 5,77±0,36* | 8,44±0,41** | 12,44±0,4 | 5,93±0,22 | 8,7±1,1 | 12,74±0,48 |
| III | 5,74±0,3* | 7,2±0,47 | 13,08±0,49 | 6,06±0,38* | 8,12±0,32** | 13,24±0,59 | 6,62±0,2 | 7,22±0,43 | 13,54±0,59 |
| IV | 6,68±0,29 | 7,64±0,49 | 12,46±0,7 | 7,36±0,51* | 12,64±0,69** | 11,46±0,52 | 8,16±0,8 | 12,14±0,47 | 13,2±0,46 |
| V | 6,02±0,43 | 8,14±0,47 | 13,44±0,49 | 4,99±0,47* | 16,16±0,33* | 9,08±0,36 | — | — | — |
| VI | 5,87±0,31 | 6,22±0,35 | 12,8±0,43 | 5,32±0,33* | 9,04±0,47** | 12,4±0,45 | 6,55±0,32 | 9,2±0,87 | 14±0,48 |
| VII | 6,62± 0,25 | 8,65±0,35 | 14,3±0,4 | 3,84±0,21 | 17,83±0,48 | 8,4±0,31 | — | — | — |
| VIII | 5,37±0,33 | 7,27±0,57 | 13,67±0,37 | 6,49±0,35 | 7,05±0,54 | 13,75±0,48 | 6,02±0,46 | 7.,7±0,59 | 13,37±0,33 |
Примечание: * — р < 0,01; ** — р < 0,05.
Из данных таблицы 38 видно, что у животных первых трех опытных групп, получавших Тубофен в дозах 20, 10 и 5 мг/кг массы, а также у животных шестой опытной группы, получавших изониазид в профилактической дозе – 10 мг/кг массы, каких-либо отклонений гематологических показателей от физиологической нормы в течение всего курса химиопрофилактики не наблюдалось.
У животных четвертой опытной группы, получавших Тубофен в дозе 2,5 мг/кг массы, через 30 дней и после окончания курса химиопрофилактики наблюдали незначительный лейкоцитоз – 12,640,69 – 12,140,47109/л и эритроцитоз – 7,360,51 – 8,160,81012/л. Содержание гемоглобина находилось в пределах физиологической нормы – 11,460,52 – 13,20,46 г/л.
У животных пятой опытной группы, получавших Тубофен в дозе 1 мг/кг, через 30 дней после начала курса химиопрофилактики количество лейкоцитов резко увеличилось с 8,140,47 до16,160,33109/л. Количество эритроцитов уменьшилось с 6,020,43 до 4,990,471012/л, количество гемоглобина с 13,440,49 до 9,080,36 г/л. Определить среднестатистические данные гематологических показателей у данной группы морских свинок после окончания курса химиопрофилактики не удалось, так как количество выживших животных составляло 3 головы.
Морские свинки седьмой контрольной группы, имели достаточно высокий уровень отклонения гематологических показателей от физиологической нормы, свидетельствующих о развитии в организме патологического процесса, вызванного микобактериями туберкулеза. Количество эритроцитов понизилось почти в 2 раза, с 6,62±0,25 до 3,84±0,21×1012/л (эритропения), количество лейкоцитов возросло с 8,65±0,59 до 17,83±0,48×109/л (лейкоцитоз), а количество гемоглобина резко упало с 14,3±0,4 до 8,4±0,31 г/л. На 42 – 54 день после заражения все морские свинки седьмой контрольной группы погибли, и провести исследование гематологических показателей через 60 дней не удалось. У морских свинок восьмой контрольной (интактные) группы за весь период наблюдения (60 дней) каких-либо отклонений гематологических показателей от физиологической нормы не наблюдалось.
1.2.13.3 Лекарственная устойчивость микобактерий выделенных от морских свинок профилактируемых Тубофеном
Лекарственную устойчивость микобактерий к Тубофену испытывали на экспериментальной модели туберкулеза морских свинок, описанной выше. Установлено, что у животных получавших ежедневно Тубофен в дозе 5, 10 и 20 мг/кг массы и изониазид в дозе 10 мг/кг массы, в течение 2-х месяцев, ни в одном случае исходная культура возбудителя туберкулеза не выделена. У морских свинок, которым Тубофен вводили ежедневно, в дозах 2,5 и 1 мг/кг массы, количество выделенных микобактерий достигало от 20 до 40% по каждой группе. Следует отметить, что рост микобактерий в посевах из патологического материала, взятого от профилактируемых животных был скудным.
Все выделенные культуры были проверены на лекарственную чувствительность к Тубофену и изониазиду, которую определяли путем выращивания микобактерий на питательной среде Левенштейна-Йенсена (без добавления картофельного крахмала). Тубофен и изониазид в концентрациях 0,1; 0,5; 1; 5 и 25 мкг/мл среды добавляли до свертывания.
Для контроля, культуры выращивали на той же среде без добавления препаратов. Взвесь микобактерий готовили по бактериальному стандарту БЦЖ, содержащему 5 мг бацилл в 1 мл. Полученную взвесь разводили 1:10 в физиологическом растворе и в дозе 0,2 мл засевали в каждую пробирку. Результаты учитывали по мере появления роста микобактерий в контрольных пробирках без препарата. Результаты исследования лекарственной чувствительности микобактерий к Тубофену отражены в таблице 39.
Из данных таблицы видно, что культура M. bovis штамма 14, использованная при заражении животных, и культуры, выделенные от морских свинок после проведенного курса химиопрофилактики при критической концентрации препаратов (0,1 мкг/мл), роста не дают (менее 20 колоний). При концентрации препаратов в дозе 0,5, 1, 5 и 25 мкг/мл рост микобактерий отсутствовал. В контрольных пробирках отмечался бурный рост микобактерий туберкулеза бычьего вида – более 50 колоний на каждый контрольный косяк.
Таблица 39 — Результаты исследования лекарственной чувствительности микобактерий туберкулеза к Тубофену
| Вариант | Минимальная концентрация препаратов, мкг/мл | Контроль | ||||
| 0,1 | 0,5 | 1 | 5 | 25 | ||
| Тубофен, 1 мг/кг | 0-6* | — | — | — | — | ++++ |
| Тубофен, 5 мг/кг | 0-5 | — | — | — | — | ++++ |
| Тубофен, 10 мг/кг | 0-4 | — | — | — | — | ++++ |
| Изониазид, 10 мг/кг | 0-5 | — | — | — | — | ++++ |
| Контроль (зараженные) | 0-6 | — | — | — | — | ++++ |
Примечание: — ++++ — пышный рост; *- количество колоний; — — отсутствие колоний.
Таким образом, чувствительность выделенных микобактерий к Тубофену и изониазиду, не зависимо от применявшейся дозы препаратов не изменялась.
1.2.14 Изучение противотуберкулезной активности Линарола in vivo
1.2.14.1 Изучение профилактической активности Линарола на экспериментальной модели туберкулеза морских свинок
Для изучения активности и для установления профилактической дозы Линарола на заражённых лабораторных животных, воспроизводили экспериментальный туберкулёз морских свинок, по методике заимствованной у Першина Г.Н. (1971).
Для проведения эксперимента использовали 28 морских свинок, весом 350-400 грамм, которых разделили на 5 групп. Из них 4 группы опытные, по 6 животных в каждой, и 1 контрольная, состоящая из 4 животных.
После адаптации морских свинок к условиям вивария, провели исследование их на туберкулез путем внутрикожного введения 0,1 мл ППД туберкулина для млекопитающих (стандартный раствор). Реакцию учитывали через 24 часа после введения аллергена. Морские свинки на туберкулин не реагировали.
Животных 4 опытных и одной контрольной групп заражали 20 дневной оттитрованной культурой возбудителя туберкулеза бычьего вида (штамм 14). Бактериальную массу, из расчета 0,1 мг на животное, вводили под кожу правой паховой области в 0,5 мл физиологического раствора.
Химиопрофилактику туберкулеза морских свинок начали проводить на следующий день после заражения. Животным четырех опытных групп перорально, с помощью атравматического зонда с оливой, надетого на шприц, ежедневно вводили растворы Линарола. Причем, морские свинки первой опытной группы получали Линарол в дозе 10 мг/кг массы, второй – 5 мг/кг массы, третьей – 2,5 мг/кг массы, четвертой – 1 мг/кг массы. Животные 5 контрольной группы ежедневно перорально получали растворитель (дистиллированную воду).
Опыт продолжался 60 суток. За животными вели клинические наблюдения и проводили аллергические исследования на туберкулез на 30 и 60 сутки после заражения. По окончании срока химиопрофилактики провели контрольный убой морских свинок. Патологический материал, отобранный у животных, использовали для проведения бактериологических и бактериоскопических исследований, с целью выделения исходной культуры возбудителя туберкулеза.
Результаты исследования профилактических свойств Линарола при экспериментальном туберкулезе морских свинок отражены в таблице 40.
Из цифровых данных таблицы 40 видно, что за время проведения опыта все животные 1, 2 и 3 опытных групп выжили, в то время как 1 морская свинка из 4-ой опытной группы, получавшая Линарол в дозе 1 мг/кг массы и 1 морская свинка из 5-ой контрольной группы (зараженные, не профилактируемые туберкулостатиками) погибли.
В результате проведенных аллергических исследований морских свинок установлено, что животные 1 и 2 опытных групп не реагировали на введение туберкулина ни через 30, ни через 60 суток после заражения их микобактериями туберкулеза.
Таблица 40 — Результаты испытания химиопрофилактической активности Линарола при экспериментальном туберкулезе морских свинок
| Группы
животных |
Препарат | Суточная доза, мг/кг | Исход | Результат аллергического исследования | Средний индекс поражения органов и высеваемости микобактерий | Средний общий индекс поражения и высеваемости микобактерий | ||||||||
| погибло | выжило | До заражения | После заражения через | Место заражения | Лимф. узлы | Регионарный
лимф. узел |
Легкие | Печень | Селезенка | |||||
| 30 дн. | 60 дн. | |||||||||||||
| I | Линарол | 10 | — | 6 | — | — | — | 0 | 0 | 01/02 | 0/0 | 0/0 | 0/0 | 0/0 |
| II | Линарол | 5 | — | 6 | — | — | — | 0 | 0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 |
| III | Линарол | 2,5 | — | 6 | — | + | + | 0 | 0 | 1,66/1,5 | 0/0 | 0/0 | 0/0 | 1,66/1,5 |
| IV | Линарол | 1 | 1 | 5 | — | + | + | 1,33 | 1 | 3/2,33 | 1,16/1,16 | 1,5/1,33 | 1,33/1,33 | 9,32/6,15 |
| V | Контроль (зараженные) | — | 1 | 3 | — | + | + | 2 | 1,75 | 4/4 | 1,75/2,5 | 3/3,75 | 1,75/2,25 | 14,25/12,5 |
Примечание: 1 – индекс поражения органов;
2 – индекс высеваемости микобактерий.
У морских свинок 3 и 4 групп, получавших Линарол в дозах 2,5 и 1 мг/кг массы, а также у животных 5-ой контрольной группы, через 30 и 60 дней после заражения наблюдалось резко выраженная аллергическая реакция в местах введения ППД туберкулина для млекопитающих (стандартный раствор), которая проявлялась в виде гиперемии кожи в местах введения аллергена и образованием уплотненной припухлости.
На основании патологоанатомических и бактериологических исследований установили средний общий индекс поражения органов и высеваемости микобактерий туберкулеза. У первых двух подопытных групп, получавших Линарол в дозах 5 и 10 мг/кг массы, этот индекс равнялся 0/0. При исследовании патологического материала от 3 подопытной группы животных, получавших препарат в дозе 2,5 мг/кг массы, средний общий индекс поражения органов и высеваемости микобактерий составил 1,66/1,5, у 4-ой подопытной группы животных, получавших Линарол в дозе 1 мг/кг массы, этот показатель оказался выше и составил — 9,32/6,15. У 5-ой контрольной группы животных общий индекс поражения органов и высеваемости микобактерий туберкулеза составил 14,25/12,5 соответственно.
Таким образом, проведенные исследования свидетельствуют, что Линарол проявил достаточно высокий профилактический эффект и обладает выраженными туберкулостатическими свойствами в дозах 5 и 10 мг/кг массы животного.
1.2.14.2 Изучение терапевтической противотуберкулезной активности Линарола на модели острого экссудативно-некротического туберкулеза мышей
Изучение терапевтической противотуберкулезной активности Линарола в системе in vivo проводили на 16 самцах инбредных мышей линии I/St. Мышей содержали в условиях, согластно ветеринарно-санитарным требованиям. Вес мышей – 22 -23 грамма. Всех животных заражали внутривенным введением M. tuberculosis штамма H37Rv в латеральную хвостовую вену в летальной дозе 5 × 106 КОЕ/мышь. Все экспериментальные животные были разделены на следующие группы:
- Зараженные мыши без лечения (контроль) – 5 шт.;
- Зараженные мыши, получающие внутрижелудочно препарат изониазид, в дозе 50 мг/кг массы тела – 5 шт.;
- Зараженные мыши, получающие внутрижелудочно препарат Линарол, в дозе 50 мг/кг массы тела – 6 шт.
Испытуемые препараты вводили через неделю после заражения, ежедневно, внутрижелудочно, с помощью металлического зонда с оливой, в течение 5 суток, предварительно растворив их в дистиллированной воде. Объем вводимых препаратов составлял 0,5 мл/мышь.
Через 14 суток после инфицирования животных опытных и контрольной групп выводили из эксперимента методом цервикальной дислокации для определения количества колониеобразующих единиц (КОЕ) M. tuberculosis в легких и селезенке мышей.
Для определения количества микобактерий (КОЕ МБТ) в органах зараженных мышей легкое и селезенку каждой мыши гомогенизировали в 2 мл физиологического раствора, готовили серию 10 кратных разведений исходной суспензии в физиологическом растворе и 50 мкл каждого разведения помещали на чашку Петри, покрытую агаром Дюбо. Чашки Петри с нанесенными суспензиями клеток легкого и селезенки инкубировали в термостате, в течение 21 суток, при температуре 370С, после чего подсчитывали число колоний на чашке и определяли количество КОЕ микобактерий в исследуемых органах мышей.
Основными показателями эффективности специфической антимикобактериальной терапии экспериментальных животных являются – средний срок жизни животных после инфицирования, количество КОЕ МБТ в органах инфицированных животных, тропных к туберкулезу и степень патологических изменений внутренних органов.
На момент убоя все экспериментальные мыши были живы и выглядели клинически здоровыми. Количество КОЕ МБТ, высеянных из органов животных, представлено в таблице 41.
Таблица 41 — Количество КОЕ МБТ в легком и селезенке мышей через 14 суток после инфицирования в дозе 5 × 106 КОЕ/мышь
| Группы животных | КОЕ МБТ (легкое) | КОЕ МБТ (селезенка) |
| Линарол (50 мг/кг) | (2,3 ± 0,46)×107 | (3,73 ± 0,23)×107 |
| Изониазид (50 мг/кг) | (2,7 ± 1,5)×105 | (1,075 ± 0,25)×107 |
| Контрольная | (6,99 ± 0,9)×107 | (3,99 ± 0,29)×108 |
Примечание: — Р 0,06.
Представленные в таблице 41 данные показывают, что по сравнению с контрольной группой, количество КОЕ микобактерий туберкулеза в легком у мышей, получавших Линарол, уменьшилось примерно в 3,5 раза. В селезенке этой группы мышей, количество КОЕ микобактерий по сравнению с контрольной группой, сократилось в 10 раз. В группе мышей, получавших изониазид, КОЕ МБТ в легком сократилось более чем в 100 раз, а в селезенке более чем в 10 раз.
Таким образом, в результате проведенного исследования установлено, что препарат Линарол при внутрижелудочном введении в дозе 50 мг/кг массы тела, в течение 5 дней достоверно снижал количество КОЕ микобактерий туберкулеза в легких и селезенке экспериментальных мышей в сравнении с мышами контрольной группы. Изониазид, в аналогичной дозе и сроках введения, снижал количество КОЕ МБТ на 2 порядка больше в легких, чем Линарол. Однако, показатели КОЕ в селезенке в группах мышей, получавших изониазид и Линарол, были практически одинаковыми.
На основании полученных данных можно заключить, что препарат Линарол обладает противотуберкулезной активностью, в отношении M. tuberculosis штамма H37Rv, которая в исследуемой дозе при краткосрочном введении была в 100 раз ниже в легком экспериментальных животных, чем препарата стандарта изониазид в аналогичной дозе и сроках введения. В селезенке противотуберкулезная активность Линарола и препарата стандарта изониазид была практически одинаковой. Учитывая низкую токсичность препарата Линарол (максимально вводимая доза белым мышам и крысам – 4000 мг/кг массы тела, для сравнения ЛД50 изониазида – 213 мг/кг массы тела), оптимально было бы изучить противотуберкулезную активность Линарола в высоких дозах и при длительном сроке лечения.
1.2.15 Изучение противотуберкулезной активности Линарола Ф-1 in vivo
1.2.15.1 Изучение терапевтической противотуберкулезной активности Линарола Ф-1 при лечении экспериментального туберкулеза у морских свинок
Изучение терапевтического действия Линарола Ф-1 проводилось на морских свинках в течение двух месяцев по методике, заимствованной у Першина Г.Н. (1971). Зараженные животные были разделены на пять групп: две опытные (зараженные животные получали лечение Линаролом Ф-1 в дозах 5 и 10 мг/кг массы тела) и три контрольные (зараженные животные получавшие лечение изониазидом в дозе 10 мг/кг массы тела, зараженные животные не получавшие никакого лечения и интактные животные).
В каждой группе было по 7 морских свинок (три самки и четыре самца). Морских свинок двух опытных и двух контрольных групп заражали 0,01 мг культуры микобактерий туберкулеза бычьего вида лабораторного штамма (штамм 14). Взвесь культуры в физиологическом растворе в объеме 0,5 мл вводили подкожно в паховую область морской свинки. Лечение животных начиналось через две недели после их заражения и продолжалось 2 месяца, при ежедневном пероральном введении Линарола Ф-1 и изониазида, путем введения растворенных в дистиллированной воде препаратов по 1 мл перорально.
Важным показателем эффективности лечения является разница в весе морских свинок на начало и окончание опыта. Данные по изменению веса животных, подвергнутых химиотерапии Линаролом Ф-1, представлены в таблице 42.
Таблица 42 — Изменение веса морских свинок зараженных микобактерими туберкулеза при терапии Линаролом Ф-1
| Группы животных | Вес морских свинок, граммы | ||
| До начала опыта | Через 30 суток после лечения | Через 60 суток
после лечения |
|
| I опытная группа
(Линарол Ф-1 в дозе 10 мг/кг) |
308±11,5 | 362±11,8* | 409±13,9* |
| II опытная группа
(Линарол Ф-1 в дозе 5 мг/кг) |
328±13,6 | 408±14,26* | 416±20,68* |
| III контрольная группа
(изониазид в дозе 10 мг/кг) |
348±10,92 | 416±14,26* | 442±10,79* |
| IV контрольная группа (нелеченные) | 320±7,91 | 298±7,56 | — |
| V контрольная группа (интактные) | 318,4±8,08 | 373,2±7,29* | 436,3±6,45* |
Примечание: * — р ≤ 0,001.
Из таблицы 42 видно, что по окончании исследований масса тела у животных первой опытной группы, получавших Линарол Ф-1 в дозе 10 мг/кг, увеличилась в среднем на 24% и практически оказалась равной привесу в группе интактных животных (27%). У морских свинок второй опытной группы, получавших Линарол Ф-1 в дозе 5 мг/кг, масса тела увеличилась на 21%, а морских свинок третьей контрольной группы, получавших изониазид на 22%. Вес животных четвертой контрольной группы (не подвергавшихся курсу химиотерапии) установить не удалось, так как к окончанию эксперимента 5 из 7 свинок погибло.
По окончании лечения животных подвергали эвтаназии, после чего проводили макроскопическое исследование и определяли индекс поражения внутренних органов. Экстракты легкого, печени, селезенки исследовали на наличие микобактерий, путем высева на плотные питательные среды. Результаты исследования терапевтических свойств Линарола Ф-1 при экспериментальном туберкулезе морских свинок, отражены в таблице 43.
Таблица 43 — Результаты испытания терапевтической активности Линарола Ф-1 при экспериментальном туберкулезе морских свинок
| Группы
животных |
Препарат | Суточная доза, мг/кг | Исход | Средний индекс поражения органов и высеваемости микобактерий | Средний общий индекс поражения и высеваемости микобактерий на 1 животное каждой группы | ||||||
| погибло | выжило | Место заражения | Лимфатические узлы | Регионарный лимф. узел | Легкие | Печень | Селезенка | ||||
| I | Линарол Ф-1 | 10 | 0 | 7 | 0,3 | 0 | 01/02 | 0/0 | 0/0 | 0/0 | 0,3/0 |
| II | Линарол Ф-1 | 5 | 0 | 7 | 0,7 | 0 | 0,3/0,5 | 0/0 | 0,3/0,3 | 0,3/0,4 | 1,6/1,2 |
| III | Изониазид | 10 | 0 | 7 | 0,3 | 0 | 0/0 | 0/0 | 0/0 | 0/0 | 0,3/0 |
| IV | Контроль
(зараженные, нелеченные) |
— | 5 | 2 | 1,4 | 1 | 2,6/2,2 | 1,2/1 | 2,1/1,7 | 1,4/1,8 | 9,7/6,7 |
| V | Контроль
(интактные) |
— | 0 | 7 | 0 | 0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 |
Примечание: 1 – индекс поражения органов;
2 – индекс высеваемости микобактерий.
В четвертой контрольной группе (не леченые животные) в течение двух месяцев от генерализованного туберкулеза погибло 5 морских свинок. Средний общий индекс поражения и высеваемости микобактерий на одну морскую свинку составил 9,7/6,7.
У животных первой опытной (Линарол Ф-1 в дозе 10 мг/кг) и третьей контрольной (изониазид в дозе 10 мг/кг) групп макроскопических туберкулезных поражений в легких, печени, селезенке не было выявлено. Средний общий индекс поражения и высеваемости микобактерий на одну морскую свинку в этих группах составил 0,3/0.
На вскрытии у животных второй опытной группы, леченых Линаролом Ф-1 в дозе 5 мг/кг массы тела, макроскопически были выявлены единичные туберкулезные изменения в регионарных лимфатических узлах, печени и селезенке. Средний общий индекс поражения и высеваемости микобактерий на одну морскую свинку во второй опытной группе составил 1,6/1,2.
При сравнении индексов поражения внутренних органов морских свинок в различных группах, отличается высокое терапевтическое действие Линарола Ф-1 в дозе 10 мг/кг массы тела, т.к. индекс поражения внутренних органов равен индексу поражения при лечении животных изониазидом.
1.2.15.2 Влияние Линарола Ф-1 на гематологические показатели крови морских свинок при лечении экспериментального туберкулеза
У экспериментальных животных во время убоя брали кровь и из показателей гемограммы определяли гемоглобин, количество лейкоцитов и эритроцитов, а также лейкоцитарную формулу, используя общепринятые методы исследования (Меньшиков В.В., 1987). Результаты исследования сравнивали с показателями здоровых животных (таблица 44).
Таблица 44 — Гематологические показатели крови зараженных микобактериями туберкулеза морских свинок на 60 сутки после терапии Линаролом Ф-1
| Показатели | Контроль
(интактные) |
Изониазид (10 мг/кг) | Линарол Ф-1 (10 мг/кг) | Линарол Ф-1 (5 мг/кг) |
| Эритроциты, (×1012/л) | 4,61 0,02 | 4,5 0,05 | 4,47 0,34 | 4,29 0,14 |
| Гемоглобин (г/л) | 132 8,49 | 129 3,31 | 137 9,12 | 133 9,02 |
| СОЭ (мм/ч) | 13 7,454 | 12,66 0,81 | 7,42 0,84 | 5,30 0,91 |
| Лейкоциты (×109/л) | 4,12 0,5 | 3,85 0,56 | 5,44 0,71 | 7,05 0,51** |
| Базофилы (%) | 0,8 0,12 | 0,85 0,02 | 0,64 0,45 | 0,8 0,2 |
| Эозинофилы (%) | 2,2 0,39 | 2,42 0,68 | 2,21 0,49 | 2,8 0,58 |
| Палочкоядерные нейтрофилы (%) | 1,44 0,17 | 1,14 0,001 | 0,9 0,001 | 0,46 0,07* |
| Сегментоядерные нейтрофилы (%) | 15 1,94 | 18,42 3,41 | 20,64 5,89 | 32,75 3,437* |
| Лимфоциты (%) | 74,10 1,49 | 64,21 3,44 | 68,91 6,03 | 57 3,73** |
| Моноциты (%) | 6,46 1,28 | 6,28 0,67 | 6,68 1,03 | 5,82 0,74 |
Примечание: — Р 0,01, * — Р 0,001.
При лечении экспериментального туберкулеза у морских свинок Линаролом Ф-1, гематологические показатели крови не меняются, но сохраняется лейкоцитоз в группе животных, получавших препарат в дозе 5 мг/кг массы, тогда как в группе животных, леченных Линаролом Ф-1 в дозе 10 мг/кг массы тела, наблюдается выраженная тенденция к нормализации количества лейкоцитов.
В группе больных туберкулезом животных, получавших изониазид, наблюдается снижение числа сегментоядерных нейтрофилов и выраженный рост числа лимфоцитов, что говорит о возможной смене фаз воспаления и соответствует переходу экссудативной реакции в продуктивную фазу инкапсуляции, что в прогностическом отношении является благоприятным. Как видно из таблицы, Линарол Ф-1 в дозе 10 мг/кг массы тела не влияет на формулу крови и гематологические показатели крови близки к показателям у здоровых животных контрольной группы.
1.2.15.3 Влияние Линарола Ф-1 на биохимические показатели сыворотки крови морских свинок при лечении экспериментального туберкулеза
Результаты исследования воздействия Линарола Ф-1 на биохимические показатели, определяемые в сыворотке крови морских свинок, после двух-месячного курса терапии экспериментального туберкулеза, представлены в таблице 45.
Таблица 45 — Биохимические показатели крови зараженных микобактериями туберкулеза морских свинок на 60 сутки после терапии Линаролом Ф-1
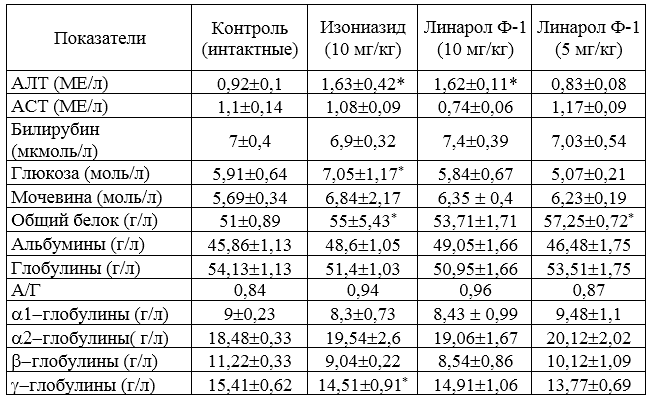
Примечание: — Р 0,01.
Из таблицы следует, что у животных, получавших изониазид, достоверного изменения общего белка не отмечалось. Нормализация количества альбумина и восстановление нормального альбумино-глобулинового соотношения в группе животных, леченных Линаролом Ф-1 в дозе 10 мг/кг массы тела, значительно опережало таковое в группе животных, леченных препаратом в дозе 5 мг/кг массы.
В группах животных, где проводилась терапия противотуберкулезными препаратами (изониазид и Линарол) концентрации мочевины в сыворотке крови достоверно не менялись. Линарол в дозе 10 мг/кг массы тела не оказывал токсического действия на почки и поджелудочную железу.
О состоянии функции печени судили по изменению аминотрансфераз в сыворотке крови. Достоверность изменений общего билирубина не наблюдалась. Как видно из данных таблицы, исходные показатели АЛТ и АСТ отличаются от полученных в процессе эксперимента. Наблюдалось снижение активности АЛТ в группе животных, получавших Линарол в дозе 5 мг/кг массы тела. Очевидно, исследуемый препарат не оказывает цитолитического действия на гепатоциты, а несколько угнетает активность АЛТ печени, что отражает понижение поступления фермента в сыворотку крови.
1.2.15.4 Применение Тубофена, Линарола и Линарола Ф-1 для специфической профилактики туберкулеза у молодняка крупного рогатого скота
В связи с высокой заболеваемостью маточного поголовья, длительной стационарностью и постоянной передержкой реагирующих на туберкулин животных в условиях Республики Татарстан, возникла необходимость выращивания ремонтного молодняка в хозяйствах с различной эпизоотической обстановкой, в том числе и телят, рожденных от реагирующих на туберкулин коров.
Завоз телок из-за пределов республики в зону с длительным неблагополучием по туберкулезу не решает проблему оздоровления. Профилактические и оздоровительные мероприятия в таких хозяйствах необходимо проводить с учетом сложившихся особенностей, а решение проблем оздоровления возможно путем полной замены неблагополучного поголовья здоровым.
Основной задачей в этом аспекте является создание внутрихозяйственных специализированных ферм по выращиванию ремонтных телок, на которых возможна изоляция телят в 5 -7 суточном возрасте. Однако, опасность заражения телят в первые дни и месяцы жизни требовала изыскания методов предохранения их от заболевания с помощью химиопрофилактических средств.
Открытие противотуберкулезных химиопрепаратов расширило возможность для успешной борьбы с туберкулезом. Они используются во многих регионах как профилактические противотуберкулезные средства у сельскохозяйственных животных, особенно в зонах с широким распространением болезни.
Эффективность химиопрофилактики во многом зависит от метода использования препарата. Оценивая методы введения противотуберкулезных средств (подкожное введение Тубофена на физиологическом растворе в дозе 10 мг/кг массы животного), нами установлено, что подкожный, как и внутримышечный метод введения, сопряжены с определенными трудностями – стерильные инструменты и растворы, индивидуальная обработка, фиксация и другие. Эти методы довольно трудоемки и не могут быть рекомендованы для крупных животноводческих комплексов.
Пероральный метод способ введения противотуберкулезных препаратов мы считали наиболее удобным и экономически выгодным, так как его можно применять групповым методом.
Обнадеживающие результаты перорального применения химиопрепаратов на лабораторных животных позволили, с разрешения Главного управления ветеринарии при Кабинете Министров Республики Татарстан, поставить контролируемые опыты в производственных условиях.
1.2.16 Изучение профилактической противотуберкулезной активности Тубофена в производственных условиях
Предыдущими исследованияями экспериментально установлено, что оптимальной дозой Тубофена для профилактики туберкулеза у морских свинок является доза 5 и 10 мг/кг массы. Однократное и длительное его применение с кормом не вызывало отрицательных изменений в организме животных, что подтверждается проведенными нами исследованиями. Все это дало основание к производственному испытанию Тубофена, как химиопрофилактического средства, для профилактики туберкулеза у молодняка крупного рогатого скота в длительно неблагополучном по этому заболеванию хозяйстве.
Опыт поставлен в условии хозяйства Агрофирма «Теньковская», филиала «Большие Салтыки» Камско-Устьинского района Республики Татарстан. Хозяйство считается неблагополучным по туберкулезу крупного рогатого скота с 1994 года, когда в январе при проведении туберкулинизации, количество реагировавших на туберкулин животных составило 192 головы – 14,2% от всего поголовья (1350 голов).
В связи с латентной формой течения туберкулеза, при которой скот не реагирует на туберкулин (ареактивные к туберкулину животные) в хозяйстве с 2002 года практикуется вакцинация новорожденных телят вакциной БЦЖ, а крупный рогатый скот исследуется на туберкулез методом БЦЖ – теста, который создает у животных не только иммунитет, но и провоцирует скрытые формы инфекции, усиливая интенсивность внутрикожной туберкулиновой пробы у инфицированных животных. Это в свою очередь предупреждает рецидивы туберкулеза в ранее оздоровленных неблагополучных хозяйствах и распространение инфекции животными микробоносителями на благополучные стада.
Наблюдения проводились над 52 телятами в возрасте от 3 до 7 дней, полученных от реагирующих на туберкулин коров. Телята были разделены на 4 группы: 3 подопытные и одну контрольную, по 13 голов в каждой. Телята первой группы получали Тубофен в дозе 5 мг/кг массы, телята второй группы – Тубофен в дозе 10 мг/кг массы, телята третьей группы изониазид в дозе – 10 мг/кг массы и телята 4-ой контрольной группы – физиологический раствор. Препараты задавали перорально, групповым методом, в течение 60 дней, в смеси с молоком. По результатам контрольного взвешивания животных, один раз в 2 недели проводили коррекцию дозы препаратов.
Телята содержались вместе в одном помещении. Условия кормления, ухода и содержания были одинаковы. Животные после рождения в течение месяца получали цельное молоко по общим нормам, принятым в хозяйстве, а затем ЗЦМ. По мере роста им в рацион вводили фураж, сено и свежескошенную, провяленную траву.
В течение 2-х месяцев за животными вели клиническое наблюдение, гематологические исследования и ежемесячно всех телят исследовали двукратным аллергическим методом на туберкулез. В качестве аллергена использовали ППД туберкулин для млекопитающих (стандартное разведение). Учет реакции проводили через 72 и 96 часов после введения туберкулина. По окончании курса химиопрофилактики по 5 животных из каждой группы были убиты на санитарной бойне Агрофирмы «Теньковское», филиала «Большие Салтыки» Камско-Устьинского района Республики Татарстан. Полученный патологический материал подвергнут лабораторным исследованиям.
Через 10 дней после окончания курса химиопрофилактики, оставшиеся животные всех четырех групп были вакцинированы вакциной БЦЖ, в дозе 1 мг, внутрикожно в 0,2 мл растворителя, согласно наставлению по применению вакцины БЦЖ на крупном рогатом скоте, утвержденному ГУВ МСХ от 26 февраля 1990 года.
В течение опыта от интеркурентных заболеваний пало 2 животных из третей и четвертой групп. Клинические наблюдение за животными показали, что применение Тубофена в испытуемых дозах не вызывает отклонений от физиологической нормы. Телята 3-х опытных групп за время проведения испытаний находились в естественной для них позе, легко и быстро передвигались, после приема корма обычно ложились и лежали в характерном для них положении. Телосложение у телят правильное, упитанность средняя, конституция плотная, мышцы, суставы, сухожилия хорошо очерчены, животные легко и быстро реагировали на внешние раздражители, конъюнктива, слизистая носа и ротовой полости бледно-розового цвета, умеренной влажности, припуханий и нарушений их целостности не отмечали. Кожа тонкая, эластичная, специфического запаха, умеренной влажности. Шерстяной покров блестящий, гладкий, хорошо удерживался в волосяных луковицах. Лимфатические узлы: подчелюстные, предлопаточные и коленной складки – гладкие, ровные, подвижные, плотные и безболезненные.
В результате проведенных аллергических исследований в длительно неблагополучном по туберкулезу хозяйстве агрофирма «Теньковская», филиалы «Большие Салтыки» установили, что в течение 2-х месяцев применения Тубофена и изониазида ни одно животное из подопытных групп не реагировало на введение туберкулина. Отрицательная реакция на введения туберкулина также отмечалась и в контрольной группе животных.
По истечении всего курса химиопрофилактики (60 дней) произвели контрольный убой пяти телят из каждой группы, при этом во внутренних органах и тканях животных опытных и контрольной групп изменений, характерных для туберкулеза, не обнаружено.
Результаты лабораторного исследования противотуберкулезной эффективности Тубофена и изониазида у телят длительно неблагополучного по туберкулезу хозяйства отражены в таблице 46.
Таблица 46 — Результаты исследований противотуберкулезной активности Тубофена в производственных условиях
| Препарат, доза | Количество животных, (гол). | Проведенные исследования | |||||
| Патолого-
анатомические |
Бактериоскопические | Бактериологические | Гистологические | Биопроба | Установлен туберкулез | ||
| Тубофен,
5 мг/кг |
5 | — | — | — | — | — | — |
| Тубофен,
10 мг/кг |
5 | — | — | — | — | — | — |
| Изониазид,
10 мг/кг |
5 | — | — | — | — | — | — |
| Контроль | 5 | — | — | 3 | — | 3 | 3 |
Из данных таблицы 46 видно, что при проведении патологических, гистологических и бактериоскопических исследований не удалось установить туберкулез ни в опытных, ни контрольной группах. Однако при проведении бактериологического исследования и проведении биопробы на морских свинках, у трёх телят из контрольной группы была выделена культура микобактерий туберкулеза бычьего вида.
Таким образом, Тубофен в дозах 10 и 5 мг/кг массы и изониазид в дозе 10 мг/кг массы, задаваемые с молоком, в течение двух месяцев, предотвратили возможное развитие туберкулезной инфекции в организме телят длительно неблагополучного по данному заболеванию хозяйства.
Кроме того, в процессе эксперимента, нами изучено влияние Тубофена на клинико-гематологические показатели телят, находившихся в данном опыте. Изменение клинико-гематологических показателей у телят трех опытных и одной контрольной групп учитывали до проведения исследований, затем через 10 дней, 30 дней и по окончании опыта (60 дней). Клинико-гематологические показатели телят при профилактическом применении Тубофена представлены в таблице 47.
Из данных таблицы 47 следует, что клинические показатели телят трех опытных и одной контрольной групп при двухмесячном курсе химиопрофилактики туберкулеза Тубофеном и изониазидом, не отклонялись от изменений возрастных показателей физиологической нормы.
В свою очередь, гематологические показатели телят трех подопытных групп также соответствовали возрастным изменениям показателей физиологической нормы. Контрольная группа животных, получавшая за весь период опыта физиологический раствор, к концу испытания имела незначительные отклонения количественного содержания эритроцитов, лейкоцитов и гемаглобина крови. Так, количество эритроцитов по завершении опыта у них составляло 8,85±0,21×1012/л, что на 5,14% меньше показателя в первой группе, на 3,38% — во второй и на 1,6% — в третьей.
Таблица 47 — Клинические и гематологические показатели телят при профилактическом применении Тубофена
| Группы животных | Показатели | Сроки исследования, сут. | |||
| До лечения | 10 | 30 | 60 | ||
| 1
(Тубофен в дозе 5 мг/кг массы) |
Температура, °С | 39,3±0,2 | 39,4±0,4 | 39,1±0,15 | 39,0±0,07 |
| Пульс, уд./мин. | 118±3,7 | 108,8±2,71 | 119,1±2,6 | 123,6±3,97 | |
| Дыхание, д.дв./мин | 49,6±2,42 | 55,8±3,17 | 52,1±2,48 | 44,7±2,38 | |
| Э, ×1012/л | 10,17±0,3* | 10,79±0,3 | 9,44±0,26* | 9,33±0,25* | |
| Л, ×109/л | 7,86±0,18 | 7,42±0,2 | 6,82±0,28* | 8,27±0,3 | |
| Нв, г/л | 162,7±0,32* | 109,5±0,3* | 114,2±0,2* | 108,25±0,3* | |
| Масса тела, кг | 29,2±0,39 | 31,3±0,3 | 41,6±0,52 | 52,1±0,56 | |
| 2
(Тубофен в дозе 10 мг/кг массы) |
Температура, °С | 38,6±0,28 | 39,3±0,1 | 39,4±0,1 | 39,2±0,11 |
| Пульс, уд./мин. | 122,2±3,8 | 120,2±3,4 | 110±3,64 | 128,5±2,61 | |
| Дыхание, д.дв./мин | 52,2±2,51 | 53±2,57 | 47,7±2,85 | 43,6±2,34 | |
| Э, ×1012/л | 11,28±0,29 | 10,66±0,3 | 9,27±0,24* | 9,16±0,24* | |
| Л, ×109/л | 8,2±0,32 | 7,82±0,27 | 6,87±0,27* | 7,9±0,28 | |
| Нв, г/л | 168,2±0,22* | 113,2±0,32* | 111,7±0,25 | 114,5±0,34* | |
| Масса тела, кг | 30,1±0,38 | 32,2±0,28 | 42,0±0,46 | 53,0±0,32 | |
| 3
(изониазид в дозе 10 мг/кг массы) |
Температура, °С | 39,4±0,21 | 39,4±0,26 | 39,6±0,23 | 39,2±0,22 |
| Пульс, уд./мин. | 109,6±4,17 | 116,3±3,62 | 121,6±2,52 | 114,1±3,17 | |
| Дыхание, д.дв./мин | 45,4±2,2 | 56,2±2,5 | 48,5±2,5 | 49,0±2,39 | |
| Э, ×1012/л | 10,35±0,46 | 10,49±0,36 | 9,14±0,23* | 9,0±0,25* | |
| Л, ×109/л | 8,33±0,32 | 8,05±0,29* | 7,3±0,23 | 8,12±0,34 | |
| Нв, г/л | 159,7±0,23 | 105,5±0,32* | 107,0±0,3 | 107,1±0,34* | |
| Масса тела, кг | 30,5±0,41 | 31,9±0,34 | 41,0±0,54 | 51,2±0,59 | |
| 4
(контрольная группа) |
Температура, °С | 39,3±0,22 | 39,6±0,19 | 39,4±0,24 | 39,1±0,19 |
| Пульс, уд./мин. | 113,2±3,94 | 117,8±3,7 | 124,5±3,71 | 122,7±2,99 | |
| Дыхание, д.дв./мин | 47,8±2,15 | 54,1±2,75 | 51,0±1,85 | 43,1±1,88 | |
| Э, ×1012/л | 11,06±0,41 | 10,36±0,18 | 8,95±0,2 | 8,85±0,21 | |
| Л, ×109/л | 7,72±0,31 | 7,55±0,3 | 7,42±0,2 | 8,67±0,3 | |
| Нв, г/л | 166,5±0,21 | 103,7±0,31 | 105,7±0,26 | 103,1±0,36 | |
| Масса тела, кг | 31,2±0,32 | 32,4±0,37 | 40,8±0,58 | 52,7±0,34 | |
Примечание: * — р < 0,01; ** — р < 0,05.
Количество лейкоцитов было незначительно увеличено и составляло 8,67±0,3×109/л, что на 4,6% больше, чем в первой контрольной группе, на 8,88% — во второй и на 6,34% — в третьей. Количество гемаглобина у контрольной группы животных было также незначительно уменьшено и составляло 103,14±0,36г/л, что на 4,7% меньше, чем в первой опытной группе, на 10 % — во второй и на 3,7% — в третьей.
Живая масса телят трех опытных и одной контрольной групп за весь период наблюдения (2 месяца) изменялась в пределах физиологической нормы.
1.2.17 Изучение профилактической противотуберкулезной активности Линарола в производственных условиях
Исследованиями в предыдущих главах установлено, что при экспериментальном туберкулезе у морских свинок, Линарол проявил достаточно высокий профилактический эффект и обладает выраженными туберкулостатическими свойствами в дозах 5 и 10 мг/кг массы животного. Двухмесячное пероральное его применение не вызывало отрицательных изменений в организме животных, что подтверждается проведенными нами бактериологическими, патоморфологическими и гистологическими исследованиями. Все это дало основание к производственному испытанию Линарола, как химиопрофилактического средства, для профилактики туберкулеза у молодняка крупного рогатого скота в неблагополучных по данному заболеванию хозяйствах.
Опыт поставлен в условии хозяйств ООО СХП «Золотой Колос» МТФ «Сокуры» Лаишевского муниципального района и ООО «Агроспецстрой» МТФ «Монашево» Менделеевского муниципального района Республики Татарстан.
На период испытаний хозяйства являлись неблагополучными по туберкулезу крупного рогатого скота. ООО СХП «Золотой Колос» приобрело статус неблагополучия по туберкулезу крупного рогатого скота с 28 октября 2008 года, когда при проведении массовых аллергических диагностических исследований реагировало на туберкулин 72 головы, в том числе 48 коров, при среднегодовом поголовье 430 голов. В ООО «Агроспецстрой» карантинные (ограничительные) мероприятия по туберкулезу крупного рогатого скоты были введены с 18 января 2010 года. При проведении массовых аллергических исследований из 438 голов стада, на туберкулин реагировали 307 голов.
В опыте находилось 28 телят в возрасте от 3 до 10 дней, которых отбирали по принципу аналогов как от реагирующих на туберкулин коров, так и от не реагирующих (условно здоровых) животных. Схема проведения производственного испытания эффективности Линарола, как химиопрофилактического средства у телят молочного периода онтогенеза в неблагополучных по туберкулезу крупного рогатого скота хозяйствах отражена в таблице 48.
Таблица 48 — Схема производственного испытания Линарола
| Название хозяйства | Группы животных | Доза Линарола, мг/кг | Количество телят в группе |
| ООО «Золотой Колос» МТФ «Сокуры» | 1 опытная | 10 | 6 |
| 2 опытная | 5 | 6 | |
| 3 контрольная | — | 6 | |
| ООО «Агроспецстрой» МТФ «Монашево» | 1 опытная | 10 | 5 |
| 2 контрольная | — | 5 |
В ООО СХП «Золотой Колос», МТФ «Сокуры» опыты проведены на 18 телятах 3-10 дневного возраста. По принципу аналогов были сформированы 3 группы телят, по 6 голов в каждой. Животным первой опытной группы групповым методом в смеси с молоком в течение 60 дней задавали перорально Линарол, в дозе 10 мг/кг, второй – Линарол, в дозе 5 мг/кг. Телята третьей, контрольной группы получали в аналогичных дозах физиологический раствор.
В ООО «Агроспецстрой» опыты проведены на 10 телятах 3-6 дневного возраста, полученных от реагировавших на туберкулин коров, которые по принципу аналогов были сформированы в 2 группы, по 5 голов в каждой. Животным первой опытной группы групповым методом в смеси с молоком в течение 60 дней задавали перорально Линарол, в дозе 10 мг/кг массы тела. Телята второй, контрольной группы получали в аналогичных дозах физиологический раствор.
В течение 2-х месяцев за животными вели клиническое наблюдение и ежемесячно всех телят исследовали аллергическим методом на туберкулез. По результатам контрольного взвешивания животных, один раз в 2 недели проводили коррекцию дозы препаратов.
Результаты аллергических исследований телят показали, что через месяц ни одно животное из опытных и контрольных групп на введение туберкулина не реагировало. При проведении аллергического исследования через 2 месяца, после начала эксперимента, реакция на туберкулин отмечалась у 2 телят контрольной группы в хозяйстве «Золотой Колос» и у 1 теленка контрольной группы в хозяйстве «Агороспецстрой» и характеризовались увеличением кожной складки на 4 — 5 мм. Животные опытных групп на введение туберкулина не реагировали.
По истечении курса химиопрофилактики (60 дней) провели контрольно — диагностический убой телят из каждой группы, причем в контрольной группе на убой отобрали телят, реагировавших на туберкулин. Результаты изучения специфической профилактической активности Линарола на телятах неблагополучных по туберкулезу крупного рогатого скота хозяйств отражены в таблице 49.
Из результатов исследований, отраженных в таблице 49, видно, что при контрольно-диагностическом убое 2 телят из каждой группы в МТФ «Сокуры» во внутренних органах и тканях животных первой опытной группы, получавших Линарол в дозе 10 мг/кг массы тела, изменений, характерных для туберкулеза, не обнаружено. У одного из двух убитых телят второй опытной группы, получавших Линарол в дозе 5 мг/кг массы тела, отмечали лишь незначительное увеличение бронхиальных лимфатических узлов. У телят контрольной группы была незначительная гиперемия и увеличение подчелюстных и бронхиальных лимфатических узлов.
Таблица 49 — Результаты изучения профилактической противотуберкулезной активности Линарола в производственных условиях
| Название хозяйства | Доза препарата (мг/кг) | Количество реагирующих на туберкулин животных (голов) | Контрольно-диагност. убой (голов) | Проведенные
исследования: |
||
| Патоморфологические | Бактериологические | Установлен туберкулез (голов) | ||||
| ООО «Золотой Колос» МТФ «Сокуры» | 10 | 0 | 2 | — | — | — |
| 5 | 0 | 2 | — | — | — | |
| контроль | 2 | 2 | 2 | 2 | 2 | |
| ООО «Агроспецстрой» МТФ «Монашево» | 10 | 0 | 3 | — | — | — |
| контроль | 1 | 3 | 1 | 1 | 1 | |
При гистологическом исследовании патологического материала (лимфатические узлы, легкие, селезенка и печень) лишь у телят контрольной группы отмечали первоначальное формирование туберкулезных узелков, состоящих из лейкоцитов, лимфоидных клеток, расположенных вокруг них эпителиоидных и разрозненных гигантских многоядерных клеток. В отдельных, из формирующихся узелков, выявлены незначительные некротические изменения. У телят, получавших Линарол в дозе 5 и 10 мг/кг массы, характерных туберкулезных изменений в органах и лимфатических узлах не установлено, за исключением разрозненных и собранных в мелкие группы лейкоцитов и потерявших четкие контуры эпителиоидных клеток.
В результате проведенных лабораторных исследований патологического материала, взятого от убитых животных опытных и контрольной групп, путем бактериологических исследований и проведения биопробы на морских свинках, у двух телят из контрольной группы была выделена культура микобактерий туберкулеза бычьего вида.
При контрольно-диагностическом убое 3 телят из каждой группы в МТФ «Монашево» во внутренних органах и тканях животных первой опытной группы, получавших Линарол в дозе 10 мг/кг массы тела, изменений, характерных для туберкулеза, не обнаружено. В свою очередь, у 2 телят из контрольной группы отмечали гиперемию и увеличение бронхиальных лимфатических узлов. Других патологических изменений, характерных для туберкулеза, не обнаружили. При гистологическом исследовании патологического материала первоначальное формирование туберкулезных узелков отмечали только в бронхиальных лимфатических узлах полученных, от одного теленка контрольной группы.
В результате проведенных лабораторных исследований патологического материала, взятого от убитых животных, путем бактериологических исследований и проведения биопробы на морских свинках, только у одного теленка из контрольной группы была выделена культура микобактерий туберкулеза бычьего вида.
Таким образом, применение Линарола по описанной схеме в комплексе оздоровительных мероприятий позволило в опытных группах вырастить свободных от возбудителя туберкулеза, здоровых телят. В контрольных группах животных, не подвергавшихся курсу химиопрофилактики Линаролом, инфицированность поголовья молодняка была в пределах 20 – 30%.
1.2.18 Изучение профилактической противотуберкулезной активности Линарола Ф-1 в производственных условиях
В предыдущих экспериментах нами установлено, что оптимальной дозой Линарола Ф-1 для терапии туберкулеза у морских свинок является доза 10 мг/кг массы. Однократное и длительное (60 суток) его пероральное применение не вызывало отрицательных изменений в организме животных, что подтверждается проведенными нами исследованиями. Все это дало основание к производственному испытанию Линарола Ф-1, как химиопрофилактического средства, для профилактики туберкулеза у молодняка крупного рогатого скота в неблагополучных по этому заболеванию хозяйствах.
Опыты по изучению профилактической противотуберкулезной активности Линарола Ф-1 проведены в условии трех хозяйств: ООО «Агроспецстрой» МТФ «Монашево» Менделеевского муниципального района РТ, ОАО «Красный Восток-Агро» ЖК «Челны» Алькеевского муниципального района РТ и ООО «Черемшан Агроуслуги», МТФ отделение «Туймет» Черемшанского муниципального района РТ. На период испытаний вышеперечисленные хозяйства являлись неблагополучными по туберкулезу крупного рогатого скота.
В опыте находилось 49 телят в возрасте от 3 до 12 дней, которых отбирали по принципу аналогов как от реагирующих, так и от не реагирующих на туберкулин коров, неблагополучного по туберкулезу стада. Схема проведения производственного испытания Линарола Ф-1, как специфического химиопрофилактического средства у телят молочного периода онтогенеза в неблагополучных по туберкулезу крупного рогатого скота хозяйствах отражена в таблице 50.
Таблица 50 — Схема производственного испытания Линарола Ф-1
| Название хозяйства | Группы животных | Доза Линарола Ф-1, мг/кг | Количество телят в группе |
| МТФ «Монашево» | 1 опытная | 10 | 5 |
| 2 опытная | 5 | 5 | |
| 3 контрольная | — | 5 | |
| Животноводческий
комплекс «Челны» |
1 опытная | 10 | 6 |
| 2 опытная | 5 | 6 | |
| 3 контрольная | — | 6 | |
| МТФ отделения «Туймет» | 1 опытная | 10 | 8 |
| 2 контрольная | — | 8 |
В ООО «Агроспецстрой», МТФ «Монашево» опыты проведены на 15 телятах 3-10 дневного возраста, полученных от реагировавших на туберкулин коров, которые по принципу аналогов были сформированы в 3 группы, по 5 голов в каждой. Животным первой опытной группы пероральным методом, в смеси с молоком, в течение 60 дней задавали Линарол Ф-1, в дозе 10 мг/кг массы, животным второй опытной группы Линарол Ф-1, в дозе 5 мг/кг массы тела. Телята четвертой (контрольной) группы получали в аналогичных дозах физиологический раствор.
В ОАО «Красный Восток-Агро», ЖК «Челны» опыты проведены на 18 телятах 4 — 10 дневного возраста, которые по принципу аналогов были сформированы в 3 группы, по 6 голов в каждой. Животным первой опытной группы пероральным методом, в смеси с молоком, в течение 60 дней задавали Линарол Ф-1, в дозе 10 мг/кг массы, животным второй опытной группы Линарол Ф-1, в дозе 5 мг/кг массы тела. Телята контрольной группы получали в аналогичных дозах физиологический раствор.
В ООО «Черемшан-Агроуслуги», МТФ отделения «Туймет» изучение химиопрофилактической активности Линарола Ф-1 проводилось на 16 телятах в возрасте от 5 до 12 дней. Животные были разделены на 2-е группы — опытную и контрольную, по 8 голов в каждой. Телята опытной группы получали Линарол Ф-1 в дозе 10 мг/кг массы, а телята контрольной группы – физиологический раствор. Препарат задавали перорально, групповым методом, в течение 60 дней, в смеси с молоком.
Телята контрольных и опытных групп содержались в одном помещении. Условия кормления, ухода и содержания были одинаковы. Животные после рождения в течение месяца получали молоко, полученное от условно благополучных по заболеванию коров, по общим нормам, принятым в хозяйстве, а затем обрат и ЗЦМ. По мере роста в рацион вводили фураж, сено или свежескошенную, провяленную траву.
В течение 2-х месяцев за животными вели клиническое наблюдение, проводили гематологические и биохимические исследования крови и ежемесячно всех телят исследовали аллергическим методом на туберкулез. В качестве аллергена использовали ППД туберкулин для млекопитающих. За весь период исследований падежа телят в опытных и контрольных группах не наблюдалось. По результатам контрольного взвешивания животных, один раз в две недели проводили коррекцию дозы препарата.
Результаты аллергических исследований на 30 сутки исследования показали, что ни одно животное подопытных и контрольных групп на введение туберкулина не реагировало. При проведении аллергического исследования через 2 месяца после начала эксперимента реакция на туберкулин отмечалась у одного теленка контрольной группы в сельскохозяйственном предприятии «Агороспецстрой» (4 мм) и у трех животных контрольной группы в хозяйстве «Черемшан-Агроуслуги», причем у двух телят с увеличением кожной складки на 3мм и у одного — на 4 мм. Животные опытных групп и одной контрольной группы в ООО «Красный Восток-Агро» на введение туберкулина не реагировали. По окончании курса химиопрофилактики по три теленка из каждой группы были подвергнуты контрольно-диагностическому убою на санитарной бойне хозяйства. Полученный патологический материал подвергнут лабораторным исследованиям.
Результаты изучения специфической профилактической активности Линарола Ф-1 на телятах неблагополучных по туберкулезу крупного рогатого скота хозяйств отражены в таблице 51.
Таблица 51 — Результаты изучения профилактической противотуберкулезной активности Линарола Ф-1 в производственных условиях
| Предприятие | Доза препарата (мг/кг) | Количество реагирующих на туберкулин животных (голов) | Контрольно -диагност. убой (голов) | Проведенные
исследования: |
||
| Патоморфологические | Бактериологические | Установлен туберкулез (голов) | ||||
| «Агроспец-строй» | 10 | 0 | 3 | — | — | — |
| 5 | 0 | 3 | — | — | — | |
| контроль | 1 | 3 | 1 | 1 | 1 | |
| «Красный Восток-Агро» | 10 | 0 | 3 | — | — | — |
| 5 | 0 | 3 | — | — | — | |
| контроль | 0 | 3 | — | 2 | 2 | |
| «Черемшан-
Агроуслуги» |
10 | 0 | 3 | — | — | — |
| контроль | 3 | 3 | — | 1 | 1 | |
Из результатов исследований, отраженных в таблице 51 видно, что при контрольно-диагностическом убое трех телят из каждой группы в ООО «Агроспецстрой» во внутренних органах и тканях животных опытных групп, получавших Линарол Ф-1 в дозе 10 и 5 мг/кг массы тела, изменений характерных для туберкулеза не обнаружено. В свою очередь у двух телят из контрольной группы отмечали гиперемию и увеличение бронхиальных лимфатических узлов. Других патологических изменений, характерных для туберкулеза, не обнаружили.
При гистологическом исследовании патологического материала первоначальное формирование туберкулезных узелков отмечали только в бронхиальных лимфатических узлах, полученных от теленка контрольной группы.
В результате проведенных лабораторных исследований патологического материала, взятого от убитых животных, путем бактериологических исследований и проведении биопробы на морских свинках, только у одного теленка из контрольной группы была выделена культура микобактерий туберкулеза бычьего вида.
При контрольно-диагностическом убое трех телят из каждой группы в ООО «Красный Восток-Агро» во внутренних органах и тканях животных подопытных и контрольной групп патологических изменений характерных для туберкулеза не обнаружено. В результате проведенных лабораторных исследований патологического материала, взятого от убитых животных, путем бактериологических исследований и проведении биопробы на морских свинках, у двух телят из контрольной группы была выделена культура микобактерий туберкулеза бычьего вида.
При проведении патологоанатомических исследований у животных в ООО «Черемшан-Агроуслуги» установлено, что во внутренних органах и тканях телят подопытной группы, получавшей Линарол Ф-1 в дозе 10 мг/массы тела, изменений, характерных для туберкулеза, не обнаружено. В контрольной группе у двух животных отмечалось лишь незначительное увеличение заглоточных лимфатических узлов.
При проведении бактериоскопических и гистологических исследований нам также не удалось выделить микобактерии туберкулеза ни в опытной, ни в контрольной группах. Однако при проведении бактериологического исследования и проведении биопробы на морских свинках у одного из трех телят контрольной группы была выделена культура микобактерий туберкулеза бычьего вида.
Для изучения влияния Линарола Ф-1 на гематологические показатели крови телят у экспериментальных животных перед началом эксперимента, на 30 сутки и по окончании эксперимента (60 суток) брали кровь и определяли количество лейкоцитов и эритроцитов, а также лейкоцитарную формулу, используя общепринятые методы исследования. Результаты исследования сравнивали с показателями животных контрольной группы.
Кроме того, важным показателем эффективности лечения является разница в весе животных на начало и окончание опыта. Данные гематологических показателей крови и массы тела телят при химиопрофилактике туберкулеза Линаролом Ф-1 представлены в таблице 52.
Из результатов, отраженных в таблице 52, следует, что пероральное введение Линарола Ф-1 телятам, в дозе 10 мг/кг массы тела в течение 60 суток, не повлияло на гематологические показатели крови, которые не отличались от таковых у контрольной группы, ни на 30, ни на 60 сутки исследования.
Установлено, что достоверно увеличивалось (в пределах верхних границ допустимой нормы) лишь количество лейкоцитов у животных контрольной группы на 60 сутки исследований. Это говорит о незначительном воспалительном процессе, происходящем в организме.
Таблица 52 — Гематологические показатели и изменение веса телят на 30 и 60 сутки после перорального введения Линарола Ф-1 в дозе 10 мг/кг массы тела
| Наименование показателей | Сроки исследования, сутки | |||||
| до начала эксперимента | 30 | 60 | ||||
| контроль | опыт | контроль | опыт | контроль | опыт | |
| Эритроциты (1012/л) | 8,94±0,17 | 9,08±0,18 | 8,4±0,15 | 8,7±0,23 | 8,62±0,27 | 8,12±0,19 |
| Лейкоциты (109/л) | 8,86±0,15 | 9,1±0,17 | 9,1±0,18 | 8,82±0,27 | 10,4±0,49 | 8,84±0,31* |
| Палочкоядерные (%) | 9,2±0,74 | 9,8±0,65 | 5,6±0,57 | 4,2±0,82 | 4,4±0,84 | 3,2±0,65 |
| Сегментоядерные (%) | 28,2±1,43 | 27,8±1,67 | 21±1,46 | 21,4±1,6 | 21,8±1,98 | 20,6±1,44 |
| Эозинофилы (%) | 1,0±0,35 | 0,4±0,27 | 0,4±0,45 | 0,2±0,22 | 0,6±0,27 | 0,2±0,22 |
| Базофилы (%) | 0,6±0,45 | 0,2±0,22 | 0,4±0,27 | 0,4±0,27 | 0,6±0,45 | 0,4±0,45 |
| Моноциты (%) | 3,4±0,57 | 4,4±0,76 | 5,4±0,57 | 4,2±0,96 | 4,6±0,57 | 4,8±1,08 |
| Лимфоциты (%) | 43±1,94 | 40,8±1,75 | 56,8±3,65 | 52,2±3,07 | 67,2±2,07 | 69,4±2,39 |
| Живая масса, кг | 36,6±1,04 | 34,6±1,2 | 48±1,27 | 49,6±1,75 | 62,8±2,9 | 67,4±2,59 |
Примечание: — Р 0,05.
Изменение массы тела телят опытной и контрольной групп происходило в результате их физиологического роста. Причем показатель живой массы телят опытной группы, получавшей перорально Линарол Ф-1, на 60 сутки исследования оказался на 7% выше, в сравнении с контрольной и составил 67,4±2,59 кг.
Характер воздействия исследуемого соединения на биохимические показатели, определяемые в сыворотке крови телят, проводили одновременно с работой по изучению гематологических показателей крови и массы тела телят при химиопрофилактике туберкулеза Линаролом Ф-1 Результаты исследования приведены в таблице 53.
Из таблицы 53 следует, что биохимические показатели сыворотки крови опытной группы, до начала эксперимента, не отличались от таковых у контрольной группы. На 30 сутки исследования у животных контрольной группы, не подвергавшихся курсу химиопрофилактики Линаролом Ф-1, отмечалось достоверное увеличение количества общего белка и альбуминов в сыворотке крови. Так, если в опытной группе показатели общего белка и альбуминов на 30 сутки эксперимента составляли 57,440,65 г/л и 260,49 г/л, то в контрольной группе они были на 5% выше (60,20,93 г/л и 27,260,21 г/л соответственно). По другим биохимическим показателям (аланинааминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), билирубин, мочевина, креатинин и другие) опытная группа не отличалась от контрольной.
На 60 сутки исследования у телят контрольной группы продолжалось достоверное увеличение количества общего белка в сыворотке крови. Так, если в опытной группе этот показатель составил 61,20,65 г/л, то в контрольной группе он был выше уже на 9%.
Таблица 53 — Биохимические показатели телят на 30 и 60 сутки после перорального введения Линарола Ф-1 в дозе 10 мг/кг массы тела
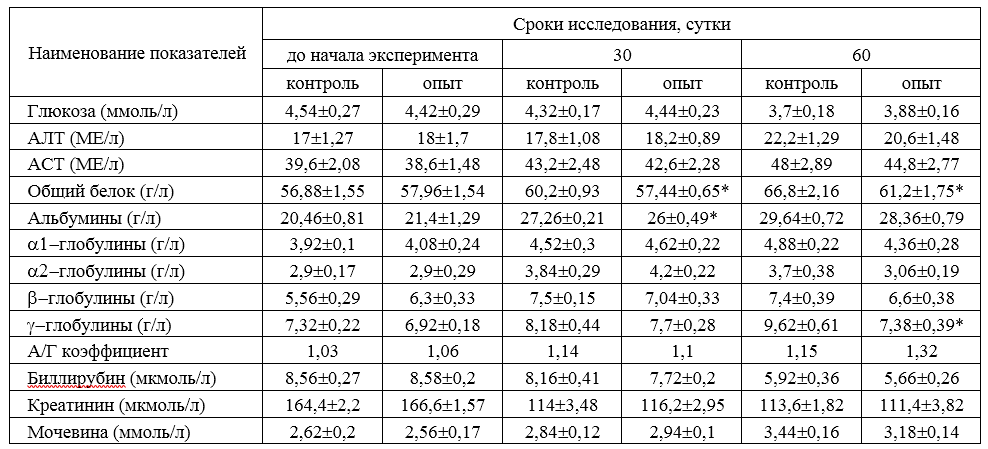
Примечание: — Р 0,05.
Выраженная гиперпротеинемия не может наблюдаться при нормальных физиологических процессах и развивается только при наличии патологии. В частности, повышение общего белка в крови может свидетельствовать о развитии инфекционного заболевания.
Кроме того, на 60 сутки исследований у животных контрольной группы отмечалось достоверное увеличение количества гамма-глобулинов в сыворотке крови, что также может свидетельствовать о развитии инфекционного процесса в организме.
Концентрации мочевины в сыворотке крови у телят опытной группы достоверно не менялись на протяжении всего исследования, тем самым можно утверждать, Линарол Ф-1 не оказывал токсического действия на почки и поджелудочную железу.
О состоянии функции печени судили по изменению аминотрансфераз в сыворотке крови. Достоверность изменений общего билирубина не наблюдалась. Как видно из данных таблицы, исходные показатели АЛТ и АСТ у телят опытной группы не отличаются от результатов, полученных в процессе эксперимента у контрольной группы. Очевидно, что исследуемый препарат не оказывает цитолитического действия на гепатоциты.
Таким образом, в результате проведенных исследований, установлено, что пероральное введение Линарола Ф-1, телятам, в течение молочного периода, в дозе 5 и 10 мг/кг массы тела, обеспечивает 100% защиту их от инфицирования микобактериями туберкулеза и позволяет провести гарантированное выращивание на внутрихозяйственных фермах здоровых животных, полученных от коров неблагополучных стад, в том числе и от больных туберкулезом.
В контрольных группах телят, не подвергавшихся курсу химиопрофилактики Линаролом Ф-1, инфицированность поголовья молодняка была в пределах 12,5 — 30%.
Однако необходимо отметить, что высокие результаты эффективности проведенной нами химиопрофилактики напрямую зависят от множества факторов, таких как инфицированность поголовья, уровня ветеринарно-санитарного состояния хозяйства, квалификации специалистов, культуры ведения животноводства и тщательного выполнения комплекса профилактических мероприятий.
Внедрение Линарола Ф-1 для химиопрофилактики туберкулеза, как вынужденного дополнительного мероприятия в технологии изолированного выращивания телят, в условиях сложной эпизоотической обстановки по туберкулезу крупного рогатого скота, позволило:
- Подтвердить правильность выбора перорального метода введения препарата и его дозу (10 мг/кг массы) для профилактики туберкулеза у молодняка крупного рогатого скота.
- Создать оптимальную и длительную концентрацию Линарола Ф-1 в крови, которая предотвращает возможность инфицирования телят на время молочного периода развития, а у инфицированных животных оказывает лечебное действие, что позволяет профилактировать, в более поздние сроки, переход скрытой инфекции в тяжелые формы заболевания.
- Провести в 100% случаев гарантированное выращивание на внутрихозяйственных фермах здоровых телят, полученных от коров неблагополучных стад, в том числе и от больных туберкулезом.
- Улучшить эпизоотическую обстановку и способствовать оздоровлению от туберкулеза крупного рогатого скота хозяйств, методом поэтапной замены поголовья, выращенным здоровым скотом.
- Рекомендовать опыт по изолированному выращиванию телят молочного периода развития с применением химиопрофилактики, на фермах неблагополучных по туберкулезу крупного рогатого скота.
ЗАКЛЮЧЕНИЕ
Несмотря на успехи, достигнутые в борьбе с туберкулезом сельскохозяйственных животных, эта инфекция остается одной из ведущих, наиболее сложных и экономически значимых в инфекционной патологии, причиняя огромный ущерб народному хозяйству и представляя серьезную опасность населению. Благодаря достижениям науки и практики, эпизоотическая обстановка по туберкулезу крупного рогатого скота за последние 15 лет в Российской Федерации неуклонно улучшается (Смолянинов Ю.И., Лопунов С.В. 2008, 2009). Однако, положительные тенденции в борьбе с этой инфекцией в целом по стране, зачастую не совпадают с таковыми в отдельных ее регионах (Жуков А.П., 2006; Баратов М.О., 2017).
Ретроспективный анализ динамики эпизоотической ситуации по туберкулезу крупного рогатого скота в хозяйствах Республики Татарстан за 40 лет (с 1960 по 2000 годы) показывает, что в этот период она оставалась крайне напряженной. Стационарность и множественность очагов инфекции, а также систематическое инфицирование животных, в силу невыполнения хозяйствами профилактических мер снижали эффективность проводимых оздоровительных мероприятий. Всего за этот период было оздоровлено 726 неблагополучных по туберкулезу крупного рогатого скота пунктов, но при том вновь было выявлено – 665. За 1960 – 2000 гг. заболело 130479 животных, на учете на территории РТ ежегодно в среднем состояло более 50 неблагополучных пунктов.
В результате изучения динамики количества неблагополучных по туберкулезу крупного рогатого скота пунктов в РТ за период с 2000 по 2018 годы, с целью определения нозоареала болезни, нами составлена эпизоотическая карта. В результате анализа этой картограммы нами установлено, что неблагополучные по туберкулезу пункты территориально приурочены к определенной местности: т.е. расположились в основном на юге, и разрозненно (небольшими группами – «очагами») в центральной части республики.
Так, в районах Предволжья и Предкамья (Арский, Атнинский, Балтасинский, Высокогорский, Зеленодольский, Кукморский, Сабинский, Тюлячинский и др.) заболевание скота протекает в виде энзоотии или проявляется спорадически, в таких хозяйствах после удаления выявленных больных животных, достигается полное оздоровление стад и редко когда наблюдаются рецидивы болезни.
Более тяжелое течение туберкулезной инфекции по широте охвата поголовья и количеству неблагополучных пунктов наблюдается в Заволжье и Закамье. Это Алькеевский, Алексеевский, Дрожжановский, Лениногорский, Черемшанский, Чистопольский и другие районы. В указанных зонах регистрируется выраженная мозаичность поражения отдельных районов и животноводческих ферм. Проведение оздоровительных мер в ряде хозяйств этой зоны связано с большими усилиями и значительными затратами. Именно здесь ранее имелись стационарные неблагополучные пункты и, как правило, в оздоровленных от туберкулеза хозяйствах через 3-5 лет вновь регистрировались рецидивы болезни.
Многолетнее наблюдение за распространением туберкулеза крупного рогатого скота в Республике Татарстан, обследование эпизоотических очагов и проведение производственных опытов позволило прийти к выводу о неадекватности проводимых противотуберкулезных мероприятий. Несмотря на большие усилия, предпринимаемые для профилактики и ликвидации туберкулеза животных, на протяжении многих лет эта инфекция в республике остается непобежденной.
Для успешной борьбы с заболеванием противотуберкулезные мероприятия должны носить активный, наступательный характер. Необходимо энергично и комплексно проводить мероприятия по выявлению и удалению из стада больных животных — источников возбудителя, с последующей тщательной многократной деконтаминацией внешней среды. Кроме того, необходимо организовать изолированное выращивание молодняка и надежную защиту его от заражения туберкулезом в молочном периоде онтогенеза.
Одним из методов, повышающих эффективность комплекса оздоровительных мероприятий при туберкулезе крупного рогатого скота, является химиопрофилактика антимикобактериальными препаратами. К настоящему времени в литературе накоплен обширный материал о высокой профилактической эффективности применения с этой целью производных изоникотиновой кислоты (Ротов В.И. и соавт., 1964; А.Б. Ли, 1980; Хайкин Б.Я. и соавт., 1983; Г.К. Щелканов, А.И. Аверихин, 1986; Ю.И. Смолянинов, Н.Н. Кощеев, 2001; Донченко Н.А., 2008).
В связи с вышеизложенным, в Институте органической и физической химии имени А.Е. Арбузова — обособленном структурном подразделении ФИЦ КазНЦ РАН синтезированы соль бис(оксиметил)фосфиновой кислоты с гидразидом изоникотиновой кислоты (Тубофен) и 3 группы новых химических соединений: изоцианураты, триазины и α,ω – бис(амидо- и гидразидометилсульфинил- и сульфонил)алканы, которые могли быть использованы в качестве средств для профилактики туберкулеза у животных.
Из широкого многообразия препаратов (82 химических соединения) нами были подобраны наиболее эффективные средства из каждой представленной группы, и этот выбор, в первую очередь, основывался на проявлении туберкулостатической активности испытуемых соединений.
Соль бис(оксиметил)фосфиновой кислоты с гидразидом изоникотиновой кислоты (Тубофен), 45 химических соединений относящихся к изоциануратам, 3 соединения относящиеся к триазинам и 34 соединения относящиеся к α,ω – бис(амидо- и гидразидометилсульфинил- и сульфонил)алканам обладают выраженными бактериостатическими свойствами в отношении микобактерий туберкулеза штамма H37Rv и оказывают свое ингибирующее действие в концентрациях от 0,075 до 50 мкг/мл среды.
В результате комплексных испытаний туберкулостатической активности исследуемых синтетических препаратов из каждой группы выбраны наиболее эффективные в отношении микобактерий туберкулеза «соединения – лидеры»: Тубофен (соль бис(оксиметил)фосфиновой кислоты с гидразидом изоникотиновой кислоты) с МИК – 0,075 мкг/мл среды; Линарол (1-5-(карбазоилметилсульфинил)-пентил)-3,5-диметилизоцианурат) с МИК – 0,1 мкг/мл среды; Аликон (2,4-диамино-6-(карбамоилметилсульфинил-метил)-1,3,5-триазин) с МИК – 0,1 мкг/мл среды и Линарол Ф-1 (1,4-бис (амидометилсульфинил) бутан) с МИК – 0,3 мкг/мл среды.
Химические соединения Линарол, Аликон и Линарол Ф-1 проявили выраженное бактериостатическое действие на микобактерии туберкулеза референтных штаммов Н37Rv, M. bovis 14 и культуру клинического штамма микобактерий туберкулеза с множественной лекарственной устойчивостью в концентрациях 10 мкг/мл среды. Тубофен в концентрации 10 мг/мл среды проявил бактериостатическое действие лишь в отношении референтных штаммов, культура клинического штамма с множественной лекарственной устойчивостью оказалась резистентной к данному препарату в исследованной дозе.
Тубофен, Линарол, Аликон и Линарол Ф-1 в концентрациях 5,0; 2,5; 1,25 и 0,6 мг/мл среды обладают избирательным антибактериальным действием лишь в отношении микобактерий туберкулеза и не проявили выраженного антибактериального и фунгистатического действия на тестируемые культуры (Staphylococcus aureus 209p, Escherichia colli F-50, Bacillus cereus 8035, Candida albicans 855-653, Trichophyton mentagrophytes — 1773, Aspergillus niger BKMF-1119).
Химиопрофилактические туберкулостатические препараты: Тубофен, Линарол, Аликон и Линарол Ф-1 являются малотоксичными соединениями, не обладают кумулятивным, эмбриотоксическим, тератогенным и местно-раздражающим действиями. Длительное (в течение 30-60 суток) их введение лабораторным животным в дозе 10 мг/кг массы тела не влияло на изменение гематологических и биохимических показателей крови. Однако препарат Аликон оказался бесперспективным для дальнейших исследований в связи с трудностью его синтеза в промышленных масштабах и дороговизной исходных реактивов, а также плохой растворимостью в воде, что ухудшает его биодоступность.
При экспериментальном туберкулезе морских свинок Тубофен и Линарол проявляют высокий химиопрофилактический эффект и в дозах 10 мг/кг массы предотвращают развитие в тканях и органах структурных изменений, характерных для туберкулезного процесса. Пероральное применение Тубофена и Линарола в течение 2-х месяцев, в сравнении с изониазидом, не вызывает развития токсической гепатоцеллюлярной патологии, деструктивных васкулитов и не угнетает лимфопролиферативные процессы в селезенке.
Туберкулостатический препарат Линарол Ф-1 в дозе 10 мг/кг массы тела животного обладает высокой терапевтической активностью при лечении экспериментального туберкулеза у морских свинок в течение 60 суток. Препарат Линарол также проявил противотуберкулезную терапевтическую активность в отношении микобактерий туберкулеза, однако эта активность на два порядка меньше в тканях легкого экспериментальных животных ((2,3 ± 0,46)×107 КОЕ МБТ), чем у препарата изониазид в аналогичной дозе и сроках введения ((2,7 ± 1,5)×105 КОЕ МБТ). В тканях селезенки противотуберкулезная активность Линарола и препарата изониазид была практически одинаковой.
Пероральное назначение Тубофена, Линарола и Линарола Ф-1 телятам, полученных от коров неблагополучных стад, в молочный период в дозе 10 мг/кг массы тела, обеспечивает 100% защиту от развития у них инфекционного процесса, вызванного микобактериями туберкулеза, и позволяет провести гарантированное выращивание на таких фермах здоровых животных.
Наиболее перспективным (из тестируемых химических соединений) оказался Линарол Ф-1, который наряду с низкой токсичностью, обладает выраженными туберкулостатическими свойствами, в том числе и по отношению к микобактериям туберкулеза с множественной лекарственной устойчивостью, протективными свойствами для телят молочного периода развития, что позволяет профилактировать болезнь и в более поздние сроки, а также переход скрытой инфекции в тяжелые формы заболевания.
Разработанный комплексный метод химиопрофилактики туберкулеза у телят молочного периода с использованием синтезированных препаратов, позволяет обеспечить их защиту от туберкулеза и способствует оздоровлению длительно неблагополучных хозяйств.
СПИСОК ЛИТЕРАТУРЫ
- Александров, Н.А. Некоторые вопросы оздоровления длительно неблагополучных по туберкулезу хозяйств / Н.А. Александров, К.К. Алексеев, З.И. Мендельман // Тр. Саратовского НИВС. – Саратов. — 1974. – Т.9. – С.51 – 54.
- Александров, Н.А. Обоснование и опыт искоренения туберкулеза методом замены / Н.А. Александров. – Саратов, 1975. – 31 с.
- Баласанянц, Г.С. Побочные действия противотуберкулезных препаратов и методы их устранения: Уч. пособие / Г.С. Баласанянц, Д.С. Суханов// СПб., 2014. – 64 с.
- Бальцева, Л.Б Устранение побочных реакций химиотерапии больных туберкулезом легких / Л.Б. Бальцева, Г.В. Мельник, В.П. Манько // Врачебное дело. – 1990. — №4. – С. 71 – 73.
- Баратов, М.О. Зависимость интенсивности эпизоотического процесса туберкулеза от природно–географических условий региона / М.О. Баратов, М.М. Ахмедов, О.П. Сакидибиров // Матер. юбилейной конф., посвящ. 40 – летию со дня создания ГНУ ПЗНИВИ «Основные проблемы ветеринарной медицины и стратегия борьбы с заболеваниями сельскохозяйственных животных в современных условиях». – Махачкала. — 2007. С. 129 – 132.
- Баратов, М.О. Особенности туберкулеза крупного рогатого скота в Республике Дагестан (эпизоотология, диагностика, дифференциальная диагностика и меры борьбы): автореф. дис. ….. докт. вет. наук: 06.02.02/ Баратов Магомед Омарович. – Ставрополь, 2017. – 46 с.
- Баратов, М.О. Эпизоотические особенности туберкулеза крупного рогатого скота в РД / М.О. Баратов, М.М. Ахмедов, О.П. Сакидибиров// Матер. Всерос. науч.-прак. конф., посвящ. 75-летию ДагГАУ «Образование, наука, инновационный бизнес сельскохозяйственных регионов». – Махачкала, 2007. – С. 88 – 92.
- Борисова, М.И. Применение феназида у больных туберкулезом легких с плохой переносимостью изониазида / М.И. Борисова, В.А. Стаханов, Т.И. Шаркова // Проблемы туберкулеза и болезней легких. – 2003. — №7. – С. 34 – 37.
- Бочарова, И.В. Доклинические исследования специфической активности нового противотуберкулезного препарата Тиозонид / И.В. Бочарова // Туберкулез и болезни легких, 2014. — №6 — С. 46-50.
- Васильева, О.А. Оценка влияния противотуберкулезных препаратов на цитохимический статус лимфоцитов in vitro / О.А. Васильева, О.И. Уразова, В.А. Серебрякова и др.// Проблемы туберкулеза. — 2008. — №3. – С 27 – 30.
- Гриценко, Н.С. Кардиотоксический эффект изониазида /Н.С. Гриценко, В.Т. Долгих, В.Г. Сенцов и др.// Медицинский вестник Башкортостана. — 2009. – С. 131 – 134.
- Джупина, С.И. Ветеринарно-технологические принципы полной замены неблагополучных по туберкулезу стад крупного рогатого скота здоровыми животными (Метод. рекомендации)// С.И. Джупина, А.С. Донченко, Ю.И.
- Смолянинов и др.// Новосибирск, 1987. – 10 с.
- Джупина, С.И. Методы оздоровления крупного рогатого скота от туберкулеза /С.И. Джупина// Туберкулез крупного рогатого скота и меры борьбы с ним. Новосибирск, 1986. — С. 3 – 11.
- Джупина, С.И. Методы эпизоотологического исследования и теория эпизоотического процесса: Монография / С.И. Джупина// Новосибирск, 1991. — 138 с.
- Джупина, С.И. Особенности эпизоотической ситуации по туберкулезу и бруцеллезу в Сибири и на Дальнем Востоке и пути оздоровления от этих инфекций / С.И. Джупина// Эпизоотология и меры борьбы с инфекционными болезнями животных. – ВАСХНИЛ, Сибирское отделение. – Новосибирск, 1985. – С. 12 – 19.
- Джусунбеков, А.Д. Методика, организация трудовой терапии и расчет ее экономической эффективности в противотуберкулезных учреждениях: Метод. Рекомендации / А.Д. Джусунбеков, С.Р. Кулаев, А.С. Кунанбеков// Алма-Ата, 1985. – 21 с.
- Доклад ВОЗ о глобальной борьбе с туберкулезом, 2016 г. [Электронный ресурс] Режим доступа: http://www.who.int/tb/publications/global_report/ru/. (дата обращения: 01.08.2017).
- Донченко, A.C. Влияние сочетанного применения вакцины БЦЖ и по-лирибоната на показатели иммунобиологического состояния организма животных / A.C. Донченко, Г.П. Протодьяконова // Сибирский вестник сельскохозяйственной науки. — 2007. — № 10. — С. 64-69.
- Донченко, А.С. Диагностика туберкулеза крупного рогатого скота / А.С. Донченко, Н.П. Овдиенко, Н.А. Донченко // Новосибирск, 2004- 309 с.
- Донченко, А.С. Эпизоотология туберкулеза крупного рогатого скота / А.С. Донченко // Актуальные проблемы эпизоотологии: Тез. докл. — КВИ, 1983. – С. 87 – 88.
- Донченко, Н.А. Применение туберкулостатика ниазона при оздоровлении хозяйств от туберкулеза / Н.А. Донченко, А.А. Колосов, А.С. Донченко // Новые фармакологические средства для животноводства и ветеринарии. – Краснодар, 2001. – С. 183 – 184.
- Донченко, Н.А. Роль туберкулостатических препаратов в системе противотуберкулезных мероприятий / Н.А. Донченко, А.С. Донченко, А.А. Колосов // Актуальные проблемы ветеринарной науки и практики. — Алматы, 2005. –Т.1. –С. 140-144.
- Донченко, Н.А. Туберкулостический препарат ниазон в системе противотуберкулезных мероприятий, обеспечивающих управление эпизоотическим процессом / Н.А. Донченко, А.С. Донченко, А.А. Колосов // Ветеринария Сибири. — 2002. – №7. — С. 8 – 13.
- Донченко, Н.А. Усовершенствование средств и методов диагностики и профилактики туберкулеза крупного рогатого скота / Н.А. Донченко // Автореф. дис. ….. докт. вет. наук. – Новосибирск, 2008. – 36 с.
- Ерохин, В.В. Клинико-морфологические критерии лекарственного гепатита у больных туберкулезом легких / В.В. Ерохин, И.А. Панасек, Н.В. Адамович // Проблемы туберкулеза. – 1991. — №1. – С. 35 – 39.
- Западнюк, И.П. Лабораторные животные. Разведение, содержание, использование / И.П. Западнюк, В.И. Западнюк, Е.А. Захария// Выща шк., Изд. 2. — Киев, 1974. – 304 с.
- Израилова, Г.Г. Обоснование состава и стандартизация лекарственного препарата, содержащего изониазид и рифампицин / Автореф. дис. ….. канд. фарм. наук. – Пятигорск, 2011. – 23 с.
- Инструкция по применению туберкулина очищенного (ППД) для млекопитающих, стандартного раствора» (утв. Заместителя руководителя Россельхознадзора 30.09.2011).
- Инструкция по унифицированным методам микробиологических исследований при выявлении, диагностике и лечении туберкулеза. Утверждена постановлением Министра здравоохранения Российской Федерации №109 от 21 марта 2003 года. Российский съезд фтизиаторов, Москва, 3 – 5 июня 2003 г. / О совершенствовании противотуберкулезных мероприятий в Российской Федерации. – М., 2003. – С. 194 – 309.
- Капков, Л.П. Эпидемическая ситуация по туберкулезу в России и пути ее стабилизации / Л.П. Капков // Вет. патология. – М., 2004. — №1 – 2 (9). – С. 3 – 23.
- Ким, М.Е. Противотуберкулезные лекарственные формы: ассортимент, основные преимущества, перспективы технологического совершенствования / М.Е. Ким, К.Б. Мурзагулова, Э.Ф. Степанова // Фармация и фармакология. — 2016. — №3. – С. 38 – 52.
- Колосов, А.А. Изолированное выращивание здорового молодняка в неблагополучных по туберкулезу хозяйствах / А А Колосов, Н.А. Донченко //АПК Сибири, Монголии и Казахстана в XXI веке — Новосибирск, 2001 — С 215-218.
- Коромыслов, Г.Ф. Научно-организационные основы борьбы с бруцеллезом и туберкулезом сельскохозяйственных животных / Г.Ф. Коромыслов// О мерах усиления борьбы с туберкулезом и бруцеллезом сельскохозяйственных животных. – Алма – Ата, 1983. – С. 55 – 63.
- Коромыслов, Г.Ф. Разработка программ профилактики и ликвидации наиболее опасных болезней животных / Г.Ф. Коромыслов// Тр. ВИЭВ. – М., 1982. – Т.55. – С. 3 – 10.
- Косилов, И.А. Меры борьбы с бруцеллезом и туберкулезом крупного рогатого скота /И.А. Косилов, А.А. Новицкий, А.А. Хайкин и др.// Ветеринария — 1987. — №12. – С. 6 – 10.
- Кузин, А.И. Оздоровление животноводческих хозяйств от туберкулеза / А.И. Кузин. – М.: Россельхозиздат, 1982. – 103 с.
- Лабораторная диагностика туберкулеза. Рекомендации /Госагропром СССР, Всесоюз. НИИ бруцеллеза и туберкулеза животных. – Омск, 1988. – 64 с.
- Лабораторные методы исследований в клинике / Под ред. В.В. Меньшикова. – М.: Медицина, 1987. – 365 с.
- Ли, А.Б. Химиопрофилактика туберкулеза крупного рогатого скота в Узбекистане / А.Б. Ли // Состояние и перспективы научных исследований по диагностике и профилактике туберкулеза и бруцеллеза и меры борьбы с этими болезнями сельскохозяйственных животных: Матер. Всесоюзн. конф. СибНИВИ. – Омск, 1980. – С. 140 – 141.
- Лысов, А.В. О побочных нейротоксических реакциях при химиотерапии туберкулеза и их лечение / А.В. Лысов, А.В. Мордык, В.А. Заворотницкий и др.// Проблемы туберкулеза и болезней легких, 2006. — №6. – С. 45 – 48.
- Мельник, В.М. Социальные и медицинские проблемы туберкулеза в Украине / В.М. Мельник, В.В. Волошина // Проблемы туберкулеза. — 2004. — №3. – С. 7 – 9.
- Меньшикова, Л.А. Фармакокинетическое исследование оригинального лекарственного средства тиазонида/ Автореф. дис. ….. канд. фарм. наук. – Москва, 2016. – 23 с.
- Меркулов, Г.А. Курс патологогистологической техники / Г.А. Меркулов. – Л., Медицина, 1969. – 423 с.
- Методические указания (МУ 1.1.578-96) «Требования к постановке экспериментальных исследований по обоснованию предельно допустимых концентраций промышленных химических аллергенов в воздухе рабочей зоны и атмосферы (утв. Госкомсанэпиднадзором РФ 21.10.1996 г.)
- Методические указания (МУ 2196-80) «К постановке исследований по изучению раздражающих свойств и обоснованию предельно допустимых концентраций избирательно действующих раздражающих веществ в воздухе рабочей зоны» (утв. Минздрав СССР 11.08.1980).
- Методические указания по доклиническому изучению общетоксического действия лекарственных препаратов. – М., 1985. – 83 с.
- Методические указания по изучению эмбриотоксического действия фармакологических свойств и влияние их на репродуктивную функцию. Одобрена фармакологическим комитетом МЗ СССР 10.01.86. и утверждена нач. управления по внедрению новых лекарственных средств и мед. техники МЗ СССР 14.03.86. – 18 с.
- Мироненко, Е.Е. Сравнительное изучение in vitro минимальной ингибирующей способности производных ГИНК против микобактерий / Е.Е. Мироненко // Эпизоотология, диагностика и профилактика туберкулеза и бруцеллеза животных. Сб. науч. тр. ВАСХНИЛ Сиб. отд. ИЭВС и ДВ. – Новосибирск, 1990. – С. 50 – 56.
- Мишин, В.Ю. Контролируемая химиотерапия туберкулеза органов дыхания в современных условиях. Проблема лекарственной устойчивости / В.Ю. Мишин, И.Э. Степанян // Русский медицинский журнал — 2000. — №12. – С. 496 — 498.
- Мишин, В.Ю. Медикаментозные осложнения комбинированной химиотерапии туберкулеза легких / В.Ю. Мишин // М., 2007. – 245 с.
- Мишин, В.Ю. Побочное действие противотуберкулезных препаратов при стандартных и индивидуализированных режимах химиотерапии / В.Ю. Мишин, В.И. Чуканов, Ю.Г. Григорьев// М.: Изд-во «Компьютербург», 2004. – 208 с.
- Мишин, В.Ю. Современные режимы химиотерапии туберкулеза легких, вызванного лекарственно – чувствительными и лекарственно – резистентными микобактериями / В.Ю. Мишин // РМЖ. — 2003. — №21. – С. 1163.
- Мишин, В.Ю. Туберкулез легких с лекарственной устойчивостью возбудителя / В.Ю. Мишин// М., 2009. — 201 с.
- Мишин, В.Ю. Фтизиопульмонология. Учебник / В.Ю. Мишин, Ю.Г. Григорьев, А.В. Митронин и др. // М.: ГЭОТАР – Медиа, 2007. – 504 с.
- Мишина, А.В. Эффективность различных режимов химиотерапии у впервые выявленных больных туберкулезом легких, сочетанным с ВИЧ – инфекцией / А.В. Мишина, И.П. Чернова, В.И. Митрушкина, В.Ю. Мишин // Практическая медицина. — 2012. — №1 (56). – С. 70 – 73.
- Мордык, А.В. Частота и патогенез неблагоприятных побочных реакций на противотуберкулезные препараты / А.В. Мордык// Вестник современной клинической медицины. — 2010. – Т. 3. – Вып. 1. – С. 16 – 21.
- Морозова, Т.И. Эффективность комбинированных химиопрепаратов при лечении больных туберкулезом с высоким риском лекарственной устойчивости / Т.И. Морозова, Л.Е. Паролина, О.Н. Докторова, О.Н. Баринбоим // Вестник современной клинической медицины. — 2013.- Т.6. – Вып. 2. – С. 46 – 51.
- Нуратинов, Р.А. Ареал и видовой спектр микобактерий, вопросы экологии возбудителя туберкулеза в РД / Р.А. Нуратинов, А.А. Султанов, Ф.И. Исламова// Юг России: экология, развитие. — 2011. — №1.- С. 124 – 130.
- Нуратинов, Р.А.. Экологические условия существования популяций микобактерий / Р.А. Нуратинов // Журнал: Юг России: экология, развитие. -2014. — №2. С. 18 — 30.
- Овдиенко, Н.П. Туберкулез как международная и национальная медико-ветеринарная проблема в современных условиях / Н.П. Овдиенко, Н.Г. Толстенко, Н.А. Яременко, П.П. Рахманин и др. // Ветеринарный врач. — 2009. — №2. – С. 14 – 17.
- Овдиенко, Н.П. Эпизоотическая обстановка по туберкулезу крупного рогатого скота в зарубежных странах в начале XXI века/ Н.П. Овдиенко, А.Х. Найманов, И.В. Солодова // Вет. патология. – М., 2004. — №1-2(9). – С. 51 – 54.
- Овчаренко, Л.П. Разработка методики количественного определения изониазида и рифампицина в крови / Л.П. Овчаренко, Е.В. Компанцева, Е.И. Хартюнова и др.// Разработка, исследование и маркетинг новой фармацевтической продукции: Сб. науч. тр.- Пятигорская ГФА. – Пятигорск, 2009. – Вып. 64. – С. 217 – 218.
- Ондар, Э.А. Клинико-социальные аспекты туберкулеза легких у коренного населения Республики Тыва / Э.А. Ондар, А.А. Рудко, А.Г. Матракшин// Проблемы туберкулеза. — 2006. — №1. – С. 45 – 48.
- Ощепков, В.Г. Усовершенствование специфической профилактики и диагностики туберкулеза крупного рогатого скота / В.Г. Ощепков, Н.Н. Кощеев, Р.А. Хамзин и др.// Уч. зап. КГАВМ. – 2013. – Т.216. –С. 102 – 104.
- Перельман, М.И. Фтизиатрия. Национальное руководство / под ред. М.И. Перельмана // М. ГЭОТАР-Медна, 2007. — 512 с.
- Першин, Г.Н. Методы экспериментальной химиотерапии / Г.Н. Першин. – М.: Медицина, 1971. – С. 171 – 195.
- Першин, Г.Н. Определение средней смертельной дозы / Г.Н. Першин // Фармакология и токсикология. – 1950. — №3. – С. 137 – 149.
- Постановление Правительства Российской Федерации № 715 «Об утверждении перечня социально-значимых заболеваний и перечня заболеваний, представляющих опасность для окружающих», 01.12.2004 г.
- Приказ МЗ РФ от 19.06.2003 г., № 267 «Об утверждении правил лабораторной практики».
- Приказ Минздравсоцразвития РФ от 23.08.2010 г., № 708н «Об утверждении Правил лабораторной практики».
- Ротов, В.И. Химиопрофилактика туберкулеза крупного рогатого скота в неблагополучных и условно благополучных хозяйствах / В.И. Ротов, Р.И. Бассараб, Ю.А. Трач // Ветеринария. – 1974. – Вып. 39. – С. 9 – 10.
- Ротов, В.И. Химиопрофилактика туберкулеза крупного рогатого скота / В.И. Ротов, А.И. Супруненко, В.П. Опанасенко и др. // Состояние и перспективы научных исследований по диагностике и профилактике туберкулеза и бруцеллеза и меры борьбы с этими болезнями сельскохозяйственных животных: Матер. Всесоюзн. конф. СибНИВИ. – Омск, 1980. – С. 142 – 144.
- Руководство по проведению доклинических исследований лекарственных средств. – Ч. 1. – М.: Гриф и К, 2012. – С. 568.
- Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ /Под общей редакцией члена-корреспондента РАМН, проф. Р.У. Хабриева. – 2 – изд., перераб. и доп. – М.: Издательство «Медицина», 2005. – 832 с.
- Саджая, Л.А. Биохимическое обоснование путей снижения гепатотоксичности изониазида на основе сочетания с полисахаридами: Автореф. дис. канд. Фарм. Наук / Пятигорская гос. Фарм. Академия. – Пятигорск, 1999. – 21 с.
- Сатторов, С.Ф. Диагностика туберкулеза крупного рогатого скота в общественном и частном секторе / Автореф. дис. ….. канд. вет. наук. – Душанбе, 2012. – 23 с.
- Сафин, М.А. Критерии снятия ограничений по туберкулезу при продолжительном выявлении реагирующего на туберкулин крупного рогатого скота / М.А. Сафин, Ф.Г. Акберов, Р.С. Сибгатуллин// Уч.зап. КГАВМ. – 2002. – С. 110 – 114.
- Сафин, М.А. Современные методы диагностики и меры борьбы с туберкулезом животных / М.А. Сафин, Г.З. Идрисов// Татарское кн. изд-во. – Казань, 1992. – 168 с.
- Смолянинов, Ю.И. Специфическая профилактика туберкулеза у молодняка крупного рогатого скота / Ю.И. Смолянинов, Н.Н. Кощеев // Инфекционная патология животных / Сб. науч. тр. ВНИИБТЖ. – Омск, 2001. – С. 168 – 170.
- Смолянинов, Ю.И. Экономика и организация противотуберкулезных мероприятий в животноводстве /Ю.И. Смолянинов, А.С. Донченко, И.В. Игнатенкова // Новосибирск, 2006. — 148 с.
- Смолянинов, Ю.И. Экономическая эффективность оздоровительных мероприятий при туберкулезе крупного рогатого скота в Центральном федеральном округе России / Ю.И. Смолянинов, С.В. Лопунов // Диагностика, профилактика и лечение болезней животных: Сб. науч. Тр./ Россельхозакадемия. Сиб. отд-ние. ИЭВСиДВ. – Новосибирск, 2008. – С. 48 – 52.
- Смолянинов, Ю.И. Экономическое значение туберкулеза крупного рогатого скота в Российской Федерации / Ю.И. Смолянинов, А.С. Донченко, В.Ф. Бордюг и др.// Научные основы обеспечения защиты животных от экотоксикантов, радионуклеидов и возбудителей опасных инфекционных заболеваний. – Казань, 2005. – Ч.2. – С. 320 – 325.
- Смолянинов, Ю.И. Эпизоотологическое обоснование оздоровления ферм крупного рогатого скота от туберкулеза методом замены поголовья /Ю.И. Смолянинов, Н.А. Шкиль// Туберкулез крупного рогатого скота и меры борьбы с ним. – Сб. науч. тр. ВАСХНИЛ. Сибирское отделение. – Новосибирск, 1986. – С. 39 – 45.
- Степанян, И.Э. Эпидемическая ситуация по туберкулезу в России / И.Э. Степанян, В.В. Пунга, М.А. Якимова, В.В. Ерохин // Вестник Российского государственного медицинского университета. — 2013. — № 5. – С. 101 – 105.
- Степанян, И.Э. Эпидемическая ситуация по туберкулезу в России / И.Э. Степанян, В.В. Пунга, М.А. Якимова, В.В. Ерохин // Вестник Российского государственного медицинского университета. — 2013. — № 5. – С. 101 – 105.
- Титаренко, Л.В. Медико-организационные мероприятия профилактики туберкулеза легких у работников железнодорожного транспорта /Л.В. Титаренко// Автореф. дис. ….. канд. мед. наук. – Москва, 2011. – 24 с.
- Урбан, В.П. Современные проблемы эпизоотической науки в связи со специализацией, концентрацией и переводом животноводства на промышленную основу / В.П. Урбан // Актуальные проблемы эпизоотологии. – Казань, 1983. – С. 3- 4.
- Ушакова, В.А. Обоснование состава и стандартизация лекарственного препарата, содержащего изониазид и этамбутола гидрохлорид / Автореф. дис. ….. канд. фарм. наук. – Пятигорск, 2007. – 26 с.
- Фисенко, В. Противотуберкулезные средства: принципы действия, побочные эффекты и перспективы создания новых лекарственных препаратов / В. Фисенко // Врач. — 2006. №12. – С.30 – 35.
- Хаертынова, И.М. Совершенствование ранней диагностики туберкулеза и особенности его течения у больных ВИЧ – инфекцией / И.М. Хаертынова // Автореф. дис. ….. докт. мед. наук. – Москва, 2008. – 43 с.
- Хазипов, Н.З. Туберклез крупного рогатого скота / Н.З. Хазипов, М.А. Сафин, Г.З. Идрисов// КГАВМ. –Казань, 1997. – 176 с.
- Хайкин, Б.Я. Комбинированный метод применения тубазида и вакцины БЦЖ в профилактике туберкулеза животных / Б.Я. Хайкин // Состояние и перспективы научных исследований по диагностике, профилактике туберкулеза и бруцеллеза и меры борьбы с этими болезнями сельскохозяйственных животных: Матер. Всесоюзн. науч. конф. СибНИВИ. – Омск, 1980. – С. 148 – 152.
- Хайкин, Б.Я. Лабораторная диагностика туберкулеза. Рекомендации / Б.Я. Хайкин, Н.М. Колычев: – Госагропром СССР. Всесоюзный НИИ бруцеллеза и туберкулеза животных. Омск, 1988. – 65 с.
- Хайкин, Б.Я. Эффективность нового противотуберкулезного препарата при экспериментальном туберкулезе телят / Б.Я. Хайкин, А.Н. Литовченко, А.И. Сливкин и др. // Разработка средств и методов борьбы с туберкулезом животных. Сб. науч. тр. ВАСХНИЛ. – Новосибирск, 1990. – С. 64 – 70.
- Хамзин, Р.А. Совершенствование диагностики, профилактики и мер ликвидации туберкулеза крупного рогатого скота в зоне длительного неблагополучия: автореф. дис. ….. докт. вет. наук: 16.00.03/ Хамзин Рафат Асванович. – Казань, 2006. – 40 с.
- Хожиматов, Х.О. Туберкулез, как глобальная медико-социальная проблема / Х.О. Хожиматов // Актуальные проблемы гуманитарных и естественных наук. — 2014. — № 5. – С.211 – 213.
- Шебанов, Ф.В. Туберкулез /Ф.В. Шебанов// М.: Медицина, 1976. – 464 с.
- Шилова, М.В. Туберкулез в России в 2004 году / М.В. Шилова // М., Форум, 2005. – 108 с.
- Шуршуков, Ю.Ю. Мониторинг состояния здоровья сельского населения Липецкой области / Ю.Ю. Шуршуков, В.Х. Мурузов // Проблемы социальной гигиены, здравоохранения и истории медицины. — 2006. — №1. — С. 4445.
- Щеткин, А.А. Влияние изониазида на организм крупного рогатого скота / А.А. Щеткин // Фармакорегуляция физиологических процессов высокопродуктивных животных. Сб. науч. тр. МВА, 1983. – С. 118 – 120.
- Healing T. TB across the globe Tuberculosis in Russia / T. Healing, G. Peremetin, T. Lyagoshina et al. // Scot Med. J. -2000. -V. 45. — P. 14 — 15.
- Heifets L. Drug susceptibility testing of Mycobacterium tuberculosis a neglected problem at the term of the century 11 Int. J. / L. Heifets, G. Cangelosi/ Tuberc. Lung Dis. — 1999. -V. 3. — P. 564 — 581.
- Muhlberger G. Ofloxacin-cycloserin-prothionamide-INH combination against treatment refractory lung tuberculosis // Pneumologie. 1995. — V. 49. — P. 72 — 76.
- Oxlade O. Глобальные тенденции заболеваемости туберкулезом: отражение перемен в противотуберкулезной работе или в состоянии здоровья населения /O. Oxlade, K. Schwartzman, M.A. Belir, A. Benedetti et al.// Международный журнал «Туберкулез и легочные заболевания», 2011. — №1. – Т. 2. – С. 107 – 119.
- Pfyffer G. Multidrug-resistant tuberculosis in prison inmates, Azerbaijan /G. Pfyffer, A. Strassle, Т. Gorkum et al. // Emerg. Infect. Dis. — 2001. -V. 7.-P. 855 — 861.
- Torossian A. A prospective study of multiple drug-resistant tuberculosis in Plovdiv region, Bulgaria 1989-2004 / A. Torossian, I. Gaidarova, V. Hodger // Europ. Respir. J. — 2006. — V. 28.- Suppl. 45. — P. 45.
- Toungoussova O.S. Drug resistance of Mycobacterium tuberculosis in the Archangels, Russia / O.S. Toungoussova, D.A. Caugant, P. Sandven et al. // Int. J. Tuberc. Lung Dis. — 2002. -V. 6. — P. 405-414.
- Zhang Y. Механизмы развития лекарственной устойчивости у Mycobacterium tuberculosis / Y. Zhang, W. Yewt // Туберкулез и легочные заболевания. — 2011. — №1. – Т. 2. – С. 7 – 20.
- Zignol M. Global incidence of multidrug-resistant tuberculosis / M. Zignol, M.S. Hosseini, A. Wright, et al. // J Infect Dis. — 2006. — V. 194. – P. 479– 485.
- Zolotarev Yu.A. Solid State Isotope Exchange with Spillover Hydrogen in Organic Compounds/Yu.A. Zolotarev, A.K. Dadayan, Yu.A. Borisov//. Chemical Reviews.- 2010. – P. 5425-5446.

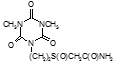
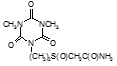
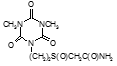
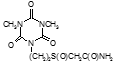
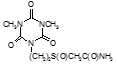
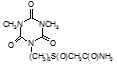
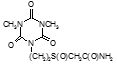
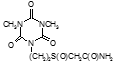
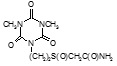
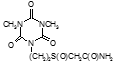
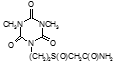
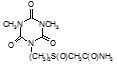
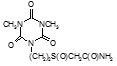
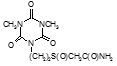
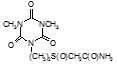
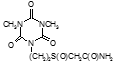
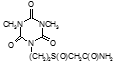
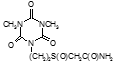
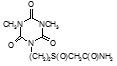
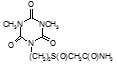
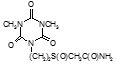
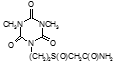
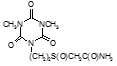
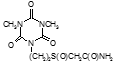
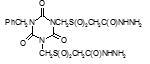
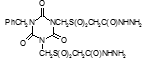 27
27