Титульный лист и исполнители
Отчет 131 с., 1 кн., 37 рис., 37 табл., 208 источн., 5 прил.
ПТИЦЕВОДСТВО, СТРЕСС КУР, АНТИСТРЕССОВЫЕ ПРЕПАРАТЫ, КОРМОВЫЕ ДОБАВКИ, ИНФЕКЦИОННЫЕ БОЛЕЗНИ ПТИЦ, ВАКЦИНАЦИЯ, ПЕРЕКИСНОЕ ОКИСЛЕНИЕ ЛИПИДОВ, АНТИОКСИДАНТНАЯ СИСТЕМА ОРГАНИЗМА
Объектом исследования являются адаптационные реакции организма кур и цыплят яичного и мясного направления продуктивности на фоне применения фармакологического комплекса СПАО и кормовой добавки СПАО-КД.
Цель исследований – разработка и испытание фармакологических средств и кормовых добавок для профилактики стрессов на птицефабриках промышленного типа с целью повышения эффективности вакцинации кур и цыплят мясного и ячного направления продуктивности.
Научная, научно-техническая и практическая ценность результатов: создание безопасных и эффективных фармакологических средств, кормовых добавок и схем их применения позволяет эффективно профилактировать технологические стрессы, которые оказывают негативное влияние на иммунную и антиоксидантную систему организма птиц, что в конечном итоге проявляется в виде снижения эффективности вакцинаций, снижения сохранности и воспроизводительных качеств и способствует развитию инфекционных заболеваний. Представленные в работе разработанные схемы и фармакологические средства целесообразно использовать на птицефабриках промышленного типа яичного и мясного направления продуктивности. В результате исследований разработаны и испытаны фармакологическое средство СПАО-комплекс и кормовая добавка СПАО-КД с целью профилактики стрессов кур. Использование данных антистрессовых средств, обладающих антиоксидантной активностью позволяет снизить иммуносупрессивное влияние гипоталамо-гипофизарной-надпочечниковой системы в период развития адаптационных реакций у птиц в условиях промышленных стрессов.
Результаты исследований внедрены в производственную деятельность ООО “Бизнес Фуд Сфера” (Белгородская область); в производственную деятельность Уральского филиала ООО «ЛОМАНН БРИДЕРС РУС» (Челябинская область, с. Еманжелинка); в производственную деятельность ООО «Воловский бройлер» (Тульская область, п. Волово); в производственную деятельность СПК «Гайская Птицефабрика» (Оренбургская область, г. Гай); в производственную деятельность ООО «Нагайбакский птицеводческий комплекс» СИТНО (Челябинская область, г. Магнитогорск), что подтверждается соответствующими актами внедрения
Практические предложения. Для повышения эффективности вакцинаций против инфекционных болезней кур и цыплят мясного и ячного направления продуктивности рекомендуем применение антистрессового фармакологического средства СПАО-комплекс с водой в дозе 185 мг/кг массы тела в течение 5 дней за 3 дня до вакцинации, в день вакцинации и один день после вакцинации. Разработанный фармакологический комплекс можно изготовить в условиях ветеринарной аптеке по рецепту, мас.%: цитрат лития – 10; аскорбиновая кислота – 15; янтарная кислота – 10; бутафосфан — 30; L-карнитин тартрат — 15; глюкоза – остальное до 100.
При необходимости использования кормовой добавки рекомендуем с целью профилактики вакцинальных стрессов использование кормовой добавки СПАО-КД в составе комбикорма в дозе 185 мг/кг массы тела в течение 5 дней за 3 дня до вакцинации, в день вакцинации и один день после вакцинации. Разработанная кормовая добавка может быть изготовлена в условиях ветеринарной аптеки, комбикормового завода и цеха по производству кормов по рецепту, мас.%: карбонат лития – 7,6; аскорбиновая кислота – 15; янтарная кислота – 10; бутафосфан — 30; L-карнитин тартрат — 15; глюкоза – остальное до 100.
Использование разработанных антистрессовых средств, обладающих антиоксидантной активностью позволяет снизить иммуносупрессивное влияние гипоталамо-гипофизарной-надпочечниковой системы в период развития адаптационных реакций у птиц в условиях вакцинальных и других промышленных стрессов и повысить эффективность вакцинопрофилактики инфекционных заболеваний за счет повышения уровня антител и их однородности, повысить сохранность и продуктивность кур и цыплят разного возраста и направлений продуктивности.
В настоящем отчете о НИР применяют следующие термины с соответствующими определениями:
Антиоксидантная система защиты организма — совокупность механизмов, которые тормозят аутоокисления в клетке.
Иммуноферментный анализ — лабораторный иммунологический метод качественного или количественного определения различных низкомолекулярных соединений, макромолекул, вирусов и пр., в основе которого лежит специфическая реакция антиген-антитело. Выявление образовавшегося комплекса проводят с использованием фермента в качестве метки для регистрации сигнала.
Перекисное окисление липидов — окислительная деградация липидов, происходящая, в основном, под действием свободных радикалов.
Соли лития — лекарственные средства из группы нормотимиков, при применении людям имеют важнейшее значение в лечении аффективных расстройств, прежде всего маниакальных и гипоманиакальных фаз биполярного расстройства, в животноводстве малоизучены.
Комплексное лекарственное средство — лекарственное средство для животных, содержащее более одного действующего вещества.
Стресс — совокупность неспецифических адаптационных реакций организма на воздействие различных неблагоприятных факторов–стрессоров (физических или психологических), нарушающее его гомеостаз, а также соответствующее состояние нервной системы организма. Стрессоры через нервную и эндокринную систему вызывают морфологические и функциональные изменения в органах и тканях, обуславливая повышенную потребность в питательных и биологически активных веществах, необходимых для формирования адаптационных механизмов.
ПЕРЕЧЕНЬ СОКРАЩЕНИЙ И ОБОЗНАЧЕНИЙ
АКТГ – адренокортикотропный гормон
АлАТ — аланинаминотрансфераза
АО – антиоксидантная (система защиты организма)
АсАТ – аспартатаминотрансфераза
Г/Л — гетерофилы/лимфоциты
ГАМК- гамма аминомасляная кислота
ДК – диеновые конъюгаты (первичные продукты ПОЛ).
Е.И.О. – единицы индекса окисления.
ЕДоп / г белка – единицы оптической плотности на 1 г белка.
ИББ — инфекционная бурсальная болезнь птиц
ИБК — инфекционный бронхит кур
ИФА – иммуноферментный анализ
КБ (карбонилированные белки) – производные, динитрофенилгидразоны (ДФГ) – продукты взаимодействия карбонилированных белков.
КБ1 — аАДФГ — алифатические альдегид-динитрофенилгидразоны.
КБ2 — аКДФГ н — алифатические кетон-динитрофенилгидразоны нейтрального характера.
КБ3 — аКДФГ осн — алифатические кетон-динитрофенилгидразоны основного характера.
КВ (CV) – коэффициент вариации
КДиСТ – кетодиены и сопряженные триены (вторичные продукты ПОЛ).
МПВИ — метапневмовирусная инфекция
НБ — ньюкаслская болезнь
ОМБ – окислительные модификации белков
ОП – оптическая плотность.
ПОЛ — перекисное окисление липидов
ПОЛ – перекисное окисление липидов.
РВТ — реовирусный теносиновит
РТГА — реакция торможения гемагглютинации
СГБК — синдром гидроперикардита кур (СГПК)
СОД – супероксиддисмутаза
СПАО – стресс-протектор антиоксидант
ССЯ — синдром снижения яйценоскости
ШО – шиффовы основания (конечные продукты ПОЛ).
ВВЕДЕНИЕ
Ключевыми понятиями для развития птицеводства сегодня и на перспективу являются эффективность и биобезопасность [1]. Получить высокие показатели продуктивности и качества продукции можно только от здоровой птицы, поэтому в современном, крупномасштабном птицеводстве особую роль играют инновации в области ветеринарной науки. Процессы изменения экологии, природы возбудителей и болезней, появление новых биоценозов требуют сегодня более тщательного научного анализа и обобщения [2].
О стрессах и их роли в снижении продуктивности и воспроизводительных качеств сельскохозяйственных птиц получено много фактов, тем не менее, каждый год появляются все новые и новые научные данные о том, что последствия стрессов гораздо глубже, чем ранее считалось [3,4]. Стало понятным, что адаптация организма к стрессу сопряжена с целой цепочкой молекулярных событий, которая ведет к включению одних генов и выключению других. Это дает возможность организму максимально использовать все имеющиеся резервы с тем, чтобы выйти из стресс-ситуации с минимальными потерями [1,5].
В плане инноваций важнейшая проблема – иммунитет, данный вопрос требует комплексного скоординированного решения, ибо иммунная система является, вероятно, одной из самых сложных в организме и, несмотря на несомненные успехи в области иммунологии, мы еще не можем с уверенностью сказать, как происходит регуляция иммунной системы на молекулярном уровне, именно поэтому в условиях стресса иммунная система страдает, как правило, первой [2,6].
При выращивании птицы серьезную проблему представляют инфекционные заболевания вирусной и бактериальной этиологии. Основной метод защиты поголовья птицефабрик связан с вакцинацией. При этом эффективность проводимых ветеринарных мероприятий в полной мере зависит от состояния иммунной системы организма птиц. Однако в современных условиях производства негативное влияние техногенных факторов способствует развитию иммунодефицитных состояний, что влечет снижение эффективности вакцинации и приводит к «прорыву» иммунитета у птицы. [7].
Кроме вакцинаций профилактика инфекционных заболеваний обязательно включает ветеринарно-санитарные мероприятия, кормление птицы полноценными и безопасными в отношении патогенных микроорганизмов, грибов и продуктов их жизнедеятельности кормами, снижение уровня и количества стрессов, использование витаминно-минеральных препаратов, пробиотиков, пребиотиков, фитопрепаратов, препаратов, поддерживающих иммунную систему и антистрессовых средств [8].
При проведении вакцинопрофилактики следует учитывать многочисленные факторы, снижающие эффективность вакцинации в том числе иммунодепрессивные состояния организма, обусловленные в том числе стрессами [9,10].
Реакция на физиологический стресс начинается, когда мозг обнаруживает гомеостатическую проблему и активирует симпатическую нервную систему, которая выделяет катехоламины, адреналин и норадреналин. Затем следует более медленная активация гипоталамо-гипофизарно-надпочечникового системы: гипоталамическая секреция кортикотропин-рилизинг-гормона, что запускает гипофизарную секрецию адренокортикотропного гормона, которая затем стимулирует секрецию глюкокортикоидов надпочечниками. Эффекты кортизола и кортикостерона не всегда идентичны эффектам стресса. Разнообразие регуляторных систем и механизмов может выражаться не совсем предсказуемым эффектом, более того, функционирование гипоталамо-гипофизарно-надпочечниковой системы демонстрирует огромную индивидуальную изменчивость — это факт, который помогает объяснить значительные индивидуальные различия в уязвимости к болезням, связанными со стрессом [11].
В этом процессе основное внимание в теоретическом и что очень важно в практическом аспектах в контексте текущего исследования должно быть сосредоточено на влиянии глюкокортикоидных гормонов и стресса на иммунитет и на воспалительную реакцию [12-14]. В настоящее время доказано, что вызванная стрессом инволюция тимуса, впервые отмеченная Г. Селье, вызвана кортикостерон-индуцированным апоптозом в незрелых Т-клетках [15]. Кроме того, хроническое воздействие глюкокортикоидов подавляет как врожденный, так и адаптивный иммунитет, доказано, что длительное воздействие глюкокортикоидных гормонов снижает количество циркулирующих лейкоцитов и снижает выработку большого количества провоспалительных цитокинов, включая IL-1β (Интерлейкин 1, бета) и TNF-α (фактор некроза опухоли-альфа) [16,17].
В период развитии стрессовой реакции кортикостерон подавляет такие физиологические процессы как размножение, рост и пищеварение. Развивающаяся иммунологическая реакция или инфекционное заболевание сами по себе является стрессорами, при этом эти процессы могут происходить на фоне развития стрессов, таким образом, дополнительно снижая иммунологическую активность и резистентность организма, данный процесс из звена адаптации превращается в дезадаптивный фактор развития иммунодефицита. Последующие исследования показали, что до высвобождения кортикостерона защитная функция системы иммунитета на самом деле увеличивается – это происходит только на ранней стадии реакции на стресс. Это привело к теории, утверждающей, что секреция кортикостерона в период развития стресса фактически опосредует восстановление после этой начальной иммунной активации, если высвобождение кортикостерона нарушено, организм может страдать от нарушений чрезмерной иммунной активации, вызывая некоторые аутоиммунные нарушения [18-20].
Следует обязательно учитывать, что на молекулярном уровне отрицательное действие стрессов опосредовано через избыточное образование свободных радикалов, повреждающих все типы биологических молекул. Таким образом, взяв под контроль образование радикалов в клетке удается достичь положительного эффекта в снижении отрицательного действия, как средовых, так и кормовых и внутренних стрессов. В последние годы всё больше внимания уделяется негативным последствиям окисления белков клеточных структур, также, как и последствиям окислительных изменений в структуре ДНК. При этом особое место занимают исследования по разработке эффективных препаратов комплексного действия, помогающих свести до минимума отрицательные последствия стрессов [1,2].
Цель исследований – разработка и испытание фармакологических средств и кормовых добавок для профилактики стрессов на птицефабриках промышленного типа с целью повышения эффективности вакцинации кур и цыплят мясного и ячного направления продуктивности.
Научная, научно-техническая и практическая ценность результатов: создание безопасных и эффективных фармакологических средств, кормовых добавок и схем их применения позволяет эффективно профилактировать технологические стрессы, которые оказывают негативное влияние на иммунную и антиоксидантную систему организма птиц, что в конечном итоге проявляется в виде снижения эффективности вакцинаций, снижения сохранности и воспроизводительных качеств и способствует развитию инфекционных заболеваний. Представленные в работе разработанные схемы и фармакологические средства целесообразно использовать на птицефабриках промышленного типа яичного и мясного направления продуктивности.
Результаты исследований внедрены в производственную деятельность ООО “Бизнес Фуд Сфера” (Белгородская область); в производственную деятельность Уральского филиала ООО «ЛОМАНН БРИДЕРС РУС» (Челябинская область, с. Еманжелинка); в производственную деятельность ООО «Воловский бройлер» (Тульская область, п. Волово); в производственную деятельность СПК «Гайская Птицефабрика» (Оренбургская область, г. Гай); в производственную деятельность ООО «Нагайбакский птицеводческий комплекс» СИТНО (Челябинская область, г. Магнитогорск), что подтверждается соответствующими актами внедрения (приложения 1-5).
1. Обзор литературы
За последнее время накопилось немало фактического материала о стрессе, о его роли организме яичной и мясной птицы. С каждым годом данных становится больше, что позволяет глубже узнать о его причинах и последствиях. Птица современных кроссов имеет высокий генетический потенциал, который не всегда может быть реализован по причине стресса. Интенсивный производственный процесс обуславливает стрессирование птицы на различных этапах. [21,22] Стресс может приводить как к положительным, так и к отрицательным последствиям в зависимости от его характера и продолжительности [23]
Стресс в производственных условиях отрицательно влияет на формирование иммунного статуса птицы и на продуктивные признаки. Например, при переводе птицы из одного корпуса в другой, происходит снижение массы тела на 10-15%, а вакцинация живыми вакцинами приводит к снижению живой массы на 9%. Стресс обуславливает гипертрофию корковой зоны надпочечников и уменьшение аскорбиновой кислоты в ее тканях, инволюцию селезенки, фабрициевой сумки, ткани тимуса. При стрессе у птицы наблюдаются высокая возбудимость, беспокойство, частое сердцебиение, дыхание, потеря аппетита. Это в свою очередь ведет к снижению продуктивных признаков, худшему качеству мяса или отходу. [24-32]
Стресс промышленной птицы яичного и мясного направления может быть вызван разными факторами: плотная посадка, смена рациона, недостаток питания или его отсутствие, отлов с целью вакцинации, инфекционный фон, воздействие микотоксинов и прочие [33-35]
Стрессы в производственных условиях могут быть различными – психические, экспериментальные, травматические, биологические, технологические, транспортные, кормовые, химические, физические [36]. Физические факторы включают в себя превышение уровня шума, влажность, изменение в световом режиме, а также воздействие солнечной и ионизирующей радиации. Для оптимального процента яйценоскости необходима температура в помещении 21-22 °С. Процент яйценоскости снижается в случае, если температура снижается или повышается на 7 °С. Существует также норма шума в птичниках, при его повышении птица находится в угнетенном состоянии и продуктивность ее снижается. [37-39]. К химических факторам относятся превышающее норму содержание сероводорода, углекислоты, аммиака. Также очень для исключения стресса необходимо достаточная концентрация кислорода в воздухе. [40-41] Кормовые факторы, вызывающие стресс у птицы – недостаток или переизбыток кормов, смена рациона, резкое изменение питательной ценности, отсутствие воды в системе поения. Транспортные факторы – любое перемещение птицы, а также агрессивная погрузка. Транспортный стресс может усугубляться дополнительными факторами, например кольцеванием. [43-45] Технологический стресс связан с любыми технологическими процессами, происходящими в условиях производства. [46-47] Ветеринарные манипуляции, к которым относятся вакцинации, — это дополнительный стресс. В качестве сильного ветеринарного фактора может выступать высокореактогенная вакцина [48] Расклевы, дебикирование, обрезка гребня, намины относятся к травматическим факторам. [49-51] Существуют психологические факторы стресса, которые обеспечиваются борьбой за лидерство, конкурентной борьбой. [52-53].
Адаптация к стрессовым факторам обуславливается молекулярными событиями, что дает возможность организму максимально использовать все резервы для cснижения последствий стресса [54].
Свободнорадикальная теория стрессов – это основа для изучения молекулярной цепочки прогрессирования стресса. «Свободные радикалы — это активированные молекулы кислорода, которые способны наносить вред всем типам биологических молекул, включая липиды, белки и нуклеиновые кислоты» [55]. Процессы ПОЛ сильно активируются в условиях стрессовой реакции. [56] Нарушение прооксидантно-антиоксидантного равновесия служит первым звеном в развитии стрессовых реакций и выступает в качестве пускового механизма адаптации организма. Продукты ПОЛ выступают в качестве как индукторов, так и первичных медиаторов стресса. [57-59] Количество перекиси в мембарне клетки поддерживается на одном уровне. Процессы образования и утилизации перекисей свойственны всем нормально функционирующим метаболизирующим клеткам [60] ПОЛ в клетке функционирует постоянно за счет антиоксидантной системы. Равновесие между ПОЛ и антиоксидантной активностью служит обязательным условием. [61]
Известно, что при стрессе происходит увеличение уровня интерлейкинов, которое обусловлено развитием воспалительной реакции организма. Стресс может вызывать изменения в регуляции иммунной системы путем увеличения активности интерлейкинов, а именно IL-6, который является основным медиатором воспалительных и иммунных реакций. Если в лабораторных условиях интерлейкин-6 подавляет выработку IL-1β и TNFα на уровне транскрипции генов, то в естественной среде при кратковременном иммобилизационном стрессе, который вызывает усиление синтеза мРНК интерлейкина-6, нивелируется эффект подавления кортикостерона на продукцию IL-1β, что увеличивает провоспалительные механизмы. Использование методов диагностики, которые разработаны в последнее время и основаны на анализе индикаторов иммунной системы птиц например, экспрессии генов провоспалительных цитокинов IL-1β, IL-6, белков теплового шока HSP-70 и лизоцима недостаточно изучены и в условиях промышленного птицеводства не могут быть применены [62-65].
Для повышения эффективности вакцинаций применяются различные фармакологические средства в большинстве своем, представленные иммуностимуляторами, иммуномодуляторами и аминокислотами. Описан способ, включающий использование иммунотропного препарата ПВ-1 (Semenov V.G. et. al, 2019). Иммунизация птиц с применением иммунотропного препарата ПВ-1 сопровождается повышением эффективности вакцинации против болезни Гамборо титры специфических антител увеличиваются на 53,3%, при болезни Ньюкасла на 50,0%, а при синдроме снижения яйценоскости на 26,5% [66].
Известен способ (Xu Y. et. al, 2018), включающий использование аргинина, что приводит к повышению сывороточных концентраций гормона роста, инсулиноподобных факторов роста-1, инсулина, IgA и IFN-g (гамма-интерферона), а также массы тимуса. Метод позволяет повысить уровень титров антител к болезни Ньюкасла и концентрацию IgM в сыворотке крови [67].
По данным Балашова В.В., 2014 результаты оценки функционального состояния отдельных звеньев иммунной системы цыплят показали, что препарат Ветостим обладает выраженным иммунокорригирующим действием и оказывает стимулирующее влияние на формирование поствакцинального иммунитета цыплят-бройлеров и индюшат, повышая титр антител при вакцинации их против Ньюкаслской болезни и инфекционного бронхита кур. Ветостим представляет собой смесь белков цитокинового ряда и рибонуклеиновых кислот различной структуры, включая информационные и двуцепочечные формы, находящиеся в сбалансированных концентрациях. Ветостим оказывает иммуномодулирующее действие, направленное на активацию макрофагального звена иммунитета. Препарат регулирует биосинтез активных веществ, контролирующих иммунные реакции, активирует фагоцитарную активность лейкоцитов, повышает устойчивость организма к воздействию различных повреждающих факторов. Механизм действия Ветостима обусловлен его способностью воздействовать на функциональное состояние макрофагов, восстанавливать пролиферативные функции Т-лимфоцитов, стимулировать синтез интерферона [68].
Таким образом, повышение эффективности вакцинаций является ключевым фактором обеспечения биобезопасности птицеводческих предприятия и высокой эффективности отрасли в целом. В настоящее время совместно с вакцинами применяются иммуностимуляторы разных фармакологических групп, непосредственно оказывающие влияние на отдельные звенья иммунной системы животных. Перспективным направлением видится использование антистрессовых средств, обладающих антиоксидантной активностью позволяющих снизить иммуносупрессивное влияние гипоталамо-гипофизарной-надпочечниковой системы в период развития адаптационных реакций у птиц в условиях промышленных стрессов.
2. СОБСТВЕННЫЕ ИССЛЕДОВАНИЯ
2.1 Материалы и методы исследований
Научные исследования были проведены в соответствии с тематическим планом-заданием на выполнение научно-исследовательских работ федеральным государственным бюджетным образовательным учреждением высшего образования ФГБОУ ВО «Южно-Уральский государственный аграрный университет» по заказу Минсельхоза России за счет средств федерального бюджета в 2019 году и темой кафедры морфологии, физиологии и фармакологии ФГБОУ ВО «Южно-Уральский государственный аграрный университет» «Антистрессовый ростостимулирующий комплекс для промышленного птицеводства» номер государственной регистрации№ 114092340076.
Экспериментальная часть работы проведена в соответствии с «Правилами проведения работ с использованием экспериментальных животных», которые утверждены Приказом МЗ СССР № 755 от 12.08.77 г. Все опыты были проведены согласно принципов гуманности, которые изложены в директиве 2010/63/EU Европейского парламента и Совета Европейского Союза от 22 сентября 2010 года по охране животных, используемых в научных целях [69].
Экспериментальная часть работы выполнялась в период с 2018 по 2019 гг. на кафедре физиологии и фармакологии, лаборатории и виварии инновационного научно-исследовательского центра ФГБОУ ВО «Южно-Уральский государственный аграрный университет». Исследования на птице мясных кроссов осуществлялись в ООО “Бизнес Фуд Сфера” (Белгородская область) и ООО «Нагайбакский птицеводческий комплекс» СИТНО (Челябинская область, г. Магнитогорск). Эксперименты на яичном кроссе Lohmann осуществлялись на базе плменного репродуктора I порядка в условиях Уральского филиала ООО «Ломанн Бридерс Рус» (Челябинская область, с. Еманжелинка).
Наличие маркеров антиоксидантной системы и активности окислительной модификации белков в плазме крови у птицы проводили в клинико-диагностической лаборатории Южно-Уральского государственного медицинского университета.
Изученные нами ранее закономерности адаптационных реакций организма кур и цыплят при промышленном содержании позволяют сделать вывод, что наиболее стрессогенными являются: транспортировка, дебикирование, вакцинации и перевод из цеха выращивания ремонтных цыплят в цех родительского стада. Данные технологические операции вызывают серию физиологических изменений у птицы, которые характеризуются повышением уровня глюкокортикоидных гормонов, соотношения гетерофилов к лимфоцитам, снижением массы тела и фертильности кур. Степень вариабельности изученных физиологических процессов может характеризовать их как стресс-реакции или как технологические стрессы. В связи с этим в текущей для активации неспецифических адаптационный реакций и стрессовой реакции нами использованы естественные раздражители, встречающиеся на птицефабриках промышленного типа: транспортировка, дебикирование, вакцинации и перевод из цеха выращивания ремонтных цыплят в цех родительского стада.
Полученные ранее результаты использования СПАО-комплекс в период развития технологических стрессов при промышленном содержании кур и цыплят позволяет повысить адаптационные возможности их организма, снизить смертность и уровень физиологических отклонений, повысить среднесуточный прирост массы тела. Доказательством усиления адаптационных ресурсов организма птицы под действием «СПАО-комплекс» является изменение соотношения гетерофилов к лимфоцитам. После транспортировочного воздействия соотношение гетерофилов к лимфоцитам крови повысилось в 3,7 раз во время применения «СПАО-комплекс» только в 2 раза. При условии применения СПАО-комплекс показатель уже на вторые сутки доходит до начальных значений в отличии от птицы контрольной группы, где соотношение гетерофилов к лимфоцитам даже через 7 дней повышается на 23,5 % и соответствует среднему уровню активизации адаптационных механизмов. На фоне применения литийсодержащего фармакологического средства отмечаются более низкие уровни кортикостерона в ответ на действие раздражителей в пробах крови в 2,7 раз, в экстрактах помета на 22,3 %.
Технологические переводы кур сопровождаются страхом и связанным с ним эмоциональным стрессом, подкрепляемым неопределенностью среды, формированием новых иерархий соподчиненности и болевым воздействием от внутримышечной вакцинации. Исследования во времени для опытной и контрольной групп указали на сокращение времени для перевода при применении «СПАО-комплекс». Временные затраты для перевода в контрольной группе составили 502,50±33,23 минут, при применении фармакологического комплекса СПАО 397,50±7,78 минут. Данный эффект предположительно связан с нормализацией процессов возбуждения и торможения в центральной нервной системе под действием литийсодержащего фармакологического средства.
После перевода содержание креатинина в сыворотке крови птицы увеличивается в 1,9 раз, мочевина возрастает на 53,1%, концентрация холестерина возрастает на 22,0%, уровень глюкозы повышается на 41,4%. В ходе развития стрессовой реакции в организме действие препарата «СПАО-комплекс» действует на снижение катаболизма белков, а именно снижает уровень креатинина на 35,3% и мочевины на 78,9%.
Опытные партии фармакологических комплексов и кормовых добавок изготавливались в условиях лаборатории инновационного научно-исследовательского центра благодаря перемешиванию компонентов комплекса, их дробления и оценки стабильности полученной смеси. Каждая полученная опытная партия подвергалась внутреннему контролю качества (контроль растворимости, оценка токсичности на белых лабораторных мышах и суточных цыплятах). При постановке опыта использовались различные методы исследований: клинические, фармакологические, биохимические, иммунологические, морфологические, токсикологические, физико-химические.
По данным исследований, проведенных в последние годы А.В. Мифтахутдиновым, А.А. Терман, Д.Е. Аносовым, В.В. Пономаренко, А.С. Митрохиной (2013-2018) была определена оптимальная эффективная терапевтическая доза «СПАО-комплекс», которая составила 185 мг/кг массы тела при применении схемы дачи препарата с водой за двое суток до, в день воздействия и в течение двух дней после воздействия стрессирующего фактора.
«СПАО-комплекс» (Стресс-протектор антиоксидант – комплексный препарат для птиц) – фармакологическая композиция, содержащая активный комплекс, включающий лимоннокислую соль лития, витамины, витаминоподобные и другие вещества, оказывающие влияние на метаболизм.
По внешнему виду препарат представляет собой порошок белого цвета, хорошо растворимый в воде.
Разработанная фармакологическая композиция включает цитрат лития, аскорбиновую кислоту, глюкозу, янтарную кислоту, бутафосфан, L-карнитин тартрат в следующих соотношениях, мас.%: цитрат лития – 10; аскорбиновая кислота – 15; янтарная кислота – 10; бутафосфан — 30; L-карнитин тартрат — 15; глюкоза – остальное до 100.
Для производства фармакологического комплекса СПАО использовали следующее сырье и материалы:
1. Цитрат лития 4-х водный производится по ТУ 6-09-431-84.
Цитрат лития использовали в виде порошка белого или слегка желтого цвета с показателями, отвечающими следующим требованиям (таблица 1).
2. Аскорбиновая кислота, соответствующая ФС 42-2668-95.
3. Янтарная кислота, соответствующая ГОСТ 6341-75.
4. Бутафосфан, чистотой не ниже 99% и показателями не хуже, представленных в таблице 2.
Таблица 1 — Показатели качества цитрата лития
| № пп | Показатель | Количество |
| Массовая доля лития цитрата в %, не менее | 98,5 | |
| Массовая доля сульфатов (SO4) в %, не более | 1*10-2 | |
| Массовая доля хлоридов (Cl), в % не более | 5*10-3 | |
| Массовая доля железа (Fe), в % не более | 3*10-3 | |
| Массовая доля калия (К) в%, не более | 1*10-2 | |
| Массовая доля натрия (Na) в%, не более | 1*10-2 | |
| Величина оптической плотности водного раствора не более | 4*10-1 | |
| Массовая доля тяжелых металлов сероводородной группы (Рb) в%, не более | 1*10-3 |
Таблица 2 — Показатели качества бутафосфана
| № пп | Показатель | Спецификация |
| Внешний вид | Белый кристаллический порошок | |
| Содержание | ≥ 99.0% | |
| Точка плавления | 211-219 °C | |
| Потери при высушивании | ≤ 0.5% | |
| Хлорид | ≤ 0.016% | |
| Сульфаты | ≤ 0.04% | |
| PH | 3-6 | |
| Растворимость в воде | 5% водный раствор |
5. L-карнитин тартрат, используется с показателями не ниже, представленных в таблице 3.
Таблица 3 — Показатели качества L-карнитина
| № пп | Показатель | Спецификация |
| Внешний вид | Белый кристаллический порошок | |
| Удельное вращение | -9.5 ~-11.0
(10% водный раствор) |
|
| РН | 3.0 ~ 4.5 (5% водный раствор) | |
| Влажность | ≤0. 5% | |
| Потери после высушивания | ≤0. 5% | |
| Растворимость в воде | Высокая | |
| Тяжелые металлы | ≤10ppm | |
| Мышьяк | ≤2ppm | |
| L-карнитин чистый | 67.2-69.2% | |
| L (+)-винная кислота | 30.8-32.8% | |
| Хлориды | ≤0. 4% | |
| Точность анализа | 100±2% |
6. Глюкоза, производимая согласно ГОСТ 975-88.
Растворимость «СПАО-комплекс» определяли при температуре 200 С методом определения концентрации насыщенного раствора. Стабильность определяли путем анализа физико-химических свойств препарата при хранении в пластиковой герметичной упаковке в течение 1 года при комнатной температуре в обычных условиях хранения.
В результате изучения физико-химических свойств полученной путем смешивания фармакологической композиции СПАО растворимость составляла 16,95 г / 100 г при 20°С, следовательно, для получения насыщенного раствора необходимо 1 г «СПАО-комплекс» растворить в 5,9 мл дистиллированной воды. По классификации растворимости лекарственных веществ фармакологический комплекс СПАО относится к группе легко растворимых веществ.
В период хранения каждые 3 месяца изучали внешний вид, растворимость и токсичность «СПАО-комплекс» на 10 белых мышах в дозе 5000 мг/кг массы тела. В результате изучения стабильности в течение 1 года наблюдений не обнаружили изменения цвета порошка, его растворимости и токсичности не наблюдалось. Учитывая стабильность при хранении, отсутствие химического антагонизма компонентов и самопроизвольных химических реакций в смеси позволяет изготовить фармакологическую композицию «СПАО-комплекс» в условиях ветеринарной аптеки. Полученную путем смешения компонентов фармакологическую композицию СПАО можно хранить в пластиковой герметичной упаковке не менее 1 года при комнатной температуре в обычных условиях ветеринарной аптеки. После вскрытия банки содержимое необходимо хранить в закрытой емкости. Длительный контакт с воздухом приводит к уплотнению порошкообразной смеси, что не влияет на фармакологические свойства комплекса.
Исследования по сравнительной эффективности СПАО-комплекс и СПАО-КД проводили в ООО «БИЗНЕС ФУД СФЕРА». Объектом исследования служили куры родительского стада кросса РОСС 308, предметом – показатели гуморального ответа на введение живой вакцины против реовирусного теносиновита из штамма 1133 на фоне применения СПАО-КД и СПАО-комплекс. Вакцинацию птицы живой вакциной проводили в возрасте 7 и 28 дней, с последующей ревакцинацией инактивированной вакциной в возрасте 9-11 недель [70,71]. Было сформировано три группы птиц с начальным поголовьем 32000 голов. Птица первой опытной группы получала основной рацион и служила контролем. Птице второй опытной группы применяли кормовую добавку СПАО-КД в составе комбикорма. Птице третьей опытной группы с водой задавали фармакологическую композицию СПАО-комплекс с водой. Кормовую добавку и фармакологическую композицию применяли в дозе в дозе 185 мг/кг массы тела на фоне вакцинации живой вакциной в течение 5 дней: 3 дня до вакцинации, в день вакцинации и один день после вакцинации.
Интерпретацию результатов вакцинации проводили путём оценки двух основных компонентов гуморального ответа после введения вакцины: интенсивность формирования антител, однородность титров, а также по индексу вакцинации [72,73]. Оценку гуморального иммунитета проводили через 7, и 14 дней после первой вакцинации и через 14 и 21 день после второй.
Экономическую эффективность оценивали по общепринятой методике [74] с учётом рекомендаций Н.А. Журавель, А.В. Мифтахутдинова и соавторов [75-79].
Во второй серии опытов с птицей мясного направления продуктивности кросса РОСС 308 в условиях ООО «Бизнес Фуд Сфера» был оценен уровень выработки антител в ответ на вакцинацию у птицы разного возраста по плану-графику мониторинга в зависимости от схемы вакцинации на следующие заболевания: Для оценки особенностей функционирования иммунной системы был оценен уровень выработки антител в ответ на вакцинацию у птицы разного возраста по плану-графику мониторинга в зависимости от схемы вакцинации на следующие заболевания: инфекционная бурсальная болезнь, инфекционный бронхит кур, реовирусная инфекция, пневмовирусная инфекция, инфекционный энцефаломиелит.
Таблица 4. Схема вакцинации кур мясного направления продуктивности кросса РОСС 308
| Заболевание | Возраст | Вакцина | Метод |
| AE | Вакцинации не проводилось, у бройлеров можно наблюдать материнские антитела, которые идут на спад со временем | ||
| APV | |||
| REO | |||
| IBV | 0 дней | Нобилис IB 4-91, MSD | спрей |
| 0 дней | Пулвак IB праймер, Zoetis | спрей | |
| 10 дней | Нобилис IB 4-91, MSD | выпойка | |
| IBD | 10 дней | Пулвак Бурса F, Zoetis | выпойка |
| 16 дней | Табик МВ, Phibro | выпойка | |
| Родители | |||
| AE | 35 дней | АвиПро Тимовак, Lohman | выпойка |
| APV | 26 дней | Хиправиар SHS, Hipra | окулярно |
| 57 дней | Хиправиар SHS, Hipra | окулярно | |
| 104 дня (14 нед) | Хиправиар TRT инакт., Hipra | внутримышечно | |
| REO | 6 дней | Нобилис REO, MSD | подкожно |
| 26 дней | Нобилис REO, MSD | подкожно | |
| 50 дней | Реомун, Seva | внутримыышечно | |
| 125 дней (18 нед) | Квадрактин VP2 инакт, Phibro | внутримышечно | |
| IBV | 0 дней | Пулвак IB-праймер 4-91, Zoetis | спрей |
| 0 дней | Нобилис IB 4-91, MSD | спрей | |
| 11 дней | Нобилис IB 4-91, MSD | окулярно | |
| 72 дня (11 нед) | Нобилис IB 4-91, MSD | окулярно | |
| 104 дня (14 нед) | Пулвак IB QX, Zoetis | окулярно | |
| 125 дней (18 нед) | Квадрактин VP2 инакт, Phibro | внутримышечно | |
| 148 дней (21 нед) | Нобилис IB 4-91, MSD | выпойка | |
| 217 дней (31 нед) | Пулвак IB-праймер 4-91, Zoetis | выпойка | |
| 259 дней (37 дней) | Пулвак IB-праймер 4-91, Zoetis | выпойка | |
| 301 день (43 нед) | Пулвак IB-праймер 4-91, Zoetis | выпойка | |
| 343 дня (49 нед) | Пулвак IB-праймер 4-91, Zoetis | выпойка | |
| 385 дней (55 нед) | Пулвак IB-праймер 4-91, Zoetis | выпойка | |
| IBD | 14 дней | Пулвак Бурса F, Zoetis | выпойка |
| 22 дня | Пулвак Бурса F, Zoetis | выпойка | |
| 72 дня (11 нед) | Авивак ИБК+ИББ+НБ, Авивак | внутримышечно | |
| 125 дней (18 нед) | Квадрактин VP2 инакт, Phibro | внутримышечно | |
СПАО-комплекс в опытной группе применяли перед внутримышечными и подкожными инъекциями вакцин
Для ИФА напряженности специфического звена иммунной системы от каждой группы было отобрано 25 проб. В качестве исследуемого материала выступала сыворотка крови. Оценка выработки антител осуществлялась с помощью тест-систем BioChek, Голландия и программного обеспечения BioChek II. Считывание результатов производитель с помощью спектрофотометра Tecan, Австрия на длине волны 405 нм. Титры антител на каждое заболевание оценивались в нескольких возрастах спустя 2-4 недель после вакцинации. Время отбора крови зависело от типа вакцины, живая или инактивированная и скорости выработки иммунного ответа (в соответствующем разделе есть сведения о возрасте птиц в зависимости от диагностируемого заболевания).
Изучение эффективности СПАО-комплекс при профилактике стрессов у кур яичного направления продуктивности в процессе вакцинации проводили в условиях Уральского филиала ООО «ЛОМАНН БРИДЕРС РУС» (Челябинская область, с. Еманжелинка).
Экспериментальную работу проводили на финальном гибриде кросса Ломан классик белый (Lohmann LSL-Classic White). Показатель яйценоскости кросса находится на уровне от 320 до 340 яиц в год. Куры кросса Lohmann LSL-Classic White несутся с возраста четырех месяцев даже в зимнее время года в условиях курятника без обогрева. Яйцо обладает крупными размерами, скорлупа имеет белый цвет. Вес этих кур не превышает 1,5 кг. Куры этого кросса потребляют малое количество корма.
Таблица 5. Система профилактики инфекционных заболеваний, принятая на предприятии «ЛОМАНН БРИДЕРС РУС»
| N | Наименование | Крат
ность |
Возраст | Препарат | Метод | Доза | Примечание |
|---|---|---|---|---|---|---|---|
| 1 | Вакцинация против болезни Марека и БН | разовая | 1 дн | VECTORMUNE НVT ND | в/м | 0,2мл/г | По инструкции |
| 2 | Вакцинация против ИБК-1 шт. «Н-120», «D-278» | 1-я | 1 дн | Poulvac IB Primer | спрей | 1 д/гол | По инструкции |
| 3 | Профилактика бактериальных инфекций | разовая | 1 дн | тиоцефур | в/м | По инструкции | |
| 4 | Профилактика бактериальных инфекций | 1-5 дн | трисульфон | выпойка | По инструкции | ||
| 5 | Кровь БН | 4дн | 25 проб | ||||
| 6 | Профилактика авитаминоза | 4 дн | 6-9 дн | фид фуд | выпойка | По инструкции | |
| 7 | Профилактика расклева | 5дн
по дням посадки |
7 дн | дебикирование | |||
| 8 | Вакцинация против ИБК-2 | 2-я | 10 дн | Нобилис шт «4/91» | выпойка | 1,2д/гол | По инструкции |
| 9 | Бак. исследование птицы | 1-10 дн | Каждая партия | ||||
| 10 | Кровь на ИББ | 16 дн | 10 проб | ||||
| 11 | Вакцинация против ИББ-1 | 1-я | 16 дн | Хипра
шт «GM97» |
выпойка | 1,3д/гол | По инструкции |
| 12 | Кровь на БН | 19 дн | 25 проб | ||||
| 13 | Вакцинация против БН-1 | 1-я | 19 дн | Авивак
«Ла-Сота» |
выпойка | 10д/гол | По инструкции |
| 14 | Вакцинация против ИББ-2 | 2-я | 24 дн | Хипра
шт «GM97» |
выпойка | 1,3д/гол | По инструкции |
| 15 | Вакцинация против ИЛТ | разовая | 29-30 дн | Ларинго Вак шт. «Salsbury 146» | окулярно | 1 д/гол | По инструкции |
| 16 | Профилактика микоплазмоза | 5 сут | 33-37 дн | тилозин-тартрат | через
корм |
По инструкции | |
| 17 | Вакцинация против ИБК-3 | 3-я | 36 дн | Авивак шт
«Н-120» |
спрей | 1д/гол | По инструкции |
| 18 | Дезинфекция воздушной среды в присутствии птицы | 40-41 дн
43-44 дн |
йодтриэтилен
гликоль |
аэрозоль | Согласно объема | По инструкции | |
| 19 | Кровь на БН | 44дн | 25 проб | ||||
| 20 | Профилактика стресса
только для зала 31-1 |
45-48 дн | СПАО-комплекс | выпойка | |||
| 21 | Вакцинация против БН
шт. «Ulster 2C» |
47-48 дн | Gallimune ND | в/м | 1д/гол | По инструкции | |
| 22 | Профилактика некротического энтерита | 5 дн | 54-58 дн | эйметерм
диклазурил |
через корм | По инструкции | |
| 23 | Дезинфекция воздушной среды в присутствии птицы | 4дн
по схеме |
54-55дн
57-58дн |
йодтриэтилен
гликоль |
аэрозоль | Согласно объема | По инструкции |
| 24 | Вакцинация против ИБК-4 | 4-я | 68 дн | Нобилис шт «4/91» | спрей | 1 д/гол | По инструкции |
| 25 | Кровь на БН | 70 дн | 25 проб | ||||
| 26 | Вакцинация против ИЭМ | разовая | 72 дн | ВНИИЗЖ шт
«Calnek 1143» |
выпойка | 1 д/гол | По инструкции |
| 27 | Кровь на БН | 80 дн | |||||
| 28 | Вакцинация против БН-3 | 3-я | 91дн | Авивак шт
«Ла-Сота» |
спрей | 2д/гол | По инструкции |
| 29 | Вакцинация против ИБК-5 | 5-я | 86 дн | Авивак шт
«Н-120» |
спрей | 1д/гол | По инструкции |
| 30 | Профилактика некротического энтерита | 5 дн | 95-99дн | Мадувет | через корм | По инструкции | |
| 31 | Дезинфекция воздушной среды в присутствии птицы | 4дн
по схеме |
96-97,
99-100д |
йодтриэтилен
гликоль |
аэрозоль | Согласно объема | По инструкции |
| 32 | Кровь на БН | 105 дн | 25 проб | ||||
| 33 | Вакцинация против ИБК+БН+ССЯ-76 | разовая | 108дн | Авивак | в/м | 0,5мл/г | По инструкции |
| 34 | Дезинфекция воздушной среды в присутствии птицы | 4дн
по схеме |
112-113,
115-116дн |
йодтриэтилен
гликоль |
аэрозоль | Согласно объема | По инструкции |
| 35 | Профилактика микоплазмоза | 5 сут | 120-124дн | тилозин-тартрат | выпойка | По инструкции | |
| 36 | Профилактика расклева | постоянно | 1 раз в неделю | молочная кислота | аэрозоль | Согласно объема | По инструкции |
| 37 | Ревакцинация против ИБК | 186,дн | Авивак шт
«Н-120» |
спрей | 1 д/гол | По инструкции | |
| 38 | Ревакцинация против БН | По показаниям | Авивак шт
«Ла-Сота» |
спрей | 2д/гол | По инструкции | |
| 39 | Кровь на БН, ИБК | 140дн
и далее 1 раз в месяц |
25 проб |
Применение СПАО-комплекс начинали в 45 суточном возрасте перед внутримышечной вакцинацией против болезни Ньюкасла вакциной Gallimune ND (Merial Italia s.p.a.) в 47-48 суточном возрасте. Вакцина представляет собой эмульсию из экстраэмбриональной жидкости СПФ-эмбрионов кур, инфицированной вирусом ньюкаслской болезни (штамм «Ulster 2С»), инактивированной р-пропиолактоном, с добавлением масляного адъюванта до 0,3 мл (легкий жидкий парафин — 178 мг, эфиры жирных кислот и этоксилированных полиолов — 2,4 мг; эфиры жирных кислот и пол иолов 11 мг) и тиомерсала (0,03 мг) — в качестве консерванта [80,81].
Возбудитель болезни Ньюкасла – РНК-содержащий вирус из рода Paramyxovirus, семейства Paramyxoviridae. Особенностью вируса является высокий полиморфизм, который в значительной мере обуславливается наличием у оболочки легко деформирующейся эластичной спирали. К болезни Ньюкасла восприимчивы куры всех возрастов, а также индейки, фазаны, цесарки и перепелки. Как правило, источниками инфекции является больная и переболевшая птица [68].
В настоящее время в мире производится и используется большое количество вакцин для профилактики болезни Ньюкасла [80,81]. В то же время неудачный выбор вакцин, способов вакцинации и ревакцинации птицы, отсутствие серологического контроля за ее иммунитетом могут привести к длительной циркуляции вируса в стадах и проявлению заболевания [68,82].
Серологические исследования (РТГА) являются важнейшим инструментом для ветеринарных специалистов и позволяют по величине, однородности и динамике титров антител дифференцировать постинфекционный и поствакцинальный иммунитет. Если исследование проводят в отдаленный после вакцинации период, то рост титра антител в сыворотке крови, взятой от той же птицы через 14 дней, свидетельствует о циркуляции в стаде вируса болезни Ньюкасла [83].
Исследования антител к вирусу ньюкаслской болезни проводили методом реакции торможения гемагглютинации согласно Методическим указаниям по определению уровня антител к вирусу ньюкаслской болезни в реакции торможения гемагглютинации (РТГА) 23.06.1997 Департамент ветеринарии Минсельхозпрода РФ (13-7-2/988).
Перевод птицы из цеха выращивания в цех получения продукции осуществляли в 105 дневном возрасте. В эксперименте использовали по 17000 цыплят в опытной группе и в контрольной группах. После перевода в цех получения продукции в 105 дневном возрасте, соответственно использовали по 16188 кур в каждой группе.
Наблюдение прекратили в 220 дней на пике яйценоскости так дальнейший период характеризуется ровным спадом продуктивности и не сопровождается физиологическими перестройками организма и стрессами.
Изучение процессов липопероксидации и адаптационных особенной антиоксидантной системы осуществляли в цехе выращивания, для этого проводили формирование групп – опытной и контрольной. Опытная группа получала фармакологический комплекс СПАО с водой через систему поения в дозе 185 мг/кг массы тела за два дня до перевода или вакцинации, в день и в течение двух суток после перевода или вакцинации. Контрольная группа соответственно при переводе или вакцинации никаких препаратов не получала.
Перевод птицы осуществляли в возрасте 120 дней, перевод сопровождался ревакцинацией от инфекционных заболеваний птиц вирусной и бактериальной природы.
Ниже представлено распределение опытных и контрольных групп при переводе и вакцинации кур родительского стада.
- Опытная группа до стресса (перевод и вакцинация).
- Контрольная группа до стресса (перевод и вакцинация)
- Опытная группа через 1,5 – 2 часа после стресса (перевод и вакцинация)
- Контрольная группа через 1,5 – 2 часа после стресса (перевод и вакцинация)
- Опытная группа через 2 суток после стресса (перевод и вакцинация)
- Контрольная группа через 2 суток после стресса (перевод и вакцинация)
В качестве более сильного стрессирующего фактора также применяли дебикирование. Его делали цыплятам – прародителям кросса на ремонте в возрасте 6 суток. Содержание цыплят было напольным. Для дебикирования использовались автоматические дебикеры фирмы Verschuuren (Голландия).
Ниже представлено распределение опытных и контрольных групп при дебикировании ремонтного молодняка.
- Контрольная группа до дебикирования.
- Контрольная группа через 1,5 – 2 часа после дебикирования.
- Контрольная группа через сутки после дебикирования .
- Контрольная группа через 2 суток после дебикирования.
- Опытная группа до дебикирования.
- Опытная группа через 1,5 – 2 часа после дебикирования.
- Опытная группа через сутки после дебикирования .
- Опытная группа через 2 суток после дебикирования.
Благодаря оценке первичных и вторичных продуктов перекисного окисления в плазме крови с возможной раздельным определением липопероксидов в изопропанольной и гептановой фазах липидного экстракта возможно оценить состояние процесса перекисного окисления липидов. Каждую фазу липидного экстракта измеряли спектрофотометрически на длинах волн 220, 232, 278 и 400 нм с оптическим контролей и расчетом единиц индексов окисления. Результаты представляют индексами окисления — Е232/Е220, Е278/Е220, Е400/220, что показывает соотношение первичных и вторичных продуктов перекисного окисления липидов. Е232/Е220 – концентрация диеновых конъюгатов, Е278/220 — содержание кетодиенов и сопряженных триенов, Е 400/220 — шиффовы основания. Было происследовано 56 (пятьдесят шесть) образцов плазмы крови на предмет содержания продуктов перекисного окисления липидов.
С помощью определения ферментативной активности церулоплазмина одного из основных антиоксидантных белков в крови – церулоплазмина. Метод определения включает окисление р – фенилендиамина при присутствии церулоплазмина. Для остановки реакции используется фтористый натрий, который вносится в инкубационную смесь. О концентрации церулоплазмина судят по оптической плотности полученного субстрата, которая прямо пропорциональная количеству в нем окрасившегося продукта ( ![]() мах = 530 нм). Активность церулоплазмина определена в 56 (пятидесяти шести) образцах плазмы крови.
мах = 530 нм). Активность церулоплазмина определена в 56 (пятидесяти шести) образцах плазмы крови.
Определение содержания альфа – токоферола – включает в себя количественную оценку содержания в исследуемых образцах одного из наиболее важных липофильных антиоксидантов – альфа-токоферола. Принцип метода состоит в экстракции альфа-токоферола из исследуемого образца гексаном с последующей флюорометрической количественной детекцией определяемого вещества при измерении на длине волны испускания 323 нм и длине возбуждения 295 нм. Концентрация альфа — токоферола рассчитывается по результатам калибровки с использованием растворов альфа — токоферола известной концентрации. Содержание токоферола определено в 55 (пятидесяти пяти) образцах сыворотки крови. Объем образца с маркировкой «1/5 (2:2)» не был достаточным для количественного определения токоферола [84-85].
Состояние процессов окислительной модификации белков включает оценку содержания карбонильных продуктов окислительной модификации белков плазмы крови по их реакции с 2,4 – динитрофенилгидразином с последующей спектрофотометрической регистрацией продуктов взаимодействия – динитрофенилгидразонов. Содержание карбонильных продуктов окислительной модификации белков определено в образцах плазмы крови. Окислительную модификацию белков (ОМБ) в плазме крови определяли по методу Е.Е. Дубининой с соавт. 1995 для определения динамики прооксидантных и антиоксидантных процессов у птицы до и после дебикирования и для определения повреждений, вызванных стрессом [86-88].
Коэффициент молярной экстинкции известен только для аКДФГ н, регистрируемых при ![]() = 370. Поэтому данная категория продуктов взаимодействия с 2,4 – ДНФГ рассчитана в двух вариантах: ЕДоп / гб, мкмоль/гб. Для аКДФГ осн и аАДФГ коэффициент молярной экстинкции неизвестен, поэтому данные представлены только в 1 варианте пересчета: ЕДоп / г б. «С/И» — соотношение «базальный уровень / при индукции» — информативно как дополнение по антиоксидантной активности [87-89].
= 370. Поэтому данная категория продуктов взаимодействия с 2,4 – ДНФГ рассчитана в двух вариантах: ЕДоп / гб, мкмоль/гб. Для аКДФГ осн и аАДФГ коэффициент молярной экстинкции неизвестен, поэтому данные представлены только в 1 варианте пересчета: ЕДоп / г б. «С/И» — соотношение «базальный уровень / при индукции» — информативно как дополнение по антиоксидантной активности [87-89].
Полученные в эксперименте данные обрабатывали статистически на персональном компьютере с помощью программы STATISTICA 12. Данные, которые представлены в таблицах, указаны в виде средней величины со стандартным отклонением. Для оценки распределения визуально оценивали гистограммы, а также критерий Шапиро–Уилка. В случае нормального распределения данных достоверность рассчитывали с помощью t-критерия Стьюдента. В случае, если данные были распределены ненормально, использовали критерий U-Критерий Манна-Уитни, при обработке значений, которые были полученны от одной и той же группы — критерий Вилкоксона, для обработки разницы между несколькими группами — критерий Краскела-Уоллиса. Уровень статистической значимости был принят равным 0,05. Для корреляционного анализа использовали коэффициента ранговой корреляции Кендалла. В каждом разделе также имеются данные о представлении данных и критериях статистической достоверности, которые были использованы.
2.2 Результаты собственных исследований
2.2.1. Состав, физико-химические свойства разработанной кормовой добавки «СПАО-КД»
В качестве альтернативы фармакологическому комплексу СПАО для снижения его стоимости и возможности применения с кормом была разработана кормовая добавка «СПАО-КД». Данная кормовая добавка, вместо водорастворимого цитрата лития включает углекислую соль лития, которая имеет плохую растворимость в воде.
Кормовая добавка включает: мас.%: карбонат лития – 7,6; аскорбиновая кислота – 15; янтарная кислота – 10; бутафосфан — 30; L-карнитин тартрат — 15; глюкоза – остальное до 100.
По внешнему виду кормовая добавка «СПАО-КД» представляет собой порошок белого цвета плохо растворима в воде.
Для производства кормовой добавки «СПАО-КД» использовали карбонат лития с показателями не хуже, представленных в таблице 6:
Таблица 6 — Показатели качества карбоната лития
| Показатель | Спецификация, % |
| Массовая доля карбоната лития, % не менее | 99,1 |
| Массовая доля нерастворимых в воде веществ, % не более | 0.001 |
| Массовая доля хлоридов , % не более | 0,005 |
| Массовая доля натрия, % не более | 0,01 |
| Массовая доля калия, % не более | 0,005 |
| Массовая доля кальция, % не более | 0,01 |
| Массовая доля магния, % не более | 0,001 |
| Массовая доля Fe2O3, % не более | 0,002 |
| Массовая доля SO4, % не более | 0,02 |
| Массовая доля мышьяка, % не более | 0,0002 |
| Тяжелые металлы, % не более | 0,002 |
| Массовая доля H2O (200 °C), % не более | 0,01 |
Остальные компоненты, включенные в состав «СПАО-КД» соответствуют таковым, используемым для изготовления СПАО-комплекс (см. п. 2.1 Материалы и методы).
Тестирование стабильности смеси при хранении хранения каждые 3 месяца в течение 1 года позволяют сделать вывод о ее стабильности. Так как в процессе наблюдений не обнаружено изменения цвета порошка, его растворимости и токсичности. Учитывая стабильность при хранении, отсутствие химического антагонизма компонентов и самопроизвольных химических реакций в смеси, можно рекомендовать изготовление СПАО-КД в условиях ветеринарной аптеки или же в условиях комбикормового завода. Полученную путем смешения компонентов кормовую добавку СПАО-КД можно хранить в пластиковой герметичной упаковке не менее 1 года при комнатной температуре в обычных условиях ветеринарной аптеки. После вскрытия банки содержимое необходимо хранить в закрытой емкости. Длительный контакт с воздухом приводит к уплотнению порошкообразной смеси, что не влияет на фармакологические свойства.
Оценку острой токсичности осуществляли на клинически здоровых беспородных белых мышах путем однократного введения водной суспензии СПАО-КД внутрь через зонд согласно ГОСТ Р ИСО 10993-11-2009. Животные были распределены на 2 группы по 10 мышей в каждой группе. Максимальная доза, для мышей составила 1621,1 мг на 1 кг массы тела. Наблюдение осуществляли в течение 14 суток после введения испытуемой суспензии, обращая внимание на картину интоксикации аппетит, общее состояние и поведение.
В результате проведенных исследований установлено, что СПАО-КД при назначении внутрь в максимально возможной дозе для внутреннего применения в течение всего периода наблюдения не вызывал гибели подопытных мышей. У животных не отмечали изменений в поведении, рефлексы были сохранены.
Оценка местно-раздражающих свойств при нанесении на кожу и слизистые оболочки выявила отсутствие изменений в месте аппликации суспензии СПАО-КД как в период его использования, так в период наблюдений. Эластичность и упругость кожи подопытных животных не нарушена. При пальпации участков аппликации повышенная болевая реакция не наблюдалась. Покраснения, отеки кожи и геморрагии не обнаружены.
При исследовании действия на слизистые оболочки порошок СПАО-КД наносили однократно в конъюнктивальный мешок правого глаза, в левый глаз такое же количество дистиллированной воды для контроля. В результате наблюдений гиперемии конъюнктивы и признаков инъецирования сосудов глаза, помутнения роговицы и сужения зрачка не наблюдалось.
Следовательно, кормовая добавка СПАО-КД по степени воздействия на теплокровных животных относится к веществам малоопасным 4 класс опасности по ГОСТ 12.1.007-76 [89]. Анализ известных фармакологических средств и кормовых добавок позволяет сделать вывод об отсутствии в них признаков, сходных с существенными отличительными признаками разработанной кормовой добавки, следовательно, разработанное антистрессовое средство можно характеризовать как обладающее новизной.
2.2.2 Вакцинация кур против реовирусной инфекции и контроль её качества на фоне применения СПАО-КД и СПАО-комплекс
Реовирусная инфекция кур (реовирусный теносиновит, вирусный артрит, «слабость ног», Viral Tenosinovinis of Chickens) – вирусная контагиозная болезнь птиц, характеризующаяся диареей, теносиновитами и артритами. Возбудитель болезни – РНК-содержащий вирус семейства Reoviridae, роду Orthoreovirus. Вирус способен длительное время персистировать в инфицированном организме. Выделены реовирусы, относящиеся к 11 серотипам [91,92]. Результаты экспериментальных исследований по изучению антигенных свойств вакцинного, эпизоотических штаммов и изолятов реовируса птиц, выделенных в различных географических зонах, показали их антигенное родство и различия в специфичности и степени и скорости нейтрализации гомологичными и гетерологичными штаммспецифическими сыворотками [91].
Реофирусная инфекция широко распространена о многих странах мира. На территории нашей страны реовирусная инфекция не зарегистрирована, но угроза заноса возбудителя остается актуальной [93]. По результатам серологического мониторинга реовируса кур в 2011-2016 гг. установлено, что 67 % положительных проб поступили из птицехозяйств, не применяющих вакцинацию против реовирусного теносиновита кур [94].
Основным подходом к контролю реовирусной инфекции, в таких ее проявлениях, как теносиновит и синдром малабсорбции, является вакцинация [95]. Широко применяют как живые, так и инактивированные вакцины.
В России для специфической профилактики болезни применяют аттенуированные вирусвакцины из штаммов реовируса ВНИВИП-ДЕП и S1133 и инактивированные вакцины как моно-, так и поливалентные из эпизоотического штамма 1733 или изолята реовируса, циркулирующего в данном регионе [96]. Высокую иммуногенность вакцин AviPro REO и сухой живой из штамма «КМИЭВ-V118» доказывает отсутствие значительных изменений в иммуноморфологической перестройки в костном мозге, вызываемой вакцинами, которая характеризуется увеличением всех клеток миелоидного ростка, а также повышением лейкоэритробластического индекса, что свидетельствует об активной гиперплазии клеток белого ростка [97].
В настоящее время меры борьбы с реовирусным теносиновитом птиц в основном направлены на предотвращение реовирусной инфекции у суточных цыплят, это осуществляется путем иммунизации племенного стада инактивированной вакциной с передачей пассивного иммунитета [98].
Проведение вакцинопрофилактики реовирусной инфекции птиц инактивированными вакцинами в раннем возрасте преследует следующие цели: повышение сохранности и продуктивности птицы, усиление уровня иммунного ответа после применения вирусвакцин и защита птицепоголовья от инфекции на протяжении всего продуктивного периода, изыскание альтернативы вирусвакцинам, снижение уровня иммунодепрессии и, как следствие, уменьшение проявления секундарных инфекций, подавление циркуляции эпизоотических штаммов реовируса, вызывающих субклиническое течение болезни [96].
Реовирусы не являются высокоиммуногенными антигенами, то есть они не вызывают образования высоких уровней нейтрализующих антител у цыплят. Это может быть проблемой при применении некоторых инактивированных вакцин, поскольку защита, которую родители передают потомству посредством материнских антител, может быть непродолжительной [98].
Высокоиммуногенные живые вакцины обладают тем преимуществом, что создают раннюю неспецифическую защиту, благодаря явлению гомологичной интерференции, сводя до минимума нежелательные эффекты. Поэтому наиболее эффективным способом профилактики реовирусной инфекции птиц является вакцинация самих цыплят живыми вакцинами [96], так называемое праймирование для образования быстрого, но краткосрочного иммунитета, с дополнительной ревакцинацией [99].
Создание эффективных вакцинных препаратов, обладающих высокой профилактической активностью и в то же время не имеющих побочных свойств, является одним из наиболее приоритетных направлений в биотехнологии и вирусологии. Одним из ключевых этапов разработки технологии изготовления качественных и эффективных вакцин против реовирусного теносиновита кур является выбор системы культивирования для репродукции вируса, обеспечивающей получение препарата с высокой протективной и антигенной активностью [100]. Исследования по сравнению иммуногенности вакцин против реовирусной инфекции кур, полученных разными методами показали, что эффективная вакцина против теносиновита птиц может быть изготовлена с использованием как СПФ-эмбрионов, так и культур клеток Vero и ФЭК. Их применение способствовало формированию у цыплят напряженного иммунитета и высокой иммуногенной активности штамма реовируса птиц «КМИЭВ-V118», полученного путем культивирования с использованием указанных объектов. Использование СПФ-эмбрионов кур ограничено их стоимостью, а также тем, что их поставляют лишь несколько стран мира. Кроме того, получение из них культуры ФЭК также требует больших материальных затрат. Поэтому наиболее оптимальным является изготовление вакцины живой против реовирусной инфекции птиц с использованием культуры клеток Vero [93]. Доказано, что вирусвакцина Теновак безвредна для птиц, обладает выраженной антигенной и иммуногенной активностью и обеспечивает специфическую защиту птицепоголовья от полевого заражения [101]. Изучено влияние разных растворителей на иммуногенную активность вакцины живой сухой против реовирусного теносиновита птиц с применением различных растворителей: ИСКОМ, фосфатный буферный раствор, физиологический раствор, среди которых более эффективным оказался растворитель ИСКОМ [102].
Основным подходом к контролю реовирусной инфекции (теносиновит, синдром малабсорбции) является вакцинопрофилактика. Клинические признаки болезни проявляются у цыплят, преимущественно зараженных в суточном возрасте, хотя птица может быть инфицирована в любом возрасте, поэтому программы вакцинации разработаны для защиты цыплят в первые недели после вывода – в период наибольшей восприимчивости [103].
Вместе с тем вакцинация птицы, несмотря на необходимость её осуществления, является технологическим стрессом в промышленном птицеводстве [104-109]. Стрессовая ситуация отрицательно сказывается на общем состоянии птиц, на формировании иммунного ответа на различные генетически чужеродные агенты, ухудшает продуктивность птиц. Например, иммунизация живыми реактогенными вакцинами – снижением живой массы цыплят более чем на 9%, при вакцинации несушек или массовом исследовании на пуллороз возможно снижение яйценоскости на 10-20%, сохраняющееся на протяжении 10-15 дней [105].
В связи с вышеизложенным, целью данного этапа исследований явилось определение и сравнительная оценка применения кормовой добавки СПАО-КД и фармакологической композиции СПАО-комплекс для профилактики вакцинального стресса при иммунизации птицы против реовирусного теносиновита.
2.2.2.1 Влияние антистрессовых фармакологических средств на эффективность вакцинации
Серологические исследования служат важным инструментом в программе мониторинга по оценке эффективности иммунизации птиц, позволяющим определить напряженность поствакцинального иммунитета, а также установить степень охвата поголовья [110].
На интенсивность отклика указывает значение среднего титра (таблица 7).
Таблица 7 – Средний титр антител и коэффициент вариации при вакцинации кур против реовирусного теосиновита
| Возраст птицы | Период после вакцинации | Ожидаемый | Основной рацион | СПАО-КД | СПАО-комплекс | ||||
| титр | CV | cредний титр | CV | cредний титр | CV | cредний титр | CV | ||
| 14 | 71 | 2000-5000 | 40-80 | 331 | 92 | 631 | 60 | 621 | 47 |
| 21 | 141 | 2000-5000 | 40-80 | 337 | 81 | 716 | 54 | 1088 | 39* |
| 42 | 142 | 2000-5000 | 40-80 | 1505 | 47 | 2453* | 45* | 4554* | 28* |
| 49 | 212 | 2000-5000 | 40-80 | 1749* | 35* | 2836* | 35* | 4603* | 26* |
Примечание: * Уровень, соответствующий «защитному»
Так, через 7 дней после первого введения вакцины, то есть на начальном формировании иммунитета, титр антител был в несколько раз ниже как защитного уровня, так и ожидаемого, или базисного. Вместе с тем показатели титра антител у птицы, которой использовали СПАО-КД и СПАО-комплекс были выше в 1,91 раза. Это может свидетельствовать об усилении праймирования.
Через 14 дней после иммунизации в группах, в которых применяли СПАО-КД и СПАО-комплекс также были выше в сравнении с титром антител в первой опытной группе, а также выше уровня антител в более ранний период – через 7 дней после вакцинации. В первой группе – незначительно, на 1,81 %, во второй группе — на 13,47 %, в третьей – на 75,2 %. Это свидетельствует об ответной реакции организма на введение вакцины на первом этапе иммунизации. Положительное влияние СПАО-КД и СПАО-комплекса на снижение уровня иммуноспрессии подтверждает относительно высокий титр антител на 14 день после вакцинации в сравнении с первой опытной группой – в 2,12 и 3,23 раза.
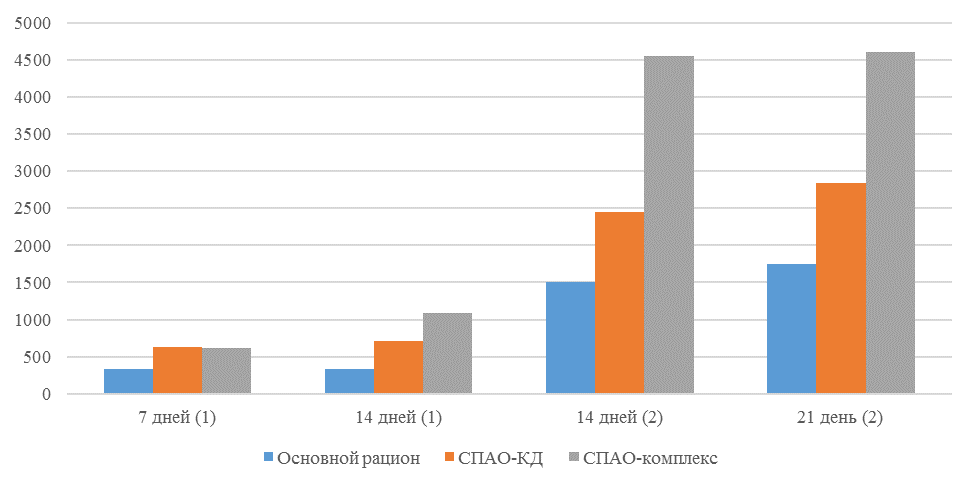
Рисунок 1 — Средний уровень антител на фоне вакцинации против реовирусного теносиновита
После второй вакцинации титр антител в сыворотке крови исследуемых кур изменился. Так, в первой опытной группе через14 дней после второй вакцинации средний титр увеличился в 4,47 раза, через 21 день – еще на 1,16 % и достиг уровня «защитного», хотя и оказался ниже ожидаемого. По-видимому, это связано состоянием иммуносупрессии, наступившей в результате активации стресс-реализующих механизмов при проведении вакцинации [111].
Применение кормовой добавки и препаратов, направленных на профилактику стресса, способствовало более интенсивному формированию антител.
Так, на фоне применения кормовой добавки СПАО-КД через 14 дней после вакцинации титр антител был на 62,99 % выше, чем в крови кур первой группы, достиг ожидаемого уровня (чуть выше минимального) и стал выше защитного. Через 21 день после вакцинации – сроку контроля напряженности иммунитета [112] увеличился на 16,7 % и стал выше, чем аналогичный показатель в контрольной группе на 62,15 %.
Следует отметить, что после первой вакцинации не был достигнут уровень антител, соответствующий защитному – 1700 [82,83].
Кукленкова И.В. с соавторами [113] свидетельствует, что напряженность иммунитета, защищающую птиц от заражения полевым штаммом следует считать при титре антител более 1:800. Следовательно, применение СПАО-комплекса способствует достижению этого показателя к 21 дню после первой вакцинации живой вакциной. Кроме того, при экспериментальном испытании живых вакцин, содержащих штаммы вируса, уровень антител [114] в той или иной степени соответствовал показателям, полученным во второй и третьей опытных группах, что указывает на ответную иммунологическую реакцию.
Применение СПАО-комплекса способствовало более интенсивному формированию иммунитета. Через 14 дней после второй вакцинации титры антител были приближены к максимальному ожидаемому уровню и выше, чем в сыворотке крови кур первой и второй опытных групп в 3,06 и 1,86 раза соответственно. К 21 дню после второй вакцинации это показатель еще немного увеличился и также был выше сравниваемых в 2,6 и 1,6 раза. Это свидетельствует о том, что СПАО-комплекс способствует сероконверсии и ускоряет срок выработки антител.
О степени однородности титров свидетельствует коэффициент вариации, по уровню которого можно судить о качестве вакцинации по партии птицы (рисунок 2). Так, вакцинация как технологический стресс снижает активность специфического гуморального иммунитета, что подтверждается величиной коэффициента вариации [102,111]. Через 7 дней после первой вакцинации этот показатель был максимальным, в контрольной группе – выше ожидаемого уровня. Применение СПАО-КД и СПАО-комплекса позволило достичь более высокого уровня однородности – коэффициент вариации во второй и третьей группах ниже, чем в первой на 65,22 % и 48,91 % соответственно и находился в пределах ожидаемого.
Через 14 дней после первой прививки отмечено снижение коэффициента вариации в каждой группе.
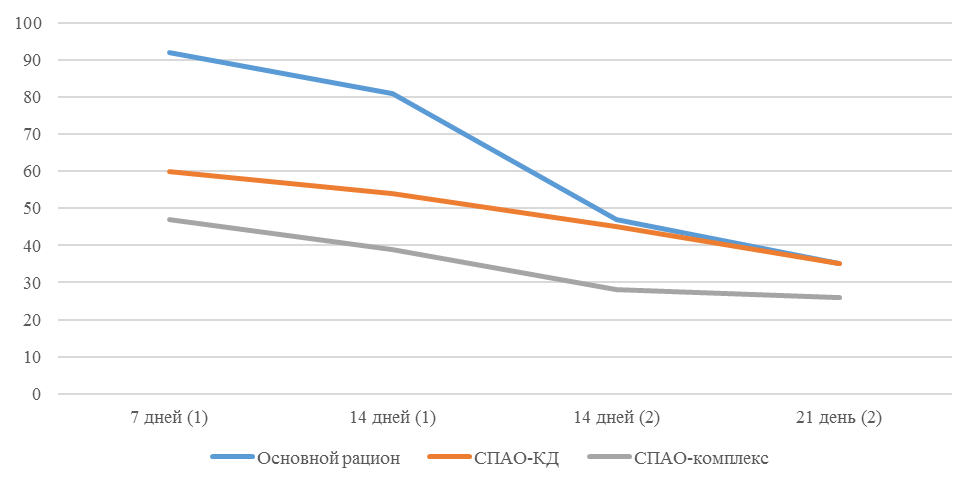
Рисунок 2 – Коэффициент вариации на фоне вакцинации против реовирусного теносиновита
Наименьшая величина была на фоне применения СПАО-комплекса, что было ниже, чем при вакцинации по схеме, принятой на производстве в 2,08 раза, на фоне применения СПАО-КД коэффициент вариации был ниже, чем в первой опытной группе в 1,5 раза. При этом, согласно инструкции [52,53], однородность вакцинации была достигнута только в третьей группе (значение коэффициента вариации менее 45 %).
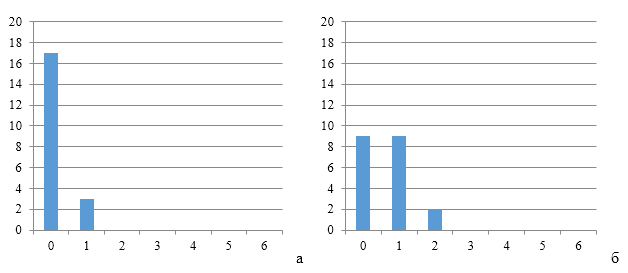
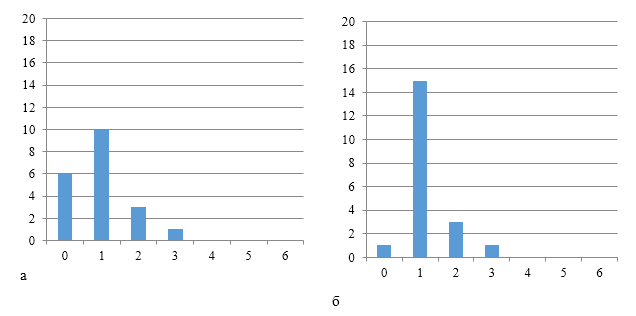
Данные рисунков 3, 4 и 5 по группам титров антител наглядно демонстрируют начальный формирования однородного иммунитета к реовирусу.
Так, через 7 и 14 дней после первой вакцинации группы титров антител в сыворотке крови кур первой опытной группы преимущественно относились к нулевой группе (19 и 18 из 20 соответственно). В группах, где курам применяли СПАО-КД и СПАО-комплекс, формирование иммунитета было чуть интенсивнее, но более ярко это выражено при использовании птице СПАО-комплекса.
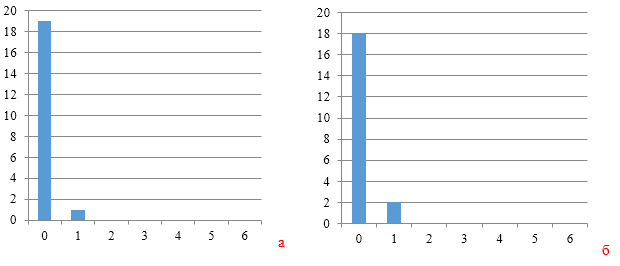 |
|
| Рисунок 3 — Группы титров антител через 7 дней (а) и 14 дней (б) после первой вакцинации против реовирусного теосиновита | |
| а | б |
| Рисунок 4 — Группы титров антител через 7 дней (а) и 14 дней (б) после первой вакцинации против реовирусного теосиновита на фоне применения СПАО-КД | |
 |
|
 |
|
| Рисунок 5 — Группы титров антител через 7 дней (а) и 14 дней (б) после первой вакцинации против реовирусного теосиновита на фоне применения СПАО-комплекса | |
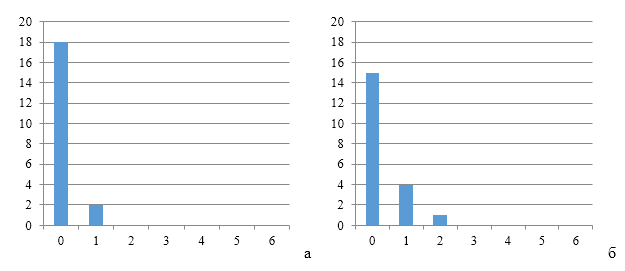
Через 14 дней после второй прививки продолжалось снижение величины коэффициента вариации в каждой группе, тем не менее в первой группе он был немного выше значения, соответствующего однородности. На фоне применения СПАО-КД коэффициент вариации совпадал с величиной показателя однородности, СПАО-комплекса – был значительно ниже – в 1,68 и 1,61 раза.
Через 21 день после второй вакцинации во всех группах была достигнута однородность вакцинации, при этом введение в рацион СПАО-КД не оказало влияние на этот показатель, контролируемый в срок проверки напряженности иммунитета, соответствующий инструкции, он в первой и второй группах был равен 35 %. При применении СПАО-комплекса значение коэффициента вариации к этому сроку стало еще ниже.
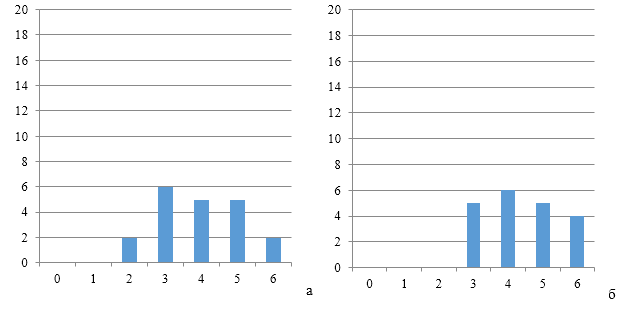
Рисунки 6-8 по распределению групп титров антител подтверждают степень однородности.
 |
|
| Рисунок 6 — Группы титров антител через 12 дней (а) и 17 дней (б) после второй вакцинации против реовирусного теосиновита | |
| а | б |
| Рисунок 7 — Группы титров антител через 12 дней (а) и 17 дней (б) после второй вакцинации против реовирусного теосиновита на фоне применения СПАО-КД | |
 |
|
| Рисунок 8 — Группы титров антител через 12 дней (а) и 17 дней (б) после второй вакцинации против реовирусного теосиновита на фоне применения СПАО-комплекса | |
Следовательно, СПАО-КД и СПАО-комплекс в большей степени способствуют однородности вакцинации. При этом влияние СПАО-КД выражено слабее, чем СПАО-комплекса. Оба средства сокращают сроки достижения уровня коэффициента вариации, указывающего на однородность (менее 45) – к 14 дню после второй вакцинации. Применение СПАО комплекса, кроме того, способствует снижению величины коэффициента к сроку контроля напряженности иммунитета – к 21 дню после второй вакцинации на 25,7 %. Применение СПАО-КД в сравнении с основным рационом не оказывает влияния на величину коэффициента вариации к 21 дню после второй вакцинации.
Б. ван Лирдам и Г.Босман [115] считают, что признаком успешной вакцинации является соотношение анализируемых параметров – среднего титра антител и коэффициента вариации, выражаемого через индекс вакцинации.
Индекс вакцинации – логический параметр, демонстрирующий высокие значения при успешно проведенной вакцинации. Данные таблицы 2 позволяют сделать вывод, что напряженность иммунитета постепенно увеличивается, достигая своего максимума к контрольной точке – через 21 день после второй вакцинации (таблица 8).
Таблица 8 – Индекс вакцинации против реовирусного теносиновита.
| Сроки после вакцинации | Вакцинация | Вакцина + СПАО-КД | Вакцина + СПАО-комплекс |
| 7 дней (1) | 3,60 | 10,52 | 13,21 |
| 14 дней (1) | 4,16 | 13,26 | 27,90 |
| 14 дней (2) | 32,02 | 54,51 | 162,64 |
| 21 день (2) | 49,97 | 81,03 | 177,04 |
Вместе с тем, более качественная сероконверсия отмечается на фоне применения СПАО-комплекса, показатель индекса вакцинации в крови кур третьей опытной группы в 3,5 раза выше, чем в первой опытной и в 2,18 раза – во второй опытной.
Результаты исследований – интенсивность и однородность титров, подтверждаемые индексом вакцинации, позволяют сделать вывод, что выработка антител произошла в результате действия вакцины, данных, свидетельствующих о развитии инфекционного процесса, не выявлено.
При выполнении всех условий при вакцинации и нормальном состоянии иммунного статуса птицы коэффициент будет низким в пределах нормы. Высокий коэффициент вариабельности создается за счет низких титров (пропуски вакцинации) или за счет высоких титров (циркуляция полевого вируса) [116].
Учитывая особенности технологического процесса в птицеводстве, следует отметить противоречие. С одной стороны, вакцинация направлена на создание невосприимчивости стада птицы к инфекционным болезням, в том числе к реовирусному теносиновиту, с другой – как стресс-фактор запускает механизм угнетения выработки антител, что приводит к снижению активности специфического гуморального иммунитета [111]. Отрицательная связь между стрессов и реакцией антител, подтверждающая представленные исследования, описана в ряде работ [117-120]. Также доказано влияние антистрессовых препаратов на достижение высокого иммунного ответа при вакцинации [106-108, 116].
2.2.2.2 Влияние антистрессовых фармакологических средств на производственные показатели кур на фоне вакцинации против реовирусной инфекции
Данные таблицы 9 и рисунка 9 позволяют сделать вывод о положительном влиянии фармакологического комплекса и кормовой добавки, применяемых в качестве антистрессовой терапии.
Таблица 9 – Производственные показатели
| Показатель | Основной рацион | СПАО-КД | СПАО-комплекс |
| Начальное поголовье | 32000 | 32000 | 32000 |
| Поголовье кур-несушек (140 дней), гол. | 31110 | 31250 | 31310 |
| Поголовье кур-несушек к концу технологического цикла, гол. | 28279 | 28500 | 29275 |
| Валовое производство яиц, тыс. шт. | 5913 | 5959 | 6119 |
| в т. ч. инкубационных, тыс. шт. | 5644 | 5697 | 5879 |
| Выход инкубационного яйца, % | 95,5 | 95,6 | 96,1 |
| Получено яиц на начальную несушку, всего, шт. | 190,2 | 190,7 | 195,4 |
| в т. ч. инкубационных, шт. | 181,9 | 182,3 | 187,8 |
| Получено цыплят на начальную несушку, гол. | 144,3 | 145,1 | 150,4 |
| вывод цыплят, % | 79,3 | 79,6 | 80,1 |
| Сохранность кур-несушек в период яйценоскости, % | 90,9 | 91,2 | 93,5 |
| Сохранность кур-несушек за технологический цикл, % | 88,4 | 89,1 | 91,5 |
| Масса птицы к концу технологического цикла, г | 2590 | 2613 | 2757 |
| Выход мяса, % | 75,1 | 75,1 | 75,2 |
| Расход корма на производство инкубационного яйца, кг/10 шт. | 2,68 | 2,67 | 2,62 |
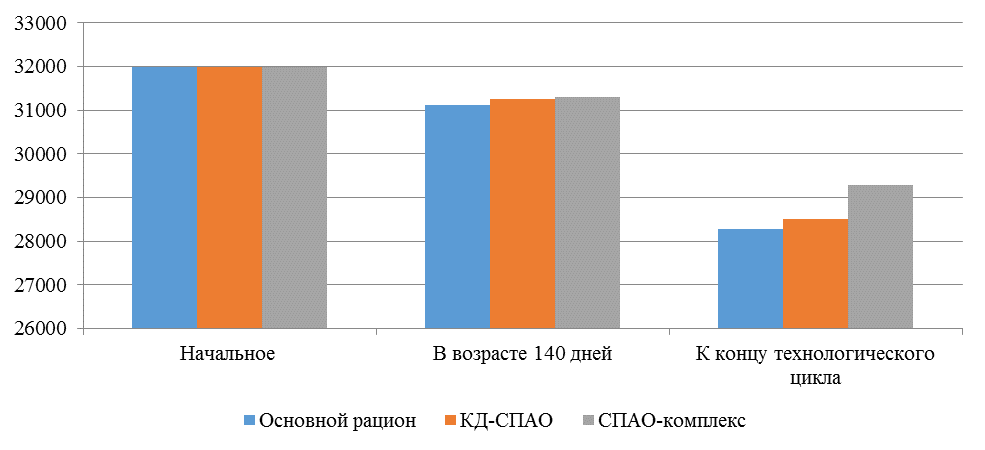
Рисунок 9 – Сохранность кур-несушек
Так, к моменту достижения 140-дневного возраста, то есть в период, в который птица подвергается интенсивной иммунизации, в том числе против реовирусного теосиновита, сохранность птицы в первой опытной группе составила 97,2 %, во второй опытной – 97,6 %, в третьей опытной – 97,8 %. В период яйценоскости (со 140-дневного возраста до убоя в возрасте 61 недели) при относительно меньшей иммунологической нагрузке на организм, сохранность-кур несушек также отличалась и составляла 90,9, 91,2 и 93,5 % соответственно. В целом за период выращивания и яйценоскости сохранность кур-несушек была выше на фоне применения кормовой добавки и фармакологического комплекса. Так, во второй опытной группе сохранность составила 89,1 %, что выше, чем в первой опытной группе на 0,79 %. В третьей опытной группе сохранность была 91,5 % что выше, чем в первой опытной группе на 3,5 %.
На фоне применения СПАО-комплекса увеличилось производство инкубационных яиц в расчёте на одну несушку на 3,24%, суточных цыплят – на 4,22 %. При использовании СПАО-КД увеличение производственных показателей было выражено слабее: производство инкубационных яиц было выше на 0,22 %, суточных цыплят – на 0,55 %
Следовательно, использование кормовой добавки и фармакологического препарата в качестве антистрессовой терапии способствует снижению смертности и увеличению сохранности поголовья, а также увеличению конечных производственных показателей – инкубационного яйца, и, следовательно, поголовья суточных цыплят.
В племенных репродукторах второго порядка птицу после использования подвергают убою, мясо используют для приготовления фарша или для реализации тушек, поэтому имеет значение масса птицы перед убоем и выход мяса. На выход мяса применение кормовой добавки и препарата влияния не оказало, но вместе с тем живая масса кур, которым применяли СПАО-КД, была выше, чем живая масса кур на фоне основного рациона, на 23 г, или 0,88 %, СПАО-комплекс – на 167 г, или 6,44 %. Исследованиями Н.О. Лазовской [121] доказано, что у птицы, иммунизированной против реовирусного теносиновита живая масса была достоверно ниже, чем у неиммунизирванной. Вакцинация, как технологический стресс, снижает прирост живой массы, применение кормовой добавки и фармакологического комплекса уменьшает негативное воздействие стресс-фактора и способствует увеличению производственных показателей. При этом влияние кормовой добавки выражено слабее, чем фармакологического комплекса.
Применение курам родительского стада кормовой добавки СПАО-КД и фармакологического комплекса СПАО-комплекс на фоне вакцинации против реовирусной инфекции снижает негативное воздействие вакцинации как стресс-фактора и стимулирует иммунный ответ организма.
2.2.2.3 Экономическая эффективность антистрессовой терапии на фоне вакцинации кур
Экономическая эффективность на один рубль затрат – показатель, отражающий величину прибыли на каждый вложенный рубль, определяется по формуле (1):
Эр = Ээ : Зв (1)
где Ээ – экономический эффект, руб.; Зв – затраты ветеринарные, руб.
Экономический эффект от проведения ветеринарных мероприятий выражают разностью между дополнительным экономическим результатом и затратами на их осуществление. Экономическим эффектом проведения ветеринарных мероприятий (в стоимостной форме) является сумма предотвращенного экономического ущерба в результате проведения ветеринарных мероприятий; стоимости продукции, полученной дополнительно в результате применения антистрессовых средств ветеринарного назначения; экономии трудовых и материальных затрат за счет проведения ветеринарных мероприятий [115].
В данном случае экономический эффект рассчитывали по формуле (2):
Ээ = Пу + Дс – Зв (2)
где Пу – предотвращенный экономический ущерб, руб.; Дс – стоимость продукции, полученной дополнительно за счет увеличения ее количества или качества, руб.; Зв – затраты ветеринарные.
Ветеринарные затраты представляют собой сумму стоимости препарата и затрат на оплату труда (3).
Зв = Зм + Зот + Оот, (3)
где Зм – материальные затраты, руб.; Зот – затраты на оплату труда, руб.; Оот – отчисления от оплаты труда, руб.
Это согласуется с исследованиями Н.Н. Никитина, который указывает, что можно учитывать не все предусмотренные виды затрат.
За период опыта было израсходовано 10,09 кг СПАО-КД и 10,09 СПАО-комплекса. Учитывая стоимость препаратов, затраты материальные во второй опытной группе составили 18168,48 руб., в третьей – 37346,32 руб.
СПАО-комплекс применяли с водой, через медикатор, затраты времени на подготовку препарата для применения составили около 10 минут в сутки – 100 минут, или 1,67 часа за период опыта.
СПАО-КД применяли, смешивая с комбикормом, затраты времени в целом были немного ниже и составили 90 минут, или 1,5 часа за период опыта.
Заработная плата ветеринарного врача на птицефабрике в среднем составляет 50000 руб. в месяц, в год – 600000 руб., в час, с учетом годового фонда рабочего времени (1761,4 часа) – 340,64 руб.
Следовательно, затраты на оплату труда при использовании СПАО-комплекса составили 568,87 руб., СПАО-КД – 510,96 руб., начисления –154,31 и 171,80 руб. соответственно.
Таким образом, затраты ветеринарные составили:
во второй опытной группе:
Зв = 18168,48 + 510,96 + 154,31 = 18833,75 руб.
в третьей опытной группе:
Зв = 37346,32 + 568,87 + 171,80 = 38086,99 руб.
Предотвращенный ущерб рассчитывали на основе сохранности кур родительского стада.
Пу = (Мн – Мб) × Ц (4)
где Мн, Мб – поголовье птицы к концу технологического цикла на фоне новых и базовой технологии соответственно, голов, Ц – цена одной птицы, руб.
Предотвращенный ущерб составил:
во второй опытной группе:
Пу = (28500 – 28279) × 740 = 163540 руб.
в третьей опытной группе:
Пу = (29275 – 28279) × 740 = 737040 руб.
Стоимость продукции, полученной дополнительно, определяли по формуле (5)
Дс = (Вн – Вб) × Ц (5)
где Вн, Вб – количество продукции, полученной на фоне новой ибазовой технологии, ед., Ц – цена единицы продукции, руб.
В качестве продукции полученной дополнительно, учитывали количество суточных цыплят и мяса кур.
Стоимость дополнительно полученных цыплят составила:
во второй опытной группе:
Дс1 = (4534375 – 4489173) × 70 = 3164140 руб.
в третьей опытной группе:
Дс1 = (4709024 – 4489173) × 70 = 15389570 руб.
С учётом поголовья к концу технологического цикла производства инкубационного яйца от одной партии, средне массы птицы перед убоем, а также выхода мяса, в первой опытной группе было получено 55005,2 кг мяса, во второй опытной группе – 55927,3 кг, в третьей опытной группе – 60694,8 кг.
Следовательно, стоимость дополнительно полученного мяса птицы составила:
во второй опытной группе:
Дс2 = (55927,3 – 55005,2) × 90 = 82989 руб.
в третьей опытной группе:
Дс2 = (60694,8 – 55005,2) × 90 = 512064 руб.
Дополнительная стоимость во второй опытной группе равна 3247129,0 руб., в третьей опытной группе — 15901634,0 руб.
Экономический эффект составил:
во второй опытной группе:
Ээ = 163540+ 3247129,00 — 18833,75 = 3391835,25 руб.
в третьей опытной группе:
Ээ = 737040 + 15901634 — 38086,99 = 16600587,01 руб.
Экономическая эффективность на один рубль затрат составила:
во второй опытной группе:
Ээ = 3391835,25 : 18833,75 = 180,09 руб.
в третьей опытной группе:
Ээ = 16600587,01 : 38086,99 = 435,86 руб.
В результате положительного влияния СПАО-КД и СПАО-комплекса на организм птицы, применяемых во время воздействия технологических стрессов, достигнут высокий экономический эффект, обусловленный сохранностью поголовья и увеличением продуктивности.
Следовательно, ярко выраженное иммунотропное действие СПАО-комлекса и менее выраженное иммунотропное действие СПАО-КД при развитии стресса подтверждается высоким уровнем производственных показателей и, как следствие, уровнем экономической эффективности внедрения антистрессовой терапии в цикл производства инкубационного яйца.
Результаты исследований подтверждают более высокий уровень экономической эффективности, полученный при использовании СПАО-комплекс, в сравнении с разработанной кормовой добавкой СПАО-КД, что указывает на целесообразность дальнейшего изучения эффективности только фармакологического средства СПАО-комплекс.
2.2.3 Влияние фармакологического средства СПАО-комплекс на эффективность вакцинации у кур разного возраста мясного направления продуктивности
В настоящий момент инактивированные вакцины применяются для профилактики широкого спектра вирусных болезней птиц: ньюкаслская болезнь (НБ), инфекционный бронхит кур (ИБК), инфекционная бурсальная болезнь птиц (ИББ), реовирусный теносиновит (РВТ), метапневмовирусная инфекция (МПВИ), синдром снижения яйценоскости-76 (ССЯ-76) и синдром гидроперикардита кур (СГПК). Серологические исследования служат важным инструментом в программе мониторинга по оценке эффективности иммунизации птиц, позволяющим определить напряженность, однородность (коэффициент вариации – %КВ), продолжительность поствакцинального иммунитета, а также установить степень охвата поголовья при вакцинации, обнаружить появление инфекции и степень ее распространения в стаде. К факторам, влияющим на эффективность иммунизации птиц инактивированными эмульсионными вакцинами однозначно необходимо отнести наличие стрессов [122,123].
Был оценен уровень выработки антител в ответ на вакцинацию у птицы разного возраста по плану-графику мониторинга в зависимости от схемы вакцинации на следующие заболевания: инфекционная бурсальная болезнь, инфекционный бронхит кур, реовирусная инфекция, пневмовирусная инфекция, инфекционный энцефаломиелит. Титры антител на каждое заболевание оценивались в динамике в зависимости от возраста птицы и поствакцинального антителогенеза. Срок взятия крови зависело от типа вакцины и скорости выработки иммунного ответа (живая или инактивированная вакцина). В сравнительном аспекте был изучен поствакцинальный антителогенез при базовой программе иммунизации птицы и при применении на фоне вакцинации СПАО-комплекса в сравнении с минимальным ожидаемом значении по данным предприятия и с защитным уровнем.
Инфекционный энцефаломиелит птиц (эпидемический тремор, Encephalomyelitis infectiosa – лат., Avian encephalomyelitis – англ.)– остро протекающая вирусная болезнь, характеризующаяся дистрофическими изменениями в центральной нервной системе, пролиферацией лимфоидной ткани в поджелудочной железе и мышечном желудке, парезами и параличами конечностей, тремором мышц головы и шеи. Возбудитель инфекционного энцефаломиелита птиц – РНК-содержащий вирус семейства Picornaviridae рода Enterovirus [124]. Штаммы вируса инфекционного энцефаломиелита птиц, в зависимости от степени адаптации к организму эмбриона, образуют два фенотипических варианта (патотипа): энтеро- и нейротропный. Нейротропность, как правило, обусловливает летальный эффект и свойственна более адаптированным штаммам. Полевые и менее адаптированные варианты вируса при титровании на эмбрионах демонстрируют слабо выраженную клиническую картину [125].
Для защиты птиц от заболевания инфекционного энцефаломиелита птиц широко применяют живые вакцины. Живой вакциной из штамма «Calnek 1143М» прививают поголовье однократно методом выпаивания [126,127]. Вакцинация предотвращает снижение у кур яйценоскости, вызванное этим заболеванием, вертикальную передачу возбудителя потомству и обеспечивает защиту молодняка в течение первых недель жизни от раннего заражения благодаря трансовариальному иммунитету. Показателем поствакцинального иммунитета является уровень специфических антител до вакцинации и через несколько недель после нее. Живая вакцина против инфекционного энцефаломиелита птиц из штамма «Calnek 1143М» способна индуцировать у однократно иммунизированной птицы образование стойкого и длительного иммунитета [128,129].
Вакцинацию кур против инфекционного энцефаломиелита в возрасте 35 дней лекарственным препаратом АвиПро АЕ вакциной против инфекционного энцефалита птиц живой (производитель «Ломанн Анимал Хелс Гмбх», Германия). Максимальный титр антител был достигнут через 30 недель после вакцинации. Включение в технологию вакцинации птицы фармакологического средства СПАО-комплекс способствует усилению основных компонентов гуморального ответа против вируса инфекционного энцефаломиелита: интенсивности и продолжительности отклика гуморального ответа (таблица 10, рисунок 10).
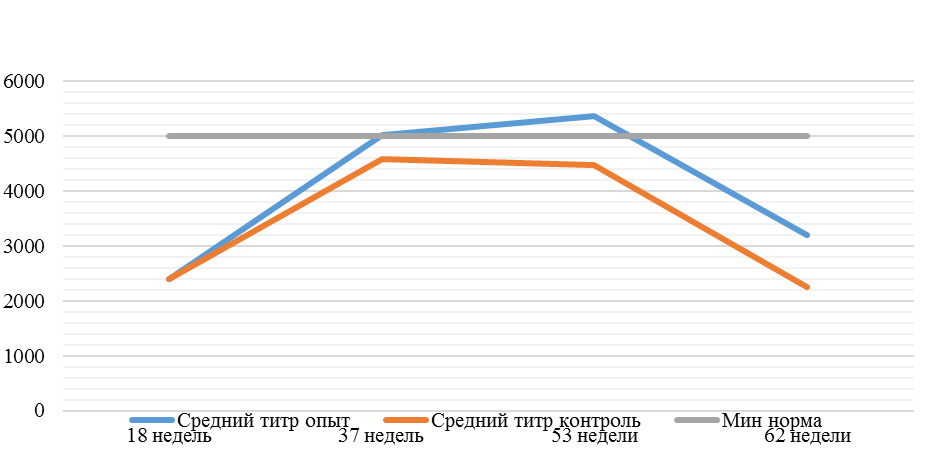
Рисунок 10 – Динамика средних титров антител к возбудителю инфекционного энцефаломиелита кур в зависимости от возраста
Из данных таблицы 10 следует, что при начальном равном уровне титров антител в возрасте 18 недель фоне использования СПАО-комплекса титры антител против инфекционного энцефаломиелита превысили ожидаемый минимальный уровень в возрасте 37 и 53 недель и были выше, чем у птицы на фоне базовой технологии вакцинации на 9,47 и 19,75 % соответственно, в возрасте 62 недель – на 42,38 %.
Это указывает не только на более высокую интенсивность гуморального ответа, но и на удлинение продолжительности отклика. Уровень титров антител в возрасте 62 недель был ниже, чем в 53 недели, но снижение на фоне СПАО-комплекса выражено менее, чем на фоне базовой технологии.
Таблица 10 – Динамика средних титров антител к возбудителю инфекционного энцефаломиелита кур в зависимости от возраста и срока вакцинации
| Период после вакцинации | Возраст | Средний титр антител | Минимальное ожидаемое значение титра антител | |
| опытная группа | контрольная группа | |||
| 11 недель1 | 18 недель | 2404 | 2404 | 5000 |
| 30 недель1 | 37 недель | 5015 | 4581 | 5000 |
| 46 недель1 | 53 недели | 5365 | 4480 | 5000 |
| 55 недель1 | 62 недели | 3205 | 2251 | 5000 |
В возрасте 62 недель, к концу продуктивного периода у кур было установлено снижение титра антител. Полученные данные согласуются с исследованиями Менщиковой А.Э. и соавторов [128], подтверждающими эффективность иммунизации вакциной штамма «Calnek 1143».
На рисунке 11 представлена динамика геометрического титра антител к возбудителю инфекционного энцефаломиелита птиц зависимости от возраста.
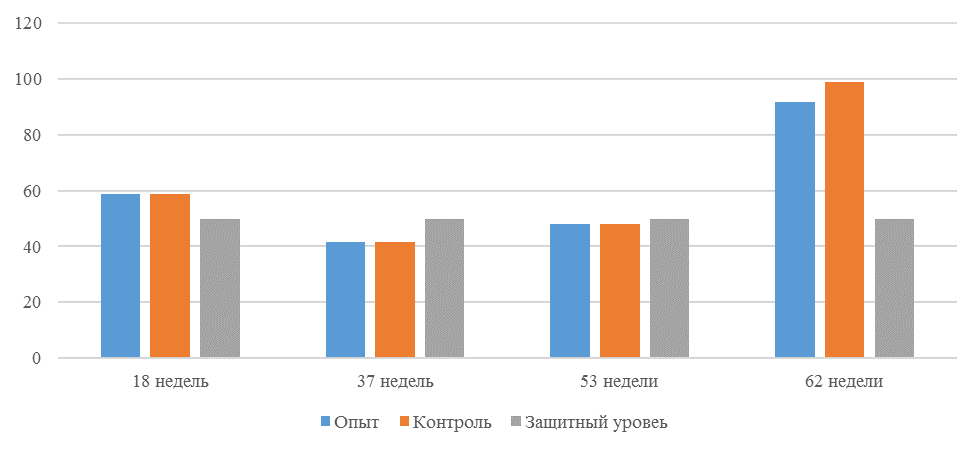
Рисунок 11 – Динамика геометрического титра антител к возбудителю инфекционного энцефаломиелита птиц в зависимости от возраста
При этом следует отметить, что уровень геометрического титра антител к возбудителю инфекционного энцефаломиелита только у кур опытной группы находился в диапазоне средних значений [130,131] в возрасте 30 (4000-6400) недель.
Об однородности свидетельствует значение коэффициента вариабельности, среднее значение которого за четыре проведённых контроля сыворотки крови составило 57,74 % на фоне базовой технологии вакцинации, 56,34 % — на фоне применения СПАО-комплекса (рисунок 12).
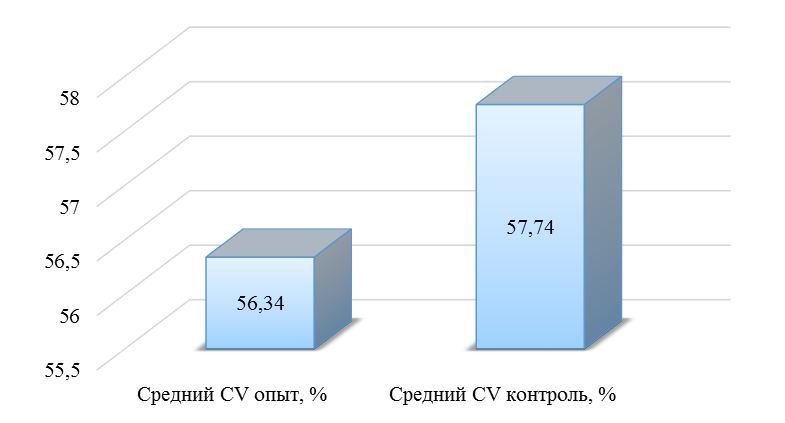
Рисунок 12 – Среднее значение коэффициента вариабельности титров антител к возбудителю инфекционного энцефаломиелита птиц.
При использовании СПАО-комплекса показатель однородности был ниже на 2,42 %, что указывает на более высокую степень однородности.
Вместе с тем данные рисунка 12 свидетельствуют, что влияние СПАО-комплекса на однородность вакцинации выражено незначительно.
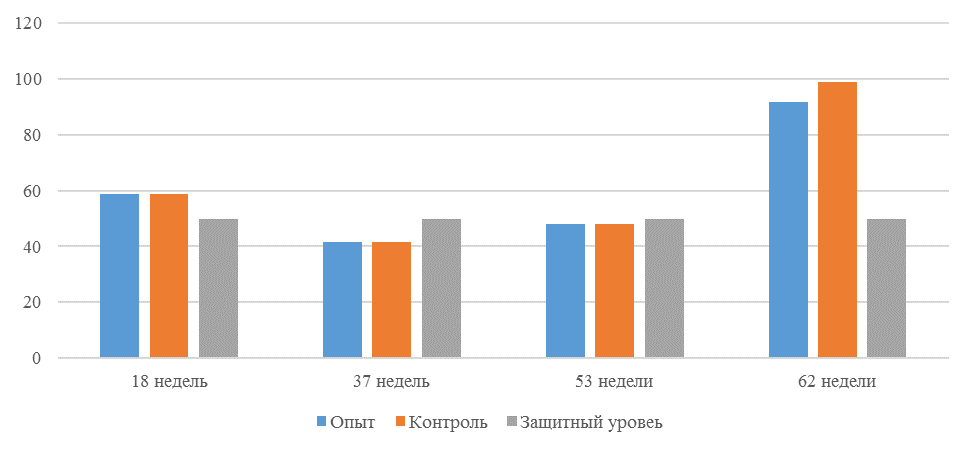
Рисунок 13 – Динамика изменения значений коэффициента вариабельности титров антител к возбудителю инфекционного энцефаломиелита птиц в зависимости от возраста птицы
В возрасте 18, 37 и 53 недель значения коэффициента вариации не отличаются, но в возрасте 37 и 53 недель их уровень свидетельствует об однородности вакцинации, так как величина коэффициента вариабельности составляет менее 50 %. К концу продуктивного периода на фоне снижения титров антител у кур опытной группы значение коэффициента вариабельности ниже на 7,1 %. Следовательно, влияние СПАО-комплекса на однородность вакцинации против инфекционного энцефаломиелита птицы выражено незначительно.
Уровень титров антител к возбудителю инфекционного энцефаломиелита птиц на фоне использования СПАО-комплекса превысил ожидаемый минимальный уровень в возрасте 37 и 53 недель и был выше, чем у птицы на фоне базовой технологии вакцинации на 9,47 и 19,75 % соответственно, в возрасте 62 недель – на 42,38 %. Влияние СПАО-комплекса на однородность вакцинации против инфекционного энцефаломиелита птицы выражено незначительно – меньше на 7,1 %.
Инфекционная бурсальная болезнь (болезнь Гамборо, инфекционный бурсит, инфекционный нефроз, Infectiosis Bursitis gallinarum – лат., Infectious bursal disease – англ.) – инфекционная контагиозная болезнь вирусного происхождения, поражающая преимущественно цыплят 2-15 недельного возраста и характеризующаяся поражением фабрициевой сумки, нефрозом, внутримышечными кровоизлияниями и диареей. Возбудитель – РНК-содержащий вирус, принадлежащий к роду Avibirnavirus семейства Birnoviridae [132]. Различают два серотипа вируса. Серотип I поражает преимущественно кур, обладает высокой контагиозностью – заболеваемость достигает 100%, а летальность может превышать 30 %. Серотип II не обладает патогенностью и встречается у индюков, уток и кур. Выявлены серологически близкие полевые вирусы, но не идентичные серотипу I, которые в настоящее время известны как вариантные штаммы, а также изоляты вируса Гамборо серотипа I, обладающие высокой патогенностью, названные высоковирулентными штаммами инфекционной бурсальной болезни [133,134,135]. Известной особенностью возбудителя инфекционной бурсальной болезни является антигенная изменчивость штаммов в пределах одного серотипа, происходящая в различные временные промежутки и зависящая от видового и породного состава птицепоголовья, его иммунного статуса и множества других факторов [136].
При специфической профилактике инфекционной бурсальной болезни нужно учитывать спектр и уровень вирулентности штаммов возбудителей, циркулирующих в хозяйстве, уровень материнского иммунитета [137].
Вакцина против болезни Гамборо должна стимулировать иммунный ответ в присутствии материнских антител, в совокупности с высокой степенью приживляемости вакцинного вируса в организме привитой птицы. Важно, чтобы вакцинный вирус длительное время персистировал в организме цыпленка, стимулируя продолжительный иммунитет. В то же время, вакцинный препарат должен быть безопасным и стабильным, а метод применения – простым [138].
Для специфической профилактики инфекционной бурсальной болезни применяют вакцины двух видов, инактивированные и живые. В последние десять лет в ряде стран используются рекомбинантные векторные и иммунокомплексные вакцины [139,140].
Вакцинации живыми вакцинами осуществляется с целью стимулирования защитного уровня иммунитета путем использования вируса вакцины, прежде чем птица будет подвержена более сильному полевому вирусу. Проведение вакцинации в определенные сроки имеет очень важное значение: при проведении ее слишком рано может произойти полная блокировка материнских антител; при проведении позже положенного срока полевой вирус может вызвать проблемы до того, как сформируется поствакцинальный иммунитет. Важным фактором является фактором является активность вакцины. В зависимости от степени аттенуации штамма, живые вакцины делят на группы: «мягкие», «умеренные» («средние»), «умеренные плюс» («средние плюс»), «горячие» и «очень горячие». «Мягкие» вакцины в настоящее время не применяются вследствие неэффективности. «Умеренные», или «средние» вакцины характеризуются небольшим количеством побочных эффектов, но обладают ограниченной эффективностью в отношении высоковирулентных полевых штаммов инфекционной бурсальной болезни или при высокой инфекционной нагрузке. Применение вакцин, относящихся к категории «средних плюс», будет более полезно в случаях, когда есть необходимость в более ранней вакцинации, что может быть обусловлено риском раннего заражения птицы (ранее происходили вспышки инфекционной бурсальной болезни). На протяжении многих лет применялись только так называемые «умеренные» вакцины, но после появления высокопатогенных вспышек болезни Гамборо различные производители разработали «умеренные плюс» и «горячие». Вакцинные штаммы препаратов «средней плюс» группы способны преодолевать противодействие материнских антител раньше, чем вакцинные штаммы «средних» вакцин. То есть они могут быстрее, чем традиционные вакцины, нейтрализовать материнские антитела и тем самым облегчить раннюю вакцинацию. «Горячие» вакцины обладают мощным и активным действием, при этом приводят к поражению бурсы, снижая в результате иммунный ответ и эффект от других вакцинаций и производственные показатели. То есть «горячие» вакцины» сами по себе иммуносупрессивны, так как после их применения бурса не восстанавливается в полной мере. «Очень горячие» применяются ограниченно [141].
В зарубежной и отечественной практике известен ряд штаммов вируса инфекционной бурсальной болезни, используемых для изготовления биопрепаратов для защиты от данной инфекции: «SR-1», «1/РV», «Сheville», «ГКВ № 2105», BIA 52/70, «Винтерфилд-2512», D-78, ATCCNVR-2041, GP/82, NCAJM № V(P)-001033, «ВНИВИП», «КБК», «Био-92». Общим недостатком известных штаммов является их низкая антигенная и иммуногенная активность. Наиболее перспективным по совокупности существенных признаков является штамм «БГ» вируса ИББ птиц, репродуцируемый на 9-11-суточных эмбрионах кур и используемый для изготовления диагностических и вакцинных препаратов. Вакцины, полученные на его основе, преодолевают у цыплят в раннем возрасте материнский иммунитет к ИББ, стимулируют выработку высоких титров антител к вирусу и позволяют защитить птицу к моменту ее контакта с вирулентным штаммом вируса ИББ [136]
Живые вакцины, производимые в России, по антигенной активности подразделяют на три группы: высокоаттенуированные вакцины (мягкие), среднеаттенуированные вакцины (промежуточные) и слабоаттенуированные вакцины (жесткие) [138].
Инактивированные вакцины обычно готовят из патогенных штаммов вирусов, разрушая вирулентность химическими или физическими методами [142]. Инактивированные вирусы в чистом виде обладают низкой иммуногенной активностью. Этот недостаток исправляется добавлением к вакцине неспецифически действующего компонента – адъюванта, повышающего специфический иммунный ответ на антигены [143]. Преимущества использования адъювантов в композициях вакцин включают их способность направлять и оптимизировать иммунные ответы, ускорять опосредованные клетками реакции, усиливать иммуногенные свойства слабых иммунных компонентов, совершенствовать качество вакцин и их эффективность в тех случаях, когда иммунные ответы реципиентов ослаблены [144].
В современном птицеводстве широко применяется иммунизация родительских стад живыми и убитыми вакцинами против болезни Гамборо. Теоретически, вакцинация птицы инактивированными вакцинами, изготовленными с применением масляного адъюванта, должна приводить к очень высокому уровню протективных материнских антител, получаемых цыплятами [144,145]. Следует отметить, что разные по вирулентности группы штаммов ИББ «пробивают» разные по значению титры материнских антител [139].Эти антитела передаются от несушек через яйца к потомству. Уровень материнских антител относительно высок у цыплят в суточном возрасте, но с течением времени он прогрессирующе снижается. Такое снижение материнских антител у птиц яйценосных пород медленное, в отличие от бройлеров. По мере того, как у цыплят снижается уровень материнских антител, птицы становятся в большей степени восприимчивыми к вакцинации, но одновременно возрастает их чувствительность к патогенным полевым штаммам. Следовательно, определение оптимального времени проведения вакцинации должно основываться на результатах определения уровня материнских антител у цыплят в суточном возрасте. При угрозе заражения стада птиц вирусом болезни Гамборо проведение как можно более ранней вакцнации цыплят не всегда целесообразно. Для того чтобы вакцинация была эффективной, у прививаемой птицы должен значительно снизиться уровень материнских антител, в противном случае вакцинация не даст полной стимуляции иммунной системы прививаемой птицы [145].
Существует мнение, что цель вакцинации цыплят суточного возраста – выравнивание титров внутри стада через частичную инактивацию материнских антител, при этом настоящая защита достигается благодаря ревакцинации. Отдельные испытания показывают, что вакцинация против болезни Гамборо в суточном возрасте в присутствии материнских антител бесполезна, так как вакцинного вируса на третий день после прививки иммунофлюоресценция не обнаруживает в фабрициевой бурсе. Успех вакцинации заключается в том, чтобы вирусы достигли бурсы и способствовали созданию в ней иммунитета. Комбинированная вакцинация в суточном возрасте живой и инактивированной вакциной (как это принято во многих странах против болезни Ньюкасла) явно улучшает защиту от болезни Гамборо [141].
Особое значение при вакцинации имеет однородность и уровень материнского иммунитета против инфекционной бурсальной болезни. Если однородности уровня материнских антител добиться не удается, то очень часто инфекционная бурсальная болезнь протекает в субклинической форме, сопровождающейся низкими привесами и колибактериозом, не поддающимся лечению. Когда невозможно исправить ситуацию на родительском стаде, следует использовать инактивированные вакцины для цыплят в суточном возрасте [137,146,147]. Это не только предупреждает развитие иммуносупрессии, возникновение субклинической формы болезни, но и снижает количество случаев проявления колибактериоза до единичных и, как следствие, позволяет отказаться от применения антибиотиков. Однако при циркуляции высоковирулентных полевых штаммов они малоэффективны [148].
Прививки против болезни Гамборо инактиватом создают надежную и стабильную материнскую защиту нового поколения, однако на более поздний срок отодвигается его ранняя вакцинация, что может привести к возникновению вспышек болезни Гамборо [141].
С целью установления различий между векторными, иммунокомплексными и традиционными живыми вакцинами против инфекционной бурсальной болезни, было проведено исследование, в результате которого установлено, что живая традиционная вакцина начинает защищать бройлеров от высоковирулентного штамма болезни Гамборо намного раньше, чем иммунокомплексные или векторные вакцины, применение качественной живой промежуточной вакцины против болезни Гамборо не приводит к иммуносупрессии. Установлено, что большинство живых аттенуированных вакцин против инфекционной бурсальной болезни может вызывать атрофию бурсы и иммуносупрессию. Последствием применения таких вакцин является низкий иммунный ответ на введение другие вакцин, возникновение сопутствующих инфекций. При применении таких вакцин может быть не достигнута полная защита против высоковирулентных и вариантных штаммов вирусов. Компромисс между возможностью наиболее ранней вакцинации и преодолением материнских антител достигается применением векторной вакцины [139].
Следовательно, при выборе вакцин для профилактики инфекционной бурсальной болезни, важно, чтобы биопрепарат оказывал минимальное повреждающее воздействие на иммунную систему.
В условиях предприятия вакцинацию птицы против инфекционной бурсальной болезни проводят четырехкратно. Первую и вторую вакцинацию в возрасте 14 и 22 дней осуществляют вакциной Пулвак Бурса F против инфекционной бурсальной болезни (производитель «Zoetis Inc.», США). Третий раз птице в возрасте 72 дней (11 недель) вводят вакцину против ньюкаслской болезни, инфекционного бронхита кур, инфекционной бурсальной болезни (производитель «Авивак», Россия). Четвёртый раз птицу иммунизируют в возрасте 125 дней (18 недель) вакциной Квадрактин VP2 против ньюкаслской болезни, инфекционного бронхита кур, инфекционной бурсальной болезни и реовирусного теносиновита птиц инактивированной эмульгированной (прозводитель Phibro Animal Health Corporation, Израиль).
Данные таблицы 30, рисунка 14 свидетельствуют о том, что схема вакцинации способствует формированию иммунитета с необходимой степенью напряжённости. В возрасте 6 дней титр антител также превышал минимальное ожидаемое значение, но в разных группах не различался. В период с 9-дневного по 30-дневный возраст установлено снижение уровня титра антител, которое было ниже минимального значения. Это связано с тем, что с момента рождения цыплят защищают материнские антитела, которые впоследствии сокращаются [149].
На фоне применения СПАО-комплекса усиливается интенсивность отклика гуморального ответа на введение вакцины против инфекционной бурсальной болезни (рисунок 14, таблица 11).
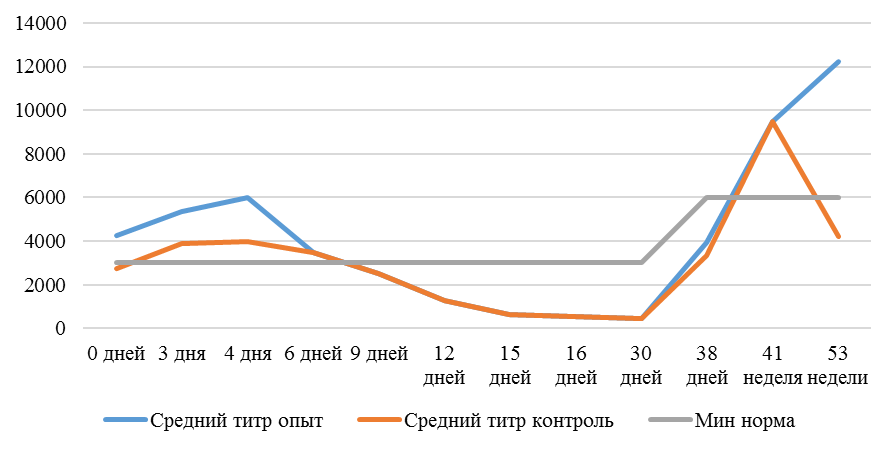
Рисунок 14 – Динамика средних титров антител к возбудителю инфекционной бурсальной болезни в зависимости от возраста
СПАО-комплекс оказывает положительное влияние на интенсивность формирования титров антител против инфекционной бурсальной болезни, на продолжительность иммунного ответа такое воздействие не установлено.
Таблица 11 – Динамика средних титров антител к возбудителю инфекционной бурсальной болезни в зависимости от возраста и срока вакцинации
| Период после вакцинации | Возраст | Средний титр антител | Минимальное ожидаемое значение титра антител | |
| опытная группа | контрольная группа | |||
| — | 0 дней | 4238 | 2743 | 3000 |
| — | 3 дня | 5354 | 3889 | 3000 |
| — | 4 дня | 5977 | 3977 | 3000 |
| — | 6 дней | 3456 | 3465 | 3000 |
| — | 9 дней | 2495 | 2495 | 3000 |
| — | 12 дней | 1287 | 1287 | 3000 |
| 1 день1 | 15 дней | 621 | 621 | 3000 |
| 2 дня1 | 16 дней | 561 | 561 | 3000 |
| 16 дней1 | 30 дней | 472 | 472 | 3000 |
| 24 дня1 | 38 дней | 3953 | 3345 | 6000 |
| 13 недель4 | 41 неделя | 9482 | 9482 | 6000 |
| 35 недель4 | 53 недели | 12218 | 4218 | 6000 |
Каждое последующее введение вакцины характеризовалось выработкой антител, уровень которых превышал ожидаемое минимальное значение в 38 дней и 41 неделю, но на фоне СПАО-комплекса это было более выражено: в возрасте 38 дней титр антител превышал контрольные показатели на 18,2 %, в возрасте 41 недели уровень антител был одинаковый.
В возрасте 53 недели у кур, которым применяли СПАО-комплекс в отличие от контроля титр антител был выше, чем ожидаемое минимальное значение более, чем в 2 раза, и в 2,9 раза выше, чем у птицы, которым СПАО-комплекс не применяли (рисунок 9). Кроме того, у птиц, получавших СПАО-комплекс, уровень антител к 53-недельному возрасту продолжал возрастать, на фоне базовой технологии, наоборот, было отмечено снижение этого показателя, что указывает на снижение продолжительности гуморального отклика.
Эти данные подтверждаются значением геометрического титра антител к возбудителю инфекционной бурсальной болезни (рисунок 15)
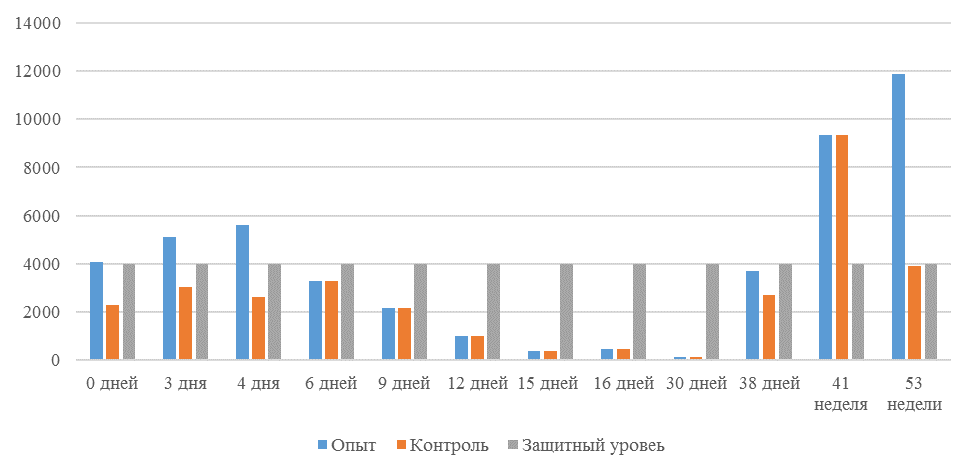
Рисунок 15 – Динамика геометрического титра антител к возбудителю инфекционной бурсальной болезни в зависимости от возраста
Из данных рисунка следует, что в возрасте 38 дней, или через 24 дня после вакцинации уровень антител к возбудителю инфекционной бурсальной болезни почти достиг защитного уровня [150], в дальнейшем, при ревакцинации отмечалось увеличение напряженности иммунитета. Применением СПАО-комплекса позволило усилить напряженность иммунитета в 1,3 раза и в 3,05 раза в возрасте 38 дней и 53 недели соответственно.
Данные рисунка 16, отражающие значение коэффициента вариабельности, позволяют сделать вывод о положительном влиянии СПАО-комплекса на однородность уровня антител против возбудителя инфекционной бурсальной болезни.
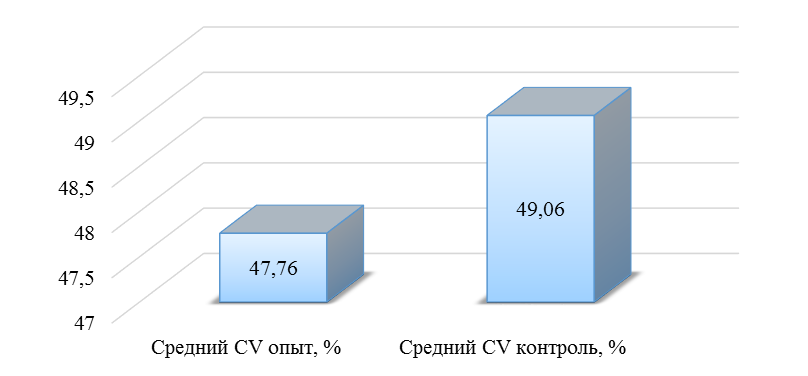
Рисунок 16 – Среднее значение коэффициента вариабельности титров антител к возбудителю инфекционной бурсальной болезни
Его среднее значение за период наблюдений в опытной группе было выше, чем в контрольной на 2,5 %.
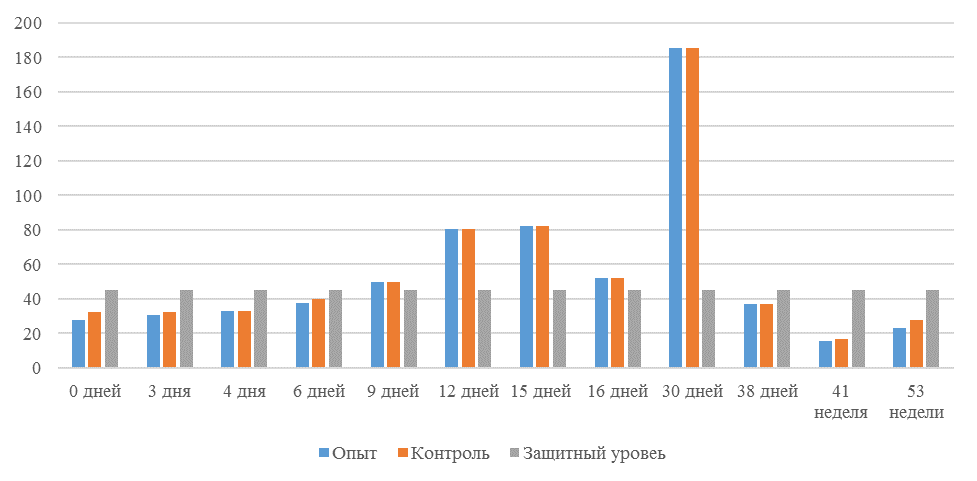
Рисунок 17 – Динамика изменения значений коэффициента вариабельности титров антител к возбудителю инфекционной бурсальной болезни в зависимости от возраста птицы
Анализ данных рисунка 17 позволяет заключить, что применение СПАО комплекса позволяет повысить однородность иммунного ответа только при ревакцинации инактивированными вакцинами.
До ревакцинации значение коэффициента вариабельности в обеих группах не отличалось. Уровень, соответствующий защитному, был достигнут в 38-дневном возрасте. После ревакцинации, в возрасте 41 недели коэффициент вариабельности титров антител к возбудителю инфекционной бурсальной болезни в опытной группе был ниже на 7,1 %, в возрасте 53 недели – на 17,8 %.
Нарастание титров антител к 53-недельному возрасту, а также относительно меньшее значение коэффициента вариабельности может указывать на увеличение продолжительности отклика гуморального ответа, которое в конечном итоге будет способствовать более высокому уровню антител к возбудителю инфекционной бурсальной болезни в организме получаемых цыплят.
Уровень средних титров антител против инфекционной бурсальной болезни на фоне использования СПАО-комплекса в начале периода вакцинации были выше на 18,2 %, после ревакцинации – в 2,9 раза, защитный уровень титров был достигнут к 41-недельнму возрасту и продолжал нарастать в дальнейшем. Влияние СПАО-комплекса на однородность вакцинации установлено на этапе формирования иммунитета после ревакцинации: коэффициент вариабельности титров антител к возбудителю инфекционной бурсальной болезни был ниже на 7,1-17,8 %.
Инфекционный бронхит кур (Bronchitis infectiosa avium – лат., Infections Bronchitis – англ.) – остро протекающая высоко контагиозная болезнь вирусной этиологии. Восприимчивы куры всех возрастов. У цыплят она проявляется респираторным и уремическим синдромами, у кур – поражением репродуктивных органов, что ведет к длительному снижению яйценоскости. В большинстве случаев болезнь протекает бессимптомно и проявляется только снижением яйценоскости. Данное заболевание является синергистом комплекса – «хроническая респираторная болезнь» где возбудитель инфекционного бронхита находится совместно с микоплазмой, E. coli [151]. Возбудитель – вирус инфекционного бронхита кур (Avian infectious bronchitis coronavirus) относится к РНК-содержащим вирусам, семейству Coronaviridae, роду Coronavirus [152]. Вирусу свойственна высокая генетическая изменчивость в результате накопления точечных мутаций (мутация, мутационная изменчивость – наследуемые изменения гена или генов, контролирующих определенные наследственные признаки), инсерций (инсерция, или вставка – мутация, в результате которой вводится одно или несколько избыточных оснований молекулы ДНК или РНК;) и делеций и рекомбинации – обмен генетическим материалом между двумя близкими, но отличающимися по наследственным свойствам вирусам [153]. В настоящее время нет общепризнанной системы классификации вируса инфекционного бронхита кур. Исследования показали, что во многих странах циркулируют различные вариантные штаммы вируса ИБК [154,155,156]. В период с 2010 г. по 2013 г. в результате филогенетического анализа, проведенного российскими учеными в РФ, выявленные изоляты вируса ИБК были отнесены к генотипам 793B, Массачусетс, D274 и QX. В это же время отмечена тенденция к росту числа случаев обнаружения изолятов вируса ИБК, относящихся к генотипу 793B. Аналогичная тенденция наблюдается в большинстве европейских стран [153].
Эпизоотическая ситуация по инфекционному бронхиту кур осложняется регулярным появлением новых вариантов вируса ИБК с низким уровнем родства к традиционным вакцинным штаммам. Возникающие вариантные штаммы вируса ИБК зачастую становятся причиной поражения птицепоголовья, вакцинированного «классическими» вакцинными штаммами, принадлежащими к серотипу Массачусетс [154,159,160]. Вакцинация птиц одним серотипом не гарантирует полной защиты от гетерологичных штаммов вируса инфекционного бронхита кур, возможность высокой защиты обеспечивает использование живых вакцин из комбинаций классического и вариантного [157,161,162,163,164,165]. Например, аттенуированный штамм вируса ИБК V1-1/96 можно применять для создания защиты цыплят от группы вирусов ИБК серотипа 793B, так как при вакцинации цыплят штаммом V1-1/96 ИБК отмечено проявление сильных протективных свойств, обеспечивающих защиту против инфицирования гомологичным вирусом 793B ИБК [166].
Значительное антигенное разнообразие вируса инфекционного бронхита кур приводит к тому, что иммунитет, сформированный к одному серотипу, слабо защищает против инфекции гетерологичным серотипом. Установлено, что в хозяйствах вакцинация штаммом, гомологичным циркулирующему в регионе, обеспечивает лучшую защиту, чем вакцинация гетерологичным штаммом [153].
В последнее время появилось много экспериментальных доказательств существования перекрестной защиты между различными штаммами. Считается, что, в связи, с этим вакцины ИБК из некоторых серотипов могут создавать защиту против штаммов ИБК, не принадлежащих этому серотипу, хотя отмечается, что это спорный вопрос [167]. Так, в экспериментальных условиях была показана высокая эффективность вакцин по программе Ма5+4/91. Но это не остановило вспышки ИБК QX в полевых условиях. Недавно разработанные вакцины на основе данного генотипа пока широко не применяются, поэтому говорить об их эффективности в промышленных условиях следует осторожно [168,169].
Защита от различных генотипов вируса ИБК возможна путем использования различных комбинаций гетерологичных вакцинных штаммов: 4/91, Н-120, Ма5, D274, IB88, IBvar, QX и др. Применение вакцин из гетерологичных штаммов ИБК по показаниям будет однозначно эффективным [153].
Однозначно, что основным средством борьбы с ИБК является специфическая профилактика с применением живых и инактивированных вакцин [152,153].
Для специфической профилактики заболевания используются живые, инактивированные и векторные вакцины [170,171,172,173,174,175,176].
Живые вакцины применяют для защиты поголовья птицы от инфекции в раннем возрасте, а также для подготовки иммунной системы птицы перед введением инактивированной вакцины. Основные преимущества живых вакцин – активизация всех звеньев иммунной системы, вызывающая сбалансированный иммунный ответ (системный и локальный, иммуноглобулиновый и клеточный). Это играет особую роль, когда клеточный иммунитет важен, а также при инфекциях слизистых оболочек, где требуется как локальный, так и системный иммунитет. Местное применение живых вакцин обычно является более эффективным для стимулирования локального ответа. Живые вакцины создают раннюю неспецифическую защиту, развивающуюся уже через 1-2 дня, благодаря явлению гомологичной интерференции [151,152,177]. Зарекомендовано использование вакцин на основе серологически отличных штаммов [178].
Недостатком использования живых вакцин в производственных условиях является то, что вирус чувствителен к факторам окружающей среды, которые могут легко его инактивировать [158], этим объясняется необходимость ревакцинации, а несоблюдение инструкции по применению вакцин часто приводит к снижению эффективности биопрепаратов.
Для создания более прочного и продолжительного иммунитета производят и применяют инактивированные вакцины.
Инактивированные вакцины менее реактогенны, менее опасны осложнениями при проведении массовой иммунопрофилактики, их применяют для усиления иммунитета, созданного живыми вакцинами. Инактивированная вакцина, в отличие от живой, малоэффективна для предотвращения респираторной формы болезни у бройлеров. Однако, она весьма полезна для профилактики снижения яйценоскости [151,152].
Тем не менее, однократное применение инактивированной вакцины не обеспечивает необходимый уровень защиты [155,179,180].
В идеале вакцинация должна повторять иммунологические стимулы естественной инфекции, сводя до минимума нежелательный эффект. Она должна вызывать высокий уровень иммунитета при небольшой дозе вакцины, слабую и кратковременную общую и местную реакции и продолжительный иммунитет. В мировой практике применяемые схемы вакцинации несколько отличаются друг от друга, но основной принцип один. Первая вакцинация проводится с использованием живой вакцины, содержащей менее вирулентный штамм, вторая – живой вакциной с более вирулентным и иммуногенным штаммом, третья – с использованием инактивированной вакцины [151,152,181].
Применяемый для изготовления вакцин против инфекционного бронхита кур штамм «Н-120» производственного вируса инфекционного бронхита кур продолжает являться достаточно иммуногенным по отношению к вирулентным вирусам инфекционного бронхита кур, относящихся к серотипу Массачусетс [181]. Включение в состав вакцин штаммов нескольких серотипов вируса значительно расширяет спектр защиты птицы такими препаратами [182]. Полиштаммные инактивированные вакцины против инфекционного бронхита кур вызывают формирование высокой специфической иммунной защиты в отношении гомологичных штаммов различных серотипов вируса инфекционного бронхита кур, входящих в состав таких вакцин [183].
Родительское стадо иммунизируют против инфекционного бронхита кур многократно. В первый день жизни вводят две вакцины: Пулвак IBпраймер против инфекционного бронхита кур живую сухую (производитель производитель «Zoetis Inc.», США) и Нобилис® IB 4/91 (производитель «Интервет Интернешнл Б.В.», Нидерланды). Второй, третий и шестой раз птицу иммунизируют вакциной Нобилис® IB 4/91. Во время третьей иммунизации одновременно с вакциной Нобилис® IB 4/91 вводят вакцину против ньюкаслской болезни, инфекционного бронхита кур, инфекционной бурсальной болезни (производитель «Авивак», Россия). Во время четвёртой, седьмой и последующих вакцинациях каждые шесть недель используют вапкцину Пулвак IB праймер против инфекционного бронхита кур живую сухую. Перед началом продуктивного периода (пятая вакцинация против инфекционного бронхита кур) применяли вакцину Квадрактин VP2 против ньюкаслской болезни, инфекционного бронхита кур, инфекционной бурсальной болезни и реовирусного теносиновита птиц инактивированной эмульгированной (прозводитель Phibro Animal Health Corporation, Израиль).
Такая схема вакцинации способствует формированию иммунного ответа на протяжении всего продуктивного периода (рисунок 18, таблица 12).
СПАО-комплекс при включении в схему вакцинации на формирование иммунитета против инфекционного бронхита кур.
Так, анализ данных рисунка 18 и таблицы 31 позволяет сделать вывод, что титр антител, вырабатываемых против инфекционного бронхита кур выше у птицы, которой применяли СПАО-комплекс.
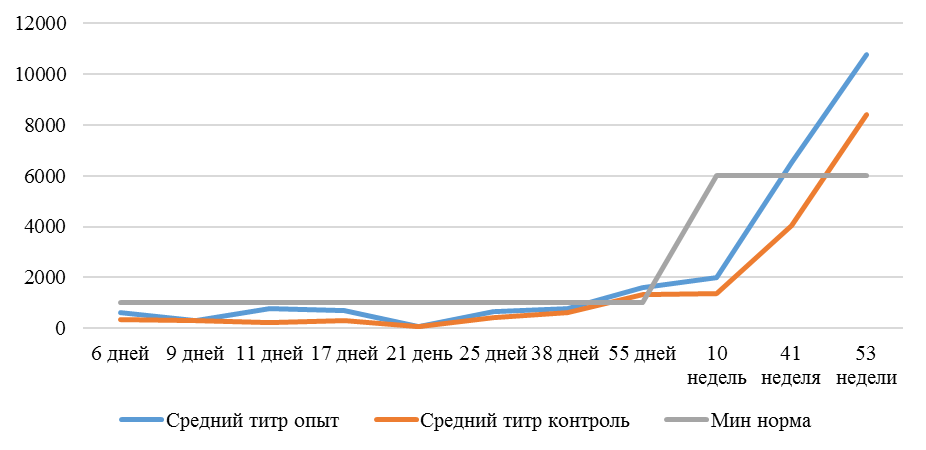
Рисунок 18 – Динамика средних антител к возбудителю инфекционного бронхита кур в зависимости от возраста
В период с 6-дневного по 17-дневный возраст кур установлено нарастание титра антител, но в контрольной группе у птицы в возрасте 11 дней отмечено снижение этого показателя, который к 17-дневному возрасту увеличивается.
Таблица 12 – Динамика средних титров антител к возбудителю инфекционного бронхита кур в зависимости от возраста и срока вакцинации
| Период после вакцинации | Возраст | Средний титр антител | Минимальное ожидаемое значение титра антител | |
| опытная группа | контрольная группа | |||
| 6 дней 1 | 6 дней | 627 | 350 | 1000 |
| 9 дней 1 | 9 дней | 307 | 307 | 1000 |
| 11 дней1 | 11 дней | 798 | 213 | 1000 |
| 6 дней2 | 17 дней | 689 | 310 | 1000 |
| 10 дней2 | 21 день | 81 | 81 | 1000 |
| 14 дней2 | 25 дней | 648 | 444 | 1000 |
| 27 дней2 | 38 дней | 761 | 604 | 1000 |
| 44 дня2 | 55 дней | 1601 | 1321 | 1000 |
| 59 дней2 | 10 недель | 1981 | 1381 | 6000 |
| 4 недели9 | 41 неделя | 6533 | 4033 | 6000 |
| 4 недели11 | 53 недели | 10769 | 8400 | 6000 |
В этот период ни в одной группе титр антител не достигал ожидаемого минимального значения, но, следует отметить, что в возрасте 6 дней у цыплят, которым применяли СПАО-комплекс, титр антител был выше сравнении с контрольной группой на 79,1 %, в возрасте 11 дней – в 3,7 раза, 17 дней – в 2,2 раза. Начиная с 25-дневного возраста отмечается нарастание титра антител, уровень которых к 55-дневному возрасту превышает минимальное ожидаемое значение. В опытной группе титр антител в возрасте 25 дней выше, чем в контрольной, на 45,9 %, 38дней – на 26,0 %, 55 дней – на 21,2 %. Позднее, начиная с 10-недельного возраста, при ревакцинации, также происходит нарастание титра антител, при этом их уровень достигает минимального ожидаемого значения раньше у птицы опытной группы – в возрасте 41 недели, у птиц контрольной группы – в возрасте 53 недель. При этом у кур, получавших СПАО-комплекс титр антител был выше, чем у кур контрольной группы в возрасте 10, 41 и 53 недель на 43,4, 62,0 и 28,2 %.
На рисунке 19 представлена динамика геометрического титра антител.
Изменения динамики уровня геометрических титров антител к возбудителю инфекционного бронхита кур в зависимости от возраста соответствует изменению средних титров.
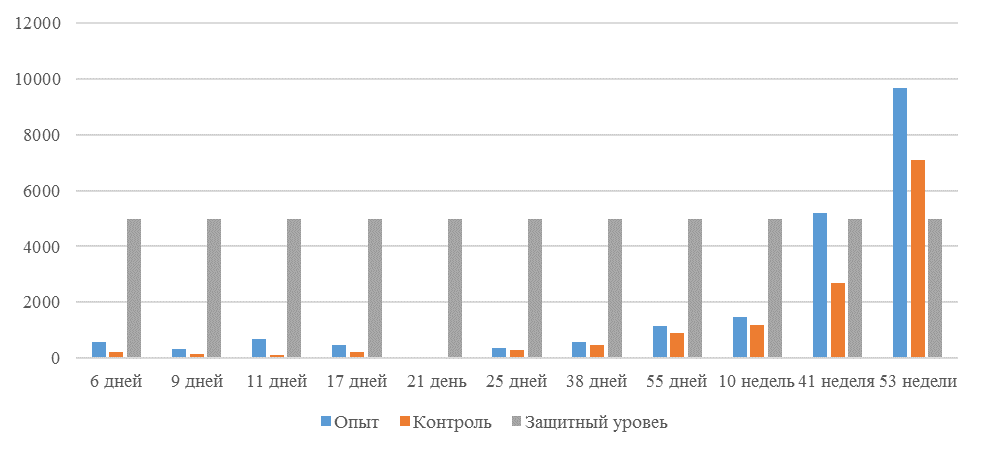
Рисунок 19 – Динамика геометрического титра антител к возбудителю инфекционного бронхита кур в зависимости от возраста
Также отмечено влияние СПАО-комплекса на формирование иммунного ответа: на 22,6 % ускоряется выработка антител в геометрическом титре выше защитного уровня [184] – на фон СПАО-комплекса этот уровень достигается в 41-недельном возрасте, на фоне базовой вакцинации – в 53-недельном.
На рисунке 20 представлено среднее значение коэффициента вариабельности антител, вырабатываемых на фоне вакцинации против инфекционного бронхита кур.
Рисунок 20 – Среднее значение коэффициента вариабельности к возбудителю инфекционного бронхита кур
Данные рисунка 20 указывают на положительное влияние СПАО-комплекса на однородность вакцинации – среднее значение коэффициента вариации в опытной группе на 7,4 % ниже, чем в контрольной.
Результаты однородности иммунитета к возбудителю инфекционного бронхита кур в динамике представлены на рисунке 21.
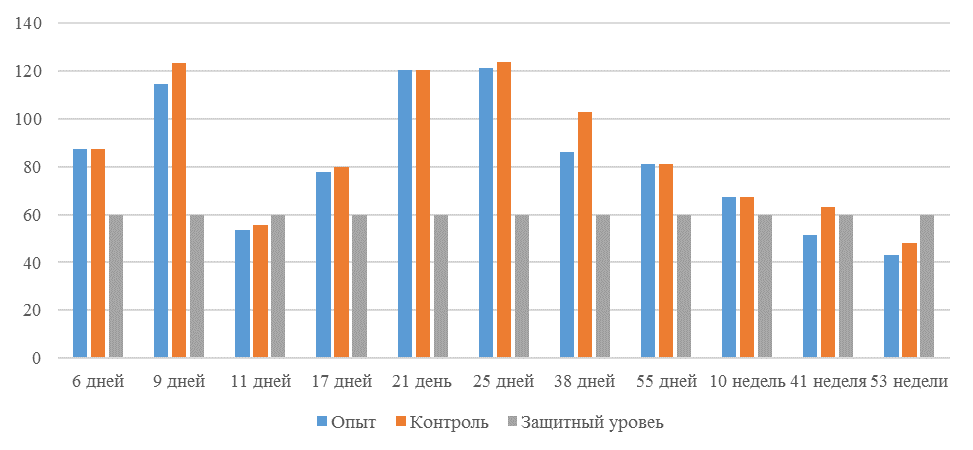
Рисунок 21 – Динамика изменения значений коэффициента вариабельности титров антител к возбудителю инфекционного бронхита кур в зависимости от возраста птицы
Из данных рисунка 21 следует, что однородность вакцинации (до уровня 40-60 % [185], соответствующего хорошей однородности) достигается в возрасте 11 дней, 41 и 53 недель: в опытной группе значения коэффициента вариабельности были ниже на 3,6, 18,2 и 10,6 % соответственно. Необходимо отметить, что по отдельным данным однородной вакцинации считается при коэффициенте вариабельности 45 % и менее [184]. При этом условии СПАО-однородность вакцинации достигается на фоне применения СПАО-комплекса в возрасте 53 недель. При этом в разные периоды исследований коэффициент вариации в опытной группе в 7 исследованиях из 11 был ниже, чем в контрольной (в остальных случаях значения были равными) на 2,6-18,2 %.
В период с 6-дневного по 17-дневный возраст у цыплят, которым использовали СПАО-комплекс, титр антител против инфекционного бронхита кур был выше сравнении на 79,1 % и в 2,2-3,7 раза, с 25-дневного по 55-дневный возраст – на 21,2-45,9 %, в 10-55-недельном возрасте – на 28,2-62,0 %. Применение СПАО-комплекса в программу вакцинации увеличивает на 3,6-18,2 % ее однородность, на 22,6 % ускоряет выработку антител в геометрическом титре выше защитного уровня.
Против реовирусной инфекции родительское стадо иммунизируют четыре раза. Первый и второй раз вакциной Нобилис® REO 1133 против реовирусной инфекции птиц живой сухой (производитель «Интервет Интернешнл Б.В.», Нидерланды). При третьей иммунизации использовали вакцину «РЕОМУН 3» против реовирусного теносиновита птиц инактивированную эмульгированную (производитель «CEVA-BIOMUNE Veterinary Biologicals Company», США). На заключительном этапе вакцинации против реовирусной ифнекции применял вакцину Квадрактин VP2 против ньюкаслской болезни, инфекционного бронхита кур, инфекционной бурсальной болезни и реовирусного теносиновита птиц инактивированной эмульгированной (прозводитель Phibro Animal Health Corporation, Израиль).
Применяемая схема вакцинации обеспечивает формование иммунитета к возбудителю реовирусной и инфекции (рисунок 22, таблица 13).
Данные рисунка 22 свидетельствуют, что включение СПАО-комплекса в программу вакцинации оказывает положительное влияние на формирование иммунитета к реовирусной инфекции.
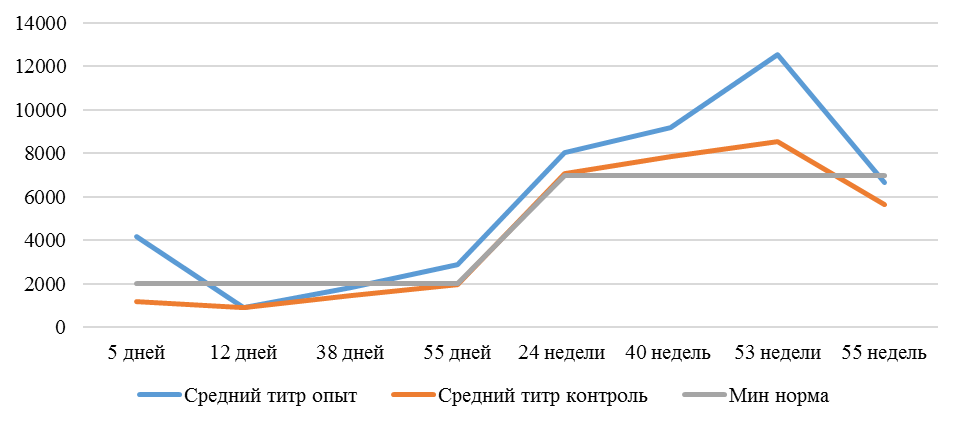
Рисунок 22 – Динамика средних титров антител к возбудителю реовирусной инфекции зависимости от возраста.
После введения вакцины в опытной группе титр антител достиг уровня, в 2,1 превышающий минимальное ожидаемое значение, и в 3,5 раза – аналогичный показатель в контрольной группе. Это свидетельствует о ярко выраженной интенсивности отклика под воздействием СПАО-комплекса.
Таблица 13 – Динамика средних титров антител к возбудителю реовирусной инфекции зависимости от возраста и срока вакцинации
| Период после вакцинации | Возраст | Средний титр антител | Минимальное ожидаемое значение титра антител | |
| опытная группа | контрольная группа | |||
| — | 5 дней | 4179 | 1179 | 2000 |
| 6 дней1 | 12 дней | 924 | 924 | 2000 |
| 12 дней2 | 38 дней | 1810 | 1460 | 2000 |
| 5 дней3 | 55 дней | 2881 | 1981 | 2000 |
| 6 недель4 | 24 недели | 8058 | 7058 | 7000 |
| 22 недели4 | 40 недель | 9210 | 7877 | 7000 |
| 35 недель4 | 53 недели | 12555 | 8555 | 7000 |
| 37 недель4 | 55 недель | 6639 | 5639 | 7000 |
Из данных таблицы 13 следует, что в возрасте 12 дней титр антител снизился, но после следующей вакцинации наблюдается нарастание титра антител к возбудителю реовирусной инфекции. В опытной группе отмечено более быстрое достижение уровня антител, которое превысило минимально ожидаемое значение – в возрасте 55 дней и 24 недели. В контрольной группе значение минимально ожидаемого титра антител отмечено только в возрасте 24 недели.
В возрасте 38 дней титр антител у кур, в схему вакцинации которых был включен СПАО-комплекс, был выше, чем в контрольной группе на 24,0 %, возрасте 55 дней – на 45,4 %. На этапе ревакцинации уровень титров антител оставался выше в опытной группе в сравнении с контролем: в возрасте 24 недель – на 14,2 %, 40 недель – 16,9 %, 53 недели – на 46,8 %.
На более продолжительный отклик указывает то, что к 55-недельному возрасту титры антител начинают снижаться, но, тем не менее, их уровень продолжает оставаться выше в опытной группе в сравнении с контролем на 17,7 %.
В результате применения СПАО-комплекса после первой однократной вакцинации против реовирусной инфекции титр антител достиг уровня, в 2,1 превышающий минимальное ожидаемое значение, и в 3,5 раза аналогичный показатель при базовой технологии вакцинации. Применение СПАО-комплекса оказывает положительное влияние на интенсивность отклика гуморального иммунитета к реовирусной инфекции, увеличивая средние титры антител на 24,0-46,8 %
На рисунке 23 представлена динамика геометрического титра антител к возбудителю реовирусной инфекции в зависимости от возраста.
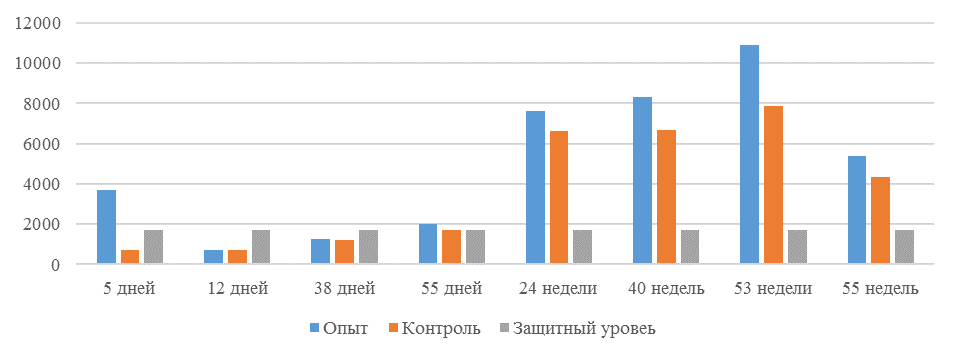
Рисунок 23 – Динамика геометрического титра антител к возбудителю реовирусной инфекции в зависимости от возраста
Данные рисунка 23 подтверждают положительное влияние СПАО-комплекса на интенсивность отклика гуморального ответа. Под воздействием фармакологического средства уровень антител достигает значения геометрического титра, соответствующего защитному [186], в 3,05 раза быстрее – уже в возрасте 55 дней. В дальнейшем он остаётся выше на 5,5-38,0 %.
Введение СПАО-комплекса птице оказывает положительное влияние на однородность вакцинации против реовирусной инфекции. На рисунке 24 представлено среднее значение коэффициента вариабельности.
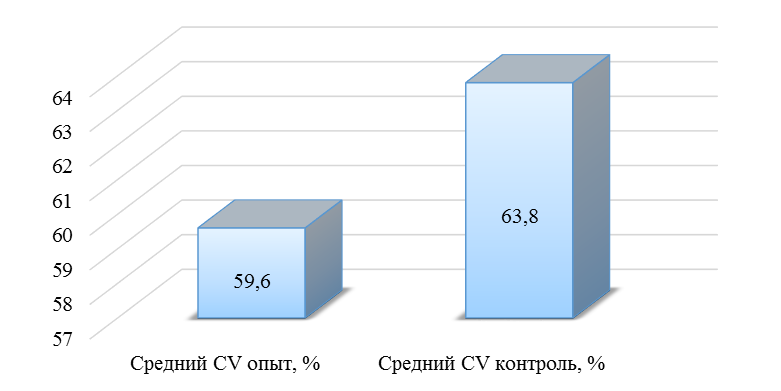
Рисунок 24 – Среднее значение коэффициента вариабельности титров антител к возбудителю реовирусной инфекции
По данным рисунка 24 следует, что включение СПАО-комплекса в программу вакцинации птицы повышает однородность отклика вакцинации против реовирусной инфекции: коэффициент вариабельности титров антител в опытной группе на 6,6 % ниже, чем в контрольной.
На рисунке 25 представлена динамика изменения значений коэффициента вариабельности титров антител к возбудителю реовирусной инфекции в зависимости от возраста птицы.
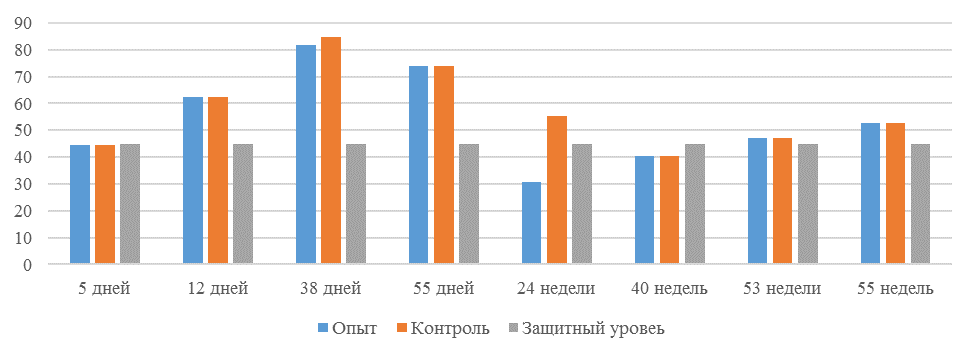
Рисунок 25 – Динамика изменения значений коэффициента вариабельности титров антител к возбудителю реовирусной инфекции в зависимости от возраста птицы.
Из данных рисунка 25 следует, что данная схема вакцинации в той или иной степени обеспечивает её однородность. При этом применение СПАО-комплекса способствует усилению однородности гуморального отклика, выявляемой в возрасте 38 дней и 24 недель – значение коэффициента вариабельности в контрольной группе на 3,4 и 44,6 % соответственно ниже в сравнении с контролем.
Под воздействием фармакологического средства СПАО-комплекса уровень антител к возбудителю реовирусной инфекции достигает значения, соответствующего защитному, в 3,05 раза быстрее, и превышает показатели интенсивности гуморального ответа в сравнении с базовой технологией вакцинации на 5,5-38,0 %, способствует сохранению напряженности гуморального ответа. Применение СПАО-комплекса способствует усилению однородности гуморального отклика при формировании иммунитета к возбудителю реовирусной инфекции, выявляемой в возрасте 38 дней и 24 недель, на 3,4 и 44,6 % соответственно.
Метапневмовирусная инфекция птиц (МПВИ), пневмовирусная инфекция – вирусное респираторное заболевание кур, индеек, фазанов, цесарок и других домашних и диких птиц всех возрастов, которое характеризуется воспалительными процессами верхних дыхательных путей, инфраорбитальных синусов, сопровождается затрудненным дыханием, чиханием, хрипами, назальными выделениями, хроническими энтеритами, перитонитами и воспалениями яичников. Это общее название двух сходных по клиническим признакам болезней: у индеек – ринотрахеита (Turkey Rhinotracheitis – TRT), а у кур – синдрома опухшей головы (Swollen Hhead Syndrome – SHS) [187,188,189]. Возбудитель заболевания – метапневмовирус. Это РНК-содержащий вирус с несегментированным одноцепочечным геномом, относящийся к семейству Paramyxoviridae, подсемейству Pneumovirinae, роду Metapneumovirus. На данный момент известно 4 подтипа вируса – А, В, С и D, которые классифицированы по антигенной структуре и аминокислотной последовательности их генов [188,189].
Подтипы А и В метапневмовируса распространены повсеместно (страны Европы, Африки, Азии, Центральной и Южной Америки), метапневмовирус птиц подтипа С регистрировали только в Северной Америке (США). О существовании еще одного подтипа D вируса сообщали исследователи из Франции [189].
Защита птицепоголовья от метапневмовирусной инфекции может быть обеспечена только проведением специфической профилактики посредством вакцинации птицы живыми и инактивированными вакцинами в зависимости от группы птицы. Вместе с тем существует мнение, что к метапневмовирусу (МПВ) уровень антител нарастает медленно, по сравнению с другими вирусами, вызывающими респираторные заболевания, особенно у цыплят [190].
В США пришли к выводу, что безопасными и эффективными зарекомендовали себя две живые аттенуированные вакцины против вируса подгруппы С [191,192]. Одна из этих вакцин была получена путём серийного размножения вирулентного APV в клеточных культурах, а другая путём холодовой адаптации APV. Эти два вакцинных штамма были названы Р63-APV и са-APV, соответственно [193].
Вакцинные штаммы 8544 и VC-03 МПВ птиц в прививочной дозе индуцируют формирование гуморальных антител в сыворотке крови птиц в низких титрах, в то же время штамм VC-03 отличается большей антигенной активностью [194].
Имеются работы по аттенуации вирусов ринотрахеита индеек и эффективного использования таких вирусов в качестве вакцин [195,196,197]. Живые и инактивированные вакцины на основе вируса ринотрахеита индеек используются как для индеек, так и для кур [198].
В России в настоящее время в птицеводстве применяются моно-и поливалентные инактивированные вакцины отечественного производства (ФГУ «ВНИИЗЖ»), которые обеспечивают достаточно напряжённый и продолжительный иммунитет против пневмовируса птиц. Защиту бройлеров обеспечивает вакцинация бройлеров живой вакциной из циркулирующего серотипа вируса. Вакцинация проводится без учета уровня материнских антител. Иммунизация родительских стад обеспечивает защиту только птицы родительского стада. При профилактике метапневмовирусной инфекции также важен местный иммунитет. Поэтому лучшим методом вакцинации является спрей-метод или интраназальное (окулярное) введение [170]. Имеются исследования, в результате которых на фоне двукратной иммунизации птицы родительского стада в 85 дней – живой вакциной спрей-методом, в 115 дней – инактивированной подкожно у полученного от них молодняка в суточном возрасте имелись антитела, что свидетельствует о защите цыплят-бройлеров от клинического проявления пневмовирусной инфекции [199].
Есть данные, что живые вакцины могут вызывать заболевания органов дыхания. Так, в результате экспериментального заражения показана способность изолята МПВ птиц подтипа В репродуцироваться в эпителии верхних дыхательных путей птиц, вызывая слабые респираторные признаки, конъюнктивиты и специфический гуморальный ответ [200].
Установлено, что инактивированная вакцина против метапневмовирусной инфекции, «PV03-B», выращенный в перевиваемой культуре клеток Vero, содержащая птиц обеспечила положительный уровень антител за весь период наблюдения (10 недель) [201]. Изучена инфекционная активность нативного метапневмовируса птиц и вакцины против метапневмовирусной инфекции птиц сухой живой, вакцина сохраняла инфекционную активность при температуре хранения – 400 С в течение 9 месяцев. Доказана способность производных 1,2,4-триазола (РАПК-60 и АИ-1) стимулировать выработку специфических к МПВ антител. При этом установлено, что соединение РАПК-60 обладает более высокой стимулирующей активностью и может быть использовано в схеме вакцинации цыплят против МПВ [200].
Было доказано, что подтип В пневмовируса, доминирующий на территории Российской Федерации, обеспечивает высокий иммунный ответ к антигенам подтипа А и В. Поэтому штаммы данного подтипа могут быть рекомендованы к использованию в качестве антигена инактивированной вакцины [202]. Преобладание на территории РФ метапневмовирусов подтипа В, высокая степень однородности вирусов внутри подтипа, а также возможность перекрестной защиты птиц после вакцинации подтипом В aMPV против вирусов подтипов А и В [203], указывают на целесообразность применения для защиты от метапневмовирусной инфекции вакцин, полученных на основе aMPV подтипа В [190].
Вакцинацию кур против метапневмовирусной инфекции проводят трехкратно, первый и второй раз используют Hipraviar-SHS – живую лиофилизированную вакцину против ринотрахеита индеек и синдрома опухшей головы кур и цыплят-бройлеров (производитель LABORATORIOS HIPRA, S.A.,(Испания), третий раз – Хиправиар ТРТ — вакцину против ринотрахеита индеек и синдрома отекшей головы кур и цыплят-бройлеров (шт. 1062 подтипа В), инактивированную.
Данные рисунка 26 и таблицы 14 указывают на формирование иммунного ответа при вакцинации птицы против метапневмовирусной ифнекции к 53-недельному возрасту.
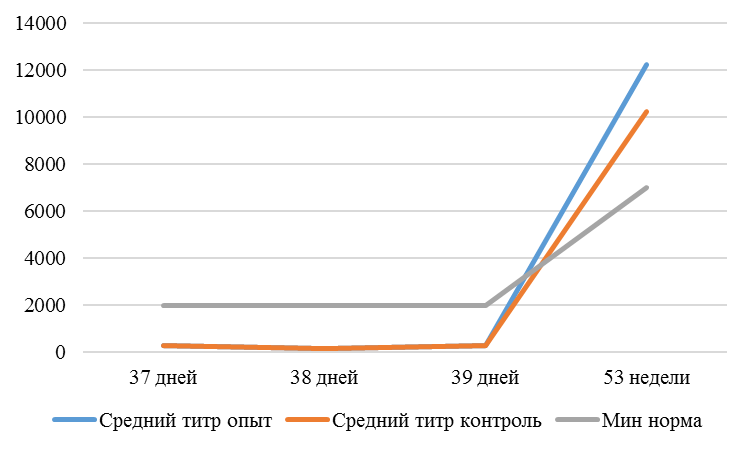
Рисунок 26 – Динамика средних титров антител к возбудителю метапневмовирусной ифнкции кур в зависимости от возраста
В таблице 14 приведены данные значений среднего титра антител к к возбудителю метапневмовирусной ифнкции кур в зависимости от возраста, срока вакцинации и в сравнении с минимальным ожидаемым значением.
Таблица 14 – Динамика средних титров антител к возбудителю метапневмовирусной ифнкции кур в зависимости от возраста
| Период после вакцинации | Возраст | Средний титр антител | Минимальное ожидаемое значение титра антител | |
| опытная группа | контрольная группа | |||
| 11 дней1 | 37 дней | 280 | 280 | 2000 |
| 12 дней1 | 38 дней | 162 | 162 | 2000 |
| 13 дней1 | 39 дней | 300 | 300 | 2000 |
| 29 недель3 | 53 недели | 12240 | 10240 | 7000 |
Так, в 37, 38 и 39-дневном возрасте уровень антител был одинаковым в обеих группах, но к 53-недельномувозрасту этот показатель уже превышал минимальное ожидаемое значение в 1,7 раза в опытной группе и 1,5 – в контрольной.
В момент контроля качества вакцинации под воздействием СПАО-комплекса уровень титра антител был выше, чем при базовой технологии вакцинации на 19,5 %.
На рисунке 27 представлена динамика геометрического титра антител к возбудителю метапневмовирусной инфекции в зависимости от возраста.
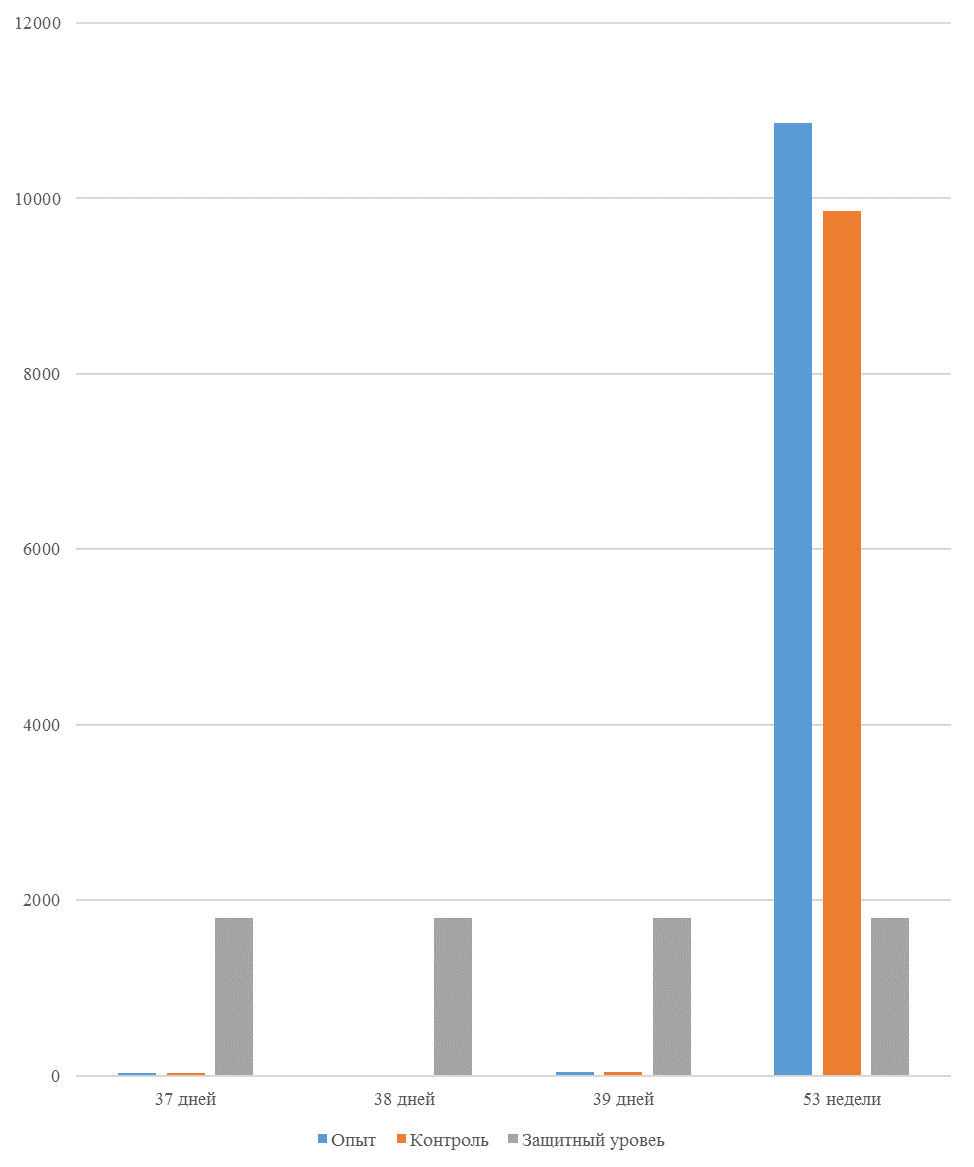
Рисунок 27 – Динамика геометрического титра антител к возбудителю метапневмовирусной инфекции в зависимости от возраста
Так же, как и среднее значение титров, значение геометрического титра антител к возбудителю реовирусной инфекции в 37, 38 и 39-дневном возрасте было одинаковым. После ревакцинации инактивированной вакциной этот показатель в опытной группе был на 10,1 % выше, чем в контрольной и превышал защитный уровень [204] в 6 раз (в контрольной группе в 5,5 раза),
Установлено положительное влияние СПАО-комплекса на среднее значение коэффициента вариабельности (рисунок 28).
Рисунок 28 – Среднее значение коэффициента вариабельности титров антител к возбудителю метапневмовирусной инфекции
В опытной группе значение коэффициента вариабельности было на 2,4 % ниже, чем в контрольной.
По данным исследований П.С. Ярославцевой с соавторами [205] на однородность вакцинации указывает значение коэффициента вариации, равное 97 %, О.Ф. Хохлачёва с соавторами [206] – 46 %. Исследованиями Е.А. Лазуткиной [207], проведенными на родительском стаде, получен коэффициент вариабельности, равный 56 %, с которым сравнивали полученные экспериментальные данные по динамике изменений значений коэффициента вариабельности титров антител к возбудителю реовирусной инфекции в зависимости от возраста птицы (рисунок 29).
Из данных рисунка 29 следует, что однородность вакцинации была достигнута к 53-недельному возрасту, при этом в контрольной группе оно было равно значению, обеспечивающему однородность. При применении СПА-комплекса однородность титров антител к возбудителю метапневмовирусной инфекции увеличивается на 22,5 %.
Под воздействием СПАО-комплекса после ревакцинации формирование титра антител к возбудителю метапневмовирусной инфекции увеличивается на 10,1 % и превышает защитный уровень в 6 раз, однородность титров антител увеличивается на 22,5 %.
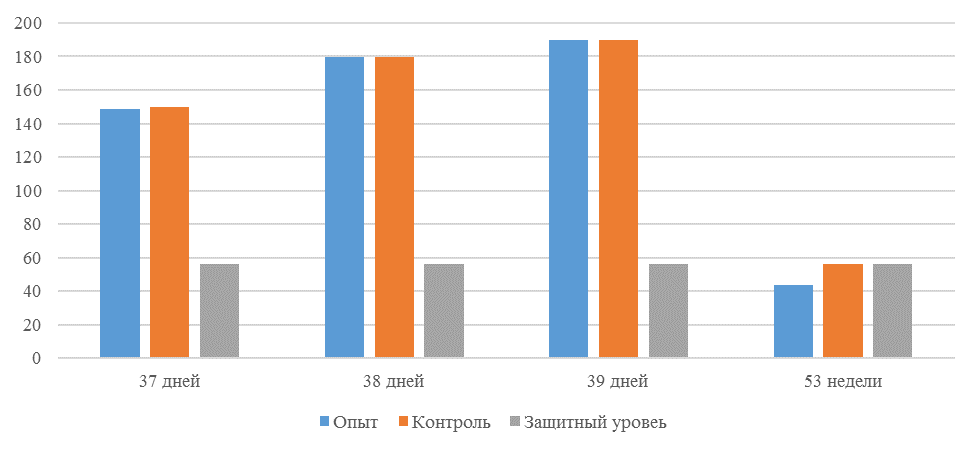
Рисунок 29 – Динамика изменения значений коэффициента вариабельности титров антител к возбудителю метапневмовирусной инфекции в зависимости от возраста птицы
В заключение необходимо отметить, что при базовой технологии вакцинации в контрольных точках контроля качества вакцинации установлен более низкий уровень антител, чем при применении СПАО-комплекса. При включении в схему вакцинации птицы СПАО-комплекса выработка антител, а, следовательно, и ответ на вакцинацию, были интенсивнее.
Однородность отклика вакцинации, или степень однородности выработки антител, которую отражает значение коэффициента вариабельности, был ниже на фоне применения СПАО-комплекса.
СПАО-комплекс способствует усилению интенсивности и однородности гуморального ответа на введение вакцин с целью профилактики вирусных болезней.
Следует отметить, что антителогенез на фоне применяемой программы вакцинации не всегда соответствует защитному уровню, предусмотренному среднестатистическими требованиями оценки вацинации. Вместе с тем оценка результатов хозяйственной деятельности птицефабрики (прирост массы тела, конверсия корма, смертность и т.д.), отсутствие фактических признаков проявления вирусных болезней, сравнение с данными предыдущих исследований, которые генерируются на предприятии в режиме реального времени, позволяют признать удовлетворительной применяемую схему вакцинации.
Таким образом, профилактика стрессов у птиц литийсодержащим фармакологическим средством СПАО-комплекс при вакцинации обеспечивает однородный и высокий уровень антител, и, соответственно, усиливает защиты птицы от полевого агента, непрерывно циркулирующего в стаде.
2.2.4 Эффективность антистрессовой терапии при вакцинации кур яичного направления продуктивности
Применение антибиотиков, вирусные и бактериальные инфекции, а также стресс-факторы оказывают отрицательное влияние на развитие иммунной системы птиц. Повреждение иммунной системы ведет к возникновению вторичных иммунодефицитов. Ведущую роль в комплексе противоэпизоотических мероприятий, направленных на ликвидацию инфекционных болезней животных и птиц, а в частности Ньюкаслской болезни и инфекционного бронхита кур играет иммунопрофилактика [206].
Перспективным направлением в повышении производительности птицеводства является сохранение естественных механизмов защиты, присущих птице от природы, позволяющих в промышленных условиях содержания адекватно, без потери продуктивности, реагировать на стрессовые факторы, в меньшей степени подвергаться болезням различной этиологии. Одним из пусковых механизмов в патогенезе инфекционных, и в особенности вирусных болезней, в условиях промышленной технологии, является снижение иммунобиологической реактивности организма птицы, вызванное различными технологическими стресс-факторами, одним из которых является многократная вакцинация цыплят в раннем постнатальном онтогенезе [207].
Среди вирусных инфекционных болезней, наносящих значительный экономический ущерб птицеводству многих стран мира, в том числе и РФ, особое место занимает Ньюкаслская болезнь [68].
В связи с вышесказанным при оценке эффективности СПАО-комплекс при профилактике инфекционных заболеваний путем вакцинации кур яичного направления продуктивности были изучены закономерности формирования иммунитета к болезни Ньюкасла. Применение СПАО-комплекс начинали в 45 суточном возрасте перед внутримышечной вакцинацией против болезни Ньюкасла вакциной Gallimune ND (Merial Italia s.p.a.) в 47-48 суточном возрасте.
При сравнительном наблюдении за поведением птицы в период применения фармакологического комплекса СПАО отмечалось, что птица в опытной группе спокойней, при появлении персонала птицефабрики реагирует адекватно, в контрольной группе отмечается высокая реактивность, реакцию можно описать как повышенную, птица проявляет признаки возбуждения даже при незначительном шумовом воздействии. Связующим звеном хронического стресса и агрессии является страх. Страх — это адаптивный ответ, реализующийся при несоответствии условий содержания удовлетворению естественных потребностей кур [208].
Эффективность СПАО-комплекс при вакцинации против болезни Ньюкасла
Исследования сыворотки крови методом РТГА на болезнь Ньюкасла показали, что вакцинация обеспечивает высокий уровень защиты в опытной и контрольной группе.
Таблица 15 — Результаты исследований титров антител на болезнь Ньюкасла
| Группа | возр | кол.
проб |
отр | 2 | 4 | 8 | 16 | 32 | 64 | 128 | 256 | 512 | 1024 | 2048 | 4096 | 8192 | 16384 | 32768 | log | % |
| Опыт | 19 | 25 | 1 | 5 | 10 | 8 | 1 | 4,12 | 96 | |||||||||||
| 43 | 25 | 1 | 5 | 9 | 10 | 5,12 | 100 | |||||||||||||
| 85 | 25 | 1 | 2 | 3 | 8 | 6 | 4 | 1 | 12,3 | 100 | ||||||||||
| 105 | 25 | 2 | 13 | 8 | 2 | 9,4 | 100 | |||||||||||||
| 110 | 25 | 3 | 6 | 10 | 3 | 3 | 9,88 | 100 | ||||||||||||
| Опыт | 152 | 25 | 4 | 10 | 8 | 3 | 13,4 | 100 | ||||||||||||
| 168 | 25 | 1 | 5 | 8 | 7 | 2 | 2 | 11,4 | 100 | |||||||||||
| 211 | 25 | 3 | 6 | 7 | 6 | 3 | 10 | 100 | ||||||||||||
| 240 | 25 | 2 | 3 | 7 | 6 | 4 | 1 | 2 | 10,7 | 100 | ||||||||||
| К-ль | 19 | 25 | 1 | 1 | 6 | 5 | 12 | 4,04 | 92 | |||||||||||
| 41 | 25 | 3 | 6 | 12 | 4 | 5,68 | 100 | |||||||||||||
| 86 | 25 | 1 | 2 | 7 | 9 | 5 | 1 | 11,7 | 100 | |||||||||||
| 104 | 25 | 4 | 2 | 2 | 12 | 4 | 1 | 8,52 | 100 | |||||||||||
| 109 | 25 | 1 | 1 | 3 | 6 | 9 | 4 | 1 | 9,44 | 100 | ||||||||||
| К-ль | 150 | 25 | 1 | 2 | 11 | 9 | 2 | 12,36 | 100 | |||||||||||
| 166 | 25 | 2 | 14 | 5 | 4 | 10,44 | 100 | |||||||||||||
| 208 | 25 | 4 | 8 | 6 | 5 | 2 | 9,72 | 100 | ||||||||||||
| 238 | 25 | 3 | 8 | 9 | 4 | 1 | 10,7 | 100 |
Титры антител после проведенной вакцинации в опытной группе, более однородны и находятся в пределах 9,40-13,40 log2, в контрольной группе в пределах 8,52-12,36. Уровень статистических различий интенсивности выработки антител log2 находится на уровне Р=0,0277 (Т-критерий Вилкоксона). Обнаруженные закономерности указывают на более однородную выработку титров антител при профилактике стрессов.
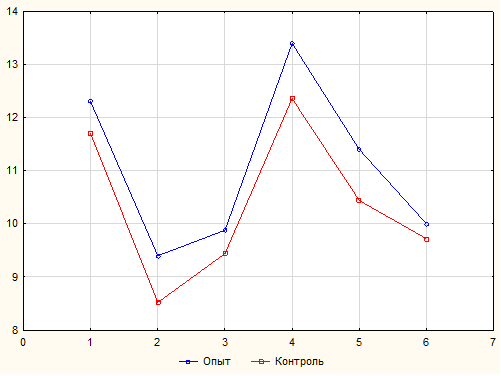
Рис. 30. log2 титров антител после вакцинации
Полученные результаты согласуются с представленными выше закономерностями, обнаруженными при профилактике стрессов у мясных кроссов кур.
Оценка влияния антистрессовой терапии при выращивании и содержании кур яичного направления продуктивности
В эксперименте использовали цыплят, полученных от кур родительского стада возрастом 340 недель и выводом цыплят из яиц на уровне 84,6 % равнозначно в опытной и контрольной группах. В течение 15 недель выращивания получены следующие показатели, представленные на рисунке 31, где вертикальная линия указывает на период антистрессовой обработки и соответственно вакцинации против болезни Ньюкасла.
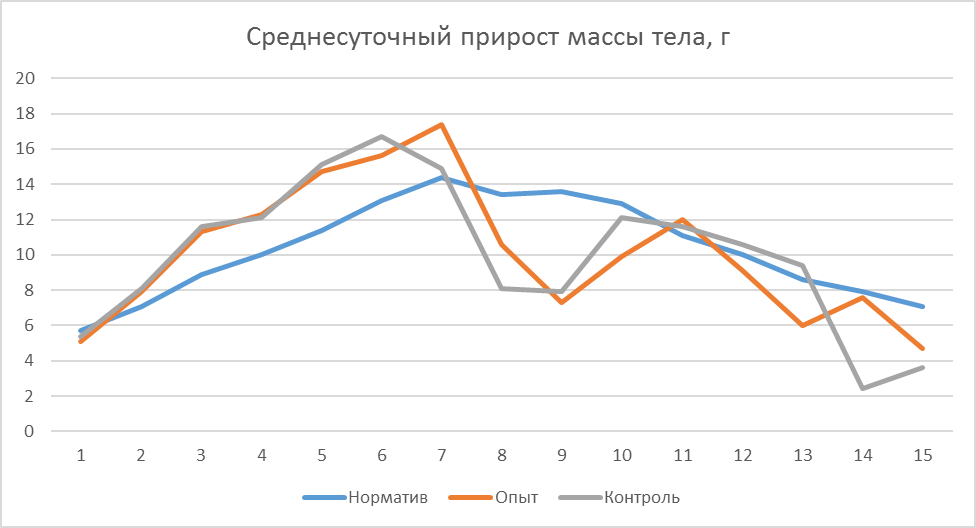
Рис. 31 Динамика изменений среднесуточных приростов массы тела цыплят, г
Таблица 16 – Масса тела кур, г
| Группа | Возраст кур, недель | ||||||||||
| 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | |
| Норматив | 337 | 429 | 530 | 624 | 719 | 809 | 887 | 957 | 1017 | 1072 | 1122 |
| Опыт | 395 | 504 | 626 | 700 | 751 | 820 | 904 | 986 | 1028 | 1081 | 1114 |
| Контроль | 403 | 520 | 624 | 681 | 736 | 821 | 902 | 976 | 1042 | 1059 | 1084 |
Применение антистрессового фармакологического средства в возрасте 47-48 суток оказало влияние на среднесуточный прирост массы тела несмотря на одинаковый уровень кормления птиц в данный период жизни. Так до 47-48 суточного возраста данный показатель был фактически равен в обеих группах, а возрасте 6 недель был выше на 6,59 % у цыплят контрольной группы, то на 7 неделю жизни, то есть сразу после проведения вакцинации характеризовался более высокими значениями в опытной группе вплоть до 9 недели жизни. Разница в 7 недельном возрасте составила 14,37 %; в 8 недельном возрасте – 23,69 %.
Вес промышленной молодки перед переводом в цех получения продукции соответствовал нормативным значениям. В период проведения вакцинации масса опытных кур была ниже контрольных на 3,08 %, после вакцинации и применения антистрессовой терапии масса к 7 недели жизни выровнялась и к 8 недели жизни стала выше на 2,71 %. В данный период уровень кормления промышленной молодки был одинаков в опытной и контрольной группах, обнаруженные закономерности могут косвенно указывать на эффективность антистрессовой профилактики.
В период выращивания кур отмечается высокий уровень сохранности, в опытной группе показатель гибели кур составил 0,79 %, в контрольной группе 1,17 %. Однако, данный показатель нельзя напрямую связать с применением антистрессовых средств, так как наиболее интенсивная гибель цыплят отмечается в первые 3 недели жизни, то есть еще до применения профилактики стрессов. Так же как нельзя судить о показатели однородности, так как он связан с санитарным убоем птицы, однако в опытной группе однородность выше на 1%, по сравнению с контрольной, где так же отмечается показатель на уровне 97 %.
После перевода кур в цех получения продукции в опытной группе по сравнению с контрольной отмечается более высокий уровень продуктивности, так в контрольной группе получена средняя яйценоскость на уровне 76,75 %, а в опытной группе 78,35 %. Динамика яйценоскости отражена на графике, где наглядно продемонстрированно, что в стадии начала яйценоскости в опытной группе наблюдается наибольший подъем показателя, эта же динамика сохраняется в период максимальной продуктивности, что указывает более качественный уровень подготовки кур к началу периода яйценоскости. Наблюдение за яйценоскостью прекратили в 220 дней на пике продуктивности так дальнейший период характеризуется ровным спадом продуктивности и не сопровождается физиологическими перестройками организма и стрессами.
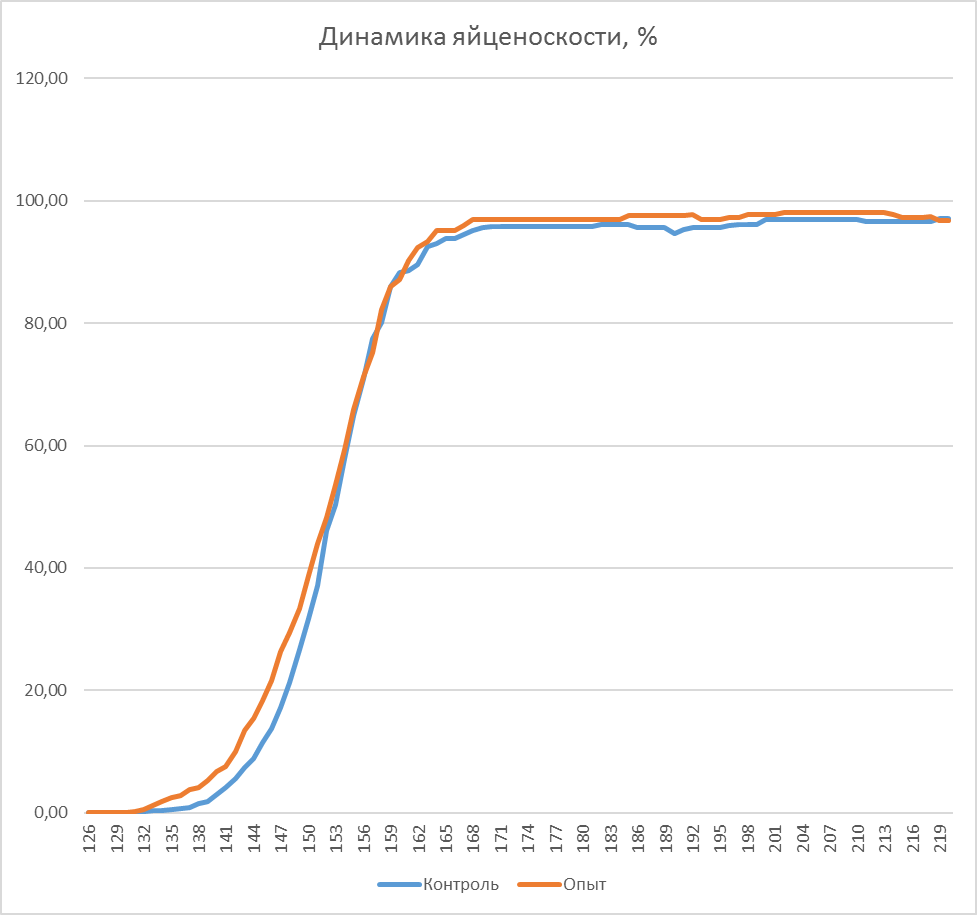
Рис. 32 Динамика яйценоскости кур, %
Другой важнейший показатель – сохранность поголовья за период наблюдений со 105 по 250 сутки жизни кур наиболее высоких значений достиг в опытной группе и составил 99,72 %, в контрольной группе 99,44 %. На графике представлена динамика смертности кур.
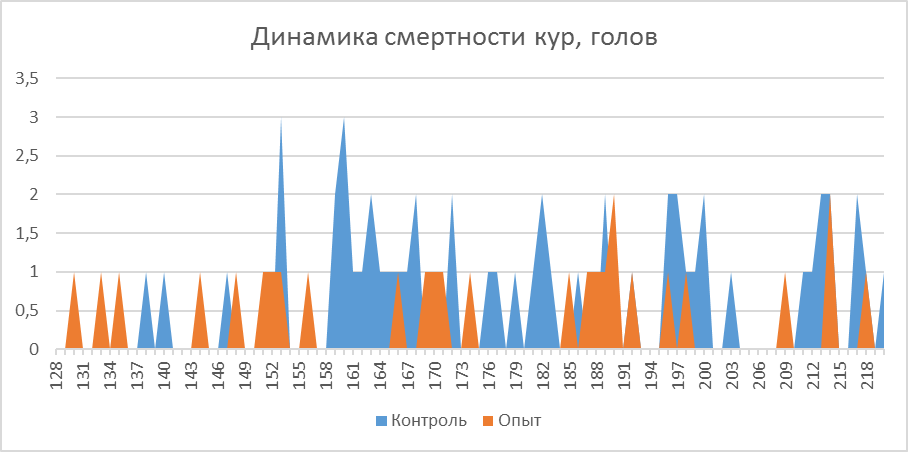
Рис. 33 Динамика смертности кур за период наблюдений, гол
Таким образом, при профилактике болезни Ньюкасла кур яичного направления продуктивности на фоне профилактики стрессов фармакологическим комплексом СПАО выработка антител более однородна по всему стаду. В опытной группе титры находятся в пределах 9,40-13,40 log2, в контрольной группе 8,52-12,36. Уровень статистических различий интенсивности выработки антител log2 находится на уровне Р=0,0277. После перевода кур в цех получения продукции в опытной группе по сравнению с контрольной отмечается более высокий уровень продуктивности: яйценоскость выше в опытной группе на 2,04 %, сохранность поголовья за период с 105 по 250 сутки жизни кур наиболее высоких значений достиг в опытной группе и составил 99,72 %, в контрольной группе 99,44 %.
2.2.5 Влияние стресса на показатели перекисного окисления липидов плазмы крови цыплят
При дебикировании в 5-6 сточном возрасте и выращивании ремонтных цыплят литийсодержащее фармакологическое средство позволило получить высоких уровень сохранности за счет снижения отхода с 3,79% до 2,14% у куриц и с 3,12% до 1,25% у петухов, во время продуктивного периода снижение смертности с 15,5% до 11 %, позволило увеличить выход делового молодняка с 76,86 до 84,64 %.
При сравнении показателей опытных и контрольных групп, представленных в таблицах не обнаружены существенные колебания показателей интенсивности ПОЛ. Через двое суток после стрессирующего воздействия обнаружено статистически выраженное повышение уровня церрулоплазмина и витамина Е в опытной группе соответственно и уровня витамина Е в контрольной группе. Данное повышение антиоксидантной активности в плазме крови возможно носит приспособительно-компенсаторный характер, статистические отличия уровня церрулоплазмина и витамина Е при прямом сравнении показателей опытной и контрольной группы не обнаружено
Таблица 17 — Показатели ПОЛ и АО плазмы крови кур опытной группы до и через 1,5-2 часа после перевода
| Показатели | Группа 1 | Группа 3 | Р | ||
| Мean | Std.Dev. | Мean | Std.Dev. | ||
| Церулоплазмин мг/л | 21,525 | 7,7358 | 25,275 | 5,6716 | 0,4640 |
| Витамин Е мкг/мл | 8,705 | 2,9099 | 9,150 | 2,3661 | 0,8314 |
| ЕИО ДК Г | 0,605 | 0,1034 | 0,580 | 0,0283 | 0,6575 |
| ЕИО КДсСТ Г | 0,283 | 0,0306 | 0,305 | 0,0129 | 0,2491 |
| ЕИО ШО Г | 0,067 | 0,0058 | 0,115 | 0,0370 | 0,0799 |
| ЕИО ДК И | 0,515 | 0,0592 | 0,490 | 0,0258 | 0,4680 |
| ЕИО КДсСТ И | 0,355 | 0,0686 | 0,320 | 0,0560 | 0,4591 |
| ЕИО ШО И | 0,063 | 0,0321 | 0,087 | 0,0574 | 0,5459 |
Таблица 18 — Показатели ПОЛ и АО плазмы крови кур контрольной группы до и через 1,5-2 часа после перевода
| Показатели | Группа 2 | Группа 4 | Р | ||
| Мean | Std.Dev. | Мean | Std.Dev. | ||
| Церулоплазмин мг/л | 21,525 | 7,7358 | 17,500 | 7,5777 | 0,5227 |
| Витамин Е мкг/мл | 8,705 | 2,9099 | 5,940 | 4,4565 | 0,4191 |
| ЕИО ДК Г | 0,605 | 0,1034 | 0,565 | 0,0191 | 0,4758 |
| ЕИО КДсСТ Г | 0,283 | 0,0306 | 0,263 | 0,0171 | 0,2966 |
| ЕИО ШО Г | 0,067 | 0,0058 | 0,075 | 0,0208 | 0,5385 |
| ЕИО ДК И | 0,515 | 0,0592 | 0,500 | 0,0523 | 0,7170 |
| ЕИО КДсСТ И | 0,355 | 0,0686 | 0,350 | 0,0535 | 0,9122 |
| ЕИО ШО И | 0,063 | 0,0321 | 0,118 | 0,0443 | 0,1353 |
Полученные данные подтверждают, что перевод в сочетании с вакцинацией для взрослых кур не являются сверхпороговыми раздражителями, не вызывают существенных сдвигов ПОЛ, но вызывают активацию ферментативного и не ферментативного звеньев антиоксидантной системы.
Таблица 19 — Показатели ПОЛ и АО плазмы крови кур опытной и контрольной групп через 1,5-2 часа после стресса (перевод)
| Показатели | Группа 3 | Группа 4 | Р | ||
| Мean | Std.Dev. | Мean | Std.Dev. | ||
| Церулоплазмин мг/л | 25,275 | 5,6716 | 17,500 | 7,5777 | 0,1782 |
| Витамин Е мкг/мл | 9,150 | 2,3661 | 5,940 | 4,4565 | 0,2666 |
| ЕИО ДК Г | 0,580 | 0,0283 | 0,565 | 0,0191 | 0,4136 |
| ЕИО КДсСТ Г | 0,305 | 0,0129 | 0,263 | 0,0171 | 0,0074 |
| ЕИО ШО Г | 0,115 | 0,0370 | 0,075 | 0,0208 | 0,1083 |
| ЕИО ДК И | 0,490 | 0,0258 | 0,500 | 0,0523 | 0,7433 |
| ЕИО КДсСТ И | 0,320 | 0,0560 | 0,350 | 0,0535 | 0,4680 |
| ЕИО ШО И | 0,087 | 0,0574 | 0,118 | 0,0443 | 0,4393 |
Таблица 20 — Показатели ПОЛ и АО плазмы крови кур опытной группы до и через 2 суток после стресса (перевод)
| Показатели | Группа 1 | Группа 5 | Р | ||
| Мean | Std.Dev. | Мean | Std.Dev. | ||
| Церулоплазмин мг/л | 21,525 | 7,7358 | 43,961 | 15,838 | 0,0437 |
| Витамин Е мкг/мл | 8,705 | 2,9099 | 16,845 | 4,457 | 0,0416 |
| ЕИО ДК Г | 0,605 | 0,1034 | 0,750 | 0,129 | 0,1301 |
| ЕИО КДсСТ Г | 0,283 | 0,0306 | 0,335 | 0,184 | 0,6584 |
| ЕИО ШО Г | 0,067 | 0,0058 | 0,187 | 0,187 | 0,3293 |
| ЕИО ДК И | 0,515 | 0,0592 | 0,530 | 0,095 | 0,7969 |
| ЕИО КДсСТ И | 0,355 | 0,0686 | 0,333 | 0,069 | 0,6599 |
| ЕИО ШО И | 0,063 | 0,0321 | 0,057 | 0,050 | 0,8681 |
Таблица 21 — Показатели ПОЛ и АО плазмы крови кур контрольной группы до и через 2 суток после стресса (перевод)
| Показатели | Группа 2 | Группа 6 | Р | ||
| Мean | Std.Dev. | Мean | Std.Dev. | ||
| Церулоплазмин мг/л | 21,525 | 7,7358 | 32,850 | 7,6210 | 0,0821 |
| Витамин Е мкг/мл | 8,705 | 2,9099 | 16,519 | 1,7948 | 0,0068 |
| ЕИО ДК Г | 0,605 | 0,1034 | 0,573 | 0,0741 | 0,6277 |
| ЕИО КДсСТ Г | 0,283 | 0,0306 | 0,200 | 0,0163 | 0,0052 |
| ЕИО ШО Г | 0,067 | 0,0058 | 0,057 | 0,0340 | 0,6709 |
| ЕИО ДК И | 0,515 | 0,0592 | 0,518 | 0,0881 | 0,9639 |
| ЕИО КДсСТ И | 0,355 | 0,0686 | 0,345 | 0,0387 | 0,8080 |
| ЕИО ШО И | 0,063 | 0,0321 | 0,072 | 0,0464 | 0,8061 |
Таблица 22 — Показатели ПОЛ и АО плазмы крови кур опытной и контрольной групп через 2 суток после перевода
| Показатели | Группа 5 | Группа 6 | Р | ||
| Мean | Std.Dev. | Мean | Std.Dev. | ||
| Церулоплазмин мг/л | 43,961 | 15,838 | 32,850 | 7,6210 | 0,2530 |
| Витамин Е мкг/мл | 16,845 | 4,457 | 16,519 | 1,7948 | 0,8964 |
| ЕИО ДК Г | 0,750 | 0,129 | 0,573 | 0,0741 | 0,0544 |
| ЕИО КДсСТ Г | 0,335 | 0,184 | 0,200 | 0,0163 | 0,1948 |
| ЕИО ШО Г | 0,187 | 0,187 | 0,057 | 0,0340 | 0,2220 |
| ЕИО ДК И | 0,530 | 0,095 | 0,518 | 0,0881 | 0,8529 |
| ЕИО КДсСТ И | 0,333 | 0,069 | 0,345 | 0,0387 | 0,7627 |
| ЕИО ШО И | 0,057 | 0,050 | 0,072 | 0,0464 | 0,6955 |
Анализ значений ОМБ после проведения перевода и вакцинации не показывает каких-либо закономерностей. Значений относительно стабильны до и после проведения манипуляций. Что подтверждает вышеописанные закономерности и указывает на отсутствие повреждений белков и липидов в результате развития стресса, связанного с переводом и вакцинацией кур.
Таблица 23 – Показатели ОМБ плазмы крови кур опытной группы до и через 1,5-2 часа после перевода
| Показатели | Группа 1 | Группа 3 | Р | |||
| Мean | Std.Dev. | Мean | Std.Dev. | |||
|
40,54 | 2,001 | 38,37 | 4,450 | 0,4082 | |
|
134,93 | 22,032 | 124,91 | 23,245 | 0,5546 | |
|
31,12 | 18,597 | 28,16 | 5,625 | 0,7712 | |
|
18,97 | 16,241 | 15,55 | 2,652 | 0,6922 | |
|
225,39 | 70,972 | 166,46 | 34,736 | 0,1863 | |
|
52,67 | 27,316 | 86,67 | 12,395 | 0,0639 | |
|
30,65 | 16,582 | 33,44 | 2,420 | 0,7506 | |
|
1,49 | 0,893 | 1,35 | 0,270 | 0,7718 | |
|
2,53 | 1,311 | 4,16 | 0,595 | 0,0639 | |
|
0,62 | 0,124 | 0,75 | 0,063 | 0,1100 | |
|
0,58 | 0,122 | 0,33 | 0,064 | 0,0111 | |
|
0,57 | 0,212 | 0,47 | 0,108 | 0,4277 | |
Таблица 24 – Показатели ОМБ плазмы крови кур контрольной группы до и через 1,5-2 часа после перевода
| Показатели | Группа 2 | Группа 4 | Р | |||
| Мean | Std.Dev. | Мean | Std.Dev. | |||
|
40,54 | 2,001 | 42,91 | 7,074 | 0,5428 | |
|
134,93 | 22,032 | 105,96 | 26,143 | 0,1411 | |
|
31,12 | 18,597 | 20,78 | 3,640 | 0,3171 | |
|
18,97 | 16,241 | 12,62 | 2,477 | 0,4691 | |
|
225,39 | 70,972 | 165,03 | 34,261 | 0,1765 | |
|
52,67 | 27,316 | 68,23 | 16,253 | 0,3653 | |
|
30,65 | 16,582 | 27,29 | 6,646 | 0,7199 | |
|
1,49 | 0,893 | 1,00 | 0,175 | 0,3175 | |
|
2,53 | 1,311 | 3,27 | 0,780 | 0,3655 | |
|
0,62 | 0,124 | 0,65 | 0,112 | 0,7924 | |
|
0,58 | 0,122 | 0,32 | 0,121 | 0,0258 | |
|
0,57 | 0,212 | 0,48 | 0,140 | 0,4933 | |
Таблица 25 — Показатели ОМБ плазмы крови кур опытной и контрольной групп через 1,5-2 часа после перевода
| Показатели | Группа 3 | Группа 4 | Р | |||
| Мean | Std.Dev. | Мean | Std.Dev. | |||
|
38,37 | 4,450 | 42,91 | 7,074 | 0,3190 | |
|
124,91 | 23,245 | 105,96 | 26,143 | 0,3203 | |
|
28,16 | 5,625 | 20,78 | 3,640 | 0,0698 | |
|
15,55 | 2,652 | 12,62 | 2,477 | 0,1579 | |
|
166,46 | 34,736 | 165,03 | 34,261 | 0,9554 | |
|
86,67 | 12,395 | 68,23 | 16,253 | 0,1212 | |
|
33,44 | 2,420 | 27,29 | 6,646 | 0,1329 | |
|
1,35 | 0,270 | 1,00 | 0,175 | 0,0697 | |
|
4,16 | 0,595 | 3,27 | 0,780 | 0,1211 | |
|
0,75 | 0,063 | 0,65 | 0,112 | 0,1442 | |
|
0,33 | 0,064 | 0,32 | 0,121 | 0,9583 | |
|
0,47 | 0,108 | 0,48 | 0,140 | 0,9265 | |
Таблица 26 – Корреляционный анализ показателей ПОЛ и АО плазмы крови кур контрольной группы (Spearman Rank Order Correlations)
| Церулоплазмин мг/л | Витамин Е мкг/мл | ЕИО ДК Г | ЕИО КДсСТ Г | ЕИО ШО Г | ЕИО ДК И | ЕИО КДсСТ И | ЕИО ШО И | |
| Церулоплазмин мг/л | 1,00 | 0,84 | 0,35 | -0,46 | -0,256 | 0,326 | 0,50 | -0,14 |
| Витамин Е мкг/мл | 0,84 | 1,00 | -0,18 | -0,81 | -0,265 | 0,255 | 0,10 | -0,20 |
| ЕИО ДК Г | 0,35 | -0,18 | 1,00 | 0,49 | -0,501 | 0,248 | 0,14 | -0,30 |
| ЕИО КДсСТ Г | -0,46 | -0,81 | 0,49 | 1,00 | 0,286 | -0,055 | -0,17 | 0,14 |
| ЕИО ШО Г | -0,25 | -0,27 | -0,50 | 0,29 | 1,00 | -0,17 | 0,08 | 0,73 |
| ЕИО ДК И | 0,32 | 0,26 | 0,25 | -0,06 | -0,17 | 1,00 | 0,64 | 0,29 |
| ЕИО КДсСТ И | 0,50 | 0,10 | 0,14 | -0,18 | 0,09 | 0,64 | 1,00 | 0,42 |
| ЕИО ШО И | -0,14 | -0,20 | -0,30 | 0,15 | 0,74 | 0,29 | 0,42 | 1,00 |
Таблица 27 – Корреляционный анализ показателей ПОЛ и АО плазмы крови кур опытной группы (Spearman Rank Order Correlations)
| Церулоплазмин мг/л | Витамин Е мкг/мл | ЕИО ДК Г | ЕИО КДсСТ Г | ЕИО ШО Г | ЕИО ДК И | ЕИО КДсСТ И | ЕИО ШО И | |
| Церулоплазмин мг/л | 1,00 | 0,95 | 0,68 | 0,17 | 0,18 | 0,12 | -0,07 | -0,32 |
| Витамин Е мкг/мл | 0,95 | 1,00 | 0,59 | 0,05 | 0,08 | 0,33 | -0,04 | -0,33 |
| ЕИО ДК Г | 0,68 | 0,59 | 1,00 | 0,26 | 0,09 | 0,17 | 0,06 | -0,24 |
| ЕИО КДсСТ Г | 0,17 | 0,05 | 0,26 | 1,00 | 0,86 | 0,42 | -0,00 | 0,31 |
| ЕИО ШО Г | 0,18 | 0,08 | 0,09 | 0,86 | 1,00 | 0,20 | -0,17 | 0,24 |
| ЕИО ДК И | 0,12 | 0,33 | 0,17 | 0,42 | 0,20 | 1,00 | 0,50 | 0,41 |
| ЕИО КДсСТ И | -0,07 | -0,04 | 0,06 | -0,00 | -0,17 | 0,50 | 1,00 | 0,75 |
| ЕИО ШО И | -0,32 | -0,33 | -0,24 | 0,31 | 0,24 | 0,41 | 0,75 | 1,00 |
Корреляционный анализ показывает высокий статистически достоверный уровень зависимости показателей концентрации витамина Е и церулоплазмина в плазме крови контрольных (r=0,84) и опытных (r=0,95) групп. Коэффициент корреляции в опытной группе выше, что может свидетельствовать о некоторой зависимости уровня концентрации витамина Е и церулоплазмина в плазме крови от применения литийсодержащего фармакологического средства, однако, данные наблюдения в рамках текущей работы проверить не представляется возможным.
Таблица 28 — Показатели ПОЛ и АО плазмы крови цыплят опытной и контрольной группы до дебикирования
| Показатели | Группа 1 | Группа 5 | Р | ||
| Мean | Std.Dev. | Мean | Std.Dev. | ||
| Церулоплазмин мг/л | 65,100 | 29,454 | 42,150 | 4,4193 | 0,1742 |
| Витамин Е мкг/мл | 29,843 | 11,476 | 16,568 | 2,3140 | 0,0639 |
| ЕИО ДК Г | 0,765 | 0,233 | 0,615 | 0,0597 | 0,2586 |
| ЕИО КДсСТ Г | 0,268 | 0,078 | 0,310 | 0,0616 | 0,4256 |
| ЕИО ШО Г | 0,023 | 0,013 | 0,065 | 0,0420 | 0,1023 |
| ЕИО ДК И | 0,570 | 0,071 | 0,558 | 0,0506 | 0,7834 |
| ЕИО КДсСТ И | 0,373 | 0,088 | 0,388 | 0,1021 | 0,8310 |
| ЕИО ШО И | 0,048 | 0,048 | 0,018 | 0,0222 | 0,2859 |
До дебикирования не обнаружены статистические различия между показателями опытной и контрольной группы, что указывает на высокую однородность и правильное формирование групп для анализа, а также на то, что введение СПАО-комплекс не оказывает прямого стимулирующего воздействия на состояние АО системы.
Таблица 29 — Показатели ПОЛ и АО плазмы крови цыплят опытной группы до и через 1,5 часа после дебикирования
| Показатели | Группа 1 | Группа 2 | Р | ||
| Мean | Std.Dev. | Мean | Std.Dev. | ||
| Церулоплазмин мг/л | 65,100 | 29,454 | 85,725 | 18,976 | 0,2837 |
| Витамин Е мкг/мл | 29,843 | 11,476 | 34,425 | 4,274 | 0,4825 |
| ЕИО ДК Г | 0,765 | 0,233 | 0,850 | 0,129 | 0,5468 |
| ЕИО КДсСТ Г | 0,268 | 0,078 | 0,280 | 0,043 | 0,7887 |
| ЕИО ШО Г | 0,023 | 0,013 | 0,038 | 0,034 | 0,4470 |
| ЕИО ДК И | 0,570 | 0,071 | 0,625 | 0,126 | 0,4749 |
| ЕИО КДсСТ И | 0,373 | 0,088 | 0,378 | 0,036 | 0,9194 |
| ЕИО ШО И | 0,048 | 0,048 | 0,045 | 0,034 | 0,9153 |
В контрольной группе в течение 1,5-2 часов после проведения дебикирования не отмечаются статистически выраженные сдвиги показателей ПОЛ и АО, в отличии от кур опытной группы, у которых уровень церулоплазмина снижается на 68,0 % (Р=0,0063), а также имеется статистическая тенденция (Р=0,0805), проявляющаяся снижением на 64,4 % уровня витамина Е в плазме крови.
Таблица 30 — Показатели ПОЛ и АО плазмы крови цыплят контрольной группы до и через 1,5 часа после дебикирования
| Показатели | Группа 5 | Группа 6 | Р | ||
| Мean | Std.Dev. | Мean | Std.Dev. | ||
| Церулоплазмин мг/л | 42,150 | 4,4193 | 28,657 | 4,8671 | 0,0063 |
| Витамин Е мкг/мл | 16,568 | 2,3140 | 10,672 | 5,1154 | 0,0805 |
| ЕИО ДК Г | 0,615 | 0,0597 | 0,558 | 0,0386 | 0,1570 |
| ЕИО КДсСТ Г | 0,310 | 0,0616 | 0,350 | 0,0606 | 0,3903 |
| ЕИО ШО Г | 0,065 | 0,0420 | 0,075 | 0,0370 | 0,7331 |
| ЕИО ДК И | 0,558 | 0,0506 | 0,563 | 0,0822 | 0,9209 |
| ЕИО КДсСТ И | 0,388 | 0,1021 | 0,385 | 0,0387 | 0,9650 |
| ЕИО ШО И | 0,018 | 0,0222 | 0,026 | 0,0306 | 0,6866 |
Таблица 31 — Показатели ПОЛ и АО плазмы крови цыплят опытной и контрольной группы через 1,5 часа после дебикирования
| Показатели | Группа 2 | Группа 6 | Р | ||
| Мean | Std.Dev. | Мean | Std.Dev. | ||
| Церулоплазмин мг/л | 85,725 | 18,976 | 28,657 | 4,8671 | 0,0011 |
| Витамин Е мкг/мл | 34,425 | 4,274 | 10,672 | 5,1154 | 0,0004 |
| ЕИО ДК Г | 0,850 | 0,129 | 0,558 | 0,0386 | 0,0049 |
| ЕИО КДсСТ Г | 0,280 | 0,043 | 0,350 | 0,0606 | 0,1088 |
| ЕИО ШО Г | 0,038 | 0,034 | 0,075 | 0,0370 | 0,1862 |
| ЕИО ДК И | 0,625 | 0,126 | 0,563 | 0,0822 | 0,4375 |
| ЕИО КДсСТ И | 0,378 | 0,036 | 0,385 | 0,0387 | 0,7860 |
| ЕИО ШО И | 0,045 | 0,034 | 0,026 | 0,0306 | 0,4275 |
При прямом сравнении показателей цыплят опытной и контрольной групп в контрольной группе наблюдаются более высокие статистически выраженные (Р=0,0011) значения показателя концентрации церулоплазмина в 3 раза, уровня витамина Е в 3,2 раза (Р=0,0004) и при этом более высокое значение (Р=0,0049) уровня ЕИО ДК экстрагируемых в гептановую фазу экстракта. Что свидетельствует о защитно-компенсаторном характере повышения уровня церулоплазмина и витамина Е.
Таблица 32 — Показатели ПОЛ и АО плазмы крови цыплят контрольной группы до и через сутки после дебикирования
| Показатели | Группа 1 | Группа 3 | Р | ||
| Мean | Std.Dev. | Мean | Std.Dev. | ||
| Церулоплазмин мг/л | 65,100 | 29,454 | 40,275 | 11,035 | 0,1655 |
| Витамин Е мкг/мл | 29,843 | 11,476 | 17,738 | 6,454 | 0,1156 |
| ЕИО ДК Г | 0,765 | 0,233 | 0,900 | 0,082 | 0,3159 |
| ЕИО КДсСТ Г | 0,268 | 0,078 | 0,265 | 0,025 | 0,9534 |
| ЕИО ШО Г | 0,023 | 0,013 | 0,013 | 0,018 | 0,4248 |
| ЕИО ДК И | 0,570 | 0,071 | 0,550 | 0,058 | 0,6766 |
| ЕИО КДсСТ И | 0,373 | 0,088 | 0,345 | 0,059 | 0,6218 |
| ЕИО ШО И | 0,048 | 0,048 | 0,027 | 0,021 | 0,4500 |
У цыплят контрольной группы через сутки после проведения дебикирования не отмечается статистически выраженного изменения показателей ПОЛ и АО
Таблица 33 — Показатели ПОЛ и АО плазмы крови цыплят опытной группы до и через сутки после дебикирования
| Показатели | Группа 5 | Группа 7 | Р | ||
| Мean | Std.Dev. | Мean | Std.Dev. | ||
| Церулоплазмин мг/л | 42,150 | 4,4193 | 26,145 | 1,6869 | 0,0005 |
| Витамин Е мкг/мл | 16,568 | 2,3140 | 8,940 | 0,5144 | 0,0007 |
| ЕИО ДК Г | 0,615 | 0,0597 | 0,552 | 0,0287 | 0,1082 |
| ЕИО КДсСТ Г | 0,310 | 0,0616 | 0,238 | 0,0359 | 0,0884 |
| ЕИО ШО Г | 0,065 | 0,0420 | 0,068 | 0,0457 | 0,9385 |
| ЕИО ДК И | 0,558 | 0,0506 | 0,530 | 0,0707 | 0,5503 |
| ЕИО КДсСТ И | 0,388 | 0,1021 | 0,263 | 0,0236 | 0,0544 |
| ЕИО ШО И | 0,018 | 0,0222 | 0,020 | 0,0216 | 0,8770 |
В плазме крови цыплят опытной группы через сутки после дебикирования отмечается снижение уровня церулоплазмина и витамина Е, что возможно связано с фармакологическим действием литийсодержащего средства.
Таблица 34 — Показатели ПОЛ и АО плазмы крови цыплят опытной и контрольной группы через сутки часа после дебикирования
| Показатели | Группа 3 | Группа 7 | Р | ||
| Мean | Std.Dev. | Мean | Std.Dev. | ||
| Церулоплазмин мг/л | 40,275 | 11,035 | 26,145 | 1,6869 | 0,0446 |
| Витамин Е мкг/мл | 17,738 | 6,454 | 8,940 | 0,5144 | 0,0348 |
| ЕИО ДК Г | 0,900 | 0,082 | 0,552 | 0,0287 | 0,0002 |
| ЕИО КДсСТ Г | 0,265 | 0,025 | 0,238 | 0,0359 | 0,2566 |
| ЕИО ШО Г | 0,013 | 0,018 | 0,068 | 0,0457 | 0,0699 |
| ЕИО ДК И | 0,550 | 0,058 | 0,530 | 0,0707 | 0,6766 |
| ЕИО КДсСТ И | 0,345 | 0,059 | 0,263 | 0,0236 | 0,0412 |
| ЕИО ШО И | 0,027 | 0,021 | 0,020 | 0,0216 | 0,6466 |
При прямом сравнении показателей крови, полученной через сутки после дебикирования цыплят опытной и контрольной групп обнаружено более высокое статистически выраженное значение у цыплят контрольной группы уровня церулоплазмина на 65,0 % (Р=0,0446) и витамина Е (Р=0,048) почти в 2 раза. При этом отмечаются более высокие уровни ЕИО ДК в гептановой фазе Р=0,0002 и ЕИО КДсСТ Р=0,0412 в изопропанольной фазе, что говорит об определенных отличиях показателей, но не указывает на развитие оксидативного стресса так как данные, представленные в таблице 25 опровергают развитие стресс-индуцированных повреждений. Данные, представленные в таблице 35 подтверждают, что повышение уровня церулоплазмина и витамина Е носят компенсаторно-приспособительный характер и их уровень не зависит от введения в организм литийсодержащего фармакологического средства СПАО-комплекс.
Таблица 35 — Показатели ПОЛ и АО плазмы крови птицы контрольной группы до и через 2 суток после стресса (дебикирование)
| Показатели | Группа 1 | Группа 4 | Р | ||
| Мean | Std.Dev. | Мean | Std.Dev. | ||
| Церулоплазмин мг/л | 65,100 | 29,454 | 60,600 | 14,142 | 0,7922 |
| Витамин Е мкг/мл | 29,843 | 11,476 | 30,030 | 8,950 | 0,9803 |
| ЕИО ДК Г | 0,765 | 0,233 | 0,740 | 0,147 | 0,8618 |
| ЕИО КДсСТ Г | 0,268 | 0,078 | 0,303 | 0,039 | 0,4522 |
| ЕИО ШО Г | 0,023 | 0,013 | 0,040 | 0,018 | 0,1702 |
| ЕИО ДК И | 0,570 | 0,071 | 0,542 | 0,045 | 0,5360 |
| ЕИО КДсСТ И | 0,373 | 0,088 | 0,340 | 0,080 | 0,6046 |
| ЕИО ШО И | 0,048 | 0,048 | 0,016 | 0,008 | 0,2299 |
Через 2 дня после дебикирования показатели у птицы контрольной группы соответствуют исходным значениям, в опытной группе отмечаются более низкие значения уровня ЕИО ДК (Р=0,0122) и ЕИО КДсСТ (Р=0,0181) изопропанольной фазы на 20,0 % и на 84,8 % соответственно.
Таблица 36 — Показатели ПОЛ и АО плазмы крови цыплят опытной группы до и через 2 суток после дебикирования
| Показатели | Группа 5 | Группа 8 | Р | ||
| Мean | Std.Dev. | Мean | Std.Dev. | ||
| Церулоплазмин мг/л | 42,150 | 4,4193 | 45,285 | 1,9415 | 0,2416 |
| Витамин Е мкг/мл | 16,568 | 2,3140 | 18,645 | 1,2916 | 0,1680 |
| ЕИО ДК Г | 0,615 | 0,0597 | 0,542 | 0,0789 | 0,1932 |
| ЕИО КДсСТ Г | 0,310 | 0,0616 | 0,268 | 0,0629 | 0,3718 |
| ЕИО ШО Г | 0,065 | 0,0420 | 0,050 | 0,0141 | 0,5239 |
| ЕИО ДК И | 0,558 | 0,0506 | 0,465 | 0,0129 | 0,0122 |
| ЕИО КДсСТ И | 0,388 | 0,1021 | 0,210 | 0,0416 | 0,0181 |
| ЕИО ШО И | 0,018 | 0,0222 | 0,020 | 0,0082 | 0,8394 |
Таблица 37 — Показатели ПОЛ и АО плазмы крови цыплят опытной и контрольной группы через 2 суток после дебикирования
| Показатели | Группа 4 | Группа 8 | Р | ||
| Мean | Std.Dev. | Мean | Std.Dev. | ||
| Церулоплазмин мг/л | 60,600 | 14,142 | 45,285 | 1,9415 | 0,0756 |
| Витамин Е мкг/мл | 30,030 | 8,950 | 18,645 | 1,2916 | 0,0454 |
| ЕИО ДК Г | 0,740 | 0,147 | 0,542 | 0,0789 | 0,0555 |
| ЕИО КДсСТ Г | 0,303 | 0,039 | 0,268 | 0,0629 | 0,3796 |
| ЕИО ШО Г | 0,040 | 0,018 | 0,050 | 0,0141 | 0,4198 |
| ЕИО ДК И | 0,542 | 0,045 | 0,465 | 0,0129 | 0,0162 |
| ЕИО КДсСТ И | 0,340 | 0,080 | 0,210 | 0,0416 | 0,0284 |
| ЕИО ШО И | 0,016 | 0,008 | 0,020 | 0,0082 | 0,5102 |
Через 2 суток после дебикирования при прямом сравнении показателей опытной и контрольной групп отмечается статистически выраженная разница показателей концентрации витамина Е, который в контрольной группе выше на 61,1 % по сравнению с опытной группой. Так же в опытной группе отмечаются более низкие значения уровня ЕИО ДК (Р=0,0122) и ЕИО КДсСТ (Р=0,0181) изопропанольной фазы на 16,5 % и на 61,9 % соответственно.
В целом полученные данные свидетельствуют об отсутствии признаков выраженного оксидативного стресса в опытной и контрольной группах. Процессы липопероксидации в при этом наименее выражены в опытной группе, что может указывать на непосредственное влияние СПАО-комплекс на состояние процессов ПОЛ и АО, данное утверждение согласуется с исследованиями Аносова Д.Е., 2017 и Пономаренко В.В., 2015. Однако, для установления механизмом этого воздействия требуются дополнительные биохимические исследования, находящиеся вне рамок этого исследования.
Отдельного внимания заслуживает вопрос динамики изменения витамина Е и церулоплазмина (рис. 34-37).
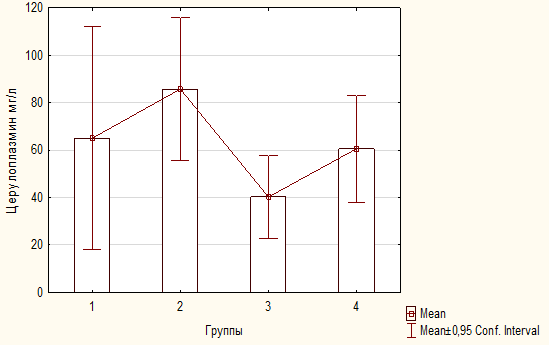
Рис. 34 – Динамика церулоплазмина в плазме цыплят контрольной группы
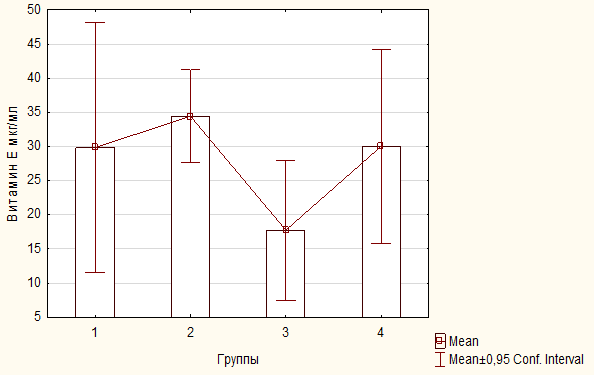
Рис. 35 – Динамика витамина Е в плазме цыплят контрольной группы
При анализе графиков (рис. 34-37) обнаружен сходный характер изменений концентраций витамина Е и церулоплазмина. В целом изменения носят компенсаторный характер. Уровень ферментативного и не ферментативного звена АС имеет подъем, наблюдаемый через 1,5-2 часа после дебикирования с последующим небольшим спадом ниже исходного уровня и через 2 суток к возвращению до нормального уровня.
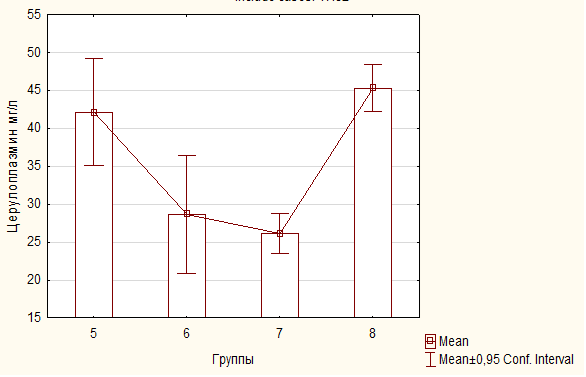
Рис. 36 – Динамика церулоплазмина в плазме цыплят опытной группы
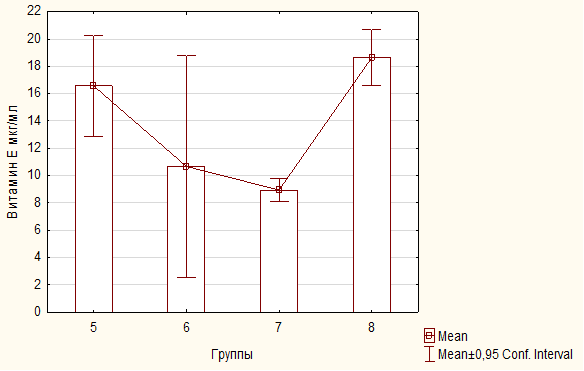
Рис. 37 – Динамика витамина Е в плазме цыплят опытной группы
В крови цыплят опытной группы характер изменений несколько иной (рис. 36-37). Через 1,5-2 часа после дебикирования и через сутки наблюдается плавное снижение показателя с последующим статистически недостоверным увеличением его выше исходного уровня ко вторым суткам после дебикирования. Между концентраций витамина Е и церулоплазмина имеется статистически достоверная корреляционная связь в опытной группе на уровне r=0,72, в контрольной r=0,66.
ЗАКЛЮЧЕНИЕ
Представленные в работе результаты исследований позволили сделать следующие выводы:
1. Разработаны и испытаны фармакологическое средство СПАО-комплекс и кормовая добавка СПАО-КД с целью профилактики стрессов кур. Использование данных антистрессовых средств, обладающих антиоксидантной активностью позволяет снизить иммуносупрессивное влияние гипоталамо-гипофизарной-надпочечниковой системы в период развития адаптационных реакций у птиц в условиях промышленных стрессов.
2. Фармакологический комплекс СПАО и кормовая добавка СПАО-КД по степени воздействия на теплокровных животных относятся к веществам малоопасным 4 класс опасности по ГОСТ 12.1.007-76.
3. Анализ известных ветеринарных препаратов и кормовых добавок позволяет сделать вывод об отсутствии в них признаков, сходных с существенными отличительными признаками разработанных фармакологических средств, что соответствует научному характеру исследований и критериям новизны.
4. Профилактика стрессов у кур родительского стада СПАО-КД и СПАО-комплекс при вакцинации против реовирусной инфекции обеспечивает однородный и высокий уровень защиты птицы от полевого вируса: сокращает сроки формирования защитного уровня антител, способствует более интенсивному достижению уровня однородности вакцинации, что подтверждается увеличением производственных показателей. Более выраженный эффект достигается при использовании СПАО-комплекса.
4.1. На фоне использования СПАО-КД и СПАО-комплекса титры антител соответствовали ожидаемому уровню и были выше защитного к 14 дню после второй вакцинации, на фоне основного рациона – к 2 дню после второй вакцинации. К 21 дню после второй вакцинации титры антител на фоне применения СПАО-КД были выше, чем на фоне основного рациона в 1,6 раза, СПАО-комплекса – в 2,6 раза.
4.2. СПАО-КД и СПАО-комплекс, применяемые на фоне вакцинации сокращают сроки достижения уровня коэффициента вариации, указывающего на однородность (менее 45) – к 14 дню после второй вакцинации. Применение СПАО комплекса способствует снижению величины коэффициента вариации к сроку контроля напряженности иммунитета – к 21 дню после второй вакцинации на 25,7 %. Применение СПАО-КД в сравнении с основным рационом не оказывает влияния на величину коэффициента вариации к этому сроку.
4.3. Показатель индекса вакцинации, демонстрирующий высокие значения при успешно проведенной вакцинации, на фоне применения СПАО-комплекса был в 3,5 раза выше, чем на фоне основного рациона, СПАО-КД – в 1,6 раза.
4.4. При применении СПАО-комплекса сохранность кур была выше 3,5 %, живая масса птицы – на 6,44 %, выход суточных цыплят – на 4,22 %, СПАО-КД – на 0,79 %, 0,88 % и 0,55 % соответственно.
4.5. Экономическая эффективность использования СПАО-КД на один рубль затрат составила 180,09 руб., СПАО-комплекса – 435,86 руб.
5. Уровень титров антител к возбудителю инфекционного энцефаломиелита птиц на фоне использования СПАО-комплекса превысил ожидаемый минимальный уровень в возрасте 37 и 53 недель и был выше, чем у птицы на фоне базовой технологии вакцинации на 9,47 и 19,75 % соответственно, в возрасте 62 недель – на 42,38 %. Влияние СПАО-комплекса на однородность вакцинации против инфекционного энцефаломиелита птицы выражено незначительно – меньше на 7,1 %.
6. Уровень средних титров антител против инфекционной бурсальной болезни на фоне использования СПАО-комплекса в начале периода вакцинации были выше на 18,2 %, после ревакцинации – в 2,9 раза, защитный уровень титров был достигнут к 41-недельнму возрасту и продолжал нарастать в дальнейшем. Влияние СПАО-комплекса на однородность вакцинации установлено на этапе формирования иммунитета после ревакцинации: коэффициент вариабельности титров антител к возбудителю инфекционной бурсальной болезни был ниже на 7,1-17,8 %.
7. В период с 6-дневного по 17-дневный возраст у цыплят, которым использовали СПАО-комплекс, титр антител против инфекционного бронхита кур был выше сравнении на 79,1 % и в 2,2-3,7 раза, с 25-дневного по 55-дневный возраст – на 21,2-45,9 %, в 10-55-недельном возрасте – на 28,2-62,0 %. Применение СПАО-комплекса в программу вакцинации увеличивает на 3,6-18,2 % ее однородность, на 22,6 % ускоряет выработку антител в геометрическом титре выше защитного уровня.
8. При комплексной вакцинации против инфекционных болезней у кур разного возраста под воздействием фармакологического средства СПАО-комплекса уровень антител к возбудителю реовирусной инфекции достигает значения, соответствующего защитному, в 3,05 раза быстрее, и превышает показатели интенсивности гуморального ответа в сравнении с базовой технологией вакцинации на 5,5-38,0 %, способствует сохранению напряженности гуморального ответа. Применение СПАО-комплекса способствует усилению однородности гуморального отклика при формировании иммунитета к возбудителю реовирусной инфекции, выявляемой в возрасте 38 дней и 24 недель, на 3,4 и 44,6 % соответственно.
9. Под воздействием СПАО-комплекса после ревакцинации формирование титра антител к возбудителю метапневмовирусной инфекции увеличивается на 10,1 % и превышает защитный уровень в 6 раз, однородность титров антител увеличивается на 22,5 %.
10. При профилактике болезни Ньюкасла кур яичного направления продуктивности на фоне профилактики стрессов фармакологическим комплексом СПАО выработка антител более однородна по всему стаду. В опытной группе титры (РТГА) находятся в пределах 9,40-13,40 log2, в контрольной группе 8,52-12,36. Уровень статистических различий интенсивности выработки антител log2 находится на уровне Р=0,0277. После перевода кур в цех получения продукции в опытной группе по сравнению с контрольной отмечается более высокий уровень продуктивности: яйценоскость выше в опытной группе на 2,04 %, сохранность поголовья за период с 105 по 250 сутки жизни кур наиболее высоких значений достиг в опытной группе и составил 99,72 %, в контрольной группе 99,44 %.
11. Стресс в виде перевода и вакцинации взрослых кур существенно не влияет на значения перекисного окисления липидов и окислительные модификации белков крови. При этом обнаружен высокий статистически достоверный уровень зависимости показателей концентрации витамина Е и церулоплазмина в плазме крови контрольных (r=0,84) и опытных (r=0,95) групп.
12. Дебикирование цыплят оказало выраженное влияние на процессы липопероксидации, что указывает на более высокий характер стрессирующего воздействия данной операции по сравнению с переводом и вакцинацией кур, к тому же цыплята в возрасте 5-6 суток более восприимчивы к внешним воздействия по сравнению с курами в период окончания полового созревания. Полученные данные свидетельствуют об отсутствии признаков выраженного оксидативного стресса в опытной и контрольной группах. Обнаружено непосредственное влияние СПАО-комплекс на состояние процессов перекисного окисления липидов и активность антиоксидантной системы организма. Изменения показателей носят выраженный хронологический характер:
12.1. В течение 1,5-2 часов после проведения дебикирования не отмечаются статистически выраженных сдвигов показателей перекисного окисления липидов и активности антиоксидантной системы организма АО. Применение СПАО-комплекс привело к снижению в плазме крови концентрации церулоплазмина на 68,0 %, на 64,4 % витамина Е. В течение 1,5-2 часов после проведения дебикирования единицы индексов окисления диеновых конъюгатов, экстрагируемых в гептановую фазу выше у птицы контрольной группы на 52,3 % в сравнении с опытной группой, что свидетельствует о защитно-компенсаторном характере повышения уровня церулоплазмина и витамина Е у цыплят, не получавших антистрессовое фармакологическое средство.
12.2. Через 1 сутки после дебикирования обнаружено более высокое значение у цыплят контрольной группы уровня церулоплазмина на 65,0 % и в 2 раза и витамина Е. При этом отмечаются более высокие уровни ЕИО ДК в гептановой фазе и ЕИО КДсСТ в изопропанольной фазе. Однако, данные факты не указывают на развитие оксидативного стресса так как обнаруженные показатели соответствуют значениям в состоянии покоя. Обнаруженные различия показателей подтверждают, что повышение уровня церулоплазмина и витамина Е носят компенсаторно-приспособительный характер. В данном случае отмечается реакция активации (по Гаркави Л. Х. с соавт. — 1969) в ответ на разные по качеству факторы средней величины.
12.3. Спустя 2 дня после дебикирования показатели у птицы контрольной группы соответствуют исходным значениям, в опытной группе отмечаются более низкие значения уровня ЕИО ДК и ЕИО КДсСТ изопропанольной фазы на 20,0 % и на 84,8 % соответственно. Концентрация витамина Е в контрольной группе выше на 61,1 % по сравнению с опытной. Так же в опытной группе отмечаются более низкие значения уровня ЕИО ДК и ЕИО КДсСТ изопропанольной фазы на 16,5 % и на 61,9 % соответственно. Характер изменений, наблюдаемых в данный период возможно связан с действием литийсодержащего фармакологического средства и может указывать на развитие реакции тренировки (по Гаркави Л. Х. с соавт. — 1969) в ответ на действие раздражителя пороговой силы и относительно малую величину действующего фактора.
12.4. Изменения концентраций витамина Е и церулоплазмина носят компенсаторно-приспособительный характер. Уровень ферментативного и не ферментативного звена АС имеет подъем, наблюдаемый через 1,5-2 часа после дебикирования с последующим небольшим спадом ниже исходных параметров и через 2 дня возвращается до нормы. В крови птицы, где применялся «СПАО-комплекс», характер изменений несколько иной — через 1,5-2 часа после дебикирования и через сутки наблюдается плавное снижение показателя с последующим статистически недостоверным увеличением его выше исходного уровня ко вторым суткам после дебикирования. Между концентраций витамина Е и церулоплазмина имеется статистически достоверная корреляционная связь в опытной группе на уровне r=0,72, в контрольной r=0,66.
Для повышения эффективности вакцинаций против инфекционных болезней кур и цыплят мясного и ячного направления продуктивности рекомендуем применение антистрессового фармакологического средства СПАО-комплекс с водой в дозе 185 мг/кг массы тела в течение 5 дней за 3 дня до вакцинации, в день вакцинации и один день после вакцинации. Разработанный фармакологический комплекс можно изготовить в условиях ветеринарной аптеке по рецепту, мас.%: цитрат лития – 10; аскорбиновая кислота – 15; янтарная кислота – 10; бутафосфан — 30; L-карнитин тартрат — 15; глюкоза – остальное до 100.
При необходимости использования кормовой добавки рекомендуем с целью профилактики вакцинальных стрессов использование кормовой добавки СПАО-КД в составе комбикорма в дозе 185 мг/кг массы тела в течение 5 дней за 3 дня до вакцинации, в день вакцинации и один день после вакцинации. Разработанная кормовая добавка может быть изготовлена в условиях ветеринарной аптеки, комбикормового завода и цеха по производству кормов по рецепту, мас.%: карбонат лития – 7,6; аскорбиновая кислота – 15; янтарная кислота – 10; бутафосфан — 30; L-карнитин тартрат — 15; глюкоза – остальное до 100.
Использование разработанных антистрессовых средств, обладающих антиоксидантной активностью позволяет снизить иммуносупрессивное влияние гипоталамо-гипофизарной-надпочечниковой системы в период развития адаптационных реакций у птиц в условиях вакцинальных и других промышленных стрессов и повысить эффективность вакцинопрофилактики инфекционных заболеваний за счет повышения уровня антител и их однородности, повысить сохранность и продуктивность кур и цыплят разного возраста и направлений продуктивности.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
- Фисинин В.И. Мировое и российское птицеводство: реалии и вызовы будущего: монография. -М.: Хлебпродинформ, 2019. -470 с.
- Фисинин В.И. Стратегические тренды развития мирового и отечественного птицеводства: состояние, вызовы, перспективы// Мировые и российские тренды развития птицеводства: реалии и вызовы будущего Материалы XIX Международной конференции. Российское отделение Всемирной научной ассоциации по птицеводству (ВНАП); НП «Научный центр по птицеводству»; под редакцией академика РАН, профессора В.И. Фисинина. 2018. С. 9-48.
- Кавтарашвили А.Ш. Физиология и продуктивность птицы при стрессе (обзор)/ А.Ш. Кавтарашвили, Т.Н. Колокольникова // Сельскохозяйственная биология 2010, № 4, с. 25-37.
- Кавтарашвили А.Ш., Колокольникова Т.Н., Кирдяшкина Г.А.Предотвращение избыточного роста когтей кур-несушек в клетках. Мат. межд. конф. Геленджик, 2007: 261-269.
- Фисинин В.И., Сурай П. Эффективная защита от стрессов в птицеводстве: от витаминов к витагенам // Птица и птицепродукты, 2011, №5, с. 23-26
- Фисинин В.И., Сурай П.Ф., Кузнецов А.И., Мифтахутдинов А.В., Терман А.А. Стрессы и стрессовая чувствительность кур в мясном птицеводстве. Диагностика и профилактика. Троицк, 2013.
- Аликин Ю. С. Опыт создания иммунологических препаратов на основе природных РНК. От экспериментальной биологии к превентивной и интегративной медицине. Здоровье человека – фундамент прогресса общества: Междунар. междисциплинарный симп. // Ю. С. Аликин, Е. Д. Даниленко, В.И. Масычева, В.Ф. Подгорный, Е.Ю. Рослякова, С.И. Прудников, Н.А. Шкиль. – Новосибирск. — 2007. — С.7.
- Джавадов Э.Д./ Вакцинация как основной фактор поддержания биобезопасности птицеводческих предприятий// Организация системы контроля инфекционных болезней, применения антимикробных препаратов и выпуска безопасной продукции птицеводства коллективная монография. Санкт-Петербург, 2018. С. 149-166.
- Джавадов Э.Д., Дмитриева M.E. / Эффективная вакцинопрофилактика — залог эпизоотического благополучия промышленного птицеводческого предприятия// Российский ветеринарный журнал. Сельскохозяйственные животные. 2012. № 3. С. 6-7.
- Джавадов Э.Д., Дмитриева М.Е. Особенности вакцинопрофилактики в промышленном птицеводстве // Птица и птицепродукты. 2011. № 5. С. 37-39.
- Sorrells S. F., Caso JR, Munhoz CD, Sapolsky RM. The stressed CNS: when glucocorticoids aggravate inflammation. Neuron. 2009;64(1):33–39.
- Sapolsky R.M. (1999). Glucocorticoids, stress, and their adverse neurological effects: relevance to aging. Exp. Gerontol. 34, 721–732.
- Sapolsky, R.M. (2004). Stress and cognition. In The Cognitive Neurosciences, M. Gazzaniga, ed. (Cambridge, Massachusetts: MIT Press), pp. 1031.
- Sapolsky R.M., and Pulsinelli, W.A. (1985). Glucocorticoids potentiate ischemic injury to neurons: therapeutic implications. Science 229, 1397–1400.
- Tarcic N., Ovadia, H., Weiss, D.W., and Weidenfeld, J. (1998). Restraint stress-induced thymic involution and cell apoptosis are dependent on endogenous glucocorticoids. J. Neuroimmunol. 82, 40–46.
- De Bosscher K., Vanden Berghe, W., and Haegeman, G. (2003). The interplay between the glucocorticoid receptor and nuclear factor-kappaB or activator protein-1: molecular mechanisms for gene repression. Endocr. Rev. 24, 488–522.
- Reichardt H.M., Tuckermann, J.P., Gottlicher, M., Vujic, M., Weih, F., Angel, P., Herrlich, P., and Schutz, G. (2001). Repression of inflammatory responses in the absence ofDNA bindingbythe glucocorticoidreceptor. EMBOJ.20, 7168–7173.
- Munck A., Guyre, P.M., and Holbrook, N.J. (1984). Physiological functions of glucocorticoids in stress and their relation to pharmacological actions. Endocr. Rev. 5, 25–44.
- Wick G., Hu, Y., Schwarz, S., and Kroemer, G. (1993). Immunoendocrine communication via the hypothalamo-pituitary-adrenal axis in autoimmune diseases. Endocr. Rev. 14, 539–563.
- Sapolsky Robert & Romero, L. & Munck, A.U.. (2000). How Do Glucocorticoids Influence Stress Responses? Integrating Permissive, Suppressive, Stimulatory, and Preparative Actions. Endocrine reviews. 21. 55-89. 10.1210/edrv.21.1.0389.
- Кочиш И.И. Динамика изменения свободных аминокислот сыворотки крови цыплят бройлеров при воздействии соли лития / И. И. Кочиш и др. // Доклады РАСХН. 2009. №6. С. 4749.
- Фисинин В.И., Кавтрашвили А.Ш. Тепловой стресс у птицы. Сообщение I. Опасность, физиологические изменения в организме, признаки и проявления (обзор). // Сельскохозяйственная биология, 2015, том 50, №2, с.162-171
- Забудский Ю.И. Миграционная активность лейкоцитов — маркер стресса птиц / Ю.И. Забудский, И.Г. Скутарь // Ветеринария. — 1993 .- №3.-С. 44-46.
- Забудский Ю.И. Современные методы диагностики состояния стресса у сельскохозяйственных птиц. Мат. Третьей межд. ирано-российской конф. «Сельское хозяйство и природные ресурсы». М., 2002: 134-135.
- Puvadolpirod S. Model of physiological stress in chickens: 4. Digestion and Metabolism / S. Puvadolpirod, J. P. Thaxton // Poult. Sci. – 2000. – № 79. – P. 383-390.
- Avoiding handling-induced stress in poultry: use of uniform parameters to accurately determine physiological stress/ Wein Y, Bar Shira E, Friedman A// Poult Sci. 2017 Jan 1;96(1):65-73.
- Фисинин В.И. Инновационные методы борьбы со стрессами в птицеводстве/ В.И. Фисинин, Т. Папазян, П. Сурай// – Птицеводство. – 2009. — № 8. – с. 10-14.
- Бусловская Л. К. Транспортный стресс кур и коррекция их нарушений / Л. К. Бусловская, О. Л. Ковалева // Эколого-физиологические проблемы адаптации : материалы XII междунар. симп. – Москва, 2007. – С. 82-84.
- Богданова Л. Стресс в курином яйце. Изобретатель и рационализатор, 1981, 2: 12-14.
- Болотников И.А. Стресс и иммунитет у птиц. Л., 1983.
- Бурксер Г.В. Стресс сельскохозяйственных животных. Ветеринария, 1974, 8: 92-94.
- Джамбулатов М.М., Алишейхов А.М., АхмедхановаР.Р.Профилактика теплового стресса у кур с помощью аскорбиновой кислоты. Зоотехния, 1997, 11: 24-25.
- Марьенко Н. Оптимальный микроклимат в птичнике. Животноводство России, 2008, 10: 19-20.
- Фисинин В.И. Оптимальные сроки перемещения молодняка и профилактики стресса пересадки /В.И. Фисинин, Н.А. Кравченко// Птицеводство. — 1977.-№7.-С.29-30.
- Квиткин Ю.П., ФедорченкоН.Г., КривцовИ.Л. Стресс сельскохозяйственной птицы: Обзорная информация. М., 1977.
- Колокольникова Т.Н. Обрезка когтей у несушек. Птицеводство, 2007, 7: 27-28.
- Кравченко Н.А., Золотарева Н.Н., Фисинин В.И. Реакция симпатико-адреналовой системы цыплят на воздействие пересадки как стресс-фактор. Мат. науч. конф. «Актуальныепроблемыразвитияптицеводства». Загорск, 1975, 8: 121-125.
- Кривошеев А.А. Фармакокоррекция литием цитратом технологических стрессов в кролиководстве// дис. кандидата биологических наук — Москва, 2010.
- Кулинский В.И. Активные формы кислорода и оксидантная модификация макромолекул: польза, вред и защита // Соросовскийобразоват. журн. – 1999. – Вып. 1. – С. 2-7.
- Лысов В. Ф. Особенности функциональных систем и основы этологии сельскохозяйственной птицы / В. Ф. Лысов, В. И. Максимов – Москва : Агропром-консалт, 2003. – 96 с.
- Маилян Э. Профилактика теплового стресса. Птицеводство, 2007, 11: 29-33.
- Марьенко Н. Оптимальный микроклимат в птичнике. Животноводство России, 2008, 10: 19-20.
- Патент РФ на изобретение 2151502. Способ прогноза стресса у яичных кур. Опубл. 27.06.2000.)
- Платонов В. Н. Адаптация в спорте / В. Н. Платонов. – Киев: Здоровья, 1988. – 216 с.
- Плященко С.И. Стрессы у сельскохозяйственных животных. М., 1987.
- Подобед Л.И. Диетопрофилактика кормовых нарушений в интенсивном птицеводстве. Одесса, 2008.
- Пономаренко В.В. Фармако-токсикологические свойства «СПАО-комплекс» и оценка его эффективности при профилактике стрессов у кур // дис.на соискание степени кандидата ветеринарных наук – Троицк, 2016
- Попов С.В. Неопределенность внешней среды и возбуждение/стресс как детерминанты поведения. // Журнал общей биологии 2010. 71(4): 287–297.
- Послов Г.А. Влияние стресс-факторов на животных. Зоотехния, 1989, 12: 43-44.
- Сарапульцев П.А., Сарапульцев А.П. Стресс и иммунная система. Цитокины и воспаление, 2014, 4;
- Сурай П. Ф. Природные антиоксиданты в эмбриогенезе кур и защита от стрессов в постнатальном развитии / П. Ф. Сурай, В. И. Фисинин // C.-х. биология. – 2013. – № 2. – С. 3
- Сурай П., Фисинин В.И. Современные методы борьбы со стрессами в птицеводстве: от антиоксидантов к витагенам // Сельскохозяйственная биология, 2012, №4, с.3-12.
- Турпаев К.Т. Активные формы кислорода и регуляция экспрессии генов // Биохимия. – 2002. – Т. 67, вып. 3. – С. 339-352.
- Фисинин В.И. Антистрессовая активность и эффективность применения фармакологического комплекса СПАО курам родительского стада/ В.И. Фисинин, А.В. Мифтахутдинов, В.В. Пономаренко, Д.Е. Аносов// Аграрный вестник Урала. 2015. № 12. С. 54-58.
- Фисинин В.И. Влияние стресс факторов на гормональный статус в тканях птицы в зависимости от возраста/ В.И. Фисинин, Н.А. Кравченко //Сельскохозяйственная биология. — 1979.- Т. XIV.-№ 2,- С. 191-194.
- Фисинин В.И. Возрастные особенности адаптационно-компенсаторных процессов у цыплят/ В.И. Фисинин, И.Н. Мудрый, Н.А. Кравченко // Доклады ВАСХНИЛ. 1975. — № 8. — С. 26-29.
- Ericsson, M., & Jensen, P. (2016). Domestication and ontogeny effects on the stress response in young chickens (Gallus gallus). Scientific Reports, 6, 35818. http://doi.org/10.1038/srep35818
- Cotter, P. F. 2015. An examination of the utility of heterophil- lymphocyte ratios in assessing stress of caged hens. Poult. Sci. 94:512-517.
- Gonzalez — Esquerra R., Leeson S. Effects of arginine, lisine and metionine source on amino acid digestibility and response to dietary electrolytes in chronically or acutely heat-stressed broilers. Canad. J. Anim. Sci., 2006, 86(2): 263-271.
- Gonzalez — Esquerra R., Leeson S. Physiological and metabolic responses of broilers to heat stress implications for protein and amino acid nutrition. World’sPoultrySci. J., 2006, 62(2): 282-295.
- Grande F. Effect of glutagon on plasma free fatty acids and blood sugar in birds. Proc. Soc. Exp. Biol. Med., 1968, 128(2): 532-536
- Hacking P.M. Welfare of broiler breeder and layer females subjected to food and water control during rearing / P. M. Hacking, M. H. Maxwell, M. A. Mitchell // British Poultry Science. – 1993. – № 34. – P. 443-458.
- Dmitriev V.B. Destabilizing effect of chicken selection using the functional adrenal reserves criteria / V. B. Dmitriev, I. V. Churkina, A. F. Smirnov, E. K. Niko- laeva // Genetika. – 2001. – № 37. – P. 517-523.
- Shini S., Huff G. R., Shini A., Kaiser P. Understanding stress-induced immunosuppression: exploration of cytokine and chemokine gene profiles in chicken peripheral leukocytes. Poult. Sci, 2010, 89: 841-851.
- Pijarska I., Czech A., Malec H., Tymczyna L. Effect of road transportation of chicks on blood biochemical indices and productive results of broilers. Med. Weter., 2006, 62(4): 408-410.
- Bird biopotential against the correction of non-specific resistance and specific immunogenesis/ Semenov, V.G. ;Baimukanov, A.; Ivanov, N. G. ;Tadzhiyeva, A. K. ;Karynbayev, A. K. ;Karibayeva, D. K. // Bulletin of the National Academy of Sciences of the Republic of Kazakhstan — № 6. – 2019 — P. 111-119
- Xu Y. Q., Guo Y. W., Shi B. L., Yan S. M., Guo X. Y. Dietary arginine supplementation enhances the growth performance and immune status of broiler chickens // Livestock Science. ‒ 2018. ‒ T. 209. ‒ C. 8-13.
- Балашов В.В. Применение препарата Ветостим с целью повышения эффективности специфической профилактики ньюкаслской болезни и инфекционного бронхита кур у цыплят-бройлеров и индюшат/ Автореф. дис. на соискание уч. степ. канд. вет. наук. Омск 2014
- Этические и правовые аспекты проведения экспериментальных биомедицинских исследований in vivo часть I / Липатов Вячеслав Александрович, Крюков Алексей Анатольевич, Северинов Дмитрий Андреевич, Саакян Араик Рубенович // Рос. мед.-биол. вестн. им. акад. И.П. Павлова. 2019. №1. URL: https://cyberleninka.ru/article/n/eticheskie-i-pravovye-aspekty-provedeniya-eksperimentalnyh-biomeditsinskih-issledovaniy-in-vivo-chast-i (дата обращения: 14.01.2020).
Инструкция по применению вакцины Нобилис® Reo 1133 против реовирусной инфекции птиц живой сухой: разработчик компания «Интервет Интернешнл Б.В.», согл. с зам. руководителя Россельхознадзора F.А. Власовым 27.12.2017 г.
Инструкция по применению вакцины против реовирусного теносиновита кур сухой живой с разбавителем «АВИВАК-РЕО»: разработчик ООО «НПП «АВМВАК», согласовано с зам. руководителя Россельхознадзора F.А. Власовым 05.07.2017 г.
Инструкция по применению набора для выявления антител к вирусам энцефаломиелита птиц (ЭП), инфекционного бронхита кур (ИБК), инфекционной бурсальной болезни птиц (ИББ), ньюкаслской болезни (НБ) и реовирусу птиц (РВП) методом иммуноферментного анализа (ИФА): утв. 22.06.2008 г. // Барышников, П.И. Лабораторная диагностика вирусных болезней животных : учебное пособие / П.И. Барышников, В.В. Разумовская. – Санкт-Петербург : Лань, 2015. – С. 436-443.
- Olson N.O. Reovirus Infection / N.O. Olson // In: Diseases of Poultry. 7th edition (edited by M.S.Hofstad, et al.) ames, Iowa, Iowa State University Press, 1978.
Методика определения экономической эффективности ветеринарных мероприятий // Ветеринарное законодательство / под ред. В. М. Авилова. – Москва: Росзооветснабпром, 2000. — Т. 1. — С. 293–326.
Журавель Н.А. Особенности расчёта экономической эффективности профилактики стресса у родительского стада кур / Н.А. Журавель, А.В. Мифтахутдинов // Достижения науки и техники АПК, 2015. — Т. 29. – № 11. – С. 25-27.
Журавель Н.А. Программа «Экономическая оценка внедрения новых методов и средств ветеринарного назначения в промышленное птицеводство» / Н.А. Журавель, Е.С. Комарова, Е.В. Тимошенкова, А.В. Мифтахутдинов / Свидетельство о регистрации программы для ЭВМ RU 2018618108, 09.07.2018. Заявка № 2018615635 от 31.05.2018.
Фисинин В.И. Методология определения эффективности внедрения новых ветеринарных методов и средств в птицеводстве / В.И. Фисинин, Н.А. Журавель, А.В. Мифтахутдинов А.В. // Ветеринария, 2018. – № 6. – С. 14-20.
Zhuravel N.A. Economic assessment of stress prevention in broiler chickens in the pre-slaughter period / N.A. Zhuravel, A.V. Miftakhutdinov, S.F. Suchanova // IOP Conference Series: Earth and Environmental Science: The proceedings of the conference AgroCON-2019, 2019. – С. 012056.
Zhuravel N.A., Economic analisis of factors causing the efficiency of introducing innovative methods and means in industrial poultry / N.A. Zhuravel A.V. Miftakhutdinov, V.V. Zhuravel / Ecological Agriculture and Sustainable Development / Editors: Prof. Dr Litovchenko Viktor Grigorievich, Dr Mirjana Radovic Markovic, 2019. – С. 117-124.
Гирин М. В. Подбор схемы вакцинации против ньюкаслской болезни / М. В. Гирин // Птицеводство. – 2012. — № 7. – С. 33-34.
Epidemiological study of Newcastle disease in backyard poultry and wild bird populations in Switzerland / E. Schelling [et al.] // Avian pathology. – 1999. -Vol. 28. — P. 263-272.
Virulence of pigeon-origin Newcastle disease virus isolates for domestic chickens / G. D. Kommers // Avian Dis. – 2001. — Vol. 45, № 4. — P. 906-921.
Современные стратегии вакцинопрофилактики инфекционных болезней птиц в российском птицеводстве. Тенденции и перспективы. / В. Н. Ирза [и др.] // Био. – 2005. — № 7. – С. 6-7.
- Волчегорский И.А. Сопоставление различных подходов к определению продуктов перекисного окисления липидов в гептан-изопропанольных экстрактах крови / И.А. Волчегорский, А.Г. Налимов, Б.Г. Яровинский, Р.И.Лифшиц // Вопросы медицинской химии. – 1989. – № 1. – С.127-131.
- Волчегорский И.А. Экспериментальное моделирование и лабораторная оценка адаптационных реакций организма / И.А. Волчегорский, И.И. Долгушин, О.Л. Колесников, В.Э. Цейликман. – Челябинск, 2000. – 167 с.
- Дубинина Е. Е. и др. Окислительная модификация белков плазмы крови больных психическими расстройствами (депрессия, деперсонализация) //Вопросы медицинской химии. – 2000. – Т. 46. – №. 4. – С. 398-409.
- Дубинина Е. Е. и др. Окислительная модификация белков сыворотки крови человека, метод ее определения //Вопросы медицинской химии. – 1995. – Т. 41. – №. 1. – С. 24-26.
- Дубинина Е.Е. Роль активных форм кислорода в качестве сигнальных молекул в метаболизме тканей при состояниях окислительного стресса // Вопр. мед.химии. – 2001. – Т. 47, № 6. – С. 561-581.
- Дубинина Е.Е. Продукты метаболизма кислорода в функциональной активности клеток (жизнь и смерть, созидание и разрушение). Физиологические и клинико — биохимические аспекты / Е.Е. Дубинина. — СПб.: изд-во Медицинская пресса, 2006. — 397 с.
- ГОСТ 12.1.007-76 «Вредные вещества. Классификация и общие требования безопасности». Утвержден и введен в действие Постановлением Государственного комитета СССР по стандартам от 10.03.76 N 579 Электронный документ, режим доступа: http://docs.cntd.ru/document/5200233
- Трефилов Б.Б. Антигенные свойства штаммов реовируса птиц / Б.Б. Трефилов, Н.В. Никитина // Современные тенденции развития науки и технологий, 2015. – № 6-3. – С. 92-97.
Трефилов Б.Б. Профилактика реовирусного теносиновита кур / Б.Б. Трефилов, Н.В. Никитина // Международный журнал экспериментального образования, 2016. – № 10-2. – С. 230-231.
Радюш И.С. Иммуногенность живых вакцин против реовирусной инфекции птиц, полученных с использованием СПФ-эмбрионов, фибробластов эмбрионов кур и культуры клеток Vero / И.С. Радюш, А.А. Гусев, А.А. Гуляко, И.В. Насонов И.В. //Труды Федерального центра охраны здоровья животных, 2013. – Т. 11. – №1. – С. 124-134
Митрофанова М.Н. Серологический мониторинг реовируса кур в птицехозяйствах России в 2011-2016 гг/ М.Н. Митрофанова, Н.С. Мудрак, А.Э. Меньщикова, В.Н. Ирза // Актуальные проблемы ветеринарной медицины: материалы международной научно-практической конференции посвященной 90-летию со дня рождения профессора В.А. Киршина. – Казань: Федеральный центр токсикологической, радиационной и биологической безопасности, 2018. – С. 239-240
- Болезни опорно-двигательной системы у птиц: информационный обзор / сост. Б.Б. Трефилов, В.В. Пругло; РАСХН, ГНУ ВНИВИП. – Санкт-Петербург, 2004. – С. 33–39.
- Трефилов Б.Б. Реовирусная инфекция птиц / Б.Б. Трефилов, Н.В. Никитина, В.С. Бочкарев // Эффективное животноводство. 2017. № 1 (130). С. 54-55.
Лазовская Н.О. Морфология костного мозга цыплят, вакцинированных против реовирусного теносиновита / Н.О. Лазовская, В.С. Прудников // Ученые записки учреждения образования «Витебская ордена «Знак почета» государственная академия ветеринарной медицины». 2015. Т. 51. № 2. С. 52-54.
Радюш И.С. Иммуногенность живых вакцин против реовирусной инфекции птиц, полученных с использованием СПФ-эмбрионов, фибробластов эмбрионов кур и культуры клеток Vero / И.С. Радюш, А.А. Гусев, А.А. Гуляко, И.В. Насонов И.В. //Труды Федерального центра охраны здоровья животных, 2013. – Т. 11. – №1. – С. 124-134
Лизун Р. Особенности ветеринарного обслуживания птицеводческих предприятий / Р. Лизун // Наука и инновации, 2014. – № 8 (138). – С. 25-26.
- Митрофанова М.Н., Культивирование реовируса птиц штамма «arv04/02» в различных клеточных системах / М.Н. Митрофанова, Л.В. Малахова, Б.Л. Манин // Ветеринария сегодня. 2017. № 1 (20). С. 13-16.
Трефилов Б.Б. Профилактика реовирусного теносиновита кур / Б.Б. Трефилов, Н.В. Никитина // Международный журнал экспериментального образования, 2016. – № 10-2. – С. 230-231.
Диагностический набор для выявления антител против реовируса у птиц [Электронный ресурс] // Наборы для диагностики болезней кур иммуноферментным методом. // Диагностические наборы Zoetis.- режим доступа: https://piginfo.ru
- Трефилов Б.Б. Реовирусная инфекция птиц / Б.Б. Трефилов, Н.В. Никитина, В.С. Бочкарев // Эффективное животноводство. 2017. № 1 (130). С. 54-55.
Журавель Н.А. Экономическая эффективность фармакологической профилактики стрессов при выращивании ремонтного молодняка и содержания родительского стада кур мясного направления продуктивности / Н.А. Журавель, Д.Е. Аносов, А.В. Мифтахутдинов // Достижения науки и техники АПК, 2017. – Т. 31. – № 1. – С. 44-48.
- Кавтарашвили А.Ш. Методы смягчения стресса в птицеводстве / А.Ш. Кавтарашвили, Т.Н. Колокольникова // Феникс–KYC, 2010. – № 8. – С. 11–18.
- Пономаренко В.В. Оценка сравнительного воздействия СПАО-комплекс и цитрата лития на показатели вакцинального иммунитета кур// Молодые ученые в решении актуальных проблем науки: материалы международной научно – практической конференции молодых ученых и специалистов (16 –17 декабря 2015 года). – Троицк: ЮУрГАУ, 2015 — с.178-181.
- Пономаренко В.В. Сравнительная оценка иммуннопротекторных свойств СПАО-комплекс и цитрата лития на фоне вакцинального стресса у кур / В.В. Пономаренко // Инновационные технологии и технические средства для АПК: материалы международной научно-практической ученых и специалистов (Россия, Воронеж, 26-27 ноября). – Ч III. – Воронеж:ФГБОУ ВО Воронежский ГАУ, 2015 – с. 108-113.
- Пономаренко В.В. Влияние литийсодержащих фармакологических средств на показатели сероконверсии при вакцинации кур / В.В. Пономаренко // Развитие научной, творческой и инновационной деятельности молодежи: материалы VII Всероссийской научно-практической заочной конференции молодых ученых. – Курган: Изд-во Курганской ГСХА, 2015 – с. 185-187.
- Anosov D. Stress protective properties of the pharmacological complex SPAO in the period of transfer, vaccination and spiking of hens / D. Anosov, V. Ponomarenko, A. Miftakhutdinov // Advances in Agricultural and Biological Sciences — № 1 – 2015. – р. 23-29.
Яшин Р.В. Изучение напряженности и продолжительности иммунитета у кур после прививки вакциной, ассоциированной против ньюкаслской болезни, реовирусного теносиновита и метапневмовирусной инфекции птиц / Р.В. Яшин, В.Н. Ирза // Ветеринария сегодня, 2012. – № 3 (3). – С. 47-54.
- Пономаренко В.В. Сравнительная оценка иммуннопротекторных свойств СПАО-комплекс и цитрата лития на фоне вакцинального стресса у кур / В.В. Пономаренко // Инновационные технологии и технические средства для АПК: материалы международной научно-практической ученых и специалистов (Россия, Воронеж, 26-27 ноября). – Ч III. – Воронеж:ФГБОУ ВО Воронежский ГАУ, 2015 – с. 108-113.
Инструкция по применению вакцины против реовирусного теносиновита кур сухой живой с разбавителем «АВИВАК-РЕО»: разработчик ООО «НПП «АВМВАК», согласовано с зам. руководителя Россельхознадзора F.А. Власовым 05.07.2017 г.
- Кукленкова И.В. Отработка (оптимизация) схемы иммунизации птиц родительских стад против вирусных болезней //И.В. Кукленкова, Т.С. Жаворонкова, А.В. Пашкин и др. // Вопросы нормативно-правового регулирования в ветеринарии, 2018. – №4. – С. 51-55.
Радюш И.С. Иммуногенность живых вакцин против реовирусной инфекции птиц, полученных с использованием СПФ-эмбрионов, фибробластов эмбрионов кур и культуры клеток Vero / И.С. Радюш, А.А. Гусев, А.А. Гуляко, И.В. Насонов И.В. //Труды Федерального центра охраны здоровья животных, 2013. – Т. 11. – №1. – С. 124-134
- Лирдам Б. ван. Индекс вакцинации: новый параметр для оценки результатов вакцинации при использовании ИФА [электронный ресурс] / Барт ван Лирдам, Герман Босман // БИО № 6 (129) июнь 2011. – Режим доступа: http://www.vetmagazines.ru/
Мифтахутдинов А.В. Разработка и испытание антистрессовых фармакологических средств для повышения иммунологической эффективности вакцинопрофилактики кур // А.В. Мифтахутдинов, Э.М. Аминева // АПК России, 2019. – Т. 26. – № 5. – С. 857-863.
- Auerbach M.I. Varying antibody responses of laying henshoused in an aviary system and in furnished cages M. I. Auerbach, G. Glunder, M. Beyerbach M. Weber // Berliner Und Munchener Tierarztliche Wochenschrift. 2014. Vol. 127. Р. 267–273.
- Burns V.E. Antibody response to vaccination and psychosocial stress in humans: relationships and mechanisms/ Burns, Victoria E; Carroll, Douglas; Ring, Christopher; Drayson, MarkVaccine, 2003. – Vol. 21. – Issue 19–20. – P. 2523–2534.
- Olson N.O. Reovirus Infection / N.O. Olson // In: Diseases of Poultry. 7th edition (edited by M.S.Hofstad, et al.) ames, Iowa, Iowa State University Press, 1978.
- Segerstrom Psychological Stress and the Human Immune System: A MetaAnalytic Study of 30 Years of Inquiry / S.C. Segerstrom, G.E. Miller // Psychological Bulletin. 2004. Vol. 130. № 4. Р. 601–630.
Лазовская Н.О. Морфология костного мозга цыплят, вакцинированных против реовирусного теносиновита / Н.О. Лазовская, В.С. Прудников // Ученые записки учреждения образования «Витебская ордена «Знак почета» государственная академия ветеринарной медицины». 2015. Т. 51. № 2. С. 52-54.
- Андрейчук Д.Б. Разработка нового метода выявления генома вируса энцефаломиелита птиц на основе ПЦР-РВ с зондом TАQ-MАN / Д.Б. Андрейчук, О.С. Осипова. И.А. Чвала, А.Н. Колотилов, В.Н. Ирза, Н.А. Перевозчикова // Российский ветеринарный журнал, 2015. – № 2. – С. 24-26.
- Беляева Н.В. Определение инфекционного титра штамма вируса инфекционного энцефаломиелита птиц, неадаптированного к куриным эмбрионам / Н.В. Беляева, А.Н. Колотилов, В.Н. Ирза // Ветеринария сегодня, 2012. – № 3. – С. 42-46.
- Brion A. L`encephalomyelite infectuse aviaire / A. Brion, J.C. Guillon, G.P. Willemart. — Paris, 1972. – 165 р.
- Nicholas R.A., Thorton D.H.. A standard vassine for the virus content test of live avian encephalomyelitis virus vassines / R.A. Nicholas, D.H. Thorton // Biologicals, 1990. – V. 18. – № 2. – P. 131-133.
- Формирование гуморального иммунитета к вирусу инфекционного энцефаломиелита птиц у цыплят, вакцинированных живой вакциной из штамма «Calnek 1143 M» / А.Э. Меньщикова, А.Н. Колотилов, Н.В. Беляева и др. // Ветеринарная патология, 2006. – № 4. – С. 137-139.
- Садовников Н.В. Инфекционный энцефаломиелит у бройлеров / Н.В. Садовников, Л.И. Дроздова // Аграрный вестник Урала, 2006. – № 6. – С. 50-54.
- Calnek B. Avian encephalomyelitis / B. Calnek, R.E. Luginbuhl, C.E. Helmboldt // Diseases of Poultry. – Iowa University Press, Ames, IA., 1991. – 9th ed. – P.520-531.
- Heide L. van der. Encephalomyelitis / A Laboratory Manual for the Isolation and Identification of Avian Pathogens / L. van der Heide. – Hunt Publishing Co.Dubuque, IA., 1989. – 3rd ed. AAAP. Kendall. — Р. 149-151.
- Дудар Л.В. «Золотой стандарт» вакцинации птицы против ИББ с помощью Хипрагамборо-GM97 / Л.В. Дудар // Птицеводство, 2015. – № 3. – С. 45-47.
- Энрике П. Профилактика субклинической формы болезни Гамборо, вызванной вариантными штаммами вируса ИББ / Пена Энрике, Вилья Хорхе, Л.В. Дудар // Птицеводство, 2015. – № 4. – С. 55-59.
- Abdel-Alim G.A. Immunogenicity and antigenicity of very virulent strains of infectious bursal disease viruses / G.A. Abdel-Alim, Y.M. Saif // Avian Diseases, 2001. – Vol. 45. – P. 92-101.
- Lukert P. Infectious bursal disease virus / P. Lukert, Y. Saif // Diseases of poultry. – Ames: Iowa State University Press, 1997. – P. 721-738.
- Борисов А.В. Иммунобиологические свойства штамма «БГ» вируса инфекционной бурсальной болезни птиц / А.В. Борисов, В.В. Борисов // 25 лет на благо промышленного птицеводства. – Санкт-Петербург, 2015. – С. 31-33.
- Джавадов Э.Д. Эффективная вакцинопрофилактика – залог эпизоотического благополучия промышленного птицеводческого предприятия / Э.Д. Джавадов, М.Е. Дмитриева // РВЖ. Сельскохозяйственные животные, 2012. – №3. – С. 6-7.
- Соколов В.В. Опыт применения вакцины «АВИВАК ИББ–АН» в лабораторных и производственных условиях / В.В. Соколов; А.Н. Калинин; С.Н. Норкина // 20 лет на благо промышленного птицеводства. – Санкт-Петербург: Издательский дом «АВИВАК», 2010. – С. 43-45.
- Ашаш У. Болезнь Гамборо: разные штаммы – одна вакцинация / У. Ашаш, А. Гнененкор, М. Дмитриева // Животноводство России, 2016. Спецвыпуск: ноябрь. – С. 14-15ю.
- Lemiere St.. Векторная вакцина VAXXITEK® HVT+IBD против вируса ИББ / St. Lemiere, Barranon J. Rojo // Наше сельское хозяйство, 2014. – № 20. – С.11-16.
- Матиас Ф. К вопросу вакцинации против болезни Гамборо / Ф. Матиас, Ф. Ханц // Животноводство России, 2008. – Спецвыпуск, январь. – С. 21-23.
- Селиверстов А.В. Инактивация вируса инфекционной бурсальной болезни штамма «К-58» / А.В. Селиверстов, А.В. Борисов, В.Н. Кузнецов // Труды Федерального центра охраны здоровья животных, 2010. – Т. 8. – № 1. С. 1.
- Сергеев В.А. Вирусы и вирусные вакцины / В.А. Сергеев, Е.А. Непоклонов, Т.И. Алипер. – М.: Библионика, 2007. – С. 186-201.
- Vaccine adjuvant: it makes the difference / K.M. Lima, S. Aparecida dos Santos, J.M. Rodrigues et al. // Vaccine, 2004. – Vol. 22. – № 19. – P. 2374-2379.
- Алиев А. Схемы вакцинации при инфекционной бурсальной болезни / А. Алиев, А. Алиева // Животноводство России. Спецвыпуск, 2014. – С 49-50.
- Дмитриева М.Е. Применение инактивированных вакцин в раннем возрасте для профилактики субклинических форм течения инфекционных болезней птиц / М.Е. Дмитриева, И.М. Алхлаев // Птицеводство, 2014. – № 2 (май-июнь). – С. 92-95.
- Джавадов Э. Вирусные болезни: диагностика и профилактика / Э. Джавадов // Животноводство России, 2015. – Спецвыпуск. – С. 7-10.
- Дмитриева М. Ветеринарное благополучие в промышленном птицеводстве / М. Дмитриева // Животноводство, 2016. – Спецвыпуск. – С. 46-48.
- Лютый Р.Ю. Динамика титров антител в сыворотке крови бройлеров кросса «Смена-7» на фоне применения препаратов «Фоспренил» И «Гамавит» [Электронный ресурс] / Р.Ю. Лютый, К.А. Сердюков // Современные проблемы науки и образования. – 2013. – № 5.- Режим доступа: URL: http://science-education.ru/ru/article/view?id=10555/
Lasher H., Shane S.W. Infectious Bursal Disease / H. Lasher, S.W. Shane // World’s Poultry Science Journal, 1994. – Vol. 50.
- Николаева И.П. Инфекционный бронхит кур (на заметку практикующему врачу) / И.П. Николаева, С.Н. Гаврилов // 20 лет на благо промышленного птицеводства. – Санкт-Петербург: Издательский дом «АВИВАК», 2010. – С. 30-32.
- Борисов А.В.. Инфекционный бронхит кур: особенности эпизоотологии и профилактики / А.В. Борисов, В.В. Борисов // 25 лет на благо промышленного птицеводства. – Санкт-Петербург, 2015. – С. 62-65
- Борисов А.В. Инфекционный бронхит кур. Особенности эпизоотологии и профилактика / А.В. Борисов, В.В. Борисов / Био, 2014. – № 6 (165) июнь. – С. 25-26.
- Wit J.J. de. Infectious bronchitis virus variants: a review of the history, current situation and control measures./ J.J. de Wit, J.K.A. Cook, H.M.J.F. van Der Heijden // Avian Pathology, 2011. – Vol. 40. – № 3. –Р. 223–235.
- Chen H.W. Identification of Taiwan and China-like recombinant avian infectious bronchitis viruses in Taiwan / H. W. Chen, Y.P. Huang, C.H Wang // Virus Res, 2009. – Vol.140. – P.121-129
- Профилактика инфекционного бронхита кур / Б.Я. Бирман [и др.]. – Изд. 2-е, доп. и перераб. – Минск: Бизнесофсет , 2008. – 88 с.
- Cavanagh, D. Infectious bronchitis / D. Cavanagh, S. Naqi // Diseases of Poultry. – Ames, Iowa, 2003. –11th ed. – P. 101-119.
- Бочков Ю.А. Диагностика инфекционного бронхита кур / Ю. А. Бочков, А.В. Борисов, С.В. Фролов и др. // Ветеринария, 2003. – № 4. – С. 21-24.
- Cavanagh D. Infectious Bronchitis. Diseases of Poultry / D. Cavanagh, J. Gelb // Diseases of Poultry. – Iowa, 2008. – P.117-135.
- Ignjatovic J. Isolation of a variant infectious bronchitis virus in Australia that further illustrates diversity among emerging strain / J. Ignjatovic, G. Gould, S. Sapats et al. // Arc. Virol, 2006. – Vol. 151. – Р. 1567-1585.
- Cavanagh D. Relationship between sequence variation in the S1 spike protein of infectious bronchitis virus and the extent of cross-protection in vivo / D. Cavanagh, M.M. Ellis, J.K. Cook // Avian Pathol. – 1997. – Vol. 26. – P.63-74.
- Alvarado I.R. Evaluation of the protection conferred by commercial vaccines against the California 99 isolate of infectious bronchitis virus / I.R. Alvarado, P.Villegas, J. El-Attrache et al. // Avian Diseases, 2003. – Vol. 47. – № 4. – Р. 1298–1304.
- Martin M.P. Evaluation of the effectiveness of two infectious bronchitis virus vaccine programs for preventing disease caused by a California IBV field isolate / M.P. Martin, P.S. Wakenell, P. Woolcock et al. // Avian Diseases, 2007. – Vol.51. –№ 2. – Р. 584–589.
- Terregino C. Pathogenicity of a QX strain of infectious bronchitis virus in specific pathogen free and commercial broiler chickens, and evaluation of protection induced by a vaccination programme based on the Ma5 and 4/91 serotypes / C. Terregino, A. Toffan, M. Serena Beato et al. // Avian Pathology, 2008. – Vol. 37. – № 5 – Р. 487–493
- Sharma J.M. Introduction to poultry vaccines and immunity /J.M. Sharma // Adv.Vet. Med, 1999. – Vol.41. – P.481-494.
- Penzes j. Z. Оценка протективных свойств аттенуированного штамма V1-1/96 вируса инфекционного бронхита (ИБК) против полевого штамма ИБК 793B у промышленных цыплят / Z. Penzes, j. Chacón, P. Soós, R. Glávits, A. Zolnai, N. Nógrády, V. Palya // РВЖ СХЖ, 2013. – №4. – С. 42-44.
- Исследование перекрестной защиты против вариантного штамма 793В вируса инфекционного бронхита кур при использовании различных сочетаний вакцин / Л. Стокер, С. Эндрюс, В. Вайменга, Т. Брю // РВЖ СХЖ, 2014. – № 3. – С. 34-35.
- Абдуллоев Х.С. Инфекционный бронхит кур генотипа QX / Х.С. Абдуллоев, В.В. Макаров // Сучасне птахiвництво, 2015. – № 5 (150), травень. – С. 25-30.
- Абдуллоев, Х.С. Инфекционный бронхит кур генотипа QX (обзор) / Х.С. Абдуллоев, В.В. Макаров // Птицеводство, 2015. – № 2. – С. 52-56.
- Джавадов Э.Д. Диагностика и профилактика новых инфекционных болезней птиц / Э.Д. Джавадов // Farm Animals. 2013. № 2 (3). С. 69-75.
- Каспарьянц С.А. Вакцина Пулвак IB Праймер против вариантных штаммов вируса инфекционного бронхита кур / С.А. Каспарьянц, А.Д. Чекмарев // Ветеринария, 2009. – № 1. – C. 15-16.
- Evaluation of the protection conferred by commercial vaccines and attenuated heterologous isolates in China against the CK/CH/LDL/97I strain of infectious bronchitis coronavirus / S. Liu et al // Vet. J, 2009. – Vol.179. – P.130-136.
- Protection of chickens after live and inactivated virus vaccination against challenge with nephropathogenic infectious bronchitis virus / B.S. Ladman, C.R Pope, A.F. Ziegler et al. // Avian Dis, 2002 – Vol.46. – P.938-944.
- Protection of chickens from infectious bronchitis by in ovo and intramuscular vaccination with a DNA vaccine expressing the S1 glycoprotein / D.R. Kapczynski, D.A. Hilt, D.P. Shapiro et al. // Avian Dis. – 2003. – Vol.47. – P.272-285.
- Transmission of infectious bronchitis virus within vaccinated and unvaccinated groups of chickens / J.J. De Wit, M. C. de John, A. Pijpers, J. H. Verheijden // Avian Pathol, 1998. – Vol.27. – P.464-471.
- Лашин А.В., Савинкова Е.В., Глотов С.В. Применение вакцины Пулвак IB QX для профилактики инфекционного бронхита кур в промышленном птицеводстве / А.В. Лашин, Е.В. Савинкова, С.В. Глотов // РВЖ СХЖ, 2014. – № 4. – С. 34.
- Efficacy and safety of an attenuated live QX-like infectious bronchitis virus strain as a vaccine for chickens / H.J. Geerligs et al. / Avian Pathol, 2011. – Vol.40. – P.93-102.
- Effects of infectious bronchitis virus (Arkansas strain) on laying chickens / M.A. Muneer, D.A. Halvorson, V. Sivanandan et al. // Avian Dis, 1986. – Vol.30. – P. 644-647.
- Breadth of protection of the respiratory tract provided by different live-attenuated infectious bronchitis vaccines against challenge with infectious bronchitis viruses of heterologous serotypes / J.K.A. Cook, S.J. Orbell, M.A. Woods, M.B Huggins // Avian Pathol, 1999. – Vol.28. – P.477-485.
- Finney P. M. Studies with a bivalent infectious bronchitis killed virus vaccine / P.M. Finney, P. G. Box, H. C. Holmes / Avian Pathol, 1990. – Vol.19. – P.435-450.
- Бахарева Н.В. Оценка протективных свойств вакцины «АВИВАК–ИБК»из штамма Н-120 / Н.В. Бахарева; С.Л. Козаков; А.Г. Кузовлева; С.Н. Норкина; Е.В. Терентьева // 20 лет на благо промышленного птицеводства. – Санкт-Петербург: Издательский дом «АВИВАК», 2010. – С. 30-32.
- Экви Б.П. Инфекционный бронхит кур / Б.П. Экви // РВЖ СХЖ, 2009. – № 2. – С. 31-32.
- Фролов С.В., Глейзер Д.А., Борисов А.В., Кулаков В.Ю., Чупина О.А. Антигенная активность инактивированных полиштаммных вакцин против инфекционного бронхита кур // Труды Федерального центра охраны здоровья животных. 2011. Т. 9. № 1. С. 148-154.
- Hofstad M.S. Avian Infectious Bronchitis / M.S. Hofstad // Diseases of Poultry (Editorial Committee of the American Association pathologists). — Iowa State University Press, Ames, IA, 1973. – 6th ed.
- Leerdam B. van. Интерпретация результатов Elisa для вируса инфекционного бронхита кур [Электронный ресурс] / B. van Leerdam, P. Kuhne // Ветеринария Кубани, 2009. — № 3. – Режим доступа: http://vetkuban.com/num3_20094.html
- Olson N.O. Reovirus Infection / N.O. Olson, M.S.Hofstad, et al. // Diseases of Poultry. – Ames, Iowa, Iowa State University Press, 1978 – 7th edition.
- Борисова И.А. Метапневмовирусная инфекция птиц / И.А. Борисова, А.В. Борисов // 25 лет на благо промышленного птицеводства. – Санкт-Петербург, 2015. – С. 51-55
- Емельянова С.А. Специфическая профилактика метапневмовирусной инфекции птиц инактивированной вакциной «АВИВАК-ПНЕВМО» / С.А. Емельянова, В.В. Борисов, И.П. Николаева, С.Н. Гаврилов // 25 лет на благо промышленного птицеводства. – Санкт-Петербург, 2015. – С. 48-51.
- Выявление и типирование метапневмовирусов птиц в Российской Федерации / З.Б. Хлебовец, А.С. Пронин, И.А. Борисова, С.К. Старов, В.В. Дрыгин // Труды Федерального центра охраны здоровья животных, 2007. – Т. 5. – С. 317-324.
- Пархомеко Л.И. Оценка эффективности вакцинации цыплят−бройлеров против пневмовирусной инфекции в эксперименте / Л.И. Пархоменко, Р.А. Дубин, М.Н. Коваленко // Ученые записки учреждения образования «Витебская ордена «Знак почета» государственная академия ветеринарной медицины», 49 (2013), 2-2, 90-91.
- Patnayak D.P. Experimental and field evaluation of a live vaccine against avian pneumovirus / D.P. Patnayak, M.A. Sheikh, B.R. Gulati et al. // Avian Pathol, 2002. – V.31. – P. 377–382.
- Patnayak D.P. Gold adapted avian pneumovirus for use as live, attenuated vaccine in turkeys / D.P. Patnayak, B.R. Gulati, M.A. Sheikh. et al. //Vaccine, 2003. – V.21. – P. 1371 – 1374
- Борисова И.А. Пневмовирусная инфекция птиц / И.А. Борисова, С.К. Старов // Труды Федерального центра охраны здоровья животных, 2006. – Т. 4. – С. 163-171.
- Антигенная специфичность и степень нейтрализации вакцинных штаммов метапневмовируса птиц / Б.Б. Трефилов, Л.Ю. Данко, В.С. Бочкарев, Н.В. Никитина // Ветеринарная практика, 2011. – № 1. – С.35-37.
- Cook J.K.A. A live attenuathed turkey rhinotracheitis virus vaccine. 2. The use of the attenuated strain as an experimental vaccine / J.K.A. Cook, H.C. Holmes, P.M. Finney [et al] // Avian Pathol, 1989. –V.18. –P. 523-534
- Cook J.K.A. Attenuation of turkey rhinotracheitis virus by alternative passage in embryonated chicken eggs and tracheal organ culturcs/ J.K.A. Cook, M.M. Ellis // Avian Pathol, 1990. –V. –19. -P. 181-185.
- Williams R.A. Development of a live attenuathed vaccine against turkey rhinotracheitis / R.A. Williams, C.E. Savage, R.C. Jones // Avian Pathol, –1991. – V.20. – P. 45–55.
- Pages-Mante A. Studies on swollen head syndrome in Spain / A. Pages-Mante // Proc. Seminar: New and Evolving Virus Dis. of Poultry, European Commission. – Brussels, 1994. – P. 89-109.
- Бессарабов Б. Методы борьбы с пневмовирусной инфекцией / Б. Бессарабов, А. Киселёв, Н. Сушкова // Животноводство России, 2015. – № S 1. – С. 15-16.
Волкова М.А. Оценка иммунного ответа цыплят на заражение изолятом метапневмовируса птиц / М.А. Волкова, А.В. Ирза, И.В. Бахчин, П.С. Ярославцева, Т.И. Ерошина // Труды Федерального центра охраны здоровья животных. 2015. Т. 13. №1. С. 113-123.
Напряженность и продолжительность иммунитета у цыплят, привитых инактивированной вакциной против метапневмовирусной инфекции птиц / А.С. Пронин, С.К. Старов, Н.И. Герасимова, М.Е. Качалова // Труды Федерального центра охраны здоровья животных, 2007. – Т. 5. – С. 380-385.
- Обоснование выбора подтипа пневмовируса птиц в качестве антигена инактивированной вакцины / А.С. Пронин, Н.И. Герасимова, М.А. Волкова, З.Б. Хлебовец, И.А. Борисова // Труды Федерального центра охраны здоровья животных, 2006. – Т. 4. – С. 188-191.
- Appearance of type B avian pneumovirus in Great Britain / C.J. Naylor, K. Shaw, P. Britton, D. Cavanagh // Avian Pathol, 1997. – Vol. 26. – P. 327-338.
- Инструкция по применению вакцины против метапневмовирусной инфекции птиц инактивированной эмульгированной: утв. заместителем Руководителя Россельхознадзора Е.А. Непоклоновым 28.12.2011 г.
- Ярославцева П.С. Разработка иммуноферментной тест-системы для определения антител к метапневмовирусу птиц подтипов А и В / П.С. Ярославцева, М.А. Волкова, Н.С. Мудрак // Российский ветеринарный журнал, 2015. – № 3. – Р. 16-18.
- Хохлачев О.Ф. Вакцинация – основа эпизоотического благополучия птицехозяйств /О.Ф. Хохлачев, А.Н. Калинин, С.Н. Гаврилов, Н.Ю. Серова Н. Ю. // 20 лет на благо промышленного птицеводства. – Санкт-Петербург: Издательский дом «АВИВАК», 2010. – С. 12-19.
- Лазуткина Е.А. Эпизоотологические особенности и эффективность специфической профилактики пневмовирусной инфекции (синдром опухшей головы) у цыплят-бройлеров: автореферат дис. … кандидата ветеринарных наук: 16.00.03 / Лазуткина Евгения Александровна; [Место защиты: Моск. гос. акад. ветеринар. медицины и биотехнологии им. К.И. Скрябина]. — Москва, 2009. – 20 с.
- Применение иммуномодуляторов продуктивным животным / А. В. Деева [и др.] // Ветеринария. — 2008. — № 6. – С. 8-12.
- Изучение динамики иммунного ответа после применения экспериментальной вакцины против гриппа и Ньюкаслской болезни птиц / А. С. Иголкин[и др.] // Ветеринарная патология. -2007. -No 4. –С. 152-154.
Мифтахутдинов А.В. Стрессовая чувствительность и физиологические особенности адаптации кур в условиях промышленного содержания : диссертация … доктора биологических наук : 03.03.01 / Мифтахутдинов Алевтин Викторович; [Место защиты: Казан. гос. акад. ветеринар. медицины им. Н.Э. Баумана].- Троицк, 2013.- 344 с.
