Титульный лист и исполнители
РЕФЕРАТ
Отчет 106 с., 4 ч., 80 рис., 22 табл., 90 источников, 2 прил.
ЦЫПЛЯТА-БРОЙЛЕРЫ, КОРМОВЫЕ АНТИБИОТИКИ, СТИМУЛЯТОРЫ РОСТА, ФИТОЭКСТРАКТЫ, ОРГАНИЧЕСКИЕ КИСЛОТЫ, ЭФИРНЫЕ МАСЛА, СОХРАННОСТЬ ПОГОЛОВЬЯ, ПРИРОСТ ЖИВОЙ МАССЫ.
Объектом исследования являлись цыплята-бройлеры, кормовые добавки.
Цель работы – изучить мясную продуктивность и обмен веществ у цыплят-бройлеров при дополнительном включении в рацион и при замене кормового антибиотика в составе комбикорма кормовой добавкой, включающей фитобиотики и защищенные органические кислоты.
Проведен научно-хозяйственный опыт и производственная проверка. В процессе выполнения работы изучены: живая масса подопытной птицы, сохранность поголовья, затраты корма на единицу продукции, мясная продуктивность бройлеров, развитие внутренних органов и качество мяса, переваримость и использование питательных веществ рациона цыплятами-бройлерами, обмен энергии, азота, кальция и фосфора, минерализация костной ткани цыплят-бройлеров, морфологический и биохимический состав крови птицы, морфогистологическое состояние внутренних органов цыплят-бройлеров. Определена экономическая эффективность работы.
Установлено, что использование кормовой добавки, включающей фитобиотики и защищенные органические кислоты в количестве 1 кг/т дополнительно к основному рациону и взамен кормового антибиотика в составе комбикорма для цыплят-бройлеров, является целесообразным с биологических и экономических позиций. При этом использование исследуемого препарата взамен кормового антибиотика показало наиболее выраженный биологический эффект.
ВВЕДЕНИЕ
Мировое и отечественное птицеводство – локомотив животноводства в производстве животного белка, это одна из самых динамично развивающихся отраслей [1,2,3]. Российское птицеводство занимает 4-е место в мировом рейтинге по производству мяса и 6-е место по производству яиц [4].
Во всем мире прослеживается тенденция к увеличению доли мяса птицы в общем объеме производства мясной продукции [5,6], что обусловлено, в первую очередь, более низкой себестоимостью производства и соответственно более низкой ценой реализации, в сравнении с говядиной или свининой.
Концепция развития птицеводства до 2020 года подразумевает увеличение отечественного производства мяса птицы до 4,5 миллионов тонн в убойной массе к 2020 году [7,8]. Для обеспечения высоких темпов производства мяса необходимо использовать последние достижения в области селекции, кормления, технологии содержания и ветеринарной защиты [9,10].
На сегодняшний день, в условиях современного промышленного птицеводства на одну из ведущих позиций выходит проблема сохранения здоровья животных при минимальном использовании антибактериальных препаратов [11].
В странах Европейского союза и США планомерное запрещение кормовых антибиотиков началось с 1999 года. Причиной данного решения послужило беспокойство о том, что устойчивость к антибиотикам, которая развивается в у животных, может быть передана патогенным бактериям, поражающим человека [12]. Большое количество исследований было сосредоточено на разработке альтернативных кормовым антибиотикам средств. Потенциал различных доступных альтернатив для повышения продуктивности животных и реализации генетического потенциала птицы огромен. Благотворное воздействие многих из разработанных альтернатив было хорошо продемонстрировано. Общее мнение состоит в том, что эти продукты не имеют последовательности, и результаты сильно варьируются от предприятия к предприятию. Кроме того, необходимо более четко определить спектр действий альтернативных антибиотикам форм. Оптимальное сочетание различных альтернатив в комбинации с хорошими методами управления и ведения производства будет ключом к улучшению производительности и поддержанию продуктивности животных [13].
Российские ученые за последние годы накопили колоссальный опыт в применении альтернативных кормовым антибиотикам биологически активных добавок в рационах птицы и установили, что применение кормовых антибиотиков в профилактических целях может повлечь за собой нежелательные последствия. А именно, накопление их в продуктах птицеводства до уровня, превышающего биологическую безопасность, снижение качества продукции, отрицательное влияние на иммунитет человека, использующего в своем питании продукты птицеводства, содержащие избыточное количество антибиотических препаратов [14]. Так же использование антибиотиков в целях профилактики приводит к нарушению баланса микрофлоры кишечника, а, следовательно, к снижению иммунитета, оказывает негативное влияние на состояние внутренних органов. Кроме всего прочего, существует опасность возникновения антибиотикорезистентных штаммов опасных микроорганизмов, устойчивых к ростостимулирующим антибиотикам, что в совокупности со сниженным иммунным статусом, представляет огромную опасность и последствия могут быть тяжелыми. В дополнении, при применении антибиотиков, их остаточные вещества переходят в животноводческую продукцию и попадают на стол человека. И что немаловажно – на вирусные формы микроорганизмов антибиотики не действуют [15].
Принимая во внимание важную роль нормального кишечного бактериального биоценоза для сохранения здоровья, а также мощного негативного воздействия антибиотиков на состояние кишечной микрофлоры в организме, необходимо принципиально пересмотреть стратегию подбора кормовых средств при выращивании птицы [16].
Недостаточную эффективность использования антибиотиков в птицеводстве констатируют многие специалисты. Так, например, сотрудники Нижегородского научно – исследовательского института эпидемологии и микробиологии им. акад. И.Н. Блохиной отмечают тот факт, что сложная экологическая обстановка, несбалансированность питания способствуют распространению на птицефабриках кишечных инфекций: сальмонеллеза, колибактериоза, листериоза. Гибель поголовья при этом наносит значительный ущерб от потерь и снижения продуктивности птицефабрик. Применение антибиотиков в этом случае малоэффективно и экологически небезопасно [17]. Стимуляторы роста, несмотря на свою большую специфичность, достаточно эффективны исключительно при точном соблюдении разработанных инструкций. При несоблюдении условий, антибиотические препараты проявляют слабый эффект, а иной раз, могут нанести вред.
Лишь в марте 2018 года, после осознания ущерба, наносимого ростостимулирующими добавками, Россельхознадзор ввел усиленный режим лабораторного контроля над продукцией предприятий, производящих птицеводческую продукцию. Ужесточение контроля качества отечественной продукции вынуждает сельхозпроизводителей пересмотреть подходы ко многим технологическим процессам и управленческим решениям. Среди которых, важным оказывается усиленный контроль над остаточным содержанием антибиотиков в готовой продукции. Более того, рано или поздно российским производителям птицеводческой продукции придется начать играть по общим мировым правилам. В связи с этим освоение препаратов, являющихся альтернативой кормовым антибиотикам сейчас является наиболее логичным шагом, и пора задуматься о переходе на технологии выращивания без использования антибиотиков. Учитывая опыт западных компаний и тенденции рынка, можно утверждать, что будущее за продукцией без антибиотиков [18].
Одним из методов решения данного вопроса является использование различных кормовых средств, способных заменить кормовые антибиотики в рационах птицы [19,20,21,22,23].
Считается, что оптимизация здоровья кишечника продуктивных животных будет одним из основных предметов для обсуждения в последующие годы. При этом, наряду с уже зарекомендовавшими себя пробиотиками и пребиотиками, препаратами с сорбционным действием, следует обратить внимание на использование с этой целью биопрепаратов на основе ароматических добавок, эфирных масел, фитоэкстрактов и защищенных форм органических кислот. В настоящее время установлено, что многие компоненты фитоэкстрактов и эфирных масел обладают антибактериальной активностью.
В итоге, использование фитоэкстрактов и эфирных масел с защищенными органическими кислотами с антибактериальным эффектом препятствует развитию многих заболеваний желудочно-кишечного тракта, что серьезно сказывается на сохранности и продуктивности поголовья. Кроме того, фитобиотики преобразуя баланс кишечной микрофлоры и стимулируя рост полезной микробиоты, улучшают всасывание питательных веществ, подавляют рост и развитие патогенных бактерий, при этом активизируется перистальтика кишечника, что приводит к увеличению сохранности цыплят и среднесуточных приростов.
Немаловажным является тот факт, что, эти соединения оказывают совокупное стимулирующее воздействие на организм птицы и, кроме противомикробного эффекта, повышают антистрессовое влияние кормов, усиливают секрецию слюны, пищеварительных ферментов, что в конечном итоге приводит к увеличению темпов производства продукции птицеводства [24].
В нашей стране пока нет серьезных ограничений по использованию антибиотиков. Оно регламентировано, установлен перечень разрешенных к применению в животноводстве антибиотиков, однако по целому ряду причин их применяют бессистемно, с нарушениями инструкций. Все это отрицательно сказывается на качестве и безопасности продуктов питания, что диктует необходимость внедрения альтернативных методов профилактики заболеваний животных и птицы.
Цель исследования – изучить мясную продуктивность и обмен веществ у цыплят-бройлеров при дополнительном включении в рацион и при замене кормового антибиотика в составе комбикорма кормовой добавкой, включающей фитобиотики и защищенные органические кислоты.
Исходя из цели исследования, поставлены следующие задачи:
- изучить влияние кормовой добавки, включающей фитобиотики и защищенные органические кислоты, на динамику живой массы подопытной птицы и сохранность поголовья;
- оценить влияние введения в рацион экспериментальной добавки на мясную продуктивность, развитие внутренних органов, качество мяса цыплят-бройлеров;
- определить переваримость питательных веществ рациона цыплятами-бройлерами, обмен энергии, обмен азота при использовании изучаемой кормовой добавки;
- изучить влияние исследуемого препарата на обмен кальция и фосфора и минерализацию костной ткани цыплят-бройлеров;
- определить различия морфологического и биохимического состава крови птицы при скармливании изучаемого препарата;
- изучить влияние экспериментальной кормовой добавки на морфогистологическое состояние внутренних органов цыплят-бройлеров;
- определить экономические показатели производства мяса бройлеров при замене кормового антибиотика в составе комбикорма экспериментальной кормовой добавкой;
- апробировать в производственной проверке результаты научно-хозяйственного опыта.
Научная новизна исследований. Впервые в сравнительном исследовании научно обоснованы резервы повышения продуктивных качеств, естественной резистентности мясной птицы за счет применения в составе комбикорма дополнительно и взамен кормовых антибиотиков кормовой добавки, включающей фитобиотики и защищенные органические кислоты. Получены новые данные о влиянии изучаемого кормового фактора на мясную продуктивность, сохранность поголовья, качество мяса, минерализацию костной ткани, переваримость и использование питательных веществ корма, обмен энергии, морфо-биохимические показатели крови, гистологическое состояние внутренних органов, экономические показатели.
Теоретическая и практическая значимость работы. Теоретическая значимость работы определяется углублением знаний об обмене веществ в организме бройлеров при использовании в составе комбикорма взамен кормовых антибиотиков кормовой добавки, включающей фитоэкстракты, эфирные масла, защищенные органические кислоты.
Практическая значимость работы заключается в том, что на основе экспериментального материала разработаны научно-практические рекомендации птицеводческим предприятиям, занимающихся производством мяса цыплят-бройлеров, по использованию альтернативных кормовым антибиотикам безопасных стимуляторов роста, с целью повышения продуктивности мясной птицы и качества продукции.
1 БИОЛОГИЧЕСКИ АКТИВНЫЕ ДОБАВКИ, КАК АЛЬТЕРНАТИВА КОРМОВЫМ АНТИБИОТИКАМ
Начало применения кормовых антибиотиков в птицеводстве кардинально изменило ветеринарную медицину. Антибиотики позволили успешно бороться со многими инфекциями и кишечными расстройствами, неизбежными в промышленном птицеводстве. Они заметно улучшили приросты, конверсию корма и повысили сохранность поголовья птицы. На протяжение многих лет кормовые антибиотики доказали свою безусловную зоотехническую эффективность [25,26].
Однако в постоянном применении антибиотиков в комбикормах присутствуют серьёзные минусы – растет число возбудителей болезней, приобретающих устойчивость к антибактериальным терапевтическим средствам. Особенно тревожным считается тот факт, что все больше возбудителей приобретают устойчивость сразу к нескольким видам антибиотиков.
Доказано, что столь широкое применение антибиотиков в животноводстве и в птицеводстве определенно связано с резистентностью к лекарствам, возникающей у людей [24].
Среди потребителей во всем мире растет спрос на продукцию, не содержащую вредных веществ, в том числе антибиотиков, пестицидов и консервантов.
Как известно страны ЕС давно ушли от применения кормовых антибиотиков в выращивании сельскохозяйственных животных и птиц, замещая их кормовыми добавками, направленными на поддержание в первую очередь здоровья кишечника и соответственно тем самым снижая уровень патогенов в нем. В данном случае альтернативной могут служить: энзимы, органические кислоты и их соли, пробиотики и пребиотики, а также различные экстракты эфирных масел, различных специй и трав.
В настоящее время, в связи со сложной экономической и политической ситуацией в России, отечественный мясной рынок находиться в точке насыщения. В связи с этим, для поддержания рентабельности своего производства все большее количество российских производителей ищут новые рынки сбыта своей продукции и рассматривают вариант экспорта за рубеж. А для этого необходимо полностью исключить применение кормовых антибиотиков в производстве своей продукции. Поэтому уже сегодня российские производители начинают постепенно отказываться от запрещенных в ЕС препаратах и ищут новые альтернативные пути.
Ферментные комплексы на НПС (некрахмалистые полисахариды). Некрахмалистые полисахариды (НПС) связывают воду и образуют комплексы с питательными веществами. Это в свою очередь повышает вязкость содержимого кишечника и снижает скорость прохождения химуса. Замедляется проникновение в него эндогенных ферментов, а также диффузия и всасывание питательных веществ. Увеличивается объем потребления воды и, соответственно, масса помета. В конечном счете, ухудшается конверсия корма. Желеподобная пищевая масса, поступая из верхних в нижние отделы кишечника, может служить субстратом для обитающих там микроорганизмов, в том числе патогенных. Особенно пагубно повышение вязкости сказывается на развитии молодняка.
Ферменты могут проявлять непрямую (косвенную) эффективность в качестве альтернативы антибиотическим стимуляторам роста. Они расщепляют питательные вещества в верхних отделах кишечника, в нижних отделах остается меньше питательного субстрата для патогенов, и в результате количество последних уменьшается [27].
Маннановые олигосахариды. Одной из альтернатив замещения кормовых антибиотиков являются стенки инактивированных дрожжевых клеток Saccharomyces сerevisiae, обладающие пребиотическим действием. Выраженный биологический эффект препаратов по всей видимости обусловлен формированием здорового микробиоценоза в желудочно-кишечном тракте бройлеров и прямым снижением депонирования токсичных агентов за счет сорбционных свойств добавок. Здоровая микробиота пищеварительного тракта способна обеспечить высокую резистентность к колонизации кишечника патогенами [28,29] благодаря синтезу ими летучих жирных кислот (ЛЖК), бактериоцинов и других, сдерживающих рост и развитие патогенных видов соединений [30,31]. Известно, что взаимодействуя между собой, а также с организмом хозяина, микроорганизмы способны оказывать глубокое воздействие не только на иммунитет и неспецифическую резистентность к инфекциям, но и на общие процессы жизнедеятельности птицы [32]. Кроме того, микробное сообщество кишечника птиц способно принимать активное участие в пищеварительных процессах при расщеплении сложных полисахаридов и белков [33], в использовании и образовании питательных веществ, синтезе витаминов [34,35], развитии ворсинок кишечника, увеличивающих всасываемую поверхность [36,37].
Saccharomyces сerevisiae — это организм “эукариот” с одним ядром. Стенки инактивированных дрожжевых клеток Saccharomyces сerevisiae состоят из внутриклеточного экстракта: цитоплазмы, органеллы и клеточной оболочки (мананоолигосахариды и b- глюканы). Структура клеточной стенки зависит от штамма и условий процесса ферментации дрожжевой культуры. Действие мананнов и b-глюканов улучшает здоровье кишечника и иммунной системы являясь альтернативой кормовым антибиотикам. Фимбрии бактериальных клеток (Грамм-) сходны по строению с мананном. Следовательно, мананны способны связывать эти патогены и выводить их из организма. B-глюканы значительно увеличивают количество бокаловидных клеток. Бокаловидные клетки в свою очередь увеличивают выработку количества муцина, который является защитным барьером от патогенов, а также сокращает межклеточное расстояние между ворсинками, тем самым улучшая морфологию слизистой кишечника.
Различными авторами показано, что использование препаратов на основе клеточных стенок дрожжей в кормлении птиц благотворно влияет на обменные процессы в организме птиц, сопровождаясь повышением продуктивных показателей [38,39,40,41,42,43].
Подкислители (препараты на основе органических кислот). Одними из наиболее эффективных средств борьбы с микроорганизмами и грибами являются короткоцепочечные органические кислоты. Бактерицидное и фунгицидное действие органических кислот определяет универсальность их применения [44]. Кроме того, органические кислоты являются естественными метаболитами и бесследно ассимилируются в организме животного, принося ему пользу в виде дополнительной энергии. Перечисленные свойства органических кислот сделали их одними из наиболее популярных средств в животноводстве и птицеводстве последнего времени [45,46,47,48,49].
Кроме задач улучшения и сохранения качества кормов после десяти лет интенсивных исследований в Европе и в США подкислители шире стали применять для профилактики различных заболеваний, подготовки питьевой воды. С подтверждением антибактериальных свойств многих препаратов, стабилизирующих деятельность желудочно-кишечного тракта, улучшающих пищеварение и конверсию корма, подкислители стали рассматривать как замену кормовым антибиотикам.
При внесении препаратов органических кислот в воду и корма достигаются сразу несколько эффектов – улучшаются вкусовые показатели (подкисление), уменьшается бактериальная нагрузка на поголовье, предотвращается развитие патогенной микрофлоры (Campylobacter, Salmonella, Pseudomonas, E. coli), снижается буферная емкость кормов, снимаются симптомы диареи и диспепсии (особенно это важно для поросят при отъеме и смене рациона, во время стрессов у птиц и животных).
В исследовании Околеловой Т. М. и Кочнева Ю. А., показано, что применение органических кислот и кормового антибиотика, совместно, либо по отдельности, положительно влияет на продуктивность птицы [50].
Современные исследования показали, что кормовые добавки на основе органических кислот и их солей являются эффективными и наиболее безопасными с точки зрения влияния на здоровье животных и человека средствами борьбы с патогенной микрофлорой как в кормах, так и в сырье для их производства. Поэтому использование продуктов на основе органических кислот — это современный способ предотвращения инфекционных заболеваний сельскохозяйственных животных и, как следствие, человека.
Микроорганизмы, включаемые непосредственно в корм (пробиотики). Под термином «пробиотик» подразумевают биологические препараты, пищевые и кормовые добавки, основу которых составляют живые микроорганизмы, являющиеся представителями микрофлоры человека или животных (бифидобактерии, лактобактерии, эшерихии, энтерококки), а также не являющиеся представителями индигенной микрофлоры, но способствующие её размножению (дрожжи, апатогенные бактерии рода Bacillus) [51,52].
Живые культуры дрожжей и молочнокислых бактерий заселяют ЖКТ (желудочно-кишечный тракт) животных и выделяют антимикробные вещества, тем самым, предотвращая развитие патогенной микрофлоры и нормализуя процессы пищеварения [53,54,55]. Молочнокислые бактерии выделяют органические кислоты, которые с одной стороны снижают рН до такого уровня, при котором патогенные микроорганизмы не живут, а с другой стороны обладают непосредственным бактерицидным эффектом. В таких условиях происходит заселение ЖКТ полезными лактобактериями и вытеснение патогенной микрофлоры. Живые культуры дрожжей растут в анаэробных условиях пищеварительной системы, регулируя метаболизм других микроорганизмов, и модифицируют кислотность желудка, предотвращая ацидозы и стимулируя увеличение потребления сухой массы, регулируют количество выделяющегося в результате обмена веществ кислорода, предотвращают образование аммиака и метана. Дрожжи богаты ферментами (глюконаза, амилаза, липаза и протеаза), аминокислотами, жирными кислотами, комплексом витамина B и факторами роста, которые могут увеличивать количество и стимулировать действие целлюлолитических и других важных анаэробных бактерий. Это улучшает усвояемость клетчатки. Дрожжи вырабатывают антимикробные вещества, включая ацидолин, ацидофилин, лактолин, низин и перекись водорода [56].
Пробиотики не только не уступают кормовым антибиотикам, но даже более предпочтительны [57].
Пробиотики из бацилл проявляют антагонизм даже в отношении патогенных штаммов, утративших чувствительность к антибиотикам. Бациллы продуцируют не отдельные антибиотики, а «семейства» пептидных антибиотиков, сходных по базовой структуре, но отличающихся по концевым группировкам. Поэтому к споровым пробиотикам, в отличие от антибиотиков, не возникает привыкания. Преимуществами споровых пробиотиков перед антибиотиками являются также возможность получения экологически чистой и вкусной продукции, отсутствие побочных реакций со стороны животного, поддержание иммунитета и нормальной микрофлоры кишечника [58,59,60,61].
Данные литературы свидетельствуют о многогранном воздействии пробиотиков на различные физиологические, биохимические и продуктивные показатели птицы [62,63,64,65,66,67,68].
Фитобиотики (ароматические добавки, эфирные масла, фитоэкстракты). В последние десятилетия лекарственные растения и их компоненты, в частности эфирные масла, представляют интерес с точки зрения естественных альтернатив для замены кормовых антибиотиков, поскольку они обладают противомикробными, противогрибковыми, противопаразитарными и противовирусными свойствами [69]. Установлено, что многие эфирные масла проявляют биологическую активность в отношении патогенных агентов [70,71,72], в качестве основного средства борьбы с которыми используют в настоящее время антибиотики. Также эфирные масла усиливают секрецию пищеварительных соков, стимулируют кровообращение, оказывают антиоксидантные свойства и могут повышать иммунный статус [73,74].
Фитобиотики оказывают положительное действие за счет следующих факторов: стимулирование приема пищи и пищеварительных секретов; противомикробная и кокцидиостатическая активность; стимуляция иммунной системы; антиоксидантная активность [75].
Капсаицин – основное действующее соединение, выделенное из перца и родственных ему растений, является не только противовоспалительным средством, но и стабилизатором процесса пищеварения.
Танины — дубильные вещества коры дуба и некоторых других растений обладают бактерицидным эффектом, воздействуя на протеины в нерастворимых соединениях. Кроме того, танины воздействуют на ворсинки слизистой оболочки кишки и помогают при расстройствах кишечника.
Масло перечной мяты оказывает дезинфицирующее воздействие при процессах разложения в желудочно-кишечном тракте, способствует образованию желчных кислот и является желчегонным. Также можно отметить, антиоксидантные свойства и способность стимулировать выделение слюны и желудочного сока.
Анетол и тимол – основные действующие вещества, присутствующие в тимьяне являются стимуляторами пищеварения, прекрасными антисептиками и антиоксидантами и имеют широкое антибактериальное действие.
Карвакрол — составляющее эфирного масла душицы (в нем содержится и тимол) обладает антисептическим свойством. Отмечена эффективность против Escherichia coli, Staphylococcus aureus, Salmonella typhimurium, Pseudomonas aerogiosa, Listeria monocytogenes, а также антигрибковая активность против нескольких видов Candida sp., и против Cryptococcus neoformans. Многочисленные исследования продемонстрировали эффективность карвакрола, в частности увеличения показателей продуктивности, снижении затрат корма, а также снижение риска развития различных заболеваний животных [76].
Карвакрол и тимол, также, оказывают воздействие на верхний слой клеток слизистой оболочки кишечника, пораженных внутриклеточными патогенами. Обновление внешнего слоя слизистой кишечника у животных проходит каждые 48 – 72 часа. Феноловые соединения, ускоряют этот процесс. Это приводит к улучшению абсорбции и усвоения питательных веществ и, как следствие, быстрому росту животного. Кроме того, ускоренное обновление слизистой кишечника лишает кокцидий (и других патогенов) среды для существования в итоге прерывается цикл развития кокцидий.
В целом использование фитоэкстрактов и эфирных масел с антибактериальным эффектом препятствует развитию многих кишечных инфекций, что серьезно сказывается на сохранности и продуктивности поголовья. Кроме того, эти соединения оказывают комплексное ростостимулирующее воздействие на организм животного и кроме антибактериального эффекта повышают привлекательность кормов, обладают антистрессовым действием, повышают секрецию слюны, пищеварительных ферментов [77], а также улучшают настроение животных.
Использование альтернативных методов контроля патогенной микрофлоры вполне реально может позволить российским производителям выпускать экологически безопасную продукцию.
Однако необходимо понимать, что только одной кормовой добавкой невозможно в полной мере заменить кормовые антибиотики, в данном случае, необходимо разрабатывать комплексные программы замещения кормовых антибиотиков при выращивании и содержании сельскохозяйственных животных.
Антибиотики, используемые в животноводстве, по данным ведущих экспертов, занимают прочную позицию на российском рынке ветеринарных препаратов. Однако общемировые тенденции, направленные на решение проблемы развития резистентности у людей и животных, уже начинают изменять структуру рынка, смещая акценты на антибиотикозамещение [78].
2 ХАРАКТЕРИСТИКА КОРМОВОЙ ДОБАВКИ, ВКЛЮЧАЮЩЕЙ ФИТОБИОТИКИ И ЗАЩИЩЕННЫЕ ОРГАНИЧЕСКИЕ КИСЛОТЫ
Экспериментальная кормовая добавка, представляет собой порошок светло-коричневого цвета со специфическим запахом. В состав препарата входят: эфирные масла, защищенные органические кислоты (фумаровая кислота, сорбиновая кислота, DL-яблочная кислота, лимонная кислота), экстракт жгучего перца, носитель – карбонат кальция и пшеничная мука.
Биологическое действие добавки обусловлено входящими в ее состав биологически активными веществами.
Эфирные масла и присутствующие в них карвакрол, тимол и эвгенол в составе препарата благодаря антибактериальным, противовоспалительным и антиоксидантным свойствам препятствуют развитию патогенной микрофлоры в корме и желудочно-кишечном тракте птицы, повышают секрецию желудочного сока и способствуют лучшей перевариваемости корма, они эффективны против E. coli, Salmonella thyphimurium, Listeria monocytognes, Staphylococcus aureus и др.
Экстракт жгучего перца и содержащийся в нем капсаицин стимулирует выработку ферментов в желудке и поджелудочной железе, что приводит к лучшему перевариванию и усвоению питательных веществ.
Защищенные органические кислоты, в том числе, фумаровая, сорбиновая, DL-яблочная кислота – обладают подкисляющим действием, работают в синергизме с эфирными маслами: эфирные масла повреждают клеточные мембраны бактериальных клеток, органические кислоты за счет снижения рН закисляют среду клетки и нарушают ее метаболизм, прекращая размножение (бактериостатический эффект).
Добавку вводят в комбикорм на комбикормовых заводах или в кормоцехах хозяйств, используя существующие технологии ступенчатого смешивания.
Принимая во внимание ростостимулирующий эффект кормовой добавки, включающей фитобиотики и защищенные органические кислоты, и не способность накапливаться в мясе представляло интерес изучить данный препарат в качестве альтернативного источника замены кормовым антибиотикам в рационе цыплят-бройлеров.
3 ЭФФЕКТИВНОСТЬ ЗАМЕНЫ КОРМОВОГО АНТИБИОТИКА В СОСТАВЕ КОМБИКОРМА КОРМОВОЙ ДОБАВКОЙ, ВКЛЮЧАЮЩЕЙ ФИТОБИОТИКИ И ЗАЩИЩЕННЫЕ ОРГАНИЧЕСКИЕ КИСЛОТЫ
3.1 МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЙ
Экспериментальная часть работы выполнялась в производственных условиях ОАО «Птицефабрика «Среднеуральская» на цыплятах бройлерах кросса «Росс 308» в 2019 году.
Технологические параметры содержания цыплят-бройлеров в ходе эксперимента соответствовали рекомендациям, разработанным в ОАО «Птицефабрика «Среднеуральская» для данного кросса, и были одинаковыми для всех подопытных групп. Вся птица подвергалась ветеринарной обработке согласно схеме профилактических мероприятий, принятой на предприятии. Птицефабрика на момент проведения исследований была благополучна по инвазионным и инфекционным заболеваниям.
Согласно схеме научно-хозяйственного опыта (табл. 1) в суточном возрасте было сформировано 3 группы цыплят-бройлеров со средней живой массой 43 г.
Таблица 1 — Схема проведения научно-хозяйственного опыта
| Группа | Количество
голов |
Условия кормления |
| Контрольная | ♂ 80
♀ 80 |
Основной рацион (ОР) — комбикорм с питательностью, соответствующей рекомендациям для кросса.
В состав ОР был включен кормовой антибиотик: с 1-го по 21-й день выращивания — Альбацин в количестве 300 г/т комбикорма и с 22-го по 30-й день Нозигептид – 250 г/т комбикорма |
| 1 опытная | ♂ 80
♀ 80 |
ОР+ кормовая добавка, включающая фитобиотики и защищенные органические кислоты, в количестве 1 кг/т комбикорма.
Период использования: с 1-го дня выращивания и до конца периода откорма |
| 2 опытная | ♂ 80
♀ 80 |
Опытный рацион — кормовой антибиотик в ОР заменен на кормовую добавку, включающую фитобиотики и защищенные органические кислоты, в количестве 1 кг/т комбикорма.
Период использования: с 1-го дня выращивания и до конца периода откорма. |
Формирование групп для научно-хозяйственного и физиологического опытов, а также научные основы исследования осуществлялись в соответствии с рекомендуемыми методиками ФНЦ «ВНИТИП» РАН (2013). Кормление птицы осуществлялось полнорационными комбикормами и включало 4 фазы в зависимости от возраста птицы: стартовая (1-10 день), ростовая 1 (11-20 день), ростовая 2 (21-30 день) и финишная (31-38 день). Птица была разделена по полу. Петушки (80 голов) и курочки (80 голов) в ходе исследований содержались в разных клетках. Эксперимент продолжался в течение всего периода выращивания.
Контрольная группа получала основной рацион (ОР), принятый в хозяйстве, с питательностью, соответствующий рекомендациям для кросса. В состав ОР с 1-го по 21-й дни выращивания цыплят-бройлеров был включен кормовой антибиотик Альбацин в количестве 300 г/т комбикорма, а с 22-го по 30-й дни выращивания — кормовой антибиотик Нозигептид — 250 г/т комбикорма. Цыплятам 1 опытной группы дополнительно к ОР с 1-го дня выращивания и до конца периода откорма включали исследуемую кормовую добавку в количестве 1 кг/т комбикорма. В рационе бройлеров 2 опытной группы кормовой антибиотик был заменен на экспериментальный препарат в количестве 1 кг/т комбикорма.
В ходе проведения опыта учитывались следующие показатели:
- Зоотехнические показатели.
- Живая масса. Для учета живой массы проводилось индивидуальное взвешивание птицы: каждые 7 дней выращивания.
- Сохранность поголовья. Ежедневно учитывался падеж цыплят-бройлеров, в конце периода выращивания по конечному поголовью был произведен расчет сохранности.
- Исходя из зоотехнических показателей продуктивности, велся расчёт европейского индекса продуктивности (ЕИП). ЕИП – показатель, применяемый в мировой практике для оценки продуктивных качеств цыплят-бройлеров, определяемый отношением основных продуктивных качеств (живая масса, умноженная на сохранность, деленные на дни выращивания, умноженные на затраты корма на 1 кг прироста), умноженным на 100.
- Для определения переваримости питательных веществ, баланса азота, кальция и фосфора, был проведен балансовый (физиологический) опыт. Для этого в возрасте 28 дней были отобраны по 5 средних, для своей группы, по живой массе петушков-бройлеров. Опыт проводился в соответствии с рекомендуемыми методиками ФНЦ «ВНИТИП» РАН (2013) [79]. Отобранный помёт и комбикорм гомогенизировался и анализировался в аналитической лаборатории «Уральский НИИСХ» — филиале ФГБНУ УрФАНИЦ УрОРАН.
Анализ корма и помета проводили по общепринятым методикам:
— содержание общего азота – по методу Кьельдаля (или Дьякову), ГОСТ Р.51417-99 (%);
— содержание массовой доли сырого жира – методом экстракции, ГОСТ13496.15-97 (%);
— содержание массовой доли сырой клетчатки – удалением из продукта кислото-щелоче-растворимых веществ и определением сырой клетчатки, ГОСТ 13496.2-97(%);
— содержание сырой золы – гравиметрическим методом, ГОСТ 26226-95 (%);
— содержание кальция – атомно-абсорбционным методом, ГОСТ 26570-95 (%);
— содержание фосфора – фотометрическим методом, ГОСТ 26657-97 (%).
- Анатомическая разделка тушек птицы проводилась согласно методике ФНЦ «ВНИТИП» РАН (2013). Для этого, в конце периода выращивания, было отобрано по 3 петушка-бройлера из каждой группы со средней живой массой по группе. Убой проводился методом декапитации.
- При проведении анатомической разделки от каждой тушки петушка- бройлера были отобраны большеберцовые кости и образцы мышечной ткани. Проанализирован их химический состав. В костях определяли количество кальция, фосфора, сырой золы. В мышечной ткани – количество сырого белка, сырого жира, сырой золы.
- Для исследования наличия в мясе бактерий рода Listeria monocytogenes, бактерий рода сальмонелла и количества мезофильных аэробных и факультативно-анаэробных микроорганизмов были отобраны замороженные тушки цыплят-бройлеров 38 дневного возраста, по 3 штуки из каждой группы. Исследование проводилось в испытательной лаборатории государственного бюджетного учреждения Свердловской области «Свердловская областная ветеринарная лаборатория». Наличие бактерий рода Listeria monocytogenes оценивалось по ГОСТ 32031-2012 «Продукты пищевые. Методы выявления бактерий Listeria monocytogenes», наличие бактерий рода сальмонелла — по ГОСТ 31468-2012 «Мясо птицы, субпродукты и полуфабрикаты из мяса птицы. Метод выявления сальмонелл», количество мезофильных аэробных и факультативно-анаэробных микроорганизмов определялось по ГОСТ 7702.2.1-2017 «Продукты убоя птицы, продукция из мяса птицы и объекты окружающей производственной среды. Методы определения количества мезофильных аэробных и факультативно-анаэробных микроорганизмов».
- В 38 дневном возрасте у трех средних по группе петушков-бройлеров, путем декапитации была отобрана кровь для определения морфологических и биохимических показателей. Из морфологических показателей крови определяли: содержание эритроцитов, гематокрита (отношение эритроцитов к общему объему крови), гемоглобина, среднее содержание гемоглобина в одном эритроците, количество лейкоцитов, лейкоцитарный профиль (лимфоциты, моноциты, эозинофилы, базофилы), СОЭ. Из биохимических показателей в сыворотки крови изучали: содержание общего белка, количество альбуминов, глобулинов, альбуминово/глобулиновый индекс, уровень мочевины, креатинина, мочевой кислоты, содержание глюкозы, холестерина, триглицеридов, уровень ферментов аланинаминотрансферазы (АЛАТ) и аспартатаминотрансферазы (АСАТ), содержание кальция, фосфора, калия, натрия, хлора. Исследование крови проводилось в МАУ Клинико-диагностический центр г. Екатеринбурга. Морфологическое исследование крови осуществлялось в лаборатории гемостаза, на автоматическом анализаторе ADVIA 120, производства фирмы BAYER, а также ручным подсчетом форменных элементов в камере Горяева. Биохимический анализ проводился в клинико-диагностической лаборатории на анализаторе Vitros 350 (Ortho-Clinical Diagnostic, США).
- Для проведения морфогистологических исследований были взяты образцы органов птиц от 3 голов из каждой группы. Материал фиксировали в 10-% растворе нейтрального формалина. Изучение общих структурных изменений в органах проводили на парафиновых срезах, препараты окрашивали гематоксилином и эозином по общепринятой методике. Все гистологические исследования документировались фотографированием на микроскопе.
На основании результатов научно-хозяйственного опыта была рассчитана экономическая эффективность использования изучаемой кормовой добавки с учетом цен на 2019 год.
Для производственной проверки результатов научно-хозяйственного опыта было сформировано три группы цыплят-бройлеров, размещающихся в трех корпусах птицефабрики: контрольный корпус — базовый вариант (37120 гол), новый-1 вариант (37760 гол) и новый-2 вариант (38280 гол). Условия кормления птиц при проведении производственной проверки соответствовали таковым при проведении научно-хозяйственного опыта: базовый вариант – основной рацион (ОР) — комбикорм с питательностью, соответствующей рекомендациям для кросса. В состав ОР с 1-го по 21-й дни выращивания цыплят-бройлеров был включен кормовой антибиотик Альбацин в количестве 300 г/т комбикорма, а с 22-го по 30-й дни выращивания — кормовой антибиотик Нозигептид — 250 г/т комбикорма. Новый 1 вариант — дополнительно к ОР с 1-го дня выращивания и до конца периода откорма включали исследуемую кормовую добавку в количестве 1 кг/т комбикорма. Новый 2 вариант — кормовой антибиотик в ОР был заменен на изучаемый кормовой компонент в количестве 1 кг/т комбикорма.
Основные экспериментальные данные обработаны методом вариационной статистики с использованием ПК “Microsoft Excel”. Оценку статистической значимости различий между группами проводили с помощью t-критерия Стьюдента.
Акты проведения научно-хозяйственного опыта и производственной проверки представлены в приложении А и приложении В соответственно.
3.2 РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
3.2.1 Зоотехнические показатели продуктивности цыплят бройлеров
Динамика живой массы является одним из важнейших показателей, характеризующих полноценность кормления птицы и состояния здоровья. В ходе опыта взвешивание цыплят проводилось еженедельно. Анализ динамики живой массы проводили в соответствии с половой принадлежностью.
В таблице 2 представлена динамика живой массы петушков-бройлеров.
В 7 дней живая масса петушков контрольной группы составляла 149,4 г, в 1 и 2 опытных группах данный показатель был достоверно выше (Р≤0,001) на 14 и 22% соответственно.
В 14, 21 и 28 дней достоверной разницы по живой массе между контрольной и 1 опытной группой не обнаружено, при этом во 2 опытной группе живая масса петушков была наибольшей, по сравнению с контрольной группой, в среднем на 7,4-10% (Р≤0,001).
В 35 дней разница по массе подопытных цыплят между контрольной и 2 опытной группой составила 4,5%. Различия между петушками контрольной и 1 опытной группы по средним показателям живой массы в 35 дней были минимальны.
Таблица 2 — Динамика живой массы петушков-бройлеров (М±m), (n=80)
| Показатель | Группа | ||
| Контрольная | 1 опытная | 2 опытная | |
| Живая масса, г: | |||
| — в суточном возрасте | 43,9±0,11 | 44,1±0,14 | 43,7±0,12 |
| — в 7 дней | 149,4±1,46 | 170,4±1,46*** | 182,2±2,34*** |
| — в 14 дней | 398,4±5,90 | 393,9±4,82 | 431,9±7,51*** |
| — в 21 день | 773,5±12,38 | 750,0±11,97 | 856,8±12,52*** |
| — в 28 дней | 1316,6±22,88 | 1308,3±20,42 | 1415,4±22,48*** |
| — в 35 дней | 1911,6±29,64 | 1908,5±29,13 | 1996,8±29,26* |
| — в 38 дней | 2149,5±35,34 | 2165,6±28,90 | 2259,0±36,08* |
| Абсолютный прирост, г | 2105,5 | 2121,6 | 2215,0 |
Примечание: здесь и далее *- Р≤0,05; **- Р≤0,01; ***- Р≤0,001
В конце периода выращивания петухи контрольной группы достигли живой массы 2149,5 г, разница между контрольной и 1 опытной группой была незначительной, составив 0,7%. Петушки 2 опытной группы превышал контроль по данному показателю на 5,1 %( Р≤0,05).
Абсолютный прирост живой массы петушков-бройлеров за период выращивания был выше в 1 и 2 опытных группах по сравнению с контролем на 0,8 и 5,2% соответственно.
Динамика живой массы курочек (табл.3) была аналогична изменению живой массы петухов в соответствующих группах.
В 7 дневном возрасте курочки 1 и 2 опытных групп превосходили по живой массе контрольных аналогов, на 11% и 17 % соответственно.
В 14 дней у курочек 1 опытной группы живая масса составила 376 г, что меньше чем аналогичный показатель цыплят контрольной группы на 6,6% (Р≤0,001); во 2 опытной группе, напротив, по данному показателю наблюдалось превышение значения контрольной группы на 5,2% (Р≤0,01).
В 21 день разница по живой массе между контрольной и 1 опытной группой значительно сократилась и составила 2%; курочки 2 опытной группы превышали контрольных аналогов на 12,5% (Р≤0,001).
В 28 и 35 дней курочки-бройлеры 1 опытной группы превышали сверстниц контрольной группы по живой массе соответственно на 1,6 и 3,0%, но при этом достоверных различий не установлено. Птицы 2 опытной группы достоверно превосходили контрольную группу по живой массе в 28 и 35 дней на 8,6 и 10% (Р≤0,001) соответственно.
В конце периода выращивания живая масса курочек 1 опытной группы была выше контроля на 0,6%, цыплята 2 опытной группы имели живую массу выше, чем в контрольной группе на 6,1% (Р≤0,001).
Таблица 3 — Динамика живой массы курочек-бройлеров (М±m), (n=80)
| Показатель | Группа | ||
| Контрольная | 1 опытная | 2 опытная | |
| Живая масса, г: | |||
| — в суточном
возрасте |
43,8±0,15 | 44,0±0,16 | 43,9±0,12 |
| — в 7 дней | 148,4±1,35 | 165,4±1,53*** | 174,1±1,84*** |
| — в 14 дней | 403,0±4,70 | 376,2±5,37*** | 424,1±6,58** |
| — в 21 день | 741,9±10,65 | 727,9±10,01 | 834,7±13,11*** |
| — в 28 дней | 1205,1±16,04 | 1224,1±16,72 | 1329,5±19,16*** |
| — в 35 дней | 1690,5±22,03 | 1741,2±22,09 | 1837,4±24,73*** |
| — в 38 дней | 1911,4±26,01 | 1922,0±26,10 | 2027,4±31,59** |
| Абсолютный прирост, г | 1867,4 | 1878,0 | 1983,4 |
В 28 и 35 дней курочки-бройлеры 1 опытной группы превышали сверстниц контрольной группы по живой массе соответственно на 1,6 и 3,0%, но при этом достоверных различий не установлено. Птицы 2 опытной группы достоверно превосходили контрольную группу по живой массе в 28 и 35 дней на 8,6 и10% (Р≤0,001) соответственно.
В конце периода выращивания живая масса курочек 1 опытной группы была выше контроля на 0,6%, цыплята 2 опытной группы имели живую массу выше, чем в контрольной группе на 6,1% (Р≤0,001).
Абсолютный прирост живой массы курочек-бройлеров контрольной группы за весь период выращивания составил 1867,4 г, в 1 и 2 опытных группах, он был выше, по сравнению с контролем, на 0,5 и 6,2%.
Самым очевидным параметром, характеризующим рост птицы в контрольные периоды, является среднесуточный прирост живой массы. Динамика среднесуточного прироста петушков и курочек бройлеров представлена в таблице 4 и рисунках 1,2 и 3.
В среднем за период откорма наибольший среднесуточный прирост был у петушков бройлеров 2 опытной группы и составил 58,3 г, что больше значения контрольной группы на 2,9 г в сутки, или 5,2%. У курочек наибольший среднесуточный прирост также наблюдался во 2 опытной группе – 52,2 г, что больше аналогичного показателя контрольной группы на 3,1 г в сутки (6,3%). Петушки и курочки 1 опытной группы превышали контрольных сверстников по среднесуточному приросту соответственно на 0,4 и 0,3 г, или 0,7 и 0,6 %.
Таблица 4 — Среднесуточный прирост цыплят-бройлеров, г
| Период | Группа | |||||
| Контрольная | 1 опытная | 2 опытная | ||||
| Петушки-бройлеры | ||||||
| 0-7 дней | 15,1 | 18,1 | 19,7 | |||
| 7-14 дней | 35,6 | 31,9 | 35,7 | |||
| 14-21 дня | 53,6 | 50,9 | 60,7 | |||
| 21-28 дней | 77,6 | 79,7 | 79,8 | |||
| 28-35 дней | 85,0 | 85,8 | 83,0 | |||
| 35-38 дней | 79,3 | 85,7 | 87,4 | |||
| В среднем за период откорма | 55,4 | 55,8 | 58,3 | |||
| Период | Курочки-бройлеры | |||||
| 0-7 дней | 14,9 | 17,3 | 18,6 | |||
| 7-14 дней | 36,4 | 30,1 | 35,7 | |||
| 14-21 день | 48,4 | 50,2 | 58,7 | |||
| 21-28 дней | 66,2 | 70,9 | 70,7 | |||
| 28-35 дней | 69,3 | 73,9 | 72,6 | |||
| 35-38 дней | 73,6 | 60,2 | 63,3 | |||
| В среднем за период откорма | 49,1 | 49,4 | 52,2 | |||
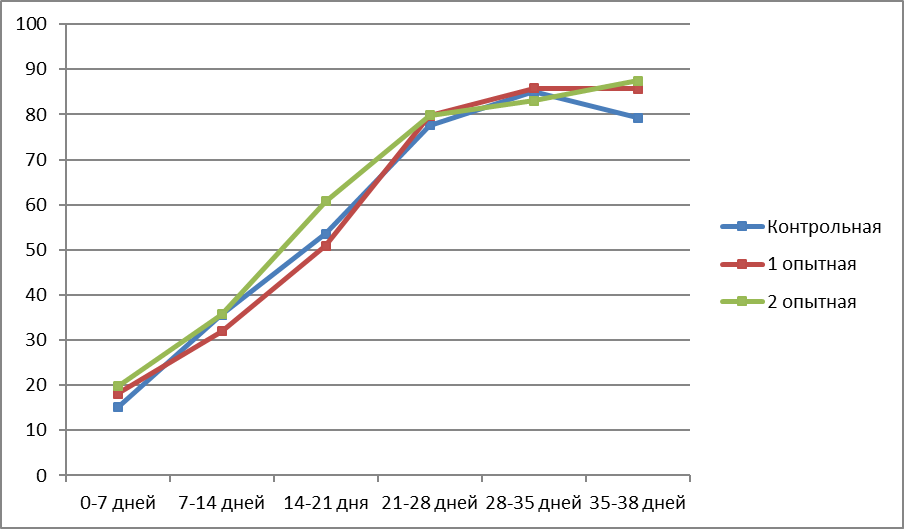
Рисунок 1 – Среднесуточный прирост живой массы петушков в разные возрастные периоды, г
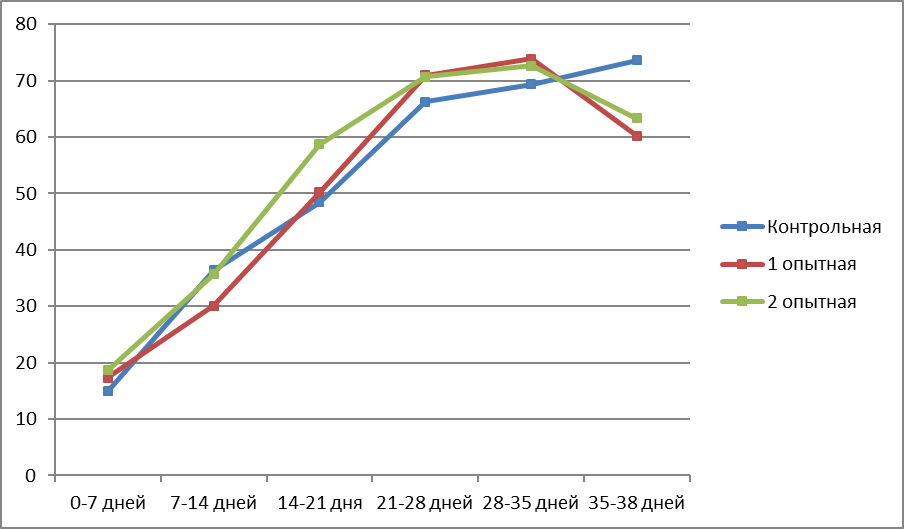
Рисунок 2 – Среднесуточный прирост живой массы курочек в разные возрастные периоды, г
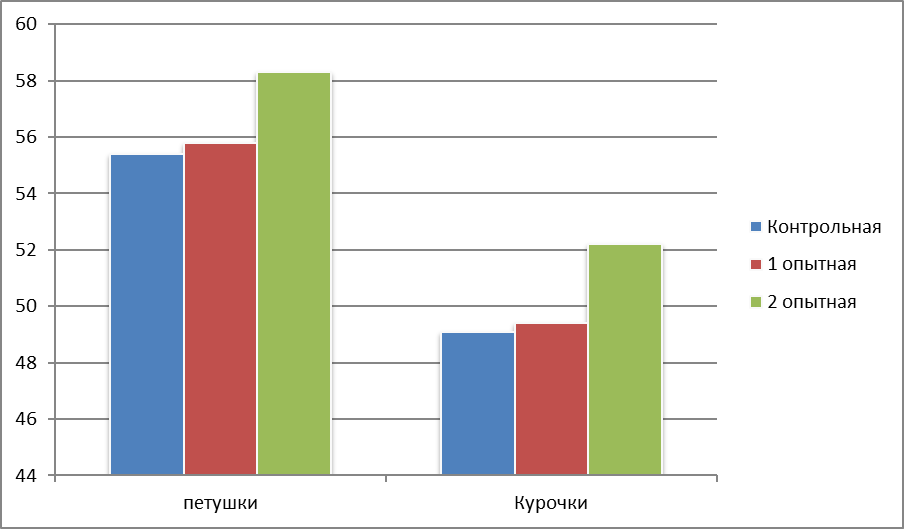
Рисунок 3 – Среднесуточный прирост живой массы цыплят-бройлеров в среднем за весь период откорма, г
При исследовании кормовых добавок необходимо учитывать их возможное влияние на жизнеспособность птицы. Одним из показателей, характеризующих жизнеспособность цыплят, является их сохранность (табл.5).
Таблица 5 — Сохранность поголовья цыплят-бройлеров за период
опыта
| Группа | Сохранность, % | ||
| Петушки | Курочки | Среднее по группе | |
| Контрольная | 91,3 | 95,0 | 93,15 |
| 1 опытная | 90,0 | 98,8 | 94,4 |
| 2 опытная | 96,3 | 92,5 | 94,4 |
Наилучшая сохранность поголовья среди петушков-бройлеров наблюдалась в 2 опытной группе, выше, чем в контрольной группе на 5%. В 1 опытной группе сохранность петушков-бройлеров уступала контролю на 1,3%.
Среди курочек наивысший процент сохранности был в 1 опытной группе (98,8%), что выше значения контрольной группы на 3,8%, напротив, во 2 опытной группе сохранность поголовья относительно контрольной группы была ниже на 2,5%.
Средние данные по сохранности поголовья (в среднем по петушкам и курочкам) в 1 и 2 опытных группах составили 94,4%, что выше показателя контрольной группы на 1,25%.
Таким образом, включение кормовой добавки, включающей фитобиотики и защищенные органические кислоты, дополнительно к основному рациону и взамен кормового антибиотика оказало положительное влияние на зоотехнические показатели цыплят-бройлеров. При этом отмечено достоверное превосходство по живой массе над контролем цыплят-бройлеров, получавших рацион с заменой кормовых антибиотиков на исследуемую кормовую добавку в среднем на 5,6%. Группа бройлеров, получавших изучаемый препарат дополнительно к основному рациону, также характеризовалась более высокой живой массой по сравнению с контролем — на 0,65%, но это различие было недостоверным. Использование препарата по предложенным схемам способствовало повышению сохранности поголовья птицы на 1,25%.
3.2.2 Результаты анатомической разделки цыплят
Под мясной продуктивностью цыплят-бройлеров принято понимать их способность в короткий срок производить то или иное количество мяса высокого качества при определенных затратах корма на единицу прироста живой массы и себестоимости. Анализ формирования мясной продуктивности позволяет использовать генетический потенциал цыплят-бройлеров разных кроссов с целью увеличения производства высококачественного мяса, а также выявить способность организма к преобразованию питательных веществ корма в мышечную, жировую и другие ткани тела. Качество мяса зависит от вида, направления продуктивности, породы и возраста птицы, а также от факторов внешней среды, из которых очень важным является кормление [80,81].
Главными показателями, характеризующими мясные качества птицы, являются предубойная живая масса, масса потрошеной тушки, выход потрошеной тушки.
В 38 дней с целью установления влияния изучаемой кормовой добавки на мясные качества бройлеров были отобраны средние по группе цыплята для проведения анатомической разделки. Живая масса отобранных цыплят-бройлеров в контрольной группе составила 2130 г, в 1 опытной 2131,33 г, во 2 опытной группе она была достоверно выше контроля на 5,13% (Р≤0,01) и достигала 2239,33 г (табл. 6).
По массе обескровленной тушки лидировала 2 опытная группа со значением 2162, 0 г, что достоверно больше контроля на 5,15% (Р≤0,01). Данный показатель у особей 1 опытной группы уступал контролю на 0,13%.
Одним из самых важных видов продукции птицеводства является потрошеная тушка цыпленка – бройлера. Установлено, что замена кормового антибиотика в рационе птиц 2 опытной группы на экспериментальную добавку способствовала повышению массы потрошеной тушки по сравнению с контролем на 3,3%, составив 1513,67 г. В 1 опытной группе данный показатель уступал контролю на 1,5 %.
Убойный выход потрошеной тушки в группе цыплят, получавших взамен кормового антибиотика добавку, включающую фитоэкстракты, эфирные масла и защищенные органические кислоты, незначительно уступал контролю — на 1,2 %. Данное обстоятельство связано с более высокой массой внутренних органов у птиц этой опытной группы, в частности массы сердца, легких, почек, мышечного желудка, кишечника, селезенки. Эти изменения находились в пределах физиологических норм. Убойный выход потрошеной тушки у бройлеров 1 опытной группы был ниже контроля на 1,1%.
Таблица 6 – Результаты анатомической разделки бройлеров (М±m), (n=3)
| Показатель | Группа | ||
| Контрольная | 1 Опытная | 2 Опытная | |
| Живая масса, г | 2130,0±11,02 | 2131,33±2,91 | 2239,33±5,9 ** |
| Масса обескровленной тушки, г | 2056,0±12,7 | 2053,33±5,21 | 2162,0±3,06 ** |
| Масса потрошеной тушки, г | 1465,33±14,62 | 1443,33±15,76 | 1513,67±9,28 |
| Убойный выход потрошеной тушки, % | 68,8 | 67,7 | 67,6 |
| Всего в составе тушки: | |||
| Мышцы, г | 1146,72±15,10 | 1102,01±7,65 | 1163,22±12,25 |
| % от массы тушки | 78,3 | 76,4 | 76,9 |
| Кости, г | 122,62±17,93 | 116,40±11,37 | 126,12±16,86 |
| % от массы тушки | 8,4 | 8,1 | 8,3 |
| Кожа, г | 136,10±6,02 | 148,95±12,27 | 175,97±14,41 |
| % от массы тушки | 9,3 | 10,3 | 11,6 |
| Мясокостный индекс | 9,4 | 9,5 | 9,2 |
В составе тушки были проанализированы количество мяса, костей и кожи, рассчитан мясокостный индекс.
Общее количество мяса в составе тушки цыплят контрольной группы составило 1146,7 г, что больше, чем у птиц 1 опытной группы на 3,9%. У особей 2 опытной группы данный показатель был наибольшим – 1163 г, что превышало контроль на 1,4%. В процентном отношении — по количеству мышечной ткани от массы тушки, наибольшее значение — 78,3% было получено в контрольной группе, в 1 и 2 опытных групп это отношение было меньше контроля на 1,9 и 1,4% соответственно.
Количество костной ткани в составе тушки цыплят контрольной группы составило 122,62 г, а относительно массы всей тушки цыплят данной группы масса костей была на уровне 8,4%. Цыплята 1 опытной группы имели меньшую массу костей, чем в контрольной группе на 5,1%, при этом в относительном значении от массы тушки разница составила 0,3 %, по сравнению с контрольной группой. Петушки 2 опытной группы по массе костей имели наибольшее значение, больше аналогов контрольной группы на 2,9%, при этом по относительной массе костей к массе тушки значение было меньше контрольного на 0,1%.
Количество кожи, в составе тушки птиц 1 и 2 опытных групп было больше значения контроля на 9,4 и 29,3%, соответственно.
Для оценки мясных качеств тушки рассчитан мясокостный индекс (отношение массы мышц к массе костей). В контрольной группе данный показатель составил 9,4, в 1 опытной группе он был больше, чем в контроле на 0,1 единицу, а во 2 опытной группе меньше на 0,2 единицы.
Результаты анатомической разделки и дальнейшей обвалки тушки цыпленка позволили определить развитие отдельных, наиболее ценных, ее частей под воздействием исследуемого кормового фактора (табл. 7).
Таблица 7 – Результаты обвалки отдельных частей тушки, (М±m), (n=3)
| Показатель | Группа | ||
| Контрольная | 1 Опытная | 2 Опытная | |
| Грудка | |||
| Общая масса, г | 557,33±13,49 | 548,0±14,0 | 549,67±8,76 |
| % от массы потрошеной тушки | 38,0 | 37,9 | 36,3 |
| мышцы, г | 500,0±16,29 | 482,0±17,78 | 484,67±11,62 |
| % от массы потрошеной тушки | 34,10 | 33,4 | 32,0 |
| кости, г | 19,3±0,66 | 24,9±2,56 | 26,2±2,6 |
| мясокостный индекс | 25,9 | 19,4 | 18,5 |
| кожа, г | 31±1,7 | 31,4±1,4 | 33,3±2,65 |
| Бедро | |||
| Общая масса, г | 134,67±3,71 | 113,33±2,4* | 146,67±5,21 |
| % от массы потрошеной тушки | 9,2 | 7,8 | 9,7 |
| мышцы, г | 112,0±3,46 | 92,82±3,0* | 116,0±3,46 |
| % от массы потрошеной тушки | 7,6 | 6,4 | 7,7 |
| кости, г | 8,44±0,19 | 8,1±0,2 | 9,2±0,84 |
| мясокостный индекс | 13,3 | 11,5 | 12,6 |
| кожа, г | 15,5±4,14 | 11,2±2,3 | 18,95±0,9 |
| Голень | |||
| Общая масса, г | 102,67±1,76 | 103,33±2,67 | 102,0±3,06 |
| % от массы потрошеной тушки | 7,0 | 7,1 | 6,7 |
| мышцы, г | 83,93±3,23 | 79,54±3,31 | 81,01±2,71 |
| % от массы потрошеной тушки | 5,7 | 5,5 | 5,3 |
| кости, г | 12,45±1 | 11,3±0,6 | 10,9±0,5 |
| мясокостный индекс | 6,7 | 7,0 | 7,4 |
| кожа, г | 4,9±0,34 | 10,3±2,1 | 8,84±3,1 |
| Крыло | |||
| Общая масса, г | 152,00±2,00 | 152,00±4,16 | 157,33±1,76 |
| % от массы потрошеной тушки | 10,37 | 10,53 | 10,39 |
| мышцы, г | 55,6±1,2 | 55,0±2,2 | 55,9±1,1 |
| % от массы потрошеной тушки | 3,8 | 3,8 | 3,7 |
| кости, г | 10,3±0,25 | 9,8±0,26 | 9,9±0,7 |
| мясокостный индекс | 5,4 | 5,6 | 5,6 |
| кожа, г | 9,65±0,25 | 16,1±6,7 | 10,6±0,46 |
| Каркас | |||
| Общая масса, г | 268,67±13,33 | 269,33±12,77 | 304,67±11,57 |
| % от массы потрошеной тушки | 18,33 | 18,66 | 20,13 |
| мышцы, г | 143,67±1,45 | 165,33±7,69 | 172,67±7,69* |
| % от массы потрошеной тушки | 9,80 | 11,45 | 11,41 |
| кости, г | 61,7±8,8 | 52,9±4,1 | 59,0±2,6 |
| мясокостный индекс | 2,3 | 3,1 | 2,9 |
| кожа, г | 45, 0±6,8 | 42,3±9,8 | 65,9±7,35 |
Особой пищевой ценностью обладает мясо грудной части тушки цыпленка-бройлера. Общая масса грудки контрольной группы незначительно превышала значения 1 и 2 опытной групп на 1,7 и 1,39% соответственно. Отношение массы грудки к массе потрошеной тушки было выше в контрольной группе, по сравнению с результатом 1 и 2 опытной групп на 0,1 и 1,7%. Костная часть грудки в 1 и 2 опытных группах была на уровне 24,9 и 26,2 г и превышала массу контрольного значения на 29 и 35,7% соответственно. За счет большего количества костей в грудке цыплят 1 и 2 опытных групп мясокостный индекс (соотношение мякотной части к массе костей) был ниже контроля на 6,5 и 7,4 единицы соответственно.
По выходу кожи в грудке на первом месте была 2 опытная группа (33,3 г), при этом контрольное значение было ниже на 6,9% (31 г), в 1 опытной группе данный показатель выше контроля на 1,29%.
По результатам обвалки бедра установлено, что наибольшая общая масса бедра была у птиц 2 опытной группы — 146,67 г, что на 8,91% превышало контрольное значение. В 1 опытной группе наблюдалось достоверное снижение массы бедра относительно контроля на 15,8% (Р≤0,05), составив 113,33 г. Отношения массы бедра к массе потрошеной тушки также было выше во 2 опытной, превысив контроль на 0,5%. Масса мышечной ткани бедра у бройлеров 2 опытной группы превосходила контрольное значение на 3,5%, а 1 опытной группе, наблюдали достоверное снижение этого показателя, по сравнению с контролем на 17,1% (Р≤0,05). По отношению массы мышечной ткани бедра к массе потрошеной тушки наименьшее значение было получено в 1 опытной группе – 6,4 единицы, что на 1,2% меньше контроля. Вторая опытная группа по данному показателю превосходила контроль на 0,1%. Наибольший мясокостный индекс бедра имела контрольная группа – 13,3 пункта, что выше, чем в 1 и 2 опытной группе на 1,8 и 0,7 пункта соответственно.
Анализ обвалки голени показал, что между группами не было достоверных различий. Процент от массы потрошеной тушки по мышцам голени был более высоким в контроле, составив 5,7 единицы. Несмотря на то, что в 1 опытной группе этот показатель был меньше контрольного значения на 0,2%, общая масса голени превышала контроль на 0,64%.
При анализе анатомической разделки крыла отмечено, что общая масса крыла была наибольшей во 2 опытной группе цыплят, составив 157,33 г, опережая контроль и 1 опытную группу на 3,5%. В крыле бройлеров 1 опытной группы наблюдали самую высокую массу кожи — 16,1 г, что превышало аналогичный показатель сверстников в контроле и во 2 опытной группе на 66,8 и 51,8%.
Анализ анатомической разделки каркаса свидетельствовал, что наибольшее количество мышц было во 2 опытной группе – 172,7 г, что достоверно больше контроля на 20,1% (Р≤0,05) и на 4,47% выше, чем в 1 опытной группе. Количество костей каркаса было ниже в 1 и 2 опытных группах по сравнению с контролем на 14,2 и 4,4 % соответственно. По массе кожи каркаса лидировала 2 опытная группа, превысив контроль на 46,4%, а 1 опытную группу на 55,6%. Мясокостный индекс был более высоким в 1 опытной группе, составив 3,1 пункта, что выше контрольного значения на 0,8 пункта.
В возрасте 22 дней были отобраны по три средних по живой массе петушка бройлера из каждой подопытной группы с целью измерения массы некоторых внутренних органов (табл. 8). По массе печени среди сравниваемых групп выделялась 2 опытная группа, её лидерство над контрольной и 1 опытной группами составило 8,24 и 17,9% соответственно. Масса печени бройлеров 1 опытной группы была ниже контроля на 1,6 г.
Относительная масса почек и сердца в сравниваемых группах не имела существенных отличий и колебалась в пределах 0,72-0,78 и 0,53-0,58% соответственно. Несомненными лидерами по массе кишечника были цыплята-бройлеры 1 опытной группы, опережая контрольную группу на 15,6%, а 2 опытную – на 30%. Данная направленность была характерна и для относительной массы кишечника и его длины. Так, по относительной массе кишечника 1 опытная группа превышала контрольное значение на 1,59%, а 2 опытную группу на 3,31%. По длине кишечника 2 опытная группа была достоверно ниже контроля на 10,3% (Р≤0,05) и меньше значения 1 опытной группы на 10,8%.
При оценке относительной массы фабрициевой бурсы разницы между группами не наблюдалось: значения были одинаковыми во всех группах и составили 0,22%.
Таблица 8 — Масса внутренних органов цыплят-бройлеров в возрасте 22 дней (М±m), (n=3)
| Показатель, ед. изм. | Группа | ||
| Контрольная | 1-опытная | 2-опытная | |
| Возраст — 22 дня | |||
| Живая масса, г | 765,33±2,91 | 751,33±1,76* | 841,0±1,53*** |
| Масса печени, г | 19,52±0,11 | 17,92±1,13 | 21,13±1,62 |
| Относительная масса
печени, % |
2,55 | 2,38 | 2,51 |
| Масса почек, г | 5,72±0,2 | 5,9±0,46 | 6,09±0,22 |
| Относительная масса
почки, % |
0,75 | 0,78 | 0,72 |
| Масса сердца, г | 4,46±0,26 | 4,01±0,23 | 4,81±0,28 |
| Относительная масса сердца, % | 0,58 | 0,53 | 0,57 |
| Масса кишечника, г | 68,62±5,05 | 79,33±4,1 | 61,0±2,53 |
| Относительная масса
кишечника, % |
8,97 | 10,56 | 7,25 |
| Длина кишечника, см | 184,0±5,75 | 185,0±6,21 | 165,0±1,0* |
| Масса фабрициевой бурсы, г | 1,7±0,46 | 1,66±0,08 | 1,88±0,06 |
| Относительная масса
фабрициевой бурсы, % |
0,22 | 0,22 | 0,22 |
| Масса селезенки, г | 0,88±0,04 | 0,71±0,02* | 1,05±0,15 |
| Относительная масса
селезенки, % |
0,11 | 0,09 | 0,12 |
| Масса желчного пузыря, г | 0,6±0,13 | 1,18±0,27 | 0,94±0,13 |
| Относительная масса
желчного пузыря, % |
0,08 | 0,16 | 0,12 |
| Масса желудка с жиром без кутикулы, г | 15,8±0,88 | 15,26±1,59 | 17,39±2,42 |
| Относительная масса
желудка с жиром без кутикулы, % |
2,06 | 2,03 | 2,07 |
| Масса железистого желудка, г | 5,78±0,29 | 4,67±0,3 | 5,02±0,15 |
| Относительная масса
железистого желудка, % |
0,75 | 0,62 | 0,6 |
Отмечено достоверное снижение массы селезенки в 1 опытной группе по сравнению с контролем на 19,3% (Р≤0,05). Напротив, во 2 опытной группе значение этого показателя было выше контроля на 19,3%. Относительная масса селезенки в контрольной, 1 и 2 опытных группах составила 0,11; 0,09 и 0,12% соответственно.
Масса желчного пузыря в 1 опытной группе 22 дневных цыплят-бройлеров была наивысшей составив 1,18 г, что выше контроля и 2 опытной на 49,15% и 20,3%, соответственно. Относительная масса желчного пузыря также была более высокой в 1 опытной группе — 0,16%, это выше контроля на 0,08% и значения 2 опытной на 0,04%.
Относительная масса желудка с жиром без кутикулы у цыплят подопытных групп не имела существенных отличий и колебалась в пределах 2,03-2,07%.
Относительная масса железистого желудка была самой высокой в контрольной группе — 0,75% и превышала значение 1 и 2 опытных групп в среднем на 0,14%.
Масса исследуемых внутренних органов цыплят-бройлеров в возрасте 38 дней соответствовала физиологическим нормам, при этом между группами отмечали следующие различия (табл. 9).
Относительная масса сердца в сравниваемых группах находилась в пределах 0,50-0,54%. Относительная масса легких была более высокой у бройлеров 2 опытной группы — 0,56%, в контроле этот показатель составил 0,51%, в 1 опытной группе – 0,48%. Наблюдалось повышение относительной массы почек в 1 и 2 опытных группах по отношению к контролю на 0,11 и 0,15%.
Относительная масса мышечного желудка была более высокой у птиц 2 опытной группы, составив 2,19%, что на 0,45% выше контроля. У цыплят 1 опытной группы этот показатель был выше контрольного значения на 0,15%. Относительная масса печени у цыплят подопытных групп находилась в пределах 2,27-2,4%, желчного пузыря – 0,08-0,11%.
Что касается массы кишечника, то во 2 опытной группе она была достоверно выше контрольного значения на 30% (Р≤0,05), при этом относительная масса этого органа превышала контроль на 1,12%. В 1 опытной группе данный показатель также превосходил контрольный уровень по абсолютной и относительной массе соответсвенно на 8,1 и 0,38%.
Одновременно с повышением абсолютной и относительной массы кишечника у птиц 2 опытной группы отмечали и увеличение длины кишечника, она была достоверно больше, чем у контрольных аналогов на 12,3% (Р≤0,05).
Масса селезенки была наибольшей у цыплят 2 опытной группы составив 3,09 г, что больше контрольного значения на 0,39 г. В 1 опытной группе этот показатель уступал контролю на 0,24 г. Относительная масса этого органа в подопытных группах бройлеров была в пределах 0,115-0,138%.
Масса фабрициевой бурсы у цыплят подопытных групп находилась в пределах 0,045-0,055%.
Таблица 9 – Масса внутренних органов цыплят-бройлеров в возрасте 38 дней (М±m), (n=3)
| Наименование органа | Группа | ||
| Контрольная | 1 Опытная | 2 Опытная | |
| Масса сердца, г | 11,15±0,27 | 10,67±0,67 | 12,03±0,33 |
| Относительная масса сердца, % | 0,52 | 0,50 | 0,54 |
| Масса легких, г | 11,02±0,3 | 10,19±1,0 | 12,54±1,32 |
| Относительная масса легких, % | 0,51 | 0,48 | 0,56 |
| Масса почек, г | 12,15±1,77 | 14,49±2,12 | 16,07±0,74 |
| Относительная масса почек, % | 0,57 | 0,68 | 0,72 |
| Масса мышечного желудка (с жиром), г | 37,13±2,17 | 40,37±2,25 | 49,12±6,09 |
| Относительная масса мышечного желудка, % | 1,74 | 1,89 | 2,19 |
| Масса печени, г | 51,22± 1,12 | 49,09± 2,94 | 50,93± 2,26 |
| Относительная масса печени, % | 2,4 | 2,3 | 2,27 |
| Масса желчного пузыря, г | 2,37±0,15 | 1,7±0,26 | 2,18±0,12 |
| Относительная масса желчного пузыря, % | 0,11 | 0,08 | 0,1 |
| Масса кишечника, г | 100,44±6,02 | 108,62±7,02 | 130,67±6,67* |
| Относительная масса кишечника, % | 4,71 | 5,09 | 5,83 |
| Длина кишечника, см | 217,0±4,9 | 208,33±6,35 | 243,67±7,13* |
| Масса селезенки, г | 2,7±0,43 | 2,46±0,27 | 3,09±0,78 |
| Относительная масса селезенки, % | 0,13 | 0,115 | 0,138 |
| Масса фабрициевой бурсы, г | 1,17±0,38 | 0,96±0,08 | 1,02±0,24 |
| Относительная масса фабрициевой бурсы, % | 0,055 | 0,045 | 0,046 |
Таким образом, введение в рацион цыплят-бройлеров исследуемого кормового компонента, как дополнительно, так и путем замены в нем кормового антибиотика, положительно влияет на мясную продуктивность птиц и не оказывает отрицательного влияния на развитие внутренних органов. Отмечено, что у бройлеров, получавших комбикорм свободный от антибиотиков с использованием препарата, включающего фитоэкстракты, эфирные масла и защищенные органические кислоты, к концу откорма (в возрасте 38 дней) относительная масса сердца, легких, почек, мышечного желудка, кишечника была выше, чем в контроле и в 1 опытной группе. При этом длина кишечника достоверно превосходила контроль. Эти изменения находились в пределах физиологической нормы, что может свидетельствовать о лучших детоксикационных возможностях организма птиц и об активизации всасывательной функции кишечника.
3.2.3 Химический состав мяса цыплят-бройлеров
Известно, что птицеводство является основным производителем мяса с высокой пищевой и биологической ценностью, благодаря высокому содержанию полноценных белков и полиненасыщенных жирных кислот. Мясо птицы по потреблению стоит на втором месте после свинины. Темпы производства мяса неуклонно растут, обещая вывести птицепродукты на первое место в мясном сегменте.
Химический состав мяса определяет его питательную ценность и является одним из основных показателей качества. Поэтому в рамках исследования был проведен анализ химического состава мяса цыплят-бройлеров в 38 дневном возрасте. Данные по химическому составу грудных мышц представлены в таблице 10.
Анализ химического состава мяса цыплят-бройлеров показал, что содержание влаги в грудных мышцах цыплят-бройлеров контрольной группы составляло 76,1%, в 1 и 2 опытных группах данный показатель был меньше, по сравнению с контролем на 2,7% (Р≤0,05) и 1,3% соответственно. Количество сухого вещества в грудных мышцах цыплят контрольной группы было на уровне 23,9%, у цыплят 1 опытной группы данный показатель был достоверно выше контроля на 1,7% (Р≤0,05), а у бройлеров 2 опытной группы на 1,3%.
Таблица 10 — Химический состав грудных мышц бройлеров, % (М±m), (n=3)
| Показатель | Группа | ||
| Контрольная | 1 Опытная | 2 Опытная | |
| Общая влага | 76,1±0,49 | 73,4±0,21* | 74,8±0,3 |
| Сухое вещество | 23,9±0,49 | 25,6±0,206* | 25,2±0,27 |
| Белок | 20,12±0,452 | 19,17±0,483 | 16,64±1,903 |
| Жир | 2,91±0,37 | 5,76±0,59* | 7,92±0,24** |
| Зола | 1,13±0,017 | 1,02±0,015* | 0,91±0,103 |
| Индекс качества мяса (Жир/Белок) | 0,14 | 0,30 | 0,47 |
| Энергетическая ценность, КДж/100 г | 446,0±14,6 | 537,3±14,0* | 576,2±12,3** |
Содержание белка в составе мышечной ткани грудки цыплят контрольной группы составляло 20,12%, в 1 и 2 опытных группах этот показатель уступал контролю на 0,95 и 3,48%.
Количество жира в мышечной ткани грудки бройлеров 2 опытной группы было наибольшим — 7,92%, превысив значение контроля на 5,01% (Р≤0,001). В 1 опытной содержание жира было выше контрольного уровня на 2,85% (Р≤0,05) и составило 5,76%.
Зола в мышцах представлена в основном минеральными веществами, входящими в состав биомолекул. Ее количество было максимальным в контрольной группе – 1,13%, что больше аналогичного показателя 1 опытной группы на 0,11% (Р≤0,05). Во 2 опытной группе количество сырой золы было минимальным – 0,91%, что уступало показателю контроля на 0,22%.
На основе химического анализа грудной мышцы бройлеров была рассчитана энергетическая ценность мяса. В контрольной группе, ввиду меньшего количества жира, энергетическая ценность мяса была наименьшей и составила 446 КДж в 100 г. В 1 опытной группе количество энергии в 100 г мышечной ткани грудки составляло 537,3 КДж, что больше контроля на 20,5% (Р≤0,05). Наиболее высокой энергетической ценностью обладали грудные мышцы цыплят 2 опытной группы – 576,2 КДЖ, что превышало контрольное значение на 29,2% (Р≤0,01).
Для характеристики качества мяса и мясопродуктов используют отношение «жир/белок» или индекс качества мяса (ИКМ)[72]. В контрольной группе ИКМ составил 0,14, в 1 и 2 опытной группах этот показатель достиг уровня 0,3 и 0,47 соответственно.
Данные по химическому составу ножных мышц представлены в таблице 11.
Содержание влаги в ножных мышцах бройлеров 1 и 2 опытных групп характеризовалось меньшим значением, по сравнению с контролем, соответственно на 1,3 и 3,46 %. Количество сухого вещества, напротив, было выше в 1 и 2 опытных группах, чем в контроле соответственно на 1,3 и 3,46%.
Таблица 11 — Химический состав ножных мышц бройлеров, % (М±m), (n=3)
| Показатель | Группа | ||
| Контрольная | 1 Опытная | 2 Опытная | |
| Общая влага | 75,5±0,32 | 74,2±0,93 | 72,04±0,31** |
| Сухое вещество | 24,5±0,32 | 25,8±0,42 | 27,96±1,31 |
| Белок | 10,49±1,02 | 9,4±0,087 | 6,47±1,58 |
| Жир | 13,58±1,28 | 15,88±0,59 | 21,35±2,69 |
| Зола | 0,62±0,053 | 0,53±0,0057 | 0,41±0,95 |
| Индекс качества мяса (Ж/Б) | 1,30 | 1,69 | 3,30 |
| Энергетическая ценность, КДж/100 г | 687,2±18,2 | 754,6±21,5 | 911,5±16,9** |
По содержанию белка в ножных мышцах лидировала контрольная группа с уровнем 10,49%, что превышало аналогичное значение в 1 опытной группе на 1,09% и на 4,02% во 2 опытной группе. Наибольший процент золы наблюдался в ножных мышцах цыплят контрольной группы — 0,62%, это превышало значение в 1 опытной группе на 0,09% и на 0,21% во 2 опытной группе.
При анализе количества жира в ножных мышцах было отмечено его повышение у цыплят-бройлеров 1 и 2 опытных групп, по сравнению с контролем на 2,3 и 7,77% соответственно.
В оценке энергетической ценности ножных мышц прослеживалась закономерная взаимосвязь с содержанием жира, характеризуясь повышением у бройлеров опытных групп. Так, в контрольной группе в 100 г ножных мышц содержалось 687,2 КДж, в 1 опытной — 754,6 КДж, во 2 опытной группе этот показатель достиг 911,5 КДж (Р≤0,01).
Индекс качества мяса контрольной группы был равен 1,3, в 1 и 2 опытных группах он составил 1,69 и 3,3 единицы соответственно.
Таким образом, химический анализ мышечной ткани цыплят-бройлеров показал, что наблюдается тенденция к снижению белка и повышению содержания жира, как в грудных, так и в ножных мышцах у цыплят, в рацион которых вводили кормовой антибиотик вместе с исследуемой добавкой и у птиц, получавших рацион с заменой антибактериального препарата на экспериментальный препарат, при этом в опытных группах наблюдалось увеличение энергетической ценности мяса.
3.2.4 Оценка мяса цыплят-бройлеров на содержание Listeria monocytogenes, бактерий рода сальмонелла и КМАФАнМ (мезофильных аэробных и факультативно-анаэробных микроорганизмов)
Бактериальная загрязнённость мясной продукции птицеводства может приводить к пищевым отравлениям потребителей [82]. К наиболее опасным микроорганизмам относятся Listeria monocytogenes, сальмонеллы и другие. Загрязнение продукции микроорганизмами происходит в основном за счет нарушения санитарно-гигиенических правил при убое птицы и первичной переработке тушек [83]. Большое значение, в этом вопросе, имеет распространенность данных патогенных микроорганизмов и мероприятия по предотвращению их распространения среди поголовья птицы [84]. Применение кормовых антибиотиков способствует снижению количества патогенных микроорганизмов, но при этом возможно появления антибиотико-резистентных форм данных бактерий, поэтому необходимо применение альтернативных средств с антимикробной активностью.
В таблице 12 приведен анализ тушек цыплят бройлеров на содержание Listeria monocytogenes, бактерий рода сальмонелла и КМАФАнМ (мезофильных аэробных и факультативно-анаэробных микроорганизмов).
Таблица 12 – Содержание Listeria monocytogenes, бактерий рода сальмонелла и КМАФАнМ (мезофильных аэробных и факультативно-анаэробных микроорганизмов) в мясе цыплят-бройлеров, (М±m), (n=3)
| Группа | Номер образца | Listeria monocytogenes | Бактерии рода сальмонелла | Количество мезофильных аэробных и факультативно-анаэробных микроорганизмов, КОЕ/г | |
| Норматив | Не допускается в 25 г | Не допускается в 25 г | Не более 1,0*105 | ||
| Контрольная | 1 | Не обнаружена в 25 г | Не обнаружены в 25 г | Менее 1,0*102 | |
| 2 | Не обнаружена в 25 г | Не обнаружены в 25 г | 1,0*103 | ||
| 3 | Не обнаружена в 25 г | Не обнаружены в 25 г | Менее 1,0*102 | ||
| 1 Опытная | 4 | Не обнаружена в 25 г | Не обнаружены в 25 г | Менее 1,0*102 | |
| 5 | Не обнаружена в 25 г | Не обнаружены в 25 г | Менее 1,0*102 | ||
| 6 | Не обнаружена в 25 г | Не обнаружены в 25 г | Менее 1,0*102 | ||
| 2 Опытная | 7 | Не обнаружена в 25 г | Не обнаружены в 25 г | Менее 1,0*102 | |
| 8 | Не обнаружена в 25 г | Не обнаружены в 25 г | Менее 1,0*102 | ||
| 9 | Не обнаружена в 25 г | Не обнаружены в 25 г | Менее 1,0*102 | ||
Listeria monocytogenes является возбудителем листериоза. Контаминация продукции в основном происходит при убое и дальнейшей переработке продукции птицеводства [85]. Данные микроорганизмы способны переживать замораживание. В норме наличие бактерий рода Listeria monocytogenes в тушках цыплят-бройлеров не допустимо. Во всех исследованных нами образцах Listeria monocytogenes не обнаружена.
Бактерии рода сальмонеллы способны скрытно существовать в кишечнике птицы и при нарушении санитарных норм при убое и переработке птицы может происходить вторичная контаминация тушек [86]. Сальмонеллы не должны присутствовать в мясе цыплят-бройлеров. Во всех исследованных образцах бактерий рода сальмонеллы не обнаружено.
Количество мезофильных аэробных и факультативно-анаэробных микроорганизмов в мясе цыплят-бройлеров не должно превышать 1,0*105 КОЕ/г. Все исследованные образцы соответствовали по данному показателю нормативным значениям. В большинстве образцов количество мезофильных аэробных и факультативно-анаэробных микроорганизмов было менее 1,0*102 КОЕ/г, лишь в одном образце — в тушке цыпленка контрольной группы, значение данного показателя было на уровне 1,0*103 КОЕ/г.
Таким образом, проведенное микробиологическое исследование тушек цыплят-бройлеров показало, что технология выращивания бройлеров в условиях ООО «Птицефабрика «Среднеуральская» обеспечивает получение безопасной продукции птицеводства.
3.2.5 Переваримость питательных веществ комбикорма
Переваримость питательных веществ рациона является одним из важнейших показателей, определяющих биологическую ценность и продуктивное действие кормов. Использование питательных веществ корма птицы влияет на уровень ее продуктивности.
Коэффициенты переваримости показывают, на сколько процентов перевариваются те или иные питательные вещества корма в организме цыплят-бройлеров (табл. 13).
Установлено, что петушки бройлеры 1 и 2 опытных групп не значительно уступали контролю в переваримости сухого вещества рациона соответственно на 1,8 и 0,6 %.
Наиболее высокая переваримость сырого протеина корма наблюдалось в контрольной группе – 92,3 %, это больше чем в 1 и 2 опытных группах соответственно на 0,3 и 0,7%.
Процент переваривания сырого жира у цыплят контрольной группы составил 75,4%. У цыплят из 1 и 2 опытных групп переваримость сырого жира была выше на 0,3 и 4,9% соответственно.
Переваривание клетчатки в организме цыплят осуществляется с помощью ферментов микрофлоры кишечника. Наибольшее значение по усвоению клетчатки получены во 2 опытной группе и составило 21,6%, что больше показателя контроля на 11%. В 1 опытной группе бройлеров коэффициент переваримости клетчатки составил 13,8%, это больше аналогичного показателя контрольной группы на 3,2%.
Таблица 13 – Коэффициенты переваримости питательных веществ цыплятами-бройлерами, % (n=5)
| Показатель | Группа | ||
| Контрольная | 1 опытная | 2 опытная | |
| Сухое вещество | 67,9 | 66,1 | 67,3 |
| Сырой протеин | 92,3 | 92,0 | 91,6 |
| Сырой жир | 75,4 | 75,7 | 80,3 |
| Сырая клетчатка | 10,6 | 13,8 | 21,6 |
| Безазотистые экстрактивные
вещества (БЭВ) |
81,9 | 78,9 | 76,8 |
Сухое вещество корма более чем на половину состоит из безазотистых экстрактивных веществ, в эту группу включают сахар и крахмал корма. Переваримость безазотистых экстрактивных веществ в контрольной группе была на уровне 81,9%, у цыплят 1 и 2 опытной группы данный показатель был ниже значения контроля на 3% и 5,1%, соответственно.
Таким образом, данные балансового опыта показывали, что переваримость питательных веществ корма подопытными цыплятами бройлерами была на высоком уровне во всех группах, при этом наивысшее переваривание сухих веществ корма наблюдалось в контрольной группе, в основном за счет лучшего усвоения безазотистых экстрактивных веществ. У цыплят-бройлеров 2 опытной группы, по сравнению с контрольной, наблюдалось увеличение переваривания клетчатки и жира.
3.2.6 Обмен энергии
Обменная энергия важнейший показатель общей питательной ценности корма. Для его расчета была вычислена валовая энергия корма и энергия помета, с помощью уравнений регрессии (табл. 14).
Потребление валовой энергии цыплятами-бройлерами в контрольной группе составило 2,11 МДж/гол в сутки. Цыплята 2 опытной группы потребляли 2,18 МДж, что на 3,3 % больше показателя контрольной группы. В 1 опытной группе потребление энергии цыплятами составило 2,06, это меньше показателя контроля на 2,4%.
Вместе с пометом из птицы экскретируется энергия непереваримых питательных веществ. В контрольной группе энергия помета составила 18,7 % от валовой энергии корма. В 1 и 2 опытных группах доля энергии помета от валовой энергии составила 20 и 19,9%, что больше показателя контрольной группы на 1,3 и 1,2%, соответственно.
Таблица 14 – Обмен энергии в организме цыплят-бройлеров, МДж/гол в сутки (n=5)
| Показатель | Группа | ||
| Контрольная | 1 опытная | 2 опытная | |
| Валовая энергия корма | 2,11 | 2,06 | 2,18 |
| Энергия помёта | 0,39 | 0,41 | 0,43 |
| % энергии помёта к валовой энергии | 18,7 | 20,0 | 19,9 |
| Обменная энергия | 1,71 | 1,65 | 1,75 |
| % обменной энергии к валовой энергии корма | 81,3 | 80,0 | 80,3 |
Обменная энергия важнейший показатель питательности кормов, который в большей мере зависит от переваримости питательных веществ комбикорма. Наибольшее количество обменной энергии было во 2 опытной группе (1,75 МДж), при этом, в процентах от валовой энергии корма, цыплята данной группы уступали контрольным аналогам на 1%. Наименьшее количество обменной энергии получено цыплятами 1 опытной группы 1,65МДж, что составило 80% от принятой валовой энергии.
3.2.7 Обмен азота
Азотистые вещества не полностью перевариваются в организме, полнота их переваримости во многом зависит от структуры белковой молекулы, вида корма, степени гидролиза в организме, содержанием в рационе других биологически активных веществ.
Баланс азота в организме цыплят-бройлеров представлен в таблице 15
Таблица 15 – Баланс азота в организме цыплят-бройлеров, г на голову в сутки (n=5)
| Показатель | Группа | ||
| Контрольная | Опытная 1 | Опытная 2 | |
| Принято | 4,06 | 3,97 | 4,20 |
| Выделено в помете | 1,92 | 1,96 | 1,72 |
| Отложилось в теле | 2,15 | 2,01 | 2,48 |
| Использовано от принятого с кормом, % | 52,8 | 50,5 | 59,1 |
У петушков контрольной группы в теле отложилось 2,15 г азота, что составило 52,8 % от принятого азота с кормом. У цыплят 1 опытной группы отложение азота в теле было ниже, чем в контрольной группе – на 0,14 г, в итоге использование этого элемента от принятого с кормом составило 50,5%, что ниже контрольного уровня на 2,3%. Общее количество азота, отложившееся в теле цыплят 2 опытной группы составило 2,48 г, при этом использование азота составило 59,1%, превысив показатель контроля на 6,3%.
Таким образом, оценка баланса азота показала, что более высоким его использованием в организме характеризовались цыплята 2 опытной группы. Вероятно, это связано с меньшей экскрецией азота с мочой, поскольку переваримость сырого протеина корма в этой группе незначительно уступала контролю.
3.2.8 Обмен кальция и фосфора, минерализация костной ткани
Минеральные вещества — кальций и фосфор, входят в группу «сырой золы». От их количества во многом зависит реакция среды, определяющая кислотно-щелочное отношение в рационе и щелочной резерв крови.
В таблице 16 показан баланс кальция. Петушки-бройлеры контрольной группы в среднем за учетный период балансового опыта потребляли с кормом около 1,8 г кальция в сутки на голову, при этом выделялось с пометом в среднем 0,88 г. В итоге отложение в теле кальция в сутки составило 0,3 г, или 25,5% от принятого с кормом.
В 1 опытной группе за тот же период, потребление кальция было несколько ниже, чем в контрольной группе (на 0,03 г), при этом экскреция кальция с пометом составила 0,86 г, а в теле отложилось 0,29 г кальция, или 25%, что ниже контрольного показателя на 0,5%.
Таблица 16 – Баланс кальция в организме цыплят-бройлеров, г на голову в сутки (n=5)
| Показатель | Группа | ||
| Контрольная | 1 опытная | 2 опытная | |
| Принято | 1,18 | 1,15 | 1,22 |
| Выделено в помете | 0,88 | 0,86 | 0,74 |
| Отложилось в теле | 0,30 | 0,29 | 0,47 |
| Использовано от принятого с кормом, % | 25,51 | 24,96 | 38,92 |
Лучше всего использовали кальций петушки 2 опытной группы. Коэффициент его использования в организме от принятого с кормом составил 38,9%. При этом поступление кальция было максимальным и составляло 1,22 г на голову в сутки, из них в теле отложились 0,47 г кальция. В таблице 17 показан баланс фосфора. Использование фосфора цыплятами контрольной группы было на уровне 24,96%. Петушки 2 опытной группы превосходили по этому показателю контрольных сверстников на 1,4%. Наибольшее усвоение фосфора наблюдалось в 1 опытной группе бройлеров (33,3%), выше, чем в контроле на 8,3%.
Таблица 17 – Баланс фосфора в организме цыплят-бройлеров, г на голову в сутки (n=5)
| Показатель | Группа | ||
| Контрольная | 1 опытная | 2 опытная | |
| Принято | 0,67 | 0,65 | 0,69 |
| Выделено в помете | 0,50 | 0,43 | 0,51 |
| Отложилось в теле | 0,17 | 0,22 | 0,18 |
| Использовано от принятого с кормом, % | 25,0 | 33,3 | 26,4 |
В таблице 18 представлены результаты химического анализа большеберцовых костей цыплят-бройлеров. Масса костей у цыплят подопытных групп не имела между собой достоверных различий. При этом наблюдались расхождения по количеству сырой золы, кальция и фосфора.
Сырая зола в костной ткани представлена различными минеральными веществами, в основном кальцием и фосфором [87]. Ее количество у цыплят контрольной группы составило 45,4%. В 1 опытной группе содержание сырой золы было ниже уровня контроля на 3,1%. В 2 опытной группе это значение было больше, чем в контрольной группе на 1,1%
Количество кальция в костной ткани петушков контрольной группы составляло 13,6%. У цыплят 1 опытной группы отмечена незначительное снижение уровня кальция в кости, в среднем на 0,5%. Во 2 опытной группе бройлеров количество кальция достоверно превышало значение контроля на 2,8% (Р≤0,01).
Таблица 18 – Содержание сырой золы, кальция и фосфора в большеберцовой кости цыплят-бройлеров, % от сухого вещества (n=3)
| Показатель | Группа | ||
| Контрольная | 1 опытная | 2 опытная | |
| Зола | 45,4±1,2 | 42,3±1,5 | 46,5±0,4 |
| Кальций | 13,6±0,5 | 13,1±0,5 | 16,4±0,2** |
| Фосфор | 6,8±0,2 | 6,3±0,12 | 6,4±0,04 |
Содержание фосфора в контрольной группе было на уровне 6,8%, в 1 и 2 опытных группах оно немного уступало контролю, в среднем на 0,45%.
Таким образом, использование кормовой добавки, включающей фитобиотики и защищенные органические кислоты, как дополнительно, так и взамен кормового антибиотика в рационе бройлеров, положительно отразилось на минеральном обмене в организме птицы. Кормление цыплят, организованное по схеме 2 опытной группы, наиболее эффективно повлияло на суточный баланс кальция, увеличивая отложение данного макроэлемента в теле бройлеров, о чем свидетельствует более высокое его содержание в костной ткани.
3.2.9 Морфологический состав крови цыплят-бройлеров
Процессы, протекающие в организме при использовании биологически активных добавок, отражаются на морфологическом составе крови и её физико-химических свойствах, по которым можно судить о степени интенсивности окислительных процессов и уровне обмена веществ. Изученные нами морфологические показатели крови цыплят-бройлеров при дополнительном включении в комбикорм кормовой добавки, включающей фитобиотики и защищенные органические кислоты и при замене ею кормового антибиотика в составе рациона представлены в таблице 19.
Морфологический анализ крови свидетельствовал о том, что при включении в рацион цыплят-бройлеров кормовой добавки, представляющей, комплекс эфирных масел, экстракта жгучего перца и защищенных жировой оболочкой органических кислот, морфологические показатели находились в пределах физиологических значений, однако между группами отмечены некоторые отличия. Так, в возрасте 22 дней количество эритроцитов в крови цыплят контрольной группы составляло 3,7 1012/л. В 1 и 2 опытной группе при меньшем количестве эритроцитов в сравнении с контрольным значением на 5,4 и 8,1 %, величина гематокрита (отношение эритроцитов к общему объему крови) была выше на 1,2 и 2,0 %, что может свидетельствовать о повышении процесса эритропоэза.
При оценке количества гемоглобина в крови установлена тенденция снижения его у птиц 1 и 2 опытных групп на 7,5 и 6,1%, при этом среднее содержание гемоглобина в одном эритроците у птиц контрольной и 1 опытной групп не имело существенной разницы, составив соответственно 32,8 и 32,2 пг, а во 2 опытной группе было выше контроля на 1,1 пг.
Анализируя количественное содержание лейкоцитов в крови цыплят видно, что у бройлеров 1 и 2 опытных групп их было больше, чем в контроле на 6,0 и 14,5%, что может говорить об усилении лейкопоэза.
Анализ процентного соотношения различных видов лейкоцитов в крови показал, что количество лимфоцитов составляло у цыплят контрольной группы 66,0%, у особей 1 опытной их было меньше на 0,3% по сравнению с контролем, а у сверстников 2 опытной группы их уровень превышал контроль на 3,3%. Количество моноцитов в крови бройлеров 1 опытной группы превышало контроль на 1,4%, а у цыплят 2 опытной группы их было меньше, чем в контроле на 2,6%. В отношении эозинофилов и базофилов отмечали снижение их по сравнению с контролем: в 1 опытной группе соответственно на 0,3 и 0,6%, во 2 опытной группе – на 0,4 и 1,0%.
Скорость оседания эритроцитов у цыплят, задействованных в опыте, соответствовала нормативному уровню и составляла 2,0 мм/час.
Таблица 19 – Морфологические показатели крови цыплят-бройлеров в возрасте 22 дней (M±m; n=3)
| Показатель | Группа | ||
| Контрольная | 1 опытная | 2 опытная | |
| Эритроциты,1012/л | 3,7±0,07 | 3,5±0,17 | 3,4±0,21 |
| Гематокрит (отношение эритроцитов к общему объему крови), % | 37,4±1,3 | 38,6±1,35 | 39,4±2,4 |
| Гемоглобин, г/л | 107,0±4 | 99,0±3,12 | 100,5±4,33 |
| Среднее содержание гемоглобина в одном эритроците, пикограмм (пг) | 32,8±0,87 | 32,2±1,15 | 33,9±0,67 |
| Лейкоциты,109/л | 23,30,94 | 24,70,57 | 26,7±2,22 |
| Лимфоциты, % | 66,02,65 | 65,71,86 | 69,32,19 |
| Моноциты, % | 10,3±1,76 | 11,7±1,33 | 7,7±0,88 |
| Эозинофилы, % | 20,3±3,18 | 20,0±0,58 | 20,7±3,18 |
| Базофилы, % | 3,3±0,33 | 2,7±0,88 | 2,3±0,33 |
| СОЭ, мм/час | 2,0 | 2,0 | 2,0 |
Таким образом, при введении препарата на основе фитобиотиков и защищенных органических кислот дополнительно к основному рациону цыплят-бройлеров (1 опытная группа) и взамен кормового антибиотика (2 опытная группа), анализируемые морфологические показатели крови птиц не выходили за пределы физиологических норм, что свидетельствует об отсутствии отрицательного влияния добавки на организм птицы.
3.2.10 Биохимический состав крови бройлеров
В таблице 20 представлены биохимические показатели крови цыплят-бройлеров в возрасте 22 дней.
Анализируя содержание общего белка в сыворотке крови мясной птицы видно, что при использовании испытуемой кормовой добавки дополнительно к основному рациону и взамен кормового антибиотика, его величина у бройлеров 1 и 2 опытных групп имела тенденцию к снижению, соответственно, на 9,97 и 5,5%, по сравнению с контролем, находясь в пределах физиологической нормы.
Таблица 20 — Биохимический состав крови цыплят-бройлеров в возрасте 22 дней, (M±m; n=3)
| Показатель | Группа | ||
| Контрольная | 1 опытная | 2 опытная | |
| Общий белок, г/л | 31,1±1,25 | 28,0±2,0,5 | 29,4±1,79 |
| Альбумин, г/л | 9,7±0,4 | 8,5±0,41 | 9,6±0,43 |
| Глобулины, г/л | 21,4±0,92 | 19,5±1,75 | 19,8±1,43 |
| А/Г индекс | 0,45±0,01 | 0,44±0,03 | 0,48±0,02 |
| Мочевина, ммоль/л | 0,50±0,06 | 0,53±0,03 | 0,47±0,03 |
| Креатинин, мкмоль/л | 23,6±0,33 | 25,5±1,56 | 24,4±0,99 |
| Мочевая кислота, мкмоль/л | 362,84±39,94 | 292,2±8,97 | 348,16±35,79 |
| Глюкоза, ммоль/л | 13,6±0,42 | 13,5±0,14 | 11,3±1,23 |
| Холестерин, ммоль/л | 2,5±0,27 | 2,8±0,35 | 2,9±0,22 |
| Триглицериды, ммоль/л | 0,44±0,07 | 0,35±0,08 | 0,36±0,03 |
| АЛАТ, МЕ/мл | 1,5±0,52 | 1,07±0,27 | 1,2±0,15 |
| АСАТ, МЕ/мл | 257,1±43,25 | 211,3±19,81 | 237,4±16,36 |
| Кальций, ммоль/л | 2,7±0,08 | 2,47±0,08 | 2,64±0,04 |
| Фосфор, ммоль/л | 1,9±0,11 | 2,01±0,15 | 1,85±0,04 |
| Калий, ммоль/л | 5,55±0,18 | 5,5±0,37 | 5,05±0,51 |
| Натрий, ммоль/л | 149,33±0,88 | 151,0±2,08 | 152,33±1,45 |
| Хлор, ммоль/л | 110,33±1,86 | 114,3±1,76 | 116,33±0,67 |
Концентрация альбуминов в сыворотке крови птиц контрольной и 2 опытной группы была практически одинаковой, составив 9,7 и 9,6 г/л соответственно, а у птиц 1 опытной группы содержание этой белковой фракции было ниже контроля на 12,4%. Уровень глобулинов у цыплят 1 и 2 опытных групп уступал контролю соответственно на 8,9 и 7,5%. Соотношение альбуминов к глобулинам — А/Г индекс, составил в контрольной группе 0,45; в 1 опытной группе 0,44; во 2 опытной группе – 0,48, что свидетельствует о преобладании альбуминсинтезирующей функции печени у бройлеров, получавших исследуемую кормовую добавку.
Мочевина является одним из конечных продуктов белкового обмена птиц. Она представляет собой диамид угольной кислоты, образующийся в печени при обезвреживании аммиака, синтезируется специальной группой ферментов. Она не выполняет каких-либо функций в крови или во внутренних органах. Её уровень в крови — отражение баланса между скоростью синтеза в печени и скоростью выведения почками с мочой. Это соединение необходимо для безопасного выведения азота из организма. Нами установлено, что при дополнительном включении изучаемого кормового компонента в рацион уровень мочевины в сыворотке крови птиц практически соответствовал контролю, составив 0,53 ммоль/л. При замене кормового антибиотика на исследуемый фактор в рационе цыплят наблюдали снижение данного метаболита в сыворотке крови бройлеров по сравнению с контролем на 6,0%.
Креатинин — это важное химическое соединение в организме, образующееся в результате распада белковых молекул, и регулирующее биоэнергетику на уровне митохондрий. Это вещество представляет собой неотъемлемую часть остаточного азота. Организм ничего с креатинином сделать не может, кроме как вывести его. Накапливаемый в крови сверх меры креатинин начинает оказывать токсическое воздействие на системы организма, постепенно увеличивая их отравление. Исходя из данных научно-хозяйственного опыта, видно, что количество креатинина в сыворотке крови у цыплят подопытных групп находилось в пределах 23,6-25,5 мкмоль/л и соответствовало физиологической норме.
Основным конечным продуктом белкового обмена у птиц является мочевая кислота. В наших исследованиях установлено, что при дополнительном включении в рацион экспериментальной кормовой добавки и при замене этим препаратом кормового антибиотика отмечается тенденция снижения количества мочевой кислоты в сыворотке крови, что свидетельствует о лучшем усвоении белкового азота в организме птиц и подтверждается более высокими приростами живой массы. Так, содержание мочевой кислоты в сыворотке крови цыплят 1 опытной группы было ниже, чем в контроле на 19,46%, а у цыплят 2 опытной группы – на 4,04%.
Глюкоза является одним из важных метаболитов энергетического обмена, её содержание в сыворотке крови цыплят 1 опытной группы соответствовало контролю, а у бройлеров 2 опытной группы было ниже – на 16,9 %.
Липидный обмен оценивали по содержанию холестерина и триглицеридов в сыворотке крови цыплят. Холестерин содержится во всех клетках животного и необходим уже на самых ранних стадиях развития. Причём его общее количество в организме остаётся примерно на одном уровне при любых экзогенных воздействиях, посредством гомеостаза организма [88]. Нами установлено, что уровень холестерина у птиц не имел существенных отличий между группами, составив в контрольной группе 2,5 ммоль/л, в 1 опытной группе – 2,8 ммоль/л, во 2 опытной – 2,9 ммоль/л. В отношении содержания триглицеридов установлена тенденция их снижения у цыплят 1 и 2 опытных групп, по сравнению с контролем, соответственно на 20,5 и 18,2 %, что говорит об активизации липидного обмена в организме птицы и согласуется с исследованиями других авторов [89,90].
Ферменты АЛАТ и АСАТ занимаются транспортировкой аминокислот из одной молекулы в другую. Аминокислоты играют основную роль в построении белков. В АЛАТ находится аминокислота — аланин (отсюда и название АЛАТ), а в АСАТ присутствует аспарагин и фермент пиридоксин (витамин В 6). Имеется перечень органов, в которых синтезируются данные ферменты, по убыванию, т.е. в списке на первом месте будет стоять орган, где фермента больше всего. АЛАТ присутствует в: печени, почках, сердце, в скелетных мышцах. АСАТ присутствует в: сердце, печени, клетках головного мозга, мышечной ткани скелетной мускулатуры. Если происходит разрушение клеток, значит, нарушается их целостность, и ферменты попадают в кровь. В зависимости от того, какого фермента больше в анализе крови, можно сделать вывод о состоянии соответствующего органа. Фермент АЛАТ является специфическим маркером функционального состояния печени, повышение его связано с гепатитами разной этиологии. Повышение активности АСАТ характерно при нарушении функций сердечно-сосудистой системы. В наших исследованиях уровень данных ферментов не имел достоверных различий между группами. Отмечено снижение уровня АЛАТ у цыплят-бройлеров 1 опытной группы по сравнению с контролем на 28,7%, а у цыплят 2 опытной группы на 20%. Количество АСАТ в сыворотке крови бройлеров 1 и 2 опытных групп было меньше, по сравнению с контролем на 17,8 и 7,7%.
Анализ минерального состава сыворотки крови показал, что количество кальция у птиц, участвующих в эксперименте, соответствовало физиологической норме, при этом в 1 и 2 опытной группе бройлеров содержание этого макроэлемента было ниже контроля на 8,5 и 2,2%.
При оценке количества фосфора в крови наблюдали повышение его уровня у птиц 1 опытной группы на 5,8% и незначительное снижение у сверстников 2 опытной группы по отношению к контрольному значению на 2,63%.
Содержание калия в крови подопытных птиц варьировало в пределах 5,05-5,55 ммоль/л и соответствовало физиологическому уровню.
Отмечена тенденция повышения в сравнении с контролем количества натрия в сыворотке крови птиц 1 и 2 опытных групп соответственно на 1,1 и 2,0% и хлора – на 3,6 и 5,4%.
Таким образом, проведенное биохимическое исследование крови цыплят-бройлеров позволило установить, что применение экспериментальной кормовой добавки при выращивании цыплят-бройлеров дополнительно к основному рациону и взамен кормового антибиотика не оказывает отрицательного влияния на обменные процессы в организме птиц. При этом использование добавки взамен кормового антибиотика приводит к улучшению усвоения белкового азота в организме бройлеров опытных групп, о чем свидетельствует снижение мочевой кислоты в сыворотке крови и подтверждается увеличением использованием азота корма (по результатам балансового опыта) и повышением прироста живой массы цыплят опытных групп.
3.2.11 Морфогистологическое состояние внутренних органов
Морфогистологическое состояние внутренних органов
цыплят-бройлеров контрольной группы
При гистологическом исследовании внутренних органов птицы контрольной группы в возрасте 22 дней патологических процессов, усугубляющих клиническое состояние птицы, обнаружено не было.
При исследовании печени видно, что архитектоника органа не нарушена, печеночные дольки, печеночные балки в строгом соответствии с анатомическим строением, имеют место незначительные полиморфноклеточные инфильтраты в системе триады (рис. 4), что прослеживается во всех трех образцах.
Рисунок 4 — Печень птицы контрольной группы 22-дневного возраста
В почках бройлеров контрольной группы на фоне зернистой дистрофии нефроцитов, свидетельствующей о нарушении белкового обмена в организме птицы, так же, как в печени, обнаружены инфильтраты между канальцами (рис.5), что можно отнести к воспалительному процессу.
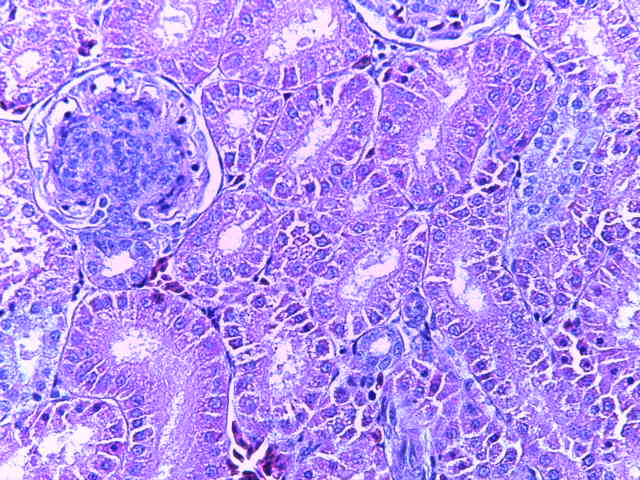
Рисунок 5 – Почки птицы контрольной группы 22-дневного возраста
Такой же воспалительный процесс, как и в почках, обнаружен и в сердечной мышце (рис.6).
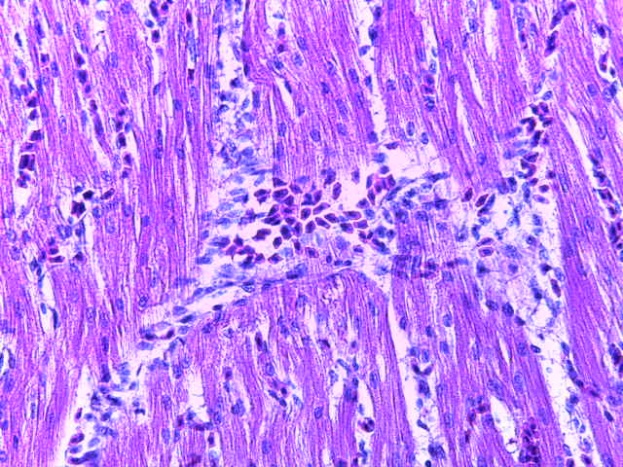
Рисунок 6 — Сердце птицы контрольной группы 22-дневного возраста
При оценке селезенки видно, что лимфоидные фолликулы четко контурированы, в них видна пролиферация лимфобластов, что характерно для иммунной реакции организма (рис.7).
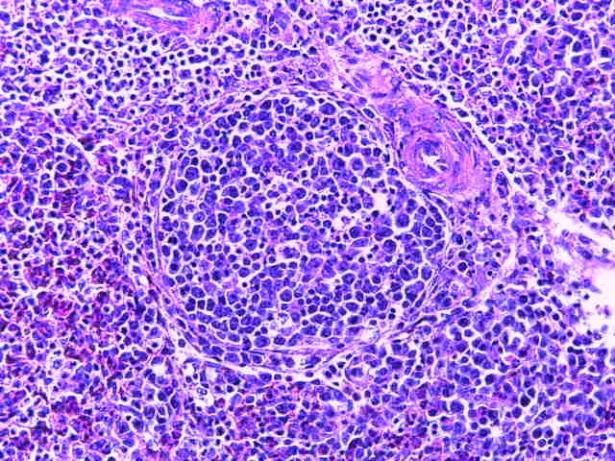
Рисунок 7 — Селезенка птицы контрольной группы 22-дневного возраста
В фабрициевой бурсе птиц контрольной группы эпителий равномерно выстилает просвет, границы слоев в фолликулах четко выражены, сосуды межуточной соединительной ткани равномерно развиты (рис. 8,9). У двух особей отмечены процессы начала инволюции (рис. 10).
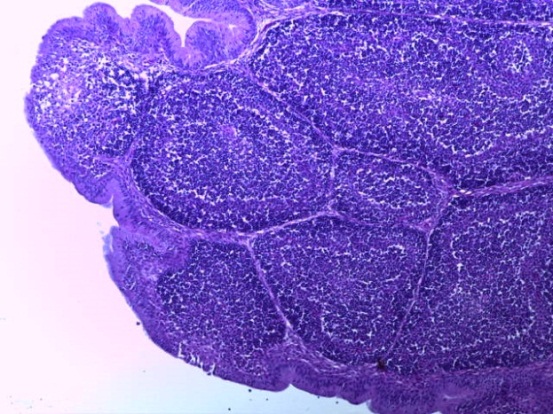
Рисунок 8 — Фабрициева бурса птицы контрольной группы
22-дневного возраста
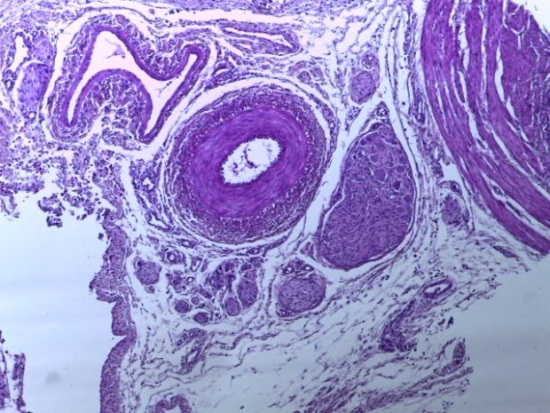
Рисунок 9 — Фабрициева бурса птицы контрольной группы
22-дневного возраста
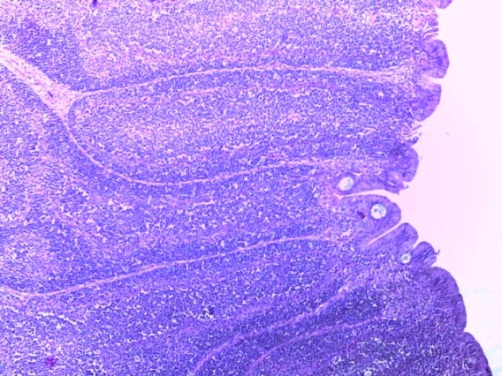
Рисунок 10 — Селезенка птицы контрольной группы 22-дневного возраста
В двенадцатиперстной кишке бройлеров все слои четко выражены, ворсинки, выстланные эпителием, имеют ограниченную наружную мембрану, бокаловидные клетки в состоянии умеренной секреции (рис.11).
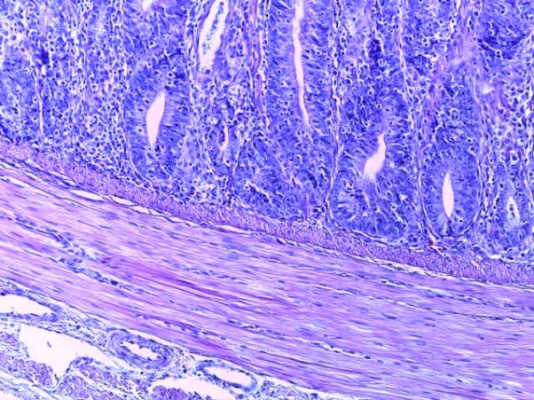
Рисунок 11 — Двенадцатиперстная кишка птицы контрольной группы
22-дневного возраста
Поджелудочная железа цыплят-бройлеров контрольной группы в возрасте 22 дней находится в состоянии слабо выраженной секреции, островки Лангерганса не активизированы, наблюдается застой секрета в мелких протоках железы (рис.12).
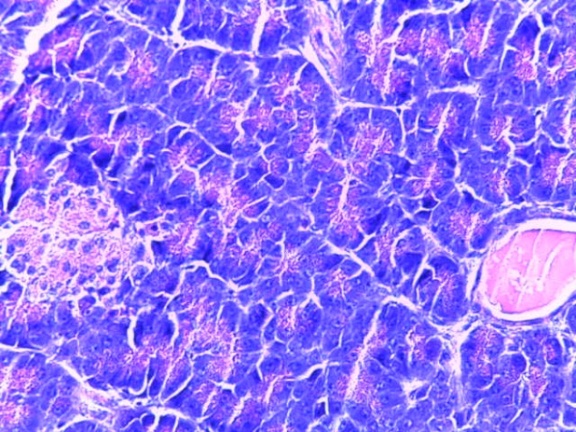
Рисунок 12 — Поджелудочная железа птицы контрольной группы
22-дневного возраста
В возрасте 38 дней в исследуемых органах контрольной птицы, наряду с физиологическими процессами отмечен ряд патологических изменений. Так, в печени у двух особей выявлены сальмонеллезные гранулемы (рис.13,14). В области триады отмечены значительные полиморфноклеточные инфильтраты у всех исследованных птиц (рис. 15), что свидетельствует о нарастающем воспалительном процессе.
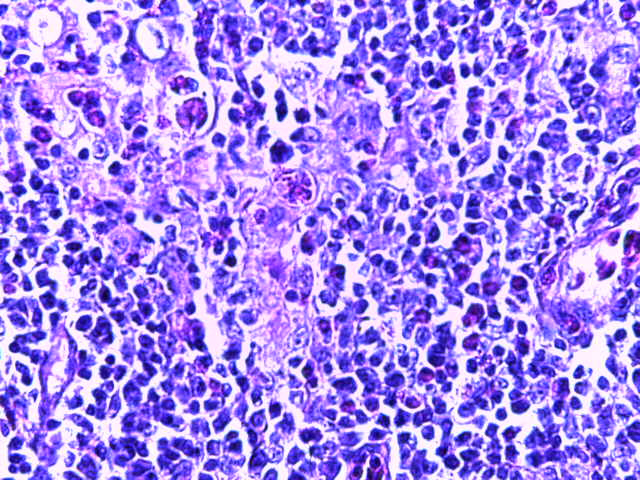
Рисунок 13 — Печень птицы контрольной группы 38-дневного возраста
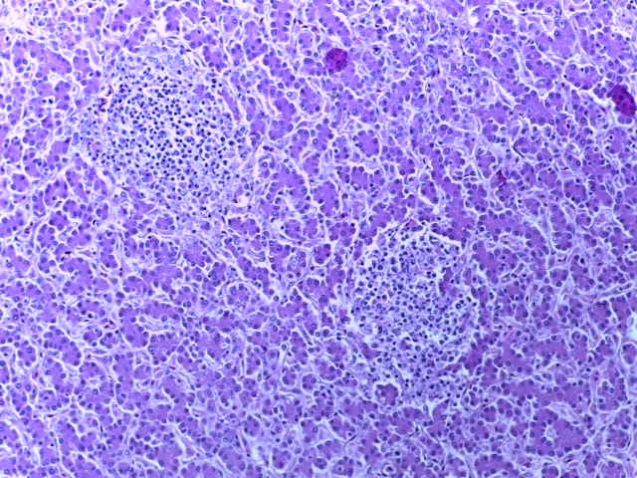
Рисунок 14 — Печень птицы контрольной группы 38-дневного возраста
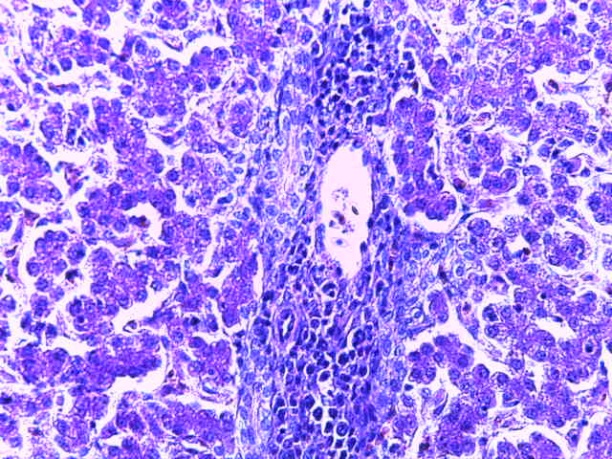
Рисунок 15 — Печень птицы контрольной группы 38-дневного возраста
В почках, наряду с зернистой дистрофией нефроцитов с одновременным отложением солей извести, выявлено нарушение гемодинамики в виде гиперемии сосудов микроциркуляторного русла и очагов кровоизлияний (Рис.16, 17, 18).
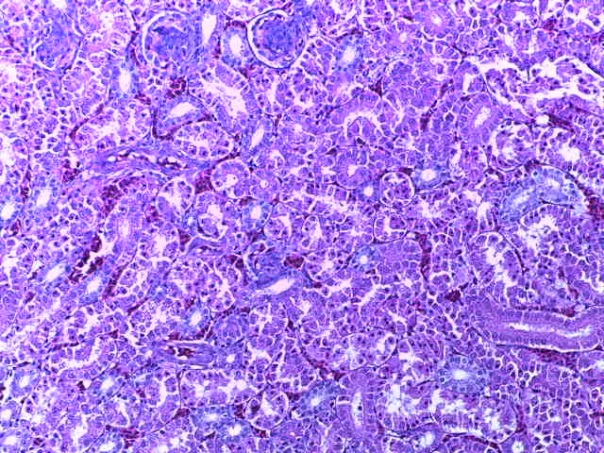
Рисунок 16 — Почки птицы контрольной группы 38-дневного возраста
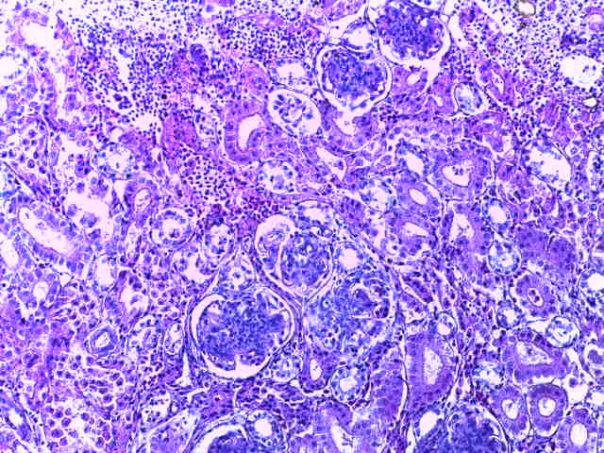
Рисунок 17 — Почки птицы контрольной группы 38-дневного возраста
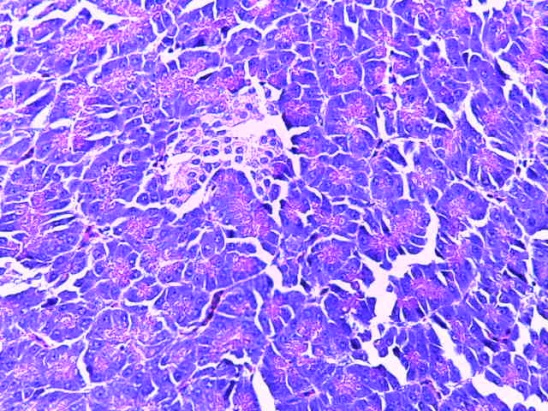
Рисунок 18 — Почки птицы контрольной группы 38-дневного возраста
Сердечная мышца характеризуется нарастанием признаков миокардита и наличия жировой клетчатки в межмышечной соединительной ткани (рис.19, 20).
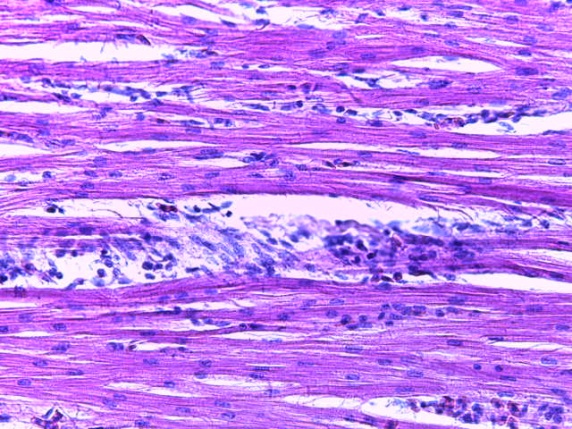
Рисунок 19 — Сердце птицы контрольной группы 38-дневного возраста
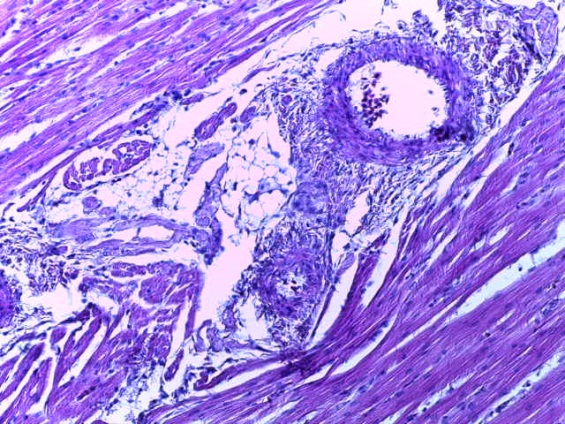
Рисунок 20 — Сердце птицы контрольной группы 38-дневного возраста
В селезенке выявлены признаки разрастания соединительной ткани, что характерно для продуктивного спленита (рис.21), наблюдаются единичные лимфоидные фолликулы – признак иммунодефицита (рис.22).
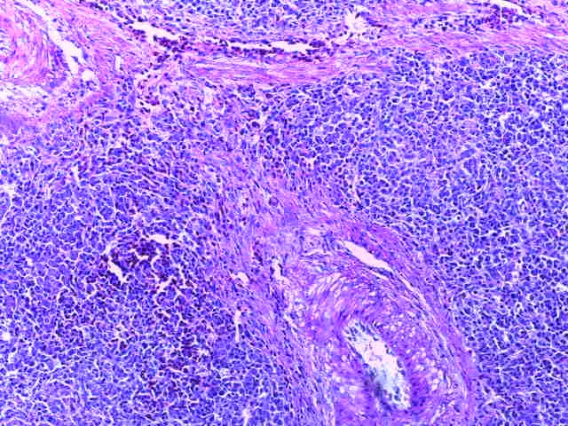
Рисунок 21 — Селезенка птицы контрольной группы 38-дневного возраста
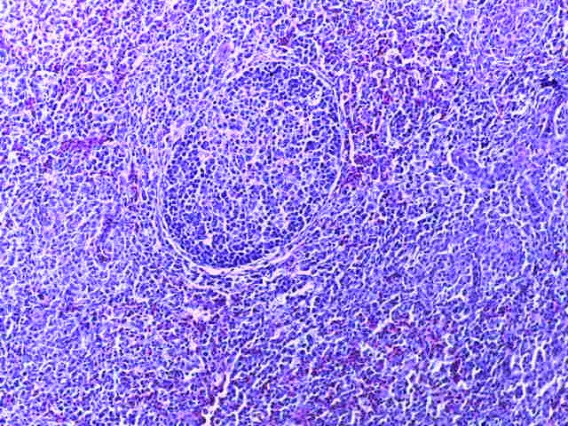
Рисунок 22 — Селезенка птицы контрольной группы 38-дневного возраста
Для фабрициевой бурсы характерно состояние умеренной инволюции (рис.23,24).
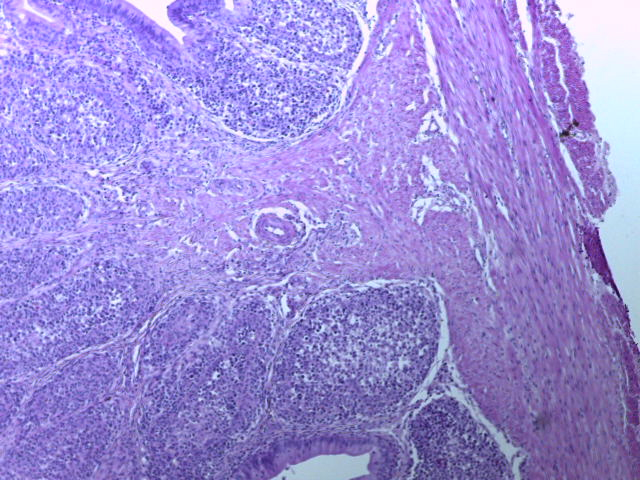
Рисунок 23 – Фабрициева бурса птицы контрольной группы
38-дневного возраста
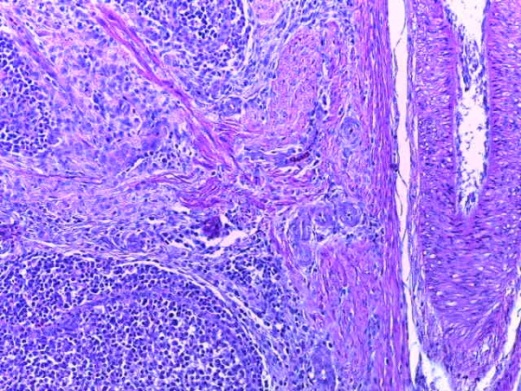
Рисунок 24 – Фабрициева бурса птицы контрольной группы
38-дневного возраста
При анализе тимуса наблюдается истончение коркового слоя (рис.25), некроз телец Гассаля (рис.26), жировая метаплазия, как признак иммунодефицита (рис. 27), при активизации одиночных телец Гассаля (рис.28) (признак компенсации).
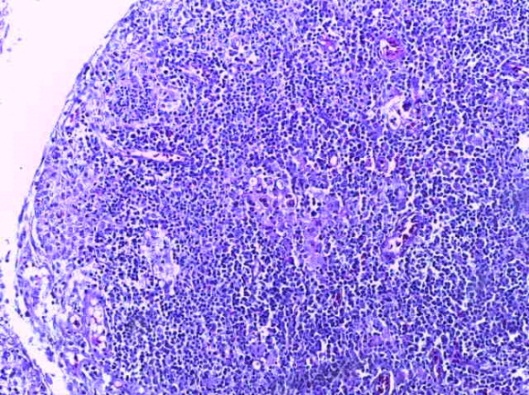
Рисунок 25 — Тимус птицы контрольной группы 38-дневного возраста
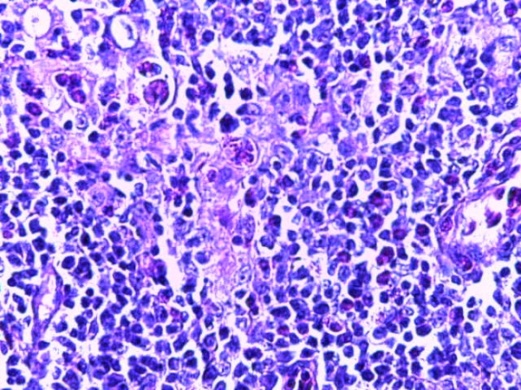
Рисунок 26 — Тимус птицы контрольной группы 38-дневного возраста
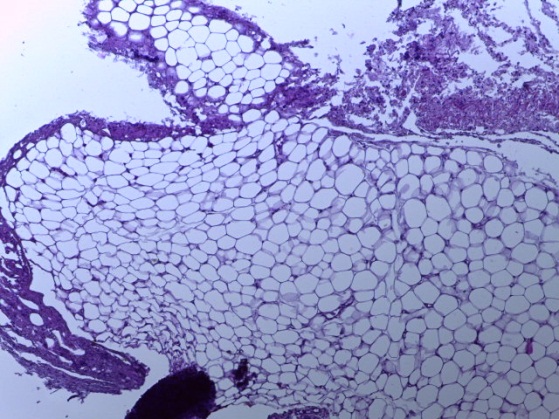
Рисунок 27 — Тимус птицы контрольной группы 38-дневного возраста
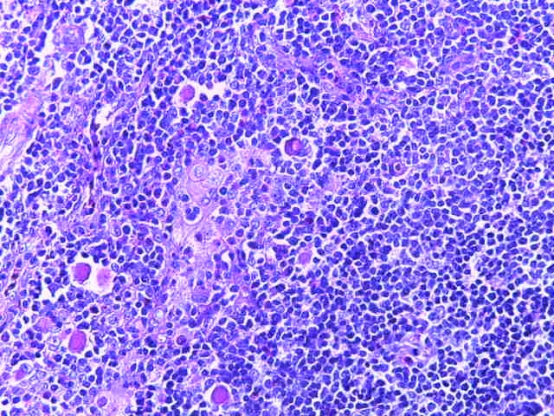
Рисунок 28 — Тимус птицы контрольной группы 38-дневного возраста
В 12-перстной кишке у всех трех петушков выявлено утолщение стенки и резкое усиление секреции бокаловидными клетками (рис.29,30) и явление катарального дуоденита (рис.31).
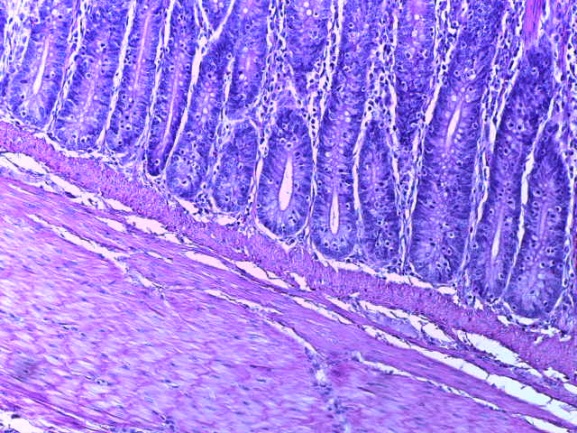
Рисунок 29 — 12-перстная кишка птицы контрольной группы
38-дневного возраста
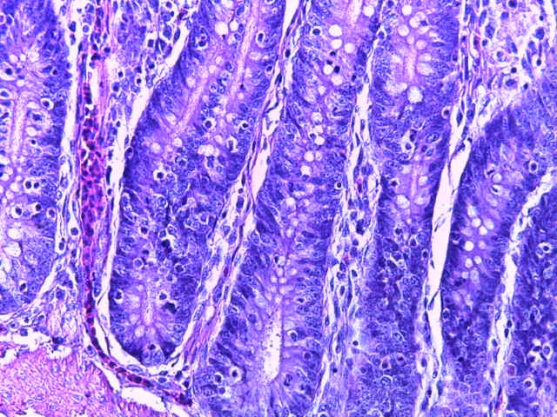
Рисунок 30 — 12-перстная кишка птицы контрольной группы
38-дневного возраста
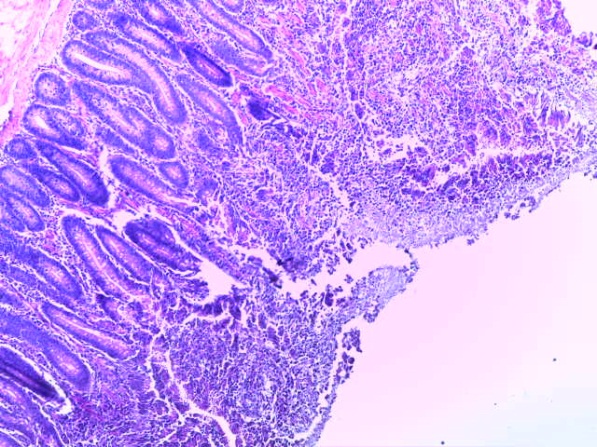
Рисунок 31 — 12-перстная кишка птицы контрольной группы
38-дневного возраста
В поджелудочной железе отмечена незначительная активизация островков Лангерганса (рис.32), тем не менее, большинство из них было со слабой секреторной активностью (рис.33).
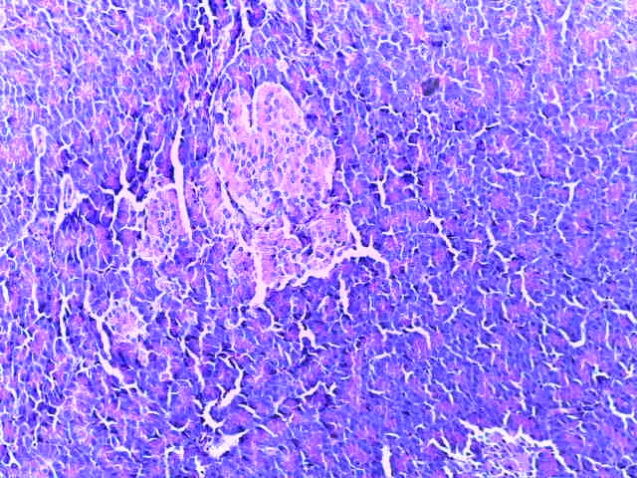
Рисунок 32 — Поджелудочная железа птицы контрольной группы
38-дневного возраста
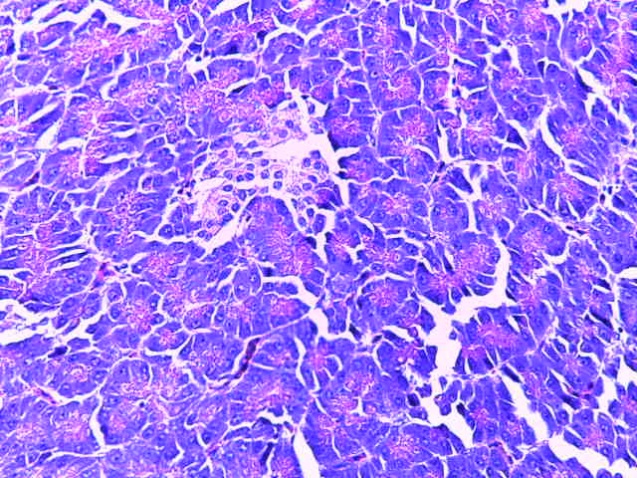
Рисунок 33 — Поджелудочная железа птицы контрольной группы
38-дневного возраста
Таким образом, комплекс процессов, обнаруженных в органах птицы контрольной группы, свидетельствует о том, что в организме цыплят-бройлеров к концу технологического цикла нарастают изменения, характерные для нарушения белково-жирового обмена и проявления воспалительных реакций в органах, регулирующих процессы гомеостаза и иммунологической защиты организма. Тем не менее, глубоких патологических процессов не было выявлено, поскольку наряду с некоторыми патологическими, прослеживались изменения компенсаторного характера.
Морфогистологическое состояние внутренних органов
цыплят-бройлеров первой опытной группы
В 1 опытной группе исследуемые внутренние органы птиц в возрасте 22 дней мало чем отличаются от таковых у сверстников контрольной группы в этот промежуток времени.
В печени наряду с зернисто-жировой дистрофией гепатоцитов(рис.34) отмечены процессы очаговой полиморфноклеточной инфильтрации (рис.35)
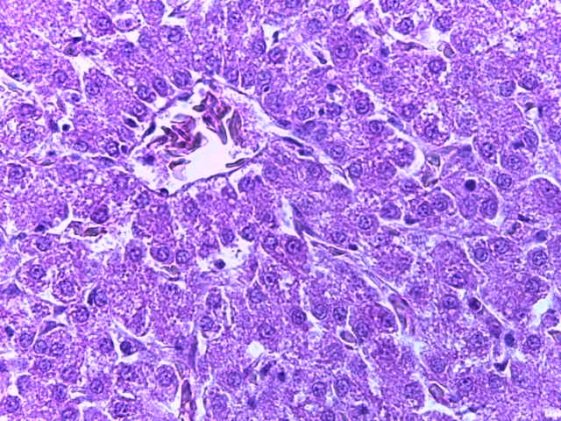
Рисунок 34 — Печень птицы 1 опытной группы 22-дневного возраста
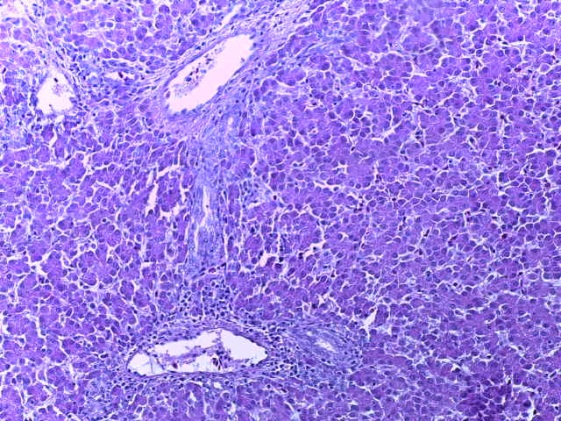
Рисунок 35 — Печень птицы 1 опытной группы 22-дневного возраста
В почках отмечена зернисто-жировая дистрофия нефроцитов на фоне нарушения процессов гемодинамики в виде гиперемии сосудов микроциркуляторного русла (рис. 36,37).
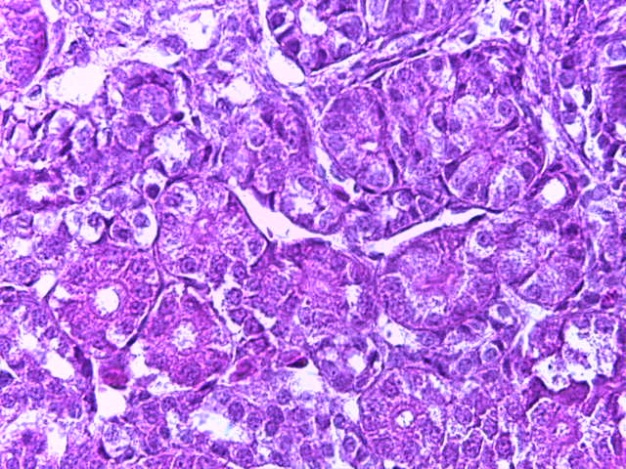
Рисунок 36 — Почки птицы 1 опытной группы 22-дневного возраста
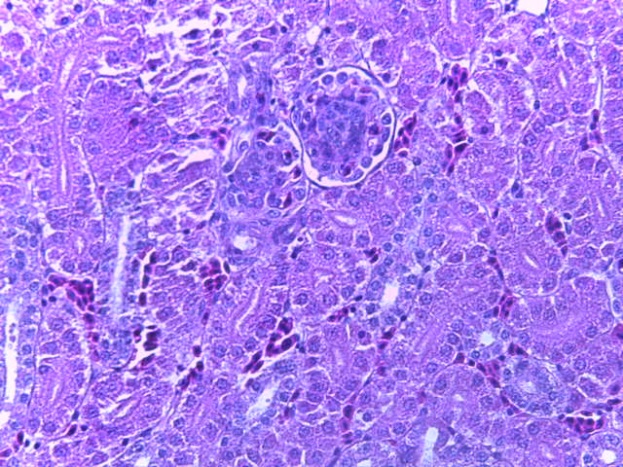
Рисунок 37 — Почки птицы 1 опытной группы 22-дневного возраста
Сердце характеризуется явлением миокардита и очаговых кровоизлияний (рис.38, 39).
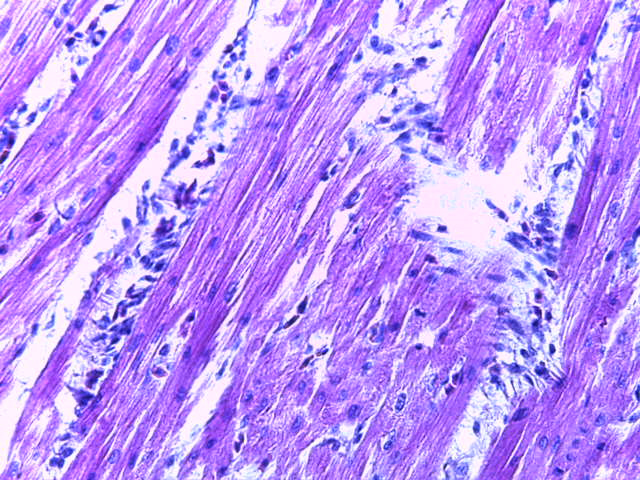
Рисунок 38 — Сердце птицы 1 опытной группы 22-дневного возраста
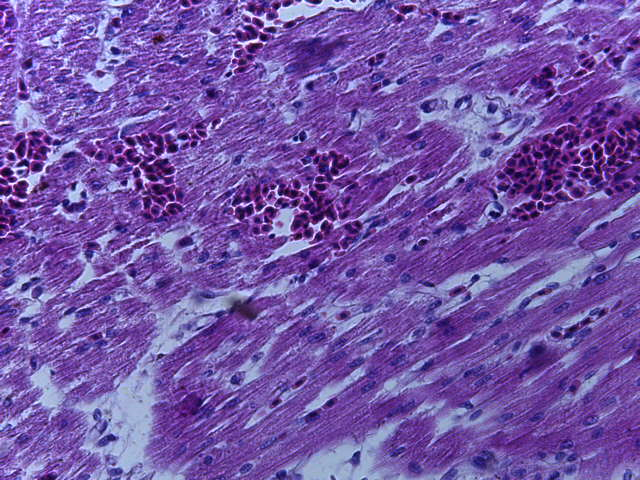
Рисунок 39 — Сердце птицы 1 опытной группы 22-дневного возраста
В фабрициевой бурсе отмечены незначительные процессы инволюции (рис.40,41).
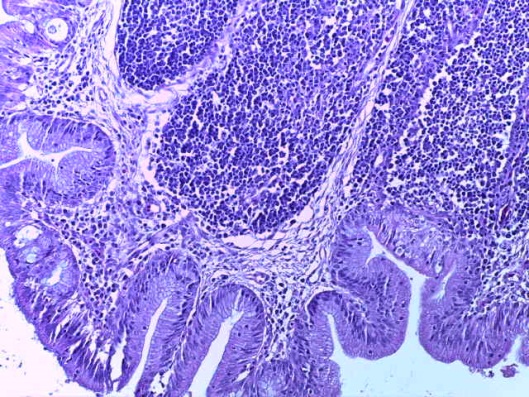
Рисунок 40 — Фабрициева бурса птицы 1 опытной группы
22-дневного возраста
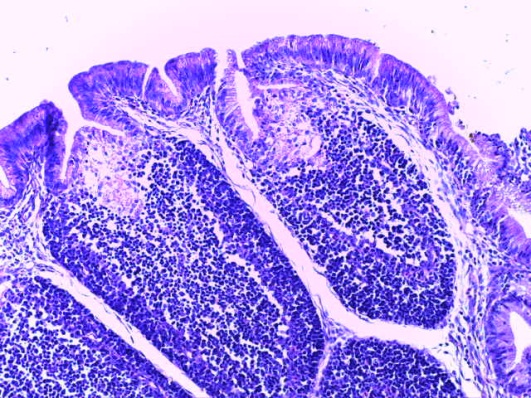
Рисунок 41 — Фабрициева бурса птицы 1 опытной группы
22-дневного возраста
В селезенке отмечено незначительное количество оформленных лимфоидных фолликулов (рис.42)
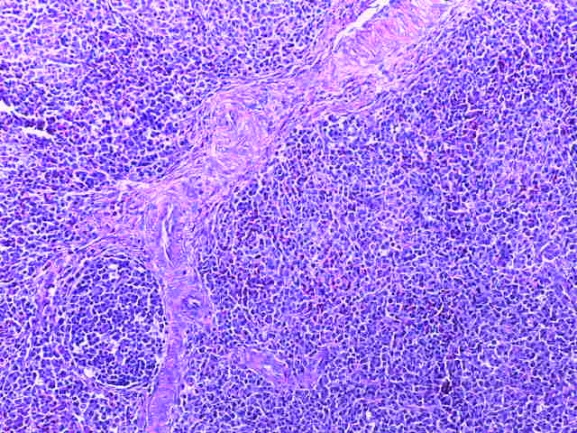
Рисунок 42 — Селезенка птицы 1 опытной группы 22-дневного возраста
В 12-перстной кишке отмечали усиление секреции (рис.43), а в поджелудочной железе – застой секрета в протоках (рис.44).
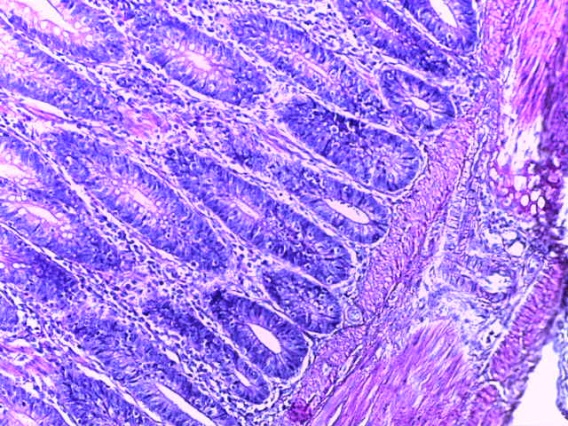
Рисунок 43 — 12-перстная кишка птицы 1опытной группы 22-дневного возраста
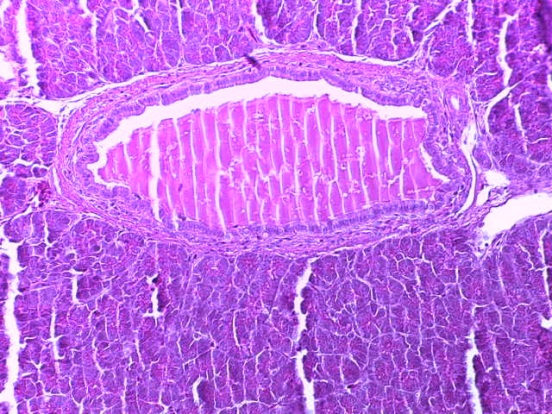
Рисунок 44 — Поджелудочная железа птицы 1 опытной группы
22-дневного возраста
В возрасте 38 дней в печени цыплят-бройлеров 1 опытной группы наблюдали незначительные инфильтраты в области триады (рис.45,46) и нарушение кровообращения в сосудах микроциркуляторного русла (рис.46).
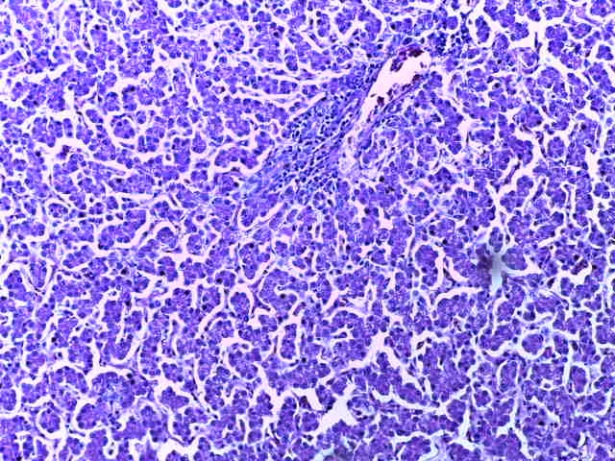
Рисунок 45 — Печень птицы 1 опытной группы 38-дневного возраста
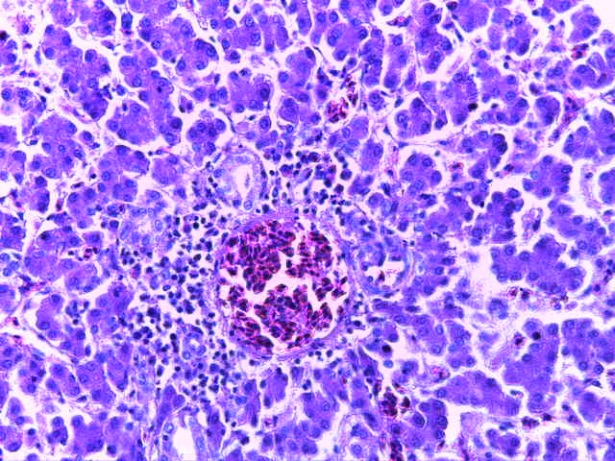
Рисунок 46 — Печень птицы 1 опытной группы 38-дневного возраста
В почках наблюдали незначительную зернистую дистрофию в эпителии извитых канальцев первого порядка (рис.47).
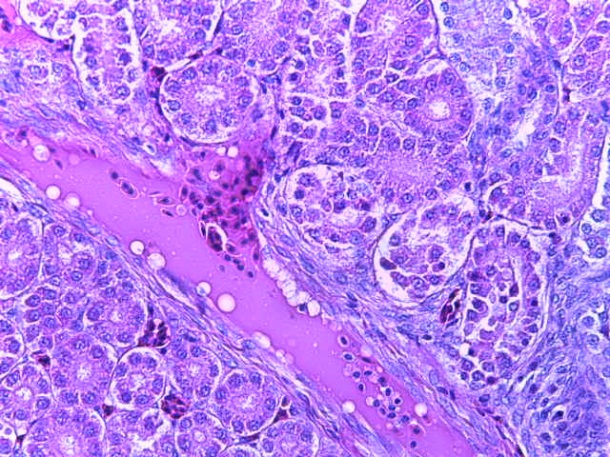
Рисунок 47 — Почки птицы 1 опытной группы 38-дневного возраста
В сердце, также, как и в почках отмечена зернистая дистрофия кардиомиоцитов и признаки очагового миокардита (рис.48, 49).
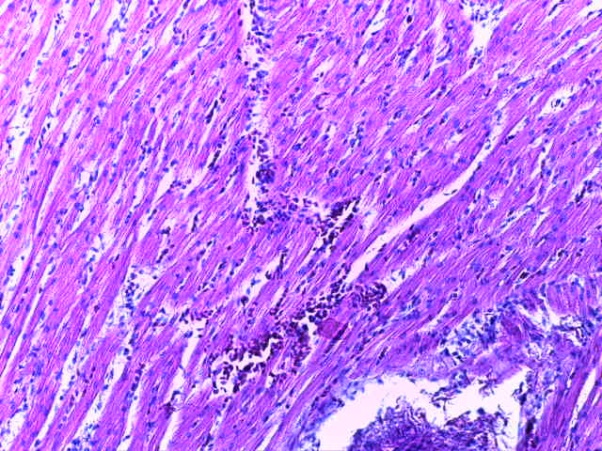
Рисунок 48 — Сердце птицы 1 опытной группы 38-дневного возраста
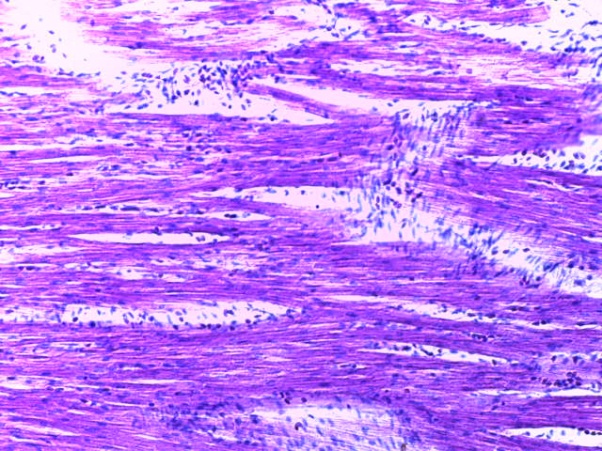
Рисунок 49 — Сердце птицы 1 опытной группы 38-дневного возраста
В органах иммунной системы выявлены процессы активизации образования лимфоидных фолликулов селезенки (рис.50, 51).
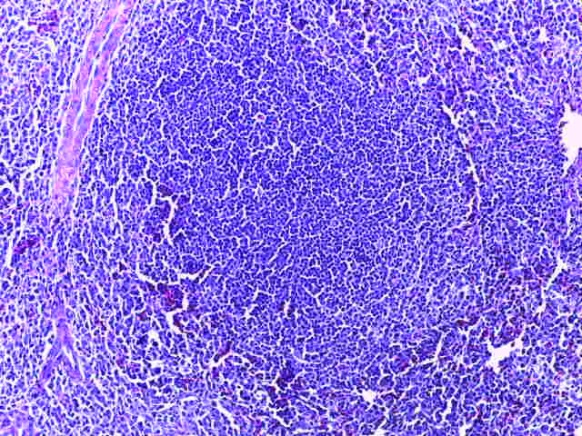
Рисунок 50 — Селезенка птицы 1 опытной группы 38-дневного возраста
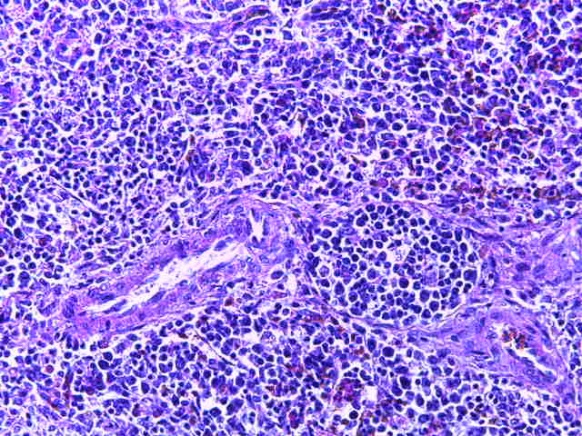
Рисунок 51 — Селезенка птицы 1 опытной группы 38-дневного возраста
Фабрициева бурса была в состоянии начала процессов инволюции (рис.52). У двух особей данный процесс был более интенсивным в виде разрастания соединительной ткани (рис.53) и поликистоза (рис. 54).
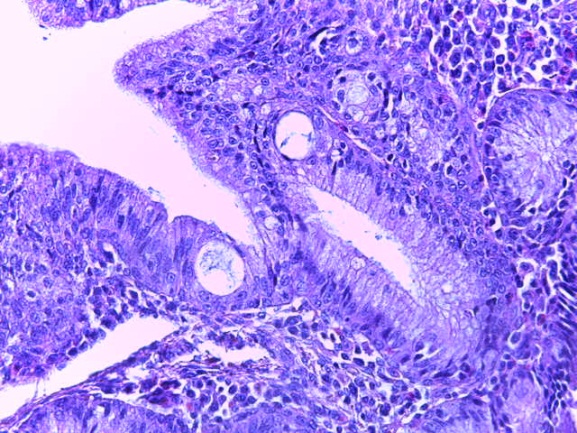
Рисунок 52 — Фабрициева бурса птицы 1 опытной группы 38-дневного возраста
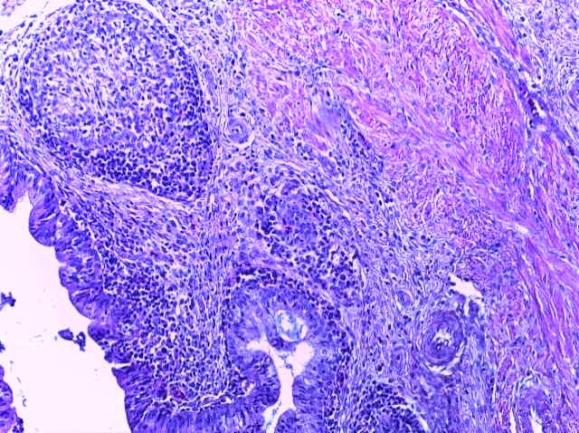
Рисунок 53 — Фабрициева бурса 1 опытной группы 38-дневного возраста
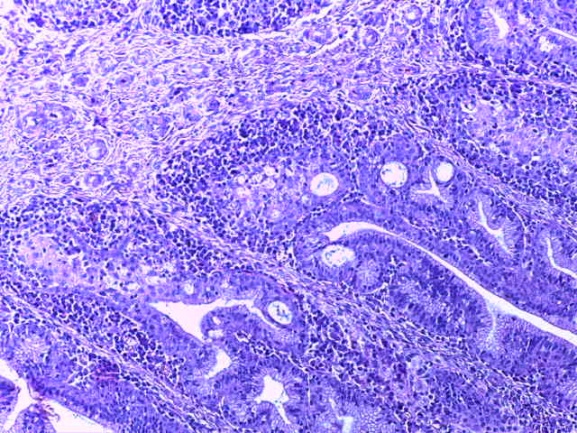
Рисунок 54 — Фабрициева бурса птицы 1 опытной группы 38-дневного возраста
В тимусе бройлеров процессов инволюции не отмечено, наблюдалось равномерное распределение коркового и мозгового вещества (рис.55), что свидетельствует о сохранении иммунного статуса птицы к концу технологического цикла.
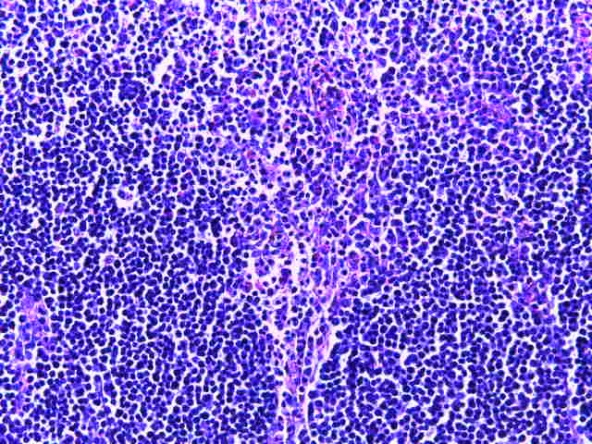
Рисунок 55 — Тимус птицы 1 опытной группы 38-дневного возраста
12-перстная кишка цыплят находилась в состоянии незначительной гиперсекреции желез (рис.56), в поджелудочной железе наблюдалась активизация островков Лангерганса (рис.57).
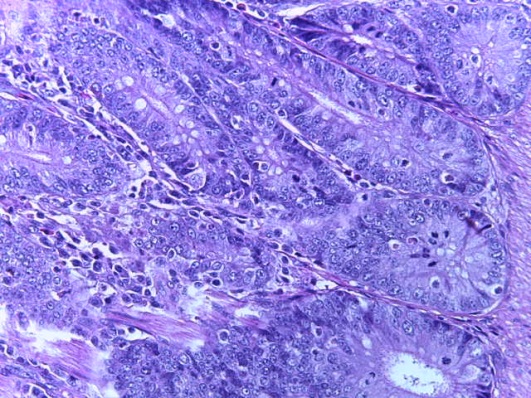
Рисунок 56 — 12-перстная кишка птицы 1 опытной группы 38-дневного возраста
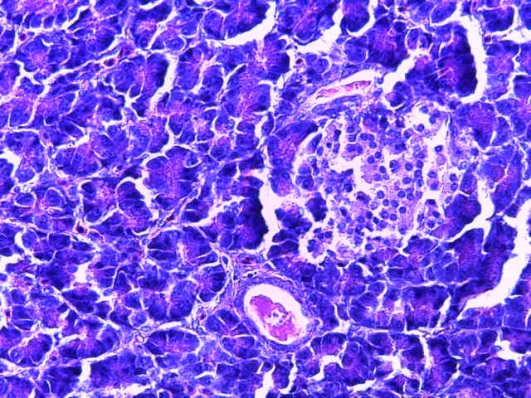
Рисунок 57 — Поджелудочная железа птицы 1 опытной группы
38-дневного возраста
Морфогистологическое состояние внутренних органов
цыплят-бройлеров второй опытной группы
В печени цыплят 2 опытной группы в возрасте 22 дней наблюдали незначительные полиморфно-клеточные инфильтраты в системе триады (рис.58) в одном из образцов, в двух других образцах — без изменений.
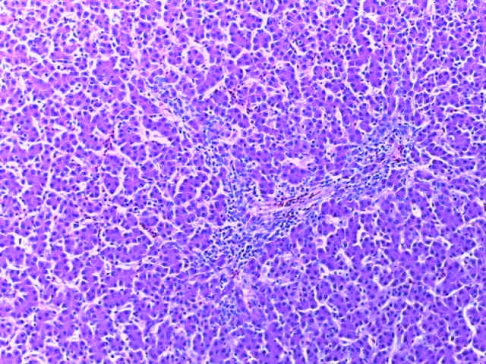
Рисунок 58 — Печень птицы 2 опытной группы 22-дневного возраста
В почках бройлеров отмечали незначительную зернистую дистрофия нефроцитов (рис.59,60).
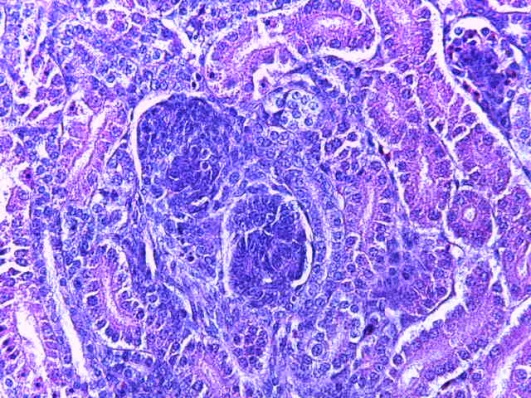
Рисунок 59 — Почки птицы 2 опытной группы 22-дневного возраста
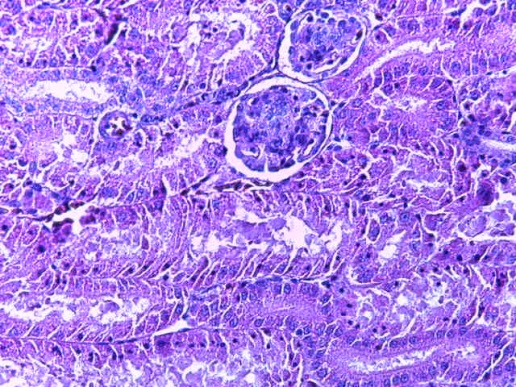
Рисунок 60 — Почки птицы 2 опытной группы 22-дневного возраста
В сердце птиц 2 опытной группы была отмечена зернистая дистрофия кардиомиоцитов (рис. 61).
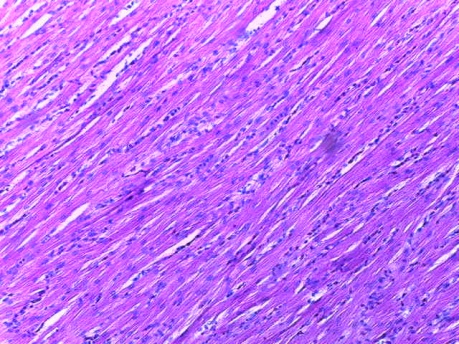
Рисунок 61 — Сердце птицы 2 опытной группы 22-дневного возраста
Селезенка характеризовалась активизацией лимфоидных фолликулов (рис.62,63).
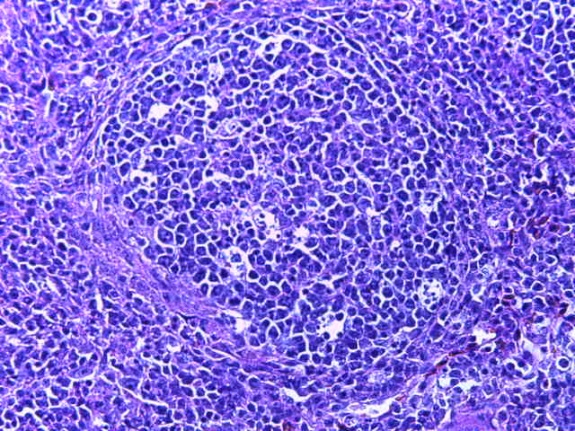
Рисунок 62 — Селезенка птицы 2 опытной группы 22-дневного возраста
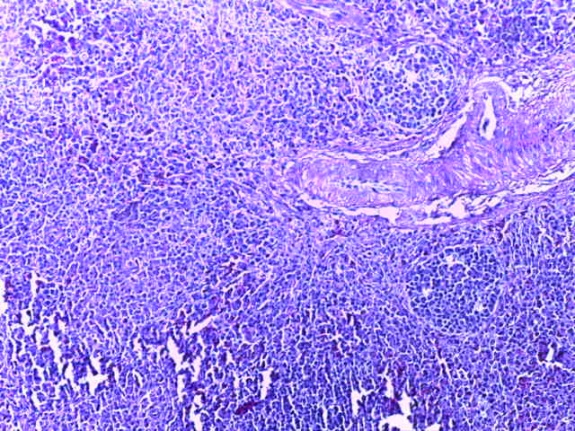
Рисунок 63 — Селезенка птицы 2 опытной группы 22-дневного возраста
В тимусе птиц отмечена пролиферация молодых телец Гассаля (рис.64).
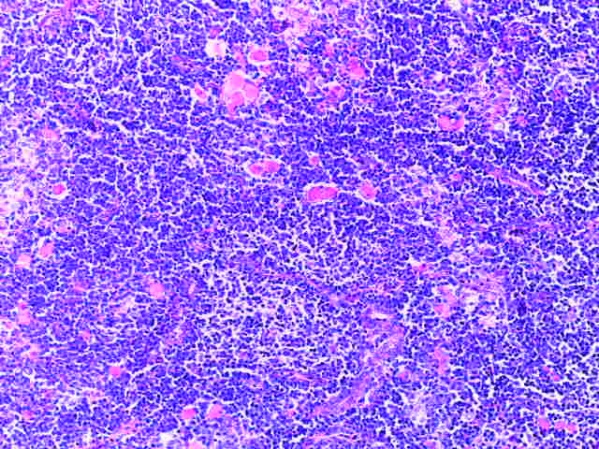
Рисунок 64 — Тимус птицы 2 опытной группы 22-дневного возраста
В фабрициевой бурсе отмечали некоторое разрастание соединительнотканной стромы, как признак начала инволютивных процессов (рис.65).
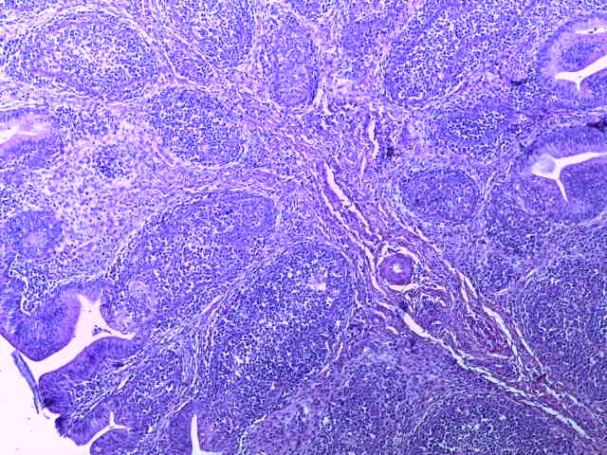
Рисунок 65 — Фабрициева бурса птицы 2 опытной группы 22-дневного возраста
В 12-перстной кишке ворсинки были четко контурированы (рис.66), с активизацией секреции бокаловидными клетками (рис.67).
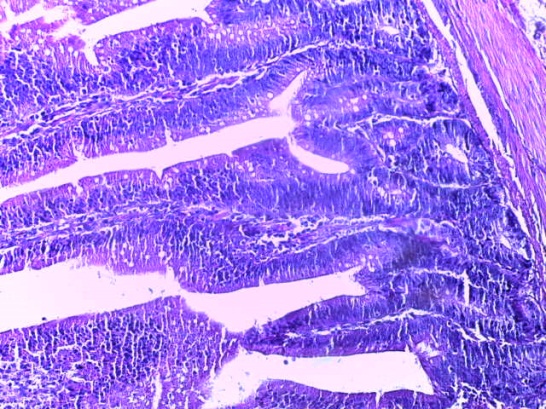
Рисунок 66 — 12-перстная кишка птицы 2 опытной группы 22-дневного возраста
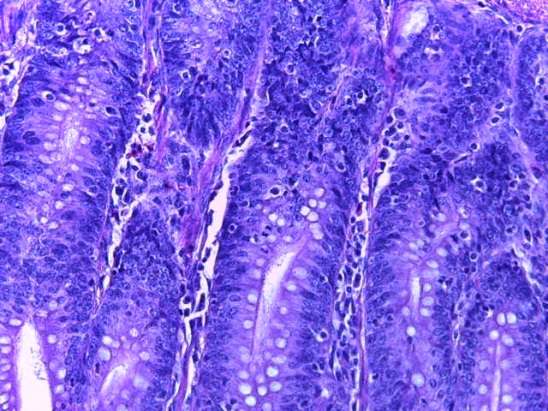
Рисунок 67 — 12-перстная кишка птицы 2 опытной группы 22-дневного возраста
В поджелудочной железе отмечено увеличение размеров и активизация секреции в островках Лангерганса (рис.68).
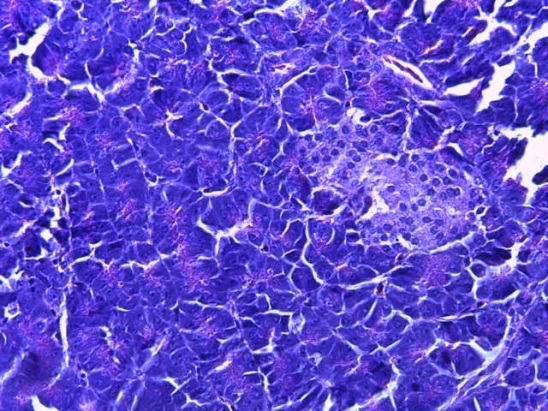
Рисунок 68 — Поджелудочная железа птицы 2 опытной группы
22-дневного возраста
В возрасте 38 дней у цыплят 2 опытной группы в печени архитектоника была сохранена, центролобулярно в гепатоцитах отмечено проявление мелкокапельной жировой дистрофии и незначительное расширение синусоидов печени (рис.69, 70, 71).
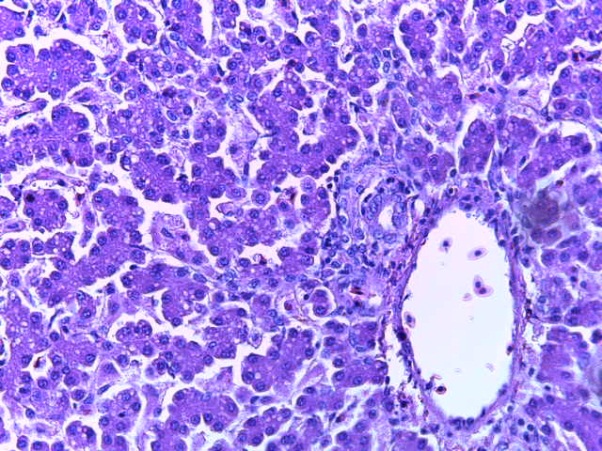
Рисунок 69 — Печень птицы 2 опытной группы 38-дневного возраста
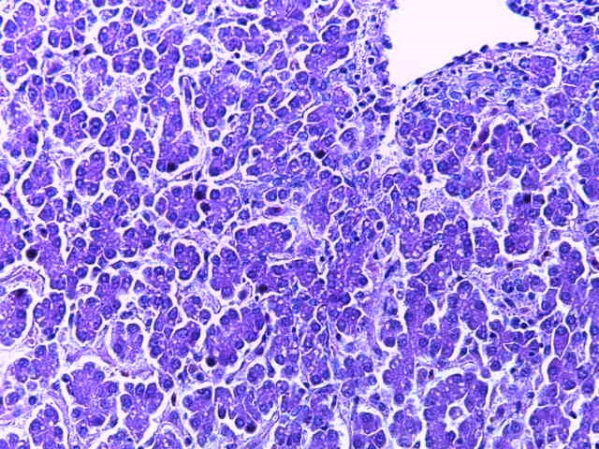
Рисунок 70 — Печень птицы 2 опытной группы 38-дневного возраста
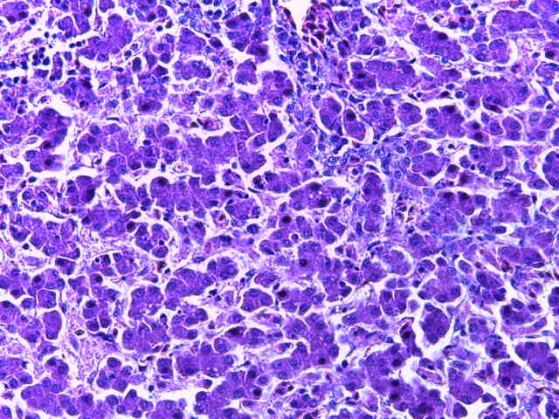
Рисунок 71 — Печень птицы 2 опытной группы 38-дневного возраста
В почках птиц отмечали сохранение зернистой дистрофии нефроцитов без нарушения общего строения органа (рис. 72, 73).
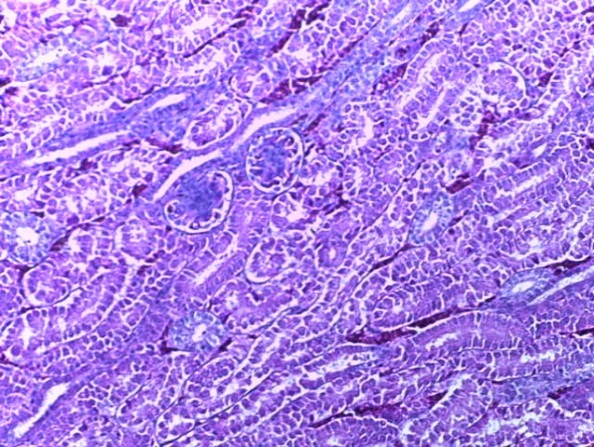
Рисунок 72 — Почки птицы 2 опытной группы 38-дневного возраста
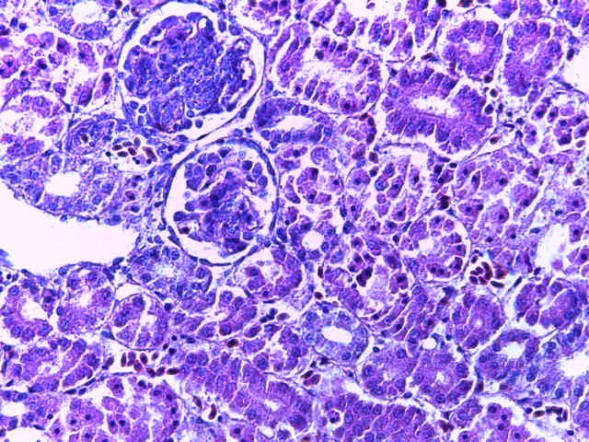
Рисунок 73 — Почки птицы 2 опытной группы 38-дневного возраста
Фолликулы селезенки были четко контурированы и активизированы (рис. 74, 75).
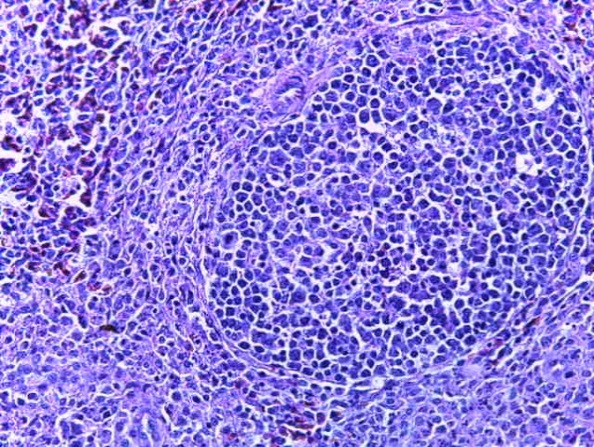
Рисунок 74 — Селезенка птицы 2 опытной группы 38-дневного возраста
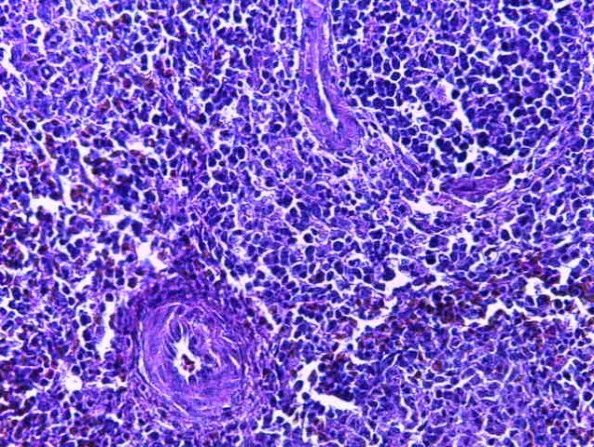
Рисунок 75 — Селезенка птицы 2 опытной группы 38-дневного возраста
В фабрициевой бурсе бройлеров были слабо выражены процессы инволюции при сохранении структуры органа (рис. 76, 77).
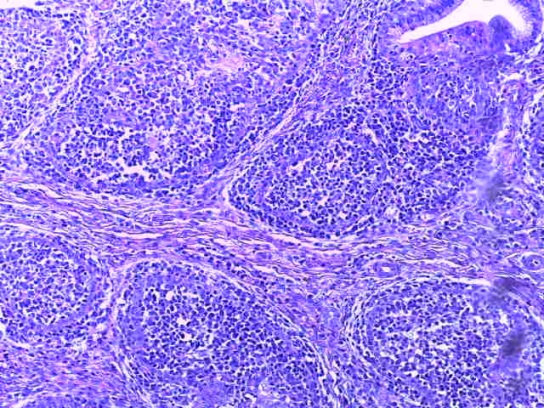
Рисунок 76 — Фабрициева бурса птицы 2 опытной группы 38-дневного возраста
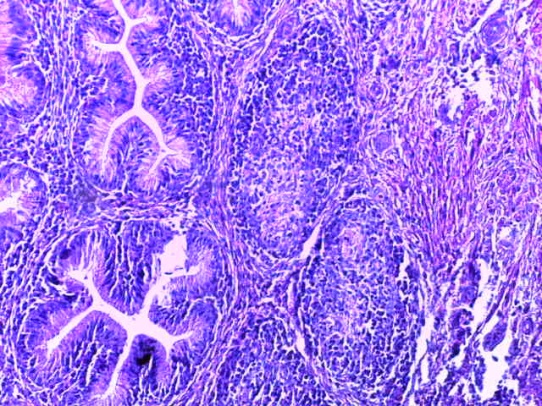
Рисунок 77 — Фабрициева бурса птицы 2 опытной группы 38-дневного возраста
В тимусе бройлеров наблюдали процессы инволюции в виде жировой метаплазии и выборочного некроза телец Гассаля в одном из образцов (рис.78).
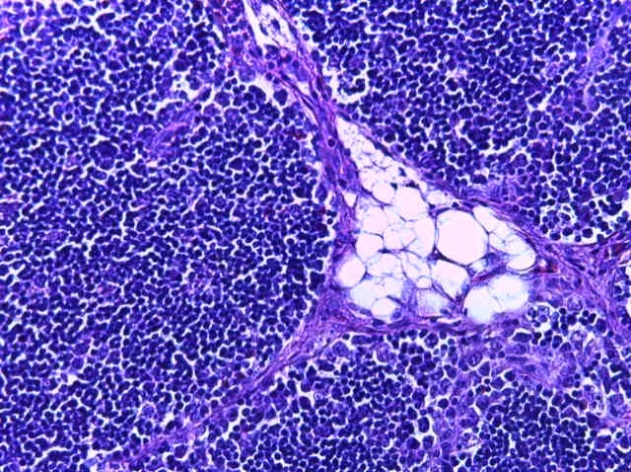
Рисунок 78 — Тимус птицы 2 опытной группы 38-дневного возраста
12-перстная кишка имела четкое очертание ворсинок без признаков воспалительного процесса с умеренной секрецией (рис.79).
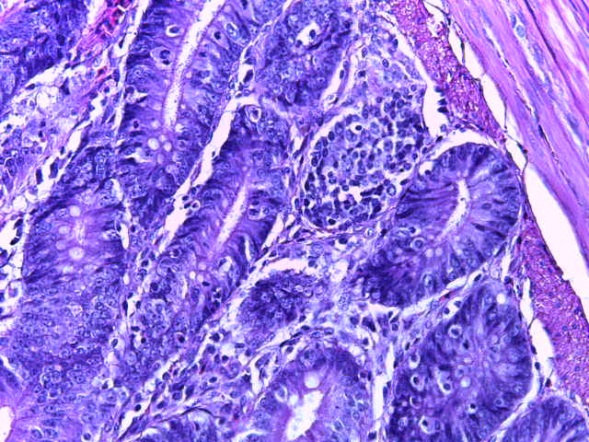
Рисунок 79 — 12-перстная кишка птицы 2 опытной группы 38-дневного возраста
Во все образцах поджелудочной железы была выражена активизация секреции островков Лангерганса (рис.80).
Рисунок 80 — Поджелудочная железа птицы 2 опытной группы
38-дневного возраста
Таким образом, сравнительный анализ гистологических изменений, обнаруженных в органах птицы контрольной и опытных групп в разные промежутки времени в течение технологического цикла, свидетельствует о том, что наиболее физиологичными были изменения, отмеченные в образцах 2 опытной группы, получавшей взамен кормового антибиотика препарат, включающий фитобиотики и защищенные органические кислоты. В органах иммунной системы цыплят этой группы прослеживались процессы, характеризующиеся стойким иммунитетом. В паренхиматозных органах на фоне зернистой дистрофии, которую можно отнести за счет некоторого белкового перекармливания птицы, и которая носит обратимый характер, не проявляющийся макроскопическими признаками нарушения внешнего состояния органов, не выявлено патологических процессов. В органах пищеварительного тракта, а именно в слизистой оболочке 12-перстной кишки цыплят отмечена умеренная секреция, то есть процессы переваривания корма при активной работе поджелудочной железы обеспечивают нормальную жизнедеятельность птицы без проявления патологических процессов.
В 1 опытной группе, также не выявлено патологических процессов в виде воспалительных и некробиотических изменений, и она по сравнению с контрольной группой выглядела более позитивной, тем не менее, общий комплекс процессов, отмеченных во 2 опытной группе, имеет преимущества перед 1 опытной группой.
3.2.12 Экономическая эффективность работы по данным научно-хозяйственного опыта
В таблице 21 представлены результаты экономической эффективности выращивания цыплят-бройлеров по данным научно-хозяйственного опыта.
Введение исследуемой кормовой добавки в 1 и 2 опытной группах и кормовых антибиотиков в контрольной и 1 опытной группе потребовало дополнительных вложений денежных средств на выращивание птицы в расчете на 1000 голов: у петушков-бройлеров в контрольной группе их стоимость составила — 471,1 рубля, в 1 опытной группе — 2194,4 рубля, во 2 опытной группе — 1907,8 рублей; у курочек-бройлеров в контрольной группе — 426,1 рубля в 1 опытной группе — 2021,7 рубля, во 2 опытной группе — 1675,8 рублей.
Дополнительный доход на одну посаженную голову в 1 опытной группе составил у курочек 2,95 рубля, в группе петушков дополнительного дохода на 1 посаженную голову не получили, показатель был ниже значения контроля на 1,51 рубля. Во 2 опытной группе у петушков дополнительный доход на 1 посаженную голову составил 14,57 рубля, в группе курочек данный показатель составил 7,58 рублей.
Рентабельность производства мяса цыплят-бройлеров, при использовании исследуемого препарата, совместно с кормовым антибиотиком (1 опытная группа), снизилась по сравнению с контролем в группе петушков на 1,6 % и увеличилась на 1,7 % у курочек. Во 2 опытной группе, при применении изучаемого кормового компонента без кормового антибиотика, рентабельность производства мяса возросла, по сравнению с контрольной группой, в группе петушков на 9,8%, а у курочек на 5,4%.
Таблица 21 — Экономическая эффективность выращивания бройлеров в расчёте на 1000 голов начального поголовья (научно-хозяйственный опыт)
| Показатель | Группа | ||
| Контрольная | 1 опытная | 2 опытная | |
| Петушки-бройлеры | |||
| Среднее поголовье, гол | 956,3 | 950,0 | 981,3 |
| Общий валовый прирост, кг | 2013,4 | 2015,5 | 2173,4 |
| Стоимость прироста живой массы, тыс. руб. | 201,3 | 201,5 | 217,3 |
| Стоимость дополнительной продукции, руб. | — | 211,7 | 16006,4 |
| Стоимость препарата, руб. | 471,1 | 2194,4 | 1907,8 |
| Общие затраты, тыс. руб. | 141,4 | 143,1 | 142,8 |
| Чистый доход,
тыс. руб. |
59,9 | 58,4 | 74,5 |
| Дополнительный доход на 1 посаженную голову, руб. | — | -1,51 | 14,57 |
| Рентабельность производства мяса бройлеров, % | 42,4 | 40,8 | 52,2 |
| Курочки-бройлеры | |||
| Среднее поголовье, гол | 975,0 | 993,8 | 962,5 |
| Общий валовый прирост, кг | 1820,7 | 1866,2 | 1909,1 |
| Стоимость прироста живой массы, тыс. руб. | 182,1 | 186,6 | 190,9 |
| Стоимость дополнительной продукции, руб. | — | 4548,9 | 8833,1 |
| Стоимость препаратов, руб. | 426,1 | 2021,7 | 1675,8 |
| Общие затраты, тыс. руб. | 127,9 | 129,5 | 129,1 |
| Чистый доход, тыс. руб. | 54,2 | 57,2 | 61,8 |
| Дополнительный доход на 1 посаженную голову, руб. | — | 2,95 | 7,58 |
| Рентабельность производства мяса бройлеров, % | 42,4 | 44,1 | 47,8 |
| В среднем по петушкам и по курочкам бройлерам | |||
| Дополнительный доход на 1 посаженную голову, руб. | 0,87 | 10,86 | |
| Рентабельность производства мяса бройлеров, % | 42,4 | 42,5 | 49,9 |
Анализируя средние данные по смешанному поголовью птиц подопытных групп (петушкам и курочкам) видно, что самая высокая рентабельность производства мяса цыплят-бройлеров наблюдалась во 2 опытной группе, составив 49,9 % и превышая контроль на 7,5%. В 1 опытной группе данный показатель практически соответствовал таковому в контрольной группе и был на уровне 42,5%, что больше контроля на 0,1%.
4 Результаты производственной проверки
В таблице 22 представлены зоотехнические показатели цыплят-бройлеров по итогам производственной проверки результатов научно-хозяйственного опыта.
Таблица 22 — Зоотехнические показатели цыплят-бройлеров по данным производственной проверки
| Показатель | Вариант | ||
| Базовый | Новый-1
|
Новый – 2 | |
| Возраст убоя цыплят-бройлеров, дней | 39,3 | 39,2 | 39 |
| Поголовье на начало опыта, гол. | 37120,0 | 37760,0 | 38280,0 |
| Поголовье на конец опыта, гол | 34670,1 | 35267,8 | 34528,6 |
| Сохранность, % | 93,4 | 93,4 | 93,6 |
| Живая масса цыплят-бройлеров в конце периода
выращивания, г |
2077 | 2051 | 2042 |
| Затраты корма на 1 кг живой массы, кг | 1,56 | 1,50 | 1,54 |
| Среднесуточный прирост живой массы, г | 50,8 | 50,2 | 50,3 |
| Европейский индекс продуктивности, единиц | 316,5 | 325,8 | 318,2 |
Как видно из данных таблицы 22, применение кормовой добавки, включающей фитобиотики и защищенные органические кислоты, совместно с кормовым антибиотиком не оказало влияния на сохранность поголовья цыплят-бройлеров за период выращивания, данный показатель соответствовал таковому в базовом варианте и составил 93,4%. В новом-2 варианте, при использовании изучаемого препарата взамен кормового антибиотика, сохранность поголовья цыплят-бройлеров составила – 93,6%, что выше, чем в базовом варианте на 0,2%.
Живая масса цыплят-бройлеров в конце откорма была самой высокой в базовом варианте – 2077 г, в новом-1 и новом-2 вариантах живая масса цыплят незначительно уступала базовому варианту на 1,3 и 1,7%, соответственно.
Затраты корма на 1 кг прироста живой массы в базовом варианте составляли 1,56 кг, в новом-1 варианте они были ниже на 0,06 кг, а в новом-2 варианте ниже базового значения на 0,02 кг.
Расчет интегрального индекса эффективности выращивания цыплят-бройлеров — Европейского индекса продуктивности (ЕИП) проводили по формуле:
ЕИП= (Живая масса (кг) х Сохранность (%))/(Срок откорма (дней) х Конверсия корма (кг/кг)) х 100%
Установлено, что при учете основных зоотехнических параметров (живая масса в конце откорма, сохранность поголовья птиц, конверсия корма), за определенный период выращивания бройлеров, в базовом варианте ЕИП составил 316,5 единиц, в новом-1варианте ЕИП был на уровне 325,8 единиц, что больше базового варианта на 9,3 единицы. В новом-2 варианте ЕИП был на уровне 318,2 единиц, что, выше, чем в базовом варианте на 1,7 единицы.
Таким образом, по результатам производственной проверки на основании Европейского индекса продуктивности можно констатировать, что использование кормовой добавки, включающей фитобиотики и защищенные органические кислоты, дополнительно к основному рациону цыплят-бройлеров и взамен кормового антибиотика эффективно.
ЗАКЛЮЧЕНИЕ
На основании проведенных исследований сделаны следующие выводы:
- Включение кормовой добавки, включающей фитобиотики и защищенные органические кислоты дополнительно к основному рациону и взамен кормового антибиотика оказало положительное влияние на зоотехнические показатели цыплят-бройлеров. Так, живая масса петушков и курочек бройлеров, получавших рацион с заменой кормовых антибиотиков на исследуемый препарат, в конце откорма достоверно превосходила контроль соответственно на 5,1% (Р≤0,05) и 6,1% (Р≤0,01). Группа бройлеров, получавших изучаемую добавку дополнительно к основному рациону, также характеризовалась более высокой живой массой петушков и курочек по сравнению с контролем — на 0,7 и 0,65%, но это различие было недостоверным. Среднесуточный прирост живой массы петушков и курочек 1 опытной группы в среднем за период выращивания был выше по сравнению с контролем на 0,7 и 0,6%, а во 2 опытной группе на 5,2 и 6,3% соответственно. Использование препарата по предложенным схемам способствовало повышению сохранности поголовья птицы на 1,25%.
- Использование нового кормового компонента взамен кормовых антибиотиков способствовало повышению массы потрошеной тушки бройлеров на 3,3%, массы костей грудки — на 35,8%, снижению мясо-костного индекса грудки на 7,4 единицы, повышению массы мышц и кожи каркаса – на 20,2 и 46,4% соответсвенно. При дополнительном включении экспериментальной добавки к основному рациону отмечено повышение массы костей грудки на 29,0%, снижение мясокостного индекса грудки на 6,5 единиц, достоверное снижение (Р≤0,05) массы мышц бедра на 17,1%, повышение мышц каркаса на 15,0%. Убойный выход потрошеной тушки в 1 и 2 опытных группах был незначительно ниже, чем в контроле на 1,1 и 1,2 % соответственно, что связано с увеличением массы внутренних органов.
- Масса исследуемых внутренних органов цыплят-бройлеров в возрасте 38 дней соответствовала физиологическим нормам, при этом в группе цыплят, получавших экспериментальную кормовую добавку дополнительно к основному рациону, отмечено увеличение относительной массы почек на 0,11%, мышечного желудка – на 0,15%, кишечника – на 0,38% по сравнению с контролем. Замена в составе рациона кормовых антибиотиков на препарат, включающий фитобиотики и защищенные органические кислоты, сопровождалась повышением относительной массы сердца – на 0,02%, легких – на 0,05%, почек – на 0,15%, мышечного желудка – на 0,45 %, кишечника – на 1,12 % (P≤0,05).
- Химический анализ мышечной ткани цыплят-бройлеров показал, что наблюдается тенденция к снижению белка и повышению содержания жира, как в грудных, так и в ножных мышцах у цыплят, в рацион которых вводили кормовой антибиотик вместе с исследуемой добавкой и у птиц, получавших рацион с заменой антибактериального препарата на экспериментальный препарат, при этом в 1 и 2 опытных группах наблюдалось увеличение энергетической ценности мяса: грудных мышц — на 20,4 (P≤0,05) и 29,0 % (Р≤0,01), ножных мышц – на 9,8 и 32,6 % (Р≤0,01) соответственно.
- Оценка мяса подопытных цыплят-бройлеров на содержание Listeria monocytogenes и бактерий рода сальмонелла свидетельствовала об их отсутствии в исследуемых образцах. Анализ мяса на наличие КМАФАнМ (мезофильных аэробных и факультативно-анаэробных микроорганизмов) показал, что их количество в образцах мяса цыплят 1 и 2 опытных групп было менее 1,0*102 КОЕ/г. В двух образцах контрольной группы количество КМАФАнМ было на уровне1,0*102 КОЕ/г, в одном образце — 1,0*103.
- Данные балансового опыта демонстрировали, что переваримость питательных веществ корма цыплятами бройлерами была на высоком уровне во всех группах, при этом более высокое переваривание сухих веществ корма наблюдалось у контрольных бройлеров, в основном за счет лучшего усвоения безазотистых экстрактивных веществ: выше, чем в опытных группах в среднем на 4,1%. Использование нового кормового компонента взамен кормовых антибиотиков способствовало повышению переваривания клетчатки бройлерами на 11% и жира на 4,9%. При дополнительном включении испытуемой добавки в основной рацион цыплят отмечали повышение переваримости клетчатки на 3,2 %.
- Количество обменной энергии в организме цыплят, получавших взамен кормового антибиотика новый кормовой фактор повысилось на 2,3%, а у птиц, которым скармливали изучаемый препарат дополнительно к основному рациону, уровень обменной энергии уступал контролю на 3,5%.
- В организме бройлеров, выращенных с экспериментальной кормовой добавкой дополнительно к основному рациону, использование азота было ниже контроля на 2,3 %, кальция – на 0,55 %, при этом использование фосфора повысилось — на 8,5%. При использовании экспериментального препарата взамен кормовых антибиотиков использование азота в организме цыплят-бройлеров повысилось на 6,3%, кальция – на 13,41%, фосфора – на 1,4%.
- Скармливание экспериментальной кормовой добавки дополнительно к основному рациону сопровождалось снижением количества золы в большеберцовой кости бройлеров на 3,1%, количества кальция – на 0,5% и повышением содержания фосфора – на 0,5%. При замене кормовых антибиотиков в составе комбикорма на изучаемый препарат количество золы в большеберцовой кости птицы повысилось на 1,1%, уровень кальция достоверно возрос на 2,8 (Р≤0,01), а количество фосфора было ниже контроля на 0,4%.
- При введении кормовой добавки, включающей фитобиотики и защищенные органические кислоты, дополнительно к основному рациону цыплят-бройлеров (1 опытная группа) и взамен кормового антибиотика (2 опытная группа) анализируемые морфологические показатели крови птиц не выходили за пределы физиологических норм, что свидетельствует об отсутствии отрицательного влияния изучаемого препарата на организм птицы.
- Проведенное биохимическое исследование крови цыплят-бройлеров позволило установить, что применение кормовой добавки, включающей фитобиотики и защищенные органические кислоты, при выращивании цыплят-бройлеров дополнительно к основному рациону и взамен кормового антибиотика не оказывает отрицательного влияния на обменные процессы в организме птиц, исследуемые параметры крови находились на уровне физиологической нормы. При этом использование добавки в рационе цыплят 1 и 2 опытных групп способствовало улучшению усвоения белкового азота в организме бройлеров, о чем свидетельствует тенденция снижения мочевой кислоты в сыворотке крови соответственно на 19,46 и 4,04%. Отмечена тенденция снижения триглицеридов в сыворотке крови у цыплят 1 и 2 опытных групп по сравнению с контролем соответственно на 20,5 и 18,2 %.
- Сравнительный анализ гистологических изменений, обнаруженных в органах птицы контрольной и опытных групп в разные промежутки времени в период технологического цикла, свидетельствует о том, что наиболее физиологичными были изменения, отмеченные в образцах 2 опытной группы, где в органах иммунной системы прослеживаются процессы, характеризующиеся стойким иммунитетом. В паренхиматозных органах цыплят этой группы на фоне зернистой дистрофии, которую можно отнести за счет некоторого белкового перекармливания птицы, и которая носит обратимый характер не проявляющаяся макроскопическими признаками нарушения внешнего состояния органов, не выявлено патологических процессов. В органах пищеварительного тракта, а именно в слизистой оболочке 12-перстной кишки отмечена умеренная секреция, то есть процессы переваривания корма при активной работе поджелудочной железы обеспечивают нормальную жизнедеятельность птицы без проявления патологических процессов. В 1 опытной группе, также не выявлено патологических процессов в виде воспалительных и некробиотических, и она по сравнению с контрольной группой выглядела более позитивной, тем не менее, общий комплекс процессов, отмеченных во 2 опытной группе имеет преимущества перед 1 опытной группой.
- По данным научно-хозяйственного эксперимента установлено, что уровень рентабельности производства мяса цыплят-бройлеров (в среднем по петушкам и курочкам-бройлерам), был самым высоким во 2 опытной группе, составив 49,9 %, в 1 опытной группе данный показатель незначительно превышал контроль — на 0,1%.
- Результаты производственной проверки подтвердили зоотехнические данные научно-хозяйственного опыта. При учете основных продуктивных параметров (живая масса в конце откорма, сохранность поголовья птиц, конверсия корма) за определенный период выращивания бройлеров Европейский индекс продуктивности в новом-1 и новом-2 вариантах был выше базового варианта на 9,3 и 1,7 единиц.
- Кормовая добавка, включающая в себя фитобиотики и защищенные органические кислоты, показала себя как достойная безопасная альтернатива кормовым антибиотикам, ее использование дополнительно к основному рациону и взамен кормовых антибиотиков, эффективно и целесообразно с биологических и экономических позиций.
Предложение производству
Рекомендуем включать в комбикорм цыплят-бройлеров кормовую добавку на основе фитобиотиков и защищенных органических кислот дополнительно к основному рациону и взамен кормового антибиотика в количестве 1,0 кг на тонну комбикорма в течение всего периода выращивания.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1. Кавардаков В.Я., Кайдалов А.Ф., Семененко И. А. Методологические аспекты управления инновационно-технологическим развитием животноводства на отраслевом уровне // Вестник Донского государственного аграрного университета. — 2017. — № 2 (24.1).- С. 37.
2. Фисинин В.И., Буяров В.С., Буяров А.В., Шуметов В.Г. Мясное птицеводство в регионах России: современное состояние и перспективы инновационного развития // Аграрная наука. — 2018.- № 2. — С. 30-38.
3. Трухачев В.И., Епимахова Е.Э., Злыднев Н.З. Обозначены векторы развития птицеводства // Птицеводство. — 2019.- № 2.- С.12-14.
4. Егорова Т.А. Развитие российского птицеводства в мировом тренде // Птицеводство. — 2019.- № 2.- С.4-9.
5. Фисинин В.И. Состояние и вызовы будущего в развитии мирового и российского птицеводства // Материалы XVIII Международной конференции Российского отделения Всемирной научной ассоциации по птицеводству (НП «Научный центр по птицеводству») «Инновационное обеспечение яичного и мясного птицеводства России» / Сергиев Посад: ВНИТИП (19-21 мая 2015 г.). — 2015. — С. 9-25.
6. Кривошлыков В. С., Жахов Н. В., Шатохин М. В. Волатильность мирового агропродовольственного рынка (на примере мирового рынка мяса) // Вестник Курской государственной сельскохозяйственной академии. — 2016.- №. 7. — С.13-18.
7. Гущин В. В., Лищенко В. Ф. Мясное птицеводство России: уроки прошлого, достижения и перспективы // Птица и птицепродукты. — 2012.- №. 5. — С. 20-22.
8. Государственная программа развития сельского хозяйства и регулирования рынков сельскохозяйственной продукции, сырья и продовольствия на 2013-2020 годы, утверждена постановлением Правительства Российской Федерации от 14 июля 2012 г. № 717.
9. Абаев А.В. Эффективность использования препаратов энтеросорбентов в рационах цыплят-бройлеров, выращиваемых в техногенной зоне РСО-Алания: дис. … канд. с.-х. наук: 06.02.08 / А.В. Абаев. — Владикавказ, 2014. — 138 с.
10. Кононенко С.И. Способы повышения генетически обусловленной продуктивности молодняка птицы // Известия Горского государственного аграрного университета. — 2015. — Т.52. — № 2. — С.84-88.
11. Вилсма Г., Сигалл С., Нуфер А.И. Пути оздоровления кишечника свиней и птицы в условиях современного промышленного производства // Вопросы нормативно-правового регулирования в ветеринарии. — Санкт-Петербург.: Издательство Санкт-Петербургской государственной академии ветеринарной медицины. — 2015.- № 2.- С.277-279.
12. Lampkin N. Organic poultry production. Final report to MAFF // Edited by Welsh Institute of Rural Studies, University of Wales Aberystwyth, SY23 3AL.- 1996.- PP. 3-6.
13. Gadde U., Kim W. H., Oh S. T., Lillehoj. Hyun S. Alternatives to antibiotics for maximizing growth performance and feed efficiency in poultry: a review // Animal health research reviews. — 2017. — Vol.18. — № 1. — PP.26-45.
14. Егоров И.А., Егорова Т.В., Жеухин Е.А., Шашков В.А., Пятачков А.А. Коллоидное серебро при выращивании цыплят-бройлеров // Птицеводство. — 2013.- № 4.- С. 17-20.
15. Стасевич К. Почему антибиотики бессильны против вирусов // Наука и жизнь. — 2019.- № 11.- С. 2-3.
16. Кощаев А.Г. Экологизация продукции птицеводства путем использования пробиотиков как альтернативы антибиотикам // Сельскохозяйственная экология. — 2007.- № 3.- С. 94 – 98.
17. Соколова К.Я., Соловьева И.В., Григорьева Г.И. Научное обоснование необходимости использования пробиотиков в птицеводческих хозяйствах // БИО. — 2005.- №10. — С. 7–8.
18. Джанарсланов Р. Бройлер без антибиотиков-тренд будущего [Электронный ресурс]. – URL:https://www.agroinvestor.ru/column/rizvan-dzhanarslanov/30096-broyler-bez-antibiotikov-trend-budushchego/ (дата обращения 12.11.19).
19. Сверчкова Н., Коломиец Э. В поисках альтернативы ветеринарным и кормовым антибиотикам // Наука и инновации. — 2014.- № 8 (138).- С.21-24.
20. Лушников К.В., Желамский C.B. Животноводство без кормовых антибиотиков реальная перспектива // Сельскохозяйственное обозрение. — 2005.- № 9.- С.11-12.
21. Буряков Н. П., Бурякова М. А., Миронов М. М. Показатели обмена веществ и продуктивности цыплят-бройлеров при использовании в кормлении пребиотика «Сель Ист» // Российский ветеринарный журнал. — 2015.- № 1. — С.13.
22. Рамирес, Д., Госсенс Т. Альтернатива антибиотикам. Добавки АДИМИКС® Precision и АПЕКС® в кормлении бройлеров // Животноводство России. Тематический выпуск. — 2017. — № S3. — С.53-56.
23. Васильева О.А., Нуфер А.И., Шацких Е.В. Альтернативные пути замены кормовых антибиотиков // Эффективное животноводство. — 2019.- № 4.- С.66-68.
24. Ткаченко К.Г., Казаринова Н.В., Музыченко Л.М., Шургая А.М., Павлова О.В., Сафонова Н.Г. Санационные свойства эфирных масел некоторых видов растений // Растительные ресурсы. — 1999.- Т. 35, вып. 3. — С. 11-24.
25. Шепёткина С.В., Новикова О.Б., Забровская А.В., Терлецкий В.П., Тыщенко В.И. Современные принципы антибиотикотерапии в птицеводстве. — СПб.: Издательство ФГБОУ ВПО «СПбГА-ВМ», 2015. — 160 с.
26. Брюшинин Н.В. Этиотропный подход к антибиотикотерапии цыплят-бройлеров // Птицеводство. — 2019. — № 3. — С.41-43.
27. Куликов Н.В. Успешный Европейский опыт отказа от кормовых антибиотиков в птицеводстве [Электронный ресурс] – URL: http://webmvc.com/show/article/show.php?id=124 (дата обращения 19.11.2019).
28. Yeoman C.J., Chia N., Jeraldo P., Sipos M., Goldenfeld N.D., White B.A. The microbiome of the chicken gastrointestinal tract // Anim. Health Res. Rev. — 2012. — Vol. 13. — PP. 89–99.
29. Kerr A.K., Farrar A.M., Waddell L.A., Wilkins W., Wilhelm B.J., Bucher O., Wills R.W., Bailey R.H., Varga C., McEwe S.A., et al. A systematic review-meta-analysis and meta-regression on the effect of selected competitive exclusion products on Salmonella spp. prevalence and concentration in broiler chickens// Prev. Vet. Med. — 2013. — Vol. 111. — PP. 112–125.
30. Dobson A., Cotter P.D., Ross R.P., Hill C. Bacteriocin production: a probiotic trait? // Appl. Environ. Microbiol. — 2012. — Vol. 78. — PP. 1–6.
31. Messaoudi S., Kergourlay G., Dalgalarrondo M., Choiset Y., Ferchichi M., Prévost H., Pilet M.F., Chobert J.M., Manai M., Dousset X. Purification and characterization of a new bacteriocin active against Campylobacter produced by Lactobacillus salivarius SMXD51 // Food Microbiol. — 2012. — Vol. 32. — PP. 129–134.
32. Sekirov I., Russell S.L., Antunes L.C.M., Finlay B.B. Gut microbiota in health and disease // Physiol. Rev.- 2010.- Vol. 90.- PP. 859–904.
33. Sun H., Tang J.W., Yao X.H., Wu Y.F., Wang X., Feng J. Molecular analysis of intestinal bacterial microbiota of broiler chickens fed diets containing fermented cottonseed meal // Trop. Anim. Health Prod.- 2013.- Vol. 45.- PP. 987–993.
34. LeBlanc J.G., Milani C., de Giori G.S., Sesma F., van Sinderen D., Ventura M. Bacteria as vitamin suppliers to their host: a gut microbiota perspective // Curr. Opin. Biotechnol. — 2013. — Vol. 24. — № 2. — PP. 160-168.
35. Stanley D., Geier M.S., Denman S.E., Haring V.R., Crowley T.M., Hughes R.J., Moore R.J. Comparison of fecal and cecal microbiotas reveals qualitative similarities but quantitative differences // Vet. Microbiol. — 2013. — Vol. 164. — PP. 85–92.
36. Fasina Y.O., Hoerr F.J., McKee S.R., Conner D.E. Influence of Salmonella enterica serovar Typhimurium infection on intestinal goblet cells and villous morphology in broiler chicks // Avian Dis.- 2010.- Vol. 54.- PP. 841–847.
37. Chae B., Ingale S., Kim J., Kim K., Sen S., Lee S., Khong C., Kim E.K., Kwon I.K. Effect of dietary supplementation of probiotics on performance, caecal microbiology and small intestinal morphology of broiler chickens // Animal Nutrition and Feed Technology.- 2012.- V. 12.- PP. 1–12.
38. Околелова Т. М., Мансуров Р.Ш., Папазян Т.Т., Петросян А.Б., Шабаев И.С. Препарат «Актиген» при выращивании бройлеров // Птицеводство. — 2012. — № 6. — С. 31–32.
39. Гуо С. С., Ма К., Гуо И.М. Влияние препарата «Актиген» на продуктивность цыплят-бройлеров, их иммунный ответ и микрофлору подвздошной кишки // Птица и птицепродукты. — 2013. — № 2. — С. 47–48.
40. Лобанок А. Г., Сапунова Л.И., Шарейко Н.А., Долженкова Е.А. Дрожжи как основа биологически активных кормовых добавок про- и пребиотического действия // Весці Нацыянальнай акадэміі навук Беларусі.Серыя біялагічных навук. — 2014. — № 1. — С. 17–22.
41. Коптев В. Ю., Шкиль Н.А., Леонова М.А., Онищенко И.С., Балыбина Н.Ю., Бычков А.Л. Влияние кормового средства, содержащего маннано-лигосахариды, на уровень бактерионосительства микроорганизмов рода Salmonella и прирост живой массы сельскохозяйственной птицы // Достижения науки и техники АПК. – 2015. — Т. 29. — № 1. — С. 46–48.
42. Шацких Е.В., Галиев Д.М., Нуфер А.И. Продуктивность бройлеров при замене в рационе кормовых антибиотиков на ростостимулирующие добавки // Птица и Птицепродукты. — 2019. — № 6. — С.26-28.
43. Шацких Е.В., Галиев Д.М. Развитие внутренних органов цыплят-бройлеров при включении в рацион кормовых добавок СафМаннан и Иммуносан // Аграрный Вестник Урала. — 2019. — № 6 (185). — С.48-53
44. Отченашко В. У каждого подкислителя свои особенности // Животноводство России. — 2014. — № 11. — С.31-33.
45. Chowdhury R., Islam K.M.S., Khan M.J., Karim M.R., Haque M.N., Khatun M., Pesti G.M. Effect of citric acid, avilamycin and their combination on the performance, tibia ash and immune status of broilers // Poultry Science. — 2009. — Vol. 88. — PP. 1616-1622.
46. Кочнев Ю.А. Подкислители в комбикормах для цыплят-бройлеров: дис. канд.с.-х. наук: 06.02.08. – Сергиев Посад, 2013. – 104 с.
47. Шацких Е.В., Васина О.В. Органические подкислители для выращивания бройлеров // Аграрный вестник Урала. – 2011. – № 10 (89). – С.39-40.
48. Шацких Е.В. Органический подкислитель «КЛИМ» в кормлении цыплят-бройлеров // Аграрный вестник Урала. — 2015. — № 10 (140). — С. 45-48.
49. Гамко Л.Н., Таринская Т.А. Влияние подкислителей на продуктивность и сохранность цыплят-бройлеров // Птицеводство. – 2015. — № 2. – С.34-36.
50. Околелова Т. М., Кочнев Ю. А. Эффективность кормового антибиотика и органических кислот при выращивании бройлеров // Птицеводство. — 2011. — №. 11. — С. 37-38.
51. Шендеров Б.А. Пробиотики, пребиотики и синбиотики. Общие и избранные разделы проблемы // Пищевые ингредиенты. Сырье и добавки. — 2005. — № 2. — С. 23-26.
52. Соколенко Г.Г., Лазарев Б.П., Миньченко С.В. Пробиотики в рациональном кормлении животных // Технологии пищевой и перерабатывающей промышленности АПК — продукты здорового питания. — 2015. — № 1. — С. 72-78.
53. Бабина М.П. Коррекция иммунного статуса и повышение продуктивности цыплят-бройлеров пробиотиками // Актуальные проблемы интенсивного развития животноводства. — Горки, 1998. — С. 294-299.
54. Буяров В.С., Червонова И.В., Ярован Н.И., Учасов Д.С. Пробиотики и пребиотики в промышленном свиноводстве и птицеводстве: монография. — Орловский государственный аграрный университет, 2014. — С. 164.
55. Егоров И.А., Вертипрахов В.Г., Манукян В.А., Ленкова Т.Н., Егорова Т.А., Грозина А.А., Байковская Е.Ю. Применение нового пробиотика в комбикормах для цыплят- бройлеров // Птицеводство. — 2017. — № 9. — С. 13-17.
56. Кокоева, А.Т. Эффективность использования жидких кормовых дрожжей на основе горца сахалинского в кормлении цыплят-бройлеров: дис. канд. с.-х. наук: 06.02.02. — Владикавказ, 2003. -127с.
57. Фисинин В.И., Егоров И.А., Лаптев Г.Ю., Ленкова Т.Н., Никонов И.Н., Ильина Л.А., Манукян В.А., Грозина А.А., Егорова Т.А., Новикова Н.И., Йылдырым Е.А. Получение продукции птицеводства без антибиотиков с использованием перспективных программ кормления на основе пробиотических препаратов // Вопросы питания. — 2017. — Т. 86. — № 6. — С. 114-124.
58. Панин А.Н., Малик Н.И. Пробиотики — неотъемлемый компонент рационального кормления животных // Ветеринария. – 2006. – № 7. – С. 21-26.
59. Похиленко В.Д., Перелыгин В.В. Пробиотики на основе Bacillus subtilis и их безопасность // Химическая и биологическая безопасность. – 2007. – № 2–3. – С. 20-41.
60. Белик С.Н., Чистяков В.А., Крючкова В.В., Сложенкина М.И. Эффективность использования пробиотического препарата на основе bacillus subtilis при выращивании цыплят-бройлеров // Известия Нижневолжского агроуниверситетского комплекса. — 2014. — № 4 (36). – С. 1-6.
61. Игнатьев В.Э., Лебедева И.А., Новикова М.В. Влияние Bacillus subtilis на биохимические показатели мяса и обмен кальция в костной ткани цыплят-бройлеров // Молодой ученый. — 2016. — № 6-5(110). — С. 68-70.
62. Суханова О.Н. Влияние антибиотического и пробиотического препаратов на продуктивность и обмен минеральных веществ в организме кур-несушек на фоне энзимсодержащих диет: авт. дис. канд. биол. наук: 06.02.02. – Оренбург, 2007. – 23с.
63. Олисаев С.В. Использование пробиотика и ферментных препаратов в кормлении молодняка и кур-несушек: дис. канд. с-х. наук: 06.02.08. – Владикавказ, 2012. – 137с.
64. Овчинников А.А., Овчинникова Л.Ю., Коновалов Д.А. Иммунный статус организма мясных кур при использовании пробиотиков в рационе // Птицеводство. – 2019. — № 5. – С.43-47.
65. Егоров И.А., Егорова Т.В., Криворучко Л.И., Брылин А.П., Белявская В.А., Большакова Д.С. Пробиотик в комбикормах для цыплят-бройлеров // Птицеводство. – 2019. -№ 3. – С.25-28.
66. Бочкарева Е.В., Агеев Б.В., Новикова Н.И., Большаков В.Н., Бражник Е.А. Условно-патогенная микрофлора под прицелом Целлобактерина-Т // Птицеводство. – 2019. — № 6. – С.37-41.
67. Меликиди В.Х., Тюрина Д.Г., Селиванов Д.Г., Новикова Н.И. Метаболиты пробиотических бактерий отвечают за эффективность действия пробиотика // Птицеводство. – 2019. — № 10. – С.45-47.
68. Саломатов Е.А., Слобожанинов К.В., Верещагина Е.Н., Падерина Р.В. Использование пробиотиков в кормлении кур-несушек // Птицеводство. – 2019. — № 10. – С.48-50.
69. Krishan G., Narang A. Use of essential oils in poultry nutrition: A new approach//Journal of Advanced Veterinary and Animal Research. — 2014. — Vol. 1.- №. 4. PP. 156-162.
70. Жученко Е.В., Семенова Е.Ф., Маркелова Н.Н., Шпичка А.И., Князькова А.А. Влияние эфирных масел на микроорганизмы различной таксономической принадлежности в сравнении с современными антибиотиками. Сообщение III. Действие масел лаванды, розового дерева, эвкалипта, пихты на некоторые грамотрицательные бактерии // Известия высших учебных заведений. Приволжский регион. Естественные науки. — 2015.- № 1 (9).- С. 30-41.
71. Семенова Е.Ф., Веденеева А.С., Жужжалова Т.П. Скрининг антимикробной активности жидких экстрактов стевии Ребо (Stevia rebaudiana Bertoni) // Вестник Воронежского госуниверситета. Серия «Химия. Биология. Фармация». — 2010. — №1.- С. 121-126.
72. Муньес, Л. Безопасная альтернатива антибиотикам // Свиноводство. — 2011. — №. 5. — С. 58-60.
73. Brenes A., Roura E. Essential oils in poultry nutrition: Main effects and modes of action //Animal Feed Science and Technology. — 2010. — Vol. 158. — №. 1-2. — PP. 1-14.
74. Лаптев Г.Ю., Ильина Л.А., Йылдырым Е.А., Филлипова В.А., Дубровин А.В., Новикова О.Б. Фитобиотик на защите иммунитета птицы // Птицеводство. – 2019. — № 7-8. – С.25-29.
75. Атландерова К.Н. Растительные экстракты как альтернатива антибиотикам в кормлении сельскохозяйственных животных //Актуальные проблемы животноводства в условиях импортозамещения. — 2018. — С. 17-21.
76. Alagawany M., El-Hack M. A., Farag M. R., Tiwari R., Dhama K. Biological effects and modes of action of carvacrol in animal and poultry pro-duction and health-a review //Advances in Animal and Veterinary Sciences.- 2015.- Vol. 3.- №. 2s. — PP. 73-84.
77. Багно О.А., Прохоров О.Н., Шевченко С. А., Шевченко А.И., Дядичкина Т.В. Фитобиотики в кормлении сельскохозяйственных животных // Сельскохозяйственная биология. — 2018.- Т. 53. — №. 4. — С.687-697.
78. Казаринова Н.В., Музыченко Л.М., Ткаченко К.Г., Шургая А.М., Брежнев В.Н., Усов О.М. Использование эфирных масел для профилактики внутрибольничных инфекций и лечения кандидозов // Медицинские технологии. — 1995.- № 1-2.- С. 23.
79. Методика проведения научных и производственных исследований по кормлению сельскохозяйственной птицы: рекомендации / разраб. И.А. Егоров [и др.]; под общ. ред. В. И. Фисинина. — Сергиев Посад.: ВНИТИП. — 2013.- 52 с.
80. Антипов В.А., Турченко А.Н., Васильев В.Ф., Самойлов В.С., Казарян Р.В., Кузьминова Е.В., Полищук Л.В. Бета-каротин: значение для жизни животных и птиц, их воспроизводства и продуктивности. — Краснодар, 2006. – 91 с.
81. Гущин В. В., Махонина В. Н. Определение мясных индексов качества потрошеных тушек цыплят-бройлеров и их частей // Птица и птицепродукты. — 2010.- №. 6.- С. 50-53.
82. Гущин В. В., Риза-Заде Н. И., Русанова Г. Е. Проблема безопасности птицепродуктов и пути ее решения // Птица и птицепродукты. — 2009.- №. 1.- С. 24-26.
83. Белянская Е.В. Влияние способа первичной обработки на санитарное состояние мяса птицы // Научный вестник государственного образовательного учреждения Луганской Народной Республики «Луганский национальный аграрный университет». — 2018. -№. 3. — С. 163-168.
84. Касьяненко О. И., Фотина Т. И., Нагорная Л. В., Назаренко С. Н., Клищева Ж.Е. Анализ практических аспектов контроля возбудителей пищевых зоонозов при выращивании птицы // Ученые записки учреждения образования Витебская Ордена знак почета государственная академия ветеринарной медицины. — 2017. — Том.53. № 1. — С. 55-58.
85. Самойленко Е. Б. Выявление бактерий Listeria monocytogenes в пищевых продуктах // Ветеринарная медицина XXI века: инновации, опыт, проблемы и пути их решения: материалы международной научно-практической конференции. — Ульяновск: УГСХА. — 2011. — Т.1. — С. 19-24.
86. Пименов Н. В., Редькин С. В., Амбражеевич Ю. В. Эффективность применения бивалентного бактериофага против сальмонеллеза для обезвреживания продуктов убоя в птицеводстве // Ветеринария, зоотехния и биотехнология. — 2014.- №. 1.- С. 31-35.
87. Иванов А. А., Ильяшенко А. Н. Формирование минерального состава костной ткани цыплят-бройлеров при включении в их рацион регуляторов минерального обмена // Известия ТСХА. — 2010. — Выпуск 3. — С.115-119.
88. Голиков А.Н., Базанова Н.У., Кожебеков З.К. [и др.]. Физиология сельскохозяйственных животных. — М.: Агропромиздат, 1991. – 432 с.
89. Кишняйкина Е.А. Продуктивный и физиологический эффект биологически активных веществ в системах выращивания цыплят-бройлеров: дис. … канд. с.-х. наук: 06.02.10 / Е.А. Кишняйкина. — Новосибирск, 2019. — 145 с.
90. Казарян Р.В., Лукьяненко М.В., Бородихин А.С., Семененко М.П., Мирошниченко П.В. Исследование биохимических показателей сыворотки крови цыплят-бройлеров, выращенных с применением комплексной кормовой добавки // Новые технологии. — 2018.- № 4. — С. 209-215.
