Титульный лист и исполнители
РЕФЕРАТ
Отчет 87 с., ч.1, 12 рис., 14 табл., 49 источников, 7 прил.
Ключевые слова: классическая чума свиней, вирус, инфекция, эпизоотическая ситуация, африканская чума свиней, дикий кабан, количественные и качественные оценки риска.
Объектом исследований являются патологический материал от диких кабанов и домашних свиней, сыворотки крови от домашних свиней, нормативная и отчетная документация КГБУ «Приморская ветеринарная служба», ФГБУ «Приморская Межобластная ветеринарная лаборатория», ГНУ «Всероссийский научно-исследовательский институт ветеринарной вирусологии и микробиологии», ФГБУ «Федеральный центр охраны здоровья животных».
Цель работы: изучить эпизоотическую ситуацию и оценить риски заноса и распространения африканской и классической чумы свиней на территории Приморского края с учетом эпизоотической ситуации в со-предельных государствах (Китай, Южная и Северная Корея).
Проведен анализ путей заноса и распространения африканской чумы свиней на территории Приморского края с учетом эпизоотической ситуации в сопредельных государствах (Китай, Южная и Северная Корея).
Осуществлен мониторинг появления эпизоотических очагов африканской и классической чумы свиней на территорию Приморского края, в том числе из эпизоотических очагов сопредельных государств; оценка риска;
Анализ эффективности противоэпизоотических мероприятий в неблагополучных пунктах.
Определены методики количественной и качественной оценки риска заноса и распространения африканской чумы свиней;
Произведена обработка результатов исследований и разработаны методические рекомендации.
Основные технико-экономические показатели: разработаны методические рекомендации по количественной и качественной оценки риска заноса и распространения африканской и классической чумы свиней на территории Приморского края с учетом рекомендации МЭБ.
Степень внедрения – разработаны методические рекомендации по количественной и качественной оценке риска заноса и распространения африканской и классической чумы свиней на территории Приморского края с учетом рекомендации МЭБ, материалы исследований используются в работе ветеринарной службы Приморского и Хабаровского края; при написании научных статей; при подготовке выпускных квалификационных работ по специальности 36.05.01 Ветеринария и в учебном процессе Института животноводства и ветеринарной медицины ФГБОУ ВО Приморская ГСХА; в пропаганде сущности и особенности заболеваний для товаропроизводителей свинины.
Использование количественных и качественных методов оценки позволяют прогнозировать риски возможного заноса и распространения данных заболеваний на территории Приморского края.
ВВЕДЕНИЕ
На данный момент, в период экономических санкций Россия взяла курс на внутреннее производство продукции животноводства, в том числе свиноводства. В Приморском крае производство свинины востребовано, создан ряд свиноводческих комплексов, содержат свиней и в крестьянско-фермерских хозяйствах, и владельцы личных подворий. При этом необходимо ветеринарное обслуживание свинопоголовья для сохранения его здоровья и получения качественной продукции.
Классическая чума свиней (далее КЧС) и африканская чума свиней (далее АЧС), вирусные болезни имеющие широкое распространение, приносящие большой экономический ущерб.
С 2015 года в Приморском крае регистрируется классическая чума свиней. В 2019 году на территория Приморского края неблагополучна по африканской чуме свиней. Чума свиней возникает в любое время года, однако её чаще регистрируют осенью, когда осуществляются массовые перемещения диких кабанов, продажа и убой свиней. Задача ветеринарной службы в данном случае – купировать эпизоотические очаги, и не допустить распространения инфекции, контролировать численность диких кабанов, которые являются одним из факторов распространения данных заболевания. Осуществляя совместную работу по ликвидации эпизоотических очагов и профилактической вакцинации, ветеринарной службой и охотинспекцией Приморского края было остановлено распространение КЧС и АЧС в свиноводческих хозяйствах разных форм собственности. Об этом свидетельствует информация мониторинга составленного по результатам лабораторных испытаний. Как отмечают С.А. Дудников, Е.В. Гусева (2001), методологически существуют следующие варианты оценки риска: качественный, полуколичествнный и количественный анализ. Качественный метод является наиболее доступным, он позволяет получить информацию быстро и в общедоступной форме [18].
Количественный метод более информативен, но требует точных данных, длительный, требует специальной подготовки. Перечисленные методы дополняют друг друга и реализуются одновременно в процессе решения поставленной задачи (оценка риска). Однако качественная методика позволяет провести оценку риска заноса заболевания на ранее благополучную территорию или хозяйство, свинокомплекс и т.д.; количественным методом оценивают возможное распространение и ущерб от заболевания, а полуколичественным – оценивают общий риск в данной ситуации.
НОРМАТИВНО-ПРАВОВАЯ ДОКУМЕНТАЦИЯ
- Инструкция о мероприятиях по предупреждению и ликвидации классической чумы свиней, утв. Главным управлением ветеринарии Минсельхоза 30.03.1990 г.
- Ветеринарные правила осуществления профилактических, диагностических, ограничительных и иных мероприятий, установления и отмены карантина и иных ограничений, направленных на предотвращение распространения и ликвидацию очагов африканской чумы свиней, утверждены приказом Министерства сельского хозяйства Российской Федерации № 213 от 31 мая 2016 года.
- Приказ Минсельхоза РФ от 19.12.2011 № 476 «Об утверждении перечня заразных, в том числе особо опасных, болезней животных, по которым могут устанавливаться ограничительные мероприятия (карантин).
4. Постановление Правительства РФ от 26.05.2006 № 310 «Об отчуждении животных и изъятии продуктов животноводства при ликвидации очагов особо опасных болезней животных».
5. Приказ Минсельхоза РФ от 10.08.2011 № 267 «Об утверждении стратегии развития мясного животноводства в РФ на период до 2020 г.».
7. Методические указания по лабораторной диагностике классической чумы свиней, утв. Заместителем руководителя Департамента ветеринарии № 13-4-2/809 от 30.12.1996.
8. Отчетность по заболеванию, документы по лабораторной деятельности и мониторингу.
9. Приказ Департамента сельского хозяйства и продовольствия Приморского края № 70 от 28.09.2015 г. «О принятии мер по предупреждению заноса, недопущению распространения и ликвидации классической чумы свиней на территории Приморского края».
10. Объявления КГБУ «Приморская ветеринарная служба» в средствах массовой информации и Интернет об опасности распространения классической чумы свиней и действии населения в случаях обнаружения падежа домашних свиней и диких кабанов.
11. База данных нормативных правовых актов Губернатора Приморского края и Администрации Приморского края / Администрация Приморского края. – Текст: электронный // Приморский край: офиц. сайт. – URL: http://domino.primorsky.ru/IS-APK/k-protokol.nsf
12. Приказ Министерство сельского хозяйства Российской Федерации от 16 апреля 2009 года N 144 «О мерах по предотвращению распространения африканской чумы свиней на территории Российской Федерации»
13. О Порядке взаимодействия государств — членов Евразийского экономического союза при профилактике, диагностике, локализации и ликвидации очагов особо опасных, карантинных и зоонозных болезней животных и проведения регионализации и компартментализации (с изменениями на 22 февраля 2019 года).
14. ГОСТ 28573-90 Свиньи. Методы лабораторной диагностики африканской чумы. ФГУП «Стандартинформ», 10 с.
15. Ветеринарно-санитарные правила сбора, утилизации и уничтожения биологических отходов (с изменениями на 16 августа 2007 года).
16. ГОСТ Р 22.1.01-95 Безопасность в чрезвычайных ситуациях. Мониторинг и прогнозирование. Основные положения (принят в качестве межгосударственного стандарта ГОСТ 22.1.01-97).
1. ЦЕЛЬ И ЗАДАЧИ ИССЛЕДОВАНИЯ
Цель работы:
Изучить эпизоотическую ситуацию и оценить риски заноса и распространения африканской и классической чумы свиней на территории Приморского края с учетом эпизоотической ситуации в сопредельных государствах (Китай, Южная и Северная Корея).
Задачи работы:
- Проанализировать пути заноса и распространения африканской и классической чумы свиней на территорию Приморского края, в том числе из эпизоотических очагов сопредельных государств;
- Дать оценку риска заноса африканской чумы свиней на территорию Приморского края;
- Разработать методические рекомендации «Количественная и качественная оценка риска заноса и распространения африканской и классической чумы свиней на территории Приморского края с учетом рекомендации МЭБ»
2. МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования проводились в течение 2019 года. Схема исследовательской работы представлена на рисунке 1.
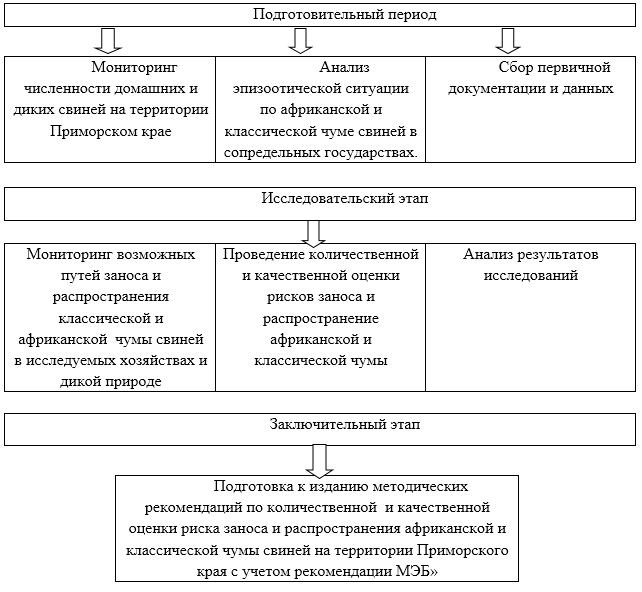
Рисунок 1 – Схема исследовательских работ
Диагноз на КЧС и АЧС ставится комплексно, на основании эпизоотологических, клинических, патологоанатомических данных и результатов лабораторного исследования, которые включают в себя выявление вируса с помощью:
— метода иммунофлуоресценции (ИФ);
— полимеразно-цепной реакции (ПЦР);
— постановки биопробы на подсвинках [11] .
Это подтверждается многими авторами, в том числе Ч.К. Авыловым, Н.М. Алтуховым, В.Д. Бойко, О.П. Бьядовской (2002) [1] .
Р.Г. Госманов, Н.М. Колычев (2006) отмечают, что в настоящее время разработан набор ПЦР для диагностики классической чумы свиней [15].
Также рекомендуют при подозрении на КЧС отправлять в лабораторию для исследования селезенку или часть ее, тонзилы, заглоточные, подчелюстные, мезентериальные и брыжжечные лимфатические узлы, пробы крови, костного мозга из грудной кости, отобранные в первые два часа после гибели или убоя больных животных [19].
При подозрении на АЧС Для лабораторных исследований отбираются: кусочки селезёнки массой 5-10 г, подчелюстные, портальные, или мезентериальные лимфоузлы (целиком). В случае разложения трупа отбирается грудинная или трубчатая кость. Трупы поросят направляются целыми (по возможности, в зависимости от их размеров) в водонепроницаемой таре. Для прижизненной диагностики отбираются пробы крови (3-5 мл) с добавлением антикоагулянтов [13].
Патологический материал отбирают в стерильную посуду и доставляют в лабораторию в термосе со льдом с соблюдением мер предосторожности с сопроводительной, в которой указывают эпизоотическое состояние хозяйства, отмеченные симптомы и патизменения у больных и павших животных. Срок исследования – до 15 дней.
Для лабораторных исследований отбираются: кусочки селезёнки массой 5-10 г, подчелюстные, портальные, или мезентериальные лимфоузлы (целиком). В случае разложения трупа отбирается грудинная или трубчатая кость. Трупы поросят направляются целыми (по возможности, в зависимости от их размеров) в водонепроницаемой таре. Для прижизненной диагностики отбираются пробы крови (3-5 мл) с добавлением антикоагулянтов. (уч пособие).
Диагноз на чуму свиней считается установленным на основании следующего:
— обнаружение скоплений форменных элементов крови и пролиферации эндотелия сосудов при микроскопическом исследовании гистосрезов головного мозга;
— положительный результат РИФ;
— установление при гематологическом исследовании лейкопении(5–6 тыс./мкл);
-положительная биопроба на 5 здоровых невакцинированных поросятах (в возрасте 2–3 мес.), зараженных фильтратом патологического материала с развитием у них через 2–6 дн. клинической картины, характерной для чумы свиней, при наличии эпизоотологических данных. [13].
Максимович, В.В. (2001) и многие другие авторы при дифференциальной диагностике КЧС исключают африканскую чуму, сальмонеллез, рожу, болезнь Ауески, трансмиссивный гастроэнтерит, дизентерию и другие септические болезни, схожие по клинике с чумой, а также отравления, характеризующиеся геморрагическим диатезом [23, 29] .
А. Коломыцев, А. Стрижаков, С. Лукьянов (2008) отмечают сочетанное течение КЧС и отечной болезни поросят [26] .
Методологически существуют три метода оценки риска: качественный, полуколичественный и количественный, представлены в таблице 1.
Таблица 1 – Характеристика методов оценки риска
| Метод | Принцип | Особенности метода |
| Качественный | описание риска проводится словами «относительно высокий», «ниже чем при…», «незначительный». | — обычно предшествует количественному методу;
— быстро реализуем; — доступен и возможен на основе литературных данных; — не требует специализированных экспериментальных исследований, — используется понятная терминология. |
| Полуколичественный | предпринимается попытка провести ранжирование уровней риска словами
(высокий, средний, низкий риск) или на основе бальной оценки (4-10 бальная система оценки), выводимой группой экспертов |
— компромиссное решение при отсутствии/недостатке количественных показателей;
— высокий уровень субъективизма в оценке. |
| Количественный | объективный метод оценки предполагаемого ущерба, вероятности
возникновения болезни, охвата поголовья и территорий, выраженный в числовых значениях. |
— наиболее информативный и точный метод;
— требует наличия/тщательного сбора количественных показателей; — необходимо наличие экспериментальных данных; — осмысление результатов требует специальной подготовки. |
Эти методы дополняют друг друга и одновременно реализуются в процессе решения одной задачи (оценка риска). Как правило, качественно оценивают риск заноса заболевания на ранее благополучную территорию; количественно — возможное распространение и ущерб от заболевания; полуколичественно — общий риск в данной ситуации (табл.1). Качественный метод является наиболее доступным, он позволяет получить информацию быстро и в общедоступной форме.
Количественный метод более информативен, но требует точных данных и специальной подготовки, длительный. Перечисленные методы дополняют друг друга и реализуются одновременно в процессе решения поставленной задачи (оценка риска). Однако качественная методика позволяет провести оценку риска заноса заболевания на ранее благополучную территорию или хозяйство, свинокомплекс и т.д.; количественным методом оценивают возможное распространение и ущерб от заболевания, а полуколичественным – оценивают общий риск в данной ситуации.
Для анализа полученных результатов был использован метод статистической обработки полученных результатов исследований: пакет анализа Microsoft Excel.
3. АРАКТЕРИСТИКА КЛАССИЧЕСКОЙ ЧУМЫ СВИНЕЙ
3.1 ОБЩИЕ СВЕДЕНИЯ
Классическая чума свиней (Pestis suum) – вирусная высококонтагиозная болезнь свиней, характеризующаяся повышением температуры тела, геморрагическим диатезом, септицемией, а также крупозной пневмонией. Очень часто данная болезнь при затяжном течении осложняется секундарной инфекцией (сальмонеллы, пастереллы), в результате возникает крупозно-дифтеретическое воспаление толстого кишечника и крупозное воспаление легких [8,10].
К вирусу чумы восприимчивы свиньи всех возрастов вне зависимости от времени года. Данному заболеванию подвержены дикие и домашние свиньи. Экономический ущерб складывается из затрат на ликвидацию данной болезни и утилизацию трупов свиней. Занос вируса возможен по многим причинам, в основе которых стоит несоблюдение ветеринарно-санитарных правил. Как было указано ранее, болеют дикие кабаны. В случае, если свиноводческое хозяйство расположено вблизи лесных массивов, заражение свиней возможно в случае занесения вируса от диких кабанов [9].
По данным А. А. Коломыцева, болезнь впервые была описана в 1810 году в штате Теннеси (США). В 1830 году зарегистрирована вспышка в штате Огайо (США). Во Франции классическая чума свиней замечена в 1822, в Германии в 1833 году. Болезнь открыта и подробно описана в 1862 году в Англии, далее была распространена на Европейском континенте. В настоящее время классическая чума свиней встречается повсеместно, за исключением США, Австралии, Канады, Новой Зеландии, Швеции, Норвегии, Австралии. При проведении противоэпизоотических мероприятий, а также введении живой вирусвакцины, удалось исключить распространение болезни [14, 26].
КЧС вызывает большой экономический ущерб из-за почти 100%-ной заболеваемости свиней и падежа, доходящего в отдельных случаях до 70%. Все поголовье неблагополучной фермы, подсобных хозяйств, а также свиней, принадлежащих населению, подвергается убою при наличии в регионе мясокомбинатов,где есть условия для переработки убитых свиней. При отсутствии мясокомбинатов поголовье подвергается уничтожению. Большие затраты также связаны с проведением карантинных мероприятий (организация и дежурство санитарных постов, проведение дезинфекции, вакцинации животных и т.д.)
3.2 ЭпизоотОЛОГИические данные
Ч.К. Авылов, Н.М. Алтухов, В.Д. Бойко утверждают, что источником болезни являются больные или переболевшие чумой свиньи-вирусоносители. Вирус от больных и переболевших чумой свиней выделяется во внешнюю среду со всеми секретами и экскретами [1].
Как известно, и это подтверждают Т.В. Дрю, С. Грэм, Х. Крук (2014), Б.Ф.Бессарабов, А.А. Вашутин, Е.С.Воронин (2007), туши вынужденно убитых свиней, субпродукты, трупы, необезвреженные боенские и кухонные отходы могут быть источником заражения свиней вирусом чумы. В.В. Макаров, С.И. Джупина, А.А. Коломыцев говорят о передаче вируса через предметы ухода, корма, водоисточники, транспортные средства, одежду, обувь обслуживающего персонала, загрязненную выделениями больных и вирусоносителей. В распространении чумы могут принимать участие собаки, птица, грызуны, мухи и даже дождевые черви. Заражение КЧС происходит через пищеварительный тракт, а также через органы дыхания и поврежденную кожу. Течение вспышки КЧС зависит от вирулентности вируса и иммунитета у свиней [8, 17].
Вирус передается алиментарно, аэрогенно, а также вертикально от матери плоду, в результате 15-25% народившегося приплода от супоросных свиноматок, зараженных эпизоотическими слабовирулентными штаммами возбудителя болезни становятся иммунологически толерантным к вакцинному вирусу классической чумы свиней.
Чума свиней возникает в любое время года, однако её чаще регистрируют осенью, когда осуществляются массовые перемещения, продажа и убой свиней. В свежих очагах при наличии неиммунного поголовья эпизоотический процесс протекает интенсивно в форме эпизоотий. При заносе возбудителя вирусоносителями в хозяйстве сначала заболевают немногие животные, а через 10-14 дней – почти всё поголовье свиней. Если вирус занесен с инфицированным кормом, то в течение 2-3 дней заболевает большая часть животных или почти все. Заболеваемость чумой достигает 95-100%, летальность – 60-100% .
Согласно Инструкции о мероприятиях по предупреждению и ликвидации классической чумы свиней 1990 года, очагом классической чумы свиней считают свиноводческие фермы, отдельные свинарники, урочища, где имеются больные классической чумой свиньи, мясоперерабатывающие предприятия в период убоя и переработки неблагополучного по КЧС поголовья [20].
Неблагополучным по классической чуме свиней считают населенный пункт, часть его по административному делению или отдельный свиноводческий (животноводческий) объект, на территории которого установлен очаг болезни.
Территория с высокой степенью риска возникновения и распространения болезни является угрожаемой и включает хозяйства и населенные пункты:
— примыкающие к неблагополучным пунктам или имеющие в ними хозяйственно-экономические связи, а также находящиеся на территории, неблагополучной по чуме диких свиней (кабанов);
— расположенные в пограничных районах страны, в районах международных аэропортов, морских портов и пограничных железнодорожных станций;
— использующие пищевые отходы для кормления животных;
— вокруг биопредприятий и учреждений, работающих с вирусом классической чумы, а также мясокомбинатов, предприятий общепита и других перерабатывающих мясо и сырье свиного происхождения. Для профилактики болезни животных на угрожаемой территории прививают против КЧС.
Территория, свободная от возбудителя классической чумы свиней, включает регионы страны, где в последние 5 и более лет не регистрировали эту болезнь среди домашних и диких свиней и не проводили их иммунизацию против КЧС.
При первичном заносе в хозяйство КЧС протекает особенно злокачественно, охватывая при этом почти все поголовье свиней. При заносе чумы в хозяйство, где имеется вакцинированное против чумы свинопоголовье, заболевание возникает первоначально у тех свиней, у которых отсутствует иммунитет к КЧС, а в дальнейшем, вследствие пассажирования возбудителя и усиления его вирулентности, начинают болеть те свиньи, у которых иммунитет недостаточно напряженный [20].
3.3 Патогенез
По данным Р.В. Белоусовой, Э.А. Преображенской, И.В. Третьяковой, попав в организм свиньи, вирус чумы репродуцируется в лимфоидно-ретикулярной ткани входных ворот и через 6 часов проникает в регионарные лимфоузлы. Спустя сутки его обнаруживают в крови. Хотя для вируса свойственнапантропность, он преимущественно репродуцируется и накапливается в органах, богатых лимфоидно-ретикулярными клетками: в селезенке, лимфоузлах, костном мозге и печени. Поражая эндотелий сосудов, вирус вызывает некроз сосудистых стенок. Возникают их разрывы и массовые кровотечения. Вследствие нарушения кровоснабжения в лимфоузлах, кишечнике и других органах образуются очаги некроза, а в селезенке – инфаркты [7,12].
В результате поражения кроветворных органов развиваются анемия и лейкопения. Атрофический процесс в лимфодно-макрофагальной ткани заканчивается блокадой иммунной системы, что проявляется сильным угнетением опсоно-фагоцитарной реакции и резким снижением бактерицидности сыворотки крови. При осложнении секундарными бактериальными инфекциями развивается пневмония и крупозно-дифтеритический колит. Может возникнуть вторичная бактериальная септицемия (пастереллез, сальмонеллез). Воспалительные процессы в мозговой ткани обусловливают развитие в головном и спинном мозге периваскулярных инфильтратов, характерных для негнойного энцефалита. Такие поражения клинически проявляются нервными явлениями (депрессия, возбуждение, припадки). При остром течении смерть наступает в результате морфологичеких поражений всех систем организма, в особенности органов кроветворения.
При подостром и хроническом течении нарушаются основные обменные процессы, развиваются блокада иммунной системы и угнетение естественной резистентности. На этом фоне усиленно размножается условно патогенная микрофлора, основной вирусный процесс осложняется секундарной инфекцией.
В таких случаях поражаются лёгкие (крупозная пневмония) и толстый кишечник (крупозно-дифтеритический колит). Это приводит к глубокому нарушению обмена веществ, истощению животного и его смерти.
3.4 Течение и симптомы болезни
По данным Ч.К.Авылова, Н.М. Алтухова, В.Д. Бойко (2006) инкубационный (скрытый) период длится 1-9 дней, реже затягивается до 2-3недель. Течение болезни острое, подострое и хроническое. У поросят подсосного возраста часто бывает молниеносное течение болезни [1].
По данным И.П. Барышникова (2006), инкубационный период обычно длится 5-8 дней, болезнь может проявляться в нервной, септической, грудной, кишечной и атипичной формах. В начале повышается температура тела до40-41°С, развивается анорексия, озноб, рвота, запор, сменяемый поносом (иногда кровавый), конъюнктивит. На коже появляются пустулы, заполненные желтым экссудатом, а несколько позже – точечные кровоизлияния, которые в дальнейшем сливаются и образуют темно-багровые пятна, не исчезающие при надавливании. Супоросные свиноматки абортируют. Нередко возникает слизисто-гнойный ринит, у отдельных животных – носовое кровотечение, некоординированные движения, дрожание конечностей, судороги, эпилептические припадки. При поражении легких развивается крупозная пневмония, проявляющаяся судорожным кашлем, затрудненным сопящим дыханием и болезненностью грудной клетки [6].
Болезнь начинается с повышения температуры тела (до 40,5-41,9°С), лихорадка носит постоянный характер. На 2-3-й день у заболевших животных уменьшается аппетит, появляется озноб, рвота, запор, сменяемый затем поносом (иногда кровавым). В начале заболевания поносы бывают редко. Слизистая оболочка глаз покрасневшая, веки опухают и происходит их склеивание слизисто-гнойным экссудатом. Больные животные неохотно поднимаются, хвост раскручен, голова опущена, спина сгорбленная, отмечается слабость задних конечностей, походка становиться шаткой, у свиней наблюдается сильная жажда. Свиньи чаще лежат, зарывшись в подстилку. В хлеву ищут место похолодней [25] .
Мочеиспускание затруднено, моча иногда становиться темно-коричневого цвета. У некоторых поросят в области живота, внутренней поверхности бедер, шеи и основания ушных раковин образуются пузырьки и пустулы, заполненные желтоватым экссудатом. Позднее (на 5-9-й день болезни) на коже начинают появляться мелкие точечные кровоизлияния. В процессе развития болезни кровоизлияния могут сливаться, образуя темно-багровые пятна, которые при надавливании не исчезают. Кровоизлияния бывают также на слизистой оболочке носа. У больных животных отмечается сердечная недостаточность, дыхание становится учащенным и затрудненным, появляется посинение живота, хвоста, ушей и пятачка.
У отдельных животных бывает носовое кровотечение, судороги, парез или паралич зада. Перед смертью температура у поросят падает до 35-36 оС. Смерть наступает на 7-10 день болезни. Летальность при этой форме КЧС до 80-100%.Супоросные свиноматки абортируют.
У поросят возможно сверхострое течение КЧС, протекающее в виде лихорадки, угнетения, приступов рвоты. Поросята погибают через 1-2 дня с явлениями эпилепсии или в коматозном состоянии.
К концу вспышки КЧС, в результате повышения устойчивости свиней и снижения вирулентности вируса, чума принимает подострое, затяжное и хроническое течение.
При подостром течении КЧС болезнь длится 2-3 недели, типичные для КЧС признаки выражены слабее. У больных животных отмечаются периодические взлеты температуры тела, в результате крупозно — некротического энтероколита — запоры, сменяющиеся поносом, извращается аппетит.
Из-за поражения легких возникает кашель, одышка, истечения из носа, пневмония. С целью облегчения дыхания и уменьшения болезненности плевры поросята стараются лежать на груди или принимают позу сидячей собаки. Животные ослабевают, худеют и в большинстве своем погибают.
При хроническом течении КЧС болезнь затягивается до 2 месяцев. У поросят наблюдаются периодические поносы, кашель, переменчивый аппетит. Кожа имеет сморщенный вид, покрывается экзематозными струпьями. Болезнь обычно приводит к падежу. Оставшиеся в живых худые животные в течение одного года могут быть вирусоносителями КЧС[1,24] .
3.5 Патологоанатомические изменения
Согласно данным Б.Л.Белкина, А.В. Жарова, В.С. Прудникова (2013) патологоанатомические изменения зависят от формы течения болезни, характера и локализации осложнений при КЧС и возраста павшего животного [19] .
Кожа ушей, шеи, брюшной стенки и внутренняя поверхность бедер имеет темно-багровый цвет. Вся поверхность кожи усеяна единичными и множественными кровоизлияниями различной формы и величины. Лимфатические узлы увеличены, от темного до черно-красного цвета, на разрезе виден характерный мраморный рисунок. Легкие пятнистые, сочные; на разрезе одиночные кровоизлияния, иногда геморрагические инфаркты.
Лимфоузлы увеличены, плотные, пронизаны кровоизлияниями, на разрезе выражена мраморность.
Сердце: в области коронарных сосудов и ушек сердца отмечаются кровоизлияния. Под эпикардом и эндокардом, пульмональной и костальной плеврой, в слизистой гортани и надгортанника – точечные и пятнистые кровоизлияния. Селезенка темно-красного цвета, увеличена в объеме, с одиночными или множественными инфарктами по краям, имеющими форму темно-красных узлов. На разрезе инфаркты имеют форму клина.Наличие инфарктов в селезенке является одним из характерных признаков КЧС. Почки анемичны, корковый слой пронизан множеством мелких кровоизлияний, которые хорошо заметны на бледном фоне. Слизистая оболочка почек, лоханок, мочеточников и мочевого пузыря покрыта пятнистыми и точечными кровоизлияниями. Слизистая желудочно-кишечного тракта катарально воспалена, пятнисто гиперемирована, с наличием петехий. Явления геморрагического диатеза наиболее резко выражены к 7-9дню КЧС.
При подостром течении КЧС в желудке и кишечнике крупозно-геморрагический гастрит и энтерит, при хроническом — крупозно-дифтеритические и язвенно-некротические поражения, особенно ярко выраженные в слепой и ободочной кишках.
Слизистая оболочка кишечника диффузно гиперемирована и покрыта дифтеритическими слоистыми струпьями, так называемыми чумными «бутонами» и фолликулярными язвами, которые возвышаются над слизистой. Поражения кишечника чаще встречаются и более резко выражены у поросят, больных КЧС, в возрасте 2-4 месяцев и старше.
При патогистологическом исследовании в органах иммунной системы отмечают ярко выраженное расстройство крово- и лимфообращения, мукоидноеифибриноидное набухание соединительной ткани стенок сосудов, пролиферацию лимфо- и плазмобластов, некрозы макрофагов и лимфоцитов по типу кариопикноза и кариорексиса, а также кариолизиса. При электронной микроскопии можно обнаружить вирионы в цитоплазме макрофагов. В центральной нервной системе устанавливают негнойный энцефалитомиелит лимфоцитарного типа с наличием периваскулярных инфильтратов, очаговую пролиферацию клеток микроглии с образованием узелков, дистрофию ганглиозных клеток, особенно при нервной форме болезни [13].
Подострое течение КЧС продолжается до трех недель, что связано с осложнением чумы пастереллезом. Характеризуется преимущественно поражением органов грудной полости (грудная форма); крупозно-геморрагической пневмонией (легочная форма), часто серознофибринозным плевритом и перикардитом. Наблюдаются множественные кровоизлияния на серозных покровах грудной полости, слизистых надгортанника, гортани, трахеи и бронхов, а также в других органах.
Осложненная сальмонеллезом чума (кишечнаяформа) в основном протекает хронически. Характеризуется преимущественным поражением органов пищеварения (миндалин, глотки, желудка и кишечника) в виде диффузно-очагового фибринозно-некротизирующего (крупозного или чаще дифтеритического) воспаления. Наиболее часто и тяжело поражаются слепая и ободочные кишки с образованием на месте лимфатического аппарата или кровоизлияний дифтеритических многослойных плотных серожелтоватого цвета «бутонов», возвышающихся над поверхностью органа, после отторжения которых остаются глубокие дефекты, или язвы.
Возможны изменения и в других органах, характерные для чумы, осложненной пастереллезом (смешаннаяформа).
Атипичная форма чумы встречается у поросят старшего возраста (2–3 мес.). Она характеризуется наличием неполного комплекса клинико-морфологических изменений (патоморфозом) в виде отдельных кровоизлияний в слизистой прямой кишки, мочевого пузыря, в почках, общей анемии, катарального гастроэнтерита, бронхопневмонии, негнойного лимфоцитарного энцефалита [19].
3.6 Лечение и профилактика
Лечение при КЧС не проводится. Больные КЧС свиньи, согласно существующих правил, подлежат немедленному убою с возможным использованием мяса в обезвреженном виде (Инструкция).
По данным А.А Лимаренко, И.А. Болоцкого, А.И Баранникова (2008) после переболевания у выживших животных развивается нестерильный иммунитет. Для активной иммунизации применяют: сухие вирусвакцины из лапинизированных и культуральных аттенуированных штаммов вируса чумы свиней, лапинизированную вирусвакцину из штамма К, которую применяют с профилактической целью при систематической иммунизации, а также в угрожаемых и неблагополучных по КЧС хозяйствах. Применяют вакцины согласно наставления по ее применению [10].
В.А. Кузьмин с соавторами (2016) говорят о том, что для профилактики классической чумы свиней в нашей стране применяют четыре живые вакцины из штамма К:
1) сухую культуральную вирусвакцину КС (НАРВАК НПО);
2) сухую культуральную вирусвакцину ВГНКИ;
3) сухую культуральную вирусвакцину ЛК-ВНИИВиМ;
4) сухую лапинизированную вирусвакцину СИНЛАК (ВНИИЗЖ).
Иммунитет после однократной прививки и у взрослых животных сохраняется не менее 1 года. В РФ разработана инактивированная сухая культуральная вирусвакцина против классической чумы свиней из штамма ЛК-К для перорального внутримышечного и аэрозольного применения. Эта вакцина является единственным эффективным средством иммунизации диких кабанов.
Как сообщает интернет источник, наиболее коварным звеном в поддержании классической чумы свиней в крупных хозяйствах репродуктивного типа, несмотря на систематическую вакцинацию, является наличие слабоиммунных латентно инфицированных свиноматок, способных к трансплацентарной передаче вирулентного вируса потомству на любой стадии супоросности. В таких хозяйствах часть поросят рождаются латентно инфицированными, способными выделять вирус в течение длительного времени. Таков в основном механизм стационарности КЧС в хозяйствах промышленного типа или в зонах с высокой концентрацией свиней, несмотря на систематическую вакцинацию [10] .
Особая ситуация сложилась с развитием промышленного свиноводства и заносом классической чумы свиней в крупные свиноводческие хозяйства (комплексы). В таких хозяйствах возникновение КЧС на фоне вакцинального иммунитета приводило к появлению стационарных очагов болезни. В них больных животных и вирулентный вирус обнаруживали в течение многих лет, несмотря на систематическую вакцинацию и строгие ветеринарно-санитарные меры. Опыт борьбы с КЧС в странах ЕС привел к выводу, что существующие в мире живые вакцины против КЧС и традиционные схемы их применения «способны защитить свиней от заболевания и гибели, но не от инфицирования».
Для многих стран с развитым свиноводством, в том числе и России, стратегия ликвидации классической чумы свиней, принятая странами ЕС, на основе массового убоя и уничтожения свиней оказалась неприемлемой по экономическим и технологическим соображениям. Негативный опыт специфической профилактики классической чумы свиней в развитых странах, в том числе в СССР и РФ, традиционными методами привел к выводу о необходимости разработки беспрецедентной стратегии вакцинопрофилактики, получившей название гипервакцинация. Данная стратегия, по мнению автора этой идеи, является единственно возможным решением проблемы ликвидации КЧС в странах с интенсивным свиноводством без депопуляции свиней. Основанием для реализации новой стратегии борьбы с КЧС прежде всего явилась высокая иммуногенность и безопасность применения больших доз живой вакцины КС.
Основная цель гипервакцинации с применением вакцины КС состоит в прекращении циркуляции вирулентного вируса КЧС в неблагополучных хозяйствах путем создания максимально выраженного вакцинального иммунитета практически у всего поголовья, и в первую очередь, у свиноматок и новорожденных поросят. Кроме того, гипервакцинация преследует цель возможного прекращения циркуляции вирулентного вируса КЧС в популяции свиней за счет замещения вакцинным вирусом. Гипервакцинацию свиней вакциной КС в течение последних 7 лет проводили в раде крупных свиноводческих комплексов России, неблагополучных по КЧС. С этой целью в НПО НАРВАК изготовлено более 20 млн доз сухой концентрированной вакцины КС.
Свиноматок прививали перед каждым осеменением в дозе > 105 ТКИД50, а поросят — на 40-50 и 85-95 дни в дозе > 5х104 ТКИД50. Наличие КЧС в хозяйствах после гипервакцинации определяли всеми существующими методами исследований. В качестве одного из свидетельств эффективности гипервакцинации против КЧС в хозяйствах содержали группы свиней (0,5—1,0% поголовья), не вакцинированных против КЧС с момента рождения до убоя (индикаторные группы). Учитывая важность и высокую вероятность трансплацентарного инфицирования, исследовали с диагностической целью кровь новорожденных поросят методом ПЦР. Итоги проведенных исследований подтвердили правильность выбора в пользу гипервакцинации как единственного радикального средства ликвидации КЧС в промышленном свиноводстве без депопуляции свиней. В последнее время для специфической профилактики классической чумы свиней были предложены различные генно-инженерные вакцины: рекомбинантные живые, субъединичные маркированные и химерные вакцины. Однако по иммуногенности они уступали или не имели преимуществ по сравнению с традиционными живыми вакцинами против КЧС.
Меры борьбы и профилактика. Согласно А.Ф.Дмитриеву, В.И.Сахно, В.В.Соловьеву и др.(2008), при возникновении подозрения на заболевание чумой больных животных изолируют, прекращают перегруппировки животных, неблагополучные станки дезинфицируют 2-3% раствором едкого натра. Одновременно вводят жёсткие ограничительные меры с целью недопущения распространения болезни. Для уточнения диагноза проводят эпизоотологический анализ, клинический осмотр с термометрией поголовья неблагополучных свинарников.
При подтверждении диагноза на чуму свиней ферму карантинируют и определяют границы угрожаемой зоны. При проведении противочумных оздоровительных мероприятий убивают все поголовье неблагополучных свинарников. По условиям карантина запрещают (Ветеринарное законодательство):
1. вывоз и ввоз свиней, а также вывоз из хозяйства сырой свинины и других продуктов вынужденного убоя свиней;
2. перегруппировку свинопоголовья внутри хозяйства без согласования с ветеринарным специалистом;
3. убой свиней без разрешения ветеринарного врача или ветеринарного фельдшера;
4. выезд любого вида транспорта из неблагополучного по чуме свиней пункта, а также выход обслуживающего персонала без санитарной обработки верхней одежды и обуви;
5. продажу на базарах и рынках в пределах карантинируемой и угрожаемой территории свиней, а также свиного мяса, сала и других продуктов, полученных от убоя, в сыром виде.
При проведении мероприятий по ликвидации чумы свиней учитывают производственное направление хозяйства:
1. в откормочных, подсобных и прикухонных хозяйствах подвергают убою все свинопоголовье неблагополучных свинарников; последующее комплектование проводят только вакцинированным против чумы свинопоголовьем;
2. в репродукторных хозяйствах, племзаводах, а также в хозяйствах, в которых убой всего свинопоголовья неблагополучной фермы нецелесообразен, проводят ежедневный клинический осмотр и термометрию животных, подвергают убою всех больных и подозрительных по заболеванию чумой, а также свиней, отстающих в развитии и страдающих легочными и желудочно-кишечными болезнями. Всех остальных свиней с нормальной температурой тела в неблагополучных и благополучных свинарниках (фермах) вакцинируют. В течение 20 дней после вакцинации ведут клиническое наблюдение за животными и в случае появления у них высокой температуры тела, сильного угнетения общего состояния и отказа от корма их также подвергают убою.
Трупы свиней, павших от чумы, сжигают.
Карантин с неблагополучного по чуме свиней пункта снимают через 40 дней после последнего случая падежа или убоя больных свиней, обезвреживания мяса, полученного от их убоя, и при условии проведения всех ветеринарно-санитарных мероприятий, предусмотренных инструкцией. После снятия карантина сохраняют ограничения, в частности запрещают вывозить оставшихся свиней, продукты животного происхождения и сырье, полученные от убоя (кроме вывоза на мясокомбинат), за пределы неблагополучного хозяйства.
По завершению откорма свиней убивают на мясокомбинате, проводят весь комплекс закрепительных мероприятий с заключительной дезинфекцией и снимают ограничения [23].
Согласно данным литературы, в том числе Инструкции, В.А. Кузьмину с соавторами (2016), в угрожаемой зоне запрещают контакт и связи с неблагополучным пунктом; вакцинируют всех свиней; устанавливают дезбарьеры при входе и выходе из свинарников; ведут строгий ветеринарно-санитарный контроль за заготовкой и вывозом свиней, сырья, фуража, а также осуществляют ветеринарно-просветительную работу среди населения.
После проведения оздоровительных мероприятий и снятия карантина в хозяйствах (пунктах), бывших неблагополучными по чуме свиней, вакцинацию свиней проводят в течение двух лет.
Ответственность за проведение организационно-хозяйственных мероприятий по борьбе с чумой свиней несут руководители хозяйств, предпиятий и граждане-владельцы животных, а специальных (ветеринарных) – ветеринарные специалисты, обслуживающие эти хозяйства и предприятия.
Профилактические мероприятия. В основе предупреждения возникновения КЧС лежат общие профилактические меры, т.е.главное внимание обращают на охрану благополучных хозяйств от заноса возбудителя чумы свиней. Для успешной профилактики классической чумы свиней необходимо учитывать и вертикальную передачу возбудителя инфекции, фактор скрытого вирусоносительства у животных определенных возрастных групп, и зависимость вирусоносительства от проводимой вакцинации животных [28].
Большую опасность представляет перемещение клинически здоровых свиней их хозяйств, оздоровленных от этой инфекции. Свинину от таких животных следует реализовать на мясные изделия, подвергающиеся по технологии высокой термической обработке. В зоне реализации такой свинины все кухонные отходы подвергаются термической обработке.
Специфическая профилактика классической чумы свиней должна проводиться с учетом эпизоотической ситуации. Необходимо учитывать, что применение противочумных вакцин на большом поголовье взрослых свиней способствует формированию у определенной части животных скрытого вирусоносительства. Поросята прививаются в 2-х месячном возрасте, через 10 дней повтор и через 1 год ревакцинация, каждый год [20].
4. ХАРАКТЕРИСТИКА АФРИКАНСКОЙ ЧУМЫ СВИНЕЙ
4.1 ОБЩАЯ ХАРАКТЕТИСТИКА ВОЗБУДИТЕЛЯ
Африканская чума (лат. — Pestis africana suum; англ. — African swine fever; болезнь Монтгомери, восточно-африканская лихорадка) — особо опасная высококонтагиозная болезнь свиней, характеризующаяся лихорадкой, обширными геморрагиями и цианозом кожи, тяжелыми дистрофическими и некротическими поражениями клеток ретикулоэндотели-альной системы, внутренних органов и высокой летальностью [1] .
Возбудитель болезни. Таксономическое положение вируса до настоящего времени не определено. Болезнь вызывает ДНК-содержащий кубической формы вирус семейства Iridoviridae размером 170 — 220нм. Вирус репродуцируется в организме диких и домашних свиней (в моноцитах, макрофагах и ретикулоэндотелиальных клетках), в культурах клеток свиней, а также в клещах рода Ornithodoros [27] .
Выявлено несколько серологических и иммунологических групп и подгрупп вируса, что представляет собой основное препятствие в разработке средств специфической профилактики (вакцин, гипериммунных сывороток).
Вирус устойчив к широкому диапазону температур, изменениям рН среды, к высушиванию и гниению. В трупах сохраняет жизнеспособность и вирулентность до 2 мес, в фекалиях — более 1 мес., в почве — более 6 мес, на объектах внешней среды и строительных материалах — более 2 мес. Солнечные лучи инактивируют вирус через 40 — 60 мин. В условиях свинарника при температуре 24 °С остается активным от 4 сут. до 4 мес.
В свинине и копченостях из мяса инфицированных свиней вирус сохраняется до 5 — 6 мес. В крови, взятой от больных свиней, при температуре 5°С жизнеспособен до 7 лет, при температуре 20 °С — до 18 мес, при 37 «С — до 30 дней. При температуре 60 °С инактивируется за 20 мин. Устойчив к кислотам и щелочам, но горячие растворы щелочи (в частности, гидроксид натрия) действуют на него губительно. Проявляет высокую чувствительность к формальдегиду и хлорсодержащим препаратам.
4.2 ЭПИЗООТОЛОГИЧЕСКИЕ ДАННЫЕ
Болеют домашние свиньи всех пород и возрастов независимо от сезона года, а также дикие африканские свиньи (бородавочники, кустарниковые, лесные) и кабаны. Установлено, что вспышки болезни у домашних свиней регистрировались во всех зонах, в которых обитали дикие африканские свиньи. Животные других видов, а также человек невосприимчивы к вирусу. У диких африканских свиней болезнь протекает субклинически. Являясь вирусоносителями, они могут заболевать в период случки и кормления поросят. От диких свиней-вирусоносителей в естественных условиях заражаются клещи рода Ornithodoros, чем обеспечивается природная очаговость болезни.
Как отмечают В.В. Макаров с соавт. (2011), «предпочтительными биотопами кабанов являются богатые водой болотистые лесистые, заросшие камышом или кустарником местности. В последние годы, в связи с прогрессирующей гуманизацией природно-территориальных комплексов, обитание кабанов проявляет выраженную приуроченность стаций к антропогенному ландшафту и даже синантропность, что значительно повышает уровень разнообразных спонтанных контактов и общений между дикими, домашними свиньями и человеком в ветеринарно-эпидемиологическом плане»[28, 33].
Основными источниками возбудителя служат больные животные и ви-русоносители, от которых заражаются клещи. Из организма этих животных вирус в больших количествах выделяется с фекалиями и мочой, слюной, секретом конъюнктивы, загрязняя окружающую среду.
К факторам передачи вируса относятся все объекты внешней среды, контаминированные выделениями больных, а также обслуживающий персонал. Особое значение как фактор передачи приобретают необеззара-женные мясо свиней и мясные продукты, отходы пищевых предприятий. Переносчиками вируса могут быть кровососущие насекомые.
Основные ворота инфекции — респираторный тракт, слизистые оболочки ротовой полости, носоглоточного кольца, глаза и поврежденные кожные покровы. При первичном возникновении болезни заболеваемость и смертность свиней хозяйства приближаются к 100 %.
4.3 Патогенез
Патогенез болезни изучен недостаточно. Полагают, что вирус, проникнув в организм, адсорбируется на клетках ретикулоэндотелиальной системы (РЭС), исчезает из крови, размножается в пораженных клетках и за 24…48 ч до повышения температуры тела вновь появляется в крови, во всех органах и тканях, где вызывает дистрофические и некротические изменения с пикнозом и рексисом ядер клеток миелоидного ряда и лимфоцитов, а также дистрофию коллагеновых и ретикулярных волокон. Развиваются некротические поражения стенок кровеносных сосудов, что приводит к застою крови, тромбозу и геморрагиям в органах и тканях.
4.4 Течение и клиническое проявление
Различают сверхострое, острое, под-острое, хроническое и латентное течение болезни, что зависит от вирулентности и природы вируса, занесенного в хозяйство.
При сверхостром и остром течении инкубационный период продолжается от 1 до 2 суток. У животных повышается температура тела до 41…42 «С. В это время вирус появляется в крови, но, несмотря на высокую температуру в начале лихорадочного периода, у животных сохраняется аппетит. В дальнейшем наблюдают угнетение, серозно-геморрагический конъюнктивит, на коже различных участков тела, особенно в области живота, на внутренних поверхностях бедер появляются фиолетово-красные пятна, кровоизлияния и гематомы размером от 1 до 3…4 мм. У большинства животных отмечают признаки пневмонии, отека легких и гастроэнтерита. Кожа становится цианотичной, животные лежат, у них наблюдают клони-ческие судороги. Смерть наступает через 1…3 сут после повышения температуры тела. Погибают все заболевшие.
При подостром течении, вызываемом вирусами пониженной вирулентности, признаки такие же, но длительность болезни увеличивается до 4…5 суток. Часть животных выживают, болезнь у них принимает хроническое течение, и они остаются носителями и выделителями вируса.
При хроническом течении преобладают признаки поражения легких, суставов и кожи (многочисленные мелкие гематомы в коже нижней стенки живота, ушных раковин). Продолжительность болезни 25…40 сут. Болезнь заканчивается смертью.
Латентное течение характерно для естественных носителей вируса — бородавочников, лесных и кустарниковых свиней и отдельных домашних свиней. Клинически болезнь не проявляется, но у таких животных периодически развивается вирусемия с вирусовыделением.
4.5 Патологоанатомические изменения
При сверхостром и остром течении упитанность сохранена, трупное окоченение выражено, кожа нижней стенки живота, ушных раковин, промежности красно-фиолетового цвета, в толще кожи многочисленные кровоизлияния, иногда гематомы величиной 1…5 мм. Лимфатические узлы — соматические и особенно висцеральные (портальные, мезентериальные, бронхиальные средостенные) — увеличены, темно-красные, на разрезе сочные, пропитаны кровью, некоторые напоминают сгустки крови. Миокард размягчен, под эпикардом множественные полостчатые кровоизлияния. Легкие увеличены, под легочной и реберной плеврой множественные точечные и пятнистые кровоизлияния. Соединительная ткань легких пропитана серозно-фибриноз-ным студенистым экссудатом, что придает органу характерное ярко выраженное дольчатое строение. Селезенка увеличена в 2 — 4 раза, темно-красная, мягкой консистенции, под капсулой точечные и пятнистые кровоизлияния. У отдельных свиней отмечают краевые инфаркты [35].
Желудок наполнен кормом, слизистая оболочка набухшая, ярко-красная, с очагами некроза. Тонкий и толстый отделы кишечника наполнены кормовыми массами, слизистая оболочка местами ярко-красного цвета, под ней — множественные точечные, полосчатые и пятнистые кровоизлияния. Печень увеличена, набухшая, дряблая; под капсулой кровоизлияния; желчный пузырь увеличен, стенки его отечны, пропитаны серозно-фибринозной студнеобразной жидкостью. Желчь густая, часто с кровью.
Почки увеличены, размягчены, под капсулой множественные точечные и пятнистые кровоизлияния. У некоторых трупов ткань, окружающая почки, пропитана желтоватым серозно-фибринозным экссудатом. Слизистая оболочка почечной лоханки отечна, покрыта кровоизлияниями.
При хроническом течении патоморфологические изменения проявляются увеличением бронхиальных и средостенных лимфатических узлов с кровоизлияниями в паренхиму, двусторонним гнойно-фибринозным плевритом и воспалением легких, серозно-фибринозным перикардитом, сероз-но-фибринозными артритами, некротическими изменениями участков кожи нижней стенки живота, ушных раковин, промежности [35].
4.6 Диагностика и дифференциальная диагностика
Диагноз устанавливают комплексно. В связи с тем, что африканская чума свиней по клиническим и патологоанатомическим признакам имеет сходство с классической чумой, то основанием для подозрения на нее является заболевание свиней, вакцинированных против чумы. При этом учитывают эпизоотологические данные.
Окончательный диагноз устанавливают заражением подозрительным материалом (кровь, суспензия селезенки и лимфатических узлов) свиней, вакцинированных против классической чумы. Заражение свиней (био-проба) проводят в специализированной лаборатории с соблюдением особых мер предосторожности. В дальнейшем при подтверждении диагноза текущую диагностику осуществляют лабораторными методами (РГАд и цитолиз в культурах клеток, РИФ, ПЦР и др.). Серологические типы вируса определяют в РП, РСК, РЗГАд и другими методами.
Африканскую чуму следует дифференцировать в первую очередь от классической чумы, а также от рожи и пастереллеза при помощи соответствующих бактериологических исследований [16, 21] .
4.7 ЛЕЧЕНИЕ И ПРОФИЛАКТИКА
В патогенезе и иммуногенезе при африканской чуме существенную роль играют аллергические и аутоаллергические реакции. Аттенуированные штаммы вируса не способны стимулировать синтез полноценных антител — последние не обладают вируснейтрализующими свойствами. Кроме того, в природе циркулирует множество серологических и иммунологических типов вируса. Поэтому надежных вакцин и специфической сыворотки против этой болезни нет.
Основу профилактики представляют мероприятия, направленные на недопущение заноса вируса на территорию страны. С этой целью анализируются данные о распространении заболевания в странах мира, ограничивается или запрещается ввоз в страну свинины и продуктов убоя свиней из неблагополучных стран. Все пищевые отходы из самолетов, вагонов-ресторанов, кораблей и других средств передвижения, прибывающих из-за границы, должны быть уничтожены или обеззаражены при высокой температуре. В случае непосредственной угрозы заноса вируса из сопредельного государства создается зона возможного заноса глубиной до 150 км от границы, и в этой зоне осуществляется вакцинация всех свиней против классической чумы и рожи, проводятся ветеринарно-санитарные мероприятия, способствующие предотвращению заноса вируса. В этой зоне все случаи заболевания свиней чумой рассматриваются как подозрительные по африканской чуме и принимаются экстренные меры по уточнению диагноза [2, 36].
Больных свиней лечить запрещается. Все заболевшие подлежат уничтожению вместе со шкурами.
Меры борьбы. При возникновении африканской чумы определяют эпизоотический очаг, инфицированный объект, первую и вторую угрожаемые зоны [13].
В эпизоотическом очаге убивают всех свиней бескровным методом. Всех свиней — павших и убитых — сжигают, остатки зарывают в землю на глубину не менее 2 м. Малоценные предметы ухода за животными, полы свинарников (а возможно, и старые ветхие свинарники), навоз и мусор с территорий, где находились свиньи, сжигают. Освободившиеся от свиней помещения очищают, промывают и трехкратно дезинфицируют горячим раствором гидроксида натрия, хлорсодержащими препаратами. Загоны, участки пастбищ обрабатывают хлорной известью и перепахивают. Проводят дезинфекцию спецодежды обслуживающего персонала. На территории этой зоны запрещают содержание свиней в течение 12 мес.
В первой угрожаемой зоне (глубиной 5 — 20 км от эпизоотического очага) всех имеющихся свиней убивают, а мясо используют на этой территории или выпускают только после термической обработки. Проводят дезинфекцию помещений. Разведение свиней в этой зоне разрешают через 6 мес после уничтожения свиней неблагополучной зоны.
Во второй угрожаемой зоне (глубиной до 100.„150 км от эпизоотического очага) за всем свинопоголовьем устанавливают ветеринарное наблюдение, берут на учет свиней всех форм собственности и вакцинируют против чумы (классической) и против рожи существующими вакцинами. Запрещают скармливать свиньям непроваренные пищевые отходы.
Карантин снимают через 30 дней после убоя свиней в двух первых зонах и осуществления мероприятий в зоне возможного заноса. После снятия карантина устанавливают ограничения на 6 мес. [13] .
5. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
5.1 Методика проведения количественной и качественной оценки риска заноса и распространения африканской и классической чумы свиней
5.1.1 ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
Анализ риска включает в себя прогнозирование или проектирование в будущем, основываясь на исторических фактах или точном анализе текущих событий [2].
Анализ риска – процесс, включающий в себя идентификацию опасности, оценку риска, управление риском и извещение о риске.
Опасность — это элементы или события, которые представляют потенциальную опасность; неблагоприятное событие или неблагоприятное последствие.
В анализе риска опасность описывается как нечто, что может пойти не так, и как это может случиться.
Риск — вероятность или последствие возникновения неблагоприятного события; размер вероятности вреда/ущерба и серьёзность неблагоприятных воздействий.
Оценка риска — это максимально объективная процедура оценки вероятности заноса экзотического болезнетворного агента и решение относительно того, будет или нет внутреннее поголовье с/х животных подвержено воздействию этого агента. Оценка риска используется для того, чтобы изучить силу воздействия экзотической болезни. Однако не всегда этому аспекту уделяется должное внимание [2].
Оценка риска важнейший инструмент количественной и сравнительной оценки риска, связанного с завозом (импортом) животных и животноводческой продукции.
Оценка риска ведется по следующей схеме:
— идентификация опасности;
— траектория движения потенциально инфицированного животного (или материала);
— вероятности контакта инфицированного животного/материала с восприимчивым поголовьем.
Методологически существует несколько вариантов оценки риска: качественный, полуколичественный и количественный. Эти методы не только дополняют друг друга, но и реализуются одновременно в процессе решения одной задачи [2].
Качественный метод – наиболее доступный, позволяющий получить информацию быстро и в общедоступной форме.
Полуколичественный — уровни риска: высокий, средний, низкий риск или на основе балльной оценки, выводимой группой экспертов.
Количественный метод – наиболее точный, но трудоемкий, требующий большого количества точной (цифровой) и достоверной информации.
Управление риском – идентификация и применение мер по снижению риска до приемлемого уровня и документальное обоснование финального решения в отношении ввоза животных и животноводческой продукции [38].
При принятии решений управление риском занимается оценкой опций по снижению или контролю существующих или потенциальных опасностей для биологического и/или финансового благополучия сельскохозяйственных товаров .
Принятые решения могут привести к применению превентивных или восстановительных мероприятий.
Оповещение о риске: открытый двусторонний процесс обмена информацией о риске, что способствует лучшему пониманию риска и принятию более правильных решений по управлению риском.
В нашей работе для оценки риска распространения АЧС на территорию Приморского края был использован качественный метод (дерево решений) и количественный метод [38].
5.1.2 КАЧЕСТВЕННЫЙ МЕТОД ОЦЕНКИ РИСКА
Дерево решений – это способ представления правил в иерархической, последовательной структуре, где каждому объекту соответствует единственный узел, дающий решение.
Под правилом понимается логическая конструкция, представленная в виде «если… то…».
Область применения деревьев решений в настоящее время широка, но задачи, решаемые этим методом, могут быть объединены в следующие три класса.
Деревья решений позволяют хранить информацию о данных в компактной форме, вместо них мы можем хранить дерево решений, которое содержит точное описание объектов.
Деревья решений отлично справляются с задачами классификации, т.е. отнесения объектов к одному из заранее известных классов. Целевая переменная должна иметь дискретные значения.
Если целевая переменная имеет непрерывные значения, деревья решений позволяют установить зависимость переменной от независимых (входных) переменных.
Дерево решений представляет один из способов дробления множества данных на классы или категории. Корень дерева неявно содержит все классифицируемые данные, а листья – определенные классы после выполнения классификации. Промежуточные узлы дерева представляют пункты принятия решения о выборе или выполнения тестирующих процедур, которые служат для дальнейшего разделения данных в этом узле [2].
Дерево решений – это структура, которая состоит из:
— узлов-листьев, каждый из которых представляет определенный класс;
— узлов принятия решения, специфицирующих определенные тестовые процедуры, которые должны быть выполнены по отношению к одному из значений атрибутов; из узла принятия решений выходят ветви, количество которых соответствует количеству возможных исходов тестирующей процедуры [38].
Использование данного метода на практике применимо в отношении определенного хозяйства [30].
Алгоритм проведения данного метода состоит из следующих этапов:
- Описание хозяйства его характеристика (географическое расположение, направление хозяйства, структура поголовья, количество животных в каждой половозрастной группе, система содержания, технологический цикл, метод осеменения, штат предприятия, комплекс противоэпизоотических мероприятий, обеспеченность кормами).
- Оценочными критериями риска заноса заболевания являются кормовая база, контакты с дикими животными, вероятность антропогенного вмешательства и перемещение животных.
Оценка кормовой базы оценивается согласно древу решений (рисунок 2). В хозяйстве при условии завоза промышленных кормов из других регионов риск заноса заболевания – высокий.
Предотвратить риск заноса и распространения возможно только при соблюдении всех ветеринарно-санитарных правил. Контакт с дикими и бродячими, синантропными животными должен быть полностью исключен (рисунок 3).
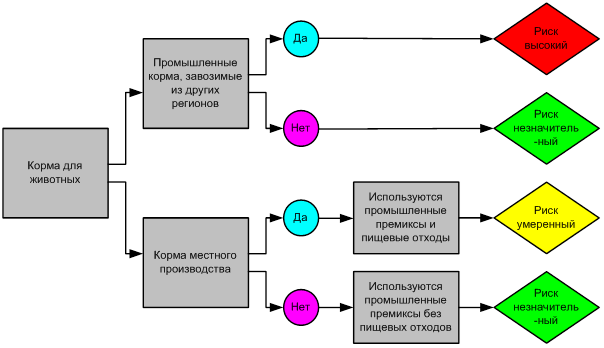
Рисунок 2 – Оценка риска по кормовой базе
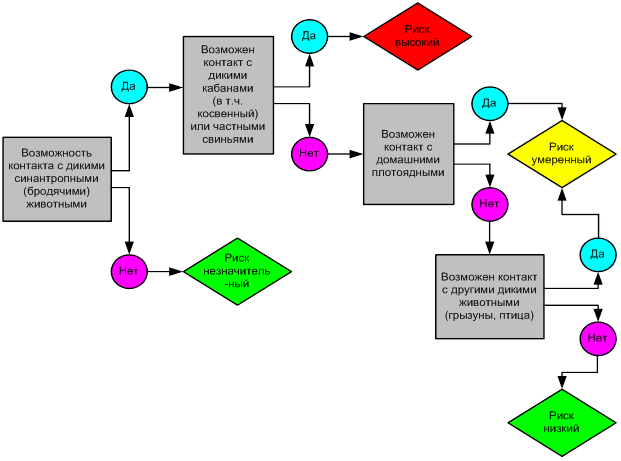
Рисунок 3 – Оценка риска по возможности контактов с дикими животными
При проведении оценки вероятности заноса АЧС антропогенным путем устанавливается, что снижение риска может быть достигнуто на предприятиях, работает по типу закрытого (рисунок 4). Въезд и работа на территории хозяйства осуществляется только автотранспортом предприятия. Посторонние автотранспортные средства не имеют право заезжать на территорию хозяйства. У всех работников свиноводческого предприятия берется подписка, запрещающая им держать свиней на личном подворье.
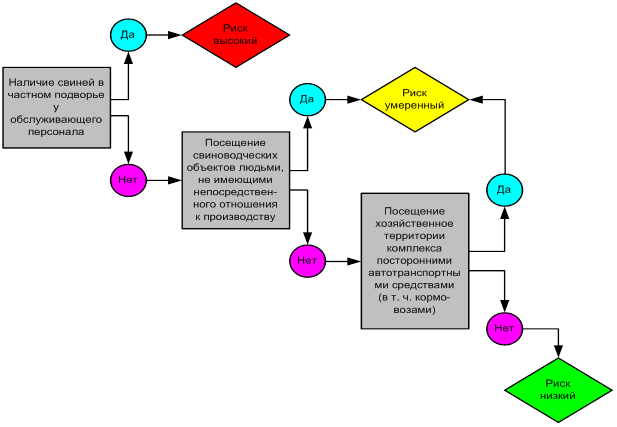
Рисунок 4 – Оценка вероятности заноса АЧС антропогенным путем
Оценка риска, связанная с ротацией (обновлением) поголовья, основано на том, что любое свиноводческое хозяйство должно быть предприятием закрытого типа, доставка новых животных не производится. При оценке риска заноса по данному показателю учитывается ввод или ввоз новых животных из других хозяйств (региона, страны) (рисунок 5)
Также качественную оценку можно провести другим методом, позволяющим определить биологическую безопасность для различных свиноводческих предприятий.
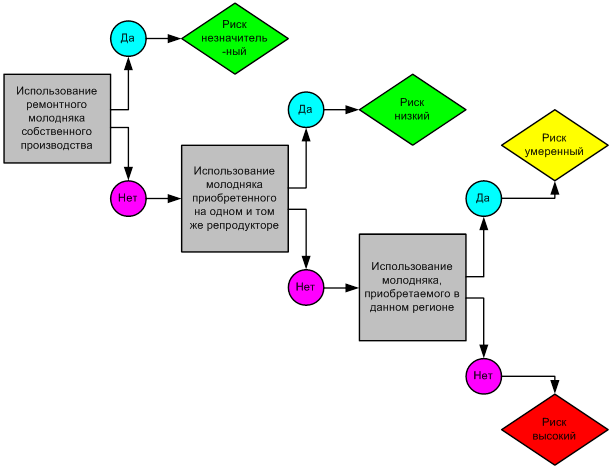
Рисунок 5 – Оценка риска с перемещением животных
Биологическая безопасность – состояние защищенности сельскохозяйственных животных от опасностей, вызванных или вызываемых источником биолого-социальной чрезвычайной ситуации [31].
Соблюдение правовых норм, выполнение санитарно-гигиенических и санитарно-эпидемиологических правил, технологических и организационно-технических требований, а также проведение соответствующего комплекса плановых, санитарно-гигиенических, санитарно- эпидемиологичеких, организационных и технических мероприятий, направленных на предотвращение, ослабление и ликвидацию заражения сельскохозяйственных животных инфекционными болезнями является основой для обеспечения биологической безопасности. Представленный метод оценки биобезопасности предложен сотрудниками ФГБУ ВНИИЗЖ, он позволяет в практических условиях оценивать любой свиноводческий объект [31].
Данный вид оценки может быть проведен силами владельцев, ветеринарными врачами или персоналом, осуществляющим надзорную деятельность. Оценку осуществляют на основании факторов, отраженных в нормативной документации.
Оценка биобезопасности предприятия осуществляется в соответствии с протоколом оценки и разделена на три блока:
Цель первого блока состоит в сборе данных об оцениваемом предприятии: название, адрес, контактные данные и т.д.
Второй блок направлен на предварительную оценку предприятия, по факту которой оцениваются минимальные требования к биобезопасности предприятия, оценка которого определяет целесообразность проведения дальнейшей оценки.
Третий блок — Заключительный – определение полуколичественной оценки биобезопасности предприятия.
Итоговая оценка биобезопасности
Этап I Оценка биобезопасности на предприятии должна проводиться ежеквартально, т.е. должна быть организована система мониторинга биобезопасности. Результаты должны протоколироваться в соответствующей документации каждого объекта предприятия.
Этап II В случае первичной оценки предприятия проводится предварительная оценка, которая определяет целесообразность проведения дальнейшего тестирования: в случае, если получен негативный результат (положительная оценка, хотя бы одного требования), к дальнейшей оценке биобезопасности переходить нет нужды, поскольку итоговая оценка система биобезопасности уже – неудовлетворительная.
Этап III В итоговой оценке каждый фактор оценивается баллами (система оценки плавающая, т.к. учитывается вес фактора в общей оценке биобезопасности), баллы присваиваются от 0 до максимального значения 2 или 3 (см далее), исходя из принципа:
0 – информации нет,
для максимальной оценки 2 балла: 1 – умеренное качество выполнения требований, 2 – высокое;
для максимальной оценки 3 балла: 1 – низкое качество выполнения требований, 2 –умеренное, 3 – высокое.
Оценка осуществляется по вышеописанным факторам и вносится в специальный формуляр (см. приложение), в соответствии с которым определяется итоговая оценка.
Максимальная сумма баллов по всему комплексу факторов – 76 баллов, минимальная – 60.
При получении оценки биобезопасности ниже критического значения 60 баллов, биобезопасность предприятия считается неудовлетворительной, в случае получения оценки от 60 до 76 баллов, биобезопасность предприятия считается удовлетворительной.
Рекомендуемые протоколы оценки биобезопасности приведены в приложениях А, Б.
В Приморском крае в настоящее время наиболее актуальна оценка риска распространения африканской чумы свиней. Для благополучных территорий Дальневосточного Федерального округа актуальным является оценка риска заноса АЧС. В каждом случае необходимо сформулировать ряд вопросов, на которые требуется ответить, собрав необходимую информацию.
Специалисты МЭБ отмечают, что оценка риска (особенно при АЧС) заключается в идентификации угроз, в оценке вероятности их возникновения и корректировке рисков посредством оценки их потенциальных последствий. После идентификации и перечисления угроз в нашем случае от АЧС следующим шагом будет оценка серьезности проникновения заболевания в страну/регион, рассмотрение каналов и механизмов проникновения [3, 22].
Следует учесть следующие факторы:
— Текущая географическая распространенность и наличие заболевания (АЧС).
— Остается ли распространенность статичной или же имеются свежие данные о проникновении заболевания в другие страны, регионы или континенты?
— Насколько близко находятся очаги заболевания? Каково положение в соседних странах/регионах с точки зрения сведений об обнаружении АЧС и насколько можно доверять способности ветеринарных служб обнаруживать и вести борьбу с вспышками заболевания?
— Если болезнь имеет место в соседних странах, где находятся ближайшие к общей границе очаги?
— Имело ли место проникновение АЧС в данную страну в прошлом? Возможен ли факт, присутствия до сих пор в стране в невыявленных эндемических зонах инфекции домашних, одичавших или диких свиней?
— Как распространяется заболевание? Какова роль живых особей, генетического материала, свинины или иных продуктов животноводства, клещей и мигрирующих животных в передаче этиологического агента?
— Имеет ли место значительный импорт животных, мясных продуктов или иных материалов, представляющих опасность с точки зрения АЧС? Происходят ли они из эндемических районов? Соответствуют ли карантинные протоколы для импорта стандартам МЭБ? Насколько надежны карантинные процедуры для импорта?
— Насколько надежны пункты пропуска и пограничные карантинные процедуры по предотвращению незаконного попадания в страну опасных с точки зрения АЧС материалов, включая пищевые отходы судов и самолетов?
— Принято ли в данной стране кормить свиней пищевыми отходами? Есть ли процедуры по обеззараживанию этих отходов?
— Имеет ли место контрабанда, неофициальные передвижения скота и сезонный перегон скота на новые пастбища, представляющие опасность заноса АЧС? В частности, имеют ли место в соседних странах гражданские беспорядки, в результате которых может произойти массовое перемещение людей, скота или появится бесхозный скот?
Следующий шаг – оценка серьезности социально-экономических последствий в случае проникновения заболевания. Учитывают ряд факторов:
— Есть ли вероятность возникновения заболевания в данной стране? Имеются ли восприимчивые популяции животных-хозяев, в том числе, диких?
— Имеется ли в ветеринарной диагностической лаборатории необходимое оборудование и обученный персонал для быстрого обнаружения инфекции?
— Будет ли затруднительно быстро распознать заболевание в разных частях страны?
— Какова величина популяции домашних свиней в стране? Насколько важную роль играет свиноводство в национальной экономике? Какова важность свиноводства для удовлетворения пищевых и прочих общественных потребностей?
— Какова структура свиноводства в стране? Существует ли крупное промышленное свиноводство или же оно сосредоточено в сельских домашних хозяйствах? Сосредоточено ли свиноводство лишь в нескольких районах страны?
— Насколько тяжелым может быть ущерб, нанесенный заболеванием? Подвергнется ли опасности продовольственная безопасность?
— Какими могут быть последствия заболевания для экспортной торговли животными и продуктами животноводства? Как заболевание отразится на торговле внутри страны?
— Имеется ли значительная популяция диких свиней, одичавших свиней или плохо контролируемых домашних свиней, которые находятся на свободном выпасе? Могут ли они послужить резервуаром инфекции АЧС, контроль которой будет существенно осложнен?
— Имеются ли в данной стране поддерживающие и передающие вирус клещи Ornithodoros spp., находящиеся в контакте со свиньями?
— Насколько затруднительна и какова материальная цена борьбы с искоренением заболевания? Возможно ли искоренение вообще?
Ответы на эти вопросы позволяют нам составить картину риска
по АЧС и качественные представления о масштабах опасности. Что самое важное, картина риска позволяет сопоставить АЧС с другими высокоприоритетными заболеваниями и решить какие ресурсы должны быть направлены на подготовку к АЧС по сравнению с ресурсами на другие заболевания. Картина риска также дает некоторое представление о том, откуда можно ожидать заноса АЧС и как должны быть усилены ветслужба и чрезвычайное планирование на случай АЧС. Если АЧС уже находится в стране, информация поможет принять решение об оптимальной стратегии борьбы с заболеванием в текущей ситуации [31].
5.1.3 Количественный метод оценки риска
Моделирование дальнейшего вероятного распространения АЧС на территории Приморского края, неблагополучного по АЧС с конца июля 2019 г., проведено с помощью Microsoft Excel, пакета анализа Microsoft Excel. Моделирование было проведено на основе эпизоотологических данных, полученных за период с 01 августа по 31 декабря 2019 г., в течение которого зарегистрировано 33 эпизоотических очага.
В зависимости от вирулентности вируса инкубационный период для данной болезни может длиться от 2 до 22 дней. По степени проявления признаков и быстроты течения патологического процесса различают сверхострое, острое, подострое, хроническое течение и латентную форму болезни. Продолжительность инкубационного периода, в соответствии с рекомендациями МЭБ, была принята равной 15 дням [22].
В 2009 г. сотрудники Федерального центра защиты животных (ВНИИЗЖ) провели исследования с целью адаптации формулы Р. Андерсона и Р. Мэя для распространения АЧС в Российской Федерации. Главной проблемой, с которой они столкнулись, был расчет величины R0, неизвестной для большинства инфекционных болезней животных.
R0 – это базовая скорость распространения инфекции среди населенных пунктов (то есть сколько новых очагов инфекции появляется за время инкубационного периода после фиксирования первой вспышки). Для решения этого вопроса ими был проведен анализ распределения свинопоголовья на конкретной территории. Зная официальное количество вспышек АЧС, авторы смоделировали динамику распространения заболевания на территории отдельного региона при условии, что в начальный момент вирус был занесен и заболевание возникло только в одном населенном пункте или ферме. Основная задача сводилась к тому, чтобы подобрать такое значение величины R0, которое могло удовлетворительно выразить динамику возникновения и распространения очагов инфекции [22].
Сотрудниками ВНИИЗЖ эта величина была установлена как R0 = 1,7. Это числовое значение стало первым приближением указанного эпизоотологического параметра для АЧС на конкретной территории, поэтому для расчетов мы использовали данное значение R0.
Для оценки вероятного масштаба распространения АЧС применяют методологию английских эпидемиологов Р. Андерсена и Р. Мэя. Зная численное значение величины R0=1,7; численность очагов АЧС в момент времени (t), Yt=1; число населённых пунктов на территории Приморского края N=643, используя формулу
Рt+t0= 1 – (1 – R0/N)Yt , (1)
можно определить вероятность (Р) появления (инфицирования) неблагополучных пунктов в момент времени t+t0 среди данного числа населённых пунктов.
Подставляя численные значения применительно к одному первичному очагу Yt=1, времени одного инкубационного периода (t0 = 15 дней), получим соотношение:
Pt+15 = 1 – (1 – 1,7/643)1 ≈ 0,003
Таким образом, вероятное максимальное количество появления среди населённых пунктов (ферм) новых очагов в момент времени t+t0 из Xt благополучных пунктов будет определено из соотношения:
Yt+t 0 = Pt+15 × (N-1) = 0,003×643 = 1,929 (2)
То есть мы можем ожидать появление одного-двух новых очагов (неблагополучных пунктов) АЧС по истечении одного инкубационного периода.
Очаговая инцидентность — среднее количество заболевших животных в одном неблагополучном пункте. Рассчитывают путем деления суммарного количества заболевших за исследуемый промежуток времени животных на общее число неблагополучных пунктов.
КЧС среди домашних свиней — ОИ (12) = 241/ 4 = 60,3, где 12 это анализируемый временной промежуток (12 лет), 241 — число заболевших животных во всех неблагополучных пунктах, 60,3 — количество очагов, выявленных за весь анализируемый интервал времени.
«Очаговая инцидентность (п = 12) = 60 ».
КЧС среди диких кабанов — ОИ (12) = 19/ 11 = 1,7, где 12 это анализируемый временной промежуток (12 лет), 19 — число заболевших животных во всех неблагополучных пунктах, 1,7 — количество очагов, выявленных за весь анализируемый интервал времени.
«Очаговая инцидентность (п = 12) = 2 » [8].
-
- Мониторинг путей заноса и распространения классической и африканской чумы свиней на территории Приморского края
Перед проведением исследований был проведен мониторинг численности домашних свиней и диких кабанов на территории районов Приморского края. Данные представлены Департаментом сельского хозяйства и продовольствия Приморского края и Департамента по охране, контролю и регулированию использования объектов животного мира Приморского края (таблица 2).
На основании приведенных данных выявили, что поголовье домашних свиней и диких кабанов распределено на территории края неравномерно. Наибольшая плотность домашних свиней отмечена в четырех районах края: Октябрьский, Уссурийский городской округ, Арсеньевский городской округ и Спасский район. Наибольшая плотность диких – Анучинский район, Находкинский городской округ, Яковлевский, Чугуевский и Дальнереченский районы.
Таблица 2 – Численность домашних свиней и диких кабанов в Приморском крае в 2019 г.
| № п/п | Район Приморского края | Площадь, тыс.км2 | Свиньи | Кабаны | ||
| тыс.гол. | гол./км2 | тыс.гол. | гол./км2 | |||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Анучинский | 3,840 | 1,218 | 0,32 | 3,902 | 1,02 | |
| Арсеньевский городской округ | 0,039 | 0,080 | 2,05 | — | — | |
| Артёмовский городской округ | 0,506 | 0,208 | 0,41 | 0,070 | 0,14 | |
| Дальнегорский городской округ | 5,1 | 0,146 | 0,03 | 0,133 | 0,03 | |
| Дальнереченский | 7,290 | 0,153 | 0,02 | 3,992 | 0,55 | |
Продолжение таблицы 2
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Кавалеровский | 4,180 | 0,313 | 0,07 | 1,379 | 0,33 | |
| Кировский | 3,430 | 0,642 | 0,19 | 1,426 | 0,42 | |
| Красноармейский | 20,660 | 1,134 | 0,05 | 3,605 | 0,17 | |
| Лазовский | 4,710 | 0,248 | 0,05 | 1,766 | 0,37 | |
| Лесозаводский городской округ | 3,064 | 0,632 | 0,21 | 1,074 | 0,35 | |
| Михайловский | 2,741 | 1,179 | 0,43 | 0,977 | 0,36 | |
| Надеждинский | 1,596 | 0,602 | 0,38 | 0,273 | 0,17 | |
| Октябрьский | 1,700 | 18,375 | 10,81 | 0,061 | 0,04 | |
| Ольгинский | 6,416 | 0,135 | 0,02 | 2,380 | 0,37 | |
| Партизанский | 4,097 | 0,905 | 0,22 | 2,102 | 0,51 | |
| Находкинский городской округ | 0,361 | 0,214 | 0,59 | 0,376 | 1,04 | |
| Партизанский городской округ | 1,289 | 0,498 | 0,38 | 0,527 | 0,41 | |
| Пограничный | 3,750 | 0,824 | 0,22 | 0,836 | 0,22 | |
| Пожарский | 22,570 | 0,304 | 0,01 | 2,918 | 0,13 | |
| Спасский | 4,209 | 6,827 | 1,62 | 1,154 | 0,27 | |
| Тернейский | 27,102 | 0,132 | 0,004 | 4,998 | 0,18 | |
| Уссурийский городской округ | 3,626 | 18,983 | 5,23 | 0,827 | 0,23 | |
| Ханкайский | 2,689 | 0,968 | 0,36 | 0,571 | 0,21 | |
| Хасанский | 4,130 | 0,151 | 0,04 | 0,504 | 0,12 | |
| Хорольский | 1,969 | 1,507 | 0,76 | 0,268 | 0,14 | |
| Черниговский | 1,840 | 1,040 | 0,57 | 0,310 | 0,17 | |
| Чугуевский | 12,347 | 0,978 | 0,08 | 7,612 | 0,62 | |
| Шкотовский | 2,665 | 0,712 | 0,27 | 1,059 | 0,40 | |
| Яковлевский | 2,400 | 0,272 | 0,11 | 1,545 | 0,64 | |
| г. Владивосток | 0,331 | 0,276 | 0,83 | — | — | |
| ИТОГО: | 160,647 | 59,656 | 26,334 | 46,645 | 9,61 |
Согласно данным, представленным в таблице 2, можно провести анализ с помощью диаграмм, построенных в Мicrosoft Excel (рисунок 6).
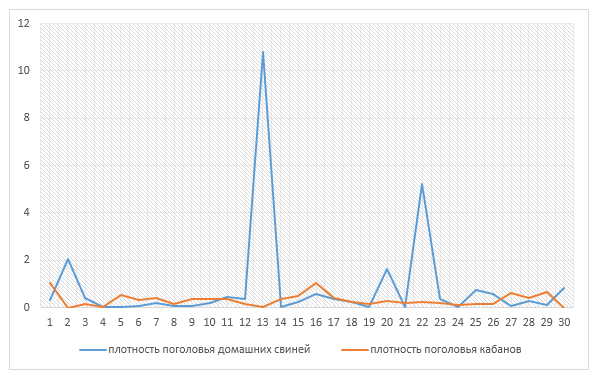
Рисунок 6 – Плотность поголовья домашних свиней и диких кабанов в Приморском крае в 2019 г.
Далее была проанализирована эпизоотическая ситуация по африканской и классической чуме свиней в сопредельных государствах. В отношении классической чумы свиней в 2019 году из сопредельных государств, эпизоотия регистрировалась только в Японии – 1255 очагов.
Согласно данным, предоставленным МЭБ/ВОЗЖ, 38 свиноферм оказались положительными на классическую чуму свиней, а число попавших в очаги заражения животных превысило 88 000. Болезнь пока остается локализованной в префектурах Гифу, Аичи и Нагано, Шига, Осака и еще не перекинулась на другие провинции [37].
Что касается случаев КЧС у диких кабанов, положительных случаев было зарегистрировано:
— Гифу: проверено 994 диких кабана (163 павших и 831 отловленный) – положительны на КЧС 318 (113 павших и 205 отловленных);
— Аичи: проверено 233 диких кабана (17 павших, 216 отловленных) – положительны 13 (2 павших и 11 отловленных) голов;
В остальных префектурах: проверено 276 диких кабанов (253 павших, 23 отловленных) – все оказались отрицательными на КЧС [39].
Данные по АЧС приведены в таблице 3.
Таблица 3 – Эпизоотическая ситуация по АЧС в Азиатско-Тихоокеанском регионе
| № п\п | Страна АТР | Период с момента выявления первой эпизоотии АЧС, годы | Количество эпизоотических очагов | |
| в популяции домашних свиней | в популяции диких кабанов | |||
| 1 | Китай | 2018-2019 | 154 | 3 |
| 2 | Вьетнам | 2019 | 6083 | 0 |
| 3 | Гонконг | 2019 | 3 | 0 |
| 4 | Камбоджа | 2019 | 13 | 0 |
| 5 | КНДР | 2019 | 1 | 0 |
| 6 | Лаос | 2019 | 94 | 0 |
| 7 | Монголия | 2019 | 11 | 0 |
| 8 | Мьянма | 2019 | 3 | 0 |
| 9 | Россия | 2007-2019 | 874 | 580 |
| 10 | Южная Корея | Октябрь 2019 | 0 | 126 уничтожено |
| 11 | КНДР | 30 мая 2019 | одно сообщение в МЭБ | нет данных |
Из таблицы 3 видно, что за исключением России и Китая АЧС появилась в странах АТР в 2019 году, что вероятнее всего связано с выносом возбудителя с территории Китая, а также, по нашему мнению, в том числе вследствие формирования природных очагов АЧС среди диких кабанов. Наибольшее количество эпизоотий выявлено во Вьетнаме.
Риски заноса инфекции на территорию края появились с момента регистрации заболевания в Китае в 2018 году. Первая эпизоотия в Приморье произошла именно на границе с Китаем.
Как сообщила пресс-служба регионального управления Россельхознадзора, возможной причиной заноса АЧС в Приморье могло стать трансграничное перемещение инфицированных диких кабанов из Китая [22].
Дальнейшее распространение АЧС по территории Приморского края проходило преимущественно по автомобильным магистралям на приграничных территориях [5,33].
Причины и риски распространения:
- Нелегальные межхозяйственные, транспортные связи;
- Отсутствие вакцинации домашних свиней против классической чумы свиней;
- Нарушение ветеринарно-санитарных правил содержания и кормления свиней (скармливание необеззараженных пищевых отходов);
- Утаивание информации о случаях заболевания/падежа животных как в ЛПХ, так и на промышленных свинокомплексах;
- Низкий уровень биобезопасности личных подсобных хозяйств и некоторых свиноводческих предприятий;
- Несанкционированные свалки трупов свиней, павших от АЧС и других биологических отходов в местах свободного доступа для дикого кабана
- Невыполнение в полном объеме действующих Правил по борьбе с африканской чумой свиней.
В таблицах 4-7 представлены результаты мониторинговых исследований патологического материала от диких кабанов соответственно за 2016-2019 годы.
Таблица 4 — Результаты мониторинговых исследований биоматериала от диких кабанов за 2016 год по данным ФГБУ «Приморская МВЛ»
| № п\п | Район
Приморского края |
Месяц | Количество проб | Количество положительных на ВКЧС проб |
| 1 | 2 | 3 | 4 | 5 |
| 1 | Артемовский городской округ | май | 2 | — |
| 2 | Лазовский район | июнь, октябрь | 6 | — |
| 3 | Партизанский район | июль, октябрь, ноябрь | 15 | — |
| 4 | Шкотовский район | январь, июль, август, сентябрь, | 49 | 1 (сентябрь) |
| 5 | Находкинский городской округ | октябрь | 4 | — |
| 6 | Анучинский район | февраль, май, ноябрь | 3 | — |
| 7 | Спасский район | февраль, март | 12 | — |
| 8 | Чугуевский район | сентябрь, октябрь, ноябрь | 32 | — |
| 9 | Кировский район | февраль | 3 | — |
| 10 | Дальнегорский район | февраль | 9 | — |
| 11 | Дальнереченский район | март | 4 | — |
| 12 | Ханкайский район | март, август | 11 | — |
| 13 | Надеждинский район | май, август | 3 | — |
| 14 | Черниговский район | январь | 2 | — |
| 15 | Уссурийский городской округ | январь, февраль, май, июль, октябрь, ноябрь | 18 | 3 (февраль, ноябрь) |
| 16 | Лесозаводский район | январь, февраль, март | 21 | — |
Продолжение таблицы 4
| 1 | 2 | 3 | 4 | 5 |
| 17 | Пограничный район | январь, февраль | 12 | — |
| 18 | Кавалеровский район | февраль | 5 | — |
| 19 | Ольгинский район | февраль, октябрь | 35 | — |
| 20 | Михайловский район | май, октябрь | 3 | — |
| ВСЕГО | 249 | 4 | ||
Таблица 5 — Результаты мониторинговых исследований биоматериала от диких кабанов за 2017 год по данным ФГБУ «Приморская МВЛ»
| №
п/п |
Район
Приморского края |
Месяц | Количество проб | Количество положительных на ВКЧС проб |
| 1 | Артемовский городской округ | январь, февраль | 19 | — |
| 2 | Лазовский район | январь, август | 65 | — |
| 3 | Партизанский район | январь, август | 54 | — |
| 4 | Шкотовский район | январь, июль, декабрь | 23 | 2 (декабрь) |
| 5 | Анучинский район | январь, ноябрь | 8 | — |
| 6 | Спасский район | январь, декабрь | 32 | — |
| 7 | Чугуевский район | январь, август, ноябрь | 42 | — |
| 8 | Кировский район | январь | 13 | — |
| 9 | Дальнегорский район | февраль | 3 | — |
| 10 | Ханкайский район | декабрь | 1 | — |
| 11 | Надеждинский район | январь | 4 | — |
| 12 | Уссурийский городской округ | январь, март, сентябрь, ноябрь, декабрь | 59 | 4 (сентябрь, ноябрь, декабрь) |
| 13 | Лесозаводский район | январь | 6 | — |
| 14 | Пограничный район | январь, февраль, ноябрь, декабрь | 34 | — |
| 15 | Кавалеровский район | февраль | 13 | — |
| 16 | Ольгинский район | январь, февраль, декабрь | 75 | — |
| 17 | Михайловский район | апрель, ноябрь | 3 | 1 (ноябрь) |
| 18 | Октябрьский район | сентябрь | 9 | — |
| 19 | Хорольский район | январь, декабрь | 10 | — |
| 20 | Черниговский район | январь | 6 | — |
| 21 | Пожарский район | январь | 47 | — |
| ВСЕГО | 526 | 7 | ||
Таблица 6 — Результаты мониторинговых исследований биоматериала от диких кабанов за 2018 год по данным ФГБУ «Приморская МВЛ»
| №
п\п |
Район
Приморского края |
Месяц | Количество проб | Количество положительных на ВКЧС проб |
| 1 | Лазовский район | январь, март, октябрь | 22 | — |
| 2 | Партизанский район | февраль, август, октябрь | 5 | — |
| 3 | Шкотовский район | январь | 1 | — |
| 4 | Спасский район | январь | 3 | — |
| 5 | Чугуевский район | январь, февраль | 26 | — |
| 6 | Дальнереченский район | февраль | 34 | — |
| 7 | Уссурийский городской округ | январь, август, сентябрь, октябрь, ноябрь | 15 | 2 (октябрь, ноябрь) |
| 8 | Пограничный район | январь, август | 15 | — |
| 9 | Кавалеровский район | ноябрь | 1 | — |
| 10 | Ольгинский район | август | 19 | — |
| 11 | Михайловский район | январь | 4 | 3 |
| 12 | Хорольский район | январь | 8 | — |
| 13 | Яковлевский район | ноябрь | 1 | 1 |
| 14 | Хасанский район | январь | 30 | — |
| ВСЕГО | 184 | 6 | ||
Таблица 7 — Результаты мониторинговых исследований биоматериала от диких кабанов за 2019 год по данным ФГБУ «Приморская МВЛ»
| № п\п | Район
Приморского края |
Месяц | Количество проб | Количество положительных на ВКЧС проб | ||
| 1 | 2 | 3 | 4 | 5 | ||
| 1 | Лазовский район | январь, март, октябрь | 2 | — | ||
| 2 | Партизанский район | февраль, август, октябрь | 8 | — | ||
| 3 | Шкотовский район | январь | 1 | — | ||
| 4 | Спасский район | январь | 8 | — | ||
| 5 | Чугуевский район | март | 20 | 2 | ||
| 6 | Уссурийский городской округ | январь, август, сентябрь, октябрь, ноябрь | 6 | — | ||
| 7 | Пограничный район | январь, август | 9 | — | ||
| 8 | Кавалеровский район | ноябрь | 15 | — | ||
| 9 | Ольгинский район | август | 6 | — | ||
| 10 | Михайловский район | январь | 1 | — | ||
Продолжение таблицы 7
| 1 | 2 | 3 | 4 | 5 | ||
| 11 | Хорольский район | январь | 31 | — | ||
| 12 | Находкинский городской округ | Апрель | 4 | 2 | ||
| 13 | Кировский район | Январь | 3 | — | ||
| 14 | Дальнегорский район | январь, февраль | 15 | — | ||
| 15 | Черниговский район | Ноябрь | 2 | — | ||
| 16 | Октябрьский район | январь, март, октябрь | 26 | |||
| ВСЕГО | 157 | 4 | ||||
Из данных таблиц видно, что неблагополучными по КЧС являются: в 2016 г. – Шкотовский район, Уссурийский городской округ; в 2017 г. – Шкотовский и Михайловский районы, Уссурийский городской округ; в 2018 г. – Яковлевский и Михайловский районы, Уссурийский городской округ; в 2019 году — Находкинский городской округ и Чугуевский район.
Необходимо отметить, что Уссурийский городской округ и Михайловский район граничат между собой; Шкотовский район находится к юго-востоку от г. Уссурийска, граничит с Партизанским районом; Яковлевский район граничит с Арсеньевским городским округом. За период с 2015 года стойко неблагополучным по КЧС диких кабанов является Уссурийский городской округ. Возможно здесь сформировался природный антропоургический очаг КЧС, что можно обосновать таким образом.
В 2015 году был зарегистрирован эпизоотический очаг в с. Алексеевка Надеждинского района в КФХ, где в октябре погибло 24 домашних свиньи, накладывался карантин. Специалисты ветеринарной службы выявили, что владельцы животных практиковали свободно-выгульное содержание поросят, также хозяйство граничит с лесными угодьями. 33].
Надеждинский район и Уссурийский городской округ граничат, а также являются территориями сельскохозяйственного производства с большим количеством сельхозугодий с посевами злаковых, овощных культур, много полей отведено под посевы сои. Уссурийский городской округ также, как и Надеждинский район богат болотистыми лесистыми местностями, которые предпочтительны для кабана. Кроме того, сельскохозяйственные угодья привлекают животных в периоды межсезонья и зимней бескормицы. Все перечисленные условия, по нашему мнению, стали причиной формирования антропоургического очага на территории Уссурийского городского округа с заносом ВКЧС в соседний Михайловский район с развитым сельским хозяйством и схожим ландшафтом.
В Уссурийском городском округе из 92 проб биологического материала от диких кабанов, полученного для исследований с 2016 по 2018 гг., в 9 (9,8%) выявлено наличие генетического материала ВКЧС. В Михайловском районе из 7 проб, полученных для исследований в 2017 и 2018 годах в 4 (57,1%) выявлен генетический материал ВКЧС. Это достаточно высокие показатели, что говорит о высоком риске заноса ВКЧС в домашнее свинопоголовье.
Из-за миграции кабанов, животные-вирусоносители выявлены уже в северных районах Приморского края – Яковлевский (2018 г.) и Чугуевский (2019 г.) районы соответственно . С целью мониторинга классической чумы в Приморском крае проводился вынужденный отстрел и исследования трупов (при падеже) диких кабанов. С 2018 года это актуально из-за угрозы заноса на территорию Приморского края африканской чумы свиней из северных провинций Китая [33].
В 2019 году согласно сообщениям Россельхознадзора, а также информации, предоставленной СМИ, по результатам лабораторных исследований ФГБУ «Приморская МВЛ» вирус КЧС выявлен в патологическом материале трупов диких кабанов, доставленных в марте из Чугуевского района, в апреле ООО «Лесная отрада» г. Находка. Результаты лабораторных исследований подтверждены ФГБУ «ВНИИЗЖ», во втором случае выявленный вирус относится к субгенотипу 2.1 и идентичен вирусу классической чумы свиней, обнаруженному в ноябре 2018 года у кабана из Яковлевского района Приморского края [14, 23, 31, 41]. Возможно теплая зима 2018-19 года стала причиной более активной миграции кабанов, в том числе и на север Приморья (Кировский район), что, в свою очередь, привело к распространению вируса и появлению новых очагов.
Таким образом, в настоящее время остро стоит проблема контроля заноса КЧС из дикой природы в домашнее свинопоголовье. Держать под контролем эпизоотии в природных очагах могут помочь следующие меры: тесное сотрудничество ветеринарных специалистов и представителей охотинспекции, вакцинация восприимчивого свинопоголовья хозяйств разных форм собственности, мониторинг напряженности поствакцинального иммунитета, строгий контроль перемещений свинопоголовья по территории Приморского края, проведение ветеринарно-санитарной экспертизы мяса и субпродуктов домашних свиней, мониторинг падежа и отбор проб для исследований домашних и диких свиней, просветительская работа с население [20, 34].
5.3 Оценка рисков распространения КЧС и АЧС на территории Приморского края
Для определения риска распространения данных заболеваний нами была проведен анализ частоты регистрации классической чумы свиней среди свинопоголовья в Приморском крае (таблица 8).
Таблица 8 – Регистрация классической чумы свиней среди свинопоголовья в Приморском крае
| Месяц, год | Кол-во животных, павших от КЧС | Место регистрации |
| Сентябрь 2007 г. | 210 домашних свиней | п.Смоляниново Шкотовского района |
| Сентябрь 2015 г. | 5 домашних свиней | с.Кролевцы Артемовского городского округа |
| Октябрь 2015 г. | 24 домашних свиньи | с.Алексеевка Надеждинского района |
| Декабрь 2015 г. | 2 диких кабана | Охотхозяйство Уссурийского района |
| Февраль 2016 г. | 2 диких кабана | Охотхозяйство «Тигровое» Михайловского района |
| Сентябрь 2016 г. | 1 дикий кабан | Шкотовский район, охот. Угодье с.Многоудобное |
| Ноябрь 2016 г. | 1 дикий кабан | Уссурийский район, 3 км на северо-запад от с.Каменушка |
| Октябрь 2017 г. | 2 домашних свиньи | Спасский район |
| Сентябрь, ноябрь, декабрь 2017 г. | 7 диких кабанов | Шкотовский р-он, Уссурийский городской округ, Михайловский р-он |
| Октябрь, ноябрь 2018 г. | 6 диких кабанов | УГО, Михайловский район, Яковлевский район |
| Март, апрель 2019 г. | 4 Диких кабана | г.Находка, Чугуевский район |
При проведении количественной оценки риска заноса и распространения классической чумы свиней на территорию Приморского края было установлено с высокой вероятностью тенденция к нарастанию очагов классической чумы среди диких кабанов. Данные приведены на рисунке 7.
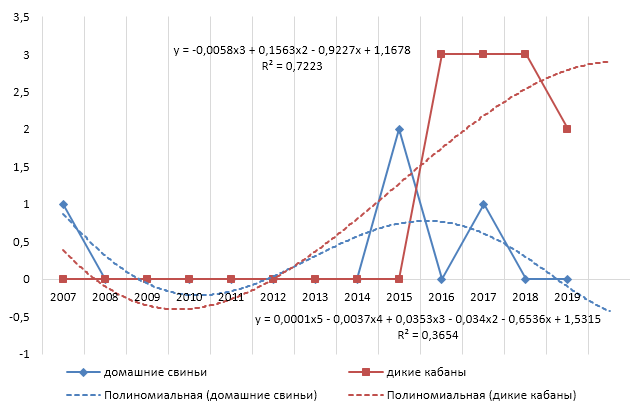
Рисунок 7 — Линия тренда по неблагополучию по КЧС
Данные рисунка 7, показывают, что линия тренда среди домашних свиней имеет тенденцию к убыванию, а среди диких кабанов имеет тенденцию к нарастанию; прогноз на 1 год.
Данная модель адекватно и корректно описывает заданный процесс, что доказывается следующим коэффициент корреляции составляет -0,84,что говорит о высокой обратно-пропорциональной связи между количеством эпизоотических очагов для домашних свиней и очагов для диких свиней, при этом коэффициент детерминации R2 составляет 72%, это означает, что 72% вариации количества очагов для домашних свиней зависит от включенного в модель фактора, а именно количество очагов для диких кабанов. Стандартная ошибка составляет 2,5%, что также говорит о адекватности модели, значимость критерия Фишера (F) на уровне 0,07что говорит о том, что с надежностью 93% модель статистически надежна в целом (данные взяти из пакета анализа модели).
Результаты мониторинговых исследований биоматериала от диких кабанов на наличие генетического материала КЧС, представленные в таблице 9 показывают, что регулярно выявляется возбудитель КЧС у дикого свинопоговья, и в разные годы количество положительных выявлений колеблется от 2,5% до 16,7 % от общего объёма исследуемых образцов.
Таблица 9 — Результаты мониторинговых исследований на классическую чуму свиней биоматериала от диких кабанов УГО по данным исследований ФГБУ «Приморская МВЛ» за период 2016-2019 гг.
| Исследовано | Годы | Всего | |||
| 2016 | 2017 | 2018 | 2019 | ||
| Пробы биоматериала (мясо, внутренние .органы и др.при отстреле, патологический материал при падеже) от диких кабанов
— всего за год, шт. |
18 | 59 | 15 | 157 | 249 |
| в т.ч. положительных на наличие генетического материала ВКЧС, шт. | 3 | 4 | 2 | 4 | 13 |
| в т.ч. положительных на наличие генетического материала ВКЧС, % | 16.7 | 6,8 | 13,3 | 2,5 | 5,2 |
По мнению ряда исследователей, в сохранении благополучия в крае по КЧС вакцинация диких кабанов играет важную роль. В 2004 году WWF России начал проведение в Приморье вакцинации диких копытных с целью предотвратить снижение численности кабана при наступлении экстремальных погодных условий в осенне-зимний период. В течение четырех последующих лет около 20 кг вакцины ежегодно закупалось WWF и распределялось по хозяйствам края, в результате чего программой было охвачено 21 охотничье хозяйство. В дальнейшем вакцинации были в 2009, 2014, 2016 годах [34].
Однако, позднее сухую оральную вакцину сняли с производства в связи с низкой эффективностью, и с 2017года вакцинация диких кабанов не проводится.
Данные о регистрации классической чумы свиней среди свинопоголовья в Приморском крае за период с 2007 по 2019 годы представлены в таблице 10.
Данные таблицы 10, показывают, что в 2018 и 2019 году вспышки КЧС регистрировались только среди поголовья дикого кабана, это связано с вакцинацией домашних свиней.
Эпизоотическая ситуация по африканской чуме свиней в России неблагополучна с 2007 года, Приморский край до 2019 года был благополучен по АЧС, также неблагополучны страны Азиатско-тихоокеанском регионе, данные приведены в таблице 11 и рисунок 8 [44, 45].
Таблица 10 — Регистрация классической чумы свиней среди свинопоголовья в Приморском крае
| Месяц, год | Кол-во животных, павших от КЧС | Место регистрации |
| Сентябрь 2007 г. | 210 домашних свиней | п.Смоляниново Шкотовского района |
| Сентябрь 2015 г. | (3)5 домашних свиней | с.Кролевцы Артемовского городского округа |
| Октябрь 2015 г. | 24 домашних свиньи | с.Алексеевка Надеждинского района |
| Декабрь 2015 г. | 2 диких кабана | Охотхозяйство Уссурийского района |
| Февраль 2016 г. | 2 диких кабана | Охотхозяйство «Тигровое» Михайловского района |
| Сентябрь 2016 г. | 1 дикий кабан | Шкотовский район, охот. Угодье с.Многоудобное |
| Ноябрь 2016 г. | 1 дикий кабан | Уссурийский район, 3 км на северо-запад от с.Каменушка |
| Октябрь 2017 г. | 2 домашних свиньи | Спасский район |
| Сентябрь, ноябрь, декабрь 2017 г. | 7 диких кабанов | Шкотовский р-он, Уссурийский городской округ, Михайловский р-он |
| Октябрь, ноябрь 2018 г. | 6 диких кабанов | УГО, Михайловский район, Яковлевский район |
| Март, апрель 2019 г. | Дикие кабаны | г.Находка, Чугуевский район |
Таблица 11 — Эпизоотическая ситуация по африканской чуме свиней в Азиатско-тихоокеанском регионе
| № п\п | Страна АТР | период с момента выявления первой эпизоотии АЧС, годы | Количество эпизоотических очагов | |
| в популяции домашних свиней | в популяции диких кабанов | |||
| 1 | Китай | 2018-2019 | 154 | 3 |
| 2 | Вьетнам | 2019 | 6083 | 0 |
| 3 | Гонконг | 2019 | 3 | 0 |
| 4 | Камбоджа | 2019 | 13 | 0 |
| 5 | КНДР | 2019 | 1 | 0 |
| 6 | Лаос | 2019 | 94 | 0 |
| 7 | Монголия | 2019 | 11 | 0 |
| 8 | Мьянма | 2019 | 3 | 0 |
| 9 | Россия | 2007-2019 | 874 | 580 |
| 10 | Южная Корея | Октябрь 2019 | 0 | 126 уничтожено |
| 11 | КНДР | 30 мая 2019 | одно сообщение в МЭБ | нет данных |
Из данных таблицы 11 видно, что за исключением России и Китая АЧС появилась в странах АТР в 2019 году, что вероятнее всего связано с выносом возбудителя с территории Китая, а также, по нашему мнению, в том числе вследствие формирования природных очагов АЧС среди диких кабанов. Наибольшее количество эпизоотий выявлено во Вьетнаме.
Риски заноса инфекции на территорию края появились с момента регистрации заболевания в Китае в 2018 году. Первая эпизоотия в Приморье произошла именно на границе с Китаем.
Как сообщила пресс-служба регионального управления Россельхознадзора, возможной причиной заноса АЧС в Приморье могло стать трансграничное перемещение инфицированных диких кабанов из Китая.
Дальнейшее распространение АЧС по территории Приморского края проходило преимущественно по автомобильным магистралям на приграничных территориях.
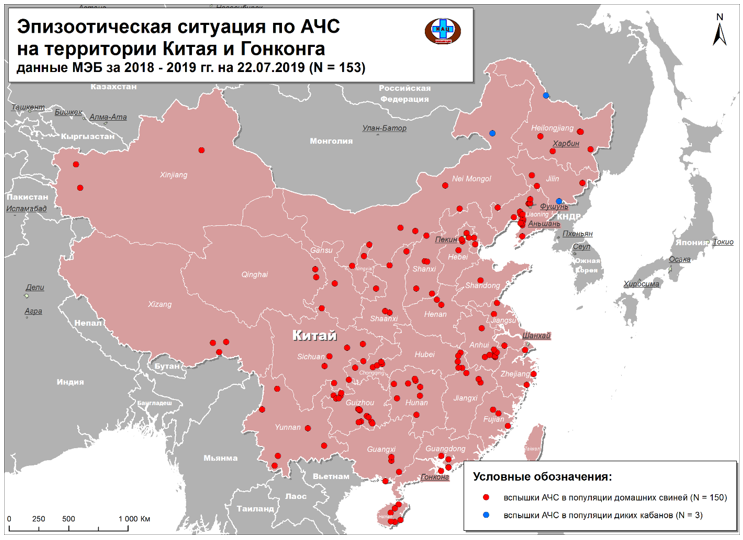
Рисунок 8 — Эпизоотическая ситуация по АЧС на территории Китая и Гонконга
Причины и риски распространения АЧС:
- Нелегальные межхозяйственные, транспортные связи;
- Нарушение ветеринарно-санитарных правил содержания и кормления свиней (скармливание необеззараженных пищевых отходов);
- Утаивание информации о случаях заболевания/падежа животных как в ЛПХ, так и на промышленных свинокомплексах;
- Низкий уровень биобезопасности личных подсобных хозяйств и некоторых свиноводческих предприятий;
- Несанкционированные свалки трупов свиней, павших от АЧС и других биологических отходов в местах свободного доступа для дикого кабана
- Невыполнение в полном объеме действующих Правил по борьбе с африканской чумой свиней [4, 13, 37].


Рисунок 9 — Трупы дикого кабана, обнаруженные в эпизоотическом по АЧС очаге
Изменения органов и тканей при патологоанатомическом вскрытии дикого кабана зараженного АЧС представлены на рисунках 10,11 [19].
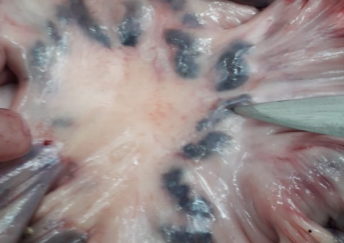
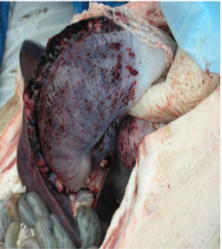
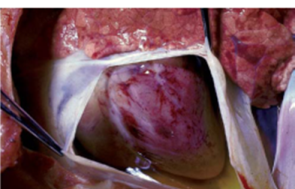
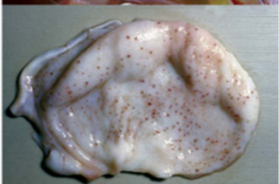
Рисунок 10 – Множественные кровоизлияния
Рисунок 11 — Увеличение селезенки
В таблицах 12-13 в хронологическом порядке представленные данные выявления эпизоотических очагов АЧС среди домашних свиней и кабанов.
Таблица 12 – Выявление эпизоотических очагов АЧС среди домашних свиней [5]
| № п/п | Район Приморского края | Эпизоотический очаг | Количество уничтоженных свиней, голов* | Распоряжение | |
| о наложении карантина | о снятии карантина | ||||
| 1 | 2 | 3 | 4 | 5 | 6 |
| 1 | Пограничный | ИП ГКФХ Бирючкова О.В. | 70 | от 01.08.2019 №386-ра | от 05.09.2019 №460-ра |
| 2 | Надеждинский | ЛПХ Шипицына С.Г., с.Ананевка на территории Неженского охотхозяйства ТОФ | 2 | от 15.08.2019 №409-ра | от 30.08.2019 №444-ра |
| 3 | Дальнереченский | ЛПХ Извеков Д.В., г.Дальнереченск | 2 | от 23.08.2019 №421-ра | от 23.10.2019 №620-ра |
| 4 | Дальнереченский | ЛПХ Высоцкий А.Н., с.Речное | 28 | от 23.08.2019 №421-ра | от 23.10.2019 №620-ра |
| 5 | Дальнереченский | ЛПХ Дмитриев В.Ф., г.Дальнереченск | 16 | от 30.08.2019 №445-ра | от 23.10.2019 №619-ра |
| 6 | Дальнереченский | ЛПХ Чвертко Р.Т., г.Дальнереченск | 2 | от 30.08.2019 №445-ра | от 23.10.2019 №619-ра |
| 7 | Дальнереченский | ЛПХ Павленко А.П., с.Лазо | 4 | от 02.09.2019 №449-ра | от 23.10.2019 №621-ра |
| 8 | Красноармейский | ЛПХ Жирякова Г.П., с.Богуславец | 2 | от 04.09.2019 №458-ра | от 10.10.2019 №571-ра |
| 9 | Пограничный | ЛПХ Ускенбаева К.Ш., в 2 км на юго-всток от пгт Пограничный | 7 | от 06.09.2019 №464-ра | от 10.10.2019 №572-ра |
| 10 | Пограничный | ЛПХ Лебедева И.А., с.Жариково | 2 | от 09.09.2019 №465-ра | от 10.10.2019 №575-ра |
| 11 | Пограничный | ЛПХ Фатов С.Н., с.Барано-Оренбургское | 3 | от 16.09.2019 №499-ра | от 10.10.2019 №574-ра |
| 12 | Лесозаводский ГО | ЛПХ Ильяшенко В.Н., с.Пантелеймоновка | 12 | от 17.09.2019 №503-ра | от 10.10.2019 №570-ра |
Продолжение таблицы 12
| 1 | 2 | 3 | 4 | 5 | 6 |
| 13 | Ханкайский | ЛПХ Краснова О.С., с.Ильинка | 1 | от 18.09.2019 №510-ра | от 18.10.2019 №599-ра |
| 14 | Ханкайский | ЛПХ Федоренко А.А., с.Ильинка | 14 | от 18.09.2019 №510-ра | от 18.10.2019 №599-ра |
| 15 | Ханкайский | ЛПХ Хагажеева Л.В., .Мельгуновка | 2 | от 20.09.2019 №520-ра | от 18.10.2019 №605-ра |
| 16 | Ханкайский | ООО «ВЭЛС-М». с.Октябрьское | 1100 | от 27.09.2019 №538-ра | от 22.10.2019 №612-ра |
| 17 | Пожарский | ЛПХ Скрипник М.А., с.Пожарское | 2 | от 12.11.2019 №665-ра | от 13.12.2019 №722-ра |
| 18 | Хорольский | ЛПХ Рагулина В.Е., с.Поповка | 7 | от 27.12.2019 №767-ра | от 14.01.2020 №4-пг |
| Всего уничтожено свиней | 1276 | ||||
Примечание: *количество голов домашних свиней, уничтоженных только в эпизоотическом очаге.
Таблица 13 – Выявление эпизоотических очагов среди диких свиней
| № п/п | Район
Приморского края |
Эпизоотический очаг | Количество павших кабанов,
голов* |
Распоряжение | |
| о наложении карантина | о снятии карантина | ||||
| 1 | 2 | 3 | 4 | 5 | 6 |
| 1 | Пограничный | участок лесного массива Гродековского потребительского общества в районе озера Щучье | 1 | от 09.08.2019 №395-ра | от 10.10.2019 № 573 |
| 2 | Ханкайский | территория отделения «Широкое» Службы Погран.Управления ФСБ РФ по Приморскому краю с.Камень-Рыболов | 1 | от 09.08.2019 №395-ра | от 10.10.2019 № 573 |
| 3 | Дальнереченский | район заставы Княжевка | 9 | от 08.10.2019 №569-ра | от 27.12.2019 № 765-ра |
Продолжение таблицы 13
| 1 | 2 | 3 | 4 | 5 | 6 |
| 4 | Ханкайский | с.Комиссарово, падь Трофимова | 2 | от 18.10.2019 №606-ра | от 19.12.2019 № 739-ра |
| 5 | Пограничный | часть распадка площадью 2,5 га, расположенная территории отделения охотугодий Гродековского потребительского общества | 1 | от 22.10.2019 №611-ра | от 12.11.2019 № 664-ра |
| 6 | Пожарский | участок лесного массива в 5 км от трассы Хабаровск-Владивосток, на территории охотхозяйства ООО «Промысловик» в 5 км от с.Знаменка | 3 | от 15.11.2019 №669-ра | |
| 7 | Лесозаводский городской округ | территория сельскохозяйственных угодий площадью 500 м2 | 1 | от 19.11.2019 №674-ра | от 27.12.2019 № 768-ра |
| 8 | Дальнереченский | территория охотугодий в границах по руслу ключа Ракитянский | 3 | от 22.11.2019 №682-ра | от 18.12.2019 № 734-ра |
| 9 | Лесозаводский городской округ | участок лесного массива площадью 500 м2, расположенного в 6,44 км от с.Курское | 5 | от 22.11.2019 №683-ра | от 27.12.2019 № 768-ра |
| 10 | Красноармейский | часть территории ООО и Р «Дальняя», площадью 5000 м2 | 3 | от 26.11.2019 № 688-ра | |
| 11 | Красноармейский | часть территории ООО и Р «Дальняя», площадью 5000 м2 | 1 | от 26.11.2019 № 689-ра |
Окончание таблицы 13
| 1 | 2 | 3 | 4 | 5 | 6 |
| 12 | Пограничный | часть лесного массива площадью 3 га, на территории отделения охотугодий Гродековского потребительского общества | 1 | от 10.12.2019 № 711-ра | |
| 13 | Пограничный | часть распадка площадью 4 га, на территории отделения охотугодий Гродековского потребительского общества | 3 | от 18.12.2019 № 735-ра | |
| 14 | Пограничный | часть распадка площадью 3 га, на территории отделения охотугодий Гродековского потребительского общества | 1 | от 18.12.2019 № 736-ра | |
| 15 | Пограничный | часть лесного массива на территории охотугодий Гродековского потребительского общества в границах реки Кордонка | 1 | от 27.12.2019 № 766-ра | |
| 16 | Пограничный | часть лесного массива на территории охотугодий общего пользования в границах: от точки Веселые ключи до пади Таловской | 1 | от 17.01.2020 № 10-пг | |
| Всего диких свиней | 37 | ||||
Примечание: *количество голов павших диких кабанов, у которых лабораторными исследованиями ФГБУ «Приморская межобластная ветеринарная лаборатория» выявлен генетический материал вируса африканской чумы свиней.
Графическая интерпретация табличных данных представлена на рисунке 12.
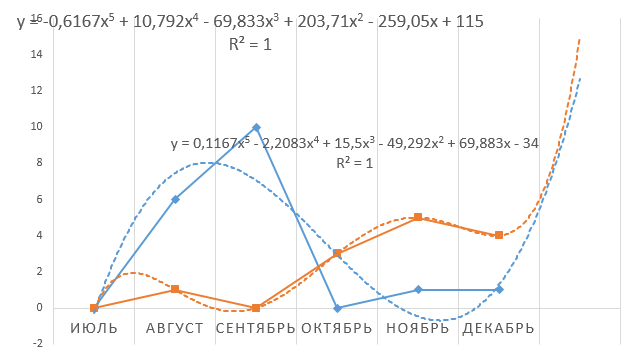
Рисунок 12 — Динамика выявления эпизоотических очагов АЧС в Приморском крае за период июля по декабрь 2019 г.
Линия тренда по неблагополучию по АЧС (как среди домашних свиней, так и диких кабанов имеет тенденцию к нарастанию; прогноз на 1 месяц)
Из представленных таблиц 12-13 и рисунка 12 видно, что максимальный пик появления эпизоотических очагов среди домашних свиней пришелся на сентябрь, а среди диких – на ноябрь 2019 г. Под конец 2019 г. в с.Поповка Хорольского района была зарегистрирована эпизоотия АЧС в личном подсобном хозяйстве, причиной заноса инфекции стала охота владельца на ранее неблагополучной по АЧС территории лесного массива Пограничного района. Кроме того, 17 января 2020 года наложен карантин на часть лесного массива на территории охотугодий общего пользования в Пограничном районе. Следовательно, точечный падеж диких кабанов от АЧС говорит о циркуляции вируса среди них, формировании аутохтонных очагов и энзоотических территорий по АЧС в дикой природе.
В таблице 14 представлены показатели количественной оценки риска, полученные на основе расчетов авторов представленных научных исследований.
Вероятность возникновения АЧС на территории Приморского края в 2020 г, а также возможное максимальное количество новых эпизоотических очагов рассчитывали по методике, предложенной сотрудниками ВНИИЗЖ (Белик Е.В., Дудников С.А., Ледянский М.М. [и др.], 2009; Коваленко А.М., Ткачёв А.В., Ткачёва О.Л. [и др.], 2019) [2]. Согласно проведенным расчетам, максимальное количество новых эпизоотических очагов по АЧС по истечении одного инкубационного периода составило 2 с учетом домашнего и дикого свинопоголовья.
Таблица 14 – Показатели количественной оценки риска распространения АЧС на территории Приморского края
| № п/п | Показатели | Домашние свиньи | Дикие кабаны |
| 1 | Неблагополучие районов края по АЧС за 2019 г. | 26,7% | 20% |
| 2 | Индекс заболеваемости на 1000 животных | 0,021 | 0,001 |
| 3 | Инцидентность на 1000 животных | 3,10 | 1,15 |
| 4 | Превалентность в неблагополучных пунктах | 20,83% | 0,28% |
| 5 | Вероятность появления (инфицирования) неблагополучных по АЧС пунктов в 2020 г. | 0,003 | |
| 6 | Максимальное количество новых эпизоотических очагов по истечении одного инкубационного периода (15 дней) | 2 | |
Вероятность появления новых неблагополучных по АЧС пунктов зависит от многих факторов: вирулентность вируса, которая определяет продолжительность инкубационного периода; своевременное выявление больных животных и лабораторное подтверждение диагноза; адекватное поведение владельца хозяйства, где появились больные АЧС животные; разъяснительная работа с населением, информирование об особенностях африканской чумы свиней и алгоритме мероприятий при выявлении эпизоотического очага; установление карантина; согласованная работа администрации населённых пунктов, районов, государственной ветеринарной службы и охотинспекции (при выявлении падежа диких кабанов) и др.
Таким образом, на основании международного опыта, научных исследований ВНИИЗЖ, опыта борьбы с африканской чумой свиней в России, можно заключить, что объем, характер и направленность мероприятий по предотвращению дальнейшего распространения АЧС должны опираться на результаты эпизоотологического обследования, оценки риска и прогноза эпизоотической ситуации по данному заболеванию с учётом неблагополучных территорий и наличия природных очагов.
ЗАКЛЮЧЕНИЕ
В Приморском крае сформированы стойкие природные очаги классической чумы свиней преимущественно в южных районах края (Шкотовский, Уссурийский, Михайловский). Нарушение технологии содержания и разведения свиней в частном секторе привело к формированию антропоургических очагов КЧС (Надеждинский район) и распространению КЧС в северные районы края (Яковлевский, Кировский).
Африканская чума свиней в Приморском крае появилась вследствие миграции инфицированных диких кабанов из Китая, попала в домашнее свинопоголовье из-за нарушения правил его содержания (свободный выпас на территории лесного массива), распространилась вдоль транспортных магистралей приграничных территорий. Только жесткие карантинные меры, строгое исполнение их требований могут предотвратить дальнейшее распространение инфекции.
Ветеринарная служба Приморского края не допустила в 2017-2019 годах заноса КЧС от диких кабанов в домашнее свинопоголовье, что позволило предотвратить большой экономический ущерб свиноводству района. Тесное сотрудничество ветеринарных специалистов и представителей охотинспекции позволило держать под контролем эпизоотию в природном очаге, расположенном на территории охотхозяйства «Раковское».
На территории Приморского края идет процесс формирования природных очагов АЧС, что необходимо учитывать при проведении противоэпизоотических мероприятий. Закрепление АЧС в дикой среде приведет к регулярным эпизоотиям инфекции. В случае укоренения АЧС в популяции диких свиней элиминировать её будет гораздо сложнее, практически невозможно, поэтому стратегия должна быть направлена на минимизацию контактов между дикими и домашними свиньями.
Приморский край среда обитания крупных краснокнижных кошачьих (амурский тигр и дальневосточный леопард), основным объектом питания которых является дикий кабан (его доля в рационе хищников составляет около 50%), и вопрос о полной ликвидации популяции дикого кабана неприемлем. Вопрос «О целесообразности сокращения дикого кабана в условиях борьбы с африканской чумой свиней» разбирался на заседании председателя правительства Российской Федерации 25 сентября 2019года.
Качественные и количественные методы анализа позволяют составить прогноз риска заноса и распространения АЧС и КЧС на благополучные территории.
СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ
- Авылов, Ч.К., Алтухов Н.М., Бойко В.Д. и др., Справочник ветеринарного врача / Сост. А.А. Кунаков.-М.:КолосС, 2006-736 с
- Анализ риска заноса и распространения африканской чумы свиней на территории Владимирской области информационно-аналитический обзор / Е.В. Белик, С.А. Дудников, М.М. Ледянский [и др.]. — Владимир: ФГУ «ВНИИЗЖ», 2009. – 99 с.
- Африканская чума свиней в Российской Федерации (2007–2012 гг.). Эпидемиологический обзор и последствия для стран Европы / Служба животноводства и здоровья животных ФАО; ред. С. Хоменко, А. Розстальный. — №178. — Рим, 2014. – 87 с.
- Африканская чума свиней. Отчет по анализу недостаточно изученных аспектов, ноябрь 2018 г. / Глобальный альянс по исследованию африканской чумы свиней (GARA). – Текст: электронный. – URL: http://www.ars.usda.gov/GARA (дата обращения: 05.12.2019)
- База данных нормативных правовых актов Губернатора Приморского края и Администрации Приморского края / Администрация Приморского края. – Текст: электронный // Приморский край: офиц. сайт. – URL: http://domino.primorsky.ru/IS-APK/k-protokol.nsf (дата обращения: 09.01.2020-20.01.2020)
- Барышников, П.И. Ветеринарная вирусология: учебное пособие / П.И. Барышников. — Барнаул: АГАУ, 2006. — 113 с.
- Белоусова, Р.В. Практикум по ветеринарной вирусологии / Р.В. Белоусова, Э.А. Преображенская. — М.: Колос, 2000. – 272 с.
- Бессарабов, Б.Ф. Инфекционные болезни животных / Б.Ф. Бессарабов, А.А. Вашутин, Е.С. Воронин. — М.: Колос, 2007. – 671 с.
- Болезни свиней / А.В. Сидоркин [и др.]. – М.: Аквариум-Принт, 2011. – 544с.
- Болезни свиней: справочник: учеб. пособие / сост.: А.А. Лимаренко,И.А. Болоцкий, А.И. Бараников. — СПб.: Лань, 2008. – 640 с.
- Бьядовская, О.П. Разработка и совершенствование методов иммуноферментной диагностики классической чумы свиней / О.П. Бьядовская — Владимир: ВНИИЗЖ, 2002.- 25 с
- Ветеринарная вирусология / Р.В. Белоусова, Э.А. Преображенская, И.В. Третьякова. — М.: Колос, 2007. — 424 с.
- Ветеринарные правила осуществления профилактических, диагностических, ограничительных и иных мероприятий, установления и отмены карантина и иных ограничений, направленных на предотвращение распространения и ликвидацию очагов африканской чумы свиней, утверждены приказом Министерства сельского хозяйства Российской Федерации № 213 от 31 мая 2016 года
- Власова, А.Н. Филогенетический анализ изолятов вируса классической чумы свиней и вируса репродуктивно-респираторного синдрома свиней, циркулирующих на территории России и Белоруссии: автореферат дис. … канд. биол. наук: 03.00.03 / Власова Анастасия Николаевна. – М., 2003 — 30 с.
- Госманов, Р.Г. Ветеринарная вирусология / Р.Г. Госманов, Н.М. Колычев. – М.: КолосС, 2006. – 304 с.
- Диагностика африканской чумы свиней в Российской Федерации / Т.В. Гребенникова, А.Д. Забережный, Т.И. Алипер, О.А. Верховский, Е.А. Непоклонов. — DOI: 10.0000/cyberleninka.ru/article/n/diagnostika-afrikanskoy-chumy-sviney-v-rossiyskoy-federatsii // Вопросы вирусологии. – 2013. – Т.57, №5. – С. 64 – 79. — URL: https://cyberleninka.ru/article/v/diagnostika-afrikanskoy-chumy-sviney-v-rossiyskoy-federatsii (дата обращения 21.10.2019). — Режим доступа: Научная электронная библиотека Киберленинка.
- Дрю, Т.В. Вирусные заболевания свиней: обзор ситуации / Т.В. Дрю, С. Грэм, Х. Крук // Свиноводство. — 2014. – № 7. – С.53-54.
- Дудников, С.А. Анализ риска в ветеринарии: принципы и методология (Анализ риска заноса ящура на территорию России) / С.А. Дудников, Е.В. Гусева. – Владимир: ОКНИИиМС, 2001. — 32 с.: схем., табл. — ISBN 5-900026-13-2.
- Жаров, А.В. Патологическая анатомия животных / А.В. Жаров. – СПб.: Лань, 2013. – 608 с.
- Инструкция о мероприятиях по предупреждению и ликвидации классической чумы свиней [Электронный ресурс]: утв. гл. упр. ветеринарии Минсельхоза Рос. Федерации 30 марта 1990 г. – Электрон.текст. дан.- Режим доступа: http://www.rsnkomi.ru/ob_upravlenii/pravovaya_baza/normativnye_dokumenty/postanovleniya/i_n_s_t_r_u_k_ts_i_ya_o_meropriyatiyax_po_preduprezhdeniju_i_likvidatsii_klassicheskoy_chumy_sviney/.-Загл. с экрана.
- Инфекционная патология животных: в 2-х т. / А.Я. Самуйленко [и др.]. — М.: Академкнига, 2006.
- Информационное сообщение от 27 декабря 2019 года по эпизоотической ситуации в РФ. Информация по сообщениям МЭБ (oie.int) / информационно-аналитическии центр управления ветнадзора. – 6 с.
- Классическая чума свиней – Электрон.текст. дан.- Режим доступа:http://www.webvet.ru/disease/klassicheskaya-chuma-sviney/
- Классическая чума свиней – Электрон.текст. дан.- Режим доступа:http://obmendoc.ru/files/users/elenka/51/view/114017-114025
- Клиническая и лабораторная диагностика классической чумы свиней / В.В. Куринов [и др.] // Ветеринария. — 2004.- №5. — С. 18-22.
- Коломыцев, А.А. Отечная болезнь поросят и классическая чума свиней: всегда вместе? / А. Коломыцев, А. Стрижаков, С. Лукьянов // Ветеринария сельскохозяйственных животных. — 2008.- №1. — С. 32-33.
- Кудряшова, А.А. Инфекционные болезни животных / А.А. Кудряшова, А.В. Святковский. – СПб.: Лань, 2007. — 608с.
- Макаров, В.В. Классическая чума свиней — особенности эпизоотического процесса и проблемы на современном этапе / В.В. Макаров, С.И. Джупина, А.А. Коломыцев // Аграрная Россия. — 2001.- №3. — С. 42-48.
- Максимович, В.В. Дифференциальная диагностика классической чумы свиней / В.В. Максимович. — Мозырь: КПУП Колор, 2001. – 100с.
- Международный опыт оценки риска и сертификации продукции при экспорте/импорте поднадзорной продукции животного происхождения и мониторинг инфекционных болезней: материалы семинара, Владимир. 19 – 20 окт. 2017 г. / ФГБУ ВНИИЗЖ, ИАЦ Управления ветнадзора; А.К. Караулов, А.С. Оганесян, С.В. Щербинин. – Владимир, 2017.
- Методические рекомендации по оценке безопасности на свиноводческих предприятиях в российской федерации / М.А. Титов, А.К. Караулов, А.А. Шевцов [и др]. – Владимир, 2010. – 53 с.
- Мингалеев, Д.Н. Географическая эпизоотология: учеб. пособие / Д.Н. Мингалеев, Н.И. Садыков, Р.Х. Равилов. — Казань, 2017. — 81 с.
- О формировании природного очага африканской чумы свиней в Приморском крае / С.В. Теребова, Г.Г. Колтун, В.В. Подвалова, И.П. Короткова / Актуальные вопросы и инновационные технологии в ветеринарной медицине, животноводстве и природоохранном комплексе: материалы Международной научно-практической конференции, 06-08 ноября 2019 н.: в 2-х ч. Ч. II / ФГБОУ ВО Приморская ГСХА; отв. ред. С.В. Иншаков. – Уссурийск, 2019. – С.108-116.
- Организация ветеринарной службы и противоэпизоотическихмероприятий: учеб. пособие для вузов / А.Ф. Дмитриев, В.М. Сахно, В.В. Соловьёв, А.Н. Кононов. — 2-е изд., перераб. и доп.-М.: Колос; Ставрополь: АГРУС, 2008. — 488 с.
- Патоморфологическая диагностика болезней животных / Б.Л. Белкин [и др.]. — М.: Аквариум Принт, 2013. — 232 с.
- Пособие по подготовке чрезвычайных планов действий на случай эпидемии африканской чумы свиней / Служба животноводства и здоровья животных ФАО; подготовили: М.-Л. Пенрит, В. Губерти, К. Депнер, Х. Луброт. — №8. — Ереван, 2011. – 83 с. — SBN 978-92-5-406426-6.
- Прогноз по африканской чуме свиней в Российской Федерации на 2016 год / О.Н. Петрова, Ф.И. Коренной, Н.С. Бардина [и др.]. – Владимир: ФГБУ «ВНИИЗЖ», 2016. – 32 с. — ISBN 978-5-900026-62-6.
- Расчет вероятности распространения африканской чумы свиней / А.М. Коваленко, А.В. Ткачёв, О.Л. Ткачёва [и др.] // Достижения науки и техники АПК; Зоотехния и ветеринария. – 2019. – Т.33. — №12. – С.90-94.
- Рахманов А.М., Срибный Н.И. Эпизоотическая и фитосанитарная обстановка в стране и в мире / А.М. Рахманов, Н.И. Срибный// Ветеринарная патология. – 2002. — №2 – С. 5-7.
- Саркисян, Х.В. Изучение биологических свойств штаммов вирусов трансграничных болезней (ящур и африканская чума свиней) в республике Армения: дис. … д-ра вет. наук: специальность 16.00.01 – «Ветеринарии» / Саркисян Хачик Вазгенович; Национальный аграрный университет Армении. — Ереван, 2017. – 218 с.
- Сергеев, В.А. Классическая чума свиней: диагностика и профилактика / В.А. Сергеев, Е.А. Непоклонов, Т.И. Алипер // Ветеринария сельскохозяйственных животных. — 2008.- №1. — С. 19-25.
- Сидорчук, А.А. Общая эпизоотология: учебник / А.А. Сидорчук, Е.С. Воронин, А.А. Глушков. — М.: КолосС, 2005. — 176 с.: ил., табл. — ( ISBN 5-9532-0063-3.
- Эпизоотическая ситуация по АЧС [Электронный ресурс].- Электрон. текст. дан.- Режим доступа: http://guv.tatarstan.ru/rus/metodichki.htm.-Загл. с экрана.
- Эпизоотическая ситуация по КЧС на территории Российской Федерации и стран Восточной Европы [Электронный ресурс]: данные МЭБ с 2007 по 2015гг. – Электрон.текст. дан.- Режим доступа: https://www.fsvps.ru/fsvps-docs/ru/iac/asf/2015/10-26/06.pdf.-Загл. с экрана.
- Эпизоотическая ситуация по некоторым инфекционным заболеваниям животных в Российской Федерации и действующие нормативно-правовые документы / О.Н. Петрова [и др.] — Владимир: ФГБУ «ВНИИЗЖ», 2014. – 48 с.
- Эпизоотологический метод исследования: учеб. пособие / В.В. Макаров, А.В. Святковский, В.А. Кузьмин, О.И. Сухарев. — СПб.: Лань, 2009. — 224 с. – ISBN 978-5-8114-0903-7.
- Эпизоотология с микробиологией: учебник / под ред.: В.А. Кузьмина, А.В. Святковского. — СПб.: Лань, 2016. — 432 с.
- Южаков, А. Г. Молекулярно-генетическийанализ вакцинных и вирулентных штаммовпестивирусов: автореферат дис. … канд. биол. наук:03.00.06 / Южаков Антон Геннадьевич. – М., 2009. – 24 с.
- Яровой, П.Н. Совершенствование планирования профилактических противоинфекционных мероприятий на основе современных компьютерных технологий: автореф. дис. канд. вет. наук: 16.00.03 / Яровой Петр Николаевич; Воронеж. гос. аграр. ун-т им. К.Д. Глинки. — Воронеж, 2004. — 22 с.
