Титульный лист и исполнители
молодняк крупного рогатого скота, коровы, куры-несушки, йодированное пищевое яйцо, молочный йодированный белок, органический селен, продуктивность, сохранность.
Отчет включает 74 страницы, 9 рисунков, 15 таблиц, 56 литературных источников.
Объектами исследований являлись дойные коровы, куры-несушки, молоко, пищевые яйца, кровь животных
Цель исследований: Разработка премикса на основе полученных биотехнологическим путём органических форм селена и йода для повышения естественной резистентности сельскохозяйственных животных и птицы, а также получения продуктов, обогащённых органическим селеном и йодом, для профилактики дефицитных состояний у населения.
Задачи:
— разработка состава премикса на основе органических форм селена и
йода;
— проведение испытаний эффектисности влияния разработанного премикса на основные показатели здоровья и продуктивности с/х животных и птицы;
— изучение содержания селена и йода в основных продуктах — мясе,
яйцах, молоке — полученных от опытных животных и птицы;
-разработка нормативно-технической документации на премикс и его
производство;
— разработать научно-практические рекомендации по применению йод-селен-содержащего премикса для повышения продуктивных параметров сельскохозяйственных животных и птицы.
Включение в рацион кормления молочных коров и кур-несушек органических форм йода и селена в виде ковалетно связанного йода и селенопирана нормализует обмен веществ и энергии на уровне клетки в организме, что усилит работу иммунной системы и повышает естественную резистентность животных и птицы..
Введение
К числу приоритетных направлений, входящих в Стратегию научно-технологического развития Российской Федерации (до 2035 г.) относится создание безопасных и качественных, в том числе функциональных, продуктов питания. Особое внимание должно быть уделено производству пищевых продуктов, обогащенных незаменимыми микронутриентами, в частности йодом.
Адекватное потребление йода является важнейшим условием, обеспечивающим здоровье человека. На протяжении многих лет проблема нехватки йода у населения России стоит крайне остро – около ста миллионов россиян подвержены заболеваниям щитовидной железы. Йод ответственен за здоровье последующих поколений, нормального развития плода, здоровье матери. Нехватка природных соединений йода в продуктах питания приводит к существенной потере интеллектуального, образовательного и профессионального потенциала нации и обуславливает высокую медико-социальную значимость проблемы йододефицита и необходимость реализации мер по его профилактики [1,2]. Цель исследований: Разработка премикса на основе полученных биотехнологическим путём органических форм селена и йода для повышения естественной резистентности сельскохозяйственных животных и птицы, а также получения продуктов, обогащённых органическим селеном и йодом, для профилактики дефицитных состояний у населения.
Поскольку одним из основных физиологических источников поступления йода для человека являются продукты питания животного происхождения, во многих странах реализуются государственные программы по коррекции содержания йода в пище путем производства обогащенных продуктов питания (яиц, молока, мяса) [3,4,5,6,7].
Обогащение пищевых яиц йодом в природной, ковалентной форме,- перспективное направление в практике птицеводства [8]. Йодированные яйца кур широко представлены в торговой сети в качестве самостоятельного бренда. В России заявляемое производителями содержание йода в яйце составляет от 27 до 50 мкг. Европейские производители поставляют яйца с содержанием йода в среднем 10-25 мкг/яйцо или менее. Максимальное содержание йода в яйцах отмечается в США и Великобритании и составляет в среднем 30 мкг/яйцо, максимально — 50 мкг/яйцо [9,10,11]. Основная проблема в попытке йодирования яиц на современном этапе посредством неорганических форм йода (преимущественно йодидами и йодатами) приводит к тому, что 1) невозможно контролировать стабильное количество йода в яйце и 2) для получения большего количества йода в яйце требуется в несколько раз (в 3-5) добавлять токсичные формы неорганических соединений йода в корма (премиксы и добавки), что негативно влияет на здоровье и сохранность кур-несушек, а также приводит к деформациям яиц.
Так, например, для получения достаточного количества йода в яйце, необходимо увеличить содержание элемента в корме птицы. В ЕС максимально безопасным для получения обогащенных яиц признан уровень содержания йода в кормах кур 5 мг/кг, при этом расчетное содержание йода в яйце составит около 70 мкг. Gesellschaft fur Ernahrungsphysiologie (Общество Физиологии Питания, Германия) и Национальный Исследовательский Совет (США) установили минимальные необходимые уровни содержания йода в корме для кур-несушек в 0,5 мг/кг, при этом расчетное содержание йода в яйце составляет не менее 10 мкг/яйцо [11,12]. В России содержание йода в кормах составляет 0,6-1,0 мг/кг.
Для получения йодированных яиц в рационе кур-несушек в качестве источника йода чаще всего применяют минеральные соли. Однако их использование имеет ряд недостатков. Эти соединения не стабильны, разлагаются в процессе приготовления и хранения комбикормов. Выделяющийся йод соединяется с другими биологически активными веществами и превращается в неусвояемые для организма животных формы [13]. Применение йодидов и йодатов в составе кормов не позволяет получать йодированные яйца со стабильным и контролируемым содержанием йода. Кроме того, при термической обработке яиц происходят значительные потери (до 60%) неорганического йода [3]. Все это обуславливает необходимость поиска новых более стабильных источников йода в комбикормах. К таким соединениям относятся органические формы микроэлемента, в частности йодированные молочные белки, исследуемые в настоящей работе.
Задачи:
— разработка состава премикса на основе органических форм селена и
йода;
— проведение испытаний эффективности влияния разработанного премикса на основные показатели здоровья и продуктивности с/х животных и птицы;
— изучение содержания селена и йода в основных продуктах — мясе,
яйцах, молоке — полученных от опытных животных и птицы;
-разработка нормативно-технической документации на премикс и его
производство;
— разработать научно-практические рекомендации по применению йод-селен-содержащего премикса для повышения продуктивных параметров сельскохозяйственных животных и птицы.
1. Обзор литературы
1.1 Современное состояние вопроса
Товарное производство молочной продукции в своей основе имеет несколько основных целей, таких, например, как наполнение рынка качественными продуктами питания, создание рабочих мест, внедрение инноваций для повышения эффективности производства, извлечение прибыли и других. При этом основная задача: нарастить производство для полного обеспечения потребностей страны отечественным молоком, так и остается не выполненной. С 2005 по 2016 год производство молока в сельскохозяйственных организациях выросло на 1 млн тонн или на 8%. За 12 лет не смотря на все усилия предприятий и огромные субсидии государства прирост производства молока в России составил всего лишь 8%! На фоне новостей об открытии новых ферм в разных регионах страны статистические данные вынуждают констатировать, что общее поголовье дойных коров в РФ снижается в среднем на 1% в год (по данным ФСГС 2017г)
Ни для кого не является секретом, что при интенсивном производстве молока животных ставят в достаточно жесткие условия производственного процесса, которые не только негативно отражаются на текущем здоровье молочного стада, но резко сокращают продолжительность их жизни, а также существенно снижают вероятность рождения здорового жизнеспособного потомства. Заболевания, получаемые в процессе хозяйственной деятельности человека (содержание коров, питание, уход и т.п.), часто являются основной причиной выбраковки коров, что ведет к снижению сроков продуктивного использования. Так, Г. Калиевская (2002) сообщает, что «из 1122 выбракованных коров на долю выбывших по причине нарушения обмена веществ приходится 51,1% коров, заболевания половых органов – 16,2, пищеварения – 16,9, что также в определенной степени связано с нарушением обмена веществ, и лишь 1,2% коров выбракованы как малопродуктивные, 8,3 – по болезни вымени и 1,2% по различным инфекциям. В результате в хозяйстве снизилось долголетие коров с 3,12 отелов до 2,66 и увеличился сервис-период с 97,1 до 154 дней.»
Задача, которую научное сообщество решало последние 100 лет, была направлена на создание генетически обусловленных пород, способных дать возможность коровам реализовать свою максимальную производительность по молоку. При этом в большинстве случаев не учитывались совсем, либо учитывались в незначительной степени кормовые составляющие этого прогресса. А как показывает практика исследования микроэлементного состава трав, то в последнее время эти показатели существенно снизились {Закон Ю. Либиха, Работы Тимирязева К.А. и Прянишникова Д.И.}. «Медленный рост урожайности в предшествующие годы, — указывает академик В. Д. Панников, — во многом объясняется тем, что баланс питательных веществ в земледелии страны в течение длительного времени нарушался и складывался отрицательно, то есть со значительным дефицитом»
Следовательно, с течением времени требуется все больше усилий со стороны специалистов по кормам добавлять в рационы коров важнейшие микроэлементы и аминокислоты, от которых зависят процессы метаболизма у животных. Так на современном этапе для предотвращения йоддефицитных состояний у животных сначала активно пропагандировался йодид калия, но после сбора доказательной базы о летучести йодид-иона было принято решение многих премиксеров перейти на йодат кальция. Вне зависимости от неорганической формулы в ЖКТ (желудочно-кишечный тракт) происходит частичное всасывание йодид иона. Вот что об этом писали в отчете № 72 «Международная Химическая оценка» в первом проекте, подготовленным Джоном Ф. Ришером и л. Сэмюэлем Китом для Агентства по регистрации токсичных веществ и болезней (АЦДР), Атланта, Джорджия, США в 2004 году: «В серии исследований Arrington (1965) проводилось испытания по выживаемости детенышей, продолжительности деторождения и наличия/отсутствия признаков лактации у лабораторных животных, получавших в рационе йод, в виде йодида натрия или калия. Крысам породы Лонг-Эванс вводили йод из расчета 2500 мг/кг в рацион питания на 12 дней. В результате имел место более высокий показатель смертности у новорожденных, менее 10% новорожденных детенышей выживали в течение 3 дней. Было также зафиксировано увеличение продолжительности родов, у примерно 25% крыс роды продолжались в течение 24 часов или больше. Признаков начала лактации не наблюдалось» (Arrington et al., 1965). Детенышей сирийских хомяков кормили рационами, содержащими йод, в дозировках из расчета 2500 мг/кг во время последней части беременности в течение 12 дней, потребление корма у них снижалось примерно на 10% по сравнению с контролем, а отъемные массы выживших детенышей были значительно меньше на 21 день после родов. Выживаемость детенышей, сроки беременности, родоразрешения и лактация не были затронуты лечением (Arrington et al., 1965). Голландских и Новозеландских кроликов кормили рационами, содержащими йод по 250, 500 или 1000 мг / кг (йодид калия или натрия четко не указан) в течение 2-5 дней до родов. При дозах 250 или 500 мг/кг, включенных в рацион за 2 дня до родов, выживаемость детенышей снижалась на две трети. На более длительной продолжительности дозировки или на больших дозах, выживание было <5%. Детеныши были нормальными по размеру и развитию, но обычно умирали в течение первых нескольких часов после рождения (Arrington et al., 1965).»
Актуальность настоящей работы сводится также к тому, чтобы пересмотреть существующие положения о введении неорганических форм йода в рацион питания молочных коров с целью снижения негативных последствий для организма коровы и ее потомства, и заменить их на нетоксичные, природные формы, в частности на ковалентно связанный йод в составе премикса «Зоо-Прост».
На международной научно-практической конференции, посвященной актуальным проблемам генетики и репродуктивной биологии животных (ВНИИГРЖ, 2014), была освещена тема улучшения и поддержания здоровья животных и, что, это особенно важно, для импортного племенного скота, долголетие и здоровье которого может быть улучшено посредством использования новых современных форм микроэлементов органического характера и правильным подходом в кормлении (Фомичев Ю.П. 2014, Материалы Международной конференции). При этом особое внимание было уделено роли специфических микроэлементов и, в частности ковалентно связанному йоду, в питании высокопродуктивных молочных коров, которые могут профилактировать многие причины болезней и бесплодия коров.
Активное направление составляют разработки различного рода гормонов искусственного происхождения, действия которых направлены на скорейшие осеменение коровы и последующие «выбросы» молока. Это приводит к «изнашиванию» организма животного, быстрой выбраковки и к появлению более слабого потомства {Методические рекомендации для ветеринарных специалистов. Москва, 2014 год}.
После анализа различных научных источников как отечественных, так и зарубежных мы пришли к выводу, что собранные и проведенные многочисленные исследования в области биологической доступности различных форм йода (неорганические соединения, клатраты, органические соединения, полученные путем искусственного синтеза и т.п.), суммарно отстаивают общую точку зрения о введении усредненных норм потребления неорганического йода для человека. В том числе и экстраполируя опыт на животных. Доказывая негативный эффект воздействия сверх нормированных доз йода практически все эти исследования сводятся к результату потребления небольших доз, но постоянно. У человека это все равно приводит к развитию гипертиреоза и прочих заболеваний. Что касается животных, и в частности коров, то небольшие дозы йодата кальция сразу не «убивают» коров, а постепенно выводят их жизненно важные системы из строя, в конечном итоге происходит выбытие животных по видимым и установленным причинам, хотя все это могло произойти и в силу ежедневной интоксикации минеральными веществами, среди которых был и неорганический йод.
Важную роль в процессе обмена веществ и энергией мы отводим так называемым катализаторам обменных процессов. На молекулярном, а еще более правильно на субатомном уровне в составе полимолекул, к таким катализаторам мы относим ковалентно связанный йод.
Последние научные работы, исследовавшие процессы метаболизма и улучшение качества и количества молока, были направлены на сбор данных о действии йода в составе минеральных неорганических премиксов с целью минимизации ущерба для здоровья животных. Для восполнения столь необходимого всем живым организмам йода, специалисты по кормам рекомендовали неорганические формы этого важного микроэлемента. Так, вначале был использован йодид калия, который явился не столь эффективным уже на стадии производства и заготовки кормов (поскольку йодид достаточно летуч и активен), и в последствие — йодат калия или кальция. А так как данные вещества являются по сути токсичными и не предназначены в процессе Эволюции к употреблению животными (чисто человеческое «изобретение»), то производители опускают упоминание, что входит в состав премикса, указывая лишь содержание атома йода и его дозировку.
Коровы, как и любое животное, подвержены заболеваниям, но вследствие «инертного» отношения к ним со стороны людей, а в основном их расценивают как источник извлечения прибыли, основное направление медикаментозного воздействия направлено на излечение болезней и поддержание качества молока. Не секрет, что для определенного круга людей болезни коров являются источником извлечения личной выгодны (закупка препаратов, услуги, работа, выбраковка и т.п.). В некоторых регионах выбраковка стада компенсируется из бюджета. В общем, существует множество инструментов немотивирующих к созданию иного здравого подхода к проблеме оздоровления стада, поддержанию генетики, сохранению породы и получению более качественной продукции – молока – с высокой производительностью. Необходимо задуматься о смене мотивационных фактов с негативных на позитивные. Вознаграждать труд людей не по итогам «излечения» болезней или выбраковки стада, а по недопущению их в хозяйствах, по сохранению поголовья и по получению правильного функционального продукта.
Вот в таких условиях мы и предлагаем изучить результаты проведенных длительных экспериментов по созданию принципиально нового продукта для поддержания обменных процессов у животных.
Основные проблемы, с которыми сталкивается отрасль животноводства (в частности КРС молочно-товарные фермы) сегодня, являются:
- Отсутствие позитивной мотивации у персонала, знаний, умений навыков, а также коррупционная составляющая.
- Генетически зависимые отношения с импортом семени и с использованием не отечественных пород коров.
- С каждым годом ухудшающая кормовая база в силу объективных и субъективных причин (нарушен кругооборот микроэлементов, загрязнение среды, усиление роли неорганической химии и т.п.)
- Сокращение окупаемости основных фондов (собственно коров). Сегодня окупаемость наступает после 4 периодов лактации, а только в Московской области средняя продолжительность жизни коровы составляет не более 3 периодов лактации (точнее 2,8)
- Удлинение сроков сервис-периода для высокопроизводительных коров. Сегодня он доходит до 270 дней. Средний показатель по Московской области около 180 дней. В СССР сервис-период составлял не более 45-60 дней. (Госкомстат СССР. 1980 год)
- Снижение качества и количества молока. Так коровы со среднем надоем около 20 литров в сутки считаются высокоудойными. При этом показатели молока сильно варьируются и зависят не только от времени года, но и в значительной степени от кормовой базы. Но отмечается тенденция ухудшения показателей молока в качестве сырья для сыроварения. Практически не осталось предприятия сыроварения, которое бы не использовало в своем производстве искусственные ферменты и закваски, поскольку их уже нет в исходном сырье.
- Полное отсутствие связи между наукой и производственной базой. 90-е годы заложили глубокие противоречия между научно-обоснованным подходом и практическим применением достижений внутри хозяйствующих субъектов. Наука пыталась «выживать» и подписывала удобные результаты применения сомнительных достижений. Ответственность за результаты здоровья и продолжительности жизни животных, равно как и качество и количество продукции, производимой ими, сегодня переложена на фирмы-поставщики кормов, ветпрепаратов, премиксов и прочих добавок. Центры развития знаний перенесены на центры коммерческого интереса, отсюда и конфликты сторон.
Не существует, по нашему мнению, более актуальных проблем в животноводческой отрасли, которые не требовали бы скорейшего, оперативного вмешательства агропромышленных элит, органов государственной и региональной власти, специалистов и экспертов, работающих в системе АПК. Если мы не начнем решать эти проблемы сегодня, то под угрозой исчезновения окажется вся система животноводства. Под ударом уже оказалась национальная безопасность в области обеспечения качественной продукцией нашего подрастающего поколения и нации в целом. Санкции, которые будут наложены в сфере поставки семени, качественных добавок и скота – вот страшный удар, который мы должны всеми силами суметь максимально нивелировать, а еще лучше не допустить.
1.2 Йод и селен в рационе сельскохозяйственных животных и птиц
Обеспечение населения высококачественными продуктами животноводства возможно лишь на базе полноценного кормления животных. Важнейшим фактором балансирования рационов по комплексу питательных и биологически активных веществ является использование микродобавок, среди которых особое место занимают микроэлементы селен и йод.
В последние годы во всем мире врачи-диетологи уделяют большое внимание коррекции недостатка селена и йода у различных групп населения.
Обогащение ими рационов кормления животных – один из способов решения этой проблемы. При скармливании селена и йода животным получают продукцию с повышенной концентрацией в ней этих элементов, что дает возможность восполнить их дефицит в питании человека (Папазян Т.Т., 2002).
Однако предложенные в настоящее время разными авторами нормы скармливания микроэлементов селена и йода различным сельскохозяйственным животным и птице ориентировочны и не могут быть приняты повсеместно в России. Необходимо отметить, что ранее не достаточно изучалось комплексное влияние селена и йода на продуктивность и обмен веществ сельскохозяйственных животных и птицы, хотя в отдельных источниках отмечается, что одновременный дефицит этих микроэлементов приводит к более высокой степени гипотиреоидизма, чем дефицит в составе рациона одного йода (Arthur J.R., Beckett G.J., 1994). Недостаток селена в организме животных снижает функциональную активность гормонов щитовидной железы, препятствуя синтезу йодтирониндейодиназы, которая превращает тироксин в более активную форму трийодтиронин (Arthur J.R., Nikol F., Beckett G.J., 1992; Шацких Е.В., Гафаров Ш.С., Бояринцева Г.Г., 2006).
Известно, что среди локальных и системных функций микробиоты кишечника животных важное место занимает улучшение всасывания различных соединений, включая микроэлементы. В экспериментах на животных и клинических исследованиях установлено, что нарушение формирования кишечной среды негативно сказывается на всасывании нутриентов и, особенно на усвоение минеральных веществ, витаминов, и в конечном итоге на состояние иммунитета (Васильев А.В., Петухов А.Б., Мальцев Г.Ю., 2004).
В последнее десятилетие пробиотические и пребиотические препараты в кормлении сельскохозяйственных животных широко применяются с целью нормализации пищеварительных и обменных процессов, а также стимуляции повышения их продуктивных качеств. Известно, что для всасывания селена и йода важное значение имеет РН среды содержимого кишечника, в регуляции которого принимает участие микрофлора. Чаще всего в кишечнике уменьшается количество бифидобактерий, которые выполняют ряд важных функций: защищают слизистую от проникновения в кровь патогенных и условно-патогенных микроорганизмов, в процессе жизнедеятельности синтезируют антибиотикоподобные вещества, органические кислоты, препятствующие развитию патогенов (Цогоева Ф., Кизинов Ф., 2005).
В настоящее время селен в малых дозах признан незаменимым микроэлементом для сельскохозяйственных животных (Болотников, Конопатов, 1987). Многочисленные опыты как отечественных, так и зарубежных ученых подтвердили положительное влияние селена на воспроизводительную функцию животных и жизнеспособность потомства (Алешко, 1971; Кудрявцева, 1974; Cantor, Scott, 1974).
Применение препаратов селена в кормлении приобретает особую актуальность в связи с резким снижением количества животных кормов (основных источников селена), широким использованием продуктов микробиологической промышленности, применением технологий заготовки и подготовки кормов к скармливанию с высокотемпературными обработками [селен начинает улетучиваться из кормов уже при (50-60) оC]. У многих веществ, обладающих канцерогенным действием, обнаружена способность резко увеличивать выделение селена из организма более чем в 20 раз и вызывать значительный дефицит этого элемента даже в случаях поступление в организм в дозах, превышающих обычно рекомендуемые (Дюкарев, Клочковский, Дюкар, 1985).
Наиболее распространенными препаратами селена, используемыми в кормлении животных, являются селенит и селенат натрия.
Селенит натрия содержит селена 45,7 %, селенат натрия – 41,4 %. Доступность селена для птицы из селенита натрия составляет 74 %. Доступность селената для птицы ниже, чем селенита (Кузнецов, Кузнецов, 2001). Селенат натрия – относительно стабильное соединение, он менее вреден для других ингредиентов премиксов и менее токсичен по сравнению с селенитом.
Если селенит всасывается через мембраны щеточной каймы в начальном отделе тонкого кишечника, то селенаты – в средней и каудальной за счет механизмов активного транспорта. Абсорбцию селена из селенита стимулируют цистеин и глутатион, а ингибируют метионин и его аналоги (Кузнецов, 1991).
Селенит натрия кормовой (0,1 %) является препаративной формой селенита натрия с добавлением инертных наполнителей, которые вводят в комбикорм непосредственно перед раздачей и тщательно перемешивают. Однородность смешивания достигает (95-96) %. Низкая концентрация селена по чистому веществу (0,046 %) обеспечивает не только удобство, но и безопасность применения препарата в производстве комбикормов и премиксов.
Несмотря на огромное биологическое значение селена, он не находил долгое время широкого применения в кормлении птицы. Лишь в отдельных странах его включали в состав комбикормов и премиксов. Между тем большинство кормов, используемых в птицеводстве, не обеспечивает потребности птицы в этом микроэлементе. Обычный хозяйственный рацион содержит (0,03-0,1) мг/кг селена. Однако предложенные разными авторами нормы скармливания птице селена ориентировочны. Не определены также потребности в селене для птицы различного направления продуктивности, а также в отдельные периоды индивидуального развития.
Для восполнения дефицита селена в кормах используют различные источники, из которых наибольшее распространение получили селенит натрия и натрий селенисто-кислый 5-водный. Их дозы (1-2) г на 1 т корма (Шкарин, 2004). Применять селенит натрия молодняку птицы разрешается с первых дней жизни из расчета 1 мг препарата на 10 кг корма (Гробовский, 1973).
После вывода, особенно на 5-й день жизни, концентрация витамина Е в печени цыплят, индюшат, гусей, уток резко падает – более чем в 20 раз. В то же самое время активность глутатионпероксидазы повышается к моменту вывода, что дало основание назвать селен главным постнатальным антиоксидантом. Этот фактор является одним из важных в обеспечении высокой жизнеспособности в течение первых 10 дней жизни цыплят.
Для птицы селенит натрия можно добавлять в питьевую воду. Для этого 10 мг препарата растворяют в 100 л воды и разливают по поилкам в течение (2-4) дней подряд (Дюкарев и др. 1985). В опытах Л.М. Борисовой (1969) применение селенита натрия с водой оказалось более эффективным, чем с кормом. Это, возможно, связано с более равномерным распределением препарата, а также лучшим всасыванием его в желудочно-кишечном тракте. В. Шипилов (2000) предлагает норму ввода селенита натрия кормового для птицы от 100 до 450 г на 1 т комбикорма.
Профилактический и ростовой эффект микродобавок селена к рациону цыплят-бройлеров [(0,2-0,4) мг/кг сухого вещества], особенно на фоне нестабильного липидного питания, наблюдали многие исследователи (Георгиевский, 1970; Цалс, 1972; Нурмухаметова, 1984; Девеча, 1984).
По данным Г.П. Белехова и А.А. Чубинской (1965), положительное действие селена сказывается на предупреждении и лечении экссудативного диатеза у цыплят в количестве 0,08 мг на 1 кг живой массы.
А. Хенниг (1976) минимальную потребность в селене для всех сельскохозяйственных животных и птицы устанавливает на уровне (0,08-0,1) мг/кг, причем эта величина может несколько изменяться в зависимости от концентрации серы в рационе. В некоторых случаях для устранения экссудативного диатеза цыплят необходимы дозы селена выше 0,1 мг/кг корма.
Оптимальным уровнем селена в кормах для птиц С.Н. Касумов (1981) предлагает считать (0,1-0,3) мг/кг, недостаточным – менее 0,1 мг/кг, токсичным – более 3,0 мг/кг. По его мнению, содержание элемента в рационе должно находиться на уровне: для цыплят (0,20±0,05), утят и индюшат (0,25±0,05), кур-несушек – (0,15±0,05) мг/кг корма. В.И. Георгиевским и др. (1985) установлена потребность в селене на уровне 0,06 мг/кг (в виде селенита) для максимального роста и ингибирования перекисного окисления. В то же время добавка 0,1 мг селена к рациону кур с уровнем селена (15-30) мкг/кг увеличивала яйценоскость, повышала выводимость и жизнеспособность молодняка и предотвращала появление экссудативного диатеза. В целом оптимальный уровень селена в кормах 0,1 мг/кг, недостаточный – менее 0,1 мг/кг, токсический – (5,0-8,0) мг/кг.
В.В. Дюкарев, А.Г. Клочковский, И.В. Дюкар (1985) потребность в селене при использовании доброкачественных кормов оценивают в (0,1-0,3) г в 1 т корма. Л.И. Тучемский (1999) определяет потребность в селене для птицы (0,15-0,2) мг/кг корма. Т.М. Околелова и др. (1999) определяют нормы ввода добавок селена в комбикорма для цыплят-бройлеров 0,15 г/т. Минимальный предел, при котором наступает явление токсикоза (селеноза), по В.В. Ермакову и В.В. Ковальскому (1974), 2,5, по Б.Д. Кальницкому (1985) – (3,0-4,0) мг селена на 1 кг сухого вещества корма.
По данным Э. Визнера (1976), А.В. Атлавина и др. (1990), при содержании селена в рационе 5 мг/кг корма снижаются темпы роста, яйценоскость и выводимость цыплят, при 8 мг/кг отмечаются тяжелые патологии у цыплят, а при 10 мг/кг наблюдается полное прекращение выводимости цыплят.
По данным И.А. Девеча (1991), стимулирующим является содержание селена от 0,19 до 5,08 мг/кг сухого вещества корма, токсическим — 7,58 мг/кг. С.Г. Кузнецов (1992) считает токсичным корм, содержащий (7,0-10,0) мг селена на 1 кг сухого вещества.
А.И. Тишков, Л.И. Войтов (1989) установили видовую чувствительность птицы к селениту натрия: наиболее чувствительны к нему индюшата, затем цыплята-бройлеры, утята. Минимальная токсическая доза селенита натрия, способная вызвать изменения в клиническом статусе цыплят-бройлеров, – 1,70 мг/кг, острый токсикоз – (13,76-27,52) мг/кг, хронический токсикоз – (1,70-7,83) мг/кг массы тела в течение 14 суток применения.
Следовательно, при введении препаратов селена в рационы птицы необходимо тщательно соблюдать дозировку и обеспечивать равномерное смешивание их с комбикормом.
В качестве источников йода можно использовать большое количество препаратов, появившихся в последние годы, однако классическими являются йодат кальция – 65,0 % йода, йодат калия – 59,0 % и йодид калия – 76,5 % (Фелтвелл, Фокс, 1983).
Йодистый натрий (NaI) и йодистый калий (KI) – основные соединения йода, применяемые в качестве добавок. Однако эти соединения нестабильны, катализируют процесс их окисления соединения железа, меди и марганца.
Йодид калия легко растворим в воде. Из препарата йод усваивается на (25-35) %. Йодистый калий по сравнению с йодистым натрием более стоек и менее гигроскопичен, поэтому его применяют в зоотехнической практике для предотвращения гипотиреоза.
Соли йода стабилизируют восстановителями, имеющими щелочную реакцию (тиосульфат натрия, двууглекислый натрий, стеарат кальция), так как перекиси и кислоты переводят йод в молекулярную форму. Применение стеарата кальция повышает стабильность йодистого калия в (1,7-1,8) раза и дает возможность увеличивать сроки хранения премиксов почти в 2 раза. Смешивание йодида калия перед введением в премикс с (8-24) % (по массе йодида) природного цеолита позволяет повысить сохранность йода в 3,5 раза, срок хранения премикса – с 4 до 12 месяцев (Кузнецов и др., 1992).
Йодаты калия и кальция меньше разрушают витамины А и Е, чем йодиды, нетоксичны и более стабильны, чем йодид калия или натрия.
В большинстве применяемых подкормок, полисолях, брикетах, комбикормах и препаратах йод не стабилизируется и улетучивается в процессе изготовления и хранения, или соединяется с другими биологически активными веществами и превращается в неусвояемые для организма животных формы (Кузнецов, 1991).
В связи с высокой летучестью йода содержание КI в корме снижается уже через 1 месяц на 25 %, через 2 месяца на 50 %, через 5 месяцев на 78 %, через год – на 90 %. Для стабилизации йодидов в условиях комбикормовых заводов используют тиосульфат, бикарбонат натрия или стеарат кальция. Этот процесс очень трудоемок и затратен (Лебедев, 1990). При стабилизации КI бикарбонатом натрия повышается сохранность йода на (10-12) % в течение первых двух месяцев (Кузнецов, Батаева, Овчаренко и др., 1992).
При невозможности использования йодистых подкормок в кормовой смеси йодид калия или натрия вводят в питьевую воду в количестве 2,0 г на 100 л воды (Георгиевский, 1970). Добавки соединений йода в корма и питьевую воду увеличивают рост, яйценоскость птицы (Вишняков и др. 1971; Гусаков, Островский, 2002; Евхутич, Лебедева, 2005), оплодотворяемость яиц и выводимость молодняка (Петров, 1963). Оптимизация содержания йода в рационах путем микродобавок йодистых соединений повышала мясную продуктивность кур на (7-37) %, а яйценоскость – на (6-26) % (Егоров, 1973; Кашин, 1987). Обнаружено, что лучше росли цыплята, которые регулярно, начиная с первого дня жизни, получали добавку йодистого калия в составе рациона (Горянов, 1959).
Токсический избыток йода в рационе птицы маловероятен, так как толерантность к данному элементу высокая. При дозах выше оптимальных в 300-1000 раз у кур временно прекращалась яйцекладка и ухудшались инкубационные качества яиц (Георгиевский и др., 1979).
Потребность в йоде зависит от возраста, физиологического состояния и его концентрации в корме. Ориентировочные нормы содержания йода в кормах для удовлетворения физиологических потребностей для птицы – (0,3-1,0) мг/кг сухого вещества корма (Хенниг, 1976; Георгиевский и др., 1979). По данным П.Д. Евдокимова и В.Д. Артемьева (1974), наиболее эффективны следующие дозы йодистого калия: цыплятам – 0,2 мг, курам – 0,5 мг на голову в сутки. По мнению Я.М. Берзиня и В.Т. Самохина (1968), общая потребность птицы в йоде составляет 0,58 мг на 1 кг сухого вещества рациона. Достаточным количеством йода для нормального роста и функции щитовидной железы у цыплят С.И. Вишняков, А.Н. Апухтин и В.С. Иноземцев (1971) считают (0,3-0,4) мг на 1 кг корма.
У птицы, как и у других сельскохозяйственных животных, недостаток йода сказывается, прежде всего, на эмбриональном развитии. Эти нарушения наблюдались в опытах А. Хеннига (1976) при содержании йода в корме менее 0,15 мг на 1 кг корма. Племенным курам требуется йода около 0,5 мг/кг. Рекомендуемые А.М. Венедиктовым и А.А. Ионасом (1979) нормы йода для птицы составляют (в мг на 1 кг сухого вещества рациона): куры – (0,3-1,0), индейки – 1,0, гуси – 1,0 утки – 1,0.
В.В. Дюкарев, А.Г. Ключковский, И.В. Дюкар (1985) рекомендуют вводить в комбикорм 0,7 г йода на 1 т. Ориентировочные рекомендации ВНИТИП по нормам ввода йодистого калия в комбикорма следующие (г/т): куры племенные и промышленных стад – 3,0, бройлеры от 1 до 30 дней и от 31 до 70 дней – 3,0. Л.И. Тучемский (1999) определяет потребность в йоде для взрослых племенных кур – 2,0, молодняка всех видов – (0,4-0,6), а для бройлеров быстрорастущих кроссов – 1,0 мг/кг корма. Признаки недостаточности проявляются при содержании в корме йода менее (0,2-0,15) мг/кг. Т.М. Околелова и др. (1999) определяют норму ввода йода в комбикорма для цыплят-бройлеров 0,7 г/т.
При недостатке селена в организме животных снижается активность целого ряда важнейших ферментов, нарушаются процессы нейтрализации гидроперекисей и перекисей липидов, развивается оксидантный стресс. Дефицит йода влияет в первую очередь на функцию щитовидной железы, недостаточная выработка тиреоидных гормонов ведет к нарушению практически всех видов обмена веществ у животных и развитию тяжелых патологических состояний.
Кроме того, йод и селен функционально связаны между собой, поскольку последний входит в состав фермента йодтирониндейодиназы, обеспечивающего трансформацию тироксина в трийодтиронин. Недостаток в организме этих двух микроэлементов может служить одним из главных факторов риска в провоцировании йодцефицитных состояний, в первую очередь эндемического зоба (P.R. Larsen, M.J. Berry, 1995). Дефицит селена вызывает симптомы гипотиреоидизма, вследствие чего снижается уровень обменных процессов в организме и невозможна полная реализация генетического потенциала продуктивности животных и птицы (JI.A. Решетник, Е.О. Парфенова, 2001).
Совместное использование селена и йода для повышения продуктивности сельскохозяйственных животных и оптимизации их гомеостаза представляет несомненный интерес, однако в доступной нам литературе этот вопрос недостаточно освещен.
До настоящего времени не было систематизированных данных о содержании йода и селена в основных типах почв Кемеровской области, в растениях, произрастающих на этих почвах, и животноводческой продукции местного производства. С учетом того, что биологический круговорот химических элементов происходит в пищевой цепи почва — растение — животное — человек, информация о содержании в различных звеньях этой цепи тех или иных элементов, в частности селена и йода, имеет большое теоретическое и практическое значение.
В последние годы во всем мире врачи-диетологи уделяют большое внимание коррекции недостатка у различных групп населения селена и йода. Обогащение ими рационов животных — один из способов решения этой проблемы. При скармливании селена и йода животным получают продукцию с повышенной концентрацией микроэлементов, что дает возможность восполнить их дефицит в питании человека (A. Aro et. al., 1996). Наиболее перспективной в этом отношении является продукция птицеводства, особенно куриные яйца (Т. Папазян, 2002). Литературные источники, освещающие данный вопрос, немногочисленны и разноречивы.
1.3 Органический йод – новое решение проблемы йоддефицитных состояний.
Йод и селен являются важнейшими микроэлементами, необходимыми для поддержания гомеостаза тиреоидных гормонов [ 1 ]. Селен необходим для иммунной, мозговой и мышечной функций и необходим для репродуктивной функции [ 2 , 3 , 4 ]. Йод необходим для производства тиреоидных гормонов, трийодтиронина (Т3) и тироксина (Т4), которые необходимы во время беременности и в младенчестве для развития головного мозга и неврологии [ 5, 6 ]. Дефицит йода признан самой предотвратимой причиной психических расстройств и является одной из основных проблем общественного здравоохранения во всем мире [ 7]
Йодирование соли является главным подходом во всем мире к контролю и профилактике дефицита йода, и мониторинг программ йодирования соли показал, что это эффективная стратегия [ 13, 14, 15]. В некоторых европейских странах, включая Великобританию, директивные органы неохотно внедряют программу йодирования соли, поскольку это может противоречить усилиям Общественного здравоохранения по сокращению потребления соли для профилактики сердечно-сосудистых заболеваний [ 14 ]. В связи с растущей проблемой дефицита йода и отсутствием профилактических мер с использованием йодированной соли требуются альтернативные стратегии для повышения йодного статуса.
Во многих странах, которые не внедрили обязательную программу йодированной соли, включая Великобританию, молоко является наиболее важным диетическим источником йода [ 16 , 17 , 18 , 19, 20 , 21 , 22 ]. Для взрослого населения Великобритании (19-64 года) молоко и молочные продукты обычно вносят 35% в суточное потребление йода и 6% в диетическое потребление Селена [ 12 ].Расчетное потребление питательных веществ основано на данных о составе пищевых продуктов [23 ], которые могут не дать точной оценки потребления йода и Селена, поскольку концентрации йода и Селена систематически не обновлялись в течение многих лет [ 24, 25]. Вариации содержания микроэлементов в аналогичных пищевых продуктах и изменения состава питательных веществ с течением времени также могут ограничивать точность данных о составе пищевых продуктов, используемых для оценки диетических приемов [ 26 ].
Более 2 млрд. населения мира и 50 млн. жителей России проживают на территориях с недостаточностью йода. Более того, реальное потребление йода с пищей и водой у ста миллионов россиян составляет всего 40-80 мкг в сутки, то есть в 2-3 раза меньше рекомендуемого уровня. Недостаточное потребление йода создает серьезную угрозу здоровью и приводит к существенной потере интеллектуального, образовательного и профессионального потенциала нации. Поэтому проблема снижения распространенности йоддефицита имеет первоочередное значение для населения страны.
В организме взрослого человека содержится всего 20 – 30 мг йода, из которых 10 –15 мг сконцентрировано в щитовидной железе. Йод является единственным из известных в настоящее время микроэлементов, участвующих в построении гормонов, а именно тиреоидных гормонов щитовидной железы, определяющих физическое и умственное развитие человека и нормальное протекание всех без исключения обменных процессов.
В ходе эволюции у человека и животных выработалась сложная и эффективная система по обеспечению организма йодом, включающая механизмы его поглощения, модификации и транспорта в виде различных органических и неорганических соединений. При этом восполнение метаболического пула йодидов происходит непрерывно, как за счет экзогенных, так и за счет эндогенных источников.
Основное количество йода поступает в организм с пищевыми продуктами растительного (30 –35%) и животного (60-56%) происхождения. И лишь небольшая его доля – с водой (3%) и воздухом (3%). Йод в ЖКТ восстанавливается до йодидов (I—), после чего быстро и почти полностью всасывается, и поступает в кровь. При нормальной функции почек более 90% йода выводится с мочой. Лишь незначительная его часть выделяется через кишечник.
Из окружающей среды в организм человека йод поступает в двух формах: неорганической и органической. Йод поступает из кишечника в кровь в неорганической форме – в виде йодидов, йодсодержащих аминокислот и йодированных жирных кислот. Неорганические соединения йода положительных степеней окисления при попадании в кишечник восстанавливаются до йодид – ионов.
Многочисленные исследования показали, что потребление продуктов с высоким содержанием неорганического йода может привести к негативным последствиям для человека. Особенно значимые отрицательные явления наблюдаются при потреблении обогащенной йодитами или йодатами поваренной соли. Они обусловлены прежде всего слишком высокой, физиологически неадекватной скоростью поступления неорганического йода во внутреннюю среду организма и последующего его захвата клетками щитовидной железы. Это приводит к появлению в щитовидной железе локальных очагов гипертрофии и гиперплазии ее клеток – тиреоцитов, что в дальнейшем может приводить к появлению тиреотоксикозов, тиреоидитов, диффузного токсического зоба и даже к развитию опухолей щитовидной железы.
Это подтверждается выводами исследований, проведенных ВОЗ в различных странах мира, наиболее подверженных йододефициту. Они следующие:
1. Увеличение частоты йод-индуцированного тиреотоксикоза может быть вызвано относительно небольшим возрастанием потребления йода, в то же время вероятность заболевания значительно увеличивается при резком возрастании количества потребляемого йода.
2. Не существует такого содержания йода в соли, которое бы обеспечило абсолютную защиту от распространения йод-индуцированного тиреотоксикоза среди населения, ранее испытывавшего нехватку этого элемента.
3. В целом для здоровья населения преимущества коррекции дефицита йода путем всеобщего йодирования соли превосходят по значимости опасность заболевания йод-индуцированным тиреотоксикозом.
Иными словами можно сказать, что от профилактики йододефицита с помощью йодированной соли «больше пользы, чем вреда». В связи с этими формулировками доводы специалистов – медиков, диетологов, технологов пищевых производств о необходимости и абсолютной эффективности применения йодированной соли для профилактики дефицита йода являются малоубедительными и спорными.
Совместными программами ЮНИСЕФ, РАММ (программа устранения дефицита пищевых микрокомпонентов), ICCIDD (Международный совет по борьбе с заболеваниями, вызываемыми йодной недостаточностью) и ВОЗ продолжают предпринимаются значительные усилия по ликвидации йодной недостаточности.
Однако, обещание ВОЗ ликвидировать дефицит йода во всем мире к 2000 году остается невыполненным. В 2002 году на специальной сессии Генеральной Ассамблеи ООН по вопросам материнства и детства, посвященной проблеме йоддефицитных заболеваний, было решено принять максимум усилий для ликвидации йоддефицита до 2005 года. И вновь эта задача выполнена не была. Это является важнейшим доказательством неправильности используемого подхода. Дефицит йода продолжает оставаться серьезной проблемой, остро стоящей перед правительствами 192 стран мира, которую необходимо решить в ближайшее время.
Сегодня назрела острая необходимость в разработке новых эффективных и безопасных подходов к решению этой важнейшей для человечества проблемы. И природа сама показывает человеку способ ее решения. Подсказкой является потребление людьми продуктов питания, содержащих значительные количества органического йода (морская рыба, морепродукты, молоко, мясо и т.д.).
Известно, что жители Японии и Юго-Восточной Азии потребляют от 1 до 10 мг и более йода в сутки. Это в десятки и сотни раз превышает рекомендуемую ВОЗ (2001г.) норму среднесуточного потребления йода, которая составляет всего 150 мкг. При этом японцы не только не имеют побочных эффектов, которые появляются при потреблении высоких доз неорганического йода, но и имеют самую высокую в мире продолжительность жизни, а индекс интеллектуального развития (IQ) у них около 130 единиц (у европейцев около 120). Убедительным примером благоприятного влияния на организм человека потребления органического йода являются его выраженные радиопротекторные свойства, которые помогли жителям Японии пережить и ядерные бомбардировки в 1945 году, и аварию на атомной электростанции в Фукусиме в 2011 году.
К сожалению, в последние годы в России примерно в 4 раза снизилось потребление морской рыбы, богатой органическим йодом, а также значительно уменьшилось потребление мяса и молока, где его тоже содержится значительно больше, чем в растительной пище. Эти печальные факты вносят существенную лепту в развитие йоддефицитных заболеваний в нашей стране.
Очевидно, что одним из реальных шагов восполнения нехватки этого элемента в масштабах России и в мире может быть организация производства продуктов питания массового потребления, обогащенных органическим йодом.
Для реализации этого нового подхода к решению йоддефицитных состояний необходимо в ближайшее время осуществить следующие мероприятия:
- Провести метрологическую оценку основных физико-химических показателей, характеризующих понятие «органический йод», разработать его стандарт и методы контроля в продуктах питания, БАД к пище и лекарственных средствах.
- Провести клинико-нутрициологические исследования с целью уточнения основных физиолого-биохимических механизмов усвоения и метаболизма неорганического и органического йода в организме у различных категорий населения.
- Уточнить физиологически адекватные нормы среднесуточного потребления органического йода для различных категорий населения.
- Организовать промышленное производство субстанции органического йода для пищевой промышленности.
- Разработать нормативные документы по производству пищевых продуктов, обогащенных определенным количеством органического йода.
- Осуществить широкомасштабное внедрение этих продуктов в ходе реализации федеральных и региональных программ по профилактике йоддефицитных состояний у детей и взрослых.
- Обеспечить эффективный оперативный контроль за ходом реализации этих программ, включающий постоянный мониторинг показателей, характеризующих обмен йода в организме, а также содержание органического йода в продуктах питания.
До сих пор среди специалистов не существует единого мнения по вопросу о том, что такое органический йод. В широком понимании к «органическому йоду» относят все соединения йода с белками, аминокислотами, полисахаридами, липидами и другими биополимерами, которые встречаются в живых организмах.
И вновь природа помогает человеку определиться в понятии «органический йод». В организме человека и животных йод присутствует в виде неорганических соединений — йодидов и органических — тиреоглобулина, йодированных аминокислот – монойодтиронина и дийодтиронина, йодсодержащих (до 65% йода) гормонов – тироксина и трийодтиронина, а также промежуточных продуктов их метаболизма. В циркулирующей крови около 75% йода находится в виде органических соединений, а остальная часть представлена йодид-ионом. Очевидно, что в обмене йода значительную роль играет органический йод.
Всем живым существам присуще такое явление как «органификация йода». Например, в щитовидной железе человека ежесекундно происходит ферментативное присоединение неорганического йода к аминокислотам белка – тиреоглобулина (йодирование). В результате реакции гидрофильного замещения йодид (J—) встраивается вместо водорода в молекулу аминокислоты – тирозина, образуя прочную связь с углеродом (С – J) и при этом одновременно приобретает положительную валентность (J+). Органический йод – это единственный из всех макро- и микроэлементов, который ковалентно связывается с молекулами различных белков. Именно благодаря своей положительной валентности органический йод способен проявлять все свои многообразные удивительные биологические свойства, в том числе через йодсодержащие гормоны – тироксин и трийодтиронин, участвующие в регуляции всех обменных процессов в организме человека. Кроме щитовидной железы процессы «органификации йода» в меньшей степени осуществляются в молочной и слюнных железах, а также других тканях и органах.
Все млекопитающие, включая и человека, при рождении потребляют в основном органический, связанный с белками молока матери, йод. С этим связано чрезвычайно важное значение положительного баланса йода в организме беременных и кормящих женщин.
В других живых организмах органический йод присутствует также в виде моно – и дийодтирозинов. Особенно много их в морских гидробионтах, таких как морские губки, ежи, водоросли и т.д.
У человека существуют два различных механизма всасывания, усвоения и метаболизма неорганического и органического йода. В конечном итоге эти механизмы и определяют эффективность и безопасность различных подходов по профилактике йоддефицита. Следует отметить, что высказываемое многими зарубежными и отечественными исследователями мнение о главной регулирующей роли дейодиназ печени в усвоении и метаболизме органического йода сильно упрощено и спорно. Подтверждением этого является неоспоримый факт высокого содержания йода в моче японцев (от 1,5 до 10 тысяч мкг йода в литре), что возможно только в случае всасывания и метаболизма органического йода. Для справки: ВОЗ считает нормальным уровень йода 100 мкг/л.
По-видимому, эффективность потребления органического йода определяется, во-первых, сложной системой его распределения и аккумуляции в организме, во-вторых слаженной работой не только дейодиназ печени, но и дейодиназ в тканях и органах, определяющих оптимальный уровень обмена йода в целом, и в-третьих, работой «йодного насоса», определяющего скорость и количество усвоенного щитовидной железой йода.
Для правильного понимания этого процесса необходимо проведение углубленных научных исследований, в том числе с меченым органическим (связанным с белками) и неорганическим йодом.
В 40-50-е годы прошлого века за рубежом и в СССР были сделаны многочисленные попытки использования йодированных белков в медицине, фармацевтической и пищевой промышленности, а также сельском хозяйстве. Но, несмотря на полученные положительные результаты, этот подход не нашел дальнейшего практического применения по следующим основным причинам:
- Сильный разброс массового содержания органического йода, а также наличие в йодированных белках больших остаточных количеств неорганического йода (в форме йодидов и молекулярного йода) не позволяли обеспечить нормирование органического йода при обогащении продуктов питания.
- Использование химических методов йодирования белков приводило к их изменению и загрязнению продуктами реакции (в том числе хлорорганическими соединениями и молекулярным йодом), что вызывало многочисленные побочные эффекты при их применении.
- Отсутствие промышленного биотехнологического оборудования и процессов (ультра- и нанофильтрации, сублимации, хроматографии и т.д.) не позволяло обеспечить физико-химические свойства и чистоту получаемых йодированных белков, тем более в промышленных масштабах.
В начале этого века ряд отечественных предприятий приступил с производству йодированных белков («Тиреойод», «Йодказеин», «Биойод», «Йоддар»), которые начали все шире применяться для обогащения пищевых продуктов (молочные, мясные, кондитерские и хлебобулочные изделия). В связи с этим особенно актуальными становятся вопросы, насколько эти новые продукты отвечают требованиям понятия «органический йод».
«Биойод» представляет собой смесь полноценных белков сыворотки молока, содержащих 2,5% ковалентно-связанных с ними атомов йода. Йод встраивается в молекулу аминокислоты тирозина или гистидина и имеет положительную валентность (J+), в которой он проявляет свои биологические функции.
Йодированные белки получают по оригинальной запатентованной технологии с помощью ферментативного метода. Именно этим способом осуществляется йодирование во всех животных и растительных организмах.
Качество и безвредность обеспечивается очисткой готового продукта с помощью макро-, микро- и ультрафильтрацией. Это позволяет полностью избавить конечный продукт от несвязавшегося неорганического йода (J2 и J-).
Благодаря ковалентной связи йода с и белками, «Биойод» обладает высокой стабильностью при нагреве (до 300о С), устойчивостью к свету и нагреванию при длительном хранении, что исключает возможность отрицательного воздействия свободного йода на физико-химические показатели и органолептические характеристики готовой продукции.
Проведенные исследования структуры и подлинности ферментативно йодированных молочных сывороточных белков подтвердили наличие в их составе йодированных аминокислот, в частности, моно- и дийодтирозинов.
Дополнительные исследования одного из молочных белков, входящих в состав «Биойода» — лактоальбумина, имеющего исходную массу 14174 Dа с помощью MALDI-спектрометрии показали, что при йодировании происходит существенное изменение масс-спектра йодированного белка, при этом появляются сигналы, соответствующие белкам, содержащим 1, 2 и 3 атома йода в молекуле, с массой 14340, 14460 и 14593 Da соответственно (рис. 1).
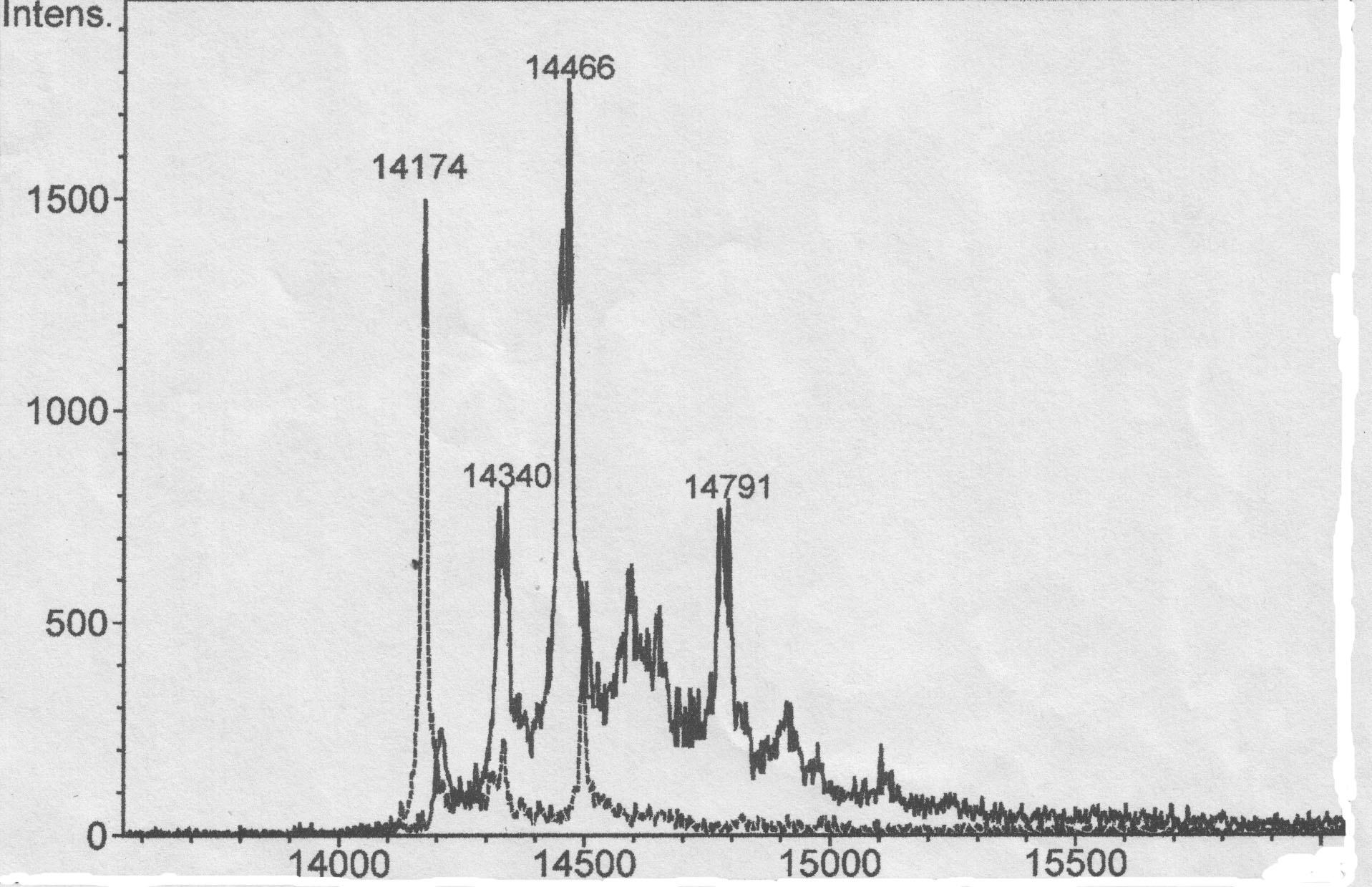 Рисунок 1 — MALDI масс-спектры фракций, полученных в результате обращено-фазной хроматографии йодированного (сплошная линия), и нейодированного (пунктир) белка.
Рисунок 1 — MALDI масс-спектры фракций, полученных в результате обращено-фазной хроматографии йодированного (сплошная линия), и нейодированного (пунктир) белка.
Предлагаемый биотехнологический способ йодирования белков обеспечивает:
- сохранение нативных свойств белков, содержащих стандартное содержание органически связанного йода (массовая доля 2,5 %);
- отсутствие неорганического йода (йодидов и молекулярного йода), а также потенциально токсичных веществ и реагентов в конечном продукте;
- получение в промышленных масштабах йодированных пищевых белков с чистотой белка свыше 90%.
В ходе эксперимента на мышах было показано, что «Биойод», содержащий [125I] подвергается в желудочно-кишечном тракте эффективному протеолизу. Тирозин, входящий в состав молочных сывороточных белков и содержащий [125I] в органической форме подвергается быстрому всасыванию и метаболизму, при этом большая часть метаболизированного йода выводится с мочой. Часть [125I] включается в щитовидную железу животных, а значительное количество [125I] пополняет пул йода в мышечной ткани, печени и почках.
Для изучения биологической эффективности усвоения йода из йодированных молочных сывороточных белков «Биойод» было проведено обследование добровольцев, детей и беременных женщин. Согласно эпидемиологическим критериям оценки степени тяжести йоддефицитных заболеваний ЙДЗ, предложенных ICCIDD, а также методическим указанием МУ 2.3.6.1064-01 Минздрава РФ. Обследование состояло из определения концентрации йода в разовой порции мочи. Определение уровня экскреции йода с мочой проводили в разовой утренней порции мочи арсенитно-цериевым методом.
С целью оценки эффективности и безвредности йодированных белков «Биойод» были проведены исследования на взрослых мужчинах-добровольцах, беременных женщинах и детях. Добровольцы принимали «Биойод», в котором содержалось 100 мкг органически связанного йода, в течение двух месяцев 2 раза в день (утром и вечером), женщины – по 50 мкг, а дети – по 25 мкг соответственно. Динамика изменений содержания йода в моче показана на рис.2. Полученные данные свидетельствуют об эффективности усвоения йода из «Биойода». В результате проведенных исследований было установлено, что длительное применение йодированных белков не вызывает токсических и аллергических реакций.
Увеличение медианы йодурии добровольцев через 2 месяца с 94 мкг/л до 308 мкг/л подтверждает включение компенсаторных механизмов организма, обеспечивающих выведение излишков йода с мочой.
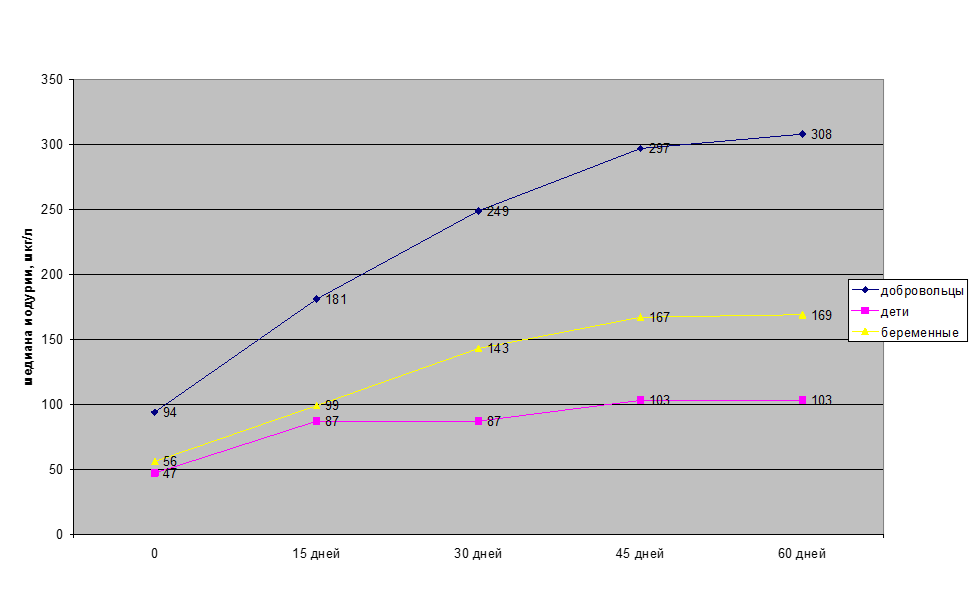
Рисунок 2 — Содержание йода в моче после потребления «Биойода» у различных групп населения
Масштабные клинико-нутрициологические исследования, проведенные в 2009 г. совместно со специалистами ГУ «Научный центр здоровья детей РАМН» и НИИ гигиены и охраны здоровья детей и подростков (г. Москва), показали положительное влияние применения «Биойода» в составе кондитерского батончика, содержащего 200 мкг органического йода в 100 г продукта, на физическое и умственное здоровье школьников.
Медиана йодурии у обследованных учащихся в динамике годового использования йодированного батончика в рационе (2-3 раза в неделю по 35-20 гр.) увеличилась с 63 до 126 мкг/л (в 2 раза).
Аналогичные положительные результаты были получены при добавления в рацион школьников Ставропольского края обогащенного «Биойодом» хлеба. По результатам этой апробации, а также испытаний, проведенной на детях ГУ «Научный центр здоровья детей РАМН», обогащенный хлеб рекомендован для использования в питании организованных детских коллективов.
В настоящее время кондитерские и хлебобулочные изделия, обогащенные «Биойодом», имеют рекомендации к применению у детей с трехлетнего возраста и поставляются в организованные дошкольные и школьные коллективы г. Москвы и других регионов страны.
Апробация «Биойода» с целью профилактики йодной недостаточности у детей и взрослых убедительно выявила следующие его преимущества, а именно:
- отсутствие побочных эффектов, позволяющее применять его в высоких дозах при тяжелых формах йоддефицита;
- высокую биологическую доступность органической формы йода и выраженный профилактический эффект;
- высокую технологичность, простоту введения йодированных белков в продукты на любом этапе технологического цикла их производства с полным сохранением основных физико-химических свойств.
Таким образом, предварительные исследования показали высокую эффективность и безвредность применения «Биойода» — полного аналога природного органического йода — для профилактики йоддефицита и нормализации обмена йода у детей и взрослых.
2. Собственные исследования
2.1 Материалы и методы исследований
В рамках исследований по данной тематике проведены научный и научно-производственный эксперимент в условиях вивария университета на курах-несушках и в условия ООО «Красная Горка» Колышлейского района Пензенской области на молочных коровах.
В рамках работы проводились совместные исследования с учеными Института биологии и иммунологии размножения при Болгарской Академии Наук, г. София, Болгария. Исследования по содержанию йода в молоке и пищевых яйцах проводились согласно договору о научном сотрудничестве с ООО НПФ «МОБИТЕК-М» г. Боровск, Калужской области.
Проведены две серии исследований на курах-несушках и молочных коровах (рис.3). Исследования осуществляли на фоне cбалaнcиpoванного кopмления по ocновным показателям в соответствии с нормами и рационами РАСХН (Ш.А. Имангулов, 2000; А.П. Калашников, В.И. Фисинин, В.В. Щеглова, Н.И. Клейменов, 2003).
В первой серии опытов были сформированы четыре группы кур-несушек в каждой по 50 голов, которых содержали на основном рационе (ОР). Птице I опытной группы с ОР скармливали неорганические формы селена в дозе 0,3 мг на 1 кг корма в виде селенита натрия и йод в дозе 0,5 мг на 1 кг корма в виде йодита калия, II опытной группе органические форы селена в виде селенопирана и молочного йодированного белка в дозах J 0,5 мг на 1 кг корма и Se 0,3 мг на 1 кг корма, III опытной группы – органические форы селена в виде селенопирана и молочного йодированного белка — J в дозах 0,7 мг на 1 кг корма и Se 0,9 мг на 1 кг корма.
Во второй серии были сформированы две группы молочных коров по 30 животных в каждой. Коров и контрольной, и опытной групп содержали на фоне ОР. Кроме того, молочным коровам опытной группы скармливали органические форы селена в виде селенопирана и молочного йодированного белка в дозах J 5 мг на1 голову в сутки и Se на 1,75 мг на1 голову в сутки.
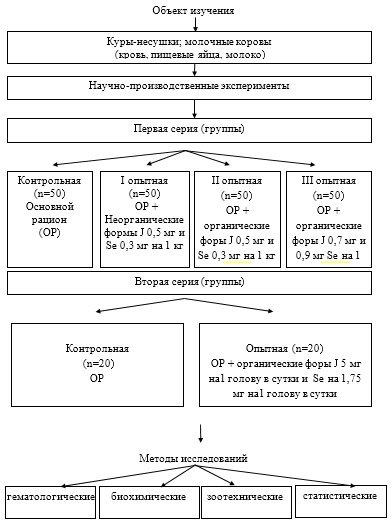
Рисунок 3 — Схема проведенных опытов
В ходе исследований определялись следующие показатели:
Биохимические – содержание селена в молозиве коров и в сыворотке крови телят; содержание общего белка, альбумина, мочевины, глюкозы,
Гематологические – лейкограмма; количество лейкоцитов в 1 л крови; количество эритроцитов в 1 л крови, количество тромбоцитов в 1 л крови содержание гемоглобина.
Зоотехнические – живая масса; абсолютный, относительный и среднесуточный приросты живой массы; температура; частота сердечных сокращений и дыхательных движений.
Лабораторные исследования проводились в межфакультетской биохимической лаборатории по описанными ниже методами.
Определение общего белка в сыворотке крови
Для определения общего белка использовали биуретовый метод, основанный на так называемой «цветной биуретовой реакции», в ходе которой белки реагируют в щелочной среде с сульфатом меди с образованием соединений, окрашенных в фиолетовый цвет, интенсивность окраски зависит от концентрации общего белка в плазме.
Для опытной пробы к 0,1 мл плазмы прибавляли 5 мл рабочего раствора биуретового реактива и смешивали, избегая образования пены. Для холостой пробы использовали дистиллированную воду, для калибровочной – раствор калибратора. Выдерживали при комнатной температуре (20-250С) 30 минут. Пробы фотометрировали против контрольной (холостой) пробы при длине волны 540 нм в кювете с толщиной поглощающего слоя 1 см не позже, чем через час после начала инкубации.
Концентрацию общего белка (С) рассчитывали в г/л по формуле 1:
![]() (1)
(1)
где Е пробы – экстинкция опытной пробы;
Е калибр. – экстинкция калибровочной пробы;
70 – концентрация белка в калибраторе в г/л.
Определение альбумина в сыворотке крови
Для определения концентрации альбумина использовали унифицированный колориметрический метод с бромкрезоловым зеленым. Принцип которого основан на том, что альбумин образует окрашенный комплекс с бромкрезоловым зеленым в слабокислой среде в присутствии детергента. Интенсивность окраски пропорциональна концентрации альбумина в пробе.
Для опытной пробы к 0,01 мл плазмы приливали 2 мл монореагента, для калибровочной пробы применяли раствор калибратора, для контрольной — дистиллированную воду. Пробы тщательно перемещивали и инкубировали 5 минут при комнатной температуре. Измеряли оптические плотности опытной и калибровочной проб против контрольной пробы при длине волны 628 нм (620-640 нм). Расчет концентрации (С) альбумина в пробе проводили по формуле 2:
![]() (2)
(2)
где Е пробы – оптическая плотность исследуемой пробы;
Е калибр. – оптическая плотность калибровочной пробы;
60 г/л – концентрация альбумина в калибраторе.
Определение мочевины в сыворотке крови
Для определения концентрации мочевины в плазме крови использовали уреазный/фенол-гипохлоритный метод по конечной точке. Мочевина поддействием фермента уреазы гидролизуется с образованием аммиака и углекислоты. Ионы аммония в щелочной среде в присутсвии нитропруссида раегируют с фено-гипохлоритным реагентом, образуя окрашенный комплекс синего цвета. Интенсивность окраски реакционной среды пропорциональна концентрации мочевины в пробе и измеряется фотометрически.
Для опытной пробы к 0,1 мл реактива 1 (стабилизирующий раствор уреазы) приливали 0,01 мл плазмы, для контрольной пробы использовали дистиллированную воду, колибровочной пробы — раствор калибратора. Реакционную смесь перемешивали и инкубировали не менее 5 минут при комнатной температуре. После окончания инкубации во все пробы вносили 1 мл реагента 2 (фенол/нитропрууидный реагент) и 1 мл реагента 3 (гипохлотит натрия), тщательно перемешиваои и инкубировали не менее 20 минут при температуре 370С. После окончания инкубации измеряли оптическую плотность опытной и калибровочных проб против контрольной пробы при длине волны 540 нм.
Расчет производили по формуле 3:
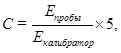 (3)
(3)
где С – концентрация мочевины, ммоль/л;
Епробы — оптическую плотность пробы;
Екалибратор — оптическую плотность калибратора;
5 ммоль/л – концентрация мочевины в калибраторе.
Определение общего холестерина в плазме крови
Для определения концентрации общего холестерина в плазме крови использовали энзиматический колориметрический метод.
Для опытной пробы к 0,02 мл плазмы добавляли 2 мл рабочего реагента, для контрольной пробы использовали дистиллированную воду, для калибровочной — калибратор. Реакционную смесь тщательно перемешивали и инкубировали не менее 15 минут при комнатной температуре. После окончания инкубации измеряли оптическую плотность опытной и калибровочной проб против контрольной пробы при длине волны 500 нм.
Расчет концентрации холестерина (С, моль/л) проводили по формуле:
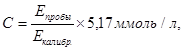
где Е пробы – оптическая плотность исследуемой пробы;
Е калибр. – оптическая плотность калибровочной пробы;
5,17 ммоль/л – концентрация холестерина в калибраторе.
Определение липопротеидов высокой плотности в плазме крови
Для опытной пробы к 0,15 мл плазме добавляли 0,3 мл осаждающего реагента, для холостой пробы использовали дистиллированную воду, для калибровочной пробы применяли раствор холестерина. Хорошо перемешивали и оставляли на 10 минут при комнатной температуре. Опытные пробы центрифугировали в течение 10 минут. Прозрачный супернатант использовали для определения концентрации ЛПВП. Для этого в опытной пробе использовалит 0,2 мл супернатанта и 2,0 мл рабочего реагента для определения холестерина. Реакционную смесь тщательно перемешивали и инкубировали не менее 10 минут при комнатной температуре (20-250С) и измеряли оптическую плотность опытной и калибровочной проб против контрольной пробы при длине волны 500 нм. Расчет концентрации (С) ЛПВП проводили по формуле:
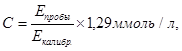 (5)
(5)
где Еоп и Ест – экстинкции опытной и калибровочной проб, измеренные относительно контрольной пробы;
1,29 – концентрация холестерина ЛПВП в калибраторе.
Определение концентрации глюкозы в сыворотке крови
Для определения содержания глюкозы в сыворотке крови использования набор реагентов «Фотоглюкоза» для количественного определения содержания глюкозы в крови и моче глюкоозооксидазным методом.
Принцип метода заключается в том, что Глюкозоксидаза окисляет D-глюкозу до глюкуроновой кислоты с образованием перекиси водорода; последняя под действием пероксидазы реагирует с 4-аминоантипирином и фенолом с образованием окрашенного продукта, интенсивность окраски которого пропорциональна концентрации глюкозы в анализируемом образце и измеряется фотометрически.
Определение концентрации глюкозы в сыворотке крови
Для определения концентрации глюкозы в сыворотке крови использовали энзиматический колориметрический метод без депротеинизации.
Принцип метода заключается в том, что β-D-глюкоза под действием фермента глюкозооксидазы окисляется с образованием эквимолярного количества перекиси водорода. Образующаяся перекись водорода при участии фермента пероксидазы способствует окислительному азосочетанию 4-аминоантипирина и фенола с образованием окрашенного соединения (хинониминовый краситель). Интенсивность окраски реакционной среды пропорциональна содержанию глюкозы в исследуемом материале и определяется фотометричски при длине волны 500 нм.
Определение концентрации железа в сыворотке крови
Для определения концентрации железа в сыворотке использовали набор реагентов для определения концентрации железа в сыворотке и плазме крови колориметрическим методом без депротеинизации «Железо ОльвексДиагностикум».
Принцип метода состоит в том, что в кислой среде под действием детергента белковые комплексы, связывающие железо, дислоцируют, и железо восстанавливается до Fe++. Ион двухвалентного железа связывается с хромогеном, образуя окрашенный комплекс, концентрация которого пропорциональна концентрации железа в образце и измеряется фотометрически. Комплексы хромогена с ионами цинка и меди маскируются, образуя не окрашиваемые комплексы с хелатором, что обеспечивает более точное определение концентрации железа, свободное от интерференций.
Определение концентрации кальция в сыворотке крови
Для определения содержания кальция в сыворотке крови использовали набор реагентов для определения концентрации кальция в сыворотке и плазме крови унифицированным колориметрическим методом с о-крезолфталеин комплексом «Кальций ОльвексДиагностикум»
Принцип метода заключается в том, что кальций в щелочной среде образует окрашенный комплекс с о-крезолфталеин комплексом. Интенсивность окраски пропорциональна концентрации кальция в пробе измеряется фотометрически.
Определение концентрации неорганического фосфора в сыворотке крови. Для определения концентрации неорганического фосфора в сыворотке крови использовали набор реагентов для определения неорганического фосфора в сыворотке и плазме крови спектрофотометрическим (UV) методом «Фосфор неорганический ОльвексДиагностикум».
Метод основан на способности фосфат-ионов образовывать в кислой среде с молибдатом аммония в присутствии детергента фосфорномолибденовый комплекс, оптическая плотность которого при длине волны 340 нм пропорциональна концентрации неорганического фосфора в исследуемом образце.
Определение концентрации аланинаминотрансферазы.
Для определения активности фермента аланинаминотрансферазы (АлАт) в сыворотке крови использовали набор реагентов для определения каталитической концентрации аминотрансферазыАлАт в сыворотке крови «Аминотрансфераза ALT 360 БИО-ТЕСТ».
Принцип метода состоит в том, что аланин-аминотрансферазакаталиризует реакцию между L-аланином и 2-оксоглутаратом, в результате которой они превращаются в L-глутамат и соль пировиноградной кислоты. Определение основано на измерении оптической плотности гидразонов 2-оксоглутаровой и пировиноградной кислот в щелочной среде. Гидразон пировиноградной кислоты обладает более высокой оптической плотностью.
Определение концентрации аспартатаминотрансферазы.
Для определения концентрации аспартатаминотрансферазы (АсАТ) в сыворотке крови использовали набор реагентов для определения каталитической концентрации аминотрансферазыАсАт в сыворотке крови «АминотрансферазаACT 360 БИО-ТЕСТ».
Принцип метода заключается в том, что аспартат-аминотрансфераза катализирует реакцию между L-аспартатом и 2-оксоглутаратом, в результате которой они превращаются в L-глутамат и оксалацетат. Определение основано на измерении оптической плотности гидразонов 2-оксоглутаровой и пировиноградной кислот в щелочной среде. Гидразон пировиноградной кислоты, возникающий при самопроизвольном декарбоксилированииоксалацетата, обладает более высокой оптической плотностью.
Определение содержания селена
Содержание селена в сыворотке крови определялось флюориметрическим методом в модификации Тутельяна В.А., Хотимченко С.А., Голубкиной Н.А. с использованием флюориметра «Флюорат-02-2М». Сущность метода заключается в мокром сжигании образца смесью азотной и хлорной кислот. В последующем восстанавливали шестивалентный селен до четырехвалентного внесением концентрированной соляной кислоты с образованием комплекса селенистой кислоты с 2,3-диаминонафталином – пиазоселенола, величена флюоресценции которого пропорциональна содержанию селена в пробе. По данной методике нижний предел определения микроэлемента селена – 0,08 мкг/дм3.
При определении концентрации селена важное значение имеет подготовка пробы. Для мокрого сжигания в специальные пробирки вносили по 0,5 мл сыворотки крови. Калибровочную кривую строили по стандартному раствору селенита натрия. Проверку проводили с помощью образцов сравнения с известным содержанием селена (лиофилизированные мышечные волокна, сухое молоко).
Минерализация проб осуществлялась в блоке сжигания при следующем температурном режиме: 120 оС – 1 час, 150 оС – 1 час, 180-185 оС – 1,5 часа. Для удаления следов азотной кислоты блок сжигания охлаждали до 150 оС, вносили в пробы 1-2 капли перекиси водорода и выдерживали при указанной температуре 10 минут. Чтобы восстановить шестивалентный селен до четырехвалентного к пробам приливали по 1 мл 6 молярного раствора соляной кислоты и выдерживали при 110 оС 10 минут, после чего вносили в пробы по 1 мл дистиллированной воды. Конденсация селенистой кислоты с 2,3-диаминонафталином производилась путем добавления к каждой пробе 1 мл раствора (рН которого предварительно доводилась до 1,0-1,5). Пробы выдерживали 30 минут при 50 оС и затем подвергали экстракции гексаном в течение 50-60 секунд. Величину флюоресценции определяли при длине возбуждения 376 нм и длине эмиссии 519 нм на флюориметре «Флюорат-02-2М».
Определение йода.
Содержание общего йода в корме, в желтке и белке яйца – методом масс-спектрометрии с индуктивно связанной плазмой (МС-ПСП), атомно-эмиссионная спектрометрия с индуктивно связанной плазмой (АЭС-ИСП). Содержание общего йода в белке и желтке (при определении йодтирозинов) — инверсионно-вольтамперометрическим методом по МУК 4.1.1187-03 [15]. Содержание моно- и дийодтирозинов в желтке и белке – методом высокоэффективной жидкостной хроматографии с масс-спекторометрическим детектором по ГОСТ 33422-2015.
Гематологические исследования проводили с помощью автоматического гематологического ветеринарного анализатора BC-2800Vet, который является количественным счётчиком форменных элементов крови с дифференциацией лейкоцитов для диагностического использования в ветеринарных лабораториях.
Принципы измерения WBC (лейкоцитов). Лейкоциты считаются и измеряются по методу Coulter. Этот метод основывается на измерении изменений электрического сопротивления, возникающего при прохождении клетки крови через апертуру известных размеров. Электроды погружены в жидкость с 2х сторон апертуры, чтобы создать электрический путь. Когда каждая частица (клетка) проходит через апертуру, возникает мимолётное электрическое сопротивление между электродами. Это изменение производит измеряемый электрический импульс.
Рисунок 4 – Проведение гематологических исследований
Количество образовавшихся сигналов является количеством частиц, которые прошли через апертуру. Амплитуда каждого импульса пропорциональна объёму каждой частицы. Каждый импульс усиливается и сравнивается во внутренних электронных схемах, которые принимают импульсы только определённой амплитуды. Если образованный импульс выше порога WBC, он считается как WBC(лейкоцит).
Измерение HGB (гемоглобина). Гемоглобин определяется колориметрическим методом. Разбавленный WBC/HGB раствор доставляется в кювету WBC, где перемешивается с некоторым количеством литика, который превращает гемоглобин в гемоглобиновый комплекс, который измеряется на длине волны 525нм. Источник света находится на одной стороне кюветы и выделяет луч монохроматического света, чья центральная волна 525нм; и затем измеряется с помощью фотосенсора на противоположенной стороне. Сигнал затем усиливается и напряжение измеряется и сравнивается с референсным считыванием бланка (считывание только когда 35 в кювете дилюент). Гемоглобин рассчитывается с помощью уравнения и выражается в г/Л. HGB(г/Л) = Constant×Log 10 (фототок бланка/фототок образца)
Принципы измерения RBC (эритроцитов). Эритроциты считаются и измеряются по методу Coulter. Этот метод основывается на измерении изменений электрического сопротивления, возникающего при прохождении клетки крови через апертуру известных размеров. Электроды погружены в жидкость с 2х сторон апертуры, чтобы создать электрический путь. Когда каждая частица (клетка) проходит через апертуру, возникает мимолётное электрическое сопротивление между электродами. Это изменение производит измеряемый электрический импульс. Количество образовавшихся сигналов является количеством частиц, которые прошли через апертуру. Амплитуда каждого импульса пропорциональна объёму каждой частицы. Каждый импульс усиливается и сравнивается во внутренних электронных схемах, которые принимают импульсы только определённой амплитуды. Если образованный импульс выше порога RBC, он считается как RBC.
Эритроциты RBC (1012/Л) является числом эритроцитов, измеренных напрямую из эритроцитов, проходящих через апертуру.
Тромбоциты PLT (109 /Л) меряется напрямую из тромбоцитов, проходящих через апертуру.
Статистическая обработка. Полученные экспериментальные данные обрабатывали на персональном компьютере с использованием программы Microsoft Office Excel. Проводили вычисление cpеднeго знaчeния, стaндаpтнoгo (cpеднeквадpатичного) oтклoнeния и стaндapтной ошибки среднего. Значимость различий между двумя средними оцeнивaлaсь по критерию Стьюдента (t). Выборочные параметры, приводимые далее в таблицах, имеют следующие обозначения: М – среднее, m – ошибка среднего, n – объем анализируемой подгруппы, р – достигнутый уровень значимости.
2.2 Результаты научных исследований на молочных коровах
Принимая во внимание значительное влияние факторов среды таких, как кормление, температурно-влажностные параметры окружающей среды и физиологическое состояние организма коров на потребность и метаболизм йода и селена была изучена дозировка его ввода в рацион кормления коров. В течение зимне-весеннего периода содержание ковалентно связанного йода в составе молочного йодированного белка в рационе кормления повышали с 118 мкг/г до 192 мкг/г, что обеспечило поступление его в составе рациона в зимне-весенний период в количестве 2,95 мг/гол/сут., в летний период 3,00 — 6,00 мг/гол/сут. и в осенне-зимний период – 16.5-19,2 мг/гол/сут. Содержание селена в составе селенопирана в рационе кормления повышали с 3,2 мкг/г до 12,5 мкг/г, что обеспечило поступление его в составе рациона в зимне-весенний период в количестве 0,312 мг/гол/сут., в летний период 0,312-0,625мг/гол/сут. и в осенне-зимний период – 1,25 мг/гол/сут. (Табл. 1).
Таблица 1 — Включение органических форм йода и селена в рацион опытной группы коров
| Периоды опыта | Показатели: | ||||
| Масса КД**, г/гол/сут. | Содержание йода в КД**, мкг/г | Содержание селена в КД**, мкг/г | Содержание йода в суточной порции КД**, мг. на голову | Содержание селена в суточной порции КД**, мг. на голову | |
| Январь — май | 25 | 117±12 | 3,2 | 2,95 | 0,312 |
| Июнь-июль | 25 | 119±12 | 3,5 | 3,00 | 0,312 |
| Август | 50 | 121±12 | 6,0 | 6,00 | 0,625 |
| Сентябрь | 100 | 163±16 | 12,0 | 16,5 | 1,25 |
| Октябрь | 100 | 191±19 | 13,0 | 19,2 | 1,25 |
| Ноябрь-декабрь | 100 | 155±15 | 12,5 | 15,4 | 1,25 |
**КД – кормовая добавка
Включение в рацион питания коров ковалентно связанного йода и органического селена в течение зимне-весенне- летнего и осенне-зимнего периодов повысило его содержание в крови на 16,6 – 66,7% (Р <0,001) по отношению к контрольной группе. (Табл.2).
Таблица 2 — Содержание йода в крови коров по периодам опыта. (М±m)
| Периоды отбора образцов, мес.года. | Содержание йода, мкг/л | Отношение опытной к контрольной | ||
| Группы коров | ||||
| Контрольная | Опытная | ± | % | |
| Февраль | 222,0±2,5 | 261,0±3,9* | +37 | 116,5 |
| Март | 103,0±1,1 | 133,0±1,9* | +34 | 132,7 |
| Август | 53,5±2,09 | 78,3±4,1* | +22,8 | 141,8 |
| Октябрь | 53,1±1,62 | 93,2±3,2* | +36,1 | 166,7 |
| Декабрь | 55,5±2,10 | 68,8±4,1* | +15,3 | 128,1 |
| В среднем | 98,0 | 127,0 | +29 | 129,6 |
*Р<0,001
Повышение содержания йода в крови повлияло на его содержание в молоке. Так в начале эксперимента содержание йода в молоке коров составляло 180 мкг на литр молока, а в осенне-зимнее время количество йода в молоке увеличилось до 400 мкг в литре. Наблюдается прямая зависимость содержания йода в сыворотке крови и молоке.
Йод влияет на органы и ткани непосредственно и как составная часть гомонов щитовидной железы – тироксина и трийодтиронина, без которых невозможно нормальное функционирование организма. Эти гормоны контролируют функционирование всех систем, рост и дифференцировку тканей, поглощение кислорода, состояние центральной и периферической нервной системы, влияют на скорость метаболизма, теплообразование, жировой, углеводный и белковый обмен, обмен витаминов, воды и электролитов.
Лактирующие коровы имеют большую потребность в йоде, чем нелактирующие, так как около 10 % потребленного йода выделяется с молоком и может возрастать при повышении продуктивности. Некоторые компоненты (белковые добавки) рациона могут снижать доступность йода из кормов и являться зобогеным фактором.
Недостаток йода у крупного рогатого скота проявляется гипофункцией щитовидной железы. Длительная нехватка йода приводит к снижению молочной продуктивности и рождению телят с зобом. Недостаточность йода проявляется в снижении его концентрации в молоке и плазме крови (10-20 мкг/л в молоке и меньше 40 мкг/л в плазме крови). Если в средней пробе молока, полученного от стада коров, меньше 20 мг/л, то в рационе возможен дефицит йода. Необходимо указать, что при избыточном употреблении йода в составе неорганических форм, таких как йодид калия или йодат кальция, для профилактики йоддефицитных состояний у животных не дали серьезных практических результатов. Следовательно, использование неорганических форм йода, или на фоне их органических клатратов, которые по существу не отличаются от первых, не привело к снижению заболеваемости у коров и к их продолжительному периоду лактации.
Таблица 3- Содержание селена в крови коров по периодам опыта. (М±m)
| Периоды отбора образцов, мес.года. | Содержание йода, мкг/л | Отношение опытной к контрольной | ||
| Группы коров | ||||
| Контрольная | Опытная | ± | % | |
| Февраль | 60,8 | 69,9 | +9,1 | 114,9 |
| Март | 65,6 | 72,4 | +6,8 | 110,4 |
| Август | 82,0 | 91,2 | +9,2 | 111,2 |
| Октябрь | 86,0 | 90,6 | +4,6 | 105,3 |
| Декабрь | 75,6 | 90,4 | +14,8 | 119,5 |
| В среднем | 74,0 | 82,9 | +8,9 | 112,0 |
Результаты исследований по содержанию селена в сыворотке крови коров указывают на существование слабого дефицита микроэлемента в организме животных. Снижение селена в сыворотке крови наблюдается в зимне-весенние месяцы. Применение в кормлении коров кормовой добавки на основе органических форм йода и селена позволило увеличить содержание селена в сыворотке крови на 5,3-19,5%. Особенно существенна разница в зимний период, когда содержание микроэлемента в кормах значительно меньше по сравнению с летним периодом. Как следствие этого наблюдается повышение микроэлемента селена в молоке. Если у коров в рационе которых отсутствовали добавки (отрицательный контроль) среднее содержание селена составляла 20 мкг/л, то в группе где применяли испытуемую кормовую добавку количество селена возросла до 53 мкг/л.
Таким образом, использование новой кормовой добавки для коров на основе органических форм йода и селена способствует повышению функциональных качеств молока. Поэтому испытуемую добавку можно рекомендовать как источник для обогащения молока и молочных продуктов через организм животного.
В рамках данных исследований было изучено влияние ковалентно связанной формы йода и селена на состояние фосфорно-кальциевого обмена у коров по показателям титрования молока СаСl2 Тº (А.А.Кабышев,)
Роль кальция в организме неизмеримо велика. Ионы Са2+ являются кофакторами многих ферментов, вместе с белами-модуляторами служат посредником в передаче сигналов. Кальций участвует в секреции, оплодотворении, мембранной проницаемости, мышечном сокращении. Множество интрацеллюлярных процессов, от митоза и рождения клеток, до апоптоза и их гибели регулируются кальцием при участии специфически распознающих его белков (кальмодулина, кальэлектринов, кальпаинов и т.д.) От кальция зависит генерация потенциалов действия и электромеханическое сопряжение, передача гормонального сигнала и клеточной локомоции (передвижения). Кальций регулирует и скорость жизненно важных внеклеточных процессов – например, свертывание крови. Будучи важным регулятором, ион кальция, в то же время ядовит для клеток, и значительное повышение его внутриклеточной концентрации запускает механизмы клеточной гибели, участвуя в некробиозе и апоптозе. Внутри клеток концентрация кальция в 10000 – 100000 раз меньше, нежели снаружи. Поэтому, уровень кальция вне и внутри клеток подлежит контролю, а при попадании в цитозоль кальций эффективно секвестируется (удаляется) митохондриями, эндоплазматичеким ретикулумом.
В ходе исследования был выявлен кумулятивный эффект применения ковлентно связанного йода и селена при обмене фосфатов. Метаболизм кальция в организме тесно связан с обменом фосфатов, связывающих большую часть внеклеточного кальция в виде кристаллов гидросиапатита (Са10(РО4)6(ОН)2), в композитных минерализованных структурах – костях. В организме 98% кальция и 85% фосфора связано в костях и зубах.
Именно роль фосфата, как ключевого участника энергетического метаболизма, главного внутриклеточного аниона, концентрация которого в клетках в 100 раз превышает наружные, предопределила биологический выбор кальция на роль убиквитарного (повсеместного) регулятора. Во внеклеточных жидкостях фосфат находится в форме фосфолипидов (около 70%) и неорганического фосфата. В плазме крови фосфаты представлены в виде свободных ионов (80%) либо связаны с белками. Одной из основных функций неорганического фосфора в организме является буферная функция. Фосфат может связывать свободный ионизированный кальций; поэтому, если уровень плазменного неорганического фосфата увеличивается, то содержание кальция уменьшается. Концентрация ионов кальция в межклеточной жидкости и крови равна 9-11 мг/дл. Половина из них — ионы кальция в растворенном состоянии, другая половина — в соединении с альбумином. Во внутриклеточной жидкости концентрация кальция в тысячи раз меньше. Разность концентрации создается главным образом Са-АТФазой при участии системы ионных каналов. Регуляция Са2+ в крови и межклеточной жидкости регулируется эндокринными гормонами, именно на которых и повлияло постоянное использование ковалентно связанного йода, в основном паратгормоном, кальцитонином и кальцитриолом.
Близкая физико-химическая аналогия катионов Са2+ и Мg2+ привела к тесному переплетению их метаболизма. Магний — важный кофактор некоторых аденилатциклаз, фосфатаз и фосфорилаз. Участник трансфосфорилирования, что связывает его судьбу в организме и с фосфором. Большая часть магния (60%) тоже депонируется в скелете.
В плазме 40% кальция связано с белками, в основном с альбумином (связанная форма кальция), 15% — с кислыми органическими анионами (комплексная форма кальция), а остальной кальций находится в свободной форме.
Количество общего кальция в плазме понижается при гипоальбуминемиии, но это не оказывает влияние на содержание катиона кальция. Содержание ионизированного кальция в плазме находится в обратной зависимости от рН и от концентрации фосфат–аниона: гиперфосфатемия и алкалоз способствуют появлению признаков гипокальциемии, хотя уровень общего кальция при этом не меняется. Ацидоз и гипофосфатемия, наоборот, повышают содержание ионизированного кальция в плазме.
Фосфор в отличие от кальция, абсорбируется в ЖКТ, напротив, очень активно. В дополнении к 5% фосфора, депонированным в костях и зубах, мягкие ткани содержат существенную часть связанного фосфора и фосфат-аниона (до14 %). Всего 1% фосфора находится во внеклеточной жидкости. Макроэргические фосфатные соединения и фосфорилированные активные метаболиты в нормальных условиях не могут свободно покидать клетки. Поэтому, только 12% фосфатов плазмы связаны с белками, остальные представлены свободными фосфат-анионами. Уровень фосфора в плазме зависит от факторов, регулирующих обмен кальция. Кроме этого, обмен фосфора определяется ходом энергетического метаболизма в клетках. В.С. Ильин считает, что «говорить надо не о фосфорном, а об «углеводно-фосфорном обмене», имея в виду исключительную зависимость судьбы фосфата от катаболизма углеводов.» При активации синтеза гликогена фосфаты переходят внутрь клеток. Поэтому, глюкоза, инсулин, сахаристая пища – вызывают гипофосфатемию из-за перемещения фосфат-анионов в клетки. Алкалоз, особенно, дыхательный, также провоцирует гипофосфатемию, как полагают М.М. Горн с соавтотами (1999) в силу активации клеточного гликолиза образования фосфорсодержащих метаболитов глюкозы. Дыхательный ацидоз, после торможения гликолиза за счёт накопления молочной кислоты, наоборот приводит к выходу фосфата из клетки и гиперфосфатемии. В силу этих некальциевых факторов, влияющих на уровень фосфора в плазме, концентрация фосфатов имеет четкий суточный ритм, тогда как у ионизированного кальция такой периодизм отсутствует.
Использование ковалентно связанного йода и селена в составе кормовой добавки благоприятно повлияло и на обменные процесс по магнию. Магний — преимущественно, внутриклеточный катион, четвертый по абсолютному содержанию в организме. Во внутриклеточной жидкости его концентрация в 8 раз выше, чем вне клетки. Магний всасывается в тонком кишечнике, при участии, витамина D примерно на 40% от его поступления с пищей. Избыток фитиновой кислоты и жирных кислот отрицательно влияют на его абсорбцию. Высокие концентрации магния в кишечном содержимом мешают всасыванию кальция, но не наоборот. Магний экскретируется почками, причем эффективность его реабсорбции может достигать 95%. Почки варьируют экскрецию магния в равновесном объёме, по отношению к его поступлению.
В связи с разной физиологической потребностью коров в период репродуктивного цикла и лактации соотношение кальция, фосфора и магния в рационе меняется. Так, в период за три недели до отёла рекомендуется снижать содержание кальция в рационе, а его соотношение к фосфору должно составлять не более 0,8-1. В этот период важно обеспечить достаточный уровень магния в рационе. Использование ковалентно связанного йода скорректировало данный метаболизм на клеточном, биохимическом уровне, где непосредственно йод выступил катализатором обменных процессов.
При достаточном наличии кальция в организме происходит резкое снижение его содержания в крови. Чаще всего это вызвано излишним содержанием кальция в рационе сухостойных коров, что приводит к нарушению его регуляции паращитовидной железой, которая регулирует накопление и выделение кальция из костяка. Выделенный с молоком кальций восполняется в недостаточном количестве, т.к. после отёла паращитовидная железа не в состоянии быстро восполнить свою функцию.
Классическим методом профилактики послеродового пареза является «тренировка» паращитовидной железы во время сухостойного периода. Цель «тренировки» — повышение уровня паратгормонов для быстрой мобилизации кальция из костяка скелета сразу после отёла. Для этого ограничивают обеспеченность рациона кальцием. Дефицит магния не способствует образованию паратгормонов, участвующих в процессе мобилизации кальция из костяка после отёла, поэтому оптимальное соотношение Ca:P:Mg = 0,6:1:1.
Включение в рацион коров йода и селена оказало положительное влияние на число случаев нарушения фосфорно-кальциевого обмена и степень тяжести его проявления, которое определяли путем титрования свежевыдоенного молока CaCl2 по Кабышеву А.А. Выяснилось, что у коров контрольной группы с признаками нарушения и средней тяжести по периодам опыта наблюдалось у 10 — 66,6%, а высокой степени тяжести — у 10-20% поголовья. У коров опытной группы эти показатели были ниже и составили соответственно – 10-50% и 0 -14,2%. (Табл.4,5).
Изучение содержания мочевины в молоке, в качестве показателя состояния энерго-протеинового отношения в рационе коров, в течение зимне-весенне-летнего периода показало, что оно в зимне-весенний период было в норме и не различалось между группами коров. В летне-пастбищный период наблюдалось значительное ее повышение, которое было выше критического
Таблица 4 — Анализ данных титрования свежевыдоенного молока CaCl2 по А А Кабышеву*.
| Периоды отбора образцов, мес. | Группы коров, значение показателя в Тº | Опыт к контролю | ||||
| Контрольная | Опытная | |||||
| М±m | lim | M±m | lim | ± | % | |
| Февраль | 1,01± | 0,8-1,2 | 0,93± | 0,7-1,1 | -0,08 | 92,0 |
| Март | 0,85± | 0,7-1,1 | 0,93± | 0,8-1,2 | +0,08 | 100,4 |
| Апрель | 1,05± | 0,8-1,2 | 1,01± | 0,4-1,3 | -0,04 | 96,2 |
| Май | 0,98± | 0,8-1,1 | 0,96± | 0,9-1,2 | -0,02 | 97,9 |
| Июнь | 0,95± | 0,7-1,2 | 0,96± | 0,9-1,1 | +0,01 | 101,0 |
| Август | 0,84± | 0,5-1,1 | 0,96± | 0,8-1,1 | +0,12 | 114,0, |
| Октябрь | 0,93± | 0.8-1,0 | 1,0± | 0,9-1,1 | +0,07 | 107,5 |
| Декабрь | 1,0± | 0,9-1,0 | 0,91± | 0,6-1,1 | -0.09 | 91,0 |
| В среднем | 0,95 | 0,75-1,11 | 0,95 | 0,75-1,15 | 0,00 | 100 |
*Значение показателей — это разница между результатами титрования молока с и без СаСl2, Tº.
Таблица 5 — Распределение коров по степени тяжести нарушения фосфорно-кальциевого обмена, %
| Показатели | Значение | Месяц отбора образцов молока (2017 г.) | |||||||
| ,Тº | II | III | IV | V | VI | VIII | X | XII | |
| Контрольная группа | |||||||||
| Норма | 0,8-0,9 | 40 | 60 | 20 | 40 | 33,3 | 20 | 55,5 | 16,7 |
| Признаки нарушения | 0,7; 1,0 | 10 | 30 | 10 | 30 | 33,3 | 50 | 44,5 | 66,6 |
| Средней тяжести | 0,6; 1,1 | 40 | 10 | 50 | 30 | 33,3 | 20 | — | 16,6 |
| Высокой степени | <0,6; >1,1 | 10 | — | 20 | — | — | 10 | — | — |
| Опытная группа | |||||||||
| Норма | 0,8-0,9 | 50 | 70 | 20 | 60,6 | 62,5 | 37,5 | 33,3 | 42,8 |
| Признаки нарушения | 0,7; 1,0 | 30 | 10 | 20 | 10,1 | 25,0 | 50 | 33,3 | 28,5 |
| Средней тяжести | 0,6; 1,1 | 20 | 10 | 30 | 10,1 | 12,5 | 12,5 | 33,3 | 14,2 |
| Высокой степени | <0,6; >1,1 | — | 10 | 10 | 10,1 | — | — | — | 14,2 |
Уровня -35 мг%, что связано с повышенным поступлением протеина с пастбищной молодой травой без дополнительной энергокомпенсацией. Включение в рацион ковалентно связанного йода в этот период позволило снизить содержание мочевины в молоке. Однако в последующие месяцы (август — декабрь) у коров, получавших КСЙ, содержание ее в молоке превышало таковой у контрольных, что может быть связано как с действием жаркой погоды в этот период, так и нормализующим действием гормонов щитовидной железы на энергетический обмен (Табл.6). Это демонстрирует природный механизм циркуляции связанных форм йода, при котором количество поступающего связанного йода не является токсичным и не влияет негативно на основные процессы в общей эндокринной системе коров.
Таблица 6 — Содержание мочевины в молоке коров по месяцам года
| Период отбора образцов | Группы коров | Отношение опытной к контрольной группе | ||
| Контрольная | Опытная | ± | % | |
| Февраль | 24,9±1,38 | 24,2±1,14 | ¬0,7 | 97,2 |
| Март | 20,6±0,63 | 20,9±1,57 | +0,3 | 101,5 |
| Май | 25,3±1,29 | 25,4±1,52 | +0,1 | 100,4 |
| Июнь | 43,2±2,20 | 38,9±2,11 | ¬4,3 | 90,0 |
| Август | 39,0±2,22 | 45,4±2,01 | +6,4 | 116,4 |
| Октябрь | 27,77±1,27 | 28,82±1,55 | +1,05 | 103,7 |
| Декабрь | 19,15±1,78 | 19,41±0,45 | +0,26 | 101,3 |
| В среднем : | 28,56±1,53 | 29,00±1,47 | +0,44 | 101,5 |
*Значения содержания мочевины в молоке. При содержании белка в молоке <3,20%
Содержание мочевины <,15,0 указывает на недостаток энергии и протеина в рационе; возможные последствия нагрузка на печень, скрытая течка, медленная ацетонемия, кисты, желтое тело, проблемы с копытами, снижение продуктивности;- при содержании мочевины 20 – 30 – кормление в порядке; — при > 35 мг/% –недостаток энергии, слишком много белка; последствия — кисты, понос, заболевания копыт.
Изучение межсуточного обмена веществ (белковый, азотистый, углеводный, липидный и минеральный) у коров в опыте проводили по скрининговым биохимическим показателям сыворотки крови.
Показатели белкового обмена у коров обеих групп в течение всего периода наблюдения были близкими и равнялись в среднем по содержанию общего белка, альбумина и глобулина, а также по их соотношению, соответственно у коров контрольной группы 88,2 г/л, 26,8 г/л, 61,3 г/л и 0,43, а у коров опытной группы 89,8, 26,9, 62,9 и 0,43. Однако по сезонам года у коров между группами имелись различия. Так, у коров опытной группы наблюдалось более высокое содержание в сыворотке крови общего белка в феврале, апреле, августе и декабре, которое составило 90,8-96,8 г/л., что было выше физиологической нормы, равной 72,0-86,0 г/л. Это повышение произошло за счет увеличения в сыворотке крови глобулиновой фракции, которая была равна 63,9 – 69,4 г/л. У коров контрольной группы повышение содержания общего белка и глобулинов в сыворотке крови отмечалось только в августе и декабре, которое было равно 91,3-99,3 г/л и 64,2-72,7г/л, соответственно, что указывает на не благоприятное действие как факторов кормления, так и климатических. По содержанию альбумина в сыворотке крови коров между группами по периодам исследования наблюдались различия. У коров контрольной группы его содержание в сыворотке крови было одинаковым на протяжении зимне-весенне-летнего периода и равнялось 27,0-27,5 г/л, что укладывалось в физиологическую норму -27-43 г/л.,а в последующий осенне-зимний период его содержание снизилось и составило 25,3 и 26,8 г/л. в то время , как у коров опытной группы в зимне-весенний период содержание его было ниже физиологической нормы и нормализовалось в летний период достигнув 29,0 г/л что превысило его содержание у коров контрольной группы в этот период наблюдения. Оно также было выше и в декабре. Эти данные могут указывать на повышение анаболических процессов в эти периоды года. В содержании мочевины в сыворотке крови у коров обеих групп наблюдалось повышение от зимнего сезона к летнему при более низком ее содержании у коров опытной группы, что может свидетельствовать о лучшем использовании азотистых веществ корма и синтетической способности печени, связанной с влиянием связанного йода (Табл.7).
Таблица 7- Белковый и азотистый обмен у первотелок
| Периоды отбора проб | Показатели (М±m) | |||||
| Общий белок, г/л | Альбумин, . г/л | Глобулин, г/л | А/Г | Мочевина,
ммоль/л |
Креатинин,
ммоль/л |
|
| Контрольная группа | ||||||
| Февраль | 84,2±2,07 | 27,0±0,92 | 57,2±2,85 | 0,47 | 5,78±0,43 | 81,8±4,46 |
| Апрель | 84,0±1,92 | 27,5±1,27 | 56,4±2,75 | 0,48 | 5,77±0,32 | 76,9±5,14 |
| Июнь | 85,5±1,45 | 27,5±1,08 | 57,9±2,34 | 0,47 | 7,79±0,76 | 78,0±4,89 |
| Август | 91,3±2,22 | 27,1±0,72 | 64,2±2,52 | 0,42 | 7,82±0,43 | 72,6±3,77 |
| Октябрь | 85,0±2,48 | 25,3±0,42 | 59,6±2,88 | 0,42 | 3,75±0,54 | 82,2±3,19 |
| Декабрь | 99,6±3,32 | 26,8±1,10 | 72,7±4,17 | 0,36 | 4,18±0,45 | 89,7±7,25 |
| В среднем. | 88,2±2,24 | 26,8±0,91 | 61,3±2,91 | 0,43 | 5,84±0,48 | 80,2±4,78 |
| Опытная группа | ||||||
| Февраль | 91,6±3,92 | 25,5±1,61 | 66,1±5,40 | 0,38 | 5,99±0,37 | 94,9±6,46 |
| Апрель | 90,8±3,19 | 26,5±1,50 | 64,4±4,58 | 0,41 | 5,52±0,23 | 71,8±6,32 |
| Июнь | 82,6±2,10 | 29,0±0,44 | 53,7±2,16 | 0,54 | 7,33±0,30 | 78,7±5,51 |
| Август | 91,6±1,96 | 27,6±0,75 | 63,9±1,72 | 0,43 | 7,57±0,47 | 75,3±4,21 |
| Октябрь | 85,5±2,26 | 25,4±0,75 | 60,1±2,67 | 0,42 | 2,90±0,86 | 91,3±5,12 |
| Декабрь | 96,8±2,24 | 27,5±0,72 | 69,4±2,57 | 0,39 | 5,48±0,57 | 104,2±10,7 |
| В среднем | 89,8±2,61 | 26,9±0,96 | 62,9±3,18 | 0,43 | 5,79±0,46 | 86,0±6,38 |
| Отношение опытной к контрольной: | ||||||
| Февраль, ± | +7,4 | ¬1,5 | +8,9 | ¬0,09 | +0,21 | +13,1 |
| % | 108,7 | 94,4 | 115,5 | ¬ | 103,6 | 116,0 |
| Апрель, ± | +6,8 | ¬1,0 | +8,0 | ¬0,07 | ¬0,25 | ¬5,1 |
| % | 108,1 | 96,3 | 114,1 | ¬ | 95,6 | 93,3 |
| Июнь, ± | ¬2,9 | +1,5 | ¬4,2 | +0,07 | ¬0,46 | +0,7 |
| % | 96,6 | 105,4 | 92,7 | ¬ | 94,0 | 100,8 |
| Август, ± | +0,3 | +0,5 | ¬0,3 | +0,01 | ¬0,25 | +2,7 |
| % | 100,3 | 101,8 | 99,5 | ¬ | 96,8 | 103,7 |
| Октябрь, ± | +0,5 | +0,1 | +0,5 | 0,00 | ¬0,85 | +9,1 |
| % | 100,5 | 100,4 | 100,8 | ¬ | 77,3 | 111,0 |
| Декабрь, ± | ¬2,8 | +0,7 | ¬3,3 | +0,03 | +1,3 | +14,5 |
| % | 97,2 | 102,6 | 95,4 | ¬ | 131,1 | 116,1 |
| В среднем, ± | +1,6 | +0,1 | +1,6 | 0,00 | ¬0,05 | +6,2 |
| % | 101,8 | 100,3 | 102,6 | ¬ | 99,1 | 107,2 |
Так, в июле-августе содержание мочевины в сыворотке крови коров контрольной группы составило 7,75 и 7,82 ммоль/л, что было выше физиологической нормы, равной 3,30-7,49 ммоль/л а у коров опытной группы 7,33 и 7,57 ммоль/л, что практически не превышало верхнее референтное значение нормы. Следует отметить, что в летний период повышение содержание мочевины в сыворотке крови у коров обоих групп положительно коррелировало с повышением ее содержания в молоке. Так у коров контрольной группы содержание мочевины в молоке в июле-августе составило 43,2 и 39,0 мг% а у коров опытной группы 38,9 и 45,4 мг%, что свидетельствует о нарушении энерго-протеинового баланса в рационе.
В содержании креатинина в сыворотке крови также имелись различия у коров между группами, что может быть связано с одной стороны с энергетическим обменом в мышечной ткани, с другой — как отражение ее массы в организме. Однако все эти изменения были в пределах физиологической нормы (табл.8).
Содержание глюкозы в сыворотке крови обеих групп коров повышалось от зимы к лету при относительно равном ее содержании и было в пределах физиологической нормы или несколько превышало ее верхний предел (табл.8). Так, наибольшее содержание глюкозы в сыворотке крови у коров контрольной и опытной группы наблюдалось в августе, которое составило соответственно 4,38 и 4,37 ммоль/л, что может также указывать на напряженность в энергетическом обмене. Стоит отметить тот факт, при что добавлении карамельного сиропа в зимний период для поддержания энергообмена количество глюкозы в крови не изменилось. Это может указать на тот факт, что выработка гормонов и инсулина было в норме.
В содержании триглицеридов в сыворотке крови имелась тенденция к их повышению от зимы к весне, и оно было выше у коров опытной группы, которую можно отнести к действию связанного йода на липидный обмен в направлении коррекции энергетического обмена. Содержание фосфолипидов в сыворотке крови у коров обеих групп было сходным и равнялось 2,18-2,87 ммоль/л и 2,09 – 2,75 ммоль соответственно у коров контрольной и опытной группы, за исключением их содержания у коров опытной группы в июле месяце, когда оно составило 3,21 ммоль/л. Фосфолипиды являются важной субстанцией в организме. Их главная роль — поддержание структурной формы ячеек путем создания двойного липидного слоя, определяющего прочность внутреннего покрова клеток. Фосфолипиды обладают гепатопротекторными и метаболическими свойствами, играют роль клеточных барьеров, растворяют «плохой» холестерин, поддерживают здоровье нервной системы, благотворно влияют на работу органов пищеварения и очищают печень от токсинов.
Содержание холестерина в сыворотке крови коров обеих групп было наибольшим в весенний период и равнялось у коров контрольной группы -5,20 -5,73 ммоль/л в апреле –июне и 5,51 ммоль/л в апреле у коров опытной группы. В остальные периоды оно было близким, но было выше физиологической нормы, равной – 2,2 -3,3 ммоль/л. (табл.8).
Анализ данных по минеральному обмену показал, что в содержании в сыворотке крови кальция, фосфора, магния, железа и хлоридов значимых различий не наблюдалось и оно укладывалось в пределы референтных значений физиологической нормы. То же самое наблюдалось и в содержании селена, меди и цинка.
Таблица 8 — Показатели углеводно-липидного обмена
| Периоды отбора проб | Показатели (М±m) | |||
| Глюкоза, ммоль/л | Триглицериды, ммоль/л | Фосфолипиды, ммоль/л | Холестерин, ммоль/л | |
| Контрольная группа | ||||
| Февраль | 2,62±0,19 | 0,56±0,03 | 2,18±0,17 | 4,95±0,34 |
| Апрель | 3,88±0,55 | 0,83±0,03 | 2,87±0,27 | 5,73±0,53 |
| Июнь | 3,35±0,23 | 2,60±0,26 | 5,20±0,49 | |
| Август | 4,38±0,15 | 2,34±0,18 | 3,94±0,28 | |
| Октябрь | 3,01±0,13 | 0,18±0,02 | 1,50±0,19 | 4,0±0,25 |
| Декабрь | 3,98±0,09 | 0,33±0,08 | 1,91±0,61 | 4,26±0,42 |
| В среднем | 3,53±0,22 | 0,47±0,04 | 2,23±0,28 | 4,68±0,39 |
| Опытная группа | ||||
| Февраль | 2,73±0,25 | 0,63±0,02 | 2,09±0,16 | 4,94±0,35 |
| Апрель | 3,28±0,23 | 0,87±0,03 | 2,75±0,19 | 5,51±0,37 |
| Июнь | 3,43±0,11 | 3,21±0,09 | 4,93±0,14 | |
| Август | 4,37±0,13 | 2,34±0,15 | 3,84±0,28 | |
| Октябрь | 3,14±0,16 | 1,35±0,17 | 3,52±0,34 | |
| Декабрь | 3,61±0,11 | 0,46±0,08 | 1,39±0,38 | 4,24±0,41 |
| В среднем | 3,43±0,16 | 0,65±0,04 | 2,19±0,19 | 4,50±0,31 |
| Отношение опытной к контрольной | ||||
| Февраль, ± | +0,11 | +0,07 | -0,09 | -0,01 |
| % | 104,2 | 112,5 | 95,9 | 99,8 |
| Апрель, ± | -0,6 | +0,04 | -0,12 | -0,22 |
| % | 84,5 | 104,8 | 95,8 | 96,2 |
| Июнь, ± | +0,08 | +0,61 | -0,27 | |
| % | 102,4 | 123,5 | 94,8 | |
| Август, ± | -0,01 | 0 | -0,1 | |
| % | 99,8 | 100 | 97,5 | |
| Октябрь, ± | +0,13 | -0,15 | -0,48 | |
| % | 104,3 | 90,0 | 88,0 | |
| Декабрь, ± | -0,37 | +0,13 | -0,52 | -0,02 |
| % | 90,7 | 139,4 | 72,8 | 99,5 |
| В среднем, ± | -0,1 | +0,22 | -0,04 | -0,18 |
| % | 97,2 | 138,3 | 98,2 | 96,1 |
Однако, у коров опытной группы интенсивность минерального обмена происходила на более низком уровне активности щелочной фосфатазы, чем у коров контрольной группы. Эти различия по отдельным периодам наблюдения составили 7,5 – 16,1%. В целом активность щелочной фосфатазы в сыворотке крови обеих групп коров была в пределах физиологической нормы, равной 17,50 – 152,70 МЕ/л. (табл.9).
Анализ данных функционального состояния печени показывает, что у коров обеих групп содержание в сыворотке крови билирубина было выше физиологической нормы, при чем у коров опытной группы его содержание превышало таковое у контрольных в течение зимне-весеннего периода, и только в летний период было ниже.
Таблица 9 – Показатели минерального обмена
| Периоды отбора
проб |
Показатели (М±m) | |||||
| Щелочная фосфатаза, МЕ/л | Кальций, ммоль/л | Фосфор, ммоль/л | Магний, ммоль/л | Железо, мкмоль/л | Хлориды, ммоль/л | |
| Контрольная группа | ||||||
| Февраль | 85,88±14,94 | 2,29±0,05 | 2,03±0,12 | 0,97±0,03 | 21,51±1,83 | 92,7±2,24 |
| Апрель | 74,83±18,55 | 2,38±0,05 | 2,02±0,09 | 1,09±0,04 | 25,42±1,95 | 107,12±1,55 |
| Июнь | 94,65±15,65 | 2,45±0,07 | 2,42±0,14 | 1,13±0,03 | 28,41±3,08 | 95,64±1,44 |
| Август | 60,41±5,99 | 2,37±0,06 | 2,35±0,07 | 1,11±0,08 | 21,88±1,83 | 96,44±1,30 |
| Октябрь | 76,93±5,53 | 2,28±0,01 | 2,14±0,10 | 1,06±0,05 | 29,94±1,21 | 100,56±1,02 |
| Декабрь | 60,50±10,63 | 2,77±0,05 | 2,17±0,22 | 0,99±0,04 | 20,73±2,15 | 98,80±1,13 |
| В среднем | 75,53±11,88 | 2,42±0,05 | 2,19±0,12 | 1,06±0,04 | 24,65±2,01 | 98,54±1,45 |
| Опытная группа | ||||||
| Февраль | 72,11±10,85 | 2,38±0,05 | 2,08±0,12 | 0,92±0,04 | 23,56±1,17 | 94,00±1,51 |
| Апрель | 69,28±10,09 | 2,45±0,06 | 2,07±0,06 | 0,97±0,04 | 23,97±1,02 | 106,52±1,91 |
| Июнь | 84,52±11,49 | 2,30±0,04 | 2,15±0,10 | 0,87±0,06 | 28,35±1,61 | 84,91±1,36 |
| Август | 52,74±3,49 | 2,32±0,03 | 2,51±0,15 | 1,11±0,07 | 20,61±2,38 | 97,40±1,65 |
| Октябрь | 72,92±14,10 | 2,24±0,05 | 2,12±0,21 | 1,03±0,05 | 29,29±1,03 | 104,71±1,00 |
| Декабрь | 84,46±12,90 | 2,74±0,08 | 2,08±0,20 | 1,29±0,29 | 19,55±0,92 | 101,52±1,97 |
| В среднем | 72,67±10,49 | 2,40±0,05 | 2,17±0,14 | 1,03±0,11 | 24,22±1,35 | 98,18±1,57 |
| Отношение опытной к контрольной | ||||||
| Февраль, ± | -13,77 | +0,09 | +0,05 | -0,05 | +2,05 | +1,3 |
| % | 83,96 | 103,9 | 102,5 | 94,8 | 109,5 | 101,4 |
| Апрель, ± | -5,55 | +0,07 | +0,05 | -0,12 | -1,45 | -0,6 |
| % | 92,6 | 102,9 | 102,5 | 89,0 | 94,3 | 99,4 |
| Июнь, ± | -10,13 | -0,15 | -0,27 | -0,26 | -0,06 | -10,73 |
| % | 89,3 | 93,9 | 88,8 | 77,0 | 99,8 | 88,8 |
| Август, ± | -7,67 | -0,05 | +0,16 | 0 | -1,27 | +0,96 |
| % | 87,3 | 97,9 | 106,8 | 100 | 94,2 | 101,0 |
| Октябрь, ± | -4,01 | -0,04 | -0,02 | -0,03 | -0,65 | 4,15 |
| % | 94,8 | 98,2 | 99,1 | 97,2 | 97,8 | 104,1 |
| Декабрь, ± | +23,96 | -0,03 | -0,09 | +0,3 | -1,18 | +2,72 |
| % | 139,6 | 98,9 | 95,8 | 130,3 | 94,3 | 102,7 |
| В среднем,± | -2,86 | -0,02 | -0,02 | -0,03 | -0,43 | -0,36 |
| % | 96,2 | 99,2 | 99,1 | 97,2 | 98,2 | 99,6 |
При физиологической норме содержания билирубина в сыворотке крови 0,20-5,10 мкмоль/л его содержание в сыворотке крови коров контрольной группы составило 7,73-12,31 мкмоль/л, а у коров опытной группы 9,23-13,06 мкмоль/л. Эти данные свидетельствуют о повышенной метаболической нагрузки на печень. Об этом также свидетельствует повышенная активность АЛТ, которая участвует в процессе переаминирования данной аминокислоты с образованием кетокислоты, которая в дальнейшем окислятся в цикле трикарбоновых кислот с освобождением энергии. Следует заметить, что в августе содержание билирубина в сыворотке крови опытной группы коров было ниже на 23,8%, чему контрольных, что свидетельствует о нормализующем действии связанного йода на энергетический обмен и, следовательно, на функциональное состояние печени. (Табл.10) Такое влияние возможно при интенсивной нагрузке минеральных составляющих в питании коров, так как многие из них являются токсичными и должны поступать в организм животного в связанной форме.
Таблица 10 — Функциональное состояние печени.
| Периоды
отбора проб |
Показатели (М±m) | ||
| Билирубин,
мкмоль/л |
АЛТ, МЕ/л | АСТ, МЕ/л | |
| Контрольная группа | |||
| Февраль | 11,09±1,21 | 19,89±1,46 | 71,87±2,53 |
| Апрель | 7,73±0,92 | 23,28±2,43 | 68,54±5,19 |
| Июнь | 8,83±0,93 | 22,15±1,88 | 69,85±4,36 |
| Август | 12,31±2,16 | 21,08±2,15 | 75,27±5,81 |
| Октябрь | 4,13±0,58 | 20,22±1,20 | 76,46±10,50 |
| Декабрь | 7,49±1,32 | 16,80±3,01 | 55,85±10,17 |
| В среднем | 8,60±1,19 | 20,57±2,02 | 69,64±6,42 |
| Опытная группа | |||
| Февраль | 13,06±1,13 | 20,28±1,36 | 82,53±8,74 |
| Апрель | 12,45±1,61 | 20,72±1,80 | 74,74±6,15 |
| Июнь | 9,23±1,56 | 25,32±1,78 | 76,98±3,90 |
| Август | 9,38±0,96 | 23,03±2,58 | 92,31±8,59 |
| Октябрь | 5,28±1,18 | 15,34±2,96 | 78,72±9,43 |
| Декабрь | 6,15±1,74 | 16,40±1,24 | 70,14±4,54 |
| В среднем | 9,25±1,36 | 20,18±1,95 | 79,24±6,89 |
| Отношение показателей опытной группы к контрольной | |||
| Февраль, ± | +1,97 | +0,39 | +10,66 |
| % | 117,8 | 102,0 | 114,8 |
| Апрель, ± | +4,72 | -2,56 | +6,2 |
| % | 161,1 | 89,0 | 109,0 |
| Июнь, ± | +0,4 | +3,17 | +7,13 |
| % | 104,5 | 114,3 | 110,2 |
| Август, ± | -2,93 | +1,95 | +17,04 |
| % | 76,2 | 109,2 | 122,6 |
| Октябрь, ± | +1,15 | -4,88 | +2,26 |
| % | 127,8 | 72,8 | 102,9 |
| Декабрь, ± | -1,34 | -0,4 | +14,29 |
| % | 82,1 | 97,6 | 125,6 |
| В среднем, ± | +0,65 | -0,39 | +9,3 |
| % | 107,6 | 98,1 | 114,0 |
Повышение активности в сыворотке крови АСТ также может отражать повышенную нагрузку на сердечно сосудистую систему организма коров. У коров опытной группы ее активность в течение всего периода наблюдения была выше, чем у коров контрольной группы на 9,0-22.6%, что может свидетельствовать о непосредственном действии связанного йода, через повышение активности щитовидной железы.
Ковалентно связанный йод в составе органического премикса «Зоо-Прост» оказал благоприятное действие на морфо-гематологические показатели крови. Так, количество лейкоцитов в крови коров, получавших данный продукт в течение зимне-весенне-летнего периода, было меньше на 18,5 — 23,5%, а количество эритроцитов в этот период несколько больше. В последующий осенне-зимний период в их содержании наблюдалась тенденция к снижению. Однако кровь коров опытной группы при этом была более насыщена гемоглобином. (Табл.11)
Таблица 11 -Морфо-гематологические показатели крови первотелок
| Периоды отбора проб, | Показатели | |||
| Лейкоциты, 109/л | Эритроциты, 1012/л | Гемоглобин, г/л | Гематокрит, % | |
| Контрольная группа | ||||
| Февраль | 15,55±1,96 | 7,97±0,30 | 93,4±2,22 | 37,09±0,73 |
| Апрель | 10,19±0,86 | 8,11±0,24 | 88,23±3,34 | 36,05±1,55 |
| Июнь | 12,17±1,08 | 8,82±0,48 | 97,8±5,49 | 39,85±2,16 |
| Август | 10,44±0,63 | 8,49±0,27 | 95,07±3,18 | 38,98±1,42 |
| Октябрь | 12,04±1,35 | 8,20±0,43 | 88,3±1,57 | 36,08±0,57 |
| Декабрь | 14,83±2,0 | 8,45±0,38 | 94,6±1,98 | 37,47±0,90 |
| В среднем | 12,53±1,31 | 8,34±0,35 | 92,9±2,96 | 37,58±1,22 |
| Опытная группа | ||||
| Февраль | 10,54±1,96 | 8,39±0,35 | 96,2±3,81 | 38,17±1,63 |
| Апрель | 9,98±0,35 | 8,28±0,27 | 89,18±2,03 | 36,78±0,26 |
| Июнь | 11,29±1,34 | 8,93±0,23 | 102,47±2,03 | 41,11±1,35 |
| Август | 9,28±0,39 | 8,38±0,28 | 95,2±2,45 | 39,10±0,96 |
| Октябрь | 10,64±0,73 | 7,75±0,34 | 89,9±1,51 | 36,34±0,78 |
| Декабрь | 13,98±1,38 | 7,93±0,29 | 93,61±2,24 | 37,26±0,96 |
| В среднем | 10,95±1,02 | 8,27±0,29 | 94,4±2,34 | 38,12±0,99 |
| Отношение опытной к контрольной: | ||||
| Февраль, ± | -5,01 | +0,42 | +2,8 | +1,08 |
| « % | 67,78 | 105,27 | 103,0 | |
| Апрель, ± | -0,21 | +0,17 | +0,95 | +0,73 |
| « % | 97,93 | 102,1 | 101,1 | |
| Июнь, ± | -0,88 | +0,11 | +4,67 | +1,26 |
| « % | 92,77 | 101,25 | 104,77 | |
| Август, ± | -1,16 | -0,11 | +0,13 | +0,12 |
| « % | 88,89 | 98,7 | 100,1 | |
| Октябрь, ± | -1,4 | -0,45 | +1,6 | +026 |
| « % | 88,37 | 94,5 | 101,8 | |
| Декабрь, ± | -0,85 | -0,52 | -0,99 | -0,21 |
| « % | 94,27 | 93,85 | 98,95 | |
| В среднем: ± | ¬1,58 | ¬0,07 | +1,5 | +0,54 |
| % | 87,3 | 99,1 | ||
В ней его содержание в течение всего периода наблюдения было равно 89,8 -102,7 г/л , в то время как у коров контрольной группы оно составило 82,9-95,8 г/л, что было меньше на 1,4 -7,8%., что в свою очередь повысило гематокрит, который составил у коров опытной группы 37,0-41.1% против 36,1-38,9%. у контрольных. Данные результаты свидетельствуют, что ковалентно связанный йод оказал на организм коров оздоровительный эффект, создал условия для повышения интенсивности процессов обмена веществ, путем лучшего обеспечения их кислородом. То есть использование в питании премикса может заложить основу формирования и нормального функционирования иммунной системы коров.
Включение органического йода в рацион коров оказало положительное влияние на молочную продуктивность, химический состав молока, на его гигиенические и технологические свойства. (табл.12) При этом отмечалось у 4-х первотелок опытной группы укороченная лактация. С учетом завершенной лактации в течение 305 дней средняя продолжительность ее составила по группе 294 дня, а по контрольной группе продолжительность лактации позволила посчитать продуктивность первотелок за 305 дней.
Среднесуточный удой молока первотелок опытной группы в течение лактации составил 21,1 кг, что было выше на 8,8%, чем в контрольной. При этом показатели его качества имели значительные различия. Так, содержание жира в молоке первотелок опытной группы было выше на 0,55%, лактозы на 0,13%, а содержание белка ниже на 0,07%. В итоге содержание сухих веществ в молоке первотелок опытной группы составило 13,41 %, что было выше на 0,41%, чем у контрольных. В результате за лактацию в среднем от первотелки опытной группы было получено на 47,78 кг жира и на 7,54 кг белка больше, чем от первотелки контрольной группы. Оно также положительно отличалось по кислотности и термостабильности и содержало меньше соматических клеток, что может отражать антисептическое действие на молочную железу. (табл.12).
Таблица 12 — Молочная продуктивность и качество молока первотелок
| Показатели | Группы коров, М±m | Опыт к контролю | ||
| контрольная | опытная | ± | % | |
| Дойные дни | 305 | 294 | — 11 | — |
| Среднесуточный удой, кг | 19,4 | 21,1 | +1,7 | 108,8 |
| Удой за период, кг | 5913±968 | 6218±425 | +305 | 105,1 |
| Массовая доля, % : | ||||
| жира | 3,73±0,19 | 4,28±0,08* | + 0,55 | — |
| белка | 3,18±0,13 | 3,11±0,06 | — 0,07 | — |
| лактозы | 4,99±0.11 | 5,12±0,04 | + 0,13 | — |
| сухих веществ | 13,00±0,32 | 13,41±0,15 | + 0,41 | — |
| Получено, кг: | ||||
| жира | 216,92±29,08 | 264,72±14,69 | +47,78 | 122,0 |
| белка | 185,64±25,74 | 193,18±12,92 | +7,54 | 104,1 |
| Содержание соматических клеток, тыс/см3 | 752±374 | 482±188 | -270 | 64,1 |
| Кислотность, ºТ | 16,5 | 16,6 | +0,1 | — |
| Термостабильность по алкогольной пробе | 78 | 79 | +1 | — |
При исследовании влияние связанного йода на функцию воспроизведения исходили из того, что его дефицит у коров нарушает цикличность течки и снижает оплодотворяемость. Использование в ранних работах иных форм йода, как это видно из литературы, не дало столь значимых результатов, а проведенные нами ранее исследования четко показали способность связанного йода проходить печеночный барьер и формировать нормальные обменные процессы в клетках организма мышей.
Так вот, включение ковалентно связанного йода в рацион коров в дозе 5 мг/гол/день и селена в дозе 1,75 мг/голову /день оказало положительное действие на воспроизводительную функцию. За 9 месяцев опытного периода в опытной группе из 23 коров, получавших связанный йод, плодотворно осеменилось 13 (56,5%) при продолжительности сервис-периода равном 98 дням, в то время как в контрольной группе коров плодотворно осеменилось только 6 из 26 голов (23,0%) при продолжительности сервис-периода — 162 дня. То есть, применение именно ковалентно связанного йода в питании коров позволило в два раза повысить результативность осеменения и сократить продолжительность сервис-периода на 64 дня. (табл.13).
Таблица 13 — Влияние ковалентно связанного йода и селена на показатели воспроизводства коров (Данные за 9 месяцев опыта)
| Группы коров | n | Показатели | ||
| Стельные | Сервис-период | |||
| Гол. | % | |||
| Контрольные | 26 | 6 | 23,07 | 162±86,7 |
| Опытная | 23 | 13 | 56,52 | 98±32,3 |
| Опыт к контролю: | ||||
| ± | +7 | 33,45 | — 64 | |
| % | 216,6 | — | 60,4 | |
По результатам, полученным за зимне-весенне-летний период, включение в рацион коров ковалентно связанного йода в дозе 5 мг/гол/день -уточнить позволило увеличить его концентрацию в крови и оказать положительное оздоровляющее действие на организм в целом, которое проявилось в нормализации фосфорно-кальциевого обмена, в снижении в крови количества лейкоцитов и повышении количества эритроцитов, гемоглобина и гематокрита. Это дало возможность нормальному функционированию эндокринной системы, иммунной системы, быстрому восстановлению репродуктивной функции, выработки качественного продукта (молока) в период активной лактации и других.
У коров, получавших ковалентно связанный йод, отмечено увеличение содержания жира, лактозы и сухих веществ в молоке. Молоко характеризовалось улучшенными технологическими свойствами, в нем содержалось меньшее количество соматических клеток.
Проведенные исследования согласуются с данными, полученными Moschini M , Battaglia M, Beone GM, (2010), в ходе эксперимента на молочных коровах установлено, что при включении в рацион кормления животных кормовых добавок с йодом и селеном увеличивается концентрация данных микроэлементов в молоке и молочных продуктах, повышается молочная продуктивность коров. Полученные результаты подчеркивают возможность обогащения йода в молоке и селена в сыре за счет скармливания животным.
Не маловажным вопросом остается экономический аспект применения премикса. Так было показана экономическая эффективность применения премикса в хозяйстве. При ежедневных затратах в период лактации и за один месяц до отела увеличение затрат на использование премикса составляло не более 10 рублей в сутки, что в конечном итоге составило около 3 300 рублей за весь период на одну голову. А увеличение надоев с повышенным качеством молока превысили доход на одну голову в размере 6 000 рублей. Это дало возврат инвестиций около 100 процентов только за счет молока, а с учетом снижения затрат на ветпрепараты и общее содержание коровы экономический эффект окажется еще выше. При этом сейчас мы не можем точно подсчитать суммарный эффект (за период до 4 лет). Но предполагаем, что выживаемость таких коров переместит период выбытия с нынешних 2,8 до 3,5 — 4 периодов лактации. То есть предположительно при использовании премикса в процессе кормления дойного стада, мы можем довести процент выбраковки коров по причинам йоддефицита до минимума, что позволит полностью окупать основные фонды фермерских хозяйств. Применение ковалентно связанного йода в питании коров позволило повысить показатели воспроизводства – плодотворное осеменение и значительное сокращение продолжительности сервис периода. В целом по хозяйству возможно получить значительный прирост показателей производства молока и сохранения основного стада, а также дать возможность рождению более здорового поколения.
По итогам проведенных всесторонних исследований применения ковалентно связанного йода в составе аминокислотного- белкового премикса, пришли к однозначному выводу о целесообразности использования предложенного нового органического премикса для восполнения рациона питания высокопроизводительных коров основным микроэлементом – йодом. Это позволит решить несколько основных задач.
- Нормализует метаболизм (обмен веществом и энергией) на уровне клетки в организме коров, что усилит работу иммунной системы и повысит резистентность коров к внешним факторам раздражения;
- Существенно сократит сервис-период при восстановлении организма животного после отела, что значительно снизит производственные издержки для предприятия.
- Повысит качество и количество молока в период лактации, что принесет дополнительный источник дохода и покроет затраты по внесению премикса непосредственно в условиях хозяйства или на кормозаготовительных комплексах.
- Сохранит здоровье животным и позволит продлить производственный цикл (периоды лактации) у животных до достижения уровня рентабельности.
- Привлечет внимание хозяйствующих субъектов к результатам деятельности научных организаций, что повысит авторитет науки и установит внутриструктурные связи.
2.3 Результаты научных исследований на курах-несушках
Одним из основных физиологических источников поступления йода и селена для человека являются пищевые продукты животного происхождения.
Обогащение пищевых яиц йодом и селеном в природной, ковалентной форме, перспективное направление в практике птицеводства [8]. Йодированные и селенизированные яйца кур могут широко представлены в торговой сети в качестве самостоятельного бренда. В России заявляемое производителями содержание йода в яйце составляет от 8 до 15 мкг/яйцо, а селена от 2 до 5 мкг/ яйцо. Европейские производители поставляют яйца с содержанием йода в среднем 10-25 мкг/яйцо и селена 5-7 мкг/яйцо. Максимальное содержание йода в яйцах отмечается в США и Великобритании и составляет в среднем 30 мкг/яйцо, максимально — 50 мкг/яйцо.
Основная проблема в попытке йодирования и селенизирования яиц на современном этапе посредством неорганических форм йода и селена (преимущественно йодидами, йодатами, селенитами) приводит к тому, что для получения большего количества йода и селена в яйце требуется в несколько раз (в 3-5) добавлять токсичные формы неорганических соединений в корма (премиксы и добавки), что негативно влияет на здоровье и сохранность кур-несушек, а также приводит к деформациям яиц.
Для получения йодированных яиц в рационе кур-несушек в качестве источника йода чаще всего применяют минеральные соли. Однако их использование имеет ряд недостатков. Эти соединения не стабильны, разлагаются в процессе приготовления и хранения комбикормов. Выделяющийся йод соединяется с другими биологически активными веществами и превращается в неусвояемые для организма животных формы. Применение йодидов и йодатов в составе кормов не позволяет получать йодированные яйца со стабильным и контролируемым содержанием йода. Кроме того, при термической обработке яиц происходят значительные потери (до 60%) неорганического йода. Применение неорганических форм селена опасно для кур. Все это обуславливает необходимость поиска новых более стабильных источников йода и селена в комбикормах. К таким соединениям относятся органические формы микроэлемента, в частности йодированные молочные белки и селенопиран.
Согласно расчетным данным концентрация йода в корме должна составлять 1 мг/кг (йод вводится в премикс в виде йодида калия). Дополнительное внесение 70 мг/кг кормовой добавки, содержащей йод в органической форме, должно обеспечить увеличение содержания йода на 0,5 мг/кг. Суммарное содержание йода должно составить 1,5 г/т.
В результате исследований было установлено, что концентрация йода в корме кур-несушек равна 1,28±0,12 г/т, т.е. практически соответствовало заявленному количеству.
2.3.1 Определение содержания йода и селена в яйце
Для определения содержания йода яйца отбирались 1-3 раза в неделю в ходе всего опыта.
Динамика концентрации йода в белке и желтке в ходе эксперимента представлена на рисунках 5,6.
Рисунок 5 – Динамика концентрации йода в желтке
в течение эксперимента
Как видно из рисунка 5 уже к 10 суткам эксперимента концентрация йода в желтке значительно увеличивается по сравнению с контрольными значениями. Количество йода в желтке в первой опытной группе, где в рацион кормления включали неорганические формы йода и селена составило 1,07 мкг/г, что на 28,6% и 69,9% ниже относительно второй и третей опытных групп, где применяли органические формы селена и йода. К 20 суткам эксперимента наблюдается аналогичная динамика накопления микроэлемента в пищевых яйцах. Однако, отмечено снижение уровня йода в желтке яиц контрольной группы по сравнению с данными, полученными в начале эксперимента, возможно это связано с тем, что происходит снижение запасов микроэлементов организма.
На рисунке 6 приведена динамика концентрации йода в белке в ходе эксперимента.
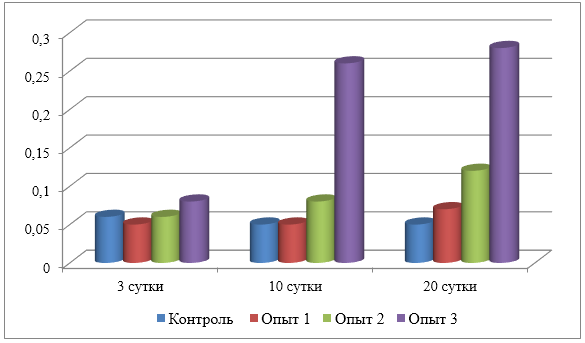
Рисунок 6 – Динамика концентрации йода в белке в ходе эксперимента
Представленные результаты показывают, что к 10 суткам исследований отмечено значительное повышение уровня йода в белке яиц третьей опытной группы, который составил 0,26 мкг/г, по сравнению с первой и второй опытными группами.
Необходимо подчеркнуть, что увеличение концентрации йода в белке и желтке по сравнению с контролем наблюдалось уже на третьи сутки после начала кормления кур-несушек молочным йодированным белком и селенопираном. При исключении его из корма концентрация микроэлемента снижалась практически до контрольных значений уже через 2-3 дня.
На рисунке 7 приведена динамика концентрации селена в желтке в ходе эксперимента.
Анализирую данные полученные в ходе эксперимента стоит отметить, что начиная с третьих суток эксперимента установлено повышение уровня селена в желтке пищевых яиц, к 10-м и 20-м суткам исследований установлено значительное наполнение микроэлемента в опытной второй и третьей группах, в которых птица получала органическую форму селена в виде селенопирана.
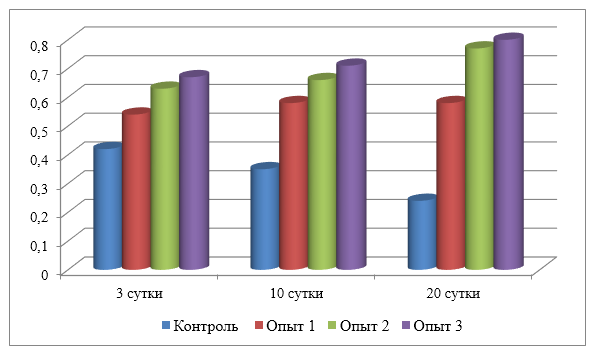
Рисунок 7– Динамика концентрации селена в желтке в ходе эксперимента
На рисунке 8 приведена динамика концентрации йода в белке в ходе эксперимента.
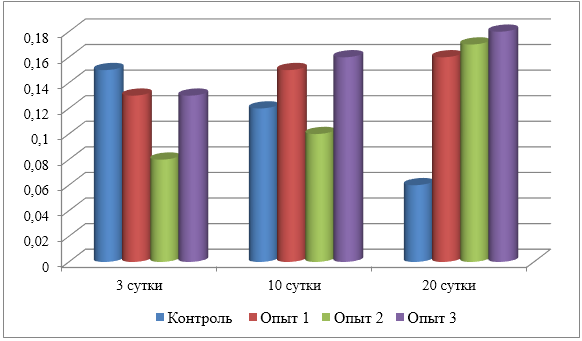
Рисунок 8 – Динамика концентрации селена в белке
в ходе эксперимента
Проводя изучение динамики концентрации селена в белке можно отметить, что в контрольной группе к 20 –м суткам отмечена тенденция к значительному снижению микроэлемента в белке пищевых яиц. Во второй опытной группе наблюдалось постепенное увеличение селена в белке.
Концентрация йода и селена в пищевых яйах в ходе научного эксперимента представлена в таблице 14.
Таблица 14 – Содержание йода и селена в яйцах
| Группы | Содержание I (мкг/г) | Содержание Se (мкг/г) | ||||
| желток | белок | желток | белок | |||
| 1 | Исходные данные | 0,8 | 0,06 | 0,43 | 0,16 | |
| 2 | Контроль 1 (без добавок I и Se) | 3 сутки | 0,84 | 0,06 | 0,42 | 0,15 |
| 10 сутки | 0,61 | 0,05 | 0,35 | 0,12 | ||
| 20 сутки | 0,27 | 0,05 | 0,24 | 0,06 | ||
| 3 | Опытная 1 (неорганич. I и Se) | 3 сутки | 0,94 | 0,05 | 0,54 | 0,13 |
| 10 сутки | 1,07 | 0,05 | 0,58 | 0,15 | ||
| 20 сутки | 1,27 | 0,07 | 0,58 | 0,16 | ||
| 4 | Опытна 2 (органический I и Se) | 3 сутки | 0,91 | 0,06 | 0,63 | 0,08 |
| 10 сутки | 1,5 | 0,08 | 0,66 | 0,1 | ||
| 20 сутки | 1,97 | 0,12 | 0,77 | 0,17 | ||
| 5 | Опытная 3 (органический I и Se) | 3 сутки | 0,88 | 0,08 | 0,67 | 0,13 |
| 10 сутки | 3,56 | 0,26 | 0,71 | 0,16 | ||
| 20 сутки | 3,86 | 0,28 | 0,8 | 0,18 | ||
Анализ данных таблицы 2 показывает, что уже к 10-м суткам опыта содержание йода в белке, желтке и в целом в яйце значимо отличается от контрольного, превышая его более чем 1,5-2 раза.
Также наблюдается прямая зависимость содержания йода и селена в яйце от концентрации в корме микроэлемента в органической форме и неорганическом виде. При внесении органических форм йода и селена в корм в количестве 0,5 г/т в яйце обнаруживается в среднем 50 мкг йода и селена мкг, при увеличении концентрации в корме до 0,7г/т йода и селена содержание йода в яйце возрастает до 65 мкг, а селена до 18 мкг.
Результаты нашего эксперимента подтверждаются рядом данных зарубежных исследований, в которых установлено, что при включении в рацион кормления термически обработанного льняного семени, миниральных веществ и витаминов происходит обогащение пищевых яиц биологически активными веществами – повышается количество омега-3 жирной кислоты, витамина Д, фолиевой кислоты, витамина Е, йода и селена. Пищевая ценность обогащенных яиц была оценена у животных и у добровольцев-людей с точки зрения их влияния на липиды крови. Установлено, что данный продукт улучшает концентрацию в крови омега-3 жирных кислот, холестерина ЛПВП, холестерина ЛПНП и триглицеридов (Bourre JM, Galea F, 2006; Bargellini A, Marchesi I, 2008).
2.4. Изучение содержания в яйце йодтирозинов
В йодированном молочном белке йод присутствует в связанном виде как моно- и дийодтирозины. В связи с этим представляло интерес изучение содержания йодированных аминокислот в яйце (табл.15). Яйца для анализа были отобраны во время первого периода опыта.
Таблица 15 – Содержание монойодтирозина (МИТ) и дийодтирозина (ДИТ) в яйце
| Показатель | Единица измерения | Результаты испытаний |
| Количество МИТ | мкг/100 г | 107±19,3 |
| Количество ДИТ | мкг/100 г | 47,6±5,47 |
| Массовая доля общего йода | мкг/100 г | 76,4±11,3 |
| Доля ковалентно связанного йода в форме МИТ | % от общего йода | 57,9 |
| Доля ковалентно связанного йода в форме ДИТ | % от общего йода | 36,8 |
Полученные данные показывают, что 95,5% обнаруживаемого в яйце йода приходится на ковалентно связанную (органическую) форму — на моно- и дийодтирозины. Причем более высокая концентрация в яйце монойодтирозина по сравнению с дийодтирозином соответствует содержанию аминокислот в йодированном белке.
2.5. Установление потерь йода в яйце при термической обработке
При обогащении яиц йодом необходимо учитывать возможную потерю его при термической обработке. Данная постановка вопроса необходима для акцентирования внимания к тому факту, что человек употребляет в основном яйца, прошедшие термическую обработку. А на данном этапе все яйца, которые были йодированы посредством токсичных неорганических форм йода (йодидами и йодатами), теряют основное количество йода и утрачивают свой статус йодированных. Таким образом, данная акция подрывает сам смысл йодирования и носит лишь маркетинговый характер, а потребитель не получает заявленного качества продукта, что подрывает рыночную нишу йодированных яиц.
В настоящем опыте была проведена оценка сохранности йода в яйце при варке (яйцо варили в кипящей воде в течение 15 мин.), а также при приготовлении глазуньи (жарка до готовности). Результаты представлены на рисунке 9.
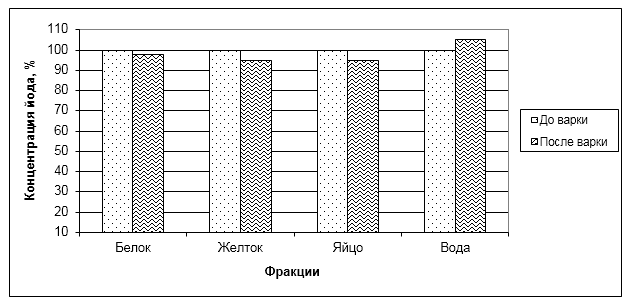
Рисунок 9 – Изменения концентрации йода в яйце при тепловой обработке (концентрация йода до варки принята за 100%)
В ходе исследования установлено, что потери йода в белке и желтке не превышали 6% и не являлись статистически значимыми. Значимо не увеличилась и концентрация йода в воде, в которой варилось яйцо. Полученные данные свидетельствуют о практически полной сохранности йода при варке яиц.
Таким образом, проведенные исследования показывают, что использование в рационе кур-несушек молочного йодированного белка позволяет получить йодированное яйцо с управляемым содержанием органического йода от 50 до 70 мкг. Йод в йодированное яйце сохраняется и после термической обработки.
В результате эксперимента на курах несушках установлено:
1. Зоотехнические показатели птицы, получавшей в составе корма молочный йодированный белок, соответствовали средним по хозяйству. Продуктивность кур-несушек за время опыта увеличилась на 0,8%.
2. Использование в рационе кур-несушек молочного йодированного белка позволяет увеличить концентрацию йода в яйце в 3-4,9 раза по сравнению с контролем. Увеличение концентрации йода и селена в белке и желтке по сравнению с контролем наблюдается уже на третьи сутки после начала кормления кур-несушек молочным йодированным белком и селенопираном.
3. Наблюдается прямая зависимость содержания йода и селена в яйце от концентрации в корме микроэлемента в органической форме и неорганическом виде. При внесении органических форм йода и селена в корм в количестве 0,5 г/т в яйце обнаруживается в среднем 50 мкг йода и селена мкг, при увеличении концентрации в корме до 0,7г/т йода и селена содержание йода в яйце возрастает до 65 мкг, а селена до 18 мкг.
5. На моно- и дийодтирозины приходится 95,5% обнаруживаемого в яйце йода.
6. Потери йода и селена в белке и желтке при варке не превышают 6% , что свидетельствует о практически полной сохранности йода при термической обработке яиц.
6. Настоящее, йодирова-селенизированное яйцо с заданными параметрами по количеству йода и селена в каждом яйце с использование нетоксичной, природной формы можно получать на постоянной основе и без ущерба для кур-несушек.
Выводы
- Включение в рацион кормления молочных животных органических форм йода и селена в виде ковалетно связанного йода и селена нормализует обмен веществ и энергии на уровне клетки в организме коров, что усилит работу иммунной системы и повышает естественную резистентность коров.
- Ковалентно связанный йод и селен в составе органический соединений оказал благоприятное действие на морфо-гематологические показатели крови. Количество лейкоцитов в крови коров, получавших данный продукт в течение зимне-весенне-летнего периода, было меньше на 18,5 — 23,5%, а количество эритроцитов в этот период больше.
- Включение ковалентно связанного йода в рацион коров в дозе 5 мг/гол/день и селена в дозе 1,75 мг/голов/день оказало положительное действие на воспроизводительную функцию -позволило в два раза повысить результативность осеменения и сократить продолжительность сервис-периода на 64 дня.
- Включение органического йода и селена в рацион коров оказало положительное влияние на молочную продуктивность, химический состав молока, на его гигиенические и технологические свойства. Среднесуточный удой молока первотелок опытной группы в течение лактации составил 21,1 кг, что было выше на 8,8%, чем в контрольной.
- Зоотехнические показатели птицы, получавшей в составе корма молочный йодированный белок, соответствовали средним по хозяйству. Продуктивность кур-несушек за время опыта увеличилась на 0,8%.
- Использование в рационе кур-несушек молочного йодированного белка позволяет увеличить концентрацию йода в яйце с 12,5 мкг до 64 мкг по сравнению с контролем, селена с 9,8 мкг до 16 мкг. Увеличение концентрации йода и селена в белке и желтке по сравнению с контролем наблюдается уже на третьи сутки после начала кормления кур-несушек молочным йодированным белком и селенопираном.
- Наблюдается прямая зависимость содержания йода и селена в яйце от концентрации в корме микроэлемента в органической форме и неорганическом виде. При внесении органических форм йода и селена в корм в количестве 0,5 г/т в яйце обнаруживается в среднем 50 мкг йода и селена мкг, при увеличении концентрации в корме до 0,7г/т йода и селена содержание йода в яйце возрастает до 65 мкг, а селена до 18 мкг. На моно- и дийодтирозины приходится 95,5% обнаруживаемого в яйце йода.
- Потери йода в белке и желтке яиц кур-несушек, получавших органический йод, при варке не превышают 6%, что свидетельствует о практически полной сохранности йода при термической обработке яиц.
Список литературы
- Архипов А.В. Организация контроля полноценности кормления высокопродуктивных коров // Ветеринария сельскохозяйственных животных. − 2005. − № 8. − С.61-67.
- Буряков Н., Косолапов А. Жидкие полисахариды в кормлении высокопродуктивных коров.// Российский ветеринарный журнал. − 2013. − № 3. − С. 34-36.
- Блоун Р., Де Роо Д. Здоровье и воспроизводительная функция высокопродуктивных коров. // Ветеринария сельскохозяйственных животных. − 2009. − № 1. − С. 28-29.
- Волгин В., Бибикова А., Романенко Л. Оптимизация питания высокопродуктивных коров. // Животноводство России. − 2007. − спецвыпуск. – С. 31-32
- Вольтамперометрическое определение йода в пищевых продуктах. Методические указания МУК 4.1.1187-03. Минздрав России. Москва. 2003.
- Георгиевский В.И. Физиология сельскохозяйственных животных. – М.: − 1990. − 512 с.
- Герасимов Г.А., Фадеев В.В., Свириденко Н.Ю. и др. Йоддефицитные заболевания в России. – М.: Адамантъ, 2002. – 168 с.
- Гланц, С. Медико-биологическая статистика / С. Гланц. – М.: Практика, 1999. – 459 с.
- Голубкина, Н. А. Флуориметрический метод определения селена / Н.А. Голубкина // Журнал аналитической химии. – 1995. – Т. 50, № 5. – С. 492–497.
- Горбатова К.К. Химия и физика молока. – Санкт-Петербург: ГИОРД, 2004. − 288 с
- Доклад №72 Агентства по токсической безопасности и здоровью. Атланта, США, 2005 год.
- Дунин М.И., Мороз Т.А., Матвеева Е.А. Влияние органических препаратов йода на биохимические показатели крови и репродукцию у коров. // Зоотехния, -2017, -№2, — С.17-19.
- Кондрахин И.П., Архипов А.В., Левченко В.И. и др. Методы ветеринарной клинической лабораторной диагностики. − М.: КолосС, 2004. − 520 с
- Кирилов М., Головин А., Кузнецов Ю., Перцев С. Лакто-Энергия для лактирующих коров // Комбикорма. − 2007. − № 2. − С. 60-61
- Киселев С., Петухова М. Полноценное кормление коров // Животноводство России. −2007. − Спецвыпуск. − С. 29-30.
- Калашников А.П., Фисинин В.И., Щеглов В.В. и др. Нормы и рационы кормления сельскохозяйственных животных. – М.: …., 2003. − 456 с.
- Камышенков В.С. Справочник по клинико-биохимическим исследованиям и лабораторной диагностики, -М.; -МЕД-пресс-информ, -2009, -с.303-322.
- Научные основы кормления сельскохозяйственной В. И. Фисинин [и др.]. — Сергиев Посад: ВНИТИП 2009. — 351 с.
- Плещук Л. Воспроизводительная способность коров // Молочное и мясное скотоводство. − 2002. − № 7. − С.13-15.
- 15.Петрухин И.В. Корма и кормовые добавки. − М.: Росагропромиздат, 1989. − С. 426-429.
- Рядчиков В.Г., Дубинина А.П. Сень Т.А., Гуляхова О.Г. Оптимизация уровня концентратов в рационе коров в переходный период // Зоотехния. − 2012. − № 1. − С.10-12.
- Спиридонов А.А. Обогащение йодом продукции животноводства. Нормы и технологии / А.А. Спиридонов, Е.В. Мурашова, О.Ф. Кислова — Санкт-Петербург: ООО «СПС Принт», 2012. — 140 с.
- Тохметов Т.М., Профилактика дефицита йода в рационах коров // Сельское, лесное и водное хозяйство, -2013. № 3, [Электронный ресурс] – URL httpHYPERLINK «http://agro.snauka,ru/2011/12/75»://HYPERLINK «http://agro.snauka,ru/2011/12/75″agroHYPERLINK «http://agro.snauka,ru/2011/12/75».HYPERLINK «http://agro.snauka,ru/2011/12/75″snaukaHYPERLINK «http://agro.snauka,ru/2011/12/75»,HYPERLINK «http://agro.snauka,ru/2011/12/75″ruHYPERLINK «http://agro.snauka,ru/2011/12/75″/2011/12/75.
- Фисинин В.И. Птицеводство России — стратегия инновационного развития. // ГНУ Всероссийский научно-исследовательский и технологический институт птицеводства, 2009 г. Москва, 2009.
- Фомичев Ю.П., Гусев И.В., Хрипякова Е.Н. Жизнеспособность молочных коров, подвергнувшихся транспортному и технологическому стрессу на фоне применения в питании органической формы йода. Доклады ТСХА, -2016, -Вып. 288, -Ч.1, -С.323-327.
- Фомичев Ю.П., Никанова Л.А., Нетеча З.А., Хрипякова Е.Н., Кузнецов А.С., Таранович А.П. Применение пропиленгликоля и конъюгированной линолевой кислоты в кормлении молочных коров // Матер. IV межд. конф. «Актуальные проблемы биологии в животноводстве». − Боровск: ВНИИФБиП, 2006. – С. 111-113.
- Фомичев Ю.П., Давыденков Г.В. Комплексное применение холин-хлорида, L-карнитина и Экостимул – 2 в профилактике кетоза у высокопродуктивных молочных коров // Известия ОГАУ. − 2010. − Т. 28. − № 4. − С. 244-248.
- Фомичев Ю.П.. Никанова Л.А., Некрасов Р.В., Чабаев М.Г., Гусев И.В. и др., Нетрадиционные корма из некондиционных продуктов пищевой промышленности в питании крупного рогатого скота и свиней – Дубровицы, ВИЖ им. Л.К.Эрнста, -2015. -80 с.
- Хинталь Т.В. Дефицит йода и йоддефицитные заболевания: актуальность проблемы профилактики и лечения в Российской Федерации// Эндокринология.– 2010.- №1.- С.25-28.
- Шантыз А.Х., Перспективы применения йодсодержащих препаратов в ветеринарии: Автореф. дис. док. вет. наук, — Краснодар, 2014, -40 с.
- Шванская И.А., Коноваленко Л.Ю. Использование отходов перерабатывающих отраслей в животноводстве. ( Научно-ааналитический обзор), -М.; — ФГБНУ « Росинформагротех» -2011, — 96 с.
- Эттер Лорен, . The Wall Street Journal/ Перевод : Кирилл Крюкин «Ведомости» (http://www.agrobel.by/ru/node/6481)
- Bell A.W. Regulation of organic nutrient metabolism during transition from late pregnancy to early lactation // J. Anim. Sci. − 1995. − Vol. 73. − P. 2804-2819.
- Drackley J.K. Biology of dairy cows during the: The final frontier?. − J. Dairy Sci. − 1999. − Vol. 82. − P. 2259-2273.
- Goff J.P. Pathophysiology of calcium and phosphorus disorders // Vet. Clin. N. Am. Food Anim. Pract.− 2000. − Vol. 16. − P. 319-337.
- Horst R.L., Goff J.P., Reinhardt T.A.. Calcium and vitamin D metabolism in the dairy cow. − J. Dairy Sci. − 1994. − Vol. 77. − P. 1936-1951.
- Koelemann E. Optimal liver support for healthy cow during transition // All About Feed. − Vol. 2. − No. 2. − Р. 14-15.
- Overton T.R., Waldron M.R. Nutritional management of transition dairy cows; strageggies to optimize methabolic health // J. Dairy Sci. − 2004. – Vol. 87. − E.Suppl. − P. 103-119.
- Pinotti L., Baldi A., Politis I., Rebucci R., Sangalli L., DellʼOrto V. Rumen-protected choline administration to transition cows: Effects on milk production and vitamin E status // J. Vet. Med. − 2003. − Vol. 50. − P. 18-21.
- Reynolds C.K., Aikman P.C., Lupoli B., Humphries D.J., Beever D.E. Splanchnic metabolism of dairy cows during the transition from late gestation through early lactation. − J. Dairy Sci. − 2003. . − Vol.86. − P. 1201-1217.
- Suryasathaporn W., Heuer C., Noordhuizen-Stassen E.N., Schukken Y.H. Hyperketonemia and the impairment of udder defense: A review // Vet. Res. − 2000. − Vol. 31. − P. 397-412.
- Stokes, S.R., J.P. Goff. Evaluation of calcium propionate and propylene glycol administered into the esophagus at calving // Prof. Anim. Sci. − 2001. − Vol.17. − P. 115-122.
- Als, С, M. Haldimann, Е. Burgi, F. Donati, H. Gerber and B. Zimmerli. Swiss pilot study of individual seasonal fluctuations of urinary iodine concentration over two years: is agedependency linked to the major source of dietary iodine? // Eur. J. Clin. Nutr. 2003 May; 57(5), 636-46. — 2003.
- SCF. Opinion of the Scientific Committee of Food on Tolerable Upper Intake Level of Iodine. European Commission. Directorate C; 2002.
- WHO. UNICEF & ICCIDD. Assessment of iodine deficiency disorder monitoring their elimination. 3rd ed. Geneva, Switzerland: WHO, 2007.
- Bruhn, J.C., A.A. Franke, R.B., Bushnell, et al. Sources and Content of Iodine in California Milk and Dairy Products. Journal of Food Protection 46:41-46. — 1983.
- Hardmann, M., A. Alt, A. Blanc, K. Bloundeau. Iodine content of food groups.// Journal of food Composition and Analysis, 18, 2005.
- Kaufmann S., J. Kursa, V. Kroupova, W.A. Rambeck. Iodine in milk by supplementing feed: An additional strategy to erase iodine deficiency. Vet. Med. — Czech, 43, 173-178. — 1998.
- FEEDАР Panel, EFSA. Opinion of the Scientific Panel on Additives and Product or Substances Used in Animal Feed on the Request from the Commission on the Use of Iodine in Feeding Stuffs. The European Food Safety Authority Journal 2005; 168.
- WHO and FAO (Food and Agriculture Organization of the United Nations). Guidelines on fortification with micronutrients. 2006.
- Кузнецов С.Г. Биологическая доступность минеральных веществ для животных из корма, добавок, химических соединений / С.Г. Кузнецов // Сельскохозяйственная биология. — 1991. — №6. — С. 150-160.
- Ljublinskij S, Savchik S, Smirnov S. The Method of Obtaining Biologically Active Food Supplements. Patent No. 2212155 of the Russian Federation of 18.07.2002.
- Bourre, JM, An important source of omega-3 fatty acids, vitamins D and E, carotenoids, iodine and selenium: a new natural multi-enriched egg / Bourre JM, Galea F. // Journal Nutria Health Aging. – 2006. — №10(5). Р.371-376.
- Bargellini, A. Selenium interactions with essential and toxic elements in egg yolk from commercial and fortified eggs./ Bargellini A 1, Marchesi I , Rizzi L , and etc. / // Journal Trace Element Medical Biology/ — 2008/ — №22(3). Р.234-241.
- O’Kane, SM. The Effect of Processing and Seasonality on the Iodine and SeleniumConcentration of Cow’s Milk Produced in Northern Ireland (NI): Implications for Population Dietary Intake. / O’Kane SM , Pourshahidi LK , Mulhern MS , and etc. // Nutrients. – 2018. — №10(3). Р. 401-408
- Moschini M . Iodine and selenium carry over in milk and cheese in dairy cows: effect of diet supplementation and milk yield. Moschini M., Battaglia M., Beone GM. and etc. // Animal. – 2010. — №4(1). Р.147-155.
