Титульный лист и исполнители
РЕФЕРАТ
Отчет 180 с.,77 рис., 17 табл., 137 источн., 11 прил.
НАНОФИБРИЛЛЯРНАЯ ЦЕЛЛЮЛОЗА, БИОТЕХНОЛОГИЯ, БАКТЕРИАЛЬНАЯ ЦЕЛЛЮЛОЗА, НАНОМАТЕРИАЛ, РАНЕВОЕ ПОКРЫТИЕ, ПЕРЕВЯЗОЧНЫЙ МАТЕРИАЛ, ЭКСПЕРИМЕНТАЛЬНАЯ ХИРУРГИЯ, ИМПЛАНТАТ, ТЕРМИЧЕСКИЙ ОЖОГ, РАНЫ, ЖИВОТНЫЕ, РЕГЕНЕРАЦИЯ, ЭПИТЕЛИЗАЦИЯ, МОРФОЛОГИЯ
Объект исследования: наноматетерал из бактериальной целлюлозы для применения в качестве раневого покрытия и имплантата для реконструкции частичного дефекта трахеи.
Цель работы: разработка технологии получения бактериальной целлюлозы с помощью продуцента Medusomycesgisevii и обоснование её применения в качестве раневого покрытия в лечении ожоговых ран и эндогенного имплантата при частичном дефекте трахеи.
Методы исследований: физические, химические, морфологические, клинические, гистологические, статистические.
Результаты работы и их новизна. Установлены оптимальные условия биосинтеза бактериальной целлюлозы, определяющие ее максимальный выход и конверсии редуцирующих веществ. Определены морфологические, физические и химические характеристики наноматериала. Обоснована эффективность раневого покрытия, выполненного из нанофибриллярной целлюлозы, при лечении термических ожогов, за счёт активной пролиферации эпидермального слоя и роста грануляционной ткани. Изучена возможность применения имплантатов из бактериальной целлюлозы при замещении частичных дефектов трахеи, способствующих восстановлению анатомической целостности дыхательных путей.
Внедрение. Методические рекомендации для ветеринарных врачей по лечению животных с термическими ожогами внедрены в ветеринарную клинику «Аврора».
Значимость работы. Обоснованы перспективы использования бактериальной целлюлозы при лечении термических ожогов и частичной имплантации трубчатых органов.
ПЕРЕЧЕНЬ СОКРАЩЕНИЙ И ОБОЗНАЧЕНИЙ
В настоящем отчёте по НИР применяют следующие сокращения и обозначения:
ВОЗ – всемирная организация здравоохранения
БУЗОО – бюджетное учреждение здравоохранения Омской области
БЦ – бактериальная целлюлоза
ВЭЖХ – высокоэффективная жидкостная хроматография
ИК спектроскопия– инфракрасная спектроскопия
ИЛ – интерлейкин
ИФН – интерферон
МЧС – министерство по чрезвычайным ситуациям
ПМ – перевязочный материал
РВ – редуцирующие вещества
РП – раневое покрытие
РЭМ – растровая электронная микроскопия
СЗМ – сканирующий зондовый микроскоп
ФНО – фактор некроза опухоли
ФП – ферментный препарат
WAC – водопоглощающая (набухающая) способность
WHC – водоудерживающая способность
WSAVA – международная ветеринарная ассоциация
εМ – максимальное относительное удлинение при разрыве
σМ – максимальный предел прочности при растяжении
1. ВВЕДЕНИЕ
На протяжении всего периода существования человечества травматизм был и остаётся одним из основных факторов развития острых и хронических заболеваний как в гуманитарной, так и ветеринарной медицине (Г.А. Матчин, А.М. Суздалева, 2015). К средствам оказания первой помощи, да и дальнейшего лечения открытых повреждений, относятся перевязочные средства и раневые покрытия, которые должны быть прочными, пластичными, антиадгезивными, обладать селективной проницаемостью для газов и пара, оставаясь барьером для воды и бактерий, должны обеспечивать комфортное существование пациента, быть экономичными и удобными в использовании, не должны иметь аллергических и токсических компонентов (М.Ю. Аверьянов, В.П. Смирнов, 2010).
Отдельным особняком в проблеме общего травматизма стоят термические травмы. При лечении ожоговых ран роль перевязочных средств возрастает в разы, неадекватность местного лечения может провоцировать развитие и генерализацию инфекции (Ю.К. Абаев, 2006; В.В. Алтухов, 2012; S.V. Chernigova et al., 2019). Анализ результатов локального лечения пациентов с ожоговыми ранами показывает, что ни одно из применяемых лекарственных средств не является универсальным (А.В. Колсанов, 2012; О.А. Легонькова, 2015). Это предрасполагает к поиску новых препаратов, улучшающих регенераторные и обменные процессы в ожоговой ране.
В настоящее время отечественный рынок лишь на 20 % заполнен медицинскими изделиями отечественного производства, включая лечебные и перевязочные средства в форме пены, плёнок, гидрогелей, гидроколлоидов, сетчатых атравматичных повязок (Е.В. Лепешкина, В.А. Одарюк, 2013; И.В. Выдрина, 2017). Большой интерес вызывают гель-плёнки из микробных полисахаридов, которые способны активировать процессы регенерации, помогают восстанавливать базальные мембраны и ускоряют эпителизацию и рубцевание ран (Н.А. Кленова и др., 2018). Наряду с этим, отдельные исследования направлены на изучение возможности бактериальной целлюлозы выступать в качестве средства, способного закрывать эндогенные дефекты повреждённых органов и тканей.
При выполнении научного исследования были установлены оптимальные условия биосинтеза бактериальной целлюлозы, определяющие её максимальный выход и конверсии редуцирующих веществ. В условиях лаборатории с помощью микробиологического синтеза получен наноматериал в виде гель-пленки, отвечающий требованиям биосовметимости, с высокой механической прочностью на растяжение и на разрыв, влагоудерживающей и абсорбционной способностью. В модельных опытах на лабораторных животных установлено, что наноматериал для лечения ожоговых ран, выполняет роль защитного покрытия раневой поверхности, обладает высокой абсорбционной способностью, что влияет на размеры и качество рубцовой ткани и приводит к снижению общего процента аутодермопластических операций. С использованием клинических и патоморфологических методов исследований доказана возможность использования бактериальной целлюлозы для выполнения реконструктивных операций при частичных дефектах трахеи, и её способность интегрироваться со здоровыми тканями и сохранять функцию травмированного (поврежденного) органа.
Для производства разработаны методические рекомендации микробиологического синтеза наноматериала в виде гель-пленки на углеводсодержащей питательной среде растительного сырья; методические рекомендации получения биосовместимого перевязочного материала на основе гель-пленки полисахаридной природы; методические рекомендации для практикующих ветеринарных врачей «Способ лечения ожоговых ран с применением перевязочного материала на основе гель-пленки полисахаридной природы», утверждённые учёным советом факультета ветеринарной медицины Омского ГАУ, протокол № 3 от 27.11.2019.
Результаты отчета могут использоваться в практике ветеринарных хирургов, а также как перспективное средство для применения в гуманитарной комбустиологии и трансплантологии.
2 ОСНОВНАЯ ЧАСТЬ
2.1 Патогенетические особенности течения ожоговой болезни на локальном и организменном уровнях
Термические ожоги, по данным ВОЗ, занимают 2-3 место среди всех травм, за последнее десятилетие частота термических поражений составила 31-34 на 10000 человек, возросло количество массовых и тяжелых ожогов. Ежегодно в Европе и США в стационарном лечении нуждается более 200 тыс. больных с ожогами. В течение одного года в Европейских странах погибает от ожогов около 60 тыс. человек, среди них большую часть составляют дети. У многих из числа тех, которые выздоравливают, остаются обезображивающие рубцы. Лечение обожженных, в особенности детского возраста, трудоемко и длительно (И.А. Буланкина, 2012; А.А. Алексеев, С.В. Попов, 2015; В.В. Сошкина, Т.С. Астамирова, 2015).
Не лучше обстоит вопрос с ожоговым травматизмом и в ветеринарной медицине. По статистике WSAVA, ожоги в структуре хирургических болезней составляют 2 %, причем наибольшая их часть приходится на долю термических ожогов. Особую группу составляют домашние животные (мелкие породы собак, котята), что объясняется их повышенной двигательной активностью (А.Н. Квочко, 2015). В настоящее время участились случаи получения ожогов при пожарах. Особенно страдают дикие и сельскохозяйственные животные и птицы, которые оказываются «заложниками» лесных пожаров. Так, согласно пресс-службы МЧС России, в 2019 году при пожаре пострадало 68 животноводческих хозяйств, погибло 13 тыс. животных. По данным Федерального агентства лесного хозяйства (Рослесхоза), в России в первом полугодии 2019 г. горело около 2,3 млн га леса в 17 регионах. Наиболее сложная обстановка отмечалась в Иркутской области, Красноярском и Забайкальском крае, где пожар «перекинулся» на населенные пункты (Г.А. Матчин, А.М. Суздалева, 2015).
Анализ литературных данных показал, что у пострадавших животных происходит одновременное поражение различных участков тела, изолированные и диффузные поражения ротовой полости, области спины, дистальных отделов конечностей (тыльная сторона лап). Данный вид травм почти всегда осложнен вторичной инфекцией, а в последующем неизбежно ведет к образованию грубых рубцов, что, в свою очередь, становится причиной развития контрактур, что нарушает двигательную функцию, а, следовательно, ведет к значительному снижению качества жизни (В.В. Анатольев, 2010; С.В. Чернигова, Ю.В. Чернигов, 2016).
В целом интенсивность термического воздействия зависит от глубины расположения различных тканей, от природы термического агента, его температуры, времени действия и длительности наступающей тканевой гипертермии. Ожоги, занимающие 30 и более процентов поверхности тела животного, считаются смертельными. При поверхностных ожогах (I-II степени) с площадью более 20 % поверхности тела и глубоких (III–IV) – с 10 %, развивается комплекс клинических симптомов, относящихся к ожоговой болезни (Р.И. Муразян, Н.Р. Паченков, 2003; А.А. Алекеев, С.В. Попов, 2015).
Если речь идет о продуктивных животных – лечение таких ожогов экономически не эффективно. Однако, ожоги, занимающие до 10 % процентов поверхности тела, хорошо поддаются терапевтическому лечению. Вследствие ожогового травматизма, у животных снижаются привесы и удои до 50 %. При ожоговом травматизме выход телят на 15-20 % ниже, чем от здоровых (А.Н. Квочко, 2015).
Длительность лечения, дорогостоящие лекарственные средства и необходимость привлечения дополнительного персонала наносит значительный экономический ущерб, как для владельцев, так и для животноводческих организаций. Своевременное проведение адекватного лечения имеет решающее значение для снижения потерь от ожогового травматизма. В разработке инновационных и высокоэффективных методов лечения термических ран большую роль играет знание о функции и механизмах взаимодействия клеток, участвующих в раневом процессе (А.А. Глухов, М.В. Аралов, 2015; В.В. Солошенко, 2016).
Процесс заживления ожоговой раны представляет собой сложный механизм, состоящий из ряда морфологических изменений. При контакте термического фактора с поверхностью кожи возникает ожоговая рана, развитие патологического процесса напрямую связано с течением воспалительного процесса. С точки зрения общей патологии раневой процесс представляет собой частный вариант воспаления, развивающийся в васкуляризованных органах и тканях в ответ на любое местное повреждение и проявляющийся в виде поэтапных изменений, направленных на локализацию, разведение, изоляцию и устранение агента, вызвавшего повреждение, и на восстановление поврежденной ткани (А.Г. Бабаева, 2009; B.G. Millan, 2010).
Острое воспаление характеризуется стереотипным комплексом морфофункциональных изменений в зоне ожога, направленных на отторжение некротизированных тканей и обеззараживание инфекционных агентов. Неразрывным компонентом целостной тканевой реакции на термическое повреждение отчетливо проявляется единство процессов: воспаление, регенерация, эпителизация и реорганизация рубца (Н.Т. Алексеева, Д.Б. Никитюк, С.В. Клочкова, 2016).
Исследования многих учёных обосновывают, что реакция клетки на термическое воздействие не носит стандартный характер и определяется кровоснабжением и локализацией участка повреждения. Степень поражения уменьшается в направлении от поверхности кожного покрова к его более глубоким слоям и от центра ожога к периферическим участкам. Вокруг центральной области коагуляции, так называемой зоне первичной альтерации, располагается зона паранекроза (Р.К. Данилов, 2008 Y. Benchamkha et al., 2017).
По данным отечественных исследователей, при тяжёлой термической травме на органы и ткани действуют три повреждающих фактора в виде гипоксии, активации биологически активных веществ и цитокинов, а также, значительного возрастания количества продуктов метаболизма и распада некротизированных тканей. В результате действия такого каскада агрессивных факторов, развиваются тяжелые морфофункциональные изменения. Характерными особенностями тканевых изменений в зоне термической травмы являются дистрофические и некротические повреждения клеток различной морфофункциональной организации. Травма сопровождается разрушением эпителиального покрова, внеклеточного матрикса, эндотелия кровеносных сосудов (А.А. Глухов, М.В. Аралов, 2015).
В зоне термической травмы возникают системные метаболические и функциональные расстройства, свойственные синдрому системного воспалительного ответа, что обусловливает в значительной мере резкими изменениями продукции антигенстимулированными лимфоцитами, моноцитами, тканевыми макрофагами и другими клетками про- и противовоспалительных цитокинов Большое значение в патогенезе локальных и системных сдвигов при термической травме имеет развитие аутоинтоксикации, связанной с интенсивной резорбцией из зоны деструкции поврежденной кожи в системный кровоток ожоговых токсинов (С.В. Чернигова, Ю.В. Чернигов, 2011).
Термическая травма инициирует клеточный и сосудистый ответы, в результате рана освобождается от девитализированных тканей и инородного материала. Существует представление, что первоначальные изменения в коже после воздействия термического фактора происходят с кератиноцитами (В.В. Алтухов, 2010). Они приобретают многие черты макрофагов под влиянием провоспалительных цитокинов – ИЛ-1 и ИЛ-6, ФНО-α, а также ИФН-γ, ИЛ-4 и ИЛ-17 (Е.Е. Дубинина, 2001).
Образующиеся при первичной и вторичной альтерации медиаторы воспаления запускают следующее звено патогенеза – стадию экссудации – первую фазу раневого процесса, которая представляет собой процесс выхода жидкой части плазмы крови в интерстиций и эмиграцию из сосудов в межклеточные пространства лейкоцитов. Данное явление, главным образом, обусловлено вазодилатацией, замедлением кровотока, резким повышением проницаемости локальной капиллярной сети окружающих рану тканей со сладжированием форменных элементов. В результате этого происходит стаз крови и выход вначале жидкой ее части (транссудата), а затем и крупных белков сыворотки вместе с лейкоцитами (экссудата) за пределы сосудистого русла (О.Н. Почепень, 2011).
Первыми клиническими признаками воспалительной реакции являются эритема и повышение местной температуры вследствие вазодилятации, отёк вследствие повышения сосудистой проницаемости, болезненность в результате повышения внутритканевого давления (Р.К. Данилов, 2008). При обширных ожогах регистрируют учащение пульса и дыхания, вначале понижение, а затем значительное повышение температуры тела, возбуждение животного, сменяющееся впоследствии общим угнетением, изменение кровяного давления. Степень общего расстройства организма зависит от размера обожженного участка тела. При ожогах ⅔ поверхности тела животного, а у лошади ½ наступают общие тяжелые явления, которые нередко ведут к смерти (А.Н. Квочко, 2015).
По данным ряда авторов, в основе воспалительного ответа лежит сосудистая реакция, проявляющаяся регионарной вазодилятацией, возрастанием капиллярной проницаемости и миграцией лейкоцитов в зону травмы (S.T. Chang et al., 2012; В.В. Солошенко, 2016). Предварительную матрицу для клеточной миграции составляет сгусток крови, состоящий из фибрина, фибронектина, витронектина, фактора фон Виллебранда и тромбоспондина. При дегрануляции тромбоцитов происходит высвобождение вазоактивных веществ и факторов роста, в том числе тромбоцитарного фактора роста, трансформирующего фактора роста β, основного фактора роста фибробластов, эпидермального фактора роста, инсулиноподобного фактора роста, фактора роста сосудистого эндотелия, фактора роста кератиноцитов, фактора роста соединительной ткани и др. (Н.В. Максимова и др., 2014). Эти белки инициируют процесс заживления раны путем привлечения и активации фибробластов, эндотелиальных клеток и макрофагов.
Лейкоциты и медиаторы воспаления активируют систему комплимента, взаимодействуют с калликреин-кининовой системой, системами свертывания крови и фибринолиза, фактором Хагемана, производными арахидоновой кислоты (С.В. Чернигова, Ю.В. Чернигов, 2011; А.О Ковальчук, 2016). Ключевым химическим медиатором ответственным за сосудистую проницаемость является гистамин. Повышенная проницаемость стенки сосудов также поддерживается кининами, которые образуются калликреином плазмы.
Увеличение степени сосудистой проницаемости в зоне травмы сопровождается притоком не только жидкой части крови, но и клеточных популяций. Первыми в очаг воспаления устремляются нейтрофилы и полиморфноядерные лейкоциты, из которых формируется линия защиты и формируется аппарат цитотоксичности, определяя дальнейшее течение и исходы воспалительного процесса (S.C. Wu, W. Marston, D.G. Armstrong, 2010; А.А. Алексеев, С.В. Попов, 2015). Нейтрофилы фагоцитируют микроорганизмы и лизируют некротизированные ткани. Результаты исследований свидетельствуют, что фагоцитоз является центральным звеном воспалительного процесса и основной защитой организма от токсических продуктов метаболизма поврежденных тканей (А.Г. Бабаева, 2009, О.Н. Почепень, 2011). Развития кровообращения в ране, отёк, выход белков плазмы и высокая протеолитическая активность лейкоцитов приводят к протеолизу некротизированных тканей.
К 48-72 часам число полиморфоядерных лейкоцитов уменьшается, в область раны мигрируют моноциты, которые приобретают макрофагальный фенотип. Макрофаги, помимо бактерицидной функции, секретируют цитокины и факторы роста, необходимые для пролиферативной фазы заживления (С.В. Чернигова, Ю.В. Чернигов, 2016). Кроме того, макрофаги могут высвобождать протеолитические ферменты, такие как коллагеназы, очищающие ткани. Внутриэпидермальные макрофаги, или клетки Лангерганса – постоянная клеточная популяция, входящая в состав многослойного эпителия (W. Sajjad et al., 2019). Эти клетки образуют «интраэпидермальную» фагоцитарную систему.
Макрофаги играют ключевую роль в ангиогенезе. За счет синтеза ИЛ-1, ИЛ-6, ИЛ-10, ИЛ-8, ФНО-α, макрофагальных воспалительных пептидов, моноцитарного хемотаксического протеина, инсулиноподобных факторов роста и других, макрофаги приводят к активации фибробластов, гладких миоцитов и эндотелиоцитов в очаге травмы (A. Khalid et al., 2017). Макрофаги способны фагоцитировать любые чужеродные вещества, от мертвых тканей до бактерий, составляющих субстрат первичного микробного загрязнения. Фагоцитоз, сопровождается выделением макрофагами биологически активных веществ, стимулирующих воспалительную реакцию, активирующих лимфоциты и запускающий процесс иммуногенеза.
Последний тип клеток фазы воспаления – лимфоциты, однако их роль значительна при хроническом воспалении. Определенное влияние оказывает количественный и качественный состав микроорганизмов. Так, при наличии стафилококка в ранах имеет место глубокая лейкоцитарная инфильтрация, развивается гнойное воспаление (А.В. Толстов, 2011; Е.Л. Безрук, 2016). При преобладании грамотрицательной микрофлоры, обладающей, преимущественно, некротическим действием, имеет место угнетение лейкоцитарной реакции.
Важным этапом заживления ран является формирование и развитие грануляционной ткани. Грануляционная ткань начинает формироваться в виде отдельных очагов в дне раны. Вокруг новообразованных капилляров концентрируются тучные клетки, которые, секретируя биологически активные вещества, способствуют пролиферации капилляров. Важнейшим клеточным компонентом грануляционной ткани является фибробласт. В фазе пролиферации количество фибробластов значительно увеличивается, и они становятся преобладающими клетками грануляционной ткани.
Миграция фибробластов на 2–4-е сутки в рану способствует синтезу внеклеточного матрикса, состоящего из коллагена I и III типов, эластина, ламинина-1 и гликозаминогликанов (хондроитин сульфат, гиалуроновая кислота и дерматансульфат). Микроокружение, изменение спектра синтезируемых субстратспецифичных протеиназ и их ингибиторов вызывает качественные и количественные изменения коллагенов, их соотношения (D.A. Gilpin, 1996; J. Kim, Z. Cai, Y. Chen, 2010; А.А. Глухов, М.В. Аралова, 2015). Капиллярные ростки внедряются в фибрин раневого сгустка и за несколько дней организуют в грануляционной ткани развитую микроваскулярную сеть. Скорость образования грануляционной ткани определяется уровнем экспрессии рецепторов к фибронектину и фибрину на фибробластах (Н.Т. Алексеева, 2012).
Коллаген I через тип III формирует фибриллы, которые ответственны за прочность тканей в организме. В здоровой коже коллаген типа I и III существует в пропорции приблизительно 4:1. В гипертрофических и незрелых рубцах соотношение коллагена типа I и III содержится в соотношении 2:1. Содержание коллагена регулируется балансом между продукцией и деградацией коллагеназы.
Одновременно происходит процесс деградации и ремоделирования неклеточного матрикса, что облегчает реэпителизацию и играет ключевую роль в процессе перехода от грануляционной ткани к рубцовой. Новообразованная соединительная ткань, заполняющая раневой дефект, может преобразовываться в плотную рубцовую ткань в зависимости от течения раневого процесса. Рубец созревает посредством формирования поперечных связей и в нем достигается соотношение коллагена типа I и III около 4:1.
Изменениям в морфологии и функции подвержены ближайшие к ране эпителиальные клетки. Показателем успеха в лечении раны служит эпителизация раневой поверхности, который включает мобилизацию, миграцию к месту травмы, митотическую пролиферацию и клеточную дифференциацию эпителиальных клеток. Слой кератиноцитов начинает мигрировать с краев раны уже в первые несколько часов после ранения, формируя тонкое покрытие взамен утраченного эпидермиса (Н.Т. Алексеева, Д.Б. Никитюк, С.В. Клочкова, 2016; Т.Н. Шнякина, Н.М. Безина, П.Н. Щербаков, 2017). Дальнейший рост базальной мембраны приводит к восстановлению многослойного эпидермиса. Хирургическая обработка, повреждение базальной мембраны, значительная экссудация тормозит скорость покрытия эпидермисом. Следует отметить, что образование струпа над раной замедляет её заживление.
Согласно теории «сближения» Weis, клетки имеют специфические стереохимические связи, которые нейтрализуются, когда существует контакт гомологичных клеток (Ю.К. Абаев, 2006). Равновесие нарушается при нанесении травмы и тогда клетки возобновляют присущую им склонность к движению. Так, благодаря, сетки фибрина, служащий как мост, эпителиальные клетки наползают на рану. Поскольку поверхность раны обезвожена, эпителиальные клетки движутся под струп, где имеется влажная среда. Регенерация эпителия становится существенным моментом восстановления тканей, обеспечивает эффективный барьер против инвазии бактерий (А.В. Толстов, 2011).
Разработка новых лекарственных средств для локального лечения термической травмы является перспективным, и требует дальнейшего изучения влияния новых препаратов на звенья патогенеза при термических ранах.
2.2 Современные биотехнологические покрытия для местного лечения ожоговых ран
В последнее время научно-технический прогресс способствует реализации и внедрению в клиническую практику новых перспективных методов лечения раневых дефектов, основанных на использовании биотехнологий с применением биомедицинских клеточных продуктов (Ю. К. Абаев, 2004; F.M. Wood, M.L. Kolybaba, P. Allen, 2006; С.Б. Богданов и соавторы, 2013). Целесообразность активной хирургической тактики при ожогах подтверждается работами исследователей в нашей стране и за рубежом (Р.И. Муразян, Н.Р. Панченков, 2003; В.В. Анатольев, 2010; F.K. Andradea et al., 2010). Основным принципом лечения глубоких ожогов является хирургическое восстановление целостности кожных покровов, однако это не исключает проведения перевязок с различными антисептическими средствами, раневыми покрытиями на основе современных технологий с учетом стадии раневого процесса и признаков инфекции. Известно, когда рана покрыта, поверхность ее остается влажной и эпителиальные клетки в состоянии мигрировать быстрее, в результате чего ускоряется эпителизация раневой поверхности. При самостоятельном открытом заживлении ожоговой раны формируется струп, что вынуждает эпителиальные клетки мигрировать под него и вызывает формирование углубленного рубца.
Существенно, увеличилось количество разновидностей перевязочных материалов, которые могут применяться на разных стадиях заживления. Во II и III стадиях раневого процесса покрытие должно предотвращать вторичную контаминацию с одновременным подавлением роста микрофлоры, оказывать протекторное действие в отношении регенерируемых тканей от механических повреждений, обеспечивать направленную стимуляцию репаративных процессов в ранах (Д.Ю. Андреев, Б.А. Параманов, А.М. Мухтарова, 2009; Y. Li et al., 2015; J. Sharma, 2015; Е.В. Самаева, И.В. Пак, 2017). Дермальный каркасный компонент покрытия должен способствовать росту, диффузии и прикреплению фибробластов, тогда как эпидермальный каркасный компонент в основном должен поддерживать рост кератиноцитов.
Раневые покрытия имеют однонаправленное действие или оказывают комплексное влияние на раневой процесс. Б.М. Даценко и соавторы (1995) сформулировали основные задачи местного лечения ран. Покрытия в первую стадию раневого процесса должны способствовать нормализации местного гомеостаза, активации отторжения некротических тканей, адсорбции токсического отделяемого раны, подавлению раневой инфекции. На ранних этапах раневого процесса характерно большое количество раневого отделяемого, что повышает риск возникновения инфекции, т.к. экссудат образует механические и биологические препятствия процессу заживления, следовательно, на первый план выходят адсорбционные свойства раневого покрытия (В.Л. Зорин и соавторы, 2009; S.M. Lien, L.Y. Ko, T.J. Huang, 2009; A. Piatkowski et al., 2011). Большое значение на данной стадии будет играть и атравматичность раневого покрытия, что обусловлено необходимостью частой замены покрытия при обширных повреждениях, иначе образующаяся грануляционная ткань, имеющая повышенную склонность к склеиванию, будет повреждаться при каждой перевязке.
Традиционные повязки, такие как хлопок, марля и бинты, имеют ограничения в управлении ожогом, так как они не могут предотвратить рост микробов и обеспечивают влажную среду для лечения (М.Г. Крутиков, А.Э. Бобровников, 2008; М.Ю. Аверьянов, В.П. Смирнов, 2010; С. Dieckmann et al., 2010).
Перспективными формами лечебных перевязочных средств за последнее десятилетие стали: гидрогелевые повязки – наиболее распространенные для применения системы (Aquaflo, Curafil, HydroTac, Гидросорб и другие); гидроколлоидные повязки – представляют собой гетерогенную систему, матрикс которой представлен, в основном, в виде полупроницаемых пленок, пен, нетканых полиэфирных материалов, содержащих межфазный слой гидрофильных коллоидных частиц на основе коллагена, желатина, целлюлозы и ее производных (Hartmann, Петролаб, Ultec); пены (Urgostart, Starmedix, Cellonex); пленки (Benehold, Hyamatrix, Биодеспол) (G. Menaker, 2002; C. Alemdaroglu et al., 2006; W. Czaja, A. Krystynowicz, S. Bielecki, 2006; N. Hoenich, 2006; О.А. Легонькова, А.А. Алексеев, 2015; M.H. Kwak et al., 2015).
G.D. Winter, H. Maibach и C.D. Hinman в 1962-1963 гг. утверждали, что влажная абактериальная среда является оптимальной для поддержания нормального митотического процесса в ране. Влажная среда ведет к быстрому очищению раневой поверхности, предотвращает высыхание нервных окончаний. Результаты исследования ряда авторов свидетельствуют, что высыхание раны и локальное применение многих лекарственных средств оказывают повреждающее действие на процесс раневого заживления (В.Г. Добыш, А.В. Васильев, О.В. Шурупова, 2001; H.E. Saied, A.H. Basta, R.H. Gobran, 2004; А.О Ковальчук, 2016; H. Nainggolan et al., 2013). Так, гидроколлоидные повязки создают в ране влажную среду, оптимальную для нормального течения процессов регенерации, способствуют элиминации раневого отделяемого и микрофлоры (A. Stoica-Guzun et al., 2012). Несмотря на то, что влажный способ местного лечения ожоговых ран атравматичный и менее болезненный, он не лишён ряда недостатков, в частности, известен факт, что размножение и развитие микроорганизмов лучше происходит во влажной среде.
Для лечебных целей используется амниотическая мембрана человека и животных. На отечественном и зарубежном рынке фармацевтической продукции производят покрытия из бесклеточной дермы. Например, из свиной кожи получены препараты «Alloask D» (Япония), из донорской кожи человека выпускается покрытие «AlloDerm», «Dermagraft» (H. Liu, Y.-L. Hsieh, 2002, А. Nakayama et al., 2004; J. Wang et al., 2012; О.А. Легонькова, А.А. Алексеев, 2015). Лечебное действие обусловлено наличием в ее составе ряда компонентов внеклеточного матрикса (коллагена, фибронектина, гликозамигликанов), и ростовых факторов. Амниотическая мембрана имеет короткий срок хранения.
В настоящее время для регенерации кожи используются аутотрансплантаты и аллотрансплантаты. В медицине известны покрытия на основе многослойного пласта культивированных аутокератоцитов (Epicel), аллогенных кератиноцитов и фибробластов (Apligraf). Продолжаются клинические испытания препаратов из аллотрансплатата, так описано двуслойное силиконовое покрытие из кожи трупа (Integra). Однако исследователи отмечали высокий процент инфекционных осложнений при его применении в послеоперационном периоде (В.Л. Зорин и соавторы, 2009; S. Gea et al., 2010; Н.А. Смирнова, А.Ш. Николаева, Н.В. Леонова, 2011; J. Meng et al., 2015). Длительность культивирования клеток, широкий процент приживления и высокая стоимость изготовления не позволяют широко использовать раневые покрытия на основе кератиноцитов. Согласно публикациям (Y. Hu, J.M. Catchmark, 2010; Y. Qiu et al., 2016; Е.В. Самаева, И.В. Пак, 2017), культивированные кератиноциты при трансплантации на раневую поверхность приживаются от 20 до 80 % случаев. Значительное влияние на приживление клеточных пластов оказывает микрофлора ран, кроме того, некоторые антисептики оказывают токсическое действие на ткани.
Известны раневые покрытия в виде коллагеновых губок и повязок, на которые нанесены активные вещества, в частности, пористые губки для лечения ран из коллагена, смеси желатина, хитозана, целлюлозы и хитозана (J.S. Boateng et al., 2008; I.P. Shidlovskiy, A.A. Shumilova, E.I. Shishatskaya, 2017), коллагена и хитозана. Описаны рассасывающие покрытия из оксиалкилцеллюлозы, амилозы, декстрана, альгинатов, хитина, хитозана, гиалуроновой кислоты и другие (А.А. Алексеев и соавторы, 2012; М.В. Погорелов и соавторы, 2012). В основе способности этих материалов к рассасыванию лежит их водо- и плазморастворимость. Включение в полимерную основу биологически активных веществ позволяет воздействовать на два важнейших этиологических звена раневого процесса – некротические ткани и микробную обсемененность (S. Jiji et al., 2019). Преимуществами натуральных полимерных матриц являются их биосовместимость, нетоксичность, контролируемый процесс биодеградации.
Ряд авторов (A. Hirai, M. Tsuji, F. Horii, 2002; Д.Ю. Андреев, Б.А. Параманов, А.М. Мухтарова, 2009) описывают бидеградирующие раневые покрытия на основе альгинатов. Впервые альгиновая кислота и ее соли были выделены из морских водорослей в 1883 г. английским химиком E. Stanford. Альгинатные раневые покрытия обладают высокими абсорбирующими (способность связывать раневой экссудат) и дренирующими (способность отводить раневой экссудат с поверхности раны, например, в вышележащую повязку) свойствами (Р. Gatenholm, D. Klemm, 2010; J. Guo, J.M. Catchmark, 2012; G.F. Picheth et al., 2017). Основными недостатками альгинатных покрытий являются их фрагментируемость и высокая растворимость геля в раневом содержимом. Утрата гелем своей волокнистой структуры сопровождается резким снижением абсорбционных и дренажных свойств повязки.
В основе многих современных покрытий, губок, пленок лежит коллаген. В последние годы с успехом используется изготовленный на основе растворимого высокоочищенного коллагена кожи крупного рогатого скота материал Коллост (А.А. Глухов, М.В. Аралова, 2015). Когда имплантант связывается с раной, фибробласты, кровеносные и лимфатические сосуды, нервные волокна из окружающей здоровой ткани, внедряясь в коллагеновую решетку, распространяются строго по ней. К ценным свойствам коллагена относятся его способность стимулировать фибриллогенез, рассасываться и замещаться живой тканью (A. Svensson, 2005; V. Leung, F. Ko, 2011; Y. Benchamkha et al., 2017).
С целью приближения свойств покрытия к нативному коллагену в них часто добавляют полисахариды: соли гиалуроновой кислоты, хондроитинсульфат (Integra), сульфинированный дермантин, гепарин, альгиновую кислоту, хитозан. Известны клеточные технологии, направленные на стимуляцию регенераторных процессов, так культивирование кератиноцитов на коллагеновом геле («Apligraf»), на культуре аллофибробластов («AlloDerm», «Apligraf») (Н.В. Островский и соавторы, 2007, V.V. Alipov, 2012; S. Jiji et al., 2019). В литературе приводятся неоднозначные мнения по поводу «живого эквивалента кожи». По мнению ряда авторов, покрытия на основе коллагена неустойчивы к воздействию ферментов и инфекции, а также снижают пролиферативную активность фибробластов.
Предложено использовать покрытия из коллагена, у которых внешняя поверхность покрыта более плотным слоем коллагена или синтетической (полиуретановой) пленкой, предохраняющей рану от высыхания (A. Khalid et al., 2017; N. Lin, A. Dufresne, 2014). Предполагается, что в коллагеновые покрытия мигрируют эндотелиальные фибробласты и другие клетки, в результате чего материал рассасывается под действием коллагеназы и замещается грануляционной тканью. Среди множества типов клеток, обладающих большим регенераторным потенциалом, особый интерес вызывают дермальные фибробласты, которые участвуют в создании, организации и обновлении внеклеточного матрикса в процессе его функционирования, а также в восстановлении ткани после повреждения (N. Lin, A. Dufresne, 2014).
В результате образования «неодермы» верхний силиконовый слой удаляли и выполняли аутодермопластику тонким трансплантантом толщиной около 0,1 мм. Дермальные фибробласты продуцируют большое число белков внеклеточного матрикса (коллагены I–V типов, фибронектин, гликозаминогликаны, ламинин, хондроитин-4-сульфат и др.), различные факторы роста (фактор роста фибробластов, фактор роста соединительной ткани, трансформирующий фактор роста, эпидермальный фактор роста, фактор роста кератиноцитов, факторы роста эндотелия сосудов), ферменты, а также ряд цитокинов (Е.В. Баранов и соавторы, 2017). Такой заменитель дермы известен под коммерческим названием «IntegraArtificialSkin. Integra», созданный в 80-е гг. XX века. Некоторые заменители дермы состоят из бесклеточной основы («AlloDerm», «Matriderm»), которые после наложения их накрывают постоянным эпидермисом. Когда аутогенный «неодермис» сформировался и васкуляризировался, на него накладывается расщепленный кожный лоскут.
Известен способ лечения ожоговой раны, включающий хирургическую обработку и закрытие раны трансплантатом, содержащим фетальные фибробласты человека первичной культуры на гидрофильном основании, покрытом коллагеном. Недостатком этого способа является использование первичных культур аллогенных фибробластов без надлежащего обследования, что не позволяет исключить наличия вирусных и микоплазменных контаминаций культур, способных инфицировать пациента.
Известно гидрогелевое биоактивное фуллерен-содержащее раневое покрытие, являющееся нетоксичным соединением и проявляющей антиоксидантную, мембранотропную, иммунотропную, противовирусную, фотодинамическую активность (H. Nainggolan et al., 2013), способное индуцировать дифференцировку фибробластов (М.Ф. Расулов, 2007), инактивировать протеолитические ферменты. В качестве верхнего слоя авторы использовали абсорбент – акрилатный гидрогель, нанесенный на пористую хлопчатобумажную основу (средний слой), и нижний, прилежащий к ране желатиновый слой, включающий биоактивные ингредиенты разнонаправленного действия (диоксидин, ε-аминокапроновая кислота, мочевина), и иммобилизованный в его составе комплекс С60/ПВП c 0,1 % содержанием фуллерена.
По данным многочисленных публикаций, одним из перспективных раневых покрытий являются наноразмерные частицы серебра, обеспечивающие дозированный и пролонгированный антимикробный эффект (А.Б. Щербаков и соавторы, 2006; А.А. Адамян и соавторы, 2009). Известно, лечение с применением коллагеновых покрытий с культивируемыми фибробластами и мезенхимальными стромальными клетками жировой ткани. Существуют разновидности раневых покрытий, в которых используются не сами фибробласты, а выделяемые ими факторы роста. Первое раневое покрытие с фактором роста тромбоцитов выпущено в составе коллагенового геля в 1994 году в США («Regranex»).
Изученный литературный материал указывает на то, что многие вопросы лечения глубоких ожогов и их последствий остаются дискутабельными, что подтверждает важность и актуальность изучаемой проблемы.
2.3 Условия и методология проведения научного исследования
Исследование проводили в соответствии с действующими нормативными документами и руководствами:
Приказ Министерства здравоохранения РФ от 1 апреля 2016 г. № 199н «Об утверждении Правил надлежащей лабораторной практики».
Руководство по проведению доклинических исследований лекарственных средств. Часть первая / под ред. А.Н. Миронова. – М.: Гриф и К, 2012 – 914 с.
Европейская конвенция по защите позвоночных животных, используемых для экспериментальных и других научных целей // Вопросы реконструктивной и пластической хирургии. – 2003. – № 4. – С. 34-36.
Исследования выполнены по заказу Министерства сельского хозяйства РФ в период с января по декабрь 2019 года. Основная часть исследований была проведена в условиях ФГБОУ ВО Омский ГАУ, а именно, кафедры диагностики, внутренних незаразных болезней, фармакологии, хирургии и акушерства факультета ветеринарной медицины; кафедры продуктов питания и пищевой биотехнологии агротехнологического факультета; учебно-научной лаборатории «Биохимия продуктов питания» агротехнологического факультета.
Отдельные исследования выполнены на базе ФГБОУ ВО ОмГТУ –кафедры физики; научно-образовательных ресурсных центров «Нанотехнологии» и «Политест» и лаборатории морфологических исследований органов и тканей БУЗОО «Клинический онкологический диспансер».
2.3.1 Методология научного исследования по получению бактериальной целлюлозы
Научные исследования условно были разделены на два этапа. Первый этап был посвящён разработке технологии получения биосовместимого с органами и тканями животных наноматериала, синтезированного на синтетической питательной среде и ферментативных гидролизатах растительного сырья. Структурно-методологическая схема исследований I этапа представлена на рисунке 1.
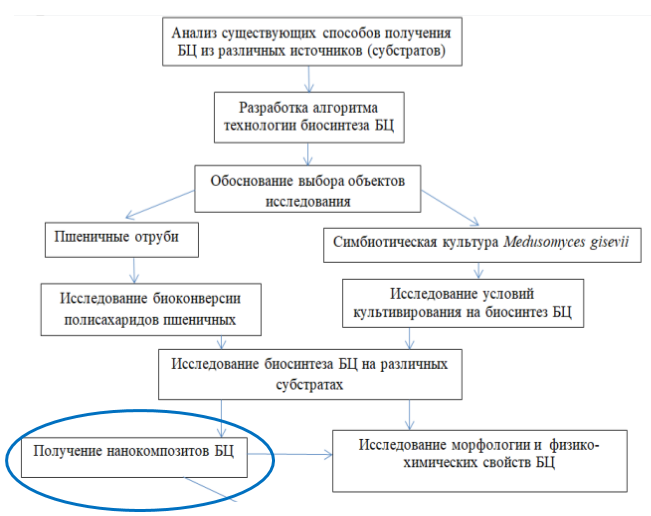
Рисунок 1 – Структурно-методологическая схема исследований I этапа по получению бактериальной целлюлозы
Объектами исследования I этапа являлись:
– продуцент бактериальной целлюлозы Medusomyces gisevii (симбиот из 15-30 родов дрожжей, в том числе Zygosaccharomeces sp., Saccharomyces sp., Schizosaccharomyces pombe и др., 8-10 родов уксуснокислых бактерий, в том числе Acetobacter sp., Gluconobacter oxydans, Bacterium kutzingianum);
– нативные пшеничные отруби ООО «МельКом» по ГОСТ Р 7169-17 Отруби технические. Технические условия.
Производство бактериальной целлюлозы, питательная среда
Биосинтез образцов бактериальной целлюлозы осуществляли при статическом культивировании симбиотической культуры Мedusomyces gisevii. Симбитон Мedusomyces gisevii состоит из уксуснокислых бактерий и дрожжей, преимущественно Gluconacetobacter, Acetobacter и Zygosaccharomyces (Marsh et al., 2014). Дрожжевые культуры, потребляя углеводы, образуют этиловый спирт и витамины, что способствует развитию уксуснокислых бактерий. Последние, в свою очередь, в ходе культивирования путем неполного окисления углеводов и спирта, синтезируют ряд органических кислот: уксусную, глюконовую, лимонную и др., которые являются дополнительным источником углерода для дрожжевых клеток. Таким образом, между популяциями устанавливается равновесие через симбиотическое взаимодействие. В экспериментах использовалась синтетическая питательная среда, приготовленная растворением глюкозы в 5 % экстракте зеленого чая (5 г чая на 1 л воды), в качестве инокулята – семидневная симбиотическая культура, выращенная на глюкозной среде, в количестве 30 %. Начальная концентрация глюкозы составила 10 %, уровень активной кислотности саморегулировался симбиотоном, культивирование проводили в статических условиях при (25±2) °С в течение 20 суток в биореакторе.
Обработка пленок бактериальной целлюлозы
По окончании культивирования симбиотическую культуру Мedusomyces gisevii энергично встряхивали для удаления прикрепленных бактериальных клеток. Пленки целлюлозы, синтезированные на поверхности воздух/жидкость, удаляли из культуральной жидкости и очищали от остатков питательной среды путем промывания деионизированной водой. Далее для полного удаления примесей и включенных в матрицу бактериальной целлюлозы клеток, пленки промывали раствором гидрооксида натрия с концентрацией 0,1 моль/л при комнатной температуре (30 °C) в течение 1 часа. Процедуру повторяли несколько раз до обесцвечивания пигментов питательной среды, получали полупрозрачные пленки бактериальной целлюлозы, далее их промывали деионизированной водой, до нейтрального значения рН. После этого пленки высушивали на воздухе при комнатной температуре и хранили в пластиковой пленке.
Определение водоудерживающей и водопоглощающей способности бактериальной целлюлозы
Водопоглощающую способность определяли в соответствии с монографией Британской Фармакопеи для альгинатных повязок и упаковки (British pharmacopoeia, 1994; Alginate Fibre., 1995; Thomas, 2000).
Образцы гидрогеля разрезали на прямоугольники размером 2 × 4 см и взвешивали в качестве исходного веса (W0). После этого образцы переносили в центрифужную пробирку, дно которой заполняли вязаной марлей для поглощения отжатой воды и подвергали центрифужной дегидратации в течение 15 мин при 1200 об/мин. Эти образцы были взвешены еще раз (W1). Вес полностью высушенных образцов (W4) измеряли после сушки при 105 °C до постоянной массы.
Набухающую способность высушенной гелевой пленки определяли следующим образом: образцы высушивали при 50 °С или вымораживанием до постоянной массы и затем замачивали в растворе, содержащем 2,5 ммоль/л CaCl2*2H2O и 142 ммоль/л NaCl (для имитации ионной силы Ca2+ и Na+ в раневом экссудате) в течение 30 минут. После инкубации образцы поднимали пинцетом в течение 30 с для удаления поверхностной жидкости и взвешивали (значение W2). Для определения количества жидкости, удерживаемой между фибриллами, набухшие образцы обезвоживали центрифугированием, как описано выше, и взвешивали (W3). Количество удерживаемой воды (WHC) и количество поглощенной воды (WAC) высчитаны как:
WHC = (W0– W4)/ W4 (5)
WAC = (W2– W4)/ W4 (6)
Жидкость, в образцах бактериальной целлюлозы, рассматривалась как состоящая из двух частей:
а) удерживаемая между волокнами (W0–W1) для нативной БЦ и (W2–W3) для дегидратированной БЦ;
b) удерживаемая внутри отдельных волокон (W1-W4) для гель-плёнок (нативная БЦ) и (W3–W4) для дегидратированных образцов БЦ.
Соответствующие W4-нормированные параметры (W0–W1)/W4; (W2–W3)/W4; (W1–W4)/W4; и (W3–W4)/W4 использовались для характеристики и сравнения перевязочных материалов (Qin, 2004, 2008).
Были также оценены соотношения (W0–W1)/(W1–W4) и (W2–W3)/(W3–W4), отражающие распределение жидкости в образце нативной и высушенной гелевой пленки солнца (Qin, 2004, 2008). Каждый тест повторяли 5 раз. Результаты представлены в виде средних значений ± стандартных отклонений.
Исследование гидролизатов пшеничных отрубей – как субстратов для биосинтеза бактериальной целлюлозы
Определение редуцирующих сахаров по ГОСТ Р 53973-2010. Ферментные препараты для пищевой промышленности. Методы определения ꞵ-глюканазной активности;
Проведение хроматографического анализа углеводов способом ВЭЖХ и электрофореза:
– подготовительные операции;
– приготовление калибровочных растворов. В мерные колбы объемом 250 мл взяли навески стандартных веществ – лактозы, глюкозы, маннозы, ксилозы – для получения пяти калибровочных растворов с концентрацией каждого вещества 0,2; 0,4; 0,9; 1,5 мг/мл. Колбы довели до метки заранее приготовленным и охлажденным раствором 20 % этилового спирта.
– приготовление производных для хроматографии: в пластиковые пробирки ёмкостью 1,5 мл с плотно закручивающейся крышкой поместили по 40 мкл калибровочных растворов, а также анализируемых гидролизатов пшеничных отрубей (гидролизаты были предварительно отцентрифугированы при 6000 об./мин в течение 15 минут). Затем в пробирки были добавлены: 100 мкл флуорофора, 100 мкл восстанавливающего агента и 100 мкл катализатора “Start-1”. Пробирки встряхнули и установили в термостат при 300С. Спустя 1 час в пробирки добавили ещё 20 мкл восстанавливающего агента, 100 мкл катализатора “Start-2” и поместили в термостат при 300С. Реакционную смесь интенсивно встряхивали каждые полчаса, визуально контролировали уровень жидкости и образование пузырьков газа в пробирках. Спустя 7 часов в пробирки добавили ещё 20 мкм восстанавливающего агента, 100 мкл катализатора “Start-4” и поместили в термостат при 900С. Спустя 30 минут пробирки вынули из термостата, охладили до комнатной температуры, а содержимое – использовали для анализа;
– проведение хроматографического анализа: анализируемые образцы и калибровочные точки анализировали на ВЭЖХ-хроматографе «Миллихром А-02». Сорбент хроматографической колонки Prontosil-C18 (ЗАО «Эконова, г. Новосибирск). Температура анализа 400С. Давление в колонке – 3-7 МПа. Детектор фотометрический. Длины волн: 220 нм, 310 нм, 350 нм, 400 нм. Режим анализа – градиентный (растворитель Б – от 20 до 22 % за 3000 мкл). Расход элюента 250 мкл/мин. Объём пробы – 2 мкл. Предпроба не использовалась;
– регистрация и обработка хроматограмм проводилась при помощи программного обеспечения «Мультихром», идущего в комплекте с хроматографом.
Определение морфологических и химических характеристик образцов бактериальной целлюлозы
Все пленки бактериальной целлюлозы и нанокомпозиты на её основе мембраны были охарактеризованы с точки зрения структуры. Для изучения структуры бактериальной целлюлозы применяли такие методы исследования, как растровая электронная микроскопия (РЭМ) и сканирующая зондовая микроскопия. Исследование топографии поверхности бактериальной целлюлозы производилось с помощью растрового электронного микроскопа JEOL JCM 5700, оснащенного энергодисперсионным анализатором JED-2300 (рисунок 2).
Сущность метода сканирующей электронной микроскопии заключается в исследовании поверхности образца с помощью «электронного зонда» – пучка электронов, испускаемых с поверхности катода под действием электрического тока, прошедшего через него. Электронный пучок ускоряется электрическим полем с разностью потенциалов от 5 кэВ до 25 кэВ и фокусируется магнитным полем катушек. После получения достаточно высокой энергии электроны падают на поверхность исследуемого образца, вызывая индукцию вторичных электронов с его поверхности,

Рисунок 2 – Растровый электронный микроскоп JEOL JCM 5700
обнаруживаемых детектором, а также возбуждение атомов образца, в результате чего образуются характерные рентгеновские лучи, спектр которых указывает на элементный состав материала. Использование больших увеличений связано с высокой плотностью энергии на поверхности, вызывающей быстрое локальное разрушение материала.
Сущность метода сканирующей электронной микроскопии заключается в исследовании поверхности образца с помощью «электронного зонда» – пучка электронов, испускаемых с поверхности катода под действием электрического тока, прошедшего через него. Электронный пучок ускоряется электрическим полем с разностью потенциалов от 5 кэВ до 25 кэВ и фокусируется магнитным полем катушек. После получения достаточно высокой энергии электроны падают на поверхность исследуемого образца, вызывая индукцию вторичных электронов с его поверхности, обнаруживаемых детектором, а также возбуждение атомов образца, в результате чего образуются характерные рентгеновские лучи, спектр которых указывает на элементный состав материала. Использование больших увеличений связано с высокой плотностью энергии на поверхности, вызывающей быстрое локальное разрушение материала.
Для уменьшения разрушающего действия, оказываемого электронным зондом на поверхность образца, исследование проводилось при минимальном ускоряющим напряжением 5 кэВ. Исследования проводились при увеличениях от 500 до 7000 крат.
Объектами исследования служили дегидратированные образцы БЦ, а также образцы, модифицированные фосфатом кальция и коллоидным серебром.
В силу того, что электронный зонд растрового электронного микроскопа наносит разрушающее воздействие на сам образец, детальное исследование структуры поверхности целлюлозы было проведено с помощью сканирующего зондового микроскопа (СЗМ) NTEGRA Prima (рисунок 3).


Рисунок 3 – Сканирующий зондовый микроскоп (СЗМ) NTEGRA Prima
В основе метода СЗМ лежит взаимодействие исследуемого образца с зондом – кантилевером. Осуществление взаимодействия возможно различными способами. В данном эксперименте применялась полуконтактная (или прерывисто-контактная) методика. Ее суть заключается в регистрации сил межатомного взаимодействия между исследуемой поверхностью и колеблющимся на резонансной частоте зондовым датчиком, представляющим собой механическую иглу, закрепленную на конце кантилевера (балки). Механические колебания балки возбуждаются с помощью пьезокерамического привода, а амплитуда и фаза этих колебаний детектируются с помощью силового оптического сенсора, представляющего собой четырехсекционный фотодетектор, позволяющий регистрировать положение луча лазера, отраженного от кантилевера и попадающего на фотодетектор.
При подводе зонда к исследуемой поверхности действие сил межатомного взаимодействия приводит к изменению условий резонансных колебаний кантилевера, и, как следствие, к изменению амплитуды и фазы колебаний. Система обратной связи позволяет поддерживать постоянным среднее расстояние между образцом и зондом за счет управления вертикальным положением кантилевера таким образом, чтобы не изменялась амплитуда колебаний. При этом в полуконтактном режиме зонд входит в физический контакт с поверхностью (в зону сил отталкивания) только в нижней части своей траектории, постукивая поверхность. В процессе сканирования образца (построчного перемещения зонда над исследуемой поверхностью) электронная подсистема СЗМ, управляемая персональным компьютером, регистрирует вертикальные перемещения кантилевера и, таким образом, реконструирует рельеф поверхности. Одновременно с изображением рельефа поверхности дополнительно могут быть получены изображение отклонения амплитуды колебаний кантилевера от заданной рабочей величины и изображение сдвига фазы колебаний. Эти изображения позволяют более отчетливо выявить особенности рельефа поверхности, а также неоднородности ее физико-химических свойств.
Сканирование производилось в воздушной среде с помощью кремниевого зонда жесткостью порядка 5 Н/м в полуконтактном режиме. В процессе сканирования вместе с сигналом Height, позволяющим исследовать топографию образца в 3-х пространственных координатах, регистрировался сигнал Mag, отражающий переменное значение амплитуды колебания зондового датчика, он позволяет визуализировать незначительные отклонения в рельефе поверхности.
Основные функциональные химические группы на поверхности образцов БК анализировали методом FTIR-спектроскопии с использованием спектрофотометра Perkin Elmer FTIR System Spectrum BX, оснащенного одной горизонтальной ячейкой (ATR Golden Gate). Спектры FTIR были получены в диапазоне (4000-500) см-1 с разрешением 4 см-1.
Определение физико-механических свойств бактериальной целлюлозы
Испытания на растяжение гидрогелей ВС проводили с использованием машины Instron 5543 (Instron, Мельбурн, Австралия). Каждую пленку разрезали на три полоски в форме гантелей (конечные размеры: 6 × 35 мм; размеры узкого сечения: 2 × 10 мм, рисунок 4). Толщину образца бактериальной целлюлозы измеряли с помощью цифрового штангенциркуля. Два конца полосы были помещены между тисками и раздвинуты с постоянной скоростью 1 мм / мин. Был использован тензодатчик 0,1 Н, и было зарегистрировано усилие, необходимое для растяжения как функции времени.
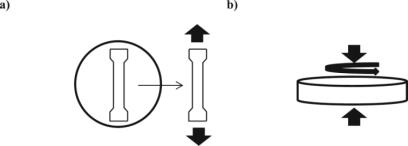
Рисунок 4 — Схематическое представление формы образца, вырезанного из пленки бактериальной целлюлозы, испытуемого на растяжение
Определены: предел прочности при растяжении (σМ) и относительное удлинение при разрыве (εМ) как максимальное напряжение и деформация, соответственно, которые образец мог выдержать до разрушения. По наклону линейной области кривой деформации-напряжения на стадии растяжения рассчитан модуль Юнга (Et). Каждый тест повторяли восемь раз, а затем давали средние значения ± стандартное отклонение.
Определение газопроницаемости бактериальной целлюлозы манометрическим методом
Газопроницаемость образцов БЦ исследовали на вакуумном тестере VAC-V1, который соответствует требованиям стандартов GB 1038 (стандарт КНР), ISO 2556, ISO 15105-1, ASTM В 1434. Вакуумный тестер VAC-V1 предназначен для испытаний проницаемости по отношению к различным газам пластмассовых пленок, ламинированных покрытий, искусственной
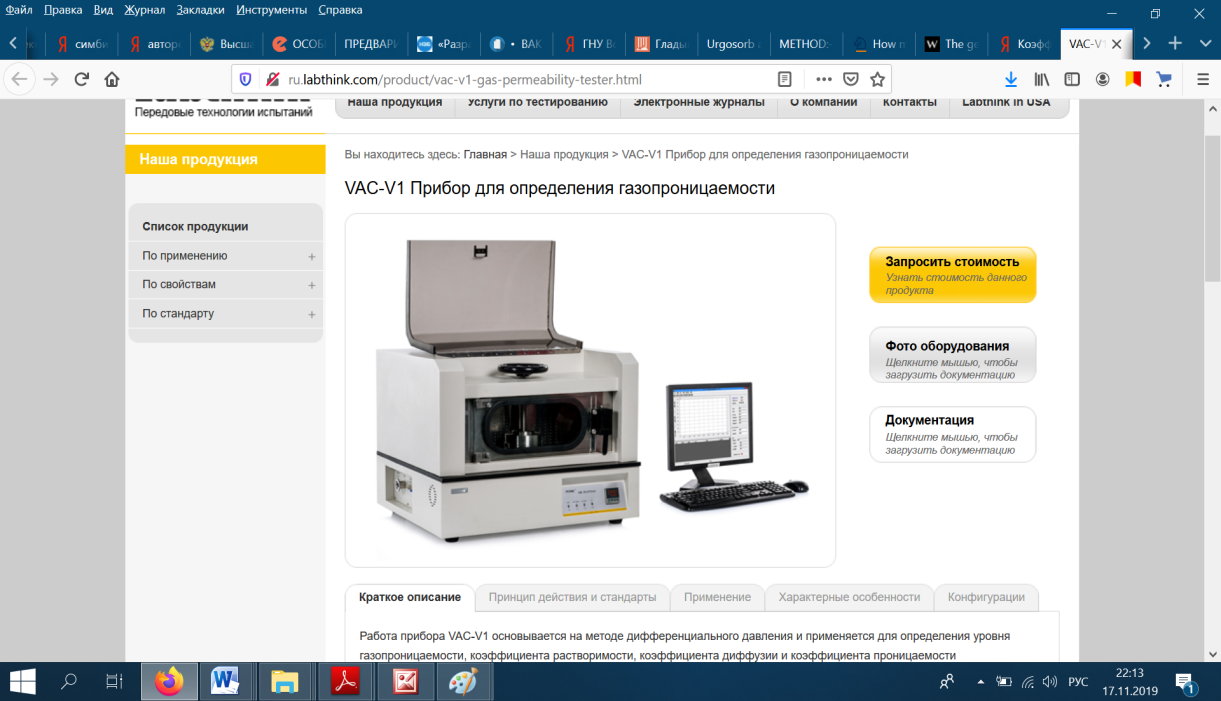
Рисунок 5 – Вакуумный тестер VAC-V1
кожи и других материалов, выступающих в качестве барьеров для газов (рисунок 5). Дегидратированный образец бактериальной целлюлозы (круг, диаметром 97 мм) помещали между верхней и нижней камерами и сильно его прижимали. Проводится вакуумирование нижней камеры, а затем всей системы. Когда достигается нужная степень вакуума, откачка нижней камеры отключается, и в верхнюю камеру напускается азот при заданном давлении, чтобы постоянный перепад давления заставил газ диффундировать через образец бактериальной целлюлозы со стороны высокого давления (верхняя камера) в направлении низкого давления (нижняя камера). Постоянно контролируя и измеряя давление в нижней камере, получаем различные барьерные характеристики испытуемого образца. Газ для исследования – азот.
Обработку полученных результатов исследования проводили с помощью программ «Microsoft Excel 2010», «Microsoft Word 2010» и STATISTICA 6.0, которая включает в себя широкий набор основных статистик в понятном русифицированном интерфейсе со всеми преимуществами. Сущность расчета оптимального значения из огромной базы экспериментальных исследований состоит в том, что набор и обработка статистической информации осуществляется на специально подготовленных таблицах, для усовершенствования технологических процессов глубокой переработки зерна и пшеничных отрубей.
Обработку результатов исследований осуществляют в соответствии с требованиями ГОСТ Р 8.736-2011. Минимальное количество результатов наблюдений, регламентированное этим стандартом – не менее четырех. Достоверность результатов исследований подтверждается соответствием теоретических данных с полученными результатами экспериментальных исследований. Опытные данные, выводы и рекомендации основаны на общепринятых теоретических закономерностях, не противоречат и с достаточной степенью точности согласуются с известными концепциями.
2.3.2 Методика научного исследования по обоснованию применения бактериальной целлюлозы в хирургии
Второй этап научного исследования был посвящён обоснованию применения наноматериала в качестве перевязочного материала при лечении ожоговых ран и эндогенной имплантации трубчатых органов.
Объектом экспериментального исследования являлись:
– крысы линии вистар (n=40), массой 332,5±3,3 г, возраст 5-6 месяцев;
– кролики породы серый великан (n=90), массой 4535±49,3 г, возраст 10 месяцев. Все животные, участвовавшие в эксперименте, прошли карантин в течение 14 суток. Животных, в зависимости от вида, содержали в клетках в стандартных условиях вивария (рисунок 6). Кормление осуществляли в соответствии с видом животного, в рацион входили грубые, сочные и концентрированные гранулированные корма, доступ к корму и воде был свободным.

Рисунок 6 – Содержание кролика группы 2 в индивидуальной клетке
Предметом исследования являлась бактериальная целлюлоза, которая поступала в виде бинтов (рисунок 7) или прямоугольных фрагментов в индивидуальной стерильной упаковке, в зависимости от задач эксперимента её моделировали непосредственно в условиях операционной.
Оценку биосовместимости раневого покрытия осуществляли путем проведения тестов острой и хронической токсичности для этого были сформированы две группы животных, это были кролики (n=20), подобранные по принципу аналогов. У всех животных в области холки выполняли линейный разрез длинной 3-5 см, рассекали кожу до подкожной клетчатки, затем формировали карман для внедрения имплантата. На рану накладывали узловатые швы.

Рисунок 7 – Внешний вид раневого покрытия из бактериальной целлюлозы
Сроки послеоперационного контроля: 3, 7, 14, 28, 90, 120-е сутки были выбраны с учетом продолжительности воспаления в области имплантатов, формирование соединительной ткани, завершение эпителизации и образования рубца. В качестве имплантата у кроликов группы 1 (n=10) выступал фрагмент марлевой салфетки, у животных группы 2 (n=10) – бактериальной целлюлозы. Размеры инородного тела составляли 3 х 3 см во всех группах. Объективными критериями контроля служили характер воспалительной реакции в области внедрения имплантата, аллергические реакции, гемосовместимость, пирогенность.
Определение эффективности бактериальной целлюлозы при заживлении термических животных проводили на крысах, группы 3 (n=20) и 4 (n=20). У крыс моделировали термический ожог кожи в области спины и оценивали процессы заживления в соответствии с фазами раневого процесса. В группе 4 в качестве раневого покрытия использовали бактериальную целлюлозу, в группе 3 раневое покрытие не применяли. Наблюдение за процессом заживления ожоговой раны и общим состоянием животных (метод «открытое поле») проводили ежедневно. Площадь ожоговой раны определяли планиметрическим способом, измерение проводили в 1-й день и на 5-е сутки после моделирования термической травмы, затем на 3-е, 7-е, 14-е, 21-е и 28-е сутки после некрэктомии.
Оценку эффективности раневого покрытия, выполненного из бактериальной целлюлозы, проводили в сравнительном аспекте с лекарственными средствами и методами, наиболее часто встречаемыми в клинической ветеринарной и гуманитарной практике. Для этого были сформированы 4 группы из кроликов, по 15 голов в каждой. Всем животным в области спины моделировали термический ожог, на 5-е сутки выполняли некрэктомию. Кроликам группы 6 на раневую поверхность 2 раза в сутки наносили спрей «Пантенол» с последующим наложением фиксирующей марлевой повязки. Животным группы 7 лечение ожоговой раны проводили с применением мазевой повязки «Бранолинд Н», которую фиксировали при помощи марлевого бинта, смену повязки проводили ежедневно. Кроликам группы 8 раневую поверхность закрывали покрытием из бактериальной целлюлозы, которая выкраивалось в условиях операционной по полиэтиленовому шаблону, повторяя контур раны, покрытие применялось однократно. У кроликов группы 5 после нанесения ожоговой травмы и проведения некрэктомии заживление раны проходило без применения лекарственных препаратов и раневых покрытий.
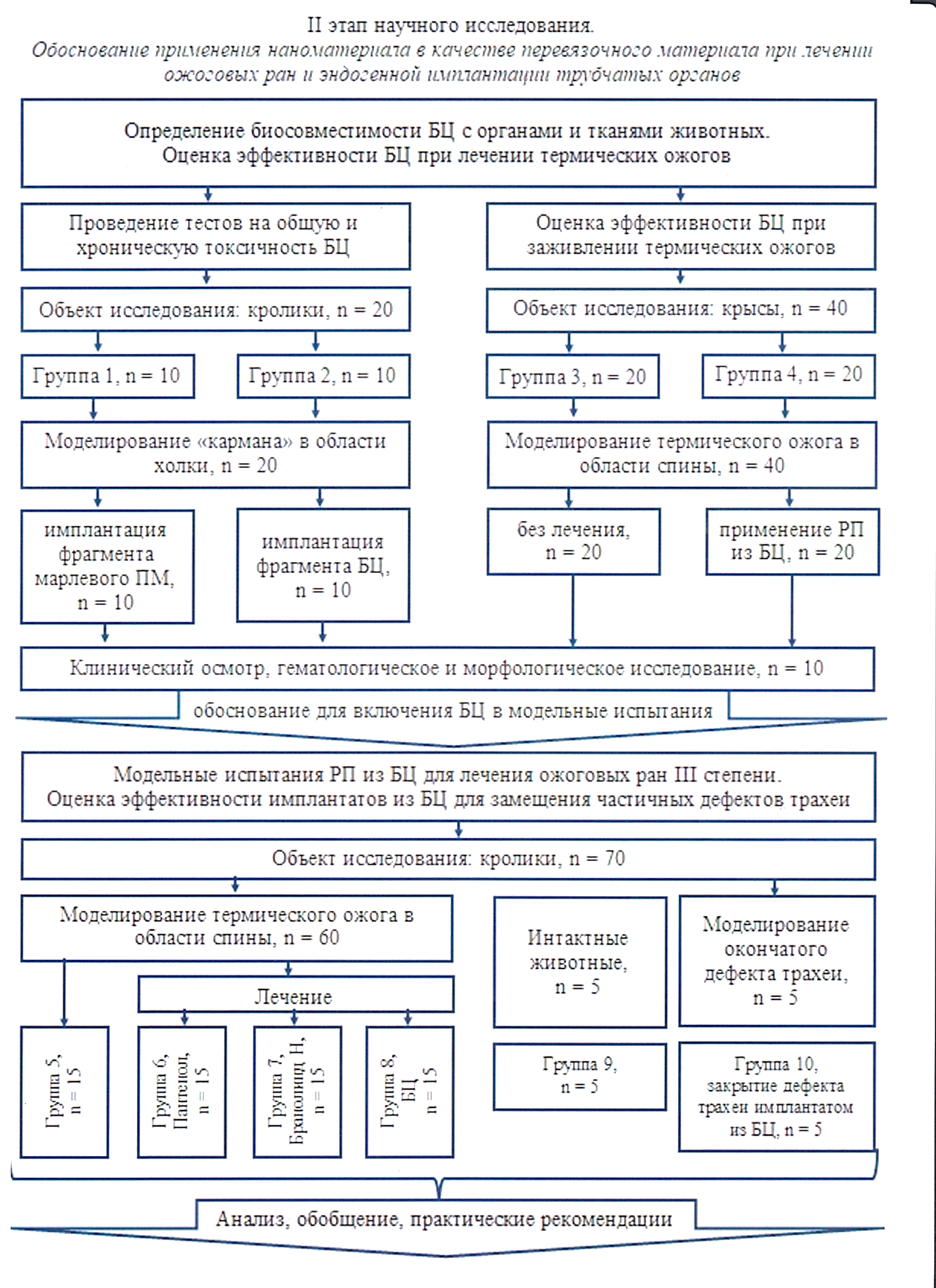
Рисунок 8 – Схема второго этапа научной работы
Оценку возможности использования бактериальной целлюлозы в качестве имплантата трахеи проводили на кроликах групп 9 (n=5) и 10 (n=5). У животных группы 10 моделировали окончатый дефект трахеи 0,8х2,3 см2 и закрывали имплантатом из бактериальной целлюлозы. В группу 8 входили интактные животные. За прооперированными животными вели систематическое наблюдение, которое включало оценку общего клинического статуса, особое внимание уделяли качеству дыхания, акту глотания. Пальпаторно исследовали вентральную часть шеи в области хирургического вмешательства: оценивали состоятельность кожных швов, наличие или отсутствие эмфиземы, гематом, сером и абсцессов. Через 6 месяцев после начала эксперимента выполняли ультразвуковое и эндоскопическое исследование трахеи. Схема второго этапа научного исследования представлена на рисунке 8.
Моделирование термического ожога кожи лабораторным животным выполняли контактным способом под нейролептанальгезией («Золетил®100», производитель Virbac, в соответствующих дозировках, внутримышечно). На депилированный участок кожи в области спины накладывали медную пластину, предварительно нагретую над пламенем спиртовки до красного каления, экспозиция 20 секунд. Затем на 5-е сутки под нейролетанальгезией проводили хирургическую некрэктомию по методике тангенциального очищения ожогового струпа, включающую послойное удаление ожогового струпа до появления жизнеспособных тканей. Очищение раны выполняли с использованием хирургических пинцетов для удержания некротической ткани, скальпеля и остроконечных ножниц. Диагноз термический ожог в области спины III степени подтверждали на основании клинических и гистологических методов.
Противоожоговую активность исследуемых покрытий оценивали по следующим критериям:
- оценка клинического состояния животных, которая включала наблюдение за общим состоянием, измерение температуры тела, пульса, частоты дыхательных движений;
- изучение регенеративных процессов поврежденных тканей у животных при помощи планиметрического и гистологического методов исследования ожоговых ран на 3-е, 7-е, 14-е, 21-е и 28-е сутки;
- изучение динамики морфологических показателей крови у животных контрольной и опытных групп до постановки опыта, а затем на 3-е, 7-е, 14-е и 21-е сутки после моделирования ожогов;
- изучение динамики общего коллагена у животных контрольной и опытных групп на 7-е и 28-е сутки после моделирования ожогов.
Клиническое сопровождение животных во время проведения модельных испытаний. После моделирования термической травмы при визуальном осмотре ожоговой раны обращали внимание на сроки формирования струпа, купирования отёка окружающих тканей, сроки полного очищения, начала появления грануляционной ткани и краевой эпителизации, полного заживления раны, фиксировали развитие инфекционных осложнений. В течение всего периода наблюдения контролировали особенности поведения животных, потребления корма и воды. Методом диагностики глубины поражения являлся визуальный осмотр с оценкой состояния дна раны и проведение «пальцевой пробы», с целью выявления степени нарушения кровотока в поврежденных участках. Критериями оценки глубины термического повреждения кожи служили признаки некроза, нарушения кровообращения, болевая чувствительность.
Забор крови для исследования у животных проводили утром, перед кормлением. Подсчет количества эритроцитов и лейкоцитов, выведение лейкоцитарной формулы проводили на гематологическом анализаторе IDEXX Laser Cyte.
Оценку скорости заживления ожоговой раны проводили планиметрическим способом. Площадь поверхностного дефекта (S) определяли по формуле Ф.Я. Божиновой (формула 1) с помощью полиэтиленовой плёнки и миллиметровой бумаги. Для этого на рану накладывали стерильный лист полиэтиленовой плёнки и переносили на неё контуры кожного дефекта. Затем полученное изображение раны накладывали на лист миллиметровой бумаги, после чего подсчитывали количество квадратных миллиметров, заключенных внутри границ контура.
S = (n+1/2 K) × C, (1)
где n – количество полных ячеек размером 2×2 мм2;
k – количество неполных ячеек размером 2×2 мм2;
С – площадь одной ячейки размером 2×2 мм2.
Для расчета площади поверхности тела (S п.т.) у крыс использовали формулу Мееh (формула 2).
S п.т. = К × W ^ 0,66 (2)
где K – коэффициент;
W – вес животного в граммах.
Скорость эпителизации ожоговой раны ![]() и уменьшение площади раны определяли по формуле Л.Н. Поповой (формула 3).
и уменьшение площади раны определяли по формуле Л.Н. Поповой (формула 3).
![]() (3)
(3)
где Sn – площадь при первом измерении, мм2;
Sn+1 – площадь при последующих измерениях, мм2;
St – число суток между измерениями.
Материалом для морфологического исследования служили ткани (кожа, подкожная клетчатка, трахея), иссеченные из зоны повреждения у животных всех исследуемых групп в разные сроки эксперимента. Взятие биоптата проводили эксцизионным методом, как по центру, так и по периферии ран. Для этого скальпелем вырезали фрагменты пораженной кожи размером 1×2 см вместе с подкожной жировой клетчаткой. Образцы фиксировали в 10 %-ном нейтральном забуференном формалине в течение 24 часов. Далее обезвоживали материал в изопропиловом спирте и заливали его в парафиновую смесь. На микротоме изготавливали срезы толщиной 5-7 мкм. Депарафинизированные срезы биоптата кожи монтировали на предметном стекле и окрашивали гематоксилином-эозином по общепринятым методикам. Чтение гистологических препаратов проводили с использованием микроскопа «Альтами БИО 1» с помощью программы «Альтами Studio». Морфометрические исследования выполняли с применением программы PhotoM 1.21, Microsort Exel на персональном компьютере.
При оценке гистологических препаратов обращали внимание на выраженность воспалительной реакции (оценивали интенсивность лейкоцитарной инфильтрации), сроки появления грануляционной ткани (формирование рыхлой подлежащей соединительной ткани, возникновение краевой эпителизации), а также структурную полноценность вновь образованного эпителия. По качественным морфометрическим характеристикам оценивали воспалительный процесс: степень деструкции клеток в очаге воспаления, отек, ростовую активность эпидермиса, направление коллагеновых волокон, наличие плазматических клеток, фибробластов, наряду с этим изучали характер васкуляризации ран.
Для изучения содержания общего коллагена изготавливали срезы по стандартной методике. Препарат исследовали в обычном и поляризованном свете с использованием микроскопа Altami БИО (×400) с использованием цифровой окулярной камеры и компьютерной программы Altami Studio и PhotoM 1.21. Для этого проводили выделение фона с яркостью 240-255, инверсию выделения и регулировку уровня до достижения значения среднего уровня яркости по гистограмме около 185. Площадь выделения фона соответствует площади, занимаемой исследуемой тканью на микропрепарате (Sтк, пикселей). На микрофотографиях было проведено измерение площади коллагеновых волокон (Sколл, пикселей) и межклеточного вещества (Sмв, пикселей). Методику оценивали по отношению оптической плотности окрашенной части препарата к оптической плотности не окрашенного фона, выраженную в условных единицах.
У животных группы 10, помимо перечисленных выше исследований выполняли ультразвуковое исследование с помощью портативного ультразвукового сканера Mindray DP-2200 (рисунок 9) и трахеоскопию с применение бронхоскопа.
Рисунок 9 – Портативный УЗИ аппарат Mindray DP- 2200
Исследования осуществляли при непрерывном режиме излучения, прямой контакт, со скоростью 1 см/сек, экспозиции 10 минут, частота сканирования 7-12 МГц.
Эвтаназию животных осуществляли внутривенным введением летальных доз средств для наркоза (Золетил 50). Процедуру проводили в соответствии с требованиями приказа МЗ СССР N 755 от 12.08.77г. «О мерах по дальнейшему совершенствованию организованных форм работы с использованием экспериментальных животных» и Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и других научных целей
Статистическую обработку проводили методами медико-биологической статистики с помощью программы STATISTICA 10. Расчеты проводили с использованием параметрического двухвыборочного t-критерия Стьюдента и критерия Фишера-Снедекора. для независимых выборок с вычислением среднего арифметического значения (М), стандартного отклонения (m), достоверности по критерию t. Доверительную вероятность (р) находили с учетом числа имеющихся наблюдений по таблице Стьюдента. Различия считали статистически достоверными при р≤0,05.
2.4 Исследование условия культивирования продуцента мedusomyces gisevii на биосинтез бактериальной целлюлозы
Получение бактериальной целлюлозы это сложный и длительный процесс. На синтез и выход целевого продукта влияют состав питательной среды и уровень активной кислотности.
Каждый целлюлозосинтезирующий микроорганизм имеет оптимальный диапазон рН для максимального выхода полимера (Goh, et al., 2012).
Изменение оптимального уровня субстрата приводит к снижению продуктивности синтеза бактериальной целлюлозы, поэтому для различных продуцентов концентрация субстрата в питательной среде должна устанавливаться экспериментально. В статических условиях культивирования бактериальная целлюлоза синтезируется в виде гель-пленки, а в динамических, в глубине питательной среды — в виде нитей (Гладышева, 2015).
В нашей работе в качестве продуцента использована симбиотическая культура Мedusomyces gisevii, в состав которой входят 8–10 видов уксуснокислых — Acetobacter sp., Acetobacter aceti, Acetobacter xylinum, Acetobacter xylinodies и др., 15–30 родов дрожжей Zygosaccharomeces sp., Schizosaccharomyces pombe, Candida tropicalis и др. (рисунок ) [].
2.4.1 Исследование кинетики биосинтеза бактериальной целлюлозы продуцентом Мedusomyces gisevii
Кинетические исследования проводили при статическом культивировании, используя D- глюкозу как C-источника и образования целлюлозы. После периода адаптации в течение 1-2 суток, концентрация D- глюкозы быстро снижается (рисунок 10). Между вторым и восьмым сутками потребляется 90 % глюкозы. Снижение количества источника углерода во времени хорошо согласуется с количеством синтезируемой целлюлозы. В диапазоне 8–10 дней эти процессы завершаются, что приводит к выходу целлюлозы – 4,8 % по отношению к используемой глюкозе (рисунок 11).
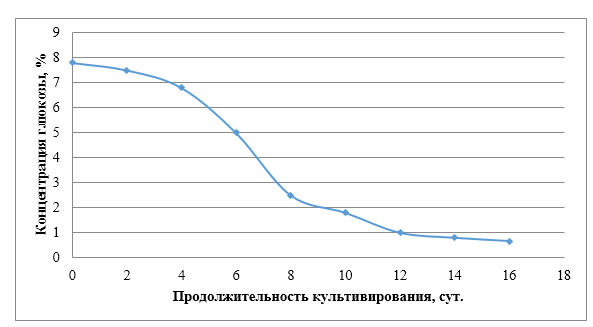
Рисунок 10 – Использование D-глюкозы симбиотической культурой Мedusomyces gisevii
В течение культивирования изменение количества глюкозы и биосинтез целлюлозы коррелирует с экспериментальными результатами Fieldler et al.
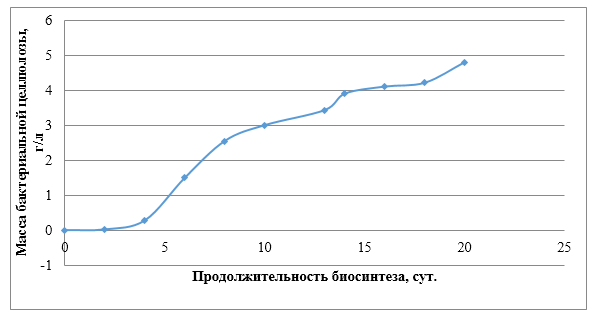
Рисунок 11 – Биосинтез бактериальной целлюлозы продуцентом
Мedusomyces gisevii
D-глюкоза как источник углерода используется не только как источник энергии, но и как предшественник целлюлозы. Моносахарид также превращается мембраносвязанной бактериальной дегидрогеназой в (кето) глюконовую кислоту. Превращение глюкозы в (кето) глюконовую кислоту снижает общую продуктивность целлюлозы. Резкое повышение кислотности (конечное значение рН=3,5), вероятно, ограничивает не только образование целлюлозы, но и снижает pH среды до субоптимальных уровней для жизнеспособности клеток и синтеза целлюлозы (Vadamme et al., 1998).
De Wulf et al. предположили жизненно важную функцию образования кето (глюконата) уксуснокислыми бактериями, поскольку мембраносвязанные дегидрогеназы, возможно, играют роль в цепи транспорта электронов. Исследования на клетках дикого типа (Park et al., 1999) показали, что продукция глюконовой кислоты оказывает не только положительное влияние на биосинтез целлюлозы, но и необходима для ее биосинтеза. Кислота может влиять на выработку целлюлозы уксуснокислыми бактериями, сначала снижая рН окружающей среды, а затем, возможно и внутриклеточное значение рН, что приводит к стабилизации и/или активации основного фермента (ов) для биосинтеза целлюлозы.
2.4.2 Исследование активной и титруемой кислотности при культивировании Мedusomyces gisevii
Благодаря определенным подвижным соотношениям микроорганизмов в условиях культивирования симбиотическая культура Мedusomyces gisevii способна утилизировать различные субстраты и устойчива к фагам. Предварительно проводили адаптацию симбиотической культуры 7 суток на исследуемой питательной среде. Инокулят вносили в питательные среды в количестве 10 %, 20 % и 30 % от объема питательной среды, культивирование проводили в статических условиях при 25 – 27 ºС в течение 20 суток.
 а а |
 б б |
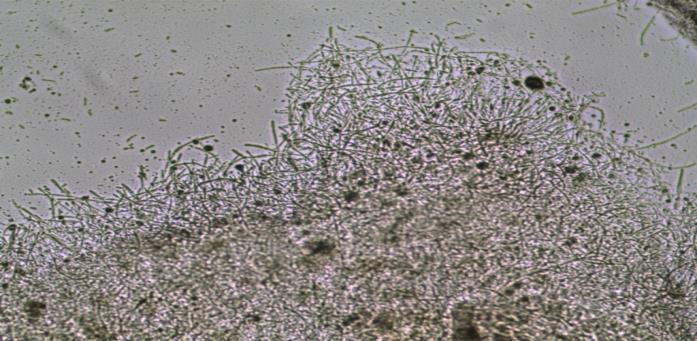
| Рисунок 12 – Морфология клеток симбиоза Мedusomyces gisevii (а)
и микрофибриллы бактериальной целлюлозы (×1000) (б) |
|
Процесс переработки субстрата начинают дрожжи, сбраживая его до этилового спирта и углекислоты. Далее уксуснокислые бактерии окисляют образовавшийся спирт до уксусной кислоты, поскольку это многовидовая многоштаммовая культура, образуются разнообразные побочные продукты. Это может быть не только глюконовая кислота, но и этанол, уксусная кислота, глицерин и ряд других соединений (янтарная, молочная, яблочная кислоты).
Изменения активной кислотности, представленные на рисунке 13 , косвенно свидетельствуют о накоплении вторичных метаболитов, определенный уровень которых снижают накопление биомассы дрожжей. Значение рН культуральной жидкости, содержащей 10 % инокулята, значительно снижалось с 4,5 до 3,8 в первые четверо суток, возможно, это связано с саморегулированием симбиотической культурой активной кислотности до оптимальных значений жизнедеятельности уксуснокислых бактерий. Определено, что для всех исследуемых образцов культуральной жидкости через 20 суток показатель активной кислотности достигал одинакового значения 3,3 ± 0,05.
Показатель титруемой кислотности отражает наличие всех кислотных компонентов раствора (рисунок 14).
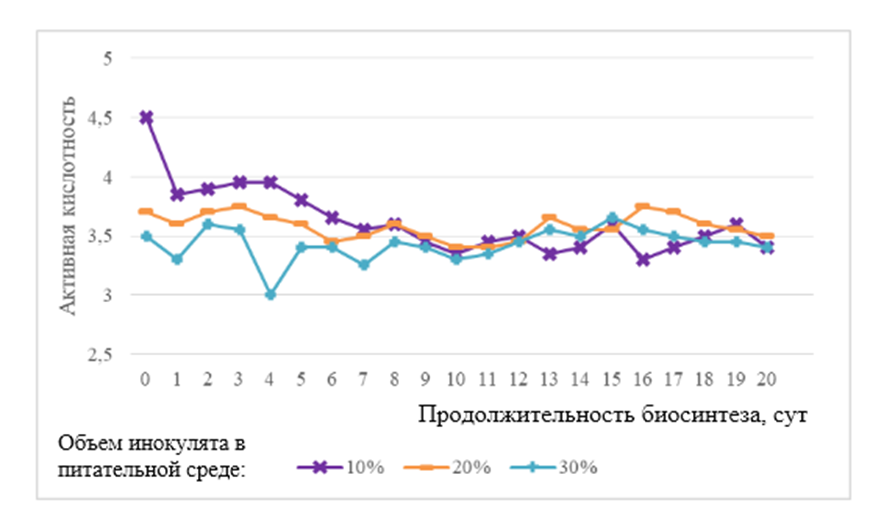
Рисунок 13 – Изменение активной кислотности сред при культивировании Мedusomyces gisevii
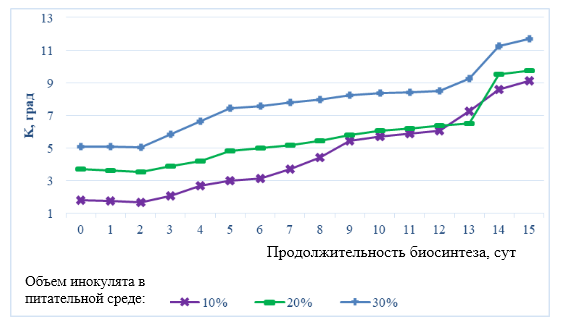
Рисунок 14 – Изменения общей титруемой кислотности сред при культивировании Мedusomyces gisevii
На рисунке изменения титруемой кислотности, можно выделить три участка: первые четверо суток культивирования происходит медленное накопление кислотных составляющих. Скорость образования кислотных метаболитов культуральной жидкости симбиоза Мedusomyces gisevii значительно возрастает на четвертые сутки. После 4–х суток культивирования, начинается активный рост титруемой кислотности.
Таким образом, во время культивирования Medusomyces gisevii во всех вариантах определено снижение рН до значения 3,3 ± 0,05 и возрастание титруемой кислотности до 11 ± 0,5. В условиях биосинтеза БЦ на 4-е сутки установлено значительное снижение величин рН на 22,0 – 24,3 %. Это может быть связано с иммобилизацией целлюлозосинтезирующих микроорганизмов в структуре бактериальной целлюлозы, что способствует активизации деятельности симбиотического сообщества микроорганизмов и его продуктивности.
Структура БЦ обеспечивает доступность уксуснокислым бактериям питательного субстрата и возможности его превращения в последовательности глюкоза → этанол → ацетальдегид → уксусная кислота.
2.4.3 Влияние на биосинтез бактериальной целлюлозы температуры и концентрации глюкозы
Для определения оптимальных условий биосинтеза исследовали влияние температуры на выход бактериальной целлюлозы (рисунок 15), количество инокулята в питательной среде 20 %.
Определено, что оптимальный диапазон температур для биосинтеза БЦ является от 24 до 27 0С, количество синтезируемого материала 4,8 — 5,3 г/л. Снижение и повышение температуры культивирования на 3 0С, снижает выход на 29,7 и 51,4 % соответственно.
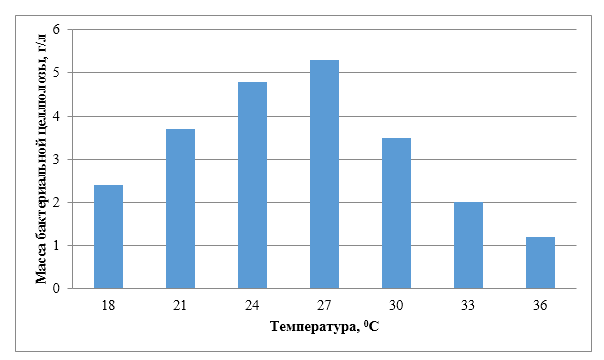
Рисунок 15 – Зависимость выхода бактериальной целлюлозы от температуры на 21 сутки культивирования.
Установлено, что концентрация глюкозы в питательной среде влияет на выход бактериальной целлюлозы, результаты представлены на рисунке 16.
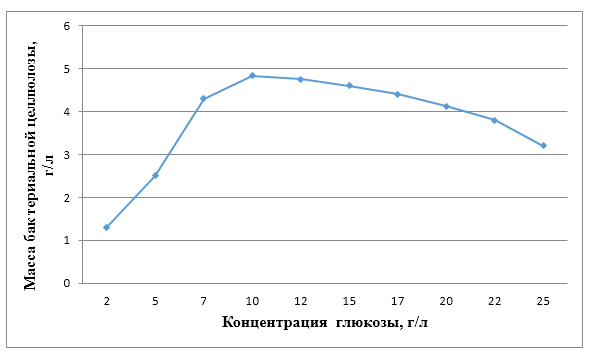
Рисунок 16 – Зависимость выхода бактериальной целлюлозы от концентрации глюкозы на 21 сутки культивирования, при Т=24 0С.
Определено, что при концентрации глюкозы 10,00 % (100 г/л) уксуснокислые бактерии продуцировали наибольшее количество целлюлозы, однако увеличение концентрации глюкозы с 10,0 до 25,0 % (от 100 до 250 г/л) привело к постепенному снижению биосинтеза. Этот вывод согласуется с более ранним исследованием Embuscado et al., 1994; Younesi et al., 2019, где наблюдалось снижение производства целлюлозы, когда концентрация субстрата была выше оптимального уровня. Следовательно, соответствующий уровень глюкозы необходим для максимизации производства бактериальной целлюлозы. Концентрация глюкозы 2,0 % (20 г/л) и 25,0 % (250 г/л) определяет самый низкий выход бактериальной целлюлозы. Дефицит глюкозы в питательных средах менее 2,0 % (20 г/л), как источника углерода, является причиной снижения биосинтеза целлюлозы. Увеличение количества глюкозы в питательной среде > 10,0 % приводит к резкому увеличению метаболических побочных продуктов, производящих уксуснокислыми бактериями, что приводит к ингибированию производства целлюлозы.
2.4.4 Влияние на биосинтез бактериальной целлюлозы отношения поверхности / высоты культуральной жидкости
Формы и размеры биореактора для биосинтеза бактериальной целлюлозы возможны различные, но наиболее эффективное получение биологически активного биоматериала с целью его максимального выхода, соотношение площади к высоте культуральной жидкости, находится в пределах 70-76 см. Данные представлены на рисунке 17.
Продуцентом биологически активного биоматериала являются аэробные микроорганизмы (Acetobacter и Gluconacetobacter симбиотической культуры Medusomyces gisevii), для которых необходимо присутствие кислорода воздуха, поэтому на выход биоматериала при статическом культивировании влияет только соотношение площади к высоте культивирования среды, а не размеры и форма биореактора, что и определяет экономический эффект его производства.
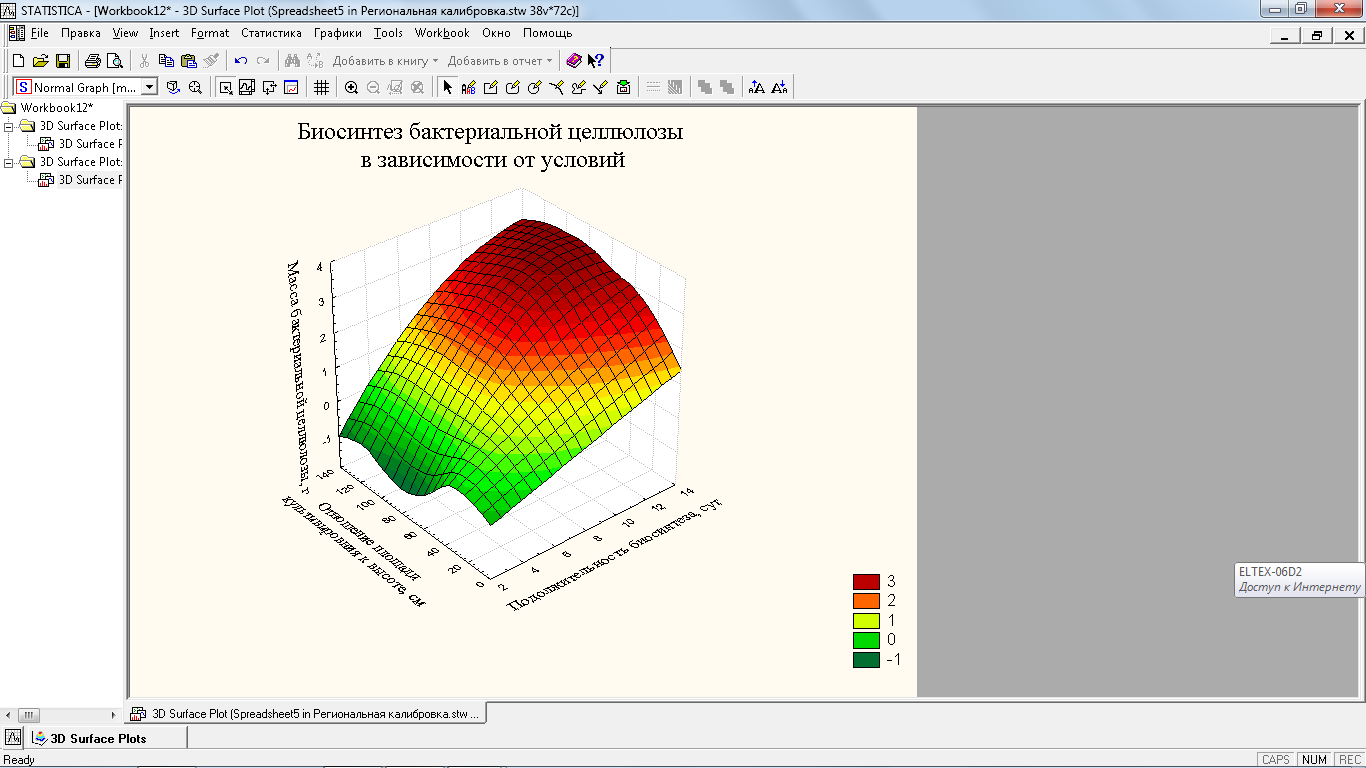
Рисунок 17 – Биосинтез бактериальной целлюлозы в зависимости от условий культивирования, г/л
Установлено, что максимальный биосинтез бактериальной целлюлозы происходит именно при отношении площади поверхности к высоте в пределах 70-76 см, а при дальнейшем повышении этого соотношения, масса получаемого биоматериала уменьшается, снижается и степень биоконверсии глюкозы (рисунок 18).
Низкое значение рН, после 8-ми суток культивирования Medusomyces gisevii, обусловленное образованием кислотных метаболитов, понижает активность симбиотической культуры, но не подавляет полностью деятельность целлюлозосинтезирующих бактерий. Так скорость биосинтеза с 4-х по 8-е сутки максимальна при всех исследуемых отношениях площади к высоте культивирования: определено наибольшее значение скорости для S/h = 75,94, что составило 0,57 г/л в сут, после 8-х суток скорость снижается до 0,18 г/л в сут.
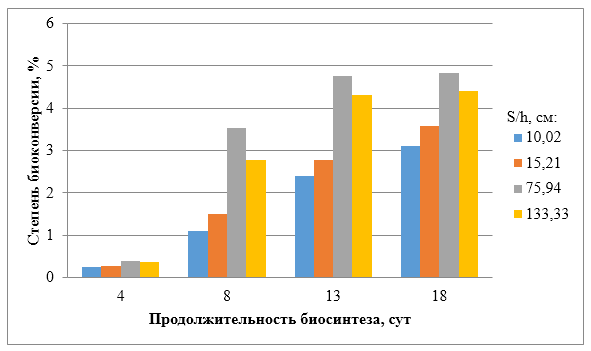
Рисунок 18 – Степень конверсии в зависимости от продолжительности биосинтеза
Аналогичная зависимость определена и в отношении степени биоконверсии глюкозы в БЦ, так после 8-х суток скорость конверсии меньше в 3,23 раза в сравнении с периодом культивирования с 4-х по 8-е сутки. На 13 сутки биосинтеза степень конверсии глюкозы достигает максимального значения 4,76 % для S/h = 75,94.
Были исследованы в отношении биосинтеза БЦ, разные объемы питательных сред и разные объемы инокулята. Однако было обнаружено, что на производство целлюлозы не влиял объем инокулята, поскольку различия в выходе целлюлозы между опытами с различными объемами инокулята не были статистически значимыми (данные не показаны). Это указывает на то, что количество клеток, введенных в культуру, практически не влияет на количество производимой целлюлозы. При соотношении объема к высоте культуральной жидкости менее 133 см, глубина была настолько малой, что целлюлоза синтезировалась только в виде очень тонкого слоя и, следовательно, была ограничена в своем выходе. Меньшие значения соотношения S/h позволили установить связь между площадью поверхности и выходом целлюлозы (рисунок 18). Поэтому при условии, что для обеспечения достаточной глубины использовался необходимый объем среды, самая высокая степень биоконверсии глюкозы и максимальный выход целлюлозы были получены из контейнеров с самой большой площадью поверхности.
В результате проведенных исследований, установлено:
— в процессе биосинтеза бактериальной целлюлозы симбиотической культурой Medusomyces gisevii уровень активной и титруемой кислотности. саморегулировался продуцентом до значений 3,3 ± 0,05 и 11 ± 0,5 соответственно, и не нуждался в корректировке. В результате при этом создаются благоприятные условия для жизнедеятельности целлюлозосинтезирующих микроорганизмов и биосинтеза бактериальной целлюлозы, но подавляющие развитие посторонней микрофлоры
— наибольшее количество бактериальной целлюлозы 4,8 ± 0,2 г/л в течение 26 –и суток синтезируется в диапазоне температур от 24 до 27 °С, степень конверсии при этих условиях – 6,67 ± 0,15 % (рисунок 15). Более низкая температура культивирования способствует снижению скорости ферментативных реакций в клетках целлюлозосинтезирующих бактерий, а температура выше этого оптимума снижала активность ферментов, входящих в целлюлозосинтезирующий энзимный комплекс, что снижало выход БЦ;
— концентрация РВ в питательной среде, обеспечивающая максимальный выход БД, находилась в диапазоне от 8 до 13 г/л (рисунок 16). При недостаточных концентрациях РВ в питательной среде целлюлозосинтезирующим микроорганизмам не хватало питания для биосинтеза БЦ, при избыточной концентрации РВ происходил синтез побочных продуктов (органических кислот), которые негативно влияли как на целлюлозосинтетическую активность микроорганизмов, так и на качество БЦ;
— симбиотическая культура не нуждалась в добавлении в питательную среду стимулирующих компонентов, таких как дрожжевой экстракт и этанол. В ходе своего развития у симбиоза сложился особый вариант обмена веществ, при котором все необходимые для его нормального функционирования вещества синтезируются у разных партнеров, что благоприятно для биосинтеза БЦ в промышленных условиях;
Использование продуцента Medusomyces gisevii является выгодным при масштабировании процесса биосинтеза БЦ, т.к. не потребуется покупка соответствующих реактивов для поддержания уровня активной кислотности, снизятся трудозатраты, поэтому это упростит аппаратурное оформление процесса.
2.5 Исследование морфологии, физико-механических и физико-химических свойств бактериальной целлюлозы
2.5.1 Определение влагоудерживающей и водопоглощающей способности бактериальной целлюлозы
Определена водоудерживающая и водопоглощающая способность бактериальной целлюлозы, очищенной от клеток. Водоудерживающая способность (WHC) гель пленок бактериальной целлюлозы составила 80,35 ± 0,33 г/г.
Далее определяли водопоглощающую способность дегидратированных образцов БЦ. Набухание происходит благодаря комбинированному эффекту набухания стенок фибрилл и разрыва межфибрилльных связей, что приводит к их смещению и вызывает увеличение объема. Это приводит к возникновению свободного пространства для поглощающей жидкости. Максимальное расширение волокон зависит от поглощающей способности фибрилл жидкости, т. е. способности набухающей жидкости образовывать водородные связи с гидроксильными группами целлюлозы. Кроме того, сорбция воды целлюлозой может значительно повлиять на свойства материалов на основе целлюлозы для медицинских изделий.
Определено, что сушка БЦ даже при низких температурах приводит к значительному снижению его водопоглощающей (набухающей) способности, WAC = 6,82 ± 0,12 г / г, что может быть связано со значительным изменением внутренней структуры полимера. Исследования распределения жидкости в сетчатой трехмерной структуре БЦ проводили согласно британской фармакопее для альгинатных раневых повязок, методом центрифугирования среды (Qin, 2004, 2008).
Бактериальная целлюлоза имеет пористую фибриллярную сеть, образованную целлюлозными микрофибриллами диаметром около 100 нм, поэтому часть жидкости может удерживаться капиллярами нанопористой структуры, другая — удерживаться в фибриллах или прочно связываться с большим количеством гидроксильных групп поверхности нанофибрилл бактериальной целлюлозы.
Поглощенную жидкость в повязках можно разделить на два вида: жидкость, удерживаемая между волокнами и жидкость, удерживаемая внутри отдельных волокон. Так, капиллярная влага способна мигрировать внутри пространственной структуры перевязочного материала, что может вызвать мацерацию окружающей здоровой кожи в клиническом применении, в то время как второй вид жидкости — связанная влага, более стабилен, что необходимо для поддержания оптимальной влажности целебной среды (Qin, 2004, 2008) .
Определено, что количество свободной влаги, жидкости удерживаемой между фибриллами набухающих образцов дегидратированной бактериальной целлюлозы (W2 – W3)/W4 составило 4,84 ± 0,06 г/г, что меньше в сравнении с нативными образцами очищенных гель пленок бактериальной целлюлозы (W0 − W1)/ W4 в 6,56 раза. Такая же тенденция установлена и в отношении жидкости, удерживаемой внутри фибрилл адсорбционными и физико-химическими силами (связанная влага): (W1 – W4)/W4 больше (W3 – W4)/W4 в 16,43 раза. Это может быть связано с уплотнением нано структур фибрилл бактериальной целлюлозы и формированием новых связей как внутри фибрилл, так и между ними.
Соотношение (W0 – W1)/(W1 – W4) и (W2 – W3)/(W3-W4) отражает распределение жидкости внутри раневых повязок. Установлено, что дегидратированные образцы после набухания (W2 – W3)/(W3-W4) обладали в 2,37 раза меньшим показателем отношения количества свободной и связанной влаги (W0 – W1)/(W1 – W4), чем образцы нативной бактериальной целлюлозы.
2.5.2 Исследование кинетики сушки бактериальной целлюлозы
Содержание воды и скорость ее изменения при высушивании – являются важными характеристиками материалов, применяемых в качестве перевязочных средств или искусственной кожи. В предыдущих исследованиях (Lamke et al., 1977) установлено, что потеря воды в результате испарения различных ран, в том числе гранулирующих ран составляет от 11,6 ± 1,1 до 214,1 ± 8,4 г/м2/ч, в то время как температура кожи поддерживалась на уровне около 36 0C. Потеря воды в результате испарения может быть уменьшена путем покрытия ран перевязочными средствами. Например, биологические повязки могут уменьшить потерю воды на 90 %, в то время как перевязочные средства из искусственных материалов могут уменьшить ее на 73 % (Lamke, et al., 1977).
Установлено, что определенная влажность перевязочных средств необходима для заживления ран. Недостаток воды в ране может повлиять на клеточный метаболизм и привести к ее высыханию (Czaja, 2006). Влажная среда перевязочных средств не только способствует регенерации тканей, но и эффективно облегчает боль.
В составе нативных гель пленок бактериальной целлюлозы находится до 98,2 % воды. Бактериальная целлюлоза, обладая высоким содержанием воды и сорбционной способностью, демонстрирует медленное уменьшение воды в результате испарения, что может способствовать поддержанию влажности раны в течение более длительного времени. Применение бактериальной целлюлозы может увеличить способность заживления раны, что позволяет широко использовать ее в качестве биоматериала для перевязочных средств, способствующих заживлению ран (Shezad, еt al., 2010; Ul-Islam, еt al., 2011).
 а
а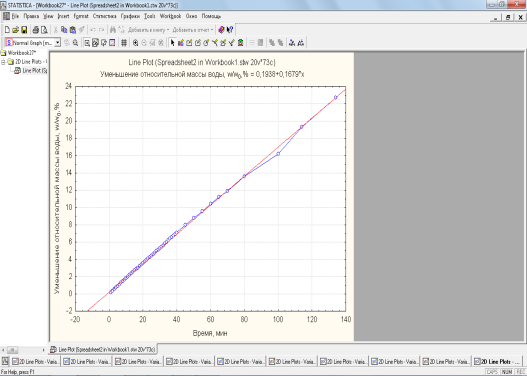 б
б
Рисунок 19 – Изменение относительной массы воды в процессе испарения от времени, образцы бактериальной целлюлозы а –нативной и б – набухшие дегидратированные. Каждый образец тестировался пять раз и усреднялся (n = 5)
Поэтому в дальнейших исследованиях определяли скорость потери воды в результате испарения образцов нативных и после набухания дегидратированных гель пленок бактериальной целлюлозы. Влажные образцы взвешивали в разные промежутки времени, чтобы контролировать потерю воды при Т=37 0С и контролируемом уровне влажности 20 %, что давало потерю веса, представленную на рисунке 19.
Потеря веса была быстрой в течение 60 минут, особенно для набухших дегидратированных образцов бактериальной целлюлозы, однако оба образца демонстрировали значительные различия в весе даже через 3 часа.
Наибольшая скорость потери веса в результате сушки определена для набухших дегидратированных образцов БЦ 0,17 %/мин, изменение массы происходило в течение 4 часов (рисунок 20). Нативные образцы бактериальной целлюлозы обладали меньшей скоростью потери веса в 2,62 раза, а среднее изменение относительной массы образцов в результате сушки составило 0,0642 % в минуту, образцы достигли постоянного сухого веса через 22 часа.Это может быть связано с большим количеством связанной влаги в образцах нативной БЦ.
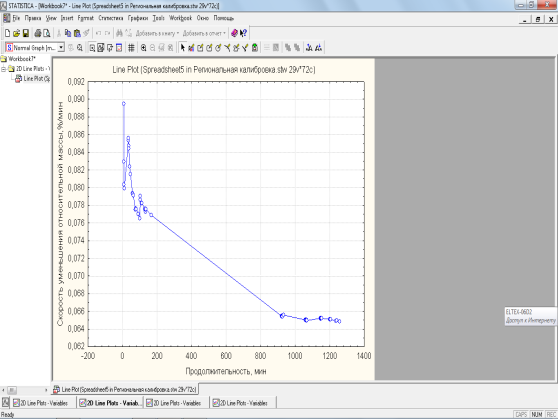 а
а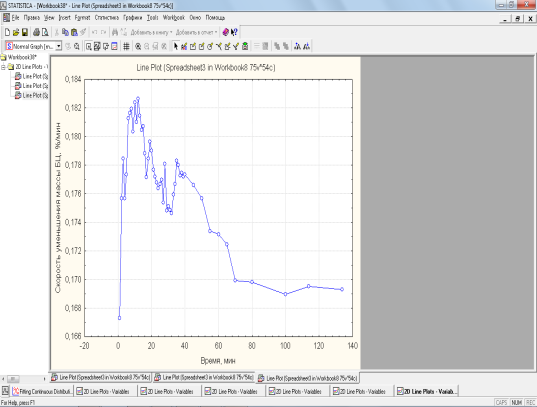 б
б
Рисунок 20 – Скорость изменения относительной массы воды в процессе испарения от времени, образцы бактериальной целлюлозы (а – нативной, б – набухшие дегидратированные)
Скорость потери воды уменьшается для всех образов бактериальной целлюлозы в начальный период сушки. Так, например, для набухшего образца дегидратированной бактериальной целлюлозы такое снижение происходит от 0,182, до 0,175 %/мин в течение 60 минут. После чего, скорость уменьшения относительной массы (ʋw/w0) остается постоянной величиной равной 0,169 ± 0,0005 %/мин. Установлено для образцов нативной целлюлозы значение ʋw/w0 меньше в сравнении с дегидратированными образцами в 2,2 раза и составило 0,082 %/мин. Отмечено, что снижение скорости потери воды для нативной целлюлозы происходит в течении 750 минут, и достигает 0,075 %/мин, что значительно меньше, чем для дегидратированных образцов.
Ранее установленно, что количество жидкости, удерживаемое внутри фибрилл адсорбционными и физико-химическими силами (связанная влага) в дегидратированных образцах после набухания значительно меньше, чем в образцах нативной бактериальной целлюлозы. Это может быть, определяющим фактором и для низких значений скорости потери водя ʋw/w0 образцами нативной бактериальной целлюлозы.
Таким образом, медленная потеря воды такими образцами может поддерживать влажность раны в течение более длительного времени, поэтому далее в качестве перевязочного средства ожоговых ран в эксперименте на животных применяли нативные образцы гель пленок бактериальной целлюлозы.
2.5.3 Исследование химического состава бактериальной целлюлозы ИК спектральным методом
Волновое число (cм-1)
Коэффициент пропускания (%)
Рисунок 21 – ИК спектры бактериальной целлюлозы. Красная линия – нативная БЦ, черная линия – очищенная БЦ
Нативные образцы БЦ обладают сильным характерным пиком OH-растяжения в целлюлозе (рисунок 21), проявляющимся при 3349,7 см-1 (широкая полоса от 3700 до 3000 см-1) (Lu & Jiang, 2014). Пики при 2896,5 см-1 можно отнести к растягивающей вибрации C-H в целлюлозе (Lu & Jiang, 2014). Область диапазона 3000-2800 см-1 связана с колебаниями групп CH2 и CH2-OH (Li and Renneckar 2011). Полоса поглощения при 1649 см-1 относится к деформационным колебаниям ОН-группы связанной воды (Черенкова и др., 2008).
Серия полос от 1200 до 1000 см-1 указывает на растягивающую вибрацию C-O-C эфирной связи в целлюлозе, а также на растягивающую вибрацию C-O первичных (C6) и вторичных (C2, C3) спиртов. Пики спектра в диапазоне от 1163 см-1 до 1203 см-1 связаны с асимметричной и симметричной растягивающей вибрацией гликозидной связи соответственно (Качуракова и др. 2002; Dokken, Davis, & Marinkovic, 2005). Пик при 1428 см-1 можно отнести к деформации изомеров и С-Н2, изогнутых в целлюлозе. Наиболее характерные полосы для целлюлозы на 1036 см-1 и 898 см-1, пики связаны с растягивающей деформацией С-О и деформацией С1-Н в гликозиде (Jiang и Hsieh 2015). Эти полосы могут служить индикаторами присутствия целлюлозы в композиционном материале (Chylinska et al. 2016; Szymańska-Chargot et al. 2015).
Таким образом, полученные ИК-спектры бактериальной целлюлозы показали все пики, характерные для растительной кристаллической целлюлозы Avicel PH-101 (Szymańska-Chargot et al., 2011), без каких-либо дополнительных спектральных признаков. Следует сделать вывод, что в БЦ отсутствуют примеси белков и остатки бактериальных клеток, продуцентов целлюлозы. Эти результаты подтверждают, что образцы БЦ служили в дальнейших экспериментальных исследованиях сырьем для производства нанокомпозитов, состоящих из очищенной целлюлозы (Qin, 2004, 2008).
Пики при 710 см-1 и 750 см-1 характерны для целлюлозы Iβ и целлюлозы Iα соответственно. Фракцию целлюлозы Iα рассчитывали с использованием высот пиков при 750 и 710 см-1 по уравнению, определенному Kataoka & Kondo, 1999.
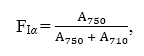
где A750 значения поглощения при 750см-1 и A710 при 710см-1 .
Найденное значение доли фракции Iα было близко к 0,45 – что хорошо согласуется со значениями, приведенными S. Keshk и K. Sameshima (2006).
2.5.4 Определение газопроницаемости и физико- механических характеристик бактериальной целлюлозы
Особые свойства БЦ определяются ее высокой степенью кристалличности, выраженной ориентацией гликозидных цепей в фибриллах и высокой степени чистоты. Внутримолекулярные и межцепочечные водородные связи придают ее фибриллам высокую прочность в сочетании с гибкостью.
Рисунок 22 — Молекулярная структура целлюлозы [Huang, Y., Zhu, C., Yang, J., Nie, Y., et al., Cellulose, 2014, vol. 21, p. 1.].
Их наноразмерная толщина обеспечивает высокую концентрацию гидроксильных групп и развитую внутреннюю поверхность (рисунок 22). В результате образуется разветвленная сеть из фибрилл БЦ, связанных друг с другом, в отличие от растительной целлюлозы, волокна которой имеют значительно большую толщину и меньшую плотность водородных связей.
Материалы, используемые как покровные средства для раневой обработки, должны сохранять свою целостность во время их использования, кроме того обладать гибкостью и способностью к растяжению, что необходимо для повторения рельефа раневой поверхности перевязочным материалом. Поэтому измерение прочности на растяжение часто применяется для оценки эффективности материалов для обработки ран (Lee, Park, Hwang, Kim, Kim & Suh, 2001).
На физико-механических свойства БЦ методом одноосного растяжения может влиять как неоднородность толщины образцов (из-за неоднородного роста БЦ при биосинтезе), так и отсутствие преобладающей ориентации фибрилл. Кроме того, прочностные характеристики существенно зависят от содержания воды в образцах бактериальной целлюлозы.
Поэтому в дальнейших исследованиях анализировали физико-механические свойства дегидратированнных (высушенные до постоянной массы) изотропных образцов БЦ, полученные в статических условиях культивирования (рисунок 23), до и после очистки раствором гидрооксида

Рисунок 23 – Испытание бактериальной целлюлозы на деформацию-растяжение
натрия (Приложение А и Б) и анизотропных образцов, полученные при динамических условиях из биореактора с вращающимся барабаном (Приложение В). Результаты испытаний по данным деформации-растяжения гидрогелевых образцов БЦ после очистки (Приложение Г) и набухших дегидратированных образцов представлены на рисунке 25-26. Очищенные образцы БЦ диспергировали, массу прессовали в пластины, а затем сушили. Определяли физико-механические свойства этих образцов до- и после набухания (Приложение Д и Е).
Механические свойства образцов бактериальной целлюлозы представлены в таблице 1, в сравнении приведены данные показатели для растительной целлюлозы на примере бумаги (Приложение Ж).
Таблица 1 – Физико-механические свойства дегидратированой бактериальной целлюлозы
| Материалы | h, мм | Модуль Юнга (МПа) | Предел прочности при растяжении (МПа) | Относительное удлинение при разрыве (%) |
| Бумага | 302 | 12,5 | 6,0 | |
| без очистки | 0,12 | 180,3±10,6 | 11,6±0,8 | 8,2±0,6 |
| очищенная | 0,07 | 428±24,1 | 26±1,6 | 7,5±0,4 |
| очищенная | 0,13 | 302±14,3 | 23±1,1 | 11,1±0,8 |
| диспергированная | 0,03 | 870±0,6 | 38±0,6 | 4,2±0,6 |
| анизотропная (продольная) | 0,08 | 15±0,6 | 2,1±0,6 | 15,2±1,3 |
Нативная БЦ состоит из случайно ориентированных параллельных агрегированных цепей глюкана, в которых сильные ковалентные связи простираются в продольном направлении и сшиты водородными связями. Во время очистки раствором щелочи натрия содержание азотсодержащих компонентов в бактериальной целлюлозе, таких как белки и нуклеиновые кислоты, а также низкомолекулярных полисахаридов существенно уменьшается. Их удаление увеличивает вероятность появления прямых контактов между макромолекулами целлюлозы. Обработка щелочью сначала раскрывает структуру фибрилл БЦ, разрушая внутрицепные водородные связи и затем вызывает образование более термодинамически стабильной структуры целлюлозы, что определяет изменение прочностных характеристик образцов дегидратированной БЦ.
Установлено, что очистка слабощелочными растворами бактериальной целлюлозы (h = 0,07 мм) увеличивает физико-механические свойства дегидратированных образцов (рисунок 24): модуль Юнга в 2,4 раза и предел прочности на разрыв в 2,2 раза больше в сравнении с дегидратированной БЦ до обработки щелочью (таблица 1).
Определено, что модуль Юнга ниже на 29,4 % для очищенных образцов дегидратированной БЦ с большей толщиной – 0,07 мм, в сравнении с образцом h = 0,13 мм. Это может быть связано с большим временем биосинтеза и формированию макроструктуры фибрилл БЦ. В результате увеличивается их диаметр, уменьшается число межфибриллярных связей вдоль каждой фибриллы и плотность структуры снижается после очистки щелочными растворами.
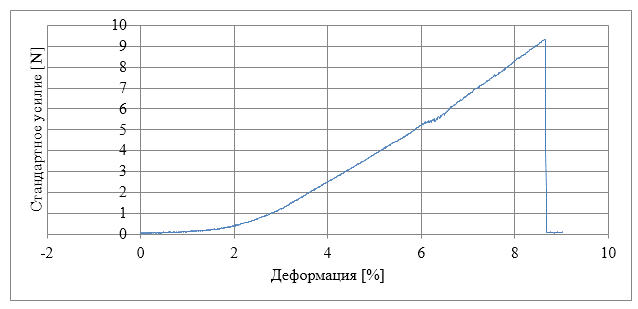
Рисунок 24 – Кривая усилие-деформация дегидратированной очищенной бактериальной целлюлозы (h = 0,07 мм)
Деформация при разрыве образцов как неочищенной так и обработанной раствором щелочи дегидратированной БЦ меньше, чем у других полимерных пленок (пленка полиэтиленовая – 330-400 %, ГОСТ 10354-82 Пленка полиэтиленовая. Технические условия (с Изменениями N 1, 2, 3, 4, 5)), что связано с формированием сетчатой структуры, которая ограничивает растяжение или удлинение молекул полимера (относительное удлинение при разрыве составило до и после очистки 8,2 ± 0,6 % и 7,5 ± 0,4 % соответственно).
Определено, что режим слабой щелочной обработки, применяемый для очистки от остатков питательной среды и клеток симбиотической культуры образцов бактериальной целлюлозы способствует улучшению прочностных характеристик биополимера.
В отличие от статических условий культивирования, дегидратированная бактериальная целлюлоза из биореактора с вращающимся барабаном обладала анизотропными свойствами на растяжение и меньшей прочностью. В частности, прочность на разрыв дегидратированной анизотропной БЦ составляет менее 10 % от прочности образцов при статическом способе культивировании (таблица 1). Анизотропия прочности на растяжение дегидратированной БЦ из вращающегося барабанного биореактора может быть связана с вращением барабана, в то время как более низкая прочность на разрыв связана с более разреженной сетью и значительно более низким содержанием сухого вещества. Хотя дегидратированные образцы бактериальной целлюлозы из биореактора с вращающимся барабаном менее прочные, но обладали лучшим свойством при растяжении (относительное удлинение при разрыве 15,2 ± 1,3 %), чем образцы, полученные при статическом культивировании (7,5 ± 0,4 %).
Испытание на деформацию гидрогелей бактериальной целлюлозы (рисунок 25) в условиях одноосного растяжения с постоянной скоростью показало, что сопротивление деформации непрерывно растет и образцы демонстрировали общее вязкоупругое поведение во время растяжения. В области низкой деформации (0 – 20 %) приложенное напряжение меньше зависело от деформации растяжения (таблица 2), при этом значения напряжений остаются на порядок ниже, чем те, которые получены при испытаниях высушенных образцов целлюлозы.
Таблица 2 – Физико-механические свойства гидрогелей бактериальной целлюлозы
| Материалы | h, мм | Модуль Юнга (МПа) | Предел прочности при растяжении (МПа) | Относительное удлинение при разрыве (%) |
| неочищенный до сушки | 0,9 | 3,1 | 1,2 | 46,2 |
| очищенный до сушки | 0,9 | 1,5±0,3 | 0,275±0,020 | 49±3,6 |
| набухшая неочищенной | 0,13 | 127,2±13,9 | 25,1±1,8 | 21,1±0,9 |
| набухшая очищенной | 0,08 | 250,4±20,1 | 31,4±2,3 | 18,5±0,8 |
| набухший диспергированной | 0,13 | 202±15,6 | 3,4±0,6 | 4,2±0,7 |
Отсутствие линейной зависимости напряжение-деформация в начальной области кривой указывает на то, что на первых этапах деформации растяжения фибриллы, которые изначально имеют случайную ориентацию, переориентируются; затем они растягиваются, как видно из постепенного увеличения наклона кривых напряжение-деформация. Эта модель поведения характерна для полимеров с сетчатым расположением волокон.
Наличие двойного пика на кривых усилие-деформация (рисунок 25, точки А и В) позволяет предположить, что при деформации гидрогеля БЦ сначала разрываются более короткие цепи; затем, когда усилие увеличивается, более длинные цепи разрываются после достижения предельной степени натяжения.
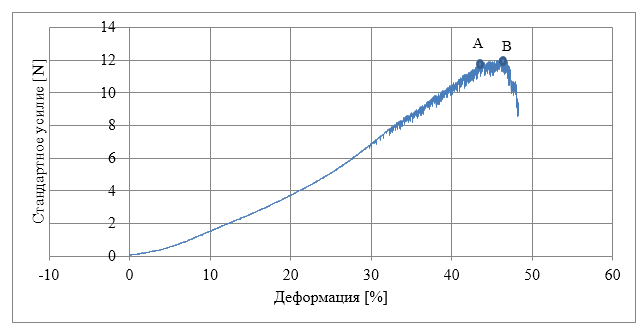
Рисунок 25 – Кривая усилие-деформация гидрогеля неочищенной (нативной) бактериальной целлюлозы
За этим следовала почти линейная пластическая область (20–45 %) до тех пор, пока напряжение не стало достаточным для разрушения образца, когда деформация была выше 45–50 %, что позволит перевязочным средствам хорошо прилегать к участкам раны.
Таким образом, при отсутствии напряжений сеть состоит из случайно расположенных фибрилл БЦ, которые возможно затем ориентируются в направлении деформации, о чем свидетельствует увеличение наклона кривой усилие-деформация. Линейная пластическая область была использована для расчета кажущегося модуля Юнга (Drury, Dennis, & Mooney, 2004). Гидрогели очищенной бактериальной целлюлозы обладают пределом прочности при растяжении 0,275 ± 0,020 МПа, деформацию при разрыве 49,8 ± 3,6 % и модуль Юнга 1,5 ± 0,3 МПа. Прочность на разрыв и модуль упругости сравнимы с таковыми для сонной артерии свиньи (предел прочности 1,0 ± 0,2 МПа, модуль Юнга 2,3 ± 0,1 МПа) (Bäckdah et al, 2006.), что дает возможность в перспективе рассматривать его в качестве каркаса для тканевой инженерии (в сравнении с пределом прочности на растяжение губки (0,016 ± 0,004 МПа) и клеточного геля (0,03 ± 0,014 МПа) в мезенхимальных стволовых клетках (MSC) — коллагеновая система тканевой инженерии) (Nirmalanandhan et al, 2007; Shearn et al, 2007.)
В дальнейших исследованиях определяли физико-механические свойства гидрогелей дегидратированной бактериальной целлюлозы после набухания (рисунок 26). Установлено, что набухшие дегидратированные образцы бактериальной целлюлозы обладали меньшим относительным удлинением на разрыв на 40,8 %, но лучшими прочностными характеристиками – модуль Юнга в 34,7 раза и предел прочности в 127,3 раза в сравнение с гидрогелем очищенной БЦ (таблица 2).
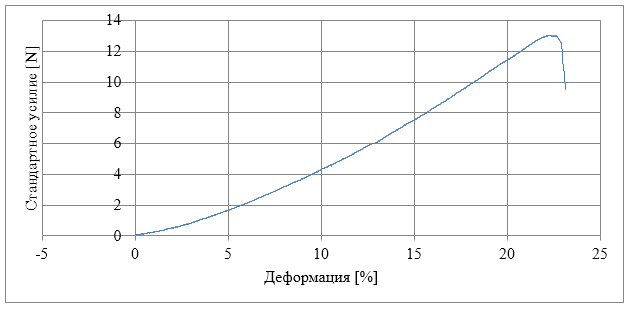
Рисунок 26 – Кривая усилие-деформация набухшей очищенной дегидратированной бактериальной целлюлозы
В сравнении прочностных характеристик матрикс для протезирования артерий изготовленный из растворов желатина с полигликолиевой кислотой (H. Hajiali et all., 2011) имеет прочность на разрыв 0,650 МПа; модуль Юнга 32 МПа и относительное удлинение 32 %, а двуслойный трубчатый протез из поликапролактона и поли-молочной кислоты, разработанный C.M. Vaz , 2005, показал модуль Юнга равный 30,9 ± 6,6 МПа.
Таким образом, набухшая дегидратированная бактериальная целлюлоза обладает меньшим относительным удлинением при разрыве в 1,78 раза, но лучшими механических характеристиками: модуль Юнга и прочность на разрыв больше в 8 и в 48 раз соответственно, в сравнении с полимерными материалами на основе поликапролактона и полигликолевой кислоты, что позволяет рассматривать дегидратированную бактериальную целлюлозу в качестве материала для протезирования артерий.
Сравнение механических свойств очищенных образцов целлюлозы: гидрогелей до сушки (не высушенных) и дегидратированных, показало, что максимальная деформация гидрогелей составляет 49 ± 3,6 % в сравнении с 7,5 — 11,1 % для дегидратированных образцов, тогда как модуль Юнга ниже как минимум на два порядка (1,5 ± 0,3 МПа).
Диспергирование бактериальной целлюлозы нарушает ее надструктуру, межфибриллярные связи, что определяет уменьшение относительного удлинения и предела прочности в сравнении с набухшим образцом БЦ без механического диспергирования.
Таким образом, так как бактериальная целлюлоза имеет иерархическую структуру с широким диапазоном масштабов от нано- до микроскопических размеров, деформация, сопровождается разрушением, происходящими на различных структурных уровнях. В то время как упругая деформация в основном определяется кристаллическими доменами фибрилл, неупругая деформация обусловлена наличием в них аморфных доменов и, кроме того, может быть реализована путем скольжения макромолекул внутри фибрилл (H.W. Haslach, 2000)
Ослабление межфибриллярных связей и скольжение и разрыв фибрилл в гидрогелях бактериальной целлюлозы возможны связаны с результатом действия воды. По-видимому, структура сети может обеспечить реализацию так называемого механизма «прилипания-скольжения», который заключается в повторяющихся случаях разрыва и восстановления водородных связей в ходе пластической деформации. Косвенным доказательством могут служить сравнение прочностных характеристик гидрогелей с нативной сетчатой структурой и диспергированных образцов БЦ, которые в результате механического разрушения не имеют сетчатую структуру из фибрилл. Для последних определены низкие значения предела прочности и относительного удлинения при разрыве (3,4 МПа и 4,2 %). Пластическая деформация возникает в результате разрыва межфибриллярных связей, что сопровождается разрывом некоторых фибрилл из сети и разрывом последней.
В настоящее время в литературе имеются данные по транспортным параметрам газов и паров в полимерах. Однако анализ, показывает, что для отдельных газов и полимеров нет комплексных исследований, неизученными оказываются новые полимеры. Между тем, транспортные параметры этих газов необходимы для создания защитных барьеров (раневых покрытий, упаковочных материалов, одежды, защитных масок и т.п.). Газопроницаемость определяли по азоту для дегидратированных образцов неочищенной бактериальной целлюлозы (Приложение И).
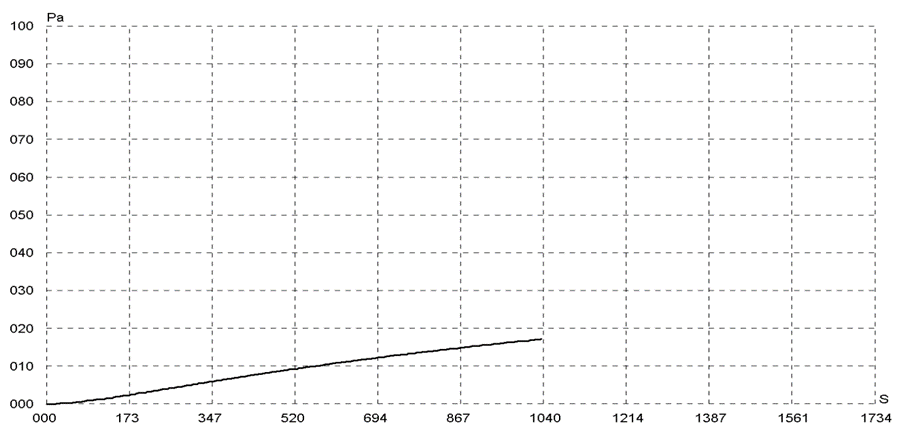
ΔР, Па
τ, с
Рисунок 27 — Зависимость изменения давления ΔР от времени τ диффузии азота через дегидратированный образец БЦ
Определено, что скорость газовой проницаемости БЦ для азота равен 35,6 см3/м2⋅24 часа⋅0,1 мПа (рисунок 27) в сравнении с однослойным вспененным полипропиленом для производства термоформованной тары для пищевых и непищевых продуктов – 70 см3/м2⋅24 часа⋅0,1 мПа (Д.М. Мяленко, 2010)
2.6 Исследование морфологии бактериальной целлюлозы и ее нанокомпозитов
2.6.1 Исследование поверхности методом растровой электронной микроскопии
Исследовали образцы бактериальной целлюлозы, очищенные от клеток продуцентов и остатков питательной среды. Поперечный скол образца БЦ, получали на этапе пробоподготовки: образец опускался в жидкий азот, скалывание производили в азотной среде, так как при изъятии образца из нее, за счет интенсивного теплообмена с окружающей средой, образец быстро возвращал свои упругие на излом свойства.


а б
Рисунок 28 – РЭМ изображения а) поверхности и б) поперечного сечения образца бактериальной целлюлозы
На рисунке 28 (а) показана морфология БЦ, которая представляет собой нанопористую трехмерную сетчатую структуру со случайным расположением микрофибрилл без какой-либо предпочтительной ориентации и множества пустых промежутков между ними. Согласно литературным данным, бактерии полимеризуют молекулы глюкозы через β- (1 → 4) глюкановые связи и выделяют полимер во внеклеточное пространство с образованием нанофибрилл, которые в дальнейшем организуются и стабилизируются внутримолекулярными водородными связями с образованием ультратонкой сетчатой структуры (Yano, Maeda, Nakajima, Hagiwara & Sawaguchi, 2008). На изображении поперечного сечения пленки БЦ (рисунке 28 (б)) структура пластинчатая (Hofinger et al., 2011, Klemm et al., 2011, Вэй и др., 2011), фибриллы однородные и ориентированны вдоль поверхности образца, их толщина составляет величину порядка 150 нм.
Элементный анализ проводили после очистки. Содержание углерода и кислорода составило 44,2 ± 1,6 и 6,3 ± 0,25 % соответственно. Этот элементный состав согласуется с составом чистой целлюлозы и с составами, сообщенными другими исследователями (Klemm et al., 2001, Yoon et al., 2006).
Наноразмерные поры между фибриллами БЦ могут выступать в качестве адсорбционных центров для кристаллизации неорганических соединений в получении композитов на основе бактериальной целлюлозы, используемой в качестве матрицы. На рисунке 29 представлена микрофотография нанокомпозита целлюлозы и фосфата кальция.


а б
Рисунок 29 – РЭМ изображение нанокомпозита целлюлозы и фосфата кальция а) поверхности и б) поперечного сечения образца
На поверхности нанокомпозита также присутствуют нанофибриллы целлюлозы, связанные с частицами фосфата кальция в кристаллической фазе со специфической тригональной и гексагональной формой. Их размер составляет порядка 50 нм. Включения неорганической фазы имеют слоистую структуру. Ориентированы частицы вдоль поверхности нанокомпозита. На микрофотографиях отчетливо видна граница раздела частиц неорганической фазы и целлюлозной матрицы. Так как толщина фибрилл на этих участках значительно меньше, можно предположить, что поперечные прочностные свойства у таких образцов будут снижены в сравнении с чистым материалом.
Качественный состав образца показал присутствие значительного количества кислорода (рисунке 30), входящего в состав оксида фосфора.
Рисунок 30– Спектр-рентгенограмма нанокомпозита целлюлозы с фосфатом
В силу значительных размеров частиц фосфата кальция, распределение элементов по поверхности образца неравномерное.
Определенная внутренняя наноструктура пленки БЦ дает возможность включения коллоидных частиц Ag в ее нанофибрилярную структуру адсорбционным методом. Результаты показали, что частицы Ag мигрируют во внутреннюю структуру гель пленки БЦ, наблюдали обесцвечивание раствора супернатанта, а получаемый нанокомпозит приобретал желтый цвет. Эта миграция может быть объяснена процессом диффузии. Фактически, бактериальная целлюлоза содержит около 96 % воды, что свидетельствует о наличии пористой мембраны, отделяющей водный коллоидный раствор от основной массы воды. На рисунке 31 представлена микрофотография нанокомпозита бактериальной целлюлозы с частицами коллоидного серебра.
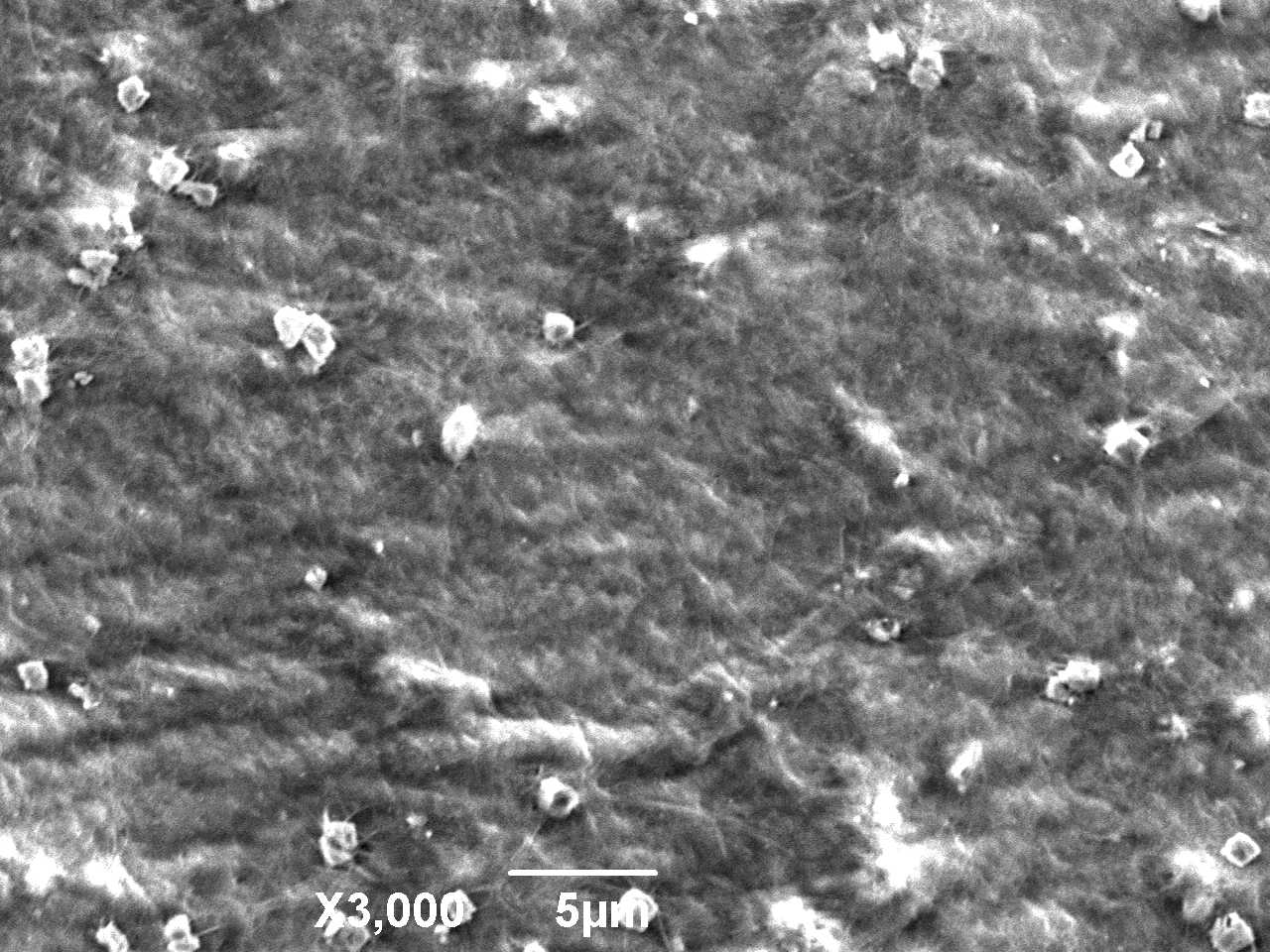

а б
Рисунок 31 – РЭМ изображение: а) поверхности, б) поперечного сечения пленки нанокомпозита бактериальной целлюлозы с частицами коллоидного серебра
Для данного образца характерна волнистая форма упаковки нанофибрилл. Их длина в некоторых участках превышает 15 мкм, а толщина варьируется от 60 нм до 150 нм. На поверхности нанофибрилл БЦ определены отдельные коллоидные частицы Ag со средним размером около 0,8 мкм. Присутствие во внутренней структуре образца композита дискретных коллоидных частиц Ag не наблюдалось (рисунке 31), даже при больших увеличениях. Это может быть связано с тем, что частицы серебра в область скола не попали, однако качественный состав показал их наличие в нанокомпозите (рисунок 32).
Рисунок 32 — Спектр-рентгенограмма нанокомпозита бактериальной целлюлозы с частицами коллоидного серебра.
Таким образом, исследование образцов методом растровой электронной микроскопии показал фибриллярную структуру бактериальной целлюлозы и ее нанокомпозитов. Фибриллы БЦ ориентированы вдоль поверхности материала, имеют неравномерную толщину, варьирующуюся от 50 нм до 150 нм, одновременно относительно большую длину, более 15 мкм. На границе раздела с частицами наполнителей присутствует межфазный слой, структура которого вероятно может снижать прочностные характеристики образцов в поперечном направлении.
В силу того, что электронный зонд растрового электронного микроскопа наносит разрушающее воздействие на сам образец, детальное исследование структуры поверхности целлюлозы было проведено с помощью сканирующего зондового микроскопа (СЗМ).
2.6.2 Исследование поверхности сканирующим зондовым микроскопом
В основе метода СЗМ лежит взаимодействие исследуемого образца с зондом – кантилевером. Осуществление взаимодействия возможно различными способами. В данном эксперименте применялась полуконтактная (или прерывисто-контактная) методика. Ее суть заключается в регистрации сил межатомного взаимодействия между исследуемой поверхностью и колеблющимся на резонансной частоте зондовым датчиком, представляющим собой механическую иглу, закрепленную на конце кантилевера (балки). Механические колебания балки возбуждаются с помощью пьезокерамического привода, а амплитуда и фаза этих колебаний детектируются с помощью силового оптического сенсора, представляющего собой четырехсекционный фотодетектор, позволяющий регистрировать положение луча лазера, отраженного от кантилевера и попадающего на фотодетектор.
При подводе зонда к исследуемой поверхности действие сил межатомного взаимодействия приводит к изменению условий резонансных колебаний кантилевера, и, как следствие, к изменению амплитуды и фазы колебаний. Система обратной связи позволяет поддерживать постоянным среднее расстояние между образцом и зондом за счет управления вертикальным положением кантилевера таким образом, чтобы не изменялась амплитуда колебаний. При этом в полуконтактном режиме зонд входит в физический контакт с поверхностью (в зону сил отталкивания) только в нижней части своей траектории, постукивая поверхность. В процессе сканирования образца (построчного перемещения зонда над исследуемой поверхностью) электронная подсистема СЗМ, управляемая персональным компьютером, регистрирует вертикальные перемещения кантилевера и, таким образом, реконструирует рельеф поверхности.
Одновременно с изображением рельефа поверхности дополнительно могут быть получены изображение отклонения амплитуды колебаний кантилевера от заданной рабочей величины и изображение сдвига фазы колебаний. Эти изображения позволяют более отчетливо выявить особенности рельефа поверхности, а также неоднородности ее физико-химических свойств.
Объектами исследования являлись также образцы высушенной нативной и очищенной целлюлозы, а также нанокомпозитов на основе целлюлозы с частицами фосфата кальция и серебра.
С целью выявления в исходном материале присутствия синтезирующих уксуснокислых бактерий, проведено топографическое исследование неочищенной БЦ. Результаты такого исследования представлены на рисунке 33.
Бактериальная целлюлоза имеет сетчатую структуру, состоящую из ультратонких целлюлозных фибрилл. Интактные бактериальные клетки находятся в структуре целлюлозы и на их поверхности непосредственно определяется структура фибрилл (рисунок 33 (с)).
. 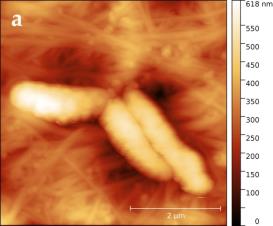
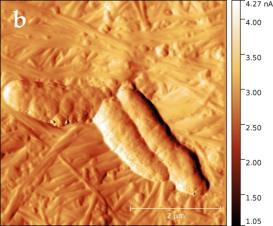
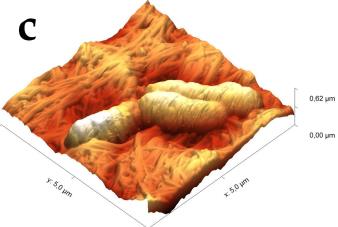
Рисунок 33 – Морфология поверхности неочищенной целлюлозы: а – двумерное изображение рельефа поверхности, b – амплитуда колебания зонда, c – трехмерное изображение рельефа поверхности
Микрофибриллы в сети ориентированы равномерно и случайным образом, вероятно, потому, что клетка удваивает сайты, синтезирующие микрофибриллы, перед делением, а сайты родительских и дочерних клеток активны непосредственно перед делением, синтезируя микрофибриллы постоянных размеров.
Бактерии имеют длину около 2 мкм, что в соответствии с литературными данными, подтверждает их принадлежность к уксусно-кислым бактериям. Отсутствие же подобных элементов структуры поверхности на других образцах, показывает высокое качество их очистки.
Микрофотографии очищенной целлюлозы представлены на рисунке 34.
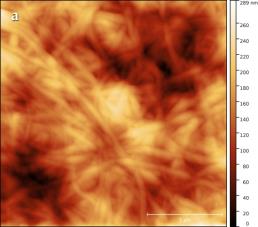
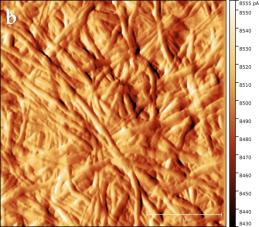
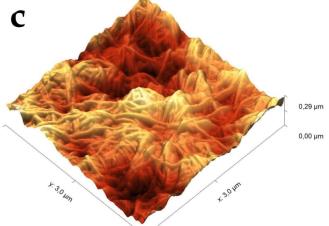
Рисунок 34 – Морфология поверхности очищенной целлюлозы: а – двумерное изображение рельефа поверхности, b – амплитуда колебания зонда, c – трехмерное изображение рельефа поверхности
На рисунке 34 отчетливо видны фибриллы, являющиеся структурными элементами поверхности образца. Толщина фибрилл составляет величину 150 – 165 нм. Фибриллы пространственно переплетены друг с другом, образуя узлы и впадины. Различная их толщина связана с тем, что они образованы переплетением элементарных фибрилл, являющихся основными структурными единицами целлюлозы.
Подтверждением данного факта являются исследования целлюлозы, выращиваемой в течение 4-х дней. Топография поверхности такой целлюлозы представлена на рисунке 35.
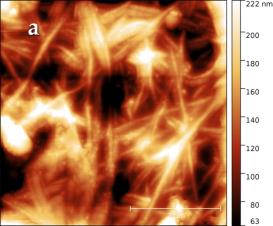
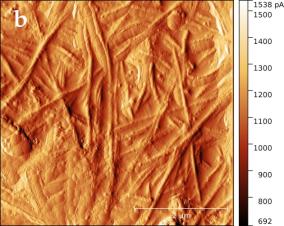
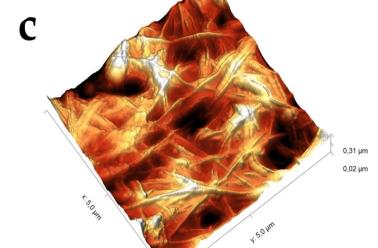
Рисунок 35 – Морфология поверхности 4-х дневной очищенной целлюлозы: а – двумерное изображение рельефа поверхности, b – амплитуда колебания зонда, c – трехмерное изображение рельефа поверхности.
На данных образцах зафиксированы фибриллы на этапе формирования макроструктур. Отчетливо видны нанофибриллы, их размер составляет около 50-60 нм. На поверхности нанофибрилл также видна периодическая структура, размером 30-35 нм, соответствующая, по-видимому, периодическим звеньям макромолекулы данного биополимера. На отдельных участках поверхности нанофибриллы закручиваются в левостороннюю спираль. Данная закономерность формирования макрофибрилл характерна для других биополимеров, таких как коллаген [нано- и биокомпозиты].
Таким образом, полученные результаты указывают на то, что фибриллы бактериальной целлюлозы, размером 150-160 нм являются многокомпонентными структурами, составными частями которых являются нанофибриллы размером 50 – 60 нм, сплетенными в спираль с левым винтом.
На следующем этапе исследовали нанокомпозиты бактериальной целлюлозы и фосфата кальция. На рисунке 36 представлена топография поверхности такого образца.
Отличительной особенностью данных образцов является присутствие узлов переплетения фибрилл размером в среднем 500 на 700 нм, связанных, по-видимому, с наличием под слоем волокон целлюлозы включений в виде неорганической фазы фосфата кальция. Ориентация волокон целлюлозы в основном хаотичная, однако, присутствует некоторая преимущественная пространственная их ориентация.


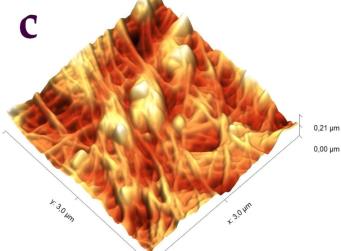
Рисунок 36 – Морфология поверхности целлюлозы, наполненной фосфатом кальция: а – двумерное изображение рельефа поверхности, b – амплитуда колебания зонда, c – трехмерное изображение рельефа поверхности
На рисунке 37 представлена топография поверхности нанокомпозита бактериальной целлюлозы с частицами коллоидного серебра.
Для данных образцов характерно присутствие на поверхности включений в виде округлых частиц, большая часть которых имеет размер около 110 нм, но также встречаются и более крупные частицы, размером 190 – 200 нм. Фибриллы, диаметром 150 – 160 нм, в большей степени имеют преимущественную пространственную ориентацию, однако на поверхности нанокомпозита встречаются и участки со значительной степенью хаотичности ориентации фибрилл.
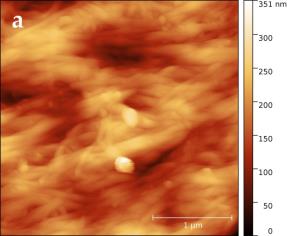
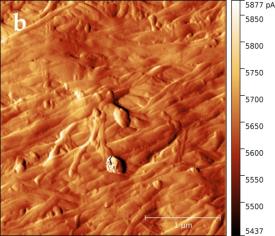
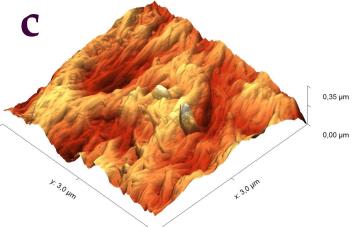
Рисунок 37 – Морфология поверхности нанокомпозита бактериальной целлюлозы с частицами коллоидного серебра: а – двумерное изображение рельефа поверхности, b – амплитуда колебания зонда, c – трехмерное изображение рельефа поверхности
В целом, для всех исследованных образцов характерно пространственное переплетение волокон целлюлозы с образованием пучностей (узлов) и впадин.
2.7 Исследование биоконверсии полисахаридов пшеничных отрубей
Производство бактериальной целлюлозы является сложным и дорогостоящим процессом. Одним из сдерживающих факторов производства является низкая степень конверсии субстрата в конечный продукт и использование дорогостоящих питательных сред, в составе которых пищевое сырье значительно снижает экономическую эффективность биосинтеза бактериальной целлюлозы.
Отсутствие промышленного производства бактериальной целлюлозы в России делает разработку экономически выгодной технологии биосинтеза актуальной. Одним из факторов снижающих себестоимость бактериальной целлюлозы является замена пищевого сырья в составе питательной среды на вторичное растительное сырье, как источника субстрата для биосинтеза БЦ, возобновляемое в промышленных масштабах.
Перспективным источником вторичного растительного сырья являются пшеничные отруби, имеющие в своем составе значительное количество полисахаридов, а также витамины, белковые соединения и другие биологически активные вещества, имеющие значение при культивировании микроорганизмов.
Для создания технологии необходимо, предварительно процессам биосинтеза бактериальной целлюлозы на гидролизатах, проводить исследования ферментативного гидролиза полисахаридов пшеничных отрубей с целью определения условий образования максимального количества редуцирующих веществ, как субстрата для синтеза бактериальной целлюлозы. Кроме того, определяющим фактором степени конверсии является не только количество РВ, но и их качественный состав.
Данные исследований направленны на разработку технологии получения бактериальной целлюлозы из вторичного растительного сырья, которая может быть масштабирована и внедрена в производство.
В ходе следующего этапа исследования подбирали композиции ферментных препаратов амилолитического и целлюлазного действия с целью максимальной степени биоконверсии полисахаридов пшеничных отрубей; а также определение содержания редуцирующих веществ, качественного и количественного состава углеводов, полученных гидролизатов;
Определение химического состава пшеничных отрубей.
Для проведения серии экспериментальных исследований использовали пшеничные отруби, ООО «МельКом», которые имели следующий химический состав, представленный в таблице 3
Таблица 3 – Химический состав пшеничных отрубей
| Наименование показателя | Значение показателя |
| Сухие вещества, % | 9,18 ± 0,12 |
| Зольность* | 5,98 ± 0,28 |
| Сырая клетчатка, % | 8,5± 1,3 |
| Сырой протеин, % | 14,70 ± 0,46 |
| Лигнин*, % | 7,55 ± 0,39 |
| Пентозаны*, % | 17,90 ± 0,01 |
| Крахмал, % | 16,2 ± 2,8 |
* — в пересчёте на сухой материал
Определено, что в составе пшеничных отрубей высокое количество пентозанов и низкое — лигнина (по сравнению с исследованными в ИХТТМ СО РАН ранее образцами другого растительного сырья – соломы пшеницы, кукурузы, древесины хвойных и лиственных растений).
Переработка растительного сырья осложнена его сложным химическим составом. Очевидно, что в комплексном лигноцеллюлозном сырье, к которому относятся пшеничные отруби, процессы кислотного или ферментативного разложения полимеров будут происходить неравномерно. Требуется проведение работ по определению количества структурообразующих компонентов сырья до обработки, а также контроль за выходом целевых веществ в процессе гидролиза.
Определение состава ферментативных гидролизатов пшеничных отрубей.
Основными задачами экспериментальных исследований являлся подбор наиболее перспективных видов ферментных препаратов, а также их комплексов, для усиления глубины ферментативной конверсии пшеничных отрубей с получением определенного набора углеводов и других ценных веществ для биосинтеза бактериальной целлюлозы.
Ферментативный гидролиз пшеничных отрубей проводили в ферментере объёмом 5 л в водной среде с гидромодулем 1:8, при (45±2) °С в течение 24 ч с помощью ферментных препаратов АмилоЛюкс АТС, АмилоЛюкс А, ЦеллолЛюкс А, ГлюкоЛюкс А и ЦеллоЛюкс F, активную кислотность поддерживали на уровне (4,5±0,2) с помощью гидроксида аммония и ортофосфорной кислоты.
Определяли степень биоконверсии по накоплению редуцирующих веществ в гидролизатах, ценных для биосинтеза бактериальной целлюлозы и пересчитывали на массу пшеничных отрубей. На рисунке представлено изменение содержания РВ в результате гидролиза пшеничных отрубей ферментными препаратами (ФП), различного в отношении их каталитического действия к углеводам, в зависимости от продолжительности процесса ферментации.
Количество вносимого в реакционную смесь ФП одинаково и составило 0,5 % на массу углеводсодержащего сырья. Наибольшая степень превращения нерастворимых полисахаридов пшеничных отрубей в растворимые сахара определена через 9 часов ферментации препаратом АмилоЛюкс АТС. Это может свидетельствовать о более высокой ферментативной активности ферментного препарата и относительно высоком содержании в отрубях субстрата фермента – крахмала (рисунок 38).
Поэтому для определения оптимальных технологических параметров процесса гидролиза выбран ферментный препарат с максимальной активностью в отношении гликозидных связей крахмала — АмилоЛюкс АТС.
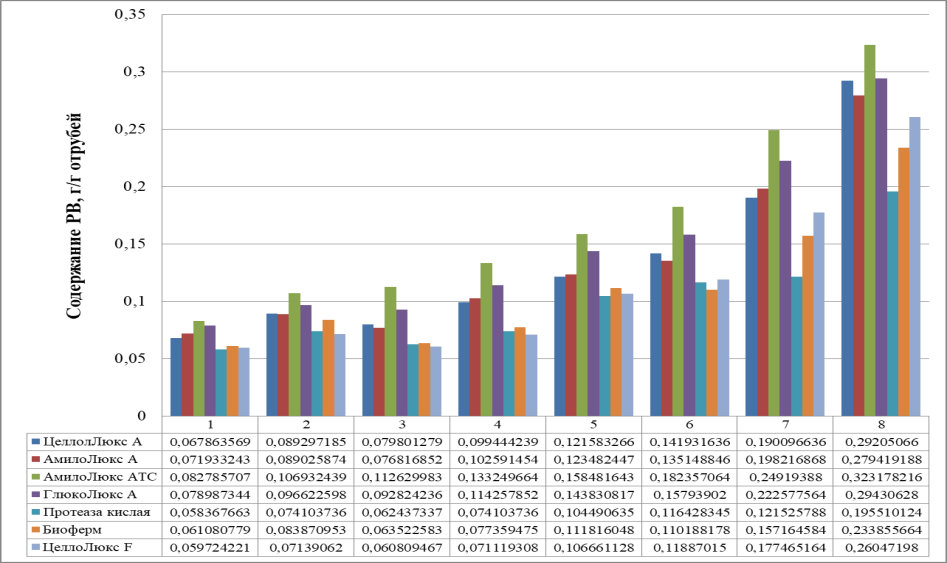
24
22
Продолжительность, ч
Рисунок 38 – Содержание редуцирующих веществ ферментативно обработанных пшеничных отрубей
В ходе экспериментальных исследований ферментные препараты вносили в заранее подготовленные пшеничные отруби (набухшие в течение 1 часа) из расчета на их массу в количестве от 0,5 до 2,0 % (рисунок 39). Процесс ферментации проводили в течение 24 часов, при температуре (50 ± 2) °С, гидромодуль 1:8, рН = 5,45. Данные условия проведения научных работ являются оптимальными и рекомендованными фирмой производителем ООО «Сиббиофарм» г. Новосибирск.
Увеличение концентрации фермента АмилоЛюкс АТС до 1 % на массу пшеничных отрубей способствует росту уровня РВ до 0,29 г/г сырья. Внесение большего количества ферментного препарата не оказывает значимого влияния на изменение содержания РВ или приводит к их снижению.
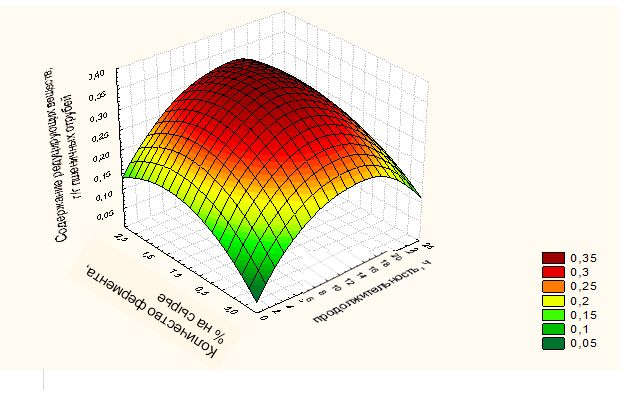
Рисунок 39 – Изменение концентрации РВ пшеничных отрубей в зависимости от концентрации ферментного препарата АмилоЛюкс АТС и продолжительности процесса
По результатам предыдущих исследований представленных на рисунке 38, определена большая ферментативная активность препарата ЦелоЛюкс А в сравнении с препаратом ЦеллоЛюкс F, что выражается в значительном накоплении РВ. Дальнейший процесс биоконверсии пшеничных отрубей осуществлять комплексом ферментных препаратов, которые вносили в заранее подготовленные пшеничные отруби (набухшие в течение 1 часа): АмилоЛюкс АТС с дозировкой 1 % на массу пшеничных отрубей и ЦеллоЛюкс А в количестве от 0,1 до 1,5 %, для определения оптимального соотношения компонентов в данной композиции (рисунок 40).
Поэтому для определения оптимальных технологических параметров процесс ферментации проводили в течение 29 часов, при температуре (50 ± 2) °С, гидромодуль 1:8, рН = 4,5, в зависимости от дозировки препарата ЦеллоЛюкс А. Данные условия проведения научных работ являются оптимальными и рекомендованными фирмой производителем.
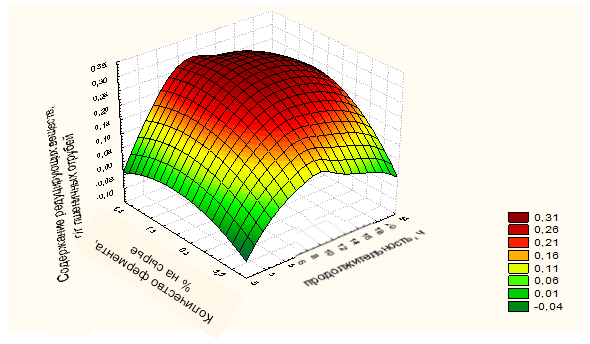
Рисунок 40 – Изменение содержания РВ пшеничных отрубей при ферментации комплексом АмилоЛюкс АТС 1% и ЦеллоЛюкс А в зависимости от концентрации препарата ЦеллоЛюкс А
В результате полученных данных гидролиза полисахаридов комплексом ферментных препаратов АмилоЛюкс АТС и ЦеллоЛюкс А, определено максимальное накопление РВ через 8 часов процесса ферментации, что составляет 0,269 г/г пшеничных отрубей при дозировке препарата ЦеллоЛюкс А 1,5 % на массу пшеничных отрубей, что больше на 28,6 % в сравнении с дозировкой препарата ЦеллоЛюкс А 0,1 % и в 3,18 раза больше в сравнении с пшеничными отрубями без добавления ферментного препарата. После 22 часов ферментации наблюдается некоторое снижение количества РВ, что может быть связано с развитием микрофлоры на не стерилизованных пшеничных отрубях.
Глюкомилаза способствует гидролизу крахмала вторичного сырья до мальтозы и глюкозы, что повышает содержание в продуктах ферментации субстратов для конверсии их в бактериальную целлюлозу. ГлюкоЛюкс А – препарат фирмы ООО ПО «Сиббиофарм», кроме глюкоамилазной обладает и ксиланазной активностью, гидролизуя ксиланы до моно и дисахаридов. Следовательно, данный препарат может быть рассмотрен в качестве перспективного фермента для биоконверсии углеводсодержащего вторичного сырья, с целью использования гидролизатов в качестве питательной среды симбиотической культуры Medusomyces gisevii.
Определено изменение концентрации редуцирующих веществ в процессе биоконверсии комплекса при сочетании препаратов: ГлюкоЛюкс А 1 % ÷ ЦеллоЛюкс А 0,5 % ÷ АмилоЛюкс АТС 0,5 %, наибольшее содержание РВ – 0,34 г/г сырья соответственно, достигнуто через 10 часов процесса биоконверсии. Сравнительная характеристика степени гидролиза полисахаридов пшеничных отрубей комплекса с ферментным препаратом АмилоЛюкс АТС дозировкой 0,5 % представлена на рисунке 41
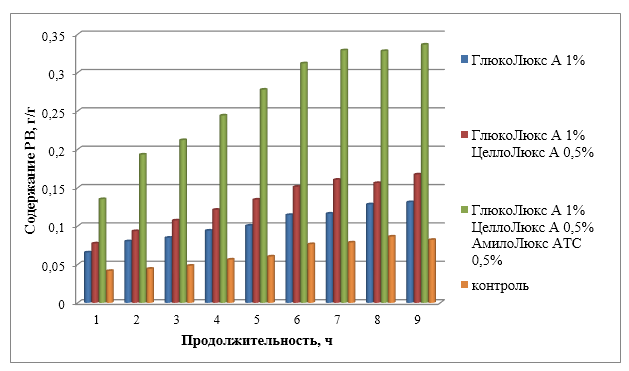
Рисунок 41 – Изменение содержания РВ при биоконверсии пшеничных отрубей ферментным комплексом (ГлюкоЛюкс А 1 %, ЦеллоЛюкс А 0,5 %
и АмилоЛюкс АТС 0,5 %)
В результате исследований определено, что сочетание препаратов ГлюкоЛюкс А и ЦеллоЛюкс А способствует повышению степени гидролиза полисахаридов пшеничных отрубей:
— изменение РВ больше для комплекса 3 (ГлюкоЛюкс А 1 % и ЦеллоЛюкс А 0,5 %) на 27,5 % в сравнении с действием отдельного ферментного препарата ГлюкоЛюкс А 1 %;
— внесение препарата АмилоЛюкс АТС 0,5 % в данную композицию приводит к значительному возрастанию РВ в 2,7 раза по сравнению с комплексом 3 и 2,6 раза
Качественный и количественный состав растворимых веществ гидролизата пшеничных отрубей
Переработка растительного сырья осложнена его сложным химическим составом. Очевидно, что в комплексном лигноцеллюлозном сырье, к которому относятся пшеничные отруби, процессы ферментативного разложения полимеров будут происходить неравномерно. Требуется проведение работ по определению количества структурообразующих компонентов сырья до обработки, а также контроль за выходом целевых веществ в процессе гидролиза.
Наиболее признанным методом для анализа качественного и количественного состава моносахаридов, например, в гидролизате является хроматография (газовая или жидкостная).
Целью данного этапа работы было проведение хроматографических исследований проб пшеничных отрубей, определение содержания гексоз (глюкоза + галактоза, манноза, сумма пентоз, сумма дисахаридов) с предоставлением хроматограмм.
В следующей серии определен качественный и количественный состав углеводов хроматографическим методом ферментативно обработанных нативных пшеничных отрубей. Определение изменения качественного и количественного состава углеводов и растворимых белковых соединений на различных технологических этапах биоконверсии углеводсодержащего сырья значим для дальнейшего биосинтеза бактериальной целлюлозы.
Выбрана композиция ферментных препаратов, которая способствовала наибольшей конверсии углеводов — ГлюкоЛюксА (1 %) АмилоЛюксАТС (0,5 %) ЦеллоЛюксА (0,5 %), концентрации ферментных препаратов взяты на единицу массы сырья. Перспективным по нашему мнению является включение препарата Протеаза кислая в комплекс ферментных препаратов амилолитического и ксилоназного действия, с целью увеличения содержания растворимых белковых соединений, необходимых для культивирования симбиотической культуры Мedusomyces gisevii.
Ферментативную обработку проводили при одинаковых условиях: температура 50 °С, рН 4,5, время ферментации 6 часов, оптимальный гидромодуль 1:8. Условия проведения эксперимента были оптимальными для действия ферментов композиций, в соответствии с рекомендациями, изложенными в спецификации фирм-производителей.
ВЭЖХ-анализ моносахаридов показал (рисунок 42) наличие в гидролизатах глюкозы, ксилозы и незначительного количества маннозы, что характерно для моносахаридного состава отрубей.
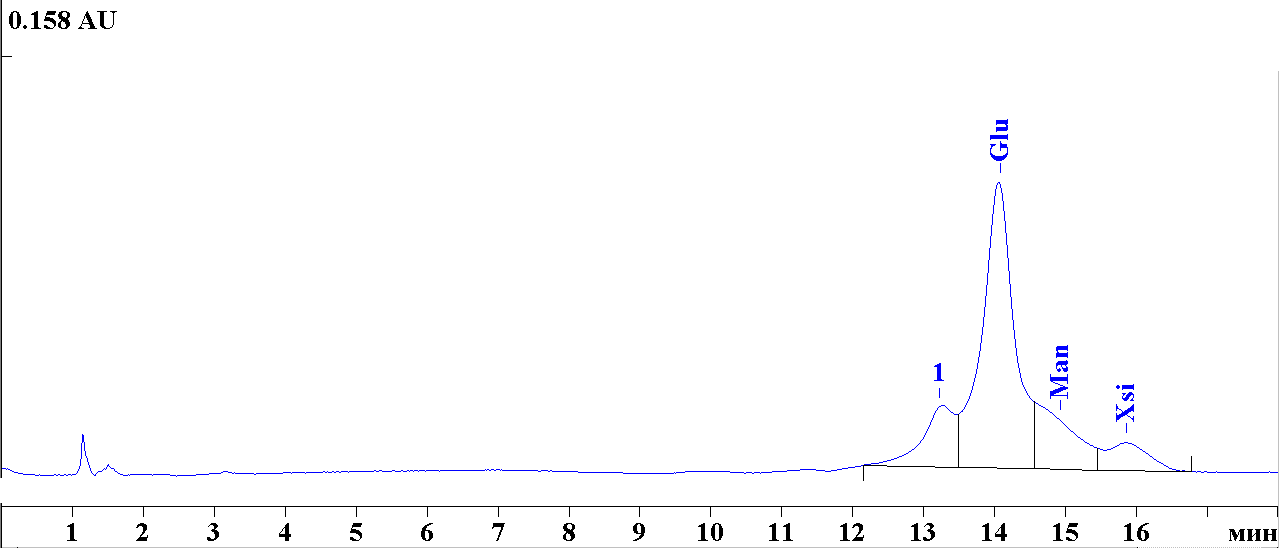
Рисунок 42 – Хроматограмма экстракта нативных пшеничных отрубей
Содержание глюкозы варьирует от 2,8 до 23,7 мг/мл, пентоз (в пересчёте на ксилозу) – от 0,2 до 7,8 мг/мл, маннозы – от 0,5 до 2,5 мг/мл. В образцах 1 и 3 обнаружены другие моносахариды неустановленной природы, предположительно, галактоза (рисунки 42 и 44). Лактоза и другие дисахариды не были обнаружены ни в одном образце.
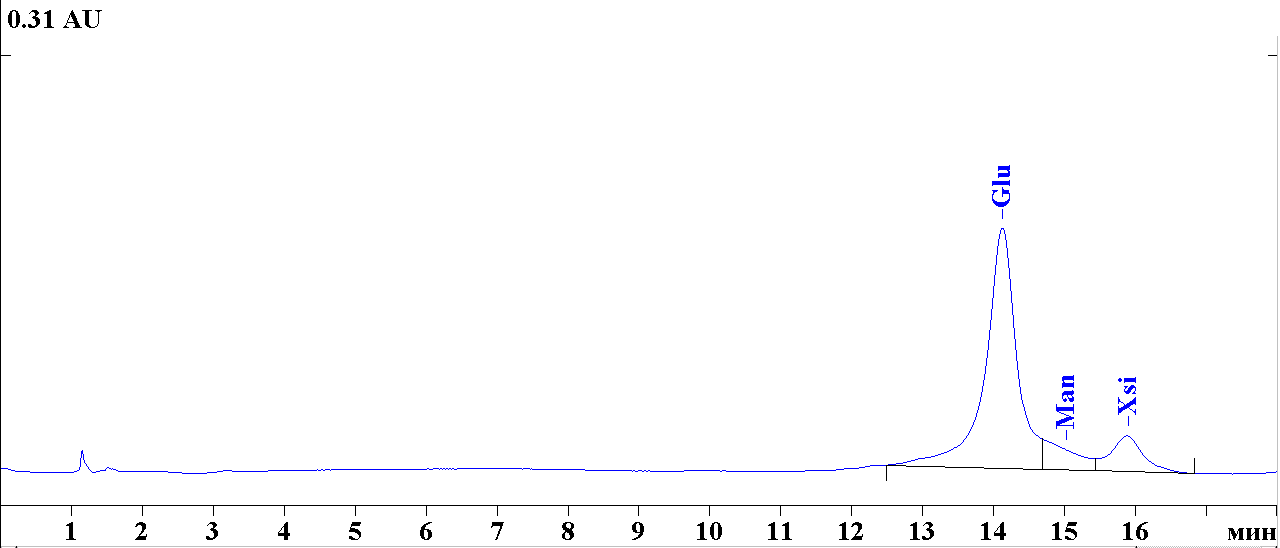
Рисунок 43 – Хроматограмма гидролизата ферментативно обработанных нативных пшеничных отрубей (комплекс: ГлюкоЛюкс А 1 %, АмилоЛюкс АТС 0,5 %, ЦеллоЛюкс А 0,5 %)
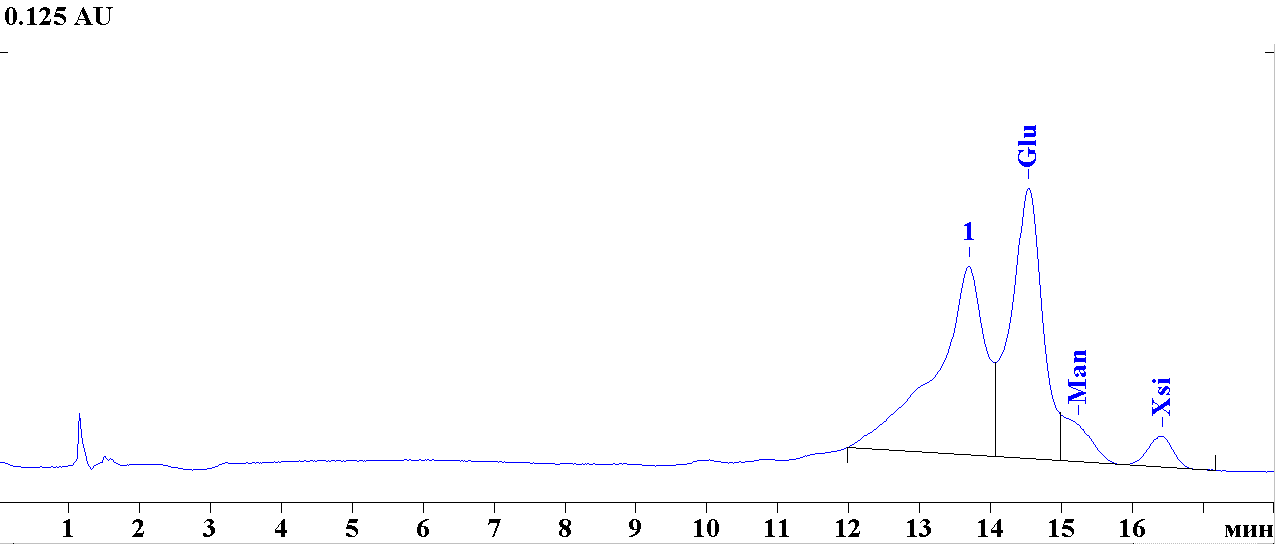
Рисунок 44 – Хроматограмма гидролизата ферментативно обработанных нативных пшеничных отрубей (комплекс: АмилоЛюкс АТС 1 %,
Биоферм 0,5 %, Протеаза кислая 0,5 %)
По данным хроматографического анализа качественный и количественный состав гидролизатов моно- и дисахаридов различен (рисунок 45). Так наибольшее содержание глюкозы определено при ферментативном гидролизе комплексом препаратов ГлюкоЛюкс А 1 %, АмилоЛюкс АТС 0,5 %, ЦеллоЛюксА 0,5 % нативных пшеничных отрубей, что составило 2,25 % в гидролизате. А количество глюкозы на массу ферментативно обработанных этих образцов пшеничных отрубей составило 18,0 % (180,0 мг/г сырья). Количество глюкозы в результате биоконверсии пшеничных отрубей комплексом ферментов: АмилоЛюкс АТС 1 %, Биоферм 0,5 %, Протеаза кислая 0,5 %, ниже в 4,3 раза по сравнению с действием предыдущего комплекса препаратов амилазного и целлюлазного действия. Хочется заострить внимание, что в гидролизате пшеничных отрубей обработанных комплексом АмилоЛюкс АТС 1 %, Биоферм 0,5 % и протеолитический фермент Протеаза кислая 0,5% содержание неустановленного моносахарида составляет 28,0 мг/г пшеничных отрубей, что сопоставимо с содержанием основного компонента – глюкозы. В гидролизатах пшеничных отрубей выбранными методами биоконверсии других моносахаридов не обнаружено.
Таким образом, наибольшее суммарное содержание моно- и дисахаридов значимых для дальнейшей биоконверсии растительного сырья микроорганизмами установлена при ферментативном методе обработки пшеничных отрубей комплексом препаратов: ГлюкоЛюкс А (1 %), АмилоЛюкс АТС (0,5 %), ЦеллоЛюксА (0,5 %), и составило 215,2 мг/г отрубей.
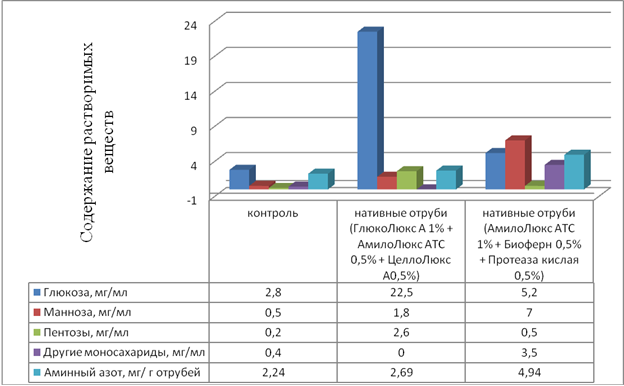
Рисунок 45 – Содержание растворимых веществ в гидролизатах пшеничных отрубей
Обработка пшеничных отрубей комплексом с протеолитическим ферментным препаратом определяют суммарный уровень моно- и дисахаридов в гидролизатах, который ниже в 1,7 раза в сравнении с комплексом амилолитических и амилазных ферментных препаратов.
Определение аминного азота подтвердило рабочую гипотезу о том, что ферментативная обработка растительного сырья повышает содержание растворимых белковых соединений, так содержание аминного азота в комплексе ферментных препаратов с Протеазой кислой и Биофермом составила 39,52 мг/г сырья. Содержание растворимого аминного азота в гидролизатах пшеничных отрубей выбранными нами другими методами сохранялся на одинаковом уровне, но значимо ниже (в 2 раза) по сравнению с ферментативной обработкой комплексом, включающим Протеазу кислую.
Количество сухих веществ в гидролизатах ферментативно обработанных нативных пшеничных отрубей максимально при биоконверсии комплексом препаратов АмилоЛюкс АТС (1,0 %), ЦеллоЛюкс А (0,5 %), Протеаза кислая (0,5 %), и составило 5,31 %, что выше контроля в 3,1 раза. Однако, содержание сухих веществ в гидролизатах нативных отрубей при биоконверсии комплексом ГлюкоЛюкс А (1,0 %), АмилоЛюкс АТС (0,5 %), ЦеллоЛюкс А (0,5 %), ниже на 12,8 %, а содержание редуцирующих веществ больше в 1,7 раза, чем предыдущим комплексом с препаратом Протеаза кислая. Полученные результаты указывают на наибольшую степень биоконверсии полимеров растительного сырья с использованием препарата Протеаза кислая, о чем свидетельствует повышенное содержание сухих веществ в экстракте — 0,425 г/г отрубей, в сравнении с действием других комплексов ферментных препаратов.
2.8 Исследование биосинтеза бактериальной целлюлозы на ферментативных гидролизатах пшеничных отрубей и углеводах
Высокая стоимость питательных сред ограничивает экономическое производство БЦ, поскольку такие среды составляют 30 % от общей стоимости производства (Rivas, Moldes, Domı́nguez, & Parajó, 2004). Поэтому поиск новых экономически эффективных питательных сред для получения максимальной производительности БЦ в крупномасштабных промышленных применениях является критическим фактором. В последних исследованиях основное внимание уделяется различным недорогим источникам питательных веществ и дополнительным веществам для эффективного биосинтеза БЦ (Kiziltas, Kiziltas, Bollin, & Gardner, 2015). Использование в качестве субстрата, возобновляемого вторичного растительного сырья – пшеничных отрубей, как способ повышения выхода и снижения затрат на производство БЦ актуально.
Биосинтез бактериальной целлюлозы осуществляли в статических условиях на гидролизате пшеничных отрубей. Для ферментации растительных полимеров пшеничных отрубей использовали наиболее эффективный (п. 2.3), в отношении производства моно- и дисахаридов ферментный комплекс ГлюкоЛюкс А (1 %), АмилоЛюкс АТС (0,5 %), ЦеллоЛюкс А (0,5 %) при Т = 50 0С и применяемый гидромодуль 1:8. Гидролизат фильтровали от твердых нерастворимых частиц и термостатировали в течение 15 минут при Т=1000С. Общее содержание моно-и дисахаридов в гидролизате составило 2,7 %. В гидролизат вносили 20 % об. инокулята симбиотической культуры Medusomyces gisevii, биосинтез проводили в статических условиях.
Поскольку гидролизат пшеничных отрубей, используемый в качестве питательной среды, содержит большое количество азотистых соединений – 0,34 г/л (рисунок 45), и других факторов роста, это может стимулировать биосинтез бактериальной целлюлозы. Образование гель пленки БЦ происходило на 6 сутки культивирования и через 21 сутки определяли выход бактериальной целлюлозы на объем культуральной жидкости. Отмечено, что полученный гидрогель обладал меньшей прозрачностью в сравнении с образцами, полученными на питательной среде, содержащей в качестве субстрата 10 % глюкозы, 5 % глицерина и 10 % глюкозы, 1 % пектина.
Установлено, что максимальный выход составил 2,71 ± 0,32 г/л на 21-е сутки для гидролизата пшеничных отрубей. Этот результат согласуется с предыдущими исследованиями Мохаммад Каземи, Азина, andAshori,(2015), Се, Ван лай, и Лю (2016), и Zhaoetal.(2018) при использовании различных источников углерода. Бактерии используют более длинный путь для синтеза, чтобы метаболизировать углеводы, в результате определен низкий выход целлюлозы от 4 до 16 суток культивирования. После 20-х суток определен максимальный выход целлюлозы на гидролизатах пшеничных отрубей. Это увеличение производства может быть связано с большим разнообразием соединений, присутствующих в пшеничных отрубях.
Микрофотографии целлюлозы, синтезированной на гидролизатах пшеничных отрубей представлены на рисунке 46. Наблюдаются длинные фибриллы с выраженным нанорельефом, которые переплетены под острым углом. Фибриллы длинные до 10 мкм, имеют структуру в виде переплетенных против часовой стрелки нитей. Вдоль фибрилл наблюдаются узлы, расстояние между которыми около 0,5 мкм. На поверхности образца бактериальной целлюлозы встречается множество впадин диаметром около 1,2 мкм.
Результаты показали, что гидролизаты пшеничных отрубей можно использовать в качестве источника углерода для производства БЦ.
Уксуснокислые бактерии способны полностью окислять различные источники углерода, такие как сахароза, глюкоза, фруктоза, галактоза, маннитол, глицерин, инозитол и спирты для синтеза целлюлозы (Ruka,Simon,&Dean,2012).
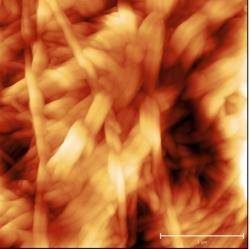

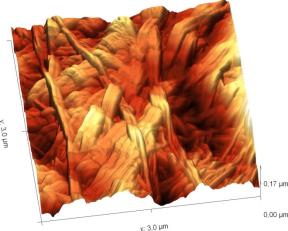
Рисунок 46 – Морфология поверхности бактериальной целлюлозы синтезированной на гидролизатах пшеничных отрубей: а – двумерное изображение рельефа поверхности, b – амплитуда колебания зонда, c – трехмерное изображение рельефа поверхности
В качестве эффективного субстрата возможно использовать глицерин для его биоконверсии в бактериальную целлюлозу это связано с различным в сравнении с глюкозой его метаболическим путем. Известно, что штаммы Acetobacter, продуцирующие БЦ, окисляют глюкозу до глюконовой кислоты под действием мембраносвязанной дегидрогеназы, а накопленние глюконовой кислоты понижает pH культуральной среды и может ингибировать продукцию бактериальной целлюлозы (Schramm et al., 1957). Следовательно, снижение биосинтеза БЦ в среде, содержащей глюкозу в качестве единственного источника углерода, может быть результатом низкого значения pH среды вследствие образования глюконовой кислоты.
Очевидно, что снижение pH не может быть единственным фактором, определяющим эффективность биосинтеза бактериальной целлюлозы, поскольку производство его из источников углерода, отличных от глицерина, было ниже, чем из глюкозы. Возможно, что синтез целлюлозы уксуснокислыми бактериями зависит от их способности синтезировать глюкозу из различных углеродных субстратов. Так Acetobacter xylinum может использовать глицерин в качестве источника углерода для роста и синтеза БЦ (Weinhouse and Benziman, 1976) путем преобразования в триозофосфат и дальнейшего метаболизма целлюлозы без образования глюконовой кислоты (Schramm et al., 1957).
Такой метаболический путь глицерина при культивировании симбиотической культуры Medusomyces gisevii, может объяснить высокий выход целлюлозы – 5,44 ± 0,37 г / л, из питательной среды, содержащей 5 % глицерина, как источника углерода, что больше на 13,3 % при использовании для биосинтеза в качестве субстрата глюкозы. СЗМ изображение показало трехмерную пористую структуру целлюлозы с преимущественно пространственно ориентированными микрофибриллами (рисунок 47). Эта структура определяет уникальные характеристики БЦ. Средняя ширина фибрилл бактериальной целлюлозы, полученной из глицериновой среды, составила около 85–110 нм, что меньше чем ширина фибрилл БЦ из глюкозной среды — около 155–165 нм.
Однако фибриллы ВС из глицериновой среды образуют более плотную сетчатую структуру, чем из глюкозной среды. Для биомедицинских применений может быть предпочтительной плотная микроструктура BC, поскольку она приводит к гладкой поверхности, которая улучшает адгезию и пролиферацию эндотелиальных клеток (ECs) и, таким образом, имеет характеристики, благоприятные для сосудистого трансплантата (Bodin et al., 2006). Он также может быть полезен в качестве материала для костного трансплантата и каркаса для тканевой инженерии хряща и кровеносных сосудов (Svensson et al., 2005). Однако, чтобы подтвердить эту возможность, необходимы дальнейшие исследования для оценки роста клеток на БЦ из глицериновой питательной среды.

а |

б |
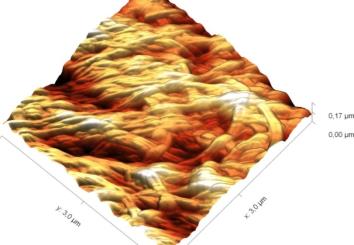
с |
|
| Рисунок 47 – Морфология поверхности бактериальной целлюлозы синтезированной на питательной среде с субстратом 10 % глицерина: а – двумерное изображение рельефа поверхности, b – амплитуда колебания зонда, c – трехмерное изображение рельефа поверхности | |
Внесение в питательную среду полисахаридов, как веществ изменяющих вязкость жидкости и как дополнительных субстратов, может быть целесообразно в целях увеличения продуктивности бактериальной целлюлозы и получения образцов с лучшими характеристиками. Определен максимальный выход целлюлозы на 21-е сутки биосинтеза – 2,73 ± 0,21 г/л.
На рисунке 48 представлена морфология поверхности целлюлозы, определены для этих образцов длинные (до 10 мкм) фибриллы. Большая их часть имеет определенную пространственную ориентацию. На поверхности наблюдается большое количество сферических образований диаметром 150 -300 нм. На макроуровне присутствуют впадины около 1 мкм в диаметре. Волокна в среднем имеют диаметр 75-100 нм
 |
 |
 |
|
| Рисунок 48 – Морфология поверхности бактериальной целлюлозы синтезированной на питательной среде с субстратами — 10% глюкозы и 1% пектина: а – двумерное изображение рельефа поверхности, b – амплитуда колебания зонда, c – трехмерное изображение рельефа поверхности | |
Используемые источники углерода заметно не изменили основную ультрадисперсную структуру фибрилл в образцах БЦ.
2.9 Оценка биосовместимости раневого покрытия на основе бактериальной целлюлозы с органами и тканями животных
2.9.1 Эффективность применения наноматериала при заживлении ожоговой раны
Оценку эффективности раневого покрытия на основе бактериальной целлюлозы начинали с определения его биосовместимости с органами и тканями животных, для этого проводили исследования на острую и хроническую токсичность. У лабораторных животных (крысы, n = 20, группа 2) после моделирования ожоговой раны III степени на 5-е сутки проводили некрэктомию, а раневую поверхность закрывали наноматериалом по всей площади ожога, контролем служили животные (крысы, n = 20, группа 3), у которых заживление проходило без применения лекарственных средств. Местное раздражающее действие бактериальной целлюлозы у опытных животных оценивали по изменениям поведенческой активности, локальным реакциям: покраснение, отёк, зуд и др.
В течение первых суток после ожоговой травмы у всех крыс отмечали нарушение координации движения, вялость. Клинические наблюдения за опытными и контрольными животными показали, что в первые сутки после нанесения ожога во всех группах снижалось потребление корма при повышенном потреблении воды. При проведении тестирования в «открытом поле» установлено, что на 1–3-е сутки после нанесения ожога во всех группах регистрировали повышение длительного груминга, что свидетельствовало о стремлении животных поддерживать поврежденные кожные покровы в чистом состоянии. Однако, данная тенденция, в опытной группе 4 сократилась на 3-е сутки после нанесения раневого покрытия, что в 2 раза раньше, чем у животных группы 3.
На фоне применения раневого покрытия к 7-м суткам у крыс (опытная группа 4) отмечали повышение различных видов поведенческой активности, так горизонтальные и вертикальные активности увеличились в 3 раза по сравнению с контролем (группа 3). При визуальном наблюдении было установлено, что у всех экспериментальных животных на месте термического ожога в течение первых суток после его нанесения формировался участок сухого коагуляционного некроза (рисунок 49).
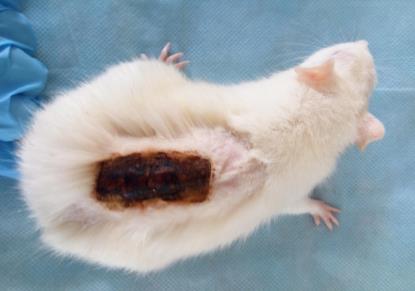 |
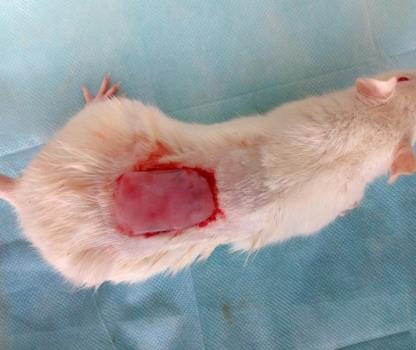 |
| Рисунок 49 – Коагуляционный некроз кожи после моделирования термического ожога, 1-е сутки эксперимента, группа 4 | Рисунок 50 – Аппликация из бактериальной целлюлозы на раневую поверхность после некрэктомии на
5-е сутки эксперимента, группа 4 |
На 5-е сутки после моделирования ожога на коже спины у крыс наблюдали рану прямоугольной формы с неровными краями. Её поверхность покрыта струпом, преимущественно, при надавливании, в центре имеются участки размягчения со скоплением под ними серозно-гнойного экссудата и отслоением струпа по периферии. Через 5 суток после моделирования ожога некротизированные ткани были удалены хирургическим методом и на ожоговую рану нанесено покрытие из бактериальной целлюлозы (рисунок 50).
Для оценки сокращения размера ожоговой раны у экспериментальных животных всех групп определяли площадь всей поверхности тела по формуле: Sп.т.=KxW0,66, (где K – коэффициент для вида животных (для крыс он равен 9,1), W– вес животного,) которая составила у животных группы 3 423,0 ± 2,6 см2; у опытной группы 4 – 416,6 ± 4,9 см2. Изменение площади ожоговых ран у крыс проходило в разные сроки (таблица 4).
Таблица 4 – Динамика заживления ожоговых ран у животных в эксперименте
| Показатель | Группа 3
(n = 20) |
Группа 4
(n = 20) |
| Площадь поверхности тела, см2 | 423,0±2,6 | 416,6±4,9 |
| Абсолютная площадь, см2
(после некрэктомии) 1 сутки 3 сутки 7 сутки 14 сутки 21 сутки 28 сутки |
33,1 ± 0,4
33,1 ± 0,4 30,6 ± 0,4 28,0 ± 0,5 25,7 ± 0,5 23,7 ± 0,6 |
32,6 ± 0,5
32,6 ± 0,5 30,1 ± 0,5 17,1 ± 0,9* 14,9 ± 0,8* 12,9 ± 0,7* |
| Относительный показатель площади ожоговой раны, % | 7,8 ± 0,1 | 7,8 ± 0,1 |
| Скорость эпителизации раны за 28 суток, % | 33,5 ± 1,3 | 68,5 ± 2,7* |
| Примечание:* р ≤ 0,05 –достоверность различий при сравнении с группой 3 | ||
На первом этапе исследований, выявлено, что применение раневого покрытия из бактериальной целлюлозы к 14-му дню наблюдения обеспечило достоверное (р≤0,05) снижение площади ожоговой раны на 48,6 % по абсолютным значениям, тогда как в контрольной группе – на 15,4 % (рисунок 51). В дальнейшем улучшение степени заживления (эпителизации) раны в опытной группе 4 сохранялось и имело интенсивную динамику – уменьшилось на 12,8 % на 21-е сутки по сравнению с 14-ми сутками и на 13,4 % на 28-е сутки по сравнению с 21-ми сутками. Так, площадь ожоговой раны у крыс опытной группы 4 сократилось за 28 суток наблюдения на 68,5 ± 2,7%, в контрольной группе 3 – 33,5 ± 1,3% (рисунок 51).
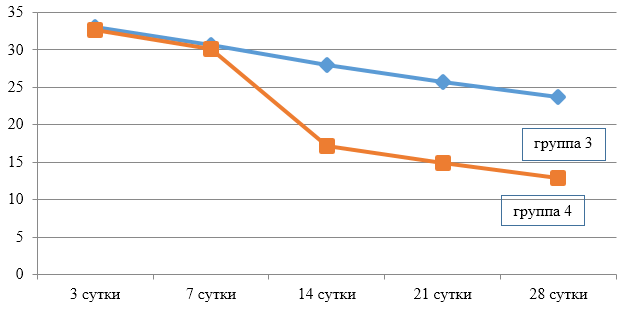
Рисунок 51 – Динамика заживления ожоговых ран у животных
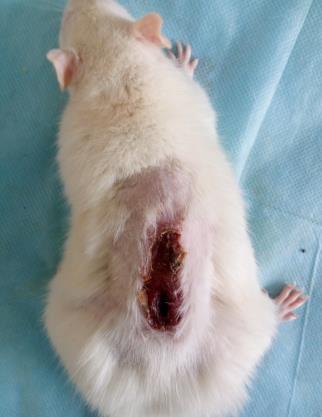 |
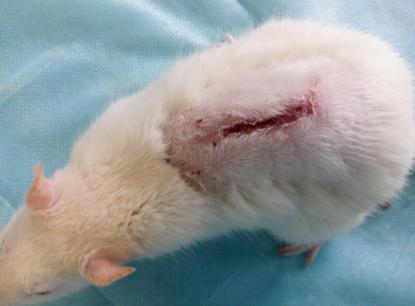 |
| Рисунок 52 – Ожоговая рана на 28-е сутки, контрольная группа 3 | Рисунок 53 – Ожоговая рана на 28-е сутки, опытная группа 4 |
Результатом проведённого эксперимента явилось, то, что при визуальном осмотре ожоговых ран на фоне применения покрытия из бактериальной целлюлозы в течение всего периода наблюдения отсутствовали признаки местного воспаления, тогда как в контрольной группе 3 у 70 % животных в зоне раневого дефекта регистрировали наличие гиперемии, зон глубокого некроза и серозно-гнойного экссудата.
2.9.2 Изучение общей и локальной реакции на бактериальную целлюлозу при её подкожной имплантации
Другим тестом на биосовместимость раневого покрытия из бактериальной целлюлозы с органами и тканями животных являлась имплантация образца из наноматериала под кожу в область холки. Для проведения исследования были сформированы две группы из кроликов (опытная и контрольная) по 10 голов в каждой, животных подбирали по принципу аналогов. У кроликов контрольной группы 1 в качестве имплантата применяли часть марлевой салфетки, по размеру соотносимой с образцом из бактериальной целлюлозы (3 × 3 см).
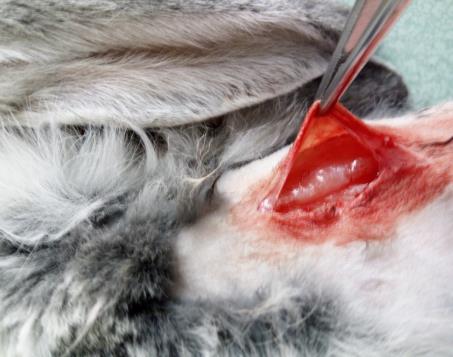
Рисунок 54 –Подкожная имплантация бактериальной целлюлозы,
кролик опытной группы 2
У животных всех групп в области холки выполняли линейный разрез длинной 3-5 см, рассекали кожу до подкожной клетчатки, затем формировали карман для внедрения имплантата (рисунок 54). Заживление операционных ран протекало по первичному натяжению, швы снимали на 7-е сутки после операции (рисунок 55).
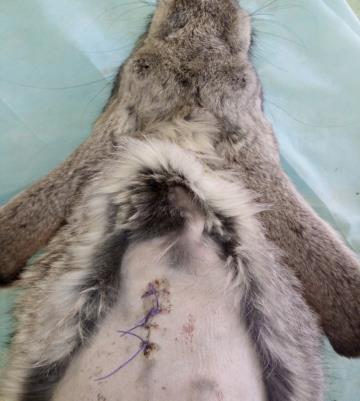
Рисунок 55 – Операционная рана на 7-е сутки эксперимента, кролик группы 2

Рисунок 56 – Абсцесс в области имплантации у кролика группы 1
В контрольной группе отмечали 100 % отторжение имплантата в первые две недели эксперимента (12 ± 0,3 сутки). На 14 сутки после операции у всех кроликов контрольной группы 1 наблюдали выраженные признаки воспаления, которые к 30 суткам продолжали нарастать с формированием плотного абсцесса (рисунок 56). При микроскопическом исследовании гистологических препаратов животных контрольной группы отмечали преобладание некробиотических процессов в области введения имплантата, очаги кровоизлияний, воспалительной инфильтрации. В окружающих тканях регистрировали различные клетки, участвующие в воспалительном процессе, в основной массе это были макрофаги, лимфоциты и многочисленные клетки фибробластического ряда разной степени зрелости.
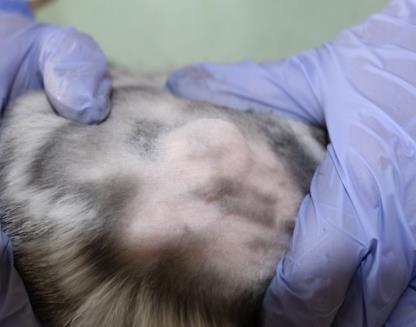
Рисунок 57 – Зона имплантации раневого покрытия из бактериальной целлюлозы на 28 сутки эксперимента, кролик группы 2
Кролики опытной группы 2 на всех этапах эксперимента были активны, клинических признаков локального воспаления не регистрировали ни у одного прооперированного животного (рисунок 57). В зоне имплантации определяли плотный, безболезненный, подвижный, округлый формы фрагмент, который на протяжении 8 месяцев не изменялся ни в размерах, ни в плотности, ни в реакции окружающих тканей. После извлечения имплантат представлял собой уплотнённый образец бактериальной целлюлозы, равномерной структуры и окраски на разрезе (рисунок 58). Макроскопически зона имплантации не отличалась от здоровых тканей кожи, подкожной клетчатки и соединительной ткани, с выраженной структурой и дифференциацией.

Рисунок 58 – Имплантат после извлечения через 8 месяцев после начала эксперимента
При морфологическом исследовании области имплантации у кроликов опытной группы 2 воспалительная реакция тканей отсутствовала. В прилегающих к имплантату мягких тканях отмечали оформленные пучки коллагеновых волокон. На парафиновых срезах раневое покрытие из бактериальной целлюлозы гистологическими красителями не окрашивается, материал визуализировался в виде бесцветного прозрачного фрагмента. Результат макро- и микроскопического исследования свидетельствовал о том, что бактериальная целлюлоза не оказывает на ткани раздражающего, токсического и аллергического воздействия.
Для изучения влияния бактериальной целлюлозы на организм кроликов опытной и контрольной группы проводили гематологические исследования крови, забор крови осуществляли путем пункции краевой вены уха, в некоторых случаях из сердечной мышцы. Контролем служили фоновые показатели этих же животных, которые определяли до начала эксперимента (таблица 5).
Таблица 5 – Изменения показателей крови кроликов на разных этапах эксперимента
| Показатели | Референс-ные значения | Группа | Сроки исследования, сутки | |||
| 1 | 7 | 14 | 21 | |||
| Эритроциты,
×1012 / л |
4,5 — 7,5 | 1 | 4,3 ± 0,1 | 4,5 ± 0,1 | 5,5 ± 0,2 | 5,7 ± 0,2 |
| 2 | 4,9 ± 0,2* | 5,6 ± 0,2* | 5,6 ± 0,2 | 5,5 ± 0,2 | ||
| Лейкоциты,
×109 / л |
6,5-9,5 | 1 | 6,9 ± 0,5 | 11,3 ± 0,9 | 10,6 ± 0,8 | 9,6 ± 0,5 |
| 2 | 6,5 ± 0,4 | 6,7 ± 0,4* | 6,4 ± 0,4* | 6,3 ± 0,3* | ||
| Примечание:* р ≤ 0,05 –достоверность различий при сравнении с контрольной группой | ||||||
Таким образом, в результате проведенных исследований было доказано увеличение скорости заживления ожогов опытной группы, проявляющееся в более быстром уменьшении их площади по отношению к контрольной группе. Выявлено улучшение качества репаративной регенерации при нанесении покрытия из бактериальной целлюлозы, характеризующееся заживлением ожоговой раны с полноценной эпителизацией ожогового дефекта и отсутствием признаков гнойного воспаления. Покрытие из БЦ следует накладывать в первые дни после некрэктомии. Установлено, что при ожоге III степени у крыс достаточно однократного применения. Покрытие отторгается после полной эпителизации раны. На модели экспериментальных термических ожогов выявлены следующие свойства покрытия из бактериальной целлюлозы: защита раны от механических воздействий, устранение избытка экссудата, обеспечение газообмена между раной и окружающей средой. Разработанное раневое покрытие за счёт своей прозрачности позволяет визуально контролировать заживление раны, а его эластичность не ограничивает подвижность кожи и позволяет находиться на ране вплоть до полной эпителизации дефекта кожи.
2.10 Эффективность применения раневого покрытия у животных с термическими ожогами
2.10.1 Анализ результатов морфометрических показателей ожоговых ран у животных при применении раневых покрытий
Целью настоящего исследования явилось обоснование эффективности применения раневого покрытия из бактериальной целлюлозы в зоне термического дефекта в сравнении с методами и средствами, наиболее широко используемыми при лечении ожогов в настоящее время.
Доклинические эксперименты проводили на 4 группах кроликов по 15 голов в каждой. Животным моделировали ожог III степени, площадь ожога составляла 26,5 ± 0,3 % от поверхности тела. Термическую травму животным наносили после предварительного проведения нейролептанальгезии, на 5-е сутки выполняли некрэктомию. У кроликов группы 5 заживление раны проходило без применения лекарственных препаратов и раневых покрытий, у группы 6 на раневую поверхность 2 раза в сутки наносили спрей Пантенол с последующим наложением марлевой защитной повязки. У животных группы 7 лечение ожоговой раны проводили с применением мазевой повязки «Бранолинд Н», которую фиксировали при помощи марлевого бинта, смену повязки проводили ежедневно. У кроликов группы 8 раневую поверхность закрывали покрытием, выполненным из бактериальной целлюлозы. Покрытие выкраивали в условиях операционной по полиэтиленовому шаблону, повторяя контур раны, применялось однократно.
Клиническое обследование, включающее наблюдение за общим состоянием организма, измерение температуры тела, частоты пульса и дыхание, проводили до постановки эксперимента, а также на 3-е, 7-е, 14-е и 21-е сутки после моделирования ожогов (таблица 6). На 1-е сутки после термической травмы у животных всех групп отмечали вялость, адинамичность, отказ от корма, полидипсию, а также повышение температуры тела, учащение пульса и дыхание. В области ожоговой травмы некротические ткани кожи плотно прилегали к подлежащим тканям, несколько возвышаясь над здоровыми тканями.
Таблица 6 – Динамика физиологически показателей у кроликов (М ± m)
| Показа-тели | Группа | Сроки исследования, сутки | |||
| 3 | 7 | 14 | 21 | ||
| Температура, °С | 5 | 39,8 ± 0,1 | 39,5 ± 0,1 | 39,3 ± 0,1 | 39,1 ± 0,1 |
| 6 | 39,9 ± 0,2 | 39,1 ± 0,2 | 39,4 ± 0,1 | 39,0 ± 0,1* | |
| 7 | 39,7 ± 0,2 | 40,1 ± 0,2*& | 39,7 ± 0,1& | 39,5 ± 0,1*& | |
| 8 | 39,7 ± 0,2 | 39,2 ± 0,1*α | 38,9 ± 0,1*& α | 38,6 ± 0,1*&α | |
| Частота пульса, уд/мин | 5 | 167,1 ± 1,9 | 158,0 ± 1,9 | 148,5 ± 2,6 | 148,4 ± 1,6 |
| 6 | 161,7 ± 4,1 | 152,3 ± 3,0 | 144,5 ± 1,9 | 145,4 ± 2,6 | |
| 7 | 172,7 ± 2,1& | 157,2 ± 2,5 | 148,8 ± 2,9 | 145,8 ± 2,5 | |
| 8 | 173,3 ± 1,5*& | 149,6 ± 3,2* | 145,3 ± 1,8 | 140,4 ± 1,2* | |
| Частота дыхания, движ./мин | 5 | 83,8 ± 2,6 | 77,4 ± 2,6 | 72,2 ± 2,4 | 61,4 ± 2,1 |
| 6 | 78,4 ± 1,2 | 78,0 ± 2,1 | 71,5 ± 1,8 | 51,1 ± 2,1* | |
| 7 | 86,4 ± 1,6& | 77,5 ± 2,3 | 65,7 ± 2,2& | 58,2 ± 1,7& | |
| 8 | 77,2 ± 1,8* α | 70,8 ± 2,1*α | 63,8 ± 1,9*& | 58,6 ± 1,5*& | |
| Примечание:
* р ≤ 0,05 –достоверность различий при сравнении с группой 5; & р ≤ 0,05 –достоверность различий при сравнении с опытной группой 6; α р ≤ 0,05 –достоверность различий при сравнении с опытной группой 7. |
|||||
На 3-е сутки после моделирования ожога у кроликов наблюдали отечность и гиперемию по краям раны (рисунок 59).
На 7-е сутки у кроликов групп 5, 6 и 8 температура тела нормализовалась, в отличие от группы 7, в которой этот показатель оставался повышенным. Данный факт связываем с развитием гнойных воспалительных процессов в поврежденном участке. Так, у 26,6 % животных наблюдали абсцедирование раны. Частота пульса и дыхания у животных всех групп на 7, 14 и 21-е сутки оставались в пределах физиологических границ.
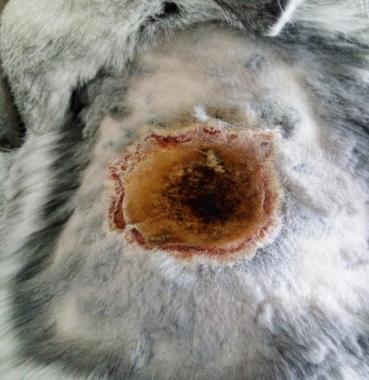 |
Рисунок 59 – Вид ожоговой раны у кролика опытной группы 8 на 3-е сутки эксперимента |
На поврежденном участке кожи отмечали выраженный коагуляционный некроз с образованием неравномерного по толщине коричневого цвета струпа, который возвышался над здоровыми тканями. На 5-е сутки проведено тангенциальное очищение некротизированных тканей в условиях операционной (рисунок 60).
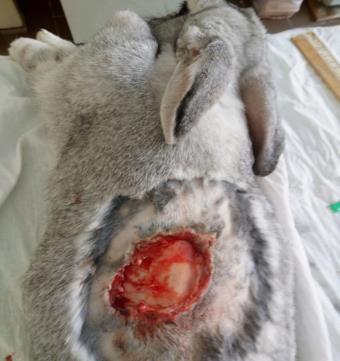 |
Рисунок 60 – Проведение хирургической некрэктомии у кролика опытной группы 8 на 5-е сутки эксперимента |
У кроликов группы 5 на 7-е сутки после некрэктомии проведено измерение площади ожоговой раны, что составила 2,4 % от поверхности тела кролика. У всех животных этой группы отмечали локальный воспалительный процесс, сопровождающийся скоплением под «вторичным струпом» гнойно-геморрагического экссудата. Дальнейшее наблюдение за ходом репарации поврежденного участка показало, что отношение площади раны к поверхности тела составило на 14-е сутки – 1,04 %, на 21-е сутки – 0,7 %, на 28-е сутки – 0,59 % (таблица 7).
Краевой эпителий раны у кроликов группы 5 проявился на 16,7 ± 0,5 сутки. Полное заживление ожогового участка регистрировали только на 51,7 ± 0,6 сутки с образованием плотной рубцовой ткани. Общая площадь раны к 28-м суткам снизилась на 2,13 % от исходной величины (рисунок 61). Показатели скорости заживления раневого дефекта в этой группе неравномерны, наибольшее увеличение отмечали в период 7 – 14-е сутки.
Таблица 7 – Планиметрические показатели динамики заживления раны при различных способах ее лечения (M ± m)
| Группа | Площадь поверхности тела, см2 | Площадь ожоговой раны, мм2
(сутки после хирургической некрэктомии) |
||||
| 1–е | 7-е | 14-е | 21-е | 28-е | ||
| 5 | 2444,3 ±39,9 | 664,9±10,0 | 586,8±10,7 | 254,3±11,8 | 189,8±8,8 | 144,5±6,4 |
| 6 | 2544,2±27,9 | 658,8±9,8 | 441,7±9,5* | 333,7±9,5* | 197,7±9,5 | 118,9±7,1* |
| 7 | 2547,1±37,3 | 712±10,6*& | 661,1±23,5*& | 316,1±12,6* | 282,8±11,6*& | 222,2±13,7*& |
| 8 | 2557,1±34,1 | 792,3±18,1*& α | 371,6±13,6*& α | 239,8±12,1& | 154,7±10,2*& α | 71,7±7,5*& α |
| Примечание:
* р≤0,05 –достоверность различий при сравнении с группой 5; & р≤0,05 –достоверность различий при сравнении с группой 6; α р≤0,05 –достоверность различий при сравнении с группой 7. |
||||||
У кроликов группы 6 отмечали более ранее завершение воспалительного процесса и существенную интенсификацию процессов краевой эпителизации, чем в группе 5. У животных этой группы отмечали прилипание повязки к ране, замена которой сопровождалась капиллярным кровотечением и травматизацией эпителия. Площадь раневого дефекта составила на 7-е сутки после некрэктомии – 1,7 % от поверхности тела, на 14-е сутки – 1,3 %, на 21-е сутки – 0,7 %. Общая площадь раны к 28-м суткам снизилась на 2,04 % от исходной величины (рисунок 61).
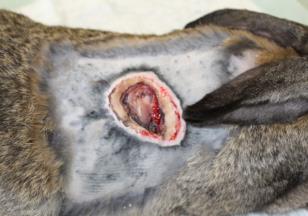 а а |
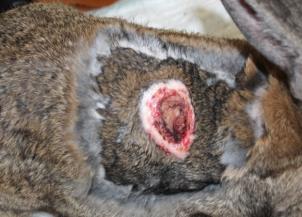 б б |
в 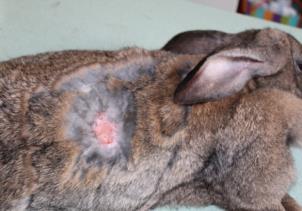 |
Рисунок 61 – Динамика заживления ожоговой раны у кролика группы 5
а) на 3-е; б) на 7-е; в) на 28-е сутки после некрэктомии |
Первые признаки появления эпителия по периферии раневого участка у кроликов группы 6 наблюдали в среднем на 9,1 ± 0,4 сутки (р ≤ 0,05), что на 7,6 суток быстрее, чем в группе 5 (таблица 8).
Таблица 8 – Динамика клинического течения раневого процесса (M ± m)
| Группа | Очищение раны от «вторичного» струпа, сутки | Появление краевой эпителизации, сутки после некрэктомии | Заполнение раны грануляционной тканью, сутки после некрэктомии |
| 5 | 21,5 ± 0,5 | 16,7 ± 0,5 | 51,7 ± 0,6 |
| 6 | 13,7 ± 0,8* | 9,1 ± 0,4* | 43,4 ± 1,3* |
| 7 | 21,8 ± 0,8& | 13,2 ± 0,6*& | 54,8 ± 0,8*& |
| 8 | 22,8 ± 0,7& | 5,8 ± 0,3*&α | 36,2 ± 0,7*&α |
| Примечание:
* р ≤ 0,05 –достоверность различий при сравнении с группой 5; & р ≤ 0,05 –достоверность различий при сравнении с группой 6; αр ≤ 0,05 –достоверность различий при сравнении с группой 7. |
|||
Полное заживление раны регистрировали к 43,4±1,3 суткам. Увеличение скорости эпителизации отмечали до 7 суток, затем, наблюдали снижение интенсивности заживления раневого процесса.
 а а |
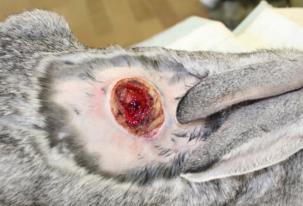 б б |
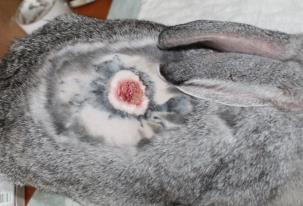 в в |
Рисунок 62 – Динамика заживления ожоговой раны у кролика группы 6
а) на 3-е; б) на 7-е; в) на 28-е сутки после некрэктомии |
Местное применение покрытия «Бранолинд Н» кроликам группы 7 предотвращает травматизацию новообразованного эпителия за счет мазевой основы, но, однако, не защищает от механического и инфекционного воздействия. Несмотря на ежедневые перевязки, у кроликов этой группы отмечали гнойный экссудат до 35-ти суток. Несмотря на раздельное содержание каждого животного, большая часть животных уже через несколько часов срывала повязки, что приводило к контракции раны, изменению ее формы и доставляло дополнительные трудности при проведении планиметрии.
Заживление ожоговой раны у кроликов группы 7 в целом шло медленно и в большинстве случаев (53,3 %) полного заживления не удалось достичь даже на 35 сутки. Динамику увеличения скорости заживления раны отмечали в период 7-14 суток (рисунок 63). Полной эпителизации ожогового участка у большинства кроликов этой группы не происходило, что связано с инфицированием раны. В среднем заживление ожоговой раны в данной группе регистрировали на 54,8 ± 0,8 сутки.
Группа 8
Группа 6
Группа 7
Группа 5
Рисунок 63 – Динамика скорости заживления ожоговых ран у животных всех опытных групп в разные периоды наблюдения (M ± m)
Процент отношение площади раневого участка к поверхности тела при использовании мазевой повязки «Бранолинд Н» в опытной группе 7 на 7-е сутки составил 2,59 %, на 14-е сутки – 1,2 %, на 21-е сутки – 1,1 %. Общая площадь раны к 28-м суткам снизилась на 1,92 % от исходной величины (рисунок 63).
В группе 8 отмечали благоприятную клиническую картину. Так, у кроликов данной группы уже на 2-е сутки после лечения, общее состояние было удовлетворительное. Кролики охотно потребляли корм и воду, двигательная активность сохранена. При наложении покрытия из бактериальной целлюлозы на поверхность раны, установлено, что оно обладает достаточной эластичностью, адаптируется к неровной поверхности и обеспечивает равномерную компрессию тканей.
Окончательный гемостаз достигнут через 1,8 ± 0,86 часа после наложения раневого покрытия, вторичного кровотечения в послеоперационный период не регистрировали. При макроскопической оценке изменений раневой поверхности при использовании раневого покрытия из БЦ выявлено более раннее завершение воспалительного процесса, чем у животных других исследуемых групп.
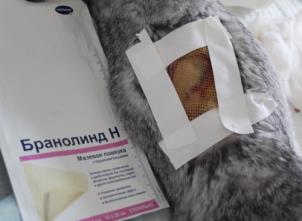 а а |
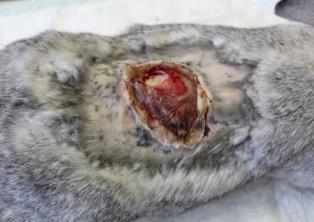 б б |
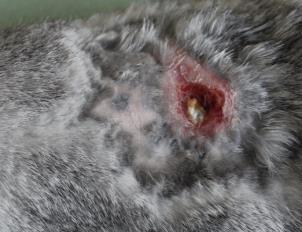 в в |
Рисунок 64 – Динамика заживления ожоговой раны у кролика группы 7
а) на 3-е; б) на 7-е; в) на 28-е сутки после некрэктомии |
Отличительной особенностью заживления ожоговой раны у кроликов группы 8 являлось наличие незначительного отёка, отсутствие гиперемии, отсутствие экссудата под некротическим пластом уже на 2-3 сутки наблюдения. Следует отметить, что раневое покрытие накладывали на рану однократно и оно сохранялось на ране вплоть до полной эпителизации.
Статистический анализ планиметрического исследования показал, что темпы сокращения размеров раны в группе 8 заметно выше, чем в группе 5. Начиная, с 3-х суток у животных этой группы наблюдали увеличение скорости заживления раневого процесса по сравнению с другими группами. Регистрировали достоверное, по отношению к группам сравнения, сокращение площади раны уже на 7-е сутки после некрэктомии (с 3,09 % до 1,45 %) (р ≤ 0,05) (рисунок 65).
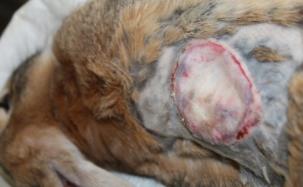 а а |
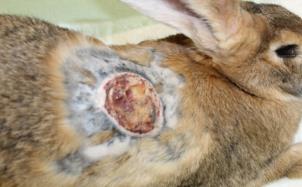 б б |
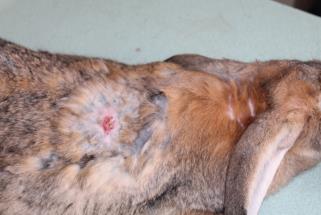 в в |
Рисунок 65 – Динамика заживления ожоговой раны у кролика группы 8
а) на 1-е; б) на 7-е; в) на 28-е сутки после некрэктомии |
В последующие сроки также отмечалось прогрессирующее заживление участка травмы у кроликов группы 8. Морфометрия ожоговой раны кроликов этой группы показала, что начало эпителизации раны происходило уже на 5,8 ± 0,3 сутки (р ≤ 0,05) наблюдения, когда как у животных группы 5 на 16,7 ± 0,5 сутки (р ≤ 0,05). Заживление ожоговой раны проходило под струпом, отмечалась краевая эпителизация шириной 0,42 ± 0,1 см уже на 3-е сутки после некрэктомии. Полное завершение регенерации ожоговой раны за счет краевой эпителизации в опытной группе 8 наступала на 36,2 ± 0,7 сутки, что на 15,5 суток (р ≤ 0,05) раньше по сравнению с группой 5, на 7,2 и на 18,6 суток (р ≤ 0,05) по сравнению с опытными группами 6 и 7 соответственно. Процессы заживления ран в группе 8 протекали быстрее в течение первых семи суток, что по срокам соответствует первой фазе раневого процесса – фазе воспаления. Усиление репаративных процессов связано с выведением экссудативной жидкости, предотвращением поступления микроорганизмов на поверхность раны. Во II и III фазах эпителизация раны происходит под раневым покрытием. Раневое покрытие на основе бактериальной целлюлозы плотно фиксируется на поверхности раны. Применение этого покрытия позволяет полностью очистить дефект тканей от омертвевших участков, бактерий и их токсических веществ. Это же помогает уменьшить общее отравление организма продуктами жизнедеятельности микробов. В группах сравнения 5, 6 и 7 регистрировали осложнения в виде нагноения ран (таблица 9).
Таблица 9 – Характер осложнений у животных опытных групп
| Осложнения и местные раневые реакции | Группы | |||||||
| 5 | 6 | 7 | 8 | |||||
| Абс. | % | Абс. | % | Абс. | % | Абс. | % | |
| Абсцесс | 4 | 26,6 | 2 | 13,3 | 3 | 20,0 | 0 | 0 |
| Флегмона | 0 | 0 | 0 | 0 | 1 | 6,6 | 0 | 0 |
Исходя из проведённых исследований, наибольший процент осложнений регистрировался у животных в опытной группе 7, что связываем с вторичным инфицированием ран.
Таким образом, уменьшение площади и увеличение скорости заживления ожоговой раны статистически достоверно в опытной группе 8, чем во всех остальных исследуемых группах. Полученные данные позволяют заключить, что использование раневого покрытия из бактериальной целлюлозы существенно снижает потребность в анестизиологическом обеспечении, уменьшает развитие гнойных осложнений раневого процесса и ускоряет эпителизацию дермальных ожогов, по сравнению с результатами использования марлевых повязок с Пантенолом и Бранолиндом.
2.10.2 Результаты течения процессов репарации ожоговых ран по данным морфологических исследований
В модельных экспериментах установлено, что ожоговая травма сопровождается развитием сухого коагуляционного некроза кожи без гибели поверхностного слоя мышц. Четкая граница некроза кожи начинает прослеживаться к 3-м суткам эксперимента. Кожа поврежденного участка полностью утрачивает свою структуру, коллагеновые волокна собраны в большие пласты. Погибшие волосяные луковицы представляют собой бесструктурные массы, интенсивно окрашенные основными красителями. Поверхностные мышцы сохраняют структуру и характерную для них окраску. Полученная гистологическая картина позволяет отнести ожог к III степени.
На 3-е сутки после моделирования термического ожога в ходе осмотра тканей во всех группах отмечали наличие классических признаков воспаления: гиперемию, отек окружающих тканей и краев раны, мелкоточечные кровоизлияния (рисунок 66). Поврежденный участок был покрыт фрагментированным струпом, состоящим их разрушенных и дегенеративно измененных клеточных элементов эпидермиса и дермы.
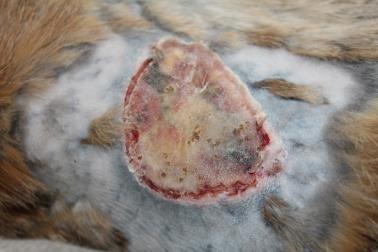
Рисунок 66 – Внешний вид ожоговой раны на 3-е сутки
эксперимента, группа 5
При микроскопическом исследовании кожи в месте ожога у кроликов отмечали выраженный отек всех слоев дермы, деструкцию коллагеновых волокон, полнокровие капилляров. В дерме регистрировали очаговое скопление лейкоцитов, которые мигрировали в ткань, образуя микроабсцессы.
По периферии зоны очага коагуляционного некроза сформирована зона демаркационной линии. По объективным показаниям на 5-е сутки всем животным провели хирургическую некрэктомию. Динамику регенерации ожоговой раны у животных исследуемых групп оценивали по основным критериям, а именно, по степени отека тканей, времени отторжения «вторичного» струпа над регенерирующей поверхностью кожи, появлению грануляций и краевой эпителизации. Следует отметить, что у кроликов группы 8 слой эпидермиса прорастал под струп по всей пораженной поверхности кожи, на границе с «молодым» эпителием струп совместно с покрытием отделялся от дна раны.
При гистологическом исследовании тканей у животных группы 5 отмечали выраженные экссудативно-некротические процессы. Поверхность центральной зоны ожоговой раны покрыта «вторичными» некротическими массами, в зоне периферии видны микроабсцессы. В дерме сосуды расширены, с выраженным полнокровием, коллагеновые волокна отечны и расположены хаотично, имеют место выраженные явления периваскулярного отека (рисунок 67).
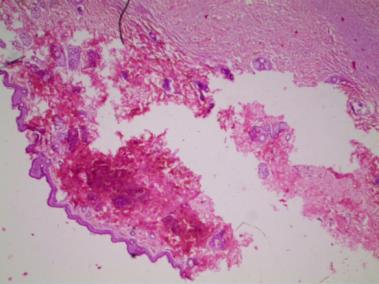
1 Рисунок 67 – Отторжение некротизированных тканей (1), группа 5, 7 сутки. Окраска гематоксилином и эозином. Ув. 100 |
На 14-е сутки регистрировали отторжение утолщенного «вторичного» струпа по периферии (толщина 167,6 ± 8,1 мкм) и обильное выделение гнойного экссудата. Под струпом наблюдали небольшой лейкоцитарный вал толщиной 62 ± 2,7 мкм (таблица 10).
Таблица 10 – Морфологические изменения кожи у кроликов с термическими ожогами на 14 сутки после хирургической некрэктомии (M ± m)
| Группы | Толщина, мкм | ||
| «Вторичный» струп | Лейкоцитарный вал | Зона эпителия | |
| 5 | 167,6 ± 8,1 | 62 ± 2,7 | 24,7 ± 2,1 |
| 6 | 275,9 ± 10,2* | 57,2 ± 1,5 | 46,5 ± 1,7* |
| 7 | 255,8 ± 5,9* | 83,2 ± 1,8*& | 21,2 ± 1,5& |
| 8 | 321,9 ± 8,2*&α | 37,5 ± 1,3*&α | 67,5 ± 3,5*&α |
| Примечание:
* р ≤ 0,05 –достоверность различий при сравнении группой 5; & р ≤ 0,05 –достоверность различий при сравнении с группой 6; αр ≤ 0,05 –достоверность различий при сравнении с группой 7. |
|||
На фоне воспалительной инфильтрации в дерме отмечали появление участков грануляционной ткани толщиной 24,7 ± 2,1 мкм. На 21-е сутки у кроликов группы 5 отмечали постепенное отторжение плотного коричневого струпа. Слабое развитие процессов эпителизации у этих животных наблюдали в интервале между 35-ми и 42-ми сутками и подтверждается наличием неравномерно утолщенного слоя эпителия. Через 2 месяца после моделирования ожога под эпидермальным слоем регистрировали бессосудистую плотную рубцовую ткань.
У животных опытной группы 6 на 7-е сутки после хирургической некрэктомии в результате осмотра и гистологических исследований ожогового участка наблюдали экссудативно-некротический характер процесса, который был выражен в меньшей степени, чем у животных группы 5. Воспалительная инфильтрация локализована как на границе струпа и дна раны, так и в тканях дермы, что говорит об увеличении скорости демаркации зоны некроза от здоровых тканей, по сравнению с группой 5.
На 14-е сутки наблюдения в группе 6 отмечали малодифференцированный струп (толщина 275,9 ± 10,2 мкм), отграниченный от дермы гистиолейкоцитарным инфильтратом (толщина 57,2 ± 1,5 мкм), по краю раны умеренная пролиферация эпидермиса (толщина 46,5 ± 1,7 мкм). В сосочковой зоне дермы коллагеновые волокна были расположены беспорядочно и рыхло. Воспалительный отек в дерме был менее выражен, тем не менее, регистрировали концентрические вакуоли средних размеров.
На 21-е сутки наблюдали базальную мембрану эпидермиса с участками утолщения и расслоения, в шиповом слое регистрировали очаговый спонгиоз. На 28-е сутки, микроскопически в тканях животных исследуемой группы, в большинстве наблюдений отмечали, что зона регенерата была полностью покрыта эпителиальным пластом неравномерной толщины (рисунок 68).
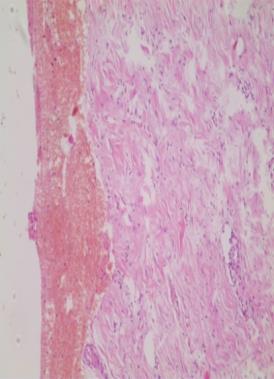
1
Рисунок 68 – Пролиферация клеток фибробластического дифферона и формирование соединительной ткани (1). Опытная группа 6, 28 сутки. Окраска гематоксилином и эозином. Ув. 100
Роговой слой эпидермиса интенсивно слущивался. Соединительнотканный регенерат состоял частично из плотной рубцовой ткани, а частично из волокнистой соединительной ткани. Производные кожи отсутствовали. Следует отметить, что в некоторых случаях у животных группы 7 сохранялось наличие очаговой воспалительной инфильтрации, что свидетельствовало о задержке процессов регенерации.
У кроликов группы 7 на 7-е сутки после некрэктомии на поверхности ожоговых ран наблюдали выраженную серозно-гнойную экссудацию. У всех животных определялись изъязвления в центральной части ожоговой раны с выраженной лейкоцитарной инфильтрацией как поверхностных, так и глубоких слоев дермы. Отличительной особенностью воспалительных проявлений в данной группе явилось формирование множественных микроабсцессов и некротических изменений в подлежащих тканях кожи.
Вместе с тем, по сравнению с 5 и 6 группами на 14-е сутки эксперимента у животных группы 7 в зоне термического ожога эпителиальный слой кожи не восстанавливался. Лишь с периферии под «вторичным» струпом (толщиной 255,8 ± 5,9 мкм) определяли небольшую зону врастающего эпителия (толщина 21,2 ± 1,5 мкм). Здесь же наблюдали скопление гнойного экссудата в центральной зоне ожогового участка с распространением на прилегающую краевую грануляционную зону, которая была представлена тонкими соединительнотканными волокнами.
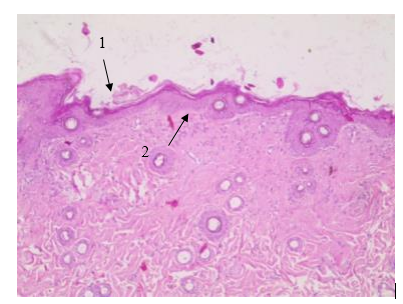
2
Рисунок 69 – Формирование сосочкового слоя дермы (2) и эпителизация дна раны (1). Опытная группа 7, 28 сутки.
Окраска гематоксилином и эозином. Ув. 100
На 14-е сутки в зоне поражения сохранялся отек и нейтрофильная инфильтрация тканей (толщина 83,2 ± 1,8 мкм) с распространением некротических изменений на гиподерму, что свидетельствовало о продолжающейся экссудативной фазе воспаления. У кроликов опытной группы 7 на 21-е сутки эксперимента наблюдали зону краевой эпителизации, однако центральная зона на значительном протяжении оставалась без эпителиальной выстилки и была покрыта струпом из фибрина, обрывками некротизированных волокнистых структур.
На 28-е сутки эксперимента вследствие продолжающихся воспалительных процессов центральная зона оставалась без эпителия и была покрыта струпом. У восьми животных этой группы наблюдали участки с отторжением струпа и наличием гнойного экссудата. Под струпом и эпителием располагалась молодая соединительная ткань (рисунок 69).
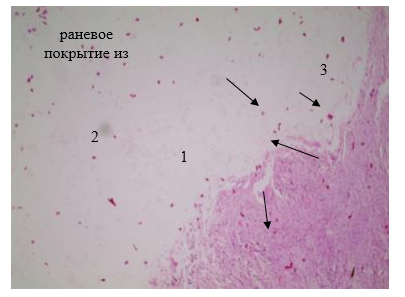
Рисунок 70 – Однородность слоев дермы (1), формирование коллагеновых волокон (2), миграция фибробластов (3). Опытная группа 8,
7-е сутки. Окраска гематоксилином и эозином. Ув. 100.
В отличие от животных других исследуемых групп у кроликов опытной группы III на 7-е сутки после некрэктомии воспалительные явления слабо выражены. Положительная динамика лечения ожогов проявляется отсутствием отделяемого из раны, незначительной гиперемией в пограничной зоне со здоровыми тканями, отсутствием отека. К 7-м суткам после хирургической некрэктомии отмечали наличие тонкого коричневого «вторичного» струпа, покрывающего поверхность ожоговой раны.
Следует отметить, что раневое покрытие из бактериальной целлюлозы надежно фиксируется к дну раны, при пальпации зон размягчения не регистрировали. У кроликов опытной группы 8 отмечали краевую эпителизацию раны (рисунок 70).
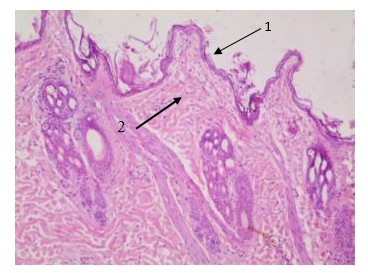 |
| Рисунок 71 –Пролиферация клеток эпителиоцитарного дифферона, формирование эпидермиса (1) и сосочкого слоя дермы (2). Группа 8,
28-е сутки. Окраска гематоксилином и эозином. Ув. 100 |
При микроскопическом исследовании в области дермы наблюдали формирование полноценных коллагеновых волокон, в грануляционной ткани выявляли умеренное количество тонкостенных сосудов.
На 14-е сутки в большинстве препаратов отмечали наличие непрерывного равномерного тонкого струпа (толщина 321,9 ± 8,2 мкм) и пролиферирующего слоя эпидермиса (толщина 67,5 ± 3,5 мкм), который прорастал под струп по всей зоне пораженной поверхности кожи. Нарастание эпителиальных клеток под струпом связываем, вероятно, с миграцией пролиферирующего эпидермиса с краев раны. Отделяемое из ран отсутствовало. У большинства животных ожоговая рана была заполнена молодой грануляционной тканью, состоящей из параллельно расположенных многочисленных тяжей коллагеновых волокон.
На 21-е сутки струп с раневым покрытием из бактериальной целлюлозы полностью десквамировался. Дно раны выстлано грануляционной тканью и покрыто слоем уплощенных клеток. В подлежащей дерме отмечали легкое полнокровие венозных сосудов, воспалительная инфильтрация отсутствовала.
Окончательная эпителизация заканчивалась к 28-м суткам, раневая поверхность имела равномерную бледно-розовую окраску, в дерме коллагеновые и эластические волокна ориентированы преимущественно горизонтально параллельно поверхности кожи (рисунок 71).
2.10.3 Результаты лабораторного анализа крови животных в различных группах эксперимента
Морфологический анализ крови является признанным информативным тестом, отражающим общее состояние животных и позволяет судить об реактивности организма. Изучение реакции системы красной крови экспериментальных животных показало, что уровень эритроцитов в крови контрольной и опытных групп находились в пределах физиологической нормы. На 5-е, 7-е, 14-е и 28-е сутки наблюдали различия по содержанию общего количества эритроцитов и лейкоцитов. Интерес вызывает понижение концентрации на 5-е сутки после моделирования ожоговой раны у всех групп, что связано с кровопотерей в связи с оперативными вмешательствами по иссечению некротизированной ткани (таблица 11).
Так, у кроликов опытной группы 6 на 28,8 % по сравнению с исходными показателями, у опытной группы 7 и 8 – 25,8 % и 23,8 % соответственно. Отмечали достоверное различие (р ≤ 0,05) количества эритроцитов на 5-е сутки у кроликов группы 6, 7 и 8 (на 2,4 %, на 12,2 %, 17,7 % соответственно) по сравнению с группой 5.
Лейкоциты играют главную роль в защите организма от внешних и внутренних патогенных агентов. Использование для лечения ожоговых ран покрытия из бактериальной целлюлозы обеспечило снижение количества лейкоцитов крови у кроликов, по сравнению с группами. Концентрация лейкоцитов на 5-е сутки после нанесение модельной ожоговой раны у животных опытной группы 8 превышало их уровень в контрольной группе (на 4,05 %), у кроликов опытной группы 8 было ниже, чем в контрольной группе 5 на 2,03 %.
Таблица 11 – Концентрация форменных элементов в крови кроликов в разные периоды наблюдения
| Показатели | Группа | До опыта | Сроки исследования,
сутки после моделирование ожоговой раны |
|||
| 5 | 7 | 14 | 28 | |||
| Эритроциты, ×1012/л | 5 | 6,1 ± 0,1 | 4,1 ± 0,1 | 4,4 ± 0,1 | 4,6 ± 0,1 | 5,9 ± 0,1 |
| 6 | 5,9 ± 0,1* | 4,2 ± 0,1* | 4,7 ± 0,1* | 4,6 ± 0,1* | 6,1 ± 0,1* | |
| 7 | 6,2 ± 0,1*& | 4,6 ± 0,2* | 4,9 ± 0,1*& | 5,1 ± 0,2* | 5,1 ± 0,1*& | |
| 8 | 6,3 ± 0,1*&α | 4,8 ± 0,1*& | 5,2 ± 0,1*&α | 5,5 ± 0,1* | 6,2 ± 0,1*&α | |
| Лейкоциты,
×109 / л |
5 | 7,6 ± 0,2 | 14,8 ± 0,3 | 14,6 ± 0,3 | 13,1 ± 0,3 | 8,9 ± 0,2 |
| 6 | 7,5 ± 0,2 | 14,8 ± 0,3 | 14,4 ± 0,3 | 13,9 ± 0,2* | 8,8 ± 0,3 | |
| 7 | 7,3 ± 0,2 | 15,4 ± 0,2 | 14,0 ± 0,3 | 13,9 ± 0,3* | 10,5 ± 0,3*& | |
| 8 | 7,6 ± 0,1 | 14,5 ± 0,2α | 13,5 ± 0,3*& | 11,8 ± 0,4*& | 7,7 ± 0,2*&α | |
| Примечание:
* р ≤ 0,05 –достоверность различий при сравнении с группой 5; & р ≤ 0,05 –достоверность различий при сравнении с группой 6; αр ≤ 0,05 –достоверность различий при сравнении с группой 7. |
||||||
На 14-е сутки концентрация лейкоцитов в крови у кроликов 7 группы была выше на 32,06% по сравнению с контролем. Тогда, как в группе 8 на 14-е сутки достоверно ниже на 9,92 % по сравнению с показателями контрольной группы 5 и на 6,11 % по сравнению с опытной группой 7. К 28-м суткам эксперимента у кроликов опытной группы 8, происходила стабилизация показателей лейкоцитов до уровня фоновых, что соответствует завершению сроков эпителизации и выздоровлению животных.
Наблюдали статистически достоверное снижение числа лейкоцитов у экспериментальных животных опытной группы 8 на 28-е сутки, в сравнении с 5-ми сутками, что предполагает купирование воспалительных процессов. Однако, у кроликов опытной группы 7 содержание лейкоцитов достоверно выше в сравнении с контрольной группой 5 (на 17,98 %) (р ≤ 0,05).
Таблица 12 – Изменения лейкоцитарной формулы крови кроликов
| Сроки, сут. | Группа | Показатель | |||
| Эозинофилы | Нейтрофилы | Лимфоциты | Моноциты | ||
| До опыта | 5 | 2,2 ± 0,1 | 28,7 ± 0,2 | 65,8 ± 0,2 | 3,3 ± 0,1 |
| 6 | 1,8 ± 0,1* | 25,6 ± 0,4* | 69,8 ± 0,4* | 2,8 ± 0,1* | |
| 7 | 1,8 ± 0,1* | 28,2 ± 0,3& | 66,5 ± 0,2*& | 3,5 ± 0,1& | |
| 8 | 1,8 ± 0,1* | 23,0 ± 0,4*&α | 71,8 ± 0,3*& α | 3,4 ± 0,1& | |
| 5 | 5 | 3,6 ± 0,1 | 28,9 ± 0,3 | 63,9 ± 0,2 | 3,6 ± 0,1 |
| 6 | 5,0 ± 0,1* | 26,2 ± 0,4* | 65,2 ± 0,3* | 3,6 ± 0,1 | |
| 7 | 4,1 ± 0,1*& | 30,0 ± 0,3*& | 62,3 ± 0,3*& | 3,6 ± 0,1 | |
| 8 | 3,3 ± 0,1*& α | 27,4 ± 0,2*& α | 65,5 ± 0,1* α | 3,8 ± 0,1 | |
| 7 | 5 | 3,6 ± 0,1 | 29,9 ± 0,2 | 61,8 ± 0,2 | 4,7 ± 0,1 |
| 6 | 4,2 ± 0,2* | 27,3 ± 0,9* | 63,1 ± 0,6* | 5,4 ± 0,1* | |
| 7 | 3,4 ± 0,1*& | 28,8 ± 0,2*& | 61,7 ± 0,2& | 6,1 ± 0,1*& | |
| 8 | 2,7 ± 0,1*& α | 25,8 ± 0,4* α | 65,9 ± 0,3*& α | 5,6 ± 0,1* α | |
| 14 | 5 | 3,3 ± 0,1 | 26,5 ± 0,3 | 64,3 ± 0,3 | 5,9 ± 0,1 |
| 6 | 4,0 ± 0,1* | 23,4 ± 0,6* | 64,7 ± 0,5 | 7,9 ± 0,1* | |
| 7 | 2,9 ± 0,1*& | 28,7 ± 0,4*& | 62,2 ± 0,3*& | 6,2 ± 0,1*& | |
| 8 | 2,1 ± 0,1*& α | 25,4 ± 0,2*& α | 67,8 ± 0,2*& α | 4,6 ± 0,1*& α | |
| 28 | 5 | 2,8 ± 0,1 | 25,5 ± 0,2 | 65,4 ± 0,2 | 6,3 ± 0,1 |
| 6 | 2,2 ± 0,1* | 23,0 ± 0,6* | 67,2 ± 0,6* | 7,6 ± 0,2* | |
| 7 | 2,8 ± 0,1& | 26,3 ± 0,2*& | 64,4 ± 0,2*& | 6,5 ± 0,2& | |
| 8 | 1,7 ± 0,1*& α | 23,1 ± 0,6* α | 70,9 ± 0,5*& α | 4,3 ± 0,1*& α | |
| Примечание:
* р ≤ 0,05 –достоверность различий при сравнении с группой 5; & р ≤ 0,05 –достоверность различий при сравнении с группой 6; αр ≤ 0,05 –достоверность различий при сравнении с группой 7. |
|||||
Изменение лейкоцитарной формулы происходит в соответствии с процессами регенерации травмированных участков. Так, в фазу экссудации происходит активация клеток грануляционного ряда. У животных всех групп на 5-е сутки увеличивалось количество эозинофилов (таблица 12).
Начиная с 5-х суток по 14-е сутки, отмечали увеличение числа эозинофилов в крови у кроликов контрольной и опытных групп. Альтерация тканей, вызванная ожоговой травмой, приводила к 5-м суткам к увеличению нейтрофилов. В 7 опытной группе на 14-е сутки после моделирования ожоговой раны уровень нейтрофилов был выше на 8,3 % по сравнению с 5 группой, в 5 и 8 группах ниже на 11,7 % и 4,1 % соответственно. На 28-е сутки количество нейтрофилов в опытной группе III было ниже на 9,41 % по отношению к контрольной группе. Отмечены значительные колебания в содержании моноцитов: на 14-е сутки они были существенно и достоверно выше в крови кроликов опытной группы I по сравнению с контролем.
2.10.4 Количественная оценка метаболизма коллагена у лабораторных животных при различных способах лечения ожоговой раны
Для изучения активности фибробластов дермы было проведено исследование количественного содержания коллагена. Измеряли оптическую плотность, которая является наиболее информативным показателем для данного маркера. Методику оценивали по отношению оптической плотности окрашенной части препарата к оптической плотности не окрашенного фона, выраженная в условных единицах. Чем больше площадь волокон по отношению к межклеточному веществу, тем больше коллагеновых волокон в образцах.
При изучении гистологических препаратов кожи, с использованием поляризационной микроскопии и программного анализа микрофотографий, у животных контрольной группы, среднее соотношение коллагена до начала эксперимента составила 6,4 ± 0,1 у.е. У кроликов контрольной группы на 7-е сутки после моделирования ожоговой раны содержание коллагена уменьшается в 48,4% по сравнению с исходными показателями, тогда как к 28-м суткам наблюдали увеличение на 33,3 %. Полученные результаты свидетельствуют об усилении распада коллагена в дерме кожи, а также большой роли воспалительного процесса в патогенезе ожога.
Минимальное содержание общего коллагена наблюдалась у кроликов опытной группы 1 на 7-е сутки – 2,8 ± 0,1 у.е. В опытной группе 6 содержание общего коллагена на 28-е сутки повышалось на 71,4 % (у.е.) по сравнению с 3-ми сутками. Исследование гистологических препаратов кожи у животных опытной группы 7 на 7-е сутки выявило содержание коллагена – 3,2 ± 0,1 у.е., на 28-е сутки – 3,2 ± 0,1.
Таблица 13 – Содержание коллагена в коже у кроликов (M ± m)
| Группы | Сроки эксперимента, сутки | ||
| до эксперимента | 7 | 28 | |
| 5 | 6,4 ± 0,1 | 3,3 ± 0,2 | 4,3 ± 0,1 |
| 6 | 6,5 ± 0,1 | 2,8 ± 0,1* | 4,8 ± 0,2* |
| 7 | 6,1 ± 0,1*& | 3,2 ± 0,1& | 4,3 ± 0,1& |
| 8 | 6,3 ± 0,1α | 3,0 ± 0,1 | 5,6 ± 0,1*& α |
| Примечание:
* р ≤ 0,05 –достоверность различий при сравнении с группой 5; & р ≤ 0,05 –достоверность различий при сравнении с группой 6; αр ≤ 0,05 –достоверность различий при сравнении с группой I7. |
|||
При анализе гистологических препаратов кожи кроликов опытной группы 8 на 7-е сутки содержание коллагена составила 3,0 ± 0,1 у.е. На 28-е сутки значение уровня коллагена в коже животных опытной группе 8 приближалось к контрольному уровню, что соответствует стадии полной очистки раны от продуктов распада и заполнения дефекта грануляциями. К тому времени содержание коллагена в коже составило 5,6 ± 0,1 у.е (таблица 13).
Таким образом, у крыс опытной группы 8 с термическим ожогом отмечается достоверное более низкое соотношение общего коллагена в коже по сравнению с контрольной группой 5. Использование метода поляризационной микроскопии для определения содержания общего коллагена в препаратах кожи имеет высокую информативность в прогнозировании риска образования вторичных болезней кожи.
2.11 Эффективность применения бактериальной целлюлозы при закрытии частичного дефекта трахеи
На протяжении многих лет актуальной проблемой остаются патологии трахеи, приводящие к ухудшению и/или нарушению функции дыхания. Наиболее распространенными являются стенозы трахеи, причиной которых могут быть травмы различной степени тяжести, ставшие следствием транспортных аварий, падения с высоты и других механических факторов. Другой группой причин, приводящих к дефектам трахеи являются, хронические патологии, например, онкологические заболевания, а также ятрогенные факторы, которые могут развиваться в результате введения в трахею проводников для проведения диагностических исследований, обеспечения искусственной вентиляции лёгких, анестезиологии, реаниматологии и другое (В.Д. Паршин и соавторы, 2007).
Присоединение патогенной микрофлоры в травмированной области может провоцировать развитие септических осложнений как на локальном, так и на организменном уровнях (С.В. Чернигова, Ю.В. Чернигов, 2013). К сожалению, консервативное лечение возможно только при «свежих» патологических изменениях, пока не сформировался грубый рубец. Во всех других случаях остро стоит вопрос о закрытии дефекта для обеспечения герметизации дыхательных путей. В связи с этим остро стоит вопрос о выборе имплантационного материала, который соответствовал бы всем требованиям, предъявляемым к средствам и материалам для выполнения реконструктивно-восстановительных операций.
Целю настоящего исследования являлось обоснование возможности применения имплантата, выполненного из бактериальной целлюлозы, для закрытия окончатого дефекта трахеи.
Данная серия эксперимента включала моделирование окончатого дефекта трахеи кролика и его закрытие имплантатом из бактериальной целлюлозы (группа 10, n = 5). За прооперированными животными вели систематическое наблюдение, которое включало оценку общего клинического статуса, особое внимание уделяли качеству дыхания, акту глотания. Пальпаторно исследовали вентральную часть шеи в области хирургического вмешательства, оценивали состоятельность кожных швов, наличие или отсутствие эмфиземы, гематом, сером и абсцессов.
Оперативное вмешательство выполняли под нейролептанальгезией (сочетание рометара и золетила в дозировках, соответствующих массе тела животного). Кроликов фиксировали на операционном столе, в дорсо-вентральном положении. В вентральной части шеи выстригали шерсть, кожу обрабатывали настойкой йода 5 % двухкратно.
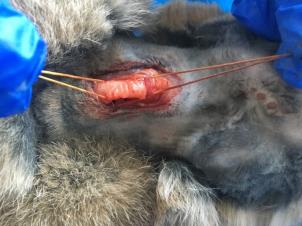 |
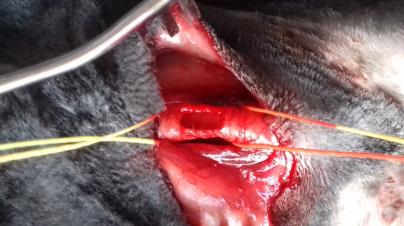 |
| а | б |
| Рисунок 72– Этапы операции по моделированию дефекта трахеи:
а – выделение и фиксация трахеи кролика лигатурами, б – моделирование окончатого дефекта трахеи |
|
При помощи скальпеля разрезали кожу по средней линии шеи от середины щитовидного хряща на 4-5 см каудальнее. После рассечения кожи, подкожной клетчатки и собственной фасции, раневыми крючками раздвигали грудино-подъязычные мышцы и выделяли трахею. Затем под трахею подводили лигатуры-держалки (рисунок 72, а). Фиксируя трахею хирургическим инструментом, скальпелем рассекали продольно и поперёк хрящевые кольца, моделируя окончатый дефект 0,8 х 2,3 см (рисунок 72, б). Затем из контейнера брали стерильный имплантат из бактериальной целлюлозы размером 1,5 х 3,0 см (рисунок 73, а). Далее при помощи шовного материала ПГА полигликоидной нити 1,5 метричности, непрерывным герметичным швом, имплантат фиксировали к стенке трахеи (рисунок 73, б). После ушивания дефекта трахеи, двумя кетгутовыми швами сближали грудино-подъязычные мышцы. Рану послойно ушивали с наложением кожных швов.
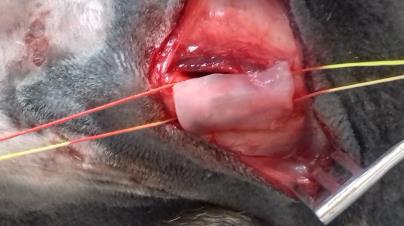 |
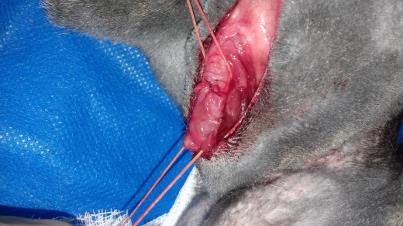 |
| а | б |
| Рисунок 73 — Завершающий этап операции по установке имплантата трахеи:
а – имплантат из бактериальной целлюлозы, б – закрытие дефекта трахеи |
|
У экспериментальных животных, которые входили во вторую серию исследований, на протяжении 6 месяцев наблюдений, основные физиологические показатели: дыхание, приём корма, соответствовали нормативным значениям контрольной группы интактных животных (группа 9, n = 5). Через 6 месяцев, перед выведением животных группы 10 из эксперимента, выполняли УЗ-исследование и трахеоскопию.
 |
 |
| Рисунок 74 – УЗИ шеи кролика группы 10 | |
При клиническом исследовании в нижней части шеи пальпаторно определяли образование мягкоэластичной консистенции величиной около 3,0×1,5 см. По данным сканирования пальпируемое образование на сканограммах четкого отображения не имело (рисунок 74). Ультразвуковое исследование области имплантации показало, что участки трахеи, расположенные вблизи оперированной области, имеют обычные размеры, однородную структуру, без очаговых изменений. В области имплантации определяется образование овальной формы с достаточно четкими контурами, величиной 3,1×0,3×1,8 см. Структура образования однородная, определяются участки линейной формы повышенной плотности. Лимфатические узлы не увеличены в объёме без признаков воспаления, просвет трахеи на всем протяжении имел примерно одинаковый диаметр.
Проведенная трахеоскопия показала, что в оперированной области сохраняется хорошая герметизация, просвет трахеи равномерный, без признаков воспаления и стенозов (рисунок 75).
Рисунок 75 – Трахеоскопия у кролика группы 10
При гистологическом исследовании стенка трахей опытных животных состояла из слизистой оболочки, подслизистой основы, фиброзно-хрящевой и адвентициальной оболочек. Слизистая оболочка представлена многорядным призматическим реснитчатым эпителием, лежащим на базальной мембране, а также собственной пластинкой – рыхлая волокнистая соединительная ткань. Подслизистая основа имела в своем составе сосудистые сплетения и белково-слизистые железы.
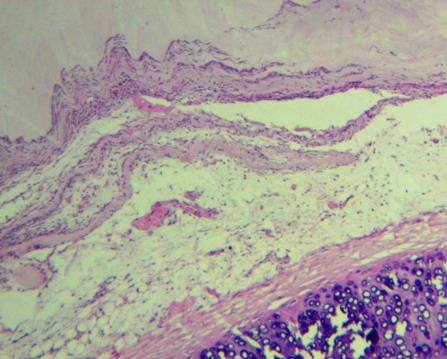
Рисунок 76 – Стенка трахей опытного животного. Окраска гематоксилином и эозином, ув. х 300. На поверхности адвентициальной оболочки локализуется наноматериал
Волокнисто-хрящевая оболочка представлена гиалиновой хрящевой тканью, покрытой надхрящницей. В наружной адвентициальной оболочке, состоящей из рыхлой волокнистой соединительной ткани, находились скопления жировых клеток липоцитов. На поверхности адвентициальной оболочки локализовалась бледно-розовая гомогенная масса наноматериала (рисунок 76).
Отмечена пролиферация клеток фибробластического дифферона на границе трахеи и интеграция их в изучаемый наноматериал (рисунок 77). Отсутствие признаков воспаления и деструкции со стороны органа, свидетельствует об интеграции и биосовместимости исследуемого наноматериала.
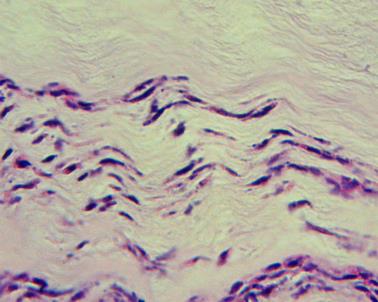
Рисунок 77 – Пролиферация клеток фибробластического дифферона на границе адвентициальной оболочки и наноматериала. Окраска гематоксилином и эозином, ув. х 400
Проведённое исследование позволило заключить, что разработанный имплантат из бактериальной целлюлозы, способен герметично закрывать дефект трахеи, интегрируясь с тканями организма животного. Результаты эксперимента открывают перспективу использования в пластике трахеальных дефектов имплантатов из бактериальной целлюлозы.
2.12 Расчетный анализ экономической эффективности технологии получения биосовместимого наноматериала
Целью данного раздела является проведение расчетного анализа экономической эффективности технологии получения биосовместимого наноматериала.
Расчетный характер анализа экономической эффективности обусловлен тем, что на современном этапе исследований рассмотренные в рамках настоящего анализа технологии получения наноматериала реализованы только в лабораторных условиях. Поэтому все полученные показатели эффективности относительно их сравнения и промышленного применения носят прогнозный характер.
К основным задачам расчетного анализа экономической эффективности технологии получения наноматериала относятся:
1) определение расходов на получение 1 квадратного метра наноматериала с применением гидролизата пшеничных отрубей, используемого в качестве питательной среды;
2) определение расходов на получение 1 квадратного метра наноматериала с применением в качестве питательной среды раствора сахара с чаем;
3) сравнение вариантов получения наноматериала с использованием разной питательной среды с определением экономически выгодного варианта;
4) прогнозный анализ рыночного потенциала применения наноматериала в качестве перевязочного средства.
При расчете сравнительной экономической эффективности получения наноматериала с применением разных вариантов питательной среды были сделаны следующие допущения:
— все расчеты выполнены на один объем питательной среды – 1000 л;
— для расчетов был выбран оптимальный вариант соотношения высоты емкости с питательной средой и ее площади – 76. В таблице 14 представлен расчет по выходу наноматериала с одного литра питательной среды при указанном соотношении высоты и площади;
— на первом этапе для проведения сравнительного экономического анализа двух вариантов получения наноматериала из расчетов были исключены расходы, которые являются одинаковыми для обоих вариантов: расходы на дистилляцию воды, расходы на поддержание оптимального температурного и светового режимов, расходы на оплату труда операторов, осуществляющих контроль основных параметров технологического процесса;
— расчетный период роста наноматериала составляет 8 суток.
Таблица 14 – Расчет выхода наноматериала с одного литра
| Показатель | Значение |
| Высота емкости с питательной средой, см | 1 |
| Площадь поверхности емкости с питательной средой, см2 | 760 |
| Объем питательной жидкости, см3 | 760 |
| Объем питательной жидкости, л | 0,76 |
| Площадь наноматериала на 1 л питательной жидкости (при оптимальном соотношении), см2 | 1000 |
| Площадь наноматериала на 1 л питательной жидкости (при оптимальном соотношении), м2 | 0,1 |
По данным таблицы 14 площадь наноматериала, получаемого с 1 л питательной жидкости составляет 0,1 м2 при соблюдении оптимального соотношения высоты и площади емкости с жидкостью (76).
Для достижения максимального выхода наноматериала (2,71 ± 0,32 г/л) по первому варианту (применение гидролизата пшеничных отрубей в качестве питательной среды) для подготовки питательной жидкости были использованы материалы, объем и стоимость которых представлена в таблице 15.
Таблица 15 – Расчет затрат на 1 м2 наноматериала по первому варианту
| Показатель | Значение |
| Концентрация ферментов в 1 л гидролизата, % | |
| ГлюкоЛюкс А | 1 |
| АмилоЛюкс АТС | 0,5 |
| ЦеллоЛюкс А | 0,5 |
| Стоимость ферментов, руб./кг (л) | |
| ГлюкоЛюкс А | 300 |
| АмилоЛюкс АТС | 679 |
| ЦеллоЛюкс А | 700 |
| Стоимость ферментов на 1 л гидролизата всего, руб., в т.ч. | 9,895 |
| ГлюкоЛюкс А | 3 |
| АмилоЛюкс АТС | 3,395 |
| ЦеллоЛюкс А | 3,5 |
| Стоимость ферментов на 1000 л гидролизата, руб. | 9895 |
| Выход наноматериала с 1000 л гидролизата, м2 | 100 |
| Расходы на 1 м2 наноматериала по первому варианту, руб. | 98,95 |
Расчет затрат на получение 1 м2 наноматериала по второму варианту представлен в таблице 16.
Таблица 16 — Расчет затрат на 1 м2 наноматериала по второму варианту
| Показатель | Значение |
| Расход глюкозы на 1 л питательной жидкости, гр. | 100 |
| Расход чая на 1 л питательной жидкости, гр. | 1,5 |
| Стоимость 1 кг глюкозы, руб. | 180 |
| Стоимость 1 кг чая, руб. | 500 |
| Расходы на глюкозу в расчете на 1 л питательной жидкости, руб. | 18 |
| Расходы на чай в расчете на 1 л питательной жидкости, руб. | 0,75 |
| Общие расходы на приготовление 1000 л питательной жидкости, руб. | 18750 |
| Выход наноматериала с 1000 л питательной жидкости, м2 | 100 |
| Расходы на 1 м2 наноматериала по второму варианту, руб. | 187,5 |
Анализ данных таблиц 15 и 16 позволяет сделать следующие выводы:
— при соблюдении температурного и светового режимов, а также оптимального соотношения высоты и площади поверхности биореактора расходы на получение 1 м2 наноматериала с применением гидролизата пшеничных отрубей в качестве питательной среды составляют 98,95 руб.;
— при аналогичных условиях использование в качестве питательной среды раствора глюкозы и чая увеличивает стоимость 1 м2 наноматериала в 1,9 раза – до 187,5 руб.;
— учет стоимости отрубей для приготовления питательного раствора по первому варианту удорожает стоимость производства наноматериала до 107 руб. за м2, что в 1,75 раза дешевле по сравнению с использованием глюкозы.
Таким образом, технология получения наноматериала с применением гидролизата пшеничных отрубей в лабораторных условиях по сумме затрат оказалась в 1,75 раза выгоднее, чем применение глюкозы и чая.
Так как представленные технологии получения наноматериала апробированы только в лабораторных условиях, провести полноценный рыночный анализ и сравнить наноматериал с рыночными аналогами в полном объеме не представляется возможным. В таблице 17 представлены данные, характеризующие обобщенные экономические показатели лечения ожоговых ран с применением различных перевязочных средств, полученные в результате экспериментальных исследований.
Таблица 17 – Сравнительный анализ эффективности лечения ожоговых ран с применением различных перевязочных средств
| Перевязочное средство | Средний срок очищения раны, сут. | Затраты на перевязку, руб. | Общие затраты на курс, руб. |
| Мазевое раневое покрытие «Бранолинд» | 42 | 59 | 730 |
| Марлевая повязка с пантенолом | 35 | 390,5 | 516,5 |
| Раневое покрытие «DermaRM» | 25 | 14,5* | 14,5* |
*в т.ч. затраты на получение наноматериала размером 3*3 см – 0,06 руб.
Расчеты, представленные в таблице 17, показывают сравнительную эффективность применения различных перевязочных средств в эксперименте по затратам на материалы и стоимость работы исследователей, непосредственно осуществляющих перевязку. Данные расчеты не включают расходы на содержание животных в течение среднего срока очищения раны, а также расходы на утилизацию отходов.
Проведенные исследования показали, что применение наноматериала в качестве перевязочного средства для лечения ожоговых ран имеет определенные преимущества перед традиционными перевязочными средствами как с точки зрения оптимизации условий заживления поврежденных поверхностей, так и с точки зрения экономического эффекта.
ЗАКЛЮЧЕНИЕ
1. Бактериальная целлюлоза имеет нанопористую трехмерную сетчатую структуру со случайным расположением макрофибрилл толщиной 150-160 нм без предпочтительной ориентации. Макрофибриллы – это левовращающиеся спирали из фибрилл толщиной 50-60 нм.
2. Физические и химические характеристики наноматериал из бактериальной целлюлозы: влагоудерживающая (80,35 ± 0,33 г/г) и набухающая (6,92 – 3,82 г/г) способность, скорость газовой проницаемости (35,6 см3/м2⋅24 часа⋅0,1 мПа 817 мл/м2⋅24 часа⋅0,1 мПа) позволяют использовать его в качестве имплантата для замещения дефекта трахеи.
3. Отсутствие воспаления и отторжения имплантата из бактериальной целлюлозы в области внедрения свидетельствует о его биосовместимости с органами и тканями животных.
4. Применение имплантата из бактериальной целлюлозы при замещении дефекта трахеи в эксперименте на кроликах позволяет восстанавливать анатомическую целостность дыхательных путей, обеспечивает надёжную герметизацию дефекта трахеи.
5. У животных контрольной группы после моделирования термического ожога III степени заживление ожоговой раны протекает по типу неполной репаративной регенерации с длительным отторжением струпа, образованием обширной рубцовой ткани и запоздалой эпителизацией.
6. Применение кроликам опытных групп марлевой повязки с «Пантенолом» и мазевого покрытия «Бранолинд Н» способствуют формированию грануляционной ткани с характерной незаконченной эпидермизацией в центральной зоне регенерата.
7. Раневое покрытие из бактериальной целлюлозы при лечении животных с термическими ожогами способствует сокращению сроков заживления раны в 1,4 раза, по сравнению с контролем. Регенерация тканей проходит в условиях отсутствия экссудата, характеризуется уменьшением зон гиперемии и отека, формированием тонкого равномерного струпа, появлением более быстрой пролиферации эпидермального слоя и активным ростом грануляционной ткани, идентичной по структуре неповрежденной ткани, частично с отсутствием элементов придатков кожи.
8. Физико-химические свойства покрытия «DermaRM» способствуют его надежной фиксации на поверхности ожоговой раны на всем этапе лечения, созданию оптимальных условий для регенерации поврежденных тканевых структур.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
- Абаев, Ю.К. Справочник хирурга. Раны и раневая инфекция. – Ростов н/Д, Феникс, 2006. – 427 с.
- Аверьянов М.Ю., Смирнов В.П. Повязки в лечебной практике. – М.: Академия, 2010. – 128 с.
- Алексеев А.А., Попов С.В. Принципы организации и оказания медицинской помощи пострадавшим от ожогов // Комбустиология. – 2015. – № 55. – С.48-54.
- Алексеева Н.Т. Отдаленные результаты регенераторного процесса в коже при заживлении асептических ран // Журнал анатомии и гистопатологии. – 2012. – № 2. – С.15-17.
- Алексеева Н.Т., Никитюк Д.Б., Клочкова С.В. Гистохимическая характеристика эпидермиса при заживлении кожных ран под действием различных региональных факторов // Крымский журнал экспериментальной и клинической медицины. – 2016. – № 6 (3). – С. 10-14.
- Алтухов В.В. Закономерности и особенности ранозаживляющей активности новых фармацевтических композиций при термическом ожоге в эксперименте на животных: автореф. дис. канд. мед. наук / В.В. Алтухов. – Челябинск, 2012. – 24 с.
- Анализ использования гель-пленок и «вторичных» пленок бактериальной целлюлозы как носителей антибактериальных и антифунгальных препаратов / Н.А. Кленова [и др.] // Успехи медицинской микологии. – 2018. – Т.18. – С. 253-255.
- Анатольев В.В. Раны и их лечение. – М., 2010. – 194 с.
- Андреев Д.Ю., Парамонов Б.А., Мухтарова А.М. Современные раневые покрытия. Ч.1 // Вестник хирургии им. И.И. Грекова. – 2009. – Т. 168, № 3. – С. 98-102.
- Афиногенова А.Г, Даровская Е.Н. Микробные биопленки ран: состояние вопроса // Травматология и ортопедия России. – 2011. – Т.3. – № 61. – C. 119-125.
- Бабаева А.Г. Регенерация – факты и перспективы. – М.: РАМН, 2009. – 334 с.
- Бактериальная целлюлоза, синтезируемая Gluconacetobacter hansenii, для использования в медицине / Т.И. Громовых [и др.] // Прикладная биохимия и микробиология. – 2017. – Т.53. – № 1. – С. 69-75.
- Безрук Е.Л. Морфологическая характеристика процессов репарации гнойных ран у крупного рогатого скота при различных способах лечения // Вестник КрасГАУ. – 2017. – № 8 (131). – С. 27-31.
- Безрук Е.Л. Раневой диализ в профилактике и лечении хирургической инфекции у животных. – Абакан: Изд-во ФГБОУ ВО «Хакасский государственный университет им. Н.Ф. Катанова», 2016. – 224 с.
- Биктимиров Е.Е., Крылов П.К. «Бранолинд Н» при лечении ран донорских участков // Скорая медицинская помощь. – 2006. – № 3. – С. 109-110.
- Биодеградируемые раневые покрытия на основе полисахаридных полимеров (экспериментальное исследование) / И.Н. Большаков [и др.] // Вопросы реконструктивной и пластической хирургии. – 2011. – № 2 (37). – С. 53-65.
- Бобровников А.Э., Тусинова С.А., Лагвилава И.К. Применение гидрогелевых повязок для лечения ожоговых ран // Материалы II съезда комбустиологов России. – Москва, 2008. – С. 134-136.
- Буланкина И.А. Изменения морфологических характеристик и биомеханических свойств структур кожи при термическом ожоге I, II степени // Сибирский медицинский журнал. – 2012. – № 5. – С. 78-80.
- Выдрина И.В. Получение бактериальной целлюлозы и исследование ее адсорбционной активности // Сборник статей Международной научно-практической конференции «Совершенствование методологии познания в целях развития науки». – Уфа, 2017. – С. 12-14.
- Выдрина И.В. Применение биологически активных покрытий на основе бактериальной целлюлозы в медицинской практике // Ломоносовские научные чтения студентов, аспирантов и молодых ученых. – Архангельск, 2017. – С. 449-451.
- Гладышева Е.К. Бактериальная целлюлоза – перспективный наноматериал для оборонной отрасли // Материалы и технологии XXI века: доклады IV всерос. научно-практ. конф. молодых ученых и специалистов. – Бийск: Изд-во Алт. гос. техн. ун-та, 2015. – С. 8–14.
- Гладышева Е.К. Исследование структуры и химического строения бактериальной целлюлозы // Ползуновский вестник. – 2015. – № 4-2. – С. 100-103.
- Глухов А.А. Патофизиология длительно незаживающих ран и современные методы симуляции раневого процесса // Новости хирургии. – 2015. – Т.23. – № 6. – С. 673-679.
- Данилов Р.К. Раневой процесс: гистогенетические основы. – СПб.: ВМедА им. С. М. Кирова, 2008. – 380 с.
- Дермальные фибробласты для лечения дефектов кожи / Зорин В.Л. [и др.]. // Клеточная трансплантология и тканевая инженерия. – 2009. – Т. IV. – № 4. – С. 26-40.
- Добыш С.В, Васильева А.В., Шурупова О.В. Современные перевязочные средства для лечения ран во второй фазе раневого процесса //Материалы международной конференции – Москва, 2001. – С. 115.
- Доклиническое исследование влияния покрытия DermaRM на заживление ожоговой раны / С.В. Чернигова [и др.] // Известия Международной академии аграрного образования. – 2018. – № 42-2. – С. 204-209.
- Доступность инновационных технологий лечения ран / Богданов С.Б. [и др.] // Комбустиология. – 2013. – № 49-50.
- Дубинина Е.Е. Роль активных форм кислорода в качестве сигнальных молекул в метаболизме тканей при состояниях окислительного стресса// Вопросы медицинской химии. – 2001. – № 6. – С. 561-581.
- Закономерности взаимодействия алифатических аминокислот с водой / Ю.А. Черенкова [и др.] // Сорбционные и хроматографические процессы. – 2008. – № 2. – С. 314–319.
- Ковальчук А.О. Морфометрические показатели кожи животных с экспериментальной ожоговой травмой при проведении раннего хирургического лечения с использованием гидрогелевых повязок и полиуретановых адсорбентов // Экспериментальная хирургия. – 2016. – № 24 (2). – С. 109-119.
- Колсанов А.В., Толстов А.В. Применение фитотерапевтических раневых покрытий в местном лечении ран и раневой инфекции кожи и мягких тканей в эксперименте // Материалы XI Конгресса Международной ассоциации морфологов. – Самара, 2012. – С. 36.
- Комплексное лечение глубоких ожогов на основе применения хирургической некрэктомии и современных биотехнологических методов и современных биотехнологических методов / А.А. Алексеев [и др.] // Анналы хирургии. – 2012. – № 2. – С. 41-45.
- Кричевский Г.Е. Нано-, био-, химические технологии и производство нового поколения волокон, текстиля и одежды. – М.: Известия, 2011. – 526 с.
- Крутиков М.Г., Бобровников А.Э. Местное лечение ран и ожогов // Скорая медицинская помощь. – 2008. –№ 5. – С. 41-42.
- Легонькова О.А., Алексеев А.А. Современные раневые покрытия: их свойства и особенности // Вестник Росздравнадзора. – 2015. – № 6. – С. 66-68.
- Легонькова О.А., Васильев В.Г, Асанова Л.Ю. Исследование эксплуатационных свойств полимерных перевязочных средств // Раны и раневые инфекции. – 2015. – Т. 2. – № 2. – С. 32-39.
- Лепешкина Е.В., Одарюк В.А. Создание нового поколения стерильных отечественных изделий медицинского назначения на основе целлюлозы и ее производных для повышения качества обслуживания населения в период чрезвычайных ситуаций // Технологии гражданской безопасности. – 2013. – Т. 10. – № 1 (35). – С. 64-67.
- Лукьянов С.А. Экспериментальное обоснование применения раневых покрытий на основе бактериальной целлюлозы пропитанных раствором фукоидана для лечения ожогов кожи III степени // Всероссийский научный форум студентов и молодых ученых с международным участием «Студенческая наука – 2018». – Санкт-Петербург, 2018. – С. 205-206.
- Матчин Г.А., Суздалева А.М. Медицина катастроф и безопасность жизнедеятельности: учебное пособие. – Оренбург: Изд-во ОГПУ, 2015. – 160 с.
- Муразян Р.И., Панченков Н.Р. Экстренная помощь при ожогах. – Москва: Медицина, 2003. – 127 с.
- Патофизиологические аспекты процесса заживления ран в норме и при синдроме диабетической стопы / Н.В. Максмова [и др.] // Вестник РАМН. – 2014. — № 11-12. – С. 110–117.
- Получение бактериальной целлюлозы и материалов на её основе / Е.В. Лияськина [и др.] // Актуальная биотехнология. – 2016. – № 3 (18). – С. 38-39.
- Получение и оценка токсичности invivo микрокристаллической целлюлозы бактериального происхождения / К.С. Болотова [и др.] // Экология человека. – 2018. — № 2. – С. 21-25.
- Почепень О. Н. Перекисное окисление липидов и окислительный стресс у пациентов с тяжелой термической травмой // Здравоохранение. – 2011. – № 1. – С. 19-23.
- Препараты серебра: вчера, сегодня, завтра / А.Б. Щербаков [и др.] // Фармацевтический журнал. – 2006. – № 5. – С. 45-57.
- Ревякин И.В., Медведева Л.В., Петренко В.А. Клинико-морфологическая оценка эффективности применения новых методов лечения кожных ран у животных в сравнительном аспекте // Вестник Алтайского государственного аграрного университета. – 2017. – № 9 (155). – С. 165-170.
- Регенеративная терапия тканевыми протекторными цитокинами в составе раневых покрытий на основе бактериальной целлюлозы / Н.Г. Венгерович [и др.] // Вестник Санкт-Петербургского университета. Медицина. – 2016. – № 1. – С. 36-46.
- Реконструктивная хирургия и микрохирургия рубцовых стенозов трахеи / В.Д. Паршин [и др.] // М. : ГЭОТАР Медиа, 2007. – 136 с.
- Руководство по проведению доклинических исследований лекарственных средств. Часть первая/ под ред. А.Н. Миронов. – М.: Гриф и К, 2012 – 914 с.
- Самаева Е.В., Пак И.В. Современные подходы в лечении ожоговых ран // Вестник КРСУ. – 2017. – Т.17. – № 10. – С. 203-204.
- Смирнова Н.А., Николаева А.Ш., Леонова Н.В. Оптимизация лечения повреждений кожи различного генеза в комбустиологии и дерматологии // Медико-биологические и социально-психологические проблемы безопасности в чрезвычайных ситуациях. – 2011. – № 2. – С. 52-55.
- Современные биотехнологии в лечении ран / Н.В. Островский [и др.] // Вопросы реконструктивной и пластической хирургии. – 2007. – № 4. – С. 88-90.
- Современные представления о строении целлюлоз (обзор) / Л.А. Алешина [и др.] // Химия растительного сырья. – 2001. – № 1. – С. 5-36.
- Солошенко В.В. Экспериментальное исследование раневого процесса в ожоговой ране при комбинированной травме// Вестник Смоленской государственной медицинской академии. – 2016. – Т.15. — № 3. – С. 39-45.
- Сорбционные свойства гель-пленок бактериальной целлюлозы / Ю.Г. Баклагина [и др.] // Журнал прикладной химии. – 2005. – Т.78. – № 7. – С. 1197-1202.
- Сошкина В.В., Астамирова Т.С. Пленочные покрытия при лечении детей с ожогами кожи // Российский вестник. – 2015. – Т.5. – № 2. – С. 56-60.
- Спиридонова Т.Г. Консервативное лечение ожоговых ран// Российский медицинский журнал. – 2003. – Т.9. – № 13-14. – С. 560-563.
- Толстов А.В. Совершенствование способов профилактики и лечения ожоговой инфекции: автореф. дис. д-ра мед. наук / А.В. Толстов. – М., 2011. – 266 с.
- Толстов А.В., Колсанов А.В. Разработка способов местной профилактики лечения ожоговых ран // Вестник российской военно-медицинской академии. – 2011. – № 1 (33). – С. 146.
- Травматизм животных / А.Н. Квочко [и др.] – Ставрополь : Изд-во Ставропольский ГАУ, 2015, – 90 с.
- Туманов В.П., Герман Г.Б. Лечение ран. – М.: Москва, 2004. – 123 с.
- Чернигова С.В., Чернигов Ю.В. Динамика метаболизма коллагена при термических ожогах // Актуальные вопросы ветеринарной хирургии: материалы международной научно-практической конференции, посвященной Дню Российской науки. – Омск, 2016. – С. 191-196.
- Чернигова С.В., Чернигов Ю.В. Динамика перекисного окисления липидов при термических ожогах (экспериментальное исследование) // Материалы I межд. науч.-практической конференции «Современные проблемы развития фундаментальных и прикладных наук». – Прага, Чешская республика, 2016. – Т.2. – С. 25-30.
- Чернигова С.В., Чернигов Ю.В. Роль провоспалительных медиаторов в развитии септических осложнений у животных // Ветеринарная патология. – 2011. – № 1-2. – С. 92-96.
- Чернигова С.В., Чернигов Ю.В. Современные принципы классификации сепсиса животных // Вестник ветеринарии. – 2013. – № 1 (64). – С. 47-49.
- Чернигова С.В., Чернигов Ю.В., Горбатенко А.В. Экспериментальное обоснование реконструктивной операции при замещении дефекта трахеи имплантом из бактериальной целлюлозы // Известия международной академии аграрного образования. – 2018. – № 42, Том 2. – С.201-204.
- Шнякина Т.Н., Безина Н.М., Щербаков Н.П. Гематологические и клинические исследования при лечении экспериментальной ожоговой раны у собак // Вестник Алтайского государственного аграрного университета. – 2017. – № 4. – С. 127-131.
- Шнякина Т.Н., Безина Н.М., Щербаков Н.П. Местное лечение термических ожогов у собак в эксперименте // Вестник Алтайского государственного аграрного университета. –2016. – № 12 (146). – С. 107-111.
- Экспериментальное изучение специфической активности раневых покрытий с наноструктурным покрытием серебра / А.А. Адамян [и др.] // Анналы пластической, реконструктивной и эстетической хирургии. – 2009. –№ 3. – С. 77-88.
- Экспериментальное исследование возможности применения бактериальной целлюлозы в хирургии / В.Г. Лубянский [и др.] // Альманах Института хирургии им. А.В. Вишневского. – 2017. – № 1. – С. 226-227.
- Экспериментальное обоснование использования раневых биопокрытий в местном лечении ран / Л.Т. Волова [и др.] // Клинические и фундаментальные аспекты тканевой терапии. Теория и практика клеточных биотехнологий: Материалы II Всерос. симп. с междунар. участ. – Самара, 2004. – С. 119-120.
- Экспериментальное обоснование применения геля на основе ацетата хитозана для лечения ожогов / М.В. Погорелов [и др.] // Российский медико-биологический вестник им. академика И.П. Павлова. – 2012. – № 4. – С. 34-35.
- Ямскова В.П., Краснов М.С., Ямсков И.А. К вопросу о механизмах, лежащих в основе процессов восстановления и репарации в тканях // Клеточные технологии в биологии и медицине. – 2010. – № 1. – C. 32-35.
- Advances in biomedical andpharmaceutical applications of functional bacterial cellulose-basednanocomposites / H. Ullah [et al.] // Carbohydr. Polym. – 2016. – № 150. – Р. 330-352.
- Alipov V.V. Lazer nanotechnology in experimental surgery // EuroMedica 2012 – Proceedings Int Kongr. – Hannover, 2012. – Р. 22-23.
- An investigation on burn wound healing in rats with chitosan gelformulation containing epidermal growth factor / C. Alemdaroglu [et al.] // Burns. – 2006. – № 32. – Р. 319-327.
- Antibacterial cellulose membrane via one-step covalent immobilization of ammonium/ amine groups / J. Meng [et al.] // Desalination. – 2015. – № 359. – Р. 156-166.
- Antimicrobial activity of silver nanoparticle impregnated bacterial cellulose membrane: effect of fermentation carbon sources of bacterial cellulose / G. Yang [et al.] // Carbohydr. Polym. – 2012. – 87. – Р. 839-845.
- Artificial vascular implants from bacterial cellulose: preliminary results of small arterial substitutes / D.A. Schumann [et al.] // Cellulose. – 2009. – № 16. – Р. 877-885.
- Bacterial cellulose and bacterialcellulose-vaccarin membranes for wound healing / Y. Qiu [et al.] // Mater. Sci. Eng. – 2016. – № 59. – Р. 303-309.
- Bacterial cellulose as a potential scaffold for tissue engineering of cartilage / A. Svensson // Biomaterials. –2005. – № 26. – P. 419-431.
- Bacterial cellulose in biomedical applications: A review / G.F. Picheth [et al.] // International Journal of Biological Macromolecules. – 2017. – № 104. – Р. 97-106.
- Bacterial cellulose membrane produced by Acetobactersp. A10 for burn wound dressing applications / M.H. Kwak [et al.] // Carbohydr. Polym. – 2015. – № 122. – Р. 387-398.
- Bacterial cellulose: Properties, production and applications. In Cellulose: Structure and Properties. Bacterial cellulose: Properties, production and applications. In Cellulose: Structure and Properties / F.K. Andradea [et al.] – New York: Nova Science Publishers. – 2010. – P. 427-458.
- Bacterial cellulose-poly (vinyl alcohol) composites prepared using an in situ process / S. Gea [et al.] // Mater. Lett. – 2010. – № 64. – Р. 901-904.
- Bacterial cellulose-zinc oxide nanocomposites as a novel dressing system for burn wounds / A. Khalid [et al.] // Carbohydr. Polym. – 2017. – № 164. – Р. 214-221.
- Bacterialcellulose-hyaluronan nanocomposite biomaterials as wound dressings forsevere skin injury repair / Y. Li [et al.] // J. Mater. Chem. – 2015. – № 3 (17). – Р. 3498-3507.
- Controlled silver nanoparticles synthesis in semi-hydrogel networks of poly (acrylamide) and carbohydrates: A rational methodology for antibacterial application / K. Vimala [et al.] // Carbohydr. Polym. – 2009. – 75. – Р. 463-471.
- De Wulf P., Joris K., Vandamme E.J. Improved cellulose formation by an Acetobacter xylinum mutant limited in (keto) gluconate synthesis. // J. Chem Technol Biotechnol. – 1996. – 67. – Р. 376-380.
- Effect of chitosan penetration on physico-chemical and mechanical properties of bacterial cellulose / M. Ul-Islam [et al.] // Korean Journal of Chemical Engineering. – 2011. – 28(8). – Р. 1736-1743.
- Field S., Füssel M., Sattler K. Gewinnung und Anwendung von Bacteriencellulose I. Übersicht zum Stand der Forschung und Untersuchungen zur Fermentationskinetik. // Zentralbl Mikrobiol. – 1989. – 144 – Р. 473-484.
- Gatenholm. P., Kllem D. Bacterial nanocellulose as a renewable material for biomedical applications // MRS Bull. – 2010. – № 35. – Р. 208-213.
- Gilpin D.A. Calculation of a new Meeh constant and experimental determination of burn // Proceedings of National Avian-Wind Power Planning Meeting. – 1996. – № 8. – P. 607-611.
- Goh W., Rosma. A., Kaur H. Fermentation of black tea broth (Kombucha): I. Effects of sucrose concentration and fermentation time on the yield of microbial cellulose // International Food Research Journal. – 2012. – № 19 (1). – P. 109-117.
- Guo J., Catchmark J.M. Surface area and porosity of acid hydrolyzedcellulose nanowhiskers and cellulose produced by Gluconacetobacterxylinus // Carbohydr. Polym. – 2012. –№ 87 (2). – Р. 1026-1037.
- High mechanical strength double-network hydrogel with bacterial cellulose / А. Nakayama [et al.] // Adv. Funct. Mater. – 2004. – №14. – Р. 1124-1128.
- Hirai A., Tsuji M., Horii F. TEM study of band-like cellulose assemblies produced by Acetobacter xylinum at 4 °C // Cellulose. – 2002. – № 9. – Р. 105-113.
- Hoenich N. Cellulose for medical applications // BioResources. – 2006. – № 1. – Р. 270-280.
- Hu Y., Catchmark J.M. Influence of 1-methylcyclopropene (1-MCP) on the production of bacterial cellulose biosynthesized by Acetobacter xylinum under the agitated culture // The Society for Applied Microbiology. – 2010. – № 51. – Р. 109-113.
- Hwan J., Kon Park H and J. Improvement of bacterial cellulose production in Acetobacter xylinum using byproduct produced by Gluconacetobacter hansenii // Korean J. Chem. Eng. – 2012. – № 29 (5). – Р. 563-566.
- Immobilization of gelatin on bacterial cellulose nanofibers surface via crosslinking technique / J. Wang [et al.] // Mater. Sci. Eng. – 2012. – № 32. – Р. 536-541.
- Improved production of bacterial cellulose and its application potential / E.J. Vandamme [et al.] //Polym Degrad Stab. – 1998. – 59. – Р. 93-99.
- Improving the affinity of fibroblasts for bacterial cellulose using carbohydrate-binding modules fused to RGD / F.K. Andrade [et al.] // J. Biomed. Mater. Res. A. – 2010. – № 92. – Р. 9-17.
- In situ synthesis of silver-nanoparticles/bacterial cellulose composites for slow-released antimicrobial wound dressing / J. Wu [et al.] // Carbohydr. Polym. – 2014. – Vol. 102. – P. 762-771
- Islana G.A., Mukherjeeb A. Castro G.R. Development of biopolymer nanocomposite for silver nanoparticles and ciprofloxacin controlled release// Int. J. Biol. Macromol. – 2015. – 72. – Р. 740-750.
- Kataoka Y., Kondo T. Quantitative analysis for the cellulose I alphacrystalline phase in developing wood cell walls // Int Biol Macromol. – 1999. – 24. – Р. 37-41.
- Katsikogianni M.G., Missirlis Y.F. Interactions of bacteria with specific biomaterial surface chemistries under flow conditions // ActaBiomater. – 2010. – № 6. – P. 1107-1118.
- Kim J., Cai Z., Chen Y. Biocompatible bacterial cellulose composites for biomedical application // Nanotechnol. Eng. Med. – 2010. – № 1. – Р. 1-7.
- Lamke L., Nilsson G.E., Reithner H.L. The evaporative water loss fromburns and the water-vapour permeability of grafts and artificial membranesused in the treatment of burns. // Burns. – 1977. – 3(3). – Р. 159-165.
- Latterini L., Tarpani L. Hierarchical assembly of nanostructures to decouple fluorescence and photothermal effect // J. Phys. Chem. – 2011. – C 115 (43). – Р. 21098-21104.
- Leung V., Ko F. Biomedical applications of nanofibers// Polym. Adv. Technol. – 2011. – № 22. – Р. 350-365.
- Lien S.M., Ko L.Y., Huang T.J. Effect of pore size on ECM secretion and cell growth in gelatin scaffold for articular cartilage tissue engineering // J. Acta Biomater. – 2009. –№ 5. – Р. 670-679.
- Ligament-like tough double-network hydrogel based on bacterial cellulose / Y. Hagiwara [et al.] // Cellulose. – 2010. –№ 17. – Р. 93-101.
- Lin N., Dufresne. A. Nanocellulose in biomedicine: current status and futureprospect // Eur. Polym. J. – 2014. – № 59. – Р. 302-325.
- Liu H., Hsieh Y.L. Ultrafine fibrous cellulose membranes from electrospinning of cellulose acetate // J. Polym. Sci. B Polym. Phys. – 2002. – № 40. – Р. 2119-2129.
- Mechanical and thermal properties of bacterial-cellulose-fibre-reinforced Mater-Bi® bionanocomposite / H. Nainggolan [et al.] // Nanotechnol. –2013. – № 4. – Р. 325-329.
- Menaker G. Wound dressings in the new millennium // Semin. Cutan. Med. Surg. –2002. – № 21. – Р.171-175.
- Microbial cellulose – the natural power to heal wounds / W. Czaja [et al.] // Biomaterials – 2006. – Vol. 27. – Р. 145-151.
- Microstructure and mechanicalproperties of bacterial cellulose/chitosan porous scaffold / T.T. Nge [et al.] // Cellulose. – 2010. – № 17 (2). – Р. 349-363.
- Millan B.G. Local care and infection in burns // J. Trauma. – 2010. – № 12. – P. 188-192.
- Morphology and structural characterization of bacterial celluloses produced by different strains in agitated culture / J.C. Bi [et al.] // J Appl Microbiol. – 2014. – № 6. – P. 1-23.
- Nano-biomaterials application: Morphology and physical properties of bacterial cellulose/gelatin composites via crosslinking / S.T. Chang [et al.] // Food Hydrocoll. – 2012. – № 27. – Р. 137-144.
- Novel silver-based nan- oclay as an antimicrobial in polylactic acid food packaging coatings Food Addit. / M.A. Busolo //Contam. – 2010. – A 27. – Р. 1617-1626.
- Park S.T., Song T., Kim Y.M. Effect of gluconic acid on the production of cellulose in Acetobacter xylinum BRC5. // J. Microb Biotechnol. –1999. – 9 (5) – 683-688.
- Physicochemical and mechanicalcharacterization of bacterial cellulose produced with an excellent productivityin static conditions using a simple fed-batch cultivation strategy / O. Shezad [et al.] // CarbohydratePolymers. – 2010. – № 82(1). – Р. 173-180.
- Qin Y. Absorption characteristics of alginate wound dressings // J. Appl. Polym. Sci. – 2004. – 91. – Р. 953-957.
- Qin Y. The gel swelling properties of alginate fibers and their applications in wound management // Polym. Adv. Technol. – 2008. – № 19. – Р. 6-14.
- Randomizedcontrolled single center study comparing a polyhexanide containingbio-cellulose dressing with silver sulfadiazine cream in partial-thicknessdermal burns / A. Piatkowski [et al.] // Burns. – 2011. –№ 37 (5). – Р. 800-804.
- Regeneration of skin tissue promoted by mesenchymal stem cells seeded in nanostructured membrane / CM. Souza [et al.] // Transplant Proc. – 2014. – №. 46(6). – Р. 1882-1886.
- Regenerative medicine in dermatology: biomaterials, tissue engineering, stem cells, gene transfer and beyond / С. Dieckmann [et al.] // Experimental Dermatology. – 2010. – № 19. – P. 697-706.
- Saied H.E., Basta A.H., Gobran R.H. Research progress in friendly environmental technology for the production of cellulose products (bacterial cellulose and its application) // Polym. Plast.Technol. Eng. – 2004. – № 43. – Р. 797-820.
- Schluesener J.K., Schluesener H.J. Nanosilver: application and novel aspectsof toxicology. // Arch. Toxicol. – 2013. – № 87 (4). – Р. 569-576.
- Shao W., Zhao Q. Efficient surface modification of biomaterial to prevent biofilm formation and the attachment of microorganisms // Colloids Surf. –2010. – B 76. – Р. 98-103.
- Sharma J. Multifunctional Nanofibers towards Active Biomedical Therapeutics // Polymers. – 2015. – № 7. – Р. 186-219.
- Shidlovskiy I.P., Shumilova A.A., Shishatskaya E.I. Рreparation and characterization of bacterial cellulose composites with silver nanoparticles // Zhurnal sibirskogo federal’nogo universiteta. seriya: Biologiya. – 2017. – Т.10. – № 2. –Р. 255-264.
- Special aspects of systemic inflammation course in animals / S.V. Chernigova [et al.] // Veterinary World – 2019. – 12 (7). –Р. 932-937.
- Szymańska-Chargot М., Cybulska J., Zdunek A. Sensing the Structural Differences in Cellulose from Apple and Bacterial Cell Wall Materials by Raman and FT-IR Spectroscopy // Sensors. – 2011. – 11. – Р. 5543-5560
- The bacteriological profile of the burned patients in the center of burns in CHU Mohamed VI Marrakech (about 123 cases) / Y. Benchamkha [et al.] // J. Burns Trauma. – 2017. – № 7 (6). – P. 72-79.
- Thymol enriched bacterial cellulose hydrogel as effective material for third degree burn wound repair / S. Jiji [et al.] // International Journal of Biological Macromolecules. – 2019. – № 122. – Р. 452-460.
- Ultrasound influence upon calcium carbonate precipitation on bacterial cellulose membranes/A. Stoica-Guzun [et al.] // Ultrason. Sonochemistry. – 2012. – № 19. – Р. 909-915.
- Vasita R., Katti D.S. Nanofibers and their applications in tissue engineering // Int. J. Nanomed. – 2006. – № 1. – Р. 15-30.
- Wood F.M., Kolybaba M.L., Allen P. The use of cultured epithelial autograft in the treatment of major burn injuries: A critical review of the literature// Burns. – 2006. – Vol. 32. – Iss. 4. – P. 395-401.
- Wound healing dressings and drug delivery systems: a review / J.S. Boateng [et al.] // J. Pharm. Sci. – 2008. – № 97. – Р. 2892-2923.
- Wu S.C., Marston W., Armstrong D.G. Wound care: the role of advanced wound healing technologies // J Vasc Surg. – 2010. – № 3. – P. 598-688.
- Hl, G. Helenius, A. Bodin, U. Nannmark, B.R. Johansson, B. Risberg, P. Gatenholm, Biomaterials 27 (2006) 2141.
- [54] V.S. Nirmalanandhan,M.R. Dressler, J.T. Shearn, N. Juncosa-Melvin, M. Rao, C. Gooch, G. Bradica, D.L. Butler, J. Biomech. Eng. 129 (2007) 919.
- J.T. Shearn, N. Juncosa-Melvin, G.P. Boivin, M.T. Galloway, W. Goodwin, C. Gooch, M.G. Dunn, D.L. Butler, J. Biomech. Eng. 129 (2007) 848.
