Титульный лист и исполнители
РЕФЕРАТ
Отчет 117 с., 1 кн., 34 рис., 14 табл., 218 источн.
КАРТОФЕЛЬ, КУЛЬТУРА IN VITRO, МИКРОКЛУБНИ, КОЭФФИЦИЕНТ РАЗМНОЖЕНИЯ, ПОЛИПЛОИД, ХЛОРОПЛАСТЫ,
Биологическими объектами исследований служили сорта картофеля: Фрителла, Утро, Скороплодный, Северное сияние, Вектор, Сатурна, Метеор, ботанические семена Solanum rybinii purple.
Цель работы – разработка методов индукции полиплоидии картофеля in vitro.
Проведенные исследования показали, что некоторые тетраплоидные сорта, представляющие собой межвидовые гибриды, в соматических клетках могут содержать ядра разного уровня плоидности. Возможно, данные генотипы представляют собой переклинальные химеры.
Хроническое воздействие колхицина в составе искусственной питательной среды в концентрации 0,01% колхицина позволяет получить до 16,3% полиплоидных генотипов. Увеличение концентрации приводит к снижению образования полиплоидных аналогов. Большинство полученных форм с изменённым уровнем плоидности являются миксоплоидами.
При воздействии колхицина на меристематическую диплоидную ткань S. rybinii экспозицией 24 часа и концентрацией колхицина 0,1%, проходит один цикл к-митоза и формируются тетраплоидные клетки. Особенностью реакции S. rybinii на воздействие колхицина является формирование многоядерных клеток, которые образуются в результате деполимеризации веретена деления и разделения диплоидного ядра на группы.
В результате инъекции в миниклубни, вводимое вещество распространяется на его треть в течение суток, а через семь суток занимает весь объём миниклубня. Введенный раствор колхицина в миниклубень начнёт воздействовать на ближние участки меристемной ткани практически сразу после инъекции. Было отмечено отрицательное действие колхицина на прорастание побегов и ризогенез.
Максимальная частота каллусообразования (100%) на высечках листьев картофеля получены на питательных средах по прописи Мурасиге-Скуга, содержащих в своем составе 6 БАП –4,0 мг/л, ИУК – 0,4 мг/л и 6 БАП –4,0 мг/л, НУК – 0,4 мг/л. Регенерация побегов была отмечена на среде с содержанием фитогормонов 6 БАП – 4,0 мг/л и 2,4-Д – 0,4 мг/л. Добавление колхицина в питательную среду подавило процесс регенерации.
ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
В настоящем отчете о НИР применяются следующие термины:
- Клональное микроразмножение ‒ массовое бесполое размножение растений в культуре клеток и тканей, при котором возникшие формы растений генетически идентичны исходному экземпляру [1].
- in vitro — это технология выполнения экспериментов, когда опыты проводятся «в пробирке» — вне живого организма [2].
- in vivo — проведение экспериментов на (или внутри) живой ткани при живом организме. Такое использование термина исключает использование части живого организма (так, как это делается при тестах in vitro) или использование мёртвого организма [2].
- Колхицин – алкалоид клубнелуковиц безвременника великолепного (Colchicum Speciosum Stev.) семейства лилейных. Белый или белый с желтоватым оттенком мелкокристаллический порошок, темнеющий на свету. Обладает антимитотической активностью [3].
- Полиплоиды – организмы, клетки которых содержат более двух наборов хромосом. Три набора – триплоид (3n), четыре – тетраплоид (4n) и т. д. Наиболее часто встречаются организмы с числом хромосомных наборов, кратным двум, – тетраплоиды, гексаплоиды (6 n) и т. д. [4].
- Секвенирование генома – определение их аминокислотной или нуклеотидной последовательности (от лат. Sequentum — последовательность) [5].
- Экспрессия генов – процесс, в ходе которого наследственная информация от гена (последовательности нуклеотидов ДНК) преобразуется в функциональный продукт — РНК или белок. Некоторые этапы экспрессии генов могут регулироваться: это транскрипция, трансляция, сплайсинг РНК и стадия посттрансляционных модификаций белков. Процесс активации экспрессии генов короткими двуцепочечными РНК называется активацией РНК [6].
- Аллополиплоидия – (от алло…и полиплоидия) –наследственное изменение в клетках растений, реже животных, заключающееся в кратном увеличении числа наборов хромосом при межвидовых или межродовых скрещиваниях. Встречается в природе и может быть получена целенаправленно (ржано-пшеничные, капустно-редечные гибриды). Имеет важное значение в процессах видообразования у растений [7].
- Аутополиплоидия – тип полиплоидной мутации, при котором умножается набор хромосом только одного вида (ауто — само, полиплоос — многократный, эйдос — образ, набор хромосом) [8].
- Филогенез — (от греческого phylon — род, племя и …генез), филогения, историческое развитие мира живых организмов, как в целом, так и отдельных таксономических групп: царств, типов (отделов), классов, отрядов (порядков), семейств, родов, видов [9].
- Каллус — новообразование из паренхимных недифференцированных клеток на раневых поверхностях растения. Возникает в виде валика или аморфной массы в местах надрезов, трещин на концах черенков, в культуре клеток и тканей. Особенно энергично образуется К. тогда, когда в раневой зоне есть камбий. Каллусная ткань способствует зарастанию ран, срастанию прививок, образованию корней при вегетативном размножении растений. Может возникать на любом органе семенных растений; у споровых образуется редко [10].
- Регенерация — процесс образования нового, органа или ткани на месте удаленного тем или иным образом участка организма. Очень часто регенерация определяется как процесс восстановления утраченного, т. е. образование органа, подобного удаленному [11].
- Эмбриокультура – выращивание зародышей (растений, животных) и регенерация растений в культуре in vitro из зародышей на ранней стадии их развития. Зародыш отделяется от семени или яйцеклетки и помещается на соответствующую питательную среду, где продолжается его развитие и происходи прорастание как из обычного семени [12].
- Митоз — основной способ деления эукариотических клеток, при котором сначала происходит удвоение, а затем равномерное распределение между дочерними клетками наследственного материала [13].
ПЕРЕЧЕНЬ СОКРАЩЕНИЙ И ОБОЗНАЧЕНИЙ
В настоящем отчете о НИР применяют следующие сокращения и обозначения:
БАП – цитокинин 6-бензиламинопурин, бензиловый аденин;
НУК — α-нафтилуксусная кислота;
ИМК — Индолил–3–масляная кислота;
2, 4 Д — 2,4–Дихлорфеноксиуксусная кислота.
ВВЕДЕНИЕ
Все сельскохозяйственные растения являются полиплоидными, и некоторые геномы были продублированы позднее, чем другие. Достижения в области цитогенетических и молекулярных инструментов, включая генетическое картирование высокой плотности, флуоресцентную гибридизацию in situ, а также секвенирование генома и EST, позволили по-новому взглянуть на состав генома и историю дупликации генома у сельскохозяйственных растений. Полиплоидия обеспечивает буферизацию генома, увеличивает аллельное разнообразие и гетерозиготность и позволяет генерировать новые фенотипические вариации. Образование полиплоидов часто сопровождается потерей дублированного хроматина, изменениями в экспрессии генов, новыми эпистатическими взаимодействиями и эффектами эндосперма. Все эти факторы необходимо учитывать в контексте всего генома для оптимизации селекции с помощью маркеров и улучшения сельскохозяйственных культур.
В естественных условиях и в культуре полиплоидные формы могут возникать под влиянием различных факторов (физических, механических, химических и др.), способных воздействовать на процесс образования половых клеток (мейоз) и на механизм клеточного деления в соматических тканях (митоз). Под влиянием этих факторов происходит образование нередуцированных гамет в процессе мейоза или нарушается расхождение хромосом к полюсам делящейся клетки в процессе митоза. Такими факторами могут быть резкие смены температуры, крайне высокие или крайне низкие температуры, ионизирующие излучения, изменение светового режима, различные механические повреждения тканей растений и т. д. [14]. Однако надо признать, что у многих видов появление спонтанных полиплоидов настолько случайное и редкое явление, что на него нельзя рассчитывать при планомерной селекции.
Для искусственного получения полиплоидов применяют те же факторы, которые вызывают их появление в природе. Особое место среди полиплоидогенных химических веществ занимает колхицин, впервые широко примененный для этих целей A. Blakeslee, A.Avery в 1937 г. После опубликования этих исследований, было проведено огромное количество опытов по воздействию колхицином на представителей самых различных групп растительного мира [15].
Получены полиплоидные формы многих диких видов картофеля. Некоторые из них вовлечены в гибридизацию с S. tuberosum: S. асаule, S. stoloniferum, S. vernei, S. commersonii, S. chacoense и многие другие.
В Институте общей генетики Академии наук СССР Н. А. Лебедева при помощи полиплоидии вовлекла в селекцию ценный вид картофеля S. bulbocastanum, обладающий иммунитетом ко всем расам фитофторы, а также S. poliadenium, устойчивый к колорадскому жуку и фитофторе.
Многие полиплоиды картофеля обладают ценными свойствами — повышенной урожайностью, более высокой устойчивостью к ряду заболеваний, высокой фертильностью. Они хорошо скрещиваются с сортами.
Используя тетраплоиды в межвидовой селекции можно достичь большого генетического разнообразия, что дает уверенность в будущем при создании материала с более высоким потенциальным уровнем сопротивляемости заболеваниям.
Полиплоидия как метод создания исходного материала для селекции картофеля, несомненно, имеет большое значение. Поэтому разработка методов индукции полиплоидии картофеля in vitro является актуальным и требует доработки.
Научная новизна. Разработан состав питательных сред для индукции каллусообразования и регенерации адвентивных побегов из каллуса. Впервые оценена мутагенная активность и специфичность действия некоторых амитотиков в условиях стерильной культуры на искусственных питательных средах на жизнеспособность, регенерационный потенциал, морфогенетические особенности культивируемых растений в условиях хронического воздействия критических, сублетальных и летальных доз. Впервые разработана экспресс методика предварительного отбора растений картофеля с изменённым уровнем плоидности путём скрининга косвенных показателей, коррелирующих с плоидностью ядер соматических клеток на основе цитологических препаратов. Перспективные для дальнейшего использования новые генотипы клонированы в необходимом количестве методами биотехнологии.
ОСНОВНАЯ ЧАСТЬ
Раздел 1. Обзор литературы
Полиплоидия, или дупликация всего генома, теперь признана в качестве основной эволюционной силы не только у растений, но и у всех эукариот [16, 17, 18].
Дупликация всего генома обычно приводит к мгновенному видообразованию, увеличению биоразнообразия и предоставлению нового генетического материала для эволюции [19, 20].
Исторически считалось, что аллополиплоидия имеет гораздо большее распространение в природе, чем аутополиплоидия. Это мнение сохраняется идо сих пор, но сейчас уже общепризнано, что оба эти явления чрезвычайно важны по своей природе [21, 22, 23, 24, 25].
Г. Стеббинс [26] предположил, что только Galaxaphylla (в настоящее время Galaxurceolata, Diapensiaceae) является однозначным примером аутополиплоидии в природе. Он также предложил Sedumternatum и S. pulchellum (Crassulaceae) в качестве дополнительно возможных примеров, а Fritillaria camschatcensis (Liliaceae), представляющим «вероятный аутотриплоид». Ко мнению Г. Стеббинса [26] о редкости автополиплоидов присоединились другие известные исследователи в области эволюции растений. Например, В. Грант [27] также предположил, что аутополиплоиды были чрезвычайно редки по своей природе, но его список истинных автополиплоидов был больше, чем у Стеббинса, и включал Galaxaphylla, Biscutellalaevigatum (Brassicaceae), Dactylis glomerata (Poaceae) и Solanum tuberosum (Solanaceae), а также несколько «вероятных» аутополиплоидов: Vaccinium uliginosum (Ericaceae), Eragrostis pallescens (Poaceae), Galiummollugo и G. verum (Rubiaceae).
Г. Стеббинс [28, стр. 126] представил довольно резкое утверждение об аутополиплоидии: «аутополиплоидия не помогает, это помеха» в природных популяциях. Один из разделов его книга [28] озаглавлен: «Адаптивная неполноценность аутополиплоидов и способы, которыми она может быть преодолена». Воспринимаемая крайняя редкость природных аутополиплоидов объясняется сложностями спаривания хромосоми сегрегации.
Г. Стеббинс [28], утверждал, что в автотетраплоиде, каждая хромосома которого представлена четыре раза, таким образом, в некоторых случаях нормальное спаривание хромосом при мейозе было бы затруднено, а образование многовалентности приводило к снижению фертильности.
Г. Стеббинс [26] утверждал, что равное и, возможно, большее значение с эволюционной точки зрения, полиплоидия оказывает на фертильность и генетику, чем на морфологию и физиологию растений. Наиболее заметным и универсальным проявлением является снижение количества пыльцы и жизнеспособности семян у автополиплоидов по сравнению с их диплоидными предками.
Указанные выше проблемы у автотетраплоидов часто фиксируются исследователями, но Г. Стеббинс [28] также считал, что буферный эффект дополнительного генома особенно важен для аутополиплоидов.
Новая полиплоидная парадигма
Уже в 1980-х годах появились новые исследования, которые противоречили многим аспектам стеббинсовской парадигмы.
Д. Левин [29] подчеркивает роль полиплоидии, в частности, автополиплоидии, в создании диапазона новых уровней организации. В ответ на заявление Стеббинса, что удвоение хромосомы — это не помощь, а помеха, Левин [29, стр. 1] подчеркнул, что «идея о том, что удвоение хромосом само по себе препятствует прогрессивной эволюции, становится менее обоснованной по мере увеличения информации об автополиплоидах».
Последующие обзоры собрали новые данные по тематике от множественного происхождения видов полиплоидией до динамической природы полиплоидных геномов [30, 31, 20].
Современная теория полиплоидии показывает большой вклад Г. Стеббинса и других [32, 27], несмотря на то, что многие более ранние представления были опровергнуты: полиплоидия повсеместно распространа среди зеленых растений, все покрытосеменные растения древнего полиплоидного происхождения; полиплоиды не являются «мертвыми»; генетические факторы способствуют успеху полиплоидов — например, полиплоиды обычно образуются больше чем один раз с важными долгосрочными генетическими последствиями, и эволюция полиплоидного генома очень динамична, с изменениями, которые начинают происходить быстро после полиплоидизации; аутополиплоидия является распространенной и основной силой в эволюции растений.
Частота полиплоидии
Недавние исследования целых геномов резко изменили теорию полиплоидии. Геномные исследования показали, что, возможно, все эукариотыобладают геномами со значительной избыточностью генов, большая частькоторый является результатом (древних) событий — дупликации всего генома.
У покрытосеменных, важность древней полиплоидии стала очевидной в результате полного секвенирования генома Arabidopsis thaliana, который имеет очень маленький геном (157 Mb) [33]. Этот вид был выбрандля секвенирования из-за его небольшого объёма, который был «несомненно» диплоидным. Тем не менее, полное секвенирование выявило множество дублирующих генов, предполагающих два или три цикла дупликации генома [34, 35].
Поскольку A. thaliana имеет только пять пар хромосом, ранее он не классифицировался как полиплоид с использованием общих критериев “cut-off”, используемых при типичных оценках полиплоидии [28].
Недавние геномные исследования не только указывают на то, что полиплоидия повсеместно распространена среди покрытосеменных растений, но также указывают на другиеосновные древние события дупликации всего генома [36, 37].
К ним относятся, те, которые предшествовали происхождению всех существующих покрытосеменных [38], а также две дупликации всего генома, которые произошли в тесной временной последовательности в начале эволюции эвдикот [39].
По крайней мере 50 независимых древних дупликаций распределены по филогенезу цветковых растений [40, 41, 36, 37]. Другой этап древней полиплоидии произошёл близко к возникновению однодольных Poales, Solanales и Lamiales. В результате секвенирования геномов покрытосеменных растений определена дата древних событий полиплоидии [42].
Несмотря на то, что Г. Стеббинс не понимал повсеместность полиплоидии, он предположил, что древняя полиплоидия иногда была важна и некоторые семейства покрытосеменных могут быть результатом этого процесса. В настоящее время генетические / геномные данные продолжают предоставлять доказательства того, что это действительно так. Данные изозимов подтвердили, что несколько семей были древними полиплоидами — Trochodendraceae, Salicaceae, Magnoliaceae, Lauraceae и Calycanthaceae – это факт экспонирования дубликата генной экспрессии [43].
Геномные данные в настоящее время указывают на то, что древняя полиплоидия сыграла важную роль в ряде других семейств, включая Asteraceae, Brassicaceae, Cleomaceae, Fabaceae, Poaceae и Solanaceae [44].
Современный взгляд на полиплоидию и диверсификацию
Идентификация древних событий удвоения генома во многих точках филогении покрытосеменных дает возможность оценить соответствие между предполагаемыми основными событиями дупликации генома и диверсификации — роль полиплоидии в «макродиверсификации».
Многие древние удвоения генома связаны с ключевыми изменениями в развитии покрытосеменных, например, происхождение покрытосеменных, эвдикот и однодольных. Изучение полиплоидии у Brassicaceae, Poaceae и Solanaceae предполагает, что древнее удвоение генома сопровождалось всплеском видового разнообразия [44]. Древняя полиплоидия также, по-видимому, связана с увеличением разнообразия растений у сложноцветных, Brassicaceae, Cleomaceae и Fabaceae [44, 45, 46].
В большинстве этих находок наблюдается филогенетическая асимметрия «генетическая ветвь» с образованием разнообразных групп видов и сестринская ветвь со скудным количеством видов [46].
Кроме того, между полным удвоением генома может быть задержка событий последующих изменений. Шранц с коллегами [46] предположил, что окончательный успех генетической ветви включает в себя не только удвоение генома и формирование новых ключевых черт, но и в значительной степени последующие эволюционные явления, включая более поздние миграционные события, изменение условий окружающей среды и/или различные темпы исчезновения.
Другие исследования указывают на увеличение биологического разнообразия и/или сложность в полиплоидных линиях [47]. Филогенетический анализ датирования нескольких древних событий полного удвоения генома предполагает связь между мелово-третичным вымиранием и этим явлением [48, 49]: полиплоидия, возможно, способствовала выживанию клонов после массового вымирания.
Майрозе [50] утверждает, что полиплоиды имеют более высокие показатели вымирания, чем диплоиды, и поэтому часто являются «тупиками», которые не оставляют наследство. Хотя вполне вероятно, что большинство новых полиплоидов вымирают вскоре после образования.
Структура генома и хромосомные изменения
Молекулярные и цитогенетические методы позволяют проводить глубокий анализ перестройки генома после полиплоидии. Например, флуоресцентная гибридизация in situ (FISH) и геномная гибридизация in situ (GISH) выявили, что аллотетраплоид T. miscellus обладает обширной хромосомной изменчивостью [51, 52]. Ни одна из исследуемых популяций не была подтверждена как определённый единый кариотип, 76% особей показали межгеномные транслокации и 69% показали анеуплоидию одной или нескольких хромосом.
Подобные результаты были недавно получены для T. mirus, хотя компенсированная анеуплоидия была выявлена не с такой частой. Множественные хромосомные вариации все еще присутствуют в T. mirus и T. miscellus после примерно 40 поколений. В связи с этим, авторами выдвинуты предположения, что существенная и продолжительная хромосомная нестабильность может быть распространена в природных популяциях после полного удвоения генома.
Обширные хромосомные вариации, включая транслокации и компенсированную анеуплоидию, также наблюдали в синтетических линиях аллотетраплоидных Brassica napus [53, 54]. Однако, такое изменение отсутствует у культивируемого B. napus, этот факт указывает на отбор на геномную стабильность посредством менее частого гомологичного спаривания [55, 56]. Принимая во внимание, что отбор, по-видимому, ограничивает динамику генома и стабилизирует его структуру довольно быстро после образования полиплоидов у B. napus. Аллополиплоиды Nicotiana разного возраста продолжают накапливать геномные перестройки в течение гораздо более длительных периодов времени (примерно 4,5 млн. лет с момента образования) [57].
Напротив, аллополиплоид Gossypium сохранил поразительно стабильный геном с момента образования (примерно 1–2 млн. лет назад) [58]. Из-за расхождения видов в Gossypium (примерно 5–10 млн. лет) в родительских хромосомах гомеологичное спаривание встречается редко, что приводит к относительно небольшому обмену между родительскими геномами [59, 60, 61].
Аллополиплоид Cardamine flexuosa представляет собой интересную генетическую систему. Недавнее исследование выявило синтению между гомеологами (что указывает намалое различие между родительскими геномами и ожидание частого гомеологического обмена), хотя, по-видимому, произошла только одна гомеологическая транслокация [62].
Натуральный и синтетический аллополиплоид Arabidopis suecica и один из его предшественников, автотетраплоид A. arenosa, поддерживают соматические анеуплоидные мозаики (внутрииндивидуальные вариации) [63]. Неополиплоидные линии Arabidopsis (A. thaliana [2 x] × A. suecica [4 x]) не только демонстрируют анеуплоидию в соматической ткани, но также вызывают анеуплоидное потомство (аналогично Brassica); Также было обнаружено, что анеуплоидия коррелирует с фенотипическими изменениями [64].
Эти хромосомные анализы показывают, что виды растений по-разному реагируют на полиплоидию. Виды Tragopogon, Brassica и Nicotiana демонстрируют значительные структурные изменения, тогда как у полиплоидов в Gossypium, Spartina и Cardamine практически не претерпели реструктуризации генома.
Потеря гена
При образовании аллополиплоиды имеют дубликат генов во всех локусах, и эти дополнительные локусы могут быть сохранены, изменены или утеряны, причем последний вариант может быть полной физической потерей ДНК и гомеологичных преобразований генов [65]. Потери одной двойной копии гена происходили в течение коротких временных периодов как у синтетических, так и у природных аллополиплоидов [66, 67, 68, 69, 70].
Потеря гена может происходят сразу после полиплоидизации, как продемонстрировали Л. Ние с коллегами [67] в S1 у синтетического гексаплоида Triticum. Однако в некоторых других случаях потеря генов происходит только в более поздних поколениях после полного удвоения генома [71, 72]. В молодых полиплоидах, эти потери, происходят чаще, как это было показано у Tragopogon miscellus с высокой интерпопуляцией и межиндивидуальным отклонением по отношению к гомеологу [73, 69].
Это не говорит, однако, что потеря всех генов является случайной. Повторные модели потери и удержания гомеологов были зарегистрированы в нескольких генотипах как T. mirus, так и T. miscellus [73, 74, 70, 69]. Кроме того, в T. miscellus, локусы, принадлежащие к определенным категориям генной онтологии (GO), были с большей долей вероятности потеряны, а паттерны потери и удержания после 40 поколений в этом молодом полиплоиде были аналогичны тем, которые были обнаружены для гораздо более старых (40 млн. лет полного удвоения генома) у сложноцветных [75].
В течение более длительного эволюционного периода паттерны удержания и потери гена-дубликата, по-видимому, связаны с функцией гена [76, 75, 77, 78].
Изменения в экспрессии генов
В дополнение к структурным изменениям генома и изменениям в содержании генов, последние исследования показали пластичность и трансгрессию в паттернах экспрессии аллополиплоидных генов, что указывает на то, что полиплоиды не являются суммой их родительских генов. Вместо этого, многие полиплоиды отклоняются от ожиданий, в которых родительские паттерны экспрессии генов объединены в аллополиплоиде, то есть средне-родительского уровня выражения.
Гомеологическое молчание и неаддитивная повышающая или понижающая регуляция могут объяснить эти отклонения, хотя эти изменения не обязательно согласованы по всему геному и не являются всегда ассоциирумыми с удвоением хромосом как таковым [79, 80, 81, 82, 83, 84, 85]. Например, Spartina townsendii, гомоплоидный гибрид S. maritima и S. аlterniflora (оба родителя полиплоиды), демонстрирует паттерны экспрессии геновсходны с таковыми у S. alterniflora [84].
Природный аллополиплоидный гибрид S. maritima и S. alterniflora, незначительно отклоняется от гомоплоидного гибрида S. anglicaпри экспрессии, демонстрируя более сбалансированные уровни родительской экспрессии [84, 85]. Так как модели экспрессии у S. anglica похожи на гомоплоидный гибрид, возможно, что гибридизация имела большое влияние при удвоении генома на экспрессию генов. О таком доминировании на уровне экспрессии генов также сообщалось о полиплоидах у Gossypium и Arabidopsis [86, 87, 88, 89].
На сегодняшний день, установлено, что происходит смещение экспрессии генов в результате гибридизации, полиплоидизации и последующей эволюции в течении определённого времени, эти изменения сохраняются у разных полиплоидов, появляется варьирование признаков среди таксонов. Однако, лежащие в основе механизмы, ответственные за смещение экспрессии генов, требуют дальнейшего изучения [89].
Помимо молчания генов, генетические изменения в полиплоидах могут привести к функциональной диверсификации гомологов, созданию генов новой функции (неофункционализации) или разделению функции генов (субфункционализации) [90, 91, 92].
Одно из самых важных открытий у аллополиплоидов — это органоспецифическая субфункционализация экспрессии генов, процесс, который может быть основным вкладом в успех полиплоидных генотипов.
Эпигенетика
Помимо геномных и генетических признаков полиплоидов, эпигенетические свойства также могут способствовать изменчивости и новизне у полиплоидов. Модификация хроматина, метилирование ДНК и цис- / трансактивные регуляторные взаимодействия могут генерировать неаддитивные паттерны экспрессии.
На самом деле, экологическая и физиологическая новизна более связана с эпигенетическими модификациями у полиплоидов [93].
Термин «геномный шок» [94] относится к геномному стрессу любого рода, включая гибридизацию и полиплоидизацию, вызывающие значительные изменения генома и связанные с ними эпигенетические эффекты. Исследования эпигенетических эффектов, связанных с полиплоидией, все еще находятся в зачаточном состоянии, при этом большинство исследований преимущественно посвящено метилированию.
Метилирование ДНК демонстрирует неаддитивные паттерны после ауто- и аллополиплоидизация [95, 96, 97, 98]. Салмон с коллегами [95], не говорит уже о роли, которую играют гибридизация и дупликация генома, а указывает на то, что слияние генома, а не полиплоидия в значительной степени ответственно за неаддитивное метилирование паттерны у Spartina. Однако изменения в паттернах метилирования не всегда сопровождают гибридизацию или полиплоидизацию, как утверждает Лиу с коллегами [58] для аллополиплоидного Gossypium.
Аналогичным образом, различные регулирующие факторы, особенно транс-факторы, действующие между родительскими геномами, также влияют на экспрессию генов в аллополиплоидах и способны заставить замолчать, активировать или подавить гомеологические локусы [99, 100, 101]. Например, у аллотетраплоида Arabidopsissuecica, ген (FRI) из родительского субгенома A. arenosa подавляет копирование копии другого гена (FLC) A. thalianaпри цветении, что приводит к гораздо более позднему времени цветения у полиплоида, чем у родительских видов. Подобные исследования хорошо показывают, что эпигенетические факторы могут контролировать паттерны экспрессии у полиплоидов и потенциально могут служить динамическими механизмами, способствующими эволюции полиплоидов.
Аутополиплоидия
Аллополиплоидия до сих пор считается более распространенной, чем аутополиплоидия [23, 24, 25], но возрастает понимание важного значения автополиплоидии, тем не менее, недооценена как распространенность, так и роль аутополиплоидии в экологии и эволюции. Воспринимаемая редкость естественных аутополиплоидов исторически отчасти объяснялась бесплодием, вызванным нерегулярным спариванием хромосом при мейозе.
Поскольку каждая хромосома представлена в автотетраплоиде четыре раза, образование мультивалентов может привести к снижению фертильности. Тем не менее, спаривание хромосом в четных полиплоидах может быть стабильным и не обязательно мешать способности полиплоида размножаться. Спаривание хромосом в пшенице находится под простым генетическим контролем [102]. Несколько генов (Ph) контролирует спаривание хромосом в пшенице, но самый сильный эффект связан с геном Phl на длинном плече хромосомы 5B, [103, 104]. Устранение последовательности вновых полученных полиплоидах пшеницы [105] предполагает, что дифференциальное исключение геном-специфических последовательностей может облегчить гомологичное спаривание хромосом. Комбертом с коллегами [106] также предложены механизмы, которые также могут способствовать переходу от многовалентного образования и полисомного наследования к дизомному наследованию.
Так как основным критерием признания аутополиплоида было полисомнымое наследованием, обнаружение автополиплоидов долго сдерживалось отсутствием простых инструментов для оценки генетического разнообразия и моделей наследования.
Результаты анализов дизомного и полисомного наследования от аллозима (Альтернативная форма фермента, закодированная другой аллелью в том же локусе) [24] и других генетических маркеров, например, микросателлитого анализа [107, 108]; произвели революцию в исследовании аутополиплоидии. На основании аллозимного электрофореза, исследования различных растений выявили ряд ранее непризнанных автополиплоидов [110, 24], включая Tolmiea menziesii (Saxifragaceae), Heuchera micrantha и H. grossulariifolia (Saxifragaceae), Turnera ulmifolia var. Elegans и var. intermedia (Turneraceae) and Allium nevii (Alliaceae).
Рамси и Шемске [111] подсчитали, что скорость образования автотетраплоидов высока и сопоставима с уровнем мутаций гена. Однако, безусловно, выживших растений немного, но в конечном итоге это приводит к большому количеству автополиплоидных видов.
Конечно, большинство цитотипов, распознаваемых как внутривидовые хромосомные серии, являются аутополиплоидами. На основе морфологического сходства среди цитотипов – многие могут быть нераспознанные отдельные линии (например, виды). Кроме того, аутополиплоидия может быть более распространенной в некоторых группах растений, чем в других. Например, много автополиплоидов установлено в Saxifragaceae [21] и Cactaceae [112, 113, 114].
Предполагаемые причины успеха некоторых аутополиплоидов и включая тетрасомные (автотетраплоиды) или полисомное наследование более высокого уровня [115, 116] — увеличение гетерозиготности по сравнению с диплоидами [117] и до четырех различных аллелей на локус в одном аутотетраплоидном растении [118].
В любом случае, автополиплоиды, по-видимому, не испытывают существенной реструктуризации генома или серьезных изменений экспрессии генов в течение первых поколений после удвоения генома, однако в течение более длительных периодов эволюции эти процессы могут стать более важными. Парисод с коллегами [119] высказали гипотезу, что полисомное наследование обеспечивает краткосрочное эволюционное преимущество для автополиплоида по сравнению с его диплоидным прародителем.
Компьютерное моделирование показало, что автополиплоиды могут также быть способными избегать полисомного наследования и восстанавливать дисомное наследование, что способствует нео- и субфункциональности [120].
Физиология
Стеббинс [28] предположил, что физиологические изменения, связанные с полиплоидией, могут быть ключом к успеху этих растений и занятие ими новых мест обитания, Левин [19] согласился с такой теорией. Некоторые исследователи предложили [19, 20, 121], что многие физиологические процессы изменяются с увеличением плоидности, в том числе скорость газообмена, активность генов, уровень гормонов, скорость фотосинтеза, и водный баланс. Последние физиологические исследования ясно указывают на то, что разнообразные изменения сопровождают удвоение генома, и это может быть полезным для новых видов полиплоидов [122, 123, 124]. Например, полиплоидия повлияла на реакцию на солевой стресс при полиплоидизации Robinia [124] и фотосинтетический ответ при полиплоидизации глицина Glycine [122].
Размножение и изолирующие механизмы
Создание и сохранность новообразованного полиплоида, безусловно, имеют решающее значение для успеха или неудачи полиплоидных видов. Стеббинс [26] исследовал эти процессы, особенно в свете изоляционных механизмов между диплоидами и полиплоидами. Теперь ясно, что ряд особенностей может способствовать репродуктивному успеху неополиплоида и, следовательно, его создание и сохранение. Эти особенности включают в себя склонность к апомиксису или самосовместимость. Кроме того, изменения в морфологических признаках (а именно во флоральных характеристиках) после полиплоидизации может усиливать постзиготические репродуктивные барьеры, которые препятствуют скрещиванию между цитотипами [24].
Новый полиплоид может быть репродуктивно изолирован от его диплоидных предшественников, не только в результате его умноженного количества хромосом, но также и потому, что физиологические и морфологические изменения, которые следуют или сопровождают полиплоидизацию могут изменить свою репродуктивную биологию. Репродуктивные барьеры могут быть презиготным (например, географическая изоляция, цветение фенологии различия, консистенция опылителей) или постзиготные (например, гибель триплоидных гибридов, инбредная депрессия). Разбивка системы генетической несовместимости часто сопровождает образование полиплоидов [125] и приводит к самооплодотворению, которое может изолировать новый полиплоид от его диплоидного родителя (ей) и способствовать созданию нового полиплоида. Это изменение происходят у видов с одноклеточной гаметофитной самонесовместимостью (GSI), но, как известно, не встречаются у видов с мультигенными системами GSI или спорофитной самонесовместимостью (SSI) [126].
Хусбанд и Сабараa [127] показали, что аутотетраплоидные особи Chamerion angustifolium (Onagraceae) были репродуктивно изолированы от диплоидов по географическому признаку, цветущей асинхронностью, способностью опылителей, самоопыления и отбору гамет. Они также предложили сделать упор на постзиготические факторы, такие как триплоидная стерильность / инвариантность, могут фактически быть вторичными по отношению к механизмам изолигации, но это предполагает достаточное время для развития презиготических барьеров.
Морфологические изменения в результате полиплоидизации могут также оказывают влияние на репродуктивную биологию неополиплоидных видов. Сегравес и Томпсон [128] обнаружили, что природные аутополиплоидные популяции Heuchera grossulariifolia (Saxifragaceae) имеют не только большие цветки, чем диплоидные популяции, а также различные формы и цветения раз. Наборы опылителей, посещающих симпатического диплоида и тетраплоидные растения, отличались пропорционально при цветении. Время двух цитотипов было синхронным. Кроме того, независимо сформированные популяции автотетраплоидов отличались в количество цветных персонажей [128].
Новые направления
Биологи и генетики растений в настоящее время исследуют новые направления полиплоидии, которые нельзя было ожидать даже 20 лет назад. Современные исследования последствий полиплоидии в настоящее время включают исследования протеом, микро РНК и влияние альтернативного сплайсинга (AS). После исследований Левина [19] и других, пожалуй, самый важный вывод из таких продолжающихся исследований является то, что полиплоидия может подтолкнуть население в новую адаптивную сферу, учитывая множество изменений, которые сопровождают удвоение генома и приводят к новшиствам [18].
Несмотря на большой прогресс в документировании геномных и транскриптомных изменений у полиплоидов по отношению к их диплоидным родителям, мы мало знаем о влиянии кратной дупликации генома на протеом [129, 130, 131, 132, 133, 134, 135, 136].
Учитывая, что функциональные состояния белков в протеоме напрямую влияют на молекулярные и биохимические события в клетках, которые определяют фенотип, исследуя, как изменения в профилях экспрессии генов и событиях альтернативного сплайсинга связаны с изменениями уровня белка, необходимо для понимания молекулярных и эволюционных последствий полиплоидии, включая молекулярные, биохимические и физиологические механизмы, которые в конечном итоге приводят к эволюционным изменениям. Несмотря на несколько протеомных исследований полиплоидов и их родителей, некоторыми исследователями выявлено, что протеом полиплоидов не всегда показывает результаты, предсказанные по одной только транскриптоме. Кроме того, могут быть получены новые белки, не обнаруженные ни у одного из родителей. Эти данные указывают на сложность уровня клеточных процессов, а также необходимость дополнительных сравнительных анализов протеомов полиплоидов и их диплоидных предшественников [131, 132, 133, 134, 135, 136].
Роль альтернативного сплайсинга сейчас исследуется у эукариот, включая растения [137]. Фракционирование, неофункционализация [138] и субфункционализация [139, 140] — это важные процессы, которые происходят после полиплоидии, но совместное воздействие этих процессов в сочетании с альтернативным сплайсингом после кратного увеличения генома неизвестно. Некоторые исследователи предполагают, что есть небольшая или нулевая корреляция между альтернативным сплайсингом и геном и дупликацией генома [141, 142].
Другие, однако, предположили отрицательную корреляцию между AS и дублированием, и что альтернативно сплайсированные изоформы между дубликатами могут значительно отличаться [143, 144]. Чжан и соавт. [146] обнаружили, что экзонический энхансеры сплайсинга и глушители экзонического сплайсинга быстро расходятся после дупликации генов, тогда как [145] представили доказательства потери изоформы и неофункционализации после дублирования. Эти результаты согласуются с гипотезой, что ген дублирование по крайней мере может повлиять на AS. Но меньше известно об общем геномном дублировании и AS. Чжан и соавт. [147] предоставили доказательства расхождения паттернов АС по гену и геному дублирование у арабидопсиса; интересно, некоторые из различий сообщается, происходит в орган-или стресс-специфическим образом. Следовательно, важный новый набор вопросов возникает: учитывая, что AS увеличивается. Протеомная гибкость, оба родительских профиля AS поддерживаются в аллополиплоид? Доминирует ли один родительский шаблон AS? Как много нового AS происходит после удвоения генома?
Еще одна важная новая область исследований включает взаимодействие многих геномных явлений, обсужденных выше. Как недавно рассмотрено, важное требование полиплоидов необходимо сохранить баланс дозировки после дупликации генов [148]. Эти авторы утверждают, что выяснение этих Эффекты дозирования представляют «один аспект возникающего плюралистического рамки» в исследовании эволюции полиплоидов.
Микроклональное размножение картофеля
Микроклональное размножение — получение неполовым путем растений, генетически идентичных исходному.
Процесс клонального микроразмножения можно разделить на четыре этапа:
‒ выбор растения-донора, изолирование эксплантов и получение хорошо растущей стерильной культуры;
‒ собственно микроразмножение, когда достигается получение максимального количества мериклонов;
‒ укоренение размноженных побегов с последующей адаптацией их к почвенным условиям, а при необходимости депонирование растений-регенерантов при пониженной температуре (+ 2°+ 10 °C);
‒ выращивание растений в условиях теплицы и подготовка их к реализации или посадке в поле [149].
Клональное микроразмножение ‒ новый перспективный способ вегетативного размножения растений, позволяющий получать генетически однородный, оздоровленный посадочный материал. Процесс получения здоровых растений из микрорастений очень трудоемок и длителен по времени. Из-за слабой способности меристем к регенерации и низкого выхода оздоровленных растений возникает необходимость вычленения большого количества меристем. Если удается создать благоприятные условия для стеблевого морфогенеза, из меристемы развивается целое растение. Клетки наружной зоны меристемы делятся, образуя вначале зачатки листьев, а затем листья; клетки центральной части делятся и вытягиваются, давая начало всем тканям стебля, на котором затем образуются корни [150].
По сравнению с традиционными методами размножения, используемыми в сельскохозяйственной практике, клональное микроразмножение в культуре in vitro обладает рядом преимуществ:
1) коэффициент размножения в этом случае гораздо выше, чем при обычных методах размножения,
2) можно быстро размножить ценный клон растения,
3) одновременно с размножением часто происходит оздоровление растений от вирусов, патогенных микроорганизмов и нематод,
4) возможно, работать в лабораторных условиях круглый год и планировать выпуск растений к определенному сроку,
5) метод размножения очень экономичен — на первоначальном этапе тысячи растений могут расти на относительно небольшой лабораторной площади,
6) этим методом можно размножать растения, которые с трудом или совсем не размножаются вегетативно,
7) можно длительно хранить пробирочные растения при пониженной температуре, что позволяет создать «банк» ценных форм растений [151].
Современные методы биотехнологии обладают неоспоримыми преимуществами и позволяют круглогодично проводить работы по производству элитного посадочного материала картофеля. Эффективное проведение таких работ обеспечивается тщательным подбором условий культивирования растений in vitro, подбору конкретно для каждого сорта питательных сред и отдельных компонентов среды, обеспечивающих максимальные параметры развития растений и их продуктивность в дальнейшем [152].
Одной из важнейших сельскохозяйственных культур в России является картофель. Как показывают данные, импорт картофеля из стран ближнего и дальнего зарубежья не оправдывает себя с экономической и стратегической точки зрения, так как не производится контроль качества семенного и товарного картофеля. Повышение урожайности и устойчивости к болезням отечественных сортов картофеля является актуальной проблемой АПК [153].
Основной проблемой, ограничивающей получение стабильно высокого урожая, является отсутствие в достаточном объеме качественного семенного материала. Семенами высоких посевных качеств в масштабах Российской Федерации засевается только около 60% сельскохозяйственных площадей, а в частном секторе зачастую используется сортосмесь без обновления [152]. Накопление вирусной инфекции в семенном материале – важнейшая причина, так называемого вырождения картофеля, которое проявляется в ухудшении развития растений, снижении урожайности и качества клубней. Вирусы не способны самостоятельно проникать в клетки растений через оболочки и покровные ткани, не имеют клеточного строения и могут размножаться только в живых клетках восприимчивых организмов [154].
Технология оздоровления картофеля – составная часть системы первичного семеноводства этой культуры. Одним из основных условий получения элитного семенного материала картофеля в условиях in vitro является оптимизация состава питательных сред, а также выбор оптимального светового режима для полноценного и максимального развития микрорастений. От состава питательной среды в значительной мере зависит успех выращивания клеток, тканей, органов растений. Поэтому разработке и совершенствованию состава сред уделялось и уделяется много внимания. Поскольку клетки и ткани различных растений растут и функционируют в различных метаболических условиях, то, по–видимому, никогда не будет создана универсальная питательная среда. Скорее совершенствование питательных сред должно идти в направлении разработки их специфического состава по отношению к объекту, группе и объектов или соответственно целям и задачам, стоящим перед исследователями [155].
У растений, выращиваемых in vitro в пробирочной культуре на искусственной питательной среде, лимитирован процесс фотосинтеза из–за недостатка углекислого газа, в связи с чем, они вынуждены потреблять сахара из культуральной среды, являясь, таким образом, преимущественно гетеротрофной культурой [156]. Фотосинтетическая активность растений картофеля в культуре in vitro значительно снижена. Поэтому сахароза в таких условиях незаменимый источник энергии и строительный материал для образования новых клеток. Рост и развитие микрорастений картофеля проходит при низкой концентрации сахарозы (2–3%). Для формирования клубней, необходимо большее количество углеводов в культуральной среде. Высокая концентрация сахарозы (6–8%) стимулирует рост биомассы, индуцирует микроклубнеобразование, а также повышает содержание сухого вещества в микроклубнях. Осмотическое давление, создаваемое сахарозой в культуральной среде, служит сигналом для индукции и роста микроклубней. С повышением ее содержания обнаружены изменения в эксперессии генов, отвечающих на гормональные сигналы, а также в активности и соотношении ферментов, участвующих в синтезе крахмала. В процессе инициации и роста клубней происходит активный биосинтез крахмала и его отложение в виде крахмальных зерен в амилопластах клеток клубня [157].
Одним из основных условий получения элитного семенного материала картофеля в условиях in vitro является оптимизация состава питательных сред, содержащих витамины и регуляторы роста, а также выбор оптимального светового режима для полноценного и максимального развития микрорастений.
Содержание регуляторов роста обычно является определяющим фактором для успешного роста культур клеток растений. Из фитогормонов в составе сред наиболее часто используют ауксины и цитокинины. Поскольку различные клетки и ткани в культуре резко отличаются по способности к автономному синтезу и метаболизму отдельных групп фитогормонов, то в связи с этим их рост в различной степени зависит от снабжения регуляторами роста.
Регенерация картофеля in vitro
Генетические основы регенерации растений in vitro и сортоспецифичность реакции на регенерацию является распространенной проблемой в культуре тканей нескольких важных сельскохозяйственных культур. Картофель не является исключением в этом отношении, и некоторые исследования четко показывают разные подходы, использованные для индукции регенерации у разных сортов [158, 159, 160, 161].
Различия в этих работах в основном связаны с составом сред регенерации, концентрацией и типом ауксинов и цитокининов, используемых для конкретных сортов.
Большинство авторов [162, 163, 164, 165, 166, 167] обычно объединяли НУК с 6-БАП для регенерации побегов.
М. Киль с коллегами [168] и Р. Тавазза [169] использовали одностадийный метод где для культивирования использовалась одна культуральная среда регенерации. Также применяют двухэтапный метод, где инициация каллуса произошла на одном экспланте, а формирование и развитие побега на другом [170]. Известен и трехступенчатый метод, применяли разные среды для каждой фазы, а именно, индукции каллуса, формирования адвентивных побегов и размножения побегов [171].
Зеатин рибозид в сочетании с ауксином часто используется в протоколе одностадийной регенерации картофеля [163, 172], зеатин рибозид оказался эффективнее, чем 6-БАП или кинетин для формирования побегов [173, 174]. С. Шерман и М.В. Беван [175] установили, что ИМК и индол-3-ацетил аспарагиновая кислота эффективнее, чем НАА в стимулирующая регенерацию.
В указанных исследованиях подчёркивали высокую степень сортоспецифичности при режиме регуляции роста растений, однако в этих работах не проиллюстрированы основы изменения уровней или комбинаций режимов регуляции роста растений.
Помимо сортоспецифичности, обнаружены различия в эндогенных уровнях ИУК эксплантов двух индийских сортов тетраплоидного картофеля (Solanum tuberosum ssp. tuberosum L.), что влияет на регенерацию побегов. На основе эти различий Пал с коллегами [176] использовали галловую кислоту для преодоления неблагоприятного влияния эндогенной ИУК на способность снижения регенерации у эксплантов, а также использовали низкие концентрации зеатина.
В настоящее время существует достаточное количество работ по клональному микроразмножению, каллусогенеза и морфогенеза картофеля in vitro, при этом существует немало сложностей в подборе условий индукции и обеспечения процессов дедифференцировки и дифференцировки тканей растения. При изучении процессов регенерации и клонирования некоторых перуанских сортов картофеля в культуре in vitro выявлено, что при длительном микрочеренковании побегов уменьшалась способность пазушных почек формировать нормальные по развитию побеги, исходя из этого можно сказать, что коэффициент размножения и способность к укоренению зависили от генотипа и времени культивирования. В связи с некоторыми различиями по регенерационной способности, отмечаемыми у образцов разного уровня плоидности, определенный интерес представляло сравнение по этому свойству таких генотипов, как селекционные тетраплоидные сорта S. tuberosum, диплоидных, триплоидных и тетраплоидных видов. При этом отмечались явно лучшие показатели (длина стебля, количество листьев, количество боковых побегов, коэффициент размножения) у тетраплоидных улучшенных (селекционных) сортов по сравнению с диплоидными, триплоидными и тетраплоидными видами [177].
Для изучения динамики образования каллуса была отобрана среда с 2,4-Д (0,1-10 мг/л), кинетином (0,2 мг/л) и зеатином (0,05 мг/л) для стеблевых, листовых и клубневых эксплантов, а также среда со ауксинами ИУК, НУК и ИМК для стеблевых эксплантов. Использование этих сред обеспечивало возможность получать интенсивно растущую каллусную ткань. Специализированная клетка дифференцированной ткани in vitro изменяется под влиянием условий выращивания. Подбор условий культивирования для каждого генотипа и типа ткани носит индивидуальный характер. Однако, на оптимальной среде различные ткани претерпевают по направленности развития аналогичный путь, приобретая свойства, характерные для каллусных тканей. В результате проведенных экспериментов выявлены сортовые различия в процессах каллусогенеза, на которые существенное влияние оказывают происхождение экспланта (максимальные эффекты получены при использовании сегментов стебля) и питательные среды. Внешний вид каллусов в большей степени зависел от тканевого происхождения экспланта [177].
Цель работы – разработка методов индукции полиплоидии картофеля
in vitro.
Задачи исследований:
- Определить эффективность регенерации и каллусообразования из высечек листьев картофеля;
- оценка цитотоксического действия амитотика в условиях стерильной культуры;
- скрининг анатомо-морфологических признаков полученных генотипов;
- тиражирование выделенных генотипов картофеля.
Раздел 2. Объекты и методика исследований
Биологическими объектами исследований служили:
- сорта картофеля: Фрителла, Утро, Скороплодный, Северное сияние, Вектор, Сатурна, Метеор.
- ботанические семена Solanum rybinii purple.
Краткое описание использованных в исследованиях сортов и видов:
Метеор: очень ранний, столового назначения. Сорт селекции ФГБНУ «ВНИИ картофельного хозяйства им. А.Г. Лорха» [178];
Утро: среднеспелый, столового назначения, селекции ФГБНУ «ВНИИ картофельного хозяйства им. А.Г. Лорха» [178];
Фрителла: среднеспелый, столового назначения. оригинаторы сорта ФГБНУ «ВНИИ картофельного хозяйства им. А.Г. Лорха» и ООО «Агроцентр «Коренево» [178, 179];
Вектор: среднеспелый, пригоден для производства чипсов. Оригинаторы сорта: ФГБНУ «ВНИИ картофельного хозяйства им. А.Г. Лорха»», ФГБНУ «Всероссийский научно-исследовательский институт фитопатологии» [178];
Сатурна: среднепоздний сорт столового назначения, пригоден для переработки на картофелепродукты зарубежной селекции (Agrico (Нидерланды)) [180, 178];
Северное Сияние: среднеспелый, пригоден для производства хрустящего картофеля и вакуумной упаковки. Сорт селекции ФГБНУ «ВНИИ картофельного хозяйства им. А.Г. Лорха», ООО «Редкинская агропромышленная компания», ООО «Суздальагропром», КФХ «Егорша» [178];
Скороплодный: раннеспелый, столового назначения, селекции ФГБНУ «ВНИИ картофельного хозяйства им. А.Г. Лорха» [178];
Solanum rybinii purple (2n=2x=24) вид картофеля родом из Колумбии. Данный вид устойчив ко многим болезням и неблагоприятным условиям выращивания. Обладает высокой урожайностью. В гнезде образуется немало округлых крупных клубней с синей кожурой и интенсивной синей мякотью внутри [181].
Подсчет количества хлоропластов в замыкающих клетках устьиц
Для приготовления цитологических препаратов листьев растений in vitro для предварительной оценки уровня плоидности применяли способ приготовления цитологических препаратов с помощью ультразвука для изучения анатомо-морфологических характеристик листьев [182].
Для облучения использовали ультразвуковую установку УДЗН-2Т (Россия). Частота излучения – 22 кГц. Мощность воздействия P=7,8 Вт/см2. Мощность рассчитывали по количеству выделившейся за единицу времени тепловой энергии. При расчёте мощности температуру воды определяли с помощью электронного термометра с погрешностью ±0,1°С.
Для облучения использовали листья со средней части микрочеренка.
Обработку УЗ листовых пластинок проводили в стеклянном бюксе объёмом 20 мл, содержащем 7,5 мл дистиллированной воды. Для обработки использовали коническую насадку излучателя, обеспечивающую воздействие УЗ непосредственно на ткани растений (рисунок. 1.). Время воздействия – 20 секунд.
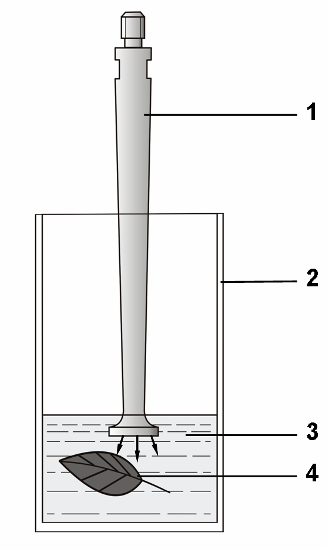 |
| Рисунок 1. — Способ приготовления препаратов листьев растений:
1 – УЗ-излучатель; 2 – стеклянный бюкс; 3 – дистиллированная вода; 4 – лист растения |
Микроскопический анализ проводили в проходящем свете на микроскопе Leica 2500, фотографирование осуществляли цифровой камерой DCM-500 с программным обеспечением Scope Photo.
Подсчёт проводили по 75 измерений в 3-х кратной повторности.
Статистическую обработку данных проводили в программной среде Microsoft Excel.
Вариационные кривые количества хлоропластов в замыкающих клетках устьиц строили по совокупности распределения данного признака у 5 растений каждого генотипа. Теоретически распределение значений признака зависит от объема выборки и при значительном количестве растений.
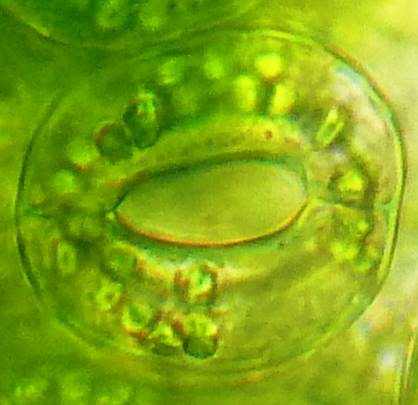
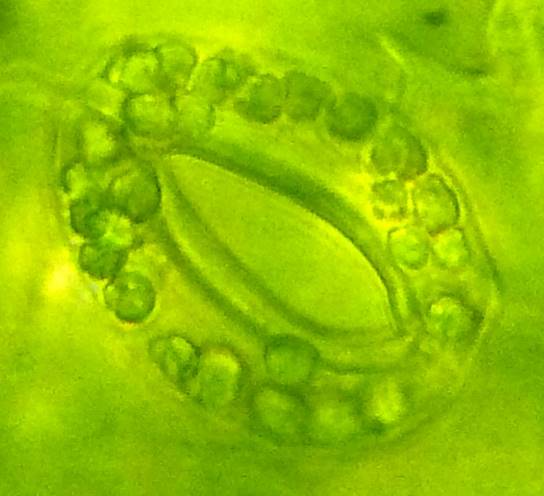
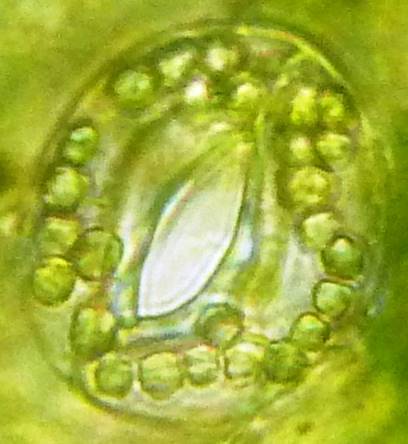
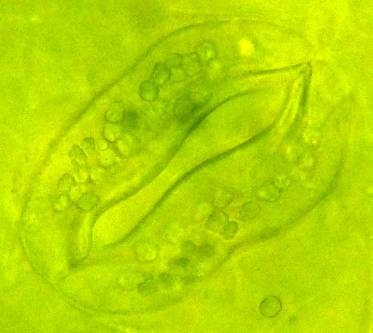
Для синхронизации митотического деления в меристемных участках корней, колбы с микрорастениями помещали в холодильник с температурой воздуха +4°С на 18 часов, затем ставили в люминостат с освещённостью 3500 люкс и температурой воздуха +26°С на 3 часа. Окрашивание хромосом осуществляли по методике ацетогематоксилиновых давленых препаратов [183], предфиксацию точек роста в корешках проводили 2,0% п-дихлорбензолом в течение 30 минут. Микрофотографирование метафазных пластинок производили фотокамерой для микроскопа DCM-900 с программным обеспечением Scope Photo.
Получение тетраплоидных форм картофеля хроническим воздействием колхицина в средах размножения in vitro
В качестве объекта исследований для получения тетраплоидных форм картофеля использовали S. rybinii. Черенки картофеля высаживали на агаризованную питательную среду Мурасиге – Скуга, c добавлением 100 мг/л мезоинозитола, 8 г/л агара и комплекса витаминов по Мурасиге-Скугу [184]. Водородный показатель среды доводили до 5,7–5,8 с помощью 0,1 Н NaOH.
В качестве регуляторов роста использовали цитокинин 6-бензиламинопурин (БАП) – 1 мг/л, ауксин — β-индолилуксусную кислоту (гетероауксин или ИУК) – 0,2 мг/л. В качестве источника углевода использовали глюкозу – 30 г/л. В опыт были включены следующие варианты:
- без колхицина (контроль);
- среда, содержащая 0,005 % колхицина;
- 0,01% колхицина;
- 0,015% колхицина;
- 0,02% колхицина.
Учитывали: коэффициент размножения побегов, длину побегов, число и длину корней.
Микрочеренки картофеля культивировали в колбах объемом 250 мл в культуральной комнате при температуре 24°С при освещении 2300-2500 люкс. Учеты проводили на 14 и 28 день культивирования.
Получение полиплоидных форм методом инъекций в микроклубни картофеля
Для опыта использовали микроклубни картофеля сортов Метеор и Жуковский ранний размером 0,8-1,2 см. В каждуй микроклубень делали 4-5 инъекций стерильным водным раствором, распределяя их по поверхности микро-клубня (рисунок 2). В опыте использовали следующие варианты:
1.- контроль (без колхицина);
2 — 0,001 % раствор колхицина;
3. 0,01% раствор колхицина;
4. 0,1% раствор колхицина;
5.1% раствор колхицина.
Культивировали в колбах объемом 250 мл по 15 штук, при температуре 24°С и освещении 2300-2500 люкс. Учеты проводили на 14 и 28 день культивирования.
 |
 |
| а | б |
| Рисунок 2. — Подготовка (проведение иньекций) (а) и высадка обработанных микро-клубней картофеля в колбы (б) | |
Цитологическое исследование последействия колхицина при полиплоидизации S. rybinii.
Для введения использовали зрелые семена S. Rybinii, которые высевали на питательную среду, состоящую из минеральных солей по Мурасиге – Скуга [184].
В качестве регулятора роста использовали цитокинин 6-бензиламинопурин (БАП) – 1 мг/л, ауксин — β-индолилуксусную кислоту (гетероауксин или ИУК) – 0,1 мг/л. В качестве источника углевода использовали сахарозу – 30 г/л. Стерилизацию семян картофеля проводили 0,1% раствором сулемы в течение 1 минуты.
Колбы с укоренёнными микрорастениями помещали в холодильник с температурой воздуха +4°С на 18 часов. Затем, для стимулирования митотического деления в меристемных участках корней, укоренённые растения помещали в колбы, каждая с 10 мл жидкой среды МS, содержащей 0,1-1,0% колхицина. Колбы с эксплантами культивировали на шейкере при комнатной температуре в течение 72 часов и освещённости 3500 люкс.
Окрашивание хромосом осуществляли по методике ацетогематоксилиновых давленых препаратов [183].
Микрофотографирование метафазных пластинок производили фотокамерой для микроскопа DCM-900 с программным обеспечением Scope Photo.
Для приготовления цитологических препаратов листьев растений in vitro для предварительной оценки уровня плоидности применяли способ приготовления цитологических препаратов с помощью ультразвука для изучения анатомо-морфологических характеристик листьев [182]. Подсчёт проводили в устьицах (от 25 до 100 шт.) в 3-х кратной повторности.
Микроскопический анализ проводили в проходящем свете на микроскопе Leica 2500, фотографирование осуществляли цифровой камерой DCM-500 с программным обеспечением Scope Photo.
Статистическую обработку данных проводили в программной среде Microsoft Excel.
Регенерация картофеля in vitro
При изучении влияния различных концентраций фитогормонов на эффективность регенерации и каллусообразования из высечек листьев картофеля использованы общепринятые биотехнологические методы культивирования растительных тканей на питательных средах [185, 155].
Культивирование листовых дисков растений картофеля проводили на модифицированной агаризованной питательной среде Мурасиге – Скуга [184]. Витамины по прописи Мурасиге – Скуга [184] (тиамин – 0,4 мг/л; пиридоксин – 0,5 мг/л, никотиновая кислота – 0,5 мг/л, глицин – 2,0 мг/л) и регуляторы роста фильтровали и добавляли в среду после автоклавирования. Водородный показатель среды доводили до 5,7–5,8 с помощью 0,1Н NaOH. Посуду и инструменты стерилизовали при температуре 1800С в течение 3 часов. Стерилизацию питательных сред проводили автоклавированием при 1,2 атм. в течение 20 минут.
Для изучения влияния различных концентраций фитогормонов на каллусообразование и эффективность регенерации из высечек листьев картофеля была постановлена серия опытов. В первом опыте использовали следующие сочетания регуляторов роста:
1 вариант: 6 БАП – 1 мг/л, 2,4-Д – 0,1 мг/л.
2 вариант: 6 БАП – 2 мг/л, 2,4-Д – 0,1 мг/л.
3 вариант: 6 БАП – 3 мг/л, 2,4-Д – 0,1 мг/л.
4 вариант: 6 БАП – 4 мг/л, 2,4-Д – 0,1 мг/л.
Во втором опыте:
1 вариант: 6 БАП – 4 мг/л, ИМК – 0,4 мг/л;
2 вариант: 6 БАП – 4 мг/л, ИУК – 0,4 мг/л;
3 вариант: 6 БАП – 4 мг/л, НУК – 0,4 мг/л;
4 вариант: 6 БАП – 4 мг/л, 2,4-Д – 0,4 мг/л.
В третьем опыте:
В качестве регуляторов роста использовали цитокинин 6-бензиламинопурин (БАП) – 4,0 мг/л, 2,4-Дихлорфеноксиуксусная кислота (2,4-Д) – 0,4 мг/л. В качестве источника углевода использовали глюкозу – 30 г/л. В опыт были включены следующие варианты:
- без колхицина (контроль);
- среда, содержащая 0,005 % колхицина;
- 0,01% колхицина;
- 0,015% колхицина;
- 0,02% колхицина.
Листовые диски картофеля культивировали в темноте при температуре 24 ± 1°С. Эксперименты продолжались в течение 3 месяцев (3 пассажа по 3,5-4 недели каждый). Итоговый учет результатов проводили на 80 день культивирования.
Интенсивность каллусообразования оценивали в баллах (5 бальная система оценки).
Статистическую обработку полученных экспериментальных данных проводили в программной среде Microsoft Office Excel 2010.
Выделенные в ходе исследований формы картофеля размножали на агаризованной питательной среде Мурасиге – Скуга, без добавления регуляторов роста. В качестве источника углевода использовали сахарозу – 30 г/л, витамины по прописи Мурасиге-Скуга. Культивировали в колбах объемом 250 мл в культуральной комнате при температуре 24°С при освещении 2300-2500 люкс.
Раздел 3. Результаты исследований и обсуждение
3.1. Исследование морфо-анатомических особенностей некоторых тетраплоидных сортов картофеля
Базовые компоненты цитоплазмы клеток растительных организмов – пластиды, обладают генетическим материалом, способностью к саморегуляции и таким образом, обеспечивают их относительную автономию от других внутриклеточных структур [186].
Теоретически, в результате самоудвоения хлоропластов в клетках, их количество должно относительно равномерно распределяться между дочерними клетками в ходе цитокинеза и распределение пластид не изменялось бы на протяжении всех циклов деления. Каждая клетка взрослого растения содержала бы такое количество пластид, сколько и инициальная клетка. Практически в клетках количество хлоропластов различается не только в разных тканях, но и в популяции клеток одной ткани [187].
В.А. Струнников [188] считает, что изменчивость числа органелл в клетках растений можно отнести к эпигенетической устойчивости.
Одной из причин вариации количества хлоропластов в клетках D’Amato [189] (1985) связывает с изменчивостью размеров клеточных ядер. Такое явление может быть связано с изменением числа геномов в ядрах клеток, что также приводит к изменению объёма цитоплазмы клеток, поскольку эти признаки чётко коррелируют. Таким образом, эпигеномная изменчивость в ядрах сопровождается эпипластомной изменчивостью числа хлоропластов в цитоплазме.
Корреляция между уровнем плоидности соматических тканей и количеством хлоропластов была выявлена у множества растений [190]. С.И. Малецкий с коллегами [186], проанализировали литературу по данной проблеме и обнаружили в некоторых исследованиях корреляцию между этими показателями на уровне 0,9.
Таким образом, эпидермальные клетки наследуют свойства материнских протедермальных клеток (размеры, плоидность, количество внутриклеточных органелл в цитоплазме).
В биологических исследованиях и селекционной работе морфологические и анатомические признаки листьев растений являются одними из ключевых для установления таксономических отношений, оценки функционального состояния растений и мониторинга окружающей среды, в которой они произрастают.
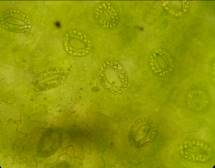
Информация о количестве хлоропластов в замыкающих клетках устьиц (ЗКУ) имеет большое значение как важный диагностический признак, который используют при изменении уровня плоидности растений, изучении влияния негативных факторов окружающей среды, питания растений, особенно в условиях in vitro.
Достоверные различия между ди- и тетраплоидами по числу устьиц на единицу площади и по количеству хлоропластов показаны в работе по получению полиплоидов дынного дерева (Carica papaya) [191], клематиса [192].
Как показали наши исследования, данный параметр так же с успехом может использоваться для предварительного отбора растений картофеля с изменениями плоидности соматических ядер.
Известно, что полиплоидия вызывает не только увеличение линейных и объёмных размеров клеток устьиц, но и достоверно повышает число хлоропластов в замыкающих клетках, по сравнению с диплоидными формами. Увеличение или уменьшение числа хлоропластов в устьичных клетках, соответствует изменчивости этого признака в меристематических (протодермальных) клетках, из которых митотическим путём формируется монослой эпидермы.
Количество хлоропластов в замыкающих клетках устьиц растений одного генотипа in vitro и in vivo является константным признаком, в отличие от количества устьиц на единицу площади и линейных размеров [193]. Однако, внутри вида, существуют достоверные различия по числу пластид между генотипами с одинаковым уровнем плоидности.
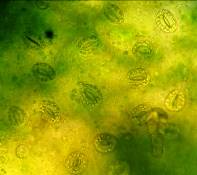
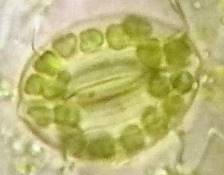
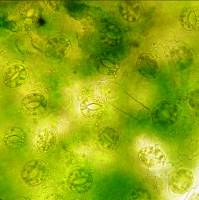
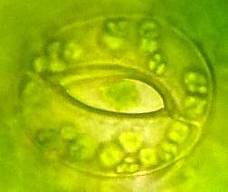
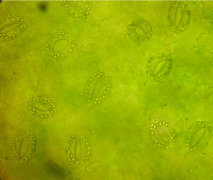
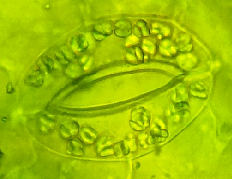
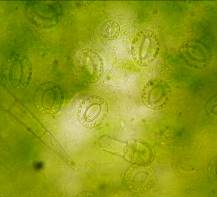
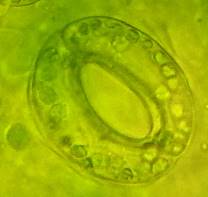
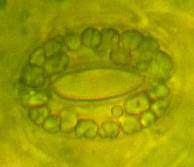
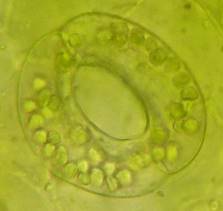
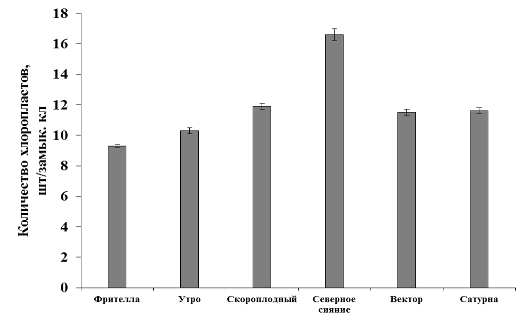
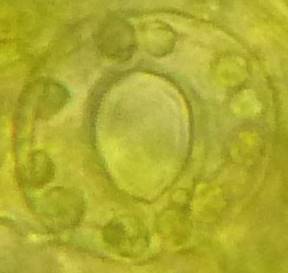
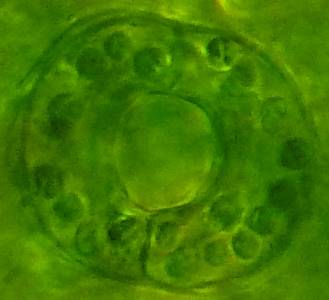
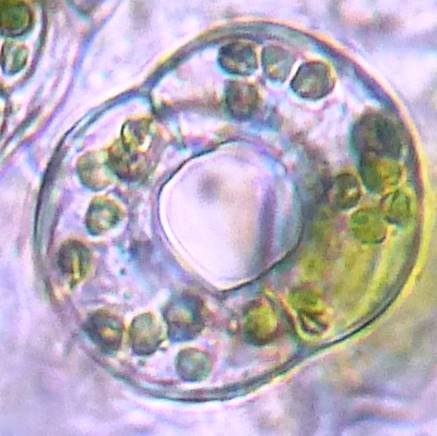
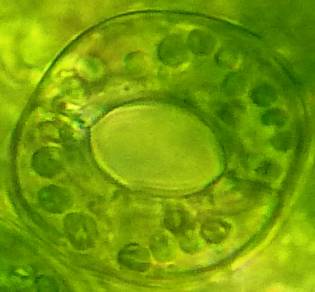
Анализ эпидермальной ткани исследуемых сортов картофеля выявил различия по данному признаку (таблица 1). Большинство генотипов имеют средние значения в пределах 9-12 хлоропластов в одной замыкающей клетке, при диапазоне распределения признака от 7 шт. до 17 шт. Это соответствует тетраплоидному уровню плоидности соматических клеток (2n=2x=48), что подтверждается цитологическим анализом (рисунок 3 (а-к), 4).
Таблица 1. — Статистические характеристики количества хлоропластов в замыкающих клетках устьиц картофеля
| Значение | Фрителла | Утро | Скороплодный | Северное сияние | Вектор | Сатурна |
| х | 9,3±0,1 | 10,3±0,2 | 11,9±0,2 | 16,6±0,4 | 11,5±0,2 | 11,6±0,2 |
| 1,7 | 3,0 | 4,0 | 11,7 | 4,0 | 2,6 | |
| Lim (min-max) | 7-14 | 7-15 | 8-17 | 11-26 | 8-17 | 8-15 |
 |
 |
| а | б |
 |
 |
| в | г |
 |
 |
| д | е |
 |
 |
| ж | з |
 |
 |
| и | к |
 |
 |
| л | м |
 |
|
| н | |
| Рисунок 3. — Эпидермис сортов картофеля in vitro: а — Фрителла, б — Фрителла, устьице с хлоропластами (9 шт.); в — Утро, г — Утро, устьице с хлоропластами (10 шт.); д — Скороплодный, е — Скороплодный, устьице с хлоропластами (16 шт.); ж — Вектор, з — Вектор, устьице с хлоропластами (14 шт.); и — Сатурна, к — Сатурна, устьице с хлоропластами (12 шт.); л, м — Северное сияние, н – Северное сияние, устьице с хлоропластами (24 шт.) | |
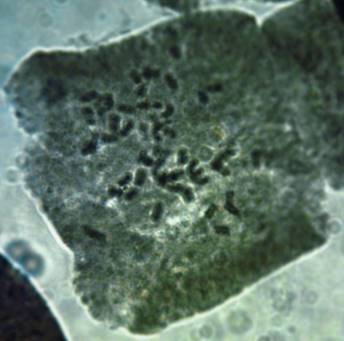 |
| Рисунок 4. — Метафазная клетка корневой меристемы микрорастений картофеля сорта Фрителла (2n=4x=48) |
Таким образом, при предварительном отборе форм по уровню плоидности можно с высокой долей вероятности ожидать наличие в тетраплоидной эпидермальной ткани картофеля наличие среднего числа хлоропластов в пределах 9-13 шт./зкл (рисунок 5).
 ожидаемые значения ожидаемые значения
2n=4x=48 |
| Рисунок 5. — Количество хлоропластов в замыкающих клетках устьиц картофеля in vitro |
Расширение диапазона распределения признака (lim=min-max) при построении вариационных кривых позволяет с высокой долей вероятности предполагать наличие химерности соматических тканей растения, на что так же может указывать и такой статистический показатель, как дисперсия признака (σ2). При полимодальном характере с двумя и более пиками проявления признака при построении вариационной кривой можно предположить о наличие нескольких уровней плоидности соматических тканей растения равных числу пиков кривой.
Данному статистическому показателю соответствуют значения исследуемого признака сорта Северное сияние (рисунок 6). Число хлоропластов в ЗКУ у этого сорта варьирует от 11 шт., что соответствует средним значениям других исследуемых сортов, до 26 шт. (таблица 1).
Как видно на рисунке 6, кривая частоты распределения хлоропластов в замыкающих клетках устьиц имеет 2 выраженных пика. Первый пик распределяется в пределах значений тетраплоидных форм (мах= 16-18 шт.). Второй пик лежит в пределах максимальных значений тетраплоидных генотипов, смещён вправо и не пересекает кривую нормального распределения. Данный факт говорит о наличие клеток с более высоким уровнем плоидности. При этом падение значений имеет плавный характер и максимальные значения зафиксированы на уровне 26 шт/зку, что означает наличие основной массы клеточной популяции соматических клеток с более высоким уровнем плоидности, чем 2n=4x=48. Полимодальный характер кривой указывает на наличие химерности с минимум двумя выраженными значениями.
На наличие химерности у сорта Северное сияние указывает и морфо-анатомическое строение эпидермиса (рисунок 3 л,м), а именно, формирование устьиц разного размера. Во многих случаях устьица имеют аномальную форму подковы или значительно превосходящие линейные размеры некоторых устьиц.
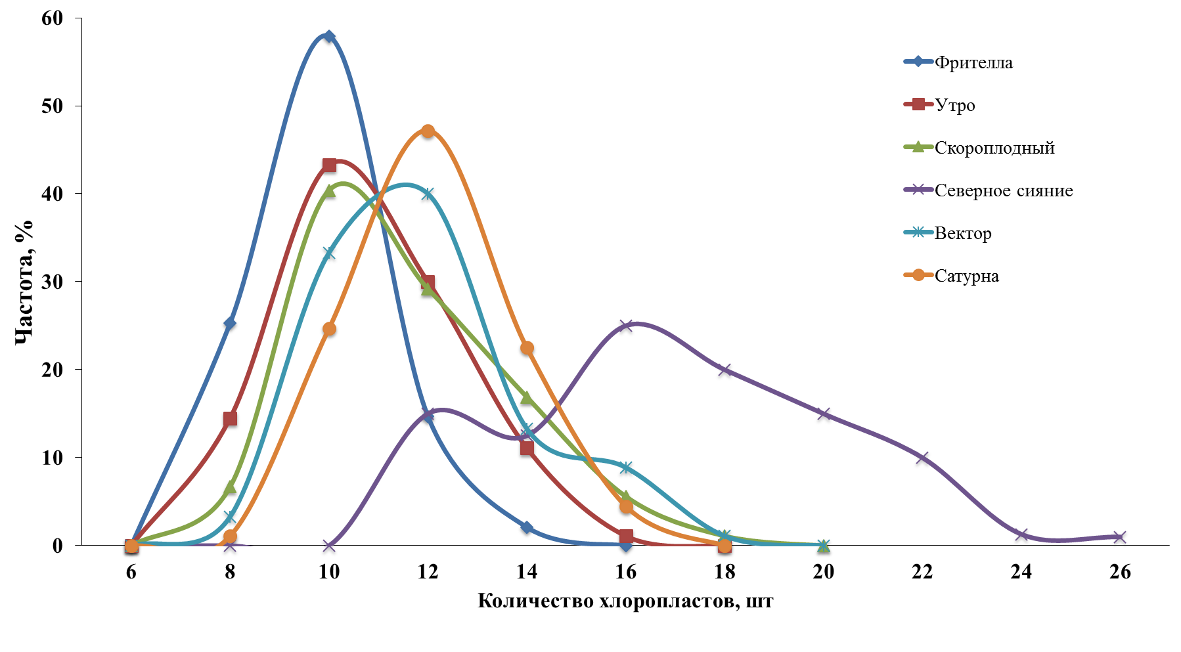 |
| Рисунок 6. — Частота распределения хлоропластов в замыкающих клетках устьиц разных сортов картофеля in vitro |
Таким образом, по уровню плоидности можно с высокой долей вероятности ожидать наличие в тетраплоидной эпидермальной ткани картофеля наличие среднего числа хлоропластов в пределах 9-13 шт/зкл. Установлено, что некоторые тетраплоидные сорта, представляющие собой межвидовые гибриды, в соматических клетках могут содержать ядра разного уровня плоидности. Возможно, данные генотипы представляют собой переклинальные химеры.
3.2. Получение тетраплоидных форм картофеля хроническим воздействием колхицина в средах размножения in vitro
Исследования показали, что с повышением концентрации колхицина в питательной среде увеличивается угнетение растений, что напрямую сказывается на снижении процента регенерации высаженных черенков. В контроле этот показатель составил 94,2%, в варианте с содержанием 0,02% колхицина – 49,9% (таблица 2).
На 14 день количество побегов на эксплант несущественно уменьшилось при повышении концентрации колхицина (таблица 2). К 28 дню картина изменилась: максимальное количество побегов было отмечено в варианте с содержанием 0,01% колхицина — 1,7±0,16 штук на эксплант (таблица 3).
Таблица 2. – Рост и развитие побегов Solanum rybinii purple на 14 день после черенкования
| Вариант опыта | Процент регенерации | Количество побегов, шт./экспл. | Длина побега, см |
| без колхицина (контроль) | 94,2 | 1,06±0,07 | 0,74±0,05 |
| 0,005 % колхицина | 90,8 | 1,05±0,03 | 0,68±0,04 |
| 0,01% колхицина | 60,8 | 1,00±0,01 | 0,49±0,06 |
| 0,015% колхицина | 51,0 | 1,00±0,01 | 0,41±0,05 |
| 0,02% колхицина | 49,9 | 1,00±0,01 | 0,32±0,04 |
| max | 94,2 | 1,06±0,07 | 0,74±0,05 |
| min | 49,9 | 1,00±0,01 | 0,32±0,04 |
Длина побега на 14 день после посадки черенков в контроле и в варианте с содержанием 0,005 % колхицина отличалась незначительно. С увеличением концентрации колхицина наблюдали уменьшение длины побега. На питательной среде с содержанием 0,02% колхицина этот показатель составил 0,32±0,04 см (таблица 2). К 28 дню максимальная длина побегов была отмечена в варианте 0,005 % колхицина — 3,39±0,41 см.
На 14 день после черенкования была отмечена обратная корреляция: с увеличением концентрации колхицина наблюдали уменьшение процента укоренения.
Таблица 3. — Развитие побегов Solanum rybinii purple на 28 день после черенкования
| Вариант опыта | Количество побегов, шт./экспл. | Длина побега, см |
| без колхицина (контроль) | 1,52±0,13 | 2,84±0,32 |
| 0,005 % колхицина | 1,4±0,1 | 3,39±0,41 |
| 0,01% колхицина | 1,7±0,16 | 2,19±0,36 |
| 0,015% колхицина | 1,3±0,15 | 1,36±0,21 |
| 0,02%колхицина | 1,28±0,1 | 0,61±0,1 |
| max | 1,7±0,16 | 3,39±0,41 |
| min | 1,28±0,1 | 0,61±0,1 |
Количество корней и их длина в контроле не значительно отличались по вариантам, кроме варианта с содержанием 0,02% колхицина, где образовалось 0,9±0,01 корней на побег со средним размером 1,36±0,2 (таблица 4).
Таблица 4. — Ризогенез Solanum rybinii purple на 14 день после черенкования
| Вариант опыта | Процент укоренения | Количество корней, шт./экспл. | Длина корня, см |
| без колхицина (контроль) | 40,8 | 1,10±0,07 | 1,76±0,2 |
| 0,005 % колхицина | 38,3 | 1,05±0,03 | 1,79±0,18 |
| 0,01% колхицина | 30,0 | 1,00±0,01 | 1,77±0,2 |
| 0,015% колхицина | 14,4 | 1,00±0,01 | 1,87±0,3 |
| 0,02%колхицина | 10,8 | 0,9±0,01 | 1,36±0,2 |
| max | 40,8 | 1,10±0,07 | 1,87±0,3 |
| min | 10,8 | 0,9±0,01 | 1,36±0,2 |
При хроническом воздействии колхицина в средах размножения in vitro наблюдали аномалии в развитии растений (рисунок 7 а, б).
 |
 |
| а | б |
| Рисунок 7. — Хлорозы, возникшие при хроническом воздействии колхицина | |
Статистические показатели количества хлоропластов в ЗКУ достоверно отличаются от контроля и позволяют быстро детектировать искомые генотипы (рисунок 8).
 |
 |
| а | б |
 |
 |
| в | г |
 |
 |
| д | е |
 |
 |
| ж | з |
 |
 |
| и | к |
| Рисунок 8. — Количество хлоропластов в ЗКУ картофеля S. rybinii после хронического воздействия колхицина на среде размножения: а – 5 шт. (контроль); б – 7 шт. (контроль); в – 8 шт. (контроль); г – 10 шт. (контроль); д – 12 шт.; е – 13 шт.; ж – 14 шт.; з – 15 шт.; и – 16 шт.; к – 21 шт. | |
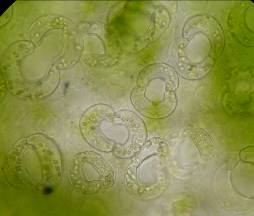
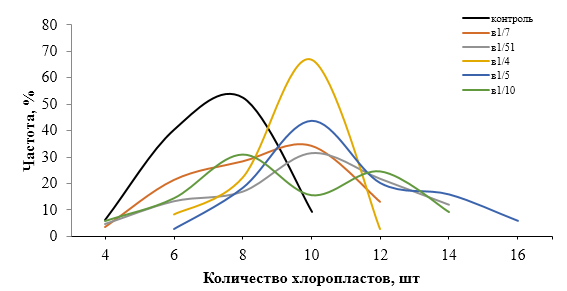
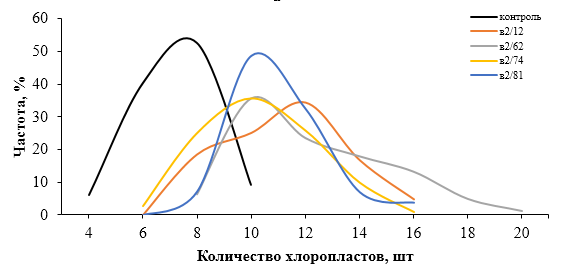
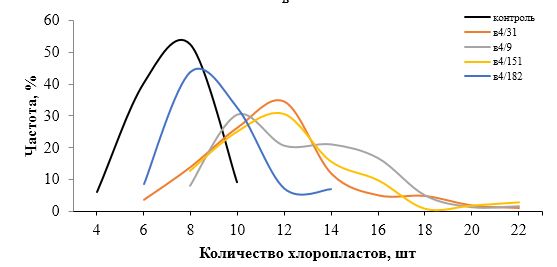
Как можно предположить согласно предварительному цитологическому анализу, что большинство индуцированных полиплоидных растений являются миксоплоидами (рисунок 9, таблица 5), что в дальнейшем удалось подтвердить при непосредственном подсчёте хромосом.
 |
| а |
 |
| б |
 |
| в |
 |
| г |
| Рисунок 9. — Распределение хлоропластов в замыкающих клетках устьиц у форм картофеля S. rybinii с изменённым уровнем плоидности |
Как видно из рисунка 9 и таблицы 5, колхицин приводит к увеличению среднего значения числа хлоропластов в замыкающих клетках, хотя некоторая часть клеточной популяции находится в пределах контроля (от 4 шт. до 10 шт.). Увеличение диапазона распределения естественно отражается и на дисперсии распределения этого признака.
Таблица 5. — Статистические показатели хлоропластов в замыкающих клетках устьиц S. rybinii и его после хронического воздействия колхицина на среде размножения in vitro
| Форма | M ± m,
шт.* |
lim
(min-max), шт. |
Дисперсия,
|
|
| Контроль | 7,2±0,3 | 4-10 | 3,1 | |
| 1 | 1/11 | 7,2±0,3 | 4-11 | 3,2 |
| 2 | 1/77 | 7,0±0,3 | 4-11 | 2,7 |
| 3 | 1/9 | 7,5±0,3 | 5-11 | 6,2 |
| 4 | 1/4 | 7,6±0,3 | 5-11 | 2,5 |
| 5 | 1/10 | 8,2±0,7 | 5-16 | 8,5 |
| 6 | 1/32 | 7,9±0,2 | 4-11 | 2,5 |
| 7 | 1/4 | 7,8±0,3 | 4-11 | 3,8 |
| 8 | 1/42 | 6,9±0,2 | 4-10 | 2,4 |
| 9 | 1/5 | 8,6± 0,4 | 5-15 | 9,5 |
| 10 | 1/51 | 8,0±0,3 | 4-14 | 2,7 |
| 11 | 1/52 | 7,2±0,3 | 5-11 | 2,2 |
| 12 | 1/6 | 7,5±0,2 | 4-10 | 3,1 |
| 13 | 1/7 | 7,6±0,4 | 5-12 | 7,3 |
| 14 | 1/8 | 7,3±0,4 | 5-10 | 2,5 |
| 15 | 1/81 | 10,6±0,3 | 7-17 | 10,0 |
| 16 | 1/91 | 7,1±0,2 | 5-11 | 9,9 |
| 17 | 1/93 | 7,4±0,2 | 4-11 | 4,4 |
| 18 | 1/101 | 7,7±0,4 | 5-15 | 6,6 |
| 19 | 1/103 | 7,3±0,3 | 4-11 | 3,0 |
| 20 | 1/105 | 6,8±0,6 | 4-10 | 3,2 |
| 1 | 2/1 | 7,3±0,2 | 4-10 | 2,4 |
| 2 | 2/11 | 6,8±0,3 | 4-10 | 2,7 |
| 3 | 2/12 | 11,3±0,5 | 9-16 | 13,6 |
| 4 | 2/2 | 8,1±0,3 | 5-12 | 12,5 |
| 5 | 2/21 | 6,8±0,3 | 3-10 | 2,7 |
| 6 | 2/22 | 7,3±0,3 | 4-10 | 5,0 |
| 7 | 2/3 | 7,6±0,2 | 5-10 | 2,3 |
| 8 | 2/31 | 7,7±0,3 | 5-11 | 5,3 |
| 9 | 2/32 | 7,4±0,4 | 4-11 | 1,8 |
| 10 | 2/41 | 7,0±0,5 | 4-10 | 2,0 |
| 11 | 2/42 | 7,2±0,4 | 4-11 | 1,7 |
| 12 | 2/43 | 7,8±0,6 | 5-14 | 5,0 |
| 13 | 2/51 | 11,7±0,5 | 6-18 | 5,3 |
| 14 | 2/52 | 7,3±0,3 | 4-11 | 1,3 |
| 15 | 2/6 | 8,6±0,5 | 5-15 | 9,5 |
| продолжение таблицы 5 | ||||
| Форма | M ± m,
шт.* |
lim
(min-max), шт. |
Дисперсия,
|
|
| 16 | 2/62 | 13,8±0,7 | 8-20 | 8,7 |
| 17 | 2/63 | 6,8±0,2 | 4-10 | 3,8 |
| 18 | 2/71 | 7,4±0,4 | 4-10 | 2,1 |
| 19 | 2/72 | 7,7±0,3 | 5-11 | 3,2 |
| 20 | 2/74 | 12,3±0,5 | 8-16 | 8,9 |
| 21 | 2/81 | 12,5±0,5 | 7-17 | 5,5 |
| 22 | 2/82 | 7,2±0,3 | 4-10 | 3,6 |
| 23 | 2/91 | 7,2±0,3 | 4-11 | 5,4 |
| 24 | 2/101 | 7,6±0,3 | 5-11 | 3,3 |
| 25 | 2/102 | 7,3±0,2 | 4-10 | 3,5 |
| 26 | 2/111 | 8,0±0,3 | 5-14 | 5,8 |
| 27 | 2/112 | 7,3±0,2 | 5-11 | 4,9 |
| 28 | 2/121 | 7,0±0,2 | 4-10 | 2,2 |
| 29 | 2/122 | 7,6±0,3 | 4-10 | 2,3 |
| 30 | 2/123 | 7,3±0,2 | 5-11 | 3,5 |
| 31 | 2/124 | 7,7±0,3 | 6-12 | 4,6 |
| 32 | 2/131 | 7,6±0,3 | 5-12 | 3,9 |
| 33 | 2/133 | 6,9±0,2 | 4-10 | 2,0 |
| 34 | 2/141 | 7,4±0,3 | 5-13 | 5,7 |
| 35 | 2/151 | 7,3±0,3 | 4-10 | 2,7 |
| 36 | 2/152 | 9,8±0,2 | 6-19 | 14,6 |
| 37 | 2/161 | 7,4±0,9 | 4-11 | 2,9 |
| 38 | 2/162 | 7,6±0,4 | 5-12 | 1,2 |
| 39 | 2/171 | 7,0±0,3 | 4-10 | 1,5 |
| 40 | 2/173 | 7,3±0,3 | 5-11 | 2,3 |
| 41 | 2/181 | 7,0±0,3 | 4-10 | 3,0 |
| 42 | 2/182 | 7,3±0,2 | 5-12 | 5,6 |
| 43 | 2/183 | 7,7±0,5 | 5-14 | 3,8 |
| 44 | 2/184 | 8,8±0,3 | 6-19 | 13,8 |
| 45 | 2/186 | 7,7±0,3 | 6-12 | 5,9 |
| 46 | 2/191 | 7,1±0,2 | 5-12 | 2,8 |
| 47 | 2/193 | 7,1±0,2 | 5-11 | 2,3 |
| 48 | 2/195 | 7,2±0,2 | 4-10 | 2,6 |
| 49 | 2/197 | 7,4±0,3 | 4-12 | 3,7 |
| 1 | 3/1 | 6,9±0,3 | 4-10 | 2,8 |
| 2 | 3/11 | 7,5±0,3 | 5-11 | 2,9 |
| 3 | 3/12 | 7,8±0,2 | 6-14 | 4,3 |
| 4 | 3/2 | 7,1±0,2 | 4-10 | 3,7 |
| продолжение таблицы 5 | ||||
| Форма | M ± m,
шт.* |
lim
(min-max), шт. |
Дисперсия,
|
|
| 5 | 3/21 | 7,5±0,2 | 5-12 | 3,0 |
| 6 | 3/23 | 7,3±0,2 | 4-10 | 4,3 |
| 7 | 3/3 | 7,3±0,3 | 4-11 | 4,4 |
| 8 | 3/31 | 8,8±0,3 | 5-18 | 14,7 |
| 9 | 3/4 | 7,7±0,2 | 5-12 | 2,0 |
| 10 | 3/5 | 6,9±0,2 | 4-10 | 5,6 |
| 11 | 3/52 | 7,0±0,2 | 4-10 | 1,8 |
| 12 | 3/6 | 7,2±0,3 | 5-11 | 1,9 |
| 13 | 3/7 | 7,2±0,2 | 5-11 | 4,2 |
| 14 | 3/72 | 7,0±0,2 | 4-10 | 2,0 |
| 15 | 3/8 | 7,7±0,3 | 5-12 | 4,9 |
| 16 | 3/9 | 7,0±0,2 | 4-10 | 2,8 |
| 17 | 3/10 | 9,8±0,3 | 6-18 | 14,0 |
| 18 | 3/111 | 6,8±0,2 | 4-10 | 2,3 |
| 19 | 3/113 | 7,4±0,2 | 4-10 | 1,1 |
| 20 | 3/122 | 7,6±0,3 | 4-12 | 3,8 |
| 21 | 3/123 | 7,5±0,2 | 5-11 | 7,7 |
| 22 | 3/131 | 7,1±0,2 | 4-10 | 2,9 |
| 23 | 3/141 | 7,5±0,3 | 4-10 | 5,0 |
| 24 | 3/151 | 7,7±0,3 | 5-12 | 2,2 |
| 25 | 3/161 | 12,3±0,5 | 7-21 | 13,4 |
| 26 | 3/163 | 7,6±0,2 | 5-15 | 4,1 |
| 27 | 3/166 | 6,8±0,2 | 4-10 | 4,5 |
| 28 | 3/173 | 7,3±0,2 | 4-11 | 1,6 |
| 29 | 3/175 | 7,3±0,3 | 4-12 | 3,3 |
| 30 | 3/181 | 12,7±0,7 | 6-20 | 15,6 |
| 31 | 3/182 | 7,1±0,2 | 5-10 | 2,0 |
| 32 | 3/183 | 7,4±0,3 | 4-12 | 1,0 |
| 33 | 3/191 | 7,4±0,2 | 4-11 | 4,3 |
| 34 | 3/201 | 7,8±0,3 | 5-12 | 4,3 |
| 35 | 3/202 | 6,9±0,2 | 4-10 | 1,8 |
| 36 | 3/211 | 8,7±0,4 | 4-18 | 12,4 |
| 37 | 3/212 | 7,6±0,3 | 5-12 | 2,5 |
| 38 | 3/221 | 7,4±0,2 | 4-11 | 3,1 |
| 39 | 3/231 | 7,5±0,2 | 5-11 | 2,5 |
| 40 | 3/241 | 7,7±0,3 | 5-12 | 5,6 |
| 41 | 3/242 | 6,9±0,2 | 4-10 | 3,6 |
| 42 | 3/244 | 6,7±0,2 | 3-10 | 2,5 |
| продолжение таблицы 5 | ||||
| Форма | M ± m,
шт.* |
lim
(min-max), шт. |
Дисперсия,
|
|
| 43 | 3/251 | 7,2±0,3 | 5-11 | 7,0 |
| 44 | 3/261 | 6,8±0,1 | 4-10 | 2,9 |
| 45 | 3/262 | 7,7±0,3 | 5-13 | 5,2 |
| 46 | 3/263 | 7,0±0,2 | 4-10 | 3,4 |
| 47 | 3/271 | 12,3±0,9 | 6-23 | 11,6 |
| 48 | 3/275 | 7,1±0,2 | 4-11 | 3,9 |
| 49 | 3/281 | 7,1±0,2 | 4-12 | 4,1 |
| 50 | 3/282 | 7,5±0,3 | 5-12 | 2,5 |
| 51 | 3/283 | 6,9±0,3 | 4-10 | 7,0 |
| 52 | 3/284 | 6,8±0,2 | 4-10 | 2,6 |
| 53 | 3/285 | 7,3±0,2 | 4-11 | 3,6 |
| 54 | 3/291 | 7,7±0,3 | 4-12 | 3,6 |
| 55 | 3/292 | 7,7±0,3 | 4-13 | 4,7 |
| 56 | 3/293 | 6,8±0,2 | 4-11 | 4,8 |
| 57 | 3/301 | 7,4±0,2 | 4-12 | 4,8 |
| 58 | 3/302 | 7,3±0,3 | 4-12 | 4,8 |
| 59 | 3/311 | 7,3±0,2 | 5-11 | 1,6 |
| 60 | 3/321 | 7,1±0,2 | 4-10 | 4,5 |
| 61 | 3/323 | 12,7±0,7 | 6-22 | 18,6 |
| 1 | 4/1 | 6,8±0,3 | 4-10 | 1,8 |
| 2 | 4/2 | 7,4±0,4 | 4-12 | 2,4 |
| 3 | 4/21 | 7,0±0,2 | 4-10 | 4,0 |
| 4 | 4/31 | 13,2±1,7 | 7-22 | 14,6 |
| 5 | 4/32 | 6,9±0,3 | 5-10 | 3,8 |
| 6 | 4/4 | 7,2±0,2 | 5-15 | 2,5 |
| 7 | 4/5 | 6,9±0,3 | 4-10 | 4,2 |
| 8 | 4/6 | 7,5±0,3 | 4-14 | 7,0 |
| 9 | 4/61 | 6,8±0,3 | 5-17 | 6,0 |
| 10 | 4/7 | 7,6±0,3 | 5-17 | 4,2 |
| 11 | 4/71 | 7,5±0,3 | 4-15 | 8,0 |
| 12 | 4/72 | 7,0±0,4 | 4-10 | 2,6 |
| 13 | 4/8 | 7,2±0,2 | 4-10 | 2,4 |
| 14 | 4/82 | 7,0±0,4 | 4-11 | 4,0 |
| 15 | 4/9 | 15,7±0,5 | 8-22 | 17,6 |
| 16 | 4/92 | 7,2±0,3 | 4-10 | 3,0 |
| 17 | 4/10 | 7,6±0,4 | 6-14 | 7,5 |
| 18 | 4/111 | 7,7±0,4 | 6-15 | 5,2 |
| 19 | 4/121 | 7,5±0,3 | 4-16 | 5,5 |
| продолжение таблицы 5 | ||||
| Форма | M ± m,
шт.* |
lim
(min-max), шт. |
Дисперсия,
|
|
| 20 | 4/131 | 7,6±0,2 | 4-14 | 3,8 |
| 21 | 4/132 | 7,5±0,2 | 4-12 | 5,6 |
| 22 | 4/141 | 7,7±0,3 | 4-10 | 5,5 |
| 23 | 4/151 | 14,3±0,8 | 8-20 | 15,3 |
| 24 | 4/152 | 6,9±0,2 | 4-10 | 6,1 |
| 25 | 4/154 | 7,0±0,2 | 4-10 | 4,0 |
| 26 | 4/161 | 6,7±0,4 | 4-10 | 4,6 |
| 27 | 4/162 | 7,1±0,3 | 5-12 | 3,6 |
| 28 | 4/171 | 7,3±0,3 | 4-12 | 3,7 |
| 29 | 4/182 | 7,6±0,3 | 5-14 | 4,1 |
| 30 | 4/183 | 6,8±0,3 | 4-10 | 2,2 |
На фоне полученных форм выделяются генотипы, которые в ЗКУ содержат меньшее количество хлоропластов, чем в контроле. В ходе статистического анализа установлено, что данное явление не имеет признаков критического изменения и существенного отклонения от контроля. На рисунке 10 видно, что кривая популяции хлоропластов, у данных форм, смещена влево относительно контроля, но не имеет значений, выходящих за него. У генотипа в 2/21 обнаружены ЗКУ с 3 хлоропластами, но их количество не является критичным.
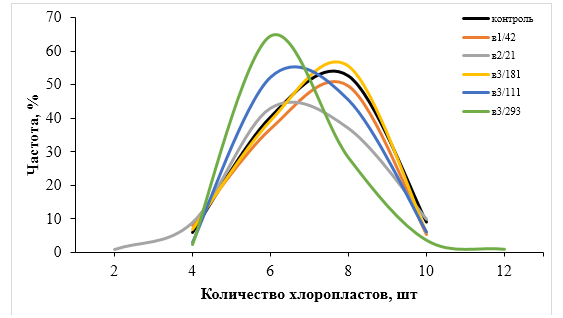 |
| Рисунок 10. — Распределение хлоропластов в замыкающих клетках устьиц у форм картофеля S. rybinii с меньшим количеством хлоропластов относительно контроля |
Для более эффективного получения полиплоидных аналогов растений, как в условиях in vivo, так и в культуре тканей, необходимо иметь представление о внешней дестабилизирующей селектирующей нагрузке полиплоидизирующего агента на уровне сублетальных и летальных доз.
Поскольку реакция организма на действие дестабилизирующего фактора идёт по определённому алгоритму, который прекрасно описан в работе Т.В. Веселовой, В.А. Веселовского, Д.С. Чернавского «Стресс у растений (биофизический подход) [194], это и послужило основанием для выбора такого жёсткого воздействия. В данном случае предполагаются достоверные изменения уровня плоидности у выживших растений по отношению к контролю. Стресс начинается стадией «тревоги». Во время этой стадии мобилизируются защитные реакции организма, но резистентность к действующему фактору падает ниже нормы. В случае если реакция оказывается слишком сильной (летальная, сверхлетальная доза), организм погибает уже на этой стадии. В случае длительного воздействия, не приводящего к летальному исходу, наступает фаза адаптации, то сопротивляемость организма возрастает. Если стрессовое воздействие продолжается, и достигнутая адаптация оказывается недостаточной, то происходит истощение живой системы. Симптомы этой фазы реакции походи на те, что имеют место на стадии тревоги: сопротивляемость падает и организм погибает.
Подобный биологический ответ на действие дестабилизирующего фактора, которым в нашем случае являлся наличие амитотика в искусственной питательной среде, отражён на графике (рисунок 11).
Так как в ходе опыта получено большое количество генотипов с широким варьированием значений количества хлоропластов в ЗКУ, то условно тетраплоидными генотипами считали формы, у которых коэффициент различия по данному показателю равен 1,2, что соответствует среднему значению 8,6 хлоропластов на ЗКУ.
В первом варианте воздействия выявлено 10,0% полиплоидных форм (рисунок 11). При увеличении концентрации данный показатель увеличивается до 16,3% на фоне высокой выживаемости генотипов. Большие концентрации приводят к уменьшению полиплоидных форм в вариантах опыта, что во многом связано с летальностью эксплантов.
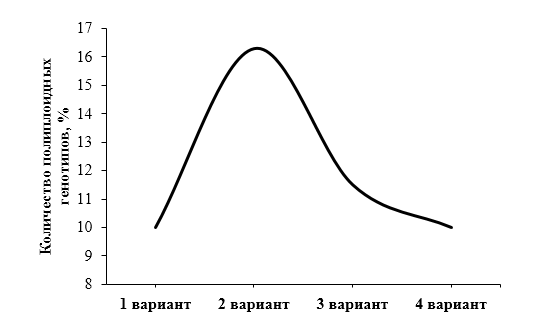 |
| Рисунок 11. — Выход полиплоидных форм в результате воздействия колхицина разной концентрацией |
Высокий уровень химерности некоторых полученных генотипов можно объяснить следующим. Поскольку колхицин блокирует деление клетки на стадии метафазы, то скорость накопления к-митозов равна скорости деления клеток. Однако при измерении скоростей деления в разных частях апекса с помощью колхицинового метода М. Денне (1966) [195] на Trifolium repens L. установил, что у этого объекта скорость деления в дистальном районе была приблизительно в 2 раза меньше, чем в боковых районах. По данным Р. Линдона [196], полученным при измерении скоростей деления в апексах побегов разных видов растений, в дистальном районе апекса скорость деления в 2-3 раза ниже, чем в боковых районах. Подобные факты различия в скорости деления в меристематических участках установлены и другими исследователями [197, 198, 199].
Таким образом, поскольку у всех или большинства видов в меристемах существует градиент скорости клеточных делений, характерный для каждого конкретного вида, то это, по сути, и является одной из основных причин возникновения химерности ткани при индукции полиплоидии. К тому же, необходимо учитывать и разное состояние клеток одной зоны меристемы, находящихся в митотическом цикле в момент начала действия митостатика. Это в свою очередь, естественным образом, влияет на количество клеток прошедших или не прошедших определённое количество колхициновых митозов на момент полного окончания действия митостатика. Помимо этого, необходимо учитывать механизмы «очищения» клеток от лишних хромосом, исключённых из процессов последующих делений в результате аномальной работы митотического веретена, что обычно приводит к возникновению анеуплоидии. Всё это в совокупности создаёт большие предпосылки для формирования химерности при индукции полиплоидии. Свести к минимуму подобное явление может лишь подбор оптимальных условий воздействия, характерных для каждого конкретного вида.
Значительное увеличение числа хлоропластов, более чем в 2 раза, отмечено у миксополиплоидных форм (рисунок 9). Например, у генотипа 4/9 зафиксировано наибольшее количество органелл в замыкающей клетке (22), что более чем в 2 раза превышает крайнее максимальное значение контроля, но при этом минимальное значение (8 шт.) приходится на основную массу клеток с контрольными значениями данного показателя. Такой разброс диапазона распределения обеспечил наибольшее значение дисперсии распределения признака (σ2=17,6) у этой формы в опыте. Показатель σ2 количества хлоропластов в замыкающих клетках листьев, полученных растений, подтверждает большое количество миксоплоидных форм, полученных в результате воздействия колхицина. Микрофотографии эпидермального слоя также подтверждает наличие химерности данного генотипа (рисунок 12).
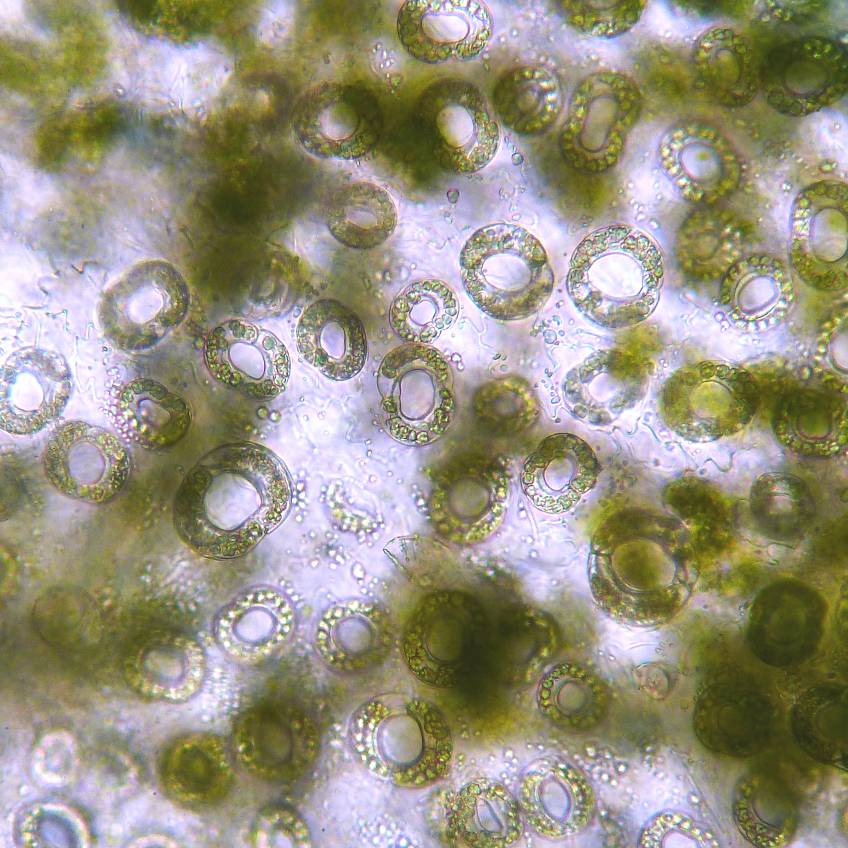 |
| а |
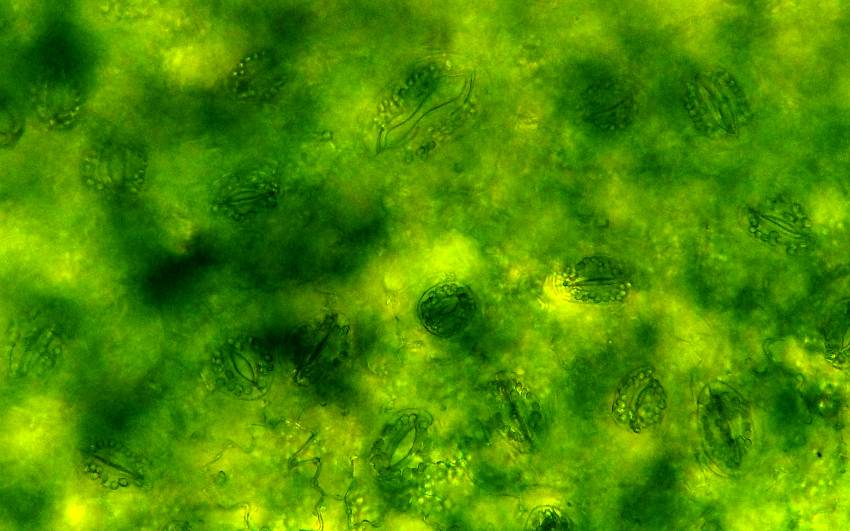 |
| б |
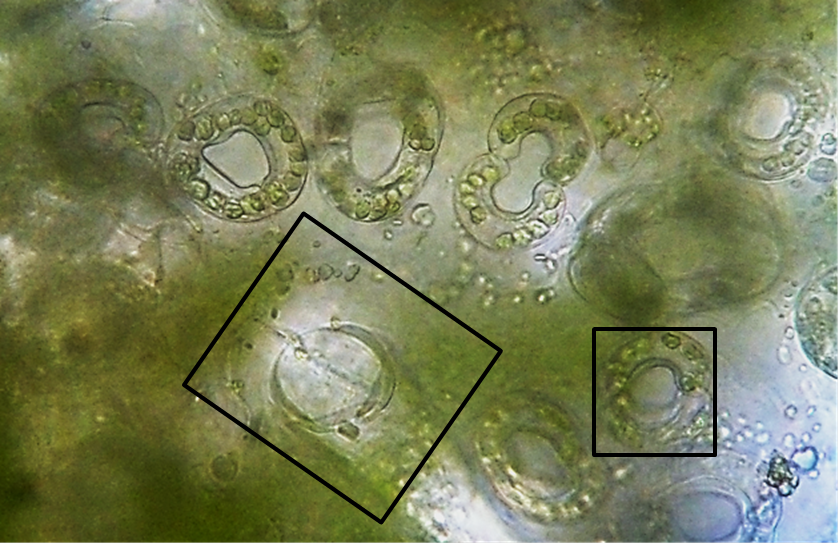 |
| в |
| Рисунок 12. — Разная величина устьиц: а, б — формы 4/9; в — площадь фигуры по линейным размерам устьиц различается в 3,5 раза |
Как и следовало ожидать, наибольшее изменение уровня плоидности относительно контроля наблюдали у форм, содержащих максимальное количество хлоропластов в замыкающих клетках (таблица 5, рисунок 13, а,б).
Однако, обнаружены формы, например, 2/81, у которых, несмотря на значительное увеличение среднего количества хлоропластов в замыкающей клетке (12,5±0,5), что говорит о явном изменении плоидности соматических ядер, значение дисперсии распределения близко к контролю. Прямой подсчёт числа хромосом выявил наличие 70% клеток, содержащих 48 хромосомы (2n=48), 20% диплоидных клеток (2n=2х=24) и 10% гиперанеуплоидных клеток (2n=24+4=28) (рисунок 13 в, г). Поскольку треть соматических клеток является или близка по объёму ядра к диплоидному уровню, то и количество хлоропластов в ЗКУ имеют близкие значения.
С середины 18 в. высшее растение рассматривается как результат деятельности промеристемных клеток, располагающихся в верхушечных растущих частях растения.
Работая с периклинальными химерами у Datura Сатина с коллегами [200, 201, 202] различали три слоя клеток: LI – эпидермальный; LII – субэпидермальный; LIII – внутренний. Клетки LI делятся антиклинально, что приводит к увеличению поверхности верхушек стеблей. Поверхностный слой делится так же периклинально только тогда, когда из него закладываются листья. Субэпидермальный слой располагается непосредственно под эпидермисом, делится антиклинально, и он определяет генетические признаки. Из этого слоя формируется спорогенная ткань. Клетки LIII делятся как периклинально, так и антиклинально и косо, в результате увеличивается объём верхушки.
Satina с коллегами [201] установлено, что все три зародышевых слоя являются самостоятельными, так как реакция каждого из них на действия амитотика индивидуальна и независима от реакции двух других слоёв.
Сравнивая данные косвенного анализа уровня плоидности по количеству хлоропластов в замыкающих клетках устьиц, и данные непосредственного подсчёта хромосом в клетках кончиков корней во всех вариантах опыта, обнаружили значительное количество периклинальных химер. Например, у формы в 3/323 (рисунок 9) в исследовании распределения числа хлоропластов в замыкающих клетках можно предположить о наличие в эпидермальном слое минимум три уровня плоидности. Это небольшая часть клеток, содержащих хлоропласты на уровне контроля, бóльшая часть клеток, содержащих хлоропласты приблизительно на уровне 4n и третья группа, с плоидностью выше 4n, характеризующаяся на графике вторым пиком роста числа хлоропластов на уровне 18-22 на клетку.
Однако при непосредственном подсчёте числа хромосом ядер клеток в меристематических участках корней, обнаружено 25% диплоидных клеток (2n=2х=24), 20,0% анеуплоидных клеток (2n=4х-10=38), 40,0% тетраплоидных клеток (2n=4х=32 хр.) и 15% пентаплоидных клеток (2n=5х=62) (рис. 2.6 д-з). Довольно высокий процент диплоидных клеток в тканях этого растения говорит о возможности меньшего в количественном отношении изменения плоидности ядер в субъэпидермальном или внутреннем слое при воздействии амитотика, чем в эпидермальном слое.
Исследовав плоидность ядер соматических клеток всех полученных форм, обнаружено, что 100% форм с изменённым уровнем плоидности имеют в своих тканях анеуплоидные клетки. Б.Н. Сидоровым с коллегами [203] на проростках Crepis capillaries установлено, что помимо распределения хромосом по дочерним ядрам, митотический аппарат клетки имеет ещё одну функцию, связанную с реконструкцией ядра в телофазе. Организуя хромосомы в метафазную пластинку и сводя её в метафазе к единому центру, веретено обеспечивает тесную пространственную близость хромосом, без чего невозможно строительство единого ядра. Блокада веретена деления, каким-либо физическим или химическим фактором, приводит к образованию полиморфных ядер или многоядерных клеток. В последнем случае в результате лизиса хромосом или нескольких ядер возникают анеуплоидные или вовсе безъядерные клетки (рисунок 13 е-о).
Необходимо отметить, что при анализе митоза, кроме массовых аномалий цитоскелета, который является главной причиной формирования анеуплоидных ядер зафиксированы нарушения движения хромосом. Обнаружено незначительное количество (0,8%) нарушений цитокинеза на стадии анафазы. В большей степени это отставание хромосом (0,5%) (рисунок 14, а) и их забегание (0,3%). Данное явление, видимо, не имеет массовый характер на данном этапе в виду прохождения массовых аномальных событий на стадии профазы и метафазы. Наиболее критичным для формирования соматических клеток является отставание хромосом, поскольку существует вероятность не включения их в состав дочернего ядра, что приведёт к образованию анеуплоидного ядра, которое тоже в последующем может делится и сформировать участок или целую ткань. К чему приведёт потеря одной или нескольких хромосом, каким физиологическим сбоям или нарушениям предсказать невозможно. Подобный случай не включения хромосомы в состав ядра представлен на рисунке 2.7 б. На стадии телофазы нарушения цитокинеза менее вероятны в силу её специфики (рисунок 14 в, г).
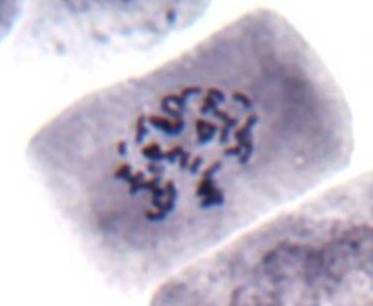 |
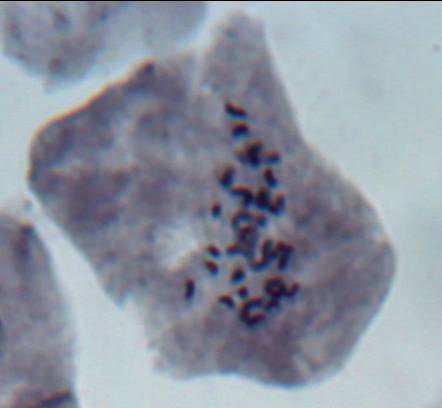 |
|
| а | б | |
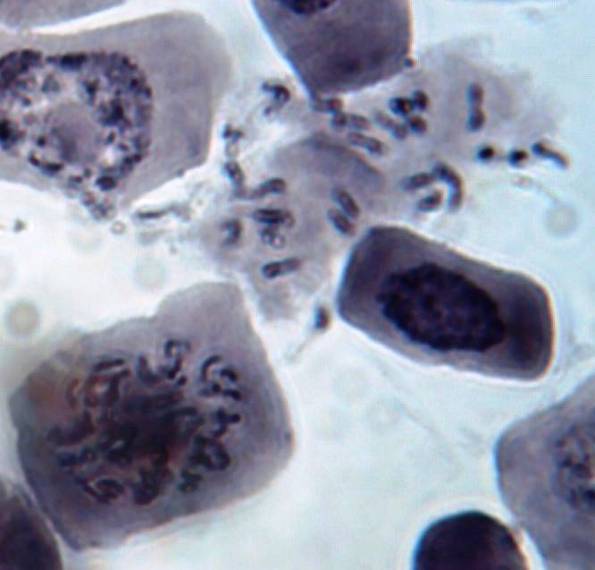 |
||
| в | ||
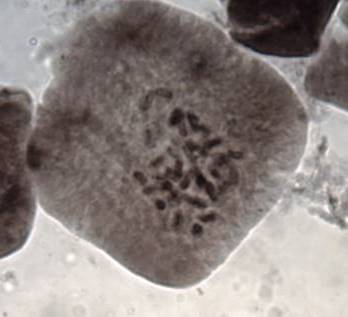 |
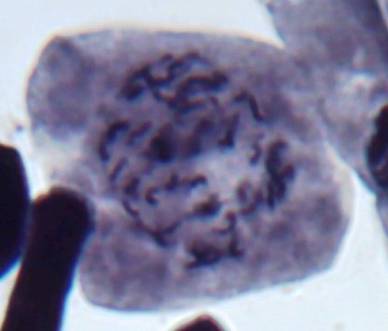 |
|
| г | д | |
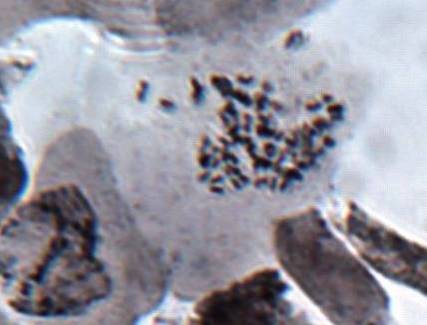 |
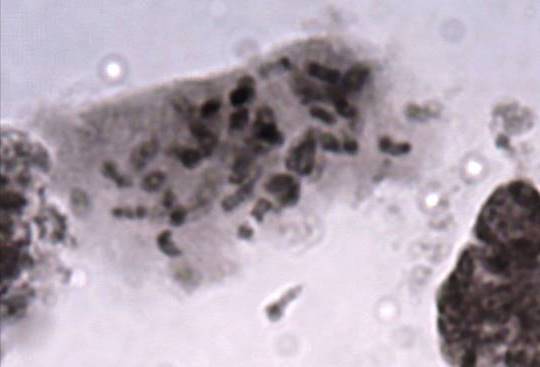 |
|
| е | ж | |
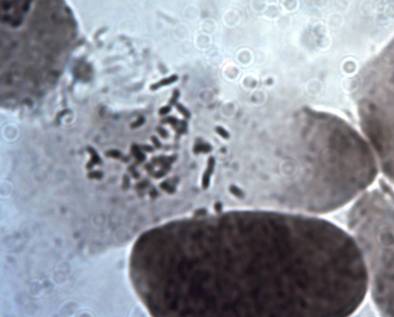 |
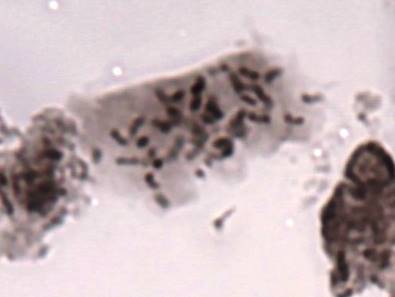 |
|
| з | и | |
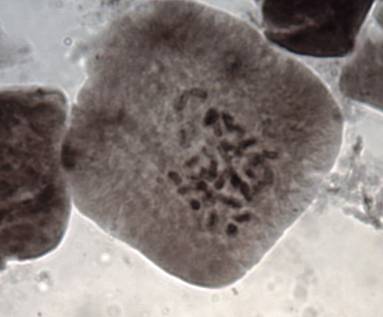 |
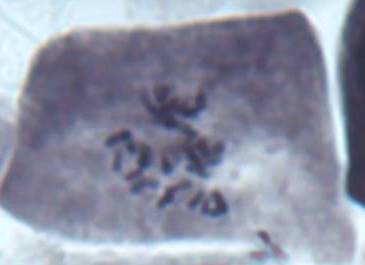 |
|
| к | л | |
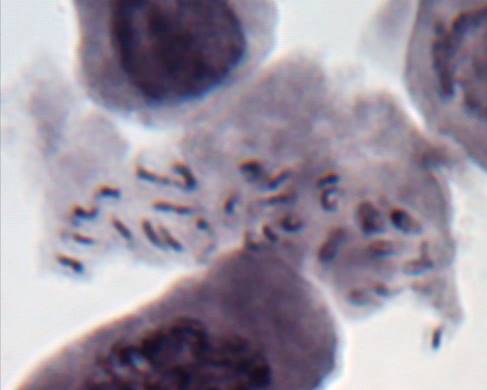 |
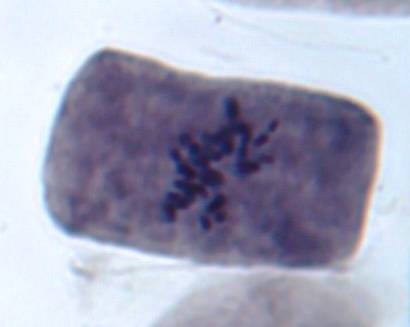 |
|
| м | н | |
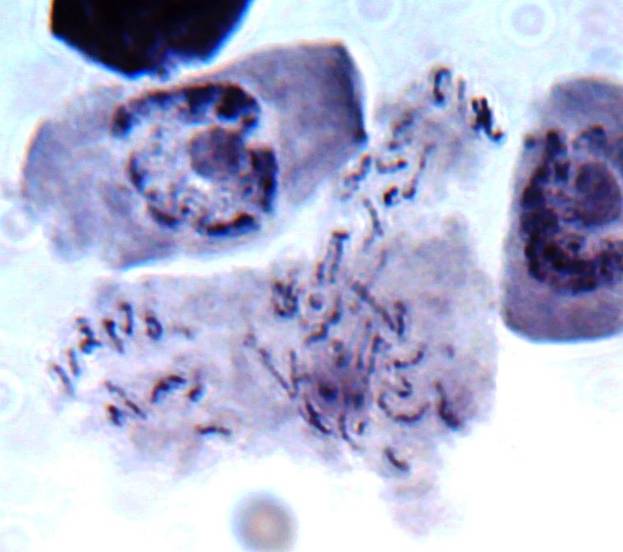 |
||
| о | ||
| Рисунок 13. — Соматические клетки S. rybinii с разным набором хромосом после воздействия колхицина: а — 2n=4x=48; б — 2n=4x=48; в — соматические клетки на стадии профазы: диплоидная клетка (2n=2х=24) (справа); тетраплоидная клетка (2n=4x= 48) (слева); г — 2n=2x+4=28; д — 2n=4x=48; е — 2n=5x=62; ж — 2n=2x=24; з — 2n=4x-10=38; и — 2n=4x-10=38; к — 2n=2x+4=28; л — 2n=2x+8=32; м — 2n=2x+6=30; н — 2n=2x+5=29; о — соматические клетки на стадии профазы: гипоанеуплоидная клетка (2n=2x-9= 15) (слева); тетраплоидная клетка (2n=4x= 48) (справа) | ||
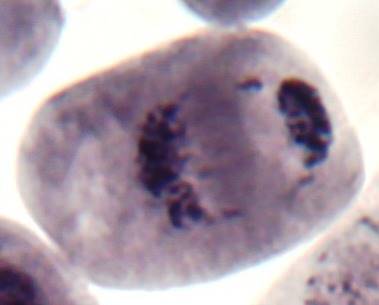 |
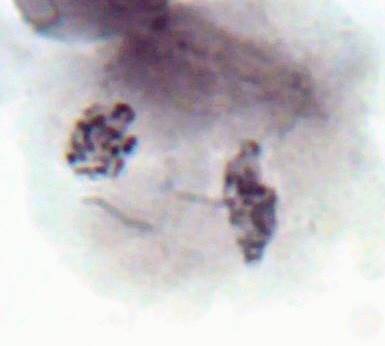 |
|
| а | б | |
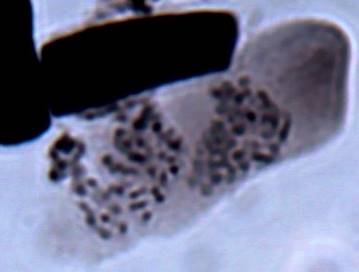 |
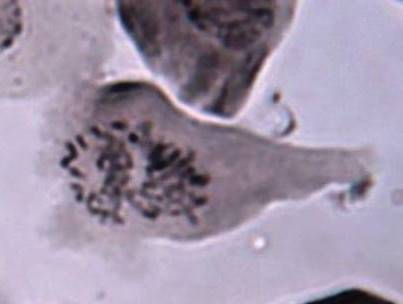 |
|
| в | г | |
| Рисунок 14. — Особенности митоза S. rybinii после хронического воздействия колхицина в среде размножения in vitro: а, б — отставание хромосом в анафазном движении; в — образование тетраплоидных ядер; г — образование диплоидных ядер | ||
Как было показано ранее [193] возможным вариантом получения «чистых» тетраплоидных аналогов является дальнейшее культивирование миксоплоидов в культуре in vitro для стабилизации 4n уровня плоидности в ходе которого во многих случаях происходит замещение анеуплоидной ткани доминирующей тетраплоидной.
Таким образом, хроническое воздействие колхицина в составе искусственной питательной среды в концентрации 0,01% колхицина позволяет получить до 16,3% полиплоидных генотипов. Увеличение концентрации приводит к снижению образования полиплоидных аналогов. Большинство полученных форм с изменённым уровнем плоидности являются миксоплоидами.
3.3. Цитологическое исследование последействия колхицина при полиплоидизации S. rybinii
Гаплоидные формы культурного картофеля получены в сороковых годах прошлого столетия. В 1938 г в США Ламм сообщил о получении гаплоида S. tuberosum (2n=24) андрогенного происхождения. Он выделил его из близнецовых растений гибрида S. chaucha (2n=24) с тетраплоидом S. tuberosum.
На первом этапе основное внимание исследователей было направлено на разработку приёмов, стимулирующих возникновение гаплоидных (дигаплоидных) форм и способов их выявления [205]. Основным способом являлось применения традиционного опыления цветков S. tuberosum пыльцой диплоидных видов Solanum. В результате часть яйцеклеток не оплодотворяется гаметами отцовского родителя, что приводит к их партенокарпическому развитию, в результате образуется семя с гаплоидным набором хромосом.
В генетике картофеля гаплоиды, полученные из тетраплоидов (2n = 4x = 48), обозначают как дигаплоиды (2n = 2x = 24), а гаплоиды от диплоидов (2n = 2x = 24) называют моноплоидами, моногаплоидами (2n = x = 12). То есть термин «дигаплоид» не соответствует значению «удвоенный гаплоид», который используется в генетике диплоидных видов растений.
Основной метод получения дигаплоидов картофеля — опыление тетраплоидных сортов или селекционных клонов пыльцой гаплопродюсеров Solanum phureja Juz. & Bukasov. Цитологический механизм, с помощью которого возникают дигаплоидные зародыши, — псевдогамия и партеногенез [204].
Значение гаплоидов, по мнению А.А. Жученко [206], прежде всего, состоит в том, что они близки к гомозиготному состоянию. Использование гаплоидов в селекционной работе позволит значительно сократить время и облегчить отбор. Обычно гомозиготность достигается путём самоопыления растений в течении нескольких поколений, что реализовать возможно только лишь в течении длительного периода, исчисляемого годами, а в случае других культур, десятилетиями. К тому же, самоопыление в роде Solanum иногда невозможно в связи с частой стерильностью генотипов.
По мнению К.З. Будина [205], применение гаплоидов в селекции картофеля особенно важно по тому, что уже в начале селекционной работы, картофель как биологический объект был сложным гетерозиготным генотипом и несколько столетий усовершенствования и отбора привели к ещё более усложнённой гетерозиготности. В результате гетерозиготность достигла такой большой сложности, что получение новых перспективных генотипов резко уменьшилось, а проблем с негативными абиотическими и биотическими факторами среды стало больше в связи с увеличением ареала возделывания этой культуры.
Как и для других культур, для картофеля актуальными являются ряд ценных хозяйственно-биологических признаков (комплексная устойчивость к болезням, раннее созревание, возможность механической уборки, соответствующий биохимический состав клубней и др.), которые востребованы рынком. В связи с высокой гетерозиготностью невозможно эффективно подобрать родительские генотипы для скрещивания и получить популяцию гибридов с желаемыми признаками исходных форм. Часто плохие сорта в качестве родителей дают ценное потомство и наоборот.
Диплоиды картофеля благодаря их дисомической природе обладают достаточно стабильным редукционным делением. Это позволяет использовать ценные фертильные генотипы для скрещивания как между собой, так и с дигаплоидными видами. Таким образом, беккроссы, самоопыление и отбор могут производиться на диплоидном уровне.
На данный момент получен широкий спектр гаплоидов не только S. tuberosum, но и других видов. В результате всесторонних исследований установлено широкое межклональное варьирование признаков дигаплоидов, обусловленное высокой гетерозиготностью сортов. Например, качественные признаки окраски клубней и цветков различаются у генотипов с разной плоидностью. Преобладающее большинство исходных тетраплоидных сортов имеет белые клубни и цветки. Такими же являются и соответствующие дигаплоиды. У генотипов с белыми клубнями и цветками отсутствуют один или несколько генов, определяющих окраску. Следовательно, этих генов лишены и гаметы и дигаплоиды.
Дигаплоиды, полученные от сортов с окрашенными цветками и пигментированными стеблями обычно гетерозиготны по признаку окраски и могут быть обоих типов.
Поскольку картофель является культурой, основной способ размножения которого вегетативный, то любой генотип, имеющий ценные хозяйственно-биологические признаки, можно долгое время сохранять, размножать и использовать в производственных целях. Однако селекционная работа в роде Solanum довольна сложная, т.к. основной сельскохозяйственно значимый вид S. tuberosum является автотетраплоидом (2n=4x=48). Соответственно новые генотипы при межсортовой гибридизации получают путём скрещивания тетраплоидных гетерозигот, что практически невозможно воспроизвести половым путём. Поэтому для повышения эффективности получения ценных генотипов предлагается использовать схему селекции, которая предполагает снижение уровня плоидности селекционного материала до диплоидного [207] с последующим отбором диплоидных генотипов по конкретным признакам и дальнейшем возвратом их на тетраплоидный уровень.
Для реализации подобной схемы селекционного процесса эффективно использовать диплоидные виды, обладающие ценными признаками, такими как повышенная устойчивость к негативным абиотическим и биотическим факторам среды.
Одним из таких видов является S. rybinii (2n=2x=24), который не является самостоятельным видом, а относится к S. phureja [208].
Дикий картофель Solanum rybinii purple (2n=2x=24) вид картофеля родом из Колумбии. Данный вид устойчив ко многим болезням и неблагоприятным условиям выращивания. Обладает высокой урожайностью. В гнезде образуется немало округлых крупных клубней с синей кожурой и интенсивной синей мякотью внутри.
Согласно данным К.З. Будина [209] использование S. phureja в качестве донора гамет для S. tuberosum является наиболее эффективным. Однако исследования С.А. Клулов с коллегами [210] показали, что полученные с помощью S. phureja дигаплоиды довольно часто элиминируют, несмотря на то, что зародыши в основном жизнеспособны.
Наблюдаемая гибель зародышей в семенах вовсе не говорит о том, что они не жизнеспособны. Существует много причин, не позволяющих нормально развиваться гибридным зародышам. В частности, материнское растение может блокировать их развитие, вследствие нарушения обмена веществ, вызванного несоответствием развития двух разных наследственных комплексов. Гибель зародыша в этом случае связана с нарушением функций проводящих тканей. Поэтому удаление зародыша из семяпочки и выращивание его на искусственной питательной среде является одним из наиболее эффективных методов в отдалённой гибридизации.
Использование биотехнологических методов в селекции облегчает и ускоряет традиционный процесс создания новых форм и сортов растений.
Поэтому очевидным является применение эмбриокультуры для повышения эффективности получения ценных генотипов картофеля.
Промытые и простерилизованные семена были посеяны на среду Мурасиге-Скуга. Первые всходы появились на 10 день.

Рисунок 15. – Нормально развитый сеянец Solanum rybinii purple
Всхожесть семян была очень низкой, всего 21,1 % от посеянных семян. Из них 75 % (6 штук) были с нормальным развитием. У остальных сеянцев: наблюдали развитие корня без развития семядольных листьев. Сохранить эти растения не удалось.
Таблица 6. — Результаты эмбриокультуры Solanum rybinii purple (2019 г.)
| Введено в культуру, шт. | Процент
регенерации |
Развитие зародышей | |||
| нормальное | с
отклонениями |
||||
| шт. | % | шт. | % | ||
| 36 | 21,1 | 6 | 75 | 2 | 25 |
После клонального микроразмножения растений Solanum rybinii, полученных из ботанических семян провели цитологический анализ эпидермальной ткани, исследуемых генотипов.
Так как ботанические семена получают путём самоопыления, то уровень плоидности у развивающихся растений из зародыша будет таким же, но гены будут иметь разное сочетание аллелей по доминантности.
В результате установлено, что генотипы различаются по признаку количества хлоропластов в ЗКУ (таблица 7). Данный показатель варьирует от 6,5±0,3шт. у формы 10-1 до 8,4±0,4шт. у формы 10-3. При этом необходимо отметить, что дисперсия признака имеет не высокие значения, т. к. это связано с большой выборкой значений и низким разбросом максимальных и минимальных значений.
Таблица 7. — Статистические характеристики количества хлоропластов в замыкающих клетках устьиц гибридов S. rybinii
| Значение | Генотип | |||||
| 10-1 | 10-2 | 10-3 | 10-4 | 10-5 | 10-6 | |
| х | 6,5±0,3 | 7,7±0,2 | 8,4±0,2 | 7,7±0,4 | 7,6±0,2 | 7,4±0,4 |
| σ2 | 2,3 | 1,8 | 4,5 | 3,4 | 1,7 | 3,1 |
| Lim (min-max) | 4-11 | 5-10 | 4-14 | 4-15 | 4-10 | 6-12 |
Частота распределения хлоропластов в ЗКУ полученных генотипов достоверно различается. На рисунке 16 представлены кривые распределения популяции хлоропластов, отражающие характер изменчивости. Если некоторые генотипы (10-2, 10-3 и 10-1) имеют значения данного признака четко в пределах диплоидной эпидермальной ткани, то формы 10-5, 10-4 и 10-6 формируют устьица, имеющие определённое количество устьиц с 12 шт. и более хлоропластами в одной замыкающей клетке (рисунок 17).
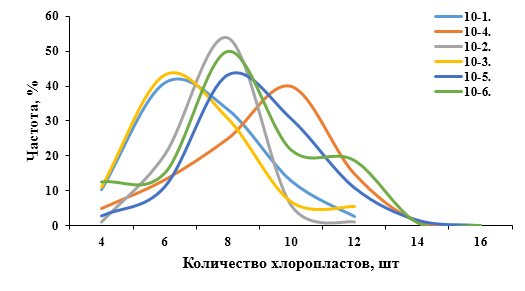 |
| Рисунок 16. — Частота распределения хлоропластов в замыкающих клетках устьиц в популяции Solanum rybinii purple |
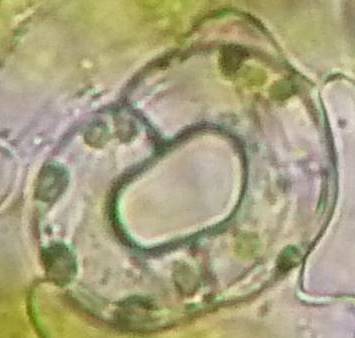 |
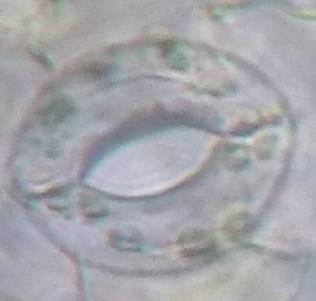 |
| а | б |
 |
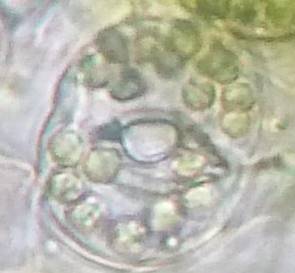 |
| в | г |
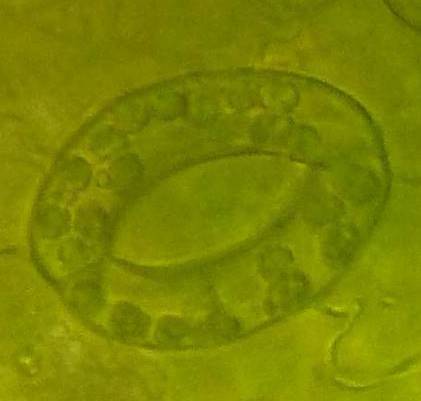 |
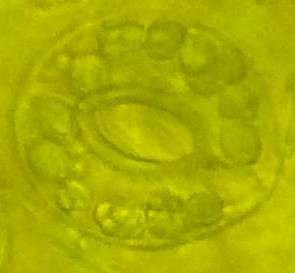 |
| д | е |
| Рисунок 17. — Количество хлоропластов в ЗКУ картофеля S. rybinii: а — 6 шт. (10-1); б, в – 7 шт. (10-2); г – 8 шт. и 10 шт. (10-5); д – 13 шт. и 10 шт. (10-6); е – 6 шт. и 9 шт. (10-3) | |
Подобная картина указывает на возможное наличие химерной ткани, что подтверждается и микрофотографиями (рисунок 18). Кроме этого, у генотипов, имеющих максимальный разброс линейных размеров устьиц они формируются разных размеров на определённой единице площади, что в свою очередь создаёт условия для образования устьиц аномальной формы. Неравномерная структура клеток образует неправильную гофрированную структуру листа.
Аномальное формирование эпидермиса выражается так же и в образовании устьичного аппарата из протодермальных материнских клеток устьиц (МКУ). На самом раннем этапе их формирования при делении МКУ происходит дегенерация одной замыкающей клетки, которая в последующем не развивается вовсе (рисунок 18) или остаётся в недоразвитом состоянии. В некоторых случаях таких устьиц формируется большое количество на единицу площади, но данное явление обычно носит секторальный характер.
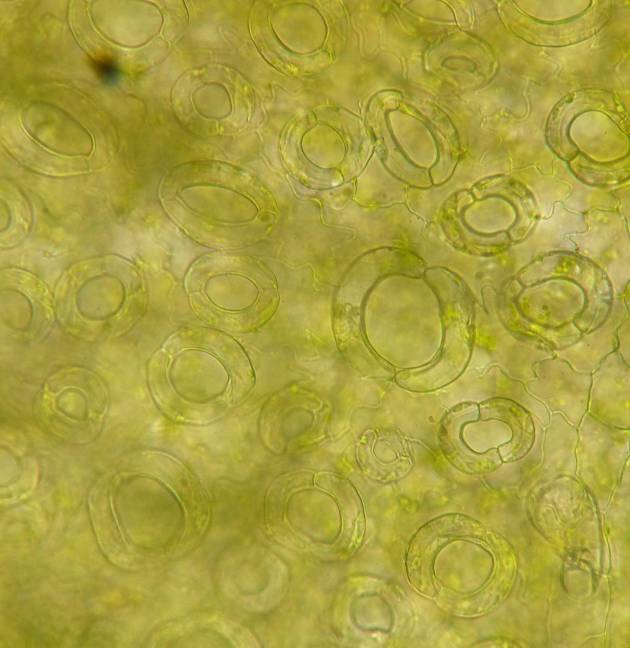 |
| а |
 |
| б |
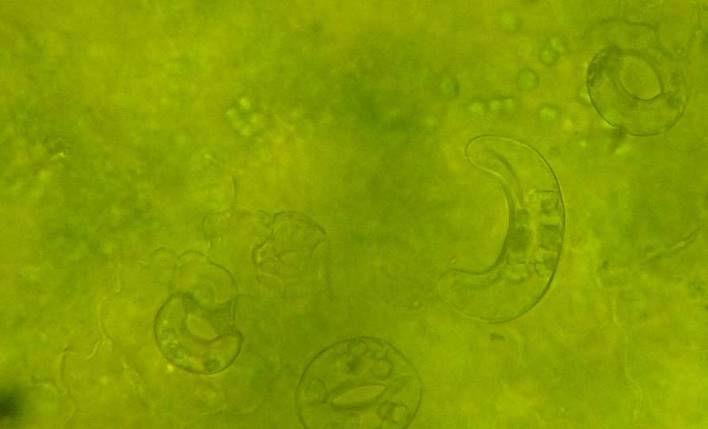 |
| в |
| Рисунок 18. — Эпидермис микрорастений: а — устьица разной величины при плотной организации на единицу площади формы (10-5); б — устьица разной величины и аномальной формы (10-6); в — формирование устьиц с одной ЗКУ или дегенерация одной из двух ЗКУ в процессе развития устьица (10-4) |
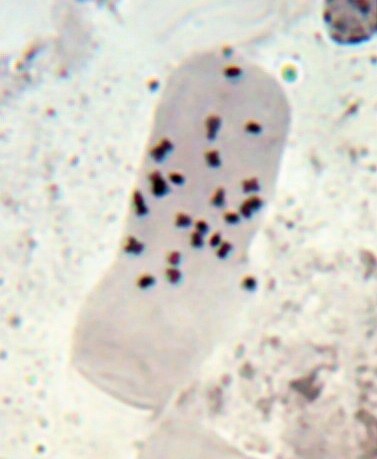 |
| Рисунок 19. — Кариотип картофеля S. rybinii. |
Таким образом, цитоморфологическое изучение хромосом позволяет систематизировать их по особенностям строения и объединить в классы подобия, тем самым проводя комплексное сравнение гибридных генотипов.
Под влиянием колхицина, на фоне высокой выживаемости растений, зафиксированы различные деструктивные проявления влияния данных веществ. А именно, некрозы, проявляющиеся в незначительной степени (рис. 3.5 а). При этом у растений во всех вариантах опыта наблюдали корни без каких-либо внешних признаков деструкции (рис. 3.5, б). Следует отметить, что во всех вариантах с использованием колхицина, отмечено появление булавовидных вздутий на кончиках корня (рис. 3.5, в, г).
В результате воздействия колхицина в концентрации 0,5% на растительные ткани ежевики S. rybinii в условиях in vitro обнаружен ряд аномалий в ходе митоза, характерных для этого химического соединения.
Действие колхицина в концентрации 0,5% наблюдали со стадии исчезновения ядерной оболочки, повышение концентрации до 1,0% влияло на состояние ядра и ориентацию хромосом до того, как исчезнет оболочка. В последнем случае наблюдали дифференциально окрашенные структуры, представляющие собой, видимо, разрушаемое веретено тубулиновых микротрубочек. Данные структуры не имели чёткой полярности (рисунок 21). При меньшей концентрации колхицина в среде (0,5%) обнаружены клетки с не полностью разрушенным или дезориентированным веретеном.
В некоторых случаях, при низких концентрациях колхицина, при большем количестве дезорганизованных хромосом, находящихся на экваториальной пластинке, единичные хромосомы начинают движение к противоположным полюсам. При этом заметны элементы веретена, обеспечивающие движение этих хромосом. Таким образом, микротрубочки митотического веретена смогли полимеризоваться навстречу друг другу от двух центров, организующих микротрубочки, расположенных на полюсах веретена, несмотря на действие амитотика. Помимо этого, произошло прикрепление микротрубочек плюс-концами к кинетохорам хромосом, что и позволило начать их расхождение к полюсам.
В случаях, более высокой концентрации или экспозиции, происходит полная блокировка веретена деления в клетках на стадии профазы и метафазы, это значительно повышает вероятность получения нежизнеспособных или миксоплоидных генотипов, поскольку последействие, например, колхицина, может проявляться до 2 и более суток [203].
 |
 |
|
| а | ||
 |
||
| б | ||
 |
||
| в | г | |
| Рисунок 20. — Деструктивное влияние колхицина на корешки микрочеренков S. rybinii: а – слабый некроз кончика корня (колхицин 0,1%); б – отсутствие видимых признаков деструкции (колхицин 0,5%); в, г – булавовидные вздутия (колхицин 0,5%) | ||
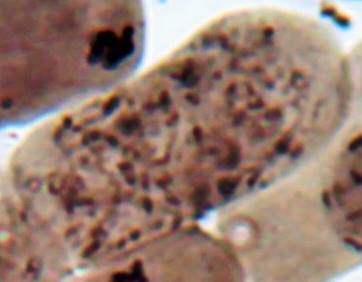 |
| Рисунок 21. — Разброс неконденсированных хромосом в профазе в результате деполимеризации микротрубочек |
Во всех вариантах воздействия колхицина на соматические ткани S. rybinii зафиксировано классическое явление колхициновых митозов или к-митозов. Наибольшее их количество обнаружено при использовании концентрации колхицина 0,5%. Во время рассеивания хромосом по клетке, их хроматиды обвиваются, образуя спирали, которые медленно начинают раскручиваться (рисунок 22), а целые хромосомы принимают форму крестовидных фигур, характерных для к-митозов.
С течением времени, хроматиды остаются соприкасающимися друг с другом только в одном месте — центромере (рисунок 22, б). Образование таких фигур, которые называют «к-пары», в виде крестов, свойственно только митотическим клеткам, подвергшимся действию амитотиков.
В таком состоянии хромосомы могут оставаться часами [190], что свидетельствует о замедленном делении центромеры. Когда происходит её деление, то дочерние хромосомы выпрямляются и располагаются параллельно друг другу (рисунок 22). А. Леван [212] дал определение такой позиции хромосом, как «положение лыж».
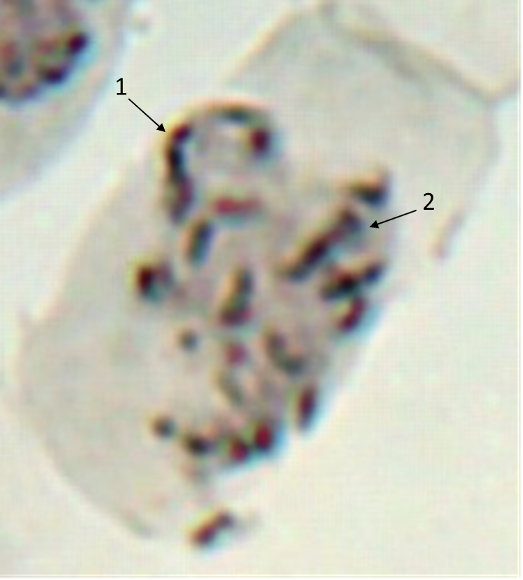 |
 |
|
| а | ||
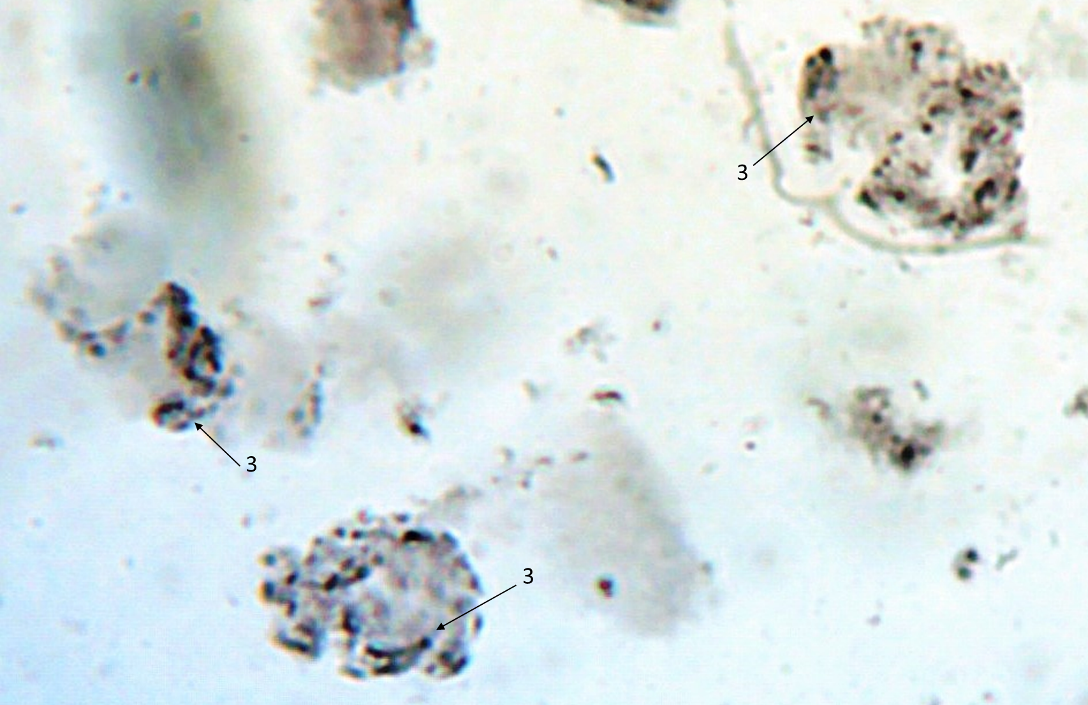 |
||
| б | ||
| Рисунок 22. — Развитие к-пар хромосом у S. rybinii: а – закручивание расщепившихся хромосом в результате действия амитотика; б – крестовидные к-пары (хромосомы соединяются только центромерой, плечи раздвинулись или разошлись); 1, 2, 3 – схемы переплетения хромосом | ||
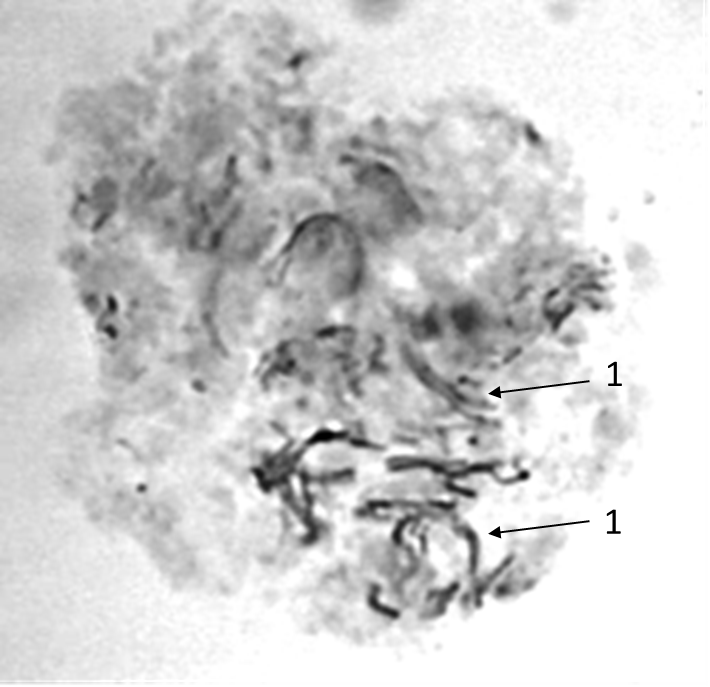 |
1 |
| а | |
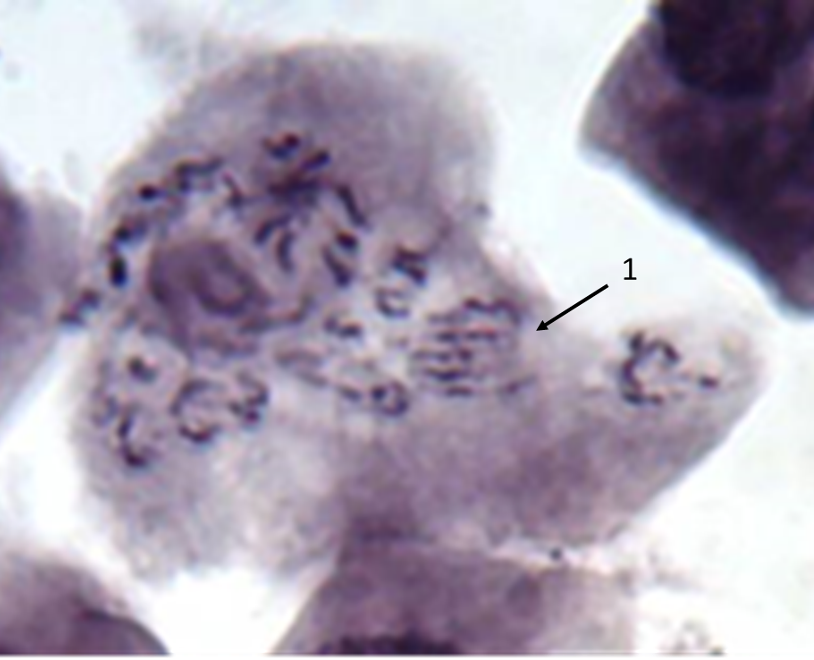 |
|
| б | |
| Рисунок 23. — Расположение хромосом параллельно друг другу после деления центромеры: а – ранняя профаза; б – поздняя профаза (1 — схема расположения хромосом) | |
На следующей стадии метафазы в результате деполимеризации тубулиновых микротрубочек происходит аномальное формирование веретена деления. Если действие амитотика началось в момент сбора хромосом в районе экваториальной пластинки, то тубулиновые тяжи, которые должны прикрепляться к кинетохорам деполимеризованы и хромосомы остаются в зоне экватора. Вероятно, что в результате полного отсутствия цитокинеза группы хромосом смещаются от экватора в дистальную часть клетки (рисунок 24, в), но при этом остаются в одной группе. Возможно, это связано с наличием остатков β-тубулина, который обеспечивает связи между хромосомами. В результате ослабевания этих связей происходит отделение некоторых хромосом или целых групп от основной массы. Судя по расположению этих хромосом в клетке перемещение происходит хаотично, что говорит о полном отсутствии связей цитоскелета и хромосом, в том числе отсутствуют связи центромеры хромосом и центриоли, посредством кинетохорных микротрубочек.
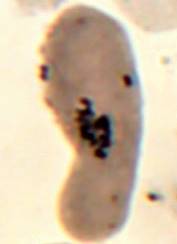 |
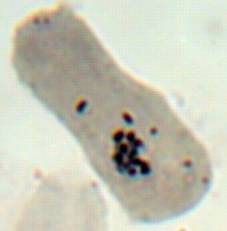 |
|||||||
| а | б | |||||||
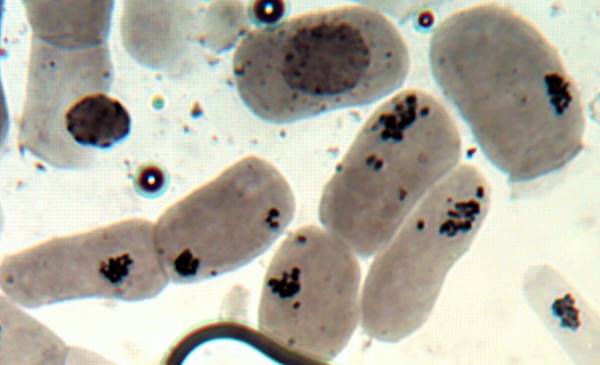 |
||||||||
| в | ||||||||
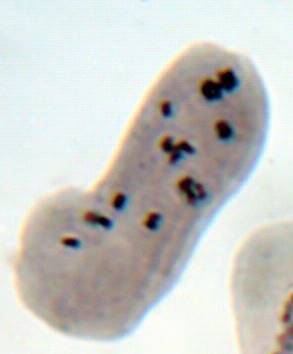 |
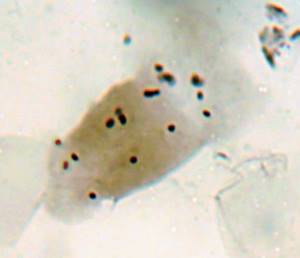 |
|||||||
| г | д | |||||||
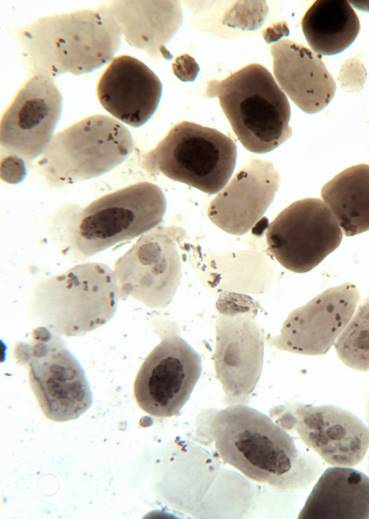 |
||||||||
| е | ||||||||
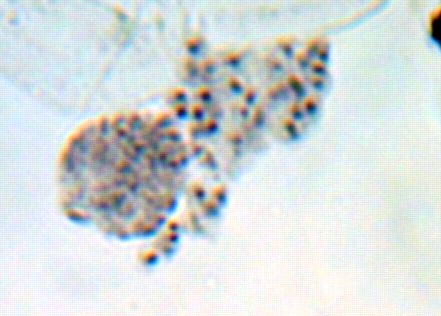 |
 |
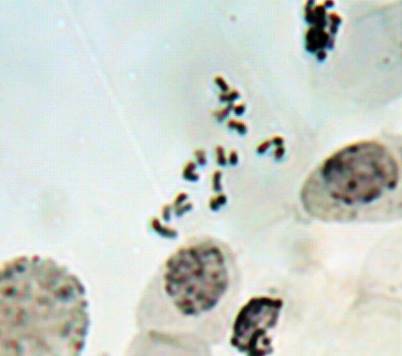 |
||||||
| ж | з | и | ||||||
 |
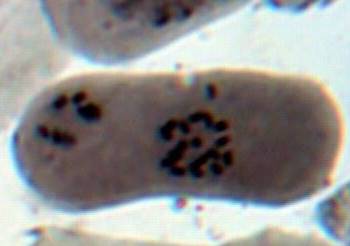 |
|||||||
| к | л | |||||||
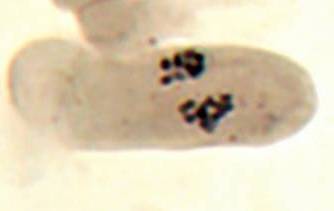 |
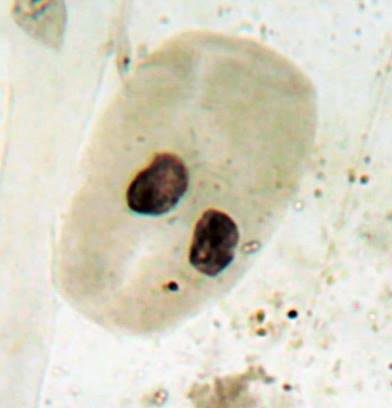 |
|||||||
| м | н | |||||||
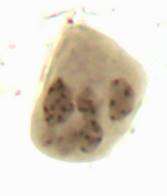 |
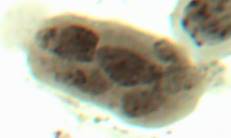 |
|||||||
| о | п | |||||||
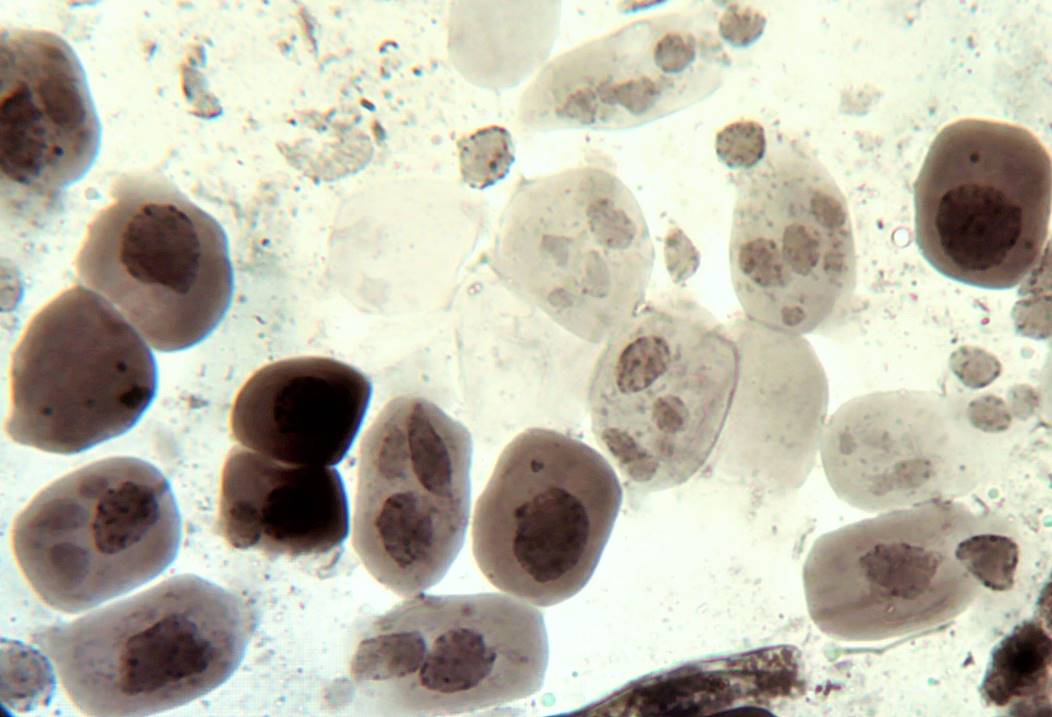 |
||||||||
| р | ||||||||
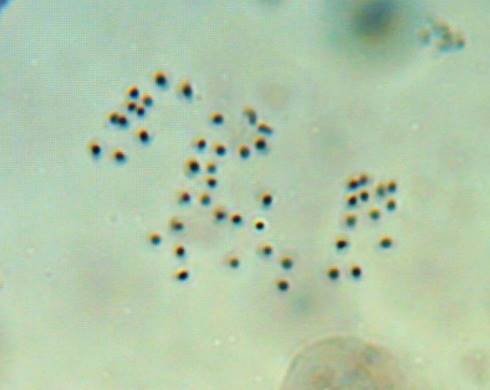 |
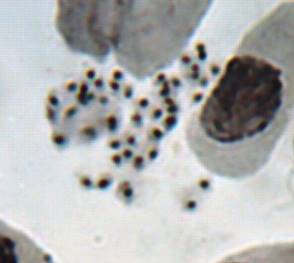 |
|||||||
| с | т | |||||||
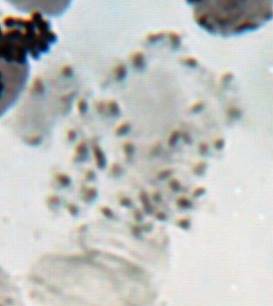 |
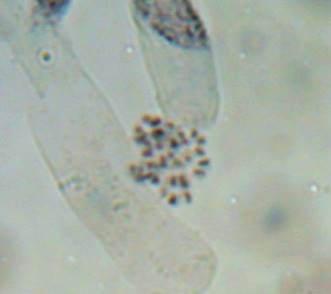 |
|||||||
| у | ф | |||||||
| Рисунок 24. — Влияние колхицина на митоз S. rybinii: а – выбросы 3 хромосом; б – выбросы 5 хромосом; в – клетки на стадии метафазы с множественными выбросами хромосом и смещением группы хромосом в дистальную часть клетки; ж – формирование «теней» в профазе под действием колхицина; з – анеуплоидная клетка (2n=2x-6=18); и — анеуплоидная клетка (2n=2x-4=20); к – разделение конденсированных хромосом на две группы в клетке; л – объединение группы хромосом; м – начало формирования микронуклеусов; н – два ядра в одной клетке без формирования клеточной стенки; о, п – образование многоядерных клеток; р – массовое образование многоядерных клеток; с, т – тетраплоидная клетка (2n=4x=48); у – гипоанеутетраплоидная клетка (2n=4x-4=44); ф — гипоанеутетраплоидная клетка (2n=4x-10=38) | ||||||||
Анализ популяции клеток на стадии метафазы показал, что в основном происходит выброс 1-3 хромосом, реже 4 и более (рисунок 25). Общее количество выбросов отдельных хромосом от всей популяции метафазных клеток составляет 19,8%, всех видимых аномалий 28,7%. Таким образом, выбросы отдельных хромосом преобладают над остальными типами нарушений.
На рисунке 24 г, д показаны метафазы, в которых происходит полная дезорганизация веретена деления. Хромосомы в этом случае хаотично разбросаны по клетке, некоторые сцеплены между собой, но также не имеют признаков направленного цитокинеза. Иногда, такое явление носит массовый характер (рисунок 24 е). Вероятно, это связано с расположением конкретной группы клеток в корне относительно внешней среды, в которой находится деструктор.
Естественно, такой характер аномалий, который в своей основе имеет потерю или удаление из общей массы метафазных хромосом не может не сказываться на состоянии плоидности клеток. Как показано выше, процесс лизиса целых хромосом или их частей у растений рода Solanum эффективно используется (рисунок 24 ж). Данный механизм предположительно выработался в ходе эволюции у растений с широким полиплоидным рядом для регуляции нежизнеспособных или нефункциональных тканей. Подобную картину активного лизиса хромосом мы также наблюдали у природных и индуцированных полиплоидов растений рода Clematis [213]. Известно, что отставание хромосом и дальнейший их лизис ферментами в цитоплазме приводит к анеуплоидии. Поскольку отставание и выбросы хромосом у растений рода Solanum под воздействием митостатика происходят уже на стадии профазы, то очевидно, что анеуплоидные клетки будут формироваться до первого деления ядра, точнее в период деполимеризации веретена деления в профазе, об этом свидетельствует характер разброса хромосом. После относительно продолжительного действия колхицина (24 часа) уже фиксируются гипоанеудиплоидные клетки (рисунок 24).
Также статистически часто встречающейся аномалией является формирование двух отдельно расположенных групп хромосом. Эти группы могут состоять из примерно равного количества хромосом. В дальнейшем вокруг микрогрупп формируется ядерная оболочка, и, в конечном счете, образуется два ядра, находящихся в одной клетке, которая не имеет признаков образования клеточной стенки, как между дочерними ядрами в нормальном митозе.
На рисунке 24 к-н показан поэтапный процесс образования двухядерной клетки. Среди телофаз с этой аномалией статистически больше образуется клеток с двумя ядрами (8,7%). С увеличением количества ядер частота данной аномалии уменьшается (рисунок 26).
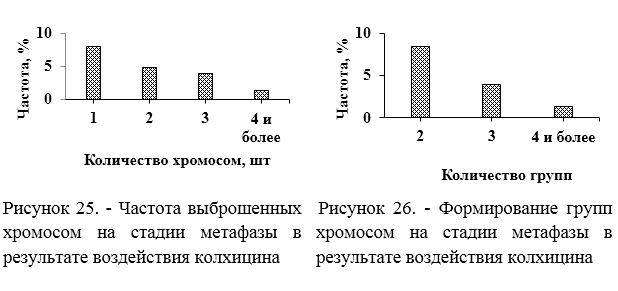 |
Поскольку в процессе деполимеризации цитоскелета происходит разделение ядра на группы и отдельные хромосомы, то вполне закономерным является образование микронуклеусов. Вероятно, система защиты организма от случайных «потерь» хромосом путём их лизиса в масштабе всей клетки сработать не может. В результате образуются многоядерные клетки (рисунок 24 о, п).
Однако необходимо отметить, что данное явление может носить и массовый секторальный характер в популяции клеток. (рисунок 24 р). Данное явление, по нашему мнению, также связано с дистальным расположением клеток, которые в большей степени подвергаются действию амитотика. Естественно в перспективе подобные клетки не смогут быть конкурентными перед более генетически сбалансированными. В последующих делениях, при условии снятия деструктивного влияния амитотика, многоядерные клетки будут лишаться микронуклеусов путём их лизиса. В целом полихимерная ткань будет замещаться сбалансированной диплоидной или полиплоидной тканью.
Как показали наши исследования для прохождения одного цикла к-митоза, т. е. формирования тетраплоидной клетки S. rybinii достаточно экспозиции 24 часа при минимальной концентрации колхицина 0,1% (рисунок 24 с, т). Частота тетраплоидных клеток при данных параметрах воздействия не высокая, но с увеличением концентрации до (0,5-1,0%) при той же экспозиции увеличивается. Таким образом, можно говорить о потенциально возможном формировании тетраплоидных тканей при воздействии колхицина на меристематические участки S. rybinii.
Образование тетраплоидных клеток так же свидетельствует о вероятном формировании клеток с гипоанеутетраплоидным набором ядра (рисунок 24), поскольку прошёл один цикл к-митоза и вероятность потери нескольких хромосом тетраплоидов при тех же механизмах лизиса равна диплоидов. Необходимо отметить, что частота таких клеток, как и в диплоидной популяции меньше образовавшейся популяции тетраплоидных клеток.
Таким образом, при воздействии колхицина на меристематическую диплоидную ткань S. rybinii экспозицией 24 часа и концентрацией колхицина 0,1%, проходит один цикл к-митоза и формируются тетраплоидные клетки. Воздействия амитотика приводит к многочисленным нарушениям: выбросам хромосом, формированию анеу, ди- и тетраплоидных ядер, многоядерных клеток.
Особенностью реакции S. rybinii на воздействие колхицина является формирование многоядерных клеток, которые образуются в результате деполимеризации веретена деления и разделения диплоидного ядра на группы.
3.4. Получение полиплоидных форм методом инъекций в микроклубни картофеля
Для выявления эффективности распространения колхицина по миниклубню после инъекции, провели предварительное исследование с использованием водных раствором витальных красителей (пригодных для прижизненной окраски, не имеющих значимого деструктивного влияния на растительные ткани): нейтральный красный водный 1%; метиленовый синий 0,1%; в – краситель Эванса 1,0%; г – Lightgrun gelblich 0,1%.
С помощью красителей установлено, что в результате инъекции в миниклубни, вводимое вещество распространяется на его треть в течение суток, а через семь суток занимает весь объём миниклубня.
Таким образом, введенный раствор колхицина в миниклубень начнёт воздействовать на ближние участки меристемной ткани практически сразу после инъекции. Для синхронизации действия колхицина на все глазки микроклубней, после введения амитотика, помещали их в холодильник при температуре +4оС на 7 суток.
 |
 |
| а | б |
 |
 |
| в | г |
| Рисунок 27. — Окрашивание микроклубней картофеля сорта Метеор после инъекций красителя: а – нейтральный красный водный 1%; б – метиленовый синий 0,1%; в – краситель Эванса 1,0%; г – Lightgrun gelblich 0,1% | |
 |
 |
| а | б |
 |
 |
| в | г |
| Рисунок 28. — Окрашивание микроклубней картофеля сорта Жуковский ранний после инъекций красителя: а – нейтральный красный водный 1%; б – метиленовый синий 0,1%; в – краситель Эванса 1,0%; г – Lightgrun gelblich 0,1%. | |
Развитие растений началось на 2-3 день после переноса колб из холодильника в культуральную комнату. В контроле (инъекции стерильной водой) проросло 90% микроклубней сорта Метеор и 88,5 – Жуковский ранний (таблица 8). Была отмечена обратная корреляция: при повышении концентрации колхицина понижалось количество проросших микроклкубней. При инъекции 0,001% раствором колхицина всхожесть составила у сорта Метеор 53,3%, Жуковский ранний — 51,2, 1% — 17,4 и 16,8, соответственно.
Таблица 8. — Жизнеспособность растений картофеля после инъекций в микроклубни различных концентраций колхицина, %
| Сорт | Концентрация колхицина,% | ||||
| 0 | 0,001 | 0,01 | 0,1 | 1 | |
| Метеор | 90,0 | 53,3 | 51,6 | 43,3 | 17,4 |
| Жуковский ранний | 88,5 | 51,2 | 50,4 | 44,1 | 16,8 |
Наименьшее количество побегов образовалось после инъекций 1% раствором колхицина -1,25±0,16 штук на эксплант, наибольшее – 0,1% — 4,00±0,67 (таблица 9). Прямой зависимости количества и длины побегов от проведенных инъекций не отмечено.
Таблица 9. – Рост и развитие побегов картофеля после инъекций в микроклубни различных концентраций колхицина (сорт Метеор)
| Концентрация колхицина,% | Количество побегов, шт./эксплант | Средняя длина побега, см |
| 0 | 2,56±0,27 | 2,54±0,19 |
| 0,001 | 3,31±0,44 | 3,32±0,37 |
| 0,01 | 2,60±0,32 | 2,65±0,28 |
| 0,1 | 4,00±0,67 | 3,21±0,37 |
| 1 | 1,25±0,16 | 2,73±0,66 |
Отмечено отрицательное действие колхицина на ризогенез растений картофеля сорта Метеор. При повышении концентрации отметили снижение укоренения и уменьшение количества корней (таблица 10). Средняя длина корней значительно меньше была только в варианте использования 1% раствора колхицина.
Таблица 10. — Влияние колхицина на ризогенез сорта картофеля Метеор
| Концентрации колхицина,% | Укоренение, % | Количество корней, шт./эксплант | Средняя длина корней, см |
| 0 | 83,33 | 5,30±0,76 | 3,76±0,15 |
| 0,001 | 53,33 | 5,13±1,06 | 3,77±0,20 |
| 0,01 | 41,94 | 4,38±0,63 | 4,41±0,24 |
| 0,1 | 33,33 | 4,67±0,67 | 4,20±0,19 |
| 1 | 21,74 | 2,00±0,33 | 2,62±0,40 |
В контроле побеги коричневые, листья зеленые мелкие, воздушные корни тонкие, белые (рисунок 29 а).
При использовании 0,001% раствора колхицина для инъекций наблюдали коричневые побеги, листья зеленые, воздушные корни сильно опушенные зеленые и белые, корни зеленые, к концам белые, имеются корни второго порядка (рисунок 29 б).
0,01% раствор колхицина — побеги коричневые, листья зелено-желтые, воздушные корни зеленые, опушенные, корни салатового цвета, есть корни второго порядка и разорвавшиеся клубни (рисунок 29 в).
0,1% — побеги толстые, листья зеленые, среднего размера, корни тонкие, корней второго порядка мало. Имеются разорвавшиеся клубни (рисунок 29 г).
1% — побеги коричневые, листья зелено-желтые, сложные, корни салатового цвета, корней второго порядка нет. Имеются разорвавшиеся клубни (рисунок 29 д).
 |
| а |
 |
| б |
 |
| в |
 |
| г |
 |
| д |
| Рисунок 29. — Развитие микропобегов из микроклубней картофеля сорта Метеор через 10 суток после инъекции амитотика: а – контроль; б – колхицин 0,001%; в — колхицин 0,01%; г — колхицин 0,1%; д — колхицин 1,0% |
Установлено, что в результате инъекции в миниклубни, вводимое вещество распространяется на его треть в течение суток, а через семь суток занимает весь объём миниклубня. Таким образом, введенный раствор колхицина в миниклубень начнёт воздействовать на ближние участки меристемной ткани практически сразу после инъекции. Было отмечено отрицательное действие колхицина на прорастание побегов и ризогенез.
3.5. Влияние различных концентраций фитогормонов на эффективность регенерации и каллусообразования из высечек листьев картофеля
Технология оздоровления картофеля – составная часть системы первичного семеноводства этой культуры. Современные методы биотехнологии обладают неоспоримыми преимуществами и позволяют круглогодично проводить работы по производству элитного посадочного материала картофеля [152].
Разработка методов индукции морфогенеза из изолированных тканей растений лежит в основе всех биотехнологических приемов, направленных на расширение генетического разнообразия сельскохозяйственных культур. В настоящее время, методы индукции морфогенеза in vitro активно разрабатываются при проведении исследований по культуре тканей растений в различных направлениях, таких как тканевая селекция на основе индукции каллусогенеза и последующего формирования побегов–регенерантов из клеточных линий, устойчивых к биотическим и абиотическим стрессам, культура пыльников, культура протопластов, соматический эмбриогенез и т.д. Морфогенная растительная ткань в клеточной культуре является основным объектом при редактировании генома.
Каллусные культуры картофеля сохраняют основные биохимические и физиологические черты, присущие нормальным клеткам растительного организма [214]. При этом морфогенез в культуре тканей картофеля остается открытым вопросом, что обусловлено сортоспецифичностью форм, требующих индивидуальной оптимизации условий культивирования. Несмотря на то, что каждая растительная клетка теоретически обладает свойством тотипотентности, на практике приходится экспериментально подбирать условия регенерации для каждого генотипа. Многие ученые отмечают, что сорта картофеля сильно различаются по их способности развиваться в культуре in vitro в зависимости от состава питательной среды [215].
Важнейшими факторами, ответственным за морфогенетические процессы в культуре растительных тканей являются генотип растения и наличие в среде оптимального соотношения экзогенных фитогормонов. В своей работе мы использовали фитогормоны, регенерационная активность которых была показана на многих культурах. 6–Бензиламинопурин или бензиловый аденин (6 БАП) используется чаще других цитокининов как промотор пробуждения пазушных почек. Во многих случаях наличие 6 БАП необходимо для процессов клонального размножения, однако известно, что цитокинин препятствует нормальному корнеобразованию. Поэтому в работе часто практикуется промежуточное культивирование на средах со сниженной концентрацией 6 БАП, после чего побеги переводят на среды для укоренения [216].
Индолил–3–масляная кислота (ИМК) в культуре растительных клеток, как и другие ауксины используется, чтобы инициировать образование корней (ризогенез) [217].
Гетероауксин (β–индолилуксусная кислота) сокращенно ИУК помимо стимуляции растяжения клеток растений влияет и на многие другие процессы. Под его действием интенсифицируется деление клеток [218].
Начиная с 1962 года 2,4-Дихлорфеноксиуксусная кислота (2,4-Д) используется в лабораториях в качестве гормона в питательных средах для выращивания культуры растительных клеток и стимуляции каллусной индукции [219, 214].
В результате учета первого опыта установлено, что процент каллусообразования был невысоким у сортов Сатурна и Скороплодный (рисунок 1). У сорта Вектор этот показатель выше: 6 БАП – 1,0 мг/л, 2,4-Д – 0,1 мг/л – 65%, 6 БАП – 3,0 мг/л, 2,4-Д – 0,1 мг/л – 67%, 6 БАП – 4,0 мг/л, 2,4-Д – 0,1 мг/л – 61% (рисунок 30).
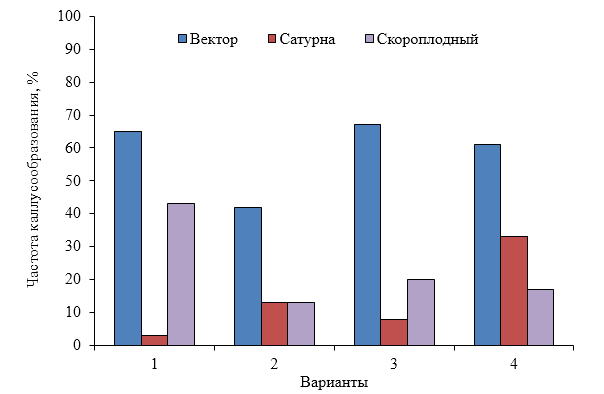 |
| Рисунок 30. – Частота каллусообразования из высечек листьев картофеля сортов Вектор, Сатурна, Скороплодный при разной концентрации цитокинина: 1 вариант (6 БАП – 1,0 мг/л, 2,4-Д – 0,1 мг/л); 2 вариант (6 БАП – 2,0 мг/л, 2,4-Д – 0,1 мг/л); 3 вариант (6 БАП – 3,0 мг/л, 2,4-Д – 0,1 мг/л); 4 вариант (6 БАП – 4,0 мг/л, 2,4-Д – 0,1 мг/л). |
По полученным данным наиболее интенсивно каллусообразование у сорта Сатурна проходило при концентрации фитогормонов 6 БАП – 4,0 мг/л, 2,4-Д – 0,1 мг/л (2,2 балла).
У сорта картофеля Вектор наибольшую интенсивность каллусообразования наблюдали при концентрации фитогормонов 6 БАП–3,0 мг/л, 2,4-Д – 0,1 мг/л (2,7 балла). У сорта картофеля Скороплодный наибольшую интенсивность каллусообразования получили при концентрации фитогормонов 6-БАП – 1,0 мг/л, 2,4-Д – 0,1 мг/л. В целом интенсивность каллусообразования во всех вариантах опыта была невысокой (таблица 11).
Таблица 11. – Эффективность каллусообразования из высечек листьев картофеля (в баллах) при разной концентрации цитокинина в питательной среде
| Сорт | Концентрации фитогормонов, мг/л | |||
| 6 БАП – 1,0
2,4-Д – 0,1 |
6 БАП – 2,0
2,4-Д – 0,1 |
6 БАП – 3,0
2,4-Д – 0,1 |
6 БАП – 4,0
2,4-Д – 0,1 |
|
| Вектор | 2,5 | 2,4 | 2,7 | 2,3 |
| Сатурна | 1,5 | 1,8 | 1,0 | 2,2 |
| Скороплодный | 2,0 | 1,6 | 1,7 | 1,5 |
Кроме того, на эксплантах зафиксированы различные типы регенерации. Так при концентрации фитогормонов 6 БАП – 2,0 мг/л и 2,4-Д – 0,1 мг/л на высечках листьев имела место регенерация корней у сорта картофеля Вектор.
У сорта картофеля Скороплодный наблюдали образование корней при концентрации фитогормонов 6 БАП – 1,0 мг/л и 2,4-Д – 0,1 мг/л, у сорта картофеля Сатурна – побегов при концентрации фитогормонов в среде 6 БАП – 4,0 мг/л и 2,4-Д – 0,1 мг/л.
Так как частота регенерации в первом опыте была незначительна, была поставлена следующая серия опытов. Для дальнейших экспериментов была выбрана концентрация 6 БАП – 4,0 мг/л, так как при этой концентрации наблюдали образование побегов. Цитокинин использовали в сочетании с различными типами ауксина, а именно, НУК, ИУК, ИМК, 2,4-Д в концентрации 0,4 мг/л.
В этом случае процент каллусообразования был высоким во всех вариантах опыта. Наилучшие результаты получены на среде, содержащей в своем составе 6 БАП – 4,0 мг/л, НУК – 0,4 мг/л. В этом варианте отмечено 100 % каллусообразование (рисунок 31).
В результате полученных данных установлено, что у сорта Сатурна наиболее интенсивно каллусообразование проходило при концентрации фитогормонов 6 БАП – 4,0 мг/л, ИМК – 0,4 мг/л – 3,7 балла, 6 БАП – 4,0 мг/л НУК – 0,4 мг/л – 4,2 (рисунок 32). При содержании в питательной среде 6 БАП – 4,0 мг/л, ИУК – 0,4 мг/л отмечено слабое каллусообразование (таблица 12).
У сорта картофеля Фрителла наибольшую интенсивность каллусообразования (4,8 балла) наблюдали при концентрации фитогормонов 6 БАП – 4,0 мг/л, НУК – 0,4 мг/л и 6 БАП – 4,0 мг/л, 2,4-Д – 0,4 мг/л (рисунок 4), наименьшую (1,5 балла) – при концентрациях 6 БАП – 4,0 мг/л, ИМК – 0,4 мг/л; 6 БАП – 4,0 мг/л, ИУК – 0,4 мг/л (таблица 12, рисунок 33).
Кроме того, на эксплантах зафиксированы различные типы регенерации. Так в варианте с фитогормонами 6 БАП – 4,0 мг/л, ИМК – 0,4 мг/л имела место единичная регенерация корней и образование почек у сорта картофеля Сатурна. При концентрациях фитогормонов 6 БАП – 4,0 мг/л, ИУК – 0,4 мг/л наблюдали образование почек.
При концентрациях фитогормонов 6 БАП – 4,0 мг/л, НУК – 0,4 мг/л отмечали достаточно интенсивное корнеобразование.
При концентрациях фитогормонов 6 БАП – 4,0 мг/л, 2,4-Д – 0,4 мг/л происходило образование побегов и микроклубней (рисунок 34).
У сорта картофеля Фрителла побеги на листовых эксплантах начали образовываться после того как экспланты были выставлены из термостата на стеллажи с люминесцентным освещением 2000 – 2200 люкс (рисунок 34).
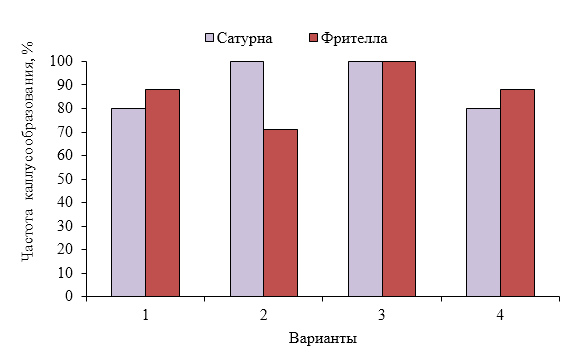 |
| Рисунок 31. – Частота калллусообразования из высечек листьев картофеля (сорта Сатурна и Фрителла) на средах с разными ауксинами: 1 вариант (6 БАП –4,0 мг/л, ИМК – 0,4 мг/л); 2 вариант (6 БАП –4,0 мг/л, ИУК – 0,4 мг/л); 3 вариант (6 БАП –4,0 мг/л, НУК – 0,4 мг/л); 4 вариант (6 БАП –4,0 мг/л, 2,4-Д – 0,4 мг/л) |
Таблица 12. –Эффективности каллусообразования из высечек листьев картофеля (в баллах) на средах с разными ауксинами.
| Сорт | Концентрации фитогормонов, мг/л | |||
| 6 БАП – 4,0
ИМК – 0,4 |
6 БАП – 4,0
ИУК – 0,4 |
6 БАП – 4,0
НУК – 0,4 |
6 БАП – 4,0
2,4-Д – 0,4 |
|
| Сатурна | 3,7 | 1,1 | 4,2 | 3,3 |
| Фрителла | 1,5 | 3,0 | 4,8 | 4,8 |
 |
 |
| а) 6 БАП – 4,0 мг/л, НУК – 0,4 мг/л | б) 6 БАП – 4,0 мг/л, 2,4-Д – 0,4 мг/л |
| Рисунок 32 (а, б). – Каллусообразование и морфогенез на высечках листьев картофеля (сорт Сатурна) при различных концентрациях фитогормонов в питательной среде. | |
 |
 |
| а) 6 БАП – 4,0 мг/л, НУК – 0,4 мг/л | б) 6 БАП – 4,0 мг/л, 2,4-Д – 0,4 мг/л |
| Рисунок 33 (а, б). – Каллусообразование и морфогенез на высечках листьев картофеля (сорт Фрителла) при различных концентрациях фитогормонов в питательной среде | |
 |
 |
| а | б |
| Рисунок 34. – Образование побегов и микроклубней на среде Мурасиге-Скуга с содержанием 6 БАП – 4,0 мг/л, 2,4-Д – 0,4 мг/л (а — сорт Сатурна, б — сорт Фрителла). | |
Предварительные исследования показали, что при сочетании фитогормонов 6 БАП – 4,0 мг/л и 2,4-Д – 0,4 мг/л происходило образование побегов и микроклубней. Поэтому для опыта использовали именно это сочетание регуляторов роста. В качестве источника углевода использовали глюкозу – 30 г/л. В опыт были включены следующие варианты:
- без колхицина (контроль);
- среда, содержащая 0,005 % колхицина;
- 0,01% колхицина;
- 0,015% колхицина;
- 0,02% колхицина.
Процент каллусообразования был высоким только в контроле. При повышении содержания колхицина в питательной среде наблюдали снижение этого показателя: у сорта Вектор от 56,9% в варианте — 0,005% колхицина до 0% — 0,02%, у сорта Фрителла только в варианте с содержанием колхицина 0,005% отмечено 31,3 процента каллусообразования. При дальнейшем увеличении колхицина в среде каллусообразование отсутствовало.
Таблица 13. — Частота каллусообразования в зависимости от различных концентраций колхицина, %
| Сорт | Колхицин, % | ||||
| 0 (контроль) | 0,005 | 0,01 | 0,015 | 0,02 | |
| Вектор | 94,8 | 56,9 | 43,3 | 16,1 | 0 |
| Фрителла | 100,0 | 31,3 | 0,0 | 0,0 | 0,0 |
У сорта картофеля Фрителла наибольшую интенсивность каллусообразования (3,6 балла) наблюдали в контроле, при концентрации колхицина 0,005% бал отмечен 1 балл (таблица 14).
У сорта Вектор даже в контроле интенсивнось каллусообразования была низкой и составила 1,9 балла и по мере повышения концентрации колхицина этот показатель уменьшился.
Таблица 14. — Зависимость различных концентраций колхицина на эффективность каллусообразования из высечек листьев картофеля, (баллы)
| Сорт | Колхицин, % | ||||
| 0 (контроль) | 0,005 | 0,01 | 0,015 | 0,02 | |
| Вектор | 1,9±0,2 | 1,1±0,0 | 1,0±0,0 | 1,0±0,0 | 0,0±0,0 |
| Фрителла | 3,6±0,2 | 1,0±0,0 | 0,0±0,0 | 0,0±0,0 | 0,0±0,0 |
Каллус, образовавшийся на листовых дисках, был коричневатого цвета. При выставленни на свет, позеленел. У сорта Вектор в контроле наблюдали регенерацию корней (средняя длина 1,1±0,2 см), побегов (1,5 шт./эксплант) со средней длиной 5,3±0,6 см. Размер листьев варьировался от 0,2×0,2 см до 0,6×0,6 см. Наличие клубней зелено- розового цвета в среднем размерами 1,1×0,7 см.
У сорта Фрителла в контроле образовался плотный каллус белого и коричневого цветов. Также отмечена регенерация корней и побегов. В среднем на один эксплант образовалось 2,8±0,5 корней длиной 0,4±0,1см и 1 побег/эксплант длиной 2,9±0,3 см.
В результате проведенных опытов установлено, что максимальная частота каллусообразования (100%) на высечках листьев картофеля получены на питательных средах с минеральным составом по прописи Мурасиге-Скуга, содержащих в своем составе 6 БАП –4,0 мг/л, ИУК – 0,4 мг/л и 6 БАП –4,0 мг/л, НУК – 0,4 мг/л.
Наиболее интенсивный рост каллуса отмечен на средах, содержащих 6 БАП – 4,0 мг/л, НУК – 0,4 мг/л и 6 БАП – 4,0 мг/л, 2,4-Д – 0,4 мг/л.
Регенерация побегов была отмечена на среде с содержанием фитогормонов 6 БАП – 4,0 мг/л и 2,4-Д – 0,4 мг/л. Добавление колхицина в питательную среду подавило процесс регенерации.
Необходимо продолжить данные исследования для подбора условий, обеспечивающих интенсивное каллусообразование и массовую регенерацию побегов из каллуса при добавлении колхицина.
Выводы
- Установлено, что некоторые тетраплоидные сорта, представляющие собой межвидовые гибриды, в соматических клетках могут содержать ядра разного уровня плоидности. Возможно, данные генотипы представляют собой переклинальные химеры.
- Хроническое воздействие колхицина в составе искусственной питательной среды в концентрации 0,01% колхицина позволяет получить до 16,3% полиплоидных генотипов. Увеличение концентрации приводит к снижению образования полиплоидных аналогов. Большинство полученных форм с изменённым уровнем плоидности являются миксоплоидами.
- При воздействии колхицина на меристематическую диплоидную ткань S. rybinii экспозицией 24 часа и концентрацией колхицина 0,1%, проходит один цикл к-митоза и формируются тетраплоидные клетки. Воздействия амитотика приводит к многочисленным нарушениям: выбросам хромосом, формированию анеу, ди- и тетраплоидных ядер, многоядерных клеток.
- Особенностью реакции S. rybinii на воздействие колхицина является формирование многоядерных клеток, которые образуются в результате деполимеризации веретена деления и разделения диплоидного ядра на группы.
- Зафиксированы различные деструктивные проявления влияния колхицина: некрозы и булавовидные вздутия на кончиках корня.
- Установлено, что в результате инъекции в миниклубни, вводимое вещество распространяется на его треть в течение суток, а через семь суток занимает весь объём миниклубня. Введенный раствор колхицина в миниклубень начнёт воздействовать на ближние участки меристемной ткани практически сразу после инъекции. Было отмечено отрицательное действие колхицина на прорастание побегов и ризогенез.
- Максимальная частота каллусообразования (100%) на высечках листьев картофеля получены на питательных средах с минеральным составом по прописи Мурасиге-Скуга, содержащих в своем составе 6 БАП –4,0 мг/л, ИУК – 0,4 мг/л и 6 БАП –4,0 мг/л, НУК – 0,4 мг/л.
- Наиболее интенсивный рост каллуса отмечен на средах, содержащих 6 БАП – 4,0 мг/л, НУК – 0,4 мг/л и 6 БАП – 4,0 мг/л, 2,4-Д – 0,4 мг/л.
- Регенерация побегов была отмечена на среде с содержанием фитогормонов 6 БАП – 4,0 мг/л и 2,4-Д – 0,4 мг/л. Добавление колхицина в питательную среду подавило процесс регенерации.
Список использованных источников
- Тимофеева О.А., Невмержицкая Ю.Ю. Клональное микроразмножение растений: Учебно-методическое пособие / О.А. Тимофеева, Ю.Ю. Невмержицкая. – Казань: Казанский университет, 2012. – 56 с.
- Википедия. — URL: https://ru.wikipedia.org/wiki/In_vitro (дата обращения: 13.12.2019).
- Колхицин. — URL: https://www.rlsnet.ru/mnn_index_id_769.htm (дата обращения: 25.12.2019)
- Классификация полиплоидов. — URL: https://helpiks.org/8-93245.html (дата обращения: 25.12.2019).
- Секвенирование. — URL: https://ru.wikipedia.org/wiki (дата обращения: 25.12.2019).
- Экспрессия генов. — URL: https://ru.wikipedia.org/wiki (дата обращения: 25.12.2019).
- Аллополиплоидия. — URL: https://dic.academic.ru/dic.nsf/enc3p/52186 (дата обращения: 25.12.2019).
- Аутополиплоидия. — URL: http://www.libma.ru/biologija/101_klyuchevaja_ideja_yevolyucija/p6.php. (дата обращения: 25.12.2019).
- Биологический словарь он-лайн. Филогенез — URL: http://bioword.ru/. (дата обращения: 25.12.2019).
- Каллус — URL: https://botanical_dictionary.academic.ru (дата обращения: 25.12.2019).
- Регенерация — URL: https://dic.academic.ru/ (дата обращения: 25.12.2019).
- Эмбриокультура культура эмбрионов — URL: https: //genetics_dictionary.academic.ru/5442/ (дата обращения: 25.12.2019).
- Лекция № 13. Способы деления эукариотических клеток: митоз, мейоз, амитоз — URL: https://licey.net/free/6-biologiya/21-lekcii_po_obschei_biologii/stages/267-lekciya__13_sposoby_deleniya_eukarioticheskih_kletok__mitoz__meioz__amitoz.html (дата обращения: 13.12.2019).
- Матвеева, Т.С. Полиплоидные декоративные растения. Однодольные/ Т.С. Матвеева – Л.: Наука, 1980. – 300с.
- Назаренко, Б.П. Полиплоидия в растениеводстве. /Б.П. Назаренко — М, 1975. — 56 с.
- Mable B. Breaking down taxonomic barriers in polyploidy research. Trends in Plant Science, 2003. Vol.8. P. 582–590.
- Gregory R.T., Mable B.K. Polyploidy in animals. In T. R. Gregory [ed.], The evolution of the genome, 2005. — P. 427–517.
- Soltis D., Vigner C., Soltis P. The polyploidy Revolution then …and now: Stebbins revisited //American Journal of Botany, 2014. Vol. 101, №7. P. 1057–1078.
- Levin D.A. Polyploidy and novelty in fl owering plants. // American Naturalist, 1983. — Vol.122. – P. 1–25.
- Levin D.A. The role of chromosomal change in plant evolution. Oxford University Press, 2002. – 240 p.
- Soltis D.E., P.S. Soltis Molecular data facilitate a reevaluation of traditional tenets of polyploid evolution. // Critical Reviews in Plant Sciences, 1993. — Vol.12. – P. 243–273.
- Ramsey J., Schemske D.W. Pathways, mechanisms, and rates of polyploid formation in fl owering plants. Annual Review of Ecology and Systematics, 1998. – Vol.29. – P. 467–501.
- Soltis D.E., P.S. Soltis, Tate J.A. Advances in the study of polyploidy since plant speciation. New Phytologist, 2004.- 161. – P.173–191.
- Tate J.A., Soltis D.E., Soltis P.S. Polyploidy in plants. In T. R. Gregory [ed.], // The evolution of the genome, 2005. –P. 371–426.
- Wendel J.F., Doyle J.J. Polyploidy and evolution in plants. In R. J. Henry [ed.], Plant diversity and evolution: Genotypic and phenotypic variation in higher plants, 2005. – P. 97–117.
- Stebbins G.L. Variation and evolution in plants. Oxford University Press, London, 1950.- P.643.
- Grant V. Plant speciation, 2nd ed. Columbia University Press, New York, New York, USA, 1981. – P. 193-204.
- Stebbins G.L. Chromosomal evolution in higher plants. Edward Arnold, London, UK. 1971.
- Levin D.A. Polyploidy and novelty in fl owering plants. American Naturalist, 1983.- Vol.122. – P: 1–25.
- Soltis P.S., Soltis D.E. The role of genetic and genomic attributes in the success of polyploids. Proceedings of the National Academy of Sciences, 2000. – Vol.97. –P. 7051–7057.
- Wendel J. Genome evolution in polyploids. Plant Molecular Biology, 2000. – Vol. 42. – P. 225–249.
- Wagner W.JR. Biosystematics and evolutionary noise. Taxon, 1970, — Vol.19. — P.146–151.
- Bennett M. D., Leitch I.J., Price H.J., Johnson J.S. Comparisons with Caenorhabditis (~100 Mb) and Drosophila (~175 Mb) using fl ow cytometry show genome size in Arabidopsis to be ~157 Mb and thus ~25% larger than the Arabidopsis Genome Initiative estimate. Annals of Botany 2003. – Vol.91. – P. 547 – 557.
- Vision T.J., Brown D.G., Tanksley S.D. The origins of genomic duplications in Arabidopsis. Science, 2000. – Vol.290. –P. 2114–2117.
- Bowers J.E., Chapman B.A., Rong J., Paterson A.H. . Unravelling angiosperm genome evolution by phylogenetic analysis of chromosomal duplication events. Nature, 2003. – Vol.422. – P. 433 – 438.
- Van de Peer Y., Fawcett J.A., Proost S., Sterck L., Vanderpoele K. The fl owering world: A tale of duplications. Trends in Plant Science, 2009. – Vol.14. – P. 680–688.
- Van de Peer Y. A mystery unveiled. Genome Biology, 2011. – 12. –P. 113.
- Jiao Y., Wickett N.J., Ayyampalayam S., Chanderbali A.S., Landherr L., Ralph P.E., Omsho L.P. Ancestral polyploidy in seed plants and angiosperms. Nature, 2011. – Vol.473. – P. 97–100.
- Jiao Y., Leebens-Mack J., Ayyampalayam S., Bowers J.E., McKain M.R., McNeal J., Rolf M. A genome triplication associated with early diversifi cation of the core eudicots. Genome Biology, 2012. – Vol.13. — P. 3.
- Cui L., Wall P.K., Leebens-Mack J.H., Lindsay B.G., Soltis D.E., Doyle J.J., Soltis P.S. Widespread genome duplications throughout the history of fl owering plants. Genome Research, 2006. – Vol.16. – P. 738–749.
- Soltis D.E., Albert V.A., Leebens-Mack J., Bell C.D., Paterson A.H., Zheng C., Sankoff D. Polyploidy and angiosperm diversify cation. American Journal of Botany, 2009. – Vol.96.- P. 336–348.
- Comparative Genomics. — — URL: http://genomevolution.org/CoGe (дата обращения 13.12.2019).
- Soltis D.E., P.S. Soltis Isozyme evidence for ancient polyploidy in primitive angiosperms. Systematic Botany, 1990. – Vol.15. – P. 328–337.
- Soltis D.E., Albert V.A., Leebens-Mack J., Bell C.D., Paterson A.H., Zheng C., Sankoff D. Polyploidy and angiosperm diversify cation. American Journal of Botany, 2009. – Vol.96. — P. 336–348.
- Doyle J.J. Polyploidy in Legumes. In P. S. Soltis and D. E. Soltis [eds.], Polyploidy and genome evolution, 2012. — P. 147–180.
- Schranz, M.E., Mohammadin S., Edger P.P. Ancient whole genome duplications, novelty and diversifi cation: The WGD radiation lag-time model. Current Opinion in Plant Biology, 2012. – Vol.15. – P. 147–153.
- De Smet R., Van de Peer Y. Redundancy and rewiring of genetic networks following genome-wide duplication events. Curr. Opin. Plant Biol., 2012. – Vol 15, N 2. – P. 168-76.
- Fawcett J.A., Maere S., Van de Peer Y. Plants with double genomes might have had a better chance to survive the Cretaceous-Tertiary extinction event. Proceedings of the National Academy of Sciences, USA, 2009. – Vol.106. – P. 5737–5742.
- Vanneste K., Maere S., Van de Peer Y. Review article: Tangled up in two: a burst of genome duplications at the end of the Cretaceous and the consequences for plant evolution. Philosophical Transactions of the Royal Society, 2014, B 369, 20130353.
- Mayrose I., Zhan S.H., Rothfels C.J., Magnuson-Ford K., Barker M.S., Rieseberg L.H., Otto S.P. Recently formed polyploid plants diversify at lower rates. Science, 2011. – Vol.333 – P. 1257.
- Lim K.Y., D.E. Soltis, P.S. Soltis, J. Tate, R. Matyasek, H. Srubarova, A. Kovarik Rapid chromosome evolution in recently formed polyploids in Tragopogon (Asteraceae). PLoS ONE, 2008. – Vol.3. – P. 3353.
- Chester M., Gallagher J.P., Symonds V.V., Cruz da Silva A.V., Mavrodiev E.V., Leitch A.R., Soltis P.S., Soltis D.E. Extensive chromosomal variation in a recently formed natural allopolyploid species, Tragopogon miscellus (Asteraceae). Proceedings of the National Academy of Sciences, USA, 2012. – Vol.109. –P. 1176–1181.
- Gaeta R.T., Pires J.C., Iniguez-Luy F., Leon E., Osborn T.C. Genomic changes in resynthesized Brassica napus and their effect on gene expression and phenotype. Plant Cell 2007. – Vol.19. – P. 3403–3417.
- Xiong Z., Gaeta R.T., Pires J.C. Homoeologous shuffling and chromosome compensation maintain genome balance in resynthe sized allopolyploid Brassica napus. Proceedings of the National Academy of Sciences, USA, 2011. – Vol.108. – P. 7908–7913.
- Udall J.A., Quijada P.A., Osborn T.C. Detection of chromosomal rearrangements derived from homologous recombination in four mapping populations of Brassica napus L. Genetics, 2005. – Vol.169. – P. 967–979.
- Gaeta R., Pires J. Homoeologous recombination in allopolyploids: the polyploid ratchet // New Phytol., 2010. — V. 186. — P. 18–28.
- Lim K.Y., Kovarik A., Matyasek R., Chase M.W., Clarkson J.J., Grandbastien M.A., Leitch A.R. Sequence of events leading to near-complete genome turnover in allopolyploid Nicotiana within fi ve million years. New Phytologist, 2007. – Vol.175. – P. 756–763.
- Liu B., C.L. Brubaker, G. Mergeai, R.C. Cronn, J.F. Wendel Polyploid formation in cotton is not accompanied by rapid genomic changes. Genome, 2001. – Vol.44. – P. 321–330.
- Hendrix B., Stewart J.M. Estimation of the nuclear DNA content of Gossypium species. Annals of Botany, 2005. – Vol.95. – P. 789–797.
- Salmon A., Flagel L., Ying B., Udall J.A., Wendel J.F. Homoeologous nonreciprocal recombination in polyploid cotton. New Phytologist, 2010. – Vol. 186. – P. 123–134.
- Wang K., Guo W., Yang Z., Hu Y., Zhang W. Structure and size variations between 12A and 12D homoeologous chromosomes based on high-resolution cytogenetic map in allotetraploid cotton. Chromosoma, 2010. – Vol. 119. – P. 255–266.
- Mandáková T., Marhold K., Lysak M.A. The widespread crucifer species Cardamine fl exuosa is an allotetraploid with a conserved subgenomic structure // New Phytologist., 2014. — Vol. 201. — No. 3. — P. 982–992.
- Pontes O., Neves N., Silva M., Lewis M.S., Maldung A., Comai L., Viegas W., Pikaard C.S. Chromosomal locus rearrangements are a rapid response to formation of the allotetraploid Arabidopsis suecica genome. Proceedings of the National Academy of Sciences, USA, 2004. – Vol.101. – P. 18240–18245.
- Matsushita S.C., Tyagi A.P., Thorton G.M., Pires J.C., Maldung A. Allopolyploidization lays the foundation for evolution of distinct populations: Evidence from analysis of synthetic Arabidopsis allohexaploids. Genetics, 2012. – Vol.191. — P. 535–547.
- Wang X.-Y., Paterson A.H. Gene conversion in angiosperm genomes with an emphasis on genes duplicated by polyploidization. Genes, 2011. – Vol. 2. – P. 1–20.
- Kashkush K., Feldman M., Levy A.A. Gene loss, silencing and activation in a newly synthesized wheat allotetraploid. Genetics, 2002. – Vol.160. – P. 1651–1659.
- Nie L., Han Z., Lu L., Yao Y., Sun Q., Ni Z. Genomic and genic sequence variation in synthetic hexaploid wheat (AABBDD) ascompared to their parental species. Progress in Natural Science, 2008. – Vol.18. – P. 533–538.
- Anssour S., Krugel T., Sharbel T.F., Saluz H.P., Bonaventure G., Baldwin I.T. Phenotypic, genetic and genomic consequences of natural and synthetic polyploidization of Nicotiana attenuata and Nicotiana obtusifolia. Annals of Botany, 2009. – Vol.103. – P. 1207 – 1217.
- Buggs R.J., Chamala S., Wu W., Tate J.A., Schanable P.S., Soltis D.E., Soltis P.S., Barbazuk W.B. Rapid, repeated, and clustered loss of duplicate genes in allopolyploid plant populations of independent origin. Current Biology, 2012. – Vol. 22. – P. 248 – 252.
- Koh J., P.S. Soltis, D.E. Soltis Homeolog loss and expression changes in natural populations of the recently and repeatedly formed allotetraploid Tragopogon mirus (Asteraceae). BMC Genomics, 2010. – Vol.11. – P. 97.
- Song K., Lu P., Tang K., Osborn T.C. Rapid genome change in synthetic polyploids of Brassica and its implications for polyploidy evolution. Proceedings of the National Academy of Sciences, 1995. – Vol.92. – P. 7719–7723.
- Buggs R.J., Doust N., Tate J., Koh J., Soltis K., Feltus F., Paterson H. Gene loss and silencing in Tragopogon miscellus (Asteraceae): Comparison of natural and synthetic allotetraploids. Heredity, 2009. – Vol.103. – P. 73 – 81.
- Tate J.A., Joshi P., Soltis K.A., Soltis P.S., Soltis D.E. On the road to diploidization? Homoeolog loss in independently formed populations of the allopolyploid Tragopogon miscellus (Asteraceae). BMC Plant Biology, 2009. – Vol.9. –P. 80.
- Tate J.A., Ni Z., Scheen A.C., Koh J., Gilbert C.A., Chen Z.J., Soltis P.S., Soltis D.E. Evolution and expression of homoeologous loci in Tragopogon miscellus (Asteraceae), a recent and reciprocally formed allopolyploid. Genetics, 2006. – Vol.173. –P. 1599–1611.
- Barker M.S., Kane N.C., Matvienko M., Kozik A., R. Michelmore W., Knapp S.J., Rieseberg L.H. Multiple paleopolyploidizations during the evolution of the Compositae reveal parallel patterns of duplicate gene retention after millions of years. Molecular Biology and Evolution, 2008. – Vol. 25. – P. 2445 – 2455.
- Paterson A.H., Chapman B.A., Kissinger J.C., Bowers J.E., Feltus F.A., Estill J.C. Many gene and domain families have convergent fates following independent whole-genome duplication events in Arabidopsis, Oryza, Saccharomyces and Tetraodon. Trends in Genetics, 2006. – Vol. 22. – P. 597–602.
- Severin A.J., Cannon S.B., Graham M.M., Grant D., Shoemaker R.C. Changes in twelve homoeologous genomic regions in soybean following three rounds of polyploidy. Plant Cell, 2011. – Vol.23. – P. 3129–3136.
- De Smet R., Adams K.L., Vanderpoele K., Van Montagu M.C.E., Maere S., Van de Peer Y. Convergent gene loss following gene and genome duplications creates single-copy families in fl owering plants. Proceedings of the National Academy of Sciences, USA, 2013. – Vol.110. – P. 2898–2903.
- Hegarty M.J.M., Jones J.M.J., Wilson I.I.D., Barker G.L., Coghill J.A., Sanchez-Baracaldo P., Liu G. Development of anonymous cDNA microarrays to study changes to the Senecio fl oral transcriptome during hybrid speciation. Molecular Ecology, 2005. – Vol.14. – P. 2493–2510.
- Hegarty M.J., Barker G.L., Wilson I.D., Abbott R.J., Edwards K.J., Hiscock S.J. Transcriptome shock after interspecifi c hybridization in Senecio is ameliorated by genome duplication. Current Biology, 2006. – Vol.16. – P. 1652–1659.
- Hegarty M.J., Abbott R.J., Hiscock S.J. Allopolyploid speciation in action: The origins and evolution of Senecio cambrensis. In P. S. Soltis and D. E. Soltis [eds.], Polyploidy and genome evolution, 2012. – P. 245–270.
- Buggs R.J., Doust N., Tate J., Koh J., Soltis K., Feltus F., Paterson H. Gene loss and silencing in Tragopogon miscellus (Asteraceae): Comparison of natural and synthetic allotetraploids. Heredity, 2009. – Vol.103. – P. 73 – 81.
- Buggs R.J., Zhang L., Miles N., Tate J., Gao L., Wei W., Schnable P.S. Transcriptomic shock generates evolutionary novelty in a newly formed, natural allopolyploid plant. Current Biology: CB, 2011. – Vol.21. – P. 551 – 556.
- Chelaifa H., Monnier A., Ainouche M. Transcriptomic changes following recent natural hybridization and allopolyploidy in the salt marsh species Spartina ×townsendii and Spartina anglica (Poaceae). New Phytologist, 2010. – Vol.186. – P. 161–174.
- Ainouche M.L., Chelaifa H., Ferreira J., Bellot S., Ainouche A., Salmon A. Polyploid evolution in Spartina : Dealing with highly redundant hybrid genomes . In P. S. Soltis and D. E. Soltis [eds.], Polyploidy and genome evolution, 2012. – P. 225–243.
- Wang J., Tian L., Lee H., Wei N., Jiang H., Watson B., Madlung A.Genomewide nonadditive gene regulation in Arabidopsis allotetraploids. Genetics, 2006. – Vol.172. – P. 507–517.
- Chang P.L., Dilkes B.P., McMahon M., Comai L., Nuzhdin S.V. Homoeolog-specifi c retention and use in allotetraploid Arabidopsis suecica depends on parent of origin and network partners. Genome Biology, 2010. – Vol.11. – P. 125.
- Flagel L.E., Wendel J.F. Evolutionary rate variation, genomic dominance and duplicate gene expression evolution during allotetraploid cotton speciation. New Phytologist, 2010. – Vol.186. – P. 184–193.
- Yoo M., Szadkovski E., Wendel J. Homoeolog expression bias and expression level dominance in allopolyploid cotton. Heredity, 2013. – Vol.110. – P. 171–180.
- Lynch M., Conery J.S. The Evolutionary Fate and Consequences of Duplicate Genes // Science, 2000. — Vol. 290. – I. 5494. – P. 1151-1155.
- Lynch M., Force A. The probability of duplicate gene preservation by sub functionalization. //Genetics, 2000. – Vol.154. – P. 459–473.
- Prince V.E., Pickett F.B. Splitting pairs: The diverging fates of duplicated genes. // Nature Reviews Genetics, 2002. – Vol.3. – P. 827–837.
- Osborn T.C., Pires J.C., Birchler J.A., Auger D.L., Chen J.Z., Lee H., Comai L. Understanding mechanisms of novel gene expression in polyploids. Trends in Genetics, 2003. – Vol.19. – P. 141–147.
- McClintock B. The significance of responses of the genome to challenge // Science. 1984. — Vol. 226. — P. 792–801.
- Salmon A., Ainouche M.L., Wendel J.F. Genetic and epigenetic consequences of recent hybridization and polyploidy in Spartina (Poaceae). Molecular Ecology, 2005. – Vol.14. – P. 1163–1175.
- Kraitshtein, Z., Yaakov, B., Khasdan, V., and Kashkush, K. Genetic andepigenetic dynamics of a retrotransposon after allopolyploidization of wheat. // Genetics, 2010. – Vol.186. – P. 801–812.
- Zhao N., Zhu B., Li M., Wang L., Xu L., Zhang H., Zheng S. Extensive and heritable epigenetic remodeling and genetic stability accompany allohexaploidization of wheat. // Genetics, 2011. – Vol.188. – P. 499–510.
- Lavalania U.C., Srivastava S., Lavania S., Basu S., Misra N.K., Mukai Y. Autopolyploidy differentially infl uences body size in plants, but facilitates enhanced accumulation of secondary metabolites, causing increased cytosine methylation. // Plant Journal, 2012. – Vol.71. – P. 539–549.
- Wang J., Tian L., Lee H.-S., Chen Z.J. Nonadditive regulation of FRI and FLC loci mediates fl owering-time variation in Arabidopsis allopolyploids. //Genetics, 2006a. – Vol.173. – P. 965–974.
- Shi X., Ng D.W.-K., Zhang C., Comai L., Ye W., Chen Z.J. Cis — and trans -regulatory divergence between progenitor species determines gene-expression novelty in Arabidopsis allopolyploids. // Nature Communications, 2012. – Vol.3. – P. 950.
- Buggs R.J, Wendel J.F., Doyle J.J., Soltis D.E., Soltis P.S., Coate J.E. The legacy of diploid progenitors in allopolyploid gene expression patterns. //Philosophical Transactions of the Royal Society of London. Series B, 2014. – Vol.369. – P. 20130354.
- Sears E.R. Genetic control of chromosome pairing in wheat. //Annual Review of Genetics, 1976. – Vol.10. – P. 31–51.
- Ji L.H., Langridge P. The genetic control of chromosome pairing in wheat. // Australian Journal of Plant Physiology, 1990. – Vol.17. – P. 239–251.
- Griffiths S., Sharp R., Foote T.N., Bertin I., Wanous M., Reader S., Colas I., Moore G. Molecular characterization of Ph1 as a major chromosome pairing locus in polyploid wheat. // Nature, 2006. – Vol.439. –P. 749–752.
- Shaked, H., K. Kashkush, H. Ozkan, M. Feldman, and A. A. Levy, Sequence elimination and cytosine methylation are rapid and reproducible responses of the genome to wide hybridization and allopolyploidy in wheat. //Plant Cell, 2001.- Vol.13. – P. 1749–1759.
- Le Comber S.C., Ainouche M.L., Kovarik A., Leitch A.R. Making a functional diploid: From polysomic to disomic inheritance. // New Phytologist, 2010. – Vol.186. – P. 113–122.
- Landergott U., Naciri Y., Schneller J.J., Holderegger R. Allelic confi guration and polysomic inheritance of highly variable microsatellites in tetraploid gynodioecious Thymus praecox agg. // Theoretical and Applied Genetics, 2006. – Vol.113. – P. 453–465.
- Stift M., Berenos C., Kuperus P., Van Tienderen P.H. Segregation models for disomic, tetrasomic and intermediate inheritance in tetraploids: A general procedure applied to Rorippa (yellow cress) microsatellite data. //Genetics, 2008. – Vol.179. – P. 2113–2123.
- Soltis D.E., P.S. Soltis Polyploidy: Recurrent formation and genome evolution. // Trends in Ecology & Evolution, 1999. – Vol.14. – P. 348–352.
- Ramsey J., Schemske D.W. Pathways, mechanisms, and rates of polyploid formation in fl owering plants. // Annual Review of Ecology and Systematics, 1998. – Vol.29. – P. 467–501.
- Hamrick J.L., Nason J.D., Fleming T.H., Nassar J.M. Genetic diversity in columnar cacti. In T. H. Fleming and A. Valiente-Banet [eds.] // Columnar cacti and their mutualists: Evolution, ecology, and conservation, 2002. — P. 122–133.
- Arakaki M., Soltis D.E., Speranza P. New chromosome counts and evidence of polyploidy in Haageocereus and related genera in tribe Trichocereeae and other tribes of Cactaceae. //Brittonia, 2007. – Vol.59. – P. 290– 297.
- Majure L.C., Puente R., Griffith M.P., Judd W.S., Soltis P.S., Soltis D.E. Phylogeny of Opuntia s.s. (Cactaceae): Reticulate evolution, geographic origins, and clade delineation. // American Journal of Botany, 2012. — Vol.99(5). – P. 847–864.
- Soltis D.E., Rieseberg L.H. Autopolyploidy in Tolmiea menziesii (Saxifragaceae): Genetic insights from enzyme electrophoresis. // American Journal of Botany, 1986. – P. 73: 310.
- Soltis D.E., P.S. Soltis Genetic consequences of autopolyploidy in Tolmiea (Saxifragaceae). // Evolution, 1989. – Vol.43. – P. 586–594.
- Moody M.E., Mueller L.D., Soltis D.E. Genetic variation and random drift in autotetraploid populations. // Genetics, 1993. – Vol.154. – P. 649–657.
- Soltis D.E., P.S. Soltis Molecular data facilitate a reevaluation of traditional tenets of polyploid evolution. // Critical Reviews in Plant Sciences, 1993. – Vol.12. – P. 243–273.
- Parisod C., Salmon A., Zerjal T., Tenaillon M., Grandbastien M.A., Ainouche M. Rapid structural and epigenetic reorganization near transposable elements in hybrid and allopolyploid genomes in Spartina. // New Phytologist, 2009. – Vol.184. – P. 1003–1015.
- Le Comber S.C., Ainouche M.L., Kovarik A., Leitch A.R. Making a functional diploid: From polysomic to disomic inheritance. // New Phytologist, 2010. – Vol.186. – P. 113–122.
- Warner D.A., Edwards G.E. Effects of polyploidy on photosynthesis. // Photosynthesis Research, 1993. – Vol.35. – P. 135–147.
- Coate J.E., Luciano A.K., Seralathan V., Minchew K.J., Owens T.G., Doyle J.J. Anatomical, biochemical, and photosynthetic responses to recent allopolyploidy in Glycine dolichocarpa (Fabaceae). // American Journal of Botany, 2012. – Vol.99. – P. 55–67.
- Coate J.E., Powell A.F., Owens T.G., Doyle J.J. Transgressive physiological and transcriptomic responses to light stress in allopolyploid Glycine dolichocarpa (Leguminosae). // Heredity, 2013. – Vol.110. – P. 160– 170.
- Wang Z., Wang M., Liu L., Meng F. Physiological and proteomic responses of diploid and tetraploid black locust (Robinia pseudoacacia L.) subjected to salt stress. // International Journal of Molecular Sciences, 2013. – Vol.14. – P. 20299–20325.
- Richards A.J. Plant breeding systems, 2nd ed.// Springer, Chapman, & Hall, London, UK. 1997. — 529 p.
- Ramsey J., Schemske D.W. Neopolyploidy in fl owering plants. // Annual Review of Ecology and Systematics, 2002. – Vol.33. – P. 589 – 639.
- Husband B.C., Sabara H.A. Reproductive isolation between autotetraploids and their diploid progenitors in fireweed, Chamerion angustifolium (Onagraceae). // New Phytologist, 2003. – Vol.161. – P. 703 – 713.
- Segraves, K. A. & Thompson, J. N () Plant polyploidy and pollination: floral traits and insect visit to diploid and tetraploid Heuchera grossulariifolia. // Evolution, 1999. – Vol.53. – P. 1114-1127.
- Albertin W, Alix K., Balliau T., Brabant P., Davanture M., Mallose C., Valot B., Thiellement H. Numerous and rapid nonstochastic modifi cations of gene products in newly synthesized Brassica napus allotetraploids. // Genetics, 2006. – Vol.173. – P. 1101 – 1113.
- Albertin W., Alix K., Balliau T., Brabant P., Davanture M., Mallosse C., Valot B., Thiellement H. Differential regulation of gene products in newly synthesized Brassica napus allotetraploids is not related to protein function nor subcellular localization. // BMC Genomics, 2007. – Vol.8. – P. 56.
- Gancel A.-L., Grimplet J., Sauvage F.-X., Ollitrault P., Brillouet J.-M. Predominant expression of diploid mandarin leaf proteome in two citrus mandarin-derived somatic allotetraploid hybrids. // Journal of Agricultural and Food Chemistry, 2006. – Vol.54. – P. 6212–6218.
- Hu G., Houston N.L., Pathak D., Schmidt L., Thelen J.J., Wendel J.F. Genomically biased accumulation of seed storage proteins in allopolyploid cotton. // Genetics, 2011. – Vol.189. – P. 1103–1115.
- Hu G., Koh J., Yoo M.-J., Grupp K., Chen S., Wendel J.F. Genomically biased accumulation of seed storage proteins in allopolyploid cotton. // New Phytologist, 2013. – Vol.200. – P. 570–582.
- Kong F., Mao S., Jiang J., Wang J., Fang X., Wang Y. Proteomic changes in newly synthesized Brassica napus allotetraploids and their early generations. // Plant Molecular Biology Reporter, 2011. – Vol.29. –P. 927–935.
- Koh J., Chen S., Zhu N., Yu F., Soltis P.S., Soltis D.E. Comparative proteomics of the recently and recurrently formed natural allopolyploid Tragopogon mirus (Asteraceae) and its parents. // New Phytologist, 2012. – Vol.196. – P. 292–305.
- Ng D.W.-K., Zhang C., Miller M., Shen Z., Briggs S.P., Chen Z.J. Proteomic divergence in Arabidopsis autopolyploids and allopolyploids and their progenitors. // Heredity, 2012. – Vol.108. – P. 419–430.
- Syed N.H., Kalyna M., Marqez Y., Barta A., Brown J.W.S. Alternative splicing in plants-Coming of age. // Trends in Plant Science, 2012. – Vol.17. – P. 616–623.
- Ohno S. Evolution by gene duplication. Springer-Verlag, New York, // New York, USA. 1970.
- Hughes A.L. The evolution of functionally novel proteins after gene duplication. Proceedings of the Royal Society, B // Biological Sciences, 1994. – Vol.256. – P. 119–124.
- Force A., Lynch M., Pickett F.B., Amores A., Yan Y., Postlethwait J. Preservation of duplicate genes by complementary, degenerative mutations. // Genetics, 1999. – Vol.151. – P. 1531–1545.
- Talavera D., Vogel C., Orozco M., Teichmann S.A., De la Cruz X. The (in)dependence of alternative splicing and gene duplication. // PLoS Computational Biology, 2007. – Vol.3. – P. 33.
- Roux J., Robinson-Rechavi M. Age-dependent gain of alternative splice forms and biased duplication explain the relation between splicing and duplication. // Genome Research, 2011. – Vol.21. – P. 357–363.
- Su Z., Wang J., Yu J., Huang X., Gu X. Evolution of alternative splicing after gene duplication. // Genome Research, 2006. – Vol.16. – P. 182–189.
- Chen T.W., Wu T.H., Ng W.V., Lin W.C. Interrogation of alternative splicing events in duplicated genes during evolution. // BMC Genomics 12 (supplement 3), 2011. – P. 16.
- Santos M.E., Athanasiadis A., Leitao A.B., Dupasquier L., Sucena E. Alternative splicing and gene duplication in the evolution of the FoxP gene subfamily. // Molecular Biology and Evolution, 2011. – Vol.28. –P. 237–247.
- Zhang Z., Zhou L., Wang P., Liu Y., Chen X., Hu L., Kong X. Divergence of exonic splicing elements after gene duplication and the impact on gene structures. // Genome Biology, 2009. – Vol.10. – P. 120.
- Zhang P.G., Huang S.Z., Pin A.-L., Adams K.L. Extensive divergence in alternative splicing patterns after gene and genome duplication during the evolutionary history of Arabidopsis. // Molecular Biology and Evolution, 2010. – Vol.27. – P. 1686–1697.
- Conant G.C., Birchler J.A., Pires J.C. Dosage, duplication, and diploidization: clarifying the interplay of multiple models for duplicate gene evolution over time. // Current Opinion in Plant Biology, 2014. – Vol.19. – P. 91– 98.
- Артюхова С.И., Киргизова И.В. Биотехнологические методы оздоровления посадочного материала картофеля от фитопатогенной вирусной инфекции // Динамика систем, механизмов и машин, 2014.–№ 6. – С. 58–60.
- Черемисин А.И., Кумпан В.Н. Влияние состава питательной среды при микроклональном размножении сортов и гибридов картофеля // Вестник Омского ГАУ. – 2017. – № 4 (28). — С. 87–91.
- Дорошенко Н. П., Трошин Л. П., Алзубайди Х.К.И. Биотехнология — наука и отрасль сельского хозяйства // Политематический сетевой электронный научный журнал КубГАУ – 2016. – №116(02). – С. 1700-1732.
- Мякишева Е.П., Дурникин Д.А., Таварткиладзе О.К. Изучение влияния витаминов на морфогенез растений – регенерантов картофеля in vitro в целях интенсификации производства элитного посадочного материала // Бiологiчний вiсник МДПУ імені Богдана Хмельницького. – 2016. — 6 (2) – С. 166–173.
- Артюхова С. И., Киргизова И. В. Модификации питательной среды с использованием биотехнологических методов микроклонального размножения картофеля для культивирования в Омской области // Омский научный вестник. – 2014. – № 2 (134).–С.187–191.
- Лапшинов Н.А. Эффективность использования модифицированной среды Кемеровского НИИСХ при оздоровлении картофеля / Лапшинов Н.А., Куликова В.И., Ходаева В.П.// Достижения науки и техники АПК. – 2010. – №7. – С.16–17.
- Дитченко Т.И. Культура клеток, тканей и органов растений // Минск, БГУ: курс лекций, 2007. – 102 с.
- Дерябин А.Н., Сабельникова Е.П., Бураханова Е.А. Зависимость формирования холодоустойчивости у растений in vitro от концентрации сахарозы в среде выращивания // Вестник Мордовского университета. – 2011. — №4. — С.200-206.
- Гизатуллина А.Т., Сташевски З., Гимаева Е.А., Сафиуллина Г.Ф. Изучение динамики микроклубнеобразования картофеля (Solanum Tuberosum l.) сорта Невский в асептической культуре in vitro// Достижения науки и техники АПК. – 2016. – Т. 30. – № 10. – С. 61–65.
- Visser R.G.F., Jacobsen E., Hesselingmeinders A., Schans M.J., Witholt B., Feenstra W.J. Transformation of homozygous diploid potato with an Agrobacterium tumefaciens vector system by adventitious shoot regeneration on leaf and stem segments. Plant Mol Biol. – 1989. – Vol.12. – P. 329–337.
- Ehsanpour A.A., Jones M.G. Evaluation of direct shoot regeneration from stem explants of potato (Solanum tuberosum L.) cv. Delaware by thidiazuron TDZ. J Sci Technol Agri Natur Res. – 2000. – Vol.4. – P. 47–54.
- Khokan E.H., Haydar A., Ara T., Alam M.K., Sharma M.D. Enhancement of Agrobacterium-mediated transformation method for the production of heme-protein (ferritin protein) rich potato. Int J Sustain Crop Prod. –2009. – Vol.4. – P.17–22.
- Afrasiab H., Iqbal J. In vitro techniques and mutagenesis for the genetic improvement of potato cvs. Desiree and Diamant. // Pak J. Bot. – 2010. – Vol.42. – P. 1629–1637.
- Dobranszki J., Takacs H.A., Magyar T.K., Ferenczy A. Effect of medium on the callus forming capacity of different potato genotypes. // Acta Agron Hung. – 1999. – Vol.47. – P. 59–61.
- Hansen J., Nielsen B., Nielsen S.V.S. In vitro shoot regeneration of Solanum tuberosum cultivars: interactions of medium composition and leaf, leaflet and explant position. // J Natur Sci Found Sri Lanka. – 1999. – Vol. 27. – P. 17–28.
- Asthma R., Beenish A., Abbasi N.A., Mussarat B., Azra Q. Effect of growth regulators on in vitro multiplication of potato. // Int J. Agr Biol. – 2001. – Vol. 3. –P.181–182.
- Torabi F., Majad A., Ehsanpour A.A. Plant regeneration from cell suspension culture of potato (Solanum tuberosum L.) // Pak J Biol Sci., 2008. – Vol.11. – P.778–782.
- Elaleem A.K.G., Modawi R.S., Khalafalla M.M. Effect of plant growth regulators on callus induction and plant regeneration in tuber segment culture of potato (Solanum tuberosum L.) cultivar Diamant. // Afr J Biotechnol. – 2009. – Vol. 8. – P.2529–2534.
- Cingel A., Vinterhalte B., Vinterhalter D., Dragosavac D.A., Smigocki A., Ninkovi S. Agrobacterium-mediated transformation of two Serbian potato cultivars (Solanum tuberosum L. cv Dragaevka and cv Jelica). Afr J Biotechnol., 2010. – V. 9. – P. 4644–4650.
- Kiel M., Sanchez-Serrano J.J., Willmitzer L. Both wound inducible and tuber specific expression mediated by the promoter of a single member of the protease inhibitor 11 gene families. // EMBO J., 1989. – Vol. 8. – P. 1323–1330.
- Tavazza R., Tavazza M., Ordas R.J., Ancora G., Benvenuto E. Genetic transformation of potato (Solanum tuberosum): An efficient method to obtain transgenic plants. // Plant Sci., 1988. – Vol. 49. – P. 175–181.
- Webb K.J., Osifio E.O., Henshaw G.G. Shoot regeneration from leaflet discs of six cultivars of potato. (S. tuberosum subsp. tuberosum). // Plant Sci., 1983. – Vol. 63. – P. 79–85.
- De Block M. Genotype-independent leaf disc transformation of potato (Solanum tuberosum) using Agrobacterium tumefaciens. // Theor Appl Genet., 1988. – Vol. 76. – P. 767–779.
- Kumar M., Chimote V., Singh R., Mishra G.P., Naik P.S., Pandey S.K., Chakrabarti S.K. Development of Bt transgenic potatoes for effective control of potato tuber moth by using cry1Ab gene regulated by GBSS promoter. // Crop Prot., 2010. – Vol. 29. – P. 121–127.
- Hoekema A., Huisman M.J., Molendijk L., Van den Elzen P.J.M., Cornelissen B.J.C. The genetic engineering of two commercial potato cultivars for resistance to potato virus X. // Bio.Tech., 1989. – Vol. 7. – P. 273–278.
- Ovesna J., Burdova I., Krizkova L., Opatrny Z. Modification of cultivar-specific regeneration capacity of potato explants by phytohormones and by Agrobacterium oncogenes. // Biol Plant., 1993. – Vol. 35. – P.199–208.
- Sheerman S., Bevan M.W. A rapid transformation method for Solanum tuberosum using binary Agrobacterium tumefaciens vectors. // Plant Cell Rep., 1988. – Vol. 7. – P. 13–16.
- Pal A.K., Acharya K., Ahuja P.S. Endogenous auxin level is a critical determinant for in vitro adventitious shoot regeneration in potato (Solanum tuberosum L.) // J. Plant Biochem. Biotechnol. – 2012. – Vol.21(2). – P. 205–212.
- Вальдеррама Р. А. С. Изучение процессов регенерации и клонирования некоторых перуанских видов картофеля в культуре in vitro. // Дис. кандидат биологических наук — Москва, 2002. — 179 с.
- Государственной реестр селекционных достижений, допущенных к использованию. – URL: https://reestr.gossort.com/reestr/culture/159 (дата обращения 10.12.2019 г.)
- ООО «Агроцентр «Коренево». Семенной картофель. – URL: http://agrokorenevo.ru/ (дата обращения 10.12.2019 г.)];
- Характеристика сортов картофеля. – URL: https://kartofan.org/category/sorta (дата обращения 10.12.2019 г.)
- Дикий картофель Solanum rybinii purple. — URL:https://purple-potatoes.ru/products/dikiy-kartofel-solanum-rybinii-purple (дата обращения 10.01. 2020 г.
- Папихин Р.В. Способ приготовления цитологических препаратов с помощью ультразвука для изучения анатомо-морфологических характеристик листьев // Вестник МичГАУ, 2014. — №1. — С. 38-43.
- Фролова Л.А., Лучникова С.В., Чувашина Н.П. Изучение соматических и мейотических хромосом плодовых и ягодных культур на ацетогематоксилиновых давленных препаратах // 50-лет факультету биологии: итоги и перспективы. Сборник статей. – Мичуринск: МГПИ, 2002. – С. 42-47.
- Murashige T., Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue cultures// Physiol. Plant. – 1962. – Vol.15, №13. – Р. 473 – 497.
- Бутенко Р.Г. Биология клеток высших растений in vitro и биотехнологии на их основе. Учеб. пособие. — М.: ФБК-ПРЕСС. – 1999. – 160 с.
- Малецкий С.И., Юданова С.С., Малецкая Е.И. Гармонические пропорции числа хлоропластов в популяциях замыкающих клеток устьиц сахарной свеклы (Beta vulgaris L.) // Вавиловский журнал генетики и селекции, 2013. — Том 17. — №1. — С. 72-80.
- Струк Т.И., Осипова З.А. Влияние гибридизации и полиплоидии на структурную организацию листа у сахарной свеклы // Популяционно-генетические аспекты продуктивности растений. Новосибирск: наука, 1982. — С. 77-87.
- Струнников В.А. Третья изменчивость // Природа, 1989. — N 2. — С. 17–27.
- D’Amato F. Cytogenetics of plant cell and tissue cultures and their regenerantes // CRC Crit. Rev. Plant Sci., 1985. — V.3. — No 1. — P. 73-112.
- Бреславец Л.П. Полиплоидия в природе и опыте / Л. — М.: Изд-во АН СССР, 1963. – 364 с.
- Wang Wei-xing, Li Chun-yan, Xiang Su-qiong, Guo Qi-gao, Li Xiao-lin, Liang Guo-lu//Guoshu xuebao. J. Fruit.Sci.-2008. -V.25, №1. — Р. 115-118.
- Папихин Р.В., Муратова С.А., Дубровский М.Л. Индуцирование полиплоидизации растений in vitro // Биотехнология как инструмент сохранения биоразнообразия растительного мира: сб. статей по материалам ΙΙΙ Всерос. науч.-практ. конф., Волгоград, 4-6 августа 2010. – Волгоград, 2010. – С. 95 – 100.
- Папихин Р.В., Муратова С.А. Повышение эффективности отдалённой гибридизации семечковых плодовых культур: Монография// Мичуринск: Изд-во Мичуринского госагроуниверситета, 2011. – 116 с.
- Веселова Т.В., Веселовский В.А., Чернавский Д.С. «Стресс у растений (биофизический подход) // Издательство МГУ, Москва, 1993. – 144 с.
- Denne M.P. Morphological changes in the scoot apex of Trifolium repens L. Changes in the vegetative apex during the plastochorn. // N. Z. J. Bot., 1966. — № 3. — Р. 300-314.
- Lyndon R. The shoot apex. – In: Cell division in highes plants / Ed. M.M. Yeoman L. etc., 1976. — P. 285-314.
- Molden M., Owens S.N. Ontogeny end histochemistry of the vegetative apex of Cosmos bipinnatus «Sensation». // Canad. J. Bot., 1972. — №6. — P. 1171-1184.
- Kaplan D.R. Comparative foliar histogenesis in Aeorus calamus and its bearing on the phyllode theory of monocotyledonous leaves. // Amer. J. Bot., 1970. — №3. — P. 331-663.
- Soma K. Morphogenesis in the shoot apex of Euphorlia lathyris L. // J. Fac. Sci. Univ. Tokyo Sec. III, Bot., 1958. — №7. — P. 199-256.
- Satina S., Blakeslee A. F., Periclinal chimeras in Datura stramonium in relation to development of leaf and flower //Amer. J. Bot., 1941. — vol. 28. — № 10. — P. 862-871.
- Satina S., Blakeslee A.F., Avery A.G., Demonstration of the three germ layers in the shoot apex of Datura by means of induced polyploidy in periclinal chimeras // Amer. J. Bot., 1940. — vol. 27. — № 10. — P. 895-905.
- Satina, S., Periclinal chimeras in Datura in relation to development and structure (A) of the style and stigma (B) of calyx and corolla// Amer. J. Bot., 1944. — v. 31. — №8. — P. 493-502.
- Сидоров Б.Н., Вокученко Н.А., Огородникова А.Р. Блокада веретена и гипополиплоидный рост при колхициновом митозе // Полиплоидия и селекция. – М.-Л., 1965. — С. 109-122.
- Montelongo — Escobedo H., Rowe P.R. Haploid induction in potato: сytological basis for the pollinator effect. //Euphytica, 1969. – 18. – P. 116-123.
- Будин К.З. Гаплоидия в селекции картофеля / Полиплоидия и селекция, 1972. — С. 67-77.
- Жученко А.А. Адаптивная система селекции растений (экологические основы): Монография – М.: РУДН, 2001. – Т.1. – 780с., Т. 2. – 708 с.
- Ермишин А.П. Отбор на диплоидном уровне и манипуляции с плоидностью в селекции картофеля // Молекулярная и прикладная генетика. Научные труды., 2007. — Т.5. — С. 20-42.
- Hawkes J.G. Origins of cultivated potatoes and species relationships // Popato genetics. Wallingford (UK): CABI, 1994. — P 109-132.
- Будин К.З. Генетические основы селекции картофеля. Ленинград: Агропромиздат, 1986. — 92 с.
- Clulow S.A, Wilkinson M.J., Waugh R. Cytological and molecular observations on Solanum phureja-induced digaploid potatoes // Theor. Appl. Genet., 1991. — Vol. 82. — P. 545-551.
- Кунах В.А. Геномная изменчивость соматических клеток растений. 2. Изменчивость в природе / Биополимеры и клетка, 1995. — Т. 11. — №6. — С. 5-40.
- Levan A. The effect of colchicine on meiosis in Allium // Hereditas, 1938. — Vol.24. — P. 471-486.
- Папихин Р.В., Муратова С.А., Дубровский М.Л. Получение и отбор растений с изменённым уровнем плоидности при полиплоидизации клематиса in vitro // Субтропическое и декоративное садоводство, 2009. — № 42-1. — С. 174-181.
- Киргизова И.В., Артюхова С.И. Индукция каллусных культур картофеля Solanum Tuberosum// Научно-технический прогресс: актуальные и перспективные направления будущего: сборник материалов V Международной научно-практической конференции (7 апреля 2017 года), Том I – Кемерово: ЗапСибНЦ., 2017. – С. 28 – 31.
- Гусева К.Ю., Бородулина И.Д., Мякишева Е.П., Таварткиладзе О.К. Укоренение in vitro сортов картофеля (Solanum tuberosum L.) – // Известия Алтайского государственного университета, 2013. – № 3-1 (79). – С. 056-060.
- Регуляторы роста в биотехнологии растений URL: http://bio–x.ru/articles/regulyatory–rosta–v–biotehnologii–rasteniy (дата обращения 09.01.2020).
- Индолил-3-масляная кислота URL: https://ru.wikipedia.org/wiki/ (дата обращения 09.01.2020).
- Википедия. Гетероауксин. — URL: https://ru.wikipedia.org/wiki/Гетероауксин (дата обращения 10.12.2019г.).
- Косолапова А.С., Ламберова М.Э. Исследование влияния ультразвука на отдельные стадии в технологии культуры растительных клеток и тканей in vitro. II. Образование каллуса и его размножение //Химия растительного сырья, 2010. – №3. – С. 189–190.
