Титульный лист и исполнители
РЕФЕРАТ
Отчет 100 с., 1 кн., 50 рис., 7 табл., 94 источн., 2 прил.
ЛАЗЕРНОЕ ОБЛУЧЕНИЕ, СТИМУЛЯЦИОННЫЙ ЭФФЕКТ, ЗАЩИТНЫЕ БИОПРЕПАРАТЫ, ПОВЫШЕНИЕ АКТИВНОСТИ, ФИТОСАНИТАРНОЕ СОСТОЯНИЕ
Цель работы: повышение функциональной активности микроорганизмов защитных биопрепаратов посредством лазерной обработки.
В ФГБОУ ВО Мичуринский ГАУ в 2019 году проводились НИОКР по разработке средств и методов фотоники для повышения активности препаратов биологической защиты растений. В ходе реализации ГЗ МСХ был апробирован лабораторный образец технологической установки для лазерной обработки микроорганизмов с использованием в качестве модельных образцов бактерий из защитных биопрепаратов КМП-St, КМП-3, Алирин-Б, Ризоплан.
Установлено увеличение числа колониеобразующих единиц (КОЕ) в рабочих растворах КМП-3 и КМП-St после обработки когерентным светом при эффективных экспозициях на 15% — 19% по сравнению с вариантом без облучения. Алирин-Б без применения лазера оказался неэффективным в борьбе с альтернариозом томата в условиях пленочной теплицы. Его облучение позволило повысить антифунгальную активность бактерии B.subtillis, входящей в его состав и, как следствие, уменьшить число погибших растений от поражения A. alternatа на 25,5% по сравнению с вариантом без облучения. Ризоплан характеризовался высокой эффективностью в борьбе с A. alternatа, а применение лазерного облучение еще в большей степени стимулировало синтез бактериальных метаболитов фунгицидного действия, что позволило полностью избежать гибели растений от болезни. Пораженность растений альтернариозом отразилась на их росте и урожайности. При использовании облученных препаратов Алирин — Б и Ризоплан высота растений была больше на 47,8% и 28,8%, соответственно, а урожайность на 60% и 25,6% соответственно по сравнению с вариантом без облучения.
Дано обоснование использования метода медленной индукции флуоресценции хлорофилла (МИФХ) для оценки физиологического состояния растений в условиях in vitro без нарушения стерильности. На высечках микрорастений яблони, контактным способом проведены экспериментальные исследования по определению максимально допустимой плотности мощности возбуждающего МИФХ излучения по критерию устойчивости к фотодеструкции. Теоретически обоснованы оптико-электронная схема и параметры рабочих органов прибора (спектральный состава интенсивность и длительность зондирующего излучения, возбуждающего флуоресценцию; параметры фотоприемника, регистрирующего МИФХ), проведен расчет-обоснование оптической схемы формирования зондирующего потока, возбуждающего флуоресценцию.
Разработано, изготовлено и испытано 2 макетных образца нового оборудования, по сумме параметров выбран оптимальный вариант конструкции прибора. Проведенные эксперименты показали, что предлагаемые критерии диагностики позволяют корректно судить о физиологическом состоянии растений в условиях in vitro с минимальным влиянием на их жизнедеятельность. Подготовлено техническое описание и инструкция по эксплуатации компьютеризированного оптико-электронного прибора для оценки физиологического состояния растений в условиях in vitro.
Обоснована необходимость изучения характера влияния на растения избыточного содержания микробных метаболитов в субстрате, синтезированных таким количеством бактерий — биоагентов контроля патогенов, которое в 2 и более раз превышает число КОЕ в их рабочих растворах. С использованием прибора для оценки физиологического состояния растений в условиях in vitro установлено, что такое увеличение концентрации фильтрата культуральной жидкости бактерий из различных биопрепаратов в питательной среде не оказывает негативного влияния на фотосинтетический аппарат микрорастений огурца и томата.
ПЕРЕЧЕНЬ СОКРАЩЕНИЙ И ОБОЗНАЧЕНИЙ
БСЗР-биологические средства защиты растений
МИФХ- медленная индукция флуоресценции хлорофилла
Fm -максимум флуоресценции
Ft -стационарный уровень флуоресценции
KfT — показатель фотосинтетической активности
Vt — динамический показатель флуоресценции
MS- Мурасиге-Скуга
ФСА- фотосинтезирующий аппарат
ФХ — флуоресценция хлорофилла
КОЕ — колониеобразующие единицы
Введение
Микробиологическая защита сельскохозяйственных культур от болезней представляет собой важнейшую часть защиты растений в целом, а её технологии базируются на использовании разнообразия микроорганизмов-антагонистов и гиперпаразитов возбудителей болезней растений с полифункциональным типом действия на растения и фитопатогенные микроорганизмы [80].
Но эффективность биологических средств защиты растений (БСЗР) не всегда бывает достаточной для подавления возбудителей опасных болезней в связи с их ограниченным сроком хранения, инактивацией высокими температурами и интенсивным светом, чувствительностью к условиям их применения, реакцию на ценотическое окружение. Все эти факторы приводят к снижению эффективности защитных биопрепаратов.
Перспективным способом решения проблемы может стать применение фоторегуляторного действия низкоинтенсивного когерентного, в частности лазерного излучения. В ходе реализации государственного задания в 2016-2018 гг. установлены закономерности стимуляции микроорганизмов биопрепаратов когерентным светом, созданы различные установки для лазерной активации микроорганизмов, на основе проведённых лабораторных исследований, доказана их эффективность. Следующим этапом разработки средств и методов биофотоники является их апробация на растениях, выращиваемых в условиях защищенного грунта наиболее приближенным к производственным.
Не смотря на относительную безопасность для растений биологических средств защиты, нарушение технологии их использования, применение рабочих растворов с высокой концентрацией и агентов биоконтроля с высокой физиологической активностью после лазерной стимуляции может привести к избыточному накоплению микробных метаболитов в грунте. В связи с этим, актуальной задачей является определение характера влияния высоких концентраций метаболитов бактерий-агентов биоконтроля на растения.
Перспективным для изучения реакции растений на какой-либо фактор в контролируемых условиях опыта является метод культуры in vitro. Изучение особенностей протекания физиологических процессов в растительных тканях требует наличия адекватных методов оценки реакции растении. Как правило, при выращивании микрорастений используют визуальный способ контроляих состояния на основе балльной оценки морфологических параметров.
Наиболее важный физиологический параметр состояния растений, активность их фотосинтезирующего аппарата, можно оценить с помощью флуоресцентного анализа, который носит неразрушающий характер и позволяет регистрировать динамические процессы. Такая экспресс-диагностика функционального состояния растений в культуре in vitro в короткие сроки выявляет биологический эффект от воздействия того или иного внешнего фактора на исследуемый объект или процесс [10; 11; 90].
Цель исследований: повышение функциональной активности микроорганизмов защитных биопрепаратов посредством лазерной обработки.
Задачи исследований:
— Анализ научной и патентной литературы, обоснование технических решений, разработка методологии исследований.
— Испытание лабораторного образца технологической установки для лазерной обработки защитных биопрепаратов. Оптимизация параметров облучения по активности различных микроорганизмов.
— Разработка компьютеризированного оптико-электронного прибора для оценки физиологического состояния растений в условиях in vitro.
— Оценка характера воздействия на растения метаболитов бактерий защитных биопрепаратов после лазерного облучения в культуре in vitro.
— Определение влияния биопрепаратов, облученных когерентным светом, на фитосанитарное состояние растений в условиях защищенного грунта.
1. Испытание лабораторного образца технологической установки для лазерной обработки микроорганизмов защитных биопрепаратов
Анализ литературы за последние годы (2018-2019гг.) показал, что проблема биологической защиты растений становится все популярнее, проводится апробация известных биопрепаратов, а также создаются их новые формы, разрабатываются комплексные подходы к решению экологически безопасной защиты растений с включением биологических, физических и химических методов борьбы с болезнями сельскохозяйственных растений.
Перспективным направлением в рамках органического земледелия является использование для контроля патогенов и вредителей штаммов микроорганизмов, способных продуцировать широкий спектр метаболитов с антимикробным действием, отличающихся высокой скоростью роста, генетической стабильностью, конкурентоспособностью, низкой чувствительностью к биоценотическим факторам и безопасностью для окружающей среды [34].
В настоящее время существенно изменились требования к биотехнологическим продуктам, которые должны соответствовать современным принципам экологически сбалансированного земледелия. Новые подходы к применению микробных препаратов, в основе которых лежит стимуляция микробно-растительных взаимодействий, способствующих связыванию азота, защите растений от фитопатогенных микроорганизмов, а также увеличение их общей стрессоустойчивости являются перспективным направлением биологической защиты растений [75].
Биопрепараты на основе живых культур микроорганизмов помимо их экологической безопасности и наличия базовых свойств, таких как фунгицидная активность, азотфиксирующая способность, мобилизация труднорастворимых фосфатов должны также сохранять свои положительные характеристики в условиях действия различных внешних факторов. Кроме того, микроорганизмы биопрепаратов должны формировать продуктивные микробно — растительные системы с широким спектром сортов растений [29].
И.И. Новиковой [52] обоснована возможность использования для снижения плотности популяций фитопатогенных микроорганизмов и фитосанитарной оптимизации агроэкосистем полифункциональных биопрепаратов на основе штаммов микробов-антагонистов, обладающих как прямым целевым действием на вредные объекты (за счет комплексов антибиотиков и гидролитических ферментов), так и повышающих стрессо-и болезнеустойчивость и опосредованно защищающих растения за счет фиторегуляторной активности штаммов-продуцентов.
Наиболее быстрый и весомый экономический эффект микробиологических препаратов проявляется при разработке региональных схем их применения, учитывающих ряд аспектов, таких как характеристики почвенного покрова, агроклиматические условия, сортовое разнообразие, особенности агротехники и др. При этом биологические средства защиты растений не отменяют, а лишь ограничивают использование химикатов, способствуют повышению эффективности и совершенствованию большинства традиционных агротехнических мероприятий [33].
Бактерии рода Bacillus (B. amyloliquefaciens, B. subtilis) и Pseudomonas (P. aureofaciens, P. fluorescens) являются распространенными продуцентами биологических фунгицидов [45; 83].
Установлено, что штаммы Bacillus subtilis проявляют разностороннее действие на возбудителей заболевания: вырабатывают антибиотики, являются антагонистами по отношению к фитопатогенам, повышают иммунитет растения. Кроме того, в большинстве случаев они проявляют стимулирующий эффект в отношении защищаемой культуры [54; 65].
Большой интерес, с точки зрения спектра подавляемых патогенов и возможностей, выпускаемых препаративных форм, представляют такие препараты как Алирин Б и Гамаир на основе бактерий р. Bacillus[58].
Р.А. Тиевым с соавторами [70] проведены исследования по изучению и разработке комплексной защиты томата в открытом грунте от болезней. Определены более эффективные комплексы с включением Фитоспорина М (Bacillus subtilis), после применения которых повышается урожайность плодов томата и показатели качества плода.
По мнению А.В. Кириченко [32] с соавторами также рекомендуют использовать системный, комплексный подход к решению проблемы заболеваемости томата, который предполагает применение биологических и физических методов (электромагнитные поля крайне низкой частоты). Это позволяет продлить срок хранения и обеспечить высокий уровень безопасности на всех этапах от выращивания до конечного получения потребителями продукции.
Отмечена эффективность действия бактерии Bacillus subtilis на увеличение массы листьев растений сладкого перца. При совместном действии бактерий и гуминовых препаратов повышалась численность плодов на растениях [55].
На томате защищенного грунта проводились исследования по определению биологической эффективности фунгицида Оргамика С, Ж (Bacillus amyloliquefaciens)против корневых гнилей. Установлено, что биологическая эффективность Оргамики С, Ж (5 л/га) после третьей обработки составила 70,3 % [45].
Д.В. Маслак [37]с соавторами изучено влияние обработки семян растений кресс-салата суспензией бактерий различных штаммов рода Pseudomonas, перспективных для создания биопрепарата корнестимулирующего действия. Так, при обработке семян растений кресс-салата бактериальными суспензиями штаммов Pseudomonas sp. K-1, Pseudomonas sp. K-8, Pseudomonas sp.K-9 и Pseudomonas putida В-40. отмечено увеличение продуктивности.
Актуальной проблемой является сохранение и повышение активности микроорганизмов, входящих в состав защитных средств биологического контроля болезней растений, в период хранения и транспортировки. Стимуляция физиологической активности биоагентов, входящих в состав препаратов, необходима в связи с быстрой потерей эффективности их действия против опасных фитопатогенов. Способом решения данной проблемы может стать применение фоторегуляторного действия низкоинтенсивного когерентного света (лазерного излучения).
Методика исследований
Внесение биопрепаратов Алирин-Б и Ризоплан в грунт растений томата в условиях теплицы
Исследования проводились на базе учебно-исследовательского тепличного комплекса и научно-исследовательской проблемной лаборатории «Биофотоника» ФГБОУ ВО «Мичуринский государственный аграрный университет».
В эксперимент были включены горшечные растения томата сорта Орлик, выращенные в условиях пленочной теплицы в весенне-летний период.Сорт Орлик −включен в Госреестр по Российской Федерации для использования в открытом грунте и пленочных укрытиях. Очень ранний. Растение детерминантное. Лист среднего размера, зеленый, соцветие простое. Плодоножка с сочленением, плод округлый, гладкий, плотный. Окраска незрелого плода светло-зеленая, зрелого — оранжевая, число гнезд 2.Средняя масса плода 53 г. Урожайность товарных плодов под пленочными укрытиями 5,2 кг/м2.
Использование грунта, зараженного Alternaria alternata создало провокационный фон для развития альтернариоза на растениях томата. В качестве субстрата применяли торфяную смесь марки Агробалт, в которую вносили инокулюм патогена. Состав смеси: верховой сфагновый торф низкой степени разложения, известняковая (доломитовая) мука, комплексное минеральное удобрение. Основные питательные вещества: N — 150 мг/л; Ca — 120 мг/л; Mg — 30 мг/л; P2O5 — 150 мг/л; K2O — 250 мг/л; рН — 5; влажность — не более 65.
Растения томата высаживали в горшки объемом 2,5 л. Их размещали в пленочной теплице по 12 штук на 1 м2.
В эксперименте использовали рабочие растворы биопрепаратов в концентрации, рекомендуемой производителем. Под корень растений томата вносили облученные квазимонохроматическим (когерентным) светом и необлученные биопрепараты Алирин-Б (Bacillus subtilis) и Ризоплан (Pseudomonas fluorescens).
Облучение проводили на лабораторном образце технологической установки для лазерной обработки микроорганизмов защитных биопрепаратов (два полупроводниковых лазерных модуля с выходной максимальной мощностью 50 мВт, длиной волны 660 нм).Скорость перекачки рабочего раствора через ёмкость облучения составляла 0,5 литра в минуту. Облучение проводили по истечению 30 минутной темновой адаптации. После облучения рабочие растворы биопрепаратов выдерживали в течение 2 часов на свету.
Внесение биопрепаратов в грунт начинали в фазу появления 3-4 настоящих листьев и продолжали до сбора урожая. В период роста и развития растений проводили оценку степени поражения болезнями, высоты растений, интенсивности цветения и урожайности согласно общепринятым методикам [5; 40].
В разных вариантах опыта для обработки грунта использовали:
1) Алирин-Б;
2) Алирин-Б + лазерное облучение;
3) Ризоплан;
4)Ризоплан + лазерное облучение.
Контролем служили растения без применения биопрепаратов, их полив проводился только водой.
Результаты исследований
Кратковременное воздействие лазерного излучения способно при определённых условиях существенно повышать функциональную активность живых организмов. Для обеспечения процесса лазерной обработки микроорганизмов защитных биопрепаратов был разработан лабораторный образец технологической установки, выполненной в виде единого блока, в котором проводится облучение рабочего раствора в проточном режиме когерентным светом на длине волны 640…660 нм (рисунок 1, 2). Интенсивность лазерного излучения меняется в диапазоне от 0,1 до 10 Вт/м2. Блок управления установкой позволяет с помощью блока питания насоса дискретно устанавливать 3 скорости прокачки:
6 вольт – 0,5 литра в минуту;
9 вольт – 1,2 литра в минуту;
12 вольт – 1,5 литров в минуту.
Оптимальные режимы облучения устанавливаются предварительно экспериментальным путем для каждого типа защитного биопрепарата. Процесс прокачки жидкости и его облучение продолжается до тех пор, пока рабочий раствор в емкости облучения будет откачена полностью. Конструкцией установки предусмотрен специализированный датчик уровня жидкости в емкости, построенный по весовому принципу. Когда уровень жидкости подходит к критическому значению, датчик подает сигнал на блок управления установкой и происходит отключение насоса и лазеров. Это позволяет существенно снизить трудоемкость процесса облучения, так как оператор занят только несколько секунд в момент запуска установки и проверки ее работоспособности. Например, при оптимальной скорости прокачки 0,5 литра в минуту 30 литровый объем рабочего раствора будет обрабатываться более часа и все это время установка работает в автономном режиме.
Внутреннее пространство блока управления установкой разделено на две условные зоны: справа — зона расположения электронных узлов и схем, слева – зона размещения ёмкости облучения и датчика контроля уровня жидкости в нем.

Рисунок 1− Передняя панель блока управления установкой.


Рисунок 2 − Фотоприемный узел контроля уровня лазерного излучения в рабочей зоне
Исследовали антагонистическую активность и реакцию на лазерное облучение бактерий Paenibacillus polymyxaП и Bacillus amyloliquefaciens 01-1 из комплексных биопрепаратов КМП-St и КМП-3, полученных в Федеральном государственном бюджетном учреждении науки «Научно-исследовательский институт сельского хозяйства Крыма».
КМП-St универсальный комплекс, применяется практически под все сельскохозяйственные культуры, плодовые деревья (персик, черешня), ягодные (малина, клубника) и декоративные.
КМП-3 – препарат находится на стадии изучения.
Проведенные исследования показали, что данные препараты в своем составе имеют бактериальные штаммы с выраженным антагонистическим эффектом в отношении патогенных микроорганизмов: Pseudomonas syringae van Hall — возбудителя бактериального некроза плодовых культур; Fusarium oxysporum Schltdl. — возбудителя фузариоза томата; Alternaria alternata (Fr.) Keissl — возбудителя альтернариоза томата и картофеля. Степень подавления роста исследуемых патогенов в двойной культуре с бактерией-антагонистом P. polymyxaиз КМП-St составила 32,5%; 4,0% и 77,9% соответственно.
Комплексный биопрепарат КМП-3 также показал свою эффективность в отношении всех патогенных штаммов, используемых в качестве модельных в эксперименте. Бактерия — антагонист B. amyloliquefaciens из данного препарата подавляла рост P. syringae на 25,9%, F. oxysporum на 49,0% и A. alternata на 61,1% по сравнению с контрольными вариантами.
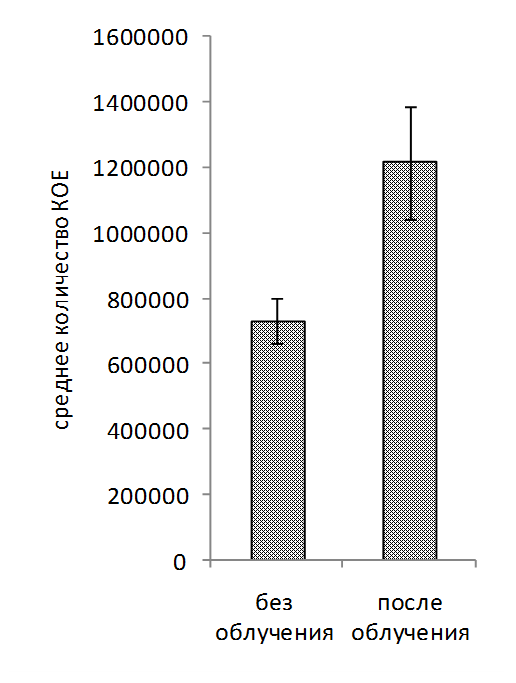
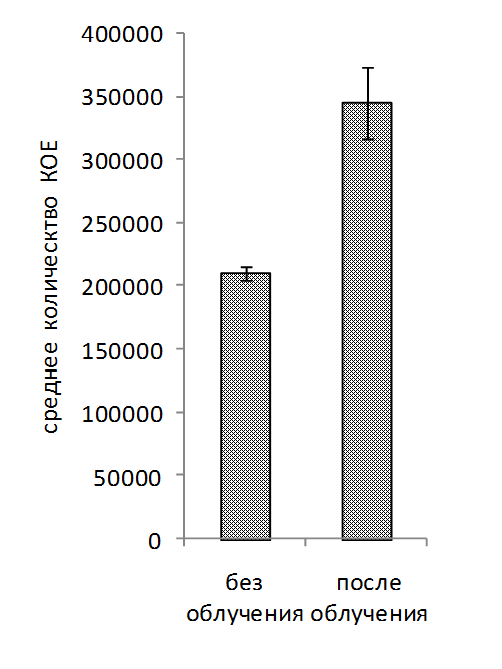
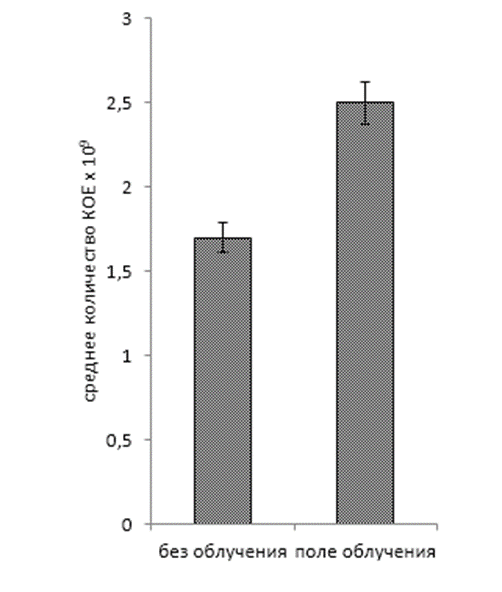
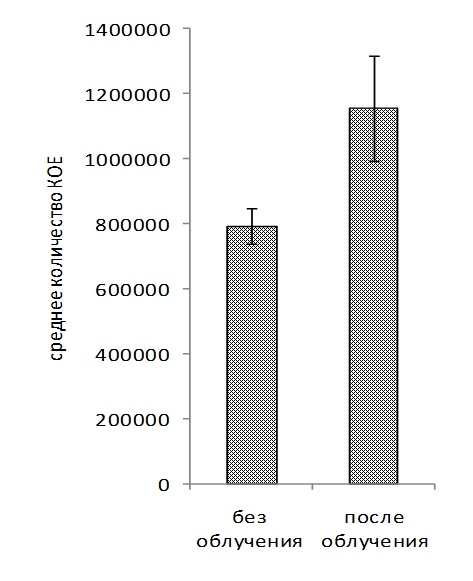
Обработка рабочих растворов биопрепаратов когерентным светом проводилась на автоматизированной установке для оптимизации режимов облучения микроорганизмов. В ходе исследований установлено увеличение числа КОЕ (колониеобразующие единицы) в рабочем растворе биопрепарата КМП-St после облучения когерентным светом в течение 60-480 св среднем на 19% по сравнению с вариантом без облучения (рисунок 3, 4, 5). Для рабочего раствора комплексного биопрепарата КМП-3 эффективными оказались длительности экспозиций 120-480 с, при которых увеличение числа КОЕ составило в среднем 15%.
Одним из распространенных грибных заболеваний томата является альтернариоз, или коричневая гниль, которая поражает все надземные органы растений (листья, стебли, черешки листьев, плоды, плодоножки). Болезнь особенно активно развивается в начале образования плода и проявляется в виде темных, округлых пятен в местах растрескивания ткани, а также плодоножки. В условиях повышенной влажности поверхность пораженного томата покрывается бархатистым черным налетом, который состоит из спор и грибницы паразита. Зараженные плоды либо опадают, либо преждевременно созревают. Переносятся споры гриба главным образом потоком воздуха, течением поливной или дождевой воды [15; 16; 93; 94].
Представители рода Alternaria широко распространены в природе и встречаются повсеместно: в почве, на растительных остатках, в воздухе и т.д. Это, в основном, сапротрофные грибы, которые играют значительную роль в круговороте органики в природе. В последние годы все чаще появляется информация о растущем экономическом значении альтернариевых грибов. Некоторые виды приобрели патогенные свойства и вызывают болезни важных сельскохозяйственных культур.
На пасленовых культурах чаще всего выявляются мелкоспоровые виды Alternaria, такие как A. tenuissima и A. arborescen, A. solani и A. tomatophila, которые вызывают развитие крупных некрозов листьев, стеблей, плодов. Виды A. alternata и A. infectoria встречаются редко [8].
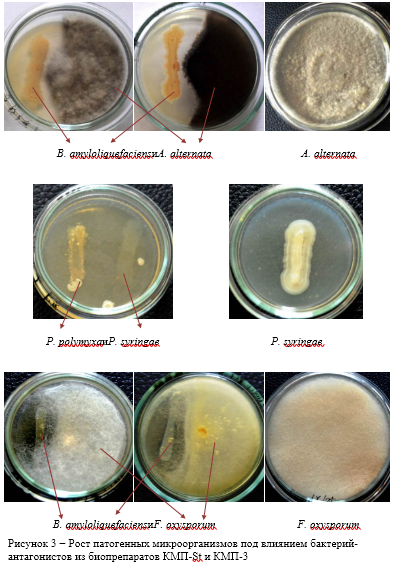
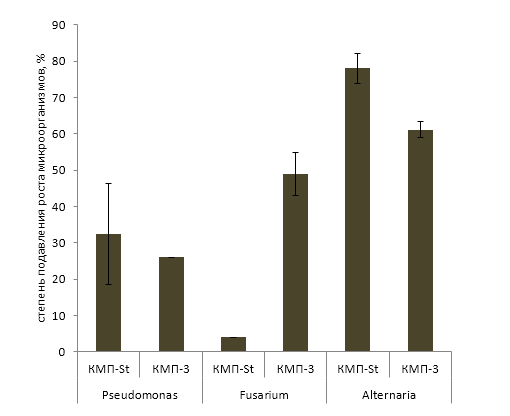
Рисунок 4−Степень подавления роста патогенных микроорганизмов под влиянием бактерий-антагонистов из препаратов КМП-St и КМП-3 при выращивании в двойной культуре
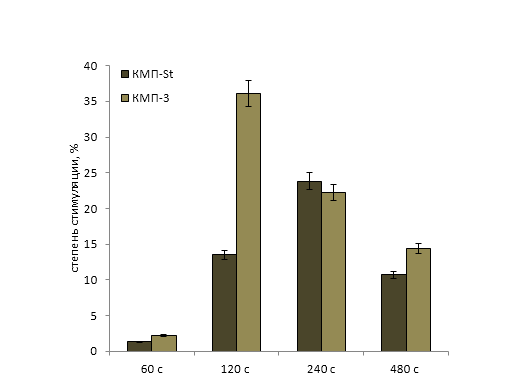
Рисунок 1 −Лазерная стимуляция биопрепаратов в зависимости от длительности экспозиции
Е.В. Ветровой [12] установлено нарушение углеводного обмена, незначительное снижение содержания органических кислот и существенное увеличение содержание витамина Свплодах томата под действием Alternaria. По данным исследователей альтернариоз снижает суммарное количество сахаров в томатах в 2,7 раза, сахарозы – в 2,4 раза, содержание редуцирующих сахаров – в 3,3 раза. Снижение суммы сахаров и сахарозы свидетельствует о нарушении углеводного обмена больных микозом растений и приводит к истощению растительного организма.
В настоящее время ассортимент препаратов, рекомендованных к применению на томате, ограничен классом неорганических фунгицидов, изготовленных на основе соединений меди, обладающих контактным, профилактическим действием, и двухкомпонентными препаратами, содержащими соединения меди (хлорокись меди), цианоацетамиды (цимоксанил) и стробилурины (фамоксадон) в различных сочетаниях[56].
Так же разрешено использование штамма Pseudomonas fluorescens, выделенного из чернозема для получения защитного препарата растений от различных фитопатогенов, в том числе грибов Alternaria [78].
Н.И. Феклистовой с соавторами [72] исследованы вне- и внутриклеточные метаболиты бактерий Pseudomonas putida F19 и Pseudomonas aurantiaca B-162.Отмечено, что они индуцируют системную устойчивость к альтернариоз у томата, огурца и др. сельскохозяйственных культур. Препараты на основе смеси высушенных культур P. aurantiaca B-162и P. putida F19 является универсальным элиситором системной устойчивости, при которой наблюдается снижение поражаемости растений альтернариозом. Элиситорная активность данных препаратов носит универсальный характер, не зависит от вида обрабатываемого растения, что позволяет их рекомендовать для применения в агропромышленном комплексе в качестве индукторов системной устойчивости растений.
С целью изучения эффективности облученных лазером защитных биопрепаратов, исследуемые растения томата высаживали в грунт, зараженный A. alternatа. В эксперименте в качестве модельных использовали Ризоплан и Алирин-Б без облучения и облученные на лабораторном образце технологической установки для лазерной обработки микроорганизмов.
В ходе проведения исследований установлены различия по фунгицидной активности B.subtillis и P.fluorescenc в вариантах с использованием лазерного облучения и без него.
Выявлено, что заражение A. alternatа привело к гибели 61,7 % растений томата обработанных препаратом Алирин-Б без облучения, 36,2% растений погибло в варианте с использованием биопрепарата, обработанного когерентным светом. Ризоплан оказался более эффективным в борьбе с альтернариозом. Его использование дало возможность сохранить 93,6% растений, а применение облученного рабочего раствора позволило избежать гибели растений томата от данной болезни. В варианте, где препараты не применялись (контроль), выпады составили 53,2%.
Часть сохранившихся экземпляров вовсе не имели симптомов поражения.В вариантах с использованием необлученного и облученного препарата Алирин-Б бессимптомных растений было 36,2% и 48,9% соответственно, на участках где применялся облученный и необлученный Ризоплан — 87,2% и 95,7% соответственно.
Таким образом, было установлено, что Алирин-Б без применения облучения оказался неэффективным в борьбе с альтернариозом томата, культивируемого в виде горшечной культуры в условиях пленочной теплицы. Облучение рабочего раствора данного препарата позволило повысить антифунгальную активность бактерии B.subtillis, входящей в его состав и, как следствие, снизить число погибших растений на 25,5%, а также увеличить количество бессимптомных экземпляров на 12,7%.
БСЗР Ризоплан характеризовался высокой эффективностью в борьбе с A. alternatа, а применение лазерного облучение еще в большей степени стимулировало синтез бактериальных метаболитов фунгицидного действия. В варианте с использованием рабочего раствора препарата погибших растений было меньше на 46,8%, а бессимптомных больше на 51,0% по сравнению с контролем. Его облучение позволило вовсе избежать выпадов растений, а число бессимптомных образцов оказалось выше на 8,5 % по сравнению с вариантом без облучения (рисунок 6, 8).
Степень поражения альтернариозом растений томата отразилась на их ростовой активности. На участке, где применялся необлученный рабочий раствор Алирина — Б, высота растений была на уровне контроля и составила в среднем 18,8 см. При использовании облученного препарата высота растений была выше на 47,8% и составила 27,8 см (рисунок 7, 8).
В вариантах с использованием необлученного и облученного рабочего раствора Ризоплан средняя высота растений составила 42,9 см и 48,6 см соответственно, что на 116,7 % и 145,5 % превышает значение данного показателя в контроле.
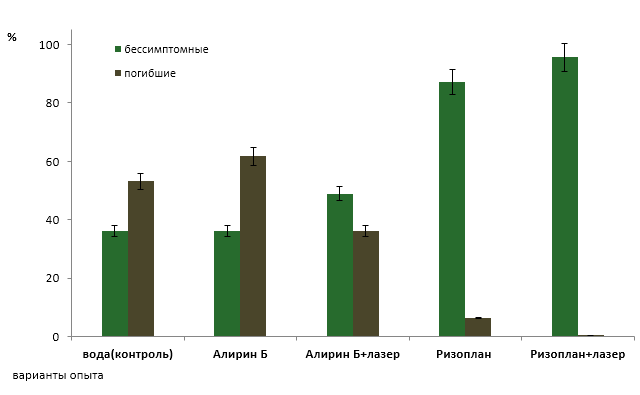
Рисунок 6 − Влияние необлученных и облученных лазером биопрепаратов на поражаемость растений томата альтернариозом
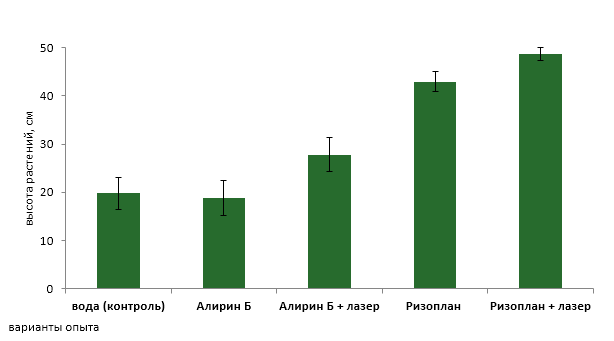
Рисунок 7 − Влияние необлученных и облученных лазером биопрепаратов на среднюю высоту растений томата

I II |
|
 |
 |
| I | II |
Рисунок 8 − Рост и развитие растений томата с симптомами поражения альтернариозом (I) и без них (II)
Проведенные исследования свидетельствуют об эффективности применения лазерного облучения рабочих растворов биопрепаратов для повышения активности бактерий, входящих в их состав. Применение БСЗР Алирин Б и Ризоплан после стимуляции когерентным светом позволило значительно повысить их ростовую активность (на 47,8% и 28,8% соответственно), за счет снижения степени поражения болезнью.
Количество завязей у растений является одним из компонентов урожайности, который отражает их максимально возможную потенциальную хозяйственную продуктивность достижимую в данных условиях [59].
Подсчет количества завязей у растений томата проводили в период между окончанием массового цветения растений и началом созревания плодов, т.е. появления единичных плодов в съемной спелости. Вызревшие плоды взвешивали, в последствие высчитывали их среднюю массу и умножали на количество образовавшихся завязей (рисунок 9).
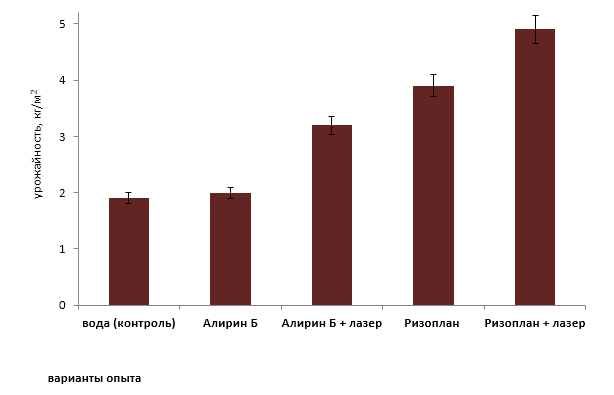
Рисунок 9 − Влияние необлученных и облученных лазером биопрепаратов на урожайность растений томата
В ходе проведения эксперимента установлено, что урожайность на участках, где применяли Алирин Б без облучения была на уровне контроля и составила 2,0 кг/м2 (в контроле – 1,9 кг/м2). Облучение рабочего раствора данного биопрепарата позволило достичь увеличения этого показателя до 3,2 кг/м2, т.е на 60%. Большие потери урожая в варианте, где биопрепараты защиты растений не применялись (контроль) и где использовали необлученный Алирин-Б, связаны с высокой степенью поражаемости растений томата альтернариозом, в связи с чем, у их значительной части плодоношение вовсе отсутствовало.
Использование Ризоплана положительно повлияло на развитие растений томата, что отразилось на их урожайности, которая в данном варианте составила 3,9 кг/м2, что вдвое превышает контрольное значение. Применение лазерного облучения позволило увеличить этот показатель до 4,9 кг/м2, т.е. на 25,6%.
2. Разработка компьютеризированного оптико-электронного прибора для оценки физиологического состояния растений в условиях in vitro
2.1. Обоснование выбранного направления исследований
Биотехнологические приемы размножения растений in vitro широко используются как в селекционной практике, так и при производстве оздоровленного посадочного материала [9; 18; 53; 61; 76]. С помощью специальных приемов в культуре in vitro сохраняют генофонд ценных и редких видов растений[14; 49] выявляют устойчивые генотипы к различным неблагоприятным факторам [63; 66; 87]. Эти методы постоянно совершенствуются: вводятся в культуру новые генотипы, модифицируются среды, оптимизируются температурные и световые режимы, используются физические и химические регуляторные приемы воздействия [13; 44; 46; 48; 60; 71; 74; 86].
В настоящее время при выращивании растений в культуре ткани используют визуальный контроль за их состоянием, как правило, проводят балльную оценку морфологических показателей [9; 30]. Однако он не позволяет выявить наиболее важный физиологический параметр — состояние фотосинтезирующего аппарата. Предварительный анализ возможных методов анализа функционального состояния растений in vitro непосредственно в колбах, без нарушения стерильности показал, что такая проблема может быть решена только с помощью дистанционных оптических методов. Известны методы оценки функционального состояния растений, основанные на определении количественного содержания фотосинтезирующих пигментов и их качественного состояния по фотометрическим параметрам, когда определяются коэффициенты пропускания, отражения или поглощения света на определенных длинах волн [28; 38]. Однако данные методы и реализующая их аппаратура в принципе не позволяют получить достоверную информацию, так как получаемые фотометрические коэффициенты в существенной степени зависят от геометрии расположения объекта в оптическом тракте, и она должна быть строго фиксированной и неизменной, что при работе с культурой ткани без нарушения ее стерильности невозможно.
Проблема решается с помощью методик исследования фотосинтетической активности по параметрам индукции флуоресценции хлорофилла, где используют не абсолютные, а относительные критерии, рассчитываемые как отношение уровней флуоресценции в различные фазы индукции флуоресценции [1; 10; 11; 36; 91]. Анализ патентной и научной литературы, рекламной информации на Интернет-сайтах ведущих фирм, выпускающих хлорофилл-флуориметры: OS(США); РАМ (Heinz Walz, Германия), РРМ (EARS, Голландия),«SPAD» (Япония)«ССМ» (Великобритания) и продукция фирм Hansatech Instruments, (Англия); LI-COR (Международная корпорация); Qubit SystemInc (Канада), «Spectrum» (Великобритания) показал, что ни в России, ни за рубежом нет приборов, адаптированных под задачи биотехнологов.
В тех случаях, когда исследователям необходимо оценить функциональное состояние растений в культуре in vitro по методике хлорофилл-флуоресценции, они вынуждены отделять кусочки фотосинтезирующей ткани от растущих в пробирке объектов [46; 87]. При этом нарушается не только стерильность материала, но и вся жизнедеятельность. Такие объекты непригодны для дальнейшего использования. Также с помощью известных приборов в принципе невозможно исследовать фотосинтезирующий аппарат (ФСА) микрорастений на то или иное воздействие.
Таким образом, предлагаемое направление актуально и для его успешного решения необходимо проведение комплексных исследований. Они должны заключаться в теоретическом и экспериментальном обосновании главных элементов проектирования оптико-электронной аппаратуры количественной оценки функционального состояния растений in vitro без нарушения стерильности.
Итоговым результатом исследований должен быть экспериментальный образец прибора, в котором должна быть предусмотрена возможность анализа состояния фотосинтезирующего аппарата растений in vitro непосредственно через стенки различных видов культуральных сосудов по критериям параметров медленной индукции флуоресценции хлорофилла.
2.2. Методика исследований
Разработку и изготовление технической базы проводили с привлечением теоретических основ конструирования оптических и электронных приборов, физического и математического моделирования, отечественного и зарубежного опыта разработок техники для прижизненного анализа биологических объектов, международных и российских стандартов [4; 19; 20; 35; 47; 57; 62; 82; 92]. В качестве источников оптического излучения для инициации флуоресценции использовали светодиоды с длиной волны 460 нм. Выходную мощность излучателей определяли с помощью универсального измерителя оптического монохроматического излучения VEGA(OHIR, Израиль). Интенсивностью зондирующего излучения управляли с помощью электронных систем питания излучателей.
Эксперименты проводили на введенных в культуру растениях яблони (Malus domestica), малины (Rúbus idáeus), ежевики (Rubus caesius L.), аронии (Arónia melanocárpa). Растения перед измерениями выдерживали не менее 30 минут в темноте или при фоновом освещении не более 20 лк.
Оценку функционального состояния культуральных растений проводили с привлечением стандартной методики медленной индукции флуоресценции хлорофилла [11; 36; 85; 89] и по авторской методике анализа устойчивости к фотоингибированию.
Повторность опытов не менее 6-ти кратной. Регистрация кривой медленной индукции флуоресценции хлорофилла происходила от 5 до 600 секунд (в зависимости от задач эксперимента) в автоматическом режиме, с помощью специально разработанной программы. Частота дискретизации — не реже 1 измерения за 1 секунду. По окончании измерений данные заносились в таблицы, совместимые с программой Excel, для последующей обработки и подготовки графиков.
При планировании и организации экспериментов, анализе данных, использовали методические подходы, изложенные в работах [22; 23; 24; 25; 43; 51]. Статистическую обработку данных и оформление результатов осуществляли с применением компьютерной программы Excel.
2.3. Результаты исследований
Анализ геометрических и оптических особенностей
объекта измерений
Анализ геометрических параметров культуральных сосудов, используемых в биотехнологии и находящихся в них растений необходим для того, чтобы задать размеры актуальной зоны возбуждения флуоресценции. В биотехнологии используются следующие типы сосудов (рисунок 10):
Пробирки диаметром 15-30 мм, высота до 180 мм;
Колбы круглые — диаметр 85 мм, высота 140 мм;
Колбы конические средние – диаметр 80 мм, высота 140 мм;
Колбы конические малые – диаметр 65 мм, высота 105 мм;
Банки цилиндрические — диаметр 50 — 90, высота 45 – 130 мм.
 |
 |
 |
 |
Рисунок 10 −Фото типовых объектов in vitro, предназначенных для
измерения
Таким образом, объем камеры для размещения культуральных сосудов должен иметь следующие размеры (не менее): 100х100х150 мм. Поскольку высота растений в сосудах изменяется по мере их развития, то следует предусмотреть в конструкции прибора механическую систему регулирования высоты расположения оптико-электронной системы приема флуоресцентного сигнала в пределах: базовая высота ± 20 мм (не менее).
При энергетическом расчете оптико-электронной системы возбуждения и регистрации флуоресценции следует также учитывать оптические параметры культуральных сосудов, а именно [67]:
— коэффициент поглощения на длине волны возбуждения флуоресценции (450-470 нм) — не более 6 %;
— коэффициент поглощения на длине волны испускания флуоресценции (640-800 нм) – не более 4 %.
Учитывая размер сосудов и наиболее вероятный объем находящихся в них растений, сделан вывод, что объем актуальной зоны измерений должен иметь следующие размеры (не менее): 30х20х20 мм.
Вторым немаловажным фактором, обеспечивающим корректность измерений, является допустимый уровень интенсивности возбуждения МИФХ. Обусловлено это тем, что судя по литературным данным, растения в культуре in vitro отличаются существенно более низкими значениями удельной фотосинтетической активности (на уровне 0,4 усл. ед.) по сравнению с растениями ex vitro (0,7-0,9 усл. ед). Низкий квантовый выход фотосинтеза приводит к фотодеструктивным процессам разрушения хлорофилла даже при низких уровнях освещенности (120-150 Вт/м2). В то же время при измерениях функционального состояния растений по параметрам индукции флуоресцентного сигнала для возбуждения флуоресценции используются так называемые насыщающие уровни зондирующего излучения (400-1200 Вт/м2). Поскольку в процессе измерений предполагается освещение довольно большой зоны растений в течение довольно длительного времени (типовое время для регистрации параметров МИФХ составляет от 3 до 5 минут), то необходимо определить оптимальный уровень зондирующего потока. Он не должен вызывать фотодеструкцию с одной стороны, но должен быть достаточным для инициации индукционных процессов и корректного определения на их основе функционального состояния фотосинтезирующего аппарата.
Теоретическое обоснование оптико-электронной схемы
и параметров рабочих органов прибора
Оптимальный диапазон длин волн для возбуждения флуоресценции хлорофилла (ФХ) соответствует максимумам поглощения хлорофилла (450..480 нм и 650..660 нм), при этом существуют специальные требования к интенсивности зондирующего излучения при работе с растениями in vitro. Основная задача при организации измерений флуоресценции — обеспечение согласования интенсивности и спектров излучения объектов со спектральными свойствами оптико-электронных элементов, особенно со спектральной чувствительностью фотоприемника S(λ) с тем, чтобы обеспечить надежную регистрацию сигнала на уровне фоновых помех и шумов фотоприемника.
Проведем энергетическую оценку люминесцентной составляющей в общем потоке рассеянного объектом излучения. Предположим, что в качестве объекта выступает интактный (живой) лист яблони с типичным содержанием хлорофилла 7..15 мг/дм2[77]. Интенсивность люминесцентного сигнала (Рл) определяется степенью эффективного поглощения возбуждающего света ![]() квантовым выходом люминесценции φ, а также спектром возбуждения и испускания люминесценции:
квантовым выходом люминесценции φ, а также спектром возбуждения и испускания люминесценции:
![]() , (1)
, (1)
где ![]() коэффициент трансформации энергетических величин в квантовые, зависящий от спектра возбуждения и испускания люминесценции.
коэффициент трансформации энергетических величин в квантовые, зависящий от спектра возбуждения и испускания люминесценции.
Оценим количественно данное выражение. Предположим, что возбуждение люминесценции проводиться на длине волны 470 нм и плотностью мощности 300 Вт/м2. Коэффициент поглощения листа на этой длине волны при выбранной концентрации пигментов составляет свыше 90 % [6; 17; 26; 68; 77]. Люминесценция хлорофилла – фотохимический процесс, поэтому для оценки интенсивности люминесцентного сигнала необходимо знать число квантов возбуждающего света (реально поглощенного объектом), квантовый выход и спектр люминесценции. Число квантов в лазерном пучке можно определить, используя преобразование энергетических единиц в квантовые[79]:
![]() , (2)
, (2)
где N– число Авогадро; h — Постоянная Планка; с – скорость света; ![]() – длина волны возбуждающего света.
– длина волны возбуждающего света.
Квантовый выход ФХ в живых листьях, с учетом перепоглощения, составляет 1-10 % [36; 88; 89; 90].Определим уровень флуоресцентного сигнала из предположения, что квантовый выход хлорофилл-люминесценции живого листа φ = 0,03; коэффициент поглощения на длине волны 470 нм ![]() а спектр люминесценции по числу квантов равномерно распределен на два диапазона – в области 690 нм и 740 нм. С учетом вышеизложенного и формулы (2), общее число квантов люминесцентного сигнала для зондирующего пучка с плотностью мощности 300 Вт/м2, будет составлять не менее 4∙10‑5 моль∙м-2∙с-1. Обратное преобразование числа фотонов в мощность потока по уравнению (2), с учетом преимущественных длин волн люминесценции 690 нм и 740 нм, позволяет получить интенсивность люминесцентного сигнала от типового листа не менее 3,5 Вт/м2 на длине волны 690 нм и 3,3 Вт/м2 на длине волны люминесценции 740 нм, что в сумме составит более 6,8 Вт/м2.
а спектр люминесценции по числу квантов равномерно распределен на два диапазона – в области 690 нм и 740 нм. С учетом вышеизложенного и формулы (2), общее число квантов люминесцентного сигнала для зондирующего пучка с плотностью мощности 300 Вт/м2, будет составлять не менее 4∙10‑5 моль∙м-2∙с-1. Обратное преобразование числа фотонов в мощность потока по уравнению (2), с учетом преимущественных длин волн люминесценции 690 нм и 740 нм, позволяет получить интенсивность люминесцентного сигнала от типового листа не менее 3,5 Вт/м2 на длине волны 690 нм и 3,3 Вт/м2 на длине волны люминесценции 740 нм, что в сумме составит более 6,8 Вт/м2.
Таким образом, величина люминесцентного сигнала превосходит порог чувствительности большинства известных фотоприемников. После выбора конкретной марки фотоприемника можно осуществить предварительную оценку возможного уровня выходного электрического сигнала, для чего воспользуемся общим выражением для отклика фотоприемникаU[2, 91]:
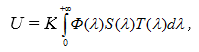 (3)
(3)
где К – коэффициент, учитывающий площадь фоточувствительной площадки и длительность экспозиции; ![]() спектральная плотность измеряемого излучения;
спектральная плотность измеряемого излучения; ![]() – спектральная характеристика чувствительности фотоприемника;
– спектральная характеристика чувствительности фотоприемника; ![]() – спектральная характеристика пропускания светофильтров между объектом и фотоприемником (рисунок 11).
– спектральная характеристика пропускания светофильтров между объектом и фотоприемником (рисунок 11).
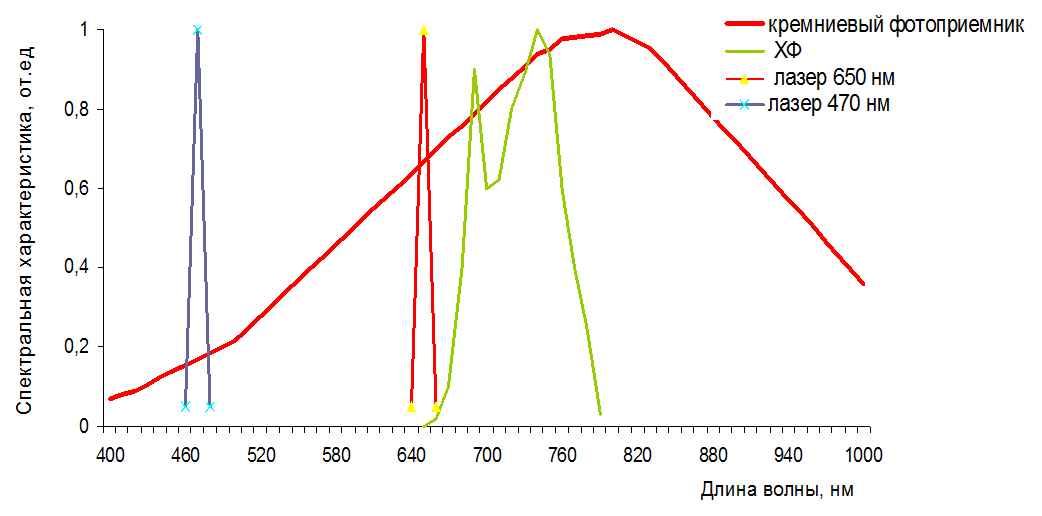
Рисунок 11 − Спектральные характеристики излучения источников, возбуждающих флуоресценцию, спектра испускания флуоресценции хлорофилла (из Lichtenthaler, 1988) и кремниевого фотоприемника [2]
Выбор конкретного фотоприемника должен проводиться по принципу стократного превышения расчетного уровня флуоресценции над порогом чувствительности фотоприемника в красной и ближне-красной области спектра, что обеспечит надежную регистрацию информационного сигнала с минимальным уровнем шумов при различных концентрациях хлорофилла в листьях.
Дальнейшая оптимизация структурно-функциональной схемы и основных рабочих органов прибора, в том числе интенсивности и длительности зондирующего излучения, геометрии оптического тракта эффективнее проводить экспериментальным путем, ввиду больших отклонений реальных параметров оптико-электронных устройств от справочных и даже паспортных данных.
Экспериментальное выявление максимально допустимого
для культуры in vitro значения интенсивности
возбуждения МИФХ при контактном способе измерений
Для проведения экспериментов был использован оптический стенд оценки устойчивости листьев растений к фотодеструкции (рисунок12, 13), включающий источник излучения 1 с длиной волны 465 нм, светофильтр 3, фотодиод 4, подключенный через линейный дифференциальный усилитель 5 к цифровому регистратору 6. Регулировка мощности светового потока излучателя производилась изменением тока накачки в диапазоне от 10 до 650 Вт/м2 с помощью схемы управления 7. Измерения фотодеструктивной реакции листьев (2) проводили в режиме пропускания, при этом фотоприемник (4) располагали на максимально близком расстоянии от листа (2), что обеспечивало условие максимального светосбора (угол приема рассеянного излучения составлял 150о…180о). Начало фотодеструкции регистрировали по подъему кривой светорассеяния листа, обусловленное выцветанием хлорофилла. Фиксировали время Тфд, прошедшее с начала включения зондирующей засветки до подъема кривой светорассеяния на 10-15 %.
7
2
5
6
1
3
4
Рисунок 12 − Структурная схема стенда для выявления максимально допустимой интенсивности излучения возбуждения флуоресценции в листьях растений культуры in vitro. 1 – излучатель, 2 – объект измерений, 3 – светофильтр, 4 – фотоприемник, 5 – усилитель, 6 –регистратор, 7 – блок управления излучателем
 |
 |
Рисунок 13 − Внешний вид стенда и схемы усилителя оптического сигнала
Листья подвоя яблони 47-118, введенного в культуру, извлекали из колбы с помощью пинцета и укладывали в зоне измерения верхней стороной к излучателю. Регистрировали в течение 600 секунд интенсивность светопропускания листа, и на основании графиков профиля светорассеяния определяли параметр Тфд (время наступления фотодеструкции).
График зависимости Тфд от плотности мощности зондирующего излучения (рисунок14) показывает, что при оптимальных для инициирования МИФХ интенсивностях 600-1200 Вт/м2 фотодеструктивные процессы наступают уже на первой минуте засветки, что существенно меньше, чем у листьев подвоя яблони ex vitro. В то же время, для получения корректных параметров МИФХ кривую тушения флуоресценции следует регистрировать в течение 3-5 минут.
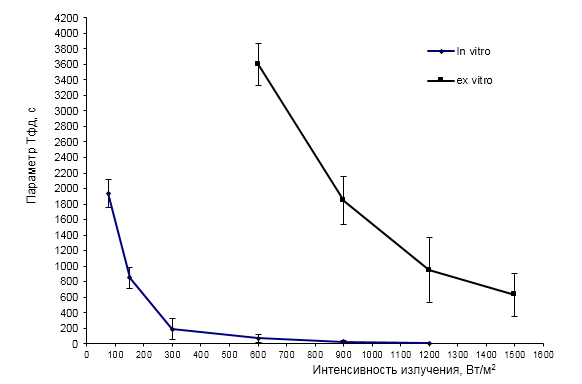
Рисунок − 14Зависимость параметра «время наступления фотодеструкции Тфд» от интенсивности зондирующего излучения
Таким образом, оценивать функциональное состояние растений in vitro по параметрам медленной индукции флуоресценции хлорофилла можно только с условием использования зондирующего излучения с плотностью мощности менее 240 Вт/м2, так как только ниже этого уровня можно гарантировать отсутствие фотодеструктивных повреждений измеряемых объектов за стандартное время измерений. Однако, это существенно меньше насыщающего уровня, необходимого для корректной оценки параметров МИФХ. Как показывает авторский опыт разработки хлорофилл-флуориметров для растений ex vitro, базовые параметры МИФХ существенно зависят от интенсивности зондирующего излучения. При этом использование плотностей мощности излучателя синей области спектра ниже 100 Вт/м2 приводит к значительному искажению получаемых данных и снижению динамического диапазона показателей (в 2-3 раза). Это в свою очередь, снижает надежность диагностики.
Поскольку фотодеструктивные и фотохимические процессы имеют дозовый характер, то выявленное противоречие может быть решено посредством использования необходимых для развития светоиндуцированных процессов МИФХ уровнях интенсивности зондирующего излучения с пропорциональным и существенным сокращением длительности засветки и использованием специальных алгоритмов обработки получаемых данных. Соответственно, это должно быть учтено при разработке конструкции прибора.
Разработка оптической схемы формирования
зондирующего потока, возбуждающего флуоресценцию
В процессе работы были выбраны и изготовлены 4 оптические схемы формирователей, отвечающих трем критериям оптимизации: максимальная компактность, максимальная однородность плотности мощности в заданном геометрическом объеме и возможность совмещения оптических трактов излучателя и приемника флуоресцентного сигнала от объекта измерения.
1 тип формирователя (условное название- МАТРИЦА): матрица 3 и 5 миллиметровых СИД типа 5013 UBC световой яркостью 6000 микро Канделл, напряжение питания 3,3 В; длина волны 460 нм, расходимость излучения 20о. На подложке из прозрачного оргстекла, изогнутого в виде полуцилиндра с радиусом 55 мм и высотой 140 мм сформирована сетка из СИД с шагом 12,5 мм по центру излучателей по горизонтали и 10 мм – по вертикали. Всего 7 рядов по 9-10 излучателей. 4 ряда из 5 мм СИД (по 10 шт. в ряду) и 3 ряда из 3 мм СИД (по 9 шт. в ряду). СИДы каждого ряда смещены относительно другого, образуя шахматный порядок расположения излучателей (рисунок15). Матрица подключена к пульту, позволяющему подключать ряды с СИДами в различных комбинациях.

Рисунок 15 − Внешний вид формирователя «МАТРИЦА»
2 тип формирователя (условное название – ТОЧКА) — мощный планарный светодиод на радиаторе типа «звезда», который может рассматриваться как точечный излучатель. Параметры: размер (с радиатором) – Ø 18 мм, размер СИД без радиатора – толщина — 6 мм, длина волны — 470 нм, номинальный ток питания – 660 мА, потребляемая мощность — 3 Вт, номинальное напряжение питания — 3,3 В, расходимость излучения – 120о. Для обеспечения длительной работы без перегрева, СИД располагали на дополнительном радиаторе из алюминия размером 90х50х25 мм (рисунок16).
3 тип формирователя (условное название — «КОЛЬЦО») — составленный из 9 синих 3 мм СИД, расположенных по кругу диаметром 40 мм и коллиматора диаметром 38 мм (рисунок 17). В геометрическом центре кольца изСИД расположено отверстие диаметром 20 мм, в котором закреплен световод для передачи испускаемой объектом флуоресценции к фотоприемнику. Параметры СИД аналогичны описанному в 1 типе формирователя «МАТРИЦА».
 |
 |
| Рисунок 16 − Внешний вид
формирователя «ТОЧКА» |
Рисунок 17− Внешний вид
формирователя «КОЛЬЦО» |
4 тип формирователя (условное название «ПОЛОСА») – представляет собой матрицу из миниатюрных планарных СИД, сформированную в виде полосы 20х50 мм. Для этого СИДы в количестве 22 штук припаивали непосредственно на фольгированную стеклотекстолитовую подложку в 4 ряда, в шахматном порядке с шагом 6-7 мм по горизонтали и 8-9 мм по вертикали (рисунок18).

Рисунок 18− Внешний вид формирователя «ПОЛОСА»
Параметры используемых СИД: длина волны – 465 нм, размер – 3х3х1,5 мм, номинальный потребляемый ток – 20 мА, расходимость – 120о, номинальное напряжение питания – 3,2 В.
Испытание формирователей зондирующего
оптического потока
Цель испытаний — оценить однородность и уровень плотности мощности излучения на различных расстояниях от излучателя. Для этого использовали полупроводниковый фотоприемник с площадью фоточувствительной площадки размером не более 1 см2, с помощью которого проводили измерения интенсивности излучения в различных точках объема наиболее вероятного местонахождения исследуемых объектов. Для удобства регистрации распределения интенсивности световых полей использовали двухкоординатную матрицу с шириной окна 10х10 мм. Количественно световые поля оценивали с помощью универсального измерителя интенсивности оптического монохроматического излучения Vega фирмы OPHIR, Израиль (рисунок 18). Критерий выбора оптимальной оптической схемы – минимальная неоднородность плотности мощности при достаточном для формирования МИФХ уровня излучения в актуальных зонах засветки. На рисунках 19 — 22 приведены образцы световых полей от разработанных излучателей, а в таблице 1 – результаты испытаний (рисунок 19, 20, 21, 22; таблица 1).
 |
 |
| Рисунок 19− Измерение распределения интенсивности светового поля | Рисунок 20−. Вид светового поля, сформированного излучателем «ТОЧКА» |

Рисунок 21−Вид светового поля, сформированного излучателем «ПОЛОСА»

Рисунок 22 − Вид светового поля, сформированного излучателем «МАТРИЦА»
Таблица 1 − Результаты испытаний излучателей
| Параметр | Тип формирователя, параметры питания | |||
| «ТОЧКА»,
3,3 вольта, 760 мА |
«КОЛЬЦО»
3,3 вольта, 180 мА |
«ПОЛОСА»
3,3 Вольта, 440 мА |
«МАТРИЦА»
3,3 Вольта, 820 мА |
|
| Форма и размер зоны засветки с интенсивностью более 90 вт/м2 | Окружность диаметром
92 мм |
Окружность диаметром
57 мм |
Прямоугольник
124х92 мм |
Прямоугольник
168х144 мм |
| Расстояние зоны засветки с интенсивностью более 90 вт/м2 от излучателей | 48 мм | 64 мм | 36 мм | 85 мм |
| Диапазон перепада интенсивности в рамках зоны засветки с интенсивностью более 90 вт/м2 | 96…428 Вт/м2 | 89…116 Вт/м2 | 92…194
Вт/м2 |
95…360
Вт/м2 |
| Размер области равномерной засветки (с неравномерностью менее 40 %), мм | 60х60х15 | 35х35х57 | 54х38х48 | 36х32х12 |
По комплексу параметров, наилучшие результаты дают формирователи «КОЛЬЦО» и «ПОЛОСА». При наименьшей энергии потребления, они обеспечивают максимально удобные световые поля для возбуждения флуоресценции в растениях in vitro через стенки различных культуральных сосудов.
Разработка лабораторного стенда для проведения исследований
по оптимизации режимов и алгоритмов диагностики
Для оптимизации параметров циклического режима измерений, позволяющего за один измерительный цикл оценивать фотосинтетическую активность и устойчивость к фотоингибированию, был изготовлен оптический стенд, позволяющий изменять интенсивность зондирующего излучения (I), длительность засветки (Тс) и длительность темновой паузы (Тт) в широких пределах: I – 100….600 Вт/м2; Тс – 10…300 с; Тт – 1….600 с.
Техническая база для проведения исследований, представляет собой оптико-электронную схему открытого типа, с возможностью оперативного изменения интенсивности возбуждения флуоресценции и длительности воздействия зондирующего потока при минимальных настройках оборудования (рисунок 23).
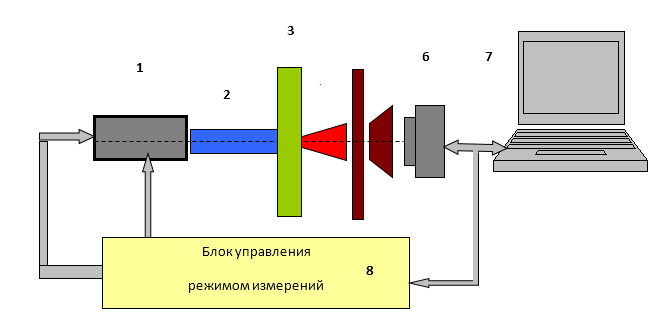
Рисунок 23− Структурная схема лабораторного стенда для оптимизации параметров циклической засветки: 1 – источник зондирующего излучения; 2 – поток зондирующего излучения, возбуждающий флуоресценцию; 3 – объект измерения; 4 – флуоресцентный поток; 5 — светофильтр; 6 – фоторегистратор (цифровая USB-камера) 7 — компьютер; 8 – интерфейс управления циклическим режимом засветки
Для реализации циклического режима включения-отключения источника зондирующего излучения, был разработан и изготовлен на базе микропроцессорного комплекта Ардуино блок управления режимом циклической засветки (рисунок 24).
Необходимость в данной разработке была вызвана следующими причинами. Для управления внешней нагрузкой промышленностью выпускаются электромеханические или цифровые таймер-розетки, но они не способны обеспечить достаточную точность выдержки времени, не работают в секундном диапазоне (дискретность задания длительность включения-отключения – не менее 1 минуты) и требуют обязательного наличия сетевого напряжения. Помимо этого, чтобы обеспечить циклический режим включения-отключения и повторного включения нагрузки необходимо как минимум два таймера, имеющие цепи синхронизации и взаимного управления.

Рисунок 24− Электронные блоки на базе микропроцессорного комплекта ARDUINO, реализующие циклический режим работы излучателя по команде с компьютера через USB-порт
Существуют также специализированные системы сопряжения компьютера с внешними устройствами, использующими программу управления по COM или LPT портам, однако в современной портативной компьютерной технике типа нетбуков или ноутбуков нет данных портов. Поскольку использование стационарного компьютера не всегда удобно для решения подобных задач, то приходится приобретать специальные дорогостоящие внешние карты или переходники с виртуальным COM или LPT портом, которые требуют дополнительной установки, настройки программного обеспечения и обслуживания. Анализ современного уровня техники показал, что для разработки недорогих устройств управления внешними нагрузками от компьютера наиболее перспективны микропроцессорные комплекты ARDUINO. Они подключаются к USB-порту компьютера, не требуют дополнительных источников питания, имеют небольшие габариты и невысокую цену. После прошивки программы такие устройства могут работать и автономно, без компьютера при условии введения дополнительных радиоэлектронных элементов подачи команды «пуск».
Испытания системы показали высокую универсальность устройства, его способность реализовывать самые различные комбинации циклического режима засветки – от 0,5 сдо нескольких часов и неограниченным числом циклов и вероятностью ошибок срабатывания менее 0,01%.
Наиболее проблемным местом таких разработок является согласование одновременной работы двух программ, использующих одновременно два канала управления по USB-портам компьютера, в нашем случае это программа циклического управления излучателем и программы сбора и обработки данных с цифровой видеокамеры, регистрирующей флуоресценцию. Они могут работать одновременно без конфликтов и «зависания» при соблюдении требования к оперативной памяти компьютера не менее 2 Гб, что также не является проблемой для современной техники (рисунок 25).
Рисунок 25− Одновременная работа двух программ – управления циклическим режимом излучателя и программы съема и обработки сигнала МИФХ
Обоснование критериев (показателей) функционального
состояния растений in vitro на базе параметров
медленной индукции флуоресценции хлорофилла
В процессе рекогносцировочных измерений было выявлено, что вследствие неопределенности ориентации растения в измерительном канале многие так называемые «абсолютные» параметры МИФХ, величина которых в существенной степени зависит от плотности мощности падающего на объект излучения и от геометрической ориентации объекта относительно измерительного канала, нельзя использовать в качестве диагностических из-за очень высокой дисперсии показателей и большой вероятности получить неверные и даже взаимоисключающие данные. В итоге диагностика исчерпывается только теми показателями МИФХ, которые являются относительными и не зависят от ориентации, удаленности или геометрического расположения объекта в измерительном канале. К ним можно причислить скорость тушения флуоресценции (V), показатель фотосинтетической активности (Fm-FТ)/Fm и показатель жизнеспособности Fm/ FТ.
Для увеличения достоверности оценок предложено ввести еще один показатель – устойчивость к фотоингибированию. Причем в качестве ингибирующего света используется непосредственно измерительный зондирующий поток. Тогда процесс измерений будет заключаться в двухкратной регистрации параметров МИФХ в течение определенного времени с темновой паузой между циклами. Параметры МИФХ первого цикла позволят оценить исходное состояние фотосинтезирующего аппарата (ФСА), а параметры МИФХ второго цикла – динамику темного восстановления ФСА после фотоингибирования.
Оптимизация алгоритма измерений при оценке
степени восстановления ФСА растений после фотоингибирования
Для реализации предложенного алгоритма измерений необходимо провести оптимизацию следующих параметров (факторов): интенсивность измерительного потока (Х1), длительность темновой паузы (Х2).длительность засветки (Х3). В качестве биологического объекта исследований использовали культуральные растения карликового подвоя яблони с типовой для растений in vitro функциональной активностью ФСА (Fv/Fm ≈ 0.4…..0,5). Спектральный состав измерительного и ингибирующего света соответствовал синему максимуму поглощения хлорофилла (465 ± 8 нм). Диапазон варьирования плотности мощности зондирующего потока выбирался из соображения получения фотоингибирующего эффекта без необратимой фотодеструкции ФСА априори в диапазоне 100 ‑ 800 Вт/м2.
В качестве целевых функций использовали отношение параметров V (скорость тушения флуоресценции) и Fm-Fst)/Fm (показатель фотосинтетической активности) (Y1 и Y2 соответственно). Для расчета дисперсии факторов использовали выборку данных не менее чем 6-ти кратной повторности опытов.
Сначала был реализован трехфакторный эксперимент 23, целью которого являлось определение степени значимости факторов.
Факторы варьировали на двух уровнях:
Х1 – длительность засветки: (-1) 30 с; (+1) 180 с;
Х2– длительность восстановления: (-1) 10 с; (+1) 300 с;
Х3 – интенсивность засветки: (-1) 100 Вт/м2; (+1) 800 Вт/м2.
Для определения коэффициентов регрессии использовался алгоритм Йейтса [38], отличающийся простотой реализации и рассчитывающий сразу все возможные коэффициенты регрессии, а не только линейные (таблица 2).
Таблица 2 −План и результат обработки ПФЭ 23 по Алгоритму Иейтса
для листьев с высоким уровнем функционального состояния ФСА
| План экcперимента | Результат | Коэффициенты регрессии | ||||||
| N | X1 | X2 | X3 | Y1 | Y2 | Y1 | Y2 | |
| 1 | — | — | — | 57,88 | 57,22 | 1 | 522,4 | 500,8 |
| 2 | + | — | — | 29,48 | 26,00 | Х1 | — 86,64 | -82,3 |
| 3 | — | + | — | 92,81 | 92,47 | Х2 | 133,0 | 150,8 |
| 4 | + | + | — | 86,04 | 89,03 | Х1Х2 | 44,8 | 34,5 |
| 5 | — | — | + | 67,61 | 59,82 | Х3 | -11,2 | — 28,6 |
| 6 | + | — | + | 39,58 | 31,68 | Х1Х3 | -2,2 | -16,3 |
| 7 | — | + | + | 86,55 | 82,96 | Х2Х3 | — 49,8 | — 44,6 |
| 8 | + | + | + | 62,21 | 61,84 | Х1Х2Х3 | -18,2 | -20,3 |
| Критерий значимости | 45,6 | 57,6 | ||||||
Поэтому проверка значимости этих коэффициентов сама по себе уже показывает, адекватно или неадекватно линейное приближение. Достаточно хотя бы одному из парных взаимодействий достоверно отличаться от нуля, чтобы сделать вывод о том, что модель не линейна. Дополнительная проверка адекватности, например, по критерию Фишера в таком случае не нужна.
Проверка значимости коэффициентов регрессии ai. осуществлялась по критерию Стьюдента: ![]() дисперсия коэффициента ai.
дисперсия коэффициента ai.
Число степеней свободы ![]() определяется числом повторностей m опыта и числом вариантов опыта N в плане ПФЭ:
определяется числом повторностей m опыта и числом вариантов опыта N в плане ПФЭ: ![]() Критерий Стьюдента для заданных условий
Критерий Стьюдента для заданных условий ![]()
Особенностью планов с двумя уровнями является то, что для всех коэффициентов регрессии, рассчитанных по их результатам, дисперсии одинаковы и определяются по формуле: ![]() дисперсия воспроизводимости опыта.
дисперсия воспроизводимости опыта.
Анализ значимости коэффициентов регрессии (табл. 2) позволяет сделать вывод, что процесс восстановления существенным образом зависит от длительности засветки и длительности темновой паузы (параметры Х1 и Х2 соответственно). Влияние интенсивности зондирующего потока (Х3) существенно меньше, поэтому следующий этап оптимизации проходил только для двух параметров: длительности засветки и длительности темновой паузы.
Реализация оптимизационных экспериментов была осуществлена для определенного фиксированного значения плотности мощности зондирующего излучения: 600 Вт/м2. Критерием оптимизации служил процент восстановления основного параметра МИФХ — показателя фотосинтетической активности — в результате некоторой темновой паузы после засветки определенной длительности. Априори мы предположи, что он должен иметь средние значения – не ниже 30 — 40 % но и не более 80 % (что бы в дальнейшем получать различия между растениями с различным функциональным состоянием). При этом длительность как засветки, так и восстановления, не должна быть чрезвычайно большой. В нашем случае, для заданной плотности мощности, оптимальная длительность засветки лежит в пределах 30…180 секунд, а время темновой восстановительной паузы – 30…300 секунд (таблица 3).
Полный цикл измерений при этом составит 5-15 минут, что более чем на порядок меньше времени, затрачиваемого на аналогичные оценки с помощью типовых методик.
Таблица 3 − Процент восстановления показателя фотосинтетической активности культуральных растений карликового подвоя яблони
| Длительность темновой паузы, с | Длительность засветки, секунды | ||||||
| 8 | 15 | 30 | 60 | 180 | 300 | 600 | |
| 5 | 85,7±6,3 | 73,7±12,7 | 47,6±9,2 | 23,5±7,3 | 12,7±3,5 | 8,0±1,2 | 2,6±1,3 |
| 15 | 89,5±6,1 | 78,9±8,4 | 52,6±6,8 | 26,3±6,8 | 15,1±3,2 | 10,0±2,4 | 8,2±1,8 |
| 30 | 90,9±7,4 | 80,6±6,5 | 60,6±5,8 | 35,2±6,5 | 27,3±4,6 | 13,6±2,8 | 13,1±2,4 |
| 60 | 95,0±3,8 | 91,2±6,2 | 67,0±4,3 | 45,0±6,5 | 35,0±4,8 | 20,0±3,4 | 16,4±2,7 |
| 300 | 98,0±2,0 | 94,3±7,1 | 77,7±4,4 | 52,4±5,4 | 43,8±4,6 | 27,3±3,6 | 20,0±2,7 |
| 900 | 97,4±2,4 | 80,7±3,9 | 64,7±5,0 | 56,5±5,2 | 36,4±4,5 | 32,2±3,4 | |
| 1 800 | 96,5±4,0 | 81,2±4,2 | 73,3±5,6 | 63,1±5,4 | 44,2±4,2 | 36,4±3,6 | |
Таким образом, при определенных условиях одна и та же оптико-электронная схема, которая предназначена для измерения параметров МИФХ может использоваться и для оценки восстановительной способности ФСА после фотоингибирования. Для этого должен быть предусмотрен циклический режим измерений с регулировкой длительности засветки и длительности темновой паузы в пределах нескольких десятков секунд.
Полученные данные позволили разработать новый алгоритм измерений функционального состояния растений в условиях in vitro. Он заключается в следующем. Регистрируют спад интенсивности флуоресценции хлорофилла (ФХ) культуральных растений в процессе первой засветки монохроматическим оптическим излучением синей области спектра (в зоне первого максимума поглощения хлорофилла 460..480 нм) плотностью мощности свыше насыщения фотосинтеза (600..900 Вт/м2) в течение 30..180 секунд, затем отключают засветку на 30…60 секунд и после этой темновой восстановительной паузы, в той же зоне измерений объекта вновь регистрируют спад интенсивности ФХ в процессе второй засветки монохроматическим оптическим излучением синей области спектра той же плотности мощности в течение 30..180 секунд. Длительность засветок определяется временем, необходимым для получения качественной кривой тушения флуоресценции.
О фотосинтетической активности судят по относительной амплитуде спада интенсивности ФХ в течение первой засветки оптическим излучением синей области спектра, а об ее устойчивости к фотоингибированию – по отношению амплитуд спада интенсивностей ФХ в процессе второй и первой засветок. Количественно фотосинтетическая активность и ее устойчивость к фотоингибированию определяются показателями КФСАи КУФИ, которые рассчитываются по формулам:
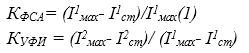 (2)
(2)
где I1мах—максимальная интенсивность ФХ на 1..2 секунде первой засветки; I1ст– стационарный уровень интенсивности ФХ на 30…180 секунде первой засветки; I2мах—максимальная интенсивность ФХ на 1..2 секунде второй засветки; I2ст– стационарный уровень ФХ на 30…180 секунде второй засветки.
При этом о фотосинтетической активности и ее устойчивости к фотоингибированию судят по величине показателей КФСА и КУФИ соответственно. Чем выше значение данных показателей – тем выше фотосинтетическая активность растений и их устойчивость к фотоингибированию.
Отличительной особенностью алгоритма измерений является то, что он пригоден и для растений in vitro и ex vitro. Тестирование работоспособности способа провели на растениях лимона, яблони, земляники, смородине черной. Для исследования выбирали листья с показателем фотосинтетической активности свыше 0,7 отн. ед., которые были разделены на 3 группы. Первая группа – контрольная (вариант А), вторая группа (вариант В) — подвергалась в течение 5 минут тепловой обработке при температуре +52оС, что приводило к небольшому ингибированию фотосистемы-2 и третья группа (вариант С) — подвергалась в течение 15 минут тепловой обработке при температуре +56оС, что приводило к значительному ингибированию функций фотосистемы-2. Далее листья всех вариантов проходили следующую процедуру измерений. После темновой 30 минутной адаптации небольшой участок листа подвергали засветке оптическим излучением с длиной волны 475 нм и плотностью мощности 800 Вт/м2, в процессе которой фиксировали изменение интенсивности флуоресценции хлорофилла (ФХ) в режиме отражения. Длительность засветки продолжалась 60 секунд, по окончании которой источник отключался на 60 секунд. После темновой паузы, в той же самой зоне листа, в течение 60 секунд фиксировали динамику изменения интенсивности ФХ в процессе второго цикла засветки синим излучением и затем определяли параметры КФСАи КУФИ по формулам 1 и 2 (таблица 4). Типичные качественные кривые (рисунок 4) имеют следующие особенности реакции ФСА на засветку в зависимости от функционального состояния:
— в варианте «А» с высоким функциональным состоянием ФСА контрольных листьев (рисунок 26А) наблюдается бурный спад ФХ в первые секунды засветки синим светом, который после темновой паузы частично восстанавливается. При этом следует отметить, что относительная амплитуда перепада интенсивности ФХ (показатель КФСА) восстанавливается за 60 с темновой паузы на 92,72% (с 0,8106 до 0,7516 отн.ед.), тогда как абсолютная амплитуда перепада (показатель КУФИ) – только на 55,75% (с 43,49 до 24,25 усл. ед.);
— в варианте «В» (рисунок 26В), абсолютный перепад ФХ в процессе первой засветки несколько меньше, после темновой паузы он восстанавливается существенно хуже – только на 27,42 %. В то же время показатель КФСА и в первом и во втором цикле засветки остается достаточно высоким (0,7993 и 0,6215 соответственно);
— в варианте «С» с низким функциональным состоянием ФСА (рисунок 26С) и абсолютная, и относительная амплитуда перепада сигнала в первом цикле засветки существенно меньше, чем у вариантов «А» и «В» (табл.4). После темновой адаптации, в результате второго цикла засветки, и без того достаточной низкий показатель КФСА уменьшается практически в 3 раза, тогда как показатель устойчивости к фотоингибированию (КУФИ) меняется незначительно (с 27,42 % до 22,98 %).
Таблица 4 − Характеристические параметры КФСА и КУФИ листьев лимона
при различном функциональном состоянии фотосинтезирующего аппарата
| Вариант | 1 цикл | 2 цикл | КУФИ | ||||
| I1мах | I1мах-I1ст | КФСА | I2мах | I2мах-I2ст | КФСА | ||
| А | 53,65 | 10,16 | 0,8106 | 32,26 | 8,014 | 0,7516 | 55,75 % |
| В | 35,82 | 7,188 | 0,7993 | 12,63 | 4,78 | 0,6215 | 27,42 % |
| С | 19,81 | 12,49 | 0,3692 | 14,59 | 12,91 | 0,1150 | 22,98 % |
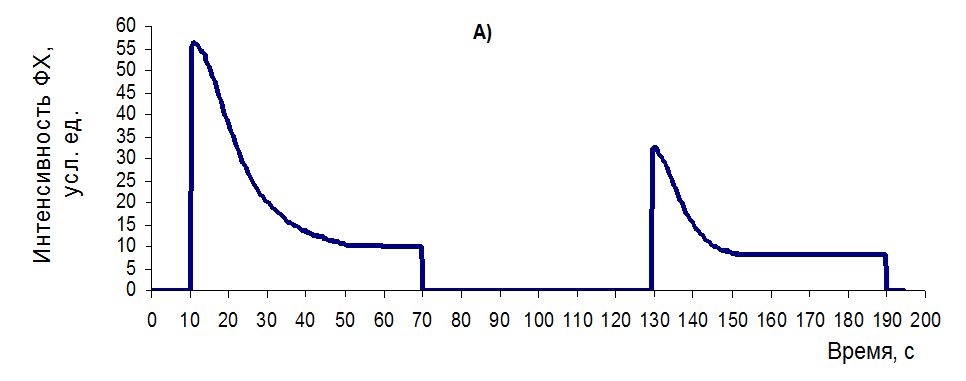
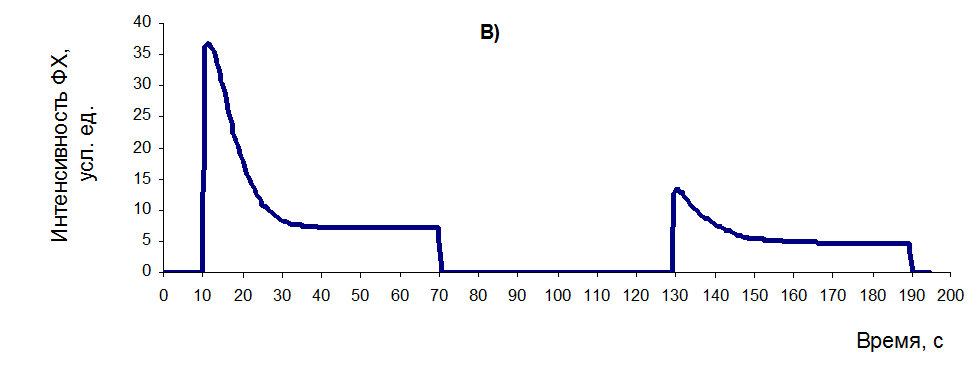
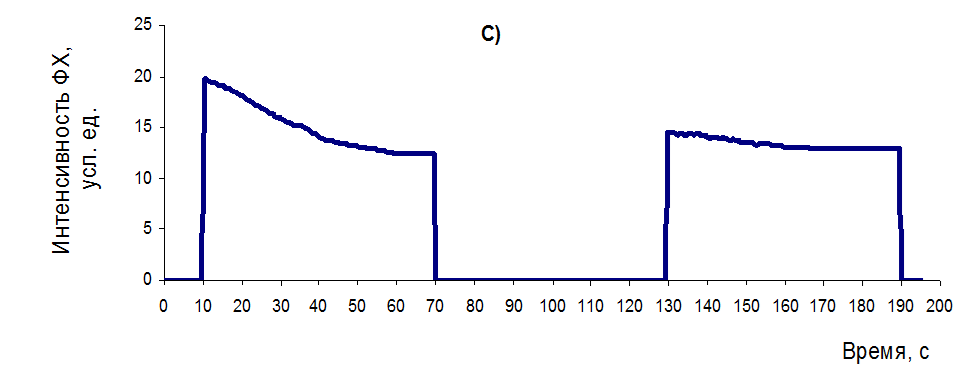
Рисунок 26 – Типовые кривые МИФХ для растений с разным уровнем функционального состояния растений
Разработка макетных образцов оборудования
По результатам испытаний (см. раздел 3.3.5) были выбраны 2 оптимальных типа формирователей потока зондирующего излучения, которое использовали для дальнейшей разработки макетных образцов оборудования диагностики растений in vitro. Изготовлены две принципиально различные конструкции так называемого «открытого» и «закрытого» типов. В приборе «открытого» типа используется «кольцевой» излучатель, составленный из нескольких точечных источников, расположенных по кругу диаметром 40 мм и коллиматора (рисунок 27А). Это позволило создавать коллимированный поток, обеспечивающий равномерное освещение на площадке диаметром 60 мм и на расстоянии от 30 до 120 мм (рисунок 27Б), что необходимо для возбуждения флуоресценции в различных растениях в культуре in vitro.
Для того чтобы максимально облегчить юстировку прибора относительно измеряемых объектов, прибор через переходник, смонтированный в нижней крышке, устанавливается на универсальный юстировочный узел с тремя степенями свободы, позволяющие вращать ось прибора по горизонтали, по вертикали и смещать весь прибор вперед-назад на расстояние до 10 см (рисунок 28). Для плавного смещения прибора в горизонтальной и вертикальной плоскостях предусмотрена съемная ручка.
 |
 |
| А | Б |
Рисунок – 27 Кольцевой излучатель (А); формирование коллимированного потока излучения, возбуждающего флуоресценцию (Б)

Рисунок 28 – Подвижная платформа с тремя степенями свободы для юстировки прибора относительно объекта измерений
Универсальный юстировочный узел закреплен на платформе, выполняющей роль утяжеленной подставки и несущей для крепежа штативов с держателями колб и пробирок (рисунок 29). Штативы универсальны и позволяют надежно фиксировать различные сосуды, а также крупные плоды, например, томаты, так как прибор можно использовать не только для измерения растений в пробирках и колбах, но и других объектов (рисунок 30).
Конструкцией прибора предусмотрено двойное управление активацией работы прибора – по нажатию встроенной в верхней крышке корпуса кнопки или с помощью внешней кнопки, которая подключается через разъем на задней панели корпуса (рисунок 31). Внешняя кнопка удобна в случаях, когда нежелательно касаться корпуса прибора, чтобы не нарушить юстировку.

Рисунок 29 – Штативы с держателями колб и пробирок
 |
 |
 |
Рисунок 30 – Фиксация объектов в зоне измерения
В качестве фотоприемника используется 8-ми битовая цифровая видеокамера. Питание видеокамеры, формирователя зондирующего излучения и всех электронных узлов, а также обмен информацией с компьютером осуществляется по USB-порту (рисунок 31).

Рисунок 31 – Общий вид прибора «открытого» типа
В приборе «закрытого» типа исследуемые объекты ставятся внутрь бокса, со всех сторон защищенного от внешнего света, и он позволяет проводить измерения «на свету». В основе конструкции лежит использование формирователей зондирующего потока «полосового» типа. Они крепятся к платформе для размещения культуральных сосудов. Таким образом обеспечивается постоянство геометрического положения светового поля относительно вероятной зоны расположения растений (рисунок 32).
Объекты устанавливаются на платформу 1 диаметром 140 мм, которая может вращаться вокруг оси на 180о и с помощью подъемника вертикального типа 3 плавно подниматься-опускаться в пределах 100 мм. Фотоприемный узел устанавливается вместе с оптикой в посадочном месте 5 за формирователями 2.

Рисунок 32 – Конструктивные элементы макетного образца «Закрытого» типа прибора диагностики растений in vitro: 1 – платформа для размещения объектов, 2 – формирователи зондирующего потока, 3 – подъемник вертикального типа, 4 – преобразователь для питания светодиодов формирователя зондирующего потока, 5 – посадочное место под фотоприемный узел
В нем предусмотрены элементы управления световым потоком, падающим на фотоприемную матрицу в широких пределах (изменением диаметра пучка от 1 до 30 мм) для согласования энергетических характеристик информационного сигнала со светочувствительностью преобразователя таким образом, что бы работа проходила на линейном участке передаточной характеристики видеокамеры. Помимо этого, предусмотрены элементы управления устройством, съемная панель и переносная ручка (рисунок 33).
Для первого типа конструкции прибора требуется обеспечить работу в затененном помещении, при использовании приборов второго типа это необязательно, так как объекты помещаются в закрытый бокс.
А Б В



Рисунок 33 – А) Вид прибора «закрытого» типа со стороны фотоприемного узла; Б) – со стороны съемной панели, В) – в процессе измерений
Результаты испытаний макетных образцов приборов
Для окончательного выбора оптимальной конструкции разработанные макетные образцы приборов тестировали по следующим критериям:
— габариты, вес;
— энергопотребление;
— ремонтоспособность;
— автономность (длительность работы без сетевого питания);
— стабильность при длительной работе (более 6 часов);
— трудоемкость;
— длительность юстировки объекта в измерительном канале;
-объем равномерного светового поля возбуждения флуоресценции;
— эстетичность;
— уровень безопасности;
— степень унификации.
По сумме требований макетный образец «открытого» (МО) типа имеет больше преимуществ по сравнению с макетным образцом закрытого типа (МЗ). Например, энергопотребление МО в 6 раз ниже, он не требует дополнительных сетевых источников питания, что обеспечивает длительную (более 4 часов) автономную работу прибора от аккумуляторов ноутбука. Благодаря более высокой унификации используемых в его конструкции узлов, он отличается большей ремонтоспособностью и более подготовлен к мелкосерийному выпуску. Благодаря универсальному держателю, данная конструкция может обслуживать существенно больший набор типов культуральных сосудов любого размера, в том числе и пробирки, тогда как МЗ – только колбы с плоским дном высотой не более 120 мм. Помимо этого, конструкция МО позволяет очень оперативно корректировать положение объекта в зондирующем пучке, визуально контролировать зону засветки и благодаря этому оператор может целенаправленно снять показания с конкретного растения (группы растений), если в культуральном сосуде их несколько.
В соответствии с вышеизложенным, подготовка технического описания и инструкции по эксплуатации проведена для образца прибора «открытого» типа, которое приведено в приложении 1 к настоящему отчету.
Примеры экспериментальных исследований
с использованием нового оборудования
По мере готовности макетных образцов их тестировали на работоспособность при решении конкретных задач биотехнологии, выявления информативных критериев диагностики и оптимизации алгоритмов обработки данных.
Пример 1. На базе макетного образца зарытого типа определяли функциональное состояние растений актинидии и параллельно выявляли наиболее репрезентативные показатели МИФХ, которые целесообразно использовать для диагностики.
Методика измерений. 8 сортов актинидии, по 1 колбе каждое, измеряли на приборе 4 раза с разрывом между измерениями не менее 30 минут (темновая адаптация). Колбы располагали внутри измерительной камеры в произвольном положении. Длительность измерений составляла 60 секунд при интенсивности зондирующего излучения 160… 340 Вт/м2 в зоне вероятного местонахождения объекта. Оценивали средние, ошибку среднего, и коэффициент вариации следующих показателей МИФХ — скорость тушения флуоресценции на 10,20,30 и 60 секунде (V10, V20, V30 и V60 соответственно), максимум флуоресценции Fm, стационарный уровень флуоресценции FT, коэффициент жизнеспособности Fm/FT и показатель фотосинтетической активности KfT (таблица 5) .
Результаты измерений. Можно выделить три группы растений с различным функциональным состоянием по показателям МИФХ:
Высокий уровень – сорт Джер Туземка и гибрид Конфетный. Имеют наивысшие средние значения показателей фотосинтетической активности и коэффициента жизнеспособности (0,52 и 2,1 отн. ед. соответственно).
Средний уровень – сорта Народная, Брюнет, Ленинградская Крупная, у которых средние значения показателей фотосинтетической активности лежат в диапазоне от 0,444 до 0,484 отн. ед.
Низкий уровень – сорта Гибридная Колбасиной, Злата и Золотая Коса — менее 0,32 отн.ед. показатель KfT и менее 1,5 отн. ед. – коэффициент жизнеспособности.
С точки зрения испытания работоспособности прибора получены важные данные, характеризующие и методологию в целом, и конкретную конструкцию, и корректность выбора тех или иных показателей МИФХ в качестве диагностических.
Таблица 5 − Сводные данные по измерениям актинидии в культуре in vitro
| гибридная колбасиной | V10 | V20 | V30 | V60+ | Fm | F_T | Fm/F_T | Kf_T |
| Среднее | 0,2525 | 0,495 | 0,695 | 1,1375 | 115,88 | 78,277 | 1,4925 | 0,3272 |
| Стандартная ошибка | 0,0554 | 0,0849 | 0,0870 | 0,0677 | 7,6486 | 7,2230 | 0,0415 | 0,0195 |
| коэффициент
вариацци, % |
43,908 | 34,303 | 25,045 | 11,911 | 13,201 | 18,454 | 5,5622 | 11,938 |
| Злата | V10 | V20 | V30 | V60+ | Fm | F_T | Fm/F_T | Kf_T |
| Среднее | 0,16 | 0,3325 | 0,48 | 1,0475 | 121,39 | 86,837 | 1,4 | 0,2832 |
| Стандартная ошибка | 0,016 | 0,0344 | 0,0437 | 0,0736 | 6,5855 | 4,5136 | 0,0346 | 0,0174 |
| коэффициент
вариацци, % |
19,76 | 20,746 | 18,241 | 14,060 | 10,850 | 10,395 | 4,9487 | 12,352 |
| Золотая коса | V10 | V20 | V30 | V60+ | Fm | F_T | Fm/F_T | Kf_T |
| Среднее | 0,2075 | 0,4225 | 0,5775 | 1,01 | 105,59 | 74,595 | 1,4125 | 0,291 |
| Стандартная ошибка | 0,0225 | 0,0188 | 0,0165 | 0,0770 | 9,8616 | 6,2280 | 0,0228 | 0,0112 |
| коэффициент
вариацци, % |
21,686 | 8,9347 | 5,7212 | 15,253 | 18,677 | 16,698 | 3,2378 | 7,7045 |
| Джер туземка | V10 | V20 | V30 | V60+ | Fm | F_T | Fm/F_T | Kf_T |
| Среднее | 0,2625 | 0,575 | 0,9025 | 2,0925 | 69,252 | 33,51 | 2,0975 | 0,5215 |
| Стандартная ошибка | 0,0292 | 0,0573 | 0,0653 | 0,0566 | 9,0846 | 5,1884 | 0,0618 | 0,0138 |
| коэффициент
вариацци, % |
22,294 | 19,955 | 14,485 | 5,4120 | 26,236 | 30,966 | 5,8955 | 5,3244 |
| Народная | V10 | V20 | V30 | V60+ | Fm | F_T | Fm/F_T | Kf_T |
| Среднее | 0,195 | 0,42 | 0,64 | 1,6675 | 49,177 | 27,815 | 1,8175 | 0,4445 |
| Стандартная ошибка | 0,0312 | 0,0704 | 0,0938 | 0,0895 | 5,4092 | 4,5461 | 0,1052 | 0,0317 |
| коэффициент
вариацци, % |
32,025 | 33,559 | 29,342 | 10,743 | 21,998 | 32,688 | 11,579 | 14,295 |
| Брюнет | V10 | V20 | V30 | V60+ | Fm | F_T | Fm/F_T | Kf_T |
| Среднее | 0,2325 | 0,55 | 0,8275 | 1,855 | 58,735 | 31,207 | 1,97 | 0,484 |
| Стандартная ошибка | 0,0363 | 0,0849 | 0,1255 | 0,1331 | 13,461 | 8,9520 | 0,1419 | 0,0370 |
| коэффициент
вариацци, % |
31,287 | 30,891 | 30,354 | 14,360 | 45,838 | 57,371 | 14,411 | 15,322 |
| Ленинградская крупная | V10 | V20 | V30 | V60+ | Fm | F_T | Fm/F_T | Kf_T |
| Среднее | 0,2125 | 0,4925 | 0,73 | 1,805 | 71,97 | 40,555 | 1,8575 | 0,4525 |
| Стандартная ошибка | 0,0278 | 0,0539 | 0,0762 | 0,1709 | 10,665 | 8,4651 | 0,1406 | 0,0387 |
| Коэффициент
вариацци, % |
26,166 | 21,892 | 20,895 | 18,936 | 29,638 | 41,746 | 15,146 | 17,143 |
| гибрид Конфетный | V10 | V20 | V30 | V60+ | Fm | F_T | Fm/F_T | Kf_T |
| Среднее | 0,9125 | 1,425 | 1,705 | 1,7425 | 75 | 35,15 | 2,2075 | 0,5415 |
| Стандартная ошибка | 0,0657 | 0,1088 | 0,1195 | 0,1486 | 8,9607 | 6,2421 | 0,1432 | 0,0298 |
| коэффициент
вариацци, % |
14,410 | 15,272 | 14,023 | 17,058 | 23,895 | 35,517 | 12,979 | 11,007 |
Для этого проанализируем коэффициент вариации всех представленных показателей. Как и следовало ожидать, вследствие сложной и непостоянной геометрии взаиморасположения объекта, источника зондирующего излучения наибольшая дисперсия наблюдается у «абсолютных» критериев – максимального Fm и стационарного FT, уровней флуоресценции – коэффициенты вариации этих показателей достигает 57%, что говорит о высокой неоднородности выборки.
Наименьшая вариабельность отмечена у коэффициента жизнеспособности (отношение максимального к стационарному уровню флуоресценции) – не более 15,2%, причем наиболее характерные значения лежат в диапазоне от 5 до 10%, что говорит о незначительной степени рассеяния данного показателя. Чуть выше вариация у показателя фотосинтетической активности — до 17,1%, но в большинстве случаев он существенно ниже, что позволяет рекомендовать эти два показателя в качестве базовых критериев диагностики культуральных растений. Сложнее дело обстоит с показателями, характеризующими скорость тушения флуоресценции. Несмотря на то, что это тоже относительные показатели, и они рассчитываются как степень функции I-Vtдля соответствующих значений времени t и не зависят от абсолютной величины интенсивности, тем не менее, коэффициент вариации для первых 30 секунд тушения весьма значителен (до 44 %). В связи с этим рекомендовано использовать более стабильный показатель V60, коэффициент вариации которого не превысил 20% для всех 8 сортов.
Таким образом, разработанное оборудование и выбранные критерии диагностики позволяют корректно судить о функциональном состоянии растений и даже при 4-х кратной повторности получать однородные выборки.
Пример 2. Влияние качества спектрального состава света на фотосинтетическую активность культуральных растений.
Методика опыта. Культуральные растения ежевики сорта Эльдорадо и аронии Amir выращивали с применением светодиодных и люминесцентных светильников. Для управления спектральным составом излучения светодиодных светильников использовали «Систему управления фитостеллажами» типа X-brightFitoSpectrV1.0 (micro) (Белгород, ООО «Электронные системы») (рис.34А). Оценку функционального состояния растений проводили с применением макетного образца прибора «открытого» типа (рисунок31). Для этого использовали по 3 колбы каждого вида растений следующих трех вариантов светового режима (рисунок 34):
 |
 |
 |
| А) Система управления фитостеллажами | Б) Тип освещения при ФАР60 | В) Тип освещения при ФАР 30 |
Рисунок 34 – Система управления фитостеллажами, создающая различные типы спектрального освещения культуральных растений
«ФАР60» (светодиоды красного, зеленого и синего цветов), освещенность 2,4 клк;
«ФАР15» (светодиодное освещение с использованием светодиодов синего, белого и красного цвета), освещенность 1,8 клк;
«контроль» (люминесцентные лампы), освещенность 2,3 клк.
Каждую колбу измеряли трижды, и таким образом на вариант получали по 9 повторностей.
Если по внешнему виду и общим морфологическим показателям культуральные растения по вариантам опыта были мало различимы (кроме корневой системы, которая в контроле более развита) (рисунок 35), то по параметрам МИФХ можно сделать однозначный вывод о наилучшем состоянии фотосинтезирующего аппарата варианта «контроль». Промежуточное состояние — у растений варианта «ФАР 60» и наихудшее — у варианта «ФАР15» (таблица 6, рисунок 36). Следует отметить, что эта тенденция характерна для обоих сортов.
Пример 3 – Испытание работоспособности нового прибора в режиме длительных динамических измерений физиологического состояния растений в культуре in vitro в процессе вегетации.
Методика опыта. Культуральные растения актинидии сорта Эстафета выращивали в культуре in vitro по стандартной технологии. Через 5 месяцев после высадки каллусов на питательную среду была выбрана колба с хорошо сформировавшимися растениями, которая использовалась как объект измерений при испытании прибора. Для осуществления динамических измерений прибор был настроен на режим автоматической записи данных при появлении информационного сигнала выше заданного порогового уровня.
 |
 |
| Ежевика, ФАР15 | Арония, ФАР15 |
 |
 |
| Ежевика, ФАР60 | Арония, ФАР60 |
 |
 |
| Ежевика, контроль | Арония, Контроль |
Рисунок 35 – Внешний вид исследуемых растений
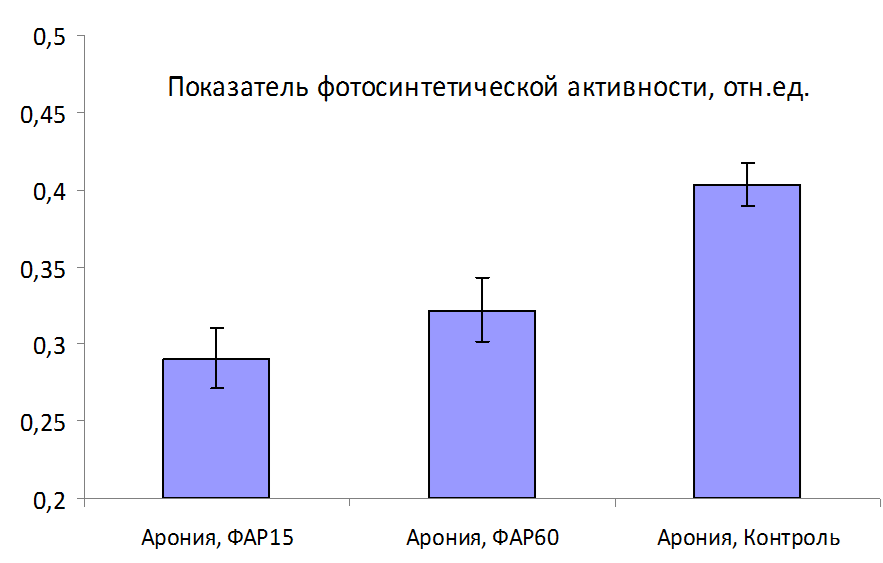
Рисунок 36 – Фотосинтетическая активность растений in vitroпри различных типах освещения
Таблица 6 − Сводные данные измерений параметров МИФХ культуральных
растений ежевики и аронии, выращиваемых при различных типах освещения
| Ежевика
ФАР 15 |
V10 | V20 | V30 | V60+ | Fm | F_T | Fm/F_T | Kf_T |
| Среднее | 0,227 | 0,552 | 0,777 | 1,013 | 94,336 | 65,622 | 1,427 | 0,294 |
| Ошибка среднего | 0,0417 | 0,0649 | 0,0874 | 0,1165 | 11,4971 | 7,7985 | 0,0441 | 0,023 |
| коэффициент
вариацци, % |
0,52 | 0,332 | 0,318 | 0,325 | 0,345 | 0,336 | 0,087 | 0,221 |
| Ежевика
ФАР 60 |
V10 | V20 | V30 | V60+ | Fm | F_T | Fm/F_T | Kf_T |
| Среднее | 0,266 | 0,638 | 0,928 | 1,29 | 91,598 | 60,253 | 1,554 | 0,348 |
| Ошибка среднего | 0,0778 | 0,1094 | 0,117 | 0,1045 | 6,8183 | 6,2053 | 0,0663 | 0,0271 |
| коэффициент
вариацци, % |
0,773 | 0,454 | 0,334 | 0,214 | 0,197 | 0,272 | 0,113 | 0,206 |
| Ежевика
Контроль |
V10 | V20 | V30 | V60+ | Fm | F_T | Fm/F_T | Kf_T |
| Среднее | 0,283 | 0,623 | 0,924 | 1,392 | 93,112 | 58,268 | 1,607 | 0,372 |
| Ошибка среднего | 0,0538 | 0,0637 | 0,0727 | 0,0819 | 3,4822 | 2,4118 | 0,0574 | 0,0215 |
| коэффициент
вариацци, % |
0,537 | 0,289 | 0,222 | 0,166 | 0,106 | 0,117 | 0,101 | 0,163 |
| Арония,
ФАР15 |
V10 | V20 | V30 | V60+ | Fm | F_T | Fm/F_T | Kf_T |
| Среднее | 0,236 | 0,492 | 0,707 | 1,039 | 95,728 | 68,27 | 1,419 | 0,291 |
| Ошибка среднего | 0,0277 | 0,0426 | 0,0572 | 0,0801 | 9,5583 | 7,663 | 0,0389 | 0,02 |
| коэффициент
вариацци, % |
0,333 | 0,245 | 0,229 | 0,218 | 0,282 | 0,317 | 0,078 | 0,195 |
| Арония,
ФАР60 |
V10 | V20 | V30 | V60+ | Fm | F_T | Fm/F_T | Kf_T |
| Среднее | 0,236 | 0,519 | 0,771 | 1,196 | 96,123 | 65,787 | 1,486 | 0,322 |
| Ошибка среднего | 0,0272 | 0,043 | 0,0562 | 0,0872 | 7,1808 | 5,8058 | 0,0504 | 0,0209 |
| коэффициент
вариацци, % |
0,327 | 0,234 | 0,206 | 0,206 | 0,211 | 0,25 | 0,096 | 0,184 |
| Арония,
Контроль |
V10 | V20 | V30 | V60+ | Fm | F_T | Fm/F_T | Kf_T |
| Среднее | 0,399 | 0,788 | 1,087 | 1,542 | 102,873 | 61,741 | 1,683 | 0,403 |
| Ошибка среднего | 0,0414 | 0,0593 | 0,0636 | 0,0607 | 4,1052 | 3,629 | 0,0398 | 0,0136 |
| коэффициент
вариацци, % |
0,294 | 0,213 | 0,165 | 0,111 | 0,113 | 0,166 | 0,067 | 0,095 |
С помощью дополнительной схемы на базе микропроцессорного модуля Arduino с периодичностью в 1 час включался излучатель прибора на 40 секунд, в течение которых программа сбора и обработки данных регистрировала кривую тушения флуоресценции и рассчитывала 8 показателей МИФХ. Прибор в таком режиме работал в течение 11 суток в автономном режиме. Оператор вручную произвел настройку и первичный запуск оборудования и по окончании измерений – выключение прибора и сохранение полученных данных.
Данное испытание продемонстрировало, что заложенные в прибор конструктивные возможности позволяют реализовать принципиально новую функцию – исследовать переходные характеристики живой системы на то или иное раздражение, выявить наличие и стабильность циркадных ритмов, выбрать оптимальное время измерений, и т.д.
Так, например, удалось выявить четкие циркадные ритмы периодического подъема и спада фотосинтетической активности культуральных растений (рисунок 37). Поскольку изменения показателя лежат в диапазоне 17-22 % от базовых значений, что может внести существенное разногласие данных, то длительность и время процесса измерений необходимо планировать с учетом циркадных ритмов. Аналогичные закономерности были обнаружены и в опытах с плодами яблони.
Рисунок 37 – Циркадные ритмы изменчивости фотосинтетической активности культуральных растений актинидии сорта Эстафета
3. Оценка характера воздействия на растения метаболитов бактерий защитных биопрепаратов после лазерной стимуляции
Способность бактерий синтезировать биологически активные вещества является одним из важнейших факторов, определяющих бактериально-растительное взаимодействие [31].
Разрабатываются микробные биопрепараты, которые являются сбалансированными по комплексу биологически активных соединений: витамины, фитогормоны (ауксины, гиббереллины и цитокинины, абсцизовая кислота), ферменты, аминокислоты, полисахариды, антибиотические вещества, действующие против фитопатогенных бактерий и грибов [29].
Хорошо известна способность почвенных бактерий PGPR-группы рода Pseudomonas синтезировать широкий спектр веществ, стимулирующих корнеобразование растений, в частности ауксины, гиббереллины, цитокинины, витамины, полисахариды, свободные аминокислоты и др. [95].
Одним из факторов, позволяющих воздействовать на фитопатогеные микроорганизмы, заселяющие ризосферу растений, является способность ризосферных бактерий к образованию различных низкомолекулярных веществ, таких как сидерофоры и антибиотики[41; 69].
Метаболиты ризосферных бактерий рода Pseudomonas и Bacillus, которые входят в состав биопрепаратов защиты растений, способны активизировать защитные свойства растений и улучшать их ростовые качества[3].
По данным Л.Р. Сулеймановой [69] бактерии рода Pseudomonas способны к утилизации основных источников углерода (органических кислот, аминокислот и углеводов) в ризосфере и секреции антигрибных метаболитов, что позволяет им интегрироваться с растением для совместного функционирования в системе, а также образовывать межмолекулярные комплексы с компонентами экзометаболитов растений. Обработка растений биопрепаратами, в том числе на основе бактериальных метаболитов, создают условия для колонизации ризосферы и филлосферы бактериями-антагонистами, изменяя микробный ценоз в направлении вытеснения фитопатогенных микроорганизмов и оказывая стимулирующее действие на рост растений [27].
Установлено, что с помощью внеклеточных метаболитов штаммов P. putida КМБУ 4308, P. fluorescens ВКМВ 561 и P. aurantiaca B-162, можно защитить растения томатов и огурцов от поражения фитопатогенным грибом B. cinerea[3]
Культуральные фильтраты Bacillus subtilis используется в качестве индуктора против биотрофных листовых патогенов на растениях ячменя [84].
М.А. Лукьянцевым [42] выявлено, что фракция метаболитов эндофитных штаммов Bacillus subtilis (B. subtilis 11В, B. subtilis 26Д, B. subtilis 49РН), содержащая антибиотики является сильным ингибитором прорастания семян пшеницы. Штамм B. subtilis 11В в определенных концентрациях способен стимулировать рост растений укропа и повышать их устойчивость к корневым гнилям.
Бактерии родов Pseudomonas и Bacillusспособны синтезировать широкий спектр веществ, стимулирующих корнеобразование растений, в частности ауксины, гиббереллины, цитокинины, витамины, полисахариды, свободные аминокислоты и др.[37].
Изменение функциональной активности и численности бактерий — продуцентов физиологически активных веществ в результате действия внешних факторов, например лазерного облучения рабочих растворов биопрепаратов, может привести к избыточному накоплению в грунте бактериальных метаболитов и вызвать гербицидный эффект.
Гербицидное действие ауксиноподобных веществ давно известно [21; 50; 64; 81].
Впервые оно было отмечено Н.Г.Холодным в 1924г. В результате многолетних исследований, проведенных в нашей стране и за рубежом, в настоящее время выделены и синтезированы различные соединения, с успехом используемые для подавления роста сорной растительности [73].
Ауксины, представляют собой регуляторы роста растений.
Гербицидами ауксиноподобного действия являются:
— феноксиуксусные кислоты (2,4-Д, 2М-4Х);
— бензойные кислоты (дикамба);
— хинолинкарбоновые кислоты (квинклорак);
— пиридинкарбоновые кислоты (флуроксипир, клопиралид) [39].
Действие ауксиноподобных гербицидов зависит от способа их использования, но прежде всего от концентрации [73].
Если ауксинов слишком много, то в растении запускается синтез гормона-антогониста этилена, вызывающего угнетение роста побегов и корней в длину, начинается окисление и образование конъюгатов ауксинов. При внешнем воздействии гормоноподобных гербицидов клетки растений увеличиваются в размерах, не успевая запасать питательные элементы, что приводит к их истощению и гибели.
В связи с тем, что в дальнейшем ауксиноподобные вещества влияют на различные метаболические функции, впоследствии нарушается нормальное функционирование растения в целом. Наблюдаются такие симптомы повреждения как образование каллусов (наплывов), уродств новых листьев (морщинистость, вытянутость, изогнутость). Предполагается, что действие экзогенных ауксинов аналогично действию растительных гормонов, однако, в отличие от них, растение не способно контролировать продолжительность этого действия[39].
Повышение функциональной активности и численности бактерий — продуцентов физиологически активных веществ в результате действия внешних факторов может привести к избыточному накоплению в грунте бактериальных метаболитов, в том числе ауксиноподобных веществ, что может оказывать гербицидный эффект.
В связи со сказанным, при разработке методов лазерной стимуляции биопрепаратов необходимо изучение характера влияния на растения избыточного количества метаболитов бактерий-агентов биоконтроля, которые могут накапливаться в грунте после внесения рабочих растворов биопрепаратов, подвергавшихся облучению когерентным светом.
Методика исследований
Определение количества КОЕ (колониеобразующих единиц)
в бактериальной суспензии
Суспензию микроорганизмов получали путем 100-кратного разведения рабочего раствора с соблюдением правил асептики и антисептики. Из каждого разведения стерильной пипеткой брали по 0,1 мл и высевали на твердую среду Сабуро чашки Петри в 3-х кратной повторности. Культуры инкубировали в течение суток при температуре 37оС. С использованием микроскопа при увеличении ×600 проводили подсчет колоний в квадрате определенной площади, затем пересчитывали на площадь чашки Петри. Полученное число колоний соответствовало количеству живых структур бактерий в 0,1 мл суспензии. Для получения числа КОЕ в рабочем растворе делали необходимый пересчет в соответствии с концентрацией рабочего раствора.
Определение характера влияния лазерного облучения на чистые культуры
бактерий, входящих в состав биопрепаратов.
Облучение суспензий и культур бактерий проводили с использованием гелий-неонового и полупроводникового лазеров с плотностью мощности – 2,0 – 2,5 Вт/м2. Для оценки влияния лазерного облучения на изменение числа КОЕ в суспензии биопрепаратов использовали длительность экспозиции 15, 30, 60, 120, 240, 480, 960 с.
Влияние метаболитов бактерий защитных биопрепаратов
на растения овощных культур в условиях in vitro.
Фильтрат культуральной жидкости бактерий из биопрепаратов получали путем их культивирования на жидкой среде Чапека в течение месяца при температуре 25°С.
Раствор бактериальных метаболитов отделяли от живых клеток, пропуская через мембранный фильтр (“Millipore” 0,22 μm, France). Бесклеточный фильтрат культуральной жидкости (ФКЖ) добавляли в питательную среду Мурасиге-Скуга (MS). Стандартную концентрацию бактериальных метаболитов в питательной среде для растений рассчитывали так, чтобы в 1 л среды MS их содержание соответствовало количеству ФКЖ, выработанного таким же числом микробных клеток, которое должно находится в том же объеме рабочего раствора биопрепаратов (таблица 7). Для оценки характера влияния на растения избыточного количества метаболитов бактерий концетрацию ФКЖ в среде MS увеличивали в 2-4 раза по сравнению со стандартной.
Таблица 7 − Число КОЕ в используемых растворах биопрепаратов.
| Название биопрепарата | число КОЕ в рабочем растворе (стандартная концентрация) | число КОЕ × 2 | число КОЕ × 4 |
| Алирин Б | 6×107 | 1,2×108 | 2,4×108 |
| Ризоплан | 1×106 | 2×106 | 4×106 |
На среду MS с метаболитами бактерий из биопрепаратов высаживали стерильные проростки или микрорастения томата и огурца (рисунок 38, 39). Диагностику функционального состояния растений проводили с использованием компьютеризированного оптико-электронного прибора для оценки физиологической активности растений в условиях in vitro открытого типа(технические характеристики и особенности эксплуатации прибора описаны в главе 2 и приложении 1).
Состав питательных сред.
Картофельно-глюкозная среда (КГС). Очищенный, вымытый, нарезанный ломтиками картофель в количестве 300 г заливали 1 л воды и кипятили в течение 40 мин. Затем жидкость отфильтровывали, восстанавливали объем до литра, прибавляли 10 г глюкозы. Кипятили до ее растворения. Жидкость разливали в лабораторную посуду и стерилизовали под давлением 1 ат в течение 30 мин.
 |
 |
| А | Б |
| Рисунок 38 – Проростки (А) и микрорастения (Б) партенокарпического огурца Мартин F1 в культуре in vitro | |

Рисунок 39 – Микрорастения томата сорта Орлик
Среда Чапека. Нитрата натрия 3,0 г, калия фосфорного однозамещенного – 1,0 г, сульфата магния семи водного – 0,5 г, калия хлористого – 0,5 г, сульфата железа семи водного – 0,01 г, сахарозы 30,0 г, дистиллированной воды – 1 л. Полученную смесь разливали в лабораторную посуду, стерилизовали под давлением 1 ат в течение 30 мин.
Среда Мурасиге и Скуга (MS) , рН 5,6-5,8.NH4NO3 – 1650 мг/л, Fe2SO4x7H2O –27,8 мг/л, KNO3 – 1900 мг/л,Na2-ЭДТА 2H2O –37,3 мг/л, CaCl2x2H2O –440 мг/л, Тиамин — HCl –0,1 мг/л,MgSO4 4H2O –370 мг/л, Пиридоксин — HCl –0,5 мг/л, KH2PO4–170мг/л, Никотиновая кислота –0,5 мг/л, MnSO4 x 4H2O –22,3 мг/л, Мезо-инозит –100 мг/л, CoCl2 6H2O –0,025 мг/л, Глицерин –2,0 мг/л, ZnSO4x7H2O –8,6, ИУК –2,0 мг/л, CuSO4x5H2O–0,025 мг/л. Кинетин –0,2 мг/л, Na2MoO4x2H2O–0,25 мг/л, Сахароза – 30 г/л.
Состав маточных растворов для MS.
Макросоли (в г/л маточного раствора): КNO3–38 г/л, CaCl2 (безводный) –8,8 г/л, NH4NO3–33 г/л или CaCl2x2H2O –13,8 г/л, MgSO4 (безводный) – 3,6 г/л или MgSO4 x 7H2O –7,4 г/л, KH2PO4–3,4 г/л. На 1 л среды брать по 50мл маточного раствора.
Микросоли маточного раствора: H3PO4–620 мг/100 мл, MnSO4x4H2O –2230 мг/100 мл, ZnSO4 –860 мг/100 мл, Kl– 83 мг/100 мл, Na2MoCl4x2H2O –25 мг/100 мл; CuSO4x 5H2O –2,5 мг/100 мл, CoCl2x 6H2O– 2,5 мг/100 мл. На 1 л среды брать по 1 мл маточного раствора.
Приготовление маточного раствора Fe-хелат: FeSO4x7H2O –557 мг/100 мл, ЭДТА-Na2 (трилон Б) –745 мг/100 мл. На 1 л среды брать по 5 мл маточного раствора.
Результаты исследования.
Изучение влияния высоких концентраций метаболитов бактерий из биопрепаратов на растения проводили с целью определения эффекта, который может наблюдаться в полевых условиях при использовании биопрепаратов после лазерной стимуляции.
В качестве модельных были взяты биопрепараты Пралин, Алирин Б, Ризоплан, Гамаир и Витаплан. Предварительно изучали способность бактериальных штаммов, входящих в состав данных биопрепаратов, к лазерной стимуляции.
С целью определения изменения активности бактерий-агентов биоконтроля болезней растений из Алирина-Б, СП (Bacillus subtilis), Гамаира, СП (Bacillus subtilis), Пралина-Экстра, КЖ (Bacillus subtilis), Витаплана — Экстра, КЖ (Pseudomonas fluorescens), Ризоплана (Pseudomonas fluorescens)после лазерного излучения нами проводилась сравнительная оценка числа КОЕ до и после обработки их когерентным светом.
Проведение эксперимента по воздействию лазерного облучения на активность живых структур в суспензии биопрепаратов позволило выявить стимуляционный эффект когерентного света в отношении микроорганизмов, входящих в состав исследуемых биологических средств защиты. Выявлено, что число КОЕ в рабочих растворах биопрепаратов Витаплан и Пралин увеличилось в наибольшей степени, в среднем на 64,11 % и 66,04 % соответственно, а при более эффективных длительностях экспозиций (240с для Витаплана и 480 с для Пралина) на 120% и 80% соответственно.
В облученной суспензии препарата Витаплан число КОЕ, в зависимости от длительности экспозиции менялось в пределах от 7,5х105 до 16,1х105 в опыте и составило 7,3х105 контроле (рисунок 40).
При этом количество живых клеток в испытуемой суспензии препарата Пралин колебалось от 2,9х105 до 3,6х105 в опытных вариантах, в контроле данный показатель был равен 2,0х105 (рисунок 41).
Достаточно высокая степень стимуляции жизнеспособности бактериальных клеток 45,9 % и 50,9% была выявлена при облучении препаратов Алирин Б и Ризоплан. У них в рабочих растворах количество живых структур после облучения изменялось в зависимости от длительности экспозиции в пределах 9,8х105 – 13,3х105 и 2,0 х109 – 2,9 х109 соответственно, а в контроле составило 7,9х105 и 1,7 х105 соответственно (рисунок 42, 43).
На эффективных экспозициях максимальная стимуляция составила 68,3% у Алирина Б (30с) и 70,5% у Ризоплана (240с).
Менее чувствительным к обработке лазерным излучением оказался препарат Гамаир, степень стимуляции жизнеспособности клеток у него составила в среднем 4,68 %. В зависимости от экспозиции в опытных вариантах значение числа КОЕ было либо на уровне контроля (15,9х105), либо изменялось в пределах ошибки среднего значения (13,9х105 – 19,5х105) (Рисунок 44). Максимальная степень стимуляции бактерий из данного препарата составила 22,6% при наиболее эффективной длительности экспозиции 15 с.
Таким образом, использование лазерного излучения может привести к увеличению числа КОЕ в бактериальных суспензиях максимум вдвое по сравнению с вариантами без облучения. В связи с этим необходимо определение характера влияния на растения избыточного количества метаболитов, синтезированных бактериальными клетками из биопрепаратов в количестве, превышающем данный показатель в их рабочих растворах в 2 и 4 раза.
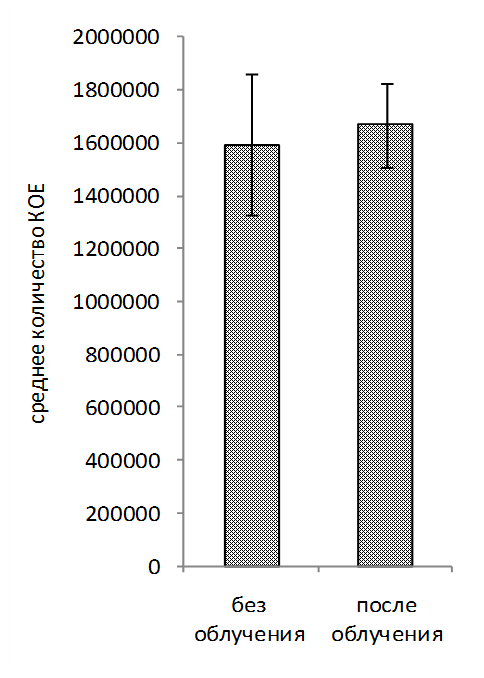 |
| Рисунок 44 – Влияние облучения на число КОЕ в рабочем растворе биопрепарата Гамаир |
Оценивали функциональное состояние растений в культуре in vitro на среде, содержащей ФКЖ бактерий из биопрепаратов в различной концентрации. Стандартом служило такое содержание метаболитов, которое синтезировано таким же числом микробных клеток, которое находится в том же объеме рабочего раствора биопрепаратов.
Для Алирина-Б и Гамаира это 6×107 кл/л; Витаплана — 1×108 кл/л; Пралина — 5×108 кл/л; Ризоплана — 1×106кл/л.
С использованием метода индуцированной флуоресценции хлорофилла на разработанном хлорофиллфлуориметре проводили измерение фотосинтетической активности исследуемых объектов по величине показателей KfT, Fm/Ft и Vt (рисунок 45).
KfT— удельная фотосинтетическая активность, его значение характеризует количество световой энергии, используемое на процесс фотосинтеза;
Fm/Ft- индекс жизнеспособности, отображающий скорость транспорта электронов между ФС 2 и ФС 1;
Vt — динамический показатель, характеризующий кинетические параметры скорости тушения флуоресценции.
 |
 |
| Рисунок 45 – Процесс измерения фотосинтетической активности микрорастений огурца в культурe in vitro | |
В исследования с использованием микрорастений огурца (рисунок 46) были включены метаболиты бактерий B.subtilis из биопрепаратов Алирин-Б, Гамаир, Пралин, а также P.fluorescenc из биопрепаратов Витаплан и Ризоплан. Проведенные исследования свидетельствуют о том, что увеличение количества метаболитов в питательной среде MS не оказывает негативного влияния на функциональное состояние хлорофиллсодержащих тканей.
У микрорастений огурца при концентрациях ФКЖ в 2 и 4 раза выше стандартной, отмечалось изменение фотосинтетической активности с тенденцией к увеличению, что отражают критерии KfT, Fm/Ft и Vt. Повышение концентрации метаболитов дало превышение исследуемых показателей при двухкратном увеличении по сравнению с их стандартным содержанием в среде на 32,5%; 3,8% и 28,6% соответственно и при четырехкратном –на 32,2%; 3,9% и 24,0% соответственно (рисунок 47, 48, 49).
 |
 |
| Рисунок 46 – Микрорастения огурца в культуре in vitro | |
Было проведено изучение функционального состояния микрорастений томата в культуре in vitro на среде, содержащей метаболиты бактерий B.subtilis из биопрепаратов Пралин, а также P.fluorescenc из биопрепаратов Витаплан и Ризоплан в различной концентрации. Оценку фотосинтетической активности исследуемых объектов проводили по величине показателей KfT, Fm/Ft и Vt.
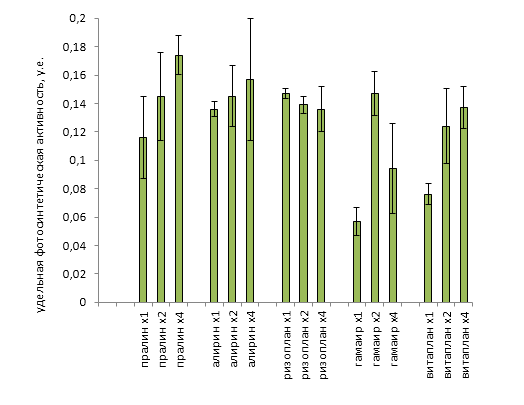
Рисунок 47 – Влияние метаболитов бактерий защитных биопрепаратов на показатель удельной фотосинтетической активности (KfT) у микрорастений огурца в культуре in vitro
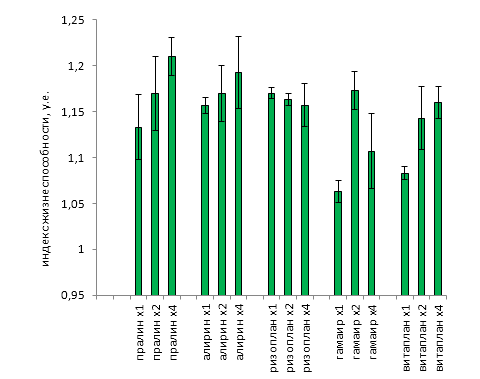
Рисунок 48 – Влияние метаболитов бактерий защитных биопрепаратов на индекс жизнеспособности (Fm/Ft) у микрорастений огурца в культуре in vitro
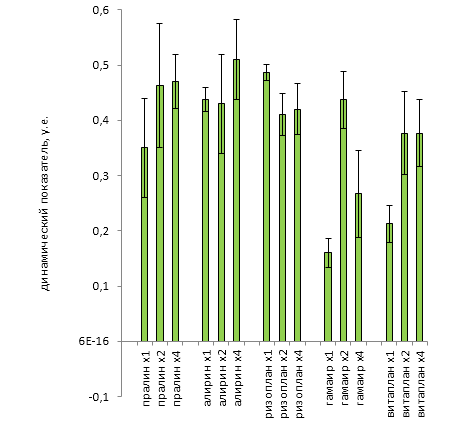
Рисунок 49 – Влияние метаболитов бактерий защитных биопрепаратов на динамический показатель фотосинтетической активности(Vt) у микрорастений огурца в культуре in vitro
Установлено, что увеличение содержания метаболитов в питательной среде MSне оказывает негативного влияния на функциональное состояние хлорофиллсодержащих тканей исследуемых растений томата. При использовании концентраций ФКЖ в 2 и 4 раза выше, по сравнению со стандартной, наблюдалось увеличение показателя KfT на 53,9%. Также отмечено незначительное изменение показателей Fm/Ft и Vt, в пределах ошибки среднего значения (превышение Vt на9,28%; снижение Fm/Ft на 1,63%) (рисунок 50).
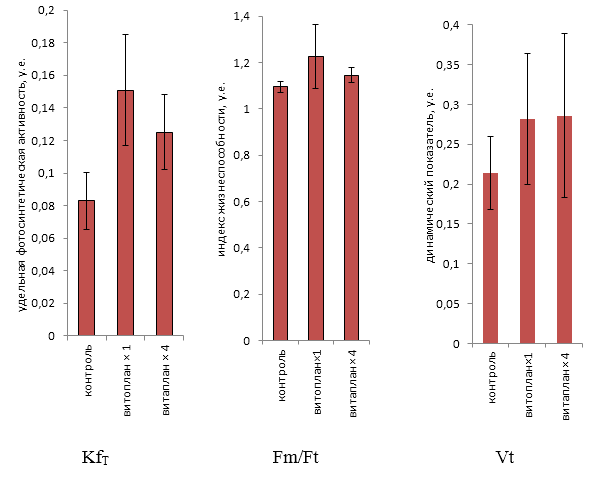
Рисунок 50 – Влияние метаболитов бактерии P.fluorescenc из препарата Витаплан в различных концентрациях на фотосинтетическую активность микрорастений томата в культуре in vitroпо показателям KfT, Fm/Ft и Vt
Таким образом, на примере микрорастений огурца и томата с использованием компьютеризированного оптико-электронного прибора для оценки физиологической активности растений в условиях in vitro открытого типа установлено, что избыточное накопление в субстрате метаболитов бактерий-агентов биоконтроля фитопатогенов в результате применения рабочих растворов защитных биопрепаратов после лазерной стимуляции не оказывает негативного воздействия на растительные ткани.
ЗАКЛЮЧЕНИЕ
- Апробирован лабораторный образец технологической установки для лазерной обработки микроорганизмов с использованием в качестве модельных образцов бактерий из защитных биопрепаратов КМП-St, КМП-3 в лабораторных условиях и Алирин-Б, Ризоплан в условиях защищенного грунта.
- Установлено увеличение числа КОЕ в рабочем растворе КМП-St после облучения когерентным светом в течение 60-480 с на 19% и КМП-3 в течение 120-480 с на 15% по сравнению с вариантом без облучения.
- Алирин-Б без применения облучения оказался неэффективным в борьбе с альтернариозом томата в условиях пленочной теплицы. Его облучение позволило повысить антифунгальную активность бактерии B.subtillis, входящей в его состав и, как следствие, уменьшить число погибших растений на 25,5%, а также увеличить количество бессимптомных экземпляров на 12,7% по сравнению с вариантом без облучения.
- БСЗР Ризоплан характеризовался высокой эффективностью в борьбе с A. alternatа, а применение лазерного облучение еще в большей степени стимулировало синтез бактериальных метаболитов фунгицидного действия. В варианте с использованием рабочего раствора препарата погибших растений было меньше на 46,8%, а бессимптомных больше на 51,0% по сравнению с контролем. Его облучение позволило вовсе избежать выпадов растений, а число бессимптомных образцов оказалось выше на 8,5 % по сравнению с вариантом без облучения.
- Степень поражения растений альтернариозом отразилась на ростовой активности растений томата и их урожайности. При использовании облученного препарата Алирин — Б высота растений была выше на 47,8% по сравнению с вариантом без облучения. На участке, где использовался облученный рабочий раствор Ризоплана средняя высота растений была на 28,8% больше по сравнению с необлученным вариантом. Обработка препарата Алирина — Б когерентным светом позволило достичь увеличения потенциальной урожайности на 60%, а использование препарата Ризоплан после лазерной стимуляции повысило данный показатель на 25,6%.
- Обосновано использование метода медленной индукции флуоресценции хлорофилла (МИФХ) для оценки физиологического состояния растений в условиях in vitro без нарушения стерильности.
- Проведен анализ геометрических параметров культуральных сосудов, наиболее часто используемых в биотехнологии и находящихся в них растений, который позволил задать размеры актуальной зоны возбуждения флуоресценции и получить исходные данных для обоснования параметров рабочих органов измерительного прибора и оптической схемы формирования зондирующего потока, возбуждающего флуоресценцию. Определено, что минимальные размеры актуальной зоны составляют 30×20×20 мм.
- Изготовлен специализированный оптический стенд и на высечках культуральных растений яблони, контактным способом проведены экспериментальные исследования по определению максимально допустимой плотности мощности возбуждающего МИФХ излучения по критерию устойчивости к фотодеструкции.
- Выявлено, что зондирующее излучение длиной волны 465 — 470 нм уже при плотности мощности 260 Вт/м2 за время менее 200 с приводит к необратимым фотодеструктивным процессам (для сравнения: типовой оптимальный режим засветки для измерения МИФХ листьев растений ex vitro: 180-300 секунд при плотности мощности 400-750 Вт/м2).
- Плотности мощности ниже 100 Вт/м2 приводит к резкому падению динамического диапазона измеряемых параметров МИФХ (в 2-3 раза). Выявленное противоречие может быть решено снижением длительности измерений, специальными методами обработки сигнала тушения флуоресценции и использованием циклических режимов засветки.
- Теоретически обоснованы оптико-электронная схема и параметры рабочих органов прибора (спектральный состава интенсивность и длительность зондирующего излучения, возбуждающего флуоресценцию; параметры фотоприемника, регистрирующего МИФХ), проведен расчет-обоснование оптической схемы формирования зондирующего потока, возбуждающего флуоресценцию.
- Разработано, изготовлено и испытано 4 типа формирователя оптического потока, из них выбрано 2 рабочих варианта, задающих конструкцию будущего прибора – так называемые кольцевой и полосовой типы формирователей.
- Предложен универсальный алгоритм оценки функционального состояния растений in vitro и ex vitro, основанный на цикличном измерении МИФХ одной и той же зоны объекта и позволяющий в рамках единой оптической схемы, за один измерительный цикл судить об активности фотосинтетических процессов в растениях и их устойчивости к фотоингибированию.
- Изготовлено специализированное электронное оборудование и проведена экспериментальная оптимизация параметров циклических измерений – интенсивности зондирующего излучения, длительности световых и темновых циклов.
- Разработано, изготовлено и испытано 2 макетных образца нового оборудования, по сумме критериев выбран оптимальный вариант конструкции прибора открытого типа, который имеет больше преимуществ по сравнению с макетным образцом закрытого типа.
- Проведенные эксперименты показали, что разработанное оборудование и предлагаемые критерии диагностики позволяют корректно судить о физиологическом состоянии растений в условиях in vitro с минимальным влиянием на их жизнедеятельность.
- Подготовлено техническое задание и инструкция по эксплуатации компьютеризированного оптико-электронного прибора для оценки физиологического состояния растений в условиях in vitro.
- Проведение эксперимента на Bacillus subtilis из Алирина-Б, Гамаира, Пралина, а также Pseudomonas fluorescens из Витаплана и Ризоплана показало, что использование лазерного излучения может привести к увеличению числа КОЕ в бактериальных суспензиях на эффективных экспозициях максимально до двух раз по сравнению с вариантами без облучения. Это явилось обоснованием необходимости изучения характера влияния на растения избыточного содержания метаболитов в субстрате, синтезированных таким количеством бактерий из биопрепаратов, которое в 2 и более раз превышает число КОЕ в их рабочих растворах.
- Установлено, что увеличение содержания метаболитов в питательной среде MS не оказывает негативного влияния на функциональное состояние хлорофиллсодержащих тканей исследуемых микрорастений огурца и томата.
- Повышение концентрации ФКЖ дало превышение показателей фотосинтетической активности KfT, Fm/Ft и Vt у микрорастений огурца при двухкратном увеличении по сравнению с их стандартным содержанием в среде на 32,5%; 3,8% и 28,6% соответственно и при четырехкратном – на 32,2%; 3,9% и 24,0% соответственно.
- Повышение концентрации метаболитов в среде при культивировании микрорастений томата в 2 и 4 раза дало превышение KfT и Vt на 53,9% и 9,28% соответственно, а также незначительное снижение показателя Fm/Ft на 1,63%.
Список литературы
- А.с. № 1750556 Способ отбора пробирочных растений земляники для беспересадочного хранения / В.А. Веселовский, Т.В. Веселова, О.Н. Самсонова // Б.И. — 1992. — №28. — 18 с.
- Аксененко М.Д., Бараночников М.Л. Приемники оптического излучения: справочник. — М.: Радио и связь, 1987. — 296 с.
- Активация защитных свойств томатов и огурцов метаболитами бактерий рода Pseudomonas / Ю.Ю. Павловец, И.Ю. Сахарута, О.В. Лагодич, А.В. Лагодич // Биологически активные препараты для растениеводства.научное обоснование — рекомендации — практические результаты: материалы международной научно-практической конференции. Минск, 2018. — С. 152-151.
- Артюхов В.Г., Путинцева О.В. Оптические методы анализа интактных и модифицированных биологических систем. — Воронеж: Из-во ВГУ, 1996. — 240с.
- Белякова А. В. Томаты. От рассады до урожая. — М.: Э, 2016. — 32 с.
- Будаговская О.Н., Будаговский А.В., Будаговский И.А. Неразрушающая диагностика функционального состояния плодов в послеуборочный период // Плодоводство и ягодоводство России. — 2012. — Т.33. — С. 43-52.
- Буровинская М.В., Юрченко Е.Г. Лабораторная оценка биологической эффективности фунгицидов в подавлении возбудителя альтернариоза винограда Alternaria tenuissima // Плодоводство и виноградарство Юга России. — 2019. — № 58. — C. 146-165.
- Буровинская М.В., Юрченко Е.Г. Лабораторная оценка биологической эффективности фунгицидов в подавлении возбудителя альтернариоза винограда Alternaria tenuissima // Плодоводство и виноградарство Юга России. — 2019. — № 58. — C. 146-165.
- Бутенко Р.Г. Биология клеток высших растений in vitro и биотехнологии на их основе: учеб. пособие МГУ им. М.В. Ломоносова. -М.: ФБК-Пресс, 1999. — 159 с.
- Веселова Т.В., Высоцкая О.Н., Веселовский В.А. Оценка состояния растений земляники, культивируемых in vitro, люминесцентным методом // Физиология растений. — 1994. — Т. 41. — № 6. — С. 942 — 946.
- Веселовский В.А., Веселова Т.В. Люминесценция растений. Теоретические и практические. — М.: Наука, 1990. — 200 с.
- Ветрова Е.В. Влияние альтернариоза на содержание некоторых органических соединений в плодах томата // Донецкие чтения 2018: образование, наука, инновации, культура и вызовы современности: материалы III международной научной конференции. — Донецк: Изд-во ДонНУ, 2018. — Т. 2: Химико-биологические науки. — С. 268-270.
- Матушкина О.В., Пронина И.Н., Ярмоленко Л.В., Матушкин С.А. Влияние минерального состава питательной среды на морфогенез садовых растений in vitro // Достижения науки и техники АПК. — 2014. — № 1. — С. 41-42.
- Высоцкий В.А. Биотехнологические приемы в размножении и сохранении ценных генотипов садовых культур // Научно-практические достижения и инновационные пути развития производства продукции садоводства для улучшения структуры питания и здоровья человека: материалы научно-практической конференции. — Мичуринск-наукоград РФ, 2008. — С. 22-25.
- Гаджиева А.М., Квасенков О.И.Новые технологии производства пищевых продуктов из томатов // Пищевая промышленность. — 2016. — № 8. — С. 50-52.
- Ганнибал Ф.Д. Мониторинг альтернариозов сельскохозяйственных культур и идентификация грибов рода Alternaria. Методическое пособие. — Спб, 2011. — 69 с.
- Гапоненко В.И., Николаева Г.Н., Шевчук С.Н. Обновление хлорофилла и продуктивность растений. — Минск: Навука i тэхнiка, 1996. — 247 с.
- Генетические основы селекции растений. Биотехнология в селекции растений. Клеточная инженерия / науч. ред. А.В. Кильчевский, Л.В. Хотылева. — Минск: Белорус.навука, 2012. — Т.3. — 489 с.
- ГОСТ 17772-88: Приемники излучения и устройства полупроводниковые фотоэлектрические. Методы измерения фотоэлектрических параметров и определения характеристик.
- ГОСТ РМЭК 60950-2002. Безопасность оборудования информационных технологий. — М.: Издательство стандартов, 2002. — 146 с.
- Гуральчук Ж.З., Мордерер Э.Ю. Резистентність рослин до ауксиноподібних гербіцидів у зв’язку з особливостями механізму їх фітотоксичної дії // Физиология растений и генетика. — 2017. — №. 49.- С. 3-14.
- Доспехов Б.А. Методика полевого опыта. — М.: Колос, 1965. — 423 с.
- Дэниел К. Применение статистики в промышленном эксперименте. -М.: Мир, 1979. — 301 с.
- Егорова Е.А., Бухов Н.Г. Влияние повышенных температур на активность альтернативных путей фотосинтетического транспорта электронов в листьях ячменя и кукурузы // Физиология растений. — 2002. — Т.49б. — №5. — С.646-655.
- Зажигаев Л.С., Киньшин А.А., Романиков Ю.И. Методы планирования и обработки результатов физического эксперимента. — М: Атомиздат, 1978. — 232.
- Златов А.С., Кушнаренко А.П. Исследование параметров полупроводниковых лазеров // Научно-технический вестник СПбГУ информационных технологий, механики и оптики. — 2006. — № 26. — С. 67-76.
- Изменение видового состава микофлоры ризосфер и филлосферы сахарной свеклы под влиянием биопрепаратов на основе эндофитных бактерий и их метаболитов / Л.И. Пусенкова, Е.Ю. Ильясова, О.В. Ласточкина, И. В. Максимов, С. А. Леонова // Почвоведение. — 2016. — № 10. — С. 1205-1213.
- Использование спектроскопии отражения в анализе пигментов высших растений / М.Н. Мерзляк, А.А. Гительсон, О.Б. Чивкунова, А.Е. Соловченко, С.И. Погосян // Физиология растений. — 2003. — Т. 50. — № 5. — С. 785 – 792.
- Иутинская Г.А. Микробные биотехнологии для решения задач устойчивого развития агросферы // Biologically active preparations for plant growing. Scientific background — recommendations — practical results: материалы XV международной научно-практической конференции. Киев. — 2019. — С. 93-96.
- Калинин Ф.Л. , Сарнацкая В.В., Полищук В.Е. Методы культуры тканей в физиологии и биохимии растений. — Киев: Наукова думка, 1980. — 487 с.
- Каменева И.А. Ассоциативные с растениями микроорганизмы как объекты биотехнологии микробных препаратов // Экобиотех: материалы VI всероссийской конференции с международным участием. — 2019. — С. 178-182.
- Кириченко А.В. , Назарько М.Д., Касьянов Г.И. Современные аспекты экологически чистых технологий и методов обработки и хранения томатов // Инновационные технологии и безопасность пищевых продуктов: сборник материалов международной научно-практической конференции. Краснодар: ИздКубГТУ, Экоинвест, 2018. — С.234-237.
- Коломиец Э. И. Микробные биотехнологии как основа экологизации и повышения продуктивности сельскохозяйственного производства // Микробные биотехнологии: фундаментальные и прикладные аспекты: сб. науч. тр. — Минск, 2018. — Т. 10. — С. 3–11.
- Коломиец Э., Сверчкова Н., Мандрик-Литвинкович М. Экологически безопасные биотехнологии для сельского хозяйства // Наука и инновации. — 2019. — №3. — С. 4-9.
- Конструирование приборов. В 2-х томах / под ред. В. Краузе. М.: Машиностроение, 1987. — 367 с.
- Корнеев Д.Ю. Информационные возможности метода индукции флуоресценции хлорофилла. — Киев: Альтенпресс, 2002. — 188 с.
- Корнестимулирующие бактерии рода Pseudomonas повышают продуктивность растений кресс-салата / Д.В. Маслак, И.Н. Феклистова, И.А. Гринева, В.А. Ломоносова и др. // Biologically active preparations for plant growing. Scientific background — recommendations — practical results: материалы XV международной научно-практической конференции. — Киев. — 2019. — С. 114.117.
- Кувалдин Э.В., Сурин В.Г. Специализированный фотометр для измерения патологических и физиологических изменений в растениях // Оптический журнал. — 1998. — Т. 65. — № 5. — С. 43 — 46.
- Куликова Н.А., Лебедева Г. Ф. Гербициды и экологические аспекты их применения: учебное пособие. М.: Книжный дом «ЛИБРОКОМ», 2010. — 152 с.
- Литвинов С.С. Методика полевого опыта в овощеводстве. М.: Россельхозакадемия, 2011. — 648 с.
- Логинов О.Н., Силищев Н.Н., Сулейманова Л.Р. Биопрепараты для защиты сельскохозяйственных растений от болезней и повышения их урожайности // Современные технологии и перспективы использования средств защиты растений, регуляторов роста, агрохимикатов в агроландшафтном земледелии: материалы 5-го Всероссийского научно-практического совещания-семинара «АНАПА-2008». — Анапа, 2008. — С. 54-55.
- Лукьянцев М.А. Особенности биологической активности эндофитных штаммов Bacillus subtilis cohn c различной степенью антагонизма к фитопатогенным грибам: автореф. дис. …канд. биол. наук. Саратов, 2010. — 21с.
- Максимов В.Н. Многофакторный эксперимент в биологии. М.: МГУ, 1980. — 280 с.
- Мартиросян Ю.Ц., Диловарова Т.А., Мартиросян В.В. Действие светодиодного облучения разного спектрального состава на фотосинтетический аппарат растений картофеля (Solanum tuberosum L.) в культуре in vitro // С.-х. биология. Сер. Биология растений. — 2016. — №5. — С. 680-687.
- Маскаленко О.А., Чурикова А.К. Эффективность микробиологических препаратов против основных болезней овощных и зерновых // Биологическая защита растений — основа стабилизации агроэкосистем. Становление и перспективы развития органического земледелия в Российской Федерации: материалы Международной научно-практической конференции. — Краснодар, 2018. — С. 43-416.
- Матушкина О.В., Пронина И.Н., Будаговская О.Н. Проблема витрификации побегов при микроразмножении плодовых растений // Аграрная наука. — 2011. — № 7. — С. 23-25.
- Мирошников, М.М. Теоретические основы оптико-электронных приборов. Л.: Машиностроение, 1983. — 696 с.
- Мирошниченк Д.Н., Филиппов М.В., Долгов С.В. Оптимизация условий для эффективного соматического эмбриогенеза и регенерации растений in vitro яровых сортов мягкой пшеницы // Доклады РАСХН. — 2012. — №6. — С. 22-26.
- Молканова О.И., Васильева О.Г., Коновалова Л.Н. Научные основы сохранения и воспроизводства генофонда ценных и редких видов растений в культуре in vitro // Бюллетень Главного ботанического сада. — 2015. — Т. 2015. — №2. — С. 78-82.
- Мордерер Э.Ю., Гуральчук Ж.З., Моргун В.В. Проблема контролювання сегетальної рослинності в агрофітоценозах у контексті збереження біорізноманіття // Український ботанічний журнал. — 2018. — №. 75. — С. 552-563.
- Мостеллер Ф., Тьюки Дж Анализ данных и регрессия.- М.: Финансы и статистика, 1982. — 317 с.
- Новикова И.И. Полифункциональные биопрепараты для фитосанитарной оптимизации агроэкосистем в биологическом земледелии // Теоретический и научно-практический журнал. ИАЭП. — 2019. — Вып. 2. — С. 183-194.
- Оздоровление и селекция растений in vitro, вирусологический мониторинг насаждений / Л.Л. Бунцевич, Г.К. Киселева, Ю.А. Денисенко, A.M. Дьяконова // Современные достижения биотехнологии в виноградарстве и других отраслях сельского хозяйства. — 2005. — С. 104-107.
- Основы органического производства / М.М. Добродькин, А.В. Кильчев ский, П.А. Саскевич, Ю.А. Миренков. Минск: ЗАО «Бонем», 2018. — 214 с.
- Особенности действия бактерий Bacillus subtilis № 2 и гуминового препарата на плодообразование перца сладкого / В.Н. Пищик, Н.И. Воробьев, О.Р. Удалова, В.Г. Сурин и др. // Российская сельскохозяйственная наука. — 2019. — № 3. — С. 22-27.
- Паластрова О.А. Эффективность фунгицидов в борьбе с болезнями томата // Вестник Курганской ГСХА. — 2018. — №2. — С.41-43.
- Приборы для неразрушающего контроля материалов и изделий. В 2-х томах / под ред. В.В. Клюева. М.: Машиностроение, 1976. — 634 с.
- Приходько Е.М., Авдеенко С.С. Анализ производства и использования биопрепаратов для защиты от основных болезней огурца в весенних теплицах 5-ой световой зоны // Развитие научной, творческой и инновационной деятельности молодежи: сборник статей по материалам X Всероссийской (национальной) научно-практической конференции молодых ученых, посвященной 75-летию Курганской ГСХА имени Т.С. Мальцева. Курганская государственная сельскохозяйственная академия им. Т.С. Мальцева (Лесниково), 2018. — С. 392-397.
- Программа и методика сортоизучения плодовых, ягодных и орехоплодных культур / Рос. акад. с.-х. наук. Всерос. науч.-исслед. ин-т селекции плодовых культур. Под общ. ред. Е. Н. Седова и Т. П. Огольцовой. — Орел : ВНИИСПК, 1999. — 606 с.
- Рожанская О.А., Сероклинов Г.В. Влияние лазерного облучения семян на морфогенез растений in vitro и in vivo // Плодоводство и ягодоводство России. — 2012. — Т. 33. — С. 293-301.
- Россеев В.М., Белан И.А., Россеева Л.П. Использование метода in vitro в селекции пшеницы // Вестник защиты растений. — 2016. — № 3. — С. 142.
- Русинов М.М. Техническая оптика. Л.: Машиностроение, 1979. — 488 с.
- Сергеева Л.Е., Бронникова Л.И. Клеточная селекция с ионами тяжёлых металлов: новые аспекты комплексной устойчивости // Биология клеток растений in vitro и биотехнология: сборник трудов X международной конференции. — 2016. — С. 99-101.
- Смеси поверхностно-активных веществ для гербицидов, основанных на действии ауксина: пат. RU (11) 2012 139 816 / Сунь Цзинься Сьюзан. Заявка: 22.02.2011; публ. 01.09.2011. 3 с.
- Совик Л.Е., Скрипчук П.М. Выращивание органических ягодных культур. Пинск: ПолесГУ, 2019. — 276 с.
- Соловых Н.В., Шорников Д.Г. Биотехнологические методы тестирования ягодных культур на устойчивость к неблагоприятным абиотическим воздействиям. Методика. Мичуринск-наукоград РФ, 2012. 48 с.
- Справочник конструктора оптико-механических приборов / под ред. В.А. Панова. Л.: Машиностроение, 1980. 742 с.
- Структурные параметры мезофилла листа при затенении растений разных функциональных типов / Л.А. Иванова, Л.А. Иванов, Д.А. Ронжина, В.И. Пьянков // Физиология растений. — 2008. — Т. 55. — № 2. — С. 230 — 239.
- Сулейманова Л. Р. Исследование комплексообразования метаболитов бактерий рода Pseudomonas: автореф. дис. …канд.биол.наук. — Уфа, 2009. — 25 с.
- Тие, Р. А., Шибзухов З.С.. Оптимизация использования химических и биологических средств защиты на томатах // Вестник АГУ. — 2018. — Вып. 4. — С. 145-148.
- Толоконцев Д.В., Тиханова Н.Н., Панкратова А.А. Влияние фиторегуляторов Мивал-агро и Рибав-экстра на динамику роста и морфометрические параметры растений картофеля in vitro // Плодоводство и ягодоводство России. — 2013. — Т.37. — Ч.1. — С. 331-337.
- Феклистова И.Н., Кулешова Ю.М., Федорович М.Н. Метаболиты бактерий Pseudomonas индуцируют системную устойчивость растений к возбудителям альтернариоза // Вестник БГУ. -2013. — Сер. 2. — № 2. — С. 38-42.
- Физиология растений: учебник для студ. вузов / Н.Д. Алехина и др. М.: Издательский центр «Академия», 2005. — 640 с.
- Ходаева B.П., Куликова В.И. Размножение сортов картофеля в культуре in vitro на различных питательных средах // Достижения науки и техники АПК. — 2016. — № 10. — С. 66-68.
- Чайковский Е.Э., Садовский В.А. Биопрепараты залог здоровой почвы и экологически чистых растений // Научный потенциал молодежи – будущему Беларуси: материалы XIII международной молодежной научно-практической конференции. Минск: ПолесГУ, 2019. — Ч. 3. — С. 106-108.
- Черкасова Н.Н., Жужжалова Т.П., Богомолов М.А. Создание линий сахарной свеклы in vitro, обладающих устойчивостью к кислотности сред // Сахарная свекла. — 2016. — №6. — С. 4-7.
- Шишкану Г.В. Фотосинтез яблони. Кишинев: Штиинца, 1973. — 292 с.
- Штамм бактерий Pseudomonas fluorescens для получения препарата против возбудителей заболеваний растений: пат. № 1825 446 РФ / И.А. Хмель, Т.А. Сорокина, Л.В. Ковалева, Н.Б. Леманова, С.Ф. Чеснокова, С.Л. Свергуненко. Заявка № 4873024 от 1990.08.09. — Опубл. 1997.02.20. — Патентовладелец: Институт молекулярной генетики РАН.
- Шульгин И.А., Клешнин А.Ф. О корреляции между оптическими свойствами и содержанием хлорофилла в листьях растений // Доклады АН СССР. — 1959. — Т. 12. — № 6. — С. 1371 — 1373.
- Эффективный метод генетической паспортизации штаммов Bacillus subtilis – перспективных продуцентов биопрепаратов / В. П. Терлецкий, В. И. Тыщенко, И. И. Новикова, И.В. Бойкова, С.Д. Тюлебаев, И. Я. Шахтамиров // Микробиология. — 2016. — Т. 85. — №1. — С. 50-55.
- Юркевич Е.С., Иода В.И. Оценка риска безопасного применения средств защиты растений на основе действующего вещества Дикамба // Сахаровские чтения 2019 года: экологические проблемы XXI века: материалы 19-й международной научной конференции Минск : ИВЦ Минфина, 2019. — Ч. 2. — С. 47-50.
- Якушенков Ю.Г. Основы оптико-электронного приборостроения. – М.: Советское радио, 1977. — 272 с.
- Akansha Jain, Sampa Das. Insight into the Interaction between Plants and Associated Fluorescent Pseudomonas spp. // International Journal of Agronomy. — 2016.
- Bacillus subtilis – mode of action of a microbial agenten hancing plant vitality / M. Kilian, U. Steiner, B. Krebs, H. Junge, G. Schmiedeknecht, R. Hain // Pflanzenschutz-Nachrichten Bayer. — 2016. — P. 72-93.
- BakerN.R. Chlorophyll fluorescence : a probe of photosynthesis in vivo. Annu. Rev. PlantBiol.59. — 2008. — Р. 89–113.
- Dobránszki J., Mendler-Drienyovszki N. Cytokinin-induced changes in the chlorophyll content and fluorescence of in vitro apple leaves // Journal Plant Physioljgy. — 2014. — V.171. — N16. — P. 1472 — 1478.
- Faraloni С. Chlorophyll fluorescence technique as a rapid tool for in vitro screening of olive cultivars (Olea europaea L.) tolerant to drought stress / С. Faraloni, I. Cutino, R. Petruccelli, A.R. Leva, S. Lazzeri, G. Torzillo // Environmental and Experimental Botany. — 2011. — V.73. — N11. — P. 49-56.
- Hart J.W. Light and plant growth. London: Unwin Hyman, 1988. — 206 p.
- Krause G.H., Weis E. Chlorophyll fluorescence and photosynthesis: the basics // Annual review of plant physiology and plant molecular biology. – 1991. — V. 42. — P. 313 — 349.
- Lichtenthaler H.K., Rindere U. The role of chlorophyll fluorescence in the detection of stress conditions in plant // CRC Critical Reviews in Analytical Chemistry. — 1988. — V. 19.Sup. 1. — P. 29 — 85.
- Maxwell K. , Johnson G.N. Chlorophyll fluorescence — a practical guide. // J. Exp. Bot. — 2000. — V. 51. — № 345. — P. 659-668.
- Portable fluorometer RAM-2000. Handbook of operation with examples of practical application. Heinz Walz Gmb H, 1993. — 199 p.
- Rodrigues T.T. First report of Alternaria tomatophila and A. grandis causing early blight on tomato and potato in Brazil / T.T. Rodrigues, M.L. Berbee, E.G. Simmons, C.R. Cardoso, A. Reis, L.A. Maffia, E.S.G. Mizubuti // New Dis. Reports, 2010. — № 22. — 28 p.
- Simmons E.G. Alternaria themes and variations (106-111) // Mycotaxon, 1994. — P. 209-427.
- Suzuki S., Hel Y., Oyaizul H. Indole-3-acetic acid production in Pseudomonas fluorescens HP72 and its association with suppression of creeping bentgrass brown patch // Current Microbiol. — 2003. — V. 47. — №2. — P.138 – 143.