Титульный лист и исполнители
РЕФЕРАТ
Отчет 171 с., 4 ч., 130 рис., 40 табл., 122 источника.
ЦЫПЛЯТА-БРОЙЛЕРЫ, ЯИЧНАЯ ПТИЦА, БЕЗОПАСНЫЕ СТИМУЛЯТОРЫ РОСТА, ФИТОЭКСТРАКТЫ, ЭФИРНЫЕ МАСЛА, ПРОБИОТИКИ, ПРЕБИОТИКИ, СИНБИОТИКИ, СОХРАННОСТЬ ПОГОЛОВЬЯ, МЯСНАЯ И ЯИЧНАЯ ПРОДУКТИВНОСТЬ ПТИЦ.
Объектом исследования являлись цыплята-бройлеры, яичная птица, кормовые добавки, включающие синбиотики и фитобиотики.
Цель работы – разработка теоретических основ и создание практических способов повышения продуктивности, неспецифической резистентности и сохранности, улучшения качества получаемой продукции цыплят-бройлеров и яичной птицы на основе введения в рацион кормовых добавок, включающих безопасные стимуляторы роста в виде синбиотиков и фитобиотиков.
Проведены научно-хозяйственные опыты и производственная проверка. В процессе выполнения работы изучены: живая масса подопытной птицы, сохранность поголовья, затраты корма на единицу продукции, мясная и яичная продуктивность птиц, развитие внутренних органов, качество мяса и яиц, переваримость и использование питательных веществ рациона птицей, обмен энергии, азота, кальция и фосфора, минерализация костной ткани, морфологический и биохимический состав крови, бактерицидная активность лейкоцитов, состояние микрофлоры толстого отдела кишечника, морфогистологическое состояние внутренних органов птиц. Определена экономическая эффективность работы.
Установлено, что использование кормовых добавок, включающих синбиотики и фитобиотики в составе комбикорма для мясной и яичной птицы, является целесообразным с биологических и экономических позиций.
ВВЕДЕНИЕ
Птицеводческая отрасль за последние десятилетия заняла лидирующие позиции в сельскохозяйственном сегменте по всему миру. Это объясняется наиболее интенсивными оборотами производства, короткими сроками воспроизводства, и, конечно же, высоким качеством получаемой продукции [1,2,3].
Производство максимального количества конкурентоспособной продукции высокого качества возможно лишь при условиях, которые учитывают биологические особенности птицы, ее физиологическое состояние, направление продуктивности и влияние на нее внешних факторов. Птица современных высокопродуктивных промышленных кроссов, отличается повышенной потребностью в питательных и биологически активных веществах, интенсивностью обменных процессов, скоростью роста и полового созревания. Такая птица является особенно чувствительной к негативному влиянию технологических и стрессовых факторов, которые приводят к определенным отклонениям обмена веществ и физиологических функций и, как следствие, снижению ее продуктивности и качества продукции [4,5,6,7].
Наиважнейшим фактором в повышении продуктивности сельскохозяйственной птицы является рациональная и сбалансированная система кормления [8,9,10]. При этом большую роль в активизации естественных защитных сил организма современных кроссов птиц, отселекцинированных на высокую продуктивность и скороспелость, имеют факторы, влияющие непосредственно на стимуляцию адаптационных способностей и иммунобиологической реактивности организма. К таким факторам относятся биологические стимуляторы различной природы: витамины, адаптогены, пробиотические, пребиотические и синбиотические препараты, ферментные препараты, фитобиотики, подкислители (препараты на основе органических кислот), хелатные соединения микроэлементов и др. Скармливание их в составе рациона обеспечивает лучшую усвояемость питательных веществ организмом, активизирует обмен веществ, обеспечивает стабильное сохранение и повышение продуктивности и жизнеспособности сельскохозяйственной птицы, при этом улучшаются финансовые показатели производства и качество продукции [11-29].
На сегодняшний день, в условиях современного промышленного птицеводства на одну из ведущих позиций выходит проблема сохранения здоровья животных при минимальном использовании кормовых антибиотиков [30-40]. Данную задачу возможно решить за счет организации правильного кормления птиц всех половозрастных групп с использованием кормовых добавок на основе натуральных природных стимуляторов роста, включающих фитобиотические, пробиотические, пребиотические, синбиотические препараты и др.
Цель исследования – разработка теоретических основ и создание практических способов повышения продуктивности, неспецифической резистентности и сохранности, улучшения качества получаемой продукции цыплят-бройлеров и яичной птицы на основе введения в рацион кормовых добавок, включающих безопасные стимуляторы роста в виде синбиотиков и фитобиотиков.
Исходя из цели исследования, поставлены следующие задачи:
- изучить влияние кормовых добавок, включающих синбиотики и фитобиотики, на динамику живой массы подопытной птицы, сохранность поголовья, затраты корма на единицу продукции;
- оценить влияние введения в рацион экспериментальных кормовых добавок на мясную и яичную продуктивность, развитие внутренних органов, качество птицепродукции;
- определить переваримость питательных веществ рациона, обмен энергии, обмен азота при использовании изучаемых кормовых факторов;
- изучить влияние исследуемых препаратов на обмен кальция и фосфора и минерализацию костной ткани птицы;
- определить различия морфологического и биохимического состава крови птицы при скармливании изучаемых препаратов;
- исследовать состояние микробиоценоза толстого отдела кишечника птицы под влиянием экспериментальных кормовых добавок;
- изучить влияние исследуемых кормовых компонентов на морфогистологическое состояние внутренних органов цыплят-бройлеров и кур-несушек;
- определить экономические показатели производства птицепродукции при включении в состав комбикорма новых кормовых препаратов.
Научная новизна исследований. Впервые в комплексном сравнительном исследовании научно обоснованы резервы повышения продуктивных качеств, естественной резистентности мясной и яичной птицы за счет применения в составе комбикорма новых кормовых добавок, включающих безопасные стимуляторы роста в виде синбиотиков и фитобиотиков. Получены новые данные о влиянии изучаемых кормовых факторов на мясную и яичную продуктивность, сохранность поголовья, затраты корма на единицу продукции, качество мяса и яйца, переваримость и использование питательных веществ корма, обмен энергии, минерализацию костной ткани, морфо-биохимические показатели крови, микробиоценоз толстого отдела кишечника, гистологическое состояние внутренних органов, экономические показатели.
Теоретическая и практическая значимость работы. Теоретическая значимость работы определяется углублением знаний об обмене веществ в организме цыплят-бройлеров и промышленных кур-несушек при использовании в составе комбикорма кормовых добавок, включающих синбиотики и фитобиотики. Практическая значимость работы заключается в том, что на основе экспериментального материала разработаны научно-практические рекомендации птицеводческим предприятиям, по использованию в составе комбикормов кормовых добавок, на основе синбиотиков и фитобиотиков, с целью повышения продуктивности птицы и качества продукции.
1 ПРИМЕНЕНИЕ БЕЗОПАСНЫХ СТИМУЛЯТОРОВ РОСТА В КОРМЛЕНИИ СЕЛЬСКОХОЗЯЙСТВЕННОЙ ПТИЦЫ
Полноценное сбалансированное кормление птицы является основой эффективного производства продуктов птицеводства. В настоящее время общемировые тенденции в области питания птиц уходят от использования в рационах кормовых антибиотиков, так как это впоследствии негативно сказывается на здоровье животных, потребителей и окружающей среде. В связи с этим сельскохозяйственные предприятия озадачены вопросами поиска альтернативных кормовых средств природного происхождения, заменяющих антибиотики. Дополнительным требованием к таким средствам выдвигают способность повышения использования птицей питательных веществ рационов.
Положительными характеристиками от применения препаратов природного происхождения являются: оказание положительного влияния на обмен веществ, повышение иммунного статуса, увеличение продуктивности животных, улучшение качества продукции.
Стимуляторами роста природного происхождения являются: пробиотики, пребиотики, синбиотики, фитобиотики, минеральные вещества, и др.
Пробиотики
Понятие пробиотик подразумевает под собой биологический препарат, пищевые и кормовые добавки, в основу которых входят живые микроорганизмы. Эти микроорганизмы являются представителями микрофлоры человека или животных (бифидобактерии, лактобактерии, эшерихии, энтерококки), но при этом не являются представителями индигенной микрофлоры, хотя способствуют ее размножению (дрожжи, апатогенные бактерии рода Bacillus) [41-44].
Пробиотики могут изменить динамику микробной популяции желудочно-кишечного тракта в положительную сторону вследствие изменения баланса полезной и вредной микрофлоры: способствовать увеличению популяции лактобактерий, бифидобактерий и снижению количества колибактерий и клостридий. Уменьшение патогенных бактерий в желудочно-кишечном тракте связано со способностью пробиотических микроорганизмов продуцировать антимикробные вещества (бактериоцины), а также органические кислоты (молочная, пропионовая и др.), в результате чего происходит повышение кислотности, что создаёт неблагоприятные условия для развития большинства вредных микроорганизмов. Кроме этого микроорганизмы-пробионты проявляют антагонистическую активность по отношению к вредной микрофлоре посредством конкуренции за питательные вещества и места адгезии к эпителию внутренней поверхности кишечника. Дополнительный положительный эффект от применения пробиотиков заключается в том, что эти микроорганизмы в процессе своей жизнедеятельности производят полезные для организма-хозяина вещества, такие как витамины, ферменты и аминокислоты [45-53].
Роль кишечной микрофлоры для оптимального, физиологичного функционирования организма животных и птиц огромна. Здоровая микробная популяция обеспечивает нормальное протекание пищеварительных процессов, повышает усвоение питательных веществ корма, что в конечном итоге положительно отражается на продуктивности сельскохозяйственных животных и птиц [54-57].
В последние годы пробиотики пользуются большим спросом у отечественных птицеводческих предприятий в качестве безопасных стимуляторов роста, заменителей кормовых антибиотиков [58,59].
На рынке представлены различные формы пробиотиков: сухие, жидкие, пастообразные. Большим спросом пользуются формы сухих порошков, сухих смесей в капсулах, таблетки, гранулы. Популярность сухой формы объясняется удобством использования, увеличенным сроком годности, а также наличием в своем составе нескольких видов штаммов.
Морозова Е.С., Мурленков Н.В. и Шуметов В.Г. проводили исследования по изучению влияния пробиотика «Oлин». Результаты экспериментов показали, что данная добавка положительно повлияла на мясную продуктивность цыплят-бройлеров. Так, графическими методами нелинейного корреляционного анализа обосновано, что максимум ведущих показателей качества полуфабриката – массы мышц и филе – достигается при дозировке пробиотика около 0,024 г/гол [60].
Исследования Червоновой И.В. подтвердили данные об эффективности применения пробиотика «Олин» на продуктивные показатели цыплят-бройлеров: живая масса цыплят возросла на 6,4%. На фоне его использования отмечено увеличение количества эритроцитов на 9,6-11,5%, концентрации гемоглобина на 5,5-7,9%. К тому же пробиотик «Олин» благоприятно повлиял на содержание общего белка, альбуминов и глобулинов в крови птицы, что свидетельствует о повышении иммунного статуса бройлеров [61].
Данилова А.А. и Ратошный А.Н. изучали действие пробиотика «Споротермин» на продуктивные показатели цыплят-бройлеров. Авторами установлено, что пробиотик способствовал увеличению живой массы цыплят на 9%, сохранности на 2,8%, а также снижению затрат корма на 1 кг прироста живой массы на 8,6% [62].
Проблемой отечественного птицеводства является то, что основными компонентами комбикормов для птицы являются — рожь, пшеница, подсолнечный шрот и овес. Данное сырье характеризуется высоким содержанием некрахмалистых полисахаридов. Переизбыток этих веществ в рационах моногастричных ведет к блокировке доступа пищеварительных ферментов к питательным веществам, что ухудшает их использование [63]. Происходит это за счет того, что из некрахмалистых полисахаридов в желудочно-кишечном тракте птицы образуется вязкий раствор. Этот раствор обволакивает кормовую массу. В итоге организм птицы вырабатывает жидкий помет, что ведет в дальнейшем к существенному снижению продуктивности и увеличению затрат корма. Современные птицеводческие предприятия нашей страны решают эту проблему за счет введения в рацион птицы ферментных препаратов или стимуляторов роста. Манукян В.А., Ленковой Т.Н и Егоровым И.А была изучена эффективность применения ферментативного пробиотика в кормлении бройлеров. В результате исследования установлено, что при введении изучаемой добавки в рацион бройлеров удалось увеличить усвояемость органического вещества на 1,3%, переваримость клетчатки на 5,2%, что привело к снижению затрат корма на 1 кг прироста живой массы на 2,4% [64].
По данным Царук Л.Л. использование пробиотика «Лактисан» в кормлении бройлеров с первого дня жизни позволило повысить массу потрошенной тушки на 12,1%, а количество съедобных частей тушки на 13,9% [65].
Гурциевой М.С. и Калоевым Б.С. проведено исследование по изучению эффективности применения ферментативного пробиотика Целлобактерин в кормлении цыплят-бройлеров. Результаты исследования показали, что он может полностью заменять в рационе кормовые ферменты и пробиотики. Благодаря его скармливанию удалось снизить потребность в антибиотиках и пребиотиках [66].
Исследования Курманаевой В. и Бушова А. по включению в рационы цыплят-бройлеров пробиотических препаратов Целлобактерин, Целлобактерин-Т и Провитол демонстрируют, что данные пробиотики способствуют увеличению сохранности на 1,0-3,0%, интенсивности роста — на 1,5-8,6% и убойного выхода тушек — на 3,2-4,5%. В своей работе авторы отмечают, что вышеперечисленные препараты улучшили видовой состав микроорганизмов желудочно-кишечного тракта птицы. При использовании пробиотика Целобактерин-Т в слепых отделах кишечника цыплят были практически не обнаружены энтеробактерии. Также применение данных пробиотиков позволило снизить уровень клостридий в кишечнике [67].
Опыты, проведённые Гиндулиным А.И., Тремасовым М.Я. и Белецким С.О. подтверждают положительное воздействие на здоровье и продуктивность цыплят-бройлеров пробиотиков на основе бактерий родов Lactobacterium и Bacillus. У опытной птицы было отмечено укрепление иммунной системы и увеличение живой массы на 24,6 и 23,0%. Введение таких пробиотиков в рацион цыплят, подверженных субхроническому Т-2 токсикозу, позволило нормализовать морфологичеcкие и биохимические показатели крови, а именно: количество лейкоцитов увеличилось до 22,4%, гемоглобина – до 8,3%, эритроцитов – до 11,7%; на 12,0 и 15,0% увеличилось содержание общего белка, на 10,3 и 12,0% – глюкозы [68].
Овчаровой А.Н. и Петраковым Е.С. (2018) опытным путём получены данные о положительном влиянии пробиотика «Белсубтил» на физиологический статус и продуктивность цыплят-бройлеров кросса «Кобб-500». В ходе применения данного пробиотика живая масса цыплят бройлеров была увеличена на 4,7%, сохранность поголовья – на 8,33%, выход потрошёной тушки – на 1,5%. Кроме этого, было отмечено повышение в крови количества эритроцитов, увеличение количества бифидобактерий и непатогенных штаммов кишечной палочки в составе микрофлоры пищеварительного тракта [69].
Использование пробиотика «Норд-Бакт» перрорально на молодняке птицы ячного направления «Родонит-3» способствовало увеличению живой массы в возрасте 16 недель на 10,3%, сохранности поголовья – до 99,5%, снижению расходов кормов, повышению концентрации в крови общего белка на 2,5%, альбуминов – на 3,4% [70]
В исследованиях Хитрого Ф.Н. и Прохорова О.Н. описывается эффективность использования пробиотика «Бацелл-М» в кормлении цыплят-бройлеров. Применение данного препарата способствовало увеличению сохранности поголовья на 2,0%, живой массы – на 9,74%, среднесуточного прироста – на 12,7% [71].
Таким образом, пробиотики, за счёт снижения кишечной колонизации и распространения зоонозных и других кишечных патогенов, оказывают положительное влияние на формирование здорового микробиоценоза в организме сельскохозяйственной птицы, тем самым способствуя повышению переваримости и усвояемости питательных и биологически активных веществ кормов, что в свою очередь положительно отражается на продуктивных показателях птицы.
Пребиотики
Пребиотики — это компоненты пищи, которые не перевариваются и не усваиваются в верхних отделах желудочно-кишечного тракта, но ферментируются микрофлорой толстого кишечника и стимулируют её рост и жизнедеятельность [72,73].
К пребиотикам относят неусвояемые, непереваримые углеводы (олигосахариды, фруктоолигасахариды, модифицированный крахмал, инулин, гемицеллюлозы, фруктаны, пектин, хитин), а также биологически активные иммунные белки — лактоглобулины, гликопептиды, отдельные витамины и их производные.
Механизм действия пребиотиков заключается в:
1) торможении роста вредных кишечных микробов (за счет конкуренции за субстраты и места прикрепления к слизистой оболочке);
2) усилении кишечной кислотности (через продукцию короткоцепочечных жирных кислот);
3) стимуляции роста кишечных абсорбирующих клеток;
4) стимулировании кишечной иммунной системы, что способствует повышению продуктивности и улучшению состояния здоровья птицы [74-78].
Осепчук Д.В., Скворцова Л.Н., Пышманцева Н.А. и др. изучали влияние скармливания пребиотика на основе инулина на продуктивные показатели цыплят-бройлеров. Результаты исследования показали, что при применении инулиносодержащего пребиотика снизилась себестоимость 1 кг прироста живой массы на 2,0%, а рентабельность производства повысилась на 3,1% [79].
По данным Кочиш И.И., Мясниковой О.В., Мартынова В.В., Смоленского В.И. использование пребиотика Ветелакт и пробиотика Профорт способствовали повышению числа бифидо- и целлюлозолитических бактерий в кишечнике кур кросса Ломанн, на фоне снижения патогенной и нежелательной микрофлоры. Уменьшение в составе микробиоты доли патогенных и нежелательных микроорганизмов закономерно снижало потребность организма в факторах неспецифической защиты и противоспалительных цитокинах [80].
Буряков Н.П., Бурякова М.А., Миронов М.М. провели исследование по изучению влияния пребиотика «Сель Ист» на показатели обмена веществ и продуктивность цыплят бройлеров. Результаты эксперимента показали, что использование данного препарата в количестве 1 кг на 1 т комбикорма способствовало повышению абсолютного прироста цыплят-бройлеров на 7,5%, сохранности поголовья – на 1,0%, убойного выхода – на 1,44%, при этом затрат корма на 1 кг прироста живой массы снизились на 8,95% [81].
Результаты исследований Шацких Е.В., Нуфер А.И., Галиева Д.М. показали, что выращивание цыплят-бройлеров при замене в составе комбикорма кормовых антибиотиков на пребиотические кормовые добавки СафМаннан и Иммуносан, представляющие углеводные комплексы клеточных стенок дрожжей, способствовало соответственно повышению, убойного выхода потрошеной тушки в среднем на 2,3 и 2,0%; массы потрошеной тушки на 5,6 и 3,8%; количества мышц в составе тушки на 8,1 и 10,2 %; количества мышц в грудке на 2,0 и 17,5 %; количества мышц в бедре на 4,2 и 1,7%; количества мышц в голени на 2,3 и 13,8 %; переваримость сухого вещества в опытных группах была выше в среднем на 4,7%, сырого жира – на 11,35% [82].
Синбиотики
Синбиотики – это кормовые добавки, включающие в себя пробиотики и пребиотики. Используются в кормлении животных с целью восстановления и/или поддержания здоровья кишечной микробиоты.
Промышленное птицеводство подразумевает под собой использование антибиотиков в борьбе с болезнетворными микроорганизмами. Негативным фактором воздействия антибиотиков на живой организм является его способность к подавлению не только болезнетворных микроорганизмов, но и полезной микрофлоры кишечника. Угнетение полезной микрофлоры в итоге ведет к возникновению дисбактериозов. Промышленное птицеводство с 20-го века использует антибиотики в качестве стимуляторов роста.
Бессистемное и длительное использование антибиотиков привело в итоге к селекции в окружающей среде устойчивой к антибиотикам болезнетворной микрофлоры. В связи с этим приходится создавать более мощные антибиотические препараты, в ответ на них селекционируется еще более устойчивая микрофлора. Все это ведет к тому, что использование антибиотиков становится не эффективным и в лечении птицы, и в лечении человека.
При острых диарейных расстройствах кишечника у животных и птицы не эффективно использование пробиотических препаратов на основе культур Lactobacillus, Bifidobacterium, Streptococcus, Bacillus subtilis и др. Так как в этот момент организм совершенно не способен ферментировать и переваривать питательные вещества корма. В итоге были разработаны синбиотические препараты, которые представляют собой активную микробиологическую составляющую (собственно пробиотик) и среду (пребиотик). В таком варианте создаются условия для жизни вносимой микрофлоры.
В работе Кузьменко П.М. изучалось воздействие синбиотического препарата «Синвет» на продуктивные показатели и сохранность цыплят-бройлеров. Результаты исследований доказали положительное воздействие изучаемой добавки на здоровье птицы. Сохранность в опытных группах цыплят, которым скармливали «Синвет», была выше на 7,6% [83].
Юрина Н.А, Омельченко Н.А., Осепчук Д.В. изучали эффективность использования синбиотика «Синбиосорб 2» в кормлении цыплят-бройлеров. Установлено, что под влиянием изучаемого препарата среднесуточный прирост живой массы опытных цыплят был выше на 3,0%, однородность поголовья — на 15,6%, сохранность поголовья — на 1,0% [84].
Буяров В.С. и Метасова С.Ю. исследовали эффективность применения синбиотика «ПроСтор» в кормлении ремонтного молодняка кросса «Росс-308». Авторами отмечено, введение этого препарата в рацион птиц способствовало повышению естественной резистентности организма опытной птицы, что подтверждалось повышением уровня эритроцитов, гемоглобина и содержания общего белка у птицы опытной группы на 12,58; 5,6 и 10,42%, соответственно. После клинических наблюдений и патологоанатомических вскрытий у птицы опытной группы уменьшилось проявление желудочно-кишечных заболеваний на 2-4% в сравнении с контрольной группой. Использование синбиотика «ПроСтор» оказало положительное влияние на рост, однородность птицы по живой массе, сохранность и выход молодняка, предназначенного для замены взрослого поголовья птицы (выход деловой молодки), способствовало сокращению затрат кормов на единицу прироста при выращивании, что вело к снижению себестоимости продукции [85].
Результаты испытания синбиотической добавки «Синбиосорб 1» были описаны в работе Чикова А.Е., Юриной Н.А., Омельченко Н.А. Авторы исследований отмечают, что современная наука направлена на разработку синбиотических препаратов — комплексных форм пробиотиков и пребиотиков. Чистые формы пробиотиков и пребиотиков доказали свою неэффективность в борьбе в диарейными явлениями у птицы. Ученые показали, что применение синбиотика «Синбиосорб 1» в количестве 0,05% способствовало повышению живой массы птицы в возрасте 37 дней на 1,8%, сохранности поголовья – на 1,6%, снижению затрат корма на 1 кг прироста живой массы – на 1,7% [86,87].
Фитобиотики
На сегодняшний день перспективным является направление создания и применения фитобиотиков в кормлении сельскохозяйственной птицы.
Под термином фитобиотики понимают натуральные добавки растительного происхождения, которые обладают различным действием на организм животного.
К функциям фитобиотиков относят:
— антимикробная;
— противовирусная;
— иммуномодулирующая;
— противогрибковая;
— противовоспалительная.
Фитобиотики зарекомендовали себя как эффективные средства в поддержании стабильно-оптимального состояния желудочно-кишечного тракта, обменных процессов в организме сельскохозяйственной птицы, их иммунного статуса, благодаря воздействию определенных биологически активных соединений, содержащихся в них [88-91].
В кормлении животных и птиц фитобиотики используются в качестве средства, повышающего их продуктивность и улучшающего качество пищевых продуктов.
Популяризация фитопрепаратов началась с Европейских стран. Причина всё та же — запрет на применение антибиотиков.
Крупнейшими мировыми производителями фитобиотиков являются Европейские компании. Например, немецкая компания Phytobiotics Futterzusatzstoffe GmbH, начавшая свою работу в 2000 году [92].
Отличительной характеристикой фитобиотиков является их способность к стимуляции эндогенных ферментов, что благоприятно действует на переваримость и усвоение питательных веществ кормов. Фитобиотики, относясь к природным стимуляторам роста (ПСР), могут стать многообещающей заменой антибиотических стимуляторов роста в современных животноводческих хозяйствах. Объединенные в сбалансированную смесь, различные ПСР, эффективно противостоят вторжению патогенных организмов и неблагоприятным условиям содержания [93-97].
Шмакова С.В. и Ланцева Н.Н. опубликовали данные об исследовании эффективности использования фитобиотика на основе отвара кипрея на продуктивные качества бройлеров. Авторы показали, что скармливание данного препарата позволило увеличить живую массу птицы на 8,7%, а среднесуточный прирост на 6,9% [98].
Ланцевой Н.Н., Мартыщенко А.Е., Швыдковым А.Н. были проведены исследования по выявлению действия фитобиотика Флорабис на продуктивные показатели бройлеров. Основу данного препарата составляют тритерпеновые кислоты пихты сибирской в комплексе с ионами кобальта. Кислоты сибирской пихты обладают ярко выраженным противовирусным, бактерицидным и иммуномодулирующим действием. Результаты исследований подтвердили предположения о благотворном влиянии фитобиотика на зоотехнические и физиологические показатели птицы. Результатом скармливания стало увеличение живой массы птицы на 3,8%, среднесуточного прироста на 3,7%, сохранности на 6,7 % на фоне повышения переваримости питательных веществ корма [99].
Результаты исследования Лапкиной Е.З. и Тирранен Л.С. по изучению эффективности использования травяной добавки на основе растений крапивы двудомной и звездчатки средней в кормлении японских перепелов демонстрировали, что травяная добавка не оказала влияния на динамику живой массы птицы, но положительно сказалась на её яйценоскости. У перепелок, которым скармливали изучаемое кормовое средство, яйценоскость наступила на 8 дней раньше, чем у контрольной птицы, при этом яйца опытных перепелок были с более высоким содержанием каротиноидов и витамина А. Также в исследованиях отмечено повышение вкусовых качеств мяса птицы и яиц [100].
Эксперименты, проведенные Кишняйкиной Е.А. и Жучаевым К.В. показали, что применение экстракта чабреца в кормлении птицы мясного направления продуктивности позволяет повысить прирост живой массы цыплят-бройлеров в опытных группах от 2,3 до 4,7 %, снизить затраты корма на 1 кг прироста на 1,1–8,1 %, увеличить сохранность птицы на 2,7–8,1 % и повысить европейский индекс продуктивности на 0,2–21,3 % [101].
Сахно О.Н. и Буяровым В.С. установлено, что использование в составе рациона для цыплят-бройлеров кормовой добавки на основе чесночного аллицина (коммерческое название «Алекс»), способствовало повышению живой массы у опытной птицы на 5,5%. Добавку «Алекс» тестировали совместно с антиоксидантом «Эмицидин», получив аналогичные результаты. Такое комплексное применение добавок позволило увеличить рентабельность производства мяса бройлеров на 4,7% [102].
Игнатович Л.С. проводил исследование по изучению эффективности применения компонентных кормовых добавок на основе травяной муки из тысячелистника на курах несушках. Автор констатирует, что введение в рацион кормовых добавок, состоящих из 0,3-1,0% муки из крапивы двудомной; 0,2-1,0% муки из хвои стланика кедрового; 0,5% муки из бурых морских водорослей (ламинарии); 0,5-1,0% муки из пижмы обыкновенной и 0,5-1,5% муки из тысячелистника обыкновенного, способствует интенсификации обменных процессов, происходящих в организме кур-несушек. Так, использование азота корма возрастало до 9,2%; золы – до 12,0%; кальция – до 7,0%; фосфора – до 13,7%; переваримости протеина – до 2,7%; жира – до 10,8% БЭВ – до 1,6%. Интенсификация обменных процессов способствовала повышению продуктивности птицы: валовой сбор яиц возрастал до 11,3%; интенсивность яйцекладки – до 8,8%; выход яичной массы – до 25,3% к контрольным показателям, в зависимости от доз включаемых компонентов [103].
Результаты исследований Шацких Е.В., Нуфер А.И. свидетельствуют об эффективности использования в рационе цыплят-бройлеров, как дополнительно, так и взамен кормовых антибиотиков, кормовой добавки, включающей в себя эфирные масла, защищенные органические кислоты, экстракт жгучего перца (коммерческое название Проактив Поултри). При этом повышается живая масса в конце откорма (38 дней) у петушков опытных групп на 0,7 и 5,1 % (Р≤0,05), у курочек – на 0,6 и 6,1% (Р≤0,01). Сохранность поголовья бройлеров (в среднем по петушкам и курочкам) в опытных группах была выше, чем в контроле на 1,25% и составила 94,4%. Анализ химического состава грудных и бедренных мышц бройлеров свидетельствует о повышении уровня жира и соответственно энергетической ценности мяса у опытных особей [104].
Подводя итог вышесказанному, стоит отметить, что применение безопасных стимуляторов роста в виде пробиотиков, пребиотиков, синбиотиков, фитобиотиков и др. является перспективным направлением в области кормления сельскохозяйственной птицы. Благодаря их использованию можно достичь повышения производительных мощностей птицеводства, получая при этом высококачественные и безопасные продукты питания, что и послужило основанием для проведения научно-исследовательской работы в данном направлении.
2 ХАРАКТЕРИСТИКА КОРМОВЫХ ДОБАВОК, ИСПОЛЬЗУЕМЫХ В ЭКСПЕРИМЕНТАХ НА ПТИЦЕ
ПроСтор – биологически активная добавка, содержащая пробиотическую составляющую — живые спорообразующие микроорганизмы Bacillus subtilis В-8130, Bacillus subtilis 44-р, Bacillus subtilis 188, в количестве не менее 1х106 КОЕ/г и вспомогательные вещества — жом свекловичный ферментированный, автолизаты дрожжей, минеральные соли, углеводы, фитодобавки (трава эхинацеи пурпурной, плоды расторопши пятнистой).
Способ приготовления биологически активной кормовой добавки ПроСтор осуществляют следующим образом. Проводят раздельное глубинное культивирование штаммов Bacillus subtilis В-8130, Bacillus subtilis 44-р, Bacillus subtilis 188 с получением жидких культур. Далее осуществляют твердофазную ферментацию жидких культур Bacillus subtilis В-8130, Bacillus subtilis 44-р, Bacillus subtilis 188. Их смешивают в соотношении 6:6:1, соответственно, до получения 65 л и наносят на предварительно подготовленный носитель для проведения твердофазной ферментации — стерильный свекловичный жом в количестве 200 кг, обработанный целлюлолитическим ферментом и обогащенный ферментолизатом кормовых дрожжей Saccharomyces cerevisiae.
Для получения ферментолизата кормовых дрожжей Saccharomyces cerevisiae готовят смесь: меласса — 255-265 г, калий фосфорнокислый двузамещенный – 98 -102 г, магний сернокислый — 25-26 г, кормовые дрожжи Saccharomyces cerevisiae — 3 кг и вода до 30 л. Смесь стерилизуют при температуре 120°С в течение 30 мин и добавляют к носителю, в который вносят 4 л раствора целловиридина или целлюлокса F с содержанием целлюлазы не менее 2000 ед/г носителя, доводят рН до 6,0-6,5, смесь тщательно перемешивают, выдерживают 2 ч при температуре 45-50°С. Твердофазную ферментацию проводят в условиях ограниченного доступа кислорода при температуре 45-50°С, рН 7,5-8,0 и влажности замеса 43-48% в течение 48-50 ч. Смесь тщательно перемешивают и высушивают до влажности 8-10%, после чего добавляют сухие порошки травы эхинацеи пурпурной и плодов расторопши пятнистой из расчета 20-50 г порошка эхинацеи и 20-50 г порошка расторопши на 1 кг конечного продукта. Полученную смесь перемешивают в течение 0,5 ч и подвергают дроблению до получения однородной массы [105].
Преимущество сорбированных форм пробиотиков, содержащих бактерии, иммобилизованные на частицах твердого сорбента, заключается в том, что за счет химических и электростатических сил их взаимодействие со стенкой кишечника животных гораздо выше. При этом сорбент ускоряет дезинтоксикационные и репаративные процессы в организме.
В препарате ПроСтор содержится набор важнейших ферментов: целлюлаза, эндоглюканаза, амилаза, протеаза, липаза, органические кислоты, витамины и аминокислоты, иммуноактивные пептиды — продукты метаболизма пробиотиков. Входящий в препарат специально обработанный свекловичный жом, содержит бактерицидные фитокомпоненты — терпены и трерпеноиды, фиточастицы – микросорбенты и пребиотики — пектины свеклы. Композиция обогащена полученным по специальной технологии ферментолизатом кормовых дрожжей Saccharomyces cerevisiae. Комбинация маннан-олигосахаридов и бета-глюканов, входящих в клеточные стенки дрожжей, служит дополнительным пребиотиком. Фитокомпоненты эхинацеи и расторопши расширяют спектр биологического действия препарата.
Пребиотики — субстраты, стимулирующие естественную микрофлору кишечника, они не перевариваются и не всасываются в желудке и тонком отделе кишечника животных. Попадая в толстый отдел кишечника, пребиотики используются в качестве питательной среды для нормальной микробиоты. У млекопитающих в первые дни после рождения основным пребиотическим субстратом является лактулоза, входящая в состав молока. С переходом на смешанное кормление субстратом, способствующим росту нормальной микробиоты, становятся структурные элементы растительных тканей, различные полисахариды (пектины, инулин и др.). Пищевые волокна выполняют и другие важные функции: нормализуют моторику, адсорбируют токсины.
Эхинацея обладает иммуномодуляторными свойствами. Все органы растения содержат полисахариды, эфирное масло (цветки до 0,5%, трава до 0,35%, корни до 0,25%). Главная составная часть эфирного масла — нециклические сесквитерпены. В корнях обнаружены гликозид эхинакозид, бетаин (0,1%), смолы (около 2%), органические кислоты (пальмитиновая, линолевая, церотиновая), а также фитостерины. Основные действующие вещества, обладающие иммуностимулирующей активностью — полисахариды. Препараты эхинацеи демонстрируют антибактериальные, противовирусные и противомикотические свойства: угнетают рост и размножение стрептококка, стафилококка, кишечной палочки, вирусов гриппа, эффективны при воспалительных заболеваниях.
Расторопша пятнистая используется для профилактики различных заболеваний печени. Основными действующими веществами расторопши являются флавоноиды и флавонолигнаны (силибин, силикристин, силидианин), обладающие мощным детоксицирующим, гепатопротекторным, антиоксидантным действием. Кроме того, в растении содержатся алкалоиды, сапонины, жирное масло (до 25%), белки, витамин К, смолы, слизь, тирамин, гистамин, а также макро- и микроэлементы. Лечебными свойствами обладают листья, корни и главное — семена расторопши. Препараты из расторопши повышают защитные свойства печени к инфекциям и отравлениям, стимулируют образование и выведение желчи, способствует очищению и образованию новых клеток печени. Положительное действие этого растения сказывается и на всем желудочно-кишечном тракте.
ГербаСтор – биологически активная добавка, содержащая в своем составе живые спорообразующие бактерии рода Bacillus и молочнокислые микроорганизмы, продукты их метаболизма (ферменты, органические кислоты, витамины), жом свекловичный ферментированный, автолизаты дрожжей, минеральные соли, углеводы, фитодобавки (трава душицы, лист подорожника, цветки ромашки, трава зверобоя). Добавка производится методом микробиологического синтеза.
Принципиальное отличие данного препарата от кормовой добавки ПроСтор заключается в том, что в состав ГербаСтора вводятся дополнительно пробиотические штаммы молочнокислых бактерий, обладающие доказанным антибактериальным действием и комплекс лекарственных трав, содержаших биологически активные вещества, обладающие бактерицидной активностью, способностью к стимуляции обменных и иммунных процессов. Технологической особенностью производства данного препарата является применение определенных частей лекарственных растений: травы душицы, листьев подорожника, цветков ромашки, травы зверобоя и их предварительная обработка биологическими способами для повышения биодоступности входящих полезных компонентов, что делает ввод лекарственных трав на порядок более эффективным.
Основным активным действующим началом душицы обыкновенной считается эфирное масло – до 1,2%. В него входят тимол и карваклол. Высокое содержание последнего делает масло сильным антигистаминным и природным антибиотиком. В растении много витаминов С, К, А, Е, дубильных веществ. Душица — повышает секрецию пищеварительных желез, усиливает аппетит, перистальтику кишечника и улучшает пищеварение.
Цветки ромашки содержат гликозиды, усиливающие отделение желчного, кишечного и желудочного соков, способствуя улучшению пищеварения. Содержащиеся в растении флавоноиды и кумарины оказывают спазмолитическое действие, а наличие хамазулена — ароматического вещества, входящего в состав эфирного масла ромашки, обеспечивает выраженное противовоспалительное, седативное и местноанестезирующее действие. Он усиливает регенеративные процессы, ослабляет аллергические реакции в организме.
Зверобой, благодаря содержанию гиперозида, кверцитина, фетонцидов, витаминов С и РР обладает противовоспалительным, антисептическим, желчегонным действием. Возбуждает аппетит, стимулирует секреторную функцию различных желез.
Подорожник обладает антисептическим, противовоспалительным, кровоочистительным действием, благодаря наличию в его составе гликозидов, дубильных веществ, ферментов, алкалоидов и фитонцидов.
Активо — кормовая добавка, содержащая в своем составе в качестве действующих веществ смесь эфирных масел из экстрактов растений тимьяна (Thymus vulgaris), розмарина (Rosmarinus officinalis), орегано (Origanum vulgaris) (170 г/кг), экстракт перца Чили (15 г/кг), а также наполнитель — гидрогенизированные растительные жиры (815 г/кг). По внешнему виду добавка представляет собой гранулы оранжевого цвета со специфическим запахом, не растворимые в воде.
Биологические свойства Активо обусловлены наличием ароматических биологически активных веществ, входящих в его состав (эфирные масла тимьяна, розмарина, орегано и экстракт перца чили), которые обладают антимикробными (в отношении бактерий Salmonella и Clostridium) и антиоксидантными свойствами, улучшают ароматические и вкусовые качества кормов.
Добавка производится в виде микрокапсул и содержит стандартизированные количества отдельных фитомолекул. Преимущества микрокапсулирования (жировой матрицы): стабильность и обеспечение защиты прохождения ингредиентов через желудок; создание разной ферментативной активности в желудочно-кишечном тракте, постепенное и продолжительное высвобождение компонентов; высокая технологичность (подходит для проведения экструзии и гранулирования).
За счет антибактериальных, противогрибковых и противопаразитарных свойств препарата происходит активация системы антиоксидантных ферментов в организме для нейтрализации свободных радикалов, ингибирование перекисного окисления липидов, увеличение регенерации гепатоцитов, стимуляция пролиферации лимфоцитов, увеличение производства иммунных медиаторов, при этом нормализуется синтез и стабилизируется состав микрофлоры кишечника.
Благодаря входящим в состав препарата компонентам стимулируются обонятельные и вкусовые рецепторы, улучшается потребление корма, обеспечивается активность собственных пищеварительных ферментов организма, повышается эффективность всасывания питательных веществ.
Использование эфирных масел в составе добавки позволяет повысить качественные характеристики мяса птицы: сократить окисление липидов и рост микроорганизмов при хранении; задержать деградацию витамина Е; обеспечить модерацию альдегидов и спиртов, связанных с посторонним привкусом; улучшить цвет в процессе хранения.
Активо Ликвид – жидкая эмульгированная кормовая добавка, содержащая в качестве действующих веществ в 1 мл: масло корицы — 0,30%, масло орегано — 6,0%, лимонную кислоту — 15%; вспомогательные вещества: пектин — 0,45%, хлорид натрия — 0,10% и дистиллированную воду — до 100%. Стандартизированные, специфические фито-молекулы в составе препарата за счет содержания в них фенольных соединений, обладают антибактериальным, противогрибковым, а также противопаразитарным действием против желудочно-кишечных паразитов (к Активо Ликвид чувствительны многие грамположительные и грамотрицательные бактерии). Добавка оказывает стимулирующее действие на процессы пищеварения и проявляет антиоксидантный эффект.
Принимая во внимание ростостимулирующий эффект экспериментальных кормовых добавок, включающих натуральные стимуляторы роста, и не способность их накапливаться в птицеводческой продукции, представляло интерес изучить данные препараты в составе рациона мясной и яичной птицы.
3 ЭФФЕКТИВНОСТЬ ИСПОЛЬЗОВАНИЯ В РАЦИОНЕ ЦЫПЛЯТ-БРОЙЛЕРОВ КОРМОВЫХ ДОБАВОК, ВКЛЮЧАЮЩИХ БЕЗОПАСНЫЕ СТИМУЛЯТОРЫ РОСТА
3.1 МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЙ
Экспериментальная часть работы выполнялась в условиях птичника учебно-опытного хозяйства ФГБОУ ВО Уральский ГАУ в 2020 году на цыплятах бройлерах кросса «Росс 308» при их напольном содержании с суточного до 37-дневного возраста.
Норма посадки, световой, температурный, влажностный режимы, фронт кормления и поения во все возрастные периоды цыплят соответствовали рекомендациям, разработанным для данного кросса [106].
Согласно схеме научно-хозяйственного опыта (табл. 1) в суточном возрасте были сформированы 4 группы цыплят-бройлеров со средней живой массой 42 г.
Таблица 1 — Схема проведения научно-хозяйственного опыта
| Группа | Количество
голов |
Условия кормления |
| Контрольная | ♂ 22
♀ 22 |
Основной рацион (ОР) — комбикорм с питательностью, соответствующей рекомендациям для кросса. |
| 1 опытная | ♂ 22
♀ 22 |
ОР + ГербаСтор в количестве 0,5 г/кг комбикорма, с 5-го дня выращивания и до конца периода откорма. |
| 2 опытная | ♂ 22
♀ 22 |
ОР + ПроСтор в количестве 0,5 г/кг комбикорма, с 5-го дня выращивания и до конца периода откорма. |
| 3 опытная | ♂ 22
♀ 22 |
ОР + Активо в количестве 0,15 г/кг комбикорма, с 5-го дня выращивания и до конца периода откорма. |
Формирование групп для научно-хозяйственного и физиологического опытов, а также научные основы исследования осуществлялись в соответствии с рекомендуемыми методиками ФНЦ «ВНИТИП» РАН [107]. При выращивании птицы использовали двухфазное кормление, без включения кормовых антибиотиков – с 5-го по 21-й день и с 22-го по 37-й день. Первые пять дней кормление цыплят осуществляли общими престартерными комбикормами.
Контрольная группа получала основной рацион (ОР), сбалансированный по всем питательным веществам согласно рекомендациям для кросса. Цыплятам опытных групп дополнительно к ОР с 5-го дня выращивания и до конца периода откорма включали исследуемые кормовые добавки: 1 опытная группа получала кормовую добавку ГербаСтор в количестве 0,5 г/кг комбикорма, 2 опытная группа – кормовую добавку ПроСтор – 0,5 г/кг комбикорма, 3 опытная группа – кормовую добавку Активо – 0,15 г/кг комбикорма.
В ходе проведения опыта учитывались следующие показатели:
- Зоотехнические показатели.
- Живая масса. Для учета живой массы проводилось индивидуальное взвешивание птицы: каждые 7 дней выращивания.
- Сохранность поголовья. Ежедневно учитывался падеж цыплят-бройлеров, в конце периода выращивания по конечному поголовью был произведен расчет сохранности.
- Затраты корма на 1 кг прироста живой массы — по фактическому расходу кормов и полученному приросту живой массы по периодам и за весь период выращивания.
- Исходя из зоотехнических показателей продуктивности, велся расчёт европейского индекса продуктивности (ЕИП). ЕИП – показатель, применяемый в мировой практике для оценки продуктивных качеств цыплят-бройлеров, определяемый отношением основных продуктивных качеств (живая масса, умноженная на сохранность, деленные на дни выращивания, умноженные на затраты корма на 1 кг прироста), умноженным на 100.
- Для определения переваримости питательных веществ, баланса азота, кальция и фосфора, был проведен балансовый (физиологический) опыт. Для этого в возрасте 21-го дня были отобраны по 5 средних, для своей группы, по живой массе петушков-бройлеров. Отобранный помёт и комбикорм гомогенизировался и анализировался в аналитической лаборатории «Уральский НИИСХ» — филиале ФГБНУ УрФАНИЦ УрОРАН.
Анализ корма и помета проводили по общепринятым методикам:
— содержание общего азота – по методу Кьельдаля (или Дьякову), ГОСТ Р.51417-99 (%);
— содержание массовой доли сырого жира – методом экстракции, ГОСТ13496.15-97 (%);
— содержание массовой доли сырой клетчатки – удалением из продукта кислото-щелоче-растворимых веществ и определением сырой клетчатки, ГОСТ 13496.2-97(%);
— содержание сырой золы – гравиметрическим методом, ГОСТ 26226-95 (%);
— содержание кальция – атомно-абсорбционным методом, ГОСТ 26570-95 (%);
— содержание фосфора – фотометрическим методом, ГОСТ 26657-97 (%).
- Анатомическая разделка тушек птицы проводилась согласно методике ФНЦ «ВНИТИП» РАН [108]. Для этого, в конце периода выращивания, было отобрано по 3 петушка-бройлера из каждой группы со средней живой массой по группе. Убой проводился методом декапитации.
- При проведении анатомической разделки от каждой тушки петушка- бройлера были отобраны большеберцовые кости и образцы мышечной ткани. Проанализирован их химический состав. В костях определяли количество кальция, фосфора, сырой золы. В мышечной ткани – количество сырого белка, сырого жира, сырой золы.
- В возрасте 29 дней у 5 средних по группе бройлеров, путем декапитации была отобрана кровь для определения морфологических, биохимических и иммунологических показателей. Из морфологических показателей крови определяли: содержание эритроцитов, средний объем эритроцита, распределение эритроцитов по объему, гематокрит (отношение эритроцитов к общему объему крови), количество гемоглобина, среднее содержание гемоглобина в одном эритроците, среднюю концентрацию гемоглобина в эритроцитах, количество лейкоцитов, лейкоцитарный профиль (лимфоциты, моноциты, эозинофилы, базофилы), СОЭ. Из биохимических показателей в сыворотки крови изучали: содержание общего белка, количество альбуминов, глобулинов, альбуминово/глобулиновый индекс, уровень мочевины, креатинина, мочевой кислоты, содержание глюкозы, холестерина, триглицеридов, уровень ферментов аланинаминотрансферазы (АЛАТ) и аспартатаминотрансферазы (АСАТ), содержание кальция, фосфора, калия, натрия, хлора. Из иммунологических показателей определяли бактерицидную активность лейкоцитов.
Исследование крови проводилось в МАУ Клинико-диагностический центр г. Екатеринбурга. Морфологическое исследование крови осуществлялось в лаборатории гемостаза, на автоматическом анализаторе ADVIA 120, производства фирмы BAYER, а также ручным подсчетом форменных элементов в камере Горяева. Биохимический анализ проводился в клинико-диагностической лаборатории на анализаторе Vitros 350 (Ortho-Clinical Diagnostic, США). Бактерицидную активность лейкоцитов определяли в иммунологической лаборатории методом проточной цитометрии на проточном цитофлуориметре BD FACSCanto II (USA) с использованием программного обеспечения Facs Diva Version 6.1.3.
- Микробиологические исследования содержимого толстого отдела кишечника (слепых отростков) подопытного поголовья птицы (у 5 голов из каждой группы) проводили по результатам вскрытия после убоя, путём микробиологического посева многократно разведенного биоматериала на необходимые селективные питательные среды.
- Для проведения морфогистологических исследований были взяты образцы органов птиц от 3 голов из каждой группы. Материал фиксировали в 10-% растворе нейтрального формалина. Изучение общих структурных изменений в органах проводили на парафиновых срезах, препараты окрашивали гематоксилином и эозином по общепринятой методике. Все гистологические исследования документировались фотографированием на микроскопе Leica.
На основании результатов научно-хозяйственного опыта была рассчитана экономическая эффективность использования изучаемых кормовых добавок с учетом цен на 2020 год.
Основные экспериментальные данные обработаны методом вариационной статистики с использованием ПК “Microsoft Excel”. Оценку статистической значимости различий между группами проводили с помощью t-критерия Стьюдента.
3.2 РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
3.2.1 Зоотехнические показатели продуктивности цыплят бройлеров
Динамика живой массы является одним из важнейших показателей, характеризующих полноценность кормления птицы и состояния здоровья. В ходе опыта взвешивание цыплят проводилось еженедельно. В таблице 2 представлена динамика средней живой массы бройлеров смешанного стада, а также отдельно по петушкам и курочкам.
Установлено, что практически на протяжении всего периода откорма в опытных группах наблюдалось превосходство цыплят-бройлеров по живой массе по сравнению с контролем. Так, данные по смешанному поголовью птиц свидетельствуют, что в 7 дневном возрасте живая масса цыплят 1, 2 и 3 опытной группы была выше значения контрольной группы на 0,6; 2,8 и 3,5%; в возрасте 14 дней — на 1,9; 4,0 и 4,1%; в 21 день – на 3,2; 3,6 и 2,8%; в 28-дневном возрасте – на 5,3; 7,4 и 2,5% соответственно. На 35-й день откорма птица контрольной группы, по живой массе, опередила цыплят 1 опытной группы на 0,7%, уступая аналогам 2 и 3 опытных групп на 1,1 и 0,1%, соответственно. К концу откорма (37 дней) цыплята 1, 2 и 3 опытных групп по живой массе опережали контрольных сверстников на 2,0; 1,8 и 2,9%, соответственно.
Рассматривая динамику живой массы птиц в зависимости от половой принадлежности видно, что петушки бройлеры опытных групп в 7 дневном возрасте незначительно отличались по живой массе от контрольных аналогов. В возрасте 14 дней отмечено увеличение данного показателя у петушков 1, 2 и 3 опытных групп относительно контроля на 0,7; 5,1 (Р≤0,01) и 4,1(Р≤0,05) % соответственно. В 21 день живая масса петушков 1 и 3 опытных групп превышала контрольных особей на 2,2%, а у представителей 2 опытной группы — на 4,4% (Р≤0,05). В 28 дневном возрасте у петушков контрольной группы наблюдалась наименьшее значение живой массы — 1762 г, при этом самцы 1, 2 и 3 опытных групп превосходили контроль на 5,3 (Р≤0,05); 8,8 (Р≤0,001) и 3,4%. К 35 дневному возрасту разница по живой массе между контрольной и опытными группами была незначительной, но уже через 2 дня, к концу периода выращивания (37 дней), вновь отмечали увеличение этого показателя у петушков опытных групп, но достоверной разницы, в эти периоды, между группами, не установлено.
Курочки бройлеры 1, 2 и 3 опытных групп в 7 дневном возрасте превосходили контрольных аналогов на 3,6; 6,1 (Р≤0,01) и 5,8%(Р≤0,05). Данное превосходство сохранялось до 28 дневного возраста, когда живая масса курочек 1, 2 и 3 опытных групп была соответственно выше контрольных аналогов на 5,2 (Р≤0,01); 5,7(Р≤0,01) и 1,5%.
Таблица 2 — Динамика живой массы цыплят-бройлеров (М±m), (n=44)
| Показатель | Группа | ||||
| Контрольная | 1 опытная | 2 опытная | 3 опытная | ||
| Живая масса, г: | |||||
| Суточный возраст
-петушки -курочки |
42,0
42,1±0,4 41,9±0,3 |
42,0
42,1±0,4 42,0±0,3 |
42,0
42,1±0,4 42,0±0,3 |
42,0
42,1±0,4 42,0±0,3 |
|
| 7 дней
-петушки -курочки |
191,9
197,0±2,6 186,8±3,0 |
193,0
192,4±2,6 193,6±2,95 |
197,3
196,5±2,0 198,2±1,9** |
198,7
199,7±4,1 197,7±2,7* |
|
| 14 дней
-петушки -курочки |
505,8
516,2±5,3 495,5±5,7 |
515,6
519,9±6,0 511,3±5,41* |
526,0
542,6±5,1** 509,4±5,2 |
526,6
537,5±7,1* 515,7±5,7* |
|
| 21 день
-петушки -курочки |
1025,0
1071,6±13,1 978,4±11,1 |
1058,1
1095,7±14,9 1020,5±13,86** |
1061,5
1119,2±12,6* 1003,8±8,1 |
1053,8
1095,6±17,4 1012,0±9,2* |
|
| 28 дней
-петушки -курочки |
1669,0
1762,2±19,1 1575,8±19,7 |
1756,8
1855,2±28,8* 1658,3±17,9** |
1791,7
1918,0±19,4*** 1665,3±14,0** |
1710,3
1821,3±39,3 1599,3±25,2 |
|
| 35 дней
-петушки -курочки |
2358,9
2549,0±25,9 2168,8±28,4 |
2342,7
2550,3±32,3 2135,1±24,77 |
2385,3
2545,1±28,9 2225,6±27,0 |
2362,4
2531,0±40,3 2193,9±30,4 |
|
| 37 дней
-петушки -курочки |
2544,4
2784,9±30,1 2303,9±25,3 |
2594,8
2836,9±32,9 2352,7±25,61 |
2589,2
2788,1±31,5 2390,4±28,5* |
2617,4
2808,5±43,1 2426,3±35,2* |
|
| Абсолютный прирост, г
-петушки -курочки |
2502,4
2742,7 2262,0 |
2552,7
2794,7 2310,7 |
2547,2
2745,9 2348,5 |
2575,4
2766,4 2384,4 |
|
| Затраты корма на 1 кг прироста, кг | 1,76 | 1,74 | 1,71 | 1,76 | |
| Сохранность, % | 97,7 | 97,7 | 97,7 | 100 | |
| Европейский индекс продуктивности | 381 | 392 | 398 | 402 | |
Примечание: здесь и далее *- Р≤0,05; **- Р≤0,01; ***- Р≤0,001
В возрасте 35 дней наблюдали снижение живой массы у курочек 1 опытной группы по сравнению с контролем на 1,6%, у птиц 2 и 3 опытных групп данный показатель превосходил контрольное значение на 2,6 и 1,2 %, но разница не была достоверной.
В конце периода выращивания (37 дней) разница по живой массе, между курочками контрольной и 1, 2 и 3 опытными группами увеличилась, составив соответственно 2,1; 3,8 (Р≤0,05) и 5,3%(Р≤0,05).
Абсолютный прирост живой массы цыплят-бройлеров за период выращивания (по смешанному поголовью) был выше в 1, 2 и 3 опытных группах по сравнению с контролем на 2,0; 1,8 и 2,9%. Данный показатель у петушков контрольной группы составил 2742,7 г, у самцов 1, 2 и 3 опытных групп он был выше контроля на 1,9; 0,1 и 0,9%. Абсолютный прирост у курочек 1, 2 и 3 опытных групп опережал контрольное значение на 2,2; 3,8 и 5,4%.
Динамика среднесуточного прироста цыплят-бройлеров (по смешанному поголовью) представлена в таблице 3 и рисунке 1.
Таблица 3 — Среднесуточный прирост цыплят-бройлеров, г (n=44)
| Период | Группа | |||
| Контрольная | 1 опытная | 2 опытная | 3 опытная | |
| 0-7 дней | 21,4 | 21,6 | 22,2 | 22,4 |
| 7-14 дней | 44,8 | 46,1 | 47,0 | 46,8 |
| 14-21 день | 74,2 | 77,5 | 76,5 | 75,3 |
| 21-28 дней | 92,0 | 99,8 | 104,3 | 93,8 |
| 28-35 дней | 98,6 | 83,7 | 84,8 | 93,2 |
| 35-37 дней | 92,7 | 126,0 | 102,0 | 127,5 |
| В среднем за период откорма | 67,6 | 69,0 | 68,8 | 69,6 |
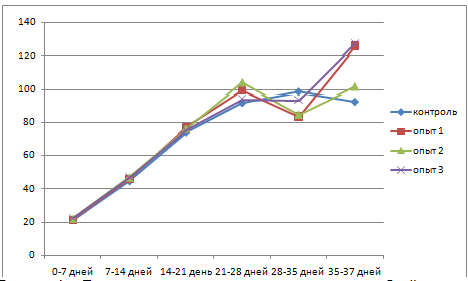
Рисунок 1 – Динамика среднесуточного прироста цыплят-бройлеров, г
В среднем за период откорма наибольший среднесуточный прирост наблюдался в 3 опытной группе и составил 69,6 г, что на 3,0% больше, чем в контроле. В 1 и 2 опытных группах этот показатель превосходил контрольный уровень на 2,1 и 1,8 %.
Затраты корма в контрольной и 3 опытной группах составили 1,76 кг на 1 кг прироста живой массы цыплят-бройлеров. В 1 и 2 опытных группах отмечено снижение затрат корма по сравнению с контролем на 0,02 и 0,05 кг, или на 1,14 и 2,8 %.
За период эксперимента максимальная сохранность поголовья (100%) наблюдалась в 3 опытной группе, превышая значение всех остальных подопытных групп птицы на 2,3%.
По совокупности данных, характеризующих основные продуктивные показатели цыплят-бройлеров, был рассчитан европейский индекс продуктивности. Данный показатель во всех подопытных группах был на достаточно высоком уровне, при этом 1, 2 и 3 опытные группы опережали контрольный уровень (381 ед) на 11, 17 и 21 единицу.
Таким образом, включение в состав комбикорма кормовых добавок ГербаСтор, ПроCтор и Активо, в соответствующих дозировках, оказало стимулирующее влияние на рост и развитие цыплят-бройлеров. В 1 и 2 опытных группах повышение живой массы птицы сопровождалось снижением затрат корма на 1 кг прироста живой массы, а в 3 опытной группе — повышением сохранности поголовья. Некоторые возможные механизмы эффекта стимуляции роста бройлеров под воздействием кормовых добавок синбиотического и фитобиотического состава, согласно литературным данным [108] обусловлены снижением общей бактериальной нагрузки, подавлением патогенных микроорганизмов и прямой модуляции иммунной системы цыплят.
3.2.2 Результаты анатомической разделки цыплят
В 38-дневном возрасте были отобраны по 3 петушка бройлера, наиболее характерных по живой массе, для каждой подопытной группы, с целью оценки влияния изучаемых кормовых добавок на мясные качества птицы. Живая масса петушков контрольной группы, при этом, составила 2869 г, в 1 опытной группе данный показатель был несколько ниже значения контроля — на 0,5%, а во 2 и 3 опытных группах, опережал контроль на 1,4 и 1,1% (табл. 4).
Одним из основных видов продукции птицефабрик являются товарные тушки цыплят-бройлеров. Масса потрошеной тушки в 1 и 2 опытных группах была ниже контроля на 1,62%, а в 3 опытной группе превосходила контроль на 0,68%. Установлено, что наибольший убойный выход потрошенной тушки был в контрольной группе, и составил 71,8%. В 1, 2 и 3 опытных группах данный показатель был ниже контрольного значения, соответственно, на 0,8; 2,1 и 0,3%. При этом в составе тушек петушков из 1, 2 и 3 опытных групп, по сравнению с контрольными аналогами, было большее количество мяса, на 2,5; 0,8 и 5,4%, а также наблюдалась меньшее значение массы костей, соответственно на 15,3; 2,6 и 13,9%. В результате этого мясокостный индекс потрошеной тушки, установленный по отношению массы мышечной ткани к массе костей, в контрольной группе составил 6,8 единиц, что меньше значений 1, 2 и 3 опытных групп, на 1,4; 0,2 и 1,5 единиц.
Содержание кожи в составе тушки в контрольной группе составило 213,8 г, в 1, 2 и 3 опытных группах ее количество было ниже значения контроля на 10,1; 2,6 и 3,1%.
Таблица 4 – Результаты анатомической разделки бройлеров, г (М±m), (n=3)
| Показатель | Группа | |||
| Контрольная | 1 Опытная | 2 Опытная | 3 Опытная | |
| Живая масса, г | 2869±4,7 | 2854,7±28,2 | 2909,3±14,6* | 2899,3±29,9 |
| Масса потрошеной тушки, г | 2060±16,3 | 2026,55±16,0 | 2026,7±24,9 | 2074±30,6 |
| Убойный выход потрошеной тушки, % | 71,8 | 71,0 | 69,7 | 71,5 |
| Всего в составе тушки | ||||
| Мышцы , г | 1511,9±31,1 | 1549,5±13,5 | 1524,7±35,9 | 1593,0±16,9 |
| Кости, г | 223,7±33,6 | 189,5±8,3 | 217,9±8,2 | 192,7±5,8 |
| Мясокостный индекс | 6,8 | 8,2 | 7,0 | 8,3 |
| Кожа, г | 213,8±4,0 | 192,2±12,9 | 208,2±9,3 | 207,2±3,6 |
Результаты анатомической разделки и дальнейшей обвалки тушек цыплят позволили определить развитие отдельных ее частей под воздействием исследуемых кормовых факторов (табл. 5).
Общая масса грудки в контрольной группе была на уровне 826,7 г, что составляет 40,1% от массы потрошеной тушки, при этом в составе грудки выделено 726 г мяса, что составляет 35,2% от массы потрошеной тушки. В 1 опытной группе масса грудки была меньше контрольного значения на 1%, но при этом получен больший процент от массы потрошеной тушки, на 0,3%. Количество мяса в грудке цыплят 1 опытной группы было больше, чем в контрольной группе на 1,2%. Во 2 опытной группе масса грудки имела наименьшее среднее значение среди остальных подопытных групп, и на 3,6% меньше контроля, мяса в составе грудки было меньше значения контроля на 1,5%, при этом процент мышц грудки от массы потрошеной тушки был практически на уровне контроля (35,3%). В 3 опытной группе масса грудки была наибольшей и составляла 40,8% от массы потрошеной тушки, что на 0,7% больше контроля, мышечной массы в составе грудки данной группы было достоверно(Р≤0,05) больше, чем в контрольной группе, на 5,4%.
Масса бедра в контрольной группе составила 160 г, в 1, 2 и 3 опытных группах данный показатель был выше на 0,4; 2,5 и 6,3%, относительно массы тушки, масса бедра 1, 2 и 3 опытных групп, также была несколько выше, чем в контроле, на 0,1; 0,3 и 0,4%.
Таблица 5 – Результаты обвалки отдельных частей тушки бройлера, (М±m), (n=3)
| Показатель | Группа | |||
| Контрольная | 1 Опытная | 2 Опытная | 3 Опытная | |
| Грудка | ||||
| Общая масса, г | 826,7±6,8 | 818,7±20,8 | 796,7±14,1 | 846,7±14,5 |
| % от массы потрошеной тушки | 40,1 | 40,4 | 39,3 | 40,8 |
| Мышцы, г | 726±6,4 | 734,7±18,8 | 715,3±11,7 | 765,3±13,3* |
| % от массы потрошеной тушки | 35,2 | 36,3 | 35,3 | 36,9 |
| Бедро | ||||
| Общая масса, г | 160,0±8,1 | 160,7±5,7 | 164,0±5,3 | 170,0±8,7 |
| % от массы потрошеной тушки | 7,8 | 7,9 | 8,1 | 8,2 |
| Мышцы, г | 122,7±8,5 | 134,7±5,7 | 131,3±6,4 | 140,7±5,8 |
| % от массы потрошеной тушки | 6,0 | 6,6 | 6,5 | 6,8 |
| Голень | ||||
| Общая масса, г | 126,0±2,0 | 128,0±1,2 | 138,0±3,5* | 130,0±5,0 |
| % от массы потрошеной тушки | 6,1 | 6,3 | 6,8 | 6,3 |
| Мышцы, г | 94,3±5,1 | 96,7±1,8 | 102,7±4,4 | 98,0±2,0 |
| % от массы потрошеной тушки | 4,6 | 4,8 | 5,1 | 4,7 |
| Крыло | ||||
| Общая масса, г | 102±1,2 | 96,7±0,7** | 106,3±2,2 | 97,3±0,9* |
| % от массы потрошеной тушки | 5,0 | 4,8 | 5,2 | 4,7 |
| Мышцы, г | 53,7±7,5 | 57,4±4,8 | 65,3±3,7 | 58,5±2,2 |
| % от массы потрошеной тушки | 2,6 | 2,8 | 3,2 | 2,8 |
| Каркас | ||||
| Общая масса, г | 410,7±15,2 | 384,0±11,7 | 374,0±10,1 | 386,0±7,6 |
| % от массы потрошеной тушки | 19,9 | 18,9 | 18,5 | 18,6 |
| Мышцы, г | 244,7±10,4 | 237,3±15,6 | 210,7±8,2* | 233,3±8,7 |
| % от массы потрошеной тушки | 11,9 | 11,7 | 10,4 | 11,3 |
Мышц в бедре цыплят 1, 2 и 3 опытных групп было большее количество, чем у контрольных аналогов на 9,8; 7,0 и 14,7% соответственно. Также 1 2 и 3 опытные группы превосходили контрольных аналогов по относительной массе мышц бедра, в среднем на 0,6%.
Голень цыплят 1, 2 и 3 опытных групп имела большее значение по массе, чем у птицы контрольной группы, как по абсолютной разнице (больше на 1,6; 9,5 (Р≤0,05) и 3,2%), так и по относительному показателю к массе потрошеной тушки (больше на 0,2; 0,7 и 0,2%). Количество мышечной ткани в голени цыплят контрольной группы составило 94,3 г, это меньше, чем у цыплят 1, 2 и 3 опытных групп на 2,5; 8,9 и 3,9%.
Масса крыла у цыплят контрольной группы находилась на уровне 102 г, у бройлеров 1 и 3 опытных групп масса крыльев была достоверно меньше — на 5,2 (Р≤0,01) и 4,6 (Р≤0,05) %, соответственно, а у птиц 2 опытной группы на 4,2% больше контроля. Количество мышечной ткани крыла у петушков 1, 2 и 3 опытных групп превосходило контроль на 6,9; 21,6 и 8,9%.
Каркас — это наименее ценная часть тушки. Все петушки опытных групп имели меньшую массу каркаса, чем контрольные аналоги, в среднем на 6-9%, а также меньшую массу соответствующих мышц на 3-14%.
Таким образом, ввод изучаемых кормовых добавок, благоприятно отразился на мясных качествах цыплят-бройлеров, выражаясь, в относительном и абсолютном повышении количества мышечной ткани в составе тушке, а также в увеличении массы наиболее ценных частей тушки (грудка, голень и бедро) и снижении массы наименее ценных частей (каркас).
3.2.3 Развитие внутренних органов цыплят
Оценку развития внутренних органов цыплят-бройлеров проводили в возрасте 29 и 37 дней, для этого были отобраны по 5 средних по живой массе бройлера из каждой подопытной группы. В таблице 6 представлены результаты измерений некоторых внутренних органов. Средняя живая масса отобранных птиц не имела достоверных отличий между подопытными группами.
В 29 дневном возрасте печень цыплят 1, 2 и 3 опытных групп имела меньшую относительную массу, по сравнению с контрольной группой на 0,12-0,16%. Абсолютная масса кишечника цыплят контрольной группы составляла 84,2 г, а относительная — 5,13%, при длине 183 см. У особей 1 опытной группы абсолютная масса кишечника была меньше, чем у цыплят контрольной группы на 15%, а относительная масса – на 0,89%, при этом кишечник был короче на 5,6 см. У цыплят 2 опытной группы в этот период кишечник имел достоверно меньшую абсолютную массу, чем в контроле, на 26,8% (Р≤0,01) и длина его была короче на 19,6 см. Масса кишечника цыплят 3 опытной группы уступала контролю на 4,5 %, но при этом он был длиннее на 7 см.
Масса поджелудочной железы цыплят подопытных групп в возрасте 29 дней находилась в пределах 3,55-4,45 г. При этом относительная масса поджелудочной железы цыплят контрольной группы составила 0,24%, у аналогов 1 и 2 опытных групп данный показатель был ниже контроля на 0,02 и 0,03%, а у птиц 3 опытной группы напротив, превысил контроль, на 0,3%.
Таблица 6 — Масса внутренних органов цыплят-бройлеров в возрасте 29 дней, (М±m), (n=3)
| Показатель | Группа | |||
| Контрольная | 1 Опытная | 2 Опытная | 3 Опытная | |
| Живая масса, г | 1640± 19,3 | 1688±14,6 | 1681,6 ± 17,5 | 1622,4±17,7 |
| Печень, г | 35,84 ±1,7 | 34,22±1,5 | 34,77 ±2,2 | 32,88±1,8 |
| % от живой массы | 2,19 | 2,03 | 2,07 | 2,03 |
| Кишечник, г | 84,16±4,7 | 71,6±4,5 | 61,6±4,0** | 80,4±7,6 |
| % от живой массы | 5,13 | 4,24 | 3,66 | 4,96 |
| Длина кишечника, см | 183±8,7 | 176,4±9,1 | 162,4±5,7 | 190±4,8 |
| Поджелудочная железа, г | 3,91±0,22 | 3,71±0,17 | 3,55±0,22 | 4,45±0,32 |
| % от живой массы | 0,24 | 0,22 | 0,21 | 0,27 |
| Слепые отростки толстого отдела кишечника, г | 11,6±0,7 | 12,4±1,8 | 13,2±0,7 | 10,2±0,5 |
| % от живой массы | 0,71 | 0,73 | 0,78 | 0,63 |
| Длина слепых отростков, см | 16,4±1,2 | 16,7±1,1 | 16,2±0,6 | 16,3±0,5 |
| Фабрициева бурса, г | 3,8±0,5 | 3,2±0,3 | 3,7±0,3 | 3,7±0,4 |
| % от живой массы | 0,23 | 0,19 | 0,22 | 0,23 |
| Тимус, г | 4,8±0,9 | 6,8±0,5 | 8,8±0,5** | 8,5±0,8** |
| % от живой массы | 0,29 | 0,41 | 0,52 | 0,52 |
| Селезенка, г | 1,77±0,17 | 1,6±0,12 | 1,45±0,11 | 1,56±0,24 |
| % от живой массы | 0,11 | 0,09 | 0,09 | 0,10 |
Слепые отростки толстого отдела кишечника у цыплят контрольной группы имели массу 11,6 г, у бройлеров 1 и 2 опытных групп их абсолютная масса была больше контроля на 6,9 и 13,8%. У цыплят 3 опытной группы данный показатель был меньше контрольного уровня на 12,1%. При этом длина слепых отростков цыплят подопытных групп изменялась в незначительных пределах 16,2-16,4 см.
Масса фабрициевой бурсы у птиц контрольной, 2 и 3 опытных групп была практически одинаковой, составляя 3,8; 3,7 и 3,7 г соответственно. У курочек 1 опытной группы масса данного органа была на 15,8% меньше значения контроля.
Отмечено, что масса тимуса цыплят 1, 2 и 3 опытных групп в возрасте 29 дней была значительно больше контрольного уровня соответственно на 41,7; 83,3(Р≤0,01) и 77,1(Р≤0,01) %.
Масса селезенки птиц контрольной группы составляла 1,8 г, у особей 1, 2 и 3 опытной группы этот показатель был ниже контроля на 9,6; 18,1 и 11,9%.
Масса исследуемых внутренних органов цыплят-бройлеров в возрасте 37 дней соответствовала физиологическим нормам, при этом между группами отмечали некоторые различия (табл. 7). Так, относительная масса печени в контрольной группе составила 2,4%, в 1 и 3 опытных группах она была ниже контроля на 0,22 и 0,06 %, а во 2 опытной группе превышала контроль на 0,02%. Относительная масса почек в контрольной группе составляла 0,62%, в 1 опытной группе данный показатель был выше значения контроля на 0,01%, в 2 и 3 опытных группах ниже — на 0,4-0,5%.
Таблица 7 — Масса внутренних органов цыплят-бройлеров в возрасте 37 дней, г (М±m), (n=3)
| Показатель | Группа | |||
| Контрольная | 1 Опытная | 2 Опытная | 3 Опытная | |
| Живая масса, г | 2869±4,7 | 2854,7±28,2 | 2909,3±14,6* | 2899,3±29,9 |
| Печень, г | 69,0±1,3 | 62,2±3,79 | 70,5±5,3 | 67,9±1,7 |
| % от живой массы | 2,40 | 2,18 | 2,42 | 2,34 |
| Почки, г | 17,7±1,2 | 17,9±0,35 | 17,0±0,8 | 16,6±0,6 |
| % от живой массы | 0,62 | 0,63 | 0,58 | 0,57 |
| Сердце, г | 14,3±0,7 | 12,9±0,53 | 13,2±0,7 | 14,2±0,5 |
| % от живой массы | 0,50 | 0,45 | 0,45 | 0,49 |
| Легкие, г | 15,9±1,6 | 16,5±1,63 | 16,3±0,7 | 14,3±2,2 |
| % от живой массы | 0,55 | 0,58 | 0,56 | 0,49 |
| Кишечник, г | 146±13,3 | 152,0±9,17 | 187,3±22,5 | 127,3±8,7 |
| % от живой массы | 5,09 | 5,32 | 6,44 | 4,39 |
| Длина кишечника, см | 223,0±5,3 | 246,3±6,77* | 266,3±7,1** | 228,0±6,0 |
| Поджелудочная железа, г | 5,91±0,4 | 8,0±0,78 | 6,3±0,3 | 5,6±0,5 |
| % от живой массы | 0,21 | 0,28 | 0,22 | 0,19 |
| Фабрициева бурса, г | 4,66±0,04 | 4,7±0,69 | 6,8±0,9 | 4,8±0,2 |
| % от живой массы | 0,16 | 0,16 | 0,23 | 0,16 |
| Тимус, г | 12,3±0,8 | 12,3±0,39 | 17,0±1,4* | 12,8±1,4 |
| % от живой массы | 0,43 | 0,43 | 0,58 | 0,44 |
| Желудок, г | 27,2±2,6 | 37,1±0,31* | 34,1±2,3 | 33,5±1,3 |
| % от живой массы | 0,95 | 1,30 | 1,17 | 1,15 |
| Селезенка, г | 2,85±0,5 | 3,0±0,3 | 3,64±0,42 | 2,4±0,3 |
| % от живой массы | 0,10 | 0,10 | 0,19 | 0,08 |
Относительная масса сердца, цыплят контрольной группы равнялась 0,5%, аналогичный показатель у цыплят 1 и 2 опытных групп был ниже на 0,05%, а у бройлеров 3 опытной — на 0,01%.
Масса легких у цыплят подопытных групп находилась в пределах 14,3-16,0 г.
Масса кишечника в контрольной группе составила 146 г, при длине 223 см. У птиц 1 и 2 опытной группы кишечник имел большую массу, на 4,1 и 28,3% и был длиннее на 23,3 (Р≤0,05) и 43,3 (Р≤0,01) см, по сравнению с контролем. Масса кишечника цыплят 3 опытной группы была меньше, чем у контроля на 12,8%, при этом он был длиннее на 5 см.
Масса тимуса была самой высокой у цыплят 2 опытной группы, на 38,2% (Р≤0,05) достоверно больше, чем у контрольных сверстников. У птиц 3 опытной данный показатель был больше контроля на 4,1%, а у бройлеров 1 опытной группы соответствовал контролю.
Масса желудка в контрольной группе была наименьшей, составив – 27,2 г. В 1, 2 и 3 группе этот показатель был выше контрольного значения на 37,4 (Р≤0,05); 26,3 и 24,1%.
Таким образом, ввод экспериментальных кормовых добавок в рацион цыплят-бройлеров, не оказал отрицательного влияния на развитие внутренних органов птиц. При этом под влиянием скармливания ГербаСтора отмечалось достоверное возрастание в конце откорма массы мышечного желудка бройлеров. Включение ГербаСтора и ПроСтора в комбикорм сопровождалось достоверным увеличением в конце технологического цикла длины кишечника и повышением относительной массы этого органа у птиц. Использование ПроСтора способствовало достоверному повышению массы центрального органа иммуногенеза цыплят – тимуса, а также характеризовалось тенденцией повышения массы фабрициевой бурсы. Отмеченные положительные изменения в повышении массы центральных органов иммунитета цыплят, с учетом проведенной нами их гистологической оценки, свидетельствующей о выраженной активизации процессов иммуногенеза, говорят о профилактирующем акцидентальную инволюцию действии данного препарата, позволяющего повысить массу органов за счет сохранения лимфоцитов корковой зоны.
3.2.4 Химический состав мяса цыплят-бройлеров
Химический состав грудных мышц представлен в таблице 8. Количество сухого вещества в грудных мышцах петушков контрольной группы составляло 24,5%, у цыплят 1 опытной группы данный показатель был выше контроля на 0,1%, у бройлеров 2 и 3 опытных групп он был меньше контрольного уровня на 0,7 и 1,0 % (Р≤0,05) соответственно. Содержание белка в составе мышечной ткани грудки опытных цыплят было на следующем уровне по отношению к контролю: в 1 опытной группе выше на 0,1%, а во 2 и 3 опытных группах меньше на 0,3 и 1,1% (Р≤0,05) соответственно. Количество жира в мясе цыплят контрольной группы было на уровне 1,36%, в 1 и 2 опытных группах этот показатель был выше, чем у контрольных сверстников на 0,07 и 0,1%, а в 3 опытной группе — меньше на 0,21%.
Таблица 8 – Химический состав грудных мышц бройлеров, % (М±m) (n=3)
| Показатель | Группа | |||
| Контрольная | 1 Опытная | 2 Опытная | 3 Опытная | |
| Сухое вещество | 24,5±0,1 | 24,6±0,1 | 23,8±1,5 | 23,5±0,4* |
| Белок | 20,7±0,27 | 20,8±0,18 | 20,4±0,60 | 19,6±0,09* |
| Жир | 1,36±0,11 | 1,43±0,09 | 1,46±0,29 | 1,15±0,15 |
| Зола | 1,07±0,03 | 1,12±0,03 | 1,08±0,05 | 1,06±0,01 |
| Энергетическая ценность, КДж/100 г | 398,73±2,37 | 402,9±5,0 | 396,1±20,6 | 371,3±7,17* |
| Индекс качества мяса (Жир/Белок) | 0,066 | 0,068 | 0,071 | 0,058 |
Зола в мышцах представлена в основном минеральными веществами, входящими в состав биомолекул. Ее количество в грудной мышце бройлеров контрольной, 2 и 3 опытных групп находилось на уровне 1,06-1,08%, во 2 опытной группе наблюдали повышение данного показателя по отношению к контролю на 0,05 %.
На основе химического анализа грудной мышцы бройлеров была рассчитана энергетическая ценность мяса. В контрольной группе энергетическая ценность составила 398,73 кДж в 100 г мяса. В 1 опытной группе количество энергии в 100 г мышечной ткани грудки составляло 402,9 кДж, что на 1% больше контроля. Во 2 опытной группе данный показатель был меньше контроля на 0,65%. Наиболее низкой энергетической ценностью обладали грудные мышцы цыплят 3 опытной группы — 371,3 кДж, что достоверно уступало контрольному значению на 6,87% (Р≤0,05).
Индекс качества мяса (ИКМ) — отношение жира к белку контрольной группе составил 0,066 единиц. В 1 и 2 опытных группах данный показатель был выше значения контроля на 0,002 и 0,005 единиц соответственно. В 3 опытной группе ИКМ был меньше контроля на 0,008 единиц.
В таблице 9 представлены результаты химического анализа ножных мышц цыплят-бройлеров.
Таблица 9 – Химический состав ножных мышц бройлеров, %
(М±m), (n=3)
| Показатель | Группа | |||
| Контрольная | 1 Опытная | 2 Опытная | 3 Опытная | |
| Сухое вещество | 27,3±0,1 | 27,1±0,1 | 26,5±1,5 | 27,6±0,4 |
| Белок | 20,59±0,35 | 19,99±0,57 | 19,88±0,49 | 20,18±0,40 |
| Жир | 4,51±0,26 | 4,62±0,21 | 4,51±0,13 | 5,48±0,43 |
| Зола | 1,10±0,01 | 1,12±0,03 | 1,10±0,01 | 1,13±0,02 |
| Энергетическая ценность, КДж/100 г | 514,8±2,37 | 509,0±5,0 | 503,0±20,6 | 544,6±7,17 |
| Индекс качества мяса (Жир/Белок) | 0,22 | 0,23 | 0,23 | 0,27 |
В контрольной и 1 опытной группах содержание сухого вещества в ножной мышце было практически на одном уровне (27,3 и 27,1%). Вторая опытная группа уступала по данному показателю контрольному значению на 0,8%, а в 3 опытной группе было наибольшее значение – 27,6%.
По содержанию белка в ножной мышце лидировала контрольная группа – 20,59 %. Уровень белка в ножной мышце 1, 2 и 3 опытных групп был ниже, чем у цыплят контрольной группы на 0,4-0,7%.
Количество жира в составе ножных мышц было наибольшим в 3 опытной группе — 5,48%. У цыплят контрольной и 2 опытной групп содержание жира было на одном уровне, и составляло 4,51 %. Содержание жира в мясе 1 опытной группы было выше, чем в контроле на 0,11%.
Количество зольных веществ в мясе цыплят подопытных групп было на уровне 1,10-1,13%.
Энергетическая ценность 100 г мяса ножных мышц в контрольной группе составила 514,8 кДж, в 1 и 2 опытных группах данный показатель был меньше, чем у контрольных аналогов на 1,1 и 2,3%. В 3 опытной группе получен наибольший показатель энергетической ценности мяса окорочка, превосходивший контрольный уровень на 5,8%.
Индекс качества мяса в контрольной группе был равен 0,22 единицы, в 1 и 2 опытных группах он был выше на 0,01 единицу, а в 3 опытной превышал контроль на 0,05 единиц.
Таким образом, химический анализ мышечной ткани цыплят-бройлеров показал, что при включении в состав рациона цыплят-бройлеров комплексных препаратов на основе синбиотиков и фитобиотиков (ГербаСтора и ПроСтора) наблюдалась тенденция повышения количества жира в грудных мышцах бройлеров и снижение содержания белка в ножных мышцах. При использовании фитобиотической микрокапсулированной добавки (Активо) отмечено достоверное снижение, по сравнению с контролем, количества сухого вещества и белка в грудных мышцах и тенденция увеличения белка и жира в ножных мышцах.
3.2.5 Переваримость питательных веществ комбикорма
В таблице 10 показаны коэффициенты переваримости питательных веществ цыплятами-бройлерами, полученные по результатам балансового опыта. Коэффициент переваримости сухого вещества цыплятами бройлерами 1, 2 и 3 опытных групп был выше значения контроля на 1,8; 0,5 и 1,9%, соответственно.
Переваримость сырого протеина у цыплят контрольной группы составляла 93,6%, у цыплят 2 группы она была ниже контрольного значения на 0,4%, а у цыплят 1 и 3 опытных групп выше, чем у контрольных сверстников — на 0,1 и 1,6%.
Сырой жир переваривался цыплятами контрольной группы на 67,3 %, в 1, 2 и 3 опытных группах данный показатель превосходил контроль на 10,7; 11,0 и 6,7%.
Во всех опытных группах отмечали повышение переваримости клетчатки по сравнению с контрольной группой: в 1 опытной группе — на 2,1; во 2 опытной группе – на 8%, в 3 опытной группе – на 3%.
Таблица 10 – Коэффициенты переваримости питательных веществ цыплятами-бройлерами, % (n=5)
| Показатель | Группа | |||
| Контрольная | 1 опытная | 2 опытная | 3 опытная | |
| Сухое вещество | 69,1 | 70,9 | 69,6 | 71,0 |
| Сырой протеин | 93,6 | 93,7 | 93,2 | 95,2 |
| Сырой жир | 67,3 | 78,0 | 78,3 | 74,0 |
| Сырая клетчатка | 18,2 | 20,3 | 26,2 | 21,2 |
| Безазотистые экстрактивные
Вещества (БЭВ) |
80,9 | 83,1 | 82,6 | 81,9 |
Переваримость безазотистых экстрактивных веществ у цыплят 1, 2 и 3 опытных групп была выше контрольного уровня на 2,2; 1,7 и 1,0%.
Таким образом, данные о переваримости питательных веществ комбикорма цыплятами-бройлерами свидетельствуют об эффективности ввода в состав рациона анализируемых кормовых добавок. Во всех опытных группах установлено повышение переваримости жира, клетчатки и безазотистых экстрактивных веществ. Помимо этого, в 3 опытной группе также отмечено повышение переваримости сырого протеина. Результаты балансового опыта подтверждают более высокий уровень живой массы птицы, получавшей экспериментальные кормовые компоненты, по сравнению с контрольными аналогами.
3.2.6 Обмен энергии
Обменная энергия важнейший показатель общей питательной ценности корма. Для его расчета была вычислена валовая энергия корма и энергия помета, с помощью уравнений регрессии (табл. 11).
Потребление валовой энергии коррелировало с потреблением корма цыплятами-бройлерами и было наибольшим во 2 опытной группе – 2,07 МДж/гол в сутки, это больше относительно контрольной группы на 2%. Контрольная и 1 опытная группы получили в период проведения балансового опыта по 2,03 МДж валовой энергии корма на голову в сутки. Меньшее количество энергии в этот период получено цыплятами 3 опытной группы, меньше значения контроля на 5,9%.
Часть энергии корма не переварилось цыплятами и вышло в составе помета. Больше всего энергии содержалось в помете у цыплят контрольной группы, в 1, 2 и 3 опытных группах количество энергии в помете было меньше на 10,0; 5,0 и 15,0%, соответственно.
Таблица 11 – Обмен энергии в организме цыплят-бройлеров, МДж/гол в сутки (n=5)
| Показатель | Группа | |||
| Контрольная | 1 опытная | 2 опытная | 3 опытная | |
| Валовая энергия корма | 2,03 | 2,03 | 2,07 | 1,91 |
| Энергия помёта | 0,40 | 0,36 | 0,38 | 0,34 |
| % энергии помёта к валовой энергии | 19,9 | 17,7 | 18,4 | 17,8 |
| Обменная энергия | 1,62 | 1,67 | 1,69 | 1,57 |
| % обменной энергии к валовой энергии корма | 80,1 | 82,3 | 81,6 | 82,2 |
Оставшееся количество энергии, называемое обменной, используется птицей на жизнедеятельность и образование продукции. Известно, что недостаток энергии приводит к изменениям метаболизма, в том числе к снижению использования протеина и выделению продуктов обмена в виде солей мочевой кислоты, что может привести к возникновению мочекислого диатеза, снижению продуктивности и резистентности птицы [109-112]. В контрольной группе количество обменной энергии на 1 цыплёнка в сутки было на уровне 1,62 МДж, что составляет 80,1 % от валовой энергии корма. В 1 и 2 опытных группах уровень обменной энергии был выше, чем в контроле на 3,1 и 4,3%, при этом использование обменной энергии от валовой энергии корма было больше аналогичного показателя контрольной группы на 2,2 и 1,5%, соответственно. В 3 опытной группе количество обменной энергии было меньше, чем в контроле на 3,1%, но при этом использование энергии в данной группе было выше контрольного уровня на 2,1%, в связи с меньшим выделением энергии с помётом.
3.2.7 Обмен азота
Азотистые вещества корма играют важную роль в реализации птицей ее продуктивного потенциала, они не полностью перевариваются организмом, и полнота их переваримости во многом зависит от структуры белковой молекулы, вида корма, степени гидролиза в организме, содержанием в рационе других биологически активных веществ.
Баланс азота в организме цыплят-бройлеров представлен в таблице 12.
У петушков бройлеров контрольной группы в теле за сутки откладывалось 2,5 г азота, что составляло 64,2% азота, принятого с кормом. Во 1,2 и 3 опытных группах наблюдалось увеличение количества удерживаемого азота корма соответственно на 0,8; 5,2 и 1,2%, по сравнению с контрольной группой. Процент использования азота от принятого с кормом также был выше в 1, 2 и 3 опытных группах, по сравнению с контролем, на 1,3; 1 и 2,6%.
Таблица 12– Баланс азота в организме цыплят-бройлеров, г на голову в сутки (n=5)
| Показатель | Группа | |||
| Контрольная | Опытная 1 | Опытная 2 | Опытная 3 | |
| Принято | 3,89 | 3,85 | 4,04 | 3,79 |
| Выделено в помете | 1,39 | 1,33 | 1,41 | 1,26 |
| Отложилось в теле | 2,50 | 2,52 | 2,63 | 2,53 |
| Использовано от принятого с кормом, % | 64,2 | 65,5 | 65,2 | 66,8 |
Таким образом, включение в рацион цыплят-бройлеров исследуемых кормовых добавок способствует увеличению использования азота птицей. Наилучшее использование данного элемента наблюдалось в 3 опытной группе.
3.2.8 Обмен кальция и фосфора, минерализация костной ткани
По результатам балансового опыта был определен баланс кальция и фосфора в организме исследуемых птиц (табл.13).
Таблица 13– Баланс кальция в организме цыплят-бройлеров, г на голову в сутки (n=5)
| Показатель | Группа | |||
| Контрольная | 1 опытная | 2 опытная | 3 опытная | |
| Принято | 0,90 | 1,16 | 1,17 | 0,99 |
| Выделено в помете | 0,61 | 0,68 | 0,81 | 0,46 |
| Отложилось в теле | 0,29 | 0,48 | 0,37 | 0,52 |
| Использовано от принятого с кормом, % | 32,59 | 41,10 | 31,18 | 52,87 |
Петушки-бройлеры контрольной группы в среднем за учетный период балансового опыта потребляли с кормом 0,9 г кальция в сутки на голову, при этом выделялось с пометом в среднем 0,61 г. В итоге отложение в теле кальция в сутки составило 0,29 г, или 32,6% от принятого с кормом.
В 1 опытной группе отложение кальция в теле птицы было больше, чем в контрольной группе на 65,5%, при этом использование этого макроэлемента от всего принятого с кормом было выше, чем аналогичный показатель контрольной группы на 8,51%.
Цыплята 2 опытной группы использовали кальций корма на 31,18%, это меньше, чем аналогичный показатель контроля на 1,4%, но при этом в теле кальция отложилось больше, чем в контроле на 27,6%.
Лучше всего использовали кальций петушки 3 опытной группы. Коэффициент его использования в организме от принятого с кормом составил 52,9%. При этом поступление кальция было минимальным и составляло 0,99 г на голову в сутки, из них в теле отложились 0,52 г кальция.
В таблице 14 показан баланс фосфора. Использование фосфора цыплятами контрольной группы составило 24,6% (табл.14). У цыплят 2 опытной группы данный показатель был меньше, чем в контрольной группе на 0,9%, но при этом в теле этого элемента отложилось больше на 0,03 г. Петушки-бройлеры 1 и 3 опытных групп в ходе опыта показали наибольшее использование фосфора, на 14,75 и 10,75%, по сравнению с контрольной группой.
Таблица 14 – Баланс фосфора в организме цыплят-бройлеров, г на голову в сутки (n=5)
| Показатель | Группа | |||
| Контрольная | 1 опытная | 2 опытная | 3 опытная | |
| Принято | 0,59 | 0,72 | 0,72 | 0,61 |
| Выделено в помете | 0,44 | 0,44 | 0,55 | 0,39 |
| Отложилось в теле | 0,14 | 0,28 | 0,17 | 0,22 |
| Использовано от принятого с кормом, % | 24,59 | 39,34 | 23,67 | 35,34 |
В таблице 15 представлены результаты химического анализа большеберцовых костей цыплят-бройлеров в возрасте 37 дней. Достоверной разницы между показателями не обнаружено. Количество сухого вещества в составе костной ткани в подопытных группах было на уровне 93,3-93,5%. Наибольшее количество сырой золы было в контрольной группе (45,1%), в 1, 2 и 3 опытных группах данный показатель уступал контролю соответственно на 1,7; 2,1 и 1,1%.
Таблица 15 – Содержание сырой золы, кальция и фосфора в большеберцовой кости цыплят-бройлеров, % (n=3)
| Показатель | Группа | |||
| Контрольная | 1 опытная | 2 опытная | 3 опытная | |
| Сухое вещество | 93,5±0,5 | 93,3±0,2 | 93,5±0,2 | 93,3±0,2 |
| Сырая зола | 45,1±1,2 | 43,4±1,0 | 43,0±0,8 | 44,0±0,5 |
| Кальций | 12,3±0,4 | 11,6±0,5 | 11,7±0,6 | 12,5±0,1 |
| Фосфор | 7,3±0,2 | 6,9±0,2 | 6,7±0,3 | 7,1±0,1 |
В 1 и 2 опытных группах количество кальция и фосфора в костях было меньше, чем в контрольной группе, соответственно на 0,6 и 0,7% и на 0,4 и 0,6%. В 3 опытной группе содержание кальция было больше контроля на 0,2%, а фосфора, меньше, на 0,2%.
Таким образом, скармливание исследуемых кормовых добавок благоприятно воздействует на использование кальция и фосфора птицей из корма и обеспечивает оптимальный процесс обмена этих макроэлементов в организме. При этом наиболее высокие показатели получены в 3 опытной группе.
3.2.9 Морфологический состав крови цыплят-бройлеров
Процессы, протекающие в организме при использовании биологически активных добавок, отражаются на морфологическом составе крови и её физико-химических свойствах, по которым можно судить о степени интенсивности окислительных процессов и уровне обмена веществ. Изученные нами морфологические показатели крови цыплят-бройлеров при включении в комбикорм кормовых добавок, включающих безопасные стимуляторы роста в составе рациона, представлены в таблице 16.
Морфологический анализ крови свидетельствовал о том, что изучаемые показатели находились в пределах физиологических значений, однако между группами отмечены некоторые отличия. Так, в возрасте 29 дней количество эритроцитов в крови цыплят контрольной группы составляло 3,38 1012/л. В 1 и 2 опытной группе содержание этих форменных элементов было выше в сравнении с контрольным значением на 4,7 и 3,9 %, что может свидетельствовать о повышении процесса эритропоэза под действием препаратов ГербаСтор и ПроСтор. В 3 опытной группе содержание эритроцитов в крови бройлеров незначительно уступало контролю – на 0,6%. Повышение количества эритроцитов во 2 опытной группе сопровождалось увеличением их среднего объема, по сравнению с контролем, на 14 % и снижением распределения эритроцитов по объему на 1,54 %. Величина гематокрита (отношение эритроцитов к общему объему крови) в 1 и 2 опытных группах превышала контроль на 1,69 и 1,81%, а в 3 опытной группе соответствовала ему.
В ходе оценки количества гемоглобина в крови установлена тенденция повышения его у птиц всех опытных групп, что свидетельствует об активизации окислительно-восстановительных процессов в организме под действием изучаемых кормовых средств. При этом более высокий его уровень наблюдали у бройлеров, получавших ПроСтор – на 5,53%. У цыплят 1 опытной группы, в рацион которых включали ГербаСтор, содержание гемоглобина было выше контроля на 4,3%, у аналогов 3 опытной группы, при использовании Активо – на 0,62 %.
Среднее содержание гемоглобина в одном эритроците — это показатель, который отражает концентрацию железосодержащего белка в красном кровяном тельце, было выше во 2 и 3 опытных группах, по сравнению с контролем – на 1,41 и 1,34 %, в 1 опытной группе этот параметр был ниже контрольного значения на 0,36%. Средняя концентрация гемоглобина в эритроцитах в крови цыплят также имела тенденцию повышения у бройлеров 2 и 3 опытных – на 0,4 и 1,04 %, а у цыплят 1 опытной группы уступала контролю на 0,29%.
Таблица 16 — Морфологические показатели крови цыплят-бройлеров в возрасте 29 дней (M±m; n=5)
| Показатель | Группа | |||
| Контрольная | 1 опытная | 2 опытная | 3 опытная | |
| Эритроциты,
1012/л |
3,38±0,20 | 3,54±0,13 | 3,51±0,13 | 3,36±0,16 |
| Средний объем эритроцита, фемтолитр (фл), или мкм3 | 121,84±0,80 | 121,78±1,2 | 138,94±17,05 | 122,32±1,61 |
| Распределение эритроцитов по объему, % | 8,10±0,07 | 8,04±0,13 | 6,56±1,78 | 8,12±0,13 |
| Гематокрит (отношение эритроцитов к общему объему крови), % | 36,31±1,97 | 38±1,24 | 38,12±1,17 | 36,14±1,54 |
| Гемоглобин, г/л | 97,80±5,44 | 102±2,83 | 103,20±3,07 | 98,40±4,27 |
| Среднее содержание гемоглобина в одном эритроците, пикограмм (пг) | 32,82±0,15 | 32,70±0,66 | 33,28±0,35 | 33,26±0,57 |
| Средняя концентрация гемоглобина в эритроцитах, г/л | 269,40±1,57 | 268,60±3,31 | 270,40±0,57 | 272,20±1,98 |
| Лейкоциты,109/л | 19,80±1,87 | 21,39±1,33 | 22,71±1,96 | 18,75±2,13 |
| Лимфоциты, % | 66,80±1,71 | 61,60±2,71 | 55±1,87** | 64,60±2,22 |
| Моноциты, % | 10,40±1,89 | 9,40±0,91 | 9,80±0,55 | 7,60±0,76 |
| Псевдоэозинофилы,
эозинофилы, % |
21,00±0,87 | 26,60±1,48* | 33,40±1,52*** | 25,20±2,27 |
| Базофилы, % | 1,80±0,42 | 2,40±0,57 | 1,80±0,42 | 2,60±0,45 |
| СОЭ, мм/час | 2,6±0,45 | 2,4±0,27 | 2,6±0,45 | 2,4±0,45 |
Анализируя содержание лейкоцитов в крови цыплят видно, что у бройлеров 1 и 2 опытных групп их было больше, чем в контроле на 8,03 и 14,75%, что может говорить об усилении лейкопоэза в пределах референсных значений. В крови особей 3 опытной группы количество лейкоцитов было ниже, чем у контрольных сверстников на 5,3%.
Сравнение процентного соотношения различных видов лейкоцитов в крови бройлеров показало, что во всех опытных группах количество лимфоцитов и моноцитов было меньше контрольного уровня: в 1 опытной группе – на 5,2 и 1,0%, во 2 опытной группе – на 11,8 и 0,6 %, в 3 опытной группе — на 2,2 и 2,8% соответственно.
Содержание псевдоэозинофилов и эозинофилов (в сумме) в контрольной группе находилось на уровне 21,00%. Использование в составе рациона испытуемых кормовых добавок сопровождалось повышением данных групп лейкоцитов в крови цыплят: в 1 опытной группе – на 5,6; во 2 опытной группе — на 12,4 % (Р≤0,001) и 3 опытной группе на 4,2%. Данные изменения находились в пределах нормативных значений.
Уровень базофилов в крови бройлеров всех групп соответствовал физиологическим требованиям для птиц этого возраста и колебался в пределах 1,8 – 2,6%.
Скорость оседания эритроцитов у цыплят, задействованных в опыте, соответствовала нормативному уровню и составляла: в контрольной группе – 2,6 мм/час, в 1 опытной группе – 2,4; во 2 опытной группе – 2,6 и в 3 опытной группе – 2,4 мм/час.
Таким образом, при введении комплексных препаратов на основе синбиотиков и фитобиотиков, а также фитобиотической микрокапсулированной добавки дополнительно к основному рациону цыплят-бройлеров, анализируемые морфологические показатели крови птиц не выходили за пределы физиологических норм, что свидетельствует об отсутствии отрицательного влияния добавок на организм птицы.
3.2.10 Биохимический состав крови бройлеров
В таблице 17 представлены биохимические показатели крови цыплят-бройлеров в возрасте 29 дней.
Анализируя содержание общего белка в сыворотке крови мясной птицы видно, что при использовании комплексной добавки ПроСтор, включающей синбиотики и фитобиотики, дополнительно к основному рациону (2 опытная группа), его величина имела тенденцию к повышению на 4,32%, по сравнению с контролем, находясь в пределах физиологической нормы. У бройлеров 1 опытной группы количество общего белка в крови соответствовало контрольному значению, а у цыплят 3 опытной группы уступало ему на 6,07%.
Концентрация альбуминов в сыворотке крови птиц контрольной и 2 опытной группы была одинаковой, составив 10,28 г/л, а у особей 1 и 3 опытной группы содержание этой белковой фракции было ниже контроля на 3,11 и 9,14%.
Таблица 17 — Биохимический состав крови цыплят-бройлеров в возрасте 29 дней, (M±m; n=5)
| Показатель | Контрольная группа | 1 опытная группа | 2 опытная
группа |
3 опытная
группа |
| Общий белок, г/л | 27,32±1,52 | 27,18±1,54 | 28,50±1,62 | 25,66±0,84 |
| Альбумин, г/л | 10,28±0,58 | 9,96±0,71 | 10,28±0,36 | 9,34±0,37 |
| Глобулины, г/л | 17,04±0,96 | 17,22±0,89 | 18,22±1,33 | 16,32±0,58 |
| А/Г индекс | 0,60±0,01 | 0,58±0,02 | 0,57±0,03 | 0,57±0,02 |
| Мочевина, ммоль/л | 0,26±0,06 | 0,26±0,06 | 0,22±0,07 | 0,22±0,02 |
| Креатинин, мкмоль/л | 23,06±0,90 | 23,06±1,23 | 23,34±1,27 | 21,94±0,47 |
| Мочевая кислота, мкмоль/л | 196,80±27,59 | 144,74±35,97 | 131,13±26,67 | 158,39±27,82 |
| Глюкоза, ммоль/л | 13,31±0,31 | 13,27±0,26 | 14,29±0,33 | 13,44±0,17 |
| Холестерин, ммоль/л | 2,94±0,23 | 2,75±0,24 | 3,31±0,24 | 2,75±0,10 |
| Триглицериды, ммоль/л | 0,56±0,05 | 0,38±0,06 | 0,44±0,08 | 0,32±0,06* |
| АЛАТ, МЕ/мл | 2,34±0,36 | 2,80±0,44 | 2,14±0,39 | 2,24±0,32 |
| АСАТ, МЕ/мл | 583,82±88,30 | 648,65±82,43 | 544,52±74,18 | 482,56±50,59 |
| Кальций, ммоль/л | 2,60±0,08 | 2,55±0,05 | 2,52±0,06 | 2,49±0,03 |
| Фосфор, ммоль/л | 2,40±0,07 | 2,73±0,19 | 2,53±0,08 | 2,40±0,07 |
| Калий, ммоль/л | 5,65±0,51 | 5,56±0,31 | 4,85±0,58 | 5,52±0,14 |
| Натрий, ммоль/л | 150,60±1,04 | 150,40±1,79 | 151,20±0,42 | 150,40±0,57 |
| Хлор, ммоль/л | 114,00±0,94 | 112,2±1,02 | 112,80±0,74 | 115,60±0,67 |
Концентрация альбуминов в сыворотке крови птиц контрольной и 2 опытной группы была одинаковой, составив 10,28 г/л, а у особей 1 и 3 опытной группы содержание этой белковой фракции было ниже контроля на 3,11 и 9,14%. Максимальное количество глобулинов было отмечено в сыворотке крови бройлеров 2 опытной группы, что на 6,93% превышало контроль. Уровень глобулинов у цыплят 1 опытной группы незначительно опережал контроль – на 1,06%, а у сверстников 3 опытной группы уступал контролю – на 4,22%. Соотношение альбуминов к глобулинам — А/Г индекс, составил в контрольной группе 0,60; в 1 опытной группе 0,58; во 2 и 3 опытной группе — 0,57 единиц, что свидетельствует о преобладании альбуминсинтезирующей функции печени у бройлеров, получавших исследуемые кормовые добавки.
Мочевина является одним из конечных продуктов белкового обмена птиц. Она представляет собой диамид угольной кислоты, образующийся в печени при обезвреживании аммиака, синтезируется специальной группой ферментов. Она не выполняет каких-либо функций в крови или во внутренних органах. Её уровень в крови — отражение баланса между скоростью синтеза в печени и скоростью выведения почками с мочой. Это соединение необходимо для безопасного выведения азота из организма. Нами установлено, что при дополнительном включении изучаемых кормовых компонентов в рацион уровень мочевины в сыворотке крови птиц 1 опытной группы соответствовал контролю, составив 0,26 ммоль/л. Во 2 и 3 опытных группах наблюдали существенное снижение данного метаболита в сыворотке крови бройлеров по сравнению с контролем на 15,38 %, что говорит о снижении катаболических процессов в организме цыплят этих групп и повышении степени усвоения азота свободных аминокислот, что благоприятно отражается на продуктивности бройлеров.
Креатинин — это важное химическое соединение в организме, образующееся в результате распада белковых молекул, и регулирующее биоэнергетику на уровне митохондрий. Это вещество представляет собой неотъемлемую часть остаточного азота. Организм ничего с креатинином сделать не может, кроме как вывести его. Накапливаемый в крови сверх меры креатинин начинает оказывать токсическое воздействие на системы организма, постепенно увеличивая их отравление. Исходя из данных научно-хозяйственного опыта, видно, что наименьшее количество креатинина было в сыворотке крови у цыплят 3 опытной группы, меньше, чем в контроле на 4,85%. У птиц 1 и 2 опытных групп данный метаболит был на уровне контрольного значения, находясь в пределах 23,06-23,34 мкмоль/л и соответствуя физиологической норме.
Основным конечным продуктом белкового обмена у птиц является мочевая кислота. Оптимальным принято считать содержание мочевой кислоты в сыворотке крови не выше — 360 мкмоль/л [113]. В наших исследованиях установлено, что у птиц всех подопытных групп количество мочевины в сыворотке крови не превышало оптимальный уровень. При этом наименьшее значение этого метаболита отмечено во 2 опытной группе – 131,13 мкмоль/л, что ниже контроля на 33,36%. Низким содержанием мочевой кислоты характеризовались 1 и 3 опытная группа, меньше, чем у особей контрольной группы на 26,45 и 19,51%. Тенденция снижения количества мочевой кислоты в сыворотке крови цыплят опытных групп свидетельствует о лучшем усвоении белкового азота в организме птиц, что подтверждается более высокими приростами живой массы.
Уровень углеводного обмена определяли по содержанию глюкозы в сыворотке крови. Данный метаболит играет роль связующего звена между энергетической и пластической функциями в организме. Более высокое содержание глюкозы в сыворотке крови отмечали у цыплят 2 опытной группы — 14,29 ммоль/л, что на 7,37% было выше контроля. У бройлеров 1 и 3 опытных групп разница по этому показателю с контролем была незначительна.
Липидный обмен оценивали по содержанию холестерина и триглицеридов в сыворотке крови цыплят. Холестерин содержится во всех клетках животного и необходим уже на самых ранних стадиях развития. Причём его общее количество в организме остаётся примерно на одном уровне при любых экзогенных воздействиях, посредством гомеостаза организма [114]. В наших исследованиях уровень холестерина у птиц контрольной группы составил 2,94 ммоль/л, у цыплят 1 и 3 опытных групп наблюдали его снижение, по отношению к контрольному уровню на 6,46%, а во 2 опытной группе, повышение — на 12,59%.
В отношении содержания триглицеридов установлена тенденция их снижения у цыплят 1 и 2 опытных групп, по сравнению с контролем, соответственно на 32,1 и 21,43 % и достоверное снижение у цыплят 3 опытной группы на 42,86%, (Р≤0,05), что говорит об активизации липидного обмена в организме птицы и согласуется с исследованиями других авторов [22,115].
Ферменты АЛАТ и АСАТ занимаются транспортировкой аминокислот из одной молекулы в другую. Аминокислоты играют основную роль в построении белков. В АЛАТ находится аминокислота — аланин (отсюда и название АЛАТ), а в АСАТ присутствует аспарагин и фермент пиридоксин (витамин В 6). Имеется перечень органов, в которых синтезируются данные ферменты, по убыванию, т.е. в списке на первом месте будет стоять орган, где фермента больше всего. АЛАТ присутствует в: печени, почках, сердце, в скелетных мышцах. АСАТ присутствует в: сердце, печени, клетках головного мозга, мышечной ткани скелетной мускулатуры. Если происходит разрушение клеток, значит, нарушается их целостность, и ферменты попадают в кровь. В зависимости от того, какого фермента больше в анализе крови, можно сделать вывод о состоянии соответствующего органа. Фермент АЛАТ является специфическим маркером функционального состояния печени, повышение его связано с гепатитами разной этиологии. Повышение активности АСАТ характерно при нарушении функций сердечно-сосудистой системы. В наших исследованиях уровень данных ферментов не имел достоверных различий между группами. Отмечено снижение уровня АЛАТ у цыплят-бройлеров 2 и 3 опытной группы по сравнению с контролем на 8,55 и 4,27%, и повышение у цыплят 1 опытной группы на 19,7%. Поскольку этот фермент в преобладающем количестве синтезируется в клетках печени, можно предполагать о меньшем клеточном повреждении в этом органе у птицы, получающей ПроСтор и Активо, что подтверждается проведенными нами морфогистологическими исследованиями печени.
Аналогично изменениям АЛАТ, изменялась активность фермента АСАТ в сыворотке крови цыплят подопытных групп. Её количество в крови бройлеров 2 и 3 опытных групп было меньше, по сравнению с контролем на 6,73 и 17,34% и превышало контрольный уровень у бройлеров 1 опытной группы на 11,1%.
Анализ минерального состава сыворотки крови показал, что количество кальция у птиц, участвующих в эксперименте, соответствовало физиологической норме, при этом в опытных группах бройлеров содержание этого макроэлемента было ниже контроля на 1,92-4,23%.
При оценке количества фосфора в крови наблюдали повышение его уровня у птиц 1 и 2 опытных групп на 13,75 и 5,42%. У сверстников 3 опытной группы содержание этого макроэлемента соответствовало контрольному значению и составляло 2,4 ммоль/л.
Содержание калия, натрия и хлора в крови подопытных птиц варьировало в пределах 4,85-5,65 ммоль/л, 150,4-151,2 ммоль/л и 112,2-115,6 ммоль/л соответственно и находилось в пределах физиологических значений.
Таким образом, проведенное биохимическое исследование крови позволило установить, что применение экспериментальных кормовых добавок при выращивании цыплят-бройлеров дополнительно к основному рациону не оказывает отрицательного влияния на обменные процессы в организме птиц. При этом наблюдается улучшение усвоения белкового азота у бройлеров опытных групп, о чем свидетельствует снижение мочевой кислоты в сыворотке крови. Данное обстоятельство подтверждается увеличением использования азота корма цыплятами (по результатам балансового опыта) и повышением их среднесуточного прироста. Кроме того, использование исследуемых кормовых средств сопровождается активизацией липидного обмена в организме птиц, что характеризуется тенденцией снижения количества триглицеридов в сыворотке крови у особей 1 и 2 опытных групп и достоверно меньшим их содержанием у бройлеров 3 опытной группы, а также способствует снижению активности трансаминаз, демонстрируя более высокую устойчивость внутренних органов, в частности печени и сердца, к неблагоприятным экзогенным и эндогенным воздействиям.
3.2.11 Бактерицидная активность лейкоцитов цыплят-бройлеров
Уровень естественной резистентности организма имеет большое значение в процессах адаптации птицы к условиям окружающей среды. Центральным звеном врожденного клеточного иммунитета являются фагоцитирующие лейкоциты, основная функция которых в организме – антимикробная защита, они играют также роль медиаторов воспаления, обладают цитотоксическим, противоопухолевым действием [116,117].
Оценка бактерицидной активности лейкоцитов цыплят-бройлеров оценивалась по интенсивности протекания фагоцитоза. Фагоцитоз – процесс узнавания, активного захвата и поглощения (переваривания) микроорганизмов, разрушенных клеток и инородных частиц специализированными клетками иммунной системы. Этот анализ позволяет оценить резерв моноцитов и псевдоэозинофилов к перевариванию чужеродных агентов.
Моноциты — большие белые кровяные клетки, которые превращаются в макрофаги в тканях. Макрофаги — мобильные клетки — широко представлены в организме птиц. При активации они могут повысить их фагоцитарную активность и миграцию в место нахождения инфекции. Антиген, преодолевший механические барьеры организма и попавший в кровоток, вначале встречается с макрофагами и либо соединяется с рецепторами на поверхности макрофага, либо захватывается макрофагом путем пиноцитоза, подвергается внутриклеточному ферментативному расщеплению, в результате чего в кровоток поступают подготовленные антигенные детерминанты — непосредственные антигенные раздражители для лимфоцитов, имеющих на своей поверхности комплементарные рецепторы. Только после этого лимфоцит может трансформироваться либо в плазматическую клетку, продуцирующую антитела, либо в клетку памяти, способную впоследствии при повторном контакте с этим агентом «узнать» его, либо в активизированный лимфоцит, участвующий в клеточном иммунном ответе, например, стать лимфоцитом — киллером, участвующим в отторжении злокачественных клеток собственного организма, или превратиться в толерантную клетку, не способную впоследствии ответить на этот антиген [118].
Основными клетками крови, защищающими организм от инфекционно-токсических воздействий, у птиц являются псевдоэозинофилы, которые активно участвуют в процессе фагоцитоза и способны переваривать микробов внутри клетки благодаря наличию ряда ферментов типа протеиназ. Кроме протеолитических, они содержат и другие ферменты, оказывающие бактерицидное действие. Псевдоэозинофилы не синтезируют антитела, но, адсорбируя молекулы иммунных глобулинов на своей поверхности, могут доставлять их к очагу воспаления. Эта популяция клеток обладает амебовидной подвижностью, что способствует выполнению фагоцитарной функции. Псевдоэозинофилы обладают большой жизнеспособностью в очаге воспаления при недостатке кислорода. Их высокая активность объясняется большими запасами гликогена, который используется для ресинтеза АТФ при анаэробном гликолизе, таким образом восполняется затраченная при фагоцитозе и движении энергия. Большой резерв псевдоэозинофилов находится в костном мозге, в случае необходимости (при инфекции) они быстро поступают в кровяное русло [119].
Результаты исследования на бактерицидную активность лейкоцитов отображаются как процент активных фагоцитов к их общему количеству. Выявление активных моноцитов и псевдоэозинофилов производится с помощью бактерий с флуоресцентными метками. Биоматериалом для исследования является цельная кровь с гепарином.
Результаты наших исследований показали (табл.18), что бактерицидная активность лейкоцитов у цыплят 1 и 3 опытной группы была достоверно выше, чем у контрольных аналогов на 11,08 и 14,38 (Р≤0,05), во 2 опытной группе этот показатель был ниже, чем в контроле на 7,48%.
Таблица 18 — Бактерицидная активность лейкоцитов цыплят-бройлеров в возрасте 29 дней, (M±m; n=5)
| Группа | Бактерицидная активность лейкоцитов, % |
| Контрольная | 37,66±2,16 |
| 1 опытная | 48,74±2,78* |
| 2 опытная | 30,18±4,89 |
| 3 опытная | 52,04±3,46* |
Таким образом, установленные изменения фагоцитарной активности лейкоцитов демонстрируют стимулирующее влияние применяемых препаратов ГербаСтор и Активо на неспецифическую резистентность организма цыплят-бройлеров, свидетельствуя о более высокой иммунологической реактивности.
3.2.12 Состояние микрофлоры толстого отдела кишечника цыплят-бройлеров
Органы и системы организма постоянно сообщаются с внешней средой, являясь открытыми биологическими системами, колонизированными микроорганизмами. Сообщество популяций микроорганизмов, обитающих в определенном биотопе, характеризуется относительным постоянством, которое поддерживается механизмами аутостабилизации [120,121].
Анализ состояния микрофлоры толстого отдела кишечника цыплят-проводили в возрасте 29 дней (табл. 19).
Проведенное исследование микрофлоры толстого отдела кишечника бройлеров, в частности, слепых отростков, показало, что анализируемые патогенные микроорганизмы (шигеллы, сальмонеллы, кампилобактеры, диарогенные эшерихии, иерсинии, вacillus cereus, аэромонас, плезиомонас) отсутствовали.
Из потенциально-патогенной флоры не были обнаружены: энтеробактерии клебсиелла, энтеробактер, серрация, неферментирующие грамотрицательные палочки — синегнойная палочка, ацинетобактер, грамположительные кокки – золотистый стафилококк, грибковая флора Candida sp.
Таблица 19 – Результаты анализа микрофлоры толстого отдела кишечника цыплят-бройлеров в возрасте 29 дней, n=5
| Показатель | Норматив | Группа | |||
| Контрольная | 1 опытная | 2 опытная | 3 опытная | ||
| Патогенные микроорганизмы | |||||
| Шигеллы
(Shigella spp.), КОЕ/мл |
н/о | н/о | н/о | н/о | н/о |
| Сальмонеллы
(Salmonella spp.), КОЕ/мл |
н/о | н/о | н/о | н/о | н/о |
| Кампилобактеры (Campylobacter spp),
КОЕ/мл |
н/о | н/о | н/о | н/о | н/о |
| Диарогенные
эшерихии, КОЕ/мл |
н/о | н/о | н/о | н/о | н/о |
| Иерсинии
(Yersinia spp), КОЕ/мл |
н/о | н/о | н/о | н/о | н/о |
| Bacillus cereus,
КОЕ/мл |
н/о | н/о | н/о | н/о | н/о |
| Аэромонас
(Aeromonas spp), КОЕ/мл |
н/о | н/о | н/о | н/о | н/о |
| Плезиомонас
(Plesiomonas spp), КОЕ/мл |
н/о | н/о | н/о | н/о | н/о |
| Потенциально-патогенная флора | |||||
| Энтеробактерии
Клебсиелла (Klebsiella spp), КОЕ/мл |
менее
104 |
н/о | н/о | н/о | н/о |
| Протей (Proteus
spp) — Proteus mirabilis, КОЕ/мл |
менее
104 |
108 | 108 | 108 | 108 |
| Энтеробактер
(Enterobacter spp), КОЕ/мл |
менее
104 |
н/о | н/о | н/о | н/о |
| Серрация
(Serratia spp), КОЕ/мл |
менее
104 |
н/о | н/о | н/о | н/о |
| Прочие,
КОЕ/мл |
менее
104 |
н/о | н/о | н/о | н/о |
| Неферменти-рующие грамотрица-
тельные палочки Синегнойная Палочка (Pseudomonas aeruginosa), КОЕ/мл |
менее
103 |
н/о | н/о | н/о | н/о |
| Ацинетобактер
(Acinectobacter spp), КОЕ/мл |
менее
103 |
н/о | н/о | н/о | н/о |
| Прочие, КОЕ/мл | менее
103 |
н/о | н/о | н/о | н/о |
| Грамположи-тельные
кокки Золотистый Стафилококк (S. aureus), КОЕ/мл |
менее
102 |
н/о | н/о | н/о | н/о |
| Прочие –
Staphylococcus Saprophyticus, КОЕ/мл |
105-107 | 4 образца -104
1 образец -105 |
3 образца -104
2 образца – н/о |
3 образца — 103
2 образца – н/о |
1 образец -105
1 образец — 103 1 образец -104 2 образца –не обнаружены |
| Грибковая флора
Candida sp., КОЕ/мл |
менее 103 | н/о | н/о | н/о | н/о |
| Прочие —
Trichosporon Asahii, КОЕ/мл |
менее 103 | 2 образца -104
1 образец -103 1 образец -102 1 образец н/о |
2 образца -104
1 образец -103 1 образец -102 1 образец н/о |
1 образец -104
2 образца — 103 1 образец — 102 1 образец – н/о |
2 образца — 102
3 образца — н/о |
| Нормальная флора | |||||
| Бифидобактерии,
КОЕ/мл |
1010-1011 | 1010 | 1010 | 1010 | 1010 |
| Лактобактерии,
КОЕ/мл |
106-107 | 108 | 108 | 4 образца — 108
1 образец — 104 |
3 образца -108
2 образца — 104 |
| Кишечная палочка (номофлор), КОЕ/мл | 106-108 | 108 | 108 | 108 | 108 |
| E.coli лактозонегатив-ные (Escherichia coli inactivae), % | менее 10 | н/о | н/о | н/о | н/о |
| E.coli гемолитические (Escherichia coli haemolytic), % | н/о | н/о | н/о | н/о | н/о |
| Энтерококки,
КОЕ/мл |
105-107 | н/о | 3 образца — 108
2 образца — н/о |
н/о | 1 образец — 108
4 образца – н/о |
| Патогенные бактерии (кампилобактер) | |||||
| Campylobacter jejuni
|
н/о | н/о | н/о | н/о | н/о |
| Campylobacter coli
|
н/о | н/о | н/о | н/о | н/о |
Примечание: не обнаружены – н/о
Во всех подопытных группах установлено наличие протей (Proteus spp) — Proteus mirabilis, в количестве 108 КОЕ/мл. Staphylococcus Saprophyticus имели место быть во всех группах, при этом в контрольной группе они были отмечены во всех 5-ти образцах, а в опытных группах – в 3-х из 5-ти. Среди прочей потенциально-патогенной флоры у птиц контрольной и опытных групп был обнаружен Trichosporon asahii: в контрольной и 1 опытной группе – в 4-х анализируемых образцах из 5-ти; во 2 опытной группе – в 4-х образцах из 5-ти, но с менее выраженным количеством КОЕ/мл, по сравнению с контрольной и 1 опытной группами; в 3 опытной группе данный представитель потенциально-патогенной флоры кишечника был определен только в 2-х образцах из 5-ти, при этом его количество не превышало норматив.
Что касается представителей нормальной флоры, которым принадлежит важная роль в регуляции и поддержании рН, водно-солевого обмена и анаэробиоза в кишечнике, деконьюгации желчных кислот, синтезе витаминов, аминов и других биологически активных соединений, то в контрольной и опытных группах содержание бифидобактерий было в норме и находилось на уровне 1010 КОЕ/мл. Содержание лактобактерий в контрольной и 1 опытных группах составляло 108 КОЕ/мл; во 2 опытной группе – в 4-х образцах — 108 КОЕ/мл, в 1-м образце — 104 КОЕ/мл; в 3 опытной группе — в 3-х образцах 108 и в 2 образцах — 104 КОЕ/мл.
Количество кишечной палочки (номофлор) во всех группах не превышало норматива и было на уровне 108 КОЕ/мл.
Ни в одной из подопытных групп не были обнаружены E.coli лактозонегативные (Escherichia coli inactivae) и E.coli гемолитические (Escherichia coli haemolytic).
Энтерококки не были обнаружены в контрольной и 2 опытной группах цыплят-бройлеров. В 1 опытной группе эти представители нормальной флоры присутствовали в 3-х исследуемых образцах в количестве 108 КОЕ/мл и 2-х образцах не обнаружены. В 3 опытной группе наличие энтерококков отмечено в 1 образце и в 4-х образцах не обнаружено.
Патогенные бактерии (кампилобактер) — Campylobacter jejuni и Campylobacter coli не были обнаружены ни в одном образце во всех подопытных группах.
Одновременно с исследованием микробиоценоза слепых отростков цыплят-бройлеров была проведена антибиотикограмма – лабораторное исследование, позволяющее определить чувствительность микрофлоры к антибактериальным препаратам. Данное исследование показало (табл. 20), что Escherichia coli во всех подопытных группах оказалась чувствительна к цефтриаксону и цефотаксиму. Установлена устойчивость Staphylococcus saprophyticus к цефокситину в контрольной, в 1 и 2 опытных группах. Proteus mirabilis был устойчив к цефтриаксону и цефотаксиму во всех экспериментальных группах. Enterococcus faecium оказался устойчивым к ванкомицину в 1 и 3 опытных группах. Escherichia coli inactivae была чувствительна к цефтриаксону и цефотаксиму в 1 опытной группе.
Таблица 20 — Чувствительность микрофлоры кишечника цыплят-бройлеров к антибиотикам (антибиотикограмма)
| Показатель | Группа | |||
| Контрольная | 1 опытная | 2 опытная | 3 опытная | |
| Escherichia coli Цефтриаксон
Цефотаксим |
Чувствительный
Чувствительный |
Чувствительный
Чувствительный |
Чувствительный
Чувствительный |
Чувствительный
Чувствительный |
| Staphylococcus saprophyticus Цефокситин | Чувствительный | Чувствительный | Чувствительный | — |
| Proteus mirabilis Цефтриаксон
Цефотаксим |
Чувствительный
Чувствительный |
Чувствительный
Чувствительный |
Чувствительный
Чувствительный |
Чувствительный
Чувствительный |
| Enterococcus faecium Ванкомицин | Устойчивый | Устойчивый | ||
| Escherichia coli inactivae Цефтриаксон Цефотаксим | Чувствительный
Чувствительный |
|||
| Staphylococcus xylosus Цефокситин | Чувствительный | Чувствительный | ||
| Staphylococcus arlettae Цефокситин | ||||
| Staphylococcus lentus Цефокситин | Чувствительный | |||
Staphylococcus xylosus проявил чувствительность к цефокситину в образцах толстого отдела кишечника цыплят 2 и 3 опытных групп, а Staphylococcus lentus оказался чувствительным к цефокситину у представителей 3 опытной группы.
Таким образом, проведенное исследование микрофлоры слепых отростков кишечника цыплят-бройлеров свидетельствовало об отсутствии во всех образцах экспериментальных групп патогенных микроорганизмов и бактерий. Из потенциально-патогенной флоры установлено: наличие во всех группах одинакового количества протей (Proteus spp) — Proteus mirabilis; присутствие Staphylococcus Saprophyticus — при меньшем их количестве в образцах опытных групп; наличие Trichosporon asahii — с минимальным проявлением в образцах 3 опытной группы. В отношении нормальной флоры слепых отростков можно констатировать, что включение комплексных добавок на основе синбиотиков и фитобиотиков и фитобиотической добавки не повлияло на количественное содержание бифидобактерий и кишечной палочки (номофлор), при этом сопровождалось незначительным снижением количества лактобактерий в единичных образцах при включении ПроСтора и Активо, а также выраженным наличием энтерококков при использовании ГербаСтора на фоне их отсутствия в образцах контрольной и 2 опытной группы и единичным присутствием в 3 опытной группе.
3.2.13 Морфогистологическое состояние внутренних органов цыплят-бройлеров
В ходе гистологического исследования изучали препараты печени, поджелудочной железы, двенадцатиперстной кишки, слепой кишки, селезенки, тимуса и фабрициевой бурсы от цыплят-бройлеров 37 дневного возраста.
ПЕЧЕНЬ
Контрольная группа. Структура органа была не нарушена, отмечено значительное количество очагов полиморфноклеточного инфильтрата (рис.2). В гепатоцитах наблюдалась зернистая дистрофия, глиссонова капсула была без изменений (рис.3). В кровеносных сосудах разного калибра отмечено формирование тромбов (рис.4). В системе триады как признак воспалительной реакции наблюдались диффузные полиморфноклеточные инфильтраты (рис. 5).
Рисунок 2 – Срез печени цыплят контрольной группы. Ув. 400
Примечание: здесь и далее Ув. – увеличение микроскопа
Рисунок 3 – Срез печени цыплят контрольной группы. Ув. 630
Рисунок 4 – Срез печени цыплят контрольной группы. Ув. 200
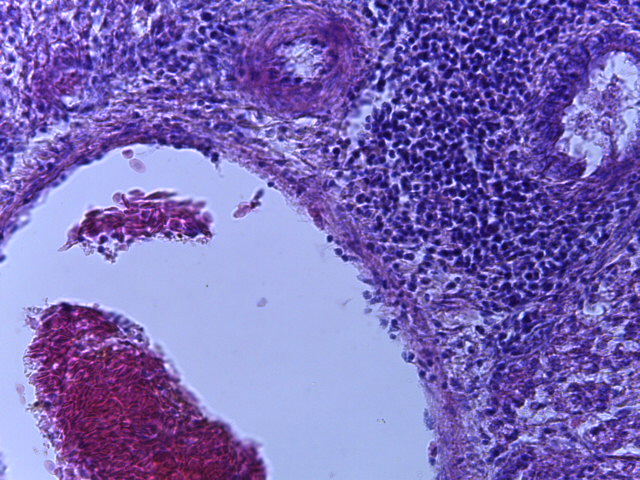
Рисунок 5 – Срез печени цыплят контрольной группы. Ув.400
1 опытная группа. В печени цыплят 1 опытной группы наблюдали утолщение тромбов в сосудистом русле и стенки сосудов (рис.6). Установлены значительные очаги некрозов, охватывающие целые дольки (рис.7). Некрозы также выявлены в стенке протоков с перидуктальной воспалительной инфильтрацией (рис.8). В гепатоцитах наблюдалась зернисто-жировая дистрофия (рис.9).
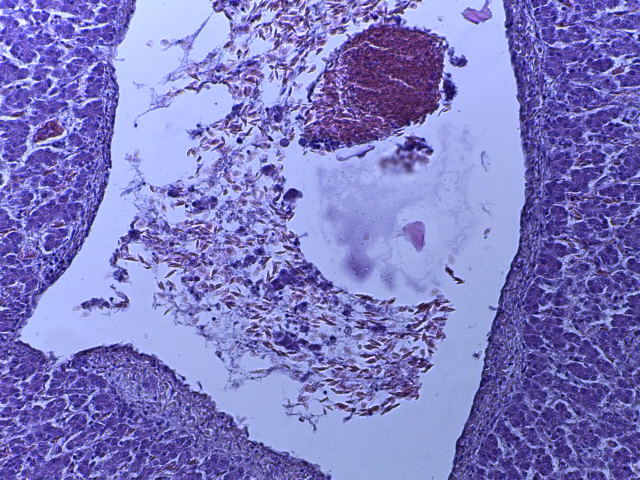
Рисунок 6 – Срез печени цыплят 1 опытной группы. Ув. 200
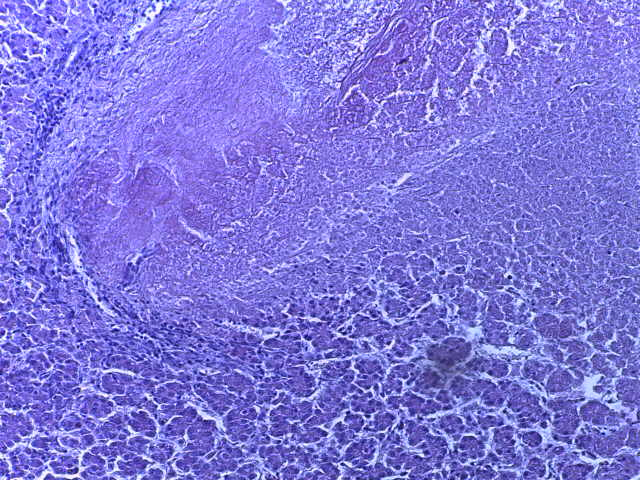
Рисунок 7 – Срез печени цыплят 1 опытной группы. Ув. 200
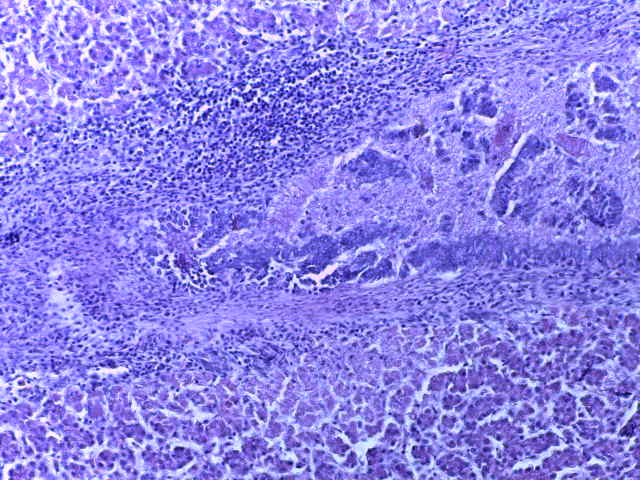
Рисунок 8 – Срез печени цыплят 1 опытной группы. Ув. 200
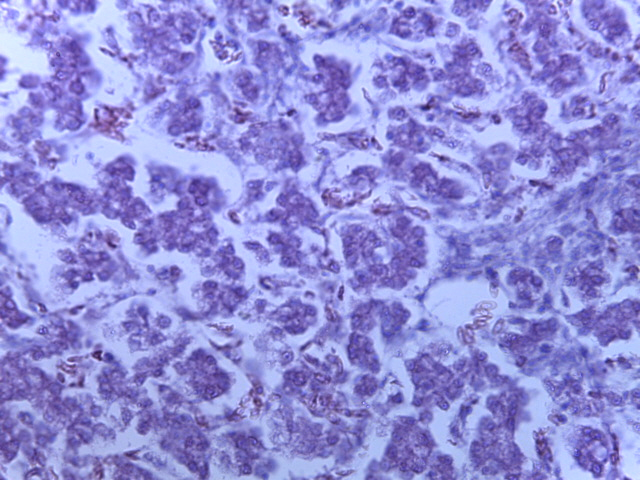
Рисунок 9 – Срез печени цыплят 1 опытной группы. Ув. 400
2 опытная группа. В органе наблюдали незначительную зернистую дистрофию гепатоцитов и некоторое разрыхление паренхимы (рис.10,11).
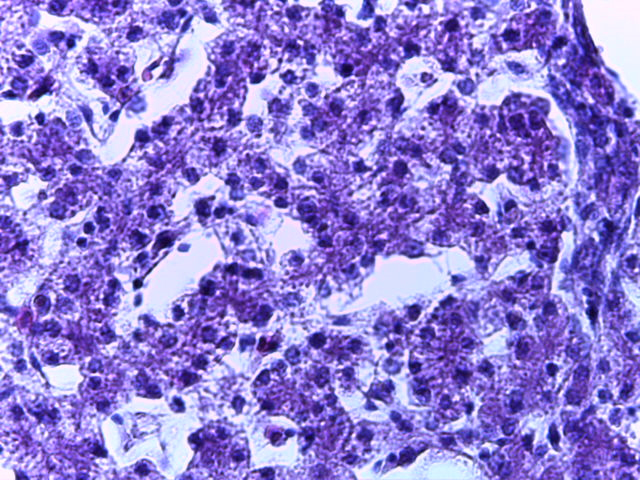
Рисунок 10 – Срез печени цыплят 2 опытной группы. Ув. 400
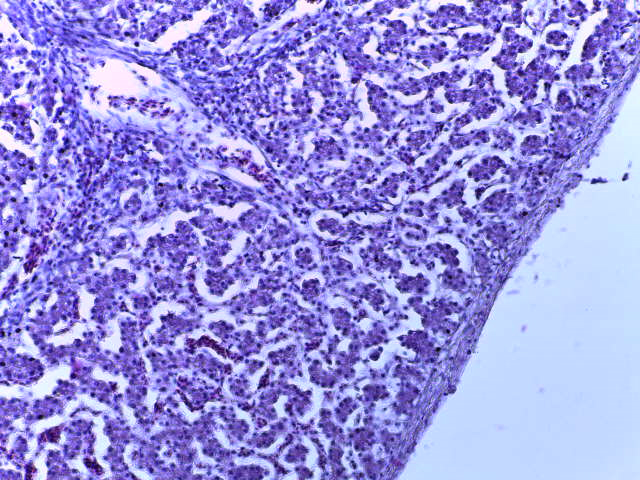
Рисунок 11 – Срез печени цыплят 2 опытной группы. Ув. 400
3 опытная группа. Отмечены полиморфноклеточные инфильтраты как в зоне островков межуточной соединительной ткани, так и между островками, а также значительное количество ограниченных лимфоидноклеточных инфильтратов и очаги вакуольной дистрофии гепатоцитов (рис. 12,13,14).
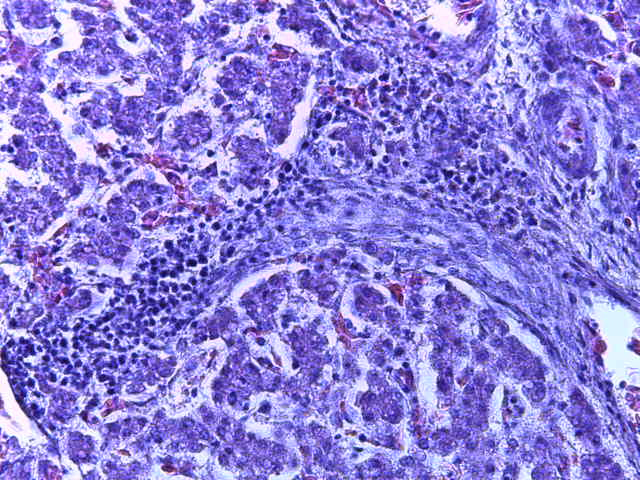
Рисунок 12 – Срез печени цыплят 3 опытной группы. Ув. 400
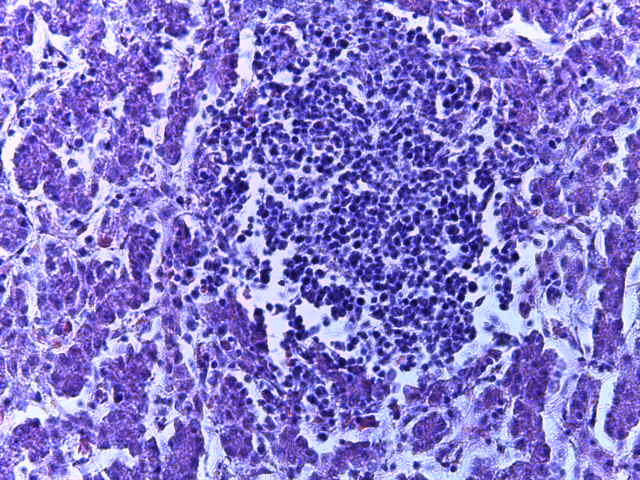
Рисунок 13 – Срез печени цыплят 3 опытной группы. Ув. 400
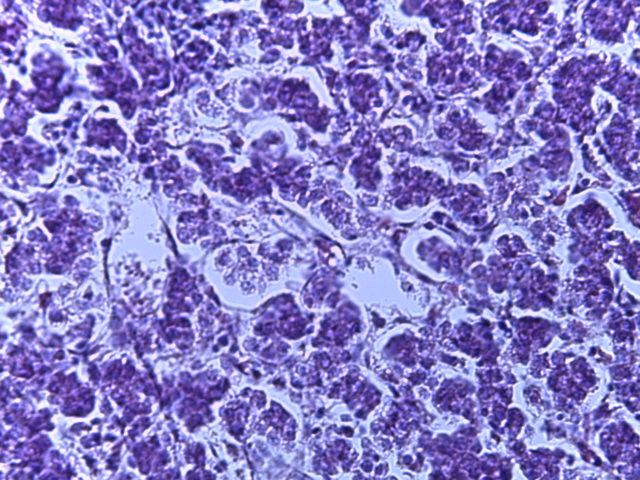
Рисунок 14 – Срез печени цыплят 3 опытной группы. Ув. 400
Поджелудочная железа
Контрольная группа. Содержимое протоков поджелудочной железы было уплотненное, в межуточной соединительной ткани отмечены воспалительные инфильтраты, наблюдается слущивание эпителия протоков в просвет, островки Лангерганса единичные многоотросчатые (рис.15,16,17, 18).
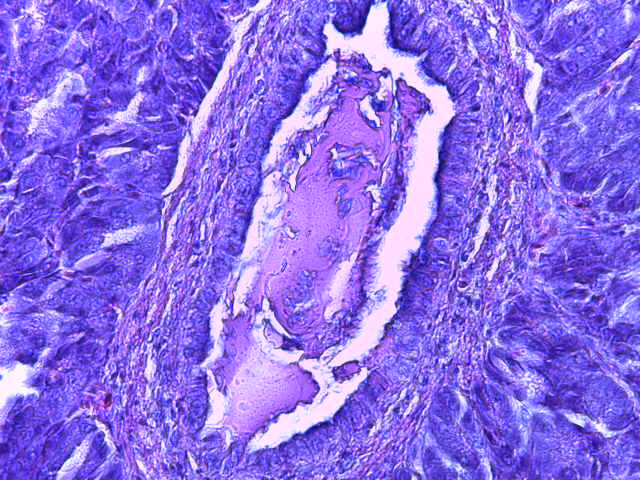
Рисунок 15 – Срез поджелудочной железы цыплят
контрольной группы. Ув. 400
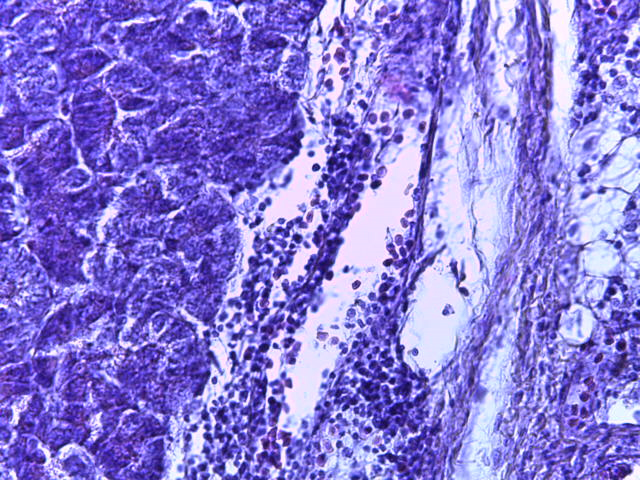
Рисунок 16 – Срез поджелудочной железы цыплят
контрольной группы. Ув. 400
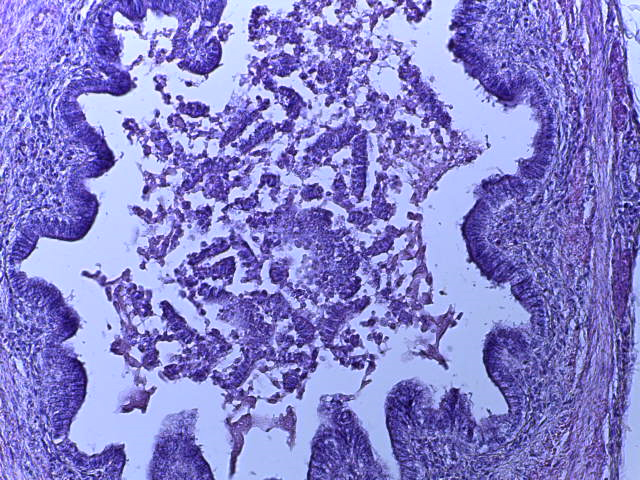
Рисунок 17 – Срез поджелудочной железы цыплят
контрольной группы. Ув. 400
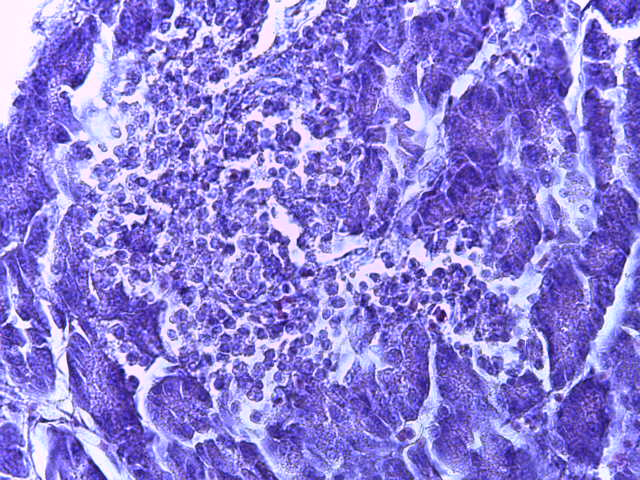
Рисунок 18 – Срез поджелудочной железы цыплят
контрольной группы. Ув. 400
1 опытная группа. В протоках поджелудочной железы наблюдается неоднородный по консистенции секрет, отмечено слущивание эпителия в просвет протока (рис. 19).
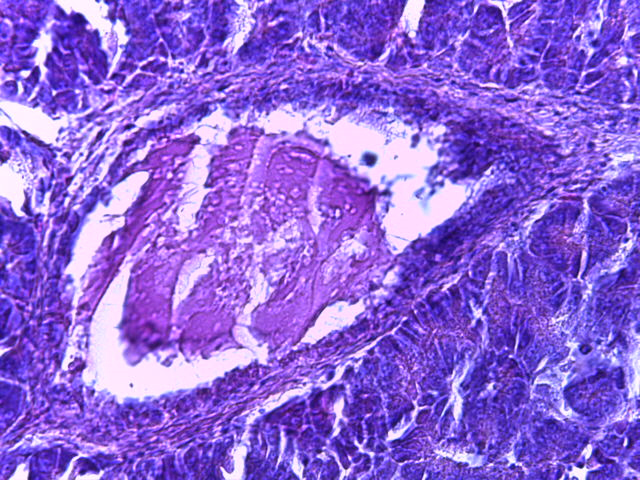
Рисунок 19 – Срез поджелудочной железы цыплят
1 опытной группы. Ув. 400
В кровеносных сосудах наблюдается формирование тромбов (рис.20), периваскулярно и в паренхиме железы располагаются рассеянные и локальные лимфоидноклеточные инфильтраты (рис. 21).
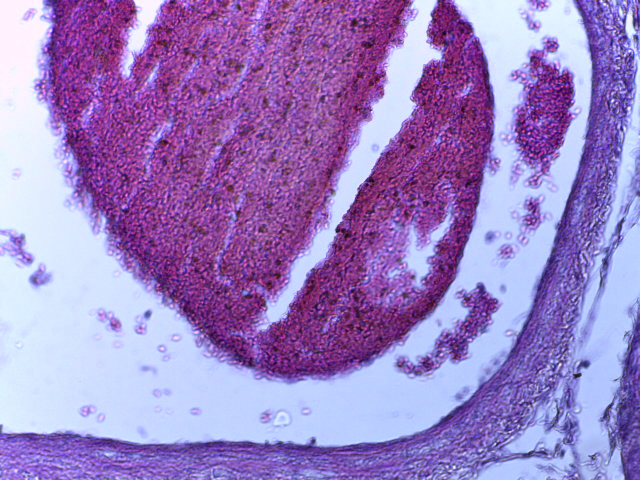
Рисунок 20 – Срез поджелудочной железы цыплят
1 опытной группы. Ув. 200
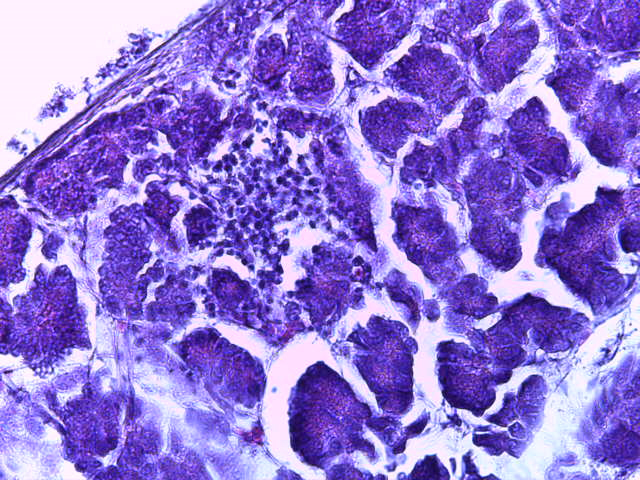
Рисунок 21 – Срез поджелудочной железы цыплят
1 опытной группы. Ув. 400
2 опытная группа. В паренхиме поджелудочной железы отмечены четко очерченные островки Лангерганса на фоне высокой функциональной активности органа (рис.22,23). Патологических процессов не выявлено.
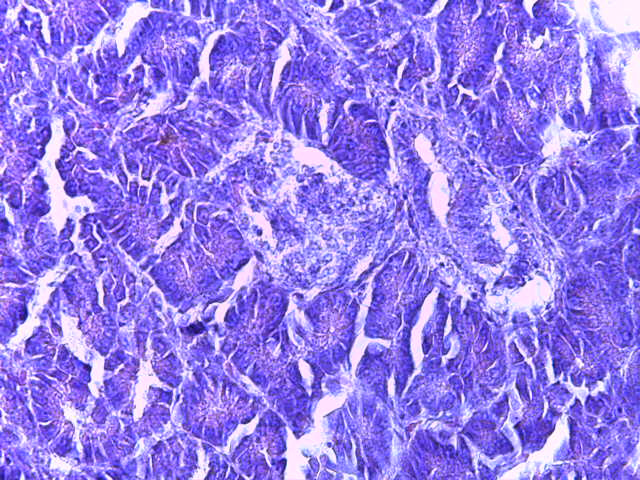
Рисунок 22 – Срез поджелудочной железы цыплят
2 опытной группы. Ув. 400
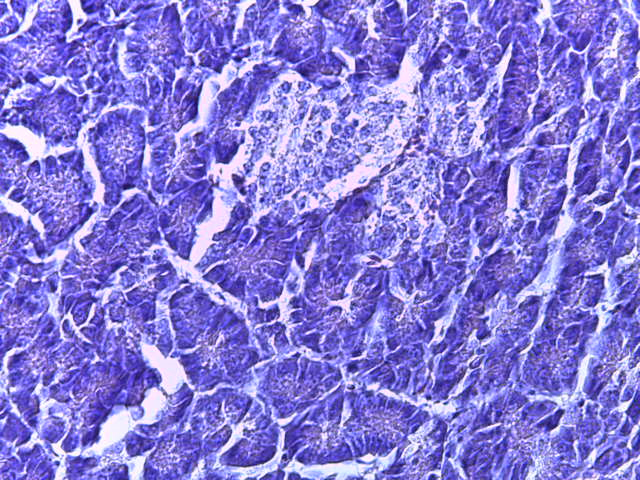
Рисунок 23 – Срез поджелудочной железы
цыплят 2 опытной группы. Ув. 400
3 опытная группа. Островки Лангерганса хорошо очерчены, отмечена выраженная секреторная активность железы (рис.24), имеют место полиморфноклеточные воспалительные инфильтраты с гиперемией сосудов венозного русла (рис. 25).
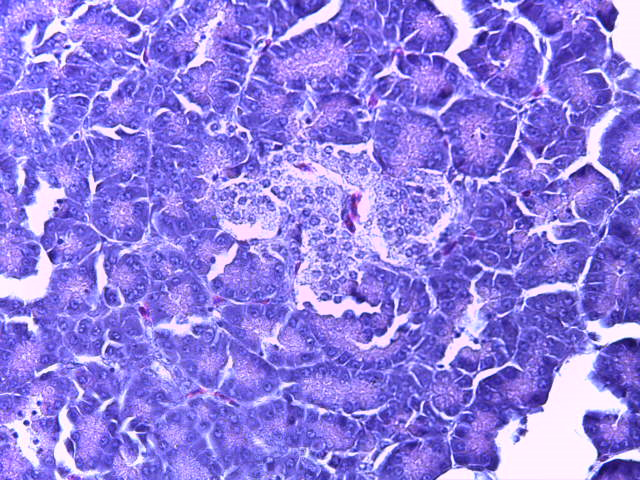
Рисунок 24 – Срез поджелудочной железы цыплят
3 опытной группы. Ув. 400
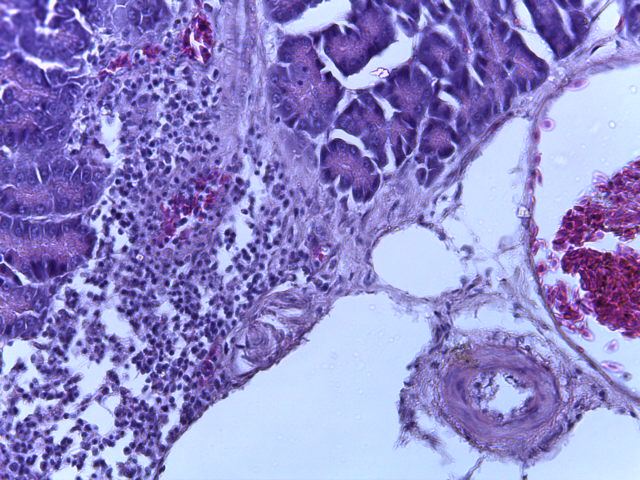
Рисунок 25 – Срез поджелудочной железы цыплят
3 опытной группы. Ув. 400
Тонкий кишечник (12-перстная кишка)
Контрольная группа. В 12-перстной кишке наблюдается воспалительная реакция ворсинок (рис.26), гиперсекреция крипт и гиперемия сосудов мышечной оболочки (рис.27,28).
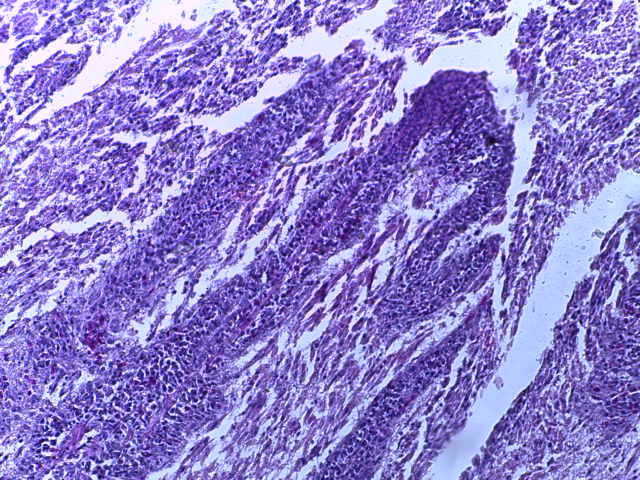
Рисунок 26 – Срез 12-перстной кишки цыплят контрольной группы. Ув. 200
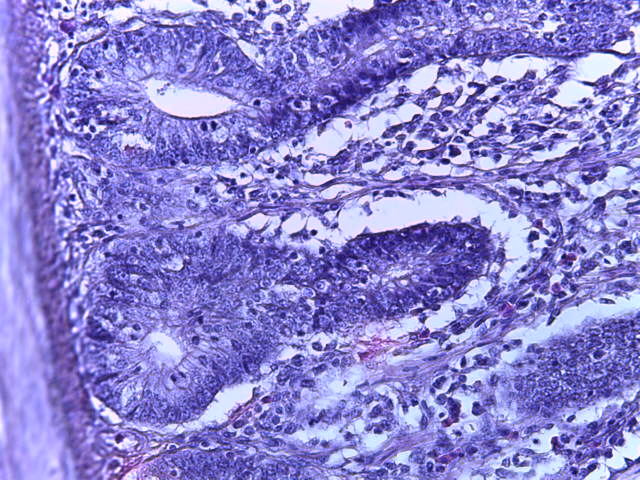
Рисунок 27 – Срез 12-перстной кишки цыплят контрольной группы. Ув. 400
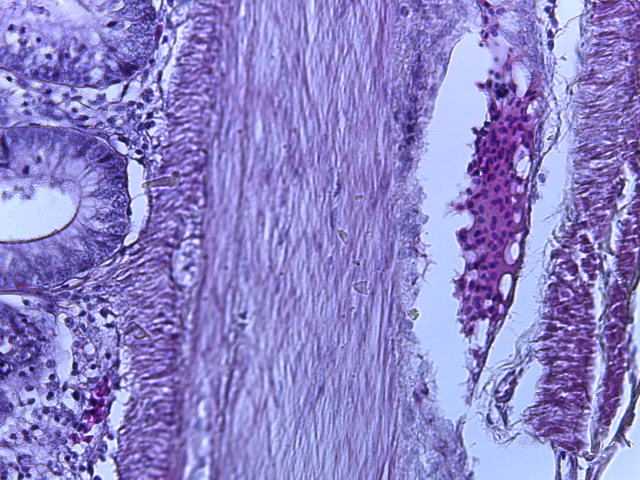
Рисунок 28 – Срез 12-перстной кишки цыплят контрольной группы. Ув. 400
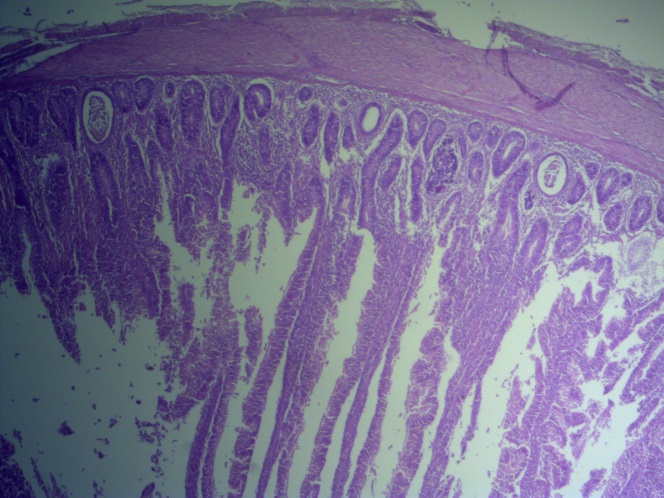 1 опытная группа. В 12-перстной кишке соотношение длины ворсинок к длине крипт составляло около 7:1. Ворсинки пальцевидной формы, утолщены. Наблюдается воспалительная инфильтрация стромы ворсинок с реактивными изменениями цилиндрического эпителия с многочисленными межэпителиальными лимфоцитами. На отдельных участках цилиндрический эпителий десквамирован в просвет, отмечена очагово выраженная деструкция ворсин (рис.29).
1 опытная группа. В 12-перстной кишке соотношение длины ворсинок к длине крипт составляло около 7:1. Ворсинки пальцевидной формы, утолщены. Наблюдается воспалительная инфильтрация стромы ворсинок с реактивными изменениями цилиндрического эпителия с многочисленными межэпителиальными лимфоцитами. На отдельных участках цилиндрический эпителий десквамирован в просвет, отмечена очагово выраженная деструкция ворсин (рис.29).
Рисунок 29 – Срез 12-перстной кишки цыплят 1 опытной группы. Ув. 200
Клеточный инфильтрат стромы ворсин 12-перстной кишки представлен мелкими округлыми клетками с четко оформленным базофильным ядром и узким ободком базофильной, реже эозинофильной цитоплазмы. Среди желез слизистой наблюдается диффузно-очаговая инфильтрация аналогичными клетками (рис.30).
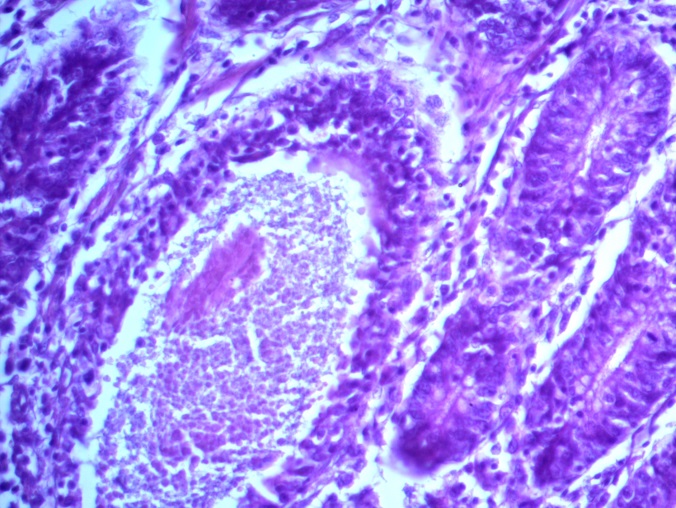
Рисунок 30 – Срез 12-перстной кишки цыплят 1 опытной группы. Ув. 400
Гладкие миоциты стенки кишки были с дистрофическими изменениями (неравномерное просветление цитоплазмы, пылевидные эозинофильные включения в цитоплазме). Наиболее выражен циркулярный слой (рис.31, 32).
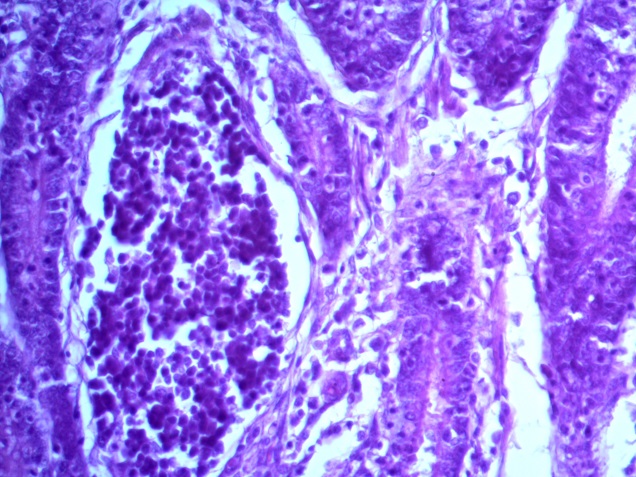
Рисунок 31 – Срез 12-перстной кишки цыплят 1 опытной группы. Ув. 400
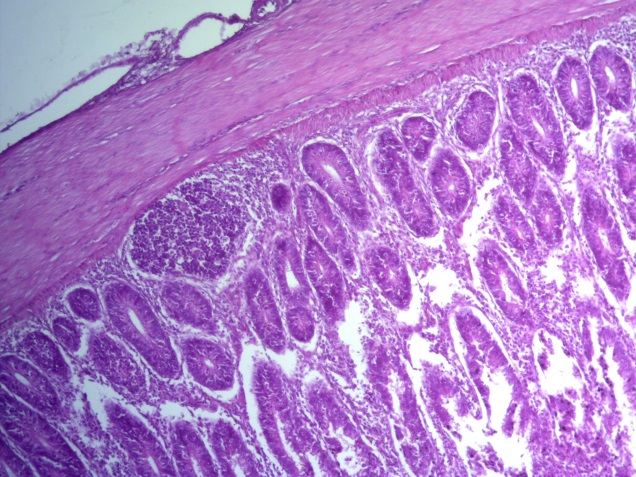
Рисунок 32 – Срез 12-перстной кишки цыплят 1 опытной группы. Ув. 100
2 опытная группа. В 12-перстной кишке выявлены процессы утолщения мышечной оболочки, утолщение ворсинок и их инфильтрация, в некоторых участках отмечено разрушение эпителия ворсинок и нарушение их структуры (рис. 33,34,35,36).
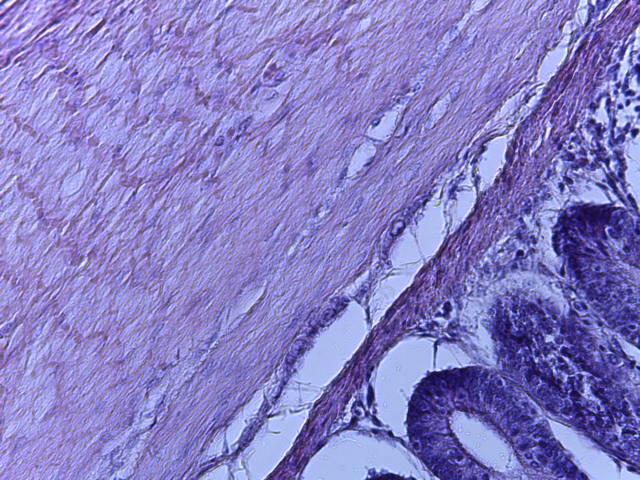
Рисунок 33 – Срез 12-перстной кишки цыплят 2 опытной группы. Ув. 400
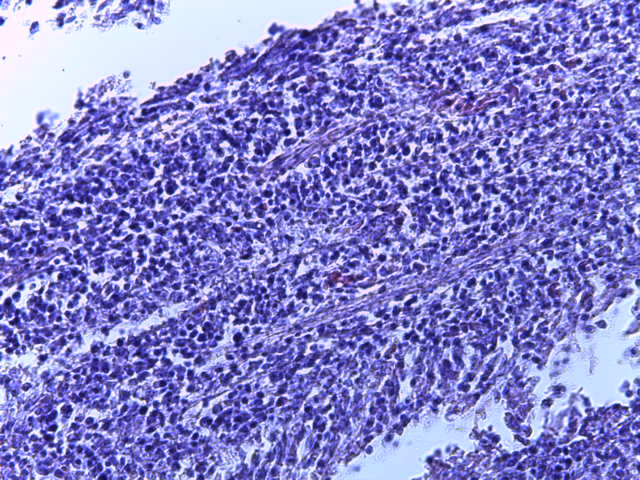
Рисунок 34 – Срез 12-перстной кишки цыплят 2 опытной группы. Ув. 400
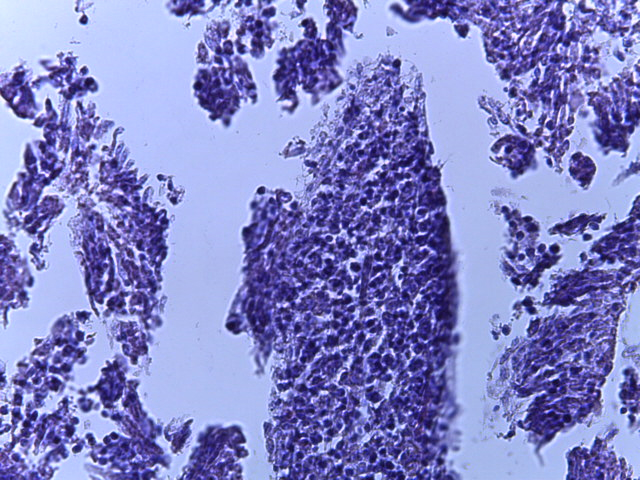
Рисунок 35 — Срез12-перстной кишки цыплят 2 опытной группы. Ув. 400
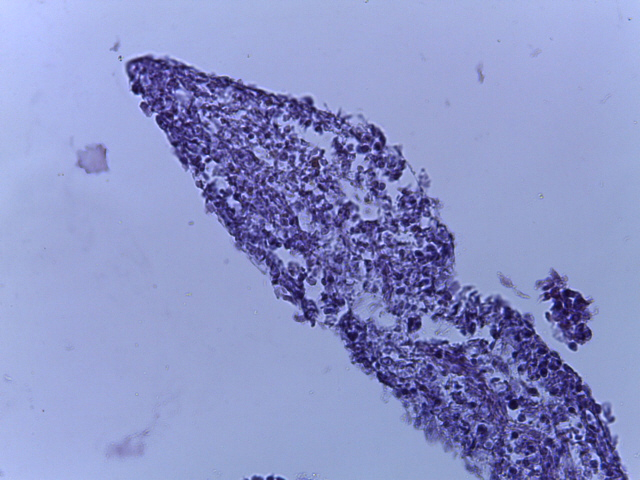
Рисунок 36 – Срез 12-перстной кишки цыплят 2 опытной группы. Ув. 400
3 опытная группа. На поверхности эпителия 12-перстной кишки, в просвете и между ворсинками наблюдается накопление катарального экссудата, отмечено утолщение мышечной оболочки и кровоизлияния (рис.37,38,39).
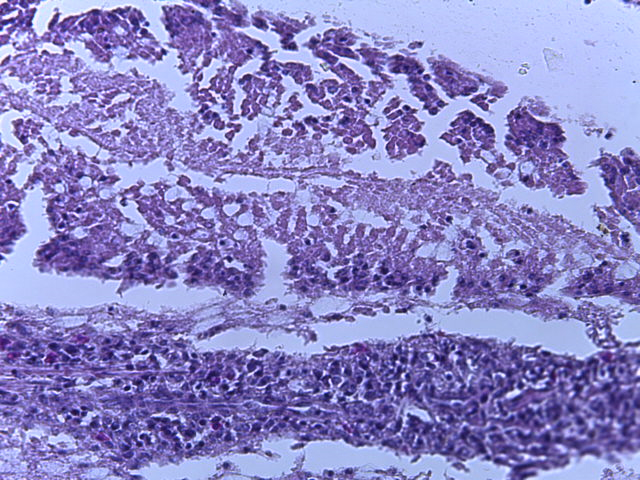
Рисунок 37 – Срез 12-перстной кишки цыплят 3 опытной группы. Ув. 400
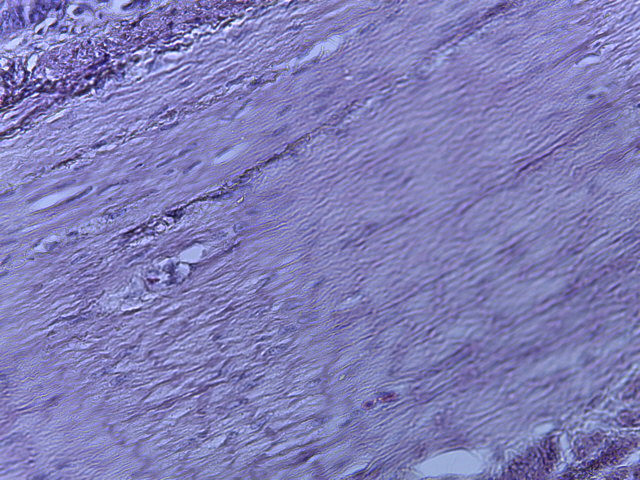
Рисунок 38 – Срез 12-перстной кишки цыплят 3 опытной группы. Ув. 400
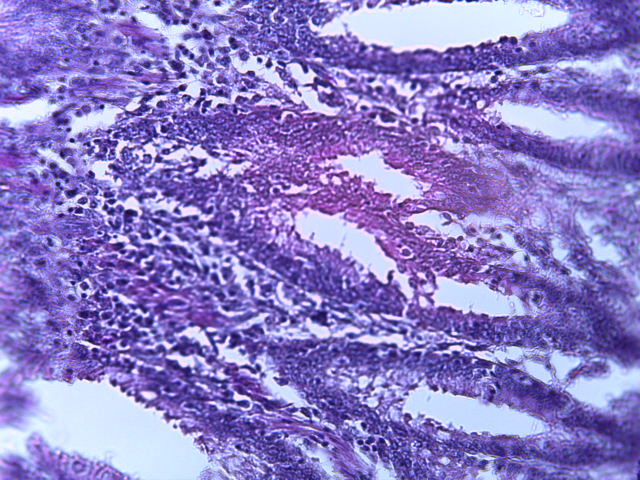
Рисунок 39 – Срез 12-перстной кишки цыплят 3 опытной группы. Ув. 400
Толстый кишечник (Слепая кишка — слепые отростки)
Контрольная группа. В слизистой оболочке слепых отростков толстого отдела кишечника наблюдались воспалительные инфильтраты (рис.40). На протяжении всего исследуемого образца демонстрировалась активная воспалительная инфильтрация (рис.41), серозная оболочка была утолщена (рис.42).
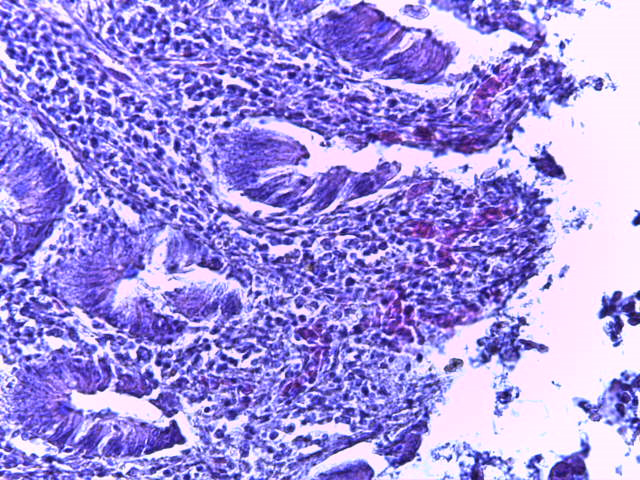
Рисунок 40 – Срез слепой кишки цыплят контрольной группы. Ув. 400
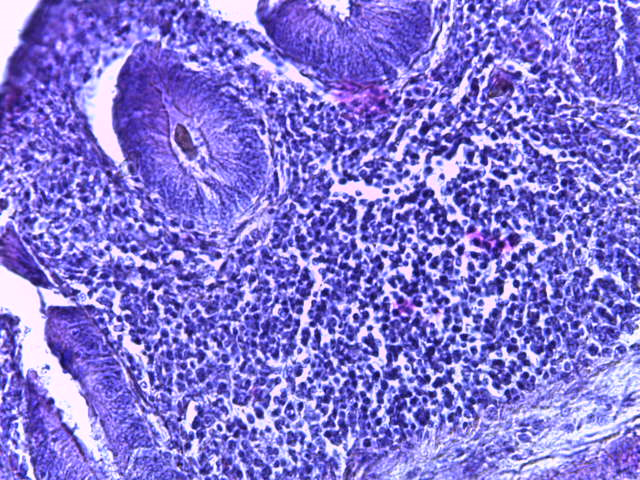
Рисунок 41 – Срез слепой кишки цыплят контрольной группы. Ув. 400
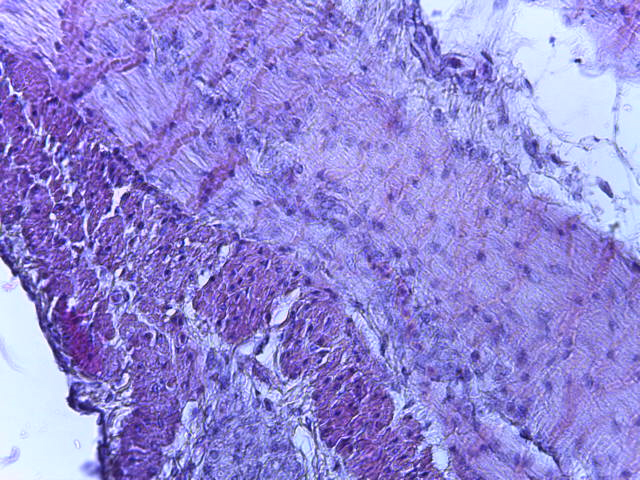
Рисунок 42 – Срез слепой кишки цыплят контрольной группы. Ув. 400
1 опытная группа. В слепой кишке цыплят 1 опытной группы наблюдали ярко выраженную воспалительную реакцию, в просвете был экссудат с наличием крови, отмечена гиперсекреция эпителия крипт рис.43,44).
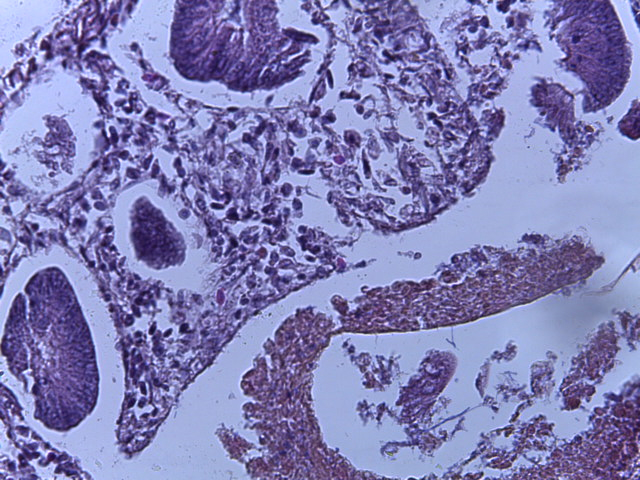
Рисунок 43 – Срез слепой кишки цыплят 1 опытной группы. Ув. 400
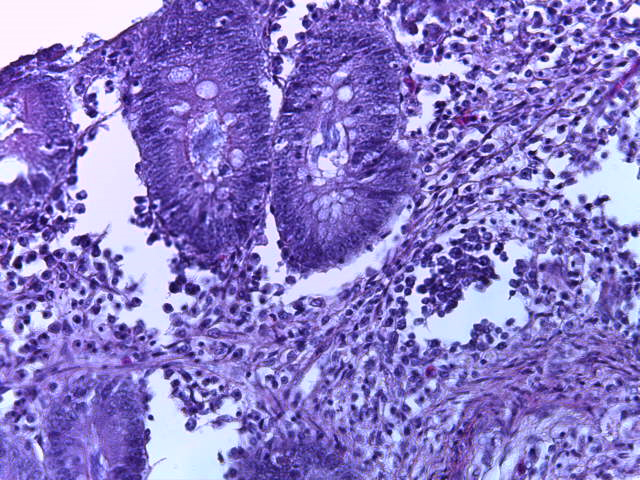
Рисунок 44 – Срез слепой кишки цыплят 1 опытной группы. Ув. 400
2 опытная группа. Наблюдалась умеренная воспалительная реакция (рис.45). Значительное количество лимфоидных фолликулов было в состоянии активизации – признак активного местного иммунитета (рис.46).
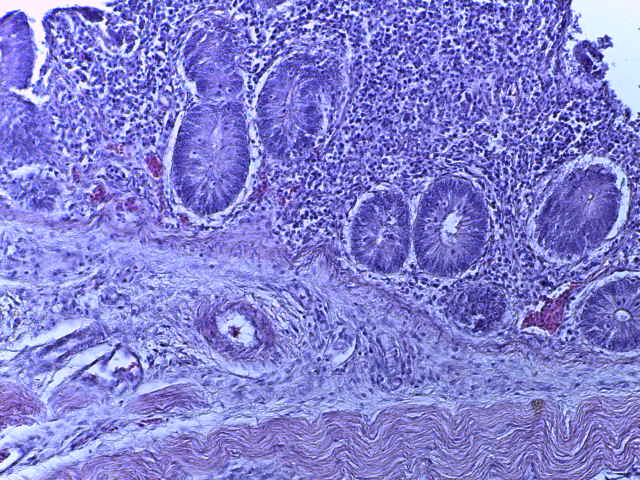
Рисунок 45 – Срез слепой кишки цыплят 2 опытной группы. Ув. 200
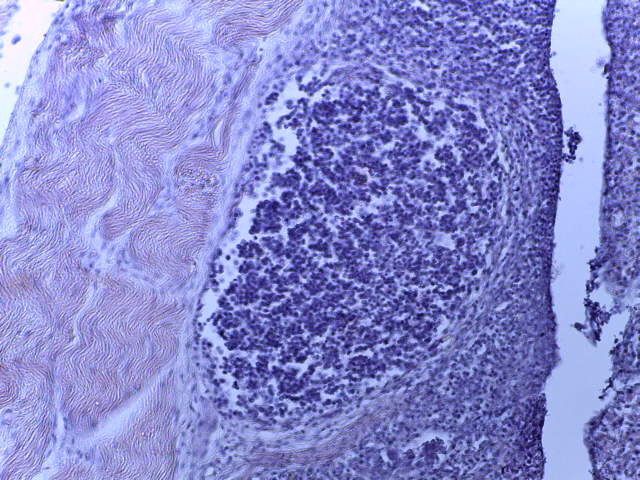
Рисунок 46 – Срез слепой кишки цыплят 2 опытной группы. Ув. 200
3 опытная группа. В слепых отростках цыплят отмечали умеренную воспалительную реакцию и наличие активизированных лимфоидных фолликулов (рис.47).
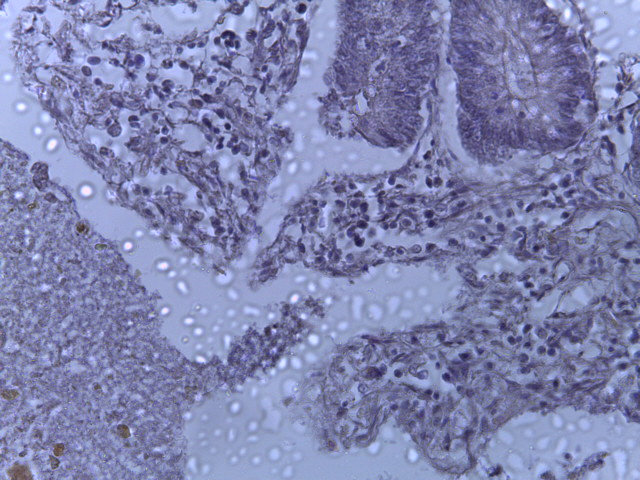
Рисунок 47 – Срез слепой кишки цыплят 3 опытной группы. Ув. 200
СЕЛЕЗЕНКА
Контрольная группа. В селезенке цыплят контрольной группы отмечена активная реакция лимфоидных фолликулов, орган значительно кровенаполнен (рис.48). Элементы стенки кровеносных сосудов трабекул в состоянии активной пролиферации (рис. 49). В некоторых участках имеют место очаги кровоизлияний (рис.50), капсула утолщена и отечна (рис.51).
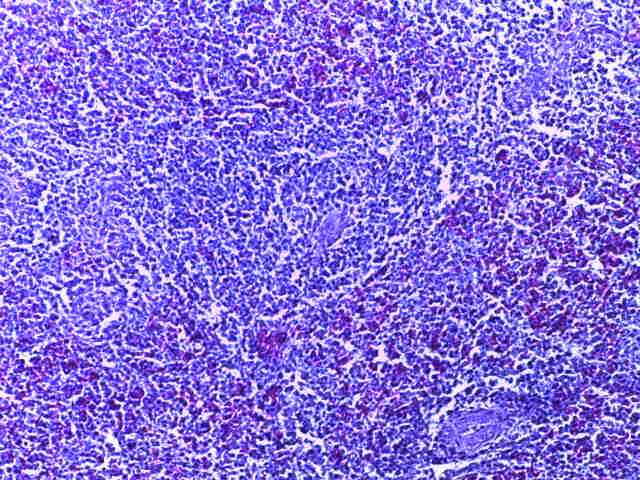
Рисунок 48 – Срез селезенки цыплят контрольной группы. Ув. 200
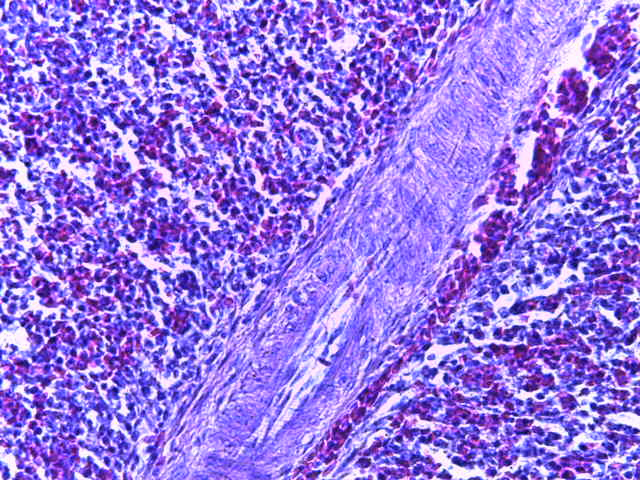
Рисунок 49 – Срез селезенки цыплят контрольной группы. Ув. 400
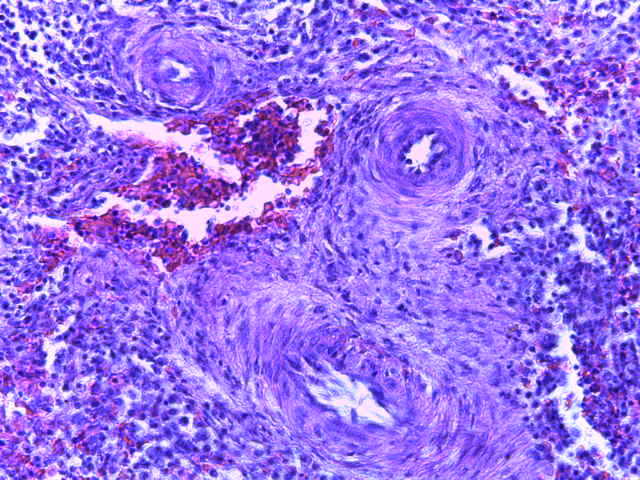
Рисунок 50 – Срез селезенки цыплят контрольной группы. Ув. 400
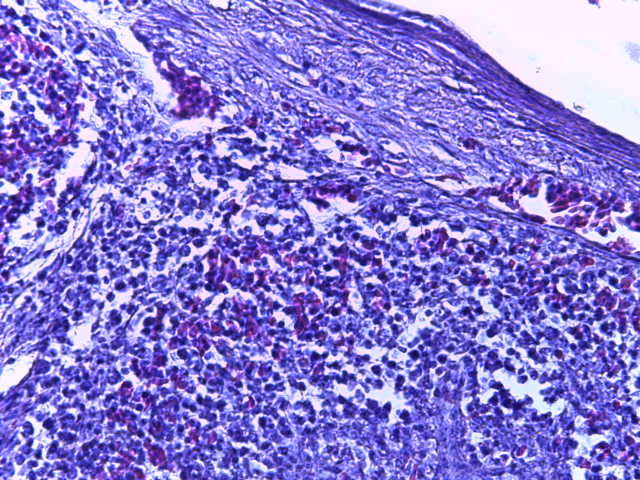
Рисунок 51 – Срез селезенки цыплят контрольной группы. Ув. 400
1 опытная группа. Наряду с центрами размножения, в селезенке цыплят 1 опытной группы встречаются четко ограниченные лимфоидные фолликулы (рис.52).
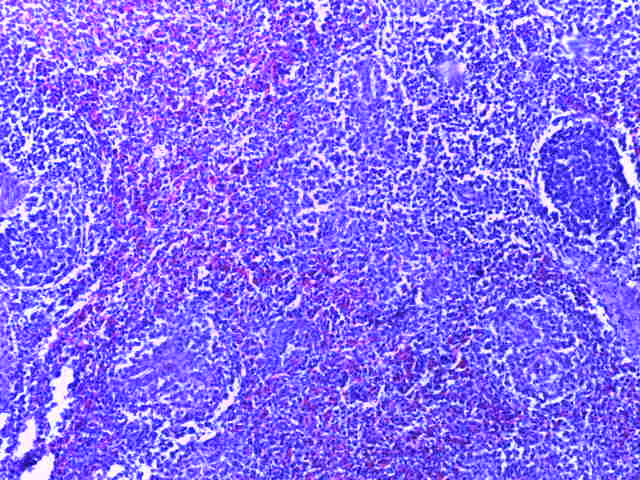
Рисунок 52 – Срез селезенки цыплят 1 опытной группы. Ув. 200
В просвете сосудов, наряду с эритроцитами, встречаются лейкоциты и макрофаги, как признак воспалительной реакции (рис.53), незначительное количество лимфоидных фолликулов (рис.54). Капсула органа была слегка утолщена (рис. 55).
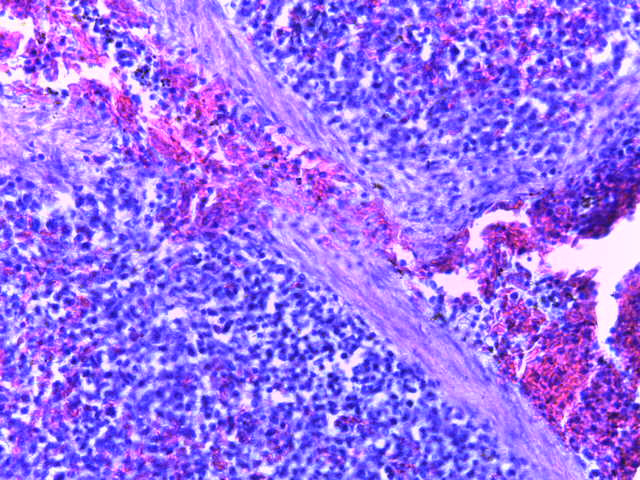
Рисунок 53 – Срез селезенки цыплят 1 опытной группы. Ув. 400
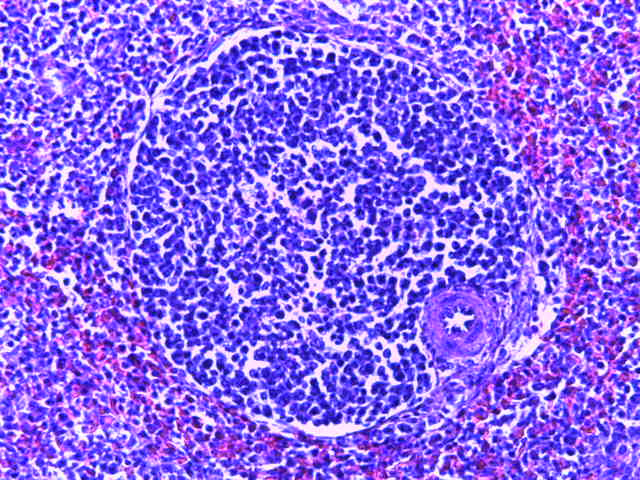
Рисунок 54 – Срез селезенки цыплят 1 опытной группы. Ув. 400
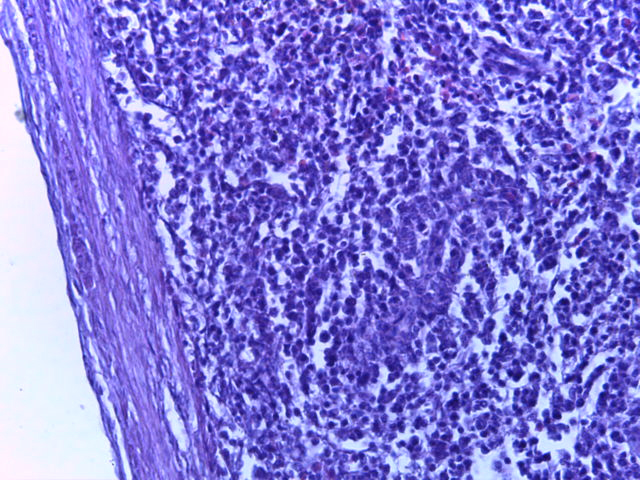
Рисунок 55 – Срез селезенки цыплят 1 опытной группы. Ув. 400
2 опытная группа. В перитрабекулярном пространстве селезенки отмечены пятнистые кровоизлияния (рис.56), четко выражены центры размножения лимфоцитов и зрелые лимфоидные фолликулы (рис.57).
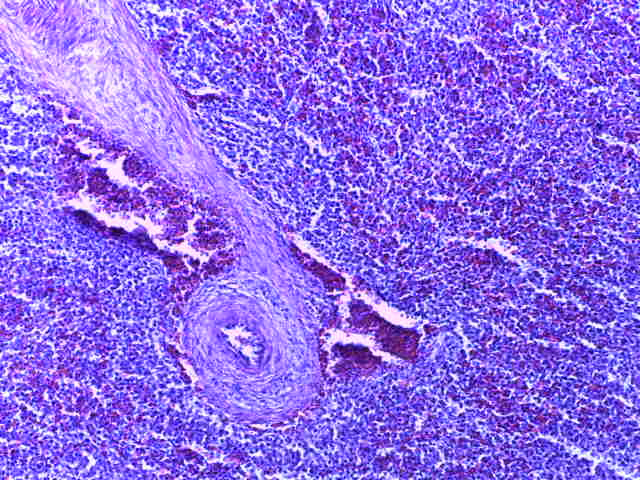
Рисунок 56 – Срез селезенки цыплят 2 опытной группы. Ув. 200
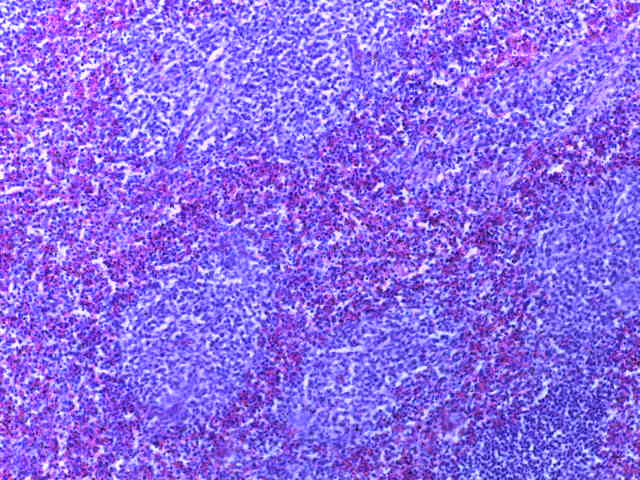
Рисунок 57 – Срез селезенки цыплят 2 опытной группы. Ув. 200
Капсула органа плотная не утолщена (рис.58), фолликулы и пульпа гиперплазированы (рис.58,59).
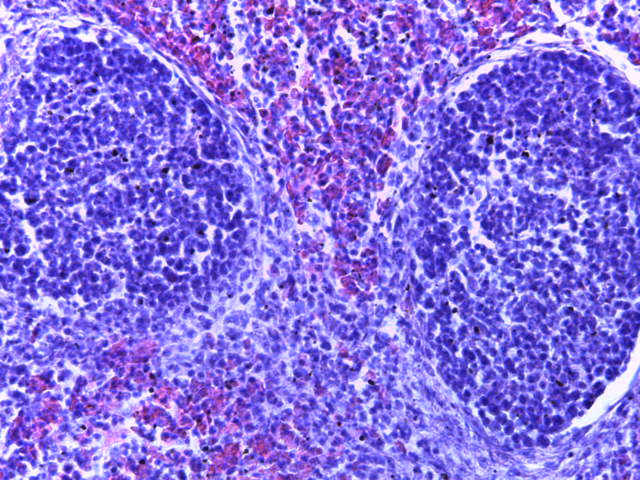
Рисунок 58 – Срез селезенки цыплят 2 опытной группы. Ув. 400
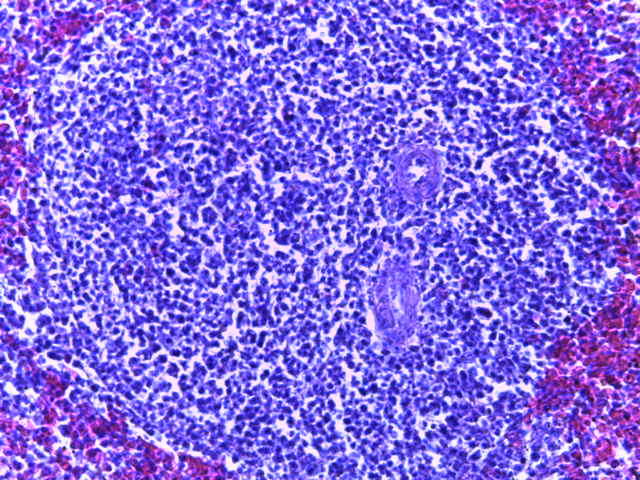
Рисунок 59 – Срез селезенки цыплят 2 опытной группы. Ув. 400
3 опытная группа. В органе отмечено активное разрастание соединительной ткани в трабекулах и пролиферация элементов стенки сосудов в ней (рис.60, увеличение 200).
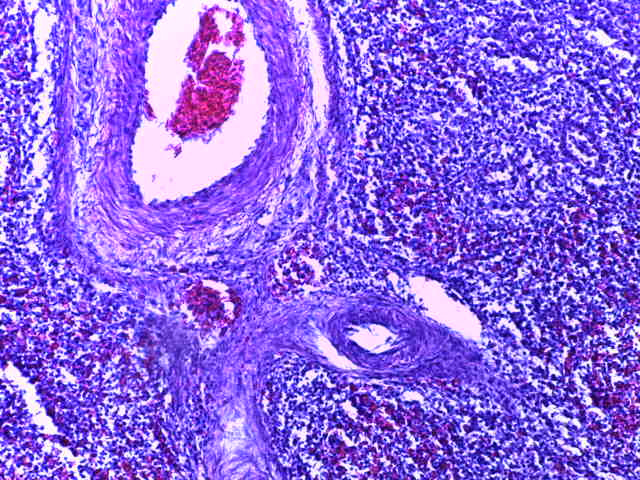
Рисунок 60 – Срез селезенки цыплят 3 опытной группы. Ув. 200
Капсула слегка утолщена отмечено расширение подкапсулярных синусов (рис.61). В пульпе отмечено появление значительного количества соединительнотканных элементов (рис.62). Наряду с этим выявлено разрыхление и оголение ретикулярной стромы органа (рис.63).
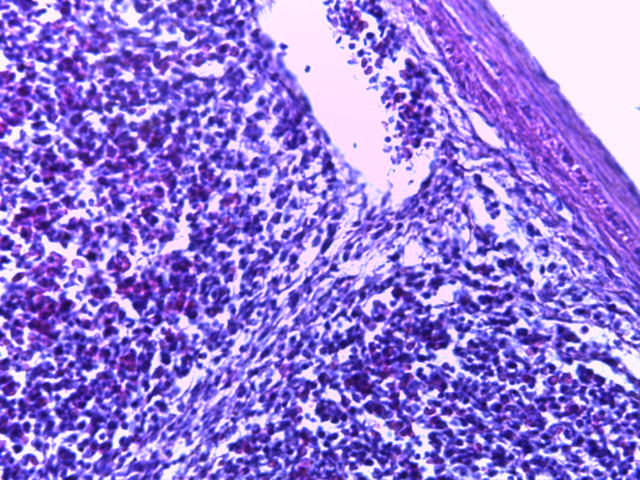
Рисунок 61 – Срез селезенки цыплят 3 опытной группы. Ув. 400
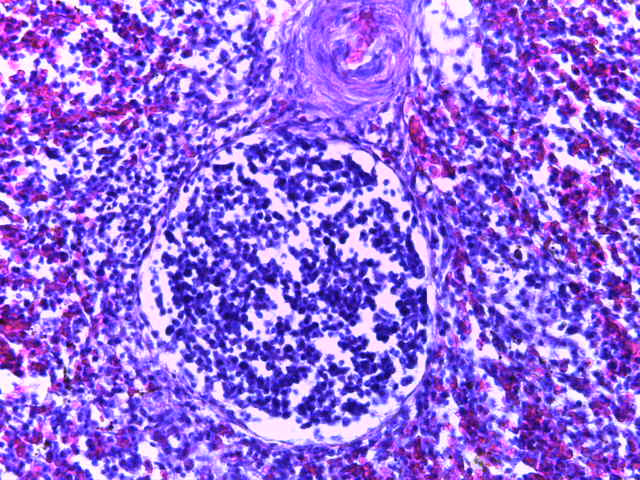
Рисунок 62 – Срез селезенки цыплят 3 опытной группы. Ув. 400
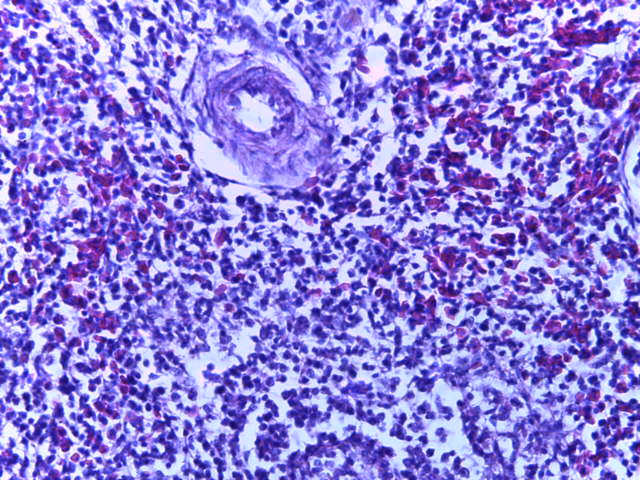
Рисунок 63 – Срез селезенки цыплят 3 опытной группы. Ув. 400
ТИМУС
Контрольная группа. В тимусе цыплят контрольной группы наблюдалась: гиперемия сосудов и жировые включения, зрелые тельца Гассаля, резкое расширение лимфатических сосудов (рис.64,65,66,67).
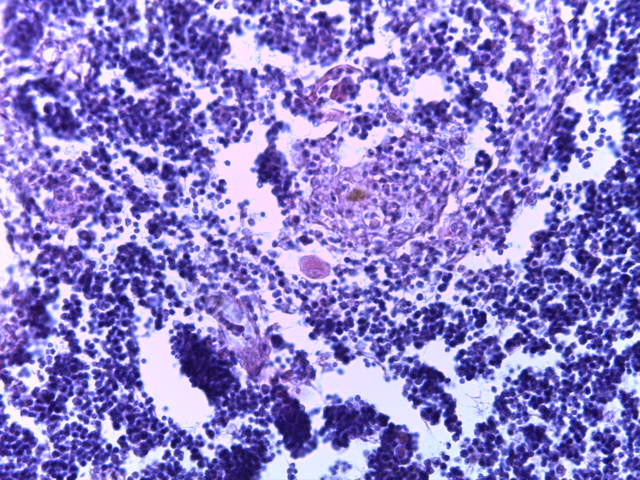
Рисунок 64 – Срез тимуса цыплят контрольной группы. Ув. 400
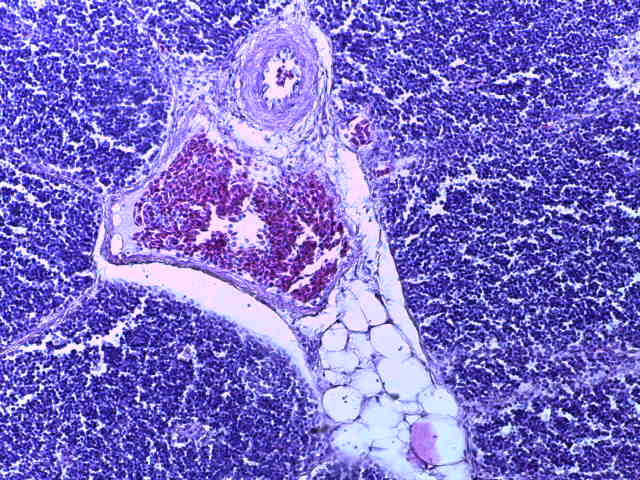
Рисунок 65 – Срез тимуса цыплят контрольной группы. Ув. 400
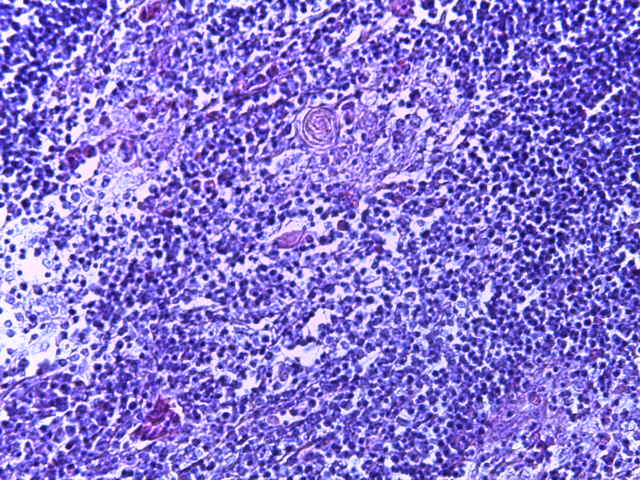
Рисунок 66 – Срез тимуса цыплят контрольной группы. Ув. 400
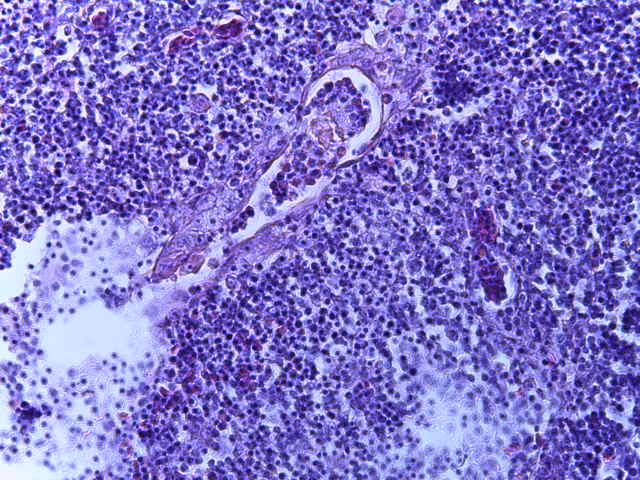
Рисунок 67 – Срез тимуса цыплят контрольной группы. Ув. 400
1 опытная группа. В органе отмечены массовые кровоизлияния и гиперемия сосудов всех калибров в той или иной степени выраженности во всех представленных образцах (рис.68,69).
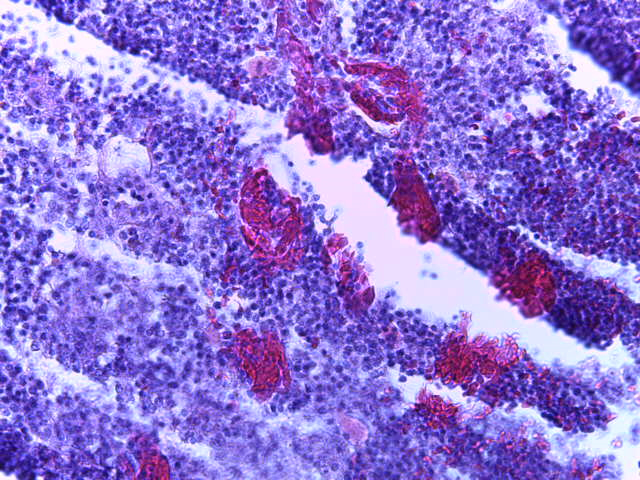
Рисунок 68 – Срез тимуса цыплят 1 опытной группы. Ув. 400
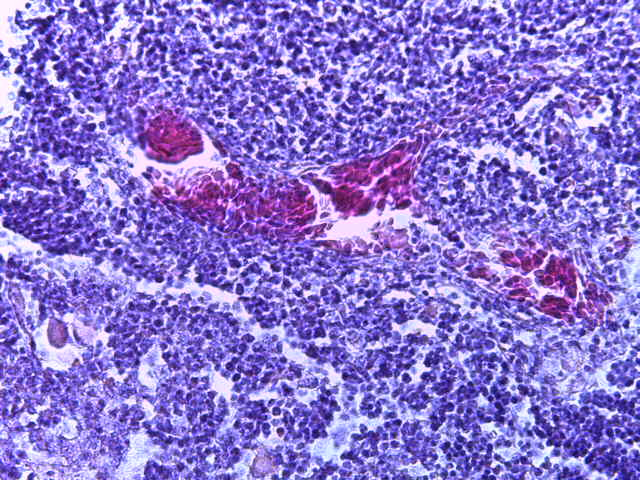
Рисунок 69 – Срез тимуса цыплят 1 опытной группы. Ув. 400
2 опытная группа. Дольки тимуса четко ограничены, в них видно разграничение на корковую и мозговую зоны, наблюдаются как сформированные, так и молодые тельца Гассаля, свидетельствующие о выраженном Т-клеточном иммунитете (рис.70,71).
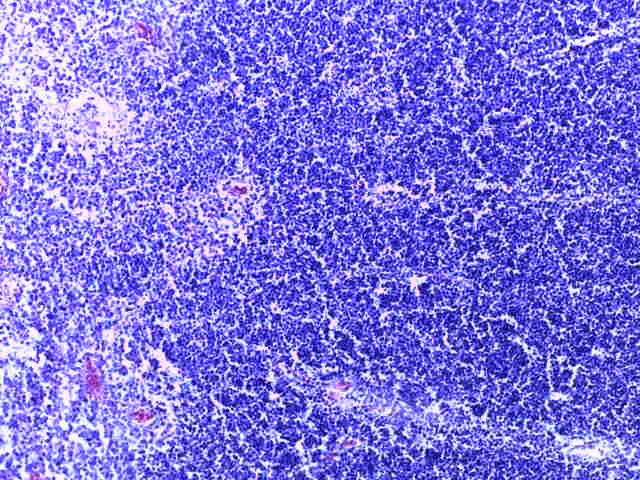
Рисунок 70 – Срез тимуса цыплят 2 опытной группы. Ув. 400
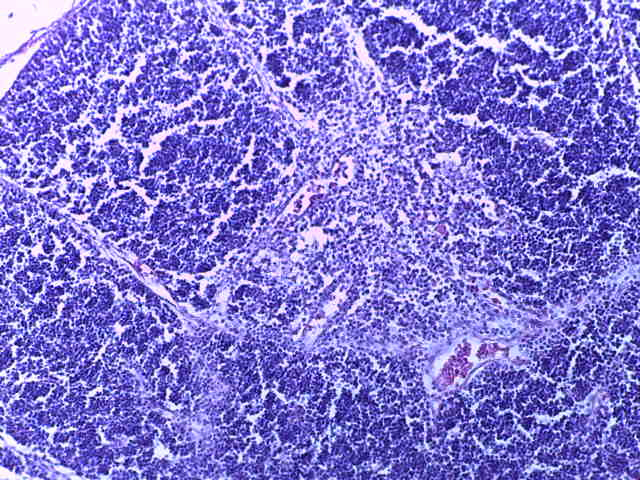
Рисунок 71 – Срез тимуса цыплят 2 опытной группы. Ув. 400
3 опытная группа. В тимусе цыплят 3 опытной группы наблюдалось разрыхление мозгового вещества, но дольки органа хорошо очерчены (рис.72,73) и представлены тимические тельца Гассаля (рис.74), увеличение 630).
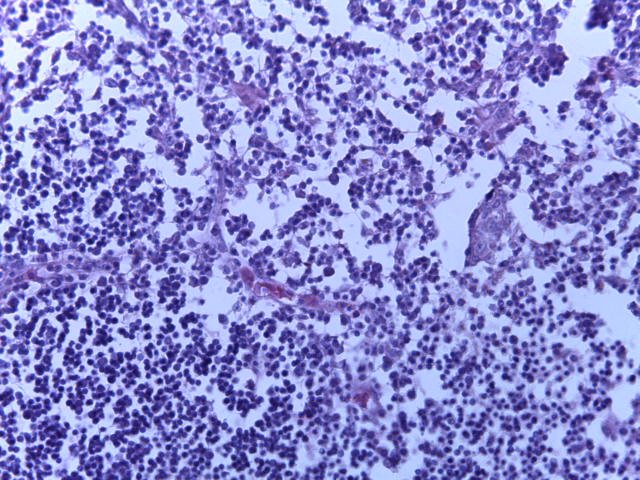
Рисунок 72 — Срез тимуса цыплят 3 опытной группы. Ув. 72
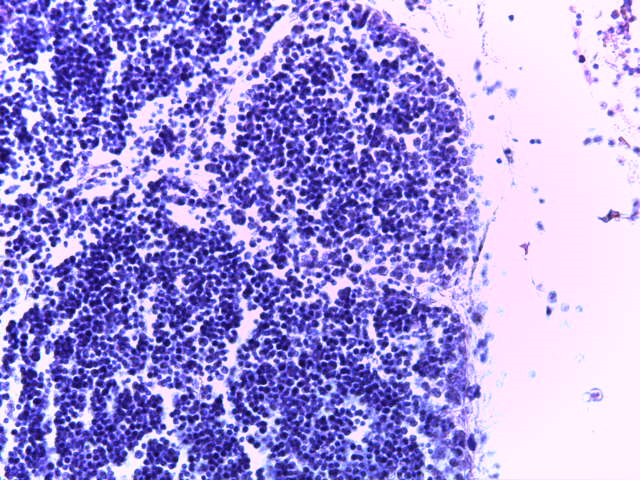
Рисунок 73 – Срез тимуса цыплят 3 опытной группы
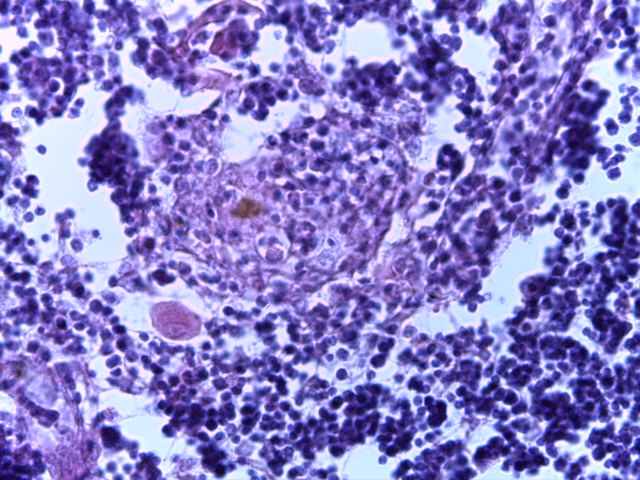
Рисунок 69 — Тимус цыплят 3 опытной группы
ФАБРИЦИЕВА БУРСА
Контрольная группа. Структура органа сохранена фолликулы четко очерчены с выраженной зональностью слоев, эпителий равномерно покрывает слизистую полости бурсы (рис. 70, увеличение 100). В некоторых участках эпителия видны кисты, как признак инволютивного процесса (рис.71, увеличение 400). В некоторых участках в эпителии отмечена слизистая дистрофия (рис.72, увеличение 400).
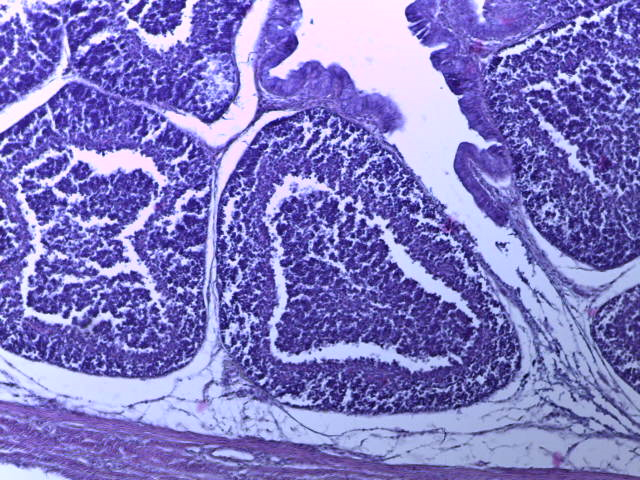
Рисунок 70 — Фабрициева бурса цыплят контрольной группы
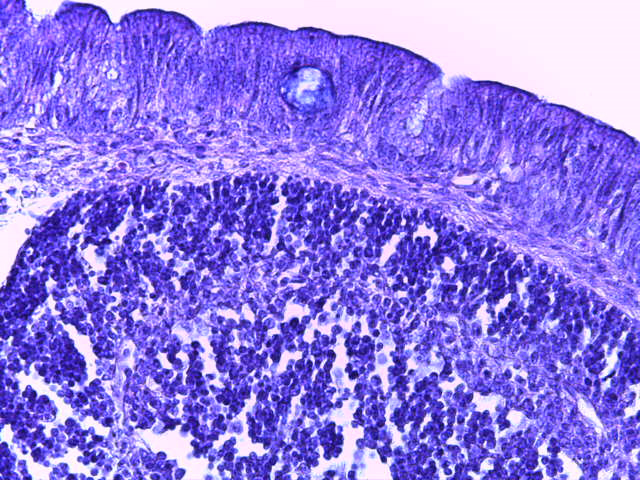
Рисунок 71 — Фабрициева бурса цыплят контрольной группы
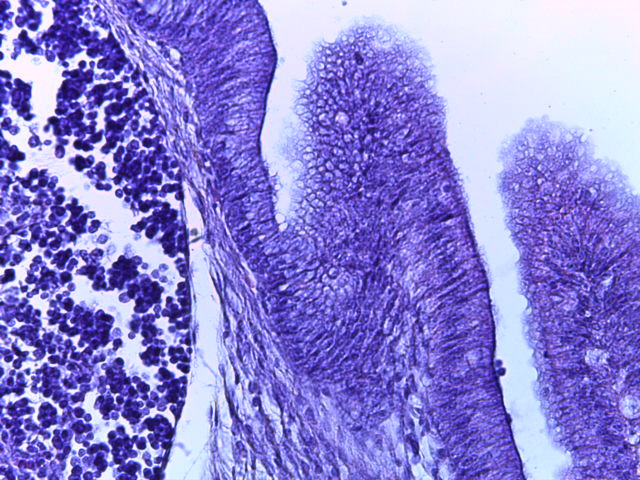
Рисунок 72 — Фабрициева бурса цыплят контрольной группы
1 опытная группа. Структура органа сохранена, но слои в фолликулах слабо разграничены (рис.73, увеличение 100). В эпителии содержится значительное количество кист, а в подэпителиальной выстилке воспалительные инфильтраты (рис.74, увеличение 400). Наружная оболочка (капсула) утолщена и огрубевшая (рис.75, увеличение100).
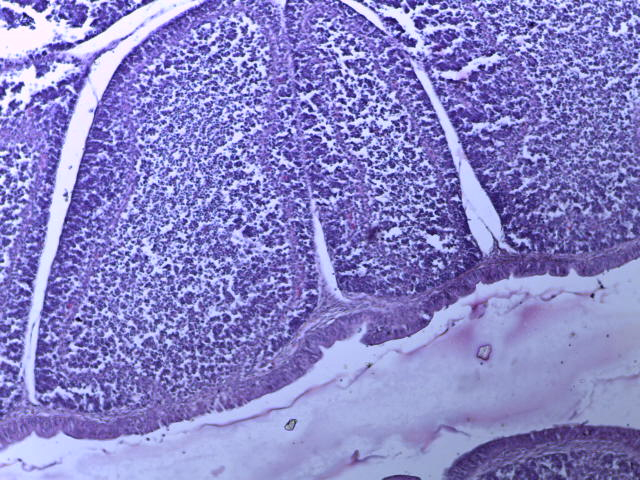
Рисунок 73 — Фабрициева бурса цыплят 1 опытной группы
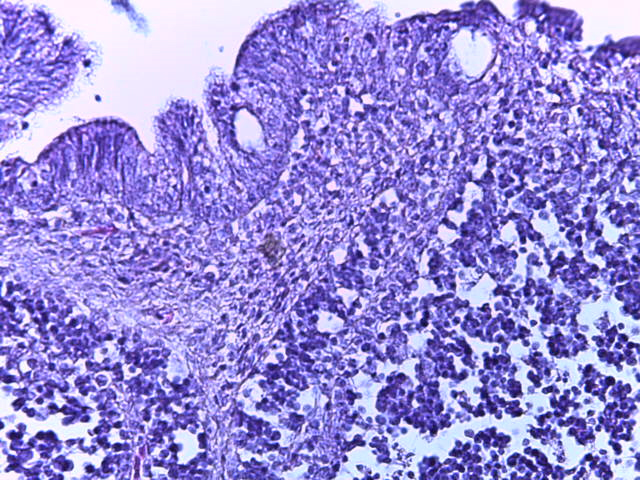
Рисунок 74 — Фабрициева бурса цыплят 1 опытной группы
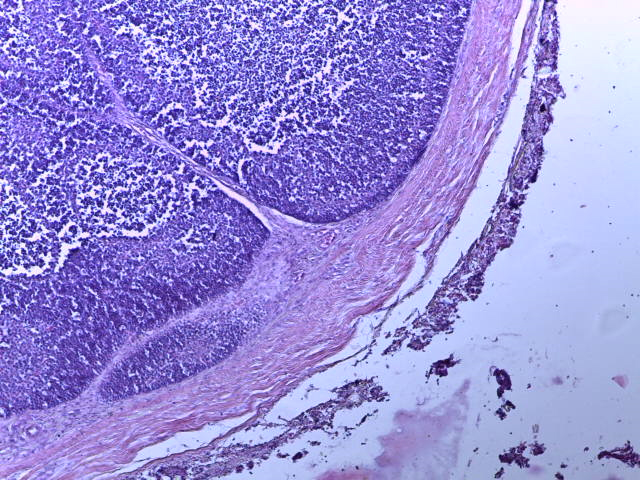
Рисунок 75 — Фабрициева бурса цыплят 1 опытной группы
2 опытная группа. В органе отмечены четко очерченные фолликулы с разделением на корковую и мозговую зоны (рис.76, увеличение 100), в некоторых фолликулах выражена активизация процесса иммуногенеза (рис.77, увеличение 400).
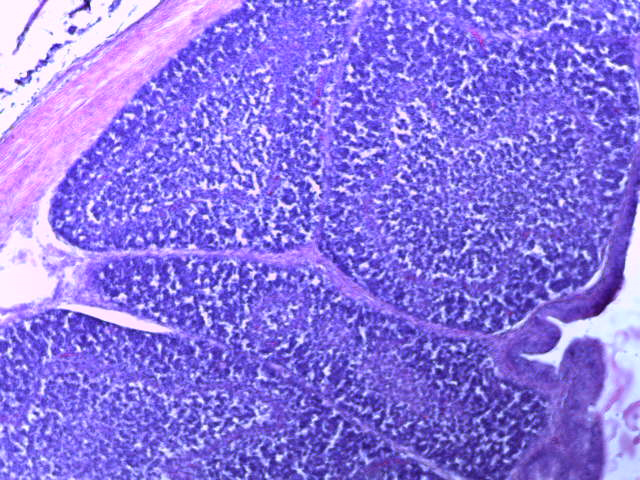
Рисунок 76 — Фабрициева бурса цыплят 2 опытной группы
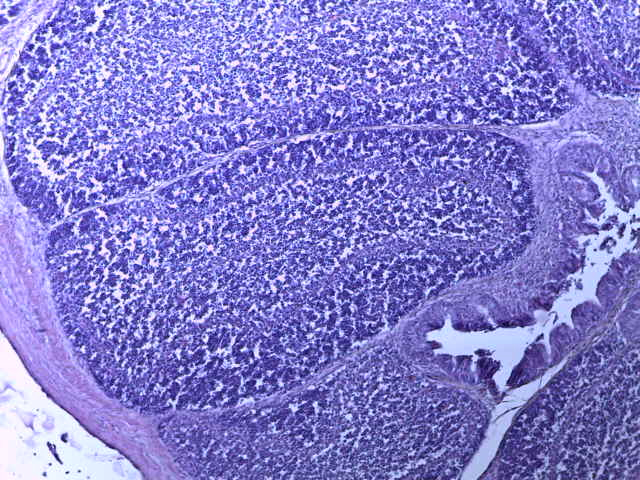
Рисунок 77 — Фабрициева бурса цыплят 2 опытной группы
3 опытная группа. Отмечено разрыхление и утолщение капсулы и наличие воспалительного инфильтрата под ней (рис.78, увеличение 200), в эпителии бурсы наблюдается воспалительный процесс с десквамацией эпителия в просвет бурсы (рис.79, увеличение 400).
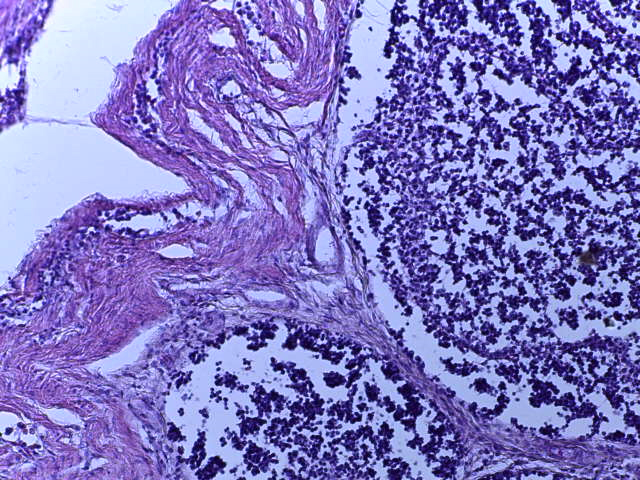
Рисунок 78 — Фабрициева бурса цыплят 3 опытной группы
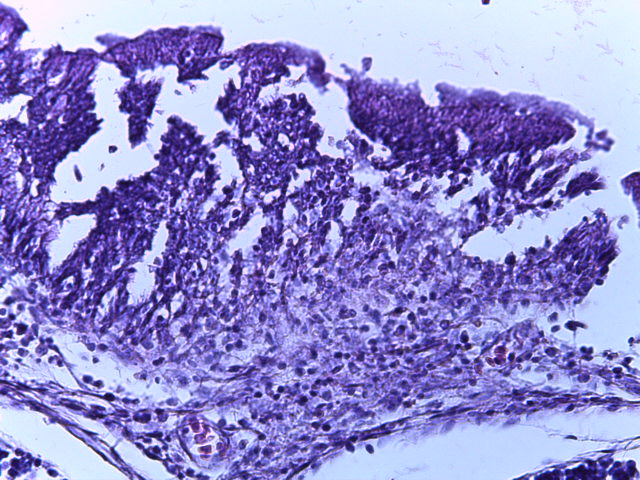
Рисунок 79 — Фабрициева бурса цыплят 3 опытной группы
Таким образом, анализ процессов, зарегистрированных на препаратах гистологических срезов печени, поджелудочной железы, двенадцатиперстной кишки, слепой кишки, селезенки, тимуса и фабрициевой бурсы от 37 дневных цыплят-бройлеров контрольной и трех опытных групп показал благополучие подопытного поголовья по инфекционным и паразитарным заболеваниям, высокие показатели по клеточному и гуморальному иммунитету.
Что касается обменных процессов, то наилучшие показатели были зарегистрированы во 2 опытной группе птиц, близкие к ним были показатели в 3 опытной группе. В 1 опытной группе наблюдались некоторые патологические процессы в печени в виде некроза и полиморфноклеточной инфильтрации, как очаговой, так и диффузной, на фоне зернистой дистрофии, характерной для гепатоза и гепатита, те же процессы отмечены и в контрольной группе цыплят-бройлеров. Секреторная активность поджелудочной железы была наиболее выраженной у представителей 2 опытной группы. Во всех группах птицы выявлены катаральные воспалительные процессы в кишечнике на стадии серозного и слизистого катара не переходящие в гнойный катар с сохранением функции пристеночного пищеварения.
Лимфоидные органы В-системы иммунитета птиц – селезенка, лимфоидные фолликулы кишечника, фабрициева бурса, и Т-системы иммунитета — тимус, к 37 дню выращивания, то есть к концу технологического периода, претерпели некоторые инволютивные процессы, но находились на высоком функциональном уровне, при этом наилучшие результаты показали представители 2 опытной группы.
3.2.12 Экономическая эффективность использования экспериментальных добавок на цыплятах-бройлерах
В таблице 21 представлены результаты экономической эффективности выращивания цыплят-бройлеров по данным научно-хозяйственного опыта в расчёте на 1000 голов начального поголовья.
Установлено, что в связи с увеличением валового прироста живой массы бройлеров в 1, 2 и 3 опытных группах при использовании экспериментальных кормовых добавок, стоимость прироста живой массы птиц возросла, по сравнению с контролем соответственно на 4,97; 4,42 и 10,56 тыс. рублей. Общие затраты в 1, 2 и 3 опытных группах с учетом затраченных денежных средств на покупку экспериментальных препаратов, были выше, чем в контроле, соответственно на 0,37; 0,37 и 1,03%. С учетом всех затрат полученный чистый доход в 1, 2 и 3 опытных группах был выше, чем в контроле на 5,9; 5,1 и 11,8%, соответственно. Дополнительный доход на 1 посаженную голову в 1 опытной группе составил 4,33 рубля; во 2 опытной группе – 3,78 рублей; в 3 опытной группе данный показатель был самым высоким и составил – 8,77 рублей.
Таблица 21 — Экономическая эффективность выращивания бройлеров в расчёте на 1000 голов начального поголовья (научно-хозяйственный опыт)
| Показатель | Группа | |||
| Контрольная | 1 опытная | 2 опытная | 3 опытная | |
| Среднее поголовье, гол | 987,0 | 987,0 | 987,0 | 1000,0 |
| Общий валовый прирост, кг | 2469,8 | 2519,6 | 2514,1 | 2575,4 |
| Стоимость прироста живой массы, тыс. руб. | 246,98 | 251,95 | 251,41 | 257,54 |
| Стоимость дополнительной продукции, тыс. руб. | — | 4,97 | 4,42 | 10,55 |
| Стоимость препарата, руб. | — | 636,6 | 645,0 | 1786,0 |
| Общие затраты, тыс. руб. | 172,89 | 173,53 | 173,53 | 174,67 |
| Чистый доход, тыс. руб. | 74,09 | 78,43 | 77,88 | 82,86 |
| Дополнительный доход на 1 посаженную голову, руб. | — | 4,33 | 3,78 | 8,77 |
| Рентабельность производства мяса бройлеров,% | 42,9 | 45,2 | 44,9 | 47,4 |
Рентабельность производства мяса бройлеров в 1 и 2 опытных группах, при использовании кормовых добавок ГербаСтор и ПроСтор, превысила контрольный уровень на 2,3 и 2,0 %. Наибольшее превосходство по этому показателю над контрольным значением — на 4,5%, было получено в 3 опытной группе, получавшей дополнительно к основному рациону кормовой препарат Активо.
4 ЭФФЕКТИВНОСТЬ ИСПОЛЬЗОВАНИЯ В РАЦИОНЕ ЯИЧНОЙ ПТИЦЫ ФИТОБИОТИЧЕСКИХ КОРМОВЫХ ДОБАВОК
4.1 МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЙ
Экспериментальная часть работы выполнялась в условиях птичника ПАО «Птицефабрика «Боровская» в 2020 году на молодняке и курах-несушках кросса «Хай-Лайн Браун» при их клеточном содержании с 14-недельного до 28-недельного возраста.
Технологические параметры содержания и кормления контрольной и опытной птицы соответствовали рекомендациям, принятым в ПАО «Птицефабрика «Боровская» для данного кросса.
Согласно схеме научно-хозяйственного опыта (табл. 22) в 14-недельном возрасте были сформированы 2 группы ремонтного молодняка со средней живой массой в контрольной группе 1262,01±6,94 г, в опытной — 1263,20±6,64 г. Формирование групп для научно-хозяйственного и физиологического опытов, а также научные основы исследования осуществлялись в соответствии с рекомендуемыми методиками ФНЦ «ВНИТИП» РАН (2013). При выращивании и содержании птицы использовали фазное кормление – с 14-ой по 24-ю недели и с 25-ой недели до конца опыта.
Таблица 22 — Схема проведения научно-хозяйственного опыта
| Группа | Количество
голов |
Условия кормления |
| Контрольная | 2100 | Основной рацион (ОР) — комбикорм с питательностью, соответствующей рекомендациям для кросса. |
| Опытная | 2100 | ОР + Активо в количестве 100 г/т комбикорма с 16-й по 21-ю недели жизни, в течение 42 дней; Активо Ликвид в количестве 500 мл/1000 л воды с 21-го недельного возраста, в течение 5 дней и с 24-х недельного возраста в течение 5 дней. |
Контрольная группа получала основной рацион (ОР), сбалансированный по всем питательным веществам согласно рекомендациям для кросса. Куры опытной группы дополнительно к ОР получали фитобиотическую капсулированную добавку Активо в количестве 100 г/т комбикорма с 16-ой по 21-ю неделю выращивания, в течение 42 дней и жидкую фитобиотическую добавку Активо Ликвид в количестве 500 мл/1000 л воды с 21-го недельного возраста, в течение 5 дней и с 24-х недельного возраста, в течение 5 дней.
В ходе эксперимента учитывались следующие зоотехнические показатели:
-
- Живая масса (г) – путем индивидуального взвешивания 203 кур еженедельно до 28 недель.
- Однородность по живой массе (%) – еженедельно до 28 недель жизни. Целевая однородность массы тела в стаде 80%, диапазон плюс/минус 10% от среднего значения.
- Сохранность поголовья (%) – путем ежедневного учета падежа с выяснением его причин и расчета в процентах от начального поголовья.
- Конверсия корма (кг) – затраты корма на 10 штук яиц путем деления количества израсходованного комбикорма за весь период опыта на количество полученной продукции.
- Яичная продуктивность за период опыта – путем ежедневного подсчета количества снесенных яиц, определения возраста снесения 1-го яйца и пика продуктивности.
- Интенсивность яйцекладки (%) – путем определения отношения количества яиц, снесенных за определенный период, к числу кормодней того же периода, выраженного в процентах.
- Масса яиц (г) – путем индивидуального взвешивания на электронных весах с точностью до 0,01 г за 5 смежных дней каждого продуктивного месяца по 30 штук яиц.
- Морфологические и биохимические показатели 30 яиц из каждой группы каждый продуктивный месяц.
В течение опыта проводились следующие исследования.
1. Оценка развития внутренних органов кур в ходе проведения анатомической разделки тушек птицы согласно методике ФНЦ «ВНИТИП» РАН (2013). Для этого в 24-х недельном возрасте было отобрано по 5 средних по живой массе кур из каждой группы. Убой проводился методом декапитации.
2. Определение переваримости питательных веществ, баланса азота, кальция и фосфора, на основании проведения балансового (физиологического) опыта. Для этого в возрасте 24-х недель из каждой группы были отобраны по 3 средних по живой массе курицы. Опыт проводился в соответствии с рекомендуемыми методиками ФНЦ «ВНИТИП» РАН (2013). Отобранный помёт и комбикорм гомогенизировался и анализировался в аналитической лаборатории «Уральский НИИСХ» — филиале ФГБНУ УрФАНИЦУрОРАН.
Анализ корма и помета проводили по общепринятым методикам:
— содержание общего азота – по методу Кьельдаля (или Дьякову), ГОСТ Р.51417-99 (%);
— содержание массовой доли сырого жира – методом экстракции, ГОСТ13496.15-97 (%);
— содержание массовой доли сырой клетчатки – удалением из продукта кислото-щелоче-растворимых веществ и определением сырой клетчатки, ГОСТ 13496.2-97(%);
— содержание сырой золы – гравиметрическим методом, ГОСТ 26226-95 (%);
— содержание кальция – атомно-абсорбционным методом, ГОСТ 26570-95 (%);
— содержание фосфора – фотометрическим методом, ГОСТ 26657-97 (%).
3. Анализ химического состава большеберцовых костей на содержание кальция, фосфора, сырой золы. Материал был взят от 5 птиц из каждой группы в возрасте 24-х недель.
4. Анализ морфологических показателей крови . Для этого в 24- недельном возрасте у 5 средних по группе кур, путем декапитации отбиралась кровь. При взятии кровь стабилизировали антикоагулянтом гепарином. В цельной крови определяли: содержание эритроцитов, средний объём эритроцита, ширину распределения эритроцитов, гематокрит, количество гемоглобина, среднее содержание гемоглобина в эритроците, содержание лейкоцитов (с визуальным подсчетом лейкоцитарной формулы: процентное содержание лимфоцитов, моноцитов, эозинофилов, псевдоэозинофилов, базофилов), количество тромбоцитов, СОЭ.
5. Анализ биохимического состава сыворотки крови кур в возрасте 24-х недель. Исследование включало определение: общего белка, альбуминов, мочевины, креатинина, мочевой кислоты, глюкозы, холестерина, триглицеридов, аланинаминотрансферазы (АЛАТ), аспартатамино-трансферазы (АСАТ), общего кальция, ионизированного кальция, неорганического фосфора, калия, натрия, хлора.
Исследование крови проводилось в лаборатории Университетской клиники ФГБОУ ВО Тюменского ГМУ Минздрава России. Морфологический анализ крови выполнялся на гематологическом анализаторе ВС-5800 MINDRAY (Китай), подсчет лейкоцитарной формулы осуществлялся с использованием микроскопа МС300 MICROS (Австралия). Биохимический анализ крови выполнялся на биохимическом анализаторе BS-380 MINDRAY (Китай) и ионселективном анализаторе ТОПАЗ (Россия).
6. Исследование микробиоценоза кишечника (дисбактериоз, с определением чувствительности к антибиотикам). Для этого в возрасте 24–х недель из каждой группы от 5 средних по живой массе кур отбиралось содержимое толстого отдела кишечника (слепых отростков) в специальные пробирки и отправлялось в микробиологическую лабораторию.
7. Для проведения морфогистологических исследований были взяты образцы органов (печень, поджелудочная железа, двенадцатиперстная кишка, селезенка, тимус, фабрициева бурса) от 3 голов птиц из каждой группы в возрасте 24-х недель. Материал фиксировался в 10-% растворе нейтрального формалина. Изучение общих структурных изменений в органах проводилось на парафиновых срезах, препараты окрашивали гематоксилином и эозином по общепринятой методике. Все гистологические исследования документировались фотографированием на микроскопе.
На основании результатов научно-хозяйственного опыта рассчитывалась экономическая эффективность использования изучаемых кормовых добавок с учетом цен на период проведения исследований.
Основные экспериментальные данные обработаны методом вариационной статистики с использованием ПК «Microsoft Excel». Оценку статистической значимости различий между группами проводили с помощью t-критерия Стьюдента.
4.2 РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
4.2.1 Зоотехнические показатели роста и развития яичных кур
Активный рост и развитие кур продолжается до 32-36 недель жизни. По физиологическим нормам, вступая в продуктивную фазу, птица должна набирать живую массу, соответствующую возрасту. Данный показатель оказывает большое влияние на массу и качество снесенных яиц.
Анализ динамики живой массы и однородности птицы кросса «Хай-Лайн Браун», представленный в таблице 23, показал, что, начиная с 19-недельного возраста — период разноса, живая масса опытных кур была ниже контрольных, при этом обе группы имели нормативную массу до 23-недельного возраста. В 24 недели жизни живая масса контрольных особей превышала норматив на 0,32%, а у опытных аналогов — уступала нормативному значению на 0,16%. С 25-недельного возраста и до конца анализируемого опытного периода (28 недель) куры-несушки контрольной и опытной групп не выполняли норматив по живой массе. Отставание опытных особей по данному показателю от контрольных аналогов с 25-й по 27-ю неделю находилось в пределах 0,06-0,28 %. При этом динамика набора живой массы до 27-недельного возраста была в обеих группах положительной. В 28 недель живая масса опытной птицы была ниже контроля на 1,78 % (Р≤0,01), что вероятно связано с более ранним и интенсивным выходом кур на пик продуктивности.
Однородность птицы обеих групп была выше норматива (80 %) на протяжении всего периода опыта. Снижение данного показателя в опытной группе в сравнении с нормативом отмечено на 18-й и 19-й неделе жизни, соответственно на 8,57 и 1,18 %, а в контрольной группе на 19-й неделе жизни – на 0,2%. Это можно объяснить тем, что в данный период содержания птица начинает быстро развивать яйцекладку и соответственно больше энергии тратит на продуктивность, в связи с чем повышается изменчивость по живой массе.
Таблица 23 — Динамика живой массы и однородности кур, М±m (n=203)
| Возраст,
недель |
Норматив по живой массе, г | Живая масса, г | Однородность
(N = 80%) |
||
| Контрольная группа | Опытная группа | Контрольная группа | Опытная группа | ||
| 15 | 1300 | 1339,12±7,20 | 1343,28±6,91 | 83,25 | 83,25 |
| 16 | 1370 | 1448,80±7,85 | 1415,84±6,86** | 81,77 | 82,76 |
| 17 | 1440 | 1504,58±8,16 | 1520,34±7,78 | 82,76 | 83,25 |
| 18 | 1520 | 1612,30±9,44 | 1641,33±10,53* | 80,78 | 71,43 |
| 19 | 1620 | 1750,74±9,92 | 1741,80±9,99 | 79,80 | 78,82 |
| 20 | 1680 | 1839,95±8,85 | 1795,76±9,64*** | 84,24 | 80,79 |
| 21 | 1720 | 1828,42±8,56 | 1803,84±9,03* | 86,21 | 82,76 |
| 22 | 1760 | 1835,07±9,18 | 1829,41±8,74 | 90,15 | 89,16 |
| 23 | 1800 | 1852,02±8,29 | 1830,64±7,97 | 87,19 | 91,13 |
| 24 | 1840 | 1845,96±8,24 | 1837,14±8,24 | 87,68 | 91,13 |
| 25 | 1852 | 1849,21±7,52 | 1843,89±7,09 | 92,12 | 94,09 |
| 26 | 1865 | 1851,92±7,11 | 1847,59±7,98 | 95,57 | 88,18 |
| 27 | 1877 | 1857,88±8,34 | 1856,70±6,84 | 87,19 | 94,58 |
| 28 | 1890 | 1867,00±7,86 | 1833,79±7,82** | 90,15 | 88,67 |
Примечание: степень достоверности *Р≤0,05; ** Р≤0,01; *** Р≤0,001 здесь и далее по сравнению с контролем
Таким образом, включение исследуемых фитобиотических кормовых добавок в рацион кур-несушек не оказало отрицательного влияния на живую массу и однородность птицы.
4.2.2 Сохранность поголовья
Несбалансированное кормление и неблагоприятные условия содержания являются причинами возникновения заболеваний органов пищеварения, яйцеобразования и других болезней незаразной этиологии. Сохранность и причины падежа птицы представлены в таблице 24. Введение изучаемых добавок в технологию содержания птицы характеризовалось более высокой сохранностью поголовья. Так, данный показатель превосходил контроль за опытный период — 14-28 недель жизни, на 0,26 %. При этом в период доращивания кур (14-20 недель) сохранность опытных птиц была выше на 0,08 %, а в продуктивный возраст (21-28 недель) – на 0,18 %.
Следует отметить, что в причинах падежа у кур опытной группы отсутствовали болезни органов желудочно-кишечного тракта (энтерит, отравления, воспаление сумки мускульного желудка¸ язвы желудка и пр.) и органов дыхания; меньший падеж зафиксирован по причинам: гепатит, истощение и перитонит, соответственно на 0,09; 0,06 и 0,03 %. Падежа по болезни органов яйцеобразования в группе кур, получавших фитобиотики, было меньше на 0,01%.
Таблица 24 – Сохранность и причины падежа кур, %
| Показатель | Группа | |
| Контрольная | Опытная | |
| Сохранность кур в период — 14-20 недель | 99,75 | 99,83 |
| Сохранность кур в период — 21-28 недель | 99,33 | 99,51 |
| Сохранность за весь период опыта –
14-28 недель |
99,08 | 99,34 |
| Причины падежа: % от начального поголовья | ||
| Болезни органов желудочно-кишечного тракта | 0,04 | — |
| Перитонит | 0,15 | 0,12 |
| Истощение | 0,25 | 0,19 |
| Гепатит | 0,28 | 0,19 |
| Болезни органов дыхания | 0,01 | — |
| Болезни органов яйцеобразования | 0,14 | 0,13 |
| Расклев | 0,01 | 0,01 |
| Травма | 0,04 | 0,02 |
Таким образом, результаты анализа сохранности поголовья и причин падежа птиц свидетельствуют, что исследуемые добавки способствуют повышению иммунного статуса и сопротивляемости организма к неблагоприятным факторам.
4.2.3 Развитие внутренних органов
Уровень физиологической скороспелости кур-несушек во время разноса яйцекладки оценивали по развитию внутренних органов и гребней в возрасте 24-х недель (табл.25). Для этого из каждой группы были отобраны по 5 голов птиц со средней живой массой.
Установлено, что у кур опытной группы масса печени была достоверно выше контроля на 12,53 % (Р≤0,05), масса мышечного желудка была меньше контрольного уровня на 4,08 %, а масса железистого желудка превышала контроль на 0,8%. Куры-несушки в опытной группе отличались большей массой пищевода и кишечника по сравнению с контрольной на 19,80 % и 0,07 % соответственно. При этом кишечник птиц, получавших фитодобавки, был длиннее такового у контрольных особей на 1,65 %. Наиболее развитыми у опытных кур оказались слепые отростки, превышающие контроль по массе на 27,59 % (Р≤0,05) и по длине на 8,41 %.
Таблица 25 – Развитие внутренних органов и гребня у кур-несушек в возрасте 24-х недель, М±m (n=5)
| Показатель | Группа | |
| Контрольная | Опытная | |
| Живая масса, г | 1845,20±2,99 | 1844,20±3,09 |
| Печень, г | 37,02±0,84 | 41,66±1,22* |
| % | 2,01 | 2,26 |
| Мышечный желудок, г | 26,00±0,81 | 24,94±1,14 |
| % | 1,41 | 1,35 |
| Железистый желудок, г | 5,98±0,31 | 6,02±0,22 |
| % | 0,32 | 0,33 |
| Пищевод, г | 3,94±0,19 | 4,72±0,31 |
| см | 17,20±0,56 | 16,84±0,52 |
| % | 0,21 | 0,26 |
| Кишечник, г | 82,28±2,88 | 82,34±2,28 |
| см | 163,80±5,60 | 166,50±2,78 |
| % | 4,46 | 4,46 |
| Яичник, г | 52,32±3,52 | 49,54±2,94 |
| % | 2,83 | 2,69 |
| Яйцевод, г | 60,72±2,97 | 58,26±1,46 |
| см | 77,30±1,97 | 80,60±1,63 |
| % | 3,29 | 3,16 |
| Слепой отросток, г | 3,19±0,23 | 4,07±0,12* |
| см | 18,30±0,25 | 19,84±0,72 |
| % | 0,17 | 0,22 |
| Высота гребня, см | 2,82±0,11 | 2,90±0,15 |
| % | 0,15 | 0,16 |
| Длина гребня, см | 5,64±0,30 | 5,56±0,20 |
| % | 0,30 | 0,30 |
В ходе анализа репродуктивных органов определено, что абсолютная масса яичников и яйцевода у контрольных кур была выше, чем у опытных аналогов на 5,61 и 4,22 % соответственно, при этом длина яйцевода превосходила контроль на 4,27 %. Оценка развития гребней кур — по высоте и длине, свидетельствовала о их полноценном, соответствующем возрасту развитии, в обеих подопытных группах.
Таким образом, сравнительный анализ состояния внутренних органов и гребней кур показал, что птицы обеих подопытных групп имели нормальное развитие и были физиологически готовы к полноценной яйцекладке. При этом, включение экспериментальных фитодобавок способствовало лучшему развитию печени и слепых отростков, о чем свидетельствует их достоверное превосходство по массе над контролем в пределах нормативных значений. У опытных кур отмечена тенденция большей массы пищевода и более высоких значений длины кишечника и яйцевода.
4.2.4 Яичная продуктивность кур-несушек
Яйценоскость – один из главных продуктивных и экономических показателей содержания промышленного стада кур-несушек, который в значительной степени обусловлен физиологическими процессами образования яйца, связанными с наследственной предрасположенностью, возрастом и условиями внешней среды. Показатели яичной продуктивности кур представлены в таблице 26.
Таблица 26 – Яичная продуктивность кур-несушек за период 18-28 недель жизни
| Показатель | Группа | |
| Контрольная | Опытная | |
| Возраст снесения 1-го яйца, дней | 113 | 114 |
| Возраст достижения 50-% продуктивности, дней | 139 | 140 |
| Пик продуктивности, % | 95,53 | 95,63 |
| Возраст достижения пика продуктивности, дней | 189 | 172 |
| Яйценоскость на начальную несушку, шт. (N – 56,3 яиц) | 53,18 | 52,73 |
| Яйценоскость на среднюю несушку, шт. (N – 56,6 яиц) | 56,07 | 55,14 |
| Расход корма на 10 штук яиц, кг
(N – 1,165 яиц) |
1,221 | 1,228 |
| Расход корма на голову, г
(N – 117,8 яиц) |
116,37 | 115,88 |
| Выбраковка загрязненного яйца, % | 5,13 | 5,03 |
| Выбраковка боя и насечки, % | 0,43 | 0,38 |
| Средняя масса яиц, г | 56,07 | 58,7 |
Примечание: N – норматив для кросса «Хай-Лайн Браун»
Сравнительный ежедневный учет яйценоскости кур в период с 18-ти по 28-ми недельный возраст показал, что контрольная птица, по сравнению с опытной, на один день раньше снесла 1-е яйцо и вышла на 50-процентную продуктивность. Однако, пика продуктивности раньше на 17 дней достигла опытная птица – в возрасте 172 дней, против 189 дней в контроле и он был выше на 0,1 %.
Отставание опытной группы по количеству снесенных яиц на начальную и среднюю несушку на 0,9 и 1,7% соответственно, а также повышение расхода корма на 0,007 кг на 10 штук яиц объясняется менее интенсивным разносом кур. При этом расход корма на голову в опытной группе был ниже, по сравнению с контрольным уровнем, на 0,49 г или 0,42 %. Обращают на себя внимание показатели качества яиц: загрязненных яиц в опытной группе было меньше, чем в контроле на 0,10 %, а яиц с поврежденной скорлупой (бой и насечка) – на 0,05 %.
Включение в рацион фитобиотических добавок способствовало повышению массы яиц в опытной группе на 4,7%.
Интенсивность яйцекладки (табл. 27) у кур опытной группы в целом за период — 18-28 недель жизни, была ниже, чем в контроле на 0,94 %, при этом стоит отметить, что более низким этот показатель был до 20-недельного возраста.
Таблица 27 – Интенсивность яйценоскости кур-несушек, %
| Возраст птицы, недель | Группа | |
| Контрольная | Опытная | |
| 18 | 0,52 | 0,52 |
| 19 | 4,34 | 5,23 |
| 20 | 36,47 | 27,76 |
| 21 | 71,68 | 67,56 |
| 22 | 87,10 | 86,96 |
| 23 | 91,64 | 92,75 |
| 24 | 93,15 | 93,85 |
| 25 | 93,87 | 94,49 |
| 26 | 94,31 | 95,17 |
| 27 | 94,12 | 95,28 |
| 28 | 95,14 | 95,36 |
| Интенсивность яйценоскости за период 18-28 недель, % | 95,3 | 94,36 |
Далее, начиная с 21-недельного возраста, опытная птица более интенсивно начала разноситься и на 28-й неделе жизни интенсивность яйценоскости у кур опытной группы опережала контроль на 0,22%. Кроме того, динамика яйценоскости у кур опытной группы была более равномерной (рис. 80). В контрольной же группе наблюдалось понижение яйценоскости в течение учетного периода: на 27-й неделе на 0,19%, по сравнению с показателем предыдущей 26-й неделей.
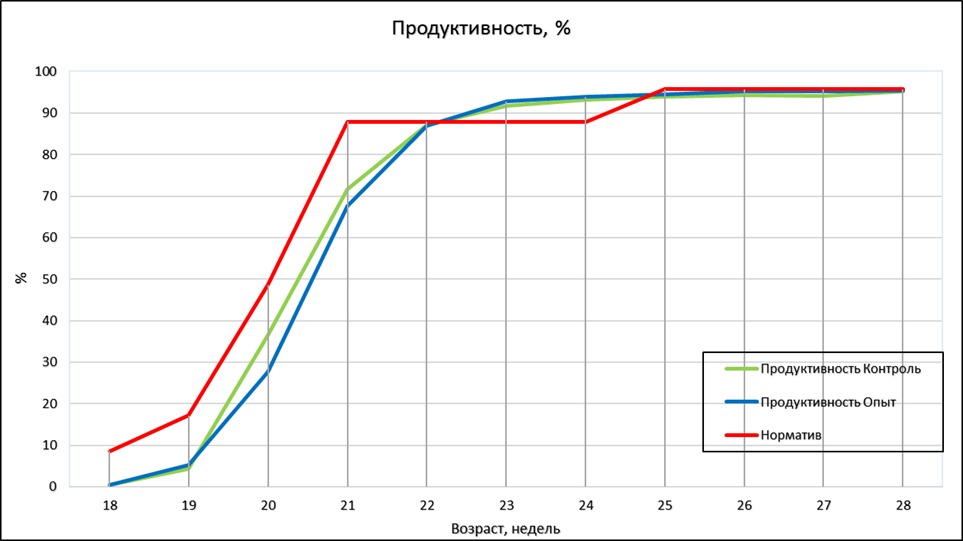
Рисунок 80 – Динамика интенсивности яйценоскости кур-несушек за период 18-28 недель
Резюмируя описанные результаты по яичной продуктивности, можно сделать вывод, что кормовые добавки Активо и Активо Ликвид имеют явный пролонгирующий эффект, который позволяет птице выдерживать высокий темп продуктивности, что не маловажно при длительном содержании кур-несушек яичных кроссов.
4.2.5 Морфологические и биохимические показатели яиц
Для оценки полноценности яиц в возрасте 24-х и 28-ми недель (каждый продуктивный месяц) исследовали по 30 яиц из каждой группы. Данные морфологического анализа яиц приведены в таблице 28.
Масса яиц является главным и первоначальным признаком для их классификации по стандарту и определения цены. При одинаковой яйценоскости количество яичной массы может быть различно, что отражается на выходе продукции и ее стоимости. Кроме того, масса яйца наряду с живой массой птицы, связана с оценкой однородности взрослого стада.
Установлено, что масса яиц опытной группы превышала контроль в 24-х и 28-ми недельном возрасте на 5,26 (Р≤0,01) и 3,32 % соответственно. При этом прочность скорлупы превосходила контроль на 0,72 и 1,73 % в те же периоды проверки.
Высота белка яиц кур контрольной группы в 24-недельном возрасте была больше, чем у опытных сверстников на 5,88 % (Р≤0,001) и соответственно, зависящая от данного показателя, единица ХАУ была больше на 4,41 % (Р≤0,001). В 28-недельном возрасте два этих показателя также были выше в контрольной группе, однако разница снизилась до 2,06 и 1,31 % соответственно, по сравнению с опытными значениями.
Таблица 28 – Морфологические показатели яиц кур-несушек, М±m (n=30)
| Показатель | Группа | |
| Контрольная | Опытная | |
| 24 недели | ||
| Масса яиц, г | 56,06±0,65 | 59,01±0,67** |
| Прочность скорлупы, Нт | 47,03±1,13 | 47,37±1,38 |
| Толщина скорлупы, мм | 0,35±0,00 | 0,36±0,00 |
| Высота белка, мм | 9,18±0,11 | 8,67±0,09*** |
| Единица ХАУ | 97,44±0,40 | 93,32±0,46*** |
| Кислотное число в желтке, мг КОН/г | 4,70±0,04 | 4,77±0,04 |
| рН белка | 9,07±0,08 | 9,08±0,05 |
| рН желтка | 6,37±0,06 | 6,28±0,09 |
| 28 недель | ||
| Масса яиц, г | 58,16±0,70 | 60,09±0,79 |
| Прочность скорлупы, Нт | 48,48±1,46 | 49,32±1,96 |
| Толщина скорлупы, мм | 0,37±0,00 | 0,36±0,00 |
| Высота белка, мм | 8,91±0,14 | 8,73±0,09 |
| Единица ХАУ | 94,61±0,71 | 93,39±0,47 |
| Кислотное число в желтке, мг КОН/г | 4,68±0,05 | 4,70±0,06 |
| рН белка | 9,30±0,07 | 9,00±0,06** |
| рН желтка | 5,97±0,10 | 6,37±0,08** |
Наряду с морфологическими показателями яиц оценивали и их биохимические параметры. Данные приведены в таблице 29. В желтке яиц опытных кур в возрасте 24-х недель наблюдалось большее содержание каротиноидов и витамина В2 на 46,93 (Р≤0,001) и 2,55 % соответственно по сравнению с контролем. В 28-недельном возрасте количество каротиноидов наоборот было большим в контрольных яйцах — на 11,52 % (Р≤0,01) по сравнению с опытным значением, а уровень витамина В2 превосходил контроль у опытных особей на 2,6%. Содержание витамина В2 в белке яиц подопытных кур в возрасте 24-х недель было практически на одном уровне, а в 28-ми недельном возрасте его количество у опытных птиц уступало контролю на 2,65 %.
Таблица 29 – Биохимические показатели качества яиц кур-несушек, М±m (n=30)
| Показатель | Группа | |
| Контрольная | Опытная | |
| 24 недели | ||
| Содержание в желтке, мкг/г: | ||
| каротиноиды | 15,00±0,17 | 22,04±0,85*** |
| витамин В2 | 5,10±0,11 | 5,23±0,10 |
| Витамин В2 в белке, мкг/г | 3,83±0,11 | 3,82±0,08 |
| Цвет желтка, по шкале Roche | 3,67±0,14 | 3,65±0,15 |
| 28 недель | ||
| Содержание в желтке, мкг/г: | ||
| каротиноиды | 27,00±0,69 | 24,21±0,42** |
| витамин В2 | 5,00±0,12 | 5,13±0,25 |
| Витамин В2 в белке, мкг/г | 3,78±0,06 | 3,68±0,08 |
| Цвет желтка, по шкале Roche | 4,02±0,08 | 3,84±0,13 |
Наиболее насыщенный цвет желтка по шкале Roche, особенно в 28-недельном возрасте, наблюдали в контрольной группе, превышение по сравнению с опытными аналогами составило 4,48 %.
4.2.6 Переваримость питательных веществ комбикорма
С целью изучения влияния кормовых добавок Активо и Активо Ликвид на переваримость и усвоение питательных веществ корма промышленной птицей в течение 3 дней был проведен балансовый опыт в возрасте 24-х недель жизни (табл.30).
Таблица 30 – Коэффициенты переваримости питательных веществ курами-несушками, % (n=3)
| Показатель | Группа | |
| Контрольная | Опытная | |
| Сухое вещество | 62,06 | 64,36 |
| Сырой протеин | 90,19 | 89,41 |
| Сырой жир | 44,65 | 57,68 |
| Сырая клетчатка | 14,35 | 31,73 |
| Безазотистые экстрактивные
вещества |
81,56 | 79,08 |
Переваримость сухого вещества в организме кур опытной группы была выше, чем контроле на 2,30 %. Переваримость сырого протеина птиц опытной группы незначительно уступала контрольной группе — на 0,78 %.
Введение в рацион изучаемых добавок Активо и Активо Ликвид способствовало существенному повышению переваримости сырого жира и сырой клетчатки у опытной птицы, по сравнению с контролем, на 13,03 и 17,38 % соответственно.
По переваримости безазотистых экстрактивных веществ куры опытной группы уступали особям контрольной группы на 2,48 %.
Таким образом, полученные в ходе физиологического опыта данные свидетельствуют о положительном влиянии изучаемых добавок на переваримость и усвоение питательных веществ корма.
4.2.7 Обмен энергии в организме кур-несушек
Потребность птицы в энергии складывается из затрат на поддержание жизни, затрат на синтез, транспорт и отложение веществ в продукцию и собственно энергии, отложенной в продукцию. Затраты энергии у птиц зависят от ее возраста, интенсивности обмена веществ, условий содержания, стресс-факторов и других внешних воздействий.
В таблице 31 представлены результаты исследований обмена энергии у птицы.
Таблица 31 – Баланс энергии в организме кур-несушек, МДж/гол в сутки (n=3)
| Показатель | Группа | |
| Контрольная | Опытная | |
| Валовая энергия корма (ВЭ) | 1,86 | 1,89 |
| Энергия помёта | 0,43 | 0,43 |
| % энергии помёта к валовой энергии | 23,12 | 22,75 |
| Обменная энергия, МДж/гол | 1,43 | 1,46 |
| % обменной энергии к валовой энергии корма | 76,88 | 77,25 |
Установлено, что дополнительное введение в рацион кур фитобиотических добавок по предлагаемым схемам способствовало повышению количества обменной энергии в организме птиц на 2,1%, по сравнению с контролем, при этом отношение обменной энергии к валовой энергии корма превысило контрольный уровень на 0,37%.
4.2.8 Обмен азота в организме птицы
Определение азота, отложенного в теле птицы, находится по разности поступившего количества и выделенного в помете. Данные по расчету баланса азота у кур представлены в таблице 32.
Таблица 32 – Баланс азота в организме кур-несушек, г на голову в сутки (n=3)
| Показатель | Группа | |
| Контрольная | Опытная | |
| Принято с кормом | 3,32 | 3,15 |
| Выделено в помете | 2,19 | 2,02 |
| Отложилось в теле | 1,13 | 1,13 |
| Использовано от принятого, % | 33,99 | 35,99 |
В обеих группах баланс азота был положительным. Потери азота в помете у кур, получавших Активо и Активо Ликвид, были ниже на 0,17 г. В результате среднесуточное использование азота в расчете от принятого с кормом в теле кур опытной группы было выше контроля на 2,00 %.
4.2.9 Обмен кальция и фосфора, минерализация костной ткани
Кальций и фосфор относятся к группе макроэлементов и выполняют в организме важные физиологические функции, связанные в основном с минеральным обменом. Недостаток или дисбаланс этих веществ нарушает минерализацию костяка птиц, что в свою очередь негативно сказывается на продуктивности и экономических показателях содержания.
Проведенный расчет баланса кальция (табл. 33) свидетельствует, что он был положительным.
Таблица 33 – Баланс кальция в организме кур-несушек, г на голову в сутки (n=3)
| Показатель | Группа | |
| Контрольная | Опытная | |
| Принято с кормом | 3,99 | 3,70 |
| Выделено в помете | 1,71 | 1,21 |
| Отложилось в теле | 2,28 | 2,48 |
| Использовано от принятого, % | 57,03 | 67,16 |
Потери кальция с помётом в опытной группе, по сравнению с контрольной группой, были ниже на 0,5 г, и как следствие, использование его в организме кур, получавших исследуемые добавки, было выше, чем в контроле на 10,13 %. Повышение использования кальция в организме опытных птиц согласуется с оценкой морфологических показателей яиц, свидетельствующей об увеличении толщины и прочности скорлупы, по сравнению с контролем.
Расчет баланса фосфора в организме кур показал (табл.34), что в обеих группах было малоэффективное использование данного макроэлемента от принятого, при этом у опытных птиц оно было выше контроля на 0,06 %.
Таблица 34 – Баланс фосфора в организме кур-несушек, г на голову в сутки (n=3)
| Показатель | Группа | |
| Контрольная | Опытная | |
| Принято с кормом | 0,621 | 0,578 |
| Выделено в помете | 0,616 | 0,573 |
| Отложилось в теле | 0,005 | 0,005 |
| Использовано от принятого, % | 0,80 | 0,86 |
Интенсивная эксплуатация кур-несушек обуславливает значительные изменения в их скелете. С обменом веществ в костной ткани тесно связана продуктивность кур. Скелет определяет потенциальные возможности несушки в смысле ее продуктивности. Химический состав большеберцовой кости кур в возрасте 24-х недель приведен в таблице 35.
Таблица 35 – Химический состав большеберцовой кости кур-несушек, % (n=5)
| Показатель | Группа | |
| Контрольная | Опытная | |
| Зола | 41,14±0,79 | 41,32±0,51 |
| Кальций | 29,20±0,49 | 31,60±1,17 |
| Фосфор | 14,21±1,16 | 15,80±1,01 |
Преимущество по содержанию золы, кальция и фосфора в большеберцовой кости было отмечено у птицы опытной группы. Так, количество золы было выше, по сравнению с контролем на 0,18 %, а содержание кальция и фосфора на 2,40 и 1,59 %.
4.2.10 Морфологический состав крови кур
Условия кормления и содержания, сезон года, порода и конституция, физиологическое состояние, уровень продуктивности влияют на состав и свойства крови. Морфологический состав крови кур-несушек представлен в таблице 36.
Результаты полученных исследований позволяют заключить, что основные морфологические показатели крови кур-несушек в 24-недельном возрасте находились в пределах физиологической нормы, но между группами по отдельным параметрам наблюдались различия. Так, количество эритроцитов в крови кур опытной группы превышало значение контрольных особей на 1,20 %, при этом средний объем эритроцитов был выше на 2,79%, а гематокрит (отношение красных клеток крови к ее общему объему) на 1,40 %. Ширина распределения эритроцитов в крови опытных кур была ниже 0,64 %, по сравнению с контрольной группой. Количество гемоглобина у кур, потреблявших фитопрепараты, было выше контроля на 5,34%, что сопровождалось повышением содержания гемоглобина в одном эритроците и средней концентрации гемоглобина в эритроците на 3,68 и 0,91%, данное обстоятельство может свидетельствовать об активизации окислительно-восстановительных процессов в организме птиц.
В ходе анализа общего количества лейкоцитов и лейкограммы крови кур отмечено, что у опытных особей было большее, по сравнению с контролем, содержание лейкоцитов — на 15,42%, меньший уровень лимфоцитов и эозинофилов – на 8,4 и 0,2%. Содержание моноцитов в крови контрольной и опытной птицы было на одном уровне и составляло 4,8%. Наблюдалась тенденция снижения у птиц, получавших экспериментальные препараты, количества псевдоэозинофилов на 2,2% по отношению к контролю.
Таблица 36 — Морфологический состав крови кур несушек, M±m (n=5)
| Показатель | Норма | Группа | |
| Контрольная | Опытная | ||
| Эритроциты, 1012/л | 3-4 | 2,51±0,09 | 2,54±0,05 |
| Средний объем эритроцита, фл | 136,12±2,83 | 139,90±1,64 | |
| Ширина распределения эритроцитов, % | 9,82±0,46 | 9,18±0,24 | |
| Гематокрит, % | 34,16±1,60 | 35,56±0,62 | |
| Гемоглобин, г/л | 80-120 | 104,80±4,28 | 110,40±2,58 |
| Среднее содержание гемоглобина в эритроците, пг | 41,82±0,66 | 43,36±0,38 | |
| Средняя концентрация гемоглобина в эритроците, г/л | 307,40±3,50 | 310,20±2,44 | |
| Лейкоциты,109/л | 20-40 | 12,00±0,61 | 13,85±0,70 |
| Лимфоциты, % | 52-60 | 85,60±2,06 | 77,20±6,25 |
| Моноциты, % | 2-7 | 4,80±1,16 | 4,80±1,11 |
| Эозинофилы, % | 6-10 | 2,20±0,37 | 2,00±1,00 |
| Псевдоэозинофилы, % | 24-30 | 7,00±0,55 | 4,80±1,77 |
| Базофилы, % | 1-3 | 0,40±0,24 | 2,20±0,58* |
| Тромбоциты, 109/л | 9,02±0,69 | 13,41±1,36* | |
| СОЭ, мм/час | до 5 | 3,40±0,51 | 2,00±0,00* |
Уровень базофилов в крови кур опытной группы достоверно превосходил контроль на 1,8% (P≤0,05), при этом находясь в пределах оптимальных референтных величин. Количество тромбоцитов у опытных особей достоверно превышало этот показатель в контроле на 48,67% (P≤0,05).
Скорость оседания эритроцитов у цыплят, задействованных в опыте, соответствовала нормативному уровню, при этом у птиц, в рацион которым вводили изучаемые кормовые средства, данный показатель был достоверно ниже на 41,2% (Р≤0,05).
Таким образом, дополнительное включение в рацион кур-несушек фитобиотических добавок Активо и Активо Ликвид не оказало отрицательного влияния на организм птицы, способствуя при этом активизации окислительно-восстановительных процессов, о чем свидетельствует увеличение количества эритроцитов и гемоглобина, и повышению защитных функций, естественной резистентности организма, что подтверждается умеренным возрастанием количества лейкоцитов, достоверным повышением базофилов и снижением скорости оседания эритроцитов, в пределах физиологических значений.
4.2.11 Биохимический состав крови кур
Биохимический состав крови экспериментальных кур-несушек представлен в таблице 37.
Таблица 37 — Биохимический состав крови кур-несушек, M±m (n=5)
| Показатель | Группа | |
| Контрольная | Опытная | |
| Общий белок, г/л | 46,40±1,67 | 49,68±1,70 |
| Альбумины, г/л | 16,98±0,33 | 17,88±0,09* |
| Мочевина, ммоль/л | 0,66±0,08 | 1,23±0,05*** |
| Креатинин, мкмоль/л | 26,40±1,17 | 33,80±0,86*** |
| Мочевая кислота, мкмоль/л | 214,40±10,70 | 191,00±30,12 |
| Глюкоза, ммоль/л | 14,48±0,29 | 12,51±0,36** |
| Холестерин, ммоль/л | 2,82±0,45 | 2,75±0,46 |
| Триглицериды, ммоль/л | 10,40±2,41 | 11,07±2,61 |
| АЛАТ, МЕ/мл | 13,44±1,05 | 7,16±0,62*** |
| АСАТ, МЕ/мл | 208,86±7,34 | 237,76±4,89* |
| Кальций общий, ммоль/л | 6,58±0,71 | 6,78±0,93 |
| Ионизированный кальций, ммоль/л | 1,50±0,03 | 1,46±0,03 |
| Неорганический фосфор, ммоль/л | 1,08±0,06 | 1,16±0,12 |
| Калий, ммоль/л | 4,04±0,11 | 4,11±0,04 |
| Натрий, ммоль/л | 155,20±1,24 | 157,22±0,37 |
| Хлор, ммоль/л | 112,84±0,91 | 112,60±0,81 |
У кур яйценоскость коррелирует с окислительными свойствами крови и интенсивностью роста. Установлена связь между белковым составом крови и жизнеспособностью, скороспелостью и яйценоскостью. Возможно прогнозирование яйценоскости по уровню кальция в сыворотке крови [122].
Включение в рацион несушек фитобиотиков по предложенным схемам способствовало повышению количества общего белка в сыворотке крови птиц на 7,07%, при этом уровень альбуминов был достоверно выше контроля на 5,30 % (Р≤0,05). Отмеченные изменения в белковом обмене у опытных птиц говорят об активизации белокобразующей функции печени, что имеет большое значение в период интенсивного образовании яйца.
Количество мочевины и креатинина в крови птиц, получавших добавки, достоверно превышало контрольный уровень на 28,03 и 86,36% (P≤0,001).
Содержание конечного продукта белкового обмена птиц – мочевой кислоты, у опытных кур было меньше, по сравнению с контрольными аналогами на 10,91 %, что свидетельствует о лучшем использовании белкового азота в организме и благоприятном состоянии печени, что в свою очередь подтверждается достоверным снижением на 46,73 % (Р≤0,001) содержания в сыворотке крови фермента АЛАТ.
Содержание АСАТ в крови опытных кур было достоверно выше контроля на 13,84%, что говорит о более высокой скорости физиологической регенерации клеток сердца, печени, почек и других органов в период интенсивной яйцекладки птиц под действием добавок.
Показательно, что в опытной группе кур, принимающих кормовые фитопрепараты, на пике продуктивности, с одной стороны снижается количество глюкозы и холестерина в крови, по сравнению с контролем на 13,60 % (Р≤0,01) и 2,48%, а с другой стороны, повышается уровень триглицеридов — необходимых компонентов яичного желтка, на 6,44 %.
Уровень большинства определяемых макроэлементов в сыворотке крови показал, что их содержание у птиц, получавших новые кормовые средства, был выше, чем у контрольных сверстников. Так, содержание общего кальция повысилось на 3,04%, неорганического фосфора – на 7,41%, калия – на 1,73%, натрия – на 1,3%.
Таким образом, фитобиотические добавки Активо и Активо Ликвид обладают стимулирующим действием на обменные процессы в организме кур-несушек. Об этом свидетельствует повышение интенсивности белкового обмена, выражающееся в возрастании уровня общего белка и снижении количества мочевой кислоты, а также катаболическая направленность углеводного обмена, характеризующегося достоверным снижением уровня глюкозы в крови, что вероятно обусловлено возрастанием энергетических потребностей организма птиц, в связи с более ранним их выходом, по сравнению с контрольными аналогами, на пик продуктивности и удержанием его на более высоком уровне.
4.2.12 Состояние микрофлоры толстого отдела кишечника кур
Микробиологическое исследование позволяет выявить нарушение видового состава и количественных соотношений микроорганизмов в норме заселяющих нижние отделы желудочно-кишечного тракта. У здоровой птицы нормальная микрофлора занимает главенствующее положение по количеству и активности, условно-патогенная проявляет весьма умеренную активность, а патогенная присутствует только в малых концентрациях. Однако, при введении в рацион кормов низкого качества, загрязненных микотоксинами, частой смене рационов, заболеваемости, снижении иммунитета, нарушении условий содержания, стрессовых факторах, условно-патогенная и патогенная микрофлора начинают получать конкурентное преимущество.
Результаты анализов содержимого толстого отдела кишечника кур в возрасте 24-х недель представлены в таблице 38.
Таблица 38 — Микробиологические исследования толстого отдела кишечника кур в возрасте 24-х недель, n=5
| Показатель | Норматив | Группа | |
| Контрольная | Опытная | ||
| Патогенные микроорганизмы | |||
| Шигеллы
(Shigella spp.), КОЕ/мл |
н/о | н/о | н/о |
| Сальмонеллы
(Salmonella spp.), КОЕ/мл |
н/о | н/о | н/о |
| Кампилобактеры (Campylobacter spp),
КОЕ/мл |
н/о | н/о | н/о |
| Диарогенные
эшерихии, КОЕ/мл |
н/о | н/о | н/о |
| Иерсинии
(Yersinia spp), КОЕ/мл |
н/о | н/о | н/о |
| Bacillus cereus,
КОЕ/мл |
н/о | н/о | н/о |
| Аэромонас
(Aeromonas spp), КОЕ/мл |
н/о | н/о | н/о |
| Плезиомонас
(Plesiomonas spp), КОЕ/мл |
н/о | н/о | н/о |
| Потенциально-патогенная флора | |||
| Энтеробактерии
Клебсиелла (Klebsiella spp), КОЕ/мл |
менее
104 |
н/о | н/о |
| Протей (Proteus
spp) — Proteus mirabilis, КОЕ/мл |
менее
104 |
н/о | н/о |
| Энтеробактер
(Enterobacter spp), КОЕ/мл |
менее
104 |
н/о | н/о |
| Серрация
(Serratia spp), КОЕ/мл |
менее
104 |
н/о | н/о |
| Прочие,
КОЕ/мл |
менее
104 |
н/о | н/о |
| Неферментирующие грамотрица-
тельные палочки Синегнойная Палочка (Pseudomonas aeruginosa), КОЕ/мл |
менее
103 |
н/о | н/о |
| Ацинетобактер
(Acinectobacter spp), КОЕ/мл |
менее
103 |
н/о | н/о |
| Прочие
Bacillus spp, КОЕ/мл |
менее
103 |
1 образец – 105
3 образца – 104 1 образец – 103 |
2 образца – 106
2 образца – 104 1 образец – 103 |
| Грамположительные
кокки Золотистый Стафилококк (S. aureus), КОЕ/мл |
менее
102 |
н/о | н/о |
| Прочие –
Staphylococcus Saprophyticus, КОЕ/мл |
105-107 | 1 образец – 105
2 образца – 104 1 образец – 102 |
4 образца – 103
1 образец – 102 |
| Грибковая флора
Candida sp., КОЕ/мл |
менее 103 | 1 образец — 105
2 образца – 104 |
1 образец – 107 |
| Geotrichium spp., КОЕ/мл | менее 103 | 1 образец – 104 | 1 образец – 104 |
| Прочие —
Trichosporon Asahii, КОЕ/мл |
менее 103 | н/о | н/о |
| Нормальная флора | |||
| Бифидобактерии,
КОЕ/мл |
1010-1011 | 3 образца – 1010
2 образца – 109 |
5 образцов – 109 |
| Лактобактерии,
КОЕ/мл |
106-107 | 2 образца – 107
3 образца – 106 |
4 образца – 107
1 образец – 105 |
| Лактострептококки,
КОЕ/мл |
н/о | 1 образец – 107
1 образец – 106 3 образца – <105 |
|
| Кишечная палочка (номофлор), КОЕ/мл | 106-108 | 4 образца – 107
1 образец – 105 |
2 образца – 107
2 образца – 106 1 образец – 104 |
| E.coli лактозонегативные (Escherichia coli inactivae), КОЕ/мл | менее 105 | н/о | 1 образец – 106 |
| E.coli гемолитические (Escherichia coli haemolytic), КОЕ/мл | н/о | 2 образца – 106 | н/о |
| Энтерококки
Enterococcus, КОЕ/мл |
105-107 | 1 образец – 106
4 образца – 105 |
2 образца – 106
3 образца – 105 |
| Клостридии
Clostridium, КОЕ/мл |
≤105 | 4 образца – >105
1 образец – <105 |
4 образца – >105
1 образец – <105 |
| Патогенные бактерии (кампилобактер) | |||
| Campylobacter jejuni
|
н/о | н/о | н/о |
| Campylobacter coli
|
н/о | н/о | н/о |
Установлено, что в содержимом толстого отдела кишечника у кур обеих групп отсутствовали патогенные микроорганизмы.
При сравнении наличия условно-патогенной микрофлоры в слепых отростках птиц, отмечено меньшее количество у опытных особей стафилококков. Так, в 4 опытных образцах содержание данных микроорганизмов составляло 103 КОЕ/мл и в 1 образце – 102 КОЕ/мл, в тоже время, в контроле, в 1 образце их содержалось 105 КОЕ/мл, в 2-х образцах – 104 КОЕ/мл и в 1 образце – 102 КОЕ/мл. Грибковая флора Candida sp. в опытной группе была обнаружена только в одном образце — в количестве 107 КОЕ/мл, а в контрольной группе — в 3-х образцах (1 образец — 105, 2 образца – 104). Повышение дрожжеподобных грибов этого рода может свидетельствовать о снижении иммунной защиты организма и низком значении рН.
Анализ нормальной флоры толстого отдела кишечника свидетельствовал о снижении количества бифидобактерий у представителей опытной группы и повышении количества лактобактерий по сравнению с контрольной группой. Кроме того, наблюдали отсутствие в контрольной группе лактострептококков и E.coli лактозонегативных. В опытной группе лактострептококки присутствовали в следующем количестве: 1 образец – 107, 1 образец – 106 и 3 образца – <105. E. coli лактозонегативные у опытных особей были обнаружены в одном образце в количестве 106.
В отношении E. coli гемолитических наблюдалась противоположная картина: в контрольной группе они были обнаружены в 2 образцах в количестве 106 КОЕ/мл, а в опытных образцах, они не были выявлены. Присутствие гемолитической кишечной палочки требует иммунокоррекции, т.к. может вызвать кишечные проблемы при малейшем ослаблении иммунитета у птиц.
Следовательно, включение в рацион кур промышленного стада фитобиотических препаратов не оказало отрицательного воздействия на состояние микробиоценоза несушек.
4.2.13 Морфо-гистологическое состояние внутренних органов кур
Гистологическое исследование, является методом диагностики заболевания на тканевом уровне, исследование под микроскопом специально подготовленного участка патологической ткани позволяет получить представление о сути и выраженности патологического процесса, выявить его особенности, определить нарушение функций, структуры исследуемых тканей.
Печень контрольных кур
На рисунке 81 в первом образце наблюдается умеренный отек стромы, полнокровие центральных вен, очаговые кровоизлияния в ткани печени, преимущественно вокруг центральных вен. Гепатоциты неправильной и округлой формы формируют хорошо различимые септы. Отмечены группы гепатоцитов с признаками белковой дистрофии.
Рисунок 81 — Срез печени 1 контрольной курицы. Ув.100
Во втором образце, представленном на рисунке 82, балки хорошо выражены, синусоиды визуализируются, на отдельных участках расширены, полнокровны.
Рисунок 82 — Срез печени 2 контрольной курицы. Ув. 200
В третьем образце (рис. 83) балки хорошо выражены, синусоиды визуализируются, присутствует очаговое полнокровие центральных вен.
Рисунок 83 — Срез печени 3 контрольной курицы. Ув. 200
Печень опытных кур
На рисунке 84 показан первый образец, на котором видно, что гепатоциты расположены немного хаотично, синусоиды узкие, присутствует венозное полнокровие.
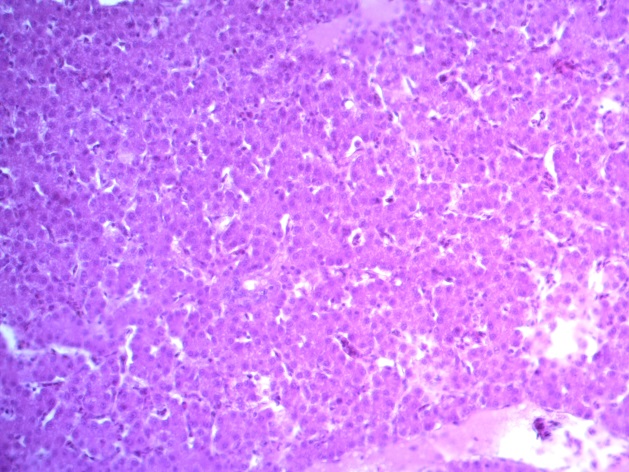
Рисунок 84 — Срез печени 1 опытной курицы. Ув. 100
Во втором образце (рис. 85) отдельные гепатоциты были с пенистой или зернистой цитоплазмой. Отмечено полнокровие центральных вен и перицентральных синусоидов.
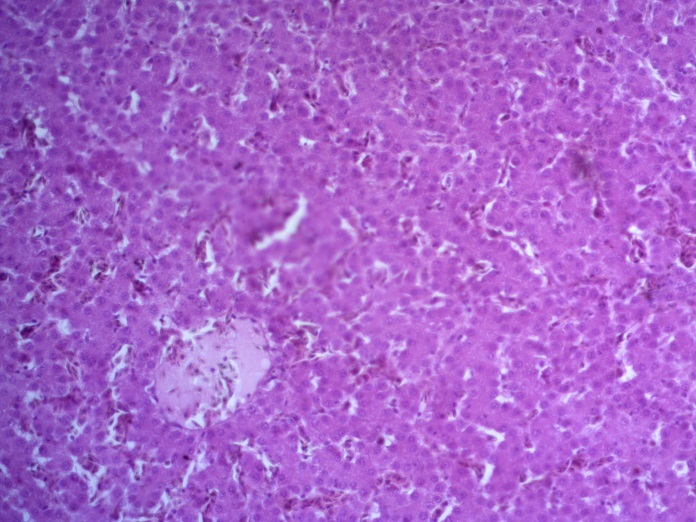
Рисунок 85 — Срез печени 2 опытной курицы. Ув. 100
Третий образец (рис. 86, 87) характеризует очаговое полнокровие центральных вен.
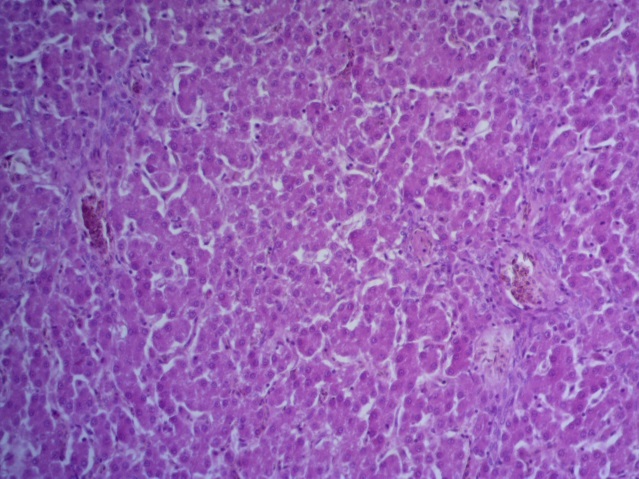
Рисунок 86 — Срез печени 3 опытной курицы. Ув. 200
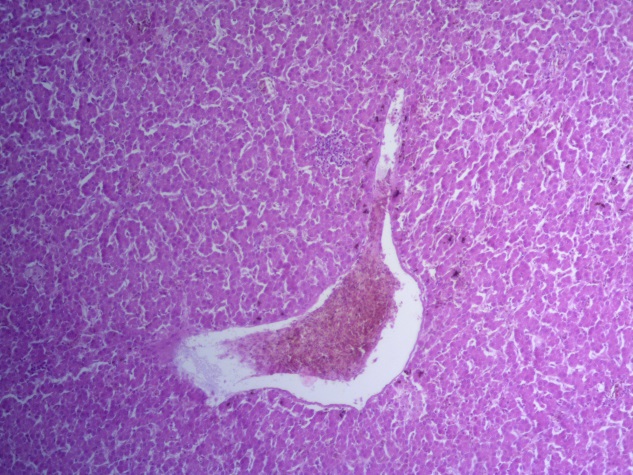
Рисунок 87 — Срез печени 3 опытной курицы. Ув. 200
Поджелудочная железа контрольных кур
На рисунке 88 отображен срез первого образца. Ткань железы слабодольчатая, септы очень тонкие. Немногочисленные капилляры полнокровны. Ацинарные клетки с оксифильной цитоплазмой и базофильным базально расположенным ядром, ядра части клеток светлые пузырьковидные. Цитоплазма с хорошо выраженной эозинофильной зернистостью. Островки Лангерганса распределены неравномерно, мелкие округлой и овоидной формы. Клетки островков с бледно-оксифильной цитоплазмой и светлым ядром.
Рисунок 88- Срез поджелудочной железы 1 контрольной курицы. Ув.100
Во втором срезе (рис. 89) ткань железы дольчатая, септы хорошо развиты, содержат полнокровные капилляры. Островки Лангерганса распределены неравномерно (парно) мелкие, преимущественно овоидной формы.
Рисунок 89 — Срез поджелудочной железы 2 контрольной курицы. Ув.100
На третьем образце (рис. 90) септы представлены отечной соединительной тканью. Островки Лангерганса разновеликие с исчезновением базофилии ядер. Капилляры развиты умеренно, полнокровны.
Рисунок 90 — Срез поджелудочной железы 3 контрольной курицы. Ув.100
Поджелудочная железа опытных кур
В первом образце (рис. 91) ткань железы слабодольчатая, септы очень тонкие, представлены отечной зрелой соединительной тканью. Ацинарные клетки с оксифильной цитоплазмой и базофильным базально расположенным ядром, ядра части клеток светлые пузырьковидные. Отдельные клетки ацинусов с хорошо выраженной эозинофильной зернистостью в цитоплазме. Островки Лангерганса распределены неравномерно, мелкие округлой и овоидной формы. Капилляры единичные.
Рисунок 91 — Срез поджелудочной железы 2 опытной курицы.Ув. 100
Во втором образце (рис. 92) видно, что ткань дольчатая, септы расширены за счёт отека. Ацинусы без особенностей. Островки Лангерганса единичные, очень мелкие, неправильной формы.
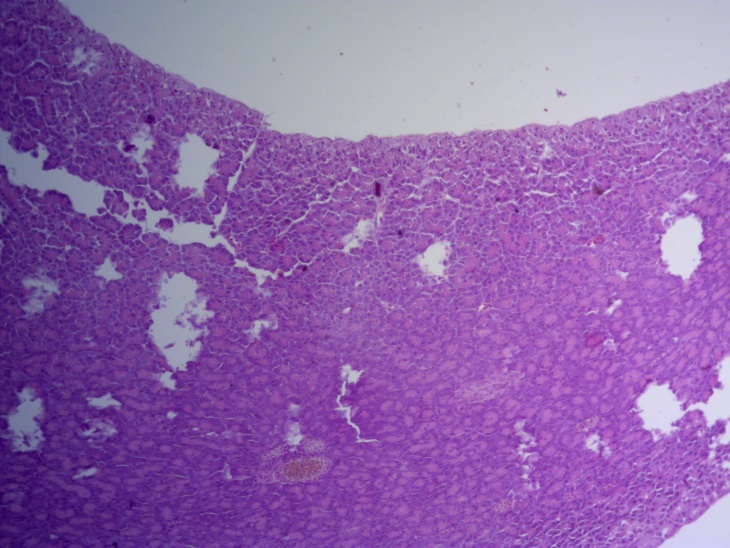
Рисунок 92 — Срез поджелудочной железы 2 опытной курицы. Ув. 100
На рисунке 93 в третьем срезе наблюдается строма железы с очаговым отеком. Выводные протоки выстланы кубическим эпителием, просвет свободен. Островки Лангерганса распределены неравномерно, мелкие, округлой формы и неправильной формы (имеют «лопасти»), отдельные островки формируют мелкие скопления – от 2 до 3. Клетки островков с нежной эозинофильной цитоплазмой, отдельные клетки с гиперхромными ядрами. Капиллярная сеть в островках и железе развита хорошо.
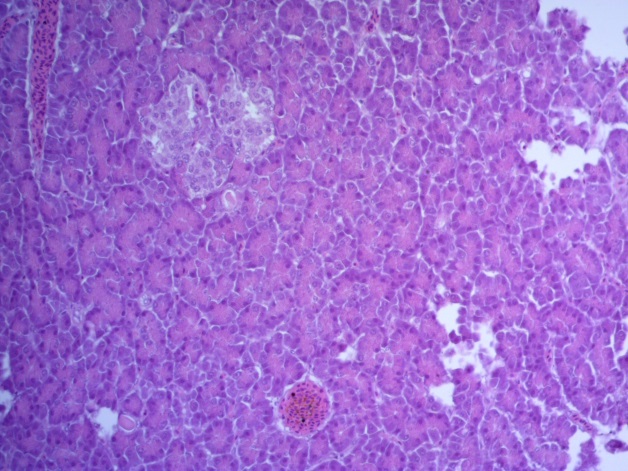
Рисунок — 93 Срез поджелудочной железы 3 опытной курицы.Ув. 100
12-перстная кишка контрольных кур
Здоровый кишечник обеспечивает надежный иммунный ответ и барьер против патогенов, токсинов и других вредных веществ. Нарушение здоровья кишечника отрицательно сказывается на усвоении питательных веществ корма, приводит к ослаблению иммунного ответа, замедлению роста, нарушению однородности стада, снижению яйценоскости.
Проведенный гистологический анализ 12-перстной кишки показал, что в первом образце (рис. 94) между поперечным и продольным слоями гладких миоцитов стенки присутствуют группы адипоцитов. Крипты расположены тесно, выстилающий эпителий высокий призматический, ядра расположены в несколько рядов, встречаются фигуры митозов в среднем 1-2 на крипту. Бокаловидные клетки в криптах немногочисленные. В строме между криптами выраженная диффузная мононуклеарная инфильтрация. Ворсины деструированы, гистологическая структура не прослеживается. В просвете кишки клеточный детрит из десквамированного призматического эпителия и лейкоцитов.
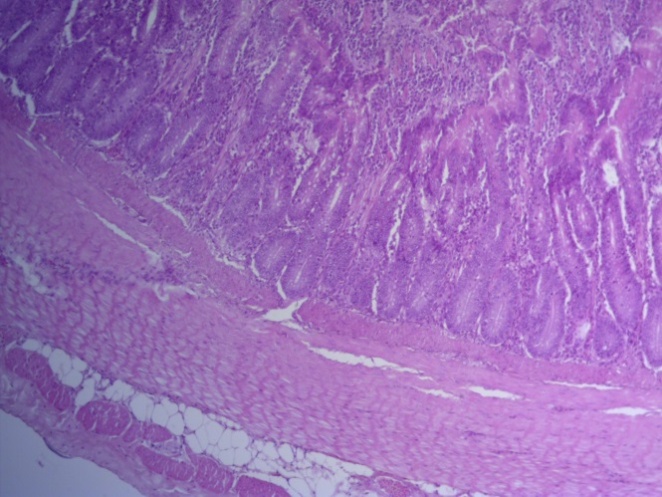
Рисунок 94 — Срез 12-перстной кишки 1 контрольной курицы. Ув. 100
Во втором контрольном образце наблюдали (рис. 95) гладкие миоциты стенки с дистрофическими изменениями. Крипты различной глубины, просвет большинства крипт не определяется, в эпителии отдельных крипт апикально крупные вакуоли. В строме неравномерно выраженная диффузная преимущественно лимфо-плазмоцитарная инфильтрация. Ворсины пальцевидные, широкие, на большем протяжении деструированы.
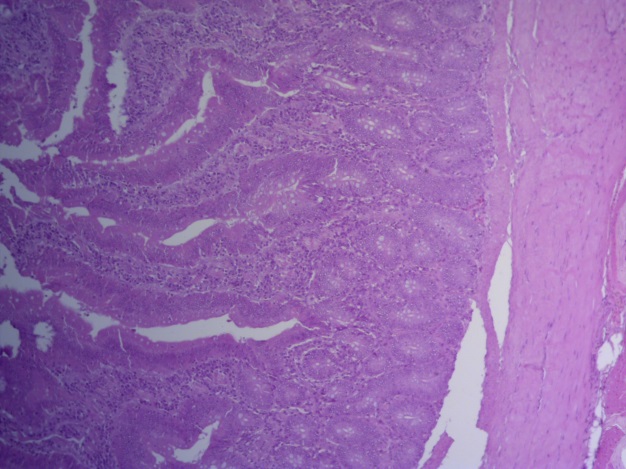
Рисунок 95 — Срез 12-перстной кишки 2 контрольной курицы.Ув. 100
В третьем срезе (рис. 96) мышечная стенка неравномерной толщины, часть крипт разрушена. В строме диффузная, от умеренной до выраженной мононуклеарная, инфильтрация (больше выраженная в строме деструированных ворсин).
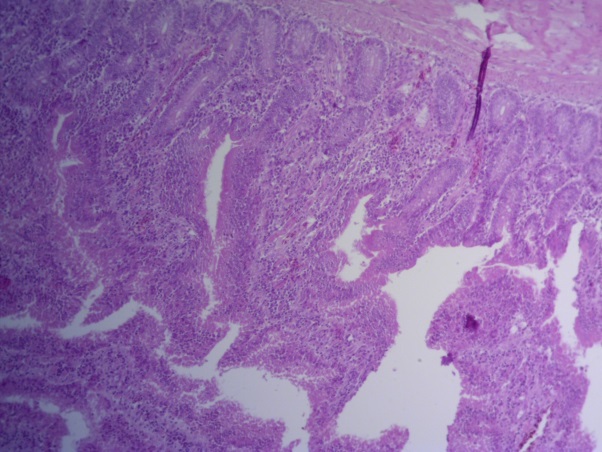
Рисунок 96- Срез 12-перстной кишки 3 контрольной курицы. Ув.100
12-перстная кишка опытных кур
На первом образце (рис. 97, 98) видно, что гладкие миоциты стенки представлены с исчезновением базофилии ядер и оксифильной зернистостью цитоплазмы. Крипты расположены тесно, выстилающий эпителий высокий призматический, ядра расположены в несколько рядов, встречаются фигуры митозов в среднем 1-2 на крипту. Ворсины деструированы, гистологическая структура не прослеживается. В просвете кишки клеточный детрит из десквамированного призматического эпителия и лейкоцитов.
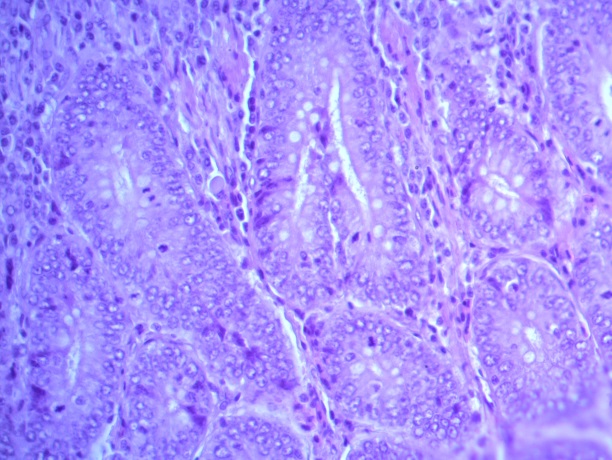
Рисунок 97 — Срез 12-перстной кишки 1 опытной курицы.Ув. 100
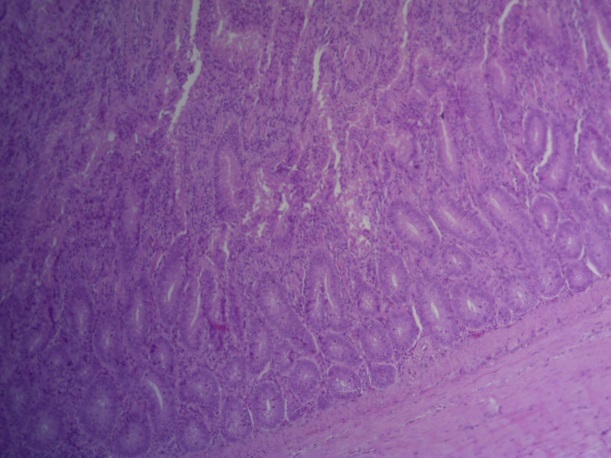
Рисунок 98 — Срез 12-перстной кишки 1 опытной курицы.Ув. 200
Во втором срезе наблюдали (рис. 99) гладкие миоциты стенки с исчезновением базофилии ядер и оксифильной зернистостью цитоплазмы. Эпителий крипт с умеренной митотической активностью. Гистоархитектоника ворсин нарушена: ворсины утолщены, в строме дистрофически измененные миоциты. Покрывающий призматический эпителий с неразличимыми границами клеток, кариопикноз, кариорексис.
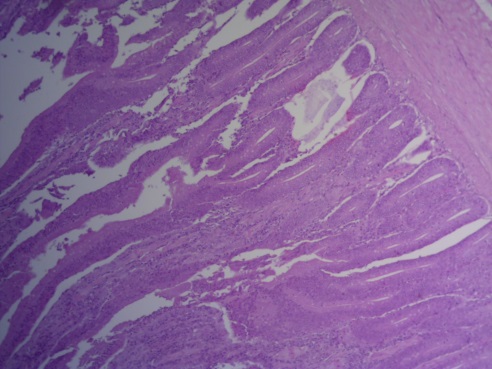
Рисунок 99 — Срез 12-перстной кишки 2 опытной курицы.Ув. 200
В третьем образце (рис. 100) гладкие миоциты стенки были с исчезновением базофилии ядер и оксифильной зернистостью цитоплазмы. Крипты деформированы, эпителий с умеренно выраженными пролиферативными изменениями. Ворсины деструированы, представлены бесструкрурными массами с включением групп клеток призматического эпителия, гладких миоцитов и лейкоцитов.
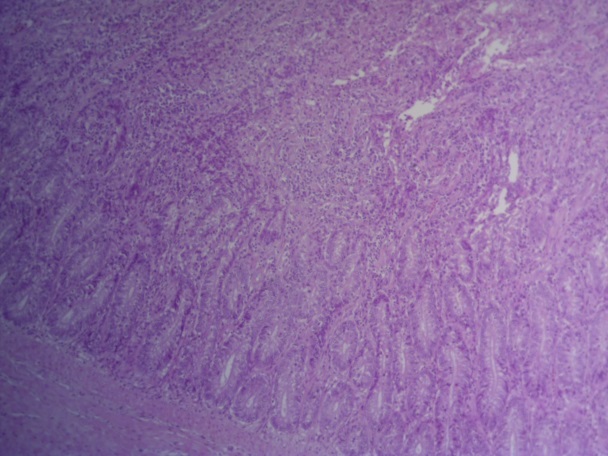
Рисунок 100 — Срез 12-перстной кишки 3 опытной курицы. Ув. 100
Наряду с гистологическим анализом двенадцатиперстной кишки была проведена оценка её морфометрических показателей (табл.39)
Таблица 39 — Морфометрические показатели 12-перстной кишки кур-несушек, М±m (n=3)
| Показатель | Группа | |
| Контрольная | Опытная | |
| Толщина мышечной стенки, мкм | 59,94±1,64 | 61,49±8,64 |
| Глубина крипт, мкм | 73,84±3,80 | 76,85±5,86 |
| Высота ворсин, мкм | 174,80±7,81 | 225,71±8,20** |
Установлено, что разница в толщине мышечной стенки 12-перстной кишки и глубине крипт между опытной и контрольной группами была незначительной, составив соответственно 2,59 и 4,08%, в сторону увеличения у опытных несушек. Включение фитобиотических добавок в рацион кур способствовало достоверному повышению высоты ворсинок по отношению к контролю на 29,12 % (Р≤0,01), что свидетельствует об увеличении всасывающей площади слизистой тонкой кишки и согласуется с данными балансового опыта, демонстрирующего повышение переваримости жира, использования азота, кальция и фосфора.
Толстая кишка (слепые отростки) контрольных кур
В первом срезе (рис.101) отмечены группы адипоцитов в подслизистой. Крипты неглубокие. В подслизистой, большое количество лимфоцитов, в том числе единичные среди эпителиоцитов.
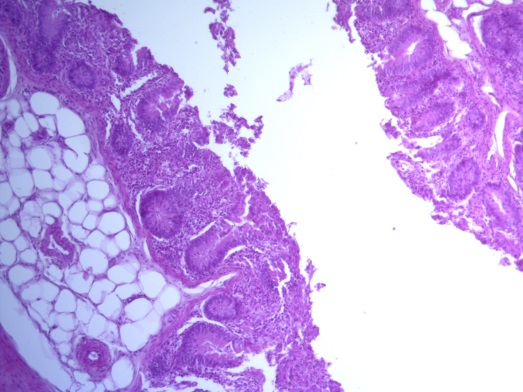
Рисунок 101 — Срез толстой кишки 1 контрольной курицы. Ув.100
Второй контрольный образец представлен на рисунках 102 и 103. Наблюдали группы адипоцитов в подслизистой. Крипты неглубокие. В подслизистой большое количество лимфоцитов, в том числе среди эпителиоцитов. Ворсины деструированы, в просвете кишки клеточный детрит.
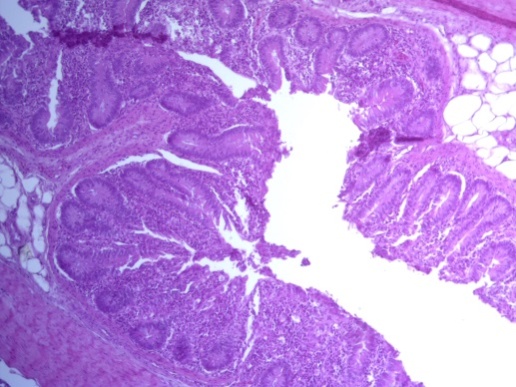
Рисунок 102 — Срез толстой кишки 2 контрольной курицы. Ув.100
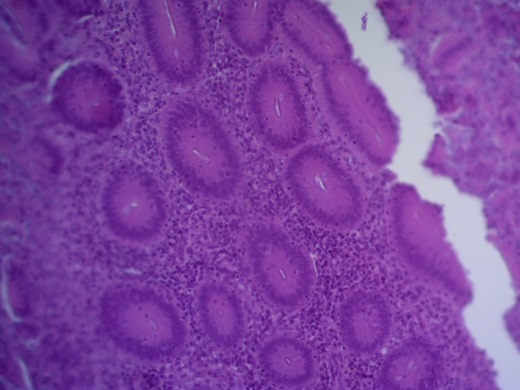
Рисунок 103 — Срез толстой кишки 2 контрольной курицы. Ув. 200
В третьем образце (рис. 104) подслизистая отечна с большим количеством адипоцитов и толстостенными запустевшими сосудами. На отдельных участках неравномерно выраженная мононуклеарная инфильтрация с преобладанием лимфоцитов, на отдельных участках с формированием скоплений лимфоидных клеток. Под собственной пластинкой слизистой оболочки визуализируются скопления лимфоидных клеток, формирующих подобие солитарных фолликулов.
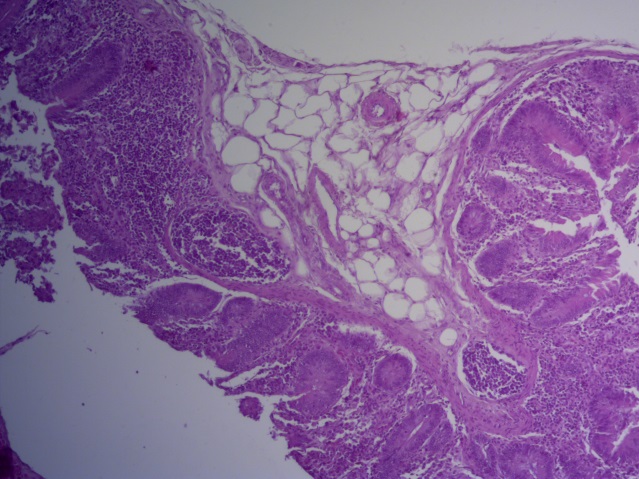
Рисунок 104- Срез толстой кишки 3 контрольной курицы. Ув. 100
Толстая кишка (слепые отростки) опытных кур
В первом образце (рис. 105) гистоархитектоника органа была сохранена, в подслизистой наблюдались скопления адипоцитов. Между криптами отмечена неравномерно выраженная мононуклеарная инфильтрация, единичные лимфоциты среди эпителиоцитов крипт.
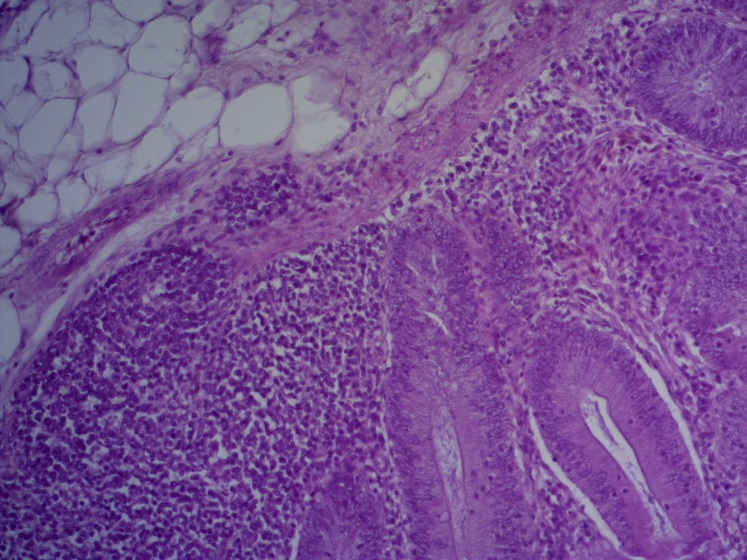
Рисунок 105 — Срез толстой кишки 1 опытной курицы.Ув. 200
Во втором образце, представленном на рисунке 106, крипты в подслизистой распределены неравномерно, различной высоты, между криптами немногочисленные лимфоциты.
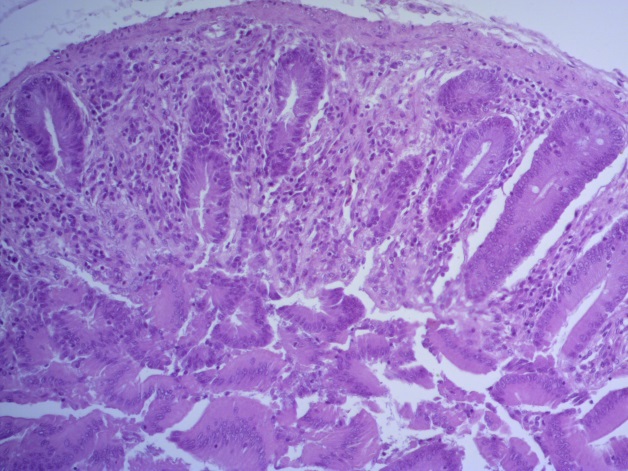
Рисунок 106 — Срез толстой кишки 2 опытной курицы.Ув. 100
В третьем образце на рисунке 107 собственная пластинка слизистой оболочки представлена рыхлой соединительной тканью с большим количеством клеток лимфоидного ряда. Под ней мелкие скопления адипоцитов и лимфоидные скопления по типу солитарных фолликулов.
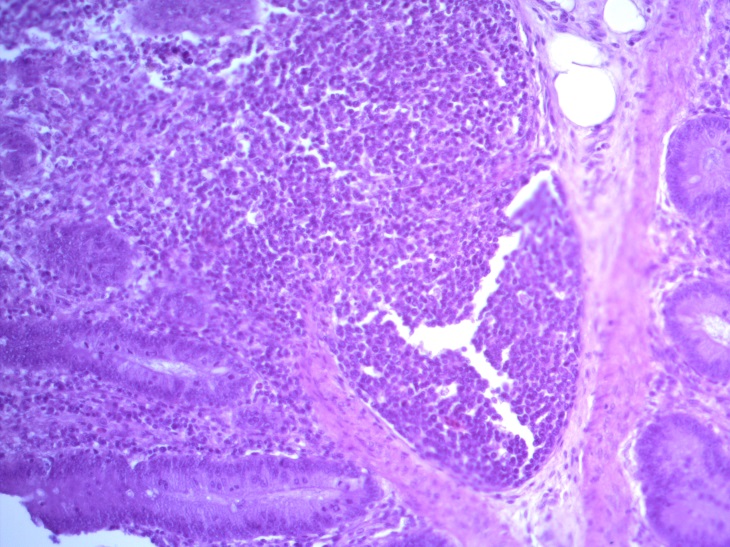
Рисунок 107 — Срез толстой кишки 3 опытной курицы.Ув. 200
Селезенка контрольных кур
На рисунке 108 видно, что в первом срезе капсула представлена соединительной тканью. Деление на красную и белую пульпу выражено не четко. Определяются средние и мелкие лимфоидные фолликулы, со слабо выраженными герминативными центрами. Красная пульпа состоит из ретикулярной ткани, которая содержит клеточные элементы: клетки крови, плазмоциты и макрофаги.
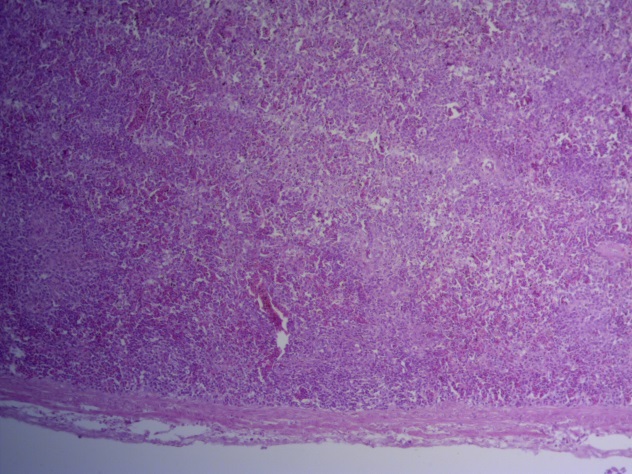
Рисунок 108 — Срез селезенки 1 контрольной курицы. Ув. 100
На втором срезе (рис. 109) фолликулы преимущественно мелкие со слабо выраженным герминативным центром. Отдельные альвеолы с периваскулярным отеком, плазматическим пропитыванием стенки.
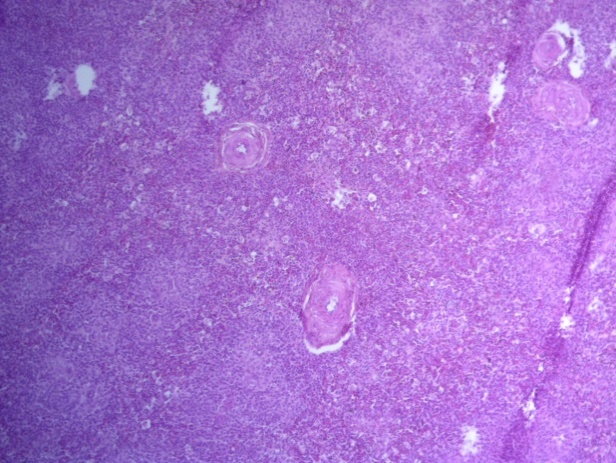
Рисунок 109 — Срез селезенки 2 контрольной курицы. Ув. 100
На третьем образце (рис. 110) отмечено, что граница между белой и красной пульпой неразличима. Фолликулы представлены хаотичными скоплениями лимфоцитов, герминативные центры не выражены. Вокруг сосудов выраженный отек.
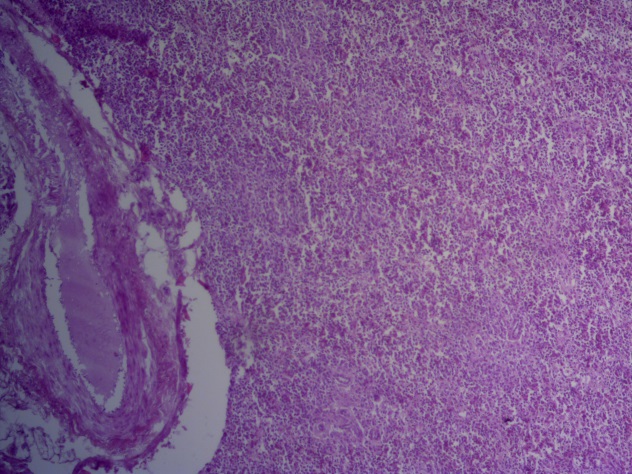
Рисунок 110- Срез селезенки 3 контрольной курицы. Ув. 200
Селезенка опытных кур
В образце номер один на рисунке 111 визуализируются немногочисленные крупные лимфоидные фолликулы со слабо выраженным герминативным центром, артериологиалиноз.
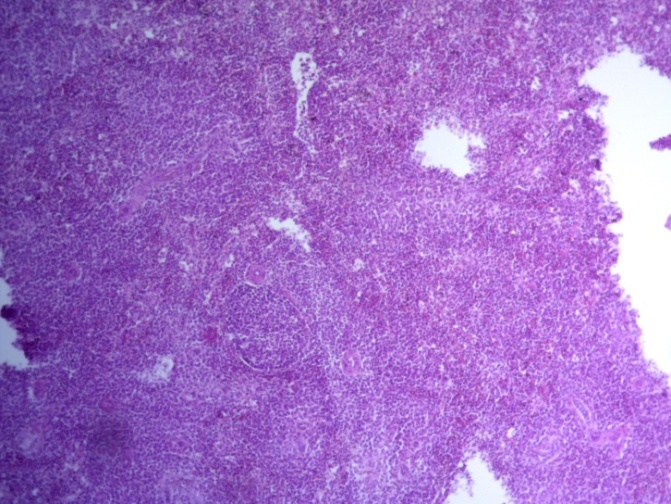
Рисунок 111 — Срез селезенки 1 опытной курицы. Ув. 100
Во втором срезе (рис. 112) граница между красной и белой пульпой слабо различима, фолликулы преимущественно мелкие со слабо выраженным герминативным центром. Выраженный периваскулярный отек.
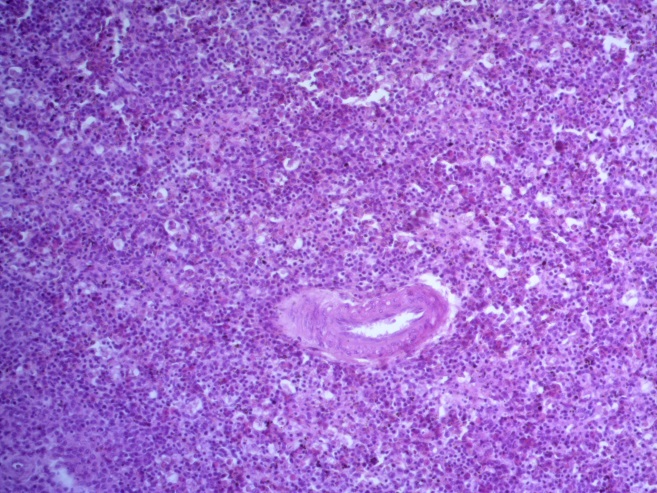
Рисунок 112- Срез селезенки 2 опытной курицы. Ув. 200
В третьем образце, представленном на рисунке 113, фолликулы мелкие, распределены неравномерно. Отдельные сосуды с резко утолщенными стенками, вакуолизированным эндотелием, полнокровны.
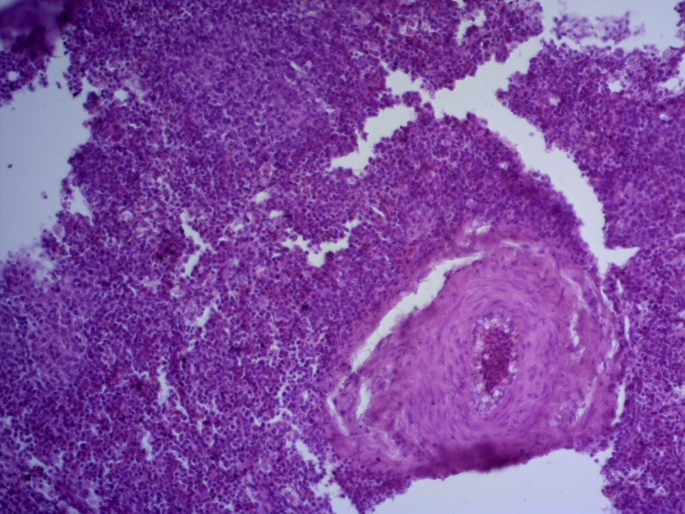
Рисунок 113 — Срез селезенки 3 опытной курицы. Ув. 200
Тимус контрольных кур
Первый образец (рис.114) представлен мелкими дольками среди жировой ткани. Мозговая зона узкая. Корковая зона содержит многочисленные мелкие тельца Гассаля (незавершенность процесса инволюции).
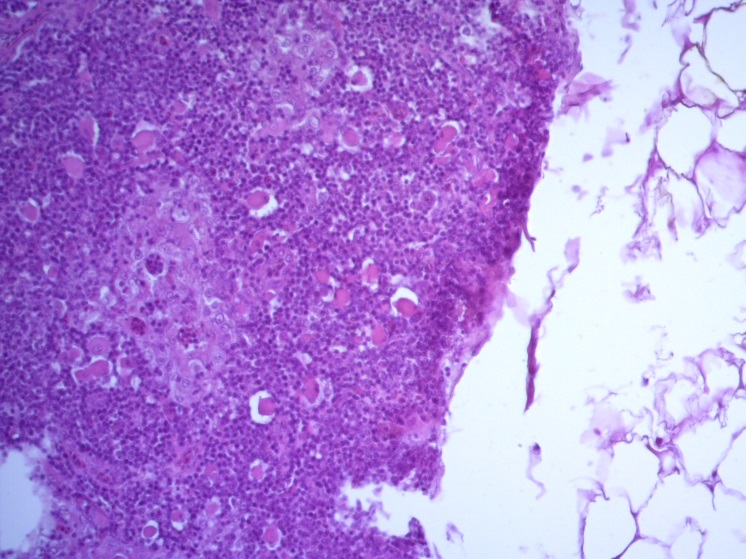
Рисунок 114 — Срез тимуса 1 контрольной курицы. Ув. 200
Во втором образце (рис. 115) материал представлен хаотично расположенными пучками зрелой соединительной ткани с очаговым отеком и кровоизлияниями, между которыми определяются поля адипоцитов.
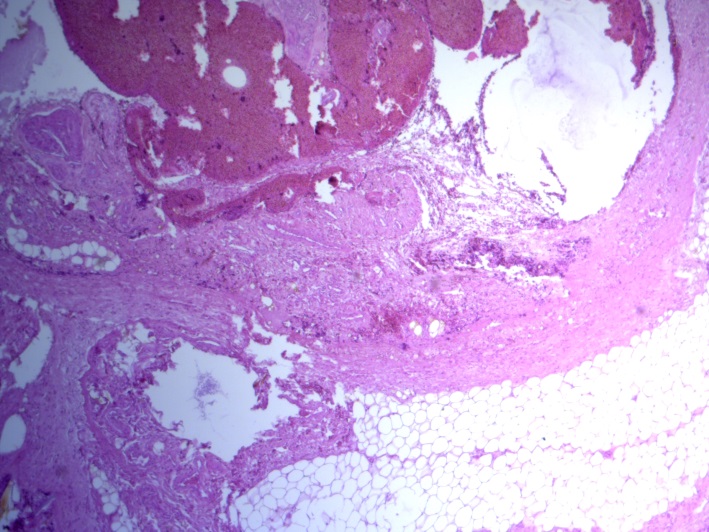
Рисунок 115 — Срез тимуса 2 контрольной курицы. Ув. 200
На рисунке 116 в третьем образце видно, что группы адипоцитов, разделены широкими прослойками зрелой соединительной ткани.
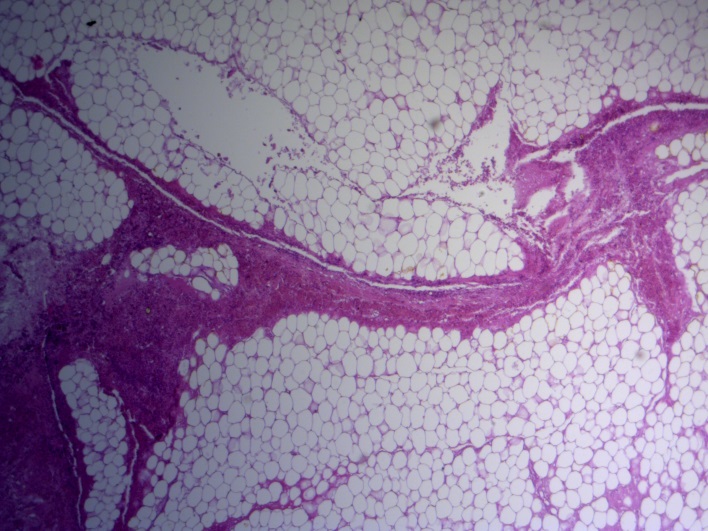
Рисунок 116 — Срез тимуса 3 контрольной курицы. Ув. 200
Тимус опытных кур
На первом и втором срезе образцов тимуса (рис. 117) представлена преимущественно жировая ткань, соединительная ткань с выраженным отеком, пучки поперечно-полосатых мышц.
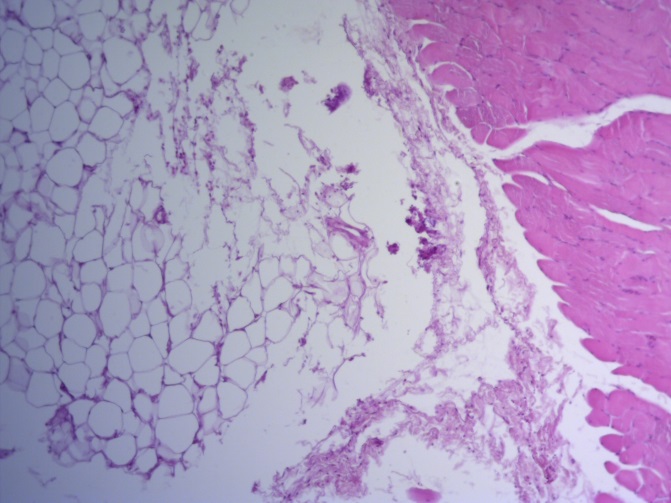
Рисунок 117 — Срез тимуса 1 и 2 опытных кур. Ув. 100
Образец номер три (рис. 118 и 119) представлен мелкими дольками среди жировой ткани. Мозговая зона относительно узкая. Корковая зона содержит немногочисленные тельца Гассаля, сосуды полнокровные.
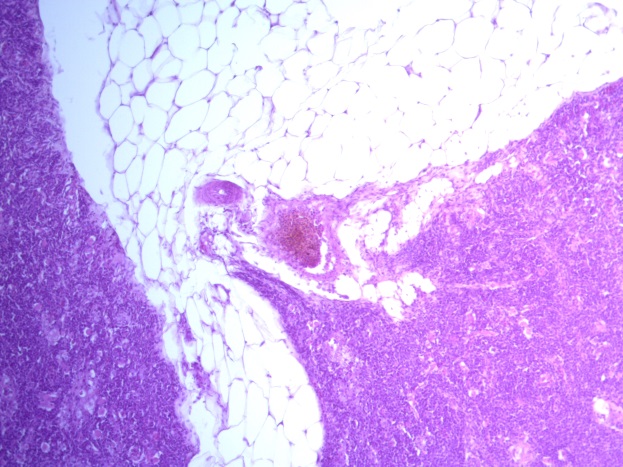
Рисунок 118 — Срез тимуса 3 опытной курицы. Ув. 100
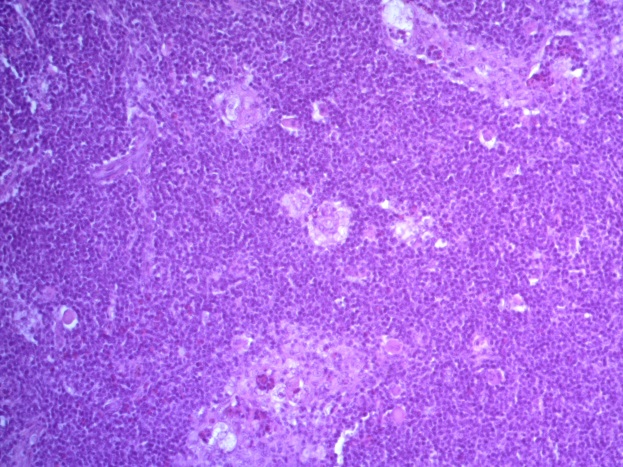
Рисунок 119- Срез тимуса 3 опытной курицы. Ув. 200
Фабрициева сумка контрольных кур
У первого контрольного образца (рис.120) мышечная оболочка со значительным отеком стромы, миоциты с дистрофическими изменениями. Просвет бурсы выстлан многорядным цилиндрическим эпителием с ресничками на апикальной поверхности без признаков повреждения. Под эпителиальным слоем в толще слизистой оболочки среди отечной стромы определяются немногочисленные лимфоциты, плазмоциты. Лимфоидные фолликулы не определяются.
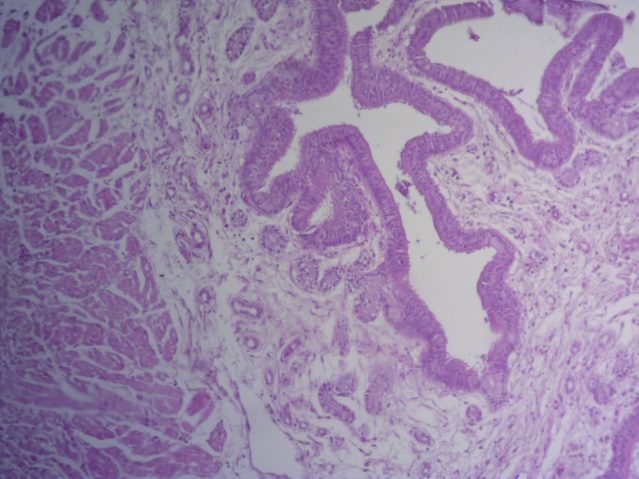
Рисунок 120 — Срез фабрициевой сумки 1 контрольной курицы. Ув.100
У второго контрольного образца (рис. 121, 122) в стенке среди пучков миоцитов отмечены группы адипоцитов. Складки различной высоты, просвет выстлан многорядным цилиндрическим эпителием с ресничками на апикальной поверхности. Под выстилающим эпителием в отечной строме единичные и в группах крупные клетки с округлым крупным базофильным ядром с равномерной хромностью и тонкостенные запустевшие капилляры.
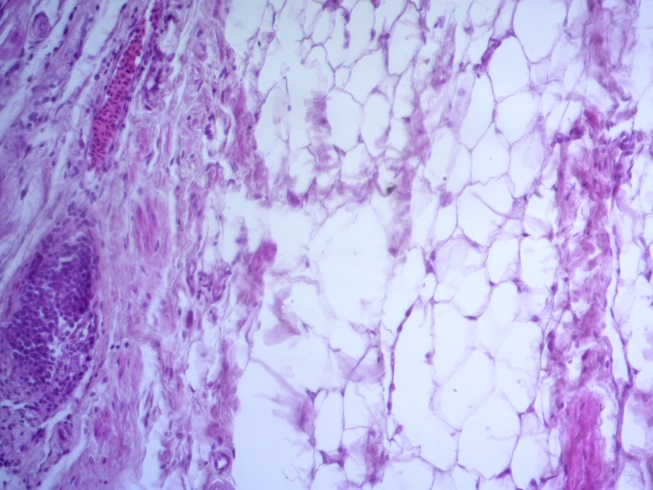
Рисунок 121 — Срез фабрициевой сумки 2 контрольной курицы. Ув. 100
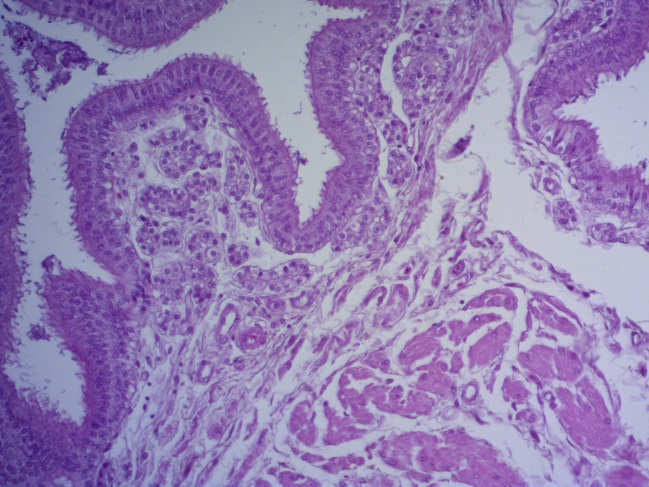
Рисунок 122 — Срез фабрициевой сумки 2 контрольной курицы. Ув. 200
В третьем контрольном образце мышечная стенка несколько утолщена, среди пучков миоцитов группы адипоцитов (рис. 123). Складки, выступающие в просвет, низкие, покрыты высоким псевдомногорядным призматическим эпителием. Под эпителиальным слоем богатая лимфоцитами строма, фолликулы не визуализируются.
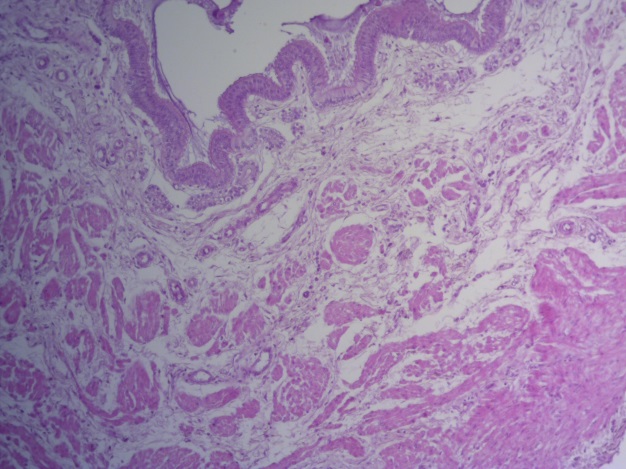
Рисунок 123 — Срез фабрициевой сумки 3 контрольной курицы. Ув.100
Фабрициева сумка опытных кур
В первом образце, представленном на рисунках 124 и 125 видно, что мышечная оболочка со значительными дистрофическими и некробиотическими изменениями клеток, среди пучков мышечных клеток, группы адипоцитов и полости, стенки которых представлены плотной соединительной тканью, выстилка представлена слоем низких кубических клеток, содержимое: гомогенные слабобазофильные массы. Так же в строме присутствуют мелкие гнезда округлых клеток с крупным базофильным ядром.
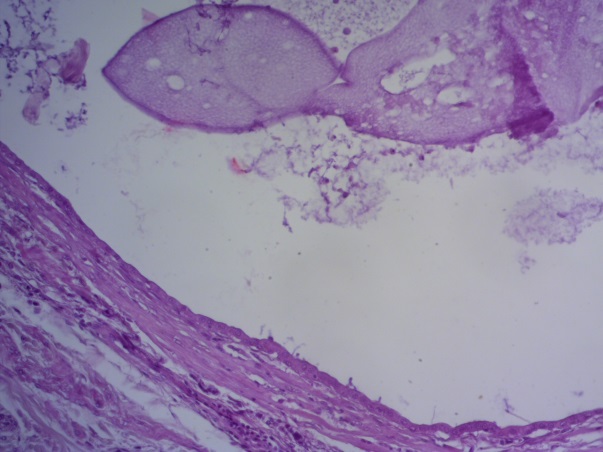
Рисунок 124 — Срез фабрициевой сумки 1 опытной курицы. Ув. 100
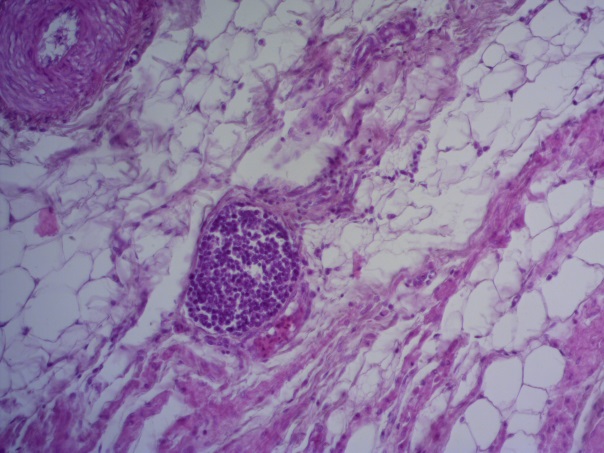
Рисунок 125 — Срез фабрициевой сумки 1 опытной курицы. Ув. 200
Во втором образце мышечная оболочка представлена хаотически переплетающимися пучками гладкомышечных клеток, отдельные пучки с признаками гипертрофии. Лимфоидная ткань истощена, состоит преимущественно из редко расположенных больших лимфоцитов и отдельных плазматических клеток, а также большого количества макрофагов и гранулоцитов (рис.126).
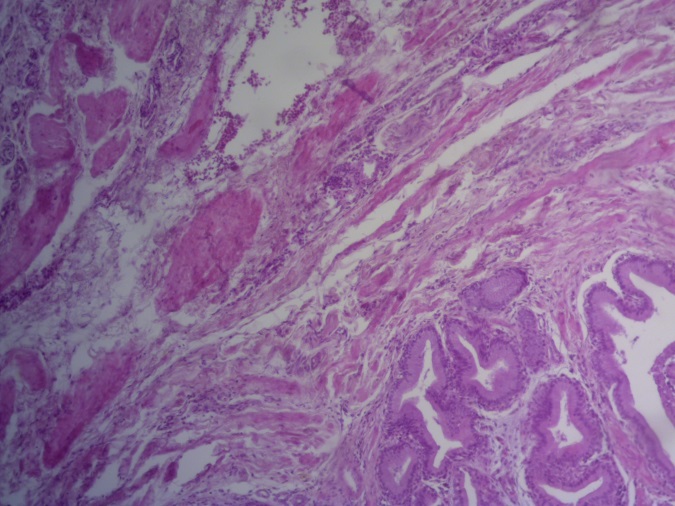
Рисунок 126 — Срез фабрициевой сумки 2 опытной курицы. Ув.100
В третьем образце (рис. 127, 128, 129, 130) гистологическая структура органа сохранена. Гладкие миоциты формируют хорошо различимые разнонаправленные слои. Просвет бурсы выстлан многорядным цилиндрическим эпителием без признаков повреждения. Непосредственно под эпителиальным слоем в толще слизистой оболочки определяются немногочисленные лимфоидные фолликулы преимущественно крупного и среднего размера, имеющие округлую, овоидную или трапециевидную форму, формирующие 1-2 ряда. Зоны в фолликулах неразличимы. В отдельных фолликулах наблюдаются редкие очаги деструкции.
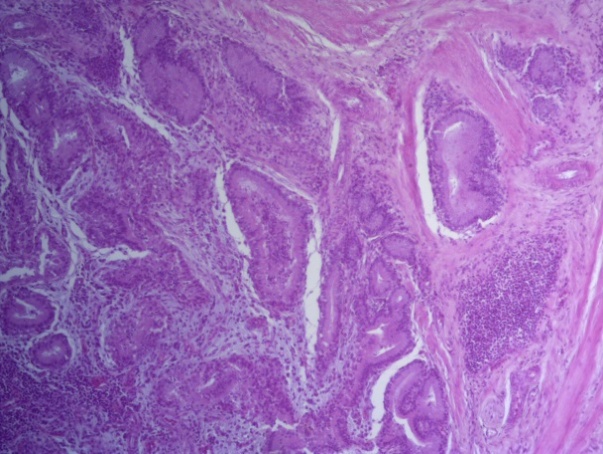
Рисунок 127 — Срез фабрициевой сумки 3 опытной курицы. Ув. 200
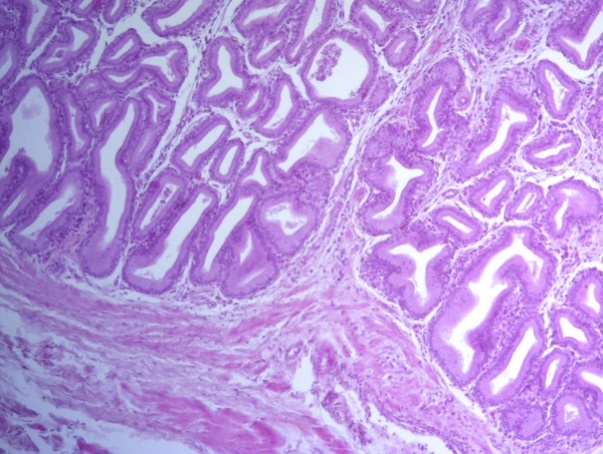
Рисунок 128 — Срез фабрициевой сумки 3 опытной курицы. Ув.200
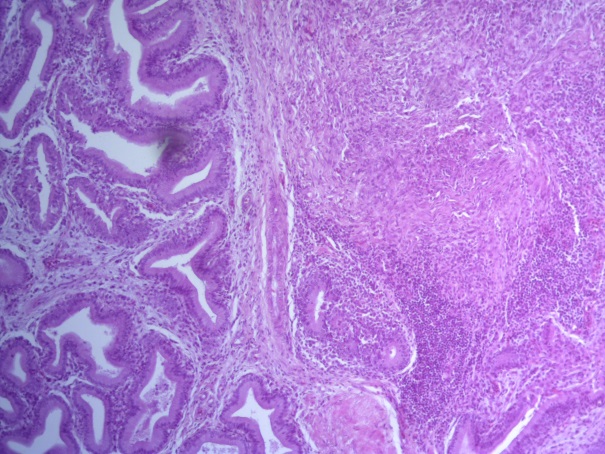
Рисунок 129 — Срез фабрициевой сумки 3 опытной курицы. Ув. 200
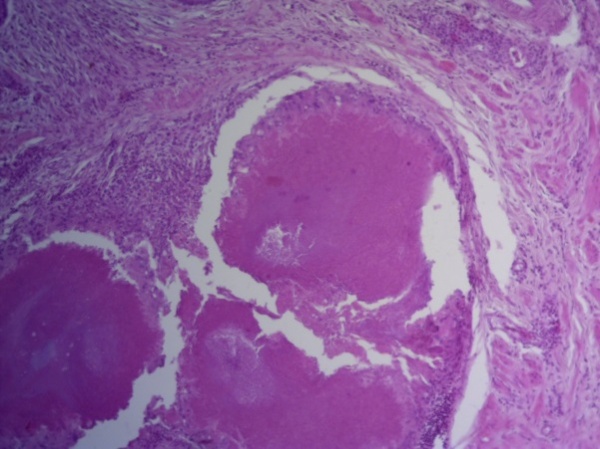
Рисунок 130 — Срез фабрициевой сумки 3 опытной курицы. Ув. 200
Сравнительный анализ гистологических изменений в органах птицы в возрасте 24-х недель свидетельствует о том, что в печени кур контрольной и опытной групп отмечены участки неравномерного кровенаполнения, расширения и полнокровия синусоидных капилляров, однако, наиболее выраженные признаки нарушения кровообращения в виде паренхиматозных кровоизлияний наблюдались в контрольной группе, что может говорить о протективном действии используемых в рационе птиц кормовых добавок на сосуды, с уменьшением их ломкости. Кроме того, в обеих экспериментальных группах в печени кур-несушек отмечены умеренно выраженные дистрофические процессы, представляющие собой появление крупных эозинофильных включений и неравномерную окраску в цитоплазме.
Экзокринная часть поджелудочной железы была одинаково выражена во всех исследуемых группах и представлена ациноцитами с хорошо визуализируемой эозинофильной зернистостью и узкими протоками, выстланными кубическим эпителием. Кальцинаты и другие патологические включения в просветах протоков железы не определялись. Эндокринная часть поджелудочной железы, представленная островками Лангерганса, слабее была выражена у птиц опытной группы, что косвенно может свидетельствовать о развитии гипергликемического синдрома.
При анализе кишечника кур в обеих подопытных группах были выявлены катаральные воспалительные процессы в 12-ти перстной кишке на стадии серозного и слизистого катара, не переходящие в гнойный катар, с сохранением функции пристеночного пищеварения. Лимфоидный аппарат толстого кишечника в виде мелких фолликулов без светлых центров был представлен у птиц и контрольной, и опытной групп, при этом в большинстве случаев в подслизистой определялась диффузная неравномерная инфильтрация собственной пластинки слизистой.
Лимфоидные органы В-системы иммунитета птиц – селезенка, лимфоидные фолликулы кишечника, фабрициева бурса и Т-системы иммунитета — тимус, претерпели некоторые инволютивные процессы в обеих подопытных группах. Так, в селезенке наблюдались выраженные изменения с нарушением дифференциации красной и белой пульпы, уменьшением числа фолликулов, слабым развитием герминативных центров, при этом в единичных образцах контрольной группы герминативные центры не были выражены. Поскольку герминативные центры — это основное место пролиферации В лимфобластов и дифференцирующихся антителообразующих плазматических клеток, то птицы контрольной группы могут характеризоваться угнетением гуморального иммунитета и повышенным риском реинфицирования. Тимус сохранил функциональную активность только в единичных образцах и был представлен несколькими мелкими дольками с признаками инволюции, в большинстве же исследуемых образцов данный орган был полностью замещен жировой и соединительной тканью. Фабрициева бурса птиц также характеризовалась инволютивными проявлениями: нет четкой границы коркового и мозгового слоя, отмечается отек соединительной ткани, присутствуют кистозные полости, тем не менее, в опытной группе были сохранены мелкие лимфоидно-подобные скопления, демонстрирующие признаки хорошего гуморального иммунитета птиц в этом возрасте.
Таким образом, по совокупности проанализированных гистологических изменений можно констатировать о благоприятном воздействии изучаемых фитобиотических кормовых добавок Активо и Активо Ликвид на функции органов пищеварения и иммуногенеза кур-несушек в данный период технологического цикла.
4.2.14 Экономическая эффективность использования фитобиотических добавок в рационе кур
В таблице 40 представлены результаты экономической эффективности использования фитобиотических добавок по данным научно-хозяйственного опыта.
Обобщая результаты зоотехнического учета и анализа экономической эффективности исследовательской работы, можно сделать вывод о том, что применение кормовых добавок Активо и Активо Ликвид в условиях индустриальных методов птицеводства способствует повышению адаптационных возможностей птицы, нормализации общего обмена в организме, тем самым улучшает производственные показатели содержания птицы и позволяет получить дополнительную прибыль и повысить рентабельность.
Таблица 40 — Экономическая эффективность применения кормовых добавок Активо и Активо Ликвид в кормлении кур-несушек (научно-хозяйственный опыт)
| Показатель | Группа | |
| Контрольная | Опытная | |
| Начальное поголовье, гол. | 2100 | 2100 |
| Сохранность 14-28 недель, % | 99,08 | 99,34 |
| Интенсивность яйцекладки, % | 95,30 | 94,36 |
| Валовое количество яиц, шт | 111 412 | 110 522 |
| Выход стандартного яйца, % | 88,65 | 89,17 |
| Яйценоскость, шт.:
-на начальную несушку -на среднюю несушку |
53,18
56,07 |
52,73
55,14 |
| Расход корма, кг | 21 197 | 20 761 |
| Израсходовано Активо, кг | 0,85 | |
| Израсходовано Активо Ликвид, л | 2,00 | |
| Затраты всего, руб. | 405 738 | 404 161 |
| Выручка всего, руб. | 450 986 | 450 008 |
| Прибыль всего, руб. | 45 248 | 45 847 |
| Дополнительная прибыль, руб. | 599 | |
| Уровень рентабельности, % | 11,15 | 11,34 |
Несмотря на то, что интенсивность яйцекладки у кур опытной группы за 18-28 недель жизни была ниже, чем в контроле на 0,94 %, выход стандартного яйца на протяжении всего эксперимента был выше на 0,52 %, при меньшем расходе корма – на 2,06%. Кроме того, сохранность поголовья птиц, получавших фитодобавки, возросла на 0,26%. В результате дополнительная прибыль в опытной группе составила 599 рублей, а рентабельность превысила контрольное значение — на 0,19%.
Таким образом, экономический эффект, полученный от кратковременного и периодичного применения испытуемых фитопрепаратов на курах-несушках по предлагаемой схеме, в анализируемых учетный период, свидетельствует о целесообразности их использования в условиях промышленных птицефабрик.
ЗАКЛЮЧЕНИЕ
На основании проведенных исследований на мясной птице сделаны следующие выводы:
- Применение кормовых добавок ГербаСтор и ПроСтор, включающих синбиотики и фитобиотики (1 и 2 опытные группы), а также микрокапсулированной фитобиотической добавки Активо (3 опытная группа) дополнительно к основному рациону, не содержащему кормовых антибиотиков, оказало положительное влияние на зоотехнические показатели цыплят-бройлеров. Так, живая масса бройлеров 1, 2 и 3 опытных групп в конце откорма превосходила контроль соответственно на 2,0; 1,8 и 2,9%, а среднесуточный прирост живой массы в среднем за период выращивания был выше по сравнению с контролем на 2,1; 1,8 и 3,0%. Затраты корма в контрольной и 3 опытной группах составили 1,76 кг на 1 кг прироста живой массы цыплят-бройлеров, при этом в 1 и 2 опытных группах отмечено снижение затрат корма по сравнению с контролем на 0,02 и 0,05 кг, или на 1,14 и 2,8 %. Максимальная сохранность поголовья (100%) наблюдалась в 3 опытной группе, превышая значение всех остальных подопытных групп птицы на 2,3%. Европейский индекс продуктивности во всех подопытных группах был на достаточно высоком уровне, при этом 1, 2 и 3 опытные группы опережали контрольный уровень (381 ед) на 11, 17 и 21 единицу.
- Использование новых кормовых компонентов сопровождалось повышением в составе тушек бройлеров 1, 2 и 3 опытных групп количества мяса на 2,5; 0,8 и 5,4% и меньшим значением массы костей, соответственно на 15,3; 2,6 и 13,9%. Результаты обвалки отдельных частей тушки опытных птиц свидетельствовали об увеличении массы наиболее ценных частей (грудка, голень и бедро) и снижении массы наименее ценных частей (каркас). Убойный выход потрошеной тушки в 1, 2 и 3 опытных группах был незначительно ниже контроля на 0,8; 2,1 и 0,3% соответственно, что связано с увеличением массы внутренних органов.
- Ввод экспериментальных кормовых добавок в рацион цыплят-бройлеров не оказал отрицательного влияния на развитие внутренних органов птиц. При этом под влиянием скармливания ГербаСтора отмечалось достоверное возрастание в конце откорма массы мышечного желудка бройлеров. Включение ГербаСтора и ПроСтора в комбикорм сопровождалось достоверным увеличением в конце технологического цикла длины кишечника и повышением относительной массы этого органа у птиц. Использование ПроСтора способствовало достоверному повышению массы центрального органа иммуногенеза цыплят – тимуса, а также характеризовалось тенденцией повышения массы фабрициевой бурсы. Отмеченные положительные изменения в повышении массы центральных органов иммунитета цыплят, с учетом проведенной их гистологической оценкой, свидетельствующей о выраженной активизации процессов иммуногенеза, говорят о профилактирующем акцидентальную инволюцию действии данного препарата, позволяющего повысить массу органов за счет сохранения лимфоцитов корковой зоны.
- Химический анализ мышечной ткани цыплят-бройлеров показал, что при включении в состав рациона цыплят-бройлеров комплексных препаратов на основе синбиотиков и фитобиотиков (ГербаСтора и ПроСтора) наблюдалась тенденция повышения количества жира в грудных мышцах бройлеров и снижение содержания белка в ножных мышцах. При использовании фитобиотической микрокапсулированной добавки (Активо) отмечено достоверное снижение, по сравнению с контролем, количества сухого вещества и белка в грудных мышцах на 1,0 и 1,1% (Р≤0,05) и тенденция увеличения белка и жира в ножных мышцах.
- Данные о переваримости питательных веществ комбикорма цыплятами-бройлерами свидетельствуют об эффективности ввода в состав рациона анализируемых кормовых добавок. Во всех опытных группах установлено повышение переваримости жира на 6,7-11,0%, клетчатки – на 2,1-8,0% и безазотистых экстрактивных веществ – на 1,0-2,2%. Помимо этого, в 3 опытной группе также отмечено повышение переваримости сырого протеина на 1,6%. Результаты балансового опыта подтверждают более высокий уровень живой массы птицы, получавшей экспериментальные кормовые компоненты, по сравнению с контрольными аналогами.
- Количество обменной энергии в организме цыплят, получавших на фоне основного рациона, свободного от кормовых антибиотиков, новые кормовые факторы, повысилось в 1 и 2 опытных группах на 3,1 и 4,3 %, при этом использование обменной энергии от валовой энергии корма было больше аналогичного показателя контрольной группы на 2,2 и 1,5%, соответственно. В 3 опытной группе количество обменной энергии было меньше, чем в контроле на 3,1%, но при этом использование энергии в данной группе было выше контрольного уровня на 2,1%, в связи с меньшим выделением энергии с помётом.
- Включение в рацион цыплят-бройлеров 1 и 2 опытных групп исследуемых кормовых добавок способствовало увеличению использования азота птицей на 1,3 и 1,0%. Наилучшее использование данного элемента наблюдалось в 3 опытной группе, превысившее показатель контроля на 2,6%. Использование кальция и фосфора было самым высоким в 1 и 3 опытных группах: кальция на 8,51 и 20,3%, фосфора на 14,75 и 10,75% соответственно по отношению к контролю. Скармливание экспериментальных кормовых добавок не отразилось на химическом составе большеберцовой кости цыплят.
- При введении комплексных препаратов на основе синбиотиков и фитобиотиков, а также фитобиотической микрокапсулированной добавки дополнительно к основному рациону цыплят-бройлеров, анализируемые морфологические показатели крови птиц не выходили за пределы физиологических норм, что свидетельствует об отсутствии отрицательного влияния добавок на организм птицы. При этом установлена тенденция повышения гемоглобина у птиц всех опытных групп, что свидетельствует об активизации окислительно-восстановительных процессов в организме под действием изучаемых кормовых средств. У бройлеров всех опытных групп (достоверно у птиц 2 опытной группы) отмечено снижение уровня агранулоцитов (лимфоцитов и моноцитов) и повышение гранулоцитов (псевдоэозинофилов и эозинофилов).
- Проведенное биохимическое исследование крови позволило установить, что применение экспериментальных кормовых добавок при выращивании цыплят-бройлеров дополнительно к основному рациону не оказывает отрицательного влияния на обменные процессы в организме птиц. При этом приводит к улучшению усвоения белкового азота в организме, о чем свидетельствует снижение мочевой кислоты в сыворотке крови цыплят 1, 2 и 3 опытных групп на 26,45; 33,66 и 19,51% и подтверждается повышением использования азота корма (по результатам балансового опыта) и увеличением прироста живой массы. Кроме того, использование исследуемых кормовых средств сопровождается активизацией липидного обмена в организме цыплят, что характеризуется тенденцией снижения количества триглицеридов в сыворотке крови у птиц 1 и 2 опытных групп на 32,1 и 21,43 % и достоверным снижением у цыплят 3 опытной группы на 42,86%, (Р≤0,05), а также способствует снижению активности трансаминаз во 2 и 3 опытных группах, демонстрируя более высокую устойчивость внутренних органов, в частности печени и сердца, к неблагоприятным экзогенным и эндогенным воздействиям.
- Бактерицидная активность лейкоцитов у цыплят 1 и 3 опытной группы была достоверно выше, чем у контрольных аналогов на 11,08 и 14,38, что говорит о стимулирующем влиянии применяемых препаратов Гербастор и Активо на неспецифическую резистентность организма цыплят-бройлеров, свидетельствуя о более высокой иммунологической реактивности.
- Проведенное исследование микрофлоры слепых отростков кишечника цыплят-бройлеров свидетельствовало об отсутствии во всех образцах экспериментальных групп патогенных микроорганизмов и бактерий. Из потенциально-патогенной флоры установлено: наличие во всех группах одинакового количества протей (Proteus spp) — Proteus mirabilis; присутствие Staphylococcus Saprophyticus — при меньшем их количестве в образцах опытных групп; наличие Trichosporon asahii — с минимальным проявлением в образцах 3 опытной группы. В отношении нормальной флоры слепых отростков можно констатировать, что включение комплексных добавок на основе синбиотиков и фитобиотиков и фитобиотической добавки не повлияло на количественное содержание бифидобактерий и кишечной палочки (номофлор), при этом сопровождалось незначительным снижением количества лактобактерий в единичных образцах при включении ПроСтора и Активо, а также выраженным наличием энтерококков при использовании ГербаСтора на фоне их отсутствия в образцах контрольной и 2 опытной группы и единичным присутствием в 3 опытной группе.
- Анализ процессов, зарегистрированных на препаратах гистологических срезов печени, поджелудочной железы, двенадцатиперстной кишки, слепой кишки, селезенки, тимуса и фабрициевой бурсы от 37 дневных цыплят-бройлеров контрольной и трех опытных групп показал благополучие подопытного поголовья по инфекционным и паразитарным заболеваниям, высокие показатели по клеточному и гуморальному иммунитету. Что касается обменных процессов, то наилучшие показатели были зарегистрированы во 2 опытной группе птиц, близкие к ним были показатели в 3 опытной группе. В 1 опытной группе наблюдались некоторые патологические процессы в печени в виде некроза и полиморфноклеточной инфильтрации, как очаговой, так и диффузной, на фоне зернистой дистрофии, характерной для гепатоза и гепатита, те же процессы отмечены и в контрольной группе цыплят-бройлеров. Секреторная активность поджелудочной железы была наиболее выраженной у представителей 2 опытной группы. Во всех группах птицы выявлены катаральные воспалительные процессы в кишечнике на стадии серозного и слизистого катара не переходящие в гнойный катар с сохранением функции пристеночного пищеварения. Лимфоидные органы В-системы иммунитета птиц – селезенка, лимфоидные фолликулы кишечника, фабрициева бурса, и Т-системы иммунитета — тимус, к 37 дню выращивания, то есть к концу технологического периода, претерпели некоторые инволютивные процессы, но находились на высоком функциональном уровне, при этом наилучшие результаты показали представители 2 опытной группы.
- По данным научно-хозяйственного эксперимента установлено, что рентабельность производства мяса бройлеров в 1 и 2 опытных группах, при использовании кормовых добавок ГербаСтор и ПроСтор, превысила контрольный уровень на 2,3 и 2,0 %. Наибольшее превосходство по этому показателю над контрольным значением — на 4,5%, было получено в 3 опытной группе, получавшей дополнительно к основному рациону кормовой препарат Активо.
- Применение кормовых добавок ГербаСтор и ПроСтор, включающих синбиотики и фитобиотики, и микрокапсулированной фитобиотической кормовой добавки Активо в технологии выращивания цыплят-бройлеров, исключающей использование кормовых антибиотиков, характеризуется выраженным биологическим и экономическим эффектом.
На основании проведенных исследований на яичной птице сделаны следующие выводы:
- Включение исследуемых фитобиотических кормовых добавок Активо и Активо Ликвид в рацион кур-несушек не оказало отрицательного влияния на живую массу и однородность птицы, способствовало повышению сохранности поголовья кур на 0,26 %.
- Сравнительный анализ состояния внутренних органов и гребней кур показал, что птицы обеих подопытных групп имели нормальное развитие и были физиологически готовы к полноценной яйцекладке. При этом, включение экспериментальных фитодобавок способствовало лучшему развитию печени и слепых отростков, о чем свидетельствует их достоверное превосходство по массе над контролем на 12,53 и 27,59% (Р≤0,05) в пределах нормативных значений. У опытных кур отмечена тенденция большей массы пищевода – на 19,8 % и более высоких значений длины кишечника и длины яйцевода – на 1,65 и 4,27%.
- Оценка яичной продуктивности кур показала, что птица опытной группы на один день позже снесла первое яйцо, однако, на пик продуктивности она вышла на 17 дней раньше и он был выше контроля на 0,10 %. Количество яиц на среднюю и начальную несушку в опытной группе было ниже, чем в контроле на 0,93 и 0,45 % соответственно, что объясняется менее интенсивным разносом птицы. Расход корма на 1 голову в опытной группе был ниже, по сравнению с контрольным уровнем, на 0,42 %.
- Морфологический анализ яиц показал, что яйца, снесенные курами опытной группы, отличались большей массой: в возрасте 24-х недель на 5,26 % (Р≤0,01), в 26-недельном возрасте – на 3,32 %, при этом прочность скорлупы превосходила контроль на 0,72 и 1,73 % в те же периоды проверки, что способствовало снижению количества яиц с поврежденной скорлупой (бой и насечка) на 0,05%.
- По результатам биохимического анализа яиц установлено, что в желтке яиц опытных кур наблюдалось большее содержание каротиноидов и витамина В2 в 24-недельном возрасте на 46,93 % (Р≤0,001) и 2,55 % соответственно, по сравнению с контролем.
- Применение фитодобавок в технологии кормления птиц способствовало повышению переваримости сухого вещества, сырого жира и сырой клетчатки у особей опытной группы по сравнению с контролем на 2,30; 13,03 и 17,38 % соответственно.
- Уровень обменной энергии в организме кур-несушек, получавших Активо и Активо Ликвид, был выше, чем у контрольных аналогов на 0,37 %.
- Коэффициенты использования азота, кальция и фосфора у кур-несушек опытной группы превышали контрольное значение на 2,00; 10,13 и 0,06 %.
- Показатели химического состава большеберцовой кости кур-несушек в 24-недельном возрасте показали, что содержание золы, кальция и фосфора в опытной группе было выше, по сравнению с контролем, на 0,18; 2,40 и 1,59 % соответственно.
- Полученные данные морфологического анализа крови показали, что дополнительное включение в рацион кур-несушек фитобиотических добавок Активо и Активо Ликвид не оказало отрицательного влияния на организм птицы, способствуя при этом активизации окислительно-восстановительных процессов, о чем свидетельствует увеличение количества эритроцитов и гемоглобина – на 1,2 и 5,34%, и повышению защитных функций, естественной резистентности организма, что подтверждается умеренным возрастанием количества лейкоцитов – на 15,42%, достоверным повышением базофилов – на 1,8% (P≤0,05) и снижением скорости оседания эритроцитов – на 41,2% (Р≤0,05).
- Фитобиотические добавки Активо и Активо Ликвид обладают стимулирующим действием на обменные процессы в организме кур-несушек. Об этом свидетельствует повышение интенсивности белкового обмена, выражающееся в возрастании уровня общего белка и количества альбуминов на 7,07 и 5,30 % (Р≤0,05) и снижении количества мочевой кислоты на 10,91 %. А также формирование катаболической направленности углеводного обмена, характеризующегося достоверным снижением уровня глюкозы в крови на 13,60 % (Р≤0,01), что вероятно обусловлено возрастанием энергетических потребностей организма птиц, в связи с более ранним их выходом, по сравнению с контрольными аналогами, на пик продуктивности и удержанием его на более высоком уровне.
- Микробиологические исследования толстого отдела кишечника демонстрировали: отсутствие у кур обеих групп патогенных микроорганизмов и бактерий; меньшее содержание у опытных птиц условно-патогенной микрофлоры в виде стафилококков и грибковой флоры Candida sp.; снижение количества бифидобактерий и повышение содержания лактобактерий у представителей опытной группы, по сравнению с контролем; отсутствие в опытных образцах — E. coli гемолитических, а в контрольных образцах — лактострептококков и E.coli лактозонегативных.
- По совокупности проанализированных гистологических изменений можно констатировать о благоприятном воздействии изучаемых фитобиотических кормовых добавок Активо и Активо Ликвид на состояние органов пищеварения и иммуногенеза кур-несушек в данный период технологического цикла. Это подтверждается менее выраженными патологическими изменениями в исследуемых органах, а, следовательно, усилением и сохранением их функциональной деятельности, что в свою очередь обусловило повышение жизнеспособности организма кур.
- Использование Активо и Активо Ликвид в технологии кормления промышленной птицы яичного кросса по предлагаемой схеме является экономически целесообразным, позволяя повысить уровень рентабельности производства яиц в анализируемый учетный период (18-28 недель) на 0,19 %.
Предложение производству
На основании результатов проведенных исследований на мясной птице рекомендуем включать в комбикорм для цыплят-бройлеров с 5-го дня выращивания и до конца периода откорма:
— кормовую добавку на основе синбиотиков и фитобиотиков – ГербаСтор в количестве 0,5 г/кг комбикорма;
— кормовую добавку на основе синбиотиков и фитобиотиков – ПроСтор в количестве 0,5 г/кг комбикорма;
— фитобиотическую микрокапсулированную кормовую добавку Активо в количестве 0,15 г/кг комбикорма.
На основании результатов проведенных исследований на яичной птице рекомендуем включать в рацион промышленных кур-несушек фитобиотическую микрокапсулированную добавку Активо в количестве — 100 г/т комбикорма с 16-й по 21-ю недели жизни, в течение 42-х дней и выпаивать Активо Ликвид в количестве 500 мл/1000 л воды с 21-го недельного возраста, в течение 5 дней и с 24-х недельного возраста, в течение 5 дней.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
- Фисинин В.И. Мировое и российское птицеводство: реалии и вызовы будущего: монография. – М.: Хлебпродинформ, 2019. – 470 с.
- Трухачев В.И., Епимахова Е.Э., Злыднев Н.З. Обозначены векторы развития птицеводства // Птицеводство. — 2019. — № 2. — С.12-14.
- Зыков С.А. Современные тенденции развития птицеводства // Эффективное животноводство. – 2019. — № 4. – С.51-54.
- Буяров А.В. Состояние и приоритетные направления развития птицепродуктового подкомплекса в различных регионах России // Мировое и российское птицеводство: состояние, динамика развития, инновационные перспективы: материалы XX Международной конференции. — Сергиев Посад, 2020. — С.703-706.
- Мельник В.А. Микроклимат и продуктивность птицы // Животноводство России. — 2014. — № 5. — С.13-15.
- Фисинин В.И. Стратегические тренды развития мирового и отечественного птицеводства: состояние, вызовы, перспективы Мировые и российские тренды развития птицеводства: реалии и вызовы будущего: материалы XIX Международной конференции / Российское отделение Всемирной научной ассоциации по птицеводству (ВНАП); НП «Научный центр по птицеводству. – Сергиев Посад, 2018. – С. 9-48.
- Сурай П.Ф., Фисинин В.И. Современные методы борьбы со стрессами в птицеводстве // Сельскохозяйственная биология. – 2012. — № 4. – С.3-13.
- Рядчиков В.Г. Основы питания и кормления сельскохозяйственных животных: учебник. — Краснодар: Кубанский государственный аграрный университет, 2014. — 616 с.
- Фисинин В.И., Егоров И.А., Драганов И.Ф. Кормление сельскохозяйственной птицы: учебник. — М.: ГЕОТАР-Медиа, 2011. — 344 с.
- Хазиахметов Ф. С. Рациональное кормление животных: учебное пособие. — Санкт-Петербург: Лань, 2019. — 364 с.
- Семенова Е.Ф., Веденеева А.С., Жужжалова Т.П. Скрининг антимикробной активности жидких экстрактов стевии Ребо (Stevia rebaudiana Bertoni) // Вестник Воронежского госуниверситета. Серия «Химия. Биология. Фармация». — 2010. — № 1. — С. 121-126.
- Околелова Т. М., Мансуров Р.Ш., Папазян Т.Т., Петросян А.Б., Шабаев И.С. Препарат «Актиген» при выращивании бройлеров // Птицеводство. — 2012. — № 6. — С. 31–32.
- Манукян В.А., Джавадов Э.Д., Дмитриева М.Е., Лаптев Г.Ю., Никонов И.Н., Новикова Н.И., Ильина Л.А. Применение ферментативного пробиотика в кормлении цыплят-бройлеров // Птица и птицепродукты. — 2013. — № 5. — С. 22-26.
- Гуо С. С., Ма К., Гуо И.М. Влияние препарата «Актиген» на продуктивность цыплят-бройлеров, их иммунный ответ и микрофлору подвздошной кишки // Птица и птицепродукты. — 2013. — № 2. — С. 47–48.
- Лобанок А. Г., Сапунова Л.И., Шарейко Н.А., Долженкова Е.А. Дрожжи как основа биологически активных кормовых добавок про- и пребиотического действия // Весці Нацыянальнай акадэміі навук Беларусі.Серыя біялагічных навук. — 2014. — № 1. — С. 17–22.
- Отченашко В. У каждого подкислителя свои особенности // Животноводство России. — 2014. — № 11. — С.31-33.
- Коптев В. Ю., Шкиль Н.А., Леонова М.А., Онищенко И.С., Балыбина Н.Ю., Бычков А.Л. Влияние кормового средства, содержащего маннано-лигосахариды, на уровень бактерионосительства микроорганизмов рода Salmonella и прирост живой массы сельскохозяйственной птицы // Достижения науки и техники АПК. – 2015. — Т. 29. — № 1. — С. 46–48.
- Alagawany M., El-Hack M. A., Farag M. R., Tiwari R., Dhama K. Biological effects and modes of action of carvacrol in animal and poultry pro-duction and health-a review //Advances in Animal and Veterinary Sciences. — 2015.- Vol. 3.- №. 2s. — PP. 73-84.
- Жученко Е.В., Семенова Е.Ф., Маркелова Н.Н., Шпичка А.И., Князькова А.А. Влияние эфирных масел на микроорганизмы различной таксономической принадлежности в сравнении с современными антибиотиками. Сообщение III. Действие масел лаванды, розового дерева, эвкалипта, пихты на некоторой грамотрицательной бактерии // Известия высших учебных заведений. Приволжский регион. Естественные науки. — 2015. — № 1 (9). — С. 30-41.
- Атландерова К.Н. Растительные экстракты как альтернатива антибиотикам в кормлении сельскохозяйственных животных //Актуальные проблемы животноводства в условиях импортозамещения. — 2018. — С. 17-21.
- Беляева С.Н., Концевая С.Ю., Коваленко А.М. Повышение неспецифических факторов иммунитета птиц // Вопросы нормативно-правового регулирования в ветеринарии. — 2019. — № 1. — С. 143-145.
- Кишняйкина Е.А. Продуктивный и физиологический эффект биологически активных веществ в системах выращивания цыплят-бройлеров: дис. … канд. с.-х. наук: 06.02.10 / Е.А. Кишняйкина. — Новосибирск, 2019. — 145 с.
- Лаптев Г.Ю., Ильина Л.А., Йылдырым Е.А., Филлипова В.А., Дубровин А.В., Новикова О.Б., Кочиш И.И. Фитобиотик ИНТЕБИО® на защите иммунитета птицы // Птицеводство. – 2019. — № 7-8. – С.25-30.
- Мурленков Н.В. Экономический эффект от пробиотических культур штамма Bacillus в бройлерном птицеводстве // Сб. материалов Международной научно-практической конференции. — Омск, 2019. — С. 157-160.
- Овчинников А.А., Овчинникова Л.Ю., Коновалов Д.А. Иммунный статус организма мясных кур при использовании пробиотиков в рационе // Птицеводство. – 2019. — № 5. – С.43-47.
- Сурай П.Ф., Фисинин В.И., Кочиш И.И. От регуляции витагенов в оптимизации иммунного ответа: новые подходы к иммуннорегуляции в птицеводстве // Мировое и российское птицеводство: состояние, динамика развития, инновационные перспективы: материалы XX Международной конференции. — Сергиев Посад, 2020. — С.56-67.
- Бохан П.Д., Карпенко Л.Ю., Бахта А.Н. Сравнительная оценка влияния на гематологический статус у цыплят-бройлеров применения симбиотиков и антибиотиков // Мировое и российское птицеводство: состояние, динамика развития, инновационные перспективы: материалы XX Международной конференции. Сергиев Посад, 2020. — С.173-175.
- Goossens H., Ferech M., Vander Stichele R., Elseviers M. Outpatient antibiotic use in Europe and association with resistance: a cross-national database study (англ.) // The Lancet: journal. — Elsevier, 2005. — Vol. 365, no. 9459. — P. 579—587.
- Ao, T. Exogenous enzymes and organic acids in the nutrition of broiler chicks: effects on growth performance and in vitro and in vivo digestion [Электронный ресурс] / Tuoying Ao // University of Kentucky Doctoral Dissertations, 2005. – 241 p. – URL: https://uknowledge. uky.edu/ gradschool _diss/241 (дата обращения: 30.11.2020).
- Wright G. D. Antibiotic resistance in the environment: a link to the clinic? (англ.) // Current Opinion in Microbiology: journal. — Elsevier, 2010. — October (vol. 13, no. 5). — P. 589—594.
- D’Costa, Vanessa; King, Christine; Kalan, Lindsay; Morar, Mariya; Sung, Wilson; Schwarz, Carsten; Froese, Duane; Zazula, Grant; Calmels, Fabrice; Debruyne, Regis; Golding, G. Brian; Poinar, Hendrik N.; Wright, Gerard D. Antibiotic resistance is ancient (англ.) // Nature. — 2011. — September (vol. 477, no. 7365). — P. 457—461.
- Bodkin H. Brexit Britain should lead the way by banning mass antibiotic use in agriculture, says top doctors //The Telegraph. -2016.6.6. Clarke P. Farmers told to cut antibiotic use by one-fifth/Clarke P.//Farmers Weekly. — 2016. URL: https://www.telegraph.co.uk/(дата обращения 30.11.2020).
- Фисинин В. И., Егоров И. А., Лаптев Г. Ю., Ленкова Т. Н., Никонов И. Н., Ильина Л. А., Манукян В. А., Грозина А.А., Егорова Т.А., Новикова Н.И., Йылдырым Е.А. Получение продукции птицеводства без антибиотиков с использованием перспективных программ кормления на основе пробиотических препаратов // Вопросы питания. — 2017. — № 6. — С.114-124.
- Канардов П. Антибиотики в животноводстве. Запретить нельзя разрешить// Ценовик. — 2017. — № 9. — С.22.
- Васильева О.А., Нуфер А.И., Шацких Е.В. Альтернативные пути замены кормовых антибиотиков // Эффективное животноводство. — 2019. — № 4. — С.13-15.
- Шацких Е.В., Галиев Д.М., Нуфер А.И. Мясная продуктивность цыплят-бройлеров при замене кормовых антибиотиков в рационе на ростостимулирующие кормовые добавки. // Птица и птицепродукты. — 2019. — № 6. — С. 26-29.
- Джанарсланов Р. Бройлер без антибиотиков-тренд будущего. URL: https://www.agroinvestor.ru/column/rizvan-dzhanarslanov/30096-broyler-bez-antibiotikov-trend-budushchego (дата обращения 29.04.2020).
- Lillehoj, H., Liu, Y., Calsamiglia, S. et al. Phytochemicals as an alternative to antibiotics to stimulate growth and improve host health. URL: https://veterinaryresearch.biomedcentral.com/articles/10.1186/s13567-018-0562-6#article-info (дата обращения 22.11.2019).
- Мамкин А.Ю. Философия о глобальных проблемах современности. URL:https://www.sites.google.com/site/2015mamkin/home/ogse-01-osnovy-filosofii/20 (дата обращения 22.04.2020).
- Омельченко Н.А., Пышманцева Н.А. Учены рекомендуют: взамен антибиотиков // Земля и жизнь. Российская аграрная газета, 2009. — №7 (12) URL: https://xn--80abhgo0bdpo5a.xn--p1ai/svinovodstvo/ bacell-monosporin-prolam-01 (дата обращения 29.04.2020).
- Швыдков А. Н., Ланцева Н.Н., Рябуха Л.А. Физиологическое обоснование использования пробиотиков, симбиотиков и природных минералов в бройлерном птицеводстве Западной Сибири: монография. — Новосибирск: НГАУ, 2015. — 149 с. URL: https://e.lanbook.com/book/71646 (дата обращения: 25.11.2020).
- Буяров В.С., Червонова И.В., Ярован Н.И., Учасов Д.С. Пробиотики и пребиотики в промышленном свиноводстве и птицеводстве: монография // Орловский государственный аграрный университет. — 2014. — С. 164-166.
- Соколенко Г.Г., Лазарев С.В., Миньченко С.В. Пробиотики в рациональном кормлении животных // Технологии пищевой и перерабатывающей промышленности АПК — продукты здорового питания. — 2015. — № 1. — С. 72-78.
- Шесточенко А. Профилактика инфекционных заболеваний молодняка. — М.: Колос, 1983. — 207 с.
- Хорошевский М.А., Афанасьева А.И. Пробиотики в животноводстве // Вестник Алтайского государственного аграрного университета. — 2003. — № 2 (10). — С. 290-292.
- Шарипова А.Ф., Хазиев Д.Д. Влияние пробиотической добавки «Ветоспорин-Актив» на эффективность выращивания цыплят-бройлеров // Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. — 2015. — Т. 221. — № 1. — С. 253-258.
- Орлова Т.Н., Дорофеев Р.В. Пробиотики — перспектива животноводства / // Аграрная наука — сельскому хозяйству: сб. материалов XII Международной научно-практической конференции. Кн. 3. — Барнаул: Алтайский государственный аграрный университет, 2017. — С. 177-180.
- Пышманцева Н.А., Чиков А.Е., Осепчук Д.В., Ковехова Н.П. Об эффективности максимально раннего применения пробиотиков у цыплят яичных пород // Проблемы биологии продуктивных животных. — Боровск. — 2011. — № 1. — С. 93-99.
- Hung A.T., Lin S.Y., Yang T.Y., Chou C.K., Liu H.C., Lu J.J., Wang B., Chen S.Y., Lien T.F. Effects of Bacillus coagulans ATCC 7050 on growth performance, intestinal morphology, and microflora composition in broiler chickens // Animal production science — 2012. — V. 52 (9). — P. 874-879.
- Hashemzadeh F., Rahimi S., Torshizi M.A., Masoudi A.A Effects of probiotics and antibiotic supplementation on serum biochemistry and intestinal microflora in broiler chicks / // Agriculture and crop sciences. — 2013. — №. 5 (20). — P. 2394-2398.
- Темираев Р.Б., Гаппоева В., Гагкоева Н. Пробиотики и ферментные препараты в рационах цыплят // Птицеводство. — 2009. — № 4. — С. 20-21.
- Темираев Р.Б., Гаппоева В.С., Олисаев С.В. Влияние пробиотика и ферментного препарата на продуктивность кур-несушек // Известия Горского государственного аграрного университета. — Владикавказ. — 2011. — Т. 48. — Ч. 1. — С. 111-114.
- Салеева И.П., Иванов А.В., Павленко И.В. и др. Новые пробиотические комплексы (препараты) и их применение при выращивании бройлеров // Птицеводство. — № 12. — 2014. — С.29-33.
- Сипайлова О.Ю., Нестеров Д.В., Шейда Е.В., Лебедев С.В. Иммуномодулирующие свойства кормовых добавок на основе Bacilus subtilis // Вестник мясного скотоводства. — 2014. — № 3 (86). — 2014. — С. 94-98.
- Петраков Е.С., Овчарова А.Н. Переваримость корма у цыплят-бройлеров под влиянием пробиотических лактобацилл // Современное состояние животноводства: проблемы и пути их использования: материалы научно-практической конференции. — Саратов, 2018. — С. 143-144.
- Степанова А.М., Неустроев М.П. Разработка и применение препарата из штаммов Bacillus subtilis в птицеводстве: монография. — Новосибирск, 2019. — 84 с.
- Орлова Т.Н. Эффективность применения пробиотического препарата «Пропионовый» в рационах цыплят-бройлеров: автореф. дис. канд. с.-х. наук 06.02.08. — Барнаул, 2020. — 22 с.
- Фисинин В.И., Егоров И.А., Лаптев Г.Ю. и др. Получение продукции птицеводства без антибиотиков с использованием перспективных программ кормления на основе пробиотических штаммов // Вопросы питания. — 2017. — Т. 89. — № 6. — С. 114 -124.
- Маркин Ю., Нестеров Н. Разумная альтернатива антибиотикам пробиотики в рационах для птицы // Животноводство России. — 2018. -№ 2. — С. 8-11.
- Морозова Е.С., Мурленков Н.В., Шуметов В.Г. Оптимизация дозировки пробиотика «olin» в рационе кормления цыплят-бройлеров по критериям качества полуфабриката // Международный студенческий научный вестник. — 2017. — № 1. — С. 30.
- Червонова И.В. Эффективность применения спорообразующего пробиотика в технологии выращивания цыплят-бройлеров // Инновации в АПК: проблемы и перспективы. — 2017. — № 1. — С. 136-141.
- Данилова А.А., Ратошный А.Н. Пробиотики в кормлении цыплят-бройлеров // Научное обеспечение агропромышленного комплекса. — 2018. — С. 288-291.
- Здоровый кишечник – залог эффективности современного птицеводства // Птица и птицепродукты. – 2019. — № 3. – С.32-33.
- Манукян В., Ленкова Т., Егоров И. Ферментативный пробиотик в кормлении бройлеров // Животноводство России. — 2018. — № 6. — С. 11-12.
- Царук Л.Л. Пробиотик Лактисан в кормлении цыплят-бройлеров // Сельское хозяйство — проблемы и перспективы. – Гродно, 2019. — С. 266-273.
- Гурциева М.С., Калоев Б.С. Применение ферментативного пробиотика в кормлении цыплят-бройлеров // Вестник научных трудов молодых учёных, аспирантов, магистрантов и студентов ФГБОУ ВО «Горский государственный аграрный университет». — 2018. — С. 250-252.
- Курманаева В., Бушов А. Биопрепараты в рационах цыплят-бройлеров кросса «Смена-7″// Птицеводство. — 2012. — № 1. — С. 31-33.
- Гиндуллин, А.И., Тремасов М.Я., Белецкий С.О. Пробиотики на основе Lactobacterium и Bacillus при Т- 2 токсикозе цыплят // Птица и птицепродукты. — 2014. — № 3. — С. 44-46.
- Овчарова А.Н., Петраков Е.С. Физиологические показатели и продуктивность цыплят- бройлеров при использовании пробиотического препарата на основе бацилл // Проблемы биологии продуктивных животных. — 2018. — № 1. — С. 94-101.
- Степанова А.М., Неустроев М.П. Разработка и применение препарата из штаммов Bacillus subtilis в птицеводстве: монография. — Новосибирск, 2019. — 84 с.
- Хитрый Ф.Н., Прохоров О.Н. Применение пробиотика «Бацелл-М» при кормлении цыплят-бройлеров в условиях напольного содержания // Агропромышленному комплексу — новые идеи и решения: материалы XIX внутривузовской научно-практической конференции. — Кемерово: Кузбасская государственная сельскохозяйственная академия, 2020. — С. 143-146.
- Шендеров Б.А. Пробиотики, пребиотики и синбиотики. Общие и избранные разделы проблемы // Пищевые ингредиенты. Сырье и добавки. — 2005. — № 2. — С. 23-26.
- Windisch W., Schedle К., Plitzner C., Kroismayr A. Use of phytogenic products as feed additives for swine and poultry // J. anim. sci. — 2008. — Vol. 86. — E140-E148 (DOI: 10.2527/jas.2007-0459).
- Collins D.M., Gibson G.R. Probiotics, prebiotics and synbiot-ics: Approaches for modulating the microbial ecology of the gut // American Journal of Clinical Nutrition. — 1999. — Vol. 69. — PP. 1052S-1057S.
- Delaquis P.J., Stanich K., Girard B., Mazza G. Antimicrobial activity of individual and mixed fractions of dill, cilantro, coriander and eucalyptus essential oils // International Journal of Food Microbiology. — 2002. — 74. — РР. 101-109
- Huyghebaert G., Ducatelle R. R., Immerseel F. An update on alternatives to antimicrobial growth promoters for broilers // Veterinary Journal. — 2001. — Vol. 187. — PP. 182-188.
- Chen W.L., Liang J.B., Jahromi M.F., Abdullah N., Ho Y.W., Tu-farelli V. Enzyme treatment enhances release of prebiotic oligosaccharides from palm kernel expeller // BioResources. — 2015. — Vol. 10. — PP. 196-209.
- Mountzouris K.C., Tsirtsikos P., Kalamara E., Nitsch S., Schatzmayr G., Fegeros K. Evaluation of the efficacy of a probiotic containing Lactobacillus, Bifidobacterium, Enterococcus and Pediococcus strains in promoting broiler performance and modulating cecal microflora composition and metabolic activities // Poultry Science. — 2007. — Vol. 86. — PP. 309-317.
- Осепчук Д.В., Скворцова Л.Н., Пышманцева Н.А.и др. Пребиотик в кормлении цыплят-бройлеров // Сборник научных трудов Северо-Кавказского научно-исследовательского института животноводства. — 2013. — № 1. — С. 133-136.
- Кочиш И.И., Мясникова О.В., Мартынов В.В., Смоленский В.И. Микрофлора кишечника кур и экспрессия связанных с иммунитетом генов под влиянием пробиотической и пребиотической кормовых добавок // Сельскохозяйственная биология. — 2020. — № 2. — С. 315-327.
- Буряков Н.П., Бурякова М.А., Миронов М.М. Показатели обмена веществ и продуктивности цыплят-бройлеров при использовании в кормлении пребиотика «Сель Ист» // Российский ветеринарный журнал. — 2015. — № 1. — С.13-15.
- Шацких Е.В., Нуфер А.И., Галиев Д.М. Эффективность выращивания цыплят-бройлеров при использовании в рационе полисахаридов клеточной стенки дрожжей взамен кормовых антибиотиков // Мировое и российское птицеводство: состояние, динамика развития, инновационные перспективы: материалы XX Международной конференции. Сергиев Посад, 2020. — С.368-371.
- Кузьменко П.М. Синбиотик «Синвет» ‒ препарат нового поколения для повышения продуктивности цыплят-бройлеров // Актуальные проблемы интенсивного развития животноводства. – 2014. — № 2. – С. 46-48.
- Юрина Н.А, Омельченко Н.А., Осепчук Д.В. Результаты производственной проверки изучения синбиотической кормовой добавки в рационах для мясных цыплят // Сборник научных трудов Краснодарского научного центра по зоотехнии и ветеринарии. – 2016. — № 5. – С. 87-88.
- Буяров В.С., Метасова С.Ю. Эффективность применения синбиотика «ПроСтор» в птицеводстве // Ученые записки Казанского университета. Серия Естественные науки. – 2019. – С. 408-421.
- Чиков А.Е., Юрина Н.А., Омельченко Н.А. Применение многофункциональной кормовой добавки в мясном птицеводстве // Сборник научных трудов Краснодарского научного центра по зоотехнии и ветеринарии. – 2014. — № 5. – С.7-10.
- Осепчук Д.В., Юрина Н.А., Омельченко Н.А. Изучение синбиотической кормовой добавки в рационах для мясных цыплят // Сельскохозяйственный журнал. – 2016. — № 3. – С.125-127.
- Фисинин В.И., Ушаков А.С., Дускаев Г.К., Казачкова Н.М., Нуржанов Б.С., и др. Изменение иммунологических и продуктивных показателей у цыплят-бройлеров под влиянием биологически активных веществ из экстракта коры дуба // Сельскохозяйственная биология. — 2018. — Т. 53. — № 2. — С. 385-392.
- Козырев С.Г., Гусова Б.Г., Уртаева А.А., Сеидов И.С., Джагаев А.А. Использование фитобиотиков при выращивании бройлеров // Достижения науки и техники АПК. – 2018. – Т.32. № 7. – С.56-58.
- Ахмедханова Р.Р., Алиева С.М., Гитинов М.М. Целесообразность применения водорослей в птицеводстве // Научный фактор интенсификации и повышения конкурентоспособности отраслей АПК: матер. Междунар. науч.-практ. конф., посвященной 80-летию факультета биотехнологии Дагестанского государственного аграрного университета имени М.М. Джамбулатова (Махачкала, 17-18 мая 2017 г.). — Махачкала, 2017. — С. 21-25.
- Буяров В.С., Червонова И.В., Меднова В.В., Ильичева И.Н. Эффективность применения фитобиотиков в птицеводстве (обзор) // Вестник аграрной науки. – 2020. — № 3. – С.44-60.
- Singh, Jaswinder, A. P. S. Sethi, S.S. Sikka Effect of Cinnamon (Cinnamomum cassia) Powder as a Phytobiotic Growth Promoter in Commercial Broiler Chickens // Animal nutrition and feed technology. — 2014. — Vol. 14. — Issue 3. — PP. 471-479 (DOI: 10.5958/0974-181X.2014.01349.3).
- Ткаченко К.Г., Казаринова Н.В., Музыченко Л.М., Шургая А.М., Павлова О.В., Сафонова Н.Г. Санационные свойства эфирных масел некоторых видов растений // Растительные ресурсы. — 1999. — Т. 35, вып. 3. — С. 11-24.
- Семенова Е.Ф., Веденеева А.С., Жужжалова Т.П. Скрининг антимикробной активности жидких экстрактов стевии Ребо (Stevia rebaudiana Bertoni) // Вестник Воронежского госуниверситета. Серия «Химия. Биология. Фармация». — 2010. — № 1. — С. 121-126.
- Жученко Е.В., Семенова Е.Ф., Маркелова Н.Н., Шпичка А.И., Князькова А.А. Влияние эфирных масел на микроорганизмы различной таксономической принадлежности в сравнении с современными антибиотиками. Сообщение III. Действие масел лаванды, розового дерева, эвкалипта, пихты, на некоторой грамотрицательной бактерии // Известия высших учебных заведений. Приволжский регион. Естественные науки. – 2015. — № 1 (9). — С. 30-41.
- Основы ветеринарной санитарии: учебное пособие / Н. В. Сахно, В. С. Буяров, О. В. Тимохин, Ю. А. Ватников. — Санкт-Петербург: Лань, 2017. — 172 с. — ISBN 978-5-8114-2407-8. — Текст: электронный // Лань: электронно-библиотечная система. — URL: https://e.lanbook.com/ book/ 91284 (дата обращения: 25.11.2020). — Режим доступа: для авториз. пользователей.
- Багно О.А., Прохоров О.Н., Шевченко С.А. и др. Фитобиотики в кормлении сельскохозяйственных животных // Сельскохозяйственная биология. — 2018. — № 4. — С. 687-697.
- Шмакова С.В., Ланцева Н.Н. Перспектива использования фитобиотика в рационах цыплят-бройлеров // Основы и перспективы органических биотехнологий. — 2020. — № 1. — С. 48-51.
- Ланцева Н.Н., Мартыщенко А.Е., Швыдков А.Н. Влияние функциональных свойств пробиотиков и фитобиотиков на показатели продуктивности цыплят-бройлеров // Фундаментальные исследования. 2015. — № 2. – С. 1417-1423.
- Лапкина Е.З., Тирранен Л.С. Использование травяной добавки на основе растений крапивы двудомной (Urtica dioica L.) и звездчатки средней (Stellaria media L.) в кормлении японских перепелов // Вестник КрасГАУ. — 2017. — № 2(125). — С.39-44.
- Кишняйкина Е.А., Жучаев К.В. Влияние экстракта чабреца на продуктивные качества и сохранность цыплят-бройлеров кросса ISA F-15 // Вестник НГАУ. – 218. — № 4(49). – С.74-80.
- Сахно О.Н., Буяров В.С. Эффективность промышленного выращивания цыплят-бройлеров с применением препаратов «Алекс» и «Эмицидин» // Аграрный вестник Верхневолжья. – 2018. — № 3. – С. 114-123.
- Игнатович Л.С. Влияние применения компонентных кормовых добавок, изготовленных с применением травяной муки из тысячелистника обыкновенного, на продуктивность кур-несушек, качество производимой продукции (яиц) и конверсию корма // Дальневосточный аграрный вестник. — 2017. -№ 2(42). — С. 75-81.
- Шацких Е.В., Нуфер А.И. Продуктивные качества цыплят-бройлеров при использовании в рационе фитобиотической кормовой добавки // Птица и Птицепродукты. – 2020. — № 5. – С.39-41.
- Пат. 2477614 Российская Федерация, МПК51, А23К 1/16. Cпособ получения комплексной биологически активной кормовой добавки для сельскохозяйственных животных, птицы и рыбы с пробиотиками и лекарственными травами / В.Г. Правдин, Л.З. Кравцова, Н.А. Ушакова; заявитель и патентообладатель Общество с ограниченной ответственностью «Научно-технический центр биологических технологий в сельском хозяйстве» (RU). — № 2011128157/13, заявл. 11.07.2011; опуб. 20.03.2013, Бюл., № 8. – 10 с.
- Справочник по выращиванию бройлеров ROSS, 2018. – 140 c. Режим доступа: https://ru.aviagen.com/assets/Tech_Center/BB_ Foreign_ Language _Docs/RUS_TechDocs/Ross-BroilerHandbook2018-RU.pdf (дата обращения: 30.11.2020).
- Методика проведения научных и производственных исследований по кормлению сельскохозяйственной птицы. Молекулярно-генетические методы определения микрофлоры кишечника /И.А. Егоров, В.А. Манукян, Т.Н. Ленкова и др. – Сергиев Посад, 2013. – 51 с.
- Engels C., Schieber A., Gänzle M.G. Inhibitory spectra and modes of antimicrobial action of gallotannins from mango kernels (Mangifera indica L.). Appl. Environ. Microb., 2011, 77(7): 2215-2223 (doi: 10.1128/AEM.02521-10).
- Растопшина Л.В. Способы повышения продуктивности цыплят-бройлеров / Л.В. Растопшина // Сибирская наука — проблемы и перспективы технологии производства и переработки продукции животноводства. Сб. научных трудов I региональной юбилейной научно-практической конференции, посвященной 70-летию биолого-технологического (зооинженерного) факультета ФГБОУ ВПО АГАУ. – Барнаул, 2013. – С. 123-127.
- Пышкина И.В. Оценка мясной продуктивности цыплят — бройлеров кросса в условиях ОАО Птицефабрика «Васильевская» Пензенской области / И.В. Пышкина // Сборник научный статей Инновационные идеи молодых исследователей для агропромышленного комплекса России. – Пенза, 2015. – С. 184-185.
- Марьина О.Н. Продуктивность цыплят-бройлеров в зависимости от используемой кормовой программы / О.Н. Марьина // Сборник научных статей по материалам Всероссийской научно- практической интернет-конференции. – Ставрополь, 2016. – С. 92-101.
- Столяров В.П., Сотникова Т.А. Продуктивность цыплят-бройлеров при разных уровнях обменной энергии в комбикорме //ИЦРОН. Новые тенденции развития сельскохозяйственных наук. Секция 19. Частная зоотехния. 2017. Режим доступа: https://izron.ru/articles/novye-tendentsii-razvitiya-selskokhozyaystvennykh-nauk-sbornik-nauchnykh-trudov-po-itogam-mezhdunaro/sektsiya-19-chastnaya-zootekhniya-tekhnologiya-proizvodstva-produktov-zhivotnovodstva-spetsialnost-0/produktivnost-tsyplyat-broylerov-pri-raznykh-urovnyakh-obmennoy-energii-v-kombikorme/ (дата обращения: 01.10.2020).
- Торшков А.А. Изменение биохимических показателей крови бройлеров при использовании арабиногалактана // Фундаментальные исследования. – 2011. – № 9-3. – С. 583-587.
- Голиков А.Н., Базанова Н.У., Кожебеков З.К. [и др.]. Физиология сельскохозяйственных животных. — М.: Агропромиздат, 1991. – 432 с.
- Казарян Р.В., Лукьяненко М.В., Бородихин А.С., Семененко М.П., Мирошниченко П.В. Исследование биохимических показателей сыворотки крови цыплят-бройлеров, выращенных с применением комплексной кормовой добавки // Новые технологии. — 2018. — № 4. — С. 209-215.
- Практикум по иммунологии / Под ред. И.А. Кондратьевой, В.Д. Самуилова. — М.: Изд-во МГУ, 2001. — 224 с.
- Зайчик А.Ш., Чурилов Л.П. Механизмы развития болезней и синдромов. — СПб.: ЭЛБИ-СПб., 2002. — 507 с.
- Конопатов Ю.В., Макеева Е.Е. Основы иммунитета и кормление сельскохозяйственной птицы. — СПб: Библиотечка практика, 2002. -120 с.
- Болотников И.А. Гематология птиц. — Л.: Наука. Ленингр. отд-ние, 1980. — 116 с.
- Шендеров Б.А. Медицинская микробная экология и функциональное питание // Микрофлора человека и животных и ее функции. – Т.1. – М.: ГРАНТЬ, 1998. – 288 с.
- Бахарева О.П., Саражакова И.М. Состав микрофлоры слепых отростков кишечника цыплят в возрасте от 1 до 63 суток // Вестник КрасГАУ. — 2009. — № 3. – С.129-135.
- Повозников Н.Г., Пустовая Н.В. Продуктивность и биохимический состав крови кур. 2013. — С. 206-219. Режим доступа: https://cyberleninka.ru /article/n/produktivnost-i-biohimicheskiy-sostav-krovi-kur/viewer (дата обращения 30.11.2020).
