Титульный лист и исполнители
РЕФЕРАТ
Отчет представлен на 73 страницах печатного текста, содержит 15 таблицы, 37 рисунков, 57источника.
СЕМЕНА ОВОЩНЫХ КУЛЬТУР, СОРНЫЕ РАСТЕНИЯ, АЛЛЕЛОПАТИЯ, ЭНЕРГИЯ ПРОРАСТАНИЯ, ЛАБОРАТОРНАЯ ВСХОЖЕСТЬ, ПРЕДШЕСТВЕННИК, КАРТОФЕЛЬ, МОРКОВЬ, СВЁКЛА СТОЛОВАЯ, УРОЖАЙНОСТЬ, ТОВАРНЫЕ КАЧЕСТВА.
Объекты исследования:сорта картофеля Танай, Кемеровчанин, моркови Шантанэ 2461, Самсон, свёклы столовойсорта Детройт и гибрида Боро F1.
Предмет исследований: технология органического выращивания овощных культур, основанной на принципах аллелопатии.
Цель работы:разработка и апробация технологии органического выращивания овощных культур, основанной на принципах аллелопатии.
Задачи исследований:
– научное обоснование взаимодействия растений в агрофитоценозах (анализ научно-технической литературы, нормативно-технической документации);
– изучение аллелопатического взаимодействия семян овощных культур и сорных растений на начальных этапах онтогенеза (лабораторные исследования);
– изучение аллелопатической активности послеуборочных растительных остатков сельскохозяйственных культур на посевные качества и первоначальный рост проростков овощных культур (лабораторные исследования);
– подбор оптимальных предшественников для овощных культур с учетом их влияния на засоренность посевов, урожайность и качество продукции (производственный полевой опыт);
– разработка практических рекомендаций по поддержанию почвенного плодородия, обеспечивающих оптимизацию фитосанитарного состояния посевов (засоренность), высокие урожаи и качество овощной продукции при минимальных затратах на выращивание, а также возможности экологических способов ведения отрасли.
ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
Аллелопатия – свойство одних организмов (микроорганизмов, грибов, растений, животных) выделять химические соединения, которые тормозят или подавляют развитие других.
Всхожесть и энергия прорастания– это процент нормально проросших семян в пробе, взятой для анализа.
Глубина посева – расстояние от поверхности почвы до нижней части высеваемых семян. Оптимальная глубина посева та, при которой обеспечивается наибольшая полнота всходов равномерных и неослабленных.
Норма высева– количество всхожих семян или их масса с учетом посевной годности, высеваемых на 1 га, обеспечивающая нормальные по густоте всходы и хорошую урожайность. Выражается числом всхожих семян (млн, тыс. шт.) и массой семян (кг, ц) на 1 га.
Период вегетации (вегетационный период)– время, в течение которого возможен рост растений. Начиная от прорастания семян или, например, распускания почек, заканчивая образованием семян или прекращением роста вегетативных органов растения.
Посев(посадка)– размещение семян, зерновок, клубней или рассады по площади поля на определенную глубину с учетом обеспечения растений оптимальной площадью питания.
Сорт–это группа растений, сходных по морфологическим признакам, биологическим свойствам, созданных человеком для возделывания в конкретной природно-климатической зоне с целью получения высокой урожайности, качества продукции с наименьшими затратами.
Онтогенез – это индивидуальное развитие организма.
НОРМАТИВНЫЕ ССЫЛКИ
– ГОСТ 12038-84 Определение энергии прорастания и лабораторной всхожести семян;
– Фенологические наблюдения проводили по методике Госсортоиспытания сельскохозяйственных культур;
– ГОСТ 7194-81 Картофель свежий. Правила приемки и методы определения качества (с Изменениями № 1, 2, 3);
– ГОСТ 31640-2012 Методы определения содержания сухого вещества;
– ГОСТ 26226-95 Корма, комбикорма, комбикормовое сырье. Методы определения сырой золы;
– ГОСТ 8756.22-80 Продукты переработки плодов и овощей. Метод определения каротина (с Изменениями N 1, 2);
– ГОСТ ISO 2173-2013 Продукты переработки фруктов и овощей. Рефрактометрический метод определения растворимых сухих веществ (Переиздание).
ВВЕДЕНИЕ
Защита посевов возделываемых сельскохозяйственных культур от сорных растений является одной из важных задач научного земледелия. Борьба с сорной растительностью в основном зависит от использования синтетических гербицидов.
В настоящее время имеется большое количество синтетических гербицидов. Однако не смотря на успешный контроль сорняков в посевах культурных растений, некоторые их виды адаптировались к некоторым химическим соединениям гербицидов. Это требует постоянного, примерно через 2-3 года, применения новых гербицидов. Загрязнение окружающей среды, опасные для здоровья людей продукты сельскохозяйственного производства являются следствием использования гербицидов синтетической природы [42].
Показатель использования пестицидов на одного человека в мире равен 400-500 г, в то время как в России и США он достигает 2 кг. Сорные растения являются причиной уменьшения сельскохозяйственного урожая на 13,2%, следственно засоренные посевы приводят к экономическим потерям. В целях уменьшения негативного действия сорняков на посевы культурных растений аграриями используются химические средства защиты – пестициды, гербициды, инсектициды, фунгициды и др. Но, применение химических средств пагубно сказывается на природных экосистемах.
Обработка гербицидами посевов сельскохозяйственных культур тормозит и губит не только сорняки, но угнетает рост и развитие культурных растений и сказывается на безопасности продуктов, получаемых от культурных растений. Закон о защите качества пищевых продуктов, который приняли передовые страны, требует регистрации пестицидов и гербицидов синтетического происхождения.
Следствием вышесказанного явилось использование классических подходов химического синтеза производителями средств защиты растений. Другие производители, напротив, остановили свой выбор на использовании соединений естественного происхождения. Природные продукты исторически служат более ценным материалом в качестве химической основы получения средств защиты растений.
В процессе эволюции среди конкурирующих видов возникло большое разнообразие растений и микроорганизмов, обладающих широким спектром химического состава, потенциал которых не используется должным образом.
Интерес к растениям как источника естественных гербицидов был незначительным, хотя многие образуемые растениями вторичные метаболиты обладают сильной фитотоксичностью. Так, например, растительная жирная кислота пеларгоновая используется для борьбы с сорной растительностью в газонах [36]. В настоящее время многие биологически активные вещества природного происхождения, остаются не изученными, в связи с этим интерес к ним не утихает.
Аллелохимические вещества растений и промышленные гербициды имеют схожий механизм действия. В связи с этим данные вещества можно использовать в качестве биогербицидов. Аелопатически активные соединения являются водорастворимыми, что облегчает их использование без дополнительных поверхностно-активных веществ [56]. В следствие малоизученности данных веществ, в настоящее время они не используются широко в промышленности.
В исследованиях Macias (2014) доказано, что в растении-доноре (Secale cereale L.) образуются бензоксазиноны и их производные, которые ингибируют рост сорняков (Avena fatua L.) [47].
Исследования M. Schulz (2013) показали, что с 1 гектара ржаных остатков можно выделить около 20 кг бензоксазинонов, а из почвы, в которой разложены ржаные остатки – до 5 кг [53].
В 1995 году Чунг и Миллер исследовали люцерну на предмет ингибирующих свойств. В результате исследований выяснено, что водная вытяжка из сухих надземных остатков люцерны угнетающе действует на рост таких растений-сорняков, как костёр ржаной (Bromus secalinus L.), щетинник Фабера (Setaria faberi L.), щирица запрокинутая (Amaranthus retroflexus L.) и марь белая (Chenopodium album L.). Отмечено также ингибирующее действие порошка из высушенных листьев и стеблей люцерны в отношении прорастания ползучих сорных растений. Но водный экстракт люцерны проявлял ингибирующие свойства не только в отношении сорных растений, но и против культурных, например – экстракт люцерны замедлял рост проростков кресс салата (Lepidium sativum L.).
Современное сельское хозяйство совмещает в себе классическую систему обработки почвы и интенсивное использование природных и промышленных ресурсов. В районах подверженных водной и ветровой эрозии природоохранным сельским хозяйством используется технология NoTill, которая подразумевает под собой нулевую обработку почвы с применением мульчирования и обязательное ведение севооборота. Такой подход позволяет сохранить почвенную влагу и плодородие [30]. Однако, использование нулевых или минимальных систем обработки почвы приводит не только к появлению, но и развитию одно- и многолетних сорных растений [29]. Подавить рост сорняков можно при помощи использования аллелопатического воздействия растений. Таким образом, аллелопатия выступает важным составляющим при планировании и управлении сельскохозяйственными посевами [39].
В природоохранном сельском хозяйстве для снижения количества сорных растений в посевах могут быть использованы сорта культур или сорняки-сорбенты, которые обладают аллелопатической активностью [48].В севообороты необходимо вводить культурные растения, являющиеся стойкими к аллелохимикалиям предшественников.
В исследованиях Qasem and Foy, (2001) выявлено ингибирующее свойство эфирных масел майорана и базилика лимонного против щирицы. Эфирные масла корицы, тимьяна красного и гвоздики вызывают выход электролитов из листьев лекарственного одуванчика, который влечет за собой гибель клеток растения. Отмечено подавляющее свойство одних сорных растений на рост и развитие других. Таким образом, сделано заключение о возможности использования культурных и сорных растений в качестве сырья для производства органических гербицидов [50].
Эфиромасличные растения при заделывании в почву или мульчировании вырабатывают эфирные масла, обладающие высокой фитотоксичностью и угнетающие рост сорняков в посевах культурных растений. Например, эфирные масла, полученные путем экстрагирования из различных сортов базилика, подавляют рост семян и развитие корневой системы обыкновенной мари и куриного проса.
Подтверждением этой гипотезы служит большое количество исследований по применению эфироносов против сорных растений. По зарубежным данным растения, обладающие аллелохимическими свойствами, против сорняков могут применяться в качестве культуры-сидерата [52], звена севооборота [55] либо в совместных и смешанных посевах [40]. Borges et al. выяснили, что при возделывании аллелопатически активных культур в междурядьях, наблюдается наибольший аллелопатический эффект [35].
Bajwa et al. использовали растения с аллелопатическим потенциалом в междурядьях и их водные вытяжки против сорных растений [31]. Покровные культуры преимущественны в разных системах земледелия, так как могут быть мульчирующей культурой и подавлять всходы сорняков. Известно, что горошек (Vicia), как и другие представители бобовых (Fabaceae), в симбиозе с клубеньковыми бактериями Rhizobium, преобразуют азот из атмосферы в аммиак. По ходу данного процесса высвобождается ряд аллелохимикалий, угнетающие на всходы сорных растений.
Основное преимущество явления аллелопатии – на результат действия химических веществ влияет природа происхождения аллелопатического донора. Поэтому донором физиологически активных соединений может явиться как сорное, так и культурное растение[4].
Идет активный поиск вторичных соединений в растениях, проявляющие менее интенсивный эффект ингибитора на других обитателей агроэкосистем. Вторичные соединения многофункциональны и играют важную роль в межвидовой конкуренции.
В системе обработки почвы NoTill рожь и овес уменьшают количество сорняков после сбора урожая, так как пожнивные остатки данных культур содержат аллелохимически активные вещества [53]. Действенным технологическим приёмом является выращивание аллелохимически активных сортов культур, которые подавляют рост и развитие сорных растений в агроэкосистемах [32].
В исследованиях Pudelko приводятся данные об использовании полевых культур с аллелопатической активностью в качестве мульчирующего слоя. Мульча из пожнивных остатков сокращала всходы и рост сорных растений. Этот факт позволяет снизить нагрузку применения промышленных гербицидов [49].
В то же время конкретные биохимические механизмы воздействия определенных аллелопатических соединений на внутриклеточные процессы, также, как и последствия подобных воздействий, до сих пор остаются не до конца выясненными [20].
А.В. Захаренко утверждает о высокой аллелопатической активности многих видов сорняков. Так, остатки культурных и сорных растений служат источников физиологически активных веществ, которые поступают в почву. Различные части растений выделяют аллелохимикалии в субстрат, которые влияют на рост семян и развитие ростков: изменение состояния покоя семян, пролонгация или акселерация проклевывания семян и формирования вегетативных органов ростка. Аллелопатическую активность культур часто связывают с почвоутомлением. После многих аллелопатически активных растений в почве не остается вредных, фитотоксичных соединений [10].
Аллелопатическое влияние растений друг на друга играет ключевое значение при разработке и обосновании различных систем земледелия. В технологии органического производства исключены технологические операции применения синтезированных препаратов.
Цель исследований:разработка и апробация технологии органического выращивания овощных культур, основанной на принципах аллелопатии.
Задачи исследований:
– научное обоснование взаимодействия растений в агрофитоценозах (анализ научно-технической литературы, нормативно-технической документации);
– изучение аллелопатического взаимодействия семян овощных культур и сорных растений на начальных этапах онтогенеза (лабораторные исследования);
– изучение аллелопатической активности послеуборочных растительных остатков сельскохозяйственных культур на посевные качества и первоначальный рост проростков овощных культур (лабораторные исследования);
– подбор оптимальных предшественников для овощных культур с учетом их влияния на засоренность посевов, урожайность и качество продукции (производственный полевой опыт);
– разработка практических рекомендаций по поддержанию почвенного плодородия, обеспечивающих оптимизацию фитосанитарного состояния посевов (засоренность), высокие урожаи и качество овощной продукции при минимальных затратах на выращивание, а также возможности экологических способов ведения отрасли.
Методология и методы исследований. В качестве методов исследования использовали классические способы биоанализа. В лабораторных условиях получены водные экстракты надземных частей сорных растений. Производственные испытания проведены к КФХ «Башмаков С.А.» Прокопьевского района Кемеровской области.
Результаты исследований докладывались на всероссийских и международных научно-практических конференциях (РИНЦ), представлены в следующих публикациях (в журналах, рекомендованных ВАК):
1. ЕгушоваЕ.А. Yield and quality of root crops using organic technology/ Е.А. Егушова, О.В. Анохина // International agricultural journal. – 2020. – Vol.63. – № 6. – P.225-232.
2. Анохина О.В. Влияние предшественников на засоренность посевов корнеплодов при применении органической технологии / О.В. Анохина, Е.А. Егушова, Д.Е. Старикова // Успехи современного естествознания. – 2020. – № 12. – С. 7-11.
3. Егушова Е.А. Влияние предшественника на урожайность свёклы столовой в условиях лесостепи Кемеровской области / Е.А. Егушова, Д.Е. Старикова // V Всероссийская (национальная) научная конференция «Роль аграрной науки в устойчивом развитии сельских территорий». – 2020. – С. 34-36.
3. Старикова Д.Е. К вопросу о развитии органического земледелия / Д.Е. Старикова, Е.А. Егушова // XVII Международная научно-практическая конференция «Пища.Экология. Качество». – 2020. – С.618-620.
4. Анохина О.В. Влияние предшественника на урожайность картофеля в условиях Кемеровской области / О.В. Анохина, А.В. Седун // XIX Международная научно-практическая конференция «Современные тенденции сельскохозяйственного производства в мировой экономике». – 2020. – С. 254-258.
6. Старикова Д.Е. Влияние предшественников на урожайность моркови сорта Шантанэ 2461 / Д.Е. Старикова, Е.А. Егушова // XIX Международная научно-практическая конференция «Современные тенденции сельскохозяйственного производства в мировой экономике». – 2020. – С. 358-361.
1 ОБЗОР ЛИТЕРАТУРЫ
Все живое на земле взаимосвязано. Для теоретического и практического земледелия основным вопросом является взаимодействие растений с окружающей средой.Сообщество культурных растений, посаженных человеком, и сорных растений, произрастающих спонтанно представляют собой агрофитоценоз. Сорные растения, как компонент агрофитоценоза, являются неотъемлемой его частью. Полностью избавиться от сорных растений невозможно, так как уничтожение компонента агрофитоценоза ведет к нарушению системы взаимодействий внутри ценоза, что прогнозирует его трансформацию, которая предполагает разрушение целостности и неоправданные затраты на восстановление первоначальных связей.
Впервые четкое понятие влияние растений на среду было сформировано швейцарским ботаником А. Деконделем, как необходимость чередования сельскохозяйственных культур в практике земледелия. Термин «аллелопатия» (от греч. аllelon – взаимно и pathos – страдание) был введен в 1937 году австрийским физиологом растений Гансом Молишом[21].
В процессе своей жизнедеятельности растения выделяют в окружающую среду различные органические соединения, обладающие физиологической активностью.Таким образом вокруг растения формируется «защитная среда» из биохимически активных соединений, оказывающая как положительное, так и отрицательное воздействие на соседние растения. Обычно одно растение является донором, выделяющим биологически активные вещества, а другое акцептором, которое подвергается воздействию данных веществ.Вещества, выделяемые растением-донором, могут иметь газообразную форму или растворяться в водных системах. В связи с этим для аллелопатии наибольший интерес представляют газообразные и водорастворимые вещества[2, 5].
Компоненты растительных сообществ отличаются широким разнообразием, в следствие чего они могут иметь различные формы взаимоотношений и оказывать как прямое, так и косвенное воздействие друг на друга.К одной из таких форм взаимоотношений в растительных биоценозах относитсяаллелопатия.Она представляет собой круговорот физиологически активных вешеств (колинов),регулирующих внешние и внутренние взаимодействия, обновление, возобновление и смену растительного покрова в биогеоценозе. В качестве растений-доноров в агрофитоценозе могут выступать как культурные, так и сорные растения. Аллелопатический эффект зависит от химического соединения, выделяемого аллелопатическим агентом в среду[4].
Сорные растения в небольшом количестве оказывают положительный эффект на аллелопатический и общий биологический режим почвы, способствуя развитию микроорганизмов и почвенной фауны, таким образом стимулируя разложения растительных остатков. В процессе разложения растительных остатков в почву выделяются различные соединения, обладающие ингибирующим и стимулирующим воздействием.
В Ставропольском государственном аграрном университете в лабораторных условиях изучали аллелопатическую активность вытяжек сорных растений осота полевого (Sonchus arvensis L.), вьюнка полевого(Сonvolvulus arvensis L.), плевела опьяняющего (Lolium temulentum L.), овсюга обыкновенного (Avena fatua L.) и почву из их ризосферы. Семена озимой пшеницы сорта Зерноградка 9 использовали в качестве тест-объекта.
Учеными установлено, что наибольшую аллелопатическую активность по отношению к тестируемому объекту проявлялLolium temulentum L., в частностиего экстракты, полученные из надземной части, под воздействием которых лабораторная всхожесть семян пшеницы снижалась на 36 % по сравнению с контрольным образцом.Экстракт из надземной части Avena fatua L.снижал лабораторную всхожесть семян пшеницы на 28%. Однако на почве, взятой из ризосферы, всхожесть семян тест-объекта уменьшилась всего на 7 % по сравнению с контролем. Сonvolvulus arvensis L.проявлялнаименьшую аллелопатическую активность. Экстракт из корней Сonvolvulus arvensis L.снижал всхожесть семян пшеницы всего на 2 %.
Водорастворимые ингибиторы прорастания семян у Sonchus arvensis L. концентрируются в надземной части растения, что способствует значительному снижению всхожести семян, но при этом экстракты из корней и почва из ризосферы уменьшаливсхожесть семян тест-объекта на 5% и 8% соответственно.
В результате проведенных экспериментов ученые отмечают наибольшую аллелопатическую активность у экстрактов, полученных из надземной части сорных растений. Ингибирующая активность водорастворимых вытяжек физиологически активных веществ из корней и почвы ризосферы проявилась в меньшей степени[14, 15].
Известно, что аллелопатическая активность многих культурных растений достаточно высока. В процессе роста и развития они выделяют через корневую систему в почву биологические ингибиторы, которые способны существенно угнетать рост и развитие последующих в севообороте растений.
Д.Н. Балеевым, М.И. Ивановой (2011) выявлено, что представитель семейства сельдерейные – растения корневого сельдерея, обладаютзначительной аллелопатической активностью. Доля нормально развитых проростков тестовых культур (редис и салат) была в пределах 1,2 и 0%. В результате проведенных исследований, отмечено, что растения петрушки корневой также являются аллелопатически агрессивной культурой. Процент нормально развитых проростков редиса составлял 2,3%, салата – 3,7%.
Авторы отмечают, что на результаты исследований существенное влияниеможет оказывать специфика тестовой культуры. Растения сельдерея корневого в возрасте трех месяцев сильно угнетали салат, доля проростков выше 10 см непревышала 2,4%. Однако при использовании в качестве тестовой культуры редиса процент нормальных проростков был существенно выше – 36,1%. По мнению исследователей, сильная аллелопатическая активность этих культур связана с эфирными маслами, которые выделяются при их выращивании.
Учеными в различных исследованиях установлено, что в зависимости от тестовой культуры капуста относится к культурам, обладающим слабой (салат –77%) или средней (редис –60,2%) аллелопатической активностью, а корневой сельдерей и петрушка являются аллелопатически агрессивными культурами. При возделывании этих культур возможно развитие почвенного утомления, что необходимо учитывать при использовании их в качестве предшественника.
Аллелопатия является мощным природным фактором жизни растений, что и определяет актуальность изучения этого явления.
Бухаровым А.Ф. (2011) показана роль аллелопатического влияния овощных сельдерейных культур на прорастание семян редиса, салата, кресс-салата и горчицы сизой. В результате исследований выявлено, что под влиянием экстракта из семян сельдерея корневого тест-объекты: японская капуста и горчица сизая снижали всхожесть семян незначительно соответственно на 1,0 и 4,0% в среднем. Наиболее активно, на вытяжку из семян сельдерея корневого реагировал кресс-салат, при этом прорастания семян за годы исследований не отмечено.
Невысокую аллелопатическую активность проявляли семена укропа. Экстракт из семян петрушки корневой умеренно снижал всхожесть семян редиса, салата (на 9,0-12,0%), пастернакза годы исследований показал стабильное угнетение прорастания семян тест-культур. Наибольшее угнетение отмечено на семенах японской капусты, где процент прорастания составил 86,0%, что ниже контроля на 12,0%.
Ученые из Ставропольского ГАУ изучали аллелопатическое влияние растительных остатков озимой пшеницы на энергию прорастания, всхожесть, и темпы роста проростков озимого рапса. В исследованиях концентрация настоя из растительных остатков озимой пшеницы в растворе составляла 0, 25, 50, 75 и 100%.
На третий день при определении энергии прорастания семян наблюдалось сильное (от 34 до 43%) ингибирование процесса прорастания семян озимого рапса при всех изученных концентрациях настоя из растительных остатков озимой пшеницы. На 7-й день всхожесть семян рапса под воздействием настоя снизилась на 64-80%, что соответствует очень сильному аллелопатическому воздействию, такая же тенденция отмечена и на 11-й день наблюдений.
Также на 11-й день нормальное развитие проростков наблюдалось и при концентрации настоя 25%, при более высокой концентрации настоя растительных остатков озимой пшеницы практически полностью подавлялось развитие проростков озимого рапса. Авторы делают вывод, что при концентрации настоя растительных остатков озимой пшеницы 25% и выше наблюдается очень сильное аллелопатическое ингибирующее влияние на прорастание семян, рост корешка и развитие проростков озимого рапса.
Растительные остатки озимой пшеницы сдерживали также первоначальный рост проростков и корней озимого рапса. На 7-й день на контроле и 5-процентной концентрации настоя практически все проростки образовали семядольные листочки зелёного цвета с длиной стебелька 37,0 и 35,3 мм, длиной корешка 22,3 и 27,8 мм. Таким образом, растительные остатки озимой пшеницы ингибируют прорастание семян и первоначальный рост проростков озимого рапса при любом количестве их присутствия в растворе питательной среды. Слабое аллелопатическое воздействие начинает проявляться при концентрации настоя 5 и 10%, при концентрации 20% и выше проявляется сильное и очень сильное воздействие[6].
К химическим агентам, проявляющималлелопатическое действие относятся: фенольные соединения, продукты белкового распада, спирты, альдегиды, органические кислоты,оксикарбоновые кислоты, метаболиты микроорганизмов, антибиотики, терпены и другие жирорастворимые вещества.
На прорастание и рост культурных растений могут влиять семена сорных растений. В процессе борьбы с сорной растительностью важную роль играют знания закономерностей химического взаимодействия растений.Данные познания позволяют спрогнозировать их численность и снизить использование средств химической защиты культурных растений.
Г.Ш. Турсумбекова изучала аллелопатическое воздействие 10 видов вытяжек сорных растений на всхожесть семян и морфометрические показатели проростков зерновых культур. В качестве тест-культуриспользовались семена и проростки зерновых культур – озимой ржи, яровой пшеницы, овса, ячменя [20].
В процессе исследования установлено, что максимальный ингибирующийэффект проявляют вытяжки из мари белой и ярутки полевой. Максимальное ингибирование прорастания семян овса зафиксировано при использованиивытяжки мари белой (количество проросших семян – 8,6 % от контроля), минимальное ингибирование прорастания семян вытяжкой этого же сорняка наблюдалось у яровой пшеницы. Вытяжка из ярутки полевой сильнее всего ингибировала прорастание семян яровой пшеницы, меньше всего – озимой ржи.
Наименьшим аллелопатическим действием на прорастание исследуемых зерновых культур обладала вытяжка, полученная из надземной части звездчатки средней.В процессе её использования прорастание семян варьировалось от 64,7 до 83,0 %. Максимальное снижение длины зародышевого корешка отмечено при использовании вытяжки ярутки полевой от 31,2 % (яровая пшеница) до 50,0 % (озимая рожь). Наименее устойчивыми к ингибирующему воздействию вытяжек из сорных растений оказались семена овса и яровой пшеницы, а наиболее устойчивыми – семена озимой ржи.
Несмотря на значительное количество исследований, связанных с анализом влияния растительных вытяжек и экстрактов на взаимоотношения в процессе роста с другими растениями в агробиоценозах, данный процесс не раскрыт полностью. Также в практике сельскохозяйственного производства вопросам аллелопатии уделяется недостаточное внимание и открываются новыеперспективы исследований.
Изучение реакции овощных культур на выбор предшественника является актуальной задачей.
2 УСЛОВИЯ ИССЛЕДОВАНИЯ
2.1 Объекты исследований, место проведения и методики исследований
Работа состояла из 2 этапов: лабораторные исследования и производственный полевой опыт.
1 этап лабораторных исследований включал изучение взаимовлияния семян овощных культур и сорных растений на начальных этапах онтогенеза;
2 этап лабораторных исследований включал изучение аллелопатической активности послеуборочных растительных остатков яровой пшеницы и картофеля на посевные качества и первоначальный рост проростков овощных культур.
Экспериментальные исследования проведены в лаборатории кафедры агрономии, селекции и семеноводства.
Объектами исследования являлись семена овощных культур – моркови (сорт Шантанэ 2461 и Самсон), свеклы (сорт Детройт и гибрид БороF1). И вытяжки следующих видов сорных растений: Amaranthus retroflexus L., Capsellabursa-pastorisMedic., SonсhusarvensisL.Внешний види химический состав сорных растений представленына рисунках1-13.

Рисунок 1 –Amaranthus retroflexus L. (щирица запрокинутая)
Amaranthus retroflexus L. – однолетник, часто встречающееся растение (рисунок 1) со стержневым корнем, произрастающее из семян. Плодовитость одного растения может достигать 5000 семян, которые сохраняют всхожесть до 40 лет. Семена покрыты твёрдой оболочкой. Обладают периодом покоя и в год созревания не прорастают. На следующий год семена начинают прорастать весной, когда температура поднимается выше 20°С, особенно много всходов растения появляется в начале лета. Наилучшая всхожесть семян наблюдается с поверхности почвы или при глубине залегания около 0,5 см. Механические повреждения оболочки семени повышают его способность к прорастанию. При заделке глубже 5 см семена щирицы, запрокинутой всходов не дают. Цветет в июне-сентябре, плодоносит в июле-октябре. В год созревания семена почти не прорастают. Amaranthus retroflexus L. запрокинутая относится к сорным растениям.
В листьях растения Amaranthus retroflexus L. содержится вещество амарантин (рисунок 2), состоящее из агликона бетанидина и углеводной части, имеет красно-фиолетовый цвет. Амарантин принимает участие в окислительно-восстановительных реакциях фотосинтеза.
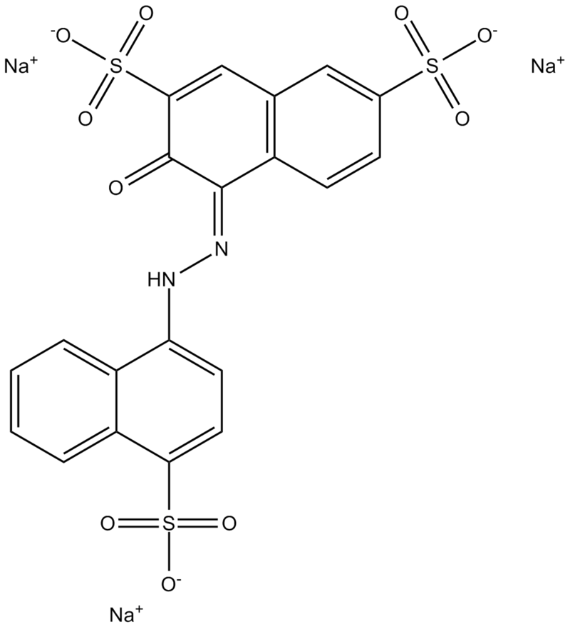
Рисунок 2 – Структурная формула амарантина содержащегося в листьях Amaranthus retroflexus L
Известно, что продукты свободнорадикальных реакций вызывают нарушение работы биологических мембран, за счет развития процессов перекисного окисления мембранных липидов [8].Амарантин ингибируюет развитие свободнорадикальных состояний. Вегетативные органы Amaranthus retroflexus L. содержат вещество лиофилизат. В исследованиях А.Н. Журавскойустановлено, что лиофилизатконцентрации раствора 1 % и 2% активизирует систему антиоксидантной защиты клеток. Но использование 4% раствора лиофилизата приводит к снижению всхожести зерна и средней массы сухого проростка [9].
В листьях Amaranthus retroflexus L. содержится фермент кислая фосфатаза (рисунок 3), который расщепляет фосфорную кислоту и помогает растениям получать из нее фосфор. Её активность зависит от развития растений и их взаимодействия с микроорганизмами-симбионтами, а также от кислотности почвы. Если среда кислая, «работает» кислая фосфатаза, а при пониженной кислотности «включается» щелочная фосфатаза [46]. Согласно исследованиям Д.К. Чернышука максимальное количество форм фермента отмечается в листьях щирицы в генеративный и сенильный периоды[27].
Рисунок 3 – Кислые фосфатазы, содержащаяся в листьях щирицы запрокинутой
А.Н. Журавская[8] установила, что семена щирицы запрокинутой содержат от 6 до 17 % масла, в котором содержится антиоксидант сквален. Скваленотносится к углеводородам тритерпенового ряда природного происхождения (рисунок 4). Молекулы сквалена связывают и обезвреживают токсические вещества, свободные радикалы, канцерогены и другие вредные соединения, которые могут разрушать клеточную мембрану и проникать внутрь клетки [16].
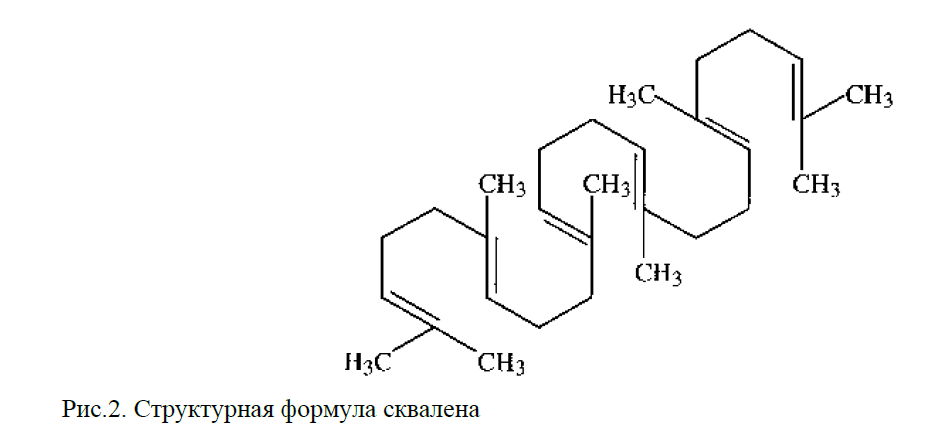
Рисунок 4– Структурная формула сквалена в семенах
Amaranthus retroflexus L
В исследованиях Н.В. Чекалиной приведены данные о том, что биологически активные вещества, содержащиеся в семенах щирицы запрокинутой оказывают ингибирующее влияние на рост и развитие семян культурных растений [26].
Пастушьясумка(Capsella Bursa-Pastoris Medic)
Пастушья сумка (рисунок 5) зимующий однолетник со стержневой корневой системой и ветвистым стеблем высотой до 40 см. Всходы появляются марте-мае, а также в августе-октябре, летнее – осенние перезимовывают. Цветет с середины апреля до осени. Пастушья сумка обладает высокой семенной продуктивностью – на одном растении может созревать от 40 тыс. до 70 тыс. семян. Жизнеспособность семян сохраняется до 35 лет, семена прорастают с глубины не более 2-3 см.

Рисунок5 –Capsella Bursa-Pastoris Medic (пастушьясумка)
В качестве защиты посевов и очистки полей от злостного сорняка, которым является пастушья сумка, в сельском хозяйстве используется прием биофумигации. Механизм дейстия биофумигации можно объяснить распадом глюкозинолатов на серосодержащие соединения – тиоцианы. Глюкозинолаты – это биологически активные вещества, которые выделяются в почву в период роста рапса, ингибируя прорастание семян и вегетативных органов размножения сорняков. ИсследователемВасильевым (2014) установлено, что, зеленая масса крестоцветных культур, заделываемая в почву, подавляет рост пастушьей сумки в пахотном слое почвы.
Пастушья сумка считается фитотоксичным растением. В ней содержатся глюкозинолаты и мирозиназа (рисунок 6,7), которые разрушают гликозиды в более биологически токсичные соединения – тиоцианаты и нитрилы. Являясь представителем семейства Brassicaceae, пастушья сумка содержит изотиоцианаты (рисунок 8), которые обладают фунгитоксическим, инсектицидным, нематицидным и фитотоксическим свойствами [54].
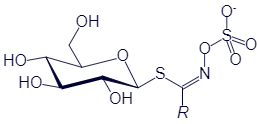
Рисунок 6– Структурная формула глюкозинолата
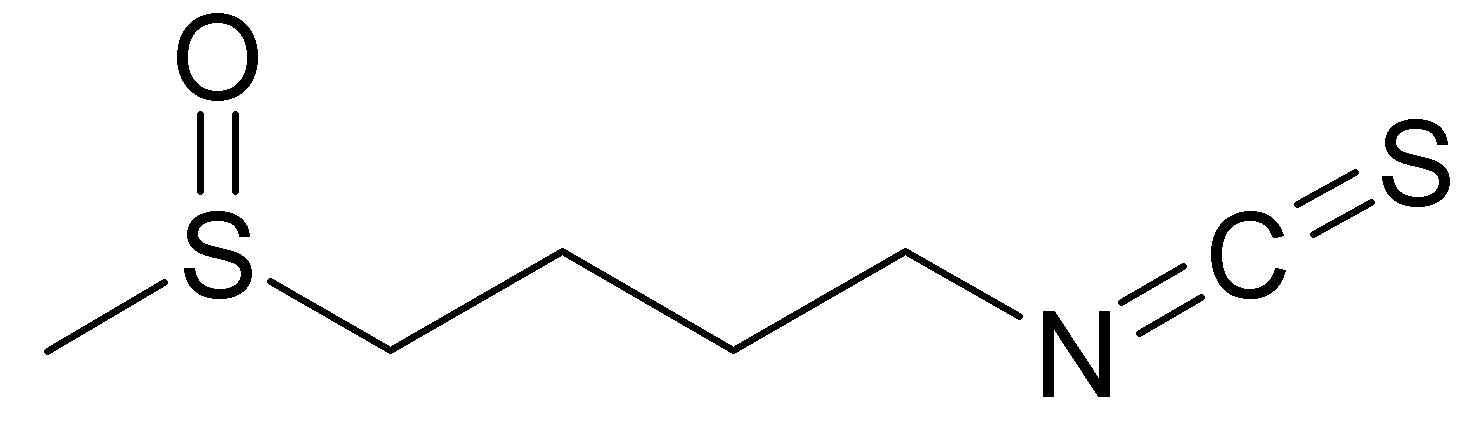
Рисунок 7 – Структурная формула мирозиназы
Рисунок 8 – Структурная формула изотиоцианатов


Рисунок 9– SonсhusarvensisL. (осот полевой)
Многолетний корнеотпрысковый сорняк (рисунок 9) со стержневым корнем, углубляющимся в почву до 100 см, горизонтальные длинные очень хрупкие корни дают большое количество придаточных почек. Стебли голые, прямые и ветвистые. Размножается семенами и вегетативно (одно растение даёт до 20 тыс. семян). Засоряет посевы всех сельскохозяйственных культур.
У SonсhusarvensisL. обнаружены водорастворимые ингибиторы прорастания семян, которые концентрируются в надземной части, поэтому можно сказать, что свежепоступившая в почву биомасса этого сорного растения вызывает ингибирование всхожести семян культурного растения примерно на 8% по сравнению с контролем. В дальнейшем снижаются рост, масса растений и развитие корешков. Ситуация меняется, если высевать семена культурных растений в почву, где растительные остатки SonсhusarvensisL. минерализовались в течении 30 суток. Так, В.Н. Передериевой с соавторамиустановлено, что разложившаяся биомасса этого сорняка благотворно влияет на всхожесть культурных растений, повышая её на 3%, т.е. разложившиеся остатки проявляют ростстимулирующие эффекты [14, 15].
Осот полевой содержит такие элементы, как кадмий и бор. Кроме того, это растение является нитрофильным растением, т.е. поглощающим азот в больших количествах[19].
Исходя из этого можно объяснить каким образом SonсhusarvensisL. оказывает ингибирующее влияние на культурные растения. Являясь нитрофилом, он лишает всходы азота, так как именно во время роста и развития молодые растения особенно нуждаются в этом элементе.
Исследование иностранных ученых Li [44] и Gomaa[38]показало, что водный SonсhusarvensisL. проявляет ингибирующее действие на всхожесть растений как других, так и собственного семейства. Проявляемый водным экстрактом, аллелопатический эффект зависит от его концентрации. Скорость прорастания семян снижалась параллельно с увеличением концентрации экстракта. Такое действие экстракта SonсhusarvensisL. связано с уменьшением клеточного деления проростков, так как фенольные аллелохимические вещества могут ингибировать деление клеток и изменять ультраструктуру клеток.
Спектрофотометрическим анализом, исследователем Gomaa[38] подтверждено наличие в растении SonсhusarvensisL.фенолов, флавоноидов (рисунок 10), дубильных веществ, сапонинов и алкалоидов (рисунок 11). Обнаруженные соединения оказывают влияние на рост многих растений [41]. Такие вещества, как сесквитерпены, флавоноиды, терпены (рисунок 12), алкалоиды, в том числе флавоноиды проявляют сильную фитотоксичность [51].Ниже приводятся химические соединения содержащиеся в растения SonсhusarvensisL.
Рисунок10 – Структурная формула флавоноидов содержащиеся в
SonсhusarvensisL.

Рисунок 11– Структурная формула алкалоидов содержащиеся в
SonсhusarvensisL.
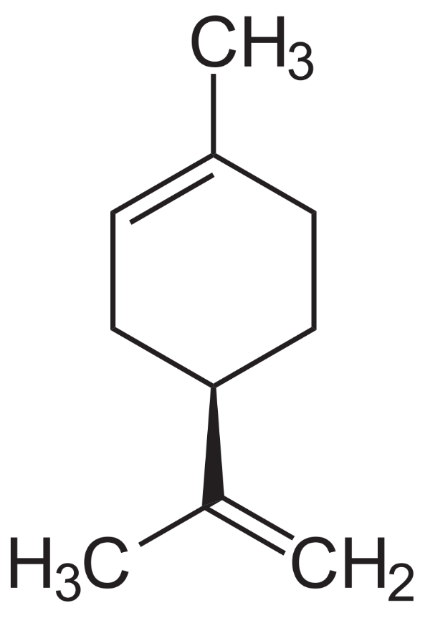
Рисунок 12 – Структурная формулатерпенов содержащиеся в
SonсhusarvensisL.
Содержание этих веществ в тканях осота объясняет ингибирующий эффект, проявляемый осотом. Кроме того, свойства, тормозящие рост других растений осотом, объясняется с высвобождением фенольных соединений [37,57].
Результаты рассмотренных исследований однозначно утверждают о содержании в SonсhusarvensisL. аллелохимических веществ, в особенности, в больших количествах растение содержит фенолы (рисунок 13). Высокий уровень вторичных метаболитов у данного вида может усиливать его аллелопатический потенциал [45].
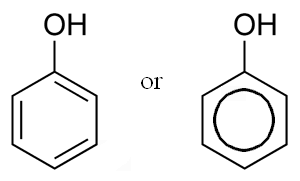
Рисунок 13 – Структурная формула фенолов содержащаяся в
Sonсhusarvensis
Обычно для изучения эффектов аллелопатических соединений проводятся лабораторные исследования. В лабораторных исследованиях нами взяты семена овощных культур 100 шт. (морковь), 50 шт. (свекла), которые проращивали в чашках Петри на фильтровальной бумаге, увлажненной водной вытяжками вегетативных органов сорных растений(Amaranthus retroflexus, CapsellaBursa-Pastoris иSonсhusarvensis). Проращивание семян проводилипри температуре 20-22°С. Контрольные образцы семян проращивалина фильтровальной бумаге, увлажненной дистиллированной водой. Опыты проводили в 4-х кратной повторности. Лабораторную всхожесть и энергию прорастания семян определяли согласно ГОСТ 12038-84.
Экстрагирование физиологически активных веществ проводили по методике А.М. Гродзинского [3]. Для этого измельчали корни и надземную часть (стебли + листья + соцветия) сорняков и настаивали в течение 24 часов при комнатной температуре в соотношениях навески и воды 1:20 (5 г сорняков на 100 мл воды) и 1:10 (10 г сорняков на 100 мл воды) (рисунок 14).

Рисунок 14 – Измельченная масса сорных растений
Аллелопатическую активность послеуборочных растительных остатков определяли методом А.П. Стаценко. Данный метод заключается в проращивание в чашках Петри семян изучаемого вида растений с последующим вычислением процента всхожести как косвенного показателя степени аллелопатического воздействия: сильная – всхожесть семян менее 50%; средняя – от 50-75%; слабая – от 75% и выше [18].
В качестве послеуборочных растительных остатков были взяты растительные остатки яровой мягкой пшеницы и картофеля.Содержание аллелохимикатов в растительных остатках яровой пшеницы и картофеля приводится на рисунках 15-16.
Аллелохимические соединения, содержащиеся в яровой пшенице, переходят в почву вследствие эксудации из корней, разложения растительных остатков и вымывания из растений водой. Растение яровой пшеницы, как и последующие его растительные остатки, содержит фенолы, которые являются наиболее распространенными водорастворимыми аллелохимическими соединениями. Они играют важную во взаимодействиях растений между собой [33, 34]. Проведенные научные исследования показывают, что фенольные соединения, попадая в почву, сорбируются, детоксифицируются или превращаются в более простые формы. СогласноY.S.Lam[43] фенолы могут подавлять рост сорняков, за счет влияния на поглощение питательных веществ. Кроме этого есть данные, где утверждается, что фенолы могут служить источником углерода для микробов.
В наших опытах в качестве предшественников для овощных культур (моркови и свеклы) рассмотрены аллелопатическая активность яровой пшеницы и картофеля. Аллелопатическая активность пшеницы приписывается гидроксамовой кислоте и родственным соединениям, а также фенольным кислотам. Гидроксамовая кислота (рисунок 15) играет важную роль в севооборотах, обладает гербицидной активность. Это очень выгодно для создания природных гербицидов.
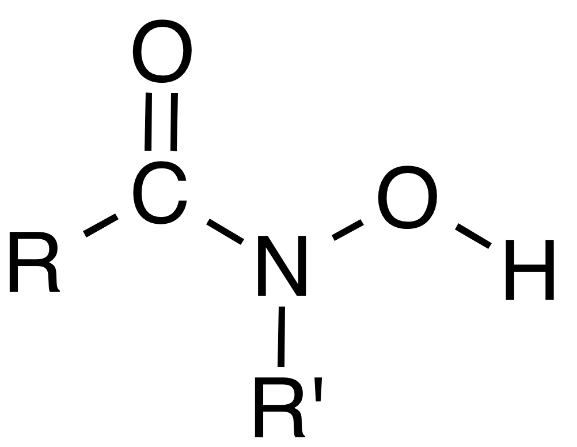
Рисунок 15– Структурная формула гидроксамовой кислоты содержащейся в растениях яровой пшеницы
В растениях пшеницы обнаружены бензоксазиноны, которые обладают сильным гербицидным действием (рисунок 16).
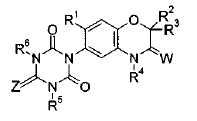
Рисунок 16– Структурная формула бензоксазинона содержащегося в растениях пшеницы
Таким образом на основе научной литературы можно сделать вывод, что растительные остатки яровой пшеницы содержат аллелохимикалии, которые обладают аллелопатической активностью.
В экстрактах листьев картофеля содержатся гликоалкалоиды, фенолы и флавоноиды. Гликоалкалоиды – основная группа биоактивных соединений видов Solanum и являются производными соланидина (агликона). Высокий уровень гликоалкалоидов в листьях – первая линия защиты от патогенов и травоядных животных. Обнаружено, что экстракты, полученные из листьев дикого картофеля, оказывают сильный ингибирующий эффект на рост и развитие проростков культурных растений. Но, экстракты из листьев культурного картофеля не проявили никаких подавляющих свойств по отношению к культурным растениям. Это объясняется содержанием в листьях картофеля гликоалкалоидов. По данным Sołtys-Kalina, (2019) вызывает интерес то, что флавоноиды и фенолы могут подавлять фитотоксическое воздействие гликоалколоидов. Исследования Е.Ф. Семеновой подтверждают, что картофель, в качестве предшественника, проявляет слабые ингибирующие свойства.
Содержание в картофеле высокотоксичные соединения, такие как терпены (состоящие полностью из углерода и водорода и включающие растительные летучие вещества – гликозиды, каротиноиды и стеролы); фенольные соединения (с общим признаком наличия одного или нескольких фенольных колец и включающие фенольные кислоты, кумарины, флавоноиды, дубильные вещества и лигнин), а также азотсодержащие соединения (алколоиды, глюкозинолаты и др.).
В свою очередь, алколоиды являются распространенными биологически активными соединениями растений из семейства пасленовых, в том числе картофеля. Алкалоиды — это физиологически активные соединения, которые проявляют от стимулирующего (наркотического) до токсического эффекта как на живых существ, так и на растения. Картофель содержит два вида гликоалколоида: α-соланин и α-хаконин – это природные пестициды (рисунок 17, 18). Известно, что гликоалколоиды в вегетативных частях картофеля образуется в качестве защитной реакции против патогенов и насекомых.
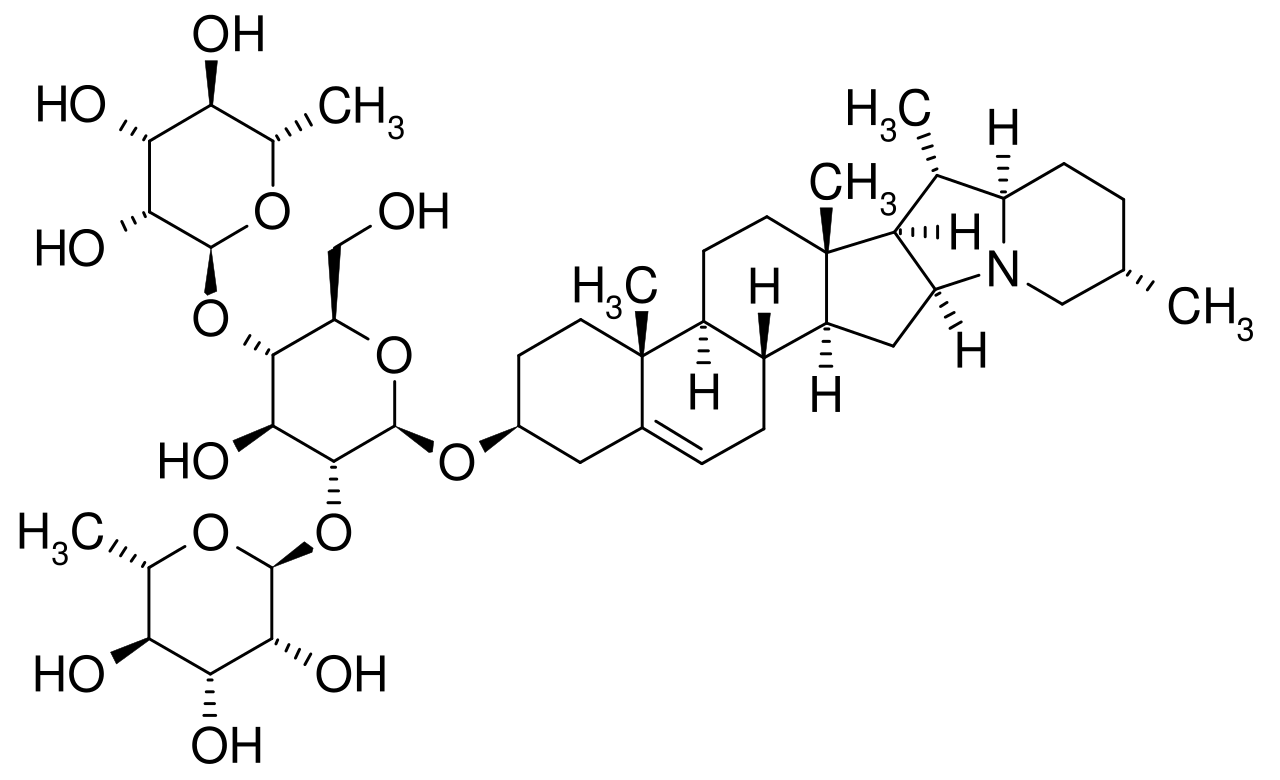
Рисунок 17– Структурная формула α-хаконина
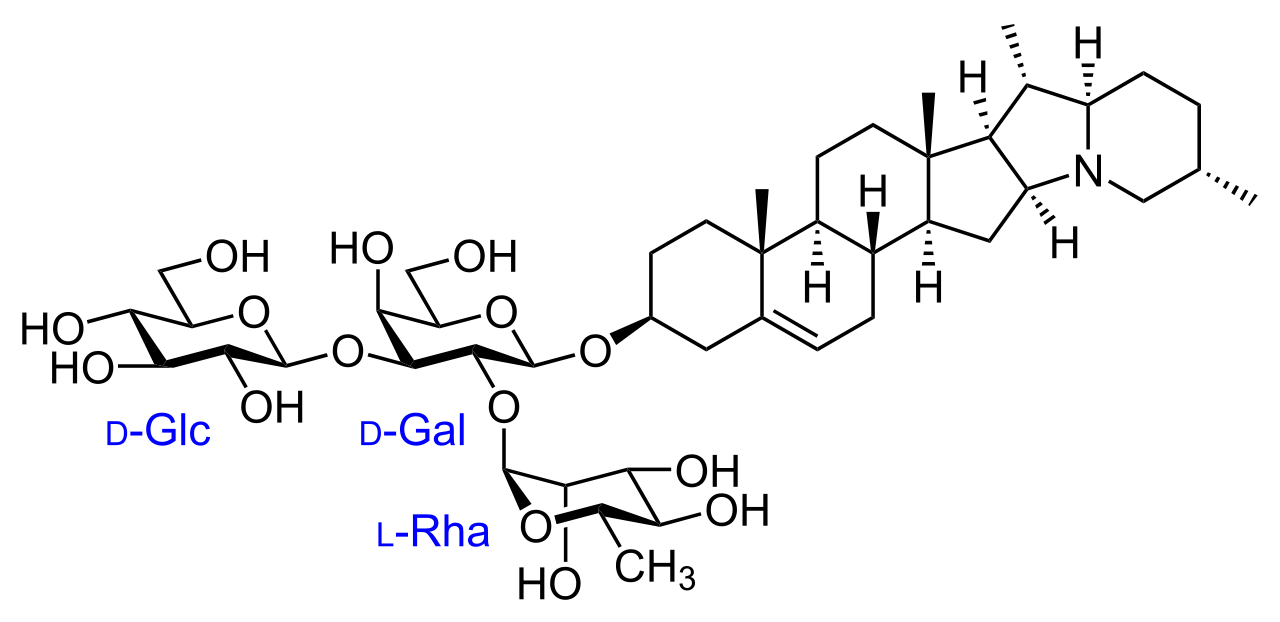
Рисунок 18 – Структурная формула α-соланина
Другие предполагаемые аллелохимические вещества в картофеле – пальмитиновая кислота, этиловый эфир линолевой кислоты могут подавлять рост сорняков. Полевые исследования показали, что заделка растительных остатков в почве угнетает рост сорных растений, в то время как на контрольном участке без заделки остатков картофеля рост сорняков прогрессировал. Ученые предполагают, что такой эффект связан с содержанием в остатках растений картофеля фенольных соединений, таких как хлорогеновая кислота, кофейная кислота и кумаринов.
На третьем этапе научных исследований по изучению аллелопатии былпоставлен производственный полевой опыт в КФХ «Башмаков С.А.» Прокопьевского района, Кемеровской области.
Почва опытного участка – чернозем оподзоленный среднемощный среднегумусный среднесуглинистый, с содержанием гумуса в пахотном слое – 6,7%, обменного калия 130 мг/кг, подвижного фосфора 147 мг/кг почвы, рНсол – 6,2.
Посев моркови проводили 3 мая, посев свеклы 15 мая, повторность опыта – трехкратная, площадь одной опытной делянки 24 м2, учетная площадь 21 м2. Морковь и свеклу высевали с междурядьями 70 см, семена моркови заделывали на глубину 1-2 см, свеклы 3-4 см. Норма высева моркови – 4 кг/га, свеклы – 10 кг/га.
Посев овощных культурпроводили по двум распространённым в Кемеровской области предшественникам – яровая пшеница и картофель.
Обработка почвы включала по зерновым предшественникам: осенью – культивацию глубину на 10-12 см, весной – ранне-весеннеее боронование (штригельная борона AS 1200 1М)и предпосевная культивация под свёклу КТП-8 на глубину 5-6 см, по пропашному предшественникупредпосадочное фрезерование Амак на глубину 12-15 см, прикатывание с последующим посевом изучаемых культур.
В период вегетации культур проводили фенологические наблюдения.Урожайность корнеплодов собирали отдельно по повторностям и сортировали на товарные и нетоварные корнеплоды [13]. Нетоварные корнеплоды взвешивали отдельно от товарных. При уборке по каждой повторности нетоварные корнеплоды сортировали на мелкие, искривленные, пораженные вредителями (морковная муха), разветвленные и треснувшие. Далее вычисляли среднюю массу корнеплодов и процент товарного урожая. Товарные корнеплоды взвешивали по каждому сорту и находили средний вес одного корнеплода. Содержание сухого вещества определяли в корнеплодах по ГОСТ 31640-2012, массовую долю сырой золы по ГОСТ 26226-95, массовую долю каротина по ГОСТ 8756.22-80, сахаристость по ГОСТ ISO 2173-2013.
Статистическая обработка экспериментальных данных проводилась однофакторным дисперсионным анализом.
Метеорологические условия 2020 г. были близки к среднемноголетним показателям, наблюдался небольшой избыток влаги в июле и первой половине августа, осадков выпало выше нормы на 15% и 30%, соответственно (рисунок 19). Температура была выше нормы на 3,7оС в мае и на 2,5оС в августе, остальные месяцы были близки к средним многолетним показателям.
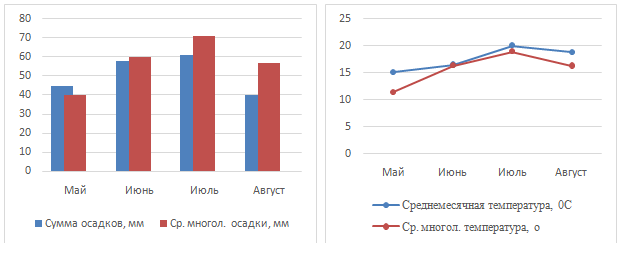
Рисунок 19 – Метеорологические условия вегетационного периода, 2020 г.
В целом условия увлажнения за вегетационный период 2020 года были благоприятными для роста и развития корнеплодов, ГТК составил 1,26.
2.2 Характеристика объектов исследования
Характеристика сортов моркови
Шантанэ 2461 –сортсреднеспелый, продолжительность вегетационного периода от всходов до технической спелости составляет 105-115 дней. Розетка листьев полустоячая. Окраска поверхности, сердцевины и мякоти корнеплода – оранжевая. Корнеплод конический, тупоконечный, длиной 15 см, диаметром 5-6 см, массой 80-250г. Корнеплод полностью погружен в почву. Вкусовые качества высокие. Сорт характеризуется устойчивостью к цветушности. Рекомендован для потребления в свежем виде и переработки. Урожайность 2,0-4,0 кг/м2.
Самсон – среднеспелый сорт, достигает технической зрелости через 110-120 дней после появления всходов. Используется в пищу, начиная со стадии пучковой (молочной) спелости, наступающей после 50-го дня вегетации. Растения мощные, листовая розетка полураскидистого типа. Листья среднерассеченные, длинные, зеленые, слегка опушенные. Созревшие корнеплоды расположены на уровне почвы (головки не выступают над поверхностью грунта). Корнеплоды среднего и крупного размера: длиной до 18-22 см, массой 120-150 г, с отчетливо шероховатой поверхностью. Вкусовые качества хорошие, дегустационная оценка – 4-5 баллов. Урожайность с 1 м2 – 5-8 кг. Корнеплоды используются для потребления в свежем виде, промышленной и домашней переработки, хранения. За счет хорошей лежкости у моркови данного сорта после 6 месяцев хранения остается 86,7% плодов товарного качества.
Характеристика свёклы столовой
Детройт – среднеспелый сорт, период от всходов до технической зрелости составляет 82-97 дней; созревание происходит дружно, урожайность товарной продукции составляет 362-692 ц/га, что выше стандарта Бордо 237 на 10- 88 ц/га; выход товарной продукции находится на уровне стандарта– 82-91%; свекла обладает устойчивостью к цветушности и стрелкованию. Корнеплод небольшой, округлой формы. Масса – 111-212 грамм. Кожица гладкая, красная. Мякоть плотная и нежная, не содержит жёстких волокон, тёмно-красного цвета, без кольцеватости. Вкусовые качества хорошие. В 100 г овоща содержится: сухих веществ 17,6- 20,4%, общего сахара 12,3-14,2%.
Боро F 1– среднеспелый гибрид столовой свеклы со сроком вегетации 110-115 дней. Розетка листьев небольшая, прямостоячая, хорошо развита. Корнеплоды округлой формы диаметром 8-10 см, могут достигать 110-210 грамм. Мякоть свеклы ярко-красного цвета без колец, кожура темная и гладкая. Средняя урожайность сорта 60-80 т/га.
3 РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
3.1 Изучение аллелопатического взаимодействия семян овощных культур и сорных растений на начальных этапах онтогенеза
В растительных сообществах между растениями происходят различные внутри- и межвидовые конкуренции за ресурсы и территорию. Ярким примером конкурентных взаимоотношений является аллелопатия, которая выражается в выделении аллелохимических веществ одними растениями для подавления роста и развития других. Например, многие виды сорняков выделяют различные аллелохимикалии, которые проявляют ингибирующий эффект на прорастание семян и развитие культурных растений. Сорные растения угнетающе действуют не только на развивающиеся растения, но и на растущие семена.
В нашем исследовании мы изучали аллелопатическое влияние сорных растений на прорастание семян моркови. Водные экстракты изучаемых сорных растений значительно повлияли на показатели на показатели энергии прорастания и лабораторной всхожести семян. Максимальным ингибирующим действием обладали водные вытяжки из пастушьей сумки (Capsellabursa-pastorisMedic.) и осота полевого (SonсhusarvensisL.), при соотношении растительного сырья и воды 1:10 (табл.1).
Таблица 1 – Аллелопатическое влияние вытяжки сорных растений на энергию прорастания и всхожесть семян моркови
| Вид сорного растения | Соотношениярастительного сырья и воды | Энергия прорастания, % | Лабораторная всхожесть, % |
| Сорт Шантанэ 2461 | |||
| Контроль (вода) | — | 61,0 | 78,0 |
| Щирица запрокинутая (AmaranthusretroflexusL.) | 1 : 20 | 51,5 | 76,5 |
| 1 : 10 | 41,0 | 68,0 | |
| Пастушья сумка
(Capsella bursa-pastoris Medic.) |
1 : 20 | 23,0 | 51,5 |
| 1 : 10 | 19,0 | 48,5 | |
| Осот полевой
(Sonсhus arvensis L.) |
1 : 20 | 21,5 | 52,5 |
| 1 : 10 | 25,0 | 42,5 | |
Продолжение таблицы 1
| Вид сорного растения | Соотношениярастительного сырья и воды | Энергия прорастания, % | Лабораторная всхожесть, % |
| Сорт Самсон | |||
| Контроль (вода) | — | 39,5 | 76,0 |
| Щирица запрокинутая (AmaranthusretroflexusL.) | 1 : 20 | 36,5 | 66,5 |
| 1 : 10 | 22,0 | 48,0 | |
| Пастушья сумка
(Capsella bursa-pastoris Medic.) |
1 : 20 | 24,0 | 44,5 |
| 1 : 10 | 22,5 | 30,0 | |
| Осот полевой
(Sonсhus arvensis L.) |
1 : 20 | 28,0 | 42,0 |
| 1 : 10 | 24,0 | 32,0 | |
Наибольшее подавление прорастания семян моркови наблюдалось у сорта Самсон водной вытяжкой пастушьей сумки (Capsellabursa-pastorisMedic.)при соотношении растительного сырья и воды 1:10. Установлено, что количество проросших семян на 46% ниже контроля (рисунок 20).

Рисунок 20 – Семена моркови Самсон, обработанные водной вытяжкой из CapsellaBursa-Pastoris (1:10) (3-й день проращивания)
Существенное снижение всхожести семян моркови нами отмечено при действии водной вытяжки пастушьей сумки (Capsellabursa-pastorisMedic.) и осота полевого (SonсhusarvensisL.)при соотношении растительного сырья и воды 1:20 на 26,5% у сорта Шантанэ 2461, и на 33% у сорта Самсон, по сравнению с контролем (рисунок 21).

Рисунок21 – Семена моркови Шантанэ 2461 (7-й день проращивания)
Наименьшее аллелопатическое влияние оказала вытяжка щирицы запрокинутой (AmaranthusretroflexusL.) – прорастание семян моркови варьировало от 68 % до 76,5% у сорта Шантанэ 2461 и от 48 % до 66,5% у сорта Самсон (рисунок 22).

Рисунок 22 – Семена моркови Самсон, обработанные водной вытяжкой из AmaranthusretroflexusL. (1:20) (3-й день проращивания)
Таким образом, согласно оценке аллелопатической активности [18] сильной степенью аллелопатического воздействия на семена моркови обоих сортов обладают водные вытяжки пастушьей сумки (Capsellabursa-pastorisMedic.)и осота полевого (SonсhusarvensisL.) при соотношении 1:20 (рисунок 23). Среднюю степень воздействия оказали водные вытяжки из щирицы запрокинутой (AmaranthusretroflexusL.) при соотношении 1:10 на сорт Шантанэ 2461 и при соотношении 1:20 на сорт Самсон. Слабую аллелопатическую активность проявила водная вытяжка щирицы запрокинутой (AmaranthusretroflexusL.) при соотношении 1:20 в отношении семян моркови сорта Шантанэ 2461.

Рисунок 23 – Семена моркови Шантанэ 2461, обработанные водной вытяжкой из SonсhusarvensisL. (1:20) (3-й день проращивания)
Проведенные научные исследования позволили выявить, что наибольшему ингибирующему действию от водных вытяжек сорных растений были подвержены семена моркови сорта Самсон.
Таким образом, изученные ответные реакции прорастающих семян сортов моркови на обработку водными вытяжками из растительных остатков сорных растений щирицы запрокинутой, осота полевого и пастушьей сумки выявлено отрицательное воздействие на энергию прорастания и лабораторную всхожесть семян овощных культур – моркови и свеклы. Отмечена сортовая специфичность моркови на обработку растительных остатков сорных растений.
При изучении аллелопатического влияния водных вытяжек сорных растений на прорастание семян свеклы выявлено, что экстракты в меньшей степени снижали показатели энергии прорастания и лабораторной всхожести семян свеклы, по сравнению с морковью (табл. 2).
Таблица 2 – Аллелопатическое влияние вытяжки сорных растений на всхожесть семян свеклы
| Вид сорного растения | Соотношения растительного сырья и воды | Энергия прорастания, % | Лабораторная всхожесть, % |
| Сорт Детройт | |||
| Контроль (вода) | — | 43,0 | 73,0 |
| Щирица запрокинутая (AmaranthusretroflexusL.) | 1 : 20 | 51,0 | 71,5 |
| 1 : 10 | 40,0 | 61,5 | |
| Пастушья сумка
(Capsella bursa-pastoris Medic.) |
1 : 20 | 30,0 | 47,0 |
| 1 : 10 | 31,0 | 42,0 | |
| Осот полевой
(Sonсhus arvensis L.) |
1 : 20 | 45,0 | 65,0 |
| 1 : 10 | 38,5 | 50,5 | |
| Гибрид Боро F1 | |||
| Контроль (вода) | — | 42,0 | 72,0 |
| Щирица запрокинутая (AmaranthusretroflexusL.) | 1 : 20 | 37,0 | 65,0 |
| 1 : 10 | 29,5 | 58,0 | |
| Пастушья сумка
(Capsella bursa-pastoris Medic.) |
1 : 20 | 24,0 | 43,5 |
| 1 : 10 | 27,0 | 38,0 | |
| Осот полевой
(Sonсhus arvensis L.) |
1 : 20 | 42,0 | 60,0 |
| 1 : 10 | 34,0 | 50,5 | |
Среднею аллелопатическую активность проявила водная вытяжка щирицы запрокинутой (AmaranthusretroflexusL.) при соотношении 1 :20, всхожесть семян свеклы составила 71,5% у сорта Детройт (что практически на уровне контроля) и 65,0% у Боро F1 (рисунок 24-25).
Рисунок 24 – Семена свеклы Боро F1 (7-й день проращивания)
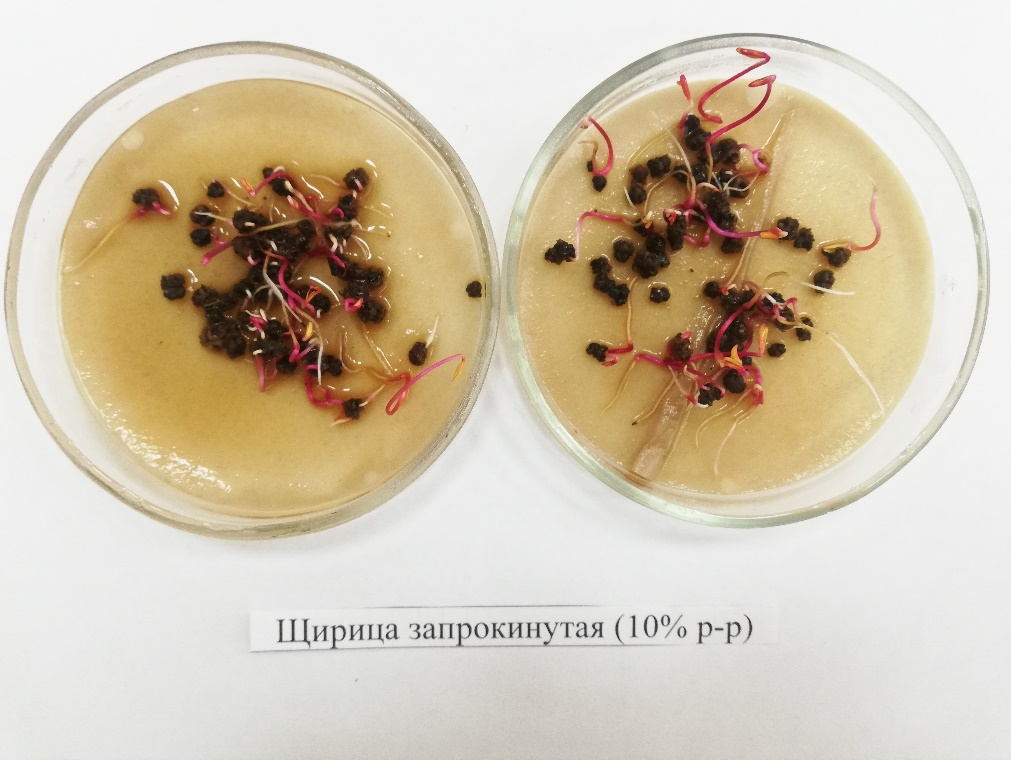
Рисунок 25 – Семена свеклы Детройт, обработанные водной вытяжкой из AmaranthusretroflexusL. (1:10) (7-й день проращивания)
Водная вытяжка из щирицы запрокинутой (AmaranthusretroflexusL.) при соотношении 1:10 снизила прорастание семян свеклы на 11,5% у сорта Детройт (рисунок 24) и на 14% у гибрида Боро F1 (рисунок 23).
Средней аллелопатической активностью по отношению к семенам свеклы обладали вытяжки осота полевого (SonсhusarvensisL.)при соотношении 1:20 и 1:10. Прорастание семян варьировало в пределах от 50,5 % до 65,0% по сортам (рисунок 26).

Рисунок 26 – Семена свеклы Детройт, обработанные водной вытяжкой из SonсhusarvensisL. (1:10) (7-й день проращивания)
Значительное угнетение прорастания семян свеклы отмечено вытяжкой пастушьей сумки (Capsellabursa-pastorisMedic.), где процент проросших семян составил от 42,0 до 47,0% (сорт Детройт) и от 38,0 до 43,5% (Боро F1) (рисунок 27).
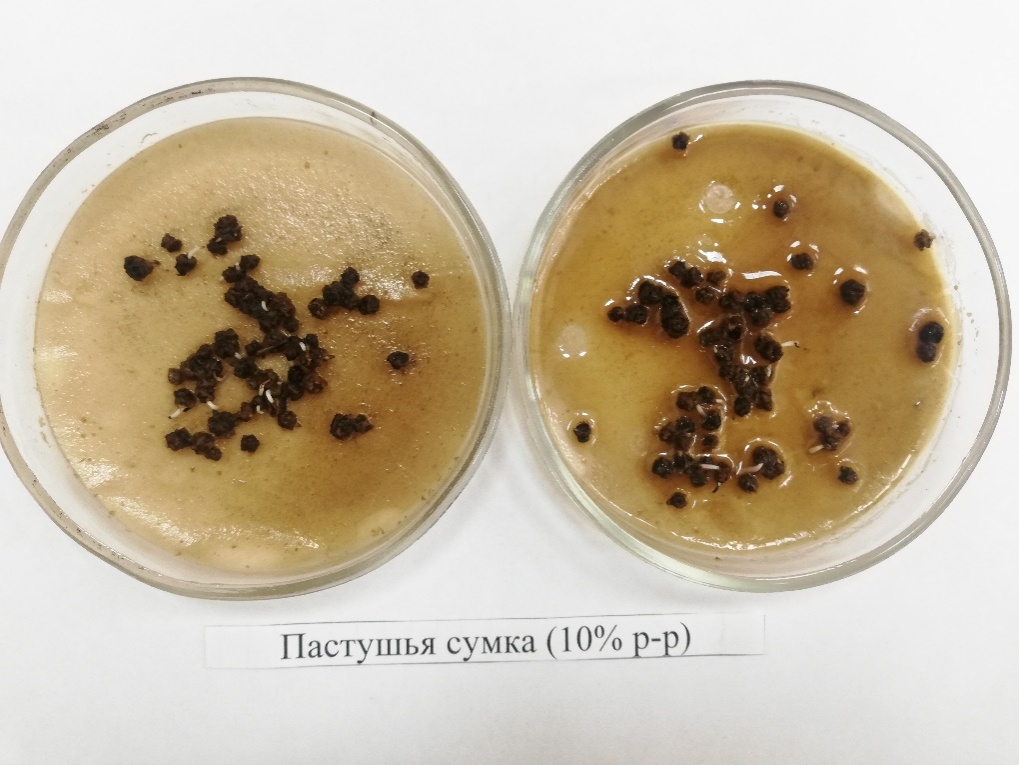
Рисунок 27 – Семена свеклы Боро F1, обработанные водной вытяжкой изCapsellaBursa-PastorisMedic (1:10) (3-й день проращивания)
Таким образом, исследования по изучению влияния водных вытяжек сорных растений на прорастание семян свеклы показали среднюю степень аллелопатического воздействия из щирицы запрокинутой (AmaranthusretroflexusL.) и осота полевого (SonсhusarvensisL.), и сильное проявление аллелопатической активности пастушьей сумки (Capsellabursa-pastorisMedic.), всхожесть семян свеклы составила менее 50%.
На основании лабораторных научных экспериментов выявлена сортовая и видовая специфичность ответных реакций на обработку водной вытяжкой растительных остатков сорных растений семян моркови и свеклы. Наблюдается ингибирующее действие водных вытяжек остатков сорных растений на рост и развитие изучаемых культур.
Выявленная нами аллелопатическая активность водных экстрактов сорных растений является малой частью ингибирующих свойств соединений, которые содержатся в сорняках и выделяемых путем водной экстракции.
Содержащиеся в водных экстрактах вторичные метаболиты были исследованы на семенах свёклы и моркови в естественных условиях. Установлено, что вторичные метаболиты проявляют ингибирующий эффект на рост семян исследуемых растений, что может быть объяснено действием водорастворимых веществ: алкалоидов, фенолов, кумаринов, терпеноидов, флавоноидов, гликозидов и фенолкарбоновых кислот. Поэтому, нами было решено установить подавляющую способность надземной части предшествующих культур на прорастание и рост свёклы и моркови. В нашем исследовании предшественниками являлись картофель и пшеница яровая.
3.2 Изучение аллелопатической активности послеуборочных растительных остатков сельскохозяйственных культур на посевные качества и первоначальный рост проростков овощных культур
Остатки культурных растений такие, как корневые остатки, солома, ботва являются одним из важнейших источников физиологически активных веществ, поступающих в почву. По мнению А.М. Гродзинского, 50% выращенного урожая биомассы культурных растений возвращается в почву. Научными исследованиями установлено, чтоаллелохимикалии задерживают или ускоряют развитие семян, изменяют или преодолевают состояние их покоя, воздействуют на прорастание семян и формирование органов проростка. Аллелопатическая активность растений нередко коррелирует со способностью к почвоутомлению [50].
Проведенные научные исследования позволили установить, что наибольшее ингибирующее действие на семена моркови оказывали вытяжки из послеуборочных остатков яровой пшеницы, при соотношении растительного сырья и воды 1:10 (табл.3).
Таблица 3 – Аллелопатическое влияние послеуборочных остатков на всхожесть семян моркови
| Вид растения | Соотношения растительного сырья и воды | Энергия прорастания, % | Лабораторная всхожесть, % |
| Сорт Шантанэ 2461 | |||
| Контроль (вода) | — | 58,0 | 76,5 |
| Яровая пшеница | 1 : 20 | 55,5 | 71,0 |
| 1 : 10 | 48,0 | 69,0 | |
| Картофель | 1 : 20 | 60,0 | 74,5 |
| 1 : 10 | 56,0 | 70,0 | |
| Сорт Самсон | |||
| Контроль (вода) | — | 59,5 | 76,0 |
| Яровая пшеница | 1 : 20 | 56,5 | 70,0 |
| 1 : 10 | 52,0 | 67,0 | |
| Картофель | 1 : 20 | 54,0 | 73,0 |
| 1 : 10 | 52,5 | 70,0 | |
На 7-й день проращивания в водной вытяжке при соотношении растительного сырья и воды 1:10 наблюдается снижение процента проросших семян моркови на 6% у сорта Шантанэ 2461 и на 9% у сорта Самсон, по сравнению с контролем.
Меньшее аллелопатическое влияние оказала вытяжка из послеуборочных остатков картофеля – прорастание семян моркови варьировало от 70 % до 74,5% у сорта Шантанэ 2461, и от 70 % до 73 % у сорта Самсон.
Таким образом, согласно оценке аллелопатической активности [18]вышеуказанные водные вытяжкирастительных остатков яровой пшеницы и картофеля оказывали среднее ингибирующее влияние на всхожесть семян моркови.
Невысокую аллелопатическую активность проявила вытяжка из послеуборочных остатков картофеля при соотношении 1:20, всхожесть семян свеклы составила 72,5% у сорта Детройт (табл.4). Водная вытяжка из остатков яровой пшеницы при соотношении 1:20 снизил прорастание семян свеклы на 7% у сорта Детройт и на 5% у гибрида Боро F1.
Таблица 4 – Аллелопатическое влияние послеуборочных остатков на всхожесть семян свеклы
| Вид растения | Соотношения растительных остатков и воды | Энергия прорастания, % | Лабораторная всхожесть, % |
| Сорт Детройт | |||
| Контроль (вода) | — | 55,0 | 75,0 |
| Яровая пшеница | 1 : 20 | 51,0 | 68,0 |
| 1 : 10 | 50,0 | 65,5 | |
| Картофель | 1 : 20 | 53,0 | 72,5 |
| 1 : 10 | 51,0 | 69,0 | |
| Гибрид Боро F1 | |||
| Контроль (вода) | — | 52,0 | 72,0 |
| Яровая пшеница | 1 : 20 | 47,0 | 67,0 |
| 1 : 10 | 49,5 | 63,0 | |
| Картофель | 1 : 20 | 54,0 | 69,0 |
| 1 : 10 | 47,0 | 66,0 | |
Проращивание семян свеклы в водных вытяжках послеуборочных остатков яровой пшеницы и картофеля при соотношении 1:10 приводит к снижению всхожести на 9 % и 6 %, соответственно у обоих сортов овощных культур.
Исследования по изучению влияния водных вытяжек послеуборочных остатковна прорастание семян свеклы показали среднюю степень аллелопатического воздействия, всхожесть семян свеклы составила от 63 % до 72,5%.
Химические вещества, которые выделяются из надземной части яровой пшеницы и картофеля обладают ингибирующими свойствами на прорастание семян моркови и свеклы. Нами отмечено, что большее ингибирующее влияние на прорастание семян, изучаемых культу, оказывает вытяжка из яровой пшеницы.
Таким образом, вещества фенольной и терпеноидной природы, флавоноиды, алколоиды, хлорогеновая, кофейная кислоты, кумарины и др. вещества содержащиеся в растительных остатках яровой пшеницы и картофеля оказывают в основном ингибирующее действие. Наиболее вероятный путь торможения ростовых процессов заключается в неспецифическом ингибировании общего метаболизма функционирующих клеток прорастающих семян овощных культур под действием аллелопатических веществ растительных остатков яровой пшеницы и картофеля.
3.3 Фазы роста и развития корнеплодов
В год посева отмечают следующие фазы развития корнеплодов: образование всходов – появление на поверхности почвы проростков и развертывание семядольных листьев. Далее отмечают образование первой – третьей пары настоящих листьев. В эту фазу развития проводят важный прием ухода за посевами корнеплодов – букетировку растений.
В дальнейшем появление новых листьев приводит к смыканию их в междурядьях, эту фазу называют фазой смыкания листьев в междурядьях.
К концу вегетации сомкнувшиеся листья корнеплодов как бы размыкаются, обнажая междурядья. На первом году жизни растений эта последняя фаза развития корнеплодов называется фазой размыкания листьев в междурядьях или техническая спелость.
Техническая спелость корнеплодов первого года жизни – состояние затухания жизненных процессов в конце вегетации, признаками которой являются: интенсивное отмирание старых листьев, снижение темпов нарастания корнеплода и накопления сахара, уменьшение количества воды в корнеплодах, изменение химического состава листьев и корнеплодов, миграция веществ из листьев в корнеплод.
Наблюдения за фенологическими фазами роста и развития корнеплодов и за продолжительностью межфазных периодов растений представлены в таблицах 5, 6, 7, 8.
Таблица 5 – Даты наступления фенологических фаз моркови
| Предшественник | Всходы | Образование настоящих листьев (3-5 пар) | Смыкание рядков (формирование корнеплодов) | Размыкание рядков (техническая спелость) |
| Шантанэ 2461 | ||||
| Яровая пшеница | 30.05 | 11.06 | 30.07 | 15.09 |
| Картофель | 30.05 | 11.06 | 20.07 | 10.09 |
| Самсон | ||||
| Яровая пшеница | 30.05 | 16.06 | 30.07 | 15.09 |
| Картофель | 30.05 | 16.06 | 20.07 | 15.09 |
В первый период вегетации отличий по наступлению фаз развития моркови по обоим сортам не наблюдалось. Всходы появились 30 мая, образование настоящих листьев у сорта Шантанэ 2461 отмечено 11 июня по обоим предшественникам, у сорта Самсон фаза наступила на 5 суток позже (рисунок 28).
Фаза смыкания рядков у сортов раньше наступила по предшественнику картофель – 20 июля, по зерновому предшественнику растения моркови вступили в эту фазу на 10 суток позже (рисунок 29).

Рисунок 28 – Всходы моркови |

Рисунок 29–Смыкание рядков |
Фаза размыкания рядков раньше всех отмечена у сорта Шантанэ 2461 по предшественнику картофель 10 сентября, на 5 суток позже фаза отмечена у сорта Самсон по обоим предшественникам и у сорта Шантанэ 2461 по яровой пшенице.
Таблица 6 – Межфазные периоды роста и развития моркови, суток
| Предшественник | Посев — всходы | Всходы – образование настоящих листьев | Образование настоящих листьев – смыкание рядков | Смыкание рядков – техническая спелость | Вегетационный период |
| Шантанэ 2461 | |||||
| Яровая пшеница | 26 | 11 | 48 | 46 | 105 |
| Картофель | 26 | 11 | 38 | 51 | 100 |
| Самсон | |||||
| Яровая пшеница | 26 | 16 | 43 | 46 | 105 |
| Картофель | 26 | 16 | 33 | 55 | 104 |
Посев моркови проведен 3 мая, всходы появились через 26 суток. Межфазный период от всходов до образования настоящих листьев у сорта Шантанэ 2461 по обоим предшественникам 11 суток, у сорта Самсон он продолжался до 16 суток. Период от образования настоящих листьев до смыкания рядков, когда происходит интенсивное формирование корнеплодов, варьировал от 33 до 48 суток по сортам. Вегетационный период составил 105 суток по зерновому предшественнику у обоих сортов моркови, по предшественнику картофель у сорта Самсон – 104, у сорта Шантанэ 2461 – 100 суток.
У свеклы по сортам практически не было отличий по датам наступления фаз роста и развития (таблица 7). Всходы у сорта Детройт отмечены 2 июня по обоим предшественникам, фаза образования настоящих листьев отмечена 16 июня. Фаза смыкания рядков раньше наступила по предшественнику картофель 20 июля, по зерновому предшественнику – 3 августа. Аналогичная картина по датам наступления фаз роста и развития свеклы наблюдали и у гибрида Боро F1.
Таблица 7 – Даты наступления фенологических фаз свёклы
| Предшественник | Всходы | Образование настоящих листьев (3-5 пар) | Смыкание рядков (формирование корнеплодов) | Размыкание рядков (техническая спелость) |
| Детройт | ||||
| Яровая пшеница | 02.06 | 16.06 | 03.08 | 15.09 |
| Картофель | 02.06 | 16.06 | 20.07 | 15.09 |
| Боро F1 | ||||
| Яровая пшеница | 02.06 | 16.06 | 03.08 | 15.09 |
| Картофель | 02.06 | 16.06 | 20.07 | 15.09 |
Посев свеклы проведен 15 мая, всходы появились достаточно быстро через 17 суток. Межфазный период от всходов до образования настоящих листьев у сортов свеклы по обоим предшественникам продолжался 14 суток (таблица 16). Период от образования настоящих листьев(рисунок 30) до смыкания рядков (рисунок 31) варьировал от 33 суток по предшественнику картофель до 47 суток по зерновому предшественнику. Вегетационный период по картофелю у обоих сортов свеклы составил 102 суток, по зерновому предшественнику 103 суток.

Рисунок30 – Образование настоящих листьев |

Рисунок 31 – Смыкание рядков |
Таблица 8 – Межфазные периоды роста и развития свёклы, суток
| Предшественник | Посев — всходы | Всходы – образование настоящих листьев | Образование настоящих листьев – смыкание рядков | Смыкание рядков – техническая спелость | Вегетационный период |
| Детройт | |||||
| Яровая пшеница | 17 | 14 | 47 | 42 | 103 |
| Картофель | 17 | 14 | 33 | 55 | 102 |
| Боро F1 | |||||
| Яровая пшеница | 17 | 14 | 47 | 42 | 103 |
| Картофель | 17 | 14 | 33 | 55 | 102 |
3.4 Влияние предшественников на засоренность посевов корнеплодов
Севооборот является одним из главных факторов, определяющих фитосанитарное состояние посевов, относясь к числу наиболее эффективных и экологически безопасных методов защиты, так как способствует конкурентоспособности различных культур.
Для изучения динамики количественного состава сорняков анализы проводили в два периода вегетации корнеплодов: всходы и смыкание рядков.
За вегетационный период 2020 года в посевах моркови и свеклы выявлено 9 видов сорных растений из 7 семейств (таблица 9). В агроценозе преобладали малолетние сорняки: щирица запрокинутая, пастушья сумка, горец почечуйный, лебеда раскидистая, щетинник сизый, просо куриное, составлявшие 76,9- 97,1% от общего количества в посевах моркови и 80,0 – 97,1% в посевах свеклы. Из многолетних сорняков встречались: пырей ползучий, осот полевой и вьюнок полевой (рисунки 32, 33).
Таблица9 – Флористический состав сорняков в посевах моркови и свеклы
| Вид сорняка | Латинское название | Семейство | Биологическая группа | |
| Малолетние | ||||
| Горец почечуйный | Polygonum persicaria L. | Гречишные | Яровой ранний | |
| Лебеда раскидистая | Atriplex patula L. | Маревые | Яровой ранний | |
| Щирица запрокинутая | Amaranthus retroflexus L. | Щирицовые | Яровой поздний | |
| Щетинник сизый | Setaria glauca L. | Мятликовые | Яровой поздний | |
| Просо куриное | Echinochloa
crusgalli L. |
Мятликовые | Яровой поздний | |
| Пастушья сумка | Capsella bursa – pastoris L. | Крестоцветные | Зимующий | |
| Многолетние | ||||
| Пырей ползучий | Elytrigia repens (L.) | Мятликовые | Корневищный | |
| Осот полевой | Sonchus
arvensis L |
Сложноцветные | Корнеотпрысковый | |
| Вьюнок полевой | Convolvulus arvensis L. | Вьюнковые | Корнеотпрысковый | |

Рисунок32 – Засорённость в фазу всходов моркови (предшественник — картофель) |

Рисунок33 – Засорённость в фазу всходов моркови (предшественник – яровая пшеница) |
Массовые всходы малолетних сорных растений обычно появляются одновременно с всходами корнеплодов. В посевах моркови и свеклы из малолетних доминировали сорняками из семейства мятликовые (Poaceae). Их плотность достигала в посевах моркови по предшественнику картофель – 25 шт./м2, по яровой пшенице 14 шт./м2(рисунок 33). В посевах свеклы численность сорняков варьировала от 20 шт./м2– предшественник картофель, до 12 шт./м2 по зерновому предшественнику (рисунок 34).
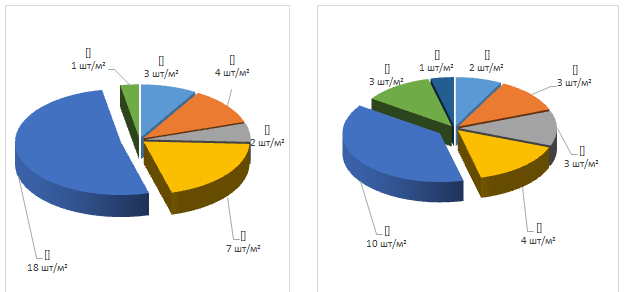
а) б)
Рисунок 34 – Численность сорняков в посевах моркови по предшественнику картофель (а) и яровая пшеница (б)
Многолетние сорняки представлены двумя биологическими группами – корнеотпрысковые и корневищные. По предшественнику картофель отмечено по одному сорняку в посевах моркови и свеклы. По предшественнику яровая пшеница в посевах моркови выявлено 6 шт./м2многолетних сорных растений, в посевах свеклы – 5 шт./м2, преобладал вьюнок полевой (рисунок 35).
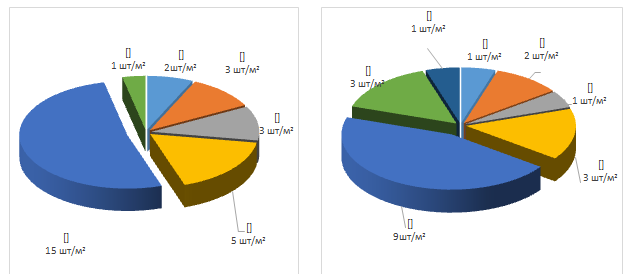
а) б)
Рисунок 35 – Численность сорняков в посевах свёклы по предшественнику картофель (а) и яровая пшеница (б)
В фазу всходов на посевах моркови насчитывалось всего 35 шт./м2 сорняков (по картофелю) и 26 шт./м2 (по яровой пшенице). В посевах свеклы численность сорняков составила 29 шт./м2 по пропашному предшественнику и 20 шт./м2 по зерновому предшественнику (таблица 10).
Ввиду слабой конкурентоспособности корнеплодов к сорнякам необходимо содержать посевы чистыми от сорных растений вплоть до уборки урожая. Для исключения потерь урожая за сезон проводили 3 ручные прополки.
Таблица10 – Влияние предшественников на численность сорняков в посевах моркови, шт./м2
| Предшественник | Фаза всходов | Фаза созревания | ||||
| мало
летние |
много
летние |
всего | мало
летние |
много
летние |
всего | |
| Картофель | 34 | 1 | 35 | 7 | — | 7 |
| Яровая пшеница | 20 | 6 | 26 | 10 | 4 | 14 |
Ко времени уборки урожая засоренность моркови не превышала 7 шт./м2 по картофелю и 14 шт./м2 – по яровой пшенице. В посевах свеклы также наименьшая засоренность отмечена по пропашному предшественнику – 5 шт./м2, по яровой пшенице насчитывалось к уборке сорняков 11 шт./м2 (таблица 11).
Таблица11 – Влияние предшественников на численность сорняков в посевах свеклы, шт./м2
| Предшественник | Фаза всходов | Фаза созревания | ||||
| мало
летние |
много
летние |
всего | мало
летние |
много
летние |
всего | |
| Картофель | 28 | 1 | 29 | 5 | — | 5 |
| Яровая пшеница | 16 | 4 | 20 | 8 | 3 | 11 |
Таким образом, на количество сорных растений оказали влияние химические вещества которые остаются в растительных остатках после уборки того или иного предшественника. Установлено, что в посевах моркови посеянного по предшественнику картофель, не обнаружено изученного нами сорняка как осот полевой. В посевах свеклы его численность составляла – 1 шт./м2.. По предшественнику яровая пшеница осота полевого насчитывалось 1-2 шт./м2. По предшественнику картофель не обнаружено сорняка пастушьей сумки, по яровой пшеницы 3 шт./м2.
Количество малолетних сорняков было больше при посеве моркови и свеклы по предшественнику картофель. По предшественнику яровая пшеница в посевах моркови и свеклы превышало численность многолетних.
Следовательно, изученные ответные реакции овощных культур моркови и свеклы на агрохимикалии выделенные яровой пщеницей и картофелем показывают, что при посеве овощных культур необходимо проводить учет сорных растений их видовой состав и не проводить посев этих культур по предшественнику яровая пшеница. Необходимо отметить, что обработка почвы, также могла повлиять на накопление сорный растений в посевах моркови и свеклы.
3.5 Урожайность и товарные качества корнеплодов
Урожайность(рисунок 36) и товарные качества сортов моркови приведены в таблице 12. Урожайность возделываемых в КФХ «Башмаков С.А.» в 2020 году сортов моркови составила у сорта Шантанэ 2461 от 14,3 т/га (предшественник зерновые) до 35,1 т/га (предшественник картофель). У сорта Самсон урожайность варьировала от 20,0 т/га (предшественник зерновые) до 32,4 т/га (предшественник картофель). Следовательно, обработка почвы, а также растительные остаткисохраняющиеся после зерновых и пропашным культур влияют на урожайность овощных культур.
Таблица 12 – Урожайность, товарные качества сортов моркови столовой
| Сорт | Урожайность, т/га | Выход товарной продукции, % | Средняя масса корнеплода, г | Нетоварные корнеплоды, % | |||||
| общая | товарная | мелкие | искривленные | разветвленные | треснувшие | повреждённые с-х вредителями | |||
| Предшественник – картофель | |||||||||
| Шантанэ 2461 | 35,1 | 25,7 | 73,2 | 187,2 | 7,5 | 7,7 | 3,9 | 3,7 | 3,9 |
| Самсон | 32,4 | 17,6 | 54,3 | 154,5 | 7,0 | 10,1 | 5,5 | 7,5 | 15,7 |
| Предшественник – яровая пшеница | |||||||||
| Шантанэ 2461 | 14,3 | 10,0 | 69,9 | 117,5 | 14,5 | 7,0 | 4,5 | 2,0 | 2,0 |
| Самсон | 20,0 | 17,1 | 85,5 | 122,8 | 1,7 | 2,3 | 6,5 | 1,7 | 2,3 |
НСР05 1,27

Рисунок 36– Урожай моркови (предшественник — картофель)
Масса корнеплодов у сортов (117-187 г) была оптимальной для реализации в торговую сеть. Товарность сортов моркови колебалась от 54,3 до 85,5%. Выход товарных корнеплодов был выше у сорта Самсон по зерновому предшественнику. Низкий выход товарных корнеплодов наблюдался у сорта Шантанэ 2461 – 69,9% и у сорта Самсон – 54,3% по зерновому предшественнику, при этом основную часть нетоварной фракции у Шантанэ 2461 составляют мелкие корнеплоды, а у сорта Самсон – поврежденные вредителями и искривленные.
По результатам 2020 года при применении органической технологии в условиях КФХ «Башмаков С.А.» рекомендуем выращивать сорт моркови Шантанэ 2461 по предшественнику картофель. Урожайность и товарные качества сортов свеклы показаны в таблице 13. В наших исследованиях урожайность корнеплодов свеклы была наибольшей по предшественнику картофель 34,3 т/га (сорт Детройт) и 31,4 т/га (Боро F1). Размещение свеклы по зерновому предшественнику привело к формированию низкой урожайности 17,3 т/га (сорт Дейтройт) и 11,1 т/га (Боро F1).
У изучаемых нами сортов в 2020 году товарность составила 64,0- 83,1%. Высокий выход товарной продукции был получен у сорта Детройт (83,1%) по предшественнику картофель, товарность гибрида Боро F1(рисунок 37) составила 77,4%. По зерновому предшественнику товарная урожайность свеклы была ниже – 70% (сорт Детройт) и 64,0% (Боро F1).

Рисунок 37– Гибрид Боро F1 по предшественнику картофель
В урожае гибридаБоро F1 (предшественник – зерновые) больший процент нетоварных корнеплодов составили мелкие (23,8%) и треснутые (12,2%); у сорта Детройт мелкие (18,2%), разветвленные (8,5%) и треснувшие (3,3%); у сорта Детройт (предшественник– картофель) отсутствовали искривленные корнеплоды, а разветвленные и мелкие составили наименьшее количество (по 2,5%), треснувшие (6,5%), поврежденные (5,4%) обеспечив тем самым самую высокую товарность.
Таблица13 – Урожайность и товарные качества сортов свёклы столовой
| Сорт | Урожайность, т/га | Выход товарной продукции, % | Средняя масса корнеплода, г | Нетоварные корнеплоды, % | |||||
| общая | товарная | мелкие | искривленные | разветвленные | треснувшие | повреждённые с-х вредителями | |||
| Предшественник – картофель | |||||||||
| Детройт | 34,3 | 28,5 | 83,1 | 245,3 | 2,5 | — | 2,5 | 6,5 | 5,4 |
| Боро F1 | 31,4 | 24,3 | 77,4 | 218,5 | 5,9 | — | — | 10,2 | 6,5 |
| Предшественник – яровая пшеница | |||||||||
| Детройт | 17,3 | 12,1 | 70,0 | 124,4 | 18,2 | — | 8,5 | 3,3 | — |
| Боро F1 | 11,1 | 7,1 | 64,0 | 108,2 | 23,8 | — | — | 12,2 | — |
НСР05 1,17
Таким образом, возделываемые по предшественнику картофель сорта свеклы столовой в условия лесостепи Кемеровской области, сформировали высокий урожай и стандартные по форме и размеру корнеплоды, чем по предшественнику яровая пшеница.
Следовательно, мы рекомендуем для получения высоких урожаев, высевать в нашей зоне овощные культуры по пропашному предшественнику картофель, чем по зерновому предшественнику яровая пшеница.
Важное значение при выращивании моркови имеет качество получаемой продукции. Содержание сухого вещества у сортов столовой моркови наибольшее отмечено по предшественнику картофель у сорта Шантанэ 2461 – 16,6% и у сорта Самсон 15,4% (таблица 14).
Таблица 14 – Качество корнеплодов моркови
| Предшественник | Сахаристость, % | Массовая доля сухого вещества, % | Массовая доля сырой золы, % | Массовая доля каротина, мг/100 г |
| Шантанэ 2461 | ||||
| Яровая пшеница | 12,26 | 15,14 | 6,00 | 4,49 |
| Картофель | 11,86 | 16,66 | 5,24 | 3,16 |
| Самсон | ||||
| Яровая пшеница | 14,96 | 14,23 | 7,03 | 2,64 |
| Картофель | 12,36 | 15,44 | 7,29 | 2,12 |
Показатель сахаристости по предшественникам варьировала от 11,8 до 14,9%, наблюдалась положительная тенденция в накоплении сахара при выращивании моркови сорта Самсон по предшественнику яровая пшеница. По содержанию каротина лучшие показатели отметили у сорта Шантанэ 2461 4,49 мг/100 г по зерновому предшественнику.
Предшественники свеклы столовой не оказали существенного влияния на содержание сухого вещества в корнеплодах (таблица 15).
Таблица 15 – Качество корнеплодов столовой свеклы
| Предшественник | Сахаристость, % | Массовая доля сухого вещества, % | Массовая доля сырой золы, % |
| Детройт | |||
| Яровая пшеница | 13,26 | 15,82 | 7,07 |
| Картофель | 10,36 | 14,87 | 9,25 |
| Боро F1 | |||
| Яровая пшеница | 10,76 | 15,71 | 9,57 |
| Картофель | 11,86 | 15,56 | 10,24 |
Незначительное повышение сухого вещества отмечали при размещении по яровой пшенице свеклы сорта Детройт – 15,8%. Сахаристость варьировала от 10,3% у сорта Детройт (предшественник картофель) до 13,2% у Боро F1 (предшественник яровая пшеница). Содержание сырой золы наибольшее показал гибрид Боро F1 по предшественнику картофель – 10,2%.
ВЫВОДЫ
1. Аллелопатический ингибирующий эффект вторичных метаболитов водных вытяжек, полученных из надземных органов сорных растений на энергию прорастания и всхожесть семян овощных культур зависел от вида сорняка, концентрации водных вытяжек полученных из частей сорных растений и сортов моркови и свеклы.
Сильной степенью аллелопатического воздействия на семена моркови обоих сортов обладают водные вытяжки полученые из Capsellabursa-pastoris и Sonсhusarvensis. Среднюю степень воздействия оказали вытяжки из AmaranthusretroflexusL. (1:10) на сорт Шантанэ 2461 и (1:20) на сорт Самсон. Слабую аллелопатическую активность проявила вытяжка Amaranthusretroflexus (1:20) в отношении семян моркови сорта Шантанэ 2461. В целом наибольшему ингибирующему действию от аллелохимкалий полученных из водных вытяжек сорных растений были подвержены семена моркови сорта Самсон.
2. Влияния вторичных соединений водных вытяжек сорных растений на прорастание семян свеклы двух сортов показали среднюю степень аллелопатического воздействия Amaranthusretroflexus и Sonсhusarvensis, и сильное проявление аллелопатической активности из наземной части Capsellabursa-pastoris, всхожесть семян свеклы составила менее 50%. Влияние вторичных метаболитов водных растворов из сорных растений зависело от соотношения надземной части сорных растений и воды (1:10 и 1:20).
3. По силе воздействия на семена моркови и свеклы водных вытяжек растительных остатков сорных растений можно распределить следующим образом: Capsellabursa-pastoris, Sonсhusarvensis и Amaranthusretroflexus, растительных остатков предшественников: яровая пшеницы, картофель.
РЕКОМЕНДАЦИИ ПРОИЗВОДСТВУ
При органическом возделывании овощных культур рекомендуется:
— возделывать свёклу и морковь после пропашной культуры – картофеля, так как система обработки почвы после картофеля, способствует глубокой заделки семян сорных растений и они не прорастают. Остающиеся в почве после картофеля растительные остатки повышают урожайность и товарные качества овощных культур.
— заделывать растительные остатки картофеля в почву. В растительных остатках картофеля содержатся ингибирующие аллелохимические вещества (пальмитиновая кислота, этиловый эфир линолевой кислоты, хлорогеновая и кофейная кислоты и кумарины), которые угнетающе действуют на рост и развитие изученных многолетних сорняков: пастушья сумка, щирица запрокинутая и осот полевой.
