Титульный лист и исполнители
РЕФЕРАТ
Отчет 154 с., 2 кн., 2 рис., 8 табл., 222 источн., 1 прил. 146с.
МИКРООРГАНИЗМЫ, АТИПИЧНЫЕ БИОЛОГИЧЕСКИЕ СВОЙСТВА, ЛАБОРАТОРНЫЕ МЕТОДЫ, КАЧЕСТВО, БЕЗОПАСНОСТЬ, ДЕЗИНФЕКТАНТЫ, АНТИМИКРОБНАЯ АКТИВНОСТЬ
Объектом исследования являются биологические пробы от крупного рогатого скота; дезинфицирующие средства «Аргенталин», «Фумийод», «Кемисепт», электрохимически активированные растворы «АКВАЭХА»; воздух и поверхности помещений.
Цели работы: 1) изучение биологических свойств штаммов возбудителей инфекционных болезней животных, выделенных на территории Российской Федерации при проведении мониторинговых исследований для оценки изменчивости их культурально-биохимических, морфологических, патогенных и вирулентных свойств; 2) разработка новых отечественных эффективных биоцидных агентов, экологически безопасных при обработке больших площадей на объектах ветеринарного надзора.
В процессе работы проводились комплексные лабораторные и экспериментальные исследования с применением бактериологических, протеометрических и молекулярно-генетических методов.
В результате работы: 1) были получены гипервирулентные Klebsiella pneumoniaе (hvKp –hypervirulent K. pneumoniae),отмечали появление возбудителей, которые реже встречались раньше: коагулазо-отрицательные стафилококки (КОС) Staphylococcus haemolyticus с мукоидным фенотипом (М-колонии), обладающих атипичными свойствами, в частности, Pseudomonas aeruginosa, Escherichia coli, S. dysgalactiae, атипичных возбудителей (Ureaplasma diversum, Mycoplasma bovis и др. связано с тем, что повышается чувствительность новых методов с внедрением в лабораторную диагностику новых экспресс-методов, разработкой и внедрением тест-систем и амплификационных тестов для диагностики; 2) были изучены антимикробные свойства четырех биоцидных препаратов, была разработана модификация аэрозольного метода с помощью фумигационных аэрозолей на основе кристаллического йода в виде термовозгонных бактерицидных шашек для целей дезинфекции воздушной среды животноводческих помещений.
Степень внедрения: имеется положительное решение о выдаче патента на атипичный микроорганизм: «Штамм бактерий Klebsiella pneumoniae subsp.pneumoniae, обладающий способностью к биопленкообразованию»; имеются акты выполненных работ в хозяйствах СЗФО, разработаны четыре Инструкции по применению испытуемых дезинфектантов и методическая рекомендация.
Эффективность комплексных лабораторных методов подтверждена значительным объемом проведенных исследований и методами вариационной статистики. Рассчитана экономическая эффективность четырех испытуемых дезинфекционных препаратов.
Методологические подходы комплексных исследований для определения атипичных антибиотикорезистентных микроорганизмов внедрены в работу ФГБУ «Ленинградская Межобластная Ветеринарная Лаборатория», а также учебный процесс ФГБОУ ВО СПбГУВМ. Научно обоснованы и внедрены в учебный процесс ФГБОУ ВО СПбГУВМ режимы применения четырех современных импортозамещающих дезинфицирующих препаратов, относящихся к 4 классу малоопасных веществ, которые обеспечивают антимикробное действие на широкий диапазон микроорганизмов и пролонгированный эффект дезсредств при проведении противоэпизоотических мероприятий на ОГВН.
ПЕРЕЧЕНЬ СОКРАЩЕНИЙ
АМП — антимикробные препараты
АС — антисептик
АДВ – активно действующее вещество
БГКП – бактерии группы кишечной палочки
ГА – глутаровый альдегид
ДВ – действующее вещество
ДНК – дезоксирибонуклеиновая кислота
ДС – дезинфицирующее средство
КДС – композиционное дезинфицирующее средство
КОС — коагулазо-отрицательные стафилококки
КПАВ – катионные поверхностно-активные вещества
МИК – минимальная ингибирующая концентрация
НЧ — наночастицы
ОГВН – объекты государственного ветеринарного надзора
ОВП – окислительно-восстановительный потенциал
РНК — рибонуклеиновая кислота
СЗФО – Северо-Западный федеральный округ
ПЦР – полимеразная цепная реакция
ПАВ – поверхностно-активные вещества
ЧАС – четвертичные аммониевые соединения
ЭХА — электрохимическая активация
ЭХАР – электрохимически активированные растворы
ВВЕДЕНИЕ
1 Основная часть НИР
1.1. ПРОВЕДЕНИЕ АНАЛИТИЧЕСКОГО ОБЗОРА ИНФОРМАЦИОННЫХ ИСТОЧНИКОВ В РАМКАХ ТЕМЫ НИР. ПРОВЕДЕНИЕ ЭПИЗООТОЛОГИЧЕСКОГО ОБСЛЕДОВАНИЯ ЖИВОТНОВОДЧЕСКИХ ХОЗЯЙСТВ. ВЗЯТИЕ ОБРАЗЦОВ ПАТОЛОГИЧЕСКОГО МАТЕРИАЛА ДЛЯ ДИАГНОСТИЧЕСКОГО ИССЛЕДОВАНИЯ
1.1.1. Обоснованность выбора исследований
Механизмы резистентности к антимикробным препаратам (дезинфектантам, антибиотикам и др.)
В последнее время отмечается значительный рост устойчивости микроорганизмов к антимикробным препаратам (дезинфектантам, антисептикам и антибиотикам) [1, 2].
Устойчивость к антимикробным препаратам (АМП) создает угрозу для проведения эффективной профилактики и лечения постоянно возрастающего числа инфекционных болезней животных. Все более необходимым становится рациональное использование имеющихся антимикробных препаратов с учетом спектра их активности и профиля антибиотикорезистентности основных возбудителей.
Возникновение резистентности и распространение ее среди микроорганизмов является естественным процессом, возникшим в ответ на широкое использование АМП в клинической практике, однако имеет большое социально-экономическое значение и в развитых странах рассматривается как угроза национальной безопасности.
Инфекционные болезни животных, вызванные резистентными штаммами микроорганизмов, отличаются более тяжелым течением, чаще увеличивается продолжительность лечения, что ведет к рецидивированию, хронизации или латенции (бактерионосительству) инфекций.
Одной из ведущих проблем является формирование лекарственной устойчивости у возбудителей, во многом обусловленной интенсивным применением антибактериальных препаратов в ветеринарной практике.
В настоящее время всё чаще обсуждается проблема перекрёстной устойчивости микроорганизмов. Под перекрёстной устойчивостью (в англ. источниках «cross-resistance», в некоторых отечественных источниках используется термин «комбинированная устойчивость» [8]) понимают формирование устойчивости микроорганизмов к антибиотикам, которая возникает в ходе адаптации микроорганизмов к дезинфицирующим средствам (ДС). Феномен формирования перекрёстной устойчивости у микроорганизмов связан с тем, что механизмы устойчивости к антибиотикам и ДС в ряде случаев могут быть сходными. К наиболее вероятным механизмам перекрёстной устойчивости относят изменение проницаемости цитоплазматической мембраны клеток и повышение эффективности эффлюкса (системы активного энергозависимого транспорта и выброса антимикробных соединений из клеток) [9]. Однако, несмотря на то, что неоднократно было показано формирование перекрёстной устойчивости in vitro [10–12], возможность формирования перекрёстной устойчивости in vivo до сих пор обсуждается. В то же время, по мнению ряда исследователей [13, 14], этот процесс может вносить значительный вклад в рост множественной лекарственной устойчивости среди возбудителей инфекций. Также необходимо учитывать, что сублетальные концентрации ДС оказывают селективное давление, которое, с одной стороны, стимулирует формирование резистентности к антимикробным препаратам, а с другой стороны, позволяет сохранять и поддерживать резистентность как свойство популяции микроорганизмов. В случае формирования перекрёстной устойчивости сублетальные концентрации ДС за счёт селективного давления могут поддерживать высокий уровень устойчивости микроорганизмов к антибиотикам, даже если микроорганизмы в ходе своего роста не взаимодействуют с этими антибиотиками. Таким образом, проблема устойчивости микроорганизмов к ДС настоятельно требует всестороннего анализа и поиска путей её практического решения.
В последнее время отмечается значительный рост устойчивости патогенных микроорганизмов к антимикробным препаратам (дезинфектантам, антисептикам и антибиотикам) [1, 2]. Так, исследование
обсеменённости помещений медицинских учреждений позволило выявить микробные изоляты, устойчивые к ряду дезинфектантов и антисептиков, таким как хлоргексидин, четвертичные аммониевые соединения, триклозан, йодоформ, глутаровый альдегид и пероксигены [3–6]. Устойчивость микроорганизмов к дезинфицирующим средствам (ДС) достигла такого уровня, что первые стали способны не только выживать на предметах, подвергаемых регулярной дезинфекции, но даже и размножаться в рабочих
растворах дезинфектантов [7]. К наиболее важным последствиям формирования устойчивости микроорганизмов к ДС можно отнести следующие:
– снижение эффективности дезинфекционных мероприятий;
– формирование перекрёстной устойчивости к антибиотикам.
Снижение эффективности дезинфекционных мероприятий, на наш взгляд, является наиболее опасным последствием резистентности к ДС. Недостаточная изученность феномена устойчивости приводит к тому, что до сих пор в практике используются ДС, к которым быстро формируется микробная устойчивость. Это в свою очередь может обусловливать возникновение вспышек госпитальных инфекций и увеличение случаев инфекций, связанных с оказанием медицинской помощи.
Таким образом, проблема устойчивости микроорганизмов к ДС настоятельно требует всестороннего анализа и поиска путей её практического решения. Казалось бы, что для решения проблемы устойчивости микроорганизмов к ДС можно использовать подходы, методологическую базу и опыт, накопленные в ходе исследования устойчивости к антибиотикам. Действительно, вопросами устойчивости микроорганизмов к антибиотикам занимаются уже более 60 лет [15]. Большая часть механизмов устойчивости к
антибиотикам была детально исследована на биохимическом, генетическом и молекулярном уровне. Однако прямой перенос терминологии и методологии
из одной области в другую в данном случае, к сожалению, вряд ли возможен. Это прежде всего связано со значительными различиями свойств антибиотиков и ДС.
Имеются различия основных свойств антибиотиков и ДС.
1. Механизмы действия. Принципиальное различие антибиотиков и дезинфектантов связано с механизмом их воздействия на микробные клетки. Антибиотики, как правило, воздействуют на единичные
мишени в клетке и, следовательно, на один жизненно важный физиологический процесс. Значительное распространение микроорганизмов, устойчивых к антибиотикам, объясняется, прежде всего, тем, что к
воздействию на единичную мишень адаптироваться
проще. В то же время дезинфектанты, как правило, имеют несколько мишеней в клетке и воздействуют на несколько классов клеточных структур, к чему клеткам гораздо сложнее адаптироваться.
2.Описание бактериальной популяции. На
наш взгляд, именно различия в механизмах воздействия во многом определяют остальные различия антибиотиков и дезинфектантов. В частности, когда мы говорим об уровне устойчивости, то в случае антибиотиков штамм может быть чувствительным либо устойчивым. При лечении животных с инфекционными болезнями, вызванными микроорганизмами, устойчивыми к антибиотику, клинический эффект от терапии может отсутствовать даже при использовании максимальных терапевтических доз антибиотика. В случае дезинфектантов можно говорить только о большей или меньшей устойчивости (чувствительности) различных штаммов, абсолютной устойчивости микроорганизмов к дезинфектантам не наблюдается.
3. Ожидаемый результат.
Значительная часть антибиотиков в терапевтических концентрациях является бактериостатиками. В соответствии с данными, приведёнными в [17], из 21 класса антибиотиков 15 проявляют бактериостатические свойства. Поэтому в ряде случаев конечным результатом антибиотикотерапии является не уничтожение патогенных микроорганизмов в организме человека, а ингибирование их роста и размножения в расчёте на то, что оставшиеся патогены будут инактивированы иммунной системой человека. В противоположность этому обязательным свойством ДС является их высокая
биоцидная эффективность. По сути это означает, что
конечным результатом воздействия дезинфектантов является полное уничтожение микроорганизмов на обрабатываемом объекте или снижение числа патогенов до приемлемого уровня (как правило, не менее чем на 99,99% от исходного уровня).
4. Определение эффективной концентрации.
Эффективную концентрацию антибиотиков определяют на основании начений минимальной подавляющей (ингибирующей) концентрации (МПК, синоним МИК) и минимальной бактерицидной концентрации
антибиотика (МБК) для исследуемой культуры. Для получения лечебного эффекта концентрация антибиотика в крови и в очагах воспаления должна в 2…3 раза превышать МИК в течение определенного времени [18]. Несколько иные подходы используют при определении эффективных концентраций ДС. Так, используемый в странах Евросоюза метод «3×5» аналогичен методикам, принятым в нашей стране [19].
По своей сути эти методы моделируют процесс дезинфекции поверхности различных объектов в условиях, приближённых к реальным, по результатам которого делают заключение об эффективности использованного режима дезинфекции.
5. Момент оценки результата. Оценку результата воздействия антибиотиков проводят, как правило, после завершения процесса антибиотикотерапии, в то же время оценку результата действия ДС можно проводить в процессе уничтожения микроорганизмов. На наш взгляд, по данному признаку антибиотики и ДС весьма близки — и для антибиотиков, и для ДС важно проводить оценку результата воздействия в процессе уничтожения микроорганизмов. Особую важность это имеет в случае антибиотиков, поскольку позволяет в экстренном порядке провести корректировку антибиотикотерапии.
6. Необходимость разбавления/промывки. При расчёте дозы антибиотиков учитывают массу/объём тела животного, а также такие фармакокинетические показатели, как всасывание препарата, его распределение, метаболизм и экскреция . Поэтому возможность разбавления в случае антибиотиков учитывается ещё на этапе расчёта их терапевтической дозы. В случае ДС возможность разбавления (например, при обработке избыточно увлажненных объектов) может существенно повлиять на эффективность дезинфекции, поскольку разбавление снижает рабочую концентрацию средства и тем самым снижает эффективность процесса инактивации микроорганизмов. Также в отличие от антибиотиков, имеющих в большинстве случаев невысокий уровень токсичности, после дезинфекции в ряде случаев требуется удаление остаточных количеств ДС с
обработанных поверхностей путём их промывания проточной водопроводной или стерильной водой. К числу объектов, требующих дополнительного промывания, можно отнести хирургический инструментарий, кормушки, поилки, вёдра для поения телят с соской и ряд других объектов, поверхность которых контактирует с кожей, слизистыми оболочками, а также с продуктами питания (ванны охлаждения тушек птицы в убойных цехах птицефабрик; технологическое оборудование, инвентарь в убойных цехах и мясоперерабатывающих предприятиях; резервуары молочных цистерн, трубопроводы для молока линии розлива и расфасовки молочных продуктов).
7. Временнáя шкала применения. Лечебный эффект у бактерицидных антибиотиков наступает через 1…2 сут, продолжительность лечения в среднем составляет 7 сут. В то же время у бактериостатических препаратов эффект может наступить через 3…4 сут, а длительность лечения до 10 сут и более [21]. Для ДС время, необходимое для достижения требуемого эффекта, составляет от нескольких минут до нескольких часов в особо сложных случаях.
8. Температура применения. Антибиотики de facto используются в достаточно узком диапазоне температур – от 37 до 40°C. В то же время ДС проявляют свою эффективность в более широком диапазоне и могут быть использованы при температурах от ниже 0 °C до +100 °C и выше.
9. Ошибки при применении. К основным ошибкам, которые чаще всего возникают при применении антибиотиков, относят некорректный выбор антибиотика и неправильный выбор его дозировки. В то же время основные ошибки при применении ДС, по их мнению, обусловлены особенностями обрабатываемой среды (возможность разбавления препарата в ходе обработки и присутствие примесей, взаимодействующих с действующим веществом препарата), а также повышенной устойчивостью прикрепленных форм микроорганизмов (биоплёнок). На наш взгляд, неправильный выбор препарата и его дозировки может являться одной
из распространенных ошибок при применении ДС, поскольку, так же как и в случае антибиотиков, он обусловлен человеческим фактором (в том числе
низкой квалификацией персонала). С другой стороны, в литературе имеется значительное количество данных, свидетельствующих о том, что повышенная устойчивость микроорганизмов к антибиотикам часто связана с формированием биоплёнок [3].
Таким образом, типичные ошибки при
применении антибиотиков и ДС весьма близки и существенных различий не имеют.
10. К возможным последствиям неправильного применения антибиотиков относят селекцию антибиотикоустойчивых микроорганизмов и селекцию устойчивых бактерий-комменсалов. К последствиям неправильного применения ДС, по их мнению, можно отнести ингибирование всей бактериальной популяции или медленное уничтожение отдельной фракции популяции и селекцию адаптированных бактерий, или отсутствие бактерицидного эффекта. На наш взгляд, всё, что было перечислено в качестве негативных последствий неправильного применения антибиотиков, вполне можно отнести и к последствиям применения ДС. И наоборот, ингибирование бактериальной популяции и отсутствие бактерицидного эффекта вполне можно отнести к последствиям неправильного применения антибиотиков. По нашему мнению, как и в случае ошибок при применении, последствия неправильного применения антибиотиков и ДС во многом сходны.
Воздействие на покоящиеся формы микроорганизмов. Антибиотики эффективны только в отношении активно растущей культуры, клетки с низким уровнем метаболизма менее чувствительны к антибиотикам. В частности, повышенную устойчивость биоплёнок к антибиотикам объясняют именно низкой метаболической активностью клеток, находящихся в стационарной фазе роста . Ввиду специфики механизмов воздействия эффективность ДС практически не зависит от метаболической активности микроорганизмов. Так, многие такие средства обладают вирулицидной активностью, ряд ДС – спороцидной.
«Рабочая среда». Антибиотики преимущественно используют для подавления или уничтожения микроорганизмов в живых тканях. Соответственно их основная «рабочая среда» – это жидкости организма (кровь, лимфа, ткани, органы). В то же время ДС практически не применяют для обработки жидкостей (исключение составляет дезинфекция
смывных вод, выделений больного и др., предусмотренная санитарными правилами по безопасности работы с микроорганизмами I-II групп патогенности [23]). В большинстве случаев ДС используют для
обработки поверхности различных объектов. именно значительные различия свойств «рабочих сред» обусловливают существенные различия в методиках
оценки эффективности антибиотиков и ДС, как было указано выше.
Количество компонентов в препарате. Как правило, препараты антибиотиков содержат одно действующее вещество, хотя в последнее время появляются подходы, позволяющие комбинировать препараты в ходе антибактериальной химиотерапии. Основной принцип комбинирования заключается в использовании антибиотиков с различным механизмом действия. Это повышает эффективность комбинированного препарата, а в ряде случаев позволяет получить синергический эффект, когда
эффективность комбинированного препарата значительно выше суммы эффективностей составляющих его компонентов. При этом необходимо помнить, что в ходе комбинирования часто происходит суммирование не только желаемых, но и побочных эффектов. В настоящее время комбинирование антибиотиков преимущественно используется при лечении
больных с особо опасными инфекциями, в том числе в случае микстинфекций, вызываемых полирезистентными
возбудителями.
В отличие от антибиотиков коммерческие препараты дС, как правило, являются многокомпонентными и содержат несколько действующих веществ. Как упоминалось выше, использование действующих веществ с различным механизмом действия позволяет значительно повысить эффективность препарата, а также нивелировать недостатки отдельных
биоцидов. В связи с этим в настоящее время существует значительное количество коммерческих препаратов, имеющих от 2 до 6 действующих веществ и более в своём составе. Также ДС, кроме действующих веществ, часто содержат вспомогательные компоненты (поверхностно-активные вещества, отдушки, красители, антикоррозионные добавки и др.),
химическое название и количество которых далеко
не всегда указываются производителем, что в свою
очередь затрудняет сравнение эффективности ДС разных производителей, даже имеющих близкий состав. Таким образом, проведённый анализ различий антибиотиков и ДС позволяет констатировать, что прямой перенос подходов и методологии из области оценки антибиотикоустойчивости в сферу устойчивости микроорганизмов к ДС, к сожалению, невозможен. Речь идёт о том, что любые подходы, даже наилучшим образом зарекомендовавшие себя области антибиотикоусточивости, должны быть критически проанализированы и адаптированы с учётом специфики ДС (фактически с учётом тех различий, которые были представлены выше).
Прежде чем переходить к поиску путей решения, необходимо обозначить наиболее важные проблемы, стоящие в настоящее время перед исследователями и практиками в области устойчивости микроорганизмов к ДС:
– до конца не известны механизмы устойчивости микроорганизмов к ДС и распространённость каждого из механизмов среди микроорганизмов,
циркулирующих в животноводческих и птицеводческих предприятиях;
— до конца не известно, насколько устойчивость микроорганизмов к ДС сопряжена с их устойчивостью к антибиотикам;
– не определены уровни устойчивости микроорганизмов к ДС (уровни, при которых микроорганизмы можно считать устойчивыми/чувствительными);
— нет системных данных о распространении устойчивости среди возбудителей нозокомиальных (клинически выраженных болезней микробного происхождения) к таким средствам, применяемым в животноводческих комплексах;
— остаётся открытым вопрос о том, насколько адекватно тест-штаммы для оценки эффективности ДС отражают реальную устойчивость микроорганизмов, циркулирующих в животноводческих комплексах;
– отсутствуют адекватные методики оценки эффективности воздействия ДС на биоплёнки микроорганизмов и соответственно не разработаны эффективные режимы обработки биоплёнок, хотя в практике дезинфекции всё чаще сталкиваются с данной проблемой [3];
– отсутствует единая, четко определённая, обоснованная терминология в области устойчивости микроорганизмов к ДС.
Исходя из сформулированных нами проблем в области устойчивости микроорганизмов к ДС, к первоочередным задачам, которые должны быть решены в ближайшее время, необходимо отнести следующие:
1. Гармонизация терминологии в области устойчивости микроорганизмов к ДС.
2. Разработка и внедрение в практику методики оценки устойчивости микроорганизмов к ДС.
Без единой, четко определённой, обоснованной
терминологии в области устойчивости микроорганизмов невозможны дальнейшие исследования и практические шаги в данной области.
В первую очередь необходимо определиться с понятиями «чувствительность/устойчивость» к ДС. Стоит также рассмотреть возможность введения термина «толерантность», который, по нашему мнению и мнению некоторых исследователей, более адекватно отражает особенности устойчивости микроорганизмов к ДС.
Разработка и внедрение в практику методики
оценки устойчивости микроорганизмов к ДС необходимы для первичной оценки устойчивости микроорганизмов. Также данная методика позволит
осуществлять мониторинг устойчивости штаммов,
циркулирующих на объектах госветнадзора, к используемым ДС и вовремя проводить ротацию ДС.
Таким образом, эта методика позволит осуществлять системный сбор данных распространении устойчивости к ДС в объектах ветеринарного надзора, что позволит прогнозировать и контролировать данный процесс.
К мероприятиям второй очереди, требующим длительных исследований, необходимо отнести следующие:
1. Исследование механизмов устойчивости микроорганизмов к ДС.
2. Разработка и внедрение в практику методики
оценки эффективности воздействия ДС на биоплёнки микроорганизмов.
Исследование механизмов устойчивости микроорганизмов к ДС позволит выявить закономерности в формировании и распространении этой устойчивости.
Изучение механизмов в совокупности с данными о распространении устойчивости позволит определиться с уровнями, при которых микроорганизмы можно считать устойчивыми/чувствительными.
разработка и внедрение в практику методики
оценки эффективности воздействия ДС на биоплёнки микроорганизмов позволят обосновать режимы обработки биоплёнок микроорганизмов.
Таким образом, решение задач, сформулированных в данной работе, по нашему мнению, позволит снизить напряженность в области устойчивости
микроорганизмов к ДС, пополнит ветеринарную науку новыми данными в области дезинфектологии и позволит приблизить нас к решению
данной проблемы.
1.1.2. Заключение. Комплексное исследование проблемы устойчивости к АМП основано на изучении механизмов устойчивости к АМП и распространенности устойчивости к группам АМП на различных уровнях и с различными тенденциями.
Необходимость комплексной оценки состояния чувствительности микрорганизмов к АМП при решении различных задач:
-лечебных — выбор антибиотиков, антисептиков и бактериофагов.
-противоэпизоотических – выбор дезинфектантов, антисептиков, бактериофагов и антибиотиков
-профилактических – выбор дезинфектантов и антисептиков.
На современном этапе сдерживание распространения устойчивости, преодоление резистентности к АМП, управление этими процессами возможны только при комплексном подходе к решению этой проблемы.
-
-
- Список литературы
-
- Фурсова, Н.К. Лекарственная устойчивость микроорганизмов. Учебное пособие. Мо, Щёлково: издатель Мархотин П.Ю., 2011.
- Родин, В.Б. Перекрёстная устойчивость микроорганизмов к антибиотикам, сопряженная с резистентностью к дезинфектантам / Родин В.Б., Кобзев Е.Н., Детушева Е.В., Мартынова В.Н., Тимошинова Е.В., Детушева К.В. и др. // Дезинфекционное дело.- 2011.-4.-С. 20–26.
- Кобзев, Е.Н. Формирование устойчивости микроорганизмов к дезинфицирующим средствам и пути решения проблемы/ Кобзев Е.Н., Чугунов В.А., Родин В.Б., Детушева Е.В., Слукин П.В. и др.// Эпидемиология и инфекционные болезни. 2014.-Т. 19.- № 6.
- Chapman, J.S. Disinfectant resistance mechanisms, cross-resistance and co-resistance / J.S. Chapman // Int. Biodeter. Biodegrad.- 2003.-N51.-
P.271–276. - Smith, K. Efficacy of common hospital biocides with
biofilms of multi-drug resistant clinical isolates./ Smith K., Hunter I.S. //J. Med. Microbiol.- 2008.-N57.-P.966–973. - Bamber, A.I. An assessment of triclosan susceptibility
in methicillin resistant and methicillin sensitive Staphylococcus
aureus. / Bamber A.I., Neal T.J.// J. Hosp. Infect.- 1999.-N 41.-P.107–109. - Fraud, S. Comparison of the mycobactericidal activity of orthophthalaldehyde, glutaraldehyde and other dialdehydes by a quantitative suspension test./ Fraud S., Maillard J.Y., Russell A.D. // J. Hosp. Infect. —2001.-N 48.-P.214–221.Weber, D.J. Outbreaks associated with contaminated antiseptics and disinfectants./ Weber D.J, Rutala W.A, Sickbert-bennett E.E.//Antimicrob.Agents Chemother.- 2007.-N51.-P. 4217–4224.
- Assessment of the Antibiotic Resistance Effects of Biocides:
Scientific Committee on Emerging and Newly Identified Health
Risks (SCENIHR). 28th plenary on 19 January 2009. available at:
http://ec.europa.eu/health/ph_risk/committees/04_scenihr/docs/ scenihr_o_021.pdf (accessed 17.02.2014). - Braoudaki, M. Adaptive resistance to biocides in Salmonella enterica and Escherichia coli O157 and cross-resistance
to antimicrobial agents./ Braoudaki M., Hilton A.C. //J. Clin. Microbiol.—2004.-N 42.-P.73–78. - Russell, A.D. antibiotic and biocide resistance in bacteria: comments and conclusion./ Russell A.D. // J. Appl. Microbiol.—2002.-N 92.-P.171–173.
14. Sheldon, A.T. Jr. Antiseptic «resistance»: real or perceived threat?/ Sheldon, A.T. Jr. // Clin. Infect. Dis.- 2005.-N 40.-P.1650–1656. - Cerf, O. Tests for determining in-use
concentrations of antibiotics and disinfectants are based on entirely different concepts: “Resistance” has different meanings. /Cerf O., Carpentier B., Sanders P.//Int. J. Food Microbiol.- 2010.-N 136.-P.247–254.
17. Егоров Н.С. Основы учения об антибиотиках: Учебник. 6-е
изд. М.: Изд-во МГУ; Наука, 2004. - Р 4.2.2643–10. Методы лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности.
- МУ 287-113. Методические указания по дезинфекции, предстерилизационной очистке и стерилизации изделий медицинского назначения.
14.СП 1.3.1285–03. Безопасность работы с микроорганизмами
I–II групп патогенности (опасности).
1.2. ИЗУЧЕНИЕ БИОЛОГИЧЕСКИХ СВОЙСТВ ШТАММОВ ВОЗБУДИТЕЛЕЙ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ ЖИВОТНЫХ, ВЫДЕЛЕННЫХ НА ТЕРРИТОРИИ РОССИЙСКОЙ ФЕДЕРАЦИИ ПРИ ПРОВЕДЕНИИ МОНИТОРИНГОВЫХ ИССЛЕДОВАНИЙ ДЛЯ ОЦЕНКИ ИЗМЕНЧИВОСТИ ИХ КУЛЬТУРАЛЬНЫХ И МОРФОЛОГИЧЕСКИХ СВОЙСТВ, ПАТОГЕННОСТИ.
1.2.1. Обоснование выбора направления исследований.
Для современной инфекционной патологии животных характерно увеличение частоты выявления новых возбудителей с измененными и ранее неизвестными свойствами ( метициллинорезистентных Staphylococcus aureus (MRSA), метициллинорезистентных S. epidermidis (MRSE), гипервирулентных Klebsiella pneumoniaе (hvKp –hypervirulent K. pneumoniae), Нарастание количества регистрации возбудителей, которые редко встречались в исследуемом биологическом материале ранее (Stenotrophomonas maltophilia, Histophilus somni, Pantoea agglomerans, атипичных возбудителей (Ureaplasma diversum, Mycoplasma bovis и др.)связано с тем, что с внедрением в лабораторную диагностику новых экспресс-методов, разработкой и внедрением тест-систем и амплификационных тестов для диагностики повышается точность идентификации.
Снижение чувствительности микроорганизмов к дезинфицирующим и антибактериальным препаратам приводит к неэффективности применения дезинфектантов и фармакотерапии. Важно изучать механизмы возниткновения устойчивости микроорганизмов к дезинфектантам и антимикробным препаратам, внедрять и поддерживать систему надзора и контроля за антимикробной резистентностью микроорганизмов и качеством дезинфекции ветеринарных объектов.
При мониторинговых бактериологических исследованиях всё чаще обнаруживаются возбудители атипичных микоплазменных, уреаплазменных и хламидийных инфекций (контагиозные маститы, риниты, бронхопневмонии, артриты и т.д.).
Атипичные возбудители — важная и значительная часть этиологии инфекций в современных условиях. В значительной части случаев выявляются ассоциации атипичных и типичных возбудителей болезней.
Атипичные микроорганизмы – это микроорганизмы, идентификация которых затруднена или невозможна при использовании традиционных бактериологических методов исследования:
— изоляты с нетипичными свойствами,
-фенотипически неразличимые виды;
— некультивируемые и медленнорастущие бактерии.
Использование молекулярно-генетических методов для видовой идентификации культивируемых бактерий
На современном этапе развития микробиологии с помощью молекулярно-генетических методов исследования проводится:
— идентификация изолятов с нетипичными свойствами, дифференциация фенотипически неразличимых видов;
— идентификация некультивируемых и медленнорастущих бактерий;
— идентификация бактерий без предварительного культивирования, непосредственно в клиническом материале;
— идентификация новых видов бактерий.
Оптимизация бактериологических исследований позволяет обнаруживать и идентифицировать возбудителей с измененными свойствами, редкими фенотипами, атипичных микроорганизмов; расширить возможности видовой расшифровки возбудителей.
Микробиологический мониторинг с целью изучения биологических свойств штаммов возбудителей инфекционных болезней животных, выделенных на территории Российской Федерации, позволяет прогнозировать эпизоотическую и эпидемическую ситуацию, при которой возбудители способны покидать природные биотопы, преодолевать межвидовые барьеры, приобретать антимикробную резистентность, что является биологической угрозой. (Указ Президента РФ от 11 марта 2019 г. № 97 «Об Основах государственной политики Российской Федерации в области обеспечения химической и биологической безопасности на период до 2025 года и дальнейшую перспективу”).
Цель исследования: изучение биологических свойств штаммов возбудителей инфекционных болезней животных, выделенных на территории Российской Федерации при проведении мониторинговых исследований для оценки изменчивости их культуральных и морфологических свойств, патогенности.
1.2.2 Материалы и методы исследований
Исследовали секрет молочной железы лактирующих коров, содержащихся в условиях нескольких молочных промышленных комплексов Северо-Западного федерального округа России без выгула, при острых, подострых и скрытых маститах. Пробы (30…50 мл) отбирали в стерильные пластиковые ёмкости после тщательной обработки вымени мыльным раствором, дезинфекции сосков 70%-м этиловым спиртом и сдаивания первой порции молока в отдельную посуду. Бактериологическое исследование начинали не позднее 2-х часов после отбора проб.
Для выявления коринебактерий первичные посевы проводили на среды: кровяной агар с 5% дефибринированной крови барана, сывороточный бульон, специальную среду для культивирования возбудителей дифтерии производства фирмы HiMedia и кровяной теллуровый агар по Эпштейну-Литваку [3]. Для приготовления кровяного теллурового агара к 100 мл расплавленного и охлаждённого ГРМ-агара добавляли 10 мл дефибринированной крови барана и 2 мл 2%-го раствора теллурита калия. Полученную среду перемешивали и разливали в чашки Петри. Для выявления других возбудителей мастита производили также посевы на желточно-солевой агар Чистовича, среду Сабуро, среду Эндо и ГРМ-агар. Полученные чистые культуры коринобактерий идентифицировали по комплексу морфологических и культурально-биохимических свойств. Микроскопическое исследование проводили после окраски мазков-отпечатков из полученных культур по Граму, Трухильо и по Цилю-Нильсону. Гемолитическую активность изучали на 5% кровяном агаре с эритроцитами барана.
Получали чистую культуру, изучали морфологические, культурально-биохимические и патогенные свойства. Для последующей идентификации стрептококков и энтерококков до вида применяли две тест-системы: STREPTOtest 24 («Erba Lachema», Чешская Республика) и api 20 Strep («BIOMERIEUX», Франция), для идентификации энтеробактерий использовали Enterotest 24 N, EnteroRapid 24 («Erba Lachema», Чешская Республика), api 20 E и Rapid 20 E («BIOMERIEUX», Франция), для идентификации грамотрицательных неферментирующих бактерий использовали Nefermtest 24 («Erba Lachema», Чешская Республика)
Окончательную идентификацию коринебактерий проводили молекулярно-генетическим методом, секвенированием по 16S РНК. Чувствительность к антибактериальным препаратам определяли на оборудовании автоматической микробиологической системы «VITEC». Вирулентность выделенных культур выявляли постановкой биопробы на взрослых белых мышах при введении им подкожно смыва суточной агаровой культуры в дозе 0,2 см3. Адгезивную активность выделенных культур проверяли на модели эритроцитов человека, барана и крупного рогатого скота [4].
Объектами исследования были пробы молока от больных коров и коз. Выделение из секрета молочных желез больных коров и коз чистой культуры Staphylococcus haemolyticus и изучение биологических свойств, а также изучение гипермукоидного фенотипа. Оптимизацию микробиологической диагностики оппортунистических маститов протеометрическим методом проводили с использованием MALDI-TOF-SM на базе НИИДИ ФМБА России (Санкт-Петербург).
Было проведено бактериоскопическое, бактериологическое, биологическое и протеометрическое исследование.
Гипермукоидный фенотип (ГМ-фенотип) обычно выявляется с помощью «стринг-теста» — тест является положительным тогда, когда нить длиной более 5 мм тянется за бактериологической петлей от колонии бактериальной культуры, выращенной на плотной питательной среде. ГМ – фенотип формируется за счет увеличения количества капсульного полисахарида.
1.2.3. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
1.2.3.1.ЭТИОЛОГИЧЕСКАЯ СТРУКТУРА ВОЗБУДИТЕЛЕЙ МАСТИТА КОРОВ И ИХ ХАРАКТЕРИСТИКА ЧУВСТВИТЕЛЬНОСТИ К АНТИБАКТЕРИАЛЬНЫМ ПРЕПАРАТАМ В СЕВЕРО-ЗАПАДНОМ ФЕДЕРАЛЬНОМ ОКРУГЕ
Цель исследования – анализ этиологической структуры возбудителей, выделенных из маститного молока коров, и их чувствительности к антимикробным препаратам с применением современных методов диагностики.
Этиологический спектр возбудителей маститов очень широк. Известно более 137 видов и подвидов потенциальных микроорганизмов, которые могут вызывать воспаление молочной железы. Многие авторы объединяют микроорганизмы в две группы [2,3,4,9].
Первая группа — это патогенные микроорганизмы, малоустойчивы во внешней среде. Вымя и сосок служат для них резервуаром, средой обитания. Облигатные микроорганизмы вызывают контагиозный мастит и распространяются в популяции коров во время доения с контаминированными микроорганизмами предметами: салфетками для подмывания вымени, руками дояров, доильными аппаратами. Животные становятся носителями возбудителя. К основным микроорганизмам, вызывающим контагиозный мастит, относят Streptococcus аgalactiae, Staphylococcus aureus, Mycoplasma spp. Достаточно часто маститы у коров вызывает Mycoplasma bovis [4]. По данным ряда авторов, Mycoplasma bovis способствует повышению восприимчивости крупного рогатого скота к вторичным бактериальным инфекциям, что осложняет их течение, приводя к гибели поголовья скота [4,6].
Контагиозные маститы, как правило, длительно протекают в субклинической форме, при этом общее количество бактерий в молоке остается в пределах референтных значений [3, 9].
Вторая группа — это условно-патогенные микроорганизмы, длительно сохраняющие жизнеспособность в окружающей среде («природные патогены», «патогены окружающей среды»). К данной группе микроорганизмов относят колиформные бактерии (E. coli, Klebsiella spp., Enterobacter spp., Citrobacter spp. Serratia spp.), ряд стрептококков (Streptococcus dysgalactiae, Streptococcus uberis), энтерококков, псевдомонад, нокардии, коринебактерии, дрожжевые грибы. [3,5,2]. Они вызывают энвиронментальный мастит (англ. environment — окружающая среда) [7]. Первичная среда обитания бактерий, вызывающих энвиронментальный мастит — окружающая среда (фекалии, почва, опилки, предметы гигиены при доении, вода и др.). Заражение может произойти как при контакте сосков с микроорганизмами во время доения, так и в периоды между дойками (при контакте с грязной подстилкой или грязным полом) [4,8].
Микробиологический мониторинг и лабораторная диагностика маститов предусматривает определение спектра возбудителей, а также выявление доминирующих групп имеющих эпизоотологическое значение микроорганизмов, которые циркулируют в хозяйстве. Лабораторная диагностика маститов в настоящее время проводится с применением двух основных методов исследования – классического бактериологического и современного молекулярно-генетического – полимеразная цепная реакция (ПЦР).
При микробиологическом мониторинге необходимо контролировать процесс появления и нарастания устойчивости выделяемых микроорганизмов к антибактериальным препаратам. Устойчивость микроорганизмов к антибиотикам может быть природной, то есть обусловленной видовыми свойствами микроорганизма (например, устойчивость микоплазм и псевдомонад к бета-лактамным антибиотикам или бактерий к антигрибковым препаратам), и приобретенной (в результате действия антимикробного препарата на популяцию микроорганизмов). Приобретенная резистентность возникает либо в результате мутации в хромосомной ДНК, либо в результате получения микробной клеткой мобильных генетических элементов (плазмид, интегронов) от других бактерий (горизонтальный перенос генов). Мобильные генетические элементы представляют большую опасность, так как они быстро передаются в популяции микроорганизмов и могут содержать как один, так и несколько генов резистентности, кодирующих устойчивость к нескольким антибактериальным препаратам одного класса (перекрестная резистентность). Они могу также передавать группы генов, обусловливающие устойчивость к нескольким классам АМП (ассоциированная резистентность) [1].
Эпизоотологический надзор за антимикробной резистентностью представляет собой систематический постоянный процесс сбора и анализа данных для количественной оценки распространенности антибиотикорезистентности и ее временной динамики.
Нами были проведены мониторинговые исследования проб секрета молочной железы при маститах в четырёх хозяйствах Северо-Западного региона России.
По результатам исследований в секрете вымени больных маститом коров из четырёх хозяйств отмечено преимущественное распространение кокковой микрофлоры по сравнению с энтеробактериями — 56,1% и 7 % соответственно. В том числе патогенные стафилококки составили, в среднем, 23,6%, коагулазоотрицательные стафилококки — 8,3%, стрептококки – 12,2%, энтерококки – 12%. Из энтеробактерий наиболее часто выделяли такие патогены, как Klebsiella pneumoniae (15.2% случаев) и E. coli (7%), Citrobacter spр. – 3,7%, Serratia marcescens – 1,5%. Доля других выделенных микроорганизмов составила 16,5%: Pseudomonas aeruginosa – 9,3%, Actinomycetes – 3,4%, Candida albicans – 2,8%, Bacillus spр. – 1%., Corynebacterium – 10%.
Выделяемые из исследуемого биоматериала микроорганизмы были вирулентны в отношении биомоделей, имели диагностически значимые отличия по культурально-биохимическим свойствам и разную чувствительность к группам антибактериальных препаратов.
Выделены гипервирулентные Klebsiella pneumoniaе (hvKp –hypervirulent K. pneumoniae) и классические Klebsiella pneumoniaе (cKP classical K. pneumoniae). В результате проведенных исследований установлено, что одним из отличий hvKp-штаммов K. pneumoniae является способность синтезировать мощную полисахаридную гиперкапсулу, образующуюся в результате гиперпродукции капсульных полисахаридов. Такие штаммы обычно называют «гипермукоидными». Гипермукоидный фенотип K. pneumoniae выявлен у 15 изолятов (9%).
Заключение
Значительная вариабельность показателей индикации той или иной микрофлоры из секрета вымени больных маститом коров указывает на существенные различия в этиологии маститных инфекций коров по хозяйствам Северо-Западного федерального округа.
Значение изучения биологических свойств и видовой идентификации:
Для микробиолога — оценка клинического значения; выбор АБ препарата для тестирования; интерпретация результатов определения чувствительности.
Лечащего ветеринарного врача — оценка клинического значения; выбор АБ препарата для лечения; выбор режима и длительности терапии.
Эпизоотолога и эпидемиолога — накопление и анализ информации; выявление и прогнозирование вспышек; определение мер инфекционного контроля, основанного на результатах проведенной эпизоотологической и эпидемиологической диагностики и направленного на снижение заболеваемости и смертности.
Необходимо упростить методы работы с труднокультивируемыми микроорганизмами (например, микоплазмы, микробиота влагалища и др.), в перспективе использовать с этой целью метод «обратной геномики» и адаптировать методы к современным условиям, чтобы сделать более доступным бактериологическое лабораторное исследование образцов от животных на наличие атипичных возбудителей, учитывая, что некультивируемые бактерии могут быть и источником принципиально новых антибиотиков.
1.2.3.1.1. Список литературы
- Забровская, А.В. Чувствительность к антимикробным препаратам микроорганизмов, выделенных от сельскохозяйственных животных и из продукции животноводства/Забровская А.В.//Farm Animals.- 2013.- № 1.- С. 78-83.
- Сухинин, А.А. Бактериологический и молекулярно-генетический метод для выделения и идентификации Mycoplasma bovis у крупного рогатого скота/ Сухинин А.А., Смирнова Л.И., Макавчик С.А. //Вопросы нормативно-правового регулирования в ветеринарии. — 2016-№ 4- C. 80-84.
- Смирнова, Л.И. Дифференциация стрептококков, выделенных из молока коров при маститах/ Смирнова Л.И., Сухинин А.А., Приходько Е.И., Дородняя И.М.//Вопросы нормативно-правового регулирования в ветеринарии.- 2014. —№ 4. — С. 136-140.
- Смирнова, Л.И., Биологические свойства микроорганизмов вида Klebsiella pneumoniae subsp. pneumoniae, изолированных из молока коров при мастите / Л.И. Смирнова, А.В. Забровская, С.А. Егорова и др. // Международный вестник ветеринарии. – 2014. – № 2. – C. 12-16.
- Макавчик, С.А. Эффективность определения Mycoplasma bovis в молоке коров при маститах с использованием полимеразной цепной реакции в режиме реального времени на микрочипе с лиофилизированными тест-системами/ Макавчик С.А.//Международный вестник ветеринарии. — 2019.- № 2.- С. 11-16.
- Makavchik, S.A. Identification Bovis bacteria by polymerase chain reaction and sequencing. / Makavchik S.A., Sukhinin A.A., Abgaryan S.R., Belkina I.V.//Dusunen Adam , 10 (1), 2004-2012.
- Shivakumar,V. Biofilms community behavior by bacteria. /Shivakumar V, Chakravortty D.//Resonance — 2014-P.1005-1016.
- Smirnova, L.I. Bacteriological monitoring of the pathogens of mastitis in dairy complex of the north-west region of the Russian Federation/
Smirnova L.I., Makavchik S.A., Sukhinin A.A., Prikhodko E.I., Zabrovskaya A.V.//Research Journal of Pharmaceutical, Biological and Chemical Sciences. -2019. -V. 10. —№ 1.- P. 2013-2020. - Tiwari, J.G. Trends In Therapeutic and Prevention Strategies for Management of Bovine Mastitis: An Overview./ Tiwari J.G., Babra C., Tiwari H.K., Williams V., Wet S.D. et al. // J. Vaccines Vaccin.-2013.-N 4.-P. 176.
1.2.3.2. БИОЛОГИЧЕСКИЕ СВОЙСТВА STAPHYLOCOCCUS HAEMOLITICUS — ВОЗБУДИТЕЛЯ МАСТИТА СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ
Инфекция вымени лактирующих животных бывает как экзогенной, так и эндогенной. При экзогенной инфекции возбудители проникают в молочную железу из внешней среды через сосковый канал. При эндогенной инфекции возбудителем мастита становится собственная условно-патогенная микрофлора вымени, активизирующаяся при снижении иммунитета животных [7].
Известны многочисленные факторы патогенности микроорганизмов рода Staphylococcus, изучена их значимость в развитии инфекционного процесса и возможность применения при создании вакцинных препаратов. Имеются вакцины, в конструкции которых использованы капсульные полисахариды, токсины, белковые антигены клеточной стенки.
Полисахаридная капсула микробной клетки позволяет бактериям выживать и распространяться внутри организма хозяина, преодолевая защитные механизмы иммунной системы. По сравнению с бескапсульными штаммами, капсульные варианты реже фагоцитируются клетками иммунной системы, как в присутствии, так и в отсутствии опсонинов Предотвращение связывания бактерий иммунными клетками ограничивает процессы развития раннего воспаления и приводит к менее надежной индукции иммунного ответа. Показано, что капсула способствует устойчивости бактерий против системы комплемента, блокирует бактерицидное действие β-дефензинов и подавляет их продукцию в эпителиальных клетках дыхательных путей. В некоторых случаях капсула связывает противомикробные пептиды, вырабатываемые в процессе иммунного ответа хозяина, и предотвращает взаимодействие этих молекул с бактериальной клеткой. В присутствии таких антимикробных пептидов, как лактоферрин и полимиксин Б, наблюдается повышение скорости секреции капсульного материала [6,5,3].
Цель работы на данном этапе – сравнение биологических свойств классических и гипермукоидных клинических изолятов Staphylococcus haemolyticus, выделенных из маститного молока коз и коров.
При стафилококковых маститах коров и коз чаще всего выделяют Staphylococcus aureus. Однако, возбудителем стафилококковых маститов могут быть микроорганизмы и других видов. В качестве примера можно привести случаи выделения из секрета воспаленной молочной железы коров и коз вирулентных культур Staphylococcus haemolyticus.
Болезнь у животных протекала в острой форме. Вымя резко отекало, увеличивалось в размерах, соски набухали, из них выделялись капельки молока. Кожа вымени была гиперемирована. При попытке сдаивания молока у коров и коз наблюдалась сильная болезненность. Молоко приобретало серый цвет и слизистую консистенцию, нити слизи тянулись на расстояние до трех-пяти сантиметров.
При бактериоскопическом исследовании в мазках были обнаружены грамположительные кокки, располагающиеся одиночно, попарно и небольшими скоплениями по 3…4 клетки. Микроорганизмы Staphylococcus haemolyticus с гипермукоидным фенотипом были окружены хорошо заметной капсулой.
При посеве на желточно-солевой агар Чистовича через 24…26 ч получали мелкие и средние серо-белые, блестящие, сливающиеся между собой, выпуклые колонии звездчатой формы с неровными краями, слизистой консистенции. Зона лецитиназной активности вокруг колоний отсутствовала.
Немукоидные изоляты образовывали мелкие и средние, блестящие колонии с каротиноидным пигментом желтовато-белого цвета с зоной лецитиназной активности.
При посеве на кровяной агар с 5% крови барана после культивирования в течение 24 ч при 37 0С учитывали наличие мелких серо-белых слизистых колоний округлой формы, окруженных широкой прозрачной зоной бета-гемолиза. Проба на плазмокоагуляцию цитратной плазмы кролика и проба на ДНК-азу была отрицательной. Проба на каталазу и ацетоин – положительная.
Определение биохимического профиля исследуемых культур проводили с помощью микротестов производства НИЦФ, Санкт-Петербург. Установили, что исследуемые микроорганизмы способны окислять галактозу, лактозу, мальтозу, маннит, сахарозу и трегалозу. Отсутствовало окисление ксилозы, ксилита, маннозы, рибозы, целлобиозы.
Окончательную идентификацию изучаемых штаммов стафилококков проводили методом MALDI-TOF-SM (ФГБУ НИИДИ ФМБА России, Санкт-Петербург). В результате исследования установили, что выделенные микрооргакнизмы относятся к виду Staphylococcus haemoliticus.
Для изучения токсигенных свойств изучаемые штаммы гемолитического стафилококка пересевали на бульон для выявления продукции энтеротоксина, содержащий пантотенат кальция, сульфат магния, цистин и триптофан (готовая среда производства HiMedia). Посевы помещали в эксикатор с 20% CO2. Инкубировали при 37ОC в течение 3-х суток. Токсигенность определяли in vitro в реакции преципитации в геле (РДП) в наборе для РДП производства НИИ эпидемиологии и
микробиологии (НИИЭМ) имени Пастера, Санкт-Петербург. Результат был положительным, что свидетельствует о том, что маститное молоко при употреблении его в пищу могло стать причиной пищевого отравления – стафилококкового токсикоза.
Биопробу проводили на беспородных взрослых белых мышах. Их заражали внутрибрюшинно в дозе 0,2 мл смывом суточной агаровой культуры стафилококков в концентрации 1 млрд микробных клеток / мл Наблюдали заболевание и гибель мышей на 4-й и 6-й день после заражения.
Чувствительность выделенной культуры к антибиотикам определяли методом диффузии в агаре с помощью стандартных дисков производства НИИЭМ имени Пастера, г. Санкт-Петербург на среде АГВ по стандартной методике. Определили, что изучаемые штамм гемолитического стафилококка были наиболее чувствительны к новобиоцину, полусинтетическим пенициллинам, обладающим устойчивостью к в-лактамазе: амоксиклаву, а также макролиду азитромицину и ципрофлоксацину.
Заключение.
Коагулазоотрицательные стафилококки (КОС) Staphylococcus haemolyticus, выделенные из маститного молока коз и коров обладали мукоидным фенотипом и образовывали слизистые колонии. В результате проведенных исследований установлено, что подобные Staphylococcus haemolyticus способны синтезировать мощную полисахаридную гиперкапсулу, образующуюся в результате гиперпродукции капсульных полисахаридов – такие штаммы обычно называют «гипермукоидными». Гиперкапсула играет весьма значительную роль в вирулентности штаммов и может выступать в качестве мишени для разработки новых препаратов, обладающих бактерицидным или бактериостатическим потенциалом действия.
Гипермукоидные штаммы Staphylococcus haemolyticus обладали более выраженной способностью к формированию микробных биопленок по сравнению с немукоидными штаммами.
Микроорганизмы с мукоидным фенотипом, колонизирующие репродуктивную, респираторную систему и молочную железу животных, объединяются в бактериальные сообщества, формируют общий защитный матрикс и становятся недоступными для антибактериальных препаратов и факторов иммунной защиты организма хозяина. Благодаря этому феномену бактерии остаются жизнеспособными после антибиотикотерапии, которая приводит только к эрадикации их планктонных форм.
1.2.3.2.1. Cписок литературы
1. Смирнова, Л.И., Биологические свойства микроорганизмов вида Klebsiella pneumonia subsp. pneumonia, изолированных из молока коров при мастите / Л.И. Смирнова, А.В. Забровская, С.А. Егорова и др. // Международный вестник ветеринарии. – 2014. – № 2. – С. 12-16.
2. Смирнова, Л.И. Дифференциация стрептококков, выделенных из молока коров при маститах/ Смирнова Л.И., Сухинин А.А., Приходько Е.И., Дородняя И.М.//Вопросы нормативно-правового регулирования в ветеринарии. -2014. -№ 4. -С. 136-140.
3. Смирнова, Л.И. Роль бактерий рода Klebsiella при ассоциированных инфекциях коров и телят в условиях промышленного комплекса / Смирнова, Л.И., Забровская А.В., Приходько Е.И., Ярикова В.Э., Гегирова Д.М.//Международный вестник ветеринарии. 2014-№ 2 — С. 7-12.
4. Сухинин, А.А.Этиологическая структура респираторных болезней крупного рогатого скота в северо-западном регионе/Сухинин А.А., Макавчик С.А., Герасимов С.В., Прасолова О.В.// Ветеринария.- 2015.- № 12.- С. 21-23.
5. Макавчик, С.А.Эффективность определения Mycoplasma bovis в молоке коров при маститах с использованием полимеразной цепной реакции в режиме реального времени на микрочипе с лиофилизированными тест-системами /Макавчик С.А.//Международный вестник ветеринарии.- 2019. -№ 2. -С. 11-16.
6. Микробные биопленки в клинической микробиологии и антибактериальной терапии / В.К. Окулич, А.А. Кабанова, Ф.В. Плотников. – Витебск: ВГМУ, 2017. – 300 с. : ил.
7. Smirnova, L.I. Bacteriological monitoring of the pathogens of mastitis in dairy complex of the NorthWest region of the Russian Federation /Smirnova L.I., Makavchik S.A., Sukhinin A.A., Prikhodko E.I., Zabrovskaya A.V.// Research Journal of Pharmaceutical, Biological and Chemical Sciences.- 2019. -V. 10.- № 1.- P. 2013-2020.
1.2.3.3. БИОЛОГИЧЕСКИЕ СВОЙСТВА КОРИНЕБАКТЕРИЙ, ИЗОЛИРОВАННЫХ ИЗ МОЛОКА КОРОВ ПРИ МАСТИТЕ
Коринебактерии – условно патогенные бактерии. Они широко распространены в природе, часто присутствуют в организме здоровых людей и животных, не принося ощутимого вреда. Однако при снижении иммунного статуса и в ассоциации с другими микроорганизмами коринебактерии могут вызывать различные патологии. Это крупозная пневмония, гнойно-септические процессы, поражения суставов, поражение органов мочеполовой системы, гастроэнтериты, тяжёлые госпитальные инфекции у недоношенных детей, пожилых и ослабленных лиц [1]. Серьёзная проблема молочного животноводства – ассоциированные, клинически выраженные и скрытые, субклинические маститы коров. Возбудителями таких маститов в составе ассоциации могут быть клебсиеллы, эшерихии, синегнойные палочки, протей, стафилококки и стрептококки. Как правило, ассоциированные маститы связаны с нарушением биологического равновесия между макроорганизмом и популяциями микробной флоры его отдельных органов и систем [1,2,5,8] Интенсивная лекарственная терапия, в частности, применение антибиотиков, при подобных состояниях часто приводит к количественным и качественным изменениям микробиоценозов кожи, слизистых оболочек, кишечника, способствующим отягощению течения основного заболевания. Одновременное развитие нескольких возбудителей характеризуется не только суммированием болезнетворных возможностей, но и вызывает взаимное усиление вирулентности ассоциантов [4,5]. Наряду с этим в популяциях взаимодействующих микроорганизмов увеличивается число особей, устойчивых к антибиотикам [6]. Подтверждением этиологической значимости условно-патогенных микроорганизмов, в частности коринебактерий, выделенных в виде ассоциаций и монокультур, является изучение их биологических свойств и патогенного потенциала [2].
Цель работы на данном этапе — изучение биологических свойств, в том числе факторов патогенности коринебактерий, выделенных из секрета молочной железы коров при маститах.
Было проведено исследование 120 проб секрета молочной железы коров при остром и подостром клиническом и субклиническом маститах. Выделили 20 культур коринебактерий, идентифицированных молекулярно-генетическим методом, то есть коринебактерии присутствовали в 10% исследованных проб. Видовой состав идентифицированных изолятов: Corynebacterium аmycolatum — 6 (30%), Corynebacterium freneyi – 6 (30%), Corynebacterium glutamicum – 3 (15%), Corynebacterium hominis – 3 (15%), Corynebacterium testudinoris 2 (10%). При этом в 50% случаев коринебактерии выделяли в ассоциации с Staphylococcus aureus, в 30% случаев – в ассоциации с Escherichia coli, в 30 % — в ассоциации с Klebsiella pneumoniae spp. pneumoniae, в 20% — в ассоциации с Proteus mirabilis, в 10% — в ассоциации с Pseudomonas aeruginosa, в 10% случаев — в ассоциации со Streptococcus dysagalactiae. Микроорганизмы, идентифицированные как коринебактерии, имели форму резко полиморфных, грамположительных палочек неправильной формы, с закруглёнными концами, не образующих споры и капсулы, располагающихся беспорядочно, одиночно и в виде скоплений, параллельно и «V» образно под углом друг к другу. В препаратах, изготовленных из старой культуры (более 5 суток культивирования) отдельные клетки бактерий окрашивались по Граму отрицательно. Изучаемые культуры росли в аэробных условиях, обладали каталазной активностью, выделяли сероводород. На кровяном агаре через 24-72 ч инкубирования при температуре 370С коринебактерии образовывали мелкие (1-2 мм), белые, желтовато-белые и коричневато-белые, плоско-приподнятые, шероховатые колонии с бугристой поверхностью и неровным краем (в R-форме). На первые и вторые сутки инкубирования при 370С культуры не проявляли гемолитической активности. После хранения в холодильнике при температуре +4…50С в течение 15…18 ч вокруг колоний появлялась хорошо заметная узкая зона бета-гемолиза. На сывороточном бульоне при росте культур наблюдали слабое помутнение и образование сухой серо-белой плёнки на поверхности среды. На кровяном теллуровом агаре изучаемые культуры коринебактерий образовывали мелкие непрозрачные серые колонии в R-форме. На специальной среде для коринебактерий производства HiMedia роста не было. Изучаемые культуры коринебактерий Corynebacterium amycolatum и Corynebacterium freneyi проявили вирулентность в отношении взрослых белых лабораторных мышей. При наблюдении в течение 7-14 сут после подкожного заражения смывом агаровой культуры коринебактерий с кровяного агара в дозе 0,2 мл у подопытных животных отмечали клинические признаки болезни в виде угнетения, сонливости, мышечной дрожи, взъерошивания шерсти, отказа от корма, истощения. 50% животных погибло. При вскрытии погибших и больных мышей наблюдали кровоизлияния в кишечнике, на перикарде, на печени, пневмонию и отек лёгких.
Тестированные культуры коринебактерий обладали устойчивостью к антимикробным препаратам нескольких классов: сульфаниламидам, ко-тримоксазолу, тетрациклину, аминогликозидам (тобрамицину, гентамицину, амикацину), β–лактамам (ампициллину, амоксиклаву, цефепиму, цефотаксиму). При определении адгезивных свойств изолированных культур коринебактерий выяснили, что они проявляют выраженную адгезивную активность на модели нативных эритроцитов барана и крупного рогатого скота.
Секвенирование 16S РНК мы применили как референс-метод для идентификации выделенных коринебактерий. Параллельно была проведена сравнительная оценка видовой идентификации по биохимическому профилю с помощью автоматической микробиологической системы «VITEC» Все случаи несовпадений проверяли дополнительными диагностическими тестами классической микробиологии и (или) реакцией секвенирования генов 16S РНК [7]. Отсутствие желаемого объёма в базе данных микробиологического анализатора «VITEC» не позволило нам провести параллельное исследование и идентификацию коринебактерий фенотипическим методом при определении биохимического профиля. Но молекулярно-генетический метод расширяет наше представление о видовом разнообразии коринебактерий в составе микробиоты молочной железы при маститах и дает основание для изучения их возможной роли как в поддержании состояния нормоценоза, так и развитии патологических процессов. Полученное разнообразие видов коринебактерий подчёркивает ценность метода секвенированаия при видовой идентификации этой группы микроорганизмов. Следует отметить, что культуры Klebsiella pneumoniae spp. pneumoniae, Pseudomonas aeruginosa, Proteus mirabilis, Staphylococcus aureus и Streptococcus dysgalactiae, выделенные из секрета молочной железы больных маститом коров в ассоциации с коринебактериями, также были вирулентны (вызывали гибель 50…100% белых мышей в течение 2…-8-х сут после заражения внутрибрюшинно в дозе 0,2 см3). Культуры Klebsiella pneumoniae spp. pneumoniae, Pseudomonas aeruginosa, Proteus mirabilis были частично устойчивы к наиболее часто применяемым классам АБП: фторхинолонам (налидиксовой кислоте, ципрофлоксацину), сульфаниламидам, котримоксазолу, тетрациклину, полимиксину, аминогликозидам (стрептомицину, гентамицину), нитрофурантоину, β-лактамам (амоксиклаву, ампициллину, цефотаксиму).
Заключение. Из молока больных маститами коров, содержащихся в условиях промышленных животноводческих комплексов Северо-Западного федерального округа России, изолированы и идентифицированы молекулярно-генетическим методом 20 культур Corynebacterium sp. Видовой состав идентифицированных изолятов: Corynebacterium amycolatum — 6 (30%), Corynebacterium freneyi – 6 (30%), Corynebacterium glutamicum – 3 (15%), Corynebacterium hominis – 3 (15%), Corynebacterium testudinoris — 2 (10%). Изученные культуры проявляли гемолитическую активность и высокую адгезивную активнось, были вирулентны для мышей. Это позволяет считать их одним из этиологических факторов ассоциированного мастита коров в данных хозяйствах.
1.2.3.3.1. Список литературы
- Smirnova, L.I. Bacteriological monitoring of the pathogens of mastitis in dairy complex of the North-West region of the Russian Federation /Smirnova L.I., Makavchik S.A., Sukhinin A.A., Prikhodko E.I., Zabrovskaya A.V.//
Research Journal of Pharmaceutical, Biological and Chemical Sciences.- 2019. -N. 10.- № 1.- P. 2013-2020. - Макавчик, С.А., Биологические свойства Staphylococcus haemolyticus как возбудителя мастита сельскохозяйственных животных /Макавчик С.А., Смирнова Л.И., Сухинин А.А.// Вопросы нормативно-правового регулирования в ветеринарии. — 2019. —№ 4.- С. 54-56.
- Скородумов, В.И. Микробиологическая диагностика бактериальных болезней животных / Скородумов Д.И., Субботин В.В., Cидоров М.А., Костенко Т.С.// М.: ИзографЪ, 2005.- С.313-321.
- Смирнова Л.И. Адгезивные свойства кишечной палочки и профилактика колибактериоза птиц: дисс. … канд.вет.наук, 1996.
- Смирнова, Л.И., Биологические свойства микроорганизмов вида Klebsiella pneumoniae subsp. pneumoniae, изолированных из молока коров при мастите / Л.И. Смирнова, А.В. Забровская, С.А. Егорова и др. // Международный вестник ветеринарии. – 2014. – № 2. – C. 12-16.
- Смирнова, Л.И.Дифференциация стрептококков, выделенных из молока коров при маститах. / Смирнова Л.И., Сухинин А.А., Приходько Е.И., Дородняя И.М. // Вопросы нормативно-правового регулирования в ветеринарии.-2014.-№ 4.-С. 136-140.
- Сухинин, А.А. Бактериологический и молекулярно-генетический метод для выделения и идентификации Mycoplasma bovis у крупного рогатого скота. Сухинин А.А., Макавчик С.А., Смирнова Л.И. // Вопросы нормативно-правового регулирования в ветеринарии.-2016.-№ 4.-С. 80-83.
- Сухинин, А.А. Этиологическая структура респираторных болезней крупного рогатого скота в Северо-Западном регионе/Сухинин А.А., Макавчик С.А., Герасимов С.В., Прасолова О.В.//Ветеринария.-2015.-№12.-С.21-23.
1.2.3.4.ГИПЕРМУКОИДНЫЕ ФЕНОТИПЫ KLEBSIELLA PNEUMONIAE И ПРОБЛЕМЫ АНТИБИОТИКОТЕРАПИИ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ
Микроорганизмы Klebsiella pneumoniae – условно патогенные, колиформные бактерии рода Klebsiella, относящиеся к семейству Enterobacteriaceae. Klebsiella широко распространены в природе: их выделяют из множества объектов внешней среды, включая почву, воду, молочные продукты. Klebsiella являются представителями резидентной микрофлоры кишечника животных различных видов и человека. В то же время данные микроорганизмы могут играть роль этиологического фактора при пневмониях, метритах, маститах, гастроэнтеритах, септических процессах у людей и животных [1, 2, 3,10].
В настоящее время известны две эволюционные ветви клебсиелл: классические Klebsiella pneumoniaе (cKP classical K. pneumoniae) и гипервирулентные Klebsiella pneumoniaе (hvKp –hypervirulent K. pneumoniae ). Группа cKP характеризуется быстрым накоплением различных детерминант устойчивости к антибиотикам. Большинство классических полирезистентных штаммов K. Pneumoniae являются продуцентами β-лактамаз расширенного спектра (БЛРС)и/или карбапенемаз в комбинации с резистентностью к фторхиналонам и аминогликозидам. [7].
В настоящее время ряд исследователей отмечает формирование новой «гипервирулентной» группы K. pneumoniae (hvKp). Первые упоминания об инфекциях, вызванных подобными штаммами, появились в 80-х годах XX века; большинство сообщений акцентировали внимание на высоком уровне вирулентности hvKp штаммов, позволяющем им инфицировать здоровых людей. Одним из ярких отличительных признаков большинства hvKp штаммов является гипермукоидность (ГМ), ассоциированная с гиперпродукцией капсульных полисахаридов [8].
Группа hvKp обладает обширным набором факторов вирулентности . характерным признаком большинства штаммов является гипермукоидность, выявляемая с помощью string –теста [4]. Изучение биологических свойств hvKp установило их способность продуцировать капсульный полисахарид (КПС), принадлежность к К1, К2,К5, К54 и К57серотипам, наличие генов вирулентности (rmpA, magA, rpu2, fimH, allS, kfu, wabG, iucA, iroN, terB и других), а также большую устойчивость к бактерицидной активности комплемента и нейтрофилов. Антибиотикорезистентность большинства гипервирулентных K. pneumoniae остается на низком уровне, однако в мире уже описаны единичные штаммы hvKp, обладающие повышенным уровнем резистентности к антибиотикам ( БЛРС — или карбапенемаза-продуцирующие штаммы), что может представлять серьезную угрозу для общества [5,6,7].
Окружающая среда может содержать широкий спектр штаммов K.pneumoniae с различным потенциалом патогенности. Klebsiella обладают 7 серологически различными типами капсулы и степень их вирулентности может быть связана с содержанием маннозы в полисахариде капсулы. Капсульные серотипы К1 и К2 обладают генами magA и rmpA, обусловливающими большую инвазивность микроорганизмов и устойчивость к фаогцитозу [7,8].
Терапия должна быть направлена на подавление адгезии микроорганизмов с гипермукоидными фенотипами к поверхности клеток и формирования матрикса. Кроме того, антимикробные препараты могут быть использованы для подавления размножения и расселения микроорганизмов, образующих биопленку, а также для интенсификации проникновения бактерицидных веществ внутрь сформированной биопленки. Терапия подобных инфекций должна сочетать использование антимикробных препаратов и деструкторов микробных биопленок. Длительное применение антибиотиков для лечения оппортунистических инфекций приводит к дополнительной проблеме – развитию антибиотикорезистентности [9].
Использование современных технологий позволяет более подробно исследовать возможности фаготерапии. Изучение тонкой структуры бактериофагов, механизмов их взаимодействия с бактериальной клеткой может открыть новые возможности в поиске альтернативных противомикробных агентов. Одно из наиболее актуальных направлений – изучение ферментов, используемых фагами в процессе адсорбции на поверхности бактериальной клетки. ПС-деполимеразы необходимы бактериофагу для того, чтобы разрушить полисахаридный слой, экранирующий рецепторы клеточной стенки бактерий, и инициировать адсорбцию. Бактериофаги, обладающие ПС-деполимеразами эффективно расщепляют гиперкапсулу, снижая способность гипермукоидных штаммов к избеганию и укрыванию от действия защитных сил иммунной системы. [7,8]
Цель данной работы — исследование клинического материала для определения спектра микрофлоры с помощью современных методов диагностики, изучение гипермукоидного фенотипа микроорганизмов и ихантибиотикорезистентности.
Бактериологический мониторинг проводили в животноводческом комплексе по производству молока Северо-Западного региона РФ. Объектами исследования были пробы молока от больных и здоровых коров, мазки с верхнего свода влагалища коров, больных вагинитами и маститами, мазки из носа телят при рините, бронхите и бронхопневмонии, ректальные мазки от телят при энтеритах, смывы с доильных стаканов и оборудования в доильном зале. Мазки и смывы брали стерильными увлажнёнными целлюлозными зондами и доставляли для исследования в транспортной среде Amis (без активированного угля). Первичные посевы делали на среды Кесслер, Эндо, глюкозо-кровяной агар, желточно-солевой агар Чистовича. Полученные чистые культуры бактерий тестировали по культурально-биохимическим свойствам.
Гипермукоидный фенотип штаммов определяли при постановке string-теста с использованием суточной культуры культуры, выращенной на кровяном агаре с добавлением 5% бараньих эритроцитов. Тест считали полложительным, если за бактериологической петлей тянулся слизистый тяж высотой более 5 мм от поверхности питательной среды.
Способность клебсиелл к капсулообразованию изучали на среде МПА с 1% глицерина и 1% глюкозы, с добавлением молока при выделении культур из мастиного молока. Гемолитическую активность – на кровяном агаре с эритроцитами человека и эритроцитами барана.
Оптимизацию микробиологической диагностики оппортунистических маститов протеометрическим методом проводили с использованием MALDI-TOF-SM на базе ФГБУ НИИ эпидемиологии и микробиологии (НИИЭМ) имени Пастера, НИИДИ ФМБА России (Санкт-Петербург).
Идентификацию и определение чувствительности к антибиотикам проводили с помощью автоматической микробиологической системы «VITEC COMPACT 2». Наличие β-лактамаз определяли методом «двойных дисков». Класс β-лактамаз устанавливали методом ПЦР.
Вирулентность выделенных культур определяли постановкой биопробы на белых мышах при введении подкожно смыва суточной агаровой культуры (500 тыс.м.т./см3) в дозе 0,2 см3.
Интенсивность образования микробных биопленок cKP и hvKp изолятами оценивали в 96-луночных полистероловых планшетах в соответствие с методикой O’Toole с соавторами (1999) с красителем генциан виолетом [6].
В 2016-2018 годах в животноводческом хозяйстве были проведены мониторинговые бактериологические исследования 135 проб биологического материала. Из доставленного материала микроскопическим, бактериологическим и протеометрическим методами исследования было выделено и идентифицировано 218 культур бактерий, имеющих практическое ветеринарное значение, в том числе 47 культур K. pneumoniae subsp. pneumoniae, 9 культур K. oxytoca, 5 культур Raoutella. В большинстве случаев их выделяли в ассоциации с Proteus mirabilis, Pseudomonas aeruginosa и Escherichia coli, частично — с участием Staphylococcus, Morganella, Providensia, Raoultella и других. Таким образом, установлено, что подавляющее большинство членов этих микробных ассоциаций – это оппортунистические патогены, способные длительно сохранять жизнеспособность в окружающей среде. микробные ассоциации выделяются также от животных с вульвовагинитами и от телят с болезнями респираторных органов и оказывают патологическое воздействие на вымя лактирующих коров.
Гипермукоидный фенотип K. pneumoniae выявлен у 20 изолятов (9,17%) положительным результатом string-теста.
Клебсиеллы вида K. pneumoniae subsp. pneumoniae представляли собой мелкие, неподвижные, грамотрицательные палочки, обладали хорошо заметной при микроскопии капсулой. При росте на ГРМ-бульоне они вызывали равномерное помутнение, тонкую слизистую плёнку на поверхности. После посева на агаризованную среду визуально рост колоний можно было наблюдать уже через 2-3 часа. На МПА через 18-24 ч вырастали серо-белые, полупрозрачные, блестящие, сливающиеся слизистые колонии диаметром 3-4 мм. На среде Эндо изучаемые культуры образовывали очень крупные колонии диаметром до 12-15 мм, лактозовариабельные, пышные, приподнимающиеся над поверхностью среды на 5-6 мм и выше, образующие после прикосновения бактериологической петлёй слизистые тяжи длиной 10 см и более. Культуры продолжали активно расти при температуре 20-23оС, через 48 часов слой слизи становился настолько мощным, что часть колоний отрывалась от поверхности среды и образовывала сгустки на крышечке в перевёрнутой чашке Петри. Через 2 дня после посева слизистая субстанция колоний уплотнялась в виде каучукоподобной клейкой массы, образуя матрикс, защищающего их от внешних воздействий (рис.1).

Рис.1. Klebsiella pneumoniae, обладающая гипермукоидным фенотипом, образующая слизистые тяжи.
На среде Эндо с добавлением 5% молока колонии данной популяции клебсиелл за 48 ч инкубации достигали диаметра 20-22 мм.
На кровяном агаре исследуемые культуры давали средние и крупные серые слизистые колонии, среда в чашке становилась тёмно-коричневой, непосредственно вокруг колоний появлялась узкая (1-2 мм) зона β-гемолиза.
При исследовании биохимических свойств выделенных культур Klebsiella pneumoniae subsp. pneumoniae определили, что они не выделяют индол и сероводород, замедленно растут на цитратной среде Симмонса, не обладают фенилаланиндезаминазой, дают отрицательную реакцию с метиловым красным и положительную (или сомнительную) Фогеса-Проскауэра, замедленно свёртывают молоко. Используя анализатор «VINEK COMPACT 2», установили, что клебсиеллы отличаются по биохимической активности. Выделены гипервирулентные Klebsiella pneumoniaе (hvKp –hypervirulent K. pneumoniae) и классические Klebsiella pneumoniaе (cKP classical K. pneumoniae). При этом оба варианта показывали нетипичный результат дифференцирующего теста на уреазу (-) и лизиндекарбоксилазу (-). Культуры гипервирулентные Klebsiella pneumoniaе (hvKp –hypervirulent K. pneumoniae) замедленно расщепляли лактозу.
Культуры Klebsiella pneumoniae subsp. pneumonie, выделенные из секрета молочной железы при мастите, были вирулентны для белых мышей и вызывали их гибель: классические Klebsiella pneumoniaе (cKP classical K. pneumoniae) в течение 4-6 дней , а гипервирулентные Klebsiella pneumoniaе (hvKp –hypervirulent K. pneumoniae) в течении 1-2 суток после подкожного заражения в дозе 0,2 мл.
Тестированные культуры hvKp-штаммов K. pneumoniae обладали устойчивостью к антимикробным препаратам нескольких классов: сульфаниламидам, ко-тримоксазолу, тетрациклину, аминогликозидам (тобрамицину, гентамицину, амикацину), β–лактамам (ампициллину, амоксиклаву, цефепиму, цефотаксиму) продуцировали β-лактамазу расширенного спектра (БЛРС) класса СТХМ-1.
Тестированные культуры классические Klebsiella pneumoniaе (cKP classical K. pneumoniae), выделенные из этих же проб молока, проявляли устойчивость только к ампициллину.
В результате проведенных исследований установлено, что одним из отличий hvKp-штаммов K. pneumoniae является способность синтезировать мощную полисахаридную гиперкапсулу, образующаяся в результате гиперпродукции капсульных полисахаридов – такие штаммы обычно называют «гипермукоидными».
Штаммы Klebsiella pneumoniae subsp.pneumoniae с гипермукоидным фенотипом обладали более выраженной способностью к формированию микробных биопленок по сравнению с мукоидными штаммами.
Подавляющее большинство гипермукоидных штаммов обладали гемолитической активностью в сравнении с немукоидными штаммами, что в целом согласуются с литературными данными.
Klebsiella pneumoniae устойчивы к наиболее часто применяемым классам АБП, обладают β-лактамазой расширенного спектра. Клебсиеллы изученного штамма (Klebsiella pneumoniae subsp. pneumoniae) продуцируют бета-лактамазу класса СТХМ-1.
Известно, что гипермукоидность штаммов тесно связана с синтезом капсульных полисахаридов, которые обеспечивают большую устойчивость бактериальных патогенов к антимикробным сывороточным факторам, таким как фагоцитарная активность и комплементзависимый лизис.
Микроорганизмы с гипермукоидным фенотипом, колонизирующие репродуктивную, респираторную систему и молочную железу коров, объединяются в бактериальные сообщества, формируют общий защитный матрикс и становятся недоступными для антибактериальных препаратов и факторов иммунной защиты организма хозяина. Благодаря этому феномену бактерии остаются жизнеспособными после антибиотикотерапии, которая приводит только к эрадикации планктонных форм.
1.2.3.4.1. Список литературы
- Воложанцев, Н.В. Роль бактериофагов в решении проблемы устойчивости Klebsiella pneumoniae к антибиотикам / Н.В. Воложанцев, А.И. Борзилов,Е.В. Комисарова, В.П. Мякинина, В.В. Веревкин, В.М. Красильникова,А.А. Кисличкина, О.В. Коробова, Т.И. Комбарова, Э.А. Светоч // Проблемы медицинской микологии. – 2017. – Том 19. – № 2. – С.48.
- Смирнова, Л.И., Биологические свойства микроорганизмов вида Klebsiella pneumonia subsp. pneumonia, изолированных из молока коров при мастите / Л.И. Смирнова, А.В. Забровская, С.А. Егорова и др. // Международный вестник ветеринарии. – 2014. – № 2. – C. 12-16.
- Тец, Г.В. Особенности совместного действия левофлоксацина и ДНКазы на биопленки возбудителей урогенитальных инфекций / Тец Г.В., Заславская Н.В., Артеменко Н.К., Тец В.В. // Урология. — 2012. — N 1. — С. 21-24. [Tec GV, Zaslavskaja NV, Artemenko NK, Tec VV. Combined action of levofloxacin and DNAase on biofilms of urogenital infection pathogens. Urologija. 2012;1:21-24. (In Russ).]
- Bialek-Davenet, S. Genomic definition of hypervirulent and multidrug-resistant Klebsiella pneumoniae clonal groups / S. Bialek-Davenet, A. Criscuolo, F. Ailloud et al. //Emerging Infectious Diseases. – 2014. – Vol. 20. – N.11. – P. 1812-1820.
- Turton, J.F. Evaluation of a multiplex PCR for detection of serotypes K1, K2 and K5 in Klebsiella sp. and comparison of isolates within these serotypes / J.F. Turton, H. Baklan, L.K. Siu et al. // FEMS Microbiology Letters. – 2008. – Vol. 284. – N.2. – P. 247-252.
- O’Toole, G.A. Biofilm formation as microbial development / O’Toole G.A., Kaplan H.B., Kolter R. // Annual review of microbiology.-2000.-Vol. 54.- P. 49–79.
- Komisarova, E.V. Isolation and genome analysis of bacteriophages infecting hypermucoviscous highly virulent strains of Klebsiella pneumoniae K1 and K2 serotypes / E.V. Komisarova,V.P. Myakinina, V.M. Krasilnikova, V.V. Verevkin, A.A. Kislichkina, N.V. Volozhantsev // Сборник тезисов «Centennial Celebration of Bacteriophage Research», Institute Pasteur, Paris, France. April 24-26, 2017. -P. 138.
- Cheng, H.Y. RmpA regulation of capsular polysaccharide biosynthesis in Klebsiella pneumoniae CG43/ H.Y.Cheng, Y.S.Chen, Wu C.Y., Chang H.Y., Lai Y.C., Peng H.L.//J.Bacteriol. – 2010. – Vol.192. – P.3144-3158.
- Makavchik, S. Results of vaginal samples in cows in the post partum period/ Makavchik S., Sukhinin A., Danko Y., Kuzmin V.// Reproduction in Domestic Animals.- 2019.- V.54.- N S3.- P. 98.
- Smirnova, L.I. Bacteriological monitoring of the pathogens of mastitis in dairy complex of the North-West region of the Russian Federation /Smirnova L.I., Makavchik S.A., Sukhinin A.A., Prikhodko E.I., Zabrovskaya A.V.//
Research Journal of Pharmaceutical, Biological and Chemical Sciences.- 2019. -V. 10.- N 1.- P. 2013-2020.
1.2.3.5. АТИПИЧНЫЕ СВОЙСТВА STREPTOCOCCUS DYSGALACTIAE – ВОЗБУДИТЕЛЕЙ МАСТИТА КОРОВ
Streptococcus dysgalactiae – это грамположительный микроорганизм круглой формы, располагающийся в мазках преимущественно цепочками и относящийся к семейству Streptococcaceae. Он часто встречается в составе сапрофитических микробиоценозов как обитатель кожи человека и животных, а также в половых путях, верхних дыхательных путях и желудочно-кишечном тракте. В то же время Streptococcus (S.) dysgalactiae способен инфицировать людей и животных и вызывать заболевание – стрептококкоз. У человека клинические проявления такого стрептококкоза варьируют от поверхностных фолликулитов, до тонзиллита, некротизирующего фасциита и бактериемии. У крупного рогатого скота S. dysgalactiae вызывает маститы. В некоторых регионах по статистике он является второй после Staphylococcus aureus причиной инфекционного мастита[2]. S. dysgalactiae был изолирован также при инфекционном полиартрите у телят, ягнят, козлят, индюшат, цыплят. Имеются сообщения о появлении некротических язв на хвостовом стебле, сепсиса и гибели прудовых рыб, вызванной S. dysgalactiae.
В настоящее время S. dysgalactiae подразделяют на подвид S. dysgalactiae ssp. equisimilis и S. dysgalactiae ssp. dysgalactiae. Первый подвид в основном связан с болезнями человека, а второй – в большинстве случаев встречается в ветеринарии. Точное таксономическое определение, однако, уже долгое время является предметом постоянных дебатов.
Большинство исследований патогенеза стрептококковой инфекции, вызванной S. dysgalactiae, основано на поисках генов вирулентности, гомологичных хорошо изученному S. pyoigenes, так как оба вида генетически сходны на 70% и имеют общее генетическое происхождение [8]. Наиболее изученный фактор вирулентности — М-белок. Он способствует адгезии стрептококка к клеткам тканей хозяина [5]. М-белок способствует уклонению от иммунитета: он подавляет фагоцитоз и инактивирует систему комплемента[6]. У S. dysgalactiae ssp equisimilis были описаны и другие адгезины: гены gfba, fnB, fbBA, fnBB, lmb, gapC. Чтобы инфицировать организм хозяина стрептококкам необходимо избежать иммунного ответа макроорганизма. Белок G — это фактор вирулентности, связывающий циркулирующие иммуноглобулины и, таким образом, препятствующий активности антител хозяина, Drsg – фактор вирулентности, нейтрализующий действие антимикробных пептидов, секретируемых иммунными клетками хозяина[8] У S. dysgalactiae были идентифицированы несколько токсинов и секретируемых ферментов, таких как гемолизин streptolisin S (SLO). Стрептокиназа S. dysgalactiae активирует фибринолиз и способствует распространению бактерий в тканях [6]. Имеются сообщения о способности S. dysgalactiae образовывать биоплёнку.
После 24-х часов культивирования S. dysgalactiae на обогащенных питательных средах колонии диаметром до 4-5 мм и вызывает гемолиз на кровяном агаре. В настоящее время считается, что S. dysgalactiae ssp. dysgalactiae является исключительно альфа-гемолитическим, в то время как S. dysgalactiae подвида equisimilis — преимущественно бета-гемолитическим. Стрептококки – это аэротолерантные факультативные анаэробы, они растут в обычных аэробных условиях, но ускоряют рост при инкубации в атмосфере с 5% углекислого газа. Оптимальная температура для культивирования – 37оС. У S. dysgalactiae экспрессируются диагностически важные поверхностные антигены C и G по Ленсфилд, в некоторых случаях выявляются также антигены A и L [7]. К сожалению, эти характеристики не являются специфичными именно для S. dysgalactiae,и для подтверждения их видовой принадлежности необходимы дополнительные исследования. Для выделения и идентификации стрептококков по-прежнему широко используется фенотипическое тестирование [3]. S. dysgalactiae PYR-отрицателен, резистентен к бацитрацину. Дифференциацию от группы S. anginosus (группы A, С, G, F Lancefield) возможно провести по размеру колоний на кровяном агаре (у S. anginosus колонии мелкие и прозрачные, а у S. dysgalactiae колонии крупнее, полупрозрачные, серо-белого цвета) и по тесту Фогеса-Проскауэра (VP-тест). S. dysgalactiae отрицательны по VP-тесту, а S. anginosus – положительны. При дифференциации от S. equi (группа С по Lancefield) и S. canis (группа G по Lancefield) учитывают, что они не содержат гиалуронидазы в отличие от S. dysgalactiae [7]. При возможности проводят протеометрическую идентификацию — масс-спектрометрическое исследование (матричная лазерная десорбция/ионизация Tim Of Flight (МALDI ТОF MS). В научных целях используется также молекулярно-генетический метод диагностики[4].
Цели исследования: оптимизация методов идентификации стрептококков, обладающих атипичными свойствами, в частности, S. dysgalactiae, выделенных из молока коров при бактериологическом мониторинге скрытых и клинически проявляющихся маститов.
Материалом для бактериологических исследований было молоко коров при скрытых и клинически проявляющихся маститах. Перед взятием пробы Кожу вымени дезинфицировали. Вымя обмывали теплой водой с жидким универсальным моющим средством, обсушивали одноразовой салфеткой, соски обрабатывали одноразовым ватным спиртовым тампоном с 70%-м этиловым спиртом, первые порции молока сдаивали в отдельную посуду, после чего брали пробы молока в стерильные флаконы отдельно из каждой четверти вымени в дозе 50-100 мл. Период от отбора проб молока до первичного посева на питательные среды не превышал 2-3-х часов. Мазки для микроскопии готовили из осадка молока, полученного при центрифугировании пробы при 1,5 тыс. об/мин 10 мин., фиксировали химическим способом, красили по Граму и по Михину (метиленовым синим)[3]. Первичный посев на питательные среды производили пастеровской пипеткой из осадка пробы после центрифугирования. Для первичных посевов использовали глюкозо-кровяной агар с 1% глюкозы, 3% агар-агара и 5% дефибринированной крови барана, а также обогащенную жидкую среду– «стрептококк-бульон» производства «HiMedia». Чашки с посевами инкубировали в микроаэрофильных условиях, при 37-38º С в течение 24-48 часов. После инкубации чашки с глюкозо-кровяным агаром просматривали и выдерживали при температуре 4-5оС 18-24 часа для лучшего проявления гемолитических свойств стрептококков. Пересев для получения чистых культур стрептококков проводили на глюкозо-кровяной агар с 1% глюкозы и 3% агар-агара и «стрептококк-агар»[3]. При просмотре первичных посевов учитывали только культуры, обладающие альфа- и бета-гемолитической активностью на глюкозо-кровяном агаре. При определении гемолитической активности использовали среды со свежей, дефибринированной кровью барана. Пересевы на кровяной агар производили после кратковременного (3-4 часа) культивирования стрептококков в жидкой питательной среде. По поверхности плотной среды посевной материал распределяли стеклянным шпателем При изучении культуральных свойств полученных колоний стрептококков чашки с посевами просматривали с помощью лупы. Культуры типичных для конкретного хозяйства стрептококков идентифицировали с помощью автоматической микробиологической системы «VITEC COMPACT2» и серологическим методом: с использованием «СТРЕП-ТЕСТ А, В, С, G» — диагностикума для выявления стрептококков групп А, В, С, G в реакции коагглютинации. Также использовали протеометрический метод иден-тификации выделенных бактерий с использованием системы MALDI TOF.
Из молока больных маститами коров были выделены микроорганизмы, образующие отличающиеся друг от друга ассоциации, характерные для каждого отдельного хозяйства. Гноеродные стрептококки выделяли в ассоциации с Enterococcus faecalis, Staphylococcus epidermidis, Staphylococcus aureus, Klebsiella pneumoniae, Corinobacterium sp., Nocardia sp. В результате проведенного мониторинга установлено, что подобные ассоциации достаточно стабильны и персистируют в хозяйствах в течение многих месяцев[2]. Обнаружение в мазках из молока большого количества грамположительных кокков, расположенных при микроскопии в поле зрения одиночно, по два, цепочками и скоплениями, позволяло предполагать стрептококковый мастит. Косвенным подтверждением того, что наблюдаемые микроорганизмы являются возбудителями мастита, было обнаружение их преимущественно внутри и непосредственно рядом с лейкоцитами [3]. Культуры S. dysgalactiae образовывали два варианта колоний: мелкие, 1- 1,5 мм в диаметре, прозрачные, круглые, с ровным краем, блестящей и влажной поверхностью, а также средние и крупные, до 4-5 мм. При идентификации стрептококков по биохимическим свойствам возникли трудности в связи с изоляцией культур, отклоняющихся по свойствам от типичных. Для выделенных культур были характерны следующие свойства: редукция метиленового молока – ; рост на среде с 40% желчью – ; рост в МПБ с 6,5% NaCl –; CAMP-тест –; тип гемолиза альфа; лактоза + ; маннит – ; сахароза –; сорбит –; раффиноза –; салицин –; рост на среде МИС –; рост на среде с оптохином +; рост на среде с бацитрацином –; тест с гиппуратом –; каталаза –. При тестировании в микробиологической системе «VITEC COMPACT 2» они были отнесены к виду S.agalactiae. При определении серологической группы этих стрептококков по Lancefield в реакции преципитации в капиллярах получены сомнительные результаты (широкая зона слабого помутнения с диагностичекими сыворотками групп В и С). Однако при постановке реакции коагглютинации с этими же культурами установлено, что они относились к группе «С», что противоречило данным микробиологической системы «VITEC COMPACT 2». Идентификация исследуемых микроорганизмов протеометрическим методом в системе MALDI TOF позволила устранить имеющиеся противоречия в диагностике. Все изучаемые культуры были идентифицированы как вид dysgalactiae.
Заключение
Бактериологический мониторинг молока коров, содержащихся в промышленных хозяйствах Северо-Запада России позволил выявить ассоциации микроорганизмов, ответственные за развитие сублинических и клинических маститов в каждом конкретном хозяйстве. Исследовано 60 проб молока из 6 хозяйств. Выделены и идентифицированы 9 культур стрептококков вида Streptococcus dysgalactiae. Стрептококки обладали атипичными биохимическими свойствами. Это затруднило их идентификацию по биохимическому профилю при лабораторном тестировании и в автоматической микробиологической системе «VITEC COMPACT-2, и при использовании тест-систем для серологической идентифиакции стрептококков по Ленсфилд. Оптимальным в таких условиях явилось использование для идентификации протеометрического метода MALDI TOF.
1.2.3.5.1. Список литературы
- Методические рекомендации по профилактике и лечению стрептококкозов у крупного рогатого скота и птиц./А.А.Сухинин [и др.] // Санкт-Петербург:ФГБОУ ВПО «Санкт-Петербургская государственная академия ветеринарной медицины», 2012.- 36с.
- Смирнов, А.В. Сравнительный анализ современных методов выявления молока, полученного от коров, больных маститом / А.В.Смирнов, И.Б.Ветров //Вопросы нормативно-правового регулирования в ветеринарии.-2012.- №2.- С.16-19.
- Смирнова, Л.И. Дифференциация стрептококков, выделенных из молока коров при маститах/ Л.И.Смирнова, А.А.Сухинин, Е.И. Приходько, И.М. Дородняя // Вопросы нормативно-правового регулирования в ветеринарии.- 2014.- № 4.- С. 136-141.
- Сухинин, А.А. Использование ПЦР для идентификации патогенных стрептококков / А.А.Сухинин, В.В.Крюкова.// Вопросы нормативно-правового регулирования в ветеринарии.-2011.- №2.- С.13-15.
- Bisno, A.L. M proteins of group G streptococci isolated from bacteremic human infections» / Bisno, A.L., Craven D.E., McCabe W.R. // Infection and Immunity-1987.-V. 55.-N3.-P. 753–757. doi : 10.1128/IAI.55.3.753-757.1987 . ISSN 0019-9567 . PMC260406 . PMID 3102380 .
- Brandt, C.M.«Human infections due to Streptococcus dysgalactiae subspecies equisimilis» / Brandt C.M., Spellerberg B. // Clinical Infectious Diseases .-2009.-V. 49.-N5.-P. 766–772. doi : 10.1086/605085 . PMID 19635028 .
- Jensen, Anders «Delineation of Streptococcus dysgalactiae, its subspecies, and its clinical and phylogenetic relationship to Streptococcus pyogenes»/ Jensen Anders, Kilian Mogens // Journal of Clinical Microbiology.-2012.-V.50.-N1.-P. 113–126. doi : 10.1128/JCM.0590011 . ISSN 109660X . PMC3256718 . PMID 22075580 .
- Sjubring, U. (1991-01-05).»Streptococcal protein G. Gene structure and protein binding properties» / Sjubring, U., Bjurck L., Kastern W. // The Journal of Biological Chemistry . -1991.-V.266.-N1.-P. 399–405. ISSN 0021-9258 . PMID 1985908
1.2.3.6. АТИПИЧНЫЕ БИОЛОГИЧЕСКИЕ СВОЙСТВА И ЧУВСТВИТЕЛЬНОСТЬ К АНТИМИКРОБНЫМ ПРЕПАРАТАМ МИКРООРГАНИЗМОВ – ВОЗБУДИТЕЛЕЙ МАСТИТА
Одна из причин маститов коров в условиях промышленного животноводческого комплекса – патологическое воздействие циркулирующих в животноводческих помещениях устойчивых ассоциаций условно-патогенных микроорганизмов [2 ]. Активно участвовать в таких ассоциациях могут коагулазоотрицательные и коагулазоположительные стафилококки, стрептококки группы С и G, бактерии группы кишечной палочки, псевдомонады, протей, микоплазмы, коринебактерии [3,6] . Первичная среда обитания бактерий, вызывающих энвиронментальный мастит – окружающая среда [4] Взаимодействие незаражённого вымени с колиформными и сходными с ними по свойствам патогенами, как правило, происходит в период между доениями, непосредственно во время доения или в сухостойный период [5]. При этом в стаде могут встречаться животные «супервыделители», которые более длительно и массивно выделяют возбудителей [ 1 ].
Под действием различных неблагоприятных факторов проявляется фенотипическая изменчивость входящих в подобные ассоциации микроорганизмов, что приводит к появлению у них новых, атипичных биологических свойств. Со стороны организма хозяина – это давление на возбудителей факторов клеточного и гуморального иммунитета, со стороны окружающей внешней среды – применение антимикробных препаратов, физические и химические воздействия. Стратегия адаптации обуславливает гетерогенность выделяемых бактериальных культур, увеличение числа штаммов с измененными морфологическими, культуральными и биохимическими свойствами, повышение резистентности к применяемым антибиотикам, дезинфектантам, универсальным моющим средствам (УМС). Актуальными являются мониторинговые исследования микроорганизмов с атипичными свойствами, что позволяет своевременно и рационально проводить диагностику, лечение и профилактику вызываемых ими болезней [7] .
Цель исследования: изучение бактерий – возбудителей мастита с отличающимися от типичных морфологическими, культуральными и биохимическими свойствами. Определение их чувствительности к антибиотикам (АБП) и универсальным моющим средства (УМС)
Для проведения работы использовали следующие материалы и методы:
- Суточные бульонные культуры стандартных штаммов бактерий:
- Staphylococcus aureus sbsp. aureus АТСС 29737тм
- Escherichia coli АТСС 11229тм
- Pseudomonas aeruginosa АТСС 15442тм
- Proteus vulgaris АТСС8427тм
- Суточные бульонные культуры микроорганизмов, выделенных при исследовании молока коров при субклиническом и клинически выраженном мастите и обладающих биологическими свойствами, отклоняющимися от стандартных. Культуры были изолированы и первично идентифицированы по комплексу морфологических и культурально-биохимических свойств. Идентификация была подтверждена протеометрическим методом MALDI TOF.
- Staphylococcus aureus
- Escherichia coli
- Pseudomonas aeruginosa
- Proteus mirabilis
- Питательные среды: МПБ, пластинчатый ГРМ-агар, полужидкий ГРМ-агар с 0,3% агар-агара, среда Эндо, цветной ряд сред Гисса, пластинчатый агар Сабуро, пластинчатый агар АГВ, 3-х сахарный агар Олькеницкого, среда Кинг 1.
- Наборы дисков с АБП производства отдела новых технологий НИИ микробиологии и эпидемиологии имени Пастера для определения чувствительности к АБП диско-диффузионным методом.
- Композиция УМС Эковирид 1 в разведениях на мясо-пептонном бульоне: 100%, 50%, 10%, 5%, 0%
- Композиция УМС Эковирид 2 в разведениях на мясо-пептонном бульоне: 100%, 50%, 10%, 5%, 0%
- Биомодель для определения вирулентности изучаемых штаммов бактерий — взрослые беспородные лабораторные белые мыши
Для определения чувствительности к универсальным моющим средствам (УМС) в пробирки с разведениями УМС вносили по 0,1 мл суточной бульонной культуры тестируемых микроорганизмов и после экспозиции 10 минут, 30 минут и 2 часа производили высев на сектора ГРМ-агара, чашки инкубировали при 37оС 24 часа и определяли интенсивность роста. Учёт проводили по следующим показателям:
++++ — сплошной сливной рост тест-культуры (при учёте пересева на ГРМ-агар и культивирования 18 часов при 37оС)
+++ — рост большого количества изолированных колоний тест-культуры
++ — скудный рост отдельных колоний тест-культуры
+ — единичные колонии тест-культуры
– — полное отсутствие роста тест-культуры
При исследовании секрета молочной железы коров из 6 хозяйств Северо-Западного региона РФ при клинически выраженном и субклиническом мастите были изолированы, идентифицированы и изучены штаммы патогенных микроорганизмов, обладающих атипичными морфологическими, культуральными и биохимическими свойствами.
- Staphylococcus aureus, выделен из секрета молочной железы коровы при клинически выраженном мастите. Морфологически представляет собой мелкие Грамположительные кокки и G-формы (сферопласты), расположенные скоплениями. В мазке из исследуемого биологического материала, окрашенном метиленовым синим по Михину, обладают хорошо заметной капсулой. Колонии на кровяном агаре мелкие, серо-белого цвета, без образования пигмента, вокруг колоний широкая зона бета-гемолиза. На среде желточно-солевой агар колонии мелкие, серого цвета, пигмент не образуется, вокруг колоний имеется широкая зона помутнения, свидетельствующая о лецитиназной активности. При постановке реакции плазмокоагуляции в модификации на стекле положительный результат появляется в течение двух-пяти минут.
Результат определения чувствительности к АБП: бензилпенициллин – 16 оксациллин – 23, эритромицин – 28, клиндамицин – 25, ципрофлоксацин – 30, левофлоксацин – 32, гентамицин – 26, ванкомицин – 28.
- Escherichia coli, выделен из секрета молочной железы коровы при субклиническом мастите. Морфологически – очень мелкие и короткие Грамотрицательные коккобактерии, расположенные беспорядочно одиночно. В мазке из исследуемого биологического материала, окрашенном метиленовым синим по Михину и по Романовскому-Гимза, обладают хорошо заметной капсулой, а также биполярностью. Способность к биполярному окрашиванию сохраняется при пересеве на полужидкий ГРМ-агар с 0,3% агар-агара. Замедленно расщепляет лактозу на среде Гисса, на среде Эндо образует мелкие розовые колонии с красным центром, без металлического блеска, на трёхсахарном агаре Олькеницкого через 24 часа культирирования наблюдается желтый столбик, розовый скос, разрывы среды, через 48 часов инкубирования вся среда желтеет. Вирулентен для белых мышей, при заражении внутрибрюшинно в дозе 0,2 мл вызывал их гибель на 5-е – 7-е сутки.
Результат определения чувствительности к АБП: ампициллин 10 – 8 мм, ампициллин/сульбактам10/10 — мм, амоксициллин/клавуналат 20/10 , цефотаксим 30 — , цефтриаксон 30 – цефтазидим 30 — , гентамицин 10 – ципрофлоксацин 5 – 30.
- Pseudomonas aeruginosa, выделен из секрета молочной железы коровы при клинически выраженном мастите. Морфологически – очень мелкие нежные Грамотрицательные палочки с заострёнными концами, расположенные в мазке беспорядочно, одиночно. При окраске фиксированных этиловым спиртом мазков из исследуемого материала по Романовскому-Гимза имеется капсула. На ГРМ-агаре образует плоские, мелкие и средние, сливающиеся между собой колонии с неровными краями, врастающие в агар. Поверхность колоний серая, с ярким серебристым блеском. Среда темнеет. На среде Эндо колонии неправильной формы, средней величины, лактозоотрицательные, бледно-розовые с голубоватым оттенком, с ярким перламутровым блеском. На среде МПБ – помутнение, хлопьевидный осадок, коричневое окрашивание жидкости, нежная белая плёнка на поверхности и пристеночное кольцо. Присутствует характерный запах «земляничного мыла». Пигмент пиоцианин практически не образуется ни на жидких, ни на плотных средах, в том числе на среде Кинг-1 при наблюдении за ростом культуры в течение 21-го дня. В то же время на 3-и — 4-е сутки культивирования образуется водорастворимый тёмно-коричневый пигмент. Вирулентен для белых мышей и вызывает их гибель при заражении внутрибрюшинно в дозе 0,2 мл на 3-и и 4-е сутки
Результат определения чувствительности к АБП: левомицетин – 6, ампициллин – 6, полимиксин – 25, гентамицин – 31, канамицин 17, стрептомицин – 26, тобрамицин – 33, амикацин – 32, тетрациклин 20, налидиксовая кислота – 6, цефуроксим (ЦОМ) – 6, цефтазидим – 24, цефотаксим (ЦТК) – 24, фуразолидон – 6, ципрофлоксацин – 38, энрофлоксацин – 31, меропенем — 40, амоксиклав 6.
- Proteus mirabilis, выделен из секрета молочной железы коровы при клинически выраженном мастите. Морфологически – грамотрицательные, полиморфные палочки и длинные нити, спор и капсул не образуют, на плотных питательных средах обладают сильно выраженной подвижностью и способностью к ползучему росту. Образуют вуалеобразную плёнку на всей поверхности среды на скошенном МПА при посеве по Шукевичу, ГРМ-агаре, среде Эндо и даже на среде Плоскирева с желчью. При росте культуры выделяется резкий, крайне неприятный запах тухлой рыбы. Проявляет бурную биохимическую активность. При росте культуры расщепляется мочевина, полностью разжижается столбик мясо-пептонной желатины. образуется большое количество сероводорода и индола.. Трёхсахарный агар становится малиновым и чернеет через 12-14 часов культивирования. Лактозу и маннит не ферментирует. При росте на ГРМ-агаре и среде АГВ на 3-и – 5-е сутки наблюдается образование водорастворимого пигмента коричневого цвета. Высоковирулентен для белых мышей и вызывает гибель при внутрибрюшинном заражении в дозе 0,2 мл в течение 48 часов.
Результат определения чувствительности к АБП: левомицетин – 26, ампициллин – 6, амоксиклав – 18, полимиксин – 24, гентамицин – 12, канамицин 6, стрептомицин – 14, тобрамицин – 22, амикацин – 6, тетрациклин 6, налидиксовая кислота – 24, цефуроксим (ЦОМ) – 6, цефтазидим – 22, цефотаксим (ЦТК) – 16, фуразолидон – 16, ципрофлоксацин – 32, энрофлоксацин – 34, меропенем – 34.
Чувствительность бактерий – возбудителей мастита — к универсальным моющим средствам изучили на примере композиций УМС Эковирид 1 и Эковирид 2. Результаты исследований представлены в таблицах № 1 и № 2.
Таблица 1
Результаты исследования бактерицидной активности композиции универсального моющего средства УМС «ЭКОВИРИД 1»
| Тест-культура | Экспозиция УМС с внесённой в него тест-культурой | ||||||||||||||
| 10 мин | 30 мин | 2 ч | |||||||||||||
| Процент разведе-ния УМС | 100% | 50% | 10% | 5% | контроль
0% |
100% | 50% | 10% | 5% | контроль
0% |
100% | 50% | 10% | 5% | контроль
0% |
| Staph.
aureus контроль |
_ | +++ | ++++ | ++++ | ++++ | _ | ++ | +++ | ++++ | ++++ | _ | + | ++ | ++++ | ++++ |
| Staph.
aureus рабочий |
_ | + | +++ | ++++ | ++++ | _ | ++ | ++ | ++++ | ++++ | _ | +++ | +++ | ++++ | ++++ |
| E.
сoli контроль |
_ | ++ | ++++ | ++++ | ++++ | _ | ++ | ++++ | ++++ | ++++ | _ | ++ | ++++ | ++++ | ++++ |
| E.
сoli рабочий |
_ | ++ | ++++ | ++++ | ++++ | _ | ++ | ++++ | ++++ | ++++ | _ | ++ | ++++ | ++++ | ++++ |
| Pseud. aeruginosa контроль | _ | _ | ++++ | ++++ | ++++ | _ | _ | ++++ | ++++ | ++++ | _ | _ | ++++ | ++++ | ++++ |
| Pseud. aeruginosa рабочий | _ | _ | ____ | ____ | ____ | _ | + | ____ | ++++ | ++++ | _ | + | ++++ | ++++ | ++++ |
| Proteus vulgaris контроль | _ | ++++ | ++++ | ++++ | ++++ | _ | ++ | ++++ | ++++ | ++++ | _ | + | ++++ | ++++ | ++++ |
| Proteus mirabilis рабочий | _ | ++++ | ++++ | ++++ | ++++ | _ | ++ | ++++ | ++++ | ++++ | _ | + | ++++ | ++++ | ++++ |
Таблица 2
Результаты исследования бактерицидной активности композиции универсального моющего средства «ЭКОВИРИД 2»
| Тест-культура | Экспозиция УМС с внесённой в него тест-культурой | ||||||||||||||
| 10 мин | 30 мин | 2 ч | |||||||||||||
| Процент
разведения УМС |
100% | 50% | 10% | 5% | Контроль
0% |
100% | 50% | 10% | 5% | Контроль
0% |
100% | 50% | 10% | 5% | Контроль
0% |
| Staph.
aureus контроль |
_ | _ | +++ | ++++ | ++++ | _ | _ | +++ | +++ | ++++ | _ | _ | ++++ | ++++ | ++++ |
| Staph.
aureus рабочий |
\_ | _ | ++++ | ++++ | ++++ | + | + | ++++ | ++++ | ++++ | + | + | +++ | ++++ | ++++ |
| Escherichia
сoli контроль |
_ | _ | +++ | ++++ | ++++ | _ | _ | +++ | ++++ | ++++ | _ | _ | ++++ | ++++ | ++++ |
| Escherichia
coli рабочий |
_ | _ | ++++ | ++++ | ++++ | _ | _ | ++ | +++ | ++++ | _ | _ | ++++ | ++++ | ++++ |
| Pseud. aeruginosa
контроль |
_ | _ | ++++ | ++++ | ++++ | _ | _ | ++++ | ++++ | ++++ | _ | _ | ++++ | ++++ | ++++ |
| Pseud. aeruginosa
рабочий |
_ | _ | + | ++ | ++++ | _ | _ | + | ++ | ++++ | _ | _ | _ | + | ++++ |
| Proteus vulgaris контроль | _ | _ | ++++ | ++++ | ++++ | _ | _ | ++++ | ++++ | ++++ | _ | _ | ++++ | ++++ | ++++ |
| Proteus mirabilis рабочий | _ | _ | ++ | ____ | ++++ | _ | _ | ++++ | ++++ | ++++ | _ | _ | ++++ | ++++ | +++++ |
Заключение. Были изучены биологические свойства бактерий — возбудителей мастита, с отличающимися от типичных морфологическими, культуральными и биохимическими свойствами. Установлено, что фенотипическая адаптация возбудителей мастита к современным условиям проявляется преимущественно уменьшением размера отдельных бактериальных клеток, образованием капсулоподобного слоя на их поверхности, тенденцией к диссоциации с появлением слизистых колоний М-формы, снижением ферментативной активности и способности к образованию специфических пигментов. Наблюдается снижение чувствительности изучаемых штаммов к отдельным группам антибиотиков, наиболее часто используемых в каждом отдельном хозяйстве. Композиции исследованных УМС (универсальных моющих средств) оказывают бактерицидное воздействие в отношении тест-культур в концентрации 100% и 50% при экспозиции 10 минут и больше. Имеются незначительные различия воздействия исследованных УМС в отношении изучаемых микроорганизмов, но существенной разницы чувствительности контрольных штаммов и штаммов, обладающих атипичными биологическими свойствами, не выявлено.
1.2.3.6.1. Список литературы
- Забровская, А.В.Энтерогеморрагические эшерихии у животных и человека./ Забровская А.В., Макарова М.А., Егорова С.А., Кафтырева Л.А., Смирнова Л.И. // Вопросы нормативно-правового регулирования в ветеринарии.- 2012.- № 1.- С. 22-26.
- Смирнова, Л.И. Биологические свойства микроорганизмов вида Klebsiella pneumoniaе subsp. pneumoniae, изолированных из молока при мастите. / Смирнова Л.И., Забровская А.В., Егорова С.А., Приходько Е.И.. Ярикова В.Э, Гегирова Д.М. // Международный вестник ветеринарии- 2014. – № 2.- С.12-17.
- Смирнова, Л.И. Дифференциация стрептококков, выделенных из молока коров при маститах. / Смирнова Л.И., Сухинин А.А., Приходько Е.И., Дородняя И.М. // Вопросы нормативно-правового регулирования в ветеринарии.- 2014.- № 4. -С. 136-140.
- Смирнова, Л.И. Маститы коров, вызванные Klebsiella pneumoniae. / Смирнова Л.И., Забровская А.В., Приходько Е.И., Гегирова Д.М., Ярикова В.Э.// Вопросы нормативно-правового регулирования в ветеринарии- 2014.-№4. — С.88-92.
- Смирнова, Л.И.Роль бактерий рода Klebsiella при ассоциированных инфекциях коров и телят в условиях промышленного комплекса./ Смирнова Л.И., Забровская А.В., Приходько Е.И., Ярикова В.Э., Гегирова Д.М. //Международный вестник ветеринарии. -2014.-№ 2.- С.7-12.
- Сухинин, А.А. Полимеразная цепная реакция для выявления Ureaplasma diversum у крупного рогатого скота./ Сухинин А.А., Макавчик С.А., Смирнова Л.И., Приходько Е.И. // Вопросы нормативно-правового регулирования в ветеринарии.- 2017. -№ 1.- С. 45-47.
- Smirnova, L.I. Bacteriological monitoring of the pathogens of mastitis in dairy complex of the north-west region of the Russian Federation// Smirnova L.I., Makavchik S.A., Sukhinin A.A., Prikhodko E.I., Zabrovskaya A.V. // Research Journal of Pharmaceutical, Biological and Chemical Sciences. -2019. –V.1.- P. 2013-2020.
1.3. ИСПОЛЬЗОВАНИЕ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИХ МЕТОДОВ ДЛЯ ИДЕНТИФИКАЦИИ БАКТЕРИЙ ИЗ КЛИНИЧЕСКОГО МАТЕРИАЛА И ВИДОВОЙ ИДЕНТИФИКАЦИИ БАКТЕРИЙ
1.3.1 Обоснование выбора направления исследований
Микоплазмы и уреаплазмы — важные этиологические микроорганизмы, вызывающие контагиозные маститы, атипичные пневмонии и репродуктивные нарушения у крупного рогатого скота (КРС), которые наносят значительный экономический ущерб хозяйствам [1,2,3,4].
Образование L — форм обусловлено влиянием неблагоприятных факторов внешней среды (например, применением антибиотиков и дезинфектантов, действующих на клеточную стенку). В условиях организма больного животного даже тогда, когда антибиотикотерапия не применяется, многие факторы самого организма (лейкоцитарные ферменты, низкий показатель рН, лизоцим, система комплемент-антитело и др.) могут способствовать образованию измененных форм бактерий, близких к L-вариантам, а также применение антисептиков в животноводческих и птицеводческих хозяйствах. У микоплазм, в отличие от других бактерий, состояние L — форм, т.е. отсутствие клеточной стенки, является их обычным состоянием [3].
Для микоплазменной инфекции животных характерна длительная персистенция – то есть длительное присутствие в инфицированном организме. Микоплазмы и уреаплазмы могут вызвать острую форму болезни, но во многих случаях инфекция протекает латентно. Проведение специфической терапии, приводящее к клиническому благополучию, часто не приводит к элиминации (удалению) возбудителя из организма, а лишь способствует переходу острой формы инфекции в хроническую и скрытую. Персистирующие микоплазмы и уреаплазмы могут активироваться под влиянием различных факторов: присоединение инфекции другой природы, изменение физиологического и иммунного статуса организма [4,5,11].
При хронических, вялотекущих болезнях бактериальной и смешанной этиологии у животных отмечают неравномерный или низкий прирост массы тела, повышенную чувствительность к стрессам, низкую инверсию корма, ослабление поствакцинального противовирусного иммунитета, снижение продуктивности. При этом клинические признаки могут быть стертыми, атипичными или соответствуют таковым при болезни, вызываемой наиболее вирулентным в каждом конкретном случае микроорганизмом [4,6].
Клинически проявляющиеся уреаплазмозы и микоплазмозы крупного рогатого скота характеризуются хроническим воспалением легких у телят, острым или хроническим воспалением половых органов взрослых животных, бесплодием. В большинстве случаев уреаплазменная и микоплазменная инфекции протекает энзоотически. Наблюдают ее спорадически у телят 1…3-месячного возраста в виде пневмонии. Чаще регистрируют вульвовагиниты и нарушения репродуктивной функции взрослых животных. При проникновении уреаплазм и микоплазм в матку возникает воспалительный процесс, что нарушает нормальное питание зародыша, может привести к аборту или рождению слабо развитых телят [7,9,10].
Возбудители могут быть занесены в стадо при поступлении зараженных животных, а также с контаминированной спермой. Они распространяется через подстилку и при гинекологическом исследовании животных без соблюдения санитарно-гигиенических правил. Телята заражаются аэрогенно или через инфицированные родовые пути при отеле, а взрослые животные – через мочеполовые органы. Кроме того, возможен вертикальный механизм передачи инфекции, который может привести в некоторых случаях к развитию внутриутробной инфекции плода [7,8,5,11].
В последнее время для выявления бактерий в любой форме
существования широко применяются молекулярно-генетиче
ские методы, и, в первую очередь, полимеразная цепная реакция
(ПЦР). Методический подход на основе ПЦР позволяет обойти
основную трудность, связанную с тестированием бактерий, находящихся в некультивируемом состоянии (НС), так как дает возможность заменить размножение бактерий как таковых, амплификацией видоспецифичного для данной бактерии фрагмента ДНК. В качестве исследуемых образцов для выявления некулитивируемых форм (НФ) методом ПЦР можно брать любые биологические жидкости, клетки, ткани и пробы из внешней среды (водные источники и почва).
Многие коммерческие наборы на основе полимеразной цепной реакции (ПЦР) позволяют обнаружить в биологическом материале генетический материал бактерии рода Mycoplasma, но не проводить видовую идентификацию.
Цель работы: видовая идентификация и дифференциации Mycoplasma bovis и Ureaplasma diversum, как одних из основных этиологических возбудителей хронической респираторной патологии телят (атипичной пневмонии).
1.3.2 Материалы и методы.
Процесс экстракции ДНК из клинического материала проводили с использованием набора «ДНК-сорб-В» (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, г. Москва) в соответствии с инструкцией изготовителя.
Для экстракции ДНК из образцов отбирали 1 мл молока коров, больных маститами, центрифугировали при 13000 × g в течение 5 мин с последующим удалением жира и супернатанта. Оставшийся осадок ресуспендировали в 100 мкл буферного раствора.
Процесс экстракции ДНК затем продолжали с использованием набора «РИБО-преп» (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, г. Москва) в соответствии с инструкцией изготовителя.
Для проведения ПЦР мы воспользовались коммерческой тест-системой для ПЦР-диагностики микроорганизмов рода Mycoplasma «МИК-КОМ», производства ФБУН ЦНИИ Эпидемиологии Роспотребнадзора (Москва) с применением электрофоретической детекцией (ФБУН «Центральным НИИ эпидемиологии» Роспотребнадзора).
Процесса амплификации проводили в приборе «Терцик» производства ООО «ДНК Технология» (Москва).
Для одновременного обнаружения Mycoplasma bovis и Ureaplasma diversum применяли микрочиповый ПЦР–РВ амплификатор «АриаДНА», разработанный группой компаний «Люмэкс»(Санкт-Петербург) .
1.3.3 Результаты исследования
Проведенный анализ результатов ПЦР-исследований атипичных пневмоний телят показал высокую частоту встречаемости микроорганизмов рода Mycoplasma — 89% случаев выделения. При молекулярно-биологическом методе исследования биологического материала идентифицировали и дифференцировали Mycoplasma bovis — 28%, Ureaplasma diversum — 31% и другие виды микоплазм в 30% случаев выделения. Аналогичные микроорганизмы обнаружены при обследовании отделяемого влагалища у стельных коров – матерей этих телят, а так же из легких абортированных плодов (рис.1)
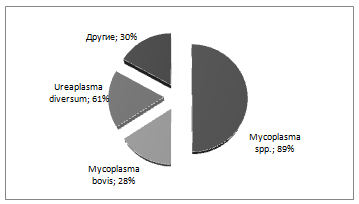
Рис.1. Доли возбудителей Mycoplasma bovis и Ureaplasma diversum, выделенных с применением ПЦР при атипичных инфекциях телят
Проведен анализ результатов молекулярно-биологических исследований секрета вымени от больных маститом коров. Установлено, что из маститного молока Mycoplasma spp. выделена в 66,6%, в 33,3% — Mycoplasma bovis от числа исследованных проб.
Микрочипы с лиофилизированными тест–системами позволили осуществить комплексный анализ и одновременную дифференциацию возбудителей Mycoplasma bovis и Ureaplasma diversum.
Видовая идентификация важна для лечащего ветеринарного врача: оценка клинического значения, выбор рационального антибактериального препарата, режима и длительности терапии атипичных пневмоний телят, ассоциированных Mycoplasma bovis и Ureaplasma diversum.
Дифференциация Mycoplasma bovis и Ureaplasma diversum важна для эпизоотолога и эпидемиолога: накопление и анализ информации, выявление и прогнозирование вспышек и осуществление мер инфекционного контроля.
Таким образом, проведенное исследование подтвердило, что условно-патогенные микоплазмы вида U. diversum более распространены среди животных в составе исследуемой выборки, чем микоплазмы вида M. bovis.
1.3.4. Список литературы
- Сухинин, А.А.Этиологическая структура респираторных болезней крупного рогатого скота в Северо-Западном регионе/Сухинин А.А., Макавчик С.А., Герасимов С.В., Прасолова О.В.//Ветеринария.- 2015.- № 12. С. 21-23.
- Сухинин, А.А., Полимеразная цепная реакция для выявления Ureaplasma diversum у крупного рогатого скота/ А.А. Сухинин, С.А. Макавчик, Л.И. Смирнова, Е.И. Приходько// Вопросы нормативно-правового регулирования в ветеринарии. — 2017.- № 1.- С. 45-47.
- Макавчик, С.А.Эффективность определения Mycoplasma bovis в молоке коров при маститах с использованием полимеразной цепной реакции в режиме реального времени на микрочипе с лиофилизированными тест-системами /Макавчик С.А.//Международный вестник ветеринарии.- 2019. —№ 2. -С. 11-16.
- L-формы возбудителей зооантропонозов / Д.А. Васильев, Л.В. Карпунина, Щербаков, Л.С. Назарова. И.Г. Швиденко, С.Н. Золотухин – Ульяновск: Изд-во УГСХА им. П.А. Столыпина, 2013 г. – 118 с.: ил.
- Bürki, S. Virulence, persistence and dissemination of Mycoplasma bovis. / Bürki S., Frey J., Pilo P. //Veterinary Microbiology.-2015.-V.179.-N1-2.P. 15-22 (doi: 10.1016/j.vetmic.2015.02.024).
- Maunsell, F. Oral inoculation of young dairy calves with Mycoplasma bovis results in colonization of tonsils, development of otitis media and local immunity./ Maunsell F., Brown M.B., Powe J., Ivey J., Woolard M. et.al. // PLoS ONE.-2012.-V.7.-N9. (doi: 10.1371/journal.pone.0044523).
7.Fraser, B.C. Associations of various physical and blood analysis variables with experimentally induced Mycoplasma bovis pneumonia in calves./ Fraser B.C., Anderson D.E., White B.J., Miesner M.D., Lakritz J. et.al. // American Journal of Veterinary Research.-2014.-V.75.-N2.P. 200-207 (doi: 10.2460/ajvr.75.2.200).
8.Vasconcellos, Cardoso M. Detection of Ureaplasma diversum in cattle using a newly developed PCR-based detection assay./ Vasconcellos Cardoso M., Blanchard A., Ferris S., Verlengia R., Timenetsky J. et.al. // Veterinary Microbiology.- 2000.-V.72.-N3-4.-P. 241-250 (doi: 10.1016/S0378-1135(99) 00203-5).
9. Parker, A.M. Comparison of culture and a multiplex probe PCR for identifying Mycoplasma species in bovine milk, semen and swab samples. / Parker A.M., House J.K., Hazelton M.S., Bosward K.L., Sheehy P.A. // PLoS ONE.- 2017.-V.12.-N3 : e0173422 (doi: 10.1371/journal.pone.0173422).
10.Bürki, S. Virulence, persistence and dissemination of Mycoplasma bovis. / Bürki S., Frey J., Pilo P. //Veterinary Microbiology.-2015.-V.179.-N1-2.-P. 15-22 (doi: 10.1016/j.vetmic.2015.02.024).
11.Parker, A.M. A review of mycoplasma diagnostics in cattle./ Parker A.M., Sheehy P.A., Hazelton M.S., Bosward K.L., House J.K. // Journal of Veterinary Internal Medicine.- 2018.-V.32.-N3.-P.1241-1252 (doi: 10.1111/jvim.15135
1.3.5. Общее заключение
Для своевременной диагностики, эффективного лечения и профилактики атипичных пневмоний телят необходимо проводить комплексные лабораторные исследования, которые включают полимеразную цепную реакцию, что позволяет идентифицировать микоплазменных возбудителей пневмоний, осуществлять серологический и биохимический мониторинг животных для исключения нарушений обмена веществ и развития иммуносупрессии, что может усугубить воспалительный процесс и затруднить лечение животных.
Внедрение в лабораторную практику молекулярных методов исследований для идентификации возбудителей атипичных пневмоний и быстрое получение результатов анализа позволяет в короткие сроки принимать решения по схеме лечения животных, а точная идентификация патогенных микроорганизмов сокращает спектр используемых антибиотиков. Значительная вариабельность показателей индикации той или иной микрофлоры из секрета вымени больных маститом коров указывает на существенные различия в этиологии маститных инфекций коров по хозяйствам СЗФО РФ.
Установлено, что одна из причин маститов коров в условиях промышленного комплекса – Mycoplasma bovis. Использование классического метода диагностики микоплазмоза животных — бактериологического — ограничено из-за трудности культивирования возбудителя. Данный метод всегда был сложен и дорог. Микоплазмы — хемогетеротрофы со сложными пищевыми потребностями, растут только на многокомпонентных средах, включающих такие ингредиенты, как дрожжевой экстракт, сыворотка крови животных, углеводы, стеролы, аминокислоты, неорганические соли. Для их дифференциации нужны специальные, сложные питательные среды, содержащие глюкозу и аргинин. При культивировании микоплазм с целью дальнейшей идентификации их условно делят на три группы, отличающиеся по биохимическим свойствам: глюкозоферментирующие, аргининферментирующие и неферментирующие ни глюкозу, ни аргинин. Приготовление специальных питательных сред для микоплазм в диагностической лаборатории требует больших затрат времени и дорогостоящих компонентов.
В настоящее время возможно использовать также готовые жидкие диагностические питательные среды различных производителей, в состав которых входит индикатор (бромтимоловый синий, феноловый красный и т.д.) и соответствующий субстрат ферментативной активности (мочевина, аргинин, глюкоза). Сложность выращивания микоплазм на бесклеточных питательных средах и возможность их перехода в некультивируемые формы существенно ограничивают применение бактериологического метода.
Именно поэтому для своевременной диагностики, эффективного лечения и профилактики маститов необходимо проводить комплексные лабораторные исследования, которые включают молекулярно-генетические, протеометрические и бактериологические методы, что позволяет наиболее достоверно идентифицировать возбудителей маститов и определить их чувствительность к препаратам антибактериального действия, а также осуществлять регулярный серологический и биохимический мониторинг основного стада для исключения нарушений обмена веществ и развития иммуносупрессии, что может усугубить воспалительный процесс и затруднить лечение маститных животных.
Внедрение в лабораторную практику молекулярных методов исследований маститного молока для идентификации возбудителей и быстрое получение результатов анализа позволяет в короткие сроки принимать решения по схеме лечения животных, а точная идентификация патогенных микроорганизмов сокращает спектр используемых антибиотиков, что поддерживает продуктивность на высоком уровне и обеспечивает продовольственную безопасность.
По результатам проведенных исследований опубликовано 5 научных статей в профильных журналах категории РИНЦ. Получен Патент №2733144: «Штамм бактерий Klebsiella pneumoniae subsp.pneumoniae, обладающий способностью к биопленкообразованию».- Дата регистрации 29 сентября 2020г.
Полученные результаты НИР могут быть использованы при проведении лекционных и практических занятий со студентами и слушателями курсов повышения квалификации по дисциплинам «Ветеринарная микробиология и микология» — ФВМ, «Микробиология» — ФВСЭ, ФБЭК.
1.4. ИЗУЧЕНИЕ БИОЛОГИЧЕСКИХ СВОЙСТВ ШТАММОВ ВОЗБУДИТЕЛЕЙ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ ЖИВОТНЫХ, ВЫДЕЛЕННЫХ НА ТЕРРИТОРИИ РОССИЙСКОЙ ФЕДЕРАЦИИ ДЛЯ ОЦЕНКИ ИХ УСТОЙЧИВОСТИ К ДЕЗИНФЕКЦИОННЫМ СРЕДСТВАМ. ИЗЫСКАНИЕ НОВЫХ ЭФФЕКТИВНЫХ СРЕДСТВ И МЕТОДОВ ДЕЗИНФЕКЦИИ
1.4.1. Обоснование выбора направления исследований
Оценка устойчивости штаммов возбудителей инфекционных болезней животных к дезинфекционным средствам. Изыскание новых эффективных средств и методов дезинфекции
Поиск, разработка и апробация новых ДС, предназначенных для проведения дезинфекции объектов ветеринарного надзора, становятся особенно важными на фоне изменений в окружающей среде. В соответствии с законом РФ «О ветеринарии» ветеринарно-санитарные мероприятия на объектах ветеринарного надзора, входящие в систему противоэпизоотических мер, являются основными и обусловливают профилактику и ликвидацию заразных болезней сельскохозяйственных животных, в том числе зооантропонозных. В общем комплексе профилактических и оздоровительных мер, направленных на обеспечение биологической защиты животноводческих предприятий, дезинфекция занимает важное место, осуществляя неспецифические противоэпизоотические мероприятия. Обеззараживая объекты внешней среды, дезинфекция устраняет факторы и механизмы передачи патогенных и условно-патогенных вирусов и бактерий от источника инфекции к восприимчивому организму [26 ].
В мировой ветеринарной практике в последние годы наметилось направление, с одной стороны, к сокращению применения для дезинфекции ранее широко используемых устаревших высокотоксичных (II-III классы опасности), экологически опасных традиционных методов химической дезинфекции с использованием формальдегида, щелочей, кислот, фенолов, соединений хлора, солей тяжелых металлов и их производных ДС [34].
С другой стороны, проявлен интерес к использованию композицион-ных препаратов, содержащих несколько совместимых активнодействующих вещества из различных групп химических соединений, таких как галогены, окислители, альдегиды, гуанидины, ПАВ, ЧАС [33,40], которые за счет синергизма составляющих компонентов обладают более широким спектром антимикробного действия в сравнении с монопрепаратами и эффективны в значительно меньших концентрациях [ 24].
Часть этих композиций, например, «Дезостерил-Форте» [4], «Кемицид» [13], «Теотропин Р+» [24], «Абалдез» [19], «Рекодез» [31], «Экоцид» и «Вироцид» [22 ] уже успешно используются в ветеринарной и медицинской практике. Другие ДС, например «БА — 12» [28], «Кемисетп» [21], «Аргенталин» [37], «Фумийод» [8]находятся на стадии внедрения.
Известно, что микроорганизмы различных групп, семейств, родов и даже разные штаммы одного вида имеют неодинаковой характер формирования устойчивости к внешним воздействиям, в том числе к дезинфицирующим препаратам [35]. Резистентность микроорганизмов к действию ДС обусловлена не полностью изученным генотипическим механизмом. К биоцидам резистентность формируется медленнее, чем к антибиотикам, и доля устойчивых штаммов в популяции микроорганизмов может оставаться низкой длительное время, что объясняется разными механизмами формирования резистентности к антибиотикам и дезинфици-рующим средствам: в первом случае это плазмидный механизм, во втором – хромосомный [14, 25].
Во многом естественная резистентность микроорганизмов зависит от того, к какой химической группе относится биоцид и от состава дезпрепарата. К некоторым ДС, в частности к хлорсодержащим препаратам, рост устойчивости микроорганизмов может быть очень сильным, что зависит от масштабов и длительности использования конкретного биоцида, что обусловливает периодическое проведение ротации дезинфектантов [32,30].
Вместе с тем среди литературных сообщений об изучении активности АМП имеют место разночтения по данной проблеме, связанные с ограниченным числом тестируемых штаммов, с применением разнообразных методик диагностики резистентности к ДС в разных странах, а также с недостаточной изученностью вопроса между устойчивостью микроорганизмов in vitro и неэффективностью ДС [ 25].
Дезинфектологи постоянно проводят исследования по изысканию, совершенствованию и апробации новых отечественных дезсредств, расширению сферы их возможного применения в ветеринарной практике с целью внедрения препаратов малотоксичных, экологически безопасных, например, ДС на основе наночастиц серебра и коллоидного серебра [17, 37, 43, 45, 48], композиционных ДС на основе ЧАС, альдегидов, перекисных соединений в комплексе с различными стабилизаторами и ПАВ, третичных аминов и др. [4, 36], электрохимически активированных растворов хлорида натрия [7, 20, 44].
В отечественной и зарубежной литературе имеют место сообщения В.А.Кузьмина с соавт., (2015) [6], А.А.Сухинина с соавт.(2012) [29], T.L. Ollivett et al. (2012) [42 ], Q.S. Wei et al.(2007) [47], в которых установлена резистентность к наиболее часто применяемым антибактериальным препаратам (фторхинолонам, сульфаниламидам, нитрофуранам, препаратам тетрациклинового и неомицинового ряда) у грамположительных и грмотрицательных микроорганизмов. Это обусловило повышенный интерес к применению в ветеринарной медицине таких противомикробных препаратов, которые не вызывают устойчивости к ним микроорганизмов и в тоже время обладают широким спектром воздействия на патогенную микрофлору желудочно-кишечного тракта.
К таким средствам относятся препараты серебра, содержащие его в коллоидной и наноформе [6, 17, 37]. К настоящему времени уникальные антимикробные и антивирусные свойства соединений серебра (обширный противобактериальный спектр устойчивых к действию серебра микроорга-низмов, низкий уровень токсичности) всесторонне изучены [16,41 ], однако касаются, они, в основном, эффективности применения препаратов ионного серебра (серебряная вода, получаемая методом электролиза) и препаратов коллоидного серебра — протаргола и колларгола, разработанных еще в начале 19 века [12, 16].
Установлено, что ионы серебра обладают уникальным признаком необратимо связываться с большим количеством разнообразных структур белкового происхождения в клетке, что обусловливает способность микроорганизмов в процессе мутаций не вырабатывать резистентность к серебру. И поэтому применение именно ионов серебра в медицине и ветеринарии в настоящее время оказалось особо актуальным в связи с появлением увличивающегося числа штаммов патогенных и условно-патогенных бактерий, устойчивых к антибиотикам узкого и широкого спектра действия, которые представляют большую угрозу для жизни и здоровья людей и животных [38].
Именно возникновение факта резистентности штаммов микроорганизмов к сульфаниламидам и антибиотикам и уменьшение эффективности этих средств при лечении животных уже в семидесятые годы прошлого века привело медицинских и ветеринарных специалистов к глубокому исследованию серебряной воды, нового в то время препарата серебра в ионной форме [43]. С этого момента начался новый этап в изучении и массовом применении препаратов серебра в ветеринарии.
Изучение соединений серебра показало, что антимикробной активностью обладает не металлическое серебро, а его ионы, которые окисляются и высвобождаются с поверхности металла, причем их количество прямо коррелирует с антимикробным эффектом [47, 39, 46]. Этот феномен обусловил перспективность применения в медицине и ветеринарии препаратов наносеребра как особого класса биоцидов. Нами представлены в отчете результаты испытаний бактерицидной, фунгицидной и вирулицидной активности современного отечественного импортозамещающего ДС для ветеринарного применения «Аргенталин» (OOO «Нанобиотех», Россия), представляющего собой коллоидные соединения серебра в наноформе.
Рынок моющих и дезинфицирующих средств постоянно пополняется и обновляется, поступают отечественные и зарубежные препараты, в определенной степени эффективные по отношению к патогенной микрофлоре, менее опасные для обслуживающего персонала и экологии, но в тоже время достаточно дорогие по стоимости, кроме того, многие из них после обработки перед сбросом в сточные воды требуют нейтрализации. Двух последних недостатков лишены водные растворы, подвергшиеся электрохимическаой активации (ЭХА) с специальных приборах –электролизёрах/активаторах. Суть ЭХА заключается в придании водным растворам необходимых в зависимости от целей исследования новых функциональных свойств перед использованием, в том числе каталитической и биокаталитической активности. ЭХА привлекает все большее внимание специалистов различных отраслей и ученых возможностью безреагентного экологически чистого изменения кислотно-щелочных и окислительно-восстановительных свойств воды различной степени минерализации: от дистиллированной до сильно минерализованной [ 1].
Жидкость, протекающая через электролизер при воздействии электрического тока высокой напряженности, переходит в метастабильное (активированное) состояние с аномально высокими окислительными и восстановительными свойствами и становится электрохимически активированным раствором (ЭХАР). ЭХАР – это пресная или слабоминерализованная вода (от 0,05 до 5,0 г/л хлористого натрия), в которой в результате электрохимического униполярного (у анода или у катода) воздействия образовались и сохраняются метастабильные продукты электрохимических реакций, которые самопроизвольно изменяются во времени, и их физико-химические параметры постепенно релаксируют, достигая при этом равновесных значений. Электрохимически активированными (электроактивированными) растворы называются только в период релаксации, т.е. пребывания их в термодинамически неравновесном состоянии после униполярной электрохохимической обработки.
ЭХАР получают из водопроводной води ГОСТ 2874 » Вода питьевая» и пищевой поваренной соли ГОСТ 13830-84 или технической поваренной соли ТУ 18-11-65; растворы технической соли предварительно фильтруют через ткань для освобождения от примесей. Водные растворы, прошедшие обработку электрическим током высокой напряженности в реакторах, в зоне анода (анолит), обладают мощным бактерицидным действием, растворы, прошедшие обработку в зоне катода (католит), имеют хорошие моющие свойства. Современные электрохимические активаторы позволяют получать 4 вида активированной воды: кислотный анолит ( рН =<5),нейтральный анолит/АНК ( рН = 61 ), щелочной анолит (рН= 7…8), нейтральный католит ( рН =7…8), щелочной католит ( рН >8). В процессе электрохимической активации значения рН и окислительно-восстановитель-ного потенциала (ОВП/red-ox) достаточно жестко связаны друг с другом. Так, для рН=1 ОВП может находиться в пределах + 1180…+1200 мВ, для рН = 12 ОВП = -900…-950 мВ, для нейтрального анолита с рН = 6±1 ширина диапазона ОВП значительно увеличивается и находится в пределах +250…+830 мВ [1,3].
В процессе получения анолита АНК при катодной обработке исходного раствора протекают реакции: 2Н2O + 2Na+ + 2е 2NaOH + H2;2НO + 2е Н2 + 2OН-. В анодной камере реактора протекают реакции, в ходе которых образуются биоцидные компоненты анолита АНК — оксиданты:
2Сl— — 2е Сl2; 2H2O — 4e 4H++O2; Cl2 + Н2O НСlO + HCI;
HCI + NaOH NaCI + Н2; Сl— + 2OН— — 2е СlO— + Н2O;
Сl— + 4OН— — 5е CIO2 +2Н2O; O2 + 2OН— — Зе О2+Н2O;
НO2— — е НO+2; ОН— — е НО+; СlO— + Н2O2 1O2 + Сl + + H2O .
Основными ДВ ЭХАР являются электрохимически активированные
гипохлорит-ион, перекись водорода, соединения активного кислорода и другие химические соединения: HClO, ClO·, ClO—, Cl·, HO2·, HO2, HO·, H·, H2O2, O3, O2·, 1O2, O· в концентрации от 0,005 до 0,1 об% по эквиваленту активного хлора. При этом следует учитывать, что ЭХАР не является хлорсодержащим. По терминологии ряда международных изданий подобные средства относятся к классу смешанных оксидантов. Слабый запах над
поверхностью ЭХАР, напоминающий запах хлора, по сути является запахом окислителей и легко устраняется обычным проветриванием. Некоторые оксиданты в анолите АНК присутствуют в следовых количествах и играют роль катализаторов [1,2,3].
Экологическая чистота ЭХАР и безопасность при их использовании в качестве антимикробных и моющих растворов обусловлены тем, что высо-кая реакционная способность ЭХАР определяется не количеством дейст-вующих веществ, а их аномальной (очень высокой или очень низкой) актив-ностью при малой концентрации солевых растворов в питьевой воде [9 ].
Получаемые ЭХАР могут использоваться как дезинфицирующие, стерилизующие, моющие растворы в медицине и ветеринарии для санитарной обработки медицинских инструментов, животноводческих и птицеводческих помещений, тушек птицы [7, 15, 20, 44 ], а также для профилактики и лечения ряда заболеваний [23]. Основными преимуществами ЭХАР перед традиционно применяемыми ДС средствами являются их экологичность (IV класс опасности по ГОСТ 12.1.007-76), физиологическая безвредность, дешевизна и биосовместимость с тканями человека и животных; ЭХАР не являются ксенобиотиками, не накапливаются в окружающей среде, при использовании в качестве ДС не требуют смывания водой на объектах госветнадзора, могут применяться с помощью технологии холодного тумана. [27, 23, 3].
Выявление новых штаммов возбудителей, устойчивых к действию большинства дезинфицирующих субстанций, приводит к необходимости разработки новых препаратов, отличающихся высоким бактерицидным и вирулицидным эффектом, экологической безопаснорстью. В связи с этим особую актуальность приобретает создание комплексных препаратов, отличающихся сочетанным воздействием входящих в его состав ингредиентов, в частности на основе солей четвертичного аммония (ЧАС) и аминов. Одной из таких наших разработок является современное отечественное импортозамещающее композиционное ДС ««Кемисепт»» (ООО «КЕМИКЛКРАФТ», Россия), представляющее собой комплекс ЧАС — 25%, и додециламина – 10% [21] для дезинфекции объектов госветнадзора. ««Кемисепт»» содержит в своём составе N,N-бис(3-аминопропил) додециламин (Триамин Y12D). Это вещество относится к группе триаминов, и проявляет химические свойства, характерные для всех алифатических аминов, сохраняя свои свойства после замерзания и последующего оттаивания.
На сегодняшний день существует множество методов/способов проведения профилактической дезинфекции, но все они обладают определёнными недостатками, характерными для каждого из них. Наиболее выгодно среди них выделяется способ аэрозольного распыления дезинфицирующего препарата, при котором ДВ быстро распределяется по всему объему помещения, при этом создается воздушная среда, свободная от патогенной микрофлоры. Наиболее перспективны разработки по применению газового метода дезинфекции [18], по созданию мельчайших аэрозолей, в частности ЭХАР, производимых передвижными генераторами холодных и горячих туманов с размером аэрозольных частиц ≤ 80 мкм [20], по применению фумигационных аэрозолей на основе йода [11], высокократных пен [10, 24]. Нашей перспективной разработкой является отечественный препарат «Фумийод» (ООО «Вет-Агроаэрозоли, Санкт-Петербург») с применением его фумигационных аэрозолей на основе кристаллического йода в виде термовозгонных бактерицидных шашек для целей дезинфекции воздушной среды животноводческих помещений одновременно с лечением телят и поросят от респираторных болезней.
Таким образом, поиск и разработка новых эффективных биоцидных агентов, снижение недостатков существующих методов их использования, экологическая безопасность и минимизации затрат при обработке больших площадей на объектах ветеринарного надзора являются актуальными задачами, имеющими важное народнохозяйственное значение.
Однако есть ряд проблем в области ветеринарной дезинфектологии, которые решены не в полной мере:
1. Недостаточный объем научных исследований по изучению: активности разрабатываемых ДС на микробную клетку и механизма их действия; эффективности ДС в зависимости от устойчивости возбудителей инфекционных заболеваний in vitro; влияния различных факторов внешней среды и особенностей обрабатываемых объектов; токсикологических характеристик, определяющих безопасность применения ДС.
2. Отсутствие единой методики диагностики резистентности к ДС в разных странах.
3. Постановку вопроса о ротации ДС в зависимости от: эпизоотической ситуации, назначения объектов государственного ветеринарного надзора, типа технологического оборудования, природы обрабатываемых поверхностей, устойчивости изолятов возбудителей инфекционных заболеваний к биоцидным препаратам, открытия новых видов возбудителей с неизученной резистентностью к биоцидным препаратам.
1.4.1.1. Список литературы
- Бахир, В.М. Электрохимическая активация: изобретериня, техника, технология /В.М.Бахир // Москва, 2014.- 510с.
- Бахир, В.М. Электрохимические установки СТЭЛ для синтеза антимикробных и моющих растворов //В.М. Бахир, В.И. Прилуцкий, Т.В. Цецхладзе, Н.Ю. Шомовская // Вестник новых медицинских технологии — 2007 — т.XIV, № 3 — C. 166-172.
- Бахир В.М. Медико-технические системы и технологии для синтеза электрохимически активированных растворов. — М., ВНИИИМТ,1998. -66 с.
- Кисиль А.С., Изучение бактерицидных свойств препарата «Дезостерил-Форте» с использованием органической нагрузки / А. С. Кисиль Кузьмин В.А., Аржаков П.В. // Вопросы нормативно-правового регулирования в ветеринарии.- 2017. —№ 3.-С.148-150.
- Костромичев Ю.Ф. Применение йодогенерирующей таблетки «Дейтран» в кролиководстве /Ю.Ф.Костромичев //Кролиководство и звероводство.-2007.-№2.-С.29.
- Кузьмин, В.А. Изучение антибактериальной и антимикотической активности препарата Аргумистин / В. А. Кузьмин, А. М. Лунегов, Ю. А. Крутяков, И. В. Белкина, К. С. Савенков // Международный вестник ветеринарии. -2015. — №2. – с.36–39.
- Кузьмин, В.А. Бактерицидное и фунгицидное действие in vitro электрохимически активированных растворов / В.А.Кузьмин, Л.С.Фогель, А.А.Сухинин, С.А.Макавчик, Л.И.Смирнова, Д.А.Орехов, А.В.Цыганов // Вопросы нормативно-правового регулирования в ветеринарии.-2020.-№4.-С.36-40. DOI: 10.17238/issn2072-6023.2020.4.36
- Кузьмин, В.А. Антимикробная активность препарата «Фумийод» в отношении изолятов условно-патогенной микрофлоры от животных с признаками респираторных болезней /В.А.Кузьмин, Л.С.Фогель, А.А.Сухинин, С.А.Макавчик, Л.И.Смирнова, Д.А.Орехов //Международный вестник ветеринарии.-2020.№2.-С.26-30.DOI:10.17238/issn2072-2419.2020.2.26
- Леонов, Б.И. Физико-химические аспекты биологического действия электрохимически активированной воды / Б.И.Леонов, В.И.Прилуцкий, В.М. Бахир // М.: ВНИИИМТ, 1999. -244с.; -ил.
- Лобанов, С.М. Дезинфекция объектов животноводства препаратами на основе йода: дисс. …канд.биол.наук.-Москва,2001.- 114с.
- Маслова, В.В. Морфофункциональное состояние лабораторных животных и телят при воздействии шашек «Тамбей» и «Вимал»: дисс. …канд.вет наук.-Саратов, 2018.- 161с.
- Мозгов, И.Е. Фармакология: Руководство для ветеринарных врачей / И.Е. Мозгов. — М.: Госсельхозиздат. — 1961. — С. 387- 390, 430- 432.
- Никитин, Г.С. Оценка токсичности дезинфицирующего средства «Кемицид» /Г.С.Никитин, А.Ф.Кузнецов // Вопросы нормативно-правового регулирования в ветеринарии.-2015.-№3.-С.136-138.
- Перепелкин, Н.В. Резистентность микроорганизмов к антисептикам и дезинфектантам http://www.agroyug.ru/news/id-18486
- Петрова, О.Г.Экспериментальное обоснование эффективности импортозамещающего дезинфекционного средства анолит (АНК+) в ветеринарии /О.Г.Петрова, М.И.Барашкин, И.М.Мильштейн// Аграрный вестник Урала 2018.-№ 12 (179).-С.21-26.
- Плевако, А.Е. Бактерицидное влияние серебра, солей серебра и их аммиачных растворов / А.Е. Плевако // Труды 1-го Московского мединститута. — М., 1935.-Т. 4.-С. 124-127.
- Поджарая, К.С. Коллоидное серебро — способы получение и перспективы применения для очистки оборудования молокозаводов /К.С.Поджарая // Инновации в сельском хозяйстве. — 2013. — № 2(4). -С.29-32.
- Попов, Н.И. Применение газового метода дезинфекции сибиреязвенных скотомогильников и способы обеспечения их безопасности /Н.И.Попов, Г.Д. Волковский //Эффективное животноводство (Краснодар).-2016.-№2(123).-С.37-39.
- Прокопенко А.А. Токсичность и дезинфицирующая активность аэрозолей препарата «Абалдез» / А.А.Прокопенко, Г.И.Павленко, В.Ю.Морозов //Ветеринария.-2018.-№1.-С.47-51.
- Прокопенко, А.А. Направленные аэрозоли электроактивированных растворов для дезинфекции птицеводческих помещений при колибакте риозе и аспергиллезе птиц / А.А. Прокопенко, А.А. Закомырдин, Ю.И. Боченин, Н.Э. Вайнер, Д.В. Грузнов // Ветеринария. — 2015. — № 3. — С. 40-44.
- Роменский Р.В.Эффективность и перспективы использования нового дезинфицирующего средства «Кемисепт» /Р.В.Роменский, Н.В.Роменская, Р.Г.Васинский, В.А.Кузьмин, Л.С.Фогель, Д.А.Орехов // Вопросы нормативно-правового регулирования в ветеринарии.-2020.-№2.-С.21-25. DOI: 10.17238/issn2072-6023.2020.2.21
- Решетникова, Т.Н. Эффективность дезинфицирующего средств «Экоцид-С» и «Вироцид», применяемых для аэрозольной дезинфекции помещений в присутствии животных, в целях профилактики респираторных и желудочно-кишечных болезней свиней /Т.Н.Решетникова //Вопросы нормативно-правового регулирования в ветеринарии.-2017.-№4.-С.43-48.
- Резников, К.М. Возможные механизмы биологического и фармакологического действия анолита и католита / К. М. Резников // Прикладные информационные аспекты медицины. – 2008. — Т. 11 — № 2. – С. 72-81
- Сайпуллаев, М.С. Дезинфекционная эффективность растворов препарата «Теотропин Р+» /М.С.Сайпуллаев, С.Ш.Кабардиев, Карпущенко, А.У. Койчуев // Журн. Ученые записки КГАВМ.- Казань, 2013.-том 213.-С. 244-247.
- Саперкин, Н.В. Устойчивость бактерий к дезинфектантам: оценка доказательной базы / Н.В.Саперкин, Л.А.Алебашина, Д.В. Квашнина // Современные проблемы науки и образования. – 2016. – № 5.;URL: http://science-education.ru/ru/article/ view?id=25429
- Сашнина, Л. Ю. Эпизоотическая ситуация по респираторным болезням свиней в хозяйствах промышленного типа, этиология и клинико-экспериментальное обоснование применения новых средств их профилактики и терапии: дисс. … докт. вет.наук.-Москва,2013.-425с.
- Спирина, А.С. Профилактика и лечение пародонтитов у плотоядных животных и использование растворов ЭХАР «АКВАЭХА»: методическое пособие /А.С.Спирина, А.В.Шипова, А.М.Коваленко //Белгород: ФГБОУ ВО БелГАУ имени В.Я.Горина, 2016.-28с
- Султанов, А.А. Новое дезинфицирующее средство «БА — 12» для обеззараживания почвенных очагов сибирской язвы / А.А.Султанов, В.Ю.Сущих, Б.Канатов, К.Нурлан // Вопросы нормативно-правового регулирования в ветеринарии.-2020.-№1.-С.75-79.
- Сухинин, А.А. Методические рекомендации по профилактике и лечению стрептококкозов у крупного рогатого скота и птиц / А.А. Сухинин, А.В. Дмитриев, А.А. Стекольников, И.Г. Идиатулин, В.В. Крючкова и др. — СПб., 2012. – 78 с.
- Тарасова, И.И. Механизмы формирования резистентности к дезинфектантам / И.И. Тарасова, Е.М. Ленченко, С. Чжун и др. // Ветеринария и кормление. — 2014. — № 6. — С. 47-48.
- Угрюмов, О.В. Изучение коррозионной и пенообразующей активности нового импортозамещающего дезинфицирующего средства «Рекодез» /О.В.Угрюмов, Р.С.Яруллин, А.Г.Хисамутдинов, В.С.Угрюмова, Р.Х.Равилов и др. // Вестник технологического университета. -2018. -Т. 21.- № 3. — С. 94-97.
- Шкарин, В.В. Характеристика устойчивости микроорганизмов к хлорсодержащим дезинфектантам и ее эпидемиологическая значимость / В.В. Шкарин, Н.В Саперкин, О.В. Ковалишена, О.М.Сутырина // Эпидемиология и Вакцинопрофилактика. – 2009. — № 5. — С. 27 — 31.
- Arrebola-Liébanas, F.J. Determination of quaternary ammonium compounds in oranges and cucumbers using QuEChERS extraction and ultra-performance liquid chromatography/tandem mass spectrometry / Arrebola-Liébanas F.J., Abdo M.A.H., Moreno J.L.F., Martínez-Vidal J.L., Frenich A.G. // Journal of AOAC International -2014. — V. 97 — N 4 — P.1021-1026.
- Baumann, H. About the toxicity of formaldehyde //Kunstoff- 1981.-B.71.-N.11.- P.835-839.
- Chladkova, K. Effect of biocides on S. cerevisiae: Relationship between short-term membrane affliction and long-term cell killing / K.Chladkova, T.Hendrych, D.Gaskova, P.Goroncy-Bermes, K.Sigler // Folia Microbiologica — 2004. — V. 49 -N 6 — P.718-724.
- Koffi-Nevry, R. Assessment of the antifungal activities of polyhexamethy-lene- guanidine hydrochloride (PHMGH)-based disinfectant against fungi isolated from papaya (Carica papaya L.) / R. Koffi-Nevry, A. Lethicia Manizan, K. Tano, Ya. C. Yue Bi, K. Oule, M. Koussemon // African Journal of Microbiology Research. — 2011. — V. 5 (24). — P. 4162-4169.
- Krutiyakov, Yurii A. In vivo study of entero- and hepatotoxicity of silver nanoparticles stabilized with benzyldimethyl[3-myristoilamine)-propyl]ammonium chloride monohydrate (miramistin) in CBF1 mice upon enteral administration / Yurii A. Krutyakov, Alexey A. Kudrinskiy, Vladimir A. Kuzmin, Alexander A. Gusev, Inna A. Vasyukova et.al. // Nanomaterials (ISSN 2079-4991) The special issue belongs to the section “Biology and Medicines” – 2020, Special Issue «Frontiers in Nanotoxico-logy» – Nanomaterials.-2021,11,332.-20p.//doi.org/10.3390/nano11020332 www.mdpi.com/journal/nanomaterials
- Levy, S.B. Antibiotic resistance—the problem intensifies / S.B. Levy // Adv.Drug. Deliv. Rev. – 2005. — V. 57. — P. 1446-1450.
- Lok, C.-N. /C.-N.Lok, C.-M.Ho, R.Chen et al. // J.Biol. Inorg. Chem.-2007.-N12.-P.527
- Martynov, L.Y. Determination of a polyhexamethylene guanidine by voltammetry at an interface between two immiscible electrolyte solutions / Martynov L.Y., Naumova A.O., Zaitsev N.K. // Journal of Analytical Chemistry -2016. – V. 71 — N 11 — P.1120-1125.
- Melaiye, A. Silver(I)-imidazole cyclophane gem-diol complexes encapsulated by electrospun tecophilic nanofibers: formation of nanosilver particles and antimicrobial activity / A.Melaiye, Z.Sun, K.Hindi, A.Milsted, D.Ely, D.H.Reneker, C.A.Tessier, W.J. Youngs // J. Am. Chem. Soc. . – 2005. — V. 127. — P. 2285-2291
- Ollivett, T.L. Effect of nutritional plane on health and performance in dairy calves after experimental infection with Cryptosporidium parvum / T.L. Ollivett, D.V. Nydam, T.C. Linden, D.D. Bowmann, and M.E. Van Amburgh // J. Am. Vet. Med. Assoc. – 2012. – V.241. – P. 1514-1520.
- Pal, S. Antibacterial Activity and Mechanism of Action of the Silver Ion in Staphylococcus aureus and Escherichia coli / S. Pal, Y.K. Так, J.M. Song // Appl. Environ. Microbiol. — 2007. — Vol. 73. — P. 1712.
- Rahman, S. M. Effectivenes of low concentration electrolyzed water to inactivate foodbozne pathogenes under different environmental conditions / S. M. Rahman, T. Ding, D. H. Oh // Jnt. J Food Microbiol. — 2010. — V. 139 (3).-N 15. — P. 147-153.
- Sondi, I. Silver nanoparticles as antimicrobial agent: a case study on E. coli as a model for Gram-negative bacteria / I. Sondi, B. Salopek-Sondi // J. Colloid Interf. Sci. — 2004. — Vol. 275. -P. 177.
- Spadaro, J.A. Silver polymethyl methacrylate antibacterial bone cement / J.A. Spadaro, D.A. Webster, R.O. Becker // Clin. Orthop.- 1979.- Vol. 143.- P. 266-270.
- Wei,Q.S. Norvancomycin-capped silver nanoparticles: synthesis and antibacterial activities against E. coli / Q.S.Wei, J.Ji, J.H.Fu, J.C. Chen // Sci. in China B .- 2007. — v. 50. — p. 418-424.
- Yamanaka, M. Bactericidal Actions of a Silver Ion Solution on Escherichia coli, Studied by Energy-Filtering Transmission Electron Microscopy and Proteomic Analysis / Yamanaka M., Нага К., Kudo J. // Appl. Environ. Microbiol. -2005. — Vol. 71. -P. 7589.
1.4.2. Материалы и методы исследований
При изучении отечественного препарата «Аргенталин» (ООО «НаноБиотех», Россия) для выявления его антибактериальной активности использовали стандартный метод серийных разведений. Критерием антибактериальной активности служила величина минимальной подавляющей концентрации (МПК) – концентрация активного компонента, при которой наблюдалось подавление роста микроорганизмов. Исследования по изучению антимикробной активности действующих веществ проводили in vitro с использованием модифицированного суспензионного метода. Рабочую суспензию тест-микроорганизма готовили из культуры конкретного тест-штамма, выращенного на плотной питательной среде при температуре и в течение времени, оптимальных для данного тест-микроорганизма. Штаммы бактерий выращивали на среде Мюллера-Хинтон (Pronadisa, Испания) 24 ч при 37оС; штаммы грибов рода Candida — на среде Сабуро (НИЦФ, Россия) при 30оС 48 ч; штаммы мицелиальных грибов — на среде Чапека (HiMedia, Индия) 4 сут при 25оС. Для приготовления микробной взвеси культуру смывали с агара стерильным физиологическим раствором. Полученную взвесь фильтровали через стерильный ватно-марлевый фильтр и разводили стерильным физраствором до концентрации ~1·109 клеток в 1 мл, соответствующей 3 ед. по стандарту Мак-Фарланда, определяемых с помощью денситометра.
Приготовление рабочей культуры тест-вируса и постановку эксперимента по изучению вирулицидной активности проводили в соответствии с методикой, изложенной в п. 5.7.3 Руководства Р 4.2.2643-10 [ 7]. Готовили 10-кратные разведения анализируемого материала на среде Игла MEM. Каждым разведением вируса, заражали не менее 4-х одинаковых ёмкостей с плотным монослоем культуры клеток 4647. После инкубации в течение 21—28 дн супернатант аттестуют на содержание вирусного антигена методом ИФА. Инфекционные титры вычисляют по методу Рида и Менча или по методу Спермана-Кербера.
В стерильные химические пробирки (количество пробирок соответствовало количеству концентраций) разливали по 4,5 мл раствора ДС с соответствующей концентрацией, в которые добавляли по 0,5 мл взвеси тест-микроорганизма, содержащей ~1·109 мк/мл, и тщательно перемешивали. Через определенные интервалы времени в пробирку, содержащую смесь «тест-микроорганизм+ДС» соответствующей концентрации добавляли 5 мл нейтрализатора и перемешивали.
Время экспозиции устанавливали в зависимости от средней устойчивости микроорганизмов к основным группам ДС согласно Руководства Р 4.2.2643-10 «Методы лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности» [7]: для наиболее чувствительных микроорганизмов (бактерий в вегетативной форме) – 15 мин; для умеренно устойчивых (грибов, кроме плесневых), микобактерий и вирусов) – 30 мин; для устойчивых (плесневых грибов) – 60 мин; для наиболее устойчивых (бактерий в споровой форме) –90 мин.
В качестве нейтрализатора применяли универсальный нейтрализатор, содержащий 3% Твин 80 .
Для изучения антимикробной активности образцов были выбраны следующие референс-штаммы: грамотрицательные бактерии: Escherichia coli, Pseudomonas aeruginosa, Klebsiella pneumoniae, Salmonella typhimurium, Enterobacter cloacae; грамположительные бактерии: Staphylococcus epidermidis, два штамма Staphylococcus aureus; бациллы:Bacillus subtilis; грибы: Aspergillus niger, Candida albicans, Trichophyton mentagrophуtes; вирусы: Poliovirus типа 1 Sabin, Adenovirus 5 типа.
Учет результатов проводили визуально, используя стандарт мутности. Минимальную подавляющую концентрацию (МПК) определяли по наименьшей концентрации средства, которая подавляла видимый рост тест-микроорганизма.
Через 10 мин из пробирки, содержащей смесь «тест-микроорганизм+дезсредство+нейтрализатор», делали посевы по 1 мл в 2 пробирки с жидкой и по 0,1 мл на 2 чашки с плотной питательной средой в зависимости от используемого тест-микроорганизма: Escherichia coli – питательная среда для выделения энтеробактерий (агар Эндо-ГРМ) и питательный бульон для культивирования микроорганизмов сухой (ГРМ-бульон), (+370С) – 48 ч (на плотной среде), 7 сут (на жидкой среде); Pseudomonas aeruginosa и Staphylococcus aureus – питательный агар для культивирования микроорганизмов сухой (ГРМ-агар) и питательный бульон для культивирования микроорганизмов сухой (ГРМ-бульон), (+370С) – 48 ч (на плотной среде), 7 сут (на жидкой среде); Candida albicans, Trichophyton mentagrophytes, Aspergillus brasiliensis – питательная среда № 2 ГРМ (Сабуро) и питательная среда для культивирования дрожжей и грибов сухая (бульон Сабуро сухой), (+270С) – 48 ч (на плотной среде), 10 сут (на жидкой среде); Bacillus cereus – питательный агар для культивирования микроорганизмов сухой (ГРМ-агар) и питательный бульон для культивирования микроорганизмов сухой (ГРМ-бульон) (+370С) – 48 ч (на плотной среде), 7 сут (на жидкой среде); Poliovirus типа I Sabin и Adenovirus 5 типа – среда Игла МЕМ с двойным набором аминокислот и с глутамином, (+360С), 5 сут (1 пассаж).
Определение суммарной массовой доли ЧАС, массовой доли полигексаметиленбигуанида гидрохлорида и количественного содержания серебра AgNPs- в препарате «Аргенталин»® фотометрическим методом проводили согласно Инструкции (2020 ) [1 ] (Приложение).
Определение безопасного для человека уровня накопления серебра в тканях цыплят-бройлеров при пероральном и аэрозольном применении аналога «Аргенталина» — «Аргумистина» (растворы наночастиц серебра (10, 50 или 300 мкг/мл), стабилизированных 100-600 мкг/мл хлорида бензилдиметил[3-(миристоиламино) пропил]аммония) — проводили при введении коллоидного серебра, стабилизированного мирамистином, в дозе 0,32 мкг серебра на 1 кг массы тела в сутки [2 ].
Отечественный препарат «Фумийод» (ООО «Вет-Агроаэрозоли», г. Санкт-Петербург) содержит в качестве ДВ кристаллический йод, по внешнему виду представляет собой металлические банки, укупоренные полиэтиленовыми крышками. Дезинфекцию воздушной среды в опытных телятниках и свинарниках проводили с помощью йодсодержащих термовозгонных шашек (препарат «Фумийод») путем возгонки при температуре помещения ≥150С, относительной влажности ≥60% и экспозиции 1 и 3 ч, а в контрольных помещениях – 1,0% глутаровым альдегидом с помощью установки САГ-2 при той же экспозиции и температурно-влажностном режиме. При проведении дезинфекции воздуха и поверхностей оборудования препаратом «Фумийод» расчетное количество шашек размещали равномерно в нескольких местах на несгораемом полу. Шашки поджигали входящей в комплект поставки спичкой. Время сгорания одной шашки составляет не менее 30 сек. При сгорании образуются пары йода фиолетового цвета высокой проникающей способности, равномерное распределение которых по объему помещения происходит за счет диффузии [4 ].
Диагноз заболевания респираторными болезнями, в том числе бронхопневмонией, ринитом устанавливали комплексно с учетом эпизоотической ситуации в хозяйствах, клинического обследования животных, лабораторных исследований, результатов патологоанатомического вскрытия.
Для изучения антимикробной активности препарата «Фумийод» от телят и поросят с симптомами бронхопневмонии, пневмонии, бронхита, ринита были взяты пробы биоматериала (смывы из носовой полости и назофарингиальные смывы) для определения чувствительности выделенной микрофлоры к изучаемому препарату «Фумийод» (опыт) и 1% глутаровому альдегиду (контроль). Носовую слизь и назофарингиальные смывы от больных телят и поросят высевали на элективные питательные среды (молочно-желточно-солевой агар, кровяной агар, среду Эндо, желточно-солевой агар). Антимикробную активность изучаемых препарата «Фумийод» в лабораторных условиях исследовали методом диффузии в агар [10] с помощью тест-культур микробов, дрожжей, грибов, вирусов, выделенных от животных [ 3].
Лабораторные испытания ДС «Фумийод» проводили в специально отгороженных секциях животноводческих помещений в присутствии животных в однотипных животноводческих помещениях. Микробную обсемененность воздуха и поверхностей технологического оборудования до и после дезинфекции изучаемыми ДС исследовали методом седиментации на плотных питательных средах: МПА, элективных питательных средах (среда Эндо, желточно-солевой агар-6,5% NaCl, среда Сабуро). Дезинфекцию технологического оборудования в опытных помещениях для выращивания телят и поросят проводили в период санитарного разрыва (после процесса механической очистки и мойки оборудования горячей водой + 600С). Контролем служили аналогичные помещения после механической очистки и мойки оборудования горячей водой +600С. Тест-объекты — поверхности металла, бетона, кафеля, дерева, резины, метлахской плитки [5,6].
Контроль качества проведенной дезинфекции изучаемыми ДС проводили по санитарно-показательным микроорганизмам (кишечной палочке и стафилококку) в соответствии с «Правилами проведения дезинфекции …… », 2002 [11]. В качестве нейтрализатора использовали 1% раствор тиосульфата натрия.
Производственные испытания возможности применения препарата «Фумийод» при респираторных болезнях проводили при групповой обработке поросят в опытной группе путем ингаляции паров йода (термическая возгонка бактерицидных шашек), один раз в сутки, четыре дня в неделю.
Животным контрольной группы назначали антибиотик окситетрациклин в/м в дозе 30…40 тыс. ЕД/кг массы тела в сутки в течение 10…12 дн для устранения действия вторичной бактериальной инфекции. Сроки лечения поросят в опыте и контроле определяли по исчезновению клинических симптомов (затрудненное дыхание, кашель, серозные и слизисто-гнойные выделения из носа).
Ремонтный молодняк свиней опытных и контрольных групп находился в однотипных помещениях с идентичными условиями кормления и содержания при +180С и относительной влажности ≥75%. Над всеми животными осуществляли постоянный ветеринарный контроль: ежедневное клиническое наблюдение с учетом общего состояния, поведения, сроков выздоровления, падежа.
Исследования по выявлению эффективности нового отечественного ДС «Кемисепт» (компания ООО «КемиклКрафт», Россия) для дезинфекции объектов ветеринарного надзора проводили на базе Федерального государ-ственного бюджетного научного учреждения «Федеральный исследова-тельский центр вирусологии и микробиологии» (ФГБНУ ФИЦВиМ). Результаты исследований ДС «Кемисепт» опубликованы в нашей совместной статье [12 ].
В качестве основных действующих веществ ДС «Кемисепт» содержит комплекс ЧАС (алкилдиметилбензиламмония хлорид, дидецилдиметил-аммония хлорид) 25%, N,N-бис(3-аминопропил) додециламин (Триамин Y12D) – 10%, рН 1% рабочего раствора – 9,5±1,0 [12 ].
В лабораторных условиях исследованы бактериостатическая и минимальная бактерицидная концентрации ДС «Кемисепт» с использованием тест-микроорганизмов I и II групп устойчивости в присутствии высокомолекулярного белка.
Исследование бактерицидного действия ЭХАР «АКВАЭХА» in vitro проводили в лаборатории кафедры микробиологии, вирусологии и иммунологии СПбГМА им. И.И. Мечникова. Методическая и экспериментальная часть изложены в Отчете о выполнении научно-исследовательской работы «Изучение бактерицидного и фунгицидного действия электрохимически активированных растворов (АКВАЭХА) in vitro»/ ГОУ ВПО СПбГМА им. И.И.Мечникова МЗСР России.-СПб.,2011 [13].
Для электрохимической активации слабых солевых растворов используют специально сконструированные электролизеры СТЭЛ, «АКВАЭХА», Аквабиоцид и другие. На базе проточного активатора растворов (ПАР) ООО НПП «ИЗУМРУД» (г.Санкт-Петербург) выпускает установки «АКВАЭХА», рекомендованные Росздравнадзором РФ в 2009 г. для применения в практике здравоохранения с целью получения дезинфицирующих и стерилизующих растворов. Для ветеринарной медицины существуют Наставления по применению ЭХАР для мойки и дезинфекции [8,9].
Для наших экспериментов ЭХАР получали на установке «АКВА-ЭХА» ООО НПП «ИЗУМРУД» (г.Санкт-Петербург) и распыляли его с помощью стационарных генераторов холодных аэрозолей/туманов с помощью промышленной установки «Туман-Агро» в дозе 10 мл на 1 м3. Из анодной и катодной камер электролизера «АКВА-ЭХА» выходят раздельно анолит и католит с физико-химическими характеристиками, определяемыми величиной тока, объемной подачей водной среды и её минеральным составом.
В экспериментах применяли свежеприготовленный ЭХАР «АКВАЭХА» с различными физико-химическими показателями значений рН и ОВП. В контроле использован раствор дихлоризоцианурата натрия с концентрацией активного хлора 1,5 г/л, приготовленный в день испытания.
В работе использованы следующие штаммы микроорганизмов Escherichia coli, Pseudomonas aeruginosa, Acinetobacter baumannii, Staphylococcus aureus, Candida albicans, два штамма Aspergillus flavus, Penicillium notatum, Penicillium crustosum, два штамма Fusarium sp.. Из чистых культур тест-микроорганизмов готовили инокулюмы.
Изготовление инокулюмов тест-микроорганизмов. Штаммы выращивали на среде Мюллера-Хинтон (Pronadisa, Испания) 24 ч при 37 °С. Суспензии бактерий в стерильном физиологическом растворе готовили по стандарту мутности ГИСК им. Л.А. Тарасевича № 20 (около 2*109 кл/мл). Фактическую концентрацию инокулюмов контролировали путем посева на плотную среду согласно п. 4.2.1. Руководства Р 4.2.2643-10 [7].
Инокулюмы грибов рода Candida. Штаммы выращивали на среде Сабуро (НИЦФ, Россия) при 30 °С 48 ч. Из культуры готовили суспензии в физиологическом растворе, концентрацию инокулюма определяли экспери-ментально путем посева на плотную среду согласно п. 4.2.1. [7].
Инокулюмы мицелиальных грибов. Штаммы выращивали на среде Чапека (HiMedia, Индия) 4 сут при 25 °С. Культуру гриба снимали миколо-гической лопаткой, затем измельчали в фарфоровой ступке, смешивали с 5 мл стерильного физиологического раствора, концентрацию клеток в иноку-люме определяли экспериментально путем посева на плотную среду согласно п. 4.2. Руководства Р 4.2.2643-10 [7].
Суспензионный метод разработан на основе пп. 5.1.1.2, 5.1.2.1 и 5.3.2.1 Руководства Р 4.2.2643-10 «Методы лабораторных исследований и испыта-ний дезинфекционных средств для оценки их эффективности и безопасно-сти» [7] с нашими модификациями. Исследуемые образцы, препарат сравнения и физиологический раствор (для контроля инокулюма) разливали в стерильные пробирки по 4,5 мл для каждого тест-штамма, в те же пробирки вносили по 0,5 мл свежеприготовленного инокулюма. Содержимое перемешивали встряхиванием и инкубировали 10 мин. Затем 0,5 содержимого каждой пробирки переносили в 0,5 мл нейтрализатора, инкубировали 5 мин, после готовили десятичные разведения полученной смеси до 10-2 в лунках стерильных полистироловых планшетов. В сериях с физиологическим раствором делали разведения до 10-8 для контроля инокулюма. 20 мкл из каждой лунки (с нейтрализатором и разведения) капельно вносили на поверхность среды Мюллера-Хинтон (Pronadisa, Испания), а из серий с мицелиальными грибами — по 200 мкл вносили на чашки Петри с той же средой и распределяли материал шпателем. Аналогично опыт повторяли спустя 60 мин инкубации.
1.4.2.1. Список литературы
- Инструкция по применению средства «Аргенталин» для дезинфекции объектов ветнадзора и профилактики инфекционных болезней животных (Организация-производитель: ООО «Нанобиотех», г. Москва) — М.,2020.
- Крутяков, Ю. А. Определение содержания серебра в тканях и органах цыплят-бройлеров после орального и ингаляционного применения водных дисперсий наночастиц серебра/ Ю. А.Крутяков, В.Ю.Коптев, А.А.Кудринский, А.И.Климов и др. // Гигиена и Санитария.-2016.- №95(2).-С.207-211.
- Кузьмин, В.А. Антимикробная активность препарата «Фумийод» в отношении изолятов условно-патогенной микрофлоры от животных с признаками респираторных болезней /В.А.Кузьмин, Л.С.Фогель, А.А.Сухинин, С.А.Макавчик, Л.И.Смирнова, Д.А.Орехов //Международный вестник ветеринарии.-2020.№2.-С.26-30.DOI:10.17238/issn2072-2419.2020.2.26
- Кузьмин, В.А. Влияние аэрозольной дезинфекции животноводческих помещений препаратом «Фумийод» на уровень бактериальной загрязненности воздуха / В.А.Кузьмин, Л.С.Фогель, А.А.Сухинин, С.А.Макавчик, Л.И.Смирнова, Д.А.Орехов //Вопросы нормативно-правового регулирования в ветеринарии.-2020.-№2.-С.28-32. DOI: 10.17238/issn2072-6023.2020.2.28
- Кузьмин, В.А. Оценка эффективности дезинфекции поверхностей оборудования препаратом «Фумийод» в животноводческих и свиноводческих помещениях в период санитарного разрыва / В.А.Кузьмин, Л.С.Фогель, А.А.Сухинин, С.А.Макавчик, Л.И.Смирнова, Д.А.Орехов // Международный вестник ветеринарии.-2020.-№3.-С.94-99. DOI: 10.17238/issn2072-2419.2020.3.94
- Кузьмин, В.А Бактерицидное и фунгицидное действие in vitro электрохимически активированных растворов / В.А.Кузьмин, Л.С.Фогель, А.А.Сухинин, С.А.Макавчик, Л.И.Смирнова, Д.А.Орехов //Вопросы нормативно-правового регулирования в ветеринарии.- 2020. -№4.- С .36-40 DOI: 10.17238/issn2072-6023.2020.4.36
- Методы лабораторных исследований и испытаний дезинфекционных средств для их оценки, эффективности и безопасности. Руководство Р 4.2.2643-10. Дата введения 2 июня 2010 г.- Москва, 2010 г.
- Наставление по применению электрохимически активированных растворов натрия хлорида (католита и анолита), полученных на установках типа СТЭЛ, для мойки и дезинфекции в ветеринарии и животноводстве. Утверждено 19.13.99г.
- Наставление по применению нейтрального анолита АНК, полученного на установке «Аквабиоцид» для дезинфекции оборудования, используемого в производстве мясных продуктов. — М., 1999.
- ОФС.1.2.4.0010.15 Определение антимикробной активности антибиотиков методом диффузии в агар.
- Правила проведения дезинфекции и дезинвазии объектов государственного ветеринарного надзора (утв. Департаментом ветеринарии РФ 15.07.2002 г.).
- Роменский, Р.В.Эффективность и перспективы использования нового дезинфицирующего средства «Кемисепт» /Р.В.Роменский, Н.В.Роменская, Р.Г.Васинский, В.А.Кузьмин, Л.С.Фогель, Д.А.Орехов // Вопросы нормативно-правового регулирования в ветеринарии.-2020.-№2.-С.21-25. DOI: 10.17238/issn2072-6023.2020.2.21
- Отчет о выполнении научно-исследовательской работы «Изучение бактерицидного и фунгицидного действия электрохимически активированных растворов (АКВАЭХА) in vitro»/ ГОУ ВПО СПбГМА им. И.И.Мечникова МЗСР России.-СПб.,2011.
1.4.3. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ОБСУЖДЕНИЕ
1.4.3.1. ИЗУЧЕНИЕ АНТИМИКРОБНОЙ АКТИВНОСТИ ДЕЗИНФИЦИРУЮЩЕГО СРЕДСТВА ДЛЯ ВЕТЕРИНАРНОГО ПРИМЕНЕНИЯ «АРГЕНТАЛИН»
Цель исследования – изучение фунгицидной, бактерицидной и вирулицидной активности дезинфицирующего средства «Аргенталин». В задачи данного исследования входило определение МПК ДC «Аргенталин» в отношении грамположительных и грамотрицательных микроорганизмов, а также вирусов, мицелиальных и дрожжеподобных грибов.
До начала 1980-х гг. научный и прикладной интерес к серебряным наночастицам (НЧ) был обусловлен лишь возможностью их применения в качестве высокодисперсной подложки для усиления сигнала молекул органических соединений в спектроскопии комбинационного рассеяния. Кроме того, антибактериальные препараты (типа колларгола) на основе коллоидного серебра хорошо зарекомендовали себя в медицине. Фундаментальные исследования, проведенные в 1980-1990-х гг. показали, что НЧ серебра обладают редким сочетанием ценных качеств: уникальными оптическими свойствами, обусловленными поверхностным плазмонным резонансом (ППР), высокоразвитой поверхностью, каталитической активностью, высокой емкостью двойного электрического слоя и др. [18]. Благодаря этому они служат материалом для создания электронных и сенсорных устройств нового поколения. Тенденция к совершенствованию технологических процессов привела за последние двадцать лет к значительному увеличению числа исследовательских работ, посвященных получению и изучению свойств серебряных НЧ, синтез которых в настоящее время интенсивно развивается [11,13].
Существует различные способы синтеза НЧ серебра — традиционные и нетрадиционные [9,12].
Традиционные методы получения НЧ серебра:
1.Цитратный метод Туркевича – использование цитрат-аниона в качестве восстановителя солей серебра и стабилизирующего агента. Несмотря на недостатки (в случае серебра диаметр агрегатов разной формы находится в размерах 60…200 нм в отличие от золота – 20+1,5 нм), цитратный метод широко используется в синтезе НЧ серебра.
2. Боргидратный метод — способ восстановления солей серебра тетрагидридоборатом (боргидридом) наиболее распространённый в процессах синтеза НЧ серебра в гомогенных и гетерогенных системах. Механизмы роста НЧ: число роста коллоидных частиц в растворе задаётся в течение короткого времени нуклеации и потом остаётся неизменным. Для получения НЧ с конкретными заданными свойствами необходим стабилизатор.
3. Синтез в двухфазных водно-органических системах — получение НЧ из реагентов, пространственно разделённых в двух несмешивающихся фазах. Существенный недостаток метода – применение значительного количества реагентов. Альтернатива двухфазного метода синтеза НЧ – метод получения НЧ серебра, стабилизированных гидрофильными лигандами (солями ЧАС).
4. Органические восстановители — в качестве восстановителя для получения НЧ серебра небольших размеров (10 нм) лучше подходит фруктоза, чем глюкоза. Используют также этанол, этиленгликоль, экстракт листьев герани. Обнаружена зависимость НЧ серебра от концентрации аммиака и pH среды в процессе восстановления.
5. Методы синтеза в обратных мицеллах — совокупность наноразмерных химических «реакторов», которые формируются из молекул ПАВ. Метод синтеза НЧ серебра состоит в смешивании двух микроэмульсий типа «вода в масле», одна из которых содержит растворённую в воде соль серебра, а другая – восстановитель. Достоинство метода – удобство контроля размеров НЧ серебра. Различные синтезы НЧ серебра проводят путем химического и фотохимического восстановления нитрата серебра в присутствии ПАВ.
нетрадиционные методы получения НЧ серебра
1. Метод лазерной обработки массивных образцов металлического серебра в жидких средах используют с минимальным количеством реагентов, иногда и в чистых растворителях.
2. Радиолитические методы — основаны на воздействии на образец электронов или γ-излучения высокой энергии для синтеза кластеров серебра и изучения их свойств. Радиолитические методы – перспективный способ препаративного получения НЧ серебра.
3. Вакуумное испарение металла: — синтез НЧ серебра из атомарного серебра путем испарения в вакууме или при пропускании высокочастотного (800…900 кГц) разряда через слой органического растворителя, содержащего порошок металла. Недостаток – разложение органического растворителя при прохождении разряда.
4. Биосинтез НЧ серебра: — экологические способы синтеза, исключающие применение токсичных реагентов, например, с помощью штамма бактерий Pseudomonas studzeri AG 259. Установлено, что при росте клеток в присутствии ионнов серебра в их периплазматическом пространстве продуцируются кристаллы серебра диаметром 100…200 нм. Механизм формирования НЧ серебра не выяснен, но есть предположение о роли белков, которые обладают сродством к серебру, отдельные участки которых могут выступать центрами нуклеации [9] .
Проведенный анализ литературы наглядно демонстрирует, что в области исследований, посвященных синтезу НЧ серебра, не наблюдается спада активности, несмотря на то, что общие принципы методов получения НЧ уже достаточно хорошо разработаны [16, 21].
Наночастицы обладают большой антибактериальной эффективностью, во-первых, благодаря своей развитой поверхности, которая создает максимальный контакт с окружающей средой, во-вторых, они обладают достаточно малыми размерами и способны проникать сквозь клеточные мембраны, влияя на внутриклеточные процессы изнутри [8,16,22].
Однако до сих пор актуальны:
1. проблема синтеза гидрофильных НЧ серебра, устойчивых в широком интервале pH;
2. разработка универсальных и высокоэффективных методов очистки дисперсий НЧ серебра для их дальнейшего использования не только в микроэлектронике, но и в медицине и других областях [9].
Современное ДС должно отвечать следующим требованиям: обладать достаточной антимикробной активностью [17] в отношении патогенных и условно-патогенных видов микроорганизмов – бактерий, грибов, вирусов, а также споровых форм микроорганизмов; относительно низкой токсичностью для человека; быть экологически безопасным; быть стабильным при хранении; не иметь резкого неприятного запаха; хорошо растворяться в воде; не повреждать обрабатываемые объекты; иметь оптимальное соотношение «стоимость–качество».
В настоящее время актуальным является поиск новых дезинфицирующих препаратов, которые содержат НЧ металлов. Эти средства характеризуются низкой токсичностью и широким спектром биоцидного действия [1,3,4,14, 11].
В последние 5 лет учёные-химики МГУ разработали и предложили линейку ДС на основе НЧ серебра для объектов ветеринарного надзора из двух препаратов: 1) «Аргумистин» — препарат на основе НЧ серебра, модифицированных мирамистином, содержащий мирамистин 100 мкг/мл и коллоидное серебро 10 мкг/мл) [5,6,2, 20,10] и 2) «Аргенталин» – препарат на основе НЧ серебра, модифицированных бензилдиметил[3-(миристоиламино)пропил]аммоний хлорид моногидратом [19].
Достоинствами ДС «Аргенталин» является, во-первых, присутствие в его составе коллоидных частиц серебра, которые обеспечивают антибактериальное воздействие на широкий диапазон бактерий, нарушая их кислородное дыхание, вызывая перекисное окисление липидов клеточных мембран и препятствует росту бактерий. Во-вторых, ДС «Аргенталин» в своем составе в качестве ДВ, кроме коллоидного серебра (0,05%), содержит также полигексаметиленбигуанид гидрохлорид – ПГМГ-гидрохлорид (4%), который в 2 раза активнее хлорамина и в 5 раз эффективнее фенола. Именно ПГМГ-гидрохлорид образует на поверхности обрабатываемых поверхностей микроплёнку, безопасную для обеззараживаемых материалов, но губительную для патогенов бактериальной и вирусной эпиологии. Данная микроплёнка, в зависимости от внешней среды, обеспечивает длительный (от 3 до 32 дн) контакт с обрабатываемыми поверхностями всех компонентов действующих веществ препарата «Аргенталин», создавая пролонгированный эффект ДС.
Дезинфицирующее средство «Аргенталин» представляет собой однородную вязкую темно-коричневую жидкость с красноватым оттенком со слабым специфическим запахом, содержащее в своем составе качестве действующих веществ: серебро коллоидное (0,05%), полигексаметиленбигуанид гидрохлорид (4%), алкилдиметилбензиламмоний хлорид (8%), дидецилдиметиламмоний хлорид (2%), а также функциональные компоненты (неионогенные поверхностно-активные вещества и регулятор кислотности) и воду [19].
Для изучения антимикробной активности образцов были выбраны следующие референс-штаммы:
Грамотрицательные бактерии:
- Escherichia coliATCC 25922.
- Pseudomonas aeruginosa ATCC 9027
- Klebsiella pneumoniae C6
- Salmonella typhimurium АТС 13311
- Enterobacter cloacae ATCC 13047
Грамположительные бактерии:
- Staphylococcus epidermidis ATCC 12228
- Staphylococcus aureus FDA 209P
- Staphylococcus aureus INA 00761 (MSSA с устойчивостью к метициллину 0,125 мкг/мл)
Бациллы:
- Bacillus subtilis ATCC 6633
Грибы:
- Aspergillus niger INA 00760
- Candida albicans ATCC 10231
- Trichophyton mentagrophуtes (штамм АТСС 9533)
Вирусы:
- Poliovirus типа 1 Sabin (вакцинный штамм Sabin (LSc2ab)
- Adenovirus 5 типа (штамм Аденоид 75)
Нами проведены исследования, представленные в табл.1, по определению активности ДС «Аргенталин» в отношении референтных штаммов грамотрицательных и грамположительных бактерий, грибов, вирусов.
Таблица 1. Антимикробная активность ДС «Аргенталин»
| Штамм | Время экспозиции, мин | Концентрация раствора по препарату, % | ||||||||||
| 2,0 | 1,5 | 1,0 | 0,5 | 0,2 | 0,1 | |||||||
| Escherichia coli ATCC 25922 | 15 | — | — | — | — | — | + | |||||
| Pseudomonas aeruginosa
ATCC 9027 |
15 | — | — | — | — | + | + | |||||
| Klebsiella pneumoniae C6 | 15 | — | — | — | — | + | + | + | ||||
| Salmonella typhimurium АТС 13311 | 30 | — | — | — | — | — | + | |||||
| Enterobacter cloacae ATCC 13047 | 30 | — | — | — | — | + | + | + | ||||
| Staphylococcus epidermidis ATCC 12228 | 15 | — | — | — | — | + | + | + | ||||
| Staphylococcus aureus FDA 209P | 15 | — | — | — | — | + | + | + | ||||
| Staphylococcus aureus INA 00761 | 15 | — | — | — | — | + | + | + | ||||
| Bacillus subtilis ATCC 6633 | 60 | — | + | + | + | + | + | + | ||||
| Aspergillus niger INA 00760 | 90 | — | — | — | + | + | + | + | ||||
| Candida albicans ATCC 10231 | 30 | — | — | + | + | + | + | + | ||||
| Trichophyton mentagrophуtes (штамм АТСС 9533) | 30 | — | + | + | + | + | + | + | ||||
| Poliovirus типа 1 Sabin (вакцинный штамм Sabin (LSc2ab) | 30 | — | — | + | + | + | + | |||||
| Adenovirus 5 типа (штамм Аденоид 75) | 30 | — | — | + | + | + | + | |||||
Из представленных в табл. 1 результатов видно, что все референсные штаммы и штаммы патогенных микроорганизмов весьма чувствительны к действию средства «Аргенталин».
Дезинфицирующее средство «Аргенталин» показало максимальное бактерицидное действие на S. typhimurium, E. сoli в пределах 15…30 мин экспозиции при МПК 0,1%, выраженное действие на грибы Candida albicans и вирусы Poliovirus типа 1 Sabin и Adenovirus типа 5 в пределах 30 мин экспозиции и 1,0%, однако наиболее устойчивой была Bacillus subtilis и МПК для нее составляла 2,0% при 90 мин экспозиции.
В табл. 2 привдены основные критерии определения антибактериальной активности препарата согласно Руководству Р 4.2.2643-10 [7 Материалы и методы ].
Таблица 2. Критерии определения бактерицидной, фунгицидной и вирулицидной активности препарата согласно Руководству Р 4.2.2643-10
| Параметр | Раз
дел Руководства |
Микроор-
ганизм |
Концентра-ция инокулюма (кл/мл) | Результат | Минима-льное время контакта (мин) |
| Бактерицидное действие | 5.1.2.1 и
5.1.2.3 |
P. aeruginosa
E. coli S. aureus S.typhimurium |
109 кл/мл | Полное уничтожение | 30 мин |
| Фунгицидное
действие |
5.3.2.1 и | C.albicans
Т. gypseum |
109 кл/мл | Полное уничтожение | 60 мин |
| 5.3.2.4 | Aspergillus niger | 120 мин | |||
| Вирулицид
ное действие |
5.7.3.1 | Poliovirus типа 1 Sabin Adenovirus типа 5 | Полное
уничтожение |
60 мин |
Согласно пп. 5.1.2.1, 5.1.2.3, 5.3.2.1, 5.3.2.4и 5.7.3.1 Руководства Р 4.2.2643-10 «Методы лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности», дезинфицирующее средство «Аргенталин» соответствует критериям оценки эффективности дезинфицирующего средства. Оно обладает бактерицидным и фунгицидным действием и вирулицидным действием с минимальным временем контакта 60 мин, следовательно, данные показатели позволяют рассматривать данное средство как дезинфицирующее.
Установлено, что опасного для человека уровня накопления серебра в тканях цыплят-бройлеров при пероральном и аэрозольном применении аналога «Аргенталина» — «Аргумистина», представляющего собой водные коллоидные растворы серебра, стабилизированного мирамистином, не происходит.
С учетом рекомендаций ВОЗ и нормативных документов РФ можно заключить, что применение препарата, содержащего 10 мкг/мл серебра и 100 мкг/мл хлорида бензилдиметил[3- (миристоиламино)-пропил]аммония, в рекомендованных терапевтических дозах не вызывает накопления серебра в тканях цыплят-бройлеров в концентрации, опасной для человека [5 ].
Проведение дезинфекции путем мелкокапельного орошения поверхностей и технологического оборудования помещений ДС «Аргенталин» обходится дешевле, чем применяемыми препаратами аналогами за счет более низких затрат на приобретение дезинфектанта, Стоимость дезинфекции 1 м² ДС «Аргенталин» обходится в 0,018 руб., что в 7 раз меньше в сравнении с препаратами-аналогами Крышталин-ЭКОДЕЗ, Цеприл, АкваДез.
Заключение
ДС для ветеринарного применения «Аргенталин», содержащее в своем составе в качестве действующих веществ: серебро коллоидное (0,05%), полигексаметиленбигуанид гидрохлорид (4%), алкилдиметил-бензиламмоний хлорид (8%), дидецилдиметиламмоний хлорид (2%), обладает бактерицидным действием в отношении грамположительных и грамотрицательных микроорганизмов, фунгицидным действием в отношении мицелиальных и дрожжеподобных грибов и вирулицидным действием. Дезинфицирующее средство «Аргенталин» показало максимальное бактерицидное действие на S. typhimurium, E. сoli в пределах 15…30 мин экспозиции при МПК 0,1%; обнаружило выраженное действие на грибы Candida albicans и вирусы Poliovirus типа 1 Sabin и Adenovirus типа 5 в пределах 30 мин экспозиции и 1,0%. Наиболее устойчивыми оказались Bacillus subtilis , для которых МПК составляла 2,0% при 90 мин экспозиции.
Согласно пп. 5.1.2.1, 5.1.2.3, 5.3.2.1, 5.3.2.4 и 5.7.3.1 Руководства Р 4.2.2643-10 «Методы лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности», ДС «Аргенталин» соответствует критериям оценки эффективности дезинфицирующего средства. Учитывая достоинства средства «Аргенталин» (наличие коллоидных частиц серебра, обеспечивающих антибактериальное воздействие на широкий диапазон бактерий; пролонгированный эффект ДС за счет присутствия 4% полигексаметиленбигуанид гидрохлорида (ПГМГ- гидрохлорида), данное новое композиционное средство «Аргенталин» рекомендуется для дезинфекционной обработки объектов ветеринарного надзора в указанных режимах: бактерицидное действие (кроме споровых форм) — концентрация 0,1%, экспозиция 15…30 мин; фунгицидное действие — концентрация 1,0%, экспозиция 30 мин; вирулицидное действие — концентрация 1,0%, экспозиция 30 мин. Проведение дезинфекции по разработанной нами технологии средством «Аргенталин» является экономически выгодной.
1.4.3.1.1. Список литературы
- Боляхина, С.А. Исследование острой и хронической токсичности препарата Аргумистин / С.А. Боляхина, Г.Ф. Насартдинова, Н.А. Донченко и др. // Сибирский вестник сельскохозяйственной науки. – 2014 – № 3.- С. 95–101.
- Коробкова, Е.А. Ветеринарные препараты на основе наночастиц серебра, модифицированных мирамистином: новые возможности в лечении кошек с ринитом, конъюнктивитом, гигнивитом различной этиологии / Е.А.Коробкова, В.А.Кузьмин, А.М.Лунегов, К.С.Савенков, Б.В. Виолин и др. // Вопросы нормативно-правового регулирования в ветеринарии.-2015.-№.3.-С.153-156.
- Казаринов, Н.П. Изучение хронической энтеротоксичности антибактериального препарата Аргумистин® при энтеральном введении / Н.П. Казаринов, Н.А. Донченко, М.С. Богданова, и др. // Аграрная наука – 2015. – № 2. – С. 21–25.
- Коптев, В.Ю. Оценка уровня накопления серебра в тканях и органах цыплят-бройлеров при пероральном и аэрозольном применении коллоидного серебра. / В.Ю. Коптев, М.А. Титова, Н.Ю. Балыбина, Е.А. Коробкова, А.А. Кудринский, А.Н. Денисов, Ю.А. Крутяков. // Проблемы биологии продуктивных животных. – 2014. — № 3. С. 92–100.
- Крутяков, Ю. А. Определение содержания серебра в тканях и органах цыплят-бройлеров после орального и ингаляционного применения водных дисперсий наночастиц серебра / Ю. А.Крутяков, В.Ю.Коптев, А.А.Кудринский, А.И.Климов и др. // Гигиена и Санитария.-2016.- №95(2).-С.207-211.
- Крутяков, Ю.А. Разработка валидированной методики количественного определения мирамистина и серебра в плазме крови и молоке коров, больных маститами и эндометритами, с использованием методов высокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием и атомно-эмиссионной спектроскопии с индуктивно-связанной плазмой / Ю.А.Крутяков, И.А.Родин, В.А.Кузьмин, Б.В. Виолин // Матер. II Междунар. Вет. Конгр. VETIstambulGroup-Россия-2015.-СПб.,2015.-С.226-229.
- Крутяков, Ю.А. Синтез, люминесцентные и антибактериальные свойства наночастиц серебра. / Ю.А. Крутяков: дисс. … канд. хим. наук, Москва, 2008.- 144 с.
- Крутяков, Ю.А. Антибактериальный препарат и способ его изучения / Ю.А. Крутяков, А.А. Кудринский, Г.В. Лисичкин, Г.К.Вертелов, А.Г.Мажуга //Патент РФ № 2419439, 2011.
- Крутяков, Ю.А. Синтез и свойства наночастиц серебра: достижения и перспективы. / Ю.А. Крутяков, А.А. Кудринский, А.Ю. Оленин, Г.В. Лисичкин // Успехи химии — 2008. — Т. 77(3). С. 242-269.
- Кузьмин, В.А. Изучение антибактериальной и антимикотической активности препарата Аргумистин / В.А. Кузьмин, А.М. Лунегов, Ю.А.Крутяков, И.В. Белкина, К.С. Савенков // Международный вестник ветеринарии.-2015.-№2.-С.36-39.
- Кузьмин, В.А. Терапевтическая эффективность комплексных препаратов на основе наносеребра / В.А. Кузьмин, А.М. Лунегов, А.В. Кудрявцева, К.С. Савенков, Ю.А. Крутяков // Иппология и ветеринария. — 2014. — Т. 3. — № 13. -С. 61–64.
- Палий, А. П. Дезинфицирующие средства в системе противоэпизооти-ческих мероприятий / А. П. Палий, А. П. Палий, Е. А. Родионова // Известия Великолукской ГСХА. — 2017. — № 2. — С. 24-33.
- Поджарая, К.С. Коллоидное серебро — способы получение и перспективы применения для очистки оборудования молокозаводов /К.С.Поджарая // Инновации в сельском хозяйстве. — 2013. — № 2(4). -С.29-32.
- Хмель, И.А. Антибактериальные эффекты ионов серебра на рост грамотрицательных бактерий и образование биопленок / И.А.Хмель, O.A.Кокшарова, М.А.Радциг // Молекулярная генетика, микробиология и вирусология. -2009.- №4.- С. 27-31.
- Шкиль, Н.Н. Влияние наночастиц серебра и диметилсульфоксида в комбинации с антибиотиками на изменение антибактериальной чувстительности St. aureus АТСС 29737 / Н.Н. Шкиль, Е.В Нефедова // Вопросы нормативно-правового регулирования в ветеринарии. — 2020.-№1.-С.55-57.
- Червинец, В.М. Антибактериальная активность наноструктури-рованного серебряного геля / В.М. Червинец и др. // Журн. Микробиологии, эпидемиологии и иммунобиологии. — 2011. — № 4. -С. 88-92.
- Artemyeva, A.A. Highly sensitive determination of poly(hexamethylene guanidine) by Rayleigh scattering using aggregation of silver nanoparticles / A.A.Artemyeva, T.O.Samarina, A. V.Sharov, S.S.Abramchuk, E.O.Ovcharenko et. al. // Microchimica Acta — 2015. — V. 182 — N 5-6 — P.965-973.
- Edrington, A. Antimicrobial resistance and serotype prevalence of Salmonella isolated from dairy cattle in the southwestern United States / T. Edrington, C.L. Schultz; K.M. Bischoff et al. // Microbial drug resistance (Larchmont, N.Y.) – 2004. – V. 10.-N1. – P. 51-56.
- Henglein, A. / A.Henglein // Chem. Rev.-1989.-N89.-P.1861
- Krutyakov, Yurii A. In vivo study of entero- and hepatotoxicity of silver nanoparticles stabilized with benzyldimethyl[3-myristoilamine)-propyl]ammonium chloride monohydrate (miramistin) in CBF1 mice upon enteral administration / Yurii A. Krutyakov, Alexey A. Kudrinskiy, Vladimir A. Kuzmin, Alexander A. Gusev, Inna A. Vasyukova et al. // Nanomaterials (ISSN 2079-4991) The special issue belongs to the section “Biology and Medicines” – 2020, Special Issue «Frontiers in Nanotoxicology.-Nanomaterials.-2021,11,332.-20p.//doi.org/10.3390/nano 11020332 www.mdpi.com/journal/nanomaterials
- Krutyakov, Yurii Benzyldimethyl[3-(miristoylamino)-propyl]ammonium chloride stabilizedsilver nanoparticles (ArgumistinTM) in medicine: results of clinical trials for treatment of infectious diseases of dogs and perspectives for humans / Yurii Krutyakov, Alexey Klimov, Boris Violin, Vladimir Kuzmin, Victoria Ryzhikh et. al. // European Journal of Nanomedicine, 2016.-P.1-11 [DOI] электр.ресурс https.//www.degruyter.com/j/ejnm. ahead-of-print/ejnm-2016-0018.xml
- Kuong, C.-L. Semi-quantitative determination of cationic surfactants in aqueous solutions using gold nanoparticles as reporter probes / C.-L.Kuong, W.Y.Chen, Y.-C. Chen // Analytical and Bioanalytical Chemistry — 2007. — Т. 387 — № 6 -С.2091-2099.
- Pal, S. Antibacterial Activity and Mechanism of Action of the Silver Ion in Staphylococcus aureus and Escherichia coli / S. Pal, Y.K. Так, J.M. Song // Appl. Environ. Microbiol. — 2007. — V. 73. — P. 1712.
1.4.3.2. ИЗУЧЕНИЕ АНТИМИКРОБНОЙ АКТИВНОСТИ ДЕЗИНФИЦИРУЮЩЕГО СРЕДСТВА «ФУМИЙОД»
Цели исследования – 1) изучить антимикробную активность фумигационных аэрозолей препарата «Фумийод» с применением бактерицидных шашек в отношении изолятов условно-патогенной микрофлоры от телят и поросят с признаками инфекционных респираторных болезней,
2) оценить действие профилактической дезинфекции животноводческих и свиноводческих помещений фумигационными аэрозолями препарата «Фумийод» на уровень бактериальной загрязненности воздуха в присутствии животных,
3) провести оценку эффективности профилактической дезинфекции поверхностей технологического оборудования фумигационными аэрозолями препарата «Фумийод» в животноводческих и свиноводческих помещениях в период санитарного разрыва,
4) в производственных условиях провести испытания препарата «Фумийод» в форме фумигационных аэрозолей для оценки возможности лечения ремонтного молодняка свиней с симптомами респираторных болезней.
Сохранение здоровья животных, профилактика и ликвидация инфекционных, в том числе респираторных болезней, являются основными проблемами ветеринарной медицины. Ассоциативные и смешанные инфекционные болезни животных в промышленных хозяйствах, появление их атипичных форм обусловлено так называемым местным микробизмом, т.е. комплексом условий, способствующих проникновению в данную среду микробов, их размножению и изменчивости. Поэтому контроль за микробной контаминацией и её снижение в зоне обитания животных входят в систему противоэпизоотических мер [6, 14, 5].
Респираторные болезни молодняка крупного рогатого скота и свиней распространены во всех странах мира, являются полифакторными и включают широкий спектр различных факторов, в том числе инфекционных и санитарно-гигиенических. Болезни органов дыхания молодняка КРС являются главой причиной экономических потерь в отрасли. В отдельных хозяйствах погибают и вынужденно убивают по этой причине около половины телят.
Ведущее место в респираторной патологии у животных принадлежит возбудителям вирусной (вирусы парагриппа-3, инфекционного ринотрахеита и вирусной диареи — болезни слизистых), бактериальной (Pasteurella, Streptococcus, Staphylococcus, Enterobacteriaceae) и хламидийно-микоплазменной природы. Причем вирусным агентам принадлежит первичная роль в возникновении острых инфекционных респираторных болезней молодняка, так как инфицированные ими животные становятся восприимчивыми к развитию сопутствующей бактериальной и грибной флоры, возникают осложнения в результате снижения общей резистентности. Полифакторность респираторных болезней, участие в инфекционном патологическом процессе различных ассоциаций бактериальной и вирусной природы, осложняет своевременную диагностику и резко снижает эффективность профилактических и лечебных мероприятий [2, 1,27].
Существует ряд определенных критериев для современных дезинфектантов, отвечающих международным правилам: биоцидное действие в отношении всего спектра патогенной микрофлоры (бактерий, грибов и вирусов); активность в присутствии органических загрязнений, в малоприспособленных условиях и труднодоступных местах; удобство в применении; стабильность при хранении и транспортировке; отсутствие коррозионного воздействия на поверхности и оборудование; возможность появление новых видов оборудования, для обеззараживания которых необходимы средства со специальными свойствами; малая токсичность для человека и животных; экологическая безопасность [16,21,26].
В мировой ветеринарной практике в последние годы наметилась тенденции, с одной стороны, к сокращению применения для дезинфекции ранее широко используемых традиционных средств (формальдегид, хлорактивные соединения и др.) ввиду их токсичности и опасности для экологии [30]. С другой стороны, проявлен интерес к использованию композиционных препаратов, содержащих несколько совместимых АДВ из различных групп химических соединений (галогены, окислители, альдегиды, ЧАС, ПАВ и др.), которые за счет синергизма составляющих компонентов обладают более широким спектром антимикробного действия в сравнении с монопрепаратами и эффективны в значительно меньших концентрациях [20, 7, 12, 19,28, 22,29].
Аэрозольный метод дезинфекции, сущность которого заключается в предотвращении аэрогенного перезаражения животных, содержащихся в одном помещении, получил в нашей стране широкое распространение. При распылении ДС с помощью струйных аэрозольных генераторов (САГов) на мельчайшие капли с дисперсностью частиц 5…30 мкм во много раз увеличивается свободная поверхность биоцида, степень его проникновения в труднодоступные места и, соответственно, химическая активность. Бактерицидное действие аэрозолей происходит в результате диффузии паров дезсредства в частицу микроорганизма [29, 18]. Использование аэрозолей позволяет проводить санацию биоцидами во всём объеме помещения и всех внешних поверхностей технологического оборудования в присутствии животных, что является их достоинством [4,18].
Однако при испытании в форме аэрозолей большого количества биоцидов, применяемых для влажной дезинфекции, лишь немногие из них (например, препараты хлора, формалин в чистом виде и в составе препаратов, перекись водорода, гексилрезорцин) оказались активными [29]. По этой причине встал вопрос о разработке для объектов ветеринарного надзора нового ассортимента отечественных дезинфектантов, используемых в аэрозольной форме (в том числе в виде шашек), обладающих широким спектром антимикробного действия и доступных по цене.
В зависимости от направленности животноводческих хозяйств и принятой промышленной технологии содержания животных используют различные виды дезинфекции: влажную, в том числе бактерицидными пенами, аэрозольную, газовую.
При широко применяемом в настоящее время влажном методе при тщательном увлажнении поверхностей, с одной стороны, происходит тотальное уничтожение микроорганизмов, с другой стороны, имеет место значительный расход биоцидов и воды для приготовления рабочих растворов, увеличение трудоёмкости обработок, коррозия технологического оборудования и многих видов транспорта [16].
Среди новых отечественных дезинфекционных средств для их возможного применения в ветеринарной практике в форме влажной дезинфекции и в форме аэрозолей имеются такие препараты, как Биодез-экстра ДВУ, Бромосепт, Тримицин-вет, Рекодез, Палоцид, Кемицид, Ника-вет-профи, бактерицидные пены, и др. [13, 21, 26, 15, 16, 12, 9].
В дезинфектологии ведутся исследования по изучению новых биоцидных побелочных составов пролонгированного действия (Гидол, Гармамид, Полисепт, Бианол, Беластер) [16, 17]. Они обладают хорошими моющими и обеззараживающими свойствами в отношении микрофлоры; позволяют в более короткие сроки и эффективно проводить обработку сетчатых и других поверхностей сложной конфигурации, снизить концентрацию препарата и экспозицию обеззараживания. Однако критерии выбора и оценки таких технологий по ряду вопросов окончательно не ясны, главным образом, по проблеме выживания некоторых видов бактериальных спор и причин появления резистентности у бактерий на обеззараживаемых поверхностях при дезинфекции высокого уровня [11, 16].
Аэрозольная дезинфекция, в том числе фумигационная, при которой биоцидный агент переводится в мелкораспыленное, туманообразное состояние, обладает по сравнению с влажной дезинфекцией рядом преимуществ: сокращение расходов дезсредств в несколько раз; механизация и автоматизация процесса; снижение коррозионного воздействия на технологическое оборудование; возможность обработки труднодоступных мест за счет высокой проникающей способности частиц аэрозолей; возможность санации не только воздуха, но и поверхностей; практически отсутствие увлажнения поверхностей помещений и оборудования, чем коррозионное действие дезсредств сводится к минимуму [11].
Известно, что природным дезинфектантом является такой химический препарат, как йод. Его желательно включать в состав многокомпонентных биоцидов, чтобы он действовал в них в парообразном состоянии в качестве фумиганта [29]. Из йодсодержащих препаратов для проведения аэрозольной профилактической и вынужденной дезинфекции в ветеринарии в настоящее время используют как старый, разработанный и апробованный более 50 лет назад йод однохлористый, так и относительно новые средства: Йодез, Диксам, Дейтран, ГААС-45 [25, 29, 8, 23] Получение фумигационных аэрозолей с помощью бактерицидных шашек или таблеток по быстроте и простоте обработки выгодно отличается от дисперсионных аэрозолей, получаемых с помощью струйных аэрозольных генераторов [29]. Использование ДС в форме аэрозолей позволяет не только осуществлять дезинфекцию поверхностей и санацию воздуха, но и проводить терапию при ираторных болезнях животных [8, 10, 18, 29].
Перспективным направлением в дезинфектологии является использование бактерицидных сухих аэрозолей, т.е. дымов [3, 8, 29], получаемых при помощи бактерицидных шашек.
Нами в производственных условиях хозяйств СЗФО установлено, что в
животноводческих и свиноводческих помещениях имеют место недостаточная вентиляция и проветривание, способствующие накоплению микрофлоры в воздухе, у значительной части поголовья животных наблюдались признаки респираторных болезней.
В серии лабораторных экспериментов изучали антимикробную активность препарата «Фумийод» (опыт) и 1% глутарового альдегида (контроль) в отношении микрофлоры, изолированной от животных с признаками респираторных болезней (Акт №1 Приложение). Антимикробную активность двух препаратов исследовали методом диффузии в агар на 6 культурах микроорганизмов, одной культуре дрожжей и двух культурах грибов, выделенных от телят с клиникой ринита, бронхита, бронхопневмонии (истечения из носа, кашель хрипы, затрудненное дыхание).
Для этого в первом случае (опыт) стерильные бумажные диски насыщали парами йода при сгорании йодных шашек в животноводческом и свиноводческом помещениях, в контроле — смачивали незначительным количеством 1% раствора глутарового альдегида. Затем бумажные диски размещали в чашках Петри с плотными элективными средами для каждого изолята (тест-культуры микроорганизма). Через 24…72 ч в условиях термостатов (280С и 370С) наблюдали рост конкретных микроорганизмов, дрожжей или грибов, а также зоны задержки их роста на питательных средах вокруг бумажных дисков. Результаты исследований представлены в табл. 1.
Таблица 1. Чувствительность микроорганизмов к испытуемым препаратам для профилактической дезинфекции
| Тест-культуры
микробов и грибов, выделенных от больных животных |
Испытуемый препарат
для дезинфекции |
|
| йодные шашки «Фумийод» | 1% глутаровый альдегид | |
| зона задержки роста, мм | ||
| Klebsiella pneumonia | 32 | 25 |
| Str.pneumoniae | 28 | 20 |
| St.aureus | 27 | 23 |
| Proteus vulgaris | 26 | 22 |
| Pseudomonas aeruginosa | 27 | 21 |
| E.coli | 29 | 25 |
| Candida albicans | 25 | 21 |
| Mucor sp. | 27 | 21 |
| Aspergillus fumigatus | 31 | 24 |
Из материалов табл.1 видно, что фумигационные аэрозоли препарата «Фумийод» in vitro обладают высокой бактерицидной активностью по отношению к изолятам условно-патогенной микрофлоры от животных с признаками респираторных болезней, что проявляется широким спектром антимикробного и антимикозного действия. У препарата «Фумийод» выявлена более высокая антимикробная активность по сравнению с 1% глутаровым альдегидом в отношении микрофлоры от этих больных животных. Препарат «Фумийод» в форме фумигационных аэрозолей, используемый в виде бактерицидных шашек, in vitro обладает высокой общей антимикробной активностью (зона ингибирования, в среднем, 28,00 мм) по отношению ко всем изолятам микрофлоры, в контроле – соответственно 22,40 мм. Выявлена конечная концентрация препарата «Фумийод» по активному ДВ — 0,20 г/м3, при которой в опыте сохраняется более широкий спектр его антимикробного (зона подавления роста, в среднем, 28,17 мм) и антимикозного (зона подавления роста, в среднем, 27,67 мм) действия. В контроле с 1% глутаровым альдегидом, соответственно, в среднем, 22,67 мм и 22,00 мм.
В ходе лабораторных экспериментов было подтверждено, что одна шашка препарата «Фумийод», обладая бактерицидной концентрацией йода 0,20г/м3, позволяет обработать помещение объемом 100м3, эффективно санируя его воздушную среду и значительно сокращая число санитарно-показательных микроорганизмов и плесневых грибов. Дезинфекция воздуха фумигационными аэрозолями заключается в непрерывном поступлении в него паров йода, то есть в получении аэродисперсной системы, обладающей бактерицидными свойствами.
Санация воздушной среды в животноводческих помещениях является отдельным элементом технологии производства и одновременно методом профилактики инфекционных болезней животных в системе противоэпизоотических мероприятий. Количество микроорганизмов в воздухе является санитарно-гигиеническим показателем его чистоты. Согласно допустимых нормативов по СНиП количество микробных тел/м3 воздуха составляет, в тыс.: в помещениях для молодняка КРС с 4 мес и нетелей – 70; в помещениях для ремонтного молодняка свиней – 40…50.
Бактериальную контаминацию воздуха в животноводческих помещениях с опытной группой телят (n=96), в контроле (n=68) в возрасте 5…6 мес и свиноводческих помещениях с опытной группой поросят (n=112), в контроле (n=80) в возрасте 3…5 мес до и после обработки испытуемыми дезинфектантами определяли в точках, взятых по диагонали: у входа в помещения (точка №1), в центре (точка №2) и в торце помещения у противоположной стены (точка №3) – (Акт №2 Приложение). Результаты этих исследований представлены в табл. 2.
Таблица 2. Влияние дезинфекции животноводческих помещений препаратом «Фумийод» на уровень микробной контаминации воздуха
| Место взятия пробы | Количество микробных тел в 1 м 3 воздуха, тыс. КОЕ | |||||||||||||||||||||||||||||||||||||||||||
| 1 опыт | 2 опыт | |||||||||||||||||||||||||||||||||||||||||||
| до обработки | после обработки | до обработки | после обработки | |||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||
ПРИМЕЧАНИЕ: * числитель — общее микробное число (общее количество микроороганизмов в 1м3 воздуха) в телятнике,
знаменатель — общее микробное число в свинарнике.
Из данных табл.2 следует, что применение фумигационных аэрозолей препарата «Фумийод» в виде аэрозольных шашек для профилактической дезинфекции помещений в присутствии телят и поросят позволило снизить бактериальную контаминацию воздуха в этих животноводческих помещениях по сравнению с исходным фоном бактериальной загрязненности, в среднем, в 8,8 раз (опыт); применение 1% глутарового альдегида — соответственно, в среднем, в 3,5 раза (контроль).
В сравнительном аспекте можно привести данные В.И. Трухачева и сотр.(2015) [24], которые, изучая эффективность аэрозольной санации воздуха препаратом Биолог-Д на основе полиалкиленгуанидина для профилактической дезинфекции воздушной среды в присутствии овец выявили, что Биолог-Д способствует снижению бактериальной обсемененности воздуха на 37,0-48,2%, что подчеркивает преимущество фумигационных аэрозолей препарата «Фумийод» для санации воздуха.
С учетом результатов лабораторных опытов для изучения действия «Фумийода» на микробную контаминацию поверхностей технологического оборудования в период санитарного разрыва были испытаны следующие концентрации препарата «Фумийод» в телятнике и свинарнике: 0,06-0,10-0,20 г/м3 по ДВ при норме расхода дезсредства — 3 шашки/1000 м3, 1 шашка/200м3 и 1 шашка/100м3 соответственно и экспозиции 1ч и 3 ч.
В результате производственных испытаний препарата «Фумийод» в животноводческом помещении (Акт №3 Приложение) бактериологическими исследованиями установлено, что при контроле качества дезинфекции: по выделению БГКП эффективное обеззараживание (полное отсутствие роста санитарно-показательных микроорганизмов) гладких поверхностей (металл – оцинкованная сетка, кафель, стена окрашенная масляной краской, пластик, резина) достигнуто при концентрации паров йода 0,10 г/м3 при экспозиции 1 ч. Эффективное обеззараживание шероховатых поверхностей (неокрашенное дерево, цементный пол) по выделению кишечной палочки достигнуто при концентрации паров йода 0,20 г/м3 при экспозиции 1 час. При микробиологическом контроле качества дезинфекции по стафилококку эффективное обеззараживание гладких поверхностей достигнуто при концентрации паров йода 0,10 г/м3 при экспозиции 1 ч, шероховатых поверхностей – соответственно, 0,20 г/м3 и экспозиции 3 ч.
В результате производственных испытаний йодсодержащего препарата «Фумийод» в помещении для содержания ремонтного молодняка свиней бактериологическими исследованиями установлено, что: при контроле качества дезинфекции по выделению БГКП эффективное обеззараживание йодсодержащими шашками гладких поверхностей (оцинкованное железо, кафель, стена с масляной краской, пластиковая труба) происходило при концентрации паров йода 0,10 г/м3 по препарату при экспозиции 1 ч. Эффективное обеззараживание шероховатых поверхностей (дерево неокра-шенное, пол цементный, пол из метлахской плитки, коврик резиновый) имело место соответственно при концентрации паров йода 0,20 г/м3 при экспозиции 1 час. При контроле качества дезинфекции по выделению стафилококков йодсодержащие шашки (препарат «Фумийод») при концентрации паров йода 0,20 г/м3 по АДВ и обеспечивали эффективность дезинфекции гладких и шероховатых поверхностей при экспозиции 3 ч.
В контроле в смывах с гладких и шероховатых поверхностей технологического оборудования (после очистки и мойки помещений перед проведением дезинфекции) кишечную палочку в свиноводческих помещениях выделяли в 70%, в животноводческих – в 70%, стафилококки соответственно – в 100% и 95% отобранных проб.
Внедрение новых биоцидов позволяет существенно снизить опасность накопления на объектах внешней среды патогенной и условно-патогенной микрофлоры, что чрезвычайно важно в репродукторных отделениях животноводческих, свиноводческих хозяйств, в птицеводстве, биологической промышленности и приблизит решение проблемы направленного регулирования микробиоценоза объектов внешней среды на предприятиях ветеринарного надзора [11, 16, 26].
Учитывая воздушно-капельный путь заражения при респираторных болезнях и положительные результаты наших экспериментов по эффективности санации воздуха препаратом «Фумийод» и его высокой антимикробной активности in vitro по отношению к микроорганизмам и грибам, выделенным от животных с признаками респираторных болезней, на последнем этапе экспериментов были проведены исследования по изучению возможности применения данного препарата для лечения поросят с респираторными болезнями (Акт №4 Приложение).
Нами проведена групповая лечебная ингаляционная обработка ремонтного молодняка свиней племенной фермы (n=150) в возрасте 3-5 мес с признаками ринита, трахеита, бронхопневмонии препаратом «Фумийод» в режиме дезинфекции, но с меньшей экспозицией, равной 20-30 мин, при t0 180C и относительной влажности ≥ 75%. Группотвую ингаляцию паров йода осуществляли 1 раз в сутки, 4 дня в неделю. Вытяжные шахты – в открытом положении, приточные клапаны вентсистемы закрыты полностью с учётом конкретных особенностей помещений для содержания поголовья. После окончания экспозиции 20-20 мин параметры вентсистемы приводили в исходное технологическое состояние. Концентрация паров йода, равная 0,20 г/м3, легко переносится молодняком животных.
Результаты опыта по изучению эффективности применения препарата «Фумийод» в виде шашек для лечения поросят от респираторных болезней показали, что терапевтическая эффективность препарата «Фумийод» для поросят составила около 90%, что соответствует терапевтической эффективности при назначении антибиотика окситетрациклин в дозе 30-40 тыс. ЕД/1 кг массы тела. Исчезновение симптомов респираторных болезней основной массы поросят (150 голов) в возрасте 3-5 мес в опытной группе происходило на 8-10-й дни после 4-кратного применения йодных ингаляций. У 10% свинопоголовья симптомы респираторных болезней остались, однако были слабо выражены (присутствовали редкие, незначительные хрипы, продуктивный кашель). Побочных явлений и осложнений, которые свидетельствуют о токсическом проявлении препарата «Фумийод» на животных, противопоказаний для его применения не установлено. Система санитарных мероприятий с применением препарата «Фумийод» в форме фумигационных аэрозолей способствует повышению эффективности противоэпизоотических мероприятий при респираторных болезней молодняка животных. Ингаляционные аэрозоли препарата «Фумийод» в форме термовозгонных бактерицидных шашек рекомендуются для свиней при респираторных болезнях (ринит, бронхопневмония).
Стоимость обработки воздушной среды помещения для выращивания молодняка животных/птицы йодными термовозгонными бактерицидными шашками «Фумийод» в 4,11 раза ниже стоимости обработки «Йодом однохлористым».
Заключение
Из смывов с носовой полости и назофарингиальных смывов от телят и поросят с симптомами бронхопневмонии, пневмонии, бронхита, ринита выделены культуры микроорганизмов (Klebsiella pneumonia, Str.pneumoniae, St.aureus, Proteus vulgaris, Pseudomonas aeruginosa, E.coli), дрожжей (Candida albicans) и грибов (Mucor sp., Aspergillus fumigatus).Одна фумигационная шашка препарата «Фумийод» с бактерицидной концентрацией 0,20 г/м3 по ДВ позволяет обработать помещение объемом 100м3 при экспозиции 3 ч. Препарат «Фумийод» в качестве эффективного дезинфицирующего средства может быть рекомендован для проведения вынужденной и профилактической дезинфекции на ОГВН при контроле её качества по выделению БГКП и стафилококков. В производственных условиях показана возможность применения ингаляционных аэрозолей препарата «Фумийод» в форме термовозгонных бактерицидных шашек для свиней при респираторных болезнях (ринит, бронхопневмония).
1.4.3.2.1. Список литературы
- Басова, Н.Ю. Структура респираторных болезней молодняка КРС бактериальной этиологии /Н.Ю.Басова, М.А.Староселов, А.К.Скатум и др. // Ветеринария Кубани.-2017.-№4.-С.123-14.
- Будулов, Н.Р. Респираторные болезни крупного рогатого скота в Дагестане: дисс. … докт. вет. наук.-Краснодар,2009.-335с
- Варюхин, А. Йодистые аэрозоли: преимущества и недостатки /А.Варюхин // Птицеводство. — 2010. — № 6. — С. 40-41
- Волков, М.Ю.Безопасное средство «Алко-Перит» для санации воздуха помещений и дезинфекции объектов ветеринарного надзора в присутствии животных /М.Ю.Волков, Т.В.Заболоцкая, Г.Х.Муртазина, Е.А.Петрова и др. //Ветеринарный врач.-2015.-№3.-С.60-64.
- Готовский, Д.Г. Использование дезинфицирующего средства «Сплендер» для санации воздушной среды животноводческих помещений / Д.Г. Готовский, В.В. Петров, А.А. Карташова // Ученые записки учреждения образования «Витебская ордена «Знак почета» государственная академия ветеринарной медицины». — 2012. — Т. 48. — Вып. 1. — С. 14-18.
- Дорожкин, В.И. Препараты для дезинфекции объектов ветеринарного надзора / В.И. Дорожкин и др. // Эффективное животноводство. — 2018. — № 3 (142). — С. 34-36.
- Кисиль, А.С. Изучение биоцидного действия дезинфекционного препарата «Дезостерил» в отношении B.rangifei / А.С Кисиль. О.Р.Полякова П.В.Аржаков, Л.Н. Гордиенко // Вопросы нормативно-правового регулирования в ветеринарии.-2017.-№1.-C.41-42
- Костромичев, Ю.Ф. Применение йодогенерирующей таблетки «Дейтран» в кролиководстве /Ю.Ф.Костромичев //Кролиководство и звероводство.-2007.-№2.-С.29.
- Лучинин, Д.Н. Изучение эффективности новых дезинфицирующих средств при обеззараживании объектов, контаминированных возбудителями чумы, туляремии и сибирской язвы / Д.Н. Лучинин, В.А. Спиридонов, Е.А. Снатенков, К.А. Ротов, Д.В. и др. // Дезинфекционное дело. -2018.-№ 1(103).-С. 13-17
- Маслова, В.В. Морфофункциональное состояние лабораторных животных и телят при воздействии шашек «Тамбей» и «Вимал»: дисс. …канд.вет наук.-Саратов, 2018.- 161с.
- Медведев, Н.П. Биологические и технологические основы экологически безопасной системы аэрозольной дезинфекции объектов ветеринарного надзора: дисс. … докт. биол. наук.-М.,2001.-293с.
- Никитин, Г.С. Оценка токсичности дезинфицирующего средства «Кемицид» /Г.С.Никитин, А.Ф.Кузнецов // Вопросы нормативно-правового регулирования в ветеринарии.-2015.-№3.-С.136-138.
- Новиков, Н.Л. Разработка средств и методов обеззараживания животноводческих помещений от возбудителей инвазионных и инфекционных заболеваний: дисс. …канд. вет. наук.- М.,2004.- 146с.
- Попов, Н.И. Изучение активности средства Палоцид для обеззараживания объектов ветеринарного надзора /Н.И.Попов, С.А.Мичко, С.М.Лобанов, З.Е.Алиева и др. // Проблемы ветеринарной санитарии, гигиены и экологии.-2018.-№1.-С.48-49.
- Попов, Н.И. Экспериментальные испытания дезинфицирующего средства «Ника-вет-профи» для ветеринарной практики / Н.И.Попов, С.М.Лобанов, С.В.Иксанов, С.А.Мичко и др.// Проблемы ветеринарной санитарии, гигиены и экологии.-2016.-№1.-С34-38.
- Попов, Н.И. Дезинфекция объектов ветеринарного надзора бактерицидными пенами: дисс. … докт. вет. наук.-Москва, 2005.-645с.
- Равилов, А.З. Беластар — универсальное побелочное средство с биоцидным пролонгированным эффектом /А.З.Равилов, В.С.Угрюмова, А.П.Савельчев // Ветеринария.- 2011.-№6.-С.37-38.
- Решетникова, Т.Н. Эффективность дезинфицирующего средств «Экоцид-С» и «Вироцид», применяемых для аэрозольной дезинфекции помещений в присутствии животных, в целях профилактики респираторных и желудочно-кишечных болезней свиней/Т.Н.Решетникова /Т.Н.Решетникова //Вопросы нормативно-правового регулирования в ветеринарии.-2017.-№4.-С.43-48.
- Сайпуллаев, М. С. Научное обоснование и разработка новых дезинфицирующих средств для ветеринарной практики: дисс. …докт. вет. наук. — Москва, 2014. — 282 с.
- Султанов, А.А. Новое дезинфицирующее средство «БА — 12» для обеззараживания почвенных очагов сибирской язвы / А.А.Султанов, В.Ю.Сущих, Б.Канатов, К.Нурлан // Вопросы нормативно-правового регулирования в ветеринарии.-2020.-№1.-С.75-79. \
- Сысоева, М.М. Дезинфекция объектов ветеринарного надзора препаратом «Тримицин-вет»: дисс. … канд. вет. наук ,2011.-147с.
- Тарасова, И.И. Механизмы формирования резистентности к дезинфектантам / И.И. Тарасова, Е.М. Ленченко, С. Чжун и др. // Ветеринария и кормление. — 2014. — № 6. — С. 47-48.
- Техническая инструкция по обработке производственных помещений по содержанию птиц или животных парами йода при использовании генератора аэрозоля на основе антисептического состава ГААС по ТУ 2449-004-05121441-2002
- Трухачев, В.И. Эффективность аэрозольной санации воздуха в помещениях для овец /В.И. Трухачев, В.Ю.Морозов, О.Р.Колесников, Л.Н.Скорых// Проблемы ветеринарной санитарии, гигиены и экологии.-2015.-№3.-С.39-45.
- Туварджиев, А.В. Аэрозольный метод профилактики и терапии колибактериоза птиц йодидом калия, его сочетанием с ампициллином / А.В.Туварджиев, С.П. Ковалев // Вопросы нормативно-правового регулирования в ветеринарии.-2020.-№1.-С.63-66.
- Хисамутдинов, А.Г. Новое импортозамещающее дезинфицирующее средство Рекодез, его эффективность в отношении возбудителя туберкулеза: дисс. …канд.биол.наук.-Казань,2018.-130с.
- Шахов, А. Этиология респираторных болезней поросят в промышленных свиноводческих хозяйствах и меры их профилактики /А. Шахов, Л. Сашнина, М. Лебедев и др.// Свиноводство. — 2008 — №5. — С. 26 – 28.
- Шкарин, В.В. Характеристика устойчивости микроорганизмов к хлорсодержащим дезинфектантам и ее эпидемиологическая значимость / В.В. Шкарин, Н.В Саперкин, О.В. Ковалишина, О.М.Сутырина // Эпидемиология и Вакцинопрофилактика. – 2009. — № 5. — С. 27 — 31.
- Ярных, В.С.Аэрозоли в ветеринарии/ В.С.Ярных.-М.,1972.-352с.
- Baumann, H. About the toxicity of formaldehyde /H. Baumann //Kunstoff- 1981.-B.71.-№.11.- P.835-839.
1.4.3.3. ИЗУЧЕНИЕ АНТИМИКРОБНОЙ АКТИВНОСТИ КОМПОЗИЦИОННОГО ПРЕПАРАТА «КЕМИСЕПТ»
Цели исследования: 1) изучить антимикробную активность нового композиционного препарата «Кемисепт»,
2) установить перспективы использования нового дезинфицирующего средства «Кемисепт» на объектах ветеринарного надзора.
В целях повышения рентабельности и обеспечения необходимого уровня конкурентоспособности, промышленное производство животноводческой продукции немыслимо без строительства крупных комплексов с высоким уровнем механизации, автоматизации и внедрения передовых технологий. Особенно это актуально для отраслей птицеводства и свиноводства, которые традиционно опираются на биологические особенности эксплуатируемого поголовья, такие как скороспелость, многоплодие, эффективное использование кормов, а также строгое соблюдение технологии. В то же время, все эти факторы, учитывая высокую концентрацию биологических объектов на ограниченных площадях, существенно изменяют условия жизни животных, вынуждая их испытывать на себе последствия техногенного стресса [5]. В результате появляются предпосылки для возникновения и широкого распространения инфекционных болезней бактериальной и вирусной природы, которые за счёт активного пассажирования возбудителей способны приводить к массовой гибели поголовья [8] и тяжёлым экономическим последствиям для производителя. При этом процессы глобализации привели к тому, что некоторые особо опасные инфекции, ещё недавно считавшиеся экзотическими, вполне могут представлять реальную угрозу не только агропромышленному комплексу, но и национальной экономике в целом.
Поэтому важнейшим звеном сохранения стратегической продовольственной безопасности страны, а также обеспечения санитарно-эпидемиологического благополучия населения является комплекс противоэпизоотических мероприятий, среди которых одно из важнейших мест принадлежит дезинфекции [2].
Необходимо отметить, что современный рынок дезинфицирующих средств изобилует препаратами как импортного, так и отечественного производства, при этом перечень входящих в их состав ингредиентов отличается существенным стереотипизмом. Так в настоящее время номенклатура зарегистрированных в Российской Федерации дезинфицирующих субстанций включает следующие группы химических веществ: галогены, альдегиды, перекись водорода и перекисные соединения, спирты, кислоты, полигуанидины, соли четвертичного аммония (ЧАС), амины. Безусловно, каждая из них характеризуется определённым спектром положительных и отрицательных качеств, поскольку ни одно соединение не отвечает в полной мере предъявляемым требованиям. Одни имеют неприятный запах, другие выраженное раздражающее действие на эпителиальные покровы, третьи обладают высокой коррозионной активностью в отношении обрабатываемых поверхностей, вызывая быстрый износ инвентаря и оборудования, в том числе дорогостоящих покрытий машин и агрегатов [7].
Поэтому даже при широком ассортименте препаратов существует насущная необходимость разработки новых высокоэффективных дезинфицирующих средств. Особую актуальность эта задача приобретает в свете продолжающегося распространения африканской чумы свиней (АЧС), представляющей колоссальную угрозу для отечественного свиноводства, а так же рисков, обусловленных пандемией коронавируса и вероятного возникновения новых эпидемических кризисов, в том числе мирового масштаба. При этом, учитывая ограниченность списка основных субстанций, наиболее перспективным направлением разработки инновационных дезинфицирующих препаратов является создание композиций с оптимальным содержанием различных групп химических соединений, обладающих синергетическим действием, улучшающих как биоцидные [9], так и потребительские характеристики средства.
Учитывая вышеизложенное, компания ООО «КемиклКрафт» (Россия) представляет свою новую разработку – препарат «Кемисепт» для дезинфекции объектов ветеринарного надзора, который является продолжением линейки подобных композиционных биоцидов, в частности препарата «Кемицид» ( ООО «КемиклКрафт»,Россия) [ 2 ].
В качестве основных действующих веществ ДС «Кемисепт» содержит комплекс ЧАС (алкилдиметилбензиламмония хлорид, дидецилдиметиламмония хлорид) 25%, N,N-бис(3-аминопропил) додециламин (Триамин Y12D) – 10%. рН 1% рабочего раствора – 9,5±1,0.
Алкилдиметилбензиламмоний хлорид – типичный представитель четвертичных аммониевых соединений, относится к категории катионных ПАВ [11, 14]. Он отличается высокой активностью в отношении вегетативных форм бактерий, грибов и оболочечных вирусов. Механизм антимикробного действия обусловлен перфорацией клеточных мембран, денатурацией белков и инактивацией комплекса бактериальных энзимов. Сам по себе может индуцировать дезинфицирующее действие других препаратов [15], в том числе полигуанидинов [12]; обладает выраженной моющей способностью, что позволяет совмещать процесс мойки и дезинфекции на умеренно загрязнённых поверхностях и материалах.
Данный компонент не имеет резкого запаха, не обладает кумулирующим эффектом, не вызывает сенсибилизации организма. Рабочие растворы не проявляют кожно-раздражающего и кожно-резорбтивного действия, хорошо биоразлагаемы, поэтому не несут серьёзной угрозы экологической безопасности [6].
Известно, что в комплексе эффективных мер предотвращения перемещения возбудителя с контаминированными объектами из одного региона в другой одним из важнейших мероприятий является проведение эффективной экспресс дезинфекции транспорта, в том числе кабин автомобилей. При этом следует учитывать, что владельца интересует не только качество дезинфекции и её пролонгация, но также сохранность оборудования, в том числе лакокрасочных покрытий, обивки и фурнитуры. Поэтому отметим, что используемый в составе ДС «Кемисепт» ЧАС совместим практически со всеми материалами (силикон, резина, пластмасса, акриловое стекло), не оказывает коррозионного действия на металлы и сплавы, не обесцвечивает ткани; стабилен в присутствии органических загрязнений.
Как было отмечено ранее, современный рынок диктует жёсткие правила конкуренции, поэтому перечень требований к дезинфектантам постоянно расширяется, особенно с точки зрения повышения бактери- и вирулицидной активности, что во многом обусловлено выявлением всё новых штаммов возбудителей, устойчивых к большинству известных субстанций, а их перечень, увы, не отличается разнообразием.
В данном ключе весьма интересны исследования, проведённые сотрудниками ЦНИИ туберкулёза РАМН. Было показано, что ЧАСы самостоятельно не способны проникнуть через наружную оболочку микобактерии, при этом концентрация в рабочем растворе здесь не имеет значения. Аргументируется это тем, что функциональная нагрузка молекулы ЧАСа лежит на положительно заряженном ионе аммония, статический эффект которого распределяется по «ветвям» гидрофобных алкильных радикалов. Следовательно, ЧАС оказывается с некоторым положительным зарядом и отталкивается «истинно» гидрофобными структурами миколарабинового пептидогликанового комплекса в наружной оболочке микобактерии [3]. При этом туберкулоцидную активность ЧАСов можно существенно нарастить, путём комбинации их растворов с другими биоцидами.
«Кемисепт» содержит в своём составе N,N-бис(3-аминопропил) додециламин (Триамин Y12D). Это вещество относится к группе триаминов, и проявляет химические свойства, характерные для всех алифатических аминов [10], сохраняет свои свойства после замерзания и последующего оттаивания.
Высокий биоцидный эффект триаминов [10, 13] послужил причиной достаточно широкого их распространения на рынке моющих и дезинфицирующих средств. В частности Триамин Y12D обладает антимикробными свойствами, может выступать в роли бактерицида, фунгицида и альгицида. На его основе можно получать адресные продукты под индивидуальные нужды мероприятий санитарной обработки. Додецилдипропилен триамин прекрасно совмещается с другими препаратами-биоцидами, при этом не теряет своих свойств даже в условиях нестандартной кислотности и высокого содержания органических субстратов.
Триамин обладает минимальными показателями токсичности, что позволяет его широко применять в помещениях коммунального пользования, а также для проведения обработок подвижного состава железнодорожного и автотранспорта.
Несмотря на то, что механизм туберкулоцидного действия триаминов окончательно не выяснен, есть основания полагать, что он основан на электронейтральности молекулы третичного амина, поэтому ей гораздо легче проникнуть через гидрофобный заслон радикалов миколарабинового пептидогликанового скелета клеточной мембраны микобактерии. Кроме того, молекулы триамина аминируют фосфолипиды клеточных мембран, приводя к нарушению их нативных структур и разрушению клетки. Проникая внутрь, они вызывают ингибирование специфических ферментов, обеспечивающих формирование спирали ДНК [3].
Для подтверждения эффективности применения препарата «Кемисепт» Федеральным государственным бюджетным научным учреждением «Федеральный исследовательский центр вирусологии и микробиологии» (ФГБНУ ФИЦВиМ) была проведена дополнительная экспертиза. В лабора-торных условиях исследованы бактериостатическая и минимальная бакте-рицидная концентрации средства, с использованием тест-микроорганизмов 1-й, 2-й групп устойчивости. Результаты исследований ДС «Кемисепт» опубликованы в нашей совместной статье [4] .
В результате экспериментов установлено, что дезинфицирующее средство «Кемисепт» обладает бактерицидной и бактериостатической активностями в отношении тест-культур грамотрицательных (Е. coli) и грамположительных (S. aureus) микроорганизмов, обеспечивая их инактивацию при концентрации 0,0039 и 0,0009% от исходной, соответственно, без добавления белковой нагрузки.
Определено снижение активности дезинфицирующего средства в присутствии высокомолекулярного белка и испытана эффективность его дезинфицирующего действия при обеззараживании контаминированных вирусом АЧС поверхностей, имитирующих объекты животноводческих помещений, с подтверждением полноты инактивации вируса постановкой биопробы на восприимчивых животных.
При испытаниях на сельскохозяйственных животных (биопроба) установлено, что полное обеззараживание тест-поверхностей, имитирующих объекты животноводческих помещений (шероховатые невпитывающие поверхности из резины), контаминированных вирулентным референс-штаммом «Ставрополь 01/08», было достигнуто после однократного орошения 0,2-0,5-1,0% растворами дезинфицирующего средства «Кемисепт» при экспозиции от 30 до 5 мин, соответственно, с нормой расхода 0,3 л/м2. Кроме того, ДС «Кемисепт» обладает вирулицидным действием в отношении вируса АЧС в концентрации 0,2% и выше при экспозиции 30…5 мин (пропорционально увеличению концентрации) с нормой расхода 0,3 л/м2 и может в данных режимах применяться в очагах заражения АЧС для дезинфекции объектов животноводства в соответствии с действующими инструктивными документами с целью полной инактивации вируса АЧС и предотвращения его распространения [4].
Дезинфицирующая активность 0,5-1,0-2,0% растворов средства «Кемисепт», находящихся в дезбарьере/дезковрике/дезванне, не снижается в течение 15 сут наблюдения в отношении возбудителей 1-й и 2-й групп устойчивости, включая возбудителей африканской и классической чумы свиней, нодулярного дерматита, ящура, высокопатогенного гриппа птиц (H5N1, H5N8). Тест-поверхности из резины были полностью обеззаражены при экспозициях от 5 до 40 сек [4].
Для дезинфекции автотранспорта применяли средство «Кемисепт» в дезбарьерах в соответствии с «Правилами проведения дезинфекции и дезинвазии объектов государственного ветеринарного надзора», утв. Департаментом ветеринарии МСХ РФ 16.07.2002 г. [1] при однократной обработке 0,5% раствором при экспозиции от 3,0 мин и выше с целью полной инактивации возбудителей 1-й и 2-й групп устойчивости и предотвращения их распространения [4 ].
Рабочие 0,5% и 1,0% растворы средства «Кемисепт» сохраняют свою эффективность в открытом дезбарьере не менее 15 сут. Добавление криопротекторов (соль техническая, пропиленгликоль) не влияет на активность средства (при t +4С° и -10С°) [4]. При значительном выносе препарата из дезбарьера или его разбавлении, методы дозаправки и корректировка концентрации осуществляются в соответствии с Инструкцией по применению препарата «Кемисепт» (Приложение к отчету).
К настоящему моменту получены данные производственной проверки дезинфицирующего средства «Кемисепт» в условиях ООО «Знаменский СГЦ» [4]. Показано, что использование данного биоцида в качестве наполнителя дезбарьера отличается низкими трудозатратами, позволяет быстро добиться бактерицидного эффекта и в целом средство «Кемисепт» полностью отвечает показателям, декларируемым в Инструкции [4 ].
Стоимость дезинфекции 1 м² препаратом «Кемисепт» обходится
в 1,95 руб.,что в сравнении с прпраратом-аналогом «Экоцидом С» в 14 раз
меньше.
Заключение
«Кемисепт» представляет собой комплексный препарат (синергидная смесь ЧАС + аминов) IV класса опасности по ГОСТ 12.1.007-76. Сочетает в себе свойства высокоэффективного дезинфектанта и моющего средства.
Средство «Кемисепт» обладает бактерицидной и бактериостатической активностями в отношении тест-культур грамотрицательных (Е. coli) и грамположительных (S. aureus) микроорганизмов, обеспечивая их инактивацию при концентрации 0,0039 и 0,0009% от исходной, соответственно, без добавления белковой нагрузки.
При постанове биопробы на с/х животных установлено полное обеззараживание тест-поверхностей, имитирующих объекты животноводческих помещений (шероховатые невпитывающие поверхности из резины), контаминированных вирулентным референс-штаммом «Ставрополь 01/08», после однократного орошения 0,2-0,5-1,0% растворами ДС «Кемисепт» при экспозиции от 30 до 5 мин, соответственно, с нормой расхода 0,3 л/м2.
Дезинфицирующая активность 0,5-1,0-2,0% растворов средства «Кемисепт», находящихся в дезбарьере/дезковрике/дезванне, не снижается в течение 15 сут наблюдения в отношении возбудителей 1-й и 2-й групп устойчивости.
«Кемисепт» способен обеспечить максимальную биологическую защиту в разных вариантах его использования, в том числе при организации дезбарьеров с высокой пропускной способностью и необходимостью использования ДС с пролонгированным дезинфицирующим действием и более длительным сроком годности рабочих растворов (не менее 15 сут). Проведение дезинфекции по разработанной нами технологии отечественным дезинфектантом нового поколения «Кемисепт» рекомендуется для применения в ветеринарной практике на объектах госветнадзора.
1.4.3.3.1. Список литературы
1. «Правила проведения дезинфекции и дезинвазии объектов государственного ветеринарного надзора» (утв. Минсельхозом РФ 15.07.2002 N 13-5-2/0525)
2. Герасимов В.Н. Современные дезинфицирующие средства в системе мер по недопущению заноса и распространению вируса африканской чумы свиней в Российской Федерации / В.Н. Герасимов, В.А. Кузьмин, Р.Г. Васинский // Ветеринарная Практика, 2013. — № 4(63). – С. 28-31.
3. Норманский В.Е. О туберкулоцидном действии некоторых дезинфицирующих средств / В.Е. Норманский, Л.П. Мартынова, Л.Н. Черноусова, Д.Е. Те, Е.К. Логинова // Поликлиника, 2008. — №6. — С. 68–69.
4. Роменский, Р.В.Эффективность и перспективы использования нового дезинфицирующего средства «Кемисепт» /Р.В.Роменский, Н.В.Роменская, Р.Г.Васинский, В.А.Кузьмин, Л.С.Фогель, Д.А.Орехов // Вопросы нормативно-правового регулирования в ветеринарии.-2020.-№2.-С.21-25. DOI: 10.17238/issn2072-6023.2020.2.21
5. Роменский Р.В. Экологические аспекты внутренней патологии сельскохозяйственных животных / Р.В. Роменский, Н.В. Роменская, А.В. Щеглов // Проблемы сельскохозяйственного производства на современном этапе и пути их решения // Материалы ХII международной научно-производственной конференции. — Белгород, 2008. — С. 110.
6. Субботина О.Г. К вопросу о токсичности препаратов на основе четвертичных аммониевых соединений / О.Г. Субботина, И.М. Донник, И.В. Вялых // Ветеринария кубани, 2013. — №6. – С. 17-18.
7. Шуварина Н.А. Главные ориентиры при выборе средств дезинфекции / Н.А. Шуварина // Поликлиника, 2013. — № 6. – С. 30-31.
8. Abreu, A.C. Current and emergent strategies for disinfection of hospital environments / Abreu A.C., Tavares R.R., Borges A., Mergulhao F., Simoes M. // Journal of Antimicrobial Chemotherapy — 2013. — T. 68 — № 12 — C.2718-2723.
9. Chladkova, K. Effect of biocides on S. cerevisiae: Relationship between short-term membrane affliction and long-term cell killing / Chladkova K., Hendrych T., Gaskova D., Goroncy-Bermes P., Sigler K. // Folia Microbiologica — 2004. — T. 49 -№ 6 — C.718-724.
10. Gao, P.-F. Determination of primary and secondary aliphatic amines with high performance liquid chromatography based on the derivatization using 1,3,5,7-tetramethyl-8-(N-hydroxysuccinimidyl butyric ester)-difluoroboradiaza-s-indacene / Gao P.-F., Zhang Z.-X., Guo X.-F., Wang H., Zhang H.-S. // Talanta — 2011. — T. 84 -№ 4 — C.1093-1098.
11. Kuong, C.-L. Semi-quantitative determination of cationic surfactants in aqueous solutions using gold nanoparticles as reporter probes / Kuong C.-L., Chen W.Y., Chen Y.-C. // Analytical and Bioanalytical Chemistry — 2007. — Т. 387 — № 6 -С.2091-2099.
12. Masadome, T. Determination of polyhexamethylene biguanide hydrochloride using photometric colloidal titration with crystal violet as a color indicator / Masadome T., Miyanishi T., Watanabe K., Ueda H., Hattori T. // Analytical Sciences — 2011. — Т. 27 — № 8 — С.817.
13. Mondin, A. Characterization and quantification of N-(3-aminopropyl)-N-dodecyl-1,3-propanediamine biocide by NMR, HPLC/MS and titration techniques / Mondin A., Bogialli S., Venzo A., Favaro G., Badocco D., Pastore P. // Chemosphere — 2014. — T. 95 — C.379-386.
14. Stojanovic, A. Analysis of quaternary ammonium and phosphonium ionic liquids by reversed-phase high-performance liquid chromatography with charged aerosol detection and unified calibration / Stojanovic A., Lammerhofer M., Kogelnig D., Schiesel S., Sturm M., Galanski M., Krachler R., Keppler B.K., Lindner W. // Journal of Chromatography A — 2008. — T. 1209 — № 1-2 — C.179-187.
15. Voorde, A. Van De Analysis of quaternary ammonium compounds in urban stormwater samples / Voorde A. Van De, Lorgeoux C., Gromaire M.C., Chebbo G. // Environmental Pollution — 2012. — T. 164 — C.150-157.
1.4.3.4. ИЗУЧЕНИЕ АНТИМИКРОБНОГО ДЕЙСТВИЯ ЭЛЕКТРОХИМИЧЕСКИ АКТИВИРОВАННЫХ РАСТВОРОВ «АКВАЭХА»
Цели исследования – 1) изучить in vitro бактерицидное и фунгицидное действие электрохимически активированных растворов «АКВАЭХА» в зависимости от их физико-химических параметров и срока хранения.
2) изучить возможность применения электрохимически активированных растворов «АКВАЭХА» для дезинфекции на объекте ветеринарного надзора.
Согласно пункту 1.2. Правил проведения дезинфекции и дезинвазии объектов государственного ветеринарного надзора № 13-5-2/0525 от 15.07.2002 г.: «Дезинфекция, дезинвазия являются важнейшим звеном в системе профилактических, противоэпизоотических мероприятий, обеспечивающих благополучие животных, включая птиц, по инфекционным, инвазионным болезням, безопасность человека в отношении зоонозов, санитарное качество продуктов, сырья и кормов животного происхождения».
Механизм действия дезинфицирующих веществ заключается в процессах, которые возникают и протекают при воздействии химических дезинфицирующих веществ на микробную клетку [15, 16]. При этом состояние обеззараживания не наступает немедленно, процесс гибели микробов происходит постепенно, со скоростью, зависящей от многих факторов, в частности от устойчивости отдельных штаммов к дезсредству. [14], от возможностей их транспорта через клеточные структуры к мишени в микробной клетке [11, 19].
Основные требования к дезинфектантам: безопасность для людей и животных; активность относительно широкого спектра воздействия разнообразных микроорганизмов; медленное формирование, а оптимально – полное отсутствие резистентности; невысокая агрессивность относительно ряда конструктивных материалов; возможность растворения в воде; экологическая безопасность; простота утилизации отработанного раствора [15]. Ни один антимикробный препарат, изготовленный по традиционным технологиям, фактически не удовлетворяет совокупности требований [2, 5].
Некорректное и нерациональное применение антибиотиков, химиопрепаратов для лечения животных [7], а также и дезинфектантов [9] привело к созданию антибиотикорезистентных групп микроорганизмов, что обусловило определённые трудности, с одной стороны, при лечении животных и с/х птицы, с другой стороны, представляя опасность для человека как потребителя животноводческой продукции.
На современном этапе развития ветеринарной науки возникла острая необходимость замены традиционных, зачастую токсичных, дезинфектантов на более эффективные, экологически чистые и недорогие препараты, что обусловливает эффективность системы противоэпизоотических мероприятий. Особый интерес в этом плане могут представлять электрохимически активированные растворы (ЭХАР).
Электрохимическая активация (ЭХА) представляет собой совокупность электрохимического и электрофизического воздействия на питьевую или слабоминерализованную воду в двойном электрическом слое анода (анолит) или катода (католит). В результате ЭХА в электролизёрах питьевая вода или разбавленные (от 0.05 до 5.0 г/л) растворы хлорида натрия переходит в метастабильное, то есть активированное состояние, которое характеризуется необычными значениями физико-химических параметров, в том числе red-ox потенциала, электропроводности, рН, диэлектрической проницаемости и других параметров и свойств [13,17].
Активированное состояние воды и растворов проявляется аномальной реакционной способностью католита и анолита в окислительно-восстановительных реакциях, в том числе изменяется вся система межмолекулярных взаимодействий и структура раствора. В литературе описаны основные факторы, обуславливающие физико-химическую активность анолита и католита [4]:
1. Устойчивые – стабильные продукты электрохимических реакций, стабильные кислоты, основания и т.д., которые определяют кислотные и щелочные свойства ЭХАР, обуславливающие значения рН.
2. Неустойчивые – высокоактивные продукты электрохимических реакций с коротким периодом существования до десятка часов (в т.ч. свободные радикалы) усиливают окислительные свойства анолита, и восстановительные свойства католита, обуславливающие аномальные характеристики окислительно-восстановительного потенциала (ОВП).
3. Метастабильные – долгоживущие квазиустойчивые структуры, сформированные в области объемного заряда у поверхности электродов, как в виде свободных структурных комплексов, так и гидратированных оболочек ионов, молекул радикалов, атомов. Они придают ЭХАР каталитические (в т.ч. биокаталитические) свойства.
В результате электрохимических превращений образуются различные по степени активности и значений рН электрохимически активированные растворы: А – анолит кислотный (рН < 5); АН – анолит нейтральный (рН = 6,0 + 1); АНК – анолит нейтральный (рН = 7,7 + 0,5); АНД – анолит нейтральный (рН = 7,3 + 0,5); К – католит щелочной (рН = > 9); КН – католит нейтральный (рН < 9) [1,3].
В результате указанного электрохимического воздействия растворы переходят в термодинамически неравновесное состояние и в течение 24 ч проявляют аномально высокую химическую активность, при этом раствор, обработанный в катодной камере (католит) обладает моющими свойствами, а раствор, обработанный в анодной камере (анолит), проявляет дезинфекционную активность. Нейтральный анолит АНК (рН=6+1) следует хранить в герметичной стеклянной или пластиковой таре любого объема при комнатной температуре в защищенном от прямых солнечных лучей месте. Хранение анолита АНК при пониженной температуре или в виде льда увеличивает период его релаксации, удлиняя тем самым срок сохранения его наивысшей биоцидной активности [1,3].
Синтезированные с помощью современного направления прикладной электрохимии – электрохимической активации — растворы дезинфицирующего средства «АКВАЭХА» являются соединениями нового поколения с набором дезинфицирующих и моющих свойств. Электрохимически активированные растворы обладают рядом достоинств — простые в изготовлении, дёшевые, имеют широкий спектр антимикробного действия, безопасные для человека и животных (малотоксичные соединения IV класса опасности), не являются ксенобиотиками [2, 17,18].
Электрохимически активированные водные растворы (анодная и катодная фракции) за счет своих аномальных физико-химических параметров приобретают особые биологические свойства. Водные солевые растворы, прошедшие обработку в зоне анода (анолит), обладают мощным бактерицидным, действием, а прошедшие обработку в зоне катода (католит), обладает хорошими моющими свойствами. ЭХАР – малотоксичные соединения, не являются ксенобиотиками, не накапливаются в окружающей среде, при применении в качестве дезинфектанта не требуют смывания водой [1,2].
ЭХАР по степени воздействия на организм на организм относятся к IV классу опасности по ГОСТ 12.1.007-76 [6], в связи с чем нашли применение в различных технологических процессах животноводства и птицеводства [12, 8].
Испытания бактерицидного действия ЭХАР «АКВАЭХА» проводили в лаборатории кафедры микробиологии, вирусологии и иммунологии СПбГМА им. И.И. Мечникова. ЭХАР «АКВАЭХА» производили на установке «АКВА-ЭХА» (ООО НПП «Изумруд», Санкт-Петербург), которая предназначена для получения экологически чистых электрохимически активированных растворов универсального назначения – анодной и катодной фракций. Установка «АКВА-ЭХА» представляет собой электролизер с разделительной полупроницаемой мембраной и электродами, покрытые рутением.
В экспериментах применяли свежеприготовленный ЭХАР «АКВАЭХА» со следующими физико-химическими показателями – № 1 «АКВАЭХА» (рН 7,4, Cl2 акт.700-800 мг/л, ОВП -870 мВ), №2 «АКВАЭХА» (рН 8,6, Cl2 акт.700-800 мг/л, ОВП -730 мВ), №3 «АКВАЭХА» (рН 6,3, Cl2 акт.700-800 мг/л, ОВП -940 мВ). В качестве препарата сравнения (контроль) использован раствор дихлоризоцианурата натрия с концентрацией активного хлора 1,5 г/л, приготовленный в день испытания (коммерческое название и производство препарата в интересах производителя не указано).
В работе использованы следующие штаммы микроорганизмов Escherichia coli ATCC 35218 и 1800, Pseudomonas aeruginosa ATCC 27853 и 293 , Acinetobacter baumannii 111 и 719, Staphylococcus aureus ATCC 25923 и 1165, Candida albicans 420 и 1857, Aspergillus flavus 13, Aspergillus flavus 24, Penicillium notatum 37, Penicillium crustosum 55, Fusarium sp. «№1» и «№2». Из чистых культур тест-микроорганизмов готовили инокулюмы.
Результаты экспериментов, приведённые в табл. 1, демонстрируют выраженное бактерицидное и фунгицидное препаратов ЭХАР прежде всего, с параметрами рН раствора «АКВАЭХА», равными 6,3 [10].
Таблица 1. Диаметр зон задержки роста (мм) вокруг дисков и лунок с ЭХАР «АКВАЭХА» в зависимости от их физико-химических параметров и срока хранения
| Препарат | Метод дисков | Метод лунок | ||||
| St. aureus | C. albicans | A. baumannii | Fusarium sp. | A. baumannii | Fusarium sp. | |
| Опыт №1 – свежеприготовленные растворы «АКВАЭХА» | ||||||
| образец «АКВАЭХА» №1 | 10 | 20 | 6 | 12 | 20 | 7 |
| образец «АКВАЭХА» №2 | 10 | 19 | 7 | 12 | 19 | 9 |
| образец «АКВАЭХА» №3 | 12 | 42 | 23 | 13 | 31 | 13 |
| ДЦУ | н/о | н/о | 15 | 20 | 22 | 12 |
| Опыт № 2 – растворы «АКВАЭХА» после 30 сут хранения | ||||||
| образец «АКВАЭХА» №1 | 6 | 15 | 0 | 12 | 24 | 11 |
| образец «АКВАЭХА» №2 | 8 | 11 | 10 | 16 | 21 | 12 |
| образец «АКВАЭХА» №3 | 11 | 22 | 12 | 17 | 26 | 18 |
| ДЦУ-контроль | 6 | 16 | 0 | 0 | 14 | 12 |
У всех исследуемых образцов «АКВАЭХА», полученных в день испытания, максимальный бактерицидный эффект в отношении вышеперечисленных микроорганизмов развивался в течение первых 10 мин инкубации, в препарате сравнения этот интервал составлял > 20 мин.
Диффузионные тесты демонстрировали превосходство исследуемого ЭХАР «АКВАЭХА» №3 (рН 6,3, Cl2 акт.700…800 мг/л, ОВП -940 мВ) по бактерицидному и бактериостатическому действию «АКВАЭХА» над препаратом сравнения в опыте №1 (свежеприготовленный ЭХАР), так и после 30-суточного хранения ЭХАР (опыт №2).
Изучение скорости развития бактерицидного действия ЭХАР и дезинфицирующего препарата сравнения — раствор дихлоризоцианурата натрия с концентрацией активного хлора 1,5 г/л — выявили бактерицидное действие электрохимически активированного раствора «АКВАЭХА» №3 (рН 6,3, 7,4 и 8,6) на Ps. aeruginosa, E. coli, Stph. aureus, Acinetobacter baumannii в пределах 10 мин инкубации. У препарата сравнения (раствора дихлоризоцианурата натрия), бактерицидный эффект развивался медленнее (>10 мин), чем у всех тестируемых образцов, что представлено в табл. 2.
Таблица 2. Микробная нагрузка (показатель эффективности), уничтожаемая исследуемыми дезинфектантами и препаратом сравнения, кл/мл
| Препараты | Снижение концентрации микробной биомассы тест-микроорганизмов | |||
| Свежие образцы | Образцы после 30 сут хранения | |||
| Степень снижения
(не менее чем в N раз) |
Минимальное
время обработки |
Степень снижения
(не менее чем в N раз) |
Минимальное
время обработки |
|
| Бактерии — Ps. aeruginosa, E. coli, Staph. aureus, Acinetobacter baumannii | ||||
| образец «АКВАЭХА» №1 | 2*109 | 10 мин | Не более 2*108 | 60 мин |
| образец «АКВАЭХА» №2 | 2*109 | 10 мин | Не более 2*107 | 60 мин |
| образец «АКВАЭХА» №3 | 2*109 | 10 мин | 2*109 | 10 мин |
| контроль — раствор дихлоризациа-нурата — ДЦУ | Не более в 2*108 | 10 мин | Не более в 2*108 | 10 мин |
| 2*109 | 60 мин | |||
| Грибы рода Candida | ||||
| образец «АКВАЭХА» №1 | 2*107 | 10 мин | 2*108 | 10 мин |
| образец «АКВАЭХА» №2 | 2*107 | 10 мин | 2*108 | 10 мин |
| образец «АКВАЭХА» №3 | 2*107 | 10 мин | 2*108 | 10 мин |
| контроль — раствор дихлоризациа-нурата — ДЦУ | 2*107 | 10 мин | 2*108 | 10 мин |
| Мицелиальные грибы | ||||
| образец «АКВАЭХА» №1 | 2*108 | 10 мин | 2*108 | 10 мин |
| образец «АКВАЭХА» №2 | 2*108 | 10 мин | 2*108 | 10 мин |
| образец «АКВАЭХА» №3 | 2*108 | 10 мин | 2*108 | 10 мин |
| контроль — раствор дихлоризациа-нурата — ДЦУ | 2*108 | 10 мин | 2*108 | 10 мин |
Результаты исследований, представленные в табл. 2, указывают, что электрохимически активированные растворы «АКВАЭХА» (рН 6,3, 7,4 и 8,6) и препарат сравнения обладают бактерицидным действием в 109. Данная величина позволяет рассматривать испытуемые препараты как дезинфекционные средства согласно пп. 5.1.2.1, 5.1.2.3, 5.3.2.1 и 5.3.2.4 Руководства Р 4.2.2643-10 [7].
Изучение бактерицидного эффекта ЭХАР в процессе их хранения при комнатной температуре в отсутствие света показало, что спустя 30 сут хранения бактерицидный эффект (109) сохранялся только у «АКВАЭХА» №3 с параметрами рН 6,3, Cl2 акт.700…800 мг/л, ОВП -940 мВ. Диффузионными тестами установлено, что «АКВАЭХА» с рН 6,3 более эффективен по бактерицидному действию, чем «АКВАЭХА» №1 и «АКВАЭХА» №2 со значениями рН, соответственно 7,4 и 8,6.
Изучение фунгицидного эффекта ЭХАР продемонстрировало, что растворы «АКВАЭХА» (рН 6,3, 7,4 и 8,6) обладают фунгицидным действием в 109, сопоставимым с действием ДЦУ. Данная величина позволяет рассматривать данные препараты как дезинфекционные средства согласно пп. 5.1.2.1, 5.1.2.3, 5.3.2.1 и 5.3.2.4 Руководства Р 4.2.2643-10 [7 гл. Материалы и методы]. Электрохимически активированные растворы «АКВАЭХА» (рН 6,3, 7,4 и 8,6) обладают in vitro выраженным фунгицидным действием на Asp. niger, Fusarium spp., Candida albicans в пределах 10 мин инкубации. Фунгицидный эффект (109) сохраняется у электрохимически активированных растворов «АКВАЭХА» (рН 6,3, 7,4 и 8,6) спустя 30 сут хранения в тёмном месте при комнатной температуре.
Стоимость 1 л ЭХАР «АКВАЭХА» в 137 раз дешевле 1 л 3% раствора хлорамина, в 10 раз дешевле 1% раствора химического гипохлорита натрия, в 56 раз — раствора «Пресепт» фирмы «Jonson&Jonson».
Заключение
Результаты испытаний in vitro антимикробного действия электрохимически активированных растворов «АКВАЭХА» (ООО НПП «Изумруд», Россия) показали, что все три испытуемых образца ЭХАР «АКВАЭХА» с различными показателями активного хлора, рН и ОВП (особенно образец ЭХАР «АКВАЭХА» №3 с параметрами рН 6,3 Cl2 акт.700-800 мг/л, ОВП -940 мВ), обладают выраженным бактерицидным и фунгицидным действием в пределах 10 мин инкубации.
У всех свежих исследуемых образцов «АКВАЭХА», полученных в день испытания, максимальный бактерицидный эффект в отношении Ps. aeruginosa, E. coli, Stph. aureus, Acinetobacter baumannii развивался в течение первых 10 мин инкубации, в препарате сравнения — раствор дихлоризацианурата (ДЦУ) — этот интервал составлял > 20 мин.
Электрохимически активированные растворы «АКВАЭХА» (рН 6,3, 7,4 и 8,6) и препарат сравнения обладают бактерицидным действием в 109. Данная величина позволяет рассматривать испытуемые препараты как дезинфекционные средства согласно пп. 5.1.2.1, 5.1.2.3, 5.3.2.1 и 5.3.2.4 Руководства Р 4.2.2643-10
Образец ЭХАР «АКВАЭХА» №3 проявляет стабильный бактерицидный и фунгицидный эффект (109) после 30 сут хранения в затемнённом помещении при комнатной температуре. У препарата сравнения — раствора дихлоризоцианурата натрия — бактерицидный эффект развивается медленнее (>10 мин), чем у трёх тестируемых образцов ЭХАР «АКВАЭХА» с различныи значениям pH и red-ox потенциала.
Достоинства импортозамещающих ЭХАР «АКВАЭХА»: не являются ксенобиотиками, безопасны для персонала, малотоксичны — IV класс опасности по ГОСТ 12.1.007-76, не накапливаются в окружающей среде, при использовании их в качестве ДС не требуют смывания водой, рекомендуются к применению на объектах госветнадзора.
1.4.3.4.1. Список литературы
- Бахир, В.М. Электрохимическая активация: изобретериня, техника, технология /В.М.Бахир // М., 2014.- 510с.
- Бахир, В.М. Электрохимические установки СТЭЛ для синтеза антимикробных и моющих растворов //В.М. Бахир, В.И. Прилуцкий, Т.В. Цецхладзе, Н.Ю. Шомовская // Вестник новых медицинских технологии — 2007 — т.XIV, № 3 — C. 166-172
- Бахир В.М. Медико-технические системы и технологии для синтеза электрохимически активированных растворов. — М., ВНИИИМТ,1998. -66 с.
- Былгаева, А.А. Перспективы использования электрохимически активированных жидких сред в сельском хозяйстве/ А.А. Былгаева, Н.А. Обоева, М.П. Неустроев, Н.П. Тарабукина, А.Н. Максимова //Международный журнал прикладных и фундаментальных исследований. – 2018. – № 4 – С. 176-181 URL: https://applied-research.ru/ru/article/view?id=12206
- Веткина, И. Ф. Современный подход к выбору дезинфицирующих средств в системе профилактики внутрибольничных инфекций (ВБИ) / И. Ф. Веткина, Л. В.Комаринская, И. Ю.Ильин, М. В. Соловьева // ФАРМиндекс Практик. – 2005. – Вып. 7. – C. 13–20.
- ГОСТ 12.1.007-76. Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности.
- Забровская А.В. Система мониторинга устойчивости к антимикробным препаратам микроорганизмов, выделенных от животных и из продуктов животного происхождения /А.В.Забровская // Вопросы нормативно-правового регулирования в ветеринарии.-2014.-№1.-С.17-19.
- Закомырдин, А.А. Экономическое обоснование к применению установок СТЭЛ для синтеза дезинфицирующих растворов в животноводстве / А.А. Закомырдин // Ветеринарная патология. — 2009. — № 1(28). -С. 43-46.
- Корчак, Г. И. Механизмы резистентности бактерий и вирусов к дезинфектантам и антисептикам / Г. И.Корчак, И. В.Клименко, Е. В.Сурмашева, Л. І.Ромененко, А. К. Горваль // Довкілля та здоров’я. 2019. №4 (93). —Enviroment@Health.-2019.-N4.-P70-79. URL: https://cyberleninka.ru/article/n/mehanizmy-rezistentnosti-bakteriy-i-virusov-k-dezinfektantam-i-antiseptikam (дата обращения: 31.10.2020).
- Кузьмин, В.А. Бактерицидное и фунгицидное действие in vitro электрохимически активированных растворов / В.А.Кузьмин, Л.С.Фогель, А.А. Сухинин, С.А. Макавчик, Л.И., Смирнова Д.А. Орехов, А.В. Цыганов // Вопросы нормативно-правового регулирования в ветеринарии.-2020.-№4.-С.36-40.DOI: 10.17238/issn2072-6023.2020.4.36
- Куликовский, А. В. Структурные и функциональные основы механизма действия дезинфицирующих средств на бактерии и споры: автореф. дис. … д-ра вет. наук / А. В. Куликовский.- М., 1979. — 50с.
- Прокопенко, А.А. Направленные аэрозоли электроактивированных растворов для дезинфекции птицеводческих помещений при колибактериозе и аспергиллезе птиц / А.А. Прокопенко, А.А. Закомырдин, Ю.И. Боченин, Н.Э. Вайнер, Д.В. Грузнов // Ветеринария. — 2015. — № 3. — С. 40-44.
- Томилов, А.П. Электрохимическая активация — новое направление прикладной электрохимии / А.П.Томилов// Жизнь и безопасность.- 2002.-№3.-C. 302 – 307.
- Хямяляйнен, М. М. Применение электрохимически активированных растворов в водопроводно-канализационном хозяйстве для обеззараживания воды : дис. … канд. биол. наук / М. М. Хямяляйнен. — СПб., 2005. — 172 с.
- Шандала, М.Г. Методологические проблемы современной дезинфектологии. / М. Г. Шандала // Актуальные проблемы дезинфектологии в профилактике инфекционных и паразитарных заболеваний: матер. Всерос. науч. конф., посвящ. 100–летию со дня рождения В. И. Вашкова. – М. : ИТАР–ТАСС, 2002. – С. 9–16.
- Becker, G. A call to action Infection control and sterilization technology. According to the guidelines of the Infectious Diseases / G. Becker // Society of America control, disinfection, sterilization. — 1995. — № 6. — P. 37-42.
- Nisola, G. M. Disinfection performances of stored acidic and neutral electrolyzed waters generated from brine solution / G. M. Nisola, X. Yang, E. Cho, M. Han, C. Lee, W. J. Chung // J. Environ. Sci Health A Tox Hazard Subst. Environ Eng. .–2011. — № 46(3).– P. 263–270.
- Rahman, S. M. Effectivenes of low concentration electrolyzed water to inactivate foodbozne pathogenes under different environmental conditions / S. M. Rahman, T. Ding, D. H. Oh // Jnt. J Food Microbiol. — 2010. — V. 139 (3), № 15. — P. 147-153.
- Russel A. D. Microbial susceptibility and resistance to biocides / A. D. Russel, J. R. Furr, J. J. Maillard // ASM News. — 1997. — №63. — P. 481-487.
Общее заключение
В настоящее время решение задач, стоящих перед животноводством и ветеринарной наукой, сдерживается из-за недостаточной обеспеченности производства экологически чистыми, эффективными и недорогими отечественными дезинфицирующими препаратами. В этой связи актуальными задачами перед дезинфектологией являются:
— изыскание и испытание новых композиционных ДС, удовлетворяющих потребностям ветеринарной дезинфекции, с учетом возросших требований по охране природной среды от загрязнения;
— разработка режимов дезинфекции и технологии применения современных ДС на объектах государственного ветеринарного надзора.
Нами научно обоснованы режимы применения следующих современных импортозамещающих дезинфицирующих препаратов при проведении противоэпизоотических мероприятий:
- «Аргенталин» на основе коллоидных частиц серебра в наноформе,
- фумигационные аэрозоли препарата «Фумийод» в форме термовозгонных бактерицидных шашек,
- «Кемисепт» — поликомпонентное ДС на основе ЧАС и полигуанидинов,
- электрохимически активированные рвстворы «АКВАЭХА».
Данные ДС обеспечивают антимикробное действие на широкий диапазон микроорганизмов и пролонгированный эффект; относятся к 4 классу малоопасных веществ («Фумийод» относится к 3 классу умеренно опасных веществ); кумулятивные свойства не выражены; наряду с дезинфицирующими обладают моющими свойствами (кроме «Фумийода»); ЭХАР «АКВАЭХА» — дёшевые, не являются ксенобиотиками, безвредны для окружающей среды благодаря самопроизвольному разрушению до обычной H2O без образования токсичных соединений, не требуют нейтрализации перед сливом в канализацию.
Определена возможность применения данных биоцидных средств для профилактической и вынужденной дезинфекции на объектах ветеринарного надзора. В производственных условиях показана возможность применения ингаляционных аэрозолей препарата «Фумийод» в форме термовозгонных бактерицидных шашек для свиней при респираторных болезнях (ринит, бронхопневмония).
По результатам проведенных исследований опубликовано 5 (пять) научных статей в профильных журналах категории РИНЦ и одна научная статья Scopus – Nanomaterials.-2021,11,332.-20p.//doi.org/10.3390/nano 11020332 www.mdpi.com/journal/nanomaterials
Полученные результаты НИР могут быть использованы при проведении лекционных и практических занятий со студентами и слушателями курсов повышения квалификации по дисциплинам «Ветеринарная микробиология и микология» — ФВМ, «Микробиология» — ФВСЭ, ФБЭК, «Эпизоотология и инфекционные болезни» — ФВМ, «Основы эпизоотологии» — ФВБРиА, «Инфекционные болезни» — ФВСЭ.
ПРИЛОЖЕНИЯ
