Титульный лист и исполнители
РЕФЕРАТ
Отчет представлен на 137 стр., содержит 93 фото, 6 табл., приложения А и Б
Настоящая работа проведена в рамках выполнения научно-исследовательских работ федеральным государственным бюджетным образовательным учреждением высшего образования «Санкт-Петербургский государственный университет ветеринарной медицины» по заказу Минсельхоза России за счет средств федерального бюджета в 2020 году. Исследования проведены на базе диагностического центра по птицеводству при кафедре эпизоотологии им. В.П. Урбана ФГБОУ ВО СПГУВМ.
Цель НИР: выделение возбудителей инфекционных болезней птиц, циркулирующих в птицеводческих хозяйствах Российской Федерации, изучение в сравнительном аспекте культуральных, морфологических, вирулентных свойств и устойчивости к факторам внешней среды и дезинфекционным средствам «полевых» изолятов возбудителей и культур возбудителей из музейных коллекций. Изыскание новых эффективных средств и методов дезинфекции с учетом разных групп и серовариантов, выделенных возбудителей.
В результате выполнения НИР проведен анализ информационных источников по вопросам инфекционной патологии птиц в птицеводческих хозяйствах Российской Федерации. Дано научно — теоретическое обоснование важности дезинфекционных мероприятий для обеспечения биобезопасности птицехозяйств. Особое внимание уделено зооантропонозам – заразным болезням, представляющим опасность для животных, птиц и человека. Систематизирован и представлен материал по существующим в настоящее время и используемым дезинфицирующим средствам. Представлены рекомендации по организации и проведению дезинфекционных мероприятий в целях обеспечения биологической безопасности птицеводческих предприятий и санитарно-эпидемиологической безопасности производимой продукции птицеводства.
Проведено эпизоотологическое обследование трех птицеводческих хозяйств разного производственного направления с целью изучения эпизоотической ситуации: племенного индейководческого хозяйства — селекционный генетический центр «Северокавказская зональная опытная станция по птицеводству» (Ставропольский край); фермерского птицеводческого хозяйства по содержанию цыплят-бройлеров (Ленинградская область); фермерского птицехозяйства по содержанию перепелов (Воронежская область). В обследованных птицехозяйствах обнаружены и выделены патогенные и условно-патогенные микроорганизмы 8 видов (Bacillus, Enterococcus, Escherichia coli, Klebsiella, Staphylococcus spp, Proteus, Pseudomonas, Salmonella spp.). Проведена идентификация возбудителей с использованием ПЦР и методом серологической типизации. Изучены вирулентные свойства изолятов и музейных штаммов, их чувствительность к действию дезинфицирующих средств отечественного производства: «Теотропин Р+», «Доктор Лайф-Дез», «Мирмекон 652 В», «Экодезрико». Отработаны методы обработки куриных пищевых и куриных инкубационных яиц с использованием названных дезинфицирующих средств. Установлена высокая степень обеззараживания поверхности скорлупы яиц с использованием испытанных препаратов. На основании полученных результатов НИР установлено, что изученные дезинфицирующие средства могут быть рекомендованы для испытания и широкого применения в производственных условиях для обеспечения эпизоотического благополучия птицеводческих предприятий различного технологического направления.
По результатам проведенной НИР разработаны «Методические рекомендации по дезинфекции объектов ветеринарного надзора в птицеводческом предприятии»
По теме НИР за отчетный период подготовлено и опубликовано в профильных научных журналах категории РИНЦ 3 научные статьи, в том числе:
Джавадов Э.Д., Хохлачев О.Ф., Новикова О.Б. Терлавин Н.В., Веретенников В.В. Изучение эффективности препарата Теотропин Р+ в отношении основных возбудителей бактериальных болезней птиц/ Международный вестник ветеринарии. 2020. №3. С. 76-83.
Джавадов Э.Д., Хохлачев О.Ф., Новикова О.Б. Дезинфекция – важный фактор обеспечения биобезопасности птицеводческих хозяйств/ Ж. «БИО». 2020. №10 (241). С. 20-25 (первая, начальная часть статьи).
Джавадов Э.Д. Хохлачев О.Ф., Новикова О.Б. Дезинфекция – важный фактор обеспечения биобезопасности птицеводческих хозяйств/. Ж. «БИО». 2020. №11 (242). С. 6-11. (вторая, заключительная часть статьи).
Новикова О.Б., Хохлачев О.Ф., Джавадов Э.Д., Терлавин Н.В., Веретенников В.В. Эффективность дезинфицирующих средств для обеззараживания куриных инкубационных яиц/Международный вестник ветеринарии. 2021. №1. С.
СПИСОК СОКРАЩЕНИЙ
ДВ – действующее вещество
АДВ – активно действующие вещества
ЧАС – четвертичные аммониевые соединения
ПАВ – поверхностно активные вещества
ТИДЭТА – тетраметилендиэтилентетрамин
МПА – мясопептонный агар
МПБ – мясопептонный бульон
МППБ – мясопептонный печеночный бульон
XLD-агар – ксилозо-лизино дезоксихолатный агар
МБК – минимальная бактерицидная концентрация
МПК – минимальная подавляющая концентрация
КОЕ – колоние образующая единица
РЭК – развивающиеся эмбрионы кур
ХАЖ – хорио-аллантоисная жидкость
СГЦ СКЗОСП – селекционно-генетический центр «Северо-Кавказская зональная опытная станция по птицеводству
НИЦФ – научно-исследовательский центр фармакотерапии
НИИЭМ им. Пастера – научно-исследовательский институт эпидемиологии и микробиологии им. Пастера.
ПЦР – полимеразная цепная реакция
ОТ-ПЦР – полимеразная цепная реакция в реальном времени
ВВЕДЕНИЕ
В последние годы все большее внимание уделяется обеспечению должного эпизоотического состояния птицеводческих хозяйств как неотъемлемой части передовых технологий в производстве конкурентоспособных экологически чистых продуктов питания. Достигается стабильное эпизоотическое благополучие птицехозяйств за счет внедрения передовых технологий содержания и кормления птицы и за счет использования экологически безопасных средств специфической и неспецифической защиты птицепоголовья от инфекционных болезней. Система специфической профилактики основана на применении вакцинных препаратов. В системе неспецифической профилактики и борьбы с инфекционными заболеваниями ведущая роль принадлежит проведению ветеринарно-санитарных мероприятий, особенно дезинфекционных, которая направлена на уничтожение возбудителей заразных болезней во внешней среде.
Проведение эпизоотологического обследования птицеводческих хозяйств, выделение циркулирующих возбудителей и изучение их иммунобиологических свойств помогают разрабатывать программы борьбы и профилактики инфекционных болезней. Важным условием при этом является определение чувствительности выделенных возбудителей к антибактериальным препаратам, в том числе дезинфицирующим средствам. Полученные знания способствуют повышению эффективности программ биозащиты птицехозяйст от инфекционных болезней, основанных на ротации антибактериальных средств в долгосрочной схеме их применения.
1. ОСНОВНАЯ ЧАСТЬ
1.1. Проведение аналитического обзора информационных источников в рамках темы НИР.
1.1.1 Обоснование выбора направления исследований
Современное промышленное птицеводство – наиболее наукоемкая и динамично развивающаяся отрасль агропромышленного комплекса России, играющая важную роль в обеспечении продовольственной безопасности страны. Мясо птицы и яйцо являются одним из важнейших сегментов полноценных рационов в питании россиян, доступным источником незаменимых нутриентов: полноценного белка, основных минеральных элементов и ряда витаминов (А, РР, группы В), полиненасыщенных жирных кислот. Мясо птицы и яйцо сравнительно не дорогие продукты, доступные и пригодные для всех категорий населения. Дополнительным фактором популярности и востребовательности продукции птицеводства является отсутствие религиозных ограничений на ее потребление. Достигнутый в последние годы прогресс в обеспечении сохранности и продуктивности птицепоголовья во многом обусловлен передовыми технологиями кормления, содержания птицы и успехами ветеринарной науки в контроле над возбудителями инфекционных болезней птиц. Вместе с тем, интенсификация отрасли, в свою очередь, приводит к появлению серьезных биологических рисков, обусловленных глобальным распространением антибиотикоустойчивости и мутации генов у секундарной микрофлоры, развитием у птицы иммунодефицитных состояний под действием антибиотиков и ветеринарных биопрепаратов, приводящих к транслокации микробов из желудочно-кишечного тракта во внутренние органы и бактерионосительству у клинически здоровой птицы, использованием хлорсодержащих биоцидов при переработке тушек, изменением профиля микробных контаминантов в сторону повышения патогенности. Исследованиями установлено, что в воздухе птичников и других производственных помещений птицефабрик может находиться более 30 видов различных, в том числе патогенных, возбудителей заразных болезней. Среди них: Bacillus, Brucella, Corinebactor, Enterobacter, Haemophilus, Leptospira, Mycoplasma, Pasteurella, Pseudomonas, Salmonella, Staphylococcus, Streptococcus, Vibrio, Aspergillus, Penicillium (11,12,16). Из данных литературы известно, что в птицехозяйствах с поголовьем до 700 тыс. кур-несушек и цыплят разного возраста в течение одного часа через вытяжную систему вентиляции в атмосферу попадает около 170 млрд. различных микроорганизмов, в основном бактериальной и грибковой этиологии (2,11,12, 19).
Значительную эпизоотическую опасность вызывает появление и широкое распространение в птицехозяйствах и на прилегающей территории ранее не регистрируемых в нашей стране инфекционных болезней птиц, выявление новых антигенных вариантов и форм уже известных возбудителей бактериальных и вирусных инфекций, возникающих вследствие их мутации и генетической трансформации в сторону повышения вирулентности и устойчивости к факторам внешней среды, действию антибактериальных препаратов (4,5,6,17).
Немалая часть инфекций, регистрируемых в настоящее время на птицеводческих предприятиях, относится к зооантропонозам – болезням, которые являются общими для животных, птиц и человека. Зооантропонозы представляют серьезную угрозу для птицепоголовья, для работников птицефабрик и для населения — потребителей птицеводческой продукции. Возбудителями зооантропонозов, передающихся человеку от птиц и инфицированных продуктов птицеводства, могут быть патогенные и условно-патогенные бактерии, вирусы, плесневые грибы и простейшие микроорганизмы (5,6,10,16).
К зооантропонозам бактериальной этиологии в птицеводстве относятся: сальмонеллез (возбудитель – Salmonella Enteritidis, Salmonella typhimurium); кампилобактериоз (возбудитель —Campylobacter jejuni); клостридиоз (возбудитель — Clostridium perfringens); колибактериоз (возбудитель – Escherichia coli – O157:Н7); листериоз (возбудитель – Listeria monocytogenes); псевдомонноз (возбудитель Pseudomonas aeruginosa); стафилококкоз (возбудитель – Staphylococcus aureus); иерсиниоз (Yersinia enterocolitica), орнитоз (возбудитель Сhlamydia psittaci); туберкулез (возбудитель – Mycobacterium avium).
К зооантропонозам вирусной этиологии, представляющим наибольшую эпизоотическую и эпидемическую опасность, относятся высокопатогенный грипп птиц (А/Н5N1), вирус гепатита Е (HEV), ротавирусы, коронавирусная инфекция. В эту группу возбудителей — зооантропонозов относят, также, прионы, являющиеся субвирусной инфекцией.
Из числа плесневых грибов наиболее эпизоотически и эпидемически опасными являются грибы рода Aspergillus. К простейшим паразитам, служащим причиной зооантропонозов, относится возбудитель криптоспоридиоза – Cryptosporidium baileyi. (5,6).
По прогнозу ВОЗ в ХХI веке прирост инфекций, в том числе зооантропонозов, вызванных новыми возбудителями, повсеместно будет обусловлен за счет пищевого пути передачи.
Из числа пищевых зооантропонозов с установленным бактериальным фактором патогенности наибольшую эпидемическую опасность представляет сальмонеллез. Наиболее часто возбудитель сальмонеллеза может быть обнаружен на поверхности куриных пищевых яиц, особенно в случаях нарушения режима хранения яиц на предприятиях торговли. Определенную опасность для птицехозяйств представляет инкубационное яйцо, завезенное из сторонних источников, возможно, неблагополучных по сальмонеллезу и другим инфекционным болезням птиц, и в случаях несоблюдения в полной мере правил дезинфекции яйца перед закладкой на инкубацию.
В общем комплексе мероприятий по обеспечению устойчивого эпизоотического благополучия птицеводческих предприятий важное место занимает диагностический мониторинг, позволяющий своевременно выявлять в хозяйстве возбудителей заразных болезней птиц вне зависимости от этиологии и формы течения инфекции (острая, подострая, латентная, хроническая, ассоциированная). Еще одним основополагающим фактором обеспечения биобезопасности птицефабрик является разработка и реализация в хозяйстве программы профилактики заразных болезней птиц и борьбы с данными заболеваниями с использованием вакцинных и антибактериальных препаратов.
Результаты научных исследований и практической деятельности показывают, что широкое применение антибактериальных средств в случаях, когда отсутствуют данные лабораторного анализа по определению чувствительности к препаратам циркулирующих в хозяйстве возбудителей, и/или допускаются нарушения в выборе оптимальной дозировки, кратности и длительности применения препарата, не только не являются эффективными, но и часто приводят к осложнению эпизоотической ситуации и увеличению экономического ущерба (1,5,6,14,16). Положительный терапевтический эффект в лечении и борьбе с бактериальными болезнями птиц может быть получен в результате применения антибактериальных препаратов из разных групп химических соединений, в частности, антибиотиков, сульфаниламидов и нитрофуранов. Однако при этом очень важно учитывать имеющиеся ограничения или даже запреты на применение отдельных антибактериальных препаратов (хлорамфеникол, фуразолидон, метранидозол, диметринидазол, ронидазол, дапсон) в животноводстве и птицеводстве, особенно из группы антибиотиков, поскольку они представляют опасность и могут наносить вред здоровью человека, в том числе детям (13,15). Устойчивость многих бактерий к антибиотикам порождает для промышленного птицеводства две основные проблемы. Первая проблема состоит в ограниченном применении и даже запрете применения антибиотиков в технологии содержания птицы для лечения и профилактики бактериальных инфекций. Вторая проблема заключается в том, что в настоящее время и безопасность продукции птицеводства необходимо рассматривать в контексте наличия генетических детерминант антибиотикоустойчивости в составе пищевых продуктов (1).
С учетом сложившейся реальности значительно возрастает роль дезинфекции в обеспечении ветеринарного благополучия птицеводческих хозяйств и микробиологической безопасности производимой продукции птицеводства (5,6,10,14). Задача дезинфекции состоит в предупреждении или ликвидации размножения и распространения возбудителей заразных болезней путем их уничтожения на всей территории птицехозяйства, на различных технологических объектах и предметах. Применяемые методы дезинфекции подразделяют на 5 основных групп: механические, физические, химические, биологические и комбинированные (6). В ветеринарной практике наиболее широкое применение получили химические методы дезинфекции, основанные на применении химических дезинфицирующих средств из разных групп. Эти препараты в зависимости от входящих активно действующих веществ (АДВ) и введенных в состав технологических добавок варьируют от простых до многокомпонентных комбинированных соединений, представленных органическими кислотами, альдегидами, гуанидинами, пероксидами, фенолами, йодофорами и другими АДВ в сочетании с поверхностно-активными веществами, в том числе на основе четвертично-аммониевых соединений (ЧАС) и амфотерных ПАВ.
В настоящее время разработано и используется большое количество, более 600 наименований, дезинфицирующих препаратов отечественного и зарубежного производства, которые получили применение в ветеринарной практике для обеззараживания объектов ветеринарного надзора (3,5,6,7,8,9). Однако, практика показывает, что используемые дезинфицирующие средства и/или методы их применения обладают различной эффективностью, и часто не обеспечивают надежного обеззараживания обрабатываемых объектов и не лишены других недостатков. Так, SWOT-анализ дезинфицирующих средств из группы ЧАС указывает, с одной стороны, на высокий бактерицидный эффект обработки, но в тоже время на слабое обеззараживающее действие в отношении патогенных грибов и вирусов. В отличие от дезпрепаратов из группы ЧАС, альдегиды не уничтожают биопленку, но высоко эффективны в отношении бактерий, вирусов и грибов. Йодофоры эффективны в отношении возбудителей, защищенных биопленкой, и обладают высоко положительным бактерицидным действием, но слабо действуют на грибы и вирусы. Пероксиды обладают бактерицидным и вирулицидным действием, но слабо действуют на патогенные грибы и биопленку. Фенолы высоко эффективны в отношении грибов и бактерий, отлично разрушают биопленку, но избирательно действуют на различные вирусы. Отдельные дезинфицирующие средства, содержащие глутаровый альдегид, хлор, фенол, формальдегид, обладают высокой токсичностью и их применение строго ограничено или запрещено из-за высокой токсичности для птицепоголовья, персонала хозяйств и окружающей среды (8).
При организации дезинфекционных мероприятий на птицефабрике следует учитывать, что при применении в хозяйстве одних и тех же дезинфектантов в течение длительного времени формируется привыкание и устойчивость циркулирующих «полевых» культур и штаммов возбудителей к препаратам. Это снижает качество и результативность всей работы и может стать следствием обострения эпизоотической ситуации. Существенная помощь в выборе необходимого дезинфицирующего средства может быть оказана по результатам лабораторной оценки чувствительности выделенных в хозяйстве культур и штаммов микроорганизмов к дезинфектантам основных групп. Полученные данные позволят разработать эффективную программу ротации дезинфицирующих средств и схемы их применения (5,6,14).
1.1.2 Заключение
Проблема поиска и внедрения в ветеринарную практику птицеводческих хозяйств новых дезинфицирующих средств, эффективных для обеззараживания широкого спектра патогенных и условно-патогенных возбудителей, но при этом безопасных для окружающей среды, имеет важное эпизоотологическое, эпидемическое, экологическое и экономическое значение. К числу таких препаратов можно отнести новые, не имеющие до настоящего времени широкого применения в ветеринарной практике, дезинфицирующие средства отечественного производства: «Доктор Лайф-Дез» (производитель ООО «БиоХимТекс», г. Шебекино, Белгородской обл.), «Мирмекон 652 В» (производитель ООО «НЕОХИМ», Санкт-Петербург), «Теотропин Р+» (производитель ООО «ПластПром», г. Владимир), «Экодезрико» (производитель ООО «РикоЭколог», г. Москва).
1.1.3 Список литературы
1. Афонюшкин В.Н. К вопросу о профилактике антибиотикоустойчивости микроорганизмов на птицефабриках // БИО. 2020. № 10 (241). С 6-8.
2. Власов М.В., Возмилов А.Г. Очистка вытяжного воздуха в агропромышленном птицеводстве// Вестник ЧГАА. 2010. №56. С.29-32.
3. Давыдов А.Д., Алексеев А.Д. Дезинфекция и современные дезинфицирующие средства в ветеринарии // Молодежь и наука. 2017. № 3. 13 с.
4. Джавадов Э.Д. Инфекционная патология в промышленном птицеводстве: реалии и перспективы // Ветеринария и кормление. 2016. № 2. С. 24-27
5. Джавадов Э.Д., Хохлачев О.Ф., Новикова О.Б. Дезинфекция – важный фактор обеспечения биобезопасности птицеводческих хозяйств// БИО. 2020. №10 (241). С.20-25.
6. Джавадов Э.Д., Хохлачев О.Ф., Новикова О.Б. Дезинфекция – важный фактор обеспечения биобезопасности птицеводческих хозяйств// БИО. 2020. №11 (242). С. 6-11.
7. Дорожкин В.И., Прокопенко А.А, Морозов В.Ю., Дронфорт М.И. Препараты для дезинфекции объектов ветеринарного надзора// Эффективное животноводство. – 2018. — №3 (142). С. 34-36.
8. Климов А.А. Ключевые подходы к разработке эффективной программы дезинфекции// Х Балтийский форум ветеринарной медицины и продовольственной безопасности: тезисы докладов. Санкт-Петербург, 2014. С. 162-163).
9. Классификация дезсредств по группам ДВ. // Дезреестр. URL: http: // www. desreestr.ru/ grupdv.html (дата обращения: 07.09.2020).
10. Козак С.С. Научное обоснование обеспечения микробиологической безопасности продукции птицеводства: дисс. д-ра биол. Наук. Москва, 2013. 360 с.
11. Крайнов Я.В., Федерякина Д.В., Паршина П.А. Санитарно-микробиологический мониторинг воздуха птичника// Ветеринарно-санитарные аспекты качества и безопасности сельскохозяйственной продукции: сборник трудов конференции. Воронеж, 2015. С. 44-46;
12. Морозов В.Ю., Ситник Д.А., Агарков А.В. /Источники контаминации воздуха закрытых помещений и видовой состав микрофлоры // Вестник АПК Ставрополья. 2016. № 1 (21). С. 73-76.).
13. Наркевич И.А., Немятых О.Д., Кулдыркаева З.А. и др. Система фармаконадзора: международный опыт и перспективы в России// Фармация. 2016. № 7. Т. 65. С. 3-7.
14. Промышленное птицеводство. Монография. Под общей редакцией академика РАН Фисинина В.И. /Профилактика заболеваний в птицеводстве// Джавадов Э.Д., Хохлачев О.Ф. и др. – Москва. – ООО «Лика». – 2016. – С. 445-454).
15. Сиукаева Д.Д., Немятых О.Д., Наркевич И.А., Павленко Н.И. Комплексная маркетинговая оценка рынка лекарственных средств для лечения пневмонии у детей // Разработка и регистрация лекарственных средств. 2017. №4 (21). С. 292-296.
16. Фисинин В.И., Трухачев В.И., Салеева И.П. и др. Микробиологические риски в промышленном птицеводстве и животноводстве. // Сельскохозяйственная биология. 2018. Т.53, № 6. С. 1120 – 1130;
17. Хохлачев О.Ф. Диагностический мониторинг – важное звено в системе биобезопасности птицехозяйств // Х Балтийский форум ветеринарной медицины и продовольственной безопасности: тезисы докладов. Санкт-Петербург, 2014. С. 180-181.
18. Long E., Plewa K. Microbiological air contamination in poultry houses // Pol. J. Environ. Stud. 2010. Vol/ 19, №1. P. 15-19
19. Vucemilo M., Matkovic K., Vinkovic B et al. The effect of animal of age on air pollutant concentration in broiler house//Czech J. Anim. Sci. 2007. Vol. 52, № 6. Р. 170-174.
1.2 Проведение эпизоотологического обследования птицеводческих хозяйств. Взятие образцов патологического материала для диагностического исследования
Эпизоотологическое обследование было проведено в трёх птицеводческих хозяйствах разных форм собственности и различного технологического направления: племенное индейководческое хозяйство (селекционный генетический центр «СКЗОСП»); фермерское птицеводческое хозяйство по выращиванию перепелов; фермерское птицеводческое хозяйство по производству мяса бройлеров. Территориально хозяйства расположены в различных регионах Российской Федерации (СЗФО, ЦФО, СКФО).
1.2.1 Обоснование выбора направления исследований
Современные интенсивные технологии, используемые в промышленном птицеводстве, экономически эффективны и позволяют в короткие сроки решить проблему снабжения населения продуктами птицеводства. В большинстве случаев это достигается благодаря высокой плотности размещения птицы на ограниченных площадях. Вместе с тем, как следствие, происходит интенсивное загрязнение воздуха в производственных корпусах и на территории птицеводческих предприятий, повышается инфекционное «давление» на птицу, ухудшается эпизоотическое состояние хозяйств.
Как уже было отмечено, исследованиями установлено, что в воздухе птичников и других производственных помещений птицефабрик может находиться более 30 видов различных, в том числе патогенных, возбудителей заразных болезней. Среди них: Bacillus, Brucella, Corinebactor, Enterobacter, Haemophilus, Leptospira, Mycoplasma, Pasteurella, Pseudomonas, Salmonella, Staphylococcus, Streptococcus, Vibrio, Aspergillus, Penicillium. В птицехозяйствах с поголовьем от 700 тыс. птицы в воздухе циркулирует около 170 млрд. различных микроорганизмов, в основном бактериальной и грибковой этиологии. Среди них — ранее не регистрируемые в нашей стране возбудители инфекционных болезней птиц новых антигенных вариантов и форм бактериальных инфекций, возникающих вследствие их мутации и генетической трансформации в сторону повышения вирулентности и устойчивости к факторам внешней среды, действию антибактериальных препаратов. Значительная часть инфекций, регистрируемых в настоящее время на птицеводческих предприятиях, относится к зооантропонозам – болезням, представляющим опасность для животных, птиц и человека.
Поэтому, являются важными и актуальными научные исследования, направленные на проведение углубленного эпизоотологического обследования птицеводческих хозяйств, работающих с птицей разных видов, и в разной степени подверженных действию возбудителей инфекционных болезней. Важной частью НИР является выделение возбудителей инфекционных болезней птиц, циркулирующих в птицеводческих хозяйства разных форм собственности, изучение в сравнительном аспекте культуральных, морфологических, вирулентных свойств и устойчивости к факторам внешней среды и дезинфекционным средствам «полевых» изолятов возбудителей и культур возбудителей из музейных коллекций. Изыскание новых эффективных средств и методов дезинфекции с учетом разных групп и серовариантов выделенных возбудителей.
1.2.2. Материалы и методы исследования
Бактериологические исследования проводили на основе общепринятых в ветеринарной практике микробиологических методов лабораторного анализа с использование искусственных питательных сред.
Вся работа в лабораторных и экспериментальных условиях была проведена строго в соответствии с Санитарными правилами СП 1.2.731-99 «Безопасность работы с микроорганизмами III-IV групп патогенности и гельминтами» (утверждены постановлением Главного государственного санитарного врача РФ от 22 февраля 1999 г. № 4).
Выделение, родовую и видовую идентификацию культур микроорганизмов проводили, руководствуясь следующими документами и справочными изданиями:
МУ 04723/3 Методические указания по микробиологической диагностике заболеваний, вызываемых энтеробактериями, 1984 г.
ГОСТ 26503-85. Животные сельскохозяйственные. Методы лабораторной диагностики клостридиозов. Госстандарт СССР. N 945 29.03.85 г.
Методические указания по применению унифицированных микробиологических (бактериологических) методов исследования в клинико-диагностических лабораториях. Приложение № 1 к приказу Министерства здравоохранения СССР от 22 апреля 1985 г. № 535
Методические указания по лабораторной диагностике инфекционной энтеротоксемии животных и анаэробной дизентерии ягнят. Справочник. Лабораторные исследования в ветеринарии. Бактериальные инфекции. По ред. Антонова Б.И. – М.: Агропромиздат, 1986 г.
Методические указания по лабораторной диагностике стафилококкоза животных. ГУВ Госагропрома СССР. N 432-3 29.07.87 г.
Методические указания по лабораторным исследованиям на псевдомоноз животных и птиц. ГУВ Госагропром СССР. N 432-3 14.11.88 г.
Лабораторная диагностика сальмонеллёзов человека и животных, обнаружение сальмонелл в кормах, продуктах питания и объектах внешней среды. ГУВ МСХ и МЗ СССР. 1990 г.
О дополнении в методические указания по лабораторной диагностике сальмонеллёзов в кормах, продуктах питания и объектах внешней среды. Департамент ветеринарии МСХ РФ. N 13-5-2/0914 02.02.04 г.
Методические указания по лабораторной диагностике стрептококкоза животных. ГУВ СМ СССР по продовольствию и закупкам. 25.09.90 г.
Методические указания по лабораторной диагностике пастереллёзов животных и птиц. ГУВ МСХ СССР. N 22-7/82 20.08.92 г.
Определитель зоопатогенных микроорганизмов, Сидоров М.А., Скородумов Д.И., Федотов В.Б. М.: Колос, 1995 г.
Определитель бактерий Берджи. Т. 1-2. М., 1997 г.
Методические указания по бактериологической диагностике колибактериоза (эшерихиоза) животных. Департамент ветеринарии МСХ и П РФ. N 13-7-2/2117 27.07.00 г.
Методические указания МУ 4.2.2723-10 Лабораторная диагностика сальмонеллёзов, обнаружение сальмонелл в пищевых продуктах и объектах окружающей среды. — М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2011. — 111 с.
Шепелин А.П., Дятлов И.А. Питательные среды для энтеробактерий // Оболенск. – 2017. – 230 с.
Меджидов М.М. Справочник по микробиологическим питательным средам // Москва «Медицина». – 2003. – 206 с.
В работе было проведено бактериологическое исследование трупов, павших и вынужденно убитых (с диагностической целью) цыплят-бройлеров, индеек и перепелов разного возраста, эмбрионов различного срока инкубации, отходов инкубации (тумаки, замершие, задохлики), помёта (в т.ч. от клинически здоровых птиц).
При бактериологическом исследовании птицы высевы делали из крови сердца, лёгких, печени, желчного пузыря, селезёнки, яичных фолликулов, тонкого (двенадцатиперстная, тощая) и толстого отделов кишечника (слепые отростки), спермы.
Посевы из внутренних органов производили стерильными стеклянными пастеровскими пипетками, либо стерильными анатомическими инструментами (ножницы, пинцеты), отрезая небольшие кусочки органов. Пробы помёта (массой ~ 0,5 г) отбирали стерильными стеклянными палочками (или пинцетом) в пробирки с транспортными средами. В работе по отбору материала пользовались «Рекомендациями по отбору, хранению и транспортировке патологического материала, взятого от птиц и предназначенного для диагностических исследований» (Сухинин А.А., Белкина И.В., Мурый В.А., Овчарова Е.С., Радчук П.Л., С-Пб, изд. СПбГАВМ, 2007 г., 12 с.).
Первичные пробы исследуемого материала засевали в стерильные стеклянные пробирки с простыми питательными средами – мясопептонным бульоном (МПБ), мясопептонным агаром (МПА), мясопептонный печеночный бульон (МППБ), либо с транспортной средой (при необходимости длительной транспортировки материала, более 6 ч) – тиогликолевой средой (среда для контроля стерильности); либо в системы транспортные со средой Кэри-Блейра, Стюарта или Эймса (с активированным углём). При необходимости исследования на сальмонеллёз первичные посевы также делали на среды накопления (обогащения) сальмонелл – селенитовый бульон или магниевую среду.
В работе были использованы питательные среды производства НИЦФ (Научно-исследовательский центр фармакотерапии, СПб), компаний «Биовитрум» и «Средофф» (Санкт-Петербург), НПО «Питательные среды» (Махачкала), ФБУН ГНЦ ПМБ (Оболенск, Московская область), НПЦ «Биокомпас-С» (Углич, Ярославская область), ООО «Биотехновация» (Московская обл., г. Электрогорск), Merk (Германия), Himedia (Индия), Oxoid (Великобритания). МПБ и МПА готовили из свежего говяжьего или куриного мяса. МППБ под вазелиновым маслом (среда Китта-Тароцци) готовили из свежего говяжьего мяса и свежей говяжьей печени. Короткий цветной ряд (глюкоза, лактоза, маннит, сахароза) — из НИЦФ.
Для взвешивания навесок питательных сред, кормов использовали весы лабораторные ВК2790.001 (ЗАО «Масса-К). Для определения рН сред использовали рН-метр-милливольтметр рН-410 (ООО «НПО Аквидон», г. Подольск, Московская обл., Россия).
Первичные посевы инкубировали в термостате при t (37,0±0,5)°С в течение 24-48 часов. В работе использовали термостат суховоздушный лабораторный ТСвЛ-160 (производство АО «ГРПЗ» — филиал Касимовский приборный завод»).
Все работы с микроорганизмами проводили в стерильных условиях, используя боксы микробиологической безопасности БМБ-II-«Ламинар-С»-1, 2 (221.120) класс II (тип А2) (LamSystems, Миасс, Челябинская область).
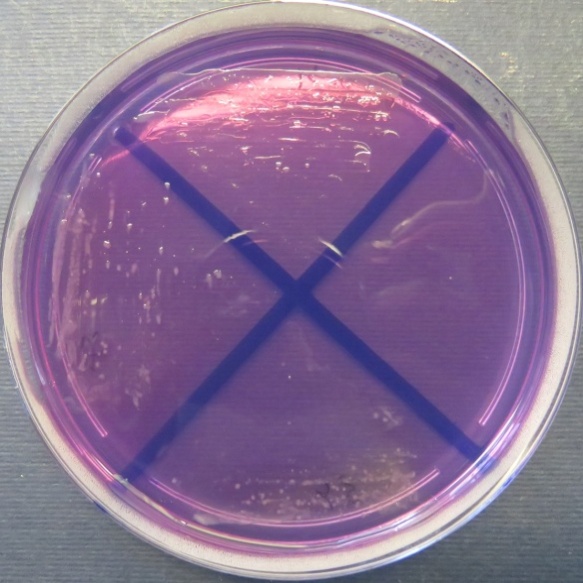
Через сутки инкубирования в термостате с первичных посевов делали пересевы на МПА в пробирках (скошенный) или чашках Петри; на чашки Петри с элективными и дифференциально-диагностическими питательными средами для выделения кишечной микрофлоры (энтеробактерий) использовали среду Эндо, ксилоза-лизин-дезоксихолатный агар (XLD-агар), на среду для выделения стафилококков — стафилококковый агар; на среду для выделения энтерококков – полимиксиновую среду. Для выявления гемолиза проводили посевы на колумбийский кровяной агар с бараньей кровью. Для выделения анаэробной микрофлоры (клостридий) использовали тиогликолевую среду и среду Вильсона-Блэра.
Посев материала на жидкие питательные среды производили стерильными одноразовыми стеклянными пастеровскими пипетками или мерными пипетками. Посевы на плотные питательные среды в чашках Петри делали бактериологической петлёй или вносили материал пастеровской пипеткой на поверхность среды, а затем равномерно растирали его стерильным стеклянным шпателем.
Засеянные пробирки и чашки помещали в термостат и инкубировали при температуре t (37,0±0,5)°С в течение 18-24 часов, стафилококковый агар и — в течение 24-48 часов, затем проводили учёт выросших колоний. У выделенных культур микроорганизмов разных видов изучали морфологические, культуральные, тинкториальные, биохимические, серологические, вирулентные свойства, определяли чувствительность к антибактериальным препаратам и к дезинфицирующим средствам.
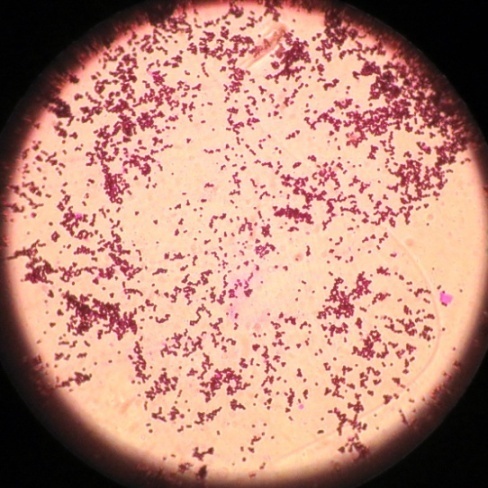
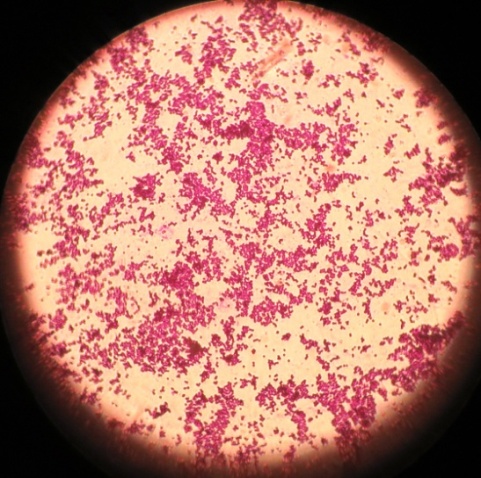
При изучении морфологии колоний производили микроскопию мазков, окрашенных по Граму. В работе использовали микроскоп медицинский МИКМЕД-6 с комплексом визуализации на базе цифровой фотокамеры.
Дальнейшую межродовую и видовую дифференциацию и идентификацию энтеробактерий проводили, используя схему идентификации основных видов энтеробактерий НИЦФ, а также согласно ранее модифицированной нами (Новикова О.Б., 2004) схеме путём изучения ферментативных и биохимических свойств культур микроорганизмов.
После просмотра культур отдельные колонии с дифференциально-диагностических сред пересевали на комбинированные среды — трёхсахарный агар Олькеницкого, среду Клиглера, среду Ресселя для определения ферментации сахаров, образования сероводорода и наличия уреазы. Ферментацию сахаров изучали также путём посева культур на короткий цветной ряд с поплавками или среды Гисса (глюкоза, лактоза, маннит, сахароза). Ассимиляцию цитрата Симмонса обнаруживали при помощи среды Симмонса. Наличие индола выявляли на МПБ с использованием эфира или ксилола и реактива Эрлиха. Изучение ферментативных свойств культур энтеробактерий также проводили с помощью тест-системы для биохимической идентификации энтеробактерий (СИБ, производство Нижний Новгород), ЭНТЕРО-тест-24 (Erba-Lachema, Чехия), тест-системы для ускоренной биохимической идентификации энтеробактерий «Рапид-энтеро 50 М» (НИИЭМ им. Пастера, СПб). Родовую и видовую принадлежность исследуемых культур устанавливали по показателям прилагаемых к наборам таблиц.
Видовую принадлежность культур сальмонелл устанавливали в реакции агглютинации на стекле с сыворотками диагностическими адсорбированными сальмонеллёзными поливалентной ABCDE и моновалентными групп О (соматические антигены) и Нmg (жгутиковые антигены). В работе использовали сыворотки ПЕТСАЛ производства Санкт-Петербургского научно-исследовательского института вакцин и сывороток (НИИВС) и ФКП Курской биофабрики – фирма «БИОК». В работе по идентификации сальмонелл дополнительно пользовались учебно-методическими пособиями «Особенности идентификации сальмонелл и их дифференциация от сходных по биологическим свойствам микроорганизмов» (Смирнова Л.И., Забровская А.В., Сухинин А.А., Санкт-Петербург, изд. СПбГАВМ, 2009 г., 20 с.) и «Особенности идентификации и определения чувствительности к антимикробным препаратам бактерий рода Salmonella» (авторы Забровская А.В., Смирнова Л.И., СПб, изд. СПбГАВМ., 2016 г., 22 с.).
Идентификацию кокков проводили, используя тесты на наличие каталазы с перекисью водорода (H2O2), плазмокоагулазы с плазмой кролика, лецитовиттелазы и др. Молекулярно-биологические исследования (ОТ-ПЦР) проводили с использованием комплекта реагентов «Рибо-сорб» и олиго нуклеотидных праймеров производства ООО «Бигль» (СПб). РНК из проб патматериала от каждой группы птиц выделяли методом афинной сорбции на силикагеле.
Для реакции секвенирования брали 50 нг ДНК, 5 pmol праймеров, набор «DYEnamic ET terminator kit». Определение нуклеотидной последовательности осуществляли по методу Сэнгера с использованием флуоресцентно меченых терминирующих нуклеотидов на секвенаторе АВI Prism3130 (Applied Biosystem, CШA) согласно инструкции изготовителя. Полученные нуклеотидные последовательности сравнивали с последовательностями штаммов опубликованными в международной базе данных NCBI (http://www.ncbi.nlm.nih.gov/) с помощью программы BioEdit, версия 7.0.5.3.
1.2.2.1 Определение чувствительности микроорганизмов к антибактериальным препаратам
В работе при определении чувствительности микроорганизмов к антибактериальным препаратам использовали следующие документы:
МУК 4.2.1890-04 Определение чувствительности микроорганизмов к антибактериальным препаратам. Методические указания. Утверждены и введены в действие Главным государственным санитарным врачом Российской Федерации — Первым заместителем Министра здравоохранения Российской Федерации Г.Г.Онищенко 4 марта 2004 г.
Клинические рекомендации Определение чувствительности микроорганизмов к антимикробным препаратам. Утверждены на расширенном совещании Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии. Москва, 22.05.2015 г.
Определение чувствительности выделенных микроорганизмов к антибактериальным препаратам проводили диско-диффузионным методом (методом дисков), основанным на диффузии антибиотика в питательную среду. Использовали диски с антибиотиками с известной концентрацией действующего вещества, изготовленные промышленным способом, производства НИЦФ, НИИЭМ им. Пастера. В качестве питательной среды для определения чувствительности использовали плотную среду Мюллера-Хинтона в чашках Петри. Инокулят для нанесения на поверхность питательной среды готовили из чистой культуры микроорганизма, предварительно выращенного на МПА. Затем чистые колонии суспендировали в физрастворе, устанавливая концентрацию по стандарту мутности 0,5 по Мак-Фарланду, что соответствует 1,5х108 КОЕ/мл. Далее инокулят вносили в чашки Петри стерильным ватным зонд-тампоном, формируя равномерный газон по всей поверхности питательной среды. Затем на поверхность чашки наносили диски с соответствующими препаратами. Посевы инкубировали в термостате в течение 18-20 ч при t (37,0±0,5)°С.
Эффективность антибактериальных препаратов учитывали, измеряя диаметр зоны задержки роста культуры. Для измерения использовали прозрачную линейку со скошенным краем. Размер высчитывали на тёмном фоне под отражённым светом. Оценку результатов проводили в соответствии с показателями таблиц, прилагаемых к наборам с дисками. Интерпретация размера зоны задержки роста зависела от вида микроорганизма и наименования антибактериального препарата.
1.2.3. Результаты эпизоотологического обследования СГЦ СКЗОСП
Взятие образцов патологического материала для исследования
1.2.3.1 Обоснование выбора направления исследований
Промышленное индейководство получило в настоящее время интенсивное развитие в Российской Федерации. Мясо индейки с каждым годом набирает популярность у населения нашей страны. Однако крупные индейководческие предприятия испытывают определенные проблемы в выращивании индейки. Связано это, в первую очередь, с трудностями в обеспечении устойчивого эпизоотологического благополучия хозяйств по инфекционным болезням (высокопатогенный грипп птиц, коронавирусный (геморрагический) энтерит индеек, микоплазмоз, ринотрахеит, лимфопролиферативные болезни, бордетеллиоз и другие бактериальные болезни). Большинство возбудителей инфекционных болезней индеек попадает в хозяйства с завозимой племенной продукцией (инкубационным яйцом и суточным молодняком). Большую опасность представляет племенная продукция, завозимая из-за рубежа. В этой связи особо важную роль в устойчивом развитии индейководства в стране играет Селекционный генетический центр «Северо-Кавказская зональная опытная станция по птицеводству» (СГЦ СКЗОСП), являющаяся частью ФНЦ «ВНИТИП» РАН.
В целях определения ветеринарного состояния данного птицеводческого предприятия было необходимо провести его эпизоотологическое обследование, провести патологоанатомическое вскрытие трупов и вынужденно забитых индеек разного возраста, сделать отбор проб клинического патматериала и провести его лабораторное диагностическое исследование. По результатам проведенной работы сделать заключение об эпизоотической ситуации в хозяйстве, при необходимости разработать программу мероприятий по обеспечению биозащиты птицепоголовья в отношении инфекционных болезней птиц.
1.2.3.2 Материалы и методы исследований.
Лабораторные исследования, направленные на выделение возбудителей бактериальных болезней птиц из доставленного патологического материала, проводили по п.п. 1.2.2.
В работе было проведено бактериологическое исследование материала 6 производственных объектов СГЦ СКЗОСП: яиц из зооветлаборатории, яиц с яйцесклада, РЭК в инкубатории (при переводе на вывод 23-й партии), вынужденно убитого молодняка индюшат (бригада № 3, корпус № 6/1), внутренних органов индеек в убойном цехе, проб спермы с разбавителем и помёта от клинически здоровых птиц (бригада № 1, корпуса № 1, 3).
При бактериологическом исследовании трупов и вынужденно забитых птиц делали высевы проб из крови сердца, печени, желчного пузыря, тонкого (двенадцатиперстная, тощая) и толстого отделов кишечника (слепые отростки). Первичные пробы исследуемого материала отбирали в системы транспортные со средой Кэри-Блейра, которые затем пересевали в стерильные стеклянные пробирки с мясопептонным бульоном (МПБ). Первичные посевы инкубировали в термостате при t 37,0±0,5°С в течение 24 часов.
1.2.3.3 Результаты бактериологического исследования патматериала и обсуждение
В зооветлаборатории было исследовано 7 проб яиц. Из 5 яиц микрофлора не была выделена, отсутствовал рост на всех питательных средах. Из двух проб были выделены 2 культуры: из одной пробы – негемолитический стафилококк Staphylococcus spp., из второй – энтерококк Enterococcus spp.
На яйцескладе было исследовано 10 проб яиц. Из 2 яиц микрофлора не была выделена, отсутствовал рост на всех питательных средах. Из восьми проб были выделены 8 культур микроорганизмов: из двух проб — стафилококки Staphylococcus spp., из трёх проб – энтерококки Enterococcus spp., из двух проб – грамположительные неспорообразующие гемолитические палочки Bacillus spp., из одной пробы – кишечная палочка Escherichia coli.
В инкубатории было исследовано 10 проб эмбрионов. Из 5 эмбрионов микрофлора не выделена, отсутствовал рост на всех питательных средах. Из пяти проб были выделены 5 культур микроорганизмов: из одной пробы – гемолитический стафилококк Staphylococcus spp., из одной пробы – энтерококк Enterococcus spp., из одной пробы — грамположительные неспорообразующие гемолитические палочки Bacillus spp., из одной пробы – культура условно-патогенной энтеробактерии Klebsiella spp.
У вынужденно убитого индюшонка (бригада № 3, корпус 6/1) на вскрытии было отмечено вздутие слепых отростков (фото1). Макроскопические изменения в других внутренних органах не выявлены. Из сердца выделены единичные колонии энтерококков Enterococcus spp., из печени – единичные колонии белого стафилококка — Staphylococcus epidermidis. Из слепого отростка выделена культура кишечной палочки Escherichia coli, а также единичные колонии энтерококков и стафилококка.
В убойном цехе были исследованы 13 проб сердца, печени, желчи, двенадцатиперстной, тощей и слепой кишок от 4-х голов индеек. На вскрытии выявлен дуоденит и энтерит (фото2), в паренхиматозных органах макроскопические изменения не обнаружены. Из проб сердца от двух индеек выделены культуры протея обыкновенного Proteus vulgaris, из остальных 11-ти проб выделены культуры кишечной палочки Escherichia coli.
Бригада 1, корпуса 1, 3 были исследованы 7 проб спермы индюков и две пробы помёта. Из всех проб спермы выделены культуры кишечной палочки Escherichia coli и энтерококков Enterococcus spp. Из проб помёта выделены культуры кишечной палочки Escherichia coli и энтерококков Enterococcus spp.
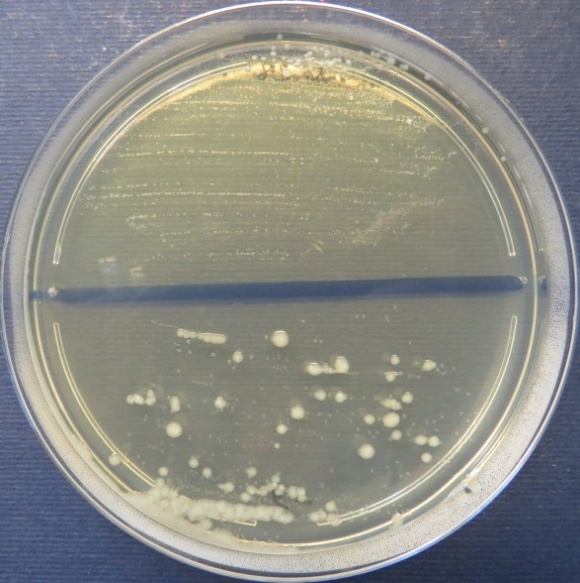
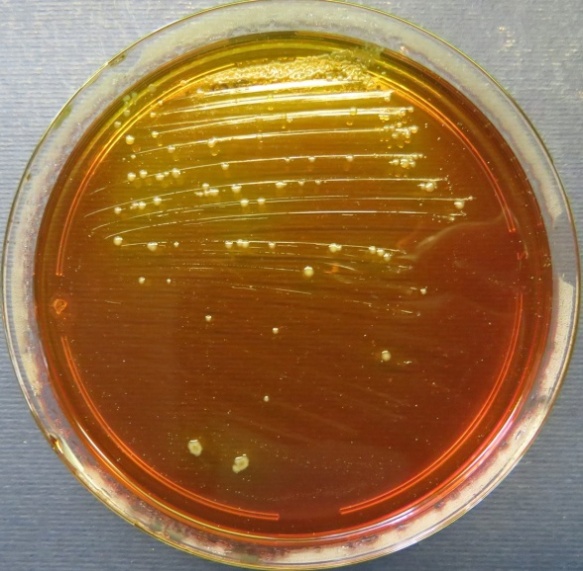
Десять проб кишечника, печени и помёта (№№ 30, 32, 36, 39, 40, 41, 42, 43, 51, 52) были посеяны на среды для выделения клостридий. В результате исследований культуры сульфитредуцирующих клостридий не выделены ни в одной пробе (фото 3). Результаты исследований представлены в таблицах 1-6.
Фото 1
Вынужденно убитый индюшонок, вздутие слепых отростков
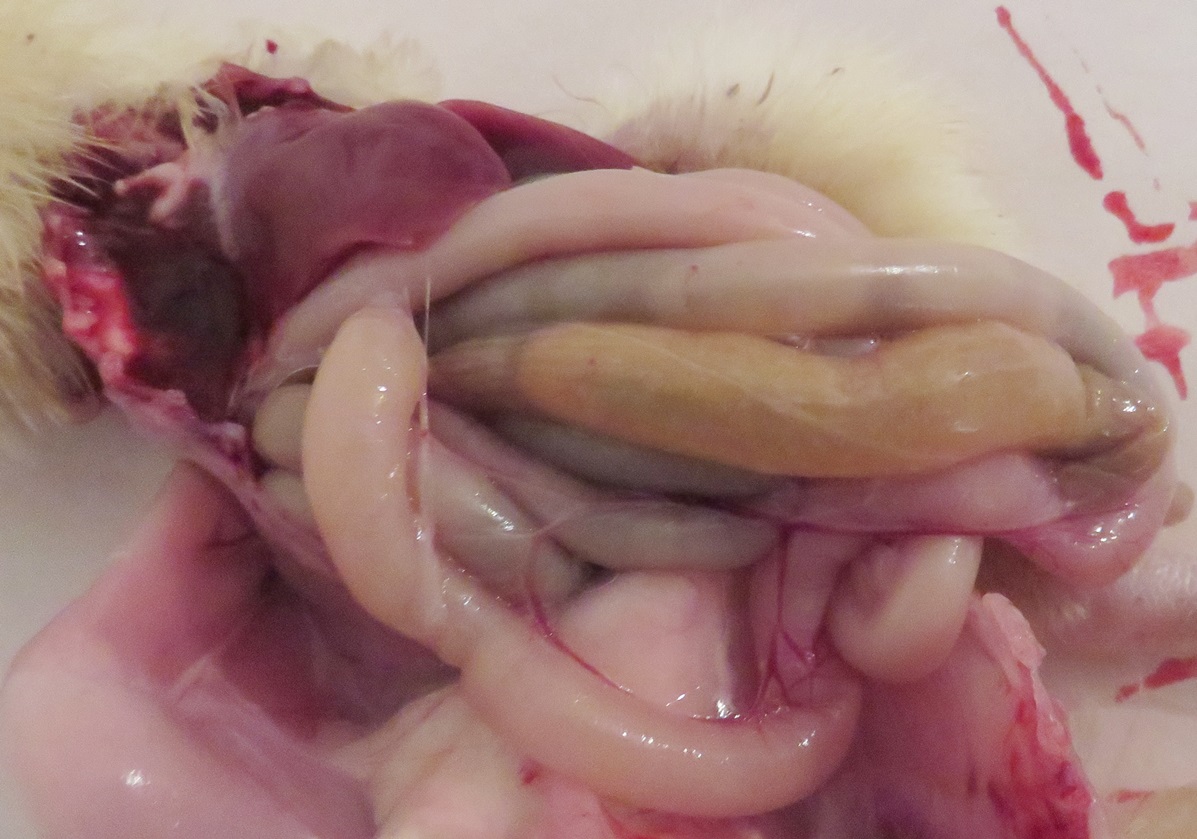
Фото 2
Дуоденит и энтерит у индейки в убойном цехе
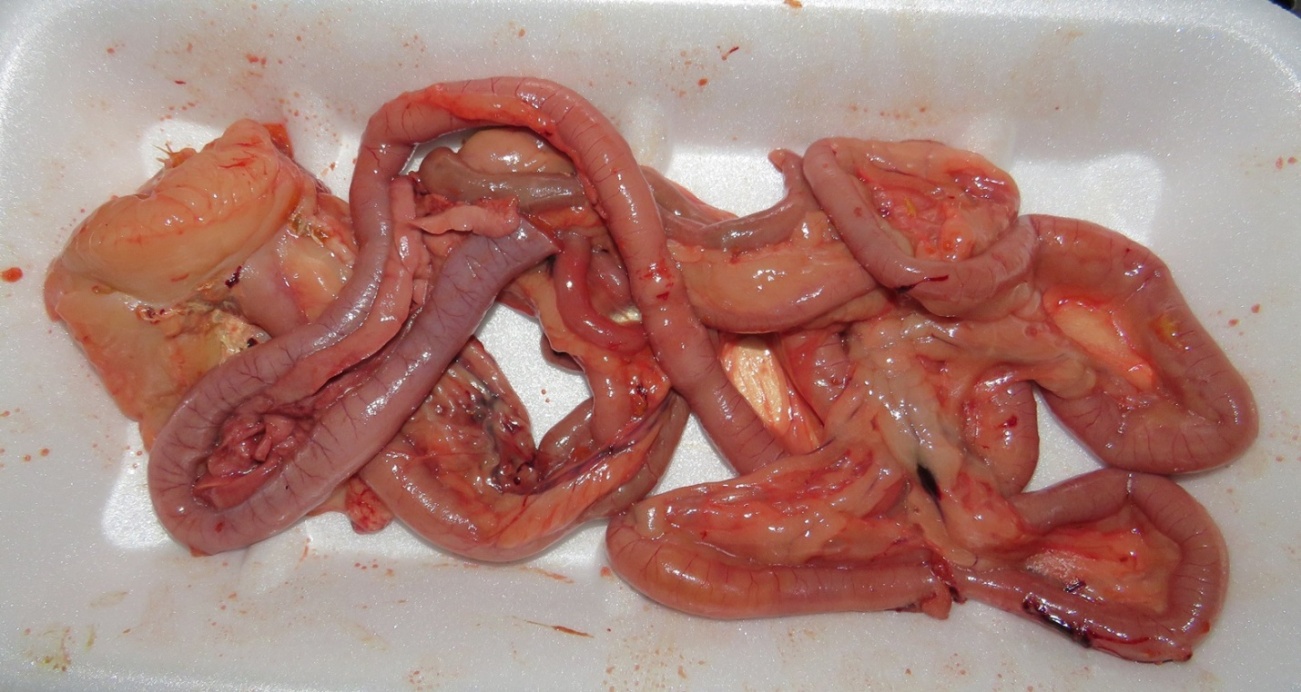
Фото 3
Отсутствие роста сульфитредуцирующих клостридий во всех пробах
на среде Вильсона-Блэра
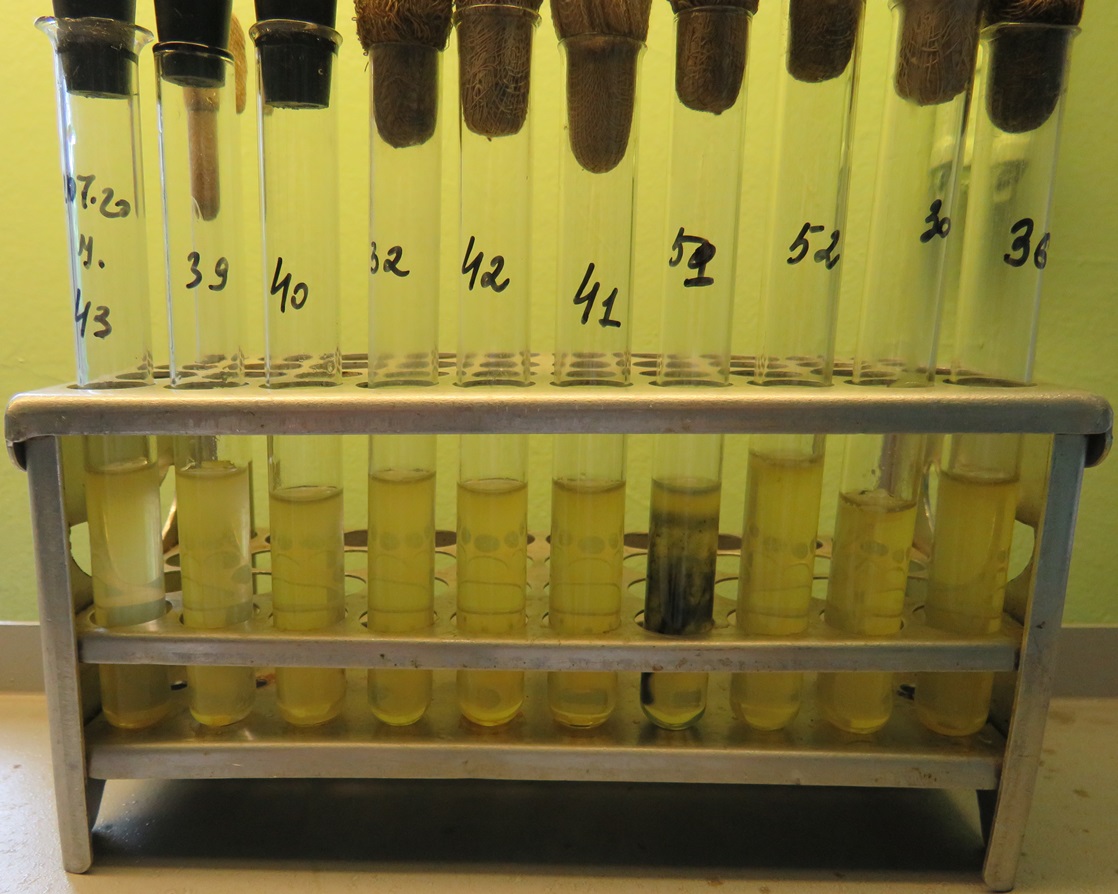
Таблица 1
Результаты бактериологического исследования проб из разных объектов
| Производствен-ный объект | Объект
исследования |
№ | Выделенные культуры |
| Зоовет
лаборатория |
Яйцо инкубационное | 1-5 | Микрофлора не выделена |
| 6 | Staphylococcus spp. | ||
| 7 | Enterococcus spp. | ||
| Яйцесклад | Яйцо инкубационное | 1-3 | Enterococcus spp. |
| 4-5 | Микрофлора не выделена | ||
| 6-7 | Bacillus spp. | ||
| 8-9 | Staphylococcus spp. | ||
| 10 | Escherichia coli | ||
| Инкубаторий | Развивающиеся эмбрионы | 1 | Enterobacter spp. |
| 2 | МПА | ||
| 3-7 | Микрофлора не выделена | ||
| 8 | Bacillus spp. | ||
| 9 | Enterococcus spp. | ||
| 10 | Staphylococcus spp. | ||
| Бригада № 3, корпус 6/1:
вынужденно убитый индюшонок |
Сердце | 1 | Enterococcus spp. |
| Печень | 2 | Staphylococcus epidermidis | |
| Слепой отросток | 3 | Escherichia coli | |
| Убойный цех | сердце | 1 | Proteus vulgaris |
| 12-перстная кишка | 2 | Escherichia coli | |
| сердце | 3 | Proteus vulgaris | |
| желчь | 4-5 | Escherichia coli | |
| сердце | 6 | Escherichia coli | |
| печень | 7 | Escherichia coli | |
| 12-перстная кишка | 8-10 | Escherichia coli | |
| тощая кишка | 11 | Escherichia coli | |
| слепой отросток | 12 | Escherichia coli | |
| слепой отросток | 13 | Escherichia coli | |
| Бригада 1,
корпуса 1, 3 |
Сперма индюков | 1-6 | Escherichia coli |
| 7 | Escherichia coli
Enterococcus spp. |
||
| Бригада 1,
корпуса 1, 3 |
Пробы помёта | 1 | Staphylococcus spp. |
| 2 | Escherichia coli |
1.2.3.4 Результаты изучения культуральных и морфологических свойств культур выделенных микроорганизмов.
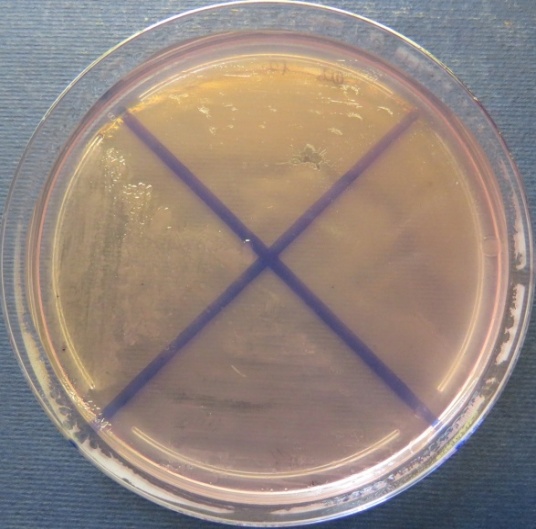
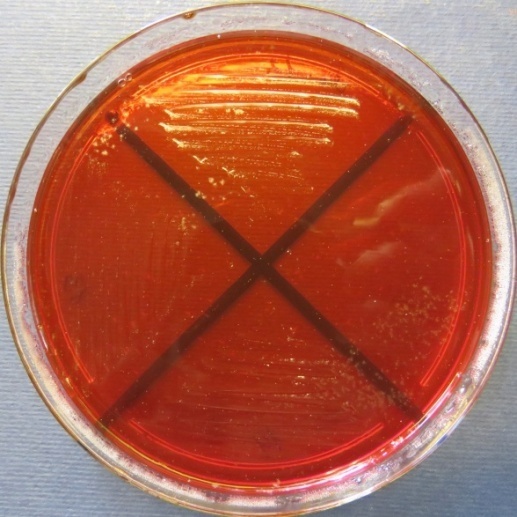
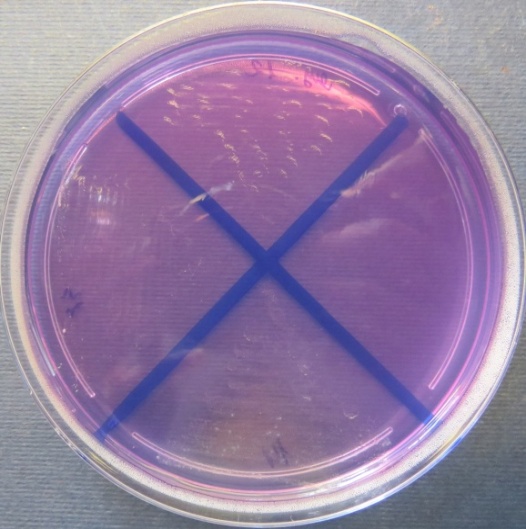
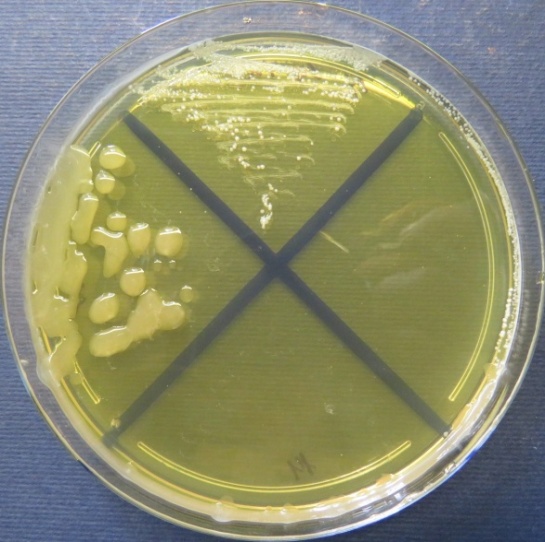
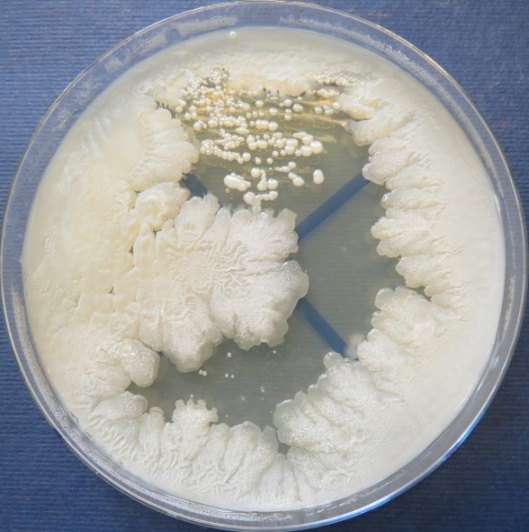
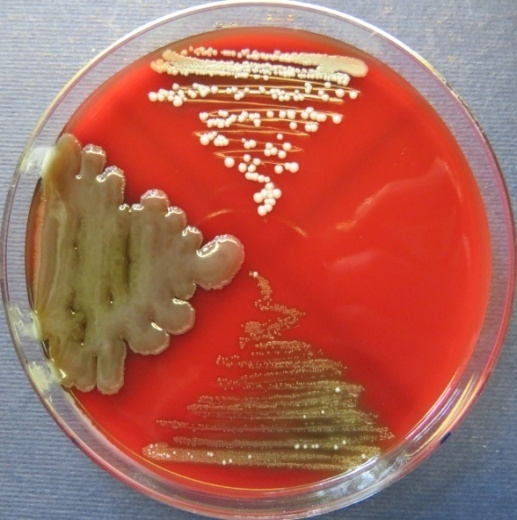
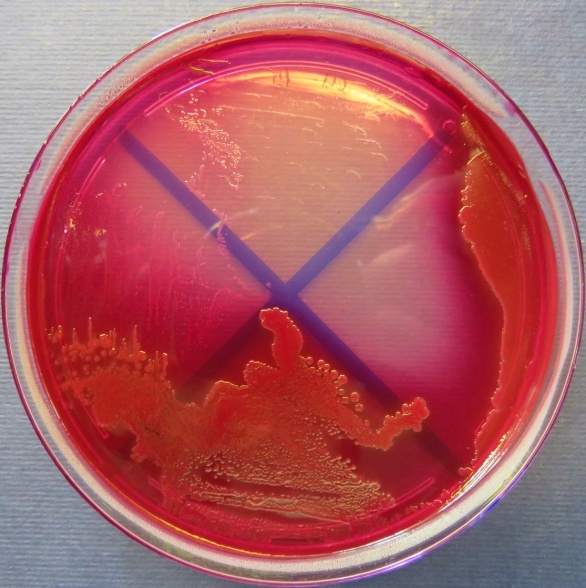
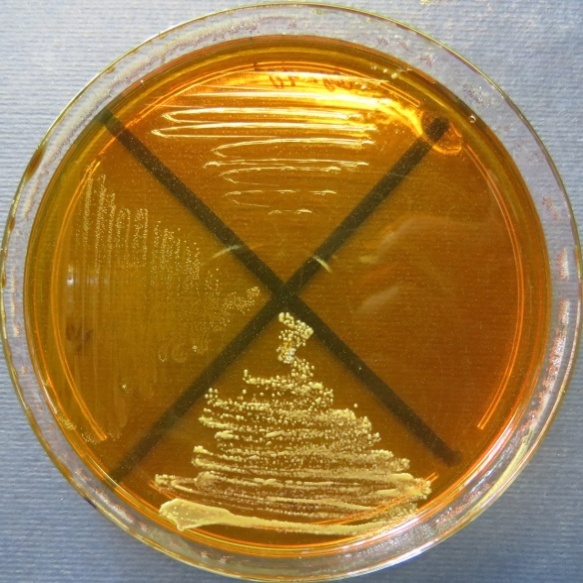
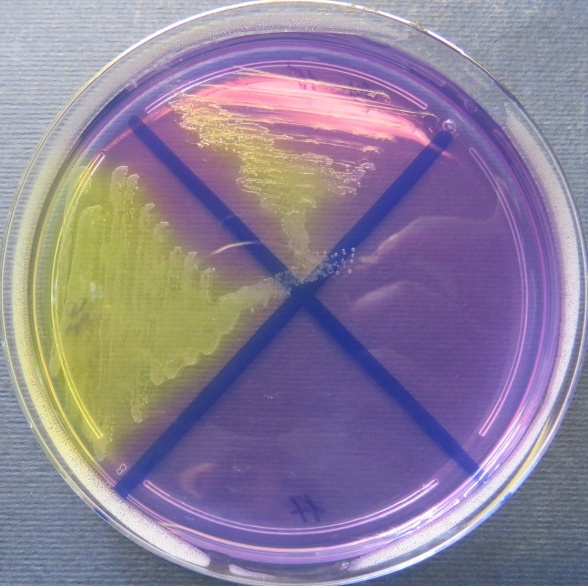
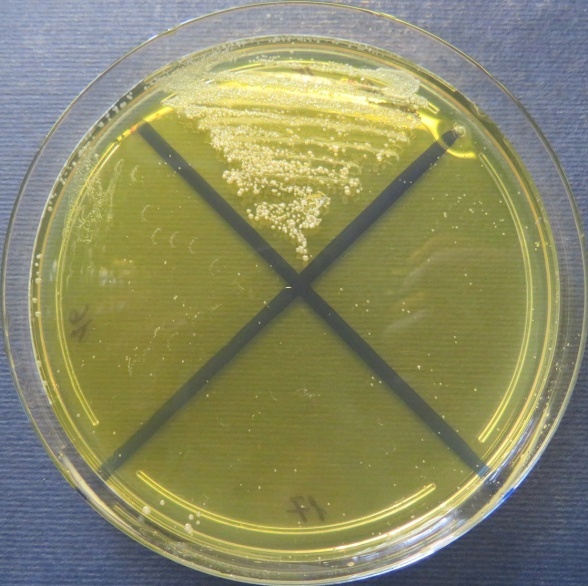
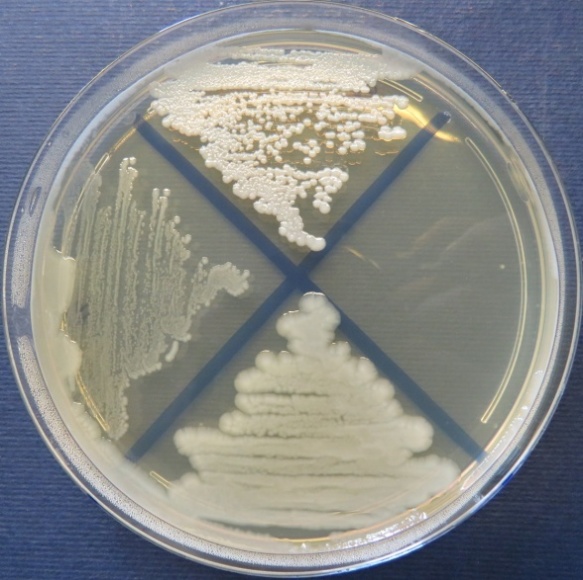
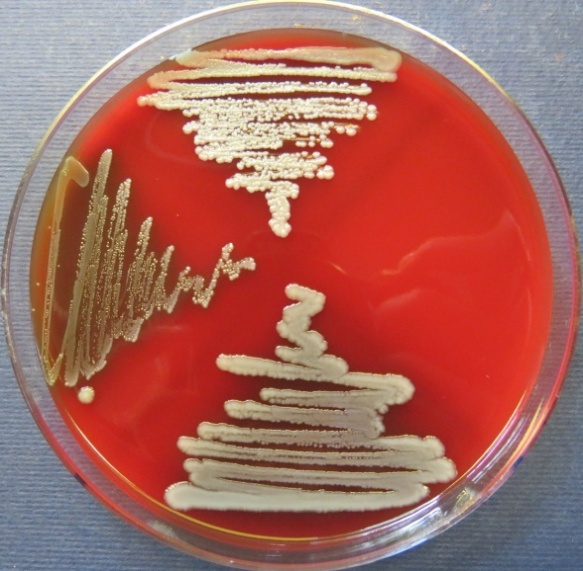
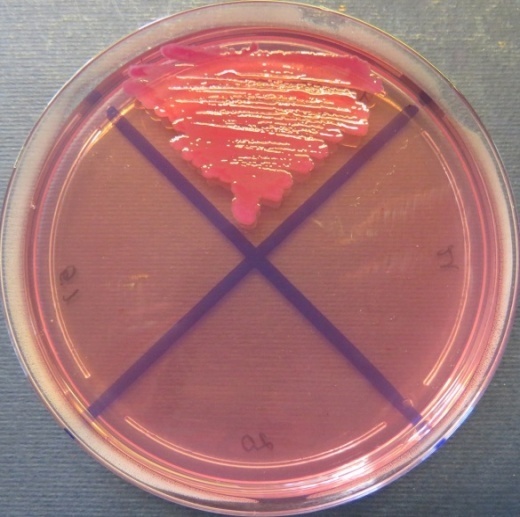
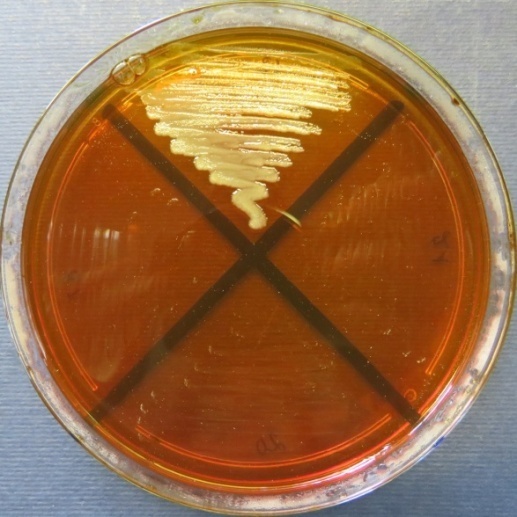
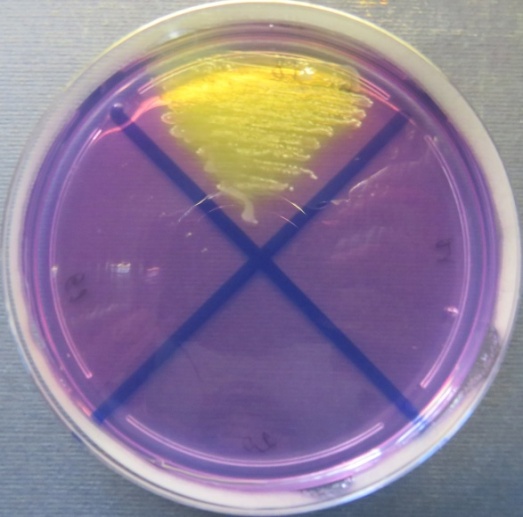
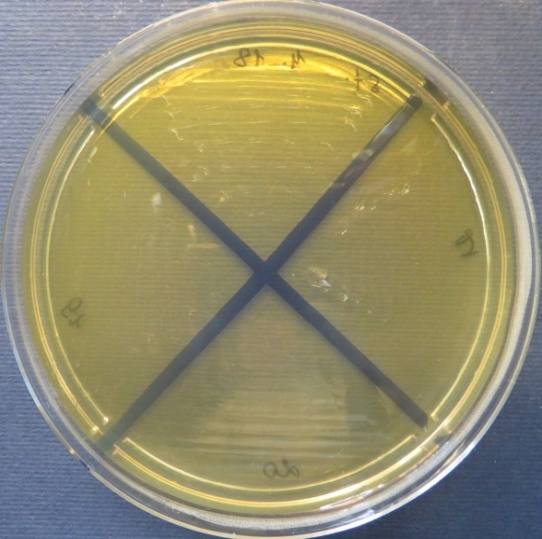
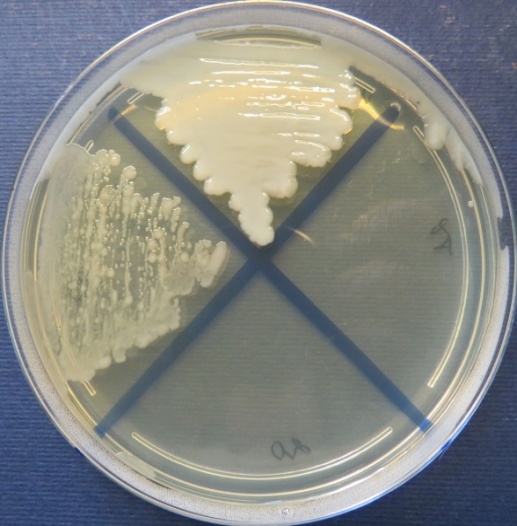
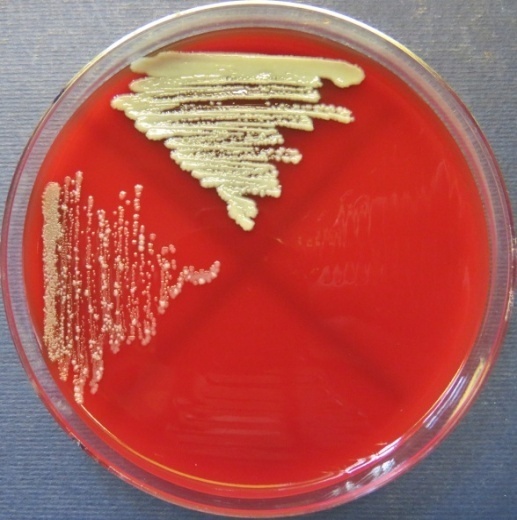
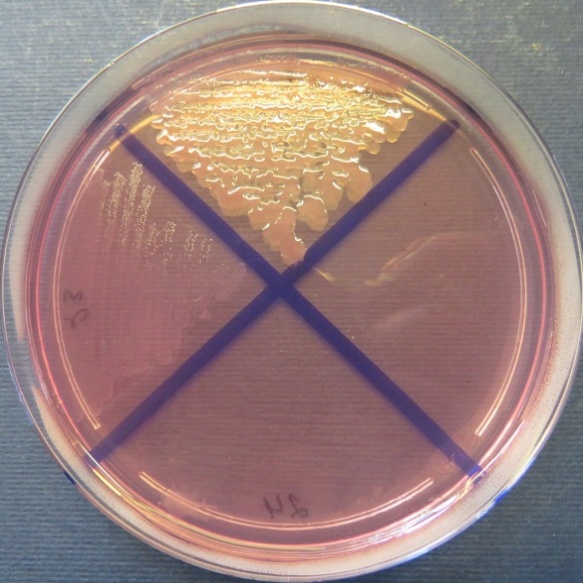
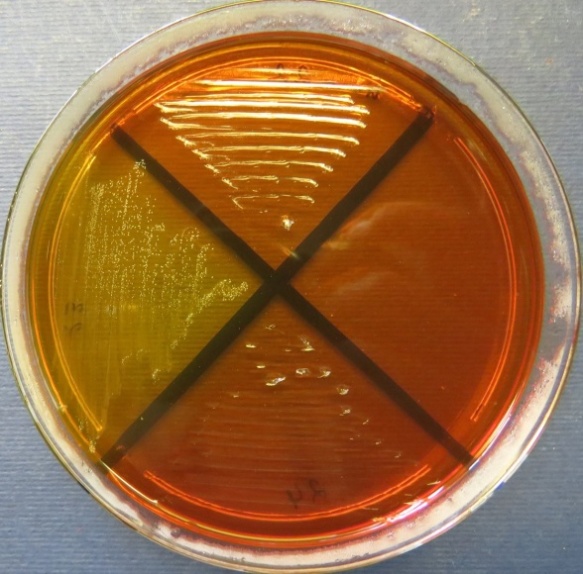
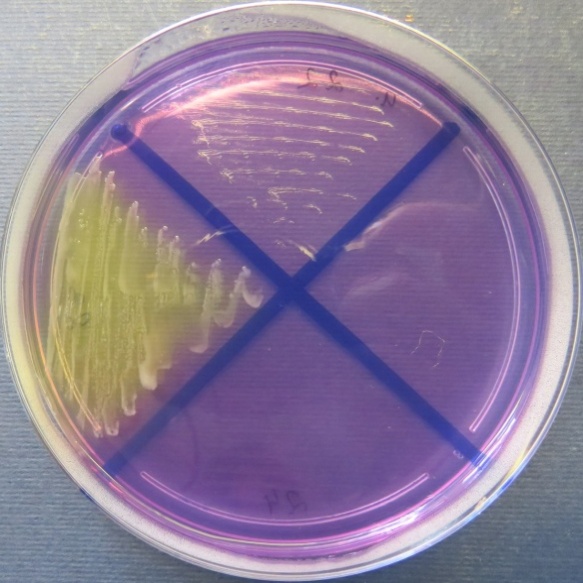
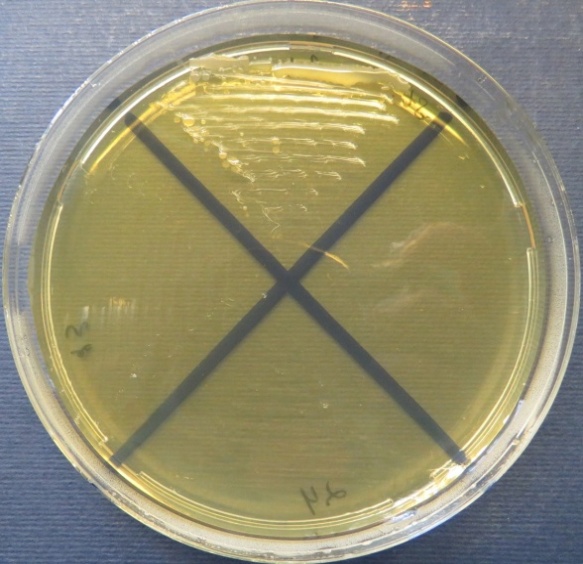
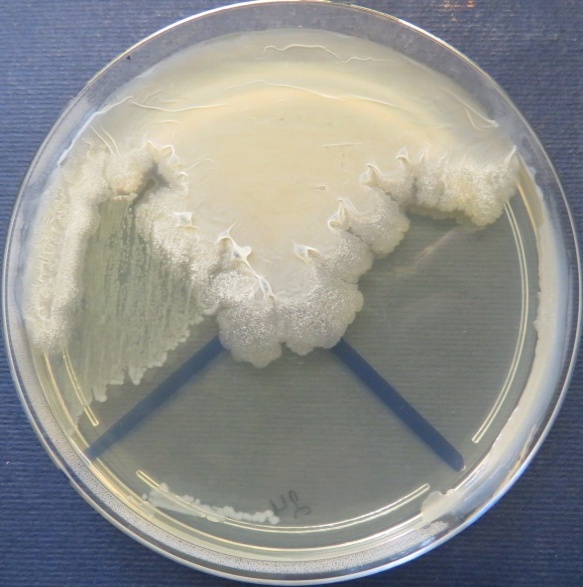
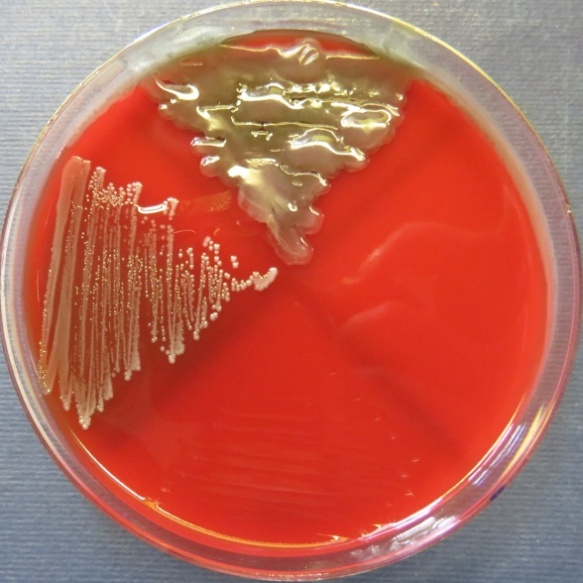
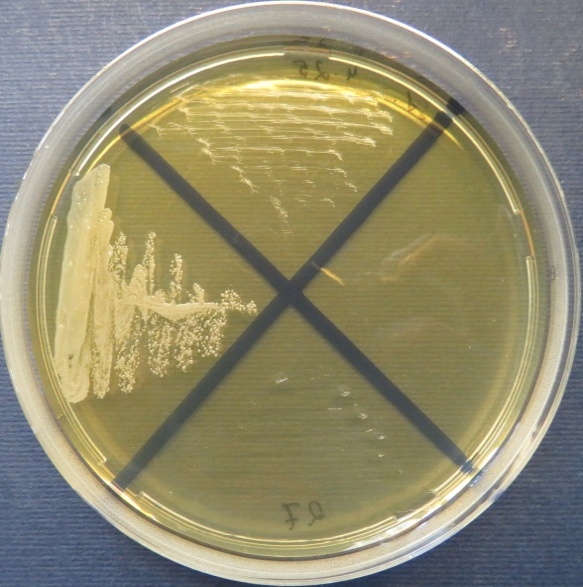
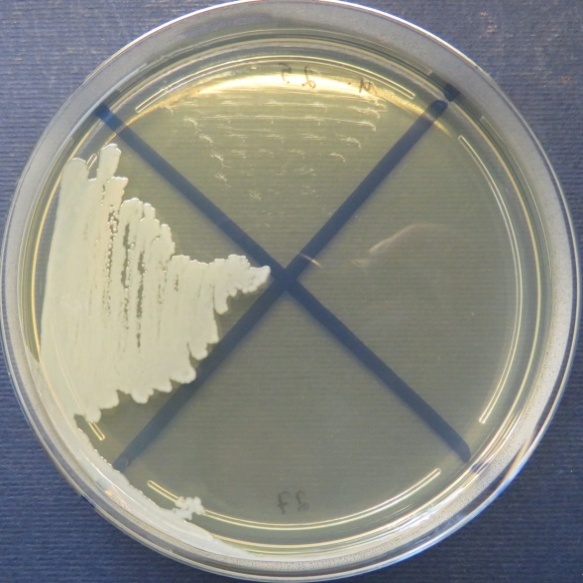
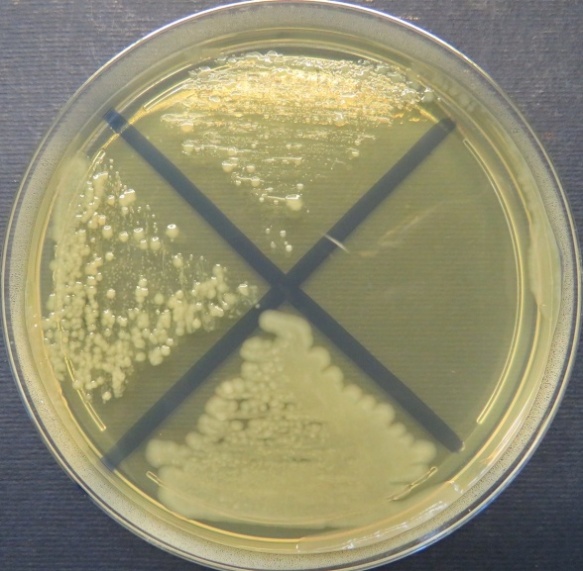
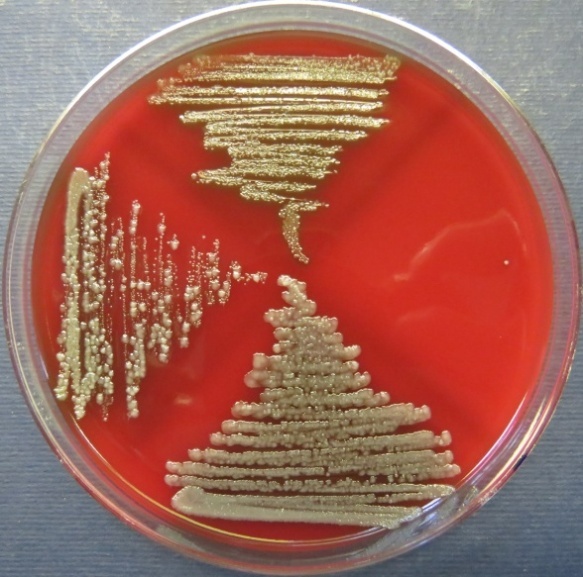
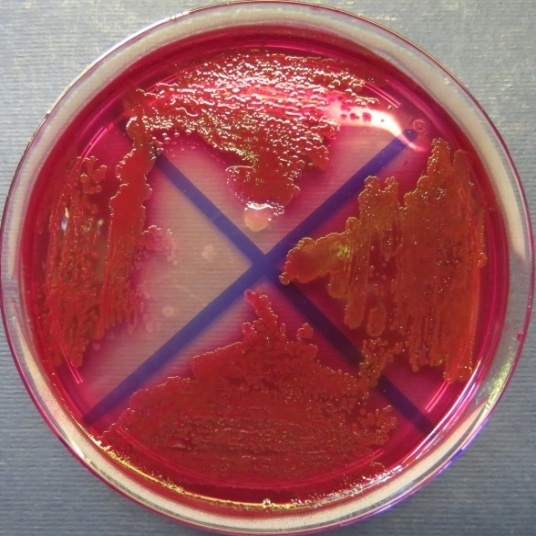
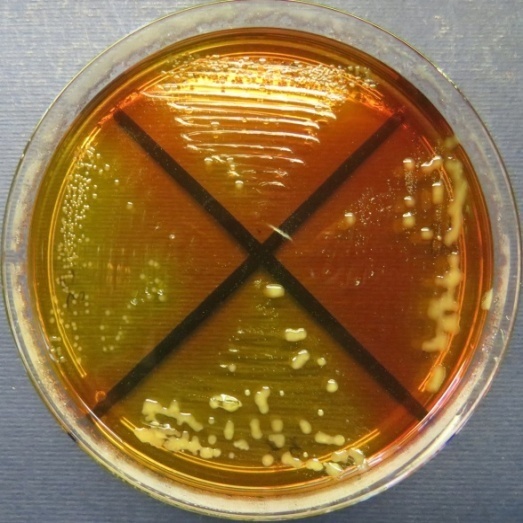
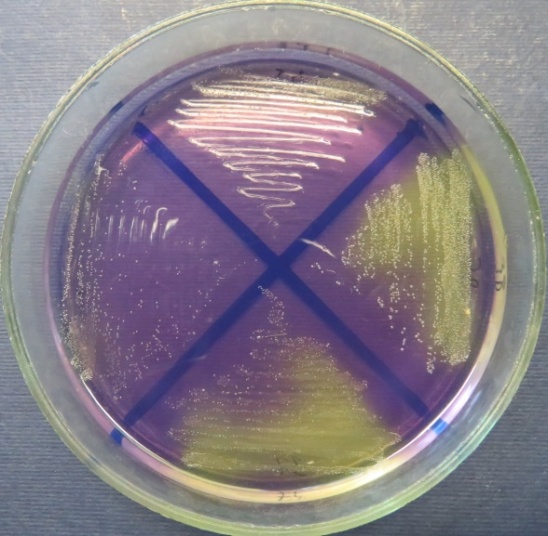
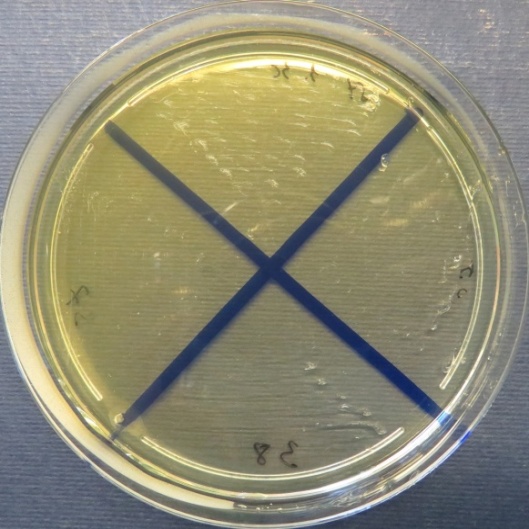
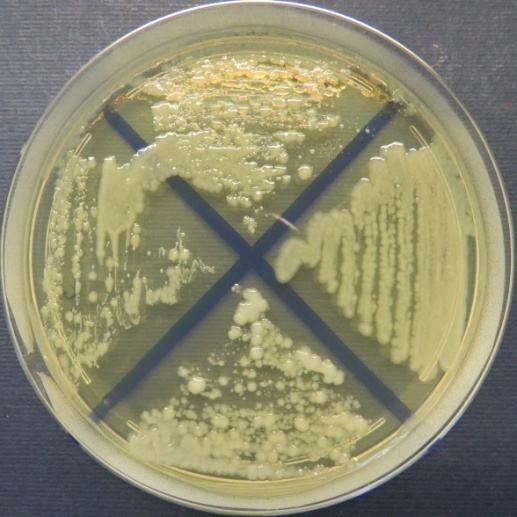
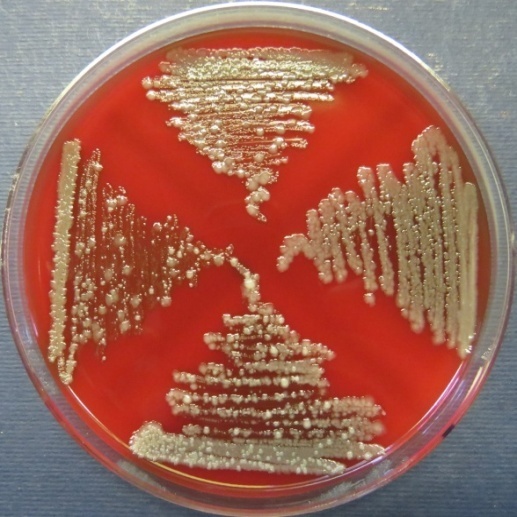
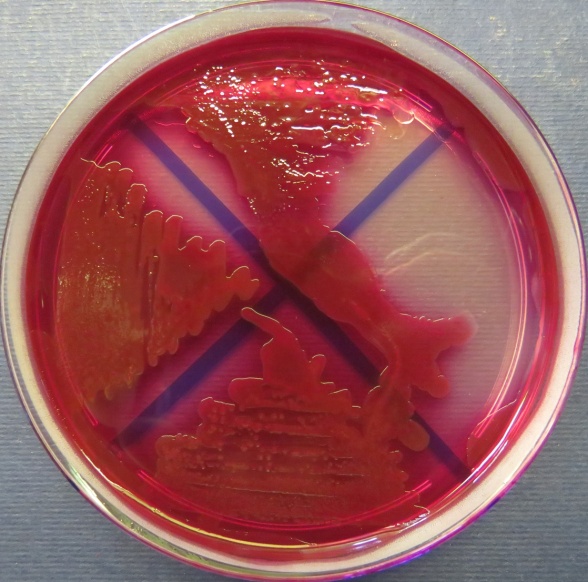
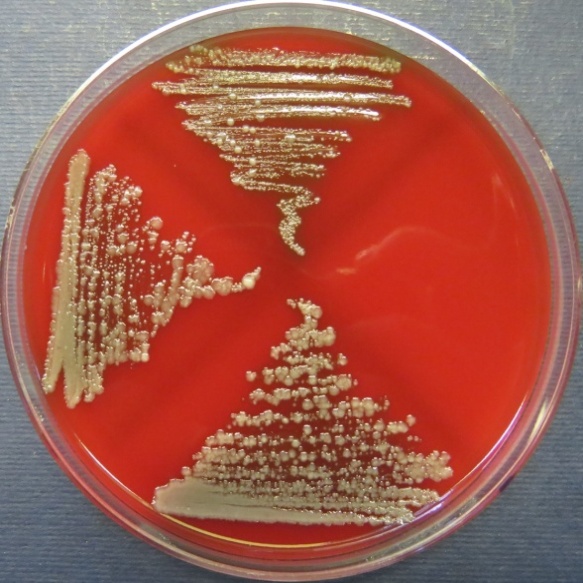
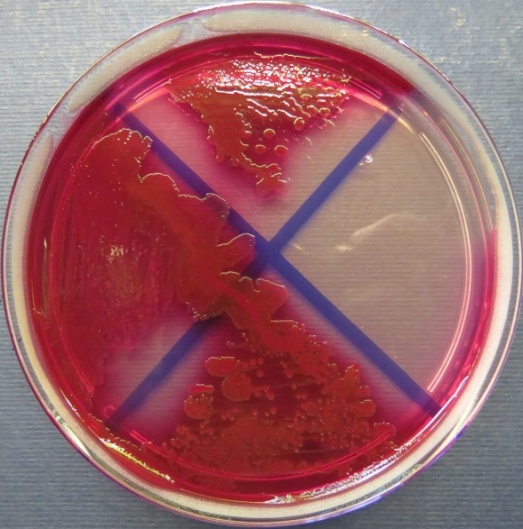
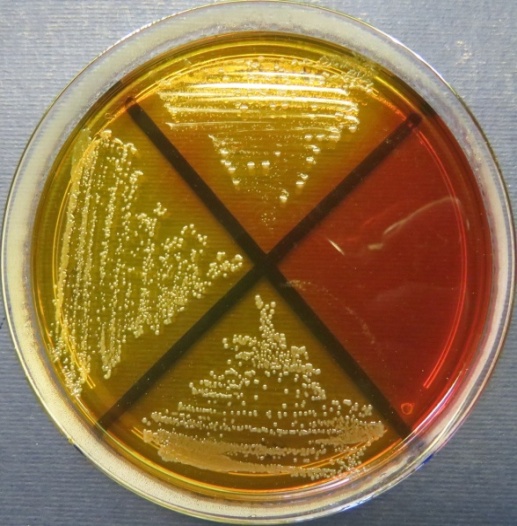
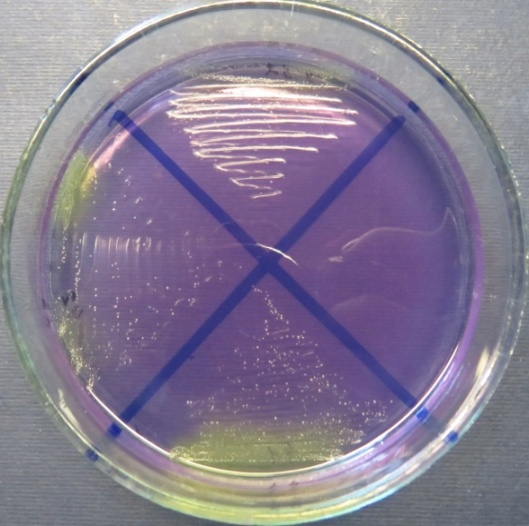
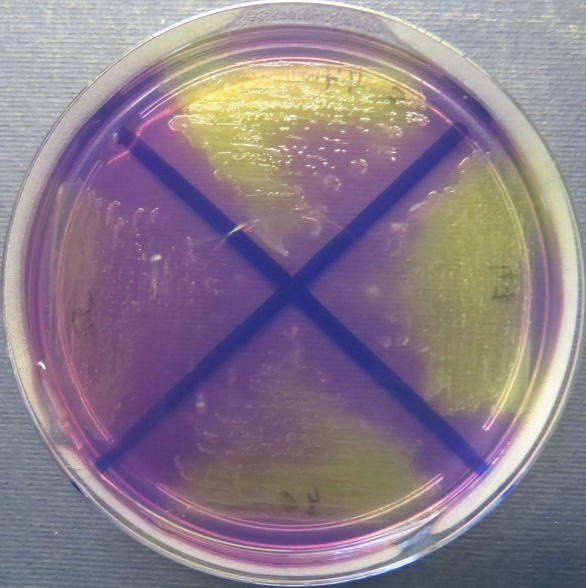
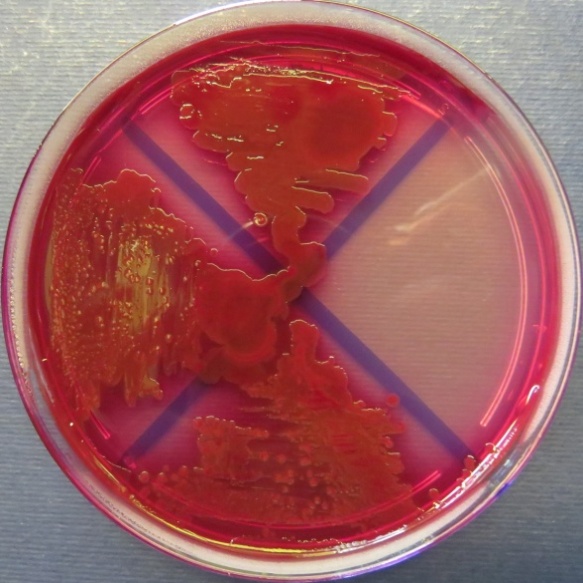
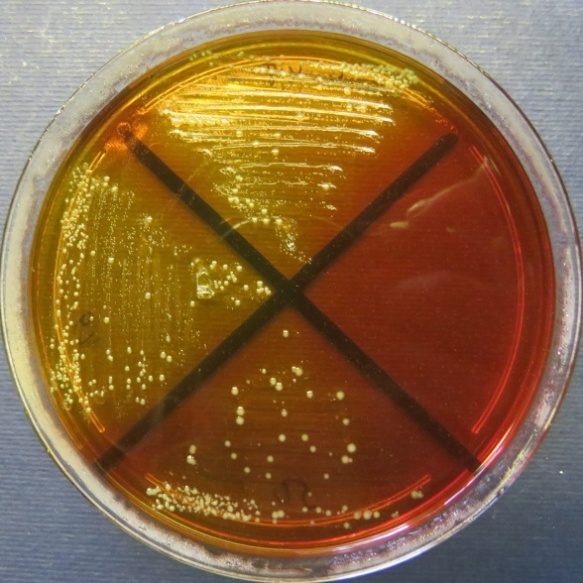
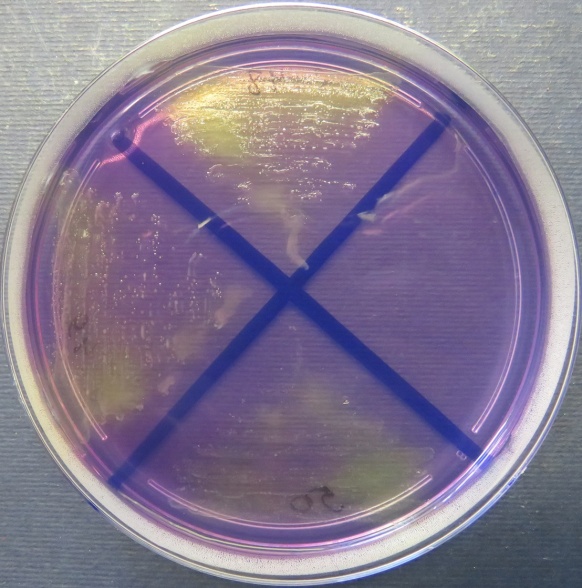
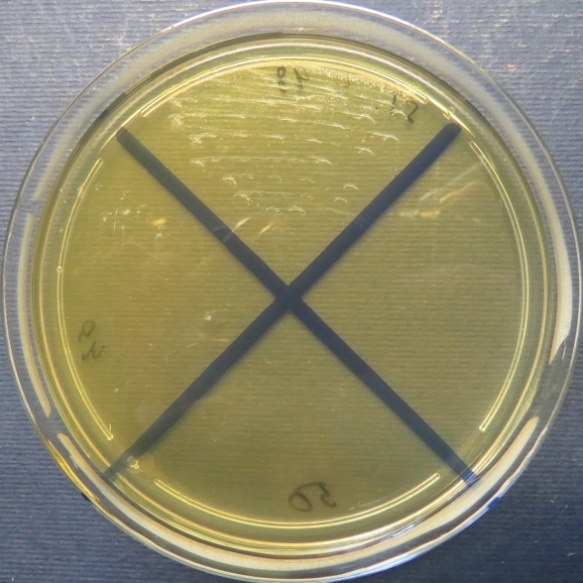
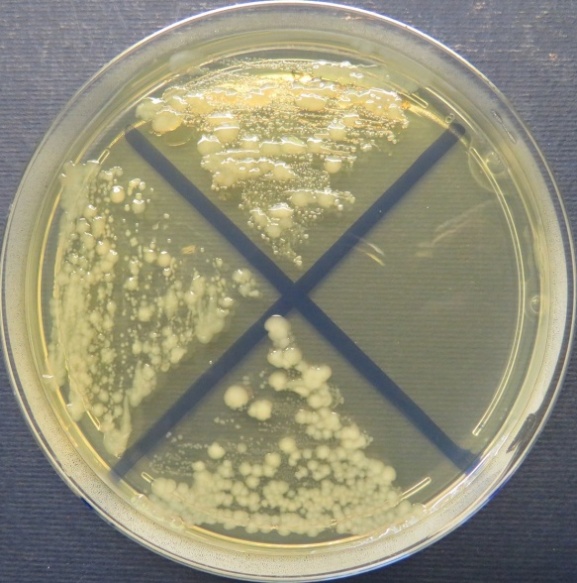
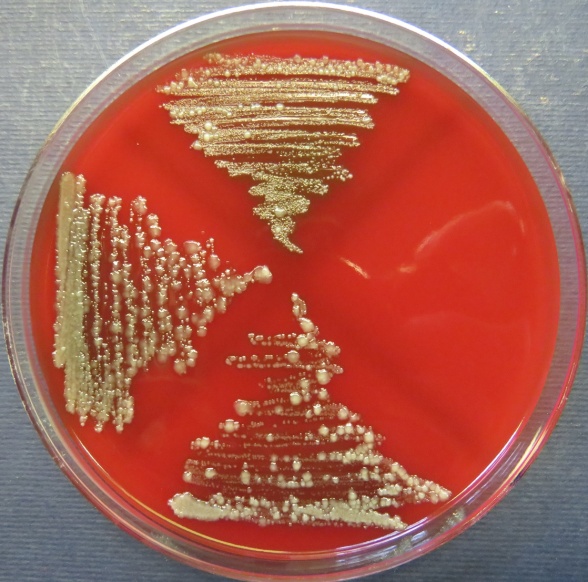
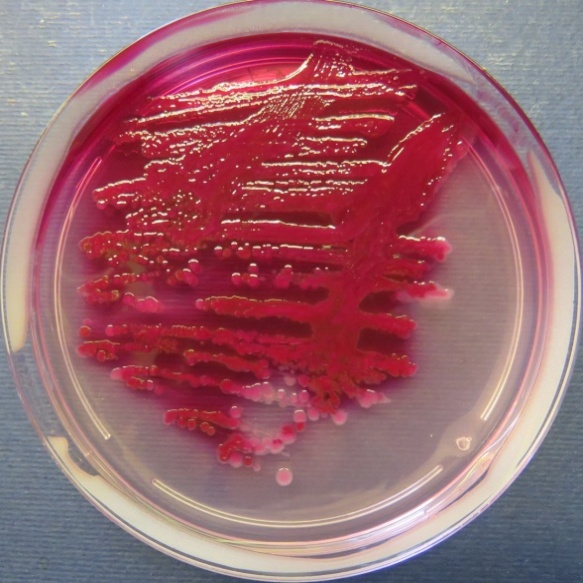
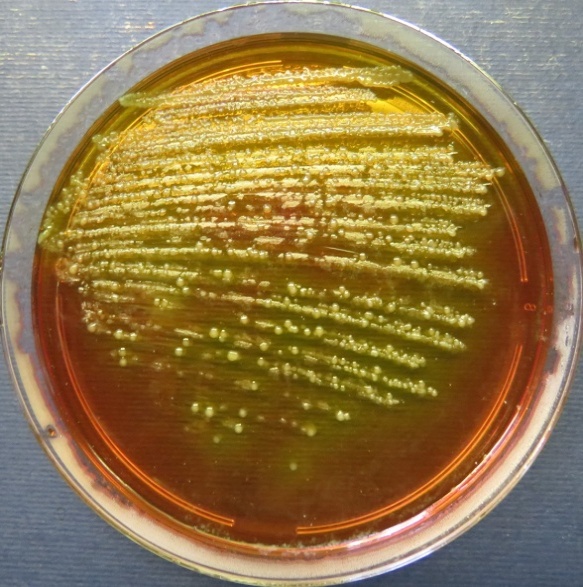
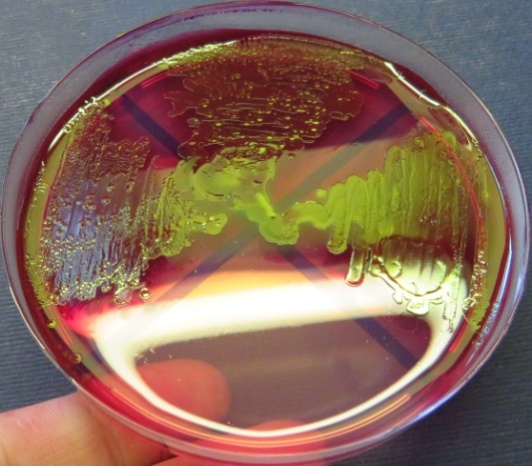
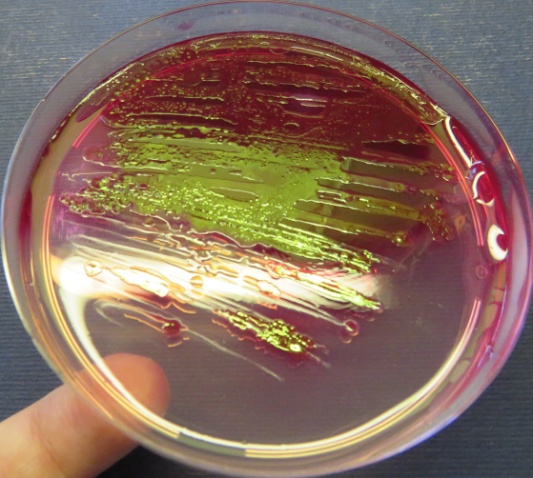
Результаты бактериологического исследования проб патматериала с разных объектов хозяйства представлен на фото-блоках 4 – 23;
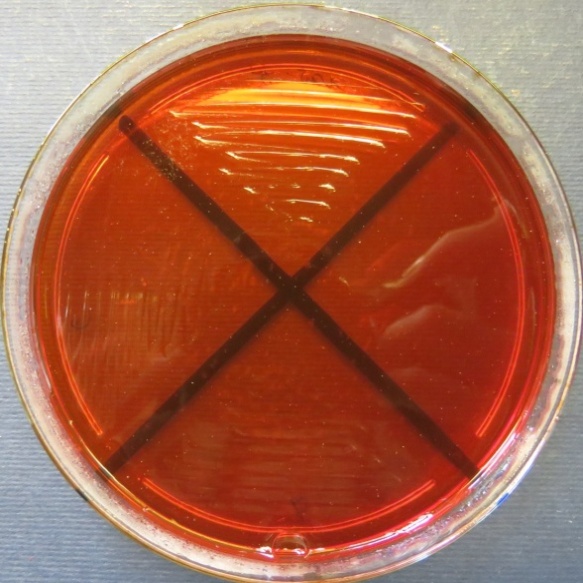
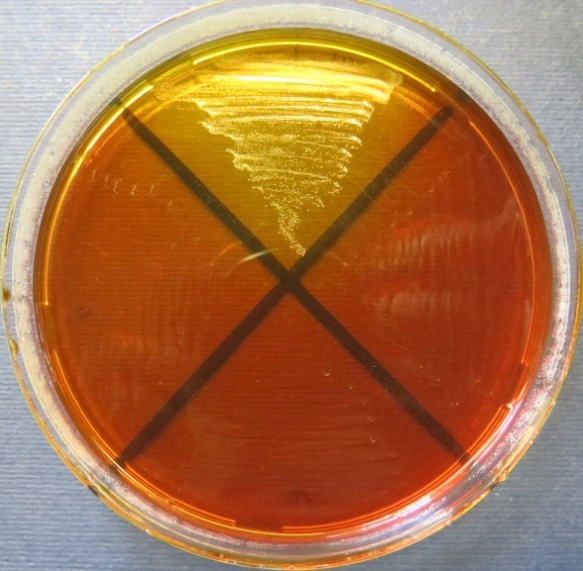
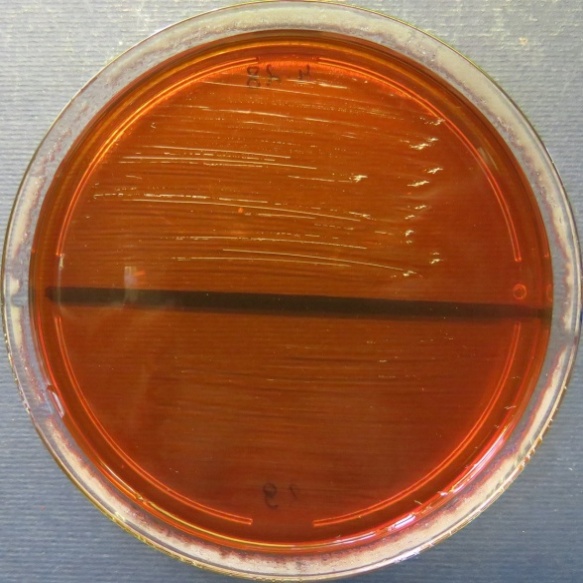
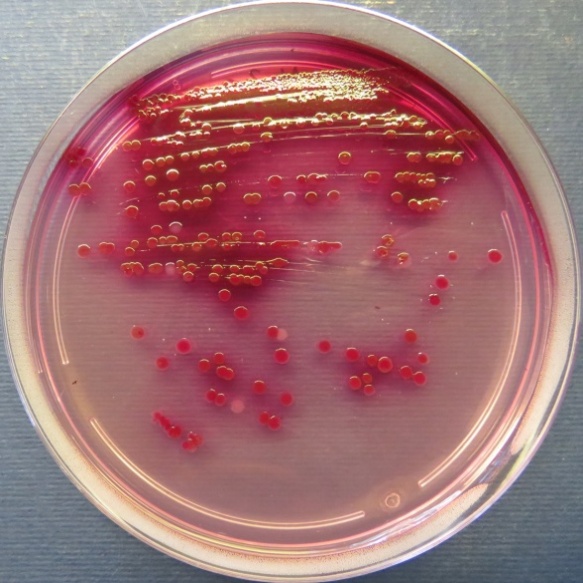
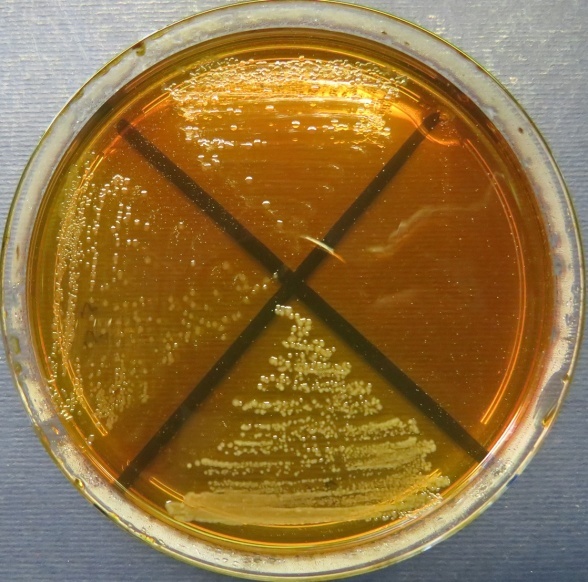
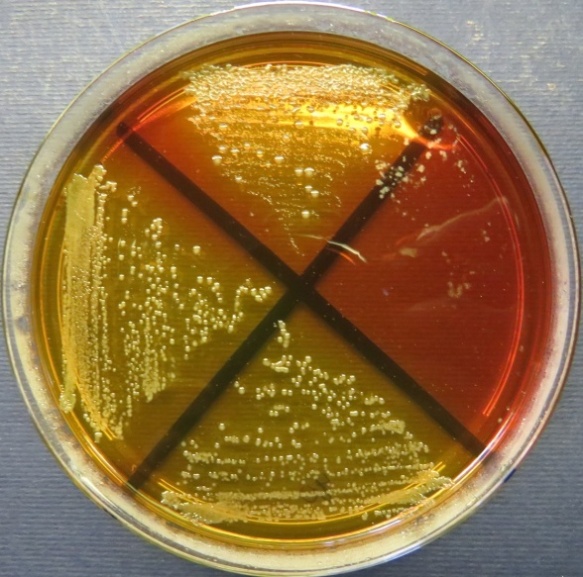
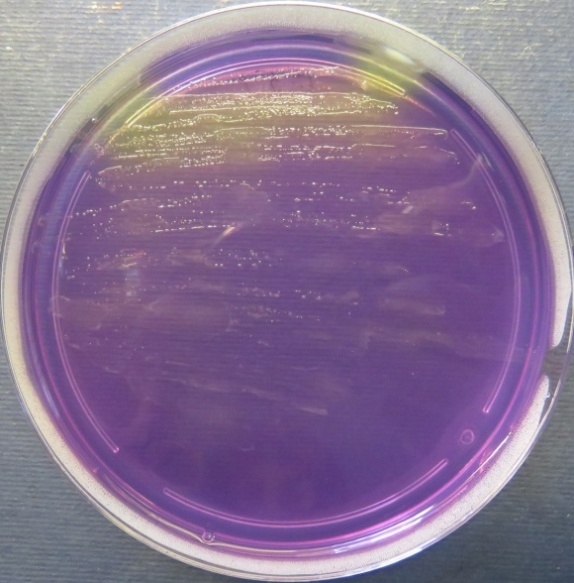
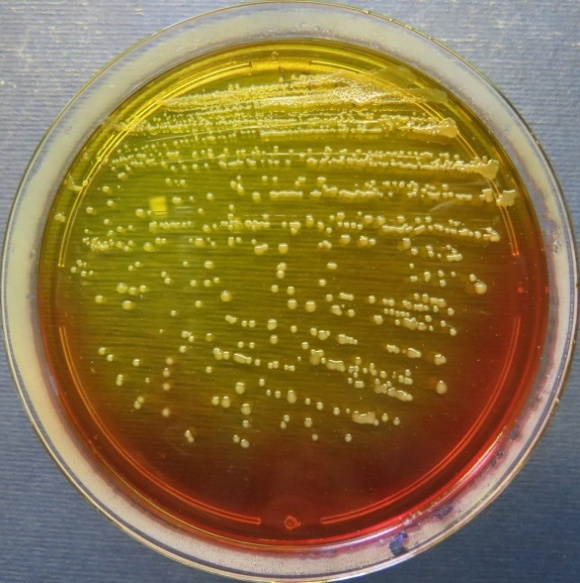
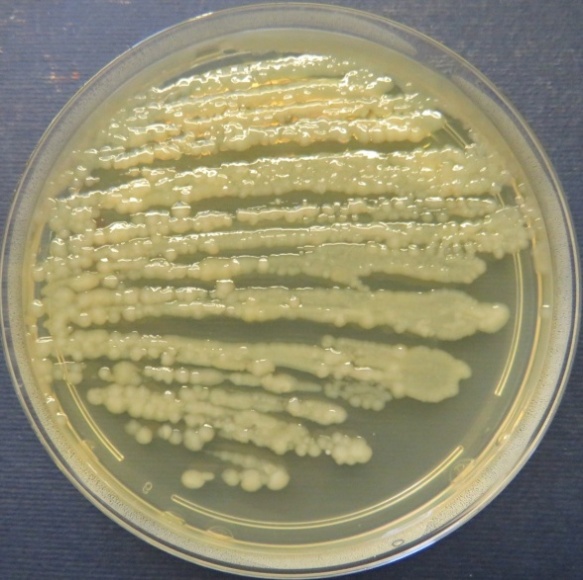
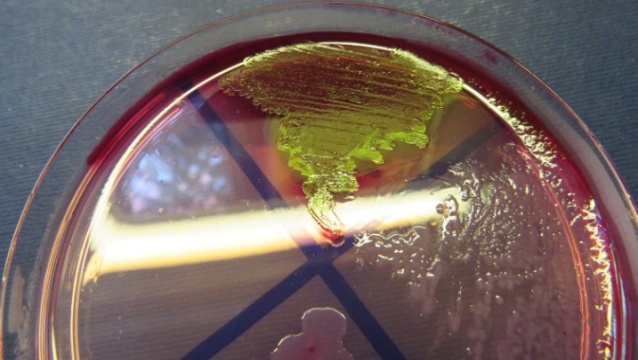
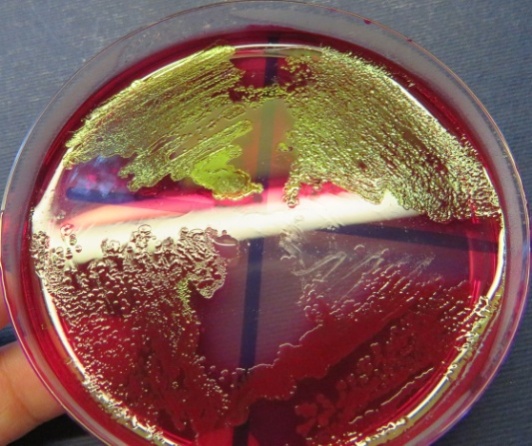
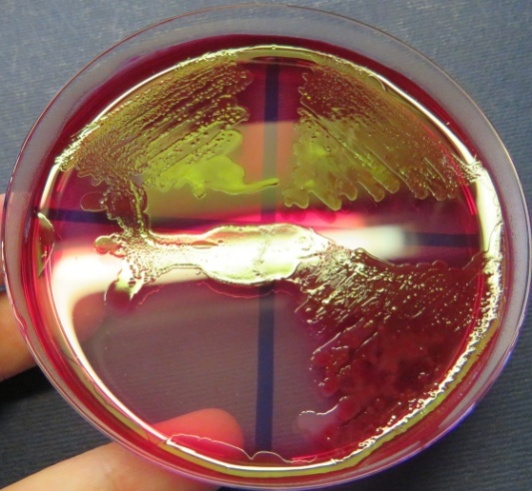
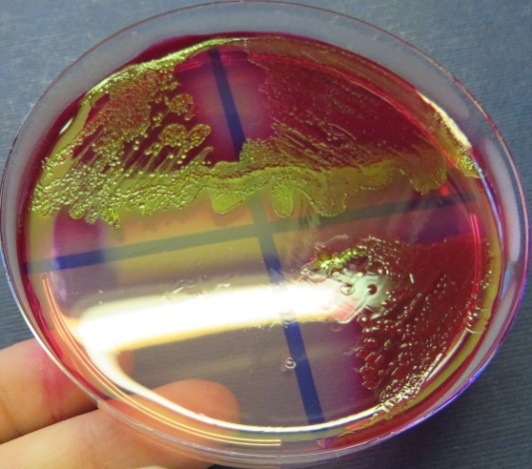
Рост выделенной культуры Escherichia coli с выраженным металлическим блеском на среде Эндо представлен на фото-блоке 24;
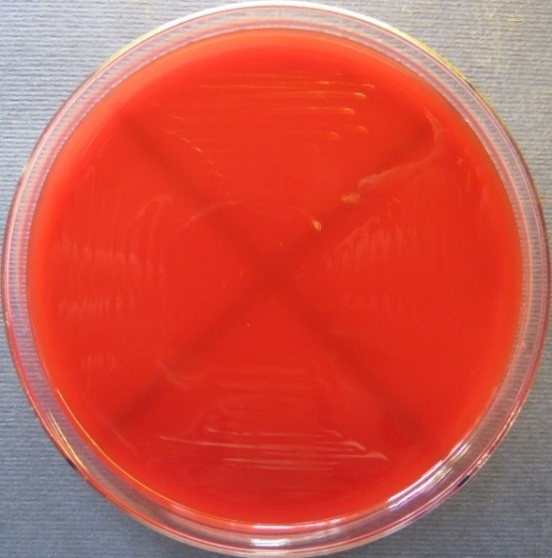
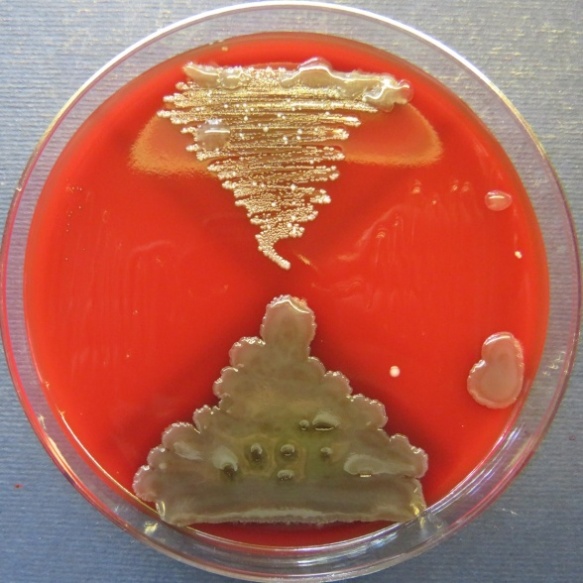
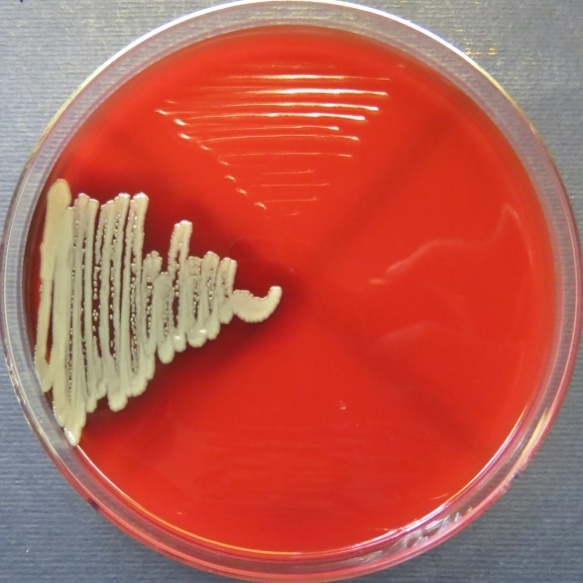
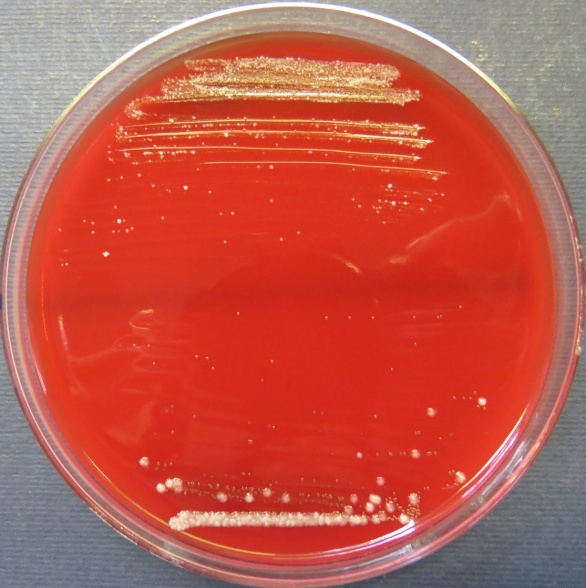
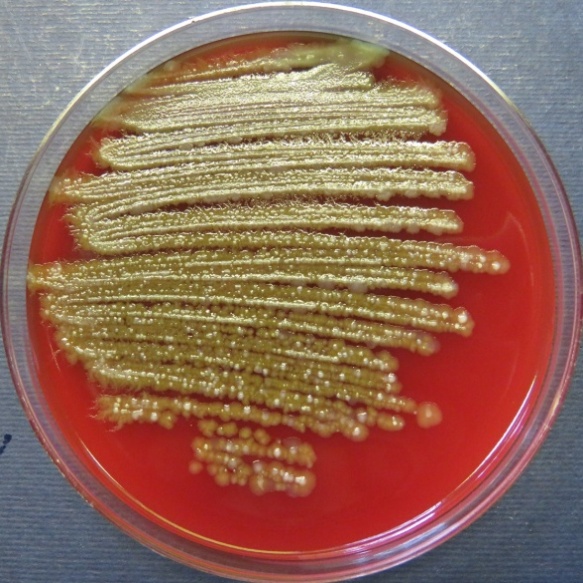
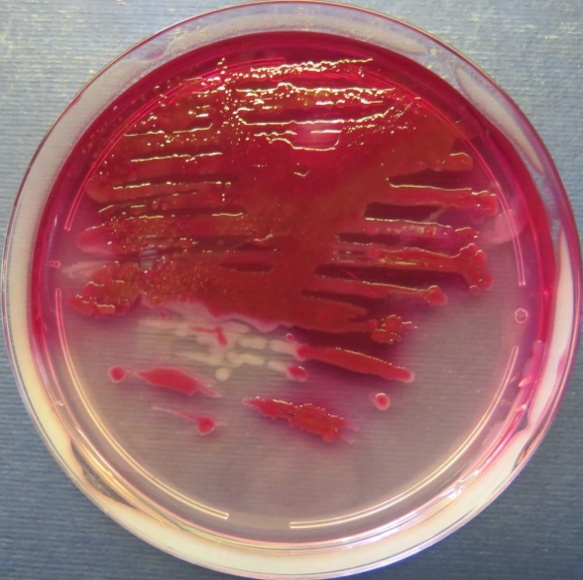
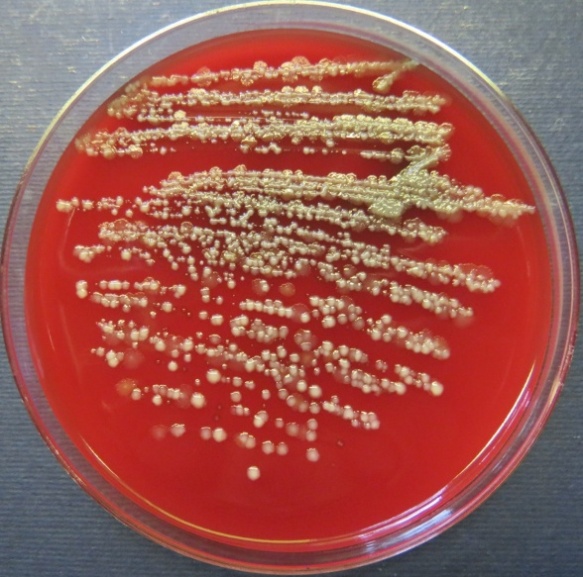
Рост выделенных культур бацилл и стафилококков на колумбийском агаре, с выраженными зонами гемолиза представлен на фото-блоке 25;
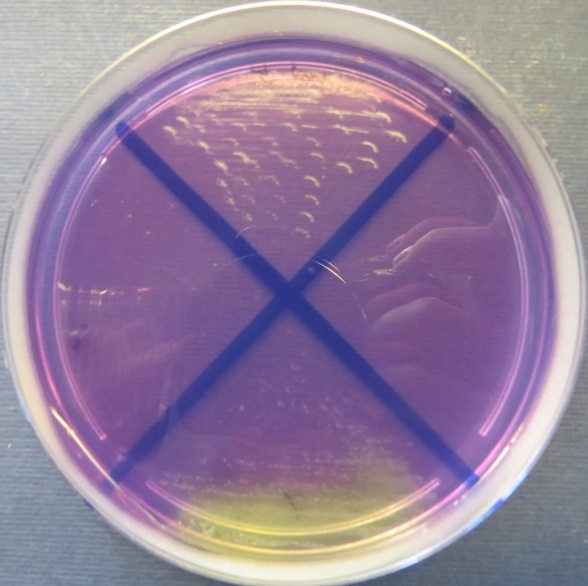
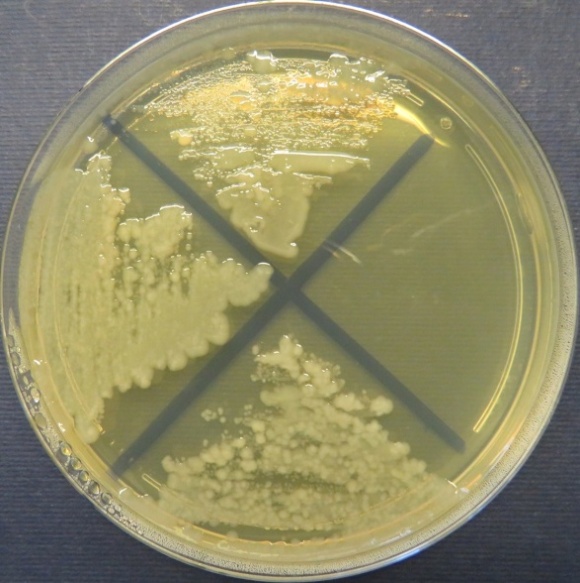
Рост выделенной культуры энтеробактерий разных видов на различных питательных средах представлен на фото-блоке 26;
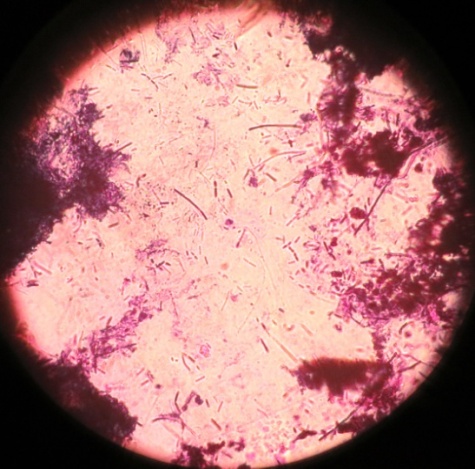
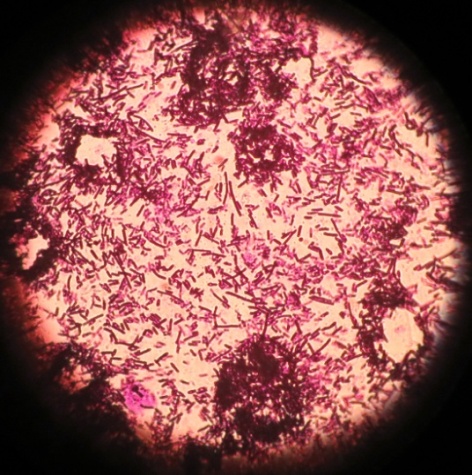
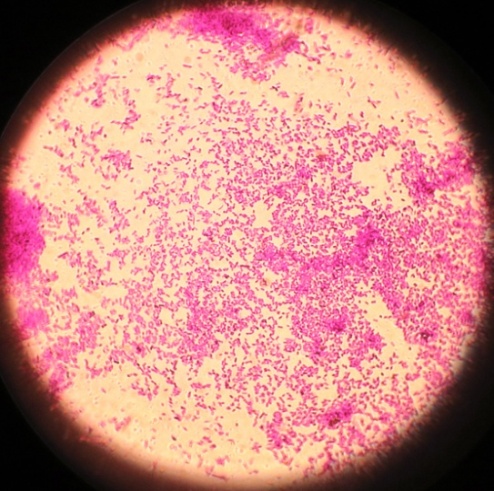
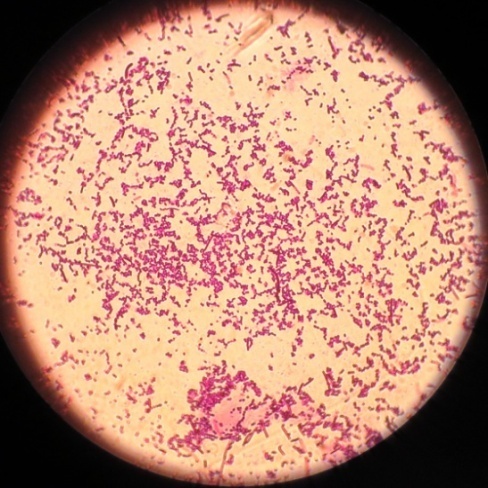
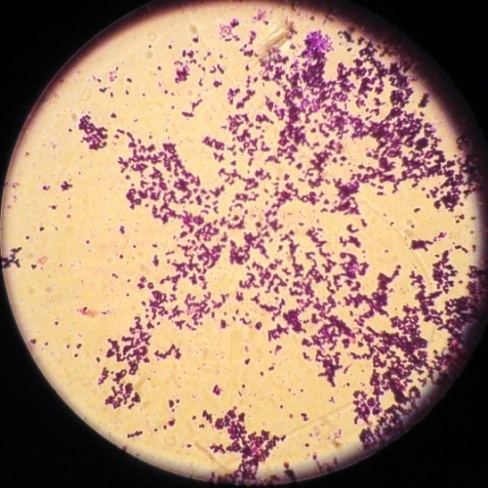
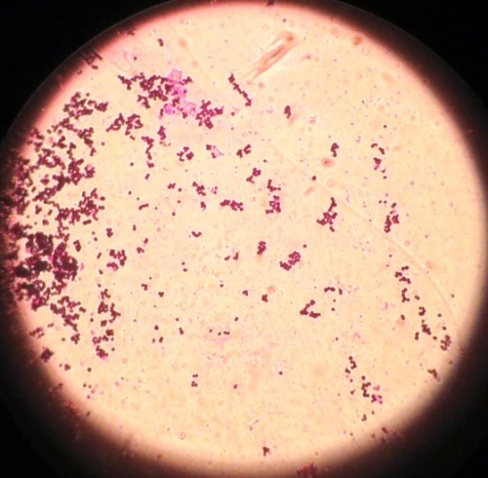
Микроорганизмы разных видов под микроскопом, выделенные с различных объектов, представлены на фото-блоке 27
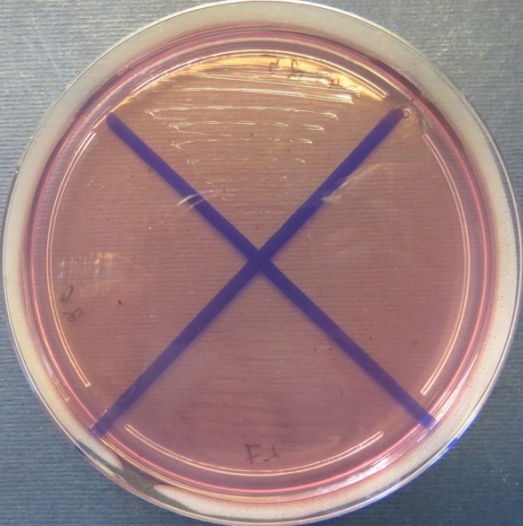
Результаты бактериологического исследования проб из разных объектов (фото-блоки 4 — 23)
| Зооветлаборатория,
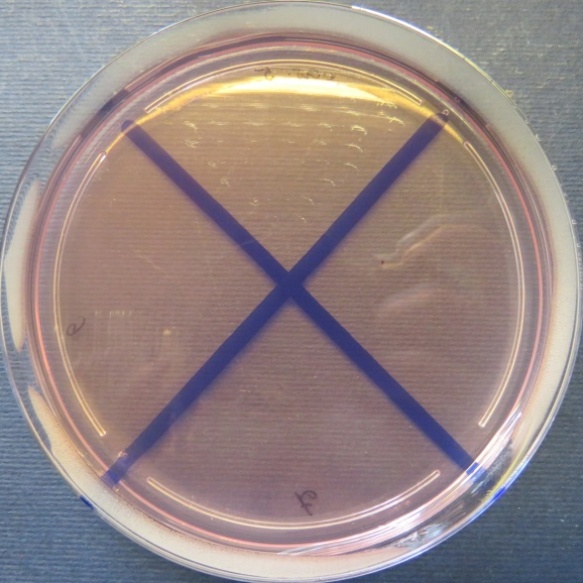
пробы №№ 1-4 Отсутствие роста микрофлоры во всех пробах на всех питательных средах |
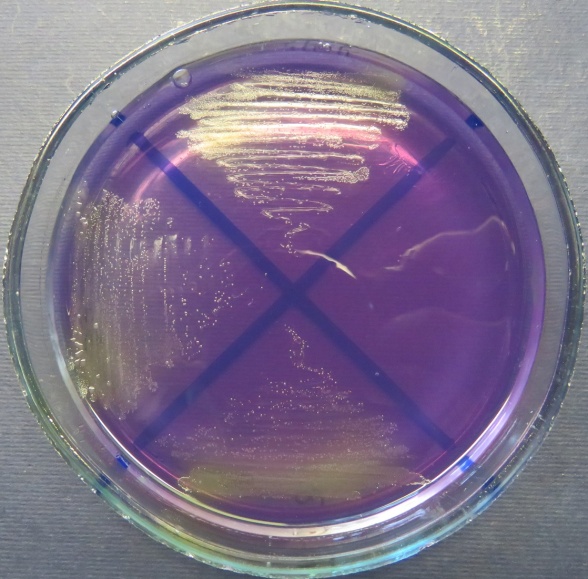
Среда Эндо | XLD-агар | Полимиксиновая среда | |
 |
 |
 |
||
| Стафилококковый агар | Мясопептонный агар | Колумбийский кровяной агар | ||
 |
 |
 |
||
| Зооветлаборатория
Пробы №№ 5-7 Отсутствие роста микрофлоры в пробе № 6 на всех средах. Отсутствие роста кишечной микрофлоры во всех пробах на среде Эндо и XLD-агаре. Рост культуры Staphylococcus spp. в пробе № 5 на стафилококковом агаре, мясопептонном агаре, колумбийском кровяном агаре. Рост культуры Enterococcus spp.в пробе № 7 на полимиксиновой среде |
Среда Эндо | XLD-агар | Полимиксиновая среда | |
 |
 |
 |
||
| Стафилококковый агар | Мясопептонный агар | Колумбийский кровяной агар | ||
 |
 |
 |
||
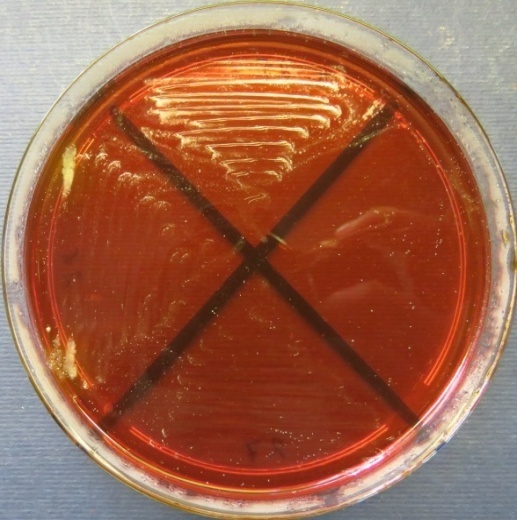
| Яйцесклад,
Пробы №№ 8-11 Отсутствие роста микрофлоры в пробах №№ 9 и 11 на всех средах. Рост культуры Enterococcus spp. в пробе № 8 на всех средах. Рост культуры Bacillus spp. в пробе № 10 на стафилококковом агаре, мясопептонном агаре, |
Среда Эндо | XLD-агар | Полимиксиновая среда |
 |
 |
 |
|
| Стафилококковый агар | Мясопептонный агар | Колумбийский кровяной агар | |
 |
 |
 |
| Яйцесклад,
пробы №№ 12-14 Рост культуры Staphylococcus spp. в пробе № 12 на стафилококковом агаре, МПА, колумбийском кровяном агаре. Рост культуры Bacillus spp. в пробе № 13 на среде Эндо, стафилококковом агаре, мясопептонном агаре, колумбийском кровяном агаре. Рост культуры Enterococcus spp. на полимиксиновой среде, |
Среда Эндо | XLD-агар | Полимиксиновая среда |
 |
 |
 |
|
| Стафилококковый агар | Мясопептонный агар | Колумбийский кровяной агар | |
 |
 |
 |
| Яйцесклад,
пробы №№ 15-17 Рост культуры Staphylococcus spp. в пробе № 15 на полимиксиновой среде, стафилококковом агаре, мясопептонном агаре, колумбийском кровяном агаре. Рост культуры Enterococcus spp. в пробе № 16 на всех средах. Рост культуры Escherichia coli в пробе № 17 на среде Эндо, XLD-агаре, мясопептонном агаре |
Среда Эндо | XLD-агар | Полимиксиновая среда |
 |
 |
 |
|
| Стафилококковый агар | Мясопептонный агар | Колумбийский кровяной агар | |
 |
 |
 |
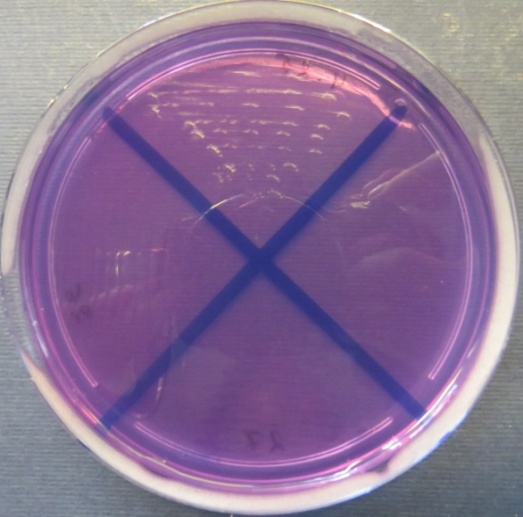
| Инкубаторий,
пробы №№ 18-21 Отсутствие роста микрофлоры в пробах №№ 20-21 на всех средах. Рост культуры Klebsiella spp. в пробе № 18 на среде Эндо, XLD-агаре, полимиксиновой среде, мясопептонном агаре |
Среда Эндо | XLD-агар | Полимиксиновая среда |
 |
 |
 |
|
| Стафилококковый агар | Мясопептонный агар | Колумбийский кровяной агар | |
 |
 |
 |
| Инкубаторий,
пробы №№ 22-24 Отсутствие роста микрофлоры в пробе № 24 на всех средах. Рост культуры Bacillus spp. в пробе № 22 на среде Эндо, стафилококковом агаре, мясопептонном агаре, колумбийском кровяном агаре. Рост культуры Enterococcus spp. в пробе № 23 на среде Эндо, XLD-агаре, полимиксиновой среде, мясопептонном агаре |
Среда Эндо | XLD-агар | Полимиксиновая среда |
 |
 |
 |
|
| Стафилококковый агар | Мясопептонный агар | Колумбийский кровяной агар | |
 |
 |
 |
| Инкубаторий,
пробы №№ 25-27 Отсутствие роста микрофлоры в пробах №№ 25, 27 на всех средах. Рост культуры Staphylococcus spp. в пробе № 26 на стафилококковом агаре, мясопептонном агаре |
Среда Эндо | XLD-агар | Полимиксиновая среда |
 |
 |
 |
|
| Стафилококковый агар | Мясопептонный агар | Колумбийский кровяной агар | |
 |
 |
 |
| Пробы №№ 28-29
Сердце и печень вынужденно убитого индюшонка (бригада № 3, корпус 6/1) Рост единичных колоний Enterococcus spp. и Staphylococcus spp. в пробах 28-29 на мясопептонном агаре, колумбийском кровяном агаре |
Среда Эндо | XLD-агар | Полимиксиновая среда |
 |
 |
 |
|
| Стафилококковый агар | Мясопептонный агар | Колумбийский кровяной агар | |
 |
 |
 |
| Проба № 30
Слепой отросток вынужденно убитого индюшонка (бригада № 3, корпус 6/1) Рост культуры Escherichia coli в пробе № 30 на среде Эндо, XLD-агаре, мясопептонном агаре, колумбийском кровяном агаре. Рост культуры Enterococcus spp. в пробе № 30 на среде Эндо, XLD-агаре, полимиксиновой среде, мясопептонном агаре |
Среда Эндо | XLD-агар | Полимиксиновая среда |
 |
 |
 |
|
| Стафилококковый агар | Мясопептонный агар | Колумбийский кровяной агар | |
 |
 |
 |
| Убойный цех,
пробы №№ 31-34 Рост культуры Proteus vulgaris в пробах №№ 31, 33 на среде Эндо. Рост культуры Escherichia coli в пробе №34 на среде Эндо, XLD-агаре, МПА, колумбийском кровяном агаре. Рост единичных колоний Enterococcus spp. во всех пробах на XLD-агаре, полимиксиновой среде, МПА, колумбийском кровяном агаре. Отсутствие роста стафилококков во всех пробах |
Среда Эндо | XLD-агар | Полимиксиновая среда |
 |
 |
 |
|
| Стафилококковый агар | Мясопептонный агар | Колумбийский кровяной агар | |
 |
 |
 |
| Убойный цех,
пробы 35-38 Рост культур Escherichia coli во всех пробах на среде Эндо, XLD-агаре, МПА, колумбийском кровяном агаре. Рост единичных колоний Enterococcus spp. во всех пробах на XLD-агаре, полимиксиновой среде, МПА, колумбийском кровяном агаре. Отсутствие роста стафилококков во всех пробах на стафилококковом агаре |
Среда Эндо | XLD-агар | Полимиксиновая среда |
 |
 |
 |
|
| Стафилококковый агар | Мясопептонный агар | Колумбийский кровяной агар | |
 |
 |
 |
| Убойный цех,
пробы: 43, 39, 40 Рост культур Escherichia coli во всех пробах на среде Эндо, XLD-агаре, МПА, колумбийском кровяном агаре. Рост единичных колоний Enterococcus spp. во всех пробах на XLD-агаре, полимиксиновой среде, МПА, колумбийском кровяном агаре. Отсутствие роста стафилококков во всех пробах на стафилококковом агаре |
Среда Эндо | XLD-агар | Полимиксиновая среда |
 |
 |
 |
|
| Стафилококковый агар | Мясопептонный агар | Колумбийский кровяной агар | |
 |
 |
 |
| Убойный цех,
пробы: 32, 42, 41 Рост культур Escherichia coli во всех пробах на среде эндо, XLD-агаре, мясопептонном агаре, колумбийском кровяном агаре. Рост единичных колоний Enterococcus spp. во всех пробах на XLD-агаре, полимиксиновой среде, МПА, колумбийском кровяном агаре. Отсутствие роста стафилококков во всех пробах на стафилококковом агаре |
Среда Эндо | XLD-агар | Полимиксиновая среда |
 |
 |
 |
|
| Стафилококковый агар | Мясопептонный агар | Колумбийский кровяной агар | |
 |
 |
 |
| Сперма индюков
(бригада 1, корпуса 1, 3), пробы №№ 44-47 Рост культур Escherichia coli во всех пробах на среде Эндо, XLD-агаре, МПА, колумбийском кровяном агаре. Рост культур Enterococcus spp. во всех пробах на XLD-агаре, полимиксиновой среде, МПА, колумбийском кровяном агаре. Отсутствие роста стафилококков во всех пробах на стафилококковом агаре |
Среда Эндо | XLD-агар | Полимиксиновая среда |
 |
 |
 |
|
| Стафилококковый агар | Мясопептонный агар | Колумбийский кровяной агар | |
 |
 |
 |
| Сперма индюков
(бригада 1, корпуса 1, 3), пробы №№ 48-50 Рост культур Escherichia coli во всех пробах на среде Эндо, XLD-агаре, МПА, колумбийском кровяном агаре. Рост культур Enterococcus spp. во всех пробах на XLD-агаре, полимиксиновой среде, МПА, колумбийском кровяном агаре. Отсутствие роста стафилококков во всех пробах на стафилококковом агаре |
Среда Эндо | XLD-агар | Полимиксиновая среда |
 |
 |
 |
|
| Стафилококковый агар | Мясопептонный агар | Колумбийский кровяной агар | |
 |
 |
 |
| Помёт индюков
(бригада 1, корпуса 1, 3), проба №51 Рост культуры Escherichia coli в пробе № 52 на среде Эндо, XLD-агаре, МПА, колумбийском кровяном агаре Рост культуры Enterococcus spp. на XLD-агаре, полимиксиновой среде, колумбийском кровяном агаре. Рост единичных колоний Staphylococcus spp. на стафилококковом агаре |
Среда Эндо | XLD-агар | Полимиксиновая среда |
 |
 |
 |
|
| Стафилококковый агар | Мясопептонный агар | Колумбийский кровяной агар | |
 |
 |
 |
| Помёт индюков
(бригада 1, корпуса 1, 3), проба №52 Рост культуры Escherichia coli в пробе № 52 на среде Эндо, XLD-агаре, МПА, колумбийском кровяном агаре Рост культуры Enterococcus spp. на XLD-агаре, полимиксиновой среде, колумбийском кровяном агаре. Рост единичных колоний Staphylococcus spp. на стафилококковом агаре |
Среда Эндо | XLD-агар | Полимиксиновая среда |
 |
 |
 |
|
| Стафилококковый агар | Мясопептонный агар | Колумбийский кровяной агар | |
 |
 |
 |
Рост культур Escherichia coli с выраженным металлическим блеском на среде Эндо (фото-блок 24)
| Проба № 17 | Проба № 30 | Проба № 34 | Пробы № 37-38 |
 |
 |
 |
 |
| Пробы № 39-40 | Пробы № 42-41 | Пробы № 48-49-50 | Проба № 52 |
 |
 |
 |
 |
Рост культур бацилл и стафилококка с выраженными зонами гемолиза
на колумбийском кровяном агаре (фото-блок 25)
| Bacillus spp. проба № 10 | Bacillus spp. проба № 13 |
 |
 |
| Bacillus spp. проба № 22 | Staphylococcus spp. проба № 26 |
 |
 |
Рост культур энтеробактерий разных видов
на трёхсахарном агаре Олькеницкого, среде Клиглера, среде Ресселя и среде Симмонса (фото-блок 26)
| Klebsiella проба № 18 | Escherichia coli проба № 30 | Escherichia coli проба № 48 | Proteus vulgaris проба № 33 |
 |
 |
 |
 |
| Утилизация глюкозы с образованием кислоты и газа, отсутствие образования сероводорода, наличие уреазы, утилизация цитрата натрия (меняет цвет среды Симмонса с зелёного на синий) | Утилизация глюкозы и лактозы с образованием кислоты и газа, отсутствие уреазы и сероводорода, отсутствие утилизации цитрата натрия (не меняет цвет среды Симмонса с зелёного на синий) | Утилизация глюкозы и лактозы с образованием кислоты и газа, отсутствие уреазы и сероводорода, отсутствие утилизации цитрата натрия (не меняет цвет среды Симмонса с зелёного на синий) | Утилизация глюкозы с образованием кислоты без газа, образование уреазы и сероводорода, отсутствие утилизации цитрата натрия
(не меняет цвет среды Симмонса с зелёного на синий) |
Микроорганизмы разных видов, выделенные с различных объектов, под микроскопом (фото-блок 27)
| Bacillus spp. проба № 10 | Bacillus spp. проба № 22 | Escherichia coli проба № 48 | Enterococcus проба № 46 |
 |
 |
 |
 |
| Staphylococcus проба № 5 | Staphylococcus проба № 5 | Staphylococcus проба № 15 | Staphylococcus проба №26 |
 |
 |
 |
 |
1.2.3.5 Результаты определения чувствительности микроорганизмов разных видов к антибактериальным препаратам
У 17 культур разных видов, выделенных из всех объектов, была изучена чувствительность к антибактериальным препаратам разных групп: пенициллины – ампициллин, амоксициллин, амоксиклав; тетрациклины – доксициклин, тетрациклин; аминогликозиды – гентамицин, неомицин, стрептомицин; макролиды – тилозин, тилмикозин; амфениколы — левомицетин, флорфеникол; линкозамиды – линкомицин; фторхинолоны – левофлоксацин, норфлоксацин, офлоксацин, ципрофлоксацин, энрофлоксацин; полипептиды — колистин; плевромутилины – тиамулин; сульфаниламиды – котримоксазол.
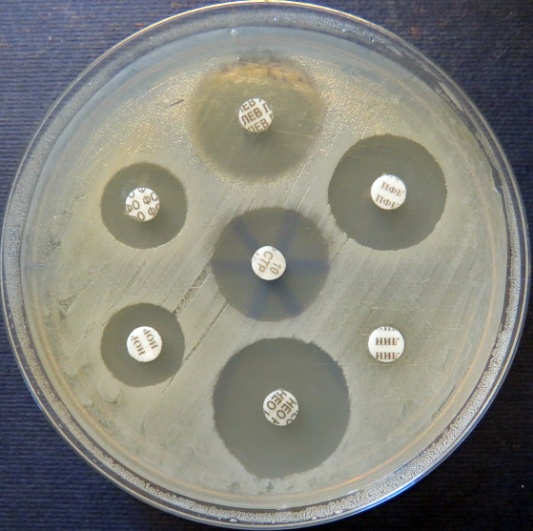
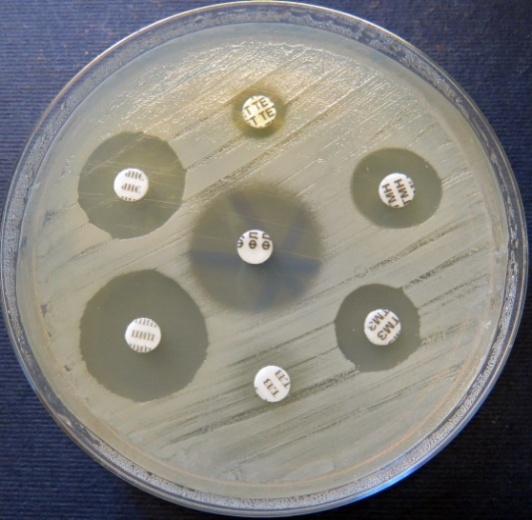
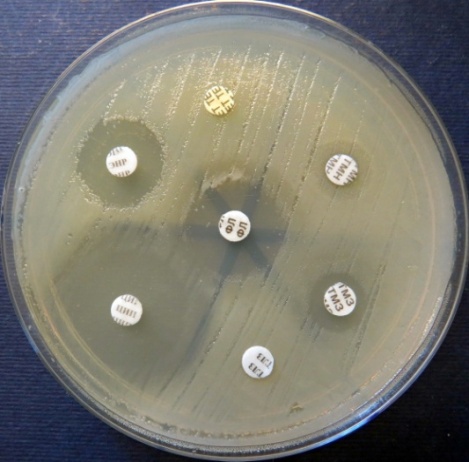
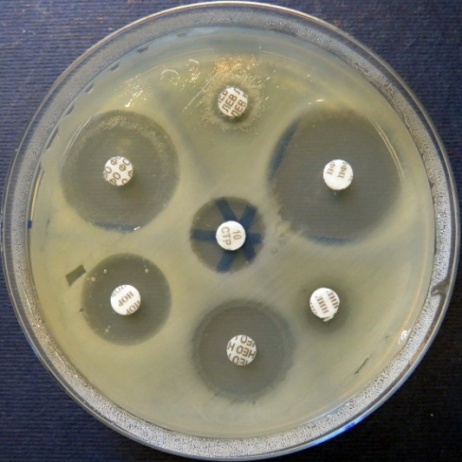
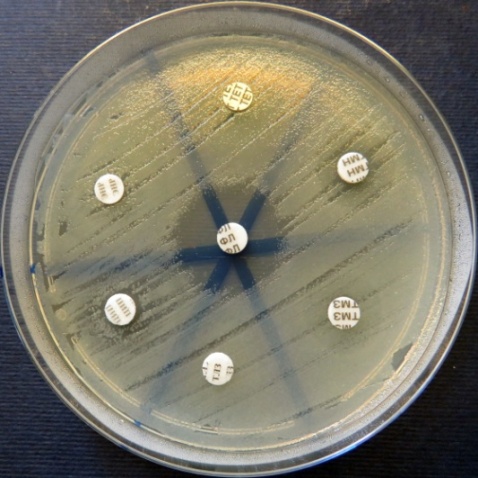
Результаты определения чувствительности микроорганизмов разных видов к антибактериальным препаратам методом дисков представлены в таблице 2 и фото-блоке 28 (зоны задержки роста в мм).
Таблица 2
Определение чувствительности микроорганизмов разных видов
к антибактериальным препаратам методом дисков на среде Мюллера-Хинтона, зоны задержки роста в мм
| Амоксиклав (13/14-17/18) | Амоксициллин (14/15-20/21) | Ампициллин (13/14-16/17) | Гентамицин (12/13-14/15) | Доксициклин (12/13-15/16) | Колистин (11/12-14/15) | Котримоксазол (10/11-15/16) | Левомицетин (12/13-17/18) | Левофлоксацин (13/14-16/17) | Линкомицин (17/18-20/21) | Неомицин (12/13-16/17) | Норфлоксацин (12/13-16/17) | Офлоксацин (12/13-15/16) | Стрептомицин (11/12-14/15) | Тетрациклин (14/15-18/19) | Тиамулин | Тилмикозин (10/11-13/14) | Тилозин (13/14-20/21) | Флорфеникол (14/15-18/19) | Ципрофлоксацин (15/16-20/21) | Энрофлоксацин (17/18-21/22) | |
| Staphylococcus № 5 | 29 | 24 | 23 | 25 | 30 | 12 | 0 | 26 | 28 | 11 | 22 | 23 | 22 | 21 | 25 | 15 | 18 | 21 | 29 | 27 | 26 |
| Enterococcus № 7 | 23 | 27 | 19 | 26 | 29 | 16 | 12 | 24 | 25 | 20 | 23 | 25 | 21 | 20 | 31 | 11 | 24 | 29 | 30 | 29 | 22 |
| Enterococcus № 8 | 26 | 24 | 26 | 19 | 9 | 0 | 0 | 24 | 18 | 10 | 19 | 14 | 9 | 9 | 7 | 26 | 0 | 0 | 24 | 17 | 14 |
| Bacillus spp. № 10 | 15 | 14 | 11 | 23 | 24 | 7 | 0 | 21 | 26 | 8 | 18 | 21 | 24 | 14 | 22 | 16 | 21 | 21 | 28 | 27 | 28 |
| Staphylococcus № 15 | 33 | 22 | 21 | 29 | 17 | 9 | 11 | 23 | 20 | 0 | 23 | 14 | 15 | 19 | 9 | 14 | 14 | 0 | 23 | 22 | 19 |
| Escherichia coli № 17 | 19 | 10 | 10 | 23 | 7 | 15 | 10 | 10 | 24 | 12 | 18 | 18 | 18 | 10 | 0 | 7 | 11 | 0 | 18 | 22 | 16 |
| Klebsiella spp. № 18 | 12 | 11 | 9 | 21 | 22 | 14 | 7 | 11 | 26 | 9 | 17 | 17 | 24 | 14 | 17 | 0 | 16 | 7 | 0 | 27 | 24 |
| Bacillus spp. № 22 | 29 | 28 | 25 | 24 | 28 | 14 | 23 | 25 | 33 | 31 | 21 | 25 | 21 | 20 | 21 | 18 | 21 | 20 | 23 | 26 | 27 |
| Staphylococcus № 26 | 40 | 29 | 30 | 28 | 27 | 14 | 13 | 23 | 26 | 23 | 23 | 20 | 21 | 19 | 27 | 23 | 20 | 21 | 22 | 26 | 23 |
| Escherichia coli № 30 | 18 | 0 | 0 | 10 | 9 | 14 | 0 | 0 | 10 | 16 | 17 | 14 | 0 | 7 | 0 | 7 | 0 | 0 | 21 | 7 | 0 |
| Proteus vulgaris № 33 | 20 | 0 | 10 | 22 | 0 | 0 | 9 | 9 | 18 | 9 | 20 | 19 | 14 | 12 | 7 | 0 | 0 | 0 | 28 | 21 | 11 |
| Escherichia coli № 36 | 14 | 7 | 10 | 20 | 21 | 15 | 7 | 23 | 23 | 0 | 19 | 17 | 19 | 15 | 25 | 0 | 0 | 0 | 24 | 23 | 21 |
| Escherichia coli № 39 | 12 | 11 | 8 | 15 | 20 | 15 | 11 | 24 | 22 | 7 | 18 | 20 | 21 | 10 | 23 | 0 | 7 | 0 | 26 | 22 | 23 |
| Enterococcus № 46 | 30 | 21 | 18 | 13 | 13 | 0 | 0 | 23 | 15 | 0 | 15 | 13 | 12 | 7 | 12 | 14 | 0 | 0 | 25 | 16 | 18 |
| Escherichia coli № 48 | 23 | 22 | 20 | 22 | 21 | 16 | 24 | 25 | 32 | 16 | 19 | 30 | 29 | 18 | 22 | 13 | 9 | 11 | 23 | 33 | 30 |
| Staphylococcus № 51 | 15 | 17 | 12 | 20 | 11 | 7 | 7 | 10 | 20 | 14 | 20 | 15 | 16 | 10 | 9 | 19 | 0 | 0 | 14 | 21 | 20 |
| Escherichia coli № 52 | 19 | 7 | 7 | 19 | 9 | 14 | 0 | 7 | 10 | 10 | 18 | 15 | 7 | 7 | 0 | 7 | 0 | 0 | 23 | 8 | 7 |
Определение чувствительности микроорганизмов разных видов
к антибактериальным препаратам методом дисков на среде Мюллера-Хинтона (фото-блок 28)
| Staphylococcus проба № 5 | Staphylococcus проба № 5 | Staphylococcus проба № 15 | Staphylococcus проба № 15 |
 |
 |
 |
 |
| Escherichia coli проба №17 | Klebsiella проба №18 | Staphylococcus проба № 26 | Escherichia coli проба №30 |
 |
 |
 |
 |
1.2.3.6 Заключение.
Из проб патологического материала, взятого с разных производственных объектов СГЦ СКЗОСП, выделена условно-патогенная микрофлора различных видов: культуры кишечной палочки, энтеробактерий, энтерококков, стафилококков.
Культуры патогенной респираторной микрофлоры (орнитобактерий, бордетелл) не выделены.
Культуры сальмонелл, синегнойной палочки, клостридий и другой патогенной микрофлоры не выделены ни в одном случае.
1.2.4 Результаты эпизоотологического обследования фермерского перепелиного хозяйства.
1.2.4.1 Обоснование выбора направления исследований
Перепелиные хозяйства разных форм собственности получили активное развитие в последнее время. Следствием этого явилась возрастающая популярность у населения диетических продуктов питания: яиц и мяса перепелов. Перепелиные яйца отличаются высокой антибактериальной активностью, что делает их востребованными при лечении и профилактике инфекционных заболеваний ротовой полости, гортани, пищевода, желудка у взрослых людей и у детей. Перепела сравнительно устойчивы к инфекционным болезням птиц вирусной этиологии и не требуют напряженных схем профилактической вакцинации. Особенно, в том случае, если инкубационное яйцо и молодняк получены от здорового родительского поголовья перепелов. Вместе с тем, следует отметить восприимчивость перепелов разного возраста к патогенным и условно-патогенным бактериальным возбудителям, в том числе: Escherichia coli, Clostridium perfringens, Staphylococcus spp., возбудителям семейства Enterobacteriaceae. Названные патогены, в основном, поражают внутренние органы птицы, вызывая дуоденит, панкреатит, гепатит, гепатоз. Патология сопровождается снижением яичной продуктивности перепелов, повышенным отходом птицы. В связи с этим, перед исполнителями стояла задача провести эпизоотологическое обследование одного или нескольких перепелиных птицехозяйств. Получить клинический патматериал, провести бактериологическое исследование, выделить возбудителей и изучить их чувствительность к антибактериальным препаратам.
1.2.4.2 Материалы и методы исследований
Бактериологические исследования проводили на основе материалов и методов, изложенных в п.п. 1.2.2. Дополнительно использовали другие, общепринятые в ветеринарной практике микробиологические методы лабораторного анализа на искусственных питательных средах для культивирования разных видов микроорганизмов.
1.2.4.3 Результаты патологоанатомического вскрытия перепелов
У павших и убитых с диагностической целью перепелок 184-дневного возраста обнаружены в результате патологоанатомического вскрытия признаки поражения во внутренних органах: печени, различных отделах кишечника, поджелудочной железе. Фактически выявлены: панкреатит, геморрагический дуоденит (фото 31), энтерит (у всех 5 трупов) (фото 29-33), увеличенная печень (в одном случае, фото 31), гепатоз (в трёх случаях, фото 30).
1.2.4.4 Результаты бактериологического исследования патматериала и обсуждение
Были сделаны высевы из внутренних органов (сердца, печени) от всех трупов; тонкого и толстого отделов кишечника (от трёх трупов).
Из внутренних органов выделена кокковая микрофлора – 4 культуры Staphylococcus spp. из печеней 2-й, 4-й и 5-й перепёлок, сердца 3-й перепёлки (фото 34).
Из кишечника выделены 2 культуры Escherichia coli – из тощей (фото 33) и слепой кишок 5-й перепёлки; и одна условно-патогенная культура семейства Enterobacteriaceae (идентификация культуры продолжается) из двенадцатиперстной кишки 4-й перепёлки.
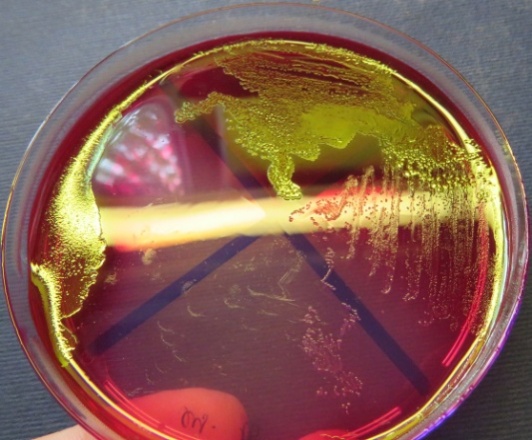
Из двенадцатиперстных кишок 3-й и 4-й перепёлок (фото) и тощей кишки 5-й перепёлки (фото 35, 36) выделены культуры Clostridium perfringens.
Выделение культур Clostridium perfringens из тонких отделов кишечника (двенадцатиперстной и тощей кишок) свидетельствует о развитии у птиц анаэробной энтеротоксемии. Вследствие повсеместного распространения Cl.perfringens заселяет толстый кишечник птиц с первых дней жизни, но при нормальном протекании процесса пищеварения носительство в толстом кишечнике не вызывает заболевания, а условия в тонком кишечнике неблагоприятны для активного размножения клостридий. Поэтому здоровая птица, являясь чувствительной к заражению, не является восприимчивой к заболеванию анаэробной энтеротоксемией без воздействия предрасполагающих факторов. Вспышки анаэробной энтеротоксемии возникают либо при повторном заражении контаминированными кормами животного происхождения (рыбная мука и др.), либо вследствие распространения имеющихся в толстом кишечнике клостридий в тонкий отдел кишечника при какой-либо патологии (паразитарные, бактериальные, вирусные заболевания).
Cl.perfringens может находиться в кишечнике здоровых цыплят, не вызывая клинически выраженного заболевания, которое возникает при застое содержимого кишечника, повреждении слизистой оболочки, вызываемом различными патогенами, в том числе энтеробактериями. Факультативно-аэробные энтеробактерии, ассоциирующие с патогенными клостридиями, повышают вирулентность и токсигенность последних, способствуя быстрому и глубокому понижению окислительно-восстановительного потенциала среды и создавая этим необходимые условия для их активного размножения. Из кишечника выделено большое количество кишечной палочки и протея. Таким образом носительство условно-патогенных энтеробактерий является предрасполагающим фактором в развитии субклинической формы анаэробной энтеротоксемии у птиц. Этот факт следует учитывать при планировании противоэпизоотических мероприятий.
1.2.4.5 Результаты определения чувствительности выделенных микроорганизмов к антибактериальным препаратам
Культура сем. Enterobacteriaceae (выделенная из двенадцатиперстной кишки 4-й перепёлки) чувствительна к линкоспектину, левомицетину, флорфениколу, энрофлоксацину, котримоксазолу, карифлоксу, фурадонину, ципрофлоксацину, гентамицину, неомицину; имеет среднюю чувствительность к фуразолидону, доксициклину, стрептомицину, флумеквину, полимиксину, колистину, каридоксу; слабочувствительна к тилозину; устойчива к окситетрациклину, ампициллину, пенициллину, линкомицину, тетрациклину, эритромицину, амоксициллину, тиамулину, каримоксу.
Культура Escherichia coli (выделенная из тощей кишки 5-й перепёлки) высокочувствительна к карифлоксу; чувствительна к доксициклину, флорфениколу, энрофлоксацину, тетрациклину, окситетрациклину, линкоспектину, ципрофлоксацину, каридоксу; имеет среднюю чувствительность к каримоксу, котримоксазолу, стрептомицину, флумеквину, полимиксину, колистину, гентамицину, неомицину, ампициллину, левомицетину, линкомицину; слабочувствительна к тилозину, эритромицину, амоксициллину; устойчива к бензилпенициллину, фурадонину, фуразолидону, тиамулину.
Культура Escherichia coli (выделенная из слепого отростка 5-й перепёлки) чувствительна к энрофлоксацину, карифлоксу, ципрофлоксацину, флорфениколу, котримоксазолу, флумеквину, каридоксу, линкоспектину, гентамицину; имеет среднюю чувствительность к каримоксу, доксициклину, ампициллину, стрептомицину, фурадонину, колистину; слабочувствительна к неомицину, фуразолидону, полимиксину, линкомицину, амоксициллину; устойчива к тетрациклину, тилозину, бензилпенициллину, левомицетину, эритромицину, окситетрациклину.
Культура Staphylococcus spp. (выделенная из сердца 3-й перепёлки) высокочувствительна к каридоксу, доксициклину, тетрациклину, окситетрациклину, энрофлоксацину, линкоспектину, тиамулину; чувствительна к флорфениколу, левомицетину, ципрофлоксацину, бензилпенициллину, флумеквину, каримоксу, неомицину, фурадонину, ампициллину, линкомицину, стрептомицину, тилозину, гентамицину; имеет среднюю чувствительность к фуразолидону, котримоксазолу, колистину, амоксициллину, полимиксину; устойчива к эритромицину.
Культура Staphylococcus spp. (выделенная из печени 4-й перепёлки) высокочувствительна к флумеквину, флорфениколу, карифлоксу; чувствительна к каридоксу, энрофлоксацину, тетрациклину, доксициклину, тиамулину, ципрофлоксацину, окситетрациклину, линкоспектину, эритромицину, гентамицину, ампициллину, бензилпенициллину, левомицетину, линкомицину, стрептомицину, фуразолидону, неомицину; имеет среднюю чувствительность к фурадонину, тилозину, полимиксину, каримоксу, амоксициллину, колистину.
Культура Staphylococcus spp. (выделенная из двенадцатиперстной кишки 5-й перепёлки) чувствительна к флорфениколу, линкоспектину, гентамицину, фурадонину, флумеквину, неомицину; имеет среднюю чувствительность к фурадонину, бензилпенициллину, каримоксу, ампициллину, карифлоксу, энрофлоксацину, стрептомицину, тилозину; слабочувствительна к полимиксину, амоксициллину, колистину, ципрофлоксацину, каридоксу, доксициклину, левомицетину, линкомицину, эритромицину; устойчива к тетрациклину, окситетрациклину, котримоксазолу, тиамулину.
Фото 29
Панкреатит и дуоденит, увеличенная печень у 3-й перепёлки
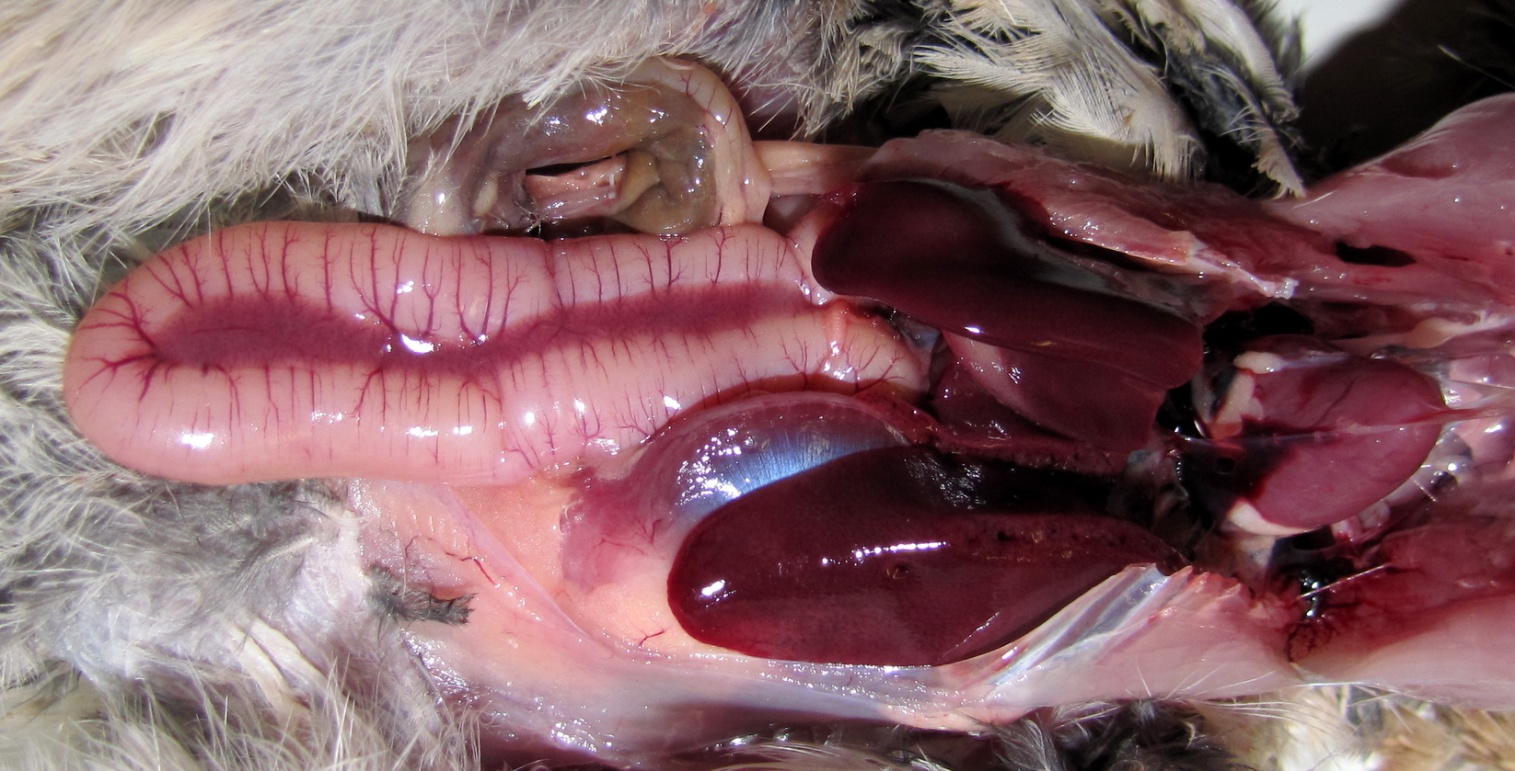
Фото 30
Гепатоз у 4-й перепёлки
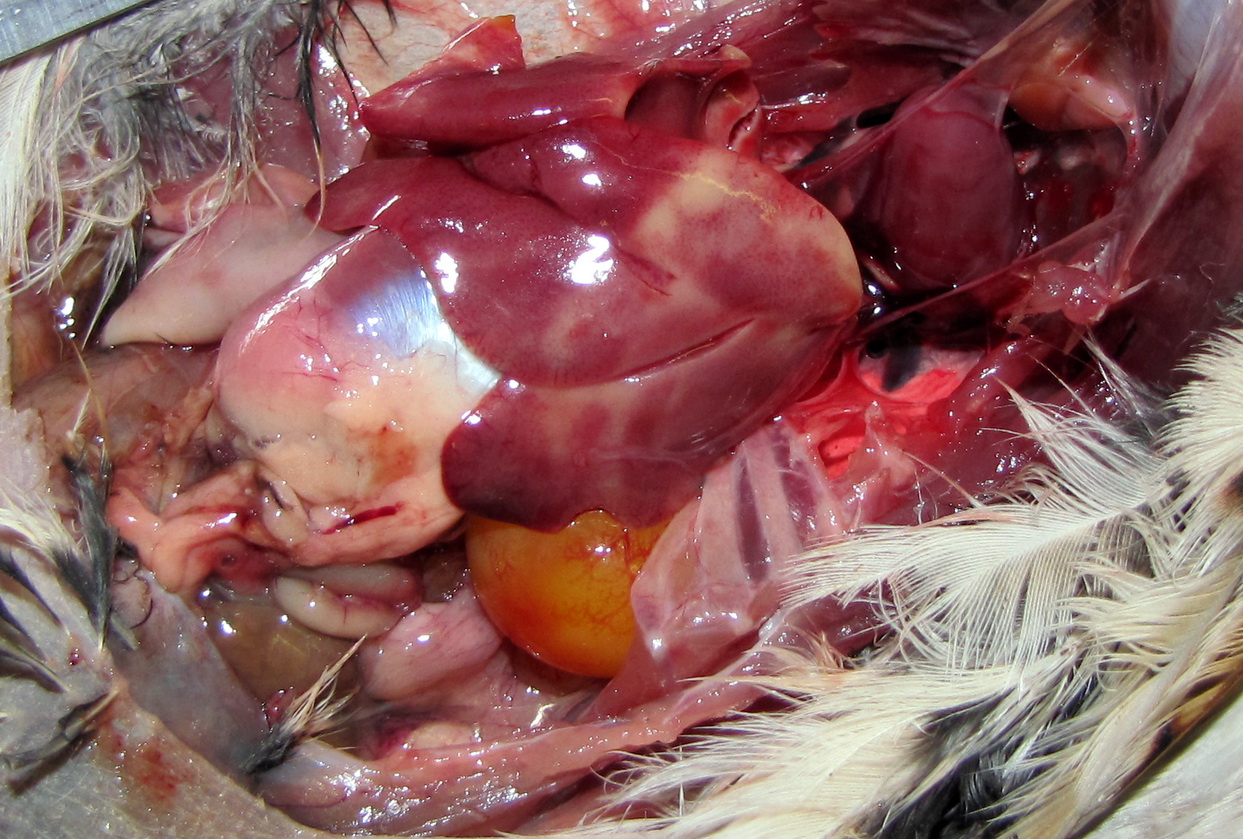
Фото 31
Панкреатит и дуоденит у 5-й перепёлки
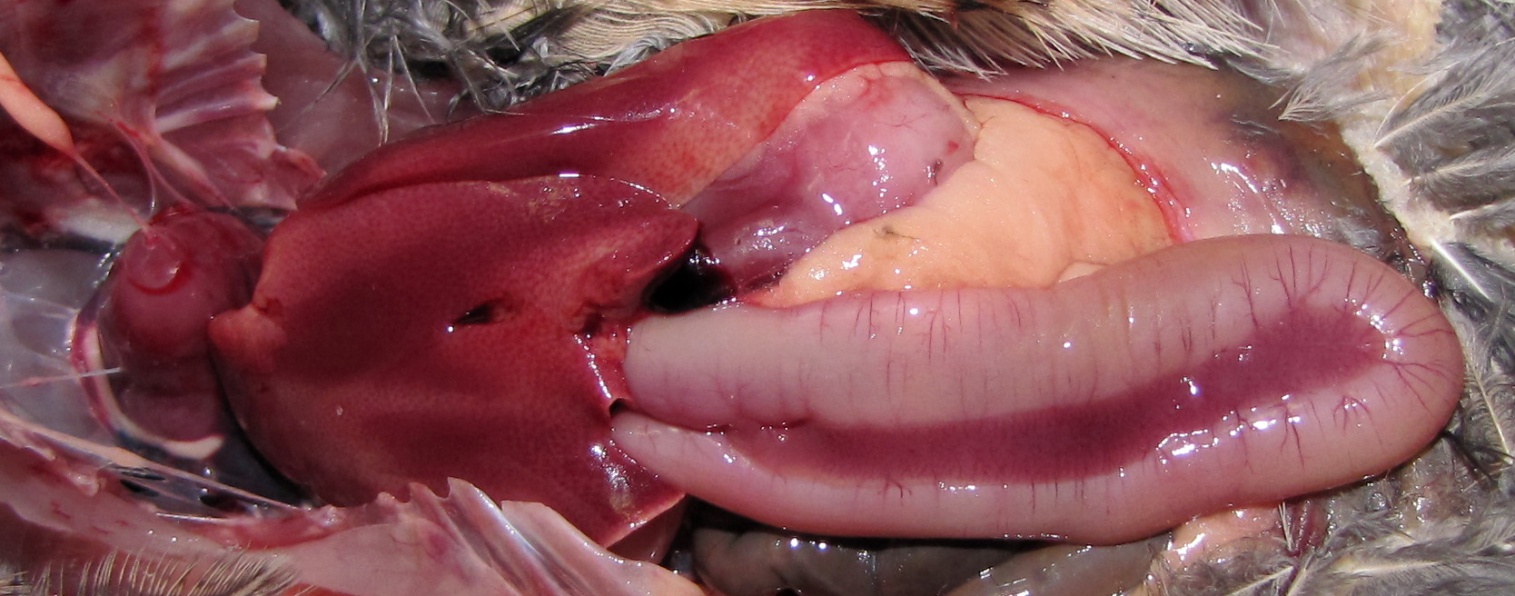
Фото 32
Воспаление слепых отростков у 5-й перепёлки
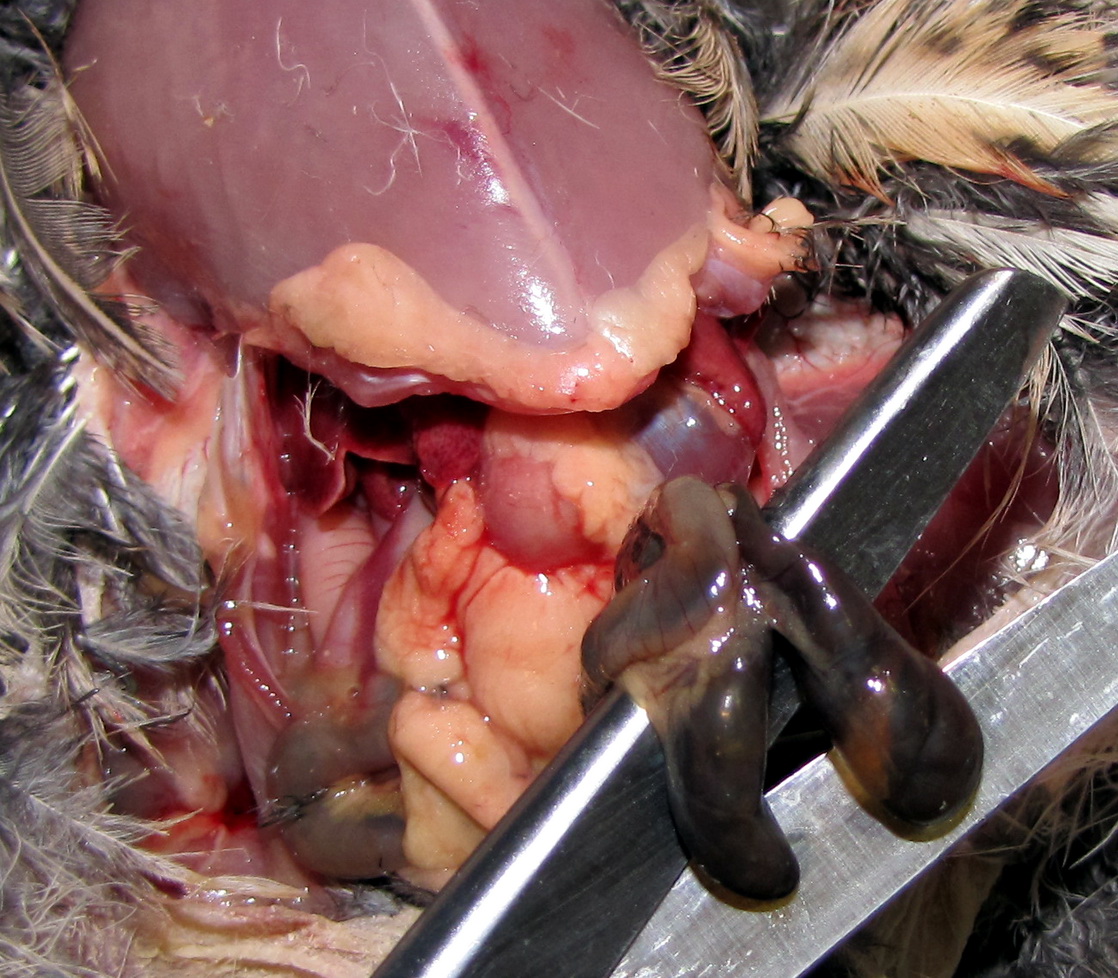
Фото 33
Рост культуры Escherichia coli, выделенной из слепой кишки
у 5-й перепёлки, на среде Эндо
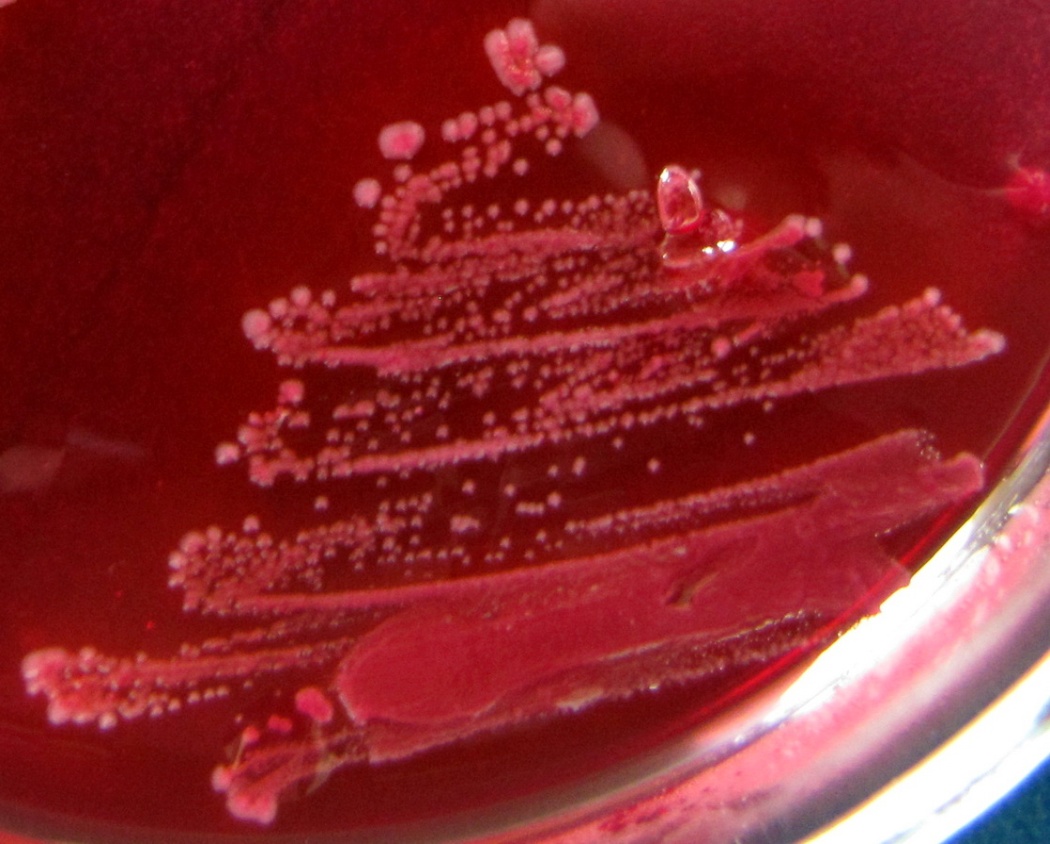
Фото 34
Рост культур Staphylococcus spp., выделенных из печени 2-й перепёлки
и сердца 3-й перепёлки, на стафилококковом агаре
Фото 35
Рост культур Clostridium perfringens, выделенных из двенадцатиперстных кишок у 3-й и 4-й перепёлок, на среде Вильсон-Блера (почернение среды и газообразование)

Фото 36
Рост культуры Clostridium perfringens,
выделенных из тощей кишки у 5-й перепёлки, на среде Вильсон-Блера
(почернение среды и сильное газообразование)

1.2.4.6 Заключение.
Выявлена незначительная инфицированность перепёлок кокковой микрофлорой. Из тонкого отдела кишечника выделены культуры Clostridium perfringens (двенадцатиперстной и тощей кишок), что свидетельствует о развитии у птиц анаэробной энтеротоксемии. Необходимо провести мероприятия по борьбе с данной инфекцией.
1.2.5 Результаты эпизоотологического обследования фермерского хозяйства по откорму цыплят-бройлеров
1.2.5.1 Обоснование выбора направления исследований
Фермерское хозяйство расположено в Гатчинском районе Ленинградской области. Занимается откормом цыплят-бройлеров по двум технологиям: а) от суточного возраста до 18-20 дневного (цыплята-корнишоны); б) от суточного возраста до 49-дневного. Содержание птицы – напольное, в приспособленном помещении. Общее количество бройлеров в одной партии составляет 2400-2500 голов. Своего родительского стада птицы в хозяйстве нет. Комплектация суточным молодняком осуществляется из ЗАО птицефабрика «Войсковицы» или ЗАО птицефабрика «Северная» (фото 38, 39). Для кормления бройлеров в хозяйстве используют готовые корма производства Кировского комбикормового завода Ленинградской области, в соответствии с технологическими нормами для кросса «Росс 308» (фото 37). В отдельных случаях в рацион дополнительно включают витаминно-минеральные премиксы и/или травяную муку. Не смотря на сравнительно малое поголовье, в хозяйстве отмечаются различные болезни птиц, в основном, бактериальной этиологии, сопровождающиеся поражением различных внутренних органов птиц. Патология сопровождается снижением привесов, увеличенным отходом цыплят-бройлеров. Падеж птицы отмечается после 20-24 — суточного возраста. В связи с этим, в задачу исследований входило проведение эпизоотологического обследования хозяйства, патологоанатомическое вскрытие трупов и вынужденно забитых цыплят, взятие патматериала с признаками патологии и проведение лабораторных диагностических исследований по выделению возбудителей болезней, их идентификации, изучению чувствительности к антибактериальным средствам и предложению рекомендаций по лечению и профилактике выявленных болезней.
1.2.5.2 Материалы и методы исследований
Бактериологические исследования проводили на основе общепринятых в ветеринарной практике микробиологических методов лабораторного анализа с использование искусственных питательных сред. С целью выделения, идентификации и дифференциации выделенных культур микроорганизмов использовали дифференциально-диагностические питательные среды: МПБ, МПА, среду Эндо, XLD-агар, колумбийский кровяной агар. Для дифференциации культуры Salmonella Enteritidis использовали диагностическую сальмонеллезную сыворотку поливалентную АВСDE и моновалентную 0-9 и Hmg. Для определения чувствительности культуры Pseudomonas aeruginosa к антибактериальным препаратам использовали среду Мюллера-Хинтона.
1.2.5.3 Результаты патологоанатомического вскрытия цыплят-бройлеров
В ходе патологоанатомического вскрытия цыплят разного возраста, павших в разные сроки и убитых по окончании откорма, выявлены следующие патизменения: катаральная пневмония, увеличенная печень, некрозы на печени, гипоплазия селезёнки, фибринозный перикардит и перигепатит, перитонит, дуоденит, точечные кровоизлияния на двенадцатиперстной кишке, энтерит, геморрагическое воспаление слепых отростков, панкреатит, анемия.
По результатам скрытия павших цыплят бройлеров в возрасте 28 дней был обнаружен фибринозный перикардит, и перигепатит (фото 40-42), фибринозный перитонит (фото 43). У трупов цыплят-бройлеров в возрасте 30 и 31 день выявлен фибринозный перикардит, перигепатит, дуоденит (фото 44, 45). У цыплят, павших в возрасте 45 дней был обнаружен дуоденит, панкреатит, энтерит (фото 46, 47)
Сводные данные выявленных патологоанатомических изменений у павших цыплят-бройлеров представлены в таблице 3.
Фото 37
Корм для цыплят-бройлеров

Фото 38
Суточные цыплята-бройлеры в фермерском хозяйстве

Фото 39
Суточные цыплята-бройлеры в фермерском хозяйстве

Фото 40
Фибринозный перикардит и перигепатит павшего 28-дневного цыплёнка-бройлера в фермерском хозяйстве
Фото 41
Фибринозный перигепатит павшего 28-дневного
цыплёнка-бройлера в фермерском хозяйстве
Фото 42
Фибринозный перикардит и перигепатит павшего 28-дневного
цыплёнка-бройлера в фермерском хозяйстве
Фото 43
Фибринозный перитонит павшего 28-дневного
цыплёнка-бройлера в фермерском хозяйстве
Фото 44
Фибринозный перикардит и перигепатит, дуоденит
павшего 30-дневного цыплёнка-бройлера в фермерском хозяйстве
Фото 45
Фибринозный перикардит и перигепатит, дуоденит
павшего 31-дневного цыплёнка-бройлера в фермерском хозяйстве
Фото 46
Дуоденит, энтерит, панкреатит павшего 45-дневного
цыплёнка-бройлера в фермерском хозяйстве
Фото 47
Дуоденит, панкреатит павшего 45-дневного
цыплёнка-бройлера в фермерском хозяйстве
Таблица 3
Результаты бактериологического исследования цыплят, павших в течение опыта, и убитых по окончании опыта
(фермерское бройлерное птицехозяйство)
| № п/п | Возраст | № птицы | Орган | Выделенные культуры | Патологоанатомические изменения |
| 1 | 1 | 1 | Сердце | Pseudomonas aeruginosa | Макроскопические изменения не выявлены |
| 2 | Печень | Pseudomonas aeruginosa | |||
| 3 | 2 | 2 | Сердце | Escherichia coli | Катаральная пневмония |
| 4 | Печень | Pseudomonas aeruginosa
Escherichia coli |
|||
| 5 | 8 | 3 | Сердце | Escherichia coli
Staphylococcus spp. ед. |
Увеличенная печень
Дуоденит Панкреатит |
| 6 | Печень | Escherichia coli
Staphylococcus spp. ед. |
|||
| 7 | 4 | Сердце | Нет роста | Макроскопические изменения не выявлены | |
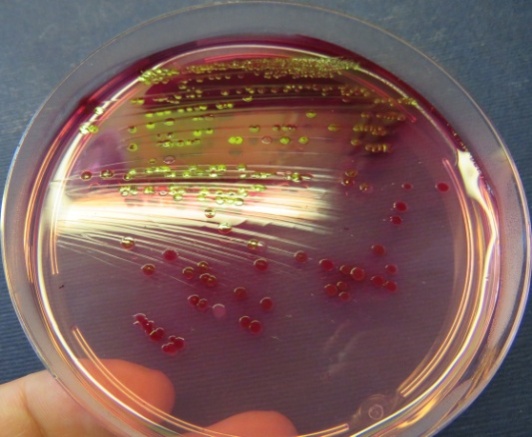
| 8 | Печень | Salmonella Enteritidis
Staphylococcus spp. ед. |
|||
| 9 | 15 | 5 | Сердце | Salmonella Enteritidis
Escherichia coli |
Макроскопические изменения не выявлены |
| 10 | Печень | Salmonella Enteritidis | |||
| 11 | 18 | 6 | Сердце | Salmonella Enteritidis | Макроскопические изменения не выявлены |
| 12 | Печень | Salmonella Enteritidis Proteus vulgaris
Escherichia coli Staphylococcus spp. ед. |
|||
| 13 | 25 | 7 | Сердце | Salmonella Enteritidis | Слабый дуоденит |
| 14 | Печень | Salmonella Enteritidis | |||
| 15 | 14 | Сердце | Enterococcus spp. | Дуоденит | |
| 16 | Печень | Escherichia coli ед. | |||
| 17 | 26 | 16 | Сердце | Escherichia coli ед. | Геморрагическое воспаление слепых отростков |
| 18 | Печень | Escherichia coli ед. | |||
| 19 | 27 | 13 | Сердце | Escherichia coli ед.
Proteus vulgaris |
Слабый дуоденит |
| 20 | Печень | Proteus vulgaris | |||
| 21 | 28 | 8 | Сердце | Salmonella Enteritidis | Слабый дуоденит |
| 22 | Печень | Escherichia coli ед. | |||
| 23 | 10 | Сердце | Нет роста | Макроскопические изменения не выявлены | |
| 24 | Печень | Escherichia coli ед. | |||
| 25 | 11 | Сердце | Enterococcus spp. | Макроскопические изменения не выявлены | |
| 26 | Печень | Escherichia coli ед. | |||
| 27 | 12 | Сердце | Нет роста | Макроскопические изменения не выявлены | |
| 28 | Печень | Нет роста | |||
| 29 | 15 | Сердце | Нет роста | Гипоплазия селезёнки | |
| 30 | Печень | Нет роста | |||
| 31 | 17 | Сердце | Escherichia coli | Фибринозный перикардит, перигепатит Дуоденит
Геморрагическое воспаление слепых отростков |
|
| 32 | Печень | Escherichia coli | |||
| 33 | 30 | 9 | Сердце | Escherichia coli | Фибринозный перикардит, перигепатит Перитонит |
| 34 | Печень | Escherichia coli | |||
| 35 | 31 | 18 | Сердце | Escherichia coli | Фибринозный перикардит
Некрозы на печени Дуоденит |
| 36 | Печень | Escherichia coli | |||
| 37 | 19 | Сердце | Salmonella Enteritidis Escherichia coli | Дуоденит | |
| 38 | Печень | Salmonella Enteritidis Escherichia coli | |||
| 39 | 20 | Сердце | Salmonella Enteritidis Escherichia coli | Слабый дуоденит
Геморрагическое воспаление слепых отростков |
|
| 40 | Печень | Salmonella Enteritidis | |||
| 41 | 21 | Сердце | Salmonella Enteritidis Escherichia coli | Анемия
Слабый дуоденит Геморрагическое воспаление слепых отростков |
|
| 42 | Печень | Salmonella Enteritidis Escherichia coli | |||
| 43 | 45 | 22 | Сердце | Нет роста | Дуоденит Энтерит
Панкреатит |
| 44 | Желчь | Нет роста | |||
| 45 | 23 | Сердце | Нет роста | Дуоденит Энтерит
Панкреатит |
|
| 46 | Печень | Нет роста | |||
| 47 | 49
(убой) |
24 | Сердце | Escherichia coli | Слабый дуоденит |
| 48 | Печень | Нет роста | |||
| 49 | 12-п кишка | Proteus vulgaris | |||
| 50 | 25 | Сердце | Bacillus spp. | Слабый дуоденит | |
| 51 | Печень | Нет роста | |||
| 52 | 26 | Сердце | Salmonella Gallinarum | Макроскопические изменения не выявлены | |
| 53 | Печень | Enterococcus spp. | |||
| 54 | 27 | Сердце | Escherichia coli | Дуоденит | |
| 55 | Печень | Proteus vulgaris | |||
| 56 | 12-п кишка | Proteus vulgaris | |||
| 57 | 28 | Сердце | Escherichia coli | Макроскопические изменения не выявлены | |
| 58 | Печень | Нет роста | |||
| 59 | 29 | Сердце | Нет роста | Макроскопические изменения не выявлены | |
| 60 | Печень | Нет роста | |||
| 61 | 30 | Сердце | Нет роста | Слабый дуоденит Энтерит | |
| 62 | Печень | Escherichia coli | |||
| 63 | 31 | Сердце | Enterococcus spp. | Слабый дуоденит | |
| 64 | Печень | Enterococcus spp. | |||
| 65 | 12-п кишка | Proteus vulgaris | |||
| 66 | 32 | Сердце | Bacillus spp. | Точечные кровоизлияния
на двенадцатиперстной кишке |
|
| 67 | Печень | Нет роста | |||
| 68 | 12-п кишка | Escherichia coli |
1.2.5.4 Результаты бактериологического исследования патматериала от цыплят-бройлеров
При бактериологическом исследовании внутренних органов – сердца, печени, кишечника были выделены культуры кишечной палочки Escherichia coli, синегнойной палочки Pseudomonas aeruginosa, сальмонелл двух серотипов – Salmonella Enteritidis и Salmonella Gallinarum, стафилококки, энтерококки (таблица). Выделенные культуры кишечной палочки были высоковирулентными, вызывали у цыплят-бройлеров характерные, яркие патологоанатомические признаками колибактериоза – фибринозный перикардит, перигепатит, перитонит.
Были изучены культуральные свойства выделенных культур микроорганизмов методом культивирования возбудителей на искусственных питательных средах. Получены следующие результаты. У культуры Pseudomonas aeruginosa, выделенной от суточных цыплят-бройлеров, выявлен характерный рост на МПА (фото 48) и на среде Эндо (фото 49), на ХLD-агаре (фото 50), на колумбийском агаре (фото 51). Культура Salmonella Enteritidis, выделенная из печени павшего 19-дневного цыпленка-бройлера, показала характерный рост на среде Эндо (фото 53) и XLD-агаре (фото 54). Выявлен характерный рост культур Escherichia coli, выделенной из сердца и печени цыпленка-бройлера, на среде Эндо (характерный металлический блеск, фото 57) и на XLD-агаре (фото 58). Культура Escherichia coli и Salmonella Enteritidis, выделенная из сердца и печени павших цыплят-бройлеров, также, показали характерный рост на среде эндо (фото 59, 60).
Для дифференциации выделенной культуры Salmonella Enteritidis были использованы диагностические сальмонеллезные сыворотки: поливалентная, АВСDE и моновалентная, 0-9 и Нmg. По результатам реакции агглютинации была подтверждена принадлежность выделенной культуры (фото 55, 56).
Патогенные культуры кишечной палочки, синегнойной палочки и сальмонеллы энтеритидис, выделенные из павших цыплят-бройлеров данного фермерского хозяйства, в дальнейшем были использованы в отдельном опыте для изучения иммунобиологических, в том числе, вирулентных свойств при заражении молодняка цыплят яичного кросса.
Фото 48
Рост культур Pseudomonas aeruginosa на МПА из сердца и печени
павшего суточного цыплёнка фермерского бройлерного хозяйства
Фото 49
Рост культур Pseudomonas aeruginosa на среде Эндо из сердца и печени
павшего суточного цыплёнка фермерского бройлерного хозяйства
Фото 50
Рост культур Pseudomonas aeruginosa на XLD-агаре из сердца и печени
павшего суточного цыплёнка фермерского бройлерного хозяйства
Фото 51
Рост культур Pseudomonas aeruginosa на колумбийском кровяном агаре из сердца и печени павшего суточного цыплёнка фермерского бройлерного хозяйства
Фото 52
Определение чувствительности культуры Pseudomonas aeruginosa
к антибактериальным препаратам тетрациклиновой группы
методом дисков на среде Мюллера-Хинтона
Фото53
Рост культуры Salmonella Enteritidis из печени павшего цыплёнка
на среде Эндо
Фото 54
Рост культуры Salmonella Enteritidis из печени павшего цыплёнка
на XLD-агаре
Фото 55
Положительная реакция агглютинации на стекле
с диагностической сальмонеллёзной сывороткой
поливалентной ABCDE культуры Salmonella Enteritidis
Фото 56
Положительная реакция агглютинации на стекле
с диагностической сальмонеллёзной сывороткой
моновалентной О-9 и Hmg культуры Salmonella Enteritidis
Фото57
Рост культур Escherichia coli с выраженным металлическим блеском
из сердца и печени павшего цыплёнка на среде Эндо
Фото 58
Рост культур Escherichia coli из сердца и печени павшего цыплёнка
на XLD-агаре
Фото 59
Рост культур Escherichia coli и Salmonella Enteritidis из сердца и печени павшего цыплёнка на среде Эндо
Фото 60
Рост культур Escherichia coli с выраженным металлическим блеском
из сердца и печени павшего цыплёнка на среде Эндо
1.2.5.5 Заключение.
В хозяйстве выявлена высокая инфицированность цыплят патогенной и условно-патогенной микрофлорой – кишечной и синегнойной палочками, сальмонеллами, кокковой микрофлорой. Было рекомендовано применение антибактериальных препаратов в соответствии с выявленной чувствительностью и усиление мероприятий по санации и дезинфекции помещений с использованием новых высокоэффективных дезинфицирующих средств.
Молекулярно-биологические исследования (ОТ-ПЦР) проводили с использованием комплекта реагентов «Рибо-сорб» и олиго нуклеотидных праймеров производства ООО «Бигль» (Санкт-Петербург). РНК из проб патматериала от каждой группы птиц выделяли методом афинной сорбции на силикагеле.
Для реакции секвенирования брали 50 нг ДНК, 5 pmol праймеров, набор «DYEnamic ET terminator kit». Определение нуклеотидной последовательности осуществляли по методу Сэнгера с использованием флуоресцентно меченых терминирующих нуклеотидов на секвенаторе АВI Prism3130 (Applied Biosystem, CШA) согласно инструкции изготовителя. Полученные нуклеотидные последовательности сравнивали с последовательностями штаммов опубликованными в международной базе данных NCBI (http://www.ncbi.nlm.nih.gov/) с помощью программы BioEdit, версия 7.0.5.3.
1.3 Изучение сравнительных биологических свойств изолятов и музейных штаммов возбудителей инфекционных болезней птиц для оценки изменчивости их культуральных, морфологических свойств, патогенности, устойчивости к факторам внешней среды и чувствительности к действию дезинфицирующих средств
1.3.1. Обоснование выбора направления исследований
Цель исследования состояла в сравнении выделенных «полевых» штаммов микроорганизмов и одноименных музейных штаммов и серовариантов по культуральным, морфологическим свойствам и вирулентности.
1.3.2. Материалы и методы исследований
Исследования были проведены на базе СПГУВМ в условиях инфекционного вивария. Для эксперимента использовали молодняк цыплят яичного кросса «Ломанн ЛСЛ-Классик». Цыплята были выведены из инкубационного яйца, полученного из племрепродуктора АО «Птицефабрика «Синявинская». Инкубацию и вывод цыплят проводили в инкубаторе отечественного производства «Стимул-ИП-16» (НПО «Стимул-Инк»). Условия содержания и плотность посадки, параметры микроклимата, освещённости, продолжительности светового дня, влажности, а также состав и питательность комбикормов на протяжении всего срока опыта соответствовали рекомендациям ФНЦ «ВНИТИП» РАН. Для кормления птицы опытных и контрольных групп использовали сухие полнорационные комбикорма производства Purina (фото 61). Кормление птицы осуществляли согласно нормам соответствующего яичного кросса. Раздачу комбикормов проводили вручную, доступ птицы к воде был постоянный, неограниченный. Перед посадкой птицы все помещения (в том числе оборудование), предназначенные для проведения опыта, тщательно мыли и дезинфицировали.
Выращивание и обращение со всей птицей проводили гуманно согласно Европейской конвенции по защите позвоночных животных, используемых для экспериментов или в иных научных целях (ETS № 123, Страсбург, 18 марта 1986 г.). При проведении опыта осуществляли ежедневный клинический осмотр птицы (несколько раз в сутки). По окончании опыта всю оставшуюся птицу как опытных, так и контрольных групп убивали, проводили полное патологоанатомическое и бактериологическое исследование. Трупы утилизировали согласно правилам утилизации биологического патматериала.
Фото 61
Корма для птицы производства Purina
Изучение вирулентных свойств культур микроорганизмов, выделенных от птиц, изучали на модели внутримышечного заражения цыплят первых дней жизни. Все цыплята были разделены на 8 групп-аналогов – 6 опытных 2 контрольных. В каждой группе было по 10 голов.
Для заражения были отобраны 6 культур 3 видов основных возбудителей бактериальных болезней птиц: кишечной палочки, эпидемиологически опасного сероварианта сальмонеллы Salmonella Enteritidis и синегнойной палочки. По три штамма каждого вида были свежевыделенные из фермерского бройлерного хозяйства, в котором мы ранее проводили эпизоотологическое обследование. И 3 штамма каждого вида – музейные культуры, выделенные ранее на птицефабриках, и хранящиеся в музее микроорганизмов отдела микробиологии ВНИВИП.
1-я опытная группа – цыплята, зараженные культурой кишечной палочки Escherichia coli (из фермерского хозяйства)
2-я опытная группа – цыплята, заражённые культурой кишечной палочки Escherichia coli (музейный штамм)
3-я опытная группа – цыплята, заражённые культурой сальмонеллы Salmonella Enteritidis (из фермерского хозяйства)
4-я опытная группа – цыплята, заражённые культурой сальмонеллы Salmonella Enteritidis (музейный штамм)
5-я опытная группа – цыплята, заражённые культурой синегнойной палочки Pseudomonas aeruginosa (из фермерского хозяйства)
6-я опытная группа – цыплята, зараженные культурой синегнойной палочки Pseudomonas aeruginosa (музейный штамм)
7-я контрольная группа – контроль введения — цыплята, которым вводили стерильный физиологический раствор
8-я контрольная группа – чистый интактный контроль – цыплятам ничего не вводили
Для заражения использовали 18-24-часовые бульонные культуры. При заражении цыплят первых дней жизни исследуемую культуру вводили в дозе 0,1 см3 в грудную мышцу. Введение культур проводили при помощи стерильных одноразовых шприцов объёмом 1,0 см3 (инсулиновых) с ценой деления от 0,01 до 0,1 см3 и толщиной игл 0,4 мм.
За заражённой птицей вели ежедневное наблюдение, несколько раз в день проводили клинический осмотр. В случае гибели птицы в тот же день производили вскрытие, патологоанатомическое исследование с фотофиксацией, бактериологическое исследование с целью выделения культуры заражающего штамма, при необходимости – отбор проб для других исследований. По окончании опыта, на 10-е сутки после заражения, осуществляли убой и вскрытие оставшейся в опыте всей птицы, патологоанатомическое и бактериологическое исследования с фотофиксацией.
В опыте параллельно с заражением ставили контроли – контроль введения и чистый контроль. В каждой контрольной группе использовали такую же птицу того же возраста и в том же количестве, что и в опытных группах. Контрольные группы содержали в тех же условиях, что опытные, но в отдельных боксах или клетках. При контроле введения птице вводили физраствор в той же дозе и тем же способом, что и культуру заражающего штамма. Чистый (интактный контроль) ничем не заражали, ничего не вводили. Результат учитывали только в том случае, если вся птица обеих контрольных групп оставалась живой и здоровой на протяжении всего срока наблюдения.
1.3.3. Результаты исследований и обсуждение
1.3.3.1 Результаты клинического наблюдения за цыплятами, зараженными культурами разных возбудителей и штаммов
Сводные данные по изучению вирулентных свойств культур микроорганизмов представлены в таблице …..
По группам птиц, получены следующие результаты.
В первой группе (заражение эпизоотическим штаммом E.coli из фермерского хозяйства) в течение 48 часов пали 9 цыплят (фото). На вскрытии у всех цыплят был отмечен выраженный разлитой некроз грудной мышцы в месте введения заражающего штамма (фото 62).
Во второй группе (заражение музейным штаммом E.coli) через 48 часов все цыплята были живы (фото 63), пал один цыплёнок на 8-е сутки после заражения. Остальные 9 цыплят были живы до убоя по окончании опыта.
В третьей группе (заражение эпизоотическим штаммом Salmonella Enteritidis из фермерского хозяйства) в течение 48 часов пал 1 цыплёнок (фото 64). На 3-е сутки пало 6 цыплят, на 8-е — один. Два цыплёнка оставались живыми до убоя по окончании опыта.
В четвёртой группе (заражение музейным штаммом Salmonella Enteritidis) в течение 48 часов пали 7 цыплят (фото 65). Один цыплёнок пал на 3-и сутки, и ещё один – на 9-е. Один цыплёнок был жив до убоя по окончании опыта.
В пятой группе (заражение эпизоотическим штаммом Pseudomonas aeruginosa из фермерского хозяйства) в течение 48 часов пали 9 цыплят (фото 66). Последний цыплёнок пал на 3-и сутки.
В шестой группе (заражение музейным штаммом Pseudomonas aeruginosa) в течение 48 часов пали все 10 цыплят (фото).
В седьмой группе контроля введения (цыплятам вводили стерильный физраствор) все цыплята оставались живыми и клинически здоровыми на протяжении всего срока наблюдения (фото 67).
В восьмой группе чистого контроля (цыплятам ничего не вводили) все цыплята также оставались живыми и клинически здоровыми на протяжении всего срока наблюдения.
Во всех случаях при бактериологическом исследования из сердца и печени были выделены культуры соответствующих заражающих штаммов.
Таблица 4
Результаты изучения вирулентных свойств культур микроорганизмов разных видов, выделенных от птиц,
на модели заражения цыплят первых дней жизни
| Дни после заражения | № группы | |||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| Опыт | Контроль | |||||||
| Вид заражающего штамма | ||||||||
| Escherichia coli
ферма ЛО |
Escherichia coli
музейная |
Salmonella Enteritidis ферма ЛО | Salmonella Enteritidis
музейная |
Pseudomonas aeruginosa
ферма ЛО |
Pseudomonas aeruginosa
музейная |
Контроль введения (физ.
раствор) |
Чистый контроль | |
| Количество голов в группе | ||||||||
| 10 | 10 | 10 | 10 | 10 | 10 | 10 | 10 | |
| Пало голов | ||||||||
| 2-е
(48 ч) |
9 | 1 | 7 | 9 | 10 | |||
| 3-е | 1 | 6 | 1 | 1 | ||||
| 8-е | 1 | 1 | ||||||
| 9-е | 1 | |||||||
| 10-е
(убой) |
9 | 2 | 1 | 10 | 10 | |||
| Пало/Выжило | 10/0 | 1/9 | 8/2 | 9/1 | 10/0 | 10/0 | 0/10 | 0/10 |
Фото 62
1-я группа на 2-е сутки после заражения, цыплята, заражённые
культурой Escherichia coli, выделенной из фермерского хозяйства
Фото 63
2-я группа на 2-е сутки после заражения, цыплята,
заражённые музейной культурой Escherichia coli
Фото 64
3-я группа на 2-е сутки после заражения, цыплята, заражённые культурой Salmonella Enteritidis, выделенной из фермерского хозяйства
Фото 65
4-я группа на 2-е сутки после заражения, цыплята,
заражённые музейной культурой Salmonella Enteritidis
Фото 66
5-я группа на 2-е сутки после заражения, цыплята, заражённые культурой Pseudomonas aeruginosa, выделенной из фермерского хозяйства
Фото 67
7-я группа на 2-е сутки после заражения, цыплята контроля введения,
был введён физраствор
Фото 68
4-я группа на 2-е сутки после заражения, цыплёнок,
заражённый музейной культурой Salmonella Enteritidis, угнетение
Фото 69
4-я группа на 2-е сутки после заражения, цыплёнок,
заражённый музейной культурой Salmonella Enteritidis, угнетение
Фото 70
3-я группа на 2-е сутки после заражения, цыплёнок, заражённый культурой Salmonella Enteritidis, выделенной из фермерского хозяйства,
угнетение, отказ от корма и воды
1.3.3.2 Результаты патологоанатомического вскрытия трупов подопытных цыплят
Были изучены сохранность и патологоанатомические признаки у павших и вынужденно убитых подопытных цыплят музейными культурами разных видов бактериальных возбудителей и культурой возбудителей, выделенными от больных и павших цыплят-бройлеров (Escherichia coli, выделенная от цыплят фермерского хозяйства, музейная культура Escherichia coli; культура Salmonella Enteritidis, выделенная от цыплят фермерского хозяйства, музейная культура Salmonella Enteritidis; культура Pseudomonas aeruginosa, выделенная от цыплят фермерского хозяйства, музейная культура Pseudomonas aeruginosa). Результаты проведенных исследований показали существенные различия выявленных признаков и показателей.
Так, в группе цыплят, зараженных «полевым» изолятом Escherichia coli, был отмечен падеж 9 птиц из 10 в течение 48 час после заражения (фото 62). При патологоанатомическом вскрытии у всех трупов обнаружен некроз грудной мышцы по месту инъекции (фото 71-73). У отдельных трупов были отмечены изменения в печени (фото 74). В группе цыплят, зараженных музейной культурой Escherichia coli, павших птиц отмечено не было. В группе цыплят, зараженных «полевой» культурой Pseudomonas aeruginosa, на вторые сутки пало 9 голов цыплят из 10 (фото 66). У трупов обнаружен некроз грудной мышцы в месте инъекции (фото 75). В группе цыплят, зараженных культурой музейного штамма Pseudomonas aeruginosa, пали все 10 голов цыплят. У трупов были выявлены изменения в печени (фото 78, 80, 81). А также, очаги некроза в грудной мышце (фото 77, 79). У цыплят, зараженных «полевым» изолятом культуры Salmonella Enteritidis на вторые сутки опыта, отмечали угнетенное состояние. Пало два цыпленка (фото 64). В группе цыплят, зараженных музейной культурой Salmonella Enteritidis, падеж составил 8 голов (фото 65). И в той, и в другой группе цыплят, зараженных культурой Salmonella Enteritidis, отмечали угнетение птицы, начиная со вторых суток опыта (фото 68-70).
У цыплята контрольных групп не было отмечено гибели в течение 20 дней (период наблюдения). Посевы мазков-отпечатков из ротовой полости цыплят и пробы помета не выявили патогенных тест-культур.
Фото 71
Некроз грудной мышцы павшего в течение 48 ч цыплёнка-1 на месте введения культуры Escherichia coli, выделенной из фермерского хозяйства
Фото 72
Некроз грудной мышцы павшего в течение 48 ч цыплёнка-2 на месте введения культуры Escherichia coli, выделенной из фермерского хозяйства
Фото 73
Некроз грудной мышцы павшего в течение 48 ч цыплёнка-3 на месте введения культуры Escherichia coli, выделенной из фермерского хозяйства
Фото 74
Изменения в печени павшего в течение 48 ч цыплёнка-4 после введения культуры Escherichia coli, выделенной из фермерского хозяйства
Фото 75
Некроз грудной мышцы павшего в течение 48 ч цыплёнка, заражённого культурой Pseudomonas aeruginosa, выделенной из фермерского хозяйства
Фото 76
Изменения в печени павшего в течение 48 ч цыплёнка, заражённого культурой Salmonella Enteritidis, выделенной из фермерского хозяйства
Фото 77
Некроз грудной мышцы павшего в течение 48 ч цыплёнка,
заражённого музейной культурой Pseudomonas aeruginosa
Фото 78
Изменения в печени павшего в течение 48 ч цыплёнка,
заражённого музейной культурой Pseudomonas aeruginosa
Фото 79
Некроз грудной мышцы павшего в течение 48 ч цыплёнка,
заражённого музейной культурой Pseudomonas aeruginosa
Фото 80
Изменения в печени павшего в течение 48 ч цыплёнка,
заражённого музейной культурой Pseudomonas aeruginosa
Фото 80
Изменения в печени павшего в течение 48 ч цыплёнка,
заражённого музейной культурой Pseudomonas aeruginosa
1.3.3.3 Изучение культуральных свойств штаммов возбудителей
Были изучены культуральные свойства штаммов возбудителей, выделенных после освежения от цыплят, павших в ходе предыдущего опыта.
Штаммы возбудителей (Escherichia coli, Salmonella Enteritidis, Pseudomonas aeruginosa) высевали на питательные среды (Эндо, МПА) для получения отдельных колоний и накопления биомассы для использования в дальнейшей работе. В процессе культивирования была подтверждена идентичность и чистота полученных культур и штаммов возбудителей. Результаты культивирования Escherichia coli представлены в фото 81 — 87; Salmonella Enteritidis (фото 88, 89); Pseudomonas aeruginosa (Фото 90).
Фото 81
Рост культур Escherichia coli из сердца и печени павшего цыплёнка
на среде Эндо
Фото 82
Рост культур Escherichia coli с выраженным металлическим блеском
из сердца и печени павшего цыплёнка на среде Эндо
Фото 83
Рост культур Escherichia coli из сердца и печени павшего цыплёнка
на среде Эндо
Фото 84
Рост культур Escherichia coli из сердца и печени павшего цыплёнка
на среде Эндо
Фото 85
Рост культур Escherichia coli из сердца и печени павшего цыплёнка
на среде Эндо
Фото 86
Рост культур Escherichia coli из сердца и печени павшего цыплёнка
на среде Эндо
Фото 87
Рост культур Escherichia coli с выраженным металлическим блеском
из сердца и печени павшего цыплёнка на среде Эндо
Фото 88
Рост культур Salmonella Enteritidis из сердца и печени павшего цыплёнка
на среде Эндо
Фото 89
Рост культур Salmonella Enteritidis из сердца и печени павшего цыплёнка
на среде Эндо
Фото 90
Рост культур Pseudomonas aeruginosa из сердца и печени павшего цыплёнка на мясопептонном агаре
1.3.3.4 Заключение.
При изучении сравнительных биологических свойств эпизоотических изолятов и музейных штаммов возбудителей инфекционных болезней птиц установлено:
Эпизоотический штамм условно-патогенного микроорганизма из семейства энтеробактерий (Enterobacteriaceae) — кишечной палочки Escherichia coli, выделенный из фермерского хозяйства от цыплёнка-бройлера, павшего с выраженной патологоанатомической картиной колибактериоза (фибринозные перикардит, перигепатит, перитонит), является высоковирулентным, все заражённые им цыплята пали в течение 3-х суток. На вскрытии были выявлены выраженные разлитые некрозы на месте введения заражающего штамма. Музейный штамм E.coli за время хранения утратил свои вирулентные свойства, в течение опыта пал лишь один заражённый им цыплёнок (на 8-е сутки после заражения);
Эпизоотический штамм патогенного микроорганизма из семейства энтеробактерий (Enterobacteriaceae) — Salmonella Enteritidis, выделенный из фермерского хозяйства от павшего цыплёнка-бройлера является вирулентным, в течение 8 дней пали 8 заражённых им цыплят. Музейный штамм S.Enteritidis также оказался вирулентным, в течение 9-ти дней пали 9 голов заражённых им цыплят. Таким образом, музейный штамм сальмонеллы сохранил свои вирулентные свойства.
Эпизоотический штамм патогенного микроорганизма из семейства псевдомонад (Pseudomonaceae) – синегнойная палочка Pseudomonas aeruginosa, выделенный из фермерского хозяйства от павшего цыплёнка-бройлера является высоковирулентным, в течение 3-х дней пали все 10 заражённых им цыплят. Музейный штамм P.aeruginosa также оказался высоковирулентным, в течение 2-х дней пали все заражённые им цыплят. Таким образом, музейный штамм синегнойной палочки сохранил свои вирулентные свойства.
1.4. Изучение бактерицидной активности дезинфицирующего средства «Теотропин Р+» для обеззараживания куриных пищевых яиц
1.4.1 Обоснование выбора направления исследований
Возбудители инфекционных болезней птиц могут быть контаминантами разных технологических участков птицеводческого предприятия, в том числе птичников, убойных цехов, объектов ветеринарного назначения, оборудования, инвентаря, производимых продуктов птицеводства (3,7). В большей степени бактериальной обсемененности подвержены товарные (пищевые) и инкубационные яйца. Установлено, что даже на только что снесенном яйце можно обнаружить до 10 тыс. бактерий. При несоблюдении в полной мере зоогигиенических норм и ветеринарно-санитарных правил сбора, транспортировки и хранения яйца, общее количество микроорганизмов на поверхности скорлупы может существенно возрастать (4, 5, 6). Пищевое яйцо, находящееся на сравнительно длительном хранении на складах и предприятиях торговли, особенно в летнее время года, является источником повышенной опасности в отношении возбудителей бактериальных инфекций, в том числе зооантропонозов. Поэтому, в целях снижения количества возможных случаев пищевых отравлений у человека через пищевое яйцо и продуктовые изделия, приготовленные на их основе, большое значение имеет дезинфицирующая обработка пищевых яиц. Вместе с тем, следует учитывать, что у многочисленных видов возбудителей инфекционных болезней животных и птиц под «давлением» факторов внешней среды и проводимых антибактериальных обработок активно формируется адаптация и устойчивость к действию антибактериальных средств, в том числе антибиотиков и дезинфицирующих препаратов. Для успешного разрешения этой проблемы необходимо проводить периодическую ротацию антибактериальных средств. Применять новые эффективные дезинфектанты (1, 2, 3, 6, 7).
Одним из таких препаратов является дезинфицирующее средство нового поколения «Теотропин Р+» отечественного производства (изготовитель — ООО «ПластПром»). По внешнему виду препарат представляет собой прозрачный водный раствор, содержащий в качестве действующего вещества тетраметилендиэтилентетрамин (ТМДЭТА), 35,0+1,5% в смеси с функциональными добавками: алкилдиметилбензиламмоний хлорид и дидецилдиметиламмоний хлорид (ПАВ). Препарат обладает бактерицидной, вирулицидной, фунгицидной и спороцидной активностью. Дезинфицирующие свойства обусловлены способностью проникать внутрь клетки бактерий, вирусов, плесневых грибов и взаимодействовать с аминогруппами пуриновых и пиримидиновых оснований РНК и ДНК, блокируя их матрично-генетическую функцию.
Целью наших исследований явилось изучение бактерицидных свойств препарата Теотропин Р+. Перед исполнителями были поставлены следующие задачи:
-изучить активность препарата Теотропин Р+ в отношении основных возбудителей бактериальных болезней птиц in vitro методом серийных разведений;
— изучить эффективность препарата Теотропин Р+ для дезинфекции поверхности скорлупы пищевых яиц.
1.4.2. Материалы и методы исследований.
Нами была изучена антимикробная активность Теотропина Р+ в отношении основных возбудителей бактериальных болезней птиц in vitro. Работу проводили на 10 культурах 7 видов возбудителей, в том числе: Salmonella typhimuruim – 1 культура; Salmonella enteritidis – 2; Escherichia coli – 3; Proteus vulgaris – 1; Pseudomonas aeruginosa – 1; Staphylococcus aureus – 1; Staphylococcus epidermidis – 1.
Используемые в работе культуры возбудителей были выделены из трупов павших и вынужденно убитых цыплят, кур и индеек разного возраста, из помёта клинически здоровых птиц, из воздуха птицеводческих помещений птицефабрик различного технологического направления разных регионов России и стран СНГ, и штаммы из музея отдела микробиологии ВНИВИП.
Антимикробную активность средства «Теотропин Р+» определяли методом последовательных серийных разведений. Для этого в 13 стерильных пробирок разливали по 2 мл жидкой питательной среды (мясопептонный бульон, МПБ). В первую пробирку вносили 2 мл 2%-ного раствора препарата. Содержимое перемешивали и 2 мл переносили во вторую пробирку и так далее до 10-й пробирки, из которой 2 мл удаляли. Таким образом, в первой пробирке концентрация препарата составляла 1%, во второй – 0,5%, в третьей — 0,25%, в четвёртой — 0,125%, в пятой — 0,0625%, в шестой — 0,03125%, в седьмой — 0,015625%, в восьмой — 0,0078125%, в девятой — 0,00390625% и в десятой — 0,001953125%.
Содержимое 11-й пробирки служило контролем роста культуры исследуемого микроорганизма, 12-й – контролем препарата, а 13-я — контролем стерильности питательной среды. Во все пробирки, кроме 12-й и 13-й, вносили 0,1 мл исследуемой суточной бульонной культуры возбудителя. Посевы инкубировали в термостате при температуре +37,5оС 24 часа, после чего делали пересев культуры на твердую питательную среду (скошенный мясопептонный агар, МПА) для учёта роста колоний культур возбудителей.
Учёт результатов проводили при наличии роста в пробирках с контрольными культурами и отсутствии роста в контрольных пробирках с препаратом и средой.
Результаты учитывали визуально по появлению роста культур в пробирках с МПБ (бактериостатическое действие). Минимальную подавляющую концентрацию (МПК) определяли по наименьшей концентрации средства, которая подавляла видимый рост тест-микроорганизма. Контролем служили бульонные культуры микроорганизмов, в которые препарат не вносился.
Бактерицидное действие препарата изучали по окончании исследований по определению бактериостатического действия. Для этого из пробирок, в которых видимый рост отсутствовал, по 0,2 мл высевали на МПА. Посевы инкубировали при 37оС. Учёт результатов проводили через 24 часа инкубирования, и затем через 5 суток.
Минимальную бактерицидную концентрацию (МБК) определяли по наименьшей концентрации препарата, при которой отсутствовал рост микроорганизмов на МПА.
1.4.3. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ОБСУЖДЕНИЕ
1.4.3.1 Результаты изучения эффективности средства «Теотропин Р+» в отношении основных возбудителей бактериальных болезней птиц
Антимикробную активность дезинфицирующего средства Теотропин Р+ изучали на жидких и плотных питательных средах. Минимальные подавляющую (бактериостатическую) и бактерицидную концентрации (МПК и МБК) определяли методом серийных разведений в МПБ с последующим высевом на МПА.
Результаты определения антимикробной активности средства «Теотропина Р+ представлены в таблице…… Из полученных и приведённых данных видно, что в отношении шести исследованных культур возбудителей Теотропин показал ярко выраженную бактерицидную активность (полное отсутствие роста как на МПБ, так и на МПА) в 0,125% концентрации препарата (4-я пробирка): Salmonella typhimuruim, обе культуры Salmonella enteritidis, одна культура Escherichia coli (штамм 0:78), Pseudomonas aeruginosa и Staphylococcus aureus. Минимальная бактерицидная концентрация (МБК) одной культуры Escherichia coli и Staphylococcus epidermidis составила 0,625% (5-я пробирка); МБК Proteus vulgaris — 0,03125% (6-я пробирка). Лишь в отношении сахарозоотрицательной культуры Escherichia coli минимальная бактерицидная концентрация (МБК) составила 0,25%.
Следует отметить, что при росте многих культур на МПА в пробирках, следующих за теми, разведение препарата в которых соответствовало МБК, отмечали рост культуры менее интенсивный, чем в контрольных без добавления препарата. Очевидно, что при уменьшении дозы препаратов имеет место бактериостатический эффект.
1.4.3.2 Результаты изучения эффективности средства «Теотропин Р+» для обеззараживания скорлупы пищевых яиц
Нами была проведена серия опытов с целью изучение бактерицидного действия разных концентраций средства «Теотропин Р+» в отношении тест-культуры Salmonella enteritidis. В процессе работы были испытаны растворы средства в следующих концентрациях (по препарату) – 0,15%, 0,25%, 0,35%, 0,5%, 1% и 1,5%, приготовленные на воде температуры 18-20оС. В контрольной и каждой опытной группе использовали по 10 штук пищевых яиц. Поверхность скорлупы каждого яйца была обработана суточной бульонной культурой Salmonella enteritidis в концентрации 1 млрд. микробных клеток. Через 1,5 часа после подсыхания скорлупы опытные группы яиц были погружены в соответствующие растворы средства «Теотропин Р+» (0,15%, 0,25%, 0,35%, 0,5%, 1% и 1,5% концентрации) комнатной температуры на 5 минут. Затем яйца были вынуты и сложены в прокладки для проведения дальнейших исследований.
Смывы с поверхности яиц контрольной и опытных групп брали через 2, 24, 72 и 120 часов после обработки растворами дезинфектанта. Смывы брали стерильными ватными тампонами в среду для накопления сальмонелл (селенитовый бульон). Через сутки пробы пересевали на дифференциально-диагностическую среду (среда Эндо). Результаты исследований представлены в таблице.
Таблица 5
Результаты дезинфекции яиц растворами средства
«Теотропин Р+» на тест-культуру Salmonella Enteritidis
| Концентрация
раствора препарата Теотропин Р+ |
Экспозиция, через (час) | |||
| 2 | 24 | 72 | 120 | |
| Контроль | + | + | + | — |
| 0,15% | + | — | — | — |
| 0,25% | — | — | — | — |
| 0,35% | — | — | — | — |
| 0,5% | — | — | — | — |
| 1% | — | — | — | — |
| 1,5% | — | — | — | — |
Примечание. « + » — наличие роста культуры Salmonella enteritidis в смывах с поверхности скорлупы яиц (фото 1)
« — » отсутствие роста культуры Salmonella enteritidis в смывах с поверхности скорлупы яиц (фото 2)
В результате исследований установлено бактерицидное действие растворов дезинфицирующего средства «Теотропин Р+» на тест культуру Salmonella enteritidis в концентрациях 0,25%, 0,35%, 0,5%, 1% и 1,5% (по препарату).
Фото 91
Рост на среде Эндо культур Sаlmonella Enteritidis
в смывах со скорлупы контрольных яиц
Фото 92
Отсутствие роста на среде Эндо культур Sаlmonella Enteritidis
в смывах со скорлупы яиц, обработанных погружением
в 0,25% раствор дезинфицирующего средства «Теотропин Р+»
1.4.3.3 Заключение.
Полученные данные по изучению эффективности средства «Теотропин Р+» in vitro в отношении основных возбудителей бактериальных болезней птиц свидетельствуют о высокой активности препарата в отношении этих культур. В отношении 6 культур Теотропин Р+ показал выраженную бактерицидную активность в 0,125% концентрации; в отношении 2-х культур – в 0,0625% концентрации, в отношении одной культуры – в 0,03125% концентрации. Таким образом, применение средства «Теотропин Р+» в птицеводстве для дезинфекции объектов ветеринарного надзора является перспективным.
На основании проведённых лабораторных испытаний установлено, что дезинфицирующее средство «Теотропин Р+» обеззараживает поверхность скорлупы пищевых яиц, обработанных культурой Salmonella enteritidis, при погружении их на 5 минут в раствор препарата в концентрациях 0,25% и выше.
Средство «Теотропин Р+» в 0,25% концентрации (по препарату) может быть рекомендовано для дезинфекции скорлупы пищевых яиц с целью предотвращения заражения потребителей эпидемиологически опасным микроорганизмом Salmonella enteritidis.
1.4.3.4 Список литература
Давыдова А.Д., Алексеев А.Д. Дезинфекция и современные дезинфицирующие средства в ветеринарии /Молодежь и наука, 2017. № 3. С.13.
Дорожкин В.И., Прокопенко А.А., Морозов В.Ю., Дронфорт М.И. Препараты для дезинфекции объектов ветеринарного надзора / Эффективное животноводство. 2018. № 3 (142). С. 34-36.
Кашковская Л.М., Панков И.Ю., Сафарова М.И. Комплексная дезинфекция на птицефабрике – залог ветеринарного благополучия / Ветеринария. 2018. №7. С. 8-11.
Николаенко В.П., Климов М.С., Зарытовский А.И., Михайлова А.В. Новые средства при инкубации яиц и их влияние на вывод цыплят// Птицеводство. 2013. №2. С 39-42.)
Фисинин В.И., Трухачёв В.И., Салеева И.П., Морозов В.Ю., Журавчук Е.В., Колесников Р.О., Иванов А.В. Микробиологические риски в промышленном птицеводстве и животноводстве/ Сельскохозяйственная биология, 2018, т. 53, № 6, С. 1120-1130.
Явников Н.В. Эффективная дезинфекция / Аграрная наука. 2020. №1. С.40-42.
Long E., Plewa K. Microbiological air contamination in poultry houses. Pol. J. Environ. Stud., 2010, 19 (1), p. 15-19.
Таблица 6
Результаты определения антимикробной активности Теотропина
в отношении основных возбудителей бактериальных болезней птиц
| Вид культуры
(10 культур 7 видов) |
Рост на питат
среде |
Концентрация раствора препарата Теотропина | |||||||||
| 1% | 0,5% | 0,25% | 0,125% | 0,0625% | 0,03125% | 0,015625% | 0,0078125% | 0,0039062% | 0,001953125% | ||
| 1. Salmonella typhimuruim | МПБ | — | — | — | — | — | — | + | + | + | + |
| МПА | — | — | — | — | + | + | + | + | + | + | |
| 2. Salmonella enteritidis-1 | МПБ | — | — | — | — | — | — | + | + | + | + |
| МПА | — | — | — | — | + | + | + | + | + | + | |
| 3. Salmonella enteritidis-2 | МПБ | — | — | — | — | — | — | + | + | + | + |
| МПА | — | — | — | — | + | + | + | + | + | + | |
| 4. Escherichia coli-1 (0:78) | МПБ | — | — | — | — | — | + | + | + | + | + |
| МПА | — | — | — | — | + | + | + | + | + | + | |
| 5. Escherichia coli-2 (сахароза отрицательная) | МПБ | — | — | — | — | — | + | + | + | + | + |
| МПА | — | — | — | + | + | + | + | + | + | + | |
| 6. Escherichia coli-3 | МПБ | — | — | — | — | — | + | + | + | + | + |
| МПА | — | — | — | — | — | + | + | + | + | + | |
| 7. Proteus vulgaris | МПБ | — | — | — | — | — | — | + | + | + | + |
| МПА | — | — | — | — | — | — | + | + | + | + | |
| 8. Pseudomonas aeruginosa | МПБ | — | — | — | — | — | — | + | + | + | + |
| МПА | — | — | — | — | + | + | + | + | + | + | |
| 9. Staphylococcus aureus | МПБ | — | — | — | — | — | + | + | + | + | + |
| МПА | — | — | — | — | + | + | + | + | + | + | |
| 10. Staphylococcus epidermidis | МПБ | — | — | — | — | — | — | + | + | + | + |
| МПА | — | — | — | — | — | + | + | + | + | + | |
Примечание: « — » — полное отсутствие роста
« + » рост единичных колоний; « + » — рост на питательной ср
1.5. Изучение дезинфицирующих средств «Доктор Лайф-Дез», «Мирмекон 652 В», «Экодезрико для обеззараживания куриных инкубационных яиц
1.5.1. Обоснование выбора направления исследований
Стабильная рентабельность современного птицеводческого предприятия зависит от многих факторов общехозяйственного, технологического, зоотехнического и ветеринарного направлений производственной деятельности. Большое значение для обеспечения ритмичной работы птицефабрики имеет устойчивое эпизоотическое благополучие хозяйства, которое достигается путём разработки и реализации программы биологической защиты всех участков и звеньев производственного процесса. Это особенно важно для племенных птицеводческих предприятий и хозяйств, имеющих своё родительское стадо кур, использующих инкубационное яйцо собственного производства. Известно, что инкубационное яйцо, полученное от инфицированного поголовья, может быть источником многих инфекционных болезней птиц. В настоящее время насчитывают более 60 трансовариальных инфекций, при которых контаминация инкубационных яиц возбудителями происходит эндогенным и/или экзогенным путем (2,8). Этому способствует строение яичной скорлупы, содержащей множество пор, через которые возбудители могут проникать внутрь яйца и репродуцироваться. В зависимости от загрязнённости скорлупы яиц количество микробных тел на поверхности скорлупы может существенно различаться: на чистой скорлупе содержится до 3400 микроорганизмов, на загрязнённой – до 57 тысяч, на грязной — до 1400 тысяч. В процессе инкубации инфицированных яиц возрастает опасность вывода заражённого молодняка и распространения инфекции на территории хозяйства и за ее пределами. Поэтому одним из основополагающих звеньев в комплексной системе профилактики инфекционных болезней птиц в хозяйстве является дезинфекция подлежащих инкубации яиц. Проведение качественной дезинфекционной обработки инкубационных яиц способствует повышению показателей выводимости и жизнеспособности цыплят.
В настоящее время разработано и используется большое количество дезинфицирующих препаратов и методов дезинфекции, применяемых в промышленном птицеводстве, в том числе для деконтаминации инкубационных яиц и инкубационного оборудования (1,3,4,5,6,7).
Для обеззараживания скорлупы яиц на практике чаще используют разные дезинфицирующие препараты и методы их применения, в т.ч. фумигацию или высокодисперсное распыление формалина, йодтриэтиленгликоля; погружение или опрыскивание яиц растворами бромосепта-50, глютекса, дезконтена, пергидроля, полисепта, хлорамина, экоцида С; озонирование или ультрафиолетовое облучение яиц (4,6). Практика показывает, что используемые методы и дезинфицирующие средства обладают различной эффективностью и не лишены недостатков. При применении в одном хозяйстве одних и тех же дезинфектантов в течение длительного времени формируется адаптация и устойчивость циркулирующих «полевых» штаммов возбудителей к препаратам, что снижает качество и эффективность дезинфекционных мероприятий и может стать следствием обострения эпизоотической ситуации. Отдельные дезинфицирующие препараты, содержащие хлор, глутаровый альдегид, формальдегид, обладают высоким раздражающим действием, являются токсичными для развивающихся эмбрионов, цыплят и персонала хозяйств. Поэтому поиск и применение новых дезинфицирующих средств, эффективных для обеззараживания различных объектов ветеринарного надзора, контаминированных патогенными и условно-патогенными возбудителями, но при этом безопасных для окружающей среды, имеет большое эпизоотическое, эпидемическое, экологическое и экономическое значение. К числу таких препаратов можно отнести новые, не имеющие до настоящего времени широкого применения в ветеринарной практике, дезинфицирующие средства отечественного производства Доктор Лайф-Дез (производитель ООО «БиоХимТекс», Шебекино); Мирмекон 652 В (производитель ООО «НЕОХИМ», Санкт-Петербург) и Экодезрико (производитель ООО «РикоЭколог», Москва).
Доктор Лайф-Дез — дезинфицирующее средство, представляющее собой прозрачную жидкость жёлтого или оранжевого цвета с запахом применяемой отдушки. В качестве активно действующих веществ содержит глутаровый альдегид в количестве 9,0%, глиоксаль – 3,0%, алкилдиметилбензиламмоний хлорид – 16,0%, дидецилдиметиламмоний хлорид – 2,0%. Средство содержит также вспомогательные компоненты: неионогенные ПАВ, отдушку, краситель, воду. Показатель активности водородных ионов (рН) 1,0% водного раствора средства находится в интервале 4,5-5,0.
Мирмекон 652 В — дезинфицирующее средство, представляющее собой прозрачную жидкость от бесцветного до жёлтого цвета со специфическим запахом. Легко смешивается с водой в любых соотношениях. Содержит в качестве действующих веществ тетраметилендиэтилентетрамин – 35% масс, алкилдиметилбензиламмоний хлорид – 15% масс. По параметрам острой токсичности согласно ГОСТ 12.1.007 средство относится к 3 классу опасности. Не вызывает коррозии металлического оборудования, не разрушает пластмассовые элементы оборудования. Не повреждает окрашенные поверхности помещений. Обладает моющими свойствами. Показатель концентрации водородных ионов (рН) находится в пределах 9,0-12,0.
Экодезрико — дезинфицирующее средство нового химического класса полиазаполицикланов. В качестве действующего вещества содержит диэндометилен тетраазациклодекан гидрофосфат натрия. Препарат представляет собой порошок белого или желтовато-белого цвета без запаха. Хорошо растворим в воде. По степени токсического воздействия на организм относится к 4 классу малоопасных веществ. Средство устойчиво к колебаниям рН в интервале 2,0-12,0. Рабочие растворы препарата образуют на обрабатываемой поверхности полимерную плёнку, за счет чего обеспечивается пролонгированное бактерицидное действие препарата.
Задачей настоящих исследований явилось изучение эффективности дезинфицирующих средств Доктор Лайф-Дез, Мирмекон 652 В и Экодезрико в отношении «полевых» культур возбудителей бактериальных болезней птиц в процессе инкубации куриных яиц.
1.5.2 Материалы и методы исследований.
Исследования были выполнены на базе консультационно-диагностического Центра ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины» (СПГУВМ).
В работе использовали инкубационное яйцо, полученное от родительского стада кур кросса Ломанн ЛСЛ-Классик. Инкубацию яиц проводили в инкубаторе российского производства «Стимул ИП-16 М» в режиме, согласно инструкции. Яйца размещали в типовых пластиковых лотках по группам в зависимости от используемой тест-культуры возбудителя, вида дезинфицирующего препарата и концентрации рабочего раствора каждого препарата. Всего было сформировано 15 групп по 10 яиц в каждой группе.
Для инфицирования скорлупы инкубационных яиц использовали смесь культур, состоящую из микроорганизмов четырёх видов: кишечной палочки Escherichia coli, сальмонеллы энтеритидис Salmonella Enteritidis, синегнойной палочки Pseudomonas aeruginosa и золотистого стафилококка Staphylococcus aureus. Все культуры были выделены от цыплят и кур из птицехозяйств Северо-Западного федерального округа. Перед использованием в работе было проведено освежение всех культур микроорганизмов. Тест-культуры на поверхность яиц наносили отдельным стерильным зонд-тампоном, смоченным смесью культур возбудителя в объёме 0,1 см3 микробной суспензии и равномерно распределяли этим же тампоном по всей поверхности каждого яйца. Концентрацию микробных клеток в суспензии предварительно определяли с использованием денситометра DEN-1 и доводили до 0,5 ЕД MF (106 м.т./см3). После полного высыхания нанесенной суспензии микробной культуры поверхность яиц обрабатывали рабочим раствором дезинфектанта. Рабочие растворы каждого из дезинфицирующих средств готовили и использовали в концентрациях 0,3% и 0,5%. Дезинфицирующую обработку яиц проводили с помощью пульверизатора крупнодисперсным аэрозолем каждого препарата по всей поверхности скорлупы (препарат после обработки с яиц не смывали) и выдерживали при комнатной температуре в течение 30 минут до полного высыхания, после чего лотки с яйцом размещали на инкубационных телегах, закатывали в шкаф и включали инкубационное оборудование. Повторную дезинфекцию яиц в процессе инкубации не проводили. Опыт сопровождали контролями. В качестве контрольных групп инкубационных яиц использовали: исходное яйцо без дополнительных обработок (чистый контроль); исходное яйцо, обработанное водопроводной водой, используемой для приготовления рабочих растворов дезинфектантов (контроль обработки); яйцо, обработанное каждым дезинфицирующим препаратом в концентрации 0,3% и 0,5% (контроль токсичности); яйцо после нанесения каждой тест-культуры возбудителя (инфицированный контроль).
Обеззараживающую обработку поверхности скорлупы инкубационных яиц проводили каждым из дезинфицирующих средств: Доктор Лайф-Дез, Мирмекон 652 В, Экодезрико. Объектами исследования были смывы с поверхности инкубационных яиц, смывы с внутренних поверхностей инкубационного и выводного шкафов до начала эксперимента и после его завершения, пробы воздуха в этих шкафах, отходы инкубации. Смывы с поверхности яиц отбирали с помощью стерильных зонд-тампонов на 7-е и 18-е сутки инкубации. Тампоны, сразу после взятия проб, помещали в пробирки с мясопептонным бульоном (МПБ). Первичные посевы инкубировали в термостате при t +37,5оС в течение 24 часов. Затем с первичных посевов делали пересевы на мясопептонный агар в чашках Петри; на чашки Петри с элективными и дифференциально-диагностическими питательными средами для выделения кишечной микрофлоры (энтеробактерий) — среду Эндо, ксилозо-лизино дезоксихолатный агар (XLD-агар); на среду для выделения стафилококков — стафилококковый агар; на среду для выделения энтерококков – полимиксиновую среду. Для выявления гемолитических культур проводили посевы на колумбийский кровяной агар с бараньей кровью. Чашки с посевами помещали в термостат и инкубировали при температуре t +37,5оС в течение 18-24 часов, стафилококковый агар — в течение 24-48 часов, затем проводили учёт выросших колоний и культур микроорганизмов. При этом изучали морфологические, культуральные, текториальные и биохимические свойства. При изучении морфологии колоний проводили микроскопию мазков, окрашенных по Граму. Дальнейшую межродовую и видовую дифференциацию и идентификацию энтеробактерий проводили путём изучения ферментативных и биохимических свойств культур микроорганизмов. Пробы воздуха на наличие микрофлоры изучали седиментационным методом с использованием чашек Петри с МПА, средой Эндо и стафилококковым агаром.
Развивающиеся эмбрионы кур (РЭК), павшие в процессе инкубации, вскрывали, учитывали патологоанатомические изменения и брали пробы хорио-аллантоисной жидкости (ХАЖ) и желточного мешка. Пробы ХАЖ высевали на те же дифференциально-диагностические среды, что и смывы, для индикации и идентификации бактериальных возбудителей. Пробы желтка из яиц до инкубации и пробы желточного мешка каждого павшего РЭК отбирали отдельной стерильной пипеткой и использовали для посева на питательные среды. Дезинфицирующую активность каждого препарата в каждом разведении определяли по результатам обеззараживания инкубационных яиц в отношении использованных тест-культур «полевых» штаммов бактериальных возбудителей: Escherichia coli, Salmonella Enteritidis, Pseudomonas aeruginosa, Staphylococcus aureus.
1.5.3 Результаты исследований и обсуждение
По итогам проведенных исследований получены следующие результаты. Общая выводимость цыплят по всем группам инкубационных яиц составила 78,0%. Количество неоплодотворенных яиц составило 12 шт. (8%). Количество замерших РЭК на ранней стадии инкубации – 6 шт. (4%).
В результате проведенных микробиологических исследований в группе чистого контроля выявлен бактериальный рост в 4-х пробах из 10. В группе контроля обработки выявлен рост в 3-х пробах из 10-ти. В группе контроля заражения выявлен рост в 10-ти пробах из 10-ти, в том числе в трёх пробах были выделены культуры заражающего штамма синегнойной палочки Pseudomonas aeruginosa, а также культуры условно-патогенной микрофлоры из рода Bacillus (в том числе гемолитические) и стафилококки (фото 1-2). Во всех опытных группах, обработанных дезинфицирующими препаратами, рост заражающих культур микроорганизмов не был выявлен ни в одной пробе. Установлено, что дезинфектанты значительно снижают обсеменённость микрофлорой: в опытных группах был отмечен рост единичных колоний условно-патогенных микроорганизмов Bacillus и Staphylococcus, но, в основном, пробы оставались стерильными в течение всего срока наблюдения.
Например, в опытной группе, обработанной 0,3% раствором препарата Доктор Лайф-Дез (без заражения) выявлен рост в 2-х пробах из 10, а в 3-х пробах отмечен рост единичных колоний культур родов Bacillus и Staphylococcus. В опытной группе, обработанной 0,3% раствором данного препарата после предварительного заражения смесью тест-культур, выявлен рост в 3-х пробах из 10, и в 2-х пробах отмечен рост единичных колоний тех же культур (таблица).
В группах контроля токсичности примененных дезинфицирующих препаратов в испытанных концентрациях 0,3% и 0,5% не было отмечено гибели РЭК после применения препаратов Доктор Лайф-Дез и Мирмекон 652 В. В группах инкубационных яиц, обработанных препаратом Экодезрико в концентрации 0,3% отмечено 2 павших эмбриона, в группе, где применяли этот препарат в концентрации 0,5%, выявлено 4 павших эмбриона. Гибель РЭК была отмечена на 14-16 сутки. В результате патологоанатомического вскрытия павших РЭК выявлено не значительное отставание эмбрионов в росте и гиперемию кожи на затылочной части головы, в области спины и на задних конечностях. Во внутренних органах, павших РЭК не было обнаружено видимых патологоанатомических изменений. В результате посева и культивирования проб ХАЖ, желточного мешка, легких, печени, почек от павших РЭК не было выделено бактериальных культур.
Фото-блок (93-95)
Результаты бактериологического исследования смывов с яиц
на 19-й день после обработки
| Рост на колумбийском кровяном агаре | ||
| Пробы 1-5 | Пробы 6-10 | |
| Контрольная группа (чистый контроль без обработки) | ||
| Контрольная группа (обработка водой) | ||
| Опытная группа – обработка 0,3% раствором Доктор Лайф-Дез | ||
Фото-блок (96-97)
Результаты бактериологического исследования смывов с яиц
на 19-й день после обработки (заражённые группы)
| Рост на колумбийском кровяном агаре | ||
| Пробы 1-5 | Пробы 6-10 | |
| Контрольная группа (заражённый контроль) | ||
| Опытная группа – обработка 0,3% раствором Доктор Лайф-Дез после
заражения |
||
1.5.4 Заключение
1. По результатам предынкубационной дезинфекции яиц была установлена безвредность использованных дезинфицирующих средств Мирмекон 652 В и Доктор Лайф-Дез для куриных эмбрионов, вне зависимости от концентрации рабочего раствора каждого препарата. В результате проведённых исследований установлено, что обработка методом орошения инкубационных яиц растворами препаратов в исследованных концентрациях (0,3% и 0,5% по препарату) не оказывает негативного влияния на развитие эмбрионов и выводимость цыплят. По результатам применения дезинфицирующего средства Экодезрико была выявлена остаточная токсичность препарата в используемых концентрациях (0,3% и 0,5% по препарату) для развивающихся эмбрионов кур.
2. Дезинфицирующая обработка поверхности скорлупы инкубационных яиц использованными препаратами обеспечивает полное обеззараживание яйца от патогенных культур микроорганизмов и способствует повышению качества вывода цыплят.
3. В пробах воздуха и смывах со стен инкубационного и выводного шкафов, инкубационных телег и пластиковых лотков, после предварительно проведенной дезинфекции с использованием препарата Мирмекон 652 В, не было обнаружено культур патогенных микроорганизмов в течение всего эксперимента.
4. В результате посева и культивирования смывов, взятых с поверхности скорлупы инкубационных яиц, заложенных на инкубацию без предварительной дезинфицирующей обработки, были выделены культуры микроорганизмов заражающего штамма синегнойной палочки Pseudomonas aeruginosa.
5. В посевах смывов с поверхности скорлупы инкубационных яиц после их обработки водопроводной водой, использованной для приготовления растворов испытуемых дезинфицирующих препаратов, были обнаружены единичные колонии культур условно патогенных микроорганизмов Bacillus и Staphylococcus.
6. Результаты сравнительной эффективности дезинфицирующих средств, использованных для обеззараживания патогенных культур микроорганизмов на поверхности инкубационных яиц, показали более предпочтительный эффект у препаратов Мирмекон 652 В и Доктор Лайф-Дез.
Таким образом, применение дезинфицирующих препаратов Мирмекон 652 В, Доктор Лайф-Дез в птицеводстве для дезинфекции куриных инкубационных яиц является перспективным. Прединкубационная обработка яиц растворами указанных дезинфицирующих средств снижает рост микрофлоры на поверхности скорлупы яиц. Вследствие чего уменьшается возможность заражения выведенных цыплят через скорлупу, снижается микробное давление в инкубаторе, что способствует повышению показателей выводимости и сохранности цыплят.
1.5.5 Список литературы
Баев В., Бочаров М. Ионизация воздуха в птичниках с клеточным содержанием птицы// Птицеводств. 2008. №1. С. 36-37.
Бакулин В.А. Болезни птиц // Санкт-Петербург. 2006. – 688 с.
Боченин Ю.В., Прокопенко А.А. Новые подходы к дезинфекции объектов птицеводства// Современные подходы к решению актуальных ветеринарно-санитарных и зоотехнических проблем в птицеводстве: сборник материалов Всероссийской научно-практической конференции. Санкт-Петербург. Ломоносов, 2013, С. 9 – 11.
Джавадов Э.Д., Хохлачев О.Ф., Новикова О.Б./ Дезинфекция – важный фактор обеспечения биобезопасности птицеводческих хозяйств// «БИО». – 2020. — №10 (241). – С. 20-25.
Джавадов Э.Д., Хохлачев О.Ф., Новикова О.Б. /Дезинфекция – важный фактор обеспечения биобезопасности птицеводческих хозяйств// «БИО». — 2020. — №11 (242). — С. 6-11.
Лыско С., Макарова О. Микробиологический мониторинг в инкубаториях// Птицеводство. -2009. -№8. – С. 43-44.
Николаенко В.П., Шестаков И.Н., Михайлова А.В. Дезинфекция инкубационных яиц и объектов ветеринарного надзора инкубатория // Птицеводство. — 2016. — №12. — С. 47-51.
Профилактика заболеваний в птицеводстве/ Джавадов Э.Д., Хохлачев О.Ф. и др.//Промышленное птицеводство/ Под общей редакцией академика РАН Фисинина В.И. Москва
Новикова О.Б. Продукция птицеводства и пищевые интоксикации // Журнал «Сфера. Птицепром». – 2020. — № 2(47). – С. 44-46.
Новикова О.Б., Карпова О.С., Ладанова М.А. Биоразнообразие патогенной микрофлоры, выделяемой от птиц разных видов в хозяйствах различного технологического направления // В сборнике: Мировое и российское птицеводство: состояние, динамика развития, инновационные перспективы. Материалы XX Международной конференции. Российское отделение Всемирной научной ассоциации по птицеводству (ВНАП РФ); НП «Научный центр по птицеводству». — 2020. – С. 657-661.
Новикова О.Б. Система контроля бактериальных болезней в птицеводстве // Журнал «Тваринництво сьогоднi». – 2020. — № 9. – С.
ОБЩЕЕ ЗАКЛЮЧЕНИЕ
1. В результате выполнения НИР, проведено эпизоотологическое обследование птицеводческих хозяйств различного производственного направления: Селекционно-генетического Центра «Северо-Кавказская зональная опытная станция по птицеводству» (СГЦ СКЗОСП, Ставропольский край), фермерского птицеводческого хозяйства по работе с цыплятами-бройлерами (Ленинградская область), фермерского птицеводческого перепелиного хозяйства (Воронежская область). Сделан отбор различного патологического материала из разных производственных участков хозяйств от птиц разных видов, возраста и разного клинического состояния.
По итогам лабораторно-диагностического исследования клинического патматериала выделено 17 культур «полевых» условно-патогенных и патогенных микроорганизмов разных видов и серологических вариантов: Bacillus spp., Enterococcus spp., Escherichia coli, Klebsiella, Staphylococcus spp., Proteus, Pseudomonas, Salmonella spp.
В результате идентификации и типирования выделенных возбудителей по культуральным, морфологическим, серологическим свойствам и с использованием ПЦР-исследования установлена принадлежность изолятов к возбудителям: сальмонеллеза (Salmonella Enteritidis, Salmonella Typhimurium), колибактериоза (Escherichia coli), штамм 1257, псевдомоноза (Pseudomonas aeruginosa), стафилококкоза (Staphylococcus epidermidis, (Staphylococcus aureus), протей-инфекции (Proteus vulgaris).
По результатам сравнительного изучения патогенных свойств, выделенных «полевых» культур возбудителей и возбудителей музейных культур микроорганизмов на цыплятах установлено, что «полевые» изоляты возбудителей сальмонеллеза (Salmonella Enteritidis), кишечной палочки (Escherichia coli, штамм 1257) и возбудитель протей-инфекции (Proteus vulgaris) имели более высокую вирулентность в сравнении с музейными штаммами названных культур возбудителей. Установлено, также, что «полевые» изоляты возбудителей были более устойчивы к факторам внешней среды (температура, ультрафиолетовое облучение) и действию дезинфицирующих средств.
Выделенные «полевые» культуры возбудителей стафилококкоза и псевдомоноза достоверно не отличались от музейных культур этих возбудителей по вирулентности и устойчивости к факторам внешней среды и действию дезинфицирующих средств.
В результате испытания дезинфицирующего средства «Теотропин Р+» для обработки куриных пищевых яиц было установлено, что препарат обладает высокой бактерицидной активностью и обеспечивает полное обеззараживание поверхности скорлупы яиц от основных возбудителей бактериальных болезней птиц в концентрации 0,2% и выше.
В опыте по изучению дезинфицирующих средств «Доктор Лайф-Дез», «Мирмекон 652 В», «Экодезрико» для обеззараживания куриных инкубационных яиц и инкубационного оборудования установлена высокая дезинфицирующая активность названных препаратов и безвредность дезсредств «Доктор Лайф-Дез» и «Мирмекон 652 В» для развивающихся куриных эмбрионов.
7. В результате испытания на цыплятах дезинфицирующих средств «Доктор Лайф-Дез», «Мирмекон 652 В», «Экодезрико» на бактерицидную активность в отношении основных культур бактериальных возбудителей установлено, что названные препараты безвредны для цыплят и обладают высокой бактерицидной активностью.
8. По итогам проведенной НИР разработаны «Методические рекомендации по дезинфекции объектов ветеринарного надзора в птицеводческом предприятии»
9. Результаты проведенных исследований свидетельствуют о повышении вирулентности «полевых» изолятов бактериальных возбудителей и имеют более выраженную устойчивость к факторам внешней среды и действию дезинфицирующих средств в сравнении с музейными штаммами этих же возбудителей.
10. По результатам проведенных исследований опубликовано 3 (три) научные статьи в профильных журналах категории РИНЦ.
11. Полученные в результате выполнения научно-исследовательской работы данные могут быть успешно использованы в дальнейшем для разработки оптимальных схем дезинфекции различных объектов ветеринарного надзора для включения их в программу биозащиты птицеводческих хозяйств с учетом производственного направления, форм собственности и эпизоотической ситуации каждого хозяйства.
12. Полученные результаты НИР могут быть использованы при проведении лекционных и практических занятий со студентами и слушателями курсов повышения квалификации по дисциплинам «Вирусология и микробиология», «Ветеринарная санитария», «Ветеринарно-санитарная экспертиза», «Эпизоотология», «Болезни птиц».
Приложения
